Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АДАЛИМУМАБ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биотехнологии, в частности, настоящее изобретение относится к фармацевтической композиции, содержащей адалимумаб.
УРОВЕНЬ ТЕХНИКИ
Ревматоидный артрит (РА) представляет собой хроническое системное аутоиммунное заболевание, которое характеризуется артросиновитом. Стойкие и повторяющиеся приступы артросиновита приводят к повреждению хрящей и костей в суставах, нарушениям функции суставов и даже инвалидности. Васкулитные поражения затрагивают каждый орган во всем организме, таким образом, указанное заболевание также называют ревматоидным заболеванием. Возраст начала заболевания у примерно 80% пациентов составляет 20-45 лет, большинство из них - молодые люди, с соотношением мужчин к женщинам 1:2-4. В мире 0,355 миллиарда пациентов с артритом. В азиатском регионе каждый шестой страдает от артрита (который является самым распространенным заболеванием в мире, вызывающим инвалидность) на определенном этапе своей жизни. В настоящее время, по некоторым оценкам, на материковой части Китая насчитывается более ста миллионов пациентов с артритом, и число больных артритом постоянно растет. Число людей с ревматоидным артритом в Китае достигает примерно 6 миллионов человек.
Фактор некроза опухолей α (ФНО-α) представляет собой цитокин, который может уничтожать опухолевые клетки напрямую, но при этом не является токсичным для нормальных клеток. В основном он образуется из макрофагов синовиальной оболочки и может стимулировать пролиферацию фибробластов синовиальной оболочки, секрецию эффекторных молекул, таких как интерлейкин 6 (ИЛ-6), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ), хемотаксический фактор, матриксная металлопротеиназа и простагландин, который играет важную роль в патогенезе РА. В настоящее время антагонист ФНО-α представляет собой наиболее эффективное лекарственное средство для лечения РА и других подобных заболеваний, которое в основном содержит этанерцепт, инфликсимаб и адалимумаб и т.д.
Путем специфического связывания ФНО-α в организме человека, адалимумаб предотвращает связывание ФНО-α с его рецептором на поверхности клетки, тем самым блокируя биологическую активность ФНО-a, в конечном итоге облегчая воспалительную реакцию и снижая активацию остеокластов, обеспечивая облегчение, снятие симптомов и признаков заболевания. Реализация адалимумаба на рынке не только принесет новую стратегию лечения пациентов с ревматоидным артритом, но также имеет крайне важное клиническое значение и достаточно большие перспективы на рынке, поскольку адалимумаб также эффективен для лечения больных хроническими активным ревматоидным артритом и анкилозирующим спондилоартритом, которые нельзя эффективно лечить другими противоревматическими лекарственными средствами, или которые не могут перенести такую лекарственную терапию. Адалимумаб также обладает преимуществами быстрого действия, высокой эффективности, хорошей безопасности и переносимости. В настоящее время присутствующий на рынке продукт, содержащий адалимумаб, представляет собой Хумира® производства Abbott Laboratories, США, утвержденный в 2002 году, и одобренные FDA показания к применению включают: умеренный/тяжелый ревматоидный артрит, умеренный/тяжелый ювенильный ревматоидный артрит, псориаз, анкилозирующий спондилоартрит и умеренную/тяжелую болезнь Крона.
Адалимумаб относится к семейству полностью гуманизированных моноклональных антител. "Полностью гуманизированное" означает, что оно не отличается от иммуноглобулина IgG, вырабатывающегося организмом человека. Обычно организм человека случайным образом вырабатывает различные антитела для защиты от различных патогенных микроорганизмов извне. Тем не менее, так как антитела вырабатываются случайным образом, также вырабатываются антитела, атакующие аутоантигены. В большинстве случаев этот тип антител, который может атаковать аутоантигены, будет устранен иммунной системой до того, как они обретают свои аутоантигенные свойства. Поэтому, иными словами, антитела к антигенам человека не могут вырабатываться в организме человека. Таким образом, антитела, применяемые в раннем лечении, как правило, вырабатываются крысами. Из-за видовых различий источника белков, эти антитела имеют короткий срок существования в организме человека, что оказывает влияние на терапевтический эффект, и может возникнуть риск аллергической реакции. Несмотря на то, что в настоящее время доля антител, полученных от крыс, может быть уменьшена путем комбинирования с человеческими антителами, влияние белков, происходящих от крыс, не может быть устранено. Человеческие антитела, вырабатываемые В-клетками человека, обнаруживают путем скрининга предшественников антител, получаемых случайным образом из В-клеток здоровых людей-доноров с помощью технологии экспрессии фага от Abbott Laboratories, США. Указанное человеческое антитело, т.е. Хумира®, может специфически связываться с ФНО-α. Другими словами, Хумира® представляет собой полностью гуманизированное антитело к ФНО-α, избегающее самообнаружения и устраняющего механизма организма человека, которое не только проявляет антагонистическое действие по отношению к ФНО-α человека, но и также значительно снижает иммунологическое отторжение.
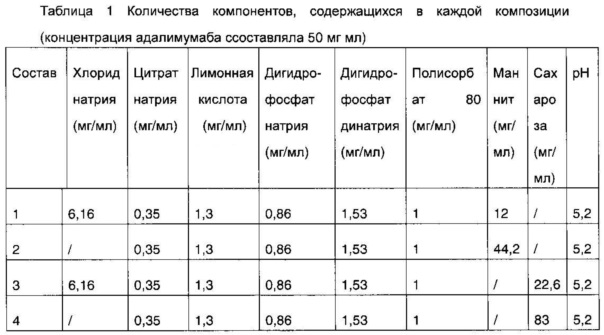
В настоящее время присутствующий на рынке состав, содержащий адалимумаб, Хумира®, представляет собой жидкий состав, содержащий 50 мг/ил адалимумаба, 6,16 мг/мл хлорида натрия, 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты 0,86 мг/мл дигидрата дигидрофосфата натрия, 1,53 мг/мл дигидрата гидрофосфата динатрия, 12 мг/мл маннита, 1 мг/мл полисорбата 80, pH раствора составляет 5,2. В указанном составе адалимумаб представляет собой активный ингредиент, хлорид натрия представляет собой изотонический агент, лимонная кислота и фосфат представляют собой буферные агенты, маннит представляет собой структурный стабилизатор, полисорбат 80 представляет собой поверхностно-активное вещество.
Авторы настоящего изобретения обнаружили, что состав Хумира®, присутствующий на рынке, не является стабильным и может распадаться в условиях испытаний на долгосрочную стабильность и в условиях ускоренных испытаний на стабильность, тем более, что он может образовывать много примесей, таких как агрегаты и нерастворимые частицы. Присутствие агрегатов и нерастворимых частиц считается критическими характеристиками качества (КХА) безопасности биофармацевтических лекарственных средств, которые непосредственно влияют на безопасность лекарственного средства, содержащего адалимумаб, особенно на их иммуногенность, что очень важно для лекарственного средства для долгосрочного приема, такого как адалимумаб.
В публикации CN 201080030083.9 описан состав, содержащий адалимумаб, который не содержит хлорид натрия, но содержит высокую концентрацию (>20 мг/мл) полирла, такого как маннит. По сравнению с присутствующим на рынке Хумира®, этот новый состав обладает более высокой стабильностью в условиях высоких температур.
Как и большинство белковых молекул, адалимумаб не является стабильным и подвержен различным химическим и физическим деградациям. По сравнению с низкомолекулярными лекарственными средствами, синтезируемыми традиционными способами, биомолекулы имеют сложные структуры, например, структуры высокого порядка, такие как первичные структуры, вторичные структуры, третичные структуры. Структуры белка, в особенности структуры высокого порядка, очень неустойчивы, легко происходят изменения структур, такие как денатурация, агрегация и осаждение. Наиболее фундаментальным требованием для обеспечения их биологической активности является поддержание структуры высокого порядка антител. Указанные продукты деградации сильно влияют на безопасность биофармацевтических лекарственных средств. В частности, некоторые из белковых агрегатов будут стимулировать иммуногенные реакции в организме человека, которые могут снизить терапевтический эффект биологического лекарственного средства, или даже привести к смерти пациентов. В ходе производства лекарственных средств на основе антител требуются продукты высокой чистоты, и стабильность структуры также должна сохраняться во время транспортировки, хранения и применения.
Таким образом, в области биотехнологии существует потребность в стабильной фармацевтической композиции адалимумаба.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая адалимумаб. Указанная композиция может поддерживать физическую и химическую стабильность фармацевтической композиции в течение длительного времени и имеет вязкость и осмотическое давление, которые пригодны для подкожного введения.
В частности, настоящее изобретение относится к фармацевтической композиции, содержащей адалимумаб и структурный стабилизатор, где концентрация адалимумаба в композиции составляет 1-200 мг/мл, предпочтительно 10-100 мг/мл, более предпочтительно 50 мг/мл. Указанный структурный стабилизатор выбран из сахарозы или трегалозы, предпочтительно сахарозы, и концентрация указанного структурного стабилизатора составляет 1-200 мг/мл, предпочтительно 10-100 мг/мл. Авторами настоящего изобретения неожиданно было обнаружено, что физическая и химическая стабильность композиции может быть значительно улучшена по сравнению с предшествующим уровнем техники, если в качестве структурного стабилизатора применяют раствор сахарозы или трегалозы с изоосмотическим давлением.
Кроме того, фармацевтическая композиция согласно настоящему изобретению не содержит хлорид натрия. Авторами настоящего изобретения неожиданно было обнаружено, что стабильность состава адалимумаба, который не содержит хлорид натрия, значительно выше, чем у состава адалимумаба, который содержит хлорид натрия, если в качестве структурного стабилизатора применяют раствор сахарозы или трегалозы с изоосмотическим давлением.
Фармацевтическая композициясогласно настоящему изобретению дополнительно содержит поверхностно-активные вещества, включая, но не ограничиваясь ими, полисорбаты, такие как полисорбат 20, полисорбат 21, полисорбат 40, полисорбат 60, полисорбат 61, полисорбат 65, полисорбат 80, полисорбат 81, полисорбат 85 или их смеси, полоксамер, тринитротолуол, додецилсульфат натрия, лаурилсульфат натрия, октилгликозид натрия, лаурил-сульфобетаин, полиэтиленгликоль, полипропиленгликоль или их смеси, предпочтительно полисорбат 80. Концентрация указанного поверхностно-активного вещества составляет 0,01-10 мг/мл, предпочтительно 0,1-2 мг/мл, более предпочтительно 1 мг/мл.
Фармацевтическая композиция согласно настоящему изобретению дополнительно содержит буферные растворы, включая, но не ограничиваясь ими, глицин, уксусная кислота/ацетат, янтарная кислота/сукцинат, лимонная кислота/цитрат, аскорбиновая кислота/аскорбат, винная кислота/тартрат, малеиновая кислота/ малеат, молочная кислота/лактат, угольная кислота/бикарбонат, бензойная кислота/бензоат, гистидин, фосфорная кислота/фосфат или трис/трис гидрохлорид, предпочтительно комбинацию лимонная кислота/цитрат и угольная кислота/бикарбонат, pH композиции согласно настоящему изобретению доводят до 4,0-9,0, предпочтительно до 4,5-8,0, более предпочтительно до 5,2 путем добавления буферного раствора.
Фармацевтическая композиция согласно настоящему изобретению дополнительно содержит фармацевтически приемлемое количество антиоксидантов, включая, но не ограничиваясь ими, аскорбиновую кислоту, триптофан, метионин, глутатион, тиосульфат натрия или каталазу.
Фармацевтическая композиция согласно настоящему изобретению дополнительно содержит фармацевтически приемлемое количество хелатирующих агентов, включая, но не ограничиваясь ими, аминополикарбоновую кислоту, гидроаминокарбоновую кислоту, N-замещенный глицин, лимонную кислоту, никотинамид, дефероксамин, дезоксихолат и их смеси, такие как этилендиаминтетрауксусная кислота (ЭДТА), диэтилентриаминпентауксусная кислота (ДТПА), нитрилотриуксусная кислоты (НТА) и их соли. Хелаторы, применяемые в настоящем изобретении, могут присутствовать в виде свободной кислоты, свободного основания или соли соединения, или могут присутствовать в безводной форме, форме гидрата или другого сольвата соединения или в форме его соответствующей соли.
Фармацевтическая композиция согласно настоящему изобретению дополнительно содержит фармацевтически приемлемое количество консервантов, включая, но не ограничиваясь ими, аметакрезол, фенол, бензиловый спирт, хлорид бензалкония, феноксиэтанол или метиловые эфиры парагидроксибензойной кислоты.
Адалимумаб в фармацевтической композиции согласно настоящему изобретению может оставаться растворимым и стабильным в широком диапазоне pH, подходящее значение pH составляет 4,0-9,0, предпочтительно 4,5-8,0, более предпочтительно 5,2.
Фармацевтическая композиция по настоящему изобретению предпочтительно содержит следующие компоненты:
(1) адалимумаб 50 мг/мл,
(2) сахароза 83 мг/мл или трегалоза 91,7 мг/мл,
(3) Твин 80 1 мг/мл,
(4) лимонная кислота 1,3 мг/мл,
(5) цитрат натрия 0,35 мг/мл,
(6) дигидрофосфат натрия 0,86 мг/мл,
(7) гидрофосфат динатрия 1,53 мг/мл,
причем pH композиции составляет 5,2.
Фармацевтическая композиция согласно настоящему изобретению может представлять собой жидкий состав, лиофилизированный состав или состав, который получают из лиофилизированного порошка и воды для инъекции через двухкамерный картридж, и ее можно вводить путем подкожной инъекции (s.c), внутривенной инъекции (i.v.), внутримышечной инъекции (i.m.) или в других парентеральных формах.
Фармацевтическую композицию согласно настоящему изобретению можно применять для получения лекарственных средств для лечения аутоиммунных заболеваний человека, включающих ревматоидный артрит, псориаз, ювенильный идиопатический артрит, анкилозирующий спондилоартрит, болезнь Крона, язвенный колит, бляшечный псориаз и т.д.
Признаки, упомянутые выше, или признаки, упомянутые в примерах, могут быть произвольно объединены. Признаки, раскрытые в настоящем описании, могут быть объединены с любыми формами композиций, и каждый признак, раскрытый в описании, можно заменить любыми альтернативными признаками, которые обеспечивают те же, эквивалентные или аналогичные цели. Таким образом, если не указано иное, раскрытые признаки представляют собой только общие примеры тех же или аналогичных признаков.
Преимущества настоящего изобретения
Согласно настоящему изобретению, стабильность фармацевтической композиции значительно возрастает при использовании растворов сахарозы или трегалозы с изоосмотическим давлением в качестве структурного стабилизатора адалимумаба, и улучшенная стабильность наблюдалась в ходе испытаний при замораживании и оттаивании, при повреждении в результате воздействия высоких температур и света, таким образом, настоящее изобретение обладает очень широким потенциалом реализации на рынке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
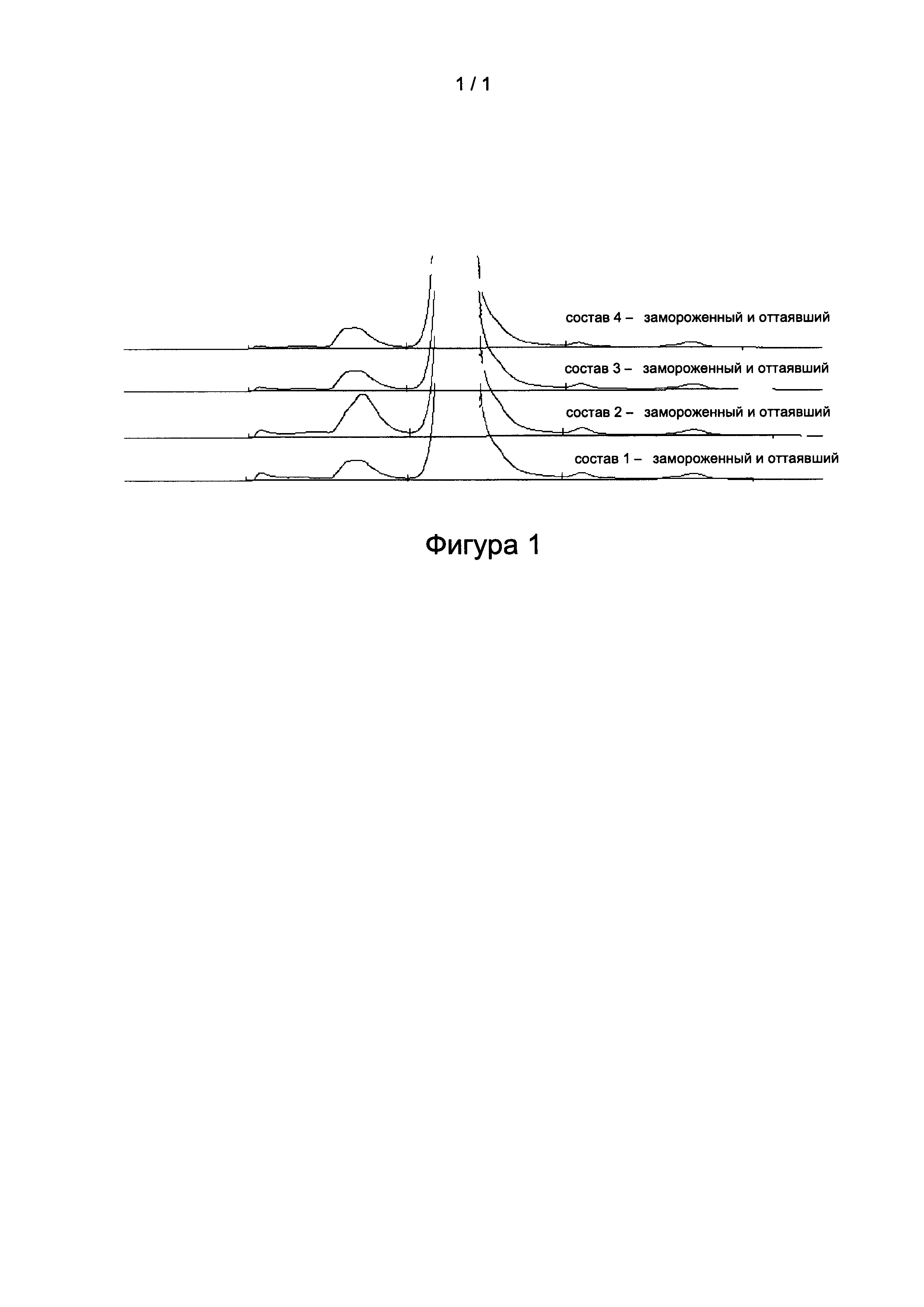
Фиг. 1 представляет собой наложение хроматограмм эксклюзионной ВЭЖХ составов 1-4 после замораживания и оттаивания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В результате многочисленных экспериментов авторами настоящего изобретения неожиданно было обнаружено, что в фармацевтических композициях, содержащих адалимумаб, стабильность фармацевтической композиции, может быть сильно повышена путем применения в качестве структурного стабилизатораадалимумаба растворов сахарозы или трегалозы с изоосмотическим давлением, так что указанный новый состав обладает очень широкими перспективами в реализации на рынке.
Настоящее изобретение будет дополнительно проиллюстрировано комбинацией следующих примеров. Следует понимать, что примеры приведены только для иллюстрации, но не ограничивают объем настоящего изобретения. В приведенных ниже примерах, методики эксперимента без специфических условий обычно осуществляли в соответствии с обычными условиями или условиями, предложенными производителями. Если не указано иное, процентные и другие соотношения рассчитывали по массе.
Пример 1. Исследование стабильности (1)
Во время производства, транспортировки, хранения и применения, биофармацевтические лекарственные средства могут подвергаться различным вредным воздействиям, таким как высокая температура, освещение и замораживание-оттаивание. В целях обеспечения безопасности они должны быть способны сохранить структуру нетронутой, особенно сохранить неповрежденной структуру высокого порядка. Агрегировавшие и нерастворимые частицы биофармацевтического средства являются ключевыми факторами, которые вызывают иммунную реакцию. Внешний вид биологических лекарственных средств также является очень важным показателем. В фармакопеях стран мира предусмотрено, что биологические лекарственные средства не должны содержать видимых посторонних веществ, так как наличие и количество частиц в биологических лекарственных средствах непосредственно связано с безопасностью биологических лекарственных средств, и они рассматриваются в качестве одного из основных факторов, которые вызывают иммунную реакцию биологических лекарственных средств.
Эксклюзионная ВЭЖХ представляет собой аналитический метод, с помощью которого осуществляется разделение на основании соотношения размеров пор геля и размеров образцов. Молекулы с большей молекулярной массой в образцах блокируются, потому что они не могут войти в поры геля и будут проходить сквозь хроматографические колонки вдоль промежутков между пористыми частицами геля, поэтому, они, первыми элюируются из колонки с помощью подвижной фазы. Молекулы с меньшей молекулярной массой могут входить в поры геля, дольше удерживаются в колонках и не могут элюироваться легко, таким образом достигается разделение молекул растворенного вещества различных размеров. Исследование биотерапевтических свойств в основном проводится с целью измерения количества агрегатов, которое могут быть представлены в основном как снижение содержания мономеров и увеличение содержания агрегатов.
В настоящем примере были разработаны несколько составов (1-4) (см. таблицу 1), где состав 1 представляет собой доступный на рынке состав Хумира®; состав 2 представлял собой состав, который содержал высокую концентрацию маннита, но не содержал хлорид натрия; состав 3 представляет собой состав, в котором вместо маннита в составе 1 был использован осмолярный эквивалент сахарозы, состав 4 представляет собой состав, в котором вместо маннита в составе 2 был использован осмолярный эквивалент сахарозы.
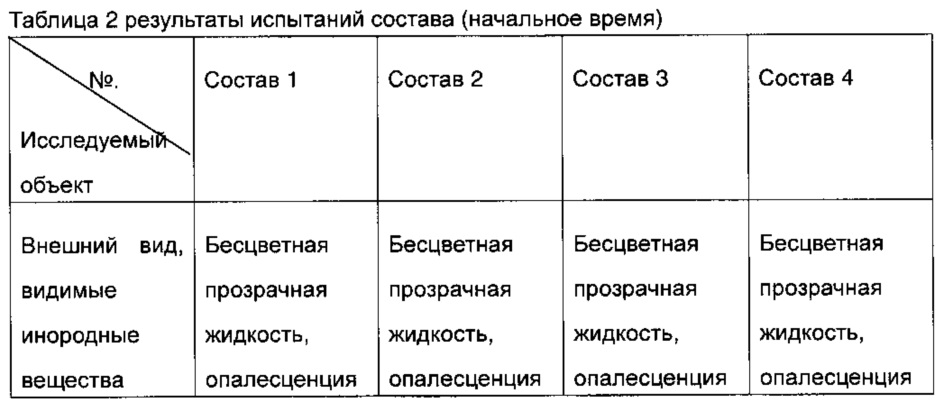
В соответствии с концентрацией каждого компонента составов в таблице 1, получали составы 0,85 мл/шприц 1-4 и проводили их испытания на стабильность. Результаты испытаний на внешний вид в начальное время, чистота по данным эксклюзионной ВЭЖХ и содержание агрегатных примесей приведены в таблице 2.

Исследования форсированной деградации (составы 1-4)
3 повторных образца для каждого из составов 1-4, полученных в соответствии с таблицей 1, подвергали воздействию высокой температуры, воздействию света и испытанию на повреждения при замораживании-оттаивании, условия испытаний были следующими:
Испытание при высокой температуре: образцы помещали в термостат при 40°C и испытывали через 2 и 4 недели.
Испытание воздействием света: образцы помещали в условия 25°C, 600 Вт/м2 (соответствует 110000 люкс) на 4 часа и затем испытывали.
Испытание на замораживание и оттаивание, образцы подвергали криоконсервации при -20°C в течение 5 часов, оставляли оттаивать при 4°C в течение 10 часов, замораживали и повторно оттаивали 8 раз.
Указанные выше образцы для исследований форсированной деградации подвергали испытаниям на внешний вид/присутствие видимых инородных веществ и на чистоту методом эксклюзионной ВЭЖХ (инструмент для анализа: Agilent 1200 жидкостный хроматограф, хроматографическая колонка: TSK-GEL G3000 SWXL, 7,8×300 мм, компания TOSOH, Япония; подвижная фаза: 0,2 М хлорид натрия, 0,02 М буферный раствор фосфата натрия, pH 7,4; скорость потока: 0,5 мл/мин; температура колонки: 25°C; время хроматографирования: 30 мин; длина волны: 282 нм).
Результаты испытаний в исследовании форсированной деградации
Испытание при высокой температуре
3 группы образцов для каждого из составов 1-4, полученных в соответствии с таблицей 1, помещали в термостат при температуре 40°C и подвергали испытаниям на внешний вид/присутствие видимых инородных веществ и на чистоту методом эксклюзионной ВЭЖХ через 2 и 4 недели, результаты представлены в таблице 3.
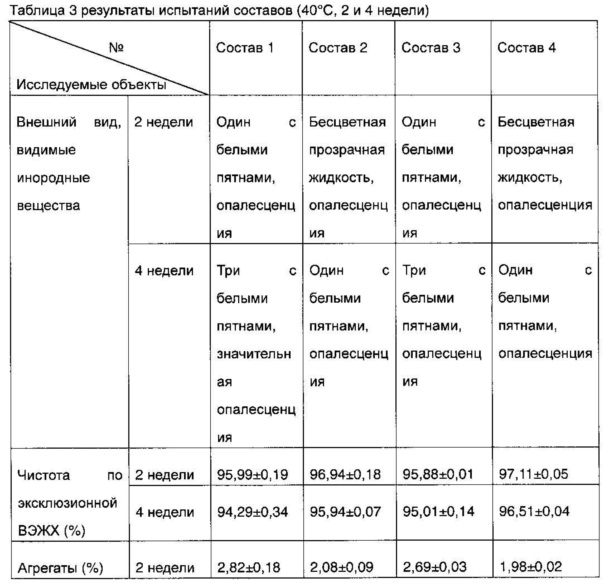

Внешний вид и присутствие видимых посторонних веществ каждого образца состава после испытания при высокой температуре наблюдали невооруженным глазом. Через 2 недели после испытания при высокой температуре немного видимых посторонних веществ появились в составе 1 и составе 3, но не в составе 2 и составе 4; через 4 недели после испытания при высокой температуре, большое количество белых пятен появились в составе 1 и составе 3, и только несколько белых пятен появились в одном образце и в составе 2 и в составе 4, соответственно. Соответствующие данные эксклюзионной ВЭЖХ также показали, что содержание агрегатов после повреждения состава 3 и состава 4, содержащих сахарозу в качестве стабилизатора, ниже, чем в соответствующем составе 1 и составе 2, которые содержали маннит в качестве стабилизатора (таблица 3). Приведенные выше данные эксперимента показали, что стабильность адалимумаба в условиях высокой температуры может быть значительно увеличена путем замены хлорида натрия на стабилизаторы структуры, и стабильность состава, который содержал сахарозу в качестве структурного стабилизатора (состав 4), была значительно выше, чем состава, который содержал маннит в качестве структурного стабилизатора (состав 2).
Испытание воздействия света
3 группы образцов для каждого из составов 1-4, полученных в соответствии с таблицей 1, освещали при 25,°C, 600 Вт/м2 в течение 4 часов и затем подвергали испытаниям на внешний вид/присутствие видимых инородных веществ и на чистоту методом эксклюзионной ВЭЖХ. Результаты представлены в таблице 4.
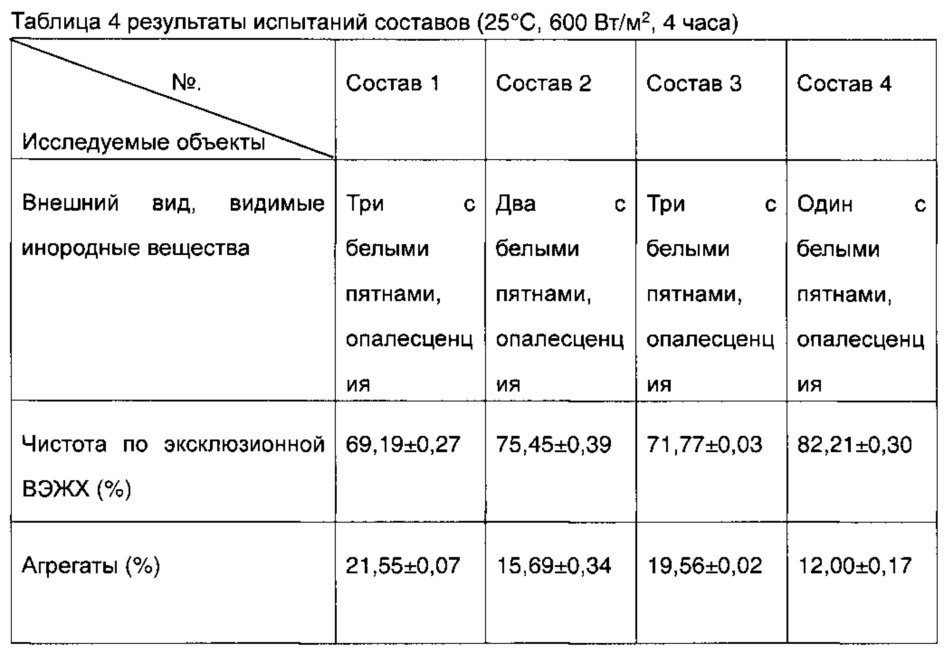
Во всех составах наблюдались белые пятна в различном количестве, но подозрительные белые пятна появились только в одном из трех образцов состава 4, который значительно превосходил другие составы. Подозрительные белые пятна появились в двух образцах состава 2, состав 1 и состав 3 были худшими, белые пятна появились во всех трех образцах. Показатели чистоты согласно эксклюзионной ВЭЖХ также были идентичными, доступный на рынке состав Хумира® (состав 1) был худшим, чистота составляла только примерно 69,19%, чистота препарата 3 повысилась до примерно 71,77% после того, как маннит в составе был заменен на эквивалентную осмолярную сахарозу; чистота согласно эксклюзионной ВЭЖХ состава 2, который не содержал хлорида натрия, составляла 75,45%, а стабильность состава 4, которая не содержала хлорид натрия, дополнительно увеличилась после того, как маннит в составе был заменен на эквивалентную осмолярную сахарозу (чистота согласно эксклюзионной ВЭЖХ достигла 82,21%). По соответствующему содержанию агрегатов состав 1> состав 3> состав 2> состав 4. Приведенные выше экспериментальные данные показали, что стабильность состава адалимумаба может быть увеличена путем замены маннита сахарозой независимо от того, содержит ли состав адалимумаба хлорид натрия, или нет.
Испытание на замораживание и оттаивание
3 группы образцов для каждого из составов 1-4, полученных в соответствии с таблицей 1, замораживали при -20°C в течение 5 часов и затем давали оттаять при 4°C в течение 10 часов и 8 раз повторно повреждали заморозкой и оттаиванием, затем подвергали испытаниям на внешний вид/присутствие видимых инородных веществ и на чистоту методом эксклюзионной ВЭЖХ, результаты представлены в таблице 5 и на фиг. 1.
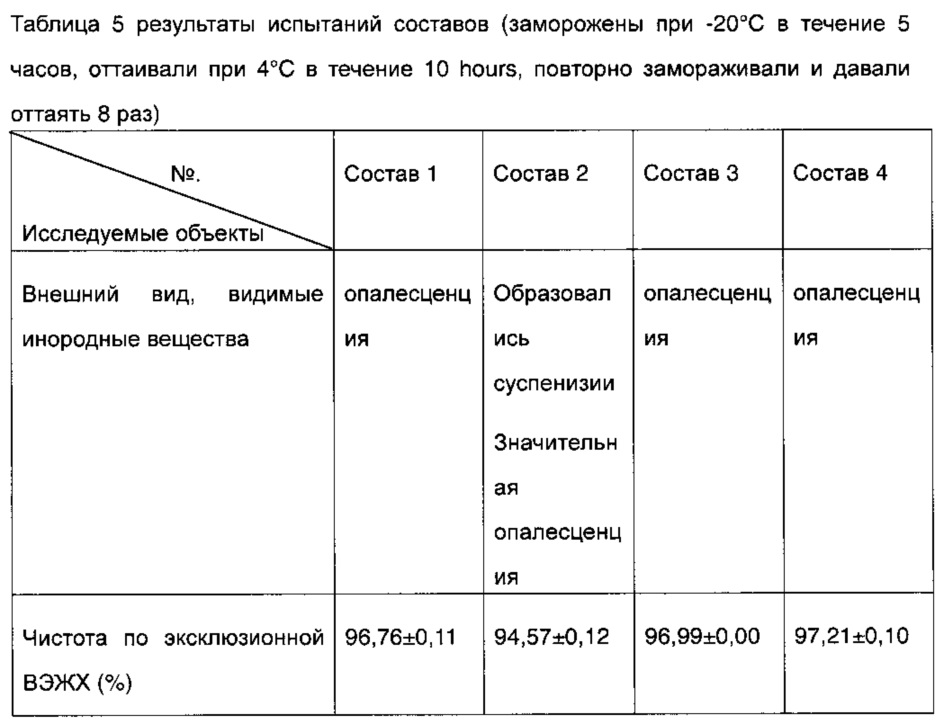
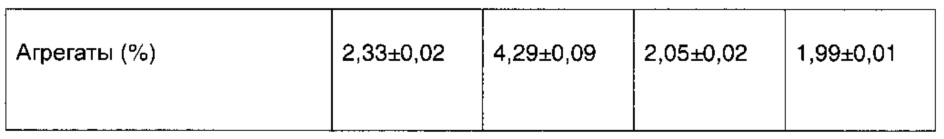
Результаты показали, что после того, как образцы 8 раз повторно повреждали путем замораживания и оттаивания, внешний вид/присутствие видимых инородных веществ и чистота согласно эксклюзионной ВЭЖХ состава 4 превосходили составы 1 и 3, в то время как состав 2 значительно изменился с появлением суспензии и возникновением явления относительно серьезной опалесценции. Чистота согласно эксклюзионной ВЭЖХ уменьшилась, и увеличение количества агрегатов было очень значительным. Это указывает на то, что после применения маннита для замены хлорида натрия в составе 2, адалимумаб не может быть защищен от замораживания и оттаивания, и деградация ускорилась. Состав 4, содержащий изоосмолярную сахарозу в качестве структурного стабилизатора, показал значительно более высокую стабильность по сравнению с составом 2, содержащим маннит в качестве стабилизатора.
Пример 2. Исследование стабильности (2)
В настоящем примере было разработано несколько составов (5-11), сравнивали влияние маннита, сахарозы и трегалозы на стабильность при замораживании-оттаивании составов с различной концентрацией адалимумаба, в сочетании с результатами испытаний состава 2 и состава 4 в примере 1, где все составы не содержат хлорид натрия, а другие компоненты в составах представляют собой: 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты, 0,86 мг/мл дигидрофосфата натрия, 1,53 мг/мл гидрофосфата динатрия, 1 мг/мл полисорбата 80, pH раствора составлял 5,2. Эти составы криоконсервировали при -20°C в течение 5 часов, и подвергали оттаиванию при температуре 4°C в течение 10 часов, и повторно замораживали и подвергали оттаиванию 8 раз, а затем подвергали испытаниям на чистоту согласно эксклюзионной ВЭЖХ и испытанию на содержание агрегатов. Результаты представлены в таблице 6.
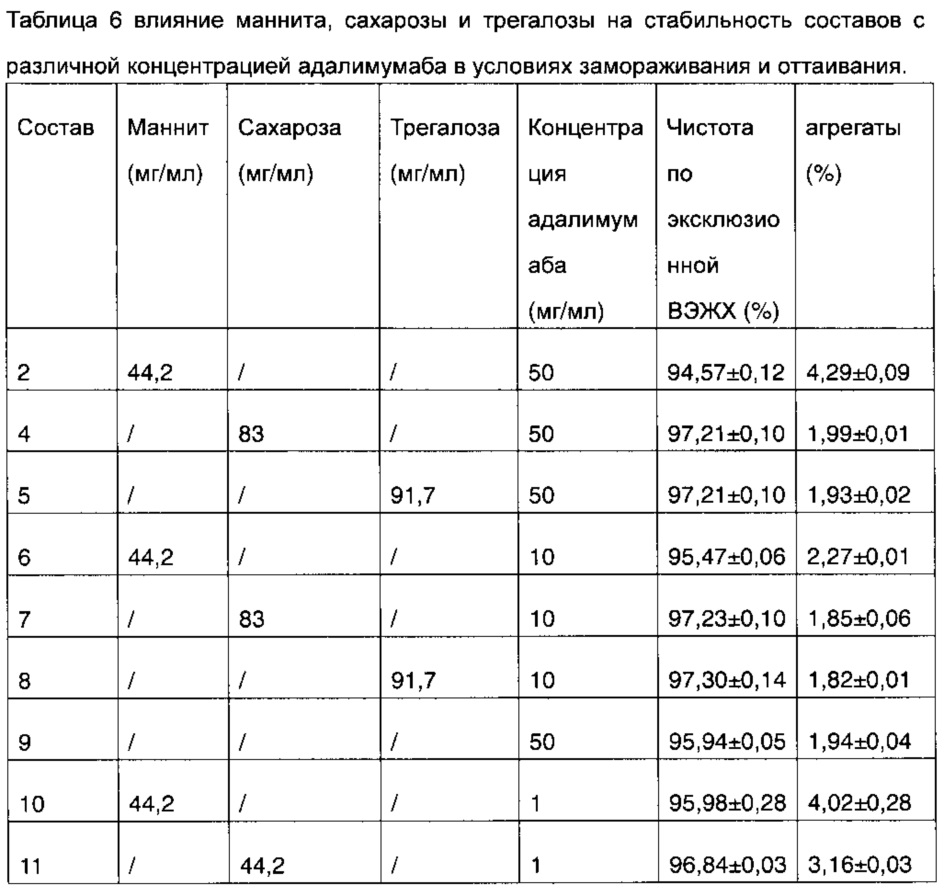
Из результатов таблицы 6 видно, что или при высокой (50 мг/мл), или при низкой (10 мг/мл) концентрации адалимумаба в составе, когда в качестве структурных стабилизаторов применяют сахарозу и трегалозу в эквивалентной мольной концентрации, стабильность состава в испытании на замораживание-оттаивание была значительно выше состава, содержащего маннит. В условиях эксперимента, когда концентрация адалимумаба составляла 1 мг/мл, стабильность при испытаниях на замораживание-оттаивание состава, содержащего сахарозу в той же массовой концентрации, что и маннит, была также значительно выше, чем у состава, содержащего маннит (состав 10 и состав 11). При этом после повреждения при замораживании-оттаивании чистота согласно эксклюзионной ВЭЖХ состава адалимумаба 2 высокой концентрации (50 мг/мл), который содержал маннит в качестве структурного стабилизатора, была даже ниже, чем чистота состава 9, который не содержал какого-либо структурного стабилизатора.
Пример 3. Получение составов адалимумаба с низкой концентрацией (1 мг/мл) и высокой концентрацией (100 мг/мл), содержащих сахарозу или трегалозу в качестве структурного стабилизатора
В настоящем примере были разработаны и получены составы 12-15 содержащие низкую концентрацию (1 мг/мл) или высокую концентрацию (100 мг/мл1) адалимумаба (таблица 7), соответственно, и указанные составы применяли, чтобы оценить, можно ли применять сахарозу и трегалозу в качестве структурного стабилизатора для получения составов адалимумаба с низкой концентрацией или высокой концентрацией. Все указанные составы не содержат хлорид натрия, и другие компоненты представляют собой: 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты, 0,86 мг/мл дигидрофосфата натрия, 1,53 мг/мл гидрофосфата динатрия, 1 мг/мл полисорбата 80, pH раствора составлял 5,2.

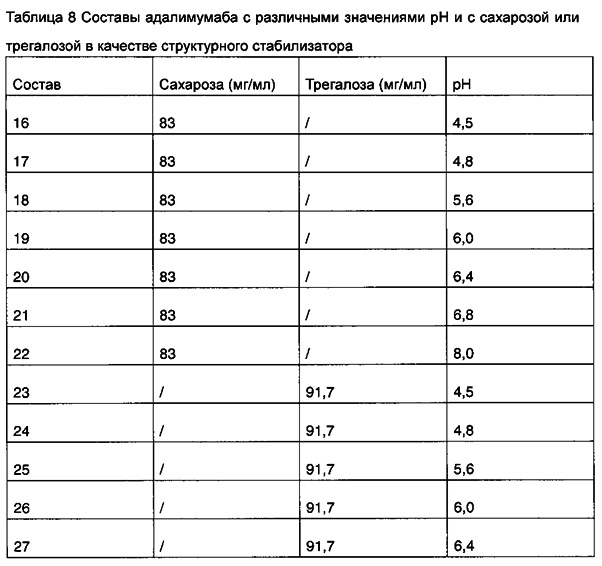
Пример 4. Составы адалимумаба с различными значениями pH и с сахарозой или трегалозой в качестве структурного стабилизатора
В настоящем примере были разработаны и получены составы 16-29, содержащие составы адалимумаба с различными значениями pH (pH 4,5-8,0, таблица 8). Указанные составы не содержат хлорид натрия, другие компоненты представляют собой: 50 мг/мл адалимумаба, 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты, 0,86 мг/мл дигидрофосфата натрия, 1,53 мг/мл гидрофосфата динатрия, 1 мг/мл полисорбата 80.

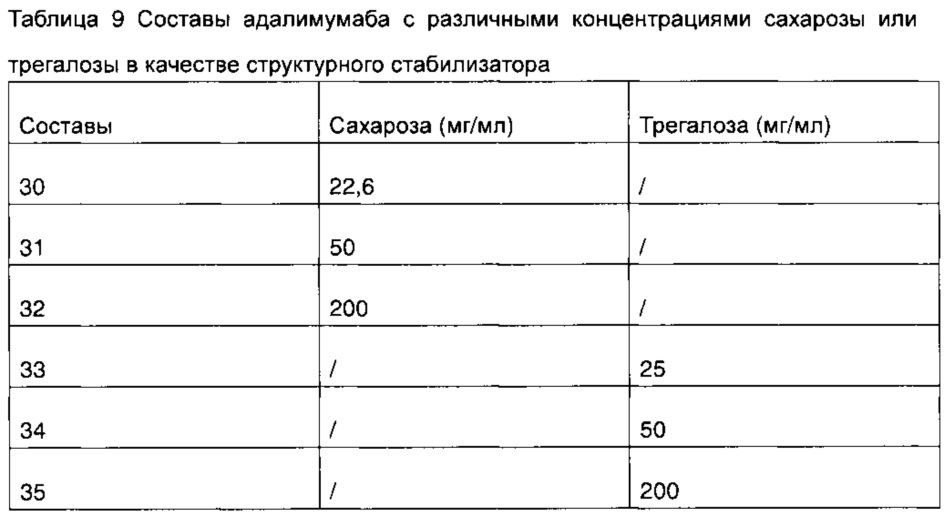
Пример 5. Получение составов адалимумаба с различной концентрацией сахарозы или трегалозы
В настоящем примере были разработаны и получены составы адалимумаба 30-35 с различной концентрацией сахарозы или трегалозы в качестве структурного стабилизатора (таблица 9). При этом указанные составы не содержат хлорид натрия, другие компоненты составов представляют собой: 50 мг/мл адалимумаба, 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты, 0,86 мг/мл дигидрофосфата натрия, 1,53 мг/мл гидрофосфата динатрия, 1 мг/мл полисорбата 80.
Пример 6. Получение составов адалимумаба с различным содержанием полисорбата 80 и с сахарозой или трегалозой в качестве структурного стабилизатора
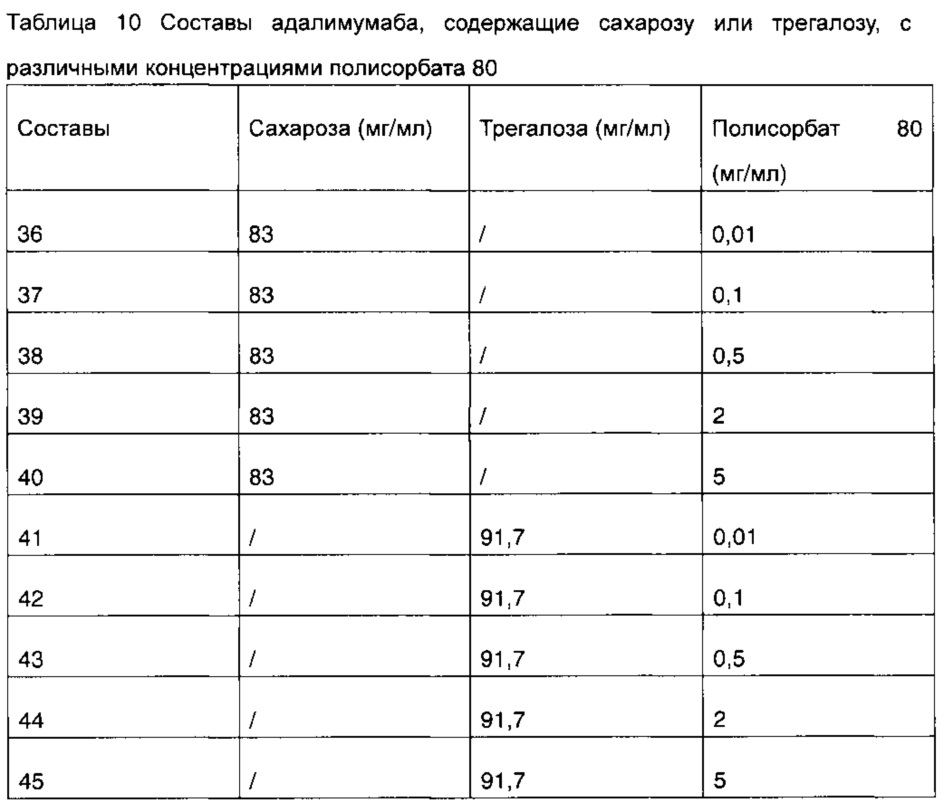
В настоящем примере были разработаны и получены составы 36-45, содержащие составы адалимумаба с различными концентрациями полисорбата 80 (таблица 10). При этом указанные составы не содержат хлорид натрия, другие компоненты составов представляют собой: 50 мг/мл адалимумаба, 0,35 мг/мл цитрата натрия, 1,3 мг/мл лимонной кислоты, 0,86 мг/мл дигидрофосфата натрия, 1,53 мг/мл гидрофосфата динатрия, pH 5.2.