Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ YARROWIA LIPOLYTICA - ПРОДУЦЕНТ ИНКАПСУЛИРОВАННОЙ ФИТАЗЫ OBESUMBACTERIUM PROTEUS
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и кормопроизводства, в частности, к созданию рекомбинантного штамма Yarrowia lipolytica - продуцента инкапсулированной фитазы Obesumbacterium proteus, и может быть использовано для получения кормовых премиксов для использования в животноводстве, обладающих высокой усвояемостью органического фосфора, находящегося в зерновом сырье.
Фитазы - группа фосфогидролаз, расщепляющих сложноэфирные связи фосфорной кислоты в молекуле фитата. По типу активного центра фермента выделяют четыре класса фитаз: кислые гистидиновые фосфатазы (histidine acid phosphatase, HAP), цистеиновые фитазы (cystein phytase, CPhy), пурпурные кислые фосфатазы (purple acid phosphatase, PAP) и β-пропеллерные фитазы (beta-propeller phytase, BPP). Для практического использования в кормовом производстве к фитазам предъявляют следующие требования: устойчивость к кратковременному (5-10 мин.) действию высоких температур (70°С - 80°С), используемых в ходе гранулирования комбикормов; высокая удельная активность в физиологических условиях желудочно-кишечного тракта (температурный оптимум около 42°С, рН 3-5); способностью выдерживать действие среды желудка животных (стабильность при низких значениях pH 1,5-2,5 и устойчивость к протеолитическим ферментам).
В зависимости от оптимальной для ферментативной активности кислотности среды фитазы разделяют на два класса: кислые и щелочные фитазы. Кислые фитазы демонстрируют наибольшую активность при pH 2,5-5,5. В аминокислотных последовательностях кислых гистидиновых фитаз имеется консервативный мотив, содержащий остаток гистидина, который участвует в нуклеофильной атаке на отщепляемую фосфатную группу. В группе кислых фитаз выделяются бактериальные и грибные ферменты. Бактериальные кислые фитазы демонстрируют более высокую удельную активность по сравнению с грибными. По литературным данным из всех изученных к настоящему времени природных фитаз самую высокую удельную активность демонстрируют фитазы Е. coli и Citrobacter freundii (продукты гена АррА). Большинство известных бактериальных кислых фитаз способны последовательно отщеплять от молекулы фитиновой кислоты до пяти фосфатных остатков, оставляя в качестве конечного продукта мио-инозитолмонофосфат. Недостатком природных бактериальных фитаз является их низкая термостабильность. Глубина гидролиза фитатов для щелочных фитаз обычно ниже, чем для кислых фитаз, но зато щелочные фитазы обладают промышленно-ценной особенностью: они более термостабильны, некоторые выдерживают нагрев до 80-95°C.
Примером щелочной бактериальной фитазы, обладающей высокой термостабильностью, является популярный на рынке препарат Nov9x. AB Vista (Германия), продающийся также под торговой маркой Quantum Blue. Готовая форма Quantum Blue представляет собой Nov9x, слитую с тиоредоксином (Trx-Nov9x6). Коммерческий препарат имеет активность 2358 FTU/мл, которая не меняется в диапазоне рН от 4,5 до 6,0. При рН 1,5 сохраняется 20% активности. При кратковременном прогреве при 70°С а течение 1 мин активность полностью сохраняется. При прогреве при 60°С в течении 2 ч сохраняется 75% первоначальной активности. После инкубации при 70°С в течение 30 мин сохраняется 29% активности.
Препарат инкапсулированной Файзим™ (Даниско Анимал Ньютришн, Финляндия) используется в технологии Thermostability Protection Technology (TPT), допуская прогрев при температуре 95°C. Капсулы TPT обеспечивают высвобождение Файзим™ в верхней части пищеварительного тракта животных.
На данный момент в России разрешены для использования три типа фитазы Файзим:
Файзим XP 5000 G - активность 5000 FTU/гр, термостабильность до 76°С;
Файзим XP 5000 TPT- активность 5000 FTU/гр, термостабильность до 96°С;
Файзим XP 10000 TPT - активность 10000 FTU/гр, термостабильность до 96°С.
Они устойчивы в диапазоне рН от 2,5 до 5,5, pH-оптимум - 5,5.
Цена препарата в зависимости от объемов поставки и условий оплаты:
Файзим XP 5000 G - 10 EUR/кг;
Файзим XP 5000 TPT- 12 EUR/кг;
Файзим XP 10000 TPT - 22 EUR/кг
Еще одним представленным на рынке препаратом фитазы является Ронозим ХайФос (DSM Нутришнл продактс), выпускаемый в трех различных формах:
- высокотермостабильная форма Ронозим ХайФос (GT) имеет улучшенные характеристики для применения, такие как отсутствие пыли, хорошая сыпучесть и смешиваемость, максимальная среди фитаз термостабильность - до 95°C. Активность - 10000 FTU/г;
- концентрированная форма Ронозим ХайФос (М) оптимальна для мягких режимов производства комбикорма; она также имеет хорошую сыпучесть и гомогенность распределения, безопасна в использовании для персонала (отсутствие пыли). Активность - 50000 FTU/г;
- жидкая форма Ронозим ХайФос (L) - стабильный продукт, применяется для жидких концентрированных продуктов. Активность - 20000 FTU/г.
Дрожжи Yarrowia lipolytica являются перспективным объектом биотехнологии, что обусловлено сочетанием в этом организме нескольких уникальных биохимических особенностей [Barth G., Gaillardin C., FEMS Microbiology Reviews, 1997, V.19. P.219]. За счет наличия пероксисом Y. lipolytica способна расти на органических субстратах самого различного биогенного и абиогенного происхождения, включая парафины нефти, коммунальные и промышленные стоки. Благодаря склонности к утилизации гидрофобных соединений микроорганизм способен осуществлять исчерпывающую биологическую очистку кормовых ингредиентов от микотоксинов, гидропероксидов и ксенобиотиков. Обладая мощным аэробным метаболизмом, Y. lipolytica устойчива ко многим агрессивным органическим соединениям: спиртам, кислотам, альдегидам и кетонам. В отличие от других видов дрожжей, Y. lipolytica обладает высокой алкало - и галотолерантностью, с высокой эффективностью секретирует белки во внешнюю среду. В течение 10 лет Y. lipolytica использовалась в СССР в качестве промышленного объекта в производстве кормового белка для животноводства, утилизируя в качестве субстратов парафины нефти (паприн, гаприн, белково-витаминный концентрат - БВК), в результате чего были накоплены данные, подтверждающие полную безопасность и высокую кормовую ценность ее биомассы [Выслоух В.А. и соавт. Патент СССР № 1479509, 1989; Ибрагимов Ф.Б. и соавт. Патент РФ № 2041946, 1995]. В 2000 г надзорный орган США - Food and Drug Administration - включил Y. lipolytica в список заведомо безопасных видов (GRAS), без ограничений пригодных для производства кормовых и пищевых ингредиентов. По данным [Guerzoni M.E. et al. International. Journal. of Food Microbiology. 2001. V. 69. P. 79-89; Suzzi G. et al. International. Journal. of Food Microbiology. 2001. V. 69. P. 69-77], живые клетки Y. lipolytica присутствуют в традиционных продуктах из регионов Италии.
В работе Зыльковой М.В. и соавт [Проблемы биологии продуктивных животных, 2012, №2, 2012, стр. 5-12] описаны результаты испытаний биологической безопасности биодобавки на основе жизнеспособной биомассы рекомбинантного штамма Y. lipolytica, продуцирующей соматолиберин. Добавку в течение 20 суток вносили в корм белых мышей-отъемышей и определяли скорость привесов. В результате работы было показано, что добавка не только не обладает токсичностью, но и характеризуется анаболическим эффектом, не присущим биомассе, не содержащей соматолиберина.
В работе Эповой Е.Ю. и соавт [Epova et al, Biotechnology and Bioprocess Engineering, 2016, Volume 21, Issue 3, pp 408-413] описана генетическая система, позволяющая получать рекомбинантные штаммы-продуценты Y. lipolytica, адаптированные к эксплуатации в условиях культивирования на малоценных промышленных ингредиентах, в частности, интегративный вектор pUVLT2, содержащий промотор митохондриального порина VDAC Y. lipolytica. С помощью транскрипционного репортера было показано, что использование этого вектора позволяет добиваться высокоэффективной экспрессии трансгенов в рекомбинантных штаммах Y. lipolytica, культивируемых на средах на основе малоценного сырья. При этом уровень экспрессии трансгена оказывался не ниже, а в некоторых случаях даже превышал уровень экспрессии под контролем наиболее эффективного из описанных в литературе промоторов - синтетического промотора hp4D. Более того, высокая вариабельность профилей экспрессии, независимо полученных при трансформации клонов, позволяет с помощью фенотипической селекции отбирать трансформанты, обладающие наибольшей эффективностью экспрессии на конкретной среде на основе малоценных ингредиентов, имеющей промышленное значение.
Описанный в рамках изобретения рекомбинантный штамм Y. lipolytica, продуцирующий инкапсулированную фитазу O. proteus, сконструирован на основании использования вектора pUVLT2 с промотором VDAC. Он предназначен для применения в рамках технологии, совмещающей решение двух независимых задач биотехнологии: продукция кормового белка путем биоконверсии отходов и получение источника ценного фермента фитазы кормового назначения. Целесообразность использования Y. lipolytica в качестве источника белка аргументирована выше. Целесообразность использования Y. lipolytica для производства микроинкапсулированных ферментов, в частности, фитазы, обусловлена следующими обстоятельствами. Во всех странах мира признано и применяется использование ферментов в производстве комбикормов для свиней, птицы и других животных. Ферменты позволяют резко повысить эффективность использования кормовых ингредиентов, вовлечь в оборот ряд видов малоценного и непригодного сырья, снизить уровень нагрузки животноводческого производства на окружающую среду. Однако, номенклатура ферментов, доступных для применения в кормовом производстве, серьезно ограничивается его технологическими особенностями. Дело в том, что гранулированные комбикорма получают методом распылительной сушки при температуре ≈70°С. Получение премиксов (комбикормов с предварительно внесенным ферментом) заставляет подвергать сушке в тех же условиях и сам ферментный препарат. Таким образом, для кормового производства приходится отбирать только те ферменты, которые обладают термостабильностью при 70°С и выше. Эта особенность, присущая только небольшой доле промышленно выпускаемых ферментов, не играет роли при их функционировании в ЖКТ сельскохозяйственных животных, где устойчиво поддерживается температура ≈37°С. Однако, за счет возникающего технологического требования термостабильности приходится использовать в кормах ферменты со свойствами, далекими от оптимальных при работе в ЖКТ животных. Например, препараты термостабильных фитаз грибного происхождения, наиболее массово продаваемые в мире: Файзим (Даниско Анимал Ньютришн, Финляндия), Quantum Blue (AB Vista, Германия) и Ронозим ХайФос (DSM Нутришнл продактс) имеют рН-оптимум 2,0 и ниже, что практически не позволяет им работать в двенадцатиперстной и тонкой кишке, имеющим рН ≈8. Поскольку при использовании фитазы на 25-40% уменьшается содержание фосфора в помете, пропорционально снижается содержание фосфора в почве и сточных водах, подвергающихся загрязнению животноводческими отходами, природоохранный аспект сыграл решающее значение для выработки рекомендаций на применение фитазы в странах Европейского Союза (например, в Голландии), где внесение этого фермента в корма регламентируется производственными стандартами: не менее 200 фитиновых ед. на кг корма. Однако, выполнение этого требования применительно к Файзим, Quantum Blue, и Ронозим ХайФос носит сугубо формальный характер, так как по своим энзиматическим характеристикам они не могут гидролизовать фитат, высвободившийся из зерна в просвете тонкого кишечника при рН тонкого кишечника.
Использование нейтрофильной фитазы из Obesumbacterium proteus (ОРР) может дать существенно бόльший эффект, но оно возможно только за счет увеличения термостабильности этих ферментов при кратковременном прогреве во время гранулирования кормов. Этот фермент [FEMS Microbiol Lett. 2004; V. 236, № 2. P. 283-90] характеризуется высокой удельной активностью, равной 310 Ед/мг. Фермент ОРР остается активным в диапазоне значений рН от 1,5 до 6,5, оптимум рН - при 4,9. Максимальная активность фермента достигается при 45°С. При культивировании в колбах рекомбинантного штамма Pichia pastoris - продуцента ОРР - фитазная активность в культуральной жидкости составляет 500 Ед/мл [RU 2388823].
Основным результатом, лежащим в основе настоящего изобретения, является доказанная возможность повышения термостабильности ОРР при кратковременном прогреве от 50 до 70°С при инкапсуляции фермента непосредственно в клетках рекомбинантного продуцента: Y. lipolytica. Выход фитазы в расчете на мл культуральной среды при этом будет несколько уступать выходу секретируемого в среду фермента. Однако, комбинирование ферментной и белковой добавки в одном и том же исходном материале, имеющим достаточно низкую себестоимость, делает рациональным внесение ее в корм в количестве 5%, а не ≈0,01%, как в случае очищенных секреторных ферментов. Поскольку производство инкапсулированного фермента является безотходным, и биомасса продуцента и остаток белка из среды не попадают в стоки и отходы, а используются для кормления животных, производство добавки остается рентабельным даже при сравнительно невысоком выходе фермента. Дополнительным преимуществом инкапсулированного в Y. lipolytica кормового фермента является защита от повреждения кислотой и пепсином в желудке животного: солюбилизация содержимого клеток Y. lipolytica и высвобождение содержимого происходит только в двенадцатиперстной кишке.
Краткое описание чертежей
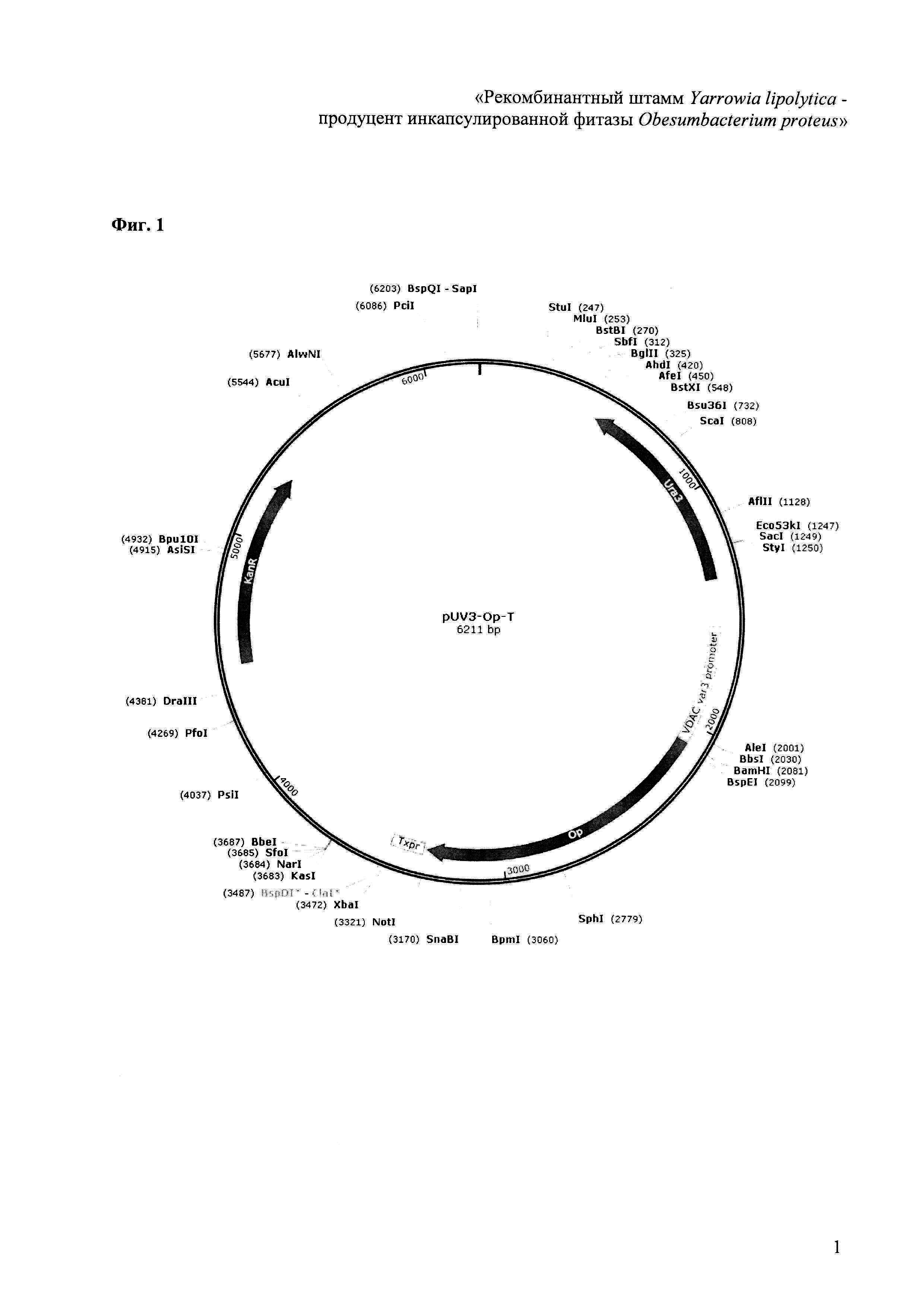
Фиг. 1 - карта конструкции pUV3-Op на основе промотора VDAC Y. lipolytica.
Фиг. 2 - аминокислотная последовательность фитазы, кодируемой конструкцией pUV3-Op.
Фиг. 3 - оценка активности фитазы в гомогенатах биомассы трансформантов Y. lipolytica PO1f, несущих интегрированную конструкцию pUV3-Op. На фотографии видны зоны просветления агаризованной среды, содержащей фитат, образовавшиеся в результате внесения в лунки гомогенатов клонов. Для дальнейшего использования отобран клон №13.
Получение рекомбинантного штамма Y. lipolytica, несущего генетическую конструкцию pUV3-Op
Получение плазмидной конструкции pUV3-Op
Клонирование гена фитазы OPP проводили с помощью ПЦР на матрице геномной ДНК O. proteus ВКПМ-5477 с праймерами OPP-for1 (BamHI) (GGGGATCCgaaaccgaaccttccggatat) и OPP-rev1 (NotI) (GGGCGGCCgcttattggcactccaccagt) (Фиг. 1). По данным электрофореза в агарозном геле, размер продукта ПЦР соответствовал ожидаемому - 1240 п.н.
Особенностью подобранных праймеров являлось то, что при их использовании происходит отсечение фрагмента кодирующей области длиной 33 кодона, соответствующих секреторному лидеру, благодаря чему продукт утрачивает способность секретироваться во внешнюю среду и накапливается в цитоплазме. Праймер OPP-for1 обеспечивал введение сайта рестриктазы BamHI, наличие которого приводило также к введению на N-конец модифицированного гена ОРР искусственного кодона GGA (Gly), который, следуя непосредственно за инициаторным кодоном ATG (присутствует в векторе pUV3LT непосредственно выше сайта рестриктазы BamHI) согласно правилу Варшавского увеличивает цитоплазматическую стабильность продукта в дрожжах (Фиг. 2).
Продукт ПЦР очищали с помощью набора DNA Gene Jet (ThermoFisher Scientific), обрабатывали рестриктазами BamHI и NotI и лигировали с ДНК вектора pUV-LT3 [Epova et al, Biotechnology and Bioprocess Engineering, 2016, V. 21, № 3, pp 408-413], обработанного рестриктазами BamHI и NotI (при этом произошло отщепление последовательности репортерного гена LacZ от остальной части вектора).
Лигазную смесь использовали для трансформации штамма E. coli TG1 по стандартному протоколу с применением ионов Ca2+. Трансформированные клетки E. coli высевали на среду LB c канамицином (30 мкг/мл) и X-gal, отбирали колонии, не имеющие синего оттенка (для контрселекции клонов, содержащих ген LacZ в составе исходного вектора pUV-LT3). 10 отобранных клонов выращивали на жидкой среде LB c добавлением канамицина (30 мкг/мл), выделяли плазмидную ДНК, которую картировали с помощью рестриктаз BamHI и NotI. Было отобрано 4 независимых клона, содержащих вставку искомого размера 1240 п.н. (вставка в клонах, содержащих исходный вектор, имела размер ~3000 п.н.). Плазмидную ДНК одного из клонов подвергали секвенированию с праймерами OPP-for1 и OPP-rev1 на капиллярном генетическом анализаторе AbiPrizm 3500 с помощью набора BigDye® Terminator v3.1, убедившись в полном соответствии полученной последовательности ранее известной [FEMS Microbiol Lett. 2004; V. 236 № 2 P. 283-90]. Полученная конструкция получила название pUV3-Oр (Фиг. 1).
Трансформация штамма Y. lipolytica PO1f плазмидной конструкцией pUV3-Op
Введение ДНК конструкции pUV3-Oр в клетки Y. lipolytica PO1f (MatA, leu2-270, ura3-302, xpr2-322, axp-2) (депонирован в коллекции CIRM-Levures (Франция) под номером CLIB-724 и в ATCC под номером MYA-2613) проводилось методом трансформации с использованием солей Li+, как описано ранее [Davidow et al, Curr. Genet. 1985, № 10. P 39.]. Отбор трансформантов проводили на минимальной синтетической среде, свободной от урацила c добавлением лейцина при 28°С.
Оценка продуктивности трансформантов штамма Y. lipolytica PO1f(pUV3-Op)
Выросшие колонии (20 клонов) упорядочивали пересевом на чашку с минимальной средой YNB, обогащенной 2% глюкозой и лейцином. После этого каждый клон высевали на стерильную жидкую среду, представляющую собой 5%-ю водную суспензию мясокостной муки с естественным рН (5,3), объемом 3 мл, разлитую в плоскодонные пенициллиновые флаконы, закрытые ватно-марлевыми пробками. Клоны культивировали в течение 34 часов при 28°С на микробиологическом шейкере-культиваторе при максимально интенсивной аэрации.
Выросшую биомассу вместе с нерастворимой фракцией среды собирали кратковременным центрифугированием на настольной центрифуге в полипропиленовые пробирки объемом 1,5 мл. Растворимую фракцию культуральной жидкости удаляли и суспендировали осадок в 500 мкл физиологического раствора, повторно осаждали на настольной центрифуге и суспендировали в 1 мл стерильной деионизованной воды. Суспензию охлаждали до 4°С, переносили в охлажденную до 0°С фарфоровую ступку объемом 100 мл, добавляли 50-70 мг стерильного кварцевого песка и гомогенизировали фарфоровым пестиком в течение 3 мин. Фитазную активность трансформантов оценивали в чашечном тесте по диаметру зон просветления суспензии фитата кальция. Для этого 50 мкл суспензии биомассы клонов Y. lipolytica вносили в лунки агаризованной среды, полученной путем суспендирования фитата кальция (2 мас.%) в 250 мМ Na-ацетатном буфере рН 5,5, содержащего 1% агарозу (Фиг. 3).
Хорошо видно, что отрицательные контрольные клоны PO1f (pUV3) (обозначены К1 и К2 на Фиг. 3) не имеют зон просветления. Для дальнейшей работы использовали клон №13.
Исследование термостабильности ОРР, инкапсулированной в биомассе рекомбинантного штамма Y. lipolytica, несущего генетическую конструкцию pUV3-Op
Получение препарата инкапсулированной фитазы ОРР
Штаммы Po1f (pUV3-Oр) №13 и Y-3852 (стандарт) выращивали при 28°С в течение 1 суток в чашках Петри с агаризованной средой YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, глюкоза - 2, агар - 2).
Инокулят (жидкую посевную культуру) выращивали в качалочных колбах Эрленмейера объемом 750 мл, содержащих по 30 мл жидкой питательной среды YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, глюкоза - 2). Засев колб осуществляли посевной культурой, выращенной на твердой агаризованной среде YPD. Колбы инкубировали на микробиологическом шейкере-инкубаторе (250 об/мин) при 28°С в течение 24 ч.
В колбу с 25 мл ферментационной среды (мас. %: мясокостная мука - 5) засевали 5 мл инокулята. Культивирование осуществляли на качалке со скоростью 250 об/мин при температуре 28°С. Ферментацию проводили в течение 34 часов.
Моделирование условий кратковременного прогрева фитазы ОРР (имитация распылительной сушки)
Полученную культуральную жидкость штаммов Po1f (pUV3-Oр) №13 и Y-3852 (стандарт) распределяли по 1 мл в стерильные полипропиленовые пробирки объемом 1,5 мл, не допуская осаждения суспензии под действием силы тяжести и замораживали в жидком азоте, после чего подвергали их лиофильному высушиванию на установке SpeedVac Savant SPD1010 в течение 6 часов до постоянной массы (при дальнейшем высушивании масса сухого остатка уменьшалась менее, чем на 2% за 1 час).
По пять пробирок, содержащих биомассу штаммов Po1f (pUV3-Oр) №13 и Y-3852 (стандарт), устанавливали в твердотельный термостат «Термит» при температуре 70°С на 30 сек, после чего пробирки охлаждали на льду. Затем по пять пробирок прогревали в аналогичных условиях при 60°С и 50°С.
Во все прогретые пробирки, а также в пять непрогретых пробирок с биомассой каждого штамма, вносили по 1 мл деионизованной воды, охлажденной на льду, суспендировали и гомогенизировали в фарфоровой ступке, как описано выше. Далее перед определением ферментативной активности проводили очистку фермента от примесей фосфата, имевшихся в гомогенатах.
Для этого гомогенаты центрифугировали на настольной центрифуге в течение 10 мин при 14,5 тыс. g, отбирали по 500 мкл супернатанта, переносили в чистые полипропиленовые пробирки объемом 1,5 мл и добавляли по 1 мл насыщенного сульфата аммония, приготовленного на 250 мМ Na-ацетате, pH 5,5. Пробирки тщательно перемешивали на ручном вортексе и инкубировали при +4°С в течение 6 часов. Осадки отделяли центрифугированием на настольной центрифуге в течение 5 мин при 14,5 тыс. g, супернатанты удаляли с помощью водоструйного насоса, а осадки растворяли в 100 мкл 250 мМ Na-ацетате, pH 5,5 в течение 15 мин при +4°С.
Фитазную активность определяли по накоплению в реакционной смеси свободного фосфат-иона, детектируемого методом Фиске-Субарроу [J. Biol. Chem., 1925, V. 66, pp. 375-400]. За единицу фитазной активности принимали количество фермента, способного высвободить 1 моль неорганического фосфата из фитата натрия в минуту при 37°С и рН 5,5. Для определения отбирали аликвоты фермента 5 мкл, проводили измерение оптической плотности при λ=415 нм, после чего нормировали остаточную активность на мл исходной культуральной жидкости штамма.
Результаты измерений (ед/мл культуральной жидкости) представлены в таблице.
Таблица 1. Активность фитазы ОРР при различных температурных режимах
|
Таким образом, приведенные выше результаты показывают, что:
1. Сконструированный в процессе осуществления изобретения штамм Po1f (pUV3-Oр) обладает способностью к синтезу фитазы при культивировании на среде, представляющей собой суспензию мясокостной муки кормового назначения.
2. Уровень продукции фитазы ОРР штаммом Po1f (pUV3-Oр) составляет около 340 ед FTU/мл культуральной жидкости или 69,2±2,1 от уровня продукции коллекционного штамма ВКПМ Y-3852.
3. После кратковременного прогрева при 70°С остаточная активность фитазы ОРР, инкапсулированной в биомассе, составляет 72,6±7,0% от исходного уровня, тогда как остаточная активность секретированной фитазы ОРР составляет только 0,2±4,0% от исходного уровня. Этот показатель позволяет сделать вывод о термостабилизации микроинкапсулированной фитазы по сравнению со свободной. Уровень термостабильности микроинкапсулированной фитазы, накопленной в биомассе рекомбинантного штамма Po1f (pUV3-Oр), обеспечивает ее пригодность для изготовления кормовых премиксов с применением распылительной сушки.
4. После кратковременного прогрева при 60°С остаточная активность фитазы ОРР, инкапсулированной в биомассе, составляет 83,9±7,0% от исходного уровня. Этот показатель позволяет сделать вывод о предпочтительности использования сниженной температуры сушки премиксов при использовании микроинкапсулированной фитазы, накопленной в биомассе рекомбинантного штамма Po1f (pUV3-Oр), для изготовления кормовых премиксов.
Рекомбинантный штамм , обладающий способностью к синтезу фитазы , инкапсулированной в цитоплазме и обладающей за счет этого повышенной термостабильностью при кратковременном прогреве при 70°С, получаемый путем введения плазмиды pUV3-Op, характеризующейся нуклеотидной последовательностью SEQ ID NO 1, в коллекционный штамм PO1f.