Результат интеллектуальной деятельности: Мутантная рекомбинантная гепариназа I с повышенной удельной активностью из Pedobacter heparinus, фрагмент ДНК, кодирующий указанную гепариназу
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и касается фермента - гепариназы I с повышенной удельной активностью, обеспечивающей повышение биодоступности антикоагулянта гепарина путем уменьшения длины его цепей.
Гепариназы, ферменты, относящиеся к классу лиаз, выделяют из различных источников, однако хорошо изучены и охарактеризованы только гепариназы I, II и III из Pedobacter heparinus. Эти ферменты используют для анализа структуры гепарина и его контаминации, снижения концентрации гепарина в крови, получения низкомолекулярного гепарина (НМГ).
Гепарин (сульфатированный гликозаминогликан) - общее название гетерогенной смеси сульфатированных полисахаридных цепей, в состав которых входят повторяющиеся единицы D-глюкозамина, L-идуроновой или глюкуроновой кислот.
Гепарин, выделяемый из легких и печени рогатого скота, применяют в медицинской практике как антикоагулянт, но только около 30% молекул нефракционированного гепарина (НФГ) обладает антикоагулянтной активностью. Уменьшение длины цепей гепарина снижает его способность связываться с белками крови, стенками сосудов, эндотелиальными клетками, макрофагами и тромбоцитами, что повышает время существования низкомолекулярного гепарина (НМГ) в плазме крови больных и обеспечивает более прогнозируемый лечебный эффект назначенной дозировки. Биодоступность низкомолекулярных гепаринов достигает почти 100%; при этом их период полувыведения в 2-4 раза превышает таковой у нефракционированного гепарина.
Применяемые в настоящее время НМГ получают из гепарина с помощью различных химических и энзиматических способов. Наиболее перспективным является способ получения НМГ путем обработки гепарина гепариназами.
Известна гепариназа I, выделенная из природного продуцента P. heparinus, которая обладает удельной активностью равной 130 ед./мг белка [The journal of biological chemistry 1992; 267 №34: 24347-24355], а также рекомбинантная гепариназа I из P. heparinus, продуцируемая клеткакми E.coli, с удельной активностью 100 ед./мг белка [Proc. Natl. Acad. Sci. USA. 1993; 90: 3660-3664].
Однако использование указанных гепариназ I как в лабораторных, так и в промышленных масштабах производства НМГ, малоэффективно из-за низкой удельной активности этих ферментов [Godavarti S. Protein engineering of heparinase I - elucidation of structure-activity relationships // Massachusetts. - 1996. – 229 pp.].
Таким образом, важной задачей является получение гепарназ I с повышенной удельной активностью.
Известно [Microbiol Immunol, 1999. 243: p. 55-86; Biophys J, 2005. 89(6): p. 4159-70], что активность белка связана с такими структурными свойствами белка, как стабильность активного центра, способность белка образовывать димеры, тетрамеры и т.д., число водородных связей, число солевых мостиков, порядок контактов, доля остатков в белке, вовлеченных в различные элементы вторичной структуры, т.е. структурными свойствами, которые играют важную роль в сворачивании белка и приобретении им своей конечной нативной структуры.
Вклад аминокислоты в формирование третичной структуры фермента определяется не только ее природой, но и ее положением в аминокислотной последовательности и, следовательно, осуществляя точечные замены аминокислот, находящихся в значимых положениях аминокислотной последовательности, можно добиться изменения структурных свойств белка и его активности [J. Mol. Biol, 1998, v. 278, р. 279-289].
Известна мутантная гепариназа I, полученная путем замены аминокислотного остатка серии в положении 377 на аминокислотный остаток аланин [US 7056504 В1]. Данная замена привела к изменению удельной активности фермента на 10%. Однако такая величина изменения удельной активности фермента недостаточна для его практического применения.
Задачей заявляемого изобретения является получение мутантной гепариназы I с повышенной удельной активностью.
Поставленная задача решена тем, что получена мутантная рекомбинантная гепариназа I из P. heparinus с повышенной удельной активностью, характеризующаяся аминокислотной последовательностью соответствующей аминокислотной последовательности гепариназы I из бактерий Pedobacter heparinus, в которой аминокислотный остаток глутаминовой кислоты в положении 117 заменен на остаток глутамина, аминокислотный остаток глутамина в положении 118 заменен на остаток пролина, аминокислотный остаток глутаминовой кислота в положении 362 заменен на остаток пролина, аминокислотный остаток тирозина в положении 363 заменен на остаток пролина.
Для получения мутантной гепариназы I к гену НерА, кодирующему гепариназу I и имеющему нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO:1 [СР 001681.1, GenBank], применяют метод сайт-направленного мутагенеза [Archives of Biochemistry and Biophysics, 2000, v. 382, №1, p. 105-112] и получают ДНК, кодирующую заявляемую гепариназу I с выбранными аминокислотными заменами.
Полученную ДНК клонируют в вектор, подходящий для ее трансформации в клетки Е. coli. Так как в силу «вырожденности» генетического кода одна и та же аминокислотная последовательность может кодироваться большим числом нуклеотидных последовательностей, то для клонирования может быть использована не только сама вышеуказанная нуклеотидная последовательность, но и все ее формы, определяемые вырожденностью генетического кода.
Полученной рекомбинантной плазмидой осуществляют трансформацию штамма-реципиента. Трансформанты тестируют на способность проявлять гепариназную активность по методу Бернштейна [Methods Enzymol., 1988, V. 137, P. 515-529] и, отбирая клон, обладающий гепариназной активностью, получают штамм, продуцирующий мутантную гепариназу I.
Пример
1. Конструирование векторов для экспрессии природного и мутантного генов, кодирующих гепариназу I.
Мутантный ген HepA-QPPP получают, применяя метод сайт-направленного мутагенеза к гену НерА, кодирующему гепариназу I. Для этого в нативный ген НерА последовательно вводятся мутации, по две аминокислотные замены за один акт мутагенеза.
1.1. Получение промежуточного мутантного гена НерА-QP, кодирующего гепариназу I, содержащую замены в позициях 117 и 118.
На данном этапе мутагенеза ПЦР-методом синтезируют два фрагмента ДНК, включающих нуклеотидную замену в положении 349-354 нуклеотидного сиквенса, указанного в перечне последовательностей под номером SEQ ID NO:1 (нативная гепариназа I), таким образом, что пара кодонов gaacag (кодирующие глутаминовую кислоту и глутамин) заменяют на пару кодонов cagccg (кодирующий глутамин и пролин).
Для ПЦР-синтеза используют следующие праймеры:
1. Для синтеза первого фрагмента
прямой - HepN1 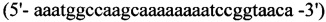
обратный - HepEQ -R 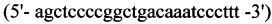
2. Для синтеза второго фрагмента
прямой - HepEQ-F 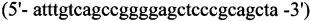
обратный - HepN2 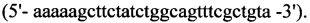
В качестве матрицы для проведения полимеразной цепной реакции используют хромосому Pedobacter heparinus.
Для проведения полимеразной цепной реакции используют 100 мкл реакционной смеси, содержащей 0,5 нг ДНК-матрицы, по 1 мкМ соответствующего прямого и обратного праймеров, 2,5 ед. Pfu-полимеразы, 10 мкл 10х Pfu-буфера, 0,8 мМ dNTP. Реакцию осуществляют по следующей схеме: 94°С - денатурирование (1 мин), 54°С - отжиг (1 мин), 72°С - полимеризация (50 с). Всего проводят 30 циклов амплификации. Амплифицированные фрагменты ДНК очищают в агарозном геле и затем при помощи «DNA gel extraction KIT» (Fermentas).
Наработанные фрагменты имеют следующие размеры:
- первый фрагмент 378 пар оснований;
- второй фрагмент 772 пар оснований.
Мутантный ген HepA-QP синтезируют методом полимеразной цепной реакции из двух вышеописанных фрагментов. Для проведения ПЦР используют 100 мкл реакционной смеси, содержащей 0,2 нг каждого ДНК-фрагмента, по 2 мкМ соответствующего прямого HepN1 и обратного HepN2 праймеров, 2,5 ед. Pfu-полимеразы, 10 мкл 10х Pfu-буфера, 0,8 мМ dNTP. Реакцию осуществляют по следующей схеме: 94°С - денатурирование (1 мин), 54°С - отжиг (1 мин), 72°С - полимеризация (1 мин). Всего проведено 30 циклов амплификации. Из агарозного геля выделен амплифицированный фрагмент ДНК, размером 1098 пар оснований, который очищен при помощи «DNA gel extraction KIT».
1.2. Конструирование плазмиды pET22b- HepA-QP.
Полученный фрагмент ДНК HepA-QP гидролизуют эндонуклеазами рестрикции MlsI и HindIII (Fermentas), очищают в агарозном геле и лигируют с вектором pET22b(+), который в качестве селективного маркера для отбора трансформантов в клетках E. coli содержит селективный маркер bla, в качестве сайта начала репликации содержит pUC f1 ori, в состав экспрессионной кассеты входит промотор Т7-полимеразы, lac - оператор, Т7-терминатор транскрипции, С-концевую последовательность His-Tag для очистки белков, ген lacI, кодирующий репрессор лактозного оперона; а в качестве сигнального пептида вектор содержит сигнальный пептид пектат лиазы В Erwinia carotovora.
Предварительно вектор pET22b(+) расщепляют ферментами рестрикции по сайтам MlsI и HindIII. Лигазной смесью трансформируют компетентные клетки E. coli Tuner DE3 [Т. Маниатис, Э. Фрич, Дж. Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84], приготовленные накануне путем обработки хлористым кальцием. После стандартной процедуры трансформации (0°С - 40 мин, 42°С - 2 мин, 0°С - 5 мин) клетки разводят в 10 раз средой LB [Т. Маниатис, Э. Фрич, Дж. Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84], подращивают в течение одного часа и высевают на агар LB, содержащий ампициллин в концентрации 50 мкг/мл. Посевы инкубируют при 37°С.
На следующие сутки выросшие устойчивые к ампициллину колонии тестируют с помощью вышеприведенных праймеров и отбирают позитивные клоны, из которых выделяют плазмидную ДНК по стандартной методике (Т. Маниатис, Э. Фрич, Дж. Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 89). Выделенные плазмидные ДНК гидролизуют эндонуклеазами рестрикции MlsI и HindIII, размер полученных фрагментов определяют с помощью гель-электрофореза. Затем отбирают клон, плазмидная ДНК которого содержит последовательность, соответствующую размеру последовательности кодирующей ген HepA-QP.
Из отобранного клона выделяют рекомбинантную плазмиду pET22b- HepA-QP. Ген HepA-QP секвенируют.
1.3. Получение мутантного гена НерА-QPPP, кодирующего гепариназу I, содержащую замены в позициях 117, 118, 362 и 363.
ПЦР-методом синтезируют ген, кодирующий мутантную гепариназу I, - QPPP, включающий нуклеотидные замены в положениях 349-354, 1084-1089 нуклеотидного сиквенса SEQ ID NO:1, таким образом, что пара кодонов gaaact (кодирующие глутаминовую кислоту и тирозин) заменяют на пару кодонов ccgccg (кодирующие пролин).
Для ПЦР-синтеза используют следующие праймеры:
прямой - HepN1 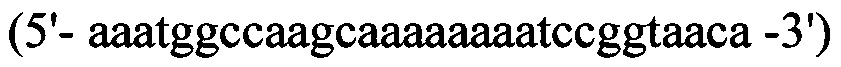
обратный - Нер2ЕТ -R 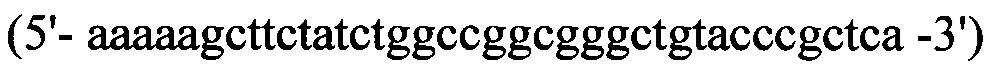
В качестве матрицы для проведения полимеразной цепной реакции используют плазмиду pET22b- HepA-QP, полученную на предыдущем этапе.
Для проведения полимеразной цепной реакции используют 100 мкл реакционной смеси, содержащей 0,5 нг ДНК-матрицы, по 1 мкМ соответствующего прямого и обратного праймеров, 2,5 ед. Pfu-полимеразы, 10 мкл 10х Pfu-буфера, 0,8 мМ dNTP. Реакцию осуществляют по следующей схеме: 94°С - денатурирование (1 мин), 54°С - отжиг (1 мин), 72°С - полимеризация (50 с). Всего проводят 30 циклов амплификации. Амплифицированные фрагменты ДНК очищают в агарозном геле при помощи «DNA gel extraction KIT» (Fermentas). Из агарозного геля выделен амплифицированный фрагмент ДНК, размером 1118 пар оснований, который очищен при помощи «DNA extraction KIT».
1.4. Конструирование плазмиды и отбор колонии трансформантов производят аналогично первому этапу мутагенеза (раздел 1.2).
В результате отбирают клон Е. coli pET22b- HepA-QPPP, плазмидная ДНК которого содержит последовательность, соответствующую размеру последовательности, кодирующей ген HepA-QPPP.
Из отобранного клона выделяют рекомбинантную плазмиду pET22b-HepA-QPPP. Ген HepA-QPPP секвенируют. Нуклеотидная последовательность гена соответствует последовательности, приведенной в перечне последовательностей под номером SEQ ID NO:2, и кодирует аминокислотную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO:3, отличающуюся от исходной заменами в позициях 117, 118, 362 и 363. Культуру отобранного и проверенного клона обозначают как штамм Е. coli pET22b- HepA-QPPP. Он способен продуцировать мутантную гепариназу I P. heparinus, отличающуюся от природного фермента заменами в позициях 117, 118, 362 и 363, и депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как Е. coli ВКПМ В-12284.
1.5. Для корректного сравнения удельной активности заявляемой мутантной рекомбинантной гепариназы I из P. heparinus и используемой в качестве контроля рекомбинантной природной гепариназы I из P. heparinus получен ген НерА (с использованием праймеров HepN1 и HepN2), кодирующий природную гепариназу I из P. heparinus, сконструирована плазмида pET22b-НерА и на ее основе получен штамм Е. coli pET22b- НерА, продуцирующий рекомбинантную природную гепариназу I из P. heparinus.
Дальнейшие действия для обоих рекомбинантных штаммов: штамма Е. coli pET22b- HepA-QPPP, продуцирующего мутантную рекомбинантную гепариназу I из P. heparinus, и штамма Е. coli pET22b- НерА, продуцирующего рекомбинантную природную гепариназу I из P. heparinus, осуществляют в одинаковых условиях.
2. Культивирование продуцентов природной и мутантной гепариназ I.
Культуру выращивают в пробирках в LB среде следующего состава, в мас. %: (пептон - 1,5; дрожжевой экстракт - 0,5; NaCl - 0,5; вода - остальное), содержащей ампициллин (100 мкг/мл) при температуре 37°С при встряхивании (200 об/мин) в течение ночи. Далее 50 мкл ночной культуры переносят в 5 мл среды LB (без ампициллина) и культивируют в течение 1,5 часа при температуре 30°С и встряхивании (200 об/мин), добавляют 100 мкл 0,5 М изопропил β- D -1-тиогалактопиранозида (IPTG) и проводят индукцию в течение 2 часов при температуре 30°С и встряхивании (200 об/мин).
3. Выделение и очистка природной и мутантной гепариназ I.
Клетки осаждают центрифугированием (1 мин при 4°С и 5000 об/мин.), промывают 1 мл дистиллированной воды, повторно осаждают центрифугированием (90 с при 9000 об/мин), супернатант удаляют.
К промытым клеткам добавляют 100 мкл дистиллированной воды и 12 мкл раствора лизоцима (30 мг/мл), ресуспендируют и оставляют при 37°С на 30 минут для разрушения клеток. После центрифугирования (90 с при 9000 об/мин) отделяют надосадочную жидкость, содержащую гепариназу I.
Очистку полученной гепариназы I проводят методом аффинной хроматографии, для чего первоначально получают гепариназу I, меченную 6His-Tag на С-конце белка, которую затем очищают по методу (Sasisekharan, P. et al., 1995).
Чистоту белка подтверждают с использованием 12,5% SDS-PAGE в соответствии с общим методом Laemmli (Laemmli, 1970) и системы Mini Protean II (Bio Rad), проявление белков производят серебром с использованием Silver Stain Plus kit (Fermentas).
4. Измерение гепариназной активности природной и мутантной гепариназ I.
Гепариназную активность определяют в соответствии с модификацией метода Бернштейна [Methods Enzymol, 1988, V. 137, Р. 515- 529].
Для определения активности проводят ферментативную реакцию с использованием гепарина в качестве субстрата. Для чего к 1 мл раствора гепарина в буфере Трис-HCl (рН 7,4) (содержащего 25 г/л гепарина; 40 мМ NaCl; 3,5 мМ CaCl 2 и 17 мМ Трис-HCl) добавляют 10 мкл раствора очищенной гепариназы I. Реакцию проводят при 30°С в течение 1 часа. Степень деградации гепарина контролируют по изменению УФ-поглощения при 232 нм на Genesys 10S UV-VIS Thermo спектрофотометре.
Все измерения проводились в трех независимых повторностях, статистическая обработка результатов осуществлялась с использованием программы MS Excel 2010.
Таким образом, удельная активность заявляемого рекомбинантного мутантного фермента гепариназа I из P. heparinus составляет 144.0±5 ЕД/мг белка, что на 29% превышает удельную активность полученного и очищенного в тех же условиях рекомбинантного не модифицированного фермента гепариназа I из P. heparinus, равную 112±5 ЕД/мг белка.




