Результат интеллектуальной деятельности: Способ получения биорезорбируемого сетчатого имплантата для пластики стенок малого таза и брюшной полости
Вид РИД
Изобретение
Изобретение относится к регенеративной медицине и тканевой инженерии, в частности к резорбируемому сетчатому имплантату, состоящему из синтетического матрикса-носителя и клеточной культуры мультипотентных стромальных клеток (МСК), предназначено для восстановления дефектов мягких тканей, требующих усиленной структурной поддержки и укрепления после оперативных хирургического вмешательств, восстановления стенок и замещения утраченного объема естественных полостей организма, в частности для герниопластики.
На сегодняшний день применение сетчатых имплантатов (хирургических сеток) является наиболее оптимальным и часто используемым методом восстановления дефектов стенки брюшной полости, малого таза и др. [1], о чем свидетельствуют продажи сетчатых имплантатов более 1 миллиона в год [2]. Рынок сетчатых имплантатов в 2011 году в одних только Соединенных Штатах составил 1.1 млрд долларов и, как ожидается, достигнет 1.5 млрд к 2015 году (Global Industry Analysts Inc.). Американский рынок представляет примерно половину мирового рынка, рост которого оценивается более чем на 6% в год [3]. Такое повышение спроса маркетологи связывают с ростом пожилого населения и увеличением частоты ожирения в развитых и развивающихся странах.
С 1959 года, когда впервые было предложено использование сеток для укрепления ворот грыжи без дополнительного натяжения собственных тканей, ведется активный поиск оптимального вида и конструкции протезирующего имплантата [4]. По мнению ряда авторов, оптимальная сетка для герниопластики должна быть биосовместимой, неканцерогенной, не изменяться в тканях организма, быть химически инертной, не вызывать воспаления и реакций гиперчувствительности, а также механически прочной, при этом обладая возможностью задавать необходимую форму и стимулировать собственные фибробласты для регенерации недостаточной в области грыжи собственно соединительной ткани [5, 6, 7].
На сегодняшний день существует две группы хирургических сеток: синтетические и биологические. Биологические сетки стали применять лишь последние 10 лет, и до сих пор отсутствует единое мнение, какие сетки являются более эффективными и безопасными [8, 9]. Чаще всего биологические сетки представляют собой децеллюляризированные ткани (дерма кожи и др.) человека или животных и гораздо реже конструкции на основе растворенного и очищенного коллагена. Несмотря на их высокую биосовместимость, их низкая механическая прочность, быстрая биорезорбция и высокая себестоимость ограничивает широкое применение по сравнению с синтетическими сетками.
Среди синтетических сеток выделяют два типа сетчатых конструкций: классические тяжелые с мелкими ячейками и более современные - легкие с крупными ячейками и, как следствие, меньшей массой [2]. Тяжелые сетки обладают наиболее высокой прочностью и способствуют формированию грубой волокнистой соединительной ткани в области дефекта, однако на отдаленных сроках они могут деформироваться, вызывать реакцию отторжения, приводить к хроническим болям, свищам, спайкам и даже инфицироваться. Легкие сетки в большей степени способствуют восстановлению физиологических характеристик стенок брюшной полости и малого таза, и количество осложнений наблюдается меньше [10]. И все же даже при применении легких сеток вероятность осложнений и тем более рецидивов грыж остается высокой.
Тем не менее, даже с использованием современных материалов из полипропилена, полиэстера, с добавлением викрила и др. проблема тканевой интеграции сеток для пластической хирургии остается нерешенной. В связи с тем, что наиболее часто используемые сетки производятся из нерезорбируемых полимеров или с добавлением резорбиоруемых (например, викрила), наиболее часто данные конструкции подвергаются кальцификации и деградации. Однако использование современных сеток лишь из резорбируемых полимеров не дало бы достаточного эффекта для полного восстановления стенок организма.
На наш взгляд, решением данной проблемы является разработка сетчатого имплантата (тканеинженерной конструкции), в основе которой будет использован принцип легких сеток для пластики со способностью стимулировать регенерацию недостаточного соединительнотканного каркаса в области дефекта. Согласно теоретическим и экспериментальных предпосылкам применение культур МСК в составе имплантата должно обеспечить более интенсивное прорастание сетки собственной соединительной тканью, стимуляцию ангиогенеза и полноценную интеграцию имплантата с тканями реципиента [11].
Технологии заселения сетчатых хирургических имплантатов стали разрабатываться лишь последние несколько лет, и разработки находятся еще на экспериментальной стадии. Были эффективные попытки лечения стрессового недержания мочи тканеинженерными слингами [12, 13], в этих работах продемонстрировано, что длительность терапевтического эффекта при применении ТИК существенно выше, чем при применении слинга без клеток, что объясняется более интенсивным образованием соединительной ткани вокруг слинга. Чаще клеточными культурами покрывают биологические имплантаты, например на основе коллагена, также это позволяет добиться более устойчивого эффекта [14, 15].
Использование алифатических полиэфиров для получения мононитей с модифицированной поверхностью в разрабатываемой сетчатой конструкции позволяет получить полностью биорезорбируемый имплантат, а скорость резорбции регулировать с помощью подбора исходного сырья (полилактиды, полигликолиды, поликапролактон и сополимеры) и толщины мононитей. Практически все осложнения, которые часто встречаются даже при использовании современных нерезорбируемых или частично резорбируемых сетчатых имплантатов так или иначе связаны с развитием реакции хронического воспаления при отторжении чужеродного материала имплантата. Существующие на сегодняшний день полностью резорбируемые хирургические сетки (например, викрил) имеют короткие сроки резорбции, не более трех месяцев, а за этот срок сетчатый имплантат не успевает заместиться собственной соединительной тканью достаточной плотности и механическими свойствами для исключения развития рецидивов. Основная проблема резорбируемых сеток состоит в том, что скорость их рассасывания непостоянна и зачастую велика, что при дефиците способной противостоять физиологическим нагрузкам новой ткани и ускоренной деструкции материала сетки приводит к рецидивам грыжи.
Расширение линейки шовных и сетчатых материалов идет в направлении синтеза и апробации новых составов, обладающих повышенными сроками резорбции. К настоящему моменту апробированы и используются в практике монофиламентные хирургические нити на основе полидиоксанона (PDO или PDS) с максимальным сроком полной резорбции до 180-210 суток.
Международная публикация WO 08042057 [13] относится к компонентам для тканевого усиления, в частности к компонентам, имеющим как макропористую, так и микропористую структуру для обеспечения возможности клеточного роста и тканевой интеграции (аналог).
Описаны биоразлагаемые каркасы на основе PLGA и других биосовместимых полимеров из групп [16]:
1) PLА, полигликолевой кислоты (PGA), MPEG-PLGA, гомо- или сополимеров: гликолида, L-лактида, DL-лактида, мезолактида, e-капролактона, 1,4-диоксан-2-она, d-валеролактона, β-бутиролактона, g-бутиролактона, е-декалактона, 1,4-диоксепан-2-она, 1,5-диоксепан-2-она, 1,5,8,12-тетраоксациклотетрадекан-7-14-диона, 6,6-диметил-1,4-диоксан-2-она и триметиленкарбоната;
2) или блок-сополимеров из группы 1 и моно- или бифункционального полиэтиленгликоля, или моно- или бифункционального полиалкиленгликоля, а также полиангидридов и полиортоэфиров,
их применение вместе с клетками или тканевыми эксплантами для регенерации мягких тканей в лечении медицинского пролапса (ректального или пролапса органов таза) или грыжи. Каркасы-носители получают в том числе по технике электропрядения и применяют в комбинации с пластами из коллагена и альгината.
Получаемые по технике электропрядения из дискретных волокон нетканые материалы имеют извилистые поры, средний размер которых составляет 60-140 мкм, достаточно низкий по сравнению с материалами, получаемыми по техникам ткачества или трикотажного плетения, уровень предела прочности на разрыв.
При этом техники ткачества или трикотажного плетения с использованием непрерывных волокон позволяют получать материалы с высоким уровнем пористости (85-95%) с регулируемым в широком диапазоне, например 1-1000 мкм, размером пор.
Клеточная культура МСК в данной конструкции будет обеспечивать более быстрое и качественное замещение собственной соединительной тканью. Таким образом, предложена полностью резорбируемая хирургическая сетка, превосходящая по своей эффективности современные легкие нерезорбируемые имплантаты и при этом лишенная их недостатков.
По данным открытых литературных и патентных источников герниопластических реконструкций с использованием содержащих МСК имплантируемых сетчатых конструкций на основе высокопористых резорбируемых сеток-носителей из нитей с пролонгированными сроками резорбции не выявлено.
Задачей настоящего изобретения является создание биорезорбируемого сетчатого имплантата пролонгированного действия на основе полидиоксанона, мультипотентных стромальных клеток пупочного канатика и фибринового геля для пластики стенок малого таза и брюшной полости и способа его получения.
Предложен способ получения имплантата, включающий следующие стадии:
1. Формирование сетчатого носителя из монофиламентных полидиоксаноновых нитей;
2. Получение клеточной культуры МСК пупочного канатика;
3. Заселение сетчатого имплантата МСК и инсталляция фибринового геля.
Формирование сетчатого носителя из монофиламентных полидиоксаноновых нитей
Формирование одноуровневой сетки на основе кулирного филейного трикотажного полотна с размером ячеек квадратной конфигурации со стороной квадрата 2,0-2,5 мм проводят из нитей полидиоксанона размерного ряда USP 3(0)-7(0) с применением металлического (стального) вязального крючка диаметром 1 мм согласно схеме (фиг. 1). Контролируют рисунок трикотажного и ткацкого полотна визуально. Не допускается отклонение рисунка от раппопорта. Контролируют размер пор визуально на соответствие образцу-эталону. Осуществляют резку/обработку края сетчатых полотен с применением лазерной установки «Комета-2» при расфокусированном до 7 мм лазерном луче (при расстоянии до среза сопла dcp ~4 мм, до фланца сопла L ~120 мм). Контролируют качество резки. Структура кромок должна быть однородной и не отличаться от структуры основного полотна, толщина подвергшегося обработке слоя не должна превышать 0, 25 мм.
Получение клеточной культуры МСК пупочного канатика человека
Биоматериал должен быть доставлен в лабораторию из операционного блока в течение 4 ч. Пробирку с биоматериалом тщательно обрабатывают этиловым спиртом. Удалить транспортную среду, материал перенести в чашку Петри. С каждым фрагментом пуповины работать отдельно. Фрагменты пупочного канатика промыть раствором Хенкса с пенициллином-стрептомицином. Раствор удалить. Повторить процедуру еще 2 раза. Фрагменты пупочного канатика промыть раствором Версена-EDTA. Раствор удалить.
Для выделения первичной культуры из пупочного канатика человека разморозить на водяной бане аликвоту ферментов (среда питательная Игла Дулбеко DME, содержащая 200 Ед/мл коллагеназы I типа и 200 Ед/мл коллагеназы II типа). Материал тщательно очистить от покровного эпителия и кровеносных сосудов, с помощью хирургических инструментов выделить участки интерваскулярной ткани (вартонова студня) и измельчить их до состояния кашицы. Измельченную ткань перенести в центрифужные пробирки, добавить 5-кратный объем раствора ферментов. Поместить центрифужные пробирки в CO2-инкубатор (5% CO2, 37°C) на 40-60 мин. С помощью пипетки перенести суспензию клеток в новые центрифужные пробирки, добавить 2-кратный объем ростовой среды (среда питательная Игла Дулбеко DME с добавлением сыворотки эмбрионов крупного рогатого скота до 10% и пенициллина-стрептомицина до 1%).
Отобрать 50 мкл суспензии, определить общее количество клеток в суспензии по формуле:
N=Σ(25)*V(мл)*10000,
где N - общее количество клеток в суспензии,
Σ(25) - сумма клеток в 25 малых квадратах сетки камеры Горяева,
V(мл) - общий объем суспензии в мл,
10000 - коэффициент пересчета единиц объема суспензии.
Поместить центрифужные пробирки в центрифугу, уравновесить ротор, осадить клетки центрифугированием (режим 220g, 10 минут, 20°C). Супернатант удалить, осадок клеток ресуспендировать в ростовой среде из расчета 100 тыс. клеток в 1 мл среды. Перенести по 1 мл клеточной суспензии в чашки Петри. Добавить 9 мл ростовой среды.
Для наращивания культуры МСК пупочного канатика замену истощенной ростовой среды на свежую проводить 2 раза в неделю. Оценку степени конфлуентности монослоя клеточных культур проводить ежедневно. Рассаживать культуру необходимо по достижении ею 80-90% конфлуентности монослоя. Отмыть клетки от ростовой среды, промыв дважды культуральную посуду раствором Версена-EDTA. Добавить диссоциирующие растворы. Культуральную посуду поместить в CO2-инкубатор на 2-4 мин. Открепление клеток от подложки проконтролировать с помощью инвертированного микроскопа. Пипеткой перенести суспензию клеток в центрифужные пробирки, добавить 2-кратный объем ростовой среды. Поместить центрифужные пробирки в центрифугу, уравновесить ротор, осадить клетки центрифугированием (режим 220g, 10 минут, 20°C). Супернатант удалить, осадок клеток ресуспендировать в 7 мл ростовой среды. Перенести клеточную суспензию в культуральную посуду из расчета 1 мл суспензии на единицу площади исходной посуды. Добавить ростовую среду до необходимого объема. Культуральную посуду поместить в СO2-инкубатор (5% CO2, 37°C). Допускается проведение не более 4 пассажей.
Заселение сетчатого имплантата МСК и инсталляция фибринового геля
Сетчатый имплантат переносят в культуральную посуду малой площади (культуральный планшет) и аккуратно наслаивают на него клеточную суспензию. Используют не менее 1,5 мл клеточной суспензии на 1 см2 поверхности. Через 6 часов сетчатый имплантат с прикрепившимися клетками переносят в новую культуральную посуду, добавляют свежую среду и культивируют в течение 18 часов.
Сетчатый имплантат переносят в культуральную посуду малой площади (культуральный планшет), переворачивая его нижней стороной наверх, и аккуратно наслаивают на него клеточную суспензию. Используют не менее 1,5 мл клеточной суспензии на 1 см2 поверхности. Через 6 часов сетчатый имплантат с прикрепившимися клетками переносят в новую культуральную посуду, добавляют свежую среду и культивируют в течение 42-48 часов.
Перед использованием предварительно замороженную до -40°C плазму крови человека, содержащую не менее 2 г/л фибриногена, размораживают при +4°C до полного оттаивания кусочков льда. Пробирки с плазмой центрифугируют при 3600 об/мин в течение 20 минут при +4°C. Супернатант аккуратно удаляют с помощью пипетки, оставляя в нижней части пробирки 1 мл (в случае использования 15 мл центрифужных пробирок) или 3 мл (в случае использования 50 мл центрифужных пробирок) плазмы.
Оставшуюся часть плазмы, обогащенную фибриногеном, тщательно пипетируют с помощью автоматического дозатора на 1000 мкл.
Лиофилизированный тромбин растворяют в 2 мл 10% раствора хлорида, раствор хранят при +4°C не более 48 часов или при -20°C не более 30 сут (допускается только однократное замораживание).
Для нанесения фибринового геля на заселенный сетчатый имплантат его аккуратно с помощью пинцета (держа за край, чтобы не повредить клетки) переносят в чашку Петри и аккуратно наслаивают на него 300 мкл подготовленной плазмы (для экспериментальных образцов размером 10×15×1 мм) или 600 мкл подготовленной плазмы (для экспериментальных образцов размером 20×15×1 мм). Капля плазмы должна полностью покрывать образец. Через 1-2 мин визуально проверяют отсутствие воздушных пузырей в ячейках сетки.
В центр сетки с помощью автоматического дозатора вносят 60 мкл (для экспериментальных образцов размером 10×15×1 мм) или 120 мкл (для экспериментальных образцов размером 20×15×1 мм) подготовленного раствора тромбина, погружая наконечник внутрь плазмы и получают сетчатый имплантат на основе полидиоксанона и мультипотентных стромальных клеток для пластики стенок малого таза и брюшной полости.
Пример 1. Получение и характеристика клеточной культуры
Выделенная из пупочного канатика человека первичная культура достаточно гетерогенна и содержит как активно пролиферирующие фибробластоподобные клетки (веретеновидные или поляризованные, с выраженным передним краем), так и крупные стромальные клетки с крупным ядром, часто являющиеся фидерным слоем для более мелких клеток. Внешний вид клеток на 1 пассаже представлен на фиг. 2.
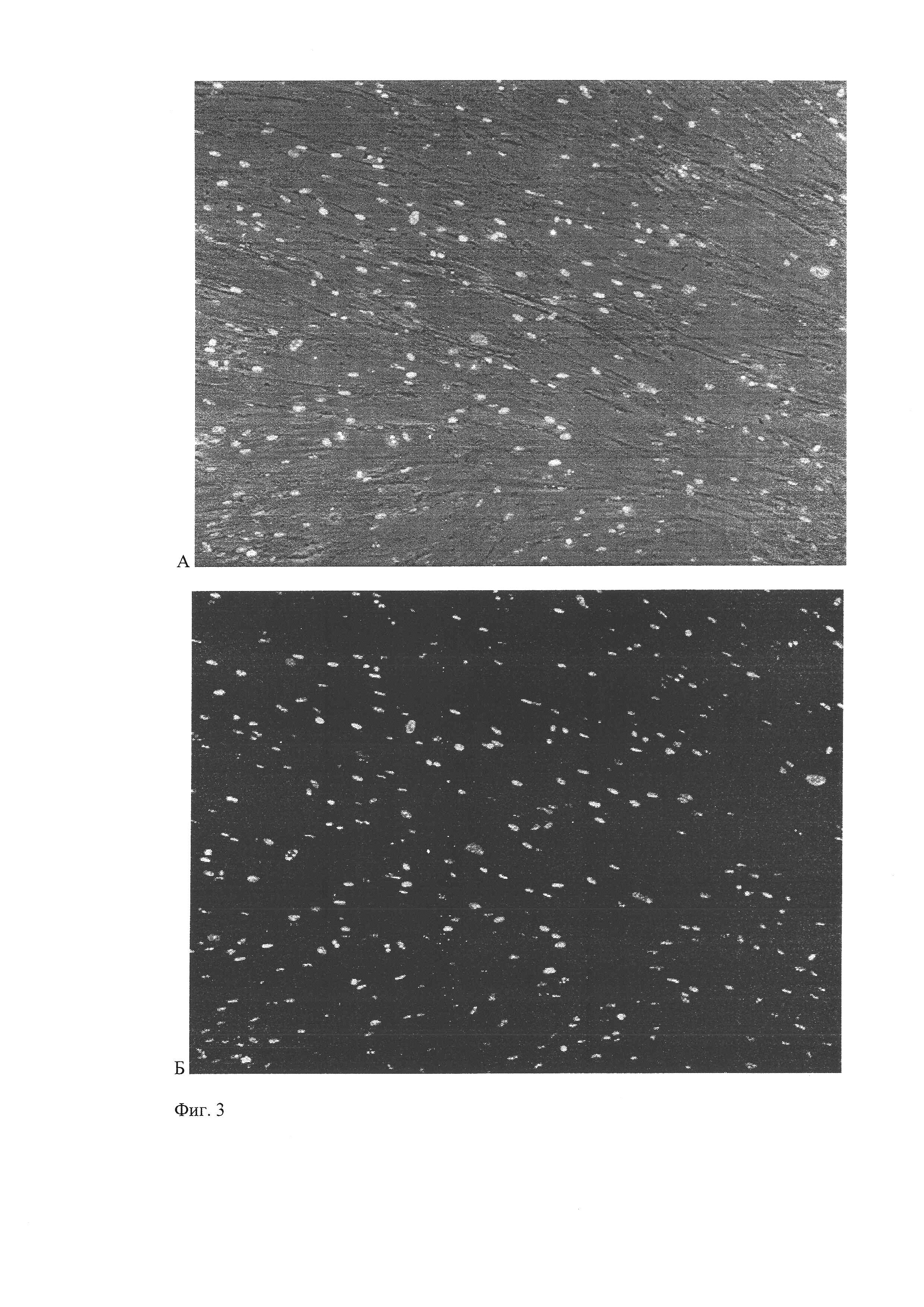
На 2-4 пассажах крупные стромальные клетки практически отсутствуют, доля Ki67-положительных клеток достигает 93-95%, что можно считать косвенным признаком высокой гетерогенности выделенной культуры (фиг. 3).
Высокий уровень экспрессии Ki67 также свидетельствует о высоком пролиферативном потенциале данной клеточной культуры. «Золотым стандартом» для сравнения любых МСК является МСК костного мозга. Показано, что период удвоения МСК пупочного канатика человека составляет около 24 часов на 1 пассаже и практически не изменяется до 10 пассажа, в то время как для МСК костного мозга период удвоения составляет около 40 часов и значительно возрастает начиная с 6 пассажа. Достаточное количество исходного материала (масса пупочного канатика около 40 г), относительно высокая теломеразная активность позволяет получить из одного образца свыше 109 клеток при сохранении нормального кариотипа в течение минимум 6 пассажей. Общее количество клеток, полученных нами из 1 образца пупочного канатика, составляет порядка 108 клеток с учетом ограничения экспансии клеток не более 4 пассажей.
Пример 2. Стандартный иммунофенотип клеточной культуры.
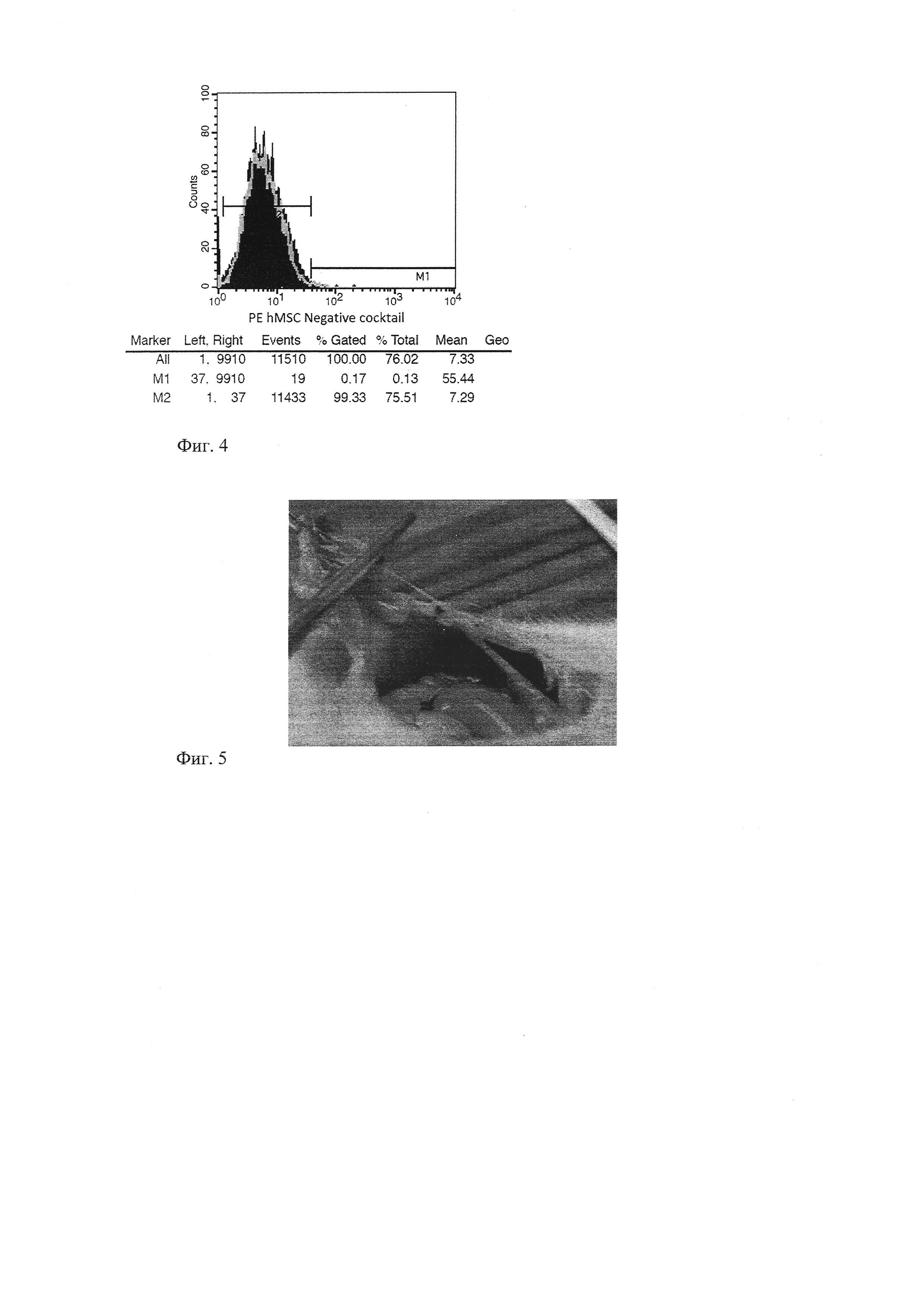
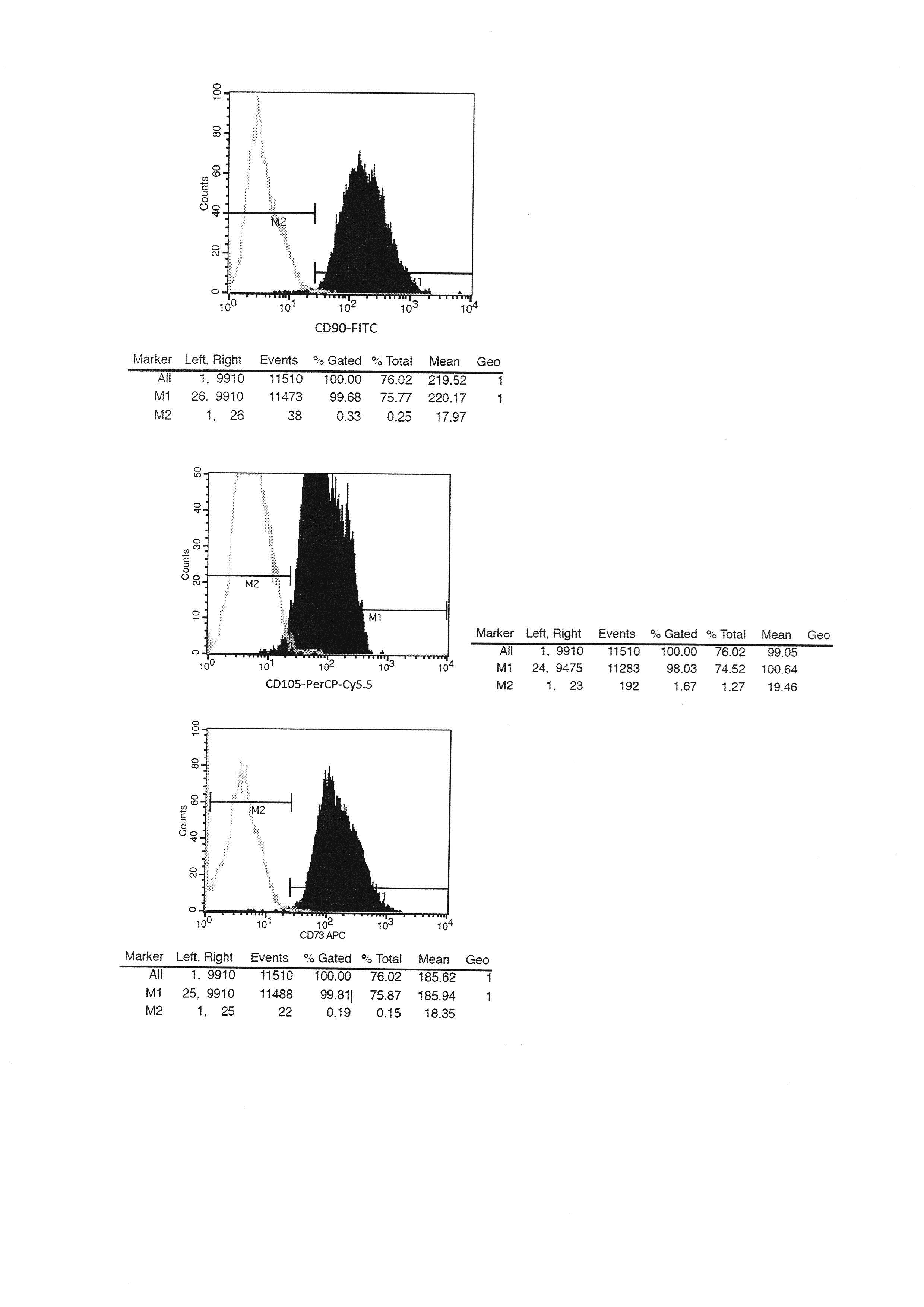
Для определения экспрессии специфических поверхностных маркеров использовали метод проточной цитофлуориметрии. В процессе подготовки проб клетки на 2-3 пассажах открепляли от подложки раствором трипсина-Версена, дважды отмывали от культуральной среды в растворе Хэнкса (pH 7,4), фиксировали 2% параформальдегидом, снова дважды отмывали раствором Хэнкса. Клетки ресуспендировали в фосфатно-солевом буфере с добавлением эмбриональной телячьей сыворотки до 0,1% в концентрации 100 тыс. клеток в 100 мкл и добавляли антитела. В работе использовали BD Stemflow™ hMSC Analysis Kit для многоцветного иммунофенотипирования. Образцы инкубировали 30 минут в темноте при комнатной температуре. После инкубации клетки отмывали от антител, ресуспендировали в 500 мкл стерильного буфера и переносили в пробирки для проточной цитофлуориметрии. Анализ проводили на цитофлуориметре FACSCalibur (BD) с помощью программы Cell Quest. Результаты исследования представлены на фиг. 4.
Как видно из фиг. 4, клеточные культуры, выделенные из пупочного канатика человека, имели специфический профиль экспрессии поверхностных антигенов, характерный для мультипотентных стромальных клеток. Всего было проанализировано 5 клеточных культур, результаты анализов не отличались друг от друга и были в пределах погрешности прибора.
Пример 3. Способность направленной дифференцировки МСК пупочного канатика
Исследование способности клеточных культур, выделенных из пупочного канатика человека, отвечать на действие индукторов дифференцировки проводили на клетках на 2-3 пассажах. В качестве отрицательного контроля использовали культуру дермальных фибробластов человека. Клеточные культуры рассаживали в 60 мм чашки Петри, культивировали до получения монослоя, после чего заменяли ростовую среду на дифференцировочную. С целью стандартизации результата в работе использовали коммерческие дифференцировочные среды StemPro® Adipogenesis Differentiation Kit, StemPro® Osteogenesis Differentiation Kit, StemPro® Chondrogenesis Differentiation Kit (все Gibco). Результаты подтверждали с помощью общепринятых гистохимических методов.
Адипогенная дифференцировка МСК пупочного канатика человека
Клетки дермальных фибробластов человека, используемые в качестве отрицательного контроля, не изменяли свой фенотип при культивировании в адипогенной среде даже в течение 28 суток.
В культуре МСК пупочного канатика человека липидные включения появлялись в отдельных клетках уже на 5 сутки индукции. Со временем доля таких клеток и количество жировых капель в них возрастало. Окрашивание на нейтральный жир проводили по стандартной методике Суданом III.
Остеогенная дифференцировка МСК пупочного канатика человека.
Через 7-10 суток МСК пупочного канатика человека начинали изменять общий рисунок монослоя, нарушая характерные волны. Через 21-28 суток индукции в культуре формировались неправильной формы скопления клеток, окрашивающиеся в интенсивный красный цвет при взаимодействии с ализариновым красным S - красителем, образующим лаки с солями кальция.
Хондрогенная дифференцировка МСК пупочного канатика человека
При индукции хондрогенеза изменения морфологии МСК пупочного канатика человека наблюдали уже через 7-10 дней: в монослое начинали формироваться скопления клеток (узелки). К концу 3 недели индукции они увеличивались в размерах, принимали округлую форму, при этом выявление мукополисахаридов во внеклеточном матриксе оценивали при окрашивали 1% раствором альцианового синего, pH 2,5.
Пример 4. Оценка эффективности сетчатого имплантата для герниопластики на экспериментальной модели подкожной трансплантации
В исследовании использовали 120 половозрелых самцов беспородных крыс массой 250-320 г. Животных в случайном порядке разделяли на следующие группы:
1. Трансплантируют имплантат из PDO;
2. Трансплантируют имплантат из PGA;
3. Трансплантируют имплантат из PDO+PLA;
4. Трансплантируют имплантат из PGA+PLA;
5. Трансплантируют протез из Permacol - контрольная группа.
Моделирование дефекта передней брюшной стенки (ДПБС) выполняют следующим образом: Животных предварительно наркотизируют смесью Золетил : Рометар 1:3, доза определяется в соответствии с массой крысы. Положение крысы на спине с фиксированными конечностями, кожа на животе выбрита с помощью триммера. Делают разрез кожи по серединной линии живота длиной 4 см. После этого острым путем с помощью ножниц иссекают полнослойный (с проникновением в брюшную полость) дефект прямоугольной формы, длиной 2 см и шириной 1,5 см, ровно в середине передней брюшной стенки, ориентируясь на белую линию живота. Затем к краям дефекта подшивают протез, длиной 2 см и шириной 1,5 см, располагая ткани передней брюшной стенки над краями протеза. Накладывают по три одиночных шва справа и слева протеза и по одному сверху и снизу, используя викриловые нити 4-0. Проверив визуально состоятельность швов и отсутствие эвентрации органов, ушивают разрез кожи и обрабатывают рану асептическим раствором. Сразу после операции крысе однократно вводят гентамицин, доза рассчитывается по массе животного. Оперированные животные размещаются в отдельных клетках.
Животных подвергали эвтаназии на 3, 10, 30 и 60 сутки после операции путем передозировки эфирного наркоза. При эвтаназии производили изъятие трансплантата путем иссечения его, отступая 2 мм от наложенных швов при его фиксации.
Все животные удовлетворительно переносили оперативное вмешательство, 100% животных выжило в ранние и отдаленные сроки после операции. Ни у одного животного не было выявлено признаков формирования крупных гематом, сером и абсцессов.
Обращало на себя внимание, что на 2-3 сутки после операции животные в группах PDO+PLA и PGA+PLA интенсивно расчесывали и даже разгрызали швы в области операционной раны. При визуальном осмотре выявляли выраженную деформацию передней брюшной стенки краем протеза, местами наблюдали его эвентрацию. Часть животных полностью выгрызали протезы, что приводило к эвентрации петель кишечника и других органов. Таких животных выводили из эксперимента. Подобных осложнений в других опытных и контрольной группах выявлено не было.
Таким образом, у 18 животных в группе PDO+PLA (75%) и у 17 животных в группе PGA+PLA (70,8%) наблюдали описанные осложнения. Как отмечалось еще на in vitro стадии исследования, дополнительное покрытие элементов протеза PLA для модифицирования поверхности приводило к повышению жесткости протеза. По-видимому, острые углы прямоугольного протеза вызывали механическое раздражение и, возможно, повреждение мягких тканей в области трансплантации, что сопровождалось локальным воспалением, зудом, болью и приводило к желанию животного избавиться от трансплантата. В результате мы были вынуждены исключить из эксперимента группы с такими осложнениями в раннем послеоперационном периоде.
При макроскопическом исследовании можно было оценить интеграцию протеза с тканями реципиента. В группах PDO и PGA наблюдали прорастание ячеек сеток собственной соединительной тканью, уже на 10 сутки отличить и отделить материал протеза от окружающих тканей было сложно, только благодаря синему цвету материла можно было определить место трансплантации, который постепенно выцветал по мере резорбции (фиг. 5). Такую же интеграцию наблюдали в группе с Permacol, но только на 30 сутки, на более ранних сроках протез интегрировался с окружающими тканями только в области швов.
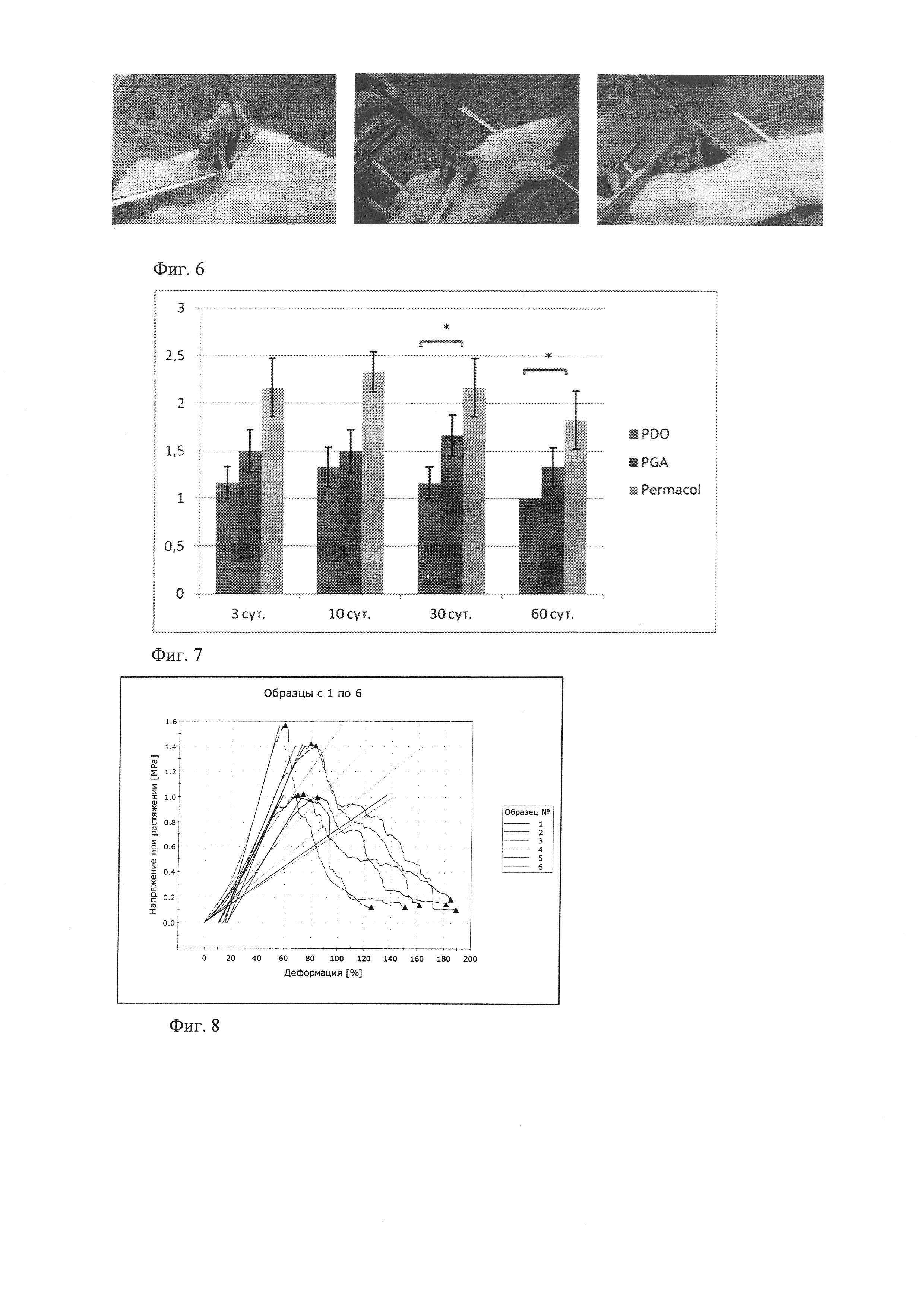
Образование спаек разной степени выраженности наблюдали во всех группах и на всех сроках наблюдения. У ряда животных в спаечный процесс вовлекались не только большой сальник, но и петли тонкого и толстого кишечника (фиг. 6). По плотности тяжей соединительной ткани между группами и сроками выявлено не было, их можно было легко отделить от протеза тупым способом. Достоверные различия выраженности спаечного процесса наблюдали только на 30 и 60 сутки между группой PDO (1,17±0,42 и 1,0±0) и Permacol (2,17±0,79 и 1,83±0,79) соответственно.
Таким образом, меньшую выраженность спаечного процесса наблюдали после трансплантации PDO, но достоверно меньше спаек было только на 30 и 60 сут. В группе Permacol спаек было больше, но нужно отметить, что площадь контакта материала с тканями брюшной полости в этом случае была существенно выше, так как Permacol представляет собой пластину с перфорациями.
Важным медико-биологическим свойством протезов для пластики объемных дефектов полостей тела являются их прочностные характеристики. А учитывая, что мы исследуем полностью резорбируемые протезы еще более важным является динамика биомеханических свойств по мере резорбции протеза и замещения его собственными тканями. При производстве хирургических протезов отсутствуют единые стандарты их биомеханических свойств, существуют лишь представления о минимальных прочностных характеристиках. Ключевыми являются два основных показателя - это эластичность и предел прочности при разрыве. Естественная эластичность передней брюшной стенки при растяжении 32 Н/см2 составляет 38%.
Для исследования биомеханических свойств нативных тканей мы провели тензиометрическое исследование полнослойно вырезанного участка передней брюшной стенки крысы (фиг. 8). Предел прочности при растяжении передней брюшной стенки крысы равнялся 1,24±0,26 МПа.
Гистологическому исследованию подвергались ткани, изъятые в области трансплантации через 3, 10, 30 и 60 суток после операции. Морфометрическое исследование позволило количественно охарактеризовать физиологические и патологические процессы в области трансплантации, а также оценить скорость резорбции материала протеза.
В течение всех сроков наблюдения во всех группах отмечали постепенные резорбцию материала протеза и его замещение собственной соединительной тканью. На всех сроках область трансплантации была представлена рыхлой волокнистой соединительной тканью разной степени зрелости (клеточность и толщина коллагеновых волокон) с последующим замещением на плотную неоформленную соединительную ткань.
Так на 3 сутки протез покрывался фибрином, с его краев начиналась инфильтрация клетками воспаления (нейтрофилами, макрофагами и др.), наблюдали формирование новых кровеносных сосудов, образование структур экстрацеллюлярного матрикса, прежде всего рыхло расположенных коллагеновых волокон.
На 10 сутки вокруг материала протезов начинала формироваться соединительнотканная капсула, еще очень тонкая. Капсула во всех группах представлена рыхлой волокнистой соединительной тканью (РВСТ), но при этом ориентация коллагеновых волокон была строго вокруг элементов протеза. Вокруг капсулы кроме РВСТ можно было видеть широкие поля хорошо васкуляризированной жировой ткани. Выраженной воспалительной инфильтрации на этих сроках уже не наблюдали, но при этом инфильтрат сохранялся преимущественно в зоне контакта с материалом протеза и был представлен преимущественно макрофагами и гигантскими клетками инородных тел и клетками Пирогова-Лангханса, количество которых заметно различалось между группами.
Через 30 суток после операции толщина капсулы и формирующих ее коллагеновых волокон увеличивались во всех группах. Вокруг капсулы встречались участки РВСТ и плотной неоформленной соединительной ткани (ПНСТ). Макрофаги и клетки Пирогова-Лангханса локализовались в основном на границе ткань-протез, редко их можно было обнаружить вне капсулы, количество их сохранялось на прежнем уровне. Нейтрофилов, плазматических клеток, тучных клеток без специальных методов окрашивания выявлено не было.
На 60 сутки эксперимента и капсула, и окружающие ткани области трансплантации протеза были представлены ПНСТ, хорошо васкуляризированной, с небольшими участками РВСТ и жировой ткани. Макрофаги сохранялись в капсуле. Гигантские клетки инородных тел и клетки Пирогова-Лангханса обнаруживали редко, особенно в группе PDO. Обращала на себя внимание более выраженная инфильтрация воспалительными клетками, прежде всего, нейтрофила в группе Permacol, которая сохранялась в течение всех сроков наблюдения.
Скорость резорбции протеза
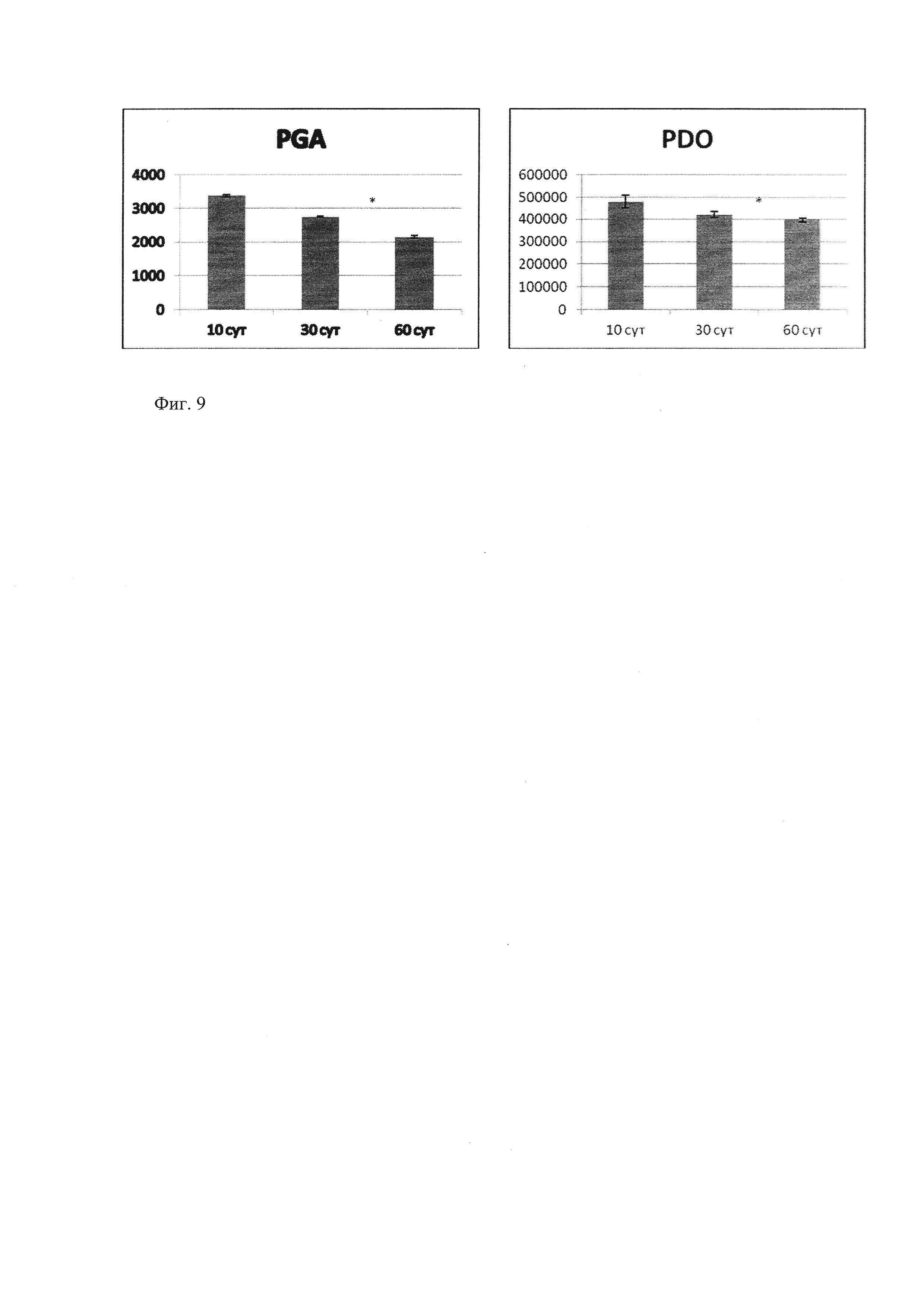
Скорость резорбции протеза оценивали по динамике изменения площади структурных элементов протеза на поперечных гистологических срезах при увеличении ×100 (фиг. 6-8) через 10, 30 и 60 суток. В группе Permacol скорость резорбции достоверно оценить оказалось невозможным, так как определить происхождение коллагеновых волокон (протез или собственные ткани) при гистологическом исследовании не удалось. Как видно на микрофотографиях, на поперечных срезах структурные элементы протеза PGA определяли как тонкие мононити в составе толстой полифиламентной нити, площадь измеряли поперечного среза тонкой нити, так как резорбции подвергалась каждая тонкая мононить по всей поверхности. В группе PDO измеряли площадь поперечно срезанной толстой мононити. На фиг. 9 представлена скорость резорбции PGA и PDO.
Оба варианта протеза подвергались резорбции - PGA к 60 суткам уменьшился на 36,5±4,7%, PDO на 17,4±2,3% (p≤0,05). Такие различия, по-видимому, обусловлены не только химической структурой протеза, но и площадью контактирования с тканями реципиента. Сетка из PGA сформирована из полифиламентных нитей, тогда как сетка из PDO представлена монофиламентной нитью, поэтому, как видно на фиг. 6-8, площадь резорбции материала в случае полифиламентной нити значительно больше, чем в случае мононити PDO. Таким образом, можно утверждать, что если мы хотим добиться более длительной резорбции, очевидно, необходимо уменьшать площадь взаимодействия материала протеза и тканей реципиента как одного из ключевых факторов, определяющих скорость резорбции.
Таким образом, в эксперименте мы сравнили безопасность и эффективность использования исходных вариантов протезов PGA и PDO без модификации поверхности, в качестве положительного контроля мы использовали Permacol - широко используемый в хирургии резорбируемый протез из дермы свиней. Все варианты протезов постепенно резобировались и замещались собственной соединительной тканью, были выявлены признаки образования новых скелетных мышц в области трансплантации. По мере резорбции уменьшалась и прочность протеза, в том числе и в контрольной группе, но предел прочности не был меньше этого показателя нативных тканей.
По ряду показателей биосовместимости и эффективности протез из PDO оказался достоверно лучше, чем протез из PGA и даже Permacol. В частности, наименьшее количество спаек наблюдали при трансплантации PDO. Степень выраженности воспалительной реакции при отторжении протеза как инородного тела также была низкой в группе PDO, по сравнению с PGA и Permacol, что проявлялось менее выраженной макрофагальной инфильтрацией, поляризацией макрофагов в M2, повышенной экспрессией противовоспалительных генов цитокинов и низкой экспрессией и продукцией провоспалительных.
Список использованных источников
1. Mettu J.R., Colaco M., Badlani G.H. Evidence-based outcomes for mesh-based surgery for pelvic organ prolapse. Curr Opin Urol. 2014, Jul; 24(4): 370-4.
2. Klosterhalfen B., Junge K., Klinge U. The lightweight and large porous mesh concept for hernia repair. Expert Rev Med Devices. 2005, Jan; 2(1): 103-17.
3. Данные сайта http://ww2.frost.com/
4. Usher F.C., Hill J.R., Ochsner J.L. Hernia repair with Marlex mesh. A comparison of techniques. Surgery. 1959; 46: 718-24.
5. Tyrell J., Silberman H., Chandrasoma P., Niland J., Shull J. Absorbable versus permant mesh in abdominal operations. Surg Gyn Obstet, 1989; 168: 227-32.
6. Metz S.A., Chegini N., Masterson B.J. In vivo and in vitro degradation of monofilament absorbable sutures, PDS and Maxon. Biomaterials, 1990; 11(1): 41-5.
7. Bagi P., Jendresen M., Kirkegaard P. Early local stoma complications in relation to the applied suture material: comparison between mono "lament and multi" lament sutures. Dis Colon Rectum 1992; 35(8): 739, 42.
8. Ferzoco S.J. A systematic review of outcomes following repair of complex ventral incisional hernias with biologic mesh. Int Surg. 2013; 98(4): 399-408. doi: 10.9738/TNTSURG-D-12-00002.1;
9. Kissane N.A., Itani K.M. A decade of ventral incisional hernia repairs with biologic acellular dermal matrix: what have we learned? Plast Reconstr Surg. 2012; 130 (5 Suppl 2): 194S-202S. doi: 10.1097/PRS.
10. Zhong C., Wu В., Yang Z., Deng X., Kang J., Guo В., Fan Y. A meta-analysis comparing lightweight mesheswith heavyweight meshes in Lichtenstein inguinal hernia repair. Surg Innov. 2013; 20(1): 24-31. doi: 10.1177/1553350612463444. Epub 2012, Oct 16.
11. Schon L.C., Gill N., Thorpe M., Davis J., Nadaud J., Kim J., Molligan J., Zhang Z. Efficacy of a mesenchymal stem cell loaded surgical mesh for tendon repair in rats. J Transl Med. 2014; 12(1): 110. doi: 10.1186/1479-5876-12-110.
12. Cannon T.W., Sweeney D.D., Conway D.A., Kamo I., Yoshimura N., Sacks M., Chancellor M.B. A tissue-engineered suburethral sling in an animal model of stress urinary incontinence. BJU Int. 2005; 96(4): 664-9.
13. Zou X.H., Zhi Y.L., Chen X., Jin H.M., Wang L.L., Jiang Y.Z., Yin Z., Ouyang H.W. Mesenchymal stem cell seeded knitted silk sling for the treatment of stress urinary incontinence. Biomaterials. 2010; 31(18): 4872-9. doi: 10.1016/j.biomaterials. 2010.02.056. Epub 2010, Mar 19.
14. Butler D.L., Juncosa-Melvin N., Boivin G.P., Galloway M.T., Shearn J.T., Gooch C., Awad H. Functional tissue engineering for tendon repair: A multidisciplinary strategy using mesenchymal stem cells, bioscaffolds, and mechanical stimulation. J Orthop Res. 2008; 26(1): 1-9.
15. Pu F., Rhodes N.P., Bayon Y., Chen R, Brans G., Benne R, Hunt J.A. The use of flow perfusion culture and subcutaneous implantation with fibroblast-seeded PLLA-collagen 3D scaffolds for abdominal wall repair. Biomaterials. 2010; 31(15): 4330-40. doi: 10.1016/j.biomaterials.2010.02.010.
16. Биоразлагаемый каркас для регенерации мягких тканей и его применение. Патент WO 08042057.
Подписи к фигурам
Фиг. 1. Схема получения сетчатого носителя из монофиламентных полидиоксаноновых нитей.
Фиг. 2. Первичная культура клеток, выделенная из пупочного канатика человека ферментативным методом. Видны мелкие фибробластоподобные клетки и крупные стромальные клетки, в среде достаточно большое количество дебриса. ФК, х50.
Фиг. 3. Экспрессия маркера пролиферации Ki67 клетками, выделенными из пупочного канатика человека на 2 пассаже. А - Совмещение фазово-контрастной и флуоресцентной микроскопии, x50. Б - Флуоресцентная микроскопия, x50.
Фиг. 4. Результаты анализа иммунофенотипа МСК пупочного канатика человека.
Фиг. 5. Интеграция протеза с собственными тканями.
Фиг. 6. Образование спаек в области трансплантации протеза на 10 сутки после операции. А - выраженность спаек на 1 балл, Б - 2 балла, В - 3 балла.
Фиг. 7. Динамика образования спаек в группах (среднее ± ошибка среднего), * - p≤0,05.
Фиг. 8. Результаты тензиометрического исследования.
Фиг. 9 - Динамика площади поперечно срезанных структурных элементов протеза через 10, 30 и 60 суток после трансплантации, (среднее ± ошибка среднего), * - p≤0,05.