Результат интеллектуальной деятельности: Способ получения инъекционного резорбируемого имплантата на основе поликапролактона и мультипотентных стромальных клеток пупочного канатика
Вид РИД
Изобретение
Изобретение относится к регенеративной медицине и тканевой инженерии и предназначено для восстановления объема и плотности волокнистой соединительной ткани стенки органа и увеличения ее биомеханических свойств. Изобретение позволяет изготовить инъекционную форму имплантата на основе полученных с помощью сверхкритического диоксида углерода частиц поли-ε-капролактона размером 100-150 мкм либо инъекционную форму имплантата на основе полученных с помощью сверхкритического диоксида углерода частиц поли-ε-капролактона размером 100-150 мкм, импрегнированных рекомбинантным человеческим фактором роста, и мультипотентных стромальных клеток.
Несостоятельность и различные формы дисплазии волокнистой соединительной ткани являются одной из причин развития таких распространенных социально-значимых заболеваний, как стрессовое недержание мочи, энкопрез, пролапс, везикоуретеральный рефлюкс, гастроэзофагеальный рефлюкс и др. Перспективным подходом, в принципе способным снизить частоту интра- и пост-операционных осложнений, а также обеспечить эффективную реабилитацию больных, является использование локального введения объемообразующих средств, создающих в области трансплантации дополнительный объем соединительной ткани, необходимый для восстановления равновесного давления между сообщающимися отделами мочеполовой или пищеварительной системы (например, мочевым пузырем и уретрой) [1]. Преимуществом введения инъекционных имплантатов является простота и удобство техники выполнения, возможность проведения под местной анестезией в амбулаторных условиях, хорошая переносимость, минимизация осложнений. Поиск идеального объемообразующего средства был начат еще в конце 20 века, однако результаты введения политетрафторэтиленовых частиц, поперечно-сшитого коллагена, гиалуроновой кислоты, аутогенного жира или хряща, силиконовых имплантатов и прочих инъекционных агентов не удовлетворяли клиницистов [1-4]. Предварительные результаты клинических исследований позволили сформулировать основные требования к имплантату: для создания продолжительного эффекта компоненты должны быть биосовместимыми, обладать минимальной иммуногенностью, длительное время сохраняться в области введения и не мигрировать в окружающие ткани [1, 5].
Известны объемообразующие препараты на основе силиконовых (патент US 8658215 В2, дата публикации 25.02.2014) и керамических микросфер (патент US 6537574 В1, дата публикации 25.03.2003). Недостатком подобных препаратов является невозможность биорезорбции вводимых частиц, которые остаются в организме реципиента в течение всей его жизни и способны вызывать хроническую воспалительную реакцию ткани на инородной тело [1].
Известны объемообразующие препараты на основе биорезорбируемых полилактидных и полилактогликолидных частиц (патент ЕР 1411861 В1, дата публикации 04.04.2012). Конечными продуктами их биодеструкции являются водорастворимые нетоксичные продукты нормального метаболизма, которые либо выводятся из организма естественным путем, либо претерпевают дальнейшую цепочку химических превращений плоть до углекислого газа и воды. Основным недостатком данных препаратов является малый размер частиц, который колеблется в пределах 20-120 мкм, что может привести к их миграции из области трансплантации [1]. Кроме того, характерные времена биорезорбции этих полимеров могут значительно варьировать в зависимости от целого ряда многочисленных факторов [6], что уменьшает эффективность применения данных веществ в отдаленном периоде.
Наиболее близким к изобретению является объемообразующий препарат на основе биорезорбируемого поликапролактона (патент WO 2009014441 А2, дата публикации 29.01.2009). Преимуществами поликапролактона является его высокая биосовместимость и длительный срок резорбции в организме, который исчисляется месяцами или даже годами, что значительно превышает показатели других алифатических полиэфиров - полилактидов и полигликолидов [7-9]. К недостатку данного изобретения следует отнести использование потенциально токсичных агентов (TWEEN, дихлорэтана) в процессе производства полимера.
Основным общим недостатком традиционных методов формирования полимерных частиц из алифатических полиэфиров (выщелачивание, двойная эмульсия технология, разделение фаз) является использование органических растворителей (ацетон, хлороформ, хлорид метилена и др.). Их остаточные примеси обладают выраженной степенью токсичности, что негативно сказывается на качестве конечного продукта. Однако получение полимерных структур и биоактивных композитов на их основе, содержащих минимально возможное количество примесей, возможно при использовании сверхкритического диоксида углерода (ск-СО2) [10]. Это обусловлено уникальным сочетанием в нем свойств газов высокого давления (низкая вязкость, высокий коэффициент диффузии, отсутствие сил поверхностного натяжения) и жидкостей (высокая растворяющая и пластифицирующая способность) [11]. Важно также, что после завершения процесса, диоксид углерода легко и практически без остатка удаляется из полимера простым сбросом давления ниже критического значения (Ркр=7,4 МПа). [12]. В настоящем изобретении использован экологически чистый и безопасный ск-СО2, который позволяет проводить нетоксичную обработку полимерных материалов практически при комнатной температуре (Ткр=31°С) с существенно более высокой эффективностью, чем при использовании обычных газов или жидких растворителей.
На эффективность восстановления недостатка соединительной ткани можно влиять путем локальной доставки биологически активных молекул: FGF2, NGF, IGF1, BDNF и др. [13-15]. Однако необходимо не просто доставить данные вещества в ткань, но и обеспечить их длительное там присутствие, что невозможно при однократном введении вследствие небольшого времени полужизни белков. Данную проблему также можно решить при использовании сверхкритической флюидной (СКФ) технологии обработки материалов, одним из преимуществ которой является возможность модифицирования полимеров. Сорбция СО2 в объеме аморфных полимеров (к которым и относится большинство алифатических полиэфиров, используемых сегодня в биомедицине и фармакологии) приводит к снижению температуры их стеклования и пластификации. Как правило, этот процесс сопровождается набуханием полимера и увеличением его свободного объема. Эти условия способствуют эффективному включению различных термолабильных биоактивных компонентов внутрь полимерной матрицы без использования токсичных органических растворителей и высоких температур [16]. В настоящем изобретении использована СКФ обработка поликапролактоновых частиц, которая позволяет равномерно распределять биологически активные вещества внутри полимерной матрицы, обеспечивая постоянный и длительный выход биоактивных молекул в окружающие ткани по мере резорбции материала.
Полимерные носители помимо функции объемообразующего агента могут выполнять также функцию носителя (скэффолда) для клеточного компонента имплантата: введение иммобилизованных на носителе клеток способствует лучшему восполнению недостатка соединительной ткани в области трансплантации. В качестве клеточного компонента таких конструкций используют фибробласты слизистой полости рта, МСК жировой ткани, амниотической жидкости, костного мозга и др. [17-20]. Очевидно, что поверхность полимерных носителей должна обеспечивать эффективное прикрепление клеток и способствовать их выживаемости в условиях in vivo. Несомненным достоинством СКФ технологий синтеза полимерных микрочастиц является возможность контроля и управления их морфологией поверхности, плотностью и пористостью [12]. В настоящем изобретении использована СКФ технология для обеспечения воспроизводимости получения полимерных частиц с заданными физико-химическими и механическими свойствами, оптимальными для адгезии клеток на их поверхности.
Вопрос выбора источника клеток для восполнения дефектов соединительной ткани до сих пор остается открытым [21, 22]. Показано, например, что периуретральная трансплантация МСК животным с моделированным стрессовым недержанием мочи более эффективна, чем трансплантация дермальных фибробластов, приводит к улучшению васкуляризации соединительной ткани и положительно влияет на показатели LPP (leak point pressure, давление точки подтекания); при этом основным предполагаемым механизмом терапевтической активности МСК является паракринный [23, 24]. В настоящем изобретении в качестве терапевтического агента допускается использование МСК, выделенных из вартонова студня пупочного канатика человека: данные клетки обладают высочайшим регенераторным потенциалом и по праву могут считаться новым «золотым стандартом» клеточной терапии [25, 26]. В случае невозможности использования аутогенной культуры МСК пупочного канатика и отказа от использования аллогенной культуры МСК пупочного канатика в изобретении допускается использование аутогенной культуры МСК из других источников (например, жировой ткани).
Важным компонентом объемообразующего препарата, помимо самих полимерных частиц, является среда введения, которая должна обеспечить равномерное распределение частиц при трансплантации. Данная задача может быть решена за счет использования сред с высоким показателем вязкости (гелей). В настоящем изобретении в качестве среды введения допускается использование растворов гидроксипропилметилцеллюлозы (гипромеллозы), карбоксиметилцеллюлозы, гиалуроната натрия, поливинилпирролидона, глицерола и их комбинаций. Преимуществами данных веществ являются возможность регулирования вязкости раствора, стабильность и высокая биосовместимость [27-31].
Технической задачей изобретения является создание инъекционной формы биорезорбируемого имплантата для восстановления объема и плотности соединительной ткани стенки органа и улучшения ее биомеханических характеристик, обладающего высокой биосовместимостью. Техническим результатом изобретения является создание двух вариантов имплантатов:
1. Имплантат на основе полученных с помощью сверхкритического диоксида углерода частиц поликапролактона размером 100-150 мкм в среде введения, состоящей из гипромеллозы, либо карбоксиметилцеллюлозы, либо гиалуроната натрия, либо поливинилпирролидона, либо глицерола, либо их комбинации.
2. Имплантат на основе полученных с помощью сверхкритического диоксида углерода частиц поликапролактона размером 100-150 мкм, импрегнированных рекомбинантным человеческим FGF2, либо PDGF, либо VEGF, либо NGF, либо IGF1, либо BDNF и аутогенных, либо аллогенных мультипотентных стромальных клеток в среде введения, состоящей из гипромеллозы, либо карбоксиметилцеллюлозы, либо гиалуроната натрия, либо поливинилпирролидона, либо глицерола, либо их комбинации.
Для получения указанного результата предложен способ получения инъекционной формы имплантата, включающий в себя: (вариант 1) этап монолитизации поликапролактона с помощью сверхкритичной флюидной технологии (СКФ), этап измельчения монолита поликапролактона и отбора фракции 100-150 мкм, этап переноса поликапролактоновых частиц в среду введения, либо (вариант 2) этап монолитизации и импрегнации ростовым фактором поликапролактона с помощью сверхкритичной флюидной технологии (СКФ), этап измельчения монолита поликапролактона и отбора фракции 100-150 мкм, этап получения клеточной культуры мультипотентных стромальных клеток (МСК) человека, этап соединения клеточного и матричного компонентов конструкции, этап переноса поликапролактоновых частиц с адгезированными на них клетками в среду введения.
Поли-ε-капролактон - частично-кристаллический полимер, который получают в реакциях полимеризации с раскрытием цикла из капролактона, используя анионный, катионный катализ или в процессе свободно-радикальной полимеризации открытого типа из 2-метилен-1,3-диокзепана. В изобретении использован низкомолекулярный поли-ε-капролактон (Sigma-Aldrich), Mw~14000 с температурой стеклования в диапазоне 55-60°С.
Для СКФ-монолитизации поли-ε-капролактона используют диоксид углерода ОСЧ, ГОСТ 8050-85 (Балашихинский кислородный завода).
Для СКФ-синтеза поликапролактоновых микрочастиц применяют метод СКФ-монолитизации с последующим криоизмельчением.
Мелкодисперсный порошок поли-ε-капролактона помещают в тефлоновую кассету (пресс-форму) 4×5×20 мм3, которую загружают в камеру высокого давления лабораторной установки. Камеру уплотняют, продувают и заполняют СО2 при комнатной температуре до давления 10 МПа. После этого включают нагрев, и температура камеры возрастает до 32°С. По мере разогрева камеры давление в ней постепенно увеличивается, и при достижении температуры 32°С, рабочее давление устанавливается в диапазоне от 10 до 20 МПа. Всю систему выдерживают при этих условиях в течение 120 минут, достаточных для полной пластификации содержимого пресс-формы, и производят сброс давления до атмосферного значения. Полученный продукт выдерживают в атмосферных условиях в течение 12 часов для полного удаления СО2 из полимера, полученный отвержденный материал извлекают из кассеты.
В связи с высокой вязкостью и пластичностью измельчение поли-ε-капролактона проводят в лабораторной криомельнице ударного типа при 1500 об/мин. Для криоизмельчения допускается использование жидкого азота: гранулы предварительно охлаждают в среде жидкого азота в течение 3-5 минут, после чего навеску (10 г) загружают в мельницу с одновременным введением 100-200 мл жидкого азота и перемалывают в течение 5 минут. Для криоизмельчения также допускается использование сухого льда: гранулы охлажденного до -18°С полимера вместе с мелкоколотым (3-5 мм3) сухим льдом засыпают в мельницу и перемалывают полученную смесь в течение 10 минут.
Для получения фракции поликапролактоновых частиц размером 100-150 мкм используют калиброванные сита. Верхняя граница обусловлена внутренним диаметром иглы 20G (603 мкм), которую можно использовать для инъекционного введения имплантата. Нижняя граница обусловлена требованиями к размеру частиц (не менее 80 мкм) для предотвращения их миграции после трансплантации [1].
Полученные поликапролактоновые частицы переносят в среду введения из расчета 30-100 мг частиц на 1 мл среды. В качестве среды введения используют раствор гипромеллозы, либо карбоксиметилцеллюлозы, либо гиалуроната натрия, либо поливинилпирролидона, либо глицерола, либо их комбинации вязкостью не менее 1000 ср (centipoise = мПа⋅с) при 25°С.
Для получения частиц поли-ε-капролактона, импрегнированных факторами роста, перед монолитизацией навеску поликапролактоновых частиц пропитывают водным раствором FGF2, либо PDGF, либо VEGF, либо NGF, либо IGF1, либо BDNF из расчета 1 нг фактора на 1 мг частиц. Далее получение микрочастиц проводят аналогично описанному выше способу.
В качестве клеточного компонента имплантата используют мультипотентные стромальные клетки (МСК), выделенные из вартонова студня пупочного канатика, либо жировой ткани, либо другой ткани-источника МСК человека. Материал отмывают от крови, с помощью хирургических инструментов удаляют эпителий и кровеносные сосуды, оставшуюся ткань измельчают. Используют ферментативный метод изолирования клеток из ткани: инкубация в растворе, содержащем по 200 Ед/мл коллагеназ I и II типов (ПанЭко), в течение 40 минут при 37°С. Полученную суспензию клеток отмывают от ферментов и рассаживают в культуральную посуду без дополнительной обработки подложки из расчета 3 тысячи клеток в 1 мл среды. Для культивирования используют среду DMEM/F12 (ПанЭко) с добавлением эмбриональной телячьей сыворотки (РАА) до 10%. После достижения субконфлуентного монослоя клетки открепляют от подложки раствором трипсина-ЭДТА (ПанЭко) и переносят в новую культуральную посуду. В изобретении допускается использование клеточной культуры, прошедшей не более 4 пассажей.
Для верификации принадлежности используемых клеток к МСК в соответствии с требованиями ISCT (International Society for Cellular Therapy) [32] подтверждают
1) способность клеток к росту на необработанной культуральной подложке;
2) специфический профиль экспрессии поверхностных антигенов (CD73+, CD90+, CD105+, CD45-, CD34-, CD11b-, CD19-, HLA-DR-;
3) способность клеток к дифференцировке в адипогенном, хондрогенном или остеогенном направлении in vitro под действием индукторов.
Для соединения клеточного и матричного компонентов конструкции поликапролактоновые частицы и суспензию МСК (30-100 мг частиц и 5 млн клеток в 1 мл среды) переносят в пробирки-биореакторы (SPL), которые размещают на орбитальном шейкере (BioSan) в СО2-инкубаторе. После инкубирования в течение 1-3 суток частицы с адгезированными на них клетками осаждают центрифугированием и переносят в среду введения аналогично описанному выше способом.
Пример 1. Получение и характеристика инъекционного имплантата
Стандартизация полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона
Изучение морфологии поверхности поликапролактоновых частиц методом сканирующей электронной микроскопии (СЭМ) проводили с помощью микроскопа LEO 1450 (Zeiss). Для этого исследуемые образцы помещали на проводящую (углеродную) клейкую ленту, на которую затем методом плазменного напыления наносили тонкую (0,05-0,1 мкм) пленку золота, обеспечивающую требуемую электропроводность их поверхности. Результаты СЭМ анализа микроструктур, полученных из поли-ε-капролактона при давлении диоксида углерода в камере высокого давления 13 МПа и температуре 32°С, позволили определить, что каждая отдельно взятая частица полученных мелкодисперсных порошков имеет сложную составную структуру микронного масштаба (фигура 1). Это является свидетельством того, что в результате процессов СКФ пластификации алифатического полиэфира и последующего "вспенивания" при резком сбросе давления СО2, вызывающего мелкомасштабные механические пертурбации всей системы, происходит эффективное образование высокопористых структур.
Эффективность отбора фракции поликапролактоновых частиц размером 100-150 мкм проводили с помощью обсчета темнопольных микрофотографий с помощью программного обеспечения LAS AF v.3.1.0 build 8587 (Leica Microsystems) (фигура 2). По результатам анализа более 98% частиц попадает в заданный размерный интервал, что обеспечивает беспрепятственное инъекционное введение имплантата и сводит к минимуму возможность миграции частиц из области трансплантации.
Определение динамики высвобождения ростового фактора (FGF2) из поликапролактоновых частиц в условиях in vitro
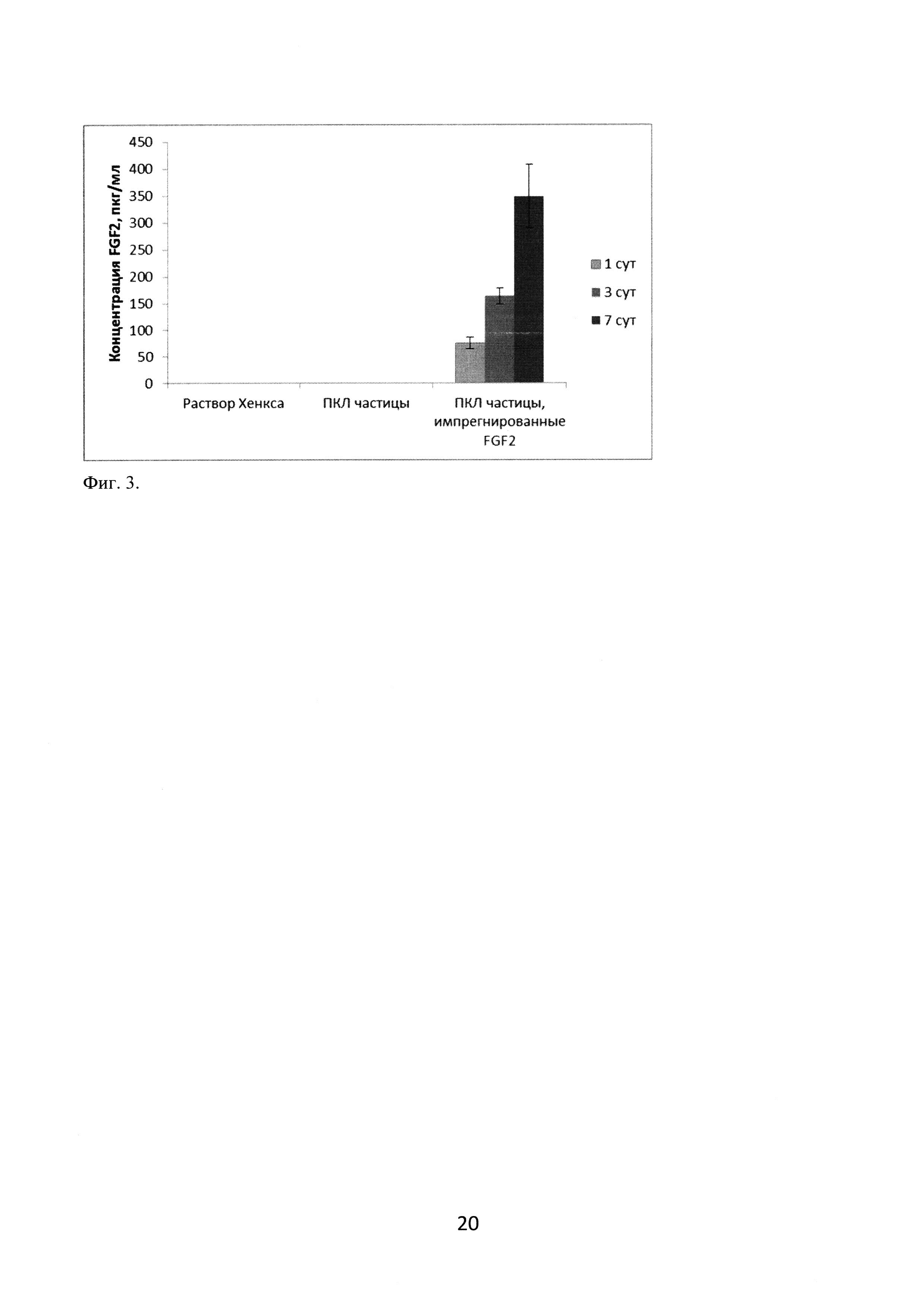
Для оценки динамики высвобождения FGF2 из поликапролактоновых частиц использовали набор для ИФА-определения FGF2 (BioLegend) с чувствительностью 4 пг/мл. Для этого навеску импрегнированных FGF2 (PAN-Biotech) частиц (7 мг) переносили в лунку, содержащую 200 мкл раствора Хенкса (ПанЭко), и помещали в CO2-инкубатор на 7 суток. В качестве контрольных использовали лунки, содержащие навеску неимпрегнированных фактором роста поликапролактоновых частиц в растворе Хенкса, или лунки только с раствором Хенкса. Анализ результатов (фигура 3) показал, что в условиях in vitro в водном растворе происходит постепенное накопление FGF2 за счет высвобождения фактора из импрегнированных микрочастиц.
Характеристика МСК человека
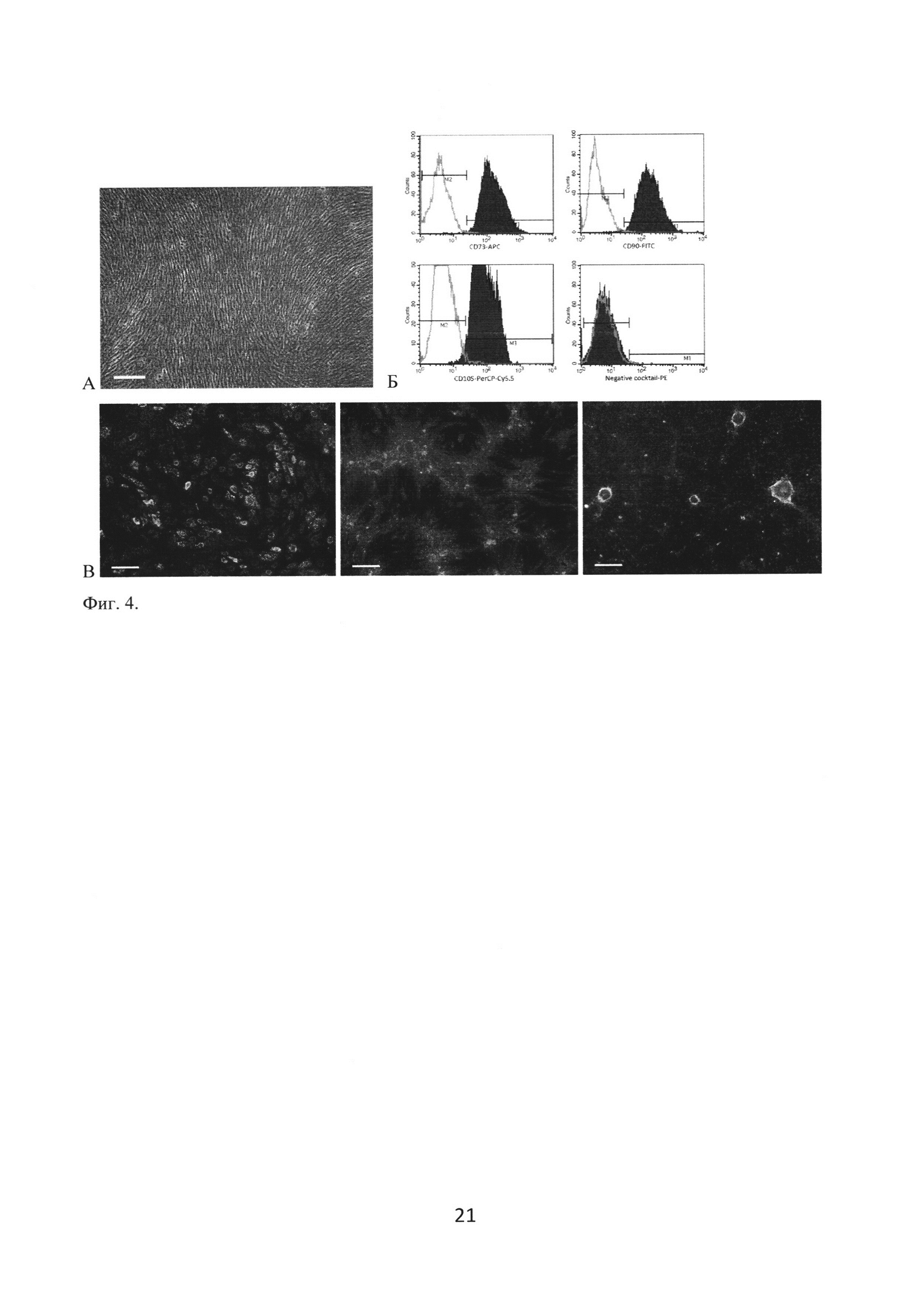
МСК человека выделяли из вартонова студня пупочного канатика ферментативным методом, в качестве ростовой среды использовали DMEM/F12 с добавлением эмбриональной телячьей сыворотки до 10%. Для анализа иммунофенотипа использовали BD Stemflow™ hMSC Analysis Kit (BD). Анализ проводили на цитофлуориметре FACS Calibur с помощью программы Cell Quest (BD). Для направленной дифференцировки in vitro использовали готовые среды StemPro® Adipogenesis Differentiation Kit, Osteogenesis Differentiation Kit или Chondrogenesis Differentiation Kit (Gibco), верификацию дифференцировки проводили общепринятыми гистохимическими методами. Проведенная характеристика культур (фигура 4) подтверждает их принадлежность к мультипотентым стромальным клеткам.
Исследование биосовместимости полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона in vitro
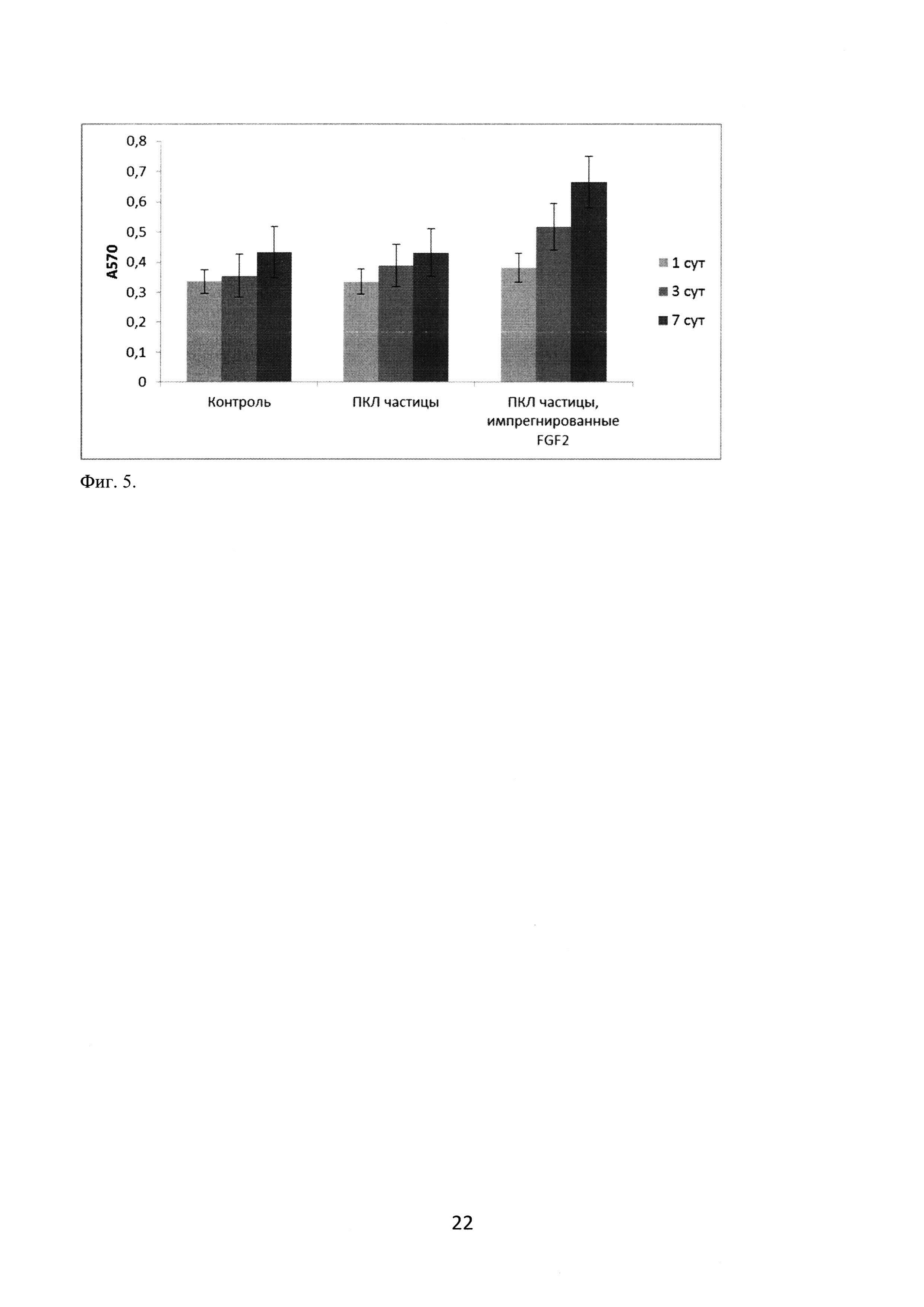
Исследование влияния полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона на жизнеспособность МСК пупочного канатика проводили с помощью колориметрического МТТ-теста. К МСК пупочного канатика, культивируемым в лунках 96-луночного планшета, добавляли нативные или импрегнированные FGF2 поликапролактоновые частицы (7 мг частиц на 200 мкл среды). После инкубации в течение 1, 3 или 7 суток частицы удаляли, в лунки вносили МТТ (Sigma-Aldrich) до конечной концентрации 1,5 мг/мл и инкубировали в течение 2 часов при 37°С. Появление кристаллов формазана визуализировали с помощью инвертированного микроскопа (Zeiss). После удаления среды в лунки вносили 100 мкл диметилсульфоксида (Sigma-Aldrich), инкубировали 15 минут (режим «встряхивание») и измеряли оптическую плотность (λ=570 нм) с помощью спектрофотометра Multiskan GO (ThermoFisher Scientific). Результаты MTT-теста показали, что поликапролактоновые носители, не импрегнированные белком FGF2, не оказывали значимого влияния на МСК пупочного канатика человека, а поликапролактоновые частицы, импрегнированные FGF2, значимо повышали детектируемую с помощью теста суммарную активность сукцинатдегидрогеназы митохондрий клеток на 7 сутки (фигура 5). Таким образом, нативные поликапролактоновые частицы не обладают цитотоксическими свойствами по отношению к МСК пупочного канатика (оценка «0 - нецитотоксичен» по шкале цитотоксичности в соответствии с ГОСТ Р ИСО 10993-5-2009), а высвобождение ростового фактора FGF2 из импрегнированных частиц стимулирует пролиферативную активность данных клеток.
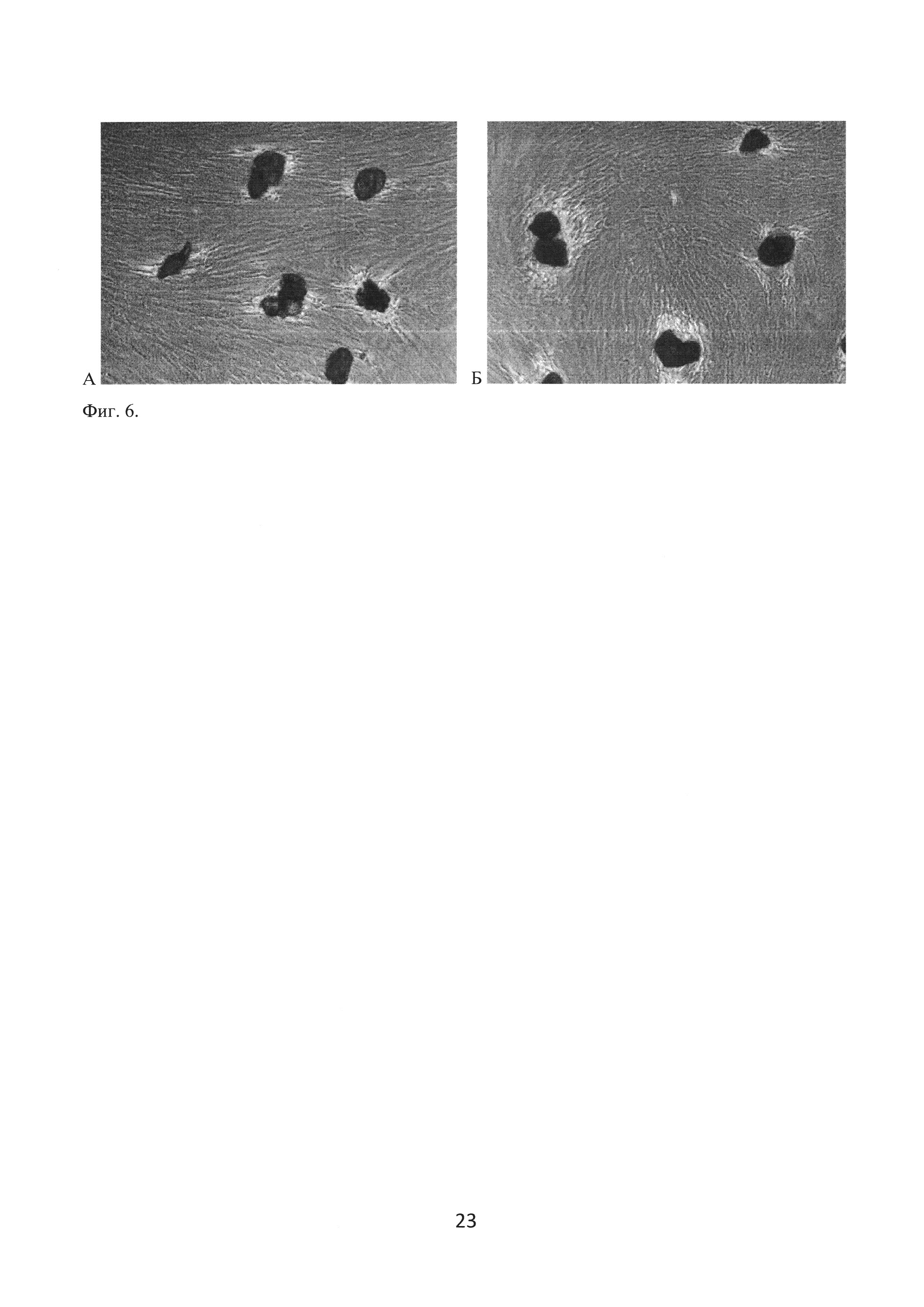
Оценку биосовместимости полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона проводили также методом прямого контакта. Для этого частицы добавляли к суспензии МСК пупочного канатика и переносили в культуральную посуду. Результаты исследования показали, что прямой контакт частиц и клеток не препятствовал экспансии клеточной культуры и не оказывал цитопатического действия. На 7 сутки сокультивирования во всех случаях наблюдали активное обрастание микрочастиц клетками, вследствие которого последние оказывались прикрепленными к подложке (фигура 6). На основании полученных данных можно предположить, что активное заселение микрочастиц резидентными клетками будет продолжаться в условиях in vivo.
Заселение поликапролактоновых частиц мультипотентными стромальными клетками
Для соединения клеточного и матричного компонентов конструкции поликапролактоновые частицы, импрегнированные FGF2, и суспензию МСК пупочного канатика (30-100 мг частиц и 5 млн клеток в 1 мл среды) переносили в пробирки-биореакторы (SPL), которые размещали на орбитальном шейкере (BioSan) (режим - 75 об/мин) в СО2-инкубаторе. После инкубирования в течение 1-3 суток частицы с адгезированными на них клетками осаждали центрифугированием (500 об/мин, 5 мин). Для количественной оценки адгезии клетки фиксировали 2% параформальдегидом (Serva) и окрашивали DAPI (Sigma-Aldrich) (фигура 7). С помощью программного обеспечения LAS AF v.3.1.0 build 8587 (Leica Microsystems) подсчитывали количество адгезированных клеток, нормированное на единицу площади поверхности, которое составило 455,7±28,1 клеток/мм2.
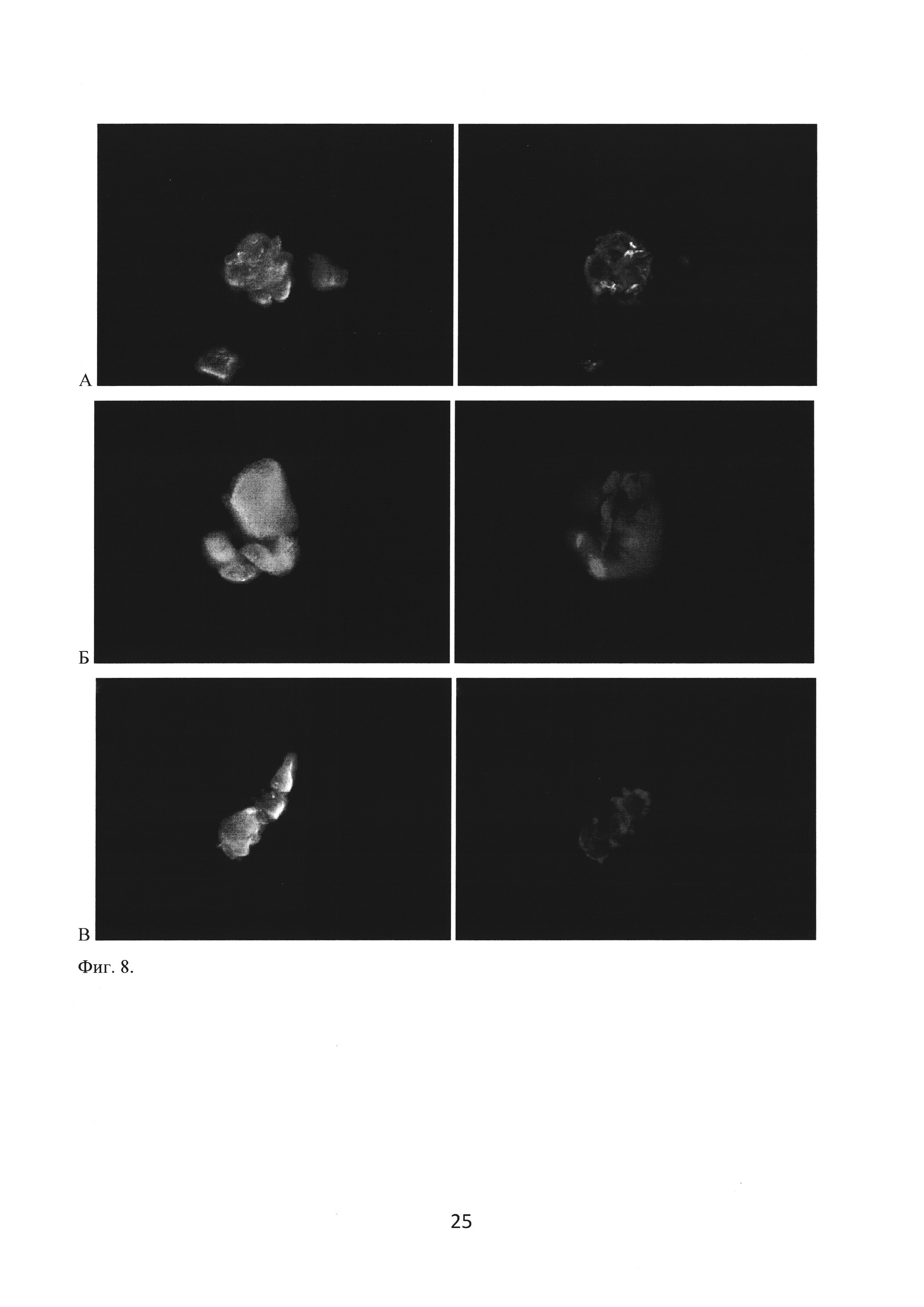
Для оценки влияния частиц, импрегнированных FGF2, на свойства адгезированных на их поверхности МСК пупочного канатика клетки непосредственно на носителе окрашивали с антителами к положительным маркерам МСК CD90, CD73 и CD105 (фигура 8).
Результаты исследования показали, что МСК пупочного канатика способны эффективно заселять полученные с помощью сверхкритической флюидной технологии поликапролактоновые частицы, импрегнированные FGF2, при сохранении специфического иммунофенотипа.
Соединение поликапролактоновых частиц и среды введения
Получение суспензии поликапролактоновых частиц в вязкой среде введения происходило без каких-либо затруднений: даже при высокой концентрации (более 100 мг на 1 мл) частицы не образовывали конгломератов (фигура 9).
Пример 2. Оценка эффективности инъекционного имплантата на модели стрессового недержания мочи
Исследование проводили на половозрелых самках крыс Sprague Dawley массой 250-320 г. Перед проведением эксперимента у всех самок регистрировали базовый уровень LPP - leak point pressure, давление в мочевом пузыре, необходимое для истечения первой капли мочи. Для моделирования стрессового недержания мочи животным делали двусторонние надрезы над большой ягодичной мышцей, препарировали ягодичную мышцу, обеспечивая доступ к нервным отросткам, отходящим от седалищного нерва. При помощи электрокоагулятора (мощность 50 ЕД) коагулировали нервные отростки, среди которых находился и половой нерв, в течение 10-15 с.
На 7 сутки после оперативного вмешательства у крыс измеряли LPP, после чего периуретрально вводили 0,9% раствор NaCl (группа сравнения 1), объемообразующий препарат «Уродекс» (группа сравнения 2), поликапролактоновые частицы в 8% растворе гипромеллозы (экспериментальная группа 1) или поликапролактоновые частицы, импрегнированные FGF2, с адгезированными на них МСК пупочного канатика (экспериментальная группа 2). Введение осуществляли в 3-4 точки вокруг уретры, объем введения составил 100 мкл.
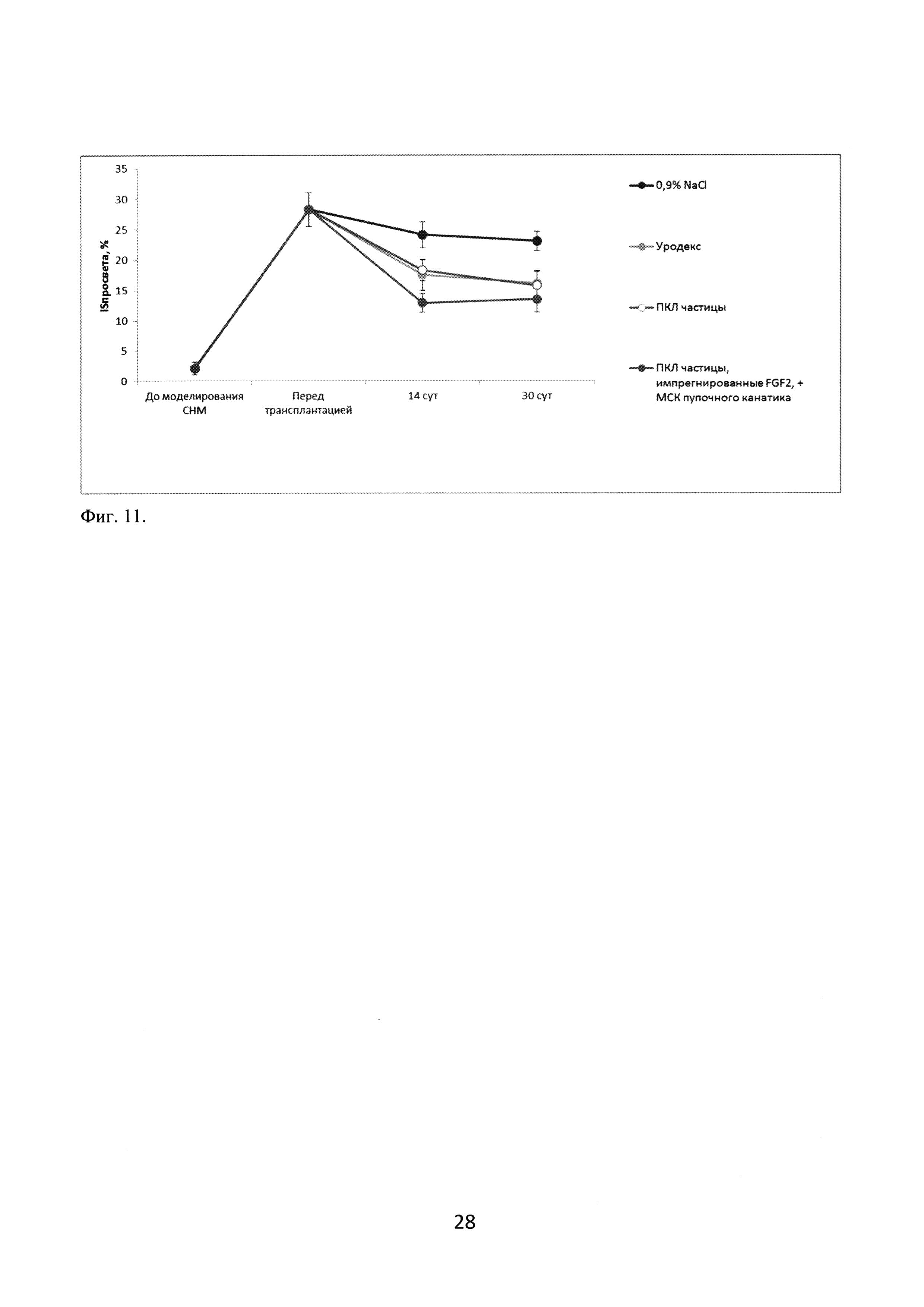
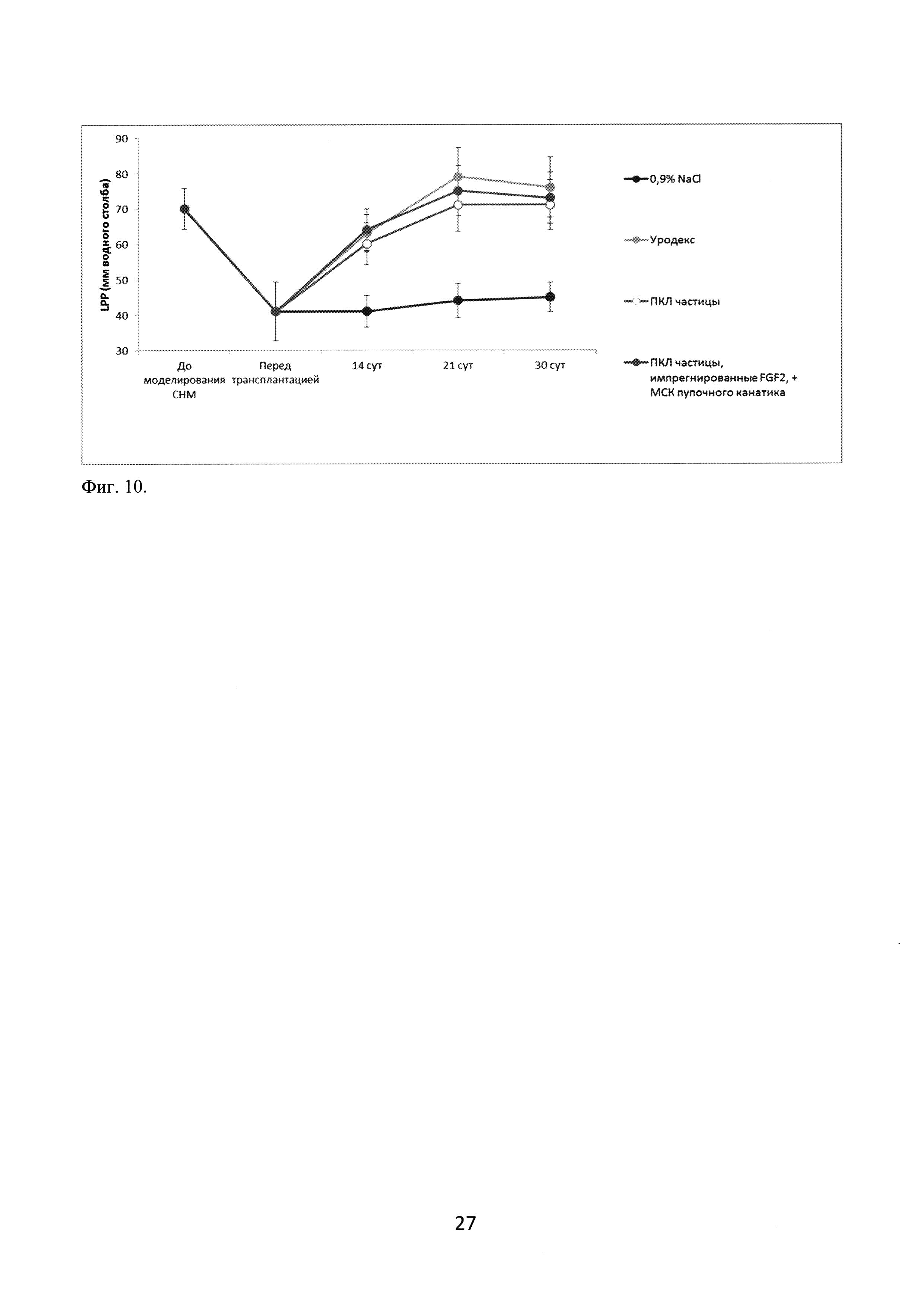
LPP измеряли на 14, 21 и 30 сутки после моделирования стрессового недержания мочи. Результаты измерений показали резкое снижение LPP после повреждения полового нерва, что подтверждает релевантность выбранной экспериментальной модели. В группе сравнения с введением 0,9% раствора NaCl значение LPP оставалось низким на протяжении всего эксперимента. В группах с введением объемообразующих препаратов LPP начинал повышаться на 7 сутки после трансплантации (14 сутки после повреждения нерва) и возвращался к исходным показателям на 14 сутки после трансплантации (21 сутки после операции), оставаясь на том же уровне и далее (фигура 10).
Часть животных выводили из эксперимента на 7 сутки после двустороннего повреждения полового нерва с целью верификации используемой модели, животных групп сравнения и экспериментальных групп - на 14 и 30 сутки после повреждения. Осуществляли забор уретры вместе с мочевым пузырем, материал помещали в 10% раствор формалина, затем заливали в парафин и делали серийные поперечные срезы толщиной 5-7 мкм на 15 уровнях от дистального конца уретры до шейки мочевого пузыря. Препараты окрашивали гематоксилином и эозином. Для морфометрического исследования измеряли площадь просвета уретры (Sпросвета) и площадь области уретры в пределах наружного периметра циркулярного (наружного) мышечного слоя (Sуретры). Рассчитывали индекс площади просвета уретры (ISпросвета) как отношение (Sпросвета/Sуретры)100%. Результаты измерений показали резкое увеличение ISпросвета после повреждения полового нерва, что подтверждает релевантность выбранной экспериментальной модели. В группе сравнения с введением 0,9% раствора NaCl значение ISпросвета оставалось высоким на протяжении всего эксперимента. В группах с введением объемообразующих препаратов ISпросвета начинал понижаться на 7 сутки после трансплантации (14 сутки после повреждения нерва), однако не возвращался к исходным показателям до окончания эксперимента (30 сутки после операции). При этом на 14 сутки максимальное улучшение было зарегистрировано в группе с введением тканеинженерной конструкции на основе поликапролактоновых частиц, импрегнированных FGF2, и МСК пупочного канатика, хотя на 30 сутки значимых различий между группами с введением объемообразующих средств не было обнаружено (фигура 11).
При морфологическом исследовании, выполненном на окрашенных гематоксилином и эозином срезах проксимальной и средней третей уретры, отмечали нормальное строение органа: отсутствие истончения циркулярного слоя мышц, четко визуализируемый просвет, отсутствие соединительнотканной капсулы в месте трансплантации. В периуретральной области на отдаленных сроках выявляли участки с частицами поликапролактона (фигура 12), признаков миграции частиц из области введения обнаружено не было.
С помощью флуоресцентной микроскопии было показано, что адгезированные на поверхности поликапролактоновых частиц МСК пупочного канатика, несущие витальную метку РКН26 (Sigma-Aldrich), также не мигрируют из области трансплантации. При этом иммуногистохимическое исследование не подтвердило дифференцировку МСК в гладкомышечные или скелетномышечные клетки (фигура 13). Таким образом, заместительный механизм не является ведущим в реализации терапевтического потенциала МСК в составе инъекционного имплантата для лечения стрессового недержания мочи.
Таим образом, данные физиологического, морфологического и морфометрического исследований подтверждают эффективность применения инъекционного имплантата на основе полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона размером 100-150 мкм либо на основе полученных с помощью сверхкритической флюидной технологии частиц поли-ε-капролактона размером 100-150 мкм, импрегнированных FGF2, и МСК пупочного канатика на модели стрессового недержания мочи.
Список использованных источников
1. Smith's Textbook of Endourology. Edited by: Arthur D. Smith. ВС Decker Inc. Hamilton, 2007.
2. Pickard R., Reaper J., Wyness L., et al. Periurethral injection therapy for urinary incontinence in women. Cochrane Database Syst Rev. 2003; (2): CD003881.
3. Rovner E.S., Wein A.J. Treatment options for stress urinary incontinence. Rev. Urol. 2004; 6 (Suppl. 3): S29-47.
4. Dmochowski RR, Appell RA. Injectable agents in the treatment of stress urinary incontinence in women: where are we now? Urology. 2000 Dec 4; 56(6 Suppl 1):32-40.
5. Davis NF, Kheradmand F, Creagh T. Injectable biomaterials for the treatment of stress urinary incontinence: their potential and pitfalls as urethral bulking agents. Int Urogynecol J. 2013 Jun; 24(6):913-9. Doi: 10.1007/s00192-012-2011-9.
6. Degradation Rate of Bioresorbable Materials: Prediction and Evaluation. Edited by F.Buchanan. 2008. Woodhead Publishing Limited. Cambridge, England.
7. Saralidze K, Koole LH, Knetsch ML. Polymeric Microspheres for Medical Applications. Materials 2010, 3, 3537-3564; doi:10.3390/ma3063537.
8. Woodruff M.A., Hutmacher D.W. The return of a forgotten polymer-polycaprolactone in the 21st century. Prog. Polym. Sci. 2010; 35: 1217-56.
9. Brugmans M.M., Soekhradj-Soechit R.S., van Geemen D. et al. Superior Tissue Evolution in Slow-Degrading Scaffolds for Valvular Tissue Engineering. Tissue Eng. Part A. 2016; 22(1-2): 123-32.
10. Tai H., Popov V.K., Shakesheff K.M., Howdle S.M. Putting the fizz into chemistry: applications of supercritical carbon dioxide in tissue engineering, drug delivery and synthesis of novel block copolymers. Biochemical Society Transactions 2007; 35: 516-521.
11. McHugh M.A., Krukonis Val J. Supercritical fluid extraction: Principles and practice; - Boston, MA, Butterworth-Heinemann, 2-d edition, 1994.
12. Гумеров Ф.М., Сабирзянов A.H., Гумерова Г.И. Суб- и сверхкритические флюиды в процессах переработки полимеров; - Казань: Фэн, 2000.
13. Oh SH, Bae JW, Kang JG, Kim IG, Son JY, Lee JY, Park KD, Lee JH. Dual growth factor-loaded in situ gel-forming bulking agent: passive and bioactive effects for the treatment of urinary incontinence. J Mater Sci Mater Med. 2015 Jan; 26(l):5365. Doi: 10.1007/s10856-014-5365-3.
14. Sumino Y, Yoshikawa S, Mori K, Mimata H, Yoshimura N. IGF-1 as an Important Endogenous Growth Factor for Recovery from Impaired Urethral Continence Function in Rats with Simulated Childbirth Injury. J Urol. 2016 Jun; 195(6):1927-35. Doi: 10.1016/j.juro.2015.12.087.
15. Song QX, Chermansky С J, Birder LA, Li L, Damaser MS. Brain-derived neurotrophic factor in urinary continence and incontinence. Nat Rev Urol. 2014 Oct;l l(10):579-88. Doi: 10.103 8/nrurol.2014.244.
16. Cape S.P., Villa J.A., Huang E.T., Yang Т.Н., Carpenter J.F., Sievers R.E. Preparation of active proteins, vaccines and pharmaceuticals as fine powders using supercritical or near-critical fluids. Pharmaceutical Research, Expert Review 2008; 25: 1967-1990.
17. Mangera A, Bullock AJ, Roman S, Chappie CR, MacNeil S. Comparison of candidate scaffolds for tissue engineering for stress urinary incontinence and pelvic organ prolapse repair. BJU Int. 2013 Sep; 112(5):674-85.Doi: 10.111 l/bju.12186.
18. Roman Regueros S, Albersen M, Manodoro S, Zia S, Osman N1, Bullock AJ, Chappie CR, Deprest J, MacNeil S. Acute in vivo response to an alternative implant for urogynecology. Biomed Res Int. 2014; 2014:853610. Doi: 10.1155/2014/853610.
19. Kim BS, Chun SY, Lee JK, Lim HJ, Bae JS, Chung HY, Atala A, Soker S, Yoo JJ, Kwon TG. Human amniotic fluid stem cell injection therapy for urethral sphincter regeneration in an animal model. BMC Med. 2012 Aug 21;10:94. Doi: 10.1186/1741-7015-10-94.
20. Kim SO, Na HS, Kwon D, Joo SY, Kim HS, Ann Y. Bone-marrow-derived mesenchymal stem cell transplantation enhances closing pressure and leak point pressure in a female urinary incontinence rat model. Urol Int. 2011; 86(1):110-6. Doi: 10.1159/000317322.
21. Boissier R, Karsenty G. Cellular therapy and urinary incontinence. Prog Urol. 2012 Jul; 22(8):454-61. Doi: 10.1016/j.purol.2012.04.008.
22. Dissaranan C, Cruz MA, Couri BM, Goldman HB, Damaser MS. Stem cell therapy for incontinence: where are we now? What is the realistic potential? Curr Urol Rep.2011 Oct; 12(5):336-44. Doi: 10.1007/s 11934-011-0210-4.
23. Sadeghi Z, Isariyawongse J, Kavran M, Izgi K2, Marini G, Molter J, Daneshgari F, Flask CA, Caplan A, Hijaz A. Mesenchymal stem cell therapy in a rat model of birth-trauma injury: functional improvements and biodistribution. Int Urogynecol J. 2016 Feb;27(2):291-300. Doi: 10.1007/s00192-015-2831-5.
24. Deng K, Lin DL, Hanzlicek B, Balog B, Penn MS, Kiedrowski MJ, Hu Z, Ye Z, Zhu H, Damaser MS. Mesenchymal stem cells and their secretome partially restore nerve and urethral function in a dual muscle and nerve injury stress urinary incontinence model. Am J Physiol Renal Physiol. 2015 Jan 15; 308(2):F92-F100. Doi: 10.1152/ajprenal.00510.2014.
25. Arutyunyan I, Elchaninov A, Makarov A, Fatkhudinov T. Umbilical Cord as Prospective Source for Mesenchymal Stem Cell-Based Therapy. Stem Cells Int. 2016; 2016:6901286. Doi: 10.1155/2016/6901286.
26. El Omar R, Beroud J, Stoltz JF, Menu P, Velot E, Decot V. Umbilical cord mesenchymal stem cells: the new gold standard for mesenchymal stem cell-based therapies? Tissue Eng Part В Rev. 2014 Oct; 20(5):523-44. Doi: 10.1089/ten.TEB.2013.0664.
27. Wu H, Du S, Lu Y, Li Y, Wang D. The application of biomedical polymer material hydroxypropyl methyl cellulose(HPMC) in pharmaceutical preparations. J. Chem. Pharm. Res., 2014, 6(5):151-160.
28. Cena RB, Park JG, Kim HJ, Son KY, Kim DS, Kang MI, Park SI, Moon du G, Yang DY, Yu DS, Lee JI, Cho КО. Effects of crosslinked dextran in hydroxylpropyl methylcellulose on soft tissue augmentation in rats. J Biomed Mater Res В Appl Biomater. 2014 Jan; 102(1):131-40. Doi: 10.1002/jbm.b.32989.
29. Sannino A, Esposito A, De Rosa A, Cozzolino A, Ambrosio L, Nicolais L. Biomedical application of a superabsorbent hydrogel for body water elimination in the treatment of edemas. J Biomed Mater Res A. 2003 Dec 1; 67(3): 1016-24.
30. Kim H, Jeong H, Han S, Beack S, Hwang BW, Shin M, Oh SS, Hahn SK. Hyaluronate and its derivatives for customized biomedical applications. Biomaterials. 2017 Apr; 123:155-171. Doi: 10.1016/j.biomaterials.2017.01.029.
31. Liu X, Xu Y, Wu Z, Chen H. Poly(N-vinylpyrrolidone)-modified surfaces for biomedical applications. Macromol Biosci. 2013 Feb; 13(2): 147-54. Doi: 10.1002/mabi.201200269.
32. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop Dj, Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006; 8(4):315-7.
Подписи к фигурам
Фиг. 1. СЭМ микрофотографии поликапролактоновых частиц после СКФ-монолитизации и криоизмельчения (А) или после СКФ-монолитизации и импрегнации FGF2 и криоизмельчения (Б).
Фиг. 2. Темнопольные микрофотографии поликапролактоновых частиц (А) и поликапролактоновых частиц, импрегнированных FGF2 (Б), после калибрования. Маркер масштаба 100 мкм.
Фиг. 3. Динамика высвобождения FGF2 из импрегнированных поликапролактоновых частиц.
Фиг. 4. Характеристика МСК пупочного канатика. А - Внешний вид культуры клеток. Фазово-контрастная микроскопия, маркер масштаба 200 мкм. Б - Профиль экспрессии поверхностных антигенов. В - Индуцированная дифференцировка in vitro в адипогенном (слева), остеогенном (в центре) и хондрогенном (справа) направлениях. Темнопольная микроскопия, маркер масштаба 200 мкм.
Фиг. 5. Оценка цитотоксичности поликапролактоновых частиц и поликапролактоновых частиц, импрегнированных FGF2, с помощью МТТ-теста. Данные представлены в виде (сред.±ст.откл.).
Фиг. 6. Оценка цитотоксичности поликапролактоновых частиц (А) и поликапролактоновых частиц, импрегнированных FGF2 (Б), методом прямого контакта. Фазово-контрастная микроскопия, ×50.
Фиг. 7. Прикрепление МСК пупочного канатика к поверхности поликапролактоновых частиц, импрегнированных FGF2. Ядра клеток докрашены DAPI. Совмещение темнопольной и флуоресцентной микроскопии, ×100.
Фиг. 8. Сохранение экспрессии положительных маркеров МСК CD73 (A), CD90 (Б) и CD 105 (В) при культивировании клеток на поверхности поликапролактоновых частиц, импрегнированных FGF2. Ядра клеток докрашены DAPI. Темнопольная (слева) и флуоресцентная микроскопия, ×100.
Фиг. 9. Соединение поликапролактоновых частиц и среды введениея (8% гипромеллозы) в концентрациях 35 мг/мл (А) и 100 мг/мл (Б). Фазово-контрастная микроскопия, ×50.
Фиг. 10. Оценка эффективности применения инъекционного имплантата на модели стрессового недержания мочи: динамика LPP.
Фиг. 11. Оценка эффективности применения инъекционного имплантата на модели стрессового недержания мочи: динамика ISпросвета.
Фиг. 12. Локализация поликапролактоновых частиц (А) или поликапролактоновых частиц, импрегнированных FGF2, с адгезированными на них МСК пупочного канатика (Б) в периуретралыюй области на 7 сутки после трансплантации. Окрашивание гематоксилином и эозином. Светлопольная микроскопия, ×50.
Фиг. 13. Трансплантация инъекционного имплантата на основе поликапролактоновых частиц, импрегнированных FGF2, и МСК пупочного канатика, несущих витальную метку РКН26 (красное свечение), в периуретральную область. 30 сутки после введения. Гладкомышечная ткань окрашена с антителами к αSMA (зеленое свечение, А), скелетная мышечная ткань окрашена с антителами к Troponin I (зеленое свечение, Б). Ядра клеток докрашены DAPI. Флуоресцентная микроскопия, ×10 (слева) и ×20 (справа).