Результат интеллектуальной деятельности: (3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью
Вид РИД
Изобретение
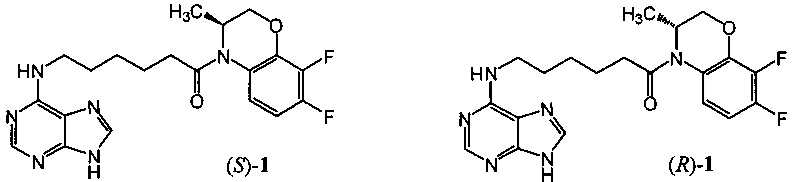
Изобретение относится к области органической химии, а именно к новым производным пурина - (3S)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазину ((S)-1) и (3R)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазину ((R)-1), которые обладают противовирусной активностью, в первую очередь в отношении вируса простого герпеса, тип 1 (ВПГ-1), и могут найти применение в медицине и ветеринарии.
Инфекции, вызываемые вирусами простого герпеса (ВПГ), имеют широчайшее распространение во всем мире: по последним оценкам ВОЗ (Информационный бюллетень №400, январь 2016 г.) [http://www.who.int/mediacentre/factsheets/fs400/ru/] 67% населения Земного шара в возрасте до 50 лет (около 3,7 миллиарда человек) инфицированы ВПГ 1-го типа (ВПГ-1), а инфицированность ВПГ 2-го типа (ВПГ-2) составляет 11% или около 417 миллионов человек в возрасте от 15 до 49 лет. Обе формы ВПГ устанавливают пожизненную периодически рецидивирующую латентную инфекцию. Контагенозность герпетической инфекции (ГИ) не только в период наличия симптомов, но и в их отсутствие обусловливает постепенное увеличение показателя инфицированности для старших возрастных групп населения [Smith J.S., Robinson N.J. Age-specific prevalence of infection with herpes simplex virus types 2 and 1: a global review // J. Infect. Dis. 2002, V. 186 (Suppl. 1), S3-S28; Diaz-Ramon J.L.,  J.L. Skin diseases with high public health impact. Herpes simplex and zoster // Eur. J. Dermatol. 2008, V. 18(1), 108-111].
J.L. Skin diseases with high public health impact. Herpes simplex and zoster // Eur. J. Dermatol. 2008, V. 18(1), 108-111].
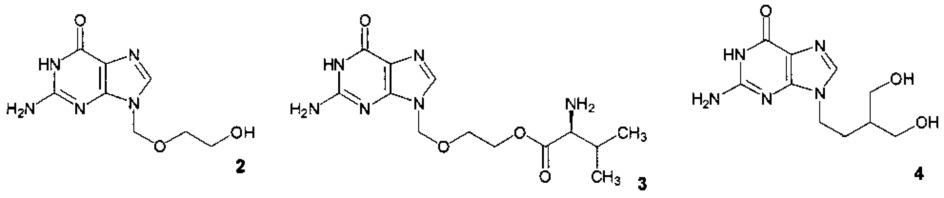
К этиотропным противогерпетическим препаратам первого ряда, используемым в медицинской практике для лечения и предотвращения рецидивов ГИ, вызываемых ВПГ, относятся модифицированный нуклеозид ацикловир (2) (зовиракс, 9-[(2-гидроксиэтокси)метил]гуанин), его производные (3, валацикловир) и аналоги (4, пенцикловир; фамцикловир) [Kimberlin D.W., Whitley R.J. Antiviral therapy of HSV-1 and -2 // In: Arvin A., Campadelli-Fiume G., Mocarski E., Moore P.S., Roizman В., Whitley R., Yamanishi K., eds. Human herpesviruses: biology, therapy, and immuno-prophylaxis. Cambridge, UK: Cambridge University Press; 2007: 1141-1160; Галегов Г.А., Андронова В.Л., Колобухина Л.В., Львов Н.Д. Специфическая лекарственная терапия распространенных и социально значимых вирусных инфекций человека // Вопросы вирусологии 2012, № S1, 180-189].
Одним из факторов, лимитирующих применение этой группы препаратов, является развитие лекарственной резистентности у ВПГ. У иммунокомпетентных пациентов частота выделения таких штаммов ВПГ составляет в среднем 0.5%. В группе иммунокомпромиссных больных этот показатель существенно выше и колеблется в диапазоне 2-36%. Изоляция таких штаммов часто коррелирует с неэффективностью проводимого лечения. Известны случаи, когда с устойчивыми к ацикловиру вариантами ВПГ были ассоциированы тяжелые клинические формы ГИ (пневмония, менингоэнцефалит, обширные кожно-слизистые поражения и др.), приведшие в ряде случаев к смерти больного [Marks G.L., Nolan Р.Е., Erlich K.S., Ellis M.N. Mucocutaneous dissemination of acyclovir-resistant herpes simplex virus in a patient with AIDS. // Rev. Infect. Dis. 1989, V. 11 (3), 474-476; Erlich K.S., Jacobson M.A., Koehler J.E., et al. Foscarnet therapy for severe acyclovir-resistant herpes simplex virus type-2 infections in patients with the acquired immunodeficiency syndrome (AIDS). An uncontrolled trial // Ann. Intern. Med. 1989, V. 110 (9), 710-713; Gateley A., Gander R.M., Johnson P.C., et al. Herpes simplex virus type 2 meningoencephalitis resistant to acyclovir in a patient with AIDS // J. Infect. Dis. 1990, V. 161 (4), 711-715; Ljungman P., Ellis M.N., Hackman R.C., Shepp D.H., Meyers J.D. Acyclovir-resistant herpes simplex virus causing pneumonia after marrow transplantation // J. Infect. Dis. 1990, V. 162 (1), 244-248; Safrin S., Ashley R., Houlihan C., Cusick P.S., Mills J. Clinical and serologic features of herpes simplex virus infection in patients with AIDS // AIDS 1991, V. 5 (1), 107-110; Dekker A.W., Rozenberg-Arska M. Successful foscarnet therapy for acyclovir-resistant mucocutaneous infection with herpes simplex virus in a recipient of allogeneic BMT // Bone Marrow Transplant 1993, V. 11 (2), 177-179; Sauerbrei A., Bohn K., Heim A., et al. Novel resistance-associated mutations of thymidine kinase and DNA polymerase genes of herpes simplex virus type 1 and type 2 // Antivir. Ther. 2011, V. 16 (8), 1297-308; Andrei G., Georgala A., Topalis D., et al. Heterogeneity and evolution of thymidine kinase and DNA polymerase mutants of herpes simplex virus type 1: implications for antiviral therapy // J. Infect. Dis. 2013, V. 207 (8), 1295-1305].
Молекулярный механизм действия ацикловира и его ближайших аналогов и их метаболических предшественников заключается в следующем. Поэтапно превращаясь в клетке в моно-, ди- и трифосфаты, они ингибируют вирусную ДНК-полимеразу, и кроме того, конкурируя с природными нуклеотидами, они селективно включаются в синтезирующуюся цепочку вирусной ДНК, что приводит к прекращению элонгации по терминационному механизму. При этом, так как первый этап кинирования с образованием монофосфатов катализируется вирусной тимидинкиназой (ТК), а два последующих - клеточными ферментами, то образование активных метаболитов (трифосфатов ацикловира и пенцикловира) возможно только в инфицированной клетке [Elion G.B. Mechanism of action and selectivity of acyclovir // Am. J. Med. 1982, V. 73 (1A), 7-13; Reardon J.E., Spector T. Herpes simplex virus type 1 DNA polymerase. Mechanism of inhibition by acyclovir triphosphate // J. Biol. Chem. 1989, V. 264 (13), 7405-7411; Boyd M.R., Safrin S., Kern E.R. Penciclovir: a review of its spectrum of activity, selectivity, and cross-resistance pattern // Antiviral Chem. Chemother. 1993, V. 4, 3-11]. Соответственно, из-за сходства механизмов действия ацикловира (2), пенцикловира (4) и их метаболических предшественников лекарственная резистентность ВПГ обусловливается мутациями в одном или двух генах, с которыми связан механизм действия этих антивирусных агентов, - UL23 (TK-ген) и UL30 (pol-гене) и в большинстве случаев носит перекрестный характер [Boyd M.R., Safrin S., Kern E.R. Penciclovir: a review of its spectrum of activity, selectivity, and cross-resistance pattern //Antiviral Chem. Chemother. 1993, V. 4, 3-11; Sarisky R.T., Bacon T., Boon R., et al. Penciclovir susceptibilities of herpes simplex virus isolates from patients using penciclovir cream for treatment of recurrent herpes labialis // Antimicrob. Agents Chemother. 2002, V. 46 (9), 2848-2853; Sarisky R.T., Bacon Т.Н., Boon R.J., et al. Profiling penciclovir susceptibility and prevalence of resistance of herpes simplex virus isolates across eleven clinical trials // Arch. Virol. 2003, V. 148 (9), 1757-1769]. В таких случаях замена одного препарата первого ряда на другой с большей биодоступностью (например, ацикловира (2) на его эфир с валином (3, валацикловир) или на фамцикловир) не всегда может обеспечить достижение терапевтического эффекта [Sauerbrei A., Bohn K., Heim A., et al. Novel resistance-associated mutations of thymidine kinase and DNA polymerase genes of herpes simplex virus type 1 and type 2 // Antivir. Ther. 2011, V. 16 (8), 1297-308]. В международной практике в случаях неэффективности противогерпетических препаратов первого ряда используют препараты второго ряда - тринатриевую соль фосфономуравьиной кислоты (фоскарнет) или, если фоскарнет также оказывается неэффективным, цидофовир (вистид). К сожалению, фоскарнет и цидофовир высокотоксичны, и в РФ их использование не разрешено.
Таким образом, поиск новых эффективных и безвредных соединений, эффективных против ВПГ, включая штаммы с лекарственной резистентностью к известным препаратам, несомненно, представляет собой актуальную задачу.
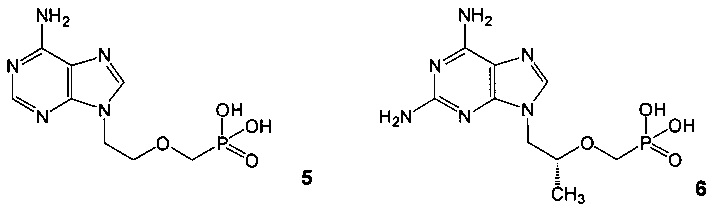
Среди производных пурина найдены соединения, обладающие выраженной противовирусной активностью, например соединения 5 и 6 [Balzarini J., Aquaro S., Perno C.-F., et al. // Biochem. Biophys. Res. Commun. 1996, V. 219, 337-341; De Clercq E. // Antiviral Res. 2007, V. 75, 1-13].
Данные о противовирусной активности ближайших структурных аналогов соединений (S)-1 и (R)-1, таких как: (3S)-4-[6-(2-аминопурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин, (3R)-4-[6-(2-аминопурин-6-иламино)-гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин, (3S)-4-[6-(2-ацетамидопурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин, (3R)-4-[6-(2-ацетамидопурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин и родственных соединений общей формулы 7 [Krasnov V.P., Grazdev D.A., Chulakov E.N. et al., Mendeleev Commun. 2015, V. 25, 412-414] в литературе отсутствуют.
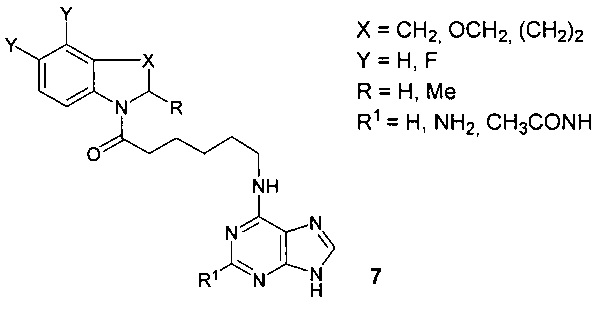
Известно, что биологическая активность хиральных соединений существенным образом зависит от их стереоконфигурации [Chiral drugs: chemistry and biological action / Eds.: Guo-Qiang Lin, Qi-Dong You, Jie-Fei Cheng. - Hoboken, New Jersey: John Wiley & Sons, 2011. - 456 p.].
Наиболее близким аналогом (прототипом) заявляемых соединений является известный препарат ацикловир (2), широко использующийся для лечения ГИ уже более 30 лет, с начала 80-х гг. прошлого века и до настоящего времени [Schaeffer H.J., Beauchamp L., de Miranda P., et al. // Nature 1978, V. 272, 583-585; O'Brien J.J., Campoli-Richards D.M. Acyclovir. An updated review of its antiviral activity, pharmacokinetic properties and therapeutic efficacy // Drugs 1989, V. 37, 233-309].
Задача предлагаемого изобретения - новые соединения с высокой противовирусной активностью, в том числе по отношению к штамму вируса герпеса, устойчивого к действию ацикловира, расширяющее арсенал известных противовирусных средств.
Техническим результатом данного изобретения является создание новых химических соединений - (3S)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((S)-1) и (3R)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((R)-1):
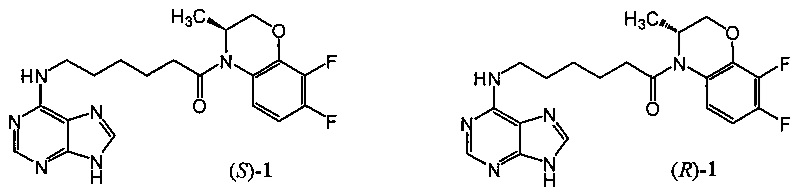
Соединения (S)-1 и (R)-1, их физико-химические характеристики, а также способ получения в литературе не описаны.
Соединение формулы ((S)-1) может быть получено в три стадии из доступного 6-хлорпурина (8):
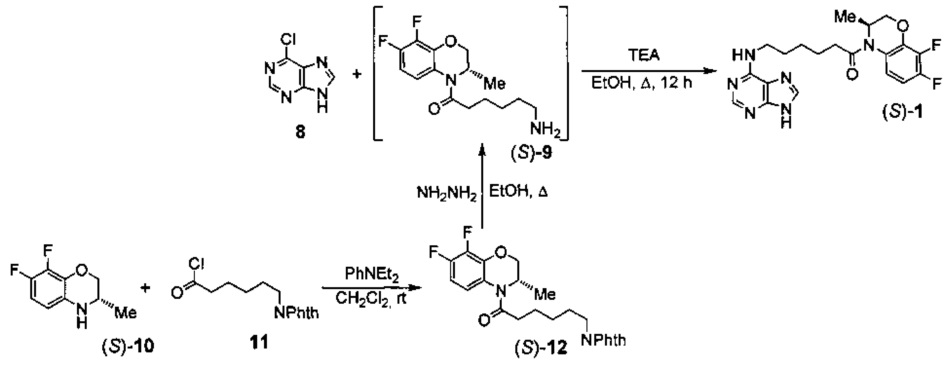
По аналогичной схеме может быть получено соединение формулы ((S)-1).
Соединение 8 вводят в реакцию с (3S)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазином ((S)-9) или (3R)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазином ((R)-9), полученными в результате гидразинолиза (3S)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]-бензоксазина ((S)-12) или (3R)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]бензоксазина ((R)-12) - продуктов ацилирования (3S)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((S)-10) или (3R)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((R)-10), соответственно, хлорангидридом 6-фталимидогексановой кислоты (11). Реакцию между соединениями 8 и 9 проводят в этиловом спирте при температуре 90°С в присутствии триэтиламина, после соответствующей обработки реакционной массы выделяют целевое соединение (S)-1 или (R)-1.
Характеристики новых соединений (S)-1 и (R)-1 и промежуточных продуктов приведены в примерах конкретного выполнения.
Структуры полученных соединений подтверждают методами спектроскопии ЯМР 1Н, 19F и 13C, элементного анализа и масс-спектрометрии высокого разрешения. Индивидуальность соединений подтверждают методами ТСХ и ВЭЖХ.
Оптическую чистоту соединений подтверждают методами ВЭЖХ на хиральной неподвижной фазе и поляриметрии.
Температуры плавления соединений определены на приборе Stuart SMP3 (Barloworld Scientific).
Удельное вращение определено на поляриметре PerkinElmer Model 341.
Элементный анализ выполнен на автоматическом CHNS-0 анализаторе РЕ 2400 серия II (Perkin Elmer).
Спектры ЯМР 1Н, 19F и 13С зарегистрированы на приборе Bruker Avance 500 (рабочая частота 500, 470 и 125 МГц, соответственно) в ДМСО-d6 относительно тетраметилсилана Si(CH3)4 и гексафторбензола (внутренние стандарты). Химические сдвиги (δ) приведены в миллионных долях (м.д.), константы спин-спинового взаимодействия (J) - в герцах (Гц).
Аналитическая ВЭЖХ на хиральной неподвижной фазе выполнена на жидкостном хроматографе Knauer Smartline-1100 (колонка Chiralcel OD-H, 250×4,6 мм, сорбент 5 мкм, детектирование при длине волны 220 нм, элюент гексан-изопропанол 5:1, скорость потока 1 мл/мин) и на жидкостном хроматографе Agilent 1100 (колонка (S,S)-Whelk-O1, 250×4,6 мм, сорбент 5 мкм, детектирование при длине волны 254 нм, элюент 80% метанол, скорость потока 0,8 мл/мин).
Масс-спектр высокого разрешения зарегистрирован на масс-спектрометре Bruker maXis Impact HD, ионизация электрораспылением с прямым вводом образца при положительном режиме, скорость потока N2 4 л/мин, давление распылительного газа 0,4 бар, напряжение 4,5 кВ.
Для ТСХ использованы пластинки Sorbfil (ООО «Имид», Россия). Проявление в УФ свете.
Примеры конкретного выполнения.
Пример 1
Синтез (3S)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((S)-1)
К раствору 1,91 г (10,3 ммоль) (3S)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((S)-10) в 60 мл сухого дихлорметана при перемешивании прибавляют 1,65 мл (10,3 ммоль) N,N-диэтиланилина, затем 2,88 г (10,3 ммоль) хлорангидрида 6-фталимидогексановой кислоты (11) в 60 мл сухого дихлорметана. Реакционную смесь выдерживают при перемешивании и комнатной температуре 24 ч, после чего последовательно промывают 4 н. HCl (3×30 мл), насыщенным раствором NaCl (6×30 мл), 5% раствором NaHCO3 (3×30 мл), насыщенным раствором NaCl (3×30 мл). Органический слой отделяют и сушат над MgSO4, растворитель упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент бензол-этилацетат 8:2) и получают 3,38 г (77%) (3S)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]бензоксазина ((S)-12) в виде светло-желтого масла, промежуточного соединения в синтезе соединения (S)-1. [α]D20 +67.7 (с 0.9, CHCl3). Ее>99%: ВЭЖХ (Chiralcel OD-H, гексан-изопропанол 5:1): τ 26.1 мин. Найдено (%): С 64.34; Н 5.44; F 8.57; N 6.43. Вычислено для C23H22F2N2O4 (%) С 64.48; Н 5.18; F 8.87; N 6.54.
Спектр ЯМР 1Н (500 МГц, ДМСО-d6) δ: 1.10 (д, J=6.2 Гц, 3 Н, Me), 1.27-1.33 (м, 2 H, гексаноил 2×Н-4), 1.53-1.65 (м, 4 Н, гексаноил 2×Н-3 и 2×Н-5), 2.42-2.50 (м, 1 Н, гексаноил Н-2В, перекрывание сигналом ДМСО), 2.61-2.67 (м, 1 Н, гексаноил Н-2А), 3.57 (т, J=7.0 Гц, 2 Н, гексаноил 2×Н-6), 4.13 (дд, J=10.6, 1.8 Гц, 1 Н, Н-2В), 4.34 (дд, J=10.6, 1.2 Гц, 1 Н, Н-2А), 4.50-4.85 (м, 1 Н, Н-3), 6.88-6.94 (м, 1 Н, Н-6), 7.45-7.75 (м, 1 Н, Н-5), 7.82-7.89 (м, 4 Н, Phth).
Спектр ЯМР 19F (470 МГц, ДМSO-d6) δ: 1.83 (м, 1 F, F-8), 19.55 (м, 1 F, F-7).
Спектр ЯМР 13С (125 МГц, ДМSO-d6, 100°С) δ: 15.07, 24.20, 25.74, 27.68, 33.23, 37.22, 44.80, 69.80, 106.72 (д, J=17.8 Гц), 119.20 (м), 121.74, 122.89, 131.52, 134.27, 135.65 (дд, J 9.8, 2.7 Гц), 138.88 (дд, J=243.3, 15.4 Гц), 146.44 (дм, J=241.8 Гц), 167.85, 170.82.
1,16 г (2,71 ммоль) (3S)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]бензоксазина ((S)-12) растворяют в 25 мл этанола, при перемешивании вносят 0,37 мл (4,87 ммоль, 1,8 экв) 64% раствора гидразин гидрата, смесь кипятят 1 ч. Затем этанол упаривают, к остатку приливают 24 мл 2 н. HCl и выдерживают при температуре +4°С 12 ч. Осадок фталилгидразида отфильтровывают, промывают 1 н. HCl (2×3 мл), к маточному раствору при перемешивании и охлаждении прибавляют твердый NaOH до pH 12. Продукт экстрагируют диэтиловым эфиром (4×10 мл), органический слой сушат над NaOH. Растворитель упаривают, получают 0,59 г (73%) (3S)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-4-2H-[1,4]бензоксазина ((S)-9) в виде светло-желтого масла.
К раствору 0,20 г (1,32 ммоль) 6-хлорпурина (8) в 10 мл абсолютного этанола при перемешивании прибавляют 0,31 мл (2,24 ммоль; 1,7 экв.) триэтиламина и 0,59 г (1,98 ммоль; 1,5 экв.) (3S)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-4-2H-[1,4]бензоксазина ((S)-9) в 10 мл абсолютного этанола, реакционную смесь кипятят 12 ч. Затем этанол упаривают, остаток растворяют в 20 мл хлороформа, промывают 1 н. HCl (3×5 мл), насыщенным раствором NaCl (3×5 мл), органический слой сушат над MgSO4, растворитель упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент хлороформ-этанол 9:1) и получают 0,24 г (44%) целевого соединения (S)-1 в виде светло-желтых кристаллов. Т.пл. 87-89°С (разл.) [α]D20 +57.6 (с 1, МеОН). Ее>99%; ОФ ВЭЖХ ((S,S)-Whelk-O1, 80% МеОН): τ 12.8 мин.
Масс-спектр высокого разрешения. Найдено, m/z: 417.1844 [М+Н]+. C20H23F2N6O2. Вычислено, m/z: 417.1850.
Спектр ЯМР 1Н (500 МГц, ДМСО-d6, 80°С) δ: 1.11 (д, J=6.9 Гц, 3 Н, Me), 1.36-1.40 (м, 2 Н, hexanoyl 2×Н-4), 1.58-1.66 (м, 4 Н, гексаноил 2×Н-3 и 2×Н-5), 2.48-2.52 (м, 1 H, гексаноил Н-2А, перекрывание сигналом ДМСО), 2.59-2.65 (м, 1 Н, гексаноил Н-2В), 3.56 (уш. с, 2 Н, гексаноил 2×Н-6,), 4.13 (дд, J=11.0, 2.6 Гц, 1 Н, Н-2А), 4.33 (дд, J=11.0, 1.2 Гц, 1 Н, Н-2В), 4.70-4.74 (м, 1 Н, Н-3), 6.68 (ддд J=9.8, 9.8, 8.5 Гц, 1 Н, Н-6), 7.21 (уш. с, 1 Н, гексаноил NH-6), 7.58 (уш. с, 1 Н, Н-5), 7.97 (с, 1 Н, пурин Н-8), 8.13 (с, 1 Н, пурин Н-2), 12.63 (уш. с, 1 Н, пурин NH-9).
Спектр ЯМР 19F (470 МГц, ДМСО-d6, 80°С) δ: 1.91-1.97 (м, 1 F, F-8), 20.05 (м, 1 F, F-7).
Спектр ЯМР 13С (125 МГц, ДМСО-d6) δ: 15.08, 24.42, 25.93, 28.93, 33.39, 44.99, 69.83, 79.10, 107.39 (д, J=17.9 Гц), 119.40, 119.97, 122.52, 136.49 (д, J=7.5 Гц), 139.23, 139.75 (дд, J=243.3, 15.4 Гц), 147.49 (дд, J=244.1, 9.5 Гц), 150.22, 152.31, 154.45, 170.95.
Пример 2
Синтез (3R)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((R)-1)
К раствору 0,52 г (2,81 ммоль) (3R)-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина ((R)-10) в 20 мл сухого дихлорметана при перемешивании прибавляют 0,45 мл (2,81 ммоль) N,N-диэтиланилина, затем 0,79 г (2,81 ммоль) хлорангидрида 6-фталимидогексановой кислоты (11) в 20 мл сухого дихлорметана. Реакционную смесь выдерживают при перемешивании и комнатной температуре 24 ч, после чего последовательно промывают 4 н. HCl (3×10 мл), насыщенным раствором NaCl (6×10 мл), 5% раствором NaHCO3 (3×10 мл), насыщенным раствором NaCl (3×10 мл). Органический слой отделяют и сушат над MgSO4, растворитель упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент бензол-этилацетат 8:2) и получают 0,75 г (63%) (3R)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]бензоксазина ((R)-12) в виде светло-желтого масла, промежуточного соединения в синтезе соединения (R)-1. [α]D20 -68.2 (с 1.0, CHCl3). Ее>99%: ВЭЖХ (Chiralcel OD-H, гексан-изопропанол 5:1): τ 20.1 мин. Найдено (%): С 64.54; Н 4.99; F 8.82; N 6.28. Вычислено для C23H22F2N2O4 (%) С 64.48; Н 5.18; F 8.87; N 6.54.
Спектры ЯМР 1Н (500 МГц, ДМСО-d6), 19F (470 МГц, ДMSO-d6) и 13С (125 МГц, ДМSO-d6, 100°С) идентичны спектрам ЯМР 1Н, 19F и 13С соединения (S)-12.
0,70 г (1,63 ммоль) (3R)-3,4-дигидро-3-метил-7,8-дифтор-4-(6-фталимидогексаноил)-2H-[1,4]бензоксазина ((R)-12) растворяют в 18 мл этанола, при перемешивании вносят 0,22 мл (2,94 ммоль, 1,8 экв) 64% раствора гидразин гидрата, смесь кипятят 2 ч. Затем этанол упаривают, к остатку приливают 20 мл 2 н. HCl и выдерживают при температуре +4°С 12 ч. Осадок фталилгидразида отфильтровывают, промывают 1 н. HCl (2×0,5 мл), к маточному раствору при перемешивании и охлаждении прибавляют твердый NaOH до pH 12. Продукт экстрагируют хлороформом (4×5 мл), органический слой сушат над NaOH. Растворитель упаривают, получают 0,28 г (57%) (3R)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-4-2H-[1,4]бензоксазина ((R)-9) в виде бесцветного масла.
К раствору 0,097 г (0,63 ммоль) 6-хлорпурина (8) в 5 мл абсолютного этанола при перемешивании прибавляют 0,15 мл (1,06 ммоль; 1,7 экв.) триэтиламина и 0,28 г (0,94 ммоль; 1,5 экв.) (3R)-(6-аминогексаноил)-3,4-дигидро-3-метил-7,8-дифтор-4-2H-[1,4]бензоксазина ((R)-9) в 5 мл абсолютного этанола, реакционную смесь кипятят 12 ч. Затем этанол упаривают, остаток растворяют в 20 мл хлороформа, промывают 1 н. HCl (3×5 мл), насыщенным раствором NaCl (3×5 мл), органический слой сушат над MgSO4, растворитель упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент хлороформ-этанол 9:1) и получают 0,12 г (46%) целевого соединения (R)-1 в виде бесцветных кристаллов. Т.пл. 87-89°С (разл.) [α]D20 -59.0 (с 1, МеОН). Ее>99%; ОФ ВЭЖХ ((S,S)-Whelk-O1, 80% МеОН): τ 17.4 мин.
Масс-спектр высокого разрешения. Найдено, m/z: 417.1845 [М+Н]+. C20H23F2N6O2. Вычислено, m/z: 417.1850.
Спектры ЯМР 1Н (500 МГц, ДМСО-d6, 80°С), 19F (470 МГц, ДМСО-d6, 80°С) и 13С (125 МГц, ДМSO-d6) идентичны спектрам ЯМР 1Н, 19F и 13С соединения (S)-1.
Пример 3
Изучение противовирусной активности (3S)-4-[6-(пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина и (3R)-4-[6-(пурин-6-иламино)-гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина в отношении вируса простого герпеса тип 1 (ВПГ-1)
Культуру клеток Vero Е6 (клетки почек африканских зеленых мартышек) поддерживают в среде Игла, содержащей 5% эмбриональной сыворотки телят.
Эталонный штамм вируса герпеса простого ВПГ-1/L2 получен из Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского (подразделение ФНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ). Штамм ВПГ-1/L2/R, глубоко резистентный к ацикловиру, получен нами путем пассирования эталонного штамма в градиенте концентраций ацикловира с последующим троекратным клонированием. Свойства полученного варианта вируса были подробно описаны в ряде публикаций [Гуськова А.А., Загурный А.В., Скоблов М.Ю., Баранова А.В., Андронова В.Л., Янковский Н.К., Галегов Г.А., Скоблов Ю.С. Молекулярно-генетический анализ тимидинкиназы вируса герпеса простого тип 1 // Мол. биол. 2005, Т. 39 (1), 155-158; Gus'kova А.А., Skoblov M.Yu., Korovina A.N., Yasko M.V., Karpenko I.L., Kukhanova M.K., Andronova V.L., Galegov G.A., Skoblov Yu.S. Antiherpetic properties of acyclovir 5'-hydrogenphosphonate and the mutation analysis of herpes virus resistant strains // Chem. Biol. Drug Des. 2009, V. 74, 382-389; Коровина A.H., Гуськова А.А., Скоблов М.Ю., Андронова В.Л., Галегов Г.А., Кочетков С.Н., Куханова М.К., Скоблов Ю.С. Анализ мутаций в генах ДНК-полимераз и тимидинкиназ клинических изолятов вируса простого герпеса, резистентных к антигерпетическим препаратам // Мол. биол. 2010, Т. 44 (3), 488-96; Андронова В.Л., Галегов Г.А., Ясько М.В., Куханова М.К., Скоблов Ю.С. Сравнительное изучение лекарственной устойчивости вируса простого герпеса к ациклогуанозину и Н-фосфонату ациклогуанозина // Вопр. вирусол. 2010, Т. 55 (1), 31-34; Гуськова А.А., Скоблов М.Ю., Андронова В.Л., Галегов Г.А., Кочетков С.Н., Скоблов Ю.С. Ферментативная активность тимидинкиназы штаммов вируса простого герпеса, резистентных к Н-фосфонату ацикловира // Биоорг. химия 2011, Т. 17 (5), 627-630]. Генотипический анализ выявил две мутации в гене ТК, приводящие к аминокислотным заменам W88R, R220H. Фенотипически вирус был охарактеризован как ТК-негативный. ТК-негативный/дефицитный фенотип является самым распространенным в клинической практике: не менее 90% изолятов ВПГ, резистентных к ацикловиру, относятся к этому фенотипу. В качестве контроля используют ацикловир (ациклогуанозин, 9-[(2-гидроксиэтокси)метил]гуанин, acyclovir, зовиракс) производства Sigma Aldrich, США (брутто-формула C8H11N5O3, М 225.20, кат. номер 59277-89-3), тринатриевая соль фосфономуравьиной кислоты гексагидрат (Foscarnet sodium hexahydrate, Sodium phosphonoformate tribasic hexahydrate) производства Sigma Aldrich, США (брутто-формула CNa3O5P⋅6H2O, M 300,04, кат. номер 34156-56-4) и рибавирин (Ribavirin, виразол, 1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) производства Sigma Aldrich, США (брутто-формула C8H12N4O5, М 244.20, кат. номер 36791-04-5).
Вирусы поддерживают путем пассирования в средах Игла и 199, соединенных в соотношении 1:1. Изучение in vitro противогерпетической активности соединений (S)-1 и (R)-1 проводят в соответствии с принятым в международной практике методом СРЕ inhibition assay [De Clerck E., Descamps J., Verheist G., et al. // J. Infect. Dis. 1980, V. 141, 563-573; Gus'kova A.A., Skoblov M.Yu., Korovina A.N., et al. // Chem. Biol. Drug Des. 2009, V. 74, 382-389]. Для этого монослойную 24-часовую культуру клеток, выращенную в 96-луночных пластиковых планшетах, инфицируют с множественностью 0,1 БОЕ/кл. Результаты учитывают через 48 ч, когда в контрольных инфицированных культурах клеток вирус-индуцированый цитопатический эффект (ЦПЭ) развивался на 100%), то есть охватывал весь клеточный монослой. Антивирусное действие оценивают по способности изучаемых соединений ингибировать развитие вирусного ЦПЭ на 50% (ИД50) и 95% (ИД95) по сравнению с контрольными инфицированными культурами.
Цитотоксичность соединений количественно определяют по окрашиванию клеток трипановым синим. За величину ЦД50 принимают концентрацию соединения, при которой выживаемость неинфицированных клеток через 72 ч контакта с изучаемыми соединениями составляет 50%. Индекс селективности (ХТИ) вычисляют как отношение ЦД50 к ИД50.
Для сравнения была изучена противовирусная активность рацемического соединения ((RS)-1) в отношении вируса герпеса простого тип 1 (данные представлены в табл. 1).
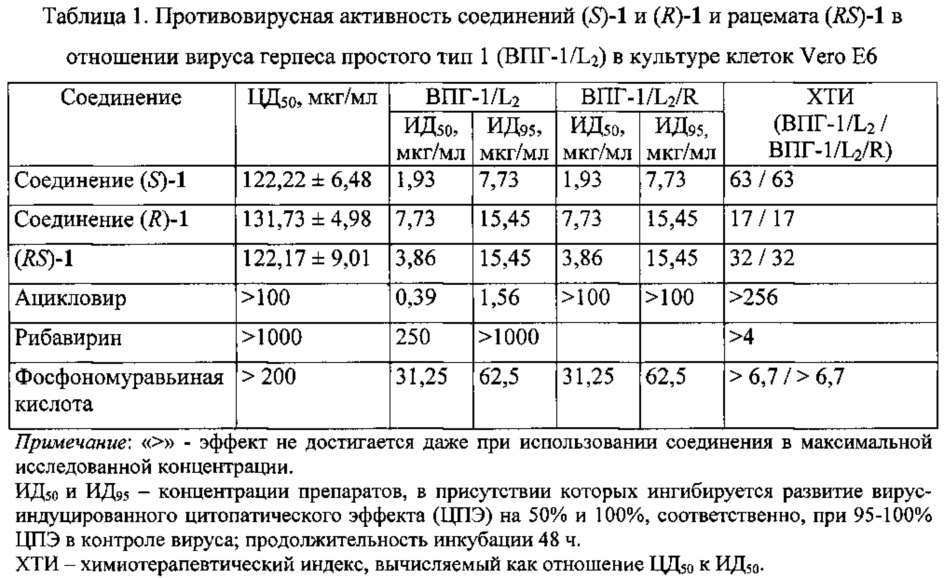
Как следует из представленных результатов, испытанные соединения обладают способностью высокоселективно ингибировать репродукцию вируса герпеса простого тип 1 при использовании в нецитотоксических концентрациях в культуре клеток Vero Е6, причем эти соединения одинаково эффективны на обеих вирусных моделях - ВПГ-1/L2 (чувствительном к ацикловиру) и ВПГ-1/L2/R (резистентном к ацикловиру). Наибольшую противогерпетическую активность проявил (S)-изомер (соединение (S)-1, химиотерапевтический индекс, ХТИ 63). Показатель ИД50 для этого соединения превышает аналогичный показатель для (R)-изомера (соединение (R)-1) в 4 раза. Фармацевтические композиции на основе соединений могут быть перспективны для создания новых лекарственных средств, необходимых для лечения герпесвирусных инфекций.
Из данных таблицы 1 следует, что соединение (S)-1 проявляет высокую противовирусную активность как в отношении вируса герпеса простого (химиотерапевтический индекс, ХТИ 63), так и в отношении штамма, устойчивого к ацикловиру (ХТИ 63). Причем активность соединения (S)-1 превосходит активность фосфоноформата (тринатриевой соли фосфономуравьиной кислоты, являющейся в клинической практике препаратом выбора в случае неэффективности ацикловира и родственных соединений, включая случаи развития лекарственной резистентности), а также известного противовирусного препарата рибавирин (ХТИ>4).
Таким образом, применительно к конкретной модели in vitro соединения (S)-1 и (R)-1 могут быть отнесены к категории малотоксичных, учитывая, что 50%-ингибирующая концентрация достигается в присутствии изучаемых соединений в нецитотоксических концентрациях (данные ЦД50). Существенно, что избирательность противогерпесвирусного действия соединений (S)-1 и (R)-1 превосходит активность таких известных используемых в клинической практике препаратов, как фосфономуравьиная кислота или рибавирин. Фармацевтические композиции на основе соединений (S)-1 и (R)-1 могут быть перспективны для создания новых противовирусных средств.
![(3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью](https://fips.edrid.ru/images/rid/b4/58/67/cbe8982827b8a7b6a0d85850fdddd2fe.jpg)
![(3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью](https://fips.edrid.ru/images/rid/b4/58/67/4f853ac60c50b67e399c964415f81825.jpg)

