Результат интеллектуальной деятельности: Субстанция протеолитического фермента на основе Протосубтилина ГЗХ, иммобилизованного на хитозане, и композиция для лечения гнойно-некротических ран
Вид РИД
Изобретение
Изобретение относится к протеолитическому ферменту (протеаза) Bacillus subtilis, иммобилизованному на носителе и композиции для лечения гнойно-некротических ран на его основе и может быть использовано в медицине, биотехнологии и биохимии для гидролиза белков.
Протеолитические ферменты ускоряют биосинтез коллагена и других белков мышц, нормализуют уровень показателей окислительно-восстановительных процессов, тем самым значительно уменьшая время заживления ран, обладают мощным противовоспалительным и противоотечным действием (Диагностика и лечение ранений/ Под ред. Ю.Г. Шапошникова. - М.: Медицина, 1984 г., с. 200, 218) [1].
Известны способы иммобилизации путем адсорбции фермента на матрицах с высокоразвитой поверхностью (Иммобилизованные ферменты. Под. ред. И.В. Березина. T. 1, М., Изд-во МГУ, 1976, с. 79-140) [2]. Недостатком таких способов является малая прочность связи фермента с носителем, в результате чего фермент в процессе эксплуатации может диффундировать с носителя в раствор.
Известен способ получения водорастворимого иммобилизованного ферментного препарата (авторское свидетельство СССР №730694, МПК С08В 37/02, опубл. 30.04.80) [3], включающий стадии:
- активирование носителя - декстрана с мол. массой 20 кДа, в реакции периодатного окисления (степень окисления носителя γ=6-48%);
- приготовление реакционной смеси: окисленный декстран растворяют в воде до концентрации 50 мг/мл и смешивают с раствором фермента - террилитина, в 0,1 М боратном буфере рН 8,5;
- иммобилизация фермента: реакционную смесь перемешивают в течение 2 часов при 21±1°С, затем добавляют 0,1 М раствор боратного буфера, содержащего боргидрид натрия и перемешивают еще в течение 40 мин;
- обессоливание иммобилизованного ферментного препарата путем диализа на холоде (4±2°С) против дистиллированной воды в течение 48 часов;
- отделение избытка не связавшегося фермента гель-фильтрацией;
- лиофильное высушивание.
Получают препарат с удельной активностью 7,4 ПЕ/мг.
Недостатками известного способа являются: сложность процесса (длительный процесс получения активированного носителя, процесс гель-фильтрации трудно масштабируется, значительные затраты времени, энергетических ресурсов и сырья), фермент в процессе эксплуатации может диффундировать вместе с носителем в кровоток при кровоточивости раневой поверхности и вызвать аллергические реакции. Кроме того - некоторое неудобство при применении: раствор высыхает через 0,5-1 час и повязку необходимо смачивать или менять повязку.
Известен способ получения водорастворимого иммобилизованного протеолитического комплекса (авторское свидетельство СССР №1442548, МПК С12N 11/00, опубл. 07.12.88) [4], заключающийся в следующем:
Протосубтилин Г10Х, представляющий собой комплекс бактериальных нейтральных и щелочных протеаз из Вас. subtilis, растворяют в 0,05 М боратном буфере рН 8,4 при 2-4°С в течение 30 мин, а нерастворившийся осадок отделяют центрифугированием при 7000 g в течение 30 мин. К полученному супернатанту добавляют 10%-ный водный раствор полиэтиленоксида с мол. массой 600-2000 Да, преимущественно 1500 Да, в соотношении носитель - протосубтилин 1:(7,5-8,5). Смесь фермента с носителем облучают тормозным γ-излучением в дозе 2,3-2,7 мрад. При этом получают водорастворимый иммобилизованный ферментный препарат с протеолитической активностью 80-120 ПЕ/мл. Препарат представляет собой прозрачную жидкость желтоватого цвета, которую хранят при 4-8°С.
Известен способ получения водорастворимого иммобилизованного протеолитического комплекса (патент РФ №2137835, МПК C12N 11/00, опубл. 20.09.1999) [5], включающий приготовление реакционной смеси, содержащей протосубтилин с полиэтиленоксидом мол. массой 1500-4000 Да, с последующим облучением полученной смеси тормозным γ-излучением, отличающийся тем, что соотношение фермент - носитель устанавливают равным 1:(2-6), из реакционной смеси перед облучением проводят солевое осаждение балластных белков путем последовательного добавления в реакционную смесь сначала фосфорнокислого натрия до конечной концентрации 0,45%, а затем хлорида кальция до конечной концентрации 0,63%. Целевой продукт подвергают лиофильной сушке в присутствии полиэтиленоксида с мол. массой 4000 Да в количестве 50-300 мг/мл.
Недостатками известных способов [5, 6] являются:
- радиационная модификация бактериальных протеаз полиэтиленоксидом приводит к гетерогенности получаемого продукта (способ иммобилизации не исключает десорбцию комплекса протеаз с матрицы, так как фермент в этом случае не является ковалентно связанным с носителем),
- фермент в процессе эксплуатации может диффундировать вместе с носителем в кровоток при кровоточивости раневой поверхности и вызвать аллергические реакции.
Кроме того, некоторое неудобство при применении: раствор высыхает через 0,5-1 час и повязку необходимо смачивать или ее менять.
Известен препарат «Повязка для лечения ран» (патент РФ №2219954, МПК A61L 15/08, опубл. 27.12.203) [6], состоящая из перфорированной пленки хитозана (1,0-6,0 ч) в поливиниловом спирте (60,0-95,0 ч), содержащая биологически активные добавки, в том числе - протеазы (0,5-30,0 ч), глутаровый альдегид (0,1-2,0 ч) и органическую кислоту (0,5-4,0 ч).
Однако ферменты, глутаровый альдегид и органическая кислота в процессе использования повязки могут диффундировать в кровоток при кровоточивости раневой поверхности и вызвать аллергические реакции (как отмечено в описании, происходит «десорбция из пленки хитозана биологически активных веществ»). Активность ферментов слабо проявляется в 60-95%-ном спирте.
Известен способ получения средства для лечения гнойно-некротических ран (патент РФ №1814764, МПК A61K 47/48, опубл. 20.03.1995) [7], заключающийся в обработке 2%-ного геля хитозана 2%-ным раствором глутарового альдегида в фосфатном буфере при рН 7,5, взятых в соотношении 1:1, выдерживании при температуре 18-20°C в течение 30 мин, отмывании и пропускании через него экстракта гепатопанкреаса камчатского краба, содержащего комплекс ферментов: ТНК-азу, РНК-азу, щелочную фосфатазу, фосфодиэстеразу 1 типа и протеазу.
Однако в известном способе получения средства технологически сложно пропускать жидкости через гели и обеспечивать точные концентрации хитозана (для получения средства используется 2%-ный гель хитозана). В случае, если используется 1%-ный гель, суспензия носителя получается жидкой и менее пригодной для получения мазевых форм. При концентрации хитозана 3-4% резко увеличивается плотность носителя. Времени активации матрицы в течение 30 мин явно недостаточно [8], а 2%-ный гель хитозана имеет небольшие сроки хранения, т.к. склонен к высыханию.
Наиболее близким аналогом (прототипом) заявляемой субстанции протеолитического фермента Bacillus subtilis является препарат иммобилизованной протеазы Bacillus subtilis на носителе в виде аминоэтилцеллюлозы, активированной глутаровым альдегидом, описанный в способе получения иммобилизованного протеолитического комплекса, заключающемся в активации аминоэтилцеллюлозы глутаровым альдегидом с последующей иммобилизацией протеазы. В результате получают комплекс иммобилизованной протеазы с удельной активностью 32-40 ед. акт/г сухого веса (патент РФ №686377, МПК A61K 37/48, опубл. 15.12.1993) [8].
Однако данная субстанция имеет недостаточную чистоту ферментативного комплекса перед иммобилизацией на носитель (используемый в способе препарат Протосубтилин ГЗХ содержит в качестве наполнителей: поваренную соль, мел, кукурузную муку, продукты жизнедеятельности Bacillus subtilis. Для очистки используется осаждение хлористым кальцием (собирают надосадочную жидкость) и этанолом (используют осадок). При этом не все примеси, имеющие аминогруппы, удаляются из субстанции и могут снижать выход иммобилизованной протеазы. Препарат "Профезим-10 мл" используется в виде взвеси, которая требует создания условий "влажной камеры" путем наложения марлевой повязки. Как показала практика, эта форма препарата неудобна при лечении ожогов и ран, так как при смене повязок происходит повреждение грануляций раны, что не способствует быстрому ее заживлению.
Наиболее близким аналогом (прототипом) заявляемой композиции для лечения гнойно-некротических ран является препарат химически иммобилизованной на аминоэтилцеллюлозе протеазы Bacillus subtilis (Профезим) в составе композиции на основе полиэтиленгликоля (ПЭГ 5000) и глицерина (патент РФ №2150936, МПК A61K 9/06, опубл. 20.06.2000) [9] (масс. %):
|
Однако ранозаживляющая композиция имеет недостаточную скорость заживления ран, а также жидкую консистенцию мази (недостаточную вязкость). Последний фактор позволяет распределяться (растекаться) препарату по значительной поверхности тела, снижая количество действующего вещества на раневой поверхности.
Техническим результатом заявляемого изобретения является повышение ранозаживляющих свойств субстанции и композиции препарата на ее основе за счет повышение степени очистки протеолитических ферментов и использования в качестве носителя хитозана, активированного глутаровым альдегидом, а также улучшения реологических свойств (вязкости) мазевой формы лекарственной композиции.
Указанный технический результат достигается созданием субстанции протеолитического фермента на основе Протосубтилина ГЗХ, используемой в качестве основного компонента композиции для лечения гнойно-некротических ран, имеющей ферментативную активность 17-19 ед.акт. нейтральной протеазы/г влажной массы и полученной путем суспендирования указанного сухого фермента в фосфатном буфере А в количестве 0,1 Моль/л при рН 7,6, очистки осаждением солью до конечной концентрации 0,1 Моль/л и удалением осадка центрифугированием, гель-фильтрации фермента на колонке с акрилексом Р-15, используя фосфатный буфер А, активации хитозана 25%-ным раствором глутарового альдегида в течение 5-6 часов с последующей иммобилизацией на активированном хитозане очищенного протеолитического фермента Протосубтилина ГЗХ при температуре 6-8°С в течение 18 часов, последовательной отмывки полученной субстанции водой, раствором Трис-HCl в концентрации 0,1 Моль/л при рН 7,6, раствором натрий-фосфата в концентрации 0,5 Моль/л при рН 7,4 и суспендирования субстанции в растворе Трис-HCl в концентрации 0,01 Моль/л при рН 7,4, содержащем 0,9%-ный NaCl.
Указанный технический результат достигается также тем, что композиция для лечения гнойно-некротических ран, включающая субстанцию протеолитического фермента (протеазы) Bacillus subtilis, иммобилизованного на носителе, целевые добавки и основу, согласно изобретению, в качестве субстанции протеолитического фермента (протеазы) Bacillus subtilis, иммобилизованного на носителе она содержит субстанцию по п. 1 формулы изобретения, в качестве целевых добавок - эмульгатор Т-2, твин 20 и 0,05%-ный раствор хлоргексидина биглюконат, а в качестве основы - масло вазелиновое при следующем количественном содержании компонентов (масс. %):
|
В соответствии с ГОСТ 20264.2-88, стр. 2 (http://www.internet-law.ru/gosts/gost/28652/) за единицу протеолитической активности принята способность фермента превращать за 1 мин при температуре 30°С казеинат натрия в неосаждаемое трихлоруксусной кислотой состояние в количестве, соответствующем 1 мкмолю тирозина. Протеолитическую активность выражают числом указанных единиц в 1 г испытуемого препарата.
Изобретение иллюстрируется электрофореграммой комплекса протеолитических ферментов, приведенной на фиг. 1. Электрофорез в 12% ПААГ в денатурирующих условиях, окрашивание Кумасси R-250, где: К - комплекс протеолитических ферментов; М - маркеры молекулярных масс (20-150 кДа).
Пример 1. Характеристика субстанции протеолитического фермента (протеазы) Bacillus subtipis, иммобилизованного на хитозане, активированном глутаровым альдегидом.
Субстанция протеолитического фермента на основе Протосубтилина ГЗХ используется в качестве основного компонента композиции для лечения гнойно-некротических ран, имеет ферментативную активность 17-19 ед.акт. нейтральной протеазы/г влажной массы и получена путем суспендирования указанного сухого фермента в фосфатном буфере А в количестве 0,1 Моль/л при рН 7,6, очистки осаждением солью до конечной концентрации 0,1 Моль/л и удалением осадка центрифугированием, гель-фильтрации фермента на колонке с акрилексом Р-15, используя фосфатный буфер А, активации хитозана 25%-ным раствором глутарового альдегида в течение 5-6 часов с последующей иммобилизацией на активированном хитозане очищенного протеолитического фермента Протосубтилина ГЗХ при температуре 6-8°С в течение 18 часов, последовательной отмывки полученной субстанции водой, раствором Трис-HCl в концентрации 0,1 Моль/л при рН 7,6, раствором натрий-фосфата в концентрации 0,5 Моль/л при рН 7,4 и суспендирования субстанции в растворе Трис-HCl в концентрации 0,01 Моль/л при рН 7,4, содержащем 0,9%-ный NaCl.
Пример 2. Композиция для лечения гнойно-некротических ран в виде мази с минимальным содержанием компонентов (масс. %):
|
Пример 3. Композиция «ПРОТОЗАН» в виде мази для лечения гнойно-некротических ран (масс. %):
|
Для получения субстанции по примеру 1 и композиции по примерам 2 и 3 использовали препараты: «Протосубтилин ГЗХ», ТУ 9291-029-13684916-2010 («Сиббиофарм», Россия), хитозан («Апифарм», Россия). (Можно использовать хитозан от компании ЗАО Биопрогресс, Щелково, Россия). Активность нейтральной протеазы определяли по методу Ансона в модификации (Грачева И.М., Грачев Ю.П., Мосичев М.С. и др. Лабораторный практикум по технологии ферментных препаратов. - М.: Легкая и пищевая пром-сть (1982). СС. 36-41) [10]. Степень деацетилирования хитозана определяли методом потенциометрического титрования (Кучина Ю.А., Долгопятова Н.В., Новиков В.Ю., Сагайдачный В.А., Морозов Н.Н. Инструментальные методы определения степени деацетилирования хитина//Вестник МГТУ, т. 15, №1, 107-113 (2012)) [11]. Использовали акрилекс Р-15, («Реанал», Венгрия); реактивы (глутаровый альдегид, бензохинон, соли) квалификации «х.ч.».
Пример 4. Подготовка ферментного препарата для иммобилизации.
Для очистки ферментов по 5 г порошка «Протосубтилин ГЗХ» суспендировали в 15 мл натрий-фосфатного буфера А (0,1 Моль/л; рН 7,6). Не растворившиеся компоненты удаляли центрифугированием (8000g, 20 мин). Добавляли 1 мл раствора хлорида кальция до конечной концентрации 0,1 Моль/л, перемешивали 20 мин и образовавшийся осадок удаляли центрифугированием. Для удаления из раствора низкомолекулярных окрашенных компонентов и солей проводили гель-фильтрацию на колонке (55 мл) с акрилексом Р-15, используя буфер А. В результате получали 20-22 мл комплекса протеолитических ферментов, содержащих 125-135 мг белка и активностью нейтральной протеазы 480-520 ед.акт. (24-26 ед.акт./мл), (3,85 ед.акт/мг белка против 2 ед.акт./мг в прототипе (Патент РФ 686377 [8]).
На фиг. 1 приведена электрофореграмма комплекса протеолитических ферментов. Электрофорез в 12% ПААГ в денатурирующих условиях, окрашивание Кумасси R-250. Где:
К - комплекс протеолитических ферментов;
М - маркеры молекулярных масс (20-150 кДа).
Пример 5. Активация носителя. Для сравнительного эксперимента по 3 г порошка хитозана помещали в воду, затем на стеклянных фильтрах промывали буфером Б (0,2 Моль/л; рН 7,8). Каждый образец суспендировали в 20 мл буфера Б.
К первой порции добавляли 1 мл, ко второй - 4 мл 25%-ного раствора глутарового альдегида (2,5 и 10 мМ) и перемешивали 5-6 ч при комнатной температуре. После этого образцы активированного хитозана промывали буфером Б на стеклянных фильтрах.
Пример 6. Иммобилизация ферментного комплекса. Каждую порцию активированного носителя вносили в 10 мл раствора фермента (по 250 ед. акт. нейтральной протеазы). Инкубацию проводили 18 ч при перемешивании и температуре 6-8°С. Затем полученные иммобилизованные препараты последовательно промывали водой, раствором Трис-НС1 (0,1 Моль/л, рН 7,6), раствором натрий-фосфата (0,5 Моль/л; рН 7,4).и суспендировали в растворе Трис-HCl (0,01 Моль/л, рН 7,4), содержащем 0,9%-ный NaCl.
Пример 7. Анализ полученных образцов по активности
Полученные образцы иммобилизованных ферментов оценивались по массе и активности нейтральной протеазы.
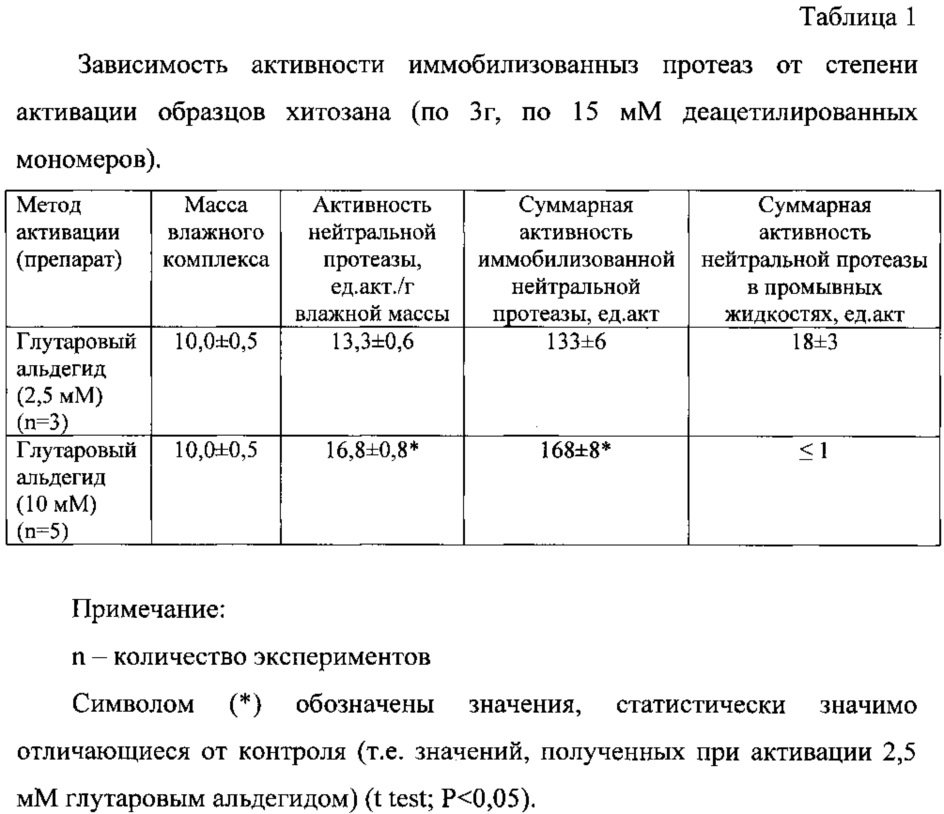
Результаты представлены в таблице 1. Из данных таблицы 1 видно, что при соотношении глутарового альдегида 10 мМ на 15 мМ деацетилированных групп хитозана белок практически полностью переходил в иммобилизованное состояние и удельная активность нейтральной протеазы отмечалась до 17 ед. акт./г влажной массы, что соответствует 57 ед. акт./г сухой массы против 32-40 ед. акт./г в прототипе (Патент РФ 686377, кл. А61K 37/48 [8]). При этом активность иммобилизованного фермента сохранялась до 70% (170 от исходных 250 ед. акт.). Препарат, полученный активацией при соотношении глутарового альдегида 10 мМ на 15 мМ деацетилированных групп хитозана, был назван «Протозан».
После хранения при плюс 37°С в течение 7 суток препараты сохраняли свою активность до 90%.
Пример 8. Получение иммобилизованных протеаз на активированном хитозане в количестве 30г для последующего получения мазевой формы
7,5 г порошка «Протосубтилин ГЗХ» суспендировали в 22 мл натрий-фосфатного буфера А (0,1 Моль/л; рН 7,6). Нерастворившиеся компоненты удаляли центрифугированием (8000g, 20 мин). Добавляли 1,5 мл раствора хлорида кальция до конечной концентрации 0,1 Моль/л, перемешивали 20 мин и образовавшийся осадок удаляли центрифугированием. Для удаления из раствора низкомолекулярных окрашенных компонентов и солей проводили гель-фильтрацию на колонке (75 мл) с акрилексом Р-15, используя буфер А. В результате получали 30-32 мл комплекса протеолитических ферментов, содержащих 370-400 мг белка и активностью нейтральной протеазы 740-800 ед. акт.
9 г порошка хитозана помещали в воду, затем на стеклянных фильтрах промывали буфером Б (0,2 Моль/л; рН 7,8). Образец суспендировали в 60 мл буфера Б.
Добавляли 12 мл 25%-ного раствора глутарового альдегида (10 мМ) и перемешивали 5-6 ч при комнатной температуре. После этого образец активированного хитозана промывали буфером Б на стеклянных фильтрах.
Активированный носитель вносили в 30 мл раствора фермента. Инкубацию проводили 18 ч при перемешивании и температуре 6-8°С. Затем полученный иммобилизованный препарат последовательно промывали водой, раствором Трис-HCl (0,1 Моль/л, рН 7,6), раствором натрий-фосфата (0,5 Моль/л; рН 7,4). и суспендировали в растворе Трис-HCl (0,01 Моль/л, рН 7,4), содержащем 0,9%-ный NaCl.
Получали 30 г влажного препарата с активностью 17-19 ед. акт./г влажной массы
Пример 9. Получение мазевой формы препарата иммобилизованных протеаз «Протозан-мазь»
Для получения мазевой формы препарата «Протозан-мазь» использовали компоненты в соотношениях, представленных в таблице 2.
Масло вазелиновое, эмульгатор Т-2 и Твин - 20 смешивали при плюс 50-55°С до однородной суспензии, охлаждали до 35-40°С и в нее вносили при интенсивном перемешивании комплекс иммобилизованных протеаз в растворе хлоргексидина. Продолжали перемешивание до полной гомогенности мази, 20-30 мин. Мазь расфасовывали по 10 г в пластиковые флаконы или гриппер - пакеты с защелками типа zip-lock.

Разработанная мазевая форма имела более плотную консистенцию, чем приготовленная на растворе полиэтиленгликоля с глицерином (прототип патент РФ №2150936, [9]) и не растекалась по поверхности. Она была названа «Протозан-мазь».
Пример 10. Изучение ранозаживляющего действия комплексов исследовали на модели термического ожога. В эксперименте использовали крыс самцов линии Вистар массой 250-300 г по 6 животных в группе. На выстриженном участке спины размером 3×3 см2 под барбамиловым наркозом (50 мг/кг, внутрибрюшинно) у животных вызывали термический ожог. Для этого использовали прибор с установленной температурной шкалой и электропаяльником, на конце которого закреплена металлическая пластина размером 1,0×1,5 см2. Размер пластины был выбран таким, чтобы получить площадь ожоговой поверхности, сравнимой с аналогичной в прототипе (патент №2150936, [9]). Время экспозиции нагретой до 190-200°С контактной пластинки составляло 10 секунд.
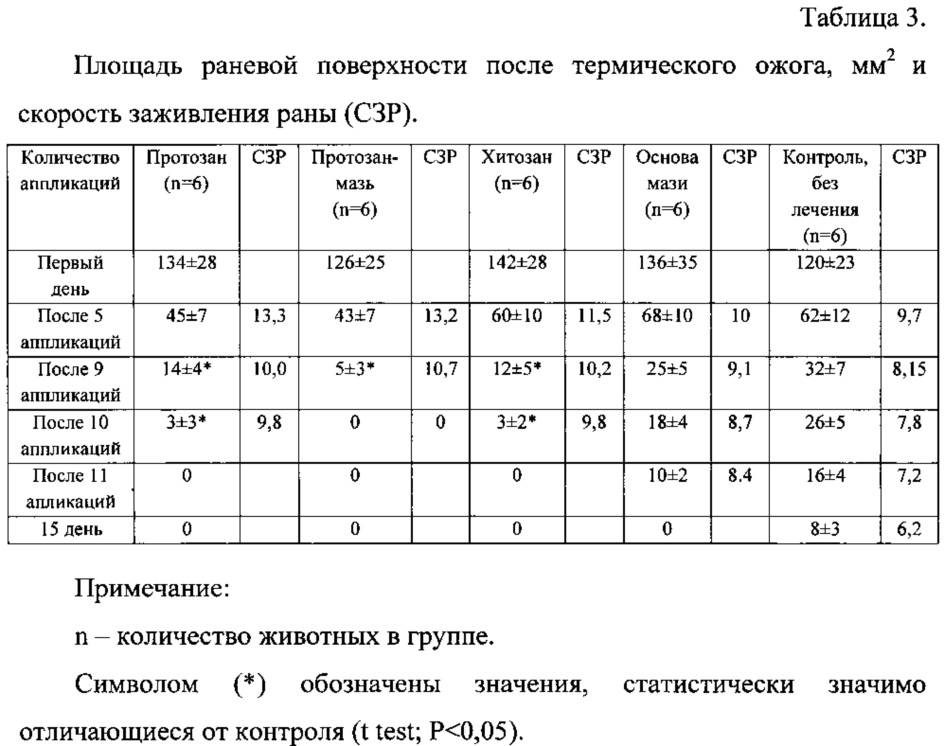
Опытных животных распределяли на 4 группы. Крысам первой опытной группы ожоговую рану лечили ежедневными аппликациями суспензии «Протозан», крысам второй - аппликациями мазевой формой «Протозан-мазь», крысам третьей группы - аппликациями суспензии хитозана (без иммобилизованного комплекса протеаз), крысам четвертой группы - аппликациями основы мази. Образцы наносили из расчета 1 г/5 см2 поверхности раны. Состояние раны регистрировали, проводя измерение ее площади, прикладывая к ране прозрачный трафарет. Скорость заживления раны (СЗР) или индекс Поповой, выраженный в процентах, рассчитывали по формуле:
СЗР=(S-Sn)×100/S×t,
где S - величина площади раны при предшествующем измерении, Sn - величина площади раны в настоящий момент, t - число дней между первым и последующим измерением (Рациональная антимикробная фармакотерапия: Руководство для практикующих врачей/ Под ред. В.П. Яковлева, С.В. Яковлева. - М., 2003) [12]. Общее состояние животных оценивали на основании поведенческих реакций, аппетита и массы тела. Результаты представлены в таблице 3.
Для сравнения были вычислены скорости заживления ран (СЗР) в прототипе (патент №2150936, [9]) и результаты представлены в таблице 4.
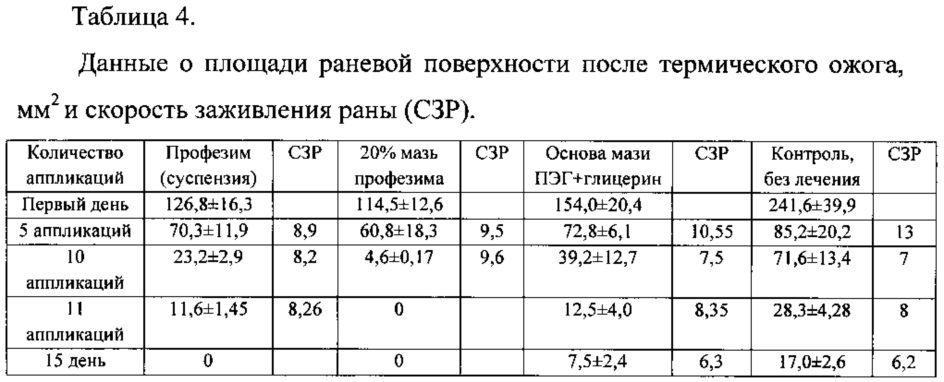
Из представленных результатов (таблицы 3 и 4) видно, что скорость заживления раны (СЗР) у животных, леченных комплексом протеазы, иммобилизованной на хитозане «протозан», достоверно отличается от результатов группы прототипа, леченных суспензией «профезим» (первые колонки таблицы). Скорость заживления раны (СЗР) у животных, леченных мазевой формой «протозан-мазь» также достоверно отличается от результатов группы прототипа, леченных 20%-й мазью «профезим» (вторые колонки таблицы). Это свидетельствует о более выраженном репаративном действии комплекса протеаз, иммобилизованных на хитозане. Полное заживление ран у животных экспериментальной группы («протозан-мазь») завершилось на 10-е сутки опыта, тогда как у животных экспериментальной группы прототипа (20%-я мазь «профезим») - на 11-е сутки. Из таблицы 4 видно, что при использовании для лечения ран матрицы - хитозана скорость заживления достоверно отличалась от результатов контрольной группы. Полное заживление ран у животных контрольной группы завершилось на 17-18-е сутки опыта с образованием грубого рубца, который рассасывался медленнее (5-6 дней), чем в опытных группах (1-3 дня). Оба комплекса («протозан» и «протозан-мазь») не вызывали изменений двигательных реакций крыс, не оказывали токсического действия на организм животных в период наблюдения.


