Результат интеллектуальной деятельности: Способ оценки эффективности воздействия химиотерапевтических препаратов ксенотрансплантатной модели in vivo
Вид РИД
Изобретение
Изобретение относится к медицине в целом, более детально к способам оценки воздействия химиотерапевтических препаратов на опухоли различного вида, используется в эксперименте для получения оценки противоопухолевой эффективности воздействия химиотерапевтических препаратов на материал с живой опухолью, предназначено для совершенствования методов химиотерапии. Более детально изобретение относится к экспериментальной онкологии и направлено на создание новой модели ксенотрансплантации на млекопитающих животных, эксперименты проведены преимущественно на кроликах. Основная идея заявленного технического решения заключается в трансплантации фрагмента опухоли человека в переднюю камеру глаза кролика и исследовании эффективности противоопухолевого воздействия лекарственных средств на трансплантированный фрагмент опухоли.
Заявленный способ оценки эффективности химиотерапевтических препаратов на ксенотрансплантатной модели in vivo может быть использован в области биологии, фармакологии, медицине и ветеринарии. Заявленное техническое решение направлено на отслеживание (мониторинг) опухолевых клеток в условиях, наиболее соответствующих организму больного, т.к. позволяет точно оценить влияние лекарственных средств на процессы онкогенеза и ангиогенеза, а при дальнейшем развитии указанного направления сделает возможным изучать динамику изменений в конкретных популяциях опухолевых клеток и межклеточные взаимодействия на фоне действия химиопрепаратов. При этом заявленное техническое решение не ограничивается только препаратами для химиотерапии.
Заявленное техническое решение, в отличие от известных и выявленных заявителем из исследованного уровня техники, может быть многократно повторено и использовано для оценки эффективности химиотерапевтических лекарственных средств в различных научных и медицинских учреждениях, особенно онкологического профиля: научно-исследовательских институтах, онкологических центрах.
Из исследованного уровня техники известно, что передняя камера глаза является иммунологически привилегированной областью, т.к. в ней не происходят реакции отторжения трансплантированных тканей, в том числе и опухолей ([1] Niederkorn J.Y. et al., OculImmunolInflamm, 2010, 18(3), p. 162-171).
Отсутствие иммунных реакций в отношении клеточных трансплантатов в передней камере глаза обеспечивается следующими факторами:
1) отсутствием кровеносных и лимфатических сосудов;
2) экспрессией Fas-лиганда клетками эпителия роговицы;
3) высоким содержанием цитокинов (например, TGFb), которые подавляют иммунные реакции, при этом ключевое значение для поддержания иммуносупрессивных свойств имеют симпатические нервы ([2] Vega J.L. et al., Am. J Pathol, 2009, 175(3), p. 1218-1225).
Опухоль оказывает системное воздействие на организм в целом за счет презентации антигенов внутри передней камеры глазного яблока ([3] Mizuno K. et al., Invest Ophthalmol Vis Sci.,1989, 30(6), p. 1112-1119).
Все вышеперечисленные факторы выявлены при исследовании трансплантации отдельных клеток линий опухолей, а не их фрагментов.
Следует обратить внимание на то, что при увеличении размеров опухоли более 2 мм опухолевые клетки находятся в условиях гипоксии ([4] Svensson R. et al., Nature, 2012, V. 485, p. 590-591). При недостатке кислорода в опухолевых клетках происходит селекция генотипа, поддерживающего выживание клеток в условиях гипоксии, а именно:
- мутирует опухольподавляющий ген р53,
- изменяется экспрессия генов, подавляющих апоптоз и поддерживающих аутофагию,
- преобладают анаболические процессы и т.д.
Как известно из уровня техники, в условиях гипоксии основные клетки стромы ([8] Строма (от греч. stroma - подстилка) - биологическая основа (или остов) органа животного организма, состоящая из неоформленной соединительной ткани, в которой расположены специфические элементы органа, имеются способные к размножению клетки, а также волокнистые структуры, обусловливающие ее опорное значение. В строме проходят кровеносные и лимфатические сосуды; элементы стромы играют и защитную роль, т.к. способны к фагоцитозу. Из клеток стромы кроветворных органов развиваются красные и белые кровяные тельца) - фибробласты и макрофаги начинают секретировать факторы, стимулирующие опухолевый процесс. За счет активации внутриклеточных механизмов опухоли приобретают устойчивость к повреждающему действию ионизирующего излучения и противоопухолевых препаратов ([5] Erler J. et al., Mol. Cell. Biol., 2004, V. 24, p. 2875-2889). Из-за остановки клеточного цикла в стадии G1 (период перед синтезом ДНК) или G2 (период между синтезом ДНК и митозом) снижается эффективность действия фторурацила; увеличение расстояния от сосудов увеличивает резистентность к таксанам (цитостатик) (таксоны - класс химиотерапевтических препаратов, имеющий широкий спектр клинических применений, включая рак молочной железы, рак легкого, рак головы и шеи, рак яичников, рак мочевого пузыря, рак пищевода, рак желудка и рак простаты), а закисление внеклеточных структур ткани снижает чувствительность к доксорубицину ([6] Wilson W., Hay M., Nat. Rev. Cancer., 2011, V. 11, p. 393-410).
При этом следует обратить внимание на то, что известные на дату подачи заявки экспериментальные модели для изучения молекулярных событий в процессе онкогенеза и влияния противоопухолевых препаратов имеют значительные недостатки.
Модели in vitro позволяют осуществлять ежедневное наблюдение за опухолевыми клетками, но условия культивации сильно отличаются от микроокружения в организме человека и поэтому корреляция данных с результатами in vivo очень низка. Ксенотрансплантация опухолей под кожу иммунодефицитным мышам считается более предпочтительной в плане соответствия условиям роста опухоли в организме больного, но при этом почти невозможно осуществлять постоянное наблюдение за изменениями в опухолевой ткани, вследствие чего данная модель не нашла широкого применения.
Из исследованного уровня техники заявителем не обнаружены источники информации, соответствующие преследуемым целям по заявленному техническому решению (ксенотрансплантация опухолей человека), при этом из исследованной области техники не выявлено технических решений, которые предполагают пересадку человеческой опухоли в переднюю камеру глаза кроликов для оценки эффективности химиотерапевтических препаратов.
Проблемами оценки эффективности при моделировании и трансплантации экспериментальных опухолей посвящены многие разработки (например, [7] РФ №2257619, РФ №2538638, РФ 212185, США №5698413), что является доказательством актуальности данной проблемы. При этом следует обратить внимание, что указанные выше технические решения не обеспечивают возможность реализации поставленных целей в заявленном техническом решении, т.к. все приведенные примеры не обеспечивают возможность мониторинга живой опухоли человека в требуемый для мониторинга интервал времени при условии, что она (опухоль) не погибает, т.к. в передней камере глаза кролика, как и у других млекопитающих, отсутствует иммунная реакция.
В патенте RU №2257619 «Способ создания экспериментальных опухолей в ретрогастральной и паранефральной клетчатке, включающий введение крысе в ретрогастральную клетчатку взвеси штамма крысиной саркомы» описан способ создания экспериментальных опухолей в ретрогастральной и паранефральной клетчатке, включающий введение крысе в ретрогастральную клетчатку 0,15 мм взвеси штамма крысиной саркомы 45 на глубину 2-3 мм и введение крысе в паранефральную клетчатку по 0,2 мм взвеси штамма крысиной саркомы 45 на глубину 3-4 мм с обеих сторон.
Недостатком аналога является то, что исключается ежедневное наблюдение за ростом опухоли, а также определение тактики лечения конкретного больного, т.к. используются клетки крысиной саркома.
В патенте RU 2538638 «Способ прогнозирования эффективности неоадъювантной химиотерапии у больных операбельным базальноподобным трипл-негативным раком молочной железы» описан способ прогнозирования эффективности неоадъювантной химиотерапии (НАХТ) у больных операбельным базальноподобным трипл-негативным раком молочной железы, включающий определение рецепторного статуса опухоли посредством иммуногистохимического исследования биопсийного материала, при котором выявляют негативную ядерную экспрессию к рецепторам эстрогена и прогестерона и негативную мембранную экспрессию HER2/neu, а также уровень маркера клеточной пролиферации Ki-67, отличающийся тем, что дополнительно определяют экспрессию СК 5/6 и EGFR1, оценивают уровень EGFR1, при этом к низкому уровню относят показатели менее 10%, к высокому - 10% и более, ожидаемую эффективность неоадъювантной химиотерапии рассчитывают по приведенной в описании формуле.
Недостатком аналога является то, что не предполагается ежедневное наблюдение реакции опухоли на химиотерапию и метод используется только для одного из типов рака молочной железы.
Наиболее близким аналогом, взятым в качестве прототипа, является патент US 5698413 «А Method of evaluating chemotherapeutic agents in vivo», в котором предлагается способ скрининга химиотерапевтических агентов в естественных условиях, включающий следующие стадии: (А) имплантация млекопитающему по меньшей мере одного биологически совместимого, трубчатого, полупроницаемого инкапсулируемого устройства, содержащего группу клеток-мишеней в пределах внутренней части упомянутого устройства, в котором указанное устройство имеет порог отсечения молекулярной массой более чем 50000 (или более чем 100000) дальтон, упомянутое устройство состоит из поливинилфторида (или поливинилиденфторида); (Б) обработка указанного млекопитающего по меньшей мере одним химиотерапевтическим агентом; а также (С) оценка реакции указанных клеток-мишеней по меньшей мере на один химиотерапевтический агент.
Недостатком указанного способа является то, что клетки культивируют в пробирке в среде, подходящей для клеточной линии, а не забирают у больного. Линии опухолевых клеток трансплантируют в организм животного в специальном контейнере, т.е. условия роста опухоли отличаются от естественных. Кроме указанного, размещение линии клеток внутри капсулы и внутри тела животного не позволяет осуществлять постоянный мониторинг реакции на химиопрепараты.
Целью заявленного технического решения является получение в эксперименте способа (модели) ксенотрансплантации опухолей человека в переднюю камеру глаза кроликов для оценки эффективности химиотерапевтических препаратов in vivo.
Новизна изобретения состоит в том, что трансплантация крупного фрагмента опухоли человека в переднюю камеру глаза кролика, вследствие сопоставимости размера глаза кролика и фрагмента опухоли, позволяет получить экспериментальную опухоль, и созданная таким образом модель может служить для оценки эффективности химиотерапевтических препаратов in vivo.
Цель достигается новым способом оценки эффективности воздействия химиотерапевтических препаратов ксенотрансплантатной модели in vivo, включающим трансплантацию опухоли в организм животного, обработку животного химиотерапевтическим агентом, оценку реакции трансплантированных клеток на действие агента, характеризующимся тем, что в качестве трансплантата используют фрагменты опухоли, выделенные у больного, трансплантацию проводят в переднюю камеру глаза кролика, вводят в качестве химиотерапевтических агентов цитостатики - доксорубицин или цисплатин, проводят постоянную визуальную оценку реакции трансплантированных клеток на действие цитостатиков, проводят постоянный анализ фотографий трансплантированной опухоли, проводят постоянную точную оценку эффективности влияния каждого цитостатика на процессы онкогенеза и ангиогенеза в отношении конкретной опухоли.
Наиболее важной характеристикой заявленного решения является то, что предлагаемая методика мониторинга опухолевых клеток в условиях, наиболее соответствующих организму больного, позволяет точно оценить влияние цитотоксических препаратов на процессы онкогенеза и ангиогенеза, а при дальнейшем развитии сделает возможным изучать динамику изменений в конкретных популяциях опухолевых клеток и межклеточные взаимодействия на фоне действия химиопрепаратов.
Для выполнения исследований было получено разрешение Этического комитета ГУАЗ Республиканского Клинического онкологического диспансера Министерства здравоохранения Республики Татарстан (Протокол заседания от 22.09.2014).
Изобретение вместе с дальнейшими задачами и их преимуществами может быть наилучшим способом осмыслено со ссылкой на следующее описание, взятое вместе с сопровождающими чертежами, на которых:
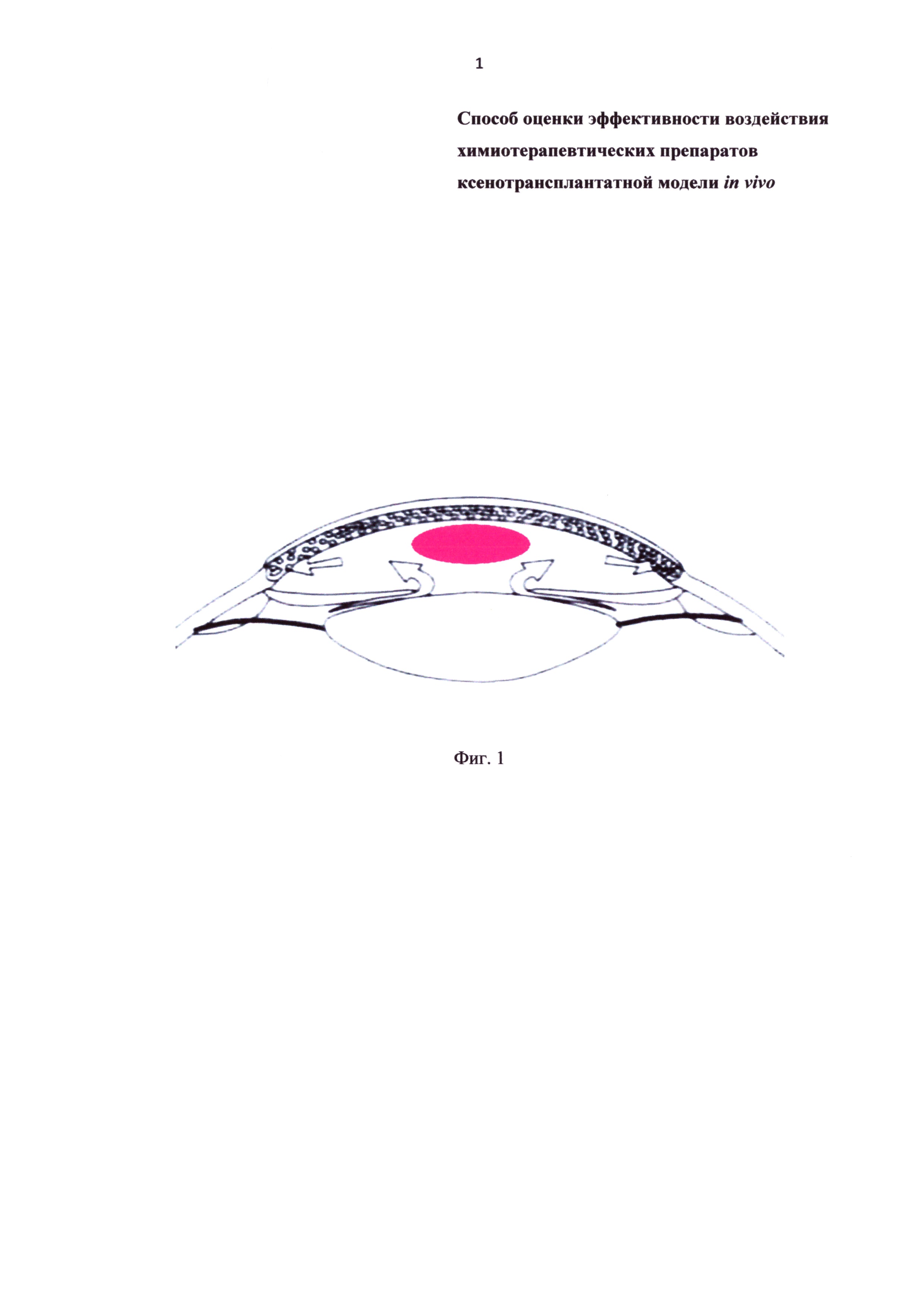
Фиг. 1 - схема передней камеры глаза кролика с трансплантированной опухолью (красного цвета). Стрелками показано направление циркуляции внутриглазной жидкости.
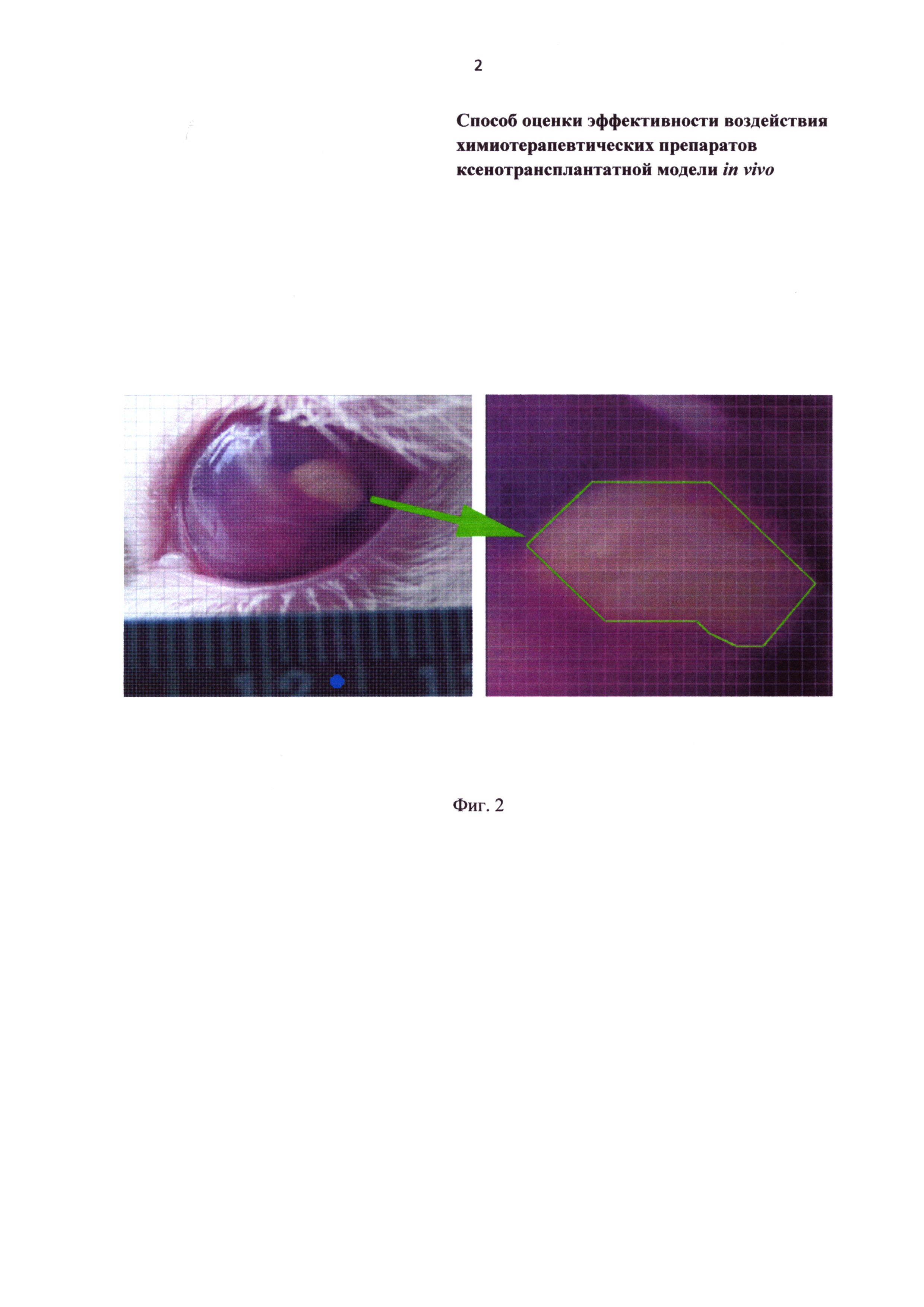
Фиг. 2 - опухоль в передней камере глаза кролика. При помощи линейки (синяя точка) определяется цена деления сетки, программно накладываемой на фотографию.
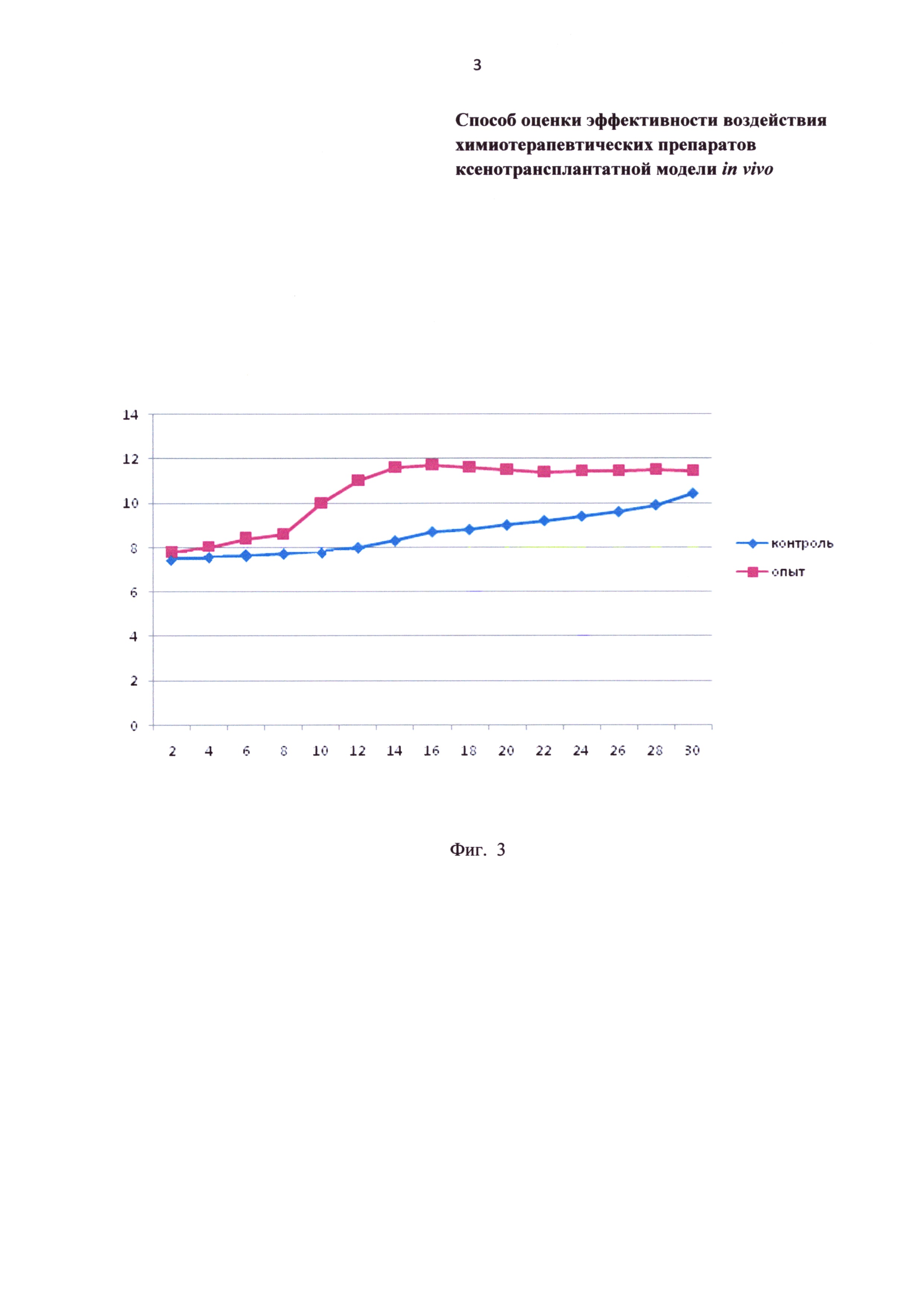
Фиг. 3 - динамика размеров ксенотрансплантированной миксофибросаркомы под влиянием химиопрепаратов. Контроль - без введения химиопрепаратов, опыт - доксорубицин. По оси ординат - площадь опухоли в мм, по оси абсцисс - время после трансплантации в сутках.
Фиг. 4 - фотография миксофибросаркомы в передней камере глаза кролика на 2 сутки после ксенотрансплантации.
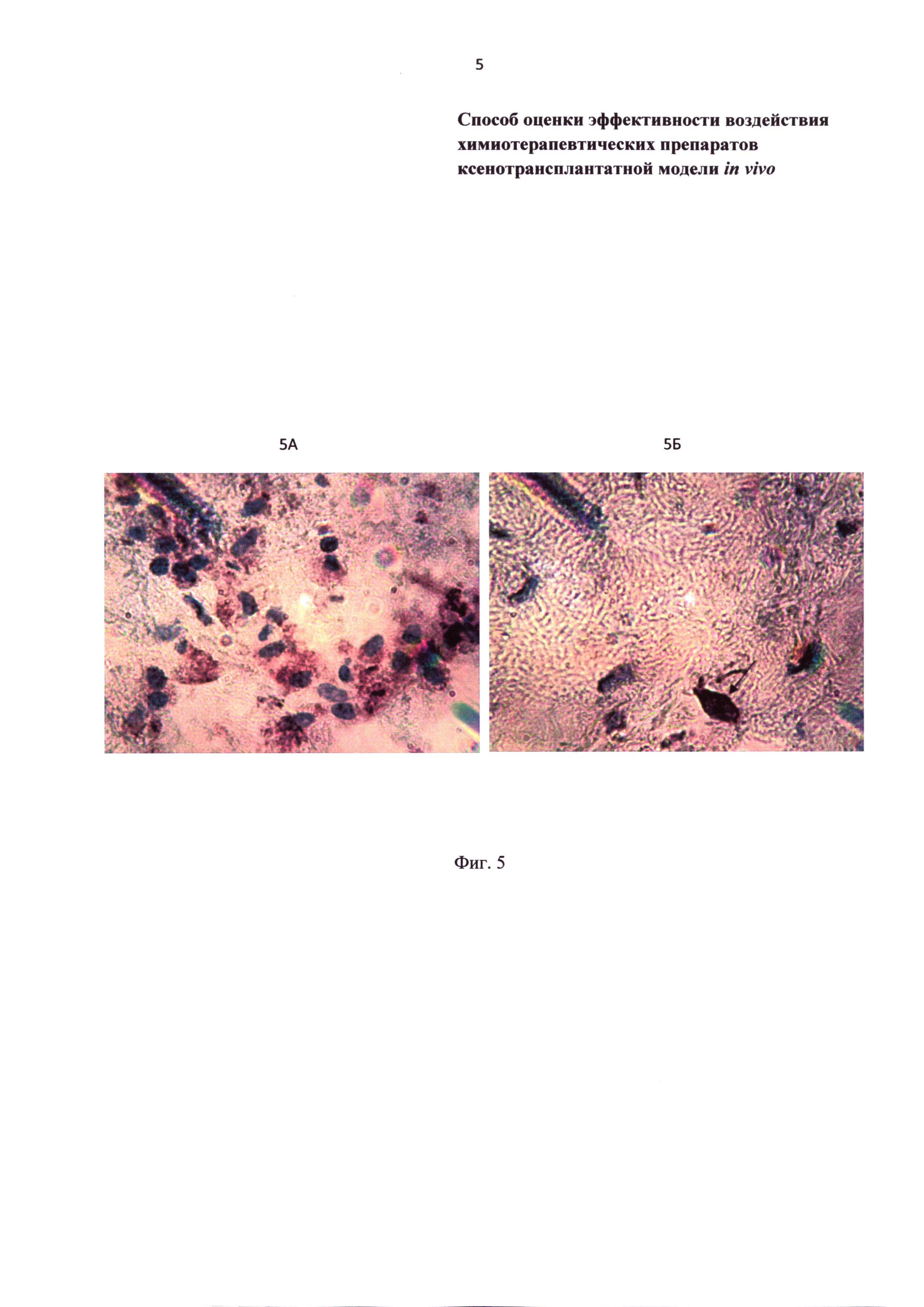
Фиг. 5 - микрофотография миксофибросаркомы на 30 сутки инкубации в передней камере глаза. 5А - контрольная группа. Осадок красного цвета соответствует позитивной иммуногистохимической реакции с антителами против виментина; 5Б - на фоне введения доксорубицина. Стрелкой показана виментинпозитивная (опухолевая) клетка.
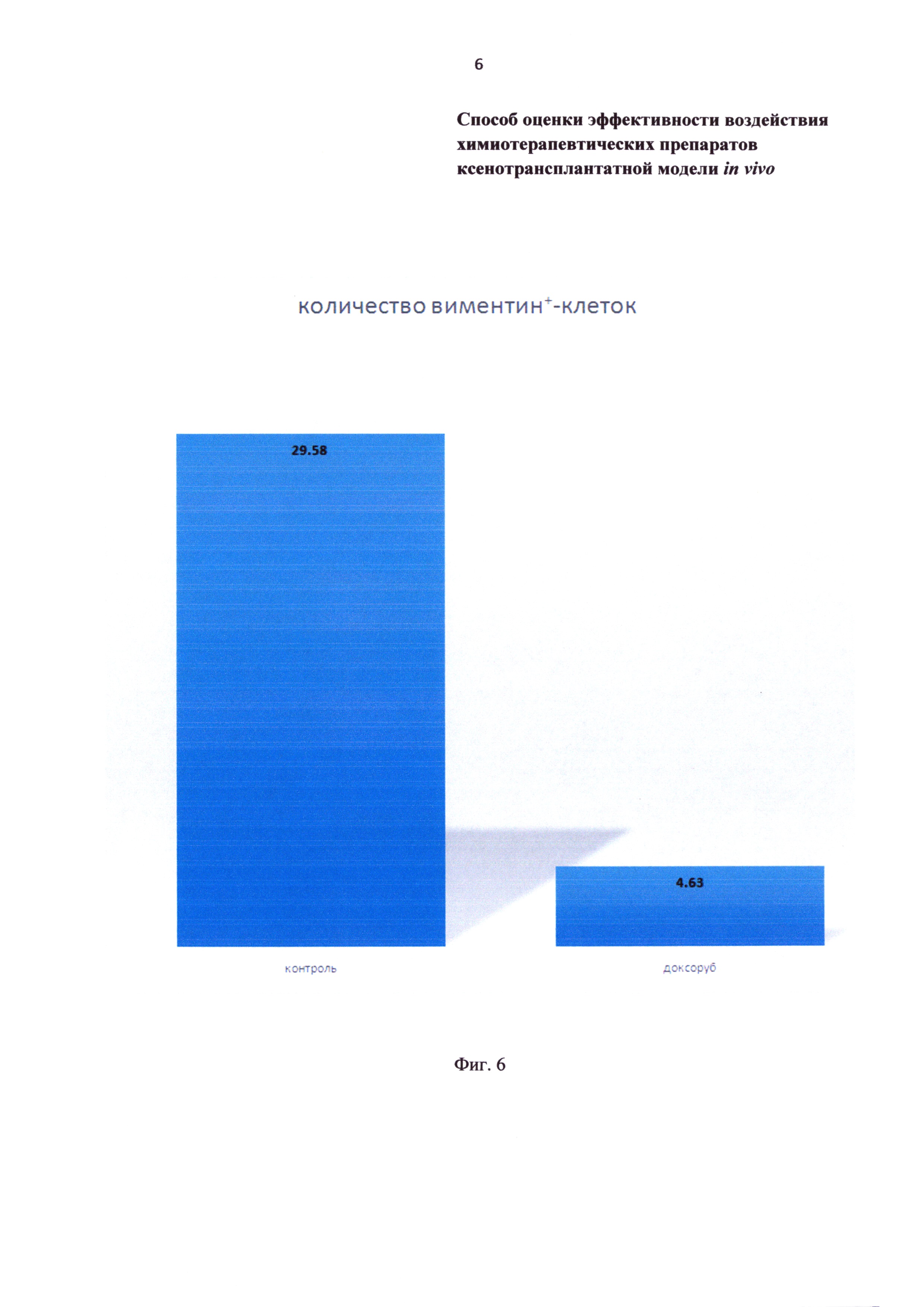
Фиг.6 - гистограмма количества виментинпозитивных (опухолевых) клеток в ксенотрансплантате на 30 сутки после операции. Контроль - без введения фармакологических препаратов; доксоруб - группа, получавшая доксорубицин.
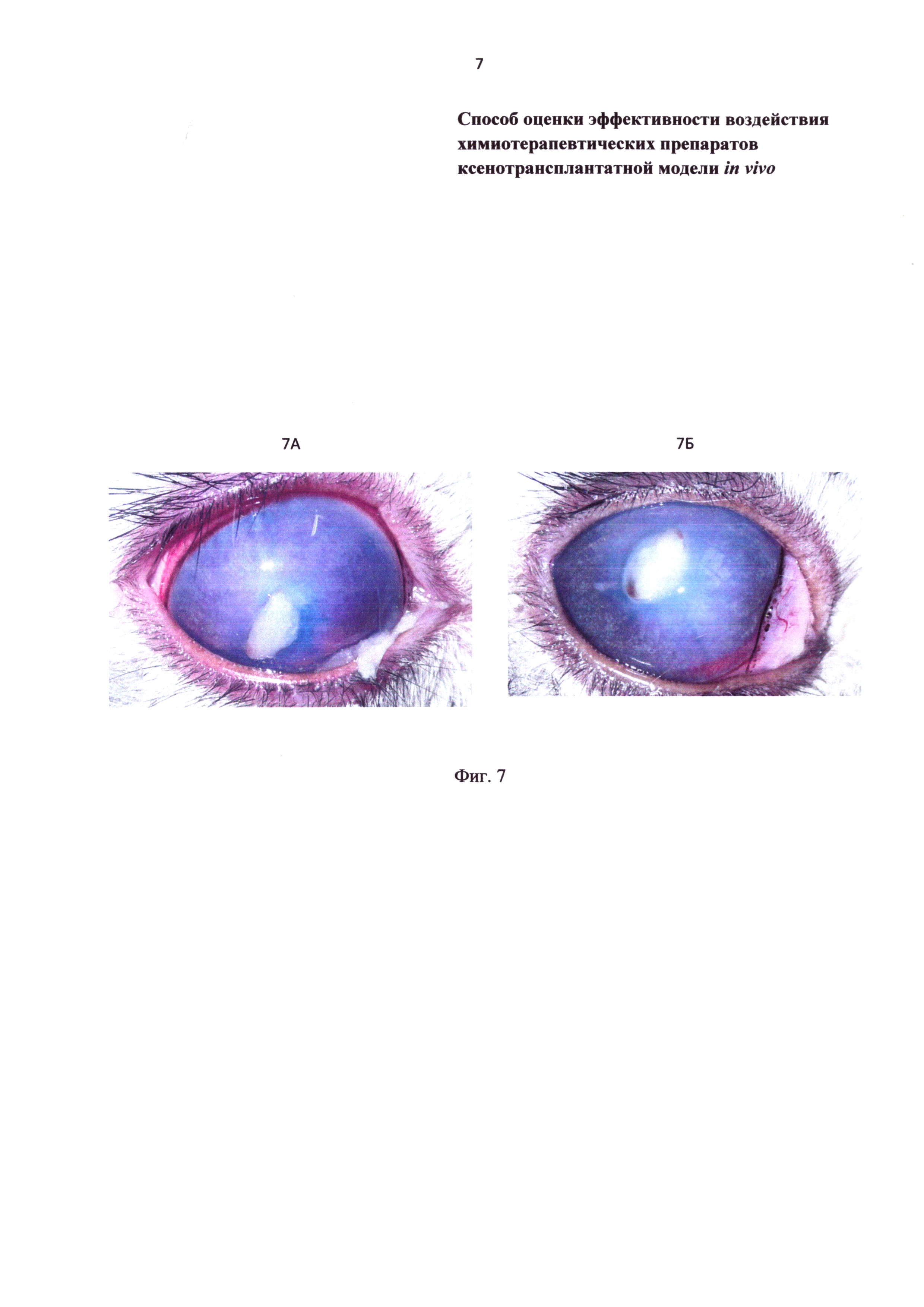
Фиг. 7 - фотография передней камеры глаза кролика после ксенотрансплантации остеосаркомы. 7А - на 2 сутки; 7Б - на 15 сутки на фоне действия доксорубицина.
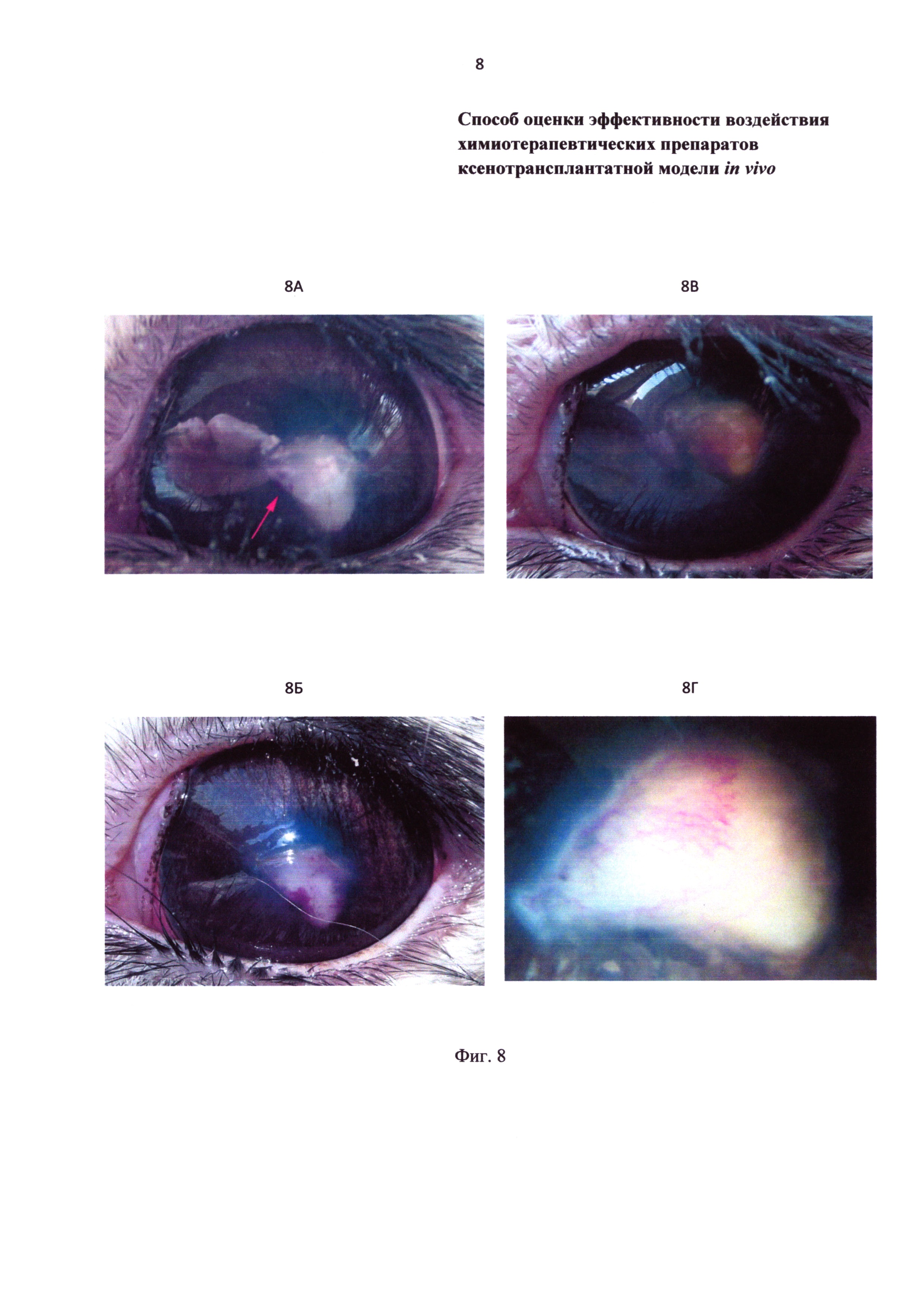
Фиг. 8 - фотография аденокарциномы после ксенотрансплантации в переднюю камеру глаза. 8А - на 3 сутки (стрелка на фото 8А указывает на кровяной островок); 8Б - на 5 сутки; 8В - на 13 сутки; 8Г - на 30 сутки.
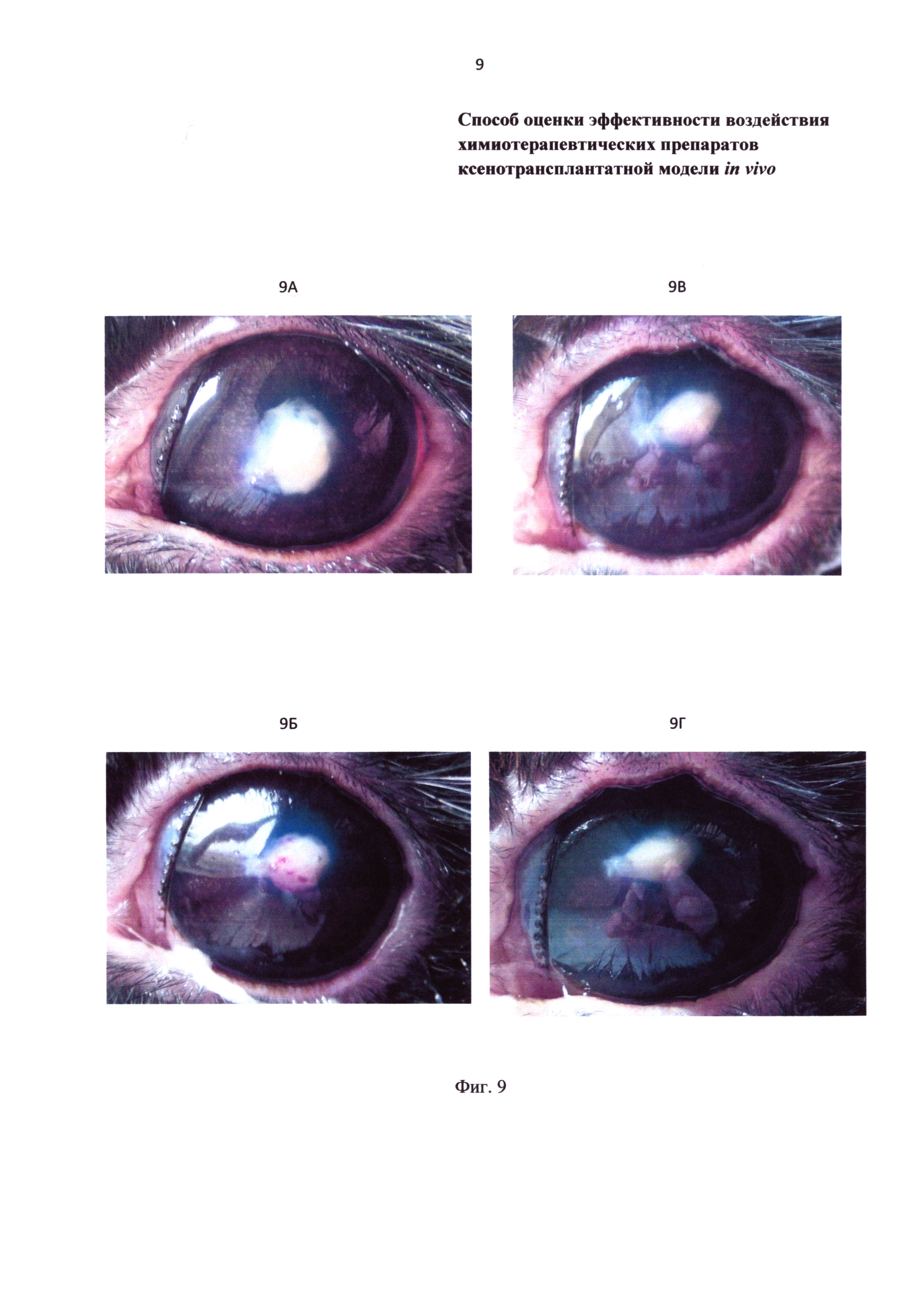
Фиг. 9 - фотография аденокарциномы после ксенотрансплантации в переднюю камеру глаза на фоне введения цисплатина. 9А - на 3 сутки, 9Б - 9 сутки, 9В - 16 сутки, 9Г - на 30 сутки после операции.
Оценка эффективности химиотерапевтических препаратов на ксенотрансплантатной модели in vivo осуществляется следующим образом.
Методика отработки in vivo модели ксенографтов опухоли на кроликах
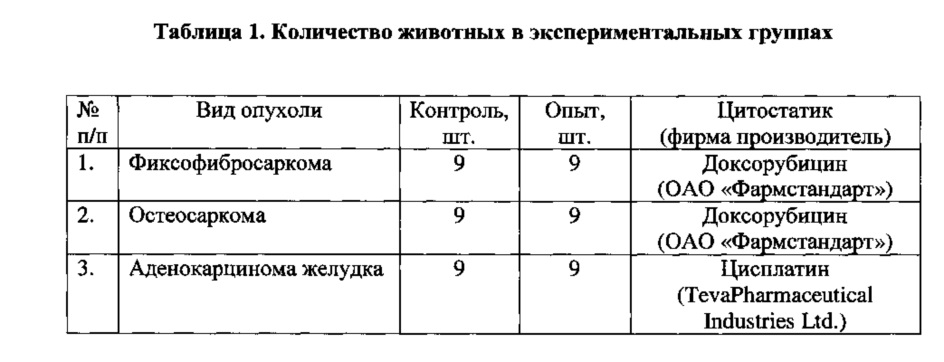
В эксперименте использовали 90 кроликов обоих полов весом 2800-3500 г. Животных содержали в стандартных условиях со свободным доступом к воде и корму. Было проведено 3 серии экспериментов по ксенотрансплантации фибросаркомы, саркомы кости и аденокарциномы желудка. В первых двух сериях исследована реакция ксенотрансплантированной саркомы на вводимые фармакологические препараты. Животные в обеих сериях были поделены на 4 группы по 9 кроликов в каждой группе (Таблица 1). Животным третьей серии ксенотрансплантировали аденокарциному желудка.
Всем животным осуществляли ксенотрансплантацию опухоли: забор операционного материала в питательную среду DMEM (Sigma) и транспортировка к месту операции занимала не более 1,5 часов. Перед трансплантацией из опухоли получали фрагменты кубической формы со стороной 3 мм. Такой размер фрагмента обеспечивает гипоксию в центральной части. Кроликам под ингаляционным наркозом хлороформом рассекали роговицу посередине между центральной частью и склерой. Пользуясь пинцетом, имплантировали опухоль под роговицу в переднюю камеру глаза (Фиг. 1, Фиг. 4).
Введение цитостатиков
Начиная со следующего дня после операции, всем животным начинают делать инъекции. Кроликам контрольных групп - физиологический раствор в объеме 1 мл/кг. Кроликам опытной группы через сутки внутрибрюшинно вводят раствор доксорубицина (Фармстандарт, Россия) в возрастающей концентрации для исключения осложнений заживления травмированной роговицы. Первые две инъекции - 1 мг/кг, следующие две - 2 мг/кг и далее - 3 мг/кг. В группе с цисплатином животные получают цитостатик в дозе 1 мг/кг через день. Растворы исходных компонентов готовят на воде для инъекций.
Анализ размеров трансплантированной опухоли
У всех животных через сутки фотографируют трансплантированные фрагменты опухоли для оценки их изменений. На изображениях осуществляют подсчет площади опухоли при помощи градуированной сетки (Фиг. 2). Статистическая обработка осуществляется с использованием критерия Стьюдента.
Через 30 суток после операции у животных выделяют трансплантаты и фиксируют в 10% формалине. Парафиновые срезы окрашивают гематоксилином или проводят иммуногистохимическое выявление виментин-позитивных (опухолевых) клеток.
Полученные результаты
Модель миксофибросаркомы
Только у одного животного опытной группы (доксорубицин) из одного глаза произошло самостоятельное отхождение трансплантата. У всех остальных животных опухоль сохранялась на всем протяжении эксперимента. Признаки воспаления не определялись. Сосуды в опухоль не прорастали. После трансплантации размеры опухолей во всех группах начали возрастать. В контрольной группе (без лечения) размер опухоли к 30 суткам увеличился на 39±4,2% (Р<0,05) (Фиг. 3). К 12 суткам после трансплантации в опытной группе (доксорубицин) увеличение размера опухоли составляет 48±4,7% (Р<0,05). После этого срока размеры опухоли достоверно не изменялись (Фиг. 3).
Морфологическое исследование во всех группах показало врастание опухоли в область травмы роговицы, отсутствие кровеносных сосудов и очаги некроза.
Иммуногистохимическое исследование
На срезах ксенотрансплантатов позитивная иммуногистохимическая реакция с антителами против виментина (белок промежуточных филаментов клеток мезенхимного происхождения) определяется в цитоплазме клеток (Фиг. 5А, 5Б). Учитывая, что используемые антитела реагируют только с антигенами человека, то выявленные виментинпозитивные клетки являются трансплантированными опухолевыми клетками. На фоне введения доксорубицина к 30 суткам после ксенотрансплантации количество виментинпозитивных клеток снижается более чем в 6 раз (Фиг. 6).
Модель остеосаркомы
После ксенотрансплантации сосуды в опухоли не визуализировались. В контрольной группе у одного животного произошло отхождение ксенотрансплантата. К 15 суткам во всех группах не произошло статистически значимого увеличения размеров опухоли (Фиг. 7А, 7Б).
Модель аденокарциномы желудка.
В контрольной группе у большинства животных на 3 сутки после ксенотрансплантации в опухоли стали заметны кровяные островки (Фиг. 8А), которые к 5 суткам значительно расширились, сформировались в сосуды (Фиг. 8Б). В среднем на 13 сутки опухоль приобретает желтое окрашивание (Фиг. 8В), что является признаком ее гибели. К 30 суткам размеры ксенотрансплантата незначительно уменьшились по сравнению с 3 сутками, в части опухоли видна сеть сосудов (Фиг. 8Г). К этому сроку на гистологическом срезе определяется соединительная ткань с множеством кровеносных сосудов. Под влиянием цисплатина динамика роста сосудов значительно отличается от контроля. Кровяные островки появляются только на 9 сутки после ксенотрансплантации (Фиг. 9А, 9Б) и не визуализируются к 16 суткам у большинства животных (Фиг. 9В, 9Г). Размер ксенотрансплантата, уменьшившийся к 9 суткам на 38% (Р<0,05), в дальнейшем не изменялся. К этому сроку на гистологическом срезе определяется соединительная ткань с множеством кровеносных сосудов.
Таким образом, показано, что после трансплантации миксофибросаркомы (в опухоли преобладает соединительная ткань) отторжения не происходит, а на фоне введения химиопрепаратов размер опухоли уменьшается в 2,5 раза, при этом виментинпозитивные (опухолевые) клетки практически отсутствуют. После трансплантации аденокарциномы желудка (ткань опухоли преимущественно состоит из раковых клеток) в опухоль прорастают кровеносные сосуды и происходит процесс отторжения, но на фоне введения цисплатина динамика роста сосудов значительно отличается. Появившись на 7 суток позже, чем в контроле, еще через 7 дней сосуды в опухоли под влиянием цисплатина не визуализировались.
В рамках данного исследования также показано, что на заключительном этапе химиотерапии доксорубицином (30 сутки) размеры ксенотрансплантированной саркомы не отличаются от контроля, но при этом количество опухолевых клеток меньше в 6,4 раза.
Таким образом, в результате экспериментов достигнута поставленная цель - получен способ (модель) ксенотрансплантации опухолей человека в переднюю камеру глаза кроликов для оценки эффективности химиотерапевтических препаратов in vivo.
Техническим результатом заявленного технического решения является то, что в результате проведенных исследований получен новый способ оценки эффективности воздействия химиотерапевтических препаратов ксенотрансплантатной модели in vivo, включающий трансплантацию опухоли в организм животного, обработку животного химиотерапевтическим агентом, оценку реакции трансплантированных клеток на действие агента, характеризующийся тем, что в качестве трансплантата используют фрагменты опухоли, выделенные у больного, трансплантацию проводят в переднюю камеру глаза кролика, вводят в качестве химиотерапевтических агентов цитостатики - доксорубицин или цисплатин, проводят постоянную визуальную оценку реакции трансплантированных клеток на действие цитостатиков, проводят постоянный анализ фотографий трансплантированной опухоли, проводят постоянную точную оценку эффективности влияния каждого цитостатика на процессы онкогенеза и ангиогенеза в отношении конкретной опухоли.
Предлагаемое изобретение по методике мониторинга опухолей в условиях, наиболее соответствующих организму больного, позволяет точно оценить влияние цитотоксических препаратов на процессы онкогенеза и ангиогенеза, а при дальнейшем развитии сделает возможным изучать динамику изменений в конкретных популяциях опухолевых клеток и межклеточные взаимодействия на фоне действия химиопрепаратов.
В списке приведенной литературы собраны некоторые публикации и патенты, описывающие состояние области, к которой относится настоящее изобретение. В настоящем изобретении можно сделать различные модификации и изменения без выхода из его объема, который определен прилагаемой формулой изобретения.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как на дату предоставления заявочных материалов заявителем из подвергнутых анализу источников патентной и не патентной информации РФ и стран зарубежья не выявлена заявленная совокупность признаков с идентичными заявленному техническому решению свойствами.
Новизна изобретения состоит в том, что трансплантация крупного фрагмента опухоли человека в переднюю камеру глаза кролика, вследствие сопоставимости размера глаза кролика и фрагмента опухоли, позволяет получить экспериментальную опухоль, и созданная таким образом модель может служить для оценки эффективности химиотерапевтических препаратов in vivo.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. совокупность заявленных признаков обеспечивает получение неочевидных для специалиста технических результатов.
Заявленное техническое решение удовлетворяет критерию «промышленная применимость», так как может быть многократно повторено и использовано для оценки эффективности химиотерапевтических препаратов в экспериментах на животных и воспроизведено в различных научных медицинских учреждениях, особенно онкологического профиля: научно-исследовательских институтах, онкологических центрах.
Список использованных источников
1. Niederkorn J.Y. Immune privilege of corneal allografts / J.Y. Niederkorn, D.F. Larkin // OculImmolInflamm. - 2010. - V.18(3). - P. 162-171.
2. Vega J.L. Surgical denervation of ocular sympathetic afferents decreases local transforming growth factor-b and abolishes immune privilege / J.L. Vega, H. Keino, S. Masli // Am J Pathol. - 2009. - V. 175(3). - P. 1218-1225.
3. Mizuno K. Anterior chamber-associated immune deviation induced by soluble antigens / K. Mizuno, A.F. Clark, J.W. Streilein // Invest Ophthalmol Vis Sci. - 1989. - V. 30(6). - P. 1112-1119.
4. Svensson R. Tumour friend or foe / R. Svensson, R. Shaw // Nature. - 2012. - V. 485. - P. 590-591.
5. Erler J.T. Hypoxia-mediated down-regulation of Bid and Bax in tumors occurs via hypoxia-inducible factor 1 dependent and -independent mechanisms and contributes to drug resistance / J.T. Erler et al. // Mol. Cell. Biol. - 2004. - V. 24. - P. 2875-2889.
6. Wilson W. Targeting hypoxia in cancer therapy / W.R. Wilson, M.P. Hay // Nat. Rev. Cancer. - 2011. - V. 11. - P. 393-410.
7. Патент США №5698413. Method of evaluating chemotherapeutic agents in vivo. Опубл. 16.12.1997.
8. Патент РФ №2401463. Способ моделирования экспериментального рака желудка. Опубл. 10.10.2010.
9. Патент РФ №2257619. Способ создания экспериментальных опухолей. Опубл. 27.07.2005.
10. Патент РФ №2538638. Способ прогнозирования эффективности неоадъювантной химиотерапии у больных операбельным базальноподобным трипл-негативным раком молочной железы. Опубл. 10.01.2015.
11. Патент РФ 212185. Способ трансплантации органов и тканей. Опубл. 20.11.1998.
12. Сайт: http://dic.academic.ru/dic.nsf/bse/136522/%D0%A1%D1%82%D1%80%D0%BE %D0%BC%D0%B0.
Способ оценки эффективности воздействия химиотерапевтических препаратов ксенотрансплантатной модели in vivo, включающий трансплантацию опухоли в организм животного, обработку животного химиотерапевтическим агентом, оценку реакции трансплантированных клеток на действие агента, отличающийся тем, что в качестве трансплантата используют фрагменты опухоли, выделенные у больного, трансплантацию проводят в переднюю камеру глаза кролика, вводят в качестве химиотерапевтических агентов цитостатики - доксорубицин или цисплатин, проводят постоянную визуальную оценку реакции трансплантированных клеток на действие цитостатиков, проводят постоянный анализ фотографий трансплантированной опухоли, проводят постоянную точную оценку эффективности влияния каждого цитостатика на процессы онкогенеза и ангиогенеза в отношении конкретной опухоли.