Результат интеллектуальной деятельности: ИНГИБИТОР АТФ-ЗАВИСИМЫХ ОБРАТНЫХ ТРАНСПОРТЕРОВ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области разработки физиологически активных веществ, а именно к группе хиральных конъюгатов (оптически активных гибридных молекул) олигоэфирполиольной природы (ОЭП), являющихся ингибиторами АТФ-зависимых обратных транспортеров клеток, сокращенно называемых ABC-транспортерами (от англ. ATP-binding cassette transporters). Изобретение может быть использовано в области биологии, фармакологии, фармацевтики, медицины, сельском хозяйстве и экологии для существенного усиления эффективности действия физиологически активных веществ, в том числе лекарственных средств - противоопухолевых, сердечно-сосудистых, противоаллергических, противовоспалительных и других, за счет подавления механизмов множественной лекарственной устойчивости клеток под действием заявленных ингибиторов ABC-транспортеров.
Одной из наиболее актуальных проблем современной фармакотерапии является множественная лекарственная устойчивость патологических клеток - врожденная или приобретенная невосприимчивость клеток к лекарственным препаратам, различающимся по механизму действия и структуре. Одним из основных механизмов возникновения лекарственной устойчивости патологических клеток является способность к обратному захвату и выбросу проникающих в клетку молекул ксенобиотиков АТФ-зависимыми насосами семейства ABC-транспортеров [1].
В семейство ABC-транспортеров входят гликопротеин P-gp (P-glycoprotein), белки множественной лекарственной устойчивости семейства MRP (multidrug resistance-associated protein) и белок устойчивости рака молочной железы BCRP (breast cancer resistance protein). Активность указанных ABC-транспортеров, экспрессия которых существенно возрастает при возникновении патологических процессов в клетке, приводит к значительному снижению эффективности фармакотерапии. Подобные эффекты детально показаны и исследованы на примере большинства лекарственных средств для химиотерапии опухолей [2], в том числе таргетных, но и при многих других патологиях ABC-транспортеры существенно снижают эффективность лекарств. ABC-транспортеры обладают широкой субстратной специфичностью, осуществляя обратный захват и выброс из клетки многих лекарств из различных терапевтических групп.
В качестве примеров, не носящих исчерпывающий характер, субстратами ABC-транспортеров являются [3]: анальгетики (асимадолин, фентанил, морфин, пентазоцин); антибиотики (ампициллин, азитромицин, цефоперазон, цефтриаксон, кларитромицин, доксициклин, эритромицин, грамицидин A, грамицидин D, грепафлоксацин, итраконазол, кетоконазол, левофлоксацин, рифампицин, спарфлоксацин, тетрациклин, валиномицин и другие); противовирусные препараты (делавирдин, лопинавир, ламивудин, нелфинавир, зидовудин); антиаритмические препараты (амиодарон, дигоксин, лидокаин, пропафенон, хинидин, верапамил); противоопухолевые препараты (5-фторурацил, актиномицин D, бисантрен, хлорамбуцил, колхицин, цисплатин, цитарабин, даунорубицин, доцетаксел, доксорубицин, эпирубицин, этопозид, гефитиниб, иринотекан, метотрексат, митомицин C, митоксантрон, паклитаксел, тамоксифен, тенипозид, топотекан, винбластин, винкристин и другие); антигистаминные препараты (циметидин, фексофенадин, ранитидин, терфенадин); гиполипидемические препараты (ловастатин, симвастатин, правастатин, розувастатин); блокаторы кальциевых каналов (азидопин, бепридил, дилтиазем, фелодипин, нифедипин, низолдипин, нитрендипин, тиапамил, верапамил); анти-ВИЧ препараты (ампренавир, индинавир, лопинавир, нелфинавир, саквинавир, ритонавир); иммуносуппрессоры (циклоспорин A, сиролимус, такролимус), антидепрессанты (хлорпромазин, фенотиазин) и многие другие лекарственные соединения природного, синтетического или полусинтетического происхождения.
Таким образом, создание эффективных и безопасных ингибиторов АТФ-зависимых обратных транспортеров клеток является перспективным подходом к увеличению эффективности действия широкого ряда физиологически активных веществ, в том числе лекарственных средств. Создание подобных препаратов позволило бы значительно уменьшить терапевтическую дозу активных веществ, и как следствие, их побочные эффекты, и тем самым совершить качественный скачок в фармакологии и медицине.
Из исследованного уровня техники известен широкий ряд соединений, в том числе разрешенных к применению лекарственных препаратов, способных ингибировать ABC-транспортеры. Так, была проведена масштабная исследовательская работа по созданию ингибиторов ABC-транспортеров в качестве препаратов, увеличивающих чувствительность раковых клеток к действию противоопухолевых препаратов [3]. В частности, в качестве ингибиторов P-gp проявили активность и исследовались для комбинированной противоопухолевой химиотерапии аторвастатин, амлодипин, циклоспорин A, дисульфирам, нифедипин, верапамил, препараты GF120918, LY475776, LY335979, MS-209, OC144-093, pluronic L61, PSC-833, R101933, S9788, VX-710, XR-9576, V-104. В качестве ингибиторов MRP2 исследовались азитромицин, циклоспорин A, фуросемид, глибенкламид, пробенецид, MK-571. В качестве ингибиторов BCRP исследовались циклоспорин A, дипиридамол, элакридар, фумитреморгин C, новобиоцин, ортатаксел, резерпин, ритонавир, тариквидар, GF120918, VX-710, XR-9576.
Как известно из уровня техники, различают три поколения ингибиторов ABC-транспортеров:
Поколение 1: циклоспорин A, верапамил (примеры). Эти соединения являются эффективными ингибиторами обратного транспорта, но сами обладают высокой токсичностью. Их применение с химиотерапевтическими препаратами не привело к существенным клиническим результатам.
Поколение 2: PSC-833 и VX-710 (примеры). Эти соединения также являются эффективными ингибиторами обратного транспорта. Однако их применение с химиотерапевтическими препаратами также не привело к существенным клиническим результатам; кроме того, наблюдались существенные побочные эффекты терапии, связанные с лекарство-лекарственными взаимодействиями.
Поколение 3: GF120918, LY335979, R101933 и XR9576 (примеры). Эти соединения являются еще более эффективными ингибиторами обратного транспорта на in vitro моделях, чем ингибиторы поколений 1 и 2. Однако их применение с химиотерапевтическими препаратами также не привело к существенным клиническим результатам по причинам низкой безопасности (наличия нежелательных побочных эффектов) и недостаточной терапевтической эффективности.
В целом современное состояние исследований в этой области характеризуется локальными успехами на уровне in vitro, однако переход к in vivo, а тем более к клиническим исследованиям, как правило, не приносит желаемого эффекта, в основном, в силу наличия нежелательных побочных эффектов композиций, неоптимальной фармакокинетики, а также недостаточной эффективности ингибирующего действия [3]. При этом во всех современных исследованиях отмечается перспективность дальнейших поисков в этом направлении.
Исходя из указанного, становится очевидным, что для полноценной реализации перспектив данного подхода требуются более активные и безопасные ингибиторы ABC-транспортеров.
Аналогов или прототипов у заявленного технического решения по совпадающим признакам на дату предоставления заявочных материалов не выявлено, однако заявителем выявлено большое количество средств для решения поставленной задачи по назначению.
В заявленном техническом решении применен творческий подход, который позволяет одновременно значительно увеличить терапевтическую эффективность, повысить безопасность, а также существенно снизить стоимость активной фармацевтической субстанции, повысить технологичность производственного процесса получения субстанции. При этом заявленное техническое решение обеспечивает возможность выхода на международный рынок с продуктом, ранее не известным в мире.
Целью заявленного технического решения является получение ингибитора обратных ABC-транспортеров клеток олигоэфирполиольной природы (ОЭП-ингибитор), состоящего из полиоксипропиленгликоля с молекулярной массой от 300 до 500 Да и полиоксипропиленгексола с молекулярной массой от 1000 до 1500 Да.
Цели заявленного технического решения достигаются путем осуществления следующего химического процесса по схеме:

где:
1 - сорбит ((2S,3R,4R,5R)-гексан-1,2,3,4,5,6-гексол);
2 - бифункциональное кислородсодержащее соединение, в котором R = -O-; [-OCH2CH(CH3)]k-O-, k=1-7;
3 - окись пропилена;
M(OH)x, - гидроокись металла, где M - щелочной или щелочноземельный металл, x=1 или 2;
n=2-6, преимущественно n=4;
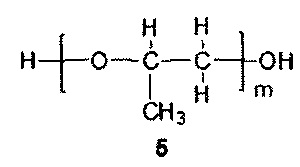
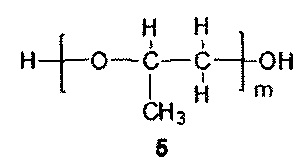
m=5-9, преимущественно m=7.
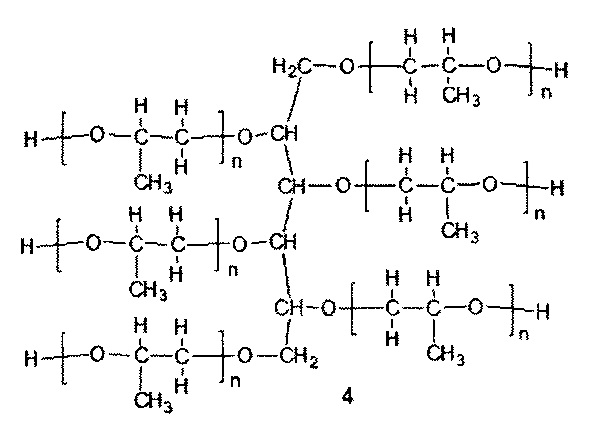
Таким образом, заявленное техническое решение в отношении способа реализуется единовременно, в одном реакторе, в один этап, с применением доступных реагентов, взятых в пропорциях, обеспечивающих получение целевого конъюгата с эквимольным соотношением оптически активного соединения 4 и соединения 5.
Процесс в целом реализуется в соответствии с представленной выше схемой, в соответствии с приведенным далее описанием.
В реактор-полимеризатор загружают исходные реагенты 1 и 2, добавляют щелочной катализатор, включают перемешивание и в атмосфере азота выдерживают реакционную смесь при температуре 90-100°C в течение 30 минут до получения гомогенной массы. Затем подается расчетное количество соединения 3 со скоростью, обеспечивающей давление в реакторе-полимеризаторе не выше 0,39 мПа (4 кгс/см2), и при температуре не выше 115°C. После этого проводится выдержка реакционной массы при температуре не выше 115°C в течение 1-1,5 часов до остановки падения давления.
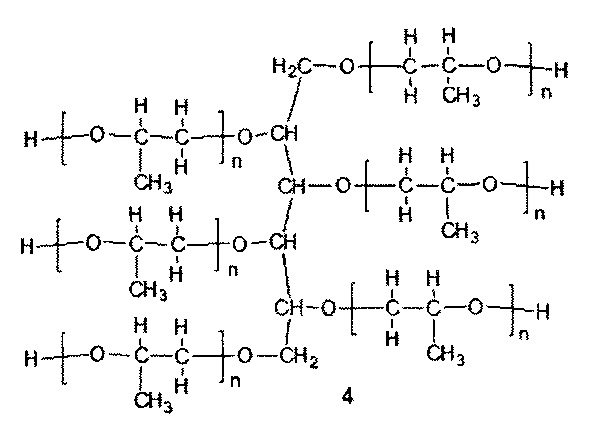
При этом соотношение реагентов 1, 2 и M(OH)x рассчитывается таким образом, чтобы в результате их реакции с окисью пропилена получилась эквимольная смесь соединений 4 и 5. Соединение 4 с n=4 и соединение 5 с m=7 представляют собой основные олигомерные компоненты, образующиеся в описанной реакции анионной олигомеризации. Количество соединения 3 рассчитывается таким образом, чтобы полученная эквимольная смесь соединений 4 и 5 обладала гидроксильным числом в пределах 215-240 мг КОН/г.
В качестве бифункционального кислородсодержащего соединения 2 могут выступать пропиленгликоль, дипропиленгликоль, трипропиленгликоль, тетрапропиленгликоль, пентапропиленгликоль, гексапропиленгликоль, гептапропиленгликоль, или вода, или их смесь. При взаимодействии гидроокиси щелочного или щелочноземельного металла с кислородсодержащим соединением или сорбитом выделяется вода, которая также должна учитываться при расчете эквимольного соотношения образующихся целевых продуктов 4 и 5.
Для соединения 4 оптимальной молекулярной массой является 1200 Да, при этом оно проявляет эффективность также в диапазоне от 1000 до 1500 Да. Для соединения 5 оптимальной молекулярной массой является 400 Да, при этом в диапазоне от 300 до 500 Да оно также обладают эффективностью. Выход за указанные диапазоны молекулярных масс также возможен, но сопровождается некоторым снижением активности получаемого ингибитора ABC-транспортеров.
Ингибитор ABC-транспортеров может быть получен альтернативным способом, который не приводится заявителем в силу его известности как такового, и заключается в раздельном получении соединений 4 и 5 путем взаимодействия соответственно соединений 1 и 2 с окисью пропилена 3 в условиях щелочного катализа, с дальнейшим их механическим смешением в эквимольных количествах.
Изобретение проиллюстрировано следующими материалами:
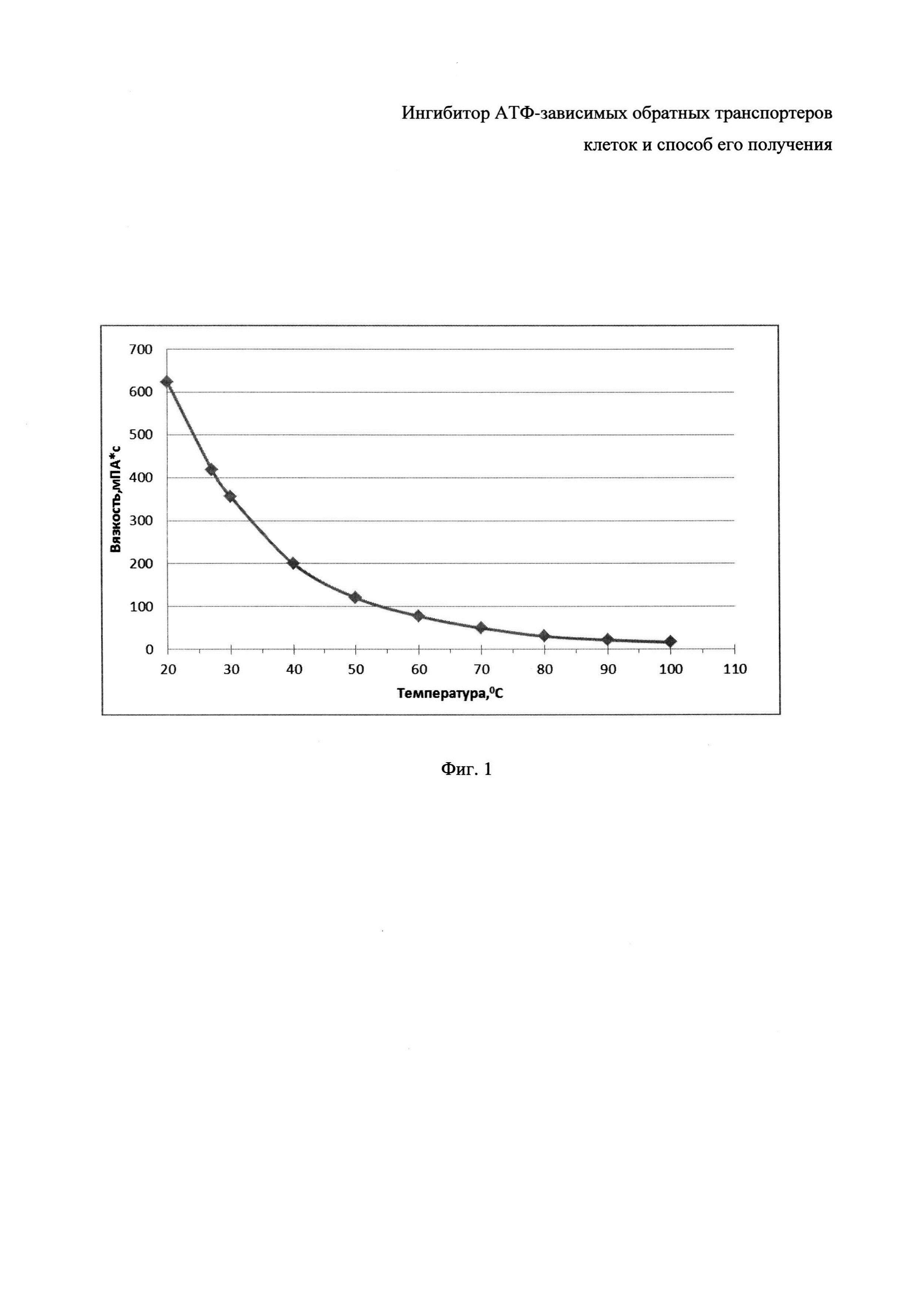
Фиг. 1 - График зависимости вязкости ОЭП-ингибитора от температуры.
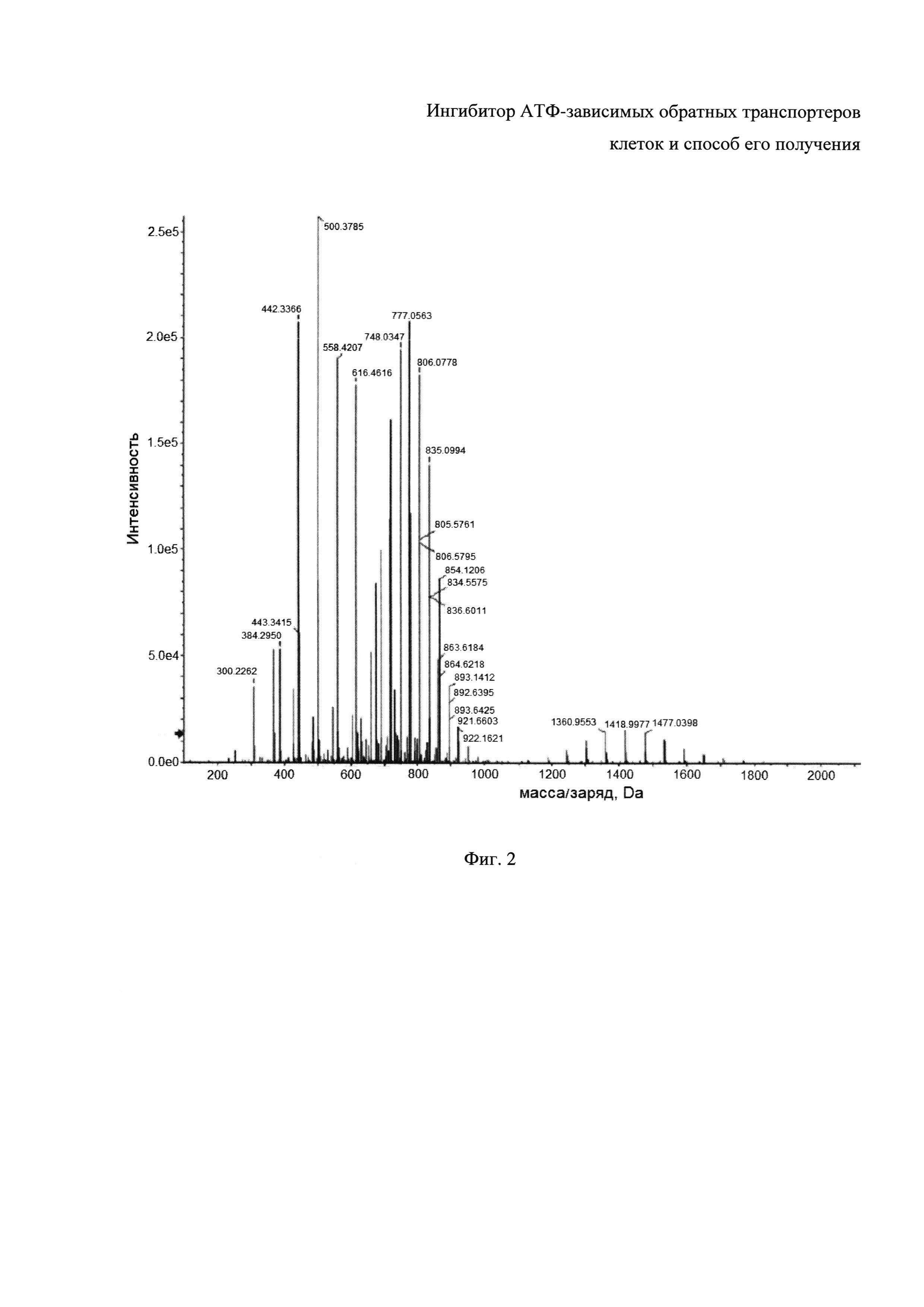
Фиг. 2 - ВЭЖХ-МС спектр ОЭП-ингибитора.
Фиг. 3 - Концентрации полумаксимального ингибирования роста (CC50 и IC50, мкМ) соединений для условно-нормальных и опухолевых клеток человека.
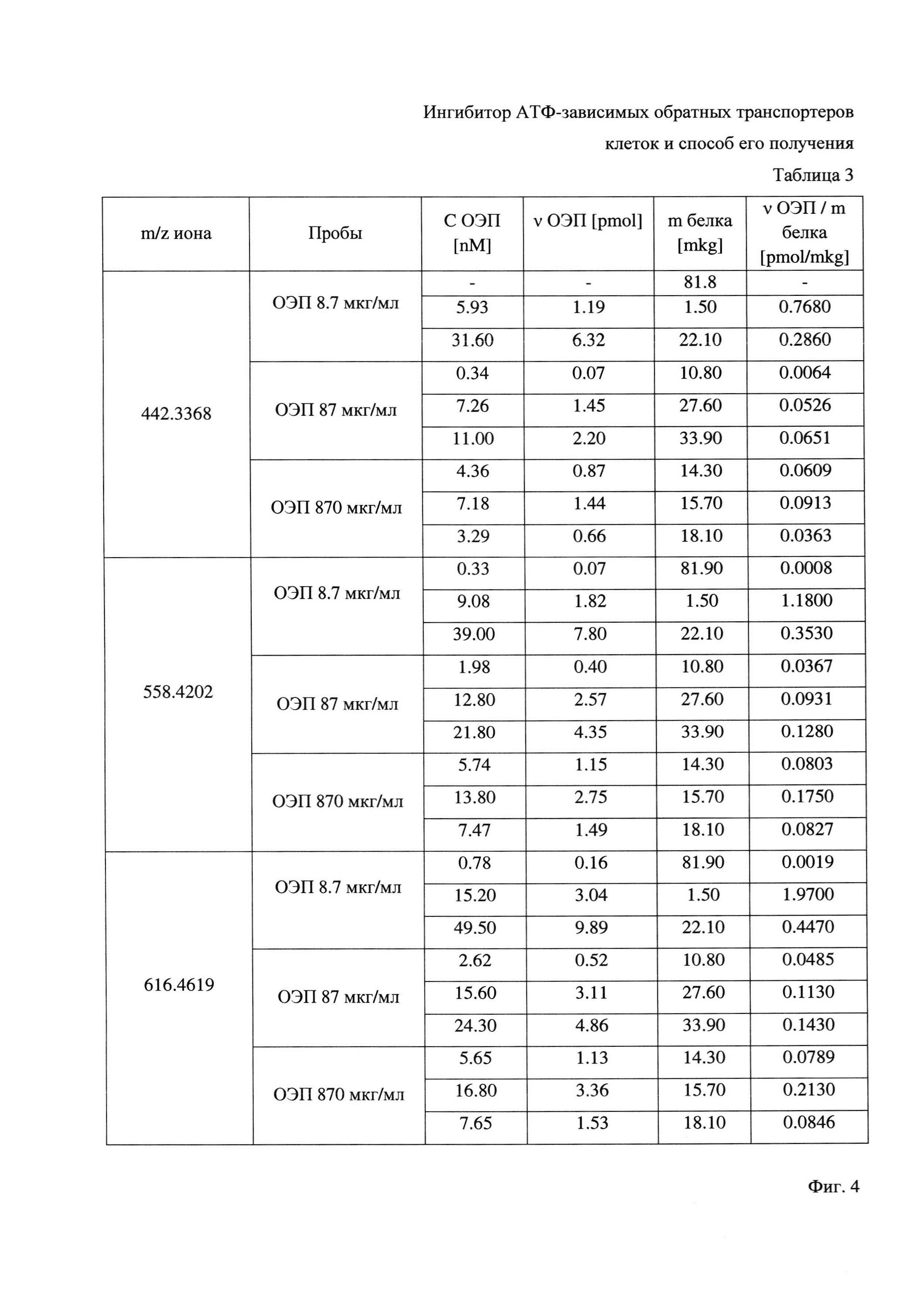
Фиг. 4 - Содержание ОЭП-ингибитора в анализируемых клеточных лизатах по данным ВЭЖХ-МС.
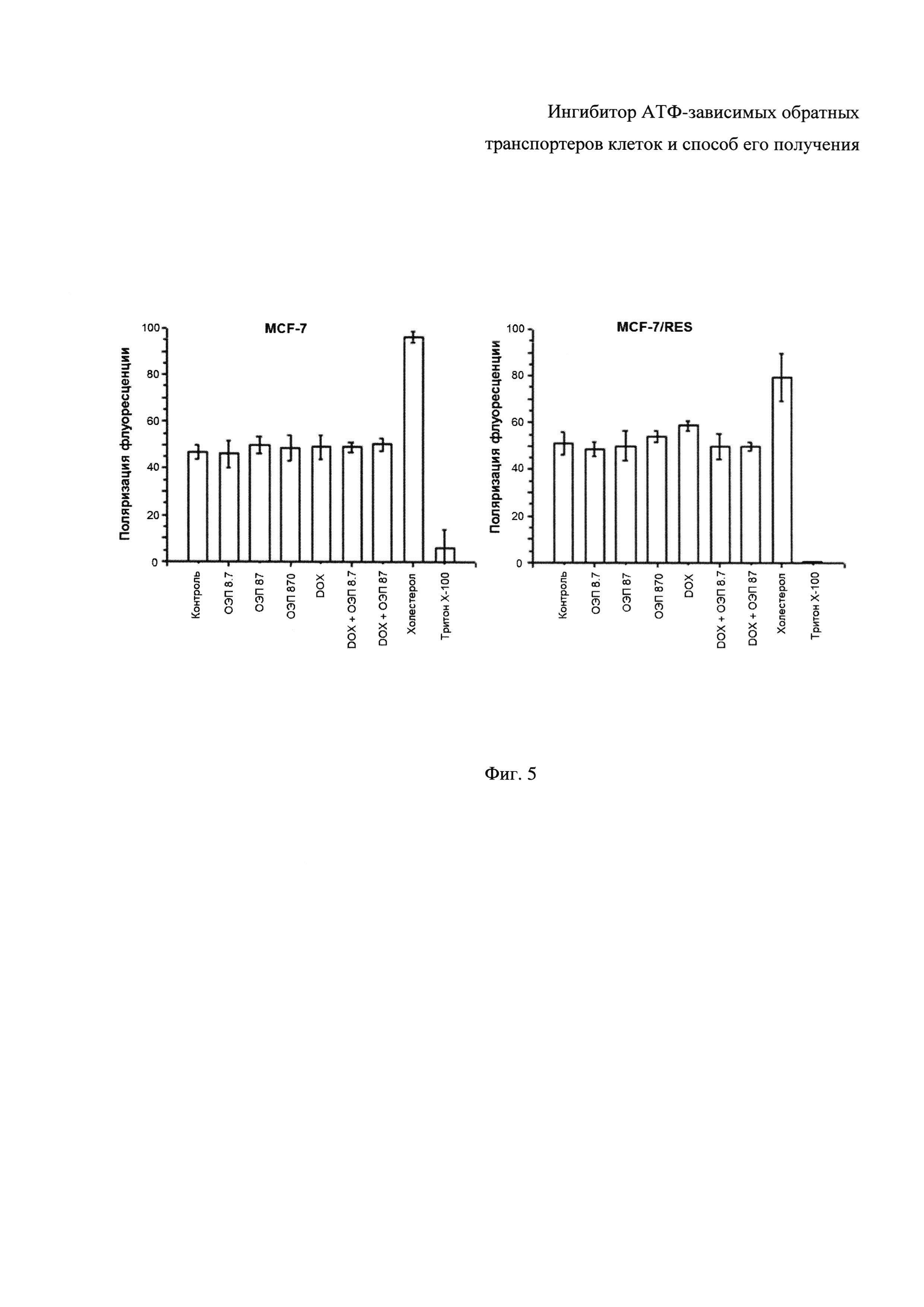
Фиг. 5 - Поляризация флуоресценции ДФГТ (1,6-дифенил-1,3,5-гексатриен) в клеточной суспензии после добавления эффекторов: ОЭП-ингибитора, композиции доксорубицина и ОЭП-ингибитора, холестерола и Тритон Х-100. (А) клетки MCF-7; (B) клетки с МЛУ MCF-7/Vin. Плотность суспензии 2×106 клеток/мл, температура 25°C, в следующих концентрациях: ОЭП-ингибитор - 8,7, 87 и 870 мкг/мл, доксорубицин - 1 мкМ, холестерол - 100 мкг/мл, Triton X-100 - 0,05%.
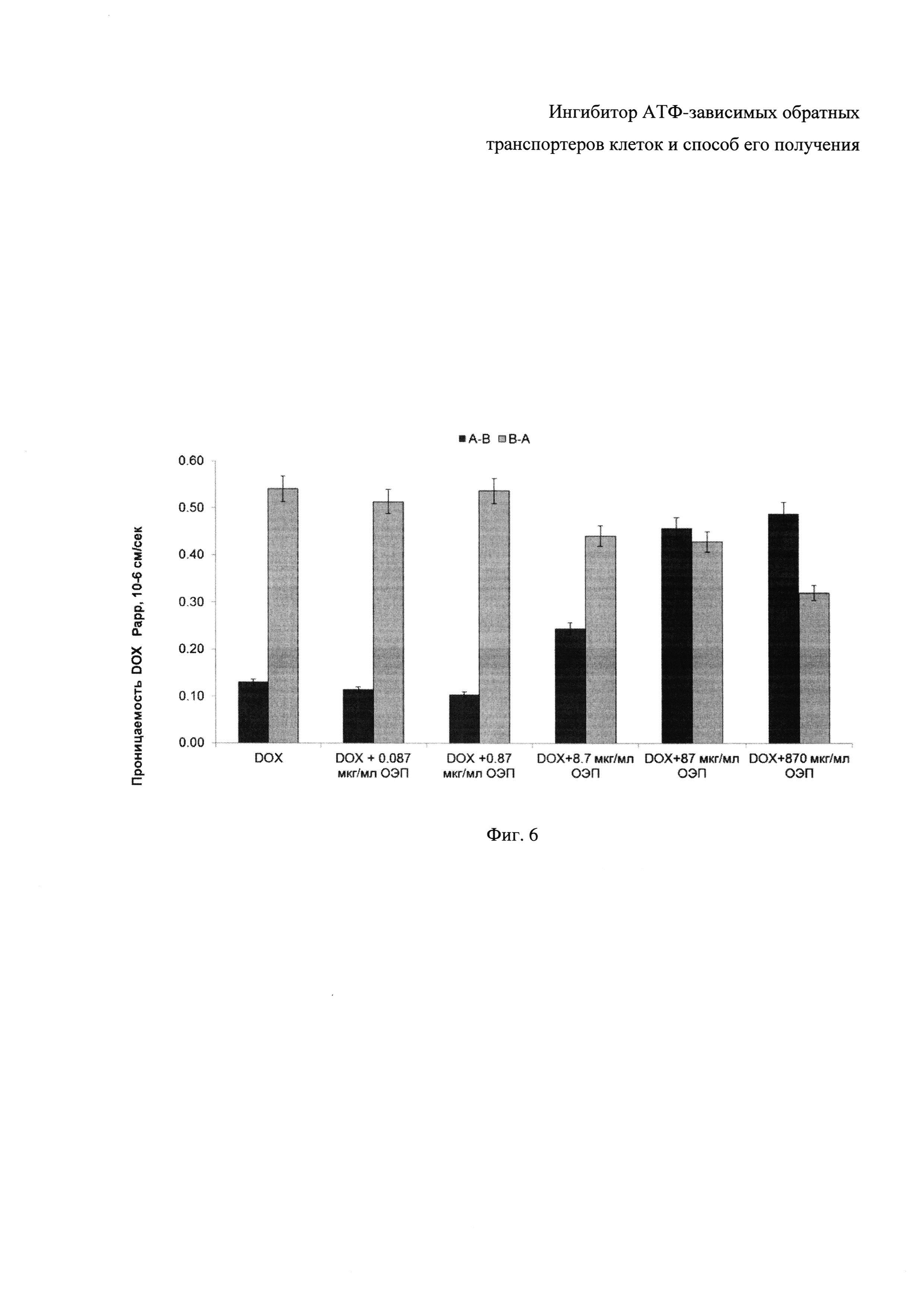
Фиг. 6 - Гистограмма трансэпителиального транспорта доксорубицина в поляризованных CaCo-2 клетках. Сокращения: апикально-базолатеральный транспорт (A-B), базолатерально-апикальный транспорт (B-A).
Фиг. 7 - Фотография результатов иммуноблоттинга исходных и генно-модифицированных клеток MCF-7, после обработки доксорубицином, ОЭП-ингибитором или их комбинацией в течение 48 часов.
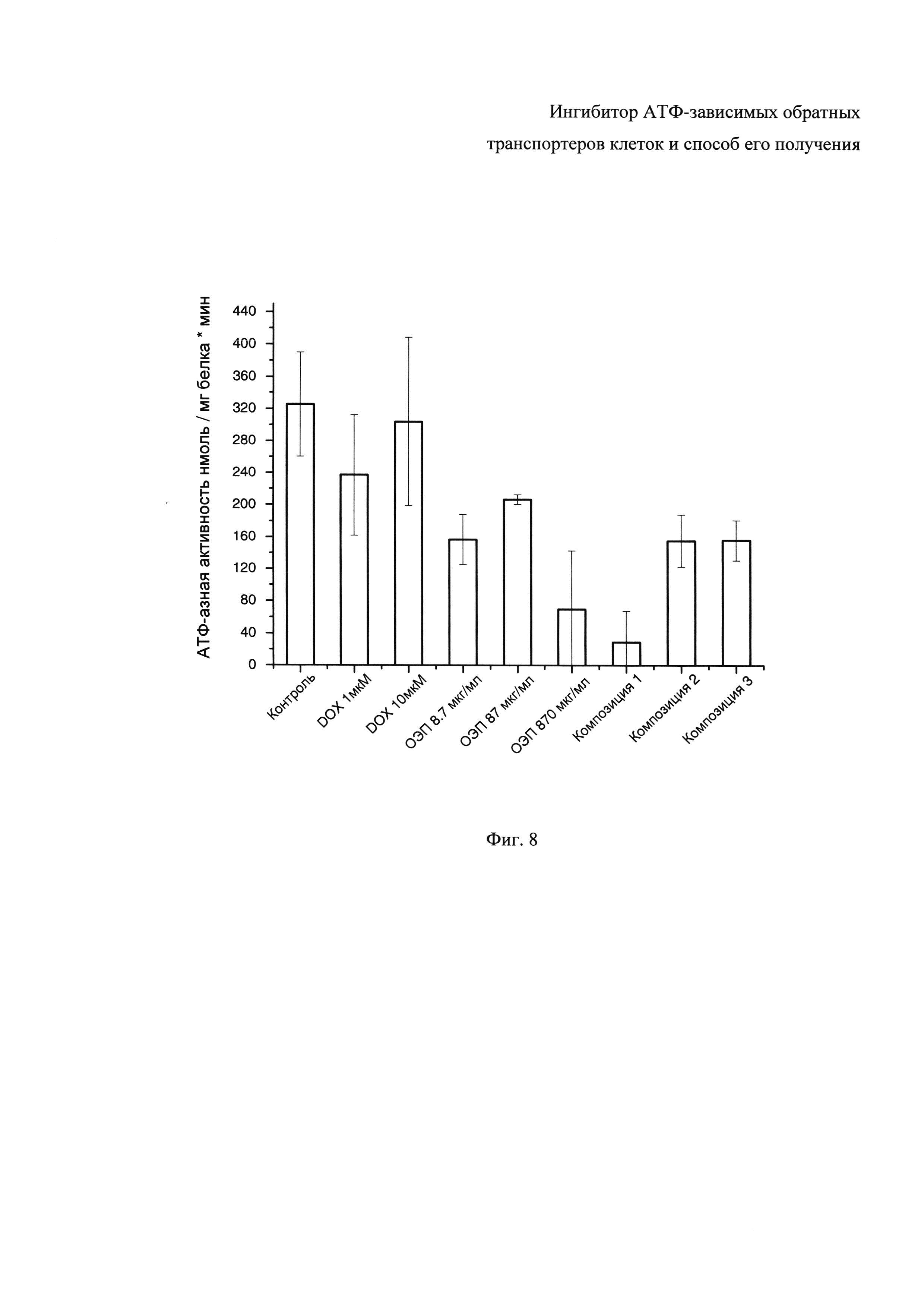
Фиг. 8 - Влияние эффекторов на АТФ-азную активность P-гликопротеина человека изолированных мембран клеток Sf9 (0,2 мг/мл по белку). Контроль: базовая активность мембран в присутствии 5 мМ АТФ и 0,1 мМ винбластина.
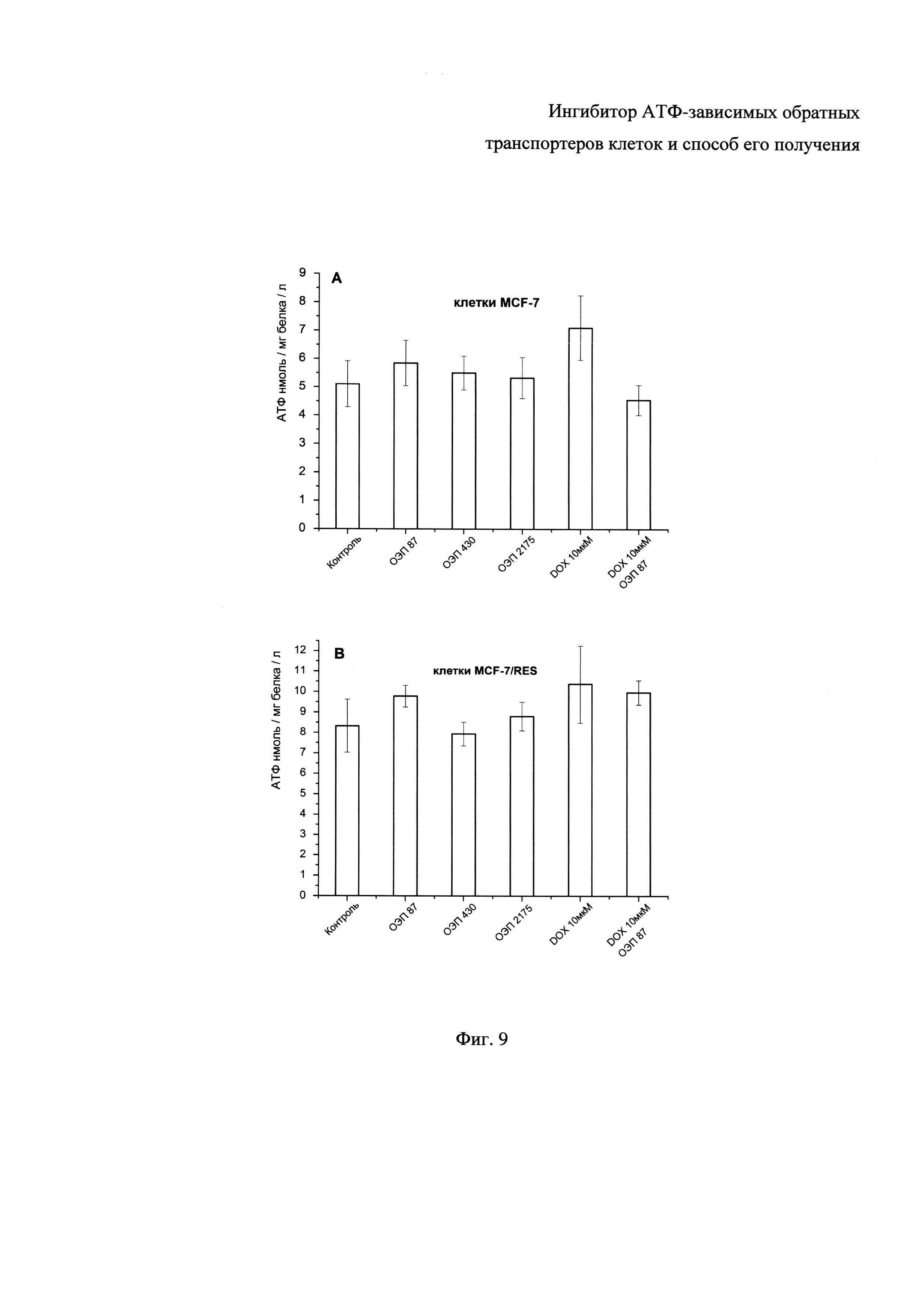
Фиг. 9 - Содержание АТФ в лизатах клеток MCF-7 (А) и MCF-7/Vin (В), обработанных ОЭП-ингибитором (87, 430, 2175 мкг/мл), доксорубицином (10 мкМ) и их композицией (ОЭП-ингибитор 87 мкг/мл + DOX 10 мкМ).
Далее заявителем представлены примеры способов получения ОЭП-ингибитора.
Пример 1. Способ получения ОЭП-ингибитора из стартовой системы сорбит-вода.
В стальной реактор-полимеризатор, снабженный механической мешалкой, холодильником, термопарой, трубкой для ввода окиси, загружают 27,3 г (0,15 моль) сорбита и добавляют 0,6 г (0,01 моль) гидроксида калия в 2,51 г (0,139 моль) воды. Реактор трижды продувают азотом. Включают перемешивание и в атмосфере азота выдерживают при температуре 90-100°C в течение 30 минут до получения гомогенной массы. Поднимают температуру до 115°C и порционно подают 270 г (4,65 моль) окиси пропилена со скоростью, обеспечивающей давление в реакторе-полимеризаторе не выше 0,39 мПа (4 кгс/см2) и температуру не выше 115°C. После подачи расчетного количества окиси пропилена выдерживают реакционную массу при температуре не выше 120°C в течение 1-1,5 часов до остановки падения давления.
Полученный ОЭП-ингибитор нейтрализуют 50% водным раствором ортофосфорной кислоты до pH 6,5-7,5, удаляют воду в вакууме при температуре 80-90°C и отфильтровывают с монтмориллонитом через бельтинг. После всех операций получают 270 г слегка желтоватого продукта. Вязкость 645 мПа⋅с, плотность 1,038 г/см3 (20°C). Гидроксильное число - 220 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 2. Получение ОЭП-ингибитора из стартовой системы сорбит-пропиленгликоль.
В стальной реактор-полимеризатор, снабженный механической мешалкой, холодильником, термопарой и трубкой для ввода окиси, загружают 28,7 г (0,157 моль) сорбита и добавляют 0,63 г (0,01 моль) гидроксида калия в 10,98 г (0,145 моль) пропиленгликоля. Реактор трижды продувают азотом. Включают перемешивание и в атмосфере азота выдерживают при температуре 90-100°C в течение 30 минут до получения гомогенной массы. Поднимают температуру до 115°C и порционно подают 274 г (4,73 моль) окиси пропилена со скоростью, обеспечивающей давление в реакторе-полимеризаторе не выше 0,39 мПа (4 кгс/см2) и температуру не выше 115°C. После подачи расчетного количества окиси пропилена выдерживают реакционную массу при температуре не выше 120°C в течение 1-1,5 часов до остановки падения давления.
Полученный ОЭП-ингибитор нейтрализуют 50% водным раствором ортофосфорной кислоты до pH 6,5-7,5, удаляют воду в вакууме при температуре бани 80-90°C и отфильтровывают с монтмориллонитом через бельтинг. После всех операций получают 285 г слегка желтоватого продукта. Вязкость 618 мПа⋅с, плотность 1,035 г/см3 (20°C). Гидроксильное число - 231 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 3. Получение ОЭП-ингибитора из стартовой системы сорбит-дипропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,3 г (0,15 моль), КОН - 0,6 г (0,011 моль), дипропиленгликоль - 18,5 г (0,14 моль). Количество окиси пропилена - 255 г (4,4 моль). После нейтрализации и фильтрования получают 308 г слегка желтоватого продукта. Вязкость 623 мПа⋅с, плотность 1,036 г/см3 (20°C). Гидроксильное число - 227 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 4. Получение ОЭП-ингибитора из стартовой системы сорбит-трипропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,3 г (0,15 моль), КОН - 0,61 г (0,011 моль), трипропиленгликоль - 26,7 г (0,14 моль). Количество окиси пропилена - 246 г (4,24 моль). После нейтрализации и фильтрования получают 280 г слегка желтоватого продукта. Вязкость 629 мПа⋅с, плотность 1,036 г/см3 (20°C). Гидроксильное число - 229 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 5. Получение ОЭП-ингибитора из стартовой системы сорбит-тетрапропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,29 г (0,15 моль), КОН - 0,6 г (0,011 моль), тетрапропиленгликоль - 34,75 г (0,14 моль). Количество окиси пропилена - 246 г (4,24 моль). После нейтрализации и фильтрования получают 285 г слегка желтоватого продукта. Вязкость 620 мПа⋅с, плотность 1,034 г/см3 (20°C). Гидроксильное число - 233 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пента-, гекса- и гептапропиленгликоли были получены при взаимодействии пропиленгликоля с окисью пропилена в условиях щелочного катализа. Для каждого из образцов определялось гидроксильное число.
Пример 6. Получение ОЭП-ингибитора из стартовой системы сорбит-пентапропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,3 г (0,15 моль), КОН - 0,61 г (0,011 моль), пентапропиленгликоль - 42,8 г (0,14 моль). Количество окиси пропилена - 230 г (3,95 моль). После нейтрализации и фильтрования получают 285 г слегка желтоватого продукта. Вязкость 627 мПа⋅с, плотность 1,033 г/см3 (20°C). Гидроксильное число - 231 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 7. Получение ОЭП-ингибитора из стартовой системы сорбит-гексапропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,31 г (0,15 моль), КОН - 0,6 г (0,011 моль), гексапропиленгликоль - 50,87 г (0,14 моль). Количество окиси пропилена - 222 г (3,83 моль). После нейтрализации и фильтрования получают 283 г слегка желтоватого продукта. Вязкость 615 мПа*с, плотность 1,037 г/см3 (20°C). Гидроксильное число - 225 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Пример 8. Получение ОЭП-ингибитора из стартовой системы сорбит-гептапропиленгликоль.
Реакцию проводили по методике, представленной в примере 2. Количество стартовых веществ: сорбит - 27,3 г (0,15 моль), КОН - 0,61 г (0,011 моль), гептапропиленгликоль - 58,9 г (0,14 моль). Количество окиси пропилена - 214 г (3,83 моль). После нейтрализации и фильтрования получают 283 г слегка желтоватого продукта. Вязкость 623 мПа⋅с, плотность 1,036 г/см3 (20°C). Гидроксильное число - 224 мг КОН/г (ГОСТ 25261-82 п. 3.1).
Полученный ОЭП-ингибитор представляет собой бесцветную или слегка желтоватую жидкость с вязкостью при комнатной температуре 575-715 мПа⋅с (на Фиг. 1 представлена зависимость вязкости ОЭП-ингибитора от температуры), с плотностью в пределах 1,01-1,05 г/см3 (20°C). Гидроксильное число - 215-240 мг КОН/г, pH 10% раствора (этанол/вода - 70/30) составляет 5,5-7,5.
ОЭП-ингибитор характеризуется множеством m/z пиков в диапазоне как небольших (400-1200 Да), так и более тяжелых масс (1500-2000 Да) (Фиг. 2), что отражает наличие статистического набора продуктов реакции поликонденсации. Анализ проводился с использованием хроматографической колонки Agilent ZORBAX Extend-C18 (размер колонки 1×150 мм, размер частиц 3,5 мкм) с предколонкой Extend Guard (1×17 мм, размер частиц 5 мкм) на хроматографе Agilent 1260 Binary System (вакуумный дегазатор G1379B, бинарный градиентный насос G1312B, колоночный термостат G1316A, автоматический пробоотборник G1367E, термостат для автоматического пробоотборника G1330B). Детектор - квадрупольно-времяпролетный масс-спектрометр высокого разрешения AB Sciex 5600 с источником ионизации DuoSpray. Подвижная фаза: растворитель A - 10 мМ раствор формиата аммония в смеси вода метанол (90:10%); растворитель B - 0,1% муравьиная кислота в ацетонитриле. Наиболее интенсивные пики ОЭП-ингибитора использовались для его количественного анализа в биологических матрицах.
Техническим результатом заявленного технического решения является способ получения хиральных конъюгатов (оптически активных гибридных молекул) олигоэфирполиольной природы, являющихся ингибиторами АТФ-зависимых обратных транспортеров клеток (ОЭП-ингибиторами), для существенного усиления эффективности действия физиологически активных веществ из числа противоопухолевых, сердечно-сосудистых, противоаллергических, противовоспалительных и других лекарственных соединений.
Далее заявителем представлены обозначения и сокращения, которые использованы для реализации заявленного технического решения
ABC (от англ. ATP binding cassette) - АТФ-зависимый транспортер
APS - ammonium persulfate, персульфат аммония
ATP (от англ. adenosine triphosphate) - аденозин-3-фосфат, АТФ
C - цитозин
DOX - доксорубицин
EGTA (от англ. ethylene glycol-bis(2-ammoethylether)-N,N,N',N'-tetraacetic acid) - этиленгликоль бис(2-аминоэтиловый эфир)-N,N,N',N'-тетрауксусной кислоты
FAM (от англ. 6-carboxyfluorescein) - 6-карбоксифлуоресцеин
G - гуанин
HRP (от англ. horseradish peroxidase) - пероксидаза хрена
LC-MS - жидкостная хроматография, совмещенная с масс-спектрометрией
m/z - соотношение массы к заряду
P-gp - P-гликопротеин
pH - водородный показатель
Pi (от англ. inorganic phosphate) - неорганический фосфат
T - тимин
U/μL - единиц в микролитре
Vin - винбластин
A260 - значение длины волны в ангстремах при 260 нм
A - аденин
ДМСО - диметилсульфоксид
ДНК - дезоксирибонуклеиновая кислота
ДФГТ - дифенилгексатриен
ЛС - лекарственное средство
ЛФ - лекарственная форма
Мкг - микрограмм
Мл - миллилитр
МЛУ - множественная лекарственная устойчивость
МТТ (от англ. 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, a yellow tetrazole) - тетразолиевый краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид
Об/мин - оборотов в минуту
ОЭП - олигоэфирполиол
РНК - рибонуклеиновая кислота
ФСБ - фосфатно-солевой буфер
ЭДТА - этилендиаминтетрауксусная кислота
Материалы и методы
Химические реагенты и материалы
Доксорубицин (DOX) гидрохлорид, уабаин октагидрат, пентаэтиленгликоль 98%, β-меркаптоэтанол, этиленгликоль тетрауксусной кислоты (EGTA), бериллия сульфат тетрагидрат, натрия фторид, аммония молибдат были приобретены в Sigma-Aldrich (США). Бромфеноловый синий, деоксихолат натрия, Трис-гидрохлорид (трис-(оксиметил)аминометан гидрохлорид), аммоний персульфат (APS), натрия додецилсульфат (SDS) приобретены в компании Amresco (США). MTT 3-(4,5-Диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) от Life technologies (США). L-глутамин, раствор Дульбекко, не содержащий ионы Са2+ и Mg2+, раствор трипсина-ЭДТА, раствор Хэнкса без фенолового красного, среды α-MEM и DMEM приобретены в компании ПанЭко (Россия). 1,6-Дифенил-1,3,5-гексатриен (ДФГТ), дитиотреитол (1,4-бис(сульфанил)бутан-2,3-диол), аскорбиновая кислота, холестерол, Triton® X-100, винбластина сульфат, АТФ динатриевая соль гидрат, HEPES (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) от компании Acros Organics. В компании Helicon были приобретены лаурилсульфат натрия (SDS) и этилендиаминтетрауксусная кислота (ЭДТА).
Условия культивирования клеток:
Клетки MCF-7, MCF-7/Vin, HSF, CaCo-2, HCT-15, HCT-116, OVCAR-4, PC-3, A-498, NCI-H322M, M-14, SNB-19, SF-539 (табл. 1) культивируют в среде α-MEM с добавлением 10%-ной эмбриональной телячьей сыворотки, L-глутамина и 1% пенициллина-стрептомицина в атмосфере 5%-го CO2 при 37°C до образования монослоя. Для получения клеточной суспензии монослой клеток трипсинизируют с последующей инактивацией трипсина добавлением среды α-MEM с сывороткой. Подсчет клеток производится в камере Неубайера методом исключения трипанового синего. Клетки пересевают 2 раза в неделю в отношении 1:6.

Пример 9. Исследование цитотоксического эффекта ОЭП-ингибитора in vitro.
Исследовали влияние ОЭП-ингибитора на пролиферативный потенциал опухолевых и условно-нормальных клеток человека при 72 часовой инкубации с использованием MTT-теста. В лунки 96-ти луночного планшета вносили 1000 клеток в 90 мкл культуральной среды и инкубировали 24 часа в CO2 инкубаторе для адгезии клеток к субстрату. Далее вносили аликвоты приготовленных растворов исследуемых соединений (ОЭП-ингибитор) в объеме 10 мкл/лунку. Исследование проводили в трипликатах. В контрольные лунки планшета вместо анализируемых соединений вносили аналогичные объемы mQ. После внесения исследуемых веществ клетки культивировали в CO2 инкубаторе в стандартных условиях в течение 72 часов. Далее культуральную среду с исследуемыми веществами удаляли из планшета с помощью вакуумного аспиратора, добавляли питательную среду и MTT-реагент 5 мг/мл, инкубировали в CO2 инкубаторе 3-4 часа. По истечении времени инкубации культуральную среду с MTT-реагентом удаляли вакуумным аспиратором, вносили по 100 мкл ДМСО и инкубировали 5-10 минут. Появившееся фиолетовое окрашивание детектировали на планшетном ридере Tecan при 555 нм (референтная длина волны - 650 нм). Строили графики зависимости доза-эффект и определяли концентрацию полумаксимального ингибирования роста клеток (IC50) Результаты представлены в таблице 2 на Фиг. 3.
Таким образом, детальный анализ таблицы позволяет сделать однозначно трактуемые выводы о том, что для большей части исследованных клеток IC50 ОЭП-ингибитор превышает 1,5 мг/мл, что свидетельствует о полной безопасности заявленного коньюгата. При этом можно констатировать специфичность ОЭП-ингибитора к клеткам глиобластомы SNB-19 и глиосаркомы SF-539 (IC50 составляет 0,46±0,12 мг/мл и 0,46±0,12 мг/мл соответственно), что свидетельствует о его некотором, хотя и незначительном собственном противоопухолевом действии на указанные виды клеток.
Пример 10. Оценка влияния ОЭП-ингибитора на микровязкость плазматических мембран клеток MCF-7 и MCF-7/Vin
Ключевой физико-химической характеристикой клеточных мембран, влияющей на их физиологическую активность, является микровязкость - мера подвижности липидов в бислое, которая играет важную роль в проницаемости мембраны и функционировании мембранных белков. Для оценки микровязкости плазмалеммы применяют флуоресцентный метод, основанный на использовании липофильного индикатора дифенилгексатриена (ДФГТ), флуоресценция которого зависит от текучести клеточной мембраны.
Клеточную суспензию плотностью 2×106 клеток/мл инкубировали с ДФГТ в конечной концентрации 1 мкМ в течение 30 мин. Далее в суспензию клеток с помощью многоканального дозатора вносили аликвоты (по 10 мкл) растворов ОЭП-ингибитора до конечной концентрации 8,7; 87 и 870 мкг/мл, а также доксорубицин в концентрации 1 мкМ и его композиции с ОЭП-ингибитором (DOX 1 мкМ + ОЭП-ингибитор 8,7 мкг/мл; DOX 1 мкМ + ОЭП-ингибитор 87 мкг/мл). В качестве положительных контролей, значимо изменяющих микровязкость плазматических мембран клеток, тестировали холестерол в конечной концентрации 100 мкг/мл, а также липофильный детергент Triton X-100 в концентрации 0,05%. Непосредственно после внесения аликвот проб детектировали поляризацию флуоресценции ДФГТ в течение 1 часа с интервалом 10 минут.
Результаты влияния ОЭП-ингибитора на микровязкость плазматических мембран клеток MCF-7 и MCF-7/Vin представлены на Фиг. 5.
Таким образом, полученные данные свидетельствуют о том, что ОЭП-ингибитор в концентрациях 8,7, 87 и 870 мкг/мл, а также доксорубицин, как и его композиции ОЭП-ингибитором, значимо не изменял поляризацию флуоресценции ДФГТ в суспензиях клеток MCF-7 и MCF-7/Vin. Поскольку поляризация флуоресценции пропорциональна вязкости микроокружения флуорофора [4], из чего можно заключить, что исследуемый ОЭП-ингибитор не влиял на микровязкость плазматических мембран исследуемых клеток. Холестерол, обладая большей вязкостью, чем фосфолипиды плазмалеммы, значительно увеличивал поляризацию флуоресценции ДФГТ и микровязкость мембраны. Triton X-100, являясь сильным детергентом, постепенно растворяет плазмалемму, о чем свидетельствует значительное уменьшение поляризации флуоресценции ДФГТ. Исследуемый ОЭП-ингибитор не оказал значимого эффекта на микровязкость цитоплазматических мембран клеток млекопитающих, что свидетельствует об его инертности в отношении липидного бислоя цитоплазматических мембран опухолевых клеток.
Пример 11. Оценка накопления ОЭП-ингибитора в резистентных опухолевых клетках.
Известно, что некоторые гидрофобные блоксополимеры этиленоксида и пропиленоксида обладают способностью проникать через барьер плазматической мембраны клеток, накапливаться в цитоплазме и оказывать эффекты на внутриклеточные органеллы и ферменты. В частности, показано, что плуроник P85 обладает свойством изменять микровязкость мембран митохондрий и разобщать окислительное фосфорилирование [5], [6]. В связи с этим, представляло интерес определить степень внутриклеточного накопления тестируемого ОЭП-ингибитора. Идентификацию и количественное определение содержания ингибитора в лизатах клеток осуществляли с использованием жидкостной хроматографии, совмещенной с масс-спектроскопией (ВЭЖХ-МС).
Клетки MCF-7/RES рассеивали в 6-луночные планшеты в количестве 50000 клеток в лунку планшета и культивировали при 37°C и 5% CO2 в течение 24-х часов. К клеткам добавляли аликвоты ингибитора, конечные концентрации которого составляли 8,7, 87 и 870 мкг/мл и культивировали в течение 96 часов при 37°C и 5% CO2. К контрольным пробам вносили соответствующие объемы деионизированной воды. По истечении времени инкубации среду, содержащую ОЭП-ингибитор, отбирали аспиратором. Клетки отделяли от поверхности планшета при помощи суспендирования раствором Хенкса и переносили в 15 мл пробирки для отмывки не менее 5 раз (400 g, 4 минуты). К осадку клеток вносили 150 мкл деионизированной воды, содержащей внутренний стандарт - пентаэтиленгликоль концентрацией 10-5 M. Клетки лизировали двумя циклами замораживания и оттаивания (4 мин при -75°C, с инкубацией на водяной бане при 37°C в течение 2 мин) с последующей обработкой ультразвуком 4 мин. Аликвоты лизатов отбирали для последующего определения количества белка в пробах с использованием набора Pierce™ ВСА Protein Assay Kit производства «Life Technologies». К клеточным лизатам вносили 700 мкл охлажденного метанола, инкубировали в течение 15 минут при -20°C с последующим центрифугированием при 17400 g и 0°C в течение 20 минут. Супернатант переносили в чистые пробирки и высушивали под вакуумом на лиофильной сушке. Непосредственно перед анализом высушенные клеточные лизаты растворяли в 200 мкл смеси метанол/вода 1:1 с добавлением 0,1% муравьиной кислоты. Все ВЭЖХ-МС эксперименты осуществляли с использованием хроматографической системы на хроматографе Agilent 1260 Infinity (Agilent Technologies, Inc., USA), сопряженном с масс-спектрометром AB Sciex 5600 (AB Sciex, USA).
Результаты оценки накопления ОЭП-ингибитора в резистентных опухолевых клетках представлены в Таблице 3 на Фиг. 4.
ВЭЖХ-МС анализ внутриклеточного накопления ОЭП-ингибитора показал наличие фемто- и пикомолярных количеств полимера в лизатах клеток, которые культивировались с ОЭП-ингибитором (концентрации ингибитора: 8,7, 87 и 870 мкг/мл, время культивирования 96 часов). Примечательно, что с увеличением концентрации ОЭП-ингибитора в культуральной среде с 8,7 до 870 мкг/мл увеличение внутриклеточного содержания не прослеживается. Отсутствие концентрационных зависимостей и низкое содержание ОЭП-ингибитора в лизатах позволяет заключить, что обнаруженные следы ОЭП-ингибитора связаны с его неспецифической адсорбцией на плазматической мембране и не обусловлены его проникновением в цитоплазму клеток, в силу указанного представляется возможным сделать вывод о высокой безопасности заявленного конъюгата.
Пример 12. Оценка влияния ОЭП-ингибитора на трансэпителиальный транспорт доксорубицина через плазматическую мембрану клеток CaCo-2
В поляризованных клетках СаСо-2 обратный транспортер P-gp располагается на апикальной стороне цитоплазматической мембраны и осуществляет обратный транспорт (B-A) большого количества субстратов, включая доксорубицин.
Клетки Caco-2 рассаживали в планшеты с двухкомпонентными ячейками Millicell 96 в количестве 10000 кл/лунку и инкубировали в течение 21 дня при 37°C и 5% CO2. Целостность монослоя проверяли путем измерения электрического сопротивления (TEER) с помощью прибора Millicell-ERS, при значении TEER не менее 3 КОм/лунку начинали эксперимент. Для определения скорости транспорта доксорубицина из апикальной (A) в базолатеральную (B) область [A-B] добавляли по 90 мкл доксорубицина либо доксорубицина и ОЭП-ингибитора (0,087-870 мкг/мл) в 3 лунки с фильтрами и по 250 мкл буфера HBSS в акцепторные лунки нижней плашки. Для определения скорости транспорта из базолатеральной (B) области в апикальную (A) [B-A] добавляли по 90 мкл Буфера HBSS с 1% ДМСО в 3 лунки с фильтрами и по 250 мкл доксорубицина либо доксорубицина и ОЭП-ингибитора (0,087-870 мкг/мл) в нижние лунки плашки. Инкубировали собранную Millicell 96 CaCo-2 систему в течение 2 ч при 37°C на шейкере с перемешиванием при 300 об/мин. Затем отбирали 70 мкл аликвоты из каждой части вставки и подвергали ВЭЖХ-МС анализу с использованием системы QTRAP 5500 (Applied Biosystems) с хроматографом Agilent Infinity 1290 (Agilent Technologies).
Результаты оценки влияния ОЭП-ингибитора на трансэпителиальный транспорт доксорубицина представлены на Фиг. 6 в виде скорости проницаемости доксорубицина через плазматическую мембрану клеток CaCo-2.
Как видно, клетки CaCo-2 экспортируют доксорубицин с базолатеральной на апикальную часть мембраны (В-А). ОЭП-ингибитор, воздействуя на P-gp, располагающийся на апикальной части мембраны, ингибирует обратный транспорт доксорубицина, увеличивая его содержание в направлении А-В: в концентрации 8,7 мкг/мл в 1,9 раз, в концентрации 87 мкг/мл в 3,5 раза и в концентрации 870 мкг/мл в 3,8 раза. Данные эксперимента представлены средним значением трех независимых опытов ± стандартное отклонение. Для статистической обработки использовался критерий Стьюдента для множественных сравнений с введением поправки Бонферрони, P≤0,05. В силу указанного представляется возможным сделать вывод о высокой эффективности АТФ-зависимого ингибитора обратных ABC-транспортеров.
Пример 13 Влияние ОЭП-ингибитора на экспрессию P-gp (ABCB1)
ОЭП-ингибитор способен элиминировать активную гликозилированную изоформу 190 кДа ABCB1, при этом наблюдается накопление в клетках неактивной высокоманнозной изоформы 175 кДа транспортера.
Клетки MCF-7, MCF-7-ABCCl-DsRed (с гиперэкспрессией MRP-1), MCF-7-ABCC2-BFP (с гиперэкспрессией MRP-2), MCF-7-АВСВ1-GFP (с гиперэкспрессией P-gp) в концентрации 3×104 клеток/см2 культивировали в полной питательной среде DMEM с добавлением или доксорубицина до конечной концентрации 3 мкМ; или ОЭП-ингибитора до конечной концентрации 261 мкг/мл; или композиции доксорубицина-ОЭП-ингибитор до конечной концентрации 3 мкМ: 261 мкг/мл в течение 48 часов при 37°C в атмосфере 5% CO2. Для исследования белков методом иммуноблоттинга (Western Blot) применялся адаптированный и модифицированный протокол ABCAM (http://www.abcam.com/ps/pdf/protocols/wb-beginner.pdf). Моноклональные антитела к ABCB1 (Кат. № sc-13131, Santa Cruz) были использованы при разведении 1:200. В качестве вторичных использовали антимышиные антитела, конъюгированные с HRP -(Кат. № ab6728, Abeam) в разведении 1:10000. Моноклональные антитела к β-актину (Кат. № mAbcam 8226, Abeam) были использованы при разведении 1:2000. Результаты проведенного анализа визуализировали на приборе ChemiDoc XRS + system (Bio-Rad).
Результаты влияния ОЭП-ингибитора на экспрессию P-gp (ABCB1) представлены на Фиг. 7.
Белок ABCB1 представлен 2 изоформами, с молекулярным весом в 190 кДа и 175 кДа (Фиг. 7, верхний и нижние банды). При этом изоформа 190 кДа представляет собой гликозилированную активную форму белка, а 175 кДа банд представляет высокоманнозный неактивный белок [7]. Результаты свидетельствуют о том, что контрольные клетки MCF-7 содержат эквивалентное количество активного и неактивного белков. Воздействие с доксорубицином увеличивает количество активной формы белка, в то время как ОЭП-ингибитор практически полностью элиминирует активную форму ABCB1. При этом наблюдается накопление в клетках неактивной формы транспортера. Клетки, подвергшиеся воздействию комбинированного препарата, экспрессируют как активную, так и высокоманнозную формы белка. Экспрессия неактивной формы доказывает, что ОЭП-ингибитор смог частично обратить доксорубицин-опосредованную активацию транспортеров. Аналогичную картину мы наблюдаем в клетках, гиперэкспрессирующих гены ABCC1 и ABCC2. В силу указанного возможно сделать вывод о том, что ОЭП-ингибитор способен подавлять активность АТФ-зависимых ингибиторов обратных ABC-транспортеров.
Пример 14. Влияние ОЭП-ингибитора на АТФ-азную активность мембран с гиперэкспрессией ABCB1
АТФ-азную активность мембранного P-гликопротеина исследовали с использованием коммерческого препарата изолированных мембран клеток насекомых Spodoptera frugiperda (линия Sƒ9), гиперэкспрессирующих человеческий рекомбинантный P-гликопротеин, согласно методике [8]. Гидролиз АТФ в процессе каталитической активности P-гликопротеина сопровождается образованием неорганического фосфата (Pi), детектируемого посредством спектрофотометрической реакции. Показано, что ОЭП-ингибитор ингибирует АТФ-азную активность с прямой концентрационной зависимостью - с увеличением концентрации ингибирующий эффект увеличивается.
Тестируемый ОЭП-ингибитор в концентрации 8,7-870 мкг/мл инкубировали с рекомбинантными мембранами, гиперэкспрессирующими P-гликопротеин и субстратами в 1,5 мл микропробирках в трипликатах. Измеряли оптическую плотность продукта реакции при 880 нм, пропорциональную активности обратного транспортера, и АТФ-азной активности фермента. В качестве контролей применяли неспецифический ингибитор активности ферментов - фторид бериллия.
Полученные значения АТФ-азной активности P-гликопротеина человека изолированных мембран клеток Sf9 в присутствие контрольных ингибиторов и исследуемых соединений представлены в виде гистограммы на Фиг. 8.
Установлено, что ОЭП-ингибитор значительно ингибирует АТФ-азную активность P-гликопротеина. Ингибирующая активность ОЭП-ингибитора незначительно уменьшается с увеличением его концентрации с 8,7 до 87 мкг/мл, однако сильно увеличивается при концентрации 870 мкг/мл. В литературных источниках превалирует мнение, что амфифильные блоксополимеры этиленоксида и пропиленоксида ингибируют АТФ-азную активность P-гликопротеина вследствие встраивания в липидную мембрану и изменения микровязкости липидного микроокружения транспортера [9]-[11]. Исследуемый ОЭП-ингибитор значимо не изменяет микровязкость клеточных мембран, следовательно, механизм его действия не исключает возможности прямого ингибирующего влияния на P-гликопротеин. В силу указанного возможно сделать вывод о том, что ОЭП-ингибитор значимо подавляет активность АТФ-зависимого обратного ABC-транспортера P-gp.
Пример 15. Влияние ОЭП-ингибитора на уровень АТФ в клетках MCF-7, MCF-7/Vin
Клеточную суспензию (MCF-7 или MCF-7/Vin) плотностью 2×106 клеток/мл инкубировали 2 часа при 25°C с ОЭП-носителем (конечные концентрации 87, 430 и 2175 мкг/мл) или доксорубицином (конечная концентрация 10 мкМ), или композицией доксорубицина с ОЭП-ингибитором в концентрациях 10 мкМ и 87 мкг/мл. Далее клетки осаждали центрифугированием (300 g, 4 минуты) и промывали в буферном растворе, активирующем выработку АТФ в клетках. Состав буфера: NaCl (122 мМ), NaHCO3 (25 мМ), глюкоза (10 мМ), KCl (3 мМ), MgSO4 (1,2 мМ), K2HPO4 (0,4 мМ), CaCl2 (1,4 мМ) и HEPES (10 мМ). Полученный клеточный осадок лизировали в течение 5 минут в охлажденном лизирующем буфере при интенсивном перемешивании. Состав лизирующего буфера: Tris-HCL (0,05 М), EDTA (2 мМ), TritonX100 (1%), NaF (10 мМ). Лизаты клеток немедленно замораживали и хранили до проведения анализа при -74°C. Непосредственно перед анализом клеточные лизаты размораживали и центрифугировали от клеточного дебриса 7 минут при 20000 g, супернатант отбирали для последующего анализа содержания АТФ. Содержание АТФ в клеточных лизатах определяли с помощью хемилюминесцентного метода в реакции с участием люциферазы, D-люциферина и АТФ с использованием высокочувствительного АТФ-реагента производства "Люмтек". Интенсивность хемилюминесценции в реакции окисления люциферина, пропорциональную концентрации АТФ в пробе, определяли с помощью планшетного ридера Infmite 200 PRO (TECAN).
Результаты влияния ОЭП-ингибитора на уровень АТФ в клетках MCF-7, MCF-7/Vin представлены на Фиг. 9.
Установлено, что ОЭП-ингибитора при 2-часовом воздействии даже в высокой концентрации не вызывает уменьшения содержания АТФ в клетках MCF-7 и MCF-7/Vin. Из литературы известно, что гидрофобные блоксополимеры этиленоксида и пропиленоксида вызывают уменьшение содержания АТФ в клетках млекопитающих в культуре в результате проникновения в цитоплазму и воздействия на функциональное состояние мембран митохондрий. В частности, показано, что плуроник Р85 изменяет микровязкость мембран митохондрий и разобщает окислительное фосфорилирование [12], [6]. Сопоставляя полученные данные с литературными, можно заключить, что исследуемый ОЭП-ингибитор вследствие особенностей структуры не проникает в цитозоль клеток и не воздействует на функции митохондрий. Совместное применение доксорубицина с ОЭП-ингибитором (ОЭП-ингибитор 87 мкг/мл + DOX 10 мкМ) также не оказало ингибирующего действия на биосинтез АТФ в клетках MCF-7 и MCF-7/Vin. В силу указанного возможно сделать вывод о том, что АТФ-зависимый ингибитор обратных ABC-транспортеров не влияет на процесс биосинтеза АТФ в опухолевых клетках.
Пример 16. Параметры токсичности ОЭП-ингибитора in vivo
Исследование острой токсичности ОЭП-ингибитора проводили на мышах линии CD-I (6-8 недель), крысах линии Sprague Dawley (6-8 недель) и кроликах породы Советская шиншилла (2-2,5 кг) обоего пола при внутривенном и внутрижелудочном способах введения.
Внутрижелудочное введение осуществляли животным, лишенным корма (на промежуток времени не менее 8 часов), со свободным доступом к воде. Объем введения рассчитывали индивидуально для каждого животного, основываясь на массе тела, зарегистрированной непосредственно перед введением вещества. Доступ к корму возобновляли через час после введения.
Параметры острой токсичности (ЛД50) ОЭП-ингибитора при разных путях введения указаны в таблице 4.

Согласно полученным результатам, ОЭП-ингибитор при введении внутрижелудочно по степени токсичности относится к нетоксичным веществам, при внутривенном введении - к малотоксичным веществам. При этом известно, что наиболее активный Плуроник L-61, входящий в состав препарата SP1049C, находящегося на 3 стадии клинических исследований, обладает более высокой токсичностью [13]. Так, ЛД50 Плуроника L-61 при внутривенном способе введения мышам соответствует 800 мг/кг. В силу указанного возможно сделать вывод о том, что АТФ-зависимый ингибитор обратных ABC-транспортеров по классу токсичности может быть отнесен к классу малотоксичных и нетоксичных соединений, более безопасных в сравнении с Плуроником L-61.
Приведенные выше заявителем сведения позволяют сделать выводы о том, что заявленный ингибитор АТФ-зависимых обратных транспортеров клеток значительно увеличивает поглощение лекарственных средств живыми клетками и тканями. При этом ингибитор АТФ-зависимых обратных транспортеров клеток характеризуется высокой безопасностью и эффективностью.
Таким образом, в результате экспериментов достигнута поставленная цель - получен новый ингибитор АТФ-зависимых обратных транспортеров клеток.
Техническим результатом заявленного технического решения является то, что в результате проведенных исследований получен ОЭП-ингибитор способом, включающим приготовление стартовой системы, оксипропилирование стартовой системы в присутствии щелочного катализатора, нейтрализацию полученного продукта, очистку с получением искомого ОЭП-ингибитора, характеризующимся тем, что соотношение сорбит: гидроокись щелочного или щелочноземельного металла: бифункциональное кислородсодержащее соединение в стартовой системе рассчитывается таким образом, чтобы в результате их реакции с окисью пропилена получалась эквимольная смесь полиоксипропиленгликоля и полиоксипропиленгексола.
Заявленный ингибитор АТФ-зависимых обратных транспортеров клеток:
- обладает низкой цитотоксичностью в отношении культур клеток человека по сравнению с большинством описанных в литературе ингибиторов ABC-транспортеров;
- не влияет на микровязкость цитоплазматических мембран опухолевых клеток линии MCF-7 и клеток MCF-7/RES с приобретенной лекарственной устойчивостью;
- не проникает через цитоплазматическую мембрану внутрь опухолевых клеток MCF-7;
- в диапазоне концентраций 8,7-870 мкг/мл вызывает специфическое ингибирование P-gp-опосредованного обратного транспорта доксорубицина, увеличивая его концентрации в акцепторных лунках в 1,9-3,8 раз соответственно;
- способен элиминировать активную гликозилированную изоформу 190 кДа ABCB1, при этом наблюдается накопление в клетках неактивной высокоманнозной изоформы 175 кДа транспортера;
- ингибирует АТФ-азную активность изолированных мембран клеток Sf9 с гиперэкспрессией P-гликопротеина человека;
- не изменяет внутриклеточный уровень АТФ;
- при введении внутрижелудочно по степени токсичности относится к нетоксичным веществам, при внутривенном введении - к малотоксичным веществам;
- характеризуется простотой получения, дешевизной исходного сырья, производство может быть осуществлено на существующих предприятиях химической отрасли промышленности.
- обеспечивает возможность выхода на международный рынок с продуктом, ранее не известным в мире.
В списке приведенной литературы представлены некоторые публикации, описывающие состояние области техники, к которой относится заявленное техническое решение.
При этом следует обратить внимание на то, что основываясь на заявленном техническом решении, представляется возможным проводить различного рода модификации и/или изменения, не выходя за объем патентных притязаний.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, по совокупности признаков, приведенных в независимом пункте формулы изобретения, т.к. указанная совокупность признаков не выявлена из исследованного заявителем уровня техники.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. полученный ингибитор АТФ-зависимых обратных транспортеров клеток и способ его получения обеспечивают возможность решения неразрешимых ранее проблем, а именно, при значительном увеличении терапевтической эффективности значительно повысить безопасность, а также при этом существенно снизить стоимость готовой лекарственной формы.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, так как может быть использовано в производстве на специализированных предприятиях, с использованием известных материалов, оборудования и технологий.
Список использованных источников
1 Choi Y.H., ABC transporters in multidrug resistance and pharmacokinetics, and strategies for drug development / Y.H. Choi, A.M. Yu // Curr. Pharm. Des. 20 (2014), P. 793-807
2. Tiwari A.K. Revisiting the ABCs of multidrug resistance in cancer chemotherapy / A.K. Tiwari, K. Sodani, C.L. Dai, C.R. Ashby Jr., Z.S. Chen // Curr. Pharm. Biotechnol. 12 (2011), P. 570-594
3. Chen Z., Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance: A review of the past decade. / Z. Chen, T. Shi, L. Zhang, P. Zhu, M. Deng, C. Huang, T. Hu et al. // Cancer Letters, 370 (2016), P.153-164
4. Кантор, Ч. Биофизическая химия. Том 2. Методы исследования структуры и функции биополимеров / Ч. Кантор, П. Шиммел, - Москва: МИР, 1985.
5. Batrakova, E.V. Mechanism of sensitization of MDR cancer cells by Pluronic block copolymers: Selective energy depletion / E.V. Batrakova, S. Li, W.F. Elmquist et al. // Br J Cancer. - 2001. - V. 85, N. 12. - P. 1987-1997.
6. Kabanov A.V. An essential relationship between ATP depletion and chemosensitizing activity of Pluronic block copolymers / A.V. Kabanov, E.V. Batrakova, V.Y. Alakhov // J Control Release. 2003. - V. 91, N. 1-2. - P. 7583.
7. Gautherot, J. Effects of Cellular, Chemical, and Pharmacological Chaperones on the Rescue of a Trafficking-defective Mutant of the ATP-binding Cassette Transporter Proteins ABCB1/ABCB4 / J. Gautherot, A-M. Durand-Schneider, D. Delautier, J-L. Delaunay, A. Rada, J. Gabillet, C. Housset, M. Maurice,  // HEJOURNAL OF BIOLOGICAL CHEMISTRY. - 2012. - Vol. 287. - №7. - P. 5070-5078.
// HEJOURNAL OF BIOLOGICAL CHEMISTRY. - 2012. - Vol. 287. - №7. - P. 5070-5078.
8. Takahashi, K. Purification and ATPase Activity of Human ABCA1 / K. Takahashi, Y. Kimura, N. Kioka, M. Matsuo, K. Ueda // The Journal of biological chemistry. - 2006. - Vol. 281, №16. P. 10760-10768.
9. Batrakova, E.V. Effect of pluronic P85 on ATPase activity of drug efflux transporters / E.V. Batrakova, S. Li, Y. Li, V.Y. Alakhov, A.V. Kabanov // Pharm Res. - 2004. - V. 21, N. 12. - P. 2226-2233.
10. Regev, R Membrane fluidization by ether, other anesthetics, and certain agents abolishes P-glycoprotein ATPase activity and modulates efflux from multidrug-resistant cells / R. Regev, Y.G. Assaraf, G.D. Eytan // Eur J Biochem. - 1999. - Vol. 259. - P. 18-24
11. Womack, M.D. Detergent effects on enzyme activity and solubilization of lipid bilayer membranes / M.D. Womack, D.A. Kendall, R.C. MacDonald // Biochimica et Biophysica Acta (BBA) - Biomembranes. - 1983. - Vol. 733. - №2. - P. 210-215.
12. Batrakova, E.V. Mechanism of pluronic effect on P-glycoprotein efflux system in blood-brain barrier: contributions of energy depletion and membrane fluidization / E.V. Batrakova, S. Li, S.V. Vinogradov et al. // J Pharmacol Exp Ther. - 2001. - Vol. 299. - №2. - P. 483-493.
13. SP1049C [Электронный ресурс]. - 2016. - Режим доступа: http://www.supratek.com/pipeline/products