Результат интеллектуальной деятельности: Новые пиримидиновые ингибиторы репликации аденовируса человека
Вид РИД
Изобретение
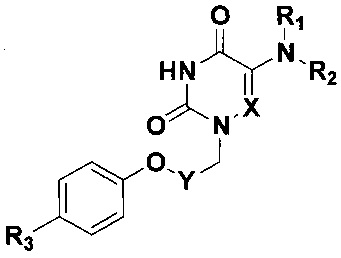
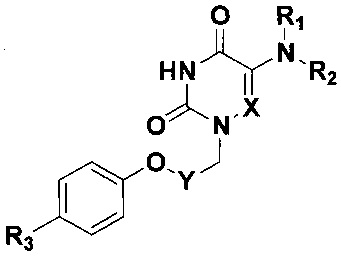
Изобретение относится к области молекулярной биологии, вирусологии и медицины, а именно к новым производным 5-аминоурацила, содержащим в положении N1 4-(фенокси)бензильный или ω-(фенокси)алкильный заместитель и обладающим противовирусным действием в отношении аденовирусов человека (HAdV), общей формулы
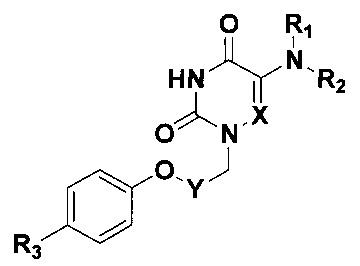
где X=СН или N; Y=(СН2)2, (СН2)3, (СН2)4 или С6Н4;
R1=Н, R2=С6Н5 или 3,5-Cl2С6Н3; R1+R2=морфолино;
R3=Н, F или Cl.
Высокоэффективные селективные химиотерапевтические противовирусные средства для лечения аденовирусных инфекций на сегодняшний день отсутствуют [Pihos А.М. Epidemic keratoconjunctivitis: А review of current concepts in management // Journal of Optometry. - 2013. - T. 6, №2. - C. 69-74]. Как правило, в терапии используют противовирусные средства широкого спектра действия, такие как интерферон или индукторы интерферона и препараты на основе кортикостероидов [Meyer-Rusenberg В., Loderstadt U., Richard G., Kaulfers P.M., Gesser C. Epidemic keratoconjunctivitis: the current situation and recommendations for prevention and treatment // Dtsch Arztebl Int. - 2011. - T. 108, №27. - C. 475-480]. Лекарственные средства, относящиеся к группе индукторов интерферона, недостаточно эффективны при борьбе с осложненными формами заболеваний, вызываемых аденовирусами, из-за низкой специфичности действия.
В настоящее время показана активность производных ациклонуклеотидов в отношении аденовирусов, например, цидофовира - (S)-1-(3-гидрокси-2-фосфонилметоксипропил)цитозина [De Clercq Е. The acyclic nucleoside phosphonates from inception to clinical use: historical perspective // Antiviral Res. - 2007. - T. 75, №1. - C. 1-13]. Действие цидофовира неспецифично в отношении аденовирусов человека: соединение является предшественником субстрата ДНК-полимеразы многих ДНК-содержащих вирусов. Проникая в клетку, цидофовир фосфорилируется клеточными киназами, превращается в аналог нуклеозидтрифосфатов, при синтезе ДНК конкурирует с обычными нуклеозидами и встраивается в растущую цепь ДНК. Гидроксильная группа в алифатической боковой цепи цидофовира оставляет возможность для дальнейшего удлинения цепи ДНК, поэтому лишь последовательное включение в растущую цепь двух молекул цидофовира приводит к невозможности ее дальнейшей элонгации. Как следствие, продукты, образующиеся в результате преждевременной остановки роста цепи ДНК, подвергаются быстрой деградации [De Clercq Е. The history of antiretrovirals: key discoveries over the past 25 years // Rev Med Virol. - 2009. - T. 19, №5. - C. 287-299]. Было показано, что HPMPC-дифосфат обладает более специфичным действием in vitro в отношении аденовирусов за счет повышенного сродства этого соединения к вирусной ДНК-полимеразе [De Clercq Е. Antivirals and antiviral strategies // Nat Rev Microbiol. - 2004. - T. 2, №9. - C. 704-720].
Цидофовир обладает широким спектром ингибирующей активности: in vitro он эффективен в отношении вирусов простого герпеса типа 1 и типа 2 человека, вируса Эпштейна-Барр, вирусов папилломы типов 6, 7 и 8 человека, полиомавирусов человека, а также аденовирусов [Waye М.М.Y., Sing С.W. Anti-Viral Drugs for Human Adenoviruses // Pharmaceuticals. - 2010. – T.3, №10. - C. 3343-3354]. В настоящее время цидофовир используют для терапии цитомегаловирусного ретинита у пациентов, страдающих синдромом приобретенного иммунодефицита (СПИД). Следует отметить, что применение цидофовира ограничено его высокой токсичностью, в том числе нефротоксичностью [Piscitelli S.С, Penzak S.R., Flexner С. Chapter 36 - Practical Therapeutics // AIDS and Other Manifestations of HIV Infection (Fourth Edition). - 2003. - C. 913-930]. Таким образом, актуальным является поиск эффективных и нетоксичных химиопрепаратов для борьбы с аденовирусами.
Наиболее близкими по химическому строению к предлагаемым соединениям являются 1-бензил-5-(ариламино)-производные урацила [Novikov М.S., Buckheit R.W., Jr., Temburnikar K., Khandazhinskaya A.L., Ivanov A.V., Seley-Radtke K.L. 1 - Benzyl derivatives of 5-(arylamino)uracils as anti-HIV-1 and anti-EBV agents // Bioorg Med Chem. - 2010. - T. 18, №23. - C. 8310-8314]. Данные соединения проявляют активность в отношении вируса иммунодефицита человека типа 1 (ВИЧ-1) и вируса Эпштейна-Барр; активность данных соединений в отношении аденовирусов человека не показана.
Целью предлагаемого изобретения является создание новых, высокоэффективных, селективных и малотоксичных антивирусных агентов для лечения аденовирусной инфекции.
Сущность изобретения заключается в синтезе новых производных 5-аминоурацила, содержащих в положении N1 пиримидинового цикла 4-(фенокси)бензильный или ω-(фенокси)алкильный заместитель и отвечающих указанной выше общей формуле.
Синтез новых соединений был осуществлен путем конденсации 2,4-бис(триметилсилилокси)-5-аминопиримидина или 6-амино-3,5-бис-(триметилсилилокси)-1,2,4-триазина с соответствующим 4-(фенокси)бензилбромидом или ω-(фенокси)алкилбромидом. Химическое строение, выход и физико-химические свойства синтезированных соединений представлены в таблице 1. Структура соединений доказана методами ЯМР-спектроскопии, чистота и индивидуальность - методом тонкослойной хроматографии.
Краткое описание чертежей
Фиг. 1. Оценка противоаденовирусной активности производных 5-аминоурацила. Различия между опытными и контрольными образцами статистически значимы при *р<0,05; ***р<0,001.
Следующие примеры иллюстрируют сущность изобретения.
Пример 1. [4-(Фенокси)бензил]-5-(фениламино)-6-азаурацил (соединение 1). Суспензию 1,0 г (4,90 ммоль) 6-аза-5-(фениламино)урацила и 0,1 г (1,87 ммоль) NH4Cl в 30 мл ГМДС кипятили в течение 12 ч до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, остаток растворили в 50 мл безводного 1,2-дихлорэтана, добавили 1,3 г (4,94 ммоль) 4-(фенокси)бензилбромида и полученную смесь кипятили с защитой от влаги воздуха в течение 24 ч. Реакционную массу охладили до комнатной температуры, обработали 10 мл изопропилового спирта, упарили при пониженном давлении и остаток чистили флэш-хроматографией, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие продукт, объединили и упарили досуха при пониженном давлении. Твердый остаток перекристаллизовали из смеси этилацетат - гексан (2:1). Получили 1,26 г мелкокристаллического продукта белого цвета с выходом 67%, Т.пл. 264-266°С, Rf 0,76 (этилацетат). 1H ЯМР (ДМСО-D6), δ, м.д.: 4,95 (2Н, с, СН2); 6,89-7,03 (5Н, м, Н-2', Н-3', Н-4', Н-5', Н-6'); 7,10 (1Н, т, J=7,1 Гц, Н-4'''); 7,22 (2Н, т, J=7,6 Гц, Н-3''', Н-5'''); 7,33 (2Н, т, J=7,7 Гц, Н-3ʺ, Н-5ʺ); 7,38 (2Н, д, J=8,2 Гц, Н-2ʺ, Н-6ʺ); 7,61 (2Н, д, J=7,8 Гц, Н-2''', Н-6'''); 8,33 (1H, с, NH); 13С ЯМР (ДМСО-D6), δ, м.д.: 52,7; 119,0; 119,1; 119,3; 122,4; 123,9; 128,9; 130,3; 130,4; 132,5; 139,8; 140,0; 148,0; 154,7; 156,8; 157,3.
Пример 2. 1-[4-(Фенокси)бензил]-5-[(3,5-дихлорфенил)амино]-6-азаурацил (соединение 2). Суспензию 0,5 г (1,84 ммоль) 6-аза-5-[(3,5-дихлорфенил)амино]урацила и 50 мг (0,97 ммоль) NH4Cl в 20 мл ГМДС кипятили в течение 12 ч до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, остаток растворили в 40 мл безводного 1,2-дихлорэтана, добавили 0,5 г (1,90 ммоль) 4-(фенокси)бензилбромида и полученную смесь кипятили с защитой от влаги воздуха в течение 24 ч. Реакционную массу охладили до комнатной температуры, обработали 10 мл изопропилового спирта, упарили при пониженном давлении и остаток чистили флэш-хроматографией, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие продукт, объединили и упарили досуха при пониженном давлении. Твердый остаток перекристаллизовали из смеси этилацетат - гексан (3:1). Получили 0,47 г мелкокристаллического продукта белого цвета с выходом 56%, Т.пл. 224,5-226°С, Rf 0,78 (этилацетат). 1Н ЯМР-спектр (ДМСО-D6, δ, м.д.: 4,95 (2Н, с, СН2); 6,93-6,98 (4Н, м, Н-2''', Н-4''', Н-6''', NH); 7,10 (1Н, т, J=6,9 Гц, Н-4'); 7,22 (2Н, т, J=7,6 Гц, Н-3', Н-5'); 7,33 (2Н, д, J=7,5 Гц, Н-2', Н-6'); 7,39 (2Н, д, J=8,2 Гц, Н-3ʺ, Н-5ʺ); 7,61 (2Н, д, J=7,8 Гц, Н-2ʺ, Н-6ʺ); 8,33 (1Н, с, N3H); 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 31,1; 36,1; 40,3; 51,9; 116,9; 118,9; 120,9; 123,8; 130,3; 130,5; 132,0; 134,2; 139,6; 142,1; 147,9; 154,3.
Пример 3.1-[4-(Фенокси)бензил]-5-(морфолино)урацил (соединение 3). Суспензию 1,0 г (5,07 ммоль) 5-(морфолино)урацила и 0,1 г (1,87 ммоль) NH4Cl в 30 мл ГМДС кипятили в течение 20 ч до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, остаток растворили в 50 мл безводного 1,2-дихлорэтана, добавили 1,35 г (5,13 ммоль) 4-(фенокси)бензилбромида и полученную смесь кипятили с защитой от влаги воздуха в течение 24 ч. Реакционную массу охладили до комнатной температуры, обработали 10 мл изопропилового спирта, упарили при пониженном давлении и остаток чистили флэш-хроматографией, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие продукт, объединили и упарили досуха при пониженном давлении. Твердый остаток перекристаллизовали из смеси этилацетат - этанол (2:1). Получили 1,3 г продукта в виде мелких игольчатых кристаллов белого цвета с выходом 68%, Т.пл. 182-184°С, Rf 0,41 (этилацетат). 1Н ЯМР (ДМСО-D6), δ, м.д.: 2,82 (4Н, с, 2×СН2); 3,64 (4Н, т, J=4,4 Гц, 2×СН2); 4,82 (2Н, с, СН2Ar); 6,96 (2Н, д, J=8,3 Гц, Н-2', Н-6'); 6,98 (2Н, д, J=8,0 Гц, Н-3ʺ, Н-5ʺ); 7,13 (1Н, т, J=8,0 Гц, Н-4'); 7,18 (1Н, с, Н-6); 7,32-7,36 (4Н, м, Н-3', Н-5', Н-2ʺ, Н-6ʺ); 11,37 (1Н, с, NH). 13С ЯМР (ДМСО-D6), δ, м.д.: 40,3; 50,2; 50,4; 66,3; 118,9; 119,0; 123,9; 127,2; 129,7; 130,2; 130,4; 132,3; 150,1; 156,5; 156,8; 161,2.
Пример 4. 1-[4-(4-Хлорфенокси)бензил]-5-(морфолино)урацил (соединение 4). Суспензию 1,0 г (5,07 ммоль) 5-(морфолино)урацила и 0,1 г (1,87 ммоль) NH4Cl в 30 мл ГМДС кипятили в течение 20 ч до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, остаток растворили в 50 мл безводного 1,2-дихлорэтана, добавили 1,55 г (5,21 ммоль) 4-(4-хлорфенокси)бензилбромида и полученную смесь кипятили с защитой от влаги воздуха в течение 24 ч. Реакционную массу охладили до комнатной температуры, обработали 10 мл изопропилового спирта, упарили при пониженном давлении и остаток чистили флэш-хроматографией, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие продукт, объединили и упарили досуха при пониженном давлении. Твердый остаток перекристаллизовали из смеси этилацетат - этанол (2:1). Получили 1,7 г продукта в виде мелких игольчатых кристаллов белого цвета с выходом 81%, Т.пл. 204-206°С, Rf 0,32 (этилацетат). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 2,82 (4Н, с, 2×NCH2); 3,64 (4Н, с, 2×ОСН2); 4,80 (2Н, с, ArСН2); 6,80 (2Н, д, J=7,6, Н-2', Н-6'); 7,12 (2Н, д, J=7,4, Н-3', Н-5'); 7,39 (2Н, д, J=8,2, Н-3ʺ, Н-5ʺ); 7,61 (2Н, д, J=7,8, Н-2ʺ, Н-6ʺ); 7,70 (1Н, с, Н-6); 11,42 (1Н, с, NH)., 3С ЯМР-спектр (ДМСО-D6), δ, м.д.: 50,1; 50,5; 67,0; 118,8; 121,1; 122,5; 123,2; 124,5; 134,0; 134,1; 138,5; 149,8; 154,2; 160,1; 164,2.
Пример 5. 1-[4-(4-Фторфенокси)бензил]-5-(морфолино)урацил (соединение 5). Суспензию 1,0 г (5,07 ммоль) 5-(морфолино)урацила и 0,1 г (1,87 ммоль) NH4Cl в 30 мл ГМДС кипятили в течение 20 ч до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, остаток растворили в 50 мл безводного 1,2-дихлорэтана, добавили 1,45 г (5,16 ммоль) 4-(4-фторфенокси)бензилбромида и полученную смесь кипятили с защитой от влаги воздуха в течение 24 ч. Реакционную массу охладили до комнатной температуры, обработали 10 мл изопропилового спирта, упарили при пониженном давлении и остаток чистили флэш-хроматографией, элюируя смесью хлороформ - метанол (10:1). Фракции, содержащие продукт, объединили и упарили досуха при пониженном давлении. Твердый остаток перекристаллизовали из смеси этилацетат - этанол (2:1). Получили 1,5 г мелкокристаллического продукта белого цвета с выходом 74%, Т.пл. 220-222°С, Rf 0,34 (этилацетат). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 2,85 (4Н, с, 2×NCH2); 3,66 (4Н, с, 2×ОСН2); 4,79 (2Н, с, ArСН2); 6,79 (2Н, д, J=7,9, Н-2', Н-6'); 7,11 (2Н, д, J=7,4, Н-3', Н-5'); 7,36 (2Н, д, J=8.2, Н-3ʺ, Н-5ʺ); 7,60 (2Н, д, J=7,9, Н-2ʺ, Н-6ʺ); 7,69 (1Н, с, Н-6); 11,47 (1Н, с, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 50,2; 50,6; 67,0; 118,8; 121,1; 122,5; 123,2; 124,5; 134,0; 134,1; 138,5; 149,8; 154,2; 160,1; 164,2.
Пример 6. 1-[3-(Фенокси)пропил]-5-(морфолино)-урацил (соединение 6). Смесь 1,5 г (4,61 ммоль) 5-бром-1-[3-(фенокси)пропил]-урацила и 1 мл (11,56 ммоль) морфолина кипятили в растворе 50 мл безводного этиленгликоля в течение 2 ч, вылили в 250 мл холодной воды и поместили в холодильник на ночь. Образовавшийся осадок отфильтровали, перекристаллизовали из смеси этилацетат - гексан (2:1) и получили 1,0 г мелкокристаллического продукта белого цвета с выходом 66%, Т.пл. 169-170°С, Rf 0,31 (этилацетат). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 2,04 (2Н, кв, J=6,3 Гц, СН2); 3,77 (2Н, т, J=6,0 Гц, NCH2); 3,87 (2Н, т, J=5,7 Гц, ОСН2); 2,82 (4Н, с, 2×NCH2); 3,69 (4Н, с, 2×ОСН2); 6,82-6,86 (3Н, м, Н-2', Н-4', Н-6'); 7,19 (2Н, т, J=8,0 Гц, Н-3', Н-5'); 7,63 (1Н, с, Н-6); 11,37 (1Н, с, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 28,0; 45,4; 50,1; 50,5; 64,6; 100,9; 112,2; 122,3; 138,6; 145,8; 151,0; 158,4; 163,9.
Пример 7. 1-[4-(Фенокси)бутил]-5-(морфолино)-урацил (соединение 7). Смесь 1,5 г (4,42 ммоль) 5-бром-1-[4-(фенокси)бутил]урацила и 1 мл (11,56 ммоль) морфолина кипятили в растворе 50 мл безводного этиленгликоля в течение 2 ч, вылили в 250 мл холодной воды и поместили в холодильник на ночь. Образовавшийся осадок отфильтровали, перекристаллизовали из смеси этилацетат - гексан (2:1) и получили 1,2 г мелкокристаллического продукта белого цвета с выходом 78%, Т.пл. 156-159°С, Rf 0,75 (этилацетат). 1Н ЯМР-спектр (ДМСО-Б6), δ, м.д.: 1,64 (4Н, с, СН2); 3,67 (2Н, т, J=6,2 Гц, NCH2); 3,89 (2Н, т, J=6,2 Гц, ОСН2); 2,85 (4Н, с, 2×NCH2); 3,66 (4H, с, 2×ОСН2); 6,79-6,83 (3Н, м, Н-2', Н-4', Н-6'); 7,13 (2Н, т, J=8,1 Гц, Н-3', Н-5'); 7,64 (1Н, с, Н-6); 11,41 (1Н, с, NH). 13С ЯМР-спектр (AMCO-D6), δ, м.д.: 25,3; 25,7; 47,3; 50,4; 51,0; 66,8; 100,9; 114,4; 120,5; 129,5; 145,7; 151,0; 158,6; 165,8.
Пример 8. 1-[5-(Фенокси)пентил]-5-(морфолино)-урацил (соединение 8). Смесь 1,5 г (4,25 ммоль) 5-бром-1-[5-(фенокси)пентил]-урацила и 1 мл (11,56 ммоль) морфолина кипятили в растворе 50 мл безводного этиленгликоля в течение 2 ч, вылили в 250 мл холодной воды и поместили в холодильник на ночь. Образовавшийся осадок отфильтровали, перекристаллизовали из смеси этилацетат - гексан (2:1) и получили 1,1 г мелкокристаллического продукта белого цвета с выходом 71%, Т.пл. 162-163,5°С, Rf 0,78 (этилацетат). 1H ЯМР-спектр (ДМСО-D6), δ, м.д.: 1,39 (2Н, кв, J=5,3 Гц, СН2); 1,63 (2Н, кв, J=7,2 Гц, СН2); 1,72 (2Н, кв, J=7,2 Гц, СН2); 3,67 (2Н, т, J=7,2 Гц, NCH2); 3,93 (2Н, т, J=6,5 Гц, ОСН2); 2,88 (4Н, с, 2×NCH2); 3,67 (4Н, с, 2×ОСН2); 6,83-6,88 (3Н, м, Н-2', Н-4', Н-6'); 7,22 (2Н, т, J=8,0 Гц, Н-3', Н-5'); 7,55 (1Н, с, Н-6); 11,29 (1H, с, NH)., 3С ЯМР-спектр (AMCO-D6), δ, м.д.: 22,9; 28,6; 28,7; 47,8; 50,5; 51,0; 67,5; 101,2; 114,8; 120,8; 129,9; 146,2; 151,4; 159,0; 164,3.

Пример 9. Определение цитотоксичности соединений.
Цитотоксичность соединений для клеток линии НЕК293 (клетки почки эмбриона мыши) [Graham F.L., Smiley J., Russell W.С., Nairn R. Characteristics of a human cell line transformed by DNA from human adenovirus type 5 // The Journal of general virology. - 1977. - T. 36. - C. 59-74] оценивали с помощью методов прижизненного окрашивания данных клеток бромидом 3-[4,5-диметилтиазолил-2]-2,5-дифенилтетразолия (МТТ) [Mosmarm Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // J Immunol Methods. - 1983. - T. 65, №1-2. - C. 55-63] или трипановым синим [Strober W. Trypan blue exclusion test of cell viability // Curr Protoc Immunol. - 2001. - T. Appendix 3. - C. Appendix 3В].
Клетки линии HEК293 культивировали на среде DMEM, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 1 мМ пирувата натрия, стрептомицин и пенициллин в концентрации 100 мкг/мл и 100 ед/мл соответственно. К клеткам НЕК293 добавляли исследуемые соединения, растворенные в диметилсульфоксиде (ДМСО) в диапазоне концентраций 2,5-200 мкМ. Контролем служили клетки, к которым вместо исследуемых соединений добавляли соответствующее количество ДМСО.
Прижизненное окрашивание клеток НЕК293 МТТ для оценки их жизнеспособности проводили через 48 ч после внесения веществ. Токсичность различных доз препарата определяли по жизнеспособности клеток относительно контроля. Все исследуемые соединения не оказывали токсического действия на клетки НЕК293 в эффективных концентрациях.
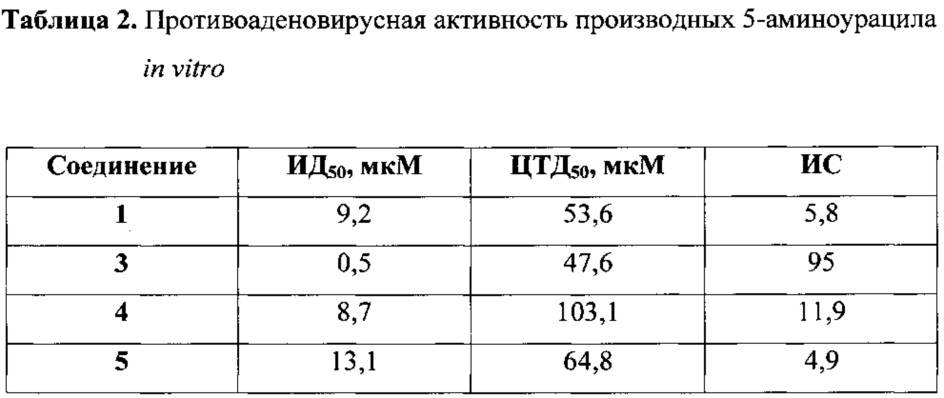
Для соединений, проявляющих ингибиторную активность в отношении аденовирусов человека, была определена концентрация, при которой количество живых клеток сокращается на 50% (ЦТД50). С этой целью проводили подсчет клеток, селективно окрашенных трипановым синим, через 24 ч после добавления соединений. Все исследуемые соединения не оказывали токсического действия на клетки НЕК293 в эффективных концентрациях. Результаты представлены в таблице 2.
Пример 10. Определение противоаденовирусной активности in vitro.
Было изучено влияние исследуемых соединений на репликацию аденовирусов в культуре клеток НЕК293.
В ходе оценки противоваденовирусной активности 5-аминопроизодных урацила клетки линии НЕК293 заражали рекомбинантным аденовирусом типа 5 человека, экспрессирующим усиленный зеленый флуоресцентный белок (HAdV 5-eGFP) [Шмаров М.М., Черенова Л.В., Шашкова Е.В., Логунов Д.Ю., Верховская Л.В., Капитонов А.В., Неугодова Г.Л., Доронин К.К., Народицкий Б.С. Эукариотические векторы на основе генома аденовируса птиц CELO, несущие гены GFP и IL-2 человека // Молекулярная генетика, микробиология и вирусология. - 2002. - №2. - С. 30-35; Logunov D.Y., Zubkova О.V., Karyagina-Zhulina A.S., Shuvalova Е.A., Karpov А.Р., Shmarov М.М., Tutykhina I.L., Alyapkina Y.S., Grezina N.M., Zinovieva N.A., Ernst L.K., Gintsburg A.L., Naroditsky B.S. Identification of Hl-like loop in CELO adenovirus fiber for incorporation of receptor binding motifs // J Virol. - 2007. - T. 81, №18. - C. 9641-9652] с множественностью инфекции 1 ФОЕ/клетку. Через 3 ч после инфекции добавляли исследуемые соединения в концентрации 25 мкМ. В качестве отрицательного контроля использовали ДМСО. Концентрация ДМСО во всех образцах не превышала 0,1%. Через 24 ч ингибиторную активность соединений оценивали по определению количества копий генома HAdV 5-eGFP методом количественной ГТЦР [Heim A., Ebnet С., Harste G., Pring-Akerblom P. Rapid and quantitative detection of human adenovirus DNA by real-time PCR // J Med Virol. - 2003. - T. 70, №2. - C. 228-239]. Было выявлено, что соединения 1, 3, 4 и 5 (примеры 1, 3, 4 и 5 соответственно) проявляют выраженную ингибиторную активность в отношении репликации HAdV 5-eGFP (фиг. 1).
Для соединений 1, 3, 4 и 5 (примеры 1, 3, 4 и 5 соответственно), проявляющих ингибиторную активность в отношении аденовирусов человека, была определена концентрация полумаксимального ингибирования (ИД50), при которой наблюдается снижение относительного количества копий генома HAdV 5-eGFP на 50% по сравнению с контролем. Клетки линии НЕК293 заражали HAdV 5-eGFP с множественностью инфекции 1 ФОЕ/клетку. Через 3 ч после инфекции добавляли исследуемые соединения в концентрации 0,5, 2,5, 5, 10, 15 и 25 мкМ. Концентрация ДМСО во всех образцах не превышала 0,1%. Через 24 ч ингибиторную активность соединений оценивали по определению количества копий генома HAdV 5-eGFP методом количественной ГТЦР и построению по полученным результатам дозозависимой кривой. Индекс селективности (ИС) рассчитывали как отношение ЦТД50 соединения к его ИД50 (табл. 2). На основании данных количественных показателей ингибирования можно судить об эффективности противовирусного действия ряда заявляемых соединений, заключающейся в высокой степени подавления репликации HAdV 5-eGFP в культуре клеток НЕК293.
Пример 11. Влияние исследуемых соединений на инфекционность аденовирусного потомства.
Было оценено влияние наиболее эффективных производных 5-аминоурацила - соединений 1 и 3 (примеры 1 и 3 соответственно) на инфекционность аденовирусного потомства.
Клетки линии НЕК293 заражали HAdV 5-eGFP с множественностью инфекции 1 и 10 ФОЕ/клетку. Через 3 ч после инфекции добавляли растворы соединений 1 и 3 (примеры 1 и 3 соответственно) в ДМСО в концентрации 25 мкМ. В качестве контроля использовали ДМСО, конечная концентрация которого в культуральной среде не превышала 0,1%. Через 48 ч культуральную среду собирали в микропробирки и замораживали при температуре -70°С. С целью разрушения клеток полученную вируссодержащую среду размораживали при комнатной температуре и снова замораживали при -70°С. После повторного размораживания аликвоты 10-кратных разведений вируссодержащих стоков добавляли к клеткам линии НЕК293. Наблюдали снижение титра вирусного потомства под воздействием указанных веществ (табл. 3).

Таким образом, открыт новый класс анти-аденовирусных агентов ненуклеозидной природы, которые проявляют ингибирующий эффект в культуре клеток НЕК293 в отношении аденовирусов человека. Это позволяет считать соединения данного ряда перспективными в плане создания на их основе лекарственных средств для лечения заболеваний, вызываемых аденовирусами.