Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ 3-(R)-[3-(2-МЕТОКСИФЕНИЛТИО)-2-(S)-МЕТИЛПРОПИЛ]АМИНО-3,4-ДИГИДРО-2Н-1,5-БЕНЗОКСАТИЕПИНА ДЛЯ ЛЕЧЕНИЯ РАКА И, В ЧАСТНОСТИ, ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ МЕТАСТАЗОВ РАКА
Вид РИД
Изобретение
Изобретение относится к применению 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепина или любой из его фармацевтически приемлемых солей при лечении рака и, в частности, при предупреждении и/или лечении раковых метастазов.
3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5 бензоксатиепин, представленный формулой:
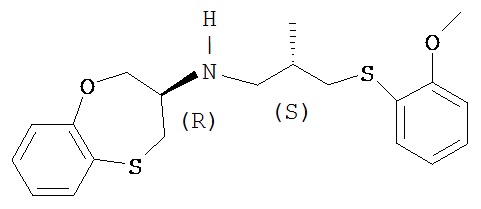
его фармацевтически приемлемые соли и его применение при лечении стенокардии, сердечной недостаточности, инфаркта миокарда и нарушений сердечного ритма раскрыты в заявке на патент WO 02/081464.
Рак может быть определен в широком смысле как заболевание, обусловленное пролиферацией и неконтролируемой диссеминации клеток организма, которые стали аномальными. Это заболевание является одной из основных причин смертности в развитых странах, и число новых случаев постоянно возрастает. Тем не менее, среди прочего, благодаря прогрессу в противораковых терапиях смертность вследствие рака значительно снизилась. Противораковые терапии включают, в соответствии с типом и степенью прогрессирования заболевания, операцию, радиотерапию и химиотерапию. В большинстве случаев необходима комбинация двух или трех из этих способов.
Радиотерапия представляет собой местно-регионарный способ лечения рака, при котором применяют ионизирующее излучение для разрушения раковых клеток, при этом насколько возможно защищая прилежащую здоровую ткань. Химиотерапия состоит в применении веществ, способных уничтожать раковые клетки или ограничивать их пролиферацию.
Когда рак обнаруживают на ранней стадии, то есть до появления метастазов, прогноз является относительно благоприятным. Однако на практике это составляет только приблизительно 30% случаев. В данном случае опухоль, известную как первичная опухоль, лечат локально посредством операции и/или радиотерапии; пациенты могут получать дополнительную химиотерапию, предназначенную для снижения рисков рецидива и возникновения вторичных опухолей или метастазов.
Многие типы рака способны к образованию метастазов, которые могут находиться на расстоянии от первичной опухоли, и могут возникать через несколько лет после лечения первичной опухоли. Это явление можно объяснить существованием преангиогенных микрометастазов или клеток, остающихся без деления в течение продолжительного периода времени во вторичном сайте (сайтах). В онкологии термин "метастазы" обозначает вторичные опухоли, образующиеся за счет распространения клеток из первичной опухоли, идентифицированной или не идентифицированной. Термин "микрометастазы" используют, когда размер этих вторичных опухолей не превышает 2 мм.
Хотя метастатические клетки имеют происхождение от первичной опухоли, они могут быть не точно идентичны ее клеткам. Действительно, этим клеткам нужно приобрести ряд характеристик, обеспечивающих переход этих клеток от ракового к метастатическому фенотипу. Тем не менее, образование метастазов является комплексным процессом, сокращенным в данном описании как "метастатический процесс", посредством которого раковые клетки покидают первичную опухоль и мигрируют в другие части организма, используя лимфатическую и/или кровеносную систему. Метастатический процесс может быть разбит на множество стадий: 1) раковые клетки отделяются от первичной опухоли и связываются, одновременно разлагая их, с белками, образующими внеклеточный матрикс, отделяющий опухоль от прилежащей ткани, 2) как только произошло разрушение в матриксе, эти клетки инфильтрируют окружающую ткань, включая лимфатические и/или кровеносные сосуды, 3) затем клетки выживают в кровообращении и транспортируются во вторичный сайт (сайты), где они выходят путем экстравазации, 4) клетки связываются с тканью и пролиферируют после активации микроокружения и индуцируют ангиогенез с образованием метастаза.
Термин "ангиогенез" обозначает серию процессов, ведущую к образованию новых кровеносных капилляров из предсуществующей сосудистой системы.
В большинстве случаев рака смертность является следствием не первичной опухоли, а метастазов, развивающихся и размножающихся на одном или на множестве органов.
Лечение метастатических форм рака по существу основано на химиотерапии; радиотерапию и/или операцию, как правило, применяют дополнительно для ослабления некоторых симптомов. Тем не менее, на практике способы лечения путем системной химиотерапии неэффективны на метастазах и не действуют на сам метастатический процесс.
Разработана дополнительная стратегия, которая состоит не в разрушении метастазов, но, скорее, в предотвращении их роста более нескольких мм путем задерживания опухолевого ангиогенеза с применением веществ, ингибирующих пролиферацию клеток из эпителия кровеносных сосудов.
Антиангиогенные вещества, применяемые в противораковых терапиях, включают бевацизумаб, сорафениб и сунитиниб. Бевацизумаб представляет собой моноклональное антитело, связывающееся со всеми изоформами фактора роста кровеносных сосудов (VEGF; от англ. "vascular epithelial growth factor") и предотвращает его связывание с рецепторами VEGF. Сорафениб и сунитиниб являются неселективными ингибиторами рецепторов тирозинкиназ, в частности, VEGF. Антиангиогенные вещества обладают косвенной антиметастатической активностью, поскольку они усиливают доставку химиотерапевтических агентов, хотя и не препятствуют самому метастатическому процессу. Тем не менее, данные лекарственные препараты включают серьезные недостатки: 1) эти препараты уменьшают плотность тканевых микрососудов и препятствуют нормальным процессам репарации; 2) они ухудшают коронарное заболевание, вызывают артериальную гипертензию и тромбоз; 3) не существует прогностических факторов ответа или возникновения резистентности, и 4) их стоимость очень высока.
С учетом ограничений современных терапий существует реальная медицинская необходимость в веществах, способных к предотвращению метастазов у пациентов, страдающих раком. Кроме того, оказываются очень желательными исследуемые вещества, обладающие прямыми антиметастатическими свойствами, следовательно, дополняющими свойства существующих лекарственных препаратов.
Описано, что ионные каналы вовлечены в механизмы инвазии и миграции, необходимые для образования метастазов (Arcangeli et al. 2009, Curr. Med. Chem. 16, 66-93). Эти каналы, аномально экспрессирующиеся в раковых клетках, включают потенциалзависимый натриевый канал Nav1.5 (Onkal and Djamgoz 2009, Eur. J. Pharmacol. 625, 206-219). В настоящем изобретении термин "Nav1.5" обозначает потенциалзависимые натриевые каналы, где альфа-субъединица, образующая отверстие канала, кодируется геном SNC5A (также известным как Н1), расположенным на хромосоме 3. Альфа-субъединица может быть ассоциирована с одной или с множеством вспомогательных субъединиц (называемых бета-субъединицей (субъединицами)), кодируемых генами SNC1B, SNC2B, SNC3B, SNC4B, расположенными на хромосомах 11 и 19.
Таким образом, показано, что экспрессия функциональных каналов Nav1.5 в клетках рака яичника значительно повышает их метастатический потенциал (Gao et al. 2010, Oncology Reports 23, 1293-1299). Аналогично, функциональные каналы Nav1.5 обнаружены в биопсиях высокометастатического рака молочной железы (Brisson et al. 2011, Oncogene 30, 2070-2076) или рака ободочной кишки (House et al. 2010, Cancer Res. 70, 6957-6967), при этом они не обнаружены в здоровых клетках из соответствующей ткани, либо из ткани опухоли с небольшими метастазами или без метастазов. Каналы Nav1.5 также обнаружены во множестве биопсий рака легкого и линиях опухолевых клеток (Roger et al. 2007, Int. J. Biochem. Cell Biol. 39, 774-786). Экспрессия или гиперэкспрессия канала типа Nav1.5, кроме того, предложена в качестве диагностического инструмента в отношении метастатического потенциала раковых клеток (Fraser et al. 2005, Clin. Cancer Res. 11, 5381-5389). Также предположили, что полезный эффект длинноцепочечных ненасыщенных жирных кислот при раках молочной железы, ободочной кишки и простаты может быть связан с их ингибиторными свойствами в отношении натриевого тока Nav1.5, хотя механизм их действия неизвестен (Gillet et al. 2011, Biochimie 93, 4-6). В экспериментах in vitro показано, что блокаторы канала Nav1.5, такие как тетродотоксин или поликлональные антитела, направленные против неонатальной формы канала Nav1.5, ослабляют метастатический потенциал во множестве линий раковых клеток (Chioni et al. 2005, J. Neurosci. Methods 147, 88-98).
Таким образом, ряд данных указывает на то, что натриевый ток, продуцируемый каналом Nav1.5, играет основную роль в метастатическом процессе раковых клеток, по меньшей мере при некоторых типах рака, в частности, при раке молочной железы, легкого, простаты, ободочной кишки, мочевого пузыря, яичника, семенника, кожи, щитовидной железы или желудка. Механизмы, посредством которых каналы Nav1.5 потенцируют образование метастазов, не объяснены, но выдвинут ряд гипотез, таких как, например, модификация адгезии, регуляция протеолитических ферментов. В заключение, канал Nav1.5, таким образом, обнаружен в качестве потенциальной мишени для предотвращения образования метастазов.
С учетом убиквитарной роли канала Nav1.5, его использование в качестве терапевтической мишени для разработки противоракового и/или антиметастатического агента, тем не менее, сложно. Действительно, канал Nav1.5 широко распределен в организме, в частности, в клетках сердца и кровеносных сосудов (Goldin 2001, Annu. Rev. Physiol. 63, 871-894).
В кардиомиоцитах открытие канала Nav1.5 запускает входящий натриевый ток, который может быть дезактивирован по меньшей мере двумя путями, каждый из которых характеризуется кинетикой закрытия канала: быстрой инактивации и медленной инактивации. Быстрая инактивация индуцирует так называемый "быстрый" ток Nav1.5, длящийся только несколько миллисекунд, тогда как медленная инактивация образует так называемый "медленный" ток, длящийся несколько десятков миллисекунд. Быстрый ток Nav1.5 играет фундаментальную роль в нормальной функции сердца, где он активирует и распространяет сердечный потенциал действия. С другой стороны, действие медленного тока, по-видимому, не является важным в нормальной функции сердца, и он продуцируется или значительно усиливается в клетках сердца и сосудов, подвергнутых стрессу (Bocquet et al. 2010, Br. J. Pharmacol. 161, 405-415).
Неожиданно авторы изобретения продемонстрировали, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин, являющийся селективным ингибитором медленного тока Nav1.5, также ингибирует натриевый ток, продуцируемый натриевыми каналами Nav1.5, обнаруженными в раковых клетках, сокращенно обозначенный в данном описании как "метастатический ток Nav1.5".
На основании этого наблюдения обнаружено, что метастатический ток Nav1.5 и медленный ток Nav1.5 обладают достаточно сходными биофизическими характеристиками, где оба тока распознаются 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепином.
Также обнаружено, что метастатический ток Nav1.5 и быстрый сердечный ток Nav1.5 могут быть фактически разъединены. Действительно, авторы изобретения продемонстрировали, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин не влияет на нормальную функцию сердечно-сосудистой системы под контролем быстрого тока Nav1.5 даже при высоких дозах. Таким образом, 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин обладает селективностью действия, требующейся для его применения в качестве антиметастатического агента, поскольку он блокирует метастатический ток Nav1.5, не препятствуя быстрому току Nav1.5, существенному для нормальной функции сердца и сосудов.
Ингибиторы/блокаторы канала Nav1.5 включают различные нe-Nav1.5-селективные соединения, такие как природные токсины, терапевтические молекулы (например, анестетические, противоаритмические агенты) и инсектициды (Anger et al. 2001, J. Med. Chem. 44, 115-137). Описано только два лекарственных препарата в качестве преимущественных блокаторов медленного сердечного тока Nav1.5: ранолазин (RN 95635-55-5) и рилузол (RN 1744-22-5), но они относительно неэффективны и неселективны по отношению к данному току. Кроме того, они взаимодействуют с молекулярными мишенями, отличающимися от канала Nav1.5. Интересно, что рилузол описан как обладающий антиметастатической активностью при меланомах, тем не менее, в данную активность вовлечены другие механизмы, отличающиеся от ингибирования медленного натриевого тока Nav1.5 (US 20100221246; Biechele et al. 2010, Chemistry & Biology 17, 1177-1182; Wu et al. 2009, NeuroToxicology 30, 677-685).
Таким образом, в настоящем изобретении предложены новые средства борьбы с раком, и, более конкретно, для профилактики или лечения его метастазов посредством прямого действия на метастатический процесс, которое неспособен осуществлять ни один существующий агент.
Хотя канал Nav1.5 идентифицирован в различных типах метастатического рака, таких как рак молочной железы, легкого, простаты или ободочной кишки, очевидно, что применение 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепина не ограничено данными формами рака, но применимо ко всем формам рака, где клетки среди прочего экспрессируют канал Nav1.5.
Более конкретно, и в качестве примера, согласно изобретению продемонстрировано, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин или любая из его фармацевтически приемлемых солей блокирует метастатический ток Nav1.5 в опухолевой линии высокометастатического рака молочной железы человека. С учетом отношения, установленного между током, продуцируемым каналами Nav1.5, обнаруженными в раковых клетках, и их склонностью к образованию метастазов, обнаружение свойств, ингибирующих этот ток, следовательно, эквивалентно обнаружению антиметастатических свойств. Кроме того, авторы изобретения продемонстрировали, что 3-(R)-[3-(2-метоксифенилтио)-2-(8)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин не обладал цитотоксичностью.
Настоящее изобретение относится к 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2H-1,5-бензоксатиепину или к любой из его фармацевтически приемлемых солей, применяемых в качестве лекарственного средства, предназначенного для лечения рака и более конкретно для профилактики или лечения его метастазов.
В настоящем изобретении термин "фармацевтически приемлемый" относится к химическим соединениям и композициям, не производящим какого-либо вредного или аллергического действия или какой-либо иной нежелательной реакции при введении человеку. При использовании в данном изобретении термин "фармацевтически приемлемый эксципиент" включает любой разбавитель, адъювант или наполнитель, например, консервирующие агенты, объемообразующие агенты, разрыхляющие, увлажняющие, диспергирующие, антибактериальные или противогрибковые агенты, либо какие-либо агенты, подходящие для замедления всасывания и резорбции в кишечнике и пищеварительном тракте. Использование этих сред или векторов хорошо известно специалистам в данной области техники.
Термин "фармацевтически приемлемые соли" соединения обозначает соли, являющиеся фармацевтически приемлемыми, как определено в данном описании, и обладающие подразумеваемой фармакологической активностью исходного соединения. Такие соли включают: соли присоединения кислоты, образованные с минеральными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные кислоты, образованные с органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталинсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, паратолуолсульфоновая кислота, триметилуксусная кислота, трифторуксусная кислота и тому подобное.
Фармацевтически приемлемые соли также включают формы присоединения растворителя (сольваты) или кристаллические (полиморфные) формы, как определено в данном описании, одной и той же соли присоединения кислоты.
Изобретение также относится к применению 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепина или любой из его фармацевтически приемлемых солей у пациентов, у которых представлена одна или более раковых опухолей, в которой клетки среди прочего экспрессируют потенциалзависимый натриевый канал Nav1.5.
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей в качестве активного агента 3-(R)-[3-(2-метоксифенилтио)-2-(8)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин или любую из его фармацевтически приемлемых солей и по меньшей мере один фармацевтически приемлемый эксципиент, применяемой при лечении рака и более конкретно для профилактики или лечения раковых метастазов. Преимущественно раки, имеющие отношение к композиции согласно настоящему изобретению, представляют собой следующие раки: рак молочной железы, легкого, простаты, ободочной кишки, мочевого пузыря, яичника, семенника, кожи, щитовидной железы или желудка.
Предпочтительно фармацевтическая композиция согласно изобретению предназначена для пациентов, опухолевые клетки которых экспрессируют среди прочего канал Nav1.5. Присутствие данного канала в опухолевых клетках пациента может быть обнаружено на основании присутствии матричной РНК гена SCN5A и/или самого белка канала. Матричную РНК и/или белок можно обнаружить методами, хорошо известными специалистам в данной области техники, такими как, например, полимеразная цепная реакция (ПЦР), Вестернблоттинг или гибридизация in situ. Клетки можно получить из образцов, взятых из первичной опухоли, метастазов, лимфатических узлов или крови, и анализировать непосредственно или культивировать in vitro, а затем анализировать.
Фармацевтическую композицию согласно изобретению можно вводить с одним или более дополнительных активных агентов, таких как противораковый агент, либо в сочетании с радиотерапией или хирургическим лечением, либо с их комбинацией. Затем введение может быть одновременным, отдельным или отрегулированным в отношении другого способа (способов) лечения. Композицию можно также применять в течение всей продолжительности или в течение более короткого или более длительного периода, чем другую противораковую терапию.
Фармацевтические композиции согласно настоящему изобретению включают в препарат для введения людям. Композиции согласно изобретению можно вводить пероральным, подъязычным, подкожным, внутримышечным, внутривенным, трансдермальным, местным или ректальным, либо также интраназальным путем. В данном случае активный ингредиент можно вводить людям в стандартных дозируемых формах смешанным с традиционными фармацевтическими носителями. Подходящие стандартные дозируемые формы включают пероральные формы, такие как таблетки, капсулы, порошки, гранулы и пероральные растворы или суспензии, подъязычные и трансбуккальные дозируемые формы, подкожные или трансдермальные, местные, внутримышечные, внутривенные, интраназальные или внутриглазные дозируемые формы, ректальные дозируемые формы.
При получении твердой композиции в форме таблетки основной активный ингредиент смешивают с фармацевтической основой, такой как желатин, крахмал, лактоза, стеарат магния, тальк, гуммиарабик, кремнезем или их эквиваленты. Таблетки могут быть покрыты сахарозой или другими подходящими веществами, либо могут быть обработаны таким образом, что обладают пролонгированной или замедленной активностью и непрерывно высвобождают предопределенное количество активного ингредиента.
Препарат в виде капсулы получают путем смешивания активного ингредиента с разбавителем и заливки полученной смеси в мягкие или твердые капсулы.
Препарат в форме сиропа или эликсира может содержать активный ингредиент в сочетании с подсластителем, антисептиком, вместе с агентом, обеспечивающим приятный запах или вкус (корригентом), и подходящим красящим веществом.
Диспергируемые в воде порошки или гранулы могут содержать активный ингредиент, смешанный с дисперсионными агентами или увлажняющими агентами, либо суспензионными агентами, вместе с корригентами или подсластителями.
Для ректального введения применяют суппозитории, которые готовят со связующими веществами, плавящимися при ректальной температуре, например с маслом какао или полиэтиленгликолями.
Для парентерального (внутривенного, внутримышечного, внутрикожного, подкожного), интраназального или внутриглазного введения применяют водные суспензии, изотонические физиологические растворы или стерильные инъекционные растворы, содержащие физиологически совместимые дисперсионные агенты и/или увлажняющие агенты.
Активный ингредиент можно также включать в форму микрокапсул, необязательно с одним или множеством дополнительных носителей.
Предпочтительно фармацевтическая композиция согласно настоящему изобретению предназначена для перорального или внутривенного введения.
Фармацевтическая композиция согласно настоящему изобретению может содержать дополнительные активные ингредиенты, приводящие в результате к дополнительному или необязательно синергетическому эффекту.
Дозировки 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепина или любой из его фармацевтически приемлемых солей в композициях согласно изобретению можно регулировать с получением количества вещества, эффективного для получения терапевтического ответа, требующегося для конкретной композиции, вводимой конкретным способом. Эффективная доза соединения согласно изобретению варьирует в соответствии с многочисленными параметрами, такими как, например, выбранный путь введения, масса, возраст, пол и чувствительность субъекта, подлежащего лечению. Следовательно, оптимальная дозировка должна определяться специалистом в релевантной области техники в соответствии с параметрами, считающимися релевантными. Хотя эффективные дозы могут варьировать в больших соотношениях, суточные дозы могут находиться в диапазоне от 1 мг до 1000 мг на 24 часа, и преимущественно от 1 до 200 мг для взрослого человека, имеющего среднюю массу тела 70 кг, в одной или более доз.
Приведенный ниже пример обеспечивает более четкое понимание изобретения без ограничения его объема.
Исключительно в качестве иллюстрации авторы изобретения выбрали использование в эксперименте линии MDA-MB-231, представляющей собой высокометастатическую линию аденокарциномы молочной железы человека. Действительно, продемонстрировано, что данные клетки экспрессируют, среди прочего, функциональные потенциалзависимые натриевые каналы Nav1.5, и что блокирование данного канала с применением различных фармакологических средств снижало метастатический потенциал этих клеток (Brackenbury et al. 2007, Breast Cancer Res. Treat. 101, 149-160). Тем не менее, обсуждаемые фармакологические средства не подходят для точной характеризации естественного натриевого тока Nav1.5, вовлеченного в метастатический процесс. Тем не менее, авторы изобретения с помощью экспериментов с локальной фиксацией потенциала на целой клетке, проведенных на клетках MDA-MB-231, продемонстрировали, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин снижает метастатический ток Nav1.5 зависимо от концентрации (lC50=1,5 мкМ). В связи с этим авторы изобретения считают, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин обладает антиметастатическими свойствами в отношении раковых клеток, экспрессирующих канал Nav1.5. Само по себе важно отметить, что описаны многочисленные типы метастатического рака, экспрессирующие канал Nav1.5.
Метод
Культура клеток: клетки MDA-MB-231 культивируют в модифицированной Дульбекко среде Игла (Life Technologies LTD, Paisley, UK) с добавлением 4 мМ L-глутамина и 10% фетельной сыворотки теленка. Клетки инокулируют в 100 мм культуральные чашки и помещают в термостат при 37°С, влажности 100% и 5% CO2.
Электрофизиологические измерения в конфигурации целой клетки: пэтч-пипетка (сопротивление 5-15 МОм) содержит следующий раствор: 5 мМ NaCl, 145 мМ CsCl, 2 мМ MgCl2, 1 мМ СаСl2, 10 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (ГЭПЭС) и 11 мМ этиленгликольтетрауксусную кислоту (ЭГТА), рН доводят до 7,4 CsOH. Сравнительный электрод погружают во внеклеточную среду, состоящую из следующего раствора: 140 мМ NaCl, 4 мМ KCl, 2 мМ MgCl2, 11 мМ глюкозы, 10 мМ ГЭПЭС, рН доводят до 7,4 NaOH. Эти два электрода соединены с усилителем Axopatch 200В (Axon Instrument). Токи фильтруют, используя бесселевский фильтр, при частоте 5 кГц и снимают образцы при частоте 5 кГц, используя интерфейс Digidata (1200). Сбор и анализ данных проводят, используя программное обеспечение pClamp (Axon Instrument). Исходный потенциал устанавливают на -110 мВ для регистрации максимальной активности канала Nav.
Использовали два следующих протокола:
1/Протокол "потенциалзависимый ток lNa " для наблюдения максимальной амплитуды lNa в соответствии с прилагаемым напряжением. Деполяризации в 5 мВ стадиях проводят при частоте 0,2 Гц, от -110 до +60 мВ. Интервал деполяризации продолжается 600 мс (см. прилагаемый чертеж).
2/Протокол "повторяющаяся деполяризация" для измерения воздействия тестируемого препарата на амплитуду тока. Для этого проводят деполяризации -20 мВ в последовательности при частоте 0,5 Гц. Интервал деполяризации длится 25 мс.
Результаты
Тестируемые клетки экспрессируют ток максимальной амплитуды порядка 900 пикоампер (пА). Пороговая активация тока расположена при -50 мВ, пик тока вокруг -20 мВ и потенциал реверсии при +30 мВ (прилагаемая фигура). Ток прекращается в отсутствие ионов Na+ в среде, что подтверждает, что исследуемый ток представляет собой натриевый ток. Ингибирование пикового тока тетродотоксином (Sigma) является лишь частичным: 30±7% при 1 мкМ и 54±8% при 5 мкМ, что указывает на то, что исследуемый ток является тетродотоксин-резистентным.
Кроме того, авторы изобретения продемонстрировали in vivo, что 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин не препятствует нормальной функции сердца даже при высоких дозах.
Таким образом, настоящее изобретение отличается тем, что: 1) 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин обладает прямым действием на метастатический процесс и как таковой дополняет существующие терапии; 2) 3-(R)-[3-(2-метоксифенилтио)-2-(S)-метилпропил]амино-3,4-дигидро-2Н-1,5-бензоксатиепин обладает селективным действием на раковые клетки, не препятствуя при антиметастатических дозах другим функциям, в которые вовлечены каналы Nav1.5, таким как нормальная функция сердца и сосудов.
![ПРИМЕНЕНИЕ 3-(R)-[3-(2-МЕТОКСИФЕНИЛТИО)-2-(S)-МЕТИЛПРОПИЛ]АМИНО-3,4-ДИГИДРО-2Н-1,5-БЕНЗОКСАТИЕПИНА ДЛЯ ЛЕЧЕНИЯ РАКА И, В ЧАСТНОСТИ, ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ МЕТАСТАЗОВ РАКА](https://fips.edrid.ru/images/rid/db/d3/1e/93f455a77a456ab9cd5b589d8272406f.png)

