Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭФИР ДГК, ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ
Вид РИД
Изобретение
Изобретение относится к фармацевтической композиции для парентерального введения, включающей эфир докозагексаеновой кислоты.
Омега-3 жирные кислоты представляют собой полиненасыщенные жирные кислоты, в частности, обнаруженные в водорослях, жирной рыбе (лосось, макрель, сардина, тунец), рапсовом семени, грецком орехе, сое и т.д. Как общее правило, классификация жирных кислот СН3-(СН2)n-СООН основана на длине углеродной цепи (короткая для n=2-4, средняя для n=6-8 и длинная для n≥10), числе двойных связей (ненасыщенные, моно- или полиненасыщенные) и положении двойных связей, начиная от атома углерода в карбоксильной группе. Система с использованием обозначения ω указывает длину углеродной цепи, число двойных связей и положение ближайшей двойной связи к ω-атому углерода, начиная с указанного ω-атома углерода, который является по определению последним атомом углерода в цепи, самым удаленным от карбоксильной группы.
Основными жирными кислотами в ω-3 группе являются:
- линоленовая кислота 18:3(9, 12, 15)или АПК;
- эйкозапентаеновая кислота 20:5 (5, 8, 11, 14, 17) или ЭПК;
- докозагексаеновая кислота 22:6 (4, 7, 10, 13, 16, 19) или ДГК Омега-3 жирные кислоты обеспечивают многочисленные полезные эффекты для здоровья человека.
В публикации WO 01/46115 А1 суммированы полезные эффекты рациона, основанного на рыбьем жире, богатом ЭПК и ДГК, на снижение инсультов и инфарктов миокарда. Парентеральная форма ЭПК и ДНК упомянута в этой публикации в форме суспензии глобулярных частиц, полученной с использованием способов, хорошо известных специалистам в данной области техники, например, путем разведения неионного поверхностно-активного вещества (ПАВ) в воде, нагревания его и добавления эфира ДГК и ЭПК. В этой заявке также описаны эмульсии, предназначенные для внутривенного введения, содержащие соевое масло и триглицериды, посредством цитирования публикации на странице 8, строка 2 (Billman et al. 1997 Lipids 32 1161-1168).
Однако, используя такой способ, трудно получить стабильные парентеральные препараты, готовые к применению, или для восстановления с использованием лиофилизированной формы, где средний размер частиц составляет менее 100 нм, для включения большого количества активного ингредиента, и не содержащие избыточно высокую долю сурфактанта, который может оказаться токсичным при длительном применении.
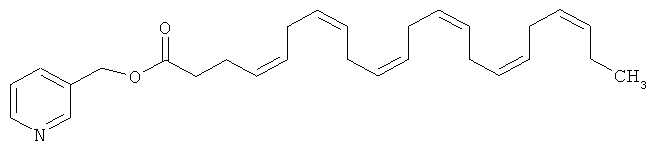
Из эфиров ДГК никотиновый эфир или пиридин-3-илметил-цис-4,7,10,13,16,19-докозагексаеновая кислота является эфиром, представляющим значительный терапевтический интерес.
Структурная формула никотинового эфира ДНК или пиридин-3-илметил-цис-4,7,10,13,16,19-докозагексаеновой кислоты приведена ниже:
Молекулярная масса составляет 419,60 г, что соответствует C28H37NO2.
Это соединение является в высокой степени липофильным (Log P примерно 7), где растворимость при равновесии в воде составляет <1 мкг/мл. Поэтому его особенно трудно включать в препарат для парентерального введения.
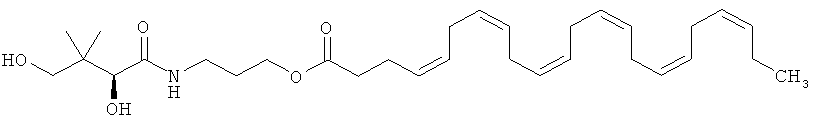
Следующим эфиром ДГК, представляющим особый интерес, является пантеноловый эфир ДГК, иначе называемый пантенилдокозагексаеноат, в частности, пантеноловый моноэфир ЭГК, 2,4-дигидрокси-3,3-диметилбутанамидо)пропилдокоза-4,7,10,13,16,19-гексаноат, имеющий приведенную ниже формулу А:

или любое из его фармацевтически приемлемых солей, энантиомеров, диастереоизомеров или их смеси, включая рацемические смеси.
Более конкретно этот сложный эфир может представлять собой пантеноловый моноэфир ДГК, имеющий приведенную ниже формулу В:
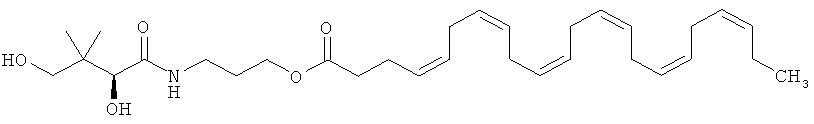
иначе называемый "D-пантеноловый эфир ДГК".
Эти эфиры очень эффективны, например, при лечении фибрилляции предсердий, как описано в WO 2007/147899. Они действуют как пролекарство, высвобождая ДГК в организме после гидролиза.
В настоящем изобретении термин "энантиомеры" относится к оптическим изомерным соединениям, которые имеют идентичные молекулярные формулы, но которые отличаются своей пространственной конфигурацией и которые представляют собой не накладывающиеся друг на друга зеркальные отображения. Термин "диастереоизомеры" относятся к изомерам, которые не являются зеркальными отображениями друг друга.
В соответствии с настоящим изобретением "рацемическая смесь" представляет собой смесь равных соотношений левовращающих и правовращающих энантиомеров хиральной молекулы.
В настоящем изобретении термин "фармацевтически приемлемый" или "приемлемый в отношении фармацевтики" относится к тому, что пригодно для применения при получении фармацевтической композиции, как правило, безопасно, нетоксично и не является в биологическом или ином отношении нежелательным, а также приемлемо как для ветеринарного, так и для медицинского фармацевтического применения.
Термин "фармацевтически приемлемые соли" относится к солям, которые являются фармацевтически приемлемыми, как определено в данной заявке, и которые обладают желаемой фармакологической активностью родительского соединения. Такие соли включают:
(1) соли присоединения кислоты, образованные с минеральными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или образованные с органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталинсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, пара-толуолсульфоновая кислота, триметилуксусная кислота, трифторуксусная кислота и тому подобное; или
(2) соли, образованные, когда протон кислоты, присутствующей в родительском соединении, либо замещается ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо объединяется с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и тому подобное. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
Предпочтительными фармацевтически приемлемыми солями являются соли, образованные из соляной кислоты, трифторуксусной кислоты, дибензоил-L-винной кислоты и фосфорной кислоты.
Следует понимать, что любые ссылки на фармацевтически приемлемые соли включают формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), как определено в данной заявке, одной и той же соли присоединения кислоты.
Авторы изобретения неожиданно обнаружили, что можно получить композиции, включающие эфир ДГК, для парентерального введения, используя сочетание двух типов сурфактантов, полиоксиэтиленовый эфир жирной кислоты и производное фосфолипида.
Настоящее изобретение, таким образом, относится к фармацевтической композиции для парентерального введения, включающей субмикронные частицы сложного эфира докозагексаеновой кислоты, диспергированные в водной фазе, с использованием смеси по меньшей мере двух сурфактантов, выбранных из а) по меньшей мере одного полиоксиэтиленового эфира жирной кислоты и b) по меньшей мере одного производного фосфолипида.
В соответствии с одной формой осуществления изобретения композиция содержит только два типа сурфактантов а) и b) в качестве сурфактанта.
Сложный эфир докозагексаеновой кислоты может быть любого типа. Он может, в частности, представлять собой этиловый эфир или эфир с витамином В, как описано публикации WO 2007/147899.
В одних формах осуществления изобретения он представляет собой никотиновый эфир ДГК, то есть пиридин-3-илметил-цис-4,7,10,13,16,19-докозагексаеновую кислоту, или пантеноловый эфир ДГК, в частности пантеноловый эфир ДГК 2,4-дигидрокси-3,3-диметилбутанамидопропилдокоза-4,7,10,13,16,19-гексаноат, и, более конкретно, D-пантеноловый эфир ДГК, которые особенно трудно включать в препарат для парентерального введения.
В одной форме осуществления изобретения концентрация сложного эфира докозагексаеновой кислоты выше или равна 10 мг/мл, например больше или равна 30 мг/мл.
Первый сурфактант (а) принадлежит к группе полиоксиэтиленовых эфиров жирных кислот. Полиоксиэтиленовые эфиры жирных кислот могут быть получены посредством взаимодействия между жирной кислотой и этиленоксидом или полиэтиленгликолем.
В частности, Полиоксиэтиленовые эфиры жирных кислот в соответствии с изобретением имеют приведенную ниже формулу (1) или (2):
(1) RCOO.(O.CH2CH2)nH
(2) R1COO.(O.CH2CH2)nCOOR2,
где R, R1 и R2 независимо друг от друга представляют собой алкильную или алкенильную группу исходной жирной кислоты и n определяет длину полимерной цепи из оксиэтиленовых структурных звеньев. Например, n равно от 10 до 60, например, от 12 до 20, например, 15.
Жирная кислота может быть насыщенной или ненасыщенной. Она является гидроксилированной. Наиболее распространенные насыщенные жирные кислоты приведены ниже:
|
Соответственно, R, R1 или R2 представляет собой, например, алкильную или алкенильную цепь, например алкил, нормальный или разветвленный, например нормальный, в С3-С23, например, в С11-С23, например, в C15-C21, например, жирная кислота представляет собой длинноцепочечную насыщенную жирную кислоту, то есть имеющую более 16 атомов углерода.
В одной форме осуществления жирная кислота имеет от 12 до 24 атомов углерода, например, от 14 до 22 атомов углерода, например, от 16 до 20 атомов углерода, например, она имеет 18 атомов углерода, например, она представляет собой стеариновую кислоту.
Эфир может представлять собой моно- или диэфир жирной кислоты либо их смесь. В одной форме осуществления изобретения он представляет собой смесь моно- или диэфира жирной кислоты. Например, полиоксиэтиленовый эфир жирной кислоты представляет собой макрогол-15 гидроксистеарат (торговое название: SOLUTOL HS15, производитель: BASF, Ludwigshafen, Germany). Он представляет собой неионный солюбилизирующий агент, по существу, состоящий из моноэфиров и диэфиров 12-гидроксистеариновой кислоты и макроголов, полученных путем этоксилирования 12-гидроксистеариновой кислоты. Число молей этиленоксида, взаимодействующих с одним молем 12-гидроксистеариновой кислоты, равно 15. Он находится в форме желтоватой восковой массы, очень хорошо растворимой в воде.
В частности, полиоксиэтиленовые эфиры жирных кислот, подходящие для применения в объеме настоящего изобретения, являются неионными сурфактантами.
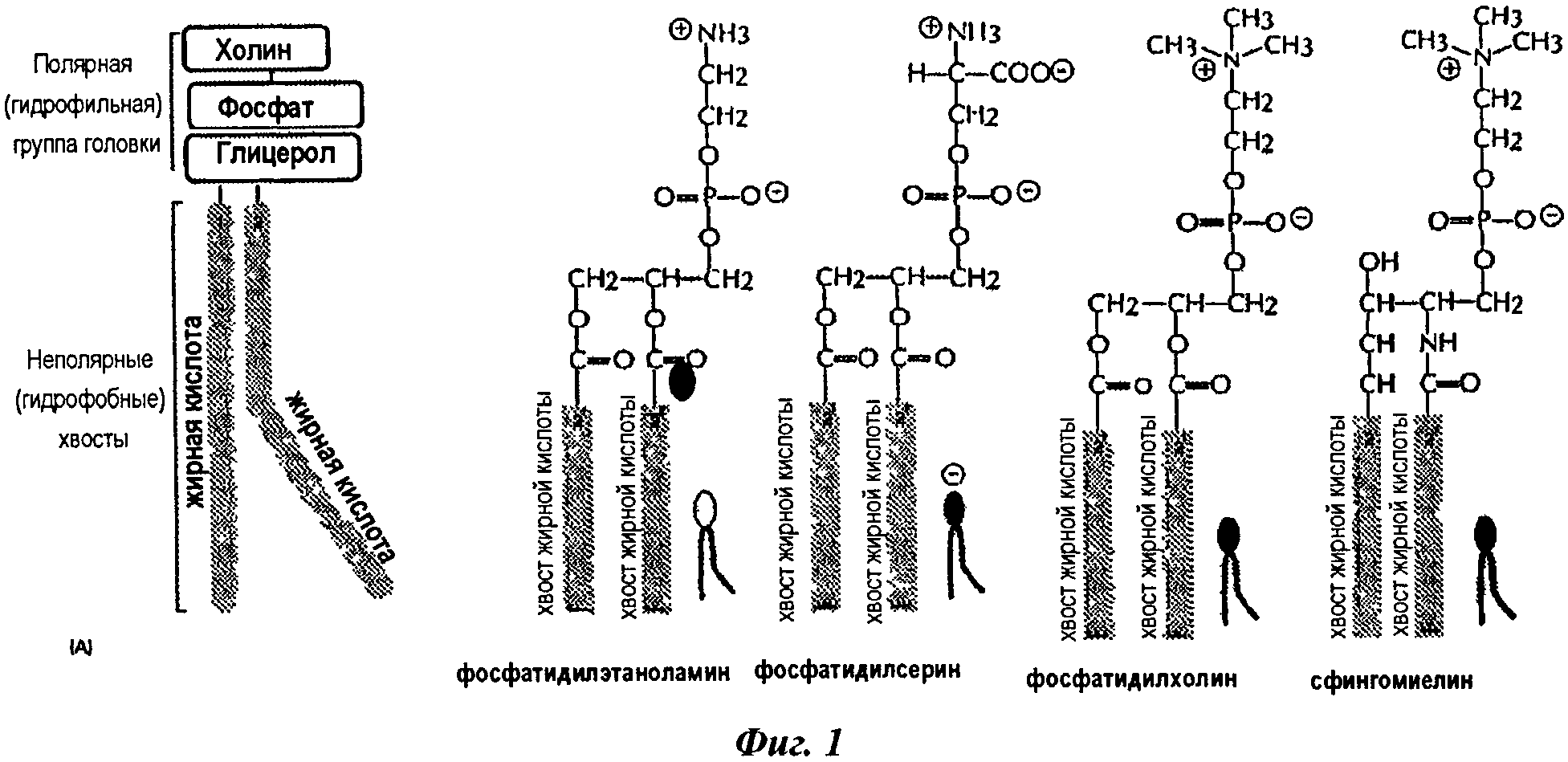
Второй сурфактант (b) принадлежит к группе производных фосфолипидов: он может, таким образом, состоять из лецитинов натурального происхождения, таких как, например, лецитины сои или куриного яйца, фосфолипидов натурального происхождения, таких как, например, фосфолипиды сои или куриного яйца, или синтетических фосфолипидов, или их смеси. Например, он может состоять из нейтральных фосфолипидов, таких как фосфатидилхолины, такие как, например, 1,2-димиристоилфосфатидилхолин или 1-пальмитоил-2-олеоилфосфатидилхолин, и фосфатидилэтаноламины, например фосфатидилхолинов; отрицательно заряженных фосфолипидов, таких как фосфатидилглицерины, такие как, например, 1,2-димиристоилфосфатидилглицерин, фосфатидилсерины, фосфатидилинозиты и фосфатидные кислоты, например фосфатидилглицеринов; или их смесей. Например, он может состоять из нейтрального фосфолипида, такого как фосфатидилхолин, либо он может состоять из смеси нейтрального фосфолипида и отрицательно заряженных фосфолипидов, например 1-пальмитоил-2-олеоилфосфатидилхолина и 1,2-димиристоилфосфатидилглицерина.
В смеси нейтрального фосфолипида и отрицательно заряженного фосфолипида массовый процент отрицательно заряженных фосфолипидов по отношению к суммарной массе композиции смеси составляет менее 10%, от 1% до 5%, например, равно 3%.
Он может также состоять из смеси лецитина натурального происхождения с отрицательно заряженным фосфолипидом, в частности лецитина куриного яйца с 1,2-димиристоилфосфатидилглицерином.
Массовое отношение сурфактант (а): сурфактант (b) может составлять от 1:3 до 3:1, например, оно равно 1:1.
Производные фосфолипидов имеют общую структуру, показанную на фиг.1.
В одной форме осуществления изобретения производное фосфолипида не содержит соевого лецитина или соевых фосфолипидов.
В одной форме осуществления субмикронные частицы представляют собой субмикронные частицы, такие как смешанные мицеллы или везикулы, либо гибриды мицеллярных или везикулярных структур.
Смешанная мицелла в соответствии с изобретением представляет собой мицеллу, например агрегат, состоящий из смеси двух различных типов сурфактантов (а) и (b), где гидрофильная полярная головка молекул сурфактантов расположена по направлению к водной фазе, а гидрофобная цепь направлена наружу, во взаимодействии со сложным эфиром ДГК.
Везикула в соответствии с изобретением представляет собой структуру, в которой сурфактанты организованы в соответствии с бислойной конфигурацией, идентичной той, которая находится в клеточных мембранах. Эти сурфактанты окружают вакуоль или водную полость.
Гибрид мицеллярной и везикулярной структур в соответствии с изобретением представляет собой промежуточную структуру между смешанной мицеллой и везикулой, необязательно при существовании указанной вакуоли.
Таким образом, например, композиция в соответствии с изобретением представляет собой дисперсию смешанных мицелл или везикул, либо гибриды мицеллярной и везикулярной структур. Например, эти частицы проявляют поверхности плоского излома под электронным микроскопом после криоскалывания.
В соответствии с одной формой осуществления настоящего изобретения композиция в соответствии с изобретением не находится в форме эмульсии.
В одной форме осуществления настоящего изобретения субмикронные частицы имеют средний размер <100 нм, например от 25 до 70 нм, например, с полидисперсностью <0,5 (размер и полидисперсность определяют с помощью спектроскопии по фотонной корреляции на приборе фирмы Malvern серии Zetasizer).
Кроме вышеописанных субмикронных частиц, композиция в соответствии с изобретением может также необязательно содержать:
- антиоксидантные агенты, защищающие сложный эфир ДГК, в частности никотиновый эфир или пантеноловый эфир ДГК, и, в частности, D-пантеноловый сложный эфир ДГК, от окисления кислородом, растворенным в композиции. Неограничивающие примеры таких агентов включают: аскорбиновую кислоту и ее производные, соединения, высвобождающие диоксид серы, такие как метабисульфит натрия, пропилгаллат, бутилгидрокситолуол, бутилгидроксианизол, D,L-α-токоферол, производные этилендиаминтетрауксусной кислоты и их комбинации. Их содержание составляет от 0,01% до 1% (масс./об.), более конкретно от 0,01% до 0,50% (масс./об.). Действие антиоксидантных агентов дополнено соответствующим использованием инертных газов, таких как азот или аргон, во время получения и упаковки композиций для инъекций;
- агенты, регулирующие рН. Эти агенты известны специалистам в данной области техники и включают минеральные или органические кислоты и основания, а также буферные системы. Их использование дает возможность установить рН композиции в соответствии с изобретением до значения от рН=4 до рН=9, совместимого с парентеральным введением. Этот агент может, таким образом, состоять из аскорбиновой кислоты;
- агенты для регуляции осмолярности композиции в соответствии с изобретением, чтобы гарантировать ее изотоничность с кровью. Эти агенты представляют собой, например, нейтральные молекулы, такие как углеводы, например, необязательно восстановленные моносахариды [например, глюкозу или маннит, в концентрации ≤5% (масс./об.)] или дисахариды [например, сахарозу в концентрации ≤10% (масс./об.)].
- воду для инъекций в качестве дисперсионной среды, например 5% раствор глюкозы или 0,9% раствор хлорида натрия.
Композиции в соответствии с изобретением находятся в форме водных дисперсий, готовых для введения, или в форме лиофилизированных дисперсий, которые восстанавливают непосредственно перед применением водой для инъекций перед введением.
В неограничивающем примере для концентрации 30 нг/мл - или 3% (масс./об.) - никотинового эфира ДГК концентрации SOLUTOL HS15 и производного фосфолипида составляют от 2,5 до 5% (масс./об.) и от 0 до 10% (масс./об.)., соответственно. Предпочтительно будет использоваться композиция с 5% (масс./об.) SOLUTOL HS15 и 5% (масс./об.) производного фосфолипида.
Препараты, приведенные ниже в таблице 1, иллюстрируют настоящее изобретение. Их можно готовить, используя первый способ, описанный в данной заявке ниже.
|
Настоящее изобретение также относится к способу получения композиции в соответствии с настоящим изобретением, включающему приведенные ниже стадии:
- диспергирование сложного эфира ДГК, в частности никотинового эфира ДГК или пантенолового эфира ДГК, в частности пантенолового моноэфира ДГК, имеющего формулу А или формулу В, производного(производных) фосфолипида и полиоксиэтиленового эфира жирной кислоты, например SOLUTOL HS15, в водном растворе для парентерального введения, например в 5% растворе глюкозы, при перемешивании, например, магнитной или лопастной мешалкой, например, примерно при 700 об/мин, до получения гомогенной, но мутной дисперсии,
- гомогенизацию полученной дисперсии, например, с использованием роторной/статорной турбины (например, типа Labortechnik Т25 (IKA) или эквивалентную), например, примерно при 13500 об/мин, а затем гомогенизатора высокого давления (например, типа EMULSIFLEX С-5 (AVESTIN) или эквивалентный), например, при давлении от 1300 до 1600 бар,
- стерилизацию полученной коллоидной композиции, например, путем пропускания через 0,2 мкм фильтр для стерилизации, такой как фильтр типа MILLIPORE DURAPORE® или эквивалентный.
Этот способ может, кроме того, включать дополнительную стадию, состоящую в заполнении стерильного фильтрата в асептической атмосфере в чистые и предварительно стерилизованные первичные упаковочные материалы.
Эта первичная упаковка представляет собой, например, либо запаянную ампулу, либо флакон, герметично закрытый эластомерной пробкой и обжимающей крышкой, либо предварительно наполненный шприц, готовый для введения.
При альтернативном способе оба сурфактанта (а) и (b) можно предварительно совместно гомогенизировать в водном растворе для парентерального введения, таком как 5% раствор глюкозы, перед добавлением сложного эфира ДГК, в частности никотинового эфира ДГК или пантенолового эфира ДГК, в частности пантенолового моноэфира ДГК, имеющего формулу А или формулу В, и конечной гомогенизацией.
Еще при одном альтернативном способе сурфактант (а) и сложный эфир ДГК гомогенизируют перед добавлением сурфактанта (b) с последующей гомогенизацией всей смеси. Затем добавляют растворитель, например смесь спирт/вода, например этанол/вода, например, 15,8:1 об./об. соответственно, и гомогенизацию продолжают. Затем растворитель удаляют путем вакуумной сушки. Затем полученный комплекс разводят в 5% растворе глюкозы. Полученную дисперсию необязательно гомогенизируют, например, используя гомогенизатор высокого давления.
Полученный препарат стерилизуют путем пропускания через 0,22 мкм фильтр, как описано выше.
Любые антиоксидантные агенты, рН-регулирующие агенты и/или изотонические агенты растворяют в водной фазе либо до, либо после гомогенизации.
В одной форме осуществления фармацевтическая композиция в соответствии с изобретением предназначена для внутривенного, внутриартериального, внутрисердечного, подкожного, внутрикожного, внутримышечного, интраарахноидального, подоболочечного, внутрибрюшинного, внутриглазного, интравентрикулярного, интраперикардиального, интрадурального или внутрисуставного введения.
Как общее правило, композиции в соответствии с изобретением вводят внутривенно, как таковые или после разведения в физиологически приемлемых растворах, таких как 5% раствор глюкозы или 0,9% раствор хлорида натрия.
Эти композиции можно также вводить посредством внутриартериального, внутрисердечного, подкожного, внутрикожного, внутримышечного или интраарахноидального пути.
Настоящее изобретение также относится к фармацевтической композиции в соответствии с изобретением для применения в качестве лекарственного средства.
Это лекарственное средство предназначено для предупреждения и/или лечения сердечно-сосудистых заболеваний, например, выбранных из наджелудочковой и/или желудочковой аритмии, тахикардии и/или фибрилляции, например фибрилляции предсердий; для предупреждения и/или лечения заболеваний, обусловленных нарушениями электрической проводимости клеток миокарда; для предупреждения и/или лечения множественных факторов риска сердечно-сосудистых заболеваний, например, выбранных из гипертриглицеридемии, гиперхолестеринемии, гиперлипидемии, дислипидемии, например смешанной дислипидемии, артериального и венозного тромбоза, индуцированного свертыванием крови и/или гиперактивностью фактора агрегации тромбоцитов II (тромбина) и/или артериальной гипертензией; для первичного или вторичного для предупреждения и/или лечения сердечно-сосудистых заболеваний, являющихся следствием наджелудочковой и/или желудочковой аритмии, тахикардии, фибрилляции и/или нарушений электрической проводимости, индуцированных инфарктом миокарда, преимущественно внезапной смерти; и/или для послеинфарктного лечения.
Изобретение будет более понятно в свете нижеследующих графических материалов и тестов на фибрилляции предсердий:
На фиг.1 представлены общие структуры производных фосфолипидов.
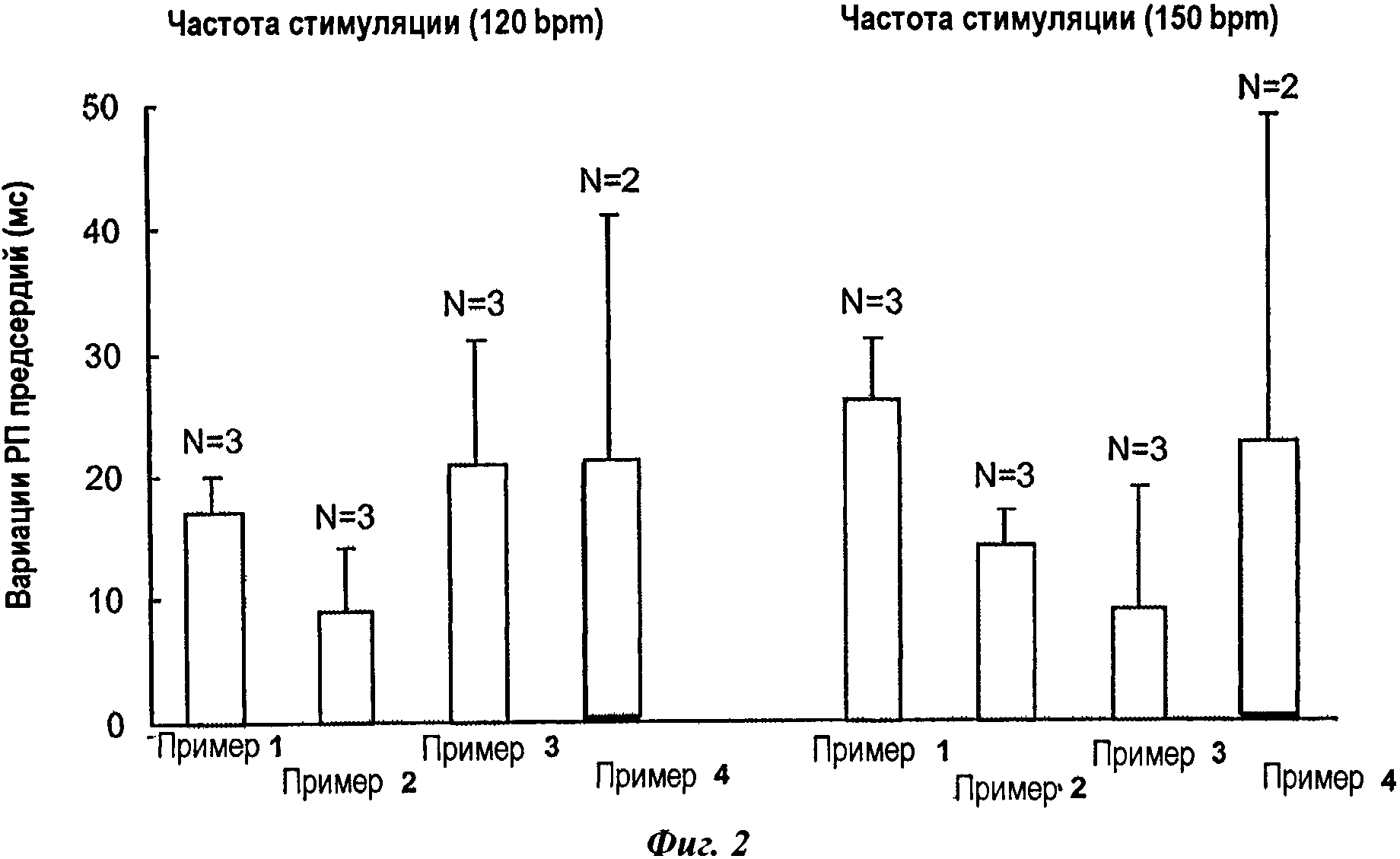
На фиг.2 представлены результаты измерений рефракторных периодов предсердий у анестезированных свиней после введения композиций в соответствии с изобретением (болюс 10 мг/кг никотинового эфира ДГК + инфузия 10 мг/мг никотинового эфира ДГК в течение 40 минут) при частоте стимуляции 120 bpm (ударов в минуту) и 150 bpm.
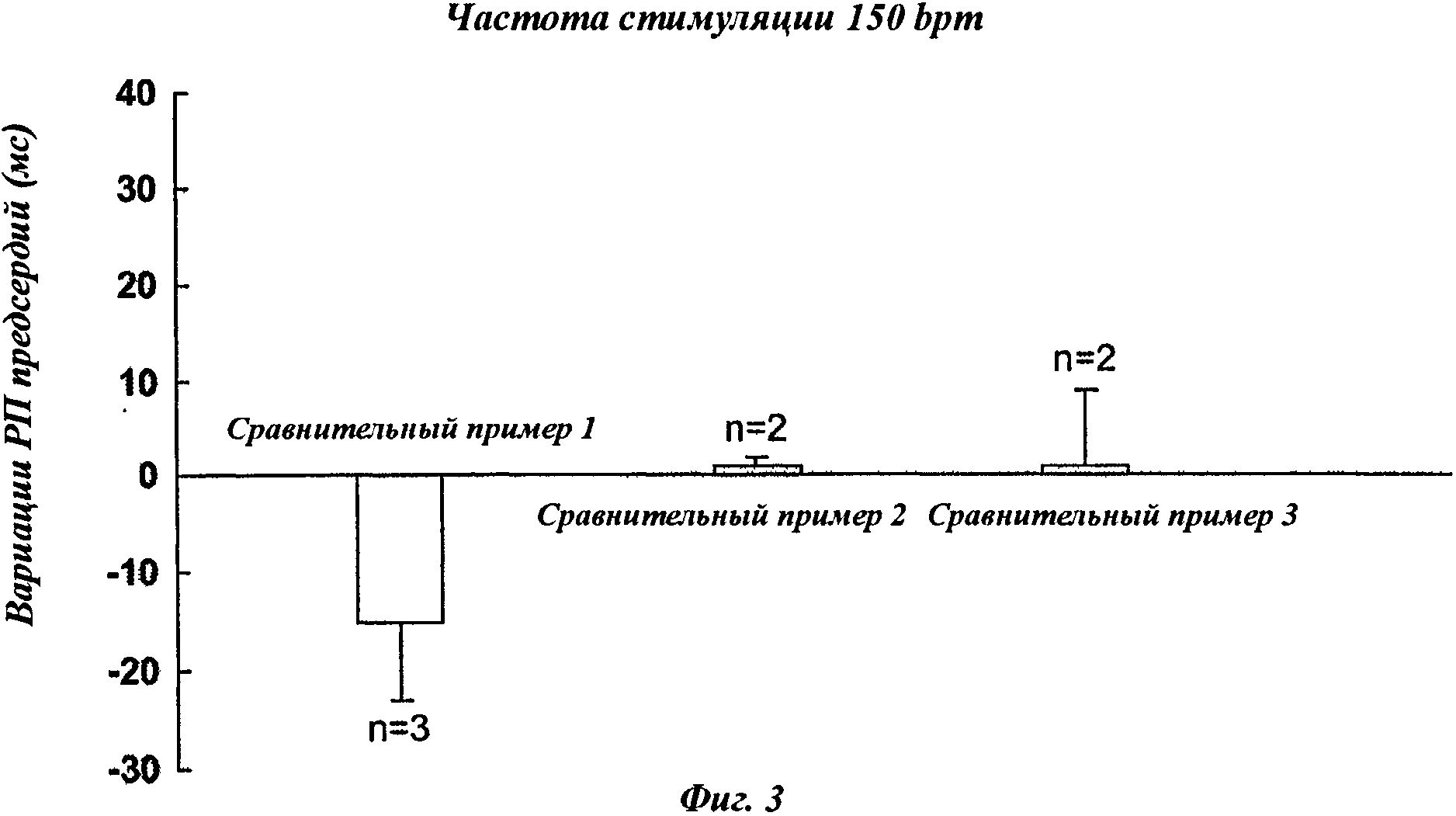
На фиг.3 представлены результаты измерений рефракторных периодов предсердий у анестезированных свиней после введения сравнительных композиций (сравнительных примеров) (болюс 10 мг/кг никотинового эфира ДГК + инфузия 10 мг/мг никотинового эфира ДГК в течение 40 минут) при частоте стимуляции 150 bpm.
Пример 1
Например, активность композиций в соответствии с изобретением, приведенных в таблице 1, при лечении фибрилляции предсердий отлично продемонстрирована фармакологическим тестом, приведенным ниже.
Самцов свиней породы Ландрас (22-25 кг) анестезируют изофлураном (1,5-3%). Затем животных интубируют и вентилируют для поддержания артериальных объемов газа в физиологических пределах. Левую торакотомию проводят в четвертом межреберном промежутке. Артерию и маммарную вену изолируют, катетеры вводят в вену для введения тестируемых препаратов и в артерию для измерения артериального давления и сбора образцов крови. Проводят тампонаду перикардия. Электрокардиограмму (ЭКГ) предсердий записывают непрерывно, три электрода помещают на эпикардий и зашивают. В связи с этим ЭКГ дает информацию только на стадии предсердий. Два биполярных электрода также помещают на левое ушко сердца: их используют для электрической стимуляции ушка сердца при данной частоте.
Экспериментальный протокол:
После достаточного периода восстановления можно начинать определение рефракторного периода предсердий в контролируемых условиях. Непрерывную серию стимулов (S1) начинают при очень низком напряжении (0,1 В), недостаточном для стимуляции сердца. Напряжение постепенно увеличивают (через интервалы 0,1 В), чтобы определить порог стимуляции для мониторинга применяемой частоты. Этот порог определяют при каждой частоте стимуляции. Существует 4 частоты стимуляции, 90, 120, 150 и 180 bpm. Если свинья имеет базовую частоту сердечных сокращений более 90 bpm, первую частоту стимуляции не применяют. Подобным образом, если базовая частота является низкой (<90 bpm), конечная тестируемая частота стимуляции (180 bpm) не всегда стимулирует сердце. Как только порог определен, напряжение стимуляции S1 (серии из 10 стимулов) равно двукратному порогу, и напряжение экстрастимула S2 равно 4-кратному порогу. Каждые 10 S1 экстрастимул S2 запускается во время рефракторного периода (то есть 80 мс после конечного S1, где ожидаемый рефракторный период составляет по меньшей мере 100 мс), и каждые 10 стимулов S1 экстрастимул отделен от конечного S1 (приращение 5 мс) до тех пор, пока он не вызовет сам удар. Самый длительный интервал, не индуцирующий ответ на S2, является рефракторным периодом предсердий. Рефракторный период оценивают 3 раза в последовательности (выражение среднего), при 4 различных частотах стимуляции, то есть 12 измерений. Тестируемый препарат вводят в форме болюса и инфузии в течение 40 мин (время, необходимое, чтобы оценить все рефракторные периоды). Пороги повторно не вычисляют, рефракторные периоды измеряют сразу (через 5 мин после окончания болюса). Если препарат активен, рефракторные периоды должны увеличиваться по сравнению с контрольной фазой.
Следует отметить, что только композиции в соответствии с изобретением положительно отвечают на данный фармакологический тест, как проиллюстрировано фиг.2 и 3.
Сравнительными примерами являются препараты, очень сходные с препаратами в соответствии с изобретением, как указано в таблице 2 ниже, но они проявляют низкую или отрицательную фармакологическую активность.
|
Таким образом, отмечено, что отсутствие одного из сурфактантов ((а) или (b), соответственно, сравнительный пример 3 и сравнительный пример 1) в композиции для парентерального введения, содержащей никотиновый эфир ДГК, или использование иного сурфактанта, чем а) или b) (сравнительный пример 2) не дает возможность получить желаемую активность.
Пример 2
Препарат для инъекций, включающий пантеноловый эфир ДГК, имеющий формулу В
РОРС=1-пальмитоил-2-олеоилфосфатидилхолин
EPCS=фосфатидилхолин куриного яйца
DMPG=1,2-димиристоилфосфатидилглицерин
1 - Способ получения путем комплексообразования в присутствии растворителя
Solutol HS 15 и пантеноловый эфир ДГК, имеющий формулу В, смешивают при температуре 50°С до гомогенизации. Затем добавляют фосфолипиды и смесь помещают в условия магнитного перемешивания при температуре 50°С в течение времени от 1 часа до 1 часа 30 мин в инертной атмосфере, например в атмосфере азота. Этанол и воду, например смесь этанол/вода [15,8:1 об./об.], добавляют к смеси, и перемешивание продолжают в инертной атмосфере до тех пор, пока липиды полностью не диспергируются. Затем смесь обрабатывают в течение 30 мин ультразвуком для получения полной дисперсии фосфолипидов. Полученную в результате дисперсию помещают в вакуум по меньшей мере на 24 ч для удаления растворителя и воды.
Комплекс разводят в 5% растворе глюкозы. Если дисперсия является непрозрачной, ее гомогенизируют гомогенизатором высокого давления, пока дисперсия не станет прозрачной и чистой. Дисперсию стерилизуют на фильтре PVDF 0,22 мкм.
2 - Способ получения путем смешивания пантенолового эфира ДГК с дисперсией фосфолипидов и Solutol HS 15
Фосфолипиды, Solutol HS 15 и 5% раствор глюкозы взвешивают, и смесь перемешивают магнитной мешалкой и нагревают до 60°С до получения дисперсии. Затем эту дисперсию подвергают циклам гомогенизатора высокого давления до получения чистой и/или прозрачной дисперсии.
Затем пантеноловый эфир ДГК, имеющий формулу В, добавляют к дисперсии, и смесь гомогенизируют в течение от 1 до 2 мин при 13500 об/мин. Дисперсию подвергают циклам гомогенизатора высокого давления до получения чистой и/или прозрачной дисперсии, например не более 5 циклов. Дисперсию фильтруют через фильтр PVDF 0,22 мкм.
3 - Способ получения путем смешивания пантенолового эфира ДГК, фосфолипидов и Solutol HS 15
Все ингредиенты взвешивают в колбе, добавляют магнитную мешалку и колбу герметично закрывают в инертной атмосфере, например в атмосфере азота. Смесь перемешивают в течение 30 мин или до получения гомогенной дисперсии. Дисперсию гомогенизируют при 13500 об/мин в течение от 1 до 2 минут и обрабатывают гомогенизатором высокого давления до получения прозрачной и/или чистой дисперсии или постоянного коэффициента пропускания, например после 6 циклов. Препараты фильтруют на фильтрах 0,22 мкм и определяют визуальный аспект, внешний вид под микроскопом, рН, коэффициент пропускания и размер частиц при ТО и после хранения в течение 2 недель при 4°С, 25°С и 40°С.
Препарат был разработан со следующими композициями, приведенными ниже в таблице 3:
|
Приведенные выше примеры использовали, чтобы оценить, можно ли комбинировать пантеноловый эфир ДГК, например пантеноловый эфир, имеющий формулу В, непосредственно с эксципиентами с образованием комплекса, который можно затем разводить 5% раствором глюкозы с получением дисперсии, пригодной для инъекции.
Композицию, полученную в соответствии с каждым из 3 способов получения, анализируют.
Визуальный аспект и внешний вид препарата наблюдают под микроскопом, рН, коэффициент пропускания и размер частиц измеряют при ТО и после хранения в течение от 2 до 4 недель при 4, 25 и 40°С.
Вывод из этих наблюдений состоит в том, что композиции, содержащие 30 мг пантенолового эфира ДГК, имеющего формулу В, на мл Solutol HS 15 и РОРС или EPCS с DPMG и 5% раствор глюкозы, могут быть получены в соответствии с тремя описанными способами. рН оставался стабильным в течение двух недель, размер частиц оставался меньшим чем 100 нм. Пик распада не наблюдали на хроматограммах ВЭЖХ.