Результат интеллектуальной деятельности: ГИДРОГЕЛЬ НА ОСНОВЕ КОМПЛЕКСНОЙ СОЛИ ХИТОЗАНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к производству фармацевтических и косметических средств, а именно к производству гидрогеля с выраженной биологической активностью, который может быть использован в качестве лечебно-профилактического препарата в медицине, ветеринарии, косметологии, средств бытовой химии, а также мягкой биооболочки для упаковки веществ в пищевой, химической технологиях, биотехнологии, сельского хозяйства и др.
Известно, что аминополисахарид хитозан в разных морфологических формах (порошок, раствор, плёнка, капсула, гель, волокно) проявляет широкий спектр биологических активностей, востребованных при создании лечебно-профилактических препаратов различного назначения (Ravi Kumar M.N.V., Muzzarelli R.A.A., Muzzarelli C., Domb A.J. Chitosan сhemistry and рharmaceutical рerspectives // Chem. Rev. 2004. V.104. P.6017-6084; Хитин и хитозан: Получение, свойства и применение / Под ред. Скрябина К.Г., Вихоревой Г.А,, Варламова В.П. М.: Наука. 2002. 368 с.; Современные перспективы в исследовании хитина и хитозана: Материалы XII-й Международ. конф. Пермь: Изд-во Центр «Биоинженерия» РАН. 2014. 454 с.). При этом наилучшими биологическими свойствами обладают низкомолекулярные образцы хитозана с молекулярной массой менее 40 кДа.
В настоящее время наиболее перспективной лекарственной формой на основе хитозана является гидрогель, обеспечивающий конгруэнтное покрытие раневой поверхности. Кроме того, использование гидрогелей поддерживает нормальное осмотическое давление клеток, что, в свою очередь, предохраняет рану от чрезмерного высыхания и, с другой стороны, не препятствует нормальному газообмену. Гидрогелевые матрицы могут также использоваться в качестве носителя лекарственных средств для адресной доставки препарата и его пролонгированного высвобождения (см. патент РФ №2432954).
Однако при создании гидрогелей на основе хитозана на сегодняшний день существует много проблем, которые затрудняют проявлять в полной мере биологические свойства полисахаридсодержащей композиции. Прежде всего, получение геля из хитозана осложнено нерастворимостью последнего в воде и тем, что он не проявляет способности к гелеобразованию без бифункциональных (сшивающих) реагентов, например, токсичного глутарового и других диальдегидов (Хитозан / Под ред. Скрябина К.Г., Михайлова С.Н., Варламова В.П. М.: Центр «Биоинженерия» РАН. 2013. С.271-306, патент №2408618). Первое затруднение преодолевается при растворении хитозана в водных растворах неорганических или органических кислот в результате протонирования аминогрупп хитозана и образования полисоли (Pillai C.K.S., Paul W., Chandra P.Sharma. Chitin and chitosan polymers: chemistry, solubility and fiber formation // Prog. In Polym. Sci. 2009. V.34. P.641-678.). Второе – в использовании иных подходов к созданию гидрогелей, включающих хитозан, либо его водорастворимые производные, например соли органических кислот. Используются различные варианты: ухудшение качества растворителя заменой воды на водно-спиртовые смеси или введение второго полимера, например поливинилпирролидона (см. патент US №5420197; RU №2270646), полиэтиленгликоля и/или поливинилового спирта (см. патент №2494746).
Общим недостатком способа использования в качестве дополнительного полимера приведенных выше синтетических полимеров является необходимый контроль за концентрацией остаточных мономеров и низкомолекулярных олигомеров (Вышемирская Л.Д., Долошицский С.Л. и др. Изучение токсичности и отдаленных последствий действия поливинилового спирта марки 18/11. Гиг.Санит. 1988 (9) 83-4; Децина А.Н. «Теория мягких косметических воздействий. Современная косметология». Новосибирск. 2001. 508 с.).
Известен способ получения хитозансодержащего гидрогеля. Способ предусматривает смешивание двух растворов, дегазацию смеси и её полимеризацию. При этом для получения первого раствора к хитозану или его производным добавляют дистиллированную воду и этилендиамин-N,N,N',N'-тетрауксусную кислоту до рН 4.0 и нагревают до растворения, далее вводят щёлочь до выпадения осадка, который отделяют, промывают дистиллированной водой до рН 6.2, снова добавляют кислоту до растворения, потом вводят щёлочь до рН 6.2 и снова кислоту до рН 5.6. После этого центрифугируют, разбавляют водой, дегазируют первый раствор под вакуумом. Для получения второго раствора к N,N,N',N'-тетраметилэтилендиамину добавляют дистиллированную воду, кислоту и персульфат натрия или калия (см. патент РФ № 2346442).
Недостатком способа является многокомпонентность, многостадийность и трудоёмкость процесса изготовления гидрогеля, использование агрессивных реагентов HCl, CH3COOH, NaOH и KOH.
Известен гидрогель карбоксиалкиламида хитозана, его приготовление и применение в косметологии и дерматологии (см. патент РФ №2476201). Согласно способу гидрогель карбоксиламида хитозана, обладающий pH, близким к уровню pH кожи и составляющий от 6.5 до 7.2, включает от 40 до 90% по молям групп N-карбоксиалкиламида D-глюкозамина с количеством алкильных фрагментов от 1 до 8, от 60 до 10% по молям протонированных групп D-глюкозамина и от 5 до 15% по молям групп N-ацетил-D-глюкозамина. Способ изготовления данного гидрогеля включает приготовление подкисленного раствора хитозана со степенью деацетилирования от 85 до 95%, химическую реакцию полученной аддитивной соли хитозана с кислотой в водном растворе двухосновной органической кислоты и корректировку pH полученного раствора.
Недостатком способа получения данного гидрогеля является совмещение нескольких трудно контролируемых процессов, а именно деструкции исходного образца хитозана под действием перекиси водорода и реакции ацилирования под действием ангидридов кислот. В данной технологии макромолекулы конечного продукта реакции приобретают кислотную (карбоксильную) группу и полимерные цепи, содержащие разноимённо заряженные группы, могут терять полностью или частично свой заряд. Потеря поликатионного характера макромолекул хитозана приводит к значительному уменьшению, а возможно, и потере биологической активности изготовленного таким способом геля. Данный способ многостадиен, длителен, требует точных расчётов компонентов и корректировки рН.
Известен способ получения модифицированной хитозановой эмульсии и продуктов на её основе (см. патент РФ №2223279). Способ включает стадию приготовления кислого водного раствора хитозана, удаление не растворившихся частиц хитозана фильтрованием или осаждением и проведение модификации хитозана, причем кислый водный раствор хитозана после удаления не растворившихся частиц хитозана диспергируют в присутствии гидрофобного поверхностно-активного вещества и ацетона путем перемешивания со скоростью не ниже 1000 об/мин. Полученную эмульсию модифицируют ангидридом органической кислоты или дихлорангидридом дикарбоновой кислоты при дополнительном перемешивании при той же скорости, получая при этом хитозановую эмульсию с размером наногранул шарообразной формы не более 100 нм. С использованием модифицированной хитозановой эмульсии получают хитозановый гель и хитозановую суспензию. Изобретение позволяет получить из хитозановой суспензии гели и эмульсии с размером наногранул шарообразной формы не более 100 нм.
Недостатком способа является использование большого числа реагентов, что экономически нецелесообразно, поскольку первоначальным этапом получения хитозанового гидрогеля является многостадийный процесс получения модифицированной хитозановой эмульсии.
Известен препарат, ускоряющий ранозаживление и обладающий антимикробной активностью, включающий действующее вещество и основу. В качестве активного вещества используются низкомолекулярные хитозаны, а в качестве основы – метилцеллюлозу (МЦ-100) и воду, при этом низкомолекулярный хитозан имеет молекулярную массу от 5 до 72 кДа, степень деацетилирования от 20 до 89% и содержится в концентрации от 0.05 до 2.0%. Препарат дополнительно может содержать глицерин (10-20%) и консервант нипагин (0.1-0.3%) (см. патент РФ №2440122).
Недостатком препарата является использование в качестве одного из основных компонентов метилцеллюлозы. Известно, что метилцеллюлоза является загустителем и образует не сетку геля, а вязкую студнеобразную систему при температуре Т 50°С и выше (Шиповская А.Б. Физико-химическая модификация ацетатов целлюлозы парами растворителей, образующих с полимером лиотропную жидкокристаллическую фазу. Дис. … канд. хим. наук. Саратов: Саратовск. гос. ун-т. 1996. 152 с.). При хранении такой студнеобразной системы при комнатной или пониженной температуре (в условиях холодильника) происходит интенсивное синергетическое отделение растворителя, причем, чем ниже концентрация метилцеллюлозы, тем более полно проходит синерезис. Данная особенность водных растворов метилцеллюлозы, в свою очередь, может привести к нестабильности заявляемого препарата. Нежелательно и включение в состав препарата консерванта нипагина (метилпарабена) – мало растворимого в воде вещества (до 0.25% при Т 20°С) и действующего лишь на грамположительные бактерии. Кроме того, нипагин может вызывать аллергические реакции, например высыпания на коже. Задача получения гидрогелей в способе получения препарата не ставилась.
Известны водорастворимые кремнийорганические производные полиолов и гидрогели на их основе, которые могут найти применение как в качестве самостоятельных средств, обладающих транскутанной, противовоспалительной, ранозаживляющей и регенерирующей активностью, так и основы фармацевтических композиций для местного применения (см. патент РФ №2382046, патент РФ №2255939). Гелеобразование проводят при температуре 80-95°С в присутствии водного раствора HCl (рН 1.0) и, дополнительно, фторида калия, хлорида кальция, хлорида натрия. Гидрогели на основе кремнийорганических производных полиолов содержат воду и гелеобразующую добавку. В качестве кремнийорганических производных полиолов гидрогели содержат, по крайней мере, одно кремнийорганическое производное, состав, которого в избытке полиола соответствует формуле
(CH3)4-nSi(O-R-OH)n · x HO-R-OH,
где R = –CH2–CH(OH)–CH2–, –CH2–СH(СН3)–, (–CH2–СН2–О–)mCH2–СН2–
0.5 ≤ x ≤ 2.9; n = 2-4; m = 7.7 или 12.0;
при следующем соотношении компонентов, мас.%:
кремнийорганические производные полиолов в избытке полиола – 44.95-98.01;
гелеобразующая добавка – 0.01-0.50;
вода – остальное.
Недостатком способа получения этих гидрогелей является проведение процесса гелеобразования при нагревании системы до Т 80-95°С, что требует дополнительных энергетических и экономических затрат.
Известны гидрогели на основе глицеролатов кремния, содержащие хитозан, полученные золь-гель методом (Ларченко Е.Ю., Хонина Т.Г., Шадрина Е.В. и др. Фармакологически активные гидрогели на основе глицеролатов кремния и хитозана // Изв. АН. Сер. химич. 2014. №5. С.1-7; Larchenko E.Yu., Shadrina E.V., Khonina T.G., Chupakhin O.N. New hybrid chitosan-silicone-containing glycerohydrogels // Mendekeev Commun. 2014. V.24. P.201-202). Синтез гидрогелей проводили путем взаимодействия предшественника, синтезированного в избытке глицерина (например, тетраглицеролата кремния в трехмольном избытке глицерина) с водно-кислотными (HCl, СН3СООН) растворами хитозана концентрации 1.5-5.0 мас.% при Т 80°С. Концентрация хитозана в готовом гидрогеле составляла 0.51-1.86 мас.%. Было установлено, что глицеролаты кремния полностью совместимы с хитозаном, фазовое разделение или осаждение при гелеобразовании не наблюдалось. Полученные гидрогели были стабильны при хранении. При диспергировании они легко переходили в мазеподобное состояние и хорошо распределялись на коже и слизистой оболочке. Комплексом фармакологических исследований была доказана безопасность применения этих гидрогелей и эффективность их гемостатического действия.
Недостатком способа получения данных гидрогелей является необходимость проведения гелеобразования в кислой среде и при повышенной температуре (Т = 85-90°С), что может приводить к деструкции хитозана и невоспроизводимости фармакологической активности гидрогелей. Недостатком является также низкая концентрация хитозана в готовом продукте.
Известна антибактериальная композиция на основе хитозана и загустителя, включающая поливиниловый спирт, и/или глицерин, и/или полиэтиленгликоль, и/или поливинилпирролидон, отличающаяся тем, что в качестве антибактериального вещества используют низкомолекулярный водорастворимый хитозан с молекулярной массой в диапазоне от 3.5 до 4.9 кДа в количестве от 0.01 до 10.0 мас.%, загустителя – поливиниловый спирт от 2 до 15 мас.%, и/или глицерин от 10 до 90 мас.%, и/или полиэтиленгликоль от 1 до 20 мас.%, и/или поливинилпирролидон от 10 до 50 мас.%, остальное – вода (см. патент РФ №2494746).
Недостатками данной композиции являются многокомпонентность, включение в нее поливинилового спирта – кристаллизующегося полимера, что может привести к фазовому разделению композиции и, следовательно, к снижению ее антибактериальной активности. Композиция представляет собой водные растворы смесей хитозана с синтетическими биологически не активными высокомолекулярными (поливиниловый спирт, полиэтиленгликоль, поливинилпирролидон) и/или низкомолекулярными веществами (глицерин). Задача получения гидрогелей хитозана в способе не ставилась.
Известен противоожоговый гель для наружного применения, содержащий хитозан, салициловую кислоту, биорегулятор, выделенный из сыворотки крови крупного рогатого скота, представляющий собой фракцию кислых белков в интервале значений рН < 3.0, и воду, взятые в определенном соотношении. Вышеописанный состав обладает выраженной заживляющей активностью (см. патент РФ №2481121).
Недостатком данного геля является трудно контролируемая характеристика биорегулятора, который выделяют из сыворотки крови крупного рогатого скота. Это может влиять на противоожоговое действие геля и увеличивать сроки эпителизации ожоговой раны. Кроме того, содержание в составе геля белкового препарата может вызывать аллергические реакции вплоть до полной непереносимости препарата.
Известен способ лечения онкогинекологических больных и гель для его осуществления, включающий в г/л: тинростим 0.05-0.1, хитозан 30.0-35.0, аскорбиновую кислоту 19-21, воду дистиллированную – остальное (см. патент РФ №2288730). При этом гель используют в послеоперационном периоде дополнительно местно 2 раза в сутки. Кроме применения геля в течение 12-14 дней до оперативного вмешательства и в течение 7-10 дней в послеоперационном периоде системно вводят тинростим в дозе 0.5-1.0 мг 2 раза в день. За счет подобранных параметров доз и продолжительности лечения способ обеспечивает иммуностимулирующее воздействие на фагоцитоз, гуморальный и клеточный иммунитет, эффективно восстанавливая их показатели у онкогинекологических больных при использовании в лечении подобранных доз и продолжительности введения, что позволяет затем сразу проводить курс радио и химиотерапии.
Недостатками заявленного геля является ограничение его использования, в частности для лечения онкогинекологических больных, невозможность достижения необходимого терапевтического эффекта без использования дополнительной медикаментозной терапии – системное введение тинростима в до- и послеоперационный периоды – в течение длительного времени (до 14 дней).
Известна гелеобразная биологически активная композиция для нанесения на кожу, содержащая активнодействующее вещество – гидрохлорид хитозана, дистиллированную воду, органическую кислоту, выбранную из ряда: уксусная, аскорбиновая, гликолиевая, молочная, лимонная, янтарная (см. патент РФ №2535141).
Недостаток данной гелеобразной композиции: она представляет собой концентрированную систему с высоким значением вязкости, в которой реализуется сетка зацеплений флуктуационного характера и сетка ион-ионно–водородных взаимодействий, что сказывается на ее кинетической стабильности, формоустойчивости и определяет сравнительно жесткие условия хранения при Т 4-10°С. Кроме того, применение данной композиции ограниченно нанесением на кожу.
Наиболее близким техническим решением к заявляемому изобретению является способ приготовления геля для лечения ран и ожогов (см. патент РФ №2545893, МПК A61K9/00, A61K31/722, A61K35/56, A61P17/02, опубл. 10.04.2015), включающий растворение хитозана в органической кислоте, соединение его с биологически активным веществом и водой, при этом хитозан растворяют в лимонной или молочной кислоте, в качестве биологически активного вещества используют гидролизат из двустворчатых моллюсков, причём перед введением гидролизата в раствор хитозана добавляют ПЭГ-600 (полиэтиленгликоль) и альгилозу кальция. Гель полужидкий, но не растекающийся при температуре тела в течение длительного времени, хорошо заполняющий раны, адгезирующий к влажной ране и образующий при взаимодействии с экссудатом раны и воздухом эластичное покрытие.
Однако в данном способе получения геля используется высокомолекулярный хитозан (500 КДа), который согласно литературным данным проявляет слабый антибактериальный эффект по сравнению с низкомолекулярным хитозаном и его солями. Кроме того, гелеобразование осуществляется за счет присутствия альгилозы кальция (смесь кальциевой соли альгиновой кислоты с целлюлозой и др. веществами), не обладающей антимикробной, ранозаживляющей, противовоспалительной и др. активностями, а хитозан вводится в небольшом количестве < 0.2 г/дл, что недостаточно для проявления в полной мере биологического действия этого полисахарида. Недостатком данного способа является также использование дорогостоящего биологически активного вещества (гидролизата из двустворчатых моллюсков), получение которого трудно стандартизировать, а также узкий спектр фармакологической активности геля – только ранозаживляющее действие. К тому же данный способ получения геля многокомпонентен и многостадиен. Кроме того, использование ПЭГ-600 и альгилозы кальция для получения фармацевтического препарата для лечения ран не обосновано: ПЭГ-600 может вызывать иммуногенность эритроцитов, а альгилоза кальция, получаемая из бурых водорослей, является БАДом и используется, в основном, как энтеросорбент.
Задачей изобретения является разработка способа получения нового высокоэффективного лечебно-профилактического гидрогеля с широким спектром биологической активности на основе двойной комплексной органо-неорганической соли низкомолекулярного хитозана за счёт введения биологически активного прекурсора – раствора глицеролата кремния в глицерине. При необходимости в прекурсор дополнительно вводят неорганическую соль NaCl или KCl.
Технический результат заключается в упрощении способа за счет уменьшения количества реагентов и стадий получения гидрогеля; повышении биологической активности получаемого гидрогеля в результате синергетического эффекта от использования двойной комплексной соли низкомолекулярного хитозана, фармакопейной кислоты и биологически активного гелеобразователя.
Поставленная задача решается путём создания способа получения гидрогелей на основе двойной комплексной соли гидрохлорид–аскорбат или гидрохлорид–лактат хитозана, воды, кремний-глицерогидрогеля и, дополнительно, неорганической соли NaCl или KCl. Формирование гидрогеля происходит в результате сочетания ионного гелеобразования с золь-гель синтезом. Структура гидрогелей представлена взаимопроникающими полимерными сетками неорганической и органической природы, стабилизированными системой ковалентных сшивок ≡Si−O–Si≡ и сложных ион-ионно–водородных взаимодействий. Ионная связь образуется между протонированной аминогруппой хитозана и кислородом гидроксильной группы аскорбат- или карбоксильной группы лактат аниона, водородная связь – между карбонильным кислородом аниона и гидроксильной группой соседней макромолекулы полисахарида. В результате получаются формоустойчивые, но в то же время мягкие гидрогели лечебно-профилактического назначения.
Указанный технический результат достигается тем, что способ получения гидрогеля включает растворение хитозансодержащего вещества в водном растворе органической кислоты и последующее введение в
раствор гелеобразователя, согласно решению в качестве хитозансодержащего вещества используют гидрохлорид хитозана, в качестве органической кислоты используют аскорбиновую или молочную кислоту, в качестве гелеобразователя используют растворы глицеролата кремния в глицерине при мольном соотношении глицеролат кремния : глицерин 1:2-1:6, причем исходные компоненты взяты в количестве, мас.%:
гидрохлорид хитозана - 1.5-20.0;
аскорбиновая кислота - 1.5-10.0 или молочная кислота - 0.5-2.0;
раствор глицеролата кремния в глицерине - 10.0-60.0;
вода - остальное.
В раствор дополнительно добавляют NaCl или KCl в количестве 0.05-1.5 мас.%.
Гидрогель на основе комплексной соли, содержащий гидрохлорид-аскорбат или гидрохлорид-лактат хитозана, 3.2-35 мас.% глицерина, 0.3-2.9 мас.% кремния и получен вышеописанным способом.
Способ получения гидрогеля включает растворение гидрохлорида хитозана в водном растворе органической кислоты - аскорбиновой или молочной, при этом образуется двойная комплексная соль гидрохлорид-аскорбат или гидрохлорид-лактат хитозана, макромолекулы которой участвуют в ионном гелеобразовании, введение гелеобразователя для протекания золь-гель синтеза и, при необходимости, неорганической соли. Согласно изобретению готовят водный раствор гидрохлорида хитозана концентрации 1.5-20.0 мас.% в аскорбиновой кислоте концентрации 1.5-10.0 мас.% или в молочной кислоте концентрации 0.5-2.0 мас.%, вводят гелеобразователь - раствор глицеролата кремния в глицерине (Si(С3Н7О3)4⋅2(3, 6)C3H8O3) в количестве 10-60 мас.% и, дополнительно, неорганическую соль (NaCl или KCl) в концентрации 0.05-1.5 мас.%. При этом получают гидрогель на основе двойной комплексной соли гидрохлорид-аскорбат или гидрохлорид-лактат хитозана, в котором содержится 3.2-35 мас.% глицерина и 0.3-2.9 мас.% кремния.
При получении заявляемого геля используют образцы низкомолекулярного гидрохлорида хитозана (ЗАО «Биопрогресс», Россия), аскорбиновую кислоту квалификации х.ч. (ЗАО «Химреактив», Россия), 80% молочную кислоту (ЗАО «Ленреактив», Россия), неорганические соли NaCl или KCl квалификации х.ч. (Реахим, Россия) и растворы глицеролата кремния в глицерине (Si(C3H7O3)4⋅2(3, 6)C3H8O3). Смешение компонентов проводят в смесителе, снабженном механическим гомогенизатором, согласно рецептуре. Процесс гелеобразования проводят при комнатной температуре (Т=18-25°С) двумя способами: в объеме, помещая полученную смесь компонентов в тубу на тубофасовочной машине и тонком слое, используя специальную квадратную фильеру размером 5×5 см, получая при этом гелеобразную пленкоподобную структуру толщиной 0.3-1.5 см. Полученный гидрогель в расфасованных полимерных тубах или упаковках для пленочных покрытий (пакеты, грипперы, вакуумная упаковка и т.п.) хранят в статических условиях при температуре 20±2°С в течение трех лет при температуре 4°С - до пяти лет.
Экспериментально установлено, что в результате взаимодействия компонентов - гидрохлорида хитозана, аскорбиновой (молочной) кислоты, воды, глицеролата кремния, глицерина и, при необходимости, NaCl (KCl) - образуется монолитный гидрогель. Продукт стабилен во времени, фазовое разделение отсутствует. При диспергировании гидрогель приобретает мазеподобную консистенцию. Глицерин в составе гидрогеля выполняет роль пластификатора, препятствует синерезису и придает гелю хорошую смазывающую способность.
Присутствие в готовом продукте двойной комплексной соли низкомолекулярного хитозана и кремний-глицерогидрогеля приводит к синергетическому эффекту и значительно расширяет спектр биологического действия гидрогеля по сравнению с их раздельным использованием, т.е. гелеобразной композицией на основе комплексных солей хитозана (см. патент РФ №2535141) и гидрогелями кремнийорганических производных полиолов (см. патент РФ №2382046, патент РФ №2255939). Использование фармакопейных аскорбиновой или молочной кислот обеспечивает образование двойной комплексной соли гидрохлорид–аскорбат хитозана или гидрохлорид–лактат хитозана с высокой биологической активностью. Кроме того, гидрогель на основе гидрохлорид–лактата хитозана может быть использован в косметологии для осветления и лифтинг-эффекта.
Экспериментально установлено, что использование в качестве реагента 1.0 мас.% и менее гидрохлорида хитозана не приводит к достижению требуемой формоустойчивости гидрогеля. При содержании полимера 20 мас.% и более возникают затруднения при перемешивании реагентов и получении однородной гидрогелевой системы.
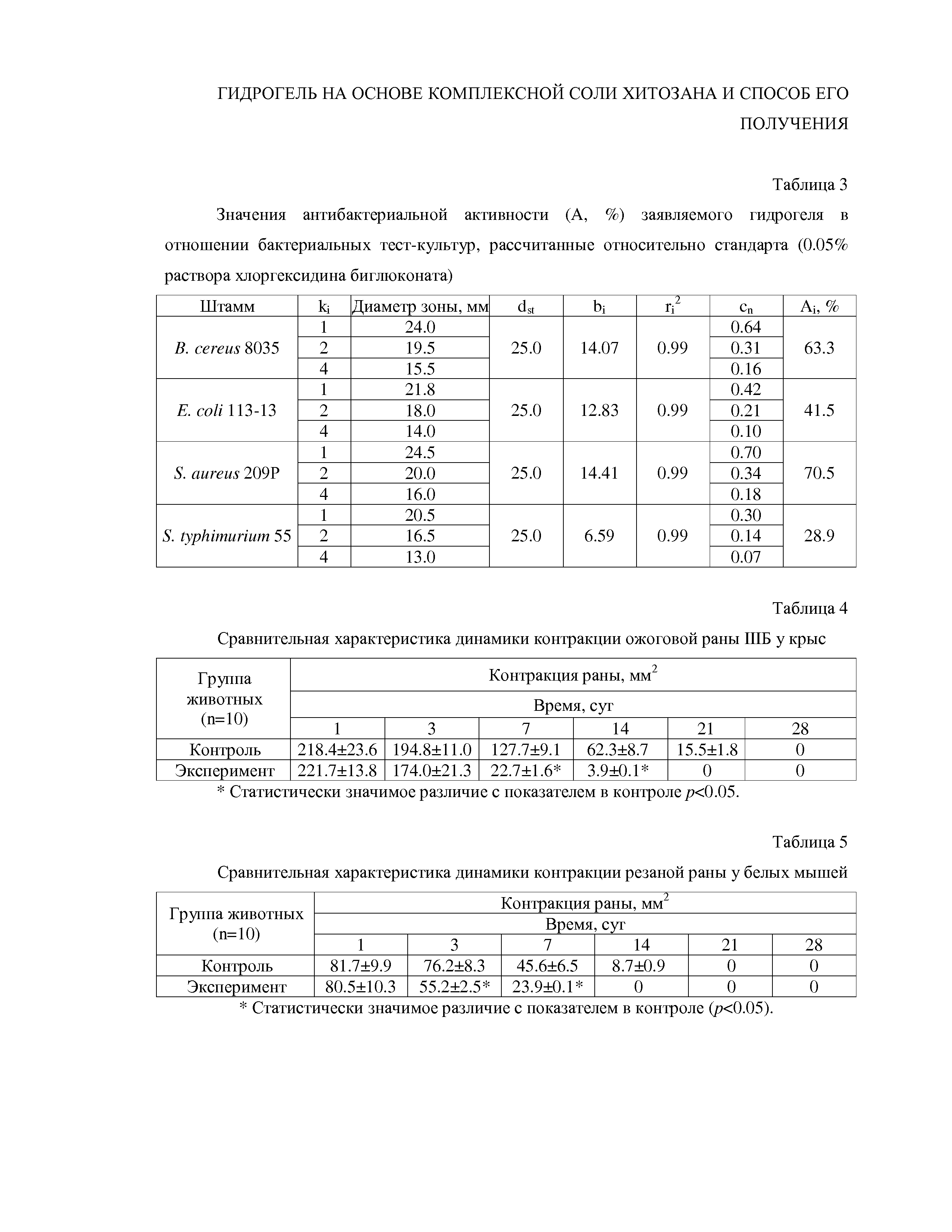
Антибактериальную активность заявляемого гидрогеля определяли in vitro методом диффузии в агар в модификации Есипова С.Е. с соавторами (Есипов С.Е., Жиркова Л.Л., Воронкова В.В. Новый математический подход при определении концентрации антибиотиков методом диффузии в агар // Антибиотики и химиотерапия. 1998. № 2. С. 14-19). В качестве бактериальной модели использовали стандартные суточные тест-культуры грамположительных (Staphylococcus aureus 209 Р, Bacillus cereus 8035) и грамотрицательных бактерий (Escherichia coli 113-13, Salmonella typhimurium 55), полученные из коллекции НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича, г. Москва.
Ранозаживляющее действие заявляемого гидрогеля изучали на разных видах ран до наступления полной эпителизации. Исследования проводили in vivo на животных моделях: лечение ожоговых ран IIIБ степени проводили на модели половозрелых беспородных крыс (самок), резаных ран – белых беспородных мышей (самки). Работу с экспериментальными животными проводили с соблюдением этических принципов и в соответствии с Директивой 2010/63/EU Европейского парламента и Совета от 22 сентября 2010 г. по охране животных, используемых в научных целях. Все манипуляции с животными проводили под эфирным наркозом. Статистическую обработку результатов проводили с использованием программы Microsoft Excel. Оценивали средние значения (М) и ошибки среднего (m). Статистическую значимость различий показателей в контрольной и экспериментальной группах проверяли по t-критерию Стьюдента для уровня значимости 0.05.
Оценивали общее состояние животных, состояние окружающих рану тканей, скорость купирования признаков воспаления и продолжительность отдельных фаз раневого процесса. Учет динамики контракции раны осуществляли с помощью градуированных прозрачных пленочных измерителей каждые 7 суток вплоть до ее полного заживления. Период эпителизации рассчитывали как среднее значение в группе срока отторжения раневой корочки при полной эпителизации поверхности раны.
Противовоспалительное действие оценивали in vivo в клинической практике на пациентах-добровольцах.
Все методики тестирования и испытаний приведены в конкретных примерах по оценке биологического действия гидрогеля.
Настоящее изобретение иллюстрируют примеры 1–16 и таблицы 1–7.
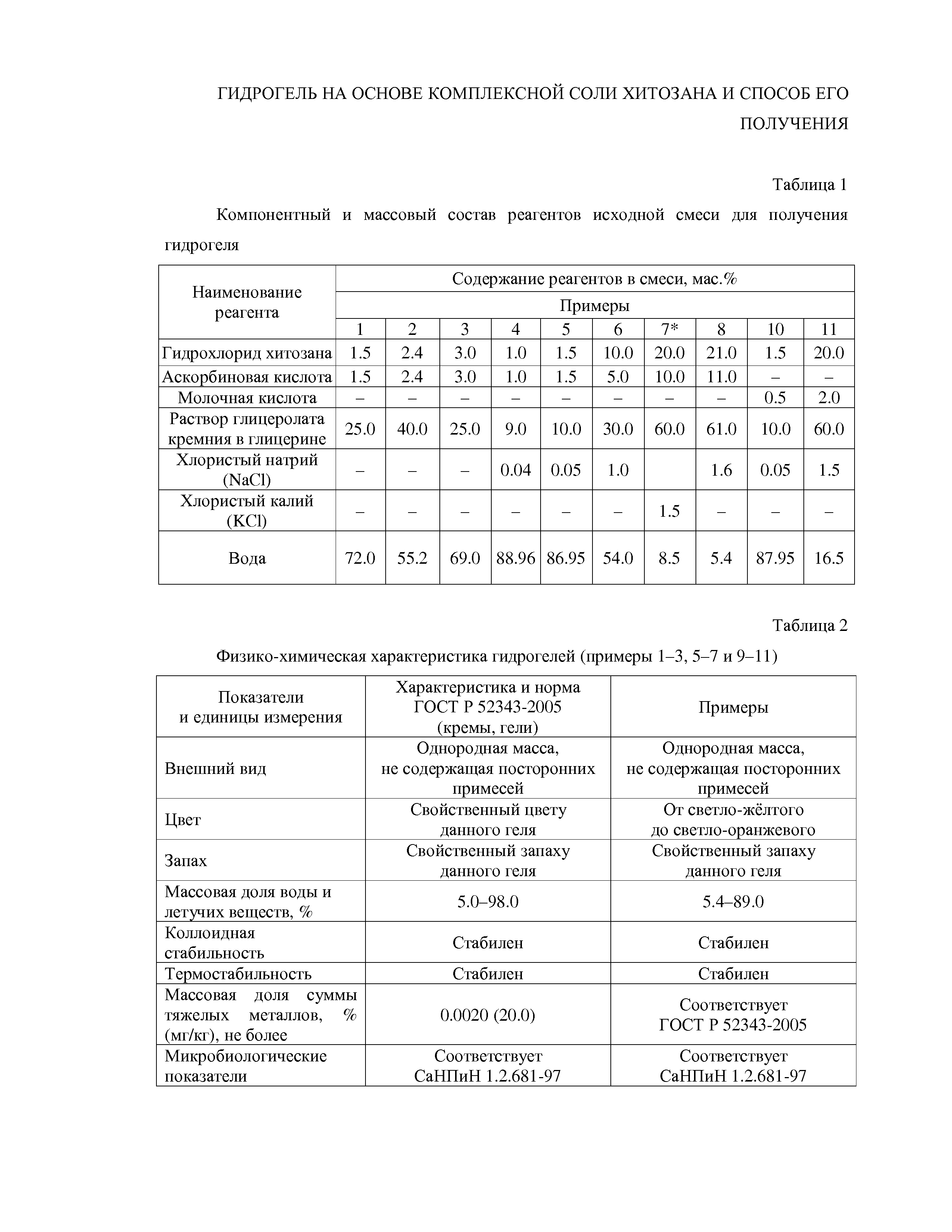
Группа примеров №1 – 10. Получение гидрогеля на основе комплексной соли хитозана. Компонентный и массовый состав реагентов приведен в табл. 1, физико-химическая характеристика гидрогелей приведена в табл. 2.
*Примечание. Пример 7 аналогичен примеру 9. Отличие состоит в способе проведения процесса гелеобразования: в примере 9 гелеобразование проводят в тонком слое.
Пример №1. Используют образец гидрохлорида хитозана с 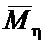 = 38 кДа, СД = 80 мольн.%. Для приготовления 1 кг геля в смеситель помещают 15 г аскорбиновой кислоты, 720 г дегазированной кипячением дистиллированной воды, 15 г порошка гидрохлорида хитозана и непрерывно перемешивают в течение 1.5 часов при Т 20±2°С (обычная температура в помещении, нет необходимости ни нагревать, ни охлаждать). Получают концентрированную систему, которую затем фильтруют через тканевый фильтр и вводят 250 г раствора глицеролата кремния в глицерине (шестимольный избыток). Систему перемешивают в течение 10 мин и выдерживают в таком состоянии 1 час, затем расфасовывают в тубы для гелеобразования и хранят в статических условиях при температуре 20±2°С или 4°С согласно инструкции.
= 38 кДа, СД = 80 мольн.%. Для приготовления 1 кг геля в смеситель помещают 15 г аскорбиновой кислоты, 720 г дегазированной кипячением дистиллированной воды, 15 г порошка гидрохлорида хитозана и непрерывно перемешивают в течение 1.5 часов при Т 20±2°С (обычная температура в помещении, нет необходимости ни нагревать, ни охлаждать). Получают концентрированную систему, которую затем фильтруют через тканевый фильтр и вводят 250 г раствора глицеролата кремния в глицерине (шестимольный избыток). Систему перемешивают в течение 10 мин и выдерживают в таком состоянии 1 час, затем расфасовывают в тубы для гелеобразования и хранят в статических условиях при температуре 20±2°С или 4°С согласно инструкции.
Пример 2. Все стадии способа получения гидрогеля аналогичны примеру 1, однако содержание исходных реагентов составляет (г):
аскорбиновая кислота - 24.0;
гидрохлорид хитозана – 24.0;
вода – 552;
раствор глицеролата кремния в глицерине – 400.
Пример 3. Все стадии способа получения гидрогеля аналогичны примеру 1, однако содержание исходных реагентов составляет (г):
аскорбиновая кислота - 30.0;
гидрохлорид хитозана – 30.0;
вода – 690;
раствор глицеролата кремния в глицерине – 250.
Пример 4. Все стадии способа получения гидрогеля аналогичны примеру 1, однако в систему дополнительно вводится NaCl и содержание исходных реагентов составляет (г):
аскорбиновая кислота - 10.0;
гидрохлорид хитозана – 10.0;
вода – 889.6;
раствор глицеролата кремния в глицерине – 90.0.
NaCl – 0.4.
Полученный гидрогель обладает недостаточной формоустойчивостью, что делает его практическое использование нецелесообразным.
Пример 5. Все стадии способа получения гидрогеля аналогичны примеру 4, однако содержание исходных реагентов составляет (г):
аскорбиновая кислота – 15.0;
гидрохлорид хитозана – 15.0;
вода – 869.5;
раствор глицеролата кремния в глицерине – 100.0;
NaCl – 0.5.
Пример 6. Все стадии способа получения гидрогеля аналогичны примеру 4, однако используют раствор глицеролата кремния в трехмольном избытке глицерина и содержание исходных реагентов составляет (г):
аскорбиновая кислота – 50.0;
гидрохлорид хитозана – 100.0;
вода – 540.0;
раствор глицеролата кремния в глицерине – 300.0;
NaCl – 10.0.
Пример 7. Все стадии способа получения гидрогеля аналогичны примеру 4, однако используют KCl и содержание исходных реагентов составляет (г):
аскорбиновая кислота – 100.0;
гидрохлорид хитозана – 200.0;
вода – 85.0;
раствор глицеролата кремния в глицерине – 600.0;
КCl – 15.0.
Пример 8. Все стадии способа получения гидрогеля аналогичны примеру 4, однако содержание исходных реагентов составляет (г):
аскорбиновая кислота – 110.0;
гидрохлорид хитозана – 210.0;
вода – 54.0;
раствор глицеролата кремния в глицерине – 610.0;
NaCl – 16.0.
Полученная композиция визуально неоднородна, что связано с высокой концентрацией гидрохлорида хитозана и, соответственно, затрудненным перемешиванием компонентов.
Пример 9. Все стадии способа получения и состав гидрогеля аналогичны примеру 7, однако гелеобразование проводят в тонком слое.
Полученная однородная композиция заливается в специальную форму для проведения гелеобразования в тонком слое. Гидрогель представляет собой гелеобразную пленкоподобную структуру размером 5 х 5 см и толщиной 0.3 - 1.5 см, которое далее упаковывается в герметичную упаковку и хранится согласно инструкции.
Пример 10. Все стадии способа получения гидрогеля аналогичны примеру 4, отличие заключается в том, что используют молочную кислоту. Содержание исходных реагентов составляет (г):
молочная кислота (80%) – 6.25;
гидрохлорид хитозана – 15.0;
вода – 878,25;
раствор глицеролата кремния в глицерине – 100.0;
NaCl – 0.5.
Пример 11. Все стадии способа получения гидрогеля аналогичны примеру 10, отличие заключается в содержании исходных реагентов (г):
молочная кислота (80%) – 25.0;
гидрохлорид хитозана – 200.0;
вода – 160.0;
раствор глицеролата кремния в глицерине – 600.0;
NaCl – 15.0.
Таким образом, на основании результатов, приведенных в примерах 1–11, можно заключить, что составы примеров №4 и 8 не удовлетворяют заявленному изобретению, т.к. не реализуется технический результат. Составы примеров №1–3, 5–7 и 9–11 соответствуют заявленному изобретению, так как компоненты лежат в пределах, ограниченных формулой изобретения.
Все заявленные составы при диспергировании легко переходят в мазеподобное состояние и обладают высокими адгезионными и мукоадгезионными свойствами.
Группа примеров 12-16. Оценка биологической активности заявляемого гидрогеля.
Пример 12 – оценка антибактериальной активности.
Используют стандартные суточные тест-культуры грамположительных (Staphylococcus aureus 209 Р, Bacillus cereus 8035) и грамотрицательных бактерий (Escherichia coli 113-13, Salmonella typhimurium 55), полученные из коллекции НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича, г. Москва.
В объем 500 мл расплавленной и охлажденной до 60-65°С питательной агаровой среды ГРМ вносят 1.5 мл взвеси суточной культуры (109 м.т./мл по стандарту мутности ГИСК им. Л.А. Тарасевича) и разливают в чашки Петри по 20 мл. После застывания чашки подсушивают в течение 30 мин и специальным стерильным приспособлением на расстоянии 28-30 мм от центра по окружности чашки делают шесть лунок диаметром 10 мм. Контрольный раствор (стандарт) – 0.05%-ный раствор хлоргексидина биглюконата – вносят автоматической пипеткой по 0.1 мл в три лунки чашки через одну. В другие три лунки вносят по 0.1 мл растворов заявляемого гидрогеля в трех концентрациях: 100, 50 и 25%. В качестве растворителя используют стерильную дистиллированную воду с рН 6.8-7.0. Для получения статистически значимого результата на каждый испытуемый препарат берут по шесть чашек. После нанесения анализируемых растворов чашки выдерживают 1ч при комнатной температуре для диффузии образцов в агар и затем помещают в термостат на 18-20 ч. Через указанное время измеряют диаметры зон задержки роста тест-штамма.
О наличии линейной зависимости между диаметром зон подавления роста и логарифмом дозы препарата по уравнению (1) судят по значению коэффициента корреляции ri2 (2).
dn = ai + bi · lg Pn (1)
ri2 = [∑lgPn · dn - (∑lgPn · ∑dn)/n]2 / [∑(lgPn)2 - (∑lgPn)2/n] · [∑dn2 - (∑dn)2/n] (2)
где dn – среднее значение диаметра зон подавления роста при соответствующем разведении (d1, d2,..., dn); Pn – доза материала в анализируемой пробе, выраженная в единицах разведения (P1, P2,..., Pn); ai и bi, – коэффициенты в уравнении, характеризующие индивидуальную зависимость dn от lgPn для i-го анализируемого образца.
Если коэффициент корреляции имеет величину не менее 0.99, то концентрацию вещества в анализируемом образце определяют по уравнению (3) с относительной ошибкой не более 5%. Значения коэффициента bi устанавливают по уравнению (4).
lgcn = lgcst + (dn - dst(nj))/bi;antilgcn = cn (3)
bi = [∑lgPn · dn - (∑lgPn · ∑dn)/n]/[∑(lgPn)2 - (∑lgPn)2/n] (4)
где c1,c2,..., cn – экспериментально определенные концентрации препарата в n (трех) разведениях анализируемого образца относительно концентрации контрольного стандартного раствора (cst); dst(nj) – среднее значение диаметра зон подавления роста контрольным стандартным раствором для nj (девяти) измерений.
Антибактериальную активность анализируемых образцов рассчитывают по уравнению (5) и выражают в единицах опорной концентрации стандарта, для которого делают допущение, что он ведет себя на чашке как анализируемый образец.
Аi = [(k1·c1 + k2·c2 + k3·c3)/3] · 100% (5)
где Аi - биологическая активность i-го образца относительно стандартного раствора, выраженная в процентах; k1, k2, k3 - кратность разведения образца препарата.
Результаты представлены в таблице 3. Как видно из данных таблицы 3, испытуемый препарат проявил высокую антибактериальную активность в отношении всех тестируемых культур, в отдельных случаях лишь незначительно уступая контрольному образцу – 0.05% раствору хлоргексидина биглюконата. Активность заявляемого гидрогеля наблюдалась даже при его 4-кратном разведении. Грампозитивные бактерии (S. aureus 209Р, B. cereus 8035) оказались более чувствительными к действию препарата по сравнению с грамнегативными микроорганизмами (E. coli 113-13, S. typhimurium 55).
Примеры 13 и 14 – оценка ранозаживляющего действия.
Пример 13.
Ранозаживляющее действие испытывают на половозрелых беспородных крысах (самки) массой 200-250 г на примере ожоговой раны. Термические ожоги IIIБ степени средней площадью 220 мм2 моделируют у крыс (n=10) в межлопаточной области малотравматическим способом, разработанным на кафедре оперативной хирургии и топографической анатомии ГОУ ВПО Саратовского ГМУ им. В.Л.Разумовского (Шуб Г.М., Алипов А.А., Лебедев М.С., Добрейкин Е.А., Алипов Н.В., Пронина Е.А., Райкова С.В., Шаповал О.Г. Опыт применения новых оригинальных мазей для лечения экспериментальной синегнойной инфекции ожоговых ран // Саратовский научно-медицинский журнал. 2011. Т.7. №2. С.523-25). Сформировавшийся на 3-й день струп и патологически измененные ткани удаляют методом острой некрэктомии. Контрольную группу животных (n=10) лечат путем ежедневного нанесения на рану препарата «Левомиколь-вет» ЗАО НПП «Агрофарм». Крысам из экспериментальной группы на обнаженную раневую поверхность однократно накладывают тестируемый гидрогель в количестве 2 г/кг массы животного.
Динамика заживления ран в контрольной и экспериментальной группах крыс отражена в табл. 4.
Как видно из таблицы 4, в экспериментальной группе отмечаются более высокие темпы уменьшения размеров раны в результате контракции. К седьмым суткам разница в динамике контракции краев раны по сравнению с контролем носит статистически значимый характер (p<0.05). Период эпителизации раны в экспериментальной группе составляет 16.1±2.0 сут, в контрольной – 26.7±1.1 сут., а полное восстановление волосяного покрова у крыс в этих группах – на 21-е и 28-е сут. соответственно.
Установлено, что присутствие гидрогеля на ране не оказывает раздражающего действия, не вызывает аллергических или каких-либо иных отрицательных реакций. За весь период наблюдения не было отмечено ни одного случая нагноения раны или осложненного течения раневого процесса.
Как видно из таблицы 4, в экспериментальной группе отмечаются более высокие темпы уменьшения размеров раны в результате контракции. К седьмым суткам разница в динамике контракции краев раны по сравнению с контролем носит статистически значимый характер (p<0.05). Период эпителизации раны в экспериментальной группе составляет 16.1±2.0 сут, в контрольной – 26.7±1.1 сут., полное восстановление волосяного покрова у крыс в этих группах – на 21-е и 28-е сут. соответственно.
Установлено, что присутствие гидрогеля на ране не оказывает раздражающего действия, не вызывает аллергических или каких-либо иных отрицательных реакций. За весь период наблюдения не было отмечено ни одного случая нагноения раны или осложненного течения раневого процесса.
Пример 14.
Ранозаживляющее действие испытывают на половозрелых белых беспородных мышах (самки) массой 18-22 г на примере резаной раны. Резаные раны средней площадью 80 мм2 моделируют у белых мышей (n=10) в межлопаточной области резекцией тканей эпителия. Контрольную группу животных (n=10) лечат путем ежедневного нанесения на рану препарата «Левомиколь-вет» ЗАО НПП «Агрофарм». Мышам из экспериментальной группы на обнаженную раневую поверхность однократно накладывают тестируемый гидрогель в количестве 2 г/кг массы животного.
Динамика заживления ран в контрольной и в экспериментальной группах белых мышей отражена в таблице 5.
Как видно из таблицы 5, в экспериментальной группе отмечаются более высокие темпы уменьшения размеров раны в результате контракции. К третьим суткам разница в динамике контракции краев раны по сравнению с контролем носит статистически значимый характер (p<0.05). Период эпителизации раны в экспериментальной группе составляет 10.2±8.1 сут, в контрольной – 17.8±5.9 сут., полное восстановление волосяного покрова у мышей в этих группах – на 14-е и 21-е сут. соответственно.
Результаты проведенных исследований показывают, что присутствие гидрогеля на ране не оказывает раздражающего действия, не вызывает аллергических или каких-либо иных отрицательных реакций у подопытных животных. За весь период наблюдения не было отмечено ни одного случая нагноения раны или осложненного течения раневого процесса.
Таким образом, описанные в примерах 13 и 14 доклинические исследования показали статистически значимое сокращение сроков заживления резаных и ожоговых ран IIIБ степени на фоне однократного применения заявляемого гидрогеля по сравнению с контрольными группами, в которых раны лечили путем ежедневного нанесения препарата «Левомиколь-вет».
Примеры 15 и 16 – определение противовоспалительного действия.
Пример 15.
25 добровольцам, страдающим хроническим генерализованным пародонтитом (ХГП) легкой степени, проводят 10-дневную комплексную терапию без применения антибиотиков, но совместно с аппликацией заявляемого гидрогеля на область сосочков и краевой десны с захватом 1-2 см слизистой оболочки альвеолярного отростка и инстилляцией в пародонтальные карманы. Продолжительность ежедневных обработок составляет 15 минут. В группу сравнения входят 15 пациентов, получающих традиционную комплексную терапию без применения заявляемого гидрогеля. Клиническое состояние тканей пародонта оценивают до и после лечения с помощью гигиенического (ИГ), пародонтального (ПИ) и папиллярно-маргинально-альвеолярного (РМА) индексов. Состояние костной ткани межзубных перегородок оценивают по данным внутриротовой рентгенографии. Противовоспалительное действие определяют как редукцию индекса РМА (%) по формуле:
ПЭ = 100 × [РМА(1) – РМА(2)] / РМА(1),
где ПЭ – противовоспалительная эффективность; индексы РМА(1) и (2) относятся к осмотру до и после терапии.
Результаты лечения приведены в табл. 6.
Из данных таблицы 6 видно, что при лечении больных ХГП легкой степени тяжести без применения антибиотических средств, но в сочетании с ежедневными аппликациями заявляемого гидрогеля оказываемый противовоспалительный эффект практически не отличается от такового в случае проведения традиционной терапии.
Пример 16. Определение противовоспалительного действия гидрогеля аналогично примеру 16, но в лечении участвуют больные хроническим генерализованным катаральным гингивитом (ХГКГ).
Результаты проведенного лечения представлены в табл. 7.
Из данных таблицы 7 видно, что статистически значимые различия в достигнутом противовоспалительном эффекте при лечении добровольцев с ХГКГ с использованием заявляемого гидрогеля и в случае проведения традиционной терапии (т.е. с применением антибиотиков) отсутствуют.
Таким образом, согласно примерам 14 и 15 заявляемый гидрогель обладает сильным противовоспалительным действием и способен успешно подавлять воспалительные процессы в тканях пародонтах у больных ХГП легкой степени и ХГКГ на фоне проведения профессиональной гигиены и без применения традиционных для стоматологии антибиотических средств.
Заявляемый способ получения гидрогеля на основе комплексной соли хитозана прост в исполнении и экономически целесообразен. Данный способ может быть воспроизведен как в условиях крупных косметических фабрик, предприятий, так и в цехах небольших косметических фирм, имеющих соответствующее оборудование.
Гидрогель на основе комплексной соли гидрохлорид-аскорбат хитозана обладает широким спектром биологического действия: антибактериальной активностью, ускоренным ранозаживляющим и высоким противовоспалительным действиями. В случае заявляемого гидрогеля на основе гидрохлорид-лактат хитозана наблюдается высокий косметический эффект: эксфолиирующий, осветляющий, кератопластический, лифтинг-эффект и т.д.
Новые многофункциональные гидрогели медицинского и косметического назначения доступны для широкого круга потребителей.