Результат интеллектуальной деятельности: ВЫСОКОАФФИННЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ GB ЦИТОМЕГАЛОВИРУСУ (CMV) ЧЕЛОВЕКА
Вид РИД
Изобретение
Родственные заявки
По настоящей заявке испрашивается приоритет временной патентной заявки США с серийным номером № 61/355499, поданной 16 июня 2010 года, содержание которой включено в настоящий документ в качестве ссылки в полном объеме.
Ссылка на список последовательностей, предоставленный через EFS-WEB
Полное содержание следующего предоставленного в электронном виде списка последовательностей через сервер USPTO EFS-WEB, как утверждено и указано в MPEP §1730 II.B.2(a)(C), включено в настоящее описание в качестве ссылки в полном объеме для всех целей. Список последовательностей указан в следующем поданном в электронном виде текстовом файле:
|
Область техники
Изобретение относится к моноклональным антителам человека (mAb) против белка gB CMV для терапевтического и профилактического применения в целях предупреждения или смягчения эффектов на плод инфекции CMV в ходе беременности и для лечения инфекции CMV у пациентов с иммунной недостаточностью, в том числе у пациентов с трансплантатом.
Уровень техники
CMV является основным вызывающим заболевание агентом у пациентов с трансплантатами, других пациентов с иммунной недостаточностью и новорожденных. Каждый год в США рождается приблизительно 40000 новорожденных, у которых выделяется CMV. Среди них 8000 рождаются с симптомами и/или тяжелыми физическими недостатками и у еще вплоть до 8000 позднее развивается прогрессирующая потеря слуха. Приблизительно половина беременных матерей имеют достаточный естественный иммунитет. Таким образом, известно, что в крови человека существуют эффективные mAb. Это также показано с помощью успешного пассивного переноса иммунитета внутривенно вводимым гамма-глобулином (IVIG), который показал очень высокую эффективность защиты плода. Это противоположно ограниченной эффективности, наблюдаемой для IVIG в условиях трансплантации, в случае которой клеточный иммунитет, по-видимому, является более важным, чем гуморальный иммунитет.
Значительная часть естественного ответа на CMV направлена против белка gB (Park, J. W., et al., J. Korean Med. Sci. (2000) 15:133-138). Вакцина Towne представляет собой ослабленную живую вирусную вакцину, широко пассируемую in vitro, которая индуцирует антитела, которые нейтрализуют инфекцию фибробластов, но не инфекцию эндотелиальных клеток. Известно, что эта вакцина является безопасной и ее исследуют на протяжении 20 лет (Adler, S. P., et al., Pediatr. Infect. Dis. J. (1998) 17:200-206). Доноры крови, которые подходят для выделения антител к gB, как описано ниже, включают серопозитивных индивидуумов с предшествующим воздействием CMV и серонегативных индивидуумов до и после вакцинации вакциной Towne.
Были получены антитела к белку gB CMV (Nozawa N., et al., J. Clin. Virol. (2009) [Epub до печати], Nakajima, N., et al. (US2009/0004198 A1), Lanzavecchia, A, et al. (US2009/0004198 A1), Ohlin, M., et al. (J Virol (1993) 67:703-710). Описано нейтрализующее антитело к домену AD-2 gB, ITC88 (Lantto, Virology (2003) 305:201-209). Однако предшествующие попытки клонировать антитела против CMV, хотя и являются успешными, ограничены в возможностях, и не было описано высокоаффинных (субнаномолярная аффинность) антител. Высокая аффинность является ключевым параметром, поскольку слабоафинные антитела к CMV в действительности стимулируют передачу через плаценту человека (Nozawa, выше), причем этот аспект патологии не наблюдали у грызунов. CMV человека имеет двухцепочечный ДНК-геном размером приблизительно 236 т.п.н. и является прототипическим представителем семейства β-герпесвирусов. Высокая комплексность генома означает, что существует множество потенциальных представляющих интерес антигенов. Попытки охарактеризовать нейтрализующие антитела и связнные с ними эпитопы привели к субъединичной вакцине на основе гликопротеина B (gB), которая индуцирует эффективный нейтрализующий ответ, но в исследовании в группе серонегативных женщин имела только 50% эффективность. Она оказалась наиболее эффективной из каких-либо вакцин против CMV. Поскольку вакцины, как правило, индуцируют антитела с диапазоном аффинностей, неутешительная эффективность исследованных к настоящему времени вакцин может быть приписана необходимости в высокоаффинных антителах, что свидетельствует в пользу предоставления непосредственно высокоаффинного mAb в качестве профилактической стратегии.
Также в качестве причины плохой эффективности был назван неуспех в фокусировании иммунного ответа на специфической нейтрализации эпитопов (Marshall, B. C., et al., Viral Immunol. (2003) 16:491-500. Другой предполагаемой технической проблемой при разработке вакцин против CMV является то, что их оценивали только в отношении их способности генерировать антитела, которые нейтрализуют инфекцию фибробластов, хотя инфекция других типов клеток в возрастающей степени становится эпицентром для понимания вирусной патологии. Это смещение отражает технические препятствия, связанные с выращиванием вируса in vitro. Полагают, что многократное пассирование вируса на фибробластных клетках привело к тому, что многие лабораторные штаммы потеряли тропизм к эндотелиальным и эпителиальным клеткам. В течение последних нескольких лет этот дефицит связывали с утратой одного или нескольких компонентов комплекса гликопротеинов gH/gL/UL131-UL128 на поверхности вируса.
Очевидно, существует потребность в более эффективной стратегии профилактики против CMV.
Описание изобретения
Были получены антитела человека, которые являются специфично иммунореактивными к белку gB CMV с увеличенной аффинностью по сравнению с предшествующими антителами (человека или мыши) и с нейтрализующей способностью. Гуморальная иммунная система способна продуцировать миллионы структур антител с десятками тысяч четко отличающихся способностей связывания, но, тем не менее, защитные антитела являются только небольшой их подгруппой. Авторы настоящего изобретения использовали технологию CellSpot™ (Harriman, W. D., et al., J. Immunol. Methods (2009) 34:135-145, Collarini, E. J., et al., J. Immunol. (2009) 183:6338-6345, и патент США 7413868), все из которых включены в настоящее описание в качестве ссылки, для получения панели mAb из крови доноров, у которых подтверждено наличие высокого титра против CMV.
Таким образом, в одном из аспектов изобретение относится к моноклональным антителам человека или их иммунореактивным фрагментам, которые связывают эпитоп на белке gB, причем предпочтительным вариантом осуществления является связывание с его консервативной последовательностью. Эти антитела проявляют нейтрализующую способность в стандартных анализах бляшкообразования в отношении нейтрализации CMV и демонстрируют EC50 в таких анализах <500 нг/мл, предпочтительно <200 нг/мл, более предпочтительно <100 нг/мл. Антитела по изобретению также обладают аффинностью к белку gB штамма CMV AD169, равной <10 нМ, или <5 нМ, или <1 нМ.
Для применения в способах по изобретению для лечения инфекции CMV или для повышения устойчивости к CMV моноклональные антитела или фрагменты по изобретению могут быть иммунореактивными к множеству штаммов CMV, и одного моноклонального антитела может быть достаточно для наличия желаемого эффекта. Альтернативно индивидууму, подлежащему лечению или приданию устойчивости, можно вводить более одного моноклонального антитела, которые связываются с одним и тем же или с различными белками CMV.
Также изобретение относится к фармацевтическим композициям, который являются подходящими для профилактики или лечения, которые содержат в качестве активного вещества одно антитело или иммунореактивный фрагмент по изобретению или не более двух антител или фрагментов по изобретению.
Другие аспекты изобретения включают способы применения антител для лечения CMV у человека или для индукции устойчивости к инфекции у человека.
Моноклональные антитела по изобретению можно получать рекомбинантными способами, и, таким образом, изобретение также включает рекомбинантные материалы для такого получения, а также клеточные линии, или иммортализованные клетки, или не являющиеся человеческими многоклеточные организмы или их клетки, или микробные клетки для получения этих антител. В одном из вариантов осуществления клетки, полученные из человека, получают в “иммортализованной” форме, где они модифицированы для обеспечения секреции антител в течение достаточного периода времени, чтобы их можно было охарактеризовать и соответствующую кодирующую последовательность клонировать.
Краткое описание чертежей
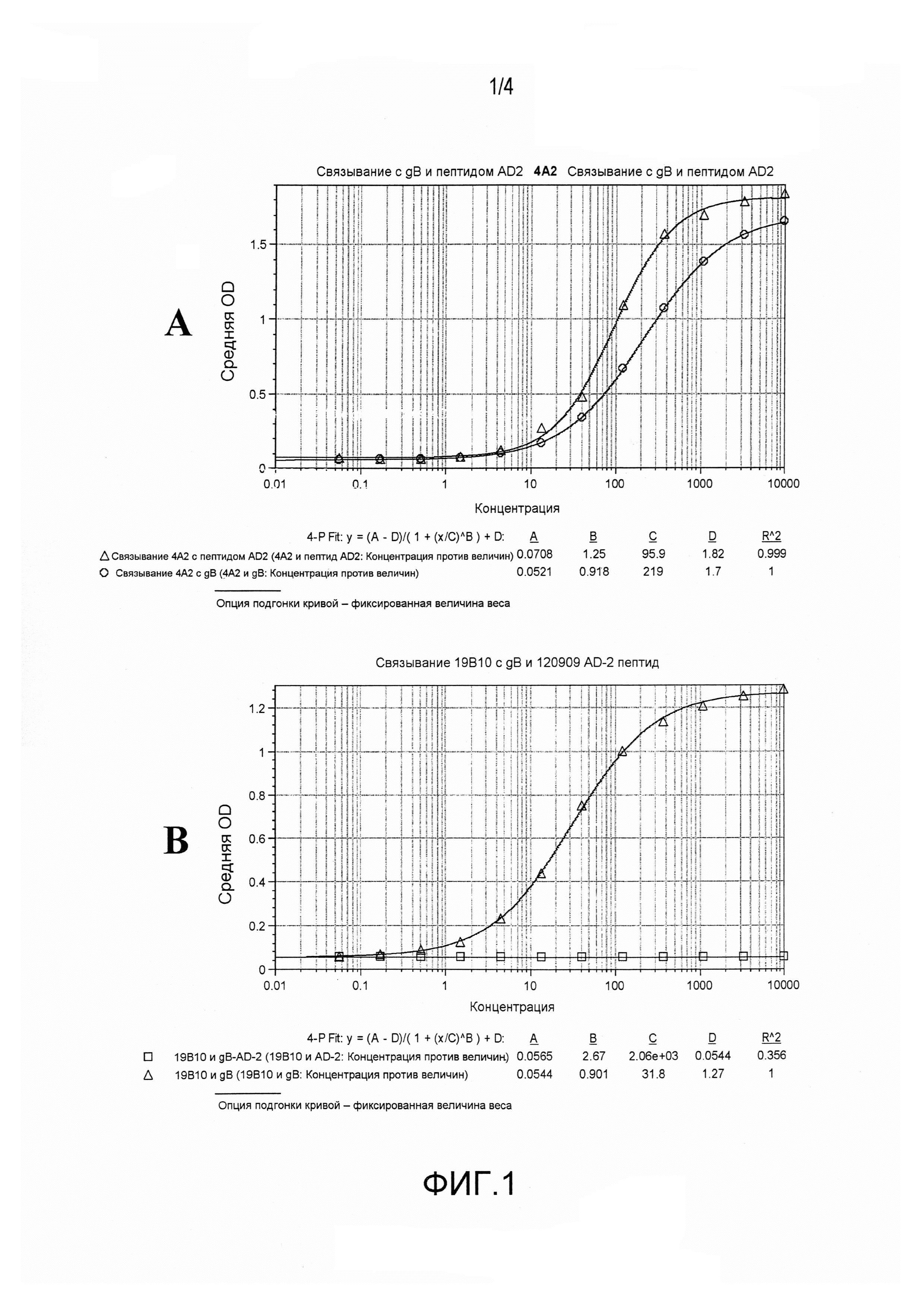
На фиг.1A и 1B представлено связывание 4A2 и 19B10 с белком gB и с их консервативной областью.
На фиг.2A и B показана нейтрализация VR1814 с помощью mAb 4A2, 310, 313, 338 и 345 в клетках HUVEC и HFF.
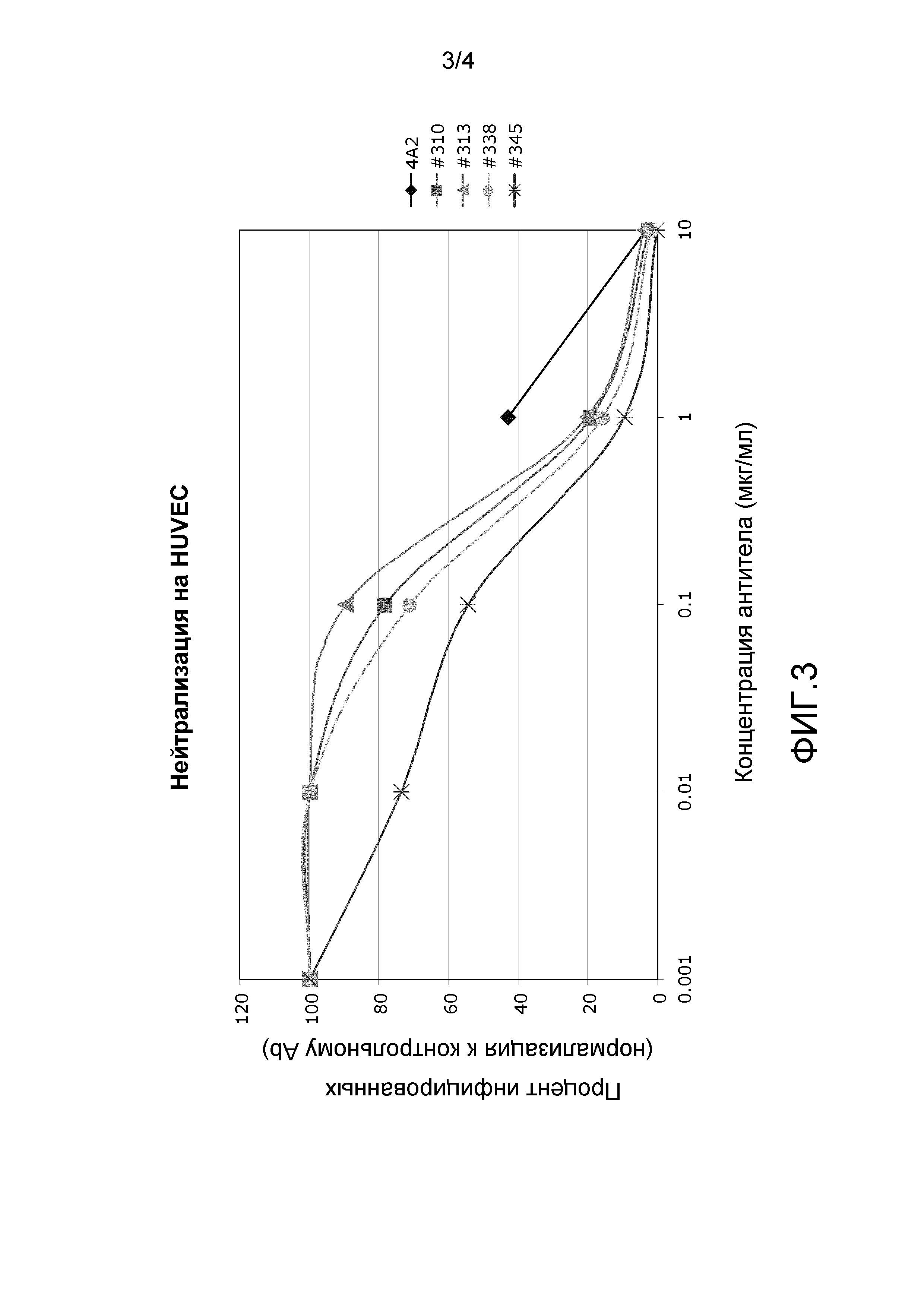
На фиг.3 представлена нейтрализация VR1814 с помощью mAb 4A2, 310, 313, 338 и 345 в HUVEC.
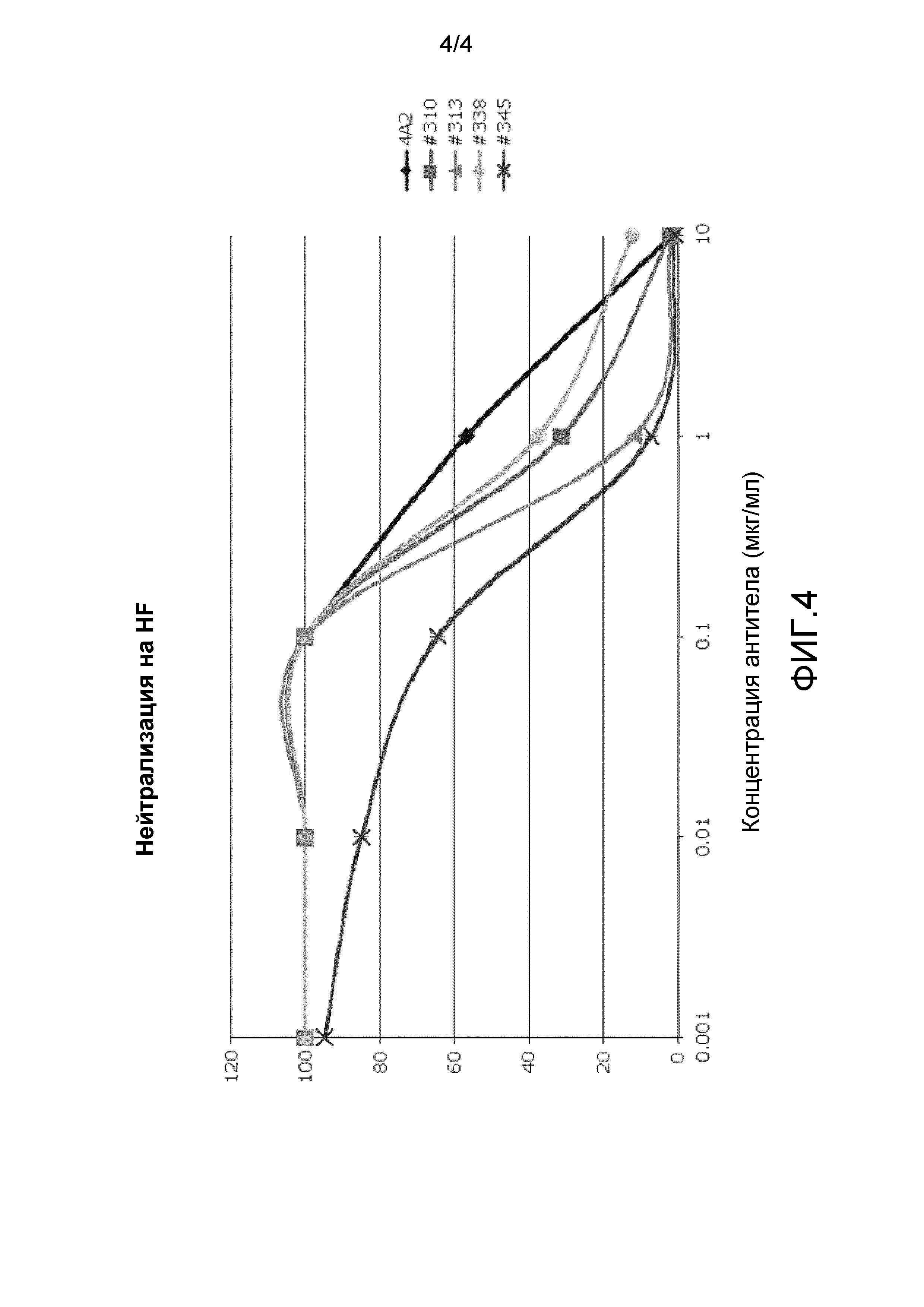
На фиг.4 представлена нейтрализация VR1814 с помощью mAb 4A2, 310, 313, 338 и 345 в клетках HFF.
Способы осуществления изобретения
Как используют в рамках изобретения, термин “лечить” относится к снижению вирусной нагрузки у индивидуума, который уже инфицирован CMV, или к смягчению симптомов заболевания у такого индивидуума. Такие симптомы включают ретинит и гепатит.
Термин “придает устойчивость к” относится к профилактическому эффекту, где по меньшей мере снижается тяжесть вирусной инфекции RSV при заражении.
“Иммортализованные клетки” относятся к клеткам, которые могут пережить значительно больше пассирований, чем немодифицированные первоначально выделенные клетки. Как используют в контексте настоящего изобретения, “иммортализованный” не обязательно означает, что клетки продолжают секретировать антитела на протяжении очень длительных периодов времени, а только то, что они могут выжить дольше, чем первичные клеточные культуры. Время, на протяжении которого происходит секреция антитела, должно быть достаточным только для его идентификации и установления кодирующей нуклеотидной последовательности.
Антитела человека, такие как описанные в настоящем описании антитела, выделенные из клеток человека, не индуцируют сильный иммунный ответ. Известно, что антитела человека индуцируют ответ у 5-10% подвергаемых лечению людей даже в случае антител, выделенных из человека, поскольку в индуцируемом иммунном ответе существует определенный уровень фонового “шума”. Иммунный ответ может быть гуморальным или клеточным или и гуморальным, и клеточным. В частности, у этого процента индивидуумов могут быть найдены повышенные уровни цитокинов.
Белок gB CMV синтезируется в качестве белка-предшественника массой 130 кДа, который расщепляется на фрагменты массой 116 кДа (N-концевые) и 58 кДа (C-концевые), которые остаются ковалентно связанными; наблюдаемые молекулярные массы могут варьировать в зависимости от состояния гликозилирования. Антигенная детерминанта AD-2 относится к остаткам 67-82 gp116. Значительная часть природного иммунитета к CMV определяется связыванием с AD-2 (т.е. он может блокироваться пептидом, охватывающим эту область), Ohlin (выше).
Антитела по изобретению были выделены из доноров-людей, подвергнутых воздействию CMV, с использованием запатентованного способа CellSpot™, который описан в патенте США № 7413868, публикациях PCT WO 2005/045396 и WO 2008/008858, все из которых включены в качестве ссылки, как указано в примере 1.
Получение антитела человека или гуманизированного антитела по изобретению проводят с помощью общепринятых рекомбинантных способов, таких как продуцирование в клетках яичника китайского хомячка, или других эукариотических клеточных линиях, таких как клетки насекомых. Альтернативно, также известны способы получения рекомбинантных материалов, включая антитела, в растениях и в трансгенных животных, например в молоке животных семейства бычьих, или микробных, или растительных, или происходящих из насекомых одноклеточных системах, или в бесклеточных экстрактах таких клеток.
Кроме того, поскольку нуклеотидные последовательности, кодирующие антитела, доступны, соответствующие фрагменты, которые связывают тот же эпитоп, например Fab-, F(ab′)2- или Fv-фрагменты, также можно получать рекомбинантными способами (или путем протеолитической обработки самого белка) и антитело можно получать в одноцепочечной форме. Различные способы манипулирования при получении рекомбинантных антител известны в данной области.
Все из химерных, гуманизированных антител и антител человека находятся в объеме настоящего изобретения, так же как и миметики антител на основе других белковых каркасов, таких как фибронектин, трансферрин или липокалин. Аналогично в настоящее время существует множество технологий получения молекул, подобных единичному антителу, которые включают антигенспецифичные домены из двух отдельных антител (биспецифическое антитело). Подходящие технологии описаны Macrogenics (Rockville, MD), Micromet (Bethesda, MD) и Merrimac (Cambridge, MA). (См., например, Orcutt KD, Ackerman ME, Cieslewicz M, Quiroz E, Slusarczyk AL, Frangioni JV, Wittrup KD. A modular IgG-scFv bispecific antibody topology. Protein Eng Des Sel. (2010) 23:221-228; Fitzgerald J, Lugovskoy A. Rational engineering of antibody therapeutics targeting multiple oncogene pathways. MAbs. (2011) 1; 3(3); Baeuerle PA, Reinhardt C. Bispecific T-cell engaging antibodies for cancer therapy. Cancer Res. (2009) 69:4941-4944).
Таким образом, можно конструировать единичное антитело с очень широкой реактивностью к штамму с использованием Fab-доменов отдельных антител с реактивностью к различным эпитопам CMV, так чтобы, например, биспецифическое антитело имело активность как против gB, так и против комплекса gH, или альтернативно оно может быть реактивным к белкам gB из одного и того же или отличающихся штаммов. Высокоаффинные антитела против gH описаны, например, Macagno A, Bernasconi NL, Vanzetta F, Dander E, Sarasini A, Revello MG, Gerna G, Sallusto F, Lanzavecchia A. Isolation of human monoclonal antibodies that potently neutralize human cytomegalovirus infection by targeting different epitopes on the gH/gL/UL128-131A complex. J Virol. (2010) 84:1005-1013. Также можно получать и использовать высокоаффинные антитела к белкам gH из других штаммов.
Для применения в терапии полученные рекомбинантными способами антитела или фрагменты изготавливают в виде фармацевтических композиций с использованием подходящих эксципиентов и вводят в соответствии со стандартными протоколами. Фармацевтические композиции могут иметь в качестве единственного активного ингредиента моноклональное антитело или фрагмент по изобретению, особенно моноклональное антитело или фрагмент, которые являются перекрестно реактивными к белку gB всех штаммов CMV. Альтернативно, два моноклональных антитела могут быть единственными активными ингредиентами, где одно из них более сильно реагирует с белком gB одного штамма, а другое из них более сильно реагирует с белком gB другого штамма. Во всех из этих случаев могут присутствовать дополнительные лекарственные средства, включая лекарственные средства, связывающиеся с другими белками CMV. Также соединения могут включать питательные вещества, такие как витамины, или любое другое полезное соединение, отличное от антитела.
В одном из вариантов осуществления, когда составы для введения используют для увеличения устойчивости к инфекции, используют полные антитела, включая содержащую комплемент Fc-область. Как правило, антитела вводят в дозировках на уровнях 0,01-20 мг/кг массы тела человека, или в количествах в диапазоне 0,01-5 мг/кг, или промежуточные количества из этих диапазонов. В одном из вариантов осуществления используют количества в диапазоне 0,1-1,0 мг/кг. Может быть полезным повторяющееся введение с интервалом в несколько суток или несколько недель или несколько месяцев.
В другом варианте осуществления в целях терапевтического эффекта для снижения вирусной нагрузки также используют полные антитела, содержащие содержащую комплемент Fc-область. Количества, вводимые в таких протоколах, составляют порядка 0,001-50 мг/кг, или используют промежуточные величины в этих диапазонах, такие как 0,01, 1 или 10 мг/кг. Также можно использовать многократное введение. Терапевтическое лечение проводят настолько быстро, насколько это возможно, после диагностики инфекции, хотя также в объем изобретения входит введение в пределах нескольких суток. Также можно использовать многократное введение. Для снижения воспалительного ответа в легких необходимо использовать только иммуноспецифические фрагменты антител. Уровни дозировок являются сходными с уровнями дозировок для целых антител. Также в объем изобретения включено введение смесей иммуноспецифических фрагментов и целых антител.
Введение композиций антител проводят, как правило, путем инъекции, главным образом, внутривенной инъекции. Таким образом, предпочтительным является парентеральное введение. Однако предусматривается любой действенный способ введения, включая генную терапию (продуцирование рекомбинантного антитела in vivo).
Составы для введения композиций антител получают способами, главным образом, известными в данной области. Подходящие составы могут быть найдены в стандартных справочниках, таких как Remington’s Pharmaceutical Sciences, последнее издание, Mack Publishing Co., Easton, PA, включенный в настоящее описание в качестве ссылки. Составы, как правило, представляют собой составы, подходящие для парентерального введения, включая изотонические растворы, которые включают буферы, антиоксиданты и т.п., а также эмульсии, которые включают носители для доставки, такие как липосомы, мицеллы и наночастицы.
Желаемые протоколы и составы зависят от мнения лечащего врача, а также от конкретного состояния индивидуума. Уровни дозирования зависят от возраста, общего состояния здоровья и тяжести инфекции, в соответствующем случае, индивидуума.
Следующие примеры приведены для иллюстрации, но не ограничения изобретения.
Пример 1
Выделение B-клеток человека, секретирующих антитело к gB CMV
Мононуклеарные клетки периферической крови от 50 взрослых людей с подтвержденным титром против CMV исследовали в отношении B-клеток человека, продуцирующих противовирусные антитела. Индивидуумов с желаемыми антителами против белка gB CMV использовали для клонирования специфических mAb. Результат исследования состоял в том, что ~10% индивидуумов имели частоту желаемых клеток более 1 на 50000.
Для проведения исследования и выделения редких подходящих клеток авторы настоящего изобретения использовали ранее описанную технологию CellSpot™ (US 7413868, включенный в настоящее описание в качестве ссылки). Способ анализа CellSpot™ эффективно сужает эквивалентный анализ ELISA практически до размеров одной клетки путем улавливания секретируемых IgG из одной клетки в качестве отпечатка вблизи клетки, так что можно легко анализировать миллионы клеток. Далее, с использованием микроскопических реагентов мультиплексирования (комбинаторно окрашенные флуоресцентные латексные микросферы, см. US 6642062, включенный в настоящее описание в качестве ссылки), отпечаток секретируемых антител каждого клона может быть детально охарактеризован в отношении специфичности и/или аффинности с использованием множества биохимических зондов. Точность количественного анализа является достаточной для обеспечения сохранения редких подходящих клеток из исследуемой популяции, причем клонированная экспрессирующая клетка демонстрирует фенотип, согласующийся с исходным идентифицирующим анализом.
Критерии скрининга представляли собой связывание с очищенным белком gB, а также с вирусным лизатом. Белок gB очищали из клеток 293, инфицированных штаммом AD169 CMV. Ранжирование аффинности, упорядывающее клоны, проводят путем разбавления антигена на гранулах сывороточным альбумином. Это снижает вероятность многозубчатого связывания с секретируемым отпечатком IgG (эффект “авидности”), таким образом, осуществляя селекцию по более высокой присущей аффинности.
Клетки, не являющиеся B-клетками, удаляли из PBMC в плазме доноров-людей с использованием стандартных способов магнитного разделения. Клетки ресуспендировали в IMDM/20% HI-FCS в количестве 1e6/мл; и иммортелизовывали с помощью EBV (прямо осажденный из супернатанта инфицированных клеток B95-8). EBV добавляли в разведении 1:100 и клетки инкубировали в течение 2 ч при 37°C. Избыток EBV смывали и клетки либо:
(1) культивировали в количестве 2e6/мл в IMDM, 20% HI-FCS, 20% кондиционированной гигантоклеточной опухолью среде, 2 мкг/мл CpG (ODN2006), и 10 нг/мл IL-10 только для исследования, либо
(2) далее подвергали селекции в отношении поверхностного IgG с использованием магнитной положительной селекции.
Клетки культивировали в количестве 200-300 клеток/лунка на облученных клетках легкого человека (MRC-5, 5000 клеток/лунка) в IMDM, 20% HI-FCS, 20% кондиционированной гигантоклеточной опухолью среде, 2 мкг/мл CpG (ODN2006) и 10 нг/мл IL-10. Среду дополняли каждые 2-3 суток. Половину содержимого лунок анализировали в CellSpot™ на 6 сутки. Затем остальные клетки в небольшом количестве лунок, положительных в анализе для исследования, разбавляли до 10, 5, 1 и 0,5 клеток/лунка с теми же питающими клетками и условиями культивирования. Через 4-5 суток эти планшеты с лимитирующими разведениями вновь анализировали с помощью ELISA или CellSpot™.
Наночастицы CellSpot™ конъюгировали с вирусным лизатом или очищенным белком gB для скрининга желаемых антител. Лизаты, полученные из клеток, инфицированных вирусом CMV AD169, приобретали от Virusys (каталожный номер # CV046). (Лизат получали из клеточной линии нормальных фибробластов кожи человека (NHDF).) Рекомбинантный антиген gB CMV получали в качестве меченного His-меткой слитого белка в клетках 293 и очищали с использованием никель-хелатирующей колонки. Очищенный белок gB использовали для ELISA и CellSpot. Препараты лизата AD169 и очищенного белка gB конъюгировали с наночастицами, соответственно, как описано ранее, см. Harriman et al (выше) и Collarini et al (выше).
Затем содержимое положительных при лимитирующем разведении лунок обрабатывали с использованием ПЦР с обратной транскриптазой для выделения мРНК для тяжелой и легкой цепей антитела. Общее время от размораживания PBMC до выделения кодирующей последовательности мРНК способом ОТ-ПЦР составляло 10-12 суток.
Пример 2
Клонирование антител человека к gB CMV
Амплификацию реаранжированных генов тяжелой цепи Ig и легкой цепи Ig из положительных лунок в ELISA проводили с использованием полугнездовой полимеразной цепной реакции (ПЦР). Для амплификации ранее неизвестных реаранжировок V-генов конструировали коллекцию специфичных к семейству праймеров V-генов, которая распознает все сегменты V-генов в локусе Ig человека. 5’-праймеры использовали вместе со смесями праймеров, специфичными к сегментам генов Cγ, Cκ и Cλ. Клональность ограниченного разведения специфичных к CMV-gB B-клеток однозначно определяли путем сравнения последовательностей амплификатов V-генов из различных клеток-потомков и амплифицированные полноразмерные реаранжированные V-гены клонировали в экспрессирующие IgG векторы.
Подробно, тотальную мРНК, выделенную из B-клеток человека, экстрагировали с использованием коммерчески доступного набора для очистки РНК (RNeasy™; Qiagen (Германия)). ПЦР с обратной транскрипцией проводили с использованием препаратов тотальной РНК и олигонуклеотидов в качестве праймеров. Для каждого образца проводили три реакции ПЦР: одну для легкой цепи каппа (κ), одну для легкой цепи лямбда (λ) и одну для тяжелой цепи гамма (γ). Для амплификации использовали набор QIAGEN® OneStep RT-PCR (Qiagen, каталожный номер № 210212). В сопряженных реакциях ОТ-ПЦР кДНК синтезируют с уникальной смесью ферментов RT (Omniscript™ и Sensiscript™) с использованием праймера, специфичного к антисмысловой последовательности, соответствующей C-κ, C-λ или консенсусной последовательности областей CH1 генов Cγ, RT проводят при 50°C в течение 1 часа с последующей амплификацией способом ПЦР кДНК с помощью ДНК-полимеразы HotStarTaq для высокой специфичности и чувствительности. В каждой реакции ПЦР использовали смесь 5’-смысловых праймеров. Последовательности праймеров были основаны на лидерных последовательностях VH, VK и VL. Реакции ПЦР проводили при 95°C в течение 15 минут, за первоначальным горячим стартом следовали 20 циклов при 95°C в течение 30 секунд (денатурация), 60°C в течение 45 секунд (отжиг) и 72°C в течение 1 минуты (элонгация).
Гнездовая ПЦР для детекции и клонирования вариабельных фрагментов Ig в векторы экспрессии. На втором раунде использовали аликвоту, равную 5 мкл, из первой реакции амплификации. Использованные праймеры имеют участки рестрикции 5’BglII и 3’ XbaI. Проводили тридцать циклов ПЦР. Для первого и второго раундов амплификации использовали идентичные условия. Пять микролитров каждой реакционной смеси наносили и разделяли на 1% агарозном геле, а затем окрашивали бромидом этидия. Согласно прогнозам продукт V-C ПЦР представляет собой амплифицированные реаранжированные фрагменты VH и VL размером 500 и 450 п.н. соответственно. Полосы ПЦР с размером молекул приблизительно 500 п.н. указывали на положительный результат. Продукты ПЦР очищали (набор для очистки из геля Qiagen, каталожный номер 28704) и экстрагированные продукты ПЦР прямо секвенировали с использованием специфических праймеров к константной области. Последовательности клонированных фрагментов подтверждали путем секвенирования плазмид, полученных для рекомбинантного продуцирования.
Фрагменты ПЦР, описанные выше, расщепляли и клонировали в индивидуальные векторы экспрессии, несущие константную область гамма 1 человека, или каппа или лямбда человека, для продуцирования антител in vitro в клетках млекопитающих. Векторы экспрессии, кодирующие тяжелые и легкие цепи, котрансфицировали в клеточную линию 293 (почка человека) (Invitrogen). Экспрессирующие плазмиды вводили с использованием реагента для трансфекции на основе катионного липида (293fectin™; Invitrogen). Для каждой реакции трансфекции 20 мкг очищенных плазмид и 40 мкл 293fectin™ смешивали с 1 мл Opti-MEM® (Invitrogen) и инкубировали в течение 5 мин при комнатной температуре, а затем объединяли и позволяли комплексам образовываться в течение 20 мин при комнатной температуре. Комплексы ДНК-293fectin добавляли к 3×106 клеток, посеянных в 90-мм чашки Петри, и инкубировали при 37°C, 8% CO2. В конечной процедуре супернатант собирали через 72 ч после трансфекции центрифугированием (3000 g, 15 мин при 4°C), для выделения секретированных антител.
Из ~2 миллионов лимфоцитов выделили 45 клонов, которые связывали лизат AD169. Из них большинство также связывали рекомбинантный белок gB.
Два mAb, которые связывали как AD169, так и gB (4A2 и 19B10), имели нейтрализующую способность. Одно из них (4A2) связывает пептид AD-2, который представляет собой консервативный участок на белке gB. Дополнительное mAb (5C5) связывает AD-2, но не нейтрализует вирус.
Аминокислотные последовательности тяжелой и легкой цепей 4A2 и 19B10, включая вариабельную область, области соединения D и J, каркасные (FR) и определяющие комплементарность (CDR) области, представлены ниже. Сигнальная последовательность для секреции на тяжелой цепи выделена курсивом и CDR 1-3 подчеркнуты.
4A2 HC, VH3-30: нуклеиновые кислоты (SEQ ID NO:1) и аминокислоты (SEQ ID NO:2)

4A2 LC L6, IgKV3-11: нуклеиновые кислоты (SEQ ID NO:3) и аминокислоты (SEQ ID NO:4)

19B10 HC VH4-31, D2, J6: нуклеиновые кислоты (SEQ ID NO:5) и аминокислоты (SEQ ID NO:6)

19B10 LC, A3, IgKV2: нуклеиновые кислоты (SEQ ID NO:7) и аминокислоты (SEQ ID NO:8)

Высокоаффинные антитела получали путем приготовления зондов CellSpot, покрытых полноразмерным белком gB или пептидом Ad-2 как при высокой, так и при низкой плотности, на флуоресцентных гранулах. Не ограничиваясь теорией, поскольку низкая плотность снижает эффект многозубчатой авидности, поиск смещен в пользу антител с высокой присущей им аффинностью. Было выделено и отсеквенировано множество высокоаффинных антител. Определяли последовательности других моноклональных антител, которые являются реактивными к CMV, и они представлены в качестве SEQ ID NO:9-36 и 38-66. Нуклеотидная последовательность константной области тяжелой цепи IgG1 человека представлена в SEQ ID NO:37.
В антителах по изобретению тяжелая цепь может иметь CDR1 GFTFNRHG (SEQ ID NO:67) или GSISSEDFC (SEQ ID NO:68); и/или область CDR2 SSDGANQ (SEQ ID NO:69) или ICYTGD (SEQ ID NO:70); и/или область CDR3 ARDGRCEGERCYSGVTDF (SEQ ID NO:71) или AREDRRQLHSRPYFYYGLDV (SEQ ID NO:72). В других вариантах осуществления легкая цепь имеет область CDR1 QNIGGY (SEQ ID NO:73) или QSLLHSNGHNY (SEQ ID NO:74); и/или область CDR2 DAS (SEQ ID NO:75) или LG (SEQ ID NO:76); и/или область CDR3 QQRNSWPPLT (SEQ ID NO:77) или QALQTPNT (SEQ ID NO:78).
Пример 3
Определение аффинности
Аффинность антител по изобретению определяли в анализе с помощью биосенсора ForteBio® (Menlo Park, CA). В этом способе группы карбоновых кислот амин-реактивных биосенсоров активировали с помощью EDC/NHS. Антитело, разбавленное в буфере MES при pH 5, связывали с активированной поверхностью зонда и оставшиеся активные карбоксилированные группы блокировали этаноламином. Белок gB инкубировали с зондом, покрытым Ab, и определяли скорости ассоциации и диссоциации от покрытого Ab зонда с помощью устройства ForteBio®.
В одном из экспериментов было выявлено, что 4A2 обладает аффинностью 168 пМ и 19B10 обладает аффинностью 697 пМ, как показано в качестве соответствующей IC50 в мкг/мл в таблице 1. Эти константы аффинности по существу лучше, чем у опубликованных моноклональных антител к gB.
|
Определяли аффинность связывания mAb 310, 313, 345 и 4A2 с эпитоптом AD-2 gB. Кинетика связывания gB представлена в таблице 2. mAb 310, 313 и 338 имеют приблизительно в 10× большую эффективность, чем mAb 4A2. mAb 323, 316 и 338 также имеют более высокую эффективность, чем mAb 4A2 (данные не представлены). Аффинность связывания остальных mAb также тестировали, и она также является лучшей, чем у опубликованных моноклональных антител к gB.
|
Пример 4
Анализ связывания Elisa и картирование эпитопов
mAb 4A2 и 19B10 оценивали в отношении связывания с очищенным белком gB и с консервативным пептидом, обозначенным AD-2: NETIYNTTLKYGDV (SEQ ID NO:79). Как показано на фиг.1, 4A2 хорошо связывается как с полноразмерным белком, так и с пептидом AD-2, в то время как 19B10 связывает только белок.
Пример 5
Анализ нейтрализации вируса
mAb 4A2 и 19B10 нейтрализовали штамм AD169 CMV в первичных фибробластах MRC5. Серийные разведения антител смешивали с равным объемом AD169 (108/мл исходного раствора, разбавленные до 2000 инфицированных клеток на лунку) и инкубировали в течение 1 ч при комнатной температуре, а затем добавляли к монослоям клеток-мишеней в 96-луночные микропланшеты. Через 24 ч клетки фиксировали, увеличивали их проницаемость и окрашивали моноклональным антителом против IE1 (среднеранний белок 1, также известный как UL123, маркер реплицирующегося вируса), конъюгированным с HRP. Инфицированные клетки выявляли после наслоения субстрата HRP. Количество инфицированных клеток наносили на график против концентрации антитела.
Нейтрализацию вируса также оценивали с использованием штамма VR1814 (Revello, et al., J. Gen. Virol. (2001) 82:1429-1438). mAb 4A2, 310, 313, 338 и 345 нейтрализовали штамм VR1814 как в эндотелиальных клетках пупочной вены человека (HUVEC), так и в фибробластных клетках крайней плоти человека (HFF). На фиг.2A и 2B показаны величины IC50 и IC90 для каждого из mAb 4A2, 310, 313, 338 и 345. На фиг.3 и 4 показана нейтрализация клеток HUVEC и HFF соответственно каждым из mAb 4A2, 310, 313, 338 и 345. Результаты получали в двух экземплярах.
Также тестировали другие mAb, которые нейтрализуют штаммы AD169 и VR1814.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
4A2 HC, VH3-30: нуклеиновые кислоты (SEQ ID NO:1) и аминокислоты (SEQ ID NO:2)

4A2 LC L6, IgKV3-11: нуклеиновые кислоты (SEQ ID NO:3) и аминокислоты (SEQ ID NO:4)

19B10 HC VH4-31, D2, J6: нуклеиновые кислоты (SEQ ID NO:5) и аминокислоты (SEQ ID NO:6)

19B10 LC, A3, IgKV2: нуклеиновые кислоты (SEQ ID NO:7) и аминокислоты (SEQ ID NO:8)

Аминокислотная последовательность константной области HC IgG1 человека (SEQ ID NO:9)
ASTKGPSVFPLVPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Аминокислотная последовательность вариабельного домена HC MAB297 (SEQ ID NO:10)
QVQLVQSGGGVVQPGRSLRLSCSASGFTFSNYNMHWVRQAPGKGPEWVAVISKDGNEKHYAESAKGRFTISRDNSKNTLYMEMHSLTPEDTAMYYCTRDGRTDGTGYSGILDIWGQGTKVIVS
Аминокислотная последовательность вариабельного домена HC MAB309 и 318 (SEQ ID NO:11)
QVQLVQSGGGVVQPGTSLRLSCAASGFMFNTYNMHWVRQAPGKGLEWVAVISNDGTYKHFADSLKGRFSISRDDSKNTLYLHMNSLRPDDTAIYYCARDGRSVGGFSGILDPWGQGTLVTVSS
Аминокислотная последовательность вариабельного домена HC MAB310 (SEQ ID NO:12)
QVQLVQSGGGVVQPGTSLRLSCAASGFMFNTYNMHWVRQAPGKGLEWVAVISNDGTYKYSADSL
KGRFSISRDNSKNTLYLHMNSLRPDDTAVYYCARDGRSVGGFSGILDPWGQGTLVTVSS
Аминокислотная последовательность вариабельного домена HC MAB313 (SEQ ID NO:13)
QVQLVQSGGGVIQPGRSLTLSCAASGFTFSAYSLHWVRQAPGKGLQWVAVISFDGNFKHFADSLRGRFTISRDNSKNRFYLQMNGLRGEDTAVYYCARDGRAVDGFSGILDFWGQGTLVSVSS
Аминокислотная последовательность вариабельного домена HC MAB314 (SEQ ID NO:14)
QVQLQESGGGLVQPGGSLKLSCAVSGFSFGGSAMHWVRQASGKGLEWIGHIRSGANNFETAYAPSLDGRFTISRDDSKNTAYLHMNSLKTDDTAMYFCTTGLIASGDANFDYWGQGTQVTVSS
Аминокислотная последовательность вариабельного домена HC MAB316 (SEQ ID NO:15)
QVQLVQSGGGVVQPGRSLTLSCAASGFTFSGFSLHWVRQAPGKGLQWVAVISFDGNHKHFADSLKGRFTISRDNSKNTLYLQINDLRGEDTAVYYCARDGRAVDGFSGILDFWGQGTLVSVSS
Аминокислотная последовательность вариабельного домена HC MAB319 (SEQ ID NO:16)
QVQLVESGGGVVQPGRSLRLSCSASGFTFSDYNLHWVRQAPGKGLEWVAVISIDGSDKHHADSVKGRFTVSRDNSKNTVSLQMDSLRPEDTAVYYCARDGRSVGGYSGILDPWGQGTLVTVSS
Аминокислотная последовательность вариабельного домена HC MAB321 (SEQ ID NO:17)
EVQLVESGAEVKKPGESLKISCQGSGYRFTNYWIAWVRQMPGKGLEWMGIIYPGDSDTRYHPSFQGQVTISSDKSLNTAYLQWSSLKPSDTAVYYCARHHCLSTNCQTAVAGYNDYWGQGNPGRRLLS
Аминокислотная последовательность вариабельного домена HC MAB322 (SEQ ID NO:18)
QVQLVQSGGGVVQPGRSLRLSCSASGFTFTNYNMHWVRQAPGKGLEWVAVTSKDGNEKHFADSVKGRFTISRDNSKNTLYLEMNTLTAEDTAIYYCTRDGRTDGTGYSGILDIWGQGTKVTVSS
Аминокислотная последовательность вариабельного домена HC MAB323 (SEQ ID NO:19)
QVQLVQSGGGVVQPGRSLRLSCAASGFTFSNFAMHWVRQAPGKGLEWVAVISNAGRETHYADSVKGRFTVSRDNSKNMLSLQMNSLRGEDTAVYYCARDGRTDGSGYSGVLDIWAQGTLVTVSS
Аминокислотная последовательность вариабельного домена HC MAB338 (SEQ ID NO:20)
QVQLVESGGGVVQPGRSLRLSCSGSGFTFSDYNLHWVRQAPGKGLEWVAVISIDGTNKHHADSVKGRFTISRDNSKNTVNLEMSRLKAEDTAVYYCVRDGRSIGGYSGIFDPWGQGTLVTVSS
Аминокислотная последовательность вариабельного домена HC MAB343 (SEQ ID NO:21)
QVQLQESGGGVVQPGRSLRLSCAASGFTFNTYNMHWVRQAPGKGLEWVAVISNDGTYKYSADSVKGRFSISRGNSKNTLYLQMNSLRPDDTAVYYCARDGRSVGGFSGILDPWGQGTLATVSS
Аминокислотная последовательность вариабельного домена HC MAB345 (SEQ ID NO:22)
QVQLVESGGGVVQPGRSLRLSCAASGFTFSDYNMHWVRQAPGKGLEWVAVISIDGTYKYSADSVAGRFSLSRDNSKNTLYLQMNSLRPDDTAIYYCARDGRSVGGFSGILDPWGQGTLVTVSS
Аминокислотная последовательность константной области каппа LC человека (SEQ ID NO:23)
TVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Аминокислотная последовательность вариабельного домена LC MAB297 и MAB322 (SEQ ID NO:24)
EIVMTQSPATLSLSPGERATLSCRASQSVGGYLAWYQQKPDQAPRLLIYDVSNRAAGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRNTWPPLTFGGGTKVEIKR
Аминокислотная последовательность вариабельного домена LC MAB309 (SEQ ID NO:25)
EIVLTQSPATLSLSPGDRATLSCRASQTVGRYLAWYQQKPGQAPRLLIYDASDRATGISARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSSWPPLTFGGGTKVEIKR
Аминокислотная последовательность вариабельного домена LC MAB310 (SEQ ID NO:26)
EIVLTQSPATLSLSPGDRATLSCRASQTVGRYLAWYQQKPGQAPRLLIYDASDRATGISARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPLTFGGGTKVEIKR
Аминокислотная последовательность вариабельного домена LC MAB313 (SEQ ID NO:27)
EIVMTQSPATLSLSPGERATLSCRASQSVGRYLTWFQQKPGQAPRLLIYDASERATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRANWPPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB314 (SEQ ID NO:28)
EIVMTQSPGTLSLFPGERATLSCRASQTVRNGYLAWYQQKPGQAPRLLIYGASIRATGIPDRFSGSGSETDFTLSITRVEPEDFAVYYCQQYGRLSSTFGQGTKLDLK
Аминокислотная последовательность вариабельного домена LC MAB316 (SEQ ID NO:29)
EIVMTQSPATLSLSPGERATLSCRASQSVGRYLTWFQQKPGQAPRLLIYDASERATGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB318 (SEQ ID NO:30)
EVVLTQSPATLSLSPGDRATLSCRASQTVGRYLAWYQQKPGQAPRLLIYDASDRATGISARFSGSGSGTDFTLTIGSLEPEDFAVYYCQQRSSWPPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB319 (SEQ ID NO:31)
EIVLTQSPATLSLSPGERATLSCRASQSVGSYLAWYQQKPGQAPRLLIYDASERATGIPARFSGSGSGTDFTLTISSLEPEDVAVYYCQQRNNWPPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB321 (SEQ ID NO:32)
EIVMTQSPDSLAVSLGERATINCKSSQSILFSSKNQNHLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYNIPHTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB323 (SEQ ID NO:33)
EIVLTQSPATLSLSPGERATLSCRASQSVNRYLAWFQHRPGQPPRLLIYDASKRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB338 (SEQ ID NO:34)
EIVLTQSPATLSLSPGERATLSCRASQSVDRYLAWYQQKPGQAPRLLIYDASQRATGIPARFSGSGSGTDFTLAISSLEPEDVAVYYCQQRSNWPPLTFGGGTKIEIK
Аминокислотная последовательность вариабельного домена LC MAB343 (SEQ ID NO:35)
EIVMTQSPATLSLSPGDRATLSCRASQSVGSYLAWYQQKPGQAPRLLIYDASDRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPLTFGGGTKVEIK
Аминокислотная последовательность вариабельного домена LC MAB345 (SEQ ID NO:36)
EIVMTQSPATLSLSPGDRATLSCRASQSVGSYLAWYQQKPGQAPRLLMYDSSVRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRNNWPPLTFGGGTKVEIK
Нуклеотидная последовательность константной области HC IgG1 человека (интроны подчеркнуты) (SEQ ID NO:37)
GCCTCCACCAAGGGCCCATCAGTCTTCCCCCTGGCACCCTCTACCAAGAGCACCTCTGGGGGCACAACGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGGTGAGAGGCCAGCACAGGGAGGGAGGGTGTCTGCTGGAAGCCAGGCTCAGCGCTCCTGCCTGGACGCATCCCGGCTATGCAGTCCCAGTCCAGGGCAGCAAGGCAGGCCCCGTCTGCCTCTTCACCCGGAGGCCTCTGCCCGCCCCACTCATGCTCAGGGAGAGGGTCTTCTGGCTTTTTCCCCAGGCTCTGGGCAGGCACAGGCTAGGTGCCCCTAACCCAGGCCCTGCACACAAAGGGGCAGGTGCTGGGCTCAGACCTGCCAAGAGCCATATCCGGGAGGACCCTGCCCCTGACCTAAGCCCACCCCAAAGGCCAAACTCTCCACTCCCTCAGCTCGGACACCTTCTCTCCTCCCAGATTCCAGTAACTCCCAATCTTCTCTCTGCAGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGGTAAGCCAGCCCAGGCCTCGCCCTCCAGCTCAAGGCGGGACAGGTGCCCTAGAGTAGCCTGCATCCAGGGACAGGCCCCAGCCGGGTGCTGACACGTCCACCTCCATCTCTTCCTCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGTGGGACCCGTGGGGTGCGAGGGCCACATGGACAGAGGCCGGCTCGGCCCACCCTCTGCCCTGAGAGTGACCGCTGTACCAACCTCTGTCCCTACAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCCCCGGGTAAATGA
Нуклеотидная последовательность вариабельного домена НС MAB297 (SEQ ID NO:38)
CAGGTGCAACTGGTGCAGTCTGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTTCAGCCTCTGGATTCACCTTCAGCAACTATAATATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCCGGAGTGGGTGGCAGTTATATCAAAAGATGGAAACGAAAAACACTATGCAGAGTCTGCGAAGGGCCGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATATGGAAATGCACAGCCTGACACCTGAGGACACGGCTATGTATTACTGTACGAGAGATGGGCGAACCGATGGTACTGGGTACTCCGGTATTCTTGATATCTGGGGCCAAGGGACAAAGGTCATCGTCTCT
Нуклеотидная последовательность вариабельного домена HC MAB309 и 318 (SEQ ID NO:39)
CAGGTGCAGCTGGTGCAGTCTGGGGGAGGCGTGGTCCAGCCTGGGACGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCATGTTCAATACCTATAATATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTATATCAAATGATGGAACCTATAAGCATTTCGCTGACTCCCTGAAGGGCCGATTCAGCATCTCCAGAGACGATTCCAAGAACACGCTGTATCTGCACATGAACAGCCTGAGACCTGACGACACGGCTATATATTACTGTGCGAGAGATGGCCGTAGTGTTGGCGGGTTTAGTGGGATCCTCGACCCCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB310 (SEQ ID NO:40)
CAGGTGCAGCTGGTGCAGTCTGGGGGAGGCGTGGTCCAGCCTGGGACGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCATGTTCAATACCTACAATATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTATATCAAATGATGGAACCTATAAGTACTCCGCTGACTCCCTGAAGGGCCGATTCAGCATCTCCAGAGACAATTCCAAGAACACGTTGTATCTGCACATGAACAGCCTGAGACCTGACGACACGGCTGTATATTACTGTGCGAGAGATGGCCGTAGTGTTGGCGGGTTTAGTGGGATCCTCGACCCCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB313 (SEQ ID NO:41)
CAGGTGCAGCTGGTGCAGTCTGGGGGAGGCGTGATCCAGCCTGGGAGGTCCCTGACACTCTCCTGTGCAGCCTCTGGATTCACCTTCAGTGCCTATTCTCTACACTGGGTCCGCCAGGCTCCAGGCAAAGGGCTACAGTGGGTGGCGGTTATCTCATTTGATGGGAATTTTAAACACTTCGCAGACTCCCTGAGGGGCCGATTCACCATCTCCAGAGACAATTCCAAGAACAGATTCTATTTGCAAATGAATGGCCTGAGAGGTGAGGACACGGCTGTATATTACTGTGCGAGAGATGGACGTGCTGTTGACGGGTTTAGTGGGATCCTCGACTTCTGGGGCCAGGGAACCCTAGTCAGCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB314 (SEQ ID NO:42)
CAGGTGCAGCTGCAGGAGTCGGGGGGAGGCTTGGTCCAGCCGGGGGGGTCCCTGAAACTCTCCTGTGCAGTCTCTGGATTCTCCTTCGGTGGCTCTGCAATGCACTGGGTCCGCCAGGCTTCCGGGAAAGGGCTGGAGTGGATTGGCCATATTAGAAGCGGAGCTAATAATTTCGAGACAGCATATGCTCCGTCGCTGGATGGCAGGTTCACCATCTCCAGAGACGATTCAAAGAACACGGCGTATCTGCACATGAACAGCCTGAAAACCGATGACACGGCCATGTATTTCTGCACTACCGGACTTATAGCGTCAGGTGATGCAAATTTTGACTACTGGGGCCAGGGAACCCAGGTCACCGTCTCCTCGG
Нуклеотидная последовательность вариабельного домена HC MAB316 (SEQ ID NO:43)
CAGGTGCAGCTGGTGCAGTCTGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGACACTCTCCTGTGCAGCCTCTGGATTCACCTTCAGTGGCTTTTCTCTACACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTACAGTGGGTGGCGGTTATCTCATTTGATGGGAACCATAAACACTTCGCAGACTCCCTGAAGGGCCGATTCACCATCTCCAGAGACAATTCCAAGAACACATTGTATTTGCAAATTAATGACCTGAGAGGTGAGGACACGGCTGTATATTACTGTGCGAGAGATGGACGTGCTGTTGACGGGTTTAGTGGGATTCTCGACTTCTGGGGCCAGGGAACCCTGGTCAGCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB319 (SEQ ID NO:44)
CAGGTGCAGCTGGTGGAGTCTGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTTCAGCCTCAGGATTCACCTTCAGTGACTATAATCTACACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTCATCTCAATTGATGGAAGCGATAAACACCACGCAGACTCCGTGAAGGGCCGATTCACCGTCTCCAGAGACAATTCCAAGAACACAGTGAGTCTACAAATGGACAGCCTGAGACCTGAAGACACGGCTGTATATTACTGTGCGAGAGATGGCCGTAGTGTGGGCGGCTACAGTGGGATCCTCGACCCCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB321 (SEQ ID NO:45)
GAGGTGCAGCTGGTGGAGTCCGGAGCAGAGGTGAAAAAGCCCGGGGAGTCTCTGAAGATCTCCTGTCAGGGTTCTGGATACAGGTTTACCAATTACTGGATCGCCTGGGTGCGCCAGATGCCCGGGAAAGGCCTGGAGTGGATGGGGATCATCTATCCTGGTGACTCTGATACCAGATATCACCCGTCCTTCCAAGGCCAGGTCACCATCTCATCCGACAAATCCCTCAACACCGCCTACCTGCAGTGGAGCAGCCTGAAGCCCTCGGACACCGCCGTGTATTACTGTGCGAGACACCACTGCCTTAGTACCAACTGCCAAACCGCAGTGGCTGGATATAATGACTACTGGGGCCAGGGAAACCCTGGTCGCCGTCTCCTCAG
Нуклеотидная последовательность вариабельного домена HC MAB322 (SEQ ID NO:46)
CAGGTGCAGCTGGTGGAGTCCGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTTTCCTGTTCAGCCTCTGGATTCACCTTCACCAACTATAACATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTACGTCAAAAGATGGAAACGAAAAACACTTTGCAGACTCCGTGAAGGGCCGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGGAAATGAACACCCTGACAGCTGAGGACACGGCGATATATTACTGTACGAGAGATGGGCGAACCGATGGTACTGGGTACTCCGGTATTCTTGATATCTGGGGCCAAGGGACAAAGGTCACCGTCTCCTCA
Нуклеотидная последовательность вариабельного домена HC MAB323 (SEQ ID NO:47)
CAGGTGCAGCTGGTGCAGTCTGGGGGAGGGGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTCAGTAACTTTGCTATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTATATCAAATGCTGGAAGGGAAACACACTACGCAGACTCCGTGAAGGGCCGATTCACCGTCTCCAGAGACAATTCCAAGAATATGTTGTCTCTGCAAATGAACAGCCTGAGAGGTGAGGACACGGCTGTGTATTACTGTGCGAGAGATGGGCGAACCGATGGTAGTGGCTATTCCGGTGTTCTTGATATCTGGGCCCAAGGGACACTGGTCACTGTCTCCTCA
Нуклеотидная последовательность вариабельного домена HC MAB338 (SEQ ID NO:48)
CAGGTGCAGCTGGTGGAGTCCGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTTCAGGCTCTGGATTCACCTTCAGTGACTATAATCTACACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAATGGGTGGCAGTCATTTCAATTGATGGAACTAATAAACACCACGCAGACTCCGTGAAGGGCCGATTCACCATCTCCAGAGACAACTCCAAGAATACAGTGAATCTGGAAATGAGTCGGCTGAAAGCAGAAGACACGGCTGTATATTACTGTGTGAGAGATGGGCGAAGTATTGGCGGCTACAGTGGAATCTTCGACCCCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCA
Нуклеотидная последовательность вариабельного домена HC MAB343 (SEQ ID NO:49)
CAGGTGCAGCTGCAGGAGTCAGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTCAATACCTACAATATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTATATCAAATGATGGAACCTATAAATACTCCGCTGACTCCGTGAAGGGCCGATTCAGCATCTCCAGAGGCAATTCCAAGAACACGTTGTATCTGCAGATGAACAGCCTGAGACCTGACGACACGGCTGTATATTACTGTGCGAGAGATGGGCGTAGTGTTGGCGGGTTTAGTGGGATCCTCGACCCCTGGGGCCAGGGAACCCTGGCCACCGTCTCCTCA
Нуклеотидная последовательность вариабельного домена HC MAB345 (SEQ ID NO:50)
CAGGTGCAGCTGGTGGAGTCCGGGGGAGGCGTGGTCCAGCCTGGGAGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTCAGTGACTACAATATGCACTGGGTCCGCCAGGCTCCAGGCAAGGGGCTGGAGTGGGTGGCAGTTATTTCAATTGATGGAACGTATAAATACTCCGCTGACTCCGTGGCGGGCCGATTCAGTCTCTCCAGAGACAATTCCAAGAACACGTTGTATTTGCAGATGAATAGTCTGAGACCTGACGACACGGCTATATATTATTGCGCGAGAGATGGGCGTAGTGTTGGCGGGTTTAGTGGGATCCTCGACCCCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCAG
Нуклеотидная последовательность константной области каппа LC человека (SEQ ID NO:51)
ACTGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCTAGCGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGTTAG
Нуклеотидная последовательность вариабельного домена LC MAB297 и MAB322 (SEQ ID NO:52)
GAAATTGTAATGACGCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCGGCTACTTAGCCTGGTACCAACAGAAACCTGACCAGGCTCCCAGGCTCCTCATCTATGATGTTTCCAATAGGGCCGCTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAGCAGCCTGGAGCCTGAAGATTTTGCAGTTTATTACTGTCAGCAGCGGAACACCTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAACGA
Нуклеотидная последовательность вариабельного домена LC MAB309 (SEQ ID NO:53)
GAAATTGTGTTGACGCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGATAGAGCCACCCTCTCCTGCAGGGCCAGTCAGACTGTTGGCAGGTACTTAGCCTGGTACCAACAAAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGACAGGGCCACTGGCATCTCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGGAGCCTGAAGATTTTGCAGTCTATTACTGTCAGCAGCGGAGCAGCTGGCCGCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAACGA
Нуклеотидная последовательность вариабельного домена LC MAB310 (SEQ ID NO:54)
GAAATTGTGTTGACTCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGATAGAGCCACCCTCTCCTGCAGGGCCAGTCAGACTGTTGGCAGGTACTTAGCCTGGTACCAACAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGACAGGGCCACTGGCATCTCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTCTATTACTGTCAGCAGCGGAGCAACTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAACGA
Нуклеотидная последовательность вариабельного домена LC MAB313 (SEQ ID NO:55)
GAAATTGTGATGACTCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCAGATACTTAACTTGGTTCCAGCAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGAGAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTTTATTACTGTCAACAGCGTGCTAACTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAACGA
Нуклеотидная последовательность вариабельного домена LC MAB314 (SEQ ID NO:56)
GAAATTGTGATGACCCAGTCTCCAGGCACCCTGTCCTTGTTTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCAGACTGTTAGGAACGGCTACTTAGCCTGGTACCAGCAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGGTGCTTCCATCAGGGCCACTGGCATCCCAGACAGGTTCAGTGGCAGTGGGTCTGAGACAGACTTCACCCTCAGCATCACCAGAGTGGAGCCTGAAGATTTTGCAGTTTATTACTGTCAACAGTATGGAAGGTTATCGTCCACTTTTGGCCAGGGGACCAAGCTGGACCTCAAACGA
Нуклеотидная последовательность вариабельного домена LC MAB316 (SEQ ID NO:57)
GAAATTGTGATGACCCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCAGATACTTAACTTGGTTCCAGCAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGAGAGGGCCACTGGCGTCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTTTATTACTGTCAACAGCGTAGTAACTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAAC
Нуклеотидная последовательность вариабельного домена LC MAB318 (SEQ ID NO:58)
GAAGTTGTGCTGACGCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGATAGAGCCACCCTCTCCTGCAGGGCCAGTCAGACTGTTGGCAGGTACTTAGCCTGGTACCAACAAAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGACAGGGCCACTGGCATCTCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGATTTCACTCTCACCATCGGCAGCCTGGAGCCTGAAGATTTTGCAGTCTATTACTGTCAGCAGCGGAGCAGCTGGCCGCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAAC
Нуклеотидная последовательность вариабельного домена LC MAB319 (SEQ ID NO:59)
GAAATTGTGTTGACGCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGGGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCAGCTACTTAGCCTGGTATCAACAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCATCCGAGAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATGTTGCAGTTTATTACTGTCAGCAGCGTAACAACTGGCCTCCGCTCACCTTCGGCGGAGGGACCAAGGTGGAGATCAAAC
Нуклеотидная последовательность вариабельного домена LC MAB321 (SEQ ID NO:60)
GAAATTGTGATGACCCAGTCTCCAGACTCCCTTGCTGTGTCTCTGGGCGAGAGGGCCACCATCAACTGCAAGTCCAGTCAGAGTATTTTATTCAGCTCCAAGAATCAGAACCACTTAGCTTGGTACCAGCAGAAACCAGGACAGCCTCCTAAGCTGCTGATTTACTGGGCATCTACCCGGGAATCCGGGGTCCCCGACCGATTCAGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTCCAGGCTGAAGATGTGGCAGTTTATTACTGTCAGCAATATTATAATATTCCTCACACTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
Нуклеотидная последовательность вариабельного домена LC MAB323 (SEQ ID NO:61)
GAAATTGTGTTGACTCAGTCTCCAGCCACCTTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCCGGGCCAGTCAGAGTGTTAACCGCTACTTAGCCTGGTTCCAACACAGACCTGGCCAGCCTCCCAGGCTCCTCATCTATGATGCGTCCAAGAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGACTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTTTATTACTGTCAGCAGCGTAGCAACTGGCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAG
Нуклеотидная последовательность вариабельного домена LC MAB338 (SEQ ID NO:62)
GAAATTGTGTTGACCCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGACAGGTACTTAGCCTGGTACCAACAGAAACCTGGCCAGGCTCCCAGACTCCTCATCTATGATGCATCCCAGAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCCGGGACAGACTTCACTCTCGCCATCAGCAGCCTGGAGCCTGAAGATGTTGCAGTTTATTACTGTCAGCAGCGTAGTAACTGGCCTCCGCTCACCTTCGGCGGAGGGACCAAAATAGAGATCAAA
Нуклеотидная последовательность вариабельного домена LC MAB343 (SEQ ID NO:63)
GAAATCGTGATGACCCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGATAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCAGCTACTTAGCCTGGTACCAACAGAAACCTGGCCAGGCTCCCAGGCTCCTCATCTATGATGCTTCCGACAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGTGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTTTATTACTGTCAGCAGCGTAGCAACTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAAC
Нуклеотидная последовательность вариабельного домена LC MAB345 (SEQ ID NO:64)
GAAATTGTGATGACCCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGATAGAGCCACCCTCTCCTGCAGGGCCAGTCAGAGTGTTGGCAGCTACTTAGCCTGGTACCAACAGAAACCTGGCCAGGCTCCCAGGCTCCTCATGTATGATTCTTCCGTCAGGGCCACTGGCATCCCAGCCAGGTTCAGTGGCAGCGGGTCTGGGACAGATTTCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGTTTATTACTGTCAGCAGCGTAACAACTGGCCTCCGCTCACTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
Нуклеотидная последовательность константной области каппа LC человека (SEQ ID NO:65)
ACTGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCTAGCGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGTTAG
Нуклеотидная последовательность константной области лямбда LC человека (SEQ ID NO:66)
GGTCAGCCCAAGGCTGCCCCCTCTGTCACTCTGTTCCCGCCCTCTAGCGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCCTGGAAGGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGTCCCTGCAGAATGCTCT