Результат интеллектуальной деятельности: НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА ЗАЯВКИ
В данной заявке заявляет приоритет предварительной заявки США 61/421157 поданной 8 декабря 2010 года и заявки PCT/US2011/050451, поданной 2 сентября 2011 года, каждая из которых включена в данную заявку посредством ссылки во всей полноте.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был представлен в ASCII формате посредством EFS-Web и включен в данную заявку посредством ссылки во всей полноте. Указанная копия ASCII, созданная 22 ноября 2011 года, называется 11200PCT.txt и имеет размер 80102 байт.
Область изобретения
Заявка в целом относится к новым композициям и способам их применения в предупреждении, лечении или облегчении гиперпролиферативных расстройств и любого их распространения, повторного проявления, рецидива или метастазов. В широком аспекте настоящее изобретение относится к применению модуляторов лигандов эфринов A (EFNA), включая анти-EFNA антитела и слитые конструкции, для лечения или профилактики опухолевых заболеваний. В особенно предпочтительных воплощениях настоящего изобретения предложено применение таких EFNA-модуляторов для иммунотерапевтического лечения злокачественных образований, включающего снижение частоты появления опухоль-инициирующих клеток.
Предшествующий уровень техники
Дифференцировка стволовых клеток и клеток-предшественников, а также клеточная пролиферация являются нормальными непрерывными процессами, которые действуют совместно для поддержания роста тканей во время органогенеза, а также замены клеток и восстановления большинства тканей в течение жизни всех живых организмов. Решения о дифференцировке и пролиферации часто контролируется многочисленными факторами и сигналами, которые уравновешены так, чтобы поддерживать решения относительно судьбы клеток и архитектуры тканей. Нормальная архитектура ткани в основном сохраняется клетками в ответ на сигналы микроокружения, которые регулируют деление клеток и созревание тканей. Соответственно, клеточная пролиферация и дифференцировка обычно происходит только по мере необходимости для замены поврежденных или умирающих клеток или для роста. К сожалению, нарушение клеточной пролиферации и/или дифференцировки может быть результатом множества факторов, в том числе, например, недостатка или избытка различных химических агентов, участвующих в передаче сигналов, наличия измененного микроокружения, генетических мутаций или любой их комбинации. Нарушение или какое-либо расстройство нормальной клеточной пролиферации и/или дифференцировки может привести к различным заболеваниям или расстройствам, в том числе к гиперпролиферативным расстройствам, таким как рак.
Обычные методы лечения рака включают химиотерапию, лучевую терапию, хирургию, иммунотерапию (например, модификаторы биологического ответа, вакцины или терапевтические средства направленного действия) или их комбинации. К сожалению, слишком многие виды рака не отвечают или минимально отвечают на такие традиционные методы лечения, предоставляя пациентам небольшой выбор. Например, у ряда больных в случае некоторых видов рака обнаруживаются генные мутации, которые делают их нечувствительными, несмотря на общую эффективность выбранной терапии. Кроме того, в зависимости от типа рака, некоторые доступные виды лечения, такие как хирургия, не являются реальной альтернативой. Ограничения, присущие существующим терапевтическим средствам, представляющим стандарт лечения, особенно очевидны при попытке лечить пациентов, прошедших предыдущее лечение и имеющих после этого рецидивы. В таких случаях безрезультатные схемы лечения и результирующее ухудшение состояния пациента может содействовать трудноизлечимым опухолям, которые часто проявляются, как более агрессивное заболевание, которое в конечном счете оказывается неизлечимым. Несмотря на большие успехи в диагностике и лечении рака на протяжении многих лет, уровень общей выживаемости для многих солидных опухолей остается в значительной степени неизменным из-за неспособности существующих методов лечения предотвратить рецидив, повторное проявление опухоли и метастазы. Таким образом, остается проблема разработки более целенаправленной и эффективной терапии.
Одно из перспективных направлений исследований предполагает использование терапевтических средств направленного действия для поиска онкогенных "затравочных" клеток, которые, по-видимому, лежат в основе многих видов рака. Исходя из этого, в настоящее время известно, что большинство твердых тканей содержит популяции взрослых, расположенных в тканях, стволовых клеток, образующих дифференцированные клеточные типы, которые составляют большую часть этой ткани. Опухоли, образующиеся в этих тканях, также состоят из гетерогенных популяций клеток, которые также возникают из стволовых клеток, но заметно отличаются по своей общей пролиферации и организации. Хотя все чаще признается, что большинство опухолевых клеток имеют ограниченную способность к пролиферации, меньшая часть популяции раковых клеток (общеизвестная как раковые стволовые клетки или CSC) обладают исключительной способностью активно самообновляться, тем самым наделяя опухоль присущей ей способностью к возобновлению. Более конкретно, гипотеза раковых стволовых клеток предполагает, что существует отдельная подгруппа клеток (то есть CSC) в каждой опухоли (приблизительно 0,1-10%), которая способна неограниченно самообновляться и образовывать опухолевые клетки с постепенным ограничением их репликативной способности в результате дифференцировки в клетки-предшественники опухоли и затем в окончательно дифференцированные опухолевые клетки.
В последние годы стало более очевидно, что эти CSC (также известные как клетки, поддерживающие опухоль, или ТРС) могут быть более резистентными к традиционным химиотерапевтическим агентам или облучению и, таким образом, сохраняться после стандартного клинического лечения, чтобы позже стимулировать рост трудноизлечимых опухолей, вторичных опухолей и содействовать образованию метастазов. Кроме того, растущие доказательства свидетельствуют о том, что пути, регулирующие органогенез и/или самообновление расположенных в нормальных тканях стволовых клеток, разрегулированы или изменены в CSC, что приводит к непрерывному увеличению количества самообновляющихся раковых клеток и к образованию опухоли. См. в целом Al-Hajj et al., 2004, PMID: 15378087; и Dalerba et al., 2007, PMID: 17548814; каждый из которых включен в настоящее описание во всей полноте посредством ссылки. Таким образом, эффективность традиционных, а также более поздних методов лечения посредством направленной доставки, по-видимому, ограничена существованием и/или появлением резистентных раковых клеток, которые способны поддерживать рак, даже несмотря на эти разнообразные методы лечения. Huff et al., European Journal of Cancer 42: 1293-1297 (2006) и Zhou et al., Nature Reviews Drug Discovery 8: 806-823 (2009), каждый из которых включен в настоящее описание во всей полноте посредством ссылки. Такие наблюдения подтверждены устойчивой неспособностью традиционных циторедуктивных агентов существенно увеличивать выживаемость пациентов, страдающих от солидных опухолей, а также развитием более тонкого понимания того, как опухоли растут, рецидивируют и метастазируют. Соответственно, недавние стратегии лечения опухолевых заболеваний признали важность ликвидации, уменьшения, подавления или стимуляции дифференцировки клеток, поддерживающих опухоль, с тем, чтобы уменьшить возможность повторного проявления опухоли, метастазов или рецидивов у пациента.
Усилия по разработке таких стратегий включают последние работы с использованием нетрадиционных ксенотрансплантатных (NTX) моделей, в которых образцы первичных человеческих солидных опухолей имплантировали и пассировали исключительно мышам с ослабленным иммунитетом. На многочисленных видах раковых заболеваний такие способы подтверждают существование субпопуляции клеток с уникальной способностью образовывать гетерогенные опухоли и поддерживать их рост в течение неопределенного времени. Как ранее предполагалось, работа на NTX моделях подтверждает, что идентифицированные CSC-субпопуляции опухолевых клеток являются более резистентными к циторедуктивным схемам лечения, таким как химиотерапия и лучевая терапия, что может объяснить несоответствие между показателями клинического ответа и общей выживаемостью. Кроме того, применение NTX-моделей в исследовании CSC вызвало фундаментальное изменение в разработке лекарственных средств и в доклинической оценке кандидатов в лекарственные средства, которые могут привести к CSC-нацеленной терапии, оказывающей существенное воздействие на повторное проявление опухоли и метастазирование, и, тем самым, повышая выживаемость пациентов. Несмотря на прогресс, главными проблемами являются имеющиеся технические трудности, связанные с обработкой первичной и/или ксенотрансплантатной опухолевой ткани, наряду с отсутствием экспериментальных оснований для характеристики отличительных особенностей CSC и способности к дифференцировке. Таким образом, по-прежнему сохраняется существенная потребность в селективном нацеливании на раковые стволовые клетки и разработке диагностических, профилактических или терапевтических соединений и методов, которые можно использовать в лечении, предупреждении и/или контролировании гиперпролиферативных расстройств.
Краткое изложение сущности изобретения
Эти и другие цели предусмотрены настоящим изобретением, которое в широком смысле относится к способам, соединениям, композициям и изделиям, которые можно использовать в лечении EFNA-ассоциированных расстройств (например, гиперпролиферативных расстройств или опухолевых заболеваний). В связи с этим в настоящем изобретении предлагаются новые модуляторы EFNA (или лиганда эфрина А), которые эффективно нацелены на опухолевые или раковые стволовые клетки и могут быть использованы для лечения пациентов, страдающих от широкого спектра злокачественных образований. Как будет обсуждаться более подробно ниже, в настоящее время имеется шесть известных лигандов эфринов А (то есть EFNA 1-6) и раскрытые модуляторы могут содержать любой один или более лиганд эфрин А или соединяться с любым одним или более лигандами эфринами А. Кроме того, в некоторых воплощения раскрытые модуляторы EFNA могут содержать любое соединение, которое распознает, конкурирует, является агонистом, является антагонистом, взаимодействует, связывается или соединяется с полипептидом EFNA, его рецептором или его геном и модулирует, регулирует, изменяет, меняет или модифицирует воздействие белка EFNA на один или более физиологических путей. Таким образом, в широком смысле настоящее изобретение относится к выделенным модуляторам EFNA. В предпочтительных воплощениях изобретение более конкретно относится к выделенным модуляторам EFNA1 или выделенным модуляторам EFNA4 (то есть модуляторам, которые содержат по меньшей мере EFNA1 или EFNA4 или соединены с ними). Кроме того, как подробно рассмотрено ниже, такие модуляторы могут быть использованы для получения фармацевтических композиций.
В отдельных воплощениях изобретения модуляторы EFNA могут содержать сам лиганд эфрин А или его фрагмент либо в выделенной форме, либо слитым, либо соединенным с другими группировками (например, Fc-EFNA, PEG-EFNA или EFNA, соединенный с группировкой, обеспечивающей направленную доставку). В других выбранных воплощениях модуляторы EFNA могут содержать антагонисты EFNA, которые в контексте настоящей заявки, означают любую конструкцию или соединение, которое распознает, конкурирует, взаимодействует, связывается или соединяется с EFNA и нейтрализует, устраняет, уменьшает, сенсибилизирует, перепрограммирует, ингибирует или контролирует рост опухолевых клеток, в том числе опухоль-инициирующих клеток. В предпочтительных воплощениях модуляторы EFNA по настоящему изобретению содержат анти-EFNA антитела или их фрагменты или их производные, которые, как было неожиданно обнаружено, останавливают, нейтрализуют, снижают, уменьшают, истощают, сдерживают, ослабляют, перепрограммируют, устраняют или иным способом ингибируют способность опухоль-инициирующих клеток размножаться, сохраняться, распространяться, пролиферировать или другим способом содействовать выживанию, повторному проявлению, регенерации и/или метастазированию опухолевых клеток. В особенно предпочтительных воплощениях антитела или иммунореактивные фрагменты могут быть соединены или конъюгированы с одним или более противораковыми агентами.
В одном воплощении модулятор EFNA может содержать гуманизированное антитело, где указанное антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:149, SEQ ID NO:153, SEQ ID NO:157 и SEQ ID NO:161, и аминокислотную последовательность вариабельной области легкой цепи, выбранную из группы, состоящей из SEQ ID NO:151, SEQ ID NO:155, SEQ ID NO:159 и SEQ ID NO:163. В других предпочтительных воплощениях изобретение будет представлено в виде композиции, содержащей гуманизированное антитело, выбранное из группы, состоящей из hSC4.5, hSC4.15, hSC4.22 и hSC4.47, и фармацевтически приемлемого носителя. В другом предпочтительном воплощении модулятор EFNA может содержать антитело, которое содержит один или более CDR с Фиг.7А (SEQ ID NO:8-59 и 70-95). Предпочтительно, антитело, содержащее по меньшей мере одну CDR с Фиг.7А, включает гуманизированное антитело.
В некоторых других воплощениях изобретение включает модулятор EFNA, который снижает частоту появления опухоль-инициирующих клеток при введении субъекту. Предпочтительно уменьшение частоты появления определяют, используя анализ методом серийных разведений in vitro или in vivo. В особенно предпочтительных воплощениях такой анализ может быть выполнен с использованием анализа методом серийных разведений in vivo, включающего трансплантацию живых опухолевых клеток человека мышам с ослабленным иммунитетом. Альтернативно, анализ методом серийных разведений может быть выполнен с использованием анализа методом серийных разведений in vitro, включающего посев живых опухолевых клеток человека in vitro методом серийных разведений в условиях, поддерживающих образование колоний. В любом случае анализ, вычисление или количественное определение снижения частоты появления предпочтительно включает использование статистических параметров распределения Пуассона для обеспечения точного подсчета. Следует иметь в виду, что, хотя такие количественные методы являются предпочтительными, другие, менее трудоемкие методы, такие как проточная цитометрия или иммуногистохимия, также могут быть использованы для получения нужных значений и, соответственно, рассматриваются как входящие в объем настоящего изобретения. В таких случаях снижение частоты появления можно определить, используя проточный цитометрический анализ или иммуногистохимическое обнаружение поверхностных маркеров опухолевых клеток, которыми, как известно, богаты опухоль-инициирующие клетки.
Соответственно, в другом предпочтительном воплощении настоящее изобретение включает способ лечения EFNA-ассоциированного расстройства, включающий введение терапевтически эффективного количества модулятора EFNA нуждающемуся в этом субъекту, в результате чего снижается частота появления опухоль-инициирующих клеток. Кроме того, снижение частоты появления опухоль-инициирующих клеток предпочтительно определяют, используя анализ методом серийных разведений in vitro или in vivo.
В связи с этим следует иметь в виду, что настоящее изобретение основано, по меньшей мере частично, на обнаружении того, что полипептиды EFNA (и в частности EFNA4, как описано ниже) ассоциированы с клетками, поддерживающими опухоль, (то есть раковыми стволовыми клетками), которые вовлечены в этиологию различных неоплазий. В частности, в настоящей заявке неожиданно продемонстрировано, что введение различных типичных модуляторов EFNA может опосредовать, снижать, ингибировать или ликвидировать онкогенную передачу сигналов опухоль-инициирующими клетками (то есть снижать частоту появления опухоль-инициирующих клеток). Это подавляет передачу сигналов либо посредством уменьшения, удаления, перепрограммирования или подавления опухоль-инициирующих клеток, либо посредством изменения морфологии опухолевых клеток (например, индуцированной дифференцировки, разрушения ниши), что в свою очередь обеспечивает возможность более эффективного лечения EFNA-ассоциированных расстройств посредством ингибирования онкогенеза, поддержания опухоли, увеличения объема и/или метастазирования и ее повторного проявления. В других воплощениях раскрытые модуляторы могут стимулировать, поддерживать или иным образом улучшать EFNA-опосредованную передачу сигналов, что может ограничивать или задерживать рост опухоли. В других воплощениях раскрытые модуляторы могут препятствовать, подавлять или иным образом замедлять EFNA опосредованную передачу сигналов, что может способствовать росту опухоли. Кроме того, как будет обсуждаться более подробно ниже, полипептиды EFNA вовлечены в образование сил адгезии и отталкивания между клетками посредством интегрина и перегруппировки цитоскелета. Вмешательство в такие межклеточные взаимодействия с использованием новых модуляторов EFNA, описанных в данной заявке, может, таким образом, облегчать расстройство посредством более чем одного механизма (то есть сокращения опухоль-инициирующих клеток и разрушения клеточной адгезии) с обеспечением аддитивных или синергических эффектов. Также в других предпочтительных воплощениях может использоваться клеточная интернализация лигандов эфринов А для доставки модулятор-опосредованного противоракового агента. В связи с этим, следует понимать, что настоящее изобретение не ограничено конкретным механизмом действия, а охватывает широкое использование раскрытых модуляторов для лечения EFNA-ассоциированных расстройств (в том числе различных неоплазий).
Таким образом, другое предпочтительное воплощение изобретения включает способ лечения EFNA-ассоциированного расстройства у субъекта, нуждающегося в этом, включающий стадию введения модулятора EFNA указанному субъекту. В особенно предпочтительных воплощениях модулятор EFNA соединен (например, конъюгирован) с противораковым агентом. Кроме того, полезные аспекты настоящего изобретения, включая любое нарушение клеточной адгезии, и сопутствующие преимущества могут быть достигнуты независимо от того демонстрирует опухолевая ткань субъекта повышенные уровни EFNA или пониженные или уменьшенные уровни EFNA по сравнению с нормальной соседней тканью.
Как упоминалось выше и обсуждается более подробно ниже, в настоящее время известно шесть лигандов эфринов А (то есть EFNA 1-6). Очевидно, что в соответствии с настоящим изобретением раскрытые модуляторы могут быть образованы, изготовлены и/или выбраны так, чтобы вступать во взаимодействие с одним лигандом эфрином А (например, EFNA4), подгруппой лигандов эфринов А (например, EFNA4 и EFNA1) или всеми шестью лигандами эфринами А. Более конкретно, как описано здесь и изложено в приведенных ниже примерах, предпочтительные модуляторы, такие как антитела, могут быть получены и выбраны таким образом, чтобы они вступали во взаимодействие или связывались с доменами или эпитопами, которые экспрессируются на одном лиганде эфрине А, или с эпитопами, которые являются консервативными (по меньшей мере в некоторой степени) и представлены в некоторых или всех полипептидах EFNA (например, EFNA 1 и 4 или EFNA 3 и 4). Это имеет большое значение в отношении настоящего изобретения, поскольку, как показано ниже в Примере 18, было обнаружено, что некоторые лиганды эфрины А предпочтительно экспрессируются на TIC и, в комбинации, могут служить в качестве особенно эффективных терапевтических мишеней, обеспечивающих селективное снижение частоты появления опухолевых клеток и/или истощение популяций раковых стволовых клеток.
Таким образом, в выбранном воплощении изобретение включает пан-модулятор EFNA, который иммуноспецифически соединяется с двумя или более лигандами эфринами А. В таких воплощениях выбранный модулятор может быть получен посредством иммунизации конкретным лигандом (например, EFNA4) и может соединяться или в большей или меньшей степени вступать в перекрестную реакцию с различными лигандами субъекта. Соответственно, в других воплощениях настоящее изобретение включает способ лечения субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества пан-модулятора EFNA. Другие воплощения включают способ лечения субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества модулятора EFNA, который иммуноспецифически соединен с одним или более лигандами эфринами А.
Соответственно, в других воплощениях настоящее изобретение включает пан-модулятор EFNA. В других воплощениях настоящее изобретение включает способ лечения EFNA-ассоциированного расстройства у субъекта, нуждающегося в этом, включающий стадию введения пан-модулятора EFNA указанному субъекту.
Конечно следует понимать, что раскрытые модуляторы EFNA могут быть получены, изготовлены и/или выбраны так, чтобы преимущественно взаимодействовать или соединяться с одним лигандом эфрином А (например, EFNA4) и демонстрировать минимальное соединение или не демонстрировать соединения с любым другим лигандом эфрином А. Соответственно, другие воплощения изобретения направлены на модуляторы EFNA, которые иммуноспецифически соединены с выбранным лигандом эфрином А и демонстрируют минимальное соединение или не демонстрируют соединения с любым другим лигандом эфрином А. В связи с этим предпочтительные воплощения, раскрытые здесь, включают способы лечения EFNA-ассоциированного расстройства у субъекта, нуждающегося в этом, включающие стадию введения модулятора EFNA, где модулятор EFNA иммуноспецифически соединяется с выбранным лигандом эфрином А и по существу не вступает во взаимодействие с каким-либо другим лигандом эфрином А. Кроме того, в объем настоящего изобретения входят способы получения, изготовления и выбора таких модуляторов.
В других аспектах настоящего изобретения используется способность раскрытых модуляторов потенциально разрушать клеточные адгезивные взаимодействия с одновременным подавлением опухоль-инициирующих клеток. Такие мультиактивные модуляторы EFNA (например, антагонисты EFNA) могут оказаться особенно эффективными при использовании в комбинации со стандартными противораковыми агентами или циторедуктивными агентами. Кроме того, два или более антагониста EFNA (например, антитела, которые специфически связываются с двумя отдельными эпитопами на лиганде эфрине А или которые соединяются с отдельными лигандами) можно использовать в комбинации в соответствии с идеей настоящего изобретения. Кроме того, как обсуждается более подробно ниже, модуляторы EFNA по настоящему изобретению можно использовать в конъюгированном или неконъюгированном состоянии и возможно в качестве сенсибилизирующего агента в комбинации с различными химическими или биологическими противораковыми агентами.
Таким образом, другое предпочтительное воплощение настоящего изобретения включает способ сенсибилизации опухоли субъекта к лечению противораковым агентом, включающий стадию введения модулятора EFNA указанному субъекту. В особенно предпочтительном аспекте изобретения модулятор EFNA конкретно приводит к снижению частоты появления опухоль-инициирующих клеток, определенной с использованием in vitro или in vivo анализа методом серийных разведений, тем самым сенсибилизируя опухоль к сопутствующему или последующему циторедуктивному воздействию.
Аналогично, так как соединения по настоящему изобретению могут приносить терапевтическую пользу через различные физиологические механизмы, настоящее изобретение также направлено на выбранные эффекторы или модуляторы, которые специально изготовлены так, чтобы использовать определенные клеточные процессы. Например, в некоторых воплощениях предпочтительный модулятор может быть сконструирован так, чтобы соединяться с EFNA на или около поверхности опухоль-инициирующей клетки и стимулировать иммунный ответ субъекта. В других воплощениях модулятор может содержать антитело, направленное на эпитоп, нейтрализующее активность лиганда эфрина А и взаимодействия с эфриновыми рецепторами, что может влиять на силы адгезии и отталкивания между клетками посредством интегрина и перегруппировки цитоскелета. В других воплощениях раскрытые модуляторы могут действовать путем истощения или удаления EFNA-ассоциированных клеток. Таким образом, важно понимать, что настоящее изобретение не ограничено каким-либо конкретным механизмом действия, а скорее охватывает любой способ или модулятор EFNA, который достигает нужного результата.
Предпочтительные воплощения в рамках раскрытых воплощений направлены на способ лечения субъекта, страдающего от опухолевого заболевания, включающий стадию введения терапевтически эффективного количества по меньшей мере одного нейтрализующего модулятора EFNA.
Другие воплощения направлены на способ лечения субъекта, страдающего от EFNA-ассоциированного расстройства, включающий стадию введения терапевтически эффективного количества по меньшей мере одного истощающего модулятора EFNA. Похожий способ направлен на истощение EFNA-ассоциированных клеток у субъекта, нуждающегося в этом, включающий стадию введения модулятора EFNA.
В еще одном воплощении в настоящем изобретении предложены способы поддерживающей терапии, в которых раскрытые эффекторы или модуляторы вводят в течение некоторого периода времени после начальной процедуры (например, химиотерапии, лучевой терапии или хирургического вмешательства), предназначенной для удаления по меньшей мере части опухолевой массы. Такие схемы лечения могут быть введены на протяжении недель, месяцев и даже лет, где модуляторы EFNA могут действовать профилактически с целью ингибирования метастазирования и/или повторного появления опухоли. В других воплощениях раскрытые модуляторы можно вводить в соответствии с известными циторедуктивными схемами для предупреждения или замедления метастазирования.
Очевидно, что, помимо терапевтических применений, описанных выше, модуляторы по настоящему изобретению можно использовать для диагностики EFNA-ассоциированных расстройств и, в частности, гиперпролиферативных расстройств. В некоторых воплощениях модулятор можно вводить субъекту и определять или контролировать in vivo. Специалистам в данной области техники понятно, что такие модуляторы могут быть мечеными или соединенными с маркерами или репортерными группами, как описано ниже, и могут быть обнаружены с использованием любого стандартного метода (например, MRI (визуализация методом ядерного магнитного резонанса) или CAT (компьютерная томография)). В других случаях модуляторы можно использовать в диагностических установках in vitro с использованием принятых в данной области операций. Таким образом, предпочтительное воплощение включает способ диагностики гиперпролиферативного расстройства у субъекта, нуждающегося в этом, включающий стадии:
а) получение образца ткани из указанного субъекта;
б) приведение образца ткани в контакт по меньшей мере с одним модулятором EFNA; и
в) обнаружение или количественное определение модулятора EFNA, соединенного с образцом.
Такие способы могут быть легко поняты с учетом настоящей заявки и могут быть легко осуществлены с использованием общедоступной промышленной технологии, таких как автоматические планшет-ридеры, специально предназначенные репортерные системы и т.д. В выбранных воплощениях модулятор EFNA соединен с клетками, поддерживающими опухоль, присутствующими в образце. В других предпочтительных воплощениях стадия обнаружения и количественного определения включает снижение частоты появления опухоль-инициирующих клеток и их обнаружение. Кроме того, анализ методом серийных разведений может быть проведен, как упоминалось выше, и предпочтительно с использованием статистических параметров распределения Пуассона для обеспечения точного подсчета снижения частоты появления.
Аналогично, в настоящем изобретении также предложены наборы, которые полезны в диагностике и контроле EFNA-ассоциированных расстройств, таких как рак. С этой целью в настоящем изобретении предпочтительно предложено изделие, полезное для диагностики или лечения EFNA-ассоциированных расстройств, содержащее контейнер, содержащий модулятор EFNA и инструкции по использованию указанного модулятора EFNA для лечения или диагностики EFNA-ассоциированного расстройства.
В других предпочтительных воплощениях изобретения также используются свойства раскрытых модуляторов как инструмента, полезного для идентификации, выделения, разделения или обогащения популяций или субпопуляций опухоль-инициирующих клеток посредством таких методов, как сортировка флуоресцентно-активированных клеток (FACS) или лазерное отделение.
Таким образом, другое предпочтительное воплощение настоящего изобретения направлено на способ идентификации, выделения, разделения или обогащения популяции опухоль-инициирующих клеток, включающий стадию приведения указанных опухоль-инициирующих клеток в контакт с модулятором EFNA.
Вышеизложенное представляет собой краткое изложение сущности изобретения и, таким образом, содержит, по необходимости, упрощения, обобщения и опускания деталей; и, следовательно, специалистам в данной области техники будет понятно, что краткое изложение является лишь иллюстративным и не предназначено являться каким-либо ограничением. Другие аспекты, характеристики и преимущества способов, композиций и/или устройств и/или другие объекты, описанные здесь, станут очевидными из изложенного здесь руководства. Краткое изложение представлено для того, чтобы изложить ряд концепций в упрощенной форме, которые дополнительно описаны ниже в Подробном описании изобретения. Это краткое изложение не предназначено для определения ключевых или существенных признаков заявленного изобретения и не предназначено для использования в определении объема заявленного изобретения.
Краткое описание графических материалов
На Фиг.1А-В показаны, соответственно, последовательность нуклеиновой кислоты, кодирующая человеческий EFNA4 (SEQ ID NO:1), соответствующая аминокислотная последовательность изоформы человеческого EFNA4 (SEQ ID NO:2) и выравнивание последовательностей изоформ человеческого EFNA4 a, b и с, показывающее аминокислотные различия (SEQ ID NO:2-4), в то время как на Фиг.1Г-Е показаны, соответственно, последовательность нуклеиновой кислоты, кодирующая человеческий EFNA1 (SEQ ID NO:5), соответствующая аминокислотная последовательность изоформы человеческого EFNA1 (SEQ ID NO:6) и выравнивание последовательностей изоформ EFNA1 а и b человека, показывающее аминокислотные различия (SEQ ID NO:6 и 7);
На Фиг.2А и 2Б показаны графики, представляющие уровень экспрессии генов выбранных человеческих лигандов эфринов А и эфриновых рецепторов А у необработанных (ФИГ.2А) и у обработанных иринотеканом (Фиг.2Б) мышей при измерении с использованием всей последовательности транскриптома популяций, значительно обогащенных клетками-предшественниками опухоли (TProg), и клетками, поддерживающими опухоль (ТРС), и неонкогенными клетками (NTG), полученными из подгруппы всех образцов колоректальной опухоли;
На Фиг.3А и 3Б показаны графики, представляющие уровень генной экспрессии человеческого лиганда эфрина А4 в образцах колоректальной опухоли (Фиг.3А) и образцах опухоли поджелудочной железы (Фиг.3Б) при измерении с использованием всей последовательности транскриптома из популяций, значительно обогащенных клетками-предшественниками опухоли (TProg) и клетками, поддерживающими опухоль (ТРС), и неонкогенными клетками (NTG) или популяций онкогенных (TG) и неонкогенных клеток (NTG);
На Фиг.4 представлен график, показывающий относительный уровень генной экспрессии человеческого EFNA4 в популяциях, значительно обогащенных клетками-предшественниками опухоли (TProg), и клетками, поддерживающими опухоль (ТРС), полученных из мышей, несущих одну из четырех разных нетрадиционных ксенотрансплантатных (NTX) клеточных линий колоректальной опухоли или опухоли поджелудочной железы, и нормализированных относительно популяций, обогащенных неонкогенными клетками (NTG), при измерении с использованием количественного OT-PCR;
На Фиг.5А и 5Б представлены графики, показывающие относительный уровень экспрессии гена человеческого EFNA4 при измерении с использованием OT-PCR во всех образцах колоректальной опухоли от пациентов с I-IV стадией болезни, нормализованных относительно средней экспрессии в нормальной ткани толстой и прямой кишки (Фиг.5А) или относительно нормальной соседней ткани (Фиг.5Б);
На Фиг.6А-6Д представлен уровень экспрессии генов человеческих EFNA, измеренный для EFNA4 на Фиг.6А и 6Б посредством OT-PCR в целых опухолевых образцах (серые точки) или соответствующие NAT (технология амплификации нуклеиновых кислот) (белые точки) от пациентов с одной из восемнадцати разных солидных типов опухоли, на Фиг.6В и 6Г посредством OT-PCR для EFNA4 и EFNA1 в выбранных NTX опухолевых клеточных линиях и посредством Вестерн-блот анализа на Фиг.6Д для EFNA4 в нормальной ткани и выбранных NTX опухолевых клеточных линиях;
На Фиг.7А-7Т представлены последовательности нескольких модуляторов EFNA, при этом на Фиг.7А представлена в табличном виде генетическая организация и последовательности CDR тяжелой и легкой цепи (как определено Chothia et al.) отдельных модуляторов EFNA, выделенных и клонированных, как описано здесь, на Фиг.7Б-7O представлены мышиные нуклеиновокислотные и аминокислотные последовательности вариабельной области тяжелой и легкой цепи для тех же модуляторов, представленных на Фиг.7А, и на Фиг.7П-7Т представлены нуклеиновокислотные и аминокислотные последовательности вариабельной области тяжелой и легкой цепи типичных гуманизированных вариантов раскрытых модуляторов EFNA;
На Фиг.8А-8Г представлены биохимические и иммунологические свойства типичных модуляторов в виде таблицы на Фиг.8А, сравнение аффинности мышиного SC4.47 и гуманизированного SC4.47 соответственно, при определении посредством анализа взаимодействия без использования метки, с фиксированным количеством антитела и серийными разведениями антигена на Фиг.8Б и 8В, и представленное в виде таблицы сравнение выбранных гуманизированных и мышиных модуляторов на Фиг.8Г;
На Фиг.9 показаны свойства связывания с клеточной поверхностью пятидесяти типичных модуляторов лиганда эфрина А по настоящему изобретению для клеток Jurkat E6 и клеток Z138 соответственно;
На Фиг.10А и 10Б показано связывание лиганда эфрина А с клетками, экспрессирующими рецепторы эфрина А в зависимости от дозы (Фиг.10А) и ингибирование связывания с клеточной поверхностью лиганда эфрина А при воздействии типичных раскрытых модуляторов (Фиг.10Б);
На Фиг.11А-11Г представлены графики, иллюстрирующие способность раскрытых модуляторов ингибировать связывание с клеточной поверхностью человеческого и мышиного лиганда эфрина А, при этом на Фиг.11А показаны кривые для положительного контроля, а на Фиг.11Б-11Г показана способность трех типичных модуляторов EFNA уменьшать связывание лиганда;
На Фиг.12А-12Д представлены графики, показывающие способность модуляторов по настоящему изобретению ингибировать связывание с клеточной поверхностью растворимого рецептора эфрина А, при этом на Фиг.12А представлена стандартная кривая связывания рецептора, на Фиг.12Б показаны свойства типичных модуляторов при изменении концентрации растворимого рецептора, на Фиг.12В показаны последствия изменения концентрации модулятора при сохранении неизменным количества рецептора, и на Фиг.12Г и 12Д показана способность модуляторов ингибировать связывание рецептора эфрина А с лигандами эфрином А4 и эфрином А1 соответственно;
На Фиг.13А-13В показана способность выбранных модуляторов по настоящему изобретению вступать в перекрестную реакцию с мышиным ортологом лиганда эфрина А4, при этом на Фиг.13А показан нереакционноспособный модулятор, а на Фиг.13Б и Фиг.13В показаны мышиный и гуманизированный модуляторы соответственно, которые вступают в перекрестную реакцию;
На Фиг.14А-14Г показано, что экспрессии лиганда эфрина А повышена во всех образцах колоректальной опухоли (Фиг.14А) и в онкогенных субпопуляциях колоректальных NTX опухолевых клеток (Фиг.14Б) и в онкогенных субпопуляциях NTX легочной клеточной линии (Фиг.14Г), но не в нормальных мононуклеарных клетках периферической крови (ФИГ.14В);
На Фиг.15А-15Г показана способность выбранных модуляторов по настоящему изобретению к интернализации при связывании с лигандами эфринами А, при этом на Фиг.15А показан сдвиг флуоресценции, связанный с тремя типичными модуляторами, на Фиг.15Б показано, что девятнадцать раскрытых модуляторов демонстрируют приращение средней интенсивности флуоресценции, свидетельствующую об интернализации, на Фиг.15В показана относительно небольшая интернализация в клетках с низкой экспрессией EFNA, и на Фиг.15Г показана значительная интернализация в клетках, экспрессирующих высокие уровни EFNA;
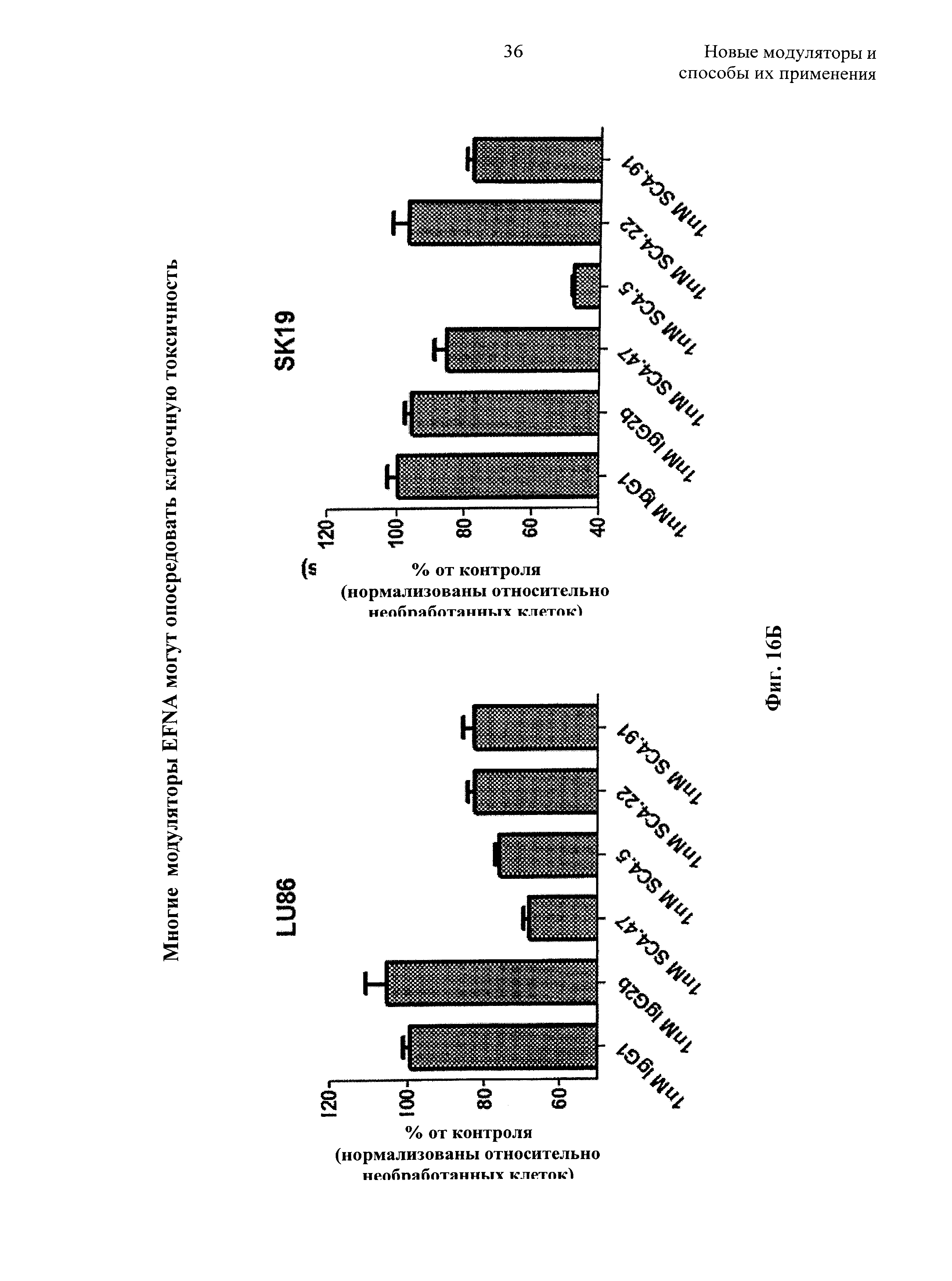
На Фиг.16А-16Е представлено доказательство того, что раскрытые модуляторы можно эффективно использовать в качестве группировок направленной доставки, чтобы направлять цитотоксические полезные грузы в клетки, экспрессирующие лиганды эфрины А, где нисходящая кривая свидетельствует о гибели клеток в результате интернализации, и где на Фиг.16А показано поражающее действие модулятора SC4.5, на Фиг.16Б показана способность выбранных модуляторов к интернализации и поражающему действию в отношении NTX опухолевых клеточных линий легких и кожи, на Фиг.16В и 16Г показано, что модуляторы переносят присоединенный цитотоксин в клетки HEK293T (Фиг.16С) и клетки HEK-.hEFNA4 (Фиг.16Г), на Фиг.16Д показано, что гуманизированные модуляторы взаимодействуют аналогично и на Фиг.16Е показана гибель целевых клеток, экспрессирующих мышиный или человеческий лиганд эфрин А4 (обратите внимание, что на Фиг.16 модуляторы могут быть названы Е, а не SC4);
На Фиг.17А-17Д графически представлены различные аспекты биохимического анализа, демонстрирующие способность раскрытых модуляторов обнаруживать секретируемый лиганд эфрин А4, при этом на Фиг.17А представлена стандартная кривая, на Фиг.17Б количественно определен уровень секретируемого EFNA из выбранных гематологических опухолей, на Фиг.17В представлена корреляция между объемом опухоли и секретируемым EFNA, на Фиг.17Г установлен диапазон циркулирующего в крови лиганда эфрина А у здоровых взрослых людей и на Фиг.17Д показано, что пациенты с выбранными солидными опухолями имеют значительно более высокий уровень циркулирующего в крови лиганда эфрина А;
На Фиг.18А-18В представлены графики, иллюстрирующие, что различные модуляторы лиганда эфрина А можно использовать в качестве группировок направленной доставки для соединения цитотоксических полезны грузов с выбранными клетками, где нисходящая кривая свидетельствует о клеточной гибели в результате интернализации токсина и где на Фиг.18А-18В, конкретно показана способность модуляторов SC4.2.1 (или Е2.1) и SC9.65 (или 9М065) опосредовать гибель клеток HEK293T, сверхэкспрессирующих лиганд эфрин А4 (Фиг.18А), лиганд эфрин А4 (Фиг.18Б) и лиганд эфрин А1 (Фиг.18В) в присутствии связанного сапорина;
На Фиг.19А и 19Б показана способность лигандов эфринов А селективно взаимодействовать с многочисленными рецепторами ЕРНА (эфрина А), где клетки HEK293T лишь незначительно связываются с конструкциями рецептора ЕРНА-ECD-Fc посредством эндогенно экспрессированных лигандов эфринов А (Фиг.19А), в то время как клетки HEK293T.hEFNA4 в различной степени связываются со всеми протестированными конструкциями рецептора ЕРНА, за исключением ЕРНА1, который несвязан (Фиг.19Б); и
На Фиг.20А и 20Б показана способность лигандов эфринов А селективно взаимодействовать с рецепторами ЕРНВ (эфрин В), где клетки HEK293Т лишь в ограниченной степени связываются с конструкциями рецептора EPHB-ECD-Fc посредством эндогенно экспрессируемых лигандов эфринов А (Фиг.20А), в то время как клетки HEK293T.hEFNA4 связывают рецепторы ЕрпВ2, но не рецепторы EphB3 и EphB4 (Фиг.20Б).
Подробное описание изобретения
I. Введение
В то время как настоящее изобретение может быть воплощено во многих разных формах, здесь описаны его конкретные иллюстративные воплощения, которые иллюстрируют принципы изобретения. Следует отметить, что настоящее изобретение не ограничено конкретными, проиллюстрированными воплощениями. Кроме того, любые используемые здесь заголовки разделов, предназначены только для организационных целей и не должны быть истолкованы как ограничивающие описываемый объект.
Как уже упоминалось, неожиданно было обнаружено, что экспрессия лигандов эфринов А (или EFNA) связана с опухолевым ростом и гиперпролиферативными расстройствами и, что такие лиганды представляют собой полезные опухолевые маркеры, которые можно использовать в лечении связанных с этим заболеваний. Более конкретно, было обнаружено, что такие модуляторы EFNA, как описаны здесь, можно с успехом использовать в диагностике, терагнозисе, лечении или предупреждении опухолевых заболеваний у пациентов, нуждающихся в этом. Соответственно, в то время как предпочтительные воплощения изобретения будут подробно рассмотрены ниже, в частности, в контексте раковых стволовых клеток и их взаимодействий с раскрытыми модуляторами, специалистам в данной области понятно, что объем настоящего изобретения не ограничен такими иллюстративными воплощениями. Точнее, настоящее изобретение и прилагаемая формула изобретения в целом и определенно направлены на модуляторы EFNA и их применение в диагностике, терагнозисе, лечении или предупреждении различных EFNA-ассоциированных или -опосредованных расстройств, в том числе опухолевых или гиперпролиферативных расстройств, независимо от любого конкретного механизма действия или конкретного целевого опухолевого компонента.
Кроме того, следует понимать, что в отличие от многих раскрытий из уровня техники, настоящее изобретение в значительной степени направлено на модуляторы эфриновых лигандов (то есть EFN), а не модуляторы эфриновых рецепторов (то есть ЕРН). То есть, в то время как эфриновые рецепторы широко вовлечены в некоторые типы расстройств и обычно являются целью терапевтического вмешательства, эфриновые лиганды до сих пор привлекали меньше внимания. Частично это может быть результатом беспорядочного поведения, характерного для лигандов, и безосновательного мнения, что такие варьирующиеся взаимодействия делают их непригодными терапевтическими мишенями, так как избыточности путей, по всей вероятности, может компенсировать антагонизм любого лиганда. Однако, как здесь показано, раскрытые модуляторы лигандов эфринов А можно эффективно использовать для нацеливания на онкогенные клетки, и устранения или выведения из строя онкогенных клеток другим способом. Кроме того, в выбранных воплощениях настоящее изобретение включает пан-EFNA модуляторы, которые ассоциированы или взаимодействуют более чем с одним лигандом эфрином А, тем самым обеспечивая неожиданный аддитивный или синергический эффект, что может обеспечить пассивность более чем одного пути, опосредованного эфриновыми лигандами.
Помимо общей связи, охарактеризованной выше, авторы настоящего изобретения обнаружили до сих пор неизвестную фенотипическую связь между выбранными "опухоль-инициирующими клетками" (TIC) и лигандами эфринами А. В связи с этим было установлено, что выбранные TIC экспрессируют повышенные уровни лигандов эфринов А по сравнению с нормальными тканями и неонкогенными клетками (NTG), которые вместе составляют большую часть солидной опухоли. Таким образом, лиганды эфрины А содержат опухоль-ассоциированные маркеры (или антигены) и, как было обнаружено, обеспечивают эффективные агенты для обнаружения и подавления TIC и ассоциированной неоплазии из-за повышенных уровней белков на поверхностях клеток или в микроокружении опухоли. Более конкретно, также было обнаружено, что модуляторы EFNA, в том числе иммунореактивные антагонисты и антитела, которые соединяются или взаимодействуют с белками, эффективно снижают частоту появления опухоль-инициирующих клеток и, следовательно, полезны в устранении, подавлении активности, снижении, содействии дифференцировке или иным образом исключают или ограничивают способность этих опухоль-инициирующих клеток бездействовать и/или продолжать подпитывать рост опухоли, метастазирование или повторное появление у пациента. Как описано более подробно ниже, субпопуляция опухолевых клеток TIC состоит из клеток, поддерживающих опухоль (ТРС) и высокопролиферативных клеток-предшественников опухоли (TProg).
В свете этих открытий специалистам в данной области понятно, что в настоящем изобретении также предложены модуляторы EFNA и их применение в сокращении частоты появления опухоль-инициирующих клеток. Как будет подробно рассмотрено ниже, модуляторы EFNA по изобретению в широком смысле включают любое соединение, которое распознает, взаимодействует, конкурирует, проявляет антагонизм, взаимодействует, связывается, проявляет агонизм или соединяется с лигандом эфрином А или его геном. Посредством этих взаимодействий модуляторы EFNA снижают или уменьшают частоту появления опухоль-инициирующих клеток. Типичные модуляторы, описанные здесь, включают нуклеотиды, олигонуклеотиды, полинуклеотиды, пептиды или полипептиды. В некоторых предпочтительных воплощениях выбранные модуляторы включают антитела к EFNA или их иммунореактивные фрагменты или производные. Такие антитела могут быть антагонистическими или агонистическими по природе и возможно могут быть конъюгированы или соединены с цитотоксическим агентом. В других воплощениях модуляторы в рамках настоящего изобретения содержат EFNA-конструкцию, содержащую лиганд эфрин А или его реакционно-способный фрагмент. Следует понимать, что такие конструкции могут содержать слитые белки и могут включать реакционно-способные домены из других полипептидов, таких как иммуноглобулины или модификаторы биологического ответа. В других аспектах модулятор EFNA содержит совокупность нуклеиновых кислот, оказывающую нужные эффекты на уровне генома. Другие модуляторы, совместимые с данным руководством, будут подробно описаны ниже.
Независимо от выбранной, в конечном счете, формы модулятора, его предпочтительно выделяют и очищают перед введением субъекту. В связи с этим, термин "выделенный модулятор EFNA" следует понимать в широком смысле и в соответствии со стандартной фармацевтической практикой как обозначающий любой препарат или композицию, содержащую модулятор в состоянии, по существу, свободном от нежелательных примесей (биологических или иных). Как будет обсуждаться более подробно ниже, эти препараты могут быть очищены и приготовлены в нужной форме с использованием различных известных в данной области методов. Конечно, следует понимать, что такие "выделенные" препараты могут быть намеренно изготовлены или скомбинированы с инертными или активными ингредиентами, целесообразными для улучшения коммерческих, производственных или терапевтические аспектов готового продукта и получения фармацевтических композиций.
Физиология EFNA
Тирозинкиназы эфриновых рецепторов (ЕРН), трансмембранные белки 1 типа, составляют большое семейство рецепторных тирозинкиназ в геноме животных и взаимодействуют с эфриновыми лигандами (EFN), которые также соединены с клеточной поверхностью. Рецепторы ЕРН-подсемейства обычно имеют один киназный домен и внеклеточную область, содержащую Cys-богатый домен и 2 повтора фибронектина III типа. Условлено, что эфриновые рецепторы делятся на две группы на основании сходства последовательностей их внеклеточного домена и их аффинностей связывания с лигандами эфрином А и эфрином В. Предварительное исследование показало, что ЕРН-опосредованные сигналы контролируют многочисленные аспекты эмбрионального развития, в частности нервной системы, и являются важными медиаторами передачи информации между клетками, регулирующей прикрепление клеток, их форму и подвижность. Кроме того, многие члены семейства эфриновых рецепторов, в отличие от эфриновых лигандов, были идентифицированы в качестве важных маркеров и/или регуляторов развития и прогрессирования рака. В настоящее время известно девять рецепторов эфрина А и шесть рецепторов эфрина В.
В рамках настоящей заявки термины "эфриновый рецептор," "рецептор эфрина А", "рецептор эфрина В", "ЕРНА" или "ЕРНВ" (либо EphA, либо EphB) можно использовать взаимозаменяемо и они означают конкретное семейство, подсемейство или отдельный рецептор (то есть ЕРНА1, ЕРНА2, ЕРНА3, ЕРНА4, ЕРНА5, ЕРНА6, ЕРНА7, ЕРНА8, ЕРНА9, ЕРНВ1, ЕРНВ2, ЕРНВ3, ЕРНВ4, ЕРНВ5, ЕРНВ6), как диктует контекст.
На основании анализов последовательности, эфриновые лиганды можно разделить на две группы: шесть лигандов эфринов А (или EFNA), обычно прикрепленных к поверхности клетки посредством гликозилфосфатидилинозитольных связей (хотя в результате альтернативного сплайсинга мРНК эфрина образуются некоторые не-GPI-прикрепленные белки; например EFNA4) и три лиганда эфрина В (или EFNB), содержащие трансмембранный домен и короткую цитоплазматическую область с консервативными остатками тирозина и PDZ-связывающий мотив. Лиганды EFNA взаимодействуют предпочтительно с любым из девяти разных ЕРНА-рецепторов, в то время как лиганды EFNB взаимодействуют предпочтительно с любым из шести разных ЕРНВ-рецепторов, хотя сообщалось о некоторых конкретных перекрестных взаимодействиях EFNA-ЕРНВ и EFNB-EPHA.
В рамках настоящей заявки термины "эфриновый лиганд," "лиганд эфрин А4," "лиганд эфрин В" "EFNA" или "EFNB" можно использовать взаимозаменяемо и они означают конкретное семейство, подсемейство или отдельный лиганд (то есть EFNA1, EFNA2, EFNA3, EFNA4, EFNA5, EFNA6, EFNB1, EFNB2, EFNB3), как диктует контекст. Например, все термины "эфрин А4," лиганд эфрин А4" или "EFNA4" обозначают одно и то же семейство изоформ белка (например, как представлено на Фиг.1 В), в то время как термины "лиганд эфрин А4" и "ENFA" должны означать эфриновое подсемейство (то есть А в отличие от В), содержащее все шесть лигандов А типа и любые их изоформы. В связи с этим "модулятор эфрина А", модулятор лиганда эфрина А4" или "модулятор EFNA" означают любой модулятор (как определено здесь), который соединяется, связывается или взаимодействует с одним или более лигандами А типа или его изоформой, фрагментом или производным.
Более подробное обобщение наименований эфриновых рецепторов и лигандов можно найти в Таблице 1 ниже.
|
Eph Nomenclature Committee, Cell. 1997; 90 (3):403-4, включенный в данное описание изобретения во всей полноте посредством ссылки.
Как и в случаях со всеми взаимодействиями рецептора поверхности клетки с лигандом, вхождение эфринового рецептора в контакт с эфриновым лигандом в конечном счете приводит к активации внутриклеточных сигнальных каскадов. Хотя взаимодействия рецептор-лиганд могут происходить между молекулами на поверхности той же клетки (cis-взаимодействия), как правило, считается, что cis-взаимодействия не приводят к запуску сигнальных каскадов или что cis-взаимодействия могут фактически противодействовать сигнальным каскадам, инициированным trans-взаимодействиями (например, между рецепторами и лигандами на отдельных клетках). Один уникальный аспект EPH-EFN trans-взаимодействий заключается в способности запускать два сигнальных каскада при контакте рецептор-лиганд - прямой сигнальный каскад в клетке, экспрессирующей эфриновый рецептор, и обратный сигнальный каскад в клетке, экспрессирующей эфриновый лиганд. Активация двух отдельных сигнальных каскадов может отражать процессы сортировки клеток и клеточного позиционирования, в которые вовлечены EPH и EFN, чтобы совместно координировать эмбриональное развитие животных.
EPH-EFN сигнальные каскады часто активируют клеточные сигнальные пути, которые регулируют динамику цитоскелета и приводят к модулированию взаимодействий притяжения и отталкивания между разными типами клеток. В качестве обобщения, белки EPH и EFN находятся на гораздо более высоких уровнях во время эмбриогенеза по сравнению с уровнями, наблюдаемыми в тканях взрослого организма, хотя продолжительная низкоуровневая экспрессии у взрослых может отражать роль этих молекул в нормальной функции тканей, таких как кишечник взрослого субъекта, который имеет строго определенную архитектуру, возникающую в результате миграции дифференцированных клеток из их источника, тканевых стволовых клеток в криптах, в окончательное местоположение на поверхности ворсинок, направленных в просвет кишечника. Так как эфриновые рецепторы впервые были идентифицированы в гепатоцеллюлярных карциномах и экспрессия EPH и EFN, как правило, ограничена у взрослых, реактивация экспрессии эфриновых лигандов и/или эфриновых рецепторов в раковых образованиях у человека может быть связана с дедифференцировкой раковых клеток и/или способностью этих раковых клеток вторгаться в окружающую нормальную ткань и мигрировать от места первичной опухоли в отдаленные участки. Другие исследования показали, что взаимодействия EPH-EFN также играют определенную роль в неоангиогенезе.
В соответствии с обнаружением того, что взаимодействия EPH-EFN в нелимфоидных тканях регулируют клеточные взаимодействия путем образования сил притяжения или отталкивания между клетками посредством интегрина и перегруппировки цитоскелета, было показано, что молекулы ЕРН и EFN, обнаруженные на лимфоидных клетках, опосредуют клеточную адгезию к компонентам внеклеточного матрикса, хемотаксис и миграцию клеток. Например, было обнаружено, что вступление EFNA1 (который связывается с рецептором EpnA2 и содержит, например, аминокислотную последовательность под учетным номером в Genbank NM_004428) в контакт на первичных CD4 и CD8 Т-клетках стимулирует миграцию клеток и усиливает хемотаксис. Аналогично EFNA1, EFNA4 экспрессируется на первичных CD4 Т-клетках, но из-за неоднородного характера взаимодействий EPH-EFN, неясно оказывает ли контактирование с EFNA4 аналогичный эффект на эти клетки. Однако, было продемонстрировано, что зрелые человеческие В-лимфоциты экспрессируют EFNA4 и секретируют его при активации. Кроме того, EFNA4, в отличие от любой другой молекулы EFN или ЕРН, также стабильно экспрессируется на В-клетках или В-клетками пациентов с хроническим лимфолейкозом (CLL). Интересно, что экспрессия изоформ EFNA4, измеренная посредством Q-PCR (количественной PCR), может коррелировать с клиническим проявлением заболевания. Также показано, что В-клетки CLL-пациентов, имеющие повышенную экспрессию EFNA4, показывали ухудшение потенциала транс-эндотелиальной миграции по сравнению с В-клетками здоровых субъектов. Видимо, участие EFNA4 снижает способность CLL-клеток прикрепляться к молекулам внеклеточного матрикса и снижает их хемотаксический ответ на CCL1. Вместе эти сообщения свидетельствуют о роли EFNA4 в направленной миграции В- и Т-клеток и, при рассмотрении вместе с данными о внутриклеточной передаче сигналов, описанными выше, делают лиганды эфрины А и, в частности, EFNA4 очень интересными мишенями для разработки противораковых терапевтических средств.
В дополнение к вышеупомянутым характеристикам, настоящее описание изобретения показывает, что экспрессия EFNA4 повышена в различных популяциях раковых стволовых клеток. Наряду с сопутствующей активацией нескольких рецепторов ЕРНА в основном объеме опухоли, возникает возможность того, что ЕРМА4-опосредованные взаимодействия лиганда с рецептором могут инициировать клеточные сигнальные каскады, связанные с пролиферацией опухоли, неоангиогенезом и/или метастазированием опухоли. Не желая быть связанными с какой-либо конкретной теорией, полагают, что модуляторы EFNA4 по настоящему изобретению (в частности, антагонистические или нейтрализующие воплощения) действуют, по меньшей мере частично, путем или снижения частоты появления опухоль-инициирующих клеток или их элиминации, тем самым влияя на распространение или выживаемость опухоли иным образом, чем традиционные стандартные схемы лечения (например, иринотекан), или через иммунотерапевтическую передачу сигнала или доставку полезного груза, способного убить ЕРМА4-экспрессирующие клетки. Например, удаление ТРС посредством антагонизма к EFNA4 может включать просто стимуляцию клеточной пролиферации, несмотря на химиотерапевтическое лечение, устраняющее пролиферирующие клетки, или содействие дифференцировке ТРС таким образом, что их способность к самообновлению (то есть неограниченная пролиферация и поддержание мультипотентности) теряется. Альтернативно, в предпочтительных воплощениях можно избирательно убивать или иным образом выводить из строя ТРС посредством рекрутмента цитотоксических Т-клеток для атаки на ЕРМА4-экспрессирующие клетки или доставки эффективного токсина, конъюгированного с анти-ЕРМА4 антителом, способным к интернализации.
При использовании здесь термин EFNA4 (также известный как лиганд eph-родственной киназы 4, LERK4; или eph-родственный лиганд рецепторной тирозинкиназы 4, EFL-4) относится к природному человеческому EFNA4, если контекст не указывает на иное. Типичные ортологи белка EFNA4 включают, но не ограничиваются ими, человеческий (то есть DEFNA4, NP_005218, NP_872631 или NP_872632), мышиный (NPJ331936), шимпанзе (ХР_001153095, ХР_001152971, ХР_524893 и ХР_001152916) и крысиный (NP_001101162). Транскрибируемый ген EFNA4 человека содержит, как минимум 5817 п.о. из хромосомы 1. Были описаны три варианта транскрипта мРНК, каждый из которых возникает в результате альтернативного сплайсинга транскрибируемой РНК: (1) 1276 п.о. вариант (NM_005227; ЕРМА4-вариант транскрипта 1; SEQ ID NO:1), который кодирует 201-аминокислотный пропротеин (NP_005218; EFNA4 вариант a; SEQ ID NO:2); (2) 1110 п.о. вариант (NM_182689; ЕРМА4-вариант транскрипта 2), который кодирует 207-аминокислотный пропротеин (NM_872631; EFNA4 вариант b; SEQ ID NO:3); и (3) 1111 п.о. вариант (NM_182690; EFNA4 вариант транскрипта 3), который кодирует 193 аминокислотный пропротеин (NP_872632; EFNA4 вариант с; SEQ ID NO:4). Следует понимать, что каждый из человеческих белков EFNA4 включает предсказанную сигнальную или лидерную последовательность, содержащую аминокислоты 1-25 из SEQ ID NO:2, которая отсекается с получением зрелой формы этого белка (то есть 168-182 ак). Этот сигнальный пептид направляет полипептид к клеточной поверхности/секреторному пути. За счет альтернативного сплайсинга мРНК с последующим действием на последовательности, кодирующие белок, изоформы белка по-разному обрабатываются клеткой - изоформа а локализована на мембране и прикреплена к поверхности клетки посредством гликозилфосфатидилинозитольной (GPI) связи, в то время как изоформы b и с лишены GPI-прикрепляющей сигнальной последовательности и поэтому, как ожидается, секретируются клеткой. Выравнивание этих трех белковых изоформ человеческого EFNA4 показано на Фиг.1В. Как отмечено ранее, если иное не указано посредством непосредственной ссылки или контекстной необходимости, термин EFNA4 относится к изоформе а человеческого EFNA4 и иммунореактивным эквивалентам. Кроме того, следует понимать, что этот термин также может относиться к производному или фрагменту нативной или вариантной формы EFNA4, которая содержит эпитоп, с которым может специфически связываться антитело или иммунореактивный фрагмент.
II. Клетки, поддерживающие опухоль
В отличие от руководств в уровне техники, в настоящем изобретении предложены модуляторы EFNA, которые особенно полезны для нацеливания на опухоль-инициирующие клетки и особенно на клетки, поддерживающие опухоль, тем самым облегчая лечение, ведение или предупреждение опухолевых заболеваний. Более конкретно, как указано ранее, неожиданно было обнаружено, что специфические субпопуляции опухолевых клеток экспрессируют EFNA и, по-видимому, модифицируют локализованную координацию передачи сигналов посредством морфогена, важную для самообновления раковых стволовых клеток и выживаемости клеток. Таким образом, в предпочтительных воплощениях модуляторы EFNA можно использовать для снижения частоты появления опухоль-инициирующих клеток, в соответствии с настоящим руководством, и, тем самым, облегчения лечения и ведения гиперпролиферативных заболеваний.
При использовании здесь термин "опухоль-инициирующая клетка" (TIC) охватывает как клетки, поддерживающие опухоль (ТРС; то есть раковые стволовые клетки или CSC), так и высоко пролиферативные клетки-предшественники опухоли (называемые TProg), которые вместе, как правило, составляют уникальную субпопуляцию (то есть 0,1-40%) объема опухоли или массы. В данном описании термины "клетки, поддерживающих опухоль" и "раковые стволовые клетки" являются эквивалентными и могут быть использованы здесь взаимозаменяемо. Наоборот, ТРС отличаются от TProg тем, что они могут полностью повторять состав опухолевых клеток, существующий в опухоли, и обладают способностью к неограниченному самообновлению, как показано с помощью серийной трансплантации (два или более пассажей у мышей) небольших количеств выделенных клеток. Как будет обсуждаться более подробно ниже, сортировка флуоресцентно-активированных клеток (FACS) с использованием подходящих клеточных поверхностных маркеров представляет собой надежный способ выделения высоко обогащенных клеточных субпопуляций (чистота более 99,5%) благодаря, по меньшей мере частично, своей способности различать одиночные клетки и скопления клеток (то есть дублеты и т.д.). С помощью таких методов было показано, что при трансплантации мышам с ослабленным иммунитетом небольшого количества высокоочищенных клеток TProg, последние могут питать рост опухоли в первичном трансплантате. Однако в отличие от очищенных субпопуляций ТРС, TProg образовывали опухоли, которые не отражают полностью фенотипическую клеточную гетерогенность родительской опухоли и являются явно неэффективными в возобновлении серийного онкогенеза при последующих трансплантациях. Напротив, субпопуляции ТРС полностью восстанавливает клеточную гетерогенность родительских опухолей и могут эффективно инициировать опухоли при серийном выделении и трансплантации. Таким образом, специалистам в данной области понятно, что определяющей разницей между ТРС и TProg, хотя обе они могут индуцировать опухоли в первичных трансплантантах, является уникальная способность ТРС постоянно питать рост гетерогенной опухоли при серийных трансплантациях с небольшим числом клеток. Другие общие подходы для характеристики ТРС включают морфологию и определение клеточных поверхностных маркеров, транскрипционного профиля и реакцию на лекарственные средства, хотя экспрессия маркера может меняться в зависимости от условий культивирования и пассажа клеточной линии in vitro.
Соответственно, в контексте настоящего изобретения, клетки, поддерживающие опухоль, аналогично нормальным стволовым клеткам, которые поддерживают клеточную иерархию в нормальной ткани, предпочтительно, определяют по их способности к бесконечному самообновлению при сохранении способности к мультилинейной дифференцировке. Клетки, поддерживающие опухоль, таким образом, способны образовать как онкогенное потомство (то есть опухоль-инициирующие клетки: ТРС и TProg), так и неонкогенное (NTG) потомство. При использовании здесь, неонкогенные клетки (NTG) относятся к опухолевым клеткам, которые происходят из опухоль-инициирующих клеток, но сами по себе не обладают способностью к самообновлению или образованию гетерогенных линий опухолевых клеток, составляющих опухоль. В эксперименте NTG-клетки не способны воспроизводимо образовывать опухоли у мышей, даже при трансплантации избыточных количеств клеток.
Как указано, TProg также относятся к категории опухоль-инициирующих клеток (или TIC) благодаря их ограниченной способности генерировать опухоли у мышей. TProg являются потомством ТРС и обычно способны к конечному числу не-самообновляющихся клеточных делений. Кроме того, клетки TProg можно дополнительно разделить на ранние клетки-предшественники опухоли (ЕТР) и поздние клетки-предшественники опухоли (LTP), каждые из которых можно отличить по фенотипу (например, клеточным поверхностным маркерам) и разным способностям воссоздавать архитектуру опухолевой клетки. Несмотря на такие технические различия, и ЕТР, и LTP функционально отличаются от ТРС тем, что они, как правило, менее способны к серийному воссозданию опухолей при трансплантации небольших количеств клеток и, как правило, не отражают гетерогенность родительской опухоли. Несмотря на вышеуказанные различия, также было показано, что различные популяции TProg могут, в редких случаях, приобретать способность к самообновлению, обычно присущую стволовым клеткам, и сами становятся ТРС (или CSC). В любом случае оба типа опухоль-инициирующих клеток, по всей видимости, представлены в массе типичной опухоли одного пациента и подлежат лечению модуляторами, как описано здесь. То есть, описанные композиции, как правило, эффективны в снижении частоты появления или в изменении химиочувствительности таких EFNA-положительных опухоль-инициирующих клеток, независимо от конкретного воплощения или смеси, представленных в опухоли.
В контексте настоящего изобретения ТРС являются более онкогенными, относительно более неактивными и часто более химиорезистентными, чем TProg (как ЕТР, так и LTP), NTG-клетки и инфильтрующие опухоль клетки, происходящие не из ТРС, (например, фибробласты/строма, эндотелиальные и гемопоэтические клетки), которые составляют основной объем опухоли. Учитывая, что обычные способы лечения и схемы лечения, в значительной степени, были разработаны, чтобы уменьшать массу опухолей и атаковать быстро пролиферирующие клетки, ТРС, вероятно, являются более резистентными к обычным терапевтическим средствам и схемам лечения, чем быстро пролиферирующие TProg и другие клеточные популяции массивных опухолей. Кроме того, ТРС часто проявляют другие характеристики, которые делают их относительно химиорезистентными к обычным терапевтическим средствам, такие как повышенная экспрессия транспортеров множественной лекарственной резистентности, усиленные механизмы репарации ДНК и антиапоптотические белки. Эти свойства, каждое из которых вносит вклад в устойчивость ТРС к лекарственным средствам, является одной из причин неудач стандартных схем лечения онкологии в обеспечении длительной пользы для большинства пациентов с поздней стадией неоплазии; то есть не удается адекватно нацелиться и уничтожить те клетки, которые питают постоянный рост опухоли и ее повторное проявление (то есть ТРС или CSC).
В отличие от многих вышеупомянутых способов лечения из уровня техники, новые композиции по настоящему изобретению предпочтительно снижают частоту появления опухоль-инициирующих клеток при введении субъекту независимо от формы и конкретной мишени (например, генетический материал, EFNA-антитело или слитая лигандная конструкция) выбранного модулятора. Как отмечалось выше, снижение частоты появления опухоль-инициирующих клеток может происходить в результате а) удаления, истощения, сенсибилизации, подавления или ингибирования опухоль-инициирующих клеток; б) контролирования роста, распространения или повторного появления опухоль-инициирующих клеток; в) нарушения инициации, распространения, сохранения или пролиферации опухоль-инициирующих клеток; или г) препятствования иным способом выживаемости, регенерации и/или метастазированию онкогенных клеток. В некоторых воплощениях снижение частоты появления опухоль-инициирующих клеток происходит в результате изменения одного или более физиологических путей. Изменение пути посредством сокращения или удаления опухоль-инициирующих клеток или модификации их активности (например, индуцированная дифференцировка, нарушение ниши) или иное вмешательство в их способность оказывать воздействие на окружение опухоли или другие клетки, в свою очередь обеспечивает возможность более эффективного лечения EFNA-ассоциированных расстройств путем ингибирования онкогенеза, ингибирования поддержания опухоли и/или метастазирования и повторного появления.
В число методов, которые можно использовать для оценки такого сокращения частоты появления опухоль-инициирующих клеток, входит анализ методом серийных разведений либо in vitro, либо in vivo, предпочтительно с последующим подсчетом с использованием статистических параметров распределения Пуассона или оценкой частоты появления предварительно установленных определяющих событий, таких как наличие или отсутствие способности генерировать опухоли in vivo. В то время как такой анализ методом серийных разведений является предпочтительным методом подсчета снижения частоты появления опухоль-инициирующих клеток, другие менее требовательные методы также могут быть использованы для эффективного, хотя и немного менее точного, определения нужных значений, и являются полностью совместимые с данным руководством. Таким образом, как очевидно специалистам в данной области, также можно определить снижение значений частоты появления с помощью хорошо известных методов проточной цитометрии или иммуногистохимического анализа. В отношении всех указанных выше способов см., например, Dylla et al. 2008, PMCID: PMC2413402 и Hoey et al. 2009, PMID: 19664991; каждый из которых включен в данную заявку посредством ссылки во всей полноте.
Что касается анализа методом серийных разведений, in vitro подсчет частоты появления опухоль-инициирующих клеток может быть осуществлен путем помещения либо фракционированных, либо нефракционированных опухолевых клеток человека (например, из обработанных и необработанных опухолей соответственно) в ростовые условия in vitro, которые способствуют колониеобразованию. Таким образом, колониеобразующие клетки можно сосчитать с помощью простого подсчета и характеристики колоний, или посредством анализа, состоящего, например, из помещения человеческих опухолевых клеток в планшеты в серийных разведениях и оценки каждой лунки, либо как положительной, либо как отрицательной в отношении образования колоний по меньшей мере через 10 суток после посева. Эксперименты или анализы с серийным разведением in vivo, которые, как правило, являются более точными в их способности определить частоту появления опухоль-инициирующих клеток, включают трансплантацию человеческих опухолевых клеток, либо из необработанного контроля, либо из обработанных клеток, например мышам с ослабленным иммунитетом в серийных разведениях, и последующую оценку каждой мыши либо как положительную, либо как отрицательную в отношении образования опухоли через по меньшей мере 60 суток после трансплантации. Выведение значений частоты появления клеток посредством анализа методом серийных разведений in vitro или in vivo предпочтительно получали, используя статистические параметры распределения Пуассона к известной частоте появления положительных и отрицательных событий, тем самым получая частоту событий, соответствующих определению положительного события; в данном случае образования колонии или опухоли соответственно.
Что касается других методов, совместимых с настоящим изобретением, которые можно использовать для вычисления частоты появления опухоль-инициирующих клеток, наиболее распространенными являются методы количественной проточной цитометрии и метода иммуногистохимического окрашивания. Хотя эти методы не так точны, как анализ методом серийных разведений, описанный непосредственно выше, эти методики гораздо менее трудоемки и обеспечивают приемлемые значения за относительно короткий период времени. Таким образом, следует понимать, что специалист может применять определение профиля маркеров клеточной поверхности с помощью проточной цитометрии с использованием одного или более антител или реагентов, связывающих белки клеточной поверхности, которыми, как известно из уровня техники, богаты опухоль-инициирующие клетки (например, потенциально совместимые маркеры, как описано в Примере 1 ниже) и таким образом измерять уровень TIC в различных образцах. С помощью еще одного совместимого метода специалист в данной области может определить частоту появления TIC in situ (например, в срезе ткани) посредством иммуногистохимии с использованием одного или более антител или реагентов, которые способны связывать белки клеточной поверхности, которыми, как предполагается, отличаются эти клетки.
Используя любой из вышеупомянутых методов, можно затем количественно определить снижения частоты появления TIC (или ТРС в них), обеспечиваемую раскрытыми модуляторами EFNA (в том числе конъюгированными с цитотоксическими агентами) в соответствии с руководством в данной заявке. В некоторых случаях соединения по настоящему изобретению могут снижать частоту появления TIC (с помощью различных механизмов, указанных выше, включая удаление, индуцированную дифференцировку, разрушение ниши, подавление и т.д.) на 10%, 15%, 20%, 25%, 30% или даже на 35%. В других воплощениях снижение частоты появления TIC может составлять около 40%, 45%, 50%, 55%, 60% или 65%. В некоторых воплощениях раскрытые соединения могут снижать частоту появления TIC на 70%, 75%, 80%, 85%, 90% или даже 95%. Конечно, следует понимать, что любое снижение частоты появления TIC вероятно приведет к соответствующему снижению онкогенности, устойчивости, повторного проявления и агрессивности неоплазии.
III. Модуляторы EFNA
В любом случае настоящее изобретение направлено на применение модуляторов EFNA, в том числе антагонистов EFNA, для диагностики, лечения и/или профилактики любой из большого количества EFNA-ассоциированных злокачественных опухолей. Раскрытые модуляторы можно использовать отдельно или в сочетании с широким спектром противораковых соединений, таких как химиотерапевтические или иммунотерапевтические агенты или модификаторы биологического ответа. В других выбранных воплощениях два или более отдельных модуляторов EFNA можно использовать в комбинации, чтобы обеспечить усиленные противоопухолевые эффекты или можно использовать для изготовления полиспецифических конструкций.
В некоторых воплощениях модуляторы EFNA по настоящему изобретению содержат нуклеотиды, олигонуклеотиды, полинуклеотиды, пептиды или полипептиды. Еще более предпочтительно модуляторы содержат растворимый EFNA (sEFNA) или его форму, вариант, производное или фрагмент, в том числе, например, слитые EFNA-конструкции (например, EFNA-Fc, EFNA-нацеленная группировка и т.д.) или конъюгаты EFNA (например, ЕРМА-РЕС(полиэтиленгликоль), EFNA-цитотоксический агент, EFNA-BRM(модификатор биологического ответа) и т.д.). Следует также иметь в виду, что в других воплощениях модуляторы EFNA включают антитела (например, анти-EFNA1 или aHTH-EFNA4 mAb (моноклональные антитела)), или их иммунореактивные фрагменты или производные. В особенно предпочтительных воплощениях модуляторы по настоящему изобретению содержат нейтрализующие антитела или их производные или фрагменты. В других воплощениях модуляторы EFNA могут содержать интернализованные антитела или их фрагменты. В других воплощениях модуляторы EFNA могут содержать истощающие антитела или их фрагменты. Кроме того, как и вышеупомянутые слитые конструкции, эти антительные модуляторы могут быть конъюгированы, связаны или иным образом соединены с выбранными цитотоксическими агентами, полимерами, модификаторами биологического ответа (BRM) и т.п. для обеспечения направленной иммунотерапии с различными (и, возможно, многочисленными) механизмами действия. Как упоминалось выше, такие антитела могут быть пан-EFNA антителами и соединяться с двумя или более лигандами эфринами А или иммуноспецифическими антителами, которые селективно взаимодействуют с одним из шести лигандов эфринов А. В других воплощениях модуляторы могут работать на генетическом уровне и могут содержать такие компоненты, как антисмысловые конструкции, миРНК (малые интерферирующие РНК), микроРНК и т.п.
На основании руководства данной заявки специалистам в данной области понятно, что особенно предпочтительные воплощения изобретения могут включать SEFNA4 или sEFNA1 или антитела-модуляторы, которые ассоциированы с одним или с обоими из EFNA4 или EFNA1.
Кроме того, следует понимать, что раскрытые модуляторы EFNA могут истощать, подавлять активность, нейтрализовать, устранять или ингибировать рост, размножение или выживаемость опухолевых клеток, в частности ТРС и/или ассоциированную неоплазию посредством различных механизмов, включая агонизм и антагонизм выбранных путей или устранение специфических клеток в зависимости, например, от формы модулятора EFNA, любой присоединенной полезной нагрузки или дозы и способа доставки. Соответственно, в то время как предпочтительные воплощения, раскрытые в данной заявке, направлены на истощение, ингибирование или подавление субпопуляций специфических опухолевых клеток, таких как клетки, поддерживающие опухоль, следует подчеркнуть, что такие воплощения являются только иллюстративными, и ни в каком смысле не ограничивающими. Скорее, как изложено в прилагаемой формуле изобретения, настоящее изобретение в широком смысле направлено на модуляторы EFNA и их применение в лечении, терапии или профилактике различных EFNA-ассоциированных гиперпролиферативных расстройств независимо от любого конкретного механизма или целевой популяции опухолевых клеток.
В том же смысле раскрытые воплощения настоящего изобретения могут включать один или более антагонистов EFNA. В связи с этим следует понимать, что антагонисты EFNA по настоящему изобретению могут включать любой лиганд, полипептид, пептид, слитый белок, антитело или его иммунологически активный фрагмент или производное, который распознает, вступает во взаимодействие, связывается, объединяется, конкурирует, соединяется или иным образом взаимодействует с белком EFNA или его фрагментом и устраняет, подавляет активность, уменьшает, ингибирует, препятствует, сдерживает или контролирует рост опухоль-инициирующих клеток или других опухолевых клеток, включая клетки опухолевой массы или NTG. В выбранных воплощениях модулятор EFNA включает антагонист EFNA.
При использовании здесь "антагонист" относится к молекуле, способной нейтрализовать, блокировать, ингибировать, отменять, уменьшать или служить препятствием активностям конкретного или специфического белка, включая связывание рецепторов с лигандами или взаимодействие ферментов с субстратами. В более общем смысле антагонисты по изобретению могут включать антитела и их антиген-связывающие фрагменты или производные, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, антисмысловые конструкции, миРНК, микроРНК, биоорганические молекулы, пептидомиметики, фармакологические агенты и их метаболиты, последовательности, контролирующие транскрипцию и трансляцию, и тому подобное. Антагонисты также могут включать низкомолекулярные ингибиторы, слитые белки, рецепторные молекулы и производные, которые специфически связываются с белком, тем самым блокируя его связывание с целевым субстратом, антагонистические варианты белка, антисмысловые молекулы, направленные на белок, РНК-аптамеры и рибозимы против белка.
При использовании здесь и применении к двум или более молекулам или соединениям, термины "узнает" или "соединяется" означают реакцию, связывание, специфическое связывание, комбинацию, взаимодействие, соединение, связь, объединение, слияние, поглощение или присоединение, ковалентное или нековалентное, молекул, где одна молекула оказывает эффект на другую молекулу.
Кроме того, как показано в примерах в данной заявке, некоторые модуляторы EFNA человека могут, в некоторых случаях, перекрестно реагировать с EFNA видов, не являющихся человеком (например, мыши). В других случаях типичные модуляторы могут быть специфичными к одной или более изоформам EFNA человека и не демонстрировать перекрестную реакцию с ортологами EFNA других видов. Конечно, в сочетании с идеями данной заявки такие воплощения могут включать пан-EFNA антитела, которые связываются с двумя или более лигандами эфринами А одного вида, или антитела, которые исключительно соединяются с одним лигандом эфрином А.
В любом случае, как будет обсуждаться более подробно ниже, специалистам в данной области очевидно, что раскрытые модуляторы можно использовать в конъюгированной или неконъюгированной форме. Таким образом, модулятор может быть соединен или конъюгирован (например, ковалентно или нековалентно) с фармацевтически активными компонентами, модификаторами биологического ответа, противораковыми агентами, цитотоксическими или цитостатическими агентами, диагностическими группировками или биосовместимыми модификаторами. В этом отношении следует иметь в виду, что такие конъюгаты могут включать пептиды, полипептиды, белки, слитые белки, молекулы нуклеиновой кислоты, малые молекулы, миметики, синтетические лекарственные препараты, неорганические молекулы, органические молекулы и радиоизотопы. Кроме того, как указано в данном описании, выбранный конъюгат может быть ковалентно или нековалентно связан с модулятором EFNA в различных молярных соотношениях в зависимости, по меньшей мере частично, от метода, используемого для осуществления конъюгации.
Антитела
а. Обзор
Как уже упоминалось, особенно предпочтительные воплощения настоящего изобретения включают модуляторы EFNA в форме антител. Термин антитело используется в наиболее широком смысле и конкретно включает синтетические антитела, моноклональные антитела, олигоклональные или поликлональные антитела, мультиклональные антитела, рекомбинантные антитела, интратела, полиспецифические антитела, биспецифические антитела, моновалентные антитела, поливалентные антитела, человеческие антитела, гуманизированные антитела, химерные антитела, CDR-привитые антитела, приматизированные антитела, Fab-фрагменты, F(ab′)-фрагменты, одноцепочечные FvFcs (scFvFc), одноцепочечные Fvs (scFv), антиидиотипические (анти-Id) антитела и любые другие иммунологически активные фрагменты антител, при условии, что они проявляют нужную биологическую активность (то есть соединение или связывание с EFNA). В более широком смысле, антитела по настоящему изобретению включают иммуноглобулиновые молекулы и иммунологически активные фрагменты иммуноглобулиновых молекул, то есть молекулы, которые содержат антиген-связывающий сайт, причем эти фрагменты могут быть или могут не быть слитыми с другим иммуноглобулиновым доменом, включая, но не ограничиваясь ими, с Fc-участком или его фрагментом. Кроме того, как описано более подробно в данной заявке, термины "антитело" и "антитела" в частности включают Fc-варианты, как описано ниже, в том числе полноразмерные антитела и варианты Fc-слияний, содержащие Fc-участки или их фрагменты, возможно содержащие по меньшей мере одну модификацию аминокислотного остатка и слитые с иммунологически активным фрагментом иммуноглобулина.
Как описано более подробно ниже, общие термины "антитело" или "иммуноглобулин" содержат пять различных классов антител, которые можно различить биохимически и, в зависимости от аминокислотной последовательности константного домена их тяжелых цепей, можно легко отнести к соответствующему классу. В силу исторических причин основные классы интактных антител называются IgA, IgD, IgE, IgG и IgM. У человека классы IgG и IgA можно дополнительно разделить на признанные подклассы (изотипы), то есть IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2 в зависимости от структуры и некоторых биохимических свойств. Следует понимать, что изотипы IgG у человека названы в порядке их распространенности в сыворотке, причем наиболее распространенным является IgG1.
Хотя все пять классов антител (то есть IgA, IgD, IgE, IgG и IgM) и все изотипы (то есть IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), а также их варианты входят в объем настоящего изобретения, предпочтительные воплощения, включающие класс иммуноглобулина IgG обсуждаются более подробно исключительно для иллюстрации. Однако следует понимать, что такое описание просто демонстрирует типичные композиции и способы осуществления настоящего изобретения на практике и никоим образом не ограничивают объем изобретения или прилагаемую формулу изобретения.
В этом отношении человеческие иммуноглобулины IgG содержат две идентичные легкие полипептидные цепи с молекулярной массой приблизительно 23000 дальтон и две идентичные тяжелые цепи с молекулярной массой 53000-70000 в зависимости от изотипа. Константные домены тяжелой цепи, которые соответствуют различным классам антител, обозначаются соответствующей строчной греческой буквой α, δ, ε, γ и µ соответственно. Легкие цепи антител из любого вида позвоночных могут быть отнесены к одному из двух четко отличающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов. Специалистам в данной области понятно, что структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
Четыре цепи соединены дисульфидными связями в Y-конфигурацию, где легкие цепи захватывают в вилку тяжелые цепи, начиная с устья Y и далее через вариабельную область до двух концов Y. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как две дисульфидные связи в шарнирной области соединяют тяжелые цепи. Соответствующие тяжелые и легкие цепи также имеют расположенные на регулярном расстоянии друг от друга внутрицепочечные дисульфидные мостики, число которых может меняться в зависимости от изотипа IgG.
Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. В связи с этим следует понимать, что вариабельные домены участков как легкой (VL), так и тяжелой (VH) цепи определяют антигенное распознавание и специфичность к антигену. Напротив, константные домены легкой цепи (CL) и тяжелой цепи (CH1, CH2 или CH3) придают и регулируют важные биологические свойства, такие как секреция, трансплацентарная подвижность, время полужизни в кровотоке, связывание комплемента и тому подобное. Принято, что нумерация доменов константной области увеличивается по мере удаления от сайта связывания антигена или амино-конца антитела. Таким образом, амино- или N-конец антитела содержит вариабельную область, а карбокси- или С-конец содержит константную область. Таким образом, CH3 и CL домены фактически включают карбокси-конец тяжелой и легкой цепи соответственно.
Термин "вариабельный" связан с тем, что некоторые участки вариабельных доменов значительно различаются своими последовательностями у иммуноглобулинов и эти горячие точки в значительной степени определяют связывание и специфические характеристик конкретного антитела. Эти гипервариабельные сайты проявляются в трех сегментах, известных как области, определяющие комплементарность (CDR), в вариабельных доменах как легкой цепи, так и тяжелой цепи соответственно. Наиболее консервативные участки вариабельных доменов, фланкирующие CDR, называются каркасными участками (FR). Более конкретно, в природных мономерных IgG-антителах шесть CDR, присутствующих на каждом плече, представляют собой короткие, несоприкасающиеся аминокислотные последовательности, которые специфически расположены с образованием антиген-связывающего сайта, когда антитело приобретает свою трехмерную конфигурацию в водной среде.
Каркасные участки, содержащие остатки вариабельных доменов тяжелой и легкой цепи, демонстрируют меньшую межмолекулярную вариабельность аминокислотной последовательности. Скорее, каркасные участки большей частью принимали β-складчатую конформацию, а CDR образовывали петли, которые соединялись и в некоторых случаях образовывали часть β-складчатой структуры. Таким образом, эти каркасные участки действуют, чтобы сформировать остов, который обеспечивает размещение шести CDR в правильной ориентации посредством межцепочечных нековалентных взаимодействий. Антиген-связывающий сайт, образованный таким образом расположенными CDR, определяет поверхность, комплементарную эпитопу на иммунореактивном антигене (то есть EFNA4). Эта комплементарная поверхность способствует нековалентному связыванию антитела с эпитопом иммунореактивного антигена. Понятно, что положения CDR могут быть легко определены специалистом в данной области техники.
Как описано более подробно ниже и показано в прилагаемых Примерах, все или часть вариабельных областей тяжелой и легкой цепи могут быть рекомбинированы или сконструированы с использованием стандартных методов рекомбинации и экспрессии с получением эффективных антител. То есть вариабельная область тяжелой или легкой цепи из первого антитела (или любой ее участок) может быть смешана и подобрана к любому выбранному участку вариабельной области тяжелой или легкой цепи из второго антитела. Например, в одном воплощении, целая вариабельная область легкой цепи, содержащая три CDR легкой цепи первого антитела, может быть спарена с целой вариабельной областью тяжелой цепи, содержащей три CDR тяжелой цепи второго антитела с получением функционального антитела. Кроме того, в других воплощениях отдельные CDR тяжелой и легкой цепи, полученные из различных антител, могут быть смешаны или подобраны с получением нужного антитела, имеющего оптимизированные характеристики. Таким образом, типичное антитело может содержать три CDR легкой цепи из первого антитела, два CDR тяжелой цепи, полученной из второго антитела, и третий CDR тяжелой цепи из третьего антитела.
Более конкретно, в контексте настоящего изобретения следует понимать, что любая из раскрытых CDR тяжелой и легкой цепи на Фиг.7А может быть перегруппирована таким образом, чтобы получить оптимизированные анти-EFNA (например, анти-пЕРМА4) антитела согласно настоящему руководству. То есть одна или более CDR, раскрытых в Фиг.7А, могут быть включены в модулятор EFNA и, в особенно предпочтительных воплощениях, в CDR-привитое или гуманизированное антитело, которое иммуноспецифически связывается с одним или более лигандами эфринами А.
В любом случае, номера остатков области, определяющей комплементарность, можно определить по Kabat et al. (1991, NIH Publication 91-3242, National Technical Information Service, Springfield, Va.), в частности остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) в вариабельном домене легкой цепи и 31-35 (CDR1), 50-65 (CDR2) и 95-102 (CDR3) в вариабельном домене тяжелой цепи. Следует обратить внимание, что CDR значительно варьируются от антитела к антителу (и в сущности не проявляют гомологии с консенсусными последовательностями Kabat). Максимальное выравнивание остатков каркаса часто требует вставки спейсерных остатков в системе нумерации, используемой для области Fv. Кроме того, идентичность некоторых отдельных остатков для любого взятого номера положения по Kabat может варьироваться от одной цепи антитела к другой цепи антитела из-за межвидовой или аллельной дивергенции. См. также Chothia et al., J. Mol. Biol. 196:901-917 (1987); Chothia et al., Nature 342, pp.877-883 (1989) и MacCallum et al., J. Mol. Biol. 262:732-745 (1996), где определения включают перекрывание или подмножества аминокислотных остатков при сравнении друг с другом. Каждая из вышеупомянутых работ включена в данную заявку посредством ссылки во всей полноте, и аминокислотные остатки, которые охватывают CDR, как определено в каждой из вышеупомянутых ссылок, приведены для сравнения.
Определения CDR
|
1Нумерация остатков согласно номенклатуре Kabat et al., выше
2Нумерация остатков согласно номенклатуре Chothia et al., выше
3Нумерация остатков согласно номенклатуре MacCallum et al., выше
Для удобства CDR, представленные на Фиг.7А (SEQ ID NO:8-59 и 70-95), определены с использованием номенклатуры Chothia et al., хотя, с учетом содержания данной заявки, специалист в данной области может легко идентифицировать и пронумеровать CDR по Kabat et al. или по MacCallum et al. для каждой соответствующей последовательности тяжелой и легкой цепи. В связи с этим, CDR, определенные по Kabat et al., использовали для анализа гуманизации, изложенного в Примере 7(b), и подчеркнуты на Фиг.7П-7Т (SEQ ID NO:148-163), где изображены последовательности гуманизированных антител в соответствии с настоящим изобретением. Соответственно, антитела, содержащие CDR, определенные согласно всем таким системам нумерации, включены в объем настоящего изобретения. В более широком смысле термин "аминокислотный остаток вариабельной области CDR" включает аминокислоты в CDR, определенные при использовании любого основанного на последовательности или структуре метода, как изложено выше.
При использовании здесь термин "аминокислотные остатки каркасного участка(РР) вариабельной области" относится к аминокислотам каркасного участка цепи Ig. Термин "каркасный участок" или "FR-участок", при использовании здесь, включает аминокислотные остатки, которые являются частью вариабельной области, но не частью CDR (например, с использованием определения CDR по Kabat). Следовательно, каркасный участок вариабельной области является прерывистой последовательностью длиной примерно 100-120 аминокислот, но включает только аминокислоты, расположенные за пределами CDR.
В качестве конкретного примера вариабельной области тяжелой цепи и CDR, определенных по Kabat et al., каркасный участок 1 соответствует домену вариабельной области, содержащему аминокислоты 1-30; каркасный участок 2 соответствует домену вариабельной области, содержащему аминокислоты 36-49; каркасный участок 3 соответствует домену вариабельной области, содержащему аминокислоты 66-94, и каркасный участок 4 соответствует домену вариабельной области от аминокислоты 103 до конца вариабельной области. Каркасные участки легкой цепи аналогично разделены каждой из вариабельных областей CDR легкой цепи. Аналогично, используя определения CDR по Chothia et al. или по McCallum et al. границы каркасные участки разделены соответствующими окончаниями CDR, как описано выше.
Учитывая вышеупомянутые структурные соображения, специалистам в данной области понятно, что антитела по настоящему изобретению могут включать любое из ряда функциональных воплощений. В этом отношении, совместимые антитела могут включать любое иммунореактивное антитело (как этот термин определен в данном описании), которое обеспечивает нужный физиологический ответа у субъекта. В то время как любые раскрытые антитела можно использовать в сочетании с идеями настоящего изобретения, определенные воплощения изобретения включают химерные, гуманизированные или человеческие моноклональные антитела или их иммунореактивные фрагменты. Тем не менее, другие воплощения могут, например, включать гомогенные или гетерогенные мультимерные конструкции, Fc-варианты и конъюгированные или измененные посредством гликозилирования антитела. Кроме того, следует понимать, что такие конфигурации не являются взаимоисключающими и, что совместимые отдельные антитела могут включать один или более функциональных аспектов, раскрытых в данной заявке. Например, совместимое антитело может включать одноцепочечное диатело с гуманизированными вариабельными областями или полноразмерное полностью человеческое антитело IgG3 с модификациями Fc, которые меняют профиль гликозилирования для изменения времени полужизни в сыворотке. Другие типичные воплощения очевидны специалистам в данной области и могут быть легко узнаны как входящие в объем изобретения.
б. Получение антител
Хорошо известно, что различные животные-хозяева, в том числе кролики, мыши, крысы и т.д. могут быть привиты и использованы для получения антител в соответствии с идеями данной заявки. Известные в данной области адъюванты, которые можно использовать для усиления иммунного ответа, в зависимости от вида привитого животного, включают, но не ограничиваются ими, адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианины фиссурелии, динитрофенол, и потенциально полезные адъюванты человека, такие как BCG (бацилла Кальметта-Герена), а также Corynebacterium parvum. Такие адъюванты могут защитить антиген от быстрого рассредоточения путем ограничения его в локальном отложении, или они могут содержать вещества, которые стимулируют организмы-хозяева секретировать факторы хемотаксические для макрофагов и других компонентов иммунной системы. Предпочтительно, при введении полипептида схема иммунизации будет включать два или более введений полипептида, произведенных в течение несколько недель.
После иммунизации животного иммуногеном EFNA (например, растворимым EFNA4 или EFNA1), который может содержать выбранные изоформы и/или пептиды, или живыми клетками или клеточными препаратами, экспрессирующими нужный белок, антитела и/или антитело-продуцирующие клетки можно получить из этого животного, используя известные в данной области методы. В некоторых воплощениях поликлональную анти-EFNA антитело-содержащую сыворотку получают посредством обескровливания или умерщвления животного. Сыворотку можно использовать в исследовательских целях в форме, полученной из животного, или, альтернативно, анти-EFNA антитела могут быть частично или полностью очищены с получением иммуноглобулиновых фракций или гомогенных препаратов антител.
в. Моноклональные антитела
В то время как поликлональные антитела могут быть использованы в некоторых аспектах настоящего изобретения, предпочтительные воплощения включают использование EFNA-реакционно-способных моноклональных антител. При использовании здесь, термин "моноклональное антитело" или "mAb" относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных мутаций, например естественных мутаций, которые могут присутствовать в незначительных количествах. Таким образом, модификатор моноклональное указывает, что антитела по природе не является смесью отдельных антител и может быть использовано вместе с любым типом антитела. В некоторых воплощениях такое моноклональное антитело включает антитело, содержащее полипептидную последовательность, которая связывается или соединяется с EFNA, где EFNA-связывающую полипептидную последовательность получали посредством процесса, включающего селекцию одной связывающей мишень полипептидной последовательности из множества полипептидных последовательностей.
В предпочтительных воплощениях антитело-продуцирующие клеточные линии получают из клеток, выделенных из иммунизированного животного. После иммунизации животное умерщвляют и лимфатические узлы и/или В-клетки селезенки иммортализуют хорошо известными в данной области способами, как показано в прилагаемых Примерах. Методы иммортализации клеток включают, без ограничения ими, трансфекцию их онкогенами, инфицирование их онкогенным вирусом и культивирование их в условиях, селетирующих иммортализованные клетки, воздействие на них карценогенных или мутагенных соединений, слияние их с иммортализованной клеткой, например клеткой миеломы, и инактивацию генов-супрессоров опухолей. При слиянии с клетками миеломы, клетки миеломы предпочтительно не секретируют полипептиды иммуноглобулинов (несекреторная клеточная линия). Иммортализованные клетки подвергали скринингу с использованием лиганда эфрина А (включая выбранные изоформы) или его иммунореактивного участка. В предпочтительном воплощении первичный скрининг выполняли с использованием иммуноферментного анализа (ELISA) или радиоиммуноанализа.
В общем случае, отдельные моноклональные антитела в соответствии с настоящим изобретением могут быть приготовлены с использованием разнообразных методов, известных в данной области техники, включая гибридомы, рекомбинантные методы, технологии фагового дисплея, дрожжевые библиотеки, трансгенных животных (например, XenoMouse® или HuMAb Mouse®) или их комбинации. Например, моноклональные антитела могут быть получены с использованием метода гибридомы, как в общих чертах описано выше и более подробно в Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling, et al., в: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), каждый из которых включен в данную заявку. Используя описанные протоколы, антител предпочтительно генерируют у млекопитающих посредством множества подкожных или внутрибрюшинных инъекций соответствующего антигена и адъюванта. Как обсуждалось ранее, эта иммунизация обычно вызывает иммунный ответ, который включает продукцию антиген-реактивных антител (которые могут быть полностью человеческими, если иммунизированное животное является трансгенным) из активированных спленоцитов или лимфоцитов. В то время как полученные антитела могут быть собраны из сыворотки животного для получения поликлональных препаратов, обычно более желательно выделить отдельные лимфоциты из селезенки, лимфатических узлов или периферической крови, чтобы получить гомогенные препараты моноклональных антител. Как правило, лимфоциты получают из селезенки и иммортализуют для получения гибридом.
Например, как описано выше, процесс селекции может заключаться в селекции уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов и рекомбинантных ДНК-клонов. Следует понимать, что выбранная EFNA-связывающаяся последовательность может быть дополнительно изменена, например, с целью улучшения аффинности к мишени, гуманизации указанной мишень-связывающей последовательности, улучшения его продуцирования в клеточной культуре, снижения ее иммуногенности in vivo, создания полиспецифического антитела и т.д., и что антитело, содержащее измененную мишень-связывающую последовательность, также представляет собой моноклональное антитело по данному изобретению. В отличие от препаратов поликлональных антител, которые обычно включают отдельные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одной детерминанты на антигене. В дополнение к их специфичности, преимуществом препаратов моноклональных является то, что они, как правило, не загрязнены другими иммуноглобулинами, которые могут обладать перекрестной реакционной способностью.
г. Химерные антитела
В другом воплощении антитело по изобретению может содержать химерные антитела, полученные из ковалентно связанных сегментов белка из по меньшей мере двух разных видов или типов антител. Следует понимать, что при использовании здесь термин "химерные антитела" относится к конструкциям, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, происходящих из определенных видов или принадлежащих конкретному классу или подклассу антител, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, происходящих из других видов или принадлежащих другому классу или подклассу антител, а также к фрагментам таких антител, при условии, что они проявляют нужную биологическую активность (патент США 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). В одном типичном воплощении химерное антитело согласно данному изобретению может содержать мышиные аминокислотные последовательности VH и VL. и константные области, происходящие из человека. В других совместимых воплощениях химерное антитело по настоящему изобретению может содержать CDR-привитое или гуманизированное антитело, как описано ниже.
Как правило, целью создания химерного антитела является создание химеры, в которой количество аминокислот от предполагаемого вида является максимальным. Одним примером является CDR-привитое антитело, в котором антитело содержит одну или более областей, определяющих комплементарность (CDR), из конкретных видов или принадлежащих конкретному классу или подклассу антител, в то время как остальная часть цепи(ей) антител(а) является/являются идентичными или гомологичными соответствующей последовательности антител, происходящих из других видов или принадлежащих другому классу или подклассу антител. Для применения у людей, вариабельную область или выбранные CDR из антитела грызуна часто прививают в антитело человека, заменяя природные вариабельные области или области CDR человеческого антитела. Преимуществами этих конструкций, как правило, является обеспечения полной силы модулятора функций (например, CDC, ADCC и т.д.) при одновременном снижении нежелательных иммунных ответов на антитело у субъекта.
д. Гуманизированные антитела
Гуманизированное антитело аналогично CDR-привитому антителу. Как правило, гуманизированное антитело получают из моноклонального антитела, изначально образованного у животного, не являющегося человеком. При использовании здесь, гуманизированные формы нечеловеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. В одном воплощении гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное или акцепторное антитело), в котором остатки из CDR реципиентного антитела замещены остатками из CDR нечеловеческих видов (донорное антитело), таких как мышь, крыса, кролик или примат, не являющийся человеком, имеющий нужную специфичность, аффинность и/или активность.
Как правило, гуманизация антитела включает анализ гомологии последовательностей и канонических структур как донорного, так и реципиентного антитела. В выбранных воплощениях реципиентное антитело может содержать консенсусные последовательности. Чтобы создать консенсусные человеческие каркасы, каркасы из нескольких аминокислотных последовательностей человеческой тяжелой цепи или легкой цепи можно выровнять, чтобы идентифицировать консенсусную аминокислотную последовательность. Более того, во многих случаях один или более каркасных остатков в вариабельном домене человеческого иммуноглобулина замещают соответствующими нечеловеческими остатками из донорного антитела. Эти каркасные замещения определяют методами, хорошо известными в данной области техники, например путем моделирования взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнения последовательности для идентификации необычных каркасных остатков в конкретных положениях. Такие замещения помогают поддерживать подходящую трехмерную конфигурацию привитого(ых) CDR и часто улучшают бесконечность по сравнению с аналогичными конструкциями без замещений в каркасе. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Эти модификации могут быть сделаны, чтобы дополнительно улучшить эффективность антител с использованием хорошо известных методов.
CDR-привитые и гуманизированные антитела описаны, например, в патентах США 6180370, 5693762, 5693761, 5585089 и 5530101. В общем случае, гуманизированное антитело содержит по существу все из по меньшей мере одного и обычно двух вариабельных доменов, где все или по существу все CDR, соответствуют CDR нечеловеческого иммуноглобулина, и все или по существу все каркасные участки являются каркасными участками последовательности человеческого иммуноглобулина. Гуманизированное антитело, возможно, также содержит по меньшей мере часть константной области иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Более подробно см., например, в Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op.Struct. Biol. 2:593-596 (1992). См. также, например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США 6982321 и 7087409. Еще один способ называется гуманиринг (humaneering) и описан, например, в патенте США 2005/0008625. В контексте настоящей заявки термин "гуманизированные антитела" включает CDR-привитые антитела (то есть человеческие антитела, содержащие один или более привитых нечеловеческих CDR) без или с минимальными замещениями в каркасе.
Дополнительно, нечеловеческое анти-EFNA антитело также может быть модифицировано посредством специфической делеции эпитопов человеческих Т-клеток или деиммунизации способами, раскрытыми в WO 98/52976 и WO 00/34317. В кратком изложении, вариабельные области тяжелой и легкой цепи антитела можно проанализировать в отношении пептидов, которые связываются с МНС (главный комплекс гистосовместимости) класса II; эти пептиды представляют собой потенциальные эпитопы Т-клеток (как определено в WO 98/52976 и WO 00/34317). Для обнаружения потенциальных эпитопов Т-клеток можно применить подход с использованием компьютерного моделирования, называемый «методом протягивания пептида", а также в базе данных пептидов, связывающих человеческий МНС класса II, можно искать мотивы, присутствующие в последовательностях VH и VL, как описано в WO 98/52976 и WO 00/34317. Эти мотивы связываются с любым из 18 основных DR-аллотипов МНС класса II и, таким образом, образуют потенциальные эпитопы Т-клеток. Обнаруженные потенциальные эпитопы Т-клеток могут быть удалены путем замещения небольших количеств аминокислотных остатков в вариабельных областях или посредством единичных аминокислотных замен. Если возможно, осуществляют консервативные замены. Часто, но не исключительно, можно использовать аминокислоты, свойственные для положения в последовательностях антитела зародышевой линии человека. После идентификации деиммунизирующих изменений можно сконструировать нуклеиновые кислоты, кодирующие VH и VL, посредством мутагенеза или других синтетических методов (например, синтеза de novo, замещения кассет и так далее). Мутагенизированные вариабельные последовательности возможно могут быть слиты с человеческой константной областью.
В выбранных воплощениях по меньшей мере 60%, 65%, 70%, 75% или 80% остатков вариабельной области гуманизированного антитела соответствуют остаткам родительских последовательностей каркасного участка (FR) и CDR. В других воплощениях по меньшей мере 85% или 90% остатков гуманизированного антитела соответствуют остаткам родительских последовательностей каркасного участка (FR) и CDR. В еще одном предпочтительном воплощении более чем 95% остатков гуманизированного антитела соответствуют остаткам родительских последовательностей каркасного участка (FR) и CDR.
Гуманизированные антитела могут быть изготовлены с использованием обычных методов молекулярной биологии и биомолекулярной инженерии, как описано здесь. Эти методы включают выделение, обработку и экспрессию нуклеиновокислотных последовательностей, которые кодируют все или часть вариабельных областей Fv иммуноглобулина по меньшей мере из одной тяжелой или легкой цепи. Источники таких нуклеиновых кислот хорошо известны специалистам в данной области и могут быть получены, например, из гибридомы, эукариотической клетки или фага, продуцирующих антитело или иммунореактивный фрагмент против определенной мишени, как описано выше, из генов иммуноглобулина зародышевой линии или из синтетических конструкций. Рекомбинантная ДНК, кодирующая гуманизированное антитело, затем может быть клонирована в подходящий экспрессирующий вектор.
Последовательности зародышевой линии человека, например, раскрыты в Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today 16: 237-242; Chothia, D. et al. (1992) J. Mol. Bio. 227:799-817; и Tomlinson et al. (1995) EMBO J 14:4628-4638. Каталог V BASE предоставляет собой полный каталог последовательностей вариабельной области человеческого иммуноглобулина (см. Retter et al., (2005) NucAcid Res 33: 671-674). Эти последовательности можно использовать в качестве источника человеческих последовательностей, например каркасных участков и CDR. Как указано здесь, также можно использовать консенсусные человеческие каркасные участки, например, как описано в патенте США 6300064.
е. Человеческие антитела
Специалистам в данной области понятно, что, в дополнение к вышеупомянутым антителам, антитела по настоящему изобретению могут включать полностью человеческие антитела. В контексте настоящей заявки термин "человеческое антитело" включает антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком, и/или было изготовлено с использованием любого из методов изготовления человеческих антител, как описано здесь. Данное определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее нечеловеческие антиген-связывающие остатки.
Человеческие антитела можно получить с использованием различных методов, известных в данной области. Как упоминалось выше, можно использовать методы фагового дисплея для обеспечения иммуноактивных связывающих областей в соответствии с настоящим изобретением. Таким образом, в некоторых воплощениях изобретения предложены способы получения анти-EFNA антител или их антиген-связывающих частей, включающие стадии синтеза библиотеки антител (предпочтительно человеческих) на фаге, скрининга этой библиотеки с помощью выбранного EFNA или его антитело-связывающего участка, выделения фага, связывающего EFNA, и получения иммунореактивных фрагментов из фага. В качестве примера один способ получения библиотеки антител для применения в методах фагового дисплея включает стадии иммунизации животных, не являющихся человеком, содержащих локус человеческого или нечеловеческого иммуноглобулина, выбранным EFNA или его антигенным участком для получения иммунного ответа, выделение антитело-продуцирующих клеток из иммунизированного животного; выделение РНК, кодирующей тяжелые и легкие цепи антитела по изобретению из выделенных клеток, обратное транскрибирование РНК с получением кДНК, амплификация кДНК с использованием праймеров, и вставка кДНК в вектор для фагового дисплея таким образом, чтобы антитела экспрессировались на фаге. Более конкретно, ДНК, кодирующую домены VH и VL рекомбинируют с линкером scFv посредством PCR и клонируют в фагмидный вектор (например, pCANTAB 6 или pComb 3 HSS). Затем этот вектор может быть подвергнут электропорации в Е. coli, после чего Е. coli инфицируют хелперным фагом. Используемый в данных способах фаг, как правило, представляет собой нитчатый фаг, включающий fd и М13, а домены VH и VL обычно рекомбинантно слиты либо с фаговым геном III, либо с геном VIII.
Рекомбинантные человеческие анти-антитела EFNA по изобретению могут быть выделены посредством скрининга библиотеки рекомбинантных комбинаторных антител, полученной как описано выше. В предпочтительном воплощении библиотека представляет собой библиотеку scFv-фагового дисплея, полученную с использованием человеческих VL и VH кДНК, полученных из мРНК, выделенных из В-клеток. Методы получения и скрининга таких библиотек хорошо известны в данной области и наборы для создания библиотек фагового дисплея имеются в продаже (например, Pharmacia Recombinant Phage Antibody System, номер по каталогу 27-9400-01; и Stratagene SurfZAP™ phage display kit, номер по каталогу 240612). Имеются также другие методы и реагенты, которые можно использовать в создании и скрининге библиотек дисплея антител (см., например, патент США 5223409; публикации РСТ WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; Fuchs et al., Bio/Technology 9:1370-1372 (1991); Hay et al., Hum. Antibod. Hybridomas 3:81-85 (1992); Низе et al., Science 246:1275-1281 (1989); McCafferty et al., Nature 348:552-554 (1990); Griffiths et al., EMBO J. 12:725-734 (1993); Hawkins et al., J. Mol. Biol. 226:889-896 (1992); Clackson et al., Nature 352:624-628 (1991); Gram et al., Proc. Natl. Acad. Sci. USA 89:3576-3580 (1992); Garrad et al., Bio/Technology 9:1373-1377 (1991); Hoogenboom et al., Nuc. Acid Res. 19:4133-4137 (1991); и Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982 (1991).
Антитела, продуцируемые интактными библиотеками (природными или синтетическими), могут обладать умеренной аффинностью (Ka примерно от 106 до 107 М-1), но созревание аффинности также можно имитировать in vitro путем конструирования и повторной селекции из вторичных библиотек, как описано в данной области техники. Например, мутация может быть введена случайным образом in vitro посредством применения допускающей ошибки полимеразы (сообщается в Leung et al., Technique, 1: 11-15 (1989)) в способе Hawkins et al., J. Mol. Biol., 226; 889-896 (1992) или в способе Gram et al., Proc. Natl. Acad. Sci. USA, 89: 3576-3580 (1992). Дополнительно, созревание аффинности может быть выполнено посредством случайных мутаций одного или более CDR, например используя PCR с праймерами, имеющими произвольные последовательности, охватывающие представляющий интерес CDR, в выбранных отдельных Fv клонах, и скрининга клонов с высокой аффинностью. В WO 9607754 описан способ индукции мутагенеза в области, определяющей комплементарность, легкой цепи иммуноглобулина для создания библиотеки генов легкой цепи. Другой эффективный подход состоит в рекомбинации доменов VH или VL, выбранных посредством фагового дисплея с репертуарами природных вариантов домена V, полученных из неиммунизированных доноров, и скрининге на более высокую аффинность в нескольких раундах реорганизации цепи, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Этот метод позволяет получать антитела и фрагменты антител с константой диссоциации Kd (koff/kon) примерно 10-9 М или менее.
Кроме того, следует понимать, что можно использовать аналогичные методики с применением библиотек, содержащих эукариотические клетки (например, дрожжи), которые экспрессируют связывающие пары на своей поверхности. Как и в методе фагового дисплея, эукариотические библиотеки подвергают скринингу в отношении интересующего антигена (то есть EFNA) и выделяют и клонируют клетки, экспрессирующие кандидат-связывающие пары. Могут быть выполнены стадии оптимизации содержания библиотеки и созревания аффинности реактивных связывающих пар. См., например, патент США 7700302 и заявку 12/404059. В одном воплощении человеческое антитело выбирают из фаговой библиотеки, где фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. Proc. Natl. Acad. Sci. 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol, 227:381 (1991); Marks et al., J. Mol. Biol, 222:581 (1991)). В других воплощениях человеческие связывающие пары могут быть выделены из библиотек комбинаторных антител, образованных в эукариотических клетках, таких как дрожжи. См. например, патент США 7700302. Такие методы, предпочтительно, позволяют осуществить скрининг большого числа кандидатов-модуляторов и обеспечивают относительно легкую обработку последовательностей кандидатов (например, посредством созревания аффинности или рекомбинантных перегруппировок).
Человеческие антитела также могут быть получены путем введения локуса человеческого иммуноглобулина трансгенным животным, например мышам, у которых эндогенные гены иммуноглобулина частично или полностью инактивированы. При введении наблюдается продуцирование человеческого антитела, которое во всех отношениях очень близко напоминает наблюдаемое у людей, в том числе перегруппировку и сборку генов, и репертуар антител. Такой подход описан, например, в патентах США 5545807; 5545806; 5569825; 5625126; 5633425; 5661016, а также 6075181 и 6150584, рассматривающих Xenomouse® технологию, наряду со следующими научными публикациями: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно, человеческое антитело может быть получено посредством иммунизации человеческих В-лимфоцитов, продуцирующих антитела, направленные против целевого антигена (такие В-лимфоциты могут быть извлечены из субъекта, страдающего опухолевым заболеванием или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J. Immunol, 147 (I):86-95 (1991); и патент США 5750373.
VI. Характеристики антител
Независимо от того, как он получены, и какую из вышеупомянутых форм принимает антительный модулятор (например, гуманизированный, человеческий и т.д.), предпочтительные воплощения раскрытых модуляторов могут обладать различными характеристиками. В связи с этим, анти-EFNA антитело-продуцирующие клетки (например, гибридомы или дрожжевые колонии) могут быть отобраны, клонированы и дополнительно подвергнуты скринингу в отношении нужных характеристик, включая, например, устойчивый рост, высокий уровень продуцирования антител и, как описано более подробно ниже, желательные свойства антител. Гибридомы могут быть размножены in vivo в сингенных животных, в животных, лишенных иммунной системы, например бестимусных мышах или в культуре клеток in vitro. Методы селекции, клонирования и размножения гибридом и/или колоний, каждая из которых продуцирует отдельный вид антител, хорошо известны специалистам в данной области техники.
а. Нейтрализующие антитела
В особенно предпочтительных воплощениях модуляторы по настоящему изобретению включают нейтрализующие антитела или их производные или фрагменты. Термин "нейтрализующее антитело" или "нейтрализующий антагонист" относится к антителу или антагонисту, который связывается или взаимодействует с лигандом эфрином А и препятствует связыванию или ассоциации этого лиганда с его партнером по связыванию (например, рецептором ЕРНА), прерывая таким образом биологический ответ, который в противном случае будет иметь место при взаимодействии молекул. При оценке связывания и специфичности антитела или иммунологически функционального фрагмента или его производного, антитело или фрагмент будет по существу ингибировать связывание лиганда с его связывающим партнером или субстратом, когда избыток антитела снижает количество связывающего партнера, соединенного с целевой молекулой, по меньшей мере примерно на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более при измерении, например, в in vitro конкурентном связывающем анализе (см., например, Примеры 9-12 в данной заявке). В случае антител к EFNA4, например, нейтрализующее антитело или антагонист предпочтительно ослабляет способность EFNA4 связываться с ЕрПА4 по меньшей мере примерно на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более. Следует иметь в виду, что эту уменьшенную активность можно измерить непосредственно с помощью известных в данной области техники методов или можно измерить по влиянию, которое такое уменьшение оказывает на активность рецептора ЕРН (например, ЕРНА4),
б. Интернализованные антитела
Хотя данные показывают, что выбранные лиганды эфрины А или их изоформы могут присутствовать в растворимой форме, по меньшей мере некоторые EFNA (например, EFNA1 и EFNA4) вероятно остаются в ассоциации с клеточной поверхностью, тем самым обеспечивая возможность интернализации раскрытых модуляторов. Соответственно, анти-EFNA антитела по настоящему изобретению могут быть интернализованы, по меньшей мере до некоторой степени, клетками, которые экспрессируют лиганд эфрин А. Например, анти-EFNA4 антитело, которое связывается с EFNA4 на поверхности опухоль-инициирующей клетки, может быть интернализовано опухоль-инициирующей клеткой. В особенно предпочтительных воплощениях такие анти-EFNA антитела могут быть соединены или конъюгированы с противораковыми агентами, такими как цитотоксические группировки, которые убивают клетки при интернализации.
При использовании здесь, интернализованное анти-EFNA антитело представляет собой антитело, захваченное клеткой при связывании с EFNA, соединенным с клеткой млекопитающего. Интернализованное антитело включает фрагменты антитела, человеческое или гуманизированное антитело и конъюгаты антител. Интернализация может происходить in vitro или in vivo. Для терапевтического применения интернализация может происходить in vivo. Количество интернализованных молекул антител может быть достаточным или эффективным для гибели EFNA-экспрессирующей клетки, особенно EFNA-экспрессирующей опухоль-инициирующей клетки. В зависимости от активности антитела или конъюгата антитела, в некоторых случаях захват одной молекулы антитела клеткой является достаточным для гибели целевой клетки, с которой связывается антитело. Например, некоторые токсины являются высокоактивными в умерщвлении, так что интернализация одной молекулы токсина, конъюгированной с антителом, является достаточной для гибели опухолевой клетки. Интернализируется ли анти-EFNA антитело при связывании EFNA с клеткой млекопитающего, можно определить с помощью различных анализов, в том числе описанных в Примерах ниже (например, Примеры 15 и 16). Методы обнаружения интернализации антитела клеткой также описаны в патенте США 7619068, который включен в данную заявку посредством ссылки во всей своей полноте.
в. Истощающие антитела
В других предпочтительных воплощениях модуляторы по настоящему изобретению включают истощающие антитела или их производные или фрагменты. Термин "истощенное антитело" относится к антителу или фрагменту, который связывается или находится в ассоциации с EFNA на или около поверхности клетки и индуцирует, стимулирует или вызывает смерть или ликвидацию клетки (например, посредством комплемент-зависимой цитотоксичности или антитело-зависимой клеточной цитотоксичности). В некоторых воплощениях, обсуждаемых более подробно ниже, выбранные истощающие антитела соединены или конъюгированы с цитотоксическим агентом. Предпочтительно, истощающее антитело способно удалить, ликвидировать или убить по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97% или 99% клеток, поддерживающих опухоль, в определенной клеточной популяции. В некоторых воплощениях клеточная популяция может содержать обогащенные, разделенные, очищенные или выделенные клетки, поддерживающие опухоль. В других воплощениях клеточная популяция может содержать образцы целой опухоли или экстракты гетерогенной опухоли, которые содержат клетки, поддерживающие опухоль. Специалистам в данной области понятно, что стандартные биохимические методы, как описано в Примерах ниже (например, в Примере 16) можно использовать для мониторинга и количественной оценки истощения онкогенных клеток или клеток, поддерживающих опухоль, согласно данному руководству.
г. Связывание с эпитопом
Кроме того, следует иметь в виду, что раскрытые анти-EFNA антитела будут вступать в ассоциацию или связываться с отдельными эпитопами или детерминантами, представленными выбранной(ыми) мишенью(ями). При использовании здесь, термин "эпитоп" относится к той части антигена-мишени, который может распознаваться и специфически связываться конкретным антителом. Когда антиген представляет собой полипептид, такой как EFNA, эпитопы могут быть сформированы как соседними аминокислотами, так и не соседними аминокислотами, которые стали соседними посредством третичного складывания белка. Эпитопы, образованные соседними аминокислотами, как правило, сохраняются при денатурации белка, в то время как эпитопы, образованные в результате третичного складывания, обычно теряются при денатурации белка. Эпитоп, как правило, включает по меньшей мере 3, а еще чаще по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Более конкретно, специалисту понятно, что термин "эпитоп" включает любую белковую детерминанту, способную к специфическому связыванию с иммуноглобулином или Т-клеточным рецептором, или к иному взаимодействию с молекулой. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или углеводы или боковые цепи сахаров, и обычно имеют специфические трехмерные структурные характеристики, а также специфические зарядные характеристики. Кроме того, эпитоп может быть линейным или конформационным. В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (например, антителом) расположены линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе точки взаимодействие расположены на аминокислотных остатках в белке, которые линейно отделены друг от друга.
Если нужный эпитоп на антигене определен, можно создать антитела к этому эпитопу, например путем иммунизации пептидом, содержащим этот эпитоп, с использованием методов, описанных в настоящем изобретении. Альтернативно, в процессе поиска, создание и характеристика антител можно дать информацию о нужных эпитопах. На основании этой информации затем можно конкурентно отбирать антитела на связывание с этим же эпитопом. Подход к достижению этого заключается в проведении конкурентных исследований для обнаружения антител, которые конкурентно связываются друг с другом, то есть антител, конкурирующих за связывание с антигеном. Высокопроизводительный процесс сортировки антител, основанный на их перекрестной конкуренции, описан в WO 03/48731.
При использовании здесь термин "сортировка" относится к способу группировки антител на основании их антиген-связывающих характеристик. Оценка групп является в некоторой степени произвольной, зависящей от того, насколько различаются наблюдаемые связывающие партнеры тестируемых антител. Таким образом, в то время как данный метод является полезным инструментом классификации антител по настоящему изобретению, группы не всегда прямо коррелируют с эпитопами и такие первоначальные результаты определения следует дополнительно подтвердить другими известными в данной области методами.
С такой оговоркой можно определить, связывается ли выбранное первичное антитело (или его фрагмент) с тем же эпитопом или перекрестно конкурирует за связывание со вторым антителом, посредством использования методов, известных в данной области и изложенных здесь в Примерах. В одном воплощении первичному антителу по изобретению позволяют связываться с EFNA в насыщающих условиях и затем измеряют способность вторичных антител связываться с EFNA. Если тестируемое антитело способно связываться с EFNA одновременно с первичным анти-EFNA антителом, тогда вторичное антитело связывается с другим эпитопом, чем первичное антитело. Однако если вторичное антитело не способно связываться одновременно с EFNA, тогда вторичное антитело связывается с тем же самым эпитопом, перекрывающимся эпитопом или эпитопом, находящимся в непосредственной близости к эпитопу, связанному первичным антителом. Как известно в данной области техники и подробно описано в Примерах ниже, необходимые данные могут быть получены с использованием твердофазного прямого или косвенного радиоиммунологического анализа (RIA), твердофазного прямого или непрямого иммуноферментного анализа (EIA), конкурентного сэндвич-анализа, системы Biacore™ (то есть поверхностного плазменного резонанса - GE Healthcare), анализатора ForteBio® (то есть двухполосной интерферометрии - ForteBio, Inc.) или метода проточной цитометрии. Термин "поверхностный плазменный резонанс", при использовании здесь, относится к оптическому явлению, которое позволяет проводить анализ биоспецифических взаимодействий в режиме реального времени путем обнаружения изменений концентраций белка на биосенсоре матрицы. В особенно предпочтительном воплощении анализ выполняют с использованием аппаратов Biacore или ForteBio, как показано в Примерах ниже.
Термин "конкурировать" при использовании в контексте антител, которые конкурируют за тот же самый эпитоп, означает, что конкуренция между антителами определена посредством анализа, в котором тестируемое антитело или иммунологически функциональный фрагмент предупреждает или ингибирует специфическое связывание контрольного антитела с общим антигеном. Как правило, такой анализ включает использование очищенного антигена, связанного с твердой поверхностью, или клеток, несущих либо немеченый тестируемый иммуноглобулин, либо меченый контрольный иммуноглобулин. Конкурентное ингибирование измеряют путем определения количества метки, связанной с твердой поверхностью или клетками в присутствии тестируемого иммуноглобулина. Обычно тестируемый иммуноглобулин присутствует в избытке. Антитела, идентифицированные посредством конкурентного анализа (конкурирующие антитела), включают антитела, связывающиеся с тем же эпитопом, что и контрольное антитело, и антитела, связывающиеся с соседним эпитопом, расположенным достаточно близко к эпитопу, связанному с контрольным антителом, для того, чтобы имело место пространственное затруднение. Дополнительные подробности методов определения конкурентного связывания приведены здесь в Примерах. Обычно, когда конкурирующее антитело присутствует в избытке, оно ингибирует специфическое связывание контрольного антитела с общим антигеном по меньшей мере на 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. В некоторых случаях связывание ингибируется по меньшей мере на 80%, 85%, 90%, 95% или 97% или более.
Кроме эпитопной специфичности раскрытые антитела могут быть охарактеризованы с использованием ряда разных физических характеристик, включающих, например, аффинности связывания, температуру плавления (Tm) и изоэлектрические точки.
д. Аффинность связывания
В связи с этим настоящее изобретение, кроме того, охватывает применение антител, которые имеют высокую аффинность связывания с выбранным EFNA, или, в случае пан-антител, более чем с одним типом лиганда эфрина А. Считается, что антитело по изобретению специфически связывается со своим целевым антигеном, когда константа диссоциации Kd (koff/kon) составляет ≤10-8 М. Антитело специфически связывается с антигеном с высокой аффинностью, когда Kd≤5×10-9 М, и с очень высокой аффинностью, когда Kd≤5×10-10 M. В одном воплощении изобретения антитело имеет Kd≤10-9 M и скорость диссоциации составляет примерно 1×10-4/сек. В одном воплощении изобретения скорость диссоциации составляет <1×10-5/сек. В других воплощениях изобретения антитела связываются с EFNA с Kd от примерно 10-8 М до 10-10 М, и в еще одном воплощении они связываются с Kd≤2×10-10 М. Другие выбранные воплощения настоящего изобретения включают антитела, которые имеют константу диссоциации или Kd (koff/kon) менее 10-2 М, менее 5×10-2 М, менее 10-3 М, менее 5×10-3 М, менее 10-4 М, менее 5×10-4 М, менее 10-5 М, менее 5×10-5 М, менее 10-6 М, менее 5×10-6 М, менее 10-7 М, менее 5×10-7 М, менее 10-8 М, менее 5×10-8 М, менее 10-9 М, менее 5×10-9 М, менее 10-10 М, менее 5×10-10 М, менее 10-11 М, менее 5×10-11 М, менее 10-12 М, менее 5×10-12M, менее 10-13 M, менее 5×10-13 M, менее 10-14 M, менее 5×10-14 M, менее 10-15 M или менее 5×10-15 M.
В конкретных воплощениях антитело по изобретению, которое иммуноспецифически связывается с EFNA, имеет константу скорости ассоциации или скорость kon (EFNA (Ab)+антиген (Ag)k on≥Ab-Ag), равную по меньшей мере 105 M-1c-1, по меньшей мере 2×105 M-1c-1, по меньшей мере 5×105 М-1с-1, по меньшей мере 106 M-1c-1, по меньшей мере 5×106 M-1c-1, по меньшей мере 107 M-1c-1, по меньшей мере 5×107 M-1c-1 или по меньшей мере 108 M-1c-1.
В другом воплощении антитело по изобретению, которое иммуноспецифически связывается с EFNA, имеет скорость koff (EFNA (Ab)+антиген (Ag)k off←Ab-Ag) менее 10-1 c-1, менее 5×10-1 c-1, менее 10-2 c-1, менее 5×10-2 с-1, менее 10-3 c-1, менее 5×10-3 s-1, менее 10-4 с-1, менее 5×10-4 с-1, менее 10-5 с-1, менее 5×10-5 с-1, менее 10-6 с-1, менее 5×10-6 с-1, менее 10-7 c-1, менее 5×10-7 c-1, менее 10-8 c-1, менее 5×10-8 с-1, менее 10-9 c-1, менее 5×10-9 c-1 или менее 10-10 c-1.
В других выбранных воплощениях настоящего изобретения анти-EFNA антитела имеют константу аффинности или Ka (kon/koff), равную по меньшей мере 102 М-1, по меньшей мере 5×102 М-1, по меньшей мере 103 М-1, по меньшей мере 5×103 М-1, по меньшей мере 10-4 M-1, по меньшей мере 5×104 М-1, по меньшей мере 105 M-1, по меньшей мере 5×105 М-1, по меньшей мере 106 M-1, по меньшей мере 5×106 М-1, по меньшей мере 107 М-1, по меньшей мере 5×107 М-1, по меньшей мере 108 М-1, по меньшей мере 5×108 М-1, по меньшей мере 109 М-1, по меньшей мере 5×109 М-1, по меньшей мере 1010 М-1, по меньшей мере 5×1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 5×1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 5×1012 М-1, по меньшей мере 1013 М-1, по меньшей мере 5×1013 М-1, по меньшей мере 1014 М-1, по меньшей мере 5×1014 М-1, по меньшей мере 10-15 М-1 или по меньшей мере 5×1015 М-1.
е. Изоэлектрические точки
В дополнение к вышеупомянутым связывающим свойствам, анти-EFNA антитела и их фрагменты, подобно всем полипептидам, имеют изоэлектрическую точку (pI), которую обычно определяют как рН, при котором полипептид не несет суммарного заряда. В данной области техники известно, что растворимость белка обычно является самой низкой при рН раствора, равном изоэлектрической точке (pI) этого белка. Таким образом, можно оптимизировать растворимость путем изменения количества и локализации ионизируемых остатков в антителе для корректировки pI. Например, на рI полипептида можно влиять посредством осуществления подходящих аминокислотных замен (например, путем замены заряженной аминокислоты, такой как лизин, на незаряженный остаток, такой как аланин). Не желая быть связанными какой-либо конкретной теорией, аминокислотные замены в антителе, которые приводят к изменению pI указанного антитела, могут улучшить растворимость и/или стабильность этого антитела. Специалисту в данной области понятно, какие аминокислотные замещения будут наиболее подходящими для конкретного антитела для достижения нужной pI.
pI белка может быть определена различными способами, включая, но не ограничиваясь ими, изоэлектрическую фокусировку и различные компьютерные алгоритмы (см., например Bjellqvist et al., 1993, Electrophoresis 14:1023). В одном воплощении pI анти-EFNA антител по изобретению находится между или является выше чем примерно 6,5, примерно 7,0, примерно 7,5, примерно 8,0, примерно 8,5 или примерно 9,0. В другом воплощении pI анти-EFNA антител по изобретению находится между или является выше, чем 6,5, 7,0, 7,5, 8,0, 8,5 или 9,0. В еще одном воплощении, замены, приводящие к изменениям pI антител по изобретению, не уменьшают значительно их аффинность связывания с EFNA. Как описано более подробно ниже, конкретно предусмотрено, что замещение(я) Fc-области, которое приводит к изменению связывания с FcγR, также может привести к изменению pI. В предпочтительном воплощении замещение(я) Fc-области специально выбрано(з) так, чтобы влиять и на желательное изменение FcγR-связывания, и на желательное изменение pI. При использовании здесь, значение pI определяют как pI преобладающей заряженной формы.
ж. Термическая стабильность
Также следует понимать, что Tm домена Fab антитела может служить хорошим индикатором термической стабильности антитела и может дополнительно служить показателем срока годности. Tm представляет собой температуру 50%-ного разворачивания для данного домена или последовательности. Низкая Tm указывает на большее агрегирование/меньшую стабильность, в то время как высокая Tm указывает на меньшее агрегирование/большую стабильность. Таким образом, антитела или фрагменты или производные, имеющие высокую Tm, являются предпочтительными. Кроме того, используя признанные в данной области методы, можно изменить композицию анти-EFNA антител или их доменов так, чтобы увеличить или оптимизировать молекулярную стабильность. См., например, патент США 7960142. Таким образом, в одном воплощении, домен Fab выбранного антитела имеет значение Tm выше, чем по меньшей мере 50°С, 55°С, 60°С, 65°С, 70°С, 75°С, 80°С, 85°С, 90°С, 95°С, 100°С, 105°С, 110°С, 115°С или 120°С. В другом воплощении, домен Fab антитела имеет значение Tm выше, чем по меньшей мере примерно 50°С, примерно 55°С, примерно 60°С, примерно 65°С, примерно 70°С, примерно 75°С, примерно 80°С, примерно 85°С, примерно 90°С, примерно 95°С, примерно 100°С, примерно 105°С, примерно 110°С, примерно 115°С или примерно 120°С. Температуры термического плавления (Tm) белкового домена (например, домена Fab) могут быть измерены с использованием любого стандартного метода, известного в данной области техники, например посредством дифференциальной сканирующей калориметрии (см., например, Vermeer et al., 2000, Biophys. J. 78:394-404; Vermeer et al., 2000, Biophys. J. 79: 2150-2154, обе включены в данное описание изобретения посредством ссылки).
VII. Фрагменты и производные модулятора EFNA
Независимо от того включают ли агенты по настоящему изобретению интактные слитые конструкции, антитела, фрагменты или производные, выбранные модуляторы будут вступать в реакцию, связываться, объединяться, образовывать комплекс, присоединяться, прикрепляться, смыкаться, взаимодействовать или иным образом вступать в ассоциацию с EFNA и тем самым обеспечивать нужные противоопухолевые эффекты. Специалистам в данной области понятно, что модуляторы, содержащие анти-EFNA антитела, взаимодействуют или вступают в ассоциацию с EFNA посредством одного или более связывающих сайтов, экспрессируемых на антителе. Более конкретно, при использовании здесь, термин "связывающий сайт" включает участок полипептида, которая отвечает за селективное связывание с целевой молекулой, представляющей интерес (например, ферментом, антигеном, лигандом, рецептором, субстратом или ингибитором). Связывающие домены содержат по меньшей мере один связывающий сайт (например, интактное антитело IgG имеет два связывающих домена и два связывающих сайта). Типичные связывающие домены включают вариабельный домен антитела, рецептор-связывающий домен лиганда, лиганд-связывающий домен рецептора или ферментативный домен. В контексте настоящего изобретения типичный активный участок EFNA (например, часть слитой конструкции Fc-EFNA) может содержать сайт связывания субстрата (например, Eph-рецептор).
а. Фрагменты
Независимо от того, какая форма модулятора (например, химерная, гуманизированная и т.д.) выбрана для осуществления изобретения на практике, следует понимать, что его иммунореактивные фрагменты можно использовать в соответствии с данным руководством. В самом широком смысле термин "фрагмент антитела" включает по меньшей мере часть интактного антитела (например, природного иммуноглобулина). Более конкретно, термин "фрагмент" относится к части или участку антитела или цепи антитела (или молекулы EFNA в случае слитых Fc), содержащим меньшее количество аминокислотных остатков, чем интактное или полное антитело или цепь антитела. Термин "антиген-связывающий фрагмент" относится к полипептидному фрагменту иммуноглобулина или антитела, который связывается с антигеном или конкурирует с интактным антителом (то есть с интактным антителом, из которого они были получены) за связывание с антигеном (то есть специфическое связывание). При использовании здесь термин "фрагмент молекулы антитела" включает антиген-связывающие фрагменты антитела, например легкую цепь антитела (VL), тяжелую цепь антитела (VH), одноцепочечное антитело (scFv), фрагмент F(ab′)2, фрагмент Fab, фрагмент Fd, фрагмент Fv, фрагменты однодоменного антитела, диатела, линейные антитела, молекулы одноцепочечного антитела и полиспецифические антитела, образованные из фрагментов антител. Кроме того, активный фрагмент EFNA содержит часть молекулы EFNA, которая сохраняет свою способность взаимодействовать с субстратами или рецепторами EFNA и модифицировать их таким же образом, что и интактный EFNA (хотя возможно с меньшей эффективностью).
Специалистам в данной области понятно, что фрагменты можно получить посредством химической или ферментативной обработки интактного или полного модулятора (например, антитела или цепи антитела) или рекомбинантными способами. В связи с этим, в то время как различные фрагменты антител определены в терминах расщепления интактного антитела, специалисту понятно, что такие фрагменты можно синтезировать de novo либо химически, либо используя методы рекомбинантной ДНК. Таким образом, при использовании здесь, термин "антитело" явным образом включает антитела или их фрагменты или производные, получаемые посредством модификации целых антител или синтезируемые de novo с использованием методов рекомбинантных ДНК.
Более конкретно, в результате расщепления антител папаином получаются два идентичных антиген-связывающих фрагмента, называемых Fab-фрагменты, каждый из которых имеет один антиген-связывающий сайт, и остаточный фрагмент Fc, название которого отражает его способность легко кристаллизоваться. В результате обработки пепсином получают фрагмент F(ab′)2, который имеет два антиген-связывающих сайта и все еще способен к перекрестному связыванию антигена. Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (Сн1) тяжелой цепи. Fab′-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце CH1-домена тяжелой цепи, включая один или более цистеина из шарнирной области антитела. Fab′-SH является здесь обозначением Fab′, в котором цистеиновый(е) остаток(ки) константных доменов несет(ут) по меньшей мере одну свободную тиольную группу. Фрагменты F(ab′)2-антитела первоначально были получены, как пара фрагментов Fab′ с шарнирными цистеинами между ними. Известны также другие химические сочетания фрагментов антител. Более подробное описание других фрагментов антител см., например, в Fundamental Immunology, W.E. Paul, ed., Raven Press, N.Y. (1999).
Также следует понимать, что фрагмент Fv представляет собой фрагмент антитела, который содержит полный сайт узнавания и связывания антигена. Эта область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в близкой ассоциации, которая может быть ковалентной по природе, например в scFv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют с образованием антиген-связывающего сайта на поверхности димера VH-VL. Вместе шесть CDR или их подмножество придают антителу антиген-связывающую специфичность. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью узнавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный связывающий сайт.
В других воплощениях фрагмент антитела, например, содержащий Fc-участок, сохраняет по меньшей мере одну из биологических функций, обычно ассоциированных с Fc-участком в случае присутствия в интактном антителе, такую как связывание FcRn, модуляция времени полужизни антитела, функция ADCC (антителозависимая клеточная цитотоксичность) и связывание комплемента. В одном воплощении фрагмент антитела является моновалентным антителом, которое имеет время полужизни in vivo по существу аналогичное интактному антителу. Например, такой фрагмент антитела может содержать антиген-связывающее плечо, соединенное с последовательностью Fc, способной придать фрагменту стабильность in vivo.
б. Производные
В другом воплощении также понятно, что модуляторы по изобретению могут быть моновалентными или поливалентными (например, бивалентными, тривалентными и т.д.). При использовании здесь, термин "валентность" относится к числу возможных сайтов связывания мишени (то есть EFNA), ассоциированных с антителом. Каждый сайт связывания мишени специфически связывает одну целевую молекулу или конкретное положение или локус на целевой молекуле. Когда антитело по настоящему изобретению содержит более одного сайта связывания мишени (поливалентное антитело), каждый сайт связывания мишени может специфически связывать одинаковые или разные молекулы (например, может связываться с разными лигандами, или разными антигенами, или разными эпитопами или положениями на одном и том же антигене). В контексте настоящего изобретения рассматриваемые антитела предпочтительно имеют по меньшей мере один сайт связывания, специфичный к человеческому EFNA. В одном воплощении антитела по настоящему изобретению являются моновалентными, так что каждый связывающий сайт молекулы специфически связывается с одним положением или эпитопом EFNA. В других воплощениях антитела являются поливалентными, так что они содержат больше одного связывающего сайта, и разные связывающие сайты специфически ассоциируют более чем с одним положением или эпитопом. В таких случаях множественные эпитопы могут присутствовать на выбранном EFNA-полипептиде или spice варианте, или один эпитоп может присутствовать на EFNA в то время как второй, другой эпитоп может присутствовать на другой молекуле или поверхности. См., например, патент США 2009/0130105.
Как упоминалось выше, поливалентные антитела могут иммуноспецифически связываться с разными эпитопами нужной целевой молекулы или могут иммуноспецифически связываться как с целевой молекулой, так и гетерологичным эпитопом, таким как гетерологичный полипептид или твердый материал носителя. Хотя предпочтительные воплощения анти-EFNA антител связывают только два антигена (то есть биспецифические антитела), антитела с дополнительными специфичностями, такие как триспецифические антитела, также охватываются настоящим изобретением. Примеры биспецифических антител включают, без ограничения ими, антитела с одним плечом, направленным против EFNA, и другим плечом, направленным против любого другого антигена (например, модуляторного клеточного маркера). Методы получения биспецифических антител известны в данной области. Традиционное получение полноразмерных биспецифических антител основано на со-экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, где две цепи обладают разной специфичностью (Millstein et al., 1983, Nature, 305:537-539). Другие, более сложные, совместимые, полиспецифические конструкции и способы их получения описаны в патенте США 2009/0155255.
В других воплощениях вариабельные домены антитела с нужными специфичностями связывания (сайты объединения антитело-антиген) слиты с последовательностями константного домена иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, CH2- и/или CH3-области. В одном примере первая константная область тяжелой цепи (CH1), содержащая сайт, необходимый для связывания с легкой цепью, присутствует по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, если необходимо, легкой цепи иммуноглобулина, встроены в отдельные экспрессирующие векторы и котрансфецированы в подходящий организм-хозяин. Это обеспечивает большую гибкость в корректировке взаимных соотношений трех полипептидных фрагментов в воплощениях, где неравные соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальные результаты. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам или когда соотношения не имеют особого значения.
В одном воплощении такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече (например, EFNA4) и гибридной пары тяжелая цепь-легкая цепь иммуноглобулина (представляющей вторую специфичность связывания) в другом плече. Было обнаружено, что ассиметричная структура облегчает отделение нужного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий способ отделения. Такой подход раскрыт в WO 94/04690. Дополнительные подробности получения биспецифических антител см., например, в Suresh et al., 1986, Methods in Enzymology, 121:210. Согласно другому подходу, описанному в WO 96/27011, можно сконструировать пару молекул антител для максимизации процента гетеродимеров, выделяемых из рекомбинантной клеточной культуры. Предпочтительная поверхность раздела включает по меньшей мере часть домена CH3 константного домена антитела. В данном способе одну или более небольших боковых цепей аминокислот с поверхности раздела первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозином или триптофаном). Компенсационные полости размера, идентичного или аналогичного большой(им) боковой(ым) цепи(ям) создаются на поверхности раздела второй молекулы антитела путем замены больших аминокислотных боковых цепей меньшими (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела также включают сшитые или гетероконъюгированные антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и ЕР 03089). Гетероконъюгированные антитела могут быть получены с использованием любого удобного метода сшивания. Пригодные сшивающие агенты хорошо известны в данной области и раскрыты в патент США 4676980, наряду с рядом сшивающих методик.
VIII. Модуляторы EFNA - Модификации константной области
а. Fc-область и Fc-рецепторы
В дополнение к различным модификациям, заменам, вставкам или делециям в вариабельной или связывающей области раскрытых модуляторов (например, Fc-EFNA или анти-EFNA антител), представленных выше, специалистам в данной области понятно, что выбранные воплощения настоящего изобретения также могут содержать замещения или модификации константной области (то есть Fc-области). В частности, предполагается, что модуляторы EFNA по изобретению могут содержать, помимо прочего, одну или более дополнительных замен, мутаций и/или модификаций аминокислотных остатков, что приводит к соединению с предпочтительными характеристиками, включая, без ограничения ими: измененную фармакокинетику, увеличенное времени полужизни в сыворотке, повышенную аффинность связывания, пониженную иммуногенность, повышенное продуцирование, измененное связывание Fc-лиганда, повышенная или пониженная активность ADCC или CDC (комплементзависимая цитотоксичность), измененное гликозилирование и/или дисульфидные связи и измененная специфичность связывания. В связи с этим следует иметь в виду, что эти Fc-варианты преимущественно могут быть использованы для усиления эффективных противоопухолевых свойств раскрытых модуляторов.
Термин "Fc-область" используется в данной заявке для обозначения С-концевой области тяжелой цепи иммуноглобулина, включая Fc-области с нативной последовательностью и вариантные Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи IgG человека обычно простирается от аминокислотного остатка в положении Cys226 или Pro230, до его карбоксильного конца. С-концевой лизин (остаток 447 согласно европейской системе нумерации) Fc-области может быть удален, например, в процессе изготовления или очистки антитела или при рекомбинантном конструировании нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител, где все остатки K447 удалены, популяции антител, где остатки К447 не удалены, и популяции антител, имеющие смесь антител с остатком или без остатка K447. Функциональная Fc-область обладает эффекторной функцией Fc-области с нативной последовательностью. Типичные эффекторные функции включают связывание C1q; CDC; связывание Fc-рецептора; ADCC; фагоцитоз; уменьшение числа клеточных поверхностных рецепторов (например, В-клеточного рецептора; BCR) и т.д. Для таких эффекторных функций, как правило, требуется, чтобы Fc-область была объединена со связывающим доменом (например, вариабельным доменом антитела), и они могут быть оценены с помощью различных анализов, как раскрыто, например, в определениях в данном описании.
Fc-рецептор или FcR обозначает рецептор, который связывается с Fc-областью антитела. В некоторых воплощениях FcR представляет собой нативный человеческий FcR. В некоторых воплощениях FcR связывается с IgG антителом (гамма-рецептор) и включает рецепторы подклассов FcγRI, Fc.RII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγII включают FcγRIIA (активирующий рецептор) и FcγRIIB (ингибирующий рецептор), которые имеют аналогичные аминокислотные последовательности, отличающиеся главным образом своими цитоплазматическими доменами. Активирующий рецептор Fcγ RIIA содержит иммунорецепторный тирозиновый активирующий мотив (1ТАМ) в своем цитоплазматическом домене. Ингибирующий рецептор FγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (1Т1М) в своем цитоплазматическом домене (см., например, Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассматриваются, например, в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, в том числе те, которые будут определены в будущем, охвачены здесь термином FcR. Термин Fc-рецептор или FcR также включает неонатальный рецептор, FcRn, который, в некоторых случаях, отвечает за перенос материнских IgG плоду (Guyeret al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Известны методы измерения связывания с FcRn (см., например, Ghetie and Ward., Immunol. Today 18(12):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol. Chem. 279(8):6213-6216 (2004); WO 2004/92219 (Hinton et al.).
б. Функции Fc
При использовании здесь "комплемент-зависимая цитотоксичность" и "CDC" относится к лизису целевой клетки в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой, например антитела, образующей комплекс с когнатным антигеном. Для оценки активации комплемента можно выполнить анализ CDC, например, как описано в Gazzano-Santoro et al., 1996, J. Immunol. Methods, 202:163.
Кроме того, антителозависимая клеточноопосредованная цитотоксичность или ADCC относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc-рецепторами (FcRs), присутствующими на некоторых цитотоксических клетках (например, естественных киллерах (NK), нейтрофилах и макрофагах) позволяет этим цитотоксическим эффекторным клеткам специфически связываться с целевой клеткой, несущей антиген, и затем убивать эту целевую клетку цитотоксинами. Специфические высокоаффинные IgG антитела направлены на целевое плечо цитотоксических клеток и абсолютно необходимы для такой гибели. Лизис целевой клетки является внеклеточным, требует непосредственного контакта между клетками и не требует участия комплемента.
Варианты EFNA-модулятора с измененной аффинностью связывания FcR или активностью ADCC обладают либо повышенной, либо ослабленной активностью связывания FcR и/или активностью ADCC по сравнению родительским или немодифицированным антителом или с модулятором, содержащим Fc-область с нативной последовательностью. Вариант модулятора, который демонстрирует повышенное связывание с FcR, связывается по меньшей мере с одним FcR с лучшей аффинностью, чем родительское или немодифицированное антитело или модулятор, содержащий Fc-область с нативной последовательностью. Вариант, который демонстрирует уменьшенное связывание с FcR, связывается по меньшей мере с одним FcR с меньшей аффинностью, чем родительское или немодифицированное антитело или модулятор, содержащий Fc-область с нативной последовательностью. Такие варианты, которые демонстрируют уменьшенное связывание с FcR, могут обладать незначительным связыванием или не иметь существенного связывания с FcR, например 0-20% связывания с FcR по сравнению с нативной последовательностью Fc-области IgG, например, как определено с помощью хорошо известных в данной области методов.
Что касается FcRn, антитела по настоящему изобретению также содержат или охватывают варианты Fc с модификациями в константной области, которые обеспечивают время полужизни (например, время полужизни в сыворотке) у млекопитающего, предпочтительно человека, более 5 суток, более 10 суток, более 15 суток, предпочтительно, более 20 суток, более 25 суток, более 30 суток, более 35 суток, более 40 суток, более 45 суток, более 2 месяца, более 3 месяца, более 4 месяца или более 5 месяцев. Увеличение времени полужизни антител (или Fc-содержащих молекул) по настоящему изобретению у млекопитающего, предпочтительно человека, приводит к более высокому титру сыворотки указанных антител или фрагментов антител у млекопитающего и, таким образом, снижает частоту введения указанных антител или фрагментов антитела, и/или снижает вводимую концентрацию указанных антител или фрагментов антител. Антитела с увеличенным временем полужизни in vivo можно получить с помощью методов, хорошо известных специалистам в данной области. Например, антитела с увеличенным временем полужизни in vivo можно получить путем модификации (например, замены, делеции или добавления) аминокислотных остатков, которые определены как участвующие во взаимодействие между доменом Fc и рецептором FcRn (см., например, международную публикацию WO 97/34631; WO 04/029207; патент США 6737056 и патент США 2003/0190311. Связывание с человеческим FcRn in vivo и время полужизни в сыворотке человеческих высокоаффинных FcRn-связывающих полипептидов можно оценить, например, на трансгенных мышах или в трансфицированных клеточных линиях человека, экспрессирующих человеческий FcRn, или на приматах, которым вводят полипептиды с вариантной Fc-областью. В WO 2000/42072 описаны варианты антител с улучшенным или ослабленным связыванием с FcRns. См. также, например, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001).
в. Модификации гликозилирования
В других воплощениях профили гликозилирования или композиции антител по изобретению являются модифицированными. Более конкретно, предпочтительные воплощения настоящего изобретения могут содержать одну или более сконструированных гликоформ, то есть измененный профиль гликозилирования или измененную композицию углеводов, ковалентно присоединенных к молекуле, содержащей Fc-область. Сконструированные гликоформы могут быть полезны для различных целей, включая, но не ограничиваясь ими, повышение или снижение эффекторной функции, увеличение аффинности антитела к целевому антигену или облегчение получения антитела. В случаях, когда желательной является пониженная эффекторная функция, следует понимать, что молекула может быть сконструирована для экспрессии в агликозилированной форме. Такие углеводные модификации могут быть выполнены, например, путем изменения одного или более сайтов гликозилирования в последовательности антитела. Это означает, что можно сделать одну или более аминокислотных замен, что приводит к удалению одного или более сайтов гликозилирования вариабельной области каркасного участка, тем самым устраняя гликозилирование в этом сайте (см., например, патенты США 5714350 и 6350861). С другой стороны, повышенные эффекторные функции или улучшенное связывание может быть придано Fc-содержащей молекуле посредством конструирования одного или более дополнительных сайтов гликозилирования.
Дополнительно или альтернативно можно получить вариант Fc, который имеет измененную гликозилирующую композицию, например гипофукозилированное антитело, имеющее пониженное количество фукозильных остатков, или антитело, имеющее увеличенные гемисекционные GlcNAc структуры. Было показано, что эти и подобные профили гликозилирования увеличивают ADCC-способность антител. Сконструированные гликоформы можно получить любым способом, известным специалисту в данной области, например используя сконструированные штаммы или штаммы, экспрессирующие варианты, посредством коэкспрессии с одним или более ферментами (например, N-ацетилглюкозаминилтрансферазой III (GnTI11)), посредством экспрессии молекулы, содержащей Fc-область в различных организмах или клеточных линиях из различных организмов или посредством модификации углевода(ов) после экспрессии молекулы, содержащей Fc-область. См., например, Shields, R.L. et al. (2002) J. Biol. Chem. 277:26733-26740; Umana et al. (1999) Nat. Biotech. 17:176-1, а также европейский патент ЕР 1176195; PCT публикации WO 03/035835; WO 99/54342, Umana et al, 1999, Nat. Biotechnol 17:176-180; Davies et al., 20017 Biotechnol Bioeng 74:288-294; Shields et al, 2002, J Biol Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473) патент США 6602684; заявки США 10/277370; 10/113929; PCT WO 00/61739 A1; PCT WO 01/292246 A1; PCT WO 02/311140 A1; PCT WO 02/30954 A1; Potillegent™ технологию (Biowa, Inc.); технологию конструирования гликозилирования GlycoMAb™ (GLYCART biotechnology AG); WO 00061739; EA 01229125; патент США 2003/0115614; Okazaki et al., 2004, JMB, 336: 1239-49.
IX. Экспрессия модулятора
а. Обзор
ДНК, кодирующая нужные модуляторы EFNA, может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антител). Выделенные и субклонированные гибридомные клетки (или колонии, полученные из фагов и дрожжей) могут являться предпочтительным источником такой ДНК, если модулятор представляет собой антитело. Если необходимо, нуклеиновую кислоту можно дополнительно обработать, как описано здесь, для создания агентов, включающих слитые белки или химерные, гуманизированные или полностью человеческие антитела. Более конкретно, выделенную ДНК (которую можно модифицировать) можно использовать для клонирования последовательностей константной и вариабельной области для получения антител, как описано в патенте США 7709611.
Этот типичный способ предусматривает экстракцию РНК из выбранных клеток, превращение в кДНК, и амплификацию посредством PCR с использованием антитело-специфических праймеров. Подходящие праймеры хорошо известны в данной области и, как приведено в качестве примера в данном описании, легкодоступны из различных коммерческих источников. Следует понимать, что для экспрессии рекомбинантного человеческого или нечеловеческого антитела, выделенного путем скрининга комбинаторной библиотеки, ДНК, кодирующую антитело, клонируют в рекомбинантный экспрессирующий вектор и вводят в клетки-хозяева, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжей и бактерий. В других воплощениях модуляторы вводят и экспрессируют при помощи обезьяньих клеток COS (африканской зеленой мартышки), клеток NSO, клеток яичника китайского хомячка (СНО) или клеток миеломы, которые иначе не продуцируют нужную конструкцию. Как обсуждается более подробно ниже, трансформированные клетки, экспрессирующие нужный модулятор, могут быть выращены в относительно больших количествах, чтобы обеспечить клинические и коммерческие поставки слитой конструкции или иммуноглобулина.
Независимо от того, получали или выделяли нуклеиновую кислоту, кодирующую необходимую часть модулятора EFNA, с помощью метода фагового дисплея, из дрожжевых библиотек, с помощью метода, основанного на гибридоме, синтетически или из коммерческих источников, следует понимать, что настоящее изобретение явным образом охватывает молекулы нуклеиновой кислоты и последовательности, кодирующие модуляторы EFNA, включая слитые белки и анти-EFNA антитела или их антиген-связывающие фрагменты или производные. Данное изобретение также охватывает нуклеиновые кислоты или молекулы нуклеиновых кислот (например, полинуклеотиды), которые гибридизуются в условиях гибридизации высокой жесткости или, альтернативно, в условиях гибридизации средней или низкой жесткости (например, как определено ниже), с полинуклеотидами, комплементарными нуклеиновым кислотам, имеющим полинуклеотидную последовательность, которая кодирует модулятор по изобретению или его фрагмент или вариант. Термин "молекула нуклеиновой кислоты" или "выделенная молекула нуклеиновой кислоты", используемый здесь, как предполагается, включает по меньшей мере молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно является двухцепочечной ДНК. Кроме того, настоящее изобретение включает любой наполнитель или конструкцию, включающую такой полинуклеотид, кодирующий модулятор, включая, без ограничения ими, векторы, плазмиды, клетки-хозяева, космиды или вирусные конструкции.
Термин "выделенная нуклеиновая кислота" означает, что нуклеиновую кислоту (1) амплифицировали in vitro, например посредством полимеразной цепной реакции (PCR), (2) рекомбинантно получали посредством клонирования, (3) очищали, например путем расщепления и гель-электрофоретического фракционирования, или (4) синтезировали, например посредством химического синтеза. Выделенная нуклеиновая кислота представляет собой нуклеиновую кислоту, которая подходит для обработки методами рекомбинантной ДНК.
Более конкретно также предложены нуклеиновые кислоты, которые кодируют модулятор, в том числе одну или обе цепи антитела по изобретению, или его фрагмент, производное, мутеин или вариант, полинуклеотиды, достаточные для использования в качестве гибридизационных зондов, PCR-праймеры или праймеры для секвенирования для идентификации, анализа, мутации или амплификации полинуклеотида, кодирующего полипептид, антисмысловые нуклеиновые кислоты для ингибирования экспрессии полинуклеотида и комплементарные последовательности вышеизложенного. Нуклеиновые кислоты могут быть любой длины. Они могут быть длиной, например, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 750, 1,000, 1,500, 3,000, 5,000 или больше нуклеотидов, и/или могут содержать одну или более дополнительных последовательностей, например регуляторных последовательностей, и/или являться частью более крупной нуклеиновой кислоты, например вектора. Эти нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными и могут включать РНК- и/или ДНК-нуклеотиды и их искусственные варианты (например, пептидные нуклеиновые кислоты). Нуклеиновые кислоты, кодирующие модуляторы по изобретению, в том числе антитела или их иммунореактивные фрагменты или производные, предпочтительно выделены, как описано выше.
б. Гибридизация и идентичность
Как указано, в изобретении также предлагаются нуклеиновые кислоты, которые гибридизуются с другими нуклеиновыми кислотами в определенных условиях гибридизации. Методы гибридизации нуклеиновых кислот хорошо известны в данной области техники. См., например, Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6. В контексте настоящей заявки в качестве умеренно жестких условий гибридизации используют раствор для предварительного промывания, содержащий 5х хлорид натрия/цитрат натрия (SSC), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (этилендиаминтетрауксусная кислота) (рН 8,0), буфер для гибридизации, состоящий из примерно 50% формамида, 6xSSC и температуру гибридизации 55°С (или другие аналогичные растворы для гибридизации, например, раствор, содержащий примерно 50% формамида, с температурой гибридизации 42°С), и следующие условия для промывания - 60°С, в 0,5×SSC, 0,1% SDS. В жестких условиях гибридизация происходит в 6xSSC при 45°С, с последующими одним или более промываниями в 0,1×SSC, 0,2% SDS при 68°С. Кроме того, специалист в данной области техники может управлять условиями гибридизации и/или промывания с целью увеличения или уменьшения жесткости гибридизации, таким образом, чтобы нуклеиновые кислоты, содержащие нуклеотидные последовательности, которые по меньшей мере на 65, 70, 75, 80, 85, 90, 95, 98 или 99% идентичны друг другу, обычно остаются гибридизованными друг с другом. В целом, в контексте настоящего описания изобретения термин "по существу идентичная" в отношении последовательности нуклеиновой кислоты следует понимать, как последовательность нуклеотидов, демонстрирующую по меньшей мере примерно 85%, или 90%, или 95%, или 97%-ную идентичность последовательности со стандартной нуклеиновокислотной последовательностью.
Основные параметры, влияющие на выбор условий гибридизации и руководство для разработки подходящих условий, изложены, например, в Sambrook, Fritsch, and Maniatis (1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., chapters 9 и 11; и Current Protocols in Molecular Biology, 1995, Ausubel et al., eds., John Wiley & Sons, Inc., sections 2.10 and 6.3-6.4) и могут быть легко определены специалистами в данной области на основании, например, длины и/или композиции оснований нуклеиновой кислоты.
Следует понимать, что нуклеиновые кислоты могут, согласно изобретению, присутствовать отдельно или в комбинации с другими нуклеиновыми кислотами, которые могут быть гомологичными или гетерологичными. В предпочтительных воплощениях нуклеиновая кислота функционально связана с последовательностями, контролирующими экспрессию, которые могут быть гомологичными или гетерологичными в отношении указанной нуклеиновой кислоты. В этом контексте термин "гомологичный" означает, что нуклеиновая кислота в природных условиях также функционально связана с последовательностью, контролирующей экспрессию, и термин "гетерологичный" означает, что нуклеиновая кислота в природных условиях функционально не связана с последовательностью, контролирующей экспрессию.
в. Экспрессия
Нуклеиновая кислота, такая как нуклеиновая кислота, экспрессирующая РНК и/или белок или пептид, и последовательность, контролирующая экспрессию, функционально связаны друг с другом, если они ковалентно соединены друг с другом таким образом, что экспрессия или транскрипция указанной нуклеиновой кислоты находится под контролем или под влиянием указанной последовательности, контролирующей экспрессию. Если нуклеиновую кислоту следует транслировать в функциональный белок, тогда, при последовательности, контролирующей экспрессию, функционально связанной с кодирующей последовательностью, индукция указанной последовательности, контролирующей экспрессию, приводит к транскрипции указанной нуклеиновой кислоты, не вызывая сдвига рамки считывания кодирующей последовательности или же указанная кодирующая последовательность не способна транслироваться в нужный белок или пептид.
Термин "последовательность, контролирующая экспрессию", содержит, согласно изобретению, промоторы, сайты связывания рибосомы, энхансеры и другие контролирующие элементы, которые регулируют транскрипцию гена или трансляцию мРНК. В конкретных воплощениях изобретения последовательности, контролирующие экспрессию, можно регулировать. Точная структура последовательностей, контролирующих экспрессию, может варьироваться в зависимости от вида или типа клетки, но, как правило, содержит 5′-нетранскрибируемые и 5′- и 3′-нетранслируемые последовательности, которые вовлечены в инициацию транскрипции и трансляции, соответственно, такие как ТАТА-бокс, кэпирующая последовательность, последовательность СААТ и тому подобное. Более конкретно, 5′-нетранскрибируемые последовательности, контролирующие экспрессию, содержат промоторную область, которая включает промоторную последовательность для контроля транскрипции функционально связанной нуклеиновой кислоты. Последовательности, контролирующие экспрессию, также могут содержать энхансерные последовательности или выше расположенные активаторные последовательности.
Согласно изобретению, термин "промотор" или "промоторная область" относится к нуклеиновокислотной последовательности, которая расположена выше (5′) экспрессируемой последовательности нуклеиновой кислоты и контролирует экспрессию последовательности, обеспечивая узнавание и сайт связывания РНК-полимеразы. Промоторная область может включать дополнительные сайты узнавания и связывания дополнительных факторов, вовлеченных в регуляцию транскрипции гена. Промотор может контролировать транскрипцию прокариотического или эукариотического гена. Кроме того, промотор может быть индуцибельным и может инициировать транскрипцию в ответ на индуцирующий агент, или может быть конститутивным, если транскрипция не контролируется индуцирующим агентом. Ген, находящийся под контролем индуцибельного промотора, не экспрессируется или лишь незначительно экспрессируется в случае отсутствия индуцирующего агента. В присутствии индуцирующего агента ген включается или уровень транскрипции увеличивается. Это опосредовано, в большинстве случаев, связыванием специфического транскрипционного фактора.
Предпочтительные промоторы по изобретению включают промоторы SP6, Т3 и Т7 полимераз, человеческий U6 RNA промотор, CMV промотор и его искусственные гибридные промоторы (например, CMV), где участок или участки слиты с участком или участками промоторов генов других клеточных белков, таких как, например, человеческий GAPDH (глицеральдегид-3-фосфатдегидрогеназа), включая или не включая дополнительный(е) интрон(ы).
Согласно изобретению, термин "экспрессия" используется в своем наиболее широком значении и включает продуцирование РНК или РНК и белка/пептида. Он также включает частичную экспрессию нуклеиновых кислот. Кроме того, экспрессия может осуществляться временно или стабильно.
В предпочтительном воплощении молекула нуклеиновой кислоты согласно изобретению находится в векторе, если целесообразно, вместе с соответствующим промотором, который контролирует экспрессию нуклеиновой кислоты. Термин "вектор" используется здесь в своем наиболее широком значении и включает любой вспомогательный носитель нуклеиновой кислоты, который позволяет вводить указанную нуклеиновую кислоту, например, в прокариотические и/или эукариотические клетки и, если целесообразно, встраивать в геном. Векторы такого типа предпочтительно реплицируются и/или экспрессируются в клетках. Векторы могут включать плазмиды, фагмиды, бактериофаги или вирусные геномы. При использовании здесь термин "плазмида", как правило, относится к конструкции экстрахромосомного генетического материала, обычно кольцевому ДНК дуплексу, который может реплицироваться независимо от хромосомной ДНК.
При осуществлении на практике настоящего изобретения следует понимать, что можно использовать многие общепринятые методы молекулярной биологии, микробиологии и рекомбинантной ДНК. Такие общепринятые методы относятся к векторам, клеткам-хозяевам и рекомбинантным методам, описанным здесь. Эти методы хорошо известны и объяснены, например, в Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif.; Sambrook et al., Molecular Cloning-A Laboratory Manual (3rd Ed.), Vol.1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 2000 и Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., выше. Другие полезные ссылки, например по выделению и культивированию клеток (например, для последующего выделения нуклеиновой кислоты или белка), включают Freshney (1994) Culture of Animal Cells, a Manual of Basic Technique, третье издание, Wiley-Liss, New York и ссылки, указанные в нем; Раупе et al. (1992) Plant Cell and Tissue Culture in Liquid Systems John Wiley & Sons, Inc. New York, N.Y.; Gamborg and Phillips (Eds.) (1995) Plant Cell, Tissue and Organ Culture; Fundamental Methods Springer Lab Manual, Springer-Verlag (Berlin Heidelberg New York) and Atlas and Parks (Eds.) The Handbook of Microbiological Media (1993) CRC Press, Boca Raton, Fla. Методы получения нуклеиновых кислот (например, посредством in vitro амплификации, очистки из клеток или химического синтеза), методы обработки нуклеиновых кислот (например, сайт-направленный мутагенез, расщепление рестриктазами, лигирование и т.д.) и различные векторы, клеточные линии и т.д., полезные в обработке и получении нуклеиновых кислот, описаны в вышеупомянутых ссылках. Кроме того, по существу любой полинуклеотид (в том числе, например, меченые или биотинилированные полинуклеотиды) могут быть индивидуально или стандартно заказаны в любом из множества коммерческих источников.
Таким образом, в одном аспекте настоящего изобретения предлагаются рекомбинантные клетки-хозяева, обеспечивающие возможность рекомбинантной экспрессии антител по изобретению или их участков. Антитела, продуцируемые путем экспрессии в таких рекомбинантных клетках-хозяевах, называются в данной заявке рекомбинантными антителами. В настоящем изобретении также предлагаются клетки, являющиеся потомками таких клеток-хозяев, и антитела, продуцируемые ими.
При использовании здесь термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") означает клетку, в которую был встроен рекомбинантный экспрессирующий вектор. Следует понимать, что рекомбинантная клетка-хозяин и клетка-хозяин означает не только клетку конкретного субъекта, но также и потомство такой клетки. Так как некоторые модификации могут иметь место в последующих поколениях в результате либо мутаций, либо влияния окружающей среды, такое потомство может, на самом деле, не быть идентичным родительской клетке, но тем не менее оно включено в объем используемого здесь термина "клетка-хозяин". Такие клетки могут содержать вектор по изобретению, как описано выше.
В другом аспекте настоящего изобретения предлагается способ получения антитела или его участка, как описано здесь. Согласно одному воплощению, указанный способ включает культивирование клетки, трансфицированной или трансформированной вектором, как описано выше, и воспроизводящий антитело или его участка.
Как указано выше, экспрессия антитела по изобретению (или его фрагмента или вариантов) предпочтительно включает экспрессирующий(е) вектор(ы), содержащий(е) полинуклеотид, который кодирует нужное анти-EFNA антитело. Методы, которые хорошо известны специалистам в данной области, можно использовать для конструирования экспрессирующих векторов, содержащих последовательности, кодирующие антитело, и соответствующие транскрипционные и трансляционные контрольные сигналы. Эти методы включают, например, методы рекомбинантной ДНК in vitro, синтетические методы и методы генетической рекомбинации in vivo. В воплощениях изобретения, таким образом, предлагаются реплицируемые векторы, содержащие нуклеотидную последовательность, кодирующую анти-EFNA антитело по изобретению (например, целое антитело, тяжелую или легкую цепь антитела, вариабельный домен тяжелой или легкой цепи антитела, или его часть, или CDR тяжелой или легкой цепи, одноцепочечный Fv или его фрагменты или варианты), функционально связанную с промотором. В предпочтительных воплощениях такие векторы могут включать нуклеотидную последовательность, кодирующую тяжелую цепь молекулы антитела (или ее фрагмент), нуклеотидную последовательность, кодирующую легкую цепь антитела (или ее фрагмент) или и тяжелую и легкую цепи.
Когда нуклеотиды по настоящему изобретению выделены и модифицированы согласно данному руководству, их можно использовать для получения выбранных модуляторов, включая анти-EFNA антитела или их фрагменты.
X. Получение и очистка модулятора
При использовании общепризнанных методов молекулярной биологии и современных методов экспрессии белка, можно получить значительные количества необходимых модуляторов. Более конкретно, молекулы нуклеиновой кислоты, кодирующие модуляторы, такие как антитела, полученные и сконструированные, как описано выше, могут быть встроены в хорошо известные и коммерчески доступные системы продуцирования белка, содержащие различные типы клеток-хозяев, для получения преклинических, клинических или коммерческих количеств нужного фармацевтического продукта. Следует понимать, что в предпочтительных воплощениях нуклеиновокислотные молекулы, кодирующие модуляторы, встроены в векторы или экспрессирующие векторы, которые обеспечивают эффективную интеграцию в выбранные клетки-хозяева с последующим высоким уровнем экспрессии нужного модулятора EFNA.
Предпочтительно, молекулы нуклеиновой кислоты, кодирующие модуляторы EFNA и векторы, содержащие эти нуклеиновокислотные молекулы, можно использовать для трансфекции подходящей клетки-хозяина млекопитающего, растения, бактерии или дрожжей, хотя следует понимать, что прокариотические системы можно использовать для производства модулятора. Трансфекцию можно осуществлять посредством любого известного метода введения полинуклеотидов в клетку-хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области техники и включают декстран-опосредованную трансфекцию, осаждение фосфатом кальция, полибрен-опосредованную трансфекцию, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида(ов) в липосомы и непосредственную микроинъекцию ДНК в ядро. Кроме того, молекулы нуклеиновых кислот можно вводить в клетки млекопитающих с помощью вирусных векторов. Методы трансформации клеток млекопитающих хорошо известны в данной области техники. См., например, патенты США 4399216, 4912040, 4740461 и 4959455. Кроме того, методы трансформации клеток растений хорошо известны в данной области техники, в том числе, например, трансформация, опосредованная агробактерией, биолистическая трансформация, непосредственная инъекция, электропорация и вирусная трансформация. Методы трансформации бактериальных и дрожжевых клеток также хорошо известны в данной области техники.
Кроме того, клетка-хозяин может быть ко-трансфицирована двумя экспрессирующими векторами по изобретению, например первым вектором, кодирующим полипептид, полученный из тяжелой цепи, и вторым вектором, кодирующим полипептид, полученный из легкой цепи. Эти два вектора могут содержать идентичные селектируемые маркеры, которые обеспечивают по существу эквивалентную экспрессию полипептидов тяжелой и легкой цепи. Альтернативно можно использовать один вектор, который кодирует и способен экспрессировать полипептиды и тяжелой и легкой цепи. В такой ситуации легкую цепь предпочтительно помещают перед тяжелой цепью, чтобы избежать избытка нетоксичной свободной тяжелой цепи. Кодирующие последовательности тяжелых и легких цепей могут содержать кДНК или геномную ДНК.
а. Системы экспрессии хозяина
Множество систем экспрессирующих векторов в клетках-хозяевах, многие из которых имеются в продаже, совместимы с данным руководством и могут быть использованы для экспрессии модуляторов по изобретению. Такие системы экспрессии хозяина представляют собой носители, с помощью которых интересующие кодирующие последовательности можно экспрессировать и затем очищать, но также представляют собой клетки, которые могут, будучи трансформированы или трансфицированы соответствующими нуклеотидными кодирующими последовательностями, экспрессировать молекулу по изобретению in situ. Такие системы включают, но не ограничиваются ими, микроорганизмы, такие как бактерии (например, Е. coli, В. subtilis, Streptomyces), трансформированные экспрессирующими векторами на основе рекомбинантной ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащими последовательности, кодирующие модулятор; дрожжи (например, Saccharomyces, Pichia), трансфицированные рекомбинантными дрожжевыми экспрессирующими векторами, содержащими последовательности кодирующие модулятор; системы клеток насекомых, инфицированные рекомбинантными вирусными экспрессирующими векторами (например, бакуловирус), содержащие последовательности, кодирующие модулятор; системы клеток растений (например, Nicotiana, Arabidopsis, ряска, зерновых, пшеницы, картошки и т.д.), инфицированные рекомбинантными вирусными экспрессирующими векторами (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или трансфицированные рекомбинантными плазмидными экспрессирующими векторами (например, Ti плазмида), содержащими последовательности, кодирующие модулятор; или системы клеток млекопитающих (например, клетки COS, СНО, ВНК, 293, 3Т3), имеющие рекомбинантные экспрессирующие конструкции, содержащие промоторы, полученные из генома клеток млекопитающих (например, металлотионеиновый промотор) или из вирусов млекопитающих (например, поздний промотор аденовируса; 7.5K промотор вируса осповакцины).
В бактериальных системах число экспрессирующих векторов может быть преимущественно выбрано в зависимости от предполагаемого использования экспрессируемой молекулы. Например, когда должно быть произведено большое количество такого белка для получения фармацевтических композиций модулятора, может быть желательно использовать векторы, которые управляют экспрессией высоких уровней слитых белковых продуктов, которые легко очищаются. Такие векторы включают, но не ограничиваются ими, Е. coli экспрессирующий вектор pUR278 (Ruther et al., EMBO 1. 2:1791 (1983)), в котором кодирующая последовательность может быть лигирована отдельно в вектор в рамке с кодирующей областью lac Z, так что продуцируется слитый белок; pIN векторы (Inouye & Inouye, Nucleic Acids Res. 13:3101-3109 (1985); Van Heeke & Schuster, J. Biol. Chem. 24:5503-5509 (1989)); и тому подобное. Также можно использовать pGEX векторы для экспрессии чужеродных полипептидов в виде слитых белков с глутатион-5-трансферазой (GST). В целом, такие слитые белки являются растворимыми и могут быть легко очищены из лизируемых клеток посредством абсорбции и связывания с матриксными глутатион-агарозными шарообразными частицами и затем элюированы в присутствии свободного глутатиона. Разработаны pGEX векторы, включающие сайты расщепления тромбином или протеазой фактором Ха, так чтобы клонируемый продукт целевого гена мог быть высвобожден из GST-группировки.
В системе насекомых можно использовать Autographa californica nuclear polyhedrosis virus (AcNPV) (вирус ядерного полиэдроза калифорнийской люцерновой совки) в качестве вектора, экспрессирующего чужеродные гены. Вирус выращивают в клетках Spodoptera frugiperda. Кодирующие последовательности можно клонировать отдельно в несущественные области (например, ген полиэдрина) вируса и помещать под контроль промотора AcNPV (например, промотора полиэдрина).
В клетках-хозяевах млекопитающих ряд систем, основанных на вирусной экспрессии можно использовать для введения нужной нуклеотидной последовательности. В случае использования аденовируса в качестве экспрессирующего вектора, представляющую интерес кодирующую последовательность можно лигировать с аденовирусным транскрипционным/трансляционным контролирующим комплексом, например поздним промотором и тройной лидерной последовательностью. Этот химерный ген затем можно встроить в аденовирусный геном посредством in vitro или in vivo рекомбинации. Вставка в несущественную область вирусного генома (например, область Е1 или Е3) приводит к рекомбинантному вирусу, который является жизнеспособным и способен экспрессировать молекулу в инфицированных хозяевах (например, см. Logan & Shenk, Proc. Natl. Acad. Sci. USA 8 1:355-359 (1984)). Специфические сигналы инициации также могут требоваться для эффективной трансляции встроенных кодирующих последовательностей. Эти сигналы включают инициирующий кодон ATG и соседние последовательности. Кроме того, инициирующий кодон должен находиться в фазе с рамкой считывания нужной кодирующей последовательности, чтобы обеспечить трансляцию всей вставки. Эти экзогенные трансляционные контролирующие сигналы и инициирующие кодоны могут быть различного происхождения, как природными, так и синтетическими. Эффективность экспрессии можно увеличить путем включения подходящих энхансерных элементов транскрипции, терминаторов транскрипция и т.д. (см., например, Bittner et al., Methods in Enzymol. 153:51-544 (1987)). Таким образом, совместимые клеточные линии млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области техники и включают многие иммортализованные клеточные линии, доступные в Американской коллекции типовых культур (АТСС). Они включают, среди прочего, клетки яичника китайского хомячка (СНО), клетки NSO, клетки SP2, клетки НЕК-293Т, клетки 293 Freestyle (Life Technologies), клетки NIH-ЗТЗ, клетки HeLa, клетки почки новорожденного хомяка (BHK), клетки почки африканской зеленой мартышки (COS), клетки гепатоклеточной карциномы человека (например, Нер G2), клетки А549 и ряд других клеточных линий.
Для длительного, высокоэффективного продуцирования рекомбинантных белков предпочтительной является стабильная экспрессия. Соответственно, с использованием стандартных общепризнанных методов могут быть сконструированы клеточные линии, которые стабильно экспрессируют выбранный модулятор. Вместо использования экспрессирующих векторов, которые содержат вирусные точки начала репликации, клетки-хозяева могут быть трансформированы ДНК, контролируемой подходящими элементами контроля экспрессии (например, промотором, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и т.д.) и селектируемым маркером. Вслед за введением чужеродной ДНК, сконструированные клетки могут расти в течение 1-2 суток в обогащенной среде с последующим переносом на селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду в свои хромосомы и расти с образованием фокусов, которые в свою очередь можно клонировать и увеличивать до клеточных линий. Этот метод преимущественно может быть использован для конструирования клеточных линий, которые экспрессируют молекулу. Такие сконструированные клеточные линии могут быть особенно полезны для скрининга и оценки композиций, которые непосредственно или опосредованно взаимодействуют с молекулой.
В данной области техники хорошо известен и может быть использован ряд селективных систем, включая, но не ограничиваясь ими, использование генов тимидинкиназы вируса простого герпеса (Wigleret al., Cell 11:223 (1977)), гипоксантингуанин-фосфорибозилтрансферазы (Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA 48:202 (1992)) и аденинфосфорибозилтрансферазы (Lowy et al., Cell 22:8 17 (1980)) в клетках tk-, hgprt- или aprt-, соответственно. Также, антиметаболическую устойчивость можно использовать как основу для селекции следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler et al., Natl. Acad. Sci. USA 77:357 (1980); O′Hare et al., Proc. Natl. Acad. Sci. USA 78:1527 (1981)); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan & Berg, Proc. Natl. Acad. Sci. USA 78:2072 (1981)); neo, который придает устойчивость к аминогликозиду G-418 (Clinical Pharmacy 12:488-505; Wu and Wu, Biotherapy 3:87-95 (1991); Tolstoshev, Ann. Rev. Pharmacol. Toxicol. 32:573-596 (1993); Mulligan, Science 260:926-932 (1993); и Morgan and Anderson, Ann. Rev. Biochem. 62: 191-217 (1993); TIB TECH 11(5): 155-2 15 (May, 1993)); и hygro, который придает устойчивость к гигромицину (Santerre et al., Gene 30:147 (1984)). Способы, широко известные в области методов рекомбинантной ДНК, можно в установленном порядке применять для селекции необходимого рекомбинантного клона, и такие способы описаны, например, в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); и в главах 12 и 13, в Dracopoli et al. (eds), Current Protocols in Human Genetics, John Wiley & Sons, NY (1994); Colberre-Garapin et al., J. Mol. Biol. 150:1 (1981). Следует понимать, что один особенно предпочтительный способ получения стабильной высокоэффективной клеточной линии включает систему экспрессии гена глутаминсинтетазы (система GS), которая обеспечивает эффективный подход для повышения экспрессии в определенных условиях. Система GS обсуждается во всей полноте или частично в связи с европейскими патентами 0216846, 0256055, 0323997 и 0338841, каждый из которых включен в данную заявку посредством ссылки.
Кроме того, можно выбирать штамм клетки-хозяина, который модулирует экспрессию встроенных последовательностей или модифицирует и подвергает процессингу продукт гена желательным конкретным образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функционирования и/или очистки белка. Разные клетки-хозяева имеют характерные и специфические механизмы посттрансляционного процессинга и модификации белков и продуктов гена. Как известно в данной области, можно выбрать подходящие клеточные линии или системы хозяев, которые обеспечивают нужную модификацию и процессинг экспрессируемого полипептида. С этой целью эукариотические клетки-хозяева, которые обладают клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования продукта гена, являются особенно эффективными для применения в настоящем изобретении. Соответственно, особенно предпочтительные клетки-хозяева млекопитающих включают, но не ограничиваются ими, СНО, VERY, BHK, HeLa, COS, NSO, MDCK, 293, 3T3, W138, а также клеточные линии рака молочной железы, такие как, например, ВТ483, Hs578T, HTB2, ВТ20 и T47D, и нормальную клеточную линию молочной железы, такую как, например, CRL7O3O и HsS78Bst. В зависимости от модулятора и выбранной системы продуцирования специалисты в данной области могут легко выбрать и оптимизировать клетки-хозяева, подходящие для эффективной экспрессии модулятора.
б. Химический синтез
Следует понимать, что, кроме вышеупомянутых систем клеток-хозяев, модуляторы по изобретению могут быть химически синтезированы с использованием методов, известных в данной области (например, см. Creighton, 1983, Proteins: Structures and Molecular Principles, W.H. Freeman & Co., N.Y., и Hunkapiller, M., et al., 1984, Nature 310:105-111). Например, пептид, соответствующий полипептидному фрагменту по изобретению, можно синтезировать с использованием пептидного синтезатора. Кроме того, при необходимости неклассические аминокислоты или химические аналоги аминокислот можно вставить в качестве замены или добавления в полипептидную последовательность. Неклассические аминокислоты включают, но не ограничиваются ими, D-изомеры обычных аминокислот, 2,4-диаминомасляную кислоту, а-аминоизомасляную кислоту, 4-аминомасляную кислоту, Abu, 2-аминомасляную кислоту, g-Abu, e-Ahx, 6-аминокапроновую кислоту, Aib, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновую кислоту, трет-бутил глицин, mpem-бутилаланин, фенилглицин, циклогексилаланин, b-аланин, фтор-аминокислоты, сконструированные аминокислоты, такие как b-метил-аминокислоты, Са-метил-аминокислоты, Na-метил-аминокислоты и аналоги аминокислот в целом. Кроме того, аминокислота может быть D (правовращающей) или L (левовращающей).
в. Трансгенные системы
Модуляторы EFNA по изобретению также можно получить трансгенно путем получения млекопитающего или растения, которое является трансгенным в отношении представляющих интерес последовательностей тяжелой и легкой цепи иммуноглобулина (или их фрагментов или производных или вариантов), и получения нужных компонентов в извлекаемой форме. Применительно к трансгенному получению в млекопитающих, анти-EFNA антитела, например, можно получить и извлечь из молока коз, коров и других млекопитающих. См., например, патенты США 5827690, 5756687, 5750172 и 5741957. В некоторых воплощениях не являющиеся человеком трансгенные животные, которые содержат локус человеческого иммуноглобулина, иммунизированы EFNA или его иммуногенной частью, как описано выше. Методы получения антител в растениях описаны, например, в патентах США 6046037 и 5959177.
Согласно данному руководству не являющиеся человеком трансгенные животные или растения можно получить путем введения одной или более молекул нуклеиновой кислоты, кодирующих модулятор EFNA по изобретению, в животное или растение посредством стандартных трансгенных методов. См. Hogan и патент США 6417429. Трансгенные клетки, используемые для получения трансгенного животного, могут быть эмбриональными стволовыми клетками или соматическими клетками или оплодотворенной яйцеклеткой. Трансгенные не являющиеся человеком организмы могут быть химерными, нехимерными гетерозиготами и нехимерными гомозиготами. См., например, Нодап et al., Manipulating the Mouse Embryo: A Laboratory Manual 2nd ed., Cold Spring Harbor Press (1999); Jackson et al., Mouse Genetics and Transgenics: A Practical Approach, Oxford University Press (2000); и Pinkert, Transgenic Animal Technology: A Laboratory Handbook, Academic Press (1999) В некоторых воплощениях, трансгенные не являющиеся человеком животные имеют целевой разрыв и замещение целевой конструкцией, которая кодирует, например, интересующую тяжелую цепь и/или легкую цепь. В одном воплощении трансгенные животные содержат и экспрессируют молекулы нуклеиновой кислоты, кодирующие тяжелые и легкие цепи, которые специфически связываются с EFNA. В то время как анти-EFNA антитела можно получить в любом трансгенном животном, в особенно предпочтительных воплощениях не являющиеся человеком животные представляют собой мышей, крыс, овец, свиней, коз, крупный рогатый скот или лошадей. В дополнительных воплощениях не являющееся человеком трансгенное животное экспрессирует нужный фармацевтический продукт в кровь, молоко, мочу, слюну, слезы, слизь и другие физиологические жидкости, из которых его легко получить с использованием общепризнанных методов очистки.
Вероятно, модуляторы, включая антитела, экспрессируемые разными клеточными линиями или в трансгенных животных, будут иметь отличные друг от друга профили гликозилирования. Однако все модуляторы, кодируемые молекулами нуклеиновой кислоты, представленными здесь, или содержащие аминокислотные последовательности, представленные здесь, являются частью настоящего изобретения, независимо от статуса гликозилирования молекулы и, в более общем смысле, независимо от присутствия или отсутствия посттрансляционной(ых) модификации(ий). Также изобретение охватывает модуляторы, которые по-разному модифицированы во время или после трансляции, например посредством гликозилирования, ацетилирования, фосфорилирования, амидирования, получения производных с помощью известных защитных/блокирующих групп, протеолитического расщепления, соединения с молекулой антитела или другим клеточным лигандом и т.д. Любую из многочисленных химических модификаций можно выполнять с помощью известных методов, включая, но не ограничиваясь ими, специфическое химическое расщепление с помощью бромциана, трипсина, химотрипсина, папаина, протеазы V8, NaBH4, ацетилирования, формилирования, окисления, восстановления, метаболического синтеза в присутствии туникамицина и т.д. Различные посттрансляционные модификации также охваченные изобретением, включают, например, N-связанные или O-связанные углеводные цепи, процессинг N-концов или С-концов), присоединение химических группировок к аминокислотному каркасу, химические модификации N-связанной или O-связанной углеводной цепи и добавление или удаление N-концевого остатка метионина в результате экспрессии в прокариотической клетке-хозяине. Кроме того, как представлено в тексте и Примерах ниже, полипептиды также могут быть модифицированы с помощью детектируемого маркера, такого как ферментативная, флуоресцентная, радиоизотопная или аффинная метка, позволяющая обнаружить и выделить модулятор.
г. Очистка
Если модулятор по изобретению был получен посредством рекомбинантной экспрессии или любым другим методом, раскрытым в данном описании изобретения, его можно очистить любым, известным в данной области методом очистки иммуноглобулинов или, в более общем смысле, любым другим стандартным методом очистки белков. При этом можно выделить модулятор. При использовании здесь, выделенный модулятор EFNA представляет собой модулятор, который идентифицирован и выделен и/или извлечен из компонента его естественного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые мешают диагностическим или терапевтическим применениям полипептида и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. Выделенные модуляторы включают модулятор in situ в рекомбинантных клетках, так как по меньшей мере один компонент полипептидного природного окружения будет отсутствовать.
При использовании рекомбинантных методов модулятор EFNA (например, анти-EFNA антитело или его производное или фрагмент) может продуцироваться внутриклеточно, в периплазматическом пространстве или непосредственно секретироваться в среду. Если нужная молекула продуцируется внутриклеточно, на первой стадии дебрис в форме частиц, или клетки-хозяева или лизированные фрагменты, можно удалить, например, посредством центрифугирования или ультрафильтрации. Например, в Carter, et al., Bio/Technology 10:163 (1992) описан процесс выделения антител, секретируемых в периплазматическое пространство E. coli. В кратком изложении, клеточную массу оттаивают в присутствии ацетата натрия (рН 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение примерно 30 минут. Клеточный дебрис можно удалить путем центрифугирования. Если антитело секретируется в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием имеющегося в продаже фильтра для концентрирования белка, например, устройства для ультрафильтрации Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF, может быть включен в любую из вышеуказанных стадий для ингибирования протеолиза и антибиотики могут быть включены для предотвращения роста случайных загрязнений.
Модуляторную композицию (например, fc-EFNA или анти-EFNA антитело), полученную из клеток, можно очистить с использованием, например, гидроксиапатитной хроматографии, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография является предпочтительным методом очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в выбранной конструкции. Белок А можно использовать для очистки антител, которые основаны на тяжелых цепях IgG1, IgG2 или IgG4 человека (Lindmark, et al., J Immunol Meth 62:1 (1983)). Белок G рекомендуется для всех мышиных изотипов и IgG3 человека (Guss, et al., EMBO J 5:1567 (1986)). Матрица, к которой присоединен аффинный лиганд, чаще всего представляет собой агарозу, но также имеются другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают большие скорости потока и более короткое время обработки, чем может быть достигнуто с помощью агарозы. Если антитело содержит домен CH3, полезной для очистки является смола Bakerbond ABX™ (J.Т. Baker; Phillipsburg, N.J.). Другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарине, сефарозная хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония также доступны в зависимости от выделяемого антитела. В особенно предпочтительных воплощениях модуляторы по настоящему изобретению будут очищены, по меньшей мере частично, с использованием аффинной хроматографии с участием белка А или белка G.
XI. Конъюгированные модуляторы EFNA
Если модуляторы по изобретению были очищены, согласно данному руководству, они могут быть связаны, слиты, конъюгированы (например, ковалентно или нековалентно) или другим образом соединены с фармацевтически активными или диагностическими группировками или биосовместимыми модификаторами. Здесь термин "конъюгировать" используется в широком смысле и означает любую молекулу, находящуюся в ассоциации с раскрытыми модуляторами, независимо от способа ассоциации. В связи с этим понятно, что такие конъюгаты могут содержать пептиды, полипептиды, белки, полимеры, молекулы нуклеиновой кислоты, небольшие молекулы, миметики, синтетические лекарственные средства, неорганические молекулы, органические молекулы и радиоизотопы. Кроме того, как указано выше, выбранный конъюгат может быть ковалентно или нековалентно соединен с модулятором и может иметь различные молярные соотношения в зависимости, по меньшей мере частично, от метода, используемого для осуществления конъюгирования.
В предпочтительных воплощениях очевидно, что модуляторы по изобретению могут быть конъюгированы или находиться в ассоциации с белками, полипептидами или пептидами, которые придают выбранные характеристики (такими как биотоксины, биомаркеры, метки для очистки и т.д.). В более общем случае, в выбранных воплощениях настоящее изобретение охватывает применение модуляторов или их фрагментов, рекомбинантно слитых или химически конъюгированных (включая ковалентные и нековалентные конъюгации) с гетерологичным белком или полипептидом, где полипептид содержит по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот. Эта конструкция не обязательно должна быть непосредственно связана, но может быть соединена через линкерные последовательности. Например, антитела могут быть использованы для нацеливания гетерологичных полипептидов на определенные клеточные типы, экспрессирующие EFNA, или in vitro или in vivo, посредством слияния или конъюгирования модуляторов по настоящему изобретению с антителами, специфичными к конкретным рецепторам клеточной поверхности. Кроме того, модуляторы, слитые или конъюгированные с гетерологичными полипептидами, также могут быть использованы в иммуноанализах in vitro и могут быть совместимы со способом очистки, известным в данной области. См., например, международную публикацию WO 93/21232; европейский патент ЕР 439,095; Naramura et al., 1994, Immunol. Lett. 39:91-99; патент США 5474981; Gillies et al., 1992, PNAS 89:1428-1432; и Fell et al., 1991, J. Immunol. 146:2446-2452.
а. Биосовместимые модификаторы
В предпочтительном воплощении модуляторы по изобретению могут быть конъюгированы или другим способом соединены с биосовместимыми модификаторами, которые могут использоваться, при необходимости, для регулирования, изменения, улучшения или ослабления характеристик модулятора. Например, антитела или слитые конструкции с увеличенным временем полужизни in vivo можно получить путем присоединения молекул полимера с относительно высокой молекулярной массой, таких как имеющийся в продаже полиэтиленгликоль (PEG) или аналогичные биосовместимые полимеры. Специалистам в данной области понятно, что PEG можно получить с множеством различных молекулярных масс и молекулярных конфигураций, которые могут быть выбраны, чтобы придать конкретные свойства антителу (например, можно скорректировать время полужизни). PEG можно присоединить к модуляторам или фрагментам или производным антитела посредством или без помощи мультифункционального линкера, либо посредством сайт-специфической конъюгации PEG с N- или С-концом указанных антител или фрагментов антитела, либо посредством эпсилон-аминогрупп, присутствующих на остатках лизина. Можно использовать получение производных линейных или разветвленных полимеров, приводящее к минимальной потере биологической активности. За степенью конъюгации можно с большой точностью следить с помощью SDS-PAGE и масс-спектрометрии, чтобы обеспечить оптимальную конъюгацию молекул PEG с молекулами антител. Непрореагировавший PEG может быть отделен от конъюгатов антитело-PEG, например посредством гель-фильтрации или ионообменной хроматографии. Аналогичным образом, раскрытые модуляторы могут быть конъюгированы с альбумином для того, чтобы сделать антитело или фрагмент антитела более стабильным in vivo или обеспечить более продолжительное временя полужизни in vivo. Эти способы хорошо известны в данной области техники, см., например, международную публикацию WO 93/15199, WO 93/15200 и WO 01/77137; и европейский патент 0413622. Другие биосовместимые конъюгаты являются очевидными для специалистов и могут быть легко идентифицированы в соответствии с данным руководством.
б. Диагностические и детектируемые агенты
В других предпочтительных воплощениях модуляторы по настоящему изобретению или их фрагменты или производные конъюгированы с диагностическим или детектируемым агентом, маркером или репортером, который может представлять собой биологическую молекулу (например, пептид или нуклеотид), небольшую молекулу, флуорофор или радиоизотоп. Меченые модуляторы могут быть полезны для мониторинга развития или прогрессирования гиперпролиферативных расстройств или как часть клинической процедуры тестирования для определения эффективности конкретной терапии, включающей раскрытые модуляторы (т.е. терагностики). Такие маркеры или репортеры также могут быть полезны для очистки выбранного модулятора, отделения или выделения TIC либо во время доклинических процедур, либо в токсикологических исследованиях.
Такая диагностика и обнаружение могут быть выполнены путем соединения модулятора с детектируемыми веществами, включая, но не ограничиваясь ими, различные ферменты, включающие, например, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; простетические группы, такие как, но не ограничиваясь ими, стрептавидин/биотин и авидин/биотин; флуоресцентные вещества, такие как, но не ограничиваясь ими, умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, дансилхлорид или фикоэритрин; люминесцентные вещества, такие как, но не ограничиваясь им, люминол; биолюминесцентные вещества, такие как, но не ограничиваясь ими, люцифераза, люциферин и экворин; радиоактивные вещества, такие как, но не ограничиваясь ими, йод (131I, 125I, 123I, 121I), углерод (14С), сера (35S), тритий (3H), индий (115In, 113In, 112In, 111In) и технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn и 117Tin; позитрон-испускающие металлы с использованием различных видов позитронно-эмиссионной томографии, нерадиоактивные ионы парамагнитных металлов и молекулы, которые помечены радиоактивными изотопами или конъюгированы с конкретными радиоизотопами. В таких воплощениях соответствующая методика обнаружения хорошо известна в данной области и доступна из различных коммерческих источников.
Как указано выше, в других воплощениях модуляторы или их фрагменты могут быть слиты с маркерными последовательностями, такими как пептид или флуорофор, для облегчения процедур очистки или диагностики, таких как иммуногистохимия или FAC. В предпочтительных воплощениях маркерная аминокислотная последовательность представляет собой гексагистидиновый (SEQ ID NO:166) пептид, такой как, наряду с прочими, тег, представленный в векторе pQE (Qiagen), многие из которых имеются в продаже. Как описано в Gentz et al., 1989, Proc. Natl. Acad. Sci. USA 86:821-824, например, гексагистидин (SEQ ID NO:166) обеспечивает удобную очистку слитого белка. Другие пептидные теги, полезные для очистки, включают, но не ограничиваются ими, тег гемагглютинина "НА", который соответствует эпитопу, полученному из белка гемагглютинина вируса гриппа (Wilson et al., 1984, Cell 37:767) и тег "flag" (патент США 4703004).
в. Терапевтические группировки
Как уже упоминалось, модуляторы или их фрагменты или производные также могут быть конъюгированы, связаны или слиты, или иным образом соединены с терапевтической группировкой, такой как противораковые агенты, цитотоксин или цитотоксический агент, например цитостатический или цитопатический агент, терапевтический агент или ион радиоактивного металла, например альфа- или бета-излучатели. При использовании здесь, цитотоксин или цитотоксический агент включает любой агент или терапевтическую группировку, которая губительная для клеток и может ингибировать рост или выживание клеток. Примеры включают паклитаксел, цитохалазин В, грамицидин D, этидия бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин, майтанзиноиды такие как DM-1 и DM-4 (Immunogen, Inc.), дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, эпирубицин и циклофосфамид и его аналоги или гомологи. Дополнительные цитотоксины включают ауристатины, в том числе монометилауристатин Е (ММАЕ) и монометилауристатин F (MMAF) (Seattle Genetics, Inc.), аманитины, такие как альфа-аманитин, бета-аманитин, гамма-аманитин или эпсилон-аманитин (Heidelberg Pharma AG), агенты, связывающиеся с малой бороздой ДНК, такие как производные дуокармицина (Syntarga, B.V.) и модифицированные димеры пирролобензодиазепина (PBDs, Spirogen, Ltd). Кроме того, в одном воплощении модуляторы EFNA по настоящему изобретению могут быть соединены с анти-CDS связывающими молекулами для рекрутмента цитотоксических Т-клеток и нацеливания их на опухоль-инициирующие клетки (BiTE technology; см., например, Fuhrmann, S. et. al. Annual Meeting of AACR Abstract No.5625 (2010), который включен сюда посредством ссылки).
Дополнительные совместимые терапевтические группировки включают цитотоксические агенты, включая, но не ограничиваясь ими, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил-декарбазин), алкилирующие агенты (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BCNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромоманнитол, стрептозотоцин, митомицин С и цис-дихлордиамин платины(II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС)) и антимитотические агенты (например, винкристин и винбластин). Более подробный перечень терапевтических группировок можно найти в публикации РСТ WO 03/075957 и патенте США 2009/0155255, каждый из которых включен в данную заявку посредством ссылки.
Выбранные модуляторы также могут быть конъюгированы с терапевтическими группировками, такими как радиоактивные вещества, или с макроциклическими хелаторами, полезными для конъюгирования ионов радиоактивных металлов (см. выше примеры радиоактивных веществ). В некоторых воплощениях, макроциклический хелатор представляет собой 1,4,7,10-тетраазациклододекан-N,N′,N″,N″-тетрауксусную кислоту (DOTA), которая может быть присоединена к антителу посредством линкерной молекулы. Такие линкерные молекулы общеизвестны в данной области и описаны в Denardo et al., 1998, Clin Cancer Res. 4:2483; Peterson et al., 1999, Bioconjug. Chem. 10:553; и Zimmerman et al., 1999, Nucl. Med. Biol. 26:943.
Примеры радиоизотопов, которые могут быть совместимы с этим аспектом изобретения включают, без ограничения ими, йод (131I, 125I, 123I, 121I), углерод (14С), медь (62Cu, 64Cu, 67Cu), серу (35S), тритий (3Н), индий (115In, 113In, 112In, 111In), висмут (212Bi, 213Bi), технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn, 117Tin, 225Ac, 76Br и 211At. Другие радионуклиды также можно использовать в качестве диагностических и терапевтических агентов, особенно радионуклиды в диапазоне энергии от 60 до 4000 кэВ. В зависимости от подлежащего лечению состояния и желаемого терапевтического профиля, специалисты в данной области техники могут легко выбрать подходящий радиоизотоп для использования с раскрытыми здесь модуляторами.
Модуляторы EFNA по настоящему изобретению также могут быть конъюгированы с терапевтической группировкой или лекарственным средством, который модифицирует данный биологический ответ (например, модификаторами биологического ответа или BRM). То есть терапевтические агенты или группировки, совместимые с настоящим изобретением, не следует рассматривать, как ограниченные классическими химическими терапевтическими агентами. Например, в особенно предпочтительных воплощениях лекарственная группировка может быть белком или полипептидом или его фрагментом, обладающим нужной биологической активностью. Такие белки могут включать, например, токсин, такой как абрин, рицин А, онконаза (или другая цитотоксическая РНКаза), экзотоксин синегнойной палочки, холерный токсин или дифтерийный токсин; белок, такой как фактор некроза опухоли, α-интерферон, β-интерферон, фактор роста нервов, тромбоцитарный фактор роста, тканевой активатор плазминогена, апоптотический агент, например TNF-α, TNF-β, AIM I (см. международную публикацию WO 97/33899), AIM II (см. международную публикацию WO 97/34911), лиганд Fas (Takahashi et al., 1994, J. Immunol., 6:1567) и VEGI (см. международную публикацию WO 99/23105), тромботический агент или анти-ангиогенный агент, например ангиостатин или эндостатин; или модификатор биологического ответа, такой как, например, лимфокин (например, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-макрофагальный колониестимулирующий фактор ("GM-CSF") и гранулоцитарный колониестимулирующий фактор ("G-CSF")) или фактор роста (например, гормон роста ("GH")). Как указано выше, методы слияния или конъюгирования модуляторов с полипептидными группировками известны в данной области. В дополнение к ранее раскрытым тематическим ссылкам см., например, патенты США 5336603; 5622929; 5359046; 5349053; 5447851 и 5112946; ЕР 307434; ЕР 367166; публикации РСТ WO 96/04388 и WO 91/06570; Ashkenazi et al., 1991, PNAS USA 88:10535; Zheng et al., 1995, J Immunol 154:5590; и Vil et al., 1992, PNAS USA 89:11337, каждая из которых включена в данную заявку посредством ссылки. Ассоциация модулятора с группировкой не обязательно должна быть непосредственной, но может быть осуществлена через линкерные последовательности. Такие линкерные молекулы общеизвестны в данной области и описаны в Denardo et al., 1998, Clin Cancer Res 4:2483; Peterson et al., 1999, Bioconjug Chem 10:553; Zimmerman et al., 1999, Nucl Med Biol 26:943; Garnett, 2002, Adv Drug Deliv Rev 53:171, каждая из которых включена в данную заявку.
В целом, способы конъюгирования терапевтических группировок или цитотоксических агентов с модуляторами хорошо известны. Группировки можно конъюгировать с модуляторами любым общепризнанным способом, включая, но не ограничиваясь ими, альдегидную/Шиффа связь, сульфгидрильную связь, кислотолабильную связь, цис-аконитильную связь, гидразонную связь, ферментативно разрушаемую связь (см. в общем Garnett, 2002, Adv Drug Deliv Rev 53:171). Также см., например, Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs in Cancer Therapy", в Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp.243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", в Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp.623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies ′84: Biological And Clinical Applications, Pinchera et al. (eds.), pp.475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", в Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp.303-16 (Academic Press 1985), и Thorpe et al., 1982, Immunol. Rev. 62:119. В предпочтительных воплощениях модулятор EFNA, который конъюгирован с терапевтической группировкой или цитотоксическим агентом, может быть интернализован клеткой при связывании с молекулой EFNA, соединенной с клеточной поверхностью, тем самым обеспечивая доставку терапевтически полезного груза.
XII. Диагностика и скрининг
а. Диагностика
Как указано выше, в настоящем изобретении предлагаются in vitro или in vivo способы обнаружения, диагностики или мониторинга гиперпролиферативных расстройств и способы скрининга клеток пациента для идентификации онкогенных клеток, в том числе ТРС. Такие способы включают идентификацию субъекта, имеющего рак, для лечения или мониторинга развития рака, включающую приведение пациента или образца, полученного от пациента, в контакт с выбранным модулятором EFNA, как описано здесь, и обнаружение присутствия или отсутствия, или уровня ассоциации модулятора со связанным или свободным лигандом эфрином А в образце. Если модулятор содержит антитело или его иммунологически активный фрагмент, ассоциация с конкретным EFNA в образце, вероятно, означает, что образец может содержать клетки, поддерживающие опухоль (например, раковые стволовые клетки), что указывает на то, что субъекта, имеющего рак, можно эффективно лечить с помощью модулятора EFNA, как описано здесь. Способы могут дополнительно включать стадию сравнения уровня связывания с контролем. Напротив, когда выбранный модулятор представляет собой Fc-EFNA, можно использовать и контролировать связывающие свойства выбранного лиганда эфрина А (прямо или косвенно, in vivo или in vitro) при контакте с образцом для получения нужной информации. Другие диагностические или терагностические способы, совместимые с данным руководством, хорошо известны в данной области техники и могут быть осуществлены на практике с использованием имеющихся в продаже веществ, таких как специализированные репортерные системы.
В особенно предпочтительном воплощении модуляторы по настоящему изобретению можно использовать для выявления и количественного определения уровней EFNA в образце, взятом от пациента (например, в плазме или крови), которое можно, в свою очередь, использовать для обнаружения, диагностики или контролирования EFNA-ассоциированные расстройств, в том числе гиперпролиферативных расстройств. Одно такое воплощение представлено в Примере 17 ниже, где осуществляют обнаружение EFNA в образцах плазмы.
Типичные совместимые методы анализа включают радиоиммуноанализы, иммуноферментный анализы, анализы конкурентного связывания, флуоресцентный иммуноанализ, иммуноблот-анализ, Вестерн-блот-анализ, анализы посредством проточной цитометрии и анализы ELISA. В целом, обнаружение EFNA в биологическом образце или измерение ферментативной активности EFNA (или ее ингибирование) может быть осуществлено с использованием любого известного в данной области анализа. Совместимая in vivo терагностика или диагностика может включать признанные в данной области методы визуализации или контроля, такие как магнитно-резонансная томография (MRI), компьютерная томография (например, САТ(компьютерная аксиальная томография)-сканирование), позитронная томография (например, РЕТ-сканирование), рентгенография, ультразвук и т.д. Специалисты в данной области легко могут узнать и осуществить подходящие методы обнаружения, контроля и визуализации (часто содержащие имеющиеся в продаже источники) на основании этиологии, патологических проявлений или клинического развития заболевания.
В другом воплощении изобретения предлагается способ анализа развития рака и/или патогенеза in vivo. В другом воплощении анализ развития рака и/или патогенеза in vivo включает определение степени развития опухоли. В другом воплощении анализ включает идентификацию опухоли. В другом воплощении анализ развития опухоли выполняют на первичной опухоли. В другом воплощении анализ выполняют в течение некоторого времени в зависимости от типа рака, как это известно специалисту в данной области. В другом воплощении дополнительный анализ вторичных опухолей, происходящих из метастазирующих клеток первичной опухоли, анализируют in vivo. В другом воплощении анализируют размер и форму вторичных опухолей. В некоторых воплощениях выполняют дополнительный анализ ех vivo.
В другом воплощении изобретения предлагается способ анализа развития рака и/или патогенеза in-vivo, включающий определение метастазирования клеток. В еще одном воплощении анализ метастазирования клеток включает определение прогрессирующего роста клеток в месте, которое отделено от первичной опухоли. В другом воплощении, анализ места метастазирования клеток включает путь опухолевого распространения. В некоторых воплощениях клетки распространяются через кровеносные сосуды, лимфатические сосуды, полости тела или их комбинацию. В другом воплощении анализ метастазирования клеток выполняют, принимая во внимание миграцию клеток, распространение, экстравазацию, пролиферацию или их комбинацию.
В некоторых примерах онкогенные клетки у субъекта или в образце, взятом у субъекта, можно оценить или охарактеризовать с использованием раскрытых модуляторов для того, чтобы установить исходный уровень перед терапией или схемой лечения. В других примерах образец получают от субъекта, подвергавшегося лечению. В некоторых примерах образец берут от субъекта по меньшей мере примерно через 1, 2, 4, 6, 7, 8, 10, 12, 14, 15, 16, 18, 20, 30, 60, 90 суток, 6 месяцев, 9 месяцев, 12 месяцев или более 12 месяцев после начала или окончания лечения субъекта. В некоторых примерах онкогенные клетки оценивают или охарактеризовывают после определенного числа доз (например, после 2, 5, 10, 20, 30 или более доз лечения). В других примерах онкогенные клетки охарактеризовывают или оценивают через 1 неделю, 2 неделю, 1 месяц, 2 месяца, 1 год, 2 года, 3 года, 4 года или более после получения одной или более терапий.
В другом аспекте и, как описано более подробно ниже, в настоящем изобретении предлагаются наборы для определения, контроля или диагностики гиперпролиферативного расстройства, идентифицирующие субъекта, имеющего такое расстройство, для возможного лечения или мониторинга развития (или регрессии) расстройства у пациента, где набор содержит модулятор, как описано здесь, и реагенты для определения влияния модулятора на образец.
б. Скрининг
Модуляторы EFNA и клетки, культуры, популяции и композиции, содержащие их, в том числе их потомки, также можно использовать для скрининга или идентификации соединений или агентов (например, лекарственных средств), которые влияют на функцию или активность опухоль-инициирующих клеток или их потомство посредством взаимодействия с лигандом эфрином А (например, его полипептидные или генетические компоненты). Следовательно, в изобретении дополнительно предлагаются системы и способы оценки или идентификации компонента или агента, который может влиять на функцию или активность опухоль-инициирующих клеток или их потомства посредством соединения с EFNA или с его субстратами. Такие соединения и агенты могут быть кандидатами в лекарственные средства, которые отбирают, например, для лечения гиперпролиферативных расстройств. В одном воплощении система или способ включает опухоль-инициирующие клетки, имеющие EFNA, и соединение или агент (например, лекарственное средство), где клетки и соединение или агент (например, лекарственное средство) находятся в контакте друг с другом.
В изобретении, кроме того, предлагаются способы скрининга и идентификации модуляторов EFNA или агентов и соединений для изменения активности или функции опухоль-инициирующих клеток или потомства клеток. В одном воплощении способ включает контактирование опухоль-инициирующих клеток или их потомства с тестируемым агентом или соединением; и определение, модулирует ли этот тестируемый агент или соединение активность или функцию ассоциированных с лигандом эфрином А опухоль-инициирующих клеток.
Тестируемый агент или соединение, модулирующие EFNA-зависимую активность или функцию таких опухоль-инициирующих клеток или их потомства внутри популяции, идентифицирует тестируемый агент или соединение в качестве активного агента. Примеры активности или функции, которые могут быть модулированы, включают изменения морфологии клеток, экспрессии маркера, дифференцировки или дедифференцировки, созревания, пролиферации, жизнеспособности, апоптоза или клеточной гибели клеток-предшественников нейронов или их потомства.
Контактирование, при использовании в отношении клеток или клеточной культуры или стадии способа или лечения, означает непосредственное или опосредованное взаимодействие между композицией (например, ассоциированной с лигандом эфрином А клеткой или клеточной культурой) и другим указанным объектом. Конкретным примером непосредственного взаимодействия является физическое взаимодействие. Конкретным примером опосредованного взаимодействия является воздействие композиции на промежуточную молекулу, которая в свою очередь воздействует на указанный объект (например, клетку или культуру клеток).
В этом аспекте изобретения "модулирует" указывает на влияние на активность или функцию опухоль-инициирующих клеток или потомства клеток способом, совместимым с определением воздействий на клеточную активность или функцию, который, как было определено, является релевантным к конкретному аспекту (например, метастазированию или пролиферации) опухоль-инициирующих клеток или потомства клеток по изобретению. Примеры активностей и функций включают, но не ограничиваются ими, морфологические измерения, маркеры развития, дифференцировку, пролиферацию, жизнеспособность, клеточное дыхание, митохондриальную активность, целостность мембраны или экспрессию маркеров, ассоциированных с определенными условиями. Соответственно, соединение или агент (например, кандидат в лекарственные средства) можно оценить по его воздействию на опухоль-инициирующие клетки или потомство клеток, посредством приведения в контакт таких клеток или потомства клеток с соединением или агентом и измерения любой модуляции активности или функции опухоль-инициирующих клеток или потомства клеток, как описано здесь или известно специалисту.
Способы скрининга и идентификации агентов и компонентов включают способы, пригодные для высокопроизводительного скрининга, который включает массивы клеток (например, микроматрицы), расположенные или помещенные, возможно, в заранее определенных положениях или местах. Высокопроизводительными роботизированными или ручными способами обработки можно исследовать химические взаимодействия и определить уровни экспрессии множества генов в течение короткого периода времени. Разработаны способы, использующие молекулярные сигналы (например, флуорофоры) и автоматизированные анализы, которые обрабатывают информацию в очень быстром темпе (см., например, Pinhasov et al., Comb. Chem. High Throughput Screen. 7:133 (2004)). Например, технология микроматрицы была широко использована для исследования взаимодействия тысяч генов одновременно, обеспечивая при этом информацию для конкретных генов (см., например, Mocellin and Rossi, Adv. Exp. Med. Biol. 593:19(2007)).
Такими методами скрининга (например, высокопроизводительными) можно быстро и эффективно идентифицировать активные агенты и соединения. Например, клетки могут быть расположены или размещены (предварительно посеяны) в культуральной чашке, пробирке, колбе, роллер-флаконе или планшете (например, в одном многолуночном планшете или чашке, таких как 8-, 16-, 32-, 64-, 96-, 384- и 1536-мультилуночный планшет или чашка), возможно в определенных положениях для идентификации потенциально терапевтических молекул. Библиотеки, которые можно скринировать, включают, например, библиотеки небольших молекул, библиотеки фагового дисплея, дрожжевые дисплейные библиотеки полностью человеческого антитела (Adimab, LLC), библиотеки миРНК и аденовирусных векторов для трансфекции.
XIII. Фармацевтические препараты и терапевтические применения
а. Композиции и способы введения
В зависимости от формы модулятора наряду с любым дополнительным конъюгатом, способа предполагаемой доставки, лечения или контролирования заболевания, и многих других параметров, можно разработать, при желании, композиции по настоящему изобретению в соответствии с признанными в данной области методами. То есть в различных воплощениях настоящего изобретения разработаны композиции, содержащие модуляторы EFNA, с широким множеством фармацевтически приемлемых носителей (см., например, Gennaro, Remington: The Science and Practice of Pharmacy with Facts and Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Различные фармацевтически приемлемые носители, которые включают наполнители, адъюванты и разбавители, легкодоступны их многочисленных коммерческих источников. Кроме того, также доступен ряд фармацевтически приемлемых вспомогательных веществ, таких как рН-регулирующие агенты и буферные агенты, регулирующие тоничность агенты, стабилизаторы, смачивающие агенты и тому подобные. Некоторые неограничивающие примеры носителей включают физиологический раствор, буферный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации.
В частности, следует понимать, что в некоторых воплощениях терапевтические композиции по изобретению можно вводить в чистом виде или с минимальным количеством дополнительных компонентов. Напротив, модуляторы EFNA по настоящему изобретению, возможно, могут быть приготовлены в виде препарата так, чтобы содержать подходящие фармацевтически приемлемые носители, включающие эксципиенты и вспомогательные вещества, которые хорошо известны в данной области техники и являются относительно инертными веществами, которые облегчают введение модулятора или которые помогают в переработке активных соединений в препараты, фармацевтически оптимизированные для доставки в место действия. Например, эксципиент может придавать форму или консистенцию или действовать в качестве разбавителя для улучшения фармакокинетики модулятора. Подходящие эксципиенты включают, но не ограничиваются ими, стабилизаторы, смачивающие агенты и эмульгаторы, соли для изменения осмолярности, инкапсулирующие агенты, буферы и усилители проникновения через кожу.
Раскрытые модуляторов для системного введения могут быть приготовлены в виде препаратов для энтерального, парентерального или местного введения. Действительно, все три типа композиции могут быть использованы одновременно для достижения системного введения активного ингредиента. Эксципиенты, а также композиции для парентерального и непарентерального введения лекарственного средства, представлены в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000). Подходящие композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме, например водорастворимые соли. Кроме того, можно вводить суспензии активных соединений в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, например кунжутное масло, или синтетические эфиры жирных кислот, например этилолеат или триглицериды. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, и включают, например, натрий-карбоксиметилцеллюлозу, сорбит и/или декстран. Возможно, суспензия также может содержать стабилизаторы. Также можно использовать липосомы для инкапсуляции агента для доставки в клетку.
Подходящие препараты для энтерального введения, включают твердые или мягкие желатиновые капсулы, пилюли, таблетки, включая таблетки с покрытием, эликсиры, суспензии, сиропы или ингаляции и их контролируемые высвобождаемые формы.
В целом, соединения и композиции по изобретению, содержащие модуляторы EFNA можно вводить in vivo нуждающемуся в этом субъекту посредством различных способов, включая, но не ограничиваясь ими, пероральное, внутривенное, внутриартериальное, подкожное, парентеральное, интраназальное, внутримышечное, внутрисердечное, внутрижелудочковое, внутритрахеальное, буккальное, ректальное, внутрибрюшинное, внутрикожное, местное, чрескожное и интратекальное, или путем имплантации или ингаляции. Интересующие композиции могут быть изготовлены в виде препаратов в твердой, полутвердой, жидкой или газообразной форме, включая, но не ограничиваясь ими, таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, клизмы, инъекции, ингаляции и аэрозоли. Подходящая композиция и путь введения могут быть выбраны в соответствии с предполагаемым применением и терапевтической схемой.
б. Дозы
Аналогично, конкретная схема приема лекарственного средства, т.е. доза, время и повторения, зависит от конкретного субъекта и его анамнеза. Эмпирические соображения, такие как фармакокинетика (например, время полужизни, скорость выведения и т.д.), будут вносить свой вклад в определение дозы. Частота введения может быть определена и скорректирована в течение курса терапии и основана на сокращении количества гиперпролиферативных или опухолевых клеток, в том числе опухоль-инициирующих клеток, поддерживая уменьшение таких опухолевых клеток, уменьшая пролиферацию опухолевых клеток или замедляя развитие метастазов. Кроме того, могут быть целесообразными интересующие терапевтические композиции с замедленным непрерывным высвобождением. Как упоминалось выше, различные композиции и устройства для достижения устойчивого высвобождения известны в данной области.
С терапевтической точки зрения фармацевтические композиции вводят в количестве, эффективном для лечения или профилактики конкретного показания. Терапевтически эффективное количество, как правило, зависит от массы субъекта, подвергаемого лечению, его или ее физического состояния или состояния здоровья, распространения состояния, подвергаемого лечению, или возраста субъекта, подвергаемого лечению. В целом модуляторы EFNA по изобретению могут быть введены в количестве в диапазоне от примерно 10 мкг/кг массы тела до примерно 100 мг/кг массы тела на дозу. В некоторых воплощениях модуляторы EFNA по изобретению могут быть введены в количестве в диапазоне от примерно 50 мкг/кг массы тела до примерно 5 мг/кг массы тела на дозу. В некоторых других воплощениях модуляторы EFNA по изобретению могут быть введены в количестве в диапазоне от примерно 100 мкг/кг массы тела до примерно 10 мг/кг массы тела на дозу. Возможно, модуляторы EFNA по изобретению могут быть введены в количестве в диапазоне от примерно 100 мкг/кг массы тела до примерно 20 мг/кг массы тела на дозу. Кроме того, возможно модуляторы EFNA по изобретению могут быть введены в количестве в диапазоне от примерно 0,5 мг/кг массы тела до примерно 20 мг/кг массы тела на дозу. В некоторых воплощениях вводимые соединения по настоящему изобретению представлены в дозе по меньшей мере примерно 100 мкг/кг массы тела, по меньшей мере примерно 250 мкг/кг массы тела, по меньшей мере примерно 750 мкг/кг массы тела, по меньшей мере примерно 3 мг/кг массы тела, по меньшей мере примерно 5 мг/кг массы тела, по меньшей мере примерно 10 мг/кг массы тела.
Другие режимы дозирования могут быть спрогнозированы на основании расчетов площади поверхности тела (BSA), как раскрыто в патенте США 7744877, который включен в данную заявку посредством ссылки во всей полноте. Как хорошо известно в данной области, BSA рассчитывают, используя рост и массу пациента, и предоставляют измерение размера субъекта, представленное площадью поверхности его или ее тела. В выбранных воплощениях изобретения с использованием BSA, модуляторы можно вводить в дозах от 10 мг/м2 до 800 мг/м2. В других предпочтительных воплощениях модуляторы вводят в дозах от 50 мг/м2 до 500 мг/м2 и еще более предпочтительно в дозе 100 мг/м2, 150 мг/м2, 200 мг/м2, 250 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2 или 450 мг/м2. Конечно, следует понимать, что, независимо от того как рассчитаны дозы, многократные дозы можно вводить в течение выбранного периода времени, чтобы обеспечить абсолютную дозу, которая значительно выше отдельных введений.
В любом случае модуляторы EFNA предпочтительно вводят, как это требуется субъекту, нуждающемуся в этом. Определение частоты введения может быть выполнено специалистом в данной области, таким как лечащий врач, на основании рассмотрения состояния, подвергаемого лечению, возраста субъекта, подвергаемого лечению, тяжести состояния, подвергаемого лечению, общего состояния здоровья субъекта, подвергаемого лечению и тому подобное. Как правило, эффективную дозу модулятора EFNA вводят субъекту за один или более раз. В частности, эффективную дозу модулятора вводят субъекту один раз в месяц, более чем один раз в месяц или реже чем один раз в месяц. В некоторых воплощениях эффективную дозу модулятора EFNA можно вводить несколько раз, в том числе в течение по меньшей мере месяца, по меньшей мере шести месяцев или по меньшей мере одного года.
Дозы и схемы приема лекарственных средств также можно определить эмпирически для раскрытых терапевтических композиций у субъектов, которые получали одно или более введение(й). Например, субъекты могут получать постепенно увеличивающиеся дозы терапевтической композиции, полученной, как описано здесь. Для оценки эффективности выбранной композиции можно следить за маркером конкретного заболевания, расстройства или состояния, как описано выше. В воплощениях, где субъект болен раком, это включает непосредственные измерения размера опухоли посредством пальпации или визуального наблюдения, косвенное измерение размера опухоли при помощи рентгеновских или других методов визуализации; улучшение при оценке посредством непосредственной биопсии опухоли и микроскопическое исследование образца опухоли; измерение косвенного опухолевого маркера (например, PSA для рака простаты) или антигена, определенного в соответствии с описанными здесь способами, уменьшение боли или паралича; улучшение речи, зрения, дыхания или других форм инвалидности, связанных с опухолью; повышенный аппетит; или повышение качества жизни, измеренное согласно признанным тестам, или удлинение сроков выживания. Специалисту в данной области техники очевидно, что доза будет варьироваться в зависимости от субъекта, типа опухолевого состояния, стадии опухолевого состояния, начало ли опухолевое состояние метастазировать в другие области субъекта и применяемого в прошлом и настоящем лечения.
в. Комбинированная терапия
Комбинированная терапия, предусмотренная изобретением, может быть особенно полезна в уменьшении или ингибировании нежелательной пролиферации опухолевых клеток (например, эндотелиальных клеток), уменьшении частоты возникновения рака, уменьшении или предупреждении рецидива рака, или уменьшении или предупреждении распространения или метастазирования рака. В таких случаях соединения по настоящему изобретению могут функционировать как сенсибилизирующие или хемосенсибилизирующие агенты путем ликвидации поддержки ТРС и сохранения опухолевой массы (например, NTG-клеток) и позволяют более эффективно использовать современного стандартного лечения с помощью циторедуктивных или противораковых агентов. То есть комбинированную терапию, включающую модулятор EFNA и один или более противораковых агентов, можно использовать для ослабления установленного рака, например для уменьшения количества присутствующих раковых клеток и/или уменьшения тяжести опухоли, или облегчения одного из проявлений или побочных эффектов рака. Таким образом, комбинированная терапия относится к введению модулятора EFNA и одного или более противораковых агентов, которые включают, не ограничиваясь ими, цитотоксические агенты, цитостатические агенты, химиотерапевтические агенты, противораковые агенты направленной доставки, модификаторы биологического ответа, иммунотерапевтические агенты, противораковые вакцины, антиангиогенные агенты, цитокины, гормональные терапевтические средства, лучевую терапию и антиметастатические агенты.
Согласно способам по настоящему изобретению, не требуется, чтобы комбинированные результаты являлись аддитивными в отношении эффектов, наблюдаемых, когда каждое лечение (например, анти-EFNA антитело и противораковый агент) проводят отдельно. Хотя по меньшей мере аддитивные эффекты являются, как правило, желательными, любое увеличение противоопухолевого эффекта выше эффекта единичной терапии, является полезным. Кроме того, в изобретении не требуется, чтобы комбинированное лечение демонстрировало синергический эффект. Тем не менее, специалистам в данной области техники должно быть понятно, что в некоторых выбранных комбинациях, которые включают предпочтительные воплощения, может наблюдаться синергизм.
Для осуществления на практике комбинированной терапии согласно изобретению, модулятор EFNA (например, анти-EFNA антитело) в комбинации с одним или более противораковыми агентами может быть введен субъекту, нуждающемуся в этом, способом, эффективным в получении в результате этого противораковой активности у субъекта. Модулятор EFNA и противораковый агент представлены в количествах, эффективных, и в течение периода времени, эффективного для их комбинированного присутствию и их комбинированных действий в окружении опухоли, как это целесообразно. Для достижения этой цели модулятор EFNA и противораковый агент могут быть введены субъекту одновременно, либо в виде одной композиции, либо в виде двух или более отдельных композиций с использованием одного и того же или разных путей введения.
С другой стороны, модулятор может предшествовать или следовать за лечением с помощью противоракового агента, например через интервалы, варьирующиеся от минут до недель. В некоторых воплощениях, где противораковый агент и антитело применяют к субъекту по отдельности, период времени между каждым введением является таким, чтобы противораковый агент и модулятор могли оказывать комбинированное воздействие на опухоль. В конкретном воплощении предполагается, что противораковый агент и модулятор EFNA вводят с интервалом от примерно 5 минут до примерно двух недель друг от друга.
В других воплощениях могут пройти несколько суток (2, 3, 4, 5, 6 или 7), несколько недель (1, 2, 3, 4, 5, 6, 7 или 8) или несколько месяцев (1, 2, 3, 4, 5, 6, 7 или 8) между введением модулятора и противоракового агента. Модулятор EFNA и один или более противораковых агентов (комбинированная терапия) можно вводить один раз, два раза или по меньшей мере в течение периода времени, пока состояние лечат, облегчают или вылечивают. Предпочтительно комбинированную терапию вводят несколько раз. Комбинированную терапию можно вводить от трех раз в сутки до одного раза в каждые шесть месяцев. Введение можно осуществлять по расписанию, например три раза в сутки, два раза в сутки, раз в сутки, один раз каждые двое суток, один раз каждые трое суток, один раз в неделю, один раз каждые две недели, один раз каждый месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые шесть месяцев или можно вводить непрерывно с помощью мини-насоса. Как было указано ранее, комбинированную терапию можно вводить пероральным, мукозальным, буккальным, интраназальным, ингаляционным, внутривенным, подкожным, внутримышечным, парентеральным, внутриопухолевым путем или местно. Комбинированная терапия может быть введена в участок, удаленный от места опухоли. Комбинированную терапию, как правило, вводят до тех пор, пока опухоль присутствует, при условии, что комбинированная терапия вызывает остановку роста опухоли или рака или уменьшение ее массы или объема.
В одном воплощении модулятор EFNA вводят в комбинации с одним или более противораковыми агентами в течение короткого цикла лечения субъекту, нуждающемуся в этом. Продолжительность лечения антителом может варьироваться в соответствии с конкретным используемым противораковым агентом. Изобретение также предусматривает прерывистое введение или суточные дозы, разделенные на несколько частичных введений. Подходящее время лечения для конкретного противоракового средства очевидно специалисту в данной области и изобретение предусматривает непрерывную оценку оптимальных схем лечения для каждого противоракового средства.
Настоящее изобретение предполагает по меньшей мере один цикл, предпочтительно более одного цикла, в течение которого применяется комбинированная терапия. Подходящий период времени для одного цикла очевиден специалисту, также как общее количество циклов и интервал между циклами. Изобретение предполагает непрерывную оценку оптимальных схем лечения для каждого модулятора и противоракового агента. Кроме того, в изобретении также предлагается более одного введения либо анти-EFNA антитела, либо противоракового агента. Модулятор и противораковый агент можно вводить взаимозаменяемо, через сутки или через неделю; либо может быть выполнена последовательность лечения антителом, а затем одна или более лечебных процедур терапии противораковым агентом. В любом случае, как понятно специалистам в данной области техники, подходящие дозы химиотерапевтических агентов, как правило, находятся вблизи уже используемых в клинической терапии доз, где химиотерапевтические агенты вводят отдельно или в комбинации с другими химиотерапевтическими агентами.
В другом предпочтительном воплощении модуляторы EFNA по настоящему изобретению можно использовать в поддерживающей терапии для снижения или устранения возможности рецидива опухоли после первого появления заболевания. Предпочтительно расстройство будет лечиться и исходная масса опухоли будет удалена, уменьшена или иным образом улучшена, так что у пациента исчезают симптомы или пациент находится в стадии ремиссии. В этот время субъекту можно вводить фармацевтически эффективные количества раскрытых модуляторов один или более раз, даже несмотря на то, что имеются незначительные указания или вообще нет указаний при использовании стандартных диагностических процедур. В некоторых воплощениях эффекторы могут быть введены на регулярной основе в течение некоторого периода времени. Например, модуляторы EFNA можно вводить еженедельно, каждые две недели, ежемесячно, каждые шесть недель, каждые два месяца, каждые три месяца, каждые шесть месяцев или ежегодно. С учетом изложенного в данной заявке, специалист в данной области может легко определить благоприятные дозы и схемы приема лекарственных средств для снижения возможности рецидива заболевания. Кроме того, такое лечение может продолжаться в течение недель, месяцев, лет или даже в течение неопределенного срока в зависимости от реакции пациента и клинических и диагностических параметров.
В еще одном предпочтительном воплощении эффекторы по настоящему изобретению можно использовать профилактически для предупреждения или уменьшения возможности метастазирования опухоли после циторедуктивной процедуры. При использовании в настоящем описании изобретения, циторедуктивная процедура определена в широком смысле и означает любую процедуру, метод или способ, который ликвидирует, уменьшает, лечит или улучшает состояние опухоли или пролиферацию опухоли. Примеры циторедуктивных процедур включают, без ограничения ими, хирургию, лучевую терапию (то есть направленное излучение), химиотерапию или абляцию. В подходящее время, легко определяемое специалистом в данной области с учетом данного описания, модуляторы EFNA можно вводить, как предложено, с помощью клинических и диагностических или терагностических процедур для снижения метастазирования опухоли. Модуляторы можно вводить один или более раз в фармацевтически эффективных дозах, как определено с использованием стандартных методов. Предпочтительно, режим дозирования сопровождается подходящими методами диагностики или мониторинга, которые позволяют его модифицировать по мере необходимости.
г. Противораковые агенты
Используемый здесь термин "противораковый агент" означает любой агент, который можно использовать для лечения клеточного пролиферативного расстройства, такого как рак, в том числе цитотоксические агенты, цитостатические агенты, антиангиогенные агенты, циторедуктивные агенты, химиотерапевтические агенты, радиотерапию и радиотерапевтические агенты, противораковые агенты направленной доставки, модификаторы биологического ответа, антитела и иммунотерапевтические средства. Следует понимать, что в выбранных воплощениях, как обсуждалось выше, противораковые агенты могут включать конъюгаты и могут находиться в ассоциации с модуляторами перед введением.
Термин "цитотоксический агент" означает вещество, которое уменьшает или ингибирует функцию клеток и/или вызывает разрушение клеток, то есть это вещество является токсичным для клеток. Как правило, это вещество является природной молекулой, полученной из живого организма. Примеры цитотоксических агентов включают, но не ограничены ими, низкомолекулярные токсины или ферментативно-активные токсины бактерий (например, дифтерийный токсин, эндотоксин и экзотоксин Pseudomonas, стафилококковый энтеротоксин А), грибов (например, α-сакрин, рестриктоцин), растений (например, абрин, рицин, модецин, вискумин, противовирусный белок фитолакки, сапорин, гелонин, моморидин, трихосантин, токсин ячменя, белки Aleurites fordii, диантиновые белки, белки Phytolacca mericana (PAPI, РАР11 и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор мыльнянки лекарственной, гелонин, митегеллин, рестриктоцин, феномицин, неомицин и трикотецены) или животных, например цитотоксические РНКазы, такие как внеклеточные РНКазы поджелудочной железы; ДНКаза I, в том числе ее фрагменты и/или варианты.
Химиотерапевтический агент означает химическое соединение, которое неспецифически уменьшает или ингибирует рост, пролиферацию и/или выживаемость раковых клеток (например, цитотоксические или цитостатические агенты). Такие химические агенты часто направлены на внутриклеточные процессы, необходимые для роста клеток или их деления, и, таким образом, особенно эффективны против раковых клеток, которые обычно быстро растут и делятся. Например, винкристин деполимеризует микротрубочки и, таким образом, предотвращает вступление клеток в митоз. В целом, химиотерапевтические агенты могут включать любой химический агент, который ингибирует или предназначен для ингибирования раковой клетки или клетки, которая может стать раковой или создать онкогенное потомство (например, TIC). Такие агенты часто вводят, и они часто являются наиболее эффективными в комбинации, например в композиции CHOP.
Примеры противораковых агентов, которые можно использовать в комбинации с (или конъюгированными с) модуляторами по настоящему изобретению включают, но не ограничиваются ими, алкилирующие агенты, алкилсульфонаты, азиридины, этиленимины и метиламеламины, ацетогенины, камптотецин, бриостатин, каллистатин, СС-1065, криптофицины, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктиин, спонгистатин, азотистые иприты, антибиотики, энедииновые антибиотики, динемицин, бисфосфонаты, эсперамицин, хромопротеиновые энедииновые антибиотические хромофоры, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, антиметаболиты, аналоги фолиевой кислоты, аналоги пурина, андрогены, антиадреналиновые средства, пополнитель фолиевой кислоты, такой как фолиновая кислота, ацеглатон, альдофосфамида гликозид, аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен, эдатраксат; дефофамин, демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон, этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидайнин; майтанзиноиды, митогуазон, митоксантрон, мопиданмол; нитраэрин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофилиновая кислота; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2′,2″-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); циклофосфамид; тиотепа; таксоиды, хлоранбуцил, GEMZAR® гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (Camptosar, CPT-11), ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды; капецитабин; комбретастатин; лейковорин (LV); оксалиплатин; ингибиторы PKC-альфа, Raf, H-Ras, EGFR и VEGF-A, которые уменьшают клеточную пролиферацию, и фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых агентов. Кроме того, в это определение включены антигормональные агенты, которые регулируют или ингибируют действие гормона на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогена (SERM), ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующий выработку эстрогена в надпочечниках, и антиандрогены; а также троксацитабин (1,3-диоксолановый аналог нуклеозина цитозина); антисмысловые олигонуклеотиды; рибозимы, такие как ингибитор экспрессии VEGF и ингибитор экспрессии HER2; вакцины, PROLEUKIN® rlL-2; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; винорелбин и эсперамицины и фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых агентов. Другие воплощения включают применение антител, одобренных для лечения рака, включающих, без ограничения ими, ритуксимаб, трастузумаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, тозитумомаб, бевацизумаб, цетуксимаб, панитумумаб, офатумумаб, ипилимумаб и брентуксимаб ведотин. Специалисты в данной области способны легко идентифицировать дополнительные противораковые агенты, которые совместимы с данным руководством
д. Радиотерапия
В настоящем изобретении также предлагается комбинация модуляторов EFNA с радиотерапией (то есть любым механизмом, индуцирующим повреждение ДНК в опухолевых клетках, таким как гамма-облучение, рентгеновское облучение, УФ-облучение, микроволновое облучение, электронное облучение и подобные). Также рассматривается комбинированная терапия с использованием непосредственной доставки радиоизотопов в опухолевые клетки, которая может быть использована в сочетании с противораковым агентом направленной доставки или другими нацеливающими средствами. Как правило, лучевую терапию применяют в виде импульсов в течение периода времени от примерно 1 до примерно 2 недель. Лучевую терапию можно применять к субъектам, имеющим рак головы и шеи в течение от примерно 6 до 7 недель. Лучевую терапию, возможно, можно применять в виде однократной дозы или в виде многократных последовательных доз.
е. Опухолевые состояния
При введении отдельно или в комбинации с противораковым агентом или радиотерапией, модуляторы EFNA по настоящему изобретению особенно полезны для лечения у пациентов или субъектов опухолевых состояний, которые могут включать доброкачественные или злокачественные опухоли (например, опухоли почек, печени, почек, мочевого пузыря, молочной железы, желудка, яичников, толстой кишки, предстательной железы, поджелудочной железы, легкого, щитовидной железы, печеночные карциномы; саркомы, глиобластомы; и различные опухоли головы и шеи); лейкозы и лимфолейкозы; другие расстройства, такие как нейрональные, глиальные, астроцитарные, гипоталамические и другие железистые, макрофагальные, эпителиальные, стромальные и бластоцельные расстройства; и воспалительные, ангиогенные, иммунологические расстройства и расстройства, вызванные патогенами. Особенно предпочтительными мишенями для лечения терапевтическими композициями и способами по настоящему изобретению являются опухолевые состояния, включающие солидные опухоли. В других предпочтительных воплощениях модуляторы по настоящему изобретению можно использовать для диагностики, предупреждения или лечения гематологических злокачественных образований. Предпочтительно субъектом или пациентом, подвергаемым лечению, является человек, хотя используемые здесь термины определенно включают любые виды млекопитающих.
В частности, опухолевые состояния, являющиеся объектом лечения согласно настоящему изобретению, могут быть выбраны из группы, включающей, без ограничения ими, опухоли надпочечников, СПИД-ассоциированный рак, альвеолярную саркому мягких тканей, астроцитомы, рак мочевого пузыря (плоскоклеточная карцинома и переходноклеточная карцинома), рак кости (адамантинома, аневризматическая костная киста, остеохондрома, остеосаркома), рак головного и спинного мозга, метастатические опухоли головного мозга, рак молочной железы, опухоль каротидного тельца, рак шейки матки, хондросаркому, хордому, хромофобную почечно-клеточную карциному, светлоклеточную карциному, рак толстой кишки, колоректальный рак, кожную доброкачественную фиброзную гистиоцитому, десмопластические мелкокруглоклеточные опухоли, эпендимомы, опухоли Юинга, внескелетную миксоидную хондросаркому, несовершенный костный фиброгенез, фиброзная дисплазия кости, рак желчного пузыря и желчных протоков, гестационная трофобластическая болезнь, опухоли половых клеток, рак головы и шеи, опухоль островков поджелудочной железы, саркома Капоши, рак почек (нефробластома, папиллярный рак почки), лейкозы, липома/доброкачественные липоматозные опухоли, липосаркома/злокачественные липоматозные опухоли, рак печени (гепатобластома, гепатоцеллюлярная карцинома), лимфомы, рак легких (мелкоклеточный рак, аденокарцинома, плоскоклеточная карцинома, крупноклеточная карцинома и т.д.), медуллобластома, меланома, менингиомы, множественная эндокринная неоплазия, множественная миелома, миелодиспластический синдром, нейробластома, нейроэндокринные опухоли, рак яичников, раковые заболевания поджелудочной железы, папиллярный рак щитовидной железы, опухоли паращитовидных желез, педиатрический рак, опухоли оболочек периферических нервов, феохромоцитому, опухоли гипофиза, рак простаты, задняя увеальная меланома, редкие гематологические расстройства, почечный метастатический рак, рабдоидная опухоль, рабдомиобластома, саркомы, рак кожи, саркомы мягких тканей, плоскоклеточный рак, рак желудка, синовиальная саркома, рак яичек, карциному тимуса, тимому, метастатический рак щитовидной железы и рак матки (рак шейки матки, рак эндометрия и лейомиома). В некоторых предпочтительных воплощениях раковые клетки выбраны из группы солидных опухолей, включая, но не ограничиваясь ими, рак молочной железы, немелкоклеточный рак легких (NSCLC), мелкоклеточный рак легких, рак поджелудочной железы, рак толстой кишки, рак простаты, саркомы, почечный метастатический рак, метастатический рак щитовидной железы и светлоклеточная карцинома.
Что касается гематологических злокачественных опухолей, следует понимать, что соединения и способы по настоящему изобретению могут быть особенно эффективны в лечении разных В-клеточных лимфом, в том числе низкодифференцированной/NHL (не-ходжкинская лимфома) фолликулярной клеточной лимфомы (FCC), лимфомы из клеток мантийной зоны (MCL), диффузной крупноклеточной лимфомы (DLCL), мелкоклеточной лимфоцитарной лимфомы (SL) NHL, среднедифференцированной/фолликулярной NHL, среднедифференцированной диффузной NHL, высокодифференцированной иммунобластной NHL, высокодифференцированной лимфобластной NHL, высокодифференцированной мелкоклеточной лимфомы с нерассеченными ядрами NHL, массивной лимфаденопатии NHL, макроглобулинемии Вальденстрема, лимфоплазмацитоидной лимфомы (LPL), лимфомы из клеток мантии (MCL), фолликулярной лимфомы (FL), диффузной крупноклеточной лимфомы (DLCL), лимфомы Беркитта (BL), СПИД-ассоциированных лимфом, моноцитной В-клеточной лимфомы, ангиоиммунобластной лимфоаденопатии, мелкоклеточной лимфоцитарной лимфомы, фолликулярной, диффузной крупноклеточной, диффузной мелкоклеточной с расщепленным ядром, крупноклеточной иммунобластной лимфобластомы, мелкоклеточной лимфомы с нерассеченными ядрами, Беркитта и не-Беркитта, фолликулярной, преимущественно крупноклеточной; фолликулярной, преимущественно мелкоклеточной с расщепленным ядром; и фолликулярной, смесь мелкоклеточных с расщепленным ядром и крупноклеточных лимфом. См., Gaidono et al., "Lymphomas", IN CANCER: PRINCIPLES & PRACTICE OF ONCOLOGY, Vol.2: 2131-2145 (DeVita et al., eds., 5.sup.th ed. 1997). Специалистам в данной области должно быть понятно, что эти лимфомы часто имеют разные названия в связи с изменением систем классификации, и что пациенты, имеющие лимфомы, классифицируемые под разными названиями, также будут получать пользу из комбинированных схем лечения по настоящему изобретению.
В других предпочтительных воплощениях модуляторы EFNA можно эффективно использовать для лечения определенных миелоидных и гематологических злокачественных опухолей, в том числе лейкозов, таких как хронический лимфоцитарный лейкоз (CLL or B-CLL). CLL преимущественно является заболеванием пожилых людей, распространенность которого начинает увеличиваться с пятидесяти лет и достигает пика к концу шестидесятых годов. Как правило, он включает в себя пролиферацию опухолевых лимфоцитов периферической крови. Клинические проявления CLL включают лимфоцитоз, лимфаденопатию, спленомегалию, анемию и тромбоцитопению. Характерной особенностью CLL является пролиферация моноклональных В-клеток и накопление В-лимфоцитов, задержанных в промежуточном состоянии дифференцировки, где такие В-клетки экспрессируют поверхностный IgM (sIgM) или и sIgM и sIgD и одну легкую цепь с плотностями ниже, чем у нормальных В-клеток. Однако, как обсуждалось выше и показано в прилагаемых Примерах, экспрессия выбранного EFNA (например, EFNA) активируется на B-CLL клетках, тем самым обеспечивая привлекательную мишень для раскрытых модуляторов.
Настоящее изобретение также относится к предупреждению или профилактическому лечению субъектов, у которых имеются доброкачественные или предраковые опухоли. Не предполагается исключать из лечения с использованием настоящего изобретения какой-либо конкретный тип опухоли или опухолевого расстройства. Однако, тип опухолевых клеток может быть важным для применения изобретения в комбинации с вторичными терапевтическими агентами, в частности химиотерапевтическими агентами и противораковыми агентами с направленной доставкой.
Другие предпочтительные воплощения настоящего изобретения включают применение модуляторов EFNA для лечения субъектов, страдающих от солидных опухолей. У таких субъектов многие из этих солидных опухолей включают ткани, имеющие различные генетические мутации, которые могут сделать их особенно чувствительными к лечению раскрытыми эффекторами. Например, мутации KRAS, АРС и CTNNB1 и CDH1 являются относительно распространенными у пациентов с колоректальным раком. Кроме того, пациенты, страдающие от опухолей с этими мутациями, являются, как правило, наиболее трудно поддаются лечению с применением имеющейся в настоящее время терапии; особенно пациенты с мутациями KRAS. KRAS-активирующие мутации, которые обычно приводят к замене одной аминокислоты, также вовлечены в другие трудные для лечения злокачественные образования, включающие аденокарциномы легких, муцинозную аденому и протоковую карциному поджелудочной железы.
В настоящее время наиболее надежный прогноз будут ли пациенты с колоректальным раком реагировать на EGFR- или VEGF-ингибирующие лекарственные средства, например, заключается в тестировании на некоторые "активирующие" мутации KRAS. KRAS мутирован в 35-45% случаев колоректального рака, и пациенты, опухоли которых экспрессируют мутантный KRAS, не реагируют эффективно на эти лекарственные средства. Например, мутации KRAS позволяют прогнозировать отсутствие реакции на терапию панитумумабом и цетуксимабом в случае колоректального рака (Lievre et al. Cancer Res 66:3992-5; Karapetis et al. NEJM 359:1757-1765). Приблизительно 85% пациентов с колоректальным раком имеют мутации в гене АРС (Markowitz & Bertagnolli. NEJM 361:2449-60) и более чем 800 мутаций АРС были охарактеризованы у пациентов с семейным аденоматозным полипозом и колоректальным раком. Большинство этих мутаций приводит к усечению белка АРС с пониженной функциональной способностью опосредовать разрушение бета-катенина. Мутации гена бета-катенина CTNNB1 также могут привести к повышенной стабилизации белка, результатом чего является импорт в ядро и последующая активация нескольких онкогенных транскрипционных программ, что также представляет собой механизм онкогенеза в результате неспособности мутантного АРС нужным образом опосредовать разрушение бета-катенина, что требуется для контролирования программ нормальной клеточной пролиферации и дифференцировки.
Потеря экспрессии CDH1 (Е-кадгерина) является еще одним распространенным явлением при колоректальном раке, часто наблюдаемым на более поздних стадиях заболевания. Е-кадгерин является главным участником адгериновых соединений, которые соединяют и организуют клетки в эпителиальные слои. Обычно Е-кадгерин физически отделяет бета-катенин (CTNNB1) на плазматической мембране; потеря экспрессии Е-кадгерина при колоректальном раке приводит к локализации бета-катенина в ядре и транскрипционной активации пути бета-катенин/WNT. Аберрантная передача сигнала бета-катенин/WNT играет главную роль в онкогенезе и бета-катенин ядра вовлечен в стволовость рака (Schmalhofer et al., 2009 PMID 19153669). E-кадгерин необходим для экспрессии и функционирования EphA2, известного партнера по связыванию для лигандов EFNA в клетках эпителия (Dodge Zantek et al., 1999 PMID 10511313; Orsulic S and Kemler R, 2000 PMID 10769210). Используя модуляторы, которые связываются с EFNA-лигандами и выступают в роли агониста или антагониста связывания с рецептором Eph, можно модифицировать, прерывать или реверсировать проонкогенные процессы. Альтернативно, модуляторы EFNA предпочтительно могут связываться с опухолевыми клетками с аберрантным Eph/эфрин взаимодействиями, основанным на предпочтениях связывания модуляторов EFNA. Поэтому пациентам с раковыми заболеваниями, имеющим вышеупомянутые генетические признаки, может быть полезно лечение вышеупомянутыми модуляторами EFNA.
XIV. Изделия
Также предложены фармацевтические упаковки и наборы, содержащие один или более контейнеров, содержащих одну или более доз модулятора EFNA. В некоторых воплощениях предложена стандартная дозировка, содержащая предварительно определенное количество композиции, содержащей, например, анти-EFNA антитело, вместе с одним или более дополнительными агентами или без них. Для других воплощений такая стандартная дозировка поставляется в одноразовом предварительно заполненном шприце для инъекций. В других воплощениях композиция, содержащаяся в стандартной дозировке, может содержать физиологический раствор, сахарозу и тому подобное; буфер, например фосфатный, и тому подобное; и/или быть приготовлена в виде препарата в пределах стабильного и эффективного диапазона рН. Альтернативно, в некоторых воплощениях композиция может быть представлена в виде лиофилизированного порошка, которые может быть восстановлен при добавлении подходящей жидкости, например стерильной воды. В некоторых предпочтительных воплощениях композиция содержит одно или более веществ, которые ингибируют агрегацию белка, включая, но не ограничиваясь ими, сахарозу и аргинин. Любой этикетка на контейнере(ах) или приложенная к контейнеру(ам) указывает, что включенная композиция используется для диагностики или лечения предпочтительного болезненного состояния.
В настоящем изобретении также предлагаются наборы для получения однодозовых или многодозовых единиц введения модулятора EFNA и, возможно, одного или более противораковых агентов. Набор содержит контейнер и этикетку или вкладыш, расположенный на контейнере или приложенный к контейнеру. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая является эффективной для лечения состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). Такие наборы обычно содержат в подходящем контейнере фармацевтически приемлемую композицию модулятора EFNA и, возможно, один или более противораковых агентов в том же или в разных контейнерах Наборы могут также содержать другие фармацевтически приемлемые композиции для диагностики или комбинированной терапии. Например, в дополнение к модулятору EFNA по изобретению, такие наборы могут содержать один или более из множества противораковых агентов, таких как химиотерапевтические или радиотерапевтические лекарственные средства; антиангиогенные агенты; антиметастатические агенты; противораковые агенты направленной доставки; цитотоксические агенты; и/или другие противораковые агенты. Такие наборы также могут предоставлять подходящие реагенты для конъюгирования модулятора EFNA с противораковым агентом или диагностическим агентом (например, см. патент США 7422739, который включен в данную заявку посредством ссылки во всей полноте).
В частности, наборы могут иметь один контейнер, содержащий модулятор EFNA, с дополнительными компонентами или без них, или они могут иметь различные контейнеры для каждого нужного агента. В случае, если предлагаются комбинированные терапевтические средства для конъюгации, один раствор может быть предварительно смешан, либо в эквивалентной молярной комбинации, либо с избытком одного компонента по сравнению с другим. Альтернативно, модулятор EFNA и любой дополнительный противораковый агент набора может храниться отдельно, внутри отдельных контейнеров перед введением пациенту. Наборы могут также содержать второй/третий контейнер для хранения стерильного, фармацевтически приемлемого буфера или другого разбавителя, такого как бактериостатическая вода для инъекций (BWFI), фосфатного буферного физиологического раствора (PBS), раствор Рингера и раствор декстрозы.
Когда компоненты набора представлены в одном или более жидких растворах, где жидкий раствор предпочтительно представляет собой водный раствор, причем стерильный водный раствор является особенно предпочтительным. Однако компоненты набора могут быть представлены в виде сухого порошка(ов). Когда реагенты или компоненты представлены в виде сухого порошка, этот порошок может быть восстановлен путем добавления подходящего растворителя. Предполагается, что растворитель также может находиться в другом контейнере.
Как указано кратко выше, наборы также могут содержать средства, с помощью которых можно вводить антитело и любые дополнительные компоненты человеку или животному, например одну или более игл и шприцев, или даже глазную пипетку, пипетку или другой аналогичный аппарат, с помощью которого композицию можно инъецировать или вводить животному или наносить на больной участок тела. Наборы по настоящему изобретению, как правило, включают средства, вмещающие флаконы или тому подобное, и другие компоненты в строгой изоляции для коммерческой продажи, такие как, например, отлитые под давлением или полученные выдувным формованием пластиковые контейнеры, в которых можно размещать и хранить флаконы и другие устройства. Любая этикетка или вкладыш указывает, что композицию модулятора EFNA используют для лечения рака, например колоректального рака.
XV. Реагенты для исследования
В других предпочтительных воплощениях изобретения также используются свойства раскрытых модуляторов в качестве инструмента, полезного для идентификации, выделения, разделения или обогащения популяций или субпопуляций опухоль-инициирующих клеток посредством таких методов, как сортировка флюоресцентно-активированных клеток (FACS), сортировка магнитно-активированных клеток (MACS) или лазерный срез. Специалистам в данной области понятно, что модуляторы можно использовать в нескольких совместимых процедурах для характеристики и обработки TIC-клеток, в том числе раковых стволовых клеток (например, см. заявки США 12/686359, 12/669136 и 12/757649, каждая из которых включена в данную заявку посредством ссылки во всей полноте).
XVI. Разное
Если в описании изобретения не определено иное, научные и технические термины, используемые в связи с настоящим изобретением, имеют значения, которые обычно понятны специалистам в этой области техники. Кроме того, если иное не предусмотрено контекстом, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. В частности, при использовании в данном описании и прилагаемой формуле, формы единственного числа "a," "an" и "the" включают множественное число, если контекст четко не указывает иное. Таким образом, например, ссылка на "белок" включает в себя множество белков, ссылка на "клетку" включает смеси клеток и так далее. Кроме того, диапазоны, приведенные в данной заявке и прилагаемой формуле изобретения, включает как конечные точки, так и все точки между этими конечными точками. Таким образом, диапазон от 2,0 до 3,0 включает 2,0, 3,0, и все точки между 2,0 и 3,0.
Как правило, терминология, используемая в отношении и методов клеточных и тканевых культур, молекулярной биологии, иммунологии, микробиологии, генетики, химии белка и нуклеиновых кислот, а также гибридизации, описанных здесь, хорошо известна и широко применяется в данной области. Методы и способы по настоящему изобретению, как правило, осуществляют в соответствии с обычными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые указаны и обсуждаются в данном описании, если не указано иное. См., например, Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и способы очистки осуществляются в соответствии с инструкциями производителя, как обычно выполняют в данной области или как описано в данном описании изобретения. Терминология, используемая в связи с лабораторными процедурами и методами аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, описанными здесь, хорошо известна и широко используется в данной области.
Все ссылки или документы, раскрытые или указанные в данном описании, без ограничения, включены сюда посредством ссылки во всей своей полноте. Кроме того, любые заголовки разделов, используемые здесь, предназначены для организационных целей и не должны быть истолкованы как ограничивающие описываемый предмет.
Примеры
Настоящее изобретение, в общем виде описанное выше, будет легче понять посредством ссылки на следующие примеры, которые приведены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения. Данные примеры не следует рассматривать как указывающие на то, что приведенные ниже эксперименты представляют собой все или единственные выполненные эксперименты. Если не указано иное, части являются частями по массе, молекулярная масса представляет собой среднемассовую молекулярную массу, температура представлена в градусах по Цельсию, и давление равно или близко к атмосферному.
Пример 1
Обогащение популяций опухоль-инициирующих клеток
Для характеристики клеточной гетерогенности солидных опухолей, как они существуют в раковых образованиях пациентов, выяснения отличительных признаков клеток, поддерживающих опухоль (ТРС; то есть раковых стволовых клеток: CSC) с использованием конкретных фенотипических маркеров и идентификации клинически значимых терапевтических мишеней, был разработан и поддерживался с использованием общепризнанных методов большой банк нетрадиционных ксенотрансплантатных (NTX) опухолей. Банк NTX-опухолей, содержащий большое число дискретных линий опухолевых клеток, размножали в мышах с ослабленным иммунитетом посредством многочисленных пассажей гетерогенных опухолевых клеток, изначально полученных от многочисленных больных раком пациентов, страдающих разнообразными солидными злокачественными опухолями. Постоянная доступность большого числа отдельных опухолевых клеточных линий NTX с ранних пассажей, имеющих четко определенное происхождение линий, значительно облегчают идентификацию и выделение ТРС, так как они обеспечивают возможность воспроизводимой и неоднократной характеристики клеток, очищенных из клеточных линий. Более конкретно, выделенные или очищенные ТРС наиболее точно определяют ретроспективно, в соответствии с их способностью создавать фенотипически и морфологически гетерогенные опухоли у мышей, которые повторяют образец опухоли пациента, из которого получена клетка. Таким образом, способность использовать небольшие популяции выделенных клеток для создания полностью гетерогенных опухолей у мышей убедительно указывает на то, что выделенные клетки содержат ТРС. В этой работе применение минимально пассированных клеточных линий NTX значительно упрощает эксперименты in vivo и обеспечивает легко проверяемые результаты. Кроме того, опухоли NTX с ранних пассажей также отвечают на терапевтические агенты, такие как иринотекан (то есть Camptosar®), что обеспечивает клинически значимое понимание механизмов, лежащих в основе управления опухолевым ростом, устойчивости к имеющимся в настоящее время терапевтическим средствам и рецидива опухоли.
Когда были созданы опухолевые клеточные линии NTX, фенотипы составляющих опухолевых клеток анализировали, используя проточную цитометрию для определения дискретных маркеров, которые можно использовать для характеристики, выделения, очистки или обогащения опухоль-инициирующих клеток (TIC) и разделения или анализа клеток ТРС и TProg внутри таких популяций. В связи с этим авторы использовали запатентованную протеомную платформу (то есть PhenoPrint™ Array), которая обеспечивала быструю характеристику клеток на основании экспрессии белка и сопутствующую идентификацию потенциально полезных маркеров. PhenoPrint Array представляет собой запатентованную протеомную платформу, содержащую сотни отдельных связывающих молекул, многие из которых получены из коммерческих источников, нанесенных на 96-луночные планшеты, где каждая лунка содержит отдельное антитело в фикоэритриновом флуоресцентном канале и множество дополнительных антител в разных флуорохромах, упорядоченные в каждой лунке по всему планшету. Это позволяет определять уровни экспрессии интересующего антигена в субпопуляции выбранных опухолевых клеток за счет быстрого включения релевантных клеток или устранения нерелевантных клеток через не-фикоэритриновые каналы. При использовании PhenoPrint Array в комбинации с хорошо известными в данной области методами расщепления ткани, трансплантации и использования стволовых клеток (AI-Hajj et al., 2004, Dalerba et al., 2007 и Dylla et al., 2008, выше, каждая из которых включена в данную заявку посредством ссылки во всей полноте), можно эффективно идентифицировать релевантные маркеры и затем выделить и трансплантировать с высокой эффективностью конкретные субпопуляции опухолевых клеток человека.
Соответственно, при формировании различных NTX-опухолевых клеточных линий, как это обычно делается для человеческих опухолей в мышах с тяжелым иммунодефицитом, опухоли резецировали из мышей после достижения 800-2000 мм3, и клетки расщепляли в одноклеточные суспензии, используя общепризнанные методы ферментативного расщепления (см., например, патент США 2007/0292414, который включен в данную заявку). Данные, полученные от этих суспензий с использованием PhenoPrint Array, представляют как абсолютную (на клетку), так и относительную (по сравнению с другими клетками в популяции) экспрессию поверхностного белка на поклеточной основе, что приводит к более комплексной характеристике и разделению на группы клеточных популяций. В частности, применение PhenoPrint Array позволяет осуществить быструю идентификацию белков или маркеров, которые в перспективе позволять отличить TIC или ТРС от NTG массы опухолевых клеток и опухолевой стромы и, будучи выделены из NTX-опухолевых моделей, обеспечивают относительно быструю характеристику субпопуляций опухолевых клеток, экспрессирующих разные уровни специфических белков клеточной поверхности. В частности, белки с гетерогенной экспрессией во всей популяции опухолевых клеток обеспечивают возможность выделения и трансплантации отдельных и высокоочищенных субпопуляций опухолевых клеток, экспрессирующих и высокий и низкий уровень конкретного белка или маркера в мышах с ослабленным иммунитетом, тем самым облегчая оценку, одной или другой субпопуляцией обогащены ТРС.
Термин "обогащение" используется как синоним выделения клеток и означает, что выход (фракция) клеток одного типа увеличен относительно фракции других типов клеток по сравнению с исходной или начальной клеточной популяцией. Предпочтительно, обогащение относится к увеличению процента на примерно 10%, на примерно 20%, на примерно 30%, на примерно 40%, на примерно 50% или более 50% одного типа клеток в популяции по сравнению с исходной популяцией клеток.
При использовании здесь "маркер" в контексте клетки или ткани означает любую характеристику в форме химического или биологического объекта, который идентифицируемо ассоциирован с, или конкретно обнаружен в или на конкретной клетке, клеточной популяции или ткани, включая идентифицируемые в или на ткани или клеточной популяции, пораженной заболеванием или расстройством, как показано, маркеры могут быть морфологическими, функциональными или биохимическими по своей природе. В предпочтительных воплощениях маркер представляет собой антиген клеточной поверхности, который дифференциально или предпочтительно экспрессируется конкретными типами клеток (например, ТРС) или клетками в определенных условиях (например, в конкретные моменты времени клеточного цикла или в клетках, находящихся в определенной нише). Предпочтительно, такие маркеры представляют собой белки и, более предпочтительно, обладают эпитопами для антител, аптамеров или других связывающих молекул, известных в данной области. Однако, маркер может состоять из любой молекулы, обнаруженной на поверхности или в клетке, включая, но не ограничиваясь ими, белки (пептиды и полипептиды), липиды, полисахариды, нуклеиновые кислоты и стероиды. Примеры морфологических характеристик или признаков маркера включают, без ограничения ими, форму, размер и отношение ядра к цитоплазме. Примеры функциональных характеристик или признаков маркера включают, без ограничения ими, способность прикрепляться к конкретным субстратам, способность включать или исключать определенные красители, например, без ограничения ими, исключать липофильные красители, способность мигрировать в определенных условиях и способность дифференцироваться в определенные линии. Маркерами также могут быть белки, экспрессируемые генами-репортерами, например геном-репортером, экспрессируемым клеткой в результате включения нуклеиновокислотной последовательности, кодирующей репортерный ген, в клетку и его транскрипции, приводящей к получению репортерного белка, который можно использовать в качестве маркера. Такие гены-репортеры, которые можно использовать в качестве маркеров, представляют собой, например, но не ограничены ими, флуоресцентные белковые ферменты, хромомерные белки, гены устойчивости и тому подобное.
В аналогичном смысле термин "фенотип маркера" в контексте ткани, клетки или клеточной популяции (например, стабильный ТРС-фенотип) означает любой маркер или комбинацию маркеров, которые можно использовать для характеристики, идентификации, разделения, выделения или обогащения конкретной клетки или клеточной популяции (например, посредством FACS). В конкретных воплощениях фенотип маркера представляет собой фенотип клеточной поверхности, который может быть определен путем обнаружения или определения экспрессии комбинации клеточных поверхностных маркеров.
Специалистам в данной области понятно, что многочисленные маркеры (или их отсутствие) связаны с различными популяциями раковых стволовых клеток и использованы для выделения или характеристики субпопуляций опухолевых клеток. В этом отношении типичные маркеры раковых стволовых клеток включают ОСТ4, Nanog, STAT3, ЕРСАМ, CD24, CD34, NB84, TrkA, GD2, CD133, CD20, CD56, CD29, В7Н3, CD46, рецептор трансферрина, JAM3, карбоксипептидазу М, ADAM9, онкостатин М, Lgr5, Lgr6, CD324, CD325, нестин, Sox1, Bmi-1, eed, easyh1, easyh2, mf2, yy1, smarcA3, smarckA5, smarcD3, smarcE1, mllt3, FZD1, FZD2, FZD3, FZD4, FZD6, FZD7, FZD8, FZD9, FZD10, WNT2, WNT2B, WNT3, WNT5A, WNT10B, WNT16, AXIN1, BCL9, MYC, (TCF4) SLC7A8, IL1RAP, TEM8, TMPRSS4, MUC16, GPRC5B, SLC6A14, SLC4A11, PPAP2C, CAV1, CAV2, PTPN3, EPHA1, EPHA2, SLC1A1, CX3CL1, ADORA2A, MPZL1, FLJ10052, C4.4A, EDG3, RARRES1, TMEPAI, PTS, CEACAM6, NID2, STEAP, ABCA3, CRIM1, IL1R1, OPN3, DAF, MUC1, MCP, CPD, NMA, ADAM9, GJA1, SLC19A2, ABCA1, PCDH7, ADCY9, SLC39A1, NPC1, ENPP1, N33, GPNMB, LY6E, CELSR1, LRP3, C20orf52, TMEPAI, FLVCR, PCDHA10, GPR54, TGFBR3, SEMA4B, PCDHB2, ABCG2, CD166, AFP, BMP-4, β-катенин, CD2, CD3, CD9, CD14, CD31, CD38, CD44, CD45, CD74, CD90, CXCR4, декорин, EGFR, CD105, CD64, CD16, CD16a, CD16b, GLI1, GLI2, CD49b и CD49T. См., например, Schulenburg et al., 2010, PMID: 20185329, патент США 7,632,678 и патенты США 2007/0292414, 2008/0175870, 2010/0275280, 2010/0162416 и 2011/0020221, каждый из которых включен в данную заявку посредством ссылки. Следует понимать, что ряд этих маркеров включен в PhenoPrint Array, описанный выше.
Аналогично, неограничивающие примеры фенотипов клеточной поверхности, ассоциированных с раковыми стволовыми клетками определенных опухолевых типов, включают CD44hiCD24low, ALDH+, CD133+, CD123+, CD34+CD38-, CD44+CD24-, CD46hiCD324+CD66c-, CD133+CD34+CD10-CD19-, CD138-CD34-CD19+, CD133+RC2+, CD44+α2 β1 hiCD133+, CD44+CD24+ESA+, CD271+, ABCB5+, а также другие фенотипы клеточной поверхности раковых стволовых клеток, которые известны в данной области. См., например, Schulenburg et al., 2010, выше, Visvader et al., 2008, PMID: 18784658 и патент США 2008/0138313, каждый из которых включен в настоящее описание во всей своей полноте посредством ссылки. Специалистам в данной области понятно, что фенотипы маркеров, такие как приведены непосредственно выше, можно использовать в сочетании со стандартным анализом методом проточной цитометрии и процедурами сортировки клеток для характеристики, выделения, очистки или обогащения TIC- и/или ТРС-клеток или клеточных популяций для дальнейшего анализа. В связи с настоящим изобретением интересно, что CD46, CD324 и возможно CD66c, интенсивно или гетерогенно экспрессируются на поверхности многих человеческих опухолевых клеток колоректального рака ("CR"), молочной железы ("BR"), немелкоклеточного рака легкого (NSCLC), мелкоклеточного рака легкого (SCLC), поджелудочной железы ("РА"), меланомы ("Mel"), яичника ("OV") и рака головы и шеи ("HN"), независимо от того являются анализируемые опухолевые образцы первичной опухолью пациента или полученными от пациента NTX-опухолями.
Клетки с отрицательной экспрессией (то есть "-") определены здесь как клетки, экспрессия которых равна или менее 95 го процентиля экспрессии, наблюдаемой с контрольным изотипом антитела в канале флуоресценции при наличии мечения полным антитело-окрашивающим коктейлем других представляющих интерес белков в дополнительных каналах эмиссии флуоресценции. Специалистам в данной области понятно, что эта процедура определения отрицательных событий упоминается, как "флуоресценция минус" или "FMO" окрашивание. Клетки с экспрессией более 95-го процентиля экспрессии, наблюдаемой с контрольным изотипом антитела с использованием процедуры FMO окрашивания, описанной выше, определены здесь как "положительные" (то есть "+"). Как определено здесь, существуют различные популяции клеток в широком смысле определенные как "положительные". Во-первых, клетки с низкой экспрессией (то есть "lo"), в общем случае определены, как клетки с наблюдаемой экспрессией выше 95-го процентиля, определенного с использованием FMO-окрашивания контрольного изотипа антитела и в пределах одного стандартного отклонения от 95-го процентиля экспрессии, наблюдаемой с контрольным изотипом антитела с использованием процедуры FMO-окрашивания, описанной выше. Клетки с "высокой" экспрессией (то есть "hi") можно определить, как клетки с наблюдаемой экспрессией выше 95-го процентиля, определенного с использованием FMO-окрашивания контрольного изотипа антитела и имеющие более чем одно стандартное отклонение выше 95-го процентиля экспрессии, наблюдаемого с контрольным изотипом антитела с использованием процедуры FMO-окрашивания, описанной выше. В других воплощениях в качестве демаркационной точки между отрицательным и положительным FMO-окрашиванием предпочтительно можно использовать 99-й процентиль и в особенно предпочтительных воплощениях процентиль может быть больше 99%.
Используя методы быстрой идентификации и ранжирования антигенов колоректальной опухоли, такие как описано выше, основанные на интенсивности экспрессии и гетерогенности нескольких NTX-опухолей от пациентов с колоректальным раком, кандидатные ТРС-антигены дополнительно оценивали путем сравнения опухоли и соседней нормальной ткани и затем выбирали на основании, по меньшей мере частично, повышенной или пониженной регуляции конкретного антигена в злокачественных клетках. Кроме того, системный анализ различных маркеров клеточной поверхностных в отношении их способности улучшать возможность трансплантации полностью гетерогенных опухолей мышам (то есть онкогенность) и последующая комбинация этих маркеров, значительно улучшали разрешающую способность метода и улучшали возможность приспосабливать метод сортировки флуоресцентно-активированных клеток (FACS) для идентификации и характеристики отдельных, высокообогащенных субпопуляций опухолевых клеток, которые исключительным образом содержали всю опухолеобразующую способности при трансплантации (то есть опухоль-инициирующие клетки). Следует повторить, что термин "опухоль-инициирующая клетка (TIC)" или "онкогенная (TG)" клетка включает как клетки, поддерживающие опухоль (ТРС; то есть раковые стволовые клетки), так и высокопролиферативные клетки-предшественники опухоли (TProg), которые вместе обычно составляют уникальную субпопуляцию (то есть 0,1-25%) объема или массы опухоли; их характеристики определены выше. Большинство опухолевых клеток, охарактеризованных таким способом, лишено данной опухолеобразующей способности и, таким образом, может быть определено, как неонкогенные клетки (NTG). Неожиданно наблюдалось, что наиболее разные маркеры, идентифицированные с использованием запатентованного PhenoPrint Array, не продемонстрировали способности обогащать популяции опухоль-инициирующих клеток в колоректальных опухолях с использованием стандартных протоколов FACS, но комбинации разных маркеров можно было использовать для идентификации двух субпопуляций опухоль-инициирующих клеток: ТРС и TProg. Специалистам в данной области понятно, что определение разницы между ТРС и TProg заключается в способности ТРС постоянно питать рост опухоли при серийной трансплантации с низким количеством клеток, хотя обе популяции являются опухоль-инициирующими в первичных трансплантантах. Кроме того, до обнаружения авторами настоящего изобретения было неизвестно, что маркер/белки, используемые в комбинации для обогащения как ТРС, так и TProg, ассоциированы с клетками, обладающими такой активностью в любой ткани или новообразовании, хотя другие исследователи определили клеточные поверхностные маркеры или ферментативную активность, которые могут быть аналогичным образом использованы для обогащения онкогенных клеток (Dylla et al 2008, выше). Как указано ниже, конкретные опухолевые клеточные субпопуляции, выделенные с использованием комбинаций маркеров клеточной поверхности, упоминаемых выше, затем анализировали с использованием полного транскриптома технологии секвенирования нового поколения для идентификации и характеристики дифференциально экспрессирующихся генов.
Пример 2
Выделение и анализ образцов РНК из обогащенных популяций опухоль-инициирующих клеток
Несколько установившихся колоректальных NTX-клеточных линий (SCRX-CR4, CR11, CR33, РА3, РА6 & РА14), полученных и пассированных, как описано в Примере 1, использовали для инициирования опухолей у мышей с ослабленным иммунитетом. Мышей, несущих опухоли SCRX-CR4, РАЗ или РА6, как только размер опухоли достигал ~300 мм3 рандомизировали и лечили с помощью 15 мг/кг иринотекана, 25 мг/кг гемцитабина или контрольного носителя (PBS) два раза в неделю в течение по меньшей мере двадцати дней до умерщвления. Извлекали опухоли, полученные из всех шести линий NTX, в том числе от мышей, прошедших химиотерапевтическое лечение, и клетки ТРС, TProg и NTG, соответственно, выделяли из свежерезецированных колоректальных NTX-опухолей и, аналогично, клетки TG и NTG выделяли из NTX-опухолей поджелудочной железы, как правило, с использованием метода, представленного в Примере 1. В частности, клеточные популяции выделяли с помощью FACS и немедленно осаждали и лизировали в лизирующем буфере Qiagen RLTplus RNA (Qiagen, Inc.). Затем лизаты хранили при -80°С до использования. После оттаивания экстрагировали общую РНК, используя набор для выделения Qiagen RNeasy (Qiagen, Inc.) в соответствии с инструкциями производителя, и производили количественное определение на Nanodrop (Thermo Scientific) и Bioanalyzer 2100 (Agilent Technologies), снова используя протоколы производителя и рекомендованные настройки прибора. Полученный в результате препарат общей РНК был пригоден для генетического секвенирования и анализа.
Образцы общей РНК, полученные из соответствующих клеточных популяций, выделенных, как описано выше, из мышей, обработанных носителем или химиотерапевтическим агентом, готовили для секвенирования целого транскриптома с использованием Applied Biosystems SOLID 3.0 (Секвенирование посредством олиголигирования/обнаружения) платформы для секвенирования следующего поколения (Life Technologies), начиная с 5 нг общей РНК на образец. Данные, полученные с помощью SOLiD платформы, были соотнесены с 34609 генами из генома человека и обеспечили возможность обнаружения лигандов эфринов А, включая EFNA4, и обеспечить проверяемые измерения уровней ENFA в большинстве образцов.
Как правило, платформа SOUD3 для секвенирования следующего поколения позволяет параллельное секвенирование клонально амплифицированных фрагментов РНК/ДНК, соединенных с шарообразными частицами. Секвенирование путем лигирования с олигонуклеотидами, мечеными красителями, затем используют для получения 50 считываний оснований каждого фрагмента, присутствующего в образце, суммарно с более чем 50 миллионами считываний, создающими значительно более точное представление об уровне экспрессии белков генома с транскрипта мРНК. Платформа SOLiD3 способна захватывать не только экспрессированные, но и SNP (однонуклеотидный полиморфизм), известные и неизвестные события альтернативного сплайсинга и, возможно, вновь открытые экзоны, основанные исключительно на охвате считывания (считывания, уникальным образом сопоставленные с положениями в геноме). Таким образом, применение этой платформы следующего поколения обеспечивает возможность определения различий в уровне экспрессии транскрипта, а также различий или предпочтений в конкретных вариантах сплайсинга этих экспрессируемых транскриптов мРНК. Кроме того, для анализа с платформой SOUD3 с использованием модифицированного протокола для суммарного транскриптома от Applied Biosystems требуется только приблизительно 5 нг исходного вещества перед амплификацией. Это важно, так как извлечение общей РНК из отсортированных клеточных популяций, где подмножество ТРС-клеток, например, значительно меньше по количеству, чем NTG или объемные опухоли, и приводит к получению очень малых количеств пригодного исходного вещества.
Данные повторного анализа секвенирования, полученные с помощью платформы SOUD3, были нормализованы и преобразованы и соотношения рассчитаны в соответствии со стандартной промышленной практикой. Как показано на Фиг.2, измеряли уровни EFNA1, EFNA3 и EFNA4 в опухоли, а также уровни Eph-рецепторов ЕРНА1, ЕРНА2 и ЕРНА10. Анализ данных показал, что EFNA4 был активирован на уровне транскрипта в 1,9-3 раза выше в SCRx-CR4 NTX опухоли ТРС по сравнению с NTG-популяцией, и в 1,2-1,4 раза в ТРС по сравнению TProg-популяцией, независимо от того, получали клетки из мышей, обработанных носителем (Фиг.2А) плацебо или 15 мг/кг иринотекана (Фиг.2Б), Кроме того, понятно, что EFNA1 также повышен в ТРС по сравнению с клетками TProg и NTG, соответственно, хотя и в меньшей степени, чем EFNA4. Кроме того, при анализе дополнительных образцов колоректальной (SCRx-CR11 и CR33) и панкреатической (SCRx-РА3, РА6 и РА14) опухоли посредством SOUD3 секвенирования суммарного транскриптома, экспрессия гена EFNA4 аналогично была повышена в ТРС по сравнению с клетками TProg и NTG в колоректальном раке (ФИГ.3А) и в TIC (или TG) субпопуляции клеток из опухоли поджелудочной железы (ФИГ.3Б), определенных с использованием панели уникальных клеточных поверхностных маркеров, обнаруженных, как показано выше (подмножества клеток ТРС и TProg, которые составляют популяцию TIC в опухоли поджелудочной железы, еще не определены).
Также наблюдали, что экспрессия рецептора ЕРНА2, с которым взаимодействуют оба лиганда, EFNA4 и EFNA1, обратная экспрессии и EFNA4 и EFNA1 во время прогрессии дифференцировки от ТРС до NTG клеток. Эта обратная картина экспрессии лигандов EFNA1/EFNA4 и рецептора ЕРНА2 позволяет предположить, что взаимное влияние этих пар лиганд/рецептор может играть важную роль в решении клеточной судьбе во время дифференцировки колоректальной раковой стволовой клетки и что нейтрализация этих взаимодействий может отрицательно влиять на рост опухоли. В частности, путем блокирования взаимодействий EphA2 с EFNA1 и/или EFNA4 с использованием нейтрализующих антител против последней пары лигандов эфринов А, ТРС можно, например, сенсибилизировать к химиотерапевтическим агентам или индуцировать их дифференцировку. Кроме того, путем нацеливания на ТРС с использованием EFNA1 и/или ЕРМА4-интернализованных антител, ТРС могут быть убиты непосредственно свободным модулятором или посредством применения токсина или лекарственного конъюгата с антителом.
Подробно описанные выше наблюдения показывают, что экспрессия EFNA1 и/или EFNA4, как правило, повышена в популяциях ТРС и позволяют предположить, что эти связанные с мембраной лиганды могут играть важную роль в онкогенезе и поддержании опухоли, таким образом представляя прекрасные мишени для новых терапевтических подходов.
Пример 3
ПЦР-анализ в режиме реального времени лигандов эфринов А в обогащенных популяциях опухоль-инициирующих клеток
Для подтверждения дифференциальной экспрессии лиганда эфрина А, наблюдаемой посредством секвенирования целого транскрипта в популяциях ТРС по сравнению с клетками TProg и NTG в колоректальном раке, и TG по сравнению с клетками NTG в раке поджелудочной железы, использовали количественный ПЦР-анализ в режиме реального времени TaqMan® для измерения уровней экспрессии гена в соответствующих клеточных популяциях, выделенных из различных NTX-линий, как указано выше. Следует понимать, что такой ПЦР-анализ в режиме реального времени обеспечивает возможность более прямого и быстрого измерения уровней экспрессии генов для различных мишеней с использованием праймеров и наборов зондов, специфичных к конкретному интересующему гену. Количественный ПЦР-анализ в режиме реального времени TaqMan® выполняли на Applied Biosystems 7900HT Machine (Life Technologies), используемом для измерения экспрессии гена FNA4 в многочисленных популяциях клеточных линий NTX, полученных от пациентов, и в соответствующих контролях. Кроме того, анализ выполняли, как указано в инструкциях, прилагаемых к TaqMan System и с использованием имеющихся в продаже наборов EFNA4 праймеров/зондов (Life Technologies).
Как видно на Фиг.4, количественное ПЦР-исследование экспрессии гена в режиме реального времени в популяциях NTG, TProg и ТРС, выделенных из 3 различных колоректальных NTX-опухолевых линий (SCRx-CR4, CR5 и CR14) показал, что экспрессия гена EFNA4 повышена более чем в 1,4 раза в субпопуляциях TIC (ТРС и/или TProg) по сравнению с клетками NTG. EFNA4 был также повышен приблизительно в 1,8 раз в популяциях TIC у мышей, подвергнутых лечению иринотеканом, и в клеточной TG-клеточной популяции опухолей поджелудочной железы (например, SCRx-РА3). Наблюдение повышенной экспрессии EFNA4 в клеточных популяциях NTX TIC по сравнению с NTG-клеточным контролем в NTX-опухолях, полученных от пациентов с колоректальным и панкреатическим раком, с использованием общепризнанной методики количественного ПЦР-анализа в режиме реального времени подтвердил более чувствительный характер данных, полученных с помощью SOLJD3 секвенирования целого транскрипта из предыдущего Примера, и подтвердил наблюдаемую связь между EFNA4 и клетками, лежащими в основе онкогенеза, устойчивости к терапевтическому лечению и рецидиву.
Пример 4
Экспрессия лигандов эфринов А в нефракционированных образцах колоректальной опухоли
В свете того, что экспрессия гена лиганда эфрина А, как было обнаружено, повышена в популяциях ТРС из колоректальных опухолей по сравнению с клетками TProg и NTG из тех же опухолей, были выполнены эксперименты для определения, наблюдается ли повышенная экспрессии лиганда эфрина А (то есть EFNA4) также и в нефракционированных образцах колоректальной опухоли по сравнению с нормальной соседней тканью (NAT). Аналогично, также производили измерения для определения экспрессии лигандов эфринов А в опухолях по сравнению с уровнем в образцах нормальных тканей. Custom TumorScan qPCR (Origene Technologies) 384-луночные панели, содержащие 110 образцов колоректальной опухоли пациентов, нормальную соседнюю ткань и 48 нормальных тканей, были запланированы и изготовлены с использованием известных в данной области методов. Используя процедуры, описанные в Примере 3, и те же наборы ЕРМА4-специфических праймеров/зондов, TaqMan количественный ПЦР-анализ в режиме реального времени выполняли в лунках обычных планшетов.
На Фиг.5А и 5Б показаны результаты данных по экспрессии в графическом формате, нормализованных относительно средней экспрессии в нормальной ткани толстой и прямой кишки. В частности, на Фиг.5А обобщены данные, полученные с использованием 168 образцов ткани, полученных из 110 пациентов с колоректальным раком (35 образцов ткани являются нормальной (NL) соседней тканью пациентов с колоректальным раком) и 48 нормальных тканей из других мест (Другие NL). На графике данные для каждого образца ткани/пациента представлены точкой, со среднегеометрическим значением для каждой популяции, нанесенным на оси X, представленным в виде линии. Аналогично, на Фиг.5Б представлены данные из 24 сопоставимых образцов от пациента с колоректальным раком, полученных из опухоли (Т) или нормальной соседней ткани (N) на разных стадиях заболевания (I-IV). На графике данные представлены на последовательной выборочной основе со связями между соответствующими опухолевой и нормальной соседней тканью отдельных пациентов. Экспрессия EFNA4 заметно выше в большинстве сопоставимых опухолей по сравнению с нормальной соседней тканью, с дифференциальной экспрессией на стадиях 2, 3 и 4, достигающей статистической значимости (n≥4, Р≤0,047). Обе Фиг.5А и 5Б указывают на то, что на всех четырех представленных стадиях уровень экспрессии гена EFNA4 повышен в большинстве колоректальных опухолей и в сопоставимых образцах опухоли относительно нормальной соседней ткани. Кроме того, среднее значение экспрессии гена EFNA4 на любой стадии колоректального рака по меньшей мере равно, если не превышает, самым высоким уровням экспрессии гена EFNA4 в любой нормальной ткани, исследованной в этих экспериментах (Фиг.5А). Эти результаты демонстрируют, что экспрессия EFNA4 повышена в колоректальном раке и в сочетании с вышеприведенными наблюдениями, что экспрессия EFNA4 является самой высокой в колоректальных ТРС и панкреатических TIC, позволяет предположить, что терапевтическое нацеливание на онкогенные клетки, экспрессирующие EFNA4, может принести значительную терапевтическую пользу раковым пациентам.
Пример 5
Дифференциальная экспрессия лиганда эфрина А в типичных образцах опухоли
Для дополнительной оценки экспрессии гена лиганда эфрина А в дополнительных образцах опухоли колоректального рака пациента и образцах опухоли пациентов с диагнозом 1 из 17 других различных типов солидной опухоли, выполняли Taqman qRT-PCR с использованием TissueScan™ qPCR (Origene Technologies) 384-луночных панелей, которые были специально приготовлены, как описано в Примере 4. Результаты измерений представлены на Фиг.6 и показывают, что экспрессия гена EFNA4 значительно повышена или подавлена в ряде образцов опухоли.
В связи с этим, на Фиг.6А и 6Б показаны относительные и абсолютные уровни экспрессии генов, соответственно, человеческого EFNA4 в целых образцах опухоли (серые точки) или сопоставимой нормальной соседней ткани (NAT; белые точки) из пациентов с одним из восемнадцати разных типов солидных опухолей. На Фиг.6А данные нормализованы относительно средней экспрессии гена в NAT для каждого анализируемого типа опухоли. На Фиг.6Б абсолютную экспрессию EFNA4 оценивали в различных тканях/опухолях, и данные на график наносили в виде числа циклов (Ct), необходимого для достижения экспоненциальной амплификации посредством количественной ПЦР в режиме реального времени. Неамплифицированным образцам приписывали значение Ct 45, которое представляет собой последний цикл амплификации в экспериментальном протоколе. Каждая точка представляет собой отдельный образец ткани со средним значением, представленным в виде черной линии.
При использовании обычной панели наблюдали, что у большинства пациентов с диагнозом колоректальный рак и у большинства пациентов с диагнозом рак эндометрия, пищевода, печени, легких, предстательной железы, мочевого пузыря и матки имеется значительно более высокая экспрессия гена EFNA4 в их опухолях по сравнению с NAT, что позволяет предположить, что EFNA4 может играть важную роль в онкогенезе и/или опухолевом развитии этих опухолей. В противоположность этому, экспрессия EFNA4 оказалась в значительной степени подавленной в опухолях пациентов с раком надпочечников и с раком поджелудочной железы. Из этих исследований ясно, что экспрессия гена EFNA4 была обычно от низкой до умеренной в большинстве образцов NAT; при этом наиболее высокая экспрессия наблюдалась в надпочечнике, молочной железе, шейке матки и яичниках. И опять эти данные свидетельствуют, что дифференциальная экспрессия EFNA4 (высокая или низкая) указывает на, и возможно регулирует, онкогенез или сохранение опухоли у пациентов с выбранными гиперпролиферативными расстройствами.
Экспрессию EFNA4 также оценивали с использованием запатентованных нетрадиционных ксенотрансплантатов (NTX), как описано выше, и количественно оценивали по сравнению с экспрессией нормальной ткани. Количественный ПЦР-анализ в режиме реального времени выполняли на имеющихся в продаже образцах РНК нормальных тканей (молочной железы, толстой кишки, пищевода, сердца, почек, печени, легких, яичников, поджелудочной железы, скелетной мышцы, тонкой кишки) и на NTX-опухолях рака молочной железы (BR), колоректального рака (CR), рака почек (KDY), рака печени (LIV), меланомы (MEL), немелкоклеточного рака легких (NSCLC), рака яичников (OV), рака поджелудочной железы (РА) и мелкоклеточного рака легких (SCLC). Результаты, показанные на Фиг.6В, демонстрируют повышенную экспрессию EFNA4 в NTX-линиях молочной железы, толстой кишки и печени по сравнению с экспрессией в нормальных тканях. С другой стороны, на Фиг.6Г показана экспрессия родственного члена семейства EFNA1 во многих из тех же самых нормальных и NTX-линиях и показана небольшая дифференциальная экспрессия между нормальными и опухолевыми тканями. Несмотря на такой профиль экспрессии, модуляторы EFNA по настоящему изобретению, которые взаимодействуют с EFNA1 (в том числе взаимодействующие с другими EFNA) можно эффективно использовать для ликвидации онкогенных клеток, о чем свидетельствуют следующие Примеры.
В любом случае, для подтверждения того, что повышенный уровень экспрессии мРНК, определенный с помощью количественного ПЦР-анализа в режиме реального времени, также приводит к повышенному уровню белка EFNA4, выполняли Вестерн-блоттинг. Клеточные лизаты из NTX и клеточных линий (293 необработанных и 293 сверхэкспрессирующих EFNA4 клеток) получали с использованием набора для экстракции общего белка (Bio Chain Institute #K3011010) согласно представленному протоколу для сопоставления с имеющимися в продаже лизатами нормальной ткани (Novus Biologicals). Концентрацию белка в лизатах определяли, используя ВСА-анализ (анализ с использованием бицинхониновой кислоты) белка (Pierce/Thermo Fisher #23225). Равные количества клеточных лизатов прогоняли в NuPAGE Novex 4-12% Bis-Tris геле (Life Technologies) в MES (2-(N-морфолино)этансульфоновая кислота) буфере в восстанавливающих условиях. Имеющееся в продаже антитело против человеческого EFNA4 (R&D Systems - AF369) использовали для определения экспрессии белка EFNA4. На верхней панели на Фиг.6Д, показано, что клетки 293, сконструированные со сверхэкспрессией EFNA4, демонстрируют высокую экспрессию по сравнению с необработанными 293 клетками. Кроме того, на верхней панели несколько образцов рака молочной железы, толстой кишки и немелкоклеточного рака легких NTX показали относительно высокую экспрессию EFNA4. В аналогичных условиях Вестерн-блоттинг на нижней панели Фиг.6Д показал, что нормальные ткани экспрессируют низкие или неопределяемые уровни EFNA4 по сравнению с высоким уровнем экспрессии EFNA4 в NTX-клеточной линии CR11. Анти-GAPDH контрольное антитело используют для демонстрации равной нагрузки клеточных лизатов в обеих панелях.
Пример 6
Получение анти-EFNA антител с использованием EFNA-иммуногенов
Модуляторы EFNA в виде мышиных антител получали согласно данному руководству путем инокуляции hEFNA4-ECD-Fc, hEFNA4-ECD-His, hEFNAI-ECD-His, целых клеток BALB/c 3T3, сверхэкспрессирующих EFNA4, или препаратов плазмы, приготовленные, как указано здесь (ECD -внеклеточный домен). Все иммуногены готовили с использованием имеющихся в продаже исходных веществ (например, Recombinant Human ephrin-A4 Fc Chimera (рекомбинантная человеческая эфрин-А4-Рс химера), CF R&D systems #369-EA-200) и/или методов, хорошо известных специалистам в данной области.
В частности, мышиные антитела получали посредством иммунизации 9 мышей-самок (3 каждых: Balb/c, CD-1, FVB) различными препаратами EFNA4 или EFNA1-антигена. Иммуногены включали Fc-конструкции или His-меченые человеческие EFNA4 или EFNA1, мембранные фракции, извлеченные из 107 сверхэкспрессирующих EFNA4 293 клеток или целые 3Т3 клетки, сверхэкспрессирующие человеческий EFNA4 на поверхности. Мышей иммунизировали путем инъекций в подушечки лап во всех случаях. Для иммунизации использовали 10 мкг EFNA4 или EFNA1-иммуногена или 1×106 клеток или клеточных эквивалентов, эмульгированных с равным объемом TITERMAX™ или квасцовым адъювантом. После иммунизации мышей подвергали эвтаназии и дренирующие лимфатические узлы (подколенные и паховые, если они были увеличены) вырезали и использовали в качестве источника антитело-продуцирующих клеток. Лимфоциты извлекали посредством механического разрушения лимфатических узлов с использованием гомогенизатора тканей.
Использовали один из двух протоколов слияния. Сначала выполняли электрослияние с помощью устройства Genetronic с последующим посевом и скринингом поликлональных гибридом и затем субклонированием для получения моноклональных гибридом. Затем выполняли электрослияние с помощью ВТХ устройства и затем с ростом библиотеки гибридомы в массе и осаждением единичных клеток гибридомы с последующим скринингом клонов.
Протокол слияния с помощью устройства Genetronic: Слияние выполняли путем смешивания одноклеточной суспензии В-клеток с несекретирующими клетками миеломы РЗх63Ад8.653, приобретенными в (АТСС CRL-1580; Kearney et al, J. Immunol. 123:1548-1550 (1979)) в соотношении 1:1. Клеточную смесь аккуратно осаждали посредством центрифугирования при 800 g. После полного удаления супернатанта клетки обрабатывали 2-4 мл раствора проназы в течение не более 2 минут. Электрослияние выполняли, используя генератор для слияния, модель ЕСМ2001 (Genetronic, Inc.).
Клетки помещали в количестве 2×104/лунка в плоскодонные микротитрационные планшеты, с последующей двухнедельной инкубацией в селективной НАТ-среде (среда с гипоксантином, аминоптерином и тимидином) (Sigma, CRL Р-7185). Затем отдельные лунки подвергали скринингу посредством ELISA и FACS в отношении моноклональных IgG антител против человеческого EFNA4.
ELISA микротитрационные планшеты покрывали очищенными рекомбинантными EFNA4-His слитыми белками из трансфицированных 293 клеток в количестве 100 нг/лунка в карбонатном буфере. Планшеты, инкубируемые при 4°С в течение ночи, затем блокировали при помощи 200 мкл/лунка 3% BSA (бычий сывороточный альбумин) в PBS/Tween (0,05%). Супернатант из планшетов с гибридомой добавляли в каждую лунку и инкубировали в течение 1-2 часов при температуре окружающей среды. Планшеты промывали PBS/Tween и затем инкубировали с IgG козы против мыши, специфическим фрагментом Fc, конъюгированным с пероксидазой хрена (HRP) Jackson ImmmoResearch) в течение одного часа при комнатной температуре. После промывания планшеты проявляли с ТМВ-субстратом (Thermo Scientific 34028) и анализировали с помощью спектрофотометра OD450 (оптическая плотность при 450 нм).
ЕРМА4-секретирующую гибридому из положительных лунок повторно подвергали скринингу и субклонировали методом серийных разведений или FACS-сортировки единичных клеток.
Субклонирование выполняли на выбранных антиген-положительных лунках с использованием посева методом серийных разведений. Планшеты визуально анализировали на наличие роста одиночных колоний, и супернатанты из лунок с одиночными колониями подвергали скринингу посредством антиген-специфических ELISA, как описано выше, и FACS-подтверждения, как описано ниже. Полученные клональные популяции размножали, замораживали в среде для замораживания (90% FBS, 10% DMSO) и хранили в жидком азоте. Такое слияние из мышей, иммунизированных EFNA4, привело к получению 159 мышиных моноклональных антител, взаимодействующих с EFNA4 при использовании протокола ELISA, описанного выше.
Протокол слияния для устройства ВТХ: Одноклеточную суспензию В-клеток сливали с несекретирующими клетками миеломы РЗх63Ад8.653 в соотношении 1:1 посредством электрослияния. Электрослияние выполняли с использованием Hybrimune System, модель 47-0300 (ВТХ Harvard Apparatus). Слитые клетки ресуспендировали в среде для селекции гибридомы с добавлением азасерина (Sigma #A9666) (DMEM (Cellgro каталожный номер 15-017-СМ), содержащей 15% клона I эмбриональной сыворотки (Hyclone), 10% BM-Condimed (Roche Applied Sciences), 1 мМ пирувата натрия, 4 мМ L-глутамина, 100 ME пенициллина-стрептомицина, 50 мкМ 2-меркаптоэтанола и 100 мкМ гипоксантина) и затем помещали в четыре колбы Т225 с 90 мл селективной среды на колбу. Эти колбы затем помещали в увлажненный 37°С инкубатор, содержащий 5% CO2 и 95% воздуха, на 6-7 суток.
На 6-7 сутки роста библиотеку высевали в количестве 1 клетка на лунку в 48 96-луночных U-образных планшетов Falcon с использованием клеточного сортировщика Aria I. В кратком изложении, культуральную среду, содержащую 15% эмбриональной сыворотки клона I (Hyclone), 10% BM-Condimed (Roche Applied Sciences), 1 мМ пирувата натрия, 4 мМ L-глутамина, 100 ME пенициллина-стрептомицина, 50 мкМ 2-меркаптоэтанола и 100 мкМ гипоксантина, помещали в количестве 200 мкл на лунку в 48 96-луночных U-образных планшетов Falcon. Жизнеспособные гибридомы помещали в количестве 1 клетка на лунку, используя клеточный сортировщик Aria I, и культивировали в течение 10-11 суток, супернатанты оценивали на антитела, взаимодействующие с EFNA4 или EFNA1 посредством FACS или ELISA.
Лунки с положительным ростом гибридом, секретирующих мышиные иммуноглобулины, подвергали скринингу на специфичность к мышиному EFNA4, используя анализ ELISA, аналогичный описанному выше. В кратком изложении, 96-луночные планшеты (VWR, 610744) покрывали 1 мкг/мл мышиного EFNA4-His в натрий-карбонатном буфере и оставляли на ночь при 4°С. Планшеты промывали и блокировали 2% FCS-PBS в течение одного часа при 37°С и использовали немедленно или хранили при 4°С. Неразбавленные супернатанты гибридомы инкубировали на планшетах в течение одного часа при комнатной температуре. Планшеты промывали и зондировали HRP-меченым IgG козы против мыши, разведенным 1:10000 в 1% BSA-PBS, в течение одного часа при комнатной температуре. Затем планшеты инкубировали с раствором субстрата, как описано выше, и считывали OD450.
Лунки с положительным ростом гибридом, секретирующих мышиные иммуноглобулины, также подвергали скринингу на специфичность к человеческому EFNA1, используя FACS-анализ следующим образом. В кратком изложении, 1×105 клеток Jurkat/лунку, экспрессирующих человеческий EFNA1, инкубировали в течение 30 минут с 25-100 мкл супернатанта гибридомы. Клетки дважды промывали PBS/2% FCS и затем инкубировали с 50 мкл/образец IgG козы против мыши, меченных DyeLight 649, вторичных, специфичных к Fc-фрагменту, разведенных 1:200 в PBS/2% FCS. После 15 минут инкубации клетки дважды промывали PBS/2% FCS и ресуспендировали в PBS/2%FCS с DAPI (4′,6-диамидин-2-фенилиндол) и анализировали посредством FACS Canto II (BD Biosciences) в стандартных условиях и используя HTS (высокопроизводительный скрининг)-прикрепление. Полученные EFNA1-специфичные клональные гибридомы размножали и криоконсервировали в среде для замораживания CS-10 (Biolife Solutions) и хранили в жидком азоте. Такое слияние из мышей, иммунизированных EFNA1, давало 1 гибридому, взаимодействующую с EFNA4, как определено с использованием FACS-анализа. Кроме того, FACS-анализ подтвердил, что очищенное антитело из большинства или из всех этих гибридом связывает EFNA4 или EFNA1 зависимым от концентрации образом.
Пример 7
Секвенирование и гуманизация модуляторов лигандов эфринов А
7(а) Секвенирование:
На основании вышеизложенного был отобран ряд типичных отдельных моноклональных антител, которые связываются с иммобилизованным человеческим EFNA4 или EFNA1 с предположительно высокой аффинностью. Как показано в табличной форме на Фиг.7А, анализ последовательности ДНК, кодирующей mAb (моноклональные антитела) из Примера 6, подтвердил, что многие имели уникальные перестановки VDJ и имели новые области, определяющие комплементарность. Обратите внимание, что области, определяющие комплементарность, показанные на Фиг.7А (SEQ ID NO:8-59 и 70-95) определены как в Chothia et al., выше.
Для инициирования секвенирования в Invitrogen (Life Technologies) был приобретен реагент TRIZOL. Одностадийный набор RT PCR и набор для очистки QIAquick PCR были приобретены в Qiagen, Inc., RNasin был из Promega. Индивидуальные олигонуклеотиды были приобретены в Integrated DNA Technologies.
Клетки гибридомы лизировали с помощью реагента TRIZOL для получения РНК. От 104 до 105 клеток ресуспендировали в 1 мл TRIZOL. После добавления 200 мкл хлороформа пробирки энергично встряхивали. Образцы центрифугировали при 4°С в течение 10 минут. Водную фазу переносили в чистую пробирку для микроцентрифуги и добавляли равный объем изопропанола. Пробирки энергично встряхивали и оставляли инкубироваться при комнатной температуре в течение 10 минут. Затем образцы центрифугировали при 4°С в течение 10 минут. Осадки промывали один раз 1 мл 70%-ного этанола и быстро сушили при комнатной температуре. Осадок РНК ресуспендировали в 40 мкл воды, обработанной DEPC (диэтилпирокарбонат). Качество препаратов РНК определяли путем фракционирования 3 мкл в 1% агарозном геле. РНК хранили в морозильнике при -80°С до использования.
Вариабельные последовательности ДНК из гибридомы, амплифицированные с помощью наборов консенсусных праймеров, специфичных для тяжелых цепей иммуноглобулина и каппа легких цепей мыши, были получены с использованием смеси праймеров для вариабельных доменов. Набор для одностадийной ОТ-ПЦР использовали для амплификации сегментов генов VH и VK из каждого образца РНК. Набор Qiagen One-Step RT-PCR включает смесь Sensiscript и Omniscript обратных транскриптаз, HotStarTaq ДНК-полимеразы, Qiagen One-Step RT-PCR буфера, смесь dNTP (дезоксирибонуклеотид-трифосфат) и Q-Solution, новый вспомогательный компонент, которые делает возможной эффективную амплификацию «трудных» (например, GC-богатых) матриц.
Готовили реакционные смеси, которые включали 3 мкл РНК, 0,5 каждого из праймеров для тяжелой цепи или каппа легкой цепи в концентрации 100 мкМ, 5 мкл 5-кратного ОТ-ПЦР буфера, 1 мкл dNTP, 1 мкл ферментативной смеси, содержащей обратную транскриптазу и ДНК-полимеразу, и 0,4 мкл ингибитора рибонуклеазы RNasin (1 единица). Реакционная смесь содержала все реагенты, необходимые как для обратной транскрипции, так и для ПЦР. Программа для термального циклера состояла из RT-стадии при 50°С в течение 30 минут, при 95°С в течение 15 минут, затем 30 циклов из (95°С в течение 30 секунд, 48°С в течение 30 секунд, 72°С в течение 1,0 минуты). Затем следовала конечное инкубирование при 72°С в течение 10 минут.
Для получения ПЦР-продуктов для непосредственного ДНК-секвенирования, их очищали с использованием набора QIAquick™ PCR Purification в соответствии с протоколом производителя. ДНК элюировали из спин-колонки, используя 50 мкл стерильной воды, и затем обе нити подвергали непосредственному секвенированию. ПЦР-фрагменты были непосредственно секвенированы и последовательности ДНК анализировали, используя VBASE2 (Retteretal., Nucleic Acid Res. 33; 671-674, 2005).
Как кратко упоминалось выше, генетические перестройки и полученные CDR (как определено в Chothia et al., выше) нескольких типичных анти-hEFNA4/hEFNA1 антител представлены в табличной форме на Фиг.7А (SEQ ID NO:8-59 и 70-95). Кроме того, нуклеиново- и аминокислотные последовательности этих же вариабельных областей тяжелой и легкой цепи типичного антитела представлены на Фиг.7Б-7O (SEQ ID NO:96-147).
7(б) Гуманизация:
Четыре мышиных антитела из Примера 6 были гуманизированы с использованием прививки области, определяющей комплементарность (CDR). Человеческие каркасные участки для тяжелых и легких цепей были выбраны на основании сходства последовательности и структуры с функциональными генами зародышевой линии человека. В связи с этим структурное сходство оценивали посредством сравнения мышиной канонической CDR-структуры с кандидатами человеческого происхождения, имеющими аналогичные канонические структуры, как описано в Chothia et al. (выше).
Более конкретно, мышиные антитела SC4.5, SC4.15, SC4.22 и SC4.47 были гуманизированы с использованием метода автоматизированной CDR-прививки (Abysis Database, UCL Business Pie.) и стандартных методов молекулярной инженерии с получением модуляторов hSC4.5, DSC4.15, hSC4.22 и hSC4.47 (Примечание: добавление следующей цифры после обозначения клона или антитела, то есть SC4.47.3, относится к конкретному субклону и не является существенным для настоящего описания изобретения, если иное не указано или не диктуется контекстом). Человеческие каркасные участки вариабельных областей выбирали на основании высокой гомологии их последовательности с мышиной каркасной последовательностью и их канонической структуры. Для анализа, распределение аминокислот к каждому из CDR-доменов проводят в соответствии с нумерацией согласно Kabat et al. Несколько вариантов гуманизированного антитела были созданы для получения оптимального гуманизированного антитела, где гуманизированные антитела, как правило, сохраняли антиген-связывающие области, определяющие комплементарность (CDR), из мышиной гибридомы в сочетании с человеческими каркасными участками. Гуманизированное SC4.15, SC4.22 и SC4.471 mAb связываются с антигеном EFNA4 с аффинностью, аналогичной их мышиным аналогами, в то время как DSC1.5 связывается с немного более низкой аффинностью, как измерено с использованием системы Biacore.
Процедуры молекулярного конструирования выполняли, используя общепризнанные методы. С этой целью общую мРНК экстрагировали из гибридомы в соответствии с протоколом производителя (Trizol® Plus RNA Purification System, Life Technologies). Смесь праймеров, содержащую тридцать два праймера для мышиной специфической 5′-лидерной последовательности, предназначенную для нацеливания на весь мышиный репертуар, использовали в комбинации с 3′ мышиным Сγ1-праймером для амплификации и секвенирования вариабельной области тяжелых цепей антитела. Аналогично, смесь праймеров, содержащую тридцать два праймера для 5′ Vk лидерной последовательности, предназначенную для амплификации каждого из Vk мышиных семейств в комбинации с одним обратным праймером, специфичным к мышиной каппа-константной области, использовали для амплификации и секвенирования каппа-легкой цепи. Транскрипты VH и VL амплифицировали, используя 100 нг общей РНК, используя ПЦР с обратной транскрипцией (ОТ-ПЦР).
В общей сложности восемь реакций ОТ-ПЦР проводили для каждой гибридомы: четыре для V каппа-легкой цепи и четыре для V гамма-тяжелой цепи (γ1). Для амплификации использовали набор QIAGEN One Step RT-PCR (Qiagen, Inc.). Экстрагированные ПЦР-продукты непосредственно секвенировали, используя специфические праймеры для области V. Нуклеотидные последовательности анализировали, используя IMGT, для идентификации V, D и J генных элементов зародышевой линии с высокой гомологией последовательности. Полученные последовательности сравнивали с известными зародышевыми ДНК-последовательностями Ig V- и J-областей, используя V-BASE2 (Retter et al., выше), и посредством выравнивания генов VH и VL с базой данных зародышевой линии мыши.
Из информации о нуклеотидной последовательности были получены данные, касающиеся V, D и J генных сегментов тяжелых и легких цепей SC4.5, SC4.15, SC4.22 и SC4.47. На основании данных о последовательности были разработаны новые комплекты праймеров, специфичных для лидерной последовательности Ig VH и VK цепи антител, для клонирования рекомбинантных моноклональных антител. Затем последовательности V-(D)-J выравнивали с последовательностями Ig зародышевой линии мыши. Гены тяжелой цепи SC4.5 были идентифицированы как IGHV2-6 (V) и JH3. Анализ короткой CDR3 тяжелой цепи моноклонального антитела Е5 не идентифицировал специфического D-гена мыши. Гены тяжелой цепи SC4.15 были идентифицированы как IGHV5-6 (V), DSP2.9 (D) и JH3. Гены тяжелой цепи SC4.22 были идентифицированы, как VHJ558 (V), D-сегмент был идентифицирован как DFL16.1e и JH4 (J). Гены тяжелой цепи SC4.47 были идентифицированы как IGHV1-26 (V), P1inv (D) и JH2 (J). Все четыре легкие цепи относились к классу К. Гены легкой цепи были идентифицированы как IGKV6-15, JK2 для SC4.5 mAb, IGKV6-b и JK5 для SC4.15 mAb, последовательности зародышевой линии IGKV1-110 и JK1 для SC4.22 mAb и последовательности зародышевой линии IGKV21-7, JK1 для SC4.47 каппа-легкой цепи. Эти результаты обобщены в ТАБЛИЦЕ 1, непосредственно ниже.
|
Полученные последовательности тяжелой и легкой цепи из всех четырех клонов выравнивали с функциональными последовательностями вариабельной области человека и рассматривали с точки зрения гомологии и канонической структуры. Результат анализа тяжелой и легкой цепи показан ниже в ТАБЛИЦАХ 3 и 4, соответственно.
|
|
Поскольку селекция зародышевой линии и способы CDR-прививки, по-видимому, обеспечивают получение антител, которые, как правило, сохраняют свои связывающие характеристики, очевидно нет большой необходимости вставлять мышиные остатков в большинство конструкций. Однако, в hSC4.15 остаток 68 тяжелой цепи претерпел обратную мутацию Thr (Т) в Lys (K) для улучшения характеристик антитела.
Аминокислотные последовательности (наряду с соответствующей нуклеиновокислотной последовательностью) гуманизированных вариабельных областей тяжелых цепей и гуманизированных каппа-легких цепей для всех четырех антител показаны на Фиг.7П-7Т (SEQ ID NO:148-163), где CDR в аминокислотных последовательностях (определенные согласно Kabat et al., выше) подчеркнуты.
Более конкретно, нуклеиновокислотные последовательности и соответствующие аминокислотные последовательности гуманизированной тяжелой цепи SC4.5 (SEQ ID NO:148 и 149) и гуманизированной легкой цепи (SEQ ID NO:150 и 151) показаны на Фиг.7П. Аналогично, нуклеиновокислотные последовательности и соответствующие аминокислотные последовательности гуманизированной тяжелой цепи SC4.15 (SEQ ID NO:152 и 153) и гуманизированной легкой цепи (SEQ ID NO:154 и 155) показаны на Фиг.7Р. Другое воплощение изобретения проиллюстрировано на Фиг.7O, где показаны нуклеиновокислотные последовательности и соответствующие аминокислотные последовательности гуманизированной тяжелой цепи SC4.22 (SEQ ID NO:156 и 157) и гуманизированной легкой цепи (SEQ ID NO:158 и 159). В еще одном воплощении на Фиг.7Т показаны нуклеиновокислотные последовательности и соответствующие аминокислотные последовательности гуманизированной тяжелой цепи SC4.47 (SEQ ID NO:160 и 161) и гуманизированной легкой цепи (SEQ ID NO:162 и 163). Как показано на Примерах ниже, каждое из вышеуказанных гуманизированных антител функционирует как эффективный модулятор EFNA согласно данному руководству.
В любом случае раскрытые модуляторы экспрессировали и выделяли, используя общепризнанные методы. С этой целью синтетические гуманизированные вариабельный фрагменты ДНК (Integrated DNA Technologies) обеих тяжелых цепей клонировали в человеческий IgG1 экспрессирующий вектор. Вариабельные фрагменты легкой цепи клонировали в человеческий С-каппа экспрессирующий вектор. Антитела экспрессировали посредством котрансфекции тяжелой и легкой цепи в клетки СНО.
Более конкретно, для получения антител выполняли направленное клонирование ПЦР-продуктов мышиного и гуманизированного вариабельного гена в экспрессирующие векторы на основе человеческого иммуноглобулина. Все праймеры, используемые в Ig ген-специфических ПЦР, включали сайты рестрикции (AgeI и XhoI для IgH, XmaI и DraIII для IgK, которые позволяли непосредственное клонирование в экспрессирующие векторы, содержащие константные области человеческого IgG1, и IGK, соответственно. В кратком изложении, ПЦР продукты очищали с помощью набора для очистки Qiaquick PCR purification kit (Qiagen, Inc.) с последующим гидролизом посредством AgeI и XhoI (IgH), XmaI и DraIII (IgK) соответственно. Гидролизованные ПЦР-продукты очищали перед лигированием в экспрессирующие векторы. Реакции лигирования проводили в общем объеме 10 мкл с 200 ЕД Т4-ДНК лигазы (New England Biolabs), 7,5 мкл гидролизованных и очищенных ген-специфических ПЦР-продуктов и 25 нг линеаризованного ДНК-вектора. Компетентные бактерии Е. coli DH10B (Life Technologies) трансформировали посредством теплового шока при 42°С с 3 мкл продукта лигирования и помещали на ампициллиновые чашки (100 мкг/мл). Затем AgeI-EcoRI фрагмент Ун-области вставляли в те же сайты экспрессирующего вектора pEE6.4HuIgG1, в то время как синтетическую XmaI-DraIII VK-вставку клонировали в XmaI-DraIII сайты соответствующего экспрессирующего вектора рЕЕ12.4Hu-каппа.
Клетки, продуцирующие гуманизированные антитела, были получены посредством трансфекции клеток НЕК 293 соответствующими плазмидами с использованием 293fectin. Для этого плазмидную ДНК очищали с помощью QIAprep спин-колонок (Qiagen). Клетки почек эмбриона человека (НЕК) 293Т (АТСС номер CRL-11268) культивировали в 150 мм чашках (Falcon, Becton Dickinson) в стандартных условиях в модифицированной Дульбекко среде Игла (DMEM) с добавлением 10% инактивированной нагреванием FCS (эмбриональная телячья сыворотка), 100 мкг/мл стрептомицина, 100 ЕД/мл пенициллина G (все от Life Technologies).
Для временной трансфекции клетки выращивали до 80%-ной конфлюентности. Равные количества IgH и соответствующей векторной ДНК на основе цепи IgL (12,5 мкг каждой векторной ДНК) добавляли к 1,5 мл Opti-МЕМ, смешанной с 50 мкл реагента для трансфекции НЕК 293 в 1,5 мл Opti-МЕМ. Смесь инкубировали в течение 30 мин. при комнатной температуре и распределяли поровну в чашки для культивирования. Супернатанты собирали через три дня после трансфекции, заменяли 20 мл свежей DMEM с добавлением 10% FBS и собирали еще раз на 6 сутки после трансфекции. Культуральные супернатанты очищали от клеточного дебриса путем центрифугирования при 800 g в течение 10 мин и хранили при 4°С. Рекомбинантные химерные и гуманизированные антитела очищали с помощью шарообразных частиц белка G (GE Healthcare).
Пример 8
Характеристики модуляторов EFNA
8 (а) Основные характеристики модуляторов
Различные методы использовали для анализа связывающих характеристик выбранных модуляторов эфрина А4, полученных, как указано выше. В частности, ряд ЕРМА4-антител охарактеризовали по аффинности, кинетике, биннингу и перекрестной реакционной способности в отношении гомологов яванского макака и мыши (внутреннего происхождения) с помощью ForteBlO®. Была измерена Вестерн-реактивность и определены эпитопы для двух антител (SC4.22 и SC4.91), которые связываются при восстанавливающих условиях. Кроме того, антитела были испытаны на их способность нейтрализовать (то есть блокировать взаимодействие рецептора и лиганда), интернализировать, и были подвергнуты сравнительному сравнению в отношении их относительных значений ЕС50 гибели посредством анализа цитотоксичности in vitro, используя процедуры, изложенные в этих Примерах (например, см. Примеры 12 и 16). Результаты этого исследования представлены на табличной форме на Фиг.8А.
Что касается данных, то аффинность измеряли тремя способами для обеспечения точности. Во-первых, сигнал связывания измеряли для фиксированного количества испытываемого антитела против серийных разведений антигена в ELISA для определения относительной модуляторной активности (данные показаны только для связывания яванского макака). Во-вторых, затем измеряли аффинности и кинетические константы kon и koff выбранных модуляторов, используя интерферометрический анализ в биослое на ForteBIO RED (ForteBIO, Inc.) со стандартной серией концентрации антигена. Наконец, аффинность выбранных модуляторов измеряли с помощью поверхностного плазменного резонанса (Biacore System, GE Healthcare). На основании стандартной серии концентрации антигена и используя 1:1 модель связывания Ленгмюра, определяли Kd связывания антитела с антигеном и кинетические константы kon и koff. В общем случае, выбранные модуляторы демонстрировали относительно высокие аффинности в наномолярном диапазоне.
Что касается биннинга антител, ForteBio использовали в соответствии с инструкциями производителя, чтобы идентифицировать антитела, которые связываются с теми же или другими бинами (bins). В кратком изложении, антитело (Ab1) было захвачено антимышиным захватывающим чипом, затем для блокирования чипа использовали высокую концентрацию несвязывающего антитела и получали исходный уровень. Мономерный, рекомбинантный эфрин-А4-His был затем захвачен специфическим антителом (Ab1) и с помощью наконечника, опущенного в лунку, было добавлено такое же антитело (Ab1) в качестве контроля или другое антитело (Ab2). Если с новым антителом наблюдалось дополнительное связывание, тогда Ab1 и Ab2 определяли, как относящиеся к разным бинам. Если не происходило дополнительного связывания, аналогичного контрольному Ab1, тогда Ab2 определяли, как относящийся к тому же бину. Этот процесс может быть распространен на скрининг больших библиотек уникальных антител с использованием целого ряда антител, представляющих уникальные бины в 96-луночном планшете. Этот эксперимент показал, что подвергнутые скринингу антитела связываются по меньшей мере с тремя различными бинами или эпитопами на белке EFNA4.
Чтобы определить, содержит ли эпитоп, узнаваемый модулятором эфрина А4, соседние аминокислоты или он образован несоседними аминокислотами, ставшими соседними из-за вторичной структуры антигена, был выполнен Вестерн-блоттинг в восстанавливающих и невосстанавливающих условиях. В частности, используя стандартные, хорошо известные в данной области методы электрофореза, антиген эфрин А4 в обоих состояниях был подвергнут воздействию выбранного модулятора. Как показано на Фиг.8А, большинство модуляторов эфрина А4 по существу взаимодействовали только с антигеном, где дисульфидные связи были неповрежденными (NR), в то время как два модулятора взаимодействовали как с невосстановленным, так и с восстановленным антигеном (NR/R). Для этих антител использовали мембрану Pepspot (JPT), чтобы определить границы антительного узнавания пептидом. Было обнаружено, что SC4.22 и SC4.91 узнают последовательность QRFTPFSLGFE (SEQ ID NO:164) и RLLRGDAWE (SEQ ID NO:165) соответственно. Повторная проверка способности этих пептидов связывать интересующие пептиды, выполненная посредством ELISA, подтвердила, что антитела действительно были специфичными к этим эпитопам.
Наконец, перекрестная реактивность в отношении гомологов эфринов А4 яванского макака оценивали в ForteBIO, используя серию концентраций с рекомбинантно экспрессируемыми, мономерными антигенами эфринами А4. Как показано на Фиг.8А, выбранные модуляторы взаимодействовали с гомологами. В частности, SC4.5, SC4.15, SC4.91 и SC4.105 перекрестно взаимодействовали с мышиным эфрином А4, в то время как все антитела перекрестью взаимодействовали с очень похожим эфрином А4 яванского макака. ND в таблице указывает, что данные не были определены.
8(б) Характеристики гуманизированного модулятора
Используя методы, представленные выше в данном Примере, гуманизированные конструкции hSC4.15, hSC4.22 и hSC4.47 анализировали, чтобы определить их связывающие характеристики. Кроме того, связывание гуманизированного антитела непосредственно сравнивали с родительским мышиным антителом для обоих антител, чтобы определить какие-либо незначительные изменения в константах скоростей, вызванные процессом гуманизации.
Более конкретно, аффинность мышиного SC4.47 измеряли посредством Biacore, используя поверхностный плазменный резонанс (SPR) с получением результатов, представленных на Фиг.8Б. На основании серии концентраций 25, 12,5 и 6,25 нМ (образующих кривые сверху вниз на Фиг.8Б и 8В) и использования 1:1 модели связывания Ленгмюра, было определено, что Кд связывания антитела с антигеном составляет 1,1 нМ. Аналогичные эксперименты, проведенные затем с гуманизированными конструкциями, показали аналогичные результаты (Фиг.8В), указывая на то, что процесс гуманизации не оказывал негативного воздействия на аффинность. В связи с этим, измерения показали, что гуманизированная конструкция имела Kd<1×10-10, что по существу было идентично родительскому мышиному антителу.
Наряду с другими методами, представленными в этом Примере, эти измерения показали, что все гуманизированные эффекторы эфрина А4 из Примера 7 обладают желательными качествами. Как указано на Фиг.8Г, SC4.15 интенсивно перекрестно взаимодействует с мышиным гомологом эфрина А4, тем самым облегчая токсикологические исследования. Реактивность всех антител в отношении антигена яванского макака, выявленную посредством ELISA, нельзя было отличить от человеческого EFNA и, таким образом, она, по-видимому, является очень похожей.
Пример 9
Модуляторы лиганда эфрина А демонстрируют связывание с клеточной поверхностью
Супернатанты от гибридом, продуцирующих антитела, генерированные против hEFNA4-Fc, как указано выше, подвергали скринингу в отношении связывания с клеточной поверхностью, измеренного с помощью цитофлуориметрического анализа. Для демонстрации связывающих свойств антител, использовали две клеточные линии: клетки JurkatES и клетки Z138, каждая из которых, как известно, экспрессирует высокий уровень поверхностного эфрина А4. Более конкретно, шесть миллионов клеток Jurkat Е6, окрашенных красителем для маркирования клеток CFSE (карбоксифлуоресцеина диацетата сукцинимидиловый эфир) (для простой идентификации) и четыре миллиона немеченых клеток Z138, инкубированных с 20 мкг/мл Fc-блокирующего реагента (Trueblock, Biolegend, Inc.), смешивали до конечной концентрации 1 миллион клеток/мл. 50 мкл этой клеточной смеси добавляли в каждую лунку к 50 мкл супернатанта, содержащего антитело, и инкубировали в течение 60 минут при 4°С. Клетки однократно промывали PBS, содержащим 2% FBS, 2 мМ EDTA и 0,05% азида натрия (промывочный буфер) и затем окрашивали в течение 60 минут при 4°С в темноте со специфическим к Fc-области F(ab)2-фрагментом IgG поликлонального антитела козы против мыши, конъюгированным с DyLight649 (Jackson Immuno Research). Клетки дважды промывали промывочным буфером и контрастно окрашивали 2 мкг/мл DAPI. Образцы с отрицательным контролем представляли собой мышиные антитела изотипа IgG1 (10 мкг/мл, Biolegend, Inc.) и супернатант от гибридомы (Н13.2), которая, как известно, не секретирует мышиный IgG. Образцы положительного контроля готовили с использованием 10 мкг/мл очищенного антитела (SC4.76.2, синоним Е76.2), идентифицированного раннее посредством ELISA как ЕРМА4-специфический (левая сторона на Фиг.9). Образцы собирали на FACS Canto II (BD Biosciences) в стандартных условиях и используя HTS-прикрепление. Восемьдесят четыре (84) клона из ста четырнадцати (114) были оценены, как демонстрирующие значительное связывание с клеточной поверхностью, показанное посредством проточной цитофлуориметрии в результате значительно большего окрашивания обеих линий по сравнению с отрицательными контрольными образцами. В связи с этим, на Фиг.9 показана относительная связывающая способность пятидесяти примеров супернатантов гибридом.
Пример 10
Выбранные модуляторы EFNA4 нейтрализуют связывание лиганда эфрина А4
Супернатанты от гибридом, продуцирующих антитела, которые, как известно, связываются с ЕМРА4-экспрессирующими клетками (Пример 9), тестировали на их способность блокировать связывание растворимого hEFNA4-Fc с его рецепторами (EphAs) на поверхности клеток HEK293Td. Первоначально, как видно на Фиг.10А, HEK293Td клетки демонстрируют дозозависимое связывание с hEFNA4-Fc по сравнению с антителом отрицательного контроля. Чтобы продемонстрировать нейтрализацию этого связывания, 60 мкл супернатантов анти-ЕРМА4 гибридомы инкубировали с 200 нг/мл hEFNA4-Fc, разведенного в промывочном буфере, в течение 2 часов при 4°С. Смесь затем добавляли к пятидесяти тысячам клеток HEK293Td и инкубировали в течение 1 часа при 4°С.Клетки промывали однократно промывочным буфером и затем окрашивали в течение 45 минут при 4°С в темноте со специфическим к Fc-области F(ab)2-фрагментом IgG поликлонального антитела козы против мыши, конъюгированным с DyLight649 (Jackson Immuno Research). Затем клетки дважды промывали промывочным буфером и контрастно окрашивали 2 мкг/мл DAPI. Образцы отрицательного контроля представляли собой неокрашенные клетки, окрашенные клетки с супернатантами от гибридомы, не продуцирующей IgG (H13.2), и окрашенные клетки с IgG Fcγ1 фрагментом человека. Образцы положительного контроля представляли собой hEFNA4-Fc окрашенные клетки в отсутствии супернатантов от гибридомы и hEFNA4-Fc окрашенные образцы в присутствии супернатанта гибридомы, не продуцирующей IgG (левая сторона Фиг.10Б). Образцы измеряли на FACS Canto II, как обсуждалось ранее. Как видно на Фиг.10Б, шестьдесят два (62) клона из восьмидесяти трех (83) протестированных клонов демонстрировали некоторую способность нейтрализовать связывание hEFNA4-Fc с его рецепторами на клеточной поверхности при измерении с использованием проточной цитометрии.
Пример 11
Модуляторы EFNA блокируют связывание EFNA на клеточной поверхности зависимым от концентрации образом
Для дополнительного определения способности модуляторов лигандов эфринов А по настоящему изобретению нейтрализовать активность EFNA, aHTH-EFNA4 антитела из выбранных гибридом очищали и использовали в качестве стерильных реагентов в PBS буфере. Сначала создавали полную кривую зависимости доза-ответ отдельно для человеческого и мышиного EFNA4-Fc (Recombinant Murine ephrin-A4 Fc Chimera, CF R&D Systems) отдельно в параллели для демонстрации дозо-ограниченного связывания EFNA4-Fc с клетками HEK293Td (Фиг.11А). После того, как контроль был установлен, серийные разведения анти-ЕРМА4 антител, полученных из трех типичных гибридом (то есть SC4.15.3, SC4.47.3 и SC4.76.2), инкубировали с ограничивающими концентрациями (0,1 мкг/мл и 1,0 мкг/мл) hEFNA4-Fc и mEFNA4-Fc соответственно, в промывочном буфере в течение 1 часа при 4°С. Полученные смеси реагентов затем переносили к пятидесяти тысячам клеток HEK293Td и инкубировали в течение 1 часа при 4°С.Клетки однократно промывали в промывочном буфере и затем окрашивали в течение 45 минут при 4°С в темноте со специфическим к Fc-области F(ab)2-фрагментом IgG поликлонального антитела козы против мыши, конъюгированным с DyLight649 (Jackson Immuno Research). Клетки дважды промывали промывочным буфером и контрастно окрашивали 2 мкг/мл DAPI. Образцы отрицательного контроля представляли собой неокрашенные клетки и окрашенные клетки с IgG Fcγ1 фрагментом человека. Образцы собирали на FACS Canto II, как уже упоминалось выше. На Фиг.11Б показана активность mAb SC4.15.3, которое частично ингибирует связывание человеческого и мышиного EFNA4-Fc с клетками при относительно высоких концентрациях. На Фиг.11В показана активность mAb SC4.47.3, которое почти полностью блокирует способность hEFNA4-Fc, но не способность mEFNA4-Fc, связываться с клетками. Аналогично, на Фиг.11Г показана способность модулятора лиганда эфрина А mAb SC4.76.2 существенно ингибировать способность hEFNA4-Fc связываться с клетками, и в то же время не влиять существенно на способность mEFNA4-Fc связываться с клетками. Эти результаты убедительно свидетельствуют о способности выбранных модуляторов по настоящему изобретению ингибировать связывание лигандов эфринов А с рецепторами клеточной поверхности и, таким образом, ингибировать любую ассоциированную онкогенную активность.
Пример 12
Модуляторы EFNA блокируют связывание EFNA с рецепторами EphA зависимым от концентрации образом
Как обсуждалось выше, EphA2 является известным партнером по связыванию для EFNA4. Чтобы использовать это известное взаимодействие, внеклеточный домен EphA2 сливали с Fc-участком человеческого IgG, используя стандартные способы, временно экспрессировали в клетках HEK293Td и очищали от супернатанта культуры, используя аффинную хроматографию с белком А. Как видно на Фиг.12А, гомодимер EphA2-Fc связывается дозозависимым образом с клетками Jurkat (которые, как известно, экспрессируют EFNA), в то время как Fc-участок человеческого IgG сам по себе не демонстрировал никакого связывания. Это связывание EphA2-Fc с клетками Jurkat можно ингибировать, используя модуляторы эфрина А по настоящему изобретению и, в частности, путем использования моноклональных антител к эфрину А4. С этой целью пятьдесят тысяч клеток Jurkat на лунку инкубировали с 10 мкг/мл четырех выбранных анти-ЕМРА4 антител (то есть SC4.22, SC4.31.3, SC4.47.3 и SC4.73, полученных, как описано выше) в промывочном буфере в течение 1 часа при 4°С. Мышиный IgG и отсутствие антител (данные не показаны) служили в качестве отрицательных контролей. После промывания серийные разведения EphA2-Fc добавляли к клеткам в промывочном буфере на 1 час при 4°С с получением результатов, графически представленных на Фиг.12Б. Анализ Фиг.12Б показывает, что модуляторы SC4.31.3 и SC4.47.3 существенно ингибируют связывание EphA2-Fc с EFNA4, в то время как модуляторы SC4.22 и SC4.73 демонстрируют относительно меньшее ингибирование. Для дополнительной иллюстрации способности раскрытых модуляторов ингибировать взаимодействия с рецептором, клетки Jurkat сначала инкубировали с серийными разведениями антител, затем инкубировали с 10 мкг/мл EphA2-Fc. Затем клетки промывали дважды промывочным буфером, контрастно окрашивали 2 мкг/мл DAPI и анализировали на FACS Canto II (BD Biosciences) в стандартных условиях, используя HTS-прикрепление, с получением данных, представленных на Фиг.12В. Также как Фиг.12Б, Фиг.12В демонстрирует, что модулятор mAb SC4.47.3 является относительно сильным ингибитором и эффективно блокирует связывание EphA2-Fc с EFNA4, экспрессируемым на клетках Jurkat. Для сравнения, другие модуляторы показывали несколько меньшую активность с SC4.31.3, обеспечивая небольшое ингибирование при более высоких концентрациях.
Чтобы расширить полученные сведения, было изучены взаимодействия между дополнительными модуляторами EFNA4 и рецепторами EphA. Эксперименты проводили аналогично описанному выше, за исключением того, что использовали клетки НЕК293Т, сверхэкспрессирующие EFNA4, посредством ретровирусной трансдукции (упоминаемые как клетки HEK293T.hEFNA4) (Фиг.12Г) или клетки HEK293T, сверхэкспрессирующие EFNA1, посредством ретровирусной трансдукции (Фиг.12Д). Кроме того, анализ выполняли при одной концентрации EphAx-Fc (10 мкг/мл). Данные показывают, что SC4.2, SC4.31 и SC4.47 способны блокировать связывание всех протестированных EphA-рецепторных связывающих партнеров с лигандом эфрином 4 (то есть EphA2, EphA3, EphA4, EphA6, EphA7, EphA8 и EphA10). Также установлено, что модулятор EFNA4, SC9.65, полученный в результате иммунизации против EFNA1 (как в Примере 6), обладал способностью влиять на связывание EphA1, EphA2, EphA4 и EphA7 с лигандом эфрином А1. Эти данные в сочетании с результатами других примеров, приведенных в данном описании, свидетельствуют о том, что эта способность модулятора противодействовать связыванию различных рецепторов может быть важна в обеспечении наблюдаемых терапевтических эффектов по настоящему изобретению.
Пример 13
Модуляторы человеческого эфрина А перекрестие взаимодействуют с мышиным ортологом
В свете того факта, что внеклеточные домены человеческого и мышиного лиганда эфрина А4 обладают 80%-ной идентичностью последовательности на белковом уровне, раскрытые модуляторы человеческого EFNA4 тестировали, чтобы посмотреть, ассоциируются ли они с мышиным гомологом. В частности, антительный сэндвич-ELISA использовали для определения уровня перекрестной реактивности hEFNA4-специфических моноклональных антител с их мышиным гомологом. 96-луночный планшет с высоким уровнем связывания белка покрывали 0,5 мкг/мл поликлональных IgG-антител осла против человека, специфичных к Fc-фрагменту молекулы IgG. Покрытие белком происходило в объеме 100 мкл на лунку с использованием 50 мМ натрий-карбонатного буфера (рН 9,6) в течение 16 часов инкубации при 4°С. Молекулы человеческого и мышиного EFNA4, слитые с Fcγ1-участком молекулы IgG человека (EFNA4-Fc), серийно разводили в буфере PBS, содержащем 2% (масса/объем) бычьего сывороточного альбумина (PBSA). После промывания покрытого планшета PBS буфером, содержащим 0,05% Tween20 (PBST), добавляли 100 мкл на лунку разведенного мышиного или человеческого EFNA4-Fc в PBSA на 3 часа при температуре окружающей среды. Затем планшет опять промывали PBST и 100 мкл/лунка PBSA, содержащего 10% отработанного супернатанта гибридомы или 1 мкг/мл очищенного моноклонального антитела (в качестве положительного контроля) добавляли в планшет на 1 час при температуре окружающей среды. После промывания планшета PBST, в планшет добавляли 100 мкл/лунку PBSA, содержащего 1:5000 разведение поликлонального IgG-антитела козы против мыши, специфичного к Fc-фрагменту мышиных IgG и конъюгированного с пероксидазой хрена (Jackson Immuno Research), на 30 минут при температуре окружающей среды. После интенсивного промывания посредством PBST, 100 мкл/лунку ТМВ субстрата (Thermo Fisher) добавляли к лункам на 15 минут. Ферментативную реакцию останавливали добавлением 2 М серной кислоты в количестве 100 мкл/лунка. Поглощение в этом колориметрическом анализе измеряли при 450 нм с использованием планшет-ридера Victor (Perkin Elmer). Данные представлены в виде среднего значения поглощения плюс стандартное отклонение при использовании двух повторов. На Фиг.13А показано типичное моноклональное антитело SC4.31.3, которое узнает hEFNA4, но не mEFNA4. С другой стороны, на Фиг.13Б показано связывание типичного моноклонального антитела SC4.91.4, которое узнает и человеческий и мышиный EFNA4.
Для подтверждения этих результатов выполняли анализ с использованием гуманизированного модулятора эфрина А4, DSC4.15. Более конкретно, титрованными количествами человеческого и мышиного эфрин-А4-His покрывали 96-луночные планшеты с высоким связыванием белка в PBS при 4°С в течение 16 часов. После блокирования планшетов в течение 2 часов при температуре окружающей среды в PBSA, добавляли 0,5 мкг/мл hSC4.15 модулятора на 2 часа в PBSA. ELISA выполняли, как описано выше, используя поликлональное IgG-антитело осла против человеке, конъюгированное с пероксидазой хрена (Jackson Immuno Research). На Фиг.13В показано, что модулятор hSC4.15 одинаково хорошо узнает как человеческий, так и мышиный лиганд эфрин А4, это указывает на то, что раскрытые гуманизированные модуляторы полностью совместимы с данным руководством.
Пример 14
Экспрессия лиганда эфрина А в типичных образцах опухоли, субпопуляциях опухолевых клеток и гемопоэтических клетках После документального подтверждения повышенного уровня экспрессии генов и генерации антител против EFNA4 в предыдущих Примерах, искали свидетельство экспрессии соответствующего белка EFNA4 в выбранных клеточных популяциях. В этом отношении, были представлены обращено-фазовые панели лизата опухолевого белка (ProteoScan Arrays; OriGene Technologies), содержащие 4 разведения 432 лизатов ткани из 11 типов опухоли или их соответствующую соседнюю ткань, наряду с контролями, состоящим из клеток HEK293 без или с ТР53-сверхэкспрессией, обеспечиваемой экзогенным промотором. Экспрессию белка EFNA4 в лизатах в этой панели определяли, используя мышиное моноклональное EFNA4-антитело по настоящему изобретению, который узнает белок EFNA4, посредством Вестерн-блоттинга (например, клон Е47.3, синоним SC4.47.3). Реагенты и протоколы для колориметрического обнаружения были предоставлены производителем ProteoScan Arrays, пятна на полученной панели были преобразованы в цифровые изображения с использованием планшетного сканера с помощью программного обеспечения BZScan2 Java (INSERM-TAGC) для количественного определения интенсивности пятна.
Некоторые результаты таких анализов показаны на Фиг.14, и они свидетельствуют, что экспрессия белка EFNA4 активирована в образцах колоректальной опухоли. В частности, на Фиг.14А показано, что экспрессия белка EFNA4 оказывается значительно более высокой в подгруппе образцов колоректальной опухоли; особенной у пациентов с IV стадией заболевания, по сравнению с нормальной соседней тканью или образцами опухолевой ткани, полученными на ранних стадиях заболевания. Данные были получены, как описано выше, и представлены в виде средней интенсивность пикселей на пятно (интенсивность пятна). Горизонтальная черная полоса в каждом образце представляет среднее значение для образцов в каждой соответствующей категории.
После подтверждения того, что белок EFNA4 активирован в некоторых колоректальных цельноклеточных опухолевых лизатах, выполняли тесты, чтобы установить, что та же мишень экспрессировалась на опухоль-инициирующих клетках. Более конкретно, чтобы определить, можно ли обнаружить экспрессию белка EFNA4 на клеточной поверхности опухоль-инициирующих клеток, опухоли расщепляли, как описано выше для проточной цитометрии. После того, как образец опухоли (например, колоректальной клеточной линии CR33, как в Примере 2) был расщеплен до одноклеточной суспензии, ее инкубировали при 37°С в течение 24 часов для облегчения реэкспрессии антигена (из-за ферментативной чувствительность EFNA4-антигена к коллагеназе/гиалуронидазе) и затем окрашивали фикоэритрин(РЕ)-конъюгированным моноклональным антителом, способным узнавать EFNA4. Затем клетки анализировали, как в предыдущих примерах, с помощью FACS Canto II (BD Biosciences) в стандартных условиях с использованием HTS-прикрепления. При проведении этих экспериментов было обнаружено, что экспрессия EFNA4 была заметно выше на субпопуляции TIC-клеток (как определено посредством совместного окрашивания клеток с антителами, узнающими TIC-определяющие клеточные поверхностные маркеры; например 46+, 324+, 66-), чем на NTG-клетках. Соответствующий результат из эксперимента с использованием колоректальных NTX-опухолевых клеток SCRX-CR33 и модулятор EFNA4 SC4.47.3 показал, что экспрессия EFNA4 была более чем в 2-раза выше на TIC-, чем на NTG-клетках (Фиг.14Б).
Для дополнительного подтверждения того, что EFNA4 относительно выше экспрессируется на TIC-клетках, клетки LU86 и LU64 культивировали in vitro в течение 10 суток и экспрессию измеряли посредством проточной цитометрией с использованием РЕ-конъюгированного SC4.47 антитела, как представлено здесь. Полученные колонии собирали и окрашивали, как описано выше. Как показано на Фиг.14Г, TIC-популяция клеток LU86 (сплошная черная линия) экспрессирует EFNA4 значительно выше контрольного изотипа (выделено серым цветом) и NTG-популяции (пунктирная черная линия) из той же опухолевой линии. Кроме того, клетки LU86, культивируемые in vivo, можно убить с помощью EFNA4-aHTHTen (как показано в Примере 16, ниже). Напротив, было обнаружено, что клетки LU64 не экспрессируют повышенных уровней EFNA4 (Фиг.14Г) и, следовательно, не были убиты анти-EFNA антителами.
Хотя считается, что экспрессия белка EFNA4 не оценивалась в образцах солидных опухолей до настоящего описания изобретения, сообщалось, что белок экспрессируется на относительно низких уровнях на В-клетках и повышен на В-клетках от пациентов с хроническим лимфоцитарным лейкозом (CLL). Для подтверждения экспрессии белков EFNA4 на нормальных мононуклеарных клетках периферической крови (РВМС), проводили анализы, как описано ранее в данном примере, с получением данных, показанных на Фиг.14В. Анализ графиков, представленных на Фиг.14В, показывает, что при измерении экспрессии EFNA4 на РВМС от нормального донора, только CD19+ В-клетки были слабо положительными, подтверждая сообщения в литературе о том, где экспрессируется EFNA4.
Эти данные подтверждают наблюдения в вышеприведенных примерах, что сверхэкспрессия EFNA4 связана с TIC и/или ТРС в колоректальном раке и может быть вовлечена в пролиферацию и/или выживаемость. Эти данные также показывают, что EFNA4 не экспрессируется на большинстве нормальных РВМС и что экспрессия на нормальных В-клетках минимальна. Принимая во внимание вышеприведенные Примеры, показывающие, что: а) экспрессия гена EFNA4 связана с субпопуляцией ТРС-клеток в колоректальном раке и онкогенной клеточной субпопуляцией в опухолях поджелудочной железы; б) что экспрессия белка EFNA4 выше на TIC-клеточной субпопуляции; в) экспрессия белка EFNA4 повышена в образцах целой опухоли на поздней стадии колоректального рака; и г) общее наблюдение, что TIC наиболее часто появляются на поздней стадии рака, представляется, что EFNA4 связан с клетками, лежащими в основе роста опухоли, устойчивости к терапевтическому лечению и рецидива опухоли, и при этом поддерживается точка зрения о возможной важной роли EFNA4 в поддержании ТРС и/или TIC в вышеупомянутых опухолях.
Пример 15
Модуляторы лиганда эфрина А интернализованы клетками K562
Учитывая профиль экспрессии лигандов эфринов А, установленный в предыдущих Примерах, были проведены анализы с целью определить, интернализуются ли модуляторы по настоящему изобретению после связывания с антигеном клеточной поверхности. Для этого супернатант гибридом, продуцирующих антитела против EFNA4-Fc в Примере, подвергали скринингу в отношении их способности интернализоваться в клетках K562, которые экспрессируют EFNA4 на низких уровнях на клеточной поверхности. Клетки K562 в начальной концентрации 106/мл (одноклеточная суспензия) блокировали с помощью Human TruStain (BioLegend, Inc.) в течение 10 минут при комнатной температуре и затем разбавляли до 5×104 клеток на лунку. Повторные образцы затем окрашивали в течение 30 минут на льду супернатантом, содержащем анти-EFNA антитела, до конечного объема 50 мкл. Затем клетки промывали FACS средой для окрашивания (FSM; 2% эмбриональной бычьей сыворотки/ буферный физиологический раствор Хэнка/25 мМ HEPES [рН 7,4]) для удаления несвязанного антитела. За этим следовало второе окрашивание Alexa647 осла против мыши (Life Technologies) в течение 30 минут на льду. Образцы снова промывали для удаления несвязанного антитела и затем повторно суспендировали в среде для интернализации (2% эмбриональной бычьей сыворотки/среда Дульбекко, модифицированная по способу Исков). Для интернализации образцы инкубировали в 5% CO2, при 37°С (или 4°С для контроля) в течение часа. Интернализацию останавливали путем перенесения образцов на лед и добавления избытка ледяного FSM. Для удаления всего антитела, которое не было интернализовано и осталось на клеточной поверхности, образцы обрабатывали фосфатным буферным физиологическим раствором с низким рН (PBS [рН 2,0]) в течение 10 минут на льду. После этой процедуры "кислотного отделения" (acid stripping) образцы интенсивно промывали FSM, ресуспендировали в 150 мкл FSM, содержащей 2 мкг/мл DAPI, и анализировали посредством проточной цитометрии (снова используя FACS Canto II (BD Biosciences) в стандартных условиях с использованием HTS-прикрепления). Любой сигнал, обнаруженный за пределами фона, являлся результатом интернализации антитела: процесс, который защищает флуоресцентный конъюгат от удаления с клеточной поверхности во время кислотного отделения. Все инкубации проводили в FSM, если не указано иное.
Скрининг 159 клонов супернатантов ЕРМА4-антителосодержащей гибридомы с использованием протокола кислотного отделения, описанного выше, показал, что многие супернатанты демонстрировали положительный сдвиг флуоресценции относительно IgG-антител, представляющих собой отрицательный контроль (данные не показаны). Типичные клоны SC4.5, SC4.22 и SC4.73, например, демонстрировали интернализацию, поскольку супернатанты из этих клонов были способны интернализировать и защищать вторичное антитело А1еха647 от кислотного отделения (Фиг.15А). По сравнению с IgG контролями, приблизительно 15% EFNA4-антителосодержащих супернатантов в разной степени индуцировали интернализацию, причем верхние девятнадцать (19) демонстрировали разницу средней интенсивности флуоресценции (MFI при 37°С по сравнению с 4°С) выше 150 (Фиг.15В). Эти данные показывают, что подгруппа модуляторов, полученных против человеческого EFNA4 ECD, связывают антиген, когда он присутствует на клетках, и способно к интернализации. Эти результаты подчеркивают потенциальную терапевтическую ценность лигандов эфринов А в качестве мишеней для модуляторов по настоящему изобретению с цитотоксическими полезными нагрузками или без них.
Анализ повторяли, используя выбранные очищенные модуляторы EFNA4 в концентрации 10 мкг/мл и клетки НЕК293Т (Фиг.15В) и HEK293T.hEFNA4 (Фиг.15Г) в качестве целевых клеток. Родительские HEK293T экспрессировали низкий уровень лиганда эфрина А4 на своей клеточной поверхности. В соответствии с протоколом, описанным выше, данные показывают, что все протестированные модуляторы эфрина А4 интернализуются после связывания с лигандом эфрином А4, экспрессируемым на поверхности клеток. Записанные значения средней интенсивности флуоресценции (MFI) для каждого образца сравнивали со стандартными шарообразными частицами (Becton Dickenson Spherotech 8-цветные радужные гранулы), содержащими восемь разных известных количеств инкапсулированного флуорофора (данные не показаны). Это позволяет трансформировать значения MFI в линейные значения и рассчитывать относительное число рецепторов на клетку.
Пример 16
Модуляторы EFNA4 в качестве нацеливающих группировок
Нацеливание цитотоксического лекарственного средства, стабильно связанного с антителом, представляет собой правомочный антительный подход, который может принести большую терапевтическую пользу пациентам с солидными опухолями. Чтобы определить, способны ли EFNA4-специфические антитела, описанные выше, опосредовать доставку цитотоксического агента в живые клетки, проводили киллинг-анализ клеток in vitro, где стрептавидин, конъюгированный с рибосома-инактивирующим белком сапорином (Advanced Targeting Systems) был соединен с биотинилированными ЕРМА4-антителами, и способность этих комплексов с сапорином к интернализации и киллингу клеток измеряли через 72 часов путем измерения жизнеспособности клеток.
Более конкретно, 105 клеток Z138 на лунку помещали в лунки 96-луночного планшета. AHTH-EFNA4 антитела, описанные выше, очищали от супернатантов, биотинилировали и затем разбавляли до 20 мкг/мл. Клеточная линия Z138 (АТСС CRL-3001) была получена от пациента с лимфомой мантийных клеток и экспрессировала небольшие количества EFNA4. Аликвоту каждого антитела соответственно смешивали в соотношении 1:1 с стрептавидин-ZAP (Advanced Targeting Systems), встряхивали в течение 5 секунд и затем инкубировали при комнатной температуре в течение 1 часа. Затем были приготовлены два дополнительных серийных 10-кратных разведения комплексов антитело-сапорин и 50 мкл каждой смеси соответственно добавляли в лунки с клетками Z138. Затем смесь клетки/антитело-сапорин инкубировали при 37°С/5% CO2 в течение 24 часов. После этой инкубации клетки центрифугировали в 96-луночных планшетах с круглым дном, супернатант удаляли, и в каждую лунку добавляли 100 мкл свежей культуральной среды. Затем клетки инкубировали в течение еще 72 часов и число жизнеспособных клеток было подсчитано с использованием CellTiter-Glo (Promega Corp.) в соответствии с протоколом производителя.
Используя этот протокол, было показано, что некоторые антитела, которые были способны к интернализации, как описано в предыдущем Примере, также были способны опосредовать клеточную гибель in vitro (данные не показаны), в то время как биотинилированный изотип контрольного антитела был не в состоянии убивать клетки. Это означает, что некоторые из этих интернализирующихся модуляторов были способны опосредовать интернализацию токсина сапорина, что приводило к клеточной гибели. На Фиг.16А показана эта способность убивать клетки для типичного интернализирующего модулятора SC4.5.3, где наклон кривой вниз представляет гибель клеток зависимым от концентрации образом по сравнению с контролем. Эти данные четко демонстрируют эффективность раскрытых модуляторов, действующих в качестве векторов для селективной интернализации цитотоксических полезных нагрузок в онкогенных клетках, экспрессирующих лиганды эфрины А.
Для подтверждения этих результатов и определения, могут ли эффекторы EFNA4 опосредовать интернализацию токсина и клеточную гибель первичных человеческих опухолевых клеток, мышиную линию истощенных NTX-клеток (то есть человеческие опухолевые клетки, размноженные в виде ксенотрансплантатов на низком пассажном уровне в мышах с ослабленным иммунитетом) высевали и затем подвергали воздействию анти-ЕРМА4 антител и Fab-ZAP.
Более конкретно, NTX-опухоли, представляющие собой образцы опухоли легкого и кожи, расщепляли до одноклеточной суспензии и помещали на планшеты BD Primaria™ (BD Biosciences) в бессывороточной среде с добавлением фактора роста, как известно в данной области. Через 3-5 суток культивирования при 37°С/5% CO2/5% O2, клетки приводили в контакт с контролем (IgG1 или IgG2b) или мышиным модулятором EFNA4 (1 нМ SC4.5, SC4.22, SC4.47 или SC4.91) и Fab-ZAP (40 нМ). Затем модулятор-опосредованную сапорин индуцированную цитотоксичность оценивали путем количественного определения оставшегося числа клеток с использованием CellTiter Glo через 5-7 суток. Как видно на Фиг.16Б, воздействие EFNA4-антитела привело к снижению числа клеток LU86, в то время как контрольное антитело изотипа IgG2b и IgG1 не влияло на число живых клеток после воздействия. На Фиг.16В воздействие SC4.5, SC4.47, SC4.91 антител привело к снижению числа клеток SK19, в то время как контрольные изотипы и SC4.22 были неэффективными. Эти данные не только показывают, что типичные антитела, описанные здесь, являются специфические к EFNA4, способны связываться с ЕРМА4-антигеном на клеточной поверхности и облегчают доставку цитотоксической полезной нагрузки, что приводит к клеточной смерти, но вышеприведенные данные также демонстрируют, что многие анти-EFNA4 антитела могут опосредовать гибель многих NTX-опухолевых клеток.
В варианте вышеупомянутого киллинг-анализа доставка цитотоксической полезной нагрузки посредством модуляторов EFNA была продемонстрирована для дополнительных антител и в дополнительных клетках. 2000 клеток/лунка следующих типов клеток высевали в 96-луночные планшеты для культуры тканей в соответствующей им культуральной среде за сутки до добавления антител и токсина: клетки НЕК293Т (Фиг.16В), клетки HEK293T.hEFNA4 (Фиг.16Г). Очищенные ("голые") мышиные моноклональные антитела d различных концентрациях и фиксированной концентрации 10 нМ антимышиного IgG Fab-фрагмента, ковалентно связанного с сапорином (Advanced Targeting Systems, #IT-48), добавляли к культурам на 72 часа. Число жизнеспособных клеток подсчитывали, как описано выше. Необработанные значения люминесценции с использованием культур, содержащих клетки с сапорин-Fab-фрагментом, были установлены в качестве 100% контрольных значений, и все другие подсчеты рассчитывали соответственно (упоминаются как "нормализованные RLU (относительные световые единицы)").
С помощью этого анализа авторы изобретения могут продемонстрировать, что все тестируемые EFNA-антитела, но не антитела с контрольным изотипом, способны убивать целевые клетки. Этот анализ также демонстрирует, что интернализация происходит исключительно из-за связывания ЕРМА4-антитела с поверхностью клетки без необходимости в дополнительном сшивании. Наконец, данные показывают, что модуляторы EFNA убивают только клетки, которые экспрессируют достаточное количество EFNA на своей поверхности. Родительские клетки НЕК293Т экспрессируют небольшое число EFNA на своей клеточной поверхности, в то время как клетки HEK293T.hEFNA4 экспрессировали этот лиганд в значительной степени (см. Фиг.15В и 15Г из предыдущего Примера). На Таблице 5 ниже перечислены значения половины максимально эффективной концентрации (обычно называемые "ЕС50") для всех комбинаций тестируемое антитело/целевая клетка. В дополнение к вышеупомянутым клеточным линиям, клетки РСЗ (АТСС CRL-1435), клеточную линию, полученную из человеческой аденокарциномы, использовали в качестве целевой клетки.
|
В другом варианте in vitro Киллинг-анализа гуманизированные модуляторы EFNA тестировали на их способность к интернализации и доставки цитотоксической полезной нагрузки. Анализ выполняли так, как описано выше, за исключением того, что помещали только 500 клеток/лунка и добавляли к культурам Fab-фрагмент IgG против человека, ковалентно связанный с сапорином (Advanced Targeting Systems, #IT-51). На Фиг.16Е показано, что гуманизированные (Hz на Фиг.16Д) модуляторы EFNA, описанные в Примере 7, способны связываться с лигандом эфрином А4, экспрессируемым на поверхности целевых клеток и индуцировать интернализацию EFNA вместе со связанным антителом и цитотоксической полезной нагрузкой.
В еще одном варианте in vitro киллинг-анализа гуманизированный модулятор EFNA hSC4.15, который, как показано, одинаково хорошо связывается с мышиным и человеческим EFNA (см. Фиг.13В), тестировали на его способность к интернализации и доставке цитотоксической полезной нагрузки в клетки HEK293T, сверхэкспрессирующие человеческий или мышиный EFNA. Для обеспечения непосредственного сравнения, клетки, трансдуцированные лентивирусами, окрашивали с помощью hSC4.15 и сортировали посредством FACS по умеренной экспрессии либо человеческого, либо мышиного эфрина А4 (данные не показаны). Киплинг-анализ выполняли так, как описано выше. На Фиг.16Е показано, что гуманизированный SC4.15 модулятор одинаково хорошо убивает клетки, экспрессирующие мышиный или человеческий EFNA.
Пример 17
Модуляторы EFNA обнаруживают секретируемый лиганд эфрин А
Как обсуждалось довольно подробно выше, EFNA4 может существовать в виде GPI-связанной молекулы, соединенной с клеточной мембраной, или в виде секретируемых усеченных лигандов или изоформ. Обнаружение этих секретируемых соединений в биологическом материале, таком как жидкости организма или среды для культивирования клеток, может быть полезным для диагностических целей или в качестве вспомогательного средства при ведении пациентов (применение в качестве биомаркеров). Например, предполагалось, что секретируемый EFNA4 можно обнаружить в повышенных концентрациях у пациентов с В-клеточным хроническим лимфолейкозом (B-CLL) (Alonso-C LM et al., 2009, Leukemia Research 33: 395-406). Для того чтобы продемонстрировать такие предпочтительные аспекты по настоящему изобретению, раскрытые модуляторы использовали для узнавания неперекрывающихся эпитопов очищенного EFNA4 и, как правило, обнаруживали и количественно определяли секретируемые лиганды EFNA в выбранных опухолевых образцах. В отношении этого последнего аспекта настоящего изобретения, модуляторы EFNA использовали для обнаружения и количественного определения секретируемого лиганда эфрина А в человеческой сыворотке (данные не показаны) и человеческой плазме, полученной из B-CLL-пациентов и из сыворотки мышей, несущих человеческие опухолевые ксенотрансплантаты (например, как описано в Примере 1 выше). В каждом случае модуляторы были способны эффективно измерять уровень лигандов, как описано непосредственно ниже.
Для обнаружения растворимого человеческого EFNA4, антитело SC4.91 абсорбировали на сильно связывающий белок микротитрационный планшет, (Greiner BioOne Microlon plates) в количестве 5 мкг/мл в 50 мМ натрий-карбонатном буфере (рН 9,6) с инкубацией в течение ночи при 4°С. После промывания планшета фосфатным буферным физиологическим раствором (PBS), содержащим 0,05% (об./об.) Tween20 (PBST), планшет блокировали в PBS, содержащем 2% (масса/объем) бычьего сывороточного альбумина (PBSA), в течение 2 часов при температуре окружающей среды. Очищенный эфрин-А4-His, временно экспрессируемый в клетках CHO-S и очищенный с использованием последовательно Nickel NTA смолы и гель-фильтрации, серийно разводили в PBSA и добавляли на 2 часа к планшету. После промывания PBST биотинилированное антитело SC4.47 добавляли в количестве 1 мкг/мл в PBSA на 1 час к планшету. Затем планшет промывали с помощью PBST и затем добавляли конъюгат стрептавидин-пероксидаза хрена (например, Jackson Immuno Research) в разведении 1:5000 в PBSA на 30 минут. Обработанный планшет затем снова промывали в PBST и добавляли раствор ТМВ-субстрата (например, Thermo Fisher) на 30 минут. Цветную реакцию останавливали добавлением равного объема 2 М серной кислоты, после чего считывали планшет, используя значения поглощения при 450 нм, в стандартном планшет-ридере. Результаты этих экспериментов показаны на Фиг.17А-В.
Используя методы, описанные непосредственно выше, концентрацию растворимого эфрина-A4-His наносили на график в зависимости от значений оптического поглощения с получением кривых, показанных на Фиг.17А. В частности, первая кривая показывает результаты измерений поглощения для концентраций растворимого EFNA4 0-40 пг/мл, в то время как на вставке показана та же кривая для концентраций 0-1000 пг/мл. Специалистам в данной области понятно, что стандартные кривые, показанные на Фиг.17А, можно использовать для обеспечения чрезвычайно чувствительного анализа для измерения концентраций EFNA4 в биологических образцах.
Используя преимущества вышеуказанных измерений и нелинейную регрессию (программное обеспечение Prism 5, Graphpad), рассчитывали концентрацию эфрина А4 в неизвестных образцах. В связи с этим, в образцах плазмы из четырех здоровых взрослых людей, четырех пациентов с диагнозом В-клеточного хронического лимфолейкоза (B-CLL) и четырех пациентов с диагнозом множественной миеломы (ММ) определяли концентрацию секретируемого эфрина-А4. Полученные данные позволяют предположить, что анализируемый DEFNA4 значительно выше у CLL-пациентов, чем у здоровых взрослых людей или других выбранных опухолей, полученных из В-клеток (Фиг.17Б). Кроме того, как указано ранее и показано на Фиг.17В, секретируемый DENFA4 также обнаруживают у мышей, имеющих ксенотрансплантаты колоректального рака человека. В частности, на Фиг.17В каждая точка представляет уровни секретируемого hEFNA4 в сыворотке, полученной из различных мышей. Напротив, уровни секретируемого hEFNA4 в сыворотке мышей без ксенотрансплантатов были по существу необнаружимыми (данные не показаны). Еще более неожиданно, что при нанесении на график зависимости объема опухоли от концентрации hEFNA4 в образцах сыворотки, наблюдалась существенная корреляция, позволяющая предположить, что секретируемый анализируемый компонент может быть особенно полезным для мониторинга опухолевого роста опухоли определенных солидных опухолей человека in vivo. В целом, эти результаты убедительно указывают на применимость настоящего изобретения как в терапии, так и для диагностики.
Используя вышеописанный метод, образцы плазмы из 23 нормальных доноров-людей, полученные из банка крови, использовали для определения диапазона концентрации этого анализируемого компонента у здоровых взрослых людей. Как показано на Фиг.17Г, была найдена средняя концентрация - 332 пг/мл EFNA4 (стандартное отклонение 6,2 пг/мл). Это указывает на то, что EFNA секретируется или выделяется в очень низкой и жестко регулируемой концентрации и делает EFNA идеальным биомаркером или диагностическим маркером для мониторинга развития заболевания или диагностики EFNA-ассоциированных расстройств.
Чтобы дополнительно исследовать эту возможность, коммерчески приобретенные образцы сыворотки от 17 пациентов с колоректальным раком и 10 образцов от пациентов с немелкоклеточным раком легких сравнивали с 12 образцами здоровых взрослых людей, где концентрацию EFNA4 определяли, используя описанный выше способ. Как показано на Фиг.17Д, пациенты и с колоректальным раком, и с немелкоклеточным раком легких имели значительно повышенные уровни циркулирующего в их крови EFNA4. При использовании непарного t-теста, сравнение между здоровыми взрослыми и пациентами с колоректальным раком достигло р-значения 0,0002, а между здоровыми взрослыми и пациентами с немелкоклеточным раком легких - 0,01. Эти данные показывают, что секретируемый или выделяемый EFNA4 повышен у пациентов с солидными опухолями и иллюстрируют значение применения описанных модуляторов в аналитическом тестировании или клинической диагностике.
Пример 18
Модуляторы EFNA4 могут нацеливаться на клетки, которые экспрессируют родственные EFNA-лиганды
Лигандную специфичность модуляторов EFNA4 тестировали против родственных EFNA-лигандов для оценки степени перекрестной реактивности. В качестве примера, SC4.2.1 и SC9.65 испытывали в киллинг-анализе in vitro с использованием клеток НЕК293Т, сверхэкспрессирующих EFNA4 (Фиг.17А), EFNA3 (Фиг.17Б) и EFNA1 (Фиг.17В). Следует отметить, что модулятор SC9.65 был получен путем иммунизации мыши EFNA1 -иммуногеном (в соответствии с Примером 6). Киллинг-анализ выполняли, как описано в Примере 16. На Фиг.17 показано, что SC4.2.1 способен убивать EFNA3 в дополнение к EFNA4-экспрессирующим клеткам, и SC9.65 способен убивать EFNA1- и EFNA4-экспрессирующие клетки. Эти данные показывают, что выбранные модуляторы, созданные против конкретного члена семейства EFNA, могут связываться с другими членами семейства достаточно хорошо, чтобы связывать, индуцировать интернализацию и доставлять цитотоксическую полезную нагрузку в лиганд-экспрессирующие клетки. Это открытие является в некоторой степени неожиданным, учитывая низкую степень гомологии между членами семейства EFNA (приблизительно 34-45%-ная идентичность аминокислотной последовательности между EFNA1, 2, 3 и 4 человека), и является примером того, как описано здесь, что пан-модуляторы EFNA могут быть созданы для диагностических или терапевтических целей.
Пример 19
Лиганды EFNA селективно взаимодействуют с многочисленными рецепторами EphA
Как обсуждалось выше, лиганды эфрины А, как известно, связываются с многочисленными рецепторами EphA. Для определения, какие EphA рецепторы могут взаимодействовать с EFNA4, был разработан цитофлуориметрический анализ связывания, аналогичный описанному в Примере 9. Более конкретно, растворимые рецепторы EphA, экспрессируемые в виде слитых конструкций человеческого IgG1-Fc, добавляли к пятидесяти тысячам клеток на лунку HEK293T (Фиг.19А) или клеток HEK293T, сверхэкспрессирующих EFNA4 (называемых клетки HEK293T.hEFNA4) (Фиг.19В), с помощью ретровирусной трансдукции на 1 час в буфере для окрашивания при 4°С. После промывания добавляли на один час вторичное поликлональное антитело против IgG человека, конъюгированное с Dylight 649 (Jackson Immuno Research). После двух промываний образцы ресуспендировали в буфере для окрашивания, содержащем 2 мкг/мл DAPI, и анализировали на FACS Canto II (BD Biosciences) в стандартных условиях с использованием HTS-прикрепления. На Фиг.19А и 19Б показано, что EphA2, EphA3, EphA4, EphA6, EphA7 и EphA10, но не EphA1, связываются с лигандом эфрином А4. Это еще раз указывает на преимущества и потенциал многосторонних точек действия, присущих модуляторам по настоящему изобретению.
Пример 20
EFNA4 связывается с EphB2-, но не с EphB3- и EphB4-рецепторами
Учитывая результаты, показанные в Примере 20, исследовали способность лиганда эфрина А4 связываться с EphB-рецепторами. EFNA4 был первоначально идентифицирован как CSC-связанная мишень, как показано выше в Примерах 2-4. В тканевой иерархии крипт нормальной толстой кишки мышей, рецепторы EphB2 и EphB3 экспрессируются на высоком уровне клетками, расположенными в основании крипт кишки, но не клетками, расположенными в верхней части крипт, указывая, что экспрессия EphB и передача сигналов вперед и назад через рецепторы EphB играет важную роль в организации ткани и в отдельных клеточных судьбах (Batlle et al.; 2002 PMID:12408869). Совсем недавно, экспрессию EphB2 клетками колоректального рака связали с инициацией опухоли и способностями к длительной пролиферации, предполагая, что EphB2 может служить фенотипическим маркером раковых стволовых клеток толстой кишки (Merlos-Suarez et al., 2011 PMID: 21419747). Следовательно, способность лиганда эфрина А4 связываться с любым из дифференциально экспрессирующихся рецепторов EphB, может иметь биологическую важность для стволовых клеток колоректального рака.
Используя общепризнанных методы, растворимые рецепторы EphB, экспрессируемые в виде слитых конструкций человеческого IgG1-Fc, а также EphA1-Fc (который не связывает EFNA4) и EphA2-Fc (который не сильно связывает лиганд EFANA4) были добавлены к пятидесяти тысячам клеток HEK293T (Фиг.20А) или клеток HEK293T.hEFNA4 (Фиг.20Б) на лунку на 1 час в буфере для окрашивания при 4°С. После промывания вторичные поликлональные антитела против IgG человека, конъюгированные с Dylight 649 (Jackson Immuno Research) добавляли на один час. После двух промываний образцы ресуспендировали в буфере для окрашивания, содержащем 2 мкг/мл DAPI, и анализировали на FACS Canto II (BD Biosciences) в стандартных условиях с использованием HTS-прикрепления. На Фиг.20А и 20Б показано, что EphB2, но не EphB3 и EphB4, связывается с лигандом EFNA4, еще раз подчеркивая потенциальное разнообразие терапевтических путей, на которые с пользой могут влиять раскрытые модуляторы.
Специалистам в данной области техники должно быть понятно, что настоящее изобретение может быть воплощено в других конкретных формах без отклонения от его сущности или его важных признаков. Таким образом, вышеприведенное описание настоящего изобретения раскрывают только его типичные воплощения, и следует понимать, что другие варианты рассматриваются как входящие в рамки настоящего изобретения. Соответственно, настоящее изобретение не ограничено конкретными воплощениями, которые были описаны здесь подробно. Скорее, следует обращаться к прилагаемой формуле как показателю объема и содержания данного изобретения.