Результат интеллектуальной деятельности: Способ определения активности миелопероксидазы нейтрофилов в мазках крови животных
Вид РИД
Изобретение
Изобретение относится к биохимической диагностике и касается способа определения пероксидазной активности нейтрофилов в мазках крови, что может быть использовано в прогнозировании развития заболеваний и выборе стратегии их лечения.
Установлено, что в клетках крови у клинически здоровых животных определяется высокая активность миелопероксидазы, а у больных - снижена. Активность миелопероксидазы снижена в нейтрофилах при инфекционных лейкоцитозах и некоторых метастазирующих опухолях. Определение активности миелопероксидазы клеток крови является одним из тестов иммунного статуса организма животных.
В цитологических исследованиях определение миелопероксидазы осуществляется с помощью бензидиновой пробы. Общепринятые методики основаны на окислении бензидина пероксидпероксидной системой до нестабильного бензидинового синего, который самопроизвольно превращается в стабильный бензидиновый коричневый.
Известны методы определения миелопероксидазы, описанные в научных и патентных публикациях.
Определение пероксидазы в мазках периферической крови и костного мозга человека [Graham (1966) З. Лойда, Р. Госсрай, Т. Шиблер. Гистохимия ферментов. Лабораторные методы. Пер. с англ. к.б.н. И.Б. Бухвалова, к.м.н. О.В. Копьева, под ред. проф. Н.Т. Райхлина. М.: изд. "Мир", 1982, с. 206]; Определение миелопероксидазы в крови [Справочник. Медицинские лабораторные технологии. / Под редакцией А.И. Карпищенко, издательство Санкт-Петербурга "Интермедика", 1999. Т. 2, с. 298]; «Способ выявления пероксидазы в иммунокомпетентных органах животных» [патент РФ №2198403, МПК7 G01N 33/50, C12Q 1/28, опубликован 10.02.2003, авторы Гугушвили Н.Н., Радуль Н.П., Шевкопляс В.Н.]; «Способ определения пероксидазной активности гемоглобина в плазме крови» [патент РФ №2458992, публ. 20.08.2012, авторы Горудко И.В., Панасенко О.М., Григорьева Д. В., Соколов А. В., Черенкевич С.Н., Сергиенко В.И.]; «Способ определения активности пероксидаз и субстратная смесь для определения активности пероксидаз» [патент РФ №2525137, опубликован 10.08.2014, авторы Сахаров И.Ю., Вдовенко М.М., Демьянова А.С.] и др.
Одним из недостатков перечисленных способов выявления миелопероксидазной активности является использование бензидина, который обладает канцерогенным действием.
Наиболее близким к заявляемому техническому решению по совокупности существенных признаков является способ определения миелопероксидазы в крови, включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микроскопированием, выбранный нами в качестве прототипа [Справочник. Медицинские лабораторные технологии. / Под редакцией А.И. Карпищенко, издательство Санкт-Петербурга "Интермедика", 1999. Т. 2, с. 298], включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микроскопированием.
Недостатками данного метода являются затруднительное получение растворения бензидина в органических растворителях и нагревание раствора, что влечет за собой разложение бензидина, а также отсутствие окраски ядер нейтрофилов.
Техническим результатом изобретения является снижение вредности используемых веществ, в том числе канцерогенности, т.е. изыскание безвредного вещества, не уступающего по чувствительности бензидину, а также снижение себестоимости методики.
Поставленная задача достигается тем, что в способе цитологического определения активности миелопероксидазы нейтрофилов в мазках крови животных используется реакция с метолом, которая основана на окислении метола пероксидпероксидной системой.
Для решения поставленной задачи проводят подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микроскопированием. Для приготовления буферно-инкубационной смеси используют 4-метилпарааминофенол сульфат (коммерческое название - метол) - вещество, не являющееся дефицитным, используется в сочетании с гидрохиноном для проявления фото- и кинопленки, он значительно дешевле бензидина, и что наиболее важно - безвреден для организма человека. Метол представляет собой белый порошок либо бесцветные кристаллы (крупноразмерный вариант). Достаточно неплохо растворяется в воде (растворимость составляет 5 г на 100 мл), но при этом не растворяется в органических растворителях. Метол легко окисляется под действием атомарного кислорода, который образуется при разрушении перекиси водорода. Это свойство метола используется нами в заявленном способе определения миелопероксидазы.
Подготовку биологического субстрата осуществляют, фиксируя мазки крови животных 96 об.% этиловым спиртом или в парах 40% формалина.
Для получения буферно-инкубационной смеси готовят 0,1 М трис-HCl буфер (рН 7,2-7,5). В день исследования 10 мг метола растворяют в 10 мл дистиллированной воды, к полученному раствору добавляют 13,5-14 мл 0,1 М трис-HCl буфера и 2-3 капли 1% раствора перекиси водорода и осуществляют инкубацию мазков крови в темноте в течение 5 мин. После окончания инкубации мазков крови их промывают дистиллированной водой, высушивают и дополнительно окрашивают ядра клеток 0,5%-водным раствором сафранина или нейтрального красного, что позволяет определить нейтрофилы крови по форме ядер. Окрашенные мазки крови промывают дистиллированной водой, сушат и микроскопируют, используя иммерсионный объектив светового микроскопа. Относительный процент пероксидазопозитивных нейтрофилов периферической крови животных определяют после подсчета 100 нейтрофилов. Об активности исследуемого фермента судят по количеству специфически окрашенных в коричневый цвет гранул в цитоплазме пероксидазопозитивных нейтрофилов крови животных.
Новизна обусловлена тем, что в предложенном способе используется метол, не обладающий способностью ингибировать активность миелопероксидазы гранулоцитов крови животных и не обладающий канцерогенным действием. Для сопоставления результатов и сравнения с известными методами и способами выявления миелопероксидазы с помощью бензидинового реактива проводилась микроскопия мазков крови с использованием иммерсионной системы при увеличении (90×10). Активность определяемого фермента устанавливали по интенсивности окрашивания и количеству гранул коричневого цвета в цитоплазме нейтрофилов.
При визуальной оценке цитохимической реакции учитывали различную степень активности фермента:
0-я степень - окрашено только ядро нейтрофилов, цитоплазма не окрашена, не видно контуров гранул;
1-я степень - вся цитоплазма диффузно окрашена в светло-коричневый цвет или окрашено не более 1/4 цитоплазмы;
2-я степень - в цитоплазме видны хорошо окрашенные в коричневый цвет
гранулы;
3-я степень - всю цитоплазму занимают гранулы, но ядро свободно от гранул;
4-я степень - гранулы занимают всю цитоплазму и наслаиваются на ядро.
Средний цитохимический индекс (СЦИ) выводили по следующей формуле, предварительно подсчитывая 100 нейтрофилов,
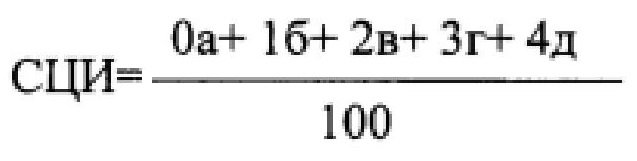
где а, б, в, г, д - количество клеток соответственно 0, 1, 2, 3, 4-й степени.
Заявляемый способ является экспресс-методом для проведения цитохимического анализа активности миелопероксидазы в нейтрофильных гранулоцитах в мазках крови животных. Способ позволяет определять как относительный процент пероксидазопозитивных нейтрофилов крови, так и внутриклеточную активность исследуемого фермента, что дает возможность оценить состояние клеточных микробицидных систем крови, принимающих участие в формировании неспецифической резистентности организма животных.
Заявляемый способ является более экономичным, т.к. метол не относится, по сравнению с бензидином, к дорогостоящим химическим реактивам.
Способ определения активности миелопероксидазы нейтрофилов в мазках крови животных, включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микроскопированием, отличающийся тем, что используют буферно-инкубационную смесь на основе 4-метилпарааминофенол сульфата.
