Результат интеллектуальной деятельности: КОНЪЮГАТ, СОДЕРЖАЩИЙ ОКСИНТОМОДУЛИН И ФРАГМЕНТ ИММУНОГЛОБУЛИНА, И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к конъюгату, содержащему оксинтомодулин и фрагмент иммуноглобулина, и его применению. Более конкретно, настоящее изобретение относится к конъюгату, содержащему оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер, и к фармацевтической композиции для предупреждения или лечения ожирения, содержащей этот конъюгат.
Предшествующий уровень техники
В последнее время экономический рост и изменения в образе жизни вызывают изменения в привычках питания. Основными причинами повышения показателей избыточного веса и ожирения у современных людей являются потребление высококалорийной пищи, такой как фастфуд, и отсутствие физической нагрузки. По оценкам Всемирной организации здравоохранения (ВОЗ) более 1 миллиарда человек во всем мире имеет избыточный вес и по меньшей мере 300 миллионов из них имеет клиническую стадию ожирения. В частности, по причине избыточного веса в Европе ежегодно умирает 250000 человек, а во всем мире ежегодно умирает более 2,5 миллионов человек (World Health Organisation, Global Strategy on Diet, Physical Activity and Health (Всемирная организация здравоохранения, Глобальная стратегия по питанию, физической активности и здоровью), 2004).
Избыточный вес и ожирение повышают кровяное давление и уровни холестерина, вызывая возникновение или обострение различных заболеваний, таких как сердечнососудистое заболевание, диабет и артрит, и также являются основными причинами увеличения коэффициентов заболеваемости артериосклерозом, гипертензией, гиперлипидемией или сердечнососудистым заболеванием как у детей или подростков, так и у взрослых.
Ожирение представляет собой тяжелое состояние, которое во всем мире приводит к различным заболеваниям. Считается, что оно может быть преодолено благодаря индивидуальным усилиям, и также полагают, что страдающим ожирением пациентам не хватает самоконтроля. Однако лечить ожирение трудно, поскольку ожирение представляет собой комплексное расстройство, затрагивающее регуляцию аппетита и энергетический обмен. Для лечения ожирения следует лечить аномальные процессы, связанные с регуляцией аппетита и энергетическим обменом, вместе с усилиями страдающих ожирением пациентов. Сделано много попыток разработать лекарственные средства, которыми можно лечить такие аномальные процессы. В результате этих усилий были разработаны такие лекарственные средства, как римонабант (Sanofi-Aventis), сибутрамин (Abbott), контрав (Takeda) и орлистат (Roche), однако они имеют такие недостатки, как серьезные неблагоприятные эффекты или очень слабый эффект против ожирения. Например, сообщалось, что римонабант (Sanofi-Aventis) проявляет побочный эффект в виде расстройства центральной нервной системы, сибутрамин (Abbott) и контрав (Takeda) демонстрируют побочные эффекты, связанные с сердечнососудистой системой, а для орлистата (Roche) показано уменьшение массы тела только на 4 кг при приеме его в течение 1 года. К сожалению, нет никаких терапевтических средств для лечения ожирения, которые можно без риска назначать страдающим ожирением пациентам.
Было проведено много исследований для разработки терапевтических средств для лечения ожирения, которые не имеют проблем, характерных для традиционных лекарственных средств против ожирения. В последнее время большое внимание привлекли производные глюкагона. Глюкагон продуцируется поджелудочной железой, когда уровень глюкозы в крови падает в результате приема других лекарственных средств или вследствие заболеваний, гормональной или ферментной недостаточности. Глюкагон стимулирует расщепление гликогена в печени и способствует высвобождению глюкозы, повышая уровни глюкозы в крови до нормального диапазона. Помимо действия по увеличению уровня глюкозы в крови глюкагон подавляет аппетит и активирует гормоночувствительную липазу (HSL) адипоцитов, что способствует протеканию липолиза, тем самым демонстрируя эффекты против ожирения. Одно из производных глюкагона, глюкагоноподобный пептид-1 (GLP-1), находится в стадии разработки в качестве терапевтического средства для лечения гипергликемии у пациентов с диабетом, и его действие заключается в стимуляции синтеза и секреции инсулина, ингибировании секреции глюкагона, замедлении опорожнения желудка, усилении утилизации глюкозы и подавлении потребления пищи. Эксендин-4 выделяют из яда ящерицы, он имеет приблизительно 50% гомологии аминокислотной последовательности с GLP-1, и также сообщается, что он активирует рецептор GLP-1, тем самым принося улучшение при гипергликемии у пациентов с диабетом. Однако сообщается, что лекарственные средства против ожирения, в том числе GLP-1, демонстрируют такие побочные эффекты, как рвота и тошнота.
Ввиду этого, в качестве альтернативы GLP-1 большое внимание было сфокусировано на оксинтомодулине, пептиде, происходящем от предшественника глюкагона, преглюкагона, который связывается с рецепторами двух пептидов, GLP-1 и глюкагона. Оксинтомодулин представляет собой сильнодействующую терапию ожирения, поскольку он подавляет потребление пищи подобно GLP-1, стимулирует насыщение и проявляет липолитическую активность подобно глюкагону.
С учетом двойной функции пептида оксинтомодулина проводилось его активное исследование в качестве лекарственного средства для лечения ожирения. Например, в патенте Кореи №925017 описана фармацевтическая композиция, включающая в себя оксинтомодулин в качестве активного ингредиента для лечения людей с избыточным весом, которую вводят пероральным, парентеральным, мукозальным, ректальным, подкожным или трансдермальным способом. Однако сообщалось, что это лекарственное средство против ожирения, включающее в себя оксинтомодулин, имеет короткий период полураспада in vivo и слабую терапевтическую эффективность даже при введении большой дозы три раза в сутки. Так, было сделано много усилий для улучшения периода полураспада in vivo или терапевтического эффекта оксинтомодулина в отношении ожирения посредством его модификации.
Например, двойной агонист оксинтомодулин (Merck) получают путем замены L-серина на D-серин в положении 2 оксинтомодулина для повышения устойчивости к дипептидилпептидазе-IV (DPP-IV) и путем присоединения холестериновой группировки на С-конце для одновременного увеличения периода полураспада в крови. ZP2929 (Zealand) получают путем замены L-серина на D-серин в положении 2 для усиления устойчивости к DPP-IV, замены аргинина на аланин в положении 17 для усиления устойчивости к протеазе, замены метионина на лизин в положении 27 для повышения устойчивости к окислению и замены глутамина на аспарагиновую кислоту и аланин в положениях 20 и 24 и аспарагина на серин в положении 28 для повышения устойчивости к деамидированию. Однако даже несмотря на то, что период полураспада двойного агониста оксинтомодулина (Merck) был увеличен примерно на 8-12 минут по сравнению с периодом полураспада нативного оксинтомодулина, его период полураспада in vivo 1,7 ч остается все еще очень коротким, и доза его введения также составляет до нескольких мг/кг. К сожалению, оксинтомодулин или его производные имеют недостатки, заключающиеся в необходимости ежесуточного введения высокой дозы вследствие короткого периода полураспада и низкой эффективности.
Описание изобретения
Техническая проблема
Соответственно, авторами настоящего изобретения приложено много усилий для разработки способа увеличения периода полураспада в крови оксинтомодулина при сохранении его активности in vivo. В результате они обнаружили, что конъюгат, полученный путем связывания носителя с оксинтомодулином с использованием непептидильного полимера, демонстрирует улучшенный период полураспада в крови при сохранении активности in vivo, показывая, таким образом, превосходные эффекты против ожирения, в чем и состоит настоящее изобретение.
Решение проблемы
Задача настоящего изобретения заключается в том, чтобы предложить конъюгат, содержащий оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер.
Задача настоящего изобретения также заключается в том, чтобы предложить фармацевтическую композицию, содержащую эти конъюгаты, для предупреждения или лечения ожирения.
Кроме того, задача настоящего изобретения заключается в том, чтобы предложить способ предупреждения или лечения ожирения, включающий стадию введения такого конъюгата или такой композиции субъекту.
Задача настоящего изобретения также заключается в том, чтобы предложить применение конъюгата или композиции в изготовлении лекарственных средств для предупреждения или лечения ожирения.
Полезные эффекты изобретения
Конъюгат, содержащий оксинтомодулин и Fc-область иммуноглобулина по настоящему изобретению, снижает потребление пищи, подавляет опорожнение желудка и способствует липолизу без побочных эффектов в отличие от нативного оксинтомодулина, и также демонстрирует превосходные рецептор-активирующие эффекты и долговременную устойчивость по сравнению с оксинтомодулином. Таким образом, его можно широко использовать для безопасного и эффективного лечения ожирения. В отличие от нативного оксинтомодулина, новый пептид по настоящему изобретению снижает потребление пищи, подавляет опорожнение желудка и способствует липолизу без побочных эффектов и также демонстрирует превосходные рецептор-активирующие эффекты. Таким образом, его можно широко использовать для безопасного и эффективного лечения ожирения.
Краткое описание графических материалов
ФИГ.1 представляет собой график, показывающий изменения в потреблении пищи в соответствии с введенной дозой оксинтомодулина (ОХМ) или производного оксинтомодулина.
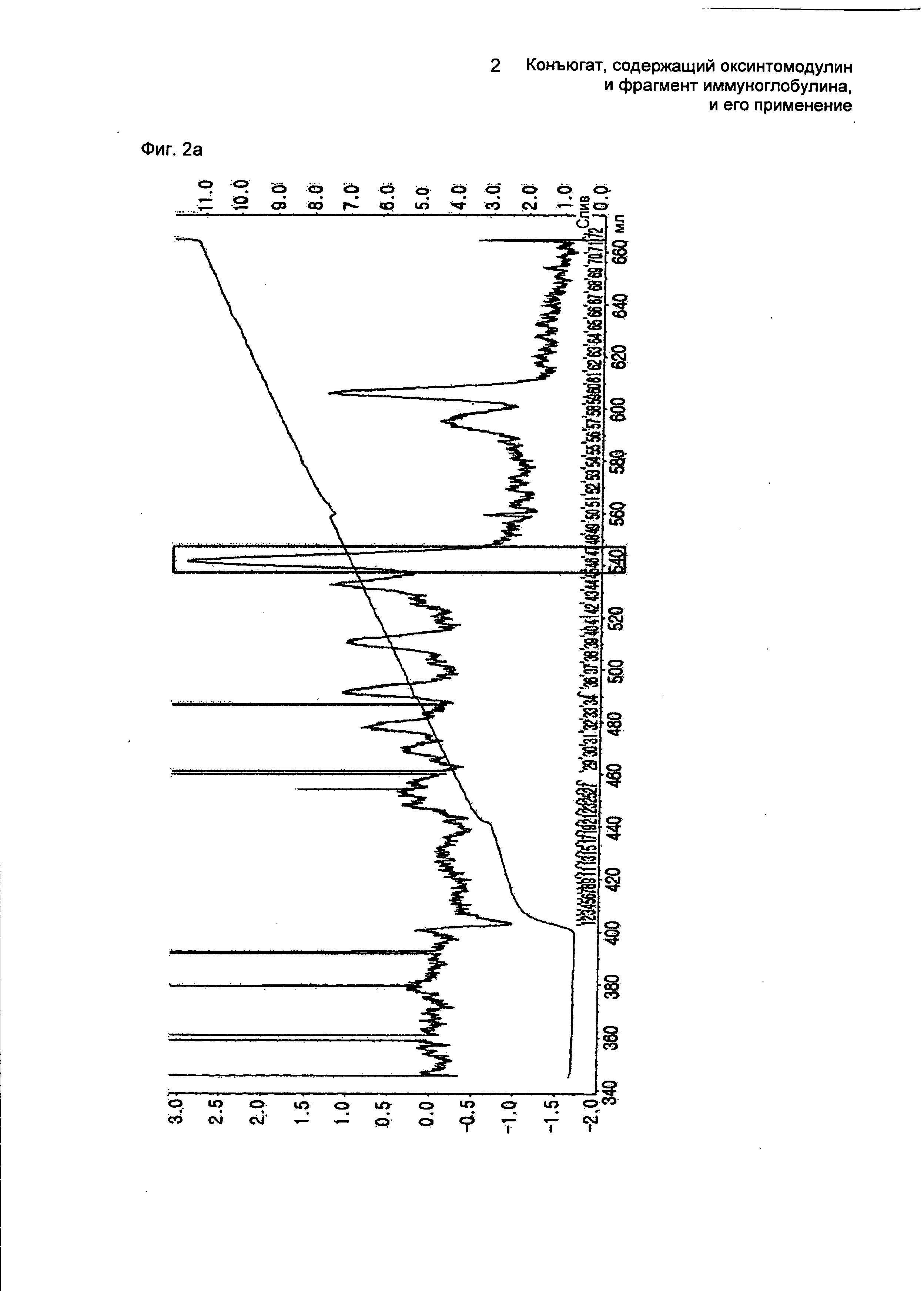
ФИГ.2а представляет собой график, показывающий результат очистки моно-ПЭГилированного оксинтомодулина на колонке для очистки SOURCE S.
ФИГ.2b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного оксинтомодулина.
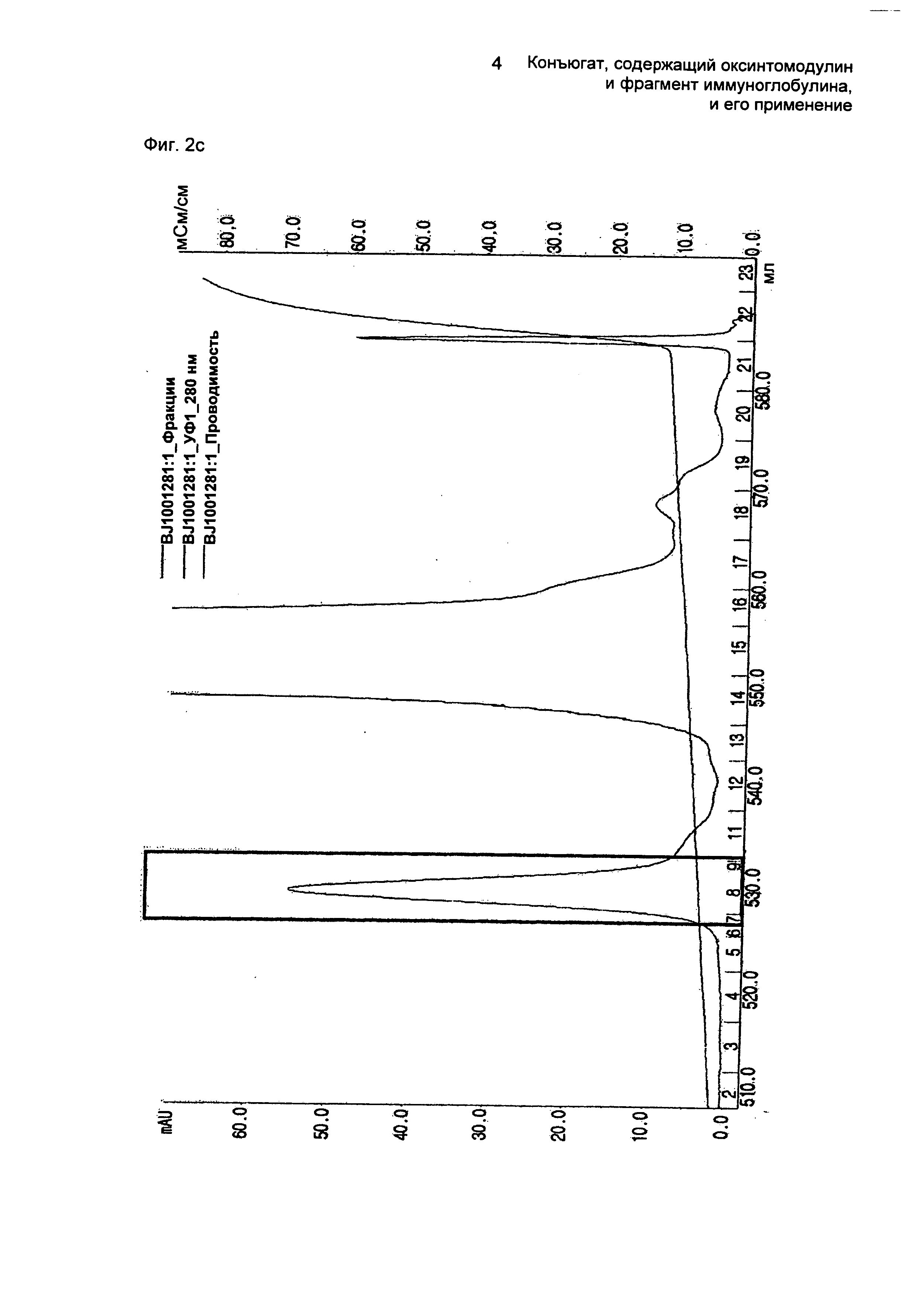
ФИГ.2c представляет собой график, показывающий результат очистки конъюгатов, содержащих оксинтомодулин и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.3а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 29) на колонке для очистки SOURCE S.
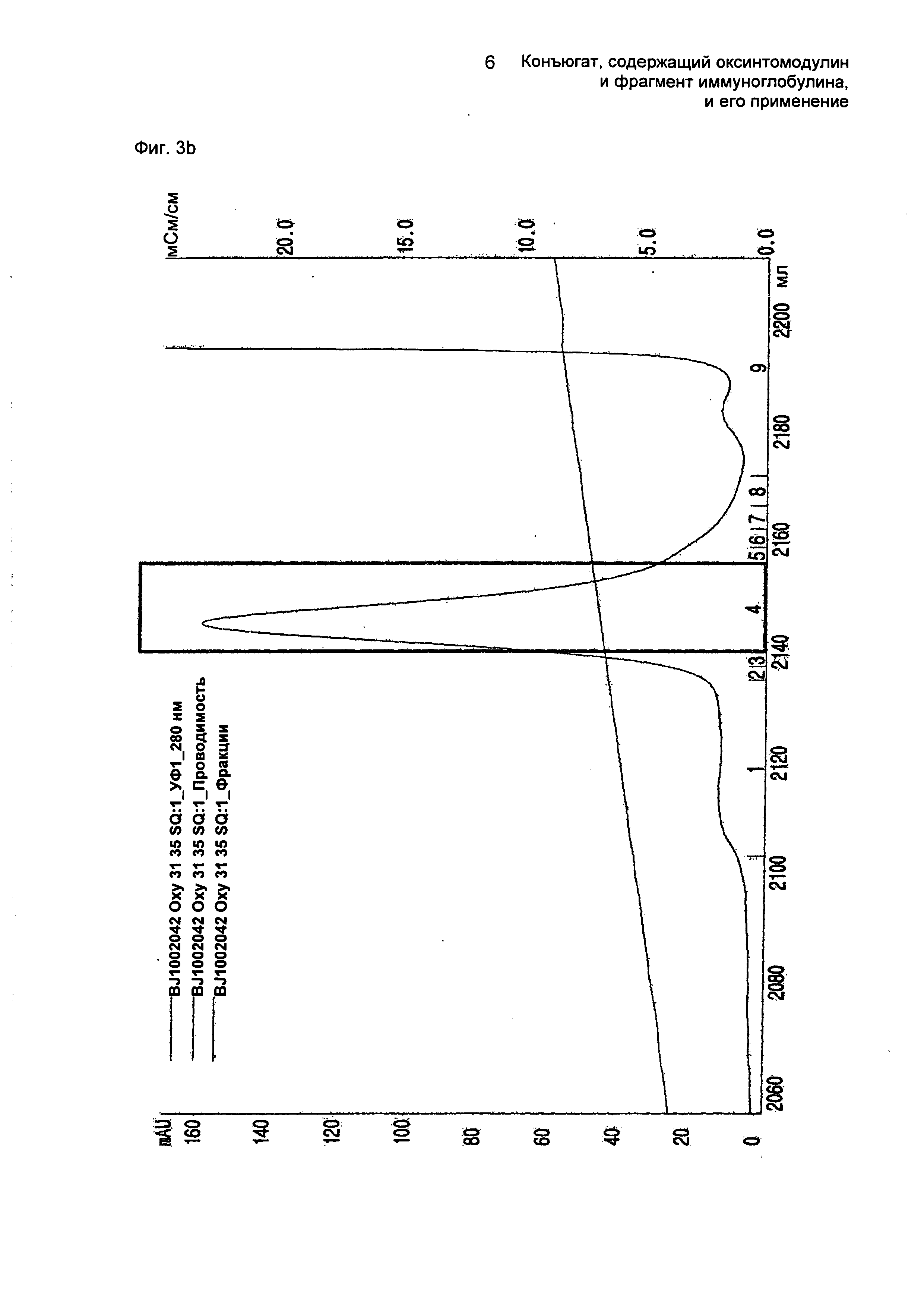
ФИГ.3b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 29) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.4а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30) на колонке для очистки SOURCE S.
ФИГ.4b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30).
ФИГ.4c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 30) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
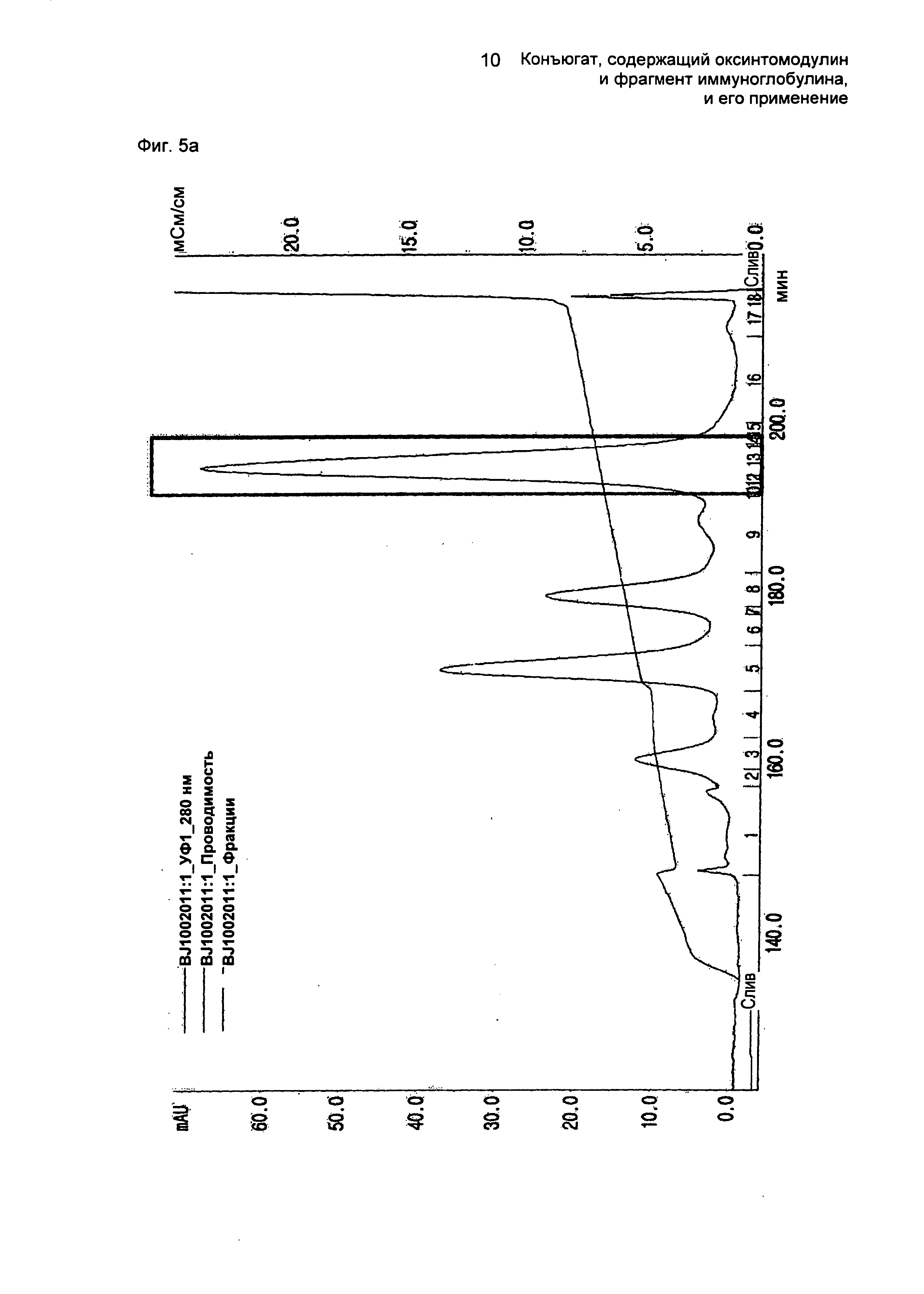
ФИГ.5а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 31) на колонке для очистки SOURCE S.
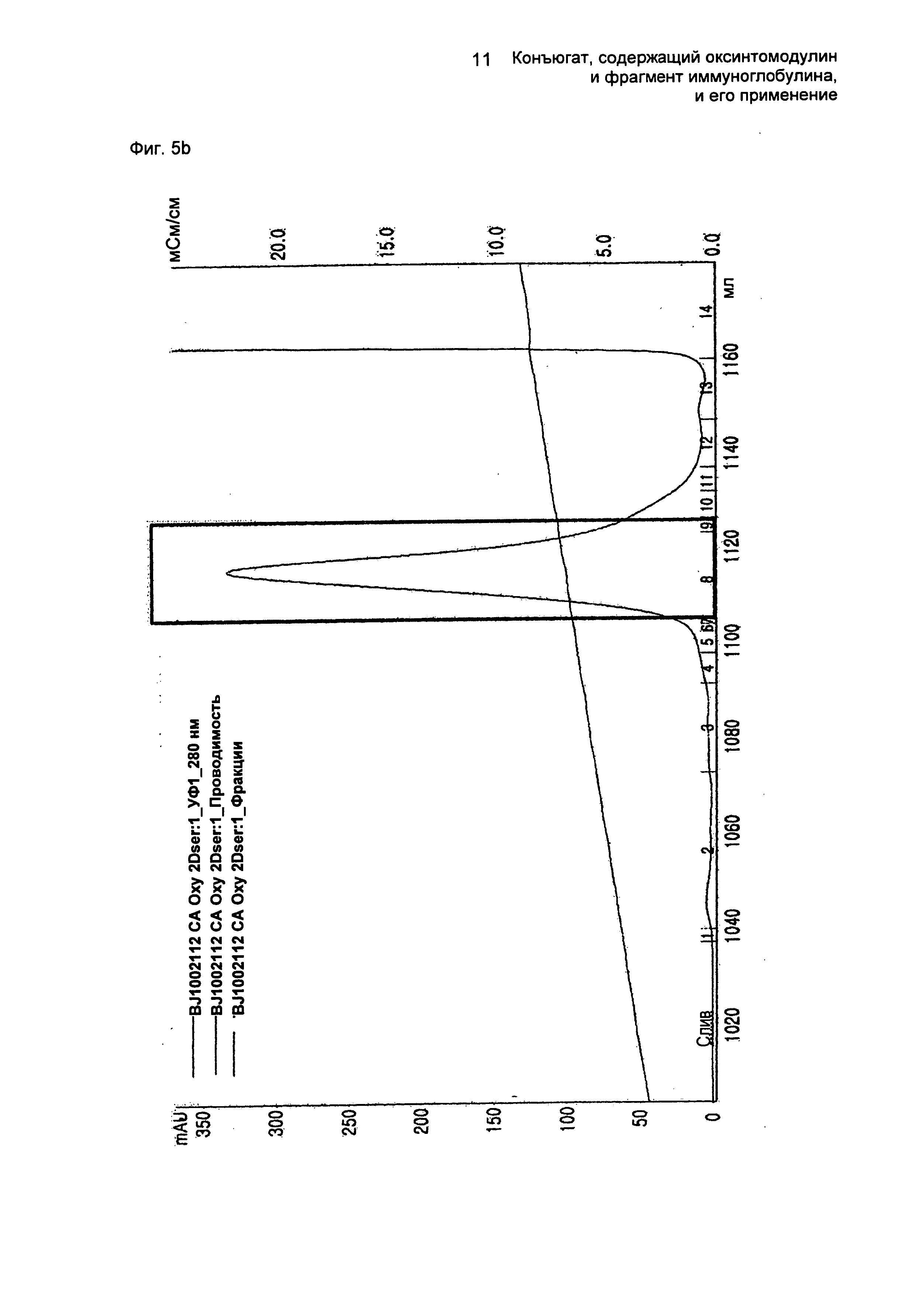
ФИГ.5b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 31) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
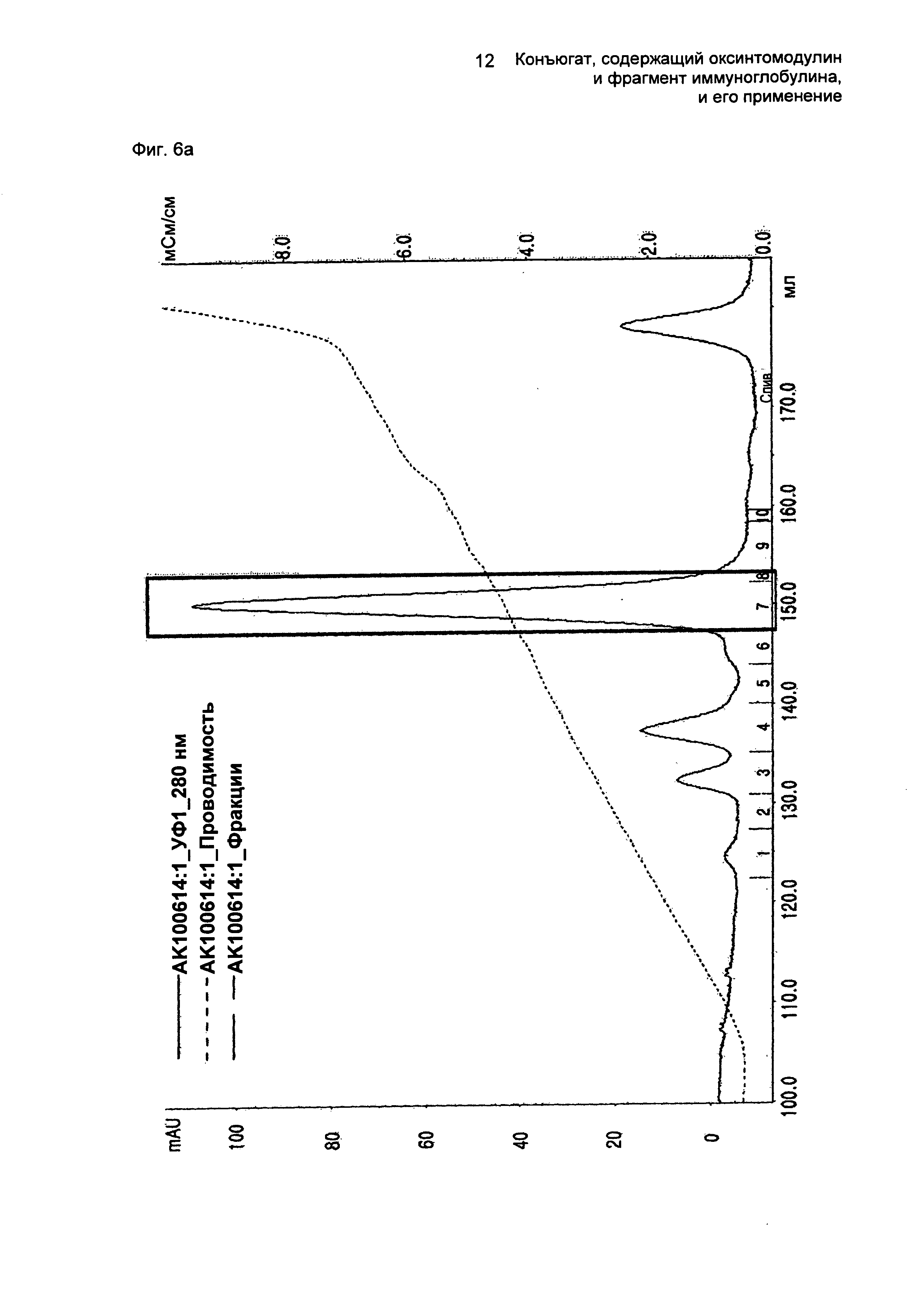
ФИГ.6а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2) на колонке для очистки SOURCE S.
ФИГ.6b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2).
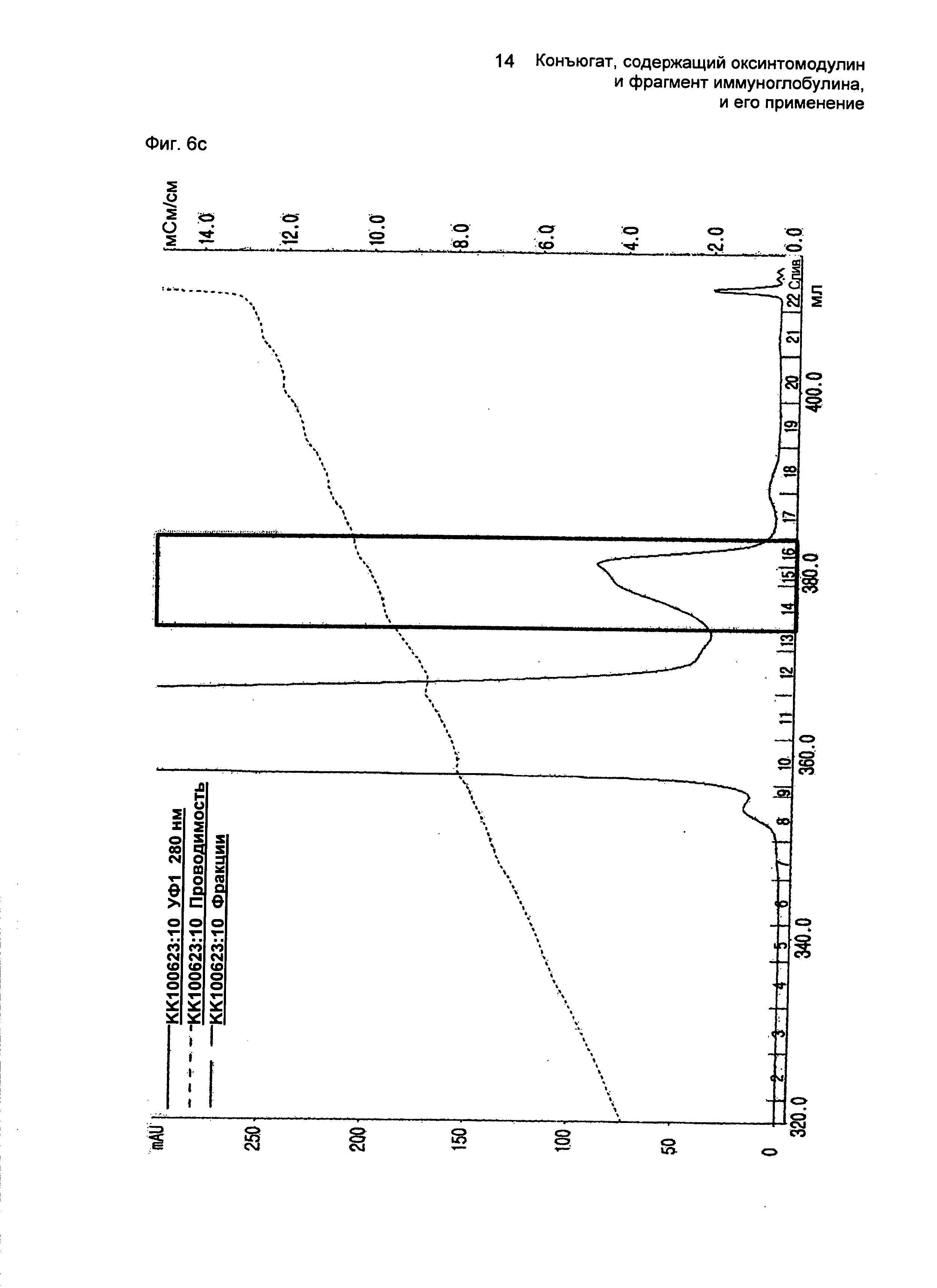
ФИГ.6c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
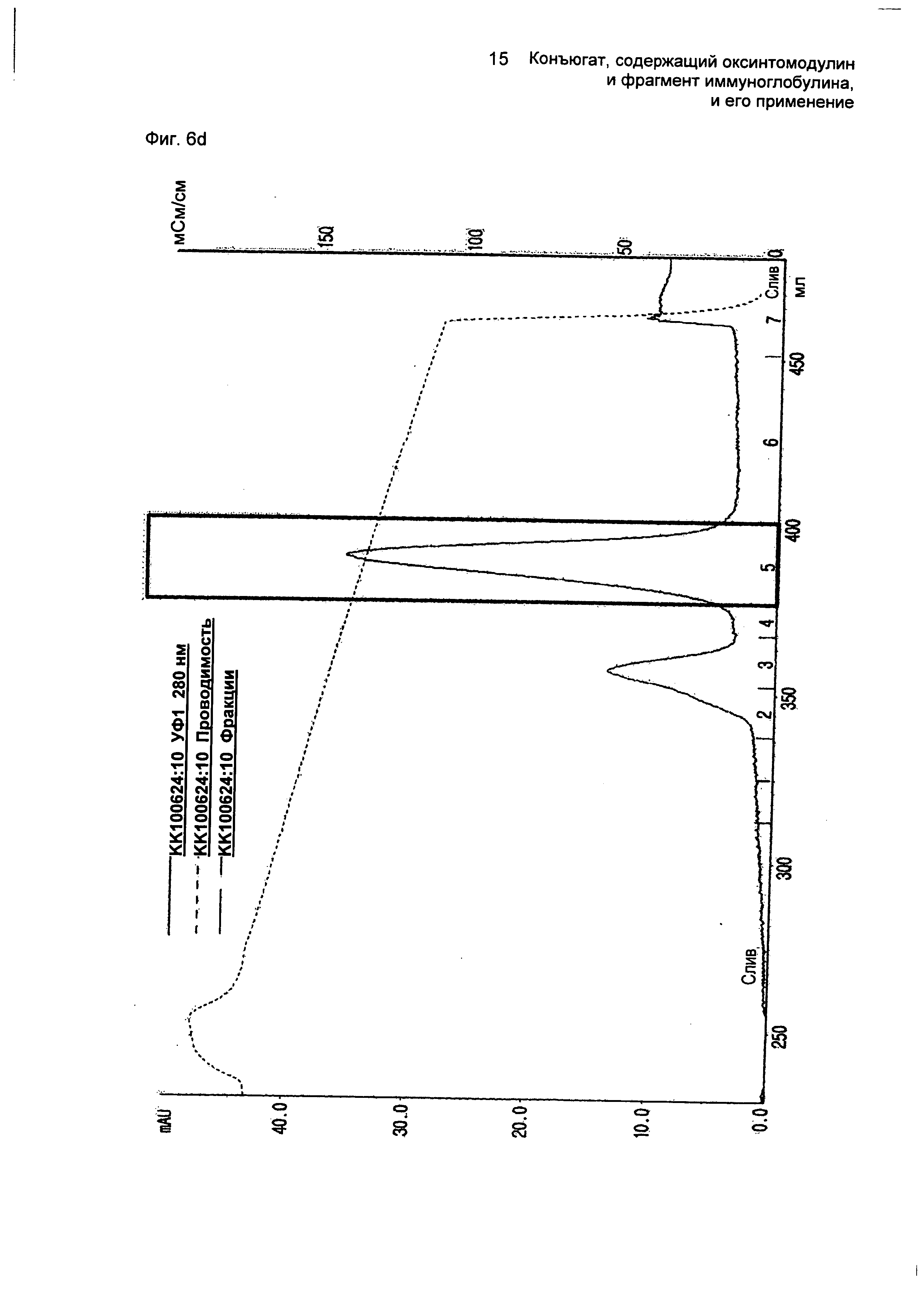
ФИГ.6d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
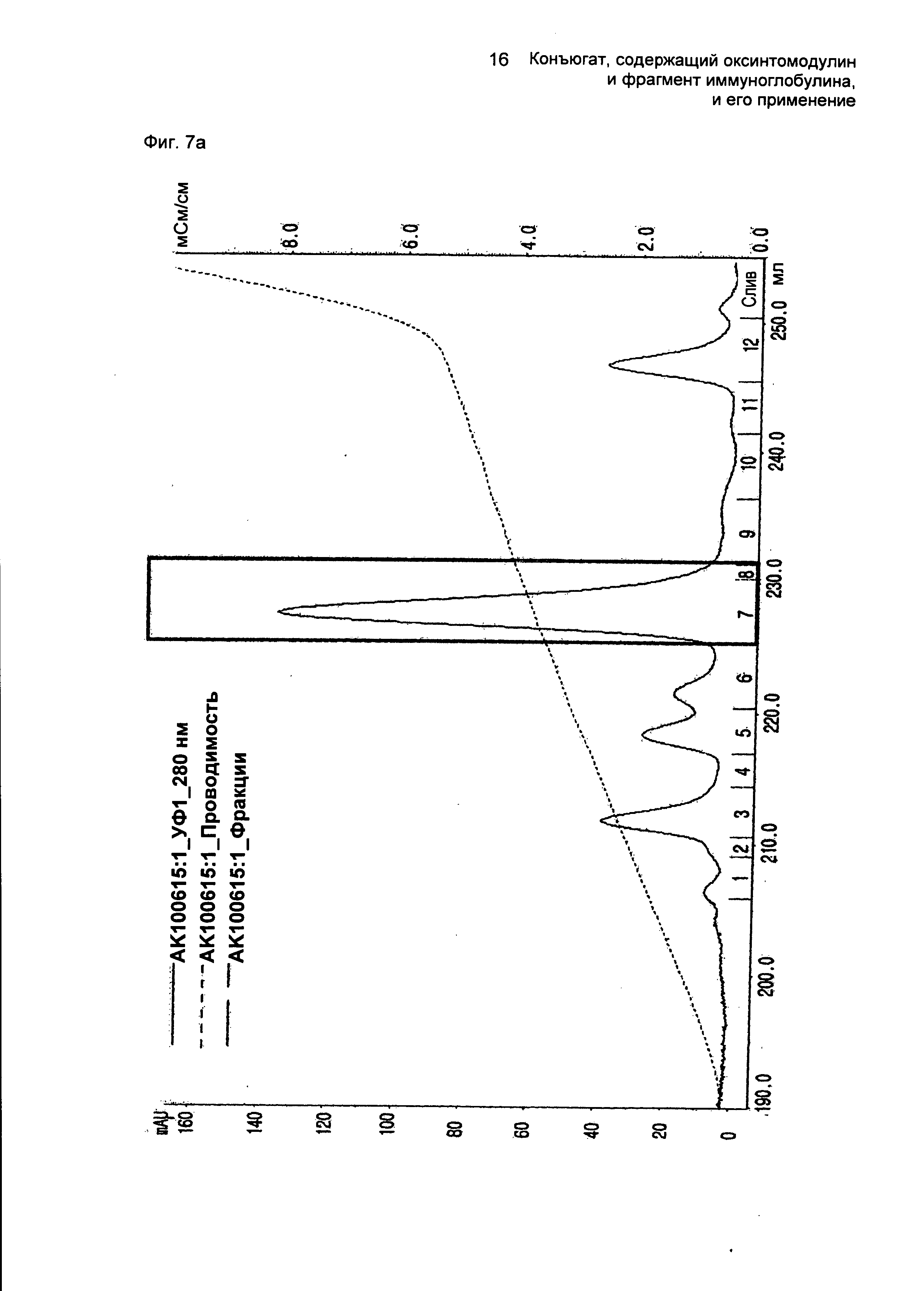
ФИГ.7а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3) на колонке для очистки SOURCE S.
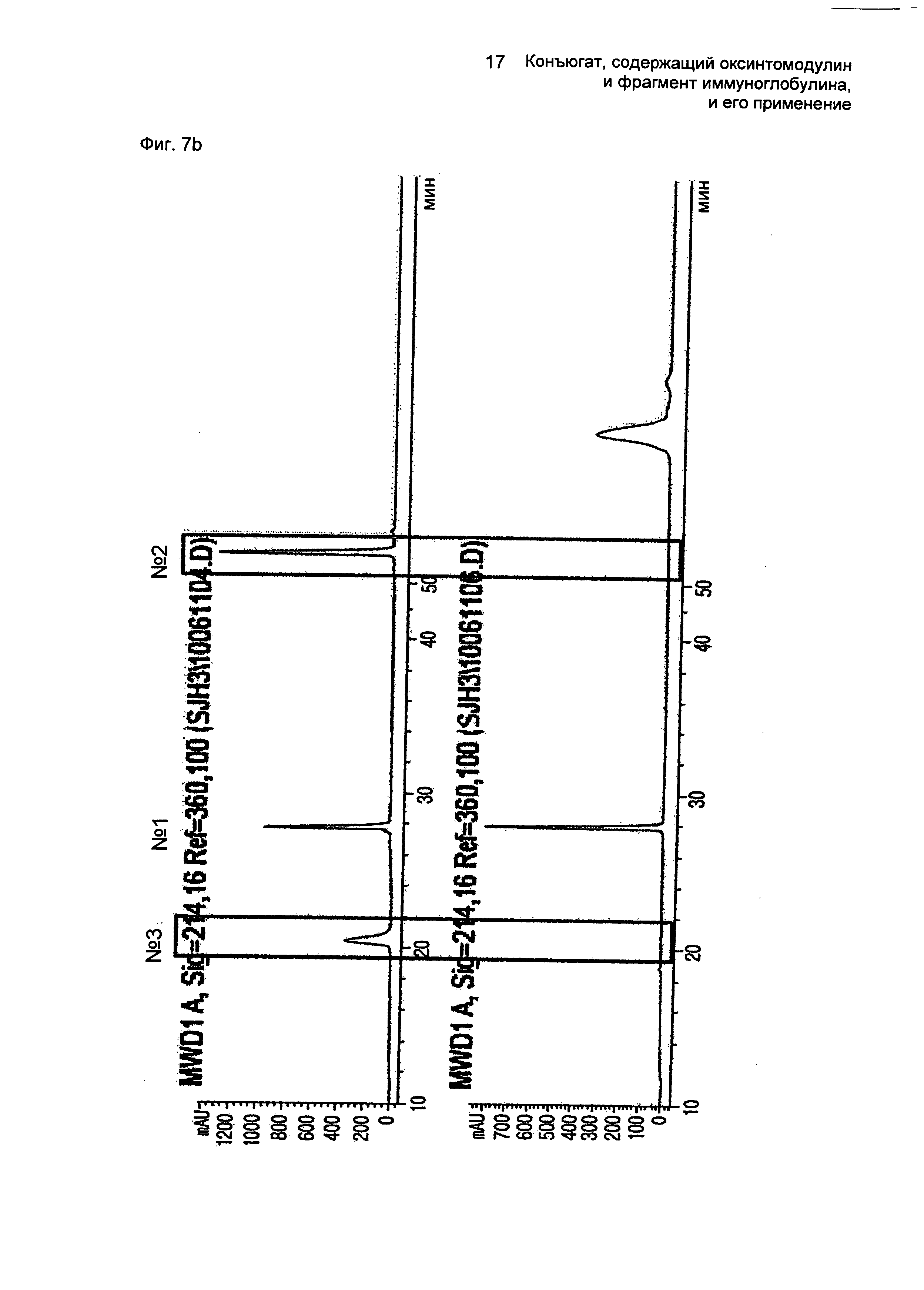
ФИГ.7b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3).
ФИГ.7c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки Butyl FF.
ФИГ.7d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
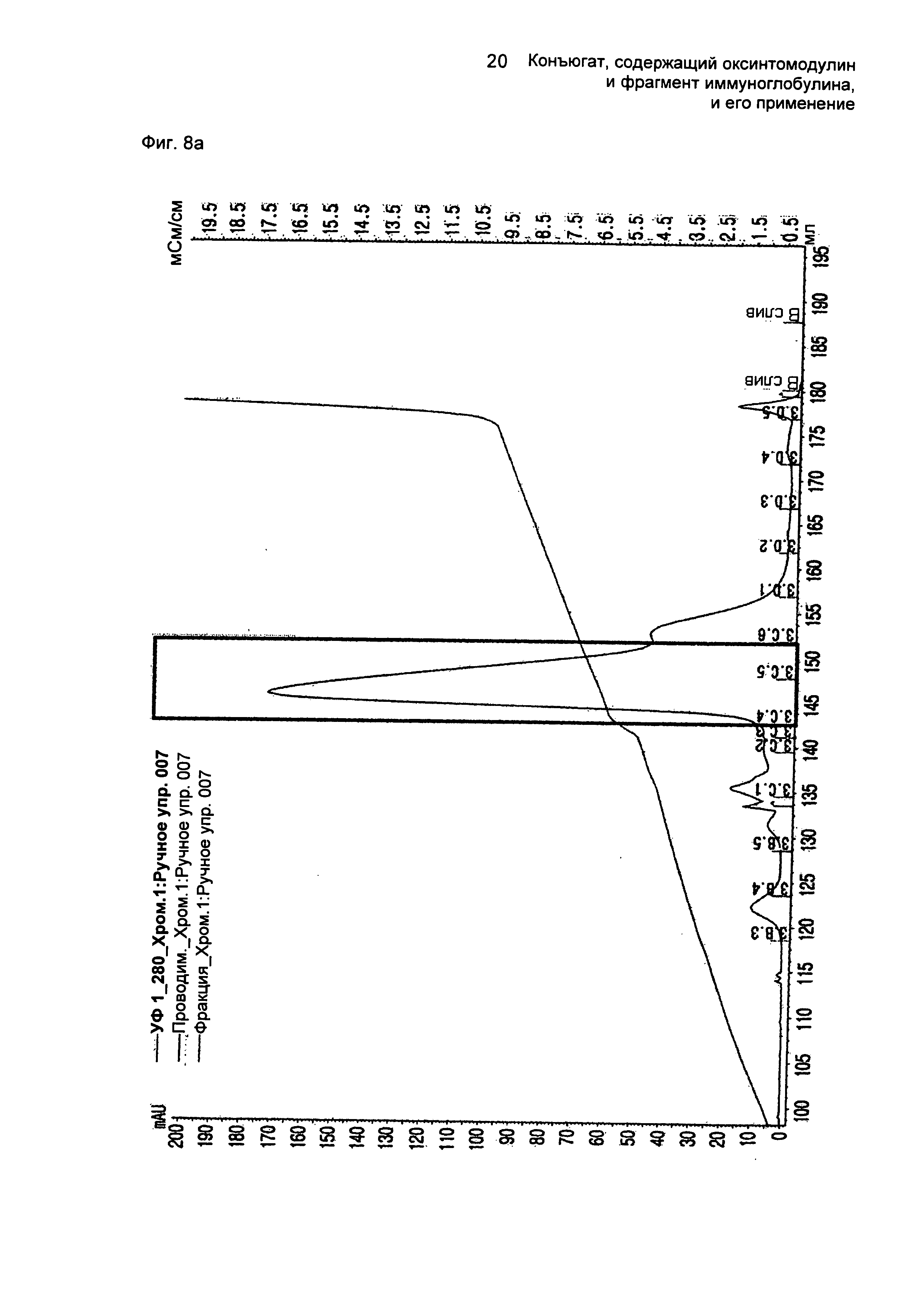
ФИГ.8а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 23) на колонке для очистки SOURCE S.
ФИГ.8b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.8c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
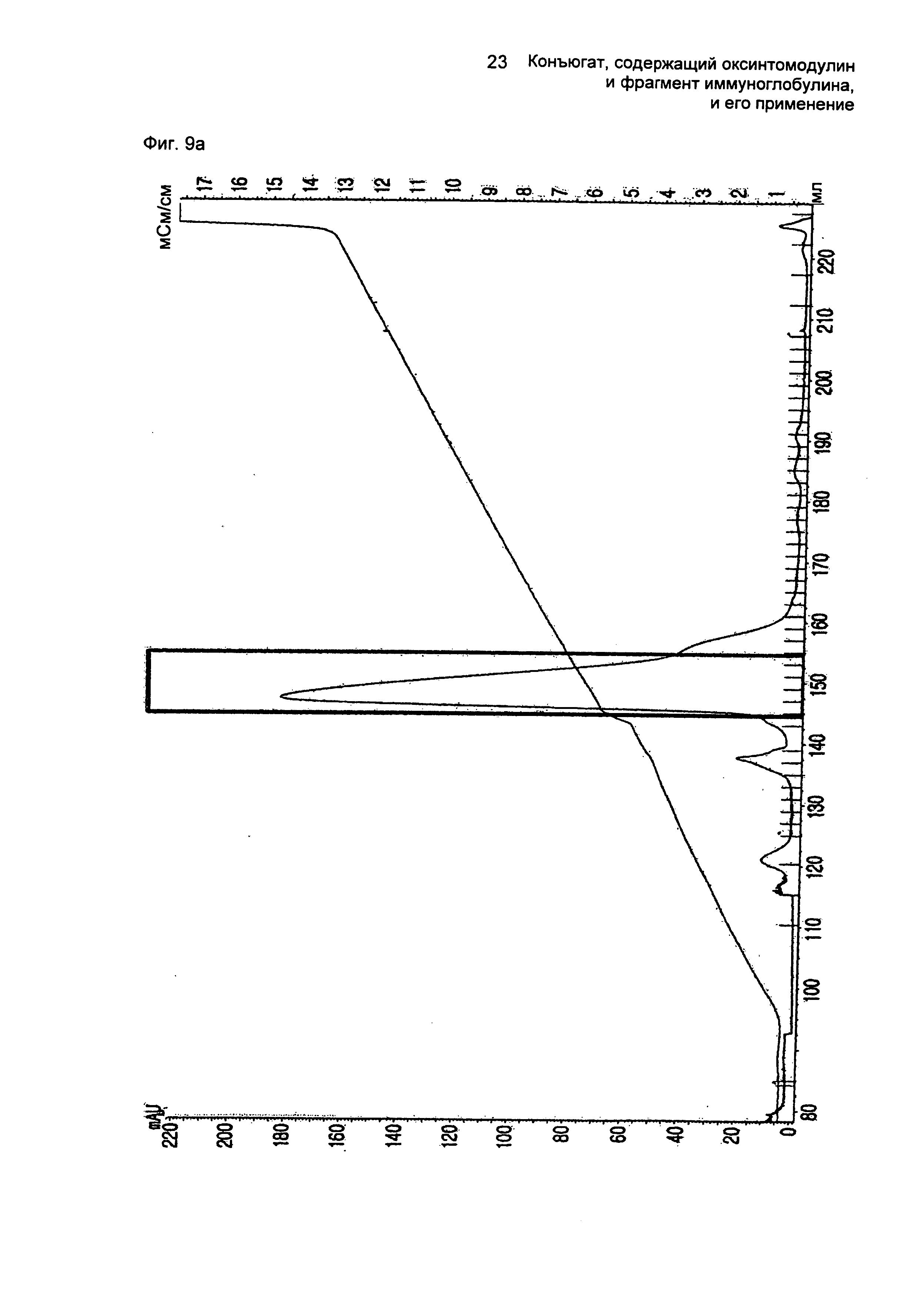
ФИГ.9а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 24) на колонке для очистки SOURCE S.
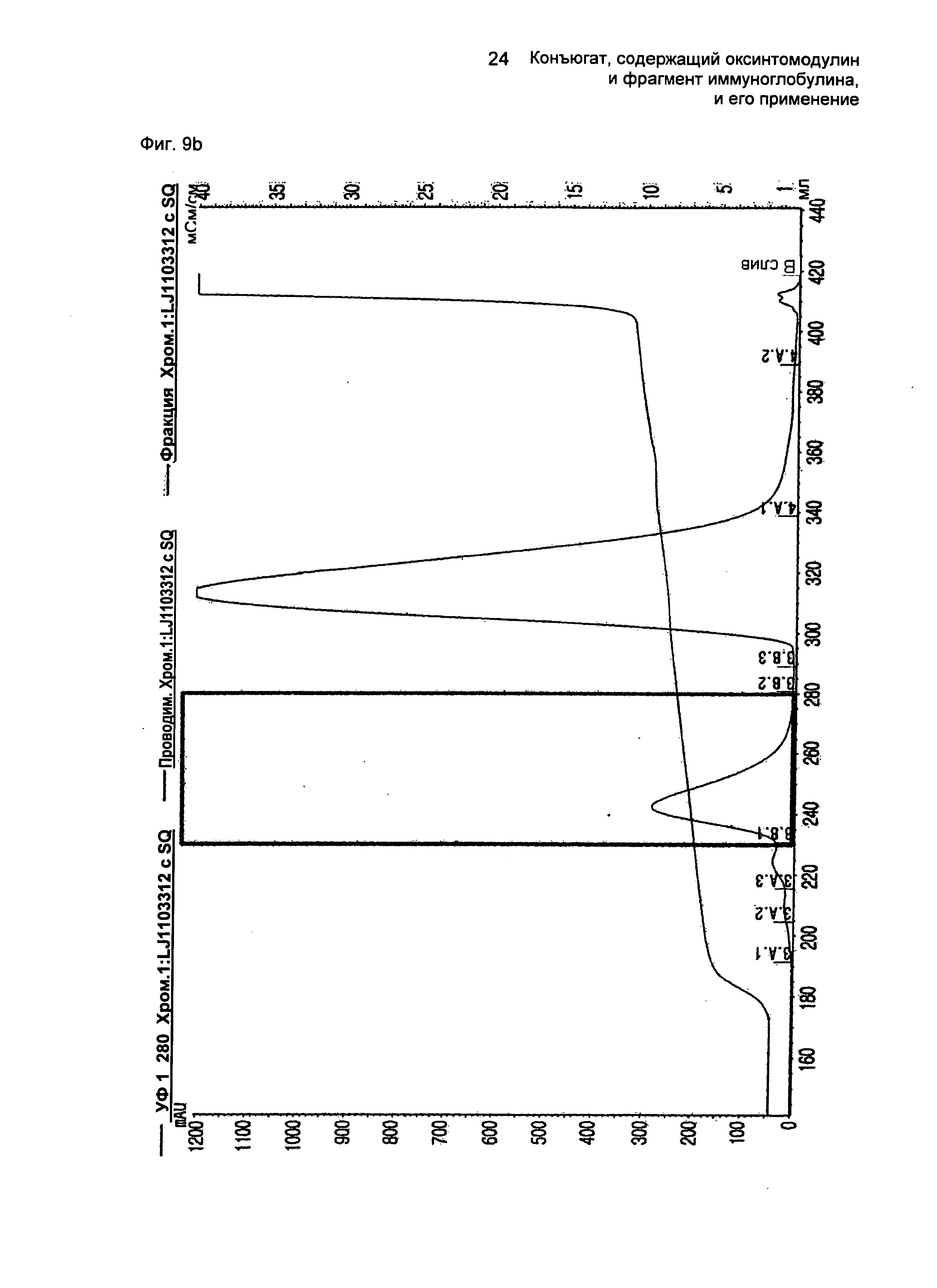
ФИГ.9b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
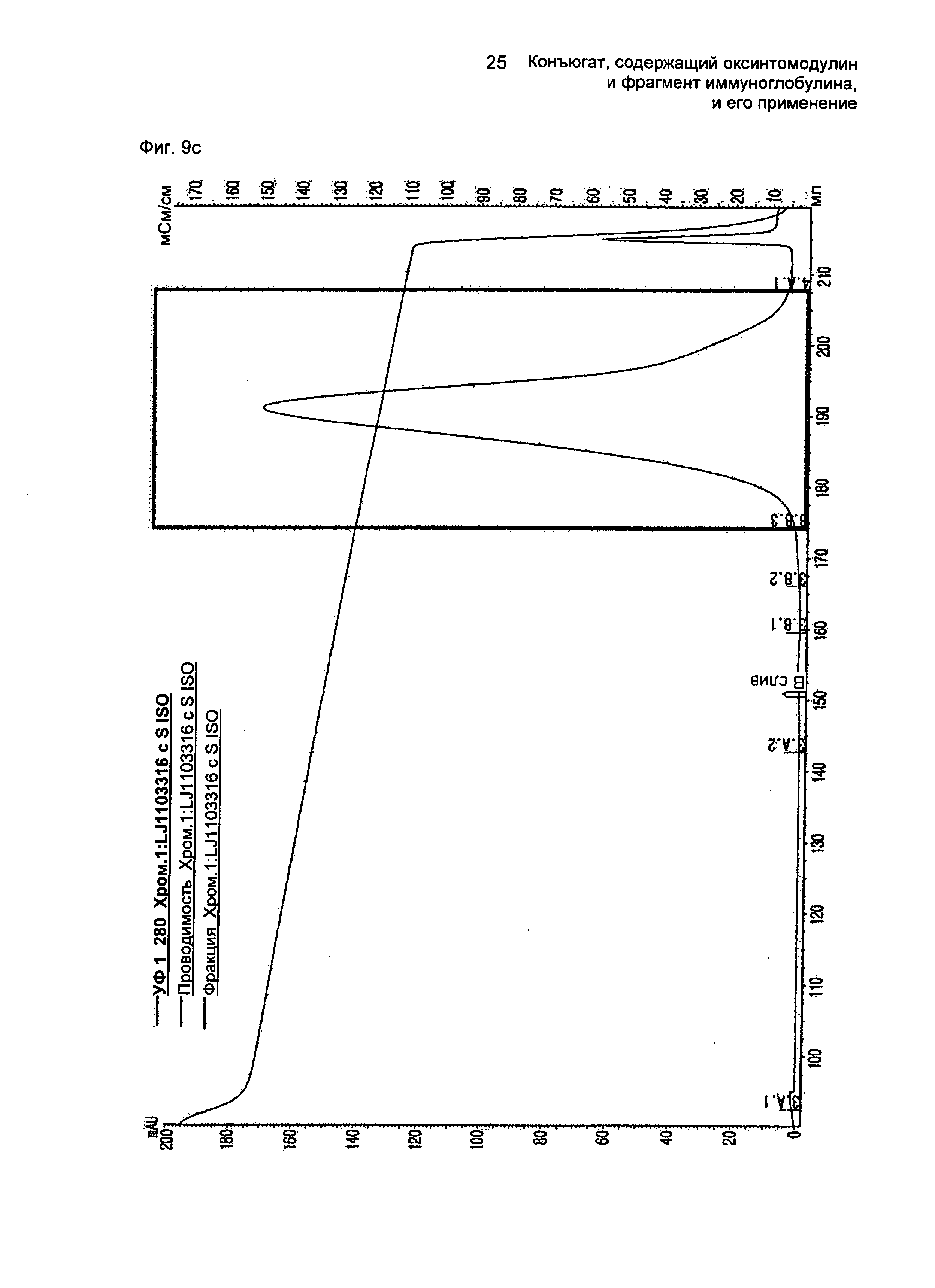
ФИГ.9c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
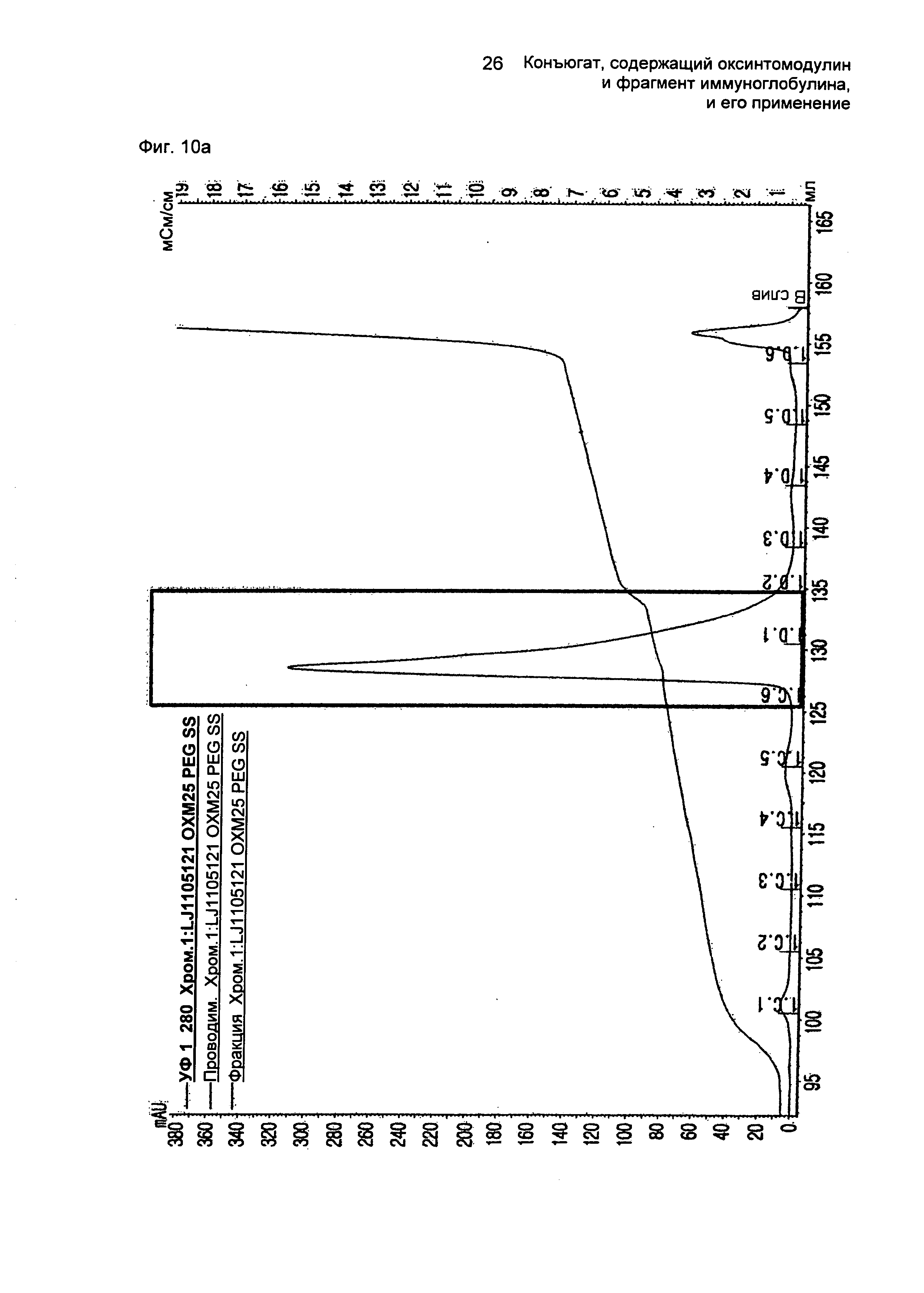
ФИГ.10а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 25) на колонке для очистки SOURCE S.
ФИГ.10b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.10c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
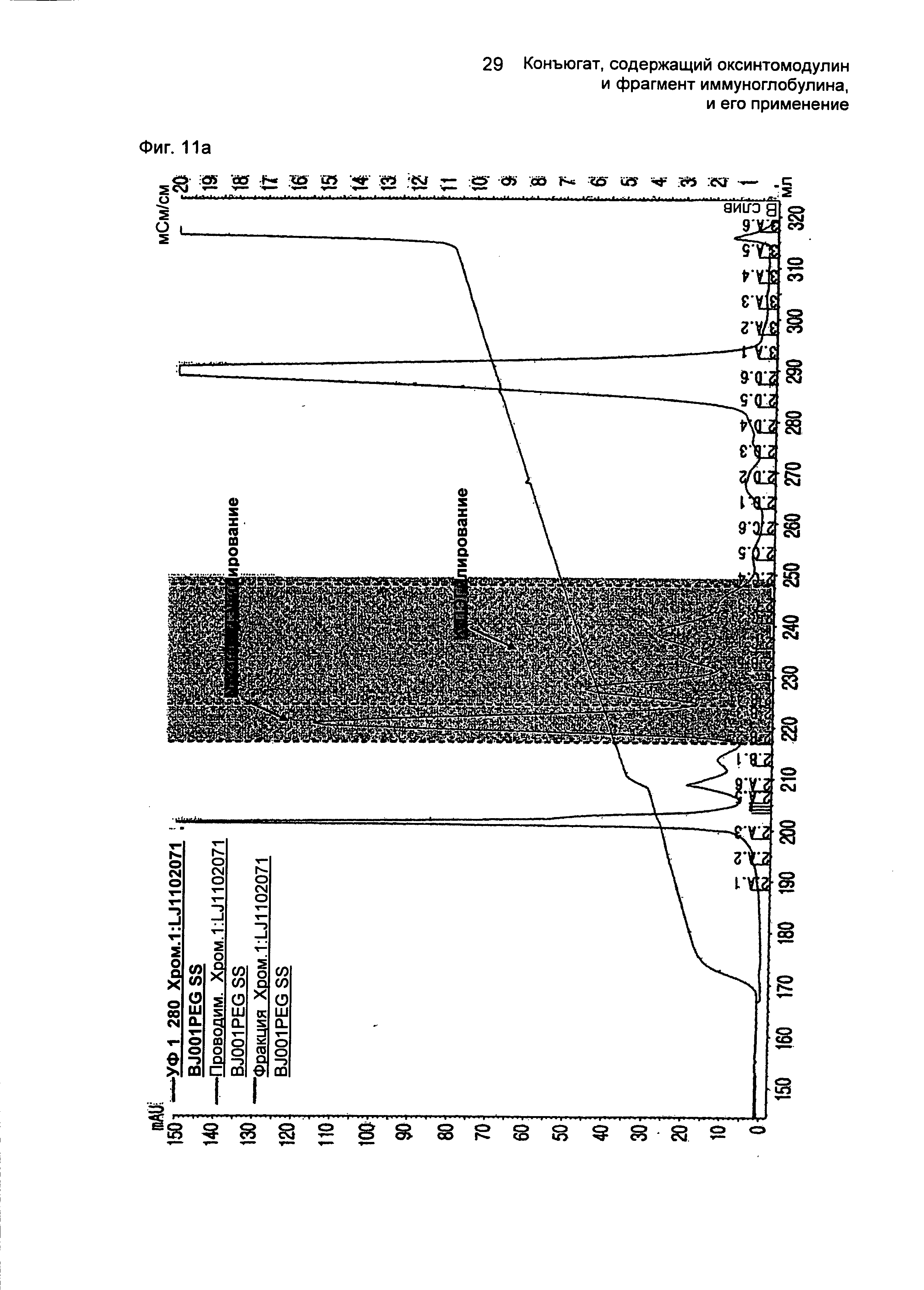
ФИГ.11a представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 28) на колонке для очистки SOURCE S.
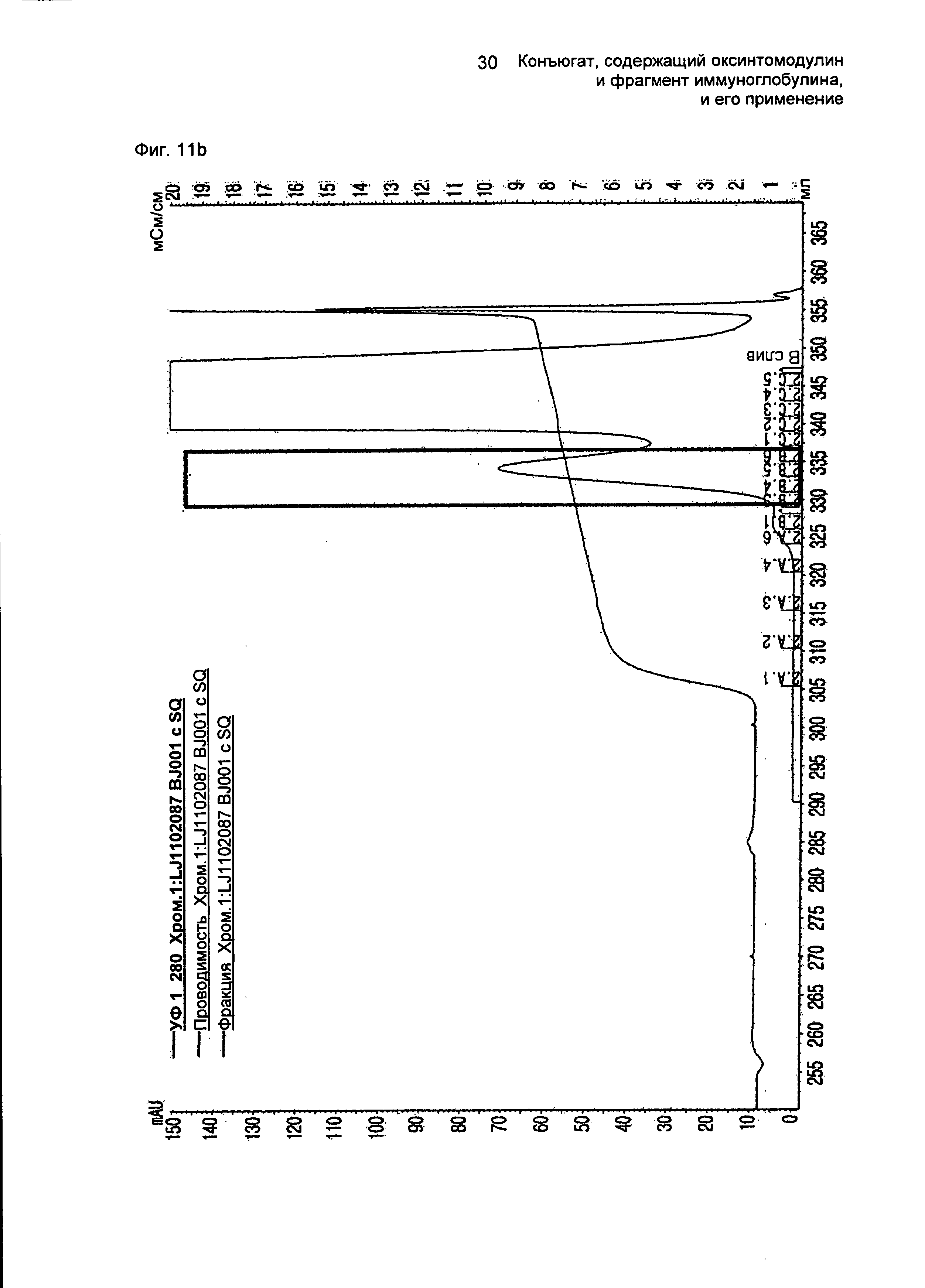
ФИГ.11b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.11c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
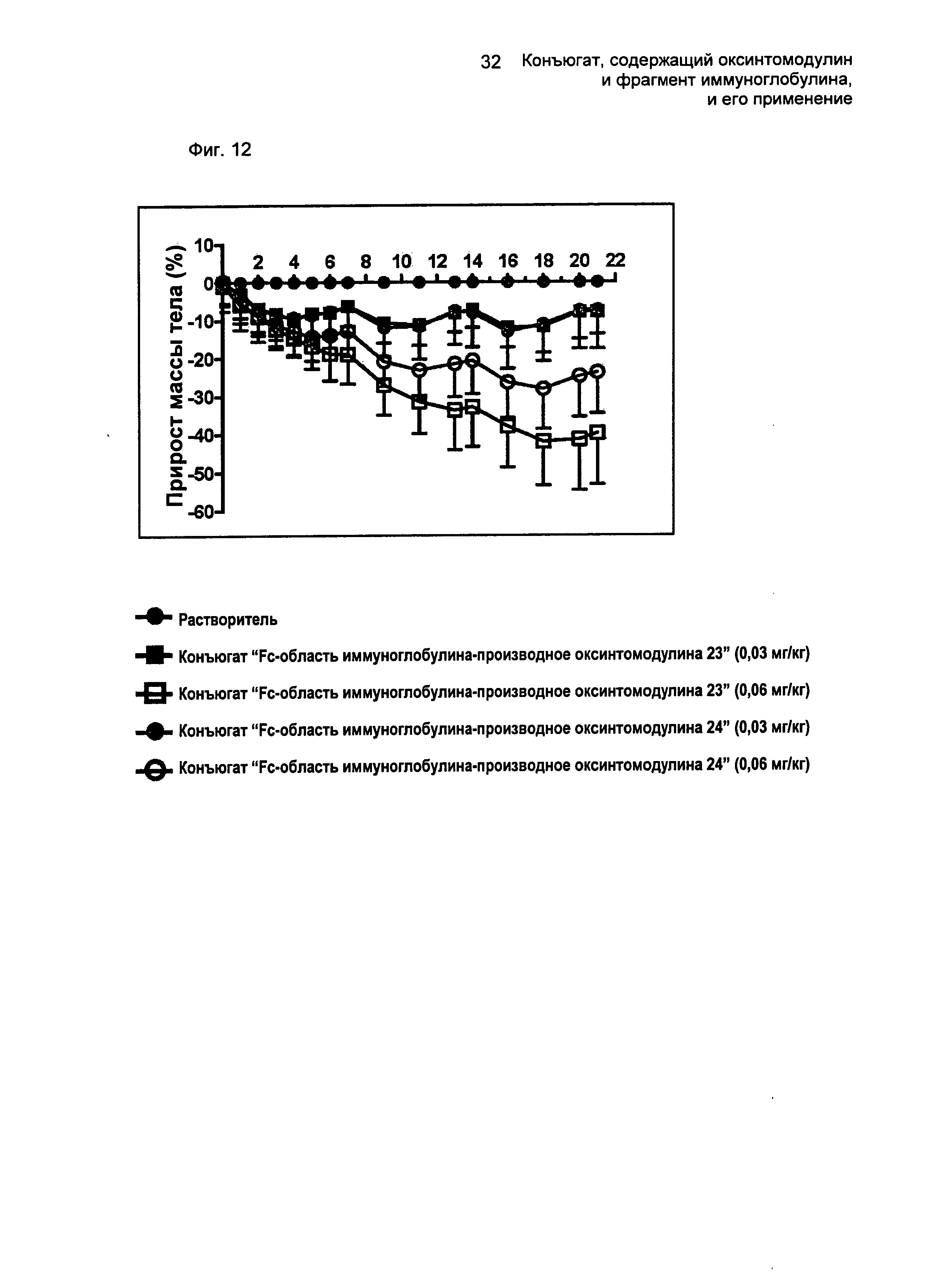
ФИГ.12 представляет собой график, показывающий изменения массы тела мышей в соответствии с типом и введенной дозой конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина".
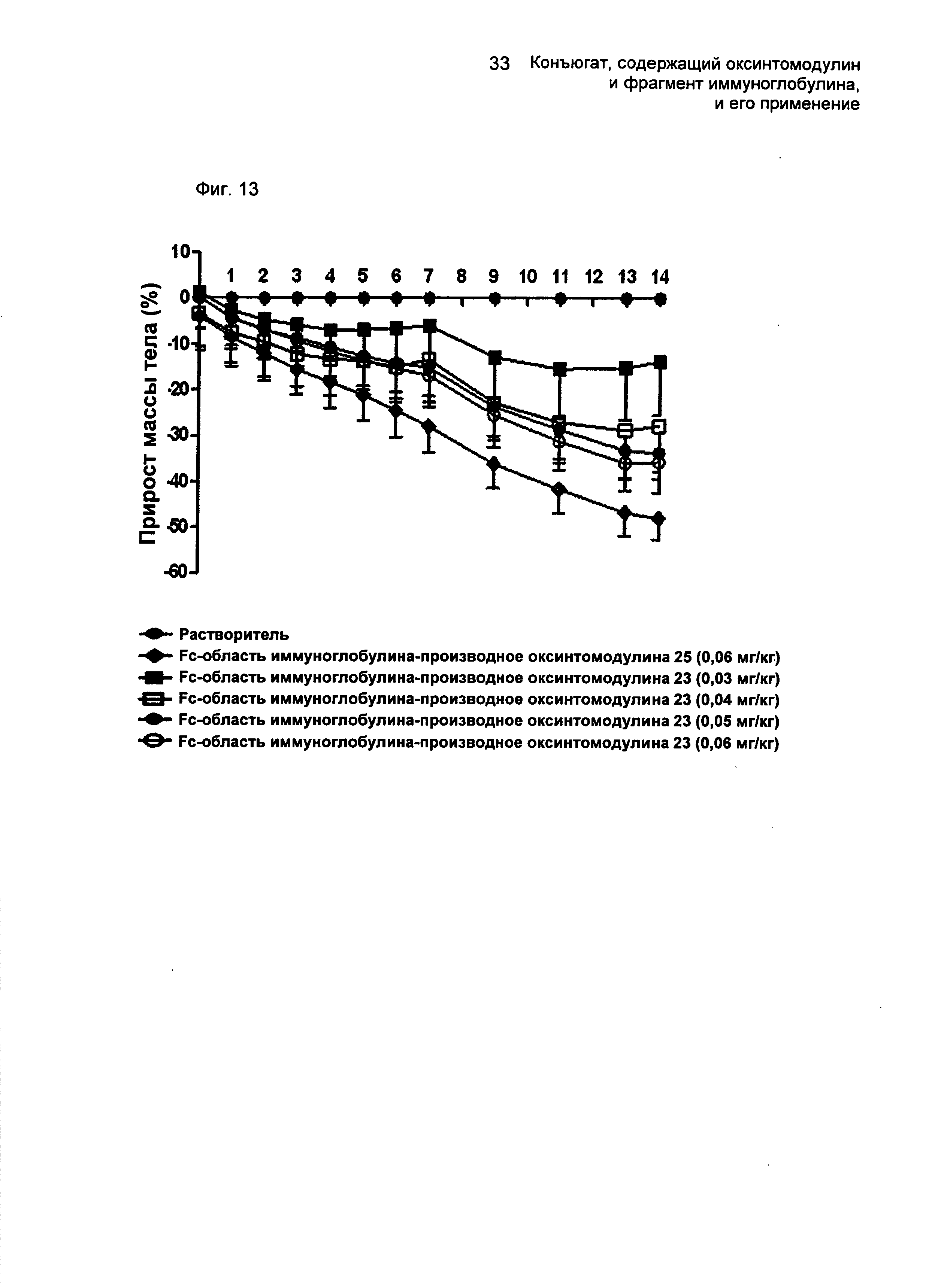
ФИГ.13 представляет собой график, показывающий изменения массы тела мышей в соответствии с типом и введенной дозой конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина".
Наилучший способ осуществления изобретения
В одном аспекте для решения упомянутых выше задач согласно настоящему изобретению предложен конъюгат, содержащий оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер.
Использованный в данном описании термин "конъюгат" означает конъюгат, содержащий оксинтомодулин и другие факторы. Другими факторами может быть любое вещество, которое может способствовать увеличению устойчивости в крови, задерживать выделение через почки или вызывать другие полезные эффекты. В настоящем изобретении таким фактором может быть Fc-область иммуноглобулина. Предпочтительно, конъюгат может состоять из оксинтомодулина и Fc-области иммуноглобулина, которые связаны через непептидильный полимер. Этот непептидильный полимер может связывать оксинтомодулин и Fc-область иммуноглобулина посредством ковалентных связей. Два конца непептидильного полимера могут быть соединены с аминогруппой или тиоловой группой Fc-области иммуноглобулина и производных оксинтомодулина, соответственно.
Подразумевается, что конъюгат по настоящему изобретению обладает улучшенной продолжительностью эффективного действия in vivo по сравнению с нативным оксинтомодулином, и такой длительно действующий конъюгат может включать оксинтомодулин, полученный в результате модификации, замещения, вставки или делеции в аминокислотной последовательности нативного оксинтомодулина, оксинтомодулин, конъюгированный с биоразлагаемым полимером, таким как полиэтиленгликоль (ПЭГ, PEG), оксинтомодулин, конъюгированный с длительно действующим белком, таким как альбумин или иммуноглобулин, оксинтомодулин, конъюгированный с жирной кислотой, обладающей способностью связываться с альбумином в организме, или оксинтомодулин, инкапсулированный в биоразлагаемые наночастицы, но этим тип длительно действующего конъюгата не ограничивается.
Использованный в данном описании термин "оксинтомодулин" означает пептид, происходящий из предшественника глюкагона, преглюкагона, и включает в себя нативный оксинтомодулин, предшественники, производные, их фрагменты и их варианты. Предпочтительно, он может иметь аминокислотную последовательность SEQ ID NO. 1
(HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA).
Термин "вариант оксинтомодулина" относится к пептиду, имеющему одну или более чем одну аминокислотную последовательность, отличающуюся от таковых для нативного оксинтомодулина, и означает пептид, который сохраняет функцию активации рецепторов GLP-1 и глюкагона, и который может быть получен путем одного из: замены, вставки, делеции и модификации, или их комбинации, в части аминокислотной последовательности нативного оксинтомодулина.
Термин "производное оксинтомодулина" включает пептиды, пептидные производные или пептидные миметики, которые получают путем вставки, делеции или замены аминокислот оксинтомодулина, чтобы осуществлять активацию как рецептора GLP-1, так и рецептора глюкагона на высоком уровне по сравнению с нативным оксинтомодулином.
Термин "фрагмент оксинтомодулина" означает фрагмент нативного оксинтомодулина, в котором на N-конце или C-конце добавлена или делетирована одна или более чем одна аминокислота, в который могут быть добавлены неприродные аминокислоты (например, аминокислота D-типа), и который обладает функцией активации как рецептора GLP-1, так и рецептора глюкагона.
Каждый из способов получения вариантов, производных и фрагментов оксинтомодулина можно использовать по отдельности или в комбинации. Например, настоящее изобретение включает пептид, который содержит одну или более чем одну аминокислоту, отличающуюся от таковых в нативном пептиде, и дезаминированный N-концевой аминокислотный остаток, и обладает функцией активации как рецептора GLP-1, так и рецептора глюкагона.
Аминокислоты, упомянутые в данном описании, имеют сокращения в соответствии с правилом номенклатуры по IUPAC-IUB (Международный союз по теоретической и прикладной химии и Международный биохимический союз), как приведено ниже:
|
В настоящем изобретении производное оксинтомодулина охватывает любой пептид, который получают путем замен, вставок, делеций или посттрансляционых модификаций (например, метилирования, ацилирования, убиквитинирования, внутримолекулярного ковалентного связывания) в аминокислотной последовательности оксинтомодулина (HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA, SEQ ID NO. 1) с тем, чтобы активировать рецепторы глюкагона и GLP-1 одновременно. Для замены или вставки аминокислот можно использовать любую из 20 аминокислот, обычно присутствующих в белках человека, а также атипичные или неприродные аминокислоты. Доступные источники атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, включающие в себя эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например, American Peptide Company или Bachem (USA) либо Anygen (Korea).
В одном из конкретных воплощений производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислоты приведенной ниже формулы 1:
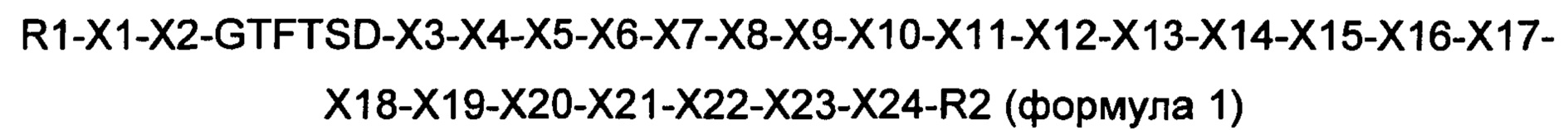
где R1 представляет собой гистидин, дезамино-гистидил, диметил-гистидил (N-диметил-гистидил), бета-гидроксиимидазопропионил, 4-имидазо-ацетил, бета-карбокси-имидазопропионил или тирозин;
Х1 представляет собой Aib (аминоизомасляная кислота), d-аланин, глицин, Sar (N-метилглицин), серин или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серин или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, серин, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин, серин или делетирован;
Х11 представляет собой аланин, аргинин, валин или делетирован;
Х12 представляет собой аланин, аргинин, серин, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, лизин, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, серин, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, глутамин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой аланин, глицин, треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид из 2-10 аминокислот, состоящий из комбинаций аланина, глицина и серина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37), HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична последовательности SEQ ID NO. 1).
Чтобы повысить активность оксинтомодулина дикого типа в отношении рецептора глюкагона и рецептора GLP-1, в пептиде по настоящему изобретению могут быть проведены замены на 4-имидазоацетил, когда делетируют альфа-углерод гистидина в положении 1 аминокислотной последовательности, представленной как SEQ ID NO. 1, на дезамино-гистидил, когда делетируют N-концевую аминогруппу, диметил-гистидил (N-диметил-гистидил, когда N-концевую аминогруппу модифицируют двумя метильными группами, на бета-гидрокси-имидазопропионил, когда N-концевую аминогруппу заменяют гидроксильной группой, или на бета-карбокси-имидазопропионил, когда N-концевую аминогруппу заменяют карбоксильной группой. Помимо этого, в участке связывания с рецептором GLP-1 могут быть проведены замены на аминокислоты, которые усиливают гидрофобные и ионные связи, или их комбинации. Для повышения активности в отношении рецептора GLP-1 часть последовательности оксинтомодулина может быть заменена на аминокислотную последовательность GLP-1 или эксендина-4.
Кроме того, часть последовательности оксинтомодулина может быть заменена на последовательность, стабилизирующую альфа-спираль. Предпочтительно, аминокислоты в положениях 10, 14, 16, 20, 24 и 28 аминокислотной последовательности формулы 1 могут быть заменены на аминокислоты или производные аминокислот из группы, состоящей из: Tyr(4-Ме), Phe, Phe(4-Me), Phe(4-Cl), Phe(4-CN), Phe(4-NO2), Phe(4-NH2), Phg (фенилглицин), Pal (β-пиридил-аланин), Nal (β-нафтил-аланин), Ala(2-тиенил) и Ala(бензотиенил), которые известны как стабилизирующие альфа-спираль, и нет никаких ограничений по типу и числу встраиваемых стабилизирующих альфа-спираль аминокислот или производных аминокислот. Предпочтительно, аминокислоты в положениях 10 и 14, 12 и 16, 16 и 20, 20 и 24 и 24 и 28 также могут быть заменены на глутаминовую кислоту или лизин, соответственно, чтобы происходило образование колец, и нет никакого ограничения по числу встраиваемых колец. Наиболее предпочтительно, пептид может представлять собой пептид, имеющий аминокислотную последовательность, выбранную из приведенных далее формул 1-6.
В одном из конкретных воплощений производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 2, где аминокислотная последовательность оксинтомодулина заменена последовательностью эксендина или GLP-1.
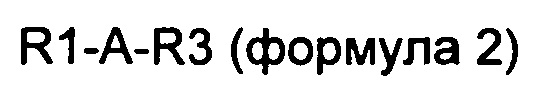
В другом конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 3, который получают путем связывания части аминокислотной последовательности оксинтомодулина и части аминокислотной последовательности эксендина или GLP-1 через подходящий аминокислотный линкер.
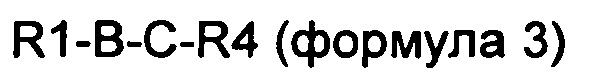
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 4, где часть аминокислотной последовательности оксинтомодулина заменена на аминокислоту, способную повышать аффинность связывания с рецептором GLP-1, например, Leu в положении 26, который связывается с рецептором GLP-1 за счет гидрофобных взаимодействий, заменен на гидрофобный остаток Ile или Val.
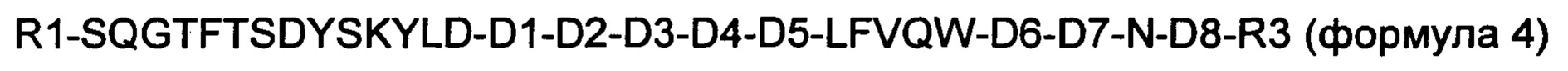
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 5, где часть аминокислотной последовательности делетирована, добавлена или заменена на другую аминокислоту для повышения активностей нативного оксинтомодулина в отношении рецептора GLP-1 и рецептора глюкагона.
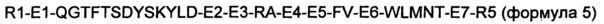
В формулах 2-5 R1 является таким же, как и в описании формулы 1;
А выбран из группы, состоящей из SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO. 41), SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO. 42), SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO. 43), GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO. 44), GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO. 45), GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO. 46) и SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO. 47);
B выбран из группы, состоящей из SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO. 41), SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO. 42), SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO. 43), GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO. 44), GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO. 45), GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO. 46), SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO. 47), GEGTFTSDLSRQMEEEAVRLFIEW (SEQ ID NO. 48) и SQGTFTSDYSRYLD (SEQ ID NO. 49);
C представляет собой пептид из 2-10 аминокислот, состоящий из комбинаций аланина, глицина и серина;
D1 представляет собой серин, глутаминовую кислоту или аргинин;
D2 представляет собой аргинин, глутаминовую кислоту или серин;
D3 представляет собой аргинин, аланин или валин;
D4 представляет собой аргинин, валин или серин;
D5 представляет собой глутамин, аргинин или лизин;
D6 представляет собой изолейцин, валин или серин;
D7 представляет собой метионин, аргинин или глутамин;
D8 представляет собой треонин, глицин или аланин;
Е1 представляет собой серин, Aib, Sar, d-аланин или d-серин;
Е2 представляет собой серин или глутаминовую кислоту;
Е3 представляет собой аргинин или лизин;
Е4 представляет собой глутамин или лизин;
Е5 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Е6 представляет собой глутамин, цистеин или лизин;
Е7 представляет собой цистеин, лизин или делетирован;
R3 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36) или GPSSGAPPPSK (SEQ ID NO. 37);
R4 представляет собой HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40); и
R5 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37) или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны последовательности SEQ ID NO. 1).
Предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой новый пептид приведенной ниже формулы 6:
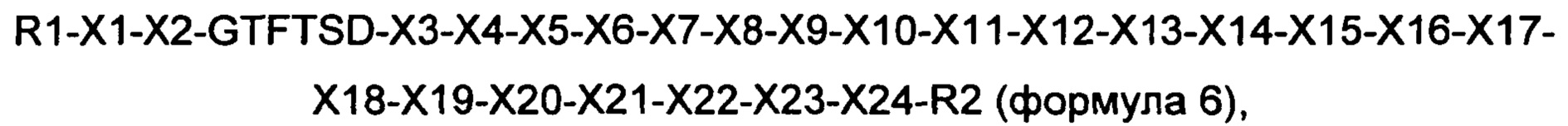
где R1 представляет собой гистидин, дезамино-гистидил, 4-имидазоацетил или тирозин;
X1 представляет собой Aib (аминоизомасляная кислота), глицин или серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серин или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин или делетирован;
X11 представляет собой аланин, аргинин или делетирован;
Х12 представляет собой аланин, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид из 2-10 аминокислот, состоящий из глицина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37), HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична последовательности SEQ ID NO. 1).
Более предпочтительно, производное оксинтомодулина по настоящему изобретению может быть выбрано из группы, состоящей из пептидов с SEQ ID NO. 2-34. Гораздо более предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой производное оксинтомодулина, описанное в Таблице 1 из примера 2-1.
Оксинтомодулин обладает активностями двух пептидов - GLP-1 и глюкагона. GLP-1 снижает уровень глюкозы в крови, снижает потребление пищи и подавляет опорожнение желудка, а глюкагон повышает уровень глюкозы в крови, способствует липолизу и уменьшает массу тела, усиливая энергетический обмен. Разные биологические эффекты, вызываемые этими двумя пептидами, могут вызывать нежелательные эффекты, такие как увеличение уровня глюкозы в крови, если глюкагон демонстрирует более доминирующий эффект по сравнению с GLP-1, или вызывание тошноты и рвоты, если GLP-1 демонстрирует более доминирующий эффект по сравнению с глюкагоном. Например, конъюгат, полученный ниже в примере 10, демонстрировал более высокую аффинность к рецептору GLP-1, чем конъюгат, полученный в примере 12, но эффективность первого была ниже, чем последнего, как показано в эксперименте in vivo в примере 18. Это могло быть обусловлено повышенной эффективностью конъюгатов в отношении рецептора глюкагона в примере 12, несмотря на их низкую эффективность в отношении рецептора GLP-1. Таким образом, производные оксинтомодулина и их конъюгаты по настоящему изобретению не ограничиваются теми производными, для которых показано безусловное увеличение активности. Например, чтобы регулировать соотношение активности между глюкагоном и GLP-1, могут быть модифицированы аминокислоты в положениях 1 и 11 оксинтомодулина, которые, как известно, подавляют активность глюкагона.
В результате связывания носителя с оксинтомодулином посредством ковалентной связи или образования микросферы конъюгаты по настоящему изобретению могут характеризоваться более высокой устойчивостью в крови, замедленным выделением через почки и измененной аффинностью к рецепторам. Носитель, который может формировать конъюгат, содержащий оксинтомодулин, может быть выбран из группы, состоящей из альбумина, трансферрина, антител, фрагментов антител, эластина, гепарина, полисахарида, такого как хитин, фибронектина и наиболее благоприятно Fc-области иммуноглобулина, все из которых могут увеличивать период полураспада конъюгатов в крови в связанном с оксинтомодулином состоянии.
Термин "Fc-область иммуноглобулина", как он здесь использован, относится к белку, который содержит константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина и не содержит вариабельных областей тяжелой и легкой цепей, константной области 1 тяжелой цепи (СН1) и константной области 1 легкой цепи (CL1) иммуноглобулина. Он может также включать шарнирную область константной области тяжелой цепи. Кроме этого, Fc-область иммуноглобулина по настоящему изобретению может содержать часть Fc-области или всю Fc-область, включая константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), и не содержать вариабельных областей тяжелой и легкой цепей, поскольку она выполняет физиологическую функцию, по существу аналогичную функции нативного белка либо улучшенную по сравнению с нативным белком. Кроме этого, Fc-область иммуноглобулина может представлять собой фрагмент с делецией в относительно длинном участке аминокислотной последовательности СН2 и/или СН3. Таким образом, Fc-область иммуноглобулина по настоящему изобретению может содержать 1) СН1-домен, СН2-домен, СН3-домен и СН4-домен, 2) CH1-домен и СН2-домен, 3) СН1-домен и СН3-домен, 4) СН2-домен и СН3-домен, 5) комбинацию одного или более чем одного домена и шарнирной области иммуноглобулина (или части шарнирной области) и 6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Fc-область иммуноглобулина по настоящему изобретению содержит нативную аминокислотную последовательность и производное этой последовательности (мутантную последовательность). Производное аминокислотной последовательности представляет собой последовательность, которая отличается от нативной аминокислотной последовательности вследствие делеции, вставки, неконсервативной или консервативной замены или их комбинаций для одного или более чем одного аминокислотного остатка. Например, аминокислотные остатки в Fc IgG в положениях 214-238, 297-299, 318-322 или 327-331, известные как важные для связывания, могут быть использованы как подходящая мишень для модификации.
Кроме этого, возможны и другие различные производные, включая производное, в котором делетирован участок, способный образовывать дисульфидную связь, или удалены определенные аминокислотные остатки на N-конце нативной формы Fc либо туда добавлен остаток метионина. Кроме того, для устранения эффекторных функций может быть осуществлена делеция в комплемент-связывающем сайте, таком как C1q-связывающий сайт, и сайте ADCC (антитело-зависимая клеточно-опосредованная цитотоксичность). Методы получения таких производных последовательности Fc-области иммуноглобулина описаны в WO 97/34631 и WO 96/32478.
В данной области техники известны аминокислотные замены в белках и пептидах, которые обычно не изменяют активность белков или пептидов (Н. Neurath, R. L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly, в обоих направлениях. Кроме того, Fc-область при желании может быть модифицирована путем фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и тому подобного.
Вышеупомянутые Fc-производные представляют собой производные, которые обладают биологической активностью, идентичной активности Fc-области по настоящему изобретению, или улучшенной структурной стабильностью, например, в отношении нагревания, рН или тому подобного.
Помимо этого, такие Fc-области могут быть получены из нативных форм, выделенных из организмов людей и других животных, включая крупный рогатый скот, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или могут представлять собой рекомбинантные формы или их производные, полученные из трансфицированных клеток животных или из микроорганизмов. Согласно настоящему описанию, они могут быть получены из нативного иммуноглобулина посредством выделения целых иммуноглобулинов из организмов человека или животного и обработки их протеолитическим ферментом. Папаин переваривает нативный иммуноглобулин с образованием Fab- и Fc-областей, а обработка пепсином приводит к получению pF'c- и F(ab)2-фрагментов. Эти фрагменты могут быть подвергнуты, например, гель-проникающей хроматографии для выделения Fc или pF'c. Предпочтительно, Fc-область иммуноглобулина человека представляет собой Fc-область рекомбинантного иммуноглобулина, которую получают из микроорганизма.
Помимо этого, Fc-область иммуноглобулина по настоящему изобретению может быть представлена в форме, имеющей нативные углеводные цепи, углеводные цепи большей длины по сравнению с нативной формой или углеводные цепи меньшей длины по сравнению с нативной формой, или может быть представлена в дегликозилированной форме. Увеличение, уменьшение или удаление углеводных цепей Fc-области иммуноглобулина может быть достигнуто общепринятыми в данной области техники методами, такими как химический метод, ферментативный метод и метод генной инженерии с применением микроорганизмов. Удаление углеводных цепей Fc-области приводит к резкому уменьшению аффинности связывания с C1q-частью первого компонента системы комплемента С1 и уменьшению или утрате антитело-зависимой клеточно-опосредованной цитотоксичности или комплемент-зависимой цитотоксичности, не вызывая таким образом ненужных иммунных ответов in vivo. В этом отношении, Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей для задачи настоящего изобретения в качестве носителя лекарственного средства.
Использованный в данном описании термин "дегликозилирование" относится к ферментативному удалению углеводных группировок из Fc-области, а термин "агликозилирование" означает, что Fc-область получают в негликозилированной форме с использованием прокариотов, предпочтительно Е.coli.
В то же время, источником для Fc-области иммуноглобулина могут быть люди или другие животные, включая крупный рогатый скот, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, и предпочтительно люди.
Помимо этого, Fc-область иммуноглобулина может представлять собой Fc-область, которая происходит из IgG, IgA, IgD, IgE и IgM, или которую получают с использованием их комбинаций или их гибридов. Предпочтительно, она происходит из IgG или IgM, которые являются одними из самых распространенных белков в крови человека, и наиболее предпочтительно из IgG, который, как известно, увеличивает периоды полураспада лиганд-связывающих белков.
С другой стороны, термин "комбинация", как он здесь использован, означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулинов одного происхождения, соединены с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть, димер или мультимер может быть образован из двух или более фрагментов, выбранных из группы, состоящей из фрагментов Fc IgG, Fc IgA, Fc IgM, Fc IgD и Fc IgE.
Термин "непептидильный полимер" относится к биосовместимому полимеру, содержащему две или более повторяющихся единиц, соединенных одна с другой любой ковалентной связью за исключением пептидной связи. В настоящем изобретении термин "непептидильный полимер" может быть использован взаимозаменяемо с термином "непептидильный линкер".
Непептидильный полимер, полезный в настоящем изобретении, может быть выбран из группы, состоящей из биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты и их комбинации, и предпочтительно, биоразлагаемым полимером может быть полиэтиленгликоль, полипропиленгликоль, сополимер этиленгликоля и пропиленгликоля, полиоксиэтилированный полиол, поливиниловый спирт, полисахарид, декстран, поливинил-этиловый простой эфир, полимолочная кислота (PLA) или полимолочная-гликолевая кислота (PLGA) и более предпочтительно, полиэтиленгликоль (ПЭГ). Помимо этого, в объем настоящего изобретения могут быть включены их производные, известные в данной области техники, и производные, легко получаемые способом, известным в данной области техники.
Пептидный линкер, который используется в слитом белке, полученном традиционным способом слияния в рамке считывания, имеет недостатки, заключающиеся в том, что он легко расщепляется in vivo под действием какого-либо протеолитического фермента, и ввиду этого невозможно получить ожидаемый значительный эффект возрастания периода полураспада активного лекарственного средства в сыворотке за счет присутствия носителя. Однако в настоящем изобретении, чтобы поддержать период полураспада пептида в сыворотке аналогичным таковому для носителя, можно использовать полимер, обладающий устойчивостью к действию этого протеолитического фермента. Таким образом, можно использовать без ограничения любой непептидильный полимер, если он представляет собой полимер, обладающий вышеупомянутой функцией, то есть полимер, обладающий устойчивостью к действию данного протеолитического фермента in vivo. Непептидильный полимер имеет молекулярную массу в диапазоне 1-100 кДа и предпочтительно 1-20 кДа. Непептидильный полимер по настоящему изобретению, соединенный с Fc-областью иммуноглобулина, может представлять собой один полимер или комбинацию полимеров разных типов.
Непептидильный полимер, используемый в настоящем изобретении, содержит реакционноспособную группу, обладающую способностью связываться с Fc-областью иммуноглобулина и белковым лекарственным средством. Непептидильный полимер содержит реакционноспособную группу на обоих концах, предпочтительно выбранную из группы, состоящей из рекационноспособных альдегида, пропиональдегида, бутиральдегида, малеимида и производного сукцинимида. Производное сукцинимида может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат. В частности, когда непептидильный полимер содержит реакционноспособную альдегидную группу на обоих своих концах, он эффективен в отношении связывания по обоим концам с физиологически активным полипептидом и иммуноглобулином с минимальным количеством неспецифических реакций. Конечный продукт, получаемый путем восстановительного алкилирования альдегидной связи, является гораздо более стабильным, чем соединенный амидной связью. Альдегидная реакционноспособная группа избирательно связывается с N-концом при низких значениях рН и связывается с остатком лизина с образованием ковалентной связи при высоких значениях рН, таких как рН 9,0. Реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или разными. Например, непептидильный полимер может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Когда в качестве непептидильного полимера используют полиэтиленгликоль, имеющий реакционноспособную гидроксигруппу на обоих его концах, эта гидроксигруппа может быть активирована с получением различных реакционноспособных групп с применением известных химических реакций, или для получения длительно действующего конъюгата по настоящему изобретению можно использовать имеющийся в продаже полиэтиленгликоль, содержащий модифицированную реакционноспособную группу.
Конъюгат по настоящему изобретению может быть таким, у которого оба конца непептидильного полимера, имеющего две реакционноспособные концевые группы, соединены с аминогруппой или тиоловой группой Fc-области иммуноглобулина и производных оксинтомодулина, соответственно.
Непептидильный полимер имеет реакционноспособную группу на обоих концах, предпочтительно выбранную из группы, состоящей из реакционноспособных альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и производного сукцинимида. Производное сукцинимида может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидил-карбонат.
Две реакционноспособные концевые группы непептидильного полимера могут быть одинаковыми или могут отличаться друг от друга. Например, непептидильный полимер может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Например, когда непептидильный полимер содержит реакционноспособную альдегидную группу в качестве концевой группы и малеимидную группу в качестве другой концевой группы, он эффективен в отношении связывания по обоим концам с физиологически активным полипептидом и иммуноглобулином с минимальным количеством неспецифических реакций. Согласно разделу Примеры настоящего изобретения конъюгаты получали путем присоединения оксинтомодулина или его производного к Fc-области иммуноглобулина посредством ковалентной связи с использованием ПЭГ, который представляет собой непептидильный полимер, содержащий только пропиональдегидную группу или как малеимидную группу, так и альдегидную группу.
Конъюгаты по настоящему изобретению демонстрируют превосходную активность в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином, а период полураспада в крови увеличен в результате присоединения к Fc-области, чтобы поддерживать активность in vivo в течение длительного периода времени.
Согласно еще одному аспекту настоящего изобретения предложена фармацевтическая композиция для предупреждения или лечения ожирения, содержащая пептид.
Использованный в данном описании термин "предупреждение" означает все действия, благодаря которым возникновение заболевания задержано или замедлено. Термин "предупреждение" в настоящем изобретении означает, что возникновение ожирения в результате действия таких факторов, как увеличение массы тела или содержания жира в организме, сдерживается или замедляется в результате введения конъюгатов по настоящему изобретению.
Использованный в данном описании термин "лечение" означает все действия, благодаря которым симптомы заболевания облегчены, снижены или улучшены. Термин "лечение" в настоящем изобретении означает, что симптомы ожирения облегчаются, снижаются или улучшаются в результате введения конъюгатов по настоящему изобретению, что приводит к уменьшению массы тела или содержания жира в организме.
Использованный в данном описании термин "ожирение" подразумевает накопление избыточного количества жировой ткани в организме, и индекс массы тела (масса тела (кг), деленная на квадрат роста (м)) больше 25 следует рассматривать как ожирение. Ожирение обычно обусловлено нарушением энергетического баланса, когда количество употребленной пищи превышает количество энергии, затраченной в течение продолжительного периода времени. Ожирение является метаболическим заболеванием, которое влияет на организм в целом и увеличивает риск развития диабета, гиперлипидемии, сексуальной дисфункции, артрита и сердечно-сосудистых заболеваний, а в некоторых случаях связано с заболеваемостью раком.
Конъюгаты по настоящему изобретению, которые получают путем присоединения оксинтомодулина или его производного к Fc-области иммуноглобулина, демонстрируют превосходную аффинность связывания с рецепторами глюкагона и GLP-1 (Таблица 3) и превосходную устойчивость к протеолитическим ферментам in vivo с проявлением таким образом активности in vivo в течение длительного периода времени, тем самым демонстрируя превосходные эффекты против ожирения, такие как уменьшения массы тела (ФИГ.12).
Фармацевтическая композиция по настоящему изобретению может также содержать фармацевтически приемлемый носитель, эксципиент или разбавитель. Использованный в данном описании термин "фармацевтически приемлемый" означает, что данная композиция является достаточной для достижения терапевтических эффектов без вредных побочных эффектов, и ее можно легко определить исходя из типа заболеваний, возраста, массы тела, состояния здоровья, пола и чувствительности пациента к лекарственному средству, пути введения, способа введения, частоты введения, продолжительности лечения, лекарственных средств, используемых в комбинации или совместно с композицией по данному изобретению, и других известных в медицине факторов.
Фармацевтическая композиция, содержащая производное по настоящему изобретению, может дополнительно содержать фармацевтически приемлемый носитель. В случае перорального введения носитель может включать, без ограничения этим, связующее вещество, смазывающее вещество, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и корригент. В случае препаратов для инъекций носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. В случае препаратов для местного введения носитель может включать основу, эксципиент, смазывающее вещество и консервант.
Композиция по настоящему изобретению может быть приготовлена в виде разнообразных лекарственных форм в комбинации с вышеупомянутыми фармацевтически приемлемыми носителями. Например, в случае перорального введения фармацевтическая композиция может быть приготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. В случае препаратов для инъекций фармацевтическая композиция может быть приготовлена в ампуле в виде разовой лекарственной формы или в виде контейнера для многократного приема. Фармацевтическая композиция также может быть изготовлена в виде растворов, суспензий, таблеток, пилюль, капсул и длительно действующих препаратов.
С другой стороны, примеры носителя, эксципиента и разбавителя, подходящих для фармацевтических композиций, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропил-гидроксибензоат, тальк, стеарат магния и минеральные масла. Кроме того, фармацевтические композиции могут дополнительно включать наполнители, противосвертывающие вещества, смазывающие вещества, увлажнители, корригенты и антисептики.
Кроме того, фармацевтическая композиция по настоящему изобретению может иметь любую форму, выбранную из группы, состоящей из таблеток, пилюль, порошков, гранул, капсул, суспензий, жидкостей для приема внутрь, эмульсий, сиропов, стерильных водных растворов, растворов в неводных растворителях, лиофилизированных композиций и суппозиториев.
Кроме того, композиция может быть приготовлена в виде разовой лекарственной формы, подходящей для организма пациента, и предпочтительно приготовлена в виде препарата, пригодного для пептидных лекарственных средств, типичным для фармацевтики способом для введения пероральным или парентеральным путем, как например, через кожу, посредством внутривенного, внутримышечного, внутриартериального, интрамедуллярного, интравентрикулярного, легочного, трансдермального, подкожного, внутрибрюшинного, интраназального, внутрь толстой кишки, местного, сублингвального, вагинального или ректального введения, без ограничения ими.
Композицию можно использовать, смешивая с рядом фармацевтически приемлемых носителей, таких как физиологический раствор или органические растворители. Чтобы повысить стабильность или всасываемость, можно использовать углеводы, такие как глюкоза, сахароза или декстраны, антиоксиданты, такие как аскорбиновая кислота или глутатион, хелатирующие агенты, низкомолекулярные белки или другие стабилизаторы.
Доза и частота введения фармацевтической композиции по настоящему изобретению определяются типом активного ингредиента вместе с различными факторами, такими как подвергаемое лечению заболевание, путь введения, возраст, пол и масса тела пациента и тяжесть заболевания.
Общую эффективную дозу композиции по настоящему изобретению можно вводить пациенту в виде разовой дозы или можно вводить в течение длительного периода времени в виде многократных доз согласно протоколу дробного лечения. Содержание активного ингредиента в фармацевтической композиции по настоящему изобретению может варьировать в зависимости от тяжести заболевания. Предпочтительно, общая суточная доза пептида по настоящему изобретению может составлять от приблизительно 0,0001 мкг до 500 мг на 1 кг массы тела пациента. Тем не менее, эффективную дозу пептида определяют, учитывая различные факторы, в том числе возраст пациента, массу тела, состояние здоровья, пол, тяжесть заболевания, питание и скорость выведения фармацевтической композиции в дополнение к пути ее введения и частоты лечения ею. Ввиду этого, специалисты в данной области могут легко определить эффективную дозу, подходящую для конкретного применения фармацевтической композиции по настоящему изобретению. Фармацевтическая композиция по настоящему изобретению, в частности, не ограничивается такой композицией и таким путем и способом введения при условии, что она оказывает эффекты в соответствии с настоящим изобретением.
Фармацевтическая композиция по настоящему изобретению показывает превосходные продолжительность эффективного действия in vivo и титр, тем самым значительно уменьшая число и частоту ее введения.
Кроме того, фармацевтическую композицию можно вводить по отдельности или в комбинации либо совместно с другими фармацевтическими композициями, демонстрирующими профилактические или терапевтические эффекты в отношении ожирения. Фармацевтические композиции, демонстрирующие профилактические или терапевтические эффекты в отношении ожирения, в частности, не ограничиваются перечисленным далее и могут включать агонист рецептора GLP-1, агонист лептинового рецептора, ингибитор DPP-IV, антагонист Y5-рецептора, антагонист рецептора меланин-концентрирующего гормона (МСН), агонист Y2/3-рецептора, агонист МС3/4-рецептора, ингибитор желудочной/панкреатической липазы, агонист 5НТ2 с, агонист β3А-рецептора, агонист рецептора амилина, антагонист грелина, и/или антагонист рецептора грелина.
Согласно еще одному аспекту настоящего изобретения предложен способ предупреждения или лечения ожирения, включающий стадию введения субъекту конъюгата или фармацевтической композиции, содержащей данный конъюгат.
Использованный в данном описании термин "введение" означает введение количества предварительно определенного вещества пациенту определенным подходящим способом. Композицию по настоящему изобретению можно вводить любым из общепринятых способов при условии, что с его помощью можно достичь желаемой ткани, например, посредством внутрибрюшинного, внутривенного, внутримышечного, подкожного, интрадермального, перорального, местного, интраназального, внутрилегочного или интраректального введения, но не ограничиваясь ими. Однако, поскольку при пероральном введении происходит расщепление пептидов, активные ингредиенты композиции для перорального введения должны иметь покрытие или быть приготовлены с защитой против разложения в желудке.
В настоящем изобретении термин "субъект" относится к тем, кто предположительно имеет ожирение, что обозначает млекопитающих, в том числе людей, мышей и домашний скот, имеющих ожирение или имеющих возможность ожирения. Тем не менее, включен любой субъект, подвергаемый лечению пептидом или фармацевтической композицией по настоящему изобретению, без ограничения. Субъекту, предположительно имеющему ожирение, вводят фармацевтическую композицию, содержащую пептид по настоящему изобретению, вследствие чего лечение данного субъекта является эффективным. Ожирение является таким, как описано выше.
Терапевтический способ по настоящему изобретению может включать стадию введения композиции, содержащей пептид в фармацевтически эффективном количестве. Общая суточная доза должна быть определена путем соответствующего медицинского обследования, проведенного врачом, и введена один или несколько раз. Что касается задач настоящего изобретения, то конкретный терапевтически эффективный уровень доз для любого конкретного пациента может варьировать в зависимости от различных факторов, хорошо известных в области медицины, включая тип и степень ответа, который должен быть достигнут, конкретные композиции с учетом того, используют вместе с ними другие агенты или нет, возраст, вес тела, состояние здоровья, пол и питание пациента, продолжительность и путь введения, скорость выведения композиции, период времени терапии, другие лекарственные средства, используемые в комбинации или совместно с композицией по изобретению, и подобные факторы, хорошо известные в области медицины.
В еще одном аспекте настоящего изобретения предложено применение конъюгата или фармацевтической композиции, содержащей данный конъюгат, в изготовлении лекарственных средств для предупреждения или лечения ожирения.
Способ осуществления изобретения
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие ниже примеры. Однако эти примеры приводятся только в целях иллюстрации, и не подразумевается, что данное изобретение ограничено этими примерами.
Пример 1. Получение активированной in vitro клеточной линии
Пример 1-1. Получение клеточной линии, демонстрирующей цАМФ(циклический аденозинмонофосфат)-ответ на GLP-1
Чтобы получить ПЦР-продукт, проводили ПЦР (полимеразную цепную реакцию), используя участок, соответствующий ORF (открытой рамке считывания) в кДНК (OriGene Technologies, Inc. USA) гена рецептора GLP-1 человека в качестве матрицы, и приведенные далее прямой и обратный праймеры, каждый из которых содержал сайты рестрикции для HindIII и EcoRI.
Прямой праймер: 5'-CCCGGCCCCCGCGGCCGCTATTCGAAATAC-3' (SEQ ID NO. 47).
Обратный праймер: 5'-GAACGGTCCGGAGGACGTCGACTCTTAAGATAG-3' (SEQ ID NO. 48).
Этот ПЦР-продукт клонировали в известный экспрессирующий вектор для клеток животных x0GC/dhfr (дигидрофолатредуктаза) с получением рекомбинантного вектора x0GC/GLP1R (рецептор GLP-1).
Линию клеток СНО DG44 (линия клеток яичников китайского хомячка, дефектных по dhfr), культивируемую в среде DMEM/F12 (модифицированная по способу Дульбекко среда Игла с питательной смесью Хэма F12) (10% FBS (эмбриональная бычья сыворотка)), трансфицировали рекомбинантным вектором x0GC/GLPIR с использованием липофектамина (Invitrogen, USA) и культивировали в селективной среде, содержащей G418 (1 мг/мл) и 10 нМ метотрексат. Из нее отбирали клеточные линии, происходящие из единичных клонов, используя метод предельных разведении, и из них окончательно отбирали клеточную линию, демонстрирующую превосходный зависимый от концентрации цАМФ-ответ на GLP-1.
Пример 1-2. Получение клеточной линии, демонстрирующей цАМФ-ответ на глюкагон
Чтобы получить ПЦР-продукт, проводили ПЦР, используя участок, соответствующий ORF в кДНК (OriGene Technologies, Inc. USA) гена рецептора глюкагона человека в качестве матрицы, и приведенные далее прямой и обратный праймеры, каждый из которых содержал сайты рестрикции для EcoRI и XhoI.
Прямой праймер: 5'-CAGCGACACCGACCGTCCCCCCGTACTTAAGGCC-3' (SEQ ID NO. 49).
Обратный праймер: 5'-CTAACCGACTCTCGGGGAAGACTGAGCTCGCC-3' (SEQ ID NO. 50).
Этот ПЦР-продукт клонировали в известный экспрессирующий вектор для клеток животных x0GC/dhfr с получением рекомбинантного вектора xOGC/GCGR (рецептор глюкагона).
Линию клеток СНО DG44, культивируемую в среде DMEM/F12 (10% FBS), трансфицировали рекомбинантным вектором x0GC/GCGR с использованием липофектамина и культивировали в селективной среде, содержащей G418 (1 мг/мл) и 10 нМ метотрексат. Из нее отбирали клеточные линии, происходящие из единичных клонов, используя метод предельных разведении, и из них окончательно отбирали клеточную линию, демонстрирующую превосходный зависимый от концентрации цАМФ-ответ на глюкагон.
Пример 2. Тестирование активности производных оксинтомодулина in vitro
Пример 2-1. Синтез производных оксинтомодулина
Чтобы измерить активности производных оксинтомодулина in vitro, синтезировали производные оксинтомодулина, имеющие следующие аминокислотные последовательности (Таблица 1).


Аминокислоты в Таблице 1, выделенные жирным шрифтом и подчеркнутые, представляют собой аминокислоты, образующие кольцо, а аминокислоты, обозначенные как X, означают ненативную аминокислоту, альфа-метил-глутаминовую кислоту. Помимо этого, СА представляет собой 4-имидазоацетил, и DA представляет собой дезаминогистидил.
Пример 2-2. Тестирование активности производных оксинтомодулина in vitro
Чтобы измерить эффективности производных оксинтомодулина против ожирения, синтезированных в примере 2-1, измеряли in vitro активность в клетках, используя клеточные линии, полученные в примерах 1-1 и 1-2.
Использовали клеточные линии, полученные трансфекцией клеток СНО (яичников китайского хомячка) для экспрессии гена рецептора GLP-1 человека и гена рецептора глюкагона, соответственно. Таким образом, они подходят для измерения активностей GLP-1 и глюкагона. Ввиду этого, активность каждого производного оксинтомодулина измеряли, используя трансфицированную клеточную линию для каждого из них.
Конкретно, каждую клеточную линию субкультивировали два или три раза в неделю и в каждую лунку 96-луночного планшета вносили аликвоты с плотностью клеток 1×105 с последующим культивированием в течение 24 часов.
Культивированные клетки промывали буфером KRB (бикарбонатный буфер Кребса-Рингера) и суспендировали в 40 мл буфера KRB, содержащего 1 мМ IBMX (изобутилметилксантин), и оставляли при комнатной температуре на 5 минут. Проводили разведение оксинтомодулина (SEQ ID NO. 1) и производных оксинтомодулина (представленных SEQ ID NO. 2-6, 8, 10-13, 17, 18, 23-25, 27, 28 и 32-34) от 1000 нМ до 0,02 нМ, используя 5-кратное серийное разведение, и по 40 мл каждого из них добавляли к клеткам и культивировали при 37°С в течение 1 часа в CO2-инкубаторе. Затем для лизиса клеток добавляли по 20 мл лизирующего буфера для клеток и для измерения концентраций цАМФ в клеточных лизатах использовали набор для анализа цАМФ (Molecular Device, USA). Исходя из этого рассчитывали величины ЕС50 и проводили их сравнение. Величины ЕС50 показаны в приведенной ниже Таблице 2.
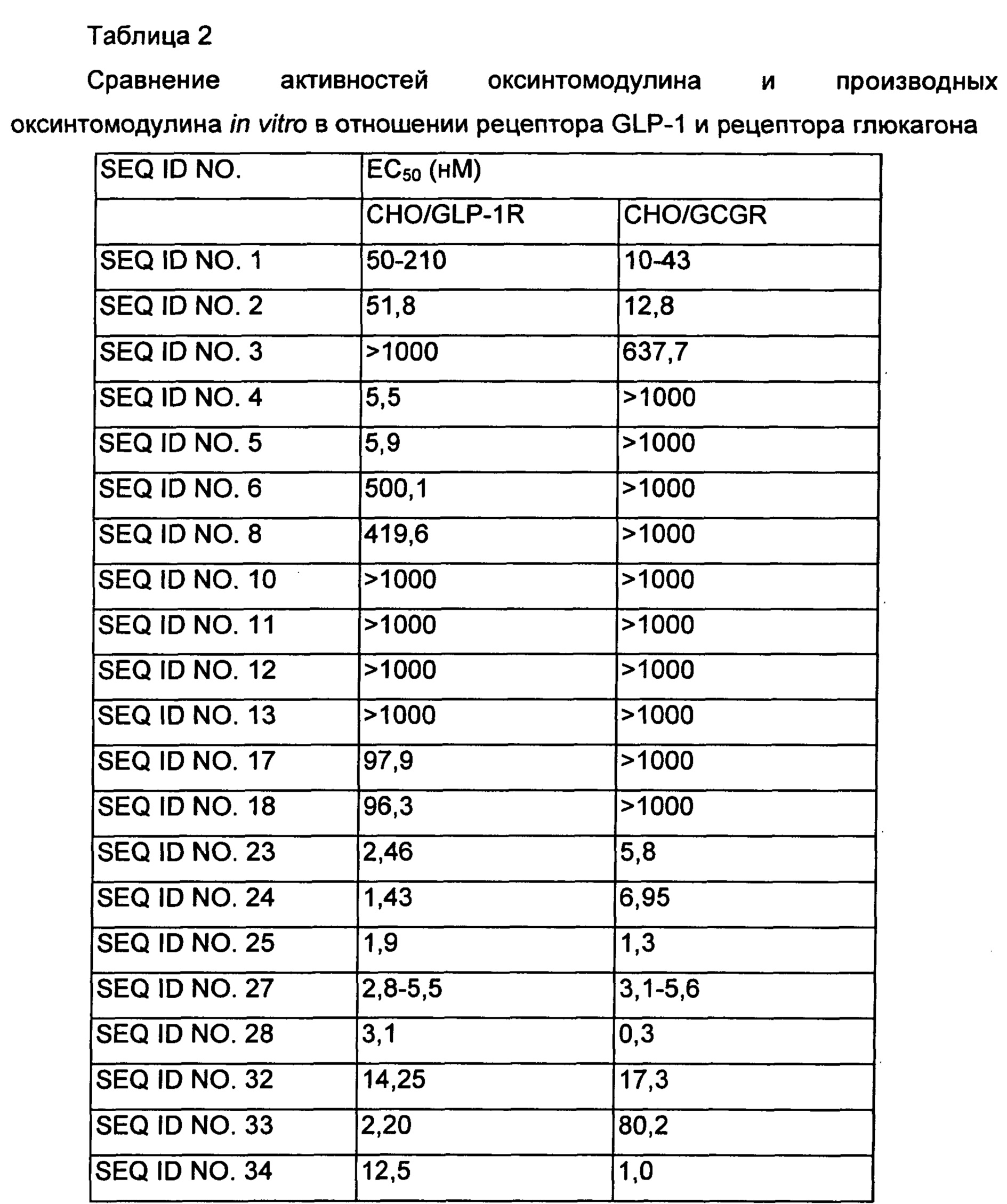
Как показано в Таблице 2, производные оксинтомодулина демонстрировали превосходные активности in vitro и разные соотношения активностей в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином, представленным SEQ ID NO. 1.
Известно, что оксинтомодулин активирует как рецептор GLP-1, так и рецептор глюкагона, подавляя аппетит, способствуя липолизу и стимулируя насыщение, тем самым демонстрируя эффекты против ожирения. Производные оксинтомодулина по настоящему изобретению демонстрируют более высокие активности in vitro в отношении как рецептора GLP-1, так и рецептора глюкагона по сравнению с оксинтомодулином дикого типа, и ввиду этого могут быть использованы в качестве терапевтического средства для лечения ожирения с более высокой эффективностью, чем известный оксинтомодулин.
Пример 3. Тестирование активности производных оксинтомодулина in vivo
Чтобы измерить терапевтическую активность in vivo производных оксинтомодулина, изучали изменения в потреблении пищи в результате введения производных оксинтомодулина ob/ob мышам, используя нативный оксинтомодулин в качестве контроля.
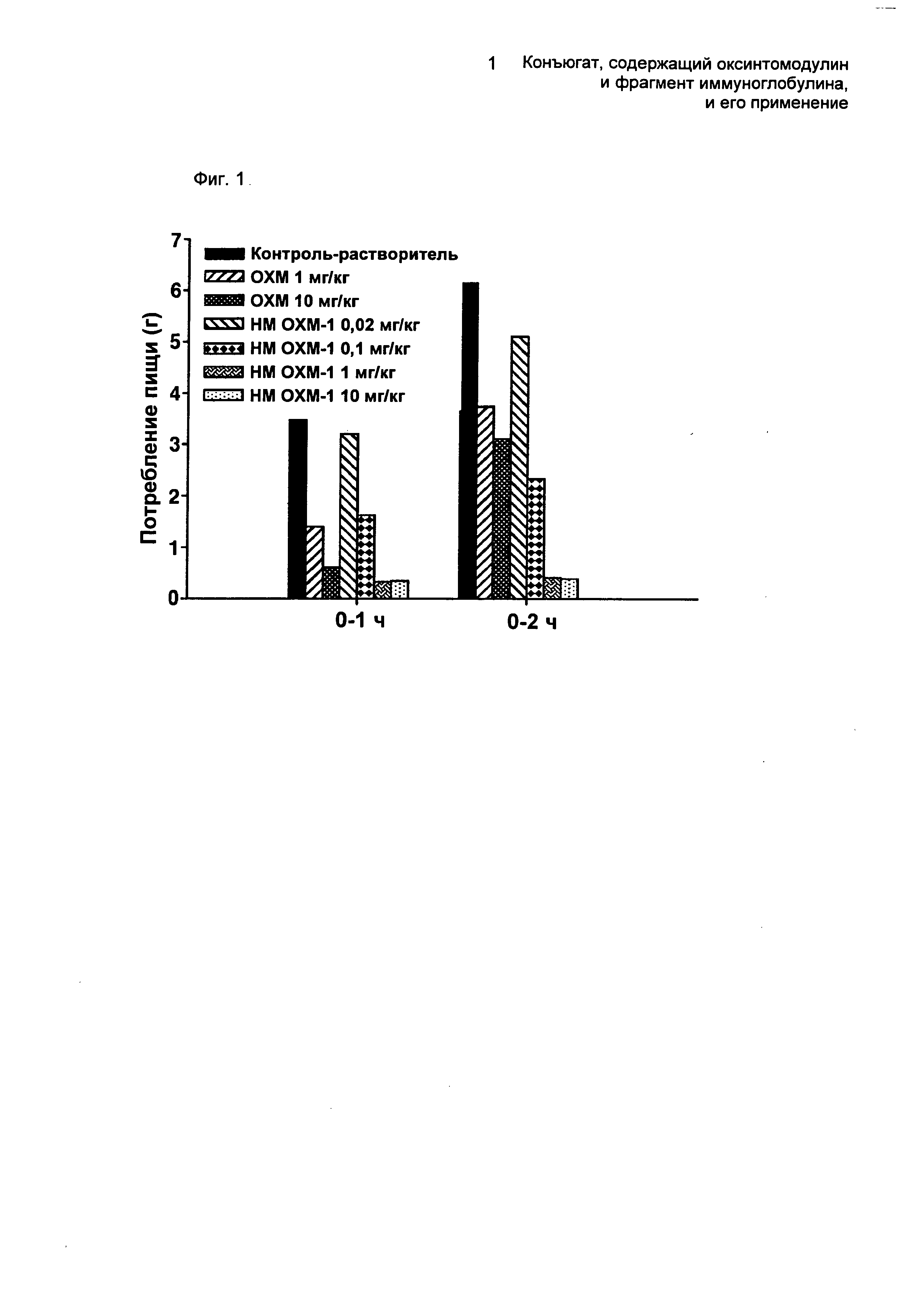
Конкретно, страдающих ожирением и диабетом ob/ob мышей, обычно используемых для проверки эффективности терапевтических средств для лечения ожирения и диабета, подвергали голоданию в течение 16 часов, и им вводили оксинтомодулин (1 или 10 мг/кг) или производное оксинтомодулина (0,02; 0,1; 1 или 10 мг/кг), представленное SEQ ID NO. 2. Затем в течение 2 часов изучали потребление пищи (ФИГ.1). ФИГ.1 представляет собой график, показывающий изменения в потреблении пищи в соответствии с введенной дозой оксинтомодулина или производного оксинтомодулина. Как показано на ФИГ.1, введение производного оксинтомодулина в дозе 1 мг/кг демонстрировало более превосходные ингибирующие эффекты на потребление пищи, чем введение 10 мг/кг оксинтомодулина.
В своей совокупности производные оксинтомодулина по настоящему изобретению производят более сильные эффекты против ожирения, чем оксинтомодулин дикого типа, даже при введении в более низкой дозе, что указывает на уменьшение проблем, связанных с оксинтомодулином дикого типа, который демонстрирует более слабые эффекты против ожирения и который следует вводить в высокой дозе три раза в сутки.
Пример 4. Получение конъюгатов, содержащих оксинтомодулин и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 30 аминокислотной последовательности оксинтомодулина (SEQ ID NO. 1) с использованием 3,4 K PropionALD(2) ПЭГ (ПЭГ с двумя пропилальдегидными группами, 3,4 кДа; NOF, Japan) осуществляли взаимодействие оксинтомодулина и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:12, причем концентрация белка составляла 5 мг/мл, при 4°С в течение 4,5 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ Na-боратного буфера (рН 9,0) и 45% изопропанола, и в нее добавляли 20 мМ цианоборгидрид натрия (SCB, NaCNBH3) в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на SOURCE S (XK16, Amersham Biosciences) для очистки оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S (XK16, Amersham Biosciences), скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.2а). ФИГ.2а представляет собой график, показывающий результат очистки моно-ПЭГилированного оксинтомодулина на колонке для очистки SOURCE S. Моно-ПЭГилирование элюированных пиков проверяли с использованием SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия), а селективность в отношении лизина проверяли посредством пептидного картирования с применением Asp-N-протеазы (ФИГ.2b). ФИГ.2b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного оксинтомодулина.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного оксинтомодулина и Fc-области иммуноглобулина в молярном соотношении 1:10, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q для очистки конъюгатов, содержащих оксинтомодулин и Fc-область иммуноглобулина (колонка: SOURCE 15Q (XK16, Amersham Biosciences), скорость потока: 2,0 мл/мин, градиент: А 0→20% 100 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.2c). ФИГ.2c представляет собой график, показывающий результат очистки конъюгатов, содержащих оксинтомодулин и Fc-область иммуноглобулина.
Пример 5. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 29) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 29) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 29) и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:12, причем концентрация белка составляла 5 мг/мл, при 4°С в течение 4,5 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ Na-боратного буфера (рН 9,0) и 45% изопропанола, и в нее добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.3а). ФИГ.3а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 29) на колонке для очистки SOURCE S.
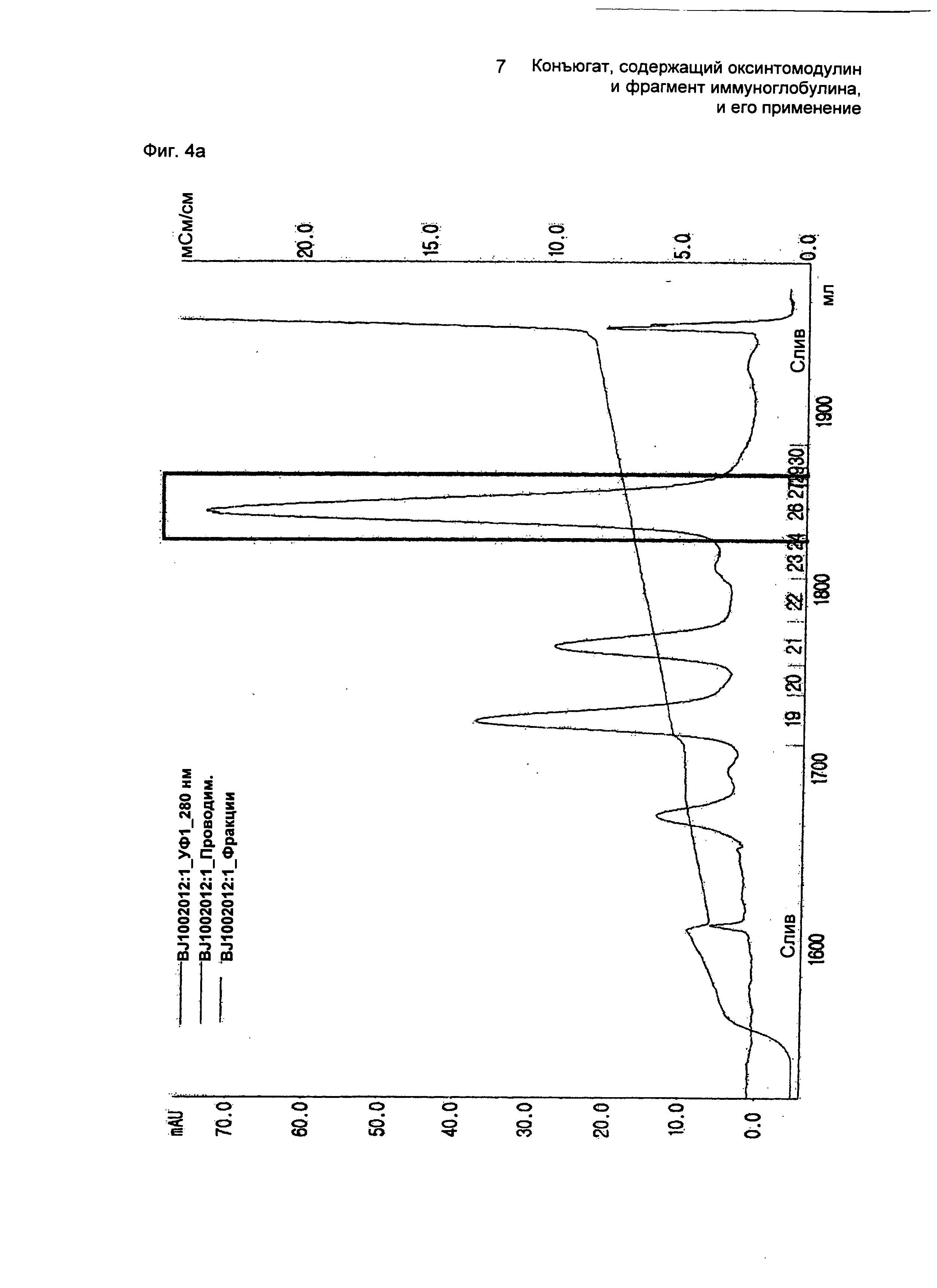
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 29) и Fc-области иммуноглобулина в молярном соотношении 1:10, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 29) и Fc-область иммуноглобулина (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→20% 100 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.3b). ФИГ.3b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 29) и Fc-область иммуноглобулина.
Пример 6. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 30) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 30) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 30) и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:15, причем концентрация белка составляла 3 мг/мл, при 4°С в течение 4,5 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ буфера на основе HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота) (рН 7,5) и 45% изопропанола, и в нее добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.4а). ФИГ.4а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30) на колонке для очистки SOURCE S. Моно-ПЭГилирование элюированных пиков проверяли с использованием SDS-PAGE, а селективность в отношении лизина проверяли посредством пептидного картирования с применением Asp-N-протеазы (ФИГ.4b). ФИГ.4b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30).
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30) и Fc-области иммуноглобулина в молярном соотношении 1:10, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 30) и Fc-область иммуноглобулина (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→20% 100 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.4c). ФИГ.4c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 30) и Fc-область иммуноглобулина.
Пример 7. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 31) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 31) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 31) и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:15, прчем концентрация белка составляла 3 мг/мл, при 4°С в течение 4,5 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ HEPES-буфера (рН 7,5) и 45% изопропанола, и в нее добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.5а). ФИГ.5а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 31) на колонке для очистки SOURCE S.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированого производного оксинтомодулина (SEQ ID NO. 31) и Fc-области иммуноглобулина в молярном соотношении 1:10, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 31) и Fc-область иммуноглобулина (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→20% 100 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.5b). ФИГ.5b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 31) и Fc-область иммуноглобулина.
Пример 8. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 2) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 2) и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:10, причем концентрация белка составляла 3 мг/мл, при 4°С в течение 4 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ HEPES-буфера (рН 7,5) и 45% изопропанола, и в нее добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.6а). ФИГ.6а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2) на колонке для очистки SOURCE S. Моно-ПЭГилирование элюированных пиков проверяли с использованием SDS-PAGE, а селективность в отношении лизина проверяли посредством пептидного картирования с применением Asp-N-протеазы (ФИГ.6b). ФИГ.6b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2).
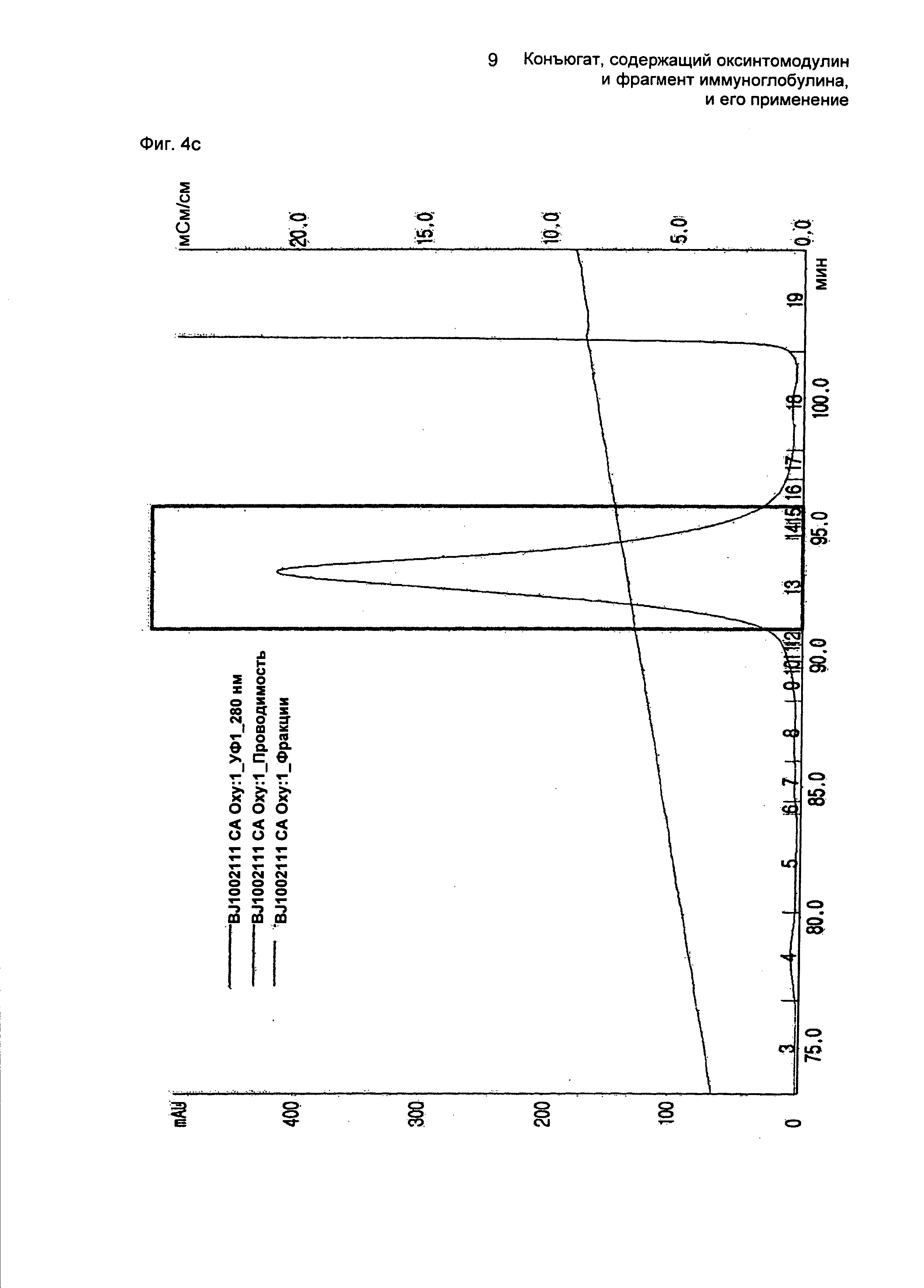
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2) и Fc-области иммуноглобулина в молярном соотношении 1:8, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.6c) и колонку SOURCE ISO (колонка: SOURCE ISO (XK16, Amersham Biosciences), скорость потока: 2,0 мл/мин, градиент: А 0→100% 100 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,3 М AS (сульфат аммония))) (ФИГ.6d) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина. ФИГ.6c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q, а ФИГ.6d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
Пример 9. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 27 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 3) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 3) и 3,4 K PropionALD(2) ПЭГ в молярном соотношении 1:10, причем концентрация белка составляла 3 мг/мл, при 4°С в течение 4 часов. В течение этого времени реакцию проводили в смеси растворителей, состоящей из 100 мМ HEPES-буфера (рН 7,5) и 45% изопропанола, и в нее добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.7а). ФИГ.7а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3) на колонке для очистки SOURCE S. Моно-ПЭГилирование элюированных пиков проверяли с использованием SDS-PAGE, а селективность в отношении лизина проверяли посредством пептидного картирования с применением Asp-N-протеазы (ФИГ.7b). ФИГ.7b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3).
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3) и Fc-области иммуноглобулина в молярном соотношении 1:8, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку Butyl FF (колонка: Butyl FF (XK16, Amersham Biosciences), скорость потока: 2,0 мл/мин, градиент: В 0→100% 5 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,5 М NaCl)) (ФИГ.7c) и колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.7d) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина. ФИГ.7c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки Butyl FF, а ФИГ.7d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
Пример 10. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 24 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 23) с использованием MAL-10K-ALD ПЭГ (NOF, Japan) осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 23) и MAL-10K-ALD ПЭГ в молярном соотношении 1:3, причем концентрация белка составляла 3 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трис-буфере (рН 8,0) и 45% изопропаноле, и к ним добавляли 1 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.8а). ФИГ.8а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 23) на колонке для очистки SOURCE S.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 23) и Fc-области иммуноглобулина в молярном соотношении 1:5, причем концентрация белка составляла 20 м г/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.8b) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) (ФИГ.8c) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина. ФИГ. 8b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q, а ФИГ.8c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
Пример 11. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 24) с использованием MAL-10K-ALD ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 24) и MAL-10K-ALD ПЭГ в молярном соотношении 1:3, причем концентрация белка составляла 3 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трис-буфере (рН 8,0) и 45% изопропаноле, и к ним добавляли 1 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.9а). ФИГ.9а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 24) на колонке для очистки SOURCE S.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 24) и Fc-области иммуноглобулина в молярном соотношении 1:5, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.9b) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) (ФИГ.9c) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина. ФИГ.9b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q, а ФИГ.9c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
Пример 12. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 25) с использованием MAL-10K-ALD ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 25) и MAL-10K-ALD ПЭГ в молярном соотношении 1:3, причем концентрация белка составляла 3 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трио-буфере (рН 8,0) и в него добавляли 1 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ.10а). ФИГ.10а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 25) на колонке для очистки SOURCE S.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 25) и Fc-области иммуноглобулина в молярном соотношении 1:5, причем концентрация белка составляла 20 м г/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.10b) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) (ФИГ.10c) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина. ФИГ.10b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q, а ФИГ. 10 с представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
Пример 13. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка лизина в положении 20 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 28) с использованием 3,4 K PropionALD(2) ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 28) и MAL-10K-ALD ПЭГ в молярном соотношении 1:5, причем концентрация белка составляла 3 мг/мл, при 4°С в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Na-боратном буфере (рН 9,0) и в него добавляли 2 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный лизин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→3% 1 мин В→40% 222 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)) (ФИГ. 11а). ФИГ.11а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 28) на колонке для очистки SOURCE S.
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 28) и Fc-области иммуноглобулина в молярном соотношении 1:10, прчем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 150, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) (ФИГ.11b) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) (ФИГ.11c) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина. ФИГ.11b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q, а ФИГ.11c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
Пример 14. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 32) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 32) с использованием MAL-10K-ALD ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 32) и MAL-10K-ALD ПЭГ в молярном соотношении 1:3, причем концентрация белка составляла 1 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трис-буфере (рН 8,0) и в него добавляли 2 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)).
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 32) и Fc-области иммуноглобулина в молярном соотношении 1:8, причем концентрация белка составляла 20 м г/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 32) и Fc-область иммуноглобулина.
Пример 15. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 33) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 33) с использованием MAL-10K-ALD ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 33) и MAL-10K-ALD ПЭГ в молярном соотношении 1:1, причем концентрация белка составляла 1 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трио-буфере (рН 8,0) и в него добавляли 2 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)).
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 33) и Fc-области иммуноглобулина в молярном соотношении 1:5, причем концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 33) и Fc-область иммуноглобулина.
Пример 16. Получение конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 34) и Fc-область иммуноглобулина
Сначала для ПЭГилирования остатка цистеина в положении 30 аминокислотной последовательности производного оксинтомодулина (SEQ ID NO. 34) с использованием MAL-10K-ALD ПЭГ осуществляли взаимодействие производного оксинтомодулина (SEQ ID NO. 34) и MAL-10K-ALD ПЭГ в молярном соотношении 1:1, причем концентрация белка составляла 3 мг/мл, при комнатной температуре в течение 3 часов. В течение этого времени реакцию проводили в 50 мМ Трис-буфере (рН 8,0) и в него добавляли 1 М гуанидин. По завершении реакции реакционную смесь наносили на колонку SOURCE S для очистки производного оксинтомодулина, имеющего моно-ПЭГилированный цистеин (колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0 + 45% этанол; В: А + 1 М KCl)).
Далее осуществляли взаимодействие очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 34) и Fc-области иммуноглобулина в молярном соотношении 1:5, при этом концентрация белка составляла 20 мг/мл, при 4°С в течение 16 часов. В течение этого времени реакцию проводили в 100 мМ калий-фосфатном буфере (рН 6,0) и в него добавляли 20 мМ SCB в качестве восстанавливающего агента. По завершении реакции реакционную смесь наносили на колонку SOURCE 15Q (колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1 М NaCl)) и колонку SOURCE ISO (колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5; В: А + 1,1 М AS)) для очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 34) и Fc-область иммуноглобулина.
Пример 17. Активность in vitro конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина"
Чтобы измерить эффективности против ожирения для конъюгатов, содержащих оксинтомодулин или производное оксинтомодулина и Fc-область иммуноглобулина, полученных в приведенных выше примерах, проводили эксперименты точно так же, как и в примере 2-2.
Конкретно, каждую из трансфицированных клеточных линий, полученных в примерах 1-1 и 1-2, субкультивировали два или три раза в неделю и в каждую лунку 96-луночного планшета вносили аликвоты с плотностью клеток 1×105 с последующим культивированием в течение 24 часов. Каждую из культивированных трансфицированных клеточных линий промывали буфером KRB, суспендировали в 40 мл буфера KRB, содержащего 1 мМ IBMX, и оставляли при комнатной температуре на 5 минут. Проводили разведение GLP-1, глюкагона и конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23, 24, 25, 32, 33 или 34) и Fc-область иммуноглобулина, от 1000 нМ до 0,02 нМ, используя 5-кратное серийное разведение, и по 40 мл каждого из них добавляли к каждой трансфицированной клеточной линии и культивировали при 37°С в течение 1 часа в CO2-инкубаторе. Затем для лизиса клеток добавляли по 20 мл лизирующего буфера для клеток и для измерения концентраций цАМФ в клеточных лизатах использовали набор для анализа цАМФ (Molecular Device, USA), применяя Victor (Perkin Elmer, USA). Исходя из этого рассчитывали величины EC50 и проводили их сравнение (Таблица 3).
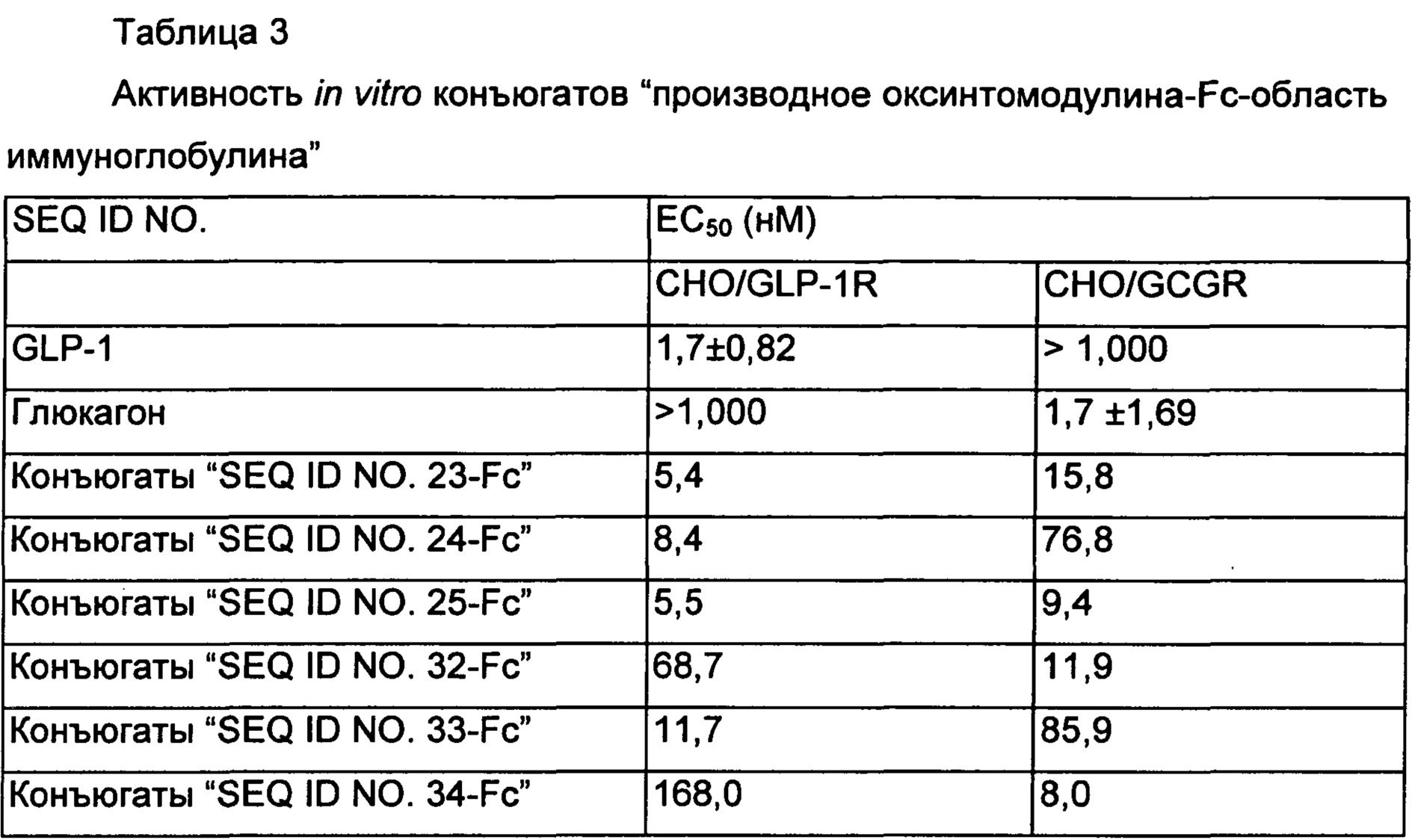
Как показано в Таблице 3, было обнаружено, что конъюгаты "производное оксинтомодулина-Fc-область иммуноглобулина" демонстрируют активность in vitro в отношении рецепторов GLP-1 и глюкагона.
Пример 18. Активность in vivo конъюгатов "производное оксинтомодулина-иммуноглобулин"
Проводили изучение на предмет того, демонстрируют ли конъюгаты "производное оксинтомодулина-Fc-область иммуноглобулина" превосходные эффекты in vivo в отношении снижения массы тела.
Конкретно, нормальные мыши C57BL/6 в возрасте 6 недель получали корм с высоким содержанием жиров из расчета 60 ккал в течение 24 недель для увеличения массы их тела в среднем приблизительно на 50 г и подкожно им вводили конъюгаты "производное оксинтомодулина (SEQ ID NO. 23, 24 или 25)-Fc-область иммуноглобулина", в дозе 0,03 или 0,06 мг/кг/неделя в течение 3 недель. После этого проводили измерения изменений массы тела мышей (ФИГ.12 и ФИГ.13). ФИГ.12 и ФИГ.13 представляют собой графики, показывающие изменения массы тела мышей в соответствии с типом и вводимой дозой конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина". Как показано на ФИГ.12 и ФИГ.13, при увеличении вводимой дозы конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина" масса тела уменьшалась прямо пропорционально, даже несмотря на различия между типами конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина", что указывает на то, что конъюгаты "производное оксинтомодулина-Fc-область иммуноглобулина" снижают массу тела дозозависимым образом.