Результат интеллектуальной деятельности: СПОСОБ ОЧИСТКИ ЧЕЛОВЕЧЕСКОГО ФАКТОРА, СТИМУЛИРУЮЩЕГО КОЛОНИИ ГРАНУЛОЦИТОВ, ИЗ РЕКОМБИНАНТНЫХ Е. COLI
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к способу очистки человеческих факторов, стимулирующих колонии гранулоцитов (hG-CSF), из рекомбинантных E. coli. Более конкретно, настоящее изобретение относится к способу очистки человеческих факторов, стимулирующих колонии гранулоцитов (hG-CSF), из рекомбинантных E. coli с получением высокой степени чистоты и высокого выхода, причем способ включает стадии: (a) культивирования hG-CSF-экспрессирующих рекомбинантных E. coli с получением клеточного осадка путем центрифугирования; (b) отделения hG-CSF-содержащей надосадочной жидкости от клеточного осадка, полученного в стадии (a); (c) обработки надосадочной жидкости, полученной в стадии (b), с помощью кислоты для отделения полученного в результате осадка путем фильтрации; (d) применения фильтрата, полученного в стадии (c), к катионообменной хроматографии; (e) применения элюата, полученного в стадии (d), к хроматографии гидрофобного взаимодействия; и (f) применения элюата, полученного в стадии (e), к анионообменной хроматографии.
Уровень техники
Колониестимулирующие факторы (CSF) вырабатываются T-клетками, макрофагами, фибробластами и эндотелиальными клетками, и эти клетки широко распространены в организме. Известные CSF включают GM-CSF, M-CSF и G-CSF. Среди них GM-CSF представляет собой гранулоцитарный макрофагальный колониестимулирующий фактор, который действует на стволовые клетки гранулоцитов или макрофагов для индукции их пролиферации и дифференцировки, стимулируя таким образом образование колоний гранулоцитов или макрофагов. M-CSF (макрофагальный CSF) представляет собой макрофагальный колониестимулирующий фактор, который прежде всего функционирует для стимулирования образования колоний макрофагов. G-CSF (гранулоцитарный CSF) представляет собой фактор, стимулирующий колонии гранулоцитов, который стимулирует образование колоний гранулоцитов и индуцирует конечную дифференцировку.
Обычно с целью выделения и очистки G-CSF, клетки культивируют, и белки G-CSF выделяют из надосадочной жидкости культуры. Однако у этого метода есть проблема низкого выхода G-CSF, и, таким образом, он не подходит для крупномасштабной выработки. Кроме того, компания Chugai Pharmaceuticals Co., Ltd. (Япония) разработала метод получения гликозилированного hG-CSF в клетке млекопитающего путем применения геномной ДНК или кДНК, включающей полинуклеотид, кодирующий hG-CSF (Корейский Патенты NO. 47178, 53723 и 57582). Однако известно, что сахарная цепь гликозилированного hG-CSF не является необходимой для активности hG-CSF, и получение гликозилированного hG-CSF с применением клеток млекопитающих требует дорогих материалов и средств, и, таким образом, такой процесс не является экономически целесообразным.
Были попытки получения не гликозилированного hG-CSF путем применения прокариотической клетки. В этих исследованиях hG-CSF, содержащие остаток метионина, присоединенный к их N-концу, продуцировались благодаря инициирующему кодону ATG, но данная форма отличается от нативной формы. Кроме того, hG-CSF, продуцированный в микроорганизме, может быть контаминирован примесями, привнесенными из клеток-хозяев или из материалов культуры, и требуется более сложный процесс очистки для применения в лекарственном средстве, имеющем высокую степень чистоты. Кроме того, когда в качестве клетки-хозяина используется E. coli, то большая часть hG-CSF депонируется в клетках в виде нерастворимых телец включения, и они должны быть превращены в активную форму посредством процесса рефолдинга со значительными потерями на выходе. Во время этого процесса индуцируется частичное восстановление, образование внутримолекулярных дисульфидных связей или ошибочное образование дисульфидов и, таким образом, необходимо осуществление затруднительного процесса для их удаления, и тем самым вызвана потеря эффективности способа. Один остаток цистеина не участвует в образовании дисульфидной связи и, таким образом, он существует в свободной форме, приводя к дополнительной потере эффективности и к уменьшению стабильности белкового раствора.
Соответственно, существует необходимость разработки способа крупномасштабного получения hG-CSF, которые бы не содержали остаток метионина на своих N-концах и, таким образом, были бы идентичны нативной форме даже при использовании микроорганизмов.
Что касается решения этих проблем, то авторы настоящего изобретения ранее сообщали, что был получен новый секреторный сигнальный пептид с высокой степенью экспрессии путем модификации известного сигнального пептида термоустойчивого энтеротоксина II E. coli (Корейский Патент No. 316347) и использован для получения нативного hG-CSF. Кроме того, авторы настоящего изобретения получили экспрессирующий вектор, включающий рекомбинантный ген, который получали путем соединения гена hG-CSF вместо гена энтеротоксина следом за модифицированным сигнальным пептидом термоустойчивого энтеротоксина II E. coli, и трансформировали E. coli экспрессирующим вектором, экспрессируя таким образом биологически активные hG-CSF в периплазматическом пространстве путем применения микробной системы секреции (Корейский Патент No. 356140).
Путем применения микробной системы секреции белка в периплазматическое пространство можно было получить нативные hG-CSF в растворимой форме, не содержащие на N-конце остаток метионина. Кроме того, периплазматические белки, как правило, составляют менее чем 10% суммарного клеточного белка и, таким образом, требуется менее интенсивная очистка рекомбинантного белка, чем для белков, локализованных в цитоплазме. Кроме того, нет необходимости в процедуре разрушения клетки и может быть минимизирована контаминация сахаридами и нуклеиновыми кислотами, присутствующими в цитоплазме. Однако из-за низкого уровня экспрессии в процессе периплазматичекого получения, его перевод в промышленное производство затруднителен. Таким образом, существует настоятельная необходимость разработки эффективного способа очистки экспрессированных белков с получением высокого выходы и высокой степени чистоты.
Область техники
Техническая проблема
Соответственно, авторы настоящего изобретения попытались решить проблемы предшествующего уровня техники. В результате они обнаружили, что нативные человеческие факторы, стимулирующие колонии гранулоцитов, могут быть получены в промышленном масштабе с высокой степенью чистоты путем культивирования рекомбинантных E. coli с получением секретирующихся белков, и затем путем применения к белкам преципитации с использованием кислоты → катионообменной хроматографии → хроматографии гидрофобных взаимодействий → анионообменной хроматографии, с осуществлением таким образом настоящего изобретения.
Решение проблемы
Целью настоящего изобретения является предложение способа очистки человеческих факторов, стимулирующих колонии гранулоцитов (hG-CSF), из рекомбинантных E. coli. с высокой степенью чистоты и с высоким выходом, причем способ включает стадии:
(a) культивирования hG-CSF-экспрессирующих рекомбинантных E. coli с получением клеточного осадка путем центрифугирования;
(b) отделения hG-CSF-содержащей надосадочной жидкости от клеточного осадка, полученного в стадии (a);
(c) обработки надосадочной жидкости, полученной в стадии (b), с помощью кислоты для удаления полученного осадка путем фильтрации;
(d) применения к фильтрату, полученному в стадии (c), катионообменной хроматографии;
(e) применения к элюату, полученному в стадии (d), хроматографии гидрофобного взаимодействия; и
(f) применения к элюату, полученному в стадии (e), анионообменной хроматографии.
Другой целью настоящего изобретения является получение физиологически активных уникальных hG-CSF, имеющих высокую степень чистоты, которые выделяют и очищают из рекомбинантных E. coli с помощью вышеописанного способа.
Выгодные эффекты изобретения
Согласно способу настоящего изобретения человеческий фактор, стимулирующий колонии гранулоцитов, идентичный нативной форме, экспрессирующейся в человеческом организме, может быть легко очищен с получением высокого выхода и высокой степени чистоты без дополнительного процесса активации. Конкретно, согласно способу настоящего изобретения варианты hG-CSF, экспрессирующиеся в E. coli, эффективно удаляются с получением физиологически активных hG-CSF, имеющих высокую степень чистоты.
Краткое описание чертежей
На ФИГ. 1 представлены результаты SDS-PAGE каждого раствора, полученного на стадиях осмотической экстракции, кислотной преципитации, катионообменной хроматографии и хроматографии гидрофобного взаимодействия для hG-CSF, которые очищали из периплазматического пространства рекомбинантных E. coli согласно способу очистки по настоящему изобретению, где
Дорожка 1: Стандарт.
Дорожка 2: Надосадочная жидкость первичного центрифугирования стадии (b).
Дорожка 3: Надосадочная жидкость вторичного центрифугирования стадии (b).
Дорожка 4: Надосадочная жидкость, полученная с помощью кислотной преципитации стадии (c).
Дорожка 5: Фильтрат, полученный с помощью фильтрации стадии (c).
Дорожка 6: Проточная фракция на колонке с SP-сефарозой стадии (d).
Дорожка 7: Элюат 1 на колонке с SP-сефарозой стадии (d).
Дорожка 8: Элюат 2 на колонке с SP-сефарозой стадии (d).
Дорожка 9: Проточная фракция 2 на колонке с бутил-сефарозой стадии (e).
Дорожка 10: Элюат 2 на колонке с бутил-сефарозой стадии (e).
На ФИГ. 2 представлен результат SDS-PAGE элюата, который был получен с помощью анионообменной хроматографии способа очистки по настоящему изобретению;
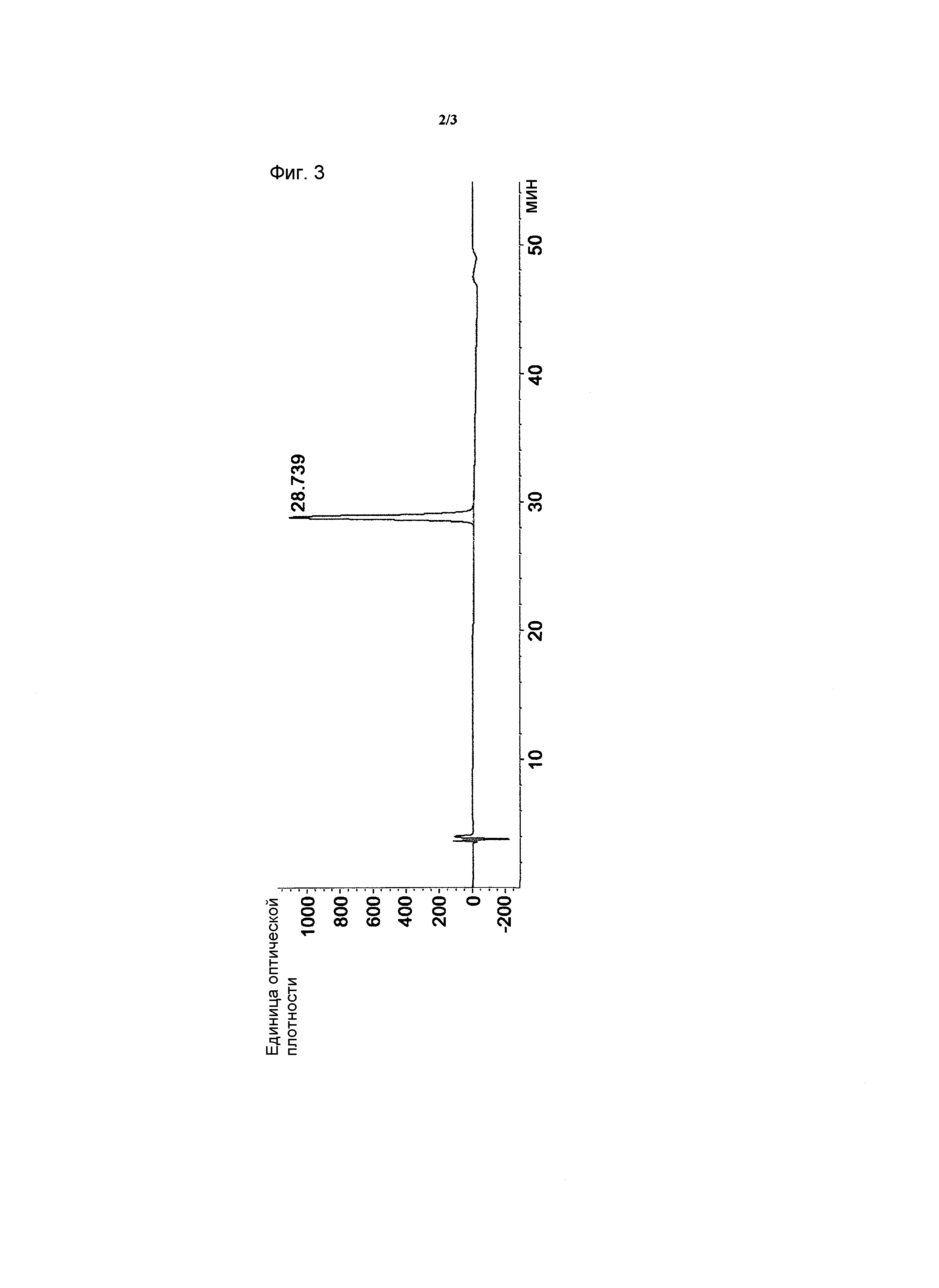
на ФИГ. 3 представлен результат высокоэффективной жидкостной хроматографии с обращенной фазой для элюата, который был получен с помощью анионообменной хроматографии способа очистки по настоящему изобретению; и
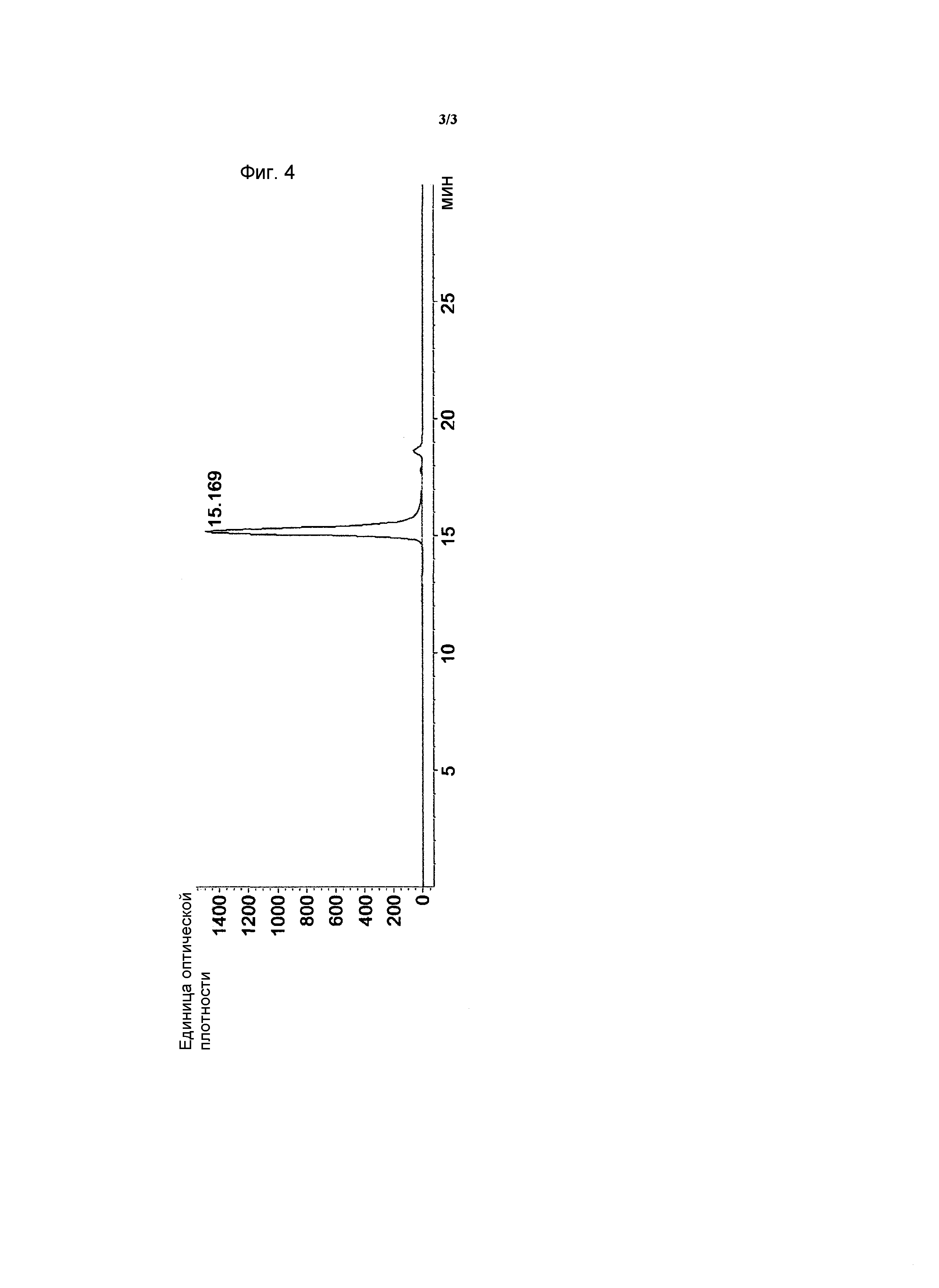
на ФИГ. 4 представлен результат эксклюзионной хроматографии высокого давления для элюата, который был получен с помощью анионообменной хроматографии способа очистки по настоящему изобретению.
Лучший вариант осуществления изобретения
В настоящем изобретении предлагается способ простой очистки большого количества человеческих факторов, стимулирующих колонии гранулоцитов (hG-CSF), имеющих высокую степень чистоты, из рекомбинантных E. coli без дополнительного процесса активации.
Конкретно, способ очистки согласно настоящему изобретению может включать стадии:
(a) культивирования hG-CSF-экспрессирующих рекомбинантных E. coli с получением клеточного осадка путем центрифугирования;
(b) отделения hG-CSF-содержащей надосадочной жидкости от клеточного осадка, полученного в стадии (a);
(c) обработки надосадочной жидкости, полученной в стадии (b), с помощью кислоты для удаления полученного осадка путем фильтрации;
(d) применения к фильтрату, полученному в стадии (c), катионообменной хроматографии;
(e) применения к элюату, полученному в стадии (d), хроматографии гидрофобного взаимодействия; и
(f) применения к элюату, полученному в стадии (e), анионообменной хроматографии.
Способ очистки согласно настоящему изобретению характеризуется тем, что после кислотной преципитации к hG-CSF, полученным из рекомбинантных E. coli, применяют серии хроматографических стадий (катионообменной хроматографии, хроматографии гидрофобного взаимодействия и к анионообменной хроматографии), с выделением таким способом hG-CSF с высокой степенью чистоты, подходящим для фармацевтического применения.
Далее каждая стадия способа очистки согласно настоящему изобретению будет описана подробно.
Стадия (a) представляет собой стадию культивирования hG-CSF-экспрессирующих рекомбинантных E. coli с получением клеточного осадка путем центрифугирования. Рекомбинантные E. coli, используемые в данной стадии, представляют собой, без ограничения, бактерии, экспрессирующие hG-CSF, предпочтительно, экспрессирующие hG-CSF в периплазматическом пространстве. Более предпочтительно, hG-CSF по настоящему изобретению представляют собой растворимые hG-CSF, экспрессирующиеся в E. coli. В настоящем изобретении рекомбинантные E. coli, экспрессирующие hG-CSF в периплазматическое пространство, представляют собой рекомбинантные E. coli, которые трансформированы экспрессирующим вектором, включающим гибридный ген, кодирующий гибридный белок с секреторной сигнальной последовательностью и hG-CSF. Характерные примеры рекомбинантных E. coli включают HM10310, HM10311 (KCCM-10154), HM10409, HM10410 (KCCM-10151), HM10411 (KCCM-10152), HM10413, HM10414, HM10415, HM10510 (KCCM-10153), HM10511 и HM10512, описанные в Корейском Патенте No. 356140 авторов настоящего изобретения, в котором рекомбинантные E. coli трансформированы экспрессирующим вектором, полученным путем сшивки модифицированного сигнального пептида термоустойчивого энтеротоксина II E. coli и hG-CSF, но не ограничиваясь этим.
С целью экспрессии hG-CSF в периплазматическое пространство рекомбинантных E. coli, где рекомбинантные E. coli могут культивироваться в ферментере, содержащем LB-среду с добавлением 1-300 г/л глюкозы в качестве источнике углеводов, 2-15 г/л KH2PO4, 0,5-3 г/л (NH4)2HPO4, 2-10 г/л NaCl и 0,5-10 г/л MgCl2 в качестве источника минеральных веществ, разнообразных микроэлементов, дрожжевого экстракта и триптона. Состав данной среды подходит для культуры высокой плотности рекомбинантных E. coli и для получения высокого уровня экспрессии hG-CSF в периплазматическом пространстве E. coli. В одном воплощении настоящего изобретения рекомбинантные E. coli HM10411 (KCCM-10152) использовали для осуществления эксперимента и в результате было обнаружено, что состав среды существенно увеличивает клеточную плотность рекомбинантных E. coli, уровень экспрессии hG-CSF в E. coli и степень секреции hG-CSF в периплазматическое пространство. Полученный культуральный бульон рекомбинантных E. coli центрифугировали с получением клеточного осадка.
Стадия (b) представляет собой стадию отделения hG-CSF-содержащей надосадочной жидкости от клеточного осадка, полученного в стадии (a). В предпочтительном воплощении настоящего изобретения, когда используют рекомбинантные E. coli, экспрессирующие hG-CSF в периплазматическое пространство, периплазматические белки, включающие hG-CSF, могут отделяться от клеток путем осмотической экстракции. В этой связи стадия (b) может включать стадии добавления к клеточному осадку буферного раствора, содержащего сахарозу, с получением клеточного осадка путем центрифугирования; и добавления к клеточному осадку дистиллированной воды с получением надосадочной жидкости путем центрифугирования, которая содержит периплазматические белки. В данной стадии периплазматические белки, включающие hG-CSF, экстрагировали с помощью осмотического давления. Сначала, когда клеточный осадок обрабатывали с помощью буферного раствора, содержащего сахарозу, например 10-30% буферным раствором, содержащим сахарозу, то клетки сжимались. Затем когда клеточный осадок снова обрабатывали дистиллированной водой, то сжатые клетки расширялись и клеточная стенка расслаблялась. Таким образом, клеточная стенка не разрушалась, но периплазматические белки, включающие hG-CSF, присутствующие между клеточной мембраной и клеточной стенкой, экстрагировались сквозь ослабленную клеточную стенку. В стадии осмотической экстракции (b) может использоваться сахароза, глюкоза, MgCl2, хлорид натрия и так далее. Предпочтительно, используется буферный раствор с сахарозой. Экстракт центрифугировали с получением надосадочной жидкости, содержащей периплазматические белки.
Стадия (c) представляет собой стадию кислотной преципитации для обработки hG-CSF-содержащей надосадочной жидкости, полученной в стадии (b), с кислотой для отделения полученного в результате преципитата путем фильтрации. В одном предпочтительном воплощении настоящего изобретения, когда использовали рекомбинантные E. coli, экспрессирующие hG-CSF в периплазматическое пространство, то растворимая надосадочная жидкость, содержащая растворимый hG-CSF, могла быть отделена от надосадочной жидкости, включающей периплазматические белки, путем кислотной преципитации. Конкретно, когда надосадочную жидкость, полученную в стадии (b), обрабатывали кислотой для регуляции pH надосадочной жидкости до 5-5,8, предпочтительно до 5,3-5,5, то из надосадочной жидкости осаждали нерастворимые вещества, включающие периплазматические белки, и этот преципитат удаляли путем фильтрации с получением надосадочной жидкости, содержащей растворимый hG-CSF. Примеры кислоты, подходящей для кислотной преципитации стадии (c), включают уксусную кислоту, фосфорную кислоту, лимонную кислоту и так далее, но предпочтительно уксусную кислоту. Фильтрация может осуществляться с использованием подходящего фильтра и предпочтительно фильтра 0,45-3 мкм. Так как в настоящем изобретении используются рекомбинантные E. coli, секретирующие hG-CSF в периплазматическое пространство, то нет необходимости разрушения E. coli, и периплазматическую фракцию можно легко получить из культурального бульона для экстракции hG-CSF.
Стадия (d) представляет собой стадию применения к фильтрату, содержащему растворимый hG-CSF, полученный в стадии (c), катионообменной хроматографии. Посредством данной стадии может быть удалено большое количество примесей, выделенных из клеток-хозяев или материалов культуры, для улучшения эффективности очистки.
Функциональная группа колонки катионообменной хроматографии, используемая в настоящем изобретении, может включать слабые катионы, такие как карбоксиметил-(CM-) и карбокси- (C-), и сильные катионы, такие как сульфо- (S-), сульфометил- (SM-), сульфоэтил- (SE-), сульфопропил- (SP-), и фосфо- (P-). Может использоваться множество колоночных смол, включающих сефарозу, сефадекс, агарозу, сефацел (sephacel), полистирол, полиакрилат, целлюлозу и тойоперл (toyopearl). В одном воплощении настоящего изобретения способ очистки может осуществляться с помощью катионообменной хроматографии с использованием колонки SP-сефарозы.
В настоящем изобретении катионообменную хроматографию осуществляют с использованием буферного раствора, содержащего уксусную кислоту в качестве элюента с pH в интервале от pH 4 до 6, предпочтительно, pH 5-6 с концентрацией соли 500 мМ или менее, предпочтительно 200-500 мМ. Используемая катионообменная колонка может быть уравновешена с помощью буферного раствора перед загрузкой элюата. Уравновешивание катионообменной колонки может осуществляться с использованием буферного раствора с pH 5-6, который подобран подходящим образом согласно условиям. В одном предпочтительном воплощении настоящего изобретения, катионообменную колонку заранее уравновешивают с помощью буферного раствора, содержащего 10 мМ ацетата натрия (pH 5,4). После загрузки hG-CSF-содержащего фильтрата и адсорбции на уравновешенной катионообменной колонке, колонку промывают с помощью уравновешивающего буферного раствора для удаления белков и примесей, которые не адсорбировались на колонке. Затем к катионообменной колонке применяют элюирующий буферный раствор, полученный путем добавления хлорида натрия к уравновешивающему буферному раствору, для элюции hG-CSF, которые адсорбировались на колонке. В этой связи предпочтительно применяют 3-7 объемов колонки элюирующего буферного раствора. В одном предпочтительном воплощении настоящего изобретения, к колонке применяют 4-6 объемов колонки буферного раствора (pH 5,2-5,6), содержащего 5-20 мМ ацетата натрия и 300-400 мМ NaCl, для элюции hG-CSF, которые адсорбировались на колонке.
В вышеописанной стадии пептиды, выделенные из клетки, или компоненты культуральной среды пропускают через колонку или удаляют в процессе стадии промывки для эффективного удаления большого количества примесей.
Стадия (e) представляет собой стадию (e) применения к элюату, полученному из катионообменной хроматографии в стадии (d), хроматографии гидрофобного взаимодействия, и стадию улучшения очистки путем дополнительного удаления примесей, которые включены в элюат, полученный из катионообменной хроматографии в предыдущей стадии.
Хроматография гидрофобного взаимодействия, используемая в настоящем изобретении, может осуществляться на гелях с гидрофобными, алифатическими или ароматическими незаряженными лигандами, присоединенными к различным коммерчески доступным матрицам. Лиганды могут быть присоединены к матрице с помощью подходящих методов конденсации с получением незаряженных лигандов. Примеры таких методов включают метод с использованием конденсации глицидилового эфира; метод активации агарозной матрицы с помощью глицидоксипропилтриметоксисилана в воде и затем иммобилизации лиганда в спирте; метод активации агарозной матрицы с помощью бис-эпоксида, такого как 1,4-бутандиол-диглицидиловый эфир, и затем путем конденсации с лигандами, такими как аминоалкил или алкилмеркаптан; метод с активацией 1,1-карбонилдиимидазолом; и метод с активацией дивинилсульфона. Гели, полученные с помощью вышеописанных методов, являются незаряженными во всем интервале pH. Примеры алифатического лиганда могут включать неразветвленные алкилы, такие как пропил, бутил, пентил, гексил, гептил и октил, разветвленные алкилы, такие как изо- или неоалкил и олигоэтиленгликоль. Ароматическим лигандом является предпочтительно фенил. Матрица может быть подходящим образом выбрана из различных сильно гидрофильных матриц, например из агарозной матрицы, такой как сефароза, матрицы из органического полимера, такой как TSK-GEL, и из высокопористой матрицы из органического полимера. Предпочтительной матрицей является агарозная матрица. Подходящей агарозной матрицей является сефароза (Amersham Biosciences), Bio-Gel A (Bio-Rad Laboratories), Minileak (Kem-En-Tec Diagnostics A/S) или им подобные. В одном воплощении настоящего изобретения хроматографию гидрофобного взаимодействия проводят в бутил-сефарозном геле.
В настоящем изобретении хроматографию гидрофобного взаимодействия осуществляют с использованием в качестве элюента буферного раствора в интервале pH от pH 7 до 8,5, предпочтительно, pH 7,5-8, с концентрацией соли 100 мМ или менее, предпочтительно, 0-50 мМ. Используемую колонку гидрофобного взаимодействия можно уравновешивать с помощью буферного раствора перед загрузкой элюата. Уравновешивание колонки гидрофобного взаимодействия может осуществляться с использованием водного буферного раствора с pH 6,8-8,5, который подобран подходящим образом согласно условиям. В одном предпочтительном воплощении настоящего изобретения колонку гидрофобного взаимодействия заранее уравновешивают с помощью буферного раствора (pH 7,5), содержащего 300 мМ сульфата аммония и 10 мМ Tris. После того как элюат, полученный в предыдущей стадии, загружают на уравновешенную колонку гидрофобного взаимодействия, колонку промывают с помощью уравновешивающего буферного раствора для удаления белков и примесей, которые не адсорбировались на колонке. Затем к колонке гидрофобного взаимодействия применяют элюирующий буферный раствор, полученный путем удаления сульфата аммония из уравновешивающего буферного раствора, для элюции hG-CSF, которые адсорбировались на колонке. В этой связи предпочтительно применяли 1-4 объемов колонки элюирующего буферного раствора. В одном предпочтительном воплощении настоящего изобретения к колонке применяли 1,2-2,5 объемов колонки буферного раствора (pH 7-8), содержащего 5-20 мМ Tris для элюции hG-CSF, которые адсорбировались на колонке.
Как правило, перед осуществлением хроматографии гидрофобного взаимодействия к фракции может быть добавлена соль с целью увеличения проводимости фракции. Затем осуществляют элюцию из матрицы с использованием буфера с низкой ионной силой. Предпочтительно, в хроматографии гидрофобного взаимодействия по настоящему изобретению сульфат аммония добавляют к элюату, полученному в стадии (d), для увеличения его проводимости, аналогичной проводимости уравновешивающего буферного раствора. Затем элюат загружают в уравновешенную колонку гидрофобного взаимодействия. В хроматографии гидрофобного взаимодействия по настоящему изобретению элюат, полученный после катионообменной хроматографии предыдущей стадии, также может быть загружен без предварительной обработки, и hG-CSF адсорбируются на колонку. Примеси проходят через колонку или удаляются во время стадии промывки для улучшения эффективности очистки.
Стадия (f) представляет собой стадию применения к элюату, полученному из хроматографии гидрофобного взаимодействия в стадии (e), анионообменной хроматографии, и стадию полного удаления примесей, которые включены в элюат, полученный из хроматографии гидрофобного взаимодействия в предыдущей стадии.
Анионообменную хроматографию по настоящему изобретению, как правило, проводят с использованием матрицы, содержащей нерастворимую подложку, модифицированную с помощью третичной или четвертичной аминогруппы (например, диэтиламиноэтил, триэтиламиноэтил, бензил-диэтиламиноэтил). Подходящая подложка включает целлюлозу, агарозу, декстран и полистироловые микросферы. Предпочтительно, подложку модифицируют с помощью триэтиламиноэтиловой группы. Примеры подходящей анионообменной матрицы включают Q-сефарозу (Amersham Biosciences), Macro-Prep Q (Bio-Rad Laboratories), Q-HyperD (BioSepra, Inc.), Fractogel EMD-TMAE 650 (Merck) или им подобные. В одном предпочтительном воплощении настоящего изобретения анионообменную хроматографию проводят с использованием Q-сефарозной колонки.
В настоящем изобретении анионообменную хроматографию осуществляют с использованием в качестве элюента буферного раствора в интервале pH от pH 6,8 до 8,5, предпочтительно, pH 7-8, с концентрацией соли 300 мМ или менее, предпочтительно, 100-250 мМ. Используемую анионообменную колонку можно уравновешивать с помощью буферного раствора перед загрузкой элюата. Уравновешивание анионообменной колонки может осуществляться с использованием буферного раствора с pH 6,8-8,5, который подобран подходящим образом согласно условиям. В одном предпочтительном воплощении настоящего изобретения анионообменную колонку заранее уравновешивают с помощью буферного раствора (pH 7,5), содержащего 10 мМ Tris и 100 мМ мочевины. После того как элюат, полученный в предыдущей стадии, загружают на уравновешенную анионообменную колонку, колонку промывают с помощью уравновешивающего буферного раствора для удаления белков и примесей, которые не адсорбировались на колонке. Затем к анионообменной колонке применяют элюирующий буферный раствор, полученный путем добавления хлорида натрия к уравновешивающему буферному раствору, для элюции hG-CSF, которые адсорбировались на колонке. В этой связи предпочтительно применяли 1,5-5 объемов колонки элюирующего буферного раствора. В одном предпочтительном воплощении настоящего изобретения к колонке применяли 2-4 объема колонки буферного раствора (pH 7-8), содержащего 5-20 мМ Tris, 5-200 мМ мочевины и 150-250 мМ NaCl, для элюции hG-CSF, которые адсорбировались на колонке.
Как описано выше, hG-CSF очищают с помощью кислотной преципитации и серии хроматографий согласно настоящему изобретению, и очищенные hG-CSF подвергают высокоэффективной жидкостной хроматографии с обращенной фазой и эксклюзионной хроматографии. В результате получали hG-CSF с чистотой 99% или выше и с высоким выходом. Конкретно, результаты анализа N-концевого секвенирования продемонстрировали, что hG-CSF, очищенный согласно способу по настоящему изобретению, имеет последовательность, идентичную последовательности нативного hG-CSF, и очищенный hG-CSF содержит белки, выделенные из клетки-хозяина, в количестве 100 нг/мг или менее, ДНК, выделенную из клетки-хозяина, в количестве 100 нг/мг или менее, и энтеротоксин 10 ЕЭ/МЕд hG-CSF или менее, и продемонстрировал отличную физиологическую активность. Эти результаты предполагают, что когда hG-CSF, секретированные в периплазматическое пространство рекомбинантных E. coli, очищают согласно способу очистки по настоящему изобретению, то может быть получен высокий выход hG-CSF с высокой физиологической активностью и чистотой, а также может преодолеваться потеря эффективности и ограниченная селекция колонок.
Таким образом, hG-CSF, очищенные согласно способу очистки по настоящему изобретению, и фармацевтическая композиция, включающая hG-CSF в качестве активного ингредиента, также включены в рамки настоящего изобретения.
Препарат фармацевтической композиции и его эффекты хорошо известны специалисту в данной области и поэтому будут опущены.
Кроме того, способ очистки согласно настоящему изобретению характеризуется тем, что hG-CSF могут быть очищены с получением высокого выхода и с высокой степенью чистоты из большого количества культурального бульона рекомбинантных E. coli. При использовании в данном документе термин "большое количество культурального бульона" обозначает культуральный бульон, полученный с помощью культивирования рекомбинантных E. coli на уровне ферментации в среде 50 л или более, предпочтительно, 80 л или более и, более предпочтительно, 100 л или более. В одном воплощении настоящего изобретения рекомбинантные E. coli инокулируют в 1 л стерилизованной среды с получением первичного посевного культурального бульона, и этот посевной культуральный бульон инокулируют в 14 л стерилизованной среды с получением вторичного посевного культурального бульона. Наконец, вторичный посевной культуральный бульон инокулируют в 120 л стерилизованной среды с последующей ферментацией. Дополнительную среду используют для ведения культуры с подпиткой с получением таким образом 180 л культурального бульона рекомбинантных E. coli. Когда hG-CSF выделяют и очищают из большого количества культурального бульона рекомбинантных E. coli согласно способу, описанному в Корейском Патенте No. 356140, то получают только 70 мг hG-CSF на 1 л. То есть стандартный метод имеет ограничение в том, что он является трудным для получения целевого белка с высокой степенью чистоты и с высоким выходом. Однако согласно способу очистки по настоящему изобретению, даже если объем культурального бульона пропорционально увеличен до 100 л или более, hG-CSF со степенью чистоты 99% или выше могут быть получены с высоким выходом, составляющим 110 мг или более на 1 л, посредством кислотной преципитации и серии хроматографий. Таким образом, способ очистки по настоящему изобретению может эффективно применяться для выделения и очистки hG-CSF из большого количества культурального бульона рекомбинантных E. coli. Таким образом, более высокая продуктивность может быть достигнута при промышленном применении.
Способ осуществления изобретения
Далее по тексту настоящее изобретение будет описано более подробно со ссылкой на следующие Примеры. Однако эти Примеры представлены исключительно в иллюстративных целях, и изобретение не ограничивается этими Примерами.
Эталонный пример 1: Культивирование рекомбинантных E. coli, экспрессирующих hG-CSF в периплазматическое пространство
E. coli HM10411 (KCCM-10152, Корейский Патент No. 356140), трансформированные с помощью экспрессирующего вектора T017SG, содержащего гибрид из модифицированного пептида термоустойчивого энтеротоксина II E. coli и hG-CSF, инокулировали в стеклянную культуральную колбу, содержащую 1 л среды LB (триптон 10 г/л, дрожжевой экстракт 5 г/л, NaCl 10 г/л)) для получения первичной посевной культуры. Культуральную среду культивировали при 37°C в течение 11-13 часов с интенсивным встряхиванием и с вентиляцией и затем инокулировали в культуральную колбу, содержащую 14 л стерилизованной среды LB для получения вторичной посевной культуры в течение 2-3 часов. Полученный культуральный бульон использовали в качестве посева для ферментации и инокулировали в 120 л стерилизованной среды с содержанием 1,4 г/л глюкозы в качестве источника углерода, 10 г/л KH2PO4, 2,5 г/л (NH4)2HPO4, 5 г/л NaCl и 1,2 г/л MgCl2 в качестве источника минеральных веществ, разнообразных микроэлементов, дрожжевого экстракта и триптона. Во время ферментации добавляли дополнительную глюкозу и дрожжевой экстракт для получения культуры с подпиткой в течение 25 часов или более, и культивирование завершали с получением 180 л культурального бульона. После завершения ферментации ферментационный бульон центрифугировали при 7000 об/мин и полученный клеточный осадок сохраняли при -70°C.
Пример 1: Очистка hG-CSF из культурального бульона рекомбинантных E. coli
<1-1> Осмотическая экстракция периплазматических белков
Осадок E. coli, полученный в Эталонном Примере, суспендировали в 170 л сахарозного буферного раствора (20% сахарозы, 1 мМ EDTA, 30 мМ Tris, pH 7,5), и встряхивали в течение 90 минут с последующим первичным центрифугированием при 7000 об/мин и таким образом отделяли осадок. 170 л дистиллированной воды при 4°C добавляли к отделенному осадку и осуществляли вторичное центрифугирование при 7000 об/мин для удаления осадка и для выделения надосадочной жидкости, содержащей периплазматические белки. Во время этой процедуры экстрагировали белки, присутствующие в периплазматическом пространстве E. coli. Надосадочные жидкости, полученные с помощью процедур первичного и вторичного центрифугирования, анализировали с помощью SDS-PAGE (дорожки 2 и 3 ФИГ. 1).
<1-2> Кислотная преципитация
1% уксусную кислоту добавляли к надосадочной жидкости, содержащей периплазматические белки, полученные в Примере <1-1>, для регуляции pH до 5,6-5,7. В это время нерастворимые материалы, включенные в надосадочную жидкость, осаждали с помощью обработки кислотой, и осуществляли фильтрацию, чтобы удалить их, с получением hG-CSF-содержащей надосадочной жидкости. Надосадочная жидкость, полученная с помощью обработки кислотой, и фильтрат, полученный фильтрацией, анализировали с помощью SDS-PAGE (дорожки 4 и 5 ФИГ. 1).
<1-3> Катионообменная хроматография
Катионообменную хроматографию фильтрата, полученного в Примере <1-2>, осуществляли с использованием SP-сефарозной колонки, как описано далее. Фильтрат загружали и адсорбировали на SP-сефарозную колонку, уравновешенную с помощью буферного раствора 1 (10 мМ ацетата натрия, pH 5,4) с низкой скоростью потока 40 см/ч, и затем белки, которые не адсорбировались на колонке, удаляли путем промывки тем же буферным раствором. Затем 5 объемов колонки буферного раствора 1 (10 мМ ацетата натрия, pH 5,4), содержащего 300 мМ хлорида натрия применяли к колонке для элюции hG-CSF с колонки. Проточную фракцию и элюат, полученные с помощью катионообменной хроматографии, анализировали с помощью SDS-PAGE (Дорожки 6-8 ФИГ. 1).
<1-4> Хроматография гидрофобного взаимодействия
Элюат, полученный в Примере <1-3>, разводили с помощью добавления сульфата аммония до конечной концентрации 300 мМ, и хроматографию гидрофобного взаимодействия осуществляли с использованием бутил-сефарозной колонки, как описано далее. Элюат загружали и адсорбировали на бутил-сефарозную колонку, уравновешенную с помощью буферного раствора 2 (300 мМ сульфата аммония, 10 мМ Tris, pH 7,5) со скоростью потока 80 см/ч, и затем белки, которые не адсорбировались на колонке, удаляли путем промывки тем же буферным раствором. Затем 1,5 объемов колонки буферного раствора 2 (10 мМ Tris, pH 7,5), не содержащего сульфат аммония, применяли к колонке для элюции hG-CSF с колонки. Проточную фракцию и элюат, полученные с помощью хроматографии гидрофобного взаимодействия, анализировали с помощью SDS-PAGE (Дорожки 9-10 ФИГ. 1).
<1-5> Анионообменная хроматография
Элюат, полученный в Примере <1-4>, разводили с помощью добавления мочевины до конечной концентрации 50 мМ, и осуществляли анионообменную хроматографию с использованием Q-сефарозной колонки, как описано далее. Элюат загружали и адсорбировали на Q-сефарозную колонку, уравновешенную с помощью буферного раствора 3 (10 мМ Tris, pH 7,5, 100 мМ мочевины) со скоростью потока 60 см/ч, и затем белки, которые не адсорбировались на колонке, удаляли путем промывки тем же буферным раствором. Затем 3 объема колонки буферного раствора 3 (10 мМ Tris, pH 7,5, 100 мМ мочевины), содержащего 250 мМ хлорида натрия, применяли к колонке для элюции hG-CSF с колонки. Элюат, полученный с помощью анионообменной хроматографии, анализировали с помощью SDS-PAGE (Дорожка 2 ФИГ. 2).
С целью определения чистоты hG-CSF, очищенных из рекомбинантных E. coli с помощью процедур Примеров <1-1> - <1-5>, осуществляли SDS-PAGE, анализ N-концевого секвенирования, высокоэффективную жидкостную хроматографию с обращенной фазой и эксклюзионную хроматографию.
Экспериментальный пример 1: анализ SDS-PAGE
Сначала согласно типичному методу анализировали с помощью SDS-PAGE проточную фракцию и элюат, полученный в каждой процедуре Примеров <1-1>-<1-5>, а также стандартный G-CSF (NIBSC, Кодовый No. 88/502). Результаты SDS-PAGE представлены на ФИГ. 1 и 2. На ФИГ. 1 Дорожка 1 - это стандартный G-CSF, Дорожка 2 - это надосадочная жидкость первичного центрифугирования, полученная с помощью осмотической экстракции Примера <1-1>, Дорожка 3 - это надосадочная жидкость вторичного центрифугирования, полученная с помощью осмотической экстракции Примера <1-1>, Дорожка 4 - это надосадочная жидкость, полученная путем обработки кислотой в стадии кислотной преципитации Примера <1-2>, Дорожка 5 - это фильтрат, полученный фильтрацией в стадии кислотной преципитации Примера <1-2>, Дорожка 6 - это проточная фракция, полученная в результате хроматографии на SP-сефарозной колонке Примера <1-3>, Дорожки 7 и 8 - это элюат 1 и 2, полученные в результате хроматографии на SP-сефарозной колонке Примера <1-3>, Дорожка 9 - это проточная фракция, полученная в результате хроматографии на бутил-сефарозной колонке Примера <1-4>, и Дорожка 10 - это элюат, полученный в результате хроматографии на бутил-сефарозной колонке Примера <1-4>. На ФИГ. 2 Дорожка 1 - это стандартный Met-hG-CSF и Дорожка 2 - это элюат, полученный в результате хроматографии на Q-сефарозной колонке Примера <1-5>.
Результаты анализа SDS-PAGE продемонстрировали, что hG-CSF, выделенные и очищенные из рекомбинантных E. coli согласно способу очистки по настоящему изобретению, имеют молекулярную массу, равную молекулярной массе нативной формы.
Экспериментальный пример 2: анализ N-концевого секвенирования
hG-CSF, очищенные с помощью процедур Примеров <1->-<1-5>, подвергали электрофорезу на геле SDS-PAGE и переносили на мембрану PVDF. После переноса мембрану сушили с использованием раствора Ponceau S и анализировали N-концевую последовательность (15 аминокислот) в Корейском Институте Фундаментальной Науки (Сеульское отделение).
В результате было обнаружено, что N-концевая последовательность hG-CSF, выделенного и очищенного из рекомбинантных E. coli согласно способу очистки по настоящему изобретению, является идентичной последовательности нативной формы, и она содержит белки, выделенные из клетки-хозяина в количестве 100 нг/мг или менее, ДНК, выделенную из клеток-хозяев, в количестве 100 пг/мг или менее и энтеротоксин 10 ЭЕ/МЕ hG-CSF или менее.
Экспериментальный пример 3: высокоэффективная жидкостная хроматография с обращенной фазой
Элюат, полученный в Примере <1-5>, применяли на бутилсилил-силикагелевой колонке и затем добавляли к колонке 0,1% TFA/вода и 0,1% TFA/ацетонитрил в качестве подвижной фазы для осуществления высокоэффективной жидкостной хроматографии с обращенной фазой. Результирующая хроматограмма представлена на ФИГ. 3.
Как представлено на ФИГ. 3, было обнаружено, что hG-CSF, выделенные и очищенные из рекомбинантных E. coli согласно способу очистки по настоящему изобретению, обладают очень высокой степенью чистоты благодаря эффективному удалению микроэлементов со сходными свойствами.
Экспериментальный пример 4: эксклюзионная хроматография высокого давления
Элюат, полученный в Примере <1-5>, применяли к гидрофильной силикагельной колонке (молекулярная масса 20000-200000) и затем добавляли к колонке 20 мМ фосфат калия (pH 6)/200 мМ хлорид натрия в качестве подвижной фазы для осуществления эксклюзионной хроматографии высокого давления. Результирующая хроматограмма представлена на ФИГ. 4.
Как представлено на ФИГ. 4, было обнаружено, что hG-CSF, выделенные и очищенные из рекомбинантных E. coli согласно способу очистки по настоящему изобретению, обладают очень высокой степенью чистоты благодаря эффективному удалению пептидов со сходными свойствами.
В Экспериментальных Примерах 1-4 подтверждали, что нативные hG-CSF со степенью чистоты 99% или выше могут быть получены с выходом 110 мг на 1 л культурального бульона рекомбинантных E. coli согласно способу очистки по настоящему изобретению. В качестве сравнительной группы hG-CSF очищали из рекомбинантных E. coli согласно способу очистки, раскрытому в Корейском Патенте No. 356140 (ионообменная смола, адсорбция и гель-фильтрационная колонка или хроматографическая колонка с антителами), и получали hG-CSF со степенью чистоты 99% или выше с выходом 70 мг на 1 л культурального бульона. Результаты указывают, что hG-CSF со степенью чистоты 99% или выше могут быть получены с выходом 50% или более с помощью способа очистки по настоящему изобретению, по сравнению со способом, раскрытым в Корейском Патенте No. 356140.
Экспериментальный пример 5: Ex vivo-тест эффективности
С целью определения физиологической активности hG-CSF, полученных согласно способу очистки по настоящему изобретению, hG-CSF, очищенные в Примере <1-5>, и международный стандарт (NIBSC) подвергали тесту ex vivo-тесту эффективности в клетках костного мозга, выделенных из костного мозга мышей. Конкретно, вскрывали бедренную кость у 4-6 недельных мышей и собирали клетки костного мозга и затем культивировали с подходящей плотностью. Очищенные hG-CSF и образец международного стандарта смешивали с культивированными клетками костного мозга с получением различных концентраций (100, 33,33, 11,11, 3,7, 1,23, 0,41, 0,14, 0,05, 0,02, 0,01 нг/мл) и культивировали в течение 2-3 дней. [Метил-H2] тимидин добавляли к культуральной среде и клетки культивировали в течение дополнительных 10-20 часов. Затем клетки выделяли и измеряли CPM с помощью бета-счетчика. В результате было обнаружено, что hG-CSF, выделенные и очищенные согласно способу очистки по настоящему изобретению, удовлетворяют международному стандарту 0,6-1,4×108 МЕ/мг.
Промышленная применимость
С помощью способа настоящего изобретения может быть легко получен человеческий фактор, стимулирующий колонии гранулоцитов, идентичный нативной форме, экспрессирующейся в человеческом организме, может быть легко очищен с получением высокого выхода и высокой степени чистоты без дополнительного процесса активации. Конкретно, согласно способу настоящего изобретения варианты hG-CSF, экспрессирующиеся в E. coli, эффективно удаляются с получением физиологически активных hG-CSF, имеющих высокую степень чистоты.