Результат интеллектуальной деятельности: ЭМУЛЬСИИ ТИПА "МАСЛО В ВОДЕ", КОТОРЫЕ СОДЕРЖАТ НУКЛЕИНОВЫЕ КИСЛОТЫ
Вид РИД
Изобретение
Родственные заявки
По этой заявке испрашивается приоритет временной заявки на патент США № 61/505091, поданной 6 июля 2011, и временной заявки на патент США № 61/585639, поданной 11 января 2012, каждая из которых полностью включена в настоящее описание посредством ссылки.
Список последовательностей
Настоящая заявка включает список последовательностей, который представлен в формате ASCII на сайте EFS-Web и полностью включен в настоящее описание посредством ссылки. Указанная копия ASCII была создана 5 июля, 2012, под именем PAT054719.txt и имеет размер 32421 байт.
Предшествующий уровень техники
Терапевтические нуклеиновые кислоты являются перспективными для лечения как наследственных, так и приобретенных заболеваний, таких как рак, инфекционные заболевания (СПИД), болезнь сердца, артрит и нейродегенеративные расстройства (например, болезни Паркинсона и Альцгеймера). Для устранения дефицита определенных генов или индуцирования экспрессии продуктов экзогенных генов могут быть введены не только функциональные гены, но также и нуклеиновые кислоты, которые могут ингибировать экспрессию эндогенных генов и, тем самым, продуцировать терапевтический эффект. Ингибирование экспрессии генов может опосредоваться, например, антисмысловыми олигонуклеотидами, двухцепочечными РНК (например, киРНК, миРНК) или рибозимами.
Ключевой стадией такой терапии является доставка молекул нуклеиновой кислоты в клетки in vivo. Однако, доставка молекул нуклеиновой кислоты in vivo, а в частности, молекул РНК, связана с рядом технических проблем. Во-первых, из-за присутствия клеточных и сывороточных нуклеаз, время полужизни РНК, инъецируемой in vivo, приблизительно составляет только 70 секунд (см., например, Kurreck, Eur. J. Bioch. 270: 1628-44 (2003)). Были предприняты попытки повысить стабильность инъецируемой РНК путем введения химических модификаций, однако, в некоторых случаях, химические модификации могут приводить к усилению цитотоксических эффектов или к потере или к снижению ее функций. В одном конкретном примере, клетки являются чувствительными к дозам иРНК-дуплекса, в котором каждый второй фосфат был заменен фосфортиоатом (Harborth, et al., Antisense Nucleic Acid Drug Rev. 13(2): 83-105 (2003)). Поэтому, необходимо разработать такие системы доставки, которые позволяли бы вводить молекулы нуклеиновой кислоты (а в частности, молекулы РНК) в количестве, достаточном для вырабатывания терапевтического ответа in vivo, но не токсичном для хозяина.
Вакцины на основе нуклеиновых кислот являются привлекательным средством для вакцинации. Так, например, внутримышечная (i.m.) иммунизация плазмидной ДНК, кодирующей антиген, может индуцировать клеточный и гуморальный иммунные ответы и защищать от заражения. ДНК-вакцины имеют ряд преимуществ по сравнению с традиционными вакцинами, полученными на основе белковых антигенов или аттенуированных патогенов. Так, например, по сравнению с белковыми вакцинами, ДНК-вакцины могут оказаться более эффективными для продуцирования антигена, имеющего правильную сборку в его нативной конформации, и для вырабатывания клеточного иммунного ответа. ДНК-вакцины также не создают каких-либо проблем в отношении безопасности, которые обычно связаны с «убитыми» или аттенуированными патогенами. Так, например, препарат на основе нейтрализованного вируса может содержать остаточные «живые» вирусы, а аттенуированный вирус может мутировать и изменять свой патогенный фенотип.
Другие ограничения применения вакцин на основе нуклеиновых кислот заключаются в том, что для вырабатывания сильных иммунных ответов у приматов, не являющихся человеком, и у человека, требуются, в основном, высокие дозы нуклеиновой кислоты. Поэтому, для повышения активности вакцин на основе нуклеиновых кислот могут потребоваться определенные системы доставки и адъюванты. Для введения молекул нуклеиновых кислот в клетки были разработаны различные методы, такие как трансфекция фосфатом кальция, трансфекция полипреном, слияние протопластов, электропорация, микроинжекция и липофекция.
Катионные липиды широко применяются в виде липосом для доставки генов в клетки. Однако, даже небольшое количество сыворотки (~10%) может резко снижать трансфекционную активность комплексов «липосома/ДНК», поскольку сыворотка содержит анионные соединения. Недавно была получена эмульсия на основе катионных липидов для доставки молекул ДНК в клетки. См., например, Kim, et al., International Journal of Pharmaceutics, 295, 35-45 (2005).
В патентах США №№ 6753015 и 6855492 описан метод доставки молекул нуклеиновой кислоты позвоночным с использованием катионных микрочастиц. Эти микрочастицы содержат полимер, такой как поли(α-гидроксикислота), полигидроксимасляная кислота, поликапролактон, полиортоэфир, полиангидрид и т.п., и были получены с использованием катионных поверхностно-активных веществ. Молекулы нуклеиновой кислоты адсорбируются на поверхностях этих микрочастиц.
В публикациях Kim et al. (Pharmaceutical Research, vol. 18, pages 54-60, 2001) и Chung et al. (Journal of Controlled Release, volume 71, pages 339-350, 2001) описаны различные препараты, полученные в виде эмульсий типа «масло в воде», которые используются для повышения эффективности трансфекции молекул ДНК in vitro и in vivo.
В публикации Ott et al. (Journal of Controlled Release, volume 79, pages 1-5, 2002) описан метод получения катионной субмикронной эмульсии, которая может быть использована в качестве системы доставки ДНК/адъюванта. Способ применения субмикронной эмульсии основан на использовании MF59, то есть, активного адъюванта, такого как сквален в воде, который изготавливается промышленностью и используется для приготовления коммерчески доступного и разрешенного к применению продукта (Fluad®). Для облегчения внутриклеточной доставки плазмидной ДНК используется 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP).
Хотя вакцины на основе ДНК являются в высокой степени перспективными средствами для предупреждения и лечения заболеваний, однако, обычно, их применение связано с некоторыми проблемами безопасности. Введенные молекулы ДНК могут интегрироваться в геном хозяина, либо, они могут вызывать нежелательную длительную экспрессию антигенов, что обусловлено распределением этих молекул в различных тканях. Кроме того, некоторые ДНК-вирусы могут быть также использованы в качестве носителя для доставки молекул ДНК. Такие вирусы, благодаря их инфекционным свойствам, имеют очень высокую скорость трансфекции. Используемые вирусы генетически модифицируют так, чтобы в трансфицированной клетке не образовывались функциональные инфекционные частицы. Однако, несмотря на такие меры предосторожности, все же нельзя полностью исключить риск неконтролируемой репликации введенных генов и вирусных генов, что, например, обусловлено, потенциальными событиями рекомбинации. Это также повышает риск встраивания ДНК в интактный ген генома клетки-хозяина, например, посредством рекомбинации, в результате чего этот ген может мутировать и тем самым полностью или частично инактивироваться, либо он может давать ошибочную информацию. Другими словами, синтез генного продукта, который является жизненно важным для клетки, может полностью ингибироваться или, альтернативно, при таком синтезе может экспрессироваться модифицированный или нерелевантный генный продукт. Кроме того, это создает определенные трудности при изготовлении и очистке клинически ценных вирусных векторов в промышленных масштабах.
Особенно высокий риск возникает в том случае, когда ДНК интегрируется в ген, ответственный за регуляцию клеточного роста. В этом случае, клетка-хозяин может разрушаться, что будет приводить к развитию рака или к образованию опухоли. Кроме того, если ДНК, введенная в клетку, экспрессируется, то необходимо, чтобы соответствующий ДНК-носитель содержал сильный промотор, такой как вирусный промотор на основе CMV. Интеграция таких промоторов в геном обработанной клетки может приводить к нежелательным изменениям регуляции экспрессии гена в клетке. Другой риск, связанный с применением ДНК в качестве агента для индуцирования иммунного ответа (например, в качестве вакцины), заключается в вырабатывании патогенных анти-ДНК антител у пациента, которому вводят чужеродную ДНК, что приводит к нежелательному иммунному ответу.
Молекулы РНК, кодирующие антиген или его производное, могут быть также использованы в качестве вакцин. РНК-вакцины имеют ряд преимуществ по сравнению с ДНК-вакцинами. Во-первых, РНК не может интегрироваться в геном хозяина, что предотвращает риск развития злокачественных заболеваний. Во-вторых, из-за быстрого разложения РНК, экспрессия чужеродного трансгена часто происходит за короткий промежуток времени, что позволяет избежать длительной нерегулируемой экспрессии антигена. В-третьих, для достижения экспрессии кодируемого антигена, молекулы РНК должны доставляться лишь в цитоплазму, тогда как молекулы ДНК должны проникать через ядерную мембрану.
Тем не менее, по сравнению с вакцинами на основе ДНК, вакцинам на основе РНК уделяется относительно мало внимания. РНК и олигонуклеотиды представляют собой гидрофильные, отрицательно заряженные молекулы, которые являются в высокой степени восприимчивыми к разложению нуклеазами при введении этих молекул в качестве терапевтических средств или вакцин. Кроме того, РНК и олигонуклеотиды не могут активно транспортироваться в клетки. См., например, Vajdy, M., et al., Mucosal adjuvants and delivery systemsfor protein-, DNA- and RNA-based vaccines, Immunol Cell Biol, 2004. 82(6): p. 617-27.
В публикации Ying et al. (Nature Medicine, vol. 5, pages 823-827, 1999) описана вакцина на основе аутореплицирующейся РНК, в которую была введена «оголенная» РНК, кодирующая β-галактозидазу, и имеются также сообщения об индуцировании CD8+-клеток.
В публикации Montana et al. (Bioconjugate Chem. 2007, 18, pages 302-308) описано применение катионных твердых липидных наночастиц в качестве РНК-носителей для переноса генов. Было обнаружено, что твердые липидные наночастицы защищают молекулу РНК от разложения, а экспрессия репортерного белка (флуоресцеина) может быть детектирована после микроинжекции комплекса «РНК-частица» в яйца морского ежа.
В WO 2010/009277 описаны наночастицы на основе липидных пептидов (NLPPs), содержащие (a) амфипатический пептид, (b) липид и (c) по меньшей мере одну иммуногенную молекулу. В некоторых вариантах изобретения NLPP также включают положительно заряженный «агент для захвата», такой как катионный липид. Агент для захвата используется для заякоривания отрицательно заряженных иммуногенных молекул (например, молекулы ДНК или молекулы РНК). Для получения NLPP требуются амфипатические пептиды, используемые для солюбилизации липидного компонента и для образования наночастиц.
Поэтому необходимо разработать системы доставки молекул нуклеиновой кислоты. Такие системы доставки могут быть использованы для приготовления вакцин на основе нуклеиновой кислоты, а в частности, вакцин на основе РНК.
Сущность изобретения
В общих чертах, настоящее изобретение относится к катионным эмульсиям типа «масло в воде», в которых молекула нуклеиновой кислоты образует комплекс с эмульсионными частицами. Эти эмульсии могут быть использованы для доставки молекул нуклеиновой кислоты, таких как молекула РНК, в клетки. Эмульсионные частицы содержат масляную сердцевину и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, что будет приводить к заякориванию молекулы с эмульсионными частицами. Эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а эмульсия имеет отношение N/P, составляющее по меньшей мере 4:1.
В некоторых вариантах изобретения эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а эмульсия имеет отношение N/P, составляющее по меньшей мере 1,1:1, по меньшей мере 1,5:1, по меньшей мере 2:1, по меньшей мере 2,5:1, по меньшей мере 3:1 или по меньшей мере 3,5:1.
Настоящее изобретение относится к иммуногенной катионной эмульсии типа «масло в воде», включающей эмульсионные частицы, содержащие масляную сердцевину и катионный липид, и молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами, где средний диаметр эмульсионных частиц составляет приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1, при условии, что указанная молекула нуклеиновой кислоты не кодирует секретированную щелочную фосфатазу, и при условии, что такая молекула нуклеиновой кислоты не является молекулой РНК, кодируемой плазмидой A317, последовательность которой представлена на фиг. 7A заявки на патент США № 61/361892. В некоторых своих вариантах настоящее изобретение также включает условие, при котором молекула нуклеиновой кислоты не кодирует белковый антиген RSV F, и/или дополнительное условие, при котором молекула нуклеиновой кислоты не кодирует белок RSV. При этом, предпочтительно, чтобы молекула нуклеиновой кислоты кодировала антиген и представляла собой молекулу РНК, такую как аутореплицирующаяся РНК.
Иммуногенная катионная эмульсия типа «масло в воде» может быть забуферена (например, цитратным буфером, сукцинатным буфером, ацетатным буфером) и имеет pH приблизительно от 6,0 до 8,0, а предпочтительно, приблизительно от 6,2 до 6,8. При этом, иммуногенная катионная эмульсия типа «масло в воде» может, но необязательно, дополнительно содержать неорганическую соль в концентрации, предпочтительно, не превышающей 30 мM. Альтернативно или дополнительно, иммуногенная катионная эмульсия типа «масло в воде» также содержит неионный агент, придающий тоничность, такой как сахар, спирт ряда сахаров или их комбинации, и/или полимер, такой как полоксамер в водной фазе. Количество полимера, если он присутствует, может составлять приблизительно от 0,05% до 20% (масс/об). В некоторых вариантах изобретения иммуногенная катионная эмульсия типа «масло в воде» является изотонической. В других вариантах изобретения иммуногенные катионные эмульсии типа «масло в воде» являются гипотоническими или гипертоническими.
В некоторых вариантах изобретения масляная сердцевина эмульсионных частиц содержит масло, выбранное из группы, состоящей из касторового масла, кокосового масла, кукурузного масла, масла семян хлопчатника, масла ипомеи, рыбьего жира, масла жожобы, лярда, льняного масла, оливкового масла, арахисового масла, сафлорового масла, кунжутного масла, соевого масла, сквалена, сквалана, подсолнечного масла, масла грушанки и их комбинаций. В конкретных вариантах изобретения масляной сердцевиной является сквален. Катионный липид может быть выбран из группы, состоящей из l,2-диолеоилокси-3-(триметиламмоний)пропана (DOTAP), 3β-[N-(N',N'-диметилaминоэтан)карбамоил]холестерина (холестерина DC), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмонийпропана (DMTAP), дипальмитоил(C16:0)триметил аммонийпропана (DPTAP), дистеароилтриметиламмонийпропана (DSTAP), хлорида N-[l-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорида N,N-диолеоил-N,N-диметиламмония (DODAC), l,2-диолеоил-sn-глицеро-3-этилфосфохолина (DOEPC), l,2-диолеоил-3-диметиламмонийпропана (DODAP), l,2-дилинолеилокси-3-диметиламинопропана (DLinDMA), липидов E0001-E0118 и их комбинаций. В предпочтительном варианте изобретения катионным липидом является DOTAP.
Эмульсионные частицы могут также включать поверхностно-активное вещество, такое как неионное поверхностно-активное вещество. Предпочтительно, чтобы такое поверхностно-активное вещество не являлось полиэтиленгликолем (ПЭГ)-липидом. Поверхностно-активное вещество может присутствовать в количестве приблизительно от 0,01% до 2,5% (масс./об.). В некоторых вариантах изобретения поверхностно-активным веществом является SPAN85 (сорбитантриолеат), твин 80 (полисорбат 80) или их комбинация. В некоторых вариантах изобретения эмульсия типа «масло в воде» содержит равные количества SPAN85 (сорбитантриолеата), твина 80 (полисорбата 80), например, 0,5% (масс./об.) каждой частицы также содержит поверхностно-активное вещество.
Настоящее изобретение также относится к способу получения иммуногенной катионной эмульсии типа «масло в воде», включающей эмульсионные частицы, содержащие масляную сердцевину и катионный липид, и молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами, где средний диаметр эмульсионных частиц составляет приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1, при условии, что указанная молекула нуклеиновой кислоты не кодирует секретированную щелочную фосфатазу, и при условии, что такая молекула нуклеиновой кислоты не является молекулой РНК, кодируемой плазмидой A317, последовательность которой представлена на фиг. 7A заявки на патент США № 61/361892. Указанный способ включает получение (i) катионных эмульсий типа «масло в воде», содержащих эмульсионные частицы, которые включают описанную здесь масляную сердцевину и катионный липид, и (ii) водный раствор, содержащий нуклеиновую кислоту, и объединение стадий (i) и (ii) с образованием указанной иммуногенной катионной эмульсии типа «масло в воде».
Настоящее изобретение также относится к способу продуцирования иммунного ответа у индивидуума, где указанный способ включает введение указанному индивидууму эффективного количества описанной здесь иммуногенной катионной эмульсии типа «масло в воде».
Краткое описание графического материала
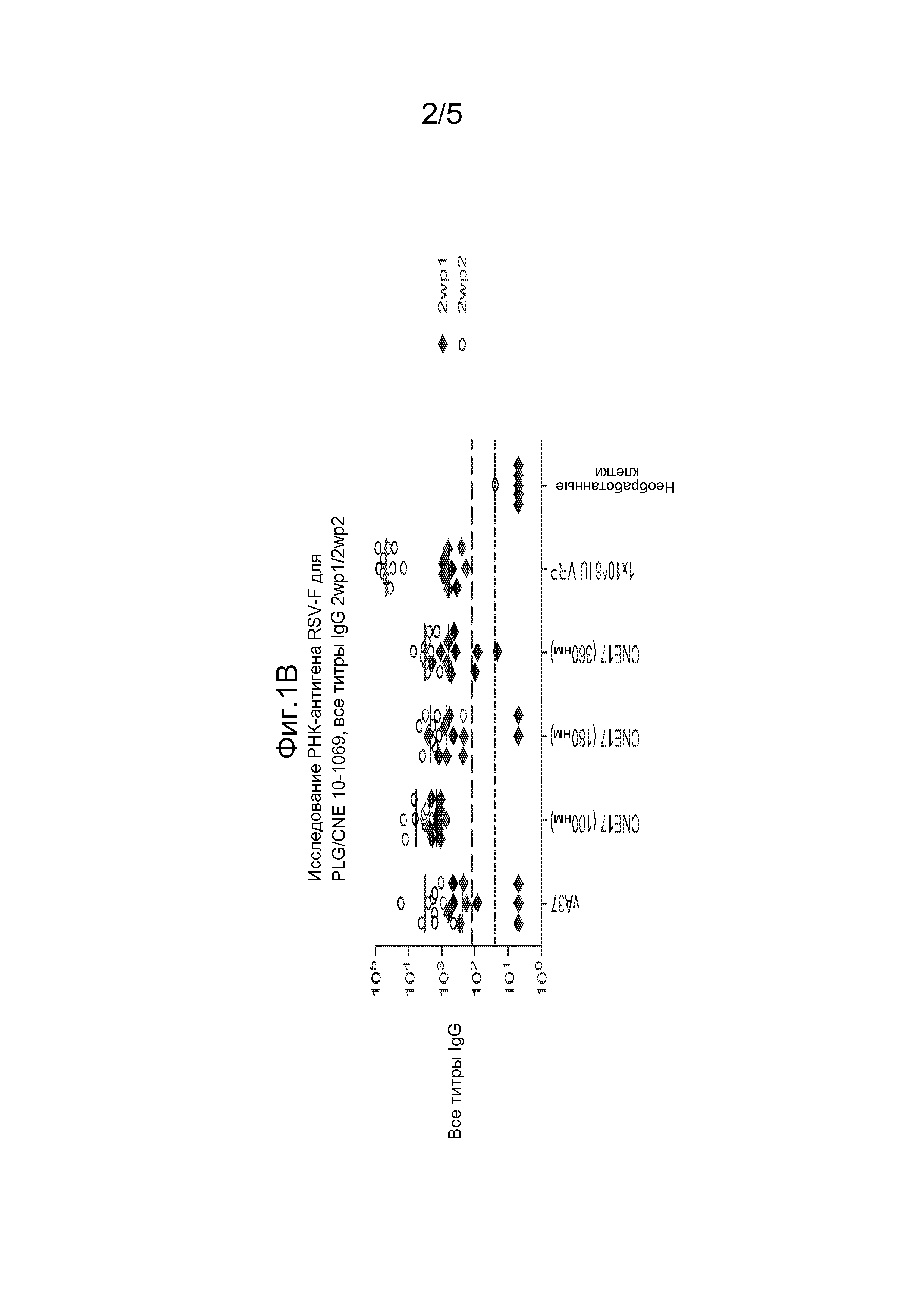
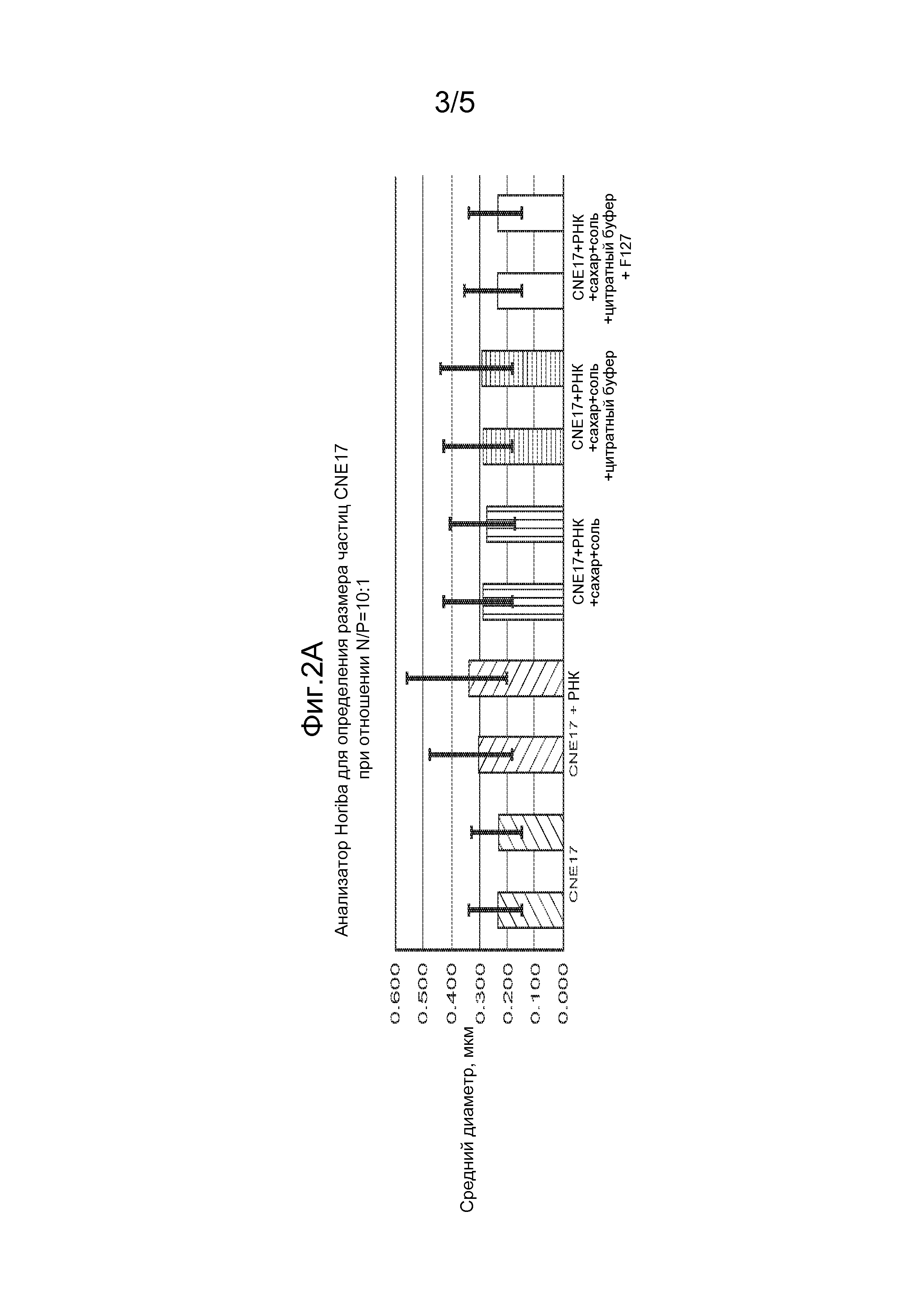
На фиг. 1A представлены результаты in vivo анализа на SEAP, проводимого с использованием 1 мкг РНК-репликона vA306, образующего комплекс с CNE17 в отношении N:P=10:1 На фиг. 1В представлены общие титры IgG у мышей BALB/c через две недели после 1-ой иммунизации (2wp1) и через две недели после 2-ой иммунизации (2wp2) РНК-репликоном A317, который кодирует белок RSV F и образует комплекс с CNE17. Эти данные показали, что по мере увеличения размера частиц, уровень экспрессии SEAP снижается и снижается иммунный ответ на белок RSV F.
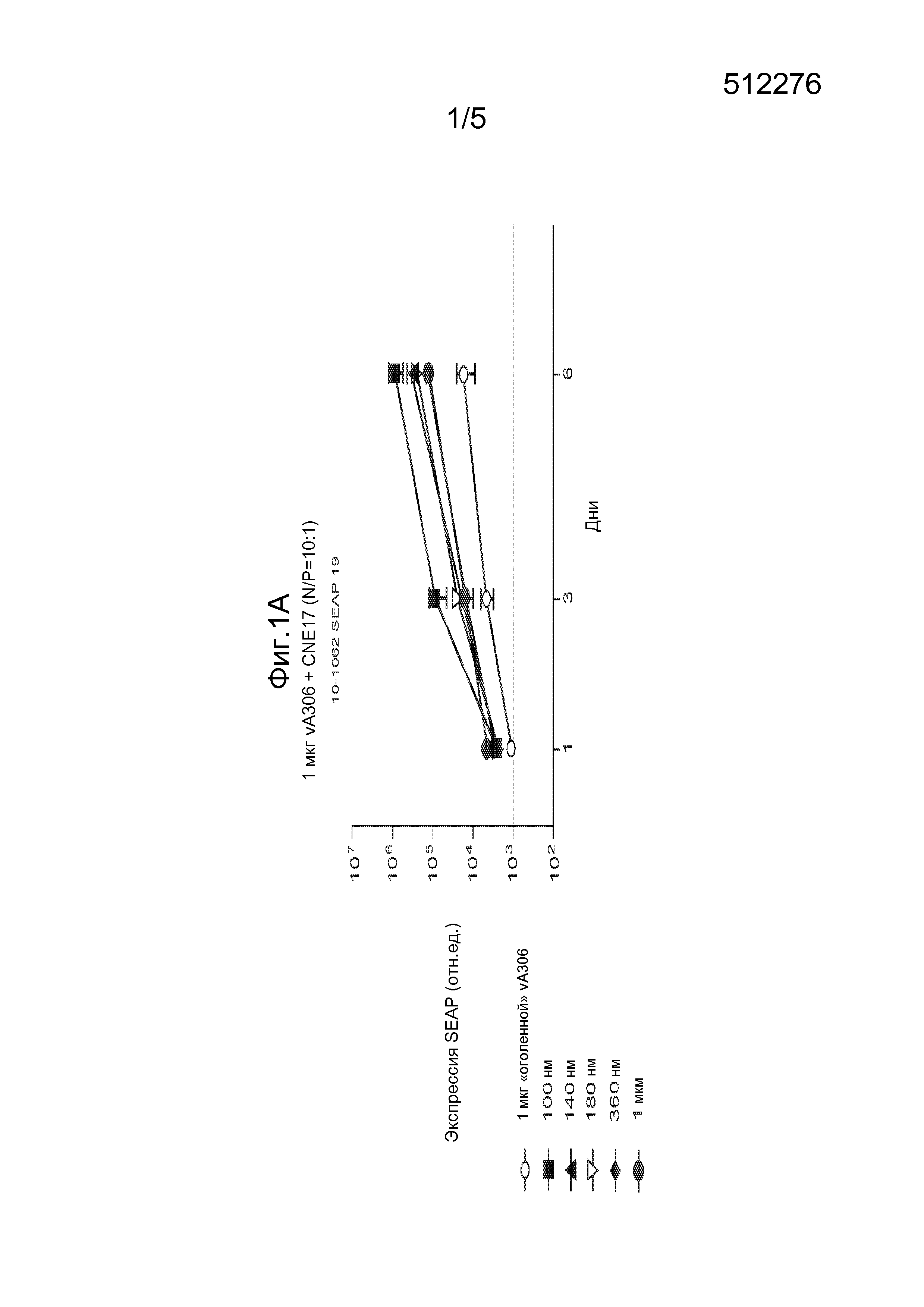
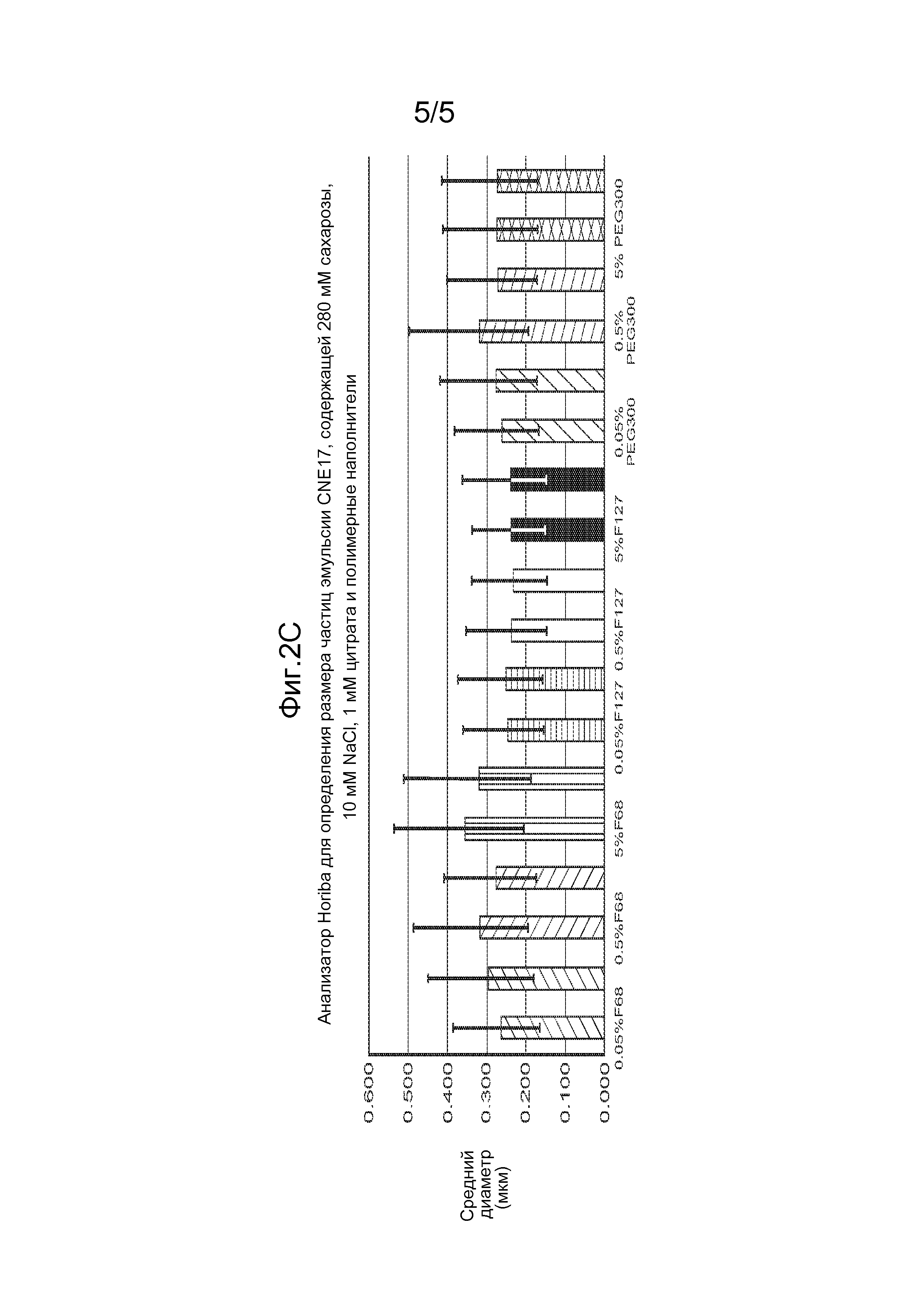
На фиг. 2A-2C проиллюстрировано влияние образования РНК-комплекса и различных составов буфера на размер частиц. На фиг. 2A показано, что образование РНК-комплекса приводит к увеличению размера частиц в эмульсии CNE17, и что присутствие сахара и/или низкой концентрации соли (NaCl, 10 мМ) приводит к уменьшению размера частиц. Добавление плюроника F127 приводит к снижению размера частиц до их размера перед образованием комплекса. На фиг. 2В проиллюстрировано влияние цитратного буфера на размер частиц. На фиг. 2С проиллюстрировано влияние полимеров на размер частиц.
Подробное описание изобретения
1. Общий обзор
В общих чертах, настоящее изобретение относится к катионным эмульсиям типа «масло в воде», в которых молекула нуклеиновой кислоты образует комплекс с эмульсионными частицами, где указанные эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1. Эмульсионные частицы содержат масляную сердцевину и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, что будет приводить к заякориванию молекулы на эмульсионных частицах. Указанные эмульсии могут быть использованы для доставки молекул нуклеиновой кислоты, таких как молекула РНК, в клетки.
Настоящее изобретение основано на обнаружении того факта, что при введении индивидууму катионной эмульсии типа «масло в воде», содержащей антиген-кодирующую молекулу РНК, на иммунный ответ, вырабатываемый против кодируемого РНК-антигена, влияют на свойства данной эмульсии, включая средний диаметр эмульсионных частиц и количество РНК, образующей комплекс с эмульсионными частицами (то есть, отношение N/P). Авторами настоящего изобретения было определено, что средний диаметр эмульсионных частиц увеличивается в случае образования комплекса молекул РНК с эмульсией, и что частицы большого диаметра способствуют снижению нейтрализующих титров. Эмульсии, в которых средний диаметр частиц составляет приблизительно от 80 нм до 180 нм, дают хорошие нейтрализующие титры. Но даже в этом интервале значений, эмульсии с частицами, имеющими средний диаметр, равный верхнему предельному значению данного интервала, являются менее предпочтительными, а особенно предпочтительным является средний размер частиц приблизительно 100 нм. Также предпочтительным является средний диаметр частиц, составляющий приблизительно от 100 нм до 130 нм. Авторами настоящего изобретения было неожиданно обнаружено, что иммунный ответ прямо пропорционально не зависит от количества РНК, образующей комплекс с эмульсией. Отношение N/P=4:1 дает хороший иммунный ответ на кодируемый антиген, однако, более высокие отношения N/P необязательно будут давать более высокие нейтрализующие титры.
В случае образования комплексов молекул РНК с эмульсией, средний диаметр частиц катионной эмульсии типа «масло в воде» увеличивается. Этот эффект может быть снижен путем введения в эмульсию неорганических солей. Однако, неорганические соли могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, а поэтому неорганическая(ие) соль(и) должна(ы) присутствовать лишь в небольших концентрациях (например, не более, чем приблизительно 30 мМ). При желании, для уменьшения размера частиц, возрастание которого связано с образованием комплекса нуклеиновой кислоты, могут быть использованы гидрофильные полимеры. Однако, и в этом случае, гидрофильные полимеры могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, а поэтому гидрофильный(е) полимер(ы) должен(ны) присутствовать лишь в небольших концентрациях (например, приблизительно от 0,05% до 20% (масс./об.)).
Катионные эмульсии типа «масло в воде», содержащие молекулу РНК, кодирующую антиген, могут быть введены индивидууму для индуцирования иммунного ответа на кодируемый антиген. При использовании катионных эмульсий типа «масло в воде» в этих целях, предпочтительно, чтобы такие эмульсии были изотоническими. Однако, поскольку неорганические соли могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, то тоничность эмульсии должна быть, предпочтительно, скорректирована путем добавления неионного агента, придающего тоничность. В предпочтительных вариантах изобретения катионные эмульсии типа «масло в воде», содержащие молукулу РНК, доводят до концентрации, составляющей от 250 мОсм/кг воды до приблизительно 320 мОсм/кг, с использованием сахара, спирта ряда сахаров или их комбинаций.
2. Определения
При употреблении артиклей «a», «an» и «the» с существительными в единственном числе подразумевается, что эти существительные могут означать множество объектов, если это не оговорено особо.
Используемый здесь термин «приблизительно» относится к величине, имеющей значение ± 10% от исходной величины.
Термин «поверхностно-активное вещество» известен специалистам и обычно означает любую молекулу, имеющую гидрофильную группу (например, полярную группу), энергетически предпочитаемой реакцией которой является сольватация с водой, и гидрофобную группу, плохо вступающую в реакцию сольватации с водой. Термин «неионное поверхностно-активное вещество» известен специалистам, и обычно означает молекулу поверхностно-активного вещества, у которого гидрофильная группа (например, полярная группа) не является электростатически заряженной.
Термин «полимер» означает молекулу, состоящую из отдельных химических групп, которые могут быть одинаковыми или различными, и которые связаны друг с другом. Используемый здесь термин «полимер» означает отдельные химические группы, которые присоединяются последовательно «друг к другу» с образованием молекулы с прямой цепью, а также отдельные химические группы, которые соединены друг с другом в форме разветвленной структуры (например, в «сверхразветвленной» или «звездообразной» форме). Репрезентативными полимерами являются, например, полоксамеры. Полоксамеры представляют собой неионные триблоксополимеры, имеющие центральную гидрофобную цепь полиоксипропилена (полипропиленоксида), фланкированную двумя гидрофильными цепями полиоксиэтилена (полиэтиленоксида).
Термин «буфер» означает водный раствор, устойчивый к изменениям pH раствора.
Используемые здесь термины «нуклеотидный аналог» или «модифицированный нуклеотид» означают нуклеотид, который содержит одну или более химических модификаций (например, замен) внутри или на поверхности азотистого основания нуклеозида (например, цитозина (C), тимина (T) или урацила (U)), аденина (A) или гуанина (G)). Нуклеотидный аналог может содержать дополнительные химические модификации внутри или на поверхности сахарной группы нуклеозида (например, рибозы, дезоксирибозы, модифицированной рибозы, модифицированной дезоксирибозы, шестичленного аналога сахаров или аналога сахаров с незамкнутой цепью) или фосфата.
Используемый здесь термин «сахарид» включает моносахариды, олигосахариды или полисахариды, имеющие прямую или кольцевую форму или их комбинацию и образующие сахаридную цепь. Олигосахаридами являются сахариды, имеющие два или более моносахаридных остатков. Примерами сахаридов являются глюкоза, мальтоза, мальтотриоза, мальтотетраоза, сахароза и трегалоза.
Термины «аутореплицирующаяся РНК», «РНК-репликон» или «РНК-вектор» известны специалистам и, по существу, означают молекулу РНК, способную регулировать свою собственную амплификацию или «ауторепликацию» in vivo обычно в клетке-мишени. РНК-репликон используется непосредственно, то есть, при этом, не требуется введения ДНК в клетку и ее транспорта в ядро, в котором происходит транскрипция. При использовании РНК-вектора для прямой доставки в цитоплазму клетки-хозяина, автономная репликация и трансляция гетерологичной последовательности нуклеиновой кислоты происходят достаточно эффективно. Запускаемая альфавирусом система ауторепликации РНК может содержать следующие компоненты в соответствующем порядке: вирусную 5'-последовательность, необходимую для in cis репликации (также обычно обозначаемую 5'-CSE); последовательности, которые, при их экспрессии, кодируют биологически активные неструктурные белки альфавируса (например, nsP1, nsP2, nsP3, nsP4); вирусные 3'-последовательности, необходимые для in cis репликации (также обычно обозначаемые 3'-CSE) и полиаденилатный путь. Запускаемая альфавирусом система ауторепликации РНК может также содержать вирусный промотор субгеномной «области стыка», последовательности одного или более генов структурных белков или их частей, чужеродную(ые) молекулу(ы) нуклеиновой кислоты, которая(ые) имеет(ют) размер, достаточный для продуцирования рекомбинантных альфавирусных частиц, а также гетерологичную(ые) последовательность(и), которая(ые) должна(ы) быть экспрессирована(ы).
Термин «адъювант» означает любое вещество, которое усиливает или модифицирует действие фармацевтического средства, включая, но не ограничиваясь ими, иммунологические адъюванты, которые усиливают и/или диверсифицируют иммунный ответ на антиген. Следовательно, иммунологическими адъювантами являются соединения, способные усиливать иммунный ответ на антигены. Иммунологические адъюванты могут усиливать гуморальный и/или клеточный иммунитет. В определение используемых здесь терминов «иммунологические адъюванты» входят вещества, стимулирующие природный иммунный ответ. Иммунологические адъюванты могут также называться «усилителями иммунных ответов».
Используемый здесь термин «антиген» означает молекулу, содержащую один или более эпитопов (например, линейный эпитоп, конформационный эпитоп или оба этих эпитопа). Используемый здесь термин «эпитоп» означает часть данной молекулы (например, антигенной молекулы или антигенного комплекса), которая определяет ее иммунологическую специфичность. Эпитоп входит в объем определенного здесь термина «антиген». Используемый здесь термин «антиген» включает субъединичные антигены, то есть, антигены, которые отделены от целого организма или отличаются от целого организма, с которым они ассоциируются в природе.
Термины «иммунологический ответ» или «иммунный ответ» означают вырабатывание у индивидуума гуморального и/или клеточного иммунного ответа на антиген или иммунологический адъювант.
Иммунные ответы включают природные и адаптивные иммунные ответы. Природные иммунные ответы представляют собой быстро действующие ответы, которые обеспечивают защиту иммунной системы организма первого ряда. В противоположность этому, при вырабатывании адаптивного иммунитета происходит отбор и клональная экспансия иммунных клеток, имеющих соматически реаранжированные гены рецепторов (например, T- и B-клеточных рецепторов), которые распознают антигены данного патогена или антигены, ассоциированные с данным расстройством (например, с опухолью), и тем самым сообщают специфичность и иммунологическую память. Природные иммунные ответы и многие ассоциированные с ними эффекты приводят к быстрой вспышке воспалительных цитокинов и к активации антигенпрезентирующих клеток (АПК), таких как макрофаги и дендритные клетки. Для дифференциации патогенов от собственных компонентов, природная иммунная система использует ряд относительно инвариабельных рецепторов, которые детектируют отличительные признаки патогенов, известные как ассоциированные с патогеном молекулярные паттерны или PAMP. Добавление микробиологических компонентов в экспериментальные вакцины приводит, как известно, к вырабатыванию стойких и длительных адаптивных иммунных ответов. Сообщалось, что после такого потенцирования иммунных ответов начинают действовать паттерн-распознающие рецепторы (PRR), которые дифференциально экспрессируются на различных иммунных клетках, включая нейтрофилы, макрофаги, дендритные клетки, природные клетки-киллеры, В-клетки и некоторые неиммунные клетки, такие как эпителиальные и эндотелиальные клетки. Действие PRR приводит к активации некоторых из этих клеток и к секреции ими цитокинов и хемокинов, а также к созреванию и миграции других клеток. В целом, это создает воспалительную среду и приводит к вырабатыванию устойчивого адаптивного иммунного ответа. PRR включают не-фагоцитарные рецепторы, такие как ловушко-подобные рецепторы (TLR) и нуклеотид-связывающие белки домена олигомеризации (NOD), и рецепторы, индуцирующие фагоцитоз, такие как рецепторы супероксидных радикалов, маннозные рецепторы и β-глюкановые рецепторы. Описанными в литературе TLR (наряду с примерами некоторых описанных лигандов, которые могут быть использованы в качестве иммуногенной молекулы в различных вариантах изобретения) являются: TLR1 (бактериальные липопротеины, происходящие от микобактерий Mycobacteria, Neisseria), TLR2 (дрожжевые зимозановые частицы, пептидогликан, липопротеины, липопептиды, гликолипиды, липополисахарид), TLR3 (двухцепочечная вирусная РНК, poly:IC), TLR4 (бактериальные липополисахариды, таксол растительного происхождения), TLR5 (бактериальные флагеллины), TLR6 (дрожжевые зимозановые частицы, липотехоевая кислота, липопептиды от mycoplasma), TLR7 (одноцепочечная РНК, имихимод, резимихимод и другие синтетические соединения, такие как локсорибин и бропиримин), TLR8 (одноцепочечная РНК, резимихимод) и TLR9 (CpG-олигонуклеотиды) и т.п. Дендритные клетки известны как типы клеток, играющие наиболее важную роль в инициации примирования «необученных» хелперных CD4+-T-клеток (TH) и в индуцировании дифференцировки CD8+-T-клеток в клетки-киллеры. Сообщалось, что передача TLR-сигнала играет важную роль в определении качества этих хелперных Т-клеточных ответов, например, природы TLR-сигнала, определяющего конкретный тип наблюдаемого TH-ответа (например, преимущественно TH1-ответа, а не TH2 ответа). Комбинация ответов с вырабатыванием антитела (гуморального ответа) и клеточного иммунного ответа продуцируется как часть ответа TH1-типа, тогда как преобладающим гуморальным ответом является ответ TH2-типа. Существует множество задокументированных данных, указывающих на то, что различные лиганды TLR, такие как CpG-ДНК (TLR9) и имидазохинолины (TLR7, TLR8), стимулируют продуцирование цитокинов иммунными клетками in vitro. Было обнаружено, что имидазохинолины представляют собой, главным образом, небольшие, соединения, которые, по своему действию, подобны лекарственным средствам и представляют собой агонисты TLR. Дополнительную информацию можно найти, например, в публикациях A. Pashine, N. M. Valiante and J. B. Ulmer, Nature Medicine 11, S63-S68 (2005), K. S. Rosenthal and D. H. Zimmerman, Clinical and Vaccine Immunology, 13(8), 821-829 (2006), и в цитируемых там работах.
В описании настоящего изобретения термин «гуморальный иммунный ответ» означает иммунный ответ, опосредуемый молекулами антител, а термин «клеточный иммунный ответ» означает ответ, опосредуемый Т-лимфоцитами и/или другими лейкоцитами. Один из важных аспектов клеточного иммунитета заключается в вырабатывании антигенспецифического ответа цитолитическими T-клетками (CTL). CTL обладают специфичностью к пептидным антигенам, которые презентируются вместе с белками, кодируемыми генами главного комплекса гистосовместимости (MHC), и экспрессируются на поверхности клеток. CTL индуцируют и стимулируют внутриклеточную деструкцию внутриклеточных микробов или лизис клеток, инфицированных такими микробами. Другим аспектом клеточного иммунитета является антигенспецифический ответ, вырабатываемый хелперными Т-клетками. Хелперные Т-клетки стимулируют функцию неспецифических эффекторных клеток и направляют их активность против клеток, которые представляют на своей поверхности пептидные антигены вместе с молекулами MHC. Термин «клеточный иммунный ответ» также означает продуцирование цитокинов, химокинов и других молекул, образующихся под действием активированных Т-клеток и/или других лейкоцитов, включая лейкоциты, происходящие от CD4+- и CD8+-T-клеток.
Композиция, такая как иммуногенная композиция или вакцина, которая вырабатывает клеточный иммунный ответ, может также служить для сенсибилизации позвоночного посредством презентации антигена вместе с молекулами МНС на клеточной поверхности. Клеточно-опосредуемый иммунный ответ вырабатывается на клетках, презентирующих антиген на своей поверхности, или на участке, находящемся поблизости от этих клеток. Кроме того, могут продуцироваться антиген-специфические Т-лимфоциты, которые будут в дальнейшем обеспечивать защиту иммунизированного хозяина. Способность конкретного антигена или композиции стимулировать клеточно-опосредуемый иммунологический ответ может быть определена с помощью различных анализов, известных специалистам, таких как анализы на лимфопролиферацию (активацию лимфоцитов), анализы на цитотоксичность CTL-клеток, анализы на T-лимфоциты, специфичные к антигену у сенсибилизированного индивидуума, или определение уровня продуцирования цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны специалистам. См., например, Erickson et al. (1993) J. Immunol 151:4189-4199; Doe et al. (1994) Eur. J. Immunol 24:2369-2376. Таким образом, иммунологический ответ, определенный в настоящем изобретении, может представлять собой ответ, стимулирующий продуцирование CTL и/или продуцирование или активацию хелперных Т-клеток. Представляющий интерес антиген может также вырабатывать опосредуемый антителом иммунный ответ. Следовательно, иммунологический ответ может включать, например, один или более из нижеследующих эффектов, которыми, среди прочих, являются: продуцирование антител, например, В-клетками; и/или активация супрессорных Т-клеток и/или γδ T-клеток, специфичных к антигену или антигенам, присутствующим в представляющей интерес композиции или в вакцине. Такие ответы могут служить, например, в целях нейтрализации инфекции и/или опосредования антитело-комплементарной или антитело-зависимой клеточной цитотоксичности (ADCC) для обеспечения защиты иммунизированного хозяина. Такие ответы могут быть определены с помощью стандартных иммуноанализов и анализов на нейтрализацию, хорошо известных специалистам.
Композиции согласно изобретению обладают «повышенной иммуногенностью» для данного антигена, если они обладают повышенной способностью вырабатывать иммунный ответ по сравнению с иммунным ответом, вырабатываемым эквивалентным количеством антигена в другой композиции (например, где антиген вводят как растворимый белок). Таким образом, композиция может обладать «повышенной иммуногенностью», если, например, такая композиция вырабатывает более сильный иммунный ответ, или если для продуцирования иммунного ответа у индивидуума, которому вводят такую композицию, может потребоваться более низкая доза или еще более низкие дозы антигена. Такая повышенная иммуногенность может быть определена, например, путем введения животным композиции согласно изобретению и антигенного контроля и сравнения результатов этих двух анализов.
3. Катионные эмульсии типа «масло в воде»
Описанные здесь катионные эмульсии типа «масло в воде» получают методами, по существу, известными специалистам, с использованием компонентов в концентрациях, подходящих для получения этих эмульсий. Следует отметить, что в процессе получения эмульсий, включая стерилизацию и другие последующие стадии, небольшие количества масла (например, сквалена), катионного липида (например, DOTAP) или других компонентов могут быть потеряны, а фактические концентрации этих компонентов в конечном продукте (например, в упакованной и в стерилизованной эмульсии, готовой для введения) могут быть несколько ниже, чем исходные количества, иногда приблизительно на 10% или приблизительно на 20%.
Частицы катионной эмульсии типа «масло в воде» содержат масляную сердцевину и катионный липид. Катионный липид может взаимодействовать с молекулой нуклеиновой кислоты, например, посредством электростатических взаимодействий и гидрофобных/гидрофильных взаимодействий, что будет приводить к заякориванию молекулы нуклеиновой кислоты на эмульсионных частицах. Описанные здесь катионные эмульсии являются особенно подходящими для доставки молекулы нуклеиновой кислоты, такой как молекула РНК, кодирующая антиген, или короткая интерферирующая РНК, в клетки in vivo. Так, например, описанные здесь катионные эмульсии имеют то преимущество, что они могут быть использованы в качестве вакцин для доставки РНК, кодирующей антигены, включая аутореплицирующиеся РНК.
Частицы эмульсий типа «масло в воде» напоминают мицеллу с центральной масляной сердцевиной. Эту масляную сердцевину покрывают катионным липидом, который обеспечивает диспергирование масляных капелек в водной (непрерывной) фазе в виде мицеллоподобных капелек. В эмульсии могут присутствовать один или более необязательных компонентов, таких как поверхностно-активные вещества и/или фосфолипиды, описанные ниже. Так, например, одно или более поверхностно-активных веществ могут быть использованы для стимуляции образования частиц и/или для стабилизации эмульсионных частиц. В этом случае, масляную сердцевину покрывают катионным липидом, а также поверхностно-активным(и) веществом(ами) с получением мицеллоподобных капелек. Аналогичным образом, один или более липидов (например, нейтральных липидов, гликолипидов или фосфолипидов) могут также присутствовать на поверхности эмульсионных частиц, если такие липиды используются в качестве эмульгаторов для диспергирования масляных капелек.
Частицы эмульсии типа «масло в воде» имеют средний (то есть, среднечисленный) диаметр, составляющий приблизительно от 80 нм до 180 нм, приблизительно от 80 нм до 150 нм, приблизительно от 80 нм до 130 нм, или приблизительно от 80 нм до 120 нм. Особенно предпочтительный средний диаметр частиц составляет приблизительно 100 нм.
Размер эмульсионных частиц может варьироваться при изменении отношения поверхностно-активного вещества к маслу (по мере увеличения отношения, размер капелек уменьшается), при изменении рабочего давления гомогенизации (по мере увеличения рабочего давления гомогенизации, размер капелек обычно уменьшается), при изменении температуры (по мере увеличения температуры, размер капелек уменьшается), при изменении типа масла, при увеличении числа пропусканий через микрофлюидизатор, и при изменении других технологических параметров, описанных в настоящей заявке. На размер частиц может также влиять включение некоторых типов буферов в водной фазе.
Описанные здесь эмульсионные частицы могут образовывать комплекс с молекулой нуклеиновой кислоты, как подробно описано в настоящей заявке. Обычно, катионную эмульсию типа «масло в воде» объединяют с водным раствором, содержащим одну или более молекул нуклеиновой кислоты, с получением эмульсии, которая содержит молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами. Водный раствор, который содержит молекулу(ы) нуклеиновой кислоты, включает нуклеиновые кислоты в концентрациях, которые позволяют получить комплексную эмульсию, имеющую отношение N/P, составляющее по меньшей мере 4:1, например, от 4:1 до 20:1 или от 4:1 до 15:1. Это может быть легко осуществлено, поскольку количество азота (N) в эмульсии может быть количественно оценено любым подходящим методом, таким как ВЭЖХ-метод, применяемый для количественной оценки описанного здесь DOTAP. Затем может быть получен водный раствор молекул нуклеиновой кислоты, который содержит нуклеиновую кислоту в количестве, достаточном для доведения количества фосфатов (P) до уровня, необходимого для достижения нужного отношения N/P.
Репрезентативной катионной эмульсией согласно изобретению является CNE17. Масляной сердцевиной CNE17 является сквален (4,3% масс./об.), а катионным липидом является DOTAP (1,4 мг/мл). CNE17 также включает поверхностно-активные вещества SPAN85 ((сорбитантриолеат) 0,5% об./об.) и твин 80 ((полисорбат 80; полиоксиэтиленсорбитанмоноолеат; 0,5% об./об.). Таким образом, частицы CNE17 содержат скваленовую сердцевину, покрытую SPAN85, твином-80 и DOTAP. Было обнаружено, что молекулы РНК эффективно образуют комплекс с частицами CNE17 в отношении N/P = 4:1 и в отношении N/P=10:1. Другая репрезентативная катионная эмульсия согласно изобретению обозначается здесь «CMF32». Масляной сердцевиной CMF32 является сквален (4,3% масс./об.), а катионным липидом является DOTAP (3,2 мг/мл). CMF32 также включает поверхностно-активные вещества SPAN85 (сорбитантриолеат, 0,5% об./об.) и твин 80 (полисорбат 80; полиоксиэтиленсорбитанмоноолеат; 0,5% об./об.). Таким образом, эмульсионные частицы CMF32 содержат сквален, SPAN85, твин 80 и DOTAP. Было показано, что молекулы РНК эффективно образуют комплекс с частицами CMF32 в отношениях N/P, составляющих 4:1, 6:1, 8:1, 10:1, 12:1 и 14:1. Другими репрезентативными катионными эмульсиями являются, например, эмульсии, обозначаемые здесь «CMF34» (4,3% масс./об. сквалена, 0,5% твина 80, 0,5% SPAN85 и 4,4 мг/мл DOTAP), «CMF35» (4,3% масс./об. сквалена, 0,5% твина 80, 0,5% SPAN85, 5,0 мг/мл DOTAP), и другие описанные здесь эмульсии.
Конкретная катионная эмульсия типа «масло в воде» согласно изобретению содержит DOTAP и сквален в концентрациях 2,1 мг/мл - 2,84 мг/мл (предпочтительно, 2,23 мг/мл - 2,71 мг/мл) и 30,92 мг/мл - 41,92 мг/мл (предпочтительно, от 32,82 мг/мл до приблизительно 40,02 мг/мл), соответственно, а также равные количества SPAN85 и твина 80 (например, приблизительно 0,5% каждого). Другая конкретная катионная эмульсия типа «масло в воде» согласно изобретению содержит DOTAP и сквален в концентрациях 2,78 мг/мл - 3,76 мг/мл (предпочтительно, 2,94 мг/мл - 3,6 мг/мл) и 18,6 мг/мл - 25,16 мг/мл (предпочтительно, от 19,69 мг/мл до приблизительно 24,07 мг/мл), соответственно, а также равные количества SPAN85 и твина 80 (например, приблизительно 0,5% каждого). Предпочтительно, частицы этих эмульсий имеют средний диаметр приблизительно от 80 нм до 180 нм.
Отдельные компоненты эмульсий типа «масло в воде» согласно изобретению известны специалистам, хотя такие композиции не были объединены описанным здесь способом. В соответствии с этим, отдельные компоненты, хотя они в общих чертах описаны ниже и более подробно описаны в предпочтительных вариантах изобретения хорошо известны специалистам, а поэтому, используемые здесь термины, такие как «масляная сердцевина», «поверхностно-активное вещество», «фосфолипиды» и т.п., являются достаточно понятными и не требуют дополнительного объяснения. Кроме того, хотя в настоящем описании указаны предпочтительные интервалы количеств отдельных компонентов эмульсий, однако, фактические отношения компонентов конкретной эмульсии могут быть скорректированы так, чтобы можно было получить эмульсионные частицы, имеющие нужный размер и желаемые физические свойства. Так, например, при использовании конкретного количества масла (например, 5% об./об.), количество поверхностно-активного вещества должно быть доведено до уровня, достаточного для диспергирования масляных капелек в водной фазе и получения стабильной эмульсии. Фактическое количество поверхностно-активного вещества, необходимое для диспергирования масляных капелек в водной фазе, зависит от типа поверхностно-активного вещества и от типа масляной сердцевины, используемой в эмульсии, а количество масла может также варьироваться в зависимости от размера капелек (поскольку это приводит к изменению площади поверхности границы раздела двух фаз). Фактические количества и относительные количества компонентов нужной эмульсии могут быть легко определены специалистом.
A. Масляная сердцевина
Частицы катионных эмульсий типа «масло в воде» содержат масляную сердцевину.
Масло, предпочтительно, представляет собой жидкую фазу при температуре 1°C или выше, и не смешивается с водой.
Таким маслом является, предпочтительно, подвергающееся метаболизму нетоксическое масло, а более предпочтительно, масло, состоящее из углеводородов приблизительно с 6-30 атомами углерода, включая, но не ограничиваясь ими, алканы, алкены, алкины и их соответствующие кислоты и спирты, простые эфиры и сложные эфиры, а также их смеси. Масло может представлять собой любое растительное масло, рыбий жир, масло животного происхождения или синтетическое масло, подвергающееся метаболизму в организме индивидуума, которому вводят данную эмульсию, и не является токсичным для указанного индивидуума. Таким индивидуумом может быть животное, обычно млекопитающее, а предпочтительно, человек.
В некоторых вариантах изобретения масляная сердцевина находится в жидкой фазе при 25°C. Масляная сердцевина может находиться в жидкой фазе при 25°C, если она обладает свойствами текучести (в отличие от твердого вещества и газа, и имеет определенный объем, но не имеет определенной формы) при хранении при 25°C. Однако, эта эмульсия может храниться и может быть использована при любой подходящей температуре. Предпочтительно, такая масляная сердцевина находится в жидкой фазе при 4°C.
Масло может представлять собой любой длинноцепочечный алкан, алкен или алкин, или их кислотные или спиртовые производные, присутствующие в виде свободной кислоты, соли или сложного эфира, такого как моно-, ди- или триэфир, такой как триглицериды и сложные эфиры 1,2-пропандиола или аналогичных полигидроксиспиртов. Спирты могут быть ацилированы моно- или полифункциональной кислотой, например, уксусной кислотой, пропановой кислотой, лимонной кислотой или т.п. Могут быть также использованы простые эфиры, происходящие от длинноцепочечных спиртов, которые представляют собой масла и удовлетворяют другим описанным здесь критериям.
Отдельные алкановые, алкеновые или алкиновые группы и их кислотные или спиртовые производные обычно имеют приблизительно от 6 до 30 атомов углерода. Такая группа может иметь прямую или разветвленную структуру. Эта молекула может быть полностью насыщенной, либо она может иметь одну или более двойных или тройных связей. При использовании масел на основе сложных или простых моно- или полиэфиров, ограничения могут быть наложены на отдельные молекулы жирной кислоты или жирного спирта, которые могут иметь приблизительно от 6 до 30 атомов углерода, но не на общее число атомов углерода.
Особенно предпочтительно, чтобы это масло могло подвергаться метаболизму у хозяина, которому была введена такая эмульсия.
При этом, могут быть использованы любые подходящие масла, полученные от животных или рыб, или растительные масла. Источниками растительных масел являются орехи, семена или зерно, и подходящими маслами являются, например, арахисовое масло, соевое масло, кокосовое масло, оливковое масло и т.п. Другими подходящими маслами, полученными из семян, являются сафлоровое масло, масло из семян хлопчатника, подсолнечное масло, кунжутное масло и т.п. Могут быть также использованы масла, полученные из зерновых культур, и масла, полученные из зерна других злаковых культур, таких как пшеница, овес, рожь, рис, тэфф, тритикале и т.п. Технология получения растительных масел хорошо разработана и известна специалистам. Составы этих и других подобных масел можно найти, например, в реестре пищевых продуктов Merck, где приводятся исходные вещества, применяемые в технологии приготовления пищевых продуктов, питательных веществ и кормов.
Сложные эфиры глицерина и жирной кислоты и 1,2-пропандиола, имеющие приблизительно от шести до десяти атомов углерода и обычно отсутствующие в маслах из семян, могут быть получены путем гидролиза, сепарирования и этерификации соответствующих веществ, происходящих от масел, полученных из орехов и семян. Эти продукты являются коммерчески доступными и поставляются под торговым знаком NEOBEES компанией PVO International, Inc., Chemical Specialties Division, 416 Division Street, Boongon, N.J. и т.п.
Масла и жиры животного происхождения часто присутствуют в твердой фазе при физиологических температурах, что обусловлено тем фактом, что они существуют в форме триглицеридов и имеют большую степень насыщения, чем рыбий жир или растительные масла. Однако, жирные кислоты могут быть получены из животных жиров путем частичного или полного омыления триглицеридов с образованием свободных жирных кислот. Жиры и масла, полученные из молока млекопитающих, могут подвергаться метаболизму, а поэтому, они могут быть использованы для осуществления изобретения. Методы сепарирования, очистки, омыления и другие методы, необходимые для получения чистых масел животного происхождения, хорошо известны специалистам.
Большинство рыб содержат подвергающиеся метаболизму масла, которые могут быть легко выделены. Так, например, некоторыми из репрезентативных рыбьих жиров, которые могут быть использованы в настоящем изобретении, являются жир печени трески, жир печени акулы и китовый жир, такой как спермацеты. Различные масла с разветвленной цепью синтезируют биохимическими методами в виде изопреновых звеньев длиной в 5 атомов углерода, и эти масла имеют общее название «терпеноиды». В соответствии с настоящим изобретением, особенно предпочтительным является сквален (2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексаен), то есть, разветвленный ненасыщенный терпеноид. Основным источником сквалена является жир печени акулы, хотя подходящими источниками могут также служить растительные масла (главным образом, масла овощных культур), включая масло семян амаранта, рисовые отруби, проростки пшеницы и оливковое масло. Сквален может быть также получен из дрожжей или других подходящих микроорганизмов. В некоторых вариантах изобретения сквален, предпочтительно, получают из источников не-животного происхождения, таких как оливки, оливковое масло или дрожжи. Также предпочтительным является сквалан, то есть, насыщенный аналог сквалена. Рыбьи жиры, включая сквален и сквалан, могут быть легко получены из коммерчески доступных источников, либо они могут быть получены известными методами.
В некоторых вариантах изобретения масляная сердцевина содержит масло, выбранное из группы, состоящей из касторового масла, кокосового масла, кукурузного масла, масла семян хлопчатника, масла ипомеи, рыбьего жира, масла жожобы, лярда, льняного масла, оливкового масла, арахисового масла, сафлорового масла, кунжутного масла, соевого масла, сквалена, сквалана, подсолнечного масла, масла грушанки и минерального масла. В репрезентативных вариантах изобретения масляная сердцевина содержит соевое масло, подсолнечное масло, оливковое масло, сквален, сквалан или их комбинации. Сквалан может быть также использован в качестве масла. В репрезентативных вариантах изобретения масляная сердцевина содержит сквален, сквалан или их комбинации.
Масляный компонент эмульсии может присутствовать в количестве приблизительно от 0,2% до 20% (об./об.). Так, например, катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,2% до 20% (об./об.) масла, приблизительно от 0,2% до 15% (об./об.) масла, приблизительно от 0,2% до 10% (об./об.) масла, приблизительно от 0,2% до 9% (об./об.) масла, приблизительно от 0,2% до 8% (об./об.) масла, приблизительно от 0,2% до 7% (об./об.) масла, приблизительно от 0,2% до 6% (об./об.) масла, приблизительно от 0,2% до 5% (об./об.) масла, приблизительно от 0,2% до 4,3% (об./об.) масла, приблизительно от 0,3% до 20% (об./об.) масла, приблизительно от 0,4% до 20% (об./об.) масла, приблизительно от 0,5% до 20% (об./об.) масла, приблизительно от 1% до 20% (об./об.) масла, приблизительно от 2% до 20% (об./об.) масла, приблизительно от 3% до 20% (об./об.) масла, приблизительно от 4% до 20% (об./об.) масла, приблизительно от 4,3% до 20% (об./об.) масла, приблизительно от 5% до 20% (об./об.) масла, приблизительно 0,5% (об./об.) масла, приблизительно 1% (об./об.) масла, приблизительно 1,5% (об./об.) масла, приблизительно 2% (об./об.) масла, приблизительно 2,5% (об./об.) масла, приблизительно 3% (об./об.) масла, приблизительно 3,5% (об./об.) масла, приблизительно 4% (об./об.) масла, приблизительно 4,3% (об./об.) масла, приблизительно 5% (об./об.) масла или приблизительно 10% (об./об.) масла.
Альтернативно, катионная эмульсия типа «масло в воде» содержит приблизительно от 0,2% до 10% (масс./об.) масла, приблизительно от 0,2% до 9% (масс./об.) масла, приблизительно от 0,2% до 8% (масс./об.) масла, приблизительно от 0,2% до 7% (масс./об.) масла, приблизительно от 0,2% до 6% (масс./об.) масла, приблизительно от 0,2% до 5% (масс./об.) масла, приблизительно от 0,2% до 4,3% (масс./об.) масла или приблизительно 4,3% (масс./об.) масла.
В репрезентативных вариантах изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 0,5% (об./об.) масла. В другом репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 4,3% (об./об.) масла. В другом репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 5% (об./об.) масла. В другом репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 4,3% (масс./об.) сквалена.
Как указывалось выше, процент содержания масла, описанного выше, определяют исходя из начального количества масла, используемого для получения эмульсий. При этом, следует отметить, что фактическая концентрация масла в конечном продукте (например, в упакованной и в стерилизованной эмульсии, готовой для введения) может быть несколько ниже, иногда приблизительно на 10% или приблизительно на 20%.
B. Катионные липиды
Описанные здесь эмульсионные частицы содержат катионный липид, который может взаимодействовать с отрицательно заряженной молекулой, способствующей заякориванию молекулы на эмульсионных частицах.
Катионный липид может иметь положительный заряд приблизительно при pH 12, приблизительно при pH 11, приблизительно при pH 10, приблизительно при pH 9, приблизительно при pH 8, приблизительно при pH 7 или приблизительно при рН 6.
Может быть использован любой подходящий катионный липид. Вообще говоря, катионный липид содержит атом азота, который имеет положительный заряд в физиологических условиях. Подходящими катионными липидами являются хлорид бензалкония (BAK), хлорид бензэтония, цетримид (который содержит бромид тетрадецилтриметиламмония и может содержать небольшие количества бромида додецилтриметиламмония и бромида гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), хлорид цетилтриметиламмония (CTAC), первичные амины, вторичные амины, третичные амины, включая, но не ограничиваясь ими, Ν,Ν',Ν'-полиоксиэтилен(10)-N-животный жир-l,3-диаминопропан, соли других четвертичных аминов, включая, но не ограничиваясь ими, бромид додецилтриметиламмония, бромид гексадецилтриметиламмония, смешанный бромид алкилтриметиламмония, хлорид бензилдиметилдодециламмония, хлорид бензилдиметилгексадециламмония, метоксид бензилтриметилaммония, бромид цетилдиметилэтиламмония, бромид диметилдиоктадециламмония (DDAB), хлорид метилбензэтония, хлорид декаметония, смешанный хлорид метилтриалкиламмония, хлорид метилтриоктиламмония, хлорид N,N-диметил-N-[2(2-метил-4-(1,1,3,3-тетраметилбутил)фенокси]этокси)этил]бензолметанаминия (DEBDA), соли диалкилдиметиламмония, хлорид [l-(2,3-диолеилокси)-пропил]-N,N,N-триметиламмония, l,2-диацил-3-(триметиламмоний)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), l,2-диацил-3-(диметиламмоний)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), 1,2-диолеоил-3-(4'-триметиламмоний)бутаноил-sn-глицерин, сложный эфир 1,2-диолеоил-3-сукцинил-sn-глицерилхолина, холестерил(4'-триметиламмоний) бутаноат), соли N-алкилпиридиния (например, бромид цетилпиридиния и хлорид цетилпиридиния), соли N-алкилпиперидиния, дикатионные болаформные электролиты (С12Ме6; C12BU6), диалкилглицерилфосфорилхолин, лизолецитин, L-α-диолеоилфосфатидилэтаноламин, сложный эфир холестерилгемисукцинатхолина, липополиамины, включая, но не ограничиваясь ими, диоктадециламидоглицилспермин (DOGS), дипальмитоилфосфатидилэтаноламидоспермин (DPPES), липополи-L (или D)-лизин (LPLL, LPDL), поли (L (или D)-лизин, конъюгированный с N-глутарилфосфатидилэтаноламином, сложный эфир дидодецилглутаминовой кислоты с боковой аминогруппой (C12GluPhCnN+), сложный эфир дитетрадецилглутаминовой кислоты с боковой аминогруппой (C14GluCnN+), катионные производные холестерина, включая, но не ограничиваясь ими, соль холестерил-3β-оксисукцинамидоэтилeнтриметиламмония, холестерил-3β-оксисукцинамидоэтилeндиметиламин, соль холестерил-3β-карбоксиамидоэтилентриметиламмония, холестерил-3β-карбоксиамидоэтилендиметиламин и 3γ-[Ν-(Ν',Ν-диметиламиноэтанкарбамоил]холестерин) (DC-холестерин), 1,2-диолеоилокси-3-(триметиламмоний)пропан (DOTAP), диметилдиоктадециламмоний (DDA), 1,2-димиристоил-3-триметиламмонийпропан (DMTAP), дипальмитоил(C16:0)триметил аммонийпропан (DPTAP), дистеароилтриметиламмонийпропан (DSTAP) и их комбинации.
Другими катионными липидами, подходящими для использования в настоящем изобретении, являются, например, катионные липиды, описанные в заявке на патент США 2008/0085870 (опубликованной 10 апреля 2008) и в заявке на патент США 2008/0057080 (опубликованной 6 марта 2008).
Другими катионными липидами, подходящими для использования в настоящем изобретении, являются, например, липиды E0001-E0118 или E0119-E0180, описанные в таблице 6 (страницы 112-139) заявки WO 2011/076807 (в которой также описаны методы получения и метод применения этих катионных липидов). Другими подходящими катионными липидами являются хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорид N,N-диолеоил-N,N-диметиламмония (DODAC), 1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC), 1,2-диолеоил-3-диметиламмонийпропан (DODAP), 1,2-дилинолеилокси-3-диметиламинопропан (DLinDMA).
Эта эмульсия может включать любую комбинацию из двух или более описанных здесь катионных липидов.
В некоторых вариантах изобретения катионный липид содержит четвертичный амин.
В предпочтительных вариантах изобретения катионный липид выбран из группы, состоящей из 1,2-диолеоилокси-3-(триметиламмоний)пропана (DOTAP), 3β-[Ν-(Ν',Ν'-диметиламиноэтан)карбамоил]холестерина (DC-холестерина), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмонийпропана (DMTAP), дипальмитоил(C16:0)триметил- аммонийпропана (DPTAP), дистеароилтриметиламмонийпропана (DSTAP), липидов E0001-E0118 или E0119-E0180, описанных в таблице 6 (страницы 112-139) заявки WO 2011/076807, и их комбинаций.
В других предпочтительных вариантах изобретения катионный липид выбран из группы, состоящей из 1,2-диолеоилокси-3-(триметиламмоний)пропана (DOTAP), 3β-[Ν-(Ν',Ν'-диметиламиноэтан)карбамоил]холестерина (DC-холестерина), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмонийпропана (DMTAP), дипальмитоил(C16:0)триметил аммонийпропана (DPTAP), дистеароилтриметиламмонийпропана (DSTAP), хлорида N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорида N,N-диолеоил-N,N-диметиламмония (DODAC), 1,2-диолеоил-sn-глицеро-3-этилфосфохолина (DOEPC), 1,2-диолеоил-3-диметиламмонийпропана (DODAP), 1,2-дилинолеилокси-3-диметиламинопропана (DLinDMA), липидов E0001-E0118 или E0119-E0180, описанных в таблице 6 (страницы 112-139) заявки WO 2011/076807 (которая вводится в настоящее описание посредством ссылки), и их комбинаций.
В некоторых вариантах изобретения катионным липидом является DOTAP. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 25 мг/мл DOTAP. Так, например, катионная эмульсия типа «масло в воде» может содержать DOTAP в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,6 мг/мл, приблизительно от 0,7 мг/мл до 1,6 мг/мл, приблизительно от 0,8 мг/мл до 1,6 мг/мл, приблизительно от 0,8 мг/мл до 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 21,8 мг/мл, приблизительно 24 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,8 мг/мл до 1,6 мг/мл DOTAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл DOTAP.
В некоторых вариантах изобретения катионным липидом является DC-холестерин. Катионная эмульсия типа «масло в воде» может содержать DC-холестерин в количестве приблизительно от 0,1 мг/мл до 5 мг/мл. Так, например, катионная эмульсия типа «масло в воде» может содержать DC-холестерин в количестве приблизительно от 0,1 мг/мл до 5 мг/мл, приблизительно от 0,2 мг/мл до 5 мг/мл, приблизительно от 0,3 мг/мл до 5 мг/мл, приблизительно от 0,4 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,62 мг/мл до 5 мг/мл, приблизительно от 1 мг/мл до 5 мг/мл, приблизительно от 1,5 мг/мл до 5 мг/мл, приблизительно от 2 мг/мл до 5 мг/мл, приблизительно от 2,46 мг/мл до 5 мг/мл, приблизительно от 3 мг/мл до 5 мг/мл, приблизительно от 3,5 мг/мл до 5 мг/мл, приблизительно от 4 мг/мл до 5 мг/мл, приблизительно от 4,5 мг/мл до 5 мг/мл, приблизительно от 0,1 мг/мл до 4,92 мг/мл, приблизительно от 0,1 мг/мл до 4,5 мг/мл, приблизительно от 0,1 мг/мл до 4 мг/мл, приблизительно от 0,1 мг/мл до 3,5 мг/мл, приблизительно от 0,1 мг/мл до 3 мг/мл, приблизительно от 0,1 мг/мл до 2,46 мг/мл, приблизительно от 0,1 мг/мл до 2 мг/мл, приблизительно от 0,1 мг/мл до 1,5 мг/мл, приблизительно от 0,1 мг/мл до 1 мг/мл, приблизительно от 0,1 мг/мл до 0,62 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,3 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,62 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,2 мг/мл, приблизительно 2,46 мг/мл, приблизительно 4,92 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,62 мг/мл до 4,92 мг/мл DC-холестерина, например, 2,46 мг/мл DC-холестерина.
В некоторых вариантах изобретения катионным липидом является DDA. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,1 мг/мл до 5 мг/мл DDA. Так, например, катионная эмульсия типа «масло в воде» может содержать DDA в количестве приблизительно от 0,1 мг/мл до 5 мг/мл, приблизительно от 0,1 мг/мл до 4,5 мг/мл, приблизительно от 0,1 мг/мл до 4 мг/мл, приблизительно от 0,1 мг/мл до 3,5 мг/мл, приблизительно от 0,1 мг/мл до 3 мг/мл, приблизительно от 0,1 мг/мл до 2,5 мг/мл, приблизительно от 0,1 мг/мл до 2 мг/мл, приблизительно от 0,1 мг/мл до 1,5 мг/мл, приблизительно от 0,1 мг/мл до 1,45 мг/мл, приблизительно от 0,2 мг/мл до 5 мг/мл, приблизительно от 0,3 мг/мл до 5 мг/мл, приблизительно от 0,4 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,6 мг/мл до 5 мг/мл, приблизительно от 0,73 мг/мл до 5 мг/мл, приблизительно от 0,8 мг/мл до 5 мг/мл, приблизительно от 0,9 мг/мл до 5 мг/мл, приблизительно от 1,0 мг/мл до 5 мг/мл, приблизительно от 1,2 мг/мл до 5 мг/мл, приблизительно от 1,45 мг/мл до 5 мг/мл, приблизительно от 2 мг/мл до 5 мг/мл, приблизительно от 2,5 мг/мл до 5 мг/мл, приблизительно от 3 мг/мл до 5 мг/мл, приблизительно от 3,5 мг/мл до 5 мг/мл, приблизительно от 4 мг/мл до 5 мг/мл, приблизительно от 4,5 мг/мл до 5 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,45 мг/мл и т.п. Альтернативно, катионная эмульсия типа «масло в воде» может содержать DDA в количестве приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 21,5 мг/мл, приблизительно 21,6 мг/мл, приблизительно 25 мг/мл.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 0,73 мг/мл до 1,45 мг/мл DDA, например, 1,45 мг/мл DDA.
В некоторых вариантах изобретения катионным липидом является DOTMA. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 25 мг/мл DOTMA. Так, например, катионная эмульсия типа «масло в воде» может содержать DOTMA в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,6 мг/мл, приблизительно от 0,7 мг/мл до 1,6 мг/мл, приблизительно от 0,8 мг/мл до 1,6 мг/мл, приблизительно от 0,8 мг/мл до 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,35 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,8 мг/мл до 1,6 мг/мл DOTMA, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл DOTMA.
В некоторых вариантах изобретения катионным липидом является DOEPC. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 25 мг/мл DOEPC. Так, например, катионная эмульсия типа «масло в воде» может содержать DOEPC в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 4 мг/мл, приблизительно от 0,5 мг/мл до 3 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,7 мг/мл, приблизительно от 0,7 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,8 мг/мл до 1,8 мг/мл DOEPC, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл, 1,6 мг/мл, 1,7 мг/мл или 1,8 мг/мл DOEPC.
В некоторых вариантах изобретения катионным липидом является DSTAP. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 50 мг/мл DSTAP. Так, например, катионная эмульсия типа «масло в воде» может содержать DSTAP в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 4 мг/мл, приблизительно от 0,5 мг/мл до 3 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,7 мг/мл, приблизительно от 0,7 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,8 мг/мл до 1,6 мг/мл DSTAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл DSTAP.
В некоторых вариантах изобретения катионным липидом является DODAC. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 50 мг/мл DODAC. Так, например, катионная эмульсия типа «масло в воде» может содержать DODAC в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 4 мг/мл, приблизительно от 0,5 мг/мл до 3 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,7 мг/мл, приблизительно от 0,7 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,15 мг/мл, приблизительно 1,16 мг/мл, приблизительно 1,17 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит от 0,73 мг/мл и приблизительно до 1,45 мг/мл DODAC, например, 1,45 мг/мл DODAC.
В некоторых вариантах изобретения катионным липидом является DODAP. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,5 мг/мл до 50 мг/мл DODAP. Так, например, катионная эмульсия типа «масло в воде» может содержать DODAP в количестве приблизительно от 0,5 мг/мл до 25 мг/мл, приблизительно от 0,6 мг/мл до 25 мг/мл, приблизительно от 0,7 мг/мл до 25 мг/мл, приблизительно от 0,8 мг/мл до 25 мг/мл, приблизительно от 0,9 мг/мл до 25 мг/мл, приблизительно от 1,0 мг/мл до 25 мг/мл, приблизительно от 1,1 мг/мл до 25 мг/мл, приблизительно от 1,2 мг/мл до 25 мг/мл, приблизительно от 1,3 мг/мл до 25 мг/мл, приблизительно от 1,4 мг/мл до 25 мг/мл, приблизительно от 1,5 мг/мл до 25 мг/мл, приблизительно от 1,6 мг/мл до 25 мг/мл, приблизительно от 1,7 мг/мл до 25 мг/мл, приблизительно от 0,5 мг/мл до 24 мг/мл, приблизительно от 0,5 мг/мл до 22 мг/мл, приблизительно от 0,5 мг/мл до 20 мг/мл, приблизительно от 0,5 мг/мл до 18 мг/мл, приблизительно от 0,5 мг/мл до 15 мг/мл, приблизительно от 0,5 мг/мл до 12 мг/мл, приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,5 мг/мл до 5 мг/мл, приблизительно от 0,5 мг/мл до 4 мг/мл, приблизительно от 0,5 мг/мл до 3 мг/мл, приблизительно от 0,5 мг/мл до 2 мг/мл, приблизительно от 0,5 мг/мл до 1,9 мг/мл, приблизительно от 0,5 мг/мл до 1,8 мг/мл, приблизительно от 0,5 мг/мл до 1,7 мг/мл, приблизительно от 0,5 мг/мл до 1,6 мг/мл, приблизительно от 0,6 мг/мл до 1,7 мг/мл, приблизительно от 0,7 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 1,7 мг/мл, приблизительно от 0,8 мг/мл до 3.0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.п.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно от 0,8 мг/мл до 1,6 мг/мл DODAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл DODAP.
В некоторых случаях может оказаться желательным использовать катионный липид, который растворяется в масляной сердцевине. Так, например, DOTAP, DOEPC, DODAC и DOTMA растворяются в сквалене или в сквалане. В других случаях может оказаться желательным использовать катионный липид, который не растворяется в масляной сердцевине. Так, например, DDA и DSTAP не растворяются в сквалене. Специалист в данной области может самостоятельно определить, растворяется или не растворяется данный липид в масле, и выбрать соответствующее масло и соответствующую комбинацию липидов. Так, например, растворимость может быть предсказана исходя из структур липида и масла (например, растворимость липида может быть определена по структуре его «хвоста»). Так, например, липиды, имеющие одну или две ненасыщенных цепи жирной кислоты (например, олеоиловые хвосты), такие как DOTAP, DOEPC, DODAC, DOTMA, растворяются в сквалене или в сквалане, а липиды, имеющие насыщенные цепи жирной кислоты (например, стеароиловые хвосты), не растворяются в сквалене. Альтернативно, растворимость может быть определена путем оценки количества липида, который растворяется в определенном количестве масла с образованием насыщенного раствора.
Как указывалось выше, концентрацию описанного выше липида определяют по исходному количеству липида, используемого для получения эмульсий. Следует отметить, что фактическая концентрация масла в конечном продукте (например, в упакованной и в стерилизованной эмульсии, готовой для введения) может быть несколько ниже, иногда приблизительно на 20%.
C. Дополнительные компоненты
Описанные здесь катионные эмульсии типа «масло в воде» могут также содержать дополнительные компоненты. Так, например, эмульсии могут содержать компоненты, которые могут стимулировать образование частиц, способствовать образованию комплекса молекул нуклеиновой кислоты с катионными частицами, или повышать стабильность молекулы нуклеиновой кислоты (например, предупреждать разложение молекулы РНК). При желании, катионная эмульсия типа «масло в воде» может содержать антиоксидант, такой как цитрат, аскорбат или их соли.
Поверхностно-активные вещества
В некоторых вариантах изобретения частицы катионной эмульсии типа «масло в воде» также содержат поверхностно-активное вещество.
В фармацевтике применяются поверхностно-активные вещества широкого ряда. Такими веществами являются природные продукты, такие как смола деревьев, растительный белок, полимеры на основе сахаров, такие как альгинаты и целлюлоза, и т.п. В качестве поверхностно-активных веществ могут быть использованы некоторые оксиполимеры или полимеры, имеющие гидроксидный или другой гидрофильный заместитель на углеродном остове, например, моно- и полифункциональные соединения на основе повидона, поливинилового спирта и гликолевого эфира. В настоящем изобретении могут быть использованы соединения, которые происходят от длинноцепочечной жирной кислоты и которые принадлежат к третьей основной группе эмульгаторов и суспендирующих агентов.
Конкретными примерами подходящих поверхностно-активных веществ являются следующие поверхностно-активные вещества:
1. Водорастворимые мыла, такие как натриевые, калиевые, аммониевые и алканоламмониевые соли высших жирных кислот (C10-C22), а в частности, мыло на основе натрий- и калий-содержащего животного жира и мыло, приготовленное из кокосового ореха.
2. Анионные синтетические поверхностно-активные вещества, которые не относятся к мылам, и которые могут быть представлены водорастворимыми солями органических продуктов реакции серной кислоты, имеющими в своей молекулярной структуре алкильный радикал, содержащий приблизительно от 8 до 22 атомов углерода, и радикал, выбранный из группы, состоящей из радикалов сульфоновой кислоты и сложного эфира серной кислоты. Примерами таких солей являются алкилсульфаты натрия или калия, происходящие от животного жира или масла кокосового ореха; алкилбензолсульфонаты натрия или калия; алкилглицерилсульфонаты натрия и простых эфиров; натрий-содержащие сульфонаты и сульфаты моноглицерида и жирной кислоты масла кокосового ореха; натриевые или калиевые соли сложных эфиров серной кислоты, которые представляют собой продукт реакции одного моля высшего жирного спирта приблизительно с 1-6 молями этиленоксида; натрий- или калий-содержащие сульфонаты эфиров алкилфенола и этиленоксида, которые содержат 1-10 звеньев этиленоксида на молекулу и в которых алкильные радикалы содержат от 8 до 12 атомов углерода; продукт реакции жирных кислот, этерифицированных сложным эфиром изетионовой кислоты и нейтрализованных гидроксидом натрия; натриевые или калиевые соли амида жирной кислоты и метилтаурида; и натриевые и калиевые соли C10-C24-α-oлефинов, содержащих сульфоновую группу SO3.
3. Неионные синтетические поверхностно-активные вещества, полученные путем реакции конденсации алкиленоксидных групп с органическим гидрофобным соединением. Типичными гидрофобными группами являются продукты реакции конденсации пропиленоксида с пропиленгликолем, алкилфенолы, продукт реакции конденсации пропиленоксида с этилендиамином, алифатические спирты, имеющие от 8 до 22 атомов углерода, и амиды жирных кислот.
4. Неионные поверхностно-активные вещества, такие как оксиды аминов, оксиды фосфинов и сульфоксиды, обладающие полуполярными свойствами. Конкретными примерами длинноцепочечных оксидов третичных аминов являются оксид диметилдодециламина и бис-(2-гидроксиэтил)додециламин. Конкретные примеры оксидов фосфинов можно найти в патенте США № 3304263, выданном 14 февраля 1967, и такими примерами являются оксид диметилдодецилфосфина и оксид диметил-(2-гидроксидодецил)фосфина.
5. Длинноцепочечные сульфоксиды, включая соединения формулы R1-SO-R2, где R1 и R2 представляют собой замещенные или незамещенные алкильные радикалы, причем, R1 содержит приблизительно от 10 до 28 атомов углерода, а R2 содержит от 1 до 3 атомов углерода. Конкретными примерами таких сульфоксидов являются додецилметилсульфоксид и 3-гидрокситридецилметилсульфоксид.
6. Амфолитические синтетические поверхностно-активные вещества, такие как 3-додециламинопропионат натрия и 3-додециламинопропансульфонат натрия.
7. Цвиттерионные синтетические поверхностно-активные вещества, такие как 3-(N,N-диметил-N-гексадециламмоний)пропан- 1-сульфонат и 3-(N,N-диметил-N-гексадециламмоний)-2-гидрокси-пропан-1-сульфонат.
Кроме того, в композиции согласно изобретению могут быть использованы поверхностно-активные вещества всех типов, описанных ниже: (a) мыла (то есть, соли щелочей), состоящие из жирных кислот, кислот канифолей и таллового масла; (b) алкиларенсульфонаты; (c) алкилсульфаты, включая поверхностно-активные вещества, имеющие гидрофобные группы с разветвленными и прямыми ветвями, а также первичные и вторичные сульфатные группы; (d) сульфаты и сульфонаты, содержащие промежуточную связь между гидрофобными и гидрофильными группами, такие как ацилированные метилтауриды жирной кислоты и сульфированные моноглицериды жирной кислоты; (e) длинноцепочечные сложные эфиры кислоты и полиэтиленгликоля, а в частности, сложные эфиры таллового масла; (f) полиэтиленгликолевые эфиры алкилфенолов; (g) полиэтиленгликолевые эфиры длинноцепочечных спиртов и меркаптанов; и (h) ацилдиэтаноламиды жирной кислоты. Поскольку поверхностно-активные вещества могут быть классифицированы по более, чем одному признаку, то ряд классов поверхностно-активных веществ, привиденных в этом параграфе, перекрывается с уже описанными классами поверхностно-активных веществ.
Существует ряд поверхностно-активных веществ, которые были специально получены в биологических целях, и в настоящее время широко применяются в биологии. Такие поверхностно-активные вещества были подразделены на четыре основных класса: анионные, катионные, цвиттерионные (амфотерные) и неионные поверхностно-активные вещества. Примерами анионных поверхностно-активных веществ являются, например, перфтороктаноат (PFOA или PFO), перфтороктансульфонат (PFOS), соли алкилсерной кислоты, такие как додецилсульфат натрия (ДСН) или лаурилсульфат аммония, лауретсульфат натрия (также известный как сульфат лаурилового эфира и натрия, SLES), алкилбензолсульфонат и соли жирной кислоты. Репрезентативными катионными поверхностно-активными веществами являются, например, соли алкилтриметиламмония, такие как бромид цетилтриметиламмония (CTAB или бромид гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), амин полиоксиэтилированного животного жира (POEA), хлорид бензалкония (BAC), хлорид бензэтония (BZT). Репрезентативными цвиттерионными (амфотерными) поверхностно-активными веществами являются, например, додецилбетаин, амидопропилбетаин кокосового ореха и амфоглицинат кокосового ореха. Репрезентативными неионными поверхностно-активными веществами являются, например, алкилполи(этиленоксид), поли(этиленоксид) алкилфенола, сополимеры поли(этиленоксида) и поли(пропиленоксида) (изготавливаемые промышленностью под названием «полоксамеры» или «полоксамины»), ацилполиглюкозиды (например, октилглюкозид или децилмальтозид), жирные спирты (например, цетиловый спирт или олеиловый спирт), кокамид MEA, кокамид DEA, Плюроник® F-68 (блоксополимер полиоксиэтилена и полиоксипропилена) и полисорбаты, такие как твин 20 (полисорбат 20), твин 80 (полисорбат 80; полиоксиэтиленсорбитанмоноолеат), оксид додецилдиметиламина, и сукцинат пропиленгликоля и токоферола, то есть, витамина Е (TPGS витамина E).
Особенно подходящей группой поверхностно-активных веществ является группа неионных поверхностно-активных веществ на основе сорбитана. Эти поверхностно-активные вещества получают посредством реакции дегидратации сорбита с образованием 1,4-сорбитана, который затем подвергают реакции взаимодействия с одним или более эквивалентами жирной кислоты. Такая группа, замещенная жирной кислотой, может быть затем подвергнута реакции взаимодействия с этиленоксидом с получением поверхностно-активных веществ второй группы.
Поверхностно-активные вещества на основе сорбитана, замещенные жирной кислотой, получают посредством реакции взаимодействия 1,4-сорбитана с жирной кислотой, такой как лауриновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота или аналогичная длинноцепочечная жирная кислота, с получением сложного моноэфира 1,4-сорбитана, сложного сесквиэфира 1,4-сорбитана или сложного триэфира 1,4-сорбитана. Эти поверхностно-активные вещества имеют общие названия, например, сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоностеарат, сорбитанмоноолеат, сорбитансесквиолеат и сорбитантриолеат. Эти поверхностно-активные вещества являются коммерчески доступными и поставляются под торговыми знаками SPAN® или ARLACEL®, и обычно имеют буквенные или числовые обозначения, что позволяет идентифицировать различные сорбитаны, замещенные сложными моно-, ди- и триэфирами.
Поверхностно-активные вещества SPAN® и ARLACEL® являются гидрофильными и, по существу, растворимыми или диспергируемыми в масле. Эти поверхностно-активные вещества также растворяются в большинстве органических растворителей. Такие поверхностно-активные вещества обычно не растворяются, но диспергируются в воде. Их гидрофильно-липофильный баланс (ГЛБ) обычно составляет 1,8-8,6. Такие поверхностно-активные вещества могут быть легко получены известными методами, либо они являются коммерчески доступными.
Родственная группа поверхностно-активных веществ включает сложные моноэфиры oлиоксиэтиленсорбитана и сложные триэфиры oлиоксиэтиленсорбитана. Эти вещества получают путем добавления этиленоксида к сложному моноэфиру или триэфиру 1,4-сорбитана. Добавление полиоксиэтилeна приводит к превращению липофильного поверхностно-активного вещества, такого как сложный моно- или триэфир сорбитана, в гидрофильное поверхностно-активное вещество, которое, в основном, растворяется или диспергируется в воде и в различной степени растворяется в органических жидкостях.
Эти вещества, выпускаемые промышленностью под торговым знаком TWEEN® (твин), могут быть использованы для получения эмульсий и дисперсий типа «масло в воде» или солюбилизации масел и приготовления безводных мазей, которые растворяются в воде или легко смываются водой. Поверхностно-активные вещества TWEEN® могут быть объединены с родственными поверхностно-активными веществами, такими как сложный моно- или триэфир сорбитана, для повышения стабильности эмульсии. Поверхностно-активные вещества TWEEN® обычно имеют величину ГЛБ, составляющую в пределах 9,6 - 16,7. Поверхностно-активные вещества TWEEN® являются коммерчески доступными.
Третья группа неионных поверхностно-активных веществ, которые могут быть использованы отдельно или в комбинации с поверхностно-активными веществами SPAN®, ARLACEL® и TWEEN®, представляет собой жирные кислоты на основе полиоксиэтилена, полученные посредством реакции взаимодействия этиленоксида с длинноцепочечной жирной кислотой. Большинство коммерчески доступных поверхностно-активных веществ этого типа имеется в продаже под торговым знаком MYRJ®, и эти поверхностно-активные вещества представляют собой полиоксиэтилeновое производное стеариновой кислоты. Поверхностно-активные вещества MYRJ® являются гидрофильными и растворяются или диспергируются в воде подобно поверхностно-активным веществам TWEEN®. Поверхностно-активные вещества MYRJ® могут быть смешаны с поверхностно-активными веществами TWEEN® или со смесями поверхностно-активных веществ TWEEN®/SPAN® или ARLACEL® в целях приготовления эмульсий. Поверхностно-активные вещества MYRJ® могут быть получены известными методами, либо они являются коммерчески доступными.
Четвертая группа неионных поверхностно-активных веществ на основе полиоксиэтилeна представляет собой полиоксиэтилeнэфиры жирной кислоты, происходящие от лауриловых, ацетиловых, стеариловых и олеиловых спиртов. Эти вещества получают как описано выше путем добавления этиленоксида к жирному спирту. Эти поверхностно-активные вещества выпускаются промышленностью под торговым знаком BRIJ®. Поверхностно-активные вещества BRIJ® могут быть гидрофильными или липофильными в зависимости от размера полиоксиэтилeновой группы поверхностно-активного вещества. Хотя эти соединения могут быть получены самим специалистом, однако, они могут быть также закуплены в готовом виде у торговых фирм.
В принципе, могут быть использованы и другие неионные поверхностно-активные вещества, например, полиоксиэтилeнэфиры полиола и жирной кислоты, полиоксиэтиленэфир, полиоксипропиленэфиры жирной кислоты, производные пчелинового воска, содержащие полиоксиэтилен; полиоксиэтиленовое производное ланолина, полиоксиэтиленглицериды жирной кислоты, сложные эфиры глицерина и жирной кислоты или другие полиоксиэтиленовые производные кислот, спиртов или простых эфиров, содержащие длинноцепочечные жирные кислоты длиной 12-22 атома углерода.
Поскольку известно, что эмульсии и препараты согласно изобретению представляют собой многофазные системы, то для приготовления эмульсии предпочтительнее выбирать неионное поверхностно-активное вещество, имеющее величину ГЛБ, составляющую в пределах приблизительно от 7 до 16. Эта величина может быть достигнута с использованием одного неионного поверхностно-активного вещества, такого как поверхностно-активное вещество TWEEN®, или с использованием смеси поверхностно-активных веществ, таких как поверхностно-активное вещество на основе сложного эфира моно-, ди- или триэфира сорбитана, полиоксиэтиленэфир сорбитана и жирной кислоты и сложный эфир сорбитана в комбинации с поверхностно-активным веществом на основе полиоксиэтиленланолина; поверхностно-активное вещество на основе сложного эфира сорбитана в комбинации с поверхностно-активным веществом на основе полиоксиэтиленэфира жирной кислоты, имеющим высокую величину ГЛБ, или поверхностно-активное вещество на основе полиэтиленэфира жирной кислоты или поверхностно-активное вещество на основе полиоксиэтилена, сорбитана и жирной кислоты.
В некоторых вариантах изобретения эмульсия содержит одно неионное поверхностно-активное вещество, а более конкретно, поверхностно-активное вещество TWEEN®, которое представляет собой неионное поверхностно-активное вещество, повышающее стабильность эмульсии. В репрезентативном варианте изобретения эмульсия содержит поверхностно-активное вещество TWEEN® 80, также известное как полисорбат 80 или сорбитанмоноолеат на основе полиоксиэтилена 20. В других вариантах изобретения эмульсия содержит два или более неионных поверхностно-активных веществ, а в частности, поверхностно-активное вещество TWEEN® и поверхностно-активное вещество SPAN®. В репрезентативном варианте изобретения эмульсия содержит TWEEN® 80 и SPAN® 85.
Эмульсии типа «масло в воде» могут содержать приблизительно от 0,01% до 2,5% поверхностно-активного вещества (об./об. или масс./об.), приблизительно от 0,01% до 2% поверхностно-активного вещества, от 0,01% до приблизительно 1,5% поверхностно-активного вещества, от 0,01% до приблизительно 1% поверхностно-активного вещества, от 0,01% до приблизительно 0,5% поверхностно-активного вещества, от 0,05% до приблизительно 0,5% поверхностно-активного вещества, от 0,08% до приблизительно 0,5% поверхностно-активного вещества, приблизительно 0,08% поверхностно-активного вещества, приблизительно 0,1% поверхностно-активного вещества, приблизительно 0,2% поверхностно-активного вещества, приблизительно 0,3% поверхностно-активного вещества, приблизительно 0,4% поверхностно-активного вещества, приблизительно 0,5% поверхностно-активного вещества, приблизительно 0,6% поверхностно-активного вещества, приблизительно 0,7% поверхностно-активного вещества, приблизительно 0,8% поверхностно-активного вещества, приблизительно 0,9% поверхностно-активного вещества или приблизительно 1% поверхностно-активного вещества.
Альтернативно или дополнительно, эмульсии типа «масло в воде» могут содержать от 0,05% до приблизительно 1%, от 0,05% до приблизительно 0,9%, от 0,05% до приблизительно 0,8%, от 0,05% до приблизительно 0,7%, от 0,05% до приблизительно 0,6%, от 0,05% до приблизительно 0,5%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9% или приблизительно 1% твина 80 (полисорбата 80; полиоксиэтилeнсорбитанмоноолеата).
В репрезентативном варианте изобретения эмульсия типа «масло в воде» содержит 0,08% твина 80.
Альтернативно или дополнительно, эмульсии типа «масло в воде» могут содержать от 0,05% до приблизительно 1%, от 0,05% до приблизительно 0,9%, от 0,05% до приблизительно 0,8%, от 0,05% до приблизительно 0,7%, от 0,05% до приблизительно 0,6%, от 0,05% до приблизительно 0,5%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9% или приблизительно 1% SPAN85 (сорбитантриолеата).
Альтернативно или дополнительно, эмульсии типа «масло в воде» могут содержать комбинацию описанных здесь поверхностно-активных веществ. Так, например, может быть использована комбинация твина 80 (полисорбата 80; полиоксиэтилeнсорбитанмоноолеата) и SPAN85 (сорбитантриолеата). Эти эмульсии могут содержать различные количества Tween® 80 и SPAN85 (например, описанных выше), включая равные количества этих поверхностно-активных веществ. Так, например, эмульсии типа «масло в воде» могут содержать приблизительно 0,05% Tween® 80 и приблизительно 0,05% SPAN®85, приблизительно 0,1% Tween® 80 и приблизительно 0,1% SPAN®85, приблизительно 0,2% Tween® 80 и приблизительно 0,2% SPAN®85, приблизительно 0,3% Tween® 80 и приблизительно 0,3% SPAN®85, приблизительно 0,4% Tween® 80 и приблизительно 0,4% SPAN®85, приблизительно 0,5% Tween® 80 и приблизительно 0,5% SPAN®85, приблизительно 0,6% Tween® 80 и приблизительно 0,6% SPAN®85, приблизительно 0,7% Tween® 80 и приблизительно 0,7% SPAN®85, приблизительно 0,8% Tween® 80 и приблизительно 0,8% SPAN®85, приблизительно 0,9% Tween® 80 и приблизительно 0,9% SPAN®85, или приблизительно 1% Tween® 80 и приблизительно 1,0% SPAN®85.
Полиэтиленгликоль (ПЭГ)-липиды, такие как ПЭГ, связанный с диалкилoксипропилами (ПЭГ-DAA), ПЭГ, связанный с диацилглицерином (ПЭГ-DAG), ПЭГ связанный с фосфотидилэтаноламином (ФЭ) (ПЭГ-ФЭ) или с некоторыми другими фосфолипидами (ПЭГ-фосфолипиды), ПЭГ, конъюгированный с церамидами (ПЭГ-Cer), или их комбинации, могут быть также использованы в качестве поверхностно-активных веществ (см., например, патент США № 5885613; публикации заявок на патент США №№ 2003/0077829, 2005/0175682 и 2006/0025366). Другими подходящими ПЭГ-липидами являются, например, ПЭГ-диалкилoксипропил (DAA)-липиды или ПЭГ-диацилглицерин (DAG)- липиды. Репрезентативными ПЭГ-DAG-липидами являются, например, ПЭГ-дилауроилглицерин (C12)-липиды, ПЭГ-димиристоилглицерин (C14)-липиды, ПЭГ-дипальмитоилглицерин (C16)-липиды или ПЭГ-дистеароилглицерин (C18)-липиды. Репрезентативными ПЭГ-DAA-липидами являются, например, ПЭГ-дилаурилоксипропил (C12)-липиды, ПЭГ-димиристоилоксипропил (C14)-липиды, ПЭГ-дипальмитоилоксипропил (C16)-липиды или ПЭГ-дистеароилоксипропил (C18)-липиды.
ПЭГ классифицируются по их молекулярным массам, например, ПЭГ 2000 имеет среднюю молекулярную массу приблизительно 2000 дальтон, а ПЭГ 5000 имеет среднюю молекулярную массу приблизительно 5000 дальтон. ПЭГ поставляются торговыми фирмами Sigma Chemical Co., а также другими компаниями, и такими ПЭГ являются, например: монометоксиполиэтиленгликоль (MeПЭГ-OH), монометоксиполиэтиленгликоль-сукцинат (MeПЭГ-S), монометоксиполиэтиленгликоль-сукцинимидилсукцинат (MeПЭГ-S-NHS), монометоксиполиэтиленгликоль-амин (MeПЭГ-NH2), монометоксиполиэтиленгликоль-трезилат (MeПЭГ-TRES) и монометоксиполиэтиленгликоль-имидазолилкарбонил (MeПЭГ-IM). Кроме того, для получения конъюгатов ПЭГ-липид, включая, например, конъюгаты ПЭГ-DAA, особенно подходящей является монометоксиполиэтиленгликоль-уксусная кислота (MeПЭГ-CH2COOH).
Предпочтительно, ПЭГ имеет среднюю молекулярную массу приблизительно от 1000 до 5000 дальтон (например, ПЭГ1000, ПЭГ2000, ПЭГ3000, ПЭГ4000, ПЭГ5000). ПЭГ может быть замещен, но необязательно, алкильной группой, алкоксигруппой, ацильной группой или арильной группой. ПЭГ может быть конъюгирован непосредственно с липидом, либо он может быть связан с липидом посредством линкерной группы. Для связывания ПЭГ с липидом может быть использована любая подходящая линкерная группа, включая, например, линкерные группы, не содержащие сложного эфира, и линкерные группы, содержащие сложный эфир.
В репрезентативных вариантах изобретения ПЭГ2000PE, ПЭГ5000PE, ПЭГ1000DMG, ПЭГ2000DMG, ПЭГ3000DMG или их комбинации могут быть использованы в качестве поверхностно-активного вещества. В некоторых репрезентативных вариантах изобретения эмульсия типа «масло в воде» содержит приблизительно от 1 мг/мл до 80 мг/мл ПЭГ2000PE, ПЭГ5000 PE, ПЭГ1000DMG, ПЭГ2000DMG или ПЭГ3000DMG.
Фосфолипиды
В некоторых вариантах изобретения частицы катионной эмульсии типа «масло в воде» также содержат фосфолипид.
Фосфолипиды представляют собой сложные эфиры жирных кислот, в которых спиртовой компонент молекулы содержит фосфатную группу. Фосфолипидами являются глицерофосфатиды (содержащие глицерин) и сфингомиелины (содержащие сфингозин). Репрезентативными фосфолипидами являются фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и сфингомиелин, и синтетические фосфолипиды, включая димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, дистеароилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, димиристоилфосфатидилсерин, дистеароилфосфатидилсерин и дипальмитоилсерин.
Могут быть использованы нижеследующие репрезентативные фосфолипиды:
|
В некоторых вариантах изобретения может оказаться предпочтительным использование нейтрального липида. Может также оказаться предпочтительным использование фосфолипида, включая цвиттерионный фосфолипид, например, фосфолипид, содержащий один или более алкильных или алкенильных радикалов длиной приблизительно 12-22 атома углерода (например, приблизительно от 12 до приблизительно 14, приблизительно до 16, приблизительно до 18, приблизительно до 20 и приблизительно до 22 атомов углерода), где указанные радикалы могут иметь, например, от 0 до 1, 2 или 3 двойных связей. Может также оказаться предпочтительным использование цвиттерионного фосфолипида.
Предпочтительными фосфолипидами являются, например, 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE), яичный фосфатидилхолин (РС) (яичный PC), пальмитоилолеоил-фосфатидилхолин (POPC), димиристоилфосфатидилхолин (DMPC), диолеоил-фосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), пальмитоиллинолеилфосфатидилхолин (PLPC), DPyPE или их комбинации.
В некоторых вариантах изобретения фосфолипидом является DOPE. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,1 мг/мл до 20 мг/мл DOPE. Так, например, катионная эмульсия типа «масло в воде» может содержать DOPE в количестве приблизительно от 0,5 мг/мл до 10 мг/мл, приблизительно от 0,1 мг/мл до 10 мг/мл или приблизительно от 1,5 мг/мл до 7,5 мг/мл DOPE.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 1,5 мг/мл DOPE.
В некоторых вариантах изобретения фосфолипидом является яичный РС. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,1 мг/мл до 20 мг/мл яичного РС. Так, например, катионная эмульсия типа «масло в воде» может содержать яичный РС в количестве приблизительно от 0,1 мг/мл до 10 мг/мл, приблизительно от 1,0 мг/мл до 10 мг/мл или приблизительно от 1,5 мг/мл до 3,5 мг/мл яичного РС.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 1,55 мг/мл яичного РС.
В некоторых вариантах изобретения фосфолипидом является DPyPE. Катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,1 мг/мл до 20 мг/мл DPyPE. Так, например, катионная эмульсия типа «масло в воде» может содержать DPyPE в количестве приблизительно от 0,1 мг/мл до 10 мг/мл, приблизительно от 1,5 мг/мл до 10 мг/мл или приблизительно от 1,5 мг/мл до 5 мг/мл DPyPE.
В репрезентативном варианте изобретения катионная эмульсия типа «масло в воде» содержит приблизительно 1,6 мг/мл DPyPE.
В некоторых вариантах изобретения эмульсионные частицы могут содержать комбинацию описанных здесь поверхностно-активных веществ и фосфолипидов.
D. Водная фаза (Непрерывная фаза)
Водная фаза (непрерывная фаза) эмульсий типа «масло в воде» представляет собой забуференный солевой раствор (например, физиологический раствор) или воду. Забуференный солевой раствор представляет собой водный раствор, который содержит соль (например, NaCl), буфер (например, цитратный буфер) и может также содержать агент, корректирующий осмомоляльность (например, сахарид), полимер, поверхностно-активное вещество или их комбинации. Водная фаза может содержать антиоксидант, такой как цитрат, аскорбат или его соли. Если эмульсии приготавливают для парентерального введения, то предпочтительно, получить конечные забуференные растворы, имеющие тоничность, то есть, осмомоляльность, в основном, аналогичную тоничности нормальных физиологических жидкостей в целях предупреждения нежелательных эффектов после введения, таких как набухание или быстрая абсорбция композиции. Для поддержания рН, совместимого с нормальными физиологическими условиями, также предпочтительно, чтобы водная фаза была забуферена. Кроме того, в некоторых случаях может оказаться желательным поддержание рН на определенном уровне для гарантии стабильности некоторых компонентов эмульсии.
Так, например, может оказаться желательным получить эмульсию, которая является изотоничной (то есть, имеет такую же концентрацию проникающего через мембрану растворенного вещества (например, соли), как и нормальные клетки организма и клетки крови) и изоосмотичной. Для регуляции тоничности, в эмульсию может быть включена физиологическая соль, например, натриевая соль. Хлорид натрия (NaCl), например, может быть использован в концентрации приблизительно 0,9% (масс./об.) (физиологический раствор). Другими солями, которые могут присутствовать, являются хлорид калия, дигидрофосфат калия, бифосфат натрия, хлорид магния, хлорид кальция и т.п. Для регуляции тоничности могут быть также использованы неионные агенты, придающие тоничность. Неионные агенты, придающие тоничность, хорошо известны специалистам. Такими агентами обычно являются углеводы различных классов (см., например, Voet & Voet (1990) Biochemistry (John Wiley & Sons, New York). В настоящем изобретении, в качестве неионных агентов, придающих тоничность, могут быть использованы моносахариды, принадлежащие к классу альдоз, таких как глюкоза, манноза, арабиноза и рибоза, а также к классу кетоз, таких как фруктоза, сорбоза и ксилулоза. Могут быть также использованы дисахариды, такие как сахароза, мальтоза, трегалоза и лактоза. В настоящем изобретении, в качестве неионных агентов, придающих тоничность, могут быть также использованы альдиты (ациклические полигидроксиспирты, также называемые спиртами ряда сахаров), такие как глицерин, маннит, ксилит и сорбит. Неионные агенты, придающие тоничность, могут присутствовать в концентрации приблизительно от 0,1% до 10% или приблизительно от 1% до 10%, в зависимости от типа используемого агента.
Водная фаза может быть забуференной. В данном случае может быть использован любой физиологически приемлемый буфер, такой как вода, цитратные буферы, фосфатные буферы, ацетатные буферы, трис-буферы, бикарбонатные буферы, карбонатные буферы, сукцинатный буфер или т.п. pH водного компонента, предпочтительно, составляет 6,0-8,0, а более предпочтительно, приблизительно 6,2-6,8. В репрезентативном варианте изобретения буфером является 10 мМ цитратный буфер с pH 6,5. В другом репрезентативном варианте изобретения водной фазой является вода, не содержащая РНКазу, или DEPC-обработанная вода или буфер, полученный с использованием такой воды. В некоторых случаях, высокая концентрация соли в буфере может препятствовать образованию комплекса молекулы нуклеиновой кислоты с эмульсионной частицей, и это следует учесть во избежание такого эффекта. В некоторых случаях, в буфер все же может быть включено определенное количество соли.
В репрезентативном варианте изобретения буфером является 10 мМ цитратный буфер с pH 6,5. В другом репрезентативном варианте изобретения водной фазой является вода, не содержащая РНКазу, или DEPC-обработанная вода, или буфер, полученный с использованием такой воды.
Водная фаза может также содержать дополнительные компоненты, такие как молекулы, которые способствуют изменению осмомолярности водной фазы, или молекулы, стабилизирующие молекулу нуклеиновой кислоты после образования комплекса. Предпочтительно, осмомолярность водной фазы корректируют с использованием неионного агента, придающего тоничность, такого как сахар (например, трегалоза, сахароза, декстроза, фруктоза, восстановленная палатиноза и т.п.), спирт ряда сахаров (такой как маннит, сорбит, ксилит, эритрит, лактит, мальтит, глицерин и т.п.) или их комбинации. При желании могут быть использованы неионный полимер (например, полиалкилгликоль, такой как полиэтиленгликоль, полипропиленгликоль или полибутиленгликоль) или неионное поверхностно-активное вещество.
В некоторых случаях, при приготовлении эмульсии на начальной стадии, в качестве водной фазы эмульсии предпочтительнее использовать воду высокой степени очистки. Так, например, чем выше концентрация соли или сахара, тем труднее получить частицы нужного размера (например, частицы размером приблизительно менее, чем 200 нм).
В некоторых вариантах изобретения водная фаза катионной эмульсии типа «масло в воде» может также содержать полимер или поверхностно-активное вещество или их комбинацию. В репрезентативном варианте изобретения эмульсия типа «масло в воде» содержит полоксамер. Полоксамеры представляют собой неионные триблоксополимеры, имеющие центральную гидрофобную цепь полиоксипропилена (полипропиленоксида), фланкированную двумя гидрофильными цепями полиоксиэтилена (полиэтиленоксида). Полоксамеры также известны как полимеры, выпускаемые промышленностью под торговым знаком Pluronic®. Полоксамерные полимеры могут повышать стабильность и резистентность молекулы РНК к РНКазе после образования комплекса с РНК.
Альтернативно или дополнительно, катионная эмульсия типа «масло в воде» может содержать приблизительно от 0,1% до 20% (масс./об.) полимера, или приблизительно от 0,05% до 10% (масс./об.) полимера. Так, например, катионная эмульсия типа «масло в воде» может содержать полимер (например, полоксамер, такой как Pluronic® F127) в количестве приблизительно от 0,1% до 20% (масс./об.), приблизительно от 0,1% до 10% (масс./об.), приблизительно от 0,05% до 10% (масс./об.) или приблизительно от 0,05% до 5% (масс./об.).
В репрезентативном варианте изобретения эмульсия типа «масло в воде» содержит приблизительно 4% (масс./об.) или приблизительно 8% (масс./об.) плюроника (Pluronic® F127).
Количество водного компонента, используемого в этих композициях, представляет собой количество, необходимое для доведения ГЛБ композиции до нужной величины. То есть, водный компонент в количестве, достаточном для доведения до 100%, смешивают с другими вышеперечисленными компонентами для доведения композиции до нужного объема.
4. Молекулы нуклеиновой кислоты
Не ограничиваясь какой-либо конкретной теорией, авторы изобретения лишь отмечают, что молекулы нуклеиновой кислоты, очевидно, взаимодействуют с катионным липидом посредством нековалентных ионных зарядных взаимодействий (электростатических сил), а ионная сила комплекса и количество молекулы нуклеиновой кислоты, которая может образовывать комплекс с частицей, соответствуют ионной силе и количеству катионного липида в частице. Кроме того, определенную роль могут также играть гидрофобные/гидрофильные взаимодействия между молекулой нуклеиновой кислоты и поверхностью частиц.
Молекулами нуклеиновой кислоты, которые могут образовывать комплексы с эмульсионными частицами, являются одноцепочечные или двухцепочечные РНК или ДНК. В предпочтительных аспектах изобретения молекулой нуклеиновой кислоты является молекула РНК, например, РНК, которая кодирует пептид, полипептид или белок, включая аутореплицирующиеся молекулы РНК, или короткая интерферирующая РНК.
Комплекс может быть получен известными методами, примеры которых описаны в настоящей заявке. Так, например, комплекс «нуклеиновая кислота - частица» может быть получен путем смешивания катионной эмульсии с молекулой нуклеиновой кислоты, например, путем вихревого перемешивания. Количество молекулы нуклеиновой кислоты и катионного липида в эмульсиях может быть скорректировано или оптимизировано для сообщения нужной ионной силы и способности к связыванию.
Так, например, как описано и проиллюстрировано в настоящей заявке, репрезентативные комплексы «РНК-частица» были получены путем изменения отношений РНК:катионный липид (определенных здесь как отношение «N/P»). Термин «отношение N/P» означает количество (в молях) протонируемых атомов азота в катионном липиде, деленное на количество (в молях) фосфатов в РНК. Отношение N/P составляет по меньшей мере, например, от 4:1 до 20:1 или от 4:1 до 15:1.
В некоторых вариантах изобретения отношение N/P составляет от 1,1:1 до 20:1; от 1,1:1 до 15:1; от 1,5:1 до 20:1; от 1,5:1 до 15:1; от 2:1 до 20:1; от 2:1 до 15:1; от 2,5:1 до 20:1; от 2,5:1 до 15:1; от 3:1 до 20:1; от 3:1 до 15:1; от 3,5:1 до 20:1 или от 3,5:1 до 15:1.
Описанные здесь катионные эмульсии типа «масло в воде» являются особенно подходящими для приготовления вакцин на основе нуклеиновой кислоты (например, ДНК-вакцин, РНК-вакцин). Образование комплекса «нуклеиновая кислота - эмульсионная частица» облегчает проникновение нуклеиновой кислоты в клетки-хозяева и защищает молекулу нуклеиновой кислоты от разложения нуклеазой. Трансфицированные клетки могут затем экспрессировать антиген, кодируемый молекулой нуклеиновой кислоты, что может приводить к вырабатыванию иммунного ответа на антиген. Подобно «живым» или аттенуированным вирусам, вакцины на основе нуклеиновой кислоты могут эффективно вступать в реакции путей MHC-I и MHC-II, что будет приводить к индуцированию CD8+- и CD4+-T-клеточных ответов, тогда как антиген, присутствующий в растворимой форме, такой как рекомбинантный белок, индуцирует, в основном, только гуморальные ответы.
Последовательность молекулы нуклеиновой кислоты (например, молекулы РНК) может быть оптимизирована по кодонам или деоптимизирована по кодонам для экспрессии в нужном хозяине, таком как человеческая клетка.
В некоторых вариантах изобретения молекулой нуклеиновой кислоты является молекула РНК. В некоторых вариантах изобретения молекула РНК кодирует антиген (пептид, полипептид или белок), и катионная эмульсия типа «масло в воде» является подходящей для ее использования в качестве РНК-вакцины. Такая композиция может содержать более, чем одну молекулу РНК, кодирующую антиген, например, две, три, четыре, пять или десять молекул РНК, которые могут образовывать комплекс с эмульсионными частицами. То есть, такая композиция может содержать одну или более молекул РНК различных видов, которые кодируют разные антигены. Альтернативно или дополнительно, одна молекула РНК может также кодировать более, чем один антиген, например, бицистронная или трицистронная молекула РНК может кодировать различные или идентичные антигены. В соответствии с этим, катионная эмульсия типа «масло в воде» может быть использована в качестве РНК-вакцины, которая является одновалентной или поливалентной.
Последовательность молекулы РНК может быть, при желании, модифицирована, например, в целях повышения эффективности экспрессии или репликации РНК или для сообщения дополнительной стабильности или резистентности к разложению. Так, например, последовательность РНК может быть модифицирована по встречаемости кодонов, например, в целях повышения эффективности трансляции и увеличения времени полужизни РНК. Поли A-хвост (например, приблизительно из 30 аденозиновых остатков или более (SEQ ID NO: 3)) может быть присоединен к 3'-концу РНК для увеличения ее времени полужизни. 5'-конец РНК может быть кэпирован модифицированным рибонуклеотидом, имеющим структуру m7G(5')ppp(5')N (структура кэп 0), или его производным, которые могут быть введены во время синтеза РНК, либо они могут быть ферментативно встроены после транскрипции РНК (например, с использованием кэпирующего фермента вируса коровьей оспы (VCE), состоящего из мРНК-трифосфатазы, гуанилил-трансферазы и гуанин-7-метилтрансферазы, которые катализируют образование N7-монометилированной структуры кэп 0). Структура кэп 0 играет важную роль в поддержании стабильности и эффективности трансляции молекулы РНК. 5'-кэп молекулы РНК может быть дополнительно модифицирован 2'-O-метилтрансферазой, что будет приводить к образованию структуры кэп 1 (m7Gppp[m2'-Ο]N), которая может также способствовать повышению эффективности трансляции.
При желании, молекула РНК может содержать, помимо любой 5'-кэп-структуры, один или более модифицированных нуклеотидов. На РНК млекопитающих присутствуют более, чем 96 природных нуклеозидных модификаций. См., например, Limbach et al, Nucleic Acids Research, 22(12):2183-2196 (1994). Методы получения нуклеотидов и модифицированных нуклеотидов и нуклеозидов хорошо известны специалистам, и описание этих методов можно найти в патентах США №№ 4373071, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530, 5700642, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки, причем, многие модифицированные нуклеозиды и модифицированные нуклеотиды являются коммерчески доступными.
Модифицированными нуклеотидными основаниями, которые могут быть включены в модифицированные нуклеозиды и нуклеотиды, и могут присутствовать в молекулах РНК, являются: m5C (5-метилцитидин), m5U (5-метилуридин), m6A (N6-метиладенозин), s2U (2-тиоуридин), Um (2'-О-метилуридин), m1A (1-метиладенозин); m2A (2-метиладенозин); Am (2-1-О-метиладенозин); ms2m6A (2-метилтио-N6-метиладенозин); i6A (N6-изопентениладенозин); ms2i6A (2-метилтио-N6-изопентениладенозин); io6A (N6-(цис-гидроксиизопентенил)аденозин); ms2io6A (2-метилтио-N6-(цис-гидроксиизопентенил)аденозин); g6A (N6-глицинилкарбамоиладенозин); t6A (N6-треонилкарбамоиладенозин); ms2t6A (2-метилтио-N6-треонилкарбамоиладенозин); m6t6A (N6-метил-N6-треонилкарбамоиладенозин); hn6A(N6-гидроксинорвалилкарбамоиладенозин); ms2hn6A (2-метилтио-N6-гидроксинорвалилкарбамоиладенозин); Ar(p) (2'-О-рибозиладенозин(фосфат)); I (инозин); m1I (1-метилинозин); m'1m (l,2'-О-диметилинозин); m3C (3-метилцитидин); Cm (2T-О-метилцитидин); s2C (2-тиоцитидин); ac4C (N4-ацетилцитидин); f5C (5-формилцитидин); m5Cm (5,2-O-диметилцитидин); ac4Cm (N4-ацетил-2T-O-метилцитидин); k2C (лизидин); m1G (1-метилгуанозин); m2G (N2-метилгуанозин); m7G (7-метилгуанозин); Gm (2'-О-метилгуанозин); m22G (N2,N2-диметилгуанозин); m2Gm (N2,2'-О-диметилгуанозин); m22Gm (N2,N2,2'-О-триметилгуанозин); Gr(p) (2'-О-рибозилгуанозин(фосфат)); yW (вибутозин); o2yW (пероксивибутозин); OHyW (гидроксивибутозин); OHyW* (немодифицированный гидроксивибутозин); imG (виозин); mimG (метилгуанозин); Q (квеозин); oQ (эпоксиквеозин); galQ (галактозилквеозин); manQ (маннозилквеозин); preQo (7-циано-7-деазагуанозин); preQi (7-аминометил-7-деазагуанозин); G* (археозин); D (дигидроуридин); m5Um (5,2'-О-диметилуридин); s4U (4-тиоуридин); m5s2U (5-метил-2-тиоуридин); s2Um (2-тио-2'-О-метилуридин); acp3U (3-(3-амино-3-карбоксипропил)уридин); ho5U (5-гидроксиуридин); mo5U (5-метоксиуридин); cmo5U (уридин-5-оксиуксусная кислота); mcmo5U (метиловый эфир уридин-5-оксиуксусной кислоты); chm5U (5-(карбоксигидроксиметил)уридин)); mchm5U (метиловый эфир 5-(карбоксигидроксиметил)уридина); mcm5U (5-метоксикарбонилметилуридин); mcm5Um (S-метоксикарбонилметил-2-O-метилуридин); mcm5s2U (5-метоксикарбонилметил-2-тиоуридин); nm5s2U (5-аминометил-2-тиоуридин); mnm5U (5-метиламинометилуридин); mnm5s2U (5-метиламинометил-2-тиоуридин); mnm5se2U (5-метиламинометил-2-селеноуридин); ncm5U (5-карбамоилметилуридин); ncm5Um (5-карбамоилметил-2'-О-метилуридин); cmnm5U (5-карбоксиметиламинометилуридин); cnmm5Um (5-карбоксиметиламинометил-2-L-O-метилуридин); cmnm5s2U (5-карбоксиметиламинометил-2-тиоуридин); m62A (N6,N6-диметиладенозин); Tm (2'-О-метилинозин); m4C (N4-метилцитидин); m4Cm (N4,2-О-диметилцитидин); hm5C (5-гидроксиметилцитидин); m3U (3-метилуридин); cm5U (5-карбоксиметилуридин); m6Am (N6,T-О-диметилaденозин); rn62Am (N6,N6,О-2-триметиладенозин); m2'7G (N2,7-диметилгуанозин); m2'2'7G (N2,N2,7-триметилгуанозин); m3Um (3,2T-О-диметилуридин); m5D (5-метилдигидроуридин); f5Cm (5-формил-2'-О-метилцитидин); m1Gm (l,2'-О-диметилгуанозин); m'Am (1,2-O-диметиладенозин)иринометилуридин); tm5s2U (S-тауринометил-2-тиоуридин)); imG-14 (4-деметилгуанозин); imG2 (изогуанозин); ac6A (N6-ацетиладенозин), гипоксантин, инозин, 8-оксоаденин, его 7-замещенные производные, дигидроурацил, псевдоурацил, 2-тиоурацил, 4-тиоурацил, 5-аминоурацил, 5-(C1-C6)-алкилурацил, 5-метилурацил, 5-(C2-C6)-алкенилурацил, 5-(C2-C6)-алкинилурацил, 5-(гидроксиметил)урацил, 5-хлорурацил, 5-фторурацил, 5-бромурацил, 5-гидроксицитозин, 5-(C1-C6)-алкилцитозин, 5-метилцитозин, 5-(C2-C6)-алкенилцитозин, 5-(C2-C6)-алкинилцитозин, 5-хлорцитозин, 5-фторцитозин, 5-бромцитозин, N2-диметилгуанин, 7-деазагуанин, 8-азагуанин, 7-деаза-7-замещенный гуанин, 7-деаза-7-(C2-C6)алкинилгуанин, 7-деаза-8-замещенный гуанин, 8-гидроксигуанин, 6-тиогуанин, 8-оксогуанин, 2-аминопурин, 2-амино-6-хлорпурин, 2,4-диаминопурин, 2,6-диаминопурин, 8-азапурин, замещенный 7-деазапурин, 7-деаза-7-замещенный пурин, 7-деаза-8-замещенный пурин, водород (неосновный остаток), m5C, m5U, m6A, s2U, W или 2'-О-метил-U. Многие из этих модифицированных нуклеотидных оснований и их соответствующих рибонуклеозидов могут быть закуплены у соответствующих компаний. См., например, заявку WO 2011/005799, которая вводится в настоящее описание посредством ссылки.
В идеальном случае, РНК, используемая в настоящем изобретении, имеет только фосфодиэфирные связи между нуклеозидами, но в некоторых вариантах изобретения она может содержать фосфорамидатные, фосфортиоатные и/или метилфосфонатные связи.
В некоторых вариантах изобретения молекула РНК не содержит модифицированных нуклеотидов, например, она не содержит модифицированных нуклеотидных оснований, и все нуклеотиды в такой РНК являются обычными стандартными рибонуклеотидами A, U, G и C, за исключением необязательного 5'-кэпа, который может включать, например, 7-метилгуанозин. В других вариантах изобретения РНК может включать 5'-кэп, содержащий 7'-метилгуанозин, а первые 1, 2 или 3 5'-рибонуклеотида могут быть метилированы в 2'-положении рибозы.
A. Аутореплицирующаяся РНК
В некоторых аспектах изобретения катионная эмульсия типа «масло в воде» содержит аутореплицирующуюся молекулу РНК. В некоторых вариантах изобретения аутореплицирующаяся молекула РНК происходит от альфавируса, либо она была получена на основе альфавируса.
Аутореплицирующиеся молекулы РНК хорошо известны специалистам и могут быть продуцированы с использованием элементов репликации, происходящих, например, от альфавирусов, и путем замены структурных вирусных белков нуклеотидной последовательностью, кодирующей представляющий интерес белок. Аутореплицирующаяся молекула РНК обычно представляет собой молекулу с (+)-цепью, которая может непосредственно транслироваться после ее доставки в клетку, и в результате такой трансляции образуется РНК-зависимая РНК-полимераза, которая затем продуцирует антисмысловые и смысловые транскрипты из введенной РНК. Таким образом, введенная РНК продуцирует множество дочерних РНК. Эти дочерние РНК, а также коллинеарные субгеномные транскрипты могут затем транслироваться с последующей экспрессией in situ кодируемого антигена, либо они могут транскрибироваться с образованием дополнительных транскриптов, имеющих такую же смысловую последовательность, как и введенная РНК, которая транслировалась с последующей экспрессией антигена in situ. Результатом таких транскрипций последовательностей является очень высокий уровень амплификации ряда введенных РНК-репликонов, а поэтому кодированный антиген становится главным полипептидным продуктом клеток. Клетки, трансфицированные аутореплицирующейся РНК, быстро начинают продуцировать антиген, а затем подвергаются апоптотической гибели. Такая гибель клеток, вероятно, является результатом потребности в образовании двухцепочечных (дц) РНК-интермедиатов, которые также, как было показано, способствуют сверхактивации дендритных клеток. Таким образом, повышенная иммуногенность аутореплицирующейся РНК может быть результатом продуцирования провоспалительной дцРНК, которая имитирует инфицирование клеток-хозяев РНК-вирусом.
Клеточный механизм преимущественно используется аутореплицирующимися молекулами РНК для экспоненциального увеличения выхода кодируемых генных продуктов, таких как белки или антигены. которые могут накапливаться в клетках или секретироваться из клеток. Сверхэкспрессия белков под действием аутореплицирующихся молекул РНК имеет иммуностимулирующее адъювантное действие, включая стимуляцию путей ловушко-подобных рецепторов (TLR) 3, 7 и 8 и не-TLR путей (например, RIG-1, MD-5) продуктами репликации и амплификации РНК, и трансляцию, которая индуцирует апоптоз трансфицированных клеток.
Аутореплицирующаяся РНК обычно содержит по меньшей мере один или более генов, выбранных их группы, состоящей из генов вирусных репликаз, вирусных протеаз, вирусных геликаз и других неструктурных вирусных белков, а также включает 5'- и 3'-концевые цис-действующие последовательности репликации, и, если это необходимо, гетерологичные последовательности, кодирующие нужные аминокислотные последовательности (например, представляющий интерес антиген). В аутореплицирующуюся РНК может быть включен субгеномный промотор, который регулирует экспрессию гетерологичной последовательности. При желании, гетерологичная последовательность (например, представляющий интерес антиген) может быть присоединена с сохранением рамки считывания к другим кодирующим областям в аутореплицирующейся РНК, и/или она может находиться под контролем внутреннего сайта связывания с рибосомой (IRES).
В некоторых вариантах изобретения аутореплицирующаяся молекула РНК не инкапсулируется в вирусоподобную частицу. Аутореплицирующиеся молекулы РНК согласно изобретению могут быть сконструированы так, чтобы такая аутореплицирующаяся молекула РНК не могла индуцировать продуцирование инфекционных вирусных частиц. Это может быть достигнуто, например, путем удаления одного или более вирусных генов, кодирующих структурные белки, которые являются необходимыми для продуцирования вирусных частиц в аутореплицирующейся РНК. Так, например, если аутореплицирующаяся молекула РНК была получена на основе альфавируса, такого как вирус Синдбис (SIN), вирус лесов Семлики и вирус венесуэльского лошадиного энцефалита (VEE), то один или более генов, кодирующих вирусные структурные белки, такие как капсидные и/или оболочечные гликопротеины, могут быть удалены.
При необходимости, аутореплицирующиеся молекулы РНК согласно изобретению могут быть также сконструированы для индуцирования продуцирования инфекционных вирусных частиц, которые являются аттенуированными или вирулентными, или для индуцирования продуцирования вирусных частиц, способных к одному раунду последующего инфицирования.
Одной из подходящих систем для достижения такой ауторепликации является система, в которой используется репликон на основе альфавируса. Альфавирусы представляют собой серию генетически, структурно и серологически родственных вирусов членистоногих, принадлежащих к семейству тогавирусов. К роду альфавирусов относятся двадцать шесть известных вирусов и их подтипов, включая вирус Синдбис, вирус лесов Семлики, вирус реки Росс и вирус венесуэльского лошадиного энцефалита. Сама аутореплицирующаяся РНК согласно изобретению может включать РНК-репликазу, происходящую от вируса лесов Семлики (SFV), вируса Синдбис (SIN), вируса венесуэльского лошадиного энцефалита (VEE), вируса реки Росс (RRV), вируса восточного лошадиного энцефалита или других вирусов, принадлежащих к семейству альфавирусов.
В настоящем изобретении может быть использован экспрессионный вектор-«репликон» на основе альфавируса. Векторы-репликоны могут быть использованы в нескольких форматах, включая ДНК, РНК и рекомбинантные репликоновые частицы. Такие векторы-репликоны происходят от альфавирусов, которыми являются, например, вирус Синдбис (SIN) (Xiong et al. (1989) Science 243: 1188-1191; Dubensky et al, (1996) J. Virol. 70:508-519; Hariharan et al. (1998) J. Virol. 72:950-958; Polo et al. (1999) PNAS 96:4598-4603), вирус лесов Семлики (Liljestrom (1991) Bio/Technology 9: 1356-1361; Berglund et al. (1998) Nat. Biotech. 16:562-565) и вирус венесуэльского лошадиного энцефалита (VEE) (Pushko et al. (1997) Virology 239:389-401). Репликоны на основе альфавирусов обычно имеют почти одинаковые общие свойства (например, структуру, репликацию), причем, отдельный альфавирус может иметь определенное конкретное свойство (например, он может обладать способностью связываться с рецептором, может быть чувствительным к интерферонам и может ассоциироваться с характерным признаком заболевания), которое является уникальным. Поэтому, могут быть также использованы химерные альфавирусные репликоны, полученные от вирусов различных семейств.
РНК-репликоны на основе альфавирусов обычно представляют собой (+)-цепь РНК, которая индуцирует трансляцию репликазы (или репликазы-транскриптазы) после ее доставки в клетку. Репликаза транслируется как полипротеин, который подвергается ауторасщеплению с образованием репликативного комплекса, создающего геномные копии (-)-цепи встроенной (+)-цепи введенной РНК. Эти транскрипты с (-)-цепью сами могут транскрибироваться с образованием дополнительных копий родительской (+)-цепи РНК, а также с образованием субгеномного транскрипта, кодирующего антиген. Трансляция субгеномного транскрипта приводит к экспрессии in situ антигена инфицированными клетками. Подходящие альфавирусные репликоны могут использовать репликазу, происходящую от вируса Синдбис, вируса лесов Семлики, вируса восточного лошадиного энцефалита, вируса венесуэльского лошадиного энцефалита и т.п.
РНК-репликон, предпочтительно, содержит РНК-геном пикорнавируса, тогавируса, флавивируса, коронавируса, парамиксовируса, вируса желтой лихорадки или альфавируса (например, вируса Синдбис, вируса лесов Семлики, вируса венесуэльского лошадиного энцефалита или вируса реки Росс), где указанный РНК-геном был модифицирован путем замены одного или более генов структурных белков выбранной гетерологичной последовательностью нуклеиновой кислоты, кодирующей представляющий интерес продукт.
Предпочтительный репликон кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК из репликона, и (ii) антиген. Полимеразой может быть альфавирусная репликаза, содержащая, например, один или более альфавирусных белков, таких как nsP1, nsP2, nsP3 и nsP4. Поскольку природные альфавирусные геномы кодируют, помимо неструктурного репликазного полипротеина, структурные вирионные белки, то предпочтительно, чтобы репликон не кодировал альфавирусные структурные белки. Таким образом, предпочтительный репликон может стимулировать продуцирование собственных геномных РНК-копий в клетке, но не продуцирование РНК-содержащих вирионов. Неспособность продуцировать эти вирионы означает, что, в отличие от альфавируса дикого типа, предпочтительный репликон не может постоянно присутствовать в инфекционной форме. В предпочтительном репликоне, альфавирусные структурные белки, необходимые для сохранения вирусов дикого типа, отсутствуют, а вместо них присутствует(ют) ген(ы), кодирующий(е) представляющий интерес антиген, в результате чего субгеномный транскрипт кодирует антиген, а не структурные вирионные белки альфавируса.
Репликон, используемый в настоящем изобретении, может иметь две открытых рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу, а вторая (3') открытая рамка считывания кодирует антиген. В некоторых вариантах изобретения РНК может иметь дополнительные (например, нижерасположенные) открытые рамки считывания, кодирующие, например, дополнительные антигены или вспомогательные полипептиды.
Предпочтительный репликон имеет 5'-кэп (например, 7-метилгуанозин), который, в большинстве случаев, может повышать уровень трансляции РНК in vivo. В некоторых вариантах изобретения 5'-последовательность репликона может оказаться необходимой для гарантии совместимости с кодируемой репликазой.
Репликон может иметь 3'-поли-A хвост. Он может также включать последовательность распознвания поли-A-полимеразы (например, AAUAAA), расположенную поблизости от 3'-конца.
Репликоны могут иметь различную длину, но обычно, их длина составляет 5000-25000 нуклеотидов, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов.
Репликон может быть легко получен посредством транскрипции in vitro (IVT). При in vitro транскрипции (IVT) может использоваться матрица (кДНК), полученная и амплифицированная в бактериях в плазмидной форме, или созданная путем синтеза (например, генного синтеза и/или полимерахной цепной реакции (ПЦР) с применением методов генной инженерии). Так, например, ДНК-зависимая РНК-полимераза (такая как РНК-полимеразы бактериофага T7, T3 или SP6) может быть использована для транскрибирования репликона из ДНК-матрицы. При необходимости могут быть проведены соответствующие реакции кэпирования и присоединения поли-А-последовательности (хотя поли-А-последовательность репликона обычно кодируется ДНК-матрицей). Эти РНК-полимеразы крайне необходимы для транскрипции 5'-нуклеотида(ов), а в некоторых случаях, они должны присутствовать вместе с кодируемой репликазой для гарантии эффективного функционирования IVT-транскрибируемой РНК в качестве субстрата для аутокодируемой репликазы. Конкретными примерами являются плазмиды на основе вируса Синдбис (pSIN), такие как pSINCP, описанные, например, в патентах США №№ 5814482 и 6015686, а также в публикациях международных заявок №№ WO 97/38087, WO 99/18226 и WO 02/26209. Конструирование таких репликонов в общих чертах описано в патентах США №№ 5814482 и 6015686.
В других аспектах, аутореплицирующаяся молекула РНК происходит от вируса или сконструирована на основе вируса, не являющегося альфавирусом, предпочтительно, на основе РНК-вируса с (+)-цепью, а более предпочтительно, пикорнавируса, флавивируса, рубивируса, пестивируса, гепацивируса, калицивируса или коронавируса. Подходящие последовательности альфавируса дикого типа хорошо известны специалистам и могут быть взяты из депозитариев, таких как Американская коллекция типовых культур, Rockville, Md. Репрезентативными примерами подходящих альфавирусов являются вирус Аура (ATCC VR-368), вирус Бебару (ATCC VR-600, ATCC VR-1240), вирус Кабассу (ATCC VR-922), вирус Чикунгунья (ATCC VR-64, ATCC VR-1241), вирус восточного лошадиного энцефаломиелита (ATCC VR-65, ATCC VR-1242), вирус Форт Морган (ATCC VR-924), вирус Гета (ATCC VR-369, ATCC VR-1243), вирус Кизильгаши (ATCC VR-927), вирус Майяро (ATCC VR-66), вирус Майяро (ATCC VR-1277), вирус Миддельбург (ATCC VR-370), вирус Мукамбо (ATCC VR-580, ATCC VR-1244), вирус Ндуму (ATCC VR-371), вирус Пиксуна (ATCC VR-372, ATCC VR-1245), вирус реки Росс (ATCC VR-373, ATCC VR-1246), вирус лесов Семлики (ATCC VR-67, ATCC VR-1247), вирус Синдбис (ATCC VR-68, ATCC VR-1248), вирус Тонате (ATCC VR-925), вирус Тринити (ATCC VR-469), вирус Уна (ATCC VR-374), вирус венесуэльского лошадиного энцефаломиелита (ATCC VR-69, ATCC VR-923, ATCC VR-1250 ATCC VR-1249, ATCC VR-532), вирус восточного лошадиного энцефаломиелита (ATCC VR-70, ATCC VR-1251, ATCC VR-622, ATCC VR-1252), вирус Ватароа (ATCC VR-926) и вирус Y-62-33 (ATCC VR-375).
Аутореплицирующиеся молекулы РНК согласно изобретению являются более крупными, чем РНК других типов (например, мРНК), которые были получены с использованием модифицированных нуклеотидов. Обычно, аутореплицирующиеся молекулы РНК согласно изобретению имеют размер по меньшей мере приблизительно 4 т.п.н. Так, например, аутореплицирующаяся молекула РНК может иметь размер по меньшей мере приблизительно 5 т.п.н., по меньшей мере приблизительно 6 т.п.н., по меньшей мере приблизительно 7 т.п.н., по меньшей мере приблизительно 8 т.п.н., по меньшей мере приблизительно 9 т.п.н., по меньшей мере приблизительно 10 т.п.н., по меньшей мере приблизительно 11 т.п.н., по меньшей мере приблизительно 12 т.п.н. или более, чем 12 т.п.н. В некоторых примерах, аутореплицирующаяся РНК имеет размер приблизительно 4 т.п.н. - 12 т.п.н., приблизительно 5 т.п.н. - 12 т.п.н., приблизительно 6 т.п.н. - 12 т.п.н., приблизительно 7 т.п.н. - 12 т.п.н., приблизительно 8 т.п.н. - 12 т.п.н., приблизительно 9 т.п.н. - 12 т.п.н., приблизительно 10 т.п.н. - 12 т.п.н., приблизительно 11 т.п.н. - 12 т.п.н., приблизительно 5 т.п.н. - 11 т.п.н., приблизительно 5 т.п.н. - 10 т.п.н., приблизительно 5 т.п.н. - 9 т.п.н., приблизительно 5 т.п.н. - 8 т.п.н., приблизительно 5 т.п.н. - 7 т.п.н., приблизительно 5 т.п.н. - 6 т.п.н., приблизительно 6 т.п.н. - 12 т.п.н., приблизительно 6 т.п.н. - 11 т.п.н., приблизительно 6 т.п.н. - 10 т.п.н., приблизительно 6 т.п.н. - 9 т.п.н., приблизительно 6 т.п.н. - 8 т.п.н., приблизительно 6 т.п.н. - 7 т.п.н., приблизительно 7 т.п.н. - 11 т.п.н., приблизительно 7 т.п.н. - 10 т.п.н., приблизительно 7 т.п.н. - 9 т.п.н., приблизительно 7 т.п.н. - 8 т.п.н., приблизительно 8 т.п.н. - 11 т.п.н., приблизительно 8 т.п.н. - 10 т.п.н., приблизительно 8 т.п.н. - 9 т.п.н., приблизительно 9 т.п.н. - 11 т.п.н., приблизительно 9 т.п.н. - 10 т.п.н. или приблизительно 10 т.п.н. - 11 т.п.н.
Аутореплицирующиеся молекулы РНК согласно изобретению могут содержать модифицированные нуклеотиды одного или нескольких типов (например, псевдоуридин, N6-метилaденозин, 5-метилцитидин, 5-метилуридин).
Аутореплицирующаяся молекула РНК может кодировать один гетерологичный полипептидный антиген или, необязательно, два или более гетерологичных полипептидных антигенов, связанных друг с другом так, что каждая из этих последовательностей (например, последовательно присоединных друг к другу) сохраняла свою идентичность, если она экспрессируется в виде аминокислотной последовательности. Гетерологичные полипептиды, происходящие от аутореплицирующейся РНК, могут быть затем продуцированы в виде гибридного полипептида или сконструированы так, чтобы они образовывали отдельные полипептидные или пептидные последовтельности.
Аутореплицирующаяся РНК согласно изобретению может кодировать один или более полипептидных антигенов, которые содержат ряд эпитопов. Предпочтительно, чтобы эти эпитопы обладали способностью вырабатывать хелперный Т-клеточный ответ или цитотоксический Т-клеточный ответ или оба этих ответа.
Описанные здесь аутореплицирующиеся молекулы РНК могут быть сконструированы так, чтобы они экспрессировали множество нуклеотидных последовательностей из двух или более открытых рамкок считывания и коэкспрессировали белки, такие как два или более антигенов вместе с цитокинами или другими иммуномодуляторами, которые могут усиливать вырабатывание иммунного ответа. Такая аутореплицирующаяся молекула РНК может быть, в частности, использована, например, для одновременного продуцирования различных генных продуктов (например, белков), например, в качестве двухвалентных или поливалентных вакцин.
Аутореплицирующиеся молекулы РНК согласно изобретению могут быть получены любым подходящим методом. Специалистам известно несколько подходящих методов продуцирования молекул РНК, содержащих модифицированные нуклеотиды. Так, например, аутореплицирующаяся молекула РНК, содержащая модифицированные нуклеотиды, может быть получена посредством транскрипции (например, транскрипции in vitro) ДНК, кодирующей аутореплицирующуюся молекулу РНК с использованием подходящей ДНК-зависимой РНК-полимеразы, такой как РНК-полимераза фага T7, РНК-полимераза фага SP6, РНК-полимераза фага T3 и т.п., или мутантов этих полимераз, что позволяет эффективно вводить модифицированные нуклеотиды в молекулы РНК. Реакционная смесь для транскрипции содержит нуклеотиды, модифицированные нуклеотиды и другие компоненты, которые сохраняют активность выбранной полимеразы, такие как подходящий буфер и подходящие соли. Введение нуклеотидных аналогов в аутореплицирующуюся РНК может быть осуществлено, например, для изменения стабильности таких молекул РНК, для повышения резистентности к РНКазам, для достижения репликации после введения РНК в соответствующие клетки-хозяева («инфекционности» РНК) и/или для индуцирования или ослабления природного и адаптивного иммунных ответов.
Подходящие методы синтеза могут быть осуществлены отдельно или в комбинации с одним или более другими методами (например, методами рекомбинантных ДНК или РНК) в целях продуцирования аутореплицирующейся молекулы РНК согласно изобретению. Подходящие методы синтеза de novo хорошо известны специалистам и могут быть адаптированы для их применения в конкретных целях. Репрезентативными методами являются, например, химический синтез, проводимый с использованием подходящих защитных групп, таких как CEM (Masuda et al., (2007) Nucleic Acids Symposium Series 51:3-4); метод с применением β-цианоэтилфосфорамидита (Beaucage S. L. et al. (1981) Tetrahedron Lett 22: 1859); метод с применением нуклеозид-H-фосфоната (Garegg P. et al. (1986) Tetrahedron Lett 27:4051-4; Froehler B.C. et al. (1986) Nucl. Acid. Res. 14:5399-407; Garegg P. et al. (1986) Tetrahedron Lett 27:4055-8; Gaffney B.L. et al. (1988) Tetrahedron Lett 29:2619-22). Эти химические методы могут быть осуществлены или адаптированы для их проведения на автоматических синтезаторах нуклеиновых кислот, которые являются коммерчески доступными. Другие подходящие методы синтеза описаны в публикациях Uhlmann et al. (1990) Chem Rev 90:544-84, и Goodchild J. (1990) Bioconjugate Chem 1:165. Синтез нуклеиновых кислот может быть также осуществлен подходящими рекомбинантными методами, хорошо известными и широко применяемыми специалистами, включая клонирование, процессинг и/или экспрессию полинуклеотидов и генных продуктов, кодируемых такими полинуклеотидами. Известными методами, которые могут быть применены для создания и конструирования полинуклеотидных последовательностей, являются перестановка ДНК посредством рандомизированной фрагментации и рефолдинг генных фрагментов и синтетических полинуклеотидов с помощью ПЦР. Сайт-направленный мутагенез может быть применен для модификации нуклеиновых кислот и кодируемых ими белков, например, для встраивания новых рестрикционных сайтов, изменения характера гликозилирования, изменения предпочтительности кодонов, продуцирования вариантов сплайсинга, введения мутаций и т.п. Подходящие методы транскрипции, трансляции и экспрессии последовательностей нуклеиновых кислот хорошо известны и широко применяются специалистами. (В общих чертах см. Current Protocols in Molecular Biology, Vol. 2, Ed. Ausubel, et al., Greene Publish. Assoc. & Wiley Interscience, Ch. 13, 1988; Glover, ДНК Cloning, Vol. II, IRL Press, Wash., D.C., Ch. 3, 1986; Bitter, et al., in Methods in Enzymology 153:516-544 (1987); The Molecular Biology of the Yeast Saccharomyces, Eds. Strathern et al., Cold Spring Harbor Press, Vols. I and II, 1982; и Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, 1989).
Присутствие и/или количество одного или более модифицированных нуклеотидов в аутореплицирующейся молекуле РНК может быть определено любым подходящим методом. Так, например, аутореплицирующаяся РНК может быть расщеплена на монофосфаты (например, с использованием нуклеазы P1) и дефосфорилирована (например, с использованием подходящей фосфатазы, такой как CIAP), и полученные нуклеозиды могут быть проанализированы с помощью обращенно-фазовой ВЭЖХ (например, на колонке YMC Pack ODS-AQ (5 микрон, 4,6×250 мм) со следующими параметрами: элюирование в градиенте 30% B (0-5 минут)-100% B (5-13 минут) и 100% B (13-40 минут); скорость потока - 0,7 мл/мин, УФ-детектирование на длине волны 260 нм, температура колонки - 30°C; буфер A (20 мM уксусная кислота - ацетат аммония, pH 3,5), буфер B (20 мM уксусная кислота - ацетат аммония, pH 3,5/метанол [90/10])).
Аутореплицирующиеся молекулы РНК согласно изобретению могут включать, но необязательно, один или более модифицированных нуклеотидов, в результате чего такая аутореплицирующаяся молекула РНК будет обладать меньшей иммуномоделирующей активностью после ее введения или доставки в клетку-хозяина (например, человеческую клетку) по сравнению с соответствующей аутореплицирующейся молекулой РНК, которая не содержит модифицированных нуклеотидов.
При необходимости, аутореплицирующиеся молекулы РНК могут быть скринированы или проанализированы для подтверждения их терапевтических и профилактических свойств с применением различных методов анализа in vitro или in vivo, известных специалистам. Так, например, вакцины, содержащие аутореплицирующуюся молекулу РНК, могут быть протестированы на ее влияние на индуцирование пролиферации или эффекторной функции конкретных представляющих интерес лимфоцитов, например, В-клеток, Т-клеток, Т-клеточных линий и Т-клеточных клонов. Так, например, клетки селезенки могут быть взяты у иммунизированных мышей, а затем может быть протестирована способность цитотоксических Т-лимфоцитов лизировать аутологические клетки-мишени, которые содержат аутореплицирующуюся молекулу РНК, кодирующую полипептидный антиген. Кроме того, дифференцировка хелперных T-клеток может быть проанализирована путем оценки пролиферации или продуцирования цитокинов клетками TH1 (IL-2 и IFN-γ) и/или TH2 (IL-4 и IL-5) с помощью ELISA или непосредственно в CD4+-T-клетках методом цитоплазматического окрашивания цитокинами и методом проточной цитометрии.
Аутореплицирующиеся молекулы РНК, которые кодируют полипептидный антиген, могут быть также протестированы на их способность индуцировать гуморальные иммунные ответы, например, с помощью анализа на индуцирование продуцирования B-клеточных антител, специфичных к представляющему интерес антигену. Эти анализы могут быть проведены с использованием, например, периферических В-лимфоцитов, выделенных у иммунизированных индивидуумов. Такие аналитические методы известны специалистам. Другие анализы, которые могут быть проведены для характеризации аутореплицирующихся молекул РНК согласно изобретению, могут включать детектирование экспрессии кодируемого антигена клетками-мишенями. Так, например, для детектирования экспрессии антигена на клеточной поверхности или внутри клеток может быть проведен FACS-анализ. Другим преимуществом методов FACS-отбора является то, что этот метод позволяет осуществлять отбор по различным уровням экспрессии; причем, иногда может оказаться желательной более низкий уровень экспрессии. Другой подходящий метод идентификации клеток, экспрессирующих конкретный антиген, включает пэннинг, проводимый с использованием моноклональных антител на планшете, или захват с использованием магнитных сфер, покрытых моноклональными антителами.
B. Антигены
В некоторых вариантах изобретения описанная здесь молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты (например, молекулу РНК), кодирующую антиген. Подходящими антигенами являются, но не ограничиваются ими, бактериальный антиген, вирусный антиген, грибковый антиген, антиген простейших, растительный антиген, раковый антиген или их комбинации.
Подходящими антигенами являются белки и пептиды, происходящие от патогена, такого как вирусы, бактерии, грибы, простейшие, растения или опухоль. Вирусными антигенами и иммуногенами, которые могут кодироваться аутореплицирующейся молекулой РНК, являются, но не ограничиваются ими, белки и пептиды, происходящие от ортомиксовирусов, таких как вирусы гриппа A, B и C; парамиксовирусов, таких как пневмовирусы (RSV), парамиксовирусы (PIV), метапневмовирус и морбилливирусы (например, вирус кори); пневмовирусов, таких как респираторно-синцитиальный вирус (RSV), бычий респираторно-синцитиальный вирус, вирус мышиной пневмонии и вирус ринотрахеита индеек; парамиксовирусов, таких как вирус парагриппа типа 1-4 (PIV), вирус паротита, вирусы Сендай, обезьяний вирус 5, бычий вирус парагриппа, нипавирус, генипавирус и вирус ньюкаслской болезни; поксвирусов, включая ортопоксвирус, такой как вирус натуральной оспы (включая, но не ограничиваясь ими, вирусы Variola major и Variola minor); метапневмовирусов, таких как человеческий метапневмовирус (hMPV) и птичьи метапневмовирусы (aMPV); морбилливирусов, таких как вирус кори; пикорнавирусов, таких как энтеровирусы, риновирусы, гепарнавирус, пареховирус, кардиовирусы и афтовирусы; энтеровирусов, таких как полиовирус типа 1, 2 или 3, вирус коксаки A типа 1-22 и 24, вирус коксаки В типа 1-6, эховирус (ECHO) типа 1-9, 11-27 и 29-34 и энтеровирус 68-71; буньявирусов, включая ортобуньявирус, такой как вирус калифорнийского энцефалита; флебовирусов, таких как вирус лихорадки долины Рифт; найровирусов, таких как вирус геморрагической лихорадки Кримеана-Конго; гепарнавирусов, таких как вирус гепатита A (HAV); тогавирусов (вируса коревой краснухи), таких как рубивирус, альфавирус или артеривирус; флавивирусов, таких как вирус клещевого энцефалита (TBE), вирус денге (типа 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус лесов Кизанур, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус российского весенне-летнего энцефалита, вирус энцефалита Повассан; пестивирусов, таких как вирус бычьей диареи (BVDV), вирус классической лихорадки свиней (CSFV) или вирус, вызывающий болезнь Бордера (BDV); гепаднавирусов, таких как вирус гепатита B, вирус гепатита C; рабдовирусов, таких как лиссавирус (вирус бешенства) и везикуловирус (VSV); калицивирусов, таких как вирус норуолк и вирусы, подобные вирусу норуолк, такие как гавайский вирус и вирус снежных гор; коронавирусов, таких как SARS, человеческий респираторный коронавирус, вирус птичьего инфекционного бронхита (IBV), вирус мышиного гепатита (MHV) и свиной трансмиссивный вирус гастроэнтерита (TGEV); ретровирусов, таких как онковирус, лентивирус или спумавирус; реовирусов, таких как ортореовирус, ротавирус, орбивирус или колтивирус; парвовирусов, таких как парвовирус B19; вируса гепатита дельта (HDV); вируса гепатита Е (HEV); вируса гепатита G (HGV); человеческих герпесвирусов, таких как, например, вирусы простого герпеса (HSV), вирус опоясывающего лишая (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), человеческий герпесвирус 6 (HHV6), человеческий герпесвирус 7 (HHV7) и человеческий герпесвирус 8 (HHV8); паповавирусов, таких как вирусы папилломы и вирусы полиомы; аденовирусов и аренавирусов.
В некоторых вариантах изобретения антиген вырабатывает иммунный ответ против вируса, инфицирующего рыб, такого как вирус лосося, вызывающий инфекционную анемию (ISAV), вирус лосося, вызывающий заболевание поджелудочной железы (SPDV), инфекционный вирус, вызывающий некроз поджелудочной железы (IPNV), вирус нерки (CCV), рыбий вирус, вызывающий лимфоцистит (FLDV), вирус, вызывающий инфекционный некроз гемопоэтической системы (IHNV), герпесвирус рыб семейства сомовых, вирус лосося, подобный пикорнавирусу (также известный как вирус, подобный пикорнавирусу атлантического лосося), вирус бурого атлантического лосося (LSV), ротавирус атлантического лосося (ASR), вирус, вызывающий заболевание у форели золотистой (TSD), вирус опухоли лосося койо (CSTV) или вирус, вызывающий геморрагический сепсис (VHSV).
В некоторых вариантах изобретения антиген вырабатывает иммунный ответ против паразитов, принадлежащих к роду Plasmodium, таких как P.falciparum, P.vivax, P.malariae или P.ovale. Таким образом, настоящее изобретение может быть использовано в целях иммунизации против малярии. В некоторых вариантах изобретения антиген вырабатывает иммунный ответ против паразитов, принадлежащих к семейству Caligidae, а в частности, к роду Lepeophtheirus и Caligus, например, морских вшей, таких как Lepeophtheirus salmonis или Caligus rogercresseyi.
Бактериальными антигенами и иммуногенами, которые могут кодироваться аутореплицирующейся молекулой РНК, являются, но не ограничиваются ими, белки и пептиды, происходящие от бактерий Neisseria meningitides, Streptococcus pneumoniae, Streptococcus pyogenes, Moraxella catarrhalis, Bordetella pertussis, Burkholderia sp. (например, Burkholderia mallei, Burkholderia pseudomallei и Burkholderia cepacia), Staphylococcus aureus, Staphylococcus epidermis, Haemophilus influenzae, Clostridium tetani (столбняк), Clostridium perfringens, Clostridium botulinums (ботулизм), Cornynebacterium diphtheriae (дифтерия), Pseudomonas aeruginosa, Legionella pneumophila, Coxiella burnetii, Brucella sp. (например, B. abortus, B. canis, B. melitensis, B. neotomae, B. ovis, B. suis и B. pinnipediae), Francisella sp. (например, F. novicida, F. philomiragia и F. tularensis), Streptococcus agalactiae, Neiserria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum (сифилис), Haemophilus ducreyi, Enterococcus faecalis, Enterococcus faecium, Helicobacter pylori, Staphylococcus saprophyticus, Yersinia enterocolitica, E. coli (таких как энтеротоксигенные E. coli (ETEC), энтероагрегирующие E. coli (EAggEC), подвергающиеся диффузной адгезии E. coli (DAEC), энтеропатогенные E. coli (EPEC), экстраинтестинальные патогенные E. coli (ExPEC; такие как уропатогенные E.coli (UPEC) и E.coli, вызывающие менингит/сепсис (MNEC)), и/или энтерогеморрагические E. coli (EHEC), Bacillus anthracis (сибирская язва), Yersinia pestis (чума), Mycobacterium tuberculosis, Rickettsia, Listeria monocytogenes, Chlamydia pneumoniae, Vibrio cholerae, Salmonella typhi (тифозная лихорадка), Borrelia burgdorfer, Porphyromonas gingivalis, Klebsiella, Mycoplasma pneumoniae и т.п.
Грибковыми антигенами и иммуногенами, которые могут кодироваться аутореплицирующейся молекулой РНК, являются, но не ограничиваются ими, белки и пептиды, происходящие от Дерматофитов, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum разновидность album, разновидность discoides, разновидность ochraceum, Trichophyton vioiaceum, и/или Trichophyton faviforme; или от Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, Encephalitozoon spp., Septata intestinalis and Enterocytozoon bieneusi; и от менее распространенных видов, таких как Brachiola spp, Microsporidium spp., Nosema spp., Pleistophora spp., Trach ipleistophora spp., Vittaforma spp Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp, Mucor spp, Absidia spp, Mortierella spp, Cunninghamella spp, Saksenaea spp., Alternaria spp, Curvularia spp, Helminthosporium spp, Fusarium spp, Aspergillus spp, Penicillium spp, Monolinia spp, Rhizoctonia spp, Paecilomyces spp, Pithomyces spp и Cladosporium spp.
Антигенами и иммуногенами простейших, которые могут кодироваться аутореплицирующейся молекулой РНК, являются, но не ограничиваются ими, белки и пептиды, происходящие от Entamoeba histolytica, Giardia lambli, Cryptosporidium parvum, Cyclospora cayatanensis и Toxoplasma.
Растительными антигенами и иммуногенами, которые могут кодироваться аутореплицирующейся молекулой РНК, являются, но не ограничиваются ими, белки и пептиды, происходящие от Ricinus communis.
Подходящими антигенами являются белки и пептиды, происходящие от вируса, такого как, например, вирус иммунодефицита человека (ВИЧ), вирус гепатита A (HAV), вирус гепатита В (HBV), вирус гепатита C (HCV), вирус простого герпеса (HSV), цитомегаловирус (CMV), вирус гриппа (flu), респираторно-синцитиальный вирус (RSV), парвовирус, норовирус, вирус человеческой папилломы (HPV), риновирус, вирус желтой лихорадки, вирус бешенства, вирус лихорадки денге, вирус кори, вирус паротита, вирус коревой краснухи, вирус опоясывающего лишая, энтеровирус (например, энтеровирус 71), вирус Эбола и вирус бычьей диареи. Предпочтительным антигеном является антиген, выбранный из группы, состоящей из гликопротеина gD HSV, гликопротеина gpl20 ВИЧ, гликопротеина gp40 ВИЧ, p55 gag ВИЧ и полипептидов, происходящих от областей pol и tat. В других предпочтительных вариантах изобретения антигеном является белок или пептид, происходящий от бактерий, таких как например, Helicobacter pylori, Haemophilus influenza, Vibrio cholerae (холера), C. diphtheriae (дифтерия), C. tetani (столбняк), Neisseria meningitidis, B. pertussis, Mycobacterium tuberculosis и т.п.
Антигены ВИЧ, которые могут кодироваться аутореплицирующимися молекулами РНК согласно изобретению, описаны в заявке США рег. № 490858, поданной 9 марта 1990, и в опубликованной Европейской заявке № 181150 (14 мая, 1986), а также в заявках США. рег. №№ 60/168471; 09/475515; 09/475504 и 09/610313, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Антигены цитомегаловируса, которые могут кодироваться аутореплицирующимися молекулами РНК согласно изобретению, описаны в патенте США № 4689225, в заявке США рег. № 367363, поданной 16 июня, 1989, и в публикации заявки PCT WO 89/07143, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Антигены гепатита С, которые могут кодироваться аутореплицирующимися молекулами РНК согласно изобретению, описаны в заявке PCT/US88/04125, в опубликованной Европейской заявке № 318216 (31 мая 1989), в опубликованной Японской заявке №№ 1-500565, поданной 18 ноября 1988, в Канадской заявке 583561 и в EPO 388232, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Другая серия антигенов HCV описана в Европейской патентной заявке 90/302866.0, поданной 16 марта 1990, в заявке США рег. № 456637, поданной 21 декабря 1989, и в заявке PCT/US90/01348, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В некоторых вариантах изобретения антиген происходит от аллергена, такого как аллергены пыльцы (аллергены пыльцы деревьев, лекарственных растений, сорняков и дикорастущих растений); аллергены насекомых или пауков (аллергены, попадающие через дыхательные пути; аллергены слюны и яда, например, аллергены клещей, тараканов и звонцов; аллергены яда перепончатокрылых); аллергены шерсти и перхоти животных (например, собак, кошек, лошадей, крыс, мышей и т.п.); и пищевые аллергены (например, глиадин). Широко распространенными аллергенами пыльцы деревьев, дикорастущих растений и культурных растений являются аллергены, происходящие от растений, принадлежащих к таксономической группе Fagales, Oleales, Pinales и platanaceae, включая, но не ограничиваясь ими, березу (Betula), ольху (Alnus), лещину (Corylus), граб (Carpinus), маслины (Olea), растения семейства кедровых (криптомерию и можжевельник), платан (Platanus), растения семейства Злаки, включая дикорастущие растения рода Лоллия, Тимофеевка, Мятлик, Канатник, Овсюг, Бухарник, Фалярия, Канареечник и растения рода Сорго, а также растения семейства Asterales и Urticales, включая растения, принадлежащие к роду Амброзия, Артемизия и Париетария. Другими широко распространенными аллергенами, попадающими через дыхательные пути, являются аллергены клещей домашней пыли рода Dermatophagoides и Euroglyphus, аллергены мучных клещей, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены тараканов, звонцов и блох, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, и аллергены млекопитающих, таких как кошки, собаки и лошади, аллергены ядов, включая аллергены жалящих или кусающих насекомых, таких как насекомые, принадлежащие к таксономическому классу Hymenoptera (Перепончатокрылых), включая пчел (Apidae), ос (Vespidea) и муравьев (Formicoidae).
В некоторых вариантах изобретения опухолевый иммуноген или антиген, или раковый иммуноген или антиген могут кодироваться аутореплицирующейся молекулой РНК. В некоторых вариантах изобретения опухолевыми иммуногенами и антигенами являются пептид-содержащие опухолевые антигены, такие как полипептидный опухолевый антиген или гликопротеиновый опухолевый антиген.
Опухолевые иммуногены и антигены, подходящие для использования в настоящем изобретении, охватывают молекулы широкого ряда, такие как (a) полипептид-содержащие опухолевые антигены, включая полипептиды (которые могут иметь длину, например, 8-20 аминокислот, хотя такие молекулы могут также иметь длину, выходящую за указанные пределы), липополипептиды и гликопротеины.
В некоторых вариантах изобретения опухолевыми иммуногенами являются, например, (a) полноразмерные молекулы, ассоциированные с раковыми клетками, (b) их гомологи и модифицированные формы, включая молекулы с делетированными, добавленными и/или замененными частями, и (c) фрагменты этих молекул. Опухолевыми иммуногенами являются, например, антигены, распознавание которых CD8+-лимфоцитами рестриктировано молекулами класса I, или антигены, распознавание которых СD4+-лимфоцитами рестриктировано молекулами класса II.
В некоторых вариантах изобретения опухолевыми иммуногенами являются, но не ограничиваются ими, (a) антигены рака яичек, такие как полипептиды семейства NY-ESO-1, SSX2, SCP1, а также RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые могут быть использованы, например, для лечения меланомы, рака легких, рака головы и шеи, немелкоклеточной карциномы легких, опухоли молочной железы, желудочно-кишечного тракта и мочевого пузыря), (b) мутированные антигены, например, p53 (ассоциированные с различными солидными опухолями, например, с раковой опухолью прямой и ободочной кишки, раковой опухолью легких и раковой опухолью головы и шеи), p21/Ras (ассоциированные, например, с меланомой, раком поджелудочной железы и раком прямой и ободочной кишки), CDK4 (ассоциированный, например, с меланомой), MUM1 (ассоциированный, например, с меланомой), каспаза-8 (ассоциированная, например, с раком головы и шеи), CIA 0205 (ассоциированный, например, с раком мочевого пузыря), HLA-A2-R1701, бета-катенин (ассоциированный, например, с меланомой), TCR (ассоциированный, например, с T-клеточной не-ходжкинской лимфомой), BCR-abl (ассоциированный, например, с хроническим миелогенным лейкозом), триозофосфатизомераза, KIA 0205, CDC-27 и LDLR-FUT, (c) сверхэкспрессируемые антигены, например, галектин 4 (ассоциированный, например, с раком прямой и ободочной кишки), галектин 9 (ассоциированный, например, с болезнью Ходжкина), протеиназа 3 (ассоциированная, например, с хроническим миелогенным лйкозом), WT1 (ассоциированный, например, с лейкозом различных типов), угольная кислота-ангидраза (ассоциированная, например, с раком почек), альдолаза A (ассоциированная, например, с раком легких), PRAME (ассоциированный, например, с меланомой), HER-2/neu (ассоциированный, например, с раком молочной железы, толстой кишки, легких и яичника), альфа-фетопротеин (ассоциированный, например, с гепатомой), KSA (ассоциированный, например, с раком прямой и ободочной кишки), гастин (ассоциированный, например, с раком поджелудочной железы и желудка), каталитический белок теломеразы, MUC-1 (ассоциированный, например, с раком молочной железы и яичника), G-250 (ассоциированный, например, с почечно-клеточной карциномой), p53 (ассоциированный, например, с раком молочной железы и толстой кишки) и карциноэмбриональный антиген (ассоциированный, например, с раком молочной железы, раком легких и раком желудочно-кишечного тракта, таким как рак прямой и ободочной кишки), (d) общие антигены, например, антигены дифференцировки клеток меланомы-меланоцитов, такие как MART-1/мелан A, gp100, MC1R, рецептор меланоцит-стимулирующего гормона, тирозиназа, родственный тирозиназе белок-1/TRP1 и родственный тирозиназе белок-2/TRP2 (ассоциированные, например, с меланомой), (e) антигены предстательной железы, такие как PAP, PSA, PSMA, PSH-P1, PSM-Pl, PSM-P2, ассоциированные, например, с раком предстательной железы, (f) иммуноглобулины различных идиотипов (ассоциированные, например, с миеломой и В-клеточной лимфомой).
В некоторых вариантах изобретения опухолевыми иммуногенами являются, но не ограничиваются ими, pl5, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барра, EBNA, антигены человеческого папилломавируса (HPV), включая антигены E6 и E7, антигены вируса гепатита B и C, антигены человеческого T-клеточного лимфотропного вируса, антигены TSP-180, p185erbB2, pl80erbB-3, c-met, mn-23H1, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, beta-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29/BCAA), CA 195, CA 242, CA-50, CAM43, CD68/KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Mac-2-связывающий белок/белок, ассоциированный с циклофилином C), TAAL6, TAG72, TLP, TPS и т.п.
C. Водный раствор для молекулы нуклеиновой кислоты
Молекулу нуклеиновой кислоты (такую как РНК) обычно получают в форме водного раствора или в форме, которая может легко растворяться в водном растворе (например, может быть лиофилизованной). Таким водным раствором может быть вода или водный раствор, содержащий соль (например, NaCl), буфер (например, цитратный буфер), неионный агент, придающий тоничность (например, сахарид), полимер, поверхностно-активное вещество или их комбинации. Если полученный препарат предназначен для введения in vivo, то предпочтительно, чтобы водный раствор представлял собой физиологически приемлемый буфер, который поддерживает pH, совместимый с рН в нормальных физиологических условиях. В некоторых случаях может также оказаться желательным поддержание pH на конкретном уровне, достаточном для гарантии стабильности некоторых компонентов данного препарата.
Так, например, может оказаться желательным получение водного раствора, который является изотоническим и/или изоосмотическим. Гипертонические и гипотонические растворы иногда могут вызывать осложнения и нежелательные эффекты при их введении, такие как набухание или быстрая абсорбция композиции после ее введения, что обусловлено различиями в концентрациях ионов композиций и физиологических жидкостей. Для регуляции тоничности, в эмульсию может быть включена физиологическая соль, такая как натриевая соль. Хлорид натрия (NaCl) может быть использован, например, в концентрации приблизительно 0,9% (масс./об.) (физиологический раствор). Другими солями, которые могут присутствовать, являются хлорид калия, дигидрофосфат калия, дегидрат бифосфата натрия, хлорид магния, хлорид кальция и т.п. В репрезентативном варианте изобретения водный раствор содержит 10 мМ NaCl и другие соли или неионные агенты, придающие тоничность. Как описано в настоящей заявке, неионные агенты, придающие тоничность, могут быть также использованы для регуляции тоничности. В одном из вариантов изобретения гипертонический и гипотонические растворы смешивают (например, гипертоническую РНК и гипотоническую эмульсию; гипотоническую РНК и гипертоническую эмульсию), так, чтобы после такого смешивания они образовывали изотонический раствор.
Водный раствор может быть забуференным. В данном случае могут быть использованы любые физиологически приемлемые буферы, такие как цитратные буферы, фосфатные буферы, ацетатные буферы, сукцинатные буферы, трис-буферы, бикарбонатные буферы, карбонатные буферы или т.п. pH водного раствора, предпочтительно, составляет 6,0-8,0, а более предпочтительно, приблизительно 6,2-6,8. В некоторых случаях, в буфер может быть включено определенное количество соли. В некоторых случаях, присутствие соли в буфере может препятствовать образованию комплекса молекулы нуклеиновой кислоты с эмульсионной частицей, и это следует учесть во избежание такого эффекта.
Водный раствор может также содержать дополнительные компоненты, такие как молекулы, которые способствуют изменению осмомолярности водного раствора, или молекулы, стабилизирующие молекулу нуклеиновой кислоты после образования комплекса. Так например, осмомоляльность может быть скорректирована с использованием неионного агента, придающего тоничность, который, в основном, является углеводом, но может быть также и полимером (см., например, Voet and Voet (1990) Biochemistry (John Wiley & Sons, New York.). Примерами подходящих неионных агентов, придающих тоничность, являются сахара (например, трегалоза, сахароза, декстроза, фруктоза, восстановленная палатиноза и т.п.), спирты ряда сахаров (такие как маннит, сорбит, ксилит, эритрит, лактит, мальтит, глицерин и т.п.) и их комбинации. При желании могут быть использованы неионный полимер (например, полиалкилгликоль, такой как полиэтиленгликоль, полипропиленгликоль или полибутиленгликоль) или неионное поверхностно-активное вещество. Агенты этих типов, а в частности, сахара и спирты ряда сахаров также являются криозащитными средствами, которые могут защищать РНК и другие молекулы нуклеиновой кислоты при лиофилизации. В репрезентативных вариантах изобретения буфер содержит приблизительно 560 нM - 600 мМ трегалозы, сахарозы, сорбита или декстрозы.
В некоторых случаях может оказаться предпочтительным получение водного раствора, содержащего молекулу нуклеиновой кислоты, в виде гипертонического раствора, и получение катионной эмульсии с использованием воды высокой степени очистки или гипотонического буфера. При объединении эмульсии и молекулы нуклеиновой кислоты, смесь становится изотоничной. Так, например, водный раствор, содержащий РНК, может представлять собой 2х гипертонический раствор, а катионная эмульсия может быть получена с использованием 10 мM цитратого буфера. При смешивании раствора РНК и эмульсии в отношении 1:1 (об./об.), композиция становится изотоничной. Исходя из желаемых относительных количеств эмульсии и водного раствора, содержащего молекулу нуклеиновой кислоты (например, смеси 1:1 (об./об.), смеси 2:1 (об./об.), смеси 1:2 (об./об.), и т.п.), можно легко определить тоничность водного раствора, необходимую для получения изотоничной смеси.
Аналогичным образом, для введения in vivo могут оказаться подходящими композиции, обладающие физиологической осмомоляльностью. Физиологическая осмомоляльность составляет приблизительно 255 мОсм/кг воды - 315 мОсм/кг воды. Иногда, может оказаться предпочтительным получение водного раствора, содержащего молекулу нуклеиновой кислоты, в виде гиперосмомолярного раствора, и получение катионной эмульсии с использованием воды высокой степени очистки или гипоосмомолярного буфера. При объединении эмульсии и молекулы нуклеиновой кислоты достигается физиологическая осмомоляльность. Очевидно, что это может быть также достигнуто с использованием гипоосмомолярного раствора нуклеиновой кислоты и гиперосмомолярного буфера. Исходя из желаемых относительных количеств эмульсии и водного раствора, содержащего молекулу нуклеиновой кислоты (например, смеси 1:1 (об./об.), смеси 2:1 (об./об.), смеси 1:2 (об./об.), и т.п.), можно легко определить осмомоляльность водного раствора, необходимую для получения изоосмомолярной смеси.
В некоторых вариантах изобретения водный раствор, содержащий молекулу нуклеиновой кислоты, может также включать полимер или поверхностно-активное вещество, или их комбинацию. В репрезентативном варианте изобретения эмульсия типа «масло в воде» содержит полоксамер. В частности, авторами настоящего изобретения было обнаружено, что добавление Pluronic® F127 к водному раствору РНК до образования комплекса с частицами катионной эмульсии приводит к повышению стабильности молекулы РНК и к повышению ее резистентности к РНКазе. Было также обнаружено, что добавление плюроника F127 к водному раствору РНК приводит к уменьшению размера частиц комплекса РНК/CNE. Полоксамерные полимеры могут также способствовать соответствующему разрушению комплекса/высвобождению молекулы РНК, предупреждать агрегацию эмульсионных частиц и оказывать иммуномодулирующее действие. Другими полимерами, которые могут быть использованы, являются, например, Pluronic® F68 или ПЭГ300.
Альтернативно или дополнительно, водный раствор, содержащий молекулу нуклеиновой кислоты, может включать приблизительно 0,05%-20% (масс./об.) полимера. Так, например, катионная эмульсия типа «масло в воде» может содержать полимер (например, полоксамер, такой как Pluronic® F127, Pluronic® F68, или ПЭГ300) в концентрации приблизительно 0,05%-10% (масс./об.), например, 0,05%, 0,5%, 1% или 5%.
Буферная система может содержать любую комбинацию из двух или более вышеописанных молекул (соль, буфер, сахарид, полимер и т.п.). В предпочтительном варианте изобретения буфер содержит 560 мМ сахарозы, 20 мM NaCl и 2 мM цитрата, которые могут быть смешаны с катионной эмульсией типа «масло в воде», описанной в настоящей заявке, с получением конечной водной фазы, содержащей 280 мМ сахарозы, 10 мМ NaCl и 1 мМ цитрата. В других вариантах изобретения буфер содержит приблизительно 2-20 мM цитрата, который может быть смешан с катионной эмульсией типа «масло в воде», описанной в настоящей заявке, с получением конечной водной фазы, содержащей приблизительно 1-10 мМ цитрата.
5. Способы получения
В другом своем аспекте, настоящее изобретение относится к способу получения композиции, содержащей молекулу нуклеиновой кислоты, которая образует комплекс с частицей катионной эмульсии типа «масло в воде» в отношении N/P по меньшей мере 4:1 и со средним диаметром приблизительно 80 нм - 180 нм, где указанный способ включает: получение катионной эмульсии типа «масло в воде», где указанная эмульсия содержит: (1) приблизительно 0,2%-20% (об./об.) масла, (2) приблизительно 0,01%-2,5% (об./об.) поверхностно-активного вещества, и (3) катионный липид; и добавление молекулы нуклеиновой кислоты к катионной эмульсии типа «масло в воде» так, чтобы эта молекула нуклеиновой кислоты образовывала комплекс с частицей указанной эмульсии.
Один из репрезентативных способов получения катионной эмульсии типа «масло в воде» включает: (1) объединение масла и катионного липида с образованием масляной фазы эмульсии; (2) приготовление водного раствора с получением водной фазы эмульсии; и (3) диспергирование масляной фазы в водной фазе, например, посредством гомогенизации. Гомогенизация может быть достигнута любым подходящим способом, например, на коммерчески доступном гомогенизаторе (например, на гомогенизаторе IKA T25, поставляемом компанией VWR International (West Chester, PA).
Катионный липид может быть растворен в подходящем растворителе, таком как хлороформ (CHCl3), дихлорметан (ДХМ), этанол, ацетон, тетрагидрофуран (ТГФ), 2,2,2-трифторэтанол, ацетонитрил, этилацетат, гексан, диметилформамид (ДМФ), диметилсульфоксид (ДМСО) и т.п., а затем непосредственно добавлен в масляный компонент эмульсии. Альтернативно, катионный липид может быть добавлен в подходящий растворитель с получением липосомной суспензии, а затем эта липосомная суспензия может быть добавлена к масляному компоненту эмульсии. Катионный липид может быть также непосредственно растворен в масле.
Может оказаться желательным нагревание масла до температуры приблизительно от 30°C до 65°C для облегчения растворения липида.
Может быть взято нужное количество катионного липида (например, DOTAP), и это количество может быть растворено в растворителе, в воде или непосредственно в масле до достижения желаемой конечной концентрации, как описано и проиллюстрировано в настоящей заявке.
Растворители, такие как хлороформ (CHCl3) или дихлорметан (ДХМ), могут быть удалены из масляной фазы, например, путем выпаривания перед объединением водной фазы и масляной фазы или перед гомогенизацией. Альтернативно, в случае, когда липид имеет плохую растворимость, первичная эмульсия может быть приготовлена с использованием растворителя (например, ДХМ), еще находящегося в масляной фазе. В таких случаях, растворитель может быть удален (например, путем выпаривания) из первичной эмульсии до проведения вторичной гомогенизации.
Если эмульсия содержит одно или более поверхностно-активных веществ, то это(и) поверхностно-активное(ые) вещество(а) может (могут) быть включено(ы) в масляной фазе или в водной фазе в соответствии со стандартной практикой. Так, например, SPAN® 85 может быть растворен в масляной фазе (например, в сквалене), а Tween® может быть растворен в водной фазе (например, в цитратном буфере).
В другом своем аспекте, настоящее изобретение относится к способу получения композиции, содержащей молекулу нуклеиновой кислоты (такую как РНК), образующую комплекс с частицей катионной эмульсии типа «масло в воде», где указанный способ включает: (i) приготовление описанной здесь катионной эмульсии типа «масло в воде»; (ii) приготовление водного раствора, содержащего молекулу нуклеиновой кислоты (такую как РНК); и (iii) объединение эмульсии типа «масло в воде» (i) и водного раствора (iii) так, чтобы молекула нуклеиновой кислоты образовывала комплекс с частицей эмульсии. Так, например, катионная эмульсия типа «масло в воде» может быть объединена с водным раствором, содержащим молекулу нуклеиновой кислоты (например, с водным раствором РНК) в любых нужных отношениях, например, приблизительно 1:1 (об./об.), приблизительно 1,5:1 (об./об.), приблизительно 2:1 (об./об.), приблизительно 2,5:1 (об./об.), приблизительно 3:1 (об./об.), приблизительно 3,5:1 (об./об.), приблизительно 4:1 (об./об.), приблизительно 5:1 (об./об.), приблизительно 10:1 (об./об.), приблизительно 1:1,5 (об./об.), приблизительно 1:2 (об./об.), приблизительно 1:2,5 (об./об.), приблизительно 1:3 (об./об.), приблизительно 1:3,5 (об./об.), приблизительно 1:4 (об./об.), приблизительно 1:1,5 (об./об.) или приблизительно 1:1,10 (об./об.), и т.п.
Концентрация каждого компонента композиции после образования комплекса (например, комплекса «РНК-эмульсия») может быть легко определена по относительным количествам используемой эмульсии типа «масло в воде» до образования комплекса и используемого водного раствора, содержащего молекулу нуклеиновой кислоты (например, водного раствора РНК). Так, например, при объединении катионной эмульсии типа «масло в воде» с водным раствором, содержащим молекулу нуклеиновой кислоты (например, с водным раствором РНК) в отношении 1:1 (об:об), концентрации масла и катионного липида составляют 1/2 от концентрации эмульсии до образования комплекса. Поэтому, при объединении эмульсии, содержащей 4,3% (масс./об.) сквалена, 1,4 мг/мл DOTAP, 0,5% об./об. SPAN®85 и 0,5% об./об. Tween® 80 (обозначаемой далее «CNE17»), с водным раствором РНК, содержащим 560 мМ сахарозы, 20 мМ NaCl, 2 мМ цитрата и 1% (масс./об.) плюроника F127 в отношении 1:1 (об:об), композиция, после образования комплекса, содержит 2,15% (масс./об.) сквалена, 0,7 мг/мл DOTAP, 0,25% об./об. SPAN®85, 0,25% об./об. Tween® 80, 280 мМ сахарозы, 10 мМ NaCl, 1 мM цитрата и 0,5% (масс./об.) плюроника F127.
При этом, для стимуляции образования частиц, для облегчения образования комплекса молекул нуклеиновой кислоты с катионными частицами, для повышения стабильности молекулы нуклеиновой кислоты (например, для предупреждения разложения молекулы РНК), для облегчения соответствующего разрушения комплекса/высвобождения молекул нуклеиновой кислоты (таких как молекула РНК) или для предупреждения агрегации эмульсионных частиц могут быть проведены дополнительные, но необязательные стадии. Так, например, полимер (например, Pluronic® F127) или поверхностно-активное вещество могут быть добавлены к водному раствору, содержащему молекулу нуклеиновой кислоты (такую как РНК). В одном из репрезентативных вариантов изобретения Pluronic® F127 добавляют к молекуле РНК до образования комплекса с эмульсионной частицей.
Размер эмульсионных частиц может варьироваться при изменении отношения поверхностно-активного вещества и масла (по мере увеличения отношения, размер капелек уменьшается), при изменении рабочего давления (по мере увеличения рабочего давления, размер капелек уменьшается), при изменении температуры (по мере увеличения температуры, размер капелек уменьшается) и при изменении других технологических параметров. Фактический размер частиц также варьируется в зависимости от конкретно используемого поверхностно-активного вещества, масла и катионного липида, и от конкретно выбранных рабочих условий. Размер эмульсионных частиц может быть подтвержден с помощью приборов для гранулометрических измерений, таких как коммерчески доступный анализатор для субмикронных частиц Sub-Micron Particle Analyzer (Model N4MD), поставляемый корпорацией Coulter Corporation, и такие параметры могут быть подвергнуты коррекции в соответствии с описанными выше руководствами до тех пор, пока средний диаметр частиц не достигнет 80 нм - 180 нм.
Необязательными стадиями получения катионной эмульсии типа «масло в воде» (перед образованием комплекса) или комплекса «молекула нуклеиновой кислоты - эмульсия» являются, например, стерилизация, подбор частиц по размеру (например, удаление крупных частиц), расфасовка, упаковка, маркировка и т.п.
Так, например, при приготовлении эмульсии до образования комплекса или при получении комплекса «молекула нуклеиновой кислоты - эмульсия» для введения in vivo, препараты могут быть стерилизованы, например, путем фильтрации через стерилизующий фильтр (например, через 0,22-микронный фильтр). Другими методами стерилизации являются термообработка, стерилизация облучением или импульсное облучение с получением стерильной композиции.
Описанная здесь катионная эмульсия типа «масло в воде» может быть использована для приготовления вакцин. Стерильные и/или клинически приемлемые катионные эмульсии типа «масло в воде» могут быть получены методами, аналогичными методам получения MF59. См., например, Ott et al, Methods in Molecular Medicine, 2000, Volume 42, 211-228, in VACCINE ADJUV ANTS (O'Hagan ed.), Humana Press. Так, например, по аналогии со способом получения MF59, масляная фаза и водная фаза эмульсии могут быть объединены и обработаны на подсоединенном к указанному устройству гомогенизаторе с получением крупнозернистой эмульсии. Эта крупнозернистая эмульсия может быть затем подана в микрофлюидизатор, после чего она может быть обработана с получением стабильной субмикронной эмульсии. Крупнозернистая эмульсия может быть несколько раз пропущена через реакционный отсек микрофлюидизатора до получения частиц нужного размера. Затем нерасфасованная эмульсия может быть отфильтрована (например, на 0,22 мкм-фильтре в атмосфере азота) для удаления крупных частиц с получением эмульсии, которая может быть расфасована в подходящие контейнеры (например, в стеклянные бутыли). В случае вакцинных антигенов, которые, как было продемонстрировано, имеют длительный срок годности в присутствии эмульсии типа «масло в воде», антиген и эмульсия могут быть объединены и простерилизованы на фильтре (например, через мембрану 0,22 мкм-фильтра). Вакцина, объединенная в одном сосуде, может быть расфасована по сосудам для одноразового использования. В случае вакцинных антигенов, стабильность которых не была подтверждена, эта эмульсия может быть помещена в отдельный сосуд. В таких случаях, нерасфасованная эмульсия может быть подвергнута стерилизации на фильтре (например, через мембрану 0,22 мкм-фильтра), расфасована и упакована в готовые сосуды для одноразового использования.
Контроль качества может быть проведен, но необязательно, на небольшом образце нерасфасованной эмульсии или вакцинной смеси, и такая нерасфасованная эмульсия или вакцинная смесь могут быть разделены на дозы и упакованы только в том случае, если данный образец прошел тест на контроль качества.
6. Фармацевтические композиции и их введение
В другом своем аспекте, настоящее изобретение относится к фармацевтической композиции, которая содержит молекулу нуклеиновой кислоты, образующую комплекс с частицей катионной эмульсии типа «масло в воде», как описано в настоящей заявке, и которая может также содержать один или более фармацевтически приемлемых носителей, разбавителей или наполнителей. В предпочтительных вариантах изобретения фармацевтической композицией является иммуногенная композиция, которая может быть использована в качестве вакцины.
Описанные здесь композиции могут быть использованы для доставки молекулы нуклеиновой кислоты в клетки. Так, например, молекулы нуклеиновой кислоты (например, ДНК или РНК) могут быть доставлены в клетки в различных целях, например, для индуцирования продуцирования нужного генного продукта (например, белка), для регуляции экспрессии гена, для генотерапии и т.п. Описанные здесь композиции могут быть также использованы для доставки молекулы нуклеиновой кислоты (например, ДНК или РНК) в клетки в терапевтических целях, например, для лечения заболеваний, таких как рак или пролиферативные расстройства, метаболические расстройства, сердечно-сосудистые заболевания, инфекции и аллергии, для индуцирования иммунного ответа и т.п. Так, например, молекулы нуклеиновой кислоты могут быть доставлены в клетки для ингибирования экспрессии гена-мишени. Такими молекулами нуклеиновой кислоты являются, например, антисмысловые олигонуклеотиды, двухцепочечные РНК, такие как короткие интерферирующие РНК и т.п. Двухцепочечные молекулы РНК, такие как короткие интерферирующие РНК, могут стимулировать РНК-интерференцию, которая обеспечивает специфический сайленсинг соответствующего гена-мишени («отключение» гена). Антисмысловые олигонуклеотиды представляют собой одноцепочечные ДНК или РНК, которые являются комплементарными выбранной последовательности. Вообще говоря, антисмысловая РНК может предотвращать трансляцию некоторых цепей матричной РНК в белок посредством связывания с ними. Антисмысловая ДНК может быть использована для нацеливания на специфическую комплементарную (кодирующую или некодирующую) РНК. Поэтому, описанные здесь катионные эмульсии могут быть использованы в целях доставки антисмысловых олигонуклеотидов или двухцепочечных РНК для лечения, например, рака, посредством ингибирования продуцирования онко-мишени.
Описанные здесь фармацевтические композиции могут быть введены отдельно или в комбинации с одним или более дополнительными терапевтическими средствами. Способами введения являются, но не ограничиваются ими, пероральное введение, ректальное введение, парентеральное введение, подкожное введение, внутривенное введение, введение в стекловидное тело, внутримышечное введение, введение путем ингаляции, интраназальное введение, местное введение, внутриглазное введение и внутриушное введение.
Терапевтически эффективное количество описанных здесь композиций может варьироваться в зависимости от типа заболевания, подвергаемого лечению, тяжести заболевания, возраста и состояния здоровья индивидуума, эффективности вводимого соединения, способа введения, выбранной схемы лечения и т.п.
В других вариантах изобретения описанные здесь фармацевтические композиции могут быть введены в комбинации с одним или более дополнительными терапевтическими средствами. Дополнительными терапевтическими средствами могут быть, но не ограничиваются ими, антибиотики, антибактериальные средства, противорвотные средства, противогрибковые средства, противовоспалительные средства, противовирусные средства, иммуномодулирующие агенты, цитокины, антидепрессанты, гормоны, алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, антимитотические агенты, ингибиторы топоизомеразы, цитостатические агенты, антиинвазивные агенты, антиангиогенные агенты, ингибиторы факторов роста, ингибиторы репликации вирусов, ингибиторы вирусных ферментов, противораковые средства, α-интерфероны, β-интерфероны, рибавирин, гормоны, другие модуляторы ловушко-подобных рецепторов, иммуноглобулины (Ig) и антитела, модулирующие функцию Ig (такие как анти-IgE антитела (омализумаб)).
В некоторых вариантах изобретения описанные здесь фармацевтические композиции могут быть использованы для лечения инфекционных заболеваний, включая, но не ограничиваясь ими, заболевания, вызываемые описанными здесь патогенами, включая вирусные заболевания, такие как остроконечные кондиломы, простые бородавки, подошвенные бородавки, бешенство, заболевания, вызываемые респираторно-синцитиальным вирусом (RSV), вирусом гепатита B, вирусом гепатита C, вирусом денге, вирусом желтой лихорадки, вирусом простого герпеса (только, например, только HSV-I, HSV-II, CMV или VZV), контагиозными моллюсками, вирусом коровьей оспы, вирусом натуральной оспы, лентивирусом, вирусом иммунодефицита человека (ВИЧ), вирусом человеческой папилломы (HPV), вирусом гепатита (гепатита С, гепатита В, гепатита А), цитомегаловирусом (CMV), вирусом опоясывающего лишая (VZV), риновирусом, энтеровирусом (например, EV71), аденовирусом, коронавирусом (например, SARS), вирусом гриппа, вирусом парагриппа, вирусом паротита, вирусом кори, вирусом коревой краснухи, паповавирусом, гепаднавирусом, флавивирусом, ретровирусом, аренавирусом (например, только LCM, вирусом Юнина, вирусом Мачупо, вирусом Гуанарито и лассавирусом лихорадки) и филовирусом (например, только вирусом Эбола или вирусом Марбург).
В некоторых вариантах изобретения описанные здесь фармацевтические композиции могут быть использованы для лечения инфекционных заболеваний, вызываемых бактериями, грибами и простейшими, включая, но не ограничиваясь ими, малярию, туберкулез, и заболевания, вызываемые Mycobacterium avium; лепру; заболевания, вызываемые Pneumocystis carnii, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомную инфекцию, лейшманиоз, инфекции, вызываемые бактериями рода Escherichia, Enterobacter, Salmonella, Staphylococcus, Klebsiella, Proteus, Pseudomonas, Streptococcus и Chlamydia, и инфекции, вызываемые грибами, такие как кандидоз, аспергиллез, гистоплазмоз и криптококковый менингит.
В некоторых вариантах изобретения описанные здесь фармацевтические композиции могут быть использованы для лечения респираторных заболеваний и/или расстройств, кожных болезней, глазных болезней и/или расстройств, заболеваний мочеполовых путей и/или других расстройств, включая отторжение аллотрансплантата, аутоиммунные и аллергические расстройства, рак или поражение или старение кожи, такое как рубцы и морщины.
В другом своем аспекте, настоящее изобретение относится к способу индуцирования или усиления иммунного ответа у индивидуума, нуждающегося в этом, такого как млекопитающее, где указанный способ включает введение эффективного количества описанной здесь композиции. Иммунный ответ, предпочтительно, является протективным, а более предпочтительно, включает гуморальный и/или клеточно-опосредуемый иммунный ответ. Указанный способ может быть применен для индуцирования первичного иммунного ответа и/или для усиления иммунного ответа.
В некоторых вариантах изобретения описанные здесь композиции могут быть использованы в качестве лекарственного препарата, например, для вырабатывания или усиления иммунного ответа у индивидуума, нуждающегося в этом, такого как млекопитающее.
В некоторых вариантах изобретения описанные здесь композиции могут быть использованы для получения лекарственного препарата в целях вырабатывания или усиления иммунного ответа у индивидуума, нуждающегося в этом, такого как млекопитающее.
Настоящее изобретение также относится к устройству для доставки, предварительно заполненному описанной здесь композицией или вакциной.
Предпочтительным млекопитающим является человек, однако, им может быть также, например, корова, свинья, курица, кошка или собака, однако, пока еще неясно, какие из описанных здесь патогенов могут инфицировать широкий круг хозяев. В случае использования вакцины в профилактических целях, предпочтительно, чтобы она была введена человеку, а именно, ребенку (например, ребенку, начинающему ходить, или ребенку до 12 месяцев), подростку или взрослому человеку, а в случае использования вакцины в терапевтических целях, ее предпочтительно вводить подростку или взрослому. Вакцина, предназначенная для детей, может быть также введена взрослому, например, для ее оценки на безопасность, дозу, иммуногенность и т.п.
Один из способов оценки эффективности терапевтического лечения включает мониторинг патогенной инфекции после введения описанных здесь композиций или вакцин. Один из способов оценки эффективности профилактического лечения включает мониторинг иммунных ответов, в кровотоке (например, мониторинг уровня продуцирования IgG1 и IgG2a) и/или в слизистой (например, мониторинг уровня продуцирования IgA) на антиген. Обычно, антигенспецифические гуморальные ответы в сыворотке определяют после иммунизации, но до сенсибилизации, тогда как антигенспецифические гуморальные ответы в слизистой определяют после иммунизации и после сенсибилизации.
Другой способ оценки иммуногенности описанных здесь композиций или вакцин, где указанная молекула нуклеиновой кислоты (например, РНК) кодирует белковый антиген, включает рекомбинантную экспрессию белкового антигена для скрининга сыворотки пациента или секреции антигена в слизистую с помощью иммуноблот-анализа и/или с использованием микромассивов. Позитивная реакция между белком и пробой, взятой у пациента, указывает на то, что у данного пациента вырабатывается иммунный ответ на рассматриваемый белок. Этот способ может быть также применен для идентификации иммонодоминантных антигенов и/или эпитопов в белковых антигенах.
Эффективность композиций может быть также определена in vivo путем сенсибилизации соответствующих животных с моделью инфицирования представляющими интерес патогенами.
Доза может быть введена по схеме введения разовых или дробных доз. Схема введения дробных доз может быть использована при первичной иммунизации и/или бустер-иммунизации. При введении дробных доз, различные дозы могут быть введены по одной и той же схеме или по различным схемам, например, путем парентерального введения первичной дозы и введения бустер-дозы в слизистую, а также путем введения первичной дозы в слизистую и парентерального введения бустер-дозы и т.п. Дробные дозы обычно вводят с интервалами по меньшей мере в 1 неделю (например, с интервалами приблизительно в 2 недели, приблизительно в 3 недели, приблизительно в 4 недели, приблизительно в 6 недель, приблизительно в 8 недель, приблизительно в 10 недель, приблизительно в 12 недель, приблизительно в 16 недель и т.п.).
Описанные здесь композиции, которые включают один или более антигенов или используются в комбинации с одним или более антигенами, могут быть применены для лечения детей и взрослых. Таким образом, возраст человека может составлять менее, чем 1 год, 1-5 лет, 5-15 лет, 15-55 лет или по меньшей мере 55 лет. Предпочтительными индивидуумами, которым могут быть введены указанные композиции, являются пожилые люди (например, в возрасте >50 лет, >60 лет, а предпочтительно, >65 лет), дети (например, <5 лет), госпитализированные пациенты, медицинский персонал, военнослужащие и личный состав воинских частей, беременные женщины, индивидуумы с хроническими заболеваниями или пациенты с иммунодефицитом. Такие композиции являются подходящими не только для указанных групп индивидуумов, они также могут быть использованы для лечения более широких групп населения.
Описанные здесь композиции, которые включают один или более антигенов или используются в комбинации с одним или более антигенами, могут быть введены пациентам, в основном, одновременно (например, во время консультации у врача или визита к врачу или в центр вакцинации) с другими вакцинами, например, в основном, одновременно с введением вакцины против кори, вакцины против паротита, вакцины против коревой краснухи, вакцины против кори-паротита-краснухи (MMR), вакцины против натуральной оспы, вакцины против кори-паротита-краснухи-натуральной оспы (MMRV), вакцины против дифтерии, вакцины против столбняка, вакцины против коклюша, вакцины против дифтерии-столбняка-коклюша (DTP), конъюгатной вакцины на основе вируса H. influenzae типа b, вакцины на основе инактивированного полиовируса, вакцины против гепатита B, конъюгатной вакцины на основе менингококков (такой как трехвалентная вакцина на основе A-C-W135-Y), вакцины на основе респираторно-синцитиального вируса и т.п.
В некоторых вариантах изобретения описанные здесь композиции включают, но необязательно, один или более иммунорегуляторных агентов, таких как адъюванты. Репрезентативными адъювантами являются, но не ограничиваются ими, адъювант ΤΗ1 и/или адъювант ΤΗ2, также подробно обсуждаются ниже. В некоторых вариантах изобретения адъювантами, используемыми в описанных здесь иммуногенных композициях, являются, но не ограничиваются ими:
1. Композиции, содержащие микроэлементы;
2. Масляные эмульвии;
3. Сапониновые препараты;
4. Виросомы и вирусоподобные частицы;
5. Бактериальные или микробные производные;
6. Биоадгезивы и мукоадгезивы;
7. Липосомы;
8. Препараты на основе полиоксиэтиленэфира и сложного полиоксиэтиленэфира;
9. Полифосфазен (PCPP);
10. Мурамиловые пептиды;
11. Соединения имидазохинолона;
12. Соединения тиосемикарбазона;
13. Соединения триптантрина;
14. Человеческие иммуномодуляторы;
15. Липопептиды;
16. Бензонафтиридины;
17. Микрочастицы;
18. Иммуностимулирующий полинуклеотид (такой как РНК или ДНК; например, CpG-содержащие олигонуклеотиды).
Примеры
Описанное здесь в общих чертах изобретение будет более понятным из описания нижеследующих примеров, которые приводятся лишь в целях иллюстрации некоторых аспектов и вариантов настоящего изобретения и не должны рассматриваться как ограничение изобретения.
Пример 1: Катионные эмульсии типа «масло в воде»
Сквален, сорбитантриолеат (Span 85), полиоксиэтиленсорбитанмоноолеат (твин 80) получали от Sigma (St. Louis, MO, USA). l,2-диолеоил-3-триметиламмонийпропан (DOTAP) закупали у Lipoid (Ludwigshafen Germany).
Компоненты эмульсий, используемых в этих исследованиях, представлены в таблице 1.
|
CNE получали методом, аналогичным методу получения заряженного MF59, как было описано ранее (Ott et al, Journal of Controlled Release, volume 79, pages 1-5, 2002). CMF32, 34 и 35 получали тем же способом, но с одним существенным изменением. DOTAP непосредственно растворяли в сквалене и не использовали органический растворитель. Было обнаружено, что включение растворителя в эмульсии, содержащие более, чем 1,6 мг/мл DOTAP, приводило к образованию пенистого исходного материала, который не мог подвергаться микрофлюидизации с продуцированием эмульсии. Нагревание сквалена до 37°C приводило к непосредственному растворению DOTAP в сквалене, после чего масляная фаза могла легко диспергироваться в водной фазе (например, посредством гомогенизации) с образованием эмульсии. DOTAP растворяется в сквалене, а поэтому, могут быть достигнуты более высокие концентрации DOTAP в сквалене, чем концентрации, перечисленные в таблице 1. Однако, сообщалось, что высокая доза DOTAP может давать токсические эффекты. См., например, Lappalainen et al., Pharm. Res., vol. 11(8): 1127-31 (1994).
Вкратце, сквален нагревали до 37°C, и DOTAP непосредственно растворяли в сквалене в присутствии SPAN 85. Полученную масляную фазу объединяли с водной фазой (твином 80 в цитратном буфере) и непосредственно гомогенизировали в течение 2 минут с использованием гомогенизатора IKA T25 при 24000 об/мин с получением гомогенного исходного материала (первичных эмульсий). Первичные эмульсии 3-5 раз пропускали через микрофлюидизатор M-110S или M-110P (Microfluidics, Newton, MA), снабженный ледяной баней с охлаждающей спиралью и работающий при давлении гомогенизации приблизительно при 15000-20000 фунтов/кв.дюйм. Партии по 20 мл образцов вынимали из устройства и хранили при 4°C.
При этом, следует отметить, что концентрации компонентов CNE, указанные в таблице 1, представляют собой концентрации, вычисленные по исходным количествам компонентов, которые были использованы для получения эмульсий. Следует также отметить, что в процессе получения эмульсий или в процессе стерилизации на фильтре, небольшие количества сквалена, DOTAP или других компонентов могут теряться, и фактические концентрации этих компонентов в конечном продукте (например, в упакованной и в стерилизованной эмульсии, готовой для введения) могут быть несколько ниже, иногда приблизительно на 20%. В некоторых случаях, фактические концентрации этих компонентов в конечном продукте могут быть несколько ниже, например, приблизительно на 20% или приблизительно на 35%. Однако, в соответствии с общей практикой, вместо фактической концентрации в конечном продукте указывают концентрацию конкретного компонента исходя из начального количества, используемого для получения эмульсии.
Синтез РНК
Плазмидную ДНК, кодирующую альфавирусный репликон (аутореплицирующуюся РНК), использовали в качестве матрицы для синтеза РНК in vitro. Каждый репликон содержит генетические элементы, которые требуются для репликации РНК, но в которых отсутствуют последовательности, кодирующие генные продукты, необходимые для сборки частиц. Структурные гены альфавирусного генома были заменены последовательностями, кодирующими гетерологичный белок (экспрессия которого запускается субгеномным промотором альфавируса). После доставки репликонов в эукариотические клетки, РНК с (+)-цепью транслируется с образованием четырех неструктурных белков, где в указанных клетках реплицируется геномная РНК и транскрибируются избыточные субгеномные мРНК, кодирующие гетерологичный белок. Из-за отсутствия экспрессии альфавирусных структурных белков, репликоны не способны генерировать инфекционные частицы. Промотор бактериофага Т7 расположен выше кДНК альфавируса, что облегчает синтез РНК репликона in vitro, а рибозим вируса гепатита дельта (HDV) расположен непосредственно ниже поли(A)-хвоста, в результате чего продуцируется «правильный» 3'-конец благодаря его способности к самоотщеплению.
После линеаризиции плазмидной ДНК, расположенной ниже рибозима HDV, под действием подходящей рестриктирующей эндонуклеазы, конечные транскрипты синтезировали in vitro с использованием ДНК-зависимой РНК-полимеразы бактериофагов T7 или SP6. Транскрипцию осуществляли в течение 2 часов при 37°C в присутствии каждого из нуклеозид-трифосфатов (ATP, CTP, GTP и UTP) с использованием конечной концентрации 7,5 мМ РНК-полимеразы T7 или 5 мМ РНК-полимеразы SP6 в соответствии с инструкциями производителей (Ambion, Austin, TX). После транскрипции, матричную ДНК гидролизовали ДНКазой TURBO (Ambion, Austin, TX). РНК-репликон осаждали хлоридом лития (LiCl) и восстанавливали в воде, не содержащей нуклеазы. Некэпированную РНК подвергали посттранскрипционному кэпированию с помощью фермента, кэпирующего вирус коровьей оспы (VCE) с использованием кэпирующей системы ScriptCap m7G (Epicentre Biotechnologies, Madison, WI), как описано в руководстве по применению. Посттранскрипционно кэпированную РНК осаждали хлоридом лития (LiCl) и восстанавливали в воде, не содержащей нуклеазы. Альтернативно, репликоны могут быть кэпированы путем проведения дополнительных реакций транскрипции с 6 мМ (для РНК-полимеразы T7) или 4 мМ (для РНК-полимеразы SP6) m7G(5')ppp(5')G, необратимого аналога кэп-структуры (New England Biolabs, Beverly, MA), и снижения концентрации гуанозинтрифосфата до 1,5 мМ (для РНК-полимеразы T7) или 1 мМ (для РНК-полимеразы SP6). Затем транскрипты могут быть очищены путем гидролиза ДНКазой TURBO (Ambion, Austin, TX) с последующим LiCl-осаждением и промывкой в 75% этаноле.
Концентрацию образцов РНК определяли путем измерения оптической плотности на 260 нм. Целостность транскриптов in vitro подтверждали с помощью электрофореза в денатурирующем агарозном геле на присутствие полноразмерной конструкции.
Образование комплексов с РНК
Азотное число в растворе вычисляли исходя из концентрации катионного липида, DOTAP, и такое число составляло 1 атом азота, который может быть протонирован, на молекулу. Концентрацию РНК использовали для вычисления количества фосфата в растворе исходя из 3 нмоль фосфата на микрограмм РНК. Путем изменения количества РНК по отношению к липиду может быть изменено отношение N/P. РНК образует комплекс с CNE при различных отношениях азот/фосфат (N/P). Отношение N/P определяли путем вычисления молярного числа протонированного азота в эмульсии на миллилитр. Для определения фосфатного числа использовали постоянную величину 3 нмоль фосфата на микрограмм используемой РНК. После определения этих величин, к РНК добавляли эмульсию в соответствующем отношении. С использованием этих величин, РНК разводили до соответствующей концентрации и непосредственно добавляли к равному объему эмульсии при легком вихревом перемешивании. Полученный раствор оставляли приблизительно на 2 часа при комнатной температуре. После образования комплекса, полученный раствор разводили до соответствующей концентрации и использовали в течение 1 часа.
Гранулометрический анализ частиц
Размер частиц эмульсии определяли с помощью прибора Zetasizer Nano ZS (Malvern Instruments, Worcestershire, UK) в соответствии с инструкциями производителей. Размер частиц выражали как Z-среднее (ZAve) и показатель полидисперсности (pdi). До проведения измерений, все образцы разводили водой. Кроме того, размер частиц эмульсии определяли с помощью анализатора частиц Horiba LA-930 (Horiba Scientific, USA). До проведения измерений, все образцы разводили водой. Z-потенциал измеряли с помощью устройства Zetasizer Nano ZS с использованием разведенных образцов в соответствии с инструкциями производителей.
Анализ на секрецию щелочной фосфатазы (SEAP)
Для оценки кинетики и определения количества продуцируемого антигена, мышам внутримышечно вводили РНК-репликон, кодирующий SEAP, в присутствии и в отсутствии препарата. Самок 8-10-недельных мышей Balb/C (в группах по 3 или 5 животных) весом приблизительно 20 граммов иммунизировали комплексом CNE с РНК-репликоном, кодирующим SEAP. «Оголенную» РНК получали в 1 х PBS без РНКазы. В четырехглавую мышцу каждой мыши вводили дозу 100 мкл (по 50 мкл на каждый участок). Пробы крови брали через 1, 3 и 6 дней после инъекции. Сыворотку выделяли из крови сразу после сбора и хранили при -30°C до использования.
Сыворотку анализировали с помощью хемилюминесцентного анализа на SEAP с использованием системы Phospha-Light System (Applied Biosystems, Bedford, MA). Мышиную сыворотку разводили 1:4 в 1х буфере Phospha-Light для разведения. Пробы сыворотки помещали на водяную баню, герметично закрытую алюминиевой фольгой, и подвергали термоинактивации в течение 30 минут при 65°C. После охлаждения на льду в течение 3 минут и уравновешивания до комнатной температуры, в лунки добавляли 50 мкл аналитического буфера Phospha-Light, и пробы оставляли на 5 минут при комнатной температуре. Затем добавляли 50 мкл реакционного буфера, содержащего 1:20 CSPD® (хемилюминесцентного субстрата щелочной фосфатазы), и люминесценцию измеряли после 20-минутного инкубирования при комнатной температуре. Люминесценцию определяли на люминометре Berthold Centro LB 960 (Oak Ridge, TN) с интеграцией в 1 секунду на лунку. Активность SEAP в каждом образце определяли в дубликатах и представляли как среднее для этих двух измерений.
Пример 2: Влияние размера частиц на иммуногенность
В этом примере показано, что размер частиц влияет на иммуногенность CNE/РНК-препаратов.
A. Протокол гранулометрического анализа частиц и in vivo анализ на SEAP описаны в примере 1. Протоколы исследований иммуногенности мышей описаны в примере 3. На фиг. 1A представлены результаты (арифметическое средее) анализа на SEAP in vivo. На фиг. 1B представлены общие титры IgG для каждой мыши BALB/c, определенные с интервалами времени 2wp1 (через 2 недели после 1 иммунизации) и 2wp2 (через 2 недели после 2 иммунизации).
Образование комплекса РНК с CNE17 приводило к увеличению размера эмульсионных частиц приблизительно от 220 нм до 300 нм. Как показано на фиг. 1A и 1B, по мере увеличения размера частиц снижались уровни экспрессии SEAP, а также снижались уровни иммунных ответов у хозяина.
B. CMF34, полученный с частицами различных размеров, подвергали реакции образования комплекса с РНК, кодирующей RSV-F, при теоретическом отношении N/P=7:1, и инъецировали билатерально в четырехглавую мышцу мышей Balb/C (0,05 мл/участок). Размеры эмульсионных частиц модулировали путем увеличения рабочего давления в микрофлюидизаторе. Данные (таблица 2) показали, что самые высокие титры анти-RSVF антител наблюдались при уменьшении размера эмульсионных частиц (ср. частицы 120 нм и 90 нм) через две недели после первой иммунизации.
|
Пример 3: Влияние буферных композиций на иммуногенность и размер частиц
В этом примере описано получение различных эмульсий на основе CNE17, но с различными буферными компонентами. В таблице 3 указан состав эмульсий, модифицированных буфером.
|
Анализ на связывание in vitro показал, что снижение концентрации цитратного буфера приводит к более тесному связыванию с РНК.
Результаты исследований на иммуногенность у мышей показали, что добавление сахаров к CNE17 не оказывает какого-либо значительного влияния на иммуногенность препарата CNE17, содержащего РНК (таблица 4, группы 9-12)). При добавлении сорбита и декстрозы наблюдалось небольшое увеличение титров IgG.
|
В таблице 5 систематизированы результаты проводимых на мышах исследований на иммуногенность препарата CNE17, содержащего РНК и полученного с использованием различных буферных систем.
|
|
На размер частиц также влияли различные составы буферов. Как показано на фиг. 2A, добавление сахара (сахарозы) приводило к снижению размера частиц комплекса РНК/CNE; добавление низких концентраций NaCl (10 мM) также приводило к снижению размера частиц комплекса РНК/CNE (фиг. 2A). Цитратный буфер не влиял на размер частиц комплекса РНК/CNE (фиг. 2В).
Влияние полимеров на размер частиц проиллюстрировано на фиг. 2C. В частности, добавление 0,5% плюроника F127 к РНК-содержащему буферу приводило к снижению размера частиц комплекса РНК/CNE до размера, наблюдаемого перед образованием комплекса (частиц CNE без РНК).
Титры всех антител и титры нейтрализующего антитела против CNE17 в предпочтительных буферных системах, содержащих 280 мM сахарозы, 10 мM NaCl и 1 мM цитрата или 280mM сахарозы, 10 мM NaCl, 1 мM цитрата и 0,5% (масс./об.) плюроника F127, представлены в таблице 5 (группы 4 и 5).
Пример 4: Влияние отношения N/P на иммуногенность
В этом примере, РНК-репликон vA375, кодирующий антиген RSV F и полученный в виде липосомы (RV01), образовывал комплекс с CNE17 в отношении N/P=10:1, и с CMF32 или CMF34 в теоретическом отношении N/P=12:1, 10:1, 8:1, 6:1 и 4:1. Теоретические отношения N/P представляют собой отношения N/P, вычисленные по исходным количествам DOTAP и РНК, которые были использованы для получения препаратов. Фактические отношения N/P были несколько меньше, чем теоретические отношения N/P, поскольку небольшое количество DOTAP терялось в процессе приготовления эмульсий. Данные GMT означают средний log10-титр для отдельных мышей в каждой группе (8 мышей/группу). Перед иммунизацией, все препараты доводили до уровня 300 мОсм/кг с использованием сахарозы. При использовании препаратов CMF32 или CMF34, каких-либо явных проблем с их переносимостью пациентами не наблюдалось (например, с точки зрения массы тела и сывороточных цитокинов на ранней стадии).
Фактические отношения N/P определяли путем количественной оценки содержания DOTAP в партиях CNE или CMF с помощью ВЭЖХ на зарядном аэрозольном детекторе (Corona Ultra, Chelmsford, MA). Образцы CNE и CMF разводили в изопропаноле и наносили путем впрыска на колонку XTera C18 размером 4,6×150 мм × 3,5 мкм (Waters, Milford, MA). Площадь под кривой вычисляли исходя из пика DOTAP на хроматограмме, и концентрацию интерполировали по стандартной кривой для DOTAP. С использованием фактической концентрации DOTAP вычисляли фактическое отношение N/P.
Данные по иммуногенности, представленные в таблице 6, показали, что хорошие титры наблюдались в том случае, когда фактическое отношение N/P составляло по меньшей мере 4:1.
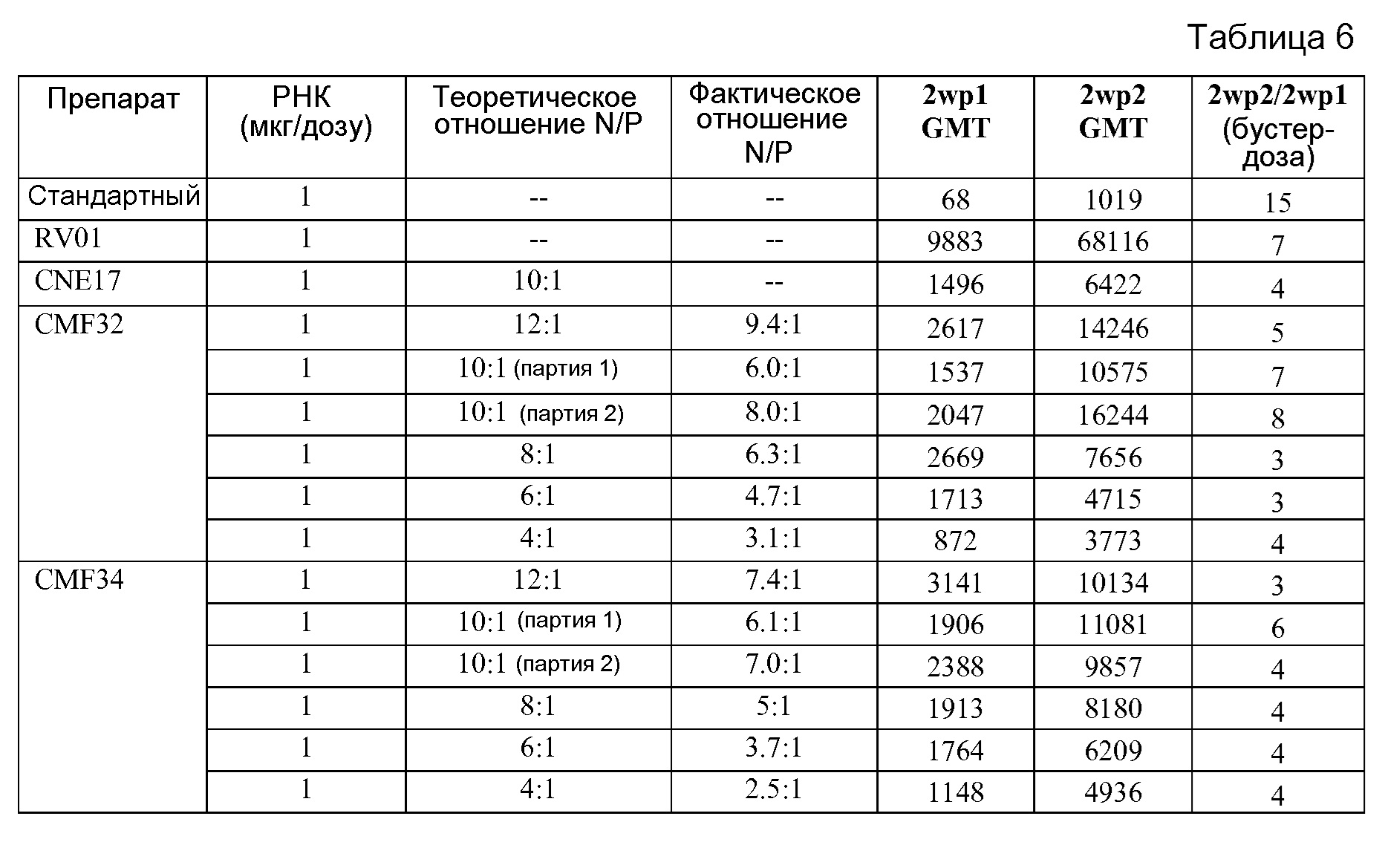
Последовательности
A317 (SEQ ID NO:1)
A375 (SEQ ID NO:2)
Для лучшего понимания изобретения следует обратиться к работам, цитируемым в настоящем описании. Варианты осуществления изобретения приводятся в настоящем описании лишь в целях иллюстрации, и не должны рассматриваться как ограничение объема изобретения. Для специалиста в данной области совершенно очевидно, что настоящее изобретение может включать множество других вариантов. Все публикации и патенты, цитируемые в настоящем описании, во всей своей полноте вводятся в это описание посредством ссылки. Если материал, включенный посредством ссылки, в каком-либо отношении противоречит или не соответствует материалу, описанному в настоящей заявке, то любой такой материал будет удален из настоящего описания. Цитирование в данной заявке любых известных работ не означает, что эти цитируемые работы являются прототипами настоящего изобретения.
Специалистам в данной области будет очевидно, или с помощью лишь рутинного экспериментирования ими может быть установлено, что описанные здесь конкретные варианты осуществления изобретения могут иметь много эквивалентов. При этом, предусматривается, что такие эквиваленты входят в объем вариантов осуществления изобретения.