Результат интеллектуальной деятельности: СПОСОБЫ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 4-ОКСООКТАГИДРОИНДОЛ-1-КАРБОНОВОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫЕ
Вид РИД
Изобретение
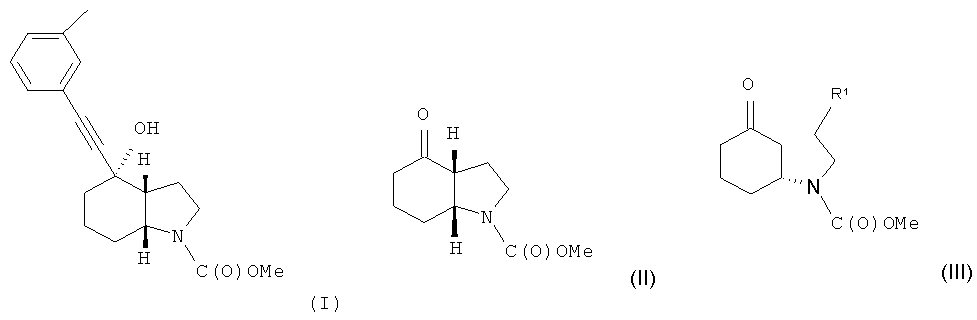
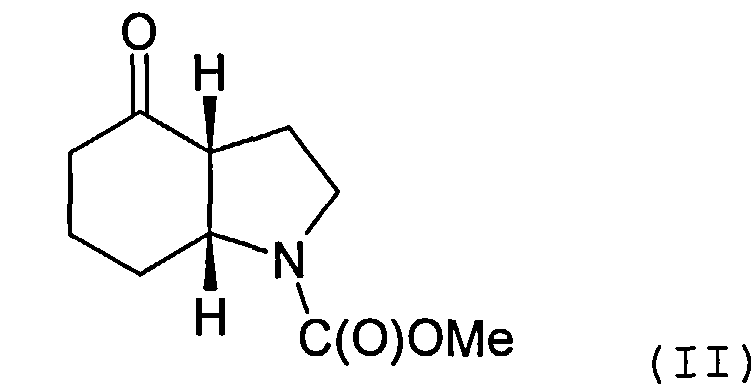
Настоящее изобретение относится к способу получения энантиомеров (2-хлорэтил)(3-оксоциклогексил)алкилового эфира карбаминовой кислоты и энантиомеров 1-карбалкокси-4-кетопергидроиндола.
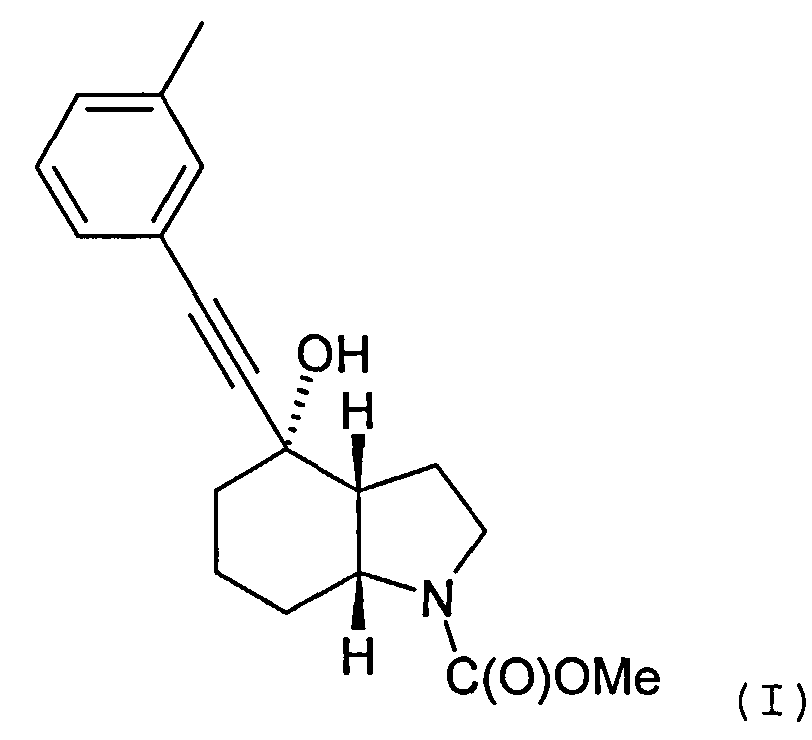
В международной заявке на изобретение WO 03/47581 описывается ряд производных ацетилена, проявляющих активность в отношении человеческих метаботропных глутаматных рецепторов (mGluR). В частности, описывается соединение метиловый эфир (3aR, 4S, 7аR)-4-гидрокси-4-; и-толилэтинилоктагидроиндол-1-карбоновой кислоты, который может быть получен в форме свободного основания или кислотно-аддитивной соли и отвечает формуле (I)
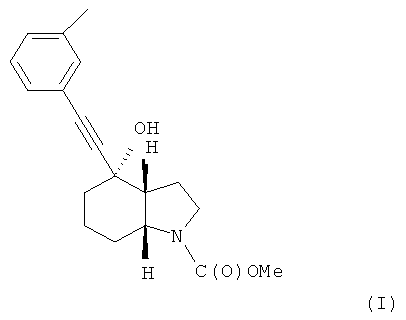
В международной заявке на изобретение WO 03/47581 также описывается способ получения вышеупомянутого соединения, который включает гидрирование производного 1,5,6,7-тетрагидроиндол-4-она. Стадия гидрирования является неудобной, характеризуется низким выходом и низкой селективностью в отношении (3aR, 4S, 7aR)-стереоизомера. Также образуется нежелательный побочный продукт.
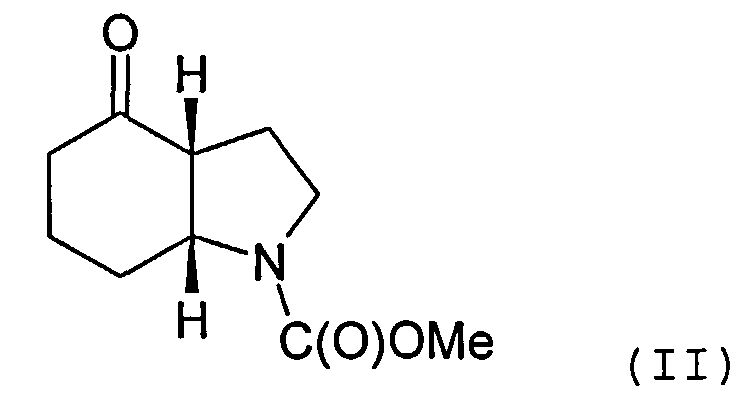
Объектом настоящего изобретения является альтернативный способ получения соединения формулы (I) или его фармацевтически приемлемой соли, включающий взаимодействие 3-этинилтолуола с соединением формулы (II) или его солью
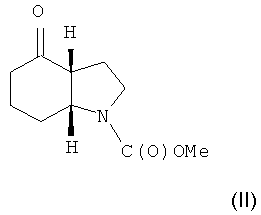
с целью получения соединения формулы (I) и, необязательно, преобразования соединения формулы (I) в фармацевтически приемлемую соль.
Вышеуказанное взаимодействие предпочтительно осуществляют в присутствии основания, обеспечивающего депротонирование этинильной группы. В одном из вариантов осуществления настоящего изобретения основание является алкиллитиевым реагентом, таким как н-гексиллитий. Реакция может быть осуществлена в апротонном растворителе, таком как тетрагидрофуран.
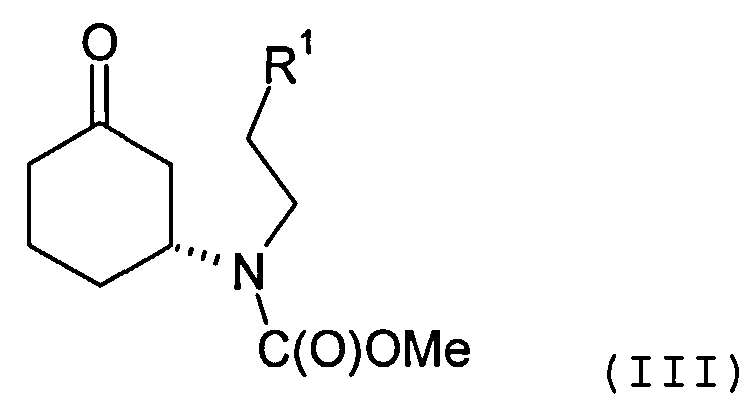
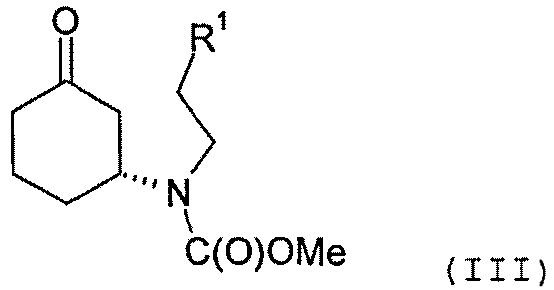
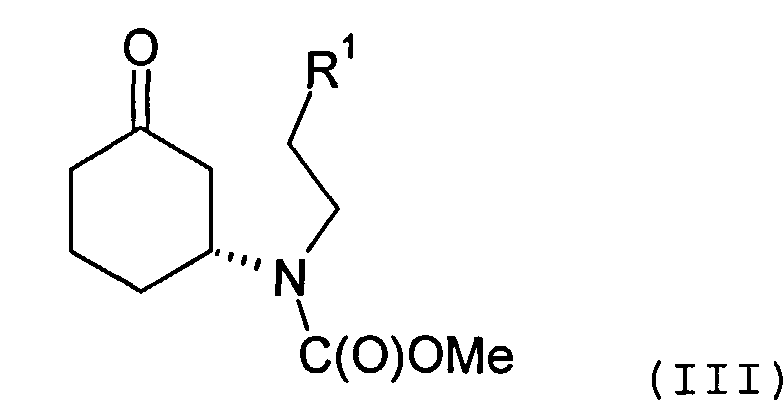
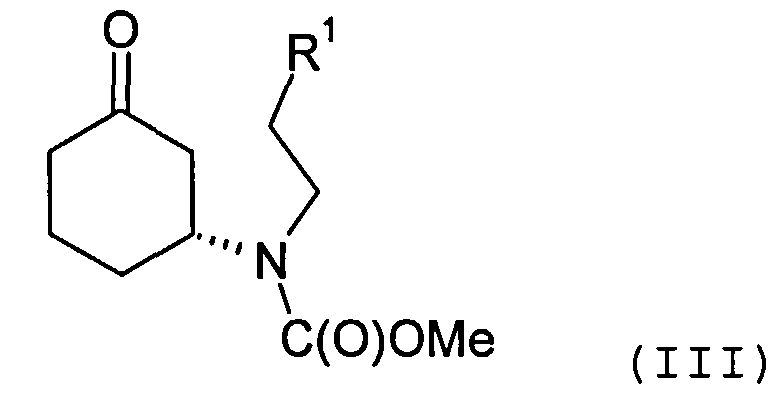
Соединение формулы (II) может быть получено посредством циклизации соединения формулы (III) или его соли
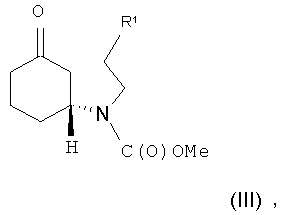
в которой R1 представляет собой уходящую группу.
Циклизация может быть осуществлена с помощью основания, депротонирующего положение 2 циклогексанонового кольца. В качестве примера, основание может включать смесь пирролидина и триэтиламина. Реакция может быть осуществлена в органическом растворителе, таком как толуол.
Подходящие уходящие группы, обозначаемые символом R, должны быть очевидны для специалиста в соответствующей области и включают, например, галоид, например хлор, бром или иод, тозилаты, мезилаты, алкилсульфонаты, например метансульфонат, и галоидсульфонаты, например фторсульфонат.
Соединение формулы (III) предпочтительно содержит избыток (R)-энантиомера, как это отображено на вышеприведенной формуле, а более предпочтительно представляет собой изомерно чистую форму такового энантиомера. В одном из вариантов осуществления настоящего изобретения соединение формулы (III) содержит более 70%, более предпочтительно, более 90%, наиболее предпочтительно, более 95% (R)-энантиомера. Искомый энантиомер может быть получен посредством разделения энантиомерной смеси, например рацемической смеси, соединения формулы (III). В одном из вариантов осуществления настоящего изобретения разделение осуществляют с помощью хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ), использующей хиральную неподвижную фазу.
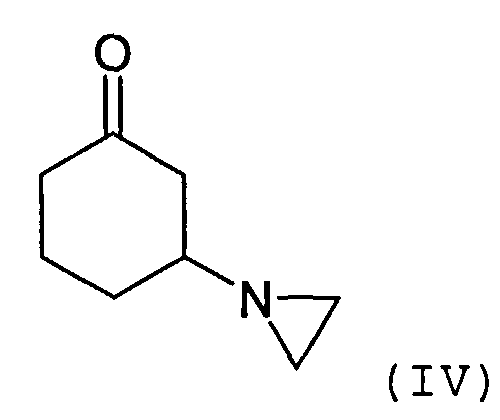
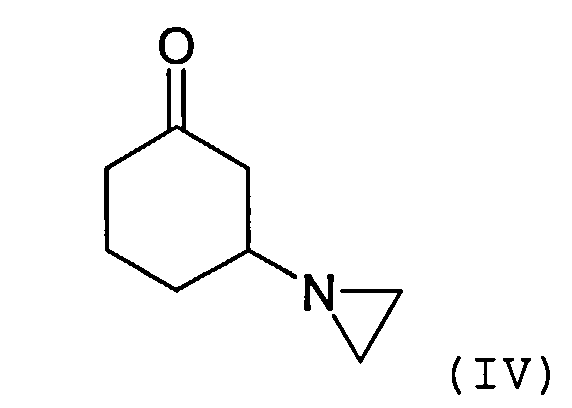
Соединение формулы (III) может быть получено посредством взаимодействия соединения формулы R1C(O)OMe с соединением формулы (IV) или его солью
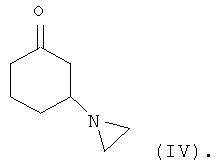
Соединение формулы (IV) может быть получено посредством взаимодействия циклогексен-2-она с азиридином или его солью. Реакция может быть осуществлена в присутствии органического растворителя, такого как толуол. Подходящие способы проиллюстрированы в приведенных ниже примерах.
Объектом настоящего изобретения являются вышеприведенные способы получения соединения формулы (I), равно как и каждая их стадия и все комбинации последовательных стадий. Как было упомянуто выше, соединение формулы (I) может быть дополнительно преобразовано в форму фармацевтически приемлемой соли, в частности в форму кислотно-аддитивной соли. Кислотно-аддитивные соли могут быть получены согласно известным способам, например, посредством добавления кислоты к последней стадии реакции или прежде перекристаллизации.
Объектом настоящего изобретения также является применение различных соединений, например, выбранных из соединений формулы (II) и (III), а также их солей, для получения соединения формулы (I) или его фармацевтически приемлемой соли.
Соединение формулы (I) или промежуточные соединения могут быть очищены и/или выделены общепринятым способом, таким как перекристаллизация, колоночная хроматография, перегонка, разделение центрифугированием, промывание или сушка.
Соединение формулы (I) или его фармацевтически приемлемая соль может быть объединена с фармацевтически приемлемым носителем или разбавителем для приготовления фармацевтической композиции.
Фармацевтические композиции согласно настоящему изобретению могут представлять собой композиции для энтерального, такого как интраназальное, перректальное или пероральное, или парэнтерального, такого как внутримышечное или внутривенное, введения теплокровным животным (людям и животным), включающие эффективную дозу фармакологически активного ингредиента, самого по себе или в сочетании со значимым количеством фармацевтически приемлемого носителя. Доза активного ингредиента зависит от вида теплокровного животного, массы тела, возраста и индивидуального состояния, индивидуальных фармакокинетических данных, подвергаемого лечению заболевания и способа введения.
Фармацевтические композиции могут содержать от, приблизительно, 1% до, приблизительно 95%, предпочтительно, от приблизительно, 20% до, приблизительно, 90%, активного ингредиента. Фармацевтические композиции согласно настоящему изобретению могут находиться, например, в форме стандартной дозировки, как то в форме ампул, флакончиков, суппозиториев, драже, таблеток или капсул.
Альтернативно, соединения могут быть введены, например, местным образом в форме крема, геля или тому подобного, или же посредством ингаляции, например, в форме сухого порошка.
Примеры композиций, содержащих средство по настоящему изобретению, включают, например, дисперсию твердых частиц, водный раствор, например, содержащий солюбилизатор, микроэмульсию и суспензию средства по настоящему изобретению. Композиция может быть забуферена до pH в диапазоне, например, от 3,5 до 9,5 с помощью подходящего буфера.
Фармацевтические композиции по настоящему изобретению могут быть приготовлены с помощью способов, которые известны сами по себе, например, с помощью общепринятых способов растворения, лиофилизации, смешения, гранулирования или изготовления подслащенных препаратов.
Соединение формулы (I) и его фармацевтически приемлемые соли применимы в лечении расстройств, связанных с нарушениями глутаматергической передачи сигналов, а также расстройств нервной системы, полностью или частично опосредованных mGluR5. Активность в отношении mGluR может быть определена согласно любому из способов, описанных в международной заявке на изобретение WO 03/047581.
Примерами расстройств, связанных с нарушениями глутаматергической передачи сигналов, являются эпилепсия, ишемические заболевания головного мозга, в особенности, острые ишемические заболевания, ишемические заболевания глаза, мышечные спазмы, такие как локальна или общая спастичность, и, в особенности, конвульсии или боль.
Расстройства нервной системы, полностью или частично опосредуемые mGluR5 включают, например, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Паркинсона, старческое слабоумие, болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессию, боль, зуд и злоупотребление наркотическими веществами, например злоупотребление алкоголем и никотином и кокаиновую наркоманию,
Для всех вышеперечисленных показаний подходящая дозировка должна, безусловно, варьироваться в зависимости от, например, задействуемого соединения, подвергаемого лечению организма, способа введения и природы и тяжести подвергаемого лечению состояния. Как правило, однако, имеются указания на достижение удовлетворительных результатов у животных при суточной дозировке от, приблизительно, 0,5 до, приблизительно, 100 мг на килограмм массы тела животного. У более крупных млекопитающих, например человека, показанная суточная дозировка находится в диапазоне от, приблизительно, 5 до, приблизительно, 1500 мг, предпочтительно, от, приблизительно, 10 до, приблизительно, 1000 мг соединения, причем ее удобно вводить в разделенных дозах до 4 раз в сутки, или же в форме с замедленным высвобождением.
Соединение формулы (I) может вводиться как индивидуально, так и в сочетании с другими фармацевтическими средствами, эффективными при лечении упомянутых выше состояний.
При показаниях, связанных с болью, соединения по настоящему изобретению могут применяться в сочетании с анальгезирующими средствами (опиатами) или с нестероидными противовоспалительными препаратами (НСПВП), такими как рофекоксиб (виокс), целекоксиб (целебрекс) или люмиракоксиб (прексиж).
Для показаний, связанных со злоупотреблением никотином, соединения по настоящему изобретению могут применяться в сочетании с бупропионом (зибан).
Объектом настоящего изобретения также является композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль в сочетании со сравнительно малой долей одного или нескольких промежуточных соединений, например, выбранных из соединений формул (II), (III) и (IV) и их солей.
Изобретение проиллюстрировано нижеследующими примерами.
3-(1-Азиридинил)циклогексанон синтезируют согласно литературным данным (J.E.Dolfini и др.. Tetrahedron Letters, №25, стр.2053-2058, 1965).
Пример 1-5: Синтез (2-хлорэтил)(3-оксониклогексил)алкилового эфира карбаминовой кислоты
21,6 ммоля 3-(1-азиридинил)циклогексанона растворяют в 15 мл толуола и охлаждают до температуры 0°C. К прозрачному раствору добавляют в продолжение 20 минут 21,6 ммоля алкилового эфира хлормуравьиной кислоты (экзотермическая реакция). Температуру поддерживают в пределах 0-10°C. Раствор цвета от желтоватого до коричневого нагревают до комнатной температуры и перемешивают еще в течение 1 часа. Растворитель и избыток реагентов отгоняют под вакуумом (60°C/20 мбар) и трижды обрабатывают остающееся маслянистое вещество 5 мл толуола с целью отгонки под вакуумом непрореагировавшего алкилового эфира хлормуравьиной кислоты, получая:
4,95 г (2-хлорэтил)(3-оксоциклогексил)метилового эфира карбаминовой кислоты (пример 1).
5,22 г (2-хлорэтил)(3-оксоциклогексил)этилового эфира карбаминовой кислоты (пример 2).
5,53 г (2-хлорэтил)(3-оксоциклогексил)пропилового эфира карбаминовой кислоты (пример 3).
5,92 г (2-хлорэтил)(3-оксоциклогексил)бутилового эфира карбаминовой кислоты (пример 4).
6,27 г (2-хлорэтил)(3-оксоциклогексил)неопентилового эфира карбаминовой кислоты (пример 5).
Пример 6-15: Синтез (R)- и (S)-(2-хлорэтил)(3-оксоциклогексил)алкилового эфира карбаминовой кислоты
5 г рацемического (2-хлорэтил)(3-оксоциклогексил)алкилового эфира карбаминовой кислоты растворяют в 50 мл смеси гептана и 2-пропанола 1/1 (об./об.) и вводят в препаративную колонку Chiralpak-AD (размер частиц: 20 мкм, размеры колонки: длина 30 см, внутренний диаметр 10 см). При использовании в качестве подвижной фазы смесь гептана 2-пропанола и метанола 90/7,5/2,5 (об./об./об.) при комнатной температуре и объемной скорости 400 мл/мин в течение 60 минут достигается полное разделение, причем R-энантиомер всегда элюируется прежде S-энантиомера. В идентичных условиях проводят второе хроматографическое разделение и объединяют соответствующие фракции. После отгонки растворителей под вакуумом получают:
4,6 г (R)-(2-хлорэтил)(3-оксоциклогексил)метилового эфира карбаминовой кислоты (пример 6).
1Н ЯМР (спектроскопия ядерного магнитного резонанса) (500 МГц, ДМСО-d6(пердейтеродиметилсульфоксид)) δ м.д. 1,47 (m, 1 Н) 1,79 (m, 1 Н) 1,92 (m, 2 Н) 2,13 (d, J=1,53 Гц, 1 Н) 2,25 (m, 1 Н) 2,31 (dt, 1 Н) 2,81 (ушир. m., 1 Н) 3,49 (t, J=7,17 Гц, 2 Н) 3,60 (s, 3 Н) 3,61-3,68 (m, 2 Н) 3,89-3,98 (m, 1 H)
4,5 г (S)-(2-хлорэтил)(3-оксоциклогексил)метилового эфира карбаминовой кислоты (пример 7).
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,47 (m, 1 Н) 1,79 (m, 1 Н) 1,92 (m, 2 Н) 2,13 (d, J=1,53 Гц, 1 Н) 2,25 (m, 1 Н) 2,31 (dt, 1 Н) 2,81 (ушир. m., 1 Н) 3,49 (t, J=7,17 Гц, 2 Н) 3,60 (s, 3 Н) 3,61-3,68 (m, 2 Н) 3,89-3,98 (m, 1 H)
4,2 г (R)-(2-хлорэтил)(3-оксоциклогексил)этилового эфира карбаминовой кислоты (пример 8)
1Н ЯМР (500 МГц, ДМСО-d6,) δ м.д. 1,17 (t,.J=7,02 Гц, 3 Н) 1,47 (m, 1 Н) 1,78 (m, 1 Н) 1,92 (m, 2 Н) 2,12 (dd, J=14,27, 1,91 Гц, 1 H) 2,25 (d, I H) 2,31 (dt, J=14,04, 7,02 Гц, 1 H) 2,80 (ушир. m., 1 H) 3,49 (t, J=7,25 Гц, 2 H) 3,63 (m, 2 H) 3,93 (m, 1 H) 4,05 (q, J=7,02 Гц, 2 H.)
4,4 г (S)-(2-хлорэтил)(3-оксоциклогексил)этилового эфира карбаминовой кислоты (пример 9)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,17 (t, J=7,02 Гц, 3 Н) 1,47 (m, 1 H) 1,78 (m, 1 H) 1,92 (m. 2 H) 2,12 (dd, J=14,27, 1,91 Гц, 1 H) 2,25 (d, 1 H) 2,31 (dt, J=14,04, 7,02 Гц, 1 H) 2,80 (ушир. m., 1 H) 3,49 (t, J=7,25 Гц, 2 H) 3,63 (m, 2 H) 3,93 (m, 1 H) 4,05 (q, J=7,02 Гц, 2 H).
3,8 г (R)-(2-хлорэтил)(3-оксоциклогексил)пропилового эфира карбаминовой кислоты (пример 10)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,47 (qt, J=13,49, 3,87 Гц, 1 Н) 1,58 (m, J=7,25, 7,00, 7,00, 7,00, 7,00 Гц, 2 Н) 1,79 (ушир. m, 1 Н) 1,92 (m, 2 Н) 2,12 (m, 1H) 2,25 (ушир. m, 1 Н) 2,29 (dt, J=14,04, 7,02 Гц, 1 Н) 2,79 (ушир. m., 1 Н) 3,50 (m, 2 Н) 3,63 (m, 2 Н) 3,85-4,09 (m, 3 Н).
3,8 г (S)-(2-хлорэтил)(3-оксоциклогексил)пропилового эфира карбаминовой кислоты (пример 11)
1Н ЯМР (500 МГц, ДМСО-d6,) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,47 (qt, J=13,49, 3,87 Гц, 1 Н) 1,58 (m, J=7,25, 7,00, 7,00, 7,00, 7,00 Гц, 2 Н) 1,79 (ушир. m, 1 Н) 1,92 (m, 2 Н) 2,12 (m, 1H) 2,25 (ушир. m, 1 H) 2,29 (dt, J=14,04, 7,02 Гц, 1 Н) 2,79 (ушир. m., 1 H) 3,50 (m, 2 H) 3,63 (m, 2 H) 3,85-4,09 (m, 3 H).
3,2 г (R)-(2-хлорэтил)(3-оксоциклогексил)-бутилового эфира карбаминовой кислоты (пример 12)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,32 (sxt, J=7,42 Гц, 2 Н) 1,47 (m, J=13,54, 3,76 Гц, 1 H) 1,55 (m, 2 H) 1,78 (ушир. s., 1 H) 1,92 (m, 2 H) 2,12 (dd, J=14,19, 1,68 Гц, 1 H) 2,25 (ушир. m, I H)2,31 (dt, J=14,11, 6,33 Гц, 1 H) 2,81 (ушир. m., 1 H) 3,49 (t, J=7,17 Гц, 2 H) 3,63 (m, 2 H) 3,93 (m, 1 H) 4,00 (t, J=6,41 Гц, 2 H).
3,4 г (S)-(2-хлорэтил)(3-оксоциклогексил)бутилового эфира карбаминовой кислоты (пример 13).
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,32 (sxt, J=7,42 Гц, 2 Н) 1,47 (m, J=13,54, 3,76 Гц, 1 H) 1,55 (m, 2 H) 1,78 (ушир. s., 1 H) 1,92 (m, 2H) 2,12(dd, J=14,19, 1,68 Гц, 1 H) 2,25 (ушир. m, 1 H)2,31 (dt, J=14,11, 6,33 Гц, 1 H) 2,81 (ушир. m., 1 H) 3,49 (t,J=7,17 Гц, 2 H) 3,63 (m, 2 H) 3,93 (m, 1 H) 4,00 (t, J=6,41 Гц, 2 H).
4,8 г (R)-(2-хлорэтил)(3-оксоциклогексил)неопентилового эфира карбаминовой кислоты (пример 14)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,90 (s, 9 Н) 1,47 (m, 1 H) 1,79 (ушир. m, 1 Н) 1,94 (ушир. m, 2 Н) 2,13 (m, 1 Н) 2,24 (ушир. m, 1 Н) 2,31 (dt, J=14.04, 6,10 Гц, 1 Н) 2,82 (ушир. m, 1 Н) 3,52 (t, J=7,17 Гц, 2 Н) 3,64 (m, 2 Н) 3,73 (ушир. m., 2 Н) 3,94 (m, 1 Н).
5,2 г (S)-(2-хлорэтил)(3-оксоциклогексил)неопентилового эфира карбаминовой кислоты (пример 15)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,90 (s, 9 Н) 1,47 (m, 1 H) 1,79 (ушир. m., 1 Н) 1,94 (ушир. m., 2 Н) 2,13 (m, 1 Н) 2,24 (ушир. m, 1 Н) 2,31 (dt, J=14,04, 6,10 Гц, 1 Н) 2,82 (ушир. m, 1 Н) 3,52 (t, J=7,17 Гц, 2 Н) 3,64 (m, 2 Н) 3,73 (ушир. m., 2 Н) 3,94 (m, 1 Н).
Пример 16-20: Синтез 1-карбалкокси-4-кетопергидроиндола
15 ммолей (2-хлорэтил)(3-оксоциклогексил)алкилового эфира карбаминовой кислоты растворяют в 15 мл хлористого метилена. К раствору оранжевого цвета добавляют 1,07 г пирролидина и 1,52 г триэтиламина. Реакционную смесь перемешивают в течение 16 часов при комнатной температуре, после чего разбавляют 45 мл изопропилацетата и 30 мл воды. Доводят pH эмульсии при перемешивании до pH=2 и продолжают перемешивание еще в течение 30 минут. После разделения фаз дважды экстрагируют водную фазу 20 мл изопропилацетата и трижды промывают объединенные органические фракции водой в объеме по 20 мл. Отгоняя растворитель под вакуумом (50°C/20 мбар), получают:
|
Пример 21-30: Синтез (S,S)- и (R,R-1-карбалкокси-4-кетопергидроиндола
5 г рацемического 1-карбалкокси-4-кетопергидроиндола растворяют в 50 мл смеси гептана и 2-пропанола 1/1 (об./об.) и вводят в препаративную колонку Chiralpak-AD (размер частиц: 20 мкм, размеры колонки: длина 30, внутренний диаметр 10 см). При использовании в качестве подвижной фазы смесь гептана 2-пропанола и метанола 90/7,5/2,5 (об./об./об.) при комнатной температуре и объемной скорости 400 мл/мин в течение 60 минут достигается полное разделение, причем S,S-энантиомер всегда элюируется прежде R,R-энантиомера. В идентичных условиях проводят второе хроматографическое разделение и объединяют соответствующие фракции. После отгонки растворителей под вакуумом получают
2,5 г (S,S)-1-карбометокси-4-кетопергидроиндол (пример 21)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,58 (ушир. m., 2 Н) 1,73 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,01 (m, 1 Н) 2,14 (m, 1 Н) 2,19 (m, 1Н) 2,37 (td, J=10,76, 5,65 Гц, 1 Н) 2,82 (m, 1 Н) 3,29 (m, 2 Н) 3,57 (s, 3 Н) 4,04 (m, 1 Н).
2,4 г (R,R)-1-карбометокси-4-кетопергидроиндол (пример 22)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,58 (ушир. m., 2 Н) 1,73 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,01 (m, 1 Н) 2,14 (m, 1 Н) 2,19 (m, 1Н) 2,37 (td, J=10,76, 5,65 Гц, 1 Н) 2,82 (m, 1 Н) 3,29 (m, 2 Н) 3,57 (s, 3 Н) 4,04 (m, 1 Н).
1,5 г (S,S)-1-карбэтокси-4-кетопергидроиндол (пример 23)
1ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,16 (t, J=7,10 Гц, 3 Н) 1,57 (m, 2 Н) 1,75 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,02 (d, J=4,58 Гц, 1 Н) 2,13 (m, 1 Н) 2,19 (m, 1Н) 2,38 (td, J=10,64, 5,57 Гц, 1 Н) 2,83 (m, 1 Н) 3,28 (m, 2 Н) 4,03 (m, 3 Н).
2,4 г (R,R)-1-карбэтокси-4-кетопергидроиндол (пример 24)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 1,16 (t, J=7,10 Гц, 3 Н) 1,57 (m, 2 Н) 1.75 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,02 (d, J=4,58 Гц, 1 Н) 2,13 (m, 1 Н) 2,19 (m, 1Н) 2,38 (td, J=10,64, 5,57 Гц, 1 Н) 2,83 (m, 1 Н) 3,28 (m, 2 Н) 4,03 (m, 3 Н).
2,3 г (S,S)-1-карбопропокси-4-кетопергидроиндол (пример 25)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,56 (m, 4 Н) 1.76 (ушир. m., 1 Н) 1,88 (m. 1 Н) 2,02 (m, 1 Н) 2,14 (ушир. m, 1Н) 2,05 (m, 1 Н) 2,36 (dt, J=10,68, 5,34 Гц, 1 Н) 2,83 (m, 1 Н) 3,29 (m, 2 Н) 3,93 (m, 2 Н) 4,04 (m, 1 Н).
2,1 г (R,R)-1-карбопропокси-4-кетопергидроиндол (пример 26)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,56 (m, 4 Н) 1,76 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,02 (m, 1 Н) 2,14 (ушир. m, 1Н) 2.05 (m, 1 Н) 2,36 (dt, J=10,68, 5,34 Гц, 1 Н) 2,83 (m, 1 Н) 3,29 (m, 2 Н) 3,93 (m, 2 Н) 4,04 (m, 1 Н).
2,3 г (8,8)-1-карбобутокси-4-кетопергидроиндол (пример 27)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0.88 (t, J=7.40 Гц, 3 Н) 1,32 (dq, J=14,97, 7,42 Гц, 2 Н) 1,54 (m, 4 Н) 1,75 (ушир. m., 1 Н) 1,88 (m, 1 H) 2,02 (m, 1 Н) 2,13 (ушир. m, 1 H) 2,19 (m, 1Н) 2,73 (dt, J=10,83, 5,42 Гц, 1 H) 2,83 (m, 1 H) 3,29 (m, 2 H) 3,99 (m, 3 H).
2,0 г (R,R)-1-карбобутокси-4-кетопергидроиндол (пример 28)
1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,88 (t, J=7,40 Гц, 3 Н) 1,32 (dq, J=14,97, 7,42 Гц, 2 Н) 1,54 (m, 4 Н) 1,75 (ушир. m., 1 Н) 1,88 (m, 1 Н) 2,02 (m, 1 Н) 2,13 (ушир. m, 1 Н) 2,19 (m, 1Н) 2,73 (dt, J=10,83, 5,42 Гц, 1 Н) 2,83 (m, 1 Н) 3,29 (m, 2 Н) 3,99 (m, 3 Н).
1,7 г (8,8)-1-карбонеопентокси-4-кетопергидроиндол (пример 29)
1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,90 (s, 9 Н) 1,59 (m, 2 Н) 1,75 (ушир. sm, 1 Н) 1,90 (m, 1 Н) 2,03 (m, 1 Н) 2,14 (ушир. M, 1Н) 2,20 (m, 1 Н) 2,36 (dt, m=10,83, 5,34 Гц, 1 Н) 2,84 (m, 1 Н) 3,33 (m, 2 Н) 3,68 (ушир. m, 2 Н) 4,07 (ушир. m., 1 Н).
1,5 г (К.,К)-1-карбонеопенокси-4-кетопергидроиндол (пример 30)
1Н ЯМР (500 МГц, ДМСО-d6) δ м.д. 0,90 (s, 9 Н) 1,59 (m, 2 Н) 1,75 (ушир. sm, 1 Н) 1,90 (m, 1 Н) 2,03 (m, 1 Н) 2,14 (ушир. M, 1Н) 2,20 (m, 1 Н) 2,36 (dt, J=10,83, 5,34 Гц, 1 Н) 2,84 (m, 1 Н) 3,33 (m, 2 Н) 3,68 (ушир. m, 2 Н) 4,07 (ушир. m., 1 H).