Результат интеллектуальной деятельности: Способ получения мультипотентных стромальных клеток из криозамороженных тканей фетоплацентарного комплекса
Вид РИД
Изобретение
Изобретение относится к криобиологии и медицине и может найти применение в области банкирования биоресурсов для обеспечения развития ауто- и аллогенной клеточной трансплантологии как одного из терапевтических подходов лечения социально значимых заболеваний. Изобретение позволяет подготовить ткани фетоплацентарного комплекса, включающего пупочный канатик, плодную часть плаценты и амнион, к длительному криохранению с их дальнейшим использованием в качестве источника мультипотентных стромальных клеток (МСК), пригодных для трансплантации.
Еще в 70-х годах прошлого века было показано, что пуповинная кровь является источником гемопоэтических стволовых и прогениторных клеток [Knudtzon S., 1974], однако остальные ткани фетоплацентарного комплекса долгое время считались просто биологическим отходом, не представлявшим научной ценности. Отношение к пупочному канатику было кардинальным образом пересмотрено, когда McElreavey и соавт. впервые описали культуру выделенных из вартонова студня пупочного канатика фибробластоподобных клеток [McElreavey K.D., 1991], а в 2004 году Wang H.S. и соавт. доказали их принадлежность к МСК [Wang H.S., 2004]. В это же время была продемонстрирована возможность получения прогениторных клеток, имевших схожие характеристики in vitro с МСК костного мозга, из терминальной плаценты человека [Wulf G.G., 2004]. В 2007 году было принято решение относительно перечня требований к культивируемым клеткам, выделенным из стромы плодной части плаценты и стромы амниона, необходимых для подтверждения принадлежности данных культур к МСК [Parolini О., 2008].
Таким образом, фетоплацентарный комплекс уже более 10 лет рассматривается в качестве транзиентного источника уникальных МСК, поскольку по совокупности биологических свойств представляют собой промежуточный вариант (в англоязычной литературе "bridge") между эмбриональными и постнатальными МСК [Taghizadeh R.R., 2011]. Это означает, что МСК, выделенные из пупочного канатика, плодной части плаценты и амниона, имеет ряд преимуществ относительно МСК, выделенных из тканей взрослого организма. Показано, что неонатальные МСК обладают более высокими пролиферативным потенциалом, пластичностью и иммуномодулирующей активностью [Malek А., 2011; Lv F., 2012; Li X., 2014]. Экспрессия маркеров плюрипотентности (SOX2, NANOG) в неонатальных МСК выше, чем в МСК костного мозга [Sabapathy V, 2012; Sabapathy V., 2014], но ниже, чем в эмбриональных стволовых клетках (ЭСК) [Wang X.Y., 2008]. Возможно, именно этим объясняется важнейшее отличие МСК фетоплацентарного комплекса от ЭСК: отсутствие неопластической трансформации при трансплантации иммунодефицитным животным [Gauthaman К., 2012].
Отсутствие этических проблем и необходимости применения инвазивных технологий при получении тканей фетоплацентарного комплекса, 100% эффективность выделения [Bieback К., 2010], высокая теломеразная активность и стабильность кариотипа [Karahuseyinoglu S., 2007; Sabapathy V, 2012; Ruan Z.B., 2014], минимальные иммуногенные свойства и отсутствие туморогенности [Weiss M.L., 2008], высокая иммуномодулирующая активность [Fierabracci А, 2015] делают данный тип клеток привлекательным объектом исследования для научных и клинических лабораторий. В настоящее время в FDA в соответствии с данными интернет-портала http://www.clinicaltrials.gov/ зарегистрированы десятки клинических испытаний (1-3 фаза) безопасности и эффективности применения нативных аллогенных МСК плаценты и пупочного канатика для терапии социально значимых заболеваний. Опубликованы обнадеживающие результаты 2-3 фазы клинических исследований безопасности и эффективности трансплантации МСК пупочного канатика для лечения диабета I типа (NCT01219465), системной красной волчанки (NCT01741857, NCT00698191), бронхолегочной дисплазии (NCT01297205), ВИЧ-инфекции (NCT01213186), первичного билиарного цирроза (NCT01662973), печеночно-клеточной недостаточности (NCT01218464) и трансплантации МСК плаценты для лечения идиопатического фиброза легких (NCT01385644).
В ЕС зарегистрирован клеточный продукт на основе МСК пупочного канатика человека - UCX®, производимый компанией ECBIO (Амадора, Португалия). В настоящее время идет работа по характеристике UCX® в соответствии с требованиями, установленными Директивой 2001/83/ЕС и Предписанием ЕС №1394/2007, для дальнейшего применения его в качестве АТМР (Advanced-therapy medicinal products) - медицинского продукта на основе генной и клеточной технологий или тканевой инженерии [Martins J.P., 2014].
МСК, полученные из плаценты человека, также являются зарегистрированным клеточным продуктом PDAC® (placenta-derived adherent cells), производимым компанией Celgene (Саммит, США). Для клинического применения разработаны 2 модификации - PDA-001 для внутривенного введения и PDA-002 для внутримышечного. Оба варианта используются в клинических испытаниях, зарегистрированных FDA: NCT01440192, NCT01769755, NCT01310114 и др. для PDA-001 и NCT02552277, NCT01859117, NCT02264288 и др. для PDA-002.
Однако у фетоплацентарного комплекса как источника МСК есть некоторые ограничения. Прежде всего, аутогенные МСК из данного комплекса тканей можно получить лишь однажды за все время существования индивидуума - при его рождении. Современные биобанки ввели новый вид услуг - хранение культивированных МСК пупочного канатика и плаценты. Среди таких банков -старейший Cryo-Cell International, Inc. (Тампа, США), Precious Cells BioBank HQ (Лондон, Великобритания), Reliance Life Sciences (Нави Мумбаи, Индия), Thai HealthBaby (Бангкок, Тайланд), Stemlife (Медоубрук, Австралия), Покровский банк стволовых клеток (Санкт-Петербург, Россия). Однако следует учитывать, что для получения достаточного для трансплантации объема охарактеризованного биологического материала необходимо использовать значительное количество ресурсов (реактивов, оборудования, трудозатрат), при этом воспользоваться данным материалом самому донору материала, возможно, никогда не понадобится. На наш взгляд, решением данной проблемы является разработка способа выделения культуры МСК из криозамороженных тканей фетоплацентарного комплекса при возникновении необходимости.
Ранее считалось, что получение культуры МСК из замороженных фрагментов пупочного канатика и плаценты невозможно [Chatzistamatiou Т.К., 2014], однако недавние работы показывают обратное. Действительно, замораживание ткани без использования криопротектора приводит к гибели всех клеток [Shimazu Т., 2015]; но тщательный подбор криопротектора и режима охлаждения все же позволяет выделить культуру МСК из криоконсервированной ткани [Da-Croce L., 2013; Badowski М., 2014; Roy S., 2014; Shimazu Т., 2015]. Особое внимание при этом исследователи уделяют составу криопротекторной среды: наличие в ней ксеногенных белков (в виде эмбриональной телячьей сыворотки) значительно снижает эффективность выделения первичной культуры [Roy S., 2014; Shimazu Т., 2015]. Одним из наиболее распространенных и эффективных проникающих криопротекторов для клеточных культур является ДМСО, однако опубликованы данные о возможной токсичности ДМСО как для самих клеток, так и токсичности ДМСО-криоконсервированных клеток для реципиента [Fahy GM., 2010; Ruiz-Delgado GJ., 2009]. Наличие диметилсульфоксида (ДМСО) в криопротекторной среде следует отнести к недостаткам используемых в настоящее время методик криоконсервирования тканей.
В последнее время все больше работ посвящено культивированию МСК без использования ксеногенных компонентов (xeno-free стандарт культивирования). Показано, что данные условия не влияют на ростовые характеристики, иммунофенотип и дифференцировочный потенциал МСК [Venugopal Р., 2011; Swamynathan Р., 2014; Chen G., 2014]. Более того, в культивируемых в xeno-free условиях МСК доля апоптотических клеток ниже, уровень секреции фактора роста гепатоцитов (HGF) и простогландина Е2 выше, а сама культура менее иммуногенна [Hartmann I., 2010; Swamynathan P., 2014].
Несомненно, отказ от потенциально токсичных реактивов и введение xeno-free стандарта культивирования МСК для дальнейшего их клинического использования является вопросом времени, но криоконсервация тканей фетоплацентарного комплекса с учетом этих требований должна начаться уже сейчас.
Настоящим изобретением поставлена и решена задача получения культуры МСК из тканей фетоплацентарного комплекса (плодная часть плаценты, амнион, пупочный канатик), предварительно подвергшихся замораживанию и криохранению без использования токсичных и ксеногенных реактивов. Предлагаемый способ позволяет не только значительно улучшить выживаемость клеток в криоконсервированных фрагментах пупочного канатика и плаценты, но и в дальнейшем в минимальные сроки получать охарактеризованные культуры МСК для ауто- или аллогенных трансплантаций.
Технический результат изобретения состоит в том, что предлагаемый способ обеспечивает эффективное выделение культур МСК из криоконсервированных тканей фетоплацентарного комплекса. Кроме того, способ позволяет отказаться от использования ксеногенных и токсичных компонентов сред при криохранении ткани, а также в процессе выделения и наращивания культур МСК. Данный результат может быть достигнут за счет предлагаемой техники обработки биоматериала, подбора состава криопротекторных и культуральных сред, разработки протоколов криоконсервации, размораживания и экспансии МСК. Это позволяет при рождении ребенка поместить в криохранилище ткани фетоплацентарного комплекса и обеспечить в случае возникновения необходимости быстрое получение культур МСК для аутогенной трансплантации.
Для получения указанного результата предложен способ получения МСК из криозамороженных тканей фетоплацентарного комплекса, включающий этап транспортировки пупочного канатика и плаценты из операционного блока в культуральную лабораторию, этап первичной подготовки биоматериала (обработки ткани и ее фрагментации), этап подготовки биоматериала к криоконсервированию, этап контролируемого охлаждения ткани, этап длительного хранения биоматериала в криохранилище, этап размораживания биоматериала, этап отмывания от криопротекторной среды, этап выделения первичных клеточных культур, этап экспансии культуры МСК.
В процессе проведения исследований был разработан протокол подготовки тканей фетоплацентарного комплекса к замораживанию, подобран состав криопротекторного раствора, оптимизированы протоколы замораживания и размораживания, разработан протокол выделения первичных клеточных культур.
Была установлена важность следующих стадий реализации изобретения:
- первичный материала при родоразрешении получают путем операции кесарева сечения, т.к. в таком случае минимизирован риск бактериальной контаминации материала;
- пуповину и плаценту транспортируют из оперативного блока в культуральную лабораторию в срок не более 24 часов при хранении материала при +4°C в транспортной среде, т.к. при большем сроке хранения значительно повышается вероятность гибели клеточного элемента стромы;
- ткань измельчают на фрагменты толщиной не более 10 мм, т.к. при большей толщине фрагментов не происходит достаточного пропитывания ткани криопротектором;
- используют криопротекторную среду на основе аутоплазмы, полученной из пуповинной крови, либо фосфатно-солевого буфера рН=7,4, дополненного тестированным человеческим альбумином до 15 г/л, содержащую 1,5 моль/л пропандиола и 0,1 моль/л сахарозы, т.к. данный состав среды обеспечивает высокую сохранность жизнеспособности клеток и не содержит токсичных или ксеногенных компонентов;
- строго соблюдают время эквилибрации ткани (не менее 20 мин) в криопротекторной среде, т.к. иначе не происходит равномерного пропитывания ткани криопротектором;
- строго соблюдают протокол замораживания (понижение стартовой комнатной температуры до +4°C со скоростью 10°C/мин, охлаждение до -6°C со скоростью 2°C/мин, инициацию кристаллизации при -6°C, выполнение пошагового охлаждения до температуры -30°C со скоростью 0,3°C/мин, и погружение в жидкую фазу азота с температурой -196°C), т.к. данный протокол обеспечивает максимальное сохранение архитектоники ткани при криоконсервации;
- строго соблюдают протокол размораживания (помещение криопробирок с материалом из жидкой фазы азота непосредственно в водяную баню с температурой +37°C), т.к. данный протокол обеспечивает максимальное сохранение архитектоники ткани при размораживании;
- материал тщательно отмывают от криопротекторов в нагретой до 37°C культуральной среде, т.к. это позволяет минимизировать повреждение клеток после размораживания;
- тщательно удаляют эпителий и кровеносные сосуды (при обработке пуповины), амниотический эпителий (при обработке амниона), хорионический трофобласт и ворсины хориона (при обработке плодной части плаценты), т.к. иначе может происходить контаминация первичных культур эпителиальными, эндотелиальными и др. клетками, а также материнскими клетками;
- используют метод эксплантов для выделения первичных клеточных культур из вартонова студня пупочного канатика, стромы плодной части плаценты и стромы амниона, т.к. данный метод позволяет избежать дополнительного повреждающего воздействия ферментов, многие из которых к тому же имеют животное (ксеногенное) происхождение;
- используют xeno-free культуральные среды при наращивании культур МСК, т.к. данный стандарт оптимален для экспансии клеточных культур, предназначенных для трансплантации.
Только строгое соблюдение всех указанных особенностей процесса позволяет эффективно сохранить жизнеспособность клеточного элемента стромы органов фетоплацентарного комплекса и в дальнейшем получить культуры МСК для проведения ауто- или аллотрансплантаций.
Возможность объективного достижения технического результата при использовании изобретения подтверждена данными, приведенными в примере, представляющем собой протокол подготовки тканей фетоплацентарного комплекса к длительному криохранению с последующим выделением из них культур МСК (пример 1), а также в примере, содержащем сведения экспериментального характера, касающиеся характеристики культур МСК, выделенных с использованием представленного в примере 1 протокола (пример 2).
Пример 1. Протокол получения мультипотентных стромальных клеток из криозамороженных тканей фетоплацентарного комплекса
1. Транспортировка плаценты и пуповины в культуральную лабораторию
Пуповину и плаценту, полученные в ходе операции кесарева сечения, нарезают на фрагменты длиной 5-6 см и помещают в пробирки, содержащие бессывороточную среду F12, охлажденную до +4°C.
Далее биоматериал в кратчайшие сроки (строго не более 24 часов) транспортируют в культуральную лабораторию.
2. Первичная подготовка биоматериала
Материал тщательно отмывают от крови в фосфатно-солевом буфере. С каждым фрагментом ткани работают отдельно. Пуповину нарезают поперек на фрагменты толщиной не более 10 мм. Из стромы амниона и стромы плодной части плаценты вырезают фрагменты с линейными размерами не более 10 мм.
3. Подготовка биоматериала к криоконсервированию
Фрагменты ткани помещают в криопротекторную среду на основе аутоплазмы, полученной из пуповинной крови, либо фосфатно-солевого буфера рН=7,4, дополненного тестированным человеческим альбумином до 15 г/л, содержащую 1,5 моль/л пропандиола и 0,1 моль/л сахарозы.
Время эквилибрации составляет 20-25 минут.
4. Контролируемое охлаждение ткани
Фрагменты ткани помещают в криопробирки со свежей криопротекторной средой. Криопробирки с тканью переносят в программный замораживатель с начальной температурой +4°C. Выбирают следующий режим замораживания: понижение стартовой комнатной температуры до +4°C со скоростью 10°C/мин, охлаждение до -6°C со скоростью 2°C/мин, инициация кристаллизации при -6°C, выполнение пошагового охлаждения до температуры -30°C со скоростью 0,3°C/мин, погружение в жидкую фазу азота с температурой -196°C.
5. Длительное криохранение биоматериала
Фрагменты тканей органов фетоплацентарного комплекса хранят в жидкой фазе азота криохранилища до момента размораживания.
6. Размораживание биоматериала
Криопробирки с материалом достают из криохранилища и немедленно помещают на водяную баню, нагретую до +37°C, до полного оттаивания материала.
7. Отмывание биоматериала от криопротекторной среды
Биоматериал переносят в культуральную посуду и заливают 10-кратным объемом нагретой до +37°C культуральной среды. Далее смешанную среду аккуратно отбирают серологической пипеткой и заливают свежей культуральной средой.
8. Выделения первичных клеточных культур
Из фрагментов пупочного канатика удаляют эпителий и кровеносные сосуды, из фрагментов плаценты удаляют ворсины хориона и хорионический трофобласт, из фрагментов амниона удаляют амниотический эпителий. Вартонов студень пупочного канатика, строму плодной части плаценты и строму амниона измельчают с помощью хирургических инструментов в небольшом объеме культуральной среды. Экспланты объемом 1-2 мм3 переносят в культуральную посуду. Смену среды проводят после прикрепления эксплантов к подложке.
9. Экспансия культур МСК
Наращивание и характеристику культур МСК проводят с использованием стандартных культуральных методик. В качестве культуральной среды используют Xeno-Free Human MSC Expansion Media (R&D Systems) или ее аналог.
Пример 2. Характеристики культур мультипотентных стромальных, выделенных с использованием представленного в примере 1 Протокола получения мультипотентных стромальных клеток из криозамороженных тканей фетоплацентарного комплекса
Получение и характеристика культур МСК, полученных от 5 доноров в соответствии с протоколом, представленным в примере 1, были проведены в ФГБУ НЦАГИП МЗ РФ (г.Москва). Краткая характеристика культур МСК представлена в Таблице 1.
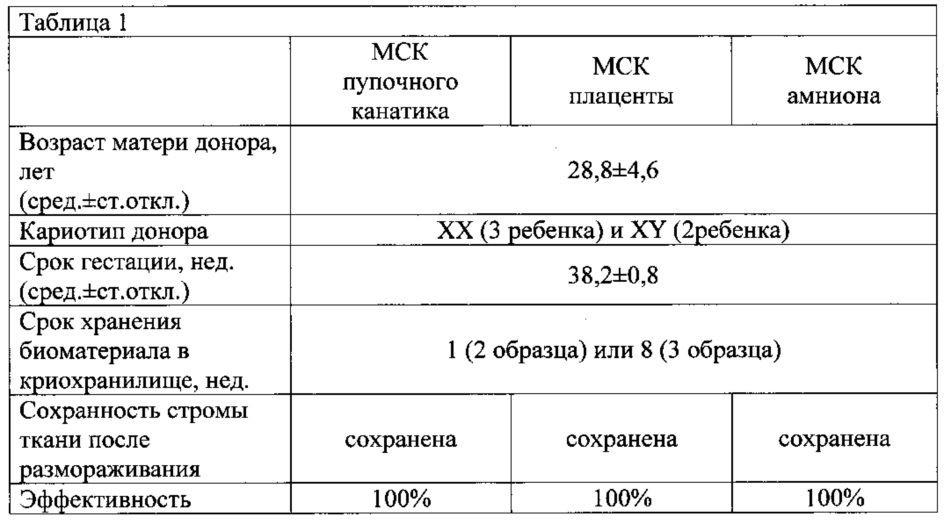
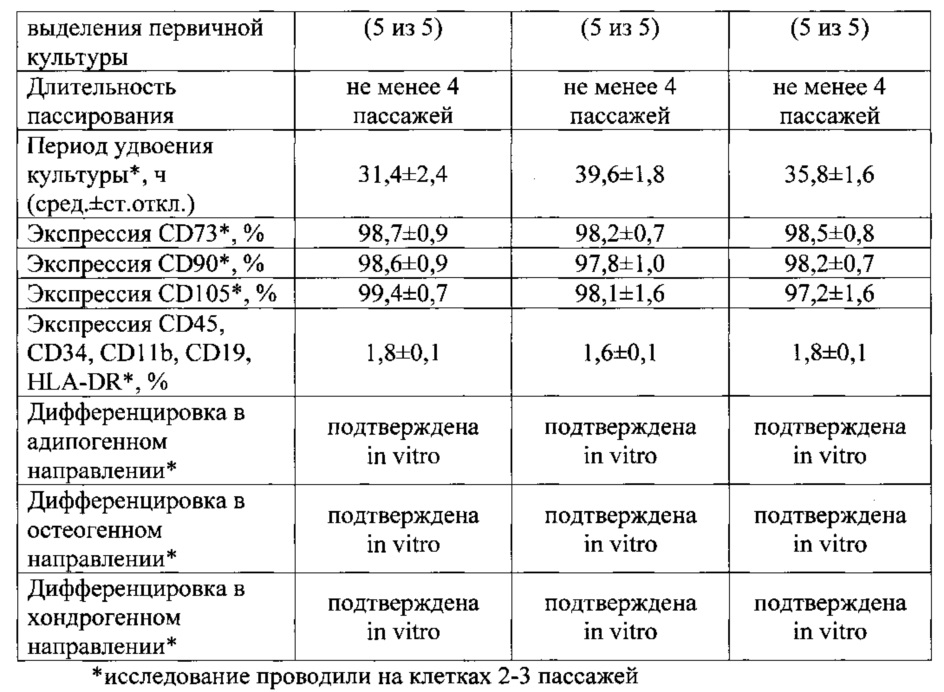
Таким образом, экспериментальные данные подтверждают принадлежность выделяемых из криозамороженных тканей фетоплацентарного комплекса культур к мультипотентным стромальным клеткам, с присущими им пролиферативными, иммунофенотипическими и пластическими свойствами, и свидетельствуют о высокой эффективности предложенного изобретения.
Список литературы
1. Badowski М, Muise A, Harris DT. Mixed effects of long-term frozen storage on cord tissue stem cells. Cytotherapy. 2014 Sep; 16 (9): 1313-21. doi: 10.1016/j.jcyt.2014.05.020.
2. Bieback K., Brinkmann I. Mesenchymal stromal cells from human perinatal tissues: From biology to cell therapy. World J. Stem Cells 2010; 2 (4): 81-92. doi: 10.4252/wjsc.v2.i4.81.
3. Chatzistamatiou Т.К., Papassavas A.C., Michalopoulos E. et al. Optimizing isolation culture and freezing methods to preserve Wharton’s jelly’s mesenchymal stem cell (MSC) properties: an MSC banking protocol validation for the Hellenic. Cord Blood Bank Transfusion 2014; 54 (12): 3108-20. doi: 10.111l/trf.12743.
4. Chen G, Yue A, Ruan Z, Yin Y, Wang R, Ren Y, Zhu L. Human umbilical cord-derived mesenchymal stem cells do not undergo malignant transformation during long-term culturing in serum-free medium. PLoS One. 2014 Jun 2; 9 (6): e98565. doi: 10.1371/journal.pone.0098565. eCollection 2014.
5. Da-Croce L, Gambarini-Paiva GH, Angelo PC, Bambirra EA, Cabral AC, Godard AL. Comparison of vitrification and slow cooling for umbilical tissues. Cell Tissue Bank. 2013 Mar; 14 (1): 65-76. doi: 10.1007/sl0561-012-9301-9.
6. Fahy GM. Cryoprotectant toxicity neutralization. Cryobiology. 2010 Jul; 60 (3 Suppl): S45-53. doi: 10.1016/j.cryobiol.2009.05.005.
7. Fierabracci A, Lazzari L, Muraca M, Parolini O. How far are we from the clinical use of placental-derived mesenchymal stem cells? Expert Opin Biol Ther. 2015 May; 15 (5): 613-7. doi: 10.1517/14712598.2015.1000856.
8. Gauthaman K., Fong C.Y., Suganya C.A. et al. Extra-embryonic human Wharton’s jelly stem cells do not induce tumorigenesis, unlike human embryonic stem cells. Reprod. Biomed. Online 2012; 24 (2): 235-46. doi: 10.1016/j.rbmo.2011.10.007.
9. Hartmann I, Hollweck T, Haffner S, Krebs M, Meiser B, Reichart B, Eissner G. Umbilical cord tissue-derived mesenchymal stem cells grow best under GMP-compliant culture conditions and maintain their phenotypic and functional properties. J Immunol Methods. 2010 Dec 15; 363 (1): 80-9. doi: 10.1016/j.jim.2010.10.008. Epub 2010 Oct 28.
10. Karahuseyinoglu S., Cinar O., Kilic E. et al. Biology of stem cells in human umbilical cord stroma: in situ and in vitro surveys. Stem Cells 2007; 25 (2): 319-31.
11. Li X, Bai J, Ji X, Li R, Xuan Y, Wang Y. Comprehensive characterization of four different populations of human mesenchymal stem cells as regards their immune properties, proliferation and differentiation. Int J Mol Med. 2014 Sep; 34 (3): 695-704. doi: 10.3892/ijmm.2014.1821.
12. Lv F, Lu M, Cheung KM, Leung VY, Zhou G. Intrinsic properties of mesemchymal stem cells from human bone marrow, umbilical cord and umbilical cord blood comparing the different sources of MSC. Curr Stem Cell Res Ther. 2012 Nov; 7 (6): 389-99.
13. Malek A, Bersinger NA. Human placental stem cells: biomedical potential and clinical relevance. J Stem Cells. 2011; 6 (2): 75-92.
14. Martins J.P., Santos J.M., de Almeida J.M. et al. Towards an advanced therapy medicinal product based on mesenchymal stromal cells isolated from the umbilical cord tissue: quality and safety data. Stem Cell. Res. Ther. 2014; 5 (1): 9. doi: 10.1186/scrt398.
15. McElreavey K.D., Irvine A.I., Ennis K.T. et al. Isolation, culture and characterisation of fibroblast-like cells derived from the Wharton’s jelly portion of human umbilical cord. Biochem. Soc. Trans. 1991; 19 (1): 29S.
16. Parolini O, Alviano F, Bagnara GP, Bilic G, Burning HJ, Evangelista M, Hennerbichler S, Liu B, Magatti M, Mao N, Miki T, Marongiu F, Nakajima H, Nikaido T, Portmann-Lanz CB, Sankar V, Soncini M, Stadler G, Surbek D, Takahashi ТА, Redl H, Sakuragawa N, Wolbank S, Zeisberger S, Zisch A, Strom SC. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem Cells. 2008 Feb; 26 (2): 300-11.
17. Roy S, Arora S, Kumari P, Та M. A simple and serum-free protocol for cry ©preservation of human umbilical cord as source of Wharton’s jelly mesenchymal stem cells. Cryobiology. 2014 Jun; 68 (3): 467-72. doi: 10.1016/j.cryobiol.2014.03.010. Epub 2014 Apr 4.
18. Ruan Z.B., Zhu L., Yin Y.G. et al. Karyotype stability of human umbilical cord-derived mesenchymal stem cells during in vitro culture. Exp. Ther. Med. 2014; 8 (5): 1508-12.
19. Ruiz-Delgado GJ, Mancias-Guerra C,  EL,
EL,  LN, Lopez-Otero A,
LN, Lopez-Otero A,  A,
A,  D,
D,  GJ. Dimethyl sulfoxide-induced toxicity in cord blood stem cell transplantation: report of three cases and review of the literature. Acta Haematol. 2009; 122 (1): 1-5. doi: 10.1159/000227267. Epub 2009 Jul 3.
GJ. Dimethyl sulfoxide-induced toxicity in cord blood stem cell transplantation: report of three cases and review of the literature. Acta Haematol. 2009; 122 (1): 1-5. doi: 10.1159/000227267. Epub 2009 Jul 3.
20. Sabapathy V, Ravi S, Srivastava V, Srivastava A, Kumar S. Long-term cultured human term placenta-derived mesenchymal stem cells of maternal origin displays plasticity. Stem Cells Int. 2012; 2012: 174328. doi: 10.1155/2012/174328.
21. Sabapathy V., Sundaram В., VM S. et al. Human Wharton’s Jelly Mesenchymal Stem Cells plasticity augments scar-free skin wound healing with hair growth. PLoS One 2014; 9 (4): e93726. doi: 10.1371/journal.pone.0093726.
22. Shimazu T, Mori Y, Takahashi A, Tsunoda H, Tojo A, Nagamura-Inoue T. Serum- and xeno-free cryopreservation of human umbilical cord tissue as mesenchymal stromal cell source. Cytotherapy. 2015 May; 17 (5): 593-600. doi: 10.1016/j.jcyt.2015.03.604.
23. Swamynathan P, Venugopal P, Kannan S, Thej C, Kolkundar U, Bhagwat S, Та M, Majumdar AS, Balasubramanian S. Are serum-free and xeno-free culture conditions ideal for large scale clinical grade expansion of Wharton’s jelly derived mesenchymal stem cells? A comparative study. Stem Cell Res Ther. 2014 Jul 28; 5 (4): 88. doi: 10.1186/scrt477.
24. Taghizadeh R.R., Cetrulo K.J., Cetrulo C.L. Wharton’s Jelly stem cells: future clinical applications. Placenta 2011; 32 Suppl 4: S311-5. doi: 10.1016/j.placenta.2011.06.010.
25. Venugopal P, Balasubramanian S, Majumdar AS, Та M. Isolation, characterization, and gene expression analysis of Wharton’s jelly-derived mesenchymal stem cells under xeno-free culture conditions. Stem Cells Cloning. 2011 Apr21; 4: 39-50. doi: 10.2147/SCCAA.S17548. eCollection 2011.
26. Wang H.S., Hung S.C., Peng S.T. et al. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord. Stem Cells 2004; 22 (7): 1330-7.
27. Wang X.Y., Lan Y., He W.Y. et al. Identification of mesenchymal stem cells in aorta-gonad-mesonephros and yolk sac of human embryos. Blood 2008; 111 (4): 2436-43.
28. Weiss M.L., Anderson C, Medicetty S. et al. Immune properties of human umbilical cord Wharton’s jelly-derived cells. Stem Cells 2008; 26 (11): 2865-74. doi: 10.1634/stemcells.2007-1028.
29. Wulf GG, Viereck V, Hemmerlein B, Haase D, Vehmeyer K, Pukrop T, Glass B, Emons G, Triimper L. Mesengenic progenitor cells derived from human placenta. Tissue Eng. 2004 Jul-Aug; 10 (7-8): 1136-47.
Способ получения мультипотентных стромальных клеток (МСК) из криозамороженных тканей фетоплацентарного комплекса, характеризующийся тем, что пуповину и плаценту, полученные в ходе операции кесарева сечения, в течение не более 24 часов в бессывороточной среде F12 транспортируют в культуральную лабораторию, где их нарезают на фрагменты толщиной не более 10 мм и выдерживают в течение 20-25 минут в криопротекторной среде на основе аутоплазмы, полученной из пуповинной крови, либо фосфатно-солевого буфера pH=7,4, дополненного тестированным человеческим альбумином до 15 г/л, содержащей 1,5 моль/л пропандиола и 0,1 моль/л сахарозы, после чего помещают в криопробирки и переносят в программный замораживатель, выбирая режим охлаждения, включающий понижение стартовой комнатной температуры до +4°C со скоростью 10°C/мин, охлаждение до -6°C со скоростью 2°C/мин, инициацию кристаллизации при -6°C, выполнение пошагового охлаждения до температуры -30°C со скоростью 0,3°C/мин, погружение в жидкую фазу азота с температурой -196°C, после чего пробирки из замораживателя переносят в криохранилище, где хранят в жидкой фазе азота до возникновения необходимости размораживания биоматериала, для чего криопробирки с материалом достают из жидкой фазы азота и немедленно помещают на водяную баню, нагретую до +37°C, до полного оттаивания материала, после чего отмывают от криопротектора нагретой до +37°C полной культуральной средой, не содержащей ксеногенных компонентов, затем из фрагментов пупочного канатика удаляют эпителий и кровеносные сосуды, из фрагментов плаценты удаляют ворсины хориона и хорионический трофобласт, из фрагментов амниона удаляют амниотический эпителий, а оставшуюся ткань (вартонов студень пупочного канатика, строму плодной части плаценты и строму амниона) измельчают с помощью хирургических инструментов в небольшом объеме культуральной среды до получения эксплантов объемом 1-2 мм, которые переносят в культуральную посуду и получают первичную культуру клеток, при этом дальнейшее наращивание и характеристику МСК проводят с использованием стандартных культуральных методик.
