Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ ВЕЗИКУЛ КЛЕТОК ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к медицине и ветеринарии, а именно к области разработки лекарств и медикаментов для терапевтических целей в промышленном масштабе. Может быть использовано преимущественно для лечения ишемического повреждения тканей, например, при ишемическом заболевании сердца, при ишемии нижних конечностей т.е. в областях организма, в которых существует проблема восстановления кровоснабжения тканей за счет собственных ресурсов организма, при этом, использование изобретения не ограничивается указанной областью.
На дату подачи заявленного технического решения заявителем проведены исследования уровня техники и тенденций развития техники в данной области по научной и патентной информации, выявлены существующие проблемы, связанные с восстановлением кровоснабжения тканей путем стимуляции роста кровеносных сосудов (ангиогенеза) за счет активации собственных ресурсов организма. Вследствие изложенного, существует неразрешенная до настоящего времени проблема по созданию новых лекарственных средств и способов изготовления препаратов, характеризующихся способностью более эффективно стимулировать рост кровеносных сосудов в местах с признаками ишемического повреждения, т.е. в местах с недостаточным кровоснабжением тканей.
Из исследованного заявителем уровня техники выявлены ряд аналогов заявленного технического решения, предназначенных для реализации указанных выше целей:
Известен способ стимуляции ангиогенеза [1]. Известный способ заключается в использовании различных очищенных факторов роста (например, эндотелиальный фактор роста сосудов - VEGF, фактор роста фибробластов 2 - FGF2, фактор роста гепатоцитов - HGF и другие), а также их смесей для локального введения в организм пациента.
Существенным недостатком известного способа является низкая эффективность применения биологически активных молекул, указанных выше, в чистом виде. В указанном случае при инъекции раствора, содержащего биоактивные молекулы (факторы роста), происходит их разрушение под действием внеклеточных ферментов организма и лишь небольшая доля этих молекул остается в тканях достаточно долго, чтобы успеть вызвать реакцию организма, вследствие чего указанные факторы роста обладают весьма низким терапевтическим эффектом. Таким образом, известный способ [1], с одной стороны отвечая критерию безопасности, является весьма ограниченным по эффективности.
Известен способ стимуляции ангиогенеза (роста кровеносных сосудов) [2]. Указанный способ [2] предлагает введение генетического материала в виде плазмиды, несущей ген, кодирующий фактор роста фибробластов, в ткани для того, чтобы клетки организма сами были способны синтезировать биоактивные молекулы (фактор роста фибробластов).
Недостатком указанного способа [2] является недостаточная эффективность действия, т.к. при введении плазмиды в ткани человека в чистом виде происходит ее разрушение внеклеточными ферментами. Кроме того, частота трансформации клеток плазмидой, является недостаточной для возникновения лечебного эффекта, так как существуют механизмы защиты стабильности генетического материала клетки от внедрения внешнего генетического материала, основой которого является разрушение чужеродной ДНК цитоплазматическими нуклеазами клетки [3, с. 487, 2 абзац]. В результате указанного, не обеспечивается синтез целевых молекул в степени достаточной для достижения лечебного эффекта.
Известен способ стимуляции ангиогенеза (заявка на предполагаемое изобретение №2005111150/14) [4]. Способ терапии инфаркта миокарда, заключающийся в назначении диеты №10, калия хлорид, магния сульфат, глюкозы, инсулина, нитросорбида, эгилока, липрамара, лазикса, эналаприла, ФТЛ, ЛФК, отличающийся тем, что у пациента с инфарктом миокарда берут 30-40 мл костного мозга, в течение 10 сут осуществляют культивирование мезенхимных стволовых клеток (далее МСК) из взятого у больного костного мозга и на 11-12 сут течения болезни трансплантируют культивированные МСК внутривенно больному из расчета 1 млн МСК на 1 кг веса пациента.
Недостатком указанного способа является применимость известного технического решения исключительно для целей терапии инфаркта миокарда, при этом в указанном способе используют костный мозг в качестве источника МСК, для чего требуется проведение весьма травматичной операции - пункции костного мозга пациента, которая в некоторых случаях может привести к инвалидизации пациента. При этом количество получаемых клеток ограничено, что требует их дополнительного наращивания путем культивирования in vitro, при этом следует обратить внимание на то, что необходимость долговременного культивирования in vitro влечет за собой вероятность накопления мутаций в геноме МСК, вследствие чего возрастает риск онкотрансформации [5].
Известен аналог изобретения - патент №ЕР 20070794267 [6]. Способ получения кондиционированной культуральной среды клеток, заключающийся в том, что выполняют культивирование МСК или эмбриональных стволовых клеток (далее ЭСК) в бессывороточной среде, выполняют отбор культуральной среды, в которой росли клетки. Таким образом, известный способ предполагает использование среды, в которой росли МСК или ЭСК, для восстановления поврежденных тканей (повреждения скелетной мускулатуры, сердечно-сосудистые заболевания), поскольку стволовые клетки секретируют в окружающую среду трофические факторы. Известный способ отчасти совпадает с заявленным техническим решением в области выбора источника клеточного материала.
Известный способ, безусловно, удовлетворяя критерию безопасности, имеет существенный недостаток:
- низкий период жизни биоактивных молекул во внеклеточной среде, так как идет процесс разрушения биоактивных молекул внеклеточными ферментами с момента отбора культуральной среды, в которой росли МСК или ЭСК. Впоследствии процесс деградации биоактивных молекул продолжается и усиливается при инъекции в ткани пациента.
Вследствие вышеизложенного, указанный известный способ является малоэффективным и дискомфортным для пациента, так как требует регулярного и частого введения данного средства пациенту.
Известен способ усиления процессов регенерации тканей человека (патент № WO 2012KR06478) [7]. Способ заключается в том, что для терапии нейродегенеративных заболеваний используют естественные микровезикулы эмбриональных стволовых клеток человека. Известный способ отчасти совпадает с заявленным техническим решением в области выбора безопасного субклеточного подхода для стимуляции процессов регенерации в организме человека.
Преимуществом известного способа является безопасность применения естественных микровезикул для человека, однако известный способ имеет недостатки, а именно:
- получение эмбриональных стволовых клеток поднимает этические вопросы, связанные с использованием эмбрионов человека (абортивные или искусственно выращенные) как сырья для выделения клеток, а также неразрешенным на дату подачи заявки вопросом остается регламентирование указанного вопроса по использованию материалов человека;
- метод выделения естественных микровезикул сложен с технологической точки зрения, так как требует много времени и специального дорогостоящего оборудования, что значительно осложняет его промышленную применимость.
Известен способ стимуляции регенерации и ангиогенеза (патент № СА20112787894) [8]. Сущность заключается в том, что культура стволовых клеток линии MIC-1 выращивается, клетки отделяются от среды и разрушаются с помощью ультразвука. Полученную смесь биоактивных молекул предлагается использовать в фармацевтической и косметической промышленности для поверхностного применения на коже, или внутрикожной инъекции, а также для регенерации нервной, эпителиальной, мышечной тканей человека. В данном способе в качестве клеточного источника используют МСК, которые обладают повышенным ангиогенным потенциалом. Поскольку существует опасность неконтролируемого клеточного роста стволовых клеток, данный способ предлагает обезопасить клетки методом ультразвуковой гомогенизации. Известный способ отчасти совпадает с заявленным техническим решением в области выбора источника клеточного материала - это МСК, так как источником получения везикул (лекарственного средства, создаваемого на основе заявленного технического решения, который находится на стадии испытаний на лабораторных крысах) являются клетки человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные МСК), а также в области безопасного использования свойств клеток человека, то есть исключающего неограниченный рост и формирование опухоли.
Недостатком известного способа является низкая эффективность применения по назначению вследствие нестабильности препарата, так как уже на первом этапе способа происходит снижение потенциальной эффективности препарата (протекают процессы, аналогичные описанным в патенте №ЕР 20070794267), поскольку при получении препарата (гомогенизации клеток) происходит высвобождение внутриклеточных ферментов, в том числе гидролитических ферментов из лизосом клеток, которые начинают разрушать биоактивные молекулы. При введении данного препарата в ткани организма разрушительное действие усиливается внеклеточными ферментами. В результате, основная масса препарата фагоцитируется и разрушается клетками самого пациента, вследствие чего наблюдается значительное снижение терапевтического эффекта.
Наиболее близким по совокупности совпадающих признаков и достигаемому техническому результату(ам), выбранному заявителем в качестве прототипа к заявленному изобретению является способ стимуляции ангиогенеза [9] - способ получения естественных микровезикул из культуры МСК, выделенных из пупочной вены человека. Сущность заключается в том, что МСК стимулируют в условиях гипоксии, после этого методом ультрацентрифугирования из культуральной среды, в которой росли МСК, выделяют естественные микровезикулы, полученные естественные микровезикулы наносят на клетки из пупочной вены человека, при этом естественные микровезикулы сливаются с эндотелиальными клетками из пупочной вены человека и стимулируют пролиферацию и формирование капилляро-подобной сети на матригеле указанных клеток. В результате, на модели ишемии у крыс выявлено восстановление поступления крови в ткань после инъекции естественных микровезикул. В известном способе используют естественные микровезикулы, которые высвобождают мезенхимные стволовые клетки, выделенные из пуповинной крови человека. Известный способ отчасти совпадает с заявленным техническим решением по использованию везикул человека для стимуляции ангиогенеза у пациентов с ишемическим повреждением тканей.
Известный способ [9], отвечая критерию безопасности, предъявляемому к лекарственным средствам, применяемым для человека, обладает существенными недостатками вследствие того, что:
- во-первых, используют мезенхимные стволовые клетки, источником которых является пуповинная кровь, доступная лишь после рождения ребенка, когда врачи получают доступ к пуповине и способны собрать кровь;
- во-вторых, зачастую невозможно получить аутологичные (собственные) клетки пациента, исключение составляют случаи, когда мезенхимные стволовые клетки были заранее собраны еще при рождении пациента;
- в-третьих, имеет место сложность реализации процесса выделения естественных микровезикул в широких промышленных масштабах, как было отмечено выше.
При этом следует отметить, что количество естественно выделяемых клетками микровезикул не обеспечивает возможность их широкого клинического применения, вследствие чего может быть использовано преимущественно для исследовательских целей.
Таким образом, из исследованного уровня техники по всем аналогам заявленного технического решения в целом и в том числе по прототипу можно сделать выводы общего характера о том, что:
- биологически активные молекулы, не защищенные от воздействия разрушающих факторов внеклеточной среды (см. аналоги представленного технического решения - 1, 2, 6, 8) являются недостаточно эффективными для стимуляции процесса ангиогенеза и регенерации;
- трансплантация клеток человека, обладающих трофическими свойствами (эмбриональные и мезенхимные стволовые клетки), (см. аналог представленного технического решения - 4) являются небезопасными для применения в качестве лекарственного средства для человека, так как обладают повышенным риском онкологической трансформации при культивировании in vitro;
- естественные микровезикулы клеток человека (см. аналоги представленного технического решения - 7, 9) не применимы в широких промышленных масштабах, так как метод выделения естественных микровезикул сложен и времязатратен, а количество естественно выделяемых клетками микровезикул не обеспечивает возможность их широкого клинического применения.
Целью заявленного технического решения является устранение недостатков прототипа и аналогов, а именно:
- повышение эффективности действия лекарственного препарата, создаваемого на основе заявленного технического решения, который (лекарственный препарат) на дату регистрации заявки находится на стадии доклинических испытаний на лабораторных крысах (см. четвертый этап изготовления композиции, с. 14-15 настоящей заявки и поясняющий указанный этап Фиг. 4);
- исключение опасности онкотрансформации и опухолевого роста;
- разработка высокоэффективного, конкурентоспособного, импортозамещающего способа получения лекарственных препаратов нового поколения (на дату регистрации заявки НИОКТР находится на стадии доклинических испытаний на лабораторных крысах (см. четвертый этап изготовления композиции, с. 14-15 настоящей заявки и поясняющий указанный этап Фиг. 4), который не требует значительного временного интервала, не требует использования специального дорогостоящего оборудования.
В представленных испытаниях показан проангиогенный эффект везикул клеток человека, то есть на практике выявлен эффект стимуляции прорастания кровеносных сосудов, сравнимый с нативными клетками человека (см. третий и четвертый этапы изготовления лекарственного средства, с. 13-15 настоящей заявки и поясняющий указанные этапы Фиг. 3, 4). При этом в экспериментах доказано, что в данном лекарственном препарате (создаваемом на основе заявленного технического решения, на дату предоставления заявленных материалов находится на стадии доклинических испытаний на лабораторных крысах) исключена опасность онкотрансформации, как следствие, возможность формирования опухоли, так как препарат везикул клеток человека не содержит жизнеспособных клеток, а выполняет функцию доставки биоактивных молекул. То есть экспериментально доказано, что препарат везикул клеток человека обладает эффективностью действия в области стимуляции ангиогенеза (см. третий и четвертый этапы изготовления лекарственного средства, с. 13-15 настоящей заявки и поясняющий указанные этапы Фиг. 3, 4), при этом следует обратить внимание на то, что в отличие от аналогов, заявленное техническое решение удовлетворяет требованиям, предъявляемым к лекарственным средствам по биологической безопасности и промышленной применимости.
Сущностью заявленного технического решения является способ получения лекарственного средства на основе везикул человека для стимуляции ангиогенеза у пациентов с ишемическим повреждением тканей, характеризующийся тем, что выращивают клетки человека линии SH-SY5Y на культуральном флаконе, промывают изотоническим буферным раствором, добавляют к клеткам стерильный раствор цитохалазина В, клетки промывают изотоническим буферным раствором, переводят в суспензию, подвергают активному перемешиванию и осуществляют серию центрифугирований с получением заявленного лекарственного средства. Способ, отличающийся тем, что проводят фильтрацию полученного лекарственного средства.
С помощью заявленного технического решения везикулы клеток человека получают в количестве, достаточном для широкого клинического применения. Таким образом, предложенное техническое решение отвечает критериям для лекарственных средств и/или лекарственных препаратов по биологической безопасности и промышленной применимости.
Более детально целью заявленного технического решения является получение везикул клеток человека из клеток человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные мезенхимные стволовые клетки), которые, проявляя высокий потенциал к стимуляции ангиогенеза, являются при этом безопасным инструментом для стимуляции ангиогенеза у пациентов с ишемическим повреждением тканей.
Основываясь на изложенном выше, возможно констатировать то, что в заявленном техническом решении для получения лекарственного средства, создаваемого на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах, на основе везикул клеток человека используются клетки человека с высоким потенциалом к стимуляции ангиогенеза. В качестве клеток человека, обладающих высоким потенциалом к стимуляции ангиогенеза, выступают:
1) опухолевые клетки, поскольку известно, что активно пролиферирующие опухолевые клетки требуют постоянного притока крови для своего питания и газообмена, поэтому они (опухолевые клетки) стимулируют активацию, пролиферацию и миграцию эндотелиальных клеток [10-11];
2) нативные и/или генетически модифицированные мезенхимные стволовые клетки, которые в результате долгого культивирования in vitro и/или генетической модификации обладают повышенным риском онкологической трансформации [5].
Несмотря на большой потенциал этих клеток (опухолевые, нативные и/или генетически модифицированные мезенхимные стволовые клетки) в области стимуляции ангиогенеза, их клиническое применение до предоставления заявочных материалов было ограничено, поскольку существовала опасность их неконтролируемого роста, что в итоге могло привести к формированию опухоли.
Цели заявленного технического решения достигают тем, что клетки человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные мезенхимные стволовые клетки) обрабатывают веществом, вызывающим нарушение цитоскелета клеток человека, например, цитохалазином В. Далее клетки человека открепляют от культурального сосуда, подвергают механическому воздействию с целью отделения везикул от клеток человека. Полученную суспензию, содержащую клетки и везикулы человека, подвергают последовательному центрифугированию с целью разделения везикул от целых клеток человека и клеточного дебриса. Полученные после процесса выделения везикулы называются везикулами клеток человека, при этом полученная суспензия не содержит жизнеспособных клеток (Фиг. 1). Таким образом, возможно констатировать факт того, что в заявленном техническом решении реализована неразрешимая ранее задача, а именно -реализована возможность применения свойств клеток человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные мезенхимные стволовые клетки), использование которых ранее, т.е. до даты предоставления заявочных материалов для указанных целей по настоящей заявке не представлялось возможным для реализации заявленных целей, вследствие существования реальной угрозы формирования опухоли [12]. Указанное является доказательством соответствия заявленного технического решения критерию «изобретательский уровень», предъявляемому к изобретениям.
При этом следует обратить внимание на то, что существует возможность введения этапа фильтрации полученного лекарственного средства, создаваемого на основе заявленного технического решения, которое находится (на дату предоставления заявочных материалов) на стадии доклинических испытаний на лабораторных крысах, с целью получения однородной по размерам фракции везикул клеток человека, что по предположению заявителя приведет к возможности стандартизации формы получаемого лекарственного средства (так как на дату предоставления заявочных материалов выявлена соответствующая тенденция), однако подтверждающие данные могут быть представлены заявителем только после завершения стадии доклинических испытаний на лабораторных крысах.
Препарат(ы), полученный(е) на базе заявленного технического решения, планируется использовать по назначению после проведения последующих клинических испытаний в условиях РКБ-2 г. Казани, с которым у КФУ имеется договор о сотрудничестве и проведении указанных клинических испытаний.
Следует отметить, что препарат хранится и применяется по мере надобности при соблюдении рекомендаций производителя. Наиболее оптимальными условиями хранения лекарственного средства, которые не требуют специального оборудования и, следовательно, могут быть воспроизведены повсеместно, являются - хранение в физиологическом растворе при температуре около +4°С или при лиофильном высушивании везикул и хранении их при температурах около +4°С или -20°С, в соответствии с проведенными экспериментами (Фиг. 5).
Заявленное техническое решение поясняется Фиг. 1-5, на которых представлено соответственно:
Фиг. 1 - Световая микрофотография суспензии везикул клеток человека, выделенных из клеток SH-SY5Y. На микрофотографии стрелками отмечены отдельные везикулы клеток человека - небольшие округлые структуры, окруженные мембраной. Увеличение 20-кратное, масштабный отрезок 20 микрометров.
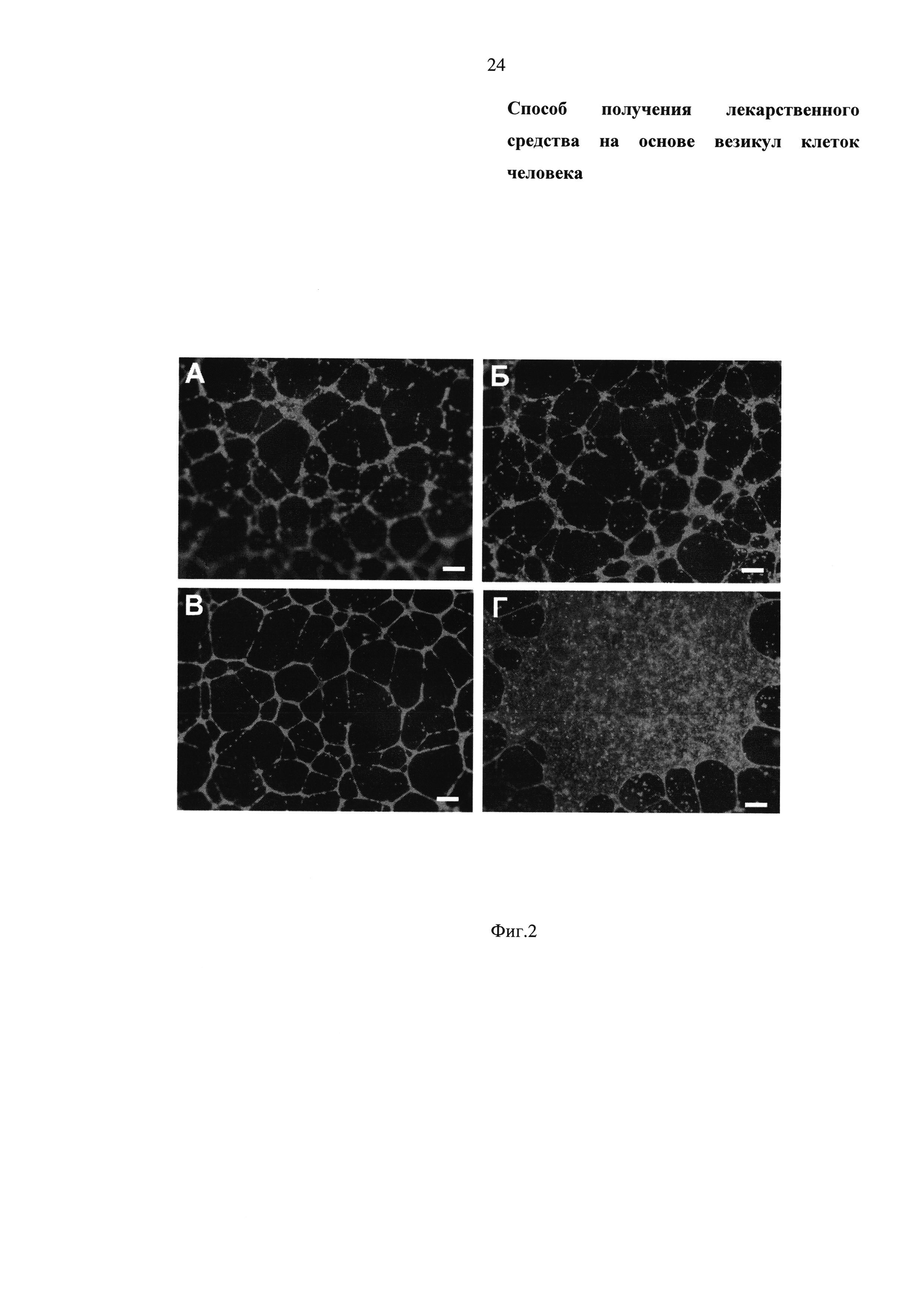
Фиг. 2 - Флуоресцентные микрофотографии культуры клеток HUVEC через 16 часов после инкубации с:
- А - нативными клетками SH-SY5Y;
- Б - везикулами клеток человека, выделенными из клеток SH-SY5Y;
- В - положительный контроль - HUVEC в «богатой» среде (с добавлением 20% телячьей эмбриональной сыворотки и необходимых факторов роста);
- Г - отрицательный контроль - HUVEC в «бедной» среде (с добавлением только 1% телячьей эмбриональной сыворотки).
Масштабный отрезок 200 микрометров.
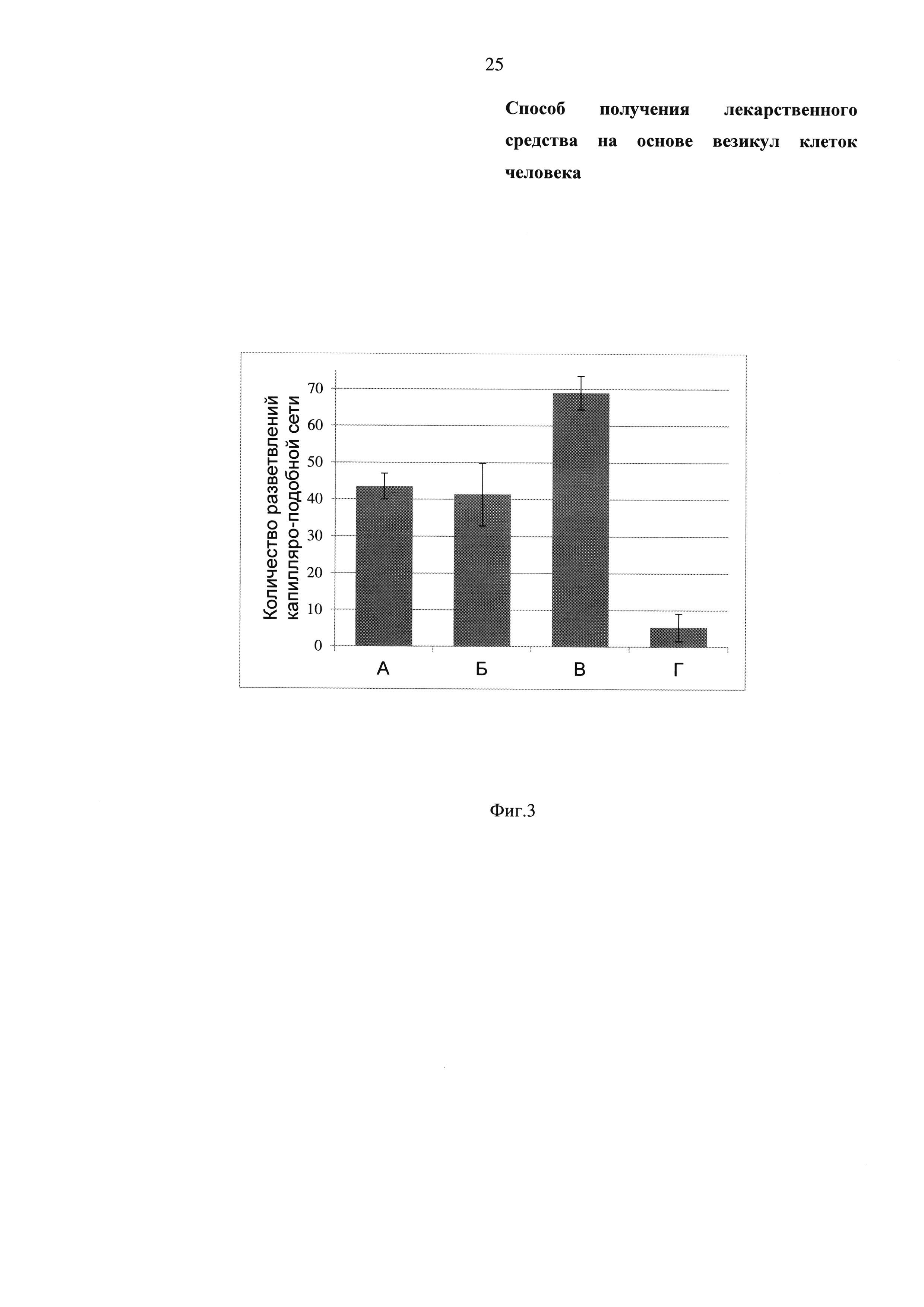
Фиг. 3 - Диаграмма, отражающая количество разветвлений капилляроподобной сети клеток HUVEC через 16 часов после инкубации с:
- А - нативными клетками SH-SY5Y;
- Б - везикулами клеток человека, выделенными из клеток SH-SY5Y;
- В - положительный контроль - HUVEC в «богатой» среде;
- Г - отрицательный контроль - HUVEC в «бедной» среде.
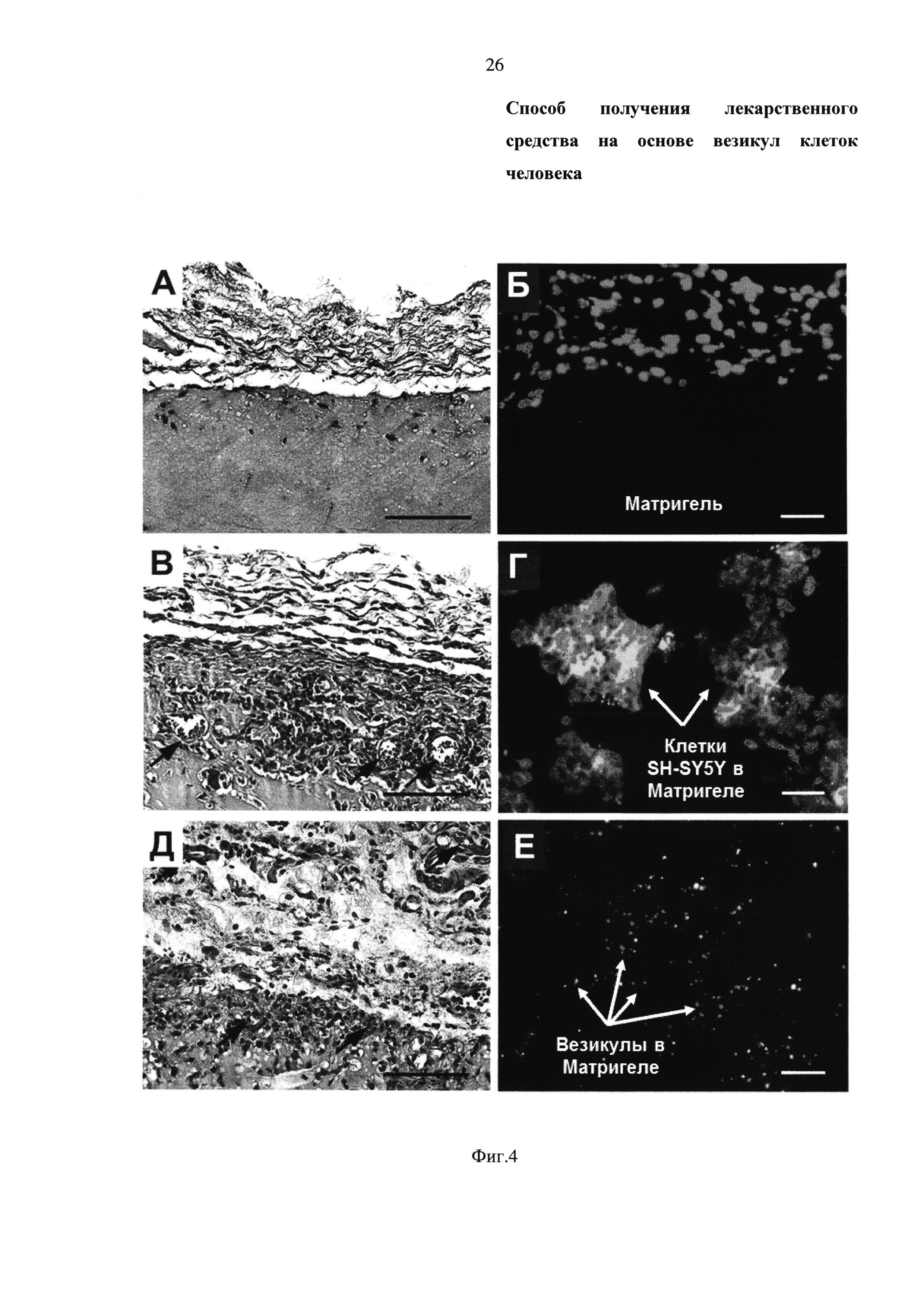
Фиг. 4 - Гистологическое исследование срезов имплантированных подкожно сгустков Матригель:
- А, Б - 200 мкл РВБ + 200 мкл Матригель;
- В, Г - 2000000 нативных клеток SH-SY5Y в 200 мкл PBS + 200 мкл Матригель;
- Д, Е - везикулы клеток человека, выделенные из клеток SH-SY5Y, в количестве, эквиалентном 2000000 клеток SH-SY5Y по общему белку, в 200 мкл PBS + 200 мкл Матригель;
- А, В, Д - окрашивание гематоксилином-эозином;
- Б, Г, Е - флуоресцентная микроскопия: флуоресценция в зеленой области спектра - мембранный краситель DiO, флуоресценция в синей области спектра - ядра клеток окрашенные DAPI.
- На микрофотографиях А, В, Д стрелками указаны кровеносные сосуды.
- На микрофотографиях Г, Е стрелками указаны клетки человека и везикулы, соответственно.
Масштабный отрезок 100 микрометров.
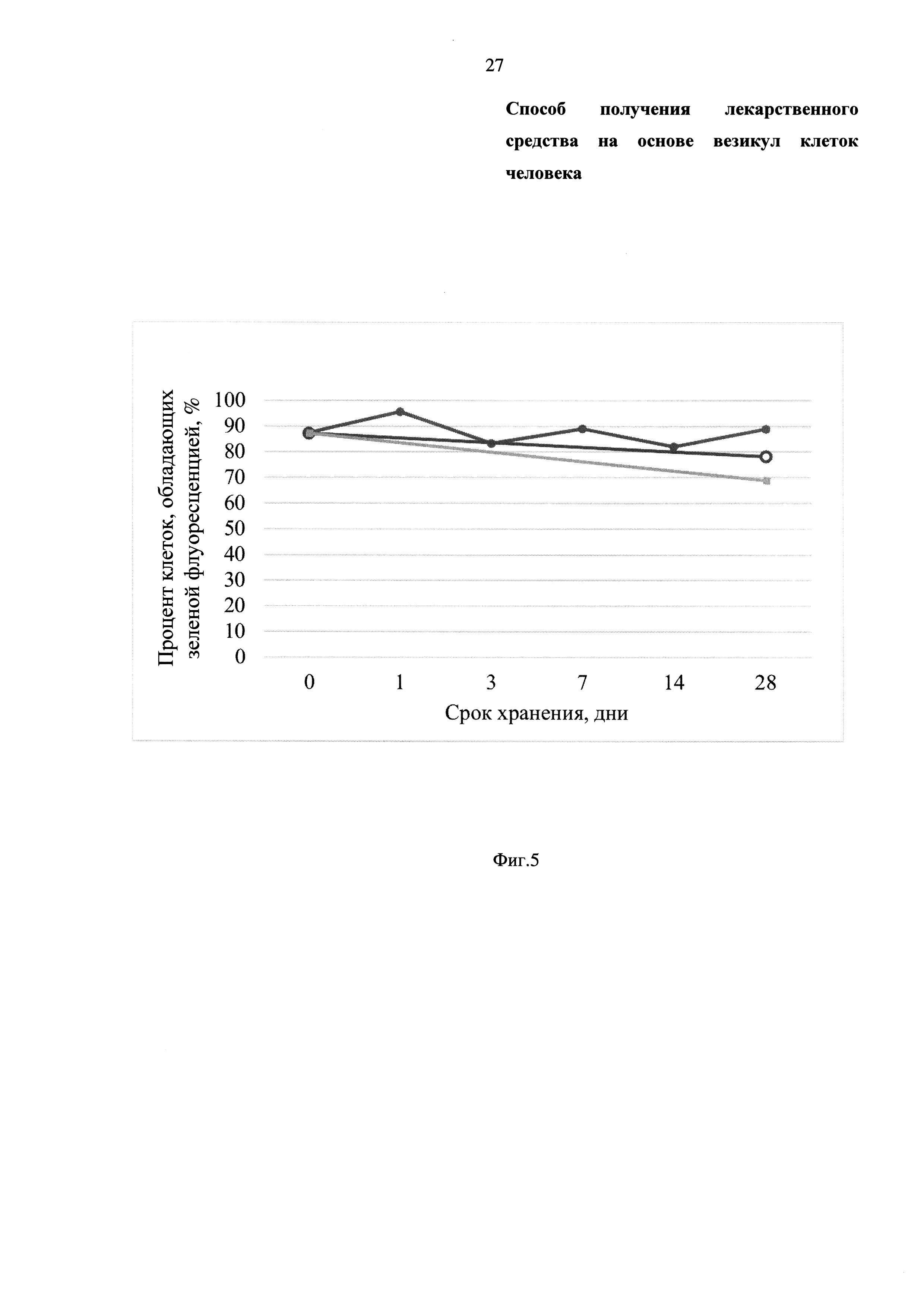
Фиг. 5 - Диаграмма, отражающая сроки хранения лекарственного средства (везикул клеток человека), создаваемого на основе заявленного технического решения, который находится на стадии испытаний на лабораторных крысах, при разных условиях хранения:
- в PBS при +4°С ( );
);
- лиофильное высушивание и хранение при +4°С ( );
);
- лиофильное высушивание и хранение при -20°С ( ).
).
В данном эксперименте использованы МСК, выделенные из жировой ткани человека. Клетки окрашены карбоксифлуоресцеин сукцинимидил эфиром (carboxy fluorescein succinimidyl ester - CFSE) (фирма-производитель eBioscience, США), который расщепляется внутриклеточными ферментами живой клетки с образованием зеленой флуоресцирующей молекулы. Из данных клеток (окрашенные CFSEMCK) были получены везикулы клеток человека, которые подвергали хранению в разных условиях. Через указанное время везикулы клеток человека наносили на клетки-реципиенты in vitro. Стабильность везикул клеток человека прямо пропорциональна проценту клеток-реципиентов с зеленой флуоресценцией.
Заявленное техническое решение:
- обладает повышенной эффективностью применения по назначению по сравнению с аналогами, так как является производным от клеток, обладающих высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные мезенхимные стволовые клетки) и заключенные внутри везикул клеток человека биомолекулы оказываются защищены липидным бислоем мембраны от разрушающего действия внеклеточных ферментов;
- позволяет получать безопасный инструмент для стимуляции ангиогенеза у пациентов с ишемическим повреждением тканей, например, при ишемическом заболевании сердца, при ишемии нижних конечностей и так далее, поскольку не содержит жизнеспособных клеток и не способно к размножению и образованию опухоли;
- обеспечивает стабильность и эффективность средства при длительном хранении благодаря тому, что везикулы клеток человека окружены мембраной, защищающей их (везикул клеток человека) содержимое (биоактивные молекулы) от биологической и структурной деградации.
Полученные в результате реализации заявленного технического решения везикулы клеток человека могут стать лекарственным препаратом, создаваемым на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах. Изготовление лекарственного средства производят, например, в четыре этапа, варианты наиболее предпочтительных этапов приведены далее.
Первый этап
На первом этапе получают и культивируют клетки, обладающие повышенным ангиогенным потенциалом, например, опухолевые (SH-SY5Y (АТСС, CRL-2266)). Известно, что активно пролиферирующие опухолевые клетки требуют постоянного притока крови для своего питания и газообмена, поэтому они (опухолевые клетки) стимулируют активацию, пролиферацию и миграцию эндотелиальных клеток [10, 11]. В ином варианте, в качестве клеток, обладающих повышенным ангиогенным потенциалом, используют, например, нативные и/или генетически модифицированные клетки (которые в результате долговременного культивирования in vitro и/или генетической модификации обладают повышенным риском онкологической трансформации [5]).
Все работы с культурой клеток проводят в стерильном ламинарном боксе согласно общепринятым правилам работы в лаборатории 2-го класса био-безопасности. Клетки инкубируют в среде DMEM (фирма-производитель ПанЭко, Россия) с добавлением 10% телячьей эмбриональной сыворотки, при температуре плюс 37°С, в насыщенно-влажной атмосфере, содержащей 5% СО2.
Получением клеток, обладающих повышенным ангиогенным потенциалом, завершают первый этап осуществления предлагаемого способа и приступают ко второму этапу.
Второй этап
Далее получают лекарственное средство на основе везикул клеток человека, полученных из клеток, обладающих повышенным ангиогенным потенциалом. Получение везикул клеток человека, не содержащих целые жизнеспособные клетки, позволяет исключить опасность образования опухоли в результате бесконтрольного клеточного деления клеток. Таким образом, используя потенциал опухолевых клеток, мы получаем биологически-безопасный лекарственный препарат на основе везикул клеток человека, создаваемый на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах.
Поскольку известно, что количество естественно выделяемых клетками микровезикул не обеспечивает возможность их широкого клинического применения, вследствие чего может быть использовано исключительно для исследовательских целей, в заявленном техническом предлагается устранить данный недостаток. Недостаток устраняется посредством стимуляции клеток человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные МСК) для получения большего количества везикул веществом, нарушающим структуру цитоскелета, например, цитохалазином В [13].
Клетки человека, например, опухолевой линии SH-SY5Y (ATCC, CRL-2266), выращивают в емкости, например, в культуральном флаконе в среде DMEM с добавлением 10% телячьей эмбриональной сыворотки до плотности монослоя 70-80%. Питательную среду удаляют, клетки промывают дважды в фосфатно-солевом буферном растворе (далее PBS), затем добавляют к клеткам стерильный раствор цитохалазина В (10 мкг/мл) в среде DMEM без сыворотки. Клетки инкубируют 30 мин при температуре +37°С, в насыщенно-влажной атмосфере, содержащей 5% СО2. Затем раствор цитохалазина В удаляют и промывают клетки 4 раза в PBS. Клетки переводят в суспензию, например, с помощью обработки 0,25% раствором трипсина-ЭДТА (фирма-производитель ПанЭко, Россия). Инактивируют действие трипсина путем добавления среды DMEM с добавлением 10% телячьей эмбриональной сыворотки. Суспензию клеток переносят в новую стерильную пробирку и осаждают на дне пробирки центрифугированием, например, в течение 5 мин при 1400 об/мин на центрифуге LMC-3000 (фирма-производитель BioSan, Латвия). Клетки ресуспензируют в PBS, затем подвергают активному перемешиванию на вортексе (фирма-производитель BioSan, Латвия) в течение 30 сек. Далее, с целью разделения остаточных целых клеток от везикул клеток человека, осуществляют последовательные центрифугирования: дважды при 500 об/мин в течение 15 мин, чтобы осадить целые клетки, крупные обломки клеток и ядра, затем при 3000 об/минв течение 25 мин, чтобы осадить везикулы клеток человека. Полученный осадок, который содержит везикулы клеток человека, ресуспензируют в PBS и снова центрифугируют при 3000 об/мин в течение 25 мин с целью отмывки фракции везикул клеток человека. Полученный осадок, который содержит везикулы клеток человека, ресуспензируют, например, в физиологическом растворе. Полученный биологически-безопасный продукт - везикулы клеток человека - является лекарственным средством, создаваемым на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах. При необходимости возможно введение этапа фильтрации полученного лекарственного средства, с целью получения более однородной по размерам фракции везикул клеток человека. Результаты второго этапа - получения везикул клеток человека - представлены на Фиг. 1. Получением везикул клеток человека завершают второй этап и переходят к выполнению третьего этапа осуществления предлагаемого способа.
Таким образом, на втором этапе получают достаточное для широкого клинического применения количество везикул. При этом метод стимуляции клеток человека с высоким потенциалом к стимуляции ангиогенеза (опухолевые, нативные и/или генетически модифицированные МСК), а также выделение везикул клеток человека не является сложным с технологической точки зрения, не требует много времени и специального дорогостоящего оборудования, что отвечает критерию промышленной применимости. Количество получаемых везикул клеток человека в результате осуществления второго этапа изготовления заявленного лекарственного средства зависит лишь от количества исходного сырья (клеток человека с высоким потенциалом к стимуляции ангиогенеза) и многократно превосходит количество естественных микровезикул (см. аналог представленного технического решения [7] и прототип [9]).
Третий этап
Проводят анализ эффективности полученного лекарственного средства, создаваемого на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах, на предмет стимуляции ангиогенеза in vitro, например, с помощью теста на формирование капилляро-подобных структур на поверхности, покрытой Матригелем (фирма-производитель BD Biosciences, США).
Везикулы клеток человека, выделенные из клеток SH-SY5Y, смешивают с HUVEC и наносят в лунки культурального планшета, покрытые Матригелем, и инкубируют в питательной среде MCDB 131 с добавлением 1% сыворотки крови плодов коровы («бедная» среда) в течение 16-18 часов. В качестве положительного контроля в тесте на формирование капилляро-подобных структур используют клетки SH-SY5Y и среду MCDB 131 с добавлением 20% сыворотки крови плодов коровы и факторов роста (например, FGF2, VEGF, IGF, ECGS) («богатая» среда). Эффективность стимуляции ангиогенеза везикулами, выделенными из клеток SH-SY5Y, оценивают по образованию капилляро-подобных структур. Результаты in vitro теста на формирование капилляро-подобных структур с использованием внеклеточного матрикса Матригель (фирма производитель BD Biosciences, США) приведены на Фиг. 2. Результаты количественной оценки проангиогенных свойств клеток SH-SY5Y и везикул клеток человека, выделенных из клеток SH-SY5Y, приведены на Фиг. З. Количество разветвлений капилляро-подобной сети HUVEC, образование которой было индуцировано везикулами составило 41,33±8,51 единиц разветвлений капилляро-подобной сети, а индуцированной нативных и опасных для применения клеток SH-SY5Y составило 43,5±3,53 единиц разветвлений капилляро-подобной сети (см. Фиг. 3А и Б соответственно). Таким образом, био-безопасные структуры - везикулы клеток человека, выделенные из клеток SH-SY5Y, стимулируют формирование капилляро-подобных структур, а, следовательно, и ангиогенез, подобно исходным клеткам SH-SY5Y.
Таким путем завершают оценку ангиогенных свойств in vitro лекарственного средства везикул клеток человека, создаваемого на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах, и приступают к четвертому этапу.
Четвертый этап
Проводят анализ эффективности полученного лекарственного средства, создаваемого на основе заявленного технического решения, который находится на стадии доклинических испытаний на лабораторных крысах, на предмет стимуляции ангиогенеза in vivo, например, путем подкожного введения везикул клеток человека, выделенных из клеток SH-SY5Y, лабораторным животным (Rattus norvegicus линии Wistar) в матриксе Матригель (фирма-производитель BD Biosciences, США). Матригель разводят с помощью PBS до концентрации 10 мг/мл. В область фланков живота животных подкожно вводят следующие композиции:
1) 2000000 нативных клеток SH-SY5Y в 200 мкл PBS+200 мкл Матригель;
2) везикулы клеток человека, полученные из клеток SH-SY5Y, в количестве, эквивалентном 2×106 клеток SH-SY5Y по концентрации общего белка в 200 мкл PBS + 200 мкл Матригель;
3) 200 мкл РВБ + 200 мкл Матригель (отрицательный контроль).
Через 8 дней после подкожного введения вышеуказанных композий лабораторным животным (Rattusnorvegicus линии Wistar) в матриксе Матригель (фирма-производитель BD Biosciences, США), матрикс был извлечен и подвергнут гистологическому исследованию. Для подсчета количества сосудов фрагменты матрикса подвергали стандартной парафиновой заливке с последующей окраской гематоксилином-эозином. Для визуализации расположения клеток SH-SY5Y и везикул из клеток SH-SY5Y во фргаментах матригеля фрагменты замораживали в жидком азоте и изготовляли замороженные микросрезы толщиной 6 мкм на микротоме-криотате НМ560 Cryo-Star (ThermoScientific). Результаты in vivo теста на выявление ангиогенного потенциала представлены на Фиг. 4.
Нативные клетки SH-SY5Y (Фиг. 4В, Г) и везикулы из клеток SH-SY5Y (Фиг. 4Д, Е) стимулируют прорастание кровеносных капилляров в толщу Матригеля (Фиг. 4, поперечный разрез кровеносных капилляров отмечен стрелками), то есть обладают способностью стимулировать ангиогенез. Кроме того, на флуоресцентных микрофотографиях гистологических срезов фрагментов матрикса отчетливо видно большое количество клеток SH-SY5Y (клетки предварительно были окрашены мембранным красителем DiO (фирма-производитель Life technologies, США), флуоресценция в зеленой области спектра), которые со временем могут привести к формированию опухоли, в то время как количество везикул (везикулы также были предварительно окрашены мембранным красителем DiO (фирма-производитель Life technologies, США)) остается постоянным, так как они не способны к делению и образованию опухоли (Фиг. 4Г, Е соответственно).
Таким образом, везикулы клеток человека, выделенные из клеток SH-SY5Y, стимулируют прорастание кровеносных сосудов, то есть оказывают проангиогенный эффект, подобно клеткам SH-SY5Y. При этом не наблюдается образования опухоли, что свидетельствует о безопасности средства везикул клеток человека.
Полученный после завершения четвертого этапа продукт является лекарственным средством, содержащим везикулы клеток человека, обладающий повышенным (по сравнению с прототипом и аналогами) лечебным действием и ангиогенным потенциалом, а также отвечающий критерию био-безопасности.
Так получением заявленного лекарственного средства, создаваемого на основе заявленного технического решения, которое находится на стадии доклинических испытаний на лабораторных крысах, завершают четвертый, заключительный этап осуществления предлагаемого способа. Полученный препарат применялся заявителем непосредственно после получения.
Основываясь на изложенном, возможно сделать вывод в целом о том, что получены подтвержденные опытами данные, доказывающие эффективность полученного лекарственного средства, а именно - доказан факт стимуляции везикулами клеток человека образования капилляро-подобных структур HUVEC in vitro (Фиг. 2Б), сравнимый со степенью стимуляции для нативных и опасных для применения клеток SH-SY5Y (Фиг. 2А). Количественное соотношение представлено на Фиг. 3: количество разветвлений капилляро-подобной сети HUVEC, образование которой было индуцировано везикулами, составило 41,33±8,51 единиц разветвлений капилляро-подобной сети, а индуцированной нативными и опасными для применения клеток SH-SY5Y составило 43,5±3,53 единиц разветвлений капилляро-подобной сети (Фиг. 3А и Б соответственно). То есть, проангиогенная активность везикул клеток человека из клеток SH-SY5Y сопоставима с активностью нативных и опасных для применения в терапевтических целях вследствие риска неограниченного роста клеток SH-SY5Y, в то время как везикулы клеток человека принципиально не способны к делению и образованию опухоли, что является неопровержимым доказательством, по мнению заявителя, соответствия заявленного технического решения критерию «неочевидность» для специалистов данной области.
Кроме того, на дату регистрации заявки лекарственное средство находится на стадии доклинических испытаний на лабораторных крысах (см. четвертый этап изготовления композиции, с. 14-15 настоящей заявки и поясняющий указанный этап Фиг. 4), однако уже на данной стадии исследований возможно констатировать факт того, что везикулы клеток человека обладают способностью стимулировать ангиогенез in vivo (Фиг. 4Д). При этом, внутри везикул клеток человека биоактивные молекулы оказываются защищены цитоплазматической мембраной от негативного воздействия внеклеточных ферментов, вследствие чего срок жизни биоактивных молекул во внеклеточном пространстве значительно возрастает, что приводит к увеличению эффективности применения по назначению заявленного технического решения. Кроме того, везикулы клеток человека обладают способностью осуществлять целенаправленную доставку в клетки-реципиенты своего содержимого, так как в их оболочке присутствуют специфические рецепторы, обеспечивающие распознавание и целевую доставку.
Заявленное техническое решение представляется возможным реализовать в другом варианте, а именно, выполняя указанные выше действия, препарат везикул клеток человека хранят и применяют по мере надобности. Результаты исследования стабильности лекарственного средства на основе везикул клеток человека при разных условиях хранения приведены на Фиг. 5. Согласно проведенному нами исследованию, наиболее оптимальными условиями хранения, которые не требуют специального оборудования и, следовательно, могут быть воспроизведены повсеместно, являются - хранение в физиологическом растворе при 44°С (Фиг. 5, кривая  ) или лиофильное высушивание везикул и хранение при температуре +4°С (Фиг. 5, кривая
) или лиофильное высушивание везикул и хранение при температуре +4°С (Фиг. 5, кривая  ) или -20°С (Фиг. 5, кривая
) или -20°С (Фиг. 5, кривая  ). При этом наиболее предпочтительными условиями хранения, которые позволяют наилучшим образом сохранить препарат везикул клеток человека, являются: хранение в физиологическом растворе при +4°С и лиофильное высушивание и хранение при -20°С. Таким образом, препарат везикул клеток человека можно хранить с сохранением целостности везикул клеток человека, что отвечает критерию «промышленная применимость», предъявляемого к изобретениям.
). При этом наиболее предпочтительными условиями хранения, которые позволяют наилучшим образом сохранить препарат везикул клеток человека, являются: хранение в физиологическом растворе при +4°С и лиофильное высушивание и хранение при -20°С. Таким образом, препарат везикул клеток человека можно хранить с сохранением целостности везикул клеток человека, что отвечает критерию «промышленная применимость», предъявляемого к изобретениям.
Полученное по приведенному примеру лекарственное средство может быть использовано для лечения заболеваний человека и животных. Лекарственное средство, полученное с использованием заявленного технического решения, может быть использовано в лечебных целях по конкретному назначению, а именно - для эффективной стимуляции прорастания кровеносных сосудов, что показано на четвертом этапе реализации способа в эксперименте in vivo, таким способом и в таком количестве, которые обеспечат лечебный эффект, например - путем непосредственного введения (трансплантации) пациенту.
В качестве клеточного материала для производства везикул клеток человека используют клетки, обладающие повышенным ангиогенным потенциалом, однако данному условию отвечают не только опухолевые клетки, приведенные в примере. В другом варианте в качестве клеточного материала для производства везикул клеток человека используют, например, мезенхимные стволовые клетки (МСК). Известно, что положительное влияние стволовых клеток на процессы регенерации связано не столько с замещением утраченных клеток организма, сколько с паракринной стимуляцией соседних клеток. Выделяя различные факторы роста, стволовые клетки ингибируют апоптоз, стимулируют пролиферацию клеток и способствуют ангиогенезу [14]. Это естественно присущее МСК свойство может быть усилено, например, путем трансдукции клеток генетически модифицированными лентивирусами, экспрессирующими про-ангиогенные факторы [15]. Однако известно, что генетическая модификация клеток ретровирусами и лентивирусами способна приводить к онкологическому перерождению клеток, что делает их похожими на опухолевые клетки и ограничивает их клиническое использование. Заявленный способ получения лекарственного средства (везикул) сочетает в себе все положительные свойства МСК, не способствует размножению и образованию опухоли и при этом обладает достаточной эффективностью действия, так как заключенные внутри везикул биомолекулы оказываются защищены липидным бислоем мембраны от разрушающего воздействия литических ферментов, указанный факт также является неочевидным для специалистов и дополнительно является доказательством наличия изобретательского уровня (неочевидности).
При этом следует акцентировать внимание на том, что, хотя указанные изобретения описаны в деталях, для заявителя очевидно, что могут быть совершены различные эквивалентные замены, например, в выборе вещества, нарушающего структуру цитоскелета, в выборе клеток, обладающих ангиогенным потенциалом и повышенным риском неограниченного деления, применение везикул из СК позволит расширить область применения данного лекарственного средства (исследование регенеративных свойств везикул из нативных, генетически модифицированных стволовых клеток человека находятся на стадии экспериментов in vitro, по которым показана перспективность данного направления исследований), и такие замены не выходят за рамки заявленного технического решения.
Заявленного техническое решение соответствует критерию «мировая новизна», предъявляемому к изобретениям, так как при определении уровня техники не обнаружены технические решения, которым присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, перечисленным в независимом пункте формулы изобретения.
Заявленный способ удовлетворяет критерию «изобретательский уровень» по приведенным выше основаниям (стр. 8, 16, 17), предъявляемому к изобретениям, поскольку из исследованного уровня техники не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками данного изобретения и обеспечивающие реализацию поставленных целей, посредством применения заявленной совокупности признаков в соответствии с приведенной формулой.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. его возможно реализовать в промышленном производстве лекарственного средства из везикул, выделенных из клеток человека, и применять препарат в деятельности организаций здравоохранения и ветеринарии посредством использования известных стандартных технических устройств и оборудования.
Источники информации
1. Schumacher, В., et al., Induction of neoangiogenesis in ischemic myocardium by human growth factors: first clinical results of a new treatment of coronary heart disease. Circulation, 1998. 97(7): p. 645-50.
2. Comerota, A.J., et al., Naked plasmid DNA encoding fibroblast growth factor type 1 for the treatment of end-stage unreconstructible lower extremity ischemia: preliminary results of a phase I trial. J VascSurg, 2002. 35(5): p. 930-6.
3. Lechardeur, D., et al., Metabolic instability of plasmid DNA in the cytosol: a potential barrier to gene transfer. Gene Ther, 1999. 6(4): p. 482-97.
4. Заявка на предполагаемое изобретение №2005111150/14.
5. Rosland, G.V., et al., Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation. Cancer Res, 2009. 69(13): p. 5331-9.
6. Патент №EP 20070794267.
7. Патент №WO 2012KR06478.
8. Патент №CA 20112787894.
9. Zhang, H.C., et al., Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev, 2012. 21(18): p. 3289-97.
10. Gupta, M.K. and R.Y. Qin, Mechanism and its regulation of tumor-induced angiogenesis. World J Gastroenterol, 2003.9(6): p. 1144-55.
11. Papetti, M. and I.M. Herman, Mechanisms of normal and tumor-derived angiogenesis. Am J Physiol Cell Physiol, 2002. 282(5): p. C947-70.
12. K.E. Hatzistergos, A.Blum, T.A. Ince, J.M. Grichnik, J.M. Hare, What Is the Oncologic Risk of Stem Cell Treatment for Heart Disease? Circulation Research. 2011; 108: p. 1300-1303
13. Mao, Z., et al., Cells as factories for humanized encapsulation. NanoLett, 2011. 11(5): p. 2152-6.
14. Baraniak, P.R. and T.C. McDevitt, Stem cell paracrine actions and tissue regeneration. Regen Med, 2010. 5(1): p. 121-43.
15. Cherqui, S., et al., Lentiviral gene delivery of vMIP-II to transplanted endothelial cells and endothelial progenitors is proangiogenic in vivo. MolTher, 2007. 15(7): p. 1264-72.