Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИЧ-ИНФЕКЦИИ ТИПА 1 СУБТИПА А
Вид РИД
Изобретение
Область техники
Изобретение относится к области иммунологии и медицины и предназначено для лечения и профилактики ВИЧ-инфекции типа 1 субтипа «А» (ВИЧ-1А).
В настоящее время проблема борьбы с ВИЧ-инфекцией (вирусом иммунодефицита человека) приобрела глобальный характер из-за распространения ВИЧ-инфекции практически во всех странах, в том числе и в Российской Федерации, где количество ВИЧ-инфицированных по официальной оценке приближается к 1 миллиону. Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок в геноме ВИЧ на несколько порядков больше, чем у эукариот. Из этого следует, что практически у каждой вирусной частицы в последовательности геномной РНК есть хотя бы один и более нуклеотидов, по которым она отличается от предшественника. В настоящее время выделяют 4 типа ВИЧ, отличающихся по наиболее характерным признакам, в частности различной структурой генома: ВИЧ-1, ВИЧ-2, ВИЧ-3, ВИЧ-4. Наиболее распространенным типом вирусов является ВИЧ-1, открытый в 1983 г. Вирус иммунодефицита человека 1-го типа (ВИЧ-1) обладает высокой генетической изменчивостью, а его штаммы разделены на три главные группы: главную (М), которая являются причиной большинства ВИЧ-1 инфекций во всем мире, особая группа (О) и новая группа (N), штаммы которой не принадлежат ни к М, ни к О. В пределах группы М выделено девять субтипов, которые получили буквенное обозначение «A-D», «F-H», «J» и «K». Также выявлены рекомбинантные формы вируса (Grant R Campbell, Erwann Ρ Loret. What Does the HIV1 Tat Protein Teach us About Developing an AIDS Vaccine? Retrovirology 2009; 6: 50-56). Наиболее часто выделяемыми от ВИЧ-1 инфицированных людей штаммами в промышленно развитых странах мира являются вирусы, принадлежащие к субтипам «В», «С», «D». В РФ, Белоруссии и Украине от ВИЧ-1 инфицированных людей чаще выделяются вирусы, принадлежащие к субтипу «А» и его рекомбинантным формам.
Предшествующий уровень техники
В настоящее время разработано достаточно много препаратов, применяемых для лечения и профилактики ВИЧ-1, различающихся механизмами воздействия, способами введения и лекарственными формами. Известна композиция, обладающая иммуногенной активностью против ВИЧ, содержащая слитый полипептид, который включает Nef, или его иммуногенный фрагмент, или производное, и р17 Gag, или его иммуногенный фрагмент, или производное, и р24 Gag, или его иммуногенный фрагмент, или производное (RU 2441878, приоритет от 05.08.2004). Указанная композиция позволяет активизировать иммунные ответы на различные типы ВИЧ и может быть использована в виде вакцины, вводимой посредством инъекций.
Известен способ (и композиция) для профилактики и лечения ВИЧ, включающий введение одного или нескольких антиретровирусных препаратов, при котором одновременно и сочетанно вводят активированную-потенцированную формы антител к белку или пептиду иммунной системы, который взаимодействует с ВИЧ или содержание и/или функциональная активность которого изменяется в связи с инфицированием ВИЧ (RU 2516931, приоритет от 06.08.2010). Предлагаемые изобретения позволяют повысить эффективность профилактики и лечения ВИЧ. Композиция может быть получена в виде раствора или таблетки, предназначенных для перорального введения.
Известен способ лечения ВИЧ, основанный на использовании композиции, включающей, по меньшей мере, один ингибитор протеазы ВИЧ, выбранный из группы нелфинавир, саквинавир, типранавир и др., и фармацевтически приемлемые вспомогательные вещества, включающие водорастворимые полимеры, при определенном количественном соотношении компонентов (RU 2505286, приоритет от 29.12.2012). Композиция изготавливается в виде твердой лекарственной формы и позволяет улучшить кинетику растворения и биологическую доступность препарата, что сокращает время до наступления лечебного эффекта.
Указанные способы и композиции согласно описаниям изобретений позволяют повысить эффективность лечения и профилактики ВИЧ-1, однако нигде не говорится о полной стерилизации организма от вируса ВИЧ. Отсутствие такой стерилизации согласно имеющимся данным в отношении клинического течения ВИЧ-1 приводит к различным негативным последствиям, в том числе нейродегеративным, которые обостряются со временем (ВИЧ-1-ассоциированная деменция). Расстройства вызывает присутствие в организме небольшого количества остаточных вирусных геномов, которые, со временем, продуцируют все возрастающие количества Tat-белка, необратимо повреждающего нейроны (Ghafouri M., S. Amini, K. Khalili, B.E. Sawaya. HIV-1 associated dementia: symptoms and causes // Retrovirology 2006, 3(1): 28-38).
Одними из наиболее эффективных способов профилактики и лечения ВИЧ-1 являются способы, основанные на применении иммунизации пациентов Tat-белком. Исследование случаев отсутствия наступления СПИДа у ВИЧ-1-инфицированных позволило установить ведущую роль Tat-белка ВИЧ-1 в механизме развития синдрома.
Известно, что у сероположительных пациентов с длительно непрогрессирующей ВИЧ-1-инфекцией (LTNP) отмечается более высокий уровень антител к Tat, чем у сероположительных пациентов с быстрым прогрессом инфекции (US Patent Application 20120121632, РСТ 2009/54846). Другим основанием необходимости разработки Tat-вакцины стал пример LTNP пациента из Габона, который являлся серопозитивным и был заражен штаммом ВИЧ-1 субтипа «В», образующего специфический Tat-белок (WO 95/31999). Tat-белок, выделенный от этого пациента и получивший название «Oyi», показал себя мощным протективным антигеном, при котором подкожная и внутримышечная иммунизация эффективна для случаев заражения ВИЧ-1 субтипов «В», «С», «D» (US Patents 7087377, US Patent Applications 20110165191). Возможность восстановления численности клеток CD4+ реализуется с применением Tat-вакцины, основанной на биологически активном белке (US Patent Applications 0110319593).
Известно использование Tat-иммунизации для усиления эффективности HAART и восстановления иммунного гомеостаза (Ensoli В. и др. Therapeutic Irnmunization with HIV-1 Tat Reduces Immune Activation and Loss of Regulatory T-Cells and Improves Immune Function in Subjects on HAART//PLoS ONE 2010, 5(11): e13540, pp. 1-29).
Однако иммунизация Tat-белком субтипа «В» (Tat-белка OyiCys22) не стимулирует эффективную реакцию против разновидностей Tat от «А» и ВИЧ «C1» субтипов, которые вызывают 75% инфекций в мире (РСТ/ЕР 09/54846). Причины малой эффективности иммунизации Tat-белком в данном случае были установлены при изучении структуры нейтрализующих моноклональных антител (7G12, 6Е7, 27А8), которые реагировали лишь с конформационным эпитопом Tat-белка «Oyi» (14-ть первых N-концевых аминокислот, US Patents 7087377).
Известен ряд попыток вызвать у человека образование нейтрализующих антител со структурой вариабельных цепей, близкой к вышеуказанным моноклональным антителам. С этой целью применяют технологию «гаптенизации» (US Patent Applications 0060210588, US Patent Applications 0070207952), а также различные «носители» для «гаптена», адъюванты (усилители иммунного ответа) и способы введения вакцины. В качестве «гаптена» применяются пептиды, соответствующие фрагментам Tat-белка «Oyi» и, в первую очередь, фрагмент, формирующий конформационный эпитоп (15-ть первых N-концевых аминокислот, US Patents 7087377). Технология «гаптенизации» преследует цель получить иммунный ответ на малую по молекулярной массе молекулу («гаптен»), что предполагает образование ковалентной связи между «носителем» и «гаптеном» так, чтобы модифицированный «гаптеном» «носитель» послужил бы мишенью для иммунологической реакции, которую усиливают адъювантами и способами введения. Однако экспериментальные усилия по совмещению технологии «гаптенизации» с определением конформационных эпитопов белков носят характер удачного стечения обстоятельств, которые, несмотря на все попытки, не удается систематизировать и регламентировать.
Известен способ профилактики и лечения ВИЧ, основанный на применении вакцин, содержащих V3-петлю gp120 и Tat ВИЧ-1 (RU 2432356, приоритет от 11.03. 2005). Tat взаимодействует с петлей V3 gp120, имитируя таким образом корецептор CCR5 как на молекулярном (структурном), так и на функциональном уровне и придавая тем самым CCR5 штаммам ВИЧ способность инфицировать клетки-мишени, экспрессирующие лишь очень малые количества CCR5, которые не могли быть инфицированы тем же самым вирусом в отсутствие иммобилизованного Tat. В связи с наличием молекулярной мимикрии между CCR5 и Tat, комплексы и антитела, получаемые против данных комплексов, будут также, частично, имитировать действие или напрямую действовать против эпитопов, присутствующих в CCR5 или в комплексе CCR5/V3-петля, способствуя повышению эффективности вакцины или антител, используемых для пассивной иммунизации, однако данное изобретение также не решает задачу по получению эффективного иммунного ответа против ВИЧ-1А и его Tat-белка.
Таким образам из уровня техники известны способы анти-Tat вакцинации, которые показали клиническую эффективность (отсутствия наступления СПИД) при заражении вирусами лишь субтипов «В», «С», «D». Однако для ВИЧ-1А, эндемичного для РФ, Белоруссии и Украины, не существует анти-Tat вакцинации и не описаны случаи сероположительных и, одновременно, длительно не прогрессирующих пациентов (LTNP).
Кроме того, все применяемые в настоящее время препараты и композиции, предназначенные для воздействия на различные типы и субтипы ВИЧ-1, не учитывают индивидуальные особенности структуры генома ВИЧ-1А конкретного инфицированного пациента, связанные с высокой частотой генетических изменений ВИЧ, приводящие, как к наличию у разных пациентов с одним субтипом ВИЧ-1А отличающихся структур геномов ВИЧ-1А, так и к наличию у одного инфицированного пациента нескольких различных структур генома ВИЧ-1А одного субтипа. Соответственно, и применяемые способы и препараты, предназначенные для лечения и профилактики ВИЧ-1А, не достаточно дифференцированы по избирательности своего воздействия и не индивидуализированы в отношении конкретного пациента, что снижает их эффективность и приводит к различным осложнениям.
Сущность изобретения
Задачей настоящего изобретения является создание персонализированного способа лечения и профилактики ВИЧ-1А с использованием пептида (ов) 6-пептидил замещенного производными аминопенициллановой кислоты (6-пептидил - АПА), позволяющего получать у сероположительных пациентов отсутствие прогрессирующего течения ВИЧ-1А. Необходимость создания персонализированного способа лечения и профилактики ВИЧ-1А возникает в связи с очень высокой вариабельностью последовательности Tat-белка, которая была выявлена при анализе выделенных ранее инфекционных молекулярных клонов этого вируса (Desfosses Y., M. Solis, Q. Sun, N. Grandvaux, C. Van Lint, A. Burny, A. Gatignol, M.A. Wainberg, R. Lin, J. Hiscott. Regulation of Human Immunodeficiency Virus Type 1 Gene Expression by Clade-Specific Tat Proteins // JOURNAL OF VIROLOGY, 2005, Vol. 79, №14 p. 9180-9191).
Решение указанной задачи обеспечивается тем, что в отличие от известных способов новым является то, что выделяют структуру генома ВИЧ-1А у инфицированного пациента, определяют первичную структуру 14-ти N-концевых аминокислот Tat-белка в выделенном геноме ВИЧ-1А, создают персонализированный препарат в виде 6-пептидил замещенного производными аминопенициллановой кислоты (6-пептидил-АПА) пептида, имеющего аминокислотную последовательность, совпадающую с 14-ю N-концевыми аминокислотами Tat-белка в выделенном геноме ВИЧ-1А инфицированного пациента, и вводят полученный персонализированный препарат пациенту, причем введение препарата осуществляют ректальным способом, при этом в случае выделения у инфицированного пациента нескольких различных структур генома ВИЧ-1А, имеющих отличия в составе 14-ти N-концевых аминокислот Tat-белка, для каждой из указанных структур генома ВИЧ-1А создается свой персонализированный препарат со структурой, совпадающей с составом 14-ти N-концевых аминокислот Tat-белка каждого из выделенных геномов ВИЧ-1А, причем все созданные препараты вводят пациенту ректальным способом.
Кроме того, 6-АПА модифицированный Tat-пептид(-ы) ВИЧ-1А вводят в виде свечи или в виде микроклизмы.
Определение первичной структуры 14-ти N-концевых аминокислот Tat-белка в выделенном геноме ВИЧ-1А позволяет идентифицировать структуру инфекционных молекулярных клонов, выделенных от инфицированного пациента, и создать персонализированный препарат в виде 6-пептидил замещенного производными аминопенициллановой кислоты (6-пептидил - АПА) пептида, имеющего аминокислотную последовательность, совпадающую с 14-ю N-концевыми аминокислотами Tat-белка в выделенном геноме ВИЧ-1А инфицированного пациента.
Введение полученного персонализированного препарата пациенту позволяет обеспечить наличие иммунной реакции пациента на ВИЧ-1А при устранении опасности самопроизвольного инфицирования пациента ВИЧ-1А в процессе вакцинации, уменьшить побочное действие от введения препарата и увеличить эффективность его применения.
Ведение пациенту нескольких различных структур генома ВИЧ-1А, имеющих отличия в составе 14-ти N-концевых аминокислот Tat-белка, в случае выделения у инфицированного пациента подобных структур, позволяет обеспечить необходимые иммунные реакции пациента на все выделенные структуры ВИЧ-1А.
Введение препарата ректальным способом позволяет повысить эффективность действия препарата за счет увеличения интенсивности воздействия, сокращения времени его усвояемости и выработки иммунного ответа на введение препарата, а также уменьшить его дозировку и снизить побочное действие.
Введение препарата в виде свечи или микроклизмы повышает удобство проведения вакцинации и расширяет возможности по его использованию в различных условиях.
Сущность настоящего изобретения иллюстрируется следующими изображениями:
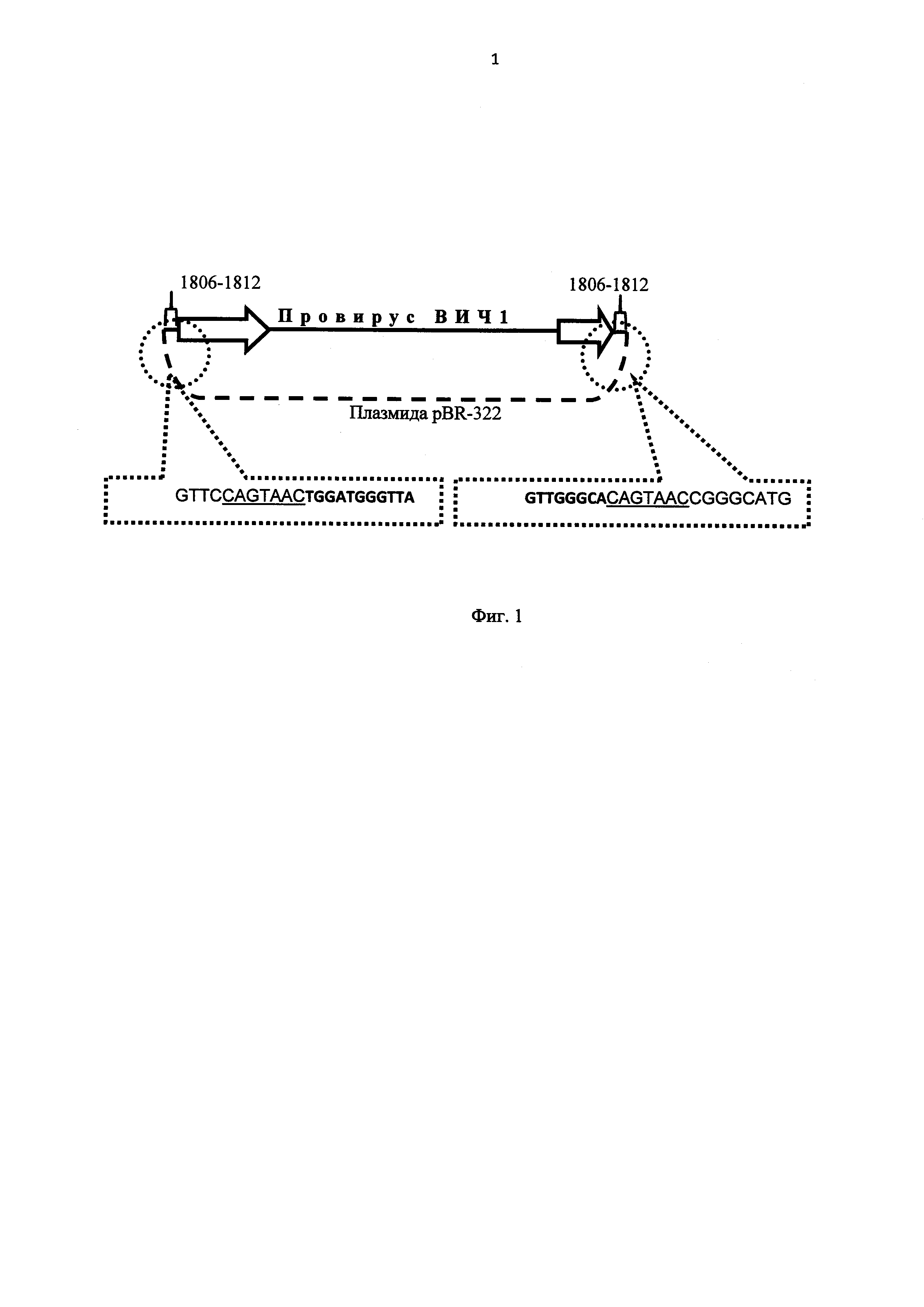
Фиг. 1 - Структура молекулярного клона.
Фиг. 2 - Микроклизма.
Фиг. 3 - Выявление предынтеграционного комплекса (ПИК) в цитоплазме ВИЧ-зараженных 106 МПКЧ (время после заражения 8 часов, дорожка «О»).
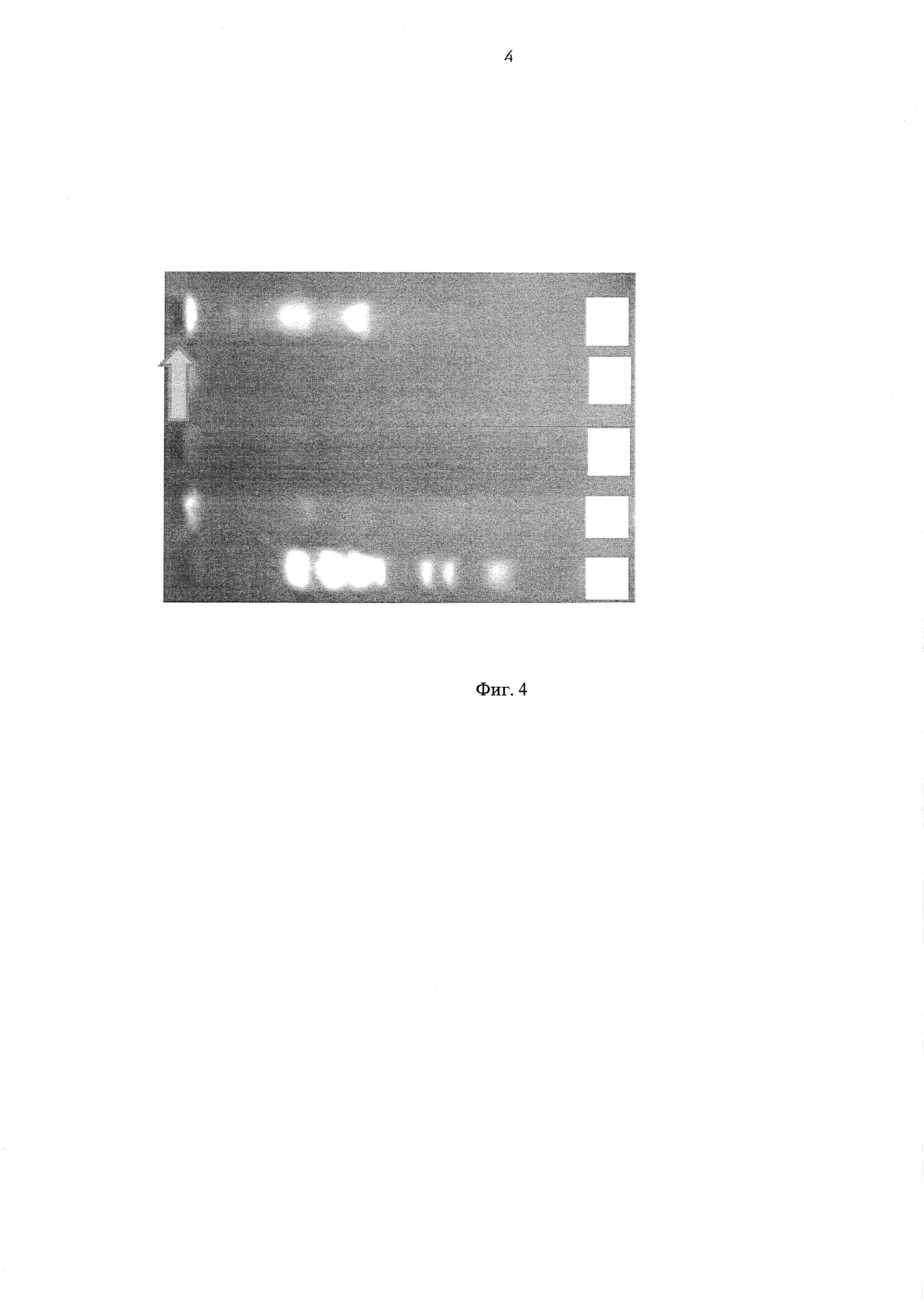
Фиг. 4 - Результат электрофореза плазмидной ДНК в 1,5% агарозном геле.
Фиг. 5 - Выделение инфекционного потомства ВИЧ-1.
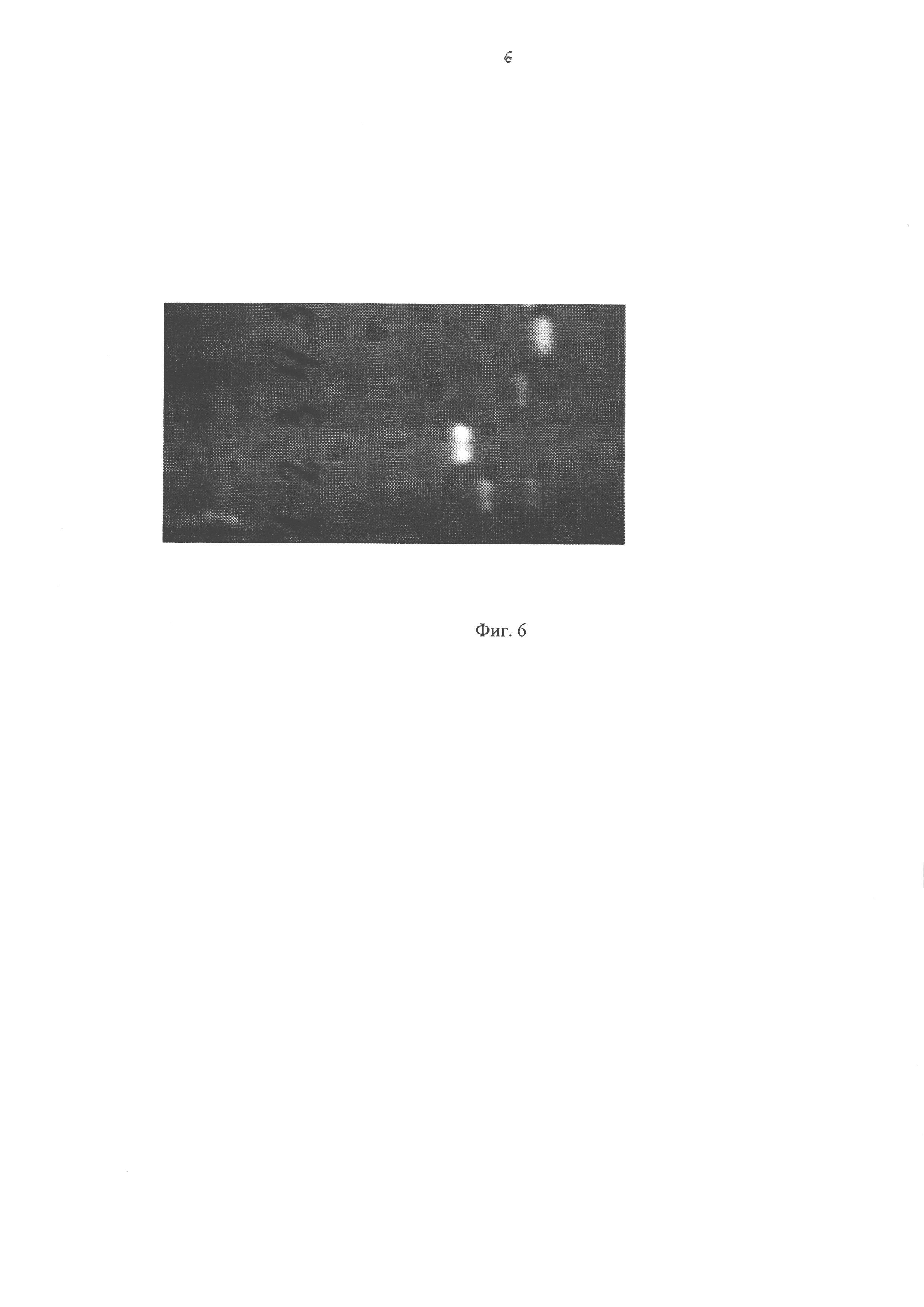
Фиг. 6 - Результаты электрофореза в 2% агарозном геле продуктов амплификации последовательностей LTR, pol и tat.
Фиг. 7 - Таблица 1. Структура праймеров для амплификации.
Осуществление изобретения
Предлагаемый способ позволяет обеспечить получение персонализированного состояния LTNP (непрогрессирующего течения ВИЧ-1А инфекции) и может быть реализован на базе существующего уровня техники следующей последовательностью операций.
Первоначально подготавливают необходимые фрагменты 6-ΑΠΑ модифицированного Tat-пептида ВИЧ-1А, для чего осуществляют определение первичной структуры 14-ти N-концевых аминокислот Tat-белка у инфекционного молекулярного клона (-ов), выделенного от пациента. Затем создают персонализированный препарат: 6-пептидил замещенного производного 6-ΑΠΑ, где пептидил структурно аналогичен 14-ти N-концевым аминокислотам Tat-белка инфекционного молекулярного клона (-ов) у ВИЧ-1А инфицированного пациента. После чего осуществляют ректальную иммунизацию (IR) пациента персонализированным препаратом, введение которого вызывает у пациента образование трех классов антител IgG, IgM и IgA (иммуноглобулины классов G, M, А соответственно) в высоком титре и, соответственно, повышение титра иммунных CTL у пациента. В случае выделения у инфицированного пациента нескольких различных структур генома ВИЧ-1А, имеющих отличия в составе 14-ти N-концевых аминокислот Tat-белка, для каждой из указанных структур генома ВИЧ-1А создается свой персонализированный препарат со структурой, совпадающей с составом 14-ти N-концевых аминокислот Tat-белка каждого из выделенных геномов ВИЧ-1А, причем все созданные препараты вводят пациенту ректальным способом.
Изобретение позволяет получать персонализированные биологически активные препараты, которые могут формировать ковалентные связи с растворимыми белками и белками клеточной поверхности и показывают желаемую биологическую активность in vivo. Первой практической задачей данного изобретения являлось определение структуры генома ВИЧ-1 у инфицированного пациента по схеме, известной специалистам (US Patent 4520113; US Patent 4647773; US Patent 4708818; EP 0178978-A/2; WO 8601827-A/1; EP 0185444-A2). На основании данного изобретения выделение и определение структуры генома ВИЧ-1 у инфицированного пациента позволяет не только уточнить диагноз, но выяснить структуру Tat-белка инфекционного молекулярного клона (-ов) у ВИЧ-1А инфицированного пациента. В ходе вакцинации открывается возможность проследить за соотношением инфекционных и неинфекционных молекулярных клонов в плазме пациента так, что можно оценить эффективность иммунизации. Следует отметить возможность контроля передачи инфекционного вируса контактирующим с пациентом лицам. Изобретение позволяет получать комбинированные «гаптены» с хорошей фармакодинамикой за счет физиологически активной половины, например, 6-ΑΠΑ, способной, после открытия β-лактамного кольца, к образованию ковалентных связей с самыми различными белковыми молекулами по ε-аминогруппам аминокислотных остатков лизина («пенициллоильная» конфигурация), или за счет дисульфидной связи с остатками цистеина («пеницилленильная» или «пеницилламинная» конфигурация). В рамках настоящего изобретения созданы нетоксичные персонализированные препараты комбинированных «гаптенов» так, что в физиологических условиях они распознаются Τ- и В-клетками в форме иммуногенных детерминант (эпитопов), как известно специалистам (US Patent 6811782; US Patent 7115266; US Patent Applications 0130236478). Дополнительно, Th1 ответы против комбинированных «гаптенов» достигаются не только структурным полиморфизмом продуктов распознавания, обеспечивающим вариацию процессинга и индукцию ответов цитотоксических Т-клеток (CTL), которые в норме являются субдоминантными (РСТ/ЕР 2004/11950), но и использованием соответствующих ODN адъювантов, известных специалистам (US Patent 6194388; US Patent 6821957). По схеме данного изобретения персонализированный препарат для ректальной иммунизации вводится по схемам, снижающим частоту повторных инъекций. На основании данного изобретения эффективная иммунизация комбинированными «гаптенами» исключает возможность для полноразмерного Tat-белка функционировать как адъювант, повышая клеточные иммунные ответы против других антигенов, как раскрыто в WO 03/0098670.
Эффективность иммунизации контролировали по известным специалистам технологическим регламентам (анализ титра специфических иммуноглобулинов и цитотоксических лимфоцитов), а вирусную нагрузку и титр инфекционного вируса - по схеме, известной специалистам (US Patent 4520113; US Patent 4647773; US Patent 4708818; EP 0178978-A/2; WO 8601827-A/1; ЕР 0185444-A2).
Экспериментальные исследования предложенного способа были осуществлены ЗАО «ЮрВелес». Привлечение пациентов к участию в исследованиях осуществлялось с учетом положений Хельсинской Декларации Всемирной медицинской ассоциации (ВМА) «Этические Принципы для медицинских исследований с человеком», параграф 22 части «В» которой гласит: «В любом исследовании на людях, каждый потенциальный участник эксперимента должен быть адекватно информирован… После того, как участнику эксперимента обеспечено понимание информации, врач должен получить добровольное информированное согласие этого участника эксперимента, предпочтительно в письменной форме, которая … должна быть юридически зарегистрирована и засвидетельствована».
Все манипуляции с материалами, подозрительными на зараженность ВИЧ-1, проводили с учетом правил поведения в лаборатории, работающей с материалом, зараженным ВИЧ-1. Результаты исследований иллюстрируются графическими материалами (Фиг. 1, 7), а на Фиг. 2-6 представлены в виде фотографий.
Структура молекулярного клона показана на Фиг. 1. Участки последовательностей ID-дупликаций плазмиды pBR-322 (K00005, GenBank) указаны номерами нуклеотидов; приведены нуклеотидные последовательности стыков между LTR ВИЧ-1 и pBR-322, ID-последовательность подчеркнута. Обозначения:

Результат выявления предынтеграционного комплекса (ПИК) в цитоплазме ВИЧ-1 зараженных МПКЧ (мононуклеары периферической крови человека) показан на Фиг. 3 (106 МПКЧ, время после заражения 8 часов, дорожка «О». Вирус получали после трансфекции активированных МПКЧ инфекционной вирусной кДНК). ПИК-сы выделяли из цитоплазматической фракции. Полосу «ПИК» вырезали из геля и в ПЦР (полимеразная цепная реакция) определяли присутствие последовательностей LTR и генов gag, pol, env. Дорожка «К» - контроль: незараженные клетки. Окраска гелей - пропидия иодидом, облучение лазерным импульсом с  . В обоих случаях на картине разделения выделяются интенсивные полосы, принадлежащие рибосомальным РНК (около 5 и 2 т.п.о.).
. В обоих случаях на картине разделения выделяются интенсивные полосы, принадлежащие рибосомальным РНК (около 5 и 2 т.п.о.).
Результат электрофореза плазмидной ДНК в 1,5% агарозном геле представлен на Фиг. 4. Дорожки: «А» - фрагменты линейной ДНК с размерами от 4-0,5 т.п.о. (тысячи пар оснований). «Б-Д» - плазмидные ДНК, выделенные из материала трансформированных клонов, очевидно присутствие гибридной плазмиды (показано стрелкой) с молекулярной массой, многократно превосходящей таковую pBR322 (4,36 т.п.о., дорожка «Д»).
Выделение инфекционного потомства ВИЧ-1 определяли по характерному изменению монослоя клеток, полученного с помощью осаждения PEI на пластиковую поверхность лунки. На Фиг. 5 воедино сведены половины лунок, на одной из которых (слева) видны характерные нарушения монослоя клеток («бляшки»).
На Фиг. 6 представлены результаты электрофореза в 2% агарозном геле продуктов амплификации последовательностей LTR, pol и tat. Дорожки: 1 - LTR, 2 - pol, 3 - tat из инфекционной кДНК, 4 - tat из неинфекционной кДНК.
Структура праймеров для амплификации приведена в Таблице 1, Фиг. 7.
Изобретение поясняется следующими примерами.
Пример 1. Выделение и клонирование ПИК-сов
Из крови здорового донора фракцию, содержащую МПКЧ, выделяли центрифугированием на ступенчатом градиенте Ficol 400. Клетки культивировали 2-е суток при 37°С в среде RPMI1640 с 10% фетальной бычьей сыворотки, рекомбинантным IL-2 человека (50 ед./мл), а также ФГА (до 0,5%). 2×107 МПКЧ, активированных ФГА (фитогемагглютинин), вносили в сыворотки больных СПИД (синдром приобретенного иммунного дефицита) с достаточно высоким титром вирусного белка р24 и инкубировали смесь 6-8 часов при 37°С. Предынтеграционные комплексы (ПИК-сы) осаждали центрифугированием (8000 об/мин, 15 минут) из осветленного лизата. Присутствие в лизатах клеток ПИК-сов ВИЧ-1 контролировали электрофорезом в агарозном геле (см. Фиг. 3). Осадок смешивали в 100 мкл буфера "А" (10 мм MgCl2, 20 мм HEPES (N-гидроксиэтилпиперазин-N′-2-этансульфоновая кислота) [рН=7.2], 10% PEG8000, 5 мМ апротинина, 1 мм DTT (дитиотрейтол)) с ДНК плазмиды pBR322 (50 нг) и инкубировали смесь при 25°С в течение 30 минут. Смесью проводили трансформацию компетентных клеток штамма χ6019. Трансформированные клетки высевали на среду с ундекилвиологеном (20 мкг/мл). Посевы инкубировали при 37°С в течение 18 часов. Частота образования колоний, содержащих гибридные плазмиды с молекулярными клонами ВИЧ-1А, составила не менее 15%.
Пример 2. Определение инфекционности молекулярных клонов ВИЧ-1А и определение их структуры (секвенирование)
Клоны, потомство которых содержало гибридные плазмиды, определяли методом электрофореза в агарозном геле, как описано ранее (Promega Technical Manual №012). На Фиг. 3 показан результат электрофореза ДНК клона, содержащего гибридную плазмиду с очень низкой подвижностью. Клеточную массу потомства колоний, содержащих гибридные плазмиды с низкой подвижностью, собирали и разрушали для выделения плазмидной ДНК по технологии, описанной в US Patent 6242220, и последующего электрофореза в 1,5% агарозном геле (см. Фиг. 4). ДНК гибридных плазмид с молекулярной массой, многократно превосходящей таковую pBR322 (4,36 т.п.о.), выделенных из агарозы, использовали для трансформации клеток линии Jurkat (по технологии Promega Transfection Guide, см. US Patent 5824812; US Patent 5869715), осажденных на поверхность чашек PEI. Образование инфекционного потомства ВИЧ-1 определяли по характерному изменению монослоя клеток (см. Фиг. 5). ДНК гибридных плазмид, которые при трансформации клеток линии Jurkat вызывали характерное изменение монослоя клеток, использовали для амплификации в ПЦР (технология дана по US Patent 4683202) для идентификации последовательностей LTR, а также генов pol и tat. В таблице 1 приведены структуры праймеров для амплификации, а на Фиг. 6 результат ПЦР эксперимента.
Пример 3. Определение структуры Tat кодирующего экзона и определение аминокислотной последовательности, совпадающей с таковой в N-концевых позициях 2-15 Tat-белка
Фрагмент ДНК гибридных плазмид с инфекционными молекулярными клонами ВИЧ-1А и кодирующими Tat-белок амплифицировали в ПНР. Продукт амплификации секвенировали в автоматическом режиме на секвенаторе 373A Automatic Sequencer (Applied Biosysthems USA) с использованием набора реагентов «Dye Deoxy Terminator ABI sequencing Kit with Taq-polymerase FS» («Perkin-Elmer», USA), как известно специалистам. Первичную структуру Tat-белка ВИЧ-1А определяли с помощью программы Vector NTI 11.5, как это изложено в US Patent 5801056.
Структуры Tat-пептидов, обнаруженные в геномах группы ВИЧ-1А-инфицированных пациентов, привлеченных к испытаниям, могут быть представлены в виде XPXDPXXEPWXHPG. Как видно из представленной последовательности в пяти позициях могут быть замены. Тем самым обсуждение возможности создания промышленной анти-Tat вакцины, направленной против ВИЧ-1А, должно быть отложено до получения большей статистики инфекционных молекулярных клонов вируса этого субтипа.
Пример 4. Синтез олигопептидов
Полученные на пептидном синтезаторе ABI 488А (Perkin Elmer, Norwalk, Conn.) методом F-moc (метод твердофазного синтеза пептидов с флуренилметоксикарбонил/трет-бутил производными аминокислот) пептиды требовали стадии «снятия защиты» с 15 мМ трифлуороуксусной кислотой (TFA), и проводили выделение целевого продукта методом жидкостной хроматографии высокого давления (HPLC) согласно прилагаемым инструкциям.
Пример 5. Синтез 6-АПА модифицированного Tat-пептида ВИЧ-1А (комбинированный «гаптен») и определение его способности ковалентно присоединяться к сывороточному альбумину человека
Лиофильно высушенные 14-членные пептиды со структурой, указанной ниже, использовали для создания конъюгатов с натриевой солью бромоацетилированной 6-АПА в 100 мМ бортном буфере (рН=8.3). Конъюгаты пептидов с 6-АПА вновь выделяли с помощью HPLC и лиофилизировали. Часть препарата комбинированного «гаптена» использовали для определения его способности ковалентно присоединяться к сывороточному альбумину человека (технология в общем виде описана в US Patent 4596768).
Пример 6. Протокол иммунизации
Введение, по крайней мере, комбинированного «гаптена» одного вида, через слизистую оболочку желудочно-кишечного тракта субъекта
Величина однократной дозы, содержащей терапевтически эффективное количество активного начала в препарате, определялась опытным путем и равнялась в среднем 200 мкг. Причем, поскольку в способе предлагается средство для иммунизации, индивидуализируемое для конкретного пациента, то выбор доз препарата корректировался исходя из принципа индивидуального подбора действующего активного вещества, с учетом результатов оценки результатов кожной пробы после каждого введения препарата. Ректальную иммунизацию добровольцев проводили двух- или трехкратно с интервалом в две недели. Количество иммунизаций также определяли с учетом результатов оценки кожной пробы.
Согласно проведенным исследованиям препараты для иммунизации имели уровни токсичности по Limulus амебному лизату <0,1 ед/мкг. Другие токсикологические характеристики препаратов изучали на базе Лаборатории лекарственной токсикологии Федерального государственного учреждения «Российский кардиологический научно-производственный комплекс» в соответствии с регламентами («Руководство по экспериментальному (доклиническому) изучению новых фармакологических препаратов» (МЗ РФ, Москва, 2000). Проведенные испытания на мышах и крысах Wistar показали, что значения доз острой и хронической токсичностей используемого препарата превышали суточную терапевтическую дозу для человека в 1400 и 20 раз.
Пример 7. ИФА
Плашки для микротитрования покрывали 200 нг N-концевых пептидов или 1 мкг бежов, растворенных в 50 мМ карбонатно-бикарбонатного буфера (Sigma-Aldrich). После стадии блокирования неспецифического связывания разведения проб плазмы (получены от ВИЧ-1А инфицированных пациентов) или контрольных материалов (здоровые пациенты, препарат «трастозумаб») в 25% DMSO (диметилсульфоксид) вносили в лунки на 18 часов при +5°С. Связывание антител и их классов выявляли используя античеловеческие IgG кролика, меченные флюорогенным красителем TAMPA (флуоресцентный краситель тетраметилродамин) (по технологии US Patent Applications 20080274488).
Уровень IgE плазмы определяли с помощью коммерческого набора IgE ELISA kit (Mabtech Inc., Sweden) и согласно прилагаемым инструкциям.
Постановка ИФА. Антитела против Tat-белка у пациента выявляли стандартным ИФА с U96 плашками (Nunc). Дно лунки предварительно покрывали 0.5 мкг/лунку каждой разновидности Tat в 100 мМ фосфатном буфере рН=4.5 и инкубировали 16 ч при 4°С с последующей инкубацией с 2%-ным молоком (для снижения неспецифического связывания). Сыворотки (одна сыворотка для одной чашки) были добавлены в различном разбавлении PBS с 0.2% молоком и мягко качали на шейкере 1 ч в RT. Вторичное антитело (античеловеческие IgG кролика, меченные TAMRA) разбавляли 1:1000 в PBS с 0.2% молоком, было добавлено к каждому хорошо и мягко качали на шейкере 1 ч в RT. Чашки были вымыты трижды с 200 мкл однократного PBS/0.05% Tween 20 (Genaxis) между каждым последующим шагом. Открытие было выполнено с 100 мкл ABTS (2,2′-azino-bis-3-ethylbenz-thiazoline-6-sulfonic кислота от Сигмы), добавленный к каждому хорошо, и мера поглощения света читалась в универсальном микроспектрофотометре для прочтения планшетов EL800 (BIO-ТЕК INSTRUMENT, INC) в 405 нм.
Пример 8. Определение CTL активности
CTL (цитотоксический лимфоцит) активность проводили методом внутрикожной пробы с синтетическим сингенным пептидным конъюгатом с сывороточным альбумином человека.
Пример 9. Определение эффективности иммунизации
Техника подсчета CD4 (клеточный рецептор-маркер лимфоцитов «помощников»): выделение на магнитных бусинах с моноклональными антителами против рецепторов CD4 (Becton Dickinson, USA).
Оценка вирусной нагрузки: количественный ПЦР, проводимый ООО «Инвитро».
Оценка QoL (показатель качества жизни): опрос, проводимый лечащим врачом, по Вопроснику ВОЗКЖ-100 (Анкета Всемирной организации здравоохранения).
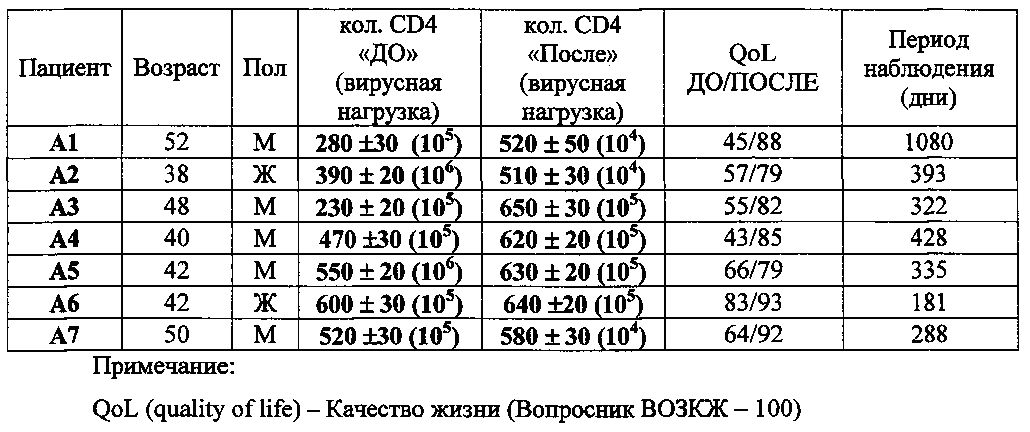
Промышленная применимость
Предлагаемый персонализированный способ позволяет обеспечить эффективное лечение и профилактику ВИЧ-1А, минимизировать побочные действия от процесса вакцинации и может быть реализован в амбулаторных условиях на базе имеющегося оборудования.