Результат интеллектуальной деятельности: СПОСОБ ПОЛИСИГНАЛЬНОЙ АКТИВАЦИИ АПОПТОЗА КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ СОЛИДНЫХ ОПУХОЛЕЙ
Вид РИД
Изобретение
Изобретение относится к области медицины и молекулярной биологии и может быть использовано для полисигнальной активации апоптоза клеток злокачественных солидных опухолей (ЗСО), реализуемой посредством адресного введения в клетки солей таллия.
В настоящее время для лечения онкологических заболеваний используются самые разнообразные методологические подходы, начиная от классических - хирургии, лучевой терапии и химиотерапии, и до самых современных высокотехнологичных инновационных методик, основанных на методах генной инженерии и молекулярной биологии. Общим для всех методов стратегий терапии опухолей является стремление врачей уничтожить в организме пациента все раковые клетки, однако пока все инновационные терапевтические и хирургические подходы, направленные на уничтожение раковых клеток, не могут обеспечить в достаточной степени оптимизации сочетания эффективности лечения с минимизацией до допустимого уровня негативное воздействия применяемой терапии.
Согласно данным исследований апоптоз признан главной формой клеточной смерти клеток ЗСО в случае осуществления эффективной антираковой терапии (Жуков Н.Н., Тюляндин С.А. Таргетная терапия в лечении солидных опухолей // Биохимия 2008, т.73, №5, стр. 605-618). В настоящее время разрабатываются различные методы воздействия на раковые клетки, инициирующие моносигнальную индукцию апоптоза в целевой клетке. Группы таких препаратов подразделяют на: мембранные индукторы апоптоза, активаторы внутриклеточных протеаз или ДНК-повреждающие агенты и проапоптотические агенты (Fischer, Schulze-Osthoff // Apoptosis-based therapies and drug targets. Cell Death and Differentiation 2005, v. 12, pp.942-961). В разработку и клинические испытания указанных препаратов включились такие фирмы из США, как Abbott Laboratories, Amgen, Eli Lilly, HGSI (Human Genome Science), Invitrogen Therapeutics, ISIS Pharmaceuticals, Johnson & Johnson, Maxim Pharmaceuticals, Pfizer, Schering-Plough, Vertex Pharmaceuticals Inc. и Wyeth, а также немецкие Roche и Merck Serono, Kyowa Hakko Kogyo Co., Ltd. (Япония), Structural Bioinformatics, Inc. (Канада). К мембранным индукторам апоптоза относят моноклональные антитела (например, трастузумаб или пертузумаб) и различные лиганды: белки (Fas и TRIAL) и небольшие молекулы (гефитиниб, ирлотиниб или циленжитид (Kurozumi K. Cilengitide Treatment for Malignant Glioma: Current Status and Future Direction // Neurol Med Chir (Tokio) 2012, v.52, 539-547). Все они получены для связывания со строго определенными антигенами, интегринами (US Patent 9073974) или трансмембранными белками и вызывают моносигнальную активацию апоптоза. Среди ДНК-повреждающих препаратов следует отметить цис-платину и карбоплатин, а также доксорубицин (US Patent 5529775). Производные полифенилмочевины известны как активаторы каспазного каскада внутриклеточных протеаз (Гарин A.M. Молекулярные мишени современной лекарственной терапии опухолей // XI Российский онкологический конгресс, Москва 20-22.11.2007, стр. 10-11). Проапоптотеческими препаратами являются производные витамина Ε (патент РФ 2328273).
При этом эффективность воздействия на раковые клетки и снижение негативных последствий применяемой терапии во многом определяется выбором способа доставки фармакологически активных веществ к указанным клеткам. Одним из наиболее новейших направлений способов доставки является таргетная терапия, обеспечивающая избирательное воздействие на специфические молекулы, участвующие в росте и развитии раковых клеток. В качестве примера можно указать на способы адресной доставки ДНК-повреждающего препарата доксорубицина (патент РФ 2143266; Карпушина И.А. и др. Применение методики направленного транспорта лекарственных препаратов в клинической практике // Журнал Всероссийского центра экстренной и радиационной медицины, Санкт Петербург. - 2004. - Т.5. - С. 404-408; Соколова Д.А. и др. Анти-MUC-1 иммунолипосомальная конструкция доксорубицина для направленной доставки в опухоль // Российский биотерапевтический журнал 2011, №3, стр. 99-104; US Patent Application 20090047318, 20130287853), активно разрабатываемые в последние несколько лет в РФ и за рубежом.
Для повышения эффективности и снижения токсичности, химиопрепараты инкапсулируют, например, в вирусные частицы (вирионы) РНК-содержащих бактериофагов (US Patent 5677124, 6159728, US Patent Application 20100167981; Carlee Ε. Ashley et al. Cell-Specific Delivery of Diverse Cargos by Bacteriophage MS2 Virus-Like Particles // ACS Nano. 2011 July 26; 5(7): 5729-5745; Jeff E. Glasgowa et al. Osmolyte-Mediated Encapsulation of Proteins inside MS2 Viral Capsids // ACS Nano. 2012 October 23; 6(10): 8658-8664; аббревиатура ACS означает American Chemical Society) или в вирус-подобные частицы (US Patent 8324149, US Patent Application 20080274905).
Также нашли применение инкапсулирование химиопрепаратов в вирионы РНК-содержащих бактериофагов (US Patent 5677124, 6159728, US Patent Application 20100167981; Carlee Ε. Ashley et al. Cell-Specific Delivery of Diverse Cargos by Bacteriophage MS2 Virus-Like Particles // ACS Nano. 2011 July 26; 5(7): 5729-5745 и Jeff Ε. Glasgowa et al. Osmolyte-Mediated Encapsulation of Proteins inside MS2 Viral Capsids // ACS Nano. 2012 October 23; 6(10): 8658-8664; аббревиатура ACS означает American Chemical Society). Внимание к РНК-содержащим бактериофагам, в частности к MS2 (US Patent 6159728; US Patent Application 20100167981), как средства адресной (таргетной) доставки, объясняется простотой организации вириона. Из-за отсутствия на поверхности бактериофага MS2 специфических рецепторов к клеткам ЗСО, проводят модификацию поверхности вириона (например, с помощью iRGD пептидов) для высокой точности введения (US Patent 5534257; US Patent Aplication 20130017210; Stacy L. Capehart et al. Controlled Integration of Gold Nanoparticles and Organic Fluorophores Using Synthetically Modified MS2 Viral Capsids // J Am. Chem. Soc. 2013, February 27; 135(8): 3011-3016). В литературе можно найти описание метода получения поверхностно модифицированных вирус-подобных частиц фага MS2, так чтобы обеспечивать их взаимодействие с рецепторами клеток ЗСО и сосудов их питающих, по механизму лиганд-рецептор (Ruoslahti Ε. Specialization of tumor vasculature // Nat Rev Cancer 2002 Feb; v. 2 (2): pp.83-90; K.N. Sugahara et al. Tissue-Penetrating Delivery of compounds and Nanoparticles into Tumors // Cancer Cell December 8 2009, v. 16 (3), pp. 510-520).
Имеется также ряд патентов и патентных заявок, раскрывающих методы поверхностной модификации бактериофага MS2 или его вирус-подобных частиц (US Patent 5698424; US Patent 5534257; US Patent 5470573; US Patent 5698424; US Patent Application 20090054246; US Patent Application 20140106982; US Patent Application 20130149336; патент РФ 2526570), которые направлены исключительно на получение специфической иммунной реакции, в том числе и для иммунотерапии ЗСО. Такие исследования и патенты являются аналогами фаговых дисплеев (Me Cafferty J. et al. Phage antibodies: filamentous phage displaying antibody variable domains // Nature 6 December 1990, v.348, pp.552-554; US Patent 5821047; US Patent 5702892) и не решают задач, поставленных в настоящем изобретении.
Однако описанные выше усилия исследователей в создании систем адресной доставки химиопрепаратов, в том числе и на основе модифицированных вирусов, пока не могут достичь приемлемого результата. При этом основной причиной данного положения является генетически детерминированная способность клеток ЗСО выводить из клеток молекулы различных токсичных химиопрепаратов с помощью MDR-белков (Stavrovskaya Α.Α., Т.P. Stromskaya. Transport Proteins of the ABC Family and Multidrug Resistance of Tumor Cells // Biochemistry (Moscow), 2008, v. 73(5), pp.592-604; Wilkens S. Structure and mechanism of ABC transporters // F1000Prime Reports 2015, 7: 14-23) или возникновения мутаций, которые снижают сродство мишени к молекулам химиопрепаратов (Bergmann J.P, Harris D. Radioresistance, chemoresistance and apoptosis resistance // Radiation Oncology 1997; v.27, №1, pp. 47-57).
Известны способы адресной доставки радионуклидов металлов или фармацевтических композиций, введенных в липосомальные наночастицы к клеткам опухолей (US Patent Application 2013/0251630; WO 2015061592A1). Указанная доставка осуществляется в целях диагностики, для которой вывод из клеток молекулы различных химиопрепаратов не критичен ввиду относительно малой концентрации радионуклидов металлов в клетках опухолей для целей диагностики (10-12-10-13 М). В то же время для активации апоптоза клеток ЗСО требуется, чтобы концентрация использующихся химпрепаратов превышала их концентрацию при диагностике как минимум на несколько порядков (10-8-10-9 М). Кроме того, чем менее эффективен химпрепарат для активации апоптоза клеток ЗСО (в силу его фармакологических свойств или скорости выведения из клеток), тем требуется его большее количество и концентрация, и, соответственно, неизбежно увеличивается токсичность химиотерапии.
Известно, что для оценки эффективности лечения ЗСО часто используется радиоизотопный метод с применением 201Tl. Проникая в цитоплазму клетки ЗСО, по каналам, специфичным для ионов калия, изотоп 201Tl не выводится из цитоплазмы (Jean С. Maublant et al. In Vitro Uptake of Technetium-99m-Teboro-xime in Carcinoma Cell Lines and Normal Cells: Comparison with Technetimn-99m-Sestarnibi and Thallium-201 // The Journal of Nuclear Medicine November 1993, v.34(11), pp.1949-1952; Brismar T. et al. Increased cation transport in mdr1-gene-expressing K562 cells // Cancer Chemother Pharmacol. 1995; v. 36(1): pp. 87-90; M. Fukumoto et al. Scintigraphic Prediction of Resistance to Radiation and Chemotherapy in Patients with Lung Carcinoma// Cancer 1999, October 15, v. 86(8), pp. 1470-1479). Доза однократно вводимого изотопа 201Tl при этом составит 10-100 пг/кг или 10-7 часть от hLD50 (Toxicological review of thallium and compounds//U.S. Environmental Protection Agency, Washington, DC. September 2009; Fukumoto M. Single-photon agents for tumor imaging: 201Tl, 99mTc-MIBI, and 99mTc-tetrofosmin // Annals of Nuclear Medicine 2004, v. 18(2), pp.79-95). Особенность строения электронной оболочки таллия (TOXICOLOGICAL REVIEW OF THALLIUM AND COMPOUNDS // U.S. Environmental Protection Agency, 2009) объясняет его способность связываться с белками митохондрий (Spenser PS. et al., EFFECTS OF THALLIUM SALTS ON NEURONAL MITOCHONDRIA IN ORGANOTYPIC CORD-GANGLIA-MUSCLE COMBINATION CULTURES // The journal of cell biology, 1973, v. 58(1), pp.79-95), а так же с нуклеиновыми кислотами: с РНК (Ailong Ke et al. Structural Roles of Monovalent Cations in the HDV Ribozyme // Structure March 2007, v. 15(1), 281-287) и ДНК (Gill M.L. et al. Crystallization and characterization of the thallium form of the Oxytricha nova G-quadruplex// Nucleic Acids Research, 2006, Vol.34, №16, pp. 4506-4514). Известно применение радиоактивных солей таллия (патент СССР 1088558; US Patent Application 20140037541; US Patent Application 20130324847 A1; US Patent 4764598; US Patent 4446123) в способах диагностики или прогностического метода визуализации ЗСО субъекта. Во всех этих примерах раскрыты лишь методы экстракорпорального введения растворов солей радиоактивных изотопов таллия-201, в дозах, не токсичных для клинического применения.
Известны способы использования таллия в терапии, например неинвазивная система доставки активного агента посредством абсорбции через эпителиальную мембрану, включающая металл-комплексный наполнитель, в качестве которого может быть использован таллий, предназначенная для применения при лечении состояния, которое требует немедленного, непрерывного или отсроченного высвобождения активного агента (заявка РФ 2011150521). Однако, при предложенном способе введения таллия, катион будет негативно воздействовать не только на клетки ЗСО, но и на здоровые клетки.
Таким образом, из уровня техники известны способы получения псевдовирионов фага MS2, токсические свойства таллия и способность радиоактивного одновалентного изотопа 201Т1 не подвергаться выведению из цитоплазмы клетки ЗСО. Кроме того, известные способы активации апоптоза клеток ЗСО инициируют преимущественно моносигнальную индукцию апоптоза в целевой клетке и не создают препятствий для выхода используемых химпрепаратов из клетки.
Задачей настоящего изобретения является создание способа полисигнальной активации апоптоза клеток ЗСО для эффективного блокирования роста и распространения раковых клеток в условиях предельной минимизации нежелательных побочных воздействий таллия.
Решение указанной задачи обеспечивается тем, что, в отличие от известных способов моносигнальной активации апоптоза клеток ЗСО, заявленный способ активации осуществляют посредством адресной доставки солей таллия к клеткам ЗСО, а для обеспечения адресности формируют iRGD модифицированный вирион фага MS2, который содержит геномную РНК с солями таллия, при этом проникновение вириона в клетки ЗСО обеспечивается за счет взаимодействия iRGD с интегринами avb3 и avb5. При этом, сердцевина модифицированного вириона фага MS2 должна содержать геномную РНК и соль Т1 (при необходимости в смеси с изотопом 201-Т1). Активация апоптоза клеток ЗСО посредством адресной доставки солей таллия к клеткам ЗСО позволяет обеспечить эффективное пролонгированное цитоксическое воздействие на очаговые и метастатические скопления клеток ЗСО при минимизации нежелательных побочных воздействий на здоровые клетки организма.
Дополнительное введение в сердцевину модифицированного вириона фага MS2 изотопа 201Т1 позволяет упростить мониторинг за результатами оказываемого лечебного воздействия на клетки ЗСО.
Полисигнальная активация апоптоза клеток ЗСО солями одновалентного таллия обеспечивает комплексное воздействие на клетки ЗСО и основана на одновременном повреждении мембраны митохондрий и связывании с ДНК и РНК. G-квадродуплексные структуры ДНК, с которыми эффективно связываются ионы одновалентного таллия, препятствуют его выходу из клетки. G-квадродуплексные структуры входят в состав теломер хромосом человека (Williamson, J.R. G-quartet structures in telomeric DNA // Annu. Rev. Biophys. Biomol. Struct. 1994, 23, 703-730) и играют важнейшую функцию в размножении ЗСО (Wentzensen I.M. et al. The Association of Telomere Length and Cancer: a Meta-analysis // Cancer Epidemiol Biomarkers Prev 2011; v.20, №6, pp. 1238-1250). Эффект полисигнальной активации апоптоза в клетках ЗСО усиливается отсутствием систем лекарственной устойчивости, специфичной для выведения одновалентного таллия из цитозоля. Таким образом, для полисигнальной активации апоптоза клеток ЗСО необходимо реализовать метод наноинъекций солей одновалентного таллия в их цитозоль, минимизирующий процесс вытекания соли из «шприца» (поверхностно модифицированных вирионов фага MS2) до момента его проникновения в клетку.
Результаты исследований иллюстрируются графическими изображениями:
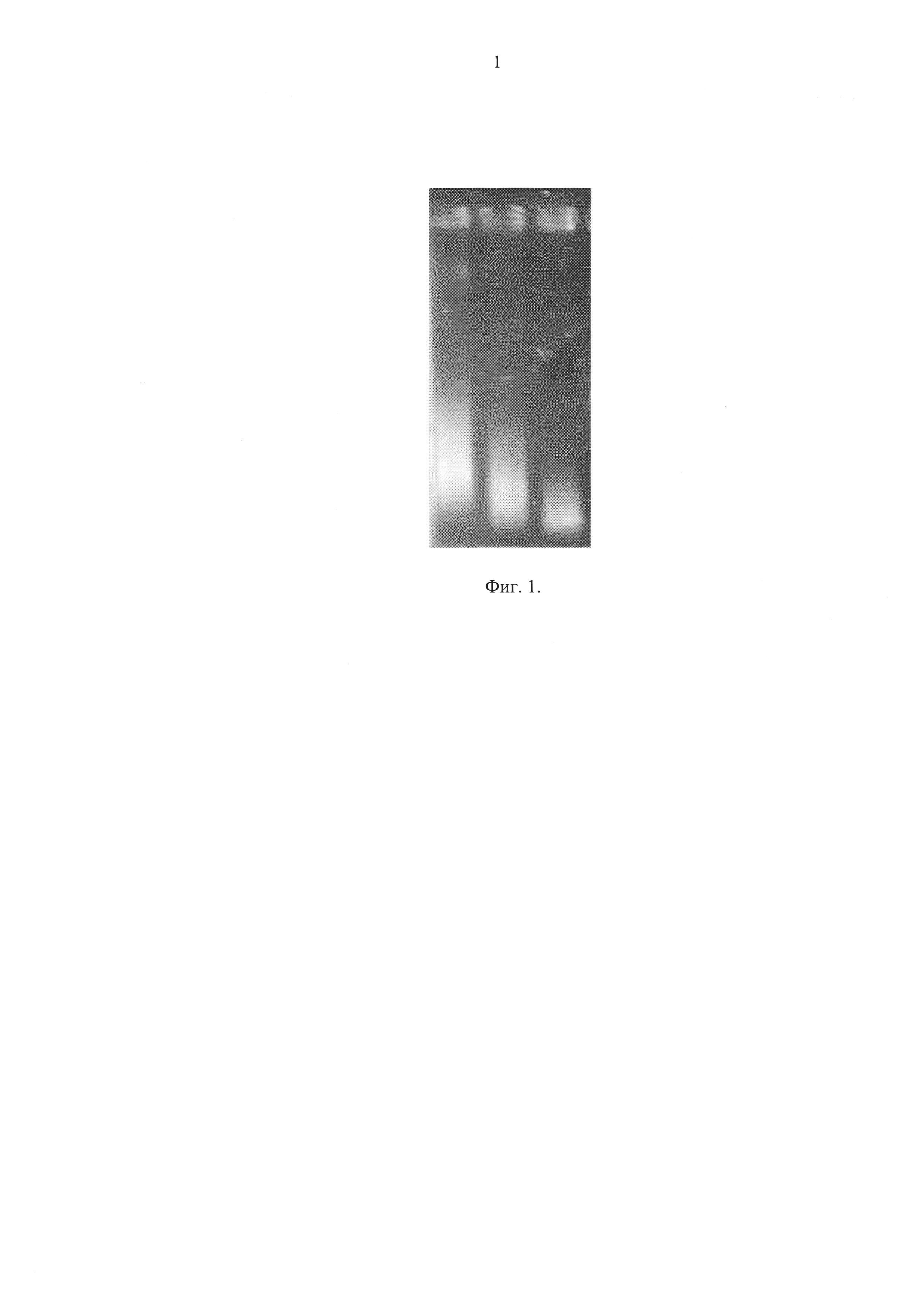
Фиг. 1 - электрофоретическое разделение частиц фага MS2: пустые частицы (крайняя левая дорожка), частично наполненные таллием (средняя дорожка), предельно наполненные таллием (крайняя правая дорожка);
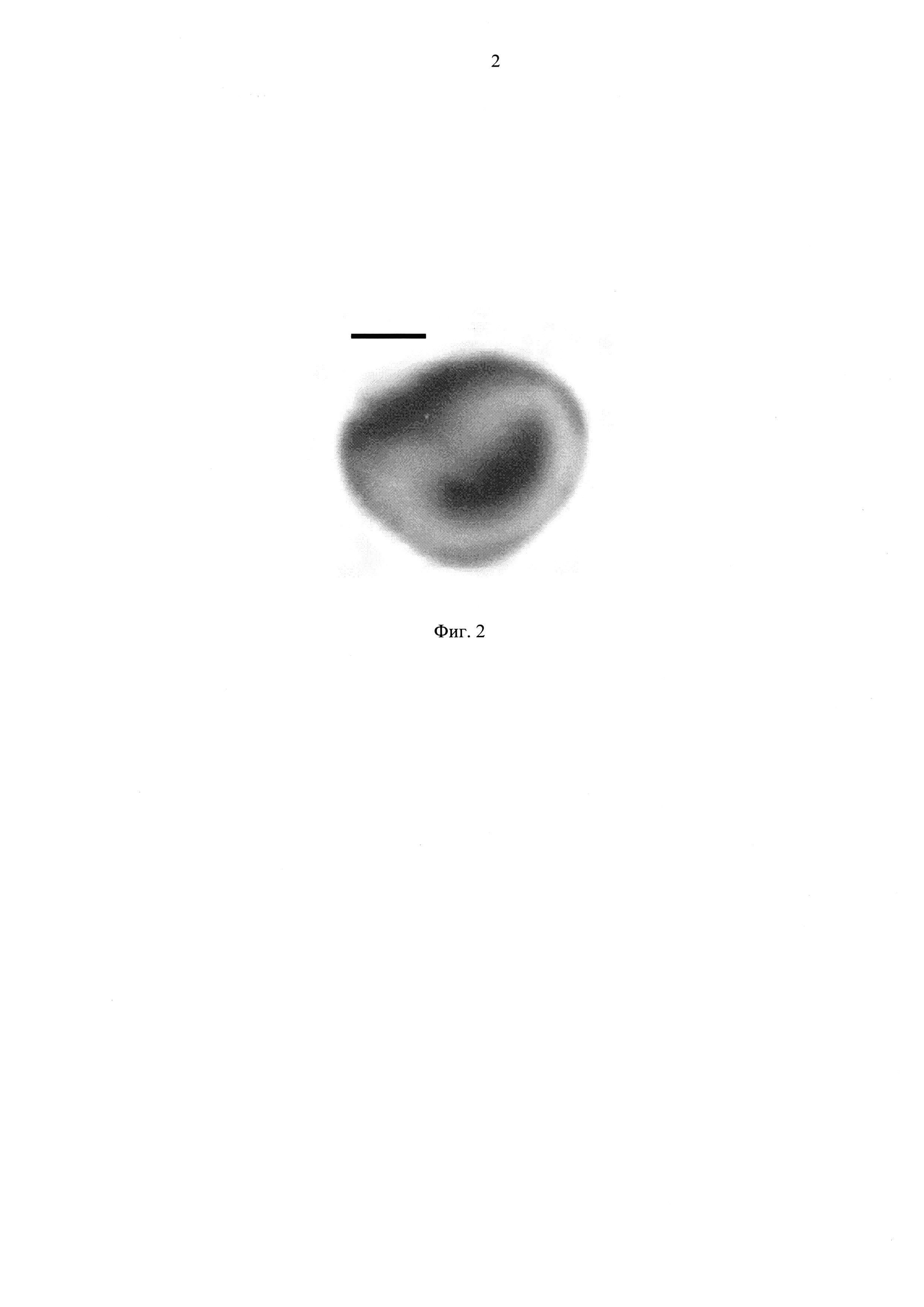
Фиг. 2 - электронная микрофотография частиц фага MS2, наполненных TINO3. Масштабная линия = 1 нм;
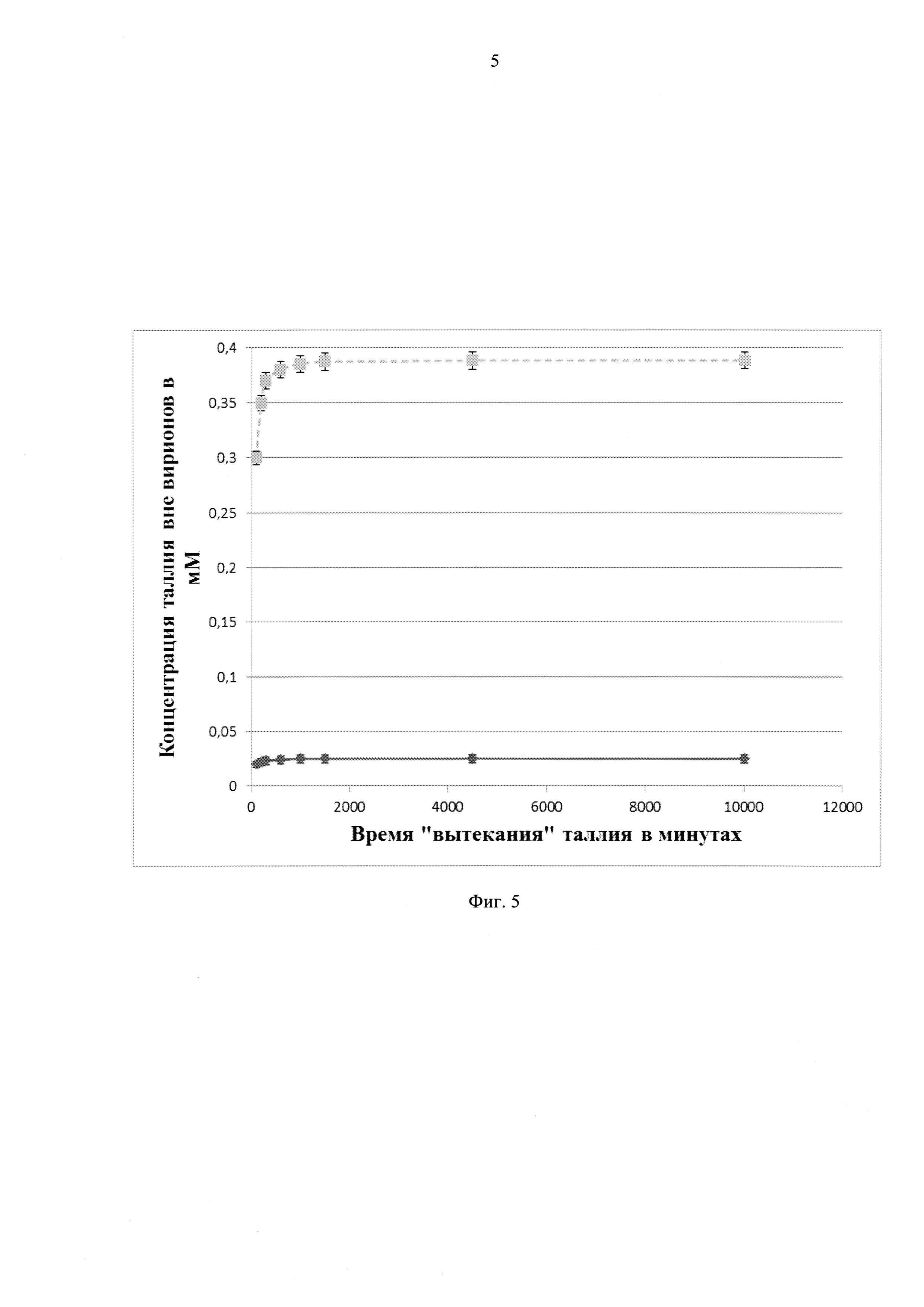
Фиг. 3 график эффективности наполнения частиц фага MS2 солями одновалентного таллия (на примере TINO3). А. Наполнение частиц фага методом высушивания смеси. Б. Наполнение частиц фага методом разборки - сборки. По осям - концентрации соли в мМ (абсцисса - добавленная в раствор, ордината - упакованная в вирион);
Фиг. 4 - электронная микрофотография частиц фага MS2 (контроль). Масштабная линия = 1 нм;
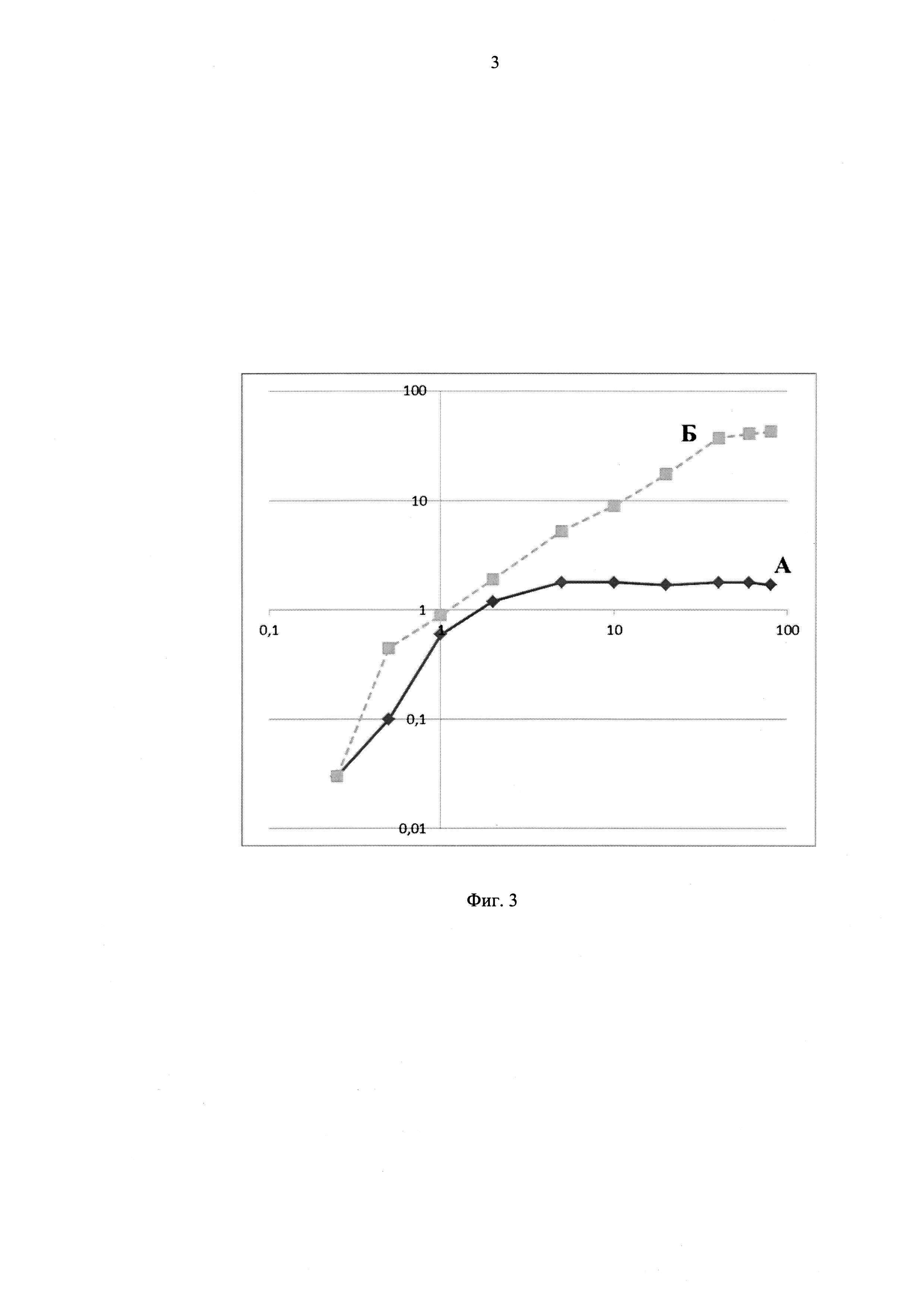
Фиг. 5 - график «вытекания» соли таллия (на примере ΤIΝO3) из 1010 частиц фага MS2, наполненных методом вакуумной сушки со временем (нижняя кривая); график «вытекания» соли таллия (на примере ΤΓΝ03) из 1010 частиц фага MS2, наполненных методом разборки-сборки со временем (верхняя кривая). Данные, представленные на графиках, анализировали с помощью программы Statistica 12 (p<0,01) или Стьюдент-теста. *Р<0,05, ***р<0,001;
Фиг. 6 - Результат определения плотности бактериофага MS2 методом равновесного центрифугирования. Наиболее плотная фракция бактериофага MS2, содержащая таллий (наполнение методом сборки-разборки), является самой тяжелой (нижняя фракция), фракция бактериофага MS2, содержащая таллий (наполнение методом высушивания), расположена выше и еще выше находится фракция бактериофага MS2 дикого типа, не содержащая таллий;
Фиг. 7 - агглютинация клеток опухоли частицами фага MS2 с модифицированной лигандом поверхностью вириона. Клетки, выросшие в среде без VEGF;
Фиг. 8 - агглютинация клеток опухоли частицами фага MS2 с модифицированной лигандом поверхностью вириона. Клетки, выросшие в среде с VEGF;
Фиг. 9 - проникновение вирионов фага MS2, наполненных таллием, в клетки. Клетки, выросшие без VEGF;
Фиг. 10 - проникновение вирионов фага MS2, наполненных таллием, в клетки. Клетки, выросшие с VEGF (Овальные включения в ядрах - накопление таллия);
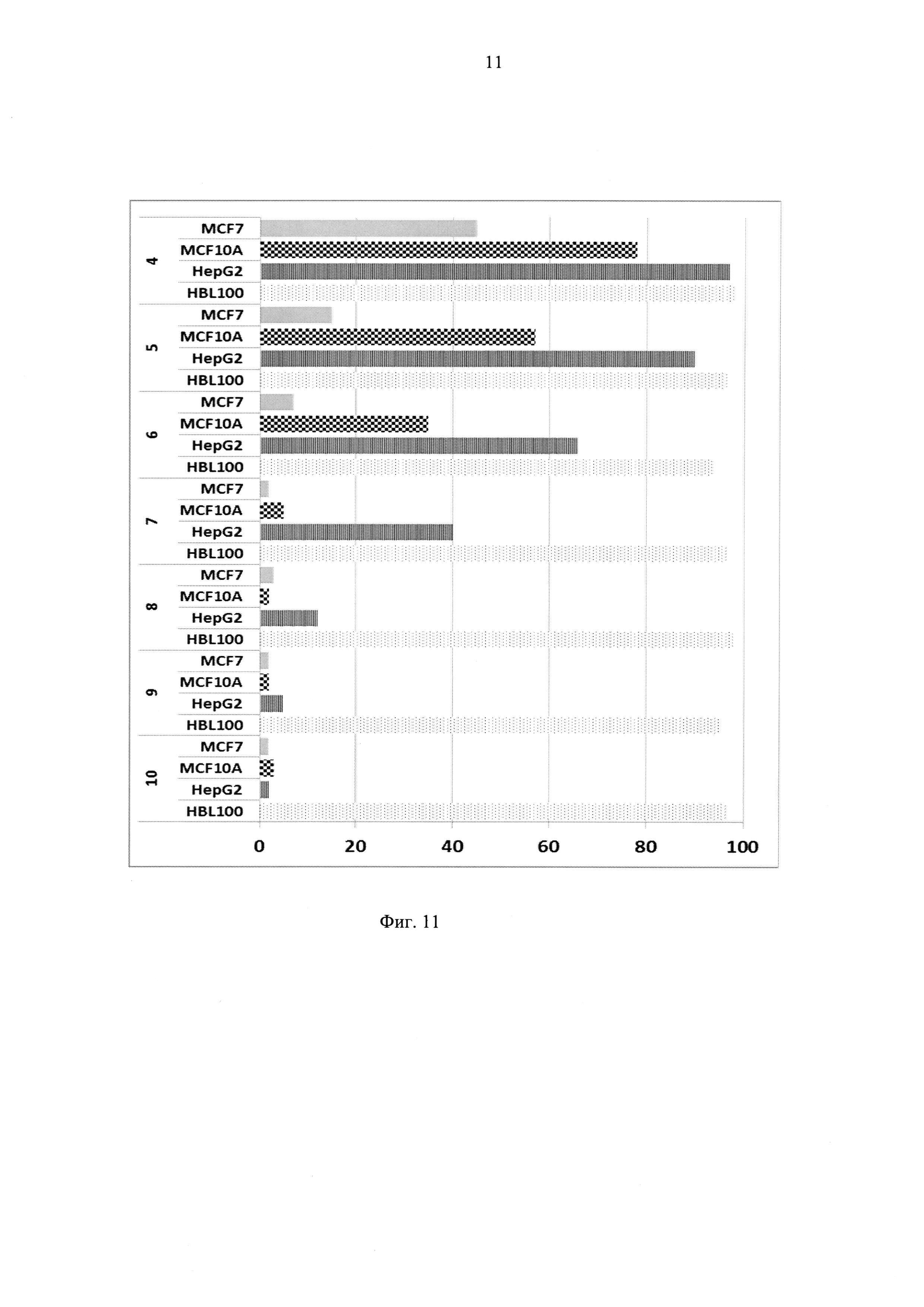
Фиг. 11 - Результаты экспериментов по определению выживаемости культур клеток (название линий указано на вертикальной оси) при культивировании их с поверхностно модифицированными вирионами фага MS2, наполненными таллием (проценты выживаемости клеток указаны на горизонтальной оси).
При разработке заявленного способа предварительно было необходимо определить минимальную концентрацию ионов одновалентного таллия, которые, взаимодействуя с геномной РНК внутри частицы фага MS2 (внутренний радиус 10 нм), достигнут летальной для клетки ЗСО концентрации. Согласно проведенным расчетам с использованием метода рентгено-структурного анализа (Ailong Ке et al. Structural Roles of Monovalent Cations in the HDV Ribozyme // Structure March 2007, v. 15(1), 281-287), рассчитали необходимую концентрацию, которая будет достигнута при поглощении 20 нагруженных вирионов. Эти расчеты послужили основанием для создания системы адресной доставки солей таллия к клеткам ЗСО, одновалентные катионы которых блокируют действие MDR-белков.
Предлагаемый способ может быть реализован на базе существующего уровня техники следующей последовательностью действий.
Первоначально производят подготовительные процедуры для получения высоких титров фага MS2, а также осуществляют синтез циклических пептидов, используемых для модификации поверхности вирионов фага MS2. Для наполнения фага MS2 используют соли таллия в виде растворов подобно описанным, например, в патентах и патентных заявках (US Patents 8367621, 6399307, 6803379, 6180389; US Patent Applications 20130343989, 20100322862, 20150044665, 20040028694, 20140045915, 20140314664, 20140341938) и которые, в соответствии с настоящим изобретением, рассматриваются в качестве ядра модифицированного вириона фага. Затем осуществляют модифицирование поверхности вирионов фага MS2 пептидами и завершают сборку модифицированного фага, состоящего из оболочки, содержащей циклический лиганд iRGD, ковалентно связанный с оболочкой, и сердцевины, содержащей геномную РНК вириона и соль таллия, у которого проникновение вириона в клетки ЗСО и их питающим сосудам обеспечивается за счет лиганд-рецепторных взаимодействий с интегринами avb3 и avb5, и проводят заключительные контрольные операции. При этом модифицированные вирионы фага могут содержать радионуклид 201Т1, который обычно используется в качестве соли одновалентного таллия, такого как хлорид, иодид или бромид. Использование радионуклидов в качестве индикаторов, как было указано выше, хорошо известно специалистам в данной области медицины и молекулярной биологии и может быть реализовано для целей изобретения на базе существующей техники. При этом радионуклиды таллия могут быть использованы при процедуре разборки-сборки модифицированных вирионов фага для наполнения солями и в качестве меток с вводимыми солями. Контроль указанных операций может осуществляться посредством метода обнаружения и исследования вирионов фага с помощью просвечивающей электронной микроскопии (ПЭМ). Другим способом контроля частиц является плазмонный резонанс (SPR), волна которого позволяет детектировать вирионы, в том числе наполненные таллием, на стекле (V.N. Konopsky et al. Photonic Crystal Biosensor Based on Optical Surface Waves // Sensors 2013, 13(20), pp. 25662578). Флуоресцентная спектроскопия может быть использована для анализа проб, содержащих соли одновалентного таллия (DI ZHANG et al. A Thallium Transport FLIPR-Based Assay for the Identification of KCC2-Positive Modulators // Journal of Biomolecular Screening 2010, v.15 (2); pp. 177-184), для определения эффективности его упаковки и интенсивности вымывания. В последнем случае, возможно использование плазмонного резонанса с селективным биосенсором для обнаружения иона одновалентного таллия (Zhou J. et al. Aptamer-based molecular recognition for biosensor development // Anal. Bioanal. Chem. 2010, v. 398, pp. 2471-2480). Кроме того, изотопная метка может быть использована для облегчения обнаружения иона при оценке эффективности упаковки и интенсивности вымывания.
Все манипуляции с материалами, содержащими соли таллия, проводятся с учетом письма Главного государственного санитарного врача РФ от 2004.01.06 №2510/92-04-32.
Изобретение поясняется следующими примерами:
Пример 1. Получение высокого титра фага MS2 проводили по методу, описанному ранее (Княжев В.А., Сивов И.Г., Сергиенко В.И. РНК-трансдукция неинфекционными вирионами фага MS2 // Молекулярная генетика, микробиология и вирусология 2002, №3, стр. 56 -63). Контролями служили секвенирование ОТ-ПЦР фрагмента геномной РНК, а также определение титра методом агаровых слоев (Gratia A. Numerical Relations between Lysogenic Bacteria and Particles of Bacteriophage // Ann. Inst. Pasteur 1936, v.57, p. 652). Концентрирование вирионов фага, проводили после осветления клеточного лизата центрифугированием (15000 об/мин) с последующим осаждением ПЭГ-6000 в присутствии NaCl, как известно специалистам. Концентрирование препарата фага так же проводили обезвоживанием сухим сефадексом G-10 (Фиг. 4).
Пример 2. Наполнение фага MS2 солями таллия и контроль процесса.
A. Методом вакуумной сушки, когда проводили сушку смеси препарата фага с растворами таллия (Фиг. 3 и 5, кривая «А»).
Б. Методом разборки - сборки, когда его проводили по протоколу, известному специалистам (US Patent 8987173), выдерживая фаг 24 часа в буфере ST (50 mM трис, 100 mM NaCl) в присутствии 0.25М ТМАО и 0,1М соли таллия. Затем раствор центрифугировали при 10,000g 10 минут. Супернатант смешивали с ПЭГ6000 и NaCl до конечной концентрации 12,5% и 0.5М, соответственно. Через 2 часа раствор осаждали центрифугированием (17,800g в течение 45 минут) при 4°C. Осадок растворяли в минимальном количестве ST буфера и вновь осаждали при 10,000g в течение 10 минут. Надосадок фракционировали и фракции, соответствующие интактным капсулам вируса MS2, собирали и после хранили в 4°С в ST буфере (Фиг. 3 и 5, кривая «Б»).
B. Контроль количества инкапсулированного таллия проводили методом флуоресценции с PTSA (четвертичной натриевой солью пирен-1,3,6,8-тетрасульфоновой кислоты) (DI Zhang et al. A Thallium Transport FLIPR-Based Assay for the Identification of KCC2-Positive Modulators// Journal of Biomolecular Screening 2010, v. 1, pp.177-184). Пробы получали после промывки инкапсулированных таллием частиц фага, а также после тепловой денатурации осадка этих частиц и последующей обработкой прогретой пробы РНК-азой.
Пример 3. Сравнение фага MS2 и его модифицированных вариантов.
A. Методом электрофореза в ПААГ: проводили в соответствии с методичкой (МГУ, кафедра биоинженерии биофака, Москва 2007 г. ) в 2% геле ПААГ с агарозой в условиях, известных специалистам (Фиг. 1).
Б. Методом равновесного центрифугирования в градиенте плотности сахарозы:
Градиенты плотности сахарозы 5-50% (вес/объем) были сформированы в пробирках (Beckman Instruments, Inc., Фуллертон, Калифорния) по методу (Brakke M.K. Density-gradient centrifugation. Methods in Virology Volume 2. Edited by: K Maramorosch and H Koprowski. New York, Academic Press; 1967: 93-118). Пробу фага суспендировали в 1 мл холодного фосфатного буфера рН=9.0 и наслаивали на градиент сахарозы и центрифугировали при 85000g в течение 6 часов (Фиг. 6).
B. Просвечивающей электронной микроскопии (ПЭМ):
Контрастирование серебром (45 мин, Aurion, Великобритания) использовали для визуализации фаговых частиц. После фиксации проводили с 1% (масса/объем) четырехокиси осмия в фосфатном буфере в течение 1 часа, а фильтры промывали в фосфатном буфере в течение 10 мин. Фильтры вынимали из вставки и случайным образом нарезать 2 сегментов 3-5 мм × 2 мм. Эти сегменты обезвоживали в 30-100% этанола и, наконец, помещали в смолу Epon. Ультратонкие срезы делали алмазным ножом Diatome 70-80 нм толщиной, которые затем помещали на медные сетки, покрытые Pioloform. Сетки подвергали контрастному окрашиванию в уранилацетате в течение 35 мин, промывали три раза, погружая сетки в цитрат свинца в течение 7 мин и промывали трижды. Сетки наблюдали на просвечивающем электронном микроскопе JEM-1400, работающем при ускоряющем напряжении 80 кВ, используя увеличении × 8000 (Фиг. 2, 4).
Г. SPR-методом:
Исследования поверхностного резонансного плазмона (SPR) был выполнен с помощью прибора Eva 2.0 (http://www.pcbiosen-sors.com, патенты РФ 2341785, 2442142). Раствор анти-MS2 IgG (10 мкг/мл) в смеси с красителем N-гидроксисукцинимидным эфиром 5-карбокси тетраметиламинородамина (0,1 мкМ, kex=575 нм; kem=605 нм) хранили в 0.1 мМ уксуснокислом натрии (рН=5,5). Стандартная процедура связывания IgG со стеклом проведена с помощью 3,3-диэтоксипропил триэтоксисилана по ранее описанной процедуре (патент РФ 681837). Непрореагировавщие группы на поверхности стекла были заблокированы с 1 M этаноламином рН=8.5 до полной дезактивации. Все исследования выполняли трижды с объемной скоростью 300 мкл/мин. Пробы, содержащие фаг, разбавляли 1:100 и/или 1:50 в «фаговом» буфере. После каждого измерения поверхность восстанавливали раствором 100 mM NaOH и последующей проточной промывкой «фаговым» буфером.
Молярное соотношение между IgG и красителем позволяет оценить максимальное количества белка, связанного с поверхностью чипа, по флуоресценции красителя (Patent US 5800996), связавшегося со стеклом, благодаря анти-MS2 IgG.
Пример 4. Модификация поверхности вирионов пептидами.
А. Синтез пептидов со структурой (NH2)GGGCRGDK/RGPD/EC(COOH).
Пептид синтезировали методом твердофазного пептидного синтеза исходя из Fmoc-аминокислот на автоматическом пептидном синтезаторе 433А Applied Biosystems на смоле с присоединенным остатком Fmoc-Cys(Acm). Использовали следующие производные аминокислот: Fmoc-Cys(Acm), Fmoc-Arg(Pbf), Fmoc-Asp(OtBu), Fmoc-Gly, Fmoc-Lys(Boc), Fmoc-Pro. Снятие Fmoc-защитной группы с N-концевой альфа-аминогруппы растущей пептидной цепи проводили 22%-ным раствором 4-метилпиперидина в N-диметилформамиде (Алешина Е.Ю., Пындык Н.В., Мойса А.А., Санжаков М.А., Харыбин О.Н., Николаев Е.Н., Колесанова Е.Ф. Синтез фрагмента P-амилоида 5RHDSGY10 и его изомеров. Биомед. химия, 2008, т. 54, №2, 154-166). Присоединение аминокислот к растущей пептидной цепи (кроме Fmoc-Cys(Acm)) осуществляли с предварительной активацией Fmoc-аминокислот гексафторфос-фатом 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния в присутствии 1-гидроксибензо-триазола и 2,4,6-коллидина согласно процедуре FastMoc, описанной в инструкции к синтезатору. Fmoc-Cys(Acm) присоединяли с активацией in situ, используя в качестве активатора диизопропилкарбодиимид в присутствии 1-гидроксибензотриазола. По окончании синтеза пептид снимали со смолы обработкой смесью трифторуксусной кислоты, три-(изопропил)-силана, 3,6-диокса-1,8-октандитиола и воды (в объемном соотношении 94:1:2,5:2,5) и осаждали метил-трет-бутиловым эфиром. Осадок пептида растворяли в 10%-ном водном ацетонитриле с 0,1% трифторуксусной кислоты, и полученный раствор подвергали очистке методом ВЭЖХ на колонке Zorbax SB-C8, 21,2×250 мм, 7 мкм в градиенте концентрации ацетонитрила в 0,1% водном растворе трифторуксусной кислоты. Фракцию, содержащую целевой пептид, собирали и упаривали под вакуумом и затем проводили удаление защитных Acm-групп с остатков цистеина с одновременным формированием дисульфидного мостика по известной методике (Fernando Albericio et al. Preparation and handling of peptides containing methionine and cysteine // In: Fmoc Solid Phase Peptide Synthesis: A Practical Approach. Eds. W.C. Chang and P.D. White. Oxford University Press, 2000). Пептид подвергали повторной очистке методом ВЭЖХ на той же колонке, фракцию целевого пептида упаривали под вакуумом.
Б. Чистоту препарата синтезированного пептида подтверждали масс-спектрометрическим анализом с ионизацией электрораспылением и детекцией методом ионной ловушки, а также аналитической ВЭЖХ в соответствии с протоколами, описанными ранее (M.H.V. Van Regenmortel, S. Muller. Synthetic peptides as antigens. Elsevier, 1999, pp.88-90).
В. Конъюгацию пептида с фаговыми частицами проводили с использованием диметиладипимидата в соответствии со стандартной процедурой, известной специалистам (M.H.V. Van Regenmortel, S. Muller. Synthetic peptides as antigens. Elsevier, 1999, pp. 88-90).
Пример 5. Определение чувствительности эндотелиальных и других клеточных культур к модифицированным вирионам, наполненных таллием (Фиг. 11), и агглютинация клеток модифицированными вирионами.
Клеточные культуры эндотелиальных клеток получали из коллекции НИИ канцерогенеза РОНЦ и размножали согласно способам, известным, например, из патента РФ 2359030 и РФ 2493251. Индукцию образования интегринов на поверхности эндотелиальных клеток и клеток ЗСО проводили эндотелиальным фактором роста (VEGF), согласно описанной процедуре (патент РФ 2377017; Фиг. 7, 8). Агглютинацию клеток проводили согласно описанной процедуре (US Patent 5401636; US Patent 5541417). Проникновение вирионов фага MS2, наполненных таллием, фиксировали при помощи флуоресцентной микроскопии с красителем PTSA по процедуре, описанной ранее (патент РФ 2305270; Фиг. 9, 10).
Расчет LD50 проводили с помощью программы Probit_Analysis. Ниже приводятся полученные результаты: для HBL100=11,2 (количество частиц на одну клетку вызывающее гибель в 50% случаев); для HepG2=6,1; для MCF10A=4,8; для MCF7=3,2.
Пример 6. Определение чувствительности животных к 1010 поверхностно модифицированным вирионам фага MS2, наполненных солями одновалентного таллия.
Эксперименты выполнены на 130 белых неинбредных крысах обоего пола массой 200-400 г. и 263 белых неинбредных мышах обоего пола массой 17-36 г., содержащихся в условиях вивария с естественным световым режимом на стандартной диете (ГОСТ Ρ 50258-92), согласно методическим руководствам и нормативным документам - ГОСТ 3 51000.3-96 и 51000.4-96; правила и Международные рекомендации Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997); правила лабораторной практики (GLP) в РФ, утвержденные приказом Минздрава РФ от 19 июня 2003 г. №267. Погибших животных при трехкратном введении дозы 108 поверхностно модифицированных вирионов фага MS2, наполненных солями одновалентного таллия, не было. Аналогичный эксперимент с новорожденными животными не выявил токсичности в указанной дозе.
Предлагаемый способ полисигнальной активации апоптоза клеток ЗСО позволяет обеспечить комплексное, эффективное пролонгированное цитоксическое воздействие на очаговые и метастатические скопления клеток ЗСО при минимизации нежелательных побочных воздействий на здоровые клетки организма и может быть реализован в амбулаторных условиях на базе имеющегося оборудования.