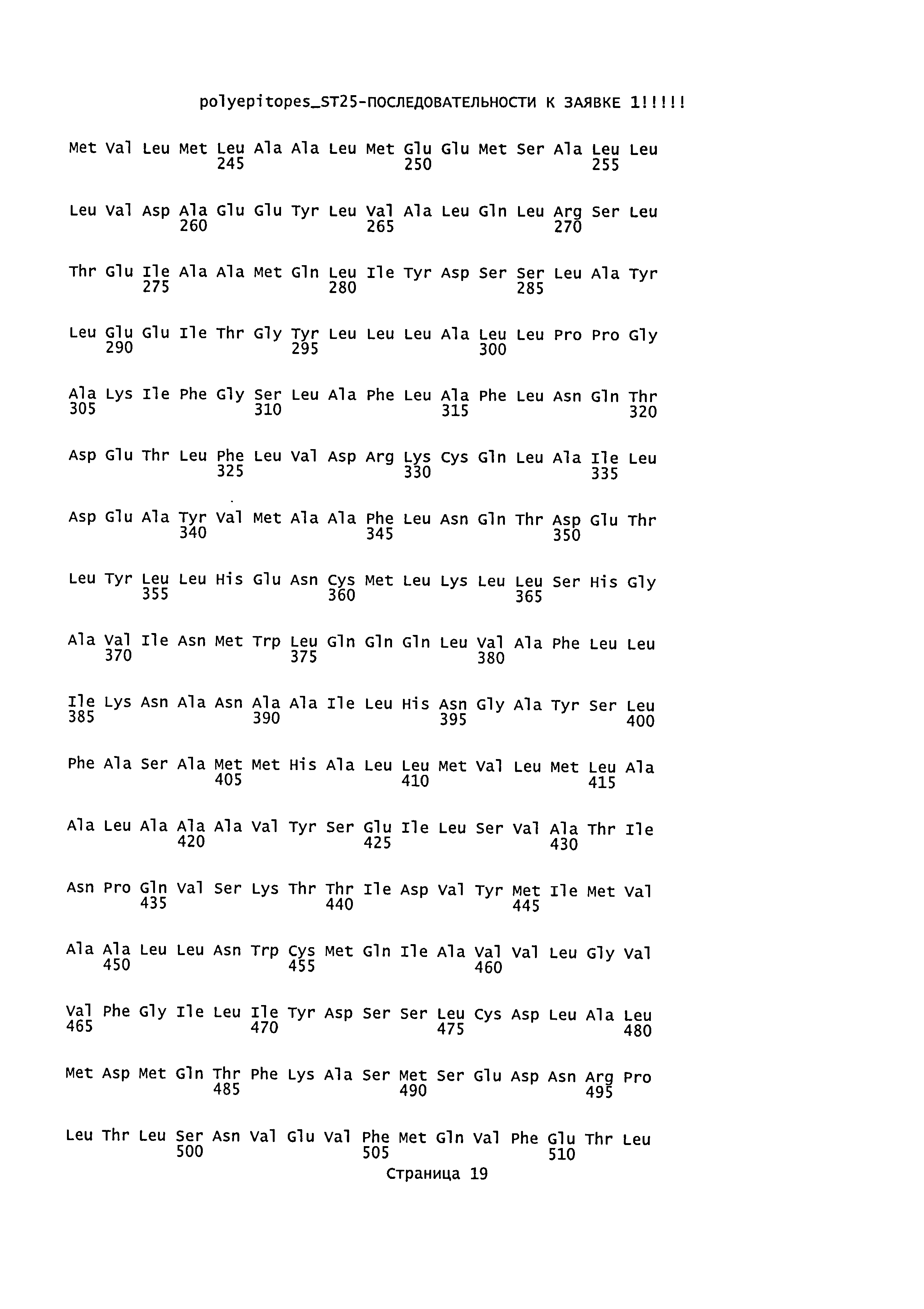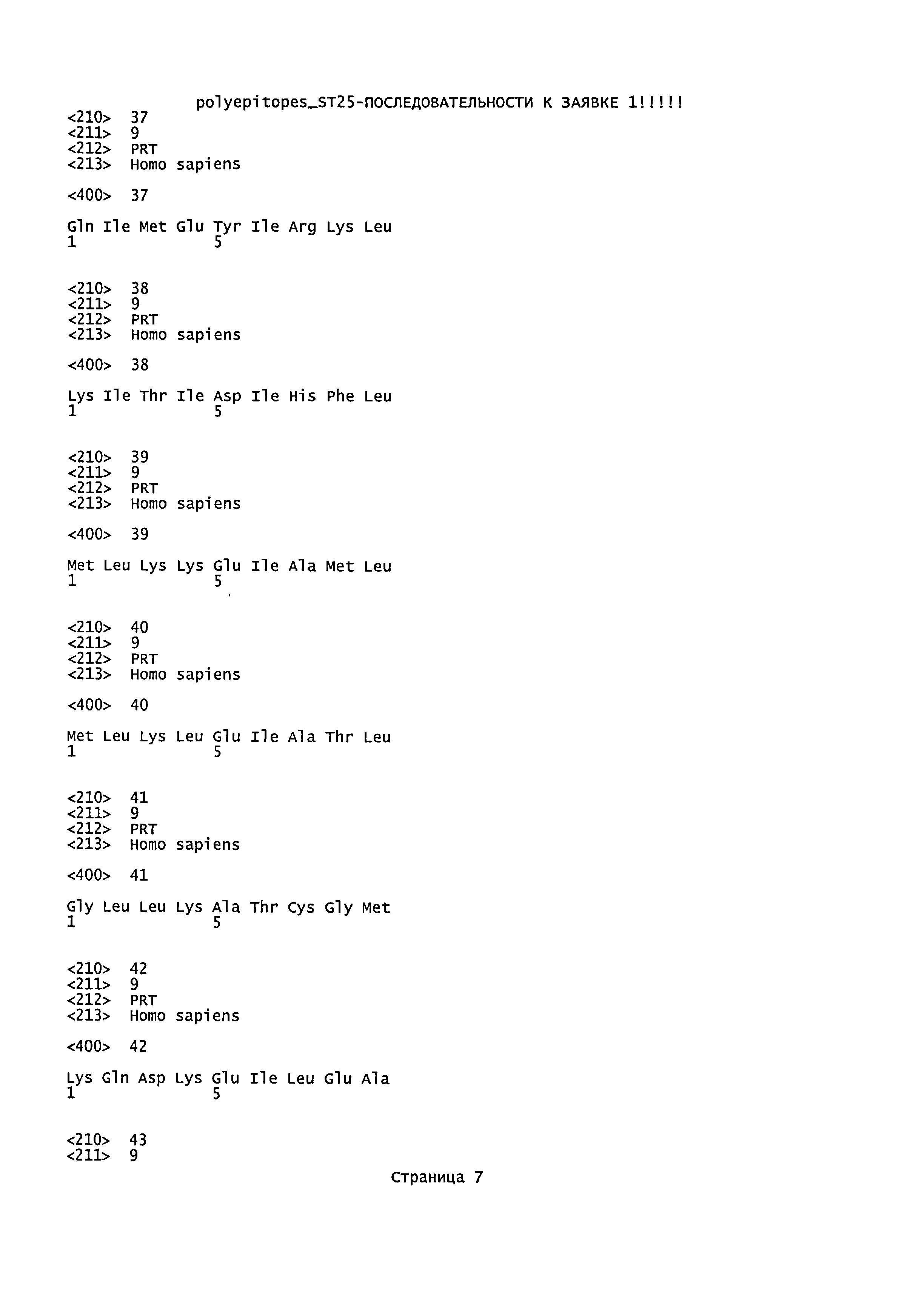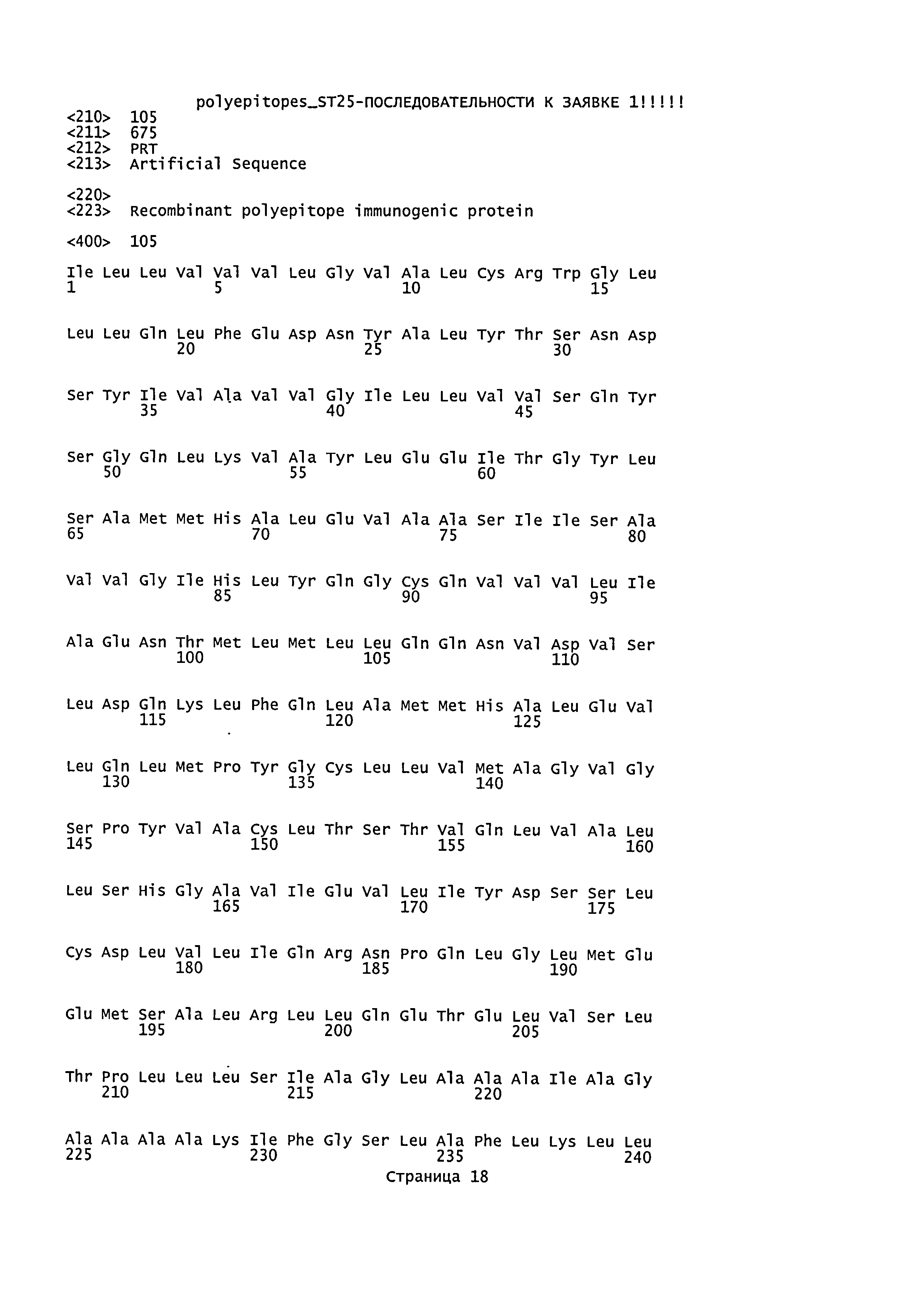Результат интеллектуальной деятельности: ПОЛИЭПИТОПНЫЕ ИММУНОГЕННЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области биохимии и иммунологии и может быть применено в медико-биологической промышленности при производстве препаратов для профилактики и лечения раковых заболеваний. В частности, для лечения больных раком молочной железы (РМЖ) и другими видами рака (колоректальный рак, рак яичника, рак пищевода, рак простаты, другие виды рака) за счет индукции антиген-специфического иммунного ответа с применением аутологичных дендритных клеток, трансфецированных ДНК-вакцинными конструкциями, кодирующими полиэпитопные иммуногены, содержащие антигенные детерминанты, специфичные для белков HER-2/neu, маммаглобина-А (mammaglobin-A), NY-BR-1, hMena (ENAH), WT1, теломераза (telomerase), сурвивин (survivin), р53.
Злокачественные новообразования являются второй по значимости в мире причиной смерти после сердечно-сосудистой патологии. Среди женского населения ведущей онкологической патологией является рак молочной железы.
Перспективным подходом к лечению рака молочной железы является активная иммунотерапия, которая в настоящее время представляется неотъемлемой частью современной клинической практики. Поскольку главная цель иммунотерапии при онкологии заключается в обеспечении сильного и устойчивого опухолеспецифического иммунного ответа, достижение подобных результатов возможно через стимуляцию CD4+ и CD8+ Т-клеток [Pardoll and Topalian, 1998; Hung et al., 1998; Marzo et al., 2000; Qin and Blankenstein, 2000]. CD8(+) цитотоксические Т-лимфоциты (CTL) являются главными эффекторными клетками противоракового иммунного ответа, образование которых зависит от подходящего антигена-мишени и эффективной презентации данного антигена иммунной системе пациента с участием антиген-презентирующих клеток (АПК). Дендритные клетки являются наиболее эффективными АПК и единственными клетками, способными представлять новые антигены неактивированным Т-клеткам. Поэтому применение аутологичных дендритных клеток, трансфецированных уникальными ДНК-вакцинными конструкциями, представляет собой хороший инструмент для презентации АГ иммунной системе пациента.
В практике лечения онкозаболеваний введен препарат против рака простаты, основанный на описанном выше подходе. Это - первая в истории медицины лечебная аутологичная противораковая вакцина Provenge компании Dendreon, одобренная Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA) в марте 2010 г. Вакцина Provenge основана на использовании одного конкретного белка, гиперэкспрессирующегося в клетках опухоли. Фактически, любой белок, гиперэкспрессирующийся в раковой клетке, может служить подходящей мишенью. Сейчас множество групп исследователей занимаются разработкой терапевтических противораковых вакцин на базе различных ассоциированных с РМЖ антигенов, например такого, как белок HER-2/neu. В качестве антигенов в них используются фрагменты как внеклеточной, так и внутриклеточной частей белка. В состав некоторых вакцин входил единственный пептид Е75 (369-377) (Mittendorf et al., 2008), другие содержали различные пептиды из HER-2/neu (Li Y et all, 2009). Клинические испытания различных конструкций для индукции CTL-ответа на базе HER-2/neu показали их низкую токсичность и отсутствие аутоиммунных реакций, при этом в ряде случаев развивались НЕР2-специфичные клеточный и гуморальный ответы (Disis ML et al., 1998, Salazar LG et al., 2003; Disis ML et al., 2004). ДНК-вакцинные конструкции, содержащие эпитопы других АГ, также проходят стадии доклинических и клинических испытаний. Однеко, несмотря на некоторые успехи, описанные выше, до сих пор не существует одобренной для применения вакцины против РМЖ и большинства других видов рака. Таким образом, актуальной задачей является разработка высокоспецифичного противоопухолевого иммуногена и вакцины на его основе, способной эффективно индуцировать цитотоксические лимфоциты (CTL) и таким образом обеспечивать эффективный противоопухолевый иммунный ответ.
Соответственно, задачей настоящего изобретения является создание ДНК-вакцинных конструкций, эффективно стимулирующих Т-клеточный ответ пациента. Данная задача решена за счет применения поли-CTL-эпитопов сразу нескольких АГ, гиперэкспрессирующихся в опухолевых клетках при РМЖ на основании данных о процессинге и презентации АГ совместно с молекулами ГКГС класса I CD8+цитотоксичсским Т-лимфоцитам. Рациональность применения таких конструкций основана на том, что в отличие от полиэпитопных вакцин, содержащих в своем составе один АГ, применение полиэпитопных вакцин на основе нескольких АГ позволяет преодолеть влзможное отсутствие гиперэкспрессии выбранного АГ в раковых клетках, а также преодолеть гетерогенность экспрессии АГ различными раковыми клетками внутри одной опухоли.
Поставленная задача решается путем выбора наилучших АГ с наибольшей иммунотерапевтической эффективностью, на основе отбора CTL-эпитопов, специфичных для гаплотипа HLA-A*0201 и затем, объединение CTL-эпитопов в единую последовательность с учетом данных о процессинге и презентации АГ.
На основе опубликованных литературных данных по клиническим испытаниям противораковых вакцин были определены АГ с наибольшей иммунотерапевтической эффективностью: HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53.
HER-2/neu - это член семейства рецепторов эпидермальных факторов роста, регулирующих клеточную пролиферацию, дифференцировку, миграцию и адгезию. Увеличение экспрессии HER-2/neu приводит к супрессии апоптоза и активации пролиферации, что может приводить к опухолевому процессу [Harariand & Yarden, 2000]. От 20 до 35% РМЖ у женщин характеризуются увеличенной экспрессией белка HER-2/neu, также ассоциированного с более агрессивным течением процесса и плохим прогнозом [Benavides et al., 2009; Ross et al., 2009]. Сверхэкспрессия HER-2/neu обнаруживается и при других онкологических заболеваниях, например рак яичника, колоректальный рак, рак матки и др. [Bernhard et al., 2002].
Mammaglobin-A (MGBA) - гликопротеин, экспрессия которого, в норме, ограничена молочными железами (Watson & Fleming, 1996). Повышенная экспрессия MGBA (как минимум в 10 раз, по сравнению с нормальной тканью) наблюдается в 80% при первичном и метастазирующем раке молочной железы, при этом уровень экспрессии MGBA сравним среди хорошо, средне и слабо дифференцированной первичной опухоли молочной железы (Watson et al., 1999). Известно, что у пациенток, больных РМЖ, наблюдается высокая частота встречаемости CD8(+) цитотоксических Т лимфоцитов (CTL) к MGBA (Narayanan et al, 2004; Basha et al., 2011).
NY-BR-1 - трансмембранный белок, потенциальный транскрипционный фактор, который в норме экспрессируется в нормальных эпителиальный клетках молочных желез, и в >70% гиперэкспрессируется в первичных опухолях молочных желез. Было показано, что пептиды NY-BR-1 рестриктированные HLA-A*0201 узнаются CD8(+) цитотоксическими Т лимфоцитами (Karbach et al., 2005; Sell et al., 2007). Уровень экспрессии NY-BR-1 прямо пропорционален экспрессии HER-2/neu и EGRF у больных РМЖ (Theurillat et al., 2007).
hMena (ENAH) - белок, ортолог мышинного белка Mena, который экспрессируется в более 70% первичных РМЖ. Mena принадлежит к семейству белков Ena/VASP, которые контролируют организацию актиновых филаментов клетки и являются ключевыми регуляторными факторами клеточной миграции и определение формы в большинстве различных типах клеток и организмов. Мышинный Mena гиперэкспрессируется в раковых клетках груди с высокими инвазивными способностями (Di Modugno et al., 2006). В исследовании с NRG1 and Herceptin была показана прямая зависимость гиперсэксрессии hMena и HER-2/neu, что ассоциируется с повышенным уровнем трансформации опухоли и плохим прогнозом (Di Modugno et al., 2010).
p53 - многофункциональный белок, транскрипционный фактор, участвует в широком спектре клеточных процессов, в том числе в индукции апоптоза, стимуляции процессов репарации ДНК, остановке клеточного цикла и регуляции основного метаболизма. Нарушения в функционировании р53 обнаруживаются более чем в 50% случаев рака. Известно, что в обычных условиях в нетрансформированных клетках р53 нестабилен и достаточно быстро деградирует. Под воздействием стресса в клетках наблюдается усиление синтеза и стабилизация р53 (Vazquez et al., 2008).
Survivin (BIRC5) - эндогенный белок, относящийся к семейству белков ингибиторов апоптоза (ТАР, Inhibitor of Apoptosis Protein). Помимо ингибирования апоптоза survivin участвует в митотическом делении клетки и процессе ангиогенеза. В норме присутствует преимущественно в эмбриональных клетках и в нормальных соматических клетках в течение краткого периода митоза (Fukuda & Pelus, 2006). Его повышенная экспрессия наблюдается практически во всех типах злокачественных опухолей (Altier, 2008). Показано, что вакцинация тремя пептидами, рестриктированными по HLA A1, A2 и B35, приводила к формированию специфичных CD8+Т cells у 50% пациентов (Becker JC et al., 2008).
WT1 - ядерный белок, транскрипционный фактор, экспрессия которого повышена во многих типах злокачественных опухолей. Продукт гена WT1 в цитоплазме клетки подвергается протеасомальному процессингу до пептидов. Было показано, что цитотоксические лимфоциты, специфичные к WT1, индуцируются в результате узнавания TCR на клетках-предшественниках CTL молекулярных комплексов МНС класса I с пептидом WT1 (Sugiyama, 2010).
Теломераза представляет собой рибонуклеопротеидный комплекс. Известно, что теломераза активна в 85% типов раковых опухолей, а в остальных 15% случаев действуют другие механизмы поддержания длины теломер, основанные на рекомбинации. Следует отметить, что теломеразная активность не обнаруживается в обычных соматических тканях. Следовательно, теломеразу можно использовать как унивесальную мишень при разработке антираковой терапии. Так, вакцинация пептидом GV1001 (611-626 hTERT) вызывала Th ответ более чем у 80% пациентов (Inderberg-Suso ЕМ, et al., 2012).
Для дизайна полиэпитопного иммуногена, нами были предсказаны CTL-эпитопы белков HER-2/neu, mammaglobin-A, NY-BR-1. hMena (ENAH), WT1, telomerase, survivin, p53, специфичных для гаплотипа HLA-A*0201.


Предсказание CTL-эпитопов проводилось на сервере IEDB Analysis Resource с помощью ГКГС Class I Prediction - ANN method (метод, основанный на нейронных сетях, который уже доказал свою применимость для поиска новых эпитопов и дизайна вакцинных конструкций (Nielsen et al., 2003).
Одним из механизмов формирования эффективного иммунного ответа на опухоль является индукция CD8+CTL. Индукция происходит за счет распознавания CD8+CTL процесированных антигенных пептидных фрагментов в ассоциации с молекулами ГКГС класса I на поверхности АПК. Антигенные пептиды образуются в цитоплазме клетки в результате расщепления антигенов протеасомами. Протеасомы представляют собой комплекс из 12-15 различных регуляторных и протеолитических белковых субъединиц (Rock KL and Goldberg AL, 1999, Annu. Rev. Immunol, 17:739-779; Niedermann G et al., 1999. Immimol. Rev, 172:29-48). Помимо констутивной протеасомы, существует иммунопротеасома, сборка которой в клетке начинается после стимуляции ее γ-интерфероном. Считается, что в отличие от констутивной, иммунопротеасома генерирует пептиды, которые в последующем используются в презентации антигена в комплексах с молекулами ГКГС класса I, так как пептиды, генерируемые иммунопротеасомой, не подвергаются дальнейшей деградации клеточными пептидазами, а используются в презентации антигена.
Образование комплексов антигенных пептидов с молекулами ГКГС класса I происходит в эндоплазматическом ретикулуме, куда пептиды попадают с участием гетеродимерных транспортных белков, кодируемых двумя генами TAP1 и TAP2. Наиболее эффективный перенос происходит в том случае, если пептиды содержат 8-15 аминокислотных остатков. После образования комплекса антигенный пептид - молекула ГКГС класса I, готовый комплекс переносится на поверхность АПК.
Согласно приведенным выше данным, отобранные нами CTL-эпитопы, были предсказаны с учетом протеасомного процессинга. Для этого использовали программу NetChop (IEDB Analysis Resource), основанную на нейронных сетях. А также, с учетом TAP-процессинга, для предсказания которого использовалась функция, предложенная Peters et al., 2003. Функция Peters добавляет к N-концу пептида A либо AY. Для объединения в единую конструкцию использовали случайное перемешивание эпитопов. При этом в составе полиэпитопного иммуногена эпитопы могут перекрываться между собой как минимум одним аминокислотным остатком. Два, три и более эпитопов могут последовательно (стык в стык) располагаться внутри полипептида. Альтернативно, любые два эпитопа могут разделяться спейсерами A, AA, AAA. Выбор типа объединения эпитопов определяется теоретическим предсказанием процессинга полиэпитопной конструкции согласно условиям описанным выше. При этом эпитопы внутри полипептидного иммуногена могут располагаться в произвольном порядке. Длина каждого эпитопа от 8 до 10 аминокислотных остатков, а суммарная полиэпитопная конструкция, ограничивается 1000 ак.
Соответственно, различные аспекты настоящего изобретения относятся к следующим изобретениям:
1. Иммуногенный полипептид для лечения или профилактики рака, содержащий по меньшей два пептида, каждый из которых содержит 9 последовательных аминокислот, представляющих участки последовательностей белков HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53, где указанные последовательности выбраны с учетом эффективности протеасомного/иммунопротеасомного процессинга, взаимодействия антигенных пептидов с TAP1/TAP2.
2. Иммуногенный полипептид по п.1, отличающийся тем, что указанный полипептид содержит по меньшей мере по одному пептиду каждого из белков: HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53.
3. Иммуногенный полипептид по п.1, отличающийся тем, что указанные пептиды выбраны из группы, состоящей из пептидов SEQ ID NO: 1-9 белка HER-2/neu, SEQ ID NO: 10-16 белка mammaglobin-A, SEQ ID NO: 17-46 белка NY-BR-1, SEQ ID NO: 47-58 белка hMena (ENAH), SEQ ID NO: 59-68 белка WT1, SEQ ID NO: 69-92 белка telomerase, SEQ ID NO: 93 белка survivin, SEQ ID NO: 94-104 белка p53.
4. Рекомбинантный белок по п.1, представляющий собой белок SEQ ID NO: 105 или SEQ ID NO: 106.
5. Молекула ДНК, кодирующая иммуногенный полипептид согласно любому из пп.1-3.
6. Экспрессионная плазмида, содержащая молекулу ДНК по п.5.
7. Экспрессионная плазмида по п.6, отличающийся тем, что указанная плазмида выбрана из группы состоящей из плазмид pDNA5-BCA020-v.1 и pDNA5-BCA020-v.2.
8. Антигенпрезентирующая клетка, презентирующая пептиды HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53, трансфицированная экспрессионной плазмидой по любому из пп.6-7.
9. Антигенпрезентирующая клетка по п.8, представляющая собой дендритную клетку человека.
10. Фармацевтическая композиция для лечения или профилактики рака, содержащая дендритные клетки человека по п.8 и фармацевтически приемлемый носитель.
11. Антигенпрезентирующая клетка, презентирующая пептиды HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53, полученная путем приведения Т-клеток в контакт с полипептидом по п.(1);
12. Способ индукции эффекторных Т-клеток, специфичных к опухолевым клеткам с гаплотипом HLA-A*0201, включающий введение в контакт Т-клеток с клетками по п.8 или 9 или с полипептидом по п.1.
13. Способ по п.12, отличающийся тем, что контактирование Т-клеток с антигенпрезентирующими клетками проводят in vitro или ex vivo.
14. Эффекторная Т-клетка, полученная способом по п.12 или 13.
15. Способ лечения или профилактики рака у субъекта, включающий введение субъекту эффективного количества антигенпрезентирующих клеток по п.11 или эффекторных Т-клеток по п.14.
16. Способ лечения по п.15, отличающийся тем, что указанный субъект имеет гаплотип HLA-A*0201.
17. Фармацевтическая композиция для лечения или профилактики рака, содержащая эффективное количество полипептида по п.1 и фармацевтически приемлемый носитель.
18. Способ лечения или профилактики рака у субъекта, включающий введение субъекту фармацевтической композиции по п.17.
19. Способ лечения или профилактики рака у субъекта, в котором введение осуществляют путем инъекции.
Таким образом, разработана стратегия создания ДНК-вакцинных конструкций, содержащих полиэпитопные иммуногены для индукции антиген-специфического иммунного ответа у больных раком молочной железы. Одним из примеров полиэпитопных иммуногенов, содержащих антигенные детерминанты, специфичные белкам HER-2/neu, mammaglobin-A, NY-BR-1, hMena (ENAH), WT1, telomerase, survivin, p53 с учетом эффективности протеасомного/иммунопротеасомного процессинга, взаимодействия антигенных пептидов с TAP1/TAP2 с целью увеличения эффективности презентации эпитопов на поверхности АПК по сравнению с использованием нативных АГ, является:
Полиэпитопный иммуноген 1:

Полиэпитопный иммуноген 2:

Специалистам в области техники, к которой относится настоящее изобретение, ясно, что данное изобретение может быть воплощено в иных формах, нежели изложенные выше, не отступая при этом от сущности и основных характеристик изобретения. Следовательно, изложенные выше конкретные варианты изобретения следует рассматривать как иллюстрирующие, но не ограничивающие. Кроме того, следует понимать, что процедуры и материалы, не описанные конкретно в данной заявки являются стандартными процедурами и материалами, известными специалисту. Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления. Следует понимать, что указанные примеры приведены исключительно в иллюстративных целях и не предполагают какого-либо ограничения объема предложенного изобретения.
ПРИМЕРЫ
В данной работе использовали протокол получения активированных ДНК-вакцинами, содержащими полиэпитопные иммуногены, дендритных клеток (ДК) и пула обученных и размноженных ex vivo цитотоксических Т-лимфоцитов, с целью формирования полноценного противоракового иммунного ответа in vivo.
Для полученных полиэпитопных иммуногенов были созданы соответствующие искусственные гены. Полинуклеотидные последовательности были оптимизированы для экспрессии в клетках человека, для чего из искусственных генов были исключены редко используемые кодоны. Дизайн нуклеотидных последовательностей проводили с таким расчетом, чтобы минимизировать сложность вторичной структуры матричной РНК.
Для создания ДНК-вакцинных конструкций с использованием полученных искусственных генов была выбрана плазмида pDNAVACC-Ultra (pDNAVACC5, NBC, USA, http://www.natx.com/). Также была создана контрольная конструкция pDNAVACC-ErbB2, содержащая последовательность, кодирующую цельный белок ErbB2 (положительный контроль). В качестве отрицательного контроля также использовалась плазмида pDNAVACC5.
Были созданы три конструкции:
1) pDNA5-BCA020-v.1 - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген 1;
2) pDNA5-BCA0201-v.2 - плазмида pDNAVACC со встроенной последовательностью, кодирующей иммуноген 2;
3) pDNA5-HER2 - плазмида pDNAVACC со встроенной последовательностью, кодирующей белок ErbB2.
Далее проводилась оценка эффективности индукции T-клеточного ответа in vitro с помощью полученных полиэпитопных конструкций.
ДК получали из адгезирующей фракции мононуклеаров периферической крови условно-здоровых доноров с подтвержденным наличием аллеля HLA-A0201 [Jarnjak-Jankovic et al., 2007; Tanaka et al., 2006; Obermaier et al., 2003]. Для введения генетических конструкций, кодирующих специфичные для гаплотипа HLA-A0201 полиэпитопные иммуногены, мы использовали метод магнитной трансфекции, основанный на проникновении магнитных наночастиц со связанной плазмидной ДНК в клетки под воздействием магнитного поля.
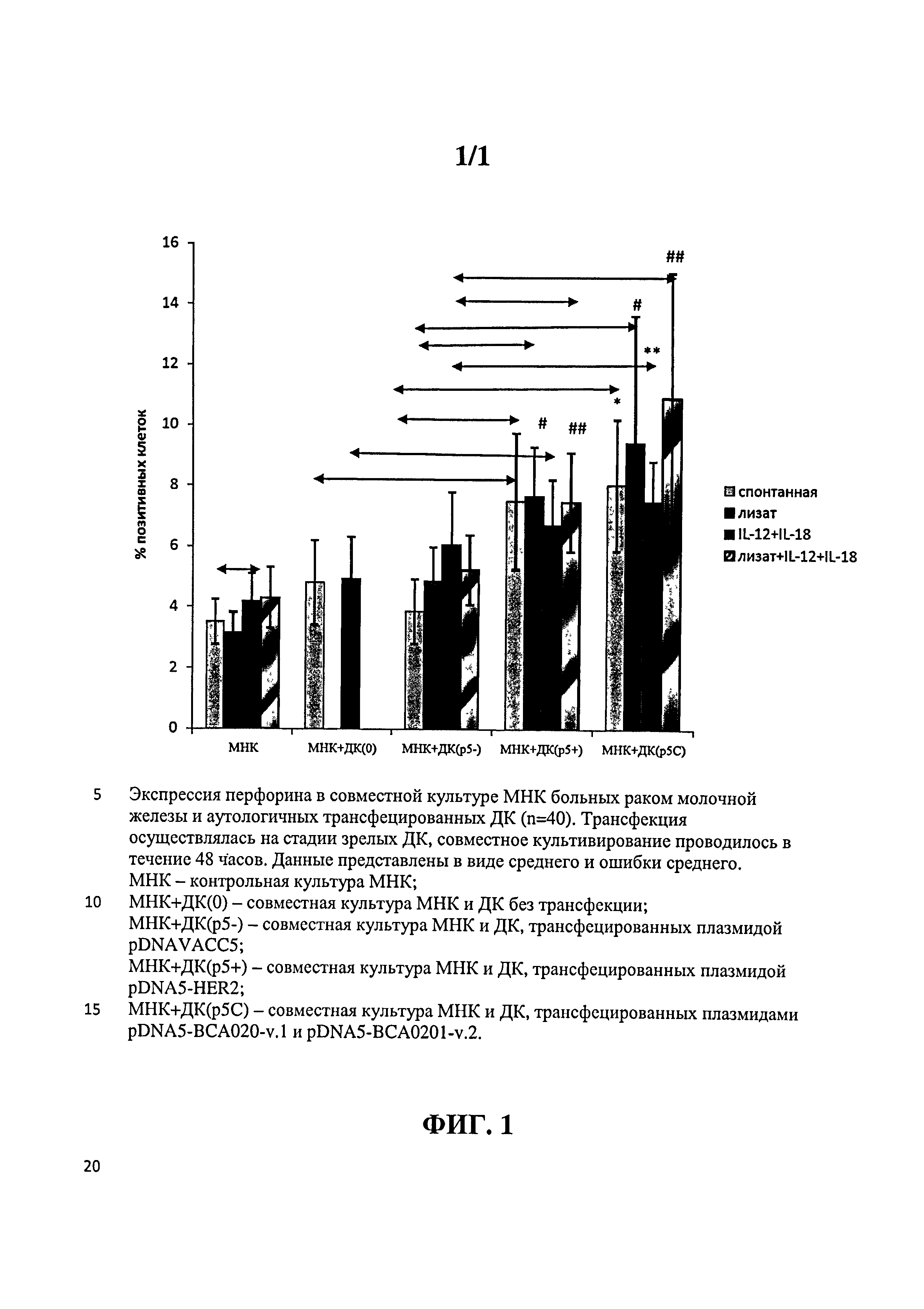
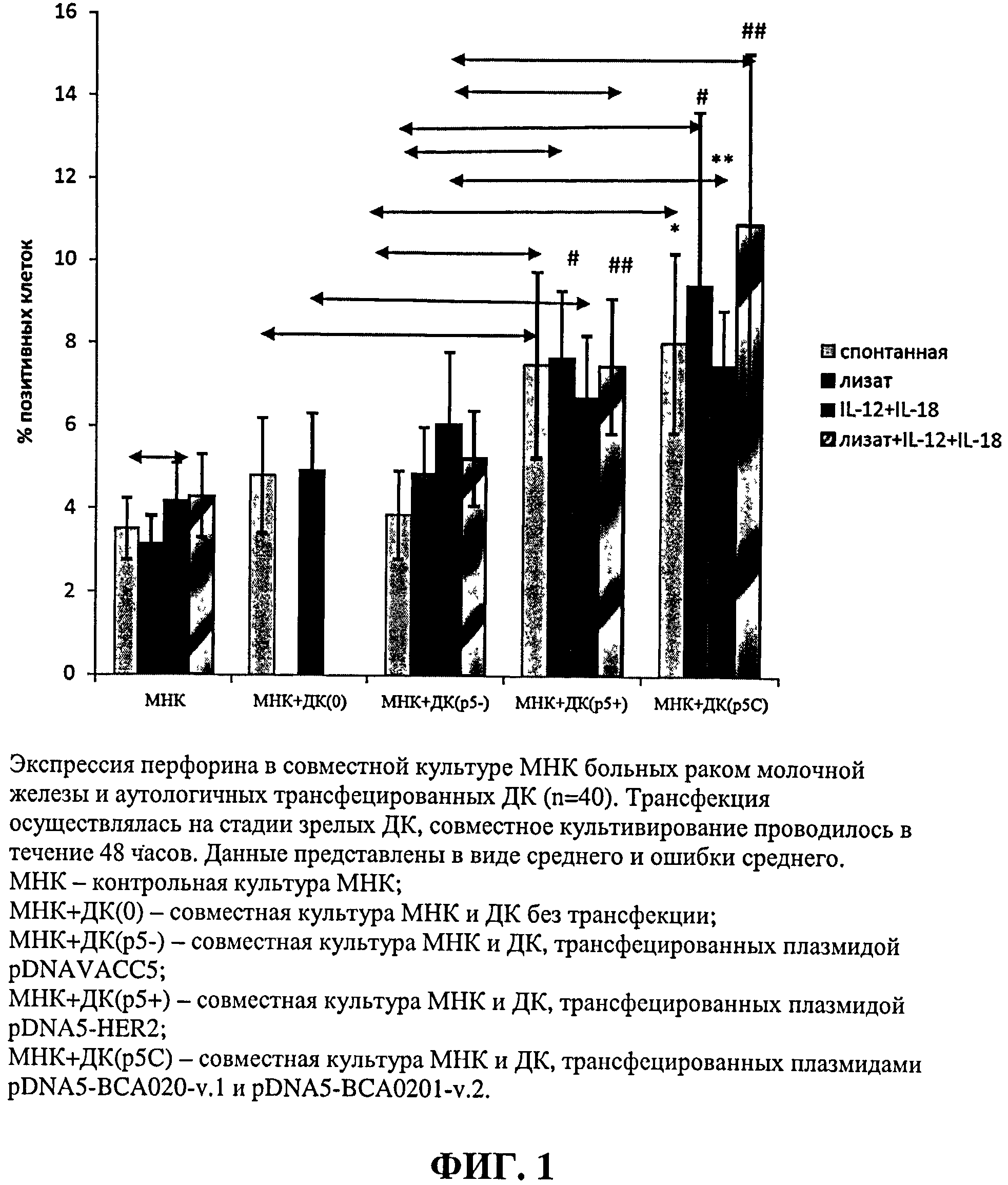
Цитотоксический потенциал Т-лимфоцитов культивируемых совместно с фракциями активированных ДК оценивали в неспецифическом тесте по стимуляции продукции перфориновых гранул в мононуклеарных клетках, а также по специфическому цитотоксическому ответу против опухолевой клеточной линии MCF-7, несущей на своей поверхности маркеры, которые должны распознаваться обученными цитотоксическими Т-лимфоцитами. В результате было установлено достоверное увеличение количества клеток, несущих перфориновые гранулы, для групп с ДК, трансфецированными плазмидными ДНК pDNA5-BCA020-v.1, pDNA5-BCA020-v.2, pDNA5-HER-2. При добавлении в совместную культуру цитокинов ИЛ-12 и ИЛ-18 отмечалось повышение содержания перфорина, для групп с трансфекцией плазмидами pDNA5-BCA020-v.1, pDNA5-BCA020-v.2, кодирующими специфичные для HLA-A0201 полиэпитопные иммуногены, были получены достоверные различия по сравнению с контрольными группами. Результаты представлены на Фиг.1.
В качестве специфического теста использовали анализ содержания ЛДГ, высвобождаемой в среду при гибели опухолевых клеток, после совместного культивирования совместной фракции ДК и Т-лимфоцитов с культурой опухолевых клеток.
Проведенные эксперименты показали достоверное повышение цитотоксического индекса в отношении клеточной линии MCF-7 в группах с ДК трансфецированными pDNA5-BCA020-v.1, pDNA5-BCA020-v.2, специфичные для HLA-A0201 полиэпитопные иммуногены, по сравнению с контрольными группами. Кроме того, в группах pDNA5-BCA020-v.1, pDNA5-BCA020-v.2 было отмечено достоверное повышение цитотоксического ответа при добавлении в совместную культуру Т-лимфоцитов и ДК иммунорегуляторных цитокинов ИЛ-12 и ИЛ-18.
Таким образом, в ходе проведения исследования показано, что полученные по протоколу из моноцитов трансфецированные ДК способны презентировать антигены аутологичным мононуклеарным клеткам, после чего последние приобретают повышенный цитотоксический потенциал за счет накопления в цитоплазме гранул перфорина и непосредственно оказывают специфический цитотоксический эффект на клеточную линию, несущую на своей поверхности молекулы мишени. Использование трансфекции плазмидой, кодирующей цельный белок Her-2/neu, оказалось менее эффективным, поскольку в тестах по оценке содержания перфорина при добавлении цитокинов данная группа не отличалась от групп контроля, а в эксперименте с клеточной линией MCF-7 оказалась неэффективна. Таким образом, еще раз подтверждается эффективность использования уникальных полиэпитопных конструкций, содержащих набор специфических полиэпитопных иммуногенов.
Литература
1. Basha HI, Tiriveedhi V, Fleming ТР., Gillanders WE & Mohanakumar T. Identification of immunodominant HLA-B7-restricted CD8+ cytotoxic T cell epitopes derived from mammaglobin-A expressed on human breast cancers. Breast Cancer Research And Treatment 2011. 127, 1, 81-89.
2. Becker JC, Wobser M, Hofmeister V, Bauer В, Broecker ЕВ, thor Straten P, Andersen MH. Safety, immunogenicity, and clinical response of a survivin-based peptide vaccine in therapy-resistant advanced cancer: Results from a phase I/II trial. J Clin Oncol. 2008, 26:3046.
3. Benavides LC, Gates JD, Carmichael MG, Patil R, Patel R, Holmes JP, Hueman MT, Mittendorf Ea, Craig D, Stojadinovic A, Ponniah S & Peoples GE The impact of HER2/neu expression level on response to the E75 vaccine: from U.S. Military Cancer Institute Clinical Trials Group Study I-01 and I-02. Clinical cancer research: an official journal of the American Association for Cancer Research 2009; 15:2895-904.
4. Bernhard H, Salazar L, Schiffman K, Smorlesi a, Schmidt B, Knutson KL & Disis ML Vaccination against the HER-2/neu oncogenic protein. Endocrine-related Cancer 2002; 9:33-44.
5. Dario С.Altier. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer. 2008. 8(1):61-70.
6. Di Modugno F, Mottolese M, Benedetto AD, Conidi A, Novelli F, Perracchio L, Venturo I, Botti C, Jager E, Santoni A, Natali PG & Nistico P. The cytoskeleton regulatory protein hMena (ENAH) is overexpressed in human benign breast lesions with high risk of transformation and human Epidermal Growth factor receptor-2-positive/hormonal receptor -negative tumors. Clin Cancer Res 2006. 12(5): 1470-8.
7. Di Modugno F, Mottolese M, DeMonte L, Trono P, Balsamo M, Conidi A, Melucci E, Terrenato I, Belleudi F, Torrisi MR, Alessio M, Santoni A, Nisticò P. The cooperation between hMena overexpression and HER2 signalling in breast cancer. PLoS One. 2010 5(12):e15852.
8. Disis ML, Goodell V, Schiffman K, Knutson KL. Humoral epitope-spreading following immunization with a HER-2/neu peptide based vaccine in cancer patients. J Clin Immunol. 2004 24(5):571-8.
9. Disis ML, Shiota FM, Cheever MA. Human HER-2/neu protein immunization circumvents tolerance to rat neu: a vaccine strategy for 'self' tumour antigens. Immunology. 1998 93(2); 192-9.
10. Disis, M.L., and M.A. Cheever. HER-2/neu protein: a target for antigen specific immunotherapy of human cancer. Adv. Cancer Res. 1997; 71:343.
11. Harari D & Yarden Y Molecular mechanisms underlying ErbB2/HER2 action in breast cancer. Oncogene 2000; 19:6102-14,
12. Hung, K., R. Hayashi, A. Lafond-Walker, C. Lowenstein, D. Pardoll, and H. Levitsky. The central role of CD4+Т cells in the antitumor immune response. J. Exp. Med. 1998; 188:2357.
13. Inderberg-Suso EM, Trachsel S, Lislerud K, Rasmussen AM, Gaudemack G. Widespread CD4+T-cell reactivity to novel hTERT epitopes following vaccination of cancer patients with a single hTERT peptide GV1001. Oncoimmunology. 2012 1(5): 670-686.
14. Jäger D, Karbach J, Pauligk C. Seil. Frei C, Chen YT, Old LJ, Knuth A, Jäger E. Humoral and cellular immune responses against the breast cancer antigen NY-BR-1: definition of two HLA-A2 restricted peptide epitopes. Cancer Immun. 2005. 12; 5:11.
15. Li Y, Matsueda S, Efferson CL, Tsuda N, Kawano K, Gao H, Peoples GE, Ioannides CG. Distinct patient responses to activation of T-cells by free HER-2, G89 (777-789) and protected LRMK-linked HER-2, {AE-39 [p776 (Ava-774-788)], AE-47 [(Ava-776-788)] and AE-37 [p776 (774-788)]} peptides could lead to development of personalized cancer vaccines. Anticancer Res. 2009 Jan; 29(1):41-58.
16. Marzo, A.L., B.F. Kinnear, R.A. Lake, J.J. Frelinger, E.J. Collins, B.W. Robinson, and B. Scott. Tumor-specific CD4+Т cells have a major "post-licensing" role in CTL mediated anti-tumor immunity J. Immunol 2000; 165:60.
17. Mittendorf E.A., Holmes J.P., Ponniah S., Peoples G.E. The E75 HER2/neu peptide vaccine. Cancer Immunol Immunother. 2008; 57(10):1511-21.
18. Narayanan K, Jaramillo A, Benshoff ND, Campbell LG., Fleming ТР., Dietz JR., Mohanakumar T. Response of established human breast tumors to vaccination with mammaglobin-a cDNA. Journal of the National Cancer Institute, 2004. 96, 18.
19. Pardoll, D. M., and S. L. Topalian The role of CD4+T cell responses in antitumor immunity. Curr. Opin. Immunol. 1998; 10:588.
20. Peters В, Bulik S, Tampe R. Van Endert PM & Holzhutter Ню Identifying ГКГС class I epitopes by predicting the TAP transport efficiency of epitope precursors. Journal of immunology (Baltimore, Md.: 1950). 2003. 171, 1741-9.
21. Qin, Z., and T. Blankenstein. CD4+Т cell-mediated tumor rejection involves inhibition of angiogenesis that is dependent on IFN_ receptor expression by nonhematopoietic cells. Immunity 2000; 12:677.
22. Ross JS, Slodkowska Ea, Symmans WF, Pusztai L, Ravdin PM & Hortobagyi GN The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. The Oncologist 2009; 14:320-68.
23. Salazar LG, Fikes J, Southwood S, Ishioka G, Knutson KL, Gooley ТА, Schiffman K, Disis ML. Immunization of cancer patients with HER-2/neu-derived peptides demonstrating high-affinity binding to multiple class II alleles. Clin Cancer Res. 2003 15; 9(15):5559-65.
24. Seiji Fukuda & Louis M. Pelus. Survivin, a cancer target with an emerging role in normal adult tissues. Mol Cancer Ther. 2006.5(5): 1087-98.
25. Seil I, Frei C, Sultmann H, Knauer SK, Engels K, Jager E, Zatloukal K. Pfreundschuh M, Knuth A, Tseng-Chen Y, Jungbluth AA, Stauber RH & Jager D. The differentiation antigen NY-BR-1 is a potential target for antibody-based therapies in breast cancer. Int. J. Cancer. 2007. 120, 2635-2642.
26. Sugiyama W. WT1 (Wilms' Tumor Gene 1): Biology and Cancer Immunotherapy. Jpn J Clin Oncol. 2010. 40(5)377-387.
27. Theurillat JP, Zürrer-Härdi U, Varga Z, Storz M, Probst-Hensch NM, Seifert B, Fehr MK, Fink D, Fen-one S, Pestalozzi B, Jungbluth AA, Chen YT, Jäger D. Knuth A, Moch H. NY-BR-1 protein expression in breast carcinoma: a mammary gland differentiation antigen as target for cancer immunotherapy. Cancer Immunol Immunother. 2007. 56(11); 1723-31.
28. Vazquez A, Bond ЕЕ, Levine AJ, Bond GL. The genetics of the p53 pathway, apoptosis and cancer therapy. Nat Rev Drug Discov. 2008. 7(12):979-87.
29. Watson MA & Fleming TP Mammaglobin, a mammary-specific member of the uteroglobin gene family, is overexpressed in human breast cancer. Cancer Research 1996. 56, 860-865.
30. Watson MA, Dintzis S, Darrow CM, Voss LE, DiPersio J, Jensen R, &and Fleming TP Mammaglobin expression in primary, metastatic, and occult breast cancer. Cancer Research 1999. 59, 3028-3031.