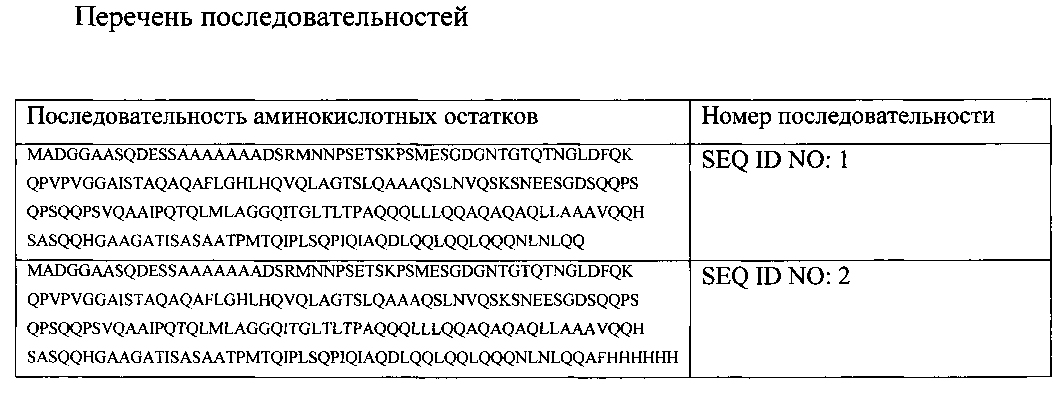
Результат интеллектуальной деятельности: АНТИТЕЛА К ИЗОФОРМАМ БЕЛКА Oct-1 ЧЕЛОВЕКА, РЕКОМБИНАТНЫЙ ПОЛИПЕПТИД И СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, генной и белковой инженерии и может быть использовано в медицине и в фармацевтической промышленности.
Белок Oct-1 - фактор транскрипции, принадлежащий к POU-семейству (Sturm et al., 1993). Oct-1 принимает участие в регуляции экспрессии ряда тканеспецифических генов, в том числе генов интерлейкинов, легких и тяжелых цепей иммуноглобулинов, генов пролактина, гонадолиберина, тиреотропина и др. При этом Oct-1 «работает» и как активатор и как репрессор транскрипции. Кроме этого Oct-1 участвует в репликации аденовирусных геномов и, вероятно, геномов эукариот, задействован в прикреплении петель хроматина к ядерной мембране и формировании участков прикрепления к ядерному матриксу, связан с апоптозом и контролем эмбрионального развития организма.
Транскрипция гена Oct-1 находится под контролем двух промоторов, промотор U - находится перед экзоном 1U, который входит в состав вездесущих Oct-1 изоформ, а промотор L - перед экзоном 1L, который входит в состав тканеспецифической Oct-1L изоформы.
В результате сложного альтернативного сплайсинга и альтернативной инициации транскрипции образуются множественные изоформы Oct-1, различающиеся на N- и С-концах белковой молекулы. Также различают убиквитарные, отличающиеся числом аминокислотных остатков на N-конце изоформы фактора транскрипции Oct-1 человека (Oct-1A, Oct-1В) и тканеспецифические для лимфоидных клеток и клеток мозга, отличающиеся аминокислотной последовательностью на N-конце изоформы фактора транскрипции Oct-1 человека (Oct-1L, Oct-1R).
Идентификация и анализ уровня экспрессии регуляторных элементов, таких как изоформы белка Oct-1, могут быть использованы для анализа состояния иммунной системы организма, изучения механизмов дифференциальной активности генов в онтогенезе организма. Предполагается, что транскрипционные комплексы, образуемые с участием белков транскрипции Oct-1, и их субъединицы и участвуют в молекулярно-клеточных процессах возникновения онкологических и нейродегенеративных заболеваний. Для исследования участия изоформ Oct-1 в регуляции генов требуется создание высокоспецифичных очищенных антител.
В настоящее время антитела против Oct-1 производятся компаниями:
http://acris-antibodies.com
http://www/pierce-antibodies.com
http://www/Idbio/com
http://www/scbt.com
http://www/abcam.com
Недостатком известных антител является то, что с их помощью невозможно определить, с какими изоформами Oct-1 они взаимодействуют, а также каждое из полученных ранее антител взаимодействует только с некоторыми изоформами Oct-1. Антитела, взаимодействующие одновременно со всем пулом изоформ Oct-1, не известны.
Задачей настоящего изобретения является получение высокоочищенных антител, взаимодействующих со всеми изоформами Oct-1 в клетках.
Для выполнения данной задачи был выбран участок аминокислотной последовательности молекулы Oct-1, был получен рекомбинантный ДНК-вектор, кодирующий эту аминокислотную последовательность, наработан в E.coli и очищен рекомбинантный полипептид. В результате иммунизации выбранным полипептидом были получены поликлональные антитела, взаимодействующие со всеми известными изоформами Oct-1. Антитела - кроличьи поликлональные имумуноглобулин G (IgG), рабочий титр 1:1000.
Технический результат: высокая аффинность и специфичность взаимодействия со всеми известными изоформами Oct-1.
Возможность осуществления изобретения проиллюстрирована следующими примерами, представленными ниже.
1.1. Выбор и оптимизация методов клонирования фрагмента изоформ Oct-1 белка в экспрессионном векторе РЕТ15, содержащем тандем из 6 остатков гистидина в конце или в начале гена РЕТ15
Методами компьютерного анализа с использованием программ Protein BLAST, ExPASY, ProtParam, ProtScale, Pole Bioinformatique Lyonnais были проанализированы аминокислотные последовательности Oct-1 изоформ, определена встречаемость и сходство этих последовательностей с другими белками человека. Расположение аминокислотных остатков на поверхности белков и антигенность различных участков белковых молекул, а также распределение гидрофильных и гидрофобных участков в молекуле белка и подвижность участков белка.
Из анализа профилей следует, что аминокислоты 1-41 в целом гидрофильны, располагаются на внешней поверхности белка и доступны для взаимодействия с антителами и содержат три блока аминокислот I (1-10), II (16-30) и III (31-41), обладающие антигенными детерминантами. Четвертый (IV) основной блок аминокислот с теми же свойствами локализован в районе 86-110 аминокислот. Остальная часть N-концевого участка содержит шесть минорных блоков аминокислот со слабыми антигенными детерминантами с позициями максимумов 160, 203.
Сравнение N-концевой аминокислотной последовательности Oct-1 с банком данных аминокислотных последовательностей человека показало, что аминокислотная последовательность этого участка является уникальной.
В силу изложенных причин участок Oct-1 (1-214) оптимален для иммунизации с целью получения специфичных антител.
На основании анализа этих результатов нами для получения антител против изоформ Oct-1 был выбран участок молекулы Oct-1: полипептид, содержащий аминокислотную последовательность Oct-1 А (1-214)- SEQ ID NO: 1:
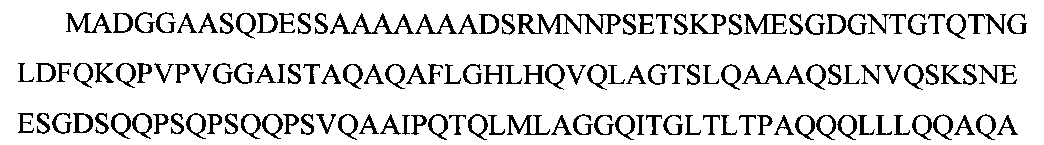

Кодирующая его кДНК была клонирована в модифицированном векторе PET15 (Novagen), содержащем 6-His на С-конце белковой молекулы, для последующей очистки белка на Ni+2-колонке. В результате трансляции синтезируется полипептид, который был использован для иммунизации, имеющий последовательность SEQ ID NO: 1, включающую N-терминальные Oct-1 1-214 аминокислотные остатки (SEQ ID NO: 2) и дополнительный участок, содержащий линкер и 6-His:
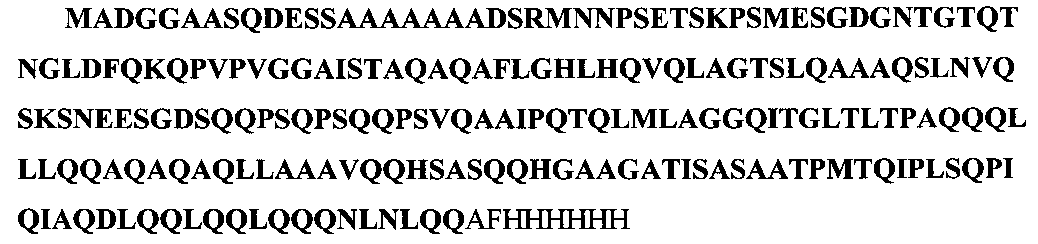
Нами была проверена гомология выбранного для иммунизации пептида с аминокислотными последовательностями белков Oct-1 других видов животных. Анализ проводился с помощью программы Protein BLAST и базы данных SWISS-Prot.
Виды животных, для которых была определена гомология Oct-1 в области пептида SEQ ID NO: 1: Mus musculus, Pig, Chick, Xenopus laevis, Mustela putorius furo, Canis lupus familiaris, Pan paniscus, Saimiri boliviensis boliviensis, Saimiri boliviensis boliviensis, Macaca mulatta, Leptonychotes weddellii, Rhinopithecus roxellana, Gorilla gorilla gorilla, Callithrix jacchus, Ceratotherium simum simum, Microcebus murinus, Canis lupus familiaris, Sus scrofa, Odobenus rosmarus divergens, Macaca nemestrina, Heterocephalus glaber, Camelus dromedarius, Chinchilla lanigera, Bos taurus, Sus scrofa, Capra hircus, Cercocebus atys, Microcebus murinus, Equus caballus, Microcebus murinus, Ovis aries musimon, Mustela putorius furo, Ailuropoda melanoleuca, Ursus maritimus, Pan paniscus, Lipotes vexillifer, Callithrix jacchus, Oryctolagus cuniculus, Mustela putorius furo, Tarsius syrichta, Canis lupus familiaris, Ceratotherium simum simum, Propithecus coquereli, Odobenus rosmarus divergens, Sus scrofa, Microcebus murinus, Ceratotherium simum simum, Oryctolagus cuniculus, Ochotona princeps, Macaca nemestrina, Camelus ferus, Heterocephalus glaber, Orycteropus afer afer, Bos taurus, Otolemur garnettii, Pan paniscus, Nomascus leucogenys, Saimiri boliviensis boliviensis, Bison bison bison, Bubalus bubalis, Echinops telfairi, Chrysochloris asiatica, Octodon degus, Galeopterus variegatus, Ochotona princeps, Callithrix jacchus, Chinchilla lanigera, Ictidomys tridecemlineatus, Fulmarus glacialis, Pan troglodytes, Dipodomys ordii, Tarsius syrichta, Canis lupus familiaris, Sorex araneus, Panthera tigris altaica, Propithecus coquereli, Odobenus rosmarus divergens, Balaenoptera acutorostrata scammoni, Microcebus murinus.
В области пептида SEQ ID NO: 1 с 24 по 214 аминокислотный остаток для изоформ Oct-1 мыши гомология составляет 92% для Oct-1А и 82% для Oct-1R, Chick - 91%, Xenopus laevis - 79% при сохранении высокой гомологии в области сильных и слабых антигенных детерминант. У остальных перечисленных выше видов животных гомология белка Oct-1 в области пептида SEQ ID NO: 1 с 24 по 214 аминокислотный остаток составляет от 98% до 100%. В эту область входят основные сильные антигенные детерминанты II, III, IV и участки с более слабыми антигенными детерминантами с позициями максимумов 160, 203.
Для Sus scrofa, Pan troglodytes, Bos taurus, Mus musculus, Pig, Chick, Xenopus laevis при сравнении использовались аннотированные последовательности полипептидов, полученные трансляцией известных мРНК, для остальных видов животных сравнение производилось с предсказанными последовательностями белка, полученными на основе компьютерного анализа геномов (Protein BLAST).
1.2. Выбор и оптимизации методов наработки изоформ в Е. coli с целью получения полноразмерных белков в нативном состоянии
В качестве базового вектора мы использовали плазмиду PET15 (Novagen), в котором вся линкерная последовательность была удалена и заменена на новую оптимальную для клонирования Oct-1 изоформ. Кроме того, короткие олигонуклеотиды, кодирующие 6 остатков гистидина, были вставлены на 5′- или 3′-конце в рамке считывания с клонированным геном.
кДНК была клонирована в векторе PET15 и экспрессировалась в клетках Е. coli RIL (Stratagen).
Были отработаны условия выращивания клеток для получения максимального количества полноразмерных водорастворимых белков в нативном состоянии. Варьировались такие параметры, как состав культуральной среды, температура инкубации, концентрация IPTG и время индукции с целью получения нативных водорастворимых белков. Уровни экспрессии визуализировались после разделения грубых лизатов при помощи денатурирующего электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия и вестерн-блоттинга с использованием антител к гистидину, а также с использованием метода хемилюминесцентного иммуноанализа.
Максимальный выход водорастворимого белка (5.4 мг/л) достигается при следующих условиях инкубации и индукции:
Среда - LB (Луриа-Бертани) (5 г. NaCl на 1 л)
Температура выращивания до индукции 37°C
Оптическая плотность клеток в момент индукции 0,4 OD600
Концентрация IPTG (изопропил-β-D-1-тиогалактопиранозида) при индукции 120 мкМ
Температура выращивания после индукции 20°C
Время индукции 2 ч 30 мин
1.3. Выбор и оптимизации методов очистки белков, использованных для иммунизации, на аффинной Ni+2-колонке для получения нативного полипептида
Процедура очистки является важным этапом исследования белков. Необходимо проводить очистку белка в условиях, дающих высокую степень очистки и одновременно сохраняющих функциональную активность белка. В результате анализа существующих методов очистки белков нами был выбран для проведения данных исследований метод очистки белков на аффинной колонке, содержащей агарозный сорбент Ni-NTA Agarose. Использование коротких аминокислотных последовательностей, таких как 6-His для аффинной очистки белков вместо протяженных полипептидных участков, также узнаваемых аффинно, имеет следующие преимущества.
1. 6-His в начале или в конце клонируемого белка практически не изменяют структуры белка. Они гидрофильны и доступны для узнавания сорбентом. Но в каждом конкретном случае все эти положения необходимо экспериментально проверять.
2. 6-His-Ni-NTA - система позволяет очень эффективно очищать белки за один этап сорбции-десорбции.
3. 6-His не влияет на ДНК связывающую активность белков.
4. Если белки получают для иммунизации, 6-His является крайне слабой антигенной детерминантой.
5. Сорбент Ni-NTA имеет высокую сорбирующую способность и относительно низкую стоимость по сравнению с другими сорбентами.
6. Метод очистки крайне пластичен, можно изменять любые параметры (концентрацию соли Imidazole, детергентов) с целью достижения максимальной степени очистки.
Данный метод, наряду с FPLC и HPLC методами, позволяет получать белки высокой степени очистки, однако этот метод гораздо экономичнее и не требует дорогостоящего оборудования.
Оптимальные условия для очистки белка были выбраны следующие: посадка белка на колонку осуществлялась в буфере, содержащем: 50 мМ натрий-фосфат pH 8,0; 300 мМ NaCl; 5% глицерин; 15 мМ имидазола (Imidazole); 0,01% нонидета (NP-40), C-Complete reagent, 1 мМ Фенилметилсульфонил фторида (PMSF). Колонку промывали 10 объемами этого же буфера, содержащего 20 мМ Imidazole, затем 5-ю объемами этого же буфера, содержащего 50 мМ Imidazole без NP-40. Сорбированные на колонке белки элюировали 5-ю объемами этого же буфера, содержащего 250 мМ Imidazole. Затем определяли распределение элюированных белков по фракциям и их чистоту методом электрофореза в денатурирующем полиакриламидном геле (SDS-ПААГ) с последующей окраской Кумасси R250 (Coomassie R250). Объединяли фракции, содержащие рекомбинантный белок, диализовали против натрий-фосфатного буфера (PBS). Концентрацию белка определяли с использованием набора Bio-Rad Protein Assay Kit (Bio-Rad). Результаты оптимизации приведены на Фиг. 3.
1.4. Иммунизация кроликов полипептидом Oct-1, определение титра антител и их специфичности методами иммуноблотинга и гистохимическими методами
Кроликов иммунизировали белками Oct-1, полученными методом аффинной хроматографии на Ni+2-содержащей колонке. Концентрацию белка для иммунизации после элюции с Ni+2-колонки определяли по Бретфорду. Иммунизацию кроликов проводили по схеме приведенной ниже.
1.5. Выделение и очистка антител из крови животных, дающих максимальный титр и специфичность
Для изучения взаимодействия фактора транскрипции Oct-1 с ядерными белками были получены и очищены поликлональные кроличьи антитела против изоформ белка Oct-1. Антитела из сыворотки очищали аффинно.
Приготовление аффинной колонки для очистки антител
Очищенный на Ni+2-колонке антиген в количестве 4,6 мг пришивали ковалентно к BrCN-активированной сефарозе (Pharmacia) по методике производителя. После инкубации белка с BrCN-активированной сефарозой определяли концентрацию белка в не связавшейся фракции по методу Бредфорда с использованием Quick start Brandford Protein assay kit (Bio-Rad). Для построения стандартной кривой концентрации белка использовали BSA Standart solution (Bio-Rad).
Очистка антител на аффинной колонке
Сыворотку кроликов после 4-й иммунизации центрифугировали при 4000 g 15 мин, 40°C для удаления преципитатов. Добавляли 3 объема фосфатно-солевого буфера (PBS) и наносили на колонку, содержащую антиген пришитый ковалентно к BrCN-сефарозе в течение ночи при 40°C. Промывали фосфатно-солевым буфером, антитела элюировали раствором, содержащим 0,1 М глицин, pH 2,8. Фракции, содержащие антитела, объединяли и диализовали против раствора PBS/20% глицерин.
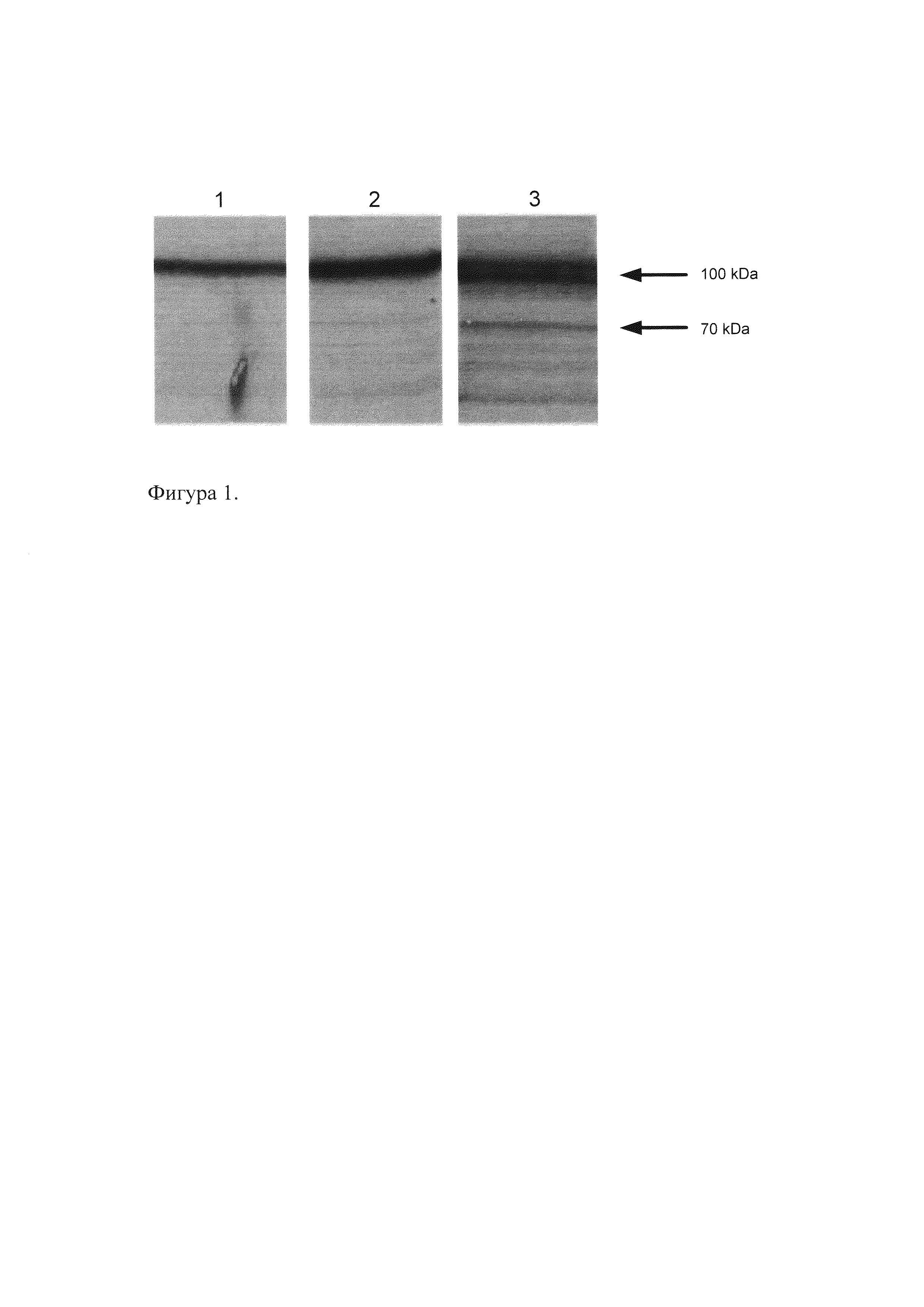
Поликлональные антитела были получены на указанный фрагмент белка, содержащие аминокислотные остатки 1-214. Было показано, что антитела детектируют полосу, молекулярная масса которой около 100 кДа, что соответствует расчетной молекулярной массе изоформ Oct-1A, L.
На Фиг. 1 представлены данные Вестерн-блот анализа на ядерном экстракте клеток HeLa с антителами к Oct-1. На каждую дорожку нанесено 10 мкг белка. Раститровка антител, полученных из сыворотки крови кролика, иммунизированного полипептидом Oct-1, содержащим аминокислотные остатки с 1 по 216. Дорожки 1-3 - разведение антител 1/1000; 1/400 и 1/200 соответственно. Гибридизация проводилась с соответствующим разведением антител, методом детекции пероксидазой ТМВ (Vector Lab).
2. Проверка интенсивности и специфичности экспрессии рекомбинантных изоформ с помощью полученных антител к Oct-1 и антител к FLAG последовательности
Специфичность антител также была проверена на препаратах клеток человека, трансфицированных и не трансфицированных ДНК-конструкциями, кодирующими изоформы Oct-1.
На Фиг. 2. представлены данные Вестерн-блот анализа на ядерных экстрактах из клеток HeLa, трансфицированных и не трансфицированных изоформами Oct-1 с FLAG-последовательностью, для проверки интенсивности и специфичности экспрессии рекомбинантных изоформ с помощью полученных антител. Дорожка 1 - клетки HeLa, трансфицированные Oct-1A, дорожка 2 - клетки HeLa, трансфицированные Oct-IL, дорожка 3 - клетки HeLa, не трансфицированные. На каждую дорожку нанесено 10 мкг белка.
На Фиг. 3. представлены данные Вестерн-блот анализа на ядерных экстрактах из клеток HeLa, трансфицированных и не трансфицированных изоформами Oct-1 с FLAG-последовательностью, для проверки специфичности экспрессии рекомбинантных изоформ с помощью антител анти-FLAG. Дорожка 1 - клетки HeLa, трансфицированные Oct-1A, дорожка 2 - клетки HeLa, трансфицированные Oct-1L, дорожка 3 - клетки HeLa, не трансфицированные. На каждую дорожку нанесено 10 мкг белка.
Из данных, приведенных на Фиг. 2 и 3, видно, что клетки человека, трансфицированные Oct-1, экспрессируют рекомбинантный белок Oct-1 с высокой эффективностью и специфичностью. При этом с помощью полученных антител к Oct-1 выявляется как эндогенный, так и рекомбинантный белок, тогда как с помощью антител к последовательности FLAG выявляются только рекомбинантные формы Oct-1.
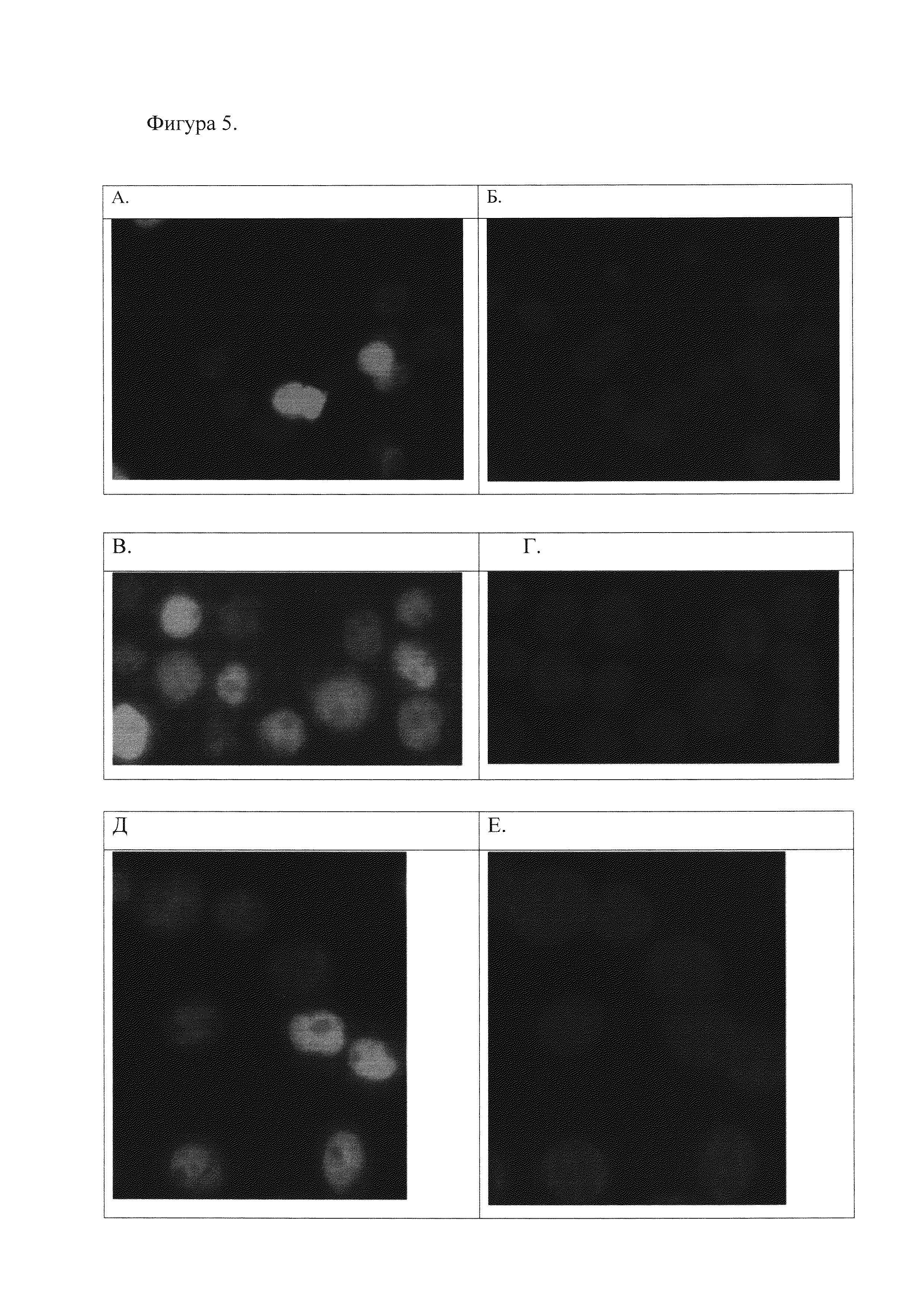
3. Проверка полученных антител методом гистохимического окрашивания клеток человека линии Namalva (см. Фиг. 4 и 5).
Проверка полученных антител проводилась методом иммуно-гистохимического анализа. Клетки человека линии Namalva окрашивали по стандартной методике полученными антителами в титре 1:300. Вторые антитела использовали анти-кролик, меченые FITC.
Фиг. 4. Иммуногистохимическое окрашивание клеток линии Namalva. А, окрашивание полученными антителами к Oct-1, Б, окрашивание DAPI для выявления ядер.
Фиг. 5. Иммуногистохимическое окрашивание клеток линии Namalva, транзиентно трансфицированных кДНК, кодирующей полноразмерный белок Oct-1 с эпитопом 3-FLAG на С-конце.
5А. Экспрессия изоформы Oct-1A, окрашивание антителами к 3-FLAG эпитопу.
5Б. Клетки, экспрессирующие изоформу Oct-1A, окрашивание DAPI для выявления ядер.
5В. Экспрессия изоформы Oct-1A, окрашивание полученными антителами к Oct-1.
5Г. Клетки, экспрессирующие изоформу Oct-1A, окрашивание DAPI для выявления ядер.
5Д. Клетки, экспрессирующие изоформу Oct-1L, окрашивание полученными антителами к Oct-1.
5Е. Клетки, экспрессирующие изоформу Oct-1L, окрашивание DAPI для выявления ядер.
5Ж. Клетки, экспрессирующие изоформу Oct-1B, окрашивание полученными антителами к Oct-1.
5З. Клетки, экспрессирующие изоформу Oct-1B, окрашивание DAPI для выявления ядер.
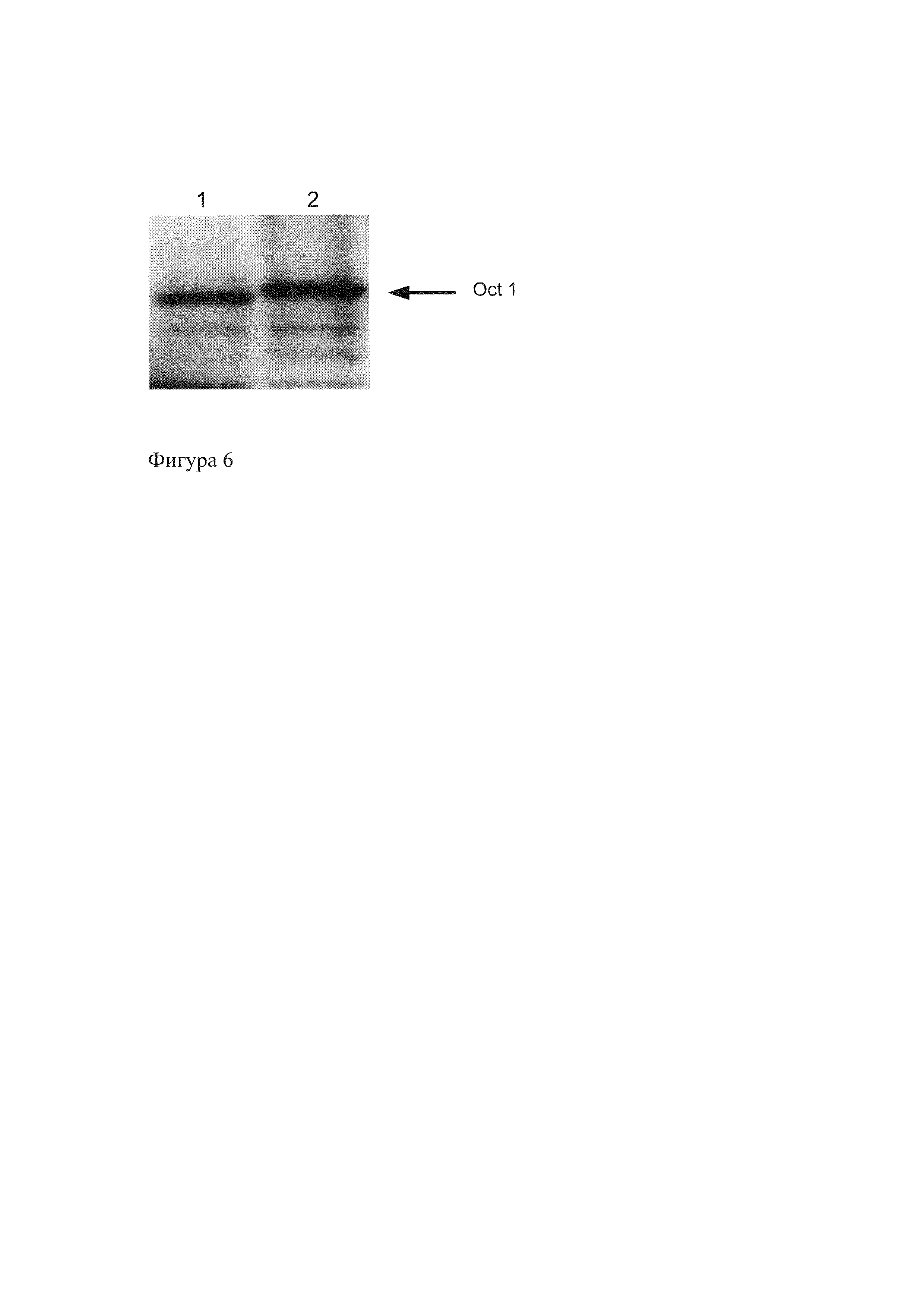
На Фиг. 6. представлены данные Вестерн-блот анализа изоформ Oct-1R и Oct-1A мыши, полученных в реакции транскрипции-трансляции in vitro. Окрашивание с помощью полученных антител к Oct-1. Дорожка 1 - изоформа Oct-1R, дорожка 2 - изоформа Oct-1A.
Из Фиг. 5 видно, что трансфицированные клетки, экспрессирующие большее количество белка Oct-1, окрашиваются более интенсивно, чем не трансфицированные клетки, тогда как с помощью антител анти-FLAG окрашиваются только клетки, экспрессирующие рекомбинантный белок.
Из Фиг. 4 и 5 видно, что полученные антитела к Oct-1 специфически окрашивают ядра клеток линии Namalva и интенсивность сигнала зависит от количества экспрессируемого белка Oct-1. Таким образом, эти антитела специфически работают в иммуногистохимическом анализе и связываются с известными изоформами белка Oct-1A, Oct-1L и Oct-1B человека.
Из Фиг. 6 видно, что полученные нами антитела окрашивают изоформы Oct-1 мыши.
Полученные нами поликлональные кроличьи антитела к Oct-1 выделяются из фракции иммуноглобулинов G (IgG) и могут быть использованы для детекции (обнаружения) белка Oct-1 в клетках человека и других видов животных методами Вестерн-блот анализа (разведение 1:200 - 1:1000), иммунофлюоресцентного анализа (разведение 1:50-1:500), иммуногистохимического анализа (разведение 1:100-1:400) и методом ELISA (разведение 1:400-1:3000).