Результат интеллектуальной деятельности: ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ
Вид РИД
Изобретение
Настоящее изобретение относится к области генной инженерии и биотехнологии растений, в частности к трансгенным растениям березы, проявляющих высокую устойчивость к гербицидам на основе фосфинотрицина.
Уровень техники
Основным способом защиты агробиоценозов от сорняков является использование синтетических гербицидов. Хлорорганические гербициды - высокотоксичные агенты. Фосфорорганические гербициды, в частности фосфинотрицин и глифосат - менее токсичны, обладают системным действием, поэтому они получили широкое распространение [1].
Фосфинотрицин - это модифицированный продукт метаболизма актиномицетов Streptomyces (S. hygroscopious, S. viridichromogenus) [2]. Фосфинотрицин блокирует фермент глутаминсинтетазу, который катализирует реакцию превращения α-кетоглутаровой кислоты и аммония в глутамин, действует как конкурентный ингибитор, так как по химической структуре близок к глутамину. При ингибировании глутаминсинтетазы происходит накопление аммонийного азота и прекращается синтез глутамина. Накопления ионов аммония ведет к соответствующему изменению pH в полостях тилакоидов, что приводит к нарушению и остановке процессов фотосинтеза, а недостаток глутамина приводит к прекращению синтеза ряда аминокислот [3, 4].
Поскольку многие гербициды, в том числе и на основе фосфинотрицина, проявляют неселективное действие, они угнетают не только сорняки, но и целевые культуры, поэтому получение растений, устойчивых к действию гербицидов является актуальной задачей.
Для получения устойчивых к действию гербицидов растений путем генетической трансформации используется три подхода: 1) сверхэкспрессия белка-мишени гербицида, когда белка синтезируется больше, чем поражается гербицидом и клетка выживает; 2) изменение белка-мишени гербицида, когда вследствие мутации ослабляется способность белка связываться с гербицидом; 3) встраивание генов, которые детоксицируют гербицид.
Основным недостатком первых двух способов является накопление гербицида в растениях, что может негативно отразиться на их дальнейшем применении, например в пищевых целях. Третий способ наиболее эффективен, так как происходит инактивация гербицида до нетоксичных соединений, что является экологически безопасным.
Фосфинотрицин относится к новому классу высокоэффективных и безопасных для животных и окружающей среды гербицидов, которые ингибируют специфический путь биосинтеза аминокислот в растениях. Из них наиболее известны гербициды «Basta», «Herbiace», «Liberty», «Фозат», «Торнадо», «Алаз», «Вихрь», «Дефолт» и др.
В настоящее время получен ряд трансгенных растений, таких как хлопок, рапс, кукуруза, соя, сахарная свекла, рис, устойчивых к действию гербицидов на основе фосфинотрицина. Это обеспечивается путем переноса в растения гена bar из S. Hygroscopicus, кодирующего синтез фермента фосфинотрицинацетилтрансферазы, которая переводит фосфинотрицин в неактивную форму [5, 6].
Но использование гербицидов для борьбы с сорняками не ограничивается их применением только в отношении сельскохозяйственных травянистых культур. Они также могут применяться и для лесных древесных пород.
Несмотря на все достижения химической промышленности, потребность в древесине постоянно возрастает и, по прогнозам специалистов, она будет увеличиваться и впредь. В отличие от других видов промышленного сырья и топлива древесина является возобновляемым ресурсом. С целью сохранения природных лесов повсеместно наблюдается переход к плантационному лесоводству, которое требует использования ценных генотипов с определенными свойствами. Получение посадочного материала для таких плантаций также представляет собой определенные сложности, так как древесные породы в первые годы жизни отличаются медленным ростом и в питомниках легко угнетаются сорняками. Эта проблема может быть решена с помощью применения в лесоводстве современных методов биотехнологии - генной инженерии, а именно получения древесных растений устойчивых к действию гербицидов.
Сущность изобретения
Задачей изобретения было получение трансгенных растений березы, обладающих повышенной устойчивостью к действию гербицидов на основе фосфинотрицина.
Используемый в настоящем описании термин «растение» охватывает целые растения, предшественники и потомство растений и части растений, включая семена, побеги, стебли, листья, корни, цветки и ткани и органы, причем все они содержат нуклеотидную последовательность с SEQ ID NO: 1. Термин «растение» также охватывает клетки растений, суспензионные культуры, каллусную ткань, зародыши, меристемы, гаметофиты, спорофиты, пыльцу и микроспоры, причем все они, опять же, содержат нуклеотидную последовательность с SEQ ID NO: 1.
Поставленная задача решается путем проведения трансформации растений березы методом агробактериальной трансформации с использованием бинарного вектора, содержащего ген bar, кодирующий фосфинотрицин ацетилтрансферазу. При этом растения березы принадлежат к виду Betula pendula. Кроме того, способ получения трансгенных растений березы, обладающих повышенной устойчивостью к действию гербицидов на основе фосфинотрицина, включает в себя стадии: генетической
трансформации растительной ткани; регенерации трансформированных клеток в целое растение; экспрессии гена bar в регенерированном растении; отбора трансформированных растений, проявляющих высокую устойчивость к гербицидам на основе фосфинотрицина, по сравнению с соответствующими растениями дикого типа или нетрансформированным.
Примеры в детальном описании приводятся для генотипа березы бб31 (Betula pendula).
Однако перечень растений для использования в данном изобретении не ограничивается указанными растениями.
В качестве эксплантов для трансформации используют листья березы in vitro.
Пример 1. Подготовка растительного материала
Для трансформации растений березы используют листовые экспланты с растений in vitro. Размножение культуры березы проводят на питательной среде WPM, содержащей 0,6 мг/л БАП, 0,1 мг/л ИМК, 20 г/л сахарозы и 7 г/л агара. Компонентный состав минеральных солей питательных сред приведен в Табл. 1, состав комплекса витаминов - в Табл. 2. Растения выращивают при фотопериоде 16/8 часов, температуре 22-24°C и освещенности 3000-3500 люкс.

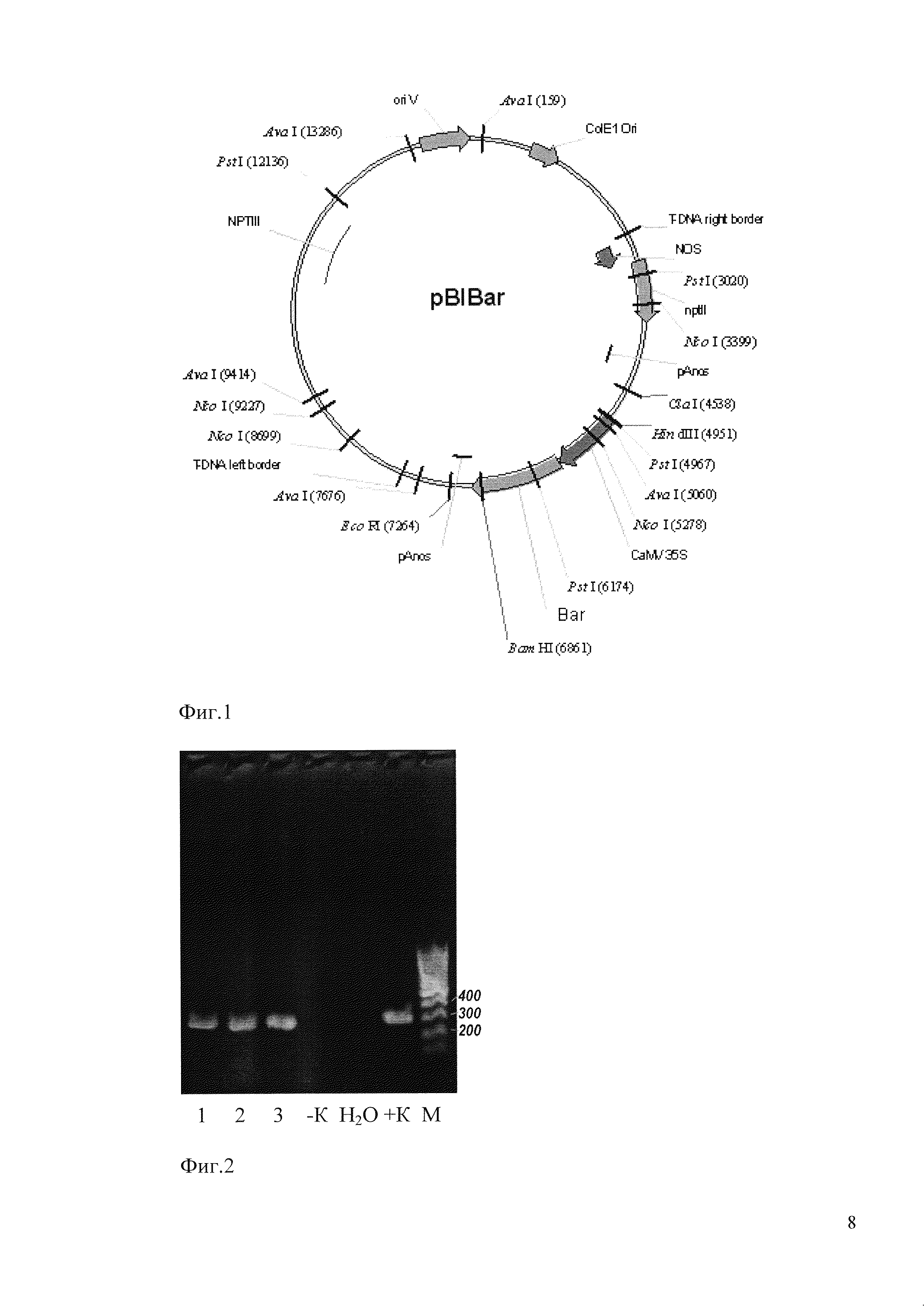
Пример 2. Подготовка штаммов бактерий A. tumefaciens СВЕ21 (рСВЕ21, pBIBAR) для трансформации растений
Для трансформации растений используют ночную культуру бактерий A. tumefaciens. Для этого 100 мкл суспензии клеток бактерий A. tumefaciens СВЕ21 (рСВЕ21, pBIBAR) (Фиг. 1) добавляют к 50 мл жидкой среды LB (Табл. 3), содержащей 50 мг/л канамицина и инкубируют в течение ночи на термостатируемом орбитальном шейкере при 28°C и 120-150 об/мин, после чего центрифугируют полученную суспензию 5 минут при 4000 об/мин, осадок промывают жидкой средой MS (Табл. 1) и повторяют центрифугирование и промывание. После осаждения клеток их заливают 50 мл жидкой среды MS и ресуспендируют.

Пример 3. Трансформация растений березы клетками бактерий А. tumefaciens СВЕ21 (рСВЕ21, pBIBAR)
Для трансформации используют листья с растений in vitro возрастом 1 месяц. У листьев удаляют черешки и верхушки (у крупных листьев - также и боковые стороны) и наносят несколько надрезов перпендикулярно центральной жилке, не доводя их до краев листа. Подготовленные таким образом экспланты помещают на 40-50 минут в суспензию агробактерий, после чего осушают стерильными фильтрами и размещают на фильтрах, расположенных в чашках Петри на поверхности среды для кокультивации, содержащей минеральные соли MS, 5 мг/л зеатина, 5 мг/л БАП, 0,2 мг/л ИМК, 30 г/л сахарозы и 7 г/л агара. В каждую чашку помещают по 10-15 эксплантов. Начиная с двух суток периодически проверяют наличие колоний агробактерий на поверхности среду под проекцией эксплантов. Кокультивацию эксплантов с агробактериями проводят в темноте при температуре 23°C в течение 2 суток. После периода кокультивации экспланты промывают в дистиллированной воде с добавлением 1 г/л цефотаксима в течение 20-30 минут и затем дважды в воде без цефотаксима. Отмытые экспланты подсушивают на фильтрах и переносят на среду для регенерации и селекции трансформантов того же состава, содержащую дополнительно 50 мг/л канамицина и 500 мг/л цефотаксима. На этой среде экспланты выдерживают в условиях 16-часового светового дня при 22-23°C с пересадкой каждые 4 недели. Регенерированные побеги пересаживают на среду для размножения, содержащую 50 мг/л канамицина и 250 мг/л цефотаксима.
Пример 4. Полимеразная цепная реакция (ПЦР) на присутствие фрагмента последовательности гена bar
Присутствие гена bar в трансгенных растениях березы подтверждают методом ПЦР с праймерами, специфичными для кодирующей области трансгенной конструкции:
1) SEQ ID NO: 2;
2) SEQ ID NO: 3.
Для экстракции геномной ДНК и березы использовался растительный материал in vitro. Из условий in vitro для растирания в жидком азоте брались кусочки листовой ткани растений. Выделение проводилось по модифицированному нами протоколу. За основу бралась стандартная методика Rogers и Bendich (1994) [7] с применением 2-кратного СТАВ-буфера:
1. 50-200 мг листовой ткани охлаждают жидким азотом и тщательно растирают в ступке до пылеобразного состояния.
2. Растертую ткань переносят в предварительно охлажденные пробирки емкостью 2 мл, добавляют 600 мкл разогретого до 65°C 2х СТАБ буфера для экстракции. Осторожно перемешивают и разбивают комки, помещают пробирки в водяную баню на 30 мин при 56°C.
3. Добавляют равный объем смеси хлороформ:изоамиловый спирт (24:1) и эмульгируют встряхиванием. Центрифугируют 1.5 мин при 13 тыс. g. Супернатант переносят в новую пробирку
4. Промывают интерфазу в исходной пробирке 100 мкл 2х СТАБ буфера для экстракции. Вновь центрифугируют, удаляют верхнюю фазу и соединяют ее с первой.
5. Добавляют 1/10 объема 10% раствора СТАБ к собранной верхней фазе и перемешивают. Повторяют экстракцию смесью хлороформ:изоамиловый спирт (24:1). Центрифугируют 1 мин при 13 тыс. g.
6. Переносят супернатант в новую пробирку и осаждают выделенную ДНК изопропанолом (0.6 объема) в течение ночи при -20°C. Осадок осаждают центрифугированием 1,5 мин при 8 тыс. g. Удаляют супернатант и подсушивают осадок.
7. Препарат ДНК растворяют в 400 мкл высокосолевого буфера ТЭ, содержащем 1М NaCl. После растворения осадка добавляют 800 мл этанола для осаждения. Оставляют на ночь при -20°C.
8. Осадок осаждают центрифугированием 2 мин при 10 тыс. об. После удаления супернатанта осадок последовательно промывают в 65% и 85% этаноле (0.5-1.0 мл) по 2 раза в течение 1 мин.
9. Сливают этанол, подсушивают осадок и обрабатывают РНКазой А растворенной в ТЭ буфере в течение 1 часа при 37°C. Добавляют к препарату равный объем смеси хлороформ:фенол (1:1), тщательно перемешивают и центрифугируют 2 мин при 8-10 тыс. g.
10. Верхнюю фазу переносят в новую пробирку, добавляют 2 объема этанола и осаждают ДНК в течение ночи при -20°C. ДНК растворяют в 50-100 мкл буфера ТЭ и определяют ОП препарата при длине волн 230, 260 и 280 нм.
Продукты ПЦР анализировали методом электрофореза. Электрофорез ДНК проводили в агарозных гелях концентрацией 1% в электрофорезной камере фирмы "Labnet". Для приготовления геля агарозу (1 г) расплавляли в 100 мл буферного раствора (электролит для электрофоретической системы) «ТВ x1», остужали до 55-60°С, добавляли 1 мкл раствора бромистого этидия (10 мг/мл) и заливали гель в собранную кассету для приготовления гелей. После застывания геля гребенку аккуратно вынимали, лунки промывали буферным раствором для электрофореза, доводили его уровень до отметки -2-3 мм над верхней поверхностью геля и приступали к нанесению в лунки геля анализируемых проб. Раствор ДНК (не более 10 мкл) смешивали с буферным раствором для нанесения проб (3 мкл) «б-Orange». Образцы наносили на гель автоматическими пипетками со сменными одноразовыми насадками.
Электрофорез проводили в 0,5х ТВЕ буфере (20 × ТВЕ буфер: 0,89 М Трис-OH, 0,89 М борная кислота, 50 мМ ЭДТА) с добавлением бромистого этидия в течение 40-60 мин при напряженности электрического поля 5-10 В/см. Промежуточный результат анализа снимали после достижения сигнальным красителем отметки  длины пробега дорожки, помещая гель на трансиллюминатор. При необходимости, продолжали электрофоретическое разделение образцов ДНК до требуемого качества. Визуализацию ДНК проводили с помощью трансиллюминатора и фотографировали в проходящем ультрафиолетовом свете.
длины пробега дорожки, помещая гель на трансиллюминатор. При необходимости, продолжали электрофоретическое разделение образцов ДНК до требуемого качества. Визуализацию ДНК проводили с помощью трансиллюминатора и фотографировали в проходящем ультрафиолетовом свете.
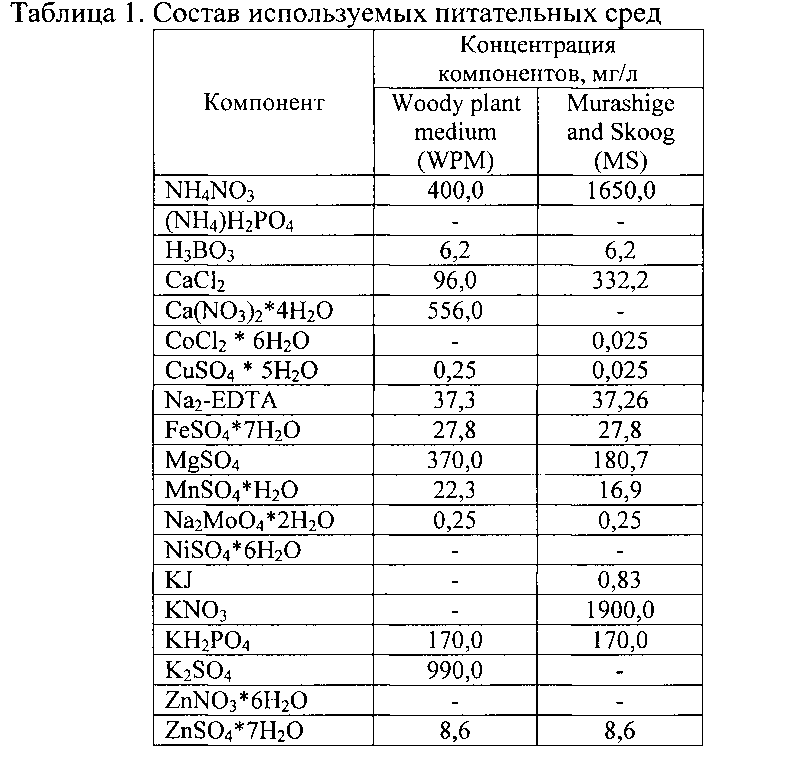
Появление продукта ПЦР (ДНК размером 310 н.п.) при использовании указанных праймеров, а также при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в ДНК исследуемых растений (Фиг. 2).
Пример 5. Адаптация и укоренения трансгенных растений березы в условиях in vivo
Укорененные в условиях in vitro растения березы высаживали в стеллажные обогреваемые теплицы в пластиковые кассеты с ячейками диаметром 40 мм. В качестве субстрата использовали пропаренную смесь торфа и песка (3:1), обогащенную 20 г комплексного минерального удобрения "Кристаллин" на 1 кг смеси. На период адаптации растений накрывали полиэтиленовой пленкой, которую снимали через один месяц.
Пример 6. Оценка устойчивости растений к фосфинотрицину
Эксперимент по оценке устойчивости линий к фосфинотрицину (РРТ) проводили на горшечных растениях. Растения были обработаны 1% гербицидом Basta (15% РРТ) в дозе, эквивалентной 5 л/га. На листьях трансгенной линии B37Barla полностью полностью отсутствовали признаки поражения (Фиг. 3).
Краткое описание фигур
Фиг. 1. Карта плазмиды pBIBAR, использованной для трансфомации растений березы.
Фиг. 2. ПЦР-анализ трансгенных растений березы, содержащих ген bar.
Обозначения: 1-3 - ДНК трансформантов березы различных линий, -К - ДНК нетрансгенного растения (отрицательный контроль), H2O - вода, +К - ДНК плазмиды pBIBAR (положительный контроль), М - маркер молекулярной массы ДНК.
Фиг. 3. Вид растений березы после обработки гербицидом, содержащим фосфинотрицин (слева - контроль, справа - трансгенная линия).
Список источников литературы
1. Афонин, А.А. Эколого-генетические риски использования химических средств защиты растений [Электрон, ресурс].
2. Murakami, Т., Anzai, H, Imai, S., Satoh, A., Nagaoka, K. and Thompson, C.J. (1986) Mol. Gen. Genet., 205, 42-50.
3. Tachibana, K., Watanabe, T., Sekizawa, Y. and Takematsu, T. (1986) J. Pesticide Sci., 11, 33-37.;
4. De Block, M. et al. (1987) EMBO J., 6, 2513-2518.
5. Comai, L., Facciotti, D., Hiatt, W.R., Thompson, G., Rose, R.E. and Stalker, D.M. (1985) Nature, 317, 741-744.
6. Shah, D., Horsch, R., Klee, H., Kishore, G., Winter, J., Tumer, N., Hironaka, C, Sanders, P., Gasser, C, Aykent, S., Siegel, N., Rogers, S.G. and Fraley, R.T. (1986) Science, 233, 478-481.
7. Rogers, S.O.; Bendish, A.J. Extraction of DNA from milligram amounts of fresh herbarium and minifield plant tissues (1985) Plant Mol. Biol., 5, 69-76.
Перечень последовательностей
SEQ ID NO: 1. Нуклеотидная последовательность гена bar:
GAATCCGGACAGAATTCCCAACCCGCCCTTCGATTTTTCTGATCATGCAGTACCCTGTCCGGCCACGAGGGGAGGCGGGATGCCGTCGGAACGTACAGAGGTGCAGGTCAGGTCGGGAGTCGAGGCCGACCTCAAAGCCCTCACCGACATCTACAACCACTATGTACGTGAGACGCCCATCACATTCGATACCGCCGCCTTCACGCCGGAAGAGCGCCGCCCTTGGCTGCTCTCCCACCCTGAAGACGGACCGCACCGGCTGATGGTTGCCACGGGCGCGGACTCACAGGAGATTCTTGGGTACGCCACCAGCAGTCCTTTCCGCGCCAAGCCCGCCTACACCACCTCCGTCGAGGTGACCGTCTACGTCGCCCCGGACGCGGCTGGCCGTGGCATCGGCACGCTCCTCTACGGCGCCCTCTTCGAGGCGCTGGCGGGCGAGGATCTCCACCGCGCCTACGCGGGCATCGCCCAGCCCAACGAAGCGTCCACGCGGCTGCATGAACGCTTCGGGTTCCGGCATGTCGGCACCTACCGGGAGGTGGGCCGCAAGTTCGGACGGTACTGGGACGTGGCCTGGTACGAGAGGGAGCTGTAGCCGTACGCCGACCAGCAGCCGTACGCCGTTCAGCCGAACTGCACCGACCGCTTCGCCAGCCCCAGCCAGAAGCCGTC
SEQ ID NO: 2. Праймер №1, специфичный для гена bar:
5′-TGCACCATCGTCAACCACTA-3′
SEQ ID NO: 3. Праймер №2, специфичный для гена bar:
5′-ACAGCGACCACGCTCTTGAA-3′.