Результат интеллектуальной деятельности: УНИВЕРСАЛЬНЫЙ ПРОМОТОР ДЛЯ ЭКСПРЕССИИ ТЕРАПЕВТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к биотехнологии, молекулярной медицине, в частности генной инженерии, к генной терапии опухолей, к искусственным ДНК-конструкциям, демонстрирующим высокую активность транскрипционного промотора человека, с которого осуществляется экспрессия расположенной ниже произвольной нуклеотидной последовательности, транскрибируемой РНК-полимеразой II.
Промоторы могут быть использованы для генной терапии онкологических заболеваний человека.
Генная терапия представляет собой одно из наиболее бурно развивающихся направлений современной молекулярной медицины. Суть метода генной терапии состоит в том, что больному человеку вводятся искусственная генетическая конструкция, которая исправляет наследственный или приобретенный генетический дефект путем рекомбинации с ДНК клеток пациента, либо обеспечивают внутри его организма временный синтез недостающих мРНК и белков. Такая конструкция должна содержать вектор-носитель (на основе искусственной плазмиды или вируса), собственно терапевтические гены, а также промотор и другие регуляторные генетические элементы, обеспечивающие необходимую экспрессию терапевтических генов. В качестве терапевтических генов используют гены токсинов, специфических белков (опухолевых супрессоров и других), пептидов, антисмысловые РНК, малые интерферирующие РНК и т.д. Часто используют различные гены, модифицирующие метаболизм клетки - таких, как тимидинкиназа, цитозиндезаминаза, пурин-нуклеотидфосфорилаза, нитроредуктаза, β-галактозидаза, цитохром Р450, дезоксицитидинкиназа, тимидинфосфорилаза и другие. При использовании генов-модификаторов метаболизма терапевтический эффект достигается дополнительным введением в клетки неактивных про-лекарств, которые под воздействием продуктов генов-модификаторов переходят в активную терапевтическую форму. В качестве про-лекарств могут выступать 6-метоксипурин арабинонуклеозид, метоксипурин арабинонуклеозид, ацикловир, ганцикловир, 1-(2′-дезокси-2′-фтор-β-D-арабинофуранозил)-5-иодурацил, 6-метилпурин-2′-дезоксирибонуклеозид, 5-фторцитозин, циклофосфамид, ифосфамид, производные нитробезамида (dinitrobenzamide mustard derivative), 1-β-D-арабинофуранозилцитозин, 5′-дезокси-5- фторуридин и другие в зависимости от использованного гена-модификатора. Средствами доставки терапевтических конструкций в организм или к отдельным тканям и органам служат плазмиды в виде чистой ДНК или в комплексе с катионными амфифильными веществами (например, с липидами в виде липосом), либо векторы на основе вирусов (например, рекомбинантных аденовирусов, аденоассоциированных вирусов, вирусов иммунодефицита HIV, FIV и других вирусов).
Настоящее изобретение представляет собой изолированный универсальный промотор гена PCNA человека, пригодный для применения в генной терапии млекопитающих, а также способ его применения.
Уровень техники
В современной биотехнологии в составе терапевтических генно-инженерных конструкций применяют различные типы промоторов: промоторы вирусов, промоторы млекопитающих (человека, мышей и других) и других животных. По наиболее важным свойствам промоторы можно разделить на тканеспецифичные, опухолеспецифичные и универсальные.
Вирусные промоторы в генной терапии
Одним из традиционно используемых промоторов для синтеза терапевтических генов в составе генно-инженерных конструкций является промотор цитомегаловируса (CMV, патенты US 5,168,062 и US 5,385,839). В частности, промотор CMV был использован для создания рекомбинантного вектора на основе аденоассоциированного вируса (AAV), экспрессирующего укороченный ген дистрофина человека (мини-дистрофин) для лечения мышечной дистрофии Дюшенна (Wang В, Li J, Xiao X. Adeno-associated virus vector carrying human minidystrophin genes effectively ameliorates muscular dystrophy in mdx mouse model. Proc Nati Acad Sci USA. 2000; 97(25); 13714-9.). Было показано, что промотор CMV в составе данного вектора обеспечивает эффективный синтез мини-дистрофина в мышечных волокнах модельных мышей, что способствует образованию дистрофин-ассоциированных белковых комплексов на плазматических мембранах и приводит к нормализации морфологии, гистологии и сократительной функции миофибрилл (Watchko J, O'Day Т, Wang В, et al. Adeno-associated virus vector-mediated minidystrophin gene therapy improves dystrophic muscle contractile function in mdx mice. Hum Gene Ther. 2002; 13(12):1451-60). В настоящее время эта генетическая конструкция прошла I стадию клинических испытаний (Bowles D, McPhee S, Li С, et al. Phase 1 gene therapy for Duchenne muscular dystrophy using a translational optimized AAV vector. Mol Ther. 2012; 20(2):443-55; Safety Study of Mini-dystrophin Gene to Treat Duchenne Muscular Dystrophy. ClinicalTrials NCT00428935).
Промотор CMV использован в работах по иммуностимуляторной генотерапии онкологических больных с помощью AdCD40L (Loskog A, Dzojic H, Vikman S, et al. Adenovirus CD40 ligand gene therapy counteracts immune escape mechanisms in the tumor microenvironment. J Immunol 2004; 172:7200-5). Данная конструкция представляет собой рекомбинантный аденовирус, лишенный генов Е1/Е3 и обеспечивающий экспрессию человеческого гена CD40L под промотором CMV. При инъекции данного вируса в опухоль вирус инфицирует опухолевые клетки и доставляет в них ген CD40L, при этом сам вирус разрушается, а ген экспрессируется. Синтезируемый белок CD40L связывается с мембраной клеток, где взаимодействует с клетками, несущими рецептор CD40L (например, дендритными клетками). Это взаимодействие активирует Т-клеточный противоопухолевый ответ. Показана эффективность такого подхода на моделях рака мочевого пузыря (Loskog A, Fransson M, Totterman Т. AdCD40L gene therapy counteracts T regulatory cells and cures aggressive tumors in an orthotopic bladder cancer model. Clin Cancer Res 2005; 11 (24 Pt 1):8816-21), рака простаты (Dzojic H, Loskog A, Tötterman TH, Essand M. Adenovirus-mediated CD40 ligand therapy induces tumor cell apoptosis and systemic immunity in the TRAMP-C2 mouse prostate cancer model. Prostate. 2006; 66(8):831-8), меланомы (von Euler H, Sadeghi A, Carisson B, et al. Efficient adenovector CD40 ligand immunotherapy of canine malignant melanoma. J Immunother. 2008; 31(4):377-84; Westberg S, Sadeghi A, Svensson E, et al., Treatment efficacy and immune stimulation by AdCD40L gene therapy of spontaneous canine malignant melanoma. J Immunother 2013; 36(6):350-8), а также мастоцитомы и колоректального рака (Loskog A, T..otterman TH. CD40L-amultipotentmolecule for tumor therapy. EndocrMetab Immune Disord Drug Targets. 2007; 7:23-28). Метод лечения больных раком мочевого пузыря и диссеминированной злокачественной меланомой проходит клинические испытания в фазе I/II (Malmstrom PU, Loskog AS, Lindqvist CA, et al. AdCD40L immunogene therapy for bladder carcinoma - the first phase Vila trial. Clin Cancer Res. 2010; 16(12):3279-87; Phase I/IIa AdCD40L Immunogene Therapy for Malignant Melanoma. ClinicalTrials NCT01455259).
Предложены и другие промоторы вирусного происхождения для применения в генной терапии. Известно использование промотора гена gD вируса простого герпеса HSV для экспрессии гена гранулоцито-макрофагального колониестимулирующего фактора GM-CSF в составе вектора на основе HSV-1 и промотора gH для экспрессии интерлейкина-2 IL-2 в векторе на основе HSV-2 (Boursnell M.E.G., Inglis S.C. Methods of gene therapy using herpes viral vectors expressing GM-CSF. US 6287557 B1). Промотор Р4 вируса MVM был использован для экспрессии ДНК-связывающего домена (DBD) поли-(АДФ)-рибоза полимеразы (PARP) в составе вирусных векторов для повышения чувствительности опухолевых клеток к радиационному облучению в результате конкуренции DBD с клеточной PARP за поврежденные участки в ДНК (Bürkle A., zur Hausen Н., Jan-Heiner К. Vectors and viruses for use in gene therapy. US 6335009 B1).
В генно-инженерных терапевтических конструкциях используют и другие промоторы -например, промоторы вирусов SV40, папилломы, аденовирусов, вируса иммунодефицита человека HIV, вируса саркомы Раусса RSV, длинные концевые повторы (LTR) вируса лейкемии мышей Молони и других ретровирусов. Эти промоторы являются конститутивными, то есть проявляют активность в различных тканях. Однако промотор CMV изучен лучше других, и некоторые генно-инженерные конструкции с ним доведены до клинических испытаний (Safety Study of Mini-dystrophin Gene to Treat Duchenne Muscular Dystrophy. ClinicalTrials NCT00428935; Phase I/IIa AdCD40L Immunogene Therapy for Malignant Melanoma. ClinicalTrials NCT01455259).
С точки зрения генной терапии вирусные промоторы имеют существенный недостаток -как правило, они быстро инактивируются в тканях человека в результате метилирования (Brooks AR, Harkins RN, Wang P, et al. Transcriptional silencing is associated with extensive methylation of the CMV promoter following adenoviral gene delivery to muscle. J Gene Med. 2004 Apr;6(4): 395-404). По-видимому, это является одним из механизмов противовирусной защиты человека. В некоторых случаях выявлен интенсивный иммунологический ответ на трансгены под управлением CMV (Cordier L, Gao GP, Hack AA,et aLMuscle-specific promoters may be necessary for adeno-associated virus-mediated gene transfer in the treatment of muscular dystrophies. Hum Gene Ther. 2001;12 (2): 205-15.) Кроме того, промотор CMV не является универсальным. При получении трансгенных мышей с конструкцией, содержащей промотор CMV, экспрессия трансгена не была выявлена в легких, печени, поджелудочной железе и мышечной ткани (Е V Schmidt, G Christoph, R Zeller, and P Leder. The cytomegalovirus enhancer: a pan-active control element in transgenic mice. Mol Cell Biol. 1990 August; 10(8): 4406-4411). Поэтому в настоящее время идет активный поиск универсальных человеческих промоторов для использования их в составе терапевтических генно-инженерных конструкций.
Тканеспецифичные и опухолеспецифичные промоторы человека в генной терапии
Промоторы генов, экспрессирующихся в специфических тканях человека, применяют для лечения заболеваний отдельных тканей или органов. Найдены также опухолеспецифичные промоторы, обеспечивающие селективную экспрессию терапевтических трансгенов в клетках опухолей, но неактивные в нормальных клетках.
Известно применение промоторов генов, экспрессирующихся в мышечной ткани, для лечения недержания мочи, вызванного мышечной недостаточностью (Coleman М. Treatment for urinary incontinence using gene therapy techniques. WO 1998033529 A1). Авторы предложили использовать промотор α-актина скелетных мышц или промотор γ-актина из гладкой мускулатуры для экспрессии генов, усиливающих тонус и иннервацию мышц (например, гена IGF-1), в составе плазмидного вектора. Была продемонстрирована преимущественная экспрессия гена IGF-I под управлением данных промоторов в мышечной ткани трансгенных мышей.
Промотор мышечной креатининкиназы был использован для экспрессии гамма-саркогликана у мышей с делецией гена gsg(-/-) и синдромом мышечной дистрофии. Авторы использовали вектор на основе аденоассоциированного вируса (Cordier L, Gao GP, Hack AA, et al. Muscle-specific promoters may be necessary for adeno-associated virus-mediated gene transfer in the treatment of muscular dystrophies. Hum Gene Ther. 2001; 12 (2): 205-15.). Данная конструкция вызывала интенсивный синтез гамма-саркогликана в мышечных волокнах при внутримышечном введении. Авторы отмечали, что при использовании промотора CMV экспрессия гамма-саркогликана была слабее, но вызывала у мышей сильный клеточный и гуморальный иммунный ответ на трансген.
Для экспрессии трансгенов в нейрональной ткани использовали промотор бета-цепи тромбоцитарного фактора роста PDGF в сочетании с энхансером немедленно-ранних генов CMV в составе вектора на основе плазмиды или вируса (Wang S., Liu В., Wang X._Promoter construct for gene expression in neuronal cells. US 7341847 B2).
Известен целый ряд промоторов, специфичных для эндотелия сосудов (промоторы генов FLT-1, молекулы клеточной адгезии-2, ангиопоэтина-2, тромбоцитарной молекулы адгезии клеток эндотелия-1, эндоглина. angiopoietin-2, platelet endothelial cell adhesion molecule 1 and endoglin и другие). Эти промоторы предложено использовать для лечения сердечно-сосудистых заболеваний. В частности, было показано, что комбинация регуляторных элементов промотора гена LOX-1 и энхансера гена Tie2 мышей с интроном обусловливает достаточно высокую экспрессию трансгена в сосудах грызунов, хотя эта экспрессия вдвое ниже, чем при использовании промотора CMV (White SJ, Papadakis ED, Rogers CA, et al. In vitro and in vivo analysis of expression cassettes designed for vascular gene transfer. Gene Ther. 200815 (5): 340-346).
Для генной терапии гепатомы было предложено использовать промоторы генов альбумина и альфа-протеина - белков, синтезируемых в печени (Kuriyama, S., Yoshikawa, М., Ishizaka, S., et al. A. potential approach for gene therapy targeting hepatoma using a liver-specific promoter on a retroviral vector. Cell Struct. Punct., 16: 503-510, 1991). Авторы показали интенсивную экспрессию маркерного гена β-галактозидазы под промотором гена альбумина в клетках перевиваемой гепатомы мышей при инъекции экспрессирующего вектора в опухоль. Экспрессирующий вектор был сконструирован на основе ретровируса мышей. Он обладал сродством к клеткам гепатомы и делящимся гепатоцитам при регенерации и не заражал покоящиеся гепатоциты.
Для селективного уничтожения клеток глиомы был выбран ряд промоторов генов, интенсивно экспрессирующихся в тканях мозга (Shimizu, К. Selective gene therapy of malignant glioma using brain-specific promoters; its efficacy and basic investigation. Nippon Rinsbo, 52: 3053-3058, 1994). Ген белка костного морфогенеза МВР наиболее активно экспрессировался в клетках глиомы мышей. С промотором МВР была создана конструкция на основе ретровирусного вектора, экспрессирующая ген HSVtk. Авторы показали регрессию глиомы мышей при лечении их данной конструкцией в сочетании с ганцикловиром - веществом, которое под воздействием тимидинкиназы вируса простого герпеса фосфорилируется и становится токсичным для клеток (Moolten, F.L. Tumor chemosensitivity conferred by inserted herpes thymidine kinase genes; paradigm for a prospective cancer control strategy. Cancer Res., 46: 5276-5281, 1986). Благодаря так называемому «эффекту свидетеля», для полного уничтожения глиомы было достаточно трансдуцирование вектором всего 25% клеток опухоли. «Эффект свидетеля» (″bystander effect″) проявляется при использовании терапевтических генов, продуцирующих токсичные вещества (так называемых генов-убийц - HSVtk, цитозиндезаминазы дрожжей FCY1 и других). Он заключается в том, что при гибели клеток, в которых продуцируются токсины, гибнут также и соседние непродуцирующие клетки (Freeman S.M., Abboud C.N., Whartenby К.А. et al. The ″bystander effect″: tumor regression when a fraction of the tumor mass is genetically modified. Cancer Res 1993; 53: 5274-83.)
Промотор гена тирозиназы в составе интегрирующего ретровирусного вектора был использован для селективной экспрессии HSVtk в клетках меланомы мышей (Vile, R.G., Nelson, J.A., Castleden, S., et al. Systemic gene therapy of murine melanoma using tissue specific expression of the HSVtk gene involves an immune component. Cancer Res., 54:6228-6234, 1994). Авторы показали выраженное уменьшение количества метастазов меланомы в легких мышей под действием данной конструкции в сочетании с ганцикловиром.
Промотор гена СЕА (раково-эмбрионального антигена) был использован в рекомбинантном аденовирусном векторе для экспрессии HSVtk в клетках карциномы желудка MKN28, MKN45 и MKN1 (Tariaka Т, Kanai F, Okabe S, et al. Adenovirus-mediated prodrug gene therapy for carcinoembryonic antigen-producing human gastric carcinoma cells in vitro. Cancer Res. 1996; 46: 1341-1345). Токсический эффект данной конструкции в сочетании с ганцикловиром проявлялся на чувствительных клетках MKN28 и MKN45, причем для гибели клеток MKN45 было достаточно присутствия в культуре всего 20% зараженных клеток («эффект свидетеля»). Авторы отмечали, что клетки MKN1 и HeLa остались устойчивыми к ганцикловиру несмотря на заражение рекомбинантным вектором.
Промотор остеокальцина был использован для экспрессии гена тимидинкиназы вируса простого герпеса в составе экспрессирующего вектора на основе рекомбинантного аденовируса. На клетках и на модельных животных показана эффективность и высокая селективность лечения данной конструкцией в сочетании с ацикловиром остеосаркомы и ряда других опухолей (опухолей мозга, меланомы и рака простаты), метастазирующих в костную ткань. Этот же метод может быть эффективным для лечения заболеваний неопухолевой природы -доброкачественной гипертрофии простаты и артериосклероза (Chung L.W.K., Као С, Sikes R.A. et al. Osteocalcin promoter-based toxic gene therapy. WO 1998031376 A9).
Промотор гена пластина может быть использован для экспрессии различных терапевтических генов, в частности, генов-модификаторов метаболизма клетки (тимидинкиназа, цитозиндезаминаза и другие). Терапевтический эффект достигается при дополнительном введении в клетки неактивных про-лекарств (6-метоксипурин арабинонуклеозид, метоксипурин арабинонуклеозид и т.д.), которые под воздействием продуктов генов-модификаторов переходят в активную терапевтическую форму. Показано, что промотор пластина в составе аденовирусного вектора способен экспрессировать гетерологичные гены, в частности, цитозиндезаминазу, в клеточных и органных опухолевых культурах и в перевиваемых на мышах опухолях карциномы яичника и убивать до 95% опухолевых клеток (Chung I., Deisseroth А.Р., Lixin Zhang L. Plastin promoter directed gene therapy. WO 2000033655 A1).
Известны примеры, демонстрирующие способность промотора гена теломеразы hTERT экспрессировать гетерологичные гены - маркерные (щелочную фосфатазу или бета-галактозидазу), и терапевтические - например, HSVtk. Конструкции, экспрессирующие HSVtk, в сочетании с ганцикловиром вызывают эффективную гибель опухолевых клеток. Промотор hTERT может быть использован и для создания онколитических вирусов, которые реплицируются и лизируют преимущественно опухолевые клетки, в которых активна теломераза (Morin G.B., Lichtsteiner S.P., Vasserot A.P., et al. Telomerase promoter driving expression of therapeutic gene sequences. US 6777203).
Предложено использовать промоторы теломеразы и циклина А человека для экспрессии как одиночных, так и сдвоенных терапевтических генов, при лечении онкологических заболеваний, в частности, в сочетании с радиационной терапией (Kandolf R., Kuepper J. -H., Meyer R., Meyer-Ficca M. Tumour-specific vector for gene therapy. WO 2001025441 A2). Синтез терапевтических генов может осуществляться опосредованно: терапевтические гены встраиваются в вектор под промотор РНК-полимеразы бактериофага Т7, а Т7-РНК-полимераза встраивается в тот же или другой вектор под промотор теломеразы или циклина А. За счет промоторов теломеразы и циклина А обеспечивается селективная транскрипция в клетках опухоли, а РНК-полимераза Т7 обеспечивает эффективную транскрипцию терапевтических генов. В качестве терапевтических генов, синтезируемых с указанных промоторов, могут выступать гены цитозиндезаминазы, HSVtk, ДНК-связывающий домен поли-(АДФ-рибоза)-полимеразы (PARP), цитотоксичные протеазы 2А и 3С пикорнавирусов.
Кроме перечисленных промоторов, в экспериментальных работах исследовали целый ряд опухолеспецифичных промоторов и регуляторных элементов: тканеспецифичные промоторы альфафетопротеина, раковоэмбрионального антигена, хромогранина, а также опухолеспецифичные промоторы циклооксигеназы, Ki-67, PEG-3, регуляторные элементы E2F RE, Oct 3/4 и другие (Dorer D.E., Nettelbeck D.M. Targeting cancer by transcriptional control in cancer gene therapy and viral oncolysis. Advanced Drug Delivery Reviews 61 (2009) 554-571). Хотя природные промоторы человека, обладающие тканевой или раковой специфичностью, обладают более продолжительным действием, чем вирусные, их общим недостатком является низкий уровень экспрессии гетерологичных генов (Yew N.S., Wysokenski D.M., Wang К.Х., et al. Optimization of plasmid vectors for high-level expression in lung epithelial cells. Human Gene Therapy; 1997; 8: 575-584), а также ограниченная тканеспецифичностью область применения. Поэтому в настоящее время идет активный поиск промоторов гена человека, не обладающих тканевой специфичностью - универсальных конститутивных промоторов, а также универсальных промоторов, индуцируемых дополнительными факторами.
Универсальные промоторы человека, применяемые в генной терапии
Для применении в генной терапии различных заболеваний респираторного тракта (муковисцидоз, астма, эмфизема, отек легких, рак легкого) предложено использовать генно-инженерные конструкции с промотором убиквитина - гена, активно экспрессирующегося во многих тканях, в том числе, легких (Charles H.S. Ubiquitin promoter in vectors for gene therapy in respiratory tract. WO 2001091800 A1; Johansen Т.Е. Expression vectors and methods for in vivo expression of therapeutic polypeptides. WO 1998032869 A1). В модельных экспериментах на лабораторных животных показано, что экспрессия трансгена люциферазы под управлением промотора CMV в составе экспрессирующей плазмиды полностью прекращается на пятый-седьмой день, а под управлением промотора убиквитина может длиться от 40 до 182 дней (Yew N.S., Wysokenski D.M., Wang К.Х., et al. Optimization of plasmid vectors for high-level expression in lung epithelial cells. Human Gene Therapy; 1997; 8: 575-584; Gazdhar A., Bilici M., Pierog J., et al. In vivo electroporation and ubiquitin promoter-a protocol for sustained gene expression in the lung. J Gene Med. 2006 Jul;8 (7): 910-8). Токсичность препаратов в экспериментах не выявлена.
Для использования в генной терапии могут быть использованы промоторы генов, активируемых стрессом (в частности, hsp-70). Под промотором hsp-70 способны экспрессироваться гены GATA-6 и ген Fas-лиганда человека в составе репликационно-дефектного аденовируса. Применение этих генно-инженерных конструкций для лечения крыс с экспериментально вызванными глиомами вызывает заметное увеличение продолжительности жизни животных (Bromley P. Stress promoter control of therapeutic genes in gene therapy: compositions and methods. ЕР 1119618 A2).
Известно использование промотора гена EGR-1, активируемого в ответ на радиационное облучение и лекарственные препараты, повреждающие ДНК (Gupta V., Kufe D.W., Mauceri, Н. Et al. Chemotherapeutic induction of egr-1 promoter activity in gene therapy. EP 1390075 B1). Авторы предложили использовать конструкции с данным промотором в сочетании с радиацией или агентами, вызывающими образование свободных радикалов, для лечения опухолей. В качестве терапевтического гена могут быть использованы индукторы апоптоза, гены-супрессоры опухолей, а также ферменты, токсины, цитокины и т.д. Авторы продемонстрировали эффективность данного подхода на ксенографтах - опухолях, образованных клетками аденокарциномы пищевода человека Seg-1, инъецированных в бестимусных мышей. При лечении мышей аденовирусным вектором, экспрессирующим ген TNF-α (ген фактора некроза опухолей альфа) под управлением промотора EGR-1, в сочетании с цисплатином наблюдалась индукция TNF-α в клетках ксенографтов и более выраженная регрессия опухолей, чем при лечении одним цисплатином.
Известно применение промотора лейкосиалина для экспрессии гетерологичных генов (цитозиндезаминазы) (Fukuda М., Kudo S., Xu A._Expression vector with non-viral promoter. WO 995028490 A1). Хотя ген лейкосиалина преимущественно экспрессируется в клетках крови, его промотор активен также в клетках эпителиоидной карциномы человека HeLa и клетках яичников китайских хомячков СНО, что позволяет считать данный промотор универсальным.
В целом, количество известных универсальных конститутивных промоторов, применяемых в генной терапии или испытываемых в генно-терапевтических конструкциях, значительно меньше, чем тканеспецифичных или опухолеспецифичных промоторов. В то же время, универсальные промоторы не являются полностью универсальными, и проявляют некоторую тканевую специфичность. К примеру, уровень экспрессии гена убиквитина С в поджелудочной железе и хрящевой ткани различается почти в 300 раз, а уровни экспрессии hsp-70 в лимфобластах и клетках тимуса - в 30 раз (Zhang, Y., S. М. Luoh, et al. (2007). GeneHub-GEPIS: digital expression profiling for normal and cancer tissues based on an integrated gene database. Nucleic Acids Res 35(Web Server issue): W152-158.), что определяется, в частности, различной активностью их промоторов в этих тканях. Поэтому необходим поиск новых универсальных конститутивных промоторов, которые перекрывали бы спектры экспрессии друг друга.
Комбинации промоторов и регуляторных элементов в генной терапии
Кроме индивидуальных промоторов, в генной терапии применяют комбинации промоторов с другими промоторами или элементами регуляции транскрипции. Известна комбинация регуляторных элементов промотора гена LOX-1 и энхансера гена Tie2 мышей с интроном, которая обусловливает достаточно высокую экспрессию трансгена в сосудах грызунов, хотя эта экспрессия вдвое ниже, чем при использовании промотора CMV (White SJ, Papadakis ED, Rogers CA, et al. In vitro and in vivo analysis of expression cassettes designed for vascular gene transfer. Gene Ther. 200815 (5): 340-346).
Известен комбинированный промотор, состоящий из модифицированного промотора гена BIRC5 и промотора гена hTERT человека (Алексеенко И.В., Виноградова Т.В., Демидюк И.В., и др. Многопрофильный промотор, экспрессирующий вектор и способ избирательного убийства раковых клеток с их использованием. RU 2476596). Данный промотор был использован для создания вектора, специфически экспрессирующего ген HSVtk в опухолевых клетках.
Промотор гена PCNA
Ген PCNA {proliferating cell nuclear antigen) кодирует ядерный антиген пролиферирующих клеток и представляет собой один из ключевых участников процесса репликации. Белок PCNA является вспомогательным фактором репарационной ДНК-полимеразы дельта и образует с ней стабильный комплекс, а при определенных условиях стимулирует и активность ДНК-полимеразы эпсилон. Ген PCNA экспрессируется в основном в тканях, в которых присутствуют интенсивно делящиеся клетки (Zhang, Y., S. М. Luoh, et al. (2007). GeneHub-GEPIS: digital expression profiling for normal and cancer tissues based on an integrated gene database. Nucleic Acids Res 35(Web Server issue): W152-158). Белок PCNA - один из самых широко распространенных и общепризнанных маркеров раковых клеток. Он в значительном количестве присутствует практически во всех опухолевых клетках (Kelman Z. PCNA: structure, functions and interactions. Oncogene; 1997; 14, 629-640). Регуляторные элементы, обусловливающие тканевую и опухолевую специфичность экспрессии гена PCNA, находится в интронах (Rizzo M.G.,, Ottavio L., Travali S., et al. The promoter of the Human Proliferating Cell Nuclear Antigen (PCNA) gene is bidirectional. 1990. Exp Cell Research, 1990, 188: 286-293 (1990); Lee J.Y., Khan A.A., Min H., et al. Identification and characterization of a noncoding RNA at the mouse PCNA locus. Mol. Cells, 2012, 33, 111-116).
Наиболее близким аналогом предлагаемого изобретения, конструкции с которым уже дошли до стадии клинических испытаний, является промотор цитомегаловируса (CMV). К недостаткам промотора CMV с точки зрения генной терапии относятся непродолжительное время активности в клетках человека по сравнению с человеческими промоторами, склонность к провоцированию иммунного ответа на экспрессируемый трансген и ограничения по набору тканей, в которых промотор активен (Yew N.S., Wysokenski D.M., Wang К.Х., et al. Optimization of plasmid vectors for high-level expression in lung epithelial cells. Human Gene Therapy; 1997; 8: 575-584; Brooks AR, Harkins RN, Wang P, et al. Transcriptional silencing is associated with extensive methylation of the CMV promoter following adenoviral gene delivery to muscle. J Gene Med. 2004 Apr; 6 (4): 395-404; (Cordier L, Gao GP, Hack AA, et al. Muscle-specific promoters may be necessary for adeno-associated virus-mediated gene transfer in the treatment of muscular dystrophies. Hum Gene Ther. 2001;12 (2): 205-15.); E V Schmidt, G Christoph, R Zeller, and P Leder. The cytomegalovirus enhancer: a pan-active control element in transgenic mice. Mol Cell Biol. 1990 August; 10 (8): 4406-4411). Настоящее изобретение решает задачу экспрессии произвольных последовательностей в клетках млекопитающих, что может быть использовано в генной терапии млекопитающих. В качестве экспрессируемых (транскрибируемых) последовательностей могут выступать различные гены терапевтических белков или пептидов, антигенов, антисмысловые РНК, рибозимы и т.д. С помощью генных конструкций, содержащих конститутивные промоторы, в клетках млекопитающих могут синтезироваться гены различных организмов, которые могут быть использованы для терапии различных, в том числе онкологических, заболеваний человека (Kale V, Chen М. Gene-directed enzyme prodrug therapy. AAPS J. 2015 Jan;17 (1):102-10. doi: 10.1208 / s 12248-014-9675-7. Epub 2014 Oct 23.).
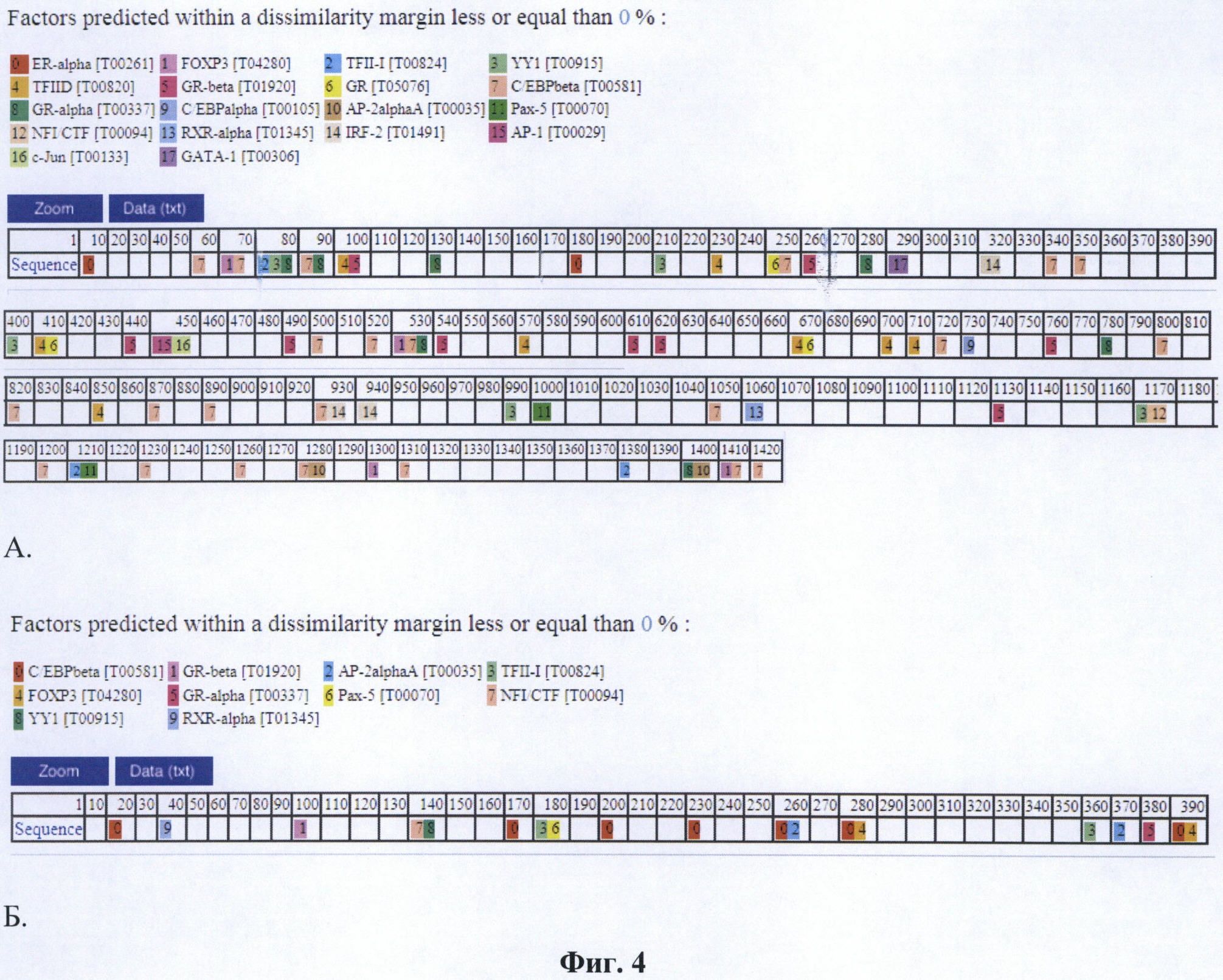
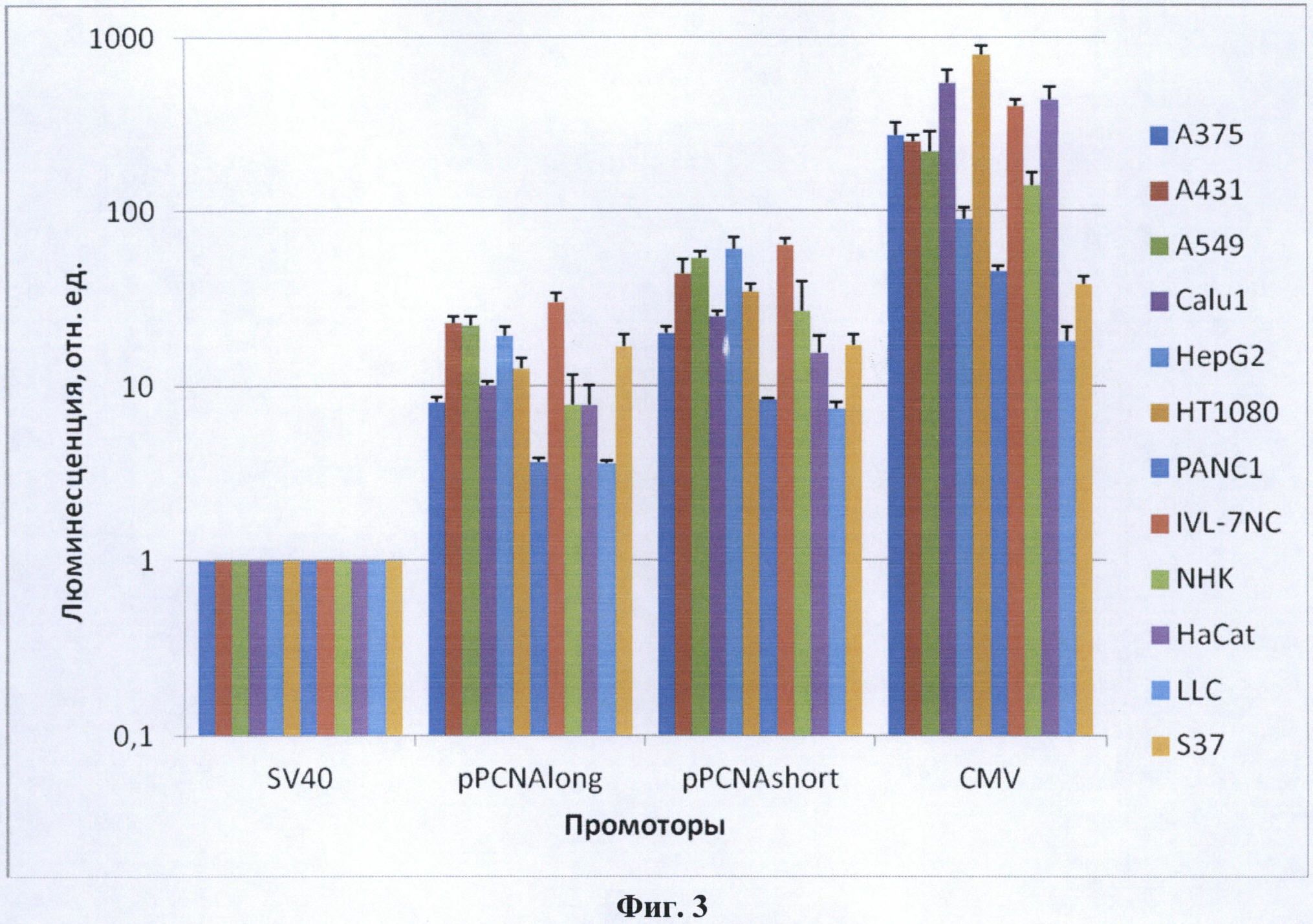
Предметом данного изобретения является изолированный промотор гена PCNA в двух формах - длинной (pPCNAlong, 1416 нуклеотидов, SEQ NO: 1) и короткой (pPCNAshort, 389 пар нуклеотидов, SEQ NO: 2), а также способ его применения. Изолированный промотор гена PCNA является универсальным промотором, пригодным для создания терапевтических генно-инженерных конструкций для применения в генной терапии млекопитающих. Промотор PCNA может использоваться как индивидуально, так и в сочетании с другими элементами регуляции транскрипции, которые могут придавать ему свойства тканеспецифичности или индуцибельности. Обе формы промотора способны обеспечивать относительно высокий уровень экспрессии гетерологичной нуклеотидной последовательности в широком спектре клеток млекопитающих, происходящих из различных опухолевых и нормальных тканей (Фиг. 3). Длинная форма промотора pPCNAlong обеспечивает экспрессию на уровне около 5% от промотора CMV, при этом он примерно в 10 раз активнее, чем промотор SV40 (Фиг. 3), что является высоким показателем для изолированных промоторов человека. Промотор pPCNAlong содержит более полный набор регуляторных элементов по сравнению с короткой формой промотора (Фиг. 4). Это обстоятельство важно для генной терапии с точки зрения обеспечения конститутивной активности промотора в различных тканях. Короткая форма промотора pPCNAshort обеспечивает экспрессию на уровне около 10% от промотора CMV, при этом она примерно в 30 раз активнее, чем SV40 (Фиг. 3). Промотор pPCNAshort за счет меньшего размера удобен для клонирования в некоторых генно-инженерных векторах, чувствительных к размеру инородных вставок ДНК, а также позволяет использовать в таких векторах более протяженные экспрессирующиеся нуклеотидные последовательности. В настоящее время промотор PCNA в генной терапии человека не используется.
На основе последовательности промоторов SEQ NO: 1 и SEQ NO: 2 могут быть созданы плазмидные, вирусные или иные векторные конструкции для экспрессии терапевтических генов в клетках млекопитающих. При этом размер промотора может быть изменен, а нуклеотидная последовательность промотора может содержать другие генетические (в том числе регуляторные) элементы, обеспечивающие повышение активности промотора.
Полученные конструкции могут быть использованы в качестве основы фармакологических композиций для генной терапии различных заболеваний млекопитающих.
Технический результат изобретения
Техническим результатом изобретения являются универсальные промоторы SEQ NO: 1 и SEQ NO: 2, получаемые с использованием набора праймеров SEQ NO: 3, SEQ NO: 4, SEQ NO: 5, с охарактеризованными свойствами, которые имеют определенный уровень активности в опухолевых и нормальных клетках млекопитающих различного тканевого происхождения и пригодны для экспрессии терапевтических генов в клетках млекопитающих, а также экспрессионные кассеты, векторы, фрагменты ДНК, фармацевтические композиции и способ лечения, включающие использование промоторов SEQ NO: 1 и SEQ NO: 2.
Краткое описание чертежей
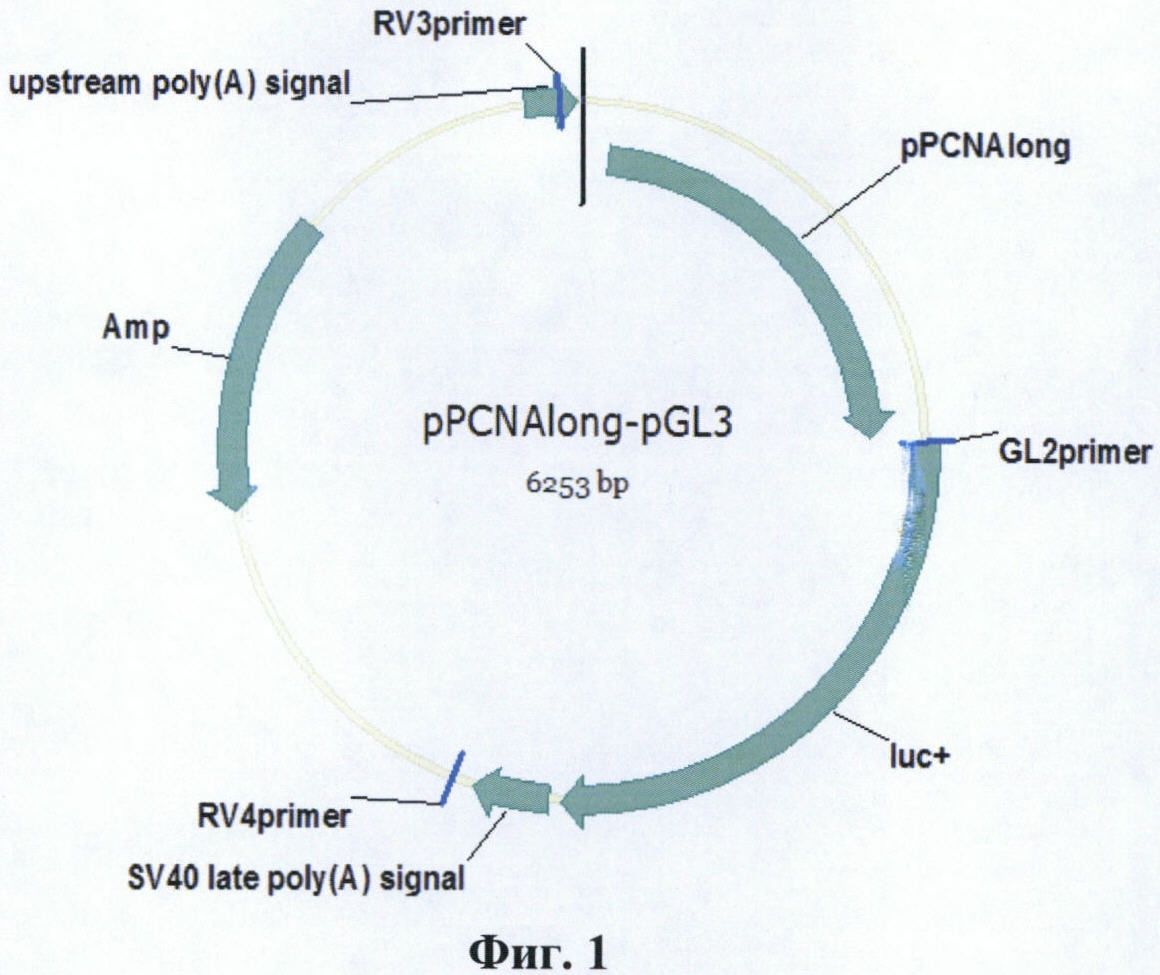
Фиг. 1. Карта плазмиды pPCNAlong-pGL3.
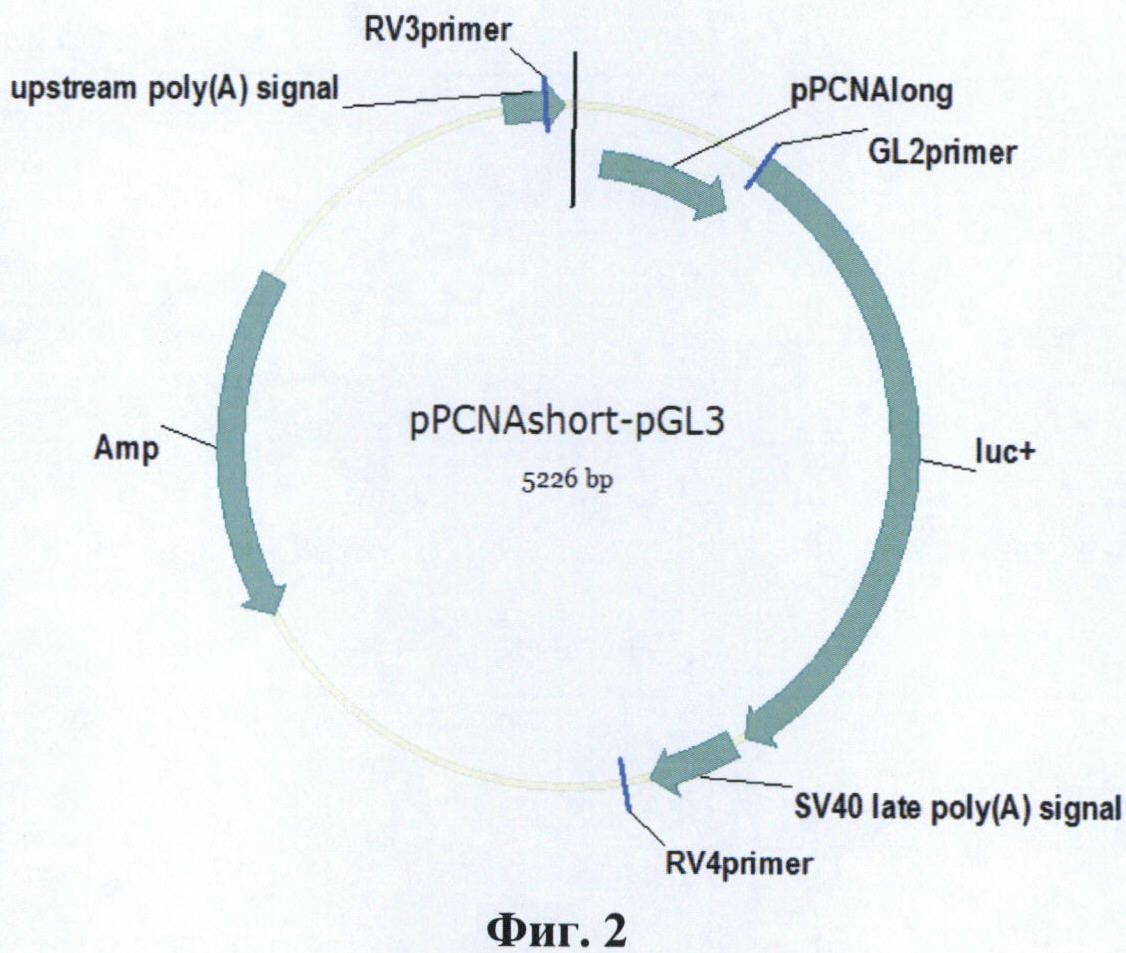
Фиг. 2. Карта плазмиды pPCNAshort-pGL3.
Фиг. 3. Хемилюминесценция лизатов клеток, трансфицированных плазмидами pGL3 Promoter Vector (SV40, величина принята за 1), pPCNAlong-pGL3 (pPCNAlong), pPCNAshort-pGL3 (pPCNAshort) и pGL3-CMV Pr/Enh (CMV). В логарифмическом масштабе представлено среднее значение из трех или более трансфекций и стандартная ошибка среднего (SEM). Уровень хемилюминесценции клеточного лизата отражает относительную активность промотора.
Фиг. 4. Сайты связывания факторов транскрипции в промоторах pPCNAlong (А) и pPCNAshort (Б). Анализ с помощью AlgGen PROMO 3.0.2 (http://alggen.lsi.upc.edu/)
Примеры
Приведенные ниже примеры предназначены исключительно для иллюстрации отдельных предпочтительных воплощений, но не должны рассматриваться в качестве ограничивающих объем настоящего изобретения.
Изобретение иллюстрируют следующие примеры.
Пример 1. Клонирование длинной формы промотора PCNA из генома человека
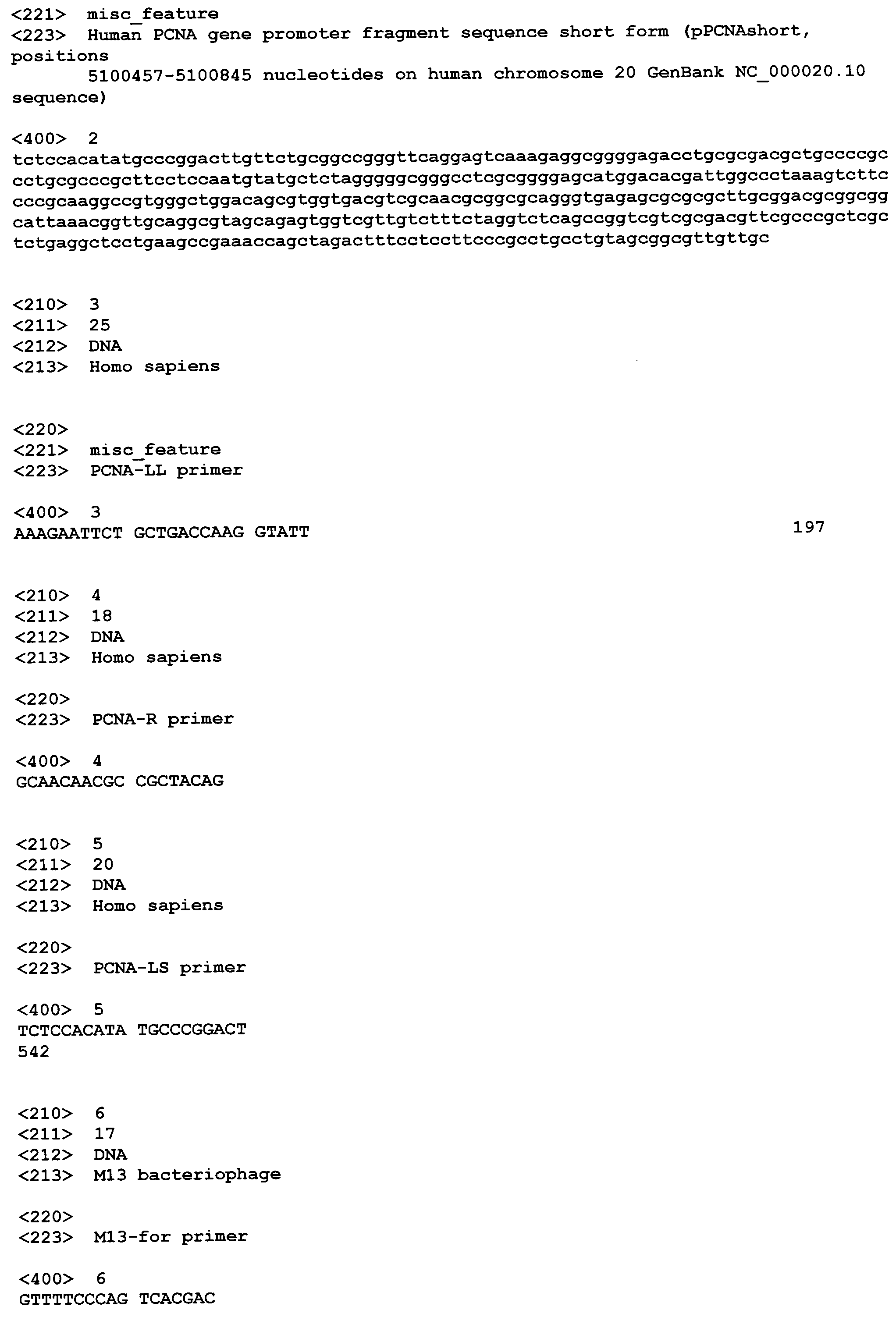
Длинную форму конститутивного промотора PCNA (pPCNAlong) амплифицируют методом ПЦР с использованием праймеров PCNA-LL (SEQ NO: 3; AAAGAATTCTGCTGACCAAGGTATT) и PCNA-R (SEQ NO: 4; GCAACAACGCCGCTACAG). Матрицей для амплификации служит геномная ДНК человека. Амплификацию фрагмента ДНК длиной 1420 п. о. проводят в течение 23 циклов с использованием ДНК-полимеразы Taq при температуре отжига праймеров 62°C. После прохождения ПЦР реакционную смесь лигируют с вектором pAL-TA, и полученной лигазной смесью трансформируют клетки E. coli штамма DH5α с использованием принципа ТА-клонирования. Плазмиды, выделенные из индивидуальных бактериальных клонов, проверяют на наличие вставки pPCNAlong методом ПЦР с праймерами M13-For (SEQ NO: 6; GTTTTCCCAGTCACGAC) и PCNA-R (SEQ NO: 4; GCAACAACGCCGCTACAG) при температуре отжига 56°C в течение 20 циклов. Среди проанализированных плазмид выбирают плазмиду со вставкой pPCNAlong-pAL-TA, не содержащую нуклеотидных замен.
Пример 2. Конструирование экспрессионного вектора на основе длинной формы промотора pPCNAlong
Конститутивный промотор гена PCNA человека (pPCNAlong) переклонируют в плазмиду pGL3 Basic Vector (Promega, США), несущую репортерный ген люциферазы Photinus pyralis. Для этого плазмиду pPCNAlong-pAL-TA обрабатывают ферментом рестрикции EcoRI, очищают электрофорезом в агарозном геле фрагмент ДНК длиной 1431 п. о. с промотором PCNA и обратывают его фрагментом Кленова. Затем полученный промотор гена PCNA человека лигируют с вектором pGL3 Basic Vector, предварительно линеаризованным рестриктазой NcoI и обработанным большой субъединицей ДНК полимеразы I E. coli. Полученной лигазной смесью трансформируют клетки E.coli штамма DH5α и отбирают клоны со вставкой в прямой ориентации. Таким образом получают плазмиду pPCNAlong-pGL3, несущую ген люциферазы P. pyralis под контролем промотора pPCNAlong размером 1416 п. о (Фиг. 1). На хромосоме 20 человека (NC_000020.10) промотор pPCNAlong имеет координаты 5100457-5101872. Плазмиду pPCNAlong-pGL3 получают в препаративных количествах по П. 5.
Пример 3. Конструирование экспрессионного вектора на основе короткой формы промотора pPCNAshort
Короткую форму промотора PCNA (pPCNAshort) амплифицируют из геномной ДНК человека с использованием праймеров PCNA-LS (SEQ NO: 5; TCTCCACATATGCCCGGACT) и PCNA-R (SEQ NO: 4; GCAACAACGCCGCTACAG). Амплификацию промотора проводят в течение 23 циклов с использованием ДНК-полимеразы Taq при температуре отжига праймеров 62°C. После прохождения ПЦР реакционную смесь лигируют с вектором pAL-TA, и полученной лигазной смесью трансформируют клетки E. coli штамма DH5α. Плазмиды, выделенные из индивидуальных бактериальных клонов, проверяют на наличие вставки методом ПЦР с праймерами M13-For (SEQ NO: 6; GTTTTCCCAGTCACGAC) и PCNA-R (SEQ NO: 4; GCAACAACGCCGCTACAG) при температуре отжига 56°C в течение 20 циклов. Среди проанализированных плазмид выбирают плазмиду со вставкой pPCNAshort-pAL-TA, не содержащую нуклеотидных замен.
Пример 4. Конструирование экспрессионного вектора на основе промотора pPCNAshort
Короткую форму конститутивного промотора гена PCNA человека (pPCNAshort) длиной 389 п. о. переклонируют в плазмиду pGL3 Basic Vector (Promega, США), несущую репортерный ген люциферазы P. pyralis. Для этого плазмиду pPCNAshort-pAL-TA обрабатывают ферментами рестрикции NcoI и SacI. Затем полученный фрагмент ДНК с промотором гена PCNA человека очищают электрофорезом в агарозном геле и лигируют с вектором pGL3 Basic Vector, предварительно линеаризованным рестриктазами NcoI и SacI. Лигазной смесью трансформируют E. coli штамма DH5α. Из полученных клонов выбирают клон, несущий плазмиду со вставкой, и получают плазмиду в препаративных количествах (Пример 5).Таким образом получают плазмиду pPCNAshort-pGL3, несущую ген люциферазы P. pyralis под контролем промотора pPCNAshort (Фиг. 2). На хромосоме 20 человека (NC_000020.10) промотор pPCNAshort имеет координаты 5100457-5100845.
Пример 5. Получение плазмид pPCNAlong-pGL3 и pPCNAshort-pGL3 в препаративных количествах
Штаммы E. coli, несущие плазмиды pPCNAlong-pGL3 или pPCNAshort-pGL3, наращивают в питательной среде LB в объеме 100 мл в течение ночи при температуре 37°C с аэрацией. Плазмидную ДНК очищают с использованием EndoFree Plasmid Maxi Kit (Qiagen N.V.) в соответствии с рекомендациями Qiagen.
Пример 6. Культивирование клеток млекопитающих
Клетки млекопитающих культивируют в среде DMEM/F12 (1:1), содержащей 10% эмбриональной сыворотки теленка, 60 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 0.25 мкг/мл амфотерицина (Invitrogen, USA) при 37°C и 5% CO2. Используют клетки, приведенные в Таблице 1.
Пример 7. Трансфекция клеток млекопитающих плазмидой pPCNAlong-pGL3
Клетки млекопитающих трансфицируют в 24-луночных стерильных планшетах с использованием препарата Lipofectamine 2000 (Invitrogen, США) в соответствии с рекомендациями изготовителя, с двукратными повторами. В каждом эксперименте плазмиду pPCNAlong-pGL3 смешивают с плазмидой pRL-TK (Promega, США) в соотношении 9:1 при общей концентрации ДНК 100 нг/мкл в буфере ТЕ (10 mM Tris-HCl, 1 mМ EDTA) pH 7.5, свободном от эндотоксинов. Плазмиду pRL-TK, экспрессирующую люциферазу R. reinformis, используют в качестве внутреннего стандарта люминесценции. Для нормирования уровней люминесценции и сравнения активности промотора PCNA с активностью известных промоторов вирусов SV40 и цитомегаловируса (CMV) в параллельных экспериментах проводят трансфекцию клеток плазмидами pGL3 Basic Vector без промотора, pGL3 Promoter Vector (Promega, США) с промотором SV40 и pGL3-CMV Pr/Enh, содержащей перед геном Luc промотор ранних генов CMV из плазмиды pEGFP-N1 (Clontech Laboratories, Inc.) Через 48 часов после трансфекции клетки лизируют стандартным объемом лизирующего буфера и измеряют активность люцифераз P. pyralis и R. reinformis с помощью набора реактивов Dual-Luciferase Reporter Assay System (Promega, США) и люминометра GENios Pro (Tecan, Швейцария) согласно руководствам к набору реактивов и люминометру.
Пример 8. Определение относительной активности промотора PCNAlonz
В каждом эксперименте по П. 7 полученные значения люминесценции для P. pyralis нормируют на значения люминесценции для люциферазы R. reinformis и вычисляют среднее значение из двух повторов. Из полученных значений для промоторов PC№41ong, SV40 и CMV вычитают фоновую люминесценцию, полученную для плазмиды pGL3 Basic Vector. Скорректированные по фону уровни люминесценции для промоторов PCNA и CMV делят на скорректированный по фону уровень люминесценции для промотора SV40. Полученные данные характеризуют относительную активность промоторов PCNAlong, SV40 и CMV (Фиг. 3).
Пример 9. Трансфекции клеток млекопитающих плазмидами pPCNAshort-pGL3
Трансфекцию клеток млекопитающих плазмидами pPCNAshort-pGL3 проводят согласно процедурам по П. 7.
Пример 10. Определение относительной активности промотора pPCNAshort-pGL3.
Определение относительной активности промотора pPCNAshort-pGL3 проводят согласно процедурам по П. 8 (Фиг. 3).
Пример 11. Противоопухолевый эффект генной конструкции, несущий ген тимидинкиназы вируса простого герпеса под контролем конститутивного промотора.
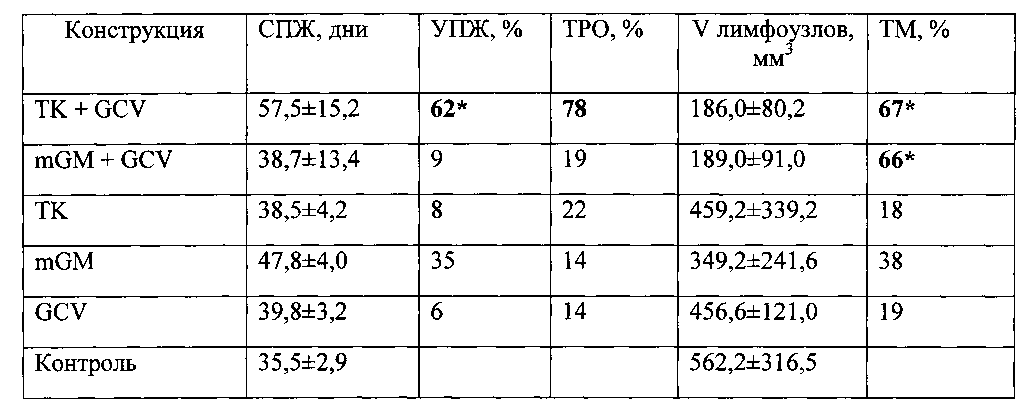
Оценку противоопухолевой эффективности конструкции (обозначим ее ТК), содержащей ген тимидинкиназы вируса простого герпеса (HSVtk) под контролем конститутивного промотора, в сочетании с ганцикловиром проводят на мышах линии F1 с привитой подкожно саркомой S37. Конструкцию в комплексе с носителем вводят в опухоль 3 раза за курс каждые 5 дней в разовой дозе 0,04 мкг ДНК/мм3. Ганцикловир вводят внутрибрюшинно дважды в день в суточной дозе 150 мг/кг в течение 15 дней. Лечение начинают на 7-е сутки роста опухоли, когда объем опухоли в среднем составляет ≈100 мм3. Противоопухолевый эффект конструкции оценивают по уровню торможения роста опухоли (ТРО, %) и увеличению продолжительности жизни (УПЖ, %) животных. ТРО и УПЖ вычисляют по следующим формулам:
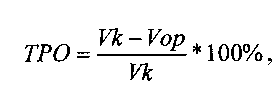 где V - средний объем опухоли (мм3) в опытной (Vop) и контрольной (Vk) группах животных;
где V - средний объем опухоли (мм3) в опытной (Vop) и контрольной (Vk) группах животных; 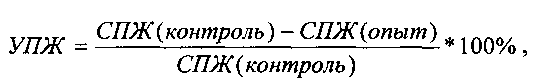 где СПЖ - средняя продолжительность жизни животных в опытной и контрольной группах, соответственно;
где СПЖ - средняя продолжительность жизни животных в опытной и контрольной группах, соответственно;
Минимальным критерием активности противоопухолевых препаратов по показателю ТРО является величина ≥50%, по показателю ТМ - не менее 25%.
Как видно из представленных данных (Таблица 2), внутриопухолевое введение конструкции, несущей ген HSVtk под контролем конститутивного промотора, в сочетании с ганцикловиром приводит к биологически значимому противоопухолевому эффекту. На 30 сутки наблюдения ТРО у животных, получавших конструкцию составило 78%; а УПЖ - 62%.
Пример 12. Противоопухолевый эффект генной конструкции, несущий ген гранулоцитарно-макрофагального колониестимулирующего фактора под контролем конститутивного промотора.
Оценку противоопухолевой эффективности конструкции (обозначим ее GM), содержащей ген гранулоцитарно-макрофагального колониестимулирующего фактора под контролем конститутивного промотора, в сочетании с ганцикловиром проводят на мышах линии F1 с привитой подкожно саркомой S37. Конструкцию в комплексе с носителем вводят в опухоль 3 раза за курс каждые 5 дней в разовой дозе 0,04 мкг ДНК/мм3. Ганцикловир вводят внутрибрюшинно дважды в день в суточной дозе 150 мг/кг в течение 15 дней. Лечение начинают на 7-е сутки роста опухоли, когда ее объем опухоли в среднем составляет ≈100 мм3. Противоопухолевый эффект конструкции оценивают по уровню торможения роста опухоли (ТРО, %), увеличению продолжительности жизни (УПЖ, %) животных и индексу торможения метастазирования (ТМ, %). ТПО и УПЖ рассчитывали как описано в Примере 11. ТМ рассчитывают по следующей формуле: 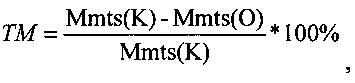 где Mmts(K) - средняя масса метастазов в контрольной группе, Mmts(O) - средняя масса метастазов в опытной группе.
где Mmts(K) - средняя масса метастазов в контрольной группе, Mmts(O) - средняя масса метастазов в опытной группе.
Саркома S37 обладает высоким потенциалом к метастазированию по лимфогенному пути, приводя к поражению регионарных лимфоузлов. Для оценки влияния конструкции, содержащей ген гранулоцитарно-макрофагального колониестимулирующего фактора под контролем конститутивного промотора, на метастазирование саркомы S37 проводят измерение пораженных лимфоузлов на 30-е и 35-е сутки роста опухоли. Было показано, что объем лимфоузлов в группах животных, получавших вышеописанную конструкцию, значительно меньше, чем в контрольной группе (Таблица 2). Торможение метастазирования у животных составило 66%.
Из представленных данных видно, что промоторы PCNA являются конститутивными промоторами и могут быть успешно использованы в генной терапии опухолей для контроля экспрессии генов-убийц, таких как ген HSVtk и генов-стимуляторов иммунной системы (в частности цитокинов), таких как ген GM-CSF.
Таблица 2. Влияние внутриопухолевого введения конструкций, содержащих ген HSVtk или ген GM-CSF под контролем конститутивного промотора, в сочетании с ганцикловиром и без ганцикловира на рост опухоли, ее метастазирование и продолжительность жизни животных с привитой опухолью S37. S37 - мыши F1, самки с опухолью S37 (в группах - по 12 животных). TKmGM (конструкция CMV-HSVtk-mGM-CSF-pGL3), ТК (CMV-HSVtk-pGL3), mGM (CMV-mGM-CSF-pGL3); GCV - ганцикловир. * - отличие от группы животных, которым вводили буферный раствор (контрольная группа) статистически значимо (р<0,05). СПЖ - средняя продолжительность жизни животных в группе, УПЖ - увеличение продолжительности жизни, ТРО - торможение роста опухоли, ТМ - торможение метастазирования.