Результат интеллектуальной деятельности: ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ЭКСПРЕСС-АНАЛИЗА КОМПЛЕКСООБРАЗОВАНИЯ АМИЛОИДА-БЕТА С ИОНАМИ МЕТАЛЛОВ
Вид РИД
Изобретение
Изобретение относится к области аналитической химии, электрохимии и биохимии и касается методики экспресс-анализа комплексообразования амилоида-бета (Aβ) с помощью печатного графитового электрода.
Изобретение может быть использовано в медицине при изучении болезни Альцгеймера и других заболеваний, где важную роль играют комплексы пептидов/белков с ионами металлов. В фармакологии изобретение может служить при тестировании потенциальных лекарственных средств от болезни Альцгеймера.
В России количество больных болезнью Альцгеймера по оценке ряда экспертов составляет от 1,3 до 1,8 млн. человек [1]. Причины, приводящие к возникновению болезни Альцгеймера, до сих пор до конца не выяснены. Считается, что переход Aβ из мономерного состояния в нерастворимые полимерные фибриллярные агрегаты, образующие амилоидные бляшки, является одним из ключевых процессов возникновения болезни Альцгеймера. Согласно исследованиям, ионы металлов (в частности, Zn(II) и Cu(II)) выполняют важную функцию в данном патологическом процессе [2]. Aβ - пептид длиной 39-42 аминокислотных остатка, который способен взаимодействовать с ионами металлов через металл-связывающий домен, состоящий из N-концевых аминокислот 1-16 [2].
Взаимодействие ионов металлов (главным образом, ионов Cu(I/II), Zn(II) и Fe(II/III)) с Aβ так же, как с другими амилоидогенными белками (прионами, α-синуклеином и т.п.), исследуется различными методами: изотермической калориметрии титрования (ИКТ), электронным парамагнитным резонансом, ядерным магнитным резонансом, масс-спектрометрией, оптическими методами и с помощью электрохимии [3].
Комплексы ионов металлов с белками или пептидами могут быть исследованы, используя электрохимическую активность аминокислотных остатков, таких как Цис, Трп, Тир, Гис, Мет и Цис-Цис [4]. Так называемая «прямая электрохимия белков» активно используется в биомедицинских исследованиях, включая нейродегенеративные заболевания [4]. В Aβ человека есть пять потенциально электроактивных аминокислотных остатка: три Гис в положении 6, 13 и 14, один Мет в положении 35 и один Тир в положении 110 [4]. Остатки Гис представляются наиболее интересными для изучения взаимодействия Aβ с ионами металлов, так как напрямую вовлечены в образование комплексов [5]. Однако окисление остатков Гис и Мет требует высоких положительных потенциалов, превышающих 1 В (отн. Ag/AgCl), к тому же до сих пор не показано их окисление для Aβ. С другой стороны, единственный остаток Тир Aβ(1-40) и Aβ(1-42), представляющий две изоформы Aβ различной длины, легко окисляется в нейтральных рН при потенциалах 0,6-0,7 В (отн. Ag/AgCl) [6]. Реакция электрохимического окисления Тир может быть выражена следующей схемой (1) [4]:
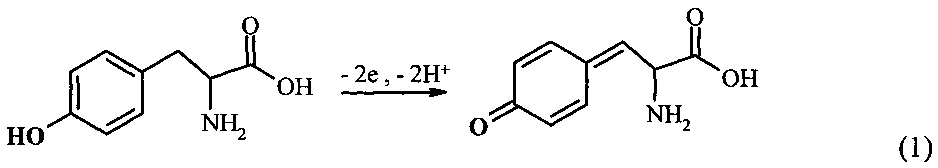
В случае самоассоциации пептид Aβ претерпевает конформационные изменения, которые делают остаток Тир менее доступным для окисления на поверхности электрода. В результате наблюдается снижение тока пика окисления с нарастанием степени агрегации. Таким образом, остаток Тир выступает как электроактивная «метка», чувствительная к концентрации, конформационным изменениям и агрегации Aβ. Регистрация электрохимического сигнала Тир была использована для слежения за агрегацией in vitro синтетических пептидов Aβ(1-40) и Aβ(1-42) [6] так же, как для анализа влияния пентапептида, разрушающего β-пластины, на кинетику агрегации Aβ(1-42) [7].
Электрохимическая активность Aβ, определяемая остатком Тир, была также использована для изучения эффекта ионов металлов (Fe(II), Cu(II), Zn(II), Mg(II)) на кинетику агрегации Аβ(1-40) [8]. J. Geng с соавторами [8] показал, что агрегация, инициированная ионами Zn(II) или Cu(II), зависит от концентрации ионов и обратима под действием этилендиаминтетрауксусной кислоты. Интенсивность пика окисления Aβ(1-40) значительно уменьшается в присутствии ионов Zn(II) или Cu(II), но не меняется в присутствие ионов Mg(II). Это показывает, что связывание иона металла может вызывать конформационные изменения и влияет на микроокружение остатка Тир. Однако в данной работе не был оценен количественный вклад стадии образования комплекса в снижение электрохимического сигнала окисления Aβ, так как и ионы Zn(II), и ионы Cu(II) сразу же запускают частичную агрегацию Aβ in vitro [6].
В настоящее время развивается подход к созданию мишень-направленных лекарственных средств лечения болезни Альцгеймера, терапевтический эффект которых обусловлен их способностью связываться с Aβ. Показано, что органические соединения и короткие пептиды способны ингибировать олигомеризацию Aβ (антиагреганты) и могут служить основой для создания средств терапии болезни Альцгеймера с низкой себестоимостью (в сравнении с моноклональными антителами). Требуется метод оценки влияния различных препаратов на процесс агрегации амилоида-бета, в том числе в присутствие ионов металлов. Имеющиеся в арсенале исследователей методы оценки комплесообразования Aβ с ионами металлов, как и начальной стадии агрегации, достаточно дороги и трудоемки [3]. Электрохимические методы анализа, отличающиеся точностью, чувствительностью, низкой себестоимостью оборудования и расходных материалов, экспрессностью и портативностью, представляются наиболее перспективными для создания такой аналитической системы. В настоящее время электрохимического способа экспресс-определения образования комплексов между Aβ и ионами металлов не существует. Одним из широко применяющихся на практике методов характеристики взаимодействий Aβ является ИКТ [9]. При изучении методом ИКТ комплексообразования Aβ, например, с ионами цинка в ячейку объемом 0,2 мл, содержащую раствор Aβ, добавляют аликвоты раствора ZnCl2 (2 мкл) до насыщения. Концентрацию пептида в ячейке варьируют от 0,25 до 0,75 мМ, а концентрацию ионов цинка в шприце составляет от 5 до 15 мМ. Расчет термодинамических параметров проводят по полученным изотермам связывания. Анализ данных, полученных с помощью ИКТ, позволяет определить термодинамические параметры взаимодействия: стехиометрию, константу ассоциации, изменение энтальпии и энтропии системы при реакции. Полученный набор термодинамических параметров позволяет охарактеризовать конформационные изменения биомолекул, гидрофобные и катион-анионные взаимодействия, детектировать присоединение ионов водорода. ИКТ - прямой метод измерения, не требующий введения меток, заморозки веществ, ограничений по молекулярной массе и составу буфера; может быть использован для окрашенных или мутных растворов. ИКТ позволяет измерять константу ассоциации в диапазоне от 103 М-1 до 109 М-1. Однако данный метод достаточно дорогостоящ и трудоемок.
Задачей настоящего изобретения является разработка электрохимического экспресс-анализ комплексообразования Aβ с ионами металлов, лишенного указанных недостатков. Метод основан на измерении сигнала окисления единственного остатка Тир-10 Aβ.
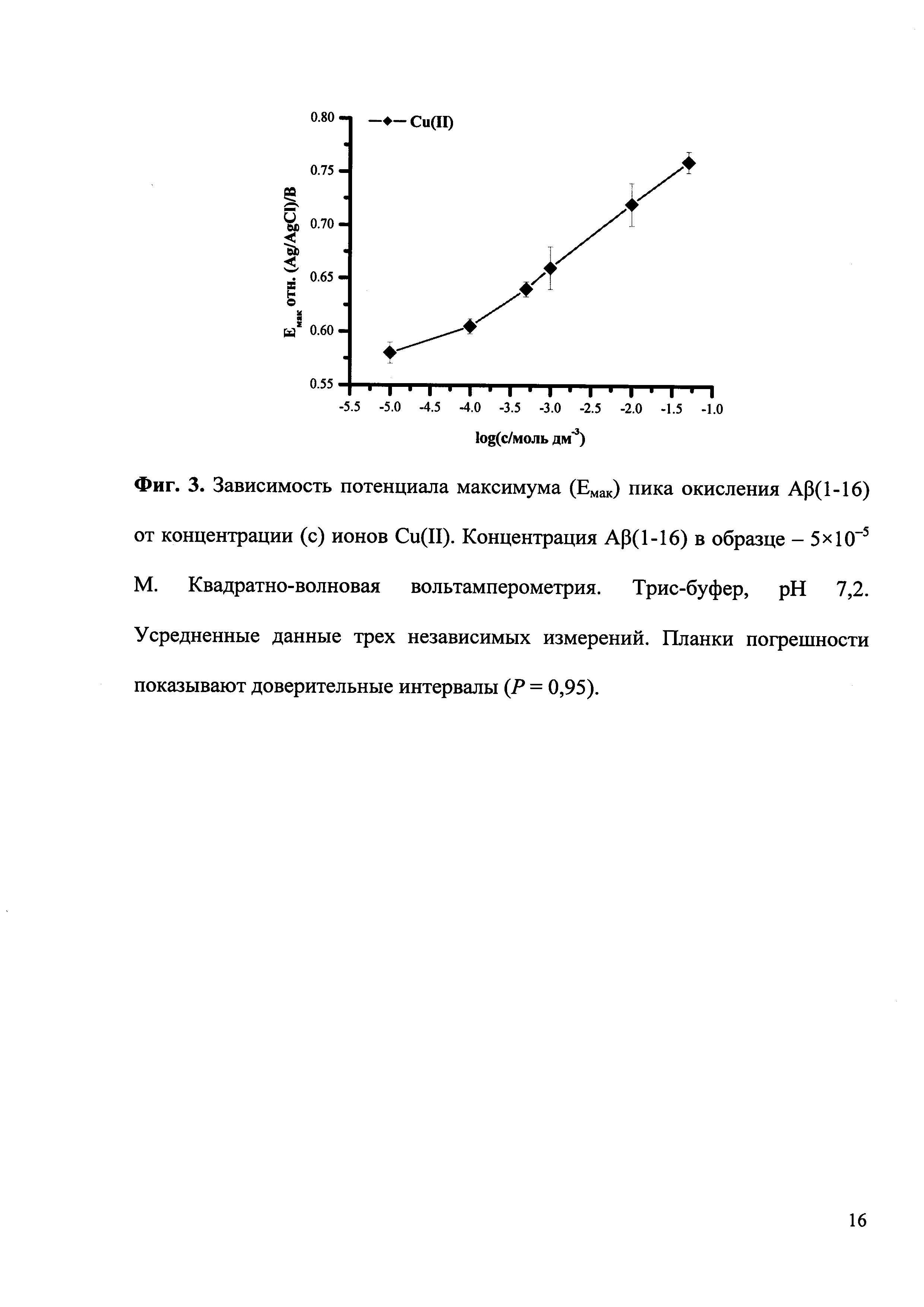
В соответствии с изобретением описывается способ экспресс-анализа комплексообразования амилоида-бета с ионами металлов, заключающийся в том, что на один электрод наносят аликвоту (60-100 мкл) 50 мкМ раствора синтетического пептида Aβ(1-16) в буферном растворе, на другой электрод наносят аликвоту (такого же объема) смеси указанного раствора синтетического пептида Aβ(1-16) с ионами исследуемого металла в соотношении 1:1-1:1000, после инкубации в течение 10 минут осуществляют электрохимическое определение Aβ(1-16) на каждом электроде путем регистрации квадратно-волновой вольтамперограммы окисления пептида, измеряют высоту и потенциал максимума полученного пика окисления в области 0,6-0,7 В (относительно псевдо-хлорсеребряного электрода сравнения) при нейтральном рН и по изменению интенсивности сигналов и сдвигу потенциала максимума в область более положительных значений относительно контроля констатируют образование комплекса.
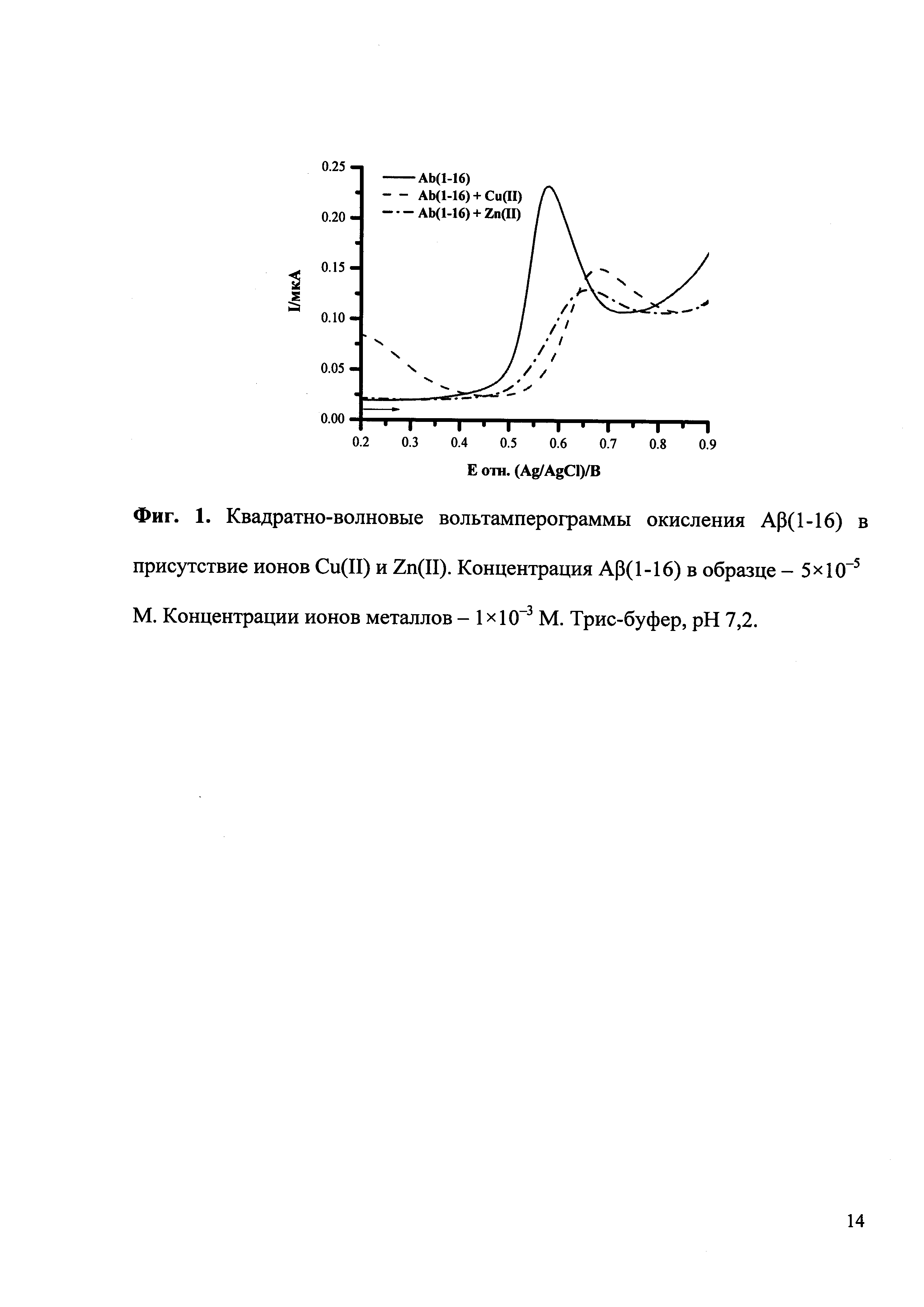
По зависимости потенциала максимума пика от логарифма концентрации ионов металла определяют соотношение ионов металла и амилоида-бета в образовавшемся комплексе.
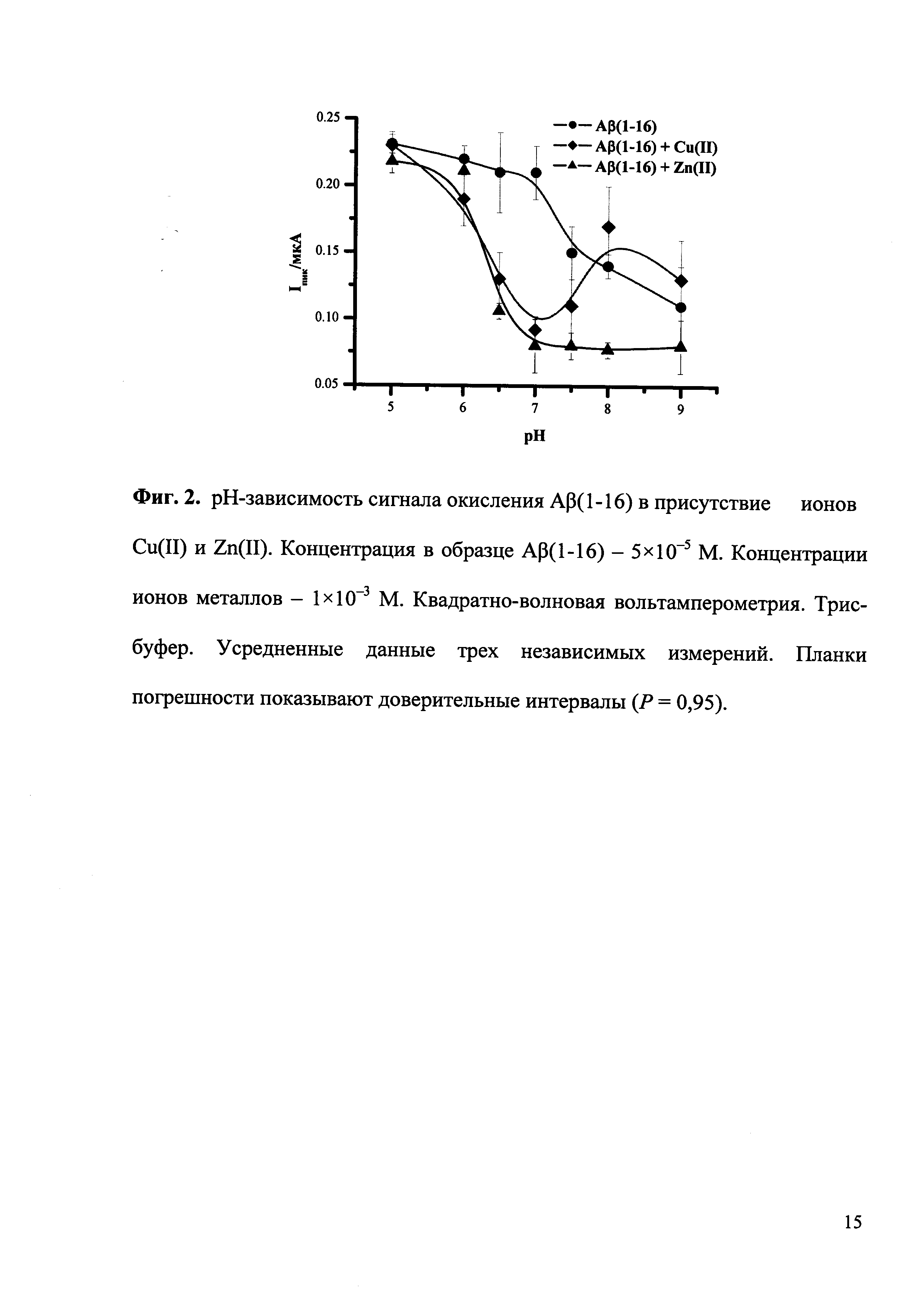
Используют водорастворимый синтетический пептид Aβ(1-16), представляющий металл-связывающий домен Aβ. Образование комплексов Aβ(1-16) с ионами двухвалентных металлов, Zn(II), Cu(II), Mg(II) и Ca(II), было исследовано при концентрации Aβ(1-16) 5×10-5 М и при концентрации ионов металлов в области 1×10-5×10 Мв Трис-буфере с рН от 5 до 9. Добавление ионов Zn(II) либо Cu(II) значительно снижало пик окисления Aβ(1-16) и вызывало сдвиг потенциала пика в область более положительных значений, в то время как ионы Mg(II) и Са(II) не оказывали какого-либо эффекта в пределах экспериментальной ошибки. Альбумин сыворотки человека (далее альбумин) и миоглобин мышц лошади (далее миоглобин) показали схожее поведение относительно тестируемых ионов металлов, что позволяет предположить, что предложенный подход может быть с успехом применен для изучения комплексов белков и пептидов с ионами металлов.
ПРИМЕР 1. Методика регистрации электрохимического сигнала Aβ(1-16)
Приготовление двойного Трис-буферного раствора. рН 7.2
Состав:
1. Трис(гидроксиметил)аминометан - 40 мМ;
2. NaCl - 100 мМ;
3. Вода деионизованная - до 100 мл.
Навески трис(гидроксиметил)аминометана массой 0,484 г и хлорида натрия массой 0,585 г помещают в мерную колбу на 100 мл и доводят деионизованной водой до метки. Содержимое колбы перемешивают до полного растворения компонентов. Переливают раствор из мерной колбы в пластиковую банку объемом 100 мл и измеряют рН буферного раствора. При помощи растворов соляной кислоты и гидроксида натрия доводят рН буферного раствора до значения 7,2.
Приготовление раствора Aβ(1-16)
Состав:
1. Вода деионизованная - до 100 мкл;
2. Aβ(1-16) - 1 мМ.
В пробирку «Эппендорф» объемом 1 мл помещают навеску лиофилизированного препарата амилоида-бета 0,0002 г. Добавляют 100 мкл деионизованной воды и перемешивают пипетированием, избегая пенообразования.
Исходный 1 мМ водный раствор Aβ(1-16) разбавляют до необходимой концентрации Трис-буферным раствором, рН 7,2. Концентрация Трис-буферного раствора в образце амилоида-бета должна составлять 20 мМ, концентрация хлорида натрия 50 мМ.
До начала проведения измерений исходный и разбавленные растворы помещают в лед.
Измерение электрохимического сигнала Aβ(1-16)
Метод: Квадратно-волновая вольтамперометрия;
Время инкубации: 5 сек;
Частота: 10 Гц;
Начальный потенциал: 0 В;
Конечный потенциал: 1 В;
Шаг потенциала: 0,005 В;
Амплитуда: 0,020 В;
В разъеме потенциостата закрепляют печатный графитовый электрод в «горизонтальном режиме».
С помощью автоматической пипетки ручного дозирования на поверхность печатного графитового электрода наносят 60-100 мкл Aβ(1-16) в Трис-буфере так, чтобы капля полностью закрыла рабочий, вспомогательный и электрод сравнения. Запускают процедуру измерения сигнала. Полученную вольтамперограмму сохраняют. Для каждого образца Aβ(1-16) повторяют процедуру измерения сигнала в трех технических повторах на трех печатных графитовых электродах. Один печатный графитовый электрод используют один раз для регистрации одной вольтамперограммы. Для каждого образца Aβ(1-16) определяют потенциал максимума и высоту полученного пика окисления амилоида-бета.
ПРИМЕР 2. Методика анализа комплексообразования Aβ(1-16) с ионами металлов
Берут 400 мкл 50 мкМ раствора Aβ(1-16) в Трис-буфере рН 7,2. Половину раствора объемом 200 мкл смешивают с 2 мкл 0,1 М водного раствора хлорида исследуемого иона металла (или раствора с такой исходной концентрацией, чтобы получить желаемое содержание иона металла в образе). Образец перемешивают и оставляют на 10 минут при комнатной температуре. После этого 60 мкл образца наносят на поверхность печатного графитового электрода и проводят измерение сигнала окисления Aβ(1-16) согласно указанной в ПРИМЕРЕ 1 «Методике регистрации электрохимического сигнала Aβ(1-16)». Оставшуюся половину раствора Aβ(1-16) используют в качестве контрольного образца, не содержащего ионы металла.
Сопоставляют полученные значения высоты и потенциала максимума пиков окисления амилоида-бета без и в присутствии ионов исследуемого металла. Достоверное снижение интенсивности сигнала и сдвиг потенциала максимума в область более положительных значений свидетельствуют об образовании комплекса.
ПРИМЕР 3. Методика определения соотношения ионов металла и Aβ(1-16) в образовавшемся комплексе
Используя указанные выше «Методику регистрации электрохимического сигнала Aβ(1-16)» и «Методику анализа комплексообразования Aβ(1-16) с ионами металлов», строят зависимость потенциала максимума пика окисления Aβ(1-16) от концентрации ионов металла в образце в широком диапазоне (например, 1×10-5-5×10-2 М). На графике полученной зависимости определяют наклон линейного участка прямой. Число ионов металла на одну молекулу Aβ(1-16) в комплексе (х) оценивают по формуле:
ΔEмак/Δlogc=2,3RTx/Fnα,
где Емак - потенциал максимума пика (В),
с - молярная концентрация иона металла в образе (М),
n - стехиометрическое число электронов, участвующих в электрохимической реакции (n=2),
α - коэффициент переноса заряда в электрохимической реакции (зависит от выбранного печатного графитового электрода и определяется отдельно),
R - универсальная газовая постоянная (8,314 Дж моль-1 К-1),
Т - температура (К), и
F - постоянная Фарадея (96485 Кулон моль-1) [10].
ПРИМЕР 4. Результаты экспресс-анализа комплексобразования Aβ(1-16), альбумина, миоглобина и свободного тирозина с ионами Zn(II). Cu(II). Mg(II) и Са(II)
Согласно указанным выше «Методике регистрации электрохимического сигнала Aβ(1-16)» и «Методике анализа комплексообразования Aβ(1-16) с ионами металлов», были получены следующие результаты измерения сигнала окисления Aβ(1-16), альбумина, миоглобина и свободного тирозина при добавлении ионов Zn(II), Cu(II), Mg(II) и Ca(II).
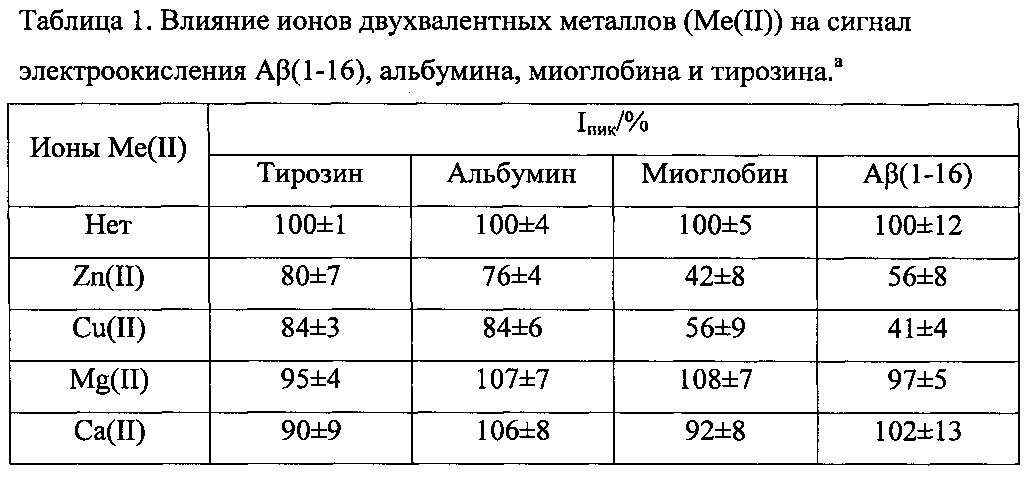
аКонцентрация тирозина, Аβ(1-16), альбумина и миоглобина - 5×10-5 М, концентрация ионов металлов - 1×10-3 М. Квадратно-волновая вольтамперометрия, Трис-буфер, рН 7,2. Средние значения высоты пика окисления (Iпик) в отсутствие ионов металлов принято за 100%. Результаты трех независимых измерений (Р=0,95).
На приведенных ниже фигурах представлены типичные квадратно-волновые вольтамперограммы окисления Aβ(1-16) без и после образования комплексов с ионами Cu(II) и Zn(II), полученные согласно разработанной методике экспресс-анализа (Фиг. 1), а также полученная согласно разработанной методике рН-зависимость комплексообразования Aβ(1-16) с ионами Cu(II) и Zn(II) (Фиг. 2) и зависимость изменения потенциала максимума пика окисления Aβ(1-16) от логарифма концентрации ионов Cu(II) (Фиг. 3).
Литература
1. С.И. Гаврилова, Фармакологические подходы к терапии болезни Альцгеймера, Журн. Неврологии и психиатрии 110 (2010) 62.
2. P. Faller, С.Hureau, О. Berthoumieu, Role of metal ions in the self-assembly of the Alzheimer's amyloid-β peptide, Inorg. Chem. 52 (2013) 12193.
3. P. Faller, C. Hureau, P. Dorlet, P. Hellwig, Y. Coppel, F. Collin, B. Alies, Methods and techniques to study the bioinorganic chemistry of metal-peptide complexes linked to neurodegenerative diseases, Coord. Chem. Rev. 256 (2012) 2381.
4. E.V. Suprun, V.V. Shumyantseva, A.I. Archakov, Protein Electrochemistry: Application in Medicine. A Review, Electrochim. Acta 140 (2014) 72.
5. C.D. Syme, R.C. Nadal, S.E. Rigby, J.H. Viles, Copper binding to the amyloid-beta (Abeta) peptide associated with Alzheimer's disease: folding, coordination geometry, pH dependence, stoichiometry, and affinity of Abeta-(1-28): insights from a range of complementary spectroscopic techniques, J. Biol. Chem. 279 (2004) 18169.
6. M. Vestergaard, K. Kerman, M. Saito, N. Nagatani, Y. Takamura, E. Tamiya, A Rapid Label-Free Electrochemical Detection and Kinetic Study of Alzheimer's Amyloid Beta Aggregation, J. Am. Chem. Soc. 127 (2005) 11892.
7. A.J. Veloso, K. Kerman, Modulation of fibril formation by a beta-sheet breaker peptide ligand: An electrochemical approach, Bioelectrochemistry 84 (2012) 49.
8. J. Geng, H. Yu, J. Ren, X. Qu, Rapid label-free detection of metal-induced Alzheimer's amyloid β peptide aggregation by electrochemical method, Electrochem. Commun. 10 (2008) 1797.
9. A.A. Kulikova, P.O. Tsvetkov, M.I. Indeykina, I.A. Popov, S.S. Zhokhov, A.V. Golovin, V.I. Polshakov, S.A. Kozin, E. Nudler, A.A. Makarov, Phosphorylation of Ser8 promotes zinc-induced dimerization of the amyloid-β metal-binding domain, Mol. BioSyst. 10 (2014) 2590.
10. К.Z. Brainina, E.Y. Neyman, Processes of electrodissolution of metals involving chemical reactions, J. Electroanal. Chem. 45 (1973) 247.