Результат интеллектуальной деятельности: ШТАММЫ Lactobacillus plantarum И Lactobacillus brevis, СИНТЕЗИРУЮЩИЕ ГАММА-АМИНОМАСЛЯНУЮ КИСЛОТУ
Вид РИД
Изобретение
Изобретение относится к фармакологии и медицине, в частности неврологии, и касается штаммов лактобацилл, способных синтезировать ГАМК, известную как релаксирующее средство, из ее предшественника глютаминовой кислоты с помощью фермента глутаматдекарбоксилазы. Штаммы могут быть использованы для получения препаратов, используемых в комплексном лечении нейродепрессивных состояний и сопутствующих заболеваний.
Уровень техники
γ-Аминомасляная кислота (ГАМК, GABA; C4H9NO2) - аминокислота, важнейший нейромедиатор, участвующий в процессах торможения центральной нервной системы млекопитающих. Не является альфа-аминокислотой и не входит в состав белков. Действие ГАМК в ЦНС осуществляется путем ее взаимодействия со специфическими ГАМКергическими рецепторами (подразделяются на ГАМК-А- и ГАМК-Б-рецепторы), приводящего к ингибированию нервного импульса. Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. За пределами нервной системы ГАМКергическая система была описана в различных тканях и органах тела человека (кишечнике, желудке, поджелудочной железе, почках, легких, печени и других).
Гамма-аминомасляная кислота в организме образуется из другой аминокислоты, L-глутамата, с помощью фермента глутаматдекарбоксилазы (GAD, ЕС 4.1.15) в ходе необратимой реакции альфа-декарбоксилирования; кофактором является пиридоксаль 5′-фосфат (активная форма витамина В6).
ГАМК обнаружена у растений, животных, микроорганизмов (бактерий, грибов, дрожжей).
ГАМК способствует секреции инсулина клетками поджелудочной железы (Adeghate, Ponery, 2002, GABA in the endocrine pancreas: cellular localization and function in normal and diabetic rats. Tussue Cell, 34, 1-6), снижает давление, имеет диуретический и транквилизационный эффект (Jakobs et al, 1993, Inherited disorders of GABA metabolism. J. Inherit. Metab. Dis., 16, 704-715; Wong et al., 2003, GABA, gamma-hydroxybutyric acid, and neurological disease. Ann. Neurol, 54, suppl 6, S3-S12). Есть данные о том, что ГАМК способствует лечению бессоницы, депрессии, вегетативных расстройств (Okado et al., Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration, 2000, Nippon Shokuhin Kagaku Kaishi, 47, 596-603; Chuang et al., 2011, Antidepressant effect of GABA-rich Monascus-fermented product on forced swimming rat model, J Agric Food Chem, 59, 3027-3034), симптомов хронической алкогольной зависимости (Oh et al., 2003, Germinated brown rice extract shows a nutraceutical effect in the recovery of chronic alcohol-related symptoms, JMedFood 6, 115-121), стимулирует иммунные клетки, имеет антиканцерогенные свойства (Al-Wadei et al., 2012, Social stress promotes and γ-aminobutyric acid inhibits tumor growth in mouse models of non small cell lung cancer, Cancer Prev Res (Phila), 5, 189-196). Наиболее выраженным является действие ГАМК на заболевания нервной системы.
Огромную роль в жизнедеятельности организма человека играет микробиом, совокупность населяющих его микроорганизмов (преимущественно бактерий). Наиболее сложным по общему числу микроорганизмов и числу составляющих его видов является микробиом кишечника. Совокупность микроорганизмов, населяющих кишечник, выполняет многочисленные функции: участвует в переваривании пищи, подавляет патогенную микрофлору, проявляет антиканцерогенные и иммуномодулирующие свойства и является частью т.н. оси кишечник - мозг (gut - brain axis) (Young, 2012, The intestinal microbiota in health and disease, Curr Opin Gastroenterol, 28:63-9; Cryan and O′Mahony, 2011, The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterol Motil., 23:187-92). Населяющие ЖКТ бактерии выделяют ряд низкомолекулярных веществ, которые являются нейромедиаторами и гормоноподобными веществами, действующими в первую очередь на нервные окончания в ЖКТ и предающими сигналы в ЦНС. К таким веществам относятся ацетилхолин и другие холины, серотонин, норадреналин, гистамин и другие амины, жирные кислоты с короткими цепями, ГАМК (Roshchina, 2010, Evolutionary Considerations of Neurotransmitters in Microbial, Plant, and Animal Cells, In: Microbial Endocrinology, p. 17-52). Такими связями микробиоты и ЦНС занимается новая область науки - микробная эндокринология. (Clarke et al., 2014, Gut microbiota: the neglected endocrine organ, Mol Endocrinol., 28:1221-38).
Влияние кишечной микробиоты на эмоциональное поведение, восприятие боли, сигнальные механизмы, реакцию на стресс у животных, преимущественно грызунов, показано неоднократно (Bravo et al, 2011; Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve, Proc Natl Acad Sci USA, 108:16050-5; Diaz et al., 2011, Normal gut microbiota modulates brain development and behavior, Proc Natl Acad Sci USA, 108:3047-52). Эти данные позволяют предполагать, что аналогичный эффект кишечная микробиота может проявлять в организме человека, влияя на его эмоциональное поведение и течение психических заболеваний, что и было показано в ряде работ (Finegold et al., 2002, Gastrointestinal microflora studies in late-onset autism. Clin Infect Dis., 35(Suppl 1):S6-S16; Messaoudi et al., 2011, Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects, Br J Nutr, 105:755-764; Tillisch et al., 2013, Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, 144, 1394-1401).
Лактобактерии обнаруживаются практически во всех отделах тела человека: ЖКТ, коже, вагинальной полости. В отличие от подавляющего большинства бактерий микробиоты человека лактобактерии являются культивируемыми организмами и хорошо изучены генетически. Лактобактерии являются пробиотическими микроорганизмами и считаются безопасными (GRAS - generally regaded as safe), они широко используются в функциональных пищевых продуктах, биологически активных добавках, лекарственных средствах. Пробиотики, и лактобактерии в частности, все чаще используются в комбинированном лечении начальных стадий различных заболеваний (язвенного колита, синдрома воспаленного кишечника, аллергических заболеваний). Преимуществами использования пробиотиков в качестве лекарственных средств является их относительная безвредность и физиологичность по сравнению с химическими препаратами и возможность подбора конкретного препарата - вплоть до индивидуальной терапии - для лечения одного и того же заболевания у разных пациентов.
Синтез ГАМК показан у ряда лактобацил, преимущественно у L. brevis (Li et al., 2008, A high gamma-aminobutyric acid-producing Lactobacillus brevis isolated from Chinese traditional paocai, Annales Microbiol., 58, 649-653; Seo et al., 2013, Expression and characterization of a glutamate decarboxylase from Lactobacillus brevis 877G producing gamma-aminobutyric acid, Biosci. Biotechnol. Biochem., 77:853-856; патенты WO 2013107913, 2013 г., KR 20140100370, 2013; KR 20140048488, 2012), у некоторых штаммов L. plantarum (патенты KR 20140087518, 2012 г., KR 20120007917, 2010 г.), а также у L. paracasei, L. buchneri, L. helveticus, L. delbrueckii, L. reuteri, L. zymae (см. обзор Li, Cao, 2010, Lactic acid bacterial cell factories for gamma-aminobutyric acid, Amino Acids, 39:1107-1116).
Введение лактобацилл перорально животным (мышам и крысам) снижает состояние тревоги, регулирует эмоциональное состояние и обцессивно-компусивное поведение (Luo et al., 2014, Ingestion of Lactobacillus strain reduces anxiety and improves cognitive function in the hyperammonemia rat, Sci China Life Sci. 57:327-35; Perez-Burgos et al., 2013, Psychoactive bacteria Lactobacillus rhamnosus (JB-1) elicits rapid frequency facilitation in vagal afferents, Am J Physiol Gastrointest Liver Physiol. 304:G211-20;
Показана связь между продукцией ГАМК лактобактериями и их действием на нервную систему (Cho et al., 2007, Production of gamma-aminobutyric acid (GABA) by Lactobacillus buchneri isolated from kimchi and its neuroprotective effect on neuronal cells, J Microbiol Biotechnol., 2007, 17:104-9; Bravo et al., 2011, Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve, Proceedings of the National Academy of Sciences of the US America, 108:16050-16055).
На данный момент лекарственные препараты на основе лактобактерий, направленные на комплексное лечение нейродепрессивных сосотояний (тревоги, нарушений сна, депрессии и др.) отсутствуют. Есть отдельные зарубежные работы, предлагающие штаммы лактобактерий для таких целей (Barrett et al., 2012, γ-Aminobutyric acid production by culturable bacteria from the human intestine, J Appl Microbiol., 113:411-7; патент WO 2013107913, Stanton et al, 2013, Gaba-producing culturable bacteria derived from the human gastrointestinal tract). Описанные в них штаммы являются ближайшим аналогом изобретения.
Мы полагаем, что разработка таких штаммов и препаратов на их основе необходимы. В России необходимы препараты на основе российских штаммов лактобацилл, адаптированных для российской популяции, с учетом происхождения штамма (т.е. выделенные из ЖКТ людей - жителей центрального региона России). Депонируемые штаммы отличаются от всех описанных ранее тем, что они 1. выделены из ЖКТ именно жителей центрального региона России; 2.имеют отличную от других штаммов последовательность гена глутаматдекарбоксилазы (см. ниже).
Раскрытие изобретения
Задачей настоящего изобретения является поиск и отбор штаммов лактобацилл, выделенных из организма людей - жителей центрального региона России, обладающих пробиотическими свойствами и способных синтезировать и выделять в среду ГАМК.
Отбор штаммов.
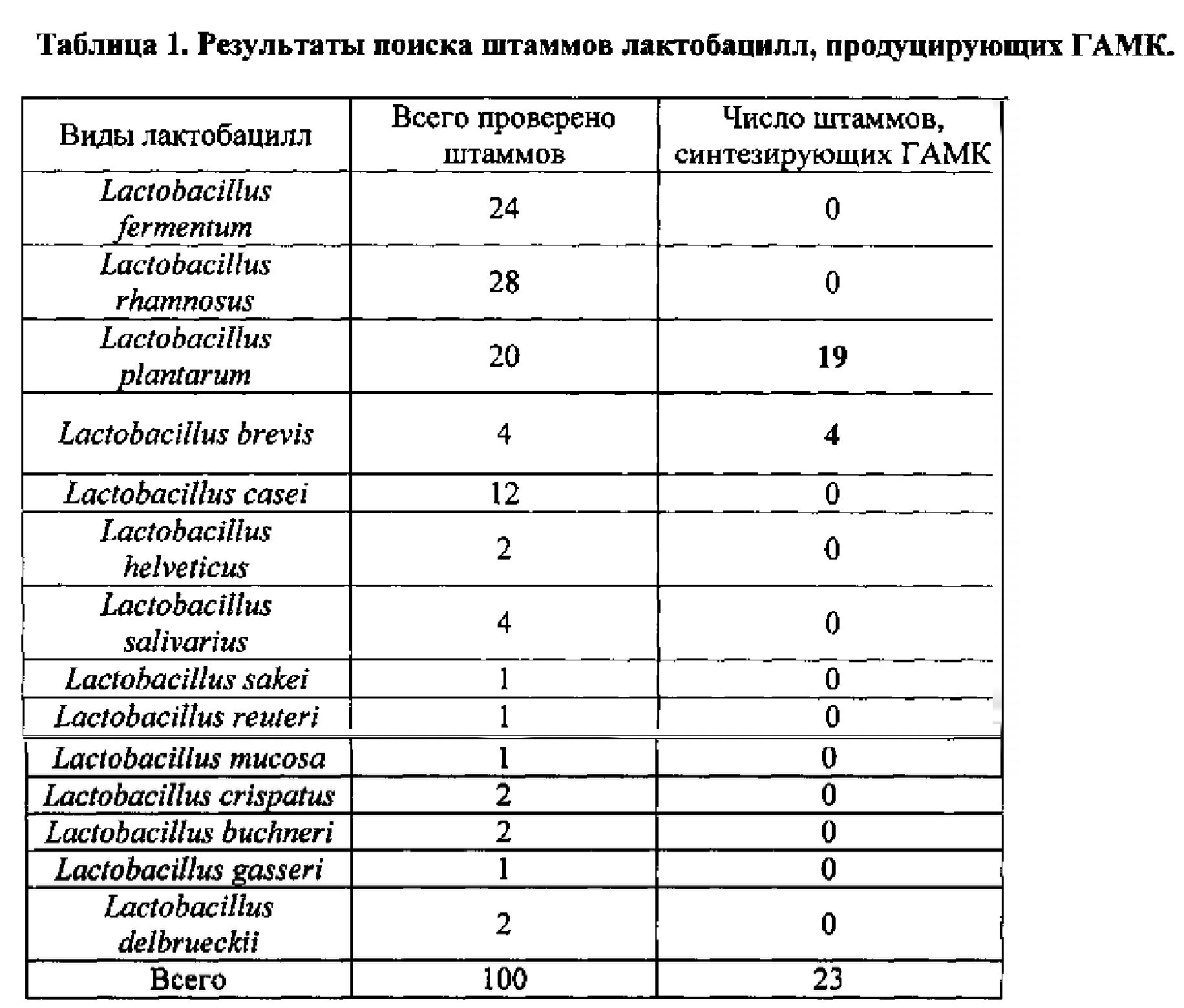
Была проверена коллекция штаммов лактобацилл, состоящая из видов L. rhamnosus, L. fermentum, L. brevis, L. casei, L. plantarum, L. helveticus, L. salivarius, L. sakei, L. reuteri, L. mucosa, L. crispatus, L. buchneri, L. gasseri, L. delbrieckii, всего 100 штаммов, на наличие ГАМК в культуральной среде. Штаммы выращивали в среде MRS с 1% глутамата натрия и определяли наличие ГАМК методом тонкослойной хромотографии на пластинах на стеклянной подложке Silica gel 60 F254 (Merck). Количество образуемой ГАМК определяли методом двумерного сканирования пластинок на денситометре Shimadzu. Синтез ГАМК был установлен у штаммов L. plantarum и L. brevis (см пример 1). Были отобраны два штамма, принадлежащие к этим видам, имеющие достаточно высокий уровень синтеза ГАМК и характеризующиеся рядом пробиотических свойств - Lactobacillus brevis 15f и Lactobacillus plantarum 90sk.
Штамм L. brevis 15f выделен в 2010 г. в г. Твери из фекалий здоровой девушки в возрасте 19 лет.
Штамм L. plantarum 90sk выделен в 2011 г. в г. Твери из кишечного биоптата женщины 56 лет.
Штаммы охарактеризованы в соответствии с требованиями по биобезопасности, опубликованными в Фармакопейной статье «Пробиотики для медицинского применения» Министерства здравоохранения Российской Федерации (Государственный стандарт качества лекарственных средств).
Штаммы депонированы в ВКПМ (г. Москва) в октябре 2014 г., коллекционные номера
Для L. brevis 15f - В-12077
Для L. plantarum 90sk - В-12076
Определение видовой принадлежности патентуемых штаммов.
Определение видовой принадлежности штамма L. brevis 15st было проведено по нуклеотидной последовательности гена 16S РНК. Штамм был идентифицирован как L. brevis, см. пример 2.
Определение видовой принадлежности штамма L. plantarum 90sk проводили: 1. по нуклеотидной последовательности гена 16S рибосомной РНК; 2. с помощью видоспецифических праймеров, сделанных по гену recA; 3. с помощью видоспецифических праймеров и НП межгенного района, предшествующего первому гену оперона F0F1 синтазы atpB. Штамм был идентифицирован как L. plantarum, см. пример 3.
Культурально-морфологические особенности штаммов:
По данным свойствам оба штамма неотличимы друг от друга.
Морфологические и тинкториальные свойства: грамположительные бесспоровые палочки короткие и длинные (2-5 мкм) с закругленными концами, некоторые расположены в цепочку.
Выросшие колонии имели следующие культуральные свойства: колонии S-формы 1-2 мм, выпуклые, гладкие, светло-желтого или белого цвета с ровными краями. При культивировании в жидкой среде MRS в течение 22-24 ч происходит равномерное помутнение среды по всему ее объему, кроме зоны аэробиоза, с образованием осадка.
Способ, условия и состав сред для размножения штаммов.
Штаммы культивировали на жидкой и агаризованной средах MRS (Himedia) в течении 24-48 час. Состав среды MRS на 1 литр в граммах: протеозопептон - 10,0; мясной экстракт - 10,0; дрожжевой экстракт - 5,0; глюкоза - 20,0; полисорбат 80-1,0; цитрат аммония - 2,0; ацетат натрия - 5,0; сульфат магния - 0,1; сульфат марганца - 0,05; фосфат калия двузамещенный - 2,0. pH (при 25°С) 6,5. Культивирование осуществляли как в анаэробных условиях с использованием анаэростата и системы GasPak+, так и в аэробном режиме. Температура инкубации 37°С.
Активность (продуктивность) штаммов.
В MRS-бульоне продуктивность штаммов достигала 109 кл/мл.
Антагонистическое действие на бактериальные и дрожжевые тест-культуры выявляли методом агаровых слоев на бактериальных тест-штаммах: Staphylococcus aureus АТСС 25923, Pseudomonas aeruginosa АТСС 27853, Shigella sonnei I фазы 941, Bacillus subtillis 534, Escherichia coli 25922, Klebsiella pneumoniae K1 5054, Candida albicans ATCC 885-653. Штамм L. plantarum 90sk проявлял во всех случаях высокую антагонистическую активность, штамм L. brevis 15st - среднюю и низкую (см. пример 4).
У обоих штаммов выявлено отсутствие гемолитической, протеолитической, летициназной, ДНК-ной и РНК-ной активностей.
Устойчивость (чувствительность) к антибиотикам.
Штамм L. brevis 15f устойчив к канамицину, амикацину, полимиксину В, бацитрацину, ванкомицину, стрептомицину, линкомицину, промежуточно устойчив к ампициллину, тетрациклину, чувствителен к рифампицину, хлорамфениколу, азитромицину, олеандомицину, эритромицину, гентамицину, неомицину. Штамм L. plantarum 90sk устойчив к канамицину, гентамицину, стрептомицину, неомицину, амикацину, линкомицину, полимиксину В, ванкомицину, промежуточно устойчив к ампициллину, азитромицину, олеандомицину, чувствителен к рифампицину, хлорамфениколу, тетрациклину, эритромицину. Устойчивость не связана с генами, расположенными на мобильных генетических элементах.
Продукты, синтезируемые штаммами:
При выращивании в питательном бульоне MRS с 1% глутамата натрия патентуемые штаммы синтезируют и секретируют в среду ГАМК. Максимальное количество ГАМК в этих условиях обнаруживается при 80-90 часах инкубации (3-3,7 суток) и достигает 770 мг/мл для L. brevis 15f и 220 мг/мл для L. plantarum 90sk (см. примеры 5, 6).
Гены глутаматдекарбоксилазы у патентуемых штаммов.
У патентуемых штаммов было установлено наличие генов gad (глютаматдекарбоксилазы) и определена нуклеотидная последовательность генов (см. пример 7). Нуклеотидная последовательность генов gad у патентуемых штаммов отличалась от таковой для всех генов gad, депонированных в GenBank, и была уникальной (см. пример 7).
Таким образом, способность штаммов Lactobacillus brevis 15f и Lactobacillus plantarum 90sk продуцировать ГАМК, антагонистическая активность по отношению к патогенной и условно-патогенной микрофлоре, отсутствие протеазной и др. активностей делают возможным использование штаммов по отдельности и в составе различных смесей бактериальных штаммов при производстве лекарственных средств в виде лиофилизированных препаратов, капсул, жидких культур и других аналогичных средств для лечения вегето-сосудистых расстройств и депрессивных состояний. Штаммы отличны от всех описанных ранее штаммов L. plantarum и L. brevis, продуцирующих ГАМК, т.к. выделены из организма людей - жителей центрального региона Российской Федерации и имеют уникальную последовательность генов gad.
Примеры по характеристике получения и свойствам штаммов L. brevis 15f и L. plantarum 90sk по настоящему изобретению.
Пример 1.
Отбор штаммов, продуцирующих ГАМК.
Пример 2.
Определение видовой принадлежности штамма L. brevis 15f
Использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT); (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1563 пн; определяли НП 500 пн (с 46 по 545).
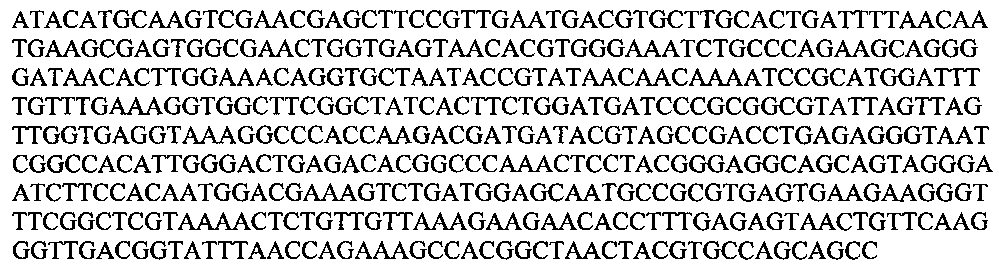
Пример 3.
Определение видовой принадлежности штамма Lactobacillus plantarum 90sk
1. Для определения вида по нуклеотидной последовательности гена 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1519 пн; определяли НП 1450 нуклеотидов, с 19 по 1468.

по этим данным штамм 90sk неотличим от видов L. plantarum, L. pentosus, L. paraplantarum. С видами L. fabifermentans и L. xiangfangensis он имеет 99% идентичности по НП гена 16S рибосомной РНК, однако различие составляет 10 и более пар нуклеотидов на исследуемый фрагмент, тогда как отличия внутри вида составляют 1-2 пары нуклеотидов. С видом L. mudanjiangensis имеет 98% идентичности, различия обнаруживаются более чем по 30 пн. С видами L. xiangfangensis и L. mudanjiangensis гомологична только часть рассматриваемой нуклеотидной последовательности (1411/1429 и 1405/1437 пар нуклеотидов соответственно).
2. Для уточнения идентификации штамма 90sk и более точного отнесения его к одному из близкородственных видов L. plantarum, L. paraplantarum, и L. pentosus, мы провели идентификацию с помощью видоспецифических F-праймеров, сделанных по гену recA: paraF (5′-GTC АСА GGC ATT ACG AAA AC-3′), pentF (5′-CAG TGG CGC GGT TGA TAT C-3′), planF (5′-CCG TTT ATG CGG AAC ACC TA-3′) и общего для них R-праймера pREV (5′-TCG GGA TTA CCA AAC АТС AC-3′), (Torrianiet al. 2001. Differentiation of Lactobacillus plantarum, L. pentosus, and L. paraplantarum by recA gene sequence analysis and multiplex PCR assay with recA gene-derived primers. Appl. Env. Microbiol. 67, 3450-3454).
По этому тесту штамм 90sk достоверно отличен от видов L. paraplantarum и L. pentosus и принадлежит к виду L. plantarum.
3. Помимо гена 16S рРНК мы используем в работе видоспецифические праймеры и НП межгенного района, предшествующего первому гену оперона F0F1 синтазы atpB
[Патент Ru 2508406 "Метод видовой идентификации лактобацилл L. casei/paracasei, L. fermentum, L. plantarum, L. rhamnosus" AHO «НИЦ «БИОАН» 2012 г.]. Праймеры F0F1Lp1-F (5′-CAAGTCACAATTACTGAGATG-3′) и F0F1Lp-R (5′-TTCAGTTCAGTGGTCTAGCA-3′).
Для штамма 90sk эта последовательность выглядит так:
Внутри вида L. plantarum различия в последовательности не превышают 1 нуклеотида на последовательность (256 пн). Идентичность с соответствующей НП штаммов L. pentosus составляет менее 92%. Для видов L. paraplantarum, L. fabifermentans гомологичных последовательностей в геномах не обнаруживается.
Севенированные геномы видов L. xiangfangensis и L. mudanjiangensis в базе данных отсутствуют, сравнение с данными видами невозможно.
Таким образом, штамм 90sk относится к виду L. plantarum.
Пример 4.
Синтез ГАМК штаммом L. plantarum 90sk.
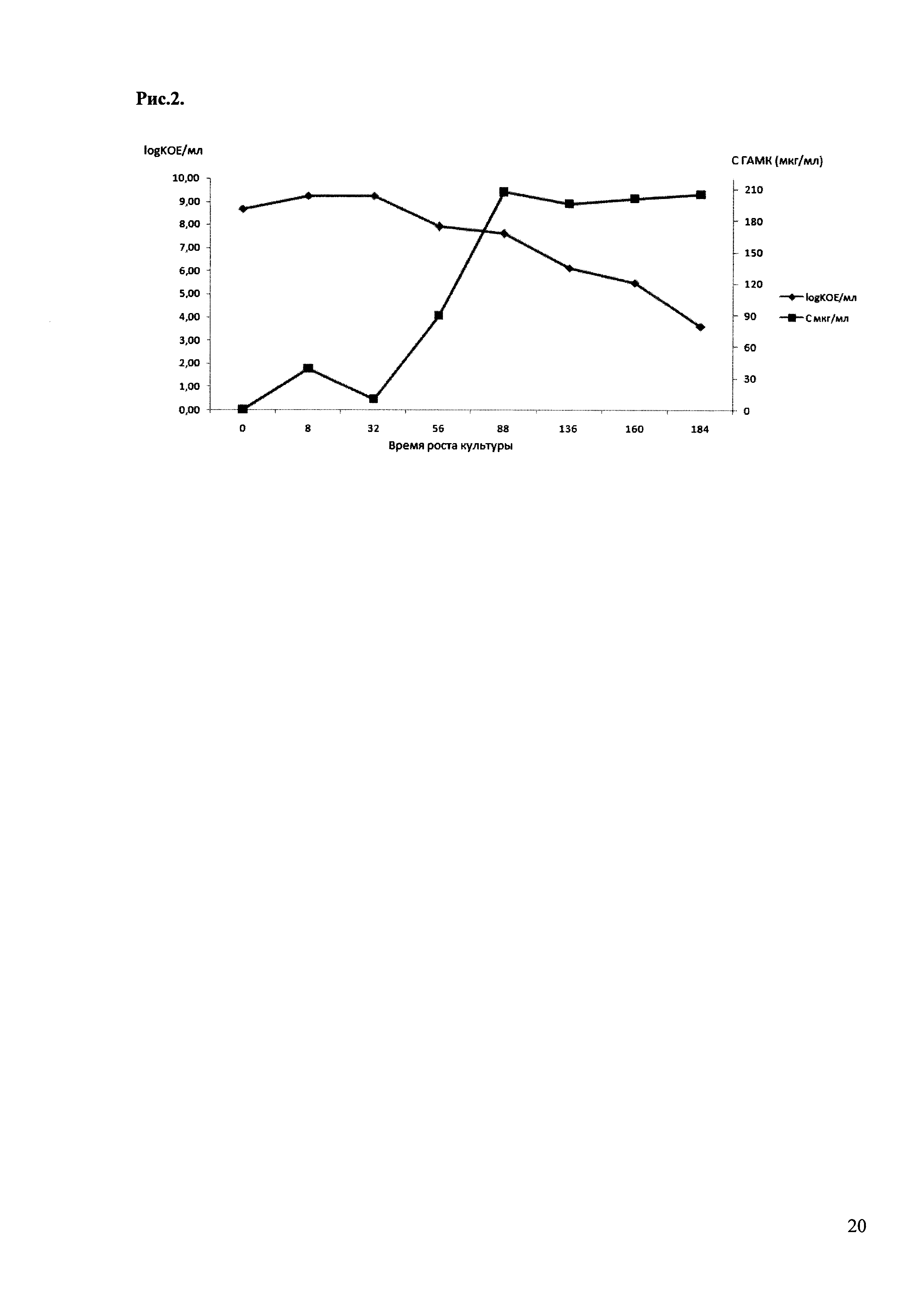
Опыт проводили в обычной ростовой среде для лактобактерий MRS, в которую добавляли 1% глютамата натрия - предшественника ГАМК. Синтез и количество ГАМК определяли методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Перед нанесением на пластинку пробы разводили в 10 раз. 2 мкл культуры наносили на пластинку, использовали смесь растворителей н-бутанол-уксусная кислота-вода 4:1:1; в общую смесь добавляли 0,2% нингидрина. После разделения фракций нагревали пластинку при 70°С в течении 10 минут для проявления пятен. Результаты представлены на рис. 1. На рис. 2 представлены графики роста культуры штамма L. plantarum 90sk и продукции ГАМК.
Пример 5.
Синтез ГАМК штаммом L. brevis 15st.
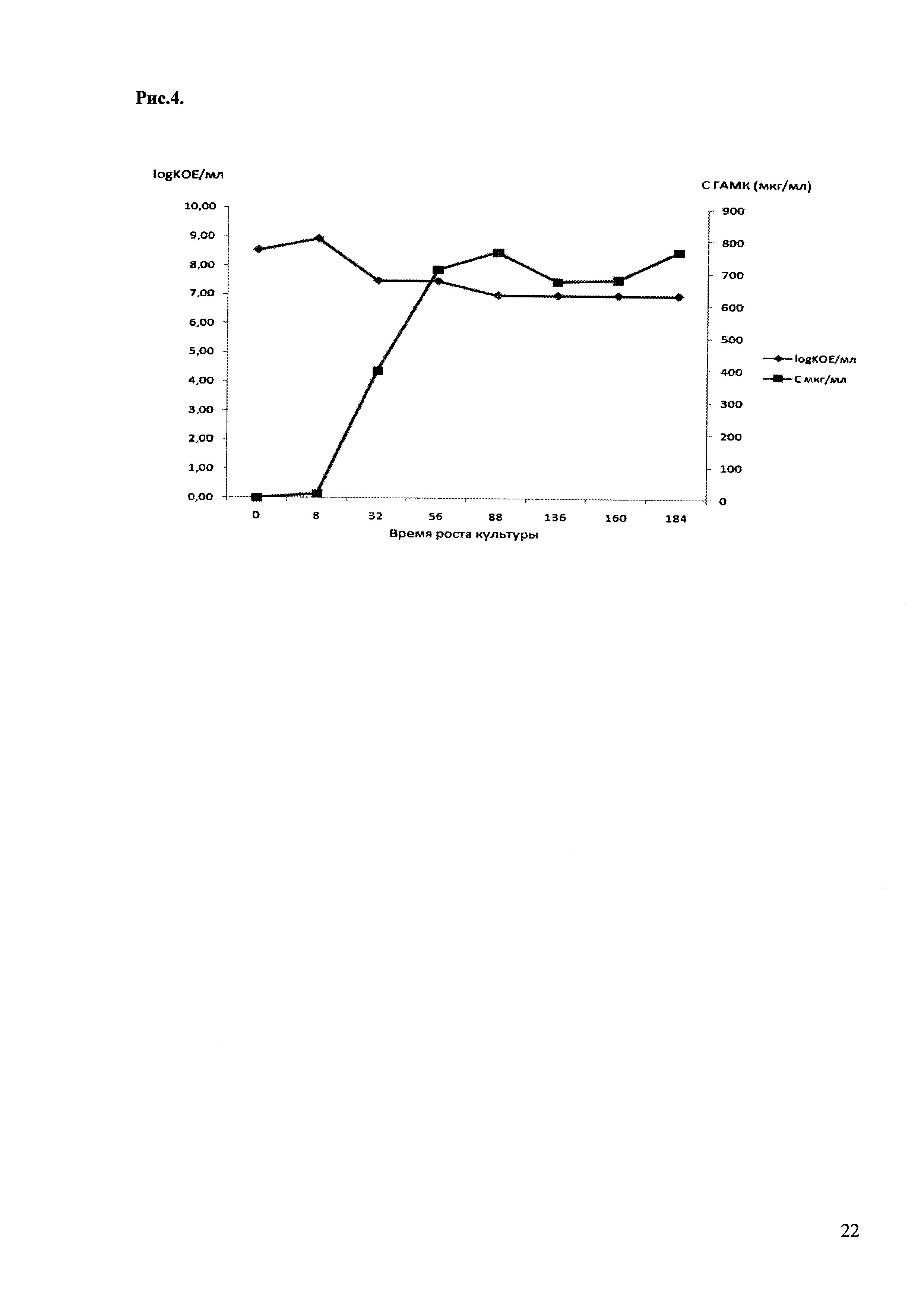
Опыт проводили в обычной ростовой среде для лактобактерий MRS, в которую добавляли 1% глютамата натрия - предшественника ГАМК. Синтез и количество ГАМК определяли методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Перед нанесением на пластинку пробы разводили в 10 раз. 2 мкл культуры наносили на пластинку, использовали смесь растворителей н-бутанол-уксусная кислота-вода 4:1:1; в общую смесь добавляли 0,2% нингидрина. После разделения фракций нагревали пластинку при 70°С в течении 10 минут для проявления пятен. Результаты представлены на рис. 3. На рис. 4 представлены графики роста культуры штамма L. brevis 15f и продукции ГАМК.
Пример 6.
Определение антагонистической активности штаммов.
Антагонистическую активность определяли при помощи модификации метода отсроченного антагонизма в агаре (Muriana P.M., Klaenhammer T.R. 1987. Conjugal transfer of plasmid-encoded determinants for bacteriocin production and immunity in Lactobacillus acidophilus 88. Appl. Environ. Microbiol. 53, 553-560). Для этого на поверхность плотной питательной среды MRS-aгар бактериологической петлей бляшками с диаметром 15 мм засевали 24 часовые культуры лактобактерий и культивировали 24 часа при 37°С в анаэробных условиях. После культивирования круглым металлическим пробойником с диаметром 16 мм удаляли фрагмент агара с выросшими бактериями. Затем на подготовленные таким образом чашки наносили 5,5 мл расплавленной и остуженной до 50°С полужидкой (0,5% агара) среды Columbia agar, в которую предварительно вносили 0,1 мл суточной культуры индикаторного штамма. После 18-часовой инкубации при 37°С измеряли величину зон задержки роста от края удаленной бляшки до края роста индикаторных штаммов. Исследования по определению антагонистической активности по отношению к индикаторным штаммам микроорганизмов повторяли три раза. Из полученных данных вычисляли среднюю величину. Полученные результаты представлены в таблице 4.
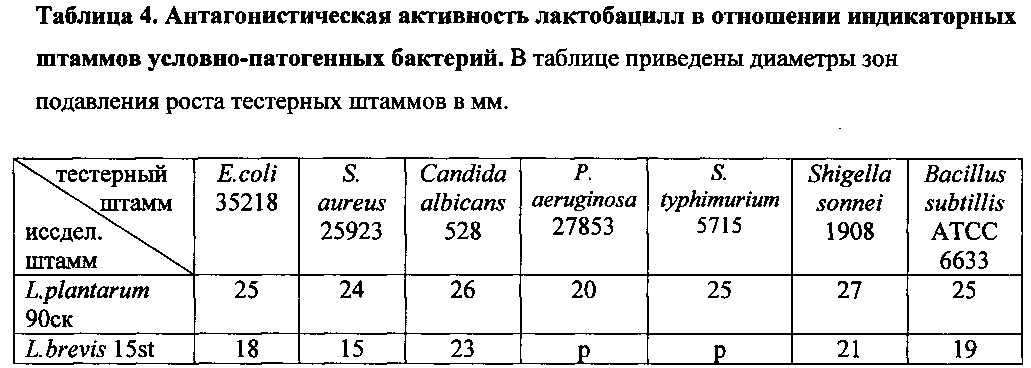
Степень антагонизма определяли по следующим критериям:
10 мм и менее - низкая,
10-20 мм - средняя,
21 мм и более - высокая.
Р - резистентность.
Пример 7.
Нуклеотидная последовательность gad-генов (генов глютаматдекарбоксилазы) патентуемых штаммов.
Ген gad L. plantarum 90sk
Для определения НП были использованы праймеры
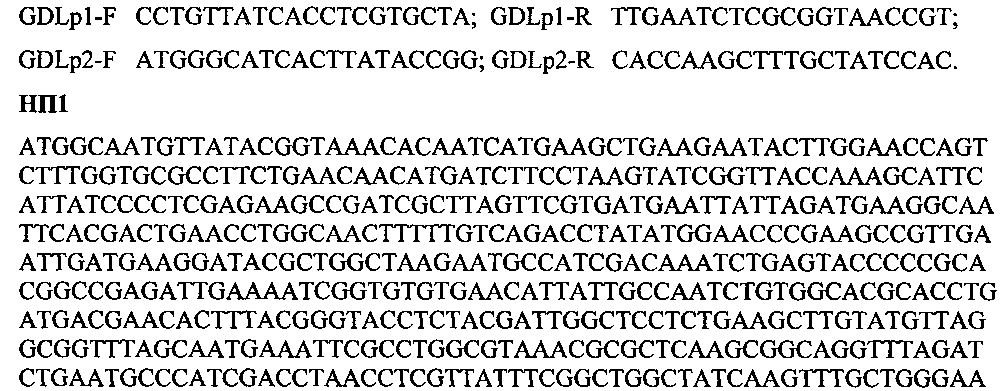
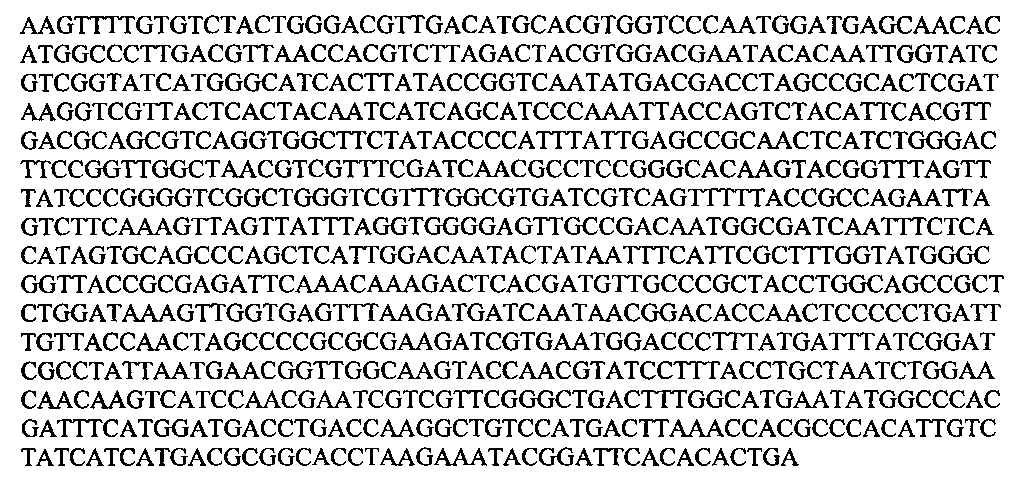
Выравнивание нуклеотидной последовательности с наиболее близким по НП геном штамма Lactobacillus plantarum subsp. plantarum ST-III gb|CP002222.1| (nucleotide BLAST).


Ген gad L. brevis 15f
Для определения НП были использованы праймеры
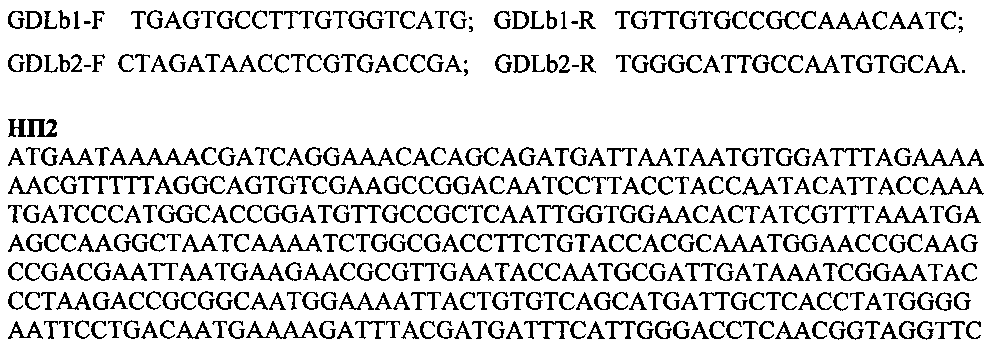
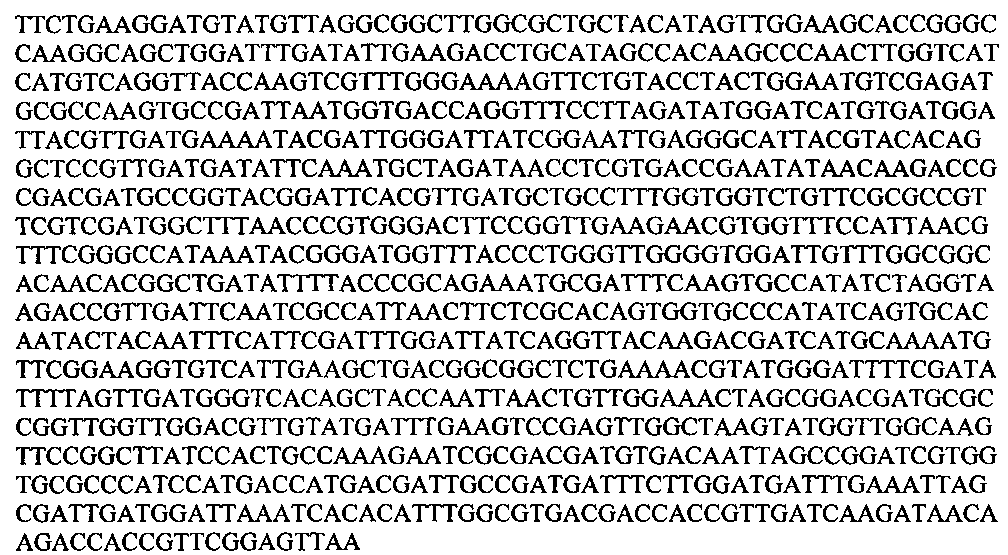
Выравнивание нуклеотидной последовательности гена с наиболее близким по НП геном штамма Lactobacillus brevis КВ290 из GenBank dbj|АР012167.1| (nucleotide BLAST)

Краткое описание чертежей (рисунков)
Рис. 1. Динамика синтеза гамма-аминомасляной кислоты штаммом L. plantarum 90sk.
Контрольные пробы: позиции 1-3 - ГАМК 1-0,5-0,25 мг/мл; позиция 4: глютамат натрия (Глт - 1 мг/мл); позиция 5: смесь питательной среды MRS и ГАМК. Позиции 6-19 - культуры штамма L. plantarum 90sk, выращенные разное время; время роста культур в часах указано под рисунком.
Рис. 2. Характер роста штамма L. plantarum 90sk (синтез ГАМК, KOE). Количество синтезированной ГАМК определялось методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Число колониеобразующих единиц бактерий (КОЕ) определяли высевом разведений бактериальной культуры на твердую среду MRS.
Рис. 3. Динамика синтеза гамма-аминомасляной кислоты штаммом L. brevis 15st.
Контрольные пробы: позиции 1-3 - ГАМК 1-0,5-0,25 мг/мл; позиция 4: глютамат натрия (Глт - 1 мг/мл); позиция 5: смесь питательной среды MRS и ГАМК. Позиции 6-19 - культуры штамма L. brevis 15f, выращенные разное время; время роста культур в часах указано под рисунком.
Рис. 4. Характер роста штамма L. brevis 15st (синтез ГАМК, KOE). Количество синтезированной ГАМК определялось методом тонкослойной хроматографии на пластинах Silica gel 60 F254 (Merck) и двумерного сканирования пластинок на денситометре Shimadzu. Число колониеобразующих единиц бактерий (КОЕ) определяли высевом разведений бактериальной культуры на твердую среду MRS.
Пример 2.
Определение видовой принадлежности штамма L.brevis 15f
Использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT); (Lane, D. J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1563 пн; определяли НП 500 пн (с 46 по 545).
ATACATGCAAGTCGAACGAGCTTCCGTTGAATGACGTGCTTGCACTGATTTTAACAATGAAGCGAGTGGCGAACTGGTGAGTAACACGTGGGAAATCTGCCCAGAAGCAGGGGATAACACTTGGAAACAGGTGCTAATACCGTATAACAACAAAATCCGCATGGATTTTGTTTGAAAGGTGGCTTCGGCTATCACTTCTGGATGATCCCGCGGCGTATTAGTTAGTTGGTGAGGTAAAGGCCCACCAAGACGATGATACGTAGCCGACCTGAGAGGGTAATCGGCCACATTGGGACTGAGACACGGCCCAAACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCACAATGGACGAAAGTCTGATGGAGCAATGCCGCGTGAGTGAAGAAGGGTTTCGGCTCGTAAAACTCTGTTGTTAAAGAAGAACACCTTTGAGAGTAACTGTTCAAGGGTTGACGGTATTTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCC
Пример 3.
Определение видовой принадлежности штамма Lactobacillus plantarum 90sk
1. Для определения вида по нуклеотидной последовательности гена 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D. J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1519 пн; определяли НП 1450 нуклеотидов, с 19 по 1468.
GCCTAATACATGCAAGTCGAACGAACTCTGGTATTGATTGGTGCTTGCATCATGATTTACATTTGAGTGAGTGGCGAACTGGTGAGTAACACGTGGGAAACCTGCCCAGAAGCGGGGGATAACACCTGGAAACAGATGCTAATACCGCATAACAACTTGGACCGCATGGTCCGAGCTTGAAAGATGGCTTCGGCTATCACTTTTGGATGGTCCCGCGGCGTATTAGCTAGATGGTGGGGTAACGGCTCACCATGGCAATGATACGTAGCCGACCTGAGAGGGTAATCGGCCACATTGGGACTGAGACACGGCCCAAACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCACAATGGACGAAAGTCTGATGGAGCAACGCCGCGTGAGTGAAGAAGGGTTTCGGCTCGTAAAACTCTGTTGTTAAAGAAGAACATATCTGAGAGTAACTGTTCAGGTATTGACGGTATTTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCAAGCGTTGTCCGGATTTATTGGGCGTAAAGCGAGCGCAGGCGGTTTTTTAAGTCTGATGTGAAAGCCTTCGGCTCAACCGAAGAAGTGCATCGGAAACTGGGAAACTTGAGTGCAGAAGAGGACAGTGGAACTCCATGTGTAGCGGTGAAATGCGTAGATATATGGAAGAACACCAGTGGCGAAGGCGGCTGTCTGGTCTGTAACTGACGCTGAGGCTCGAAAGTATGGGTAGCAAACAGGATTAGATACCCTGGTAGTCCATACCGTAAACGATGAATGCTAAGTGTTGGAGGGTTTCCGCCCTTCAGTGCTGCAGCTAACGCATTAAGCATTCCGCCTGGGGAGTACGGCCGCAAGGCTGAAACTCAAAGGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGAAGCTACGCGAAGAACCTTACCAGGTCTTGACATACTATGCAAATCTAAGAGATTAGACGTTCCCTTCGGGGACATGGATACAGGTGGTGCATGGTTGTCGTCAGCTCGTGTCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATTATCAGTTGCCAGCATTAAGTTGGGCACTCTGGTGAGACTGCCGGTGACAAACCGGAGGAAGGTGGGGATGACGTCAAATCATCATGCCCCTTATGACCTGGGCTACACACGTGCTACAATGGATGGTACAACGAGTTGCGAACTCGCGAGAGTAAGCTAATCTCTTAAAGCCATTCTCAGTTCGGATTGTAGGCTGCAACTCGCCTACATGAAGTCGGAATCGCTAGTAATCGCGGATCAGCATGCCGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGAGAGTTTGTAACACCCAAAGTCGGTGGGGTAACCTTTTAGGAACCAGCCGCCTAAG
3. Помимо гена 16S рРНК мы используем в работе видоспецифические праймеры и НП межгенного района, предшествующего первому гену оперона F0F1 синтазы atpB
[Патент Ru 2508406 “Метод видовой идентификации лактобацилл L.casei/paracasei, L.fermentum, L.plantarum, L.rhamnosus” АНО «НИЦ «БИОАН» 2012 г.]. Праймеры F0F1Lpl-F (5'-CAAGTCACAATTACTGAGATG-3') и F0F1Lp-R (5'- TTCAGTTCAGTGGTCTAGCA -3').
Для штамма 90sk эта последовательность выглядит так:
GCCGTCATTGCGCGTGCCAAGAATGAAAATAAAGTCAAAATAATGAAAATCCAACGATTTGAAAGCTTAATGAAAGCTTGATATTGTTGGATTTTTATTGATTGACGAAATGTTGAAATTATTTTGAATTTTTTCGACGGTGGTGGTATTATTACCTTTGTATTTTGATTAGGGGTGTCTCTAATCTACCATTTCAGGTTACGATAAAATTGACGTTGACTAGCTCAAAGGTTAAGGTTATCGTAGCACCGAAATTAAAGGAAAGAGGTGATATTCA
Пример 7.
Нуклеотидная последовательность gad-генов (генов глютаматдекарбоксилазы) патентуемых штаммов.
Ген gad L.plantarum 90sk
Для определения НП были использованы праймеры
GDLp1-F CCTGTTATCACCTCGTGCTA; GDLp1-R TTGAATCTCGCGGTAACCGT;
GDLp2-F ATGGGCATCACTTATACCGG; GDLp2-R CACCAAGCTTTGCTATCCAC.
НП1
ATGGCAATGTTATACGGTAAACACAATCATGAAGCTGAAGAATACTTGGAACCAGTCTTTGGTGCGCCTTCTGAACAACATGATCTTCCTAAGTATCGGTTACCAAAGCATTCATTATCCCCTCGAGAAGCCGATCGCTTAGTTCGTGATGAATTATTAGATGAAGGCAATTCACGACTGAACCTGGCAACTTTTTGTCAGACCTATATGGAACCCGAAGCCGTTGAATTGATGAAGGATACGCTGGCTAAGAATGCCATCGACAAATCTGAGTACCCCCGCACGGCCGAGATTGAAAATCGGTGTGTGAACATTATTGCCAATCTGTGGCACGCACCTGATGACGAACACTTTACGGGTACCTCTACGATTGGCTCCTCTGAAGCTTGTATGTTAGGCGGTTTAGCAATGAAATTCGCCTGGCGTAAACGCGCTCAAGCGGCAGGTTTAGATCTGAATGCCCATCGACCTAACCTCGTTATTTCGGCTGGCTATCAAGTTTGCTGGGAAAAGTTTTGTGTCTACTGGGACGTTGACATGCACGTGGTCCCAATGGATGAGCAACACATGGCCCTTGACGTTAACCACGTCTTAGACTACGTGGACGAATACACAATTGGTATCGTCGGTATCATGGGCATCACTTATACCGGTCAATATGACGACCTAGCCGCACTCGATAAGGTCGTTACTCACTACAATCATCAGCATCCCAAATTACCAGTCTACATTCACGTTGACGCAGCGTCAGGTGGCTTCTATACCCCATTTATTGAGCCGCAACTCATCTGGGACTTCCGGTTGGCTAACGTCGTTTCGATCAACGCCTCCGGGCACAAGTACGGTTTAGTTTATCCCGGGGTCGGCTGGGTCGTTTGGCGTGATCGTCAGTTTTTACCGCCAGAATTAGTCTTCAAAGTTAGTTATTTAGGTGGGGAGTTGCCGACAATGGCGATCAATTTCTCACATAGTGCAGCCCAGCTCATTGGACAATACTATAATTTCATTCGCTTTGGTATGGGCGGTTACCGCGAGATTCAAACAAAGACTCACGATGTTGCCCGCTACCTGGCAGCCGCTCTGGATAAAGTTGGTGAGTTTAAGATGATCAATAACGGACACCAACTCCCCCTGATTTGTTACCAACTAGCCCCGCGCGAAGATCGTGAATGGACCCTTTATGATTTATCGGATCGCCTATTAATGAACGGTTGGCAAGTACCAACGTATCCTTTACCTGCTAATCTGGAACAACAAGTCATCCAACGAATCGTCGTTCGGGCTGACTTTGGCATGAATATGGCCCACGATTTCATGGATGACCTGACCAAGGCTGTCCATGACTTAAACCACGCCCACATTGTCTATCATCATGACGCGGCACCTAAGAAATACGGATTCACACACTGA
Выравнивание нуклеотидной последовательности с наиболее близким по НП геном штамма Lactobacillus plantarum subsp. plantarum ST-III gb|CP002222.1| (nucleotide BLAST).
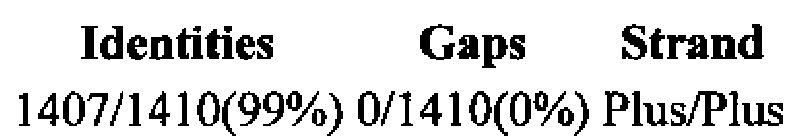
Query 1 ATGGCAATGTTATACGGTAAACACAATCATGAAGCTGAAGAATACTTGGAACCAGTCTTT 60
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998620 ATGGCAATGTTATACGGTAAACACAATCATGAAGCTGAAGAATACTTGGAACCAGTCTTT 2998679
Query 61 GGTGCGCCTTCTGAACAACATGATCTTCCTAAGTATCGGTTACCAAAGCATTCATTATCC 120
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998680 GGTGCGCCTTCTGAACAACATGATCTTCCTAAGTATCGGTTACCAAAGCATTCATTATCC 2998739
Query 121 CCTCGAGAAGCCGATCGCTTAGTTCGTGATGAATTATTAGATGAAGGCAATTCACGACTG 180
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998740 CCTCGAGAAGCCGATCGCTTAGTTCGTGATGAATTATTAGATGAAGGCAATTCACGACTG 2998799
Query 181 AACCTGGCAACTTTTTGTCAGACCTATATGGAACCCGAAGCCGTTGAATTGATGAAGGAT 240
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998800 AACCTGGCAACTTTTTGTCAGACCTATATGGAACCCGAAGCCGTTGAATTGATGAAGGAT 2998859
Query 241 ACGCTGGCTAAGAATGCCATCGACAAATCTGAGTACCCCCGCACGGCCGAGATTGAAAAT 300
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998860 ACGCTGGCTAAGAATGCCATCGACAAATCTGAGTACCCCCGCACGGCCGAGATTGAAAAT 2998919
Query 301 CGGTGTGTGAACATTATTGCCAATCTGTGGCACGCACCTGATGACGAACACTTTACGGGT 360
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998920 CGGTGTGTGAACATTATTGCCAATCTGTGGCACGCACCTGATGACGAACACTTTACGGGT 2998979
Query 361 ACCTCTACGATTGGCTCCTCTGAAGCTTGTATGTTAGGCGGTTTAGCAATGAAATTCGCC 420
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2998980 ACCTCTACGATTGGCTCCTCTGAAGCTTGTATGTTAGGCGGTTTAGCAATGAAATTCGCC 2999039
Query 421 TGGCGTAAACGCGCTCAAGCGGCAGGTTTAGATCTGAATGCCCATCGACCTAACCTCGTT 480
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999040 TGGCGTAAACGCGCTCAAGCGGCAGGTTTAGATCTGAATGCCCATCGACCTAACCTCGTT 2999099
Query 481 ATTTCGGCTGGCTATCAAGTTTGCTGGGAAAAGTTTTGTGTCTACTGGGACGTTGACATG 540
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999100 ATTTCGGCTGGCTATCAAGTTTGCTGGGAAAAGTTTTGTGTCTACTGGGACGTTGACATG 2999159
Query 541 CACGTGGTCCCAATGGATGAGCAACACATGGCCCTTGACGTTAACCACGTCTTAGACTAC 600
||||||||||||||||||||||||||||||| ||||||||||||||||||||||||||||
Sbjct 2999160 CACGTGGTCCCAATGGATGAGCAACACATGGTCCTTGACGTTAACCACGTCTTAGACTAC 2999219
Query 601 GTGGACGAATACACAATTGGTATCGTCGGTATCATGGGCATCACTTATACCGGTCAATAT 660
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999220 GTGGACGAATACACAATTGGTATCGTCGGTATCATGGGCATCACTTATACCGGTCAATAT 2999279
Query 661 GACGACCTAGCCGCACTCGATAAGGTCGTTACTCACTACAATCATCAGCATCCCAAATTA 720
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999280 GACGACCTAGCCGCACTCGATAAGGTCGTTACTCACTACAATCATCAGCATCCCAAATTA 2999339
Query 721 CCAGTCTACATTCACGTTGACGCAGCGTCAGGTGGCTTCTATACCCCATTTATTGAGCCG 780
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999340 CCAGTCTACATTCACGTTGACGCAGCGTCAGGTGGCTTCTATACCCCATTTATTGAGCCG 2999399
Query 781 CAACTCATCTGGGACTTCCGGTTGGCTAACGTCGTTTCGATCAACGCCTCCGGGCACAAG 840
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999400 CAACTCATCTGGGACTTCCGGTTGGCTAACGTCGTTTCGATCAACGCCTCCGGGCACAAG 2999459
Query 841 TACGGTTTAGTTTATCCCGGGGTCGGCTGGGTCGTTTGGCGTGATCGTCAGTTTTTACCG 900
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999460 TACGGTTTAGTTTATCCCGGGGTCGGCTGGGTCGTTTGGCGTGATCGTCAGTTTTTACCG 2999519
Query 901 CCAGAATTAGTCTTCAAAGTTAGTTATTTAGGTGGGGAGTTGCCGACAATGGCGATCAAT 960
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999520 CCAGAATTAGTCTTCAAAGTTAGTTATTTAGGTGGGGAGTTGCCGACAATGGCGATCAAC 2999579
Query 961 TTCTCACATAGTGCAGCCCAGCTCATTGGACAATACTATAATTTCATTCGCTTTGGTATG 1020
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999580 TTCTCACATAGTGCAGCCCAGCTCATTGGACAATACTATAATTTCATTCGCTTTGGTATG 2999639
Query 1021 GGCGGTTACCGCGAGATTCAAACAAAGACTCACGATGTTGCCCGCTACCTGGCAGCCGCT 1080
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999640 GACGGTTACCGCGAGATTCAAACAAAGACTCACGATGTTGCCCGCTACCTGGCAGCCGCT 2999699
Query 1081 CTGGATAAAGTTGGTGAGTTTAAGATGATCAATAACGGACACCAACTCCCCCTGATTTGT 1140
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999700 CTGGATAAAGTTGGTGAGTTTAAGATGATCAATAACGGACACCAACTCCCCCTGATTTGT 2999759
Query 1141 TACCAACTAGCCCCGCGCGAAGATCGTGAATGGACCCTTTATGATTTATCGGATCGCCTA 1200
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999760 TACCAACTAGCCCCGCGCGAAGATCGTGAATGGACCCTTTATGATTTATCGGATCGCCTA 2999819
Query 1201 TTAATGAACGGTTGGCAAGTACCAACGTATCCTTTACCTGCTAATCTGGAACAACAAGTC 1260
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999820 TTAATGAACGGTTGGCAAGTACCAACGTATCCTTTACCTGCTAATCTGGAACAACAAGTC 2999879
Query 1261 ATCCAACGAATCGTCGTTCGGGCTGACTTTGGCATGAATATGGCCCACGATTTCATGGAT 1320
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999880 ATCCAACGAATCGTCGTTCGGGCTGACTTTGGCATGAATATGGCCCACGATTTCATGGAT 2999939
Query 1321 GACCTGACCAAGGCTGTCCATGACTTAAACCACGCCCACATTGTCTATCATCATGACGCG 1380
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 2999940 GACCTGACCAAGGCTGTCCATGACTTAAACCACGCCCACATTGTCTATCATCATGACGCG 2999999
Query 1381 GCACCTAAGAAATACGGATTCACACACTGA 1410
||||||||||||||||||||||||||||||
Sbjct 3000000 GCACCTAAGAAATACGGATTCACACACTGA 3000029
Ген gad L.brevis 15f
Для определения НП были использованы праймеры
GDLb1-F TGAGTGCCTTTGTGGTCATG; GDLb1-R TGTTGTGCCGCCAAACAATC;
GDLb2-F CTAGATAACCTCGTGACCGA; GDLb2-R TGGGCATTGCCAATGTGCAA.
НП2
ATGAATAAAAACGATCAGGAAACACAGCAGATGATTAATAATGTGGATTTAGAAAAAACGTTTTTAGGCAGTGTCGAAGCCGGACAATCCTTACCTACCAATACATTACCAAATGATCCCATGGCACCGGATGTTGCCGCTCAATTGGTGGAACACTATCGTTTAAATGAAGCCAAGGCTAATCAAAATCTGGCGACCTTCTGTACCACGCAAATGGAACCGCAAGCCGACGAATTAATGAAGAACGCGTTGAATACCAATGCGATTGATAAATCGGAATACCCTAAGACCGCGGCAATGGAAAATTACTGTGTCAGCATGATTGCTCACCTATGGGGAATTCCTGACAATGAAAAGATTTACGATGATTTCATTGGGACCTCAACGGTAGGTTCTTCTGAAGGATGTATGTTAGGCGGCTTGGCGCTGCTACATAGTTGGAAGCACCGGGCCAAGGCAGCTGGATTTGATATTGAAGACCTGCATAGCCACAAGCCCAACTTGGTCATCATGTCAGGTTACCAAGTCGTTTGGGAAAAGTTCTGTACCTACTGGAATGTCGAGATGCGCCAAGTGCCGATTAATGGTGACCAGGTTTCCTTAGATATGGATCATGTGATGGATTACGTTGATGAAAATACGATTGGGATTATCGGAATTGAGGGCATTACGTACACAGGCTCCGTTGATGATATTCAAATGCTAGATAACCTCGTGACCGAATATAACAAGACCGCGACGATGCCGGTACGGATTCACGTTGATGCTGCCTTTGGTGGTCTGTTCGCGCCGTTCGTCGATGGCTTTAACCCGTGGGACTTCCGGTTGAAGAACGTGGTTTCCATTAACGTTTCGGGCCATAAATACGGGATGGTTTACCCTGGGTTGGGGTGGATTGTTTGGCGGCACAACACGGCTGATATTTTACCCGCAGAAATGCGATTTCAAGTGCCATATCTAGGTAAGACCGTTGATTCAATCGCCATTAACTTCTCGCACAGTGGTGCCCATATCAGTGCACAATACTACAATTTCATTCGATTTGGATTATCAGGTTACAAGACGATCATGCAAAATGTTCGGAAGGTGTCATTGAAGCTGACGGCGGCTCTGAAAACGTATGGGATTTTCGATATTTTAGTTGATGGGTCACAGCTACCAATTAACTGTTGGAAACTAGCGGACGATGCGCCGGTTGGTTGGACGTTGTATGATTTGAAGTCCGAGTTGGCTAAGTATGGTTGGCAAGTTCCGGCTTATCCACTGCCAAAGAATCGCGACGATGTGACAATTAGCCGGATCGTGGTGCGCCCATCCATGACCATGACGATTGCCGATGATTTCTTGGATGATTTGAAATTAGCGATTGATGGATTAAATCACACATTTGGCGTGACGACCACCGTTGATCAAGATAACAAGACCACCGTTCGGAGTTAA
Выравнивание нуклеотидной последовательности гена с наиболее близким по НП геном штамма Lactobacillus brevis KB290 из GenBank dbj|AP012167.1| (nucleotide BLAST)
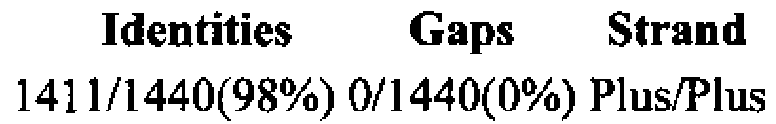
Query 1 ATGAATAAAAACGATCAGGAAACACAGCAGATGATTAATAATGTGGATTTAGAAAAAACG 60
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 68817 ATGAATAAAAACGATCAGGAAACACAGCAGATGATTAATAATGTGGATTTAGAAAAAACG 68876
Query 61 TTTTTAGGCAGTGTCGAAGCCGGACAATCCTTACCTACCAATACATTACCAAATGATCCC 120
||||||||||||||||||||||| ||||||||||| ||||||||||||||| ||||||||
Sbjct 68877 TTTTTAGGCAGTGTCGAAGCCGGGCAATCCTTACCCACCAATACATTACCAGATGATCCC 68936
Query 121 ATGGCACCGGATGTTGCCGCTCAATTGGTGGAACACTATCGTTTAAATGAAGCCAAGGCT 180
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 68937 ATGGCACCGGATGTTGCCGCTCAATTGGTGGAACACTATCGTTTAAATGAAGCCAAGGCT 68996
Query 181 AATCAAAATCTGGCGACCTTCTGTACCACGCAAATGGAACCGCAAGCCGACGAATTAATG 240
|||||||| || ||||||||||||||||||||||||||||| |||||||| |||||||||
Sbjct 68997 AATCAAAACCTAGCGACCTTCTGTACCACGCAAATGGAACCACAAGCCGATGAATTAATG 69056
Query 241 AAGAACGCGTTGAATACCAATGCGATTGATAAATCGGAATACCCTAAGACCGCGGCAATG 300
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69057 AAGAACGCGTTGAATACCAATGCGATTGATAAATCGGAATACCCTAAGACCGCGGCAATG 69116
Query 301 GAAAATTACTGTGTCAGCATGATTGCTCACCTATGGGGAATTCCTGACAATGAAAAGATT 360
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69117 GAAAATTACTGTGTCAGCATGATTGCTCACCTATGGGGAATTCCTGACAATGAAAAGATT 69176
Query 361 TACGATGATTTCATTGGGACCTCAACGGTAGGTTCTTCTGAAGGATGTATGTTAGGCGGC 420
|||||||||||||||||||||||||| |||||||||||||||||||||||||||||||||
Sbjct 69177 TACGATGATTTCATTGGGACCTCAACTGTAGGTTCTTCTGAAGGATGTATGTTAGGCGGC 69236
Query 421 TTGGCGCTGCTACATAGTTGGAAGCACCGGGCCAAGGCAGCTGGATTTGATATTGAAGAC 480
|||||||| ||||||||||||||||||||||||||||||||||| |||||||||||||||
Sbjct 69237 TTGGCGCTACTACATAGTTGGAAGCACCGGGCCAAGGCAGCTGGTTTTGATATTGAAGAC 69296
Query 481 CTGCATAGCCACAAGCCCAACTTGGTCATCATGTCAGGTTACCAAGTCGTTTGGGAAAAG 540
||||||||||||||||||||||||||||||||||||||||||||||| ||||||||||||
Sbjct 69297 CTGCATAGCCACAAGCCCAACTTGGTCATCATGTCAGGTTACCAAGTTGTTTGGGAAAAG 69356
Query 541 TTCTGTACCTACTGGAATGTCGAGATGCGCCAAGTGCCGATTAATGGTGACCAGGTTTCC 600
||||||||||| |||||||||||||||||||||||||| |||||||||||||| ||||||
Sbjct 69357 TTCTGTACCTATTGGAATGTCGAGATGCGCCAAGTGCCAATTAATGGTGACCAAGTTTCC 69416
Query 601 TTAGATATGGATCATGTGATGGATTACGTTGATGAAAATACGATTGGGATTATCGGAATT 660
|||||||||||||||||||||||||| |||||||||||||||||||||||||||||||||
Sbjct 69417 TTAGATATGGATCATGTGATGGATTATGTTGATGAAAATACGATTGGGATTATCGGAATT 69476
Query 661 GAGGGCATTACGTACACAGGCTCCGTTGATGATATTCAAATGCTAGATAACCTCGTGACC 720
|||||||||||||||||||||||||||||||||||||||| |||||||||||||||||||
Sbjct 69477 GAGGGCATTACGTACACAGGCTCCGTTGATGATATTCAAACGCTAGATAACCTCGTGACC 69536
Query 721 GAATATAACAAGACCGCGACGATGCCGGTACGGATTCACGTTGATGCTGCCTTTGGTGGT 780
|||||||| ||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69537 GAATATAATAAGACCGCGACGATGCCGGTACGGATTCACGTTGATGCTGCCTTTGGTGGC 69596
Query 781 CTGTTCGCGCCGTTCGTCGATGGCTTTAACCCGTGGGACTTCCGGTTGAAGAACGTGGTT 840
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69597 CTGTTCGCGCCGTTCGTCGATGGCTTTAACCCGTGGGACTTCCGGTTGAAGAACGTGGTT 69656
Query 841 TCCATTAACGTTTCGGGCCATAAATACGGGATGGTTTACCCTGGGTTGGGGTGGATTGTT 900
||||||||||||||||||||||| ||||||||||||||||||||||||||||||||||||
Sbjct 69657 TCCATTAACGTTTCGGGCCATAAGTACGGGATGGTTTACCCTGGGTTGGGGTGGATTGTT 69716
Query 901 TGGCGGCACAACACGGCTGATATTTTACCCGCAGAAATGCGATTTCAAGTGCCATATCTA 960
|||||||||||||||||||||||||||||||||||||||||||| |||||||||||||||
Sbjct 69717 TGGCGGCACAACACGGCTGATATTTTACCCGCAGAAATGCGATTCCAAGTGCCATATCTA 69776
Query 961 GGTAAGACCGTTGATTCAATCGCCATTAACTTCTCGCACAGTGGTGCCCATATCAGTGCA 1020
||||||||||||||||||||||||||||||||||| |||||||||||||||||||||||
Sbjct 69777 GGTAAGACCGTTGATTCAATCGCCATTAACTTCTCACACAGTGGTGCCCATATCAGTGCG 69836
Query 1021 CAATACTACAATTTCATTCGATTTGGATTATCAGGTTACAAGACGATCATGCAAAATGTT 1080
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69837 CAATACTACAATTTCATTCGATTTGGATTATCAGGTTACAAGACGATCATGCAAAATGTT 69896
Query 1081 CGGAAGGTGTCATTGAAGCTGACGGCGGCTCTGAAAACGTATGGGATTTTCGATATTTTA 1140
|||||||||||||||||||||||||| |||||||||||||||||||||||||||||||||
Sbjct 69897 CGGAAGGTGTCATTGAAGCTGACGGCAGCTCTGAAAACGTATGGGATTTTCGATATTTTA 69956
Query 1141 GTTGATGGGTCACAGCTACCAATTAACTGTTGGAAACTAGCGGACGATGCGCCGGTTGGT 1200
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 69957 GTTGATGGGTCACAGCTACCAATTAACTGTTGGAAACTAGCGGACGATGCGCCGGTTGGT 70016
Query 1201 TGGACGTTGTATGATTTGAAGTCCGAGTTGGCTAAGTATGGTTGGCAAGTTCCGGCTTAT 1260
|||||||| ||||||||| ||||||||||||||||||||||||||||||||||||| |||
Sbjct 70017 TGGACGTTATATGATTTGGAGTCCGAGTTGGCTAAGTATGGTTGGCAAGTTCCGGCATAT 70076
Query 1261 CCACTGCCAAAGAATCGCGACGATGTGACAATTAGCCGGATCGTGGTGCGCCCATCCATG 1320
||||||||||||||||||||||||||||||||||||||||||||||| ||||||||||||
Sbjct 70077 CCACTGCCAAAGAATCGCGACGATGTGACAATTAGCCGGATCGTGGTACGCCCATCCATG 70136
Query 1321 ACCATGACGATTGCCGATGATTTCTTGGATGATTTGAAATTAGCGATTGATGGATTAAAT 1380
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 70137 ACCATGACGATTGCCGATGATTTCTTGGATGATTTGAAATTAGCGATTGATGGATTAAAT 70196
Query 1381 CACACATTTGGCGTGACGACCACCGTTGATCAAGATAACAAGACCACCGTTCGGAGTTAA 1440
||||||||||||||||||||||||||||||||| ||||||||||||||||||| ||||||
Sbjct 70197 CACACATTTGGCGTGACGACCACCGTTGATCAAAATAACAAGACCACCGTTCGAAGTTAA 70256