Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к новым производным пирроло[3,2-d]пиримидин-4-она, к способам их получения, к композициям, содержащим их, и к их применению в терапии.
Предшествующий уровень техники
Миелопероксидаза (МПО) представляет собой гемсодержащий фермент, обнаруживаемый главным образом в полиморфоядерных лейкоцитах (ПМЯЛ). МПО является одним из членов разнообразного белкового семейства пероксидаз млекопитающих, которое также включает пероксидазу эозинофилов, пероксидазу щитовидной железы, пероксидазу слюны, лактопероксидазу, простагландин Н синтазу и другие. Зрелый фермент представляет собой димер из идентичных частей. Каждая часть молекулы содержит ковалентно связанный тем, который демонстрирует необычные спектральные свойства, ответственные за характерный зеленый цвет МПО. Расщепление дисульфидного мостика, связывающего две части МПО, дает геми-фермент, который демонстрирует спектральные и каталитические свойства, неотличимые от свойств интактного фермента. Данный фермент использует пероксид водорода для окисления хлорида до хлорноватистой кислоты. Другие галогениды и псевдогалоген иды (такие как тиоцианат) также являются физиологическими субстратами МПО.
ПМЯЛ особенно важны для борьбы с инфекциями. Эти клетки содержат МПО с хорошо подтвержденным бактерицидным действием. ПМЯЛ действуют неспецифично путем фагоцитоза для поглощения микроорганизмов, включают их в вакуоли, называемые фагосомами, которые сливаются с гранулами, содержащими миелопероксидазу, с образованием фаголизосом. В фаголизосомах ферментативная активность миелопероксидазы приводит к образованию хлорноватистой кислоты, сильнодействующего бактерицидного соединения. Сама хлорноватистая кислота является окислителем и наиболее сильно реагирует с тиолами и тиоэфирами, но также превращает амины в хлорамины и хлорирует ароматические аминокислоты. Макрофаги представляют собой большие фагоцитирующие клетки, которые, подобно ПМЯЛ, способны фагоцитировать микроорганизмы. Макрофаги могут генерировать пероксид водорода и при активации также продуцируют миелопероксидазу. МПО и пероксид водорода также могут высвобождаться наружу из клеток, где реакция с хлоридом может индуцировать повреждение прилегающей ткани.
Связь активности миелопероксидазы с заболеванием подразумевали при неврологических заболеваниях с нейровоспалительной реакцией, включая рассеянный склероз, болезнь Альцгеймера, болезнь Паркинсона и инсульт, а также при других воспалительных заболеваниях или состояниях, таких как астма, хроническая обструктивная болезнь легких, кистозный фиброз, атеросклероз, воспалительная болезь кишечника, гломерулярное повреждение почек и ревматоидный артрит.Также предполагали, что рак легкого связан с высокими уровнями МПО.
Рассеянный склероз (PC)
МПО-позитивные клетки в большом количестве присутствуют в кровотоке и в ткани, подвергающейся воспалению. Более конкретно, макрофаги и микроглия, содержащие МПО, были подтверждены в ЦНС во время заболевания: рассеянного склероза (Nagra RM, et al. Journal of Neuroimmunology 1997; 78(1-2):97-107), болезни Паркинсона (Choi D-K. et al. J. Neurosci. 2005; 25(28):6594-600) и болезни Альцгеймера (Green PS. et al. Journal of Neurochemistry. 2004; 90(3):724-33). Предполагается, что некоторые аспекты хронического продолжающегося воспаления приводят к очень сильной деструкции, где важную роль имеют агенты из реакций МПО.
Данный фермент высвобождается внеклеточно, а также в фаголизосомы в нейтрофилах (Hampton MB, Kettle AJ, Winterbourn CC. Blood 1998; 92(9):3007-17). Предпосылкой для активности МПО является присутствие пероксида водорода, генерированного никотинамидаденин-динуклеотидфосфат-оксидазой (NADPH-оксидазой) и последующей дисмутацией супероксида. Окисленный фермент способен использовать множество разных субстратов, из которых лучше всего распознается хлорид. В этой реакции образуется сильный нерадикальный окислитель - хлорноватистая кислота (HOCl). HOCl очень эффективно окисляет серосодержащие аминокислоты, такие как цистеин и метионин (Peskin AV, Winterbourn CC. Free Radical Biology and Medicine 2001; 30(5);572-9). Она также образует хлорамины с аминогруппами как в белках, так и в других биомолекулах (Peskin AV. et al. Free Radical Biology and Medicine 2004; 37(10): 1622-30). Она хлорирует фенолы (такие как тирозин) (Hazen SL. et al. Mass Free Radical Biology and Medicine 1997; 23(6):909-16) и ненасыщенные связи в липидах (Albert CJ. et al. J. Biol. Chem. 2001; 276(26):23733-41), окисляет центры с железом (Rosen H, Klebanoff SJ. Journal of Biological Chemistry 1982; 257(22): 13731-354) и перекрестно связывает белки (Fu X, Mueller DM, Heinecke JW. Biochemistry 2002; 41(4):1293-301).
Протеолитические каскады участвуют как в проникновении клеток через гематоэнцефалический барьер (ГЭБ), так и в разрушении ГЭБ, миелина и нервных клеток (Cuzner ML, Opdenakker G. Journal of Neuroimmunology 1999; 94(1-2): 1-14; Yong VW. et al. Nature Reviews Neuroscience 2001; 2(7):502-11.). Активация металлопротеиназ матрикса (МПМ) может осуществляться через действие протеаз, расположенных выше в каскаде, а также через окисление дисульфидного мостика (Fu X. et al. J. Biol. Chem. 2001; 276(44):41279-87; Gu Z. et al. Science 2002; 297(5584):1186-90). Это окисление может быть либо нитрозилированием, либо окислением, опосредованным HOCl. Обе реакции могут быть следствием активности МПО. В нескольких сообщениях предполагали о роли МПМ в целом и, в частности, МПМ-9 во влиянии на инфильтрацию клеток, а также в повреждении ткани (разрушении ГЭБ и демиелинизации), как при PC, так и при ЕАЕ (для обзора смотри Yong VW. et al. выше). Важность этих конкретных видов механизмов при PC исходит из исследований, где в ткани мозга и цереброспинальной жидкости (ЦСЖ) при PC идентифицировали повышенную активность и присутствие протеаз. Поддерживающие данные также получали путем проведения исследований ЕАЕ с мышами, имеющими дефицит некоторых протеаз, для которых подразумевали вовлечение в патологию PC, или путем применения фармакологических подходов.
Предполагают, что демиелинизация зависит от цитотоксических Т-клеток и токсичных продуктов, генерированных активированными фагоцитами (Lassmann H.J Neurol Neurosurg Psychiatry 2003; 74(6):695-7). На потерю аксонов, таким образом, влияют протеазы и реакционноспособные промежуточные соединения кислорода и азота. Когда присутствует МПО, она очевидно будет иметь способность как к активации протеаз (непосредственно, а также через отмену ингибирования, влияя на ингибиторы протеазы), так и к генерации реактивных соединений.
Хроническая обструктивная болезнь легких (ХОБЛ)
Хроническая обструктивная болезнь легких (ХОБЛ) представляет собой болезненное состояние, отличающееся ограничением потока воздуха, которое не является полностью обратимым. Ограничение потока воздуха обычно является как прогрессирующим, так и связанным с ненормальной воспалительной реакцией легких на токсичные частицы или газы. ХОБЛ представляет собой важную проблему здравоохранения. В Соединенных Штатах она является четвертой лидирующей причиной хронической заболеваемости и смертности, и в 2020 прогнозируется на 5-ом месте в мире в качестве самого обременительного заболевания. В Великобритании распространение ХОБЛ составляет 1,7% у мужчин и 1,4% у женщин. ХОБЛ охватывает диапазон тяжести заболевания от умеренной до очень тяжелой, причем стоимость лечения быстро возрастает по мере увеличения тяжести.
Уровни МПО в мокроте и бронхоальвеолярных выделениях (БАВ) значительно выше у пациентов с ХОБЛ, чем у нормальных некурящих контрольных пациентов (Keatings V.M., Barnes P.J. Am J Respir Crit Care Med 1997; 155:449-453; Pesci, A. et al. Eur Respir J 1998:12:380-386). Уровни МПО дополнительно повышаются во время обострений данного заболевания (Fiorini G. et al. Biomedicine & Pharmacotherapy 2000; 54:274-278; Crooks S.W. et al. European Respiratory Journal. 15(2):274-80, 2000). Роль МПО, вероятно, является более важной при обострениях ХОБЛ (Sharon S.D. et al. Am J Respir Crit Care Med. 2001:163:349-355).
Помимо деструктивной способности МПО существует сильная клиническая связь с сосудистым заболеванием (Baldus S. et al. Circulation 2003:108:1440-5). Дисфункциональные полиморфизмы МПО ассоциированы с пониженным риском смертности от заболевания коронарных артерий (Nikpoor В. et al. Am Heart J 2001; 142:336), и пациенты с высокими уровнями МПО в сыворотке имеют повышенный риск острого коронарного синдрома. Эффекты МПО на сосудистое заболевание могут простираться до ХОБЛ, так как существует строгое доказательство того, легочные сосуды являются одним из самых ранних мест поражения легких курящих. Описали поразительные изменения в интиме артерий легких, которые показывают взаимосвязь с дозой курения (Hale K.A., Niewoehner D.E., Cosio M.G. Am Rev Resp Dis 1980:122:273-8). Физиологическая функция МПО связана с врожденной защитой хозяина. Эта роль, однако, не является критической, так как в большинстве случаев пациенты с недостаточностью МПО имеют относительно неопасные симптомы (Parry M.F. et al. Ann Int Med. 1981; 95:293-301, Yang, K.D., Hill, H.R. Pediatr Infect Dis J. 2001:20: 889-900). В итоге, существует множество доказательств того, что повышенные уровни МПО при ХОБЛ могут способствовать заболеванию посредством нескольких механизмов. Следовательно, можно ожидать, что избирательный ингибитор МПО облегчит как острые, так и хронические воспалительные аспекты ХОБЛ, и может ослабить развитие эмфиземы.
Атеросклероз
Ингибитор МПО должен ослаблять предрасположенность к атеросклерозу и/или восприимчивость существующих атеросклеротических поражений и, посредством этого, снижать риск острого инфаркта миокарда, нестабильной стенокардии или инсульта. Несколько групп данных подтверждают роль МПО в атеросклерозе. МПО экспрессируется в плечевых участках и в некротическом ядре атеросклеротических поражений человека, и активный фермент выделили из аутопсических образцов поражений человека (Daugherty, А. et al. (1994) J Clin Invest 94(1): 437-44). Повышенное количество макрофагов, экспрессирующих МПО, продемонстрировали в поражениях человека, связанных с эрозией и разрывом, по сравнению с жировыми прослойками, что свидетельствует об особой роли МПО в острых коронарных синдромах (Sugiyama, S. et al. (2001) Am J Pathol 158(3): 879-91). Пациенты с установленным заболеванием коронарных артерий имеют более высокие уровни МПО в плазме и в лейкоцитах, чем здоровые контрольные пациенты (Zhang, R. et al. (2001) Jama 286(17): 2136-42). Кроме того, в двух больших проспективных исследованиях уровни МПО в плазме предсказывали риск развития будущих коронарных осложнений или реваскуляризации (Baldus, S. et al. (2003) Circulation 108(12): 1440-5; Brennan, M. et al. (2003) N EngI J Med 349(17): 1595-604). Общая недостаточность МПО у человека имеет частоту случаев 1 на 2000-4000 индивидуумов. Эти индивидуумы в основном выглядят здоровыми, но сообщали о нескольких случаях серьезной инфекции Candida. Интересно, что человек с недостатком МПО менее подвержен сердечно-сосудистому заболеванию, чем контроли с нормальными уровнями МПО (Kutter, D. et al. (2000) Acta Haematol 104(1)). Полиморфизм в промоторе МПО воздействует на экспрессию, что приводит к появлению индивидуумов с сильной и слабой экспрессией МПО. В трех разных исследованиях генотип с сильной экспрессией связывали с повышенным риском сердечно-сосудистого заболевания (Nikpoor, В. et al. (2001) Am Heart J 142(2): 336-9; Makela, R„ P. J. Karhunen, et al. (2003) Lab Invest 83(7): 919-25; Asselbergs, F. W, et al. (2004) Am J Med 116(6): 429-30). Данные, собранные на протяжении последних десяти лет, указывают на то, что проатерогенные действия МПО включают окисление липопротеинов, индукцию дисфункции эндотелия через потребление оксида азота и дестабилизацию атеросклеротических поражений путем активации протеаз (Nicholls, S. J. and S. L. Hazen (2005) Arterioscler Thromb Vase Biol 25(6): 1102-11). Недавно несколько исследований сосредоточились на нитро- и хлортирозиновых модификациях липопротеинов низкой плотности (ЛНП) и липопротеинов высокой плотности (ЛВП). Поскольку хлортирозиновые модификации in vivo могут генерироваться только хлорноватистой кислотой, продуцируемой МПО, эти модификации рассматриваются как специфические маркеры активности МПО (Hazen, S. L. and J. W. Heinecke (1997) J Clin Invest 99(9): 2075-81). Частицы ЛНП, подверженные действию МПО in vitro, становятся агрегированными, что приводит к облегченному поглощению посредством фагоцитарных рецепторов макрофагов и образования пенистых клеток (Hazell, L. J. andR. Stocker (1993) Biochem J 290 (Pt 1): 165-72). Хлортирозиновая модификация апоА1, главного аполипопротеина холестерина ЛВП, приводит к ослабленной холестерин-акцепторной функции (Bergt, С., S. et al. (2004) Proc NatI Acad Sci USA; Zheng, L. et al. (2004) J Clin Invest 114(4): 529-41). Систематические исследования этих механизмов показали, что в плазме МПО связывается и транспортируется с апоА1. Кроме того, МПО специфически направляется к тем остаткам тирозина апоА1, которые физически взаимодействуют с кассетным транспортером макрофагов АВСА1 во время оттока холестерина из макрофага (Bergt, С. et al. (2004) J Biol Chem 279(9): 7856-66; Shao, В. et al. (2005) J Biol Chem 280(7): 5983-93; Zheng et al. (2005) J Biol Chem 280(1): 38-47). Таким образом, МПО, по-видимому, имеет двойную усугубляющую роль в атеросклеротических поражениях, то есть увеличивает накопление липидов через агрегацию частиц ЛНП и снижает обратный транспорт холестерина посредством атаки на белок апоА1 ЛВП.
1-β-O-Рибофуранозил-2-оксопирроло[3,2-d]пиримидин-4(3Н,5Н)-тион и 1-(2,3,5-три-O-бензоил-1-β-G-рибофуранозил)-2-оксопирроло[3,2-d]пиримидин-4(3Н,5Н)-тион
раскрыты в J. Heterocyclic Chemistry, 1992, 29, 343-354. Этим соединениям не приписывают никакой фармакологической активности. 5,7-Димеркапто-1,4,6-триазаинден S
раскрыт в Chem. Pharm. Bull., 1964, 12, 1030-1042 и в патенте Японии JP 02160235 А2. Этому соединению не приписывают никакой фармакологической активности.
В настоящем изобретении раскрыты новые производные пирроло[3,2-d]пиримидин-4-она, которые неожиданно проявляют полезные свойства в качестве ингибиторов фермента МПО. Эти соединения также могут показывать избирательность в отношении родственных ферментов, например лактопероксидазы (ЛПО) и пероксидазы щитовидной железы (ПЩЗ).
Описание избретения
В настоящем изобретении предложены соединения формулы (I)
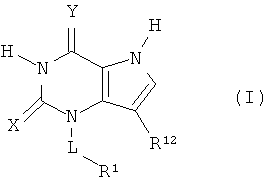
где:
по меньшей мере один из Х и Y представляет собой S, и другие
представляют собой О или S;
L представляет собой прямую связь или С1-7алкилен, возможно включающий гетероатом, выбранный из О, S(O)n и NR6, где указанный алкилен возможно включает одну или две двойные связи углерод-углерод, и где указанный алкилен возможно замещен одним или более чем одним заместителем, независимо выбранным из ОН, галогена, CN и NR4R5, C1-6алкила и C1-6алкокси, где указанный алкокси возможно включает карбонил, смежный с кислородом;
n представляет собой целое число 0, 1 или 2;
R1 представляет собой водород или
1) насыщенное или частично ненасыщенное 3-7-членное кольцо, возможно включающее один или два гетероатома, независимо выбранных из О, N и S, и возможно включающее карбонильную группу, возможно замещенную одиним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SO2NR9R10, ОН, С1-7алкила, С1-7алкокси, CN, CONR2R3, NR2COR3 и COR3, где указанный алкокси возможно дополнительно замещен C1-7алкокси и возможно включает карбонил, смежный с кислородом, и где указанный алкил возможно дополнительно замещен гидрокси или C1-6алкокси, и где указанные алкил или алкокси возможно включают карбонил, смежный с кислородом, или в любом положении в алкиле;
или
2) ароматическую кольцевую систему, выбранную из фенила, бифенила, нафтила или моноциклической или бициклической гетероароматической кольцевой структуры, содержащей 1-3 гетероатома, независимо выбранных из О, N и S, где указанная ароматическая кольцевая система возможно замещена одним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SO2NR9R10, ОН, С1-7алкила, С1-7алкокси, CN, CONR2R3, NR2COR3 и COR3; где указанный алкокси возможно дополнительно замещен C1-6алкокси и возможно включает карбонил, смежный с кислородом, и где указанный алкил возможно дополнительно замещен гидрокси или C1-6алкокси, и где указанные алкил или алкокси возможно включают карбонил, смежный с кислородом, или в любом положении в алкиле;
R12 представляет собой водород или галоген, или углерод, возможно замещенный одним-тремя атомами галогена;
в каждом случае, R2, R3, R4, R5, R6, R9 и R10 независимо представляют собой водород, C1-6алкил или С1-6алкокси, где указанный алкокси возможно включает карбонил, смежный с кислородом, где указанный алкил возможно дополнительно замещен галогеном, C1-6алкокси, СНО, С2-6алканоилом, ОН, CONR7R8 и NR7OR8;
или каждая группа NR2R3, NR4R5 и NR9R10 независимо представляет собой 5-7-членное насыщенное азациклическое кольцо, возможно включающее один дополнительный гетероатом, выбранный из О, S и NR11, где указанное кольцо возможно дополнительно замещено галогеном, C1-6алкокси, СНО, C2-6алканоилом, ОН, CONR7R8 и NR7COR8;
в каждом случае, R7, R8 и R11 независимо представляют собой водород или С1-6алкил, или группа NR7R8 представляет собой 5-7-членное насыщенное азациклическое кольцо, возможно включающее один дополнительный гетероатом, выбранный из О, S и NR11;
и его фармацевтически приемлемые соли;
при условии, что соединения 1-β-D-рибофуранозил-2-оксопирроло[3,2-d]пиримидин-4(3Н,5Н)-тион, 1-(2,3,5-три-O-бензоил-1-β-D-рибофуранозил)-2-оксопирроло[3,2-d]пиримидин-4(3Н,5Н)-тион и 5,7-димеркапто-1,4,6-триазаинден исключены из объема защиты.
Соединения формулы (I) могут существовать в энантиомерных формах. Следует понимать, что все энантиомеры, диастереомеры, рацематы, таутомеры и их смеси включены в объем изобретения.
Соединения формулы (I) могут существовать в таутомерных формах. Все такие таутомеры и смеси таутомеров включены в объем настоящего изобретения.
Если не указано иначе, термин «C1-6алкил», на который здесь ссылаются, означает алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 атомов углерода. Примеры таких групп включают метил, этил, 1-пропил, н-бутил, изо-бутил, mpem-бутил, пентил и гексил, но не ограничены ими. Термин «С1-7алкил» следует интерпретировать аналогичным образом.
Если не указано иначе, термин «С1-7алкилен», на который здесь ссылаются, означает алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 7 атомов углерода, имеющую две свободные валентности. Примеры таких групп включают метилен, этилен, пропилен, гексаметилен и этилэтилен, но не ограничены ими. Термин «C1-3алкилен» следует интерпретировать аналогичным образом.
Если не указано иначе, термин «C1-6алкокси», на который здесь ссылаются, означает алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 6 атомов углерода. Примеры таких групп включают метокси, этокси, 1-пропокси, 2-пропокси (изо-пропокси), mpem-бутокси и пентокси, но не ограничены ими. Термин «С1-7алкокси» следует интерпретировать аналогичным образом.
Если не указано иначе, термин «С2-6алканоил», на который здесь ссылаются, означает алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 5 атомов углерода с возможным расположением карбонильной группы на алкильной группе. Примеры таких групп включают ацетил, пропионил и пивалоил, но не ограничены ими.
Если не указано иначе, термин «галоген», на который здесь ссылаются, означает фторо, хлоро, бромо и йодо.
Примеры насыщенного или частично ненасыщенного 3-7-членного кольца, возможно включающего один или два гетероатома, независимо выбранных из О, N и S, и возможно включающего карбонильную группу, включают циклопропан, циклопентан, циклогексан, циклогексен, циклопентанон, тетрагидрофуран, пирролидин, пиперидин, тетрагидропиридин, морфолинм, пиперазин, пирролидинон и пиперидинон, но не ограничены ими.
Примеры моноциклической или бициклической гетероароматической кольцевой структуры, содержащей 1-3 гетероатома, независимо выбранных из О, N и S, включают фуран, тиофен, пиррол, оксазол, изоксазол, тиазол, имидазол, пиразол, триазол, тетразол, пиридин, пиразин, пиримидин, пиридазин, бензофуран, индол, изоиндол и бензимидазол, но не ограничены ими.
Примеры 5-7-членного насыщенного азациклического кольца, возможно включающего один дополнительный гетероатом, выбранный из О, S и NR, включают пирролидин, пиперидин, пиперазин, морфолин и тиоморфолин, но не ограничены ими.
В определении L, «С1-7алкилен; возможно включающий гетероатом, выбранный из О, S(O)n и NR6; где указанный алкилен возможно включает одну или две двойные связи углерод-углерод» охватывает структуру насыщенной или ненасыщенной прямой или разветвленной цепи из 1-7 атомов углерода, имеющей две свободные валентности, в которой любые два атома углерода, связанных одиночными связями, возможно разделены О, S или NR6. Данное определение, таким образом, включает, например, метилен, этилен, пропилен, гексаметилен, этилэтилен, -СН2=СН2-, -СН2СН=СН-СН2-, -СН(СН3)=СН2-, -СН2=СН2-СН2O-, -СН2O-, -СН2СН2O-СН2-, -СН2СН2O-СН2-СН2-, -CH2CH2S-и -CH2CH2NR6-.
В одном воплощении R1 представляет собой водород.
В другом воплощении Х представляет собой S, и Y представляет собой О.
В еще одном другом воплощении Y представляет собой S, и Х представляет собой О.
В еще одном другом воплощении L представляет собой прямую связь или представляет собой С1-7алкилен, возможно включающий гетероатом, выбранный из О, S(O)n и NR6, где указанный алкилен возможно включает одну или две двойные связи углерод-углерод, и где указанный алкилен возможно замещен одним или более чем одним заместителем, независимо выбранным из ОН, C1-6алкокси, галогена, CN и NR4R5.
В еще одном другом воплощении L представляет собой прямую связь или представляет собой С1-7алкилен, возможно замещенный одним или более чем одним заместителем, независимо выбранным из ОН, С1-6алкокси, галогена, CN и NR4R5.
В еще одном другом воплощении L представляет собой прямую связь или представляет собой С1-7алкилен, возможно замещенный одним или более чем одним C1-6алкокси.
В еще одном другом воплощении L представляет собой прямую связь или представляет собой C1-3алкилен, где указанный алкилен возможно замещен одним или более чем одним заместителем, независимо выбранным из ОН, C1-6алкокси, галогена, CN и NR4R5.
В еще одном другом воплощении L представляет собой C1-3алкилен, где указанный алкилен возможно замещен одним или более чем одним C1-6алкокси.
В еще одном другом воплощении L представляет собой прямую связь или представляет собой возможно замещенный метилен (-СН2-).
В еще одном другом воплощении L представляет собой прямую связь или представляет собой возможно замещенный этилен (-СН2СН2-).
В еще одном другом воплощении R1 представляет собой насыщенное или частично ненасыщенное 3-7-членное кольцо, возможно включающее один или два гетероатома, независимо выбранных из О, N и S, и возможно включающее карбонильную группу, где указанное кольцо возможно замещено одиним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SC2NR9R10, ОН, C1-6алкила, С1-6алкокси, CN, CONR2R3, NR2OR3 и COR3, где указанный алкокси возможно дополнительно замещен C1-6алкокси, и где указанный алкил возможно дополнительно замещен гидрокси или C1-6алкокси.
В еще одном другом воплощении R1 представляет собой насыщенное или частично ненасыщенное 3-7-членное кольцо, возможно включающее один или два гетероатома, независимо выбранных из О, N и S, и возможно включающее карбонильную группу, где указанное кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, C1-6алкила и C1-6алкокси, где указанный алкокси возможно дополнительно замещен C1-6алкокси.
В еще одном другом воплощении R1 представляет собой ароматическую кольцевую систему, выбранную из фенила, бифенила, нафтила, или моноциклическую или бициклическую гетероароматическую кольцевую структуру, содержащую 1-3 гетероатома, независимо выбранных из О, N и S, где указанное ароматическое кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SO2NR9R10, ОН, C1-6алкила, С1-6алкокси, CN, CONR2R3, NR2COR3 и COR3, где указанный алкокси возможно дополнительно замещен С1-6алкокси, и где указанный алкил возможно дополнительно замещен гидрокси или С1-6алкокси.
В еще одном другом воплощении R1 представляет собой ароматическую кольцевую систему, выбранную из фенила, бифенила, нафтила, или пяти- или шестичленное гетероароматическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из О, N и S, где указанное ароматическое кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, C1-6алкила и C1-6алкокси, где указанный алкокси возможно дополнительно замещен C1-6алкокси.
В еще одном другом воплощении R1 представляет собой возможно замещенный фенил.
В еще одном другом воплощении R1 представляет собой возможно замещенный пиридил.
В еще одном другом воплощении L представляет собой С1-7алкилен, и R1 представляет собой Н.
В еще одном другом воплощении L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой насыщенное или частично ненасыщенное 3-7-членное кольцо, возможно включающее один или два гетероатома, независимо выбранных из О, N и S, и возможно включающее карбонильную группу, где указанное кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SO2NR9R10, ОН, C1-6алкила, C1-6алкокси, CN, CONR2R3, NR2COR3 и COR3, где указанный алкокси возможно дополнительно замещен C1-6алкокси, и где указанный алкил возможно дополнительно замещен гидрокси или C1-6алкокси.
В еще одном другом воплощении L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой насыщенное или частично ненасыщенное 3-7-членное кольцо, возможно включающее один или два гетероатома, независимо выбранных из О, N и S, и возможно включающее карбонильную группу, где указанное кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, C1-6алкила и C1-6алкокси, где указанный алкокси возможно дополнительно замещен С1-6алкокси.
В еще одном другом воплощении L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой ароматическую кольцевую систему, выбранную из фенила, бифенила, нафтила, или пяти- или шестичленного гетероароматического кольца, содержащего 1-3 гетероатома, независимо выбранных из О, N и S; где указанное ароматическое кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, SO2R9, SO2NR9R10, ОН, C1-6алкила, C1-6алкокси, CN, CONR2R3, NR2COR3 и COR3, где указанный алкокси возможно дополнительно замещен C1-6алкокси, и где указанный алкил возможно дополнительно замещен гидрокси или C1-6алкокси.
В еще одном другом воплощении L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой ароматическую кольцевую систему, выбранную из фенила, бифенила, нафтила, или пяти- или шестичленного гетероароматического кольца, содержащего 1-3 гетероатома, независимо выбранных из О, N и S, где указанное ароматическое кольцо возможно замещено одним или более чем одним заместителем, независимо выбранным из галогена, C1-6алкила и C1-6алкокси, где указанный алкокси возможно дополнительно замещен C1-6алкокси.
В еще одном другом воплощении Х представляет собой S, Y представляет собой О, L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой возможно замещенный фенил.
В еще одном другом воплощении Х представляет собой S, Y представляет собой О, L представляет собой возможно замещенный C1-3алкилен, и R1 представляет собой возможно замещенный пиридил.
В еще одном другом воплощении Х представляет собой S, Y представляет собой О, L представляет собой C1-3алкилен, замещенный C1-3алкокси, и R1 представляет собой водород.
Конкретные соединения по данному изобретению включают:
1-бутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(2-фтор-бензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-[2-(2-метоксиэтокси)-3-пропоксибензил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(6-этокси-пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-пиперидин-3-илметил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-бутил-4-тиоксо-1,3,4,5-тетрагидро-2Н-пирроло[3,2-d]пиримидин-2-он;
1-(2-изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(2-метокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(2-этокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(пиперидин-4-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-[(1-метилпиперидин-3-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-[2-гидрокси-2-(4-метоксифенил)этил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(2-метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(3-метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(2,4-диметоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-[(3-хлорпиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-OH;
1-{[3-(2-этоксиэтокси)пиридин-2-ил]метил}-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-[(6-оксо-1,6-дигидропиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(1Н-индол-3-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-(1Н-бензимидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-[(5-хлор-1Н-индол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-[(5-фтор-1Н-индол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(1Н-индол-6-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-(1Н-индол-5-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-[(5-фтор-1Н-индол-3-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1(1Н-имидазол-5-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1(1Н-имидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн;
1-[(5-хлор-1Н-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
1-[(4,5-диметил-1Н-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он;
7-бром-1-изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он; и
1-(3-хлорфенил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
и их фармацевтически приемлемые соли.
Другим аспектом данного изобретения является применение новых соединений формулы (I) в качестве лекарственного средства.
Другим аспектом данного изобретения является применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики заболеваний или состояний, при которых ингибирование фермента МПО является полезным.
Согласно другому аспекту данного изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики нейровоспалительных расстройств, сердечно-сосудистых атеросклеротических расстройств и атеросклеротических расстройств сосудов мозга, заболевания периферических артерий и респираторных заболеваний, таких как хроническая обструктивная болезнь легких.
Согласно еще одному другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики рассеянного склероза. Лечение может включать замедление прогрессирования заболевания.
Согласно еще одному другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики атеросклероза путем предупреждения и/или снижения образования новых атеросклеротических поражений или бляшек и/или путем предупреждения или замедления развития существующих поражений и бляшек.
Согласно еще одному другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики атеросклероза путем изменения состава бляшек для снижения риска отрыва бляшек и атеротромботических осложнений.
Согласно еще одному другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики респираторных расстройств, таких как хроническая обструктивная болезнь легких. Лечение может включать замедление прогрессирования заболевания.
Согласно данному изобретению также предложен способ лечения или снижения риска заболеваний или состояний, при которых ингибирование фермента МПО является полезным, включающий введение субъекту, страдающему указанным заболеванием или состоянием или подверженному риску указанного заболевания или состояния, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Кроме того, также предложен способ лечения или снижения риска нейровоспалительных расстройств, сердечно-сосудистых атеросклеротических расстройств и атеросклеротических расстройств сосудов мозга или заболевания периферических артерий, или респираторных заболеваний, таких как хроническая обструктивная болезнь легких, у субъекта, страдающего указанным заболеванием или состоянием или подверженного риску указанного заболевания или состояния, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Кроме того, также предложен способ лечения или снижения риска рассеянного склероза у субъекта, страдающего указанным заболеванием или состоянием или подверженного риску указанного заболевания или состояния, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Также предложен способ лечения или снижения риска атеросклероза путем предупреждения и/или уменьшения образования новых атеросклеротических поражений или бляшек и/или путем предупреждения или замедления развития существующих поражений и бляшек у субъекта, страдающего указанным заболеванием или состоянием или подверженного риску указанного заболевания или состояния, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Также предложен способ лечения или снижения риска атеросклероза путем изменения состава бляшек так, чтобы снизить риск отрыва бляшек и атеротромботических осложнений у субъекта, страдающего указанным заболеванием или состоянием или подверженного риску указанного заболевания или состояния, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В другом аспекте данного изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем для применения в лечении или профилактике заболеваний или состояний, при которых ингибирование фермента МПО является полезным.
В другом аспекте данного изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем для применения в лечении или профилактике нейровоспалительных расстройств.
В другом аспекте данного изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем, для применения в лечении или профилактике рассеянного склероза, сердечнососудистых атеросклеротических расстройств, атеросклеротических расстройств сосудов мозга, заболевания периферических артерий и респираторных расстройств, таких как хроническая обструктивная болезнь легких.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем, для применения в лечении или профилактике атеросклероза путем предупреждения или уменьшения образования новых атеросклеротических поражений и/или бляшек и/или путем предупреждения или замедления развития существующих поражений и бляшек.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем, для применения в лечении или профилактике атеросклероза путем изменения состава бляшек так, чтобы снизить риск отрыва бляшек и атеросклеротических осложнений.
Согласно данному изобретению дополнительно предложен способ получения новых соединений формулы (I) или их фармацевтически приемлемой соли, таутомера, энантиомера, диастереомера или рацемата, включающий взаимодействие соединения формулы (II),
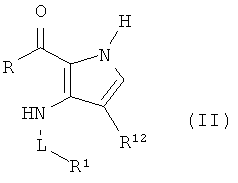
где R1, R12 и L являются такими, как определено в формуле (I), и R представляет собой C1-6алкокси с кислородом в прямой связи с карбонилом в формуле (II) с алкокси, как определено выше, или NH2;
с C1-6алкоксикарбонилизотиоцианатом или с фенилкарбонилизотиоцианатом, где фенильная группа возможно замещена одной или более чем одной группой, независимо выбранной из C1-6алкила, галогена, C1-6алкокси, NO2, ОН, CN, С1-6алкиламино или NН21; и, где необходимо, превращение полученного соединения формулы (I) или его другой соли в его фармацевтически приемлемую соль; или превращение полученного соединения формулы (I) в другое соединение формулы (I); и, когда желательно, превращение полученного соединения формулы (I) в его оптический изомер.
В данном способе соединение формулы (II) и алкоксикарбонилизотиоцианат или фенилкарбонилизотиоцианат растворяют или суспендируют в подходящем безводном органическом растворителе, таком как дихлорметан, и перемешивают при 0-30 градусах, например, при температуре окружающей среды, пока реакция не заканчивается, обычно в течение 5-60 минут, но, если это необходимо, в течение ночи. Предпочтительно алкоксикарбонилизотиоцианат представляет собой этоксикарбонилизотиоцианат, и фенилкарбонилизотиоцианат предпочтительно представляет собой бензоилизотиоцианат. После стандартной обработки промежуточный продукт затем возможно очищают перед обработкой основанием, таким как этоксид натрия в этаноле, водный гидроксид натрия или аммиак в растворе, аммиак в метаноле, с получением требующегося соединения формулы (I). Циклизацию проводят при повышенной температуре либо в масляной бане, либо микроволновом реакторе. Смотри, например, Norman et al, J. Med. Chem.2000, 43, 4288-4312. Когда используют аммиак в метаноле, предпочтительно используют сосуд под давлением.
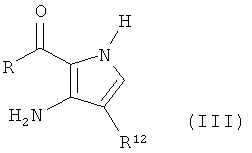
Соединения формулы (II) могут быть получены путем взаимодействия соединения формулы (III), где R12 является таким, как определено в формуле I, R является таким, как определено в формуле II (смотри, например, Furneaux et al, J. Org. Chem. 1999, 64, 8411-8412), и оно может быть проведено путем
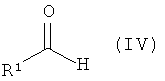
а) восстановительного аминирования. В данном способе соединение формулы (III) можно смешать с альдегидом формулы (IV), где R1 является таким, как определено в формуле I, в присутствии восстанавливающего агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия. Для катализа данной реакции можно добавить кислоту, предпочтительно уксусную кислоту. Реакцию можно провести в растворителе, таком как метанол, при температуре от температуры окружающей среды до 50°С, предпочтительно при температуре окружающей среды. После стандартной обработки продукт затем возможно очищают колоночной флэш-хроматографией. Смотри, например, Suzuki et al, Chem. Pharm. Bull. 2002, 50, 1163-1168, или Furneaux, R.H., Tyier, P.C, J. Org. Chem. 1999, 64, 8411-8412.
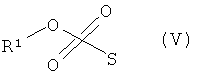
б) алкилирования. В данном способе мезилат формулы (V), где R1 является таким, как определено выше, можно добавить к перемешиваемому раствору соединения формулы (III), йодида калия и основания, предпочтительно карбоната калия. Данную реакцию можно провести в растворителе, таком как N,N-диметилформамид, при повышенной температуре реакции, предпочтительно при 85°С. Реакционную смесь можно обработать путем экстракции и затем очистить колоночной флэш-хроматографией с получением соединения формулы (II).
в) перекрестного связывания соединения формулы (III) с подходящим арилом соединения (VI), где R1 является таким, как определено выше, и Halo представляет собой галоген, предпочтительно бромо, с получением соединения формулы (II). Данную реакцию можно провести с использованием подходящего палладиевого катализатора, такого как Pd2(dba)3 или Pd(OAc)2, вместе с подходящим лигандом, таким как BINAP. В данной реакции, которую проводят в интервале температур от 80°С до 100°С, можно использовать подходящее основание, такое как карбонат цезия, в подходящем растворителе, таком как тетрагидрофуран, диоксан или толуол. Смотри, например, J.P. Wolfe, S.L. Buchwald J. Org. Chem. 2000, 65, 1144-1157.
Соединения формулы (II) либо являются известными в литературе, либо могут быть получены с использованием известных способов, которые будут легко понятными специалисту в данной области техники. Смотри, например, Suzuki et al, Chem. Pharm. Bull. 2002, 50, 1163-1168, или Furneaux, R.H., Tyier, P.C., J. Org. Chem. 1999, 64, 8411-8412.
Соединения формул (IV), (V) и (VI) либо являются доступными в продаже, либо могут быть получены с использованием способов, которые хорошо известны в литературе.
Настоящее изобретение включает соединения формулы (I) в форме солей. Подходящие соли включают соли, образованные органическими или неорганическими кислотами, или органическими или неорганическими основаниями. Такие соли обычно будут фармацевтически приемлемыми, хотя и соли кислот или оснований, которые не являются фармацевтически приемлемыми, могут быть полезными в получении и очистке рассматриваемого соединения. Таким образом, предпочтительные соли присоединения кислоты включают соли, образованные из соляной, бромистоводородной, серной, фосфорной, лимонной, винной, молочной, пировиноградной, уксусной, янтарной, фумаровой, малеиновой, метансульфоновой и бензолсульфоновой кислот. Предпочтительные соли присоединения основания включают соли, в которых катион представляет собой натрий, калий, кальций, алюминий, литий, магний, цинк, холин, этаноламин или диэтиламин.
Соли соединений формулы (I) можно получить путем осуществления взаимодействия данного соединения, или его соли, энантиомера или рацемата с одним или более чем одним эквивалентом подходящей кислоты или основания. Данное взаимодействие можно проводить в растворителе или среде, в которых соль является нерастворимой, или в растворителе, в котором соль является растворимой, например, в воде, диоксане, этаноле, тетрагидрофуране или диэтиловом эфире, или в смеси растворителей, которые можно удалить в вакууме или сублимационной сушкой. Данное взаимодействие также может быть обменным процессом, или его можно проводить на ионообменной смоле.
Соединения по изобретению и промежуточные соединения для них можно выделить из их реакционных смесей и при необходимости дополнительно очистить, используя стандартные методики.
Соединения формулы (I) могут существовать в энантиомерных формах. Следовательно, все энантиомеры, диастереомеры, рацематы, таутомеры и их смеси включены в объем данного изобретения. Разные оптические изомеры можно выделить путем разделения рацемической смеси соединений, используя традиционные методики, например, фракционную кристаллизацию или ВЭЖХ. Альтернативно, различные оптические изомеры можно получить непосредственно, используя оптически активные исходные вещества.
Промежуточные соединения также могут существовать в энантиомерных формах и могут быть использованы как очищенные энантиомеры, диастереомеры, рацематы или смеси.
Соединения формулы (I) могут существовать в таутомерных формах. Все такие таутомеры и смеси таутомеров включены в объем данного изобретения.
Промежуточные соединения также могут существовать в таутомерных формах и могут быть использованы как очищенные таутомеры или смеси.
Соединения формулы (I) и их фармацевтически приемлемые соли являются полезными, так как они обладают фармакологической активностью в качестве ингибиторов фермента МПО.
Соединения формулы (I) и их фармацевтически приемлемые соли показаны для применения в лечении или профилактике заболеваний или состояний, в которых желательна модуляция активности фермента миелопероксидазы (МПО). В частности, связь активности МПО с заболеванием подразумевали при нейровоспалительных заболеваниях. Следовательно, соединения по настоящему изобретению особенно показаны для применения в лечении нейровоспалительных состояний или расстройств у млекопитающих, включая человека. Также показано, что данные соединения являются полезными в лечении сердечно-сосудистых атеросклеротических расстройств и атеросклеротических расстройств сосудов мозга или при заболевании периферических артерий. Также показано, что данные соединения являются полезными в лечении респираторных расстройств, таких как расстройства дыхательных путей: обструктивных заболеваний дыхательных путей, включающих астму, включая бронхиальную, аллергическую, эндогенную, экзогенную, астму напряжения, астму, индуцированную лекарственным средством (включая астму, индуцированную аспирином и нестероидным противовоспалительным лекарственным средством (NSAID)) и астму, индуцированную пылью, как интермиттирующую, так и постоянную, и всех степеней тяжести, и других причин гиперреактивности дыхательных путей;
хроническую обструктивную болезнь легких (ХОБЛ); бронхит, включая инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; кистозный фиброз; саркоидоз; аллергический альвеолит у сельскохозяйственных рабочих и родственные заболевания; гиперчувствительную пневмонию; фиброз легкого, включая криптогенный фиброзный альвеолит, идеопатические интерстициальные пневмонии, фиброз, осложняющий антинеопластическую терапию, и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения при трансплантации легкого; сосудистые и тромботические расстройства сосудов легкого и легочную гипертензию;
противокашлевую активность, включая лечение хронического кашля, связанного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенный кашель; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, включая сенную лихорадку (rhinitis nervosa); полипоз носа; острую вирусную инфекцию, включая обычную простуду и инфекцию, обусловленную респираторно-синцитиальным вирусом, вирусом гриппа, коронавирусом (включая SARS) и аденовирусом. Такие состояния или расстройства будут легко понятными специалисту в данной области.
Состояния или расстройства, которые можно конкретно упомянуть, включают рассеянный склероз, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и инсульт, а также другие воспалительные заболевания или расстройства, такие как астма, хроническая обструктивная болезнь легких, кистозный фиброз, идиопатический фиброз легкого, синдром острой дыхательной недостаточности, синусит, ринит, псориаз, дерматит, увеит, гингивит, атеросклероз, инфаркт миокарда, инсульт, коронарная болезнь сердца, ишемическая болезнь сердца, рестеноз, воспалительное заболевание кишечника, гломеруллярное повреждение почки, фиброз печени, сепсис, проктит, ревматоидный артрит и воспаление, связанное с реперфузионным повреждением, повреждением спинного мозга и повреждением ткани/рубцеванием/адгезией/отторжением. Также предполагали, что рак легкого связан с высокими уровнями МПО. Также ожидается, что данные соединения являются полезными в лечении боли.
Ожидается, что профилактика является особенно уместной для лечения субъектов, которые страдали от предыдущего эпизода или иным способом рассматривались как подверженные риску рассматриваемого заболевания или состояния. Субъекты, подверженные риску развития конкретного заболевания или состояния, обычно включают тех, которые имеют семейную историю заболевания или состояния, или тех, кого идентифицировали посредством генетического анализа или скрининга как особенно подверженных развитию данного заболевания или состояния.
Что касается вышеупомянутых терапевтических показаний, вводимая дозировка, конечно, будет варьировать, в зависимости от используемого соединения, способа введения и желательного лечения. Однако, в общем, удовлетворительные результаты получают, когда соединения вводят в дозировке твердой формы от 1 мг до 2000 мг в сутки.
Соединения формул (I) и их фармацевтически приемлемые соли можно использовать сами по себе или в форме подходящих фармацевтических композиций, в которых соединение или производное находятся в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Таким образом, другой аспект данного изобретения касается фармацевтической композиции, содержащей новое соединение формулы (I) или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Введение может быть осуществлено энтеральным (включая пероральный, подъязычный или ректальный), внутриназальным путем, ингаляцией, внутривенным, местным или другими парентеральными путями, но не ограничено ими. Традиционные методики выбора и получения подходящих фармацевтических композиций описаны, например, в "Pharmaceuticals - The Science of Dosage Form Designs", M.E. Aulton, Churchill Livingstone, 1988. Фармацевтическая композиция предпочтительно содержит менее 80% и более предпочтительно менее 50% соединения формул (I) или его фармацевтически приемлемой соли.
Также предложен способ получения такой фармацевтической композиции, включающий смешивание ингредиентов.
Примеры фармацевтической композиции
Следующее иллюстрирует репрезентативные фармацевтические лекарственные формы, содержащие соединение формулы I, или его соли, сольваты или сольватированные соли (обозначенные ниже как соединение X) для профилактического или терапевтического применения у млекопитающих:
|
Приведенные выше композиции могут быть получены традиционными методиками, хорошо известными в области фармацевтики.
Данное изобретение дополнительно относится к комбинированным терапиям, где соединение формулы (I) или его фармацевтически приемлемую соль, или фармацевтическую композицию или препарат, содержащий соединение формулы (I), вводят одновременно или последовательно с терапией и/или с агентом для лечения любого из сердечно-сосудистых атеросклеротических расстройств или атеросклеротических расстройств сосудов мозга и болезни периферических артерий.
В частности, соединение формулы (I) или его фармацевтически приемлемую соль можно вводить в сочетании с соединениями из одной или более чем одной из следующих групп:
1) противовоспалительные агенты, например
а) NSAIDs (например, ацетилсалициловая кислота, ибупрофен, напроксен, флурбипрофен, диклофенак, индометацин);
б) ингибиторы синтеза лейкотриенов (ингибиторы 5-LO, например, AZD4407, зилейтон, ликофелон, CJ13610, CJ13454; ингибиторы FLAP, например, BAY-Y-1015, DG-031, MK591, МК886, А81834; ингибиторы гидролазы LTA4, например, SC56938, SC57461A);
в) антагонисты рецептора лейкотриенов (например, СР195543, амелубант, LY293111, акколат, МК571);
2) противогипертензивные агенты, например
а) бета-блокаторы (например, метопролол, атенолол, соталол);
б) ингибиторы ангиотензин-превращающего фермента (например, каптоприл, рамиприл, квинаприл, эналаприл);
в) блокаторы кальциевых каналов (например, верапамил, дилтиазем, фелодипин, амлодипин);
г) антагонисты рецептора ангиотензиа II (например, ирбесартан, кандесартан, телемисартан, лосартан);
3) противосвертывающие средства, например,
а) ингибиторы тромбина (например, ксимелагатран), гепарины,
ингибиторы фактора Ха;
б) ингибиторы агрегации тромбоцитов (например, клопидрогрел, тиклопидин, прасугел, AZ4160);
4) модуляторы метаболизма липидов, например,
а) сенсибилизаторы инсулина, такие как агонисты рецепторов, активируемых пролифератором пероксисом (PPAR) (например, пиоглитазон, розиглитазон, галида, мураглитазаар, гефемрозил, фенофибрат);
б) ингибиторы HMG-CoA редуктазы, статины (например, симвастатин, правастатин, аторвастатин, росувастатин, флувастатин);
в) ингибиторы всасывания холестерина (например, эзетимиб);
г) ингибиторы IBAT (например, AZD-7806);
д) агонисты LXR (например, GW-683965A, Т-0901317);
е) модуляторы рецептора FXR;
ж) ингибиторы фосфолипазы;
5) противостенокардические агенты, например нитраты и нитриты;
6) модуляторы окислительного стресса, например антиоксиданты (пробукол).
Общие способы
Все использованные растворители были аналитического качества, и для реакций обычно использовали имеющиеся в продаже безводные растворители. Реакции обычно проводили в инертной атмосфере азота или аргона.
1H и 13С ЯМР спектры записывали при 400 МГц для протона и при 100 МГц для углерода-13 либо на ЯМР-спектрометре Varian Unity+, оснащенном 5 мм измерительной головкой ВВО с Z-градиентами, либо на ЯМР-спектрометре Bruker Avance 400, оснащенном 60 мкл измерительной головкой с двойным инвертированным током и Z-градиентами, либо на ЯМР-спектрометре Bruker DPX400, оснащенном 4-ядерной измерительной головкой, оснащенной Z-градиентами. Если в примерах особо не отмечено, спектры записывали при 400 МГц для протона и при 100 МГц для углерода-13. Использовали следующие эталонные сигналы: среднюю линию DMSO-d6 δ 2.50 (1Н), 5 39.51 (13С); среднюю линию CD3OD δ 3.31 1Н) или 5 49.15 (13С); ацетон-d6 2.04 1Н), 206.5 (13С); и CDCl3 δ 7.26 (1H), среднюю линию CDCl3 5 77.16 (13С) (если не указано иначе).
Масс-спектры записывали на ЖХМС Waters, состоящем из Alliance 2795 (ЖХ), Waters PDA 2996, детектора ELS (Sedex 75) и одиночного квадрупольного масс-спектрометра ZMD. Данный масс-спектрометр был оснащен электрораспылительным ионным источником (ЭР), работающим в режиме положительного или отрицательного иона. Напряжение капилляра составляло 3 кВ, и напряжение конуса составляло 30 В. Данный масс-спектрометр сканировал в интервале т/г 100-600 с временем сканирования 0,7 с. Температура колонки была установлена на 40°С. Детектор с диодной матрицей сканировал в интервале от 200 до 400 нм. Температуру ELS детектора доводили до 40°С, и давление устанавливали на уровне 1,9 бар (190 кПа). Для разделения ЖХ использовали линейный градиент, начиная от 100%А (А: 10 мМ NhitOAc в 5%-ном MeCN) и заканчивая при 100% В (В: MeCN) через четыре минуты. Используемой колонкой была X-Terra MS C8, 3,0 × 50; 3,5 мкм (Waters), работающая при скорости 1,0 мл/мин.
Альтернативно, масс-спектры получали на ГХ-МС (GC 6890, 5973N MSD), оснащенном Agilent Technologies. Используемой колонкой была VF-5 MS, внутр. диаметр 0,25 мм × 30 м, 0,25 мкм (Varian Inc.). Применяли линейный градиент температуры, начиная при 40°С (выдерживали 1 мин) и заканчивая при 300°С (выдерживали 1 мин), 25°С/минуту. МС был оснащен ионным источником CI, и газом-реагентом был метан. МС сканировали в интервале m/z 50-500, и скорость сканирования была установлена на 3,25 сканирований/с.МС был оснащен ионным источником EI. МС сканировали в интервале m/z 50-500, и скорость сканирования была установлена на 3,25 сканирований/с. Напряжение электронов было установлено на уровне 70 эВ.
Анализы ВЭЖХ (высокоэффективная жидкостная хроматография) проводили на системе Agilent HP1100, состоящей из микровакуумного дегазатора G1379A, бинарного насоса G1312A, автоматического пробоотборника G1367A Well, ячейки термостатируемой колонки G1316A и детектора с диодной матрицей G1315B. Колонка: X-Terra MS, Waters, 3,0 × 100 мм, 3,5 мкм. Температура колонки была установлена на 40°С, и скорость потока на 1,0 мл/мин. Детектор с диодной матрицей сканировал в интервале 210-300 нм, шаг и ширина пика были установлены на 2 нм и 0,05 мин, соответственно.
Использовали линейный градиент, начиная от 100% А (А: 10 мМ NH40Ac в 5%-ном МеСМ) и заканчивая при 100% Б (Б: МеСМ) за 6 мин.
Микроволновое нагревание проводили в инициаторе или в синтезаторе Смита с однорежимной микроволновой емкостью, дающей непрерывное излучение с частотой 2450 МГц.
Типичная процедура обработки после реакции состояла в экстракции продукта растворителем, таким как этилацетат, промывке водой с последующей сушкой органической фазы над МgSO4 или Na2SO4, фильтрации и концентрирования раствора в вакууме.
Тонкослойную хроматографию (ТСХ) проводили на планшетах для ТСХ Merck (силикагель 60 F254) и пятна визуализировали при УФ. Колоночную флэш-хроматографию проводили на Combi Flash® Companion™ с использованием флэш-колонок с нормальной фазой RediSep™. Типичными используемыми растворителями для колоночной флэш-хроматографии были смеси хлороформ/метанол, дихлорметан/метанол и гептан/этилацетат.
Препаративную хроматографию проводили на установке ВЭЖХ с автоочисткой Waters с детектором на основе диодной матрицы. Колонка: ХТегга MS C8, 19 × 300 мм, 10 мкм. Использовали узкие градиенты с МеСМ/(95:5 0,1 М NH4OAc:MeCN) при скорости потока 20 мл/мин. В качестве альтернативы, использовали другую колонку; колонку Atlantis C18 19 × 100 мм, 5 мкм. Градиент с ацетонитрилом/0,1 М ацетатом аммония в 5%-ном ацетонитриле в воде MilliQ прогоняли от 0% до 35-50% ацетонитрила за 15 мин. Скорость потока: 15 мл/мин. В качестве альтернативы, очистки достигали на установке для полупрепаративной ВЭЖХ Shimadzu LC-8A с детектором УФ-видимая область Shimadzu SPD-10A, оснащенной колонкой Waters Symmetry® (C18, 5 мкм, 100 мм × 19 мм). Использовали узкие градиенты с МеСМ/0,1%-ной трифторуксусной кислотой в воде MilliQ со скоростью потока 10 мл/мин.
Перекристаллизацию обычно проводили в растворителях или смесях растворителей, таких как эфир, этилацетат/гептан и метанол/вода.
|
Использованные исходные вещества были либо доступными из коммерческих источников, либо полученными согласно литературным методикам и имели экспериментальные данные, соответствующие литературным данным. Следующее является примером исходного вещества, которое было получено: сложный эфир 3-амино-1Н-пиррол-2-карбоновой кислоты: Furneaux, R.H., Tyier, P.O., J. Org. Chem. 1999, 64, 8411-8412.
Общий способ А
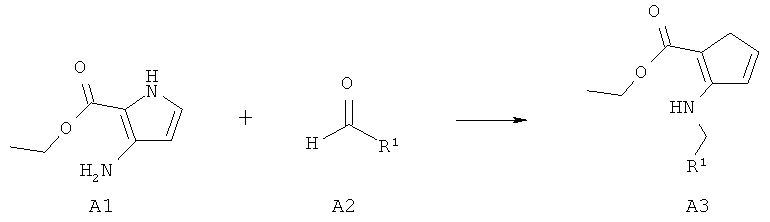
Реакционную смесь аминопиррольного эфира A1 (1,0 экв.), альдегида A2 (от 1,0 до 2,0 экв.) и NaCNBH3 (1,0 экв.) в метаноле перемешивали при комн. темп. в течение 24 ч. В некоторых примерах добавляли уксусную кислоту (от 1 до 2 экв.) для того, чтобы катализировать данную реакцию. Если реакция не завершалась через 24 ч (контролировали по ТСХ или ЖХ-МС), добавляли дополнительное количество альдегида A2, и перемешивали смесь при комн. темп., пока реакция на завершалась. Данную смесь затем упаривали на силикагеле и очищали колоночной флэш-хроматографией.
Общий способ Б

Этоксикарбонилизотиоцианат Б2 (от 1,0 до 1,2 экв.) добавляли к аминопиррольному эфиру Б1 (1,0 экв.) в CH2Cl2 и перемешивали смесь при комн. темп. в течение 5-60 минут или в течение ночи. Добавляли воду и водную фазу экстрагировали CH2Cl2. Органическую фазу объединяли, сушили (MgSO4) и концентрировали. Неочищенное промежуточное соединение с открытым кольцом очищали колоночной флэш-хроматографией. Промежуточный продукт растворяли в 1 М NaOEt в ЕtOН (1,1-1,5 экв.) и нагревали в микроволновом реакторе в течение 10 минут при 120°С. рН доводили до нейтрального рН 2 М HCl; твердое вещество собирали фильтрацией и промывали водой. Неочищенный продукт очищали с использованием препаративной ВЭЖХ или путем колоночной флэш-хроматографии, или путем перекристаллизации.
Данное изобретение иллюстрируется, но никоим образом не ограничивается следующими примерами. За исключением того, где это указано иначе, соединения по Примерам от 1а до 4а и 5в и 7б получали с использованием методики общего способа А, и соединения по Примерам от 1б до 4б и 5г и 7в получали с использованием методики общего способа Б.
Пример 1
1-Бутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-(бутиламино)-1Н-пиррол-2-карбоновой кислоты Соединение, указанное в заголовке, получали в виде масла с 60%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,81 г, 5,26 ммоль) и бутиральдегида (0,47+0,55 мл, 11,4 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.71 (1Н, br s), 6.74 (1H, t, J=3.1 Гц), 5.62 (1H, t, J=2.6 Гц) 5.19 (1H, s), 4.17 (2H, q, J=7.0 Гц), 3.04 (2H, q, J=6.6 Гц), 1.50 (2Н, m), 1.34 (2H, m), 1.25 (3H, t, J=7.0 Гц), 0.90 (3Н, t, J=7.3 Гц);
MC (ЭРИ) (масс-спектроскопия с электрораспылительной ионизацией) m/z 211 (M+1).
(б) 1-Бутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 44%-ным выходом, начиная с этилового эфира 3-(бутиламино)-1Н-пиррол-2-карбоновой кислоты (0,10 г, 0,48 ммоль) и этоксикарбонилизотиоцианата (0,06 мл, 0,58 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.38 (1Н, s), 12.10 (1Н, s), 7.37 (1H, d, J=2.9), 6.31 (1Н, d, J=2.6 Гц), 4.36 (2H, m), 1.69 (2H, m), 1.38 (2H, m), 0.92 (3H, t, J=7.5 Гц);
МС(ЭРИ) m/z 224(М+1).
Пример 2
1-Изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-(изобутиламино)-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 71%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,40 г, 2,59 ммоль) и изобутиральдегида (0,26+0,07 мл, 3,61 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.68 (1Н, s), 6.74 (1Н, t, J=3.0 Гц), 5.62 (1Н. t, J=2.4 Гц), 5.30 (1Н, brs), 4.18 (2H, q, J=7.2 Гц), 2.88 (2H, t, J=6.4 Гц), 1.79 (1Н, m), 1.26 (3H, t, J=7.1 Гц), 0.90 (3H, s), 0.89 (3H, s);
13C ЯМР (DMSO-d6) δ млн-1 160.9, 124.2, 95.0, 58.2, 52.4, 27.9, 20.0, 14.7;
МС(ЭРИ) m/z 211 (М+1).
(б) 1-Изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 24%-ным выходом, начиная с этилового эфира 3-(изобутиламино)-1Н-пиррол-2-карбоновой кислоты (0,38 г, 1,79 ммоль) и этоксикарбонилизотиоцианата (0,24 мл, 2,15 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.36 (1Н, br s), 12.13 (1Н, br s), 7.35 (1Н, d, J=2.8 Гц), 6.34 (1Н, d, J=2.8 Гц), 4.21 (2H, d,=7.33 Гц), 2.44 (1Н, m), 0.91 (3H, s), 0.90 (3H,s);
13C ЯМР (DMSO-de) 5 млн-1 172.8, 152.4, 137.3, 127.7, 113.6, 97.1, 56.2, 26.4, 19.7;
МС(ЭРИ) m/z 224(М+1).
Пример 3
1-(Пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-[(пиридин-2-илметил)амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 54%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,40 г, 2,59 ммоль) и 2-пиридинкарбоксальдегида (0,27+0,07 мл, 3,55 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.77 (1Н, br s), 8.52 (1H, d, J=4.0 Гц), 7.80-7.67 (1H, m), 7.35 (1H, d, J=7.8 Гц), 7.25 (1H, dd, J=7.3, 5.0 Гц), 6.71 (1H, t, J=3.0 Гц), 6.10 (1H, br s), 5.57 (1H, t, J=2.4 Гц), 4.37 (2H, d, J=5.8 Гц), 4.21 (2H, q, J=7.2 Гц), 1.29(3H,t,J=7.1 Гц);
МС(ЭРИ) m/z 246(М+1).
(б) 1-(Пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин -4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 14%-ным выходом, начиная с этилового эфира 3-[(пиридин-2-илметил)амино]-1Н-пиррол-2-карбоновой кислоты (0,34 г, 1,39 ммоль) и этоксикарбонилизотиоцианата (0,19 мл, 1,66 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.34 (2H, br s), 8.49 (1H, d, J=4.5 Гц), 7.73 (1H, m), 7.29 (1H, d, J=2.8 Гц), 7.27 (1H, m), 7.21 (1H, d, J=7.8 Гц), 6.09 (1H, d, J=2.8 Гц), 5.75 (2H, s);
13C ЯМР (DMSO-d6) δ млн-1 173.4, 155.2, 152.6, 149.1, 137.1, 136.8, 127.9, 122.4, 121.2, 113.6,96.9,54.2;
MC(ЭРИ) m/z 259(M+1).
Пример 4
1-(2-Фтор-бензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-(2-фтор-бензиламино)-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с количественным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,50 г, 3,2 ммоль) и 2-фторбензальдегида (0,34 мл, 3,2 ммоль), используя общую методику А, но со следующими модификациями. Через 5 ч добавляли дополнительное количество NaCNBH3 (100 мг, 1,6 ммоль) с последующим добавлением дополнительного количества 2-фторбензальдегида (120 мг, 1 ммоль) и затем перемешивали реакционную смесь в течение ночи.
1H ЯМР (DMSO-d6) δ млн-1 10.76 (1Н, br s), 7.47 (1Н, m), 7.38 (1Н, m), 7.28 (2H, m), 6.70 (1Н, m), 5.74 (1Н, br s), 5.61 (1Н, m), 4.34 (2H, m), 4.18 (2H, q, J=7.1 Гц),1.25(3Н,t, J=7.1 Гц);
МС(ЭРИ) m/z 263(М+1).
(б) 1-(2-Фтор-бензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 45%-ным выходом, начиная с этилового эфира 3-(2-фторбензиламино]-1Н-пиррол-2-карбоновой кислоты (0,85 г, 3,2 ммоль) и этоксикарбонилизотиоцианата (0,44 мл, 3,9 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.41 (2H, br s.), 7.33 (2H, m), 7.24 (1Н, m), 7.10 (1Н, m, J=7.5, 7.5 Гц), 7.01 (1Н, m, J=7.1 Гц, 7.1 Гц), 6.12 (1Н, d, J=2.8 Гц), 5.72 (2H, s);
13C ЯМР (DMSO-d6) δ млн-1 173.9, 161.4, 159.0, 152.9, 137.1, 129.6, 129.5, 128.5, 128.1, 128.1, 125.0, 124.9, 123.2, 123.0, 115.8, 115.6, 114.1, 96.9, 47.1, 47.1;
МС(ЭРИ) m/z 276(М+1).
Пример 5
1-[2-(2-Метоксиэтокси)-3-пропоксибензил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) 3-Гидрокси-2-(2-метоксиэтокси)бензальдегид
2-Хлорэтилметиловый эфир (4,63 мл, 50,7 ммоль) добавляли по каплям к смеси 2,3-дигидроксибензальдегида (7,0 г, 50,7 ммоль), йодида калия (8,41 г, 50,69 ммоль) и карбоната калия (7,71 г, 55,8 ммоль) в DMF (80 мл). Образующуюся смесь перемешивали при комн. темп.в атмосфере азота в течение двух суток и при 70°С в течение двух суток. Реакционную смесь распределяли между насыщенным хлоридом аммония (водн.) и CH2Cl2. Водную фазу повторно экстрагировали CH2Cl2, и объединенные органические фазы промывали рассолом, сушили (Na2SO4) и упаривали на диоксиде кремния.
Очистка колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 30% этилацетата) дала неочищенное масло, которое далее очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 40% этилацетата) с получением соединения, указанного в заголовке (3,13 г, 31%) в виде масла.
1H ЯМР (DMSO-d6) δ млн-1 10.34 (1Н, br s), 9.88 (1H, br s), 7.16 (2H, m), 7.05 (1H, m), 4.25 (2H, m), 3.60 (2H, m), 3.26 (3Н, m);
13С ЯМР (DMSO-d6) δ млн-1 190.5, 150.7, 149.6, 129.9, 124.1, 122.6, 116.9, 72.1,70.9,57.9;
MC(ЭРИ) m/z 197(M+1).
(б) 2-(2-Метоксиэтокси)-3-пропоксибензальдегид
1-Йодпропан (3,09 мл, 31,60 ммоль) добавляли к раствору 3-гидрокси-2-(2-метоксиэтокси)бензальдегида (3,1 г, 15,8 ммоль) и карбоната калия (4,37 г, 31,60 ммоль) в DMF (80 мл) и перемешивали данную смесь при 100°С в течение ночи в атмосфере азота. Реакционную смесь распределяли между насыщенным хлоридом аммония (водн.) и CH2Cl2. Органическую фазу промывали рассолом, сушили (Na2SO4) и концентрировали с получением соединения, указанного в заголовке, с количественным выходом (3,8 г) в виде масла. Это вещество использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (DMSO-d6) δ млн-1 10.37 (1H, s), 7.36 (1H, m, J=8.0 Гц), 7.26 (1H, m), 7.17 (1H. t, J=7.8 Гц), 4.28 (2H, m), 4.02 (2H, t, J=6.3 Гц), 3.62 (2H, m), 3.26 (3Н, s), 1.80 (2H, m), 1.02 (3Н, t, J=7.3 Гц);
13C ЯМР (DMSO-d6) δ млн-1 190.3, 152.1, 150.9, 129.6, 124.4, 119.4, 117.8, 72.5, 70.9, 70.0, 57.9, 22.1, 10.4;
MC(3PH) m/z 239(M+1).
(в) Этиловый эфир 3-{[2-(2-метоксиэтокси)-3-пропоксибензил]амино}-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с количественным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,35 г, 2,27 ммоль) и 2-(2-метоксиэтокси)-3-пропоксибензальдегида (0,47+0,08 г, 3,06 ммоль).
1H ЯМР (DMSO-d6) 5 млн-1 10.69 (1Н, brs), 7.13 (1H, s), 7.6.99 (2H, m), 6.70 (1H, m), 5.63 (1H, m), 4.92 (1H, t, J=5.7 Гц), 4.52 (2H, d, J=5.8 Гц), 4.19 (2H, m), 4.05 (2H, m), 3.92 (2H, t, J=6.4 Гц), 3.59 (2H, m), 3.32 (3Н, s), 1.76 (2H, m), 1.26 (3H, t, J=7.1 Гц), 1.00(3H,m);
МС(ЭРИ) m/z 377(М+1).
(г) 1-[2-(2-Метоксиэтокси)-3-пропоксибензил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 13%-ным выходом, начиная с этилового эфира 3-{[2-(2-метоксиэтокси)-3-пропоксибензил]амино}-1Н-пиррол-2-карбоновой кислоты (0,87 г, 2,31 ммоль) и этоксикарбонилизотиоцианата (0,26 мл, 2,31 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.43 (1H, br s), 12.31 (1H, br s), 7.29 (1H, d, J=3.0 Гц), 6.96-6.85 (2H, m), 6.41 (1H, dd, J=7.3, 1.5 Гц), 6.02 (1H, d, J=2.8 Гц), 5.71 (2H, s), 4.23 (2H, m), 3.95 (2H, t, J=6.3 Гц), 3.65 (2H, m), 3.33 (3Н, s), 1.82-1.72 (2H, m), 1.02 (3Н, t, J=7.4 Гц);
MC(ЭРИ) m/z 390(M+1).
Пример 6
1-(6-Этокси-пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 6-этокси-пиридин-2-карбоновой кислоты Йодистый этил (2,3 мл, 28,8 ммоль) добавляли к суспензии 6-гидрокси-пиридин-2-карбоновой кислоты (1,0 г, 7,2 ммоль) и карбоната серебра(1) (4,0 г, 14,4 ммоль) в СНСl3 (70 мл). Данную суспензию перемешивали при температуре окружающей среды в течение 3 суток. Нерастворимое вещество удаляли фильтрацией и твердое вещество промывали СНСl3. Фильтрат концентрировали с получением продукта, указанного в заголовке, с количественным выходом (1,5 г) в виде масла. Это вещество использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (CDCl3) δ млн-1 7.65 (2H, m), 6.88 (1H, m), 4.45 (2H, q, J=7.0 Гц), 4.41 (2H, q, J=7.3 Гц), 1.40 (6Н, m);
MC(ЭРИ) m/z 196(M+1).
(б) (6-Этокси-пиридин-2-ил)-метанол
NaBH4 (5,7 г, 151 ммоль) добавляли порциями к этиловому эфиру 6-этокси-пиридин-2-карбоновой кислоты (1,5 г, 7,5 ммоль) в ЕtOН (75 мл) в течение 35 минут. Образующуюся смесь перемешивали при температуре окружающей среды в течение двух суток. Добавляли воду и смесь экстрагировали CH2Cl2. Органическую фазу сушили (Na2SO4), фильтровали и затем концентрировали с получением соединения, указанного в заголовке (0,85 г), с 74%-ным выходом в виде масла. Это вещество использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (CDCl2) δ млн-1 7.55 (1Н, m), 6.77 (1Н, d, J=7,4 Гц), 6.61 (1Н, d, J=8.1 Гц), 4.66 (2H, d, J=5.3 Гц), 4.38 (2Н, q, J=7.1 Гц), 3.46 (1Н, t, J=5.2 Гц), 1.41 (3H,t,J=7.1 Гц).
(в) 6-Этокси-пиридин-2-карбальдегид
DMSO (0,50 мл, 6,4 ммоль) в CH2Cl2 (10 мл) добавляли по каплям к раствору оксалилхлорида (2М в CH2Cl2, 3,1 мл, 6,1 ммоль) в CH2Cl2 (20 мл) при -60°С. Образующуюся смесь перемешивали при -60°С в течение 10 минут. Добавляли по каплям (6-этоксипиридин-2-ил)-метанол (0,85 г, 5,6 ммоль) в CH2Cl2 (5 мл) и DMSO (4 мл). Данную смесь перемешивали при -60°С в течение 3 ч, затем оставляли нагреваться до -20°С и добавляли Et3N (6 мл). Образующийся раствор перемешивали при температуре окружающей среды в течение 40 минут. Добавляли воду и смесь экстрагировали CH2Cl2. Органическую фазу промывали рассолом, сушили (Na2SO4) и концентрировали. Добавляли к остатку диэтиловый эфир и нерастворимое веществ® удаляли фильтрацией. Фильтрат концентрировали с получением соединения, указанного в заголовке (0,60 г), с 70%-ным выходом в виде твердого вещества. Этот неочищенный продукт использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (CDCl2) δ млн-1 9.93 (1Н, s), 7.71 (1Н, m), 7.53 (1Н, d, J=7.1 Гц), 6.94 (1Н, d, J=8.3 Гц), 4.46 (2H, d, J=7.1 Гц), 1.42 (3Н, t, J=7.1 Гц).
(г) Этиловый эфир 3-[(6-этокси-пиридин-2-илметил)-амино]-1Н-пиррол-2-карбоновой кислоты
Уксусную кислоту (0,3 мл) добавляли к 6-этокси-пиридин-2-карбальдегиду (0,59 г, 3,9 ммоль) и этиловому эфиру 3-амино-1Н-пиррол-2-карбоновой кислоты (0,30 г, 1,9 ммоль) в этаноле (10 мл). Через 1,5 ч добавляли NaCNBH3 (0,24 г, 3,9 ммоль) и образующуюся смесь перемешивали при температуре окружающей среды в течение 19 ч. Растворитель удаляли в вакууме, добавляли к остатку этилацетат и нерастворимое вещество удаляли фильтрацией. Фильтрат концентрировали и неочищенный продукт очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 35% этилацетата), получая 0,25 г (45%) соединения, указанного в заголовке, в виде твердого вещества.
1H ЯМР (CDCl2) δ млн-1 8.16 (1Н, br s), 7.50 (1H, m), 6.89 (1H, d, J=7.3 Гц), 6.70 (1H,brs), 6.57 (1H,d,J=8.1 Гц), 4.45 (2H, q, J=7.0 Гц), 5.71 (1H, m), 4.38 (5Н, m), 1.37(6H,m);
MC(ЭРИ) m/z 290(M+1).
(д) 1-(6-Этокси-пиридин-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Этоксикарбонилизотиоцианат (0,12 г, 0,90 ммоль) добавляли к этиловому эфиру 3-[(6-этокси-пиридин-2-илметил)-амино]-1Н-пиррол-2-карбоновой кислоты (0,24 г, 0,82 ммоль) в CH2Cl2 (5 мл), и перемешивали данный раствор при температуре окружающей среды в течение 35 минут. Растворитель выпаривали, добавляли к остатку 0,4 M NaOEt в этаноле (3 мл, 1,2 ммоль) и кипятили смесь с обратным холодильником в течение 1 ч. Добавляли дополнительное количество NaOEt (0,4 М в этаноле, 1,5 мл, 0,6 ммоль) и кипятили раствор с обратным холодильником в течение еще 1,5 ч. Растворитель выпаривали, остаток растворяли в воде, и рН доводили до нейтрального рН 1 M HCl. Образующееся твердое вещество собирали, промывали и сушили с получением неочищенного продукта. Это вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (38 мг, 15%), в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.32 (2H, br s), 7.62 (1H, m), 7.29 (1H, d, J=3.0 Гц), 6.78 (1H, d, J=7.3 Гц), 6.64 (1H, d, J=8.3 Гц), 6.13 (1H, d, J=2.8 Гц), 5.65 (2H, s), 4.17 (2H, q, J=7.1 Гц), 1.19 (3Н, 7, J=7.0 Гц);
13C ЯМР (DMSO-d6) δ млн-1 173.5, 162.7, 152.8, 152.5, 139.6, 137.2, 127.8, 113.9, 113.6, 109.0,97.0,61.0,53.8, 14.3;
МС(ЭРИ) m/z 303(М+1).
Пример 7 1-Пиперидин-3-илметил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) трет-Бутиловый эфир 3-формил-пиперидин-1-карбоновой кислоты DMSO (0,18 мл, 2,6 ммоль) в CH2Cl2 (5 мл) добавляли по каплям к раствору оксалилхлорида (2 М в CH2Cl2, 0,65 мл, 1,3 ммоль) в CH2Cl2 (4 мл) при -78°С. Образующуюся смесь перемешивали при -68°С в течение 15 минут. Добавляли по каплям mpem-бутиловый эфир 3-гидроксиметил-пиперидин-1-карбоновой кислоты (Dean A. Wacker et al. Bioorganic & Medicinal Chemistry Letters 2002, 12, 1785-1789) (0,22 г, 1,0 ммоль) в CH2Cl2 (4 мл), и после 15 мин перемешивания при -78°С добавляли Et3N (6 мл). Образующийся раствор перемешивали при температуре окружающей среды в течение 16 ч. Добавляли воду, экстрагировали смесь диэтиловым эфиром, органический слой сушили (Na2SO4) и концентрировали с получением продукта в виде желтого масла (0,20 г, 92%-ный выход). Этот неочищенный продукт использовали на следующей стадии без дальнейшей очистки. МС(ЭРИ) m/z 214(М+1).
(б) трет-Бутиловый эфир 3-[(2-этоксикарбонил-1Н-пиррол-3-иламино)-метил]-пиперидин-1-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 30%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,14 г, 0,92 ммоль) и трет-бутилового эфира 3-формил-пиперидин-1-карбоновой кислоты (0,20 г, 0,92 ммоль).
1H ЯМР (CDCl3) δ млн-1 8.29 (1Н, br s), 6.70 (1Н, s), 5.67 (1Н, m), 4.27 (2H, m), 3.93 (1Н, br s), 3.85 (1Н, d, J=13.2 Гц), 3.10-2.94 (2H, m), 2.83 (1Н, m), 2.65 (1Н, br s), 1.85 (1Н, m), 1.76 (1Н, m), 1.64 (1Н, m), 1.42 (9H, s), 1.31 (3H, t, J=6.8 Гц), 1.22(1H, m);
MC(ЭРИ) m/z 352(M+1).
(в) 1-Пиперидин-3-илметил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 20%-ным выходом, используя трет-бутиловый эфир 3-[(2-этоксикарбонил-1Н-пиррол-3-иламино)-метил]-пиперидин-1-карбоновой кислоты (97 мг, 0,27 ммоль) и этоксикарбонилизотиоцианат (36 мг, 0,27 ммоль) с использованием общей методики Б со следующими модификациями. После реакции циклизации, опосредованной основанием, к реакционной смеси добавляли 6 М НСl (0,3 мл) с последующим нагреванием в микроволновом реакторе в течение 4 минут при 100°С.Растворитель удаляли в вакууме и остающееся твердое вещество очищали препаративной ВЭЖХ с использованием колонки Atlantis С18 19 × 100 мм, 5 мкм. Градиент с ацетонитрилом/0,1 М ацетатом аммония в 5%-ном ацетонитриле в воде MilliQ прогоняли от 0% до 50% ацетонитрила за 15 мин. Скорость потока: 15 мл/мин.
1H ЯМР (Метанол-d4) δ млн-1 7.23 (1Н, d, J=3.2 Гц), 6.21 (1Н, d, J=3.2 Гц), 4.46 (1Н, m), 4.23 (1Н, m), 3.22 (2H, m), 2.86 (2H, m), 2.58 (1Н, m), 1.83 (2H, m), 1.62 (1H, m), 1.42 (1H, m);
13С ЯМР (Метанол-d4) δ млн-1 178.8, 154.7, 139.3, 129.5, 115.3, 97.8, 53.7, 48.0, 45.2, 34.5, 27.6, 23.2;
МС(ЭРИ) m/z 265(М+1).
Пример 8
1-Бутил-4-тиоксо-1,3,4,5-тетрагидро-2Н-пирроло[3,2-d]пиримидин-2-он
Этоксикарбонилизотиоцианат (0,13 мл, 1,1 ммоль) добавляли к этиловому эфиру 3-(бутиламино)-1Н-пиррол-2-карбоновой кислоты (0,23 г, 1,1 ммоль) в толуоле (5 мл) и смесь нагревали при 90°С в течение 1 ч. Осадок отфильтровывали и промывали гексаном. Промежуточный продукт обрабатывали гидроксидом калия (0,55 г, 9,9 ммоль) в воде (9 мл) и нагревали с обратным холодильником в течение 15 ч. После охлаждения до температуры окружающей среды рН доводили до 5, используя 12 М HCl. Образующийся осадок собирали фильтрацией и промывали водой. Неочищенный продукт очищали с использованием препаративной ВЭЖХ с получением соединения, указанного в заголовке (16 мг, 6%), в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.04 (1 Н, br s), 11.95 (1 H, br s), 7.40 (1 H, s), 6.23 (1 H, d, J=2.7 Гц), 3.84 (2 H, t, J=7.2 Гц), 1.66-1.56 (2 H, m), 1.32 (2 H, m), 0.89 (3 H, t, J=7.3 Гц);
MC(ЭРИ) m/z 224(M+1).
Пример 9
1-(2-Изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-[(2-изопропоксиэтил)амино]-1Н-пиррол-2-карбоновой кислоты
Трихлорциануровую кислоту (1,84 г, 7,93 ммоль) добавляли к раствору 2-изопропоксиэтанола (0,75 г, 7,21 ммоль) в CH2Cl2 (3 мл). Реакционную смесь охлаждали до 0°С и осторожно малыми порциями добавляли TEMPO (0,022 г, 0,14 ммоль). Данную смесь перемешивали при комн. темп. в течение 20 минут, затем фильтровали через целит и промывали CH2Cl2. На протяжении фильтрации фильтрат сохраняли холодным, 0°С. К перемешиваемой смеси эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,83 г, 5,41 ммоль) и НОАс (0,62 мл, 10,8 ммоль) при 0°С в метаноле (5 мл) добавляли раствор альдегида. Данную смесь перемешивали в течение 20 минут, затем добавляли NaCNBH3 (0,34 г, 5,41 ммоль). После перемешивания при комн. темп. в течение 2 ч раствор упаривали на диоксиде кремния и очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 100% этилацетата) с получением соединения, указанного в заголовке (0,75 г, 58%), в виде масла.
1H ЯМР (DMSO-d6) δ млн-1 10.72 (1Н, br s), 6.76-6.74 (1H, m), 5.66-5.65 (1H, m), 5.34(1Н, br s), 4.17 (2H, q, J=7.0 Гц), 3.59-3.49 (3H, m), 3.15 (2H, q, J=5.6 Гц), 1.26 (3H, t, J=7.0 Гц), 1.10 (3H, s), 1.08 (3H, s);
МС (ЭРИ) m/z 241 (М+1).
(6) 1-(2-Изопропоксиэтил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке (0,17 г, 23%), получали согласно общему способу Б с использованием этилового эфира 3-[(2-изопропоксиэтил)амино]-1Н-пиррол-2-карбоновой кислоты (0,7 г, 2,91 ммоль) и этоксикарбонилизотиоцианата (0,40 мл, 3,50 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.74 (2H, brs), 7.35 (1H, d, J=2.8 Гц), 6.29 (1H, d, J=3.0 Гц), 4.49 (2H, t, J=6.3 Гц), 3.72 (2H, t, J=6.3 Гц), 3.60-3.58 (1H, m), 1.02 (3H,s),1.01 (3H,s);
МС (ЭРИ) m/z 254 (М+1).
Пример 10
1 -(2-Метокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Эфир 3-[(2-метокси-2-метилпропил)амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 75%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,250 г, 1,62 ммоль) и 2-метокси-2-метилпропаналя (US 3652579) (0,331 г, 3,24 ммоль) с использованием общей методики А, но со следующими модификациями. Через 6 ч добавляли дополнительное количество 2-метокси-2-метилпропаналя (0,165 г, 1,62 ммоль) и затем реакционную смесь перемешивали в течение ночи.
1H ЯМР (DMSO-d6) δ млн-1 10.69 (1Н, br s), 6.74 (1Н, t, J=3.0 Гц), 5.64 (1Н, t, J=2.6 Гц), 5.33 (1Н, br s), 4.17 (2H, q, J=7.1 Гц), 3.11 (3Н, s), 3.03 (2H, d, J=5.8 Гц),1.26(3Н, t, J=7.1 Гц), 1.13(6H,s);
МС (ЭРИ) m/z 241 (М+1).
(б) 1-(2-Метокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 3%-ным выходом, начиная с этилового эфира 3-[(2-этокси-2-метилпропил)амино]-1Н-пиррол-2-карбоновой кислоты (0,283 г, 1,18 ммоль) и этоксикарбонилизотиоцианата (0,13 мл, 1,18 ммоль) с использованием общей методики Б, но со следующими модификациями. Реакцию проводили в микроволновом реакторе в целом в течение 35 минут.
1H ЯМР (DMSO-d6) δ млн-1 12.29 (1Н, br s), 12.17 (1Н, br s), 7.30 (1Н, d, J=2.76), 6.29 (1Н, d, J=2.76), 4.58 (2H, brs), 3.12 (3Н, s), 1.21 (6H, s);
MC(ЭРИ) m/z 254(M+1).
Пример 11
1-(2-Этокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-в]пиримид-4-он
(а) 2-Бром-1,1-диэтокси-2-метилпропан
Данный продукт синтезировали согласно модифицированной методике, описанной в US 3652579. Бромистую воду (2,95 мл, 57,6 ммоль) добавляли по каплям к изобутиральдегиду (4,82 г, 66,8 ммоль) в этаноле (22 мл) и образующуюся смесь перемешивали при комн. темп. в течение 40 минут. Добавляли дополнительное количество бромистой воды (0,3 мл, 5,86 ммоль). Реакционную смесь нейтрализовали добавлением карбоната кальция (3,5 г, 25,3 ммоль). Остающийся карбонат кальция отфильтровывали и фильтрат выливали на смесь лед-вода. Водную фазу экстрагировали CH2Cl2, сушили (Na2SO4), фильтровали и концентрировали. После вакуумной перегонки получали продукт (10,10 г, 67%), указанный в заголовке.
1H ЯМР (DMSO-d6) δ млн-1 4.43 (1Н, s), 3.80-3.73 (2Н, m), 1.64 (6H, s), 1.15 (6H, t, J=7.1 Hz).
(б) 2-Этокси-2-метилпропаналь
Данный продукт синтезировали согласно методике, описанной в US 3652579.
2-Этокси-2-метилпропаналь (5,63 г, 25 ммоль) добавляли по каплям к битартрату калия (2,35 г, 12,5 ммоль) в деионизированной воде, кипящей под обратным холодильником (22,5 мл), на протяжении 50 минут. Образующуюся смесь кипятили с обратным холодильником в течение 70 минут. Растворитель и продукт отгоняли. Добавляли к смеси продукт-растворитель сульфат аммония (всего 8,5 г). Данную смесь перемешивали, затем разделяли две фазы, и верхнюю фазу перегоняли из хлорида кальция с получением продукта (1,60 г, 55%), указанного в заголовке.
МС (ХИ) (химическая ионизация) m/z 117 (M+1).
(в) Этиловый эфир 3-[(2-этокси-2-мет ил пропил) амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 63%-ным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,200 г, 1,30 ммоль) и 2-этокси-2-метилпропиональдегида (0,292 г, 2,86 ммоль) с использованием общей методики А, но со следующей модификацией. Реакционную смесь перемешивали при комн. темп. в течение 48 ч.
1H ЯМР (CDCl2) δ млн-1 6.74 (1Н, br s), 5.70 (1Н, br s), 4.32 (2Н, q, J=7.4 Гц), 3.54-3.47 (2Н, m), 3.44 (2Н, q, J=7.6 Гц), 3.12 (2Н, d, J=4 Гц), 1.25 (6H, s), 1.20 (3H, t, J=7.4 Гц), 1.19 (3H, t, J=7.6 Гц);
МС(ЭРИ) m/z 255(М+1).
(s) 1-(2-Этокси-2-метилпропил)-2-тиоксо-1,2,3,5-тетразидро-пирроло[3,2-d]пиримидин-4-он
Этиловый эфир 3-(2-метокси-2-метил)-пропиламино-1Н-пиррол-2-карбоновой кислоты (0,200 г, 0,79 ммоль) растворяли в СН2Сl2 (2 мл) при комн. темп. в атмосфере азота. Добавляли по каплям этоксикарбонилизотиоцианат (0,12 мл, 1,02 ммоль) и реакционную смесь перемешивали при комн. темп. в течение ночи. Растворитель выпаривали, добавляли этоксид натрия (1 М в этаноле, 0,94 мл, 0,94 ммоль) и реакционную смесь нагревали до 40°С в течение 48 ч. Добавляли воду (2 мл) и рН доводили до нейтрального значения, используя 2 М HCl. Осадок собирали фильтрацией и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, с 6%-ным выходом (0,12 г).
1H ЯМР (DMSO-d6) δ млн-1 12.22 (1Н, br s), 7.30 (1Н, d, J=2.8 Гц), 6.35 (1Н, d, J=3 Гц), 4.60 (2Н, brs), 3.40-3.34 (3H, m), 1.22 (6H, s), 1.04 (3H, t, J=7.0 Гц);
МС(ЭРИ) m/z 267(М+1).
Пример 12
1-(Пиперидин-4-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) трет-Бутиловый эфир 4-[(2-(этокси карбонил)-1Н-пиррол-3-иламино)-метил]пиперидин-1-карбоновой кислоты
Соединение, указанное в заголовке (0,156 г, 10%), получали согласно общему способу А, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,68 г, 4,4 ммоль) и mpem-бутилового эфира 4-формилпиперидин-1-карбоновой кислоты (Р. С.Ting et al., Bioorganic & Medicinal Chemistry Letters, 2001, 11, 491-494) (0,98 г, 4,6 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.70 (1Н, br s), 6.74 (1Н, br s), 5.65 (1Н, br s), 4.19 (2Н, q, J=7.2 Гц), 3.95 (2Н, d, J=12.0 Гц), 2.97 (2Н, t, J=6.0 Гц), 2.65 (2Н, br s), 1.66 (2Н, d, J=12.0 Гц), 1.39 (9H, s), 1.26 (3H, t, J=7.2 Гц), 1.07-0.95 (2Н, m);
MC(ЭРИ) m/z 352(M+1).
(б) 1-(Пиперидин-4-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d] пиримидин-4-он
Этоксикарбонилизотиоцианат (0,058 г, 0,44 ммоль) добавляли к перемешиваемому раствору mpem-бутилового эфира 4-[(2-(этоксикарбонил)-1Н-пиррол-3-иламино)-метил]пиперидин-1-карбоновой кислоты (0,156 г, 0,44 ммоль) в CH2Cl2 (2 мл), и данную смесь перемешивали при комн. темп. в течение 1 ч. Растворитель удаляли в вакууме и остаток растворяли в этаноле (1 мл), содержащем натрий (0,015 г, 0,66 ммоль). Образующуюся смесь нагревали в микроволновом реакторе при 120°С в течение 10 минут. Добавляли 6 М HCl (0,5 мл) и вновь нагревали реакционную смесь в микроволновом реакторе при 100°С в течение 3 минут. рН подводили до нейтрального значения, используя 2 М HCl, и концентрировали раствор в вакууме. Неочищенный продукт очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (0,038 г, 14%), в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 7.36 (1Н, d, J=2.8 Гц), 6.33 (1Н, d, J=2.8 Гц), 4.27 (2Н, br s), 2.95 (2H, d, J=12.0 Гц), 2.40 (2Н, t, J=10.4 Гц), 2.25-2.15 (1Н, m), 1.50 (2Н, d, J=10.8 Гц), 1.37-1.20 (2Н, m);
13C ЯМР (DMSO-d6) δ млн-1 173.2, 152.9, 137.6, 128.1, 114.0, 97.5, 55.2, 45.5, 34.7, 30.0;
MC(ЭРИ) m/z 265(M+1).
Пример 13
1-[(1-Метилпиперидин-3-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
1-Пиперидин-3-илметил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиpимидин-4-oн (Пример 7) (0,092 г, 0,35 ммоль) растворяли в метаноле (2 мл) и добавляли муравьиную кислоту (37% водн., 0,059 мл, 0,7 ммоль). После 5 минут перемешивания при комн. темп. образовался осадок. Добавляли NaCNBH3 (0,026 г, 0,42 ммоль) и перемешивали смесь при комн. темп. в течение 1 ч. Растворитель удаляли в вакууме и остаточное твердое вещество очищали препаративной ВЭЖХ, получая соединение, указанное в заголовке (0,022 г, 22%), в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.22 (1Н, br s), 7.36 (1Н, d, J=2.8 Гц), 6.33 (1Н, s), 4.27 (2Н, br s), 2.61-2.5 (1Н, m), 2.36-2.30 (1Н, m), 2.09 (3Н, s), 1.93-1.82 (3Н, m), 1.65-1.52 (2Н, m), 1.44-1.32 (1Н, m), 1.16-1.07 (1Н, m);
13C ЯМР (DMSO-d6) δ млн-1 173.2, 152.9, 137.6, 128.1, 114.0, 97.3, 59.2, 56.0, 53.3, 46.7, 34.9, 27.7, 24.7;
МС(ЭРИ) m/z 279(М+1).
Пример 14
1-[2-Гидрокси-2-(4-метоксифенил)этил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Метил-{[трет-бутил(диметил)силил]окси}(4-метоксифенил)ацетат
TBDMSCI (1,5 г, 9,94 ммоль) и имидазол (1,0 г, 14,6 ммоль) добавляли к раствору метилгидрокси-(4-метоксифенил)ацетата (Teodozyj Kolasa et al., J. Org. Chem., 1987, 22, 4978-4984) (1,3 г, 6,62 ммоль) в DMF (8 мл), и данную смесь перемешивали при комн. темп. в течение 2 ч. Добавляли воду и смесь экстрагировали диэтиловым эфиром. Органический слой промывали рассолом, сушили (MgSO4), фильтровали и концентрировали с получением соединения, указанного в заголовке (2,0 г, 97%).
1H ЯМР (CDCl3) δ млн-1 7.39 (2Н, d, J=8.8 Гц), 6.88 (2Н, d, J=8.8 Гц), 5.19 (1Н, s), 3.81 (3H, s), 3.69 (3H, s), 0.92 (9H, s), 0.11 (3H, s), 0.03 (3H, s).
(б) {[трет-Бутил(диметил)силил]окси}(4-метоксифенил)ацетальдегид Метил{[трет-бутил(диметил)силил]окси}(4-метоксифенил)ацетат (0,5 г, 1,61 ммоль) растворяли в толуоле (10 мл) и охлаждали до -78°С в атмосфере азота. Медленно добавляли DIBAL (1,0 М в толуоле, 1,9 мл, 1,93 ммоль) и перемешивали смесь в течение 1 ч при -78°С. Данную реакционную смесь выливали на смесь льда (20 г) и СНСl3 (20 мл). Смесь перемешивали при комн. темп. в течение 30 минут. Слои разделяли и водную фазу экстрагировали СНСl3. Органическую фазу промывали рассолом, сушили (MgSO4), фильтровали и концентрировали, получая 99% (0,45 г) соединения, указанного в заголовке. Данный продукт непосредственно использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (CDCl3) δ млн-1 7.40-7.38 (2Н, m), 6.89-6.87 (2Н, m), 5.19 (1Н, s), 3.81 (3H, s), 0.92 (9H, s), 0.11 (3H, s), 0.03 (3H, s).
(в) Этиловый эфир 3-{[2-{[трет-бутил(диметил)силил]окси}-2-(4-метоксифенил)этил]амино}-1 Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке (0,13 г, 19%), получали согласно общему способу А, используя этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,16 г, 1,07 ммоль) и {[трет-бутил(диметил)силил]окси}(4-метоксифенил)ацетальдегид (0,3 г, 1,07 ммоль).
МС(ЭРИ) m/z 417(М-1).
(г) 1-[2-{[трет-Бутил(диметил)силил]окси}-2-(4-метоксифенил)этил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке (0,07 г, 90%), получали согласно общему способу Б, используя этиловый эфир 3-{[2-{[mpem-бутил(диметил)силил]окси}-2-(4-метоксифенил)этил]амино}-1Н-пиррол-2-карбоновой кислоты (0,13 г, 0,31 ммоль) и этоксикарбонилизотиоцианат (0,042 мл, 0,37 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.28-12.23 (2Н, m), 7.42 (2Н, d, J=8.6 Гц), 7.34-7.33 (1Н, m), 6.96 (2Н, d, J=8.6 Гц), 6.33 (1Н, br s), 5.53-5.50 (1H, m), 4.57 (1H, br s), 4.15 (1H,brs), 3.76 (3H,s), 0.61 (9H, s), 0.31 (3Н, s), 0.39 (3Н, s);
MC(ЭРИ) m/z 432(M+1).
(д) 1-[2-Гидрокси-2-(4-метоксифенил)этил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Фторид тетра-н-бутиламмония (1 M в THF, 1,27 мл, 1,27 ммоль) добавляли к 1-[2-{[трет-бутил(диметил)силил]окси}-2-(4-метоксифенил)этил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-ону (0,065 г, 0,152 ммоль) в THF (8 мл). Данную смесь перемешивали при 50°С в течение ночи. Добавляли этилацетат, органическую фазу промывали водой и рассолом, сушили (MgSO4), фильтровали и концентрировали. Это неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (0,018 г, 37%) в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.20 (2Н, br s), 7.40 (2Н, d, J=8.5 Гц), 7.29 (1H, d, J=2.8 Гц), 6.91 (2Н, d, J=8.8 Гц), 6.27 (1H, d, J=2.8 Гц), 5.42-5.41 (1H, m), 5.28-5.24 (1H, m), 4.62-4.58 (1H, m), 4.19-4.16 (1H, m), 3.74 (3Н, s);
MC(ЭРИ) m/z 316(M-1).
Пример 15
1-(2-Метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-[(2-метоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде белого твердого вещества с количественным выходом, начиная с этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,350 г, 2,27 ммоль) и орто-анисальдегида (0,37 г, 2,71 ммоль), используя общую методику А, но со следующими модификациями. После перемешивания в течение ночи реакционную среду упаривали. Неочищенное твердое вещество растворяли в СНСl3, фильтровали и растворитель выпаривали в вакууме, этот неочищенный продукт использовали на следующей стадии без дальнейшей очистки.
MC(ЭРИ) m/z 275(M+1).
(б) 1-(2-Метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 16%-ным выходом, начиная с этилового эфира 3-[(2-метоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты (0,622 г, 2,27 ммоль) и этоксикарбонилизотиоцианата (0,26 мл, 2,27 ммоль), используя общую методику Б, но со следующей модификацией. Промежуточный неочищенный продукт растворяли в 1 М NaOEt (2,27 мл, 2,27 ммоль) и перемешивали при 80°С в течение 3 ч.
1H ЯМР (DMSO-d6) δ млн-1 12.36 (2Н, br s), 7.27 (1Н, d, J=2.8 Гц), 7.27-7.21 (1Н, m), 7.06 (1Н, d, J=8.1 Гц), 6.82 (1Н, t, J=7.3 Гц), 6.79-6.75 (1Н, m), 5.96 (1Н, d, J=2.8 Гц), 5.61 (2Н, s), 3.89 (3Н, s);
МС(ЭРИ) m/z 288(М+1).
Пример 16
1-(3-Метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-[(3-Метоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 57%-ным (0,508 г) выходом и получали согласно общему способу А, используя этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,50 г, 3,24 ммоль) и м-анисальдегид (0,47 мл, 3,89 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.73 (1Н, brs), 7.24-7.20 (1Н, m), 6.90-6.86 (1Н, m), 6.80-6.77 (1Н, m), 6.71-6.69 (1Н, m), 5.75 (1Н, br s), 5.59-5.58 (1Н, m), 4.46 (1Н, d, J=5.8 Гц), 4.25 (2Н, d, J=6.3 Гц), 4.19 (2Н, q, J=7.1 Гц), 3.72 (3Н, s), 1.26 (3H, t, J=7.1 Гц);
МС(ЭРИ) m/z 275(М+1).
(б) 1-(3-Метоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 3%-ным (0,014 г) выходом и получали согласно общему способу Б, используя этиловый эфир 3-[(3-метоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты (0,494 г, 1,80 ммоль) и этоксикарбонилизотиоцианат (0,20 мл, 1,18 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.41-12.34 (2Н, m), 7.29 (1Н, d, J=2.7 Гц), 7.23 (1Н, t, J=8.0 Гц), 6.93-6.91 (1Н, т), 6.86 (1Н, d, J=7.8 Гц), 6.83 (1Н, dd, J=8.2, 2.4 Гц), 6.14 (1Н, d, J=2.8 Гц), 5.67 (2Н, s), 3.71 (3H, s);
MC(ЭРИ) m/z 288(M+1).
Пример 17
1-(2,4-Диметоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-[(2,4-диметоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде масла с 85%-ным (0,838 г) выходом и получали согласно общему способу А, используя этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,50 г, 3,24 ммоль) и 2,4-диметоксибензальдегид (0,647 г, 3,89 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.69 (1Н, br s), 7.14 (1Н, d, J=8.3 Гц), 6.71 (1Н, t, J=3.0 Гц), 6.54 (1Н, d, J=2.3 Гц), 6.44 (1Н, dd, J=8.3 Гц), 5.66 (1Н, t, J=2.5 Гц), 5.59 (1Н, brs), 4.20-4.13 (4H, m), 3.80 (3H, s), 3.73 (3H, s), 1.25 (3H, t, J=7.1 Гц);
13C ЯМР (DMSO-d6) δ млн-1 160.9, 159.6, 158.0, 129.2, 124.0, 120.0, 104.2, 98.3, 95.5, 58.3, 55.4, 55.1, 43.6, 14.7;
MC(ЭРИ) m/z 303(M-1).
(б) 1-(2,4-Диметоксибензил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 14%-ным (0,118 г) выходом и получали согласно общему способу Б, используя этиловый эфир 3-[(2,4-диметоксибензил)амино]-1Н-пиррол-2-карбоновой кислоты (0,828 г, 2,72 ммоль) и этоксикарбонилизотиоцианат (0,31 мл, 2,72 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.41 (1Н, br s), 12.27 (1Н, s), 7.27 (1Н, t, J=2.9 Гц), 6.77 (1Н, d, J=8.3 Гц), 6.61 (1Н, d, J=2.3 Гц), 6.41 (1Н, dd, J=8.5, 2.4 Гц), 5.95 (1Н, t, J=2.3 Гц), 5.54 (2Н, s), 3.88 (3H, s), 3.72 (3H, s);
MC(ЭРИ) m/z 318(M+1).
Пример 18
1-[(3-Хлорпиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-{[(3-хлорпиридин-2-ил)метил]амино}-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке, получали в виде твердого вещества с 91%-ным (0,225 г) выходом и получали согласно общему способу А, используя этиловый эфир 3-амино-1H-пиррол-2-карбоновой кислоты (0,231 г, 1,50 ммоль) и 3-хлорпиридин-2-карбальдегид (Nadeem Iqbal et al., J. Med. Chem. 1998, 41, 1827-1837) (0,212 г, 1,50 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.81 (1Н, br s), 8.53-8.51 (1H, m), 7.94-7.92 (1H, m), 7.40-7.36 (1H, m), 6.77-6.76 (1H, m), 5.74-5.73 (1H, m), 4.43 (1H, d, J=5.5 Гц), 4.20-4.15 (2H, m), 1.30-1.27 (3H, m);
MC(ЭРИ) m/z 280(M+1).
(б) 1-[(3-Хлорпиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 5%-ным (0,011 г) выходом и получали согласно общему способу Б, используя этиловый эфир 3-{[(3-хлорпиридин-2-ил)метил]амино}-1Н-пиррол-2-карбоновой кислоты (0,215 г, 0,77 ммоль) и этоксикарбонилизотиоцианат (0,09 мл, 0,77 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.26 (1H, br s), 8.32-8.30 (1H, m), 7.96-7.93 (1H, m), 7.34-7.30 (1H, m), 7.28 (1H, d, J=3.0 Гц), 6.16 (1H, d, J=2.8 Гц), 5.80 (2H, s);
МС(ЭРИ) m/z 293(М+1).
Пример 19
1-{[3-(2-Этоксиэтокси)пиридин-2-ил]метил}-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) 3-(2-Этоксиэтокси)-2-метилпиридин
Карбонат калия (2,20 г, 15,9 ммоль) добавляли к перемешиваемому раствору 3-гидрокси-2-метилпиридина (1,45 г, 13,3 ммоль) и 2-хлорэтилэтилового эфира (1,75 мл, 15,9 ммоль) в DMF (7 мл) и смесь перемешивали при 70°С в течение ночи. Реакция не была завершена, добавляли дополнительное количество 2-хлорэтилэтилового эфира (1 экв.) и карбоната калия (1 экв.) и перемешивали данную смесь при 85°С в течение 8 ч. Добавляли воду и этилацетат и водный слой экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 50% этилацетата), получая 1,80 г (75%) соединения, указанного в заголовке.
1H ЯМР (DMSO-d6) δ млн-1 8.03-7.99 (1Н, m), 7.33-7.31 (1Н, m), 7.18-7.14 (1H, m), 4.13-4.11 (2H, m), 3.73-3.71 (2H, m), 3.52 (2H, q, J=7.0 Гц), 2.35 (3Н, s), 1.12(3Н, t, J=6.9 Гц);
MC(ЭРИ) m/z 182(M+1).
(б) 3-(2-Этоксиэтокси)пиридин-2-карбальдегид
Смесь 3-(2-этоксиэтокси)-2-метилпиридина (0,506 г, 2,79 ммоль) и диоксида селена (0,31 г, 2,79 ммоль) в 1,4-диоксане (10 мл) нагревали при 75°С в течение ночи. После охлаждения до комн. темп. данную смесь фильтровали и твердые вещества промывали этилацетатом. Растворитель удаляли в вакууме. Реакция не была завершена, и твердое вещество растворяли в 1,4-диоксане (15 мл) и добавляли диоксид селена (0,31 г, 2,79 ммоль). Данную смесь нагревали при 110°С в течение ночи. Добавляли этилацетат (10 мл) и смесь фильтровали. Черное твердое вещество промывали этилацетатом и фильтрат упаривали в вакууме. Неочищенный продукт очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 100% этилацетата), получая 0,21 г (39%) соединения, указанного в заголовке.
1H ЯМР (DMSO-d6) δ млн-1 10.23 (1Н, s), 8.35 (1Н, d, J=4.3 Гц), 7.77 (1Н, d, J=8.6 Гц), 7.66-7.62 (1Н, m), 4.29 (2H, m), 3.75 (2H, m), 3.55-3.49 (2H, m), 1.14-1.09(3H, m).
(в) Этиловый эфир 3-({[3-(2-этоксиэтокси)пиридин-2-ил]метил}амино)-1Н-пиррол-2-карбоновой кислоты
Соединение, указанное в заголовке (0,17 г, 73%), получали согласно общему способу А, используя 3-(2-этоксиэтокси)пиридин-2-карбальдегид (0,21 г, 1,08 ммоль) и этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,11 г, 0,717 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 10.76 (1Н, s), 8.13-8.12 (1H, m), 7.46-7.44 (1H, m), 7.30-7.28 (1H, m), 6.76-6.75 (1H, m), 6.29 (1H, br s), 5.71-5.70 (1H, m), 4.32-4.31 (2H, m), 4.22-4.17 (4H, m), 3.77-3.74 (2H, m), 3.57-3.51 (2H, m), 1.30 (3H, t, J=7.0 Гц), 1.15-1.12 (3H, m);
МС(ЭРИ) m/z 334(М+1).
(г) 1-{[3-(2-Этоксиэтокси)пиридин-2-ил]метил}-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-с1]пиримидин-4-он
Соединение, указанное в заголовке (0,051 г, 28%), получали согласно общему способу Б, используя этиловый эфир 3-({[3-(2-этоксиэтокси)пиридин-2-ил]метил}амино)-1Н-пиррол-2-карбоновой кислоты (0,17 г, 0,52 ммоль) и этоксикарбонилизотиоцианат (0,07 мл, 0,62 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.32-12.19 (2H, m), 7.92 (1H, d, J=4.0 Гц), 7.47 (1H, d, J=7.8 Гц), 7.32-7.14 (2H, m), 5.98 (1H, d, J=2.8 Гц), 5.73 (2H, s), 4.26-4.23 (2H, m), 3.78-3.76 (2H, m), 3.55 (2H, q, J=7.1 Гц), 1.14 (3H, t, J=6.9 Гц);
13C ЯМР (DMSO-d6) δ 173.5, 152.7, 152.4, 143.7, 140.3, 137.8, 127.7, 123.0, 119.0, 113.5, 96.8, 68.2, 65.8, 49.8, 15.1;
MC(ЭРИ) m/z 347(M+1).
Пример 20
1-[(6-Оксо-1,6-дигидропиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-{[(6-оксо-1,6-дигидропиридин-2-ил)метил]амино}-1Н-пиррол-2-карбоновой кислоты
б-Оксо-1,6-дигидропиридин-2-карбальдегид (WO 2002/006272) (0,31 г, 2,5 ммоль) растворяли в ЕtOН (10 мл). Добавляли этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,19 г, 1,3 ммоль), с последующим добавлением НОАс (0,14 мл, 2,5 ммоль). Данную смесь перемешивали в течение 75 минут при комн. темп. и затем добавляли NaCNBH3 (0,16 г, 2,5 ммоль). Реакционную смесь перемешивали при комн. темп. в течение ночи. Растворитель выпаривали в вакууме и неочищенный продукт очищали колоночной флэш-хроматографией (градиент СН2Сl2/метанола; от 0 до 10% метанола), получая 0,288 г (85%) продукта, указанного в заголовке, в виде масла, которое кристаллизовалось при отстаивании.
1H ЯМР (DMSO-d6) δ млн-1 11.57 (1Н, br s), 10.77 (1H, br s), 7.34-7.30 (1H, m), 6.71-6.70 (1H, m), 6.16-6.13 (2H, m), 5.98 (1H, br s), 5.75 (1H, s), 5.64-5.63 (1Н, m), 4.20 (2H, q, J=7.1 Гц), 4.09-4.08 (2Н, m), 1.27 (3H, t, J=7.1 Гц);
МС(ЭРИ) m/z 262(М+1).
(б) 1-[(6-Оксо-1,6-дигидропиридин-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Бензоилизотиоцианат (0,27 г, 1,6 ммоль), растворенный в CH2Cl2 (3 мл), добавляли к этиловому эфиру 3-{[(6-оксо-1,6-дигидропиридин-2-ил)метил]амино}-1Н-пиррол-2-карбоновой кислоты (0,25 г, 0,96 ммоль) в CH2Cl2 (7 мл). Образующуюся смесь перемешивали при комн. темп. в течение ночи. Растворитель удаляли в вакууме, остаток растворяли в метаноле (15 мл) и добавляли карбонат калия (0,50 г, 3,6 ммоль). Реакционную смесь перемешивали при 50°С в течение 6,5 ч. После охлаждения до комн. темп., добавляли по каплям 1 M HCl, пока не получали нейтральный рН. Образующийся осадок собирали, промывали метанолом и очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке (0,097 г, 37%), в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.46-12.38 (2H, m), 11.69 (1H, br s), 7.34-7.29 (2H, m), 6.23 (2H, s), 5.75 (1H, br s), 5.49 (2H, s);
13C ЯМР (DMSO-d6) δ 173.6, 162.7, 152.5, 140.6, 136.7, 128.0, 113.6, 96.6;
МС(ЭРИ) m/z 275(М+1).
Пример 21
1-(1Н-Индол-3-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этил-3-[(1Н-индол-3-илметил)амино]-1Н-пиррол-2-карбоксилат
Реакционную смесь этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,075 г, 0,49 ммоль), индол-3-карбоксальдегида (0,085 г, 0,58 ммоль), NaCNBH3 (0,031 г, 0,49 ммоль) и НОАс (0,056 мл, 0,97 ммоль) в метаноле (3 мл) перемешивали при комн. темп. в течение ночи. Данную смесь концентрировали в вакууме и смесь неочищенного продукта использовали на следующей стадии без дальнейшей очистки.
МС(ЭРИ) m/z 284(М+1).
(6) 1-(1Н-Индол-3-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Неочищенную смесь этил-3-[(1Н-индол-3-илметил)амино]-1Н-пиррол-2-карбоксилата (максимум 0,49 ммоль) добавляли к CH2Cl2 (5 мл). Добавляли несколько капель метанола для повышения растворимости. Добавляли бензоилизотиоцианат (0,072 г, 0,53 ммоль) и смесь перемешивали при комн. темп. в течение 1 ч. Данную смесь концентрировали в вакууме. Добавляли аммиак (7 н. в метаноле, 3 мл) и смесь нагревали при 80°С в течение 2 ч. Данную смесь концентрировали и очищали препаративной ВЭЖХ, получая соединение, указанное в заголовке (0,030 г, 21%), в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.13 (2Н, br s), 11.08(1H, s), 7.87 (1Н, d, J=8.1 Гц), 7.54-7.47 (1Н, m), 7.38-7.30 (1Н, m), 7.29-7.25 (1Н, m), 7.10-7.03 (1Н, m), 7.01-6.93 (1Н, m), 6.33 (1Н, d, J=2.8 Гц), 5.88 (2Н, s);
13C ЯМР (DMSO-d6) δ млн-1 173.14, 152.86, 136.71, 136.42, 128.02, 126.45, 125.83, 121.61, 119.67, 119.16, 114.36, 111.95, 109.51, 97.74, 46.31;
МС(ЭРИ) m/z 295(М-1).
Пример 22
1-(1Н-Бензимидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этил-3-[(1Н-бензимидазол-2-илметил)амино]-1Н-пиррол-2-карбоксилат
Реакционную смесь этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,77 г, 4,99 ммоль), 1Н-бензимидазол-2-карбоксальдегида (0,88 г, 5,99 ммоль), NaCNBH3 (0,31 г, 4,99 ммоль) и НОАс (0,57 мл, 9,99 ммоль) в метаноле (15 мл) перемешивали при комн. темп. в течение ночи. Данную смесь затем нагревали при 50°С в течение 5 ч, охлаждали до комн. темп. и упаривали в вакууме. Остаток растворяли в этилацетате и промывали водой. Водную фазу экстрагировали этилацетатом (дважды). Объединенные органические слои сушили (MgSO4) и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией (гептан/этилацетат (от 1:0 до 0:1), получая 1,15 г (81%) соединения, указанного в заголовке.
1H ЯМР (DMSO-de) δ млн-1 12.27 (1Н, s), 10.85 (1H, s), 7.63-7.37 (2H, m), 7.17-7.08 (2H, m), 6.71 (1H, t, J=3.0 Гц), 5.99 (1H, br s), 5.60 (1H, t, J=2.7 Гц), 4.48 (2H, d, J=5.8 Гц), 4.22 (2H, q, J=7.1 Гц), 1.29 (3H, t, J=7.1 Гц);
MC(ЭРИ) m/z 285(M+1).
(б) 1-(1Н-Бензимидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Этил-3-[(1Н-бензимидазол-2-илметил)амино]-1Н-пиррол-2-карбоксилат (0,33 г, 1,16 ммоль) добавляли к CH2Cl2 (3 мл) и добавляли метанол, пока не получали прозрачный раствор. Данный раствор перемешивали при комн. темп. в течение 1 ч. Добавляли бензоилизотиоцианат (0,73 мл, 0,46 ммоль) и концентрировали смесь после перемешивания при комн. темп. в течение 30 минут. Остаток растворяли в аммиаке (7 н. в метаноле, 7 мл) и смесь нагревали при 80°С в герметично закрытом стальном контейнере в течение 2 ч. После охлаждения до комн. темп. осажденный продукт фильтровали и промывали метанолом, диэтиловым эфиром и этилацетатом, получая 0,23 г (66%) соединения, указанного в заголовке, в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.27 (3H, brs), 7.61-7.37 (2H, m), 7.43-7.27 (1H, m), 7.18-7.07 (2H, m), 6.19 (1H, d, J=2.8 Гц), 5.89 (2H, s);
МС(ЭРИ) m/z 298(М+1).
Пример 23
1-[(5-Хлор-1Н-индол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
5-Хлор-1Н-индол-2-карбальдегид (0,15 г, 0,76 ммоль), NaCNBH3 (0,040 г, 0,63 ммоль) и Et3N (0,088 мл, 0,63 ммоль) добавляли к перемешиваемому раствору гидрохлорида этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,12 г, 0,63 ммоль) в метаноле (3 мл). Образующуюся смесь перемешивали при комн. темп. в течение ночи. Реакционную смесь нагревали до 50°С. Добавляли дополнительное количество NaCNBH3 (0,5 экв.) и смесь перемешивали при 50°С в течение 3 ч. Добавляли несколько капель НОАс и через 1 ч реакционную среду охлаждали до комн. темп. и концентрировали в вакууме. Остаток растворяли в CH2Cl2 (2 мл) и метаноле (2 мл). Добавляли бензоилизотиоцианат (0,093 мл, 0,69 ммоль) и после перемешивания при комн. темп. в течение 1 ч данную смесь концентрировали в вакууме. Остаток растворяли в аммиаке (7 н. в метаноле, 3 мл) и нагревали при 80°С в течение 2 ч. Осажденный продукт фильтровали и промывали метанолом и диэтиловым эфиром, с последующей очисткой препаративной ВЭЖХ, получая 0,063 г (30%) соединения, указанного в заголовке, в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.41 (2Н, br s), 11.51-11.04 (1H, m), 7.51-7.46 (1H, m), 7.40-7.33 (1H, m), 7.33-7.30 (1H, m), 7.07-6.99 (1H, m), 6.34-6.27 (2Н, m), 5.87-5.80 (2Н, m);
13C ЯМР (DMSO-de) 5 млн-1 173.65, 153.05, 136.84, 135.98, 134.74, 129.28, 128.27, 123.97, 121.26, 119.19, 114.24, 113.25, 100.33, 97.17, 47.31;
МС (ЭРИ) m/z 331 (M+1).
Пример 24
1-[(5-Фтор-1Н-индол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 19%-ным (0,038 г) выходом и получали согласно общему способу из Примера 23, используя гидрохлорид этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,12 г, 0,63 ммоль), 5-Фтор-1Н-индол-2-карбальдегид (0,12 г, 0,76 ммоль), МаСМВНз(0,040 г, 0,63 ммоль, +0,5 экв.), Et3N (0,088 мл, 0,63 ммоль) и бензоилизотиоцианат (0,093 мл, 0,69 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.38 (2Н, br s), 11.10 (1H, s), 7.41-7.26 (2Н, m), 7.25-7.11 (1H, m), 6.96-6.79 (1H, m), 6.37-6.24 (2Н, m), 5.83 (2Н, s);
13C ЯМР (DMSO-d6) δ млн-1 173.61, 173.81, 158.46, 156.17, 152.94, 136.85, 136.10, 132.94, 128.39, 128.30, 114.19, 112.71, 112.61, 109.54, 109.28, 104.75, 104.51, 100.82, 100.78, 97.23, 47.35;
МС (ЭРИ) m/z 315 (M+1).
Пример 25
1-(1Н-Индол-6-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 19%-ным (0,035 г) выходом и получали согласно общему способу из Примера 23, используя гидрохлорид этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,12 г, 0,63 ммоль), 6-формилиндол (0,11 г, 0,76 ммоль), МаСМВНз (0,040 г, 0,63 ммоль, +0,5 экв.), Et3N (0,088 мл, 0,63 ммоль) и бензоилизотиоцианат (0,093 мл, 0,69 ммоль).
1H ЯMP(DMSO-d6) δ млн-1 12.37 (2H, br s), 11.01 (1H, s), 7.53-7.43 (1H, m), 7,33 (1H, s), 7.32-7.25 (2H, m), 7.09-7.03 (1H, m), 6.41- 6.34 (1H, m), 6.17 (1H, d, J=2.8 Гц), 5.79 (2H, s);
13С ЯМР (DMSO-d6) δ млн-1 173.76, 152.91, 137.06, 136.21, 128.88, 128.27, 127.31, 125.99, 120.35, 118.91, 114.16, 110.24, 101.28, 97.63, 53.32;
МС(ЭРИ) m/z 297(М+1).
Пример 26
1-(1Н-Индол-5-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Соединение, указанное в заголовке, получали в виде твердого вещества с 39%-ным (0,073 г) выходом и получали согласно общему способу из Примера 23, используя гидрохлорид этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,12 г, 0,63 ммоль), 5-формилиндол (0,11 г, 0,76 ммоль), NaCNBH3 (0,040 г, 0,63 ммоль, +0,5 экв.), Et3N (0,088 мл, 0,63 ммоль) и бензоилизотиоцианат (0,093 мл, 0,69 ммоль).
1H ЯМР (DMSO-d6) δ млн-1 12.33 (2H, br s), 11.07 (1H, s), 7.52 (1H, s), 7.36-7.29 (2H, m), 7.29-7.25 (1H, m), 7.21-7.12 (1H, m), 6.39-6.34 (1H, m), 6.21-6.16 (1H, m), 5.77 (2H, s);
13C ЯМР (DMSO-d6) δ млн-1 173.32, 152.51, 136.63, 135.20, 127.83, 127.50, 126.15, 125.81, 120.54, 118.81, 113.82, 111.40, 101.00, 97.28, 52.99;
МС(ЭРИ) m/z 297(М+1).
Пример 27
1-[(5-Фтор-1Н-индол-3-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Гидрохлорид этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,10 г, 0,52 ммоль) растворяли в метаноле (4 мл) и добавляли 5-Фтор-1Н-индол-3-карбоксальдегид (0,10 г, 0,63 ммоль), NaCNBH3 (0,033 г, 0,52 ммоль) и Et3N (0,073 г, 0,52 ммоль). Образующуюся смесь перемешивали при комн. темп. в течение ночи. Добавляли дополнительное количество NaCNBH3 (0,01 г) и нагревали смесь при 50°С в течение 5 ч. Реакционную смесь охлаждали до комн. темп. и концентрировали в вакууме. Неочищенное промежуточное соединение растворяли в СН2Сl г (3 мл) и метаноле (1 мл). Добавляли бензоилизотиоцианат (0,078 мл, 0,58 ммоль) и после перемешивания при комн. темп. в течение 1 ч данную смесь концентрировали в вакууме. Остаток растворяли в аммиаке (7 н. в метаноле, 3 мл) и нагревали при 80°С в течение 2 ч. Растворитель удаляли в вакууме и после очистки препаративной ВЭЖХ получали соединение, указанное в заголовке (0,035 г, 21%), в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.29 (2Н, s), 11.38-11.08 (1Н, m), 7.76-7.68 (1Н, m), 7.65-7.59 (1Н, m), 7.37-7.30 (1Н, m), 7.30-7.27 (1Н, m), 6.96-6.86 (1Н, m), 6.37 (1H,d,J=2.81-H), 5.84(2H, s);
13C ЯМР (DMSO-d6) δ млн-1 173.09, 158.27, 155.97, 152.81, 136.59, 133.11, 128.14, 128.09, 126.70, 126.59, 114.37, 113.01, 112.91, 109.95, 109.91, 109.86, 109.68, 104.70, 104.46, 97.74, 46.10;
МС(ЭРИ) m/z 315(М+1).
Пример 28
1-(1Н-Имидазол-5-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Гидрохлорид этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,10 г, 0,52 ммоль) растворяли в метаноле (4 мл) и добавляли 4-формилимидазол (0,060 г, 0,63 ммоль), NаСNВН3 (0,033 г, 0,52 ммоль) и Et3N (0,073 г, 0,52 ммоль). Образующуюся смесь перемешивали при комн. темп. в течение ночи. Растворитель удаляли в вакууме и остаток растворяли в CH2Cl2 (3 мл) и метаноле (1 мл). Добавляли бензоилизотиоцианат (0,078 мл, 0,58 ммоль) и после перемешивания при комн. темп. в течение 30 минут данную смесь концентрировали в вакууме. Остаток растворяли в аммиаке (7 н. в метаноле, 3 мл) и нагревали при 80°С в течение 1 ч. Выпавший в осадок продукт фильтровали и промывали метанолом с последующей промывкой диэтиловым эфиром. Неочищенный продукт очищали препаративной ВЭЖХ, получая 0,017 г (13%) соединения, указанного в заголовке, в виде твердого вещества.
ОС 710/07
1H ЯМР (DMSO-d6) δ млн-1 12.49-11.78 (ЗН, m), 7.53 (1Н, s), 7.30 (1Н, d, J=2.8 Гц), 7.05 (1Н, s), 6.36 (1Н, d, J=3.0 Гц), 5.54 (2Н, s);
MC(ЭРИ) m/z 335(M+1).
Пример 29
1-(1Н-Имидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этил-3-[(1Н-имидазол-2-илметил)амино]-1Н-пиррол-2-карбоксилат
Реакционную смесь с этиловым эфиром 3-амино-1Н-пиррол-2-карбоновой кислоты (0,2 г, 1,30 ммоль), 2-имидазолкарбоксальдегидом (0,15 г, 1,53 ммоль), NaCNBH3 (0,082 г, 1,30 ммоль) и ОНАс (0,15 мл, 2,60 ммоль) в метаноле (5 мл) перемешивали при комн. темп. в течение 2 ч. Растворитель выпаривали в вакууме и остаток растворяли в этилацетате, промывали водой и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои сушили (МgSO4), фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией (градиент СН2Сl2/метанола; от 0 до 20% метанола), получая 0,30 г (99%) соединения, указанного в заголовке.
1H ЯМР (DMSO-d6) δ млн-1 10.84 (1Н, br s), 7.03 (2Н, s), 6.79-6.64 (1Н, m), 5.76 (1Н, br s), 5.68-5.57 (1Н, m), 4.29 (2Н, d, J=5.8 Гц), 4.19 (2Н, q, J=7.1 Гц), 3.16 (1H,s), 1.26(3H,t,J=7.1 Гц);
МС(ЭРИ) m/z 235(М+1).
(б) 1-(1Н-Имидазол-2-илметил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Бензоилизотиоцианат (0,19 мл, 1,41 ммоль) добавляли к перемешиваемому раствору этил-3-[(1Н-имидазол-2-илметил)амино]-1Н-пиррол-2-карбоксилата (0,3 г, 1,28 ммоль) в CH2Cl2 (4 мл) и метаноле (2 мл) и данную смесь перемешивали при комн. темп. в течение 1 ч. Растворитель выпаривали в вакууме и остаток растворяли в аммиаке (7 н. в метаноле, 7 мл) и нагревали при 80°С в течение 1 ч. Неочищенный продукт фильтровали и очищали препаративной ВЭЖХ, получая 0,110 г (35%) соединения, указанного в заголовке, в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.46-12.14 (2Н, m), 11.81 (1Н, brs), 7.28 (1Н, d, J=2.5 Гц), 6.99 (1Н, s), 6.79 (1Н, s), 6.13 (1Н, d, J=2.8 Гц), 5.67 (2Н, s);
МС(ЭРИ) m/z 248(М+1).
Пример 30
1-[(5-Хлор-1H-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этил-3-{[(5-хлор-1Н-бензимидазол-2-ил)метил]амино}-1Н-пиррол-2-карбоксилат
Реакционную смесь этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,077 г, 0,5 ммоль), NaCNBH3 (0,057 г, 0,9 ммоль) и НОАс (0,030 г, 0,5 ммоль) в метаноле (4 мл) перемешивали при комн. темп. в течение 5 минут перед добавлением 5-хлор-1Н-бензимидазол-2-карбальдегида (0,144 г, 0,8 ммоль) с последующим добавлением CH2Cl2 (1 мл) и DMF (0,4 мл). Образующуюся смесь оставляли перемешиваться в течение 16 ч при комн. темп. в атмосфере азота. Добавляли дополнительное количество 5-хлор-1Н-бензимидазол-2-карбальдегида (0,030 г) и NaCNBH3 (0,015 г) и перемешивали реакционную смесь в течение 4 ч. Данную реакционную смесь нейтрализовали 2 М NaOH и разбавляли этилацетатом. Экстрагировали водой и органический слой сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 100% этилацетата), получая 0,074 г (46%) продукта, указанного в заголовке.
1H ЯМР (CDCl3) δ млн-1 8.28 (1Н, br s), 7.52 (1H, s), 7.44 (1H, d, J=2.0 Гц), 7.22 (1H, d, J=2.0 Гц), 6.66 (1H, s), 5.61 (1H, t, J=2.4 Гц), 4.67 (2Н, s), 4.27 (2H, m), 1.33(3Н, t, J=6.8 Гц);
MC(ЭРИ) m/z 319(M+1).
(б) 1-[(5-Хлор-1Н-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Раствор этил-3-{[(5-хлор-1Н-бензимидазол-2-ил)метил]амино}-1Н-пиррол-2-карбоксилата (0,074 г, 0,23 ммоль) в CH2Cl2 перемешивали в течение 5 минут. Для повышения растворимости добавляли DMF (0,2 мл). Добавляли бензоилизотиоцианат (0,045 г, 0,28 ммоль) и перемешивали смесь в течение 1 ч, затем концентрировали в вакууме. Неочищенное промежуточное соединение растворяли в аммиаке (7 н. в метаноле, 2 мл) и перемешивали при 70°С в течение 1,5 ч в герметично закрытом сосуде. После охлаждения до комн. темп. выпавший в осадок продукт собирали вакуумной фильтрацией, промывали диэтиловым эфиром и сушили, получая 0,033 г (43%) продукта, указанного в заголовке, в виде белого твердого вещества.
1Н ЯМР (DMSO-d6) δ млн-1 12.33 (3Н, br s), 7.48 (2H, m), 7.32 (1H, s), 7.17 (1H, d, J=8.0 Гц), 6.21 (1H, s), 5.88 (2H, s);
MC(ЭРИ) m/z 332(M+1).
Пример 31
1-[(4,5-Диметил-1Н-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) 4,5-Диметил-1Н-бензимидазол-2-карбальдегид 3,4-Диметилбензол-1,2-диамин (0,409 г, 3,0 ммоль) и дихлоруксусную кислоту (0,768 г, 6,0 ммоль) в 4 н. HCl (10 мл) нагревали при 100°С в течение двух суток. После охлаждения до комн. темп. данную смесь фильтровали и маточный раствор экстрагировали хлороформом (4 раза). рН доводили до 12, используя 2 М NaOH, и образующийся белый осадок собирали фильтрацией. Неочищенный продукт использовали на следующей стадии без дальнейшей очистки.
MC(ЭРИ) m/z 175(M+1).
(б) Этил-3-{[(4,5-диметил-1Н-бензимидазол-2-ил)метил]амино}-1Н-пиррол-2-карбоксилат
Этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,077 г, 0,5 ммоль), 4,5-диметил-1Н-бензимидазол-2-карбальдегид (0,130 г, 0,75 ммоль) и НОАс (0,045 г, 0,75 ммоль) перемешивали в метаноле (4 мл) с последующим добавлением NаСNВН3. Образующуюся смесь перемешивали при комн. темп. в течение 16 ч. Реакционную смесь нейтрализовали 2 М NaOH и растворитель удаляли в вакууме. Остаток растворяли в этилацетате и экстрагировали водой. Органический слой сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от О до 100% этилацетата), получая белое твердое вещество, 0,043 г (27%) соединения, указанного в заголовке, в виде смеси таутомеров (1:1).
1H ЯМР (DMSO-d6) δ млн-1 12.15 (1Н, s), 12.04 (1Н, s), 10.81 (2H, s), 7.26 (1H, d, J=8.4 Гц), 7.12 (1Н, d=8.0 Гц), 6.94 (2H, d, J=8.4 Гц), 6.72 (2H, s), 5.93 (2H, s), 5.70 (1Н, s), 5.61 (1Н, s), 4.44 (4H, dd, J=9.2, 6.0 Гц), 4.22 (4Н, m), 2.44 (3H, s), 2.37 (3H, s), 2.29 (6H, s), 1.30 (6H, m);
МС(ЭРИ) m/z 313(М+1).
(в) 1-[(4,5-Диметил-1Н-бензимидазол-2-ил)метил]-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Этил-3-{[(4,5-диметил-1Н-бензимидазол-2-ил)метил]амино}-1Н-пиррол-2-карбоксилат (0,043 г, 0,14 ммоль) растворяли в CH2Cl2 (1,5 мл) и добавляли бензоилизотиоцианат (0,026 г, 0,16 ммоль). После перемешивания при комн. темп. в течение 1 ч растворитель удаляли в вакууме. Остаток растворяли в аммиаке (7 н. в метаноле) и нагревали до 70°С в течение 2 ч в герметично закрытом сосуде. Растворитель удаляли в вакууме и остаток очищали препаративной ВЭЖХ, получая белое твердое вещество, 0,008 г (18%) соединения, указанного в заголовке, в виде смеси таутомеров (1:1).
1H ЯМР (DMSO-d6) δ млн-1 12.18 (2Н, s), 11.98 (2Н, s), 7.28 (2Н, t, J=2.4 Гц), 7.19 (1Н, d, J=8.0 Гц), 7.08 (1H, d, J=8.0 Гц), 6.92 (2Н, t, J=8.0 Гц), 6.14 (2Н, dd, J=8.0, 2.8 Гц), 5.89 (2Н, s), 5.86 (2Н, s), 2.41 (3H, s), 2.37 (3H, s), 2.29 (3H, s), 2.28 (3H, s);
MC(ЭРИ) m/z 326(M+1).
Пример 32
7-Бром-1-изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этиловый эфир 3-амино-4-бром-1Н-пиррол-2-карбоновой кислоты
Этиловый эфир 3-амино-1Н-пиррол-2-карбоновой кислоты (0,92 г, 0,6 ммоль) растворяли в НОАс (1 мл) и добавляли бромную воду (0,96 г, 0,6 ммоль). Данную смесь перемешивали при комн. темп. в течение 1 ч, образующийся белый осадок собирали фильтрацией и промывали диэтиловым эфиром. Соединение, указанное в заголовке (0,136 г, 97%) получали в виде белого твердого вещества и использовали на следующей стадии без дальнейшей очистки.
1H ЯМР (DMSO-d6) δ млн-1 11.67 (1H, s), 7.05 (1H, s), 6.02 (2Н, br s), 4.25 (2Н, q, J=7.2 Гц), 1.28 (3H, t, J=7.2 Гц);
MC(ЭРИ) m/z 233(M+1).
(б) Этиловый эфир 4-бром-3-(изобутиламино)-1Н-пиррол-2-карбоновой кислоты
Этиловый эфир 3-амино-4-бром-1Н-пиррол-2-карбоновой кислоты (0,136 г, 0,58 ммоль) и изобутиральдегид (0,067 г, 0,93 ммоль) перемешивали в CH2Cl2/MeOH (1:1, 3 мл) при комн. темп. в течение 2 ч. Добавляли NaCNBH3 (0,065 г, 1,04 ммоль) и НОАс (0,035 г, 0,58 ммоль), перемешивали смесь при комн. темп. в течение 2 ч и затем перемешивали при 50°С в течение 16 ч. Добавляли дополнительное количество изобутиральдегида (1 экв.) и NаСNВН3 (0,5 экв.) и продолжали перемешивание данной смеси при 50°С в течение ночи. Реакционную смесь нейтрализовали раствором 2 М NaOH и растворители удаляли в вакууме. Осадок растворяли в этилацетате и экстрагировали водой. Органический слой сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали флэш-хроматографией (градиент гептана/этилацетата, от 0 до 30% этилацетата), получая соединение, указанное в заголовке (0,040 г, 24%), в виде белого твердого вещества.
1H ЯМР (CDCl3) δ млн-1 6.75 (1Н, s), 4.32 (2Н, q, J=7.2 Гц), 3.28 (2Н, d, J=6.8 Гц), 1.85 (1Н, m), 1.35 (3H, t, J=7.2 Гц), 0.97 (3Н, d, J=6.8 Гц);
МС(ЭРИ) m/z 289(М+1).
(в) 7-Бром-1-изобутил-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Бензоилизотиоцианат (0,034 г, 0,2 ммоль) добавляли к раствору этилового эфира 4-бром-3-(изобутиламино)-1Н-пиррол-2-карбоновой кислоты (0,050 г, 0,17 ммоль) в CH2Cl2 и образующуюся смесь перемешивали при комн. темп. в течение 1 ч перед ее концентрированием в вакууме. Остаток растворяли в аммиаке (7 М в метаноле, 1,5 мл) и перемешивали при 70°С в течение 4 ч. Добавляли дополнительное количество аммиака (7 М в метаноле, 1 мл) и смесь перемешивали в течение при 80°С 5 ч. Данную смесь охлаждали до комн. темп. и выпавший в осадок продукт фильтровали и промывали диэтиловым эфиром. После перекристаллизации с метанолом получали соединение, указанное в заголовке (0,028 г, 55%), в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.57 (2Н, brs), 7.58 (1Н, s), 4.92 (1Н, brs), 4.42 (1Н, brs), 2.39 (1Н, m), 0.94 (6H, d, J=6.4 Гц);
MC(ЭРИ) m/z 303(M+1).
Пример 33
1-(3-Хлорфенил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
(а) Этил-3-[(3-хлорфенил)амино]-1Н-пиррол-2-карбоксилат
Смесь этилового эфира 3-амино-1Н-пиррол-2-карбоновой кислоты (0,20 г, 1,3 ммоль), 3-бромхлорбензола (0,30 г, 1,6 ммоль), Pd2(dba)3 (0,048 г, 0,052 ммоль), рац. -BINAP (0,048 г, 0,078 ммоль) и карбоната цезия (0,59 г, 1,8 ммоль) нагревали при 100°С в герметично закрытом сосуде для облучения микроволнами в атмосфере азота в течение ночи. Добавляли дополнительное количество Pd2(dba)3 (0,10 г, 0,11 ммоль) и R.S-BINAP (0,11 г, 0,18 ммоль) и продолжали перемешивание реакционной смеси в течение ночи при 100°С. Добавляли дополнительное количество 3-бромхлорбензола (0,15 г), Pd2(dba)3 (0,098 г) и R,S-BINAP (0,098 г) и продолжали перемешивание реакционной смеси при 100°С в течение еще трех суток. Реакционную смесь вливали в этанол и образующийся раствор фильтровали. Фильтрат упаривали в вакууме и остаток очищали колоночной флэш-хроматографией (градиент гептана/этилацетата; от 0 до 30% этилацетата), получая 0,052 г (15%) соединения, указанного в заголовке.
1H ЯМР (CDCl3) δ млн-1 8.42 (1Н, br s), 7.17 (1Н, t, J=8.0 Гц), 7.14 (1Н, t, J=2.0 Гц), 6.96-6.94 (1Н, m), 6.87-6.84 (1Н, m), 6.82 (1Н, t, J=3.0 Гц)', 6.32 (1Н, t, J=3.0 Гц), 4.35 (2Н, q, J=7.2 Гц), 1.38 (3H, t, J=7.1 Гц);
МС(ЭРИ) m/z 263(М-1).
(б) 1-(3-Хлорфенил)-2-тиоксо-1,2,3,5-тетрагидро-пирроло[3,2-d]пиримидин-4-он
Бензоилизотиоцианат (0,035 г, 0,22 ммоль) в СН2Сl2 (0,5 мл) добавляли к этил-3-[(3-хлорфенил)амино]-1Н-пиррол-2-карбоксилату (0,052 г, 0,20 ммоль) в CH2Cl2 (0,5 мл). Данную смесь перемешивали при комн. темп. в течение ночи. Добавляли дополнительное количество бензоилизотиоцианата (0,035 г + 0,035 г + 0,035 г) в течение 6 ч, и продолжали перемешивание реакционной смеси в течение 3 суток при 50°С. Растворитель удаляли в вакууме и остаток растворяли в аммиаке (7 н. в метаноле, 4 мл). Реакционную смесь нагревали при 50°С в течение 2 ч. Неочищенный продукт очищали препаративной хроматографией, получая 0,009 г (15%) соединения, указанного в заголовке, в виде твердого вещества.
1H ЯМР (DMSO-d6) δ млн-1 12.41 (2Н, br s), 7.60-7.57 (3H, m), 7.41-7.37 (1Н, m), 7.25 (1Н, d, J=2.8 Гц), 5.36 (1Н, d, J=2.8 Гц);
13C ЯМР (DMSO-d6) δ млн-1 173.8, 152.8, 141.5, 137.9, 133.5, 131.,3 129.0, 128.6, 127.7, 127.3, 113.3,96.7;
MC(ЭРИ) m/z 278(M+1).
Скрининги
Способы определения активности ингибирования МПО раскрыты в заявке на патент WO 02/090575. Фармакологическую активность соединений по изобретению тестировали в следующем скрининге, в котором соединения тестировали либо в отдельности, либо в присутствии добавленного тирозина:
Буфер для анализа: 20 мМ натриевого/калиевого фосфатного буфера, рН 6,5, содержащего 10 мМ таурина и 100 мМ NaCl.
Проявляющий реагент: 2 мМ 3,3',5,5'-тетраметилбензидина (ТМВ), 200 мкМ KI, 200 мМ ацетатного буфера, рН 5,4, с 20%-ным DMF.
К 10 мкл разбавленных соединений в буфере для анализа добавляли 40 мкл человеческой МПО (конечная концентрация 2,5 нМ), содержащей или не содержащей 20 мкМ тирозина (конечная концентрация, в случае его присутствия, 8 мкМ), и инкубировали данную смесь в течение 10 минут при температуре окружающей среды. Затем добавляли 50 мкл Н2O2 (конечная концентрация 100 мкМ) или только буфер для анализа в качестве контроля. После инкубации в течение 10 минут при температуре окружающей среды реакцию останавливали добавлением 10 мкл 0,2 мг/мл каталазы (конечная концентрация 18 мкг/мл). Реакционную смесь оставляли в течение дополнительных 5 минут перед добавлением 100 мкл проявляющего реагента ТМВ. Затем измеряли количество образовавшегося окисленного 3,3',5,5'-тетраметилбензидина примерно через 5 минут, используя абсорбционную спектроскопию при приблизительно 650 нм. Затем определяли значения HKso, используя стандартные методики.
При тестировании в по меньшей мере одном варианте приведенного выше скрининга соединения из Примеров 1-32 давали значения ИК50 менее 60 мкМ, указывая на то, что они, как ожидается, показывают полезную терапевтическую активность. Репрезентативные результаты показаны в следующей Таблице.
|
![НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/8b/bc/11/4336e30ab4ebe875d30a9c35c8be9859.jpg)
![НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/8b/bc/11/09417415d7117ff7cad4fd88ecd7b2cd.jpg)
![НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/8b/bc/11/a1a4410441e364d5c24313b507d501e7.jpg)

