Результат интеллектуальной деятельности: БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ АЛЛОФЕРОНА-1
Вид РИД
Изобретение
Изобретение относится к белкам и биологически активным пептидам с иммуномодулирующей и противовирусной активностью.
Известна группа противовирусных пептидов, выделенных из насекомых, с общим названием Аллофероны и общей формулой: X1-His-Gly-Х2-His-Gly-Val-Х3 или их фармацевтически приемлемые соли, или эфиры, или амиды, где X1 отсутствует либо содержит не менее 1 аминокислоты, Х2 содержит не менее 1 аминокислоты либо представляет собой пептидную связь; Х3 отсутствует либо содержит не менее 1 аминокислоты, причем указанные аминокислоты выбраны из групп: алифатической, ароматической или гетероциклической (Патент РФ №2172322, МПК С07К 7/06, С07К 7/08, А61К 38/08, А61К 38/10, А61Р 37/02, опубл. 20.08.2001 г.).
На основе одного из пептидов этой группы Аллоферона-1, имеющего структуру His-Gly-Val-Ser-Gly-His-Gly-Gln-His-Gly-Val-His-Gly, был разработан лекарственный препарат «Аллокин-альфа лиофилизат для приготовления раствора для подкожного введения», который выпускается с 2003 г. в качестве лекарственного средства для лечения хронического рецидивирующего герпеса 1 и 2 типа, острого гепатита В и папилломовирусных инфекций.
Противовирусная активность Аллоферона-1 обусловлена многими факторами.
Так установлено, что он обладает прямым противовирусным действием (1). Однако основным механизмом биологической активности Аллоферона-1 можно считать индукцию цитокинов, в том числе интерферона-альфа (2) и интерлейкина-18 (3).
Семейство Аллоферонов, описываемое общей формулой:
X1-His-Gly-X2-His-Gly-Val-X3,
включает большое число молекул, построенных на основе природных аминокислот, обладающих широким спектром биологических свойств. Одной из возможностей изменения молекул и, соответственно, их биологической активности является введение в состав пептида химически модифицированных аминокислот. Наиболее простым объектом для модификации является введение в молекулу Аллоферона-1 фенилаланина, содержащего заместители в ароматическом ядре.
Технической задачей, на решение которой направлено заявляемое изобретение, является создание новых производных пептида Аллоферона-1, обладающих повышенной биологической активностью, которые могут быть использованы для создания лекарственных препаратов для лечения и профилактики вирусных и микробных инфекций.
Поставленная техническая задача решена путем замены в молекуле Аллоферона-1 гистидина в положении 1 на фенилаланин, имеющий в параположении нуклеофильный заместитель, получен пептид:
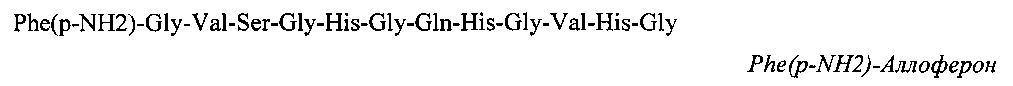
Предложено применение производного Аллоферона-1
Phe(p-NH2)-Gly-Val-Ser-Gly-His-Gly-Gln-His-Gly-Val-His-Gly в качестве средства, обладающего высокой иммуномодулирующей и противовирусной активностью.
Кроме того, предложена иммуномодулирующая и противовирусная композиция, содержащая пептид Phe(p-NH2)-Gly-Val-Ser-Gly-His-Gly-Gln-His-Gly-Val-His-Gly или его фармацевтически приемлемые соли в сочетании со стандартными вспомогательными веществами.
Технический результат состоит в том, что полученный пептид обладает высокой иммуномодулирующей и противовирусной активностью, что будет подтверждено примерами.
Синтез пептида произведен по стандартной Fmoc-процедуре твердофазным способом. Удаление защиты производилось 20%-ным раствором пиперидина в диметилформамиде. Реакцию сочетания проводили с помощью HBTU в присутствии HOBt и NMM в течение 2 часов при комнатной температуре. Финишное отделение пептида проводили с помощью TFA, EDT и воды (95:2,5:2,5) в течение 2 часов при комнатной температуре.
Сырой пептид промывали холодным диэтиловым эфиром, растворяли в воде и лиофилизовали. Очистка пептида производилась методом HPLC с использованием колонок TOSOH Bioscience С18 (21,5 мм × 300 мм) (Tosoh, Japan) с UV-детектором 210/240 нм. Процесс проводили в градиенте вода - ацетонитрил содержащий 0,1% TFA при скорости потока 7 мл/мин. Очищенный лиофилизованный пептид имел чистоту более 95%.
Финишная стадия получения пептида - лиофилизация из раствора в 50% уксусной кислоте.
Химическая идентификация пептида была подтверждена методом масс-спектрометрии с использованием масс-спектрометра типа Microflex LT MALDI-TOF (Bruker Daltonics GmbH).
Возможность достижения цели изобретения подтверждается следующими примерами.
Пример 1. Изучение влияния Phe(р-NH2)-Аллоферона на индукцию IL-18
Индукция осуществлялась путем введения подкожно Phe(p-NH2)-Аллоферона и для сравнения Аллоферона-1 однократно в дозе 2 мг на кг веса лабораторных животных. Для эксперимента использовались мыши линии BALB/C, самки, массой 16-22 грамма, возраста 14 недель, полученные из питомника лабораторных животных и прошедшие необходимый карантин. Температура окружающей среды была 22±2°C, относительная влажность 60±5%, содержание аммиака составляло 10 ррм, углекислого газа - не превышало 0,15% к объему воздуха, кратность воздухообмена составляла 10-15 крат/час при скорости движения воздуха - 0,3 м/с. Фильтрование воздуха обеспечивали с помощью фильтров грубой фильтрации. Кормили мышей гранулированным комбикормом, изготовленным в соответствии со стандартами приготовления кормов для лабораторных животных. Корм предварительно стерилизовали в автоклаве с использованием вакуума при 121°C и 1,2 атм. в течение 20 мин. Кормление проводили 1 раз в сутки из расчета 8,0 г на одну мышь, после чистки клеток. Питьевую воду заливали в бутылки-поилки вместимостью 200 мл и стерилизовали при 121°С и 1,2 атм. в течение 45 мин, пробки автоклавировали отдельно. Поилки ежедневно заменяли на новые. Определялся уровень интерлейкина-18 (IL-18) в сыворотке крови методом иммуноферментного анализа, с использованием специфических антител. Количество IL-18 в сыворотке определяли на 1, 2, 3, 4, 5, 6, 8, 12, 16, 24, 32, 40, 48, 56 ч после введения препаратов.
Параллельно изучалось «фоновое» количество IL-18, присутствующее в сыворотке крови исследуемых животных. Для этой цели использовалось 14 мышей в качестве контрольной группы, которые получали подкожную инъекцию физиологического раствора. В опытной группе использовалось 84 животных. В случае контрольной группы доверительный интервал рассчитывался по измерениям разведения одного и того же образца. В опытной группе доверительный интервал вычислялся относительно трех образцов от трех животных на каждую измеряемую точку.
Через 3-4 часа после введения у пептидов наблюдается небольшой достоверный пик увеличения концентрации IL-18. Через 24 часа наблюдается второй пик значительного увеличения содержания IL-18 в сыворотке крови опытной группы животных, который длится около 20 часов. Наличие первого пика на 3-4 часу возможно обусловлено не специфической индукцией. Значительное повышение IL-18 на 2-3-й день эксперимента свидетельствует о специфической способности препаратов индуцировать изучаемый цитокин.
Результаты испытания препарата приведены в таблице 1.
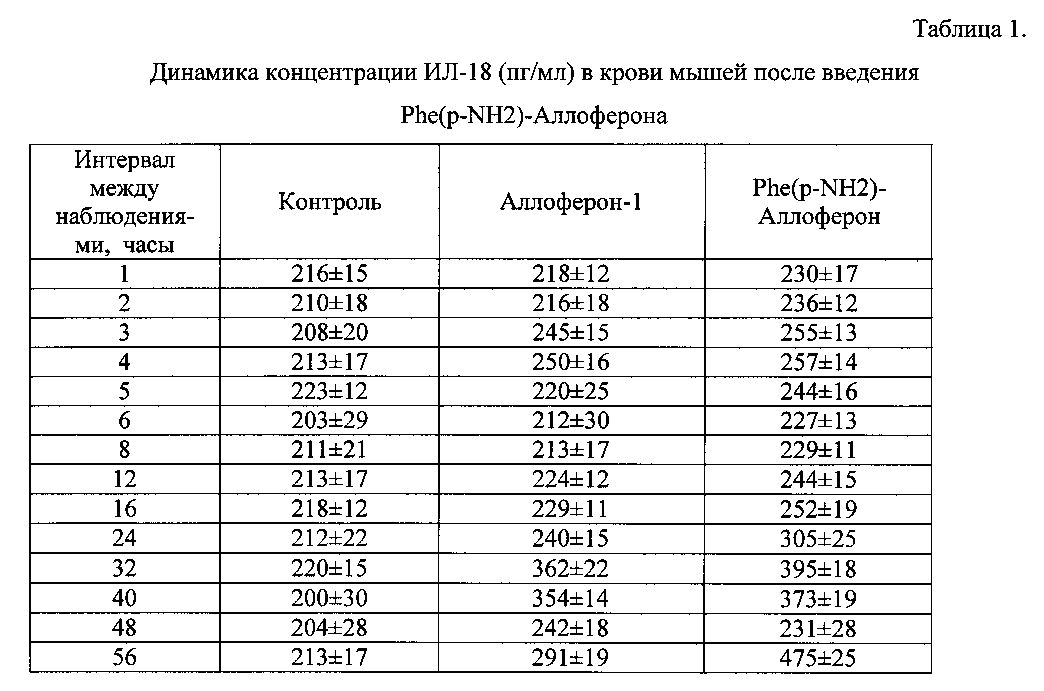
Введение как Phe(p-NH2)-Аллоферона, так и Аллоферона-1, вызвало индукцию ИЛ-18, которая длилась до 3 суток. Максимальная концентрация ИЛ-18 достигается спустя 32 часа после однократного введения пептида. Характер индукции - интенсивность и временной диапазон - для пептидов одинакова. При этом Phe(р-NH2)-Аллоферон показывают более высокий уровень индукции интерлейкина-18, чем Аллоферон-1.
Максимальный уровень интерлейкина-18 был зафиксирован для Phe(p-NH2)-Аллоферона через 32 часа (395 пг/мл). Фоновый уровень в среднем в группе контрольных животных составил 200 пг/мл.
Пример 2. Изучение интерфероногенности Phe(p-NH2)-Аллоферона
Активность определялась путем введения Phe(p-NH2)-Аллоферона и Аллоферона-1 подкожно однократно в дозе 1 мг на кг веса лабораторных животных. Для эксперимента использовались мыши линии BALB/C, самки, массой 16-22 грамма, возраста 18 недель, содержавшиеся в соответствии с протоколом, изложенным выше в примере 1. Определялся уровень интерферона гамма в сыворотке крови методом иммуноферментного анализа, с использованием специфических антител. Количество интерферона в сыворотке определяли на 3, 6, 12, 16, 24, 32, 40 и 48 ч после введения препарата.
Параллельно изучалось «фоновое» количество интерферона гамма, присутствующее в сыворотке исследуемых животных. Для этой цели использовалось 8 мышей в качестве контрольной группы, которые получали подкожную инъекцию физиологического раствора. Среднее значение по контрольной группе на 5% уровне значимости составило 29±8 пг/мл исследуемой сыворотки. В каждой опытной группе также использовались по 8 мышей, которые получали подкожную инъекцию в дозе 25 мкг с изучаемым Phe(p-NH2)-Аллофероном, а также Аллофероном-1. Результаты испытания препаратов представлены в таблице 2.
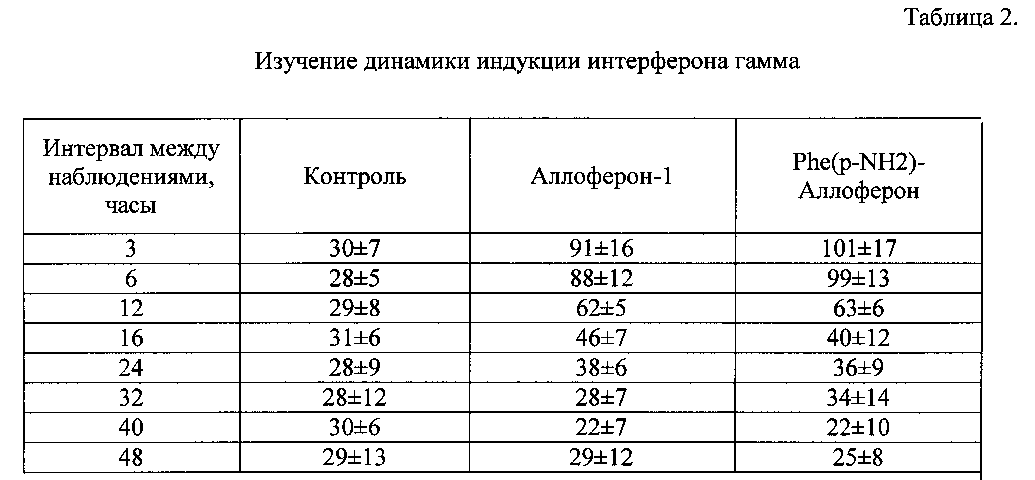
Полученные данные свидетельствуют о том, что Phe(р-NH2)-Аллоферон вызывает индукцию интерферона гамма, превышающую уровень индукции Аллоферона-1.
На основании вышеизложенного можно утверждать, что разработанный пептид обладает всеми заявленными свойствами.
Пример 3. Изучение влияния Phe(p-NH2)-Аллоферона на резистентность мышей к вирусу гриппа А
Антивирусное действие пептида изучали на модели летальной вирусной инфекции мышей вирусом гриппа А. Суспензию вируса вводили интраназально в дозе, соответствующей 10 LD50. Аллоферон-1 и Phe(p-NH2)-Аллоферон в 0,5 мл 0.9% раствора натрия хлорида вводили внутрибрюшинно за одни сутки до инокуляции вируса, затем через 1, 2, 4, 6 и 8 дней после инокуляции. Препараты испытывали в дозе 25 мкг. В контроле мышам вводили равный объем растворителя. Критерием эффективности служила выживаемость животных через 10 суток после инфицирования вирусом. Для проведения эксперимента были отобраны половозрелые белые мыши, самцы, весом 20,0-22,0 г, полученные из питомника лабораторных животных и прошедшие необходимый карантин. Содержание мышей осуществлялось по протоколу, изложенному выше в примере 1. В эксперименте были использованы 60 мышей.
Введение Phe(p-NH2)-Аллоферона и Аллоферона-1 инфицированным животным вызывало дозозависимый протекторный эффект (Таблица 3). Препараты в дозе 25 мкг вызывали значительное увеличение числа выживших в течение срока наблюдения животных. Эффект данной дозы высокодостоверен.

Таким образом, результаты примера 3 свидетельствуют о том, что Phe(p-NH2)-Аллоферон в дозе 25 мкг оказывает выраженное антивирусное действие на мышей, инфицированных вирусом гриппа А, превышающее антивирусное действие Аллоферона-1.
Пример 4. Изучение влияния Phe(р-NH2)-Аллоферона на резистентность мышей к вирусу гриппа В
Исследование влияния Phe(р-NH2)-Аллоферона на устойчивость мышей к вирусу гриппа В проводилось на 120 мышах. Для проведения эксперимента были отобраны половозрелые белые мыши, самцы, весом 20,0-22,0 г, полученные из питомника лабораторных животных и прошедшие необходимый карантин. Содержание мышей осуществлялось по протоколу, изложенному выше в примере 1. Мышей инфицировали штаммом LEE 1/40 вируса гриппа В, взятым в инфекционной дозе, соответствующих 30 ЛД50. В качестве позитивного контроля использовали специфический антивирусный препарат Рибавирин.
Аллоферон-1 и Phe(р-NH2)-Аллоферон вводили внутрибрюшинно в дозе 25 мкг за 1 сутки до инфицирования вирусом, затем через 1, 2, 4, 6 и 8 суток.
Результаты изложены в Таблице 4.
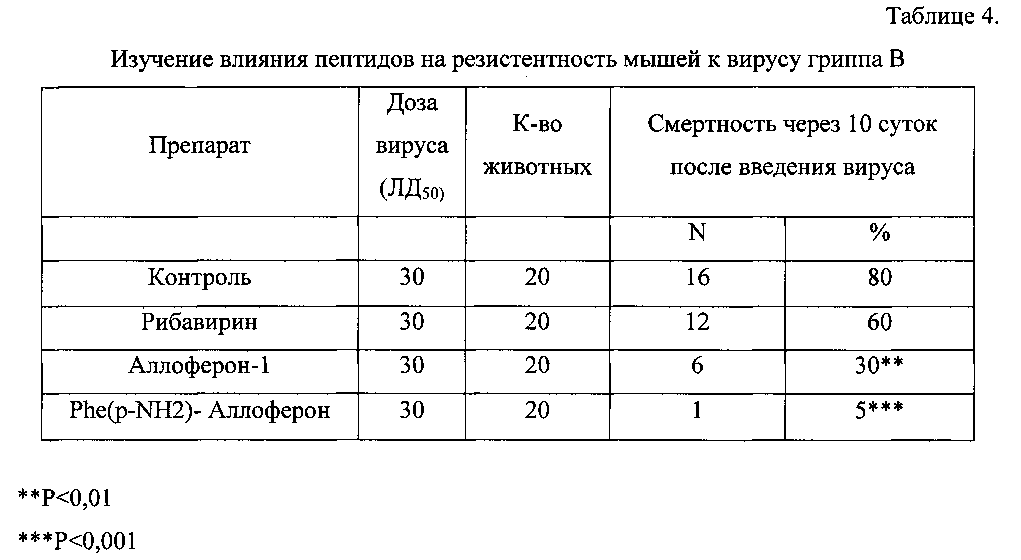
В контроле интраназальное введение вируса вызвало тяжелую пневмонию с высокой летальностью (80%). На этом фоне Рибавирин при высокой инфекционной нагрузке (30 ЛД50) в условиях данного эксперимента оказался малоэффективным. В то же время Phe(р-NH2)-Аллоферон оказал выраженное протекторное действие, превышающее антивирусное действие Аллоферон-1.
Таким образом, результаты примера 4 свидетельствуют о том, что Phe(p-NH2)-Аллоферон в дозе 25 мкг оказывает выраженное антивирусное действие на мышей, инфицированных вирусом гриппа В, существенно превышающее защитный эффект Рибавирина, хорошо зарекомендовавшего себя антивирусного средства, а также Аллоферона-1, и может служить основой для создания новых антивирусных препаратов.

