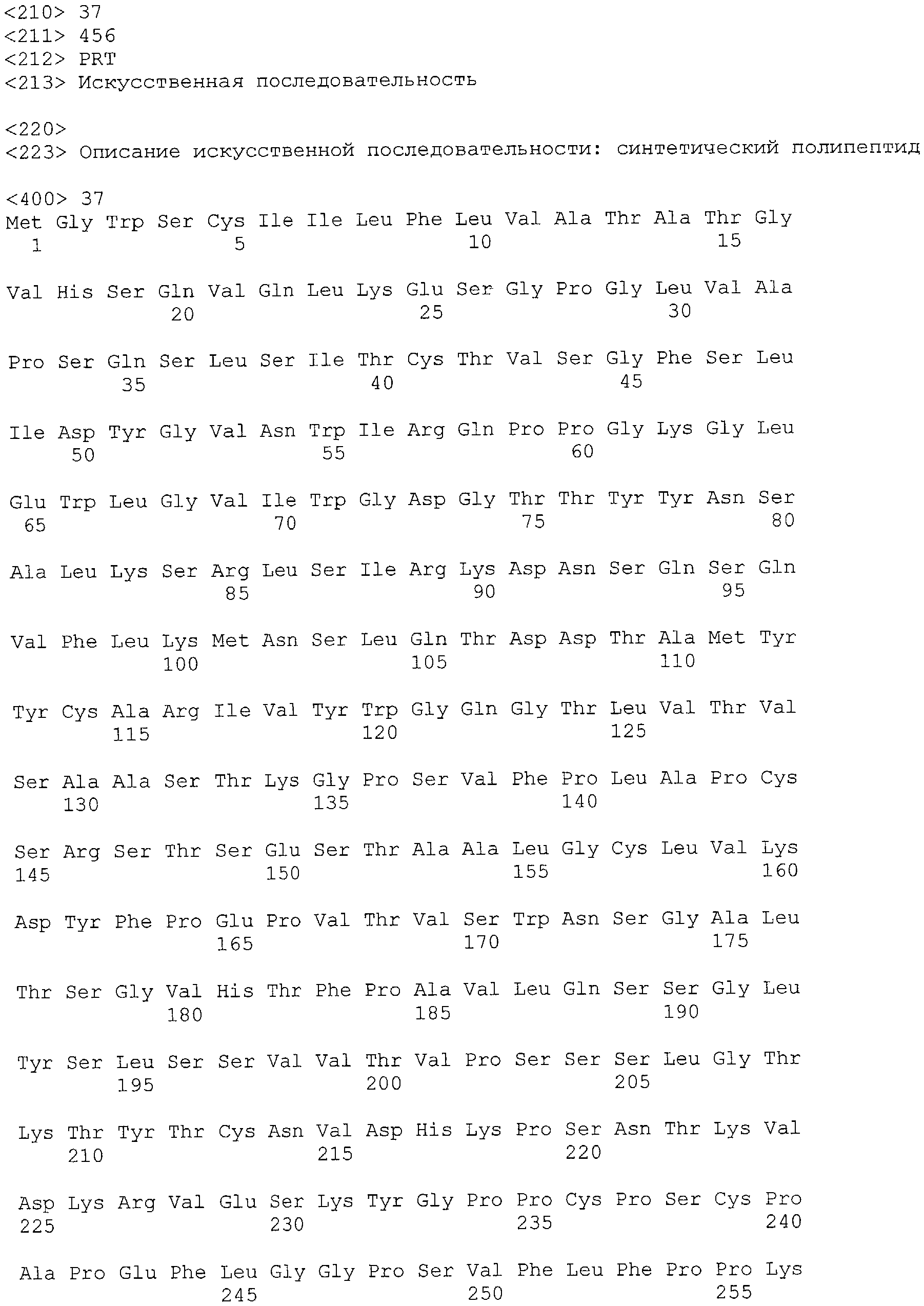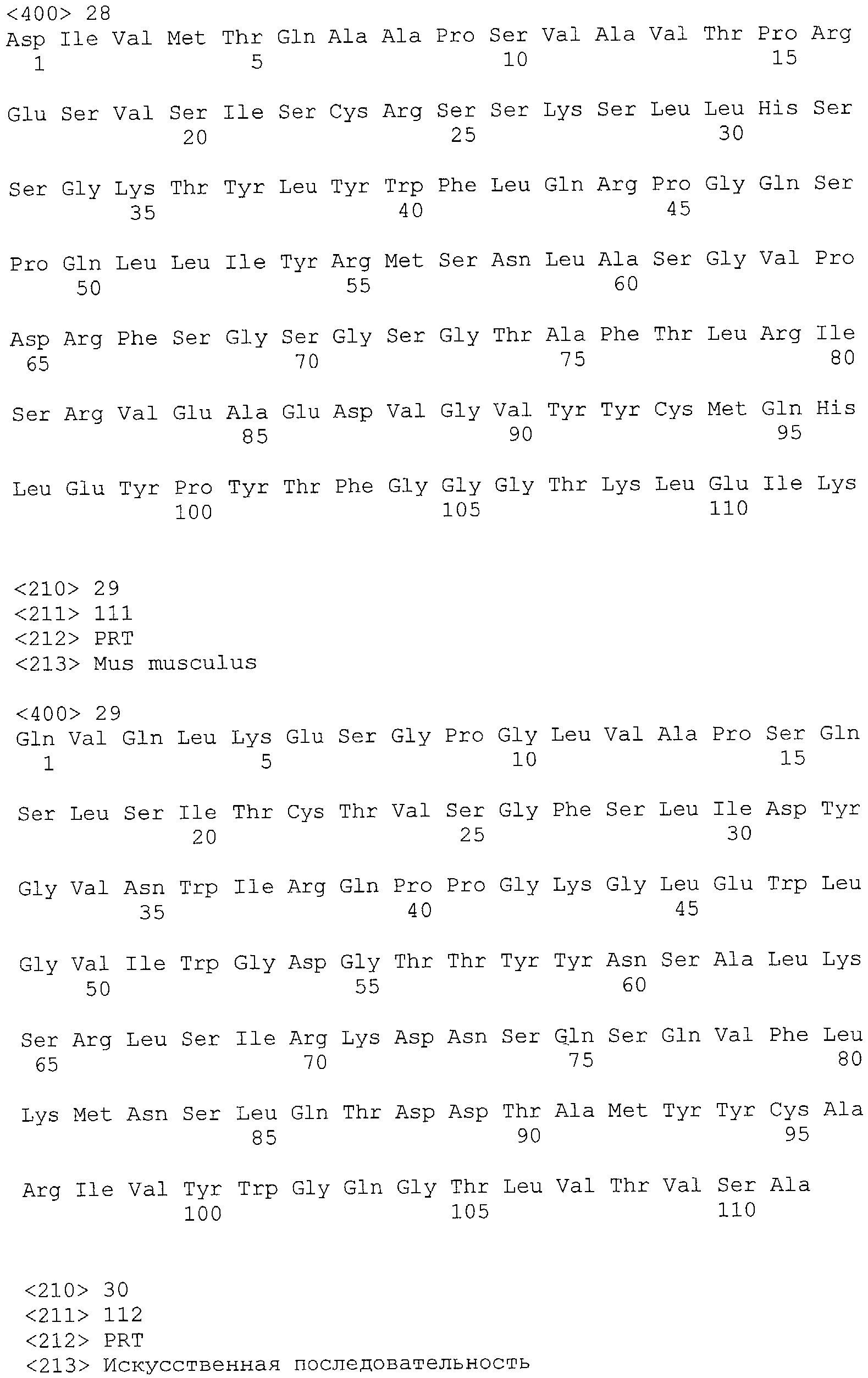Результат интеллектуальной деятельности: ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR5, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антителам к CXCR5 и их применению для облегчения состояния, лечения или профилактики заболеваний или расстройств у млекопитающих, включая человека, вызванных аномальной активностью или метаболизмом CXCR5, или аномальным или случайным их связыванием, например с патогеном. Рассматриваемое антитело может блокировать связывание лиганда, например CXCL13, со своим рецептором, например, CXCR5. Также раскрывается информация о профилактических, иммунотерапевтических и диагностических препаратах, содержащих рассматриваемые антитела и их производные, и их применение в рамках методов профилактики или лечения заболеваний млекопитающих, включая человека, которые вызваны аномальным метаболизмом и/или активностью клеток CXCR5+, например В-лимфоцитов. К таким заболеваниям относятся аутоиммунные болезни, а также болезни, вызванные или характеризующиеся воспалительными процессами, например ревматоидный артрит (РА), при котором наблюдается повышенная активность CXCR5.
УРОВЕНЬ ТЕХНИКИ
CXCR5, также известный как рецептор лимфомы Беркитта (BLR1), CD185, MDR15 и MGC117347, является рецептором, связанным с G-белком, который входит в семейство рецепторов хемокина CXC. В качестве лиганда выступает BLC, другое название - CXCL13, который является хемоаттрактантом B-клеток.
Непроцессированный предшественник CXCR5 состоит из 372 аминокислот и имеет молекулярный вес 42 KD.
CXCR5 участвует в миграции и локализации В-клеток в определенных анатомических отделах. У нокаутных мышей с отсутствующими периферическими лимфатическими узлами меньше пейеровых бляшек и более низкий уровень В-клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются новые гуманизированные и человеческие антитела, а также их фрагменты и производные, которые специфическим образом связываются с CXCR5. Некоторые из антител и их CXCR5-связывающие фрагменты могут быть изменены, с тем, чтобы воспрепятствовать образованию внутрицепьевой дисульфидной связи, что приводит к образованию молекулы, которая сохраняет стабильность в процессе получения и использования in vivo. Другие рассматриваемые антитела могут быть также изменены, с тем, чтобы свести к минимуму связывание с FcR. Некоторые рассматриваемые антитела CXCR5 конкурируют с CXCL13 за связывание с CXCR5. Другие антитела снижают активность CXCR5.
Изобретение включает аминокислотные последовательности вариабельной тяжелой и легкой цепи антител и соответствующие им последовательности нуклеиновых кислот.
Другой пример осуществления изобретения включает последовательности гипервариабельных участков (CDR) антител, с тем, чтобы получить связывающие молекулы, которые содержат одну или несколько участков CDR или производных от участков CDR, сохраняющих способность связывания CXCR5 исходной молекулы, из которой был получен CDR.
Рассматриваемым антителом может быть такое, которое не позволяет CXCL13 или другому лиганду связываться с клетками CXCR5+, например В-клетками.
Другой пример осуществления настоящего изобретения включает клеточные линии и векторы, содержащие последовательности антител по настоящему изобретению.
Еще один пример осуществления настоящего изобретения предполагает использование антител для изготовления медикамента или лекарственного препарата для лечения заболеваний и нарушений, связанных с функцией и метаболизмом CXCR5.
В другом примере осуществления настоящего изобретения предлагается использовать указанные антитела при лечении нарушений, связанных с атипичной или аномальной биологической природой и функционированием CXCR5.
Дополнительные особенности и преимущества описаны в настоящем документе и будут очевидны из приведенного ниже полного описания изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение не ограничивается конкретной методологией, протоколами, клеточными линиями, векторами или реагентами, описанными в настоящем документе, поскольку их можно менять, не затрагивая при этом основной идеи и объема изобретения. Далее, используемая в настоящем документе терминология предназначена исключительно для описания конкретных осуществлений и не подразумевает ограничения объема настоящего изобретения. Если не указано иное, все технические и научные термины и сокращения, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение. Любые способы и материалы, аналогичные или идентичные описанным в настоящем документе, могут использоваться в практическом применении настоящего изобретения, и ниже приводятся только примеры способов, устройств и материалов.
Все публикации и патенты, указанные в настоящем документе, включаются в настоящий документ в качестве ссылки на них для целей описания и раскрытия приводимых в нем белков, ферментов, векторов, клеток-хозяев и методологий, которые могут использоваться в настоящем изобретении и в сочетании с ним. Вместе с тем, никакие положения настоящего документа не следует рассматривать как признание того, что настоящее изобретение не имеет права на более ранний приоритет такого раскрытия по причине предшествующего изобретения.
Перед описанием формулирования и приложения способов, связанных с CXCR5, и рассматриваемых продуктов для сведения специалистов ниже приводятся определения некоторых терминов и словосочетаний.
«CXCR5» означает встречающуюся в природе известную молекулу, присутствующую в лимфоцитах, в частности В-клетках, и в особенности, в интактных В-клетках; такую молекулу, выделенную из таких клеток; такую молекулу, полученную с помощью рекомбинантных технологий с использованием известных материалов и методов и с использованием нуклеиновой кислоты, кодирующей CXCR5; а также части CXCR5, например внеклеточный домен (EC), который сохраняет характеристики и свойства, важные для практического применения настоящего изобретения, такого как связывание CXCL13. Растворимая молекула CXCR5 может, по существу, включать EC домен CXCR5, который обычно состоит из первых шестидесяти аминокислот молекулы, то есть аминотерминальной части CXCR5.
CXCR5 не является промискуитетным рецептором. CXCL13 выступает в качестве лиганда CXCR5 и конститутивно экспрессируется на стромальных клетках, например фолликулярных дендритных клетках и в лимфоидных тканях. CXCL13 специфично привлекает В-клетки и небольшую субпопуляцию Т-клеток, которые называются В-хелперными фолликулярными Т-клетками, TFH. Такое поведение нельзя назвать неожиданным, принимая во внимание множество взаимодействий между популяциями Т-клеток и В-клеток в иммунной системе. Более того, активированные Т-клетки индуцируют или усиливают экспрессию CXCR5. Было установлено, что инфильтрация лимфоцитов в третичные эктопические герминативные центры (GC) хорошо коррелирует с усиливающейся остротой заболевания и падением переносимости в случае определенных расстройств, которые характерны для подобных атипических лимфоузловых структур. В моделях мышей in vivo, например мыши CXCR5-/- и CXCL13-/-, отсутствие рецептора или лиганда приводит к измененной тонкой структуре GC из-за изменения локализации Т- и В-клеток, а, возможно, и взаимодействия. Эти мыши также защищены от развития острого коллаген-индуцированного артрита (КИА). Поскольку CXCR5 селективно экспрессируется на зрелых В-клетках, которые связаны с патогенезом РА, блокирование этого рецептора будет модулировать артритогенный ответ у страдающих заболеванием пациентов. Была продемонстрирована клиническая эффективность лечения ревматоидного артрита биологическими молекулами (такими как анти-TNFα и антитела к CD20, ритуксимаб); в частности, у пациентов, получавших ориентированное на В-клетки лечение, отмечались стойкие улучшения клинических признаков и симптомов. Селективное направленное действие против CXCR5, который экспрессируется только в зрелых В-клетках и В-хелперных Т-клетках, не будет влиять на развитие В-клеток, и не будет вызывать иммунную недостаточность у пациента. В отличие от ритуксимаба рассматриваемое антитело относится к нейтрализующим антителам, которые не опосредуют цитотоксичность клеток.
Под «болезнью CXCR5» понимают расстройство, нарушение, заболевание, патологическое состояние, отклонение и пр., которое характеризуется или вызывается сверхэкспрессией или повышенными уровнями CXCL13 или другого лиганда CXCR5, повышенными уровнями В-клеток, повышенными уровнями активности В-клеток, повышенными уровнями CXCR5 или аномальным метаболизмом и активностью CXCR5.
Под «активностью В-клеток» подразумеваются более высокие по сравнению с нормой уровни В-клеток, которые могут быть локальными, или признаки биологического проявления или функционирования В-клеток, например экспрессия антитела, присутствие или активность тирозинкиназы Брутона, экспрессия или присутствие CD19, экспрессия или присутствие фактора, активирующего В-клетки и пр.
Термин «по существу идентичны» по отношению к последовательности полипептидной цепи антитела может быть истолкован как идентичность, последовательности цепи антитела и сопоставляемой полипептидной последовательности по меньшей мере на 70%, 80%, 90%, 95% или больше. Тот же термин в отношении последовательности нуклеиновой кислоты может быть истолкован как идентичность последовательности нуклеотидов и сопоставляемой последовательности нуклеиновой кислоты, по меньшей мере на 85%, 90%, 95%, 97% или более.
Термины «идентичность» или «гомология» могут означать процент оснований нуклеотидов или аминокислотных остатков в последовательности кандидата, которые идентичны остатку соответствующей последовательности, с которой она сравнивается, после сопоставления последовательностей и введения пропусков, если необходимо, для обеспечения максимального процента идентичности по всей последовательности и без учета каких-либо консервативных замещений в рамках идентичности последовательности. Ни N-терминальные или C-терминальные удлиняющие сегменты, ни вставки не следует рассматривать как уменьшающие идентичность или гомологию. Методы и компьютерные программы для сопоставления доступны и известны специалистам в области. Идентичность последовательности может оцениваться с помощью программного обеспечения для сопоставления последовательностей.
Словосочетания и термины «функциональный фрагмент, вариант, производное или аналог» и им подобные, а также их формы, применяемые в отношении антитела или антигена, описывают соединение или молекулу, обладающую качественной биологической активностью, присущей рассматриваемому антителу или антигену полной длины. Например, функциональный фрагмент или аналог антитела к CXCR5 может связываться с молекулой CXCR5 или может препятствовать или существенно снижать способность лиганда, например CXCL13, или агониста или антагонистического антитела связываться с CXCR5. Примером является молекула scFV. Что касается CXCR5, ее вариантом или производным является молекула, которая неидентична встречающейся в природе CXCR5, но, тем не менее, может использоваться для целей настоящего изобретения, например, несмотря на отсутствие идентичности с немутантной CXCR5, тем не менее может использоваться в качестве иммуногена для повышения уровня антител, которые селективно связываются с немутантной CXCR5.
«Субституционными» вариантами называют такие, где по меньшей мере один аминокислотный остаток в нативной последовательности удален и заменен другой аминокислотой, введенной на его место в том же положении. Замещения могут быть одиночными, при которых заменяется только одна аминокислота в молекуле, или множественными, если в одной и той же молекуле замещаются две или более аминокислоты. Множественные замещения могут производиться в последовательных сайтах. Кроме того, одна аминокислота может замещаться несколькими остатками, такой вариант содержит как замещения, так и вставки. «Инсерционными» вариантами называют такие, где одна или несколько аминокислот были введены непосредственно по соседству с той или иной аминокислотой в конкретном положении нативной последовательности. Под непосредственно соседствующей с той или иной аминокислотой понимается аминокислота, связанная с α-карбоксильной или α-аминной функциональной группой аминокислоты. «Делеционными» вариантами называют такие, где удалена одна или несколько аминокислот из нативной аминокислотной последовательности. Обычно в делеционных вариантах удаляют одну или две аминокислоты в конкретной области молекулы.
Термин «антитело» используется в наиболее широком смысле и, в частности, включает моноклональные антитела (включая моноклональные антитела полной длины), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), фрагменты антител или синтетические полипептиды, содержащие одну или более последовательностей CDR или производных CDR, при условии, что полипептиды проявляют желательную биологическую активность. Антитела (Abs) и иммуноглобулины (Igs) относятся к гликопротеинам, обладающим одинаковыми структурными особенностями. Как правило, антитела рассматривают как Igs с определенной или распознаваемой специфичностью. Таким образом, антитела проявляют специфичность связывания с конкретной мишенью, тогда как к иммуноглобулинам относятся и антитела, и другие подобные антителам молекулы, которые не обладают специфичностью к мишени. Антитела по настоящему изобретению могут относиться к любому классу (например, IgG, IgE, IgM, IgD, IgA и пр.) или подклассу (например, IgG1, IgG2, IgG2a, IgG3, IgG4, IgA1, IgA2 и пр.) (термины «тип» и «класс», а также «подтип» и «подкласс» равнозначно используются в настоящем документе). Нативные или немутантные, то есть полученные от представителя популяции без искусственных манипуляций, антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины с молекулярным весом примерно 150000 дальтон, состоящие из двух одинаковых легких цепей (L) и двух одинаковых тяжелых цепей (H). Каждая тяжелая цепь имеет на конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет на конце вариабельный домен (VL), а на другом конце - константный домен. Под выражением «без искусственных манипуляций» понимают отсутствие обработки, после которой элементы содержат или экспрессируют чужеродную антигенсвязывающую молекулу. Определение «нативный» может относиться к наиболее преобладающей аллели или видам, регистрируемым в популяции, или к антителу, полученному от животного без манипуляций, в сопоставлении с аллелью или полиморфизмом, или вариантам, или производным, полученным за счет той или иной формы манипуляций, например мутагенеза, применения рекомбинантных методик и пр. для изменения аминокислоты антигенсвязывающей молекулы.
Используемый в настоящем документе термин «антитело к CXCR5» означает антитело или полученный из него полипептид (производное), которые специфически связываются с человеческим CXCR5 в соответствии с настоящим документом, в том числе, среди прочих, молекулы, которые ингибируют или существенно снижают уровень связывания CXCR5 с его лигандами или ингибируют активность CXCR5.
Термин «вариабельный» в контексте вариабельного домена антител относится к определенным частям соответствующей молекулы, которые в значительной мере отличаются своей последовательностью от одного до другого антитела и используются для специфического распознавания и связывания конкретного антитела с его определенной мишенью. При этом вариабельность неравномерно распределяется по вариабельным доменам антител. Вариабельность сосредоточивается в трех сегментах, называемых определяющими комплементарность областями (CDR; то есть CDR1, CDR2 и CDR3), также известными как гипервариабельные участки, которые находятся в вариабельных доменах как легкой, так и тяжелой цепи. Области вариабельных доменов с более высокими уровнями консервативности называют каркасными участками (FR) или последовательностями. Вариабельные домены нативных тяжелых и легких цепей содержат по четыре области FR, в значительной мере имеют конформацию β-листа и связаны тремя CDR, которые образуют петли, соединяющие, а в некоторых случаях и образующие, часть структуры β-листа. CDR в каждой цепи часто соседствуют с областями FR и вместе с CDR другой цепи способствуют формированию искомого (эпитопа или детерминанта) сайта связывания антител (см., Kabat et al. Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, MD (1987)). Если не указано иначе, используемая в настоящем документе нумерация аминокислотных остатков иммуноглобулина производится в соответствии с системой нумерации аминокислотных остатков иммуноглобулина в работе Kabat et al. Один CDR может обладать способностью специфически связывать когнатный эпитоп.
Определение «фрагмент антитела» относится к части интактной или полной цепи или антитела, как правило области связывания мишени или вариабельной области. К примерам фрагментов антитела, среди прочих, относятся фрагменты Fab, Fab', F(ab')2 и Fv. «Функциональным фрагментом» или «аналогом антитела к CXCR5» называют такой фрагмент, который может препятствовать способности рецептора, или существенно снижать такую способность, связываться с лигандом или инициировать сигнал. Используемый в настоящем документе термин «функциональный фрагмент» является синонимом термина «фрагмент антитела» и при употреблении в отношении антител может относиться к таким фрагментам, как Fv, Fab, F(ab')2 и пр., которые в состоянии препятствовать способности рецептора, или существенно снижать такую способность, связываться с лигандом или инициировать сигнал. Фрагмент «Fv» состоит из димера вариабельного домена с одной тяжелой и одной легкой цепью, образованного посредством нековалентной ассоциации (димер VH-VL). В такой конфигурации три CDR каждого вариабельного домена взаимодействуют, формируя искомый сайт связывания на поверхности димера VH-VL, так же как в интактном антителе. В совокупности такие шесть CDR обеспечивают специфичность связывания мишени на интактном антителе. При этом даже единичный вариабельный домен (или половина Fv, содержащая всего три CDR, специфичных к мишени) может обладать способностью распознавать и связывать мишень.
«Одноцепочечные Fv», фрагменты антител «sFv» или «scAb» включают домены антитела VH и VL, где эти домены присутствуют в единой полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер, часто гибкую молекулу, между доменами VH и VL, что позволяет sFv образовать нужную структуру для связывания мишени.
Термин «диатела» относится к фрагментам антител с двумя антигенсвязывающими сайтами, такие фрагменты могут включать вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи. За счет использования линкера, который слишком короткий, чтобы обеспечивать объединение двух вариабельных доменов одной и той же цепи, домены диател вынуждены объединяться с доменами связывания другой цепи для формирования двух антигенсвязывающих сайтов.
Фрагмент Fab содержит вариабельные и константные домены легкой цепи и вариабельный и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков в карбоксильном терминальном конце домена CH1, так чтобы он содержал один или несколько цистеинов из шарнирной области антитела. Фрагменты Fab' могут быть получены расщеплением дисульфидной связи в цистеинах шарнирной области продукта разрушения пепсином F(ab')2. Дополнительная ферментативная и химическая обработка антител может приводить к образованию других представляющих интерес функциональных фрагментов.
Используемый в настоящем документе термин «моноклональное антитело» относится к антителу, полученному из популяции в значительной мере однородных антител, то есть отдельные антитела, образующие популяцию, идентичны, если не учитывать возможные природные мутации, которые могут присутствовать в незначительных количествах.
В данном случае к моноклональным антителам, в частности, относятся «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретных видов или принадлежащих к определенному классу или подклассу (типу или подтипу) антител, при этом остальная цепь (цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных от других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии что они проявляют желаемую биологическую активность при связывании с CXCR5 или воздействии на активность или метаболизм CXCR5 (патент США № 4816567; и Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)). Поэтому CDR одного класса антител могут быть привиты в FR антитела другого класса или подкласса.
Моноклональные антитела обладают высокой специфичностью, они ориентированы на единственный сайт-мишень, эпитоп или детерминант. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые, как правило, содержат различные антитела, направленные против различных детерминантов (эпитопов) антигена, каждое моноклональное антитело направлено против единственного детерминанта в мишени. В дополнение к специфичности, преимущество моноклональных антител состоит в том, что они продуцируются клеткой-хозяином без примесей других иммуноглобулинов, что обеспечивает клонирование соответствующего гена и мРНК, кодирующей антитело его цепей. Модификатор «моноклональное» указывает на характеристику антитела, которое было получено из в значительной мере однородной популяции антител, и не должен быть истолкован как требующий продукции антитела любым конкретным методом. Например, моноклональные антитела для использования в настоящем изобретении могут быть выделены из фаговой библиотеки антител с помощью хорошо известных методик или же могут быть выделены из поликлонального препарата. Исходные моноклональные антитела для использования в соответствии с настоящим изобретением могут быть изготовлены с помощью гибридомного метода, описанного в Kohler et al., Nature 256:495 (1975), или могут быть получены рекомбинантными методами, которые хорошо известны специалистам в области.
По сравнению с человеческим антителом «гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например Fv, Fab, Fab', F(ab')2 или других связывающих мишень подпоследовательностей антител), которые содержат последовательности, производные от нечеловеческого иммуноглобулина. Как правило, гуманизированное антитело будет включать по существу всю последовательность одного, а обычно двух вариабельных доменов, в которых все или по существу все участки CDR соответствуют участкам CDR нечеловеческого иммуноглобулина, и все или по существу все области FR представляют собой матричную последовательность человеческого иммуноглобулина. Гуманизированное антитело может также включать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, выбранной матричной последовательности человеческого иммуноглобулина. Как правило, основной целью является получение молекулы антитела, которая минимально иммуногенна для человека. Поэтому существует возможность также заменить одну или несколько аминокислот в одной или нескольких CDR на такие, которые будут менее иммуногенны для организма-хозяина человека, существенно не снижая специфическую функцию связывания одной или нескольких CDR с CXCR5 или с CXCL13. В качестве альтернативы можно использовать нечеловеческую FR, но в ней наиболее иммуногенные аминокислоты заменяются на менее иммуногенные. Тем не менее, обсуждавшееся выше CDR-привитие не является единственным методом получения гуманизированного антитела. Например, модификации одних только областей CDR может быть недостаточно, поскольку довольно часто каркасные остатки могут играть важную роль в определении трехмерной структуры петель CDR и общей аффинности антитела к своему лиганду. Поэтому могут применяться любые способы модификации молекулы нечеловеческого исходного антитела, так чтобы быть менее иммуногенной для человека, и полная идентичность с человеческим антителом не всегда является обязательной. Итак, гуманизация может также достигаться, например, простым замещением всего лишь нескольких остатков, в частности, тех, которые находятся на поверхности молекулы антитела и не скрыты внутри ее структуры, а потому недоступны для иммунной системы хозяина. Подобный способ предложен в настоящем документе в отношении замещения «мобильных» или «гибких» остатков молекулы антитела, при этом цель заключается в том, чтобы уменьшить или подавить иммуногенность получающейся молекулы, не нарушая специфичность антитела в отношении эпитопа или детерминанта. См., например, Studnicka et al., Prot Eng 7(6)805-814, 1994; Mol Imm 44:1986-1988, 2007; Sims et al., J Immunol 151:2296 (1993); Chothia et al., J Mol Biol 196:901 (1987); Carter et al., Proc Natl Acad Sci USA 89:4285 (1992); Presta et al., J Immunol 151:2623 (1993), WO 2006/042333 и патент США № 5869619.
Адаптивный иммунный ответ имеет два основных аспекта: клеточный иммунный ответ Т-лимфоцитов и гуморальный иммунный ответ антитела, продуцирующий В-лимфоциты. Эпитопы В-клеток могут быть линейными, образованными непрерывной последовательностью аминокислот, или могут быть конформационными (Protein Science (2005) 14, 246). Напротив, эпитопы Т-клеток представляют собой короткие линейные пептиды, которые отщепляются от антигенных белков, существующих в форме белков основного комплекса гистосовместимости (MHC) или, в случае человека, молекул лейкоцитарного антигена человека (HLA) класса I или класса II. Форма эпитопа зависит как от связывания MHC-пептида, так и от взаимодействия с рецептором Т-клеток (TCR). Белки MHC обладают высоким полиморфизмом, и каждый из них связывается с ограниченным набором пептидов. Поэтому конкретное сочетание аллелей МНС, присутствующих в организме хозяина, ограничивает набор потенциальных эпитопов, распознаваемых в случае инфекции.
Два основных типа Т-клеток различаются по экспрессии белков CD8 и CD4, которые определяют, будет ли Т-клетка распознавать эпитопы, представленные молекулами класса I или класса II, соответственно. Процессинг CD4+ T-эпитопов происходит после инкапсуляции антигенсодержащих клеток в связанных с мембраной везикулах, где антиген расщепляется протеазами на пептидные фрагменты, которые связываются с белками MHC класса II. Напротив, CD8+ T-клетки обычно распознают вирусные или собственные антигены, экспрессированные внутри клетки, белки, которые расщепляются на более короткие пептиды иммунопротеасомами в цитозоли. После расщепления пептиды перемещаются переносчиком, связанным с процессингом антигена, (TAP) в эндоплазматический ретикулум для связывания с антигенами HLA I. Эпитопы CD4+ T (хелперных) клеток имеют большое значение для иммунных ответов, зависимых от T-клеток, на белковые антигены.
Предлагаемый способ гуманизации основан на воздействии гибкости молекулы антитела в процессе и в момент иммунного распознавания. Гибкость белка связана с молекулярным движением его молекулы. Под гибкостью белка подразумевают способность всего белка, части белка или отдельно взятого аминокислотного остатки формировать ансамбль конформаций, которые в значительной мере отличаются друг от друга. Данные о гибкости белка можно получить по результатам экспериментов рентгеновской кристаллографии (см., например, Kundu et al. 2002, Biophys J 83:723-732.), ядерного магнитного резонанса (см., например, Freedberg et al., J Am Chem Soc 1998, 120(31):7916-7923) или по результатам моделирования молекулярной динамики (MD). Моделирование MD белка проводится на компьютере и позволяет выявить движения всех атомов белка за определенный период времени посредством расчета физических взаимодействий атомов друг с другом. Результатом моделирования MD является траектория для исследуемого белка за период времени моделирования. Траектория представляет собой ансамбль конформаций белка, также называемый статическими конфигурациями, которые периодически регистрируются за время моделирования, например каждую пикосекунду (псек). Именно посредством анализа ансамбля статических конфигураций можно определить гибкость аминокислотных остатков белка. Поэтому гибким остатком считается такой, который может иметь ансамбль различных конформаций в структуре полипептида, где такой остаток находится. Методы MD известны специалистам в области, см., например,, Brooks et al. “Proteins: A Theoretical Perspective of Dynamics, Structure and Thermodynamics” (Wiley, New York, 1988). Several software enable MD simulations, such as Amber (см., Case et al. (2005) J Comp Chem 26:1668-1688), Charmm (см., Brooks et al. (1983) J Comp Chem 4:187-217; and MacKerell et al. (1998) in “The Encyclopedia of Computational Chemistry” vol. 1:271-177, Schleyer et al., eds. Chichester: John Wiley & Sons) or Impact (см. Rizzo et al. J Am Chem Soc; 2000; 122(51):12898-12900.)
Большинство комплексов белков объединены сравнительно большой и планарной скрытой поверхностью, и, было показано, что гибкость связывающих партнеров обеспечивает основу для их пластичности, что позволяет им конформационно адаптироваться друг к другу (Structure (2000) 8, R137-R142). Соответственно, было показано, что примеры «индуцированного соответствия» играют доминирующую роль в областях контакта белок-белок. Кроме того, существует постоянно пополняющаяся совокупность данных, которые показывают, что белки на самом деле связывают лиганды различных форм, размеров и структур (Protein Science (2002) 11:184-187) и что конформационное разнообразие, очевидно, является существенной чертой способности распознавать различных партнеров (Science (2003) 299, 1362-1367). Гибкие остатки принимают участие в связывании партнеров в паре белок-белок (Structure (2006) 14, 683-693).
Гибкие остатки могут принимать самые разные конформации, формирующие ансамбль областей взаимодействия, которые, скорее всего, будут распознаваться В-клетками памяти и вызывать иммуногенный ответ. Таким образом, антитела могут быть гуманизированы посредством модификации ряда остатков каркасного участка, так чтобы ансамбль конформаций и экспонированных областей распознавания в модифицированном антителе как можно более походил на существующие в антителе человека.
Этого можно достигнуть модификацией ограниченного числа остатков посредством: (1) построения модели гомологии исходного моноклонального антитела (mAb) и проведения молекулярно-динамического моделирования (MD); (2) анализа гибких остатков и идентификации наиболее гибких остатков в молекуле нечеловеческого антитела, а также выявления остатков или мотивов, которые, скорее всего, будут источником гетерогенности или реакции распада; (3) идентификации человеческого антитела, которое демонстрирует наличие наиболее похожего ансамбля зон распознавания, в качестве исходного антитела; (4) выявления гибких остатков для мутации, остатков или мотивов, которые, скорее всего, будут источником гетерогенности и распада и также будут подвергаться мутации; и (5) проверки на наличие известных эпитопов Т- или В-клеток. Гибкие остатки можно выявлять на основе расчетов MD, которые предлагаются в настоящем документе, с использованием модели предполагаемого растворителя, которая учитывает взаимодействие водного растворителя с атомами белка за период времени моделирования.
После выявления набора гибких остатков в вариабельных легких и тяжелых цепях определяют набор каркасных участков тяжелых и легких цепей вариабельных областей человека, которые обладают близким сходством с существующим в рассматриваемом антителе набором. Для этого, например, можно воспользоваться поиском BLAST для набора гибких остатков по базе данных для последовательностей антител человеческой зародышевой линии. Этого также можно достичь посредством сопоставления динамики исходного mAb с динамикой библиотеки канонических структур зародышевой линии. Остатки и соседние остатки CDR исключаются из поиска, с тем, чтобы обеспечить сохранение высокой аффинности для антигена.
Таким образом, проводили сопоставление траектории молекулярной динамики для рассматриваемого антитела с траекториями библиотеки структур антител зародышевой линии. 16D7 сопоставляли с библиотекой 49 структур зародышевой линии. Траектория молекулярной динамики, зафиксированная для каждого антитела, представляет собой ансамбль расчетов молекулярной динамики, полученный в ходе компьютерного моделирования молекулярной динамики, где, например, использовали 10 различных конформаций в качестве различных точек отсчета, и для каждой точки отсчета проводили примерно 10 расчетов моделей молекулярной динамики. 49 трехмерных гомологических моделей антител зародышевой линии человека строили посредством систематической комбинации 7 наиболее часто встречающихся легких цепей человека (vκ1, vκ2, vκ3, vκ4, vλ1, vlλ2 и vλ3) и 7 наиболее часто встречающихся тяжелых цепей (vh1a, vh1b, vh2, vh3, vh4, vh5 и vh6) (Nucleic Acids Research, 2005, Vol. 33, Database issue D593-D597). Гибкие остатки 16D7 затем заменяли на соответствующие остатки структуры зародышевой линии с траекторией, наиболее близкой к траектории рассматриваемого антитела.
Затем производили замену гибких остатков. Когда несколько человеческих остатков проявляли сходную гомологию, выбор определялся также природой остатков, которые наиболее способны повлиять на поведение гуманизированного антитела в растворе. Например, предпочтение отдавалось полярным остаткам в экспонированных гибких петлях, а не гидрофобным остаткам. Остатки, которые являются потенциальным источником нестабильности и гетерогенности, также подвергали мутации, даже если их обнаруживали в CDR. Сюда включаются экспонированные метионины, поскольку образование сульфоксида может быть следствием взаимодействия с кислородными радикалами, протеолитическое расщепление кислотно-неустойчивых связей, например, в дипептиде Asp-Pro (Drug Dev Res (2004) 61:137-154), сайты деамидирования, присутствующие в экспонированном остатке аспарагина, за которым следует небольшая по размерам аминокислота, например Gly, Ser, Ala, His, Asn или Cys (J Chromatog (2006) 837:35-43), а также сайты N-гликозилирования, например сайт Asn-X-Ser/Thr. Как правило, экспонированные метионины будут замещаться лейцинами, экспонированные аспарагины будут замещаться глутамином или аспартатом, или же будет замещаться следующий за ними остаток. В случае сайта гликозилирования (Asn-X-Ser/Thr) будет заменяться либо Asn, либо остаток Ser/Thr.
Результирующая композитная последовательность проверяется на предмет присутствия известных эпитопов В-клеток или линейных эпитопов Т-клеток. Поиск проводится, например, по общедоступной базе данных иммунных эпитопов (IEDB) (PLos Biol (2005) 3(3)e91). Если внутри композитной последовательности обнаруживается известный эпитоп, ищется другой набор человеческих последовательностей, внутри которых производится замещение.
В отличие от предложенного в патенте США № 5639641 способа изменения поверхности, в предлагаемом способе учитываются также иммуногенные ответы, опосредованные В- и Т-клетками. Данный способ также позволяет обойти проблему потери активности, которая иногда наблюдается при CDR-привитии (патент США № 5530101). Кроме того, в процессе инженерии и селекции также учитываются аспекты стабильности и растворимости, что позволяет создать антитело, оптимизированное в плане низкой иммуногенности, высокой аффинности к антигену и более приемлемых биофизических характеристик.
Стратегии и способы изменения поверхности антител, а также другие способы снижения иммуногенности антител в различных организмах хозяина изложены, например, в патенте США № 5639641. В целом, в рамках предпочтительного способа: (1) проводится сопоставление положений набора вариабельных областей тяжелых и легких цепей антитела, с тем, чтобы определить экспонированные поверхностные положения тяжелой и легкой цепи вариабельной области каркасного участка, при этом сопоставленные положения для всех вариабельных областей должны быть по меньшей мере примерно на 98% идентичны; (2) определяется набор нечеловеческих экспонированных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области каркасного участка, например, для антитела грызунов (или его фрагмента); (3) определяется набор экспонированных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области каркасного участка, который наиболее близок набору экспонированных поверхностных аминокислотных остатков грызунов; и (4) набор экспонированных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области каркасного участка, идентифицированный на этапе (2), заменяется набором экспонированных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области каркасного участка, идентифицированным на этапе (3), за исключением тех аминокислотных остатков, которые размещаются в пределах 5Å от любого атома любого остатка CDR антитела грызунов, с тем, чтобы получить гуманизированное антитело, например антитело грызунов, сохраняющее специфичность связывания.
Антитела могут гуманизироваться множеством других методик, в том числе CDR-привитием (EPO 0 239 400; WO 91/09967; а также патенты США №№ 5530101 и 5585089), изменения поверхности антител (EPO 0592106; EPO 0519596; Padlan, 1991, Molec Imm 28(4/5):489-498; Studnicka et al., 1994, Prot Eng 7(6):805-814; и Roguska et al., 1994, PNAS 91:969-973) и перестановки в цепи (патент США № 5565332). Человеческие антитела могут изготовляться с применением различных методов, известных специалистам в области, в том числе, среди прочих, методов фаг-дисплея, см. патенты США №№ 4444887, 4716111, 5545806 и 5814318; и WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741, с использованием трансгенных животных, например грызунов, с использованием химерных клеток и пр.
Термины «гомолог антитела» или «гомолог» относятся к любой молекуле, которая специфическим образом связывает CXCR5 в соответствии с содержанием настоящего документа. Таким образом, к гомологам антитела относятся нативное или рекомбинантное антитело, модифицированное или немодифицированное; части антитела, которые сохраняют представляющие интерес биологические свойства; например связывание CXCR5; например молекулы Fab или Fv; одноцепочечное антитело; полипептид, содержащий одну или несколько областей CDR и пр. Аминокислотная последовательность гомолога необязательно должна быть идентична последовательности существующего в природе антитела, но может быть изменена или модифицирована включением замещающих аминокислот, введенных аминокислот, удаленных аминокислот, аминокислот, не входящих в число двадцати, которые обычно встречаются в белках, и пр., с тем, чтобы получить полипептид с улучшенными или иными полезными свойствами.
Антителами с гомологичными последовательностями называют антитела с аминокислотными последовательностями, которые обладают гомологией последовательности с аминокислотными последовательностями антитела CXCR5 по настоящему изобретению. Предпочтительно, гомология существует с аминокислотной последовательностью вариабельных областей антитела по настоящему изобретению. «Гомология последовательности», применительно к последовательности аминокислот настоящего документа, определяется как последовательность с гомологией по меньшей мере примерно 90%, 91%, 92%, 93%, 94% или выше и, более предпочтительно, с гомологией по меньшей мере около 95%, 96%, 97%, 98% или 99% по отношению к другой последовательности аминокислот, которая определяется, например, по методу поиска FASTA в соответствии с Pearson & Lipman, Proc Natl Acad Sci USA 85, 2444-2448 (1988).
Химерным антителом называют антитело, содержащее различные части антитела, полученные из различных источников, таких как различные антитела, различные классы антител, различные виды животных, например антитела, имеющие вариабельную область, полученную из мышиного моноклонального антитела, соединенные с константной областью человеческого иммуноглобулина и пр. Таким образом, гуманизированное антитело представляет собой вид химерного антитела. Методы изготовления химерных антител известны специалистам в области, см, напр., Morrison, 1985, Science 229:1202; Oi et al., 1986, BioTechniques 4:214; Gillies et al., 1989, J Immunol Methods 125:191-202; и патенты США №№ 5807715, 4816567 и 4816397.
К искусственным антителам относятся одноцепочечные антитела, фрагменты scFv, химерные антитела, диатела, триатела, тетратела и mru (см. рецензии Winter & Milstein, 1991, Nature 349:293-299; и Hudson, 1999, Curr Opin Imm 11:548-557), каждое из них обладает способностью связывать антиген или эпитоп. В одноцепочечном фрагменте Fv (scFv), домены VH и VL антитела связаны гибким пептидом. Обычно линкер представляет собой пептид длиной около 15 аминокислот. Если линкер существенно меньше, например длиной в 5 аминокислот, образуются диатела, которые представляют собой бивалентные димеры scFv. Если линкер сокращается до менее трех аминокислотных остатков, формируются тримерные и тетрамерные структуры, которые называют триателами и тетрателами, соответственно. Наименьшей связывающей единицей антитела может быть отдельный CDR, как правило, CDR2 или 3 тяжелой цепи, который обладает достаточной способностью к распознаванию и связыванию, но может быть также любая комбинация последовательностей CDR, которая может определяться с использованием практических методов, изложенных в настоящем документе. Такой фрагмент называют молекулярной областью распознавания, или mru. Несколько таких mru могут быть связаны вместе с короткими линкерными пептидами, тем самым, образуя искусственный связывающий белок с более высокой авидностью по сравнению с отдельной mru.
В объем настоящего изобретения также включаются функциональные эквиваленты рассматриваемого антитела. Термин «функциональные эквиваленты» включает, например, антитела с гомологичными последовательностями, гомологи антител, химерные антитела, искусственные антитела и модифицированные антитела, например те, в которых каждый функциональный эквивалент определяется способностью связываться с CXCR5, ингибировать способность или функцию CXCR5 передавать сигнал, или ингибировать связывание CXCL13 и других лигандов с CXCR5. Опытному специалисту в области будет очевидно частичное наложение терминов, обозначающих группы молекул, «фрагменты антител» и «функциональные эквиваленты». Методы получения функциональных эквивалентов, которые сохраняют способность к связыванию CXCR5, известны квалифицированным специалистам в области и изложены, например, в WO 93/21319, EPO Серийный номер 239,400, WO 89/09622, EPO Серийный номер 338745 и EPO Серийный номер 332424.
К функциональным эквивалентам настоящей заявки также относятся модифицированные антитела, например антитела, модифицированные за счет ковалентной связи молекулы любого типа с антителом. Например, к модифицированным антителам относятся антитела, которые были модифицированы, например гликозилированием, ацетилированием, связыванием с полиэтиленгликолем, деамидированием, фосфорилированием, амидированием, введением известных защитных/блокирующих групп, протеолитическим расщеплением, связью с клеточным лигандом, связью с токсином или цитотоксической группой или другим белком и пр. Ковалентное связывание необязательно приводит к антителу, которое защищено от формирования антиидиотипического ответа. Модификация может проводиться с использованием известных методик, в том числе, среди прочих, специфического химического расщепления, ацетилизирования, формилирования, метаболического синтеза и пр. Кроме того, модифицированные антитела могут содержать одну или несколько неклассических аминокислот.
Рядовым специалистам в области известно множество методик, которые позволяют проводить оптимизацию аффинности связывания. Как правило, такие методики включают замещение различных аминокислотных остатков в рассматриваемом сайте с последующим скрининговым анализом аффинности связывания мутантного полипептида с когнатным антигеном или эпитопом.
После идентификации и выделения антитела часто бывает полезно получить вариант или мутант антитела, или мутеин, где изменены один или несколько аминокислотных остатков, например, в одном или нескольких гипервариабельных областей антитела. В альтернативном варианте или дополнительно в структуру антитела может быть внесено одно или несколько изменений (например, замещений) в остатках каркасного участка, что приводит к повышению аффинности связывания мутанта антитела с CXCR5. Примерами остатков каркасного участка, которые могут быть модифицированы, являются такие остатки, которые напрямую нековалентно связывают антиген (Amit et al., Science 233:747-753 (1986)); взаимодействуют с конформацией CDR или влияют на нее (Chothia et al., J Mol Biol 196:901-917 (1987)); и/или находятся в области контакта VL-VH (EP 239400). В некоторых примерах осуществления модификация одного или нескольких таких остатков каркасного участка приводит к повышению аффинности связывания антитела с когнатным антигеном. Например, в настоящем примере осуществления изобретения можно менять от одного до примерно пяти остатков каркасного участка. Иногда этого может быть достаточно, чтобы получить мутант антитела, пригодный для использования в доклинических испытаниях, даже если ни в один из остатков гипервариабельной области не вносили изменения. Однако, как правило, мутант антитела может включать одно или несколько изменений гипервариабельной области. Константные области также можно менять, с тем, чтобы добиться желаемых или более желаемых эффекторных свойств.
Остатки гипервариабельной области, которые подвергаются замещению, можно изменять произвольно, особенно, если исходная аффинность связывания исходного антитела такова, что произвольно полученные мутанты антител могут легко анализироваться в процессе скрининга на изменение связывания по методике анализа, приведенной в настоящем документе.
Одним из методов получения мутантов антител, например мутантов CDR, является «мутагенез сканирования аланина» (Cunningham & Wells, Science 244:1081-1085 (1989); и Cunningham & Wells, Proc Nat Acad Sci USA 84:6434-6437 (1991)). Один или несколько остатков гипервариабельной области заменяются аланином или полиаланиновыми остатками. Такой остаток (остатки) гипервариабельной области, который проявляет функциональную чувствительность к замещениям, затем модифицируют, вводя дальнейшие или другие мутации в сайтах замены. Таким образом, несмотря на то, что сайт для введения вариации последовательности аминокислоты предопределен, сам по себе характер мутации необязательно заранее задан. Можно попытаться ввести аналогичные замещения с другими аминокислотами, в зависимости от желательных свойств сканируемых остатков.
Более систематический метод идентификации аминокислотных остатков для модификации включает идентификацию остатков гипервариабельной области, задействованных в связывании CXCR5, а также тех остатков гипервариабельной области, которые незначительно или совсем не задействованы в связывании CXCR5. Проводится аланиновое сканирование остатков несвязывающей гипервариабельной области, причем каждый Ala мутант проходит тестирование на улучшение связывания с CXCR5. В другом примере осуществления для модификации выбирается тот остаток (остатки), которые существенным образом задействованы в связывании CXCR5. Модификация может предусматривать делецию остатка или введение одного или нескольких остатков в непосредственной близости от рассматриваемого остатка. Однако, как правило, модификация предусматривает замену остатка другой аминокислотой. Первая замена может быть консервативной. Если такая замена приводит к изменению биологической активности (например аффинности связывания), тогда можно провести следующую консервативную замену, чтобы узнать, удалось ли добиться более существенных изменений.
Еще более значимое изменение в линии антител и проявлении биологических свойств может быть достигнуто при выборе аминокислоты, которая более заметно отличается по свойствам от той, которая обычно присутствует на этом сайте. Поэтому такое замещение может производиться при одновременном сохранении: (a) структуры полипептидного остова в зоне замены, например, в виде листа или спиральной конформации; (б) заряда или гидрофобности молекулы в целевом сайте, или (в) объема боковой цепи.
Например, встречающиеся в природе аминокислоты могут быть подразделены на группы на основе общих свойств боковой цепи:
(1) гидрофобные: метионин (M или Met), аланин (A или Ala), валин (V или Val), лейцин (L или Leu) и изолейцин (I или Ile);
(2) нейтральные, гидрофильные: цистеин (C или Cys), серин (S или Ser), треонин (T или Thr), аспарагин (N или Asn) и глутамин (Q или Gln);
(3) кислые: аспарагиновая кислота (D или Asp) и глутаминовая кислота (E или Glu);
(4) основные: гистидин (H или His), лизин (K или Lys) и аргинин (R или Arg);
(5) остатки, которые влияют на ориентацию цепи: глицин (G или Gly) и пролин (P или Pro);
(6) ароматические: триптофан (W или Trp), тирозин (Y или Tyr) и фенилаланин (F или Phe).
Под неконсервативными замещениями может подразумеваться замена одной из аминокислот на аминокислоту из другой группы. Под консервативными замещениями может пониматься замена одной аминокислоты на другую внутри одной группы.
К предпочтительным замещениям аминокислот относятся такие, которые: (1) снижают подверженность протеолизу, (2) уменьшают склонность к окислению, (3) изменяют аффинность связывания и (4) обеспечивают или изменяют другие физико-химические или функциональные свойства таких аналогов. Среди аналогов могут присутствовать различные мутеины с последовательностью, отличающейся от существующей в природе пептидной последовательности. Например, единичные или множественные замены аминокислот (предпочтительно консервативные замены аминокислот) могут производиться в существующей в природе последовательности (предпочтительно в части полипептида за пределами домена (доменов), ответственного за межмолекулярные контакты). Консервативная замена аминокислот не должна существенно изменять структурные характеристики исходной последовательности (например, замена аминокислоты обычно не должна приводить к нарушению спиральной конформации, которая присутствовала в исходной последовательности, или же нарушать другие элементы вторичной структуры, которые характеризуют исходную последовательность), исключением являются изменения общего объема или изменения конформации R-группы или боковой цепи, Proteins, Structures and Molecular Principles (Creighton, ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (Branden & Tooze, eds., Garland Publishing, New York, N. Y. (1991)); и Thornton et al. Nature 354:105 (1991).
Обычно мутант антитела с улучшенными биологическими свойствами будет иметь аминокислотную последовательность, которая по меньшей мере на 75% идентична или подобна аминокислотной последовательности тяжелой или легкой цепи вариабельного домена исходного античеловеческого антитела CXCR5, или обладает по крайнем мере 80%-ной, по меньшей мере 85%-ной, по меньшей мере 90%-ной и часто по меньшей мере 95%-ной идентичностью. Идентичность или подобие в отношении последовательности исходного антитела определяется в настоящем документе как процент аминокислотных остатков в последовательности кандидата, которые идентичны (то есть тот же остаток) или подобны (то есть аминокислотный остаток из той же группы, основанных на близких свойствах боковой цепи, см. выше) остаткам исходного антитела после сопоставления последовательностей и введения пропусков, если необходимо, для обеспечения максимального процента идентичности последовательности.
В альтернативном варианте мутанты антитела могут быть получены систематической мутацией участков FR и CDR тяжелой и легкой цепей или же участка Fc антитела к CXCR5. Другой метод получения мутантов антитела включает использование созревания аффинности с помощью фаг-дисплея (Hawkins et al., J Mol Biol 254:889-896 (1992) и Lowman et al., Biochemistry 30(45):10832-10838(1991)). Слитые белки оболочки бактериофага (Smith, Science 228:1315 (1985); Scott & Smith, Science 249:386 (1990); Cwirla et al. Proc Natl Acad Sci USA 8:309 (1990); Devlin et al. Science 249:404 (1990); Wells & Lowman, Curr Opin Struct Biol 2:597 (1992); и патент США № 5223409) известны как удобные объекты для связывания фенотипа белков и пептидов дисплея с генотипом частиц бактериофага, которые их кодируют. При использовании фаг-дисплея также отображаются домены Fab антител (McCafferty et al., Nature 348: 552 (1990); Barbas et al. Proc Natl Acad Sci USA 88:7978 (1991); и Garrard et al. Biotechnol 9:1373 (1991)).
Моновалентный фаг-дисплей отображает набор вариантов белка слитых с белком оболочки бактериофага на частицах фага (Bass et al., Proteins 8:309 (1990). Созревание аффинности, или улучшение равновесной аффинности связывания различных белков, ранее достигалось посредством последовательного применения мутагенеза, моновалентного фаг-дисплея и функционального анализа (Lowman & Wells, J Mol Biol 234:564 578 (1993); и патент США № 5534617), например, особое внимание уделялось участкам CDR антител (Barbas et al., Proc Natl Acad Sci USA 91:3809 (1994); и Yang et al., J Mol Biol 254:392 (1995)).
Библиотеки множества (например, 106 или более) вариантов белков, которые отличаются в определенных положениях последовательности, можно построить на частицах бактериофагов, каждая из которых содержит ДНК, кодирующую определенный вариант белка. После циклов аффинной очистки с использованием иммобилизированного антигена, изолируют отдельные клоны бактериофагов и на основании ДНК определяют аминокислотную последовательность отображаемого белка.
После получения мутанта антитела можно определить биологическую активность данной молекулы по сравнению с исходным антителом, в соответствии со сведениями, изложенными в настоящем документе. Как отмечалось выше, для этого может потребоваться определить аффинность связывания и/или иную биологическую активность или физические свойства антитела. В предпочтительном осуществлении настоящего изобретения готовится набор мутантов антитела с последующим скринингом аффинности связывания для антигена. Один или несколько мутантов антитела, выбираемых по результатам скрининга, могут дополнительно проверяться с использованием одного или нескольких других методов анализа биологической активности, с тем, чтобы подтвердить, что мутант (мутанты) антитела обладает новыми или улучшенными свойствами. В предпочтительных примерах осуществления мутант антитела сохраняет способность связывания CXCR5 с аффинностью связывания, близкой или лучшей/более высокой по сравнению с характеристиками исходного антитела.
Отобранный таким образом мутант (мутанты) антитела может подвергаться дальнейшим модификациям, которые часто зависят от предполагаемого использования антитела. Такие модификации могут включать дальнейшее изменение аминокислотной последовательности, слияние с гетерологическим полипептидом (полипептидами) и/или ковалентные модификации. Например, остаток цистеина, который не задействован в сохранении надлежащей конформации мутанта антитела, можно замещать, как правило, на серин, с тем, чтобы улучшить стабильность молекулы к окислению и предупредить образование аберрантных сшивок. Напротив, цистеин можно вводить в структуру антитела, с тем, чтобы улучшить его стабильность (особенно если в качестве антитела выбирается фрагмент антитела, например фрагмент Fv).
Другой тип мутанта антитела имеет измененную структуру гликозилирования. С этой целью можно удалять одну или несколько углеводных групп, присутствующих в антителе, и/или добавлять один или несколько сайтов гликозилирования, которых нет в молекуле антитела. Гликозилирование антител, как правило, либо N-связано с Asn, либо O-связано с Ser или Thr. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X-любая аминокислота, кроме пролина, являются распространенными последовательностями распознавания для ферментативного связывания углеводной группы с боковой цепью аспарагина. N-ацетилгалактозамин, галактоза, фукоза или ксилоза, например, связываются с гидроксиаминокислотой, как правило, с серином или треонином, хотя может использоваться и 5-гидроксипролин или 5-гидроксилизин. Добавление одного или нескольких остатков серина или треонина к последовательности исходного антитела или замещение этими остатками может повысить вероятность O-связанного гликозилирования.
Возможно, будет желательно модифицировать антитело по настоящему изобретению в плане эффекторной функции, с тем, чтобы повысить эффективность антитела. Например, в область Fc может вводиться остаток (остатки) цистеина, что обеспечивает возможность образования межцепочечной дисульфидной связи в этой области. Полученное таким образом гомодимерное антитело может характеризоваться более высокой способностью к интернализации и/или комплемент-зависимому лизису и антителозависимой клеточной цитотоксичности (ADCC), см. Caron et al., J Exp Med 176:1191-1195 (1992) и Shopes, Immunol 148:2918-2922 (1993). В альтернативном варианте может быть сконструировано антитело, которое имеет двойные области Fc и поэтому может обеспечивать повышенные комплемент-зависимый лизис и способность к ADCC, см. Stevenson et al., Anti-Cancer Drug Design 3: 219 230 (1989).
Ковалентные модификации антитела включаются в объем настоящего изобретения. Они могут проводиться посредством химического синтеза или, если возможно, ферментативного или химического расщепления антитела. Другие формы ковалентных модификаций антитела вводятся в молекулу посредством взаимодействия выбранных аминокислотных остатков антитела с органическим агентом, используемым для получения производных, который в состоянии реагировать с выбранными боковыми цепями или с N-терминальным или C-терминальным остатком.
Цистеиновые остатки могут реагировать с α-галоацетатами (и соответствующими аминами), например хлоруксусной кислотой или хлорацетамидом, с образованием карбоксиметильных или карбоксиамидометильных производных. Производные цистеиновых остатков также можно получать, например, путем реакции с бромтрифторацетоном, α-бром-β-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкиламалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлормеркурбензоатом, 2-хлормеркур-4-нитрофенолом или хлор-7-нитробензо-2-оксадиазолом-1,3.
Производные гистидиновых остатков могут быть получены реакцией с диэтилпирокарбонатом при pH 5,5-7,0. П-бромофенацилбромид может также использоваться, реакцию предпочтительно проводить в 0,1 M растворе какодилата натрия при pH 6,0.
Лизиновые остатки и α-терминальные остатки могут реагировать с янтарным ангидридом или с ангидридами других карбоновых кислот, с тем, чтобы изменить заряд остатков. К другим удобным реагентам для получения производных α-аминосодержащих остатков относятся имидоэфиры, например метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборогидрид, тринитробензолсульфоновая кислота, O-метилизомочевина и 2,4-пентандион, и аминокислота может катализироваться трансаминазой в присутствии глиоксилата.
Остатки аргинина могут модифицироваться реакцией с одним или несколькими стандартными реагентами, например фенилглиоксалем, 2,3-бутандионом, 1,2-циклогександионом и нингидрином. Для получения производных в случае остатков аргинина часто требуется проводить реакцию в щелочной среде. Кроме того, реагенты могут взаимодействовать с лизином, а также с ε-аминогруппой аргинина.
Специфическая модификация остатков тирозина может производиться с помощью ароматических диазониевых соединений или тетранитрометана. Например, N-ацетилимидазол и тетранитрометан используются для образования O-ацетилтирозильных соединений и 3-нитропроизводных, соответственно. Остатки тирозина могут йодироваться с использованием 125I или 131I, чтобы получить меченные белки для применения в радиоиммунологическом анализе.
Карбоксильные боковые группы (аспартил или глутамил) могут быть модифицированы реакцией с карбодиимидами (R-N=C=C-R'), где R и R' могут быть различными алкильными группами, например 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспартил и глутамил могут быть трансформированы в аспарагиновые и глутаминовые остатки реакцией с ионами аммония.
Глутаминовые и аспарагиновые остатки часто деамидируют до соответствующих глутамильных и аспартильных остатков, соответственно, в нейтральной или основной среде. Деамидированная форма таких остатков входит в объем настоящего изобретения.
К другим модификациям относится гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серина или треонина, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-терминального амина и амидирование любой C-терминальной карбоксильной группы.
Другая форма ковалентной модификации представляет собой химическое или ферментативное связывание гликозидов с антителом. Такие методы не требуют продукции антител в клетке-хозяине, которая проявляет гликозилирующие свойства в N-связанном или O-связанном гликозилировании. В зависимости от использованного метода сочетания сахар (сахара) могут связываться с: (a) аргинином и гистидином; (б) свободными карбоксильными группами; (в) свободными сульфгидрильными группами, например в цистеине; (г) свободными гидроксильными группами, например в серине, треонине или гидроксипролине; (д) ароматическими остатками, например в фенилаланине, тирозине или триптофане; или (е) амидной группой глутамина. Подобные методы описаны в WO 87/05330 и в Aplin & Wriston, CRC Crit Rev Biochem, pp. 259-306 (1981).
Удаление любой углеводной группы, присутствующей в структуре антитела, может осуществляться химическим или ферментативным способом. Например, для химического дегликозилирования может потребоваться подействовать на антитело таким реагентом, как трифторметансульфоновая кислота или равноценным соединением, что приводит к расщеплению большинства или всех сахаров, кроме связывающего сахара (N-ацетилглюкозамин или N-ацетилгалактозамин), при этом антитело остается интактным. Химическое дегликозилирование описано, например, в Hakimuddin et al. Arch Biochem Biophys 259:52 (1987) и в Edge et al., Anal Biochem 118:131 (1981). Ферментативное расщепление углеводных групп на антителах может осуществляться посредством любой из множества эндогликозидаз и экзогликозидаз, как это описано, например, в Thotakura et al., Meth Enzymol 138:350 (1987).
Другая форма ковалентной модификации антитела включает связывание антитела с одним из множества небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, на основе метода, приведенного в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
Другая предпочтительная методика получения мутантов или мутеинов представляет собой созревание аффинности с помощью фаг-дисплея (Hawkins et al., J Mol Biol 254:889-896 (1992) и Lowman et al., Biochemistry 30(45):10832-10838(1991)). Вкратце, проводится мутация нескольких сайтов гипервариабельной области (например, 6-7 сайтов), чтобы получить все возможные аминокислотные замещения на каждом сайте. Полученные таким образом мутанты антитела моновалентно проявляются на частицах фага как слитые с белком, находящимся на частицах. Фаг, экспрессирующий различные мутанты, может проходить цикл процедур селекции связывания с последующим выделением и секвенированием тех мутантов, которые демонстрируют высокую аффинность.
Метод селекции новых связывающих полипептидов может опираться на использование библиотеки структурно связанных полипептидов. Библиотека структурно связанных полипептидов, например, слитых с белком оболочки фага, получается посредством мутагенеза и проявляется на поверхности частицы. Затем частицы вступают в контакт с молекулой-мишенью, и частицы с самой высокой аффинностью к мишени отделяются от частиц, обладающих более низкой аффинностью. Связывающиеся с высокой аффинностью частицы затем амплифицируют посредством инфицирования подходящего бактериального хозяина, и стадию конкурентного связывания повторяют. Процесс повторяют, до тех пор пока не будут получены полипептиды с желаемой аффинностью.
В альтернативном варианте мультивалентный фаг (McCafferty et al. (1990) Nature 348:552-554; и Clackson et al. (1991) Nature 352:624-628) может также использоваться для экспрессии случайных точковых мутаций (например, мутаций, полученных в результате использования допускающей ошибки ДНК-полимеразы) для получения фаговой библиотеки фрагментов антител, которые затем могут подвергаться скринингу для проверки аффинности к CXCR5, Hawkins et al., (1992) J Mol Biol 254:889-896.
Предпочтительно, чтобы в процессе созревания аффинности реплицируемый вектор экспрессии оставался под строгим контролем регуляторного элемента транскрипции, а условия культивирования корректировались таким образом, чтобы количество или число частиц, несущих более одной копии слитого белка, было менее примерно 1%. Кроме того, предпочтительно, чтобы количество частиц, несущих более одной копии слитого белка, было менее 10% от количества частиц, несущих единственную копию слитого белка. Предпочтительно, чтобы такое количество было менее 20%.
Функциональные эквиваленты можно получать заменой различных CDR в различных цепях антител в каркасной или композитной FR, полученной от многих антител. Так, например, возможно получить различные классы антител для заданного набора CDR посредством замещения различных тяжелых цепей, например IgG1-4, IgM, IgA1-2 или IgD, с тем чтобы получить различающиеся типы и изотипы антител CXCR5. Аналогичным образом, искусственные антитела, входящие в объем настоящего изобретения, могут быть получены посредством заключения заданного набора CDR в полностью синтетический каркасный участок.
Например, из молекулы IgG4, обладающей пониженной функцией эффектора, получают подходящую каркасную область и часть Fc для включения вариабельной области или одной или нескольких представляющих интерес CDR.
В других примерах осуществления для усиления свойств связывающей CXCR5 молекулы, которая представляет интерес, могут вноситься определенные модификации в каркасную часть и/или Fc часть молекулы, несущей антигенсвязывающий участок рассматриваемой молекулы. Например, могут производиться аминокислотные замены для усиления или ослабления рассматриваемых свойств. Таким образом, для проведения модификации в молекуле IgG4 подходят замещения на сайтах, известных своим воздействием на функцию, например в шарнирной области, в области, которая влияет на эффекторную функцию или которая воздействует на связывание Fc. Для достижения желательных свойств в молекуле IgG4 могут проводиться замещения следующих аминокислот по нумерации Кабата: 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255 и пр., или же их комбинации. Например, замещение пролином серина 241 может стабилизировать третичную и четвертичную структуры молекулы (Mol Imm 30(1)105-108, 1993), а замещение глутаминовой кислотой лейцина 248 может подавлять эффекторную функцию (функции) (J Imm 164(4)1925-1033, 2000; и Clin Imm 98(2)164-174, 2001).
Другим полезным свойством является возможность получения производного антитела, которое связывается с CXCR5, но, например, не приводит к истощению B-клеток. За счет этого могут достигаться определенные преимущества, поскольку не происходит нарушения продукции антител в организме пациента. Лечение таким реагентом также упрощает проведение комбинированных схем терапии со вторым препаратом с конкретными показаниями действия на уровне, не затрагивающем В-клеток. Это может быть, например, уровень Т-клеток.
Поэтому, например, 16D7-HC1-LC3 обрабатывался таким образом, чтобы содержать два замещения, S241P и L248E. Остатки пролина и глутаминовой кислоты придают желаемые свойства рассматриваемой CXCR5-связывающей молекуле, которая содержит каркасный участок IgG4, например стабильность и пониженную функцию эффектора.
К фрагментам антител и функциональным эквивалентам настоящего изобретения относятся такие молекулы, которые обладают регистрируемым уровнем специфического связывания с CXCR5. Регистрируемый уровень связывания включает все значения в диапазоне по меньшей мере 10-100%, предпочтительно по меньшей мере 50%, 60% или 70%, более предпочтительно по меньшей мере 75%, 80%, 85%, 90%, 95% или 99% способности связывания представляющего интерес антитела. В объем настоящего изобретения также включаются эквиваленты с аффинностью более 100% по сравнению с рассматриваемым антителом.
CDR обычно имеют большое значение для распознавания эпитопов и связывания антитела. При этом, однако, могут вноситься изменения в остатки, которые входят в состав CDR, с одновременным отсутствием воздействия на способность антитела распознавать когнатный эпитоп и связываться с ним. Например, могут вноситься изменения, которые не оказывают воздействия на распознавание эпитопов, но, тем не менее, повышают аффинность связывания антитела с эпитопом. В ряде исследований приводится обзор эффектов влияния проведения замен одной или нескольких аминокислот в различных положениях последовательности антитела, исходя из знаний о первичной последовательности антитела, на их свойства, например связывание и уровень экспрессии (Yang et al., 1995, J Mol Biol 254:392-403; Rader et al., 1998, Proc Natl Acad Sci USA 95:8910-8915; и Vaughan et al., 1998, Nature Biotechnology 16, 535-539).
Таким образом, эквиваленты рассматриваемого антитела могут быть получены изменением последовательностей генов тяжелой и легкой цепей в CDR1, CDR2 или CDR3, или в каркасных областях с помощью таких методов, как олигонуклеотид-опосредованный сайт-направленный мутагенез, кассетный мутагенез, ПЦР пониженной точности, перестановка в ДНК или штаммы мутатора E. coli (Vaughan et al., 1998, Nat Biotech 16:535-539; и Adey et al., 1996, Chap. 16, pp. 277-291, в Phage Display of Peptides and Proteins, eds. Kay et al., Academic Press). Методы изменения последовательности нуклеиновой кислоты первичного антитела могут приводить к образованию антител с повышенной аффинностью (Gram et al., 1992, Proc Natl Acad Sci USA 89:3576-3580; Boder et al., 2000, Proc Natl Acad Sci USA 97:10701-10705; Davies & Riechmann, 1996, Immunotech 2:169-179; Thompson et al., 1996, J Mol Biol 256:77-88; Short et al., 2002, J Biol Chem 277:16365-16370; и Furukawa et al., 2001, J Biol Chem 276:27622-27628).
Повторяющиеся циклы «полипептидной селекции» могут применяться для отбора систем со все более высокой аффинностью связывания, например, посредством селекции изменений нескольких аминокислот, которые отбираются в ходе множества циклов селекции. После первого цикла селекции, включающего первую область селекции аминокислот в лиганде или полипептиде антитела, проводятся дополнительные циклы селекции в других областях или аминокислотах лиганда. Циклы селекции повторяются до достижения желаемых характеристик аффинности.
К усовершенствованным антителам также относятся антитела, обладающие усовершенствованными характеристиками, полученные с использованием стандартных методик иммунизации животных, образования гибридом и селекции антител с определенными характеристиками.
Термин «антагонист» относится к молекуле, способной ингибировать одно или несколько проявлений биологической активности молекулы-мишени, например, передачу сигнала CXCR5. Антагонист может препятствовать связыванию рецептора с лигандом и наоборот, выводя из строя или уничтожая клетки, активируемые лигандом, и/или блокируя активацию рецептора или лиганда (например активацию тирозинкиназы), или передачу сигнала после связывания лиганда с рецептором. Антагонист в состоянии полностью блокировать взаимодействие рецептор-лиганд или может существенно подавлять такие взаимодействия. Для целей настоящего изобретения все подобные аспекты воздействия антагониста считаются эквивалентными. Поэтому в объем настоящего изобретения включаются антагонисты (например, нейтрализующие антитела), которые связываются с CXCR5, CXCL13 или другими лигандами CXCR5, или комплексом CXCR5 и его лигандом, например CXCL13; варианты аминокислотных последовательностей или производные CXCR5 или CXCL13, которые являются антагонистами взаимодействия между CXCR5 и лигандом, например CXCL13; растворимый CXCR5, в одном из вариантов слитой с гетерологической молекулой, например областью иммуноглобулина (например, иммуноадгезин); комплекс, включающий CXCR5, связанный с другим рецептором или биологической молекулой, пептиды с синтетической или нативной последовательностью, которые связываются с CXCR5; и пр.
Термин «агонист» относится к соединению, включающему белок, полипептид, пептид, антитело, фрагмент антитела, конъюгат, большую молекулу, малую молекулу, которое активирует одно или несколько проявлений биологической активности CXCR5. Агонисты могут вмешиваться в связывание рецептора с лигандом и наоборот, действовать в качестве митогена клеток, активируемых лигандом, и/или препятствовать инактивации клеток или ингибированию сигнала после связывания лиганда с рецептором. Для целей настоящего изобретения все подобные аспекты воздействия агониста считаются эквивалентными. Поэтому в объем настоящего изобретения включаются агонисты, которые связываются с CXCR5, CXCL13 или другими лигандами CXCR5, или комплексом CXCR5 и его лигандом, например CXCL13; варианты аминокислотных последовательностей или производные CXCR5 или CXCL13, которые стимулируют взаимодействие между CXCR5 и лигандом, например CXCL13; растворимый CXCR5, в одном из вариантов слитый с гетерологической молекулой, например областью иммуноглобулина (например, иммуноадгезин); комплекс, включающий CXCR5, связанный с другим рецептором или биологической молекулой, пептиды с синтетической или нативной последовательностью, которые связываются с CXCR5; и пр. Агонистом обычно является соединение, которое напрямую активирует CXCR5, например, для передачи сигнала.
Используемые в настоящем документе термины «клетка», «линия клеток» и «клеточная культура» включают их потомство. Также подразумевается, что все потомство не может быть в точности идентичным, например, по содержанию ДНК, вследствие намеренных или случайных мутаций. Сюда входит вариант потомства, который обладает такими же функциями или представляющей интерес биологической характеристикой, для которых проводится скрининг в исходных клетках. «Клетка-хозяин», используемая в настоящем изобретении, как правило, является прокариотической или эукариотической клеткой, отбираемой в зависимости от поставленной цели.
«Трансформация» клеточного организма, клетки или клеточной линии с помощью нуклеиновой кислоты означает введение нуклеиновой кислоты в клетку-мишень, с тем, чтобы обеспечить возможность репликации нуклеиновой кислоты как в качестве внехромосомного элемента, так и посредством хромосомной интеграции, а также, возможно, ее экспрессию. «Трансфекцией» клетки или организма нуклеиновой кислотой называется поглощение нуклеиновой кислоты, например вектора экспрессии, клеткой или организмом независимо от того, будет ли фактически проходить экспрессия каких-либо кодирующих последовательностей. Термины «трансфицированная клетка-хозяин» и «трансформированная» относятся к клетке, в которую была введена нуклеиновая кислота. Характерной прокариотической клеткой-хозяином являются различные штаммы E. coli. Характерными эукариотическими клетками-хозяевами являются клетки млекопитающих, например клетки яичников китайского хомячка или клетки человеческого происхождения. Вводимая последовательность нуклеиновой кислоты может быть взята от того же вида, что и вид клетки-хозяина, или от вида, отличающегося от вида клетки-хозяина, или же может представлять собой исходную последовательность нуклеиновой кислоты, содержащую определенные чужеродные и определенные гомологические нуклеиновые кислоты. Трансформация может также происходить посредством трансдукции или инфекции элементами вирусного происхождения.
Термин «вектор» означает конструкцию нуклеиновой кислоты, носитель, содержащий нуклеиновую кислоту, трансген, чужеродный ген или рассматриваемый ген, который может быть функционально связан с подходящими контрольными последовательностями для экспрессии трансгена в организме подходящего хозяина. К таким контрольным последовательностям, например, относятся промотор для проведения транскрипции, дополнительная операторная последовательность для контроля такой транскрипции, последовательность, кодирующая подходящие сайты связывания мРНК на рибосоме, а также последовательности, которые контролируют остановку транскрипции и трансляции. Вектором может быть плазмида, частица фага или просто потенциальная геномная вставка. После трансформации в подходящего хозяина вектор может реплицироваться и функционировать независимо от генома хозяина, или может в некоторых случаях интегрироваться в геном клетки-хозяина. В приведенном описании термины «плазмида» и «вектор» используются равнозначно, поскольку плазмида является широко применяемой формой вектора. Вместе с тем предполагается, что изобретение включает такие другие формы векторов, которые выполняют эквивалентные функции носителей, которые известны или становятся известны специалистам в области, например вирусы, синтетические молекулы, которые содержат нуклеиновые кислоты, липосомы и пр.
Под «млекопитающим» для целей лечения понимается любое животное, классифицируемое как млекопитающее, в том числе человек, домашние и сельскохозяйственные животные, нечеловекообразные приматы, а также животные из зоопарков, спортивные или домашние животные, например собаки, лошади, кошки, коровы и пр.
Рассматриваемые антитела могут подвергаться скринингу или могут использоваться в методах анализа, которые описаны в настоящем документе или известны специалистам в области. Часто для таких анализов требуется реагент, который можно обнаружить доступными методами, например содержащий метку. Используемый в настоящем документе термин «метка» относится к детектируемому соединению или составу, который напрямую или косвенно может конъюгироваться с молекулой или белком, например антителом. Метка может быть сама по себе детектируемой (например радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химические изменения субстрата или состава, которые поддаются детектированию.
Используемый в настоящем документе термин «твердая фаза» означает неводную матрицу, к которой может прикрепляться частица или молекула, например антитело по настоящему изобретению. Примерами твердых фаз, входящих в объем настоящего изобретения, являются полностью или частично образованные из стекла (например стекла с контролируемой пористостью), полисахариды (например агароза), полиакриламиды, полистирол, поливиниловый спирт и силиконы. В некоторых примерах осуществления, в зависимости от контекста, твердая фаза может представлять собой лунку в аналитическом планшете; в иных случаях она может использоваться в колонке для очистки (например, в колонке для аффинной хроматографии). Таким образом, твердой фазой может быть бумага, гранулы, полимерная поверхность, чип и пр., она может быть изготовлена из самых различных материалов, например нитроцеллюлозы, агарозы, полистирола, полипропилена, силикона и пр., а также может иметь самые различные конфигурации.
Растворимый CXCR5 или его фрагменты, например внеклеточный домен (EC), могут использоваться в качестве иммуногенов для получения рассматриваемых антител. Иммуноген может получаться или выделяться из природных источников, или может быть получен с помощью рекомбинантных технологий. Цельные клетки, например клетки CXCR5+, клетки, полученные из природных источников (например, В-клетки, линии В-клеток или линии раковых клеток), или трансформированные (или трансфицированные) клетки, полученные с помощью рекомбинантных методик для экспрессии или, возможно, сверхэкспрессии CXCR5, могут использоваться в качестве иммуногена для изготовления представляющих интерес антител. Кроме того, могут использоваться мембранные препараты, переносящие CXCR5 или синтетические пептиды, или процессированные полипептиды, соответствующие областям EC CXCR5, которые известны специалистам в области.
В качестве иммуногена может использоваться EC CXCR5, длиной примерно 60 аминокислот, или его часть. Специалистам в области будут очевидны и другие формы иммуногена, пригодные для получения антител, например конъюгаты. Таким образом, CXCR5 или его части могут связываться с молекулой носителя, например с альбумином или KLH, с тем, чтобы использоваться в качестве иммуногена. Конечно, в случае клеток, экспрессирующих CXCR5, именно домен EC является предпочтительным иммуногеном или частью иммуногена.
Как известно специалистам в области, ген или кДНК, кодирующие CXCR5, могут клонироваться в плазмиду или другой вектор экспрессии и экспрессироваться в рамках любой из нескольких систем экспрессии в соответствии с методами, хорошо известными квалифицированным специалистам в области, см., например, ниже. Из-за вырождения генетического кода для экспрессии рекомбинантного CXCR5 или его функциональных продуктов на практике может использоваться множество нуклеотидных последовательностей, кодирующих белок CXCR5 или полипептиды. Нуклеотидную последовательность можно изменять посредством селекции комбинаций на основании возможного выбора кодонов, например тех, которые предпочтительны для клетки-хозяина. Комбинации составляют в соответствии со стандартным триплетным генетическим кодом в применении к нуклеотидной последовательности, которая кодирует существующий в природе CXCR5, и могут рассматриваться все подобные вариации. Поэтому кодирующая CXCR5 последовательность может быть изменена, так чтобы содержать кодоны, экспрессирующие рассматриваемые аминокислоты, при этом триплетный кодон является предпочтительным для механизма экспрессии генов в клетке-хозяине, например человеческой клетке. Любой из таких полипептидов может использоваться для иммунизации животного, например верблюдов, или в другой системе для генерации антител, которые связываются с CXCR5.
Как отмечалось выше, при благоприятных обстоятельствах иммуноген CXCR5 может экспрессироваться в форме слитого белка, содержащего CXCR5, связанный с сегментом слияния, который обычно представляет собой полипептид с одной или несколькими полезными функциями. Сегмент слияния часто помогает проводить очистку белка, например, дает возможность выделить и очистить слитой белок с помощью аффинной хроматографии, но может также использоваться для повышения иммуногенности. Слитые белки можно продуцировать посредством культивирования рекомбинантных клеток, трансформированных с помощью слитой последовательности нуклеиновой кислоты, которая кодирует белок, связанный с карбоксильным и/или аминотерминальным окончанием полипептида CXCR5. Сегменты слияния могут, среди прочих, включать области Fc иммуноглобулина, глутатион-S-трансферазу, β-галактозидазу, полигистидиновый сегмент, который в состоянии связываться с двухвалентным ионом металла, и белок, связывающий мальтозу.
Молекулы нуклеиновых кислот, кодирующие аминокислотную последовательность мутантов, могут быть получены с помощью самых различных методов, известных специалистам в области. К таким методам, среди прочих, относятся олигонуклеотидный (или сайт-направленный) мутагенез, ПЦР-мутагенез и кассетный мутагенез ранее изготовленного мутированного или немутированного варианта рассматриваемой молекулы (см., например, Kunkel, Proc Natl Acad Sci USA 82:488 (1985)).
Рекомбинантная экспрессия антитела по настоящему изобретению или его фрагмента, производного или аналога (например, тяжелой или легкой цепи антитела по настоящему изобретению, одноцепочечного антитела по настоящему изобретению или антитела мутеина по настоящему изобретению) подразумевает конструирование вектора экспрессии, содержащего полинуклеотид, который кодирует антитело или фрагмент антитела, как описано в настоящем документе. После получения полинуклеотида, кодирующего молекулу антитела, можно приготовить вектор для продукции антитела, используя технологию рекомбинантной ДНК, известную специалистам в области. Конструируется вектор экспрессии, содержащий кодирующие антитело последовательности, а также соответствующие маркеры контроля транскрипции и трансляции. К таким методам относятся, например, методики рекомбинантной ДНК in vitro, синтетические методики и генетическая рекомбинация in vivo.
Вектор экспрессии переносится в клетку-хозяина с помощью стандартных методик, и трансфицированные клетки затем культивируют с помощью стандартных методик с целью получить антитело по настоящему изобретению или его фрагмент. В одном из аспектов изобретения в клетке-хозяине может проводиться совместная экспрессия векторов, кодирующих тяжелую и легкую цепи, с тем, чтобы обеспечить экспрессию всей молекулы иммуноглобулина, как это подробно описано в настоящем документе.
При экспрессии молекул антитела, представленных в настоящем изобретении, могут использоваться самые разнообразные системы хозяина/вектора экспрессии. Такие системы экспрессии представляют собой носители для получения и последующей очистки рассматриваемых кодирующих последовательностей, но также представляют собой клетки, которые при трансформации или трансфекции соответствующими кодирующими нуклеотидными последовательностями в состоянии экспрессировать молекулу антитела по настоящему изобретению in situ. Бактериальные клетки, например, E. coli, а также эукариотические клетки широко используются для экспрессии молекулы рекомбинантного антитела, особенно для экспрессии всей молекулы рекомбинантного антитела. Например, клетки млекопитающих, такие как клетки CHO, в сочетании с вектором, например несущим основной элемент промежуточного раннего гена-промоутера цитомегаловируса человека, являются эффективной системой экспрессии антител (Foecking et al., Gene 45:101 (1986); и Cockett et al., Bio/Technology 8:2 (1990)). Как известно специалистам в области, для изготовления представляющих интерес белков могут также использоваться растения и культуры растительных клеток, клетки насекомых и пр.
Кроме того, может выбираться клетка-хозяин, которая модулирует экспрессию введенных последовательностей или модифицирует и обеспечивает процессинг генного продукта конкретным заданным образом. Подобные модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут иметь важное значение для функционирования белка. Различные клетки-реципиенты обладают характерными и специфическими механизмами пост-трансляционного процессинга и модификации белков и генных продуктов. Соответствующие линии клеток или системы реципиентов могут выбираться для обеспечения необходимой модификации и процессинга рассматриваемого экспрессированного антитела. Следовательно, может использоваться эукариотическая клетка-хозяин, которая обладает клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. К таким клеткам-реципиентам млекопитающих, среди прочих, относятся CHO, COS, 293, 3T3 или клетки миеломы.
Стабильная экспрессия является предпочтительной для долгосрочной высокопроизводительной продукции рекомбинантных белков. Например, могут быть сконструированы линии клеток, которые стабильно экспрессируют молекулу антитела. Вместо использования векторов экспрессии, которые содержат вирусные источники репликации, клетка-хозяин может быть трансформирована с помощью ДНК в условиях регулирования, которое обеспечивается соответствующими элементами контроля экспрессии (например, промоутером, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и пр.) и селектируемым маркером. После интродукции чужеродной ДНК сконструированным клеткам в течение одного или двух дней дают расти в обогащенной среде, затем их переносили в селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает стабильность по отношению к селекции и позволяет клетками стабильно интегрировать плазмиду в хромосому с последующим развитием в линию клеток. Такие сконструированные линии клеток удобны не только для продукции антител, но также пригодны для скрининга и оценки соединений, которые прямо или косвенно взаимодействуют с молекулой антитела.
Может использоваться ряд систем селекции, в том числе, среди прочих, тимидинкиназа вируса Herpes simplex (Wigler et al., Cell 11:223 (1977)), гипоксантин-гуанинфосфорибозилтрансфераза (Szybalska et al., Proc Natl Acad Sci USA 48:202 (1992)), селекция глутаматсинтазы в присутствии метионинсульфоксимида (Adv Drug Del Rev 58, 671, 2006, см. также веб-сайт или подборку литературы Lonza Group Ltd.), а также гены аденинфосфорибозилтрансферазы (Lowy et al., Cell 22:817 (1980)) в клетках tk, hgprt или aprt, соответственно. Также устойчивость к антиметаболитам может использоваться в качестве основы для селекции следующих генов: dhfr, который обеспечивает устойчивость к метатрексату (Wigler et al., Proc Natl Acad Sci USA 77:357 (1980); O'Hare et al., Proc Natl Acad Sci USA 78:1527 (1981)); gpt, который определяет устойчивость к микофеноловой кислоте (Mulligan et al., Proc Natl Acad Sci USA 78:2072 (1981)); neo, который обеспечивает устойчивость к аминогликозиду, G-418 (Wu et al., Biotherapy 3:87 (1991)); hygro, который определяет устойчивость к гигромицину (Santerre et al., Gene 30:147 (1984)). Методы, известные специалистам в области технологии рекомбинантной ДНК, могут стандартным образом применяться для селекции желаемого рекомбинантного клона, и такие методы описаны, например, в Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press (1990); Dracopoli et al., eds., Current Protocols in Human Genetics, John Wiley & Sons (1994); и Colberre-Garapin et al., J Mol Biol 150:1 (1981).
Уровни экспрессии молекулы антитела могут быть повышены с помощью векторной амплификации (например, см. Bebbington et al., в DNA Cloning, Vol. 3. Academic Press (1987)). В случае возможности амплификации маркера в векторной системе, экспрессирующей антитело, увеличение уровня ингибитора, присутствующего в культуре, будет приводить к росту числа копий маркерного гена. Поскольку амплифицируемая область ассоциирована с геном антитела, продукция антитела будет также возрастать (Crouse et al., Mol Cell Biol 3:257 (1983)).
Клетка-хозяин может совместно трансфицироваться двумя или более векторами экспрессии по настоящему изобретению, например первым вектором, кодирующим производный от тяжелой цепи полипептид, и вторым вектором, кодирующим производный от легкой цепи полипептид. Эти два вектора могут содержать идентичные селектируемые маркеры, которые обеспечивают равную экспрессию полипептидов тяжелой и легкой цепей. В качестве альтернативы может использоваться единичный вектор, который кодирует и в состоянии экспрессировать полипептиды как тяжелой, так и легкой цепей. В подобных случаях легкая цепь должна располагаться до тяжелой во избежание появления избытка токсичной свободной тяжелой цепи (Proudfoot, Nature 322:52 (1986); и Kohler, Proc Natl Acad Sci USA 77:2197 (1980)). Кодирующие последовательности для тяжелой и легкой цепей могут включать кДНК или геномную ДНК.
После того как молекула антитела по настоящему изобретению была получена в организме животного, синтезирована химическим путем или посредством рекомбинантной экспрессии, ее можно очистить с помощью любого метода, известного специалистам в области, применяемого для очистки молекулы иммуноглобулина, например хроматографии (например ионообменной, аффинной, в частности, опирающейся на аффинность CXCR5 для белка A, а также гель-фильтрацией и пр.), центрифугирования, дифференциальной растворимости или с помощью любой другой стандартной методики для очистки белков. Кроме того, для упрощения процесса очистки антитела по настоящему изобретению или их фрагменты могут быть слиты в гетерологические полипептидные последовательности, описанные в настоящем документе или же известные специалистам в области.
Рекомбинантный белок CXCR5, который рассматривается в приведенных ниже примерах, использовался для иммунизации мышей, с тем, чтобы получить гибридомы, которые продуцируют моноклональные антитела по настоящему изобретению. Из полученных моноклональных антител отбирались те, которые обладали полезными терапевтическими свойствами, например, препятствовали связыванию лиганда CXCR5 с этим белком. Отобранные антитела затем модифицировались с целью придания им полезных свойств, например, повышенной стабильности in vivo.
Антитела по настоящему изобретению могут быть получены любым удобным методом, известным специалистам в области. К антителам по настоящему изобретению могут относиться поликлональные антитела, хотя по причине модификации антител для оптимизации применения на человеке, а также для оптимизации применения антител самих по себе, моноклональные антитела являются предпочтительными из-за простоты получения и обработки конкретных белков. Методы изготовления поликлональных антител известны квалифицированным специалистам в области (Harlow et al., Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988)).
Например, рассматриваемый в настоящем документе иммуноген может вводиться различным животным-реципиентам, в том числе, среди прочих, кроликам, мышам, верблюдам, крысам и пр., с тем, чтобы индуцировать продукцию сыворотки, содержащей поликлональные антитела, специфичные по отношению к CXCR5. Введение иммуногена может предполагать одну или несколько инъекций иммунизирующего агента и, если желательно, адъюванта. Для усиления иммунного ответа могут использоваться различные адъюванты, зависящие от вида хозяина, и к ним, среди прочего, относятся адъюванты Фрейнда (полные и неполные), минеральные масла, гели, гидроксид алюминия, поверхностно-активные вещества, например лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки (KLH), динитрофенол, а также потенциально применимые человеческие адъюванты, например БКГ (Bacille Calmette-Guerin) или Corynebacterium parvum. Дополнительные примеры адъювантов, которые могут применяться, включают адъювант MPL-TDM (монофосфориллипид А, синтетический дикориномиколат трегалозы). Протоколы иммунизации хорошо известны специалистам в области, и она может производиться в соответствии с любым методом, который обеспечивает иммунный ответ в выбранном организме животного-реципиента. Таким образом, в зависимости от поставленной цели в различные периоды времени могут использоваться самые разнообразные методы введения.
Как правило, иммуноген (с адъювантом или без него) вводится млекопитающему посредством нескольких подкожных или внутрибрюшинных инъекций, или внутримышечно, или внутривенно. Иммуноген может включать полипептид CXCR5, слитой белок или их варианты, которые могут получаться в клетке, продуцирующей или сверхпродуцирующей CXCR5, каковой клеткой может быть существующая в природе клетка, существующая в природе клетка-мутант или клетка, сконструированная с помощью генной инженерии. В определенных обстоятельствах могут использоваться цельные клетки, экспрессирующие CXCR5. В зависимости от природы полипептидов (то есть процента гидрофобности, гидрофильности, стабильности, суммарного заряда, изоэлектрической точки и пр.) CXCR5 или его часть могут модифицироваться или конъюгироваться, чтобы обеспечить иммуногенность или более высокую иммуногенность в организме животного, например млекопитающего, которое подвергается иммунизации. Например, CXCR5 или его часть может конъюгироваться с носителем. Под конъюгацией понимается химическая конъюгация посредством получения производных активных химических функциональных групп иммуногена и конъюгируемого иммуногенного белка, с тем, чтобы образовать ковалентную связь, или же конъюгация с использованием методологии слитых белков, или же других методов, известных квалифицированным специалистам в области. Примерами таких носителей или иммуногенных белков, среди прочих, являются KLH, овальбумин, сывороточный альбумин, бычий тироглобулин, соевый ингибитор трипсина и промискуитетные Т-хелперные пептиды. Как описывалось выше, для усиления иммунного ответа могут использоваться различные адъюванты.
После получения пригодного препарата появляется возможность выделить конкретные антитела из множества антител с использованием известных методик разделения, например аффинной хроматографии, пэннинга, абсорбции и пр. Таким способом могут быть получены индивидуальные виды антител для дальнейшего исследования, например секвенирования с установлением аминокислотных последовательностей одной или нескольких CDR.
Антитела по настоящему изобретению предпочтительно включают моноклональные антитела. Моноклональные антитела могут быть изготовлены с помощью гибридомных методик, например описанных в Kohler et al., Nature 256:495 (1975); патент США № 4376110; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988) и Hammerling et al., Monoclonal Antibodies and T-Cell Hybridomas, Elsevier (1981), методик рекомбинантной ДНК, например изготовление и использование трансфектом, или других методов, известных специалистам в области. Другие примеры методов, которые могут использоваться для продукции моноклональных антител, среди прочих, включают, гибридомные методики В-клеток человека (Kosbor et al., Immunology Today 4:72 (1983); и Cole et al., Proc Natl Acad Sci USA 80:2026 (1983)), и EBV-гибридомную методику (Cole et al., Monoclonal Antibodies and Cancer Therapy, pp. 77-96, Alan R. Liss (1985)). Такие антитела могут относиться к любому классу иммуноглобулинов, в том числе IgG, IgM, IgE, IgA и IgD, а также к любому их подклассу. Гибридомы, продуцирующие mAb по настоящему изобретению, могут культивироваться in vitro или in vivo.
В рамках гибридомной модели организм хозяина, например мыши, гуманизированной мыши, трансгенной мыши с генами иммунной системы человека, хомячка, кролика, крысы, верблюда или любого другого подходящего животного-хозяина, иммунизируется с целью активировать лимфоциты, которые продуцируют или в состоянии продуцировать антитела, специфично связывающиеся с CXCR5. В альтернативном варианте лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с помощью подходящего реагента для слияния, например полиэтиленгликоля, с тем, чтобы образовать клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)).
Как правило, при изготовлении продуцирующих антитела гибридом используются лимфоциты периферической крови (PBL), если желательно получить клетки человеческого происхождения, или же клетки селезенки или лимфатических узлов, если требуются клетки, происходящие от млекопитающих, кроме человека. Иммортализованные линии клеток обычно представляют собой трансформированные клетки млекопитающих, в частности, клетки миеломы, полученные от грызунов, крупного рогатого скота или человека. Обычно используют линию клеток миеломы крыс или мышей. Клетки гибридомы могут культивироваться в подходящей культуральной среде, которая предпочтительно содержит одно или несколько соединений, ингибирующих рост или выживание неслитых, иммортализованных клеток. Например, если в родительских клетках отсутствовал фермент гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT или HPRT), культуральная среда для гибридом, как правило, будет содержать гипоксантин, аминоптерин и тимидин («среда НАТ»)-вещества, которые препятствуют росту HGPRT-дефицитных клеток.
К предпочтительным линиям иммортализованных клеток относятся такие, которые эффективно участвуют в слиянии, поддерживают стабильно высокий уровень продукции антитела отобранными антитело-продуцирующими клетками и чувствительны к среде, например к среде НАТ. К таким линиям клеток миеломы относятся линии миеломы мыши, например полученные из мышиных опухолей MOPC-21 и MPC-11, поставляемых Salk Institute Cell Distribution Center, San Diego, Calif. а также клетки SP2/0, FO или X63-Ag8-653, поставляемые American Type Culture Collection, Manassas, VA.
Описывалась также продукция человеческих моноклональных антител из линий клеток миеломы человека и мышино-человеческих клеток гетеромиеломы (Kozbor, J Immunol 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc, pp. 51-63 (1987)). Может также использоваться линия клеток миеломы мыши NSO (European Collection of Cell Cultures, Salisbury, Wilshire, UK).
В альтернативном варианте для получения гибридом предлагается использовать электрическое слияние вместо химического. Вместе слияния В-клетки могут быть иммортализованы с использованием, например, вируса Эпштейна-Барра или другого трансформирующего гена, см., например, Zurawaki et al., в Monoclonal Antibodies, ed., Kennett et al., Plenum Press, pp. 19-33. (1980). Могут также использоваться трансгенные мыши и мыши с тяжелым комбинированным иммунодефицитом (SCID), которым трансплантированы В-лимфоциты человека.
Культуральная среда, в которой выращивают клетки гибридомы, анализируется на предмет продукции моноклональных антител, направленных против CXCR5. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, может определяться по иммунопреципитации или анализом связывания in vitro, например радиоиммунологическим анализом (RIA), флуороцитометрическим анализом (FACS) или твердофазным иммуноферментным анализом (ELISA). Перечисленные методики известны в области, и ими владеет любой специалист в области. Аффинность связывания моноклонального антитела с CXCR5 может, например, определяться анализом по Скэтчарду (Munson et al., Anal Biochem 107:220 (1980)).
После идентификации клеток гибридомы, продуцирующих антитела с желаемой специфичностью, аффинностью и/или активностью, клоны могут быть субклонированы с использованием процедур серийных разведений и культивироваться с помощью стандартных методов (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)). К пригодным культуральным средам, например, относится модифицированная среда Дульбекко-Игла (D-MEM) или среда RPMI-1640. Кроме того, клетки гибридомы могут выращиваться in vivo в форме асцитных опухолей в организме животного.
Моноклональные антитела, продуцируемые субклонами, надлежащим образом отделяются или изолируются из культуральной среды, асцитной жидкости или сыворотки с применением стандартных процедур очистки иммуноглобулина, например белка А-сефароза, белка G-сефароза, хроматографии на гидроксиапатите, гель-фильтрационной хроматографии, гель-электрофореза, диализа или аффинной хроматографии.
В области существует широкое разнообразие методик продукции моноклональных антител, а потому изобретение не ограничивается только их продукцией в гибридомах. Например, моноклональные антитела могут быть получены на основе методик рекомбинантной ДНК, например методик, подобных описанным в патенте США № 4816567. В данном контексте термин «моноклональное антитело» относится к антителу, полученному от единственного эукариотического, фагового или прокариотического клона.
ДНК, кодирующая моноклональные антитела по настоящему изобретению, легко выделяется и секвенируется с использованием стандартных процедур (например, с применением олигонуклеотидных зондов, которые в состоянии специфично связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител или эти же цепи человека, гуманизированные или из других источников) (Innis et al. в PCR Protocols. A Guide to Methods and Applications, Academic (1990), и Sanger et al., Proc Natl Acad Sci 74:5463 (1977)). Клетки гибридом служат в качестве источника такой ДНК. После выделения ДНК может вводиться в векторы экспрессии, которые затем трансфицируются в клетки-реципиенты, например клетки E. coli, клетки NS0, клетки COS, клетки яичников китайского хомячка (CHO) или клетки миеломы, которые в иных ситуациях не продуцируют иммуноглобулиновый белок, с тем, чтобы добиться синтеза моноклональных антител в рекомбинантных клетках-реципиентах. ДНК может также модифицироваться, например, посредством подстановки константных доменов кодирующей последовательности тяжелых и легких цепей человека вместо гомологичных последовательностей мыши (патент США № 4816567; и Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)) или же ковалентного связывания кодирующей последовательности иммуноглобулина со всей или частью кодирующей последовательности неиммуноглобулинового полипептида. Такой неиммуноглобулиновый полипептид может быть использован вместо константных доменов антитела по настоящему изобретению или может вместо вариабельных доменов одного из сайтов комбинирования CXCR5 антитела по настоящему изобретению, так чтобы образовать химерное бивалентное антитело.
Антитела могут быть моновалентными. Методы получения моновалентных антител хорошо известны специалистам в области. Например, один из методов предусматривает рекомбинантную экспрессию легкой цепи иммуноглобулина и модифицированной тяжелой цепи. Тяжелая цепь обычно обрезается в любой точке области Fc, с тем, чтобы предупредить образование перекрестных сшивок в тяжелой цепи. В альтернативном варианте соответствующие цистеиновые остатки заменяются другим аминокислотным остатком или удаляются, с тем, чтобы воспрепятствовать перекрестным сшивкам.
Фрагменты антитела, которые распознают специфические эпитопы, могут быть получены с использованием известных методик. Такие фрагменты традиционно получают методом протеолитического разрушения интактных антител (см., например, Morimoto et al., J Biochem Biophys Methods 24:107 (1992); и Brennan et al., Science 229:81 (1985)). Например, фрагменты Fab и F(ab')2 по настоящему изобретению могут быть получены протеолитическим расщеплением молекул иммуноглобулина под действием таких ферментов, как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2). Фрагменты F(ab')2 содержат вариабельную область, константный домен легкой цепи и константную область CH1 тяжелой цепи. Вместе с тем эти фрагменты могут быть получены напрямую из рекомбинантных клеток-реципиентов. Например, фрагменты антитела могут быть выделены из фаговой библиотеки антитела. В альтернативном варианте фрагмены F(ab')2-SH могут быть напрямую выделены из E. coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163 (1992). В соответствии с другим подходом фрагменты F(ab')2 могут быть напрямую выделены из культуры рекомбинантных клеток-реципиентов. Опытному экспериментатору будут очевидны и другие методики получения фрагментов антител. В других примерах осуществления предпочтительным антителом является одноцепочечный фрагмент Fv (Fv) (WO 93/16185).
Для некоторых приложений, в том числе применения антител в организме человека in vivo и аналитических методах детектирования in vitro, может оказаться предпочтительным использовать химерные, гуманизированные или человеческие антитела. Методы получения химерных антител известны специалистам в области, см., например, Morrison, Science 229:1202 (1985); Oi et al., BioTechniques 4:214 (1986); Gillies et al., J Immunol Methods 125:191 (1989); и патенты США №№ 5807715; 4816567 и 4816397.
Гуманизированные антитела получают из молекул антител, которые продуцируются организмами, кроме человека, и связываются с CXCR5, причем одна или несколько их CDR введена в области FR молекулы человеческого иммуноглобулина. Антитела могут гуманизироваться на основе множества методик, известных специалистам в области, в том числе, например, вставки в CDR (EPO 239,400; WO 91/09967; и патенты США №№ 5225539; 5530101 и 5585089), изменения поверхности антител (EPO 592,106; EPO 519,596; Padlan, Molecular Immunology 28:489 (1991); Studnicka et al., Protein Engineering 7:805 (1994); и Roguska et al., Proc Natl Acad Sci USA 91:969 (1994)), и перестановки в цепи (патент США № 5565332).
Гуманизированное антитело содержит один или несколько аминокислотных остатков, источником которых является любой организм, кроме человеческого. Не присутствующие у человека аминокислотные остатки часто называют «импортированными» остатками, которые обычно берут из «импортируемого» вариабельного домена. Гуманизация может в основном проводиться с использованием методов Винтера с сотрудниками (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); и Verhoeyen et al., Science 239:1534 (1988)), посредством замещения нечеловеческими CDR или участками последовательностей CDR соответствующие последовательности человеческого антитела. Соответственно, такие «гуманизированные» антитела являются химерными (патент США № 4816567), в которых значительно меньший участок по сравнению с интактным человеческим вариабельным доменом замещен на соответствующую последовательность организма, не являющегося человеческим. На практике гуманизированные антитела обычно представляют собой человеческие антитела, в которых определенные остатки CDR и, возможно, некоторые остатки FR замещены аналогичными сайтами антител грызунов. Константная область тяжелой цепи, которая может включать один или несколько доменов тяжелой цепи, а также шарнирная область могут быть взяты от любого класса или подкласса, с тем, чтобы добиться желаемого эффекта, например конкретной эффекторной функции.
Часто остовные остатки каркасных участков человека могут быть заменены соответствующим остатком CDR донорного антитела, с тем, чтобы изменить и, по возможности, улучшить связывание антигена. Остовные замещения определяют по методам, известным специалистам в области, например посредством моделирования взаимодействий CDR и остовных остатков, с тем, чтобы определить остовные остатки, имеющие важное значение для связывания антигена, а также путем сопоставления последовательности для идентификации необычных остовных остатков в конкретных положениях, см., например, патент США № 5585089; и Riechmann et al., Nature 332:323 (1988).
Кроме того, предпочтительно, чтобы гуманизированные антитела сохраняли высокую аффинность к CXCR5, а также сохраняли или приобретали другие благоприятные биологические свойства. Таким образом, гуманизированные антитела готовятся в рамках процесса анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с помощью трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и известны специалистам в области. Существуют компьютерные программы, которые визуально представляют и отображают возможные трехмерные конформационные структуры выбранных кандидатов иммуноглобулиновых последовательностей. Изучение изображений позволяет проводить анализ вероятной роли различных остатков в функционировании иммуноглобулиновой последовательности-кандидата, то есть анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать CXCR5. Таким образом, могут отбираться и комбинироваться остатки FR из реципиентной и импортируемой последовательностей, с тем, чтобы максимизировать желательную характеристику антитела, например, возросшую аффинность к антигену-мишени, хотя именно остатки CDR напрямую и наиболее существенным образом влияют на связывание CXCR5. Области CDR также могут модифицироваться, так чтобы содержать одну или несколько аминокислот, отличающихся от полученных от исходного антитела, от которого была взята CDR, с тем, чтобы обеспечить усиление или появление других представляющих интерес свойств, например связывания с большей аффинностью или большей авидностью.
Можно проводить манипуляции и вносить изменения в определенные части константных областей антитела, с тем, чтобы придать гомологам, производным, фрагментам и другим элементам антитела свойства, отличающиеся от наблюдавшихся в исходном антителе или лучшие по сравнению с ним. Так, например, многие антитела IgG4 образуют внутрицепьевые дисульфидные связи в окрестностях шарнирной области. Внутрицепьевая связь в состоянии дестабилизировать исходную бивалентную молекулу с образованием моновалентных молекул, содержащих тяжелую цепь с ассоциированной легкой цепью. Такие молекулы могут вновь ассоциироваться, но уже случайным образом.
Отмечалось, что модификация аминокислот в шарнирной области молекул IgG4 может снизить вероятность образования внутрицепьевой связи, тем самым стабилизируя молекулу IgG4, что сведет к минимуму вероятность образования биспецифических молекул. Подобная модификация может оказаться полезной, если используемым для лечения антителом является молекула IgG4, поскольку возросшая стабильность будет сводить к минимуму вероятность диссоциации молекулы в процессе получения и производства, а также и in vivo. Моновалентное антитело может не обладать такой же эффективностью, что и бивалентная исходная молекула. Например, если пациенту вводится бивалентный IgG4, процент бивалентного IgG4 спадает до примерно 30% за двухнедельный период. Замещение аминокислоты в положении 228 увеличивает стабильность IgG4. Серин, который находится в положении 228, может быть замещен на другую аминокислоту, например, на одну из остальных 19 аминокислот. Такое изменение может быть сделано, в частности, в случае рекомбинантных антител, где кодирующая последовательность нуклеиновой кислоты может быть мутирована, с тем, чтобы получить заменяющую аминокислоту в положении 228. Например, компонент S может быть заменен на пролин.
Другой набор аминокислот, пригодный для модификации, включает аминокислоты в шарнирной области, которые влияют на связывание молекулы, содержащей тяжелую цепь с рецептором, связывающимся с Fc, и интернализацию связанного антитела. В молекулах IgG1 к таким аминокислотам относятся остатки с примерно 233 по примерно 237 (Glu-Leu-Leu-Gly-Gly); (SEQ ID №:49) с примерно 252 по примерно 256 (Met-Ile-Ser-Arg-Thr) (SEQ ID №:50) и с примерно 318 (Glu) по примерно 331 (Pro), включая, например, Lys320, Lys 322 и Pro329.
Использование полностью человеческих антител особенно желательно при терапевтическом воздействии на людей-пациентов. Человеческие антитела могут изготовляться с применением различных методов, известных специалистам в области, в том числе фаг-дисплея, описанных выше, с использованием библиотеки антител человека, полученных из иммуноглобулиновых последовательностей человека, см. патенты США №№ 4444887 и 4716111; и WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741. Методики из работ Cole et al. и Boerder et al. также могут применяться для изготовления человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss (1985); и Boerner et al., J Immunol 147:86 (1991)).
Человеческие антитела могут быть также получены с использованием трансгенных мышей, которые неспособны к экспрессии функциональных эндогенных иммуноглобулинов, но которые также экспрессируют определенные гены человеческого иммуноглобулина. Например, генные комплексы человеческой тяжелой и легкой цепей иммуноглобулина могут вводиться в мышиные эмбриональные стволовые клетки случайным образом или посредством гомологической рекомбинации. В альтернативном варианте человеческая вариабельная область, константная область и D-область могут вводиться в мышиные эмбриональные стволовые клетки в дополнение к генам тяжелой и легкой цепи человека. Мышиные гены тяжелой и легкой цепи иммуноглобулина могут перевести в нефункциональное состояние по отдельности или одновременно с введением локусов человеческого иммуноглобулина посредством гомологической рекомбинации. В частности, гомозиготная делеция в области JH препятствует эндогенной продукции антитела. Модифицированные эмбриональные стволовые клетки размножают и проводят их микроинъекцию в бластоцисты для получения химерных мышей. Химерных мышей затем выращивают для получения гомозиготного потомства, которое экспрессирует человеческие антитела, см., например, Jakobovitis et al., Proc Natl Acad Sci USA 90:2551 (1993); Jakobovitis et al., Nature 362:255 (1993); Bruggermann et al., Year in Immunol 7:33 (1993); и Duchosal et al., Nature 355:258 (1992)).
Трансгенные мыши обычным образом подвергаются иммунизации CXCR5, например полной последовательностью CXCR5 или ее частью, таким как ее домен EC. Моноклональные антитела, ориентированные против CXCR5, могут быть получены от иммунизированных трансгенных мышей с помощью стандартной гибридомной технологии. Трансгены человеческого иммуноглобулина, накопленные трансгенными мышами, реорганизуются во время дифференциации В-клеток и затем подвергаются классовому переключению и соматической мутации. Таким образом, с помощью данной методики есть возможность продуцировать терапевтически применимые антитела IgG, IgA, IgM и IgE. Обзор см. в работе Lonberg et al., Int Rev Immunol 13:65-93 (1995). Обсуждение продукции человеческих антител и человеческих моноклональных антител и протоколов получения таких антител: см., например, WO 98/24893; WO 92/01047; WO 96/34096 и WO 96/33735; EPO No. 0 598 877; и патенты США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 и 5939598. Кроме того, такие компании, как Amgen (Fremont, CA), Genpharm (San Jose, CA) и Medarex, Inc. (Princeton, NJ) могут привлекаться для поставки человеческих антител, нацеленных против CXCR5, с использованием технологии, которая аналогична приведенной выше.
Кроме того, человеческие mAbs могут быть получены иммунизацией мышей, которым трансплантированы человеческие лейкоциты периферической крови, спленоциты или костный мозг (например методика триом XTL Biopharmaceuticals, Israel). Полностью человеческие антитела, которые распознают выбранный эпитоп, могут быть получены с использованием методики, называемой «направленной селекцией». В рамках этого подхода отобранное нечеловеческое моноклональное антитело, например мышиное антитело, используется для направленной селекции полностью человеческого антитела, распознающего тот же эпитоп (Jespers et al., Bio/technology 12:899 (1988)).
При использовании рекомбинантных методик вариант антитела может продуцироваться внутриклеточно, в периплазматическом пространстве, или напрямую секретироваться в среду. Если вариант антитела продуцируется внутриклеточно, на первом этапе можно отделить остатки частиц, клетки-реципиенты или фрагменты после лизиса, например, с помощью центрифугирования или ультрафильтрации. В работе Carter et al., Bio/Technology 10:163 (1992) описана процедура изолирования антител, которые секретируются в периплазматическое пространство E. coli. Коротко говоря, клеточную пасту обрабатывают ацетатом натрия (pH 3,5) и EDTA. Остатки клеток можно удалить центрифугированием. Если вариант антитела секретируется в среду, супернатант от такой системы экспрессии обычно вначале концентрируют с помощью коммерчески доступных фильтров для концентрации белков, например, системы ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза может добавляться ингибитор протеазы, например, PMSF, а также можно включить антибиотики, чтобы воспрепятствовать росту случайных загрязнителей.
Препарат антител, изготовленный из клеток, может очищаться с использованием, например, хроматографии на гидроксиапатите, гель-электрофореза, диализа и аффинной хроматографии. Пригодность белка А или белка G в качестве аффинного лиганда зависит от вида и изотипа любого домена Fc иммуноглобулина, который содержится в варианте антитела. Белок А может применяться для очистки антител, в основе которых лежат человеческие тяжелые цепи IgG1, IgG2 или IgG4 (Lindmark et al., J Immunol Meth 62:1 (1983)). Белок G может использоваться для изотипов мышей и человеческого IgG3 (Guss et al., EMBO J 5:1567 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, чаще всего используется агароза, но существуют и другие матрицы. Механически прочные матрицы, например стекло с регулируемой пористостью или поли(стирол-дивинил)бензол, допускают использование более высоких скоростей потока и позволяют добиваться более коротких времен обработки по сравнению с агарозой. Если в вариант антитела включен домен CH3, для очистки удобно использовать смолу Bakerbond ABXTM (JT Baker; Phillipsburg, NJ). В зависимости от выделяемого антитела и его варианта могут также применяться другие методики очистки белка, например фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин-агарозе, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После любой стадии (стадий) предварительной очистки можно провести хроматографию с гидрофобным взаимодействием при низких рН для смеси, содержащей рассматриваемое антитело или его вариант и примеси, в условиях элюирования буфером при pH в интервале примерно 2,5-4,5, предпочтительно проводимого при низких концентрациях солей (например, в интервале примерно 0-0,25 M соли).
Кроме того, антитела по настоящему изобретению могут, в свою очередь, использоваться для получения антиидиотипических антител, которые «имитируют» CXCR5, применяя методики, хорошо известные специалистам в области (см., например, Greenspan et al., FASEB J 7:437 (1989); и Nissinoff, J Immunol 147:2429 (1991)). Например, антитела, которые связываются с CXCR5 и конкурентно ингибируют мультимеризацию и/или связывание лиганда с CXCR5, могут использоваться для получения антиидиотипов, которые «имитируют» CXCR5 и домен связывания, и в результате связываются с CXCR5 и нейтрализуют CXCR5 и/или его лиганд. Подобные нейтрализующие антиидиотипы или фрагменты Fab таких антиидиотипов могут использоваться в терапевтических схемах лечения, например, для нейтрализации CXCL13.
Антитела по настоящему изобретению могут быть биспецифическими. Биспецифические антитела могут быть моноклональными, предпочтительно человеческими или гуманизированными антителами, которые обладают специфичностью связывания по меньшей мере к двум различным антигенам. В настоящем изобретении одно из направлений специфичности связывания касается CXCR5, а второе может относиться к любому другому антигену, например белку клеточной поверхности, рецептору, субъединице рецептора, лиганду, тканеспецифическому антигену, белку вирусного происхождения, кодируемому вирусом оболочечному белку, белку бактериального происхождения, белку бактериальной поверхности и пр. При этом вторая специфичность может быть к CXCL13.
Методы изготовления биспецифических антител хорошо известны специалистам в области. Обычно рекомбинантная продукция биспецифических антител основана на совместной экспрессии пар тяжелая цепь/легкая цепь двух иммуноглобулинов, причем две тяжелые цепи обладают различными специфичностями (Milstein et al., Nature 305:537 (1983)). Вследствие случайного распределения тяжелых и легких цепей иммуноглобулина гибридомы (квадромы) продуцируют вероятную смесь десяти различных молекул антител, из которых лишь одна обладает правильной биспецифической структурой. Выделение нужной молекулы обычно проводится посредством нескольких стадий аффинной хроматографии. Аналогичные процедуры описаны в заявке WO 93/08829 и в работе Traunecker et al., EMBO J 10:3655 (1991). Другие методы изготовления биспецифических антител приводятся, например, в Kufer et al., Trends Biotech 22:238-244, 2004.
Вариабельные домены антитела с желаемыми специфичностями связывания можно сливать с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно проводится с константным доменом тяжелой цепи иммуноглобулина, включающий по меньшей мере часть шарнирных областей CH2 и CH3. По меньшей мере в одном из продуктов слияния может содержаться константная область первой тяжелой цепи (CH1), включающая сайт, необходимый для связывания легкой цепи. ДНК, кодирующие продукты слияния тяжелой цепи иммуноглобулина, и, если желательно, легкая цепь иммуноглобулина вводятся в различные векторы экспрессии и совместно трансформируются в подходящем организме хозяина. Более подробно о получении биспецифических антител можно узнать, например, в работе Suresh et al., Meth Enzym 121:210 (1986).
Гетероконъюгаты антител также составляют часть настоящего изобретения. Гетероконъюгаты антител состоят их двух ковалентно связанных антител. Такие антитела, например, были предложены для ориентирования клеток иммунной системы на нежелательные клетки (патент США № 4676980). Предполагается, что антитела могут быть изготовлены in vitro с помощью известных методов синтетической химии белков, в том числе с применением агентов для перекрестных сшивок. Например, иммунотоксины могут конструироваться с помощью реакции дисульфидного обмена или за счет образования тиоэфирной связи. Примерами подходящих для этого реагентов являются иминотиолат и метил-4-меркаптобутиримидат, а также предложенные, например, в патенте США № 4676980.
Кроме того, можно получить однодоменные антитела к CXCR5. Примеры подобной технологии были описаны в заявке WO9425591 для случая антител, полученных из тяжелой цепи Ig верблюда, а также в US 20030130496, где обсуждается выделение однодоменных полностью человеческих антител из фаговых библиотек.
В альтернативном варианте методики, описанные при получении одноцепочечных антител (патент США № 4946778; Bird, Science 242:423 (1988); Huston et al., Proc Natl Acad Sci USA 85:5879 (1988); и Ward, et al., Nature 334:544 (1989)), могут быть адаптированы для получения одноцепочечных антител. Одноцепочечные антитела образуются посредством связывания фрагментов тяжелой и легкой цепей области Fv через аминокислотный мостик с образованием одноцепочечного полипептида. Можно также использовать методики сборки функциональных фрагментов Fv в E. coli (Skerra et al., Science 242:1038 (1988)).
Настоящее изобретение включает антитела, рекомбинантно слитые или химически конъюгированные (в том числе ковалентно и нековалентно конъюгированные) с полипептидом. Слитые или конъюгированные антитела по настоящему изобретению могут использоваться для простоты очистки, см., например, WO 93/21232; EP 439,095; Naramura et al., Immunol Lett 39:91 (1994); патент США № 5474981; Gillies et al., Proc Natl Acad Sci USA 89:1428 (1992); и Fell et al., J Immunol 146:2446 (1991). Аминокислотная последовательность маркера может представлять собой гексагистидиновый пептид (SEQ ID №:51), например пепетид, подобный маркеру в векторе pQE (QIAGEN, Inc., Chatsworth, CA), среди прочих, многие из которых коммерчески доступны, Gentz et al., Proc Natl Acad Sci USA 86:821 (1989). К другим пептидным маркерам, удобным для очистки, среди прочих, относятся маркер «НА», который соответствует эпитопу, полученному из гемагглютинирующего белка гриппа (Wilson et al., Cell 37:767 (1984)) и маркер «flag».
Можно также создать одноцепочечные пептидные связывающие молекулы, в которых области тяжелой и легкой цепи Fv соединены друг с другом. Одноцепочечные антитела («scFv») и метод их конструирования описаны, например, в патенте США № 4946778. В альтернативном варианте аналогичными способами можно сконструировать и экспрессировать Fab. Все полностью или частично человеческие антитела могут быть менее иммуногенными, чем полностью мышиные mAbs, фрагменты и одноцепочечные антитела также могут быть менее иммуногенными.
Антитела или фрагменты антител могут выделяться из фаговых библиотек антител, полученных с помощью методик, описанных в McCafferty et al., Nature 348:552 (1990). Clarkson et al., Nature 352:624 (1991) и Marks et al., J Mol Biol 222:581 (1991) рассматривают выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описана продукция высокоаффинных (в интервале нМ) человеческих антител посредством перестановки в цепи (Marks et al., Bio/Technology 10:779 (1992)), а также метод комбинаторной инфекции и рекомбинация in vivo как стратегии построения очень больших фаговых библиотек (Waterhouse et al., Nucl Acids Res 21:2265 (1993)). Таким образом, подобные методики являются практической альтернативой традиционным гибридомным методикам в получении моноклональных антител.
Антитела к CXCR5 анализировались методами твердофазного иммуноферментного анализа (ELISA), FACS, вестерн-блоттингом или другими иммунохимическими методами, известными специалистам в области. Так, В-клетки или клетки, экспрессирующие CXCR5, могут использоваться для детектирования связывания с ним антитела с помощью той или иной известной методики, или же рекомбинантно экспрессированный CXCR5 или его часть, например домен EC, могут закреплять на твердой фазе и использовать как элемент захвата при анализе, построенном в зависимости от поставленной цели.
Чтобы определить, связывается ли тот или иной конкретный гомолог антитела с человеческим CXCR5, можно использовать любой стандартный метод анализа связывания. К удобным методам анализа связывания CXCR5 относятся анализ FACS, анализ ELISA, радиоиммунологические методы анализа и им подобные, которые детектируют связывание антитела с CXCR5 человека и возникающие в результате функции. Для таких анализов удобны рассмотренные в настоящем описании, имеющие полную длину и растворимые формы человеческого CXCR5. Связывание антитела или гомолога с CXCR5, или с его растворимыми фрагментами, можно легко регистрировать за счет использования второго антитела, специфического к иммуноглобулинам вида, от которого получены антитело или гомолог.
Чтобы установить, блокирует ли в заметной степени то или иное антитело или гомолог связывание CXCL13 или другого лиганда с человеческим CXCR5, можно воспользоваться любым удобным методом конкурентного анализа. К пригодным методам анализа, например, относятся методы ELISA, методы FACS, радиоиммунологические методы анализа и им подобные, которые позволяют количественно определить способность антитела или гомолога конкурировать с CXCL13 или другим лигандом за связывание с человеческим CXCR5. Предпочтительно, оценивается способность лиганда блокировать связывание меченного человеческого CXCR5 с иммобилизированным антителом или гомологом.
Способность антитела или гомолога связываться с человеческим CXCR5 можно оценить проверкой его способности связываться с человеческими клетками CXCR5+. Пригодными клетками CXCR5+ для использования при определении того, может ли то или иное конкретное антитело или гомолог связываться с человеческим CXCR5, являются клетки культур тканей млекопитающих, трансформированные с помощью ДНК, которая кодирует человеческий CXCR5 полной длины, и экспрессирует CXCR5 на поверхности клеток или в линиях В-клеток.
Связывание антитела или гомолога с клеткой CXCR5+ может регистрироваться посредством окрашивания клеток флуоресцентно-меченным вторым антителом, специфическим к иммуноглобулинам того же вида, от которого получен анализируемый гомолог антитела. Клеточный сортер с активацией флуоресценции («FACS») может использоваться для регистрации и количественного описания любого связывания, см., в общем случае, Shapiro, Practical Flow Cytometry, Alan R. Liss, Inc., New York, N.Y. (1985).
Кроме того, способность гомолога антитела блокировать связывание лиганда, например, CXCL13, с человеческим CXCR5 может определяться посредством преинкубирования избытка лиганда с клетками CXCR5+ и количественной регистрации степени блокирования связывания антитела или гомолога с клетками за счет присутствия связанного лиганда. Связывание гомолога антитела с клетками CXCR5+ может регистрироваться посредством FACS, с использованием флуоресцентно-меченного второго антитела, специфического к иммуноглобулинам того же вида, от которого получен анализируемый гомолог антитела. В альтернативном варианте возможна постановка конкурентного анализа, известного специалистам в области, с помощью меченого лиганда или антитела.
Лиганд, например, CXCL13, который использовался в описанных выше процедурах анализа, может продуцироваться клетками, трансформированными геном для синтеза лиганда, или же может применяться выделенный CXCL13, получаемый с применением изложенных в настоящем документе практических методов, или же может приобретаться серийно выпускаемый лиганд.
Чтобы определить, не приводит ли то или иное конкретное антитело или гомолог к заметному снижению количества циркулирующих клеток CXCR5+ in vivo, определялось количество циркулирующих клеток CXCR5+, взятых у млекопитающего в течение 24 часов после введения антитела или гомолога млекопитающему с нормальной иммунной функцией, и эта величина сопоставлялась с количеством до введения или количеством у контрольного млекопитающего, которому вводили антитело или гомолог соответствующего изотипа без определенной специфичности вместо антитела или гомолога по настоящему изобретению. Количественное определение клеток CXCR5+ у животных, получивших дозу антитела CXCR5 или его функциональной части, или его производного, может проводиться, например, посредством окрашивания полученных клеток флуоресцентно-меченными антителами, которые связывают антитела к CXCR5, а также меченными антителами, специфическими к Т-клеткам и В-клеткам, с последующим анализом FACS.
Антитела по настоящему изобретению могут описываться или характеризоваться с точки зрения эпитопа (эпитопов) или части (частей) CXCR5, которые антитело распознает или с которыми оно специфически связывается. Эпитоп (эпитопы) или часть (части) полипептидов, как описано в настоящем документе, могут характеризоваться, например, по N-терминальным и C-терминальным положениям, по длине непрерывной цепи аминокислотных остатков, конформационным эпитопам и пр.
Антитела по настоящему изобретению могут также описываться или характеризоваться по перекрестной реакционной способности. В объем настоящего изобретения также включаются антитела, которые связывают полипептиды CXCR5, характеризующиеся по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55% и по меньшей мере 50% идентичностью (которая рассчитывается с помощью методов, известных специалистам в области и описанных в настоящем документе) к CXCR5.
Антитела по настоящему изобретению могут также описываться или характеризоваться по аффинности связывания с рассматриваемым CXCR5. Антитела к CXCR5 могут связываться с KD менее примерно10-7 M, менее примерно 10-6 M или менее примерно 10-5 M. Более высокая аффинность связывания рассматриваемого антитела может быть более желательна, например, с равновесной константой диссоциации или KD от примерно 10-8 до примерно 10-15 M, от примерно 10-8 до примерно 10-12 M, от примерно 10-9 до примерно 10-11 M или от примерно 10-8 до примерно 10-10 M. В настоящем изобретении также предлагаются антитела, которые конкурентно ингибируют связывание антитела с эпитопом по настоящему изобретению, что определяется любым методом, известным специалистам в области, для регистрации конкурентного связывания, например, описанными в настоящем документе методами иммунологического анализа. В предпочтительных примерах осуществления антитело конкурентно ингибирует связывание с эпитопом по меньшей мере на 95%, по меньшей мере на 90%, по меньшей мере на 85%, по меньшей мере на 80%, по меньшей мере на 75%, по меньшей мере на 70%, по меньшей мере на 60% или по меньшей мере на 50%.
В объем настоящего изобретения также включаются конъюгаты, содержащие рассматриваемое антитело. Конъюгаты состоят из двух основных компонентов: рассматриваемого антитела и второго компонента, которым может быть связывающий клетки агент, цитотоксический агент и пр.
Используемый в настоящем документе термин «связывающий клетки агент» относится к веществу, которое специфически распознает и связывает молекулу на поверхности клетки. Так, в качестве связывающего клетки агента может выступать антиген CD, патогенный антиген, например вирусный антиген, дифференцирующий антиген, раковый антиген, клеточноспецифичный антиген, тканеспецифичный антиген, Ig или подобная Ig молекула и пр.
В одном из примеров осуществления связывающий клетки агент специфически распознает CXCL13 или комплекс CXCR5 с его лигандом, например с CXCL13. Конъюгат может находиться в контакте с клеткой-мишенью в течение продолжительного периода времени, с тем, чтобы дать возможность эффекторной функции конъюгата оказать воздействие на клетку и/или обеспечить достаточное время, в течение которого произойдет интернализация конъюгата клеткой.
Связывающие клетки агенты могут быть любого типа, который известен в настоящее время или станет известным в будущем, к ним относятся пептиды, непептидные соединения, сахариды, нуклеиновые кислоты, лиганды, рецепторы и пр. или их комбинации. Связывающим клетки агентом может быть любое соединение, которое связывает клетку как специфическим, так и неспецифическим образом. Как правило, в качестве агента может выступать антитело (в частности моноклональное антитело), лимфокины, гормоны, факторы роста, витамины, молекулы-переносчики питательных веществ (например, трансферрин) или любая другая связывающая клетку молекула или вещество.
К другим примерам связывающих клетку агентов, которые могут использоваться в настоящем изобретении, относятся: поликлональные антитела, моноклональные антитела и фрагменты антител, например, Fab, Fab', F(ab')2 и Fv (Parham, J. Immunol. 131:2895-2902 (1983); Spring et al., J. Immunol. 113:470-478 (1974); и Nisonoff et al., Arch. Biochem. Biophys. 89: 230-244 (1960)).
Вторым компонентом также может быть цитотоксический агент. Используемый в настоящем документе термин «цитотоксический агент» относится к веществу, которое подавляет или блокирует функционирование или рост клеток и/или вызывает деструкцию клеток. Так, в качестве цитотоксического агента может выступать таксол, майтансиноид, например DM1 или DM4, CC-1065 или CC-1065 аналог, рицин, митомицин C и пр. В некоторых примерах осуществления цитотоксический агент, подобно любому связывающему агенту конъюгата по настоящему изобретению, ковалентно связан с рассматриваемым антителом напрямую или через расщепляемый или нерасщепляемый линкер.
Примерами подходящих майтансиноидов являются майтансинол и аналоги майтансинола. Майтансиноиды подавляют образование микроканальцев и в высшей степени токсичны для клеток млекопитающих.
К примерам подходящих аналогов майтансинола относятся аналоги, имеющие модифицированное ароматическое кольцо, а также аналоги с модификациями в других положениях. Такие пригодные для использования майтансиноиды предлагаются в патентах США №№ 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 6333410; 5475092; 5585499 и 5846545.
Примеры подходящих аналогов майтансинола с модифицированным ароматическим кольцом включают: (1) C-19-дехлор (патент США № 4256746) (получаемый, например, LAH-восстановлением ансамитоцина P2); (2) C-20-гидрокси (или C-20-деметил) +/- C-19-дехлор (патенты США № 4361650 и 4,307,016) (получаемый, например, деметилированием с использованием стрептомицетов или актиномицетов или дехлорированием с применением литийалюминийгидрида (LAH)); и (3) C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (получаемый ацилированием под действием ацилхлоридов).
Примеры подходящих аналогов майтансинола с модификациями в других положениях включают: (1) C-9-SH (патент США № 4424219) (получаемый реакцией майтансинола с H2S или P2S5); (2) C-14-алкоксиметил (деметокси/CH2OR) (патент США № 4,331,598); (3) C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (патент США № 4450254) (получаемый из нокардий); (4) C-15-гидрокси/ацилокси (патент США № 4364866) (получаемый конверсией майтансинола стрептомицетами); (5) C-15-метокси (патенты США № 4313946 и 4315929) (выделяемый из Trewia nudiflora); (6) C-18-N-деметил (патенты США № 4362663 и 4322348) (получаемый деметилированием майтансинола стрептомицетами); и (7) 4,5-деокси (патент США № 4371533) (получаемый восстановлением майтансинола под действием треххлористого титана/LAH).
Цитотоксические конъюгаты могут быть получены методами in vitro. Для связывания цитотоксического агента, лекарства или пролекарства с антителом, как правило, используется линкерная группа. Подходящие линкерные группы известны специалистам в области, к ним относятся дисульфидные группы, тиоэфирные группы, кислотонеустойчивые группы, фотолабильные группы, группы, неустойчивые к воздействию пептидазы, а также группы, неустойчивые к воздействию эстеразы. Например, конъюгаты могут конструироваться с помощью реакции дисульфидного обмена или за счет образования тиоэфирной связи между рассматриваемым антителом и лекарством или пролекарством.
Как обсуждалось выше, в настоящем изобретении предлагаются последовательности выделенных нуклеиновых кислот, кодирующих описанные в настоящем документе антитело или его функциональный вариант, конструкции векторов, включающие нуклеотидную последовательность, кодирующую связывающие CXCR5 полипептиды по настоящему изобретению, клетки-реципиенты, несущие такой вектор, а также рекомбинантные методики продукции такого полипептида.
Вектор, как правило, состоит из компонентов, известных специалистам в области, и обычно, среди прочих, включает один или несколько перечисленных ниже элементов: сигнальная последовательность, точка начала репликации, один или несколько маркеров или генов селекции, последовательности, способствующие и/или стимулирующие трансляцию, энхансер и пр. Таким образом, векторы экспрессии содержат нуклеотидную последовательность, которая функционально связана с такими подходящими транскрипционными или трансляционными регуляторными нуклеотидными последовательностями как, например, производными от генов млекопитающих, микробов, вирусов или насекомых. К примерам дополнительных регуляторных последовательностей относятся операторы, рибосомальные сайты связывания мРНК и/или другие соответствующие последовательности, которые контролируют транскрипцию и трансляцию, например их инициирование и прекращение. Нуклеотидные последовательности являются «функционально связанными», если регуляторная последовательность имеет функциональное отношение к нуклеотидной последовательности соответствующего полипептида. Так, нуклеотидная последовательность промотора функционально связана, например, с последовательностью тяжелой цепи антитела, если нуклеотидная последовательность промотора контролирует транскрипцию такой нуклеотидной последовательности.
Кроме того, в векторы экспрессии можно встраивать последовательности, кодирующие соответствующие сигнальные пептиды, которые обычно не являются природным образом связанными с последовательностями тяжелой и/или легкой цепей антитела. Например, нуклеотидная последовательность сигнального пептида (секреторный лидер) может быть слита внутри рамки с полипептидной последовательностью, так чтобы антитело секретировалось в периплазматическое пространство или в среду. Сигнальный пептид, который действует в предполагаемых клетках-реципиентах, усиливает внеклеточную секрецию соответствующего антитела или его части. Сигнальный пептид может отщепляться от полипептида при выделении антитела из клетки. Примеры таких секреторных сигналов хорошо известны и включают, например, описанные в патентах США № 5698435; 5698417 и 6204023.
В качестве вектора может выступать плазмида, одноцепочечный или двухцепочечный вирусный вектор, фаговый вектор одноцепочечной или двухцепочечной РНК или ДНК, фагмид, космида или любой другой носитель представляющего интерес трансгена. Такие векторы могут вводиться в клетки как полинуклеотиды, с использованием хорошо известных методик введения ДНК и РНК в клетки. Векторы, в случае фаговых или вирусных векторов, также могут вводиться в клетки в форме вируса в оболочке или в капсуле с использованием хорошо известных методик инфекции и трансдукции. Вирусные векторы могут быть компетентными или дефективными по отношению к репликации. В последнем случае размножение вируса будет, как правило, проходить только в комплементарных клетках-реципиентах и с использованием множественных векторов, несущих различные вирусные компоненты, необходимые для продукции частиц. Бесклеточные системы трансляции могут также применяться для продукции белка с использованием РНК, полученных из существующих конструкций ДНК (см., например, WO 86/05807 и WO 89/01036; и патент США № 5122464).
Экспрессия антител по настоящему изобретению может осуществляться в любой подходящей клетке-хозяине. К примерам клеток-реципиентов, пригодных для использования в настоящем изобретении, относятся прокариотические, дрожжевые или высшие эукариотические клетки, и сюда, среди прочих, входят микроорганизмы, например бактерии (в частности E. coli, B. subtilis, энтеробактер, эрвинии, клебсиеллы, протеус, сальмонеллы, серратии и шигеллы, а также палочковидные бактерии, псевдомонады и стрептомицеты), трансформированные с помощью векторов экспрессии рекомбинантной ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащих кодирующие последовательности рассматриваемого антитела; дрожжи (например, сахаромицеты, пичиа, актиномицеты, клюверомицеты, шизосахаромицеты, кандиды, триходерма, нейроспора и гифомицеты, такие как нейроспора, пеницилл, толипокладиум и аспергиллы), трансформированные с помощью рекомбинантных векторов экспрессии дрожжей, содержащих кодирующие антитела последовательности; клеточные системы насекомых, инфицированные рекомбинантными векторами экспрессии вируса (например, бакуловируса), содержащими последовательности, кодирующие антитела; растительные клеточные системы, инфицированные рекомбинантными векторами экспрессии вируса (например, вирус мозаики цветной капусты, CaMV; или вирус табачной мозаики, TMV) или трансформированные векторами экспрессии рекомбинантной плазмиды (например, плазмиды Ti), содержащими кодирующие последовательности антитела; или же клеточные системы млекопитающих (например, клетки COS, CHO, BHK, 293 или 3T3), несущие рекомбинантные конструкции экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовируса или 7.5K промотор вируса осповакцины).
Векторы экспрессии для использования в прокариотических клетках-реципиентах обычно включают один или несколько фенотипических селектируемых маркерных генов. Фенотипический селектируемый маркерный ген, например, представляет собой ген, кодирующий белок, который обеспечивает устойчивость по отношению к антибиотикам или удовлетворяет аутотрофным требованиям. К примерам пригодных для использования векторов экспрессии для прокариотических клеток-реципиентов относятся векторы, полученные на основе коммерчески доступных плазмид, например, серии векторов pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden), pGEM1 (Promega Biotec, Madison, WI), pET (Novagen, Madison, WI) и pRSET (Invitrogen, Carlsbad, CA) (Studier, J Mol Biol 219:37 (1991); и Schoepfer, Gene 124:83 (1993)). К промоторным последовательностям, которые обычно используются для рекомбинантных векторов экспрессии прокариотических клеток-реципиентов, относятся T7, (Rosenberg et al., Gene 56:125 (1987)), β-лактамаза (пенициллиназа), промоторная система лактозы (Chang et al., Nature 275:615 (1978); и Goeddel et al., Nature 281:544 (1979)), промоторная система триптофана (Trp) (Goeddel et al., Nucl Acids Res 8:4057 (1980)), и tac-промотор (Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory (1990)).
В дрожжевых векторах часто присутствуют последовательность точки начала репликации, например, от плазмиды дрожжей 2μ, автономно реплицирующаяся последовательность (ARS), область промотора, последовательности полиаденилирования, последовательности прекращения транскрипции и ген селектируемого маркера. К подходящим промоторным последовательностям для векторов дрожжей, среди прочих, относятся промоторы металлотионеина, 3-фосфоглицераткиназы (Hitzeman et al., J Biol Chem 255:2073 (1980)) или другие гликолитические ферменты (Holland et al., Biochem 17:4900 (1978)), например енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа. Другие пригодные векторы и промоторы для использования в экспрессии дрожжей подробно описаны в работе Fleer et al., Gene 107:285 (1991). Другие пригодные промоторы и векторы для дрожжей и протоколов трансформации дрожжей хорошо известны специалистам в области. Протоколы трансформации дрожжей также хорошо известны. Один из таких протоколов описан в Hinnen et al., Proc Natl Acad Sci 75:1929 (1978), где производится отбор трансформантов Trp+ в селективной среде.
Применима любая клеточная культура эукариотов, как из культуры позвоночных, так и беспозвоночных. К примерам клеток беспозвоночных относятся клетки растений и насекомых (Luckow et al., Bio/Technology 6:47 (1988); Miller et al., Genetic Engineering, Setlow et al., eds., vol. 8, pp. 277-9, Plenum Publishing (1986); и Maeda et al., Nature 315:592 (1985)). Например, для продукции гетерологичных белков могут использоваться бакуловирусные системы. В системе насекомых вирус ядерного полиэдроза Autographa californica (AcNPV) может использоваться в качестве вектора для экспрессии чужеродных генов. Вирус растет в клетках Spodoptera frugiperda. Кодирующая последовательность антитела может клонироваться под контролем промотора AcNPV (например, промотора полиэдрина). К другим установленным реципиентам относятся Aedes, Drosophila melanogaster и Bombyx mori. Широкодоступны разнообразные вирусные штаммы для трансфекции, например вариант L-1 AcNPV и штамм Bm-5 Bombyx mori NPV. Кроме того, как известно специалистам в области, клеточные культуры растений, например хлопка, кукурузы, картофеля, соевых бобов, петунии, помидоров и табака, также могут использоваться в качестве реципиентов.
Использование клеток позвоночных и размножение клеток позвоночных в клеточной культуре (культуре тканей) может представлять собой стандартную процедуру, хотя в реальности и существуют прихотливые линии клеток, которые требуют, например, специализированной среды с уникальными факторами, питающими клетками и пр., см. Tissue Culture, Kruse et al., eds., Academic Press (1973). Примеры пригодных для использования линий клеток-реципиентов млекопитающих включают клетки почек обезьяны; клетки мезонефроса человека; клетки почек новорожденного хомячка; клетки яичников китайского хомячка/-DHFR (CHO, Urlaub et al., Proc Natl Acad Sci USA 77:4216 (1980)); мышиные клетки Сертоли; клетки карциномы шейки матки человека (например, HeLa); клетки почек собаки; клетки легкого человека; клетки печени человека; клетки опухоли молочной железы мышей и клетки NS0.
Клетки-реципиенты трансформируют с помощью векторов для продукции антител и культивируют в стандартной питательной среде, содержащей факторы роста, витамины, минеральные вещества и пр., а также индукторы, подходящие для используемых клеток и векторов. Широко применяемые последовательности промотора и последовательности энхансера получают из вируса полиомы, аденовируса 2, вируса обезьян 40 (SV40) и цитомегаловируса человека (CMV). Последовательности ДНК, полученные из вирусного генома SV40, могут использоваться для подготовки других генетических элементов для экспрессии структурной генетической последовательности в клетках-реципиентах млекопитающих, например последовательности, полученные из SV40, ранних и поздних промоторов, энхансера, сайтов сплайсинга и полиаденилирования. Вирусные ранние и поздние промоторы в особенности удобны, поскольку и тот, и другой достаточно просто получить из вирусного генома в виде фрагмента, который также может содержать вирусную точку начала репликации. В продаже имеются коммерчески доступные стандартные векторы экспрессии для использования в клетках-реципиентах млекопитающих.
Для культивирования клеток-реципиентов пригодны коммерчески доступные среды, например среда Хэма F10, минимальная поддерживающая среда (MEM), RPMI-1640 и модифицированная среда Дульбекко-Игла (DMEM). Кроме того, любая среда из описанных в Ham et al., Meth Enzymol 58:44 (1979) и Barnes et al., Anal Biochem 102:255 (1980), и в патентах США №№ 4767704; 4657866; 4560655; 5122469; 5712163 или 6048728, может использоваться в качестве культуральной среды для клеток-реципиентов. Любая из этих сред может при необходимости быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (например, хлоридами, в частности, хлоридами натрия, кальция или магния; и фосфатами), буферами (например, HEPES), нуклеотидами (например, аденозин и тимидин), антибиотиками, микроэлементами (которые определяются как неорганические соединения, обычно присутствующие в конечных концентрациях, лежащие в микромолярном диапазоне), а также глюкозой или эквивалентным ей источником энергии. В зависимости от поставленной цели могут включаться и любые другие необходимые добавки в соответствующих концентрациях. Условия культивирования, например температура, рН и пр., как известно специалистам в области, подходят для клеток и обеспечивают желаемую экспрессию трансгена.
С помощью любого метода, известного специалистам в области, можно получить представляющие интерес полинуклеотиды и определить нуклеотидную последовательность таких полинуклеотидов. Например, если известна нуклеотидная последовательность антитела, полинуклеотид, кодирующий антитело, может быть составлен из химически синтезированных олигонуклеотидов (например, как это описано в Kutmeier et al., Bio/Techniques 17:242 (1994)), а затем связанные с лигандами полинуклеотиды амплифицируют, например, с помощью ПЦР.
В качестве альтернативы можно создать полинуклеотид, кодирующий антитело, из нуклеиновой кислоты, которую экспрессирует та или иная клетка. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, недоступен, но последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин, можно получить из подходящего источника, например библиотеки, которая может быть специфичной для продуцирующих антитело клеток, например клеток гибридомы, отобранных для экспрессии антитела по настоящему изобретению. Для ПЦР-амплификации могут быть подготовлены подходящие праймеры. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, могут затем клонироваться в реплицируемые векторы клонирования с помощью любого метода, известного специалистам в области.
После того как нуклеотидная последовательность и соответствующая последовательность антитела установлены, возможны манипуляции с нуклеотидной последовательностью антитела, с тем чтобы получить представляющие интерес эквиваленты, описанные в настоящем изобретении, с использованием методов манипуляции нуклеотидными последовательностями, которые известны специалистам в области, например, методики рекомбинантной ДНК, сайт-направленный мутагенез, ПЦР и пр. (см., например, Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory (1990); и Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1998), с тем, чтобы получить антитела, содержащие различные аминокислотные последовательности, например, для проведения замещений, делеций и/или вставок аминокислот.
Аминокислотная последовательность тяжелой и/или легкой цепей вариабельного домена может анализироваться на предмет идентификации последовательностей CDR с помощью хорошо известных методов, например, сопоставлением с известными аминокислотными последовательностями других тяжелых и легких цепей вариабельных областей, с тем, чтобы определить области гипервариабельности последовательности. Применяя стандартные методики рекомбинантной ДНК, можно ввести одну или несколько CDR в каркасные участки, например в каркасные участки белка человека, с тем, чтобы гуманизировать нечеловеческое антитело, как описано выше. Представляющий интерес полинуклеотид, полученный за счет комбинации каркасных участков и одной или нескольких CDR, кодирует антитело, которое специфически связывает CXCR5 или по меньшей мере его ED домен. Такие методы, например, могут использоваться для проведения замен или делеций аминокислот для одного или нескольких цистеиновых остатков вариабельной области, которые участвуют в образовании внутрицепочечной дисульфидной связи, с тем, чтобы получить молекулу антитела без одной или нескольких внутрицепочечных дисульфидных связей.
Антитела или фрагменты антитела по настоящему изобретению могут быть использованы для обнаружения CXCR5, а значит, и клеток, экспрессирующих CXCR5, в биологическом образце как in vitro, так и in vivo. В одном из примеров осуществления антитело к CXCR5 по настоящему изобретению используется, для того чтобы установить присутствие и уровень CXCR5 в тканях или в клетках, выделенных из ткани. Уровни CXCR5 в ткани или образце биопсии можно определять, например, посредством иммуноанализа для антител или фрагментов антител по настоящему изобретению. Ткань или проба ее биопсии могут замораживаться или фиксироваться. Такие же или другие методы могут использоваться, чтобы установить другие свойства CXCR5, например его уровень, клеточную локализацию, уровни мРНК, их мутации и пр.
Описанный выше способ, например, может использоваться для диагностики рака у пациента, у которого подтвержден или подозревается рак, при этом уровень CXCR5, регистрируемый у указанного пациента, сопоставляется с нормальным уровнем здорового пациента или со стандартом. Рассматриваемый анализ также может использоваться для диагностики артрита или других аутоиммунных заболеваний, для которых характерна инфильтрация и концентрация В-клеток наряду с развитием дифференцированной лимфоидной ткани.
В настоящем изобретении также предлагаются моноклональные антитела, гуманизированные антитела и их фрагменты, связывающие эпитопы, в которые вводится метка для последующего использования в исследовательских или диагностических приложениях. В некоторых примерах осуществления метка является радиоактивной, также в качестве метки используется флуорофор, хромофор, контрастный агент или ион металла.
Предлагается также способ диагностики, в котором указанные меченные антитела или их связывающие эпитоп фрагменты вводятся пациенту, у которого подозревается рак, артрит, аутоиммунное заболевание или другие связанные с CXCR5 болезни, и измеряется или отслеживается распределение метки в организме пациента.
Антитела или их фрагменты, предлагаемые в настоящем изобретении, могут использоваться в качестве агентов для аффинной очистки. В этом процессе антитела иммобилизуют на твердой фазе, например смоле с декстраном или агарозой, или на фильтровальной бумаге, с помощью методов, известных специалистам в области. Иммобилизованное антитело обрабатывается образцом, содержащим CXCR5 или несущие его клетки, которые подвергаются очистке, после чего подложку промывают подходящим растворителем, который удалит практически весь материал из образца, кроме CXCR5 или клеток, которые подвергаются очистке, поскольку они связаны с иммобилизированным антителом, которое представляет интерес для по настоящему изобретению. Наконец, подложку промывают другим подходящим растворителем, таким как глициновый буфер, рН 5,0, который обеспечивает высвобождение CXCR5 или клеток от связи с рассматриваемым антителом.
Для диагностических приложений рассматриваемое антитело, как правило, будет помечаться контрастным веществом. Существует множество различных меток, которые, в целом, можно сгруппировать в следующие категории: (a) радиоизотопы, например 36S, 14C, 125I, 3H и 131I (антитело может помечаться радиоизотопом на основе методик, например методик, описанных в работе Current Protocols in Immunology, vol. 12, Coligen et al., ed., Wiley-Interscience, New York (1991), и радиоактивность может измеряться на основе сцинтилляционного счета); (б) флуоресцентные метки, например хелаты редкоземельных металлов (хелаты европия), флуоресцеин и его производные, родамин и его производные, дансил, лиссамин, фикоэритрин и техасский красный, флуоресцентные метки могут конъюгироваться с антителом с помощью методики, изложенной, например, в Current Protocols in Immunology, как упоминалось выше, причем флуоресценция может количественно определяться с помощью флуориметра; и (в) доступны также метки в виде субстратов различных ферментов (патент США № 4275149 содержит обзор), причем фермент, как правило, катализирует химическую трансформацию хромогенного субстрата, что может определяться с помощью различных методик, например, фермент может катализировать изменение цвета субстрата, что может регистрироваться спектрофотометрически, или же фермент может воздействовать на флуоресценцию или хемилюминесценцию субстрата. Хорошо известны методы количественного определения изменения флуоресценции, например, с помощью люминометра, или же регистрации передачи энергии от метки флуоресцентному акцептору. К примерам ферментативных меток относятся люциферазы (например люцифераза светлячка и бактериальная люцифераза; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, например, пероксидаза, такая как пероксидаза из хрена (HRPO), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы (например глюкозоксидаза, галактозоксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклические оксидазы (например уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза и пр. Методики конъюгирования ферментов с антителами описаны в O'Sullivan et al., Meth Enz, ed. Langone & Van Vunakis, Academic Press, New York, 73 (1981).
На случай использования таких меток существуют подходящие субстраты, например: (i) для пероксидазы из хрена с перекисью водорода в качестве субстрата, причем перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (TMB)); (ii) для щелочной фосфатазы (AP) в качестве хромогенного субстрата выступает п-нитрофенилфосфат; и (iii) для β-D-галактозидазы (β-D-Gal) используется хромогенный субстрат (например, п-нитрофенил-β-D-галактоза) или флуорогенный субстрат, например 4-метилумбеллиферил-β-D-галактозидаза.
Квалифицированным специалистам в области доступны и другие сочетания фермент-субстратов. Общий обзор см. в патентах США № 4275149 и 4318980.
В некоторых случаях метка непрямым образом конъюгируется с антителом. Например, антитело может конъюгироваться с биотином, и любой из указанных выше репортеров может конъюгироваться в авидином или наоборот. Биотин селективно связывается с авидином, и в этих условиях метка может непрямо конъюгироваться с антителом. В альтернативном варианте для получения непрямой конъюгации метки антитело связывается с небольшим гаптеном (например, дигоксином), и один из различных видов меток или репортеров, указанных выше, конъюгируется с антителом анти-дигоксина. Таким образом, используя второе антитело, можно провести непрямую конъюгацию метки с антителом или мутеином.
В другом примере осуществления изобретения в антитело необязательно вводится метка и его наличие может регистрироваться с помощью другой формы второго антитела - меченого антитела, которое связывается с рассматриваемым антителом.
Антитела по настоящему изобретению могут использоваться в любом известном методе анализа, например анализе конкурентного связывания, прямых и непрямых сэндвичевых анализах и анализах иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques (CRC Press, Inc. 1987).
Анализ конкурентного связывания опирается на способность меченного стандарта конкурировать с испытываемым образцом в процессе связывания с ограниченным количеством антитела. Количество антигена в испытываемом образце обратно пропорционально количеству стандарта, который связывается с антителами. Чтобы упростить определение количества стандарта, который оказывается связанным, антитела, как правило, до или после конкурентного взаимодействия переводят в нерастворимую форму. В результате стандартный и испытываемый образцы, которые связаны с антителами, могут без труда отделяться от стандарта и испытываемого образца, которые остаются несвязанными.
Сэндвичевый анализ предполагает использование двух антител, каждое из которых в состоянии связываться с различными иммуногенными частями, детерминантами или эпитопами, мишени, которая детектируется. В сэндвичевом методе испытываемый образец, связывается с первым антителом, прямо или косвенно иммобилизированным на твердой подложке, после чего второе антитело, помеченное прямым или непрямым образом, связывается с зафиксированным испытываемым образцом, тем самым образуя нерастворимый трехчастный комплекс, см., например, патент США № 4376110. Второе антитело может быть само по себе помечено регистрируемой меткой (прямой сэндвичевый метод) или может детектироваться с использованием антииммуноглобулинового антитела или другого подходящего компонента связанной пары (например, антитело/антиген, рецептор/лиганд, фермент/субстрат), который помечен детектируемой меткой (непрямой сэндвичевый метод). Например, одним из видов сэндвичевого анализа является метод ELISA, в этом случае в качестве детектируемой метки выступает фермент.
Для целей иммуногистохимии образец клеток или тканей может быть свежеизготовленным или замороженным, или же может быть внесен в парафин и фиксирован консервантом, например, формалином.
Антитела могут также использоваться в методах диагностики in vivo. Как правило, в мутант антитела вводится радионуклидная метка (например, 111In, 99Tc, 14C, 131I, 3H, 32P или 35S), с тем, чтобы сайты, экспрессирующие CXCR5, можно было бы локализовать с использованием иммуносцинтиграфии.
В объем настоящего изобретения также входят наборы, например, включающие антитела, их фрагменты, гомологи, их производные и пр., такие как меченные или цитотоксические конъюгаты, а также инструкции по применению антитела, конъюгата для уничтожения определенных видов клеток и пр. В инструкциях могут содержаться указания по использованию антитела, конъюгата и пр. in vitro, in vivo или ex vivo. Антитело может находиться в жидкой или твердой форме, как правило, лиофилизованной. Набор может содержать другие пригодные реагенты, например буфер, восстанавливающий раствор и другие необходимые ингредиенты для предполагаемого использования. Предполагается, что набор будет представлять собой упакованную комбинацию реагентов в заранее установленных количествах с инструкциями по их применению, например, в лечебных целях для проведения диагностических анализов. Если в антитело вводится метка, например фермента, набор может включать субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает образование регистрируемого хромофора или флуорофора). Кроме того, в набор могут включаться другие добавки, например стабилизаторы, буферы (например, блок-буфер или лизисный буфер) и пр. Относительные количества различных реагентов можно менять, с тем, чтобы в наборе присутствовали концентраты растворов реагентов, что обеспечивает пользователю гибкость, экономию места, реагентов и пр. Реагенты могут поставляться в виде сухих порошков, обычно лиофилизованных, вместе с наполнителями, которые после растворения образуют раствор реагента в надлежащей концентрации.
Антитела по настоящему изобретению могут быть использованы для лечения млекопитающих. В одном из примеров осуществления антитело или его эквивалент, представляющие интерес, вводятся млекопитающему, кроме человека, например, с целью получить доклинические данные. К примерам млекопитающих, кроме человека, которые могут получать препарат, относятся нечеловекообразные приматы, собаки, кошки, грызуны и другие млекопитающие, на которых проводятся доклинические исследования. Такими млекопитающими могут быть апробированные модели животных для той или иной болезни, которую предполагается лечить с помощью антитела, или же они могут использоваться для изучения токсичности рассматриваемого антитела. В каждом из таких примеров осуществления для млекопитающего могут проводиться исследования нарастающей дозы.
В качестве лекарственного препарата может использоваться антитело в присутствии или в отсутствие второго компонента, например терапевтической функции, конъюгированной с ним, вводится без добавок или в сочетании с цитотоксическим фактором (факторами). Настоящее изобретение посвящено терапии антителами, которая предполагает введение антител по настоящему изобретению животному, млекопитающему или человеку для лечения опосредованных CXCR5 болезней, нарушений или патологических состояний. Животным или пациентом может быть млекопитающее, нуждающееся в конкретном лечении, такое как млекопитающее с поставленным диагнозом конкретного нарушения, например, вызванного CXCR5. Антитела, направленные против CXCR5, пригодны для использования, например, для профилактики или лечения артрита, воспалительных заболеваний в целом, отторжения трансплантата, рака и аутоиммунных расстройств. Например, посредством введения терапевтически приемлемой дозы антитела к CXCR5 по настоящему изобретению или смеси различных антител по настоящему изобретению, или их эквивалентов, или в сочетании с другими антителами из различных источников, у получающего лечение млекопитающего, в особенности, человека, можно смягчить симптомы заболевания или предотвратить их проявление.
Лечебные препараты по настоящему изобретению включают, среди прочих, антитела по настоящему изобретению (в том числе их фрагменты, аналоги, эквиваленты и производные, как описано в настоящем документе), и нуклеиновые кислоты, кодирующие антитела по настоящему изобретению, которые описаны в настоящем документе (в том числе их фрагменты, аналоги и производные), а также антиидиотипические антитела, которые описаны в настоящем документе. Антитела по настоящему изобретению могут использоваться для лечения, подавления или профилактики заболеваний, нарушений или патологических состояний, связанных с аберрантной экспрессией и/или активностью CXCR5, в том числе, среди прочих, какого-либо одного или нескольких заболеваний, нарушений или патологических состояний, которые описаны в настоящем документе. Лечение и/или профилактика заболеваний, нарушений или патологических состояний, связанных с аберрантной экспрессией и/или активностью CXCR5, включает, среди прочих, смягчение по меньшей мере одного симптома таких заболеваний, нарушений или патологических состояний. Антитела по настоящему изобретению могут поставляться в форме фармацевтически приемлемых составов, которые известны специалистам в области или описаны в настоящем документе. Термин «физиологически приемлемый», «фармацевтически приемлемый» и пр. означает утвержденный распорядительным органом федерального правительства или правительства штата или внесенный в Фармакопею США или другую общепринятую фармакопею для использования на животных и, в особенности, на человеке.
Антитело к CXCR5 может вводиться млекопитающему любым приемлемым способом. К методам введения, среди прочих, относятся парентеральный, подкожный, внутрибрюшинный, внутрилегочный, интраназальный, эпидуральный, ингаляция и оральные пути, а также, если это желательно в случае иммунодепрессивного лечения, предусматривается введение внутрь пораженного участка. Парентеральные вливания включают внутримышечное, внутрикожное, внутривенное, внутриартериальное или внутрибрюшинное введение. Антитела или составы могут вводиться любым подходящим способом, например вливанием или болюсной инъекцией, абсорбцией через эпителиальные или кожно-слизистые оболочки (например, слизистая ротовой полости, слизистая прямой кишки и кишечника и пр.) и могут вводиться совместно с другими биологически-активными агентами. Введение может быть системным или локальным. Кроме того, может быть желательно вводить терапевтические антитела или составы по настоящему изобретению в центральную нервную системы любым удобным методом, в том числе посредством интравентрикулярной инъекции и инъекции в полость позвоночного канала; причем интравентрикулярной инъекции может способствовать интравентрикулярный катетер, например, соединенный с резервуаром, например с резервуаром Оммайа. Кроме того, антитело удобно вводить импульсными вливаниями, особенно в случае понижающихся доз антитела. Предпочтительно, дозировка производится инъекцией, предпочтительно посредством внутривенных или подкожных инъекций, частично в зависимости от того, носит ли введение кратковременный или продолжительный характер.
Известны другие различные системы доставки, и они могут использоваться для введения антитела по настоящему изобретению, например инкапсуляция в липосомы, микрочастицы, микрокапсулы (см. Langer, Science 249:1527 (1990); Treat et al., в Liposomes in the Therapy of Infectious Disease and Cancer; Lopez-Berestein et al., eds., p. 353-365 (1989); и Lopez-Berestein, там же, p. 317-327), а также рекомбинантные клетки, способные экспрессировать соединения, опосредованный рецепторами эндоцитоз (см., например, Wu et al., J Biol Chem 262:4429 (1987)); конструирование нуклеиновой кислоты в рамках ретровирусного или другого вектора и пр.
Активные ингредиенты могут также захватываться в изготовленные микрокапсулы, например, с помощью методик коацервации или межфазной полимеризации, например микрокапсулы гидрокисметилцеллюлозы или желатина и микрокапсулы полиметилметакрилата, соответственно, в коллоидные системы доставки лекарств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences, 16th edition, A. Osal, Ed. (1980).
Может также применяться пульмональная доставка, например, с использованием ингалятора или аэрозольного аппарата, а также состава, содержащего агент для перевода в аэрозоль. Антитело также может вводиться в легкие пациента в форме сухого порошкового состава, см., например, патент США № 6514496.
В одном из конкретных примеров осуществления может быть желательно вводить лечебные антитела или составы по настоящему изобретению местно, в зону, которая нуждается в лечении; этого можно добиться различными методами, например, среди прочих, местным вливанием, топикальным применением, посредством инъекции, катетера, с помощью суппозитория или импланта, причем указанный имплант может иметь пористый, непористый или желатиноподобный материал, в том числе представлять собой мембрану, например силастиковую мембрану или волокна. Предпочтительно при введении антитела по настоящему изобретению стараться использовать материалы, которые не адсорбируют и не абсорбируют белок.
В еще одном примере осуществления антитело может доставляться в системе контролируемого высвобождения. В одном из примеров осуществления может использоваться насос (см. Langer, Science 249:1527 (1990); Sefton, CRC Crit Ref Biomed Eng 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); и Saudek et al., N Engl J Med 321:574 (1989)). В другом примере осуществления могут применяться полимерные материалы (см. Medical Applications of Controlled Release, Langer et al., eds., CRC Press (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen et al., eds., Wiley (1984); Ranger et al., J Macromol Sci Rev Macromol Chem 23:61 (1983); см. также Levy et al., Science 228:190 (1985); During et al., Ann Neurol 25:351 (1989); и Howard et al., J Neurosurg 71:105 (1989)). В еще одном примере осуществления система контролируемого высвобождения может размещаться в непосредственной близости от терапевтической мишени.
Лечебные препараты полипептида или антитела могут готовиться для хранения в форме лиофилизованных составов или водных растворов посредством смешения полипептида желательной степени чистоты с возможными «фармацевтически приемлемыми» носителями, растворителями, наполнителями или стабилизаторами, которые обычно используются в области, например буферными реагентами, стабилизирующими реагентами, консервантами, изотонификаторами, неионогенными детергентами, антиоксидантами и другими разнообразными добавками, см. Remington's Pharmaceutical Sciences, 16th ed., Osol, ed. (1980). Такие добавки, как правило, нетоксичны для организма реципиентов в применяемых дозах и концентрациях, а значит, наполнители, разбавители, носители и пр. являются фармацевтически приемлемыми.
«Выделенное», или «очищенное» антитело не содержит существенного количества клеточного материала или других загрязняющих белков из клеточного или тканевого источника, или среды, из которой получен белок, либо не содержат существенного количества химических предшественников или других химических веществ при получении путем химического синтеза. Выражение «не содержат существенного количества клеточного материала» включает препараты антитела, в которых данный полипептид/белок отделен от клеточных компонентов клеток, из которых он выделен или получен при рекомбинации. Таким образом, антитело, не содержащее существенного количества клеточного материала, включает препараты антитела, содержащие менее чем примерно 30%, 20%, 10%, 5%, 2,5% или 1% (сухого веса) загрязняющего белка. В том случае, когда антитело получено с помощью рекомбинантных методик, также предпочтительно, чтобы оно не содержало существенного количества культуральной среды, то есть если культуральная среда составляет менее чем примерно 20%, 10%, 5%, 2,5% или 1% от объема препарата белка. В том случае, когда антитело получают химическим синтезом, предпочтительно, чтобы оно не содержало существенного количества химических предшественников или других химических веществ и реагентов, то есть чтобы рассматриваемое антитело было отделено от химических предшественников или других химических веществ, использованных в синтезе белка. Соответственно, такие препараты антитела содержат менее чем приблизительно 30%, 20%, 10%, 5% или 1% (сухого веса) химических предшественников или химических веществ, отличных от рассматриваемого антитела. В предпочтительном примере осуществления настоящего изобретения проводится выделение или очистка антител.
Приведенное в настоящем документе выражение «от низких до неопределяемых уровней агрегирования» относится к образцам, содержащим не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и часто не более 0,5% агрегатов по весу белка, что определяется, например, высокоэффективной гель-проникающей хроматографией (ВЭГПХ).
Используемый в настоящем документе термин «от низких до неопределяемых уровней фрагментации» относится к образцам, содержащим не менее 80%, 85%, 90%, 95%, 98% или 99%, суммарного белка, например, в одном пике, что определяется ВЭГПХ, или в 2 (двух) пиках (тяжелая цепь и легкая цепь), определяемых, например, с помощью восстановительного капиллярного гель-электрофореза (rCGE) и не содержащих других единичных сигналов с более 5%, более 4%, более 3%, более 2%, более 1% или более 0,5% суммарного белка каждый. Используемый в настоящем документе термин rCGE относится к капиллярному гель-электрофорезу в условиях восстановления, достаточных для восстановления дисульфидных связей в антителе или молекуле типа антитела, или производной молекуле.
Используемые в настоящем документе термины «стабильность» и «стабильный» в контексте жидкого препарата, содержащего антитело CXCR5 или его связывающий фрагмент, относятся к устойчивости антитела или его антигенсвязывающего фрагмента в препарате к термическому или химическому разворачиванию, агрегации, деградации или фрагментации в конкретных условиях производства, получения, транспортировки и хранения. «Стабильные» препараты по настоящему изобретению сохраняют биологическую активность не менее чем на 80%, 85%, 90%, 95%, 98%, 99% или 99,5% в конкретных условиях производства, получения, транспортировки и хранения. Стабильность указанного препарата антитела может оцениваться по степени агрегации, деградации или фрагментации с применением методов, известных квалифицированным специалистам в области, в том числе, среди прочих, rCGE, гель-электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и ВЭГПХ, по сравнению со стандартом.
Термин «носитель» относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводится лекарственный препарат. Такими физиологическими носителями могут быть стерильные жидкости, например вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и подобные им масла. При внутривенном введении лекарственного препарата подходящим носителем является вода. Физиологические растворы и водные растворы декстрозы и глицерина также могут использоваться в качестве жидких носителей, особенной для инъекционных растворов. К подходящим фармацевтическим наполнителям относятся крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, вода, этанол и подобные им вещества. Если желательно, состав может также содержать небольшие количества смачивающих веществ или эмульгаторов, или буферных веществ для поддержания рН. Такие препараты могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, препаратов с замедленным высвобождением, депо и им подобных. Состав может иметь форму суппозитория со стандартными связующими и носителями, например триглицеридами. Препараты для перорального применения могут включать стандартные носители, такие как относящиеся к фармацевтической категории маннитол, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и пр. Примеры подходящих носителей описаны в "Remington's Pharmaceutical Sciences," Martin. Такие составы будут содержать эффективное количество антитела, предпочтительно в очищенной форме, наряду с соответствующим количеством носителя, с тем, чтобы обеспечить форму для надлежащего введения пациенту. Как известно специалистам в области, состав будет создаваться таким образом, чтобы соответствовать способу введения.
Буферные реагенты помогают поддерживать рН в интервале, который приближается к физиологическим условиям. Буферы предпочтительно присутствуют в концентрациях в интервале от примерно 2 мМ до примерно 50 мМ. В качестве подходящих буферных реагентов по настоящему изобретению могут использоваться как органические, так и неорганические кислоты и их соли, например цитратные буферы (например, смесь мононатрия цитрат-динатрия цитрат, смесь лимонная кислота-тринатрия цитрат, смесь лимонная кислота-мононатрия цитрат и пр.), сукцинатные буферы (например, смесь янтарная кислота-мононатрия сукцинат, смесь янтарная кислота-гидроксид натрия, смесь янтарная кислота-динатрия сукцинат и пр.), тартратные буферы (например, смесь винная кислота-натрия тартрат, винная кислота-калия тартрат, смесь винная кислота-гидроксид натрия и пр.), фумаратные буферы (например, смесь фумаровая кислота-мононатрия фумарат, смесь фумаровая кислота-динатрия фумарат, смесь мононатрия фумарат-динатрия фумарат и пр.), глюконатные буферы (например, смесь глюконовая кислота-глюконат натрия, смесь глюконовая кислота-гидроксид натрия, смесь глюконовая кислота-глюконат калия и пр.), оксалатные буферы (например, смесь щавелевая кислота-оксалат натрия, смесь щавелевая кислота-гидроксид натрия, смесь щавелевая кислота-оксалат калия и пр.), лактатные буферы (например, смесь молочная кислота-лактат натрия, смесь молочная кислота-гидроксид натрия, смесь молочная кислота-лактат калия и пр.) и ацетатные буферы (например, смесь уксусная кислота-ацетат натрия, смесь уксусная кислота-гидроксид натрия и пр.). Могут применяться фосфатные буферы, карбонатные буферы, гистидиновые буферы, соли триметиламина, например, Tris, HEPES, а также другие подобные им известные буферы.
Для замедления роста микроорганизмов могут добавляться консерванты, которые можно использовать в количествах в интервале 0,2%-1% (вес./об.). К консервантам, пригодным для использования в настоящем изобретении, относятся фенол, бензиловый спирт, м-крезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмонийхлорид, галоиды бензалкония (например хлорид, бромид и иодид), гексаметонийхлорид, алкилпарабены, например метил- или пропилпарабен, катехол, резорцинол, циклогексанол и 3-пентанол.
Изотонификаторы вводятся, с тем, чтобы обеспечить физиологическую изотоничность жидких препаратов по настоящему изобретению, к таковым относятся многоатомные сахарные спирты, предпочтительно, трехатомные и более высокие сахарные спирты, например глицерин, эритритол, арабитол, ксилитол, сорбитол и маннитол. Многоатомные спирты могут присутствовать в количествах от примерно 0,1% до примерно 25%, по весу, предпочтительно от 1% до 5% с учетом относительных количеств других ингредиентов.
Стабилизаторами называют широкую категорию наполнителей, функции которых меняются от объемообразующих веществ до добавок, солюбилизирующих лекарственный препарат или способствующих предупреждению денатурации или адгезии к стенкам емкости. В качестве характерных стабилизаторов могут выступать многоатомные сахарные спирты; аминокислоты, например аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и пр., органические сахара или сахарные спирты, например лактоза, трегалоза, стахиоза, арабитол, эритритол, маннитол, сорбитол, ксилитол, рибитол, миоинозитол, галактитол, глицерин и им подобные, в том числе циклитолы, например инозитол; полиэтиленгликоль; полимеры аминокислот; серосодержащие восстановители, например мочевина, глутатион, липоевая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; полипептиды с низким молекулярным весом (то есть <10 остатков); белки, например альбумин сыворотки человека, альбумин бычей сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, например поливинилпирролидон, сахариды, моносахариды, например ксилоза, манноза, фруктоза, глюкоза; дисахариды, например лактоза, мальтоза и сахароза; трисахариды, например раффиноза; полисахариды, например декстран и пр. Стабилизаторы присутствуют в интервале от 0.1 до 10000 вес./вес. на одну часть активного белка.
К дополнительным различным наполнителям относятся объемообразующие агенты (например, крахмал), хелатирующие агенты (например, EDTA), антиоксиданты (например, аскорбиновая кислота, метионин или витамин Е) и вспомогательные растворители.
Приведенные в настоящем документе составы также могут содержать более одного активного компонента, если необходимо для индивидуальных показаний при лечении, предпочтительно компоненты, обладающие взаимодополняющей активностью, которые не оказывают неблагоприятного влияния друг на друга. Например, может быть желательно дополнительно ввести иммунодепрессант. Подобные молекулы надлежащим образом присутствуют в составе в количествах, которые эффективны для предполагаемой цели.
Используемый в настоящем документе термин «поверхностно-активные вещества» относится к органическим соединениям, обладающим амфипатической структурой, а именно, состоящим из групп с противоположными характеристиками растворимости, как правило, из жирорастворимой углеводородной цепочки и водорастворимой ионной группы. В зависимости от заряда поверхностно-активной группы поверхностно-активные вещества могут подразделяться на анионные, катионные и неионогенные. Поверхностно-активные вещества часто применяются как смачивающие, эмульгирующие, солюбилизирующие и диспергирующие агенты для различных лекарственных составов и препаратов биологических материалов.
Неионогенные поверхностно-активные вещества или детергенты (также известные как «смачивающие вещества») могут добавляться, с тем, чтобы способствовать солюбилизации лекарственного средства, а также чтобы защитить лекарственный белок от вызванного встряхиванием агрегирования, что также позволяет подвергать состав воздействию поверхностного сдвига, не вызывая денатурации белка. К подходящим неионогенным поверхностно-активным веществам относятся полисорбаты (20, 80 и пр.), полиоксамеры (184, 188 и пр.), полиолы Pluronic® и моноэфиры полиоксиэтиленсорбитана (TWEEN-20®, TWEEN-80® и пр.). Неионогенные поверхностно-активные вещества могут присутствовать в количествах в интервале от примерно 0,05 мг/мл до примерно 1,0 мг/мл, предпочтительно от примерно 0,07 мг/мл до примерно 0,2 мг/мл.
Используемый в настоящем документе термин «неорганическая соль» относится к любому соединению, не содержащему углерод, которое образуется в результате замены части или всех кислых водородов или кислоты металлом или группой, выступающей в качестве металла, и часто используемому в качестве вещества для корректировки тоничности в лекарственных составах и препаратах из биологических материалов. Наиболее распространенными неорганическими солями являются NaCl, KCl, NaH2PO4 и пр.
В настоящем изобретении предлагаются жидкие составы анти-CXCR5-связывающего вещества или его фрагмента, обладающего рН в диапазоне от примерно 5,0 до примерно 7,0, или от примерно 5,5 до 6,5, или от примерно 5,8 до примерно 6,2, или примерно 6,0.
Настоящее изобретение включает жидкие составы, обладающие стабильностью при температурах, характерных для коммерческих холодильников и морозильников, которые используются в кабинетах врача или лабораториях, например, от примерно -20°C до примерно 5°C, причем указанная стабильность оценивается, например, высокоэффективной гель-проникающей хроматографией (ВЭГПХ), для целей хранения, например, в течение примерно 60 дней, примерно 120 дней, примерно 180 дней, примерно года, примерно 2 лет или более. Жидкие составы по настоящему изобретению также проявляют стабильность, которая оценивается, например, посредством ВЭГПХ, при комнатных температурах по меньшей мере за нескольких часов, например одного часа, двух часов или примерно трех часов, до применения.
В объем термина «малая молекула» и аналогичных терминов, среди прочих, входят пептиды, пептидомиметики, аминокислоты, аналоги аминокислот, полинуклеотиды, аналоги полинуклеотидов, нуклеотиды, аналоги нуклеотидов, органические или неорганические соединения (например, в том числе гетероорганические и/или металлоорганические соединения), имеющие молекулярный вес менее чем примерно 10000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 5000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 1000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 500 грамм на моль, а также соли, эфиры и другие фармацевтические приемлемые формы таких соединений.
Поэтому, например, в случае рака антитела по настоящему изобретению могут вводиться по отдельности или в сочетании с другими препаратами для лечения рака, включая стандартные химиотерапевтические лекарства (паклитаксель, карбоплатин, цисплатин и доксорубицин), анти-EGFR агенты (гефитиниб, эрлотиниб и цетуксимаб), антиангиогенные агенты (бевакузимаб и сунитиниб), а также иммуномодуляторы, например интерферон α и талидомид.
В другом примере осуществления, в случае ревматических заболеваний, например ревматоидного артрита (РА), может использоваться комбинационная терапия, включающая CXCR-связывающую представляющую интерес молекулу,. Например, гуманизированные антитела CXCR5 можно смешивать с малой молекулой, например модифицирующим антиревматическим препаратом, в том числе, среди прочих, например метотрексатом и ингибиторами синтеза пиридина, например лефлуномидом (Mader & Keystone, J Rheum 34 Supp (16-24) 2007, Gaffo et al., Am J Health Syst Pharm 63:2451-2465, 2006).
Поскольку различные формы представляющей интерес CXCR5-связывающей молекулы могут и не приводить к истощению В-клеток, рассматриваемую молекулу можно сочетать с другими лекарствами, демонстрирующими перекрывающиеся механизмы действия, чтобы добиться аддитивного или синергического результата. Поэтому, например, вторым лекарством может быть лекарство, действующее на уровне цитокина в направлении Т-клеток и пр.
Используемые в настоящем изобретении определения «терапевтический агент» и «терапевтические агенты» относятся к любому агенту (агентам), которые могут использоваться при лечении, контроле и смягчении заболеваний, нарушений, расстройств и пр., связанных с аберрантными метаболизмом и активностью CXCR5 и/или CXCL13. Проявлениями этого могут быть аномальные уровни В-клеток или активность В-клеток. Сюда также входят известные соединения с фармакологическим эффектом при лечении нарушений и пр., которые связаны с аберрантными метаболизмом и активностью CXCR5 и/или CXCL13.
Кроме того, антитела по настоящему изобретению могут конъюгироваться с различными эффекторными молекулами, например гетерологическими полипептидами, лекарствами, радионуклеотидами или токсинами, см., например, WO 92/08495; WO 91/14438; WO 89/12624; патент США № 5314995; и EPO 396387. Антитело или его фрагмент могут конъюгироваться с терапевтическим агентом, например цитотоксином (например цитостатическим или цитопатическим агентом), терапевтическим агентом или ионом радиоактивного металла (например α-активным изитопом, таким как 213Bi). К цитотоксинам или цитотоксическим агентам относятся любые вещества, которые оказывают разрушительное воздействие на клетки. К примерам относятся паклитаксол, цитохалазин B, грамицидин D, этидий бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги или гомологи. К терапевтическим агентам, среди прочих, относятся антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил и декарбазин), алкилирующие агенты (например, мехлорэтамин, хлорамбуцил, мельфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин C и цис-дихлородиаминплатина (II) (DDP) цисплатин), антрациклины (например, даунорубицин, дауномицин и доксорубицин), антибиотики (например, дактиномицин, актиномицин, блеомицин, митрамицин и антрамицин (AMC)), а также антимитотические агенты (например, винкристин и винбластин).
Методики конъюгации такой терапевтической функции с антителами хорошо известны, см., например, Arnon et al., в Monoclonal Antibodies and Cancer Therapy, Reisfeld et al. (eds.), p. 243-56 Alan R. Liss (1985); Hellstrom et al., в Controlled Drug Delivery, 2nd ed., Robinson et al., eds., p. 623-53, Marcel Dekker (1987); Thorpe, в Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al., eds., p. 475-506 (1985); Monoclonal Antibodies For Cancer Detection and Therapy, Baldwin et al., eds., p. 303-16, Academic Press (1985); и Thorpe, et al., Immunol Rev 62:119 (1982). В качестве альтернативы антитело можно конъюгировать со вторым антителом с образованием гетероконъюгата антитела, например бифункционального антитела, см., например, патент США № 4676980.
Конъюгаты по настоящему изобретению могут использоваться для модификации заданного биологического ответа, терапевтический агент или лекарственный препарат не должны рассматриваться как ограничиваемые классическими химическими терапевтическими агентами. Например, в качестве лекарственной функции может выступать белок или полипептид, обладающий желательной биологической активностью. К таким белкам могут, например, относиться токсин, такой как абрин, рицин А, экзотоксин псевдомонад или дифтерический токсин; белок, например фактор некроза опухоли, α-интерферон, β-интерферон, фактор роста нервов, тромбоцитарный фактор роста, активатор тканевого плазминогена, агент апоптоза, например TNF-α, TNF-β, AIM I (WO 97/33899), AIM II (WO 97/34911), лиганд Fas (Takahashi et al., Int Immunol, 6:1567 (1994)), VEGF (WO 99/23105); тромботический агент; антиангиогенный агент, например ангиостатин или эндостатин; или модификаторы биологического ответа, например лимфокины, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (GCSF) или другие факторы роста.
Препараты для введения in vivo должны быть стерильными. Этого можно добиться, например, фильтрацией через стерильные фильтровальные мембраны. Например, жидкие препараты по настоящему изобретению могут стерилизоваться фильтрацией через фильтр 0,2 мкм или 0,22 мкм.
Могут готовиться препараты с замедленным высвобождением. К характерным примерам препаратов с замедленным высвобождением относятся полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, эти матрицы представляют собой формованные изделия, например пленки или матрицы. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например поли(2-гидроксиэтилметакрилат), поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагающийся этиленвинилацетат, разлагающиеся сополимеры молочной кислоты-гликолевой кислоты (например, инъекционные микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты) и поли-D-(-)-3-гидроксимасляная кислота. Такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение более 100 дней, тогда как некоторые гидрогели высвобождают белки в течение более короткого времени. Можно выработать рациональные стратегии для стабилизации в зависимости от механизмов реакций. Например, если установлено, что механизм агрегирования связан с образованием межмолекулярной связи S-S за счет тиодисульфидного обмена, стабилизация может достигаться за счет модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги, использования необходимых добавок, замены аминокислот и разработки специальных составов полимерных матриц.
Состав, содержащий антитело или его вариант, будет формулироваться, дозироваться и вводиться таким способом, который находится в соответствии с принципами надлежащей медицинской практики. В этом плане к рассматриваемым факторам относятся конкретное нарушение, подлежащее лечению, конкретное млекопитающее, получающее лечение, клиническое состояние конкретного пациента, причина заболевания, зона доставки агента, метод введения, схема введения и другие факторы, известные медицинским работникам. «Терапевтическое эффективное количество» антитела или варианта, которое будет при этом вводиться, определяется приведенными выше соображениями, и может представлять собой минимальное количество, необходимое для профилактики, подавления или лечения заболевания, патологического состояния или нарушения, вызванного CXCR5.
Антитело или его вариант, возможно, включается в состав вместе с одним или несколькими агентами, используемыми в настоящее время для профилактики или лечения рассматриваемого заболевания. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, вида расстройства или лечения и других обсуждавшихся выше факторов. Они, как правило, используются в тех же дозировках и с теми же методами введения, которые применялись в описанном выше тексте или же составляют примерно от 1 до 99% от применявшихся до сих пор дозировок.
Использованный в настоящем документе термин «эффективное количество» относится к количеству лекарства (например, профилактического или терапевтического агента), достаточного для уменьшения остроты и/или продолжительности заболевания, вызванного CXCR5, облегчения одного или нескольких его симптомов, предупреждения развития заболевания, вызванного CXCR5, или начала регрессии заболевания, вызванного CXCR5, или достаточного для предупреждения развития, рецидивов, начала или прогресса заболевания, вызванного CXCR5, или одного или нескольких его симптомов, или усиления или улучшения профилактического и/или терапевтического эффекта (эффектов) другого лекарства (например, другого терапевтического агента), применяемого для лечения заболевания, вызванного CXCR5. Например, рассматриваемое лечение может снизить повышенный уровень В-клеток по сравнению с исходным или нормальным уровнем по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. В другом примере осуществления эффективное количество лекарственного или профилактического препарата облегчает симптомы заболевания, вызванного CXCR5, например, артрита или отторжения трансплантата, по меньшей мере на 5%, предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. Кроме того, в качестве эквивалента в настоящем документе используется термин «терапевтически эффективное количество».
Количество лекарственного полипептида, антитела или его фрагмента, которое будет эффективно при использовании или лечении конкретного заболевания или состояния, будет зависеть от природы расстройства или состояния и может определяться стандартными клиническими методиками. По возможности, вначале in vitro можно получить кривую доза-эффект и лекарственные препараты по настоящему изобретению. При наличии удобной модели животных можно вновь исследовать кривую доза-эффект, и использовать ее для экстраполяции подходящей дозы для человека, опираясь на практические методы, известные специалистам в области. Вместе с тем, исходя из общих знаний в области, лекарственный препарат, эффективно стимулирующий снижение воспалительного эффекта, например, может обеспечивать локальные концентрации лекарственного средства между 5 и 20 нг/мл, и, предпочтительно, между примерно 10 и 20 нг/мл. В дополнительном специфическом примере осуществления изобретения лекарственный препарат, эффективно улучшающий рост и выживаемость клеток, ответственных за аутоиммунные проявления или отторжения трансплантата, зависимые от В-клеток, может обеспечивать локальные концентрации лекарственного препарата в пределах от примерно 10 нг/мл до примерно 100 нг/мл.
В предпочтительном примере осуществления водный раствор лекарственного полипептида, антитела или его фрагмента может вводиться посредством подкожной инъекции. Каждая доза может меняться от примерно 0,5 мг до примерно 50 мг на килограмм веса тела, или, более предпочтительно, от примерно 3 мг до примерно 30 мг на килограмм веса тела. Дозировку можно установить эмпирически для конкретного заболевания, группы пациентов, способа введения и пр. с использованием фармацевтических методов, известных специалистам в области.
Схема дозировки для подкожного введения может меняться от раза в неделю до ежедневной, в зависимости от набора клинических факторов, включая характер заболевания, степень остроты болезни и чувствительности пациента к терапевтическому агенту.
В настоящем изобретении предлагаются способы изготовления жидких препаратов антитела или его CXCR5-связывающего фрагмента, причем указанные способы включают концентрирование фракции очищенного антитела до конечной концентрации примерно 15 мг/мл, примерно 20 мг/мл, примерно 30 мг/мл, примерно 40 мг/мл, примерно 50 мг/мл, примерно 60 мг/мл, примерно 70 мг/мл, примерно 80 мг/мл, примерно 90 мг/мл, примерно 100 мг/мл, примерно 200 мг/мл, примерно 250 мг/мл, примерно 300 мг/мл или более, с использованием, например, полупроницаемой мембраны с соответствующим отсечением молекулярного веса (мв) (например, отсечением 30 KD для его F(ab')2 фрагментов; и отсечением 10 KD для Fab фрагментов) и дополнительным диафильтрованием концентрированной фракции антител в препаративный буфер с использованием той же мембраны.
Кроме того, настоящее изобретение включает стабильные, например, стабильные по KD, жидкие препараты рассматриваемой продукции, которые улучшали полувыведение in vivo. Так, период полувыведения рассматриваемого антитела из организма, предпочтительно человека, больше 3 дней, больше 7 дней, больше 10 дней, больше 15 дней, больше 25 дней, больше 30 дней, больше 35 дней, больше 40 дней, больше 45 дней, больше 2 месяцев, больше 3 месяцев, больше 4 месяцев, больше 5 месяцев или более.
Для увеличения продолжительности циркуляции антитела в сыворотке in vivo могут использоваться различные методики. Например, инертные полимерные молекулы, такие как полиэтиленгликоль (PEG) с высоким молекулярным весом, могут связываться с антителом через многофункциональный линкер или без него, либо посредством сайт-специфической конъюгации PEG с N-терминальным или с C-терминальным окончанием антитела, либо через ε-аминогруппы, присутствующие в лизиновых остатках. Могут использоваться линейные или разветвленные производные полимера, которые приводят к минимальной потере биологической активности. Степень конъюгации можно четко отслеживать по SDS-PAGE и с помощью масс-спектрометрии, чтобы обеспечить надлежащую конъюгацию молекул PEG с антителами. Непрореагировавший PEG можно отделять от конъюгатов антитело-PEG посредством гель-фильтрации или ионообменной хроматографии. Модифицированные PEG антитела могут также испытываться на предмет активности связывания, а также эффективности in vivo, для чего могут использоваться методы, известные специалистам в области, например, описанные в настоящем документе методы иммуноанализа.
Антитело, обладающее повышенным уровнем полувыведения in vivo, может также получаться посредством проведения одной или нескольких модификаций аминокислот (например, замен, вставок или делеций) в константный домен IgG, или его FcR-связывающий фрагмент (например Fe или фрагмент шарнирной области домена Fe), см., например, WO 98/23289; WO 97/34631; и патент США № 6277375.
Кроме того, антитело можно конъюгировать с альбумином с образованием антитела, более стабильного in vivo или обладающего более продолжительным периодом полувыведения in vivo. Методики хорошо известны специалистам в области, см., например, WO 93/15199, WO 93/15200 и WO 01/77137; а также EPO 413622. Антитело можно также модифицировать, например посредством гликозилирования, ацетилирования, фосфорилирования, амидирования, введения известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным лигандом или другим белком и пр.
В одном из примеров осуществления состав препарата определяется в соответствии со стандартными процедурами для лекарственных препаратов, изготовляемых для внутривенного введения в организм человека. Как правило, составы для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. В необходимых случаях состав может также включать солюбилизирующий агент и местный анестетик, например лидокаин или другой «каиновый» анестетик, для уменьшения боли в месте введения. Обычно ингредиенты поставляются либо отдельно, либо смешиваются в дозированной лекарственной форме, например, в виде сухого лиофилизованного порошка, или безводного концентрата в герметичном контейнере, например в ампуле или в пакете с указанием количества активного агента. В случаях, когда состав должен вводиться посредством вливания, он может поставляться с флаконом для вливания, содержащим стерильную воду или физиологический раствор фармацевтической категории чистоты. Если состав вводится посредством инъекции, может поставляться ампула со стерильной водой или физиологическим раствором для инъекции, например в наборе, так что ингредиенты могут смешиваться перед введением.
В изобретении также предусматривается, что жидкий препарат по настоящему изобретению помещается в герметичный контейнер, например ампулу или пакет с указанием количества рассматриваемого продукта. Жидкие препараты по настоящему изобретению могут находиться в герметичном контейнере с указанием количества и концентрации антитела или фрагмента антитела. Жидкие препараты по настоящему изобретению могут поставляться в герметичном контейнере, содержащем по меньшей мере 15 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл, 250 мг/мл или 300 мг/мл антитела CXCR5, например, в объеме, равном 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл или 20 мл.
Выпускается изделие, в состав которого входят средства для лечения описанных выше расстройств. Изделие представляет собой контейнер и этикетку. К подходящим контейнерам относятся, например, бутылки, флаконы, шприцы и пробирки. Контейнеры могут изготовляться из самых разных материалов, например, стекла или пластика. Контейнер содержит состав, который пригоден для диагностики, профилактики или лечения патологического состояния или заболевания, вызванного CXCR5, и может иметь стерильное отверстие для отбора (например, в качестве контейнера может использоваться мешок с раствором для внутривенного введения или флакон с пробкой, которую можно прокалывать иглой для подкожной инъекции). На этикетке, которая находится на контейнере или прилагается к нему, указывается, что состав используется для лечения определенного заболевания. Изделие также может включать второй контейнер, содержащий фармацевтически приемлемый буфер, например фосфатно-буферный физиологический раствор, раствор Рингера и раствор декстрозы. Изделие также может включать другие материалы, желательные с точки зрения коммерческих приложений и пользователя, включая буферы, разбавители, фильтры, иголки, шприцы и вкладыши с инструкцией по применению.
В другом аспекте настоящего изобретения нуклеиновые кислоты, включающие последовательности, которые кодируют антитела или их функциональные производные, применяются для лечения, подавления или профилактики заболевания или расстройства, связанного с аберрантной экспрессией и/или активностью CXCR5, с помощью генной терапии. Генной терапией называют терапию, которая проводится посредством введения пациенту экспрессированной или экспрессируемой представляющей интерес нуклеиновой кислоты. В этом примере осуществления настоящего изобретения нуклеиновые кислоты продуцируют кодируемый белок в выступающих в качестве мишеней клетках-реципиентах, которые опосредуют терапевтическое воздействие и такими клетками. В соответствии с настоящим изобретением могут использоваться любые доступные методы генной терапии.
Общий обзор методов генной терапии можно найти в Goldspiel et al., Clinical Pharmacy 12:488 (1993); Wu et al., Biotherapy 3:87 (1991); Tolstoshev, Ann Rev Pharmacol Toxicol 32:573 (1993); Mulligan, Science 260:926 (1993); Morgan et al., Ann Rev Biochem 62:191 (1993); и May, TIBTECH 11:155 (1993).
В одном из аспектов соединение включает последовательности нуклеиновых кислот, кодирующих антитело или его функциональные связывающие фрагменты, причем указанные последовательности нуклеиновых кислот являются частью векторов экспрессии, которые экспрессируют антитело, или его фрагменты, химерные белки, или его тяжелые или легкие цепи в подходящем хозяине. В частности, такие последовательности нуклеиновых кислот содержат промоторы, функционально связанные с кодирующей антитело областью, причем указанные промоторы являются индуцируемыми или конститутивными, а также, возможно, тканеспецифичными, также присутствуют и другие регуляторные последовательности.
В другом конкретном примере осуществления используются молекулы нуклеиновых кислот, в которых кодирующие антитело последовательности и любые другие желательные последовательности фланкируются областями, которые промотируют гомологическую рекомбинацию в нужном сайте генома, тем самым, создавая условия для внутрихромосомной экспрессии нуклеиновых кислот, кодирующих антитело (Koller, et al., Proc Natl Acad Sci USA 86:8932 (1989); Zijlstra et al., Nature 342:435 (1989)). В конкретных примерах осуществления молекула экспрессируемого антитела представляет собой одноцепочечное антитело; в альтернативных вариантах последовательности нуклеиновой кислоты включают последовательности, кодирующие тяжелые и легкие цепи антитела или его фрагменты. К альтернативным методам включения относится использование конкретных факторов транскрипции, которые распознают специфические последовательности нуклеиновых кислот, «цинковые пальцы» и пр.
Доставка нуклеиновых кислот в организм пациента может производиться напрямую, в этом случае пациент напрямую подвергается воздействию нуклеиновой кислоты или векторов, несущих нуклеиновую кислоту, или непрямым образом, в этом случае клетки вначале трансформируются под воздействием нуклеиновых кислот in vitro, а затем трансплантируются пациенту.
В одном из примеров осуществления последовательности нуклеиновых кислот напрямую вводятся in vivo и экспрессируются для получения кодированного продукта. Такая процедура может производиться с использованием любого из множества методов, известных специалистам в области, например, посредством конструирования кодирующих антитело последовательностей как части соответствующего вектора экспрессии нуклеиновой кислоты, и введения его таким образом, чтобы векторы становились внутриклеточными, например, посредством инфекции с использованием дефектных или ослабленных ретровирусных или других вирусных векторов (см. патент США № 4980286), прямой инъекцией депротеинизированной ДНК, с помощью бомбардировки микрочастицами (например, генная пушка; Biolistic, Dupont), с использованием невирусных векторов, например синтетических составов, включающих амфипатические соединения, которые связывают гидрофильную нуклеиновую кислоту и обладают способностью слияния с клетками, как правило, при этом содержащие гидрофобную часть для связывания с мембранами, покрытием липидами, или рецепторами клеточной поверхности или агентами трансфекции, инкапсулированием в липосомах, микрочастицах или микрокапсулах, посредством введения вектора, связанного с пептидом, для которого известна возможность проникновения в ядро, посредством введения вектора, связанного с лигандом, который подвергается опосредованному рецептором эндоцитозу (см., например, Wu et al., J Biol Chem 262:4429 (1987)) (что может использоваться для клеток-мишеней, селективно экспрессирующих рецепторы) и пр. В другом примере осуществления могут быть изготовлены комплексы нуклеиновая кислота-лиганд, в которых лиганд включает склонный к слиянию вирусный пептид для разрушения эндосом, что позволяет нуклеиновой кислоте избежать лизосомального распада. В еще одном примере осуществления нуклеиновую кислоту можно подвергать клеточно-специфичному поглощению и экспрессии in vivo, нацеливаясь на конкретный рецептор (см., например, WO 92/06180; WO 92/22635; WO92/20316; WO93/14188 и WO 93/20221).
Что касается векторов, то в соответствии с подходами, известными специалистам в области, может использоваться, например, лентивирусный вектор. Лентивирусные векторы содержат компоненты для упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновых кислот, кодирующих антитело, которые будут использоваться в генной терапии, клонируются в один или несколько векторов, что способствует доставке гена в организм пациента. Например, лентивирусный вектор может использоваться для доставки трансгена в гематопоэтические стволовые клетки. Применение ретровирусных векторов в генной терапии рассматривается в следующих литературных источниках: Clowes et al., J Clin Invest 93:644 (1994); Kiem et al., Blood 83:1467 (1994); Salmons et al., Human Gene Therapy 4:129 (1993); и Grossman et al., Curr Opin Gen and Dev 3:110 (1993).
В настоящем изобретении также могут использоваться аденовирусы. Мишенями для систем доставки на основе аденовирусов являются, например, печень, центральная нервная система, эндотелиальные клетки и мышцы. Аденовирусы инфицируют неделящиеся клетки, что является преимуществом по сравнению с ранними ретровирусными векторами. В работе Kozarsky et al., Curr Opin Gen Dev 3:499 (1993) представлен обзор генной терапии на основе аденовирусов. В работе Bout et al., Human Gene Therapy 5:3 (1994) продемонстрировано использование аденовирусных векторов для передачи генов клеткам дыхательного эпителия макак-резусов. Другие примеры использования аденовирусов в генной терапии можно найти в работе Rosenfeld et al., Science 252:431 (1991); Rosenfeld et al., Cell 68:143 (1992); Mastrangeli et al., J Clin Invest 91:225 (1993); WO94/12649; и Wang et al., Gene Therapy 2:775 (1995).
В генной терапии также может использоваться аденосателлитный вирус (AAV) (Walsh et al., Proc Soc Exp Biol Med 204:289 (1993); и патенты США №№ 5436146; 6632670 и 6642051).
Другой подход к генной терапии предусматривает перенос гена в клетки клеточной культуры с помощью таких методов, как электропорация, липофекция, трансфекция, опосредованная фосфатом кальция или вирусная инфекция. Как правило, метод переноса предусматривает перенос селектируемого маркера в клетки. Затем проводится селекция клеток, с тем, чтобы выделить те клетки, которые захватили и экспрессируют перенесенный ген. Затем такие клетки доставляют в организм пациента.
Таким образом, нуклеиновая кислота может вводиться в клетку до введения полученной рекомбинантной клетки in vivo. Такое введение можно проводить любым методом, известным специалистам в области, включая, среди прочих, трансфекцию, электропорацию, микроинжекцию, инфекцию вектором вируса или бактериофага, содержащим последовательности нуклеиновых кислот, слияние клеток, опосредованный хромосомами перенос генов, опосредованный микроклетками перенос генов, слияние сферопластов и пр. Специалистам в области известно множество методик введения чужеродных генов в клетки (см., например, Loeffler et al., Meth Enzymol 217:599 (1993); Cohen et al., Meth Enzymol 217:618 (1993); и Cline Pharm Ther 29:69 (1985)), и они могут использоваться в рамках настоящего изобретения, при условии сохранения необходимых функций развития и физиологических функций клеток-реципиентов. Методика должна обеспечивать стабильный перенос нуклеиновой кислоты в клетку, так чтобы нуклеиновая кислота экспрессировалась клеткой, была наследуемой и экспрессировалась потомством клетки.
Полученные рекомбинантные клетки могут доставляться в организм пациента с использованием различных методов, известных специалистам в области. Рекомбинантные клетки крови (например, гематопоэтические стволовые клетки или клетки-предшественники) предпочтительно вводить внутривенно. Количество клеток для применения зависит от желаемого эффекта, состояния пациента и пр. и может определяться квалифицированным специалистом в области.
К клеткам, в которые для целей генной терапии может вводиться та или иная нуклеиновая кислота, относятся любые желаемые и доступные виды клеток, которые включают, среди прочих, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты, клетки крови, например, Т-лимфоциты, В-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты и гранулоциты; различные стволовые клетки или клетки-предшественники, в частности, гематопоэтические стволовые клетки или клетки-предшественники, например клетки, полученные из костного мозга, крови пуповины, периферической крови, печени эмбриона и пр.
В одном примере осуществления используемая для генной терапии клетка является аутологичной пациенту. Нуклеиновые последовательности, кодирующие антитело по настоящему изобретению, вводятся в клетки, так что трансген экспрессируется клетками или их потомством, и рекомбинантные клетки затем вводятся in vivo для получения терапевтического эффекта. В конкретном примере осуществления используются стволовые клетки или клетки-предшественники. Для возможного примера осуществления настоящего изобретения используются любые стволовые клетки и/или клетки-предшественники, которые могут быть выделены и сохранены in vitro (см., например, WO 94/08598; Stemple et al., Cell 71:973 (1992); Rheinwald Meth Cell Bio 21A:229 (1980); и Pittelkow et al., Mayo Clinic Proc 61:771 (1986)). Подходящими клетками-реципиентами являются клетки крови и клетки костного мозга, поскольку CXCR5 экспрессируется, например, на В-клетках. Вместе с тем объем настоящего изобретения в плане использования стволовых клеток-реципиентов не предусматривает изготовления и применения трансгена для получения трансгенного организма посредством введения такого представляющего интерес трансгена в эмбрионы и эмбриональные стволовые клетки.
В настоящем изобретении предлагаются способы лечения, профилактики и ослабления заболеваний, вызванных CXCR5, или одного или нескольких их симптомов посредством введения пациенту эффективного количества, например, жидкого препарата по настоящему изобретению. Пациентом предпочтительно является млекопитающее, например неприматные виды (коровы, свиньи, лошади, кошки, собаки, крысы и пр.) и приматы (например, обезьяны, в частности яванский макак cynomolgus и человек). В предпочтительном примере осуществления таким пациентом является человек.
CXCR5 также экспрессируется на некоторых раковых клетках, например раковых клетках поджелудочной железы, толстой кишки и мочевого пузыря и при T-клеточных лейкозах (Qinping et al., Oncogene 24:573-584, 2005), а также В-клеточных лейкозах (Burkel et al., Blood, Jul 2007; doi:10.1182/blood-2007-05-089409), кроме того, стимулирование CXCR5 коррелировало с пролиферацией клеток карциномы, Meijer et al., Canc Res 66:9576-9582, 2006.
Таким образом, рассматриваемое антитело или его производное могут использоваться для контроля пролиферации раковых клеток, экспрессирующих CXCR5, при этом наличие рака диагностируется по экспрессии CXCR5 с помощью приведенных в настоящем документе методов анализа. Представляющее интерес антитело может уменьшить инфильтрацию злокачественных клеток, снизить устойчивость к апоптозу и свести к минимуму пролиферацию. Как предлагается в настоящем изобретении, указанным пациентам вводится такое количество рассматриваемого антитела или его производного, которое обеспечивает ингибирование пролиферации раковых клеток.
Аутоиммунные расстройства связаны с аберрантным и/или высоким уровнем экспрессии CXCL13, например, при волчанке (Ishikawa et al., J Exp Med 193:1393-1402, 2001) и Sjoren's Syndrome (Salomonsson et al., Scan J Imm 55:336-342, 2002; и Barone et al., Arth Rheum 52(6)1773-1784, 2005), или высоким уровнем экспрессии CXCR5, например, при злокачественной миастении (Sims et al., J Imm 167:1935-1944, 2001; Saito et al., J Neuroimm 55:336-342, 2005; и Tackenberg et al., Eur J Imm 37:849-863, 2007). Поэтому рассматриваемое антитело используется для минимизации воздействия высоких уровней или высокой активности лиганда CXCL13 или CXCR5. При аутоиммунных расстройствах, характеризующихся высокими уровнями В-клеток, высокими уровнями CXCR5, или высокими уровнями CXCL13, или другого лиганда CXCR5, как указано в настоящем документе, вводится такое количество рассматриваемого антитела, которое подавляет активность В-клеток.
Аберрантная экспрессия CXCR5 наблюдалась при рассеянном склерозе, Brain 129(Pt 1)200-211, 2006.
При колите CXCR5 играет определенную роль в образовании и функционировании лимфоидной ткани, связанной с кишечником (Carlsen et al., Gut, 2002, 51(3)364-367). Рассматриваемое антитело подавляет опосредованную CXCR5 миграцию и инфильтрацию В-клеток в собственную пластинку слизистой оболочки кишечника, а также инфильтрацию слизистой оболочки в целом (Mazzucchelli et al., J Clin Invest, 1999, 104(10)R49-R54) и их экспрессию в очагах язвенного колита, которые содержат эктопические герминативные центры.
Истощение В-клеток может иметь терапевтический эффект при подавлении симптомов в определенных обстоятельствах и при определенных показаниях, например при ревматоидном артрите (Oligino & Dalrymple, Arth Res Ther 5(Suppl 4)S7-S11, 2003). Высокие уровни экспрессии CXCR5 регистрируются в синовиальной ткани страдающих артритом пациентов по сравнению с тканью отдельных лиц, которые не страдают ревматоидным артритом (Schmutz et al., Arth Res Ther 7:R217-R229, 2005). Таким образом, определенные формы рассматриваемого антитела и его производных могут снижать популяцию В-клеток и предупреждать инфильтрацию и взаимодействие В-клеток в суставе. Соответственно, лечение может включать введение пациенту, страдающему артритом, определенного количества рассматриваемого антитела, которое снижает уровень В-клеток. Антитело может вводиться локально в болезненный сустав.
Эктопический лимфоидный неогенез наблюдается при различных условиях, в том числе псориатическом артрите (Canete et al., Ann Rheum Dis, Jan 12, 2007, doi:10:1136/ard.2006.062042), хронических воспалительных заболеваниях общего характера (Aloisi & Pujol-Borrell, Nat Rev Imm 6:205-217, 2006) и в трансплантатах, с отторжением как при хроническом течении (Baddoura et al., Am J Trans 5:510-516, 2005), так и в ситуациях обострения (DiCarlo et al., Am J Trans 7:201-210, 2007). CXCL13 и CXCR5 присутствовали в случае кардиотрансплантатов (DiCarlo et al., выше); а CXCL13 регистрировался в случае псориатического артрита (Canete et al., выше). Присутствие CXCL13 и/или CXCR5 связано с развитием эктопических лимфоидных фолликулов с зонами В-клеток и Т-клеток, которые присутствуют в нормальных узлах. Формирование аллоантигена для антигена B-клеток также связывалось с моделью острого отторжения сердечного аллогенного трансплантата (Noorchashm et al., J Imm 177:7715-7722, 2006).
Таким образом, рассматриваемое антитело может использоваться для подавления воспаления и отторжения трансплантата. Пациенту вводится ингибирующее В-клетки количество антитела, с тем, чтобы подавить воспаление, свести к минимуму развитие эктопических герминативных центров, как можно больше снизить захват В-клеток трансплантатом и минимизировать формирование аллоантигена В-клеток до или после процедуры трансплантации.
Ниже для сведения специалистов в области приводятся иллюстрации настоящего изобретения в следующих, не исчерпывающихся данным перечислением, примерах, описывающих некоторые из вариантов осуществления, с помощью которых настоящее изобретение может быть реализовано на практике.
ПРИМЕРЫ
ПРИМЕР 1: ПОЛУЧЕНИЕ ИММУНОГЕНА
Моноклональные антитела к CXCR5 можно вырабатывать в трансформированных клетках CHO с ДНК, кодирующей человеческий CXCR5 полной длины и экспрессируемой на поверхности клеток («клетки r-CXCR5-CHO»). Используемая для трансформирования клеток последовательность CXCR5 может быть получена из баз данных, таких как NM 001716.2, NC000011.8 или NM001716, и синтезирована или выделена из подходящего клеточного источника.
Открытую рамку считывания CXCR5 помещали в экспрессирующий вектор, такой как pCDNA3.1neo_DEST, и затем трансфицировали в клетки 300-19 (иммуноген).
Кроме того, внеклеточный домен CXCR5 (EC-домен) с аминокислотной последовательностью MNYPTLEMDLENLEDLFWELDRLDNYNTSLVENHLC (SEQ ID №:1) конъюгировали с гемоцианином лимфы улитки (KLH) через С-терминальный цистеин и использовали в качестве иммуногена. Экспрессирующие CXCR5 или внеклеточный домен CXCR5 клетки вводили внутрибрюшинно (5×106 клеток в 0,2 мл, или 50 мкг пептида в 100 мкл буферного раствора, дополнительно смешанные со 100 мкл адъюванта, такого как полный адъювант Фрейнда). Инъекции антигена повторяли каждые две недели до обнаружения в сыворотке высокого титра антител CXCR5 с использованием любого из известных методов, например, иммуноферментного анализа (ELISA) или клеточного сортера с активацией флуоресценции (FACS), используя, например, клетки CXCR5+, которые могут быть выделены, например, с помощью FACS, и, например, коммерчески доступные моноклональные антитела MAB190 (R & D Systems) в качестве положительного контроля.
Экспрессирующие CXCR5 клетки держали при температуре 37°C в атмосфере 5% CO2 в RPMI-растворе (Invitrogen, Carlsbad, CA) с добавлением 10% диализованной эмбриональной бычьей сыворотки (FBS) (Invitrogen). Клетки готовили к инъекции путем замены указанной выше культуральной среды на не содержащий Ca/Mg фосфатный буферный раствор (CMF-PBS) с добавлением 5 мМ EDTA, собирая клетки в этом буфере. Собранные клетки отделяли центрифугированием на 500×g в течение примерно 5 минут, однократно промывали путем ресуспендирования полученного концентрата в CMF-PBS и повторного центрифугирования, подсчитывали и доводили до соответствующего объема (например, до 5×106 клеток на 0,2 мл) для инъекции путем ресуспендирования клеточного концентрата в CMF-PBS.
Как отмечено выше, экспрессию CXCR5 контролировали, например, с помощью анализа FACS, используя коммерчески доступные антитела CXCR5, такие как MAB190 (R & D), клоны RF8B2 и 2G8 (2G8 представляет собой крысиное антимышиное антитело CXCR5, остальные приобретенные антитела являются античеловеческими антителами CXCR5) (BD), и 2C1 (Abnova), а также различные активные в отношении hCXCR5 поликлональные антитела, изготовленные стандартными в данной области методами.
Для облегчения создания плазмиды и повышения уровня экспрессии CXCR5 готовили олигонуклеотиды, соответствующие сигнальной последовательности первых 135 пар оснований кодирующей CXCR5 последовательности нуклеиновой кислоты. Изготовленные олигонуклеотиды были несколько модифицированы в положениях неоднозначности кодона для снижения количества герминативных центров (GC). Все изменения нуклеотидной последовательности были немыми, т.е. не приводили к изменению аминокислотной последовательности. После совместного отжига олигонуклеотидов созданную таким образом сигнальную последовательность связывали с остальной частью кодирующей последовательности методом ПЦР со сплайсингом перекрывающихся терминальных фрагментов PCR-SOE (Ho et al., Gene 77:51 (1989); и Horton et al., BioTechniques 8:528 (1990)).
Перед использованием клеток в качестве иммуногена проверяли степень экспрессии CXCR5. Клетки культивировали в RPMI-растворе (Invitrogen, Carlsbad, CA) с добавлением 10% FBS, 0,2 мМ глутамина и 1× раствора заменимых аминокислот, затем высевали примерно 3-5×105 клеток на лунку в стандартном сосуде T75 и выращивали в течение примерно 24-48 часов.
Трансформированные или трансфицированные клетки культивировали в течение примерно двух недель, пока не несущие экспрессирующих CXCR5 плазмид клетки не были селективно уничтожены антибиотиком. Клетки устойчивых клеточных линий можно лизировать, выделить из них белки и провести с ними вестерн-блоттинг.
Стабильно или временно трансфицированные клетки анализировали на экспрессию CXCR5, используя методы для обнаружения экспрессии CXCR5 на поверхности клеток, такие как FACS анализ. Кроме того, клетки можно лизировать и полученные белки анализировать, например методом вестерн-блоттинга. Трансфицированные клетки, собранные из чашек с культуральной средой, однократно промывали фосфатно-солевым буферным раствором (PBS), ресуспендировали в деионизованной воде, смешанной с равным объемом 2× загрузочного буфера для белковых образцов (BioRad, Hercules, CA), и затем выдерживали при температуре около 100°C в течение 10 минут. Мембранный белок анализировали с использованием кондиционированной среды, смешанной с равным объемом 2× загрузочного буфера для белковых образцов, выдерживая при 100°C в течение 10 минут. Образцы разделяли методом электрофореза в полиакриламидном геле SDS-PAGE, используя 4-12% градиентный гель. Затем белки переносили с геля на нитроцеллюлозную мембрану (BioRad, Hercules, CA), перед переносом блокированную 5% нежирным сухим молоком в фосфатном буфере с твином PBST (PBS с добавлением 0,05% TWEEN-20®) в течение не менее часа.
CXCR5 детектировали путем инкубирования мембраны с CXCR5-специфичными первичными антителами в блокирующем буфере в течение не менее часа при комнатной температуре с встряхиванием на шейкере. Затем мембрану промывали не менее трех раз, добавляли конъюгированные с репортером вторичные антитела в блокирующем буфере, и инкубировали не менее часа при комнатной температуре с встряхиванием на шейкере. Затем мембрану трижды промывали PBST и проявляли, например, используя хемилюминесцентный субстрат.
ПРИМЕР 2: ПОЛУЧЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CXCR5
Мышей линий A/J или BALB/cJ в возрасте примерно 4-6 недель (Jackson Labs, Bar Harbor, ME) иммунизировали CXCR5-трансфицированными клетками или содержащим внеклеточный домен CXCR5 пептидом. В день 0 группу мышей первично внутрибрюшинно инфицировали 1:1 эмульсией конъюгированного с KLH пептида в смеси с адъювантом (полный адъювант Фрейнда, CFA), в день 20 повторно внутрибрюшинно инфицировали смесью пептида с неполным адъювантом Фрейнда (IFC) и/или клетками в фосфатном буфере без адъюванта, и в третий раз инфицировали внутривенно в день 44 смесью конъюгированного с KLH пептида в IFC и (или клетками) в фосфатном буфере без адъюванта. Другую группу мышей первично внутрибрюшинно инфицировали в день 0, повторно внутрибрюшинно инфицировали в день 15, 39, 53 и 67, и наконец, инфицировали внутривенно в день 81 (все инъекции выполняли с взвесью клеток в фосфатном буфере без адъюванта). Для обеих групп мышей каждая инъекция содержала примерно от 3×106 до 2×107 клеток в объеме примерно 200 мкл. В другом варианте, иммунизацию пептидом и/или клетками проводили каждые две недели, 3-6 раз до достижения желаемого титра анти-CXCR5, который определялся, например, методами FACS или ELISA.
Через три дня после последней инъекции в некоторых случаях мышей, проверяли на титр анти-CXCR5 в плазме крови, умерщвляли, извлекали селезенку и помещали ее в чашку Петри, содержащую примерно 10 мл бессывороточной модифицированной способом среды Дульбекко-Игла (DMEM) (Gibco). Спленоциты пинцетом отделяли от капсулы и дважды промывали в 10 мл бессывороточной модифицированной способом Исков среды Дульбекко (IMDM) (Cellgro, Herndon, VA) при температуре 37ºC. Взвесь клеток селезенки переносили в пробирку с коническим дном объемом 15 мл и ждали осаждения взвеси в течение примерно 2-5 минут. Содержащий спленоциты супернатант переносили в чистую пробирку с коническим дном объемом 15 мл и перед проведением слияния еще трижды промывали IMDM. Отобранные из разных животных спленоциты мыши можно объединять.
В некоторых случаях из неиммунизированной мыши готовили 5 мл одноклеточной взвеси контрольных фидерных спленоцитов, практически как описано выше для иммунизированных спленоцитов, и поместили ее в инкубатор (37°C, 5% CO2) для будущего использования.
Роль партнера для слияния для иммунизированных спленоцитов может играть гипоксантин/аминоптерин/тимидин (HAT)-чувствительная, несекретирующая клеточная линия миеломы, такая как P3X63-AG8.653 или SP2/0 (ATCC, Manassas, VA), или FO_B лимфобласты (ATCC, CRL-1646)). Перед слиянием лимфоидные клетки выдерживали в IMDM/10% FBS (37°C, 7% CO2), следя за тем, чтобы в день слияния клетки находились в логарифмической фазе роста. Другой возможный механизм отбора основан на использовании азасерина, который обычно добавляют через день после проведения слияния.
Слияние проводили, следуя гибриду протоколов, предложенных в работах Lerner (Yale J Biol Med, 1981, 54(5)387-402) и Gefter et al. (Somatic Cell Genet, 1977, 3(2)231-236). Перед слиянием объединенные фракции спленоцитов трижды промывали бессывороточной IMDM и подсчитывали клетки. Также непосредственно перед слиянием находящиеся в логарифмической фазе миеломные клетки трижды промывали бессывороточной IMDM и подсчитывали. Лимфоидные клетки ресуспендировали до концентрации 1×107 клеток на мл в бессывороточной IMDM. Для каждого слияния 1-1,5×108 спленоцитов смешивали с 1-3×107 миеломных клеток в полипропиленовой пробирке объемом 50 мл с коническим дном, и однократно промывали клетки бессывороточной IMDM. Соотношение спленоцитов к миеломным клеткам составляло 5:1. Пробирки центрифугировали при 500×g в течение 10 минут для осаждения клеток. После удаления супернатанта осадок осторожно ресуспендировали путем постукивания по дну пробирки. Затем пробирки помещали в сосуд с водой при 37°C. Все последующие стадии слияния проводили в этом сосуде.
Затем медленно, в течение примерно одной минуты, добавляли 1 мл предварительно нагретого до 37°C полиэтиленгликоля 1500 (Roche Applied Science, Indianapolis, IN) к клеточному осадку в каждой пробирке при легком покачивании пробирки. Клетки инкубировали в полиэтиленгликоле в течение примерно одной минуты, затем в каждую пробирку в течение 30 секунд по каплям добавляли по одному мл бессывороточной IMDM, затем в течение следующей минуты в каждую пробирку добавили еще по 9 мл бессывороточной IMDM. Пробирки центрифугировали при 500×g в течение 10 минут при комнатной температуре и затем супернатант аспирировали. Клеточный осадок ресуспендировали в 100 мл фильтрованной полной среды для производства гибридом (500 мл IMDM (Cellgro) с добавлением 10% FBS (SeraCare, Millford, MA), 0,2 мМ L-глутамина, 1× раствора заменимых аминокислот, 1 мМ пирувата натрия, 0,01% смеси пенициллина и стрептомицина (pen-strep, Invitrogen), и 1× смеси гипоксантина и тимидина (HT supplement, Invitrogen)).
Каждую клеточную взвесь объемом 100 мл высадили в 10 96-луночных титрационных микропланшетов с плоским дном с объемом примерно 100 мкл/лунку. Планшеты выдержали в инкубаторе при температуре 37°C, в атмосфере 7% CO2. На 2-ой день после слияния клетки отобрали путем добавления 5,7 мкМ раствора азасерина в IMDM к получившимся в результате слияния гибридым клеткам в количестве 100 мкл на лунку. Из содержащих клоны лунок собрали супернатанты для первичного скрининга, как правило, на 10-14 день после слияния. Эффективность слияния составила 75-99% (в 720-950 из 960 возможных лунок образовались клоны, на которых проводили скрининг).
Для первичного скрининга можно использовать радиоиммуноанализ (RIA), предназначенный для детектирования антител, связывающихся с человеческим CXCR5. Для проведения радиоиммунноанализа раствор аффинно-очищенного козьего антимышиного IgG (специфичного к Fc фрагменту) (Cappell, Cochranville, PA) в фосфатном буфере наносили на 96-луночные ПВХ титрационные микропланшеты (50 мкл/лунку) и инкубировали в течение ночи при температуре 4°C. Затем козий антимышиный IgG удаляли с планшета, и лунки в течение часа блокировали 5% раствором FCS в фосфатном буфере (PBS/5% FCS, 100 мкл/лунку) при комнатной температуре. После удаления блокирующего раствора в лунки добавляли чистый супернатант культуры гибридомы (50 мкл/лунку), и планшет инкубировали 1 час при комнатной температуре. Затем планшеты трижды промывали фосфатным буфером с 0,05% Tween-20 (PBS/0,05% Tween-20). Далее в каждую лунку добавляли 50 мкл 125I-CXCR5 (активность ~20000 cpm) в PBS/5% FCS, и планшеты инкубировали в течение одного часа при комнатной температуре. Наконец, лунки трижды промывали PBS/0,05% Tween-20. После полного и быстрого удаления промывочного буферного раствора планшет разрезали на отдельные лунки, которые анализировали на гамма-радиометре. В качестве фонового контроля использовали лунки, в которые вместо супернатанта клеточной культуры добавляли PBS/5% FCS.
Очищенный CXCR5 метили изотопом 125I по методу Болтона-Хантера, главным образом следуя описанию, приводимому поставщиком реагента Болтона-Хантера (New England Nuclear, Boston, MA). Качество полученного 125I-CXCR5 контролировали путем проверки того, что процедура введения метки не привела к разрушению эпитопов, опознаваемых коммерчески доступными антителами CXCR5 (R & D или Becton Dickinson, Mountain View, CA).
При первичном скрининге клоны считаются положительными, если по результатам радиоиммунноанализа количество меток в супернатанте образцов оказывается примерно в 10 раз больше, чем для фонового контроля. Положительные клоны извлекают, обогащают и хранят в замороженном виде.
Процедуру первичного скрининга гибридомы разрабатывали для определения того, опознает ли антитело нативные эпитопы CXCR5. Эта цель была достигнута с помощью анализа FACS поверхностных CXCR5 на поверхности клеток CXCR5+, окрашенных моноклональными антителами, для визуализации связывания использовали козье антимышиное вторичное антитело с флюоресцентной меткой. При первичном скрининге клоны считались положительными, если по результатам анализа FACS количество меток в супернатанте образцов было примерно в 10 раз больше, чем для фонового контроля. Также для локализации эпитопов CXCR5, с которыми связывались антитела, проводили конкурентный анализ с антителами CXCR5. Положительные клоны извлекали, обогащали и хранили в замороженном виде
ПРИМЕР 3: КЛЕТОЧНЫЙ АНАЛИЗ СВЯЗЫВАНИЯ
ДЛЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CXCR5
Для характеризации моноклональных антител к CXCR5 использовали клеточный анализ связывания. Например, можно использовать описанные выше экспрессирующие CXCR5 трансфицированные клетки, такие как hCXCR5/HEK293. Полноразмерную открытую рамку считывания человеческого CXCR5 клонировали в вектор, например pCDNA3.1neo DEST (Invitrogen, Carlsbad, CA). Кодирующую CXCR5 область синтезировали методом ОТ-ПЦР, используя в качестве матрицы РНК человеческого мозга и печени (Ambion, Inc., Austin, TX). Созданный таким образом плазмидный гибрид CXCR5/CDNA3.1neo экспрессировал полноразмерный белок CXCR5. Стабильную линию клеток, экспрессирующих CXCR5, получили трансфекцией плазмидного гибрида CXCR5/pCDNA3.1neo в клетки CHO или HEK293 (ATCC No. CRL-1573), используя стандартный и коммерчески доступный набор реагентов Lipofectamine 2000. После трансфицирования клетки культивировали в среде DMEM в течение ночи, затем пересевали их в среду с добавлением 200 мкг/мл неомицина и культивировали 12-14 дней. Выделенные одиночные колонии отбирали и выращивали в отдельных лунках до наработки достаточного количества клонированных клеток. Стабильные клоны, устойчивые к неомицину и экспрессирующие высокие уровни белка CXCR5, идентифицировали методом FACS анализа с использованием поликлональных антител к CXCR5 (R&D Systems, Minneapolis, MN) или специально изготовленных поликлональных антител.
Методом FACS анализа также подтвердили экспрессию CXCR5 для нативно экспрессирующих CXCR5 клеток человека линии HS Sultan (ATCC No. CRL-1484). Клетки HS Sultan выращивали в растворе RPMI 1640, содержащем 10% эмбриональной телячьей сыворотки, 0,2 мМ глутамина, и 0,1% раствор пенициллина/стрептомицина (100 мкг/мл пенициллина и 10 мкг/мл стрептомицина).
Степень связывания антител с клетками можно анализировать, используя флюоресцентную макроконфокальную систему высокопроизводительного скрининга FMAT™ 8100 HTS или систему клеточного детектирования 8200 Cellular Detection System (Applied Biosystems, Foster City, CA), следуя прилагаемым производителем протоколам. Клеточные линии, нативно экспрессирующие CXCR5 или стабильно трансфицированные экспрессирующими CXCR5 плазмидными гибридами, высевали в 96-луночные планшеты. Кроме того, в 96-луночный планшет высевали временно трансфицированные клетки линий 293T или CHO. Клетки высевали с плотностью 5000-30000 клеток на лунку. Через 20-24 часа в лунки совместно добавляли моноклональные антитела к CXCR5 и конъюгированные с FMAT козьи антимышиные IgG антитела, и планшеты инкубировали в течение 1 часа, 2 часов, 4 часов или ночи при комнатной температуре.
Степень связывания антител с клетками также анализировали методом FACS, используя экспрессирующую CXCR5 устойчивую клеточную линию HEK293/CXCR5. Клетки инкубировали с моноклональными антителами к CXCR5 в фосфатном буфере. После трехкратной промывки клетки инкубировали с вторичными антителами, конъюгированными с флюоресцирующей молекулой (BD Sciences, Palo Alto, CA).
Результаты показали, что несколько моноклональных антител связываются с CXCR5, экспрессируемыми из рекомбинантных плазмидных гибридов. Например, клоны 11D6, 14C9, 19H5, H28, 54G6, G7, 56H6, 79B7 и 16D7, а также гуманизированные варианты последнего антитела, 16D7, 16D7-HC1-LC3, 16D7-HC1-LC2, 16D7-HC1-LC1 и 16D7-HC2-LC1, используемое в качестве отрицательного контроля антитело IL13, CA13, положительные контроли, MAB190, 2C1 и RF8B2, три мышиных изотипных контроля к IgG1, IgG2a и IgG2b, и крысиный IgG2b изотипный контроль (соответствующий RF8B2), проверили на связывание с клетками HEK293, трансфицированными для экспрессии CXCR5. Используемые в качестве положительных контролей антитела 2C1 и MAB190 связываются с CXCR5 клетками. RF8B2 демонстрировал промежуточные уровни связывания. Используемые в качестве отрицательных контролей антитела показали только фоновый уровень связывания. Профили связывания всех антител, за исключением CA13, с клетками hCXCR5/HEK293 и кинетики титрования были сходны с соответствующими профилями и кинетиками для исходного антитела 16D7 и для 79B7.
Временно трансфицированные клетки HEK293, содержащие CXCR5/неоплазмиду, также окрашивали иммунофлюоресцентными методами, как описано выше, и наблюдали с помощью флюоресцентной микроскопии. Клеточные FMAT и FACS анализы подтверждали, что моноклональные антитела действительно связываются с CXCR5, экспрессируемыми либо из рекомбинантных плазмидных гибридов, либо как нативный белок в культивируемых клетках. Сигнал связывания считается положительным при получении выходного сигнала FMAT анализатора, существенно превышающего сигнал фонового связывания и связывания с клонами отрицательных гибридом (p>0,01).
Вырабатываемые моноклональные антитела CXCR5, такие как 16D7, 14C9, 19H5, H28, 54G6, G7, 56H6 и 79B7, связывались с внеклеточным доменом и препятствовали связыванию CXCL13 с CXCR5 на клетке.
ПРИМЕР 4: АНАЛИЗ АФФИННОСТИ МЕТОДОМ BIACORE
Синтезировали N-терминальный внеклеточный участок CXCR5 (аминокислоты 1-59) человека и мыши с терминальным биотиновым маркером, который затем использовали в анализе методом поверхностного плазмонного резонанса (Biacore) прямого типа, когда исследуемые пептиды иммобилизуют на поверхности сенсорного чипа, и затем определяют кинетику взаимодействия антител с фиксированными на чипе пептидами. Синтетические пептиды иммобилизовали на чипе Biacore до достижения плотности примерно 20 единиц отклика (RU). Затем для проведения кинетических измерений чип обрабатывали моноклональными антителами, следуя рекомендациям производителя (GE Healthcare, Piscataway, NJ).
Клон мышиного анти-hCXCR5 моноклонального антитела, 16D7, имел рассчитанную константу KD=2,16х 10-12 M; мышиный/человеческий IgG4 химерный 16D7 (вариабельные домены VH и VL 16D7, привитые на константный домен человеческого иммуноглобулина IgG4 Fc, последовательность которого известна специалистам в области, с возможной оптимизацией кодона, с использованием стандартных методов, таких как клонирование, амплификация концов, определение массы участков и клонирование отдельных частей) имел KD=1,41×10-12 M; и различные гуманизированные варианты 16D7, для которых структура вариантов и модификация тяжелых и легких цепей обозначается с использованием символов “HC_” для конкретной тяжелой цепи и “LC_” для конкретной легкой цепи, привитых на иммуноглобулиновый остов IgG4, где состав цепей приводится ниже, имели следующие константы: 16D7-HC1-LC1 имел KD=3,11×10-12 M; 16D7-HC1-LC2 имел KD=1,41×10-12 M; 16D7-HC2-LC1 имел KD=2,40×10-12 M; 16D7-HC1-LC3 имел KD=1,21×10-12 M; 16D7-HC3-LC4 имел KD=4,92 ×10-12 M; 16D7-HC3-LC5 имел KD=1,84×10-10 M; и 16D7-HC1-LC6 имел KD=9,17×10-11 M.
SAR 113244, разновидность гуманизированного варианта 16D7, 16D7-HC1-LC3, несущая замены S241P и L248E (замены выполняли с использованием известных методов и реагентов, использовали систему нумерации по Кабату), захватывали на сенсорный чип Biacore предварительно иммобилизованными мышиными античеловеческими IgG Fc антителами, и затем использовали для проведения Biacore анализа обратного типа, когда определяется кинетика взаимодействия немаркированного N-терминального пептида (аминокислоты 1-59) человеческого CXCR5 с моноклональными антителами на чипе. Для величин констант KD для SAR 113244, были получены значения 1,13±0,08×10-11 M. Величины констант KD, определенных в анализе прямого типа с использованием иммобилизованного на поверхности чипа биотинилированного человеческого пептида, и SAR 113244 в качестве аналита, согласовывались с величинами констант, полученных в анализе обратного типа.
ПРИМЕР 5: ВЕСТЕРН-БЛОТ АНАЛИЗ АКТИВНОСТИ СВЯЗЫВАНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CXCR5
Для оценки активности связывания моноклональных антител к CXCR5 в условиях денатурации, а также уровней экспрессии CXCR5 и других связанных с CXCR5 белков в клетках линий человека проводили вестерн-блоттинг. Кроме того, готовили образцы белков из стабильно трансфицированных клеток, используя набор реагентов для извлечения белков млекопитающих M-PER (Pierce, Rockland, IL, Cat # 78501) и следуя инструкциям производителя, и нагревали при температуре 70°C в течение 10 минут после добавления равного объема 2× загрузочного буфера для белковых образцов. Все образцы разделяли методом электрофореза в полиакриламидном геле SDS-PAGE, используя 4-12% градиентный гель. Затем белки переносили с геля на ПВДФ мембрану, и мембрану для блоттинга обрабатывали моноклональными антителами к CXCR5 в качестве первичного детектирующего антитела. Для детектирования использовали конъюгированные с Alexa 680 вторичные антитела, мембраны сканировали с помощью системы инфракрасного сканирования Odyssey (Licor, Lincoln, Nebraska) или используя химилюминесценцию (ECL). Положительные контрольные антитела человеческого CXCR5 получали, как описано в данном документе.
ПРИМЕР 6: FACS АНАЛИЗ ДЛЯ КОНТРОЛЯ ИНТЕРНАЛИЗАЦИИ CXCR5
У здоровых добровольцев отбирали клетки лейкоцитарной пленки (Gulf Coast Blood Center, Houston, TX). Мононуклеарные клетки периферической крови (PBMC) человека выделяли стандартным градиентным методом Фиколл-Гипак. PBMC культивировали (0,5×106 клеток/лунку) в 96-луночном планшете при 4°C. Каждая лунка содержала 0,2 мл раствора RPMI 1640 с добавлением 10% FBS в присутствии/в отсутствие моноклональных антител (10 мкг/мл). После 30 минут инкубации среду меняли на свежий холодный раствор RPMI 1640 с добавлением 10% FBS, не содержащий антител. Клетки переносили в прогретую до 37°C увлажненную камеру для выращивания культур, содержащую 5% CO2. Обработанные моноклональными антителами клетки собирали немедленно, через 2 и через 24 часа после переноса клеток на 37°C. Клетки однократно промывали фосфатным буфером и инкубировали в холодном фосфатном буфере с добавлением 1% БСА (PBSB) в течение 30 минут. Затем клетки окрашивали конъюгированным с фикоэритрином античеловеческим CXCR5 (BD Biosciences). Через 30 минут клетки трижды промывали PBSB и фиксировали в 1% растворе параформальдегида в течение ночи. На следующий день с помощью проточного цитометра BD FACSCalibur™ system (BD Biosciences, San Jose, CA) анализировали присутствие CXCR5.
ПРИМЕР 7: FLIPR АНАЛИЗ
Изменения внутриклеточного содержания кальция определяли путем нанесения на планшет по 9000 клеток/лунку и инкубирования в течение ночи. Использовали клетки линии RBL-2H3, стабильно трансфицированные человеческим CXCR5. Затем клетки промывали и обработали 2 мМ раствора fluo-4/AM (Molecular Probes) в буфере, содержащем 2,5 мМ пробеницида. Клетки обработали моноклональными антителами CXCR5 и промывали буфером. Затем клетки обработали 10 нМ CXCL13 (R&D). Изменения внутриклеточного уровня Ca+2 регистрировали с помощью FLIPR анализатора 384-B (Molecular Devices). В качестве контроля использовали коммерчески доступные античеловеческие моноклональные антитела CXCR5, мышиные IgG1 и IgG2b.
Как будет обсуждаться далее, было создано несколько гуманизированных вариантов моноклональных антител 16D7, таких как химерное 16D7 (химера hIgG4), 16D7-HC1-LC1, 16D7-HC1-LC2, 16D7-HC2-LC1, 16D7-HC1-LC3, 16D7-HC3-LC4, 16D7-HC3-LC5 и 16D7-HC1-LC6, которые были проверены на биологическую активность, отражаемую в потоке ионов кальция.
Гуманизированные антитела, за исключением отрицательного контроля, CA13, показали на трансфицированных клетках со стабильной экспрессией CXCR5 активность в отношении нейтрализации сигнала, равную активности исходного антитела 16D7.
ПРИМЕР 8: ХЕМОТАКСИЧЕСКИЙ АНАЛИЗ
Клетки CXCR5+ HS Sultan (ATCC CRL1484) помещали в верхнюю камеру платы для хемотаксиса (TransWell plate, Millipore) в количестве 0,5×106 клеток/лунку в присутствии 100 нМ CXCL13 (R&D) или буфера CTX (RPMI-раствор без фенолового красного, содержащий 1% FBS, 0,5% БСА и 1 нМ пирувата натрия) и подсчитывали клетки, мигрирующие в нижнюю камеру. Камеры собрали и инкубировали в течение двух часов. Клетки в нижней камере подсчитывали после добавления колориметрического реагента (Promega), измеряя OD490.
CXCR5-специфичную миграцию определяли как разницу между полным количеством мигрировавших клеток и количеством самопроизвольно мигрировавших клеток. При анализе на антитела к CXCR5 клетки инкубировали с антителом в течение 30 минут перед помещением в верхнюю камеру платы. Степень ингибирования антителом определяли как отношение специфичной миграции в присутствии антитела к величине миграции в отсутствие антитела. Отношение можно умножить на 100% для получения процентного выражения степени ингибирования.
Антитела примера 7 сравнили с исходным антителом 16D7 по способности нейтрализовать хемотаксис. Все гуманизованные антитела, за исключением отрицательного контроля, CA13, показали профиль нейтрализации хемотаксиса, сравнимый с профилем для 16D7 и 79B7, 14C9, 19H5, H28, 54G6, G7, 56H6. Антитело MAB190 (R&D) показало промежуточную активность, а H28 и антитело 2C1 (Abnova) были не в состоянии полностью нейтрализовать индуцированную лигандом миграцию клеток.
ПРИМЕР 9: АНАЛИЗ РЕАКТИВНОСТИ ПЕРВИЧНЫХ B КЛЕТОК ЧЕЛОВЕКА
Мононуклеарные клетки периферической крови (PBMC) человека выделяли из цельной крови на колонках Accuspin (Sigma). Затем PBMC ресуспендировали в окрашивающем буфере BD Stain buffer (Becton Dickinson) до концентрации 20 миллионов клеток/мл. Один мкг мышиных античеловеческих CXCR5 моноклональных антител добавляли к 50 мкл PBMC и выжидали 20 минут при температуре 4°C для связывания. Клетки дважды промывали окрашивающим буфером BD. К смеси PBMC и антитела добавляли 50 мкл вторичного антитела, разведенного 1/100 козьего антимышиного IgG-PE F(ab') (Beckman Coulter), и выжидали 20 минут при температуре 4°C для связывания. Клетки трижды промывали окрашивающим буфером BD. К клеткам добавляли смесь, содержащую мышиные античеловеческие CD20-FITC (BD) и CD4-APC (BD) в разведении 1/50 каждое, полученную смесь инкубировали 20 минут при температуре 4°C для оценки специфичности к B/T-клеткам. Клетки трижды промывали окрашивающим буфером BD, ресуспендировали в 250 мкл окрашивающего буфера BD, и провели с ними FACS анализ на анализаторе FACStar Plus. В качестве положительного контроля использовали мышиное античеловеческое CXCR5 антитело (R&D; mAb190). Для гуманизированных антител получали кривые титрования и построили зависимость средней интенсивности флюоресценции (Mean Fluorescence Intensity, MFI) от концентрации.
Гуманизированные антитела примера 7 проверили на связывание с клетками PMBCs человека.
Все антитела, за исключением отрицательного контроля CA13, связывались и имели одинаковый профиль титрования на B-клетках человека. Отрицательный контроль CA13 показал только фоновое связывание. Клон RF8B2 (BD) плохо связывался с клетками PMBCs человека.
ПРИМЕР 10: АНАЛИЗ РЕАКТИВНОСТИ B-КЛЕТОК МАКАКИ (CYNOMOLGUS)
Цельную кровь макаки Cynomolgus (cyno) получали из компании Bioreclamation, Inc. (Hicksville, NY). Кровь была получена в специализированных пробирках для изготовления клеток BD Cell Preparation Tube (CPT) после центрифугирования. Содержащиеся в плазматическом слое мононуклеарные клетки периферической крови макаки (cyno PBMC) переносили из пробирки CPT в пробирку объемом 50 мл, не затрагивая слой градиентного геля в пробирке CPT. Пробирку промывали 5 мл фосфатного буфера для полного извлечения всех клеток, использованный при промывке раствор собирали в отдельную пробирку объемом 50 мл. Клетки cyno PBMC центрифугировали на 1200 об./мин. в течение 10 минут при температуре 4ºC. Полученный осадок ресуспендировали в 1 мл окрашивающего буфера BD для FACS анализа (BD). Для каждого анализа использовали один миллион клеток. Один мкг мышиного античеловеческого CXCR5 моноклонального антитела (очищенного) добавляли к 50 мкл клеток PBMC и выжидали 20 минут при температуре 4°C для связывания. Клетки дважды промывали окрашивающим буфером BD. К смеси PBMC и антитела добавляли 50 мкл вторичного антитела, разведенного 1/100 козьего антимышиного IgG-PE F(ab') (Beckman Coulter), и выжидали 20 минут при температуре 4°C для связывания. Клетки трижды промывали окрашивающим буфером BD. К клеткам добавляли смесь, содержащую мышиные античеловеческие CD20-FITC (BD) и CD4-APC (BD) в разведении 1/20 каждое, полученную смесь инкубировали 20 минут при температуре 4°C для оценки специфичности к B/T-клеткам. Клетки трижды промывали окрашивающим буфером BD, ресуспендировали в 250 мкл окрашивающего буфера BD, и проводилили с ними FACS анализ на анализаторе FACStar Plus. В качестве положительного контроля использовали коммерчески доступное мышиное античеловеческое CXCR5 антитело (R&D; mAb190).
Мышиное моноклональное антитело 11D6 по данному изобретению, активное в отношении человеческого CXCR5, сравнивали с изотипным IgG контролем. Гуманизированные варианты 16D7 и коммерчески доступные антитела MAB190 проверяли на активность в отношении CXCR5 макаки. Также проверяли 79B7.
Положительные в отношении CD20 и CXCR5 клетки выявили с помощью MAB190 и 11D6. С другой стороны, 16D7 и его гуманизированные варианты, а также G7, RF8B2 (BD) и 2C1 (Abnova) не связывались с B-клетками макаки. 14C9, 19H5, H28, 54G6, 56H6 и 79B7 также связывались с B-клетками макаки.
Для изучения клеток периферической крови использовали антитела по данному изобретению к CXCR5. B-клетки экспрессировали CXCR5, и по меньшей мере в одном эксперименте примерно 10% периферических T-клеток также экспрессировали CXCR5.
ПРИМЕР 11: СЕКВЕНИРОВАНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CXCR5
Мышиные моноклональные антитела изотипировали, используя коммерчески доступный набор для изотипирования. Секвенировали вариабельные последовательности 16D7 и других моноклональных антител к CXCR5. Используя набор Qiagen Qianeasy miniprep и следуя прилагаемому к набору протоколу, выделили полную РНК из примерно пяти миллионов клеток гибридомы. Для синтеза кДНК использовали набор реагентов Invitrogen Superscript kit (Cat 11904-018), следуя прилагаемым к набору протоколам.
Вариабельные области тяжелой цепи и легкой цепи сначала амплифицировали, используя следующие вырожденные ПЦР праймеры и полимеразу Taq (Roche) на основе методов, описанных в работе Wang et al. J Immunol Methods. 233:167-77, 2000.
Тяжелая цепь: левый праймер:
1: CTTCCGGAATTCSARGTNMAGCTGSAGSAGTC (SEQ ID №:2)
2: CTTCCGGAATTCSARGTNMAGCTGSAGSAGTCWGG (SEQ ID №:3)
Тяжелая цепь: правый праймер:
GGAGGATCCATAGACAGATGGGGGTGTCGTTTTGGC (SEQ ID №:4)
Легкая цепь: левый праймер:
GGAGCTCGAYATTGTGMTSACMCARWCTMCA (SEQ ID №:5)
Легкая цепь: правый праймер:
TATAGAGCTCAAGCTTGGATGGTGGGAAGATGGATACAGTTGGTGC (SEQ ID №:6)
где R может быть A или G; N может быть A, G, T или C; M может быть A или C; W может быть A или T; S может быть G или C; и Y может быть C или T.
Продукты ПЦР клонировали в плазмиду pCR4-TOPO®, используя набор реагентов для клонирования Invitrogen TOPO TA cloning® kit (Cat #: 45-0641), и затем секвенировали, используя праймеры T3 и T7. Полученные последовательности сравнивали программой BLAST с базой данных генов для поиска сигнальных последовательностей для клонирования полных вариабельных участков. По результатам компьютерного анализа BLAST для второго этапа ПЦР амплификации с использованием Pfx полимеразы (Invitrogen) были выбраны следующие праймеры (Chardes et al., FEBS Letters 452:386-394, 1999).
Тяжелая цепь:
Левый праймер:
CCAAGCTGTGTCCTRTCC (SEQ ID №:7)
Правый праймер:
CGACAAGTCGACTAGCCCTTGACCAGGCATCC (SEQ ID №:8)
Легкая цепь:
Левый праймер:
WTCTCTRGAGTCAGTGGG (SEQ ID №:9)
Правый праймер:
CGACTAGTCGACTGGTGGGAAGATGGATACAG (SEQ ID №:10)
Продукты ПЦР клонировали в плазмиду pCR-Blunt II®-TOPO®, используя набор реагентов для клонирования Invitrogen Zero Blunt® TOPO® PCR cloning kit (Cat 45-0245), и секвенировали, используя праймеры T7.
После секвенирования легкой и тяжелой цепей нуклеиновые кислоты можно перекодировать для оптимизации экспрессии, например в человеческих клетках-хозяевах.
ПРИМЕР 12: ТРАНСФЕКТОМЫ
Клетки NS0-eu растили до плотности 1×106 клеток/мл. Клетки поддерживали в экспоненциальной фазе роста и заменяли среду за день до трансфекции. В день трансфекции промывали 40×106 клеток. Затем к клеточной взвеси добавляли 10 мкг линеаризованной нуклеиновой кислоты, такой как ДНК легкой цепи, и 10 мкг, например, линеаризованной ДНК тяжелой цепи (полный объем ДНК должен быть меньше 50 мкл), и инкубировали культуру на льду в течение 15 минут. Смесь клеток и ДНК переносили в охлажденную кювету (0,4 см) и подавали электрический импульс (750 В и 25 мкФ). Сразу же после электрического импульса кювету помещали на лед и выдерживали на льду 10-15 минут. Затем клетки собирали и высеивали на планшет. Клетки инкубировали в инкубаторе с 5% CO2 в течение 12-16 дней или до появления колоний. Супернатант клеточных колоний или выращенные во взвеси клетки проверяли иммуноферментным анализом (ELISA), и выявленные положительные трансфектомы клонировали на свежей среде. Для дальнейшего скрининга на положительные трансфектомы проводили титрационный ИФА (ELISA) или анализ Biacore. Обогащенные трансфектомы содержали в сосудах для шейкера и собирали из супернатанта антитела или их производные.
ПРИМЕР 13: АНАЛИЗЫ IN VIVO
Для демонстрации эффективности антител в отношении TNFα (Williams et al., PNAS 1992, 89:9784-9788), а также слитых белков CTLA-4 и TNFα (Webb et al., Eur J Immunol. 1996, 26:2320-2328; и Wooley et al., J Immunol. 1993, 151:6602-6607) использовали коллаген-индуцированный артрит (CIA) - хорошо известную модель ревматоидного артрита (RA) человека. Для крысиного антимышиного моноклонального антитела CXCR5, клона 1038, получали профиль в мышиной модели CIA, в которой мышей линии DBA/1J иммунизировали и затем повторно инфицировали куриным коллагеном типа II. Степень тяжести болезни (которую оценивали визуально путем измерения степени опухания лапок и воспаления) проверяли два раза в неделю, а собранные по окончании исследования суставы анализировали на изменение степени воспаления, паннус, разложение хрящевой ткани и эрозию костной ткани. Клон 1038 при введении в режим профилактического дозирования приводил к значительному снижению как степени тяжести болезни, так и степени патологии суставов по сравнению с CIA мышами, получавшими изотипное лечение (ANOVA на повторных измерениях, p<0,05).
Для оценки эффективности 16D7-HC1-LC3 в in vivo хемотаксисе использовали модель мыши с острой формой заболевания. Вкратце, мышей линии C57/Bl6 (возраст 8-16 недель) с селективной экспрессией huCXCR5 на иммуноцитах, таких как B-клетки, T-клетки и нейтрофилы, получали традиционными трансгенными методами с использованием промотора CD11a. В используемой модели in vivo хемотаксис стимулировался нейтрофилами. При внутрибрюшинном введении 20 мкг лиганда huCXCL13 (R&D) экспрессирующие рецептор huCXCR5 нейтрофилы мыши мигрировали в брюшную полость в ответ на возникновение градиента концентрации huCXCL13. Через 80 минут после внутрибрюшинного введения huCXCL13 брюшную полость промывали для извлечения клеток и проводили флюороцитометрический анализ для определения числа экспрессирующих huCXCR5 нейтрофилов, которые специфично мигрировали в брюшную полость в ответ на введение huCXCL13, в образцах перитонеальных смывов объемом 2 мл. Для идентификации нейтрофилов использовали фенотипические маркеры, такие как Ly6G, CD19 и CD11b. Подкожное введение гуманизированного анти-hCXCR5, 16D7-HC1LC3 в двух различных дозировках (7,5 мкг или 15 мкг) за 24 часа до введения huCXCL13 показало эффективность для снижения миграции экспрессирующих huCXCR5 нейтрофилов в брюшную полость в ответ на введение huCXCL13 по сравнению с изотипным контролем, причем для двух получавших антитело CXCR5 образцов не было зафиксировано статистически значимых отличий уровня нейтрофилов по сравнению с уровнем нейтрофилов у изотипного отрицательного контрольного образца. При дозе 1,5 мкг гуманизированное антитело CXCR5 имело низкий уровень подавления миграции нейтрофилов по сравнению с более высокими дозами антител CXCR5, проверенными в эксперименте.
ПРИМЕР 14: ИЗМЕНЕНИЕ ПОВЕРХНОСТИ АНТИТЕЛ (RESURFACING)
Изменение поверхности мышиного клона 16D7 провели, следуя процедуре, описанной в работе Proc. Natl. Acad. Sci. USA (1994) 91:969 и в патенте США № 5639641.
Последовательности областей VL и VH 16D7 сравнивали программой BLAST с банком данных по структуре белков Protein Data Bank PDB (Nucleic Acids Research, 28:235-242 (2000), также доступен в сети Internet), который содержит пространственные координаты для биологических макромолекул, и выбирали из него десять аминокислотных последовательностей для легкой и тяжелой цепей, наиболее близких к соответствующим последовательностям 16D7. Для идентификации последовательностей использовали идентификационные коды PDB.
Десятью самыми близкими гомологами к вариабельной легкой цепи оказались 1MJU (J Mol Biol 332:423-435, 2003), 1AE6 (Proteins 29:161-171, 1997), 1QYG (Pozharski et al., “Carving a Binding Site: Structural Study of an Anti-Cocaine Antibody” в “Complex with Three Cocaine Analogs”), 1UZG (J Virol 79:1223, 2005), 1UB5 (Beuscher et al., “Structure and Dynamics of Blue Fluorescent Antibody 19G2 at Blue and Violet Fluorescent Temperatures”), 1RUR (Proc Natl Acad Sci USA 110:2247-2252, 2004, 1FPT (Nat Struct Biol 2:232-243, 1995), 1QFU (Nat Struct Biol 6:530-534, 1999), 1NAK (Virology 315:159-173, 2003) и 1CGS (J Mol Biol 236:247-274, 1994) (избыточные последовательности удалили), а десятью самыми близкими гомологами к вариабельной тяжелой цепи оказались 1FNS (Nat Struct Biol 7:881-884, 2000), 1OAK (Nat Struct Biol 5:189-194, 1998), 1VFB (Proc Natl Acad Sci 91:1089-1093, 1994), 1CIC Nature 348:254-257, 1990), 1GIG (Acta Crystallogr D Biol Crystallogr 50:768-777, 1994), 1T4K (J Mol Biol 343:1269-1280, 2004), 1A7P (Marks et al.), 1FE8 (J Biol Chem 276:9985-9991, 2001), 1DL7 (J Exp Med 191:2101-2112, 2000) и 1YY8 (Cancer Cell 7:301-311, 2005). Самыми близкими гомологами легкой и тяжелой цепи оказались последовательности 1MJU и 1FNS, соответственно. Эти две последовательности использовали для построения гомологической модели вариабельных доменов, которую затем минимизировали по энергии путем минимизации координат атомов методом сопряженных градиентов с силовым полем CHARMM22 (J Comput Chem (1983) 4, 187; J Comput Chem (1986) 7, 591), реализованным в программном пакете Molecular Operating Environment (MOE) (Chemical Computing Group, Quebec, CA). Построенную модель использовали для поиска гипервариабельных областей и остовных остатков. Для каждого остатка вариабельной области каждого из десяти ближайших гомологов к вариабельной области каждого антитела рассчитали доступность растворителю и усреднили полученные значения в электронной таблице Excel, следуя протоколу Scitegic (Hill & Lewicki (2006) Statistics: Methods and Applications, Statsoft, Tulsa, OK). Положения с усредненной доступностью более 30% считали остатками, находящимися на поверхности. Положения с усредненной доступностью в диапазоне от 25% до 30% далее рассматривали в зависимости от степени их близости к петлям гипервариабельных участков.
Находящиеся на поверхности положения вариабельной области мышиного 16D7 сравнивали с соответствующими положениями для последовательностей антител человека. При поиске учитывали только остатки, имевшие долю доступной растворителю поверхности более 30%, включив также ряд остатков с долей доступной растворителю поверхности более 25%, фланкирующие доступные растворителю остатки. Для улучшения конвергации поиска в анализ также включили ряд консервативных остатков последовательностей всех иммуноглобулинов. Для анализа совпадений оставили только последовательности зародышевых линий. Для замены находящихся на поверхности остатков вариабельной области мышиного 16D7 выбирали поверхность вариабельной области антитела человека с наибольшей степенью совпадения находящихся на поверхности остатков, уделяя особое внимание положениям, находящимся в пределах 5,0 Е от гипервариабельной области.
Ни одна из полученных последовательностей не содержит известных эпитопов B клеток или T клеток, перечисленных в базе данных иммунных эпитопов человека Immune Epitope Database (IEDB, Immune Epitope Database and Analysis Resource web site; PLoS Biol. 2005;3(3):e91).
Исходные последовательности вариабельных доменов мышиного 16D7 имеют следующий вид:
легкая цепь (CDR подчеркнуты):
DIVMTQAAPSVAVTPRESVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRMSNLASGVPDRFSGSGSGTAFTLRI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:11); и
тяжелая цепь (CDR подчеркнуты)
QVQLKESGPGLVAPSQSLSITCTVSGFSLIDYGVNWIRQPPGKGLEWLGVIWGDGTTYYNSALKSRLSIRKDNSQSQVFL KMNSLQTDDTAMYYCARIVYWGQGTLVTVSA (SEQ ID №:12).
В набор сохраняемых остатков, находящихся на поверхности, при поиске для легкой цепи включили D1, V3, A7, P9, P15, R16, E17, S18, P45, G46, Q47, D65, R79, R82, E86, K108, E110 и K112.
Запрос на поиск для легкой цепи содержал определенный выше набор находящихся на поверхности остатков и консервативные аминокислоты, C23, W40, Q43, Y91, C93, F103, G104, G106 и T107, которые включили для конвергации протокола BLAST. В качестве всех остальных аминокислот могли присутствовать любые из 20 природных аминокислот. Поиск в программе BLAST вели по базе данных последовательностей антител зародышевых линий человека, подготовленной Международной информационной системой по иммуногенетике IMGT (International Immunogenetics Information Systems website, Molec Immunol, 2004, 40:647-659). Наилучшее совпадение получили для X72482 (protein_id=CAA51150.1), из которой была получена легкая цепь LC4. Предложили также два варианта участка VL4 (VL означает вариабельный участок легкой цепи), LC5 и LC6, для замены потенциально проблематичных остатков легкой цепи: мутацией одного доступного растворителю метионина (M51) на лейцин (LC5 и LC6), и заменой аспарагина N53 на остаток серина в одном потенциальном сайте деамидирования (LC6). В целом предложено три варианта вариабельной легкой цепи, содержащих от 4 до 6 мутаций по сравнению с исходным клоном мышиного 16D7. Соответствующие мутации даны в приводимой ниже таблице 1. В таблице приведена как последовательная нумерация, так и нумерация по Кабату.
В набор сохранившихся на поверхности остатков при поиске для вариабельной тяжелой цепи включили Q1, Q3, K5, S7, P9, L11, S15, Q16, S20, P41, G42, K43, S61, A62, K64, S65, R70, S74, Q75, Q86, T87, D88, Q103, L106, A111, A112 и K113 (последовательная нумерация). В набор инвариантных аминокислот, включенных в запрос BLAST для сходимости поиска, вошли C22, W36, I37, Q39, D89, Y93, C95, W101, G102, G104 и T105. Поиск в программе BLAST вели по базе данных последовательностей антител зародышевых линий человека, подготовленной IMGT. По результатам поиска оставили один вариант тяжелой цепи (HC3). Две VH области AF062266 (protein_id=AAC18304.1) и AY393082 (protein_id=AAS86018.1), показавшие наилучшее совпадение для набора находящихся на поверхности остатков, имели эквивалентные степени гомологии и одинаковые находящиеся на поверхности остатки. Поэтому для тяжелой цепи была оставлена только одна последовательность с десятью мутациями. Последовательности с меньшей степенью совпадения, имевшие иные находящиеся на поверхности остатки, были отброшены как имеющие менее полярные остатки, что указывает на потенциально меньшую растворимость.
|
Для легкой цепи предложено три варианта (LC4, LC5 и LC6). Индивидуальные мутации, вводимые посредством изменения поверхностности вариабельных цепей, указаны маленькими буквами и выделены подчеркиванием, гипервариабельные участки подчеркнуты. Ниже приведены последовательности вариабельных участков с измененной поверхностью, константный домен (IgG4) опущен.
LC4:
DIVMTQsAlS VAVTPgESVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRMSNLA SGVPDRFSGS GSGTAFTLkI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:13)
LC5:
DIVMTQsAlS VAVTPgESVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRlSNLA SGVPDRFSGS GSGTAFTLkI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:14)
LC6:
DIVMTQsAlS VAVTPgESVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRlSsnLA SGVPDRFSGS GSGTAFTLkI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:15)
Для тяжелой цепи предложен один вариант (VH3) (VH означает вариабельный участок тяжелой цепи). Мутации, вводимые через изменение поверхностности вариабельной цепи, указаны маленькими буквами и выделены подчеркиванием, гипервариабельные участки подчеркнуты. Последовательность константного домена опущена.
HC3:
QVQLqESGPG LVAPSeSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYN psLKSRLSIs KDNSkSQVFL KMNSLtaaDT AMYYCARIVY WGQGTLVTVS s (SEQ ID №:16)
Нуклеотидные последовательности получали методом ПЦР с перекрыванием терминальных фрагментов OE-PCR и клонировали в сайты NheI/HindIII вектора эписомной экспрессии pXL4214 (Durocher et al., NAR, 2002, 30(2), E9). Последовательности оптимизировали по кодону для экспрессии в клетках человека. Участок VL сливали с IGKC (AAH93097). Участок VH сливали с IGHG4 (AAH25985) с отсутствующим C-терминальным лизином (IGHG4∆K). Последовательности проверяли двухцепочечным секвенированием
LC4:
MGWSCIILFLVATATGVHSDIVMTQSALSVAVTPGESVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRMSNLASGVPDRFSGSGSGTAFTLKISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:17)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGAGCGCCCTCAGCGTGGCCGTGACCCCCGGCGAGAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCATGAGCAACCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGAAGATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:18)
LC5:
MGWSCIILFLVATATGVHSDIVMTQSALSVAVTPGESVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRLSNLASGVPDRFSGSGSGTAFTLKISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:19)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGAGCGCCCTCAGCGTGGCCGTGACCCCCGGCGAGAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCCTGAGCAACCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGAAGATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:20)
LC6:
MGWSCIILFLVATATGVHSDIVMTQSALSVAVTPGESVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRLSSLASGVPDRFSGSGSGTAFTLKISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:21)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGAGCGCCCTCAGCGTGGCCGTGACCCCCGGCGAGAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCCTGAGCAGCCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGAAGATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:22)
HC3:
MGWSCIILFLVATATGVHSQVQLQESGPGLVAPSESLSITCTVSGFSLIDYGVNWIRQPPGKGLEWLGVIWGDGTTYYNPSLKSRLSISKDNSKSQVFLKMNSLTAADTAMYYCARIVYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLG (SEQ ID №:23)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCCAGGTGCAGCTGCAGGAGAGCGGCCCCGGCCTGGTGGCCCCCAGCGAGAGCCTGAGCATCACCTGCACCGTGAGCGGCTTCAGCCTGATCGACTACGGCGTGAACTGGATCCGCCAGCCCCCCGGCAAGGGCCTGGAGTGGCTGGGCGTGATCTGGGGCGACGGCACCACCTACTACAACCCCAGCCTGAAGAGCCGCCTGAGCATCTCCAAGGACAACAGCAAGAGCCAGGTGTTCCTGAAGATGAACAGCCTGACCGCCGCCGACACCGCCATGTACTACTGCGCCCGCATCGTGTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGCGCCAGCACCAAGGGCCCTTCCGTGTTCCCTCTGGCCCCTTGCTCCCGGTCCACCTCCGAGTCCACCGCCGCTCTGGGCTGCCTGGTGAAGGACTACTTCCCTGAGCCTGTGACCGTGTCCTGGAACTCTGGCGCCCTGACCTCCGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTGACCGTGCCTTCCTCCTCCCTGGGCACCAAGACCTACACCTGTAACGTGGACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGTCCAAGTACGGCCCTCCTTGCCCTTCCTGCCCTGCCCCTGAGTTCCTGGGCGGACCTAGCGTGTTCCTGTTCCCTCCTAAGCCTAAGGACACCCTGATGATCTCCCGGACCCCTGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCTGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAGCAGTTCAATTCCACCTACCGGGTGGTGTCTGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAATACAAGTGTAAGGTCTCCAACAAGGGCCTGCCCTCCTCCATCGAGAAAACCATCTCCAAGGCCAAGGGCCAGCCTAGGGAGCCTCAGGTGTACACCCTGCCTCCTAGCCAGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGCTTCTACCCTTCCGACATCGCCGTGGAGTGGGAGTCCAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAGGCTGACCGTGGACAAGTCCCGGTGGCAGGAGGGCAACGTCTTTTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCTGGGCTGAAGCTT (SEQ ID №:24)
ПРИМЕР 15: ГУМАНИЗАЦИЯ
Последовательности областей VL и VH 16D7 проанализировали программой BLAST, ближайшими гомологами для вариабельной легкой цепи оказались 1MH5, 1MJJ и 1MJU (J Mol Biol 332:423-435, 2003) с эквивалентными степенями гомологии. В качестве шаблона выбирали последовательность 1MJU, исходя из высокой точности кристаллической структуры, которая для нее определена с разрешением до 1,22Е. Ближайшим гомологом для тяжелой цепи оказалась последовательность 1FNS (Nat Struct Biol 7:881-884, 2000). Выбранные последовательности, 1MJU и 1FNS, использовали для построения гомологической модели вариабельных доменов, которую затем минимизировали по энергии стандартными методами. Затем провели моделирование трехмерной гомологической модели 16D7 методами молекулярной динамики (MD) в течение 1,7 наносекунд, используя обобщенную модель растворителя Борна (см. Gallicchio&Levy, J Comput Chem 2004, 25:479-499).
Молекулярно-динамическое моделирование начали с выбора начальных значений скоростей в соответствии с гауссовым распределением при температуре 298,15K с последующим периодом прихода к равновесию длительностью 300 пс. При моделировании наличие всех связей учитывали с помощью алгоритма SHAKE (см. Barth. et al., J Comp Chem, 1995, 16:1192-1209), использовали шаг по времени 1 фемтосекунду (фс), моделирование вели на основе алгоритма интегрирования Верле в каноническом ансамбле NVT (число частиц, объем и температура) при температуре 298,15K. В процессе моделирования сохранили 1700 кадров, по кадру каждую 1 пс. Полученные таким образом 1700 конформаций мышиного антитела составили ансамбль, на котором проводился последующий анализ по выявлению наиболее гибких остатков. Для программирования анализа использовали язык Scientific Vector Language (SVL), поддерживаемый средой молекулярного моделирования MOE (Molecular Operating Environment (MOE), Chemical Computing Group, Quebec, Canada). Прежде всего, каждый кадр N оптимальным образом накладывали на предыдущий кадр N-1 для учета вращения и трансляции молекулы как целого в процессе молекулярно-динамического моделирования и расчета. Такое наложение получали путем минимизации среднеквадратичного расстояния (Root Mean Square Distance, RMSD) между всеми парами соответствующих атомов двух кадров. При построении наложения учитывали только тяжелые атомы остова антитела. Затем, используя тот же самый метод наложения, каждый кадр наложили на медоидный кадр. Медоидным кадром называется конформация антитела с декартовыми координатами атомов, наиболее близкими к средним координатам по всем конформациям.
Для каждого остатка антитела i рассчитали среднеквадратичное расстояние между тяжелыми атомами конформации j и медоидной конформации сравнения k. Среднеквадратичное расстояние рассчитывается по следующей формуле: 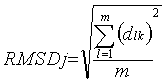 , где dlk - эвклидово расстояние в ангстремах (Å) между тяжелым атомом l остатка j и этим же атомом в медоидной конформации сравнения k. Для попарного отождествления тяжелых атомов l также учитывали симметрию по тяжелым атомам боковых цепей аминокислот Asp, Leu, Val, Glu, Arg, Phe и Tyr. Конформация сравнения k изменяется при переходе от одного остатка к другому и соответствует медоидной конформации k с минимальным эвклидовым расстоянием до средних по всем конформациям координат для анализируемого остатка i. Затем для каждого остатка i получили распределение 1700 среднеквадратичных расстояний, которое отражает изменение координат остатка i в ходе молекулярно-динамического моделирования. Объединением всех величин RMSD для всех аминокислотных остатков изучаемого антитела получили глобальное распределение всех среднеквадратичных расстояний для данного антитела. Глобальное распределение по всем среднеквадратичным расстояниям затем использовали как эталонное распределение. Для каждого высокогибкого остатка i проводили статистическую проверку для выяснения того, является ли наблюдаемое среднее среднеквадратичное расстояние для остатка i, mi, значительно большим, чем глобальное среднее среднеквадратичное расстояние по всем остаткам, mg. Поскольку размер выборки был достаточно велик, 1700 для анализа клона 16D7, использовали односторонний Z-критерий (см. Dorofeev & Grant, “Statistics for real-life sample surveys. Non-simple-random samples and weighted data” 2006. Cambridge University Press) с нулевой гипотезой H0 для расчета статистики: «наблюдаемая величина mi меньше глобального среднего mg» и рассчитали величины Zi по формуле
, где dlk - эвклидово расстояние в ангстремах (Å) между тяжелым атомом l остатка j и этим же атомом в медоидной конформации сравнения k. Для попарного отождествления тяжелых атомов l также учитывали симметрию по тяжелым атомам боковых цепей аминокислот Asp, Leu, Val, Glu, Arg, Phe и Tyr. Конформация сравнения k изменяется при переходе от одного остатка к другому и соответствует медоидной конформации k с минимальным эвклидовым расстоянием до средних по всем конформациям координат для анализируемого остатка i. Затем для каждого остатка i получили распределение 1700 среднеквадратичных расстояний, которое отражает изменение координат остатка i в ходе молекулярно-динамического моделирования. Объединением всех величин RMSD для всех аминокислотных остатков изучаемого антитела получили глобальное распределение всех среднеквадратичных расстояний для данного антитела. Глобальное распределение по всем среднеквадратичным расстояниям затем использовали как эталонное распределение. Для каждого высокогибкого остатка i проводили статистическую проверку для выяснения того, является ли наблюдаемое среднее среднеквадратичное расстояние для остатка i, mi, значительно большим, чем глобальное среднее среднеквадратичное расстояние по всем остаткам, mg. Поскольку размер выборки был достаточно велик, 1700 для анализа клона 16D7, использовали односторонний Z-критерий (см. Dorofeev & Grant, “Statistics for real-life sample surveys. Non-simple-random samples and weighted data” 2006. Cambridge University Press) с нулевой гипотезой H0 для расчета статистики: «наблюдаемая величина mi меньше глобального среднего mg» и рассчитали величины Zi по формуле 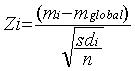 , где mi - среднее среднеквадратичное расстояние, рассчитанное из распределения по среднеквадратичным расстояниям для остатка i, mg - среднее среднеквадратичное расстояние, рассчитанное из глобального распределения по среднеквадратичным расстояниям, sdi - стандартное отклонение, рассчитанное из распределения по среднеквадратичным расстояниям для остатка i, и n-размер выборки, n=1700 для анализа клона 16D7. Рассчитанные величины Zi затем сравнили с интегральными вероятностями стандартного нормального распределения для оценки 99,9% уровня значимости альтернативной гипотезы, а именно, «наблюдаемая величина mi больше глобального среднего mg», что соответствует величине Zi≥3,08. Параметр Zi, который можно рассматривать в качестве некоторого критерия степени гибкости, не коррелировал ни с молекулярным весом, ни с числом тяжелых атомов в остатке антитела (r2=0,014 и 0,0009, соответственно, при анализе молекулярно-динамической модели клона 16D7 антитела к CXCR5).
, где mi - среднее среднеквадратичное расстояние, рассчитанное из распределения по среднеквадратичным расстояниям для остатка i, mg - среднее среднеквадратичное расстояние, рассчитанное из глобального распределения по среднеквадратичным расстояниям, sdi - стандартное отклонение, рассчитанное из распределения по среднеквадратичным расстояниям для остатка i, и n-размер выборки, n=1700 для анализа клона 16D7. Рассчитанные величины Zi затем сравнили с интегральными вероятностями стандартного нормального распределения для оценки 99,9% уровня значимости альтернативной гипотезы, а именно, «наблюдаемая величина mi больше глобального среднего mg», что соответствует величине Zi≥3,08. Параметр Zi, который можно рассматривать в качестве некоторого критерия степени гибкости, не коррелировал ни с молекулярным весом, ни с числом тяжелых атомов в остатке антитела (r2=0,014 и 0,0009, соответственно, при анализе молекулярно-динамической модели клона 16D7 антитела к CXCR5).
В набор гибких остатков для легкой цепи вошли следующие остатки (последовательная нумерация): D1, T14, P15, R16, E17, Q47, D65, S72 R79, R82, E86, K108, E110 и K112; в набор для тяжелой цепи вошли следующие остатки: Q1, V2, Q3, L11, S15, Q16, S61, A62, K64, S65, R70, D72, Q75, K81, M82, N83, Q86, Q103, S110, A111, A112 и K113. Гибкие участки последовательности 16D7 сравнили с соответствующими положениями последовательностей антитела человека, взятых с сайта базы данных ImMunoGeneTics Database сентябрьской версии 2005 года.
Остатки, для которых при анализе была получена значимо высокая степень гибкости, и ряд фланкирующих остатков, сохраняющих трехмерную структуру гибких остатков, включили в запросы для дальнейшего поиска.
Для замены гибких остатков вариабельного участка мышиного антитела 16D7 выбирали вариабельную область человеческого антитела с наибольшей степенью идентичности гибких остатков, особенно с положениями, находящимися в пределах 5,0Å от гипервариабельных участков. Полученные таким образом гуманизированные последовательности проанализировали программой BLAST на сходство последовательностей по базе данных UniProtKB/SwissProt, чтобы подтвердить рациональность сделанных предположений. Для всех последовательностей получили высокую степень гомологии с рядом антител человека. Кроме того, ни одна из последовательностей не содержала ни одного из известных эпитопов для B клеток или T клеток, перечисленных в базе данных IEDB.
Наилучшее совпадение с последовательностью из базы данных IEDB для легкой цепи (LC1, LC2 и LC3) было получено для последовательности KPGQPPRLLIYDASNRATGIPA (SEQ ID №:25), которая покрывает гипервариабельный участок CDR2, но существенно отличается по составу остатков, о чем говорит степень идентичности последовательностей 56%, полученная при поиске программой BLAST по базе данных IEDB.
Наилучшее совпадение с последовательностью из базы данных IEDB для тяжелой цепи (HC1 и HC2) было получено для последовательности TDDTAMYYCARI (SEQ ID №:26), которая находится перед началом участка CDR3. Для данной последовательности получили степень идентичности 61% с последовательностью пептида SEDSALYYCARD (SEQ ID №:27), что делает маловероятным возможность ее функционирования в качестве потенциального эпитопа для T клеток человека (J Exp Med (1995) 181, 1540).
Исходные последовательности вариабельных доменов мышиного 16D7 имеют следующий вид:
легкая цепь (CDR подчеркнуты):
DIVMTQAAPS VAVTPRESVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRMSNLA SGVPDRFSGS GSGTAFTLRI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:28); и
тяжелая цепь (CDR подчеркнуты):
QVQLKESGPG LVAPSQSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYN SALKSRLSIR KDNSQSQVFL KMNSLQTDDT AMYYCARIVY WGQGTLVTVS A (SEQ ID №:29).
Предложено два варианта тяжелой цепи (HC1 и HC2) и три варианта легкой цепи (LC1, LC2 и LC3). Оба варианта тяжелой цепи получены модификацией последовательностей AF262096/AAF79987 и AB063657/BAC01285.1, соответственно. Эти две последовательности имеют эквивалентные степени гомологии, но были обе оставлены для анализа, поскольку они имеют относительно различные наборы мутируемых остатков и различаются по своим физико-химическим свойствам. Последовательность LC1 получена из последовательности BAC01682/AB064054.1, в которой требуется мутация только двух остатков. Последовательности LC2 и LC3 - варианты последовательности LC1, в которой рекомендуется заменить потенциально проблематичные остатки легкой цепи: мутацией одного доступного растворителю метионина (M51) на лейцин (версии 3 и 4), и заменой аспарагина N53 на остаток серина в одном потенциальном сайте деамидирования (версия 4). Не все возможные комбинации были оставлены, однако четыре комбинации покрывают большинство требующих внимания моментов. Используется нумерация по Кабату.
|
Мутации, вводимые через гуманизацию вариабельных цепей, указаны маленькими буквами и выделены подчеркиванием, гипервариабельные участки подчеркнуты. Последовательности константных доменов опущены.
LC1:
DIVMTQAAPS VAVTPgaSVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRMSNLA SGVPDRFSGS GSGTAFTLRI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:30)
LC2:
DIVMTQAAPS VAVTPgaSVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRlSNLA SGVPDRFSGS GSGTAFTLRI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:31)
LC3:
DIVMTQAAPS VAVTPgaSVS ISCRSSKSLL HSSGKTYLYW FLQRPGQSPQ LLIYRlSsLA SGVPDRFSGS GSGTAFTLRI SRVEAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:32)
HC1:
QVQLKESGPG LVAPSeSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYN psLKSRLSIs KDNSkSQVFL KvtSLtTDDT AMYYCARIVYWGQGTLVTVS A (SEQ ID №:33)
HC2:
eVQLKESGPG LVAPggSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYN apLKgRLSIs KDNSkSQVFL qMNSLkTDDT AMYYCARIVYWGQGTLVTVS s (SEQ ID №:34)
Последовательности полученных химерных гибридов имеют следующий вид:
Химерные последовательности LC
MGWSCIILFLVATATGVHSDIVMTQAAPSVAVTPRESVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRMSNLASGVPDRFSGSGSGTAFTLRISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:35)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGGCCGCCCCCAGCGTGGCCGTGACCCCCCGCGAGAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCATGAGCAACCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGCGCATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:36)
Химерные последовательности HC
MGWSCIILFLVATATGVHSQVQLKESGPGLVAPSQSLSITCTVSGFSLIDYGVNWIRQPPGKGLEWLGVIWGDGTTYYNSALKSRLSIRKDNSQSQVFLKMNSLQTDDTAMYYCARIVYWGQGTLVTVSAASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLG (SEQ ID №:37)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCCAGGTGCAGCTGAAGGAGAGCGGCCCCGGCCTGGTGGCCCCCAGCCAGAGCCTGAGCATCACCTGCACCGTGAGCGGCTTCAGCCTGATCGACTACGGCGTGAACTGGATCCGCCAGCCCCCCGGCAAGGGCCTGGAGTGGCTGGGCGTGATCTGGGGCGACGGCACCACCTACTACAACAGCGCCCTGAAGAGCCGCCTGAGCATCCGCAAGGACAACAGCCAGAGCCAGGTGTTCCTGAAGATGAACAGCCTGCAGACCGACGACACCGCCATGTACTACTGCGCCCGCATCGTGTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCGCCGCCAGCACCAAGGGCCCTTCCGTGTTCCCTCTGGCCCCTTGCTCCCGGTCCACCTCCGAGTCCACCGCCGCTCTGGGCTGCCTGGTGAAGGACTACTTCCCTGAGCCTGTGACCGTGTCCTGGAACTCTGGCGCCCTGACCTCCGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTGACCGTGCCTTCCTCCTCCCTGGGCACCAAGACCTACACCTGTAACGTGGACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGTCCAAGTACGGCCCTCCTTGCCCTTCCTGCCCTGCCCCTGAGTTCCTGGGCGGACCTAGCGTGTTCCTGTTCCCTCCTAAGCCTAAGGACACCCTGATGATCTCCCGGACCCCTGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCTGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAGCAGTTCAATTCCACCTACCGGGTGGTGTCTGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAATACAAGTGTAAGGTCTCCAACAAGGGCCTGCCCTCCTCCATCGAGAAAACCATCTCCAAGGCCAAGGGCCAGCCTAGGGAGCCTCAGGTGTACACCCTGCCTCCTAGCCAGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGCTTCTACCCTTCCGACATCGCCGTGGAGTGGGAGTCCAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAGGCTGACCGTGGACAAGTCCCGGTGGCAGGAGGGCAACGTCTTTTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCTGGGCTGAAGCTT (SEQ ID №:38)
Гуманизированные последовательности VL
LC1:
MGWSCIILFLVATATGVHSDIVMTQAAPSVAVTPGASVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRMSNLASGVPDRFSGSGSGTAFTLRISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:39)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGGCCGCCCCCAGCGTGGCCGTGACCCCCGGCGCCAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCATGAGCAACCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGCGCATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:40)
LC2:
MGWSCIILFLVATATGVHSDIVMTQAAPSVAVTPGASVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRLSNLASGVPDRFSGSGSGTAFTLRISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:41)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGGCCGCCCCCAGCGTGGCCGTGACCCCCGGCGCCAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCCTGAGCAACCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGCGCATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:42)
LC3:
MGWSCIILFLVATATGVHSDIVMTQAAPSVAVTPGASVSISCRSSKSLLHSSGKTYLYWFLQRPGQSPQLLIYRLSSLASGVPDRFSGSGSGTAFTLRISRVEAEDVGVYYCMQHLEYPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №:43)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGACATCGTGATGACCCAGGCCGCCCCCAGCGTGGCCGTGACCCCCGGCGCCAGCGTGAGCATCAGCTGCCGCAGCAGCAAGAGCCTGCTGCACAGCAGCGGCAAGACCTACCTGTACTGGTTCCTGCAGCGCCCCGGCCAGAGCCCCCAGCTGCTGATCTACCGCCTGAGCAGCCTGGCCAGCGGCGTGCCCGACCGCTTCAGCGGCAGCGGCAGCGGCACCGCCTTCACCCTGCGCATCAGCCGCGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCATGCAGCACCTGGAGTACCCCTACACCTTCGGCGGCGGCACCAAGCTGGAGATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGAAGCTT (SEQ ID №:44)
Гуманизированные последовательности VH
HC1:
MGWSCIILFLVATATGVHSQVQLKESGPGLVAPSESLSITCTVSGFSLIDYGVNWIRQPPGKGLEWLGVIWGDGTTYYNPSLKSRLSISKDNSKSQVFLKVTSLTTDDTAMYYCARIVYWGQGTLVTVSAASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLG (SEQ ID №:45)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCCAGGTGCAGCTGAAGGAGAGCGGCCCCGGCCTGGTGGCCCCCAGCGAGAGCCTGAGCATCACCTGCACCGTGAGCGGCTTCAGCCTGATCGACTACGGCGTGAACTGGATCCGCCAGCCCCCCGGCAAGGGCCTGGAGTGGCTGGGCGTGATCTGGGGCGACGGCACCACCTACTACAACCCCAGCCTGAAGAGCCGCCTGAGCATCAGCAAGGACAACAGCAAGAGCCAGGTGTTCCTGAAGGTGACCAGCCTGACCACCGACGACACCGCCATGTACTACTGCGCCCGCATCGTGTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCGCCGCCAGCACCAAGGGCCCTTCCGTGTTCCCTCTGGCCCCTTGCTCCCGGTCCACCTCCGAGTCCACCGCCGCTCTGGGCTGCCTGGTGAAGGACTACTTCCCTGAGCCTGTGACCGTGTCCTGGAACTCTGGCGCCCTGACCTCCGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTGACCGTGCCTTCCTCCTCCCTGGGCACCAAGACCTACACCTGTAACGTGGACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGTCCAAGTACGGCCCTCCTTGCCCTTCCTGCCCTGCCCCTGAGTTCCTGGGCGGACCTAGCGTGTTCCTGTTCCCTCCTAAGCCTAAGGACACCCTGATGATCTCCCGGACCCCTGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCTGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAGCAGTTCAATTCCACCTACCGGGTGGTGTCTGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAATACAAGTGTAAGGTCTCCAACAAGGGCCTGCCCTCCTCCATCGAGAAAACCATCTCCAAGGCCAAGGGCCAGCCTAGGGAGCCTCAGGTGTACACCCTGCCTCCTAGCCAGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGCTTCTACCCTTCCGACATCGCCGTGGAGTGGGAGTCCAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAGGCTGACCGTGGACAAGTCCCGGTGGCAGGAGGGCAACGTCTTTTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCTGGGCTGAAGCTT (SEQ ID №:46)
HC2:
MGWSCIILFLVATATGVHSEVQLKESGPGLVAPGGSLSITCTVSGFSLIDYGVNWIRQPPGKGLEWLGVIWGDGTTYYNAPLKGRLSISKDNSKSQVFLQMNSLKTDDTAMYYCARIVYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLG (SEQ ID №:47)
GCTAGCACCATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCCACCGCCACCGGCGTGCACAGCGAGGTGCAGCTGAAGGAGAGCGGCCCCGGCCTGGTGGCCCCCGGCGGCAGCCTGAGCATCACCTGCACCGTGAGCGGCTTCAGCCTGATCGACTACGGCGTGAACTGGATCCGCCAGCCCCCCGGCAAGGGCCTGGAGTGGCTGGGCGTGATCTGGGGCGACGGCACCACCTACTACAACGCCCCCCTGAAGGGCCGCCTGAGCATCAGCAAGGACAACAGCAAGAGCCAGGTGTTCCTGCAGATGAACAGCCTGAAGACCGACGACACCGCCATGTACTACTGCGCCCGCATCGTGTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGCGCCAGCACCAAGGGCCCTTCCGTGTTCCCTCTGGCCCCTTGCTCCCGGTCCACCTCCGAGTCCACCGCCGCTCTGGGCTGCCTGGTGAAGGACTACTTCCCTGAGCCTGTGACCGTGTCCTGGAACTCTGGCGCCCTGACCTCCGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTGACCGTGCCTTCCTCCTCCCTGGGCACCAAGACCTACACCTGTAACGTGGACCACAAGCCTTCCAACACCAAGGTGGACAAGCGGGTGGAGTCCAAGTACGGCCCTCCTTGCCCTTCCTGCCCTGCCCCTGAGTTCCTGGGCGGACCTAGCGTGTTCCTGTTCCCTCCTAAGCCTAAGGACACCCTGATGATCTCCCGGACCCCTGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCTGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAGCAGTTCAATTCCACCTACCGGGTGGTGTCTGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGAATACAAGTGTAAGGTCTCCAACAAGGGCCTGCCCTCCTCCATCGAGAAAACCATCTCCAAGGCCAAGGGCCAGCCTAGGGAGCCTCAGGTGTACACCCTGCCTCCTAGCCAGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGCTTCTACCCTTCCGACATCGCCGTGGAGTGGGAGTCCAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCAGGCTGACCGTGGACAAGTCCCGGTGGCAGGAGGGCAACGTCTTTTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCTGGGCTGAAGCTT (SEQ ID №:48)
ПРИМЕР 16: ГУМАНИЗАЦИЯ НА ОСНОВЕ МОЛЕКУЛЯРНО-ДИНАМИЧЕСКИХ ТРАЕКТОРИЙ
Последовательности областей VL и VH 16D7 проанализировали программой BLAST в базе данных белков (PDB) (Berman et al., Nucleic Acids Research, 2000, 28:235-242), и ближайшими гомологами для вариабельной легкой цепи оказались 1MH5, 1MJJ и 1MJU (J Mol Biol 332:423-435, 2003) с эквивалентными степенями гомологии. В качестве шаблона выбирали последовательность 1MJU исходя из высокой точности кристаллической структуры, которая для нее определена с разрешением до 1,22Å. Ближайшим гомологом для тяжелой цепи оказалась последовательность 1FNS (Nat Struct Biol 7:881-884, 2000). Выбранные последовательности 1MJU и 1FNS использовали для построения гомологической модели вариабельных доменов, которую затем минимизировали по энергии стандартными методами.
Затем провели моделирование трехмерной гомологической модели 16D7 методами молекулярной динамики (MD) в течение 1,1 наносекунд, используя неявного обобщенного растворителя Борна (см. Gallicchio & Levy, J Comput Chem 2004, 25:479-499). Молекулярно-динамическое моделирование начали с выбора начальных значений скоростей в соответствии с гауссовым распределением при температуре 500K с последующим периодом прихода к равновесию длительностью 200 пикосекунд (пс). При моделировании наличие всех связей учитывали с помощью алгоритма SHAKE (см. Barth. et al., J Comp Chem, 1995, 16:1192-1209), использовали шаг по времени 1 фемтосекунду (фс), моделирование вели на основе алгоритма интегрирования Верле в каноническом ансамбле NVT (число частиц, объем и температура) при температуре 500K. Моделирование вели с наложением гармонических ограничений на атомы остова. В ходе последней 1 нс этого первого моделирования сохранили 10 различных конформаций, по одной каждые 100 пс.
Полученные 10 различных конформаций затем использовали в качестве 10 исходных точек для 10 циклов молекулярно-динамического моделирования без ограничений на атомы остова при температуре 300K продолжительностью 2,3 нс каждое в неявном обобщенном растворителе Борна. Каждое молекулярно-динамическое моделирование начинается с выбора начальных значений скоростей в соответствии с гауссовым распределением при температуре 298,15K с последующим периодом прихода к равновесию длительностью 300 пс. Наличие всех связей учитывали с помощью алгоритма SHAKE (см. Barth. et al., J Comp Chem, 1995, 16:1192-1209), использовали шаг по времени 1 фс, моделирование вели на основе алгоритма интегрирования Верле в каноническом ансамбле NVT (число частиц, объем и температура) при температуре 298,15K. В процессе моделирования сохранили 2000 кадров, по кадру каждую 1 пс. Для программирования следующего протокола на этапе после введения использовали язык Scientific Vector Language (SVL), поддерживаемый средой молекулярного моделирования MOE (Molecular Operating Environment (MOE), Chemical Computing Group, Quebec, Canada).
Прежде всего, каждый кадр N оптимальным образом накладывали на предыдущий кадр N-1 для устранения вращения и трансляции молекулы как целого в процессе молекулярно-динамического моделирования и расчета. Такое наложение получали путем минимизации среднеквадратичного расстояния (Root Mean Square Distance, RMSD) между всеми парами соответствующих атомов двух кадров. При построении наложения учитывали только тяжелые атомы остова антитела. Затем, используя тот же самый метод наложения, каждый кадр наложили на медоидный кадр. Медоидным кадром называется конформация антитела с декартовыми координатами атомов, наиболее близкими к средним координатам по всем конформациям. Для каждого из 10 проведенных циклов молекулярно-динамического моделирования использовали последние 2000 конформаций для количественной оценки отклонения положений атомов каждой аминокислоты мышиного антитела от их положений в медоидной конформации для данной аминокислоты. Для каждого остатка антитела i рассчитали среднеквадратичное расстояние между тяжелыми атомами конформации j и медоидной конформации сравнения k. Среднеквадратичное расстояние рассчитывается по следующей формуле: 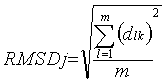 , где dlk - эвклидово расстояние в ангстремах (Å) между тяжелым атомом l остатка j и этим же атомом в медоидной конформации сравнения k. Для попарной ассоциации тяжелых атомов l также учитывали симметрию по тяжелым атомам боковых цепей аминокислот Asp, Leu, Val, Glu, Arg, Phe и Tyr. Конформация сравнения k изменяется при переходе от одного остатка к другому и соответствует медоидной конформации k с минимальным эвклидовым расстоянием до средних по всем конформациям координат для анализируемого остатка i.
, где dlk - эвклидово расстояние в ангстремах (Å) между тяжелым атомом l остатка j и этим же атомом в медоидной конформации сравнения k. Для попарной ассоциации тяжелых атомов l также учитывали симметрию по тяжелым атомам боковых цепей аминокислот Asp, Leu, Val, Glu, Arg, Phe и Tyr. Конформация сравнения k изменяется при переходе от одного остатка к другому и соответствует медоидной конформации k с минимальным эвклидовым расстоянием до средних по всем конформациям координат для анализируемого остатка i.
Гуманизирующие мутации искали путем определения зародышевых линий антител человека, наиболее близких к мышиному антителу в терминах их наиболее гибких аминокислот. Для этого движения 60 наиболее гибких аминокислот мышиного антитела в процессе 20 нс (10×2 нс) молекулярно-динамического моделирования сравнили с движениями соответствующих аминокислот 49 гомологических моделей зародышевых линий антител человека, для каждой из которых провели по 10 циклов молекулярно-динамического моделирования, следуя тому же протоколу. 49 трехмерных гомологических моделей зародышевых линий антител человека построили путем систематического комбинирования 7 наиболее часто встречающихся легких цепей антител человека (vк1, vк2, vк3, vк4, vλ1, vλ2, vλ3) и 7 наиболее часто встречающихся тяжелых цепей (vh1a, vh1b, vh2, vh3, vh4, vh5, vh6) (Nucleic Acids Research, 2005, Vol. 33, Database issue D593-D597).
В состав 60 наиболее гибких аминокислот не входили аминокислоты из гипервариабельной области и ее непосредственной окрестности, т.е. аминокислоты с α атомом углерода, находящимся на расстоянии менее 5 Е от любого α атома углерода аминокислот гипервариабельной области в трехмерной гомологической модели.
Степень гибкости аминокислоты количественно характеризовали путем сравнения среднеквадратичного расстояния (Fi) для данной аминокислоты (i) до ее медоидной конформации согласно данному ранее определению последней, усредненного по результатам 10 циклов молекулярно-динамического моделирования, со среднеквадратичным расстоянием (Fm) по всем аминокислотам мышиного антитела, усредненным по тем же самым 10 циклам молекулярно-динамического моделирования. Аминокислоту считали достаточно гибкой для возможного взаимодействия с рецепторами T-клетки и инициации иммунного ответа, если ее параметр гибкости Zi, определяемый по формуле Zi=(Fi-Fm)/Fm, превышал 0,15.
Используя описанный протокол оценки гибкости аминокислот на основе усреднения результатов молекулярно-динамического моделирования, 23 аминокислоты были признаны гибкими в вариабельной области мышиного антитела 16D7, исключая гипервариабельный участок и его непосредственную окрестность.
В набор гибких остатков легкой цепи вошли следующие остатки (используется последовательная нумерация): R16, E17, R44, G46, Q47, S48, R79, R82, E84, E86, и E110; для тяжелой цепи в набор вошли следующие остатки: K5, P41, G42, K43, K64, R70, D72, N73, S74, Q75, Q86 и Q103.
Степень четырехмерного соответствия мышиного антитела 49 гомологическим моделям зародышевых линий человека количественно характеризуется путем анализа по положениям отдельных атомов 60 гибких аминокислот на единой пространственной кубической решетке, используя все пикосекундные кадры для 10 циклов молекулярно-динамического моделирования. Решетка имеет разрешение 1Е и состоит из 445740 узлов. Решетку инициализировали, используя трехмерную структуру кристаллографической модели антитела человека на основе антитела 8FAB (Biochem 30:3739-3748, 1991). Модель 8FAB также используется для позиционирования всех конформаций антитела из пикосекундных кадров на пространственной решетке. Для этого полученная в процессе молекулярно-динамического моделирования медоидная конформация антитела накладывается на модель 8FAB. Процедура наложения заключается в выравнивании моментов инерции двух моделей с последующей минимизацией скалярных расстояний между α атомами углерода обеих моделей. Все остальные полученные в ходе молекулярно-динамического моделирования конформации таким же образом накладываются на медоидную конфигурацию.
Для пары сравниваемых антител проводится два типа анализа и получаются две меры гомологии (электростатическая гомология и липофильная гомология), которые затем суммируются для получения полной степени гомологии. При анализе электростатической гомологии на решетке учитываются все атомы боковых цепей аминокислот. Искомую величину в некотором узле решетки x получают путем вычисления для атома значения пространственной гауссовой функции f(x), взятой с весом, соотнесенным с частичным зарядом атома согласно описанию силового поля Amber99 (Cieplak et al.; J. Comp. Chem. 2001, 22:1048-1057). Функцию f(x) берут в системе пространственных декартовых осей координат в следующем виде: 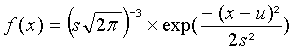 , где x и u - соответственно декартовы координаты узла решетки и атома в аминокислотном остатке, s=r/1,6 (где r - ковалентный радиус атома). Анализ проводят для всех конформаций аминокислоты, полученные результаты усредняют по всем узлам пространственной решетки. При анализе липофильной гомологии учитываются только липофильные атомы боковых цепей аминокислот. Искомую величину в некотором узле решетки x получают с той же самой гауссовой функцией f(x) без зарядового взвешивания. В результате для двух наборов конформаций молекулярного динамического моделирования, взятых из пикосекундных кадров для двух сравниваемых антител, получают дискретизацию по одной и той же пространственной решетке. Степень электростатической гомологии (sim-elec) между антителом a и антителом b можно рассчитать, используя следующее выражение:
, где x и u - соответственно декартовы координаты узла решетки и атома в аминокислотном остатке, s=r/1,6 (где r - ковалентный радиус атома). Анализ проводят для всех конформаций аминокислоты, полученные результаты усредняют по всем узлам пространственной решетки. При анализе липофильной гомологии учитываются только липофильные атомы боковых цепей аминокислот. Искомую величину в некотором узле решетки x получают с той же самой гауссовой функцией f(x) без зарядового взвешивания. В результате для двух наборов конформаций молекулярного динамического моделирования, взятых из пикосекундных кадров для двух сравниваемых антител, получают дискретизацию по одной и той же пространственной решетке. Степень электростатической гомологии (sim-elec) между антителом a и антителом b можно рассчитать, используя следующее выражение: 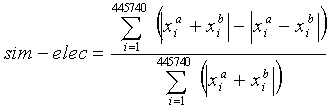 . Степень липофильной гомологии рассчитывается по той же формуле с использованием данных, полученных при описанной выше дискретизации по липофильности.
. Степень липофильной гомологии рассчитывается по той же формуле с использованием данных, полученных при описанной выше дискретизации по липофильности.
Наибольшая степень четырехмерной гомологии (полная степень гомологии =50%) по 60 наиболее гибким аминокислотам в сравнении с 60 наиболее гибкими аминокислотами мышиного антитела 16D7 наблюдается для модели зародышевой линии человека vλ2-vh4. Поэтому для замены гибких остатков мышиного антитела 16D7 использовали модель зародышевой линии человека vλ2-vh4. Перед заменой аминокислоты двух последовательностей выравнивали для получения наилучшего наложения α атомов углерода в соответствующих трехмерных гомологических моделях. Нежелательные мотивы в полученных гуманизированных последовательностях искали анализом в программе BLAST, как описано ранее в параграфе 41, см. выше. Кроме того, используя базу данных IEDB, полученные гуманизированные последовательности проверили на наличие известных эпитопов для B-клеток или T-клеток, как описано ранее в параграфе 44.
Наилучшее совпадение с последовательностью из базы данных IEDB для легкой цепи (LC7) было получено для последовательности PGKAPQLLIYRMSNL (SEQ ID №:52), которая покрывает гипервариабельный участок CDR2. Последовательность имеет степень совпадения 73% с последовательностью пептида PGKAPKLLIYAASSL (SEQ ID №:53), который демонстрирует связывание с HLA-DRB1 0404*, но иммуногенность которого для человека не показана (J Immunol (1995) 155, 5655).
Наилучшее совпадение с последовательностью из базы данных IEDB для тяжелой цепи (HC4 и HC5) было получено для последовательности SLIDYGVNWIRQPPG (SEQ ID №:54), которая покрывает гипервариабельный участок CDR1, но имеет существенно отличную последовательность остатков, о чем свидетельствует степень совпадения 40%, полученная анализом в программе BLAST по базе данных IEDB.
Получено два варианта тяжелой цепи (HC4 и HC5) и один вариант легкой цепи (LC7). Оба варианта тяжелой цепи получены модификацией последовательностей модели зародышевой линии человека vλ2-vh4. Последовательность HC5-варианта последовательности HC4 с дополнительной заменой потенциально проблематичного остатка: заменой аспарагина N60 на остаток пролина в одном потенциальном сайте деамидирования.
Мутации, вводимые через гуманизацию вариабельных цепей, указаны маленькими буквами и выделены подчеркиванием, гипервариабельные участки подчеркнуты. Последовательности константных доменов опущены.
LC7:
DIVMTQAAPS VAVTPgqSVS ISCRSSKSLL HSSGKTYLYW FLQhPGkaPQ LLIYRMSNLA SGVPDRFSGS GSGTAFTLtI SgVqAEDVGV YYCMQHLEYP YTFGGGTKLE IK (SEQ ID №:55)
HC4:
QVQLqESGPG LVAPSQSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYN SALKSRLSIs KDtSkSQVFL KMNSLtTDDT AMYYCARIVY WGQGTLVTVS AAK (SEQ ID №:56)
HC5:
QVQLqESGPG LVAPSQSLSI TCTVSGFSLI DYGVNWIRQP PGKGLEWLGV IWGDGTTYYp SALKSRLSIs KDtSkSQVFL KMNSLtTDDT AMYYCARIVY WGQGTLVTVS AAK (SEQ ID №:57)
|
ПРИМЕР 17: ФАРМАКОКИНЕТИКА
Исследование фармакокинетики проводилось на соответствующем количестве животных (например, 4 в одном исследовании; 2 для одинарной дозы и 2 для повторной дозы, 5 доз в неделю), здоровых, специально выращенных самцах макаки Cynomolgus весом от 2,0 до 5,4 кг в возрасте от 2 до 7 лет. Животных разделили на две группы лечения, животные одной группы получали антитела IgG4 в качестве контроля, животные второй группы получали гуманизированный 16D7. Обезьянам каждой группы единовременно внутривенно вводили болюсную дозу, например, 2,5-10 мг/кг в объеме дозы 2-3 мл/кг, или 5 доз в неделю, внутривенно. Образцы крови отбирали в различные моменты времени после введения каждой дозы и обрабатывали для отделения плазмы. Образцы плазмы анализировали на концентрацию полного IgG4 и моноклональных антител CXCR5, используя иммуноферментный анализ (ELISA).
ПРИМЕР 18: СРАВНИТЕЛЬНЫЕ ИССЛЕДОВАНИЯ
Ряд антител данного изобретения сравнивали с коммерчески доступными антителами в параллельных экспериментах. MAB190, поставляемое компанией R & D Systems, представляет собой мышиное моноклональное антитело. RF82B представляет собой крысиное античеловеческое CXCR5 антитело и поставляется компанией BD. Клон 2C1 представляет собой мышиное моноклональное антитело с введенным маркером (глутатион-S-трансфераза, GST), поставляемое компанией Abnova. Описанные здесь различные гуманизированные антитела изотипировали с использованием реагентов и методов, известных в области. Например, многие из описанных антител имели легкую цепь κ, многие являлись IgG1, а 46C9, 68D3 и H28 относились к IgG2a. Большинство антител связывались с амино-терминальным окончанием CXCR5, и несколько антител конкурировали друг с другом за связывание с одним и тем же эпитопом или областью.
Антитело компании BD плохо связывается с мононуклеарными клетками периферической крови (PBMC) человека.
Хотя антитела, как правило, не связываются с клетками Cynomolgus, описанные в данном изобретении антитела 14C9, 19H5, H28, 54G6, 56H6 и 79B7 связываются с клетками макаки.
Обнаружено, что антитело 16D7 имело более высокую аффинность, по меньшей мере десятикратно превышающую аффинность коммерчески доступных антител, и имело в 100 раз лучшую скорость диссоциации комплекса антиген-антитело по сравнению с другими антителами.
ПРИМЕР 19: МАСШТАБИРОВАНИЕ
Каждый вариант моноклонального антитела производили в культивируемых в суспензии клетках HEK293 FS™ путем временной трансфекции двух экспрессирующих плазмид, кодирующих тяжелую или легкую цепь, в комплексе с 293fectin™ (Invitrogen). Секретируемые белки собирали через восемь дней после трансфекции и центрифугировали. Белки очищали аффинной хроматографией со средой Protein A (ProSepvA, Millipore) после промывания колонки 0,15 M NaCl буфером с 25 мМ цитрата, pH 3. Моноклональные антитела перенесли в фосфатный буфер и пропустили через 0,22 мкм фильтр. Концентрацию белка определяли по поглощению на длине волны 280 нм. Каждую партию анализировали гель-электрофорезом SDS-PAGE (Nupage Bistris/ MES-SDS 10%) в восстановительных и невосстановительных условиях для определения чистоты и молекулярного веса каждой субъединицы и мономера. Каждую партию белка также анализировали гель-фильтрацией (Tricorn 10/300 GL Superdex 200) для определения степени однородности мономера и присутствия примесей с высоким молекулярным весом.
Из культур объемом 240 мл получали от 30 до 40 мг восьми вариантов моноклонального антитела 16D7 достаточного качества для дальнейших анализов in vitro и in vivo.
Специалисты в области без труда предложат, либо смогут найти, используя лишь стандартные эксперименты, множество эквивалентов к конкретным примерам осуществления описываемого изобретения, изложенным в данном документе. Такие эквиваленты призваны быть охвачены следующей формулой изобретения.