Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ БЕНЗОИЛАМИНОИНДАН-2-КАРБОНОВЫЕ КИСЛОТЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к замещенным бензоиламиноиндан-2-карбоновым кислотам и родственным им соединениям, а также к их промежуточным соединениям, их получению, в том числе стереоселективным способам синтеза промежуточных соединений, фармацевтическим композициям, содержащим эти соединения, и к применению соединений или композиций на их основе, которые обладают способностью блокировать рецептор CXCR5 и подавлять функцию В-клеток, связанную с активацией рецептора. Соединения, обладающие способностью ингибировать CXCR5, особенно эффективны при лечении или профилактике различных воспалительных заболеваний, таких как ревматоидный артрит, рассеянный склероз, волчанка, болезнь Крона, связанных с модулированием рецептора CXCR5 человека.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CXCR5 является непромискуитентным рецептором хемокинов, относящимся к семейству рецепторов, связанных с G-белком (GPCR). В частности, рецептор CXCR5 взаимодействует со своим лигандом CXCL13, который конститутивно экспрессируется в стромальных клетках, таких как фолликулярные дендритные клетки, и в лимфоидных тканях. Лиганд CXCL13 специфично притягивает В-клетку и малую субпопуляцию Т-клеток, называемую фолликулярными В-хелперами Т-клеток (TFH). Если взаимодействие CXCR5/CXCL13 блокируется антагонистом, то может быть проведено лечение пациентов, страдающих ревматоидным артритом (РА) и другими аутоиммунными или воспалительными заболеваниями, при которых повышающая регуляция CXCR5 и/или его лиганда CXCL13 ответственны за патогенез или обострение заболевания. Несмотря на то что анти-В-клеточная терапия с использованием анти-CD20 моноклональных антител (ритуксимаб) продемонстрировала эффективность при лечении РА, известно, что блокирование В-клеток, например клеток, экспрессирующих CXCR5, приводит к положительным результатам лечения на экспериментальных моделях артрита у мышей.
Кроме того, известно, что CXCR5 и/или CXCL13 активированы у пациентов, страдающих ревматоидным артритом [Arthritis Res Ther. 2005; 7(2): R217-29. Epub 2004 Dec 16], синдромом Шегрена [Arthritis Rheum. 2001 Nov; 44(11):2633-41], злокачественной миастенией [J Neuroimmunol. 2005 Dec 30; 170 (1-2):172-8. Epub 2005 Oct 7] и рассеянным склерозом [Brain. 2006 Jan; 129(Pt 1):200-11. Epub 2005 Nov 9]. Также известна связь между CXCR5 и карциномой поджелудочной железы [Cancer Res. 2006 Oct 1; 66(19):9576-82]. За счет блокирования лиганд-рецепторного взаимодействия с помощью антагониста CXCR5 можно добиться благоприятных результатов лечения перечисленных выше заболеваний, а также других заболеваний, при которых инфильтрация В-клеток (или других субпопуляций лимфоцитов, экспрессирующих рецептор CXCR5) ответственна за патогенез заболевания [ Front Biosci. 2007 Jan 1; 12:2194-2006, J Rheumatol Suppl. 2006 May; 77:3-11].
Известно, что инфильтрация лимфоцитов в третичные эктопические зародышевые центры (GC) хорошо коррелирует с возрастающей тяжестью заболевания и утратой толерантности. При использовании мышиных моделей in vivo, таких как, например, мыши CXCR5-/- и CXCL13-/-, отсутствие рецептора или лиганда приводит к измененной тонкой архитектуре GC, вызванной изменением локализации Т- и В-клеток. Известно, что такие мыши защищены от развития острого коллаген-индуцированного артрита (CIA, КИА). Поэтому, поскольку CXCR5 селективно экспрессируется в зрелых В-клетках, которые связаны с патогенезом РА, антагонист, который способен блокировать данный рецептор, может модулировать артритогенный ответ у пациентов, страдающих заболеванием. В настоящее время продемонстрирована клиническая эффективность лечения ревматоидного артрита анти-CD20 антителами, например, у пациентов, проходящих анти-В-клеточную терапию, у которых зарегистрированы продолжительные улучшения клинических признаков и симптомов. Поэтому не ожидается, что селективный выбор CXCR5 в качестве мишени, которая экспрессируется только на зрелых В-клетках и Т-хелперах, повлияет на развитие В-клеток или ухудшит иммунный статус пациента.
Таким образом, существует потребность в антагонистах CXCR5 для лечения ревматоидного артрита и других воспалительных, аутоиммунных заболеваний и различных форм рака, вызванных взаимодействием B-клеток, экспрессирующих CXCR5 в ответ на экспрессию CXCL13.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям-антагонистам формулы I, которые, как найдено, блокируют миграцию В-клеток в ответ на градиент лиганда, без истощения периферических В-клеток. Поэтому такие соединения обеспечивают фармакологическую безопасность при длительном лечении воспалительных заболеваний.
Настоящее изобретение относится к новым соединениям формулы I
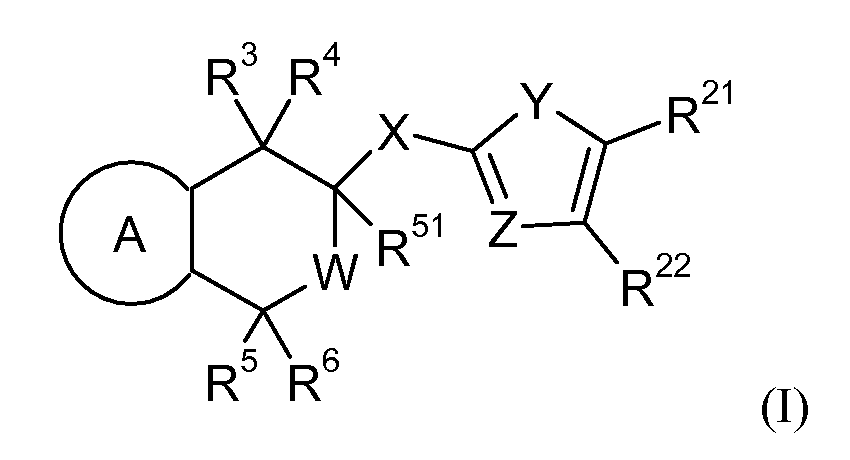
где
кольцо A является бензольным кольцом или моноциклическим 5-членным или 6-членным ароматическим гетероциклическим кольцом, содержащим 1 или 2 одинаковых или различных членов гетерокольца, выбираемых из группы, содержащей N, N(R1), O и S, причем все указанные кольца могут быть замещены одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкил-S(O)m-, циано и нитро;
W выбирают из группы, содержащей связь или CH2;
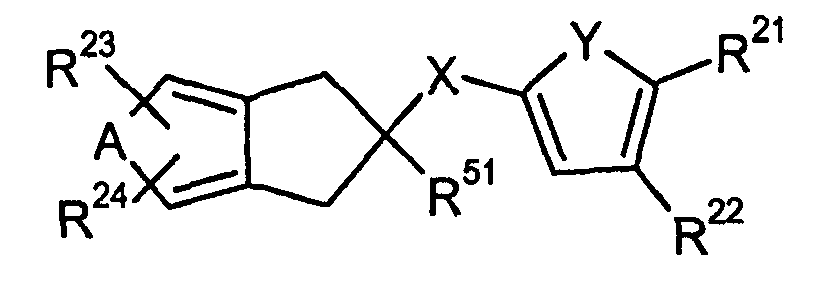
X выбирают из группы, содержащей N(R7)C=O, N(R7)S(O)m, N(R7)CR8(R9), C=ON(R7), S(O)mN(R7), CR8(R9)N(R7), CR8(R9)N(R7)C=O, CR8(R9)N(R7)S(O)m;
Y выбирают из группы, содержащей N(R11), S, O, C(R12)=C(R13), N=C(R14) и C(R15)=N;
C(R12)=C(R13) может быть 5-7-членным карбоциклом или гетероциклом с любым заместителем;
Z выбирают из группы, содержащей N и C (R16);
R1 выбирают из группы, содержащей водород и (C1-C4)-алкил;
R3 и R4 выбирают независимо друг от друга из группы, содержащей водород и (C1-C4)-алкил;
R5 и R6 выбирают независимо друг от друга из группы, содержащей водород и (C1-C4)-алкил;
R7 выбирают из группы, содержащей водород, (C1-C4)-алкил и (C1-C6)-циклоалкил;
R8 и R9 выбирают независимо друг от друга из группы, содержащей водород и (C1-C4)-алкил, или вместе как (C1-C6)-циклоалкил;
R11 выбирают из группы, содержащей водород, (C1-C10)-алкил, гидрокси-(C1-C10)-алкил-, (C1-C10)-алкилокси, (C1-C10)-алкил-S(O)m-, (C1-C10)-алкилкарбонил-, амино, (C1-C10)-алкиламино, ди((C1-C10)-алкил)амино;
R12, R15 и R16 выбирают независимо друг от друга из группы, содержащей водород, галоген, (C1-C10)-алкил, гидрокси-(C1-C10)-алкил-, (C1-C10)-алкилокси, (C1-C10)-алкил-S(O)m-, циано, (C1-C10)-алкилкарбонил-, амино, (C1-C10)-алкиламино, ди((C1-C10)-алкил)амино и нитро;
R13, R14, R21 и R22 выбирают независимо друг от друга из группы, содержащей водород, галоген, (C1-C4)-алкил, гидрокси-(C1-C3)-алкил-, (C1-C3)-алкилокси, (C1-C3)-алкил-S(O)m-, циано, (C1-C2)-алкилкарбонил-, амино, (C1-C3)-алкиламино, ди((C1-C3)-алкил)амино и нитро;
при условии, что общее число атомов C, N, O и S, присутствующих в любой из групп R13, R14, R21 и R22, не превышает 4;
R51 выбирают из группы, содержащей COOR52, CONR53(R54) и 5-6-членные гетероциклы, насчитывающие 3 или более гетероатомов;
R52 выбирают из группы, содержащей водород и (C1-C4)-алкил;
R53 выбирают из группы, содержащей водород, гидроксил, (C1-C4)-алкилокси, (C1-C4)-алкил, циано и R55-SO2-;
R54 выбирают из группы, содержащей водород, (C1-C4)-алкил, (C1-C2)-алкилкарбонил-, (C1-C3)-алкил-S(O)m-;
R55 выбирают из группы, содержащей (C1-C4)-алкил и фенил;
R61 выбирают из группы, содержащей водород и (C1-C4)-алкил;
R62 выбирают из группы, содержащей водород и (C1-C4)-алкил;
гетероарил является моноциклическим 5-членным или 6-членным ароматическим гетероциклическим кольцом, содержащим 1, 2 или 3 одинаковых или различных членов гетерокольца, выбираемых из группы, содержащей N, N(R61), O и S;
гетероциклил является моноциклическим 4-7-членным гетероциклическим кольцом, которое содержит 1 или 2 одинаковых или различных члена гетерокольца, выбираемых из группы, содержащей N, N(R62), O, S, SO и SO2, но два члена гетерокольца из ряда, состоящего из N(R62), O и S, не могут находиться в смежных положениях в кольце, которое является насыщенным или частично ненасыщенным и которое может быть замещено одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей (C1-C4)-алкил;
m является целым числом, выбираемым из группы, содержащей 0, 1 и 2, где все числа m независимы друг от друга и могут быть одинаковыми или различными;
все фенильные и гетероарильные группы в соединении формулы Ia могут быть независимо друг от друга замещены одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкилсульфонил и циано;
все алкильные группы в соединении формулы Ia могут быть независимо друг от друга замещены одним или более атомами фтора;
в любых его стереоизомерных формах или смеси стереоизомерных форм в любом соотношении, или его физиологически приемлемой соли.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Содержание каждого из патентных документов и прочие ссылки, приводимые в настоящем описании, включены в настоящее описание в полном объеме посредством ссылки.
В конкретном осуществлении настоящее изобретение включает соединение формулы Ia,
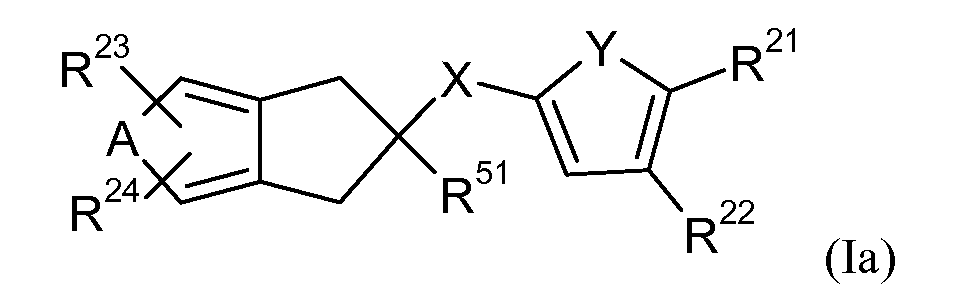
где
A означает CH=CH или S;
R23 означает водород, галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкил-S- или нитро;
R24 означает водород или галоген, когда A означает CH=CH, или означает водород, галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкил-S- или нитро, когда A означает S;
X означает N(H)C=O, N(H)S(O)2, C=ON(H) или S(O)2N(H);
Y означает N(R11), S, O, C(R12)=C(R13), N=C(R14) или C(R15)=N, или конденсированный необязательно замещенный 5-7-членный карбоциклил;
R11 означает водород, (C1-C10)-алкил, гидрокси-(C1-C10)-алкил-, (C1-C10)-алкилокси, (C1-C10)-алкил-S(O)m-, (C1-C10)-алкилкарбонил-, фенил, амино, (C1-C10)-алкиламино или ди((C1-C10)-алкил)амино;
R12 означает водород, галоген, (C1-C10)-алкил, (C2-C10)-алкенил, (C3-C6)-циклоалкилокси, (C3-C10)-циклоалкенилокси, (C3-C6)-циклоалкил, (C3-C10)-циклоалкенил, (C3-C6)-циклоалкил[(C1-C4)-алкил или (C2-C4)-алкенил], (C3-C6)-циклоалкил(C1-C4)-алкилокси, гидрокси-(C1-C10)-алкил-, (C1-C10)-алкилокси, (C2-C10)-алкенилокси, (C1-C10)-алкил-S-, циано, (C1-C10)-алкилкарбонил-, фенил или нитро;
R13 означает водород, галоген или (C1)-алкил;
R14 означает водород, галоген, (C1-C4)-алкил, гидрокси-(C1-C3)-алкил-, (C1-C3)-алкилокси, (C1-C3)-алкил-S(O)m-, циано, (C1-C2)-алкилкарбонил-, амино, (C1-C3)-алкиламино, ди((C1-C3)-алкил)амино или нитро, при условии, что общее число атомов C, N, O и S, присутствующих в R14, не превышает 4;
R15 означает водород, галоген, (C1-C10)-алкил, (C2-C10)-алкенил, (C3-C6)-циклоалкил, (C3-C6)-циклоалкенил, (C3-C6)-циклоалкил[(C1-C4)-алкил или (C2-C4)-алкенил], гидрокси-(C1-C10)-алкил-, циано, (C1-C10)-алкилкарбонил-, фенил, амино, [(C1-C10)-алкил или (C2-C10)-алкенил]амино, [(C1-C10)-алкил или (C2-C10)-алкенил]((C1-C10)-алкил)амино или нитро;
R21 означает водород, когда Y означает C(R12)=C(R13), N=C(R14) или C(R15)=N, и означает водород, галоген, (C1-C4)-алкил, гидрокси-(C1-C3)-алкил-, (C1-C3)-алкилокси, (C1-C3)-алкил-S(O)m-, циано, (C1-C2)-алкилкарбонил-, амино, (C1-C3)-алкиламино, ди((C1-C3)-алкил)амино или нитро, когда Y означает N(R11), S или O, при условии, что общее число атомов C, N, O и S, присутствующих в R21, не превышает 4;
R22 означает водород, галоген, (C1)-алкил, когда Y означает C(R12)=C(R13), N=C(R14) или C(R15)=N, или означает водород, гидрокси-(C1-C3)-алкил-, (C1-C3)-алкилокси, (C1-C3)-алкил-S(O)m-, циано, (C1-C2)-алкилкарбонил-, амино, (C1-C3)-алкиламино, ди((C1-C3)-алкил)амино или нитро, когда Y означает N(R11), S или O, при условии, что общее число атомов C, N, O и S, присутствующих в R22, не превышает 4;
R51 означает COOH или CONH(R53);
R53 означает R55-SO2- или тетразолил;
R55 означает (C1-C4)-алкил или фенил, необязательно замещенный одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкилсульфонил и циано; и
m равно 0, 1 или 2;
где все перечисленные фенильные группы могут быть независимо друг от друга необязательно замещены одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкилсульфонил и циано;
где все перечисленные алкильные группы могут быть независимо друг от друга необязательно замещены одним или более атомами фтора; или
его стереоизомерную форму, смесь стереоизомерных форм в любом соотношении или его физиологически приемлемую соль.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R23 означает водород, галоген, (C1-C4)-алкил или (C1-C4)-алкилокси;
R24 означает водород или галоген, когда A означает CH=CH, или означает водород, галоген или (C1-C4)-алкил, когда A означает S;
X означает N(H)C=O, N(H)S(O)2 или C=ON(H);
Y означает C(R12)=C(R13) или C(R15)=N, или конденсированный необязательно замещенный 5-6-членный карбоциклил;
R12 означает (C1-C6)-алкил, (C3-C6)-алкенил, (C4-C6)-циклоалкилокси, (C5-C6)-циклоалкил, (C5-C6)-циклоалкенил, (C3)-циклоалкил[(C2)-алкил или (C2)-алкенил], (C3)-циклоалкил(C1)-алкилокси, (C3-C4)-алкилокси, (C3)-алкенилокси, (C1-C3)-алкил-S- или (C3)-алкилкарбонил-, фенил;
R13 означает водород, галоген или (C1)-алкил;
R15 означает (C1-C6)-алкил, (C2-C6)-алкенил или [(C2-C3)-алкил или (C3)-алкенил]((C1)-алкил)амино;
R21 означает водород, когда Y означает C(R12)=C(R13) или C(R15)=N;
R22 означает водород или галоген, (C1)-алкил, когда Y означает C(R12)=C(R13) или C(R15)=N;
R51 означает COOH;
где все перечисленные фенильные группы могут быть независимо друг от друга необязательно замещены одним или более одинаковыми или различными заместителями, выбираемыми из группы, содержащей галоген, (C1-C4)-алкил, (C1-C4)-алкилокси, (C1-C4)-алкилсульфонил и циано;
где все перечисленные алкильные группы могут быть независимо друг от друга необязательно замещены одним или более атомами фтора; или
его стереоизомерная форма, смесь стереоизомерных форм в любом соотношении или его физиологически приемлемая соль.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
A означает CH=CH.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R23 означает водород или галоген.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R24 означает водород или галоген, когда A означает CH=CH;
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
X означает N(H)C=O.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
Y означает C(R12)=C(R13).
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
Y означает C(R15)=N.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
Y означает конденсированный необязательно замещенный 5-6-членный карбоциклил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C4-C6)-алкил или, в частности, изобутил или пропил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C3-5)-алкенил или, в частности, пентен-1-ил, изобутен-1-ил или пропен-1-ил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C4)-циклоалкилокси (циклобутилокси).
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C5-C6)-циклоалкил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C5-C6)-циклоалкенил или, в частности, циклопентен-1-ил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C3)-циклоалкил[(C2)-алкил или (C2)-алкенил] или, в частности, циклопропилэтил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C3)-циклоалкил(C1)-алкилокси (циклопропилметил).
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C3-C4)-алкилокси.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает (C3)-алкенилокси.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R12 означает фенил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R13 означает галоген или (C1)-алкил.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R13 означает (C1)-алкил, где алкил необязательно замещен 1-3 атомами фтора, или, в частности, трифторметилилом.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R13 означает (C1)-алкил (метил).
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R13 означает (C1)-алкил, который замещен 2-3 атомами фтора.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R13 означает галоген.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R15 означает [(C2-C3)-алкил или (C3)-алкенил]((C1-C10)-алкил)амино.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R15 означает (C2-C3)-алкил(C1)-алкил)амино или, в частности, изопропилметиламино.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R21 означает водород.
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R22 означает водород или галоген, (C1)-алкил, когда Y означает C(R12)=C(R13).
Еще одним конкретным осуществлением настоящего изобретения является соединение формулы Ia, где:
R51 означает COOH.
Конкретные варианты осуществления настоящего изобретения выбраны из группы, которую составляют:
2-(2-аллилокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклопропилметокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-втор-бутокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(3-хлор-2-изопропоксибензоиламино)индан-2-карбоновая кислота,
2-(2-аллилокси-3-хлорбензоиламино)индан-2-карбоновая кислота,
2-(3,5-дихлор-2-циклобутоксибензоиламино)-5-фториндан-2-карбоновая кислота,
2-(3,5-дихлор-2-изопропоксибензолсульфониламино)индан-2-карбоновая кислота,
2-(2-аллилокси-3,5-дихлорбензолсульфониламино)индан-2-карбоновая кислота,
2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота,
1,3-диметил-5-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновая кислота,
5-метокси-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота,
2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5-трифторметилиндан-2-карбоновая кислота,
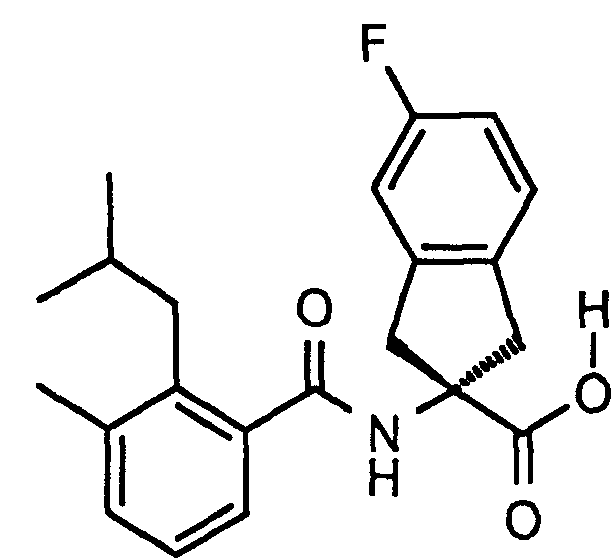
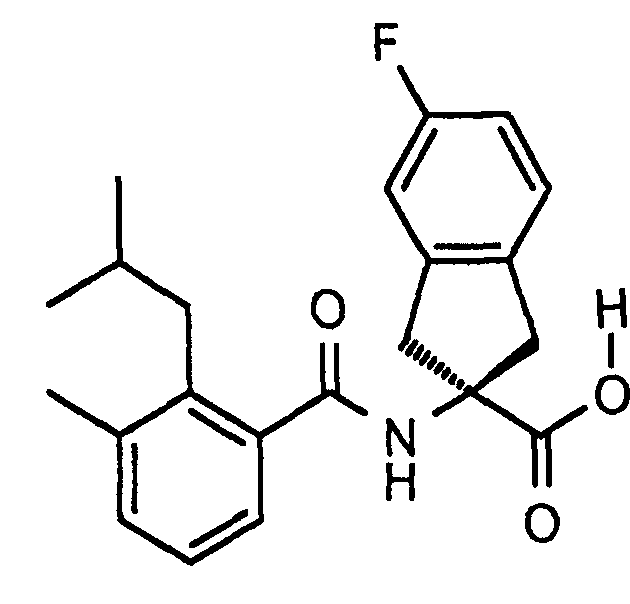
5-фтор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота,
5-(2-изопропокси-3-метилбензоиламино)-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновая кислота,
2-(2-изопропокси-3-метилбензоиламино)-5-метоксииндан-2-карбоновая кислота,
2-(2-изопропокси-3-метилбензоиламино)-5-трифторметилиндан-2-карбоновая кислота,
5-фтор-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-5-трифториндан-2-карбоновая кислота,
5-бром-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-5,6-дифториндан-2-карбоновая кислота,
2-[3-метил-2-((Z)-пент-1-енил)бензоиламино]индан-2-карбоновая кислота,
2-(3-метил-2-пентилбензоиламино)индан-2-карбоновая кислота,
2-[2-(1-этилбут-1-енил)-3-метилбензоиламино]индан-2-карбоновая кислота,
2-[2-(1-этилбутил)-3-метилбензоиламино]индан-2-карбоновая кислота,
2-(2-циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклопентил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-[2-(2-циклопропилвинил)-3-метилбензоиламино]индан-2-карбоновая кислота,
2-[2-(2-циклопропилэтил)-3-метилбензоиламино]индан-2-карбоновая кислота,
2-(2-циклогекс-1-енил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-[3-метил-2-(1-пропенил)бензоиламино]индан-2-карбоновая кислота,
2-(3-метил-2-пропилбензоиламино)индан-2-карбоновая кислота,
2-[3-метил-2-((E)-пент-1-енил)бензоиламино]индан-2-карбоновая кислота,
5-фтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
5-фтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-циклопент-1-енил-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота,
5-фтор-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновая кислота,
5-фтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
5,6-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
5,6-дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
5,6-дифтор-2-(3-метил-2-пропенилбензоиламино)индан-2-карбоновая кислота,
5,6-дифтор-2-(3-метил-2-пропилбензоиламино)индан-2-карбоновая кислота,
5-бром-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновая кислота,
2-[(2-хлор-6-метилбензоил)амино]индан-2-карбоновая кислота,
2-[(2-метилтиобензол-1-карбонил)амино]индан-2-карбоновая кислота,
2-(5-хлор-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-изобутирил-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2,3-диметилбензоиламино)индан-2-карбоновая кислота,
2-(3-циано-2-метилбензоиламино)индан-2-карбоновая кислота,
2-[(бифенил-2-карбонил)амино]индан-2-карбоновая кислота,
2-[2-(1,1-диметилпропил)бензоиламино]индан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-4,5-дихлориндан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-5-хлориндан-2-карбоновая кислота,
2-(2-циклобутокси-3-метилбензоиламино)-4-фториндан-2-карбоновая кислота,
2-(2-циклобутилокси-3-метилбензоиламино)индан-2-уксусная кислота,
2-(3-бром-2-метилбензоиламино)индан-2-карбоновая кислота,
2-(5-бром-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота,
2-(2-изопропилсульфанилбензоиламино)индан-2-карбоновая кислота,
2-(5-хлор-2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота,
2-{[2-(этилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота,
2-{[2-(аллилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота,
2-{[2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота,
2-{[5-хлор-2-(изопропилметиламино)пиридин-3-карбонил)амино]индан-2-карбоновая кислота,
4,5-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
4,5-дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
4,7-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
4,7-дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
5-хлор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота,
5-хлор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота,
2-(5,6,7,8-тетрагидронафталин-1-илкарбамоил)индан-2-карбоновая кислота,
2-циклобутокси-N-(2-метансульфониламинокарбонилиндан-2-ил)-3-метилбензамид,
2-циклобутокси-3-метил-N-(2-трифторметансульфониламинокарбонилиндан-2-ил)бензамид,
2-циклопент-1-енил-3-метил-N-(2-трифторметансульфониламинокарбонилиндан-2-ил)бензамид,
2-циклобутокси-3-метил-N-[2-(1H-тетразол-5-ил)индан-2-ил]бензамид и
2-[2-(2-метилпропенил)-3-трифторметилбензоиламино]индан-2-карбоновая кислота, или
их стереоизомерная форма, смесь стереоизомерных форм в любом соотношении или их физиологически приемлемая соль.
Еще одним конкретным осуществлением настоящего изобретения является соединение следующей структуры
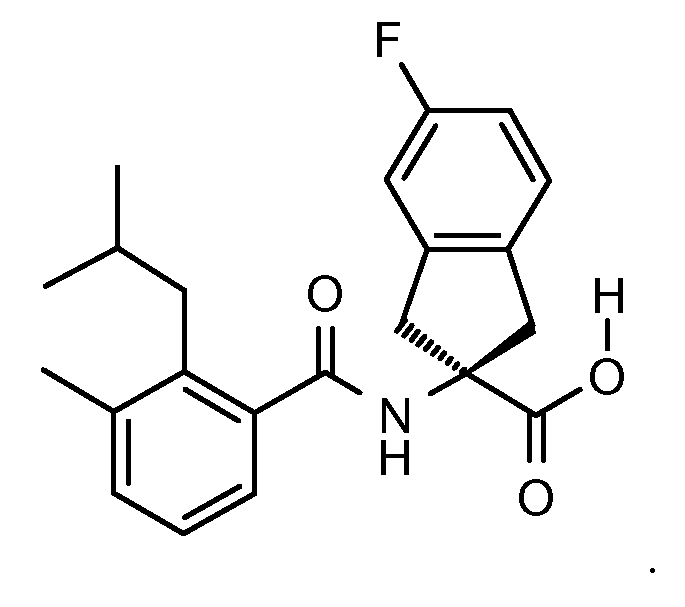
Еще одним конкретным осуществлением настоящего изобретения является соединение следующей структуры
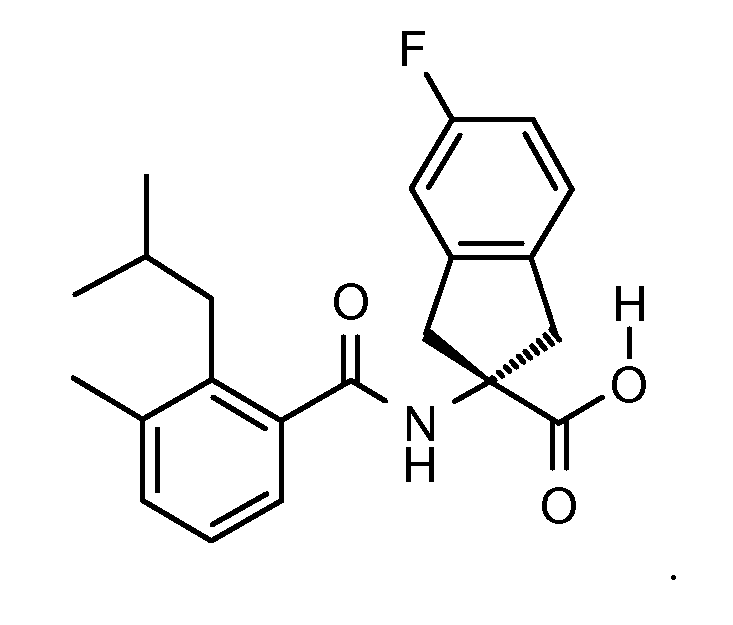
Еще одним конкретным осуществлением настоящего изобретения является соединение, выбираемое из примеров 232, 150, 231, 149, 136, 158, 152, 159, 144, 397, 135, 161, 155, 132, 139, 125, 329, 262, 154, 143, 160, 163, 21, 87, 212, 103, 352, 395, 392 или 388.
Еще одним конкретным осуществлением настоящего изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемое количество соединения формулы Ia и по меньшей мере один фармацевтически приемлемый эксципиент и фармацевтически приемлемый носитель.
Еще одним конкретным осуществлением настоящего изобретения является способ лечения пациента, страдающего от такого физиологического состояния или подверженного такому физиологическому состоянию, которое может быть улучшено введением пациенту фармацевтически эффективного количества ингибитора рецептора CXCR5, включающий введение указанному пациенту соединения формулы Ia.
Еще одним конкретным осуществлением настоящего изобретения является способ лечения физиологического состояния, представляющего собой воспалительное заболевание.
Еще одним конкретным осуществлением настоящего изобретения является способ лечения физиологического состояния, представляющего собой ревматоидный артрит.
Еще одним конкретным осуществлением настоящего изобретения является способ лечения физиологического состояния, представляющего собой астму.
Еще одним конкретным осуществлением настоящего изобретения является способ лечения, заключающийся во введении соединения по п.1 и введении одновременно или последовательно дополнительного лекарственного средства.
Еще одним конкретным осуществлением настоящего изобретения является способ получения соединения формулы Ia, описанный в настоящем документе.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы I, и способу применения соединения формулы I или формулы Ia для профилактики и (или) лечения воспалительных заболеваний, таких как ревматоидный артрит, рассеянный склероз, волчанка, болезнь Крона, связанных с модулированием у пациента рецептора CXCR5 человека.
Изобретение также относится к способу получения промежуточного соединения, полезного при получении соединения формулы I или формулы Ia.
Еще одним аспектом изобретения являются способы лечения или профилактики физиологического или патологического состояния у нуждающегося в таком лечении пациента, которые заключаются во введении указанному пациенту фармацевтически эффективного количества одного или нескольких соединений формулы I или формулы Ia.
Количество соединений формулы I или формулы Ia или других соединений, способных воздействовать на физиологическое или патологическое состояние в связи с любым из вышеперечисленных применений, может представлять собой фармацевтически эффективное количество, субклиническое эффективное количество или их комбинации, при условии, что окончательная комбинация представляет собой фармацевтически эффективное количество соединений, действенное для профилактики и (или) лечения воспалительных заболеваний, таких как ревматоидный артрит, рассеянный склероз, волчанка, болезнь Крона, связанных с модулированием у пациента рецептора CXCR5 человека.
Список сокращений
Используемые по тексту описания изобретения следующие сокращения имеют следующие значения, если не указано иное:
|
Определения
Используемые выше и по тексту описания изобретения следующие термины имеют следующие значения, если не указано иное:
«Кислый биоизостер» означает группу, которая обладает химическим и физическим сходством, обеспечивающим в целом аналогичные карбоксигруппе биологические свойства (см. Lipinski, Annual Reports in Medicinal Chemistry, "Bioisosterism In Drug Design" 21, 283 (1986); Yun, Hwahak Sekye, "Application of Bioisosterism To New Drug Design" 33, 576-579, (1933); Zhao, Huaxue Tongbao, "Bioisosteric Replacement And Development Of Lead Compounds In Drug Design" 34-38, (1995); Graham, Theochem, "Theoretical Studies Applied To Drug Design ab initio Electronic Distributions In Bioisosteres" 343, 105-109, (1995)). Примеры кислых биоизостеров включают -C(O)-NHOH, -C(O)-CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, 3,5-диоксо-1,2,4-оксадиазолидинил или гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3-гидрокси-1-метилпиразолил, и им подобные.
«Кислотная функциональная группа» означает группу, содержащую кислый водород. Примеры кислотных функциональных групп включают карбоксил (-C(O)OH), -C(O)-NHOH, -C(O)-CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил или 3-гидрокси-3-циклобутен-1,2-дион, имидазолил меркапто и им подобные, а также соответствующую гидроксигруппу, такую как ароматическая гидроксигруппа, например, гидроксифенил, гидроксигетероарил, такой как 3,5-диоксо-1,2,4-оксадиазолидинил, 3-гидроксиизоксазолил или 3-гидрокси-1-метилпиразолил.
«Кислотная защитная группа» означает легко удаляемую группу, которая известна специалистам в данной области как обеспечивающая защиту кислого водорода карбоксильной группы от нежелательного взаимодействия в процессе синтеза, например, для блокирования или защиты кислотной функции при проведении реакции с другими функциональными сайтами соединения, и которая поддается селективному удалению. Такие кислотные защитные группы хорошо известны специалистам в данной области и активно используются для защиты карбоксильных групп, как описано в патентах США №№ 3840556 и 371966, раскрытие информации по каждому из которых полностью включено в настоящий документ посредством ссылки. Подходящие кислотные защитные группы см. в публикации T.W. Green and P.G.M. Wuts в "Protective Groups in Organic Chemistry," John Wiley and Sons, 1991. Кислотные защитные группы также включают нестабильные при гидрировании кислотные защитные группы, определенные в настоящем описании. Примеры кислотных защитных групп включают сложные эфиры, такие как замещенный и незамещенный C1-8 низший алкил, например, метил, этил, трет-бутил, метоксиметил, метилтиометил, 2,2,2-трихлорэтил и им подобные, тетрагидропиранил, замещенный и незамещенный фенилалкил, такой как бензил и его замещенные производные, например, алкоксибензильная или нитробензильная группы и им подобные, циннамил, диалкиламиноалкил, например, диметиламиноэтил и тому подобное, триметилсилил, замещенные и незамещенные амиды и гидразиды, например, амиды и гидразиды N,N-диметиламина, 7-нитроиндола, гидразина, N-фенилгидразина и им подобные, ацилоксиалкильные группы, такие как пивалоилоксиметил или пропионилоксиметил и им подобные, ароилоксиалкил, такой как бензоилоксиэтил и тому подобное, алкоксикарбонилалкил, такой как метоксикарбонилметил, циклогексилоксикарбонилметил и им подобные, алкоксикарбонилоксиалкил, такой как трет-бутилоксикарбонилоксиметил и тому подобное, алкоксикарбониламиноалкил, такой как трет-бутилоксикарбониламинометил и тому подобное, алкиламинокарбониламиноалкил, такой как метиламинокарбониламинометил и тому подобное, ациламиноалкил, такой как ацетиламинометил и тому подобное, гетероциклилкарбонилоксиалкил, такой как 4-метилпиперазинилкарбонилоксиметил и тому подобное, диалкиламинокарбонилалкил, такой как диметиламинокарбонилметил и тому подобное, (5-(низший алкил)-2-оксо-1,3-диоксолен-4-ил)алкил, такой как (5-трет-бутил-2-оксо-1,3-диоксолен-4-ил)метил и тому подобное, и (5-фенил-2-оксо-1,3-диоксолен-4-ил)алкил, такой как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил и тому подобное.
«Кислотонеустойчивая защитная для аминной функции группа» («кислотонейустойчивая аминозащитная группа») означает аминозащитную группу, определенную в настоящем документе, которая легко удаляется обработкой кислотой, оставаясь при этом сравнительно стабильной по отношению к другим реагентам. Предпочтительной кислотонеустойчивой аминозащитной группой является ВОС.
«Алифатический» означает алкильный, алкенильный или алкинильный, как определено в настоящем документе.
«Заместители алифатической группы» означают заместители, присоединенные к алифатической группе, как определено в настоящем документе, в том числе арил, гетероарил, гидрокси, алкокси, циклилокси, арилокси, гетероарилокси, ацил или его тиоксоаналог, циклилкарбонил или его тиоксоаналог, ароил или его тиоксоаналог, гетероароил или его тиоксоаналог, ацилокси, циклилкарбонилокси, ароилокси, гетероароилокси, галоген, нитро, циано, карбокси (кислота), -C(O)-NHOH, -C(O)-CH2OH, -C(O)-CH2SH, -C(O)-NH-CN-сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3,5-диоксо-1,2,4-оксадиазолидинил или 3-гидрокси-1-метилпиразолил, алкоксикарбонил, циклилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, алкилсульфонил, циклилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфинил, циклилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио, циклилтио, арилтио, гетероарилтио, циклил, арилдиазо, гетероарилдиазо, тиол, метилен (H2C=), оксо (O=), тиоксо (S=), Y1Y2N-, Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3-, Y1Y2NSO2- или Y3SO2NY1-, где R2 определен в настоящем документе, Y1 и Y2 представляют собой независимо водород, алкил, арил или гетероарил, и Y3 представляет собой алкил, циклоалкиларил или гетероарил, или когда заместителем является Y1Y2N-, тогда один из Y1 и Y2 может представлять собой ацил, циклилкарбонил, ароил, гетероароил, алкоксикарбонил, циклилоксикарбонил, арилоксикарбонил или гетероарилоксикарбонил, как определено в настоящем документе, а другой член пары Y1 и Y2 является таким, как определено ранее, или там, где заместителем является Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3- или Y1Y2NSO2-, Y1 и Y2 могут также быть взяты вместе с атомом азота, посредством которого Y1 и Y2 связаны, образуя 4-7-членный азагетероциклил или азагетероцикленил. Заместителями кислотных/амидных алифатических групп являются карбокси (кислота), -C(O)-NHOH, -C(O)CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо?), фосфоно?), алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3,5-диоксо-1,2,4-оксадиазолидинил или 3-гидрокси-1-метилпиразолил и Y1Y2NCO-. Заместителями некислотных полярных алифатических групп являются гидрокси, оксо (O=), тиоксо (S=), ацил или его тиоксоаналог, циклилкарбонил или его тиоксоаналог, ароил или его тиоксоаналог, гетероароил или его тиоксоаналог, алкоксикарбонил, циклилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, ацилокси, циклилкарбонилокси, ароилокси, гетероароилокси, алкилсульфонил, циклилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфинил, циклилсульфинил, арилсульфинил, гетероарилсульфинил, тиол, Y1Y2N-, Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3- или Y1Y2NSO2-. Примеры алифатических групп, содержащих заместитель алифатической группы, включают метоксиметокси, метоксиэтокси, этоксиэтокси, (метокси-, бензилокси-, фенокси- или этокси-)карбонил(метил или этил), бензилоксикарбонил, пиридилметилоксикарбонилметил, метоксиэтил, этоксиметил, н-бутоксиметил, циклопентилметилоксиэтил, феноксипропил, феноксиаллил, трифторметил, циклопропилметил, циклопентилметил, карбокси(метил или этил), 2-фенетенил, бензилокси, 1- или 2-нафтилметокси, 4-пиридилметилокси, бензилоксиэтил, 3-бензилоксиаллил, 4-пиридилметилоксиэтил, 4-пиридилметилоксиаллил, бензил, 2-фенетил, нафтилметил, стирил, 4-фенил-1,3-пентадиенил, фенилпропинил, 3-фенилбут-2-инил, пирид-3-илацетиленил и хинолин-3-илацетиленил, 4-пиридилэтинил, 4-пиридилвинил, тиенилэтенил, пиридилэтенил, имидазолилэтенил, пиразинилэтенил, пиридилпентенил, пиридилгексенил и пиридилгептенил, тиенилметил, пиридилметил, имидазолилметил, пиразинилметил, тетрагидропиранилметил, тетрагидропиранилметоксиметил и им подобные.
«Ацил» означает H-CO- или (алифатическую или циклическую)-CO-группу, где алифатическая группа описана в настоящем документе. Предпочтительные ацилы содержат низший алкил. Примеры ацильных групп включают формил, ацетил, пропаноил, 2-метилпропаноил, бутаноил, пальмитоил, акрилоил, пропиноил, циклогексилкарбонил и им подобные.
«Алкеноил» означает группу алкенил-CO-, где алкенил определен в настоящем документе.
«Алкенил» означает алифатическую углеводородную группу с двойной углерод-углеродной связью, которая может быть неразветвленной или разветвленной и которая содержит от примерно 2 до примерно 15 атомов углерода в цепи. Предпочтительные алкенильные группы содержат от 2 до примерно 12 атомов углерода в цепи; и более предпочтительно от примерно 2 до примерно 4 атомов углерода в цепи. Разветвленный означает, что к линейной алкенильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкенил» означает от примерно 2 до примерно 4 атомов углерода в цепи, которая может быть неразветвленной или разветвленной. Примеры алкенильных групп включают этенил, пропенил, н-бутенил, изобутенил, 3-метилбут-2-енил, н-пентенил, гептенил, октенил, циклогексилбутенил, деценил и им подобные. «Замещенный алкенил» означает алкенильную группу, определенную выше, которая замещена одним или несколькими «заместителями алифатических групп» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры заместителей алкенильных алифатических групп включают галогены или циклоалкильные группы.
«Алкенилокси» означает группу алкенил-O-, где алкенильная группа описана в настоящем документе. Примеры алкенилоксигрупп включают аллилокси, 3-бутенилокси и им подобные.
«Алкокси» означает группу алкил-O-, где алкильная группа описана в настоящем документе. Примеры алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, гептокси и им подобные.
«Алкоксикарбонил» означает группу алкил-O-CO-, где алкильная группа определена в настоящем документе. Примеры алкоксикарбонильных групп включают метоксикарбонил, этоксикарбонил, трет-бутилоксикарбонил и им подобные.
«Алкил» означает алифатическую углеводородную группу, которая может быть неразветвленной или разветвленной и которая содержит от примерно 1 до примерно 20 атомов углерода в цепи. Предпочтительные алкильные группы содержат от 1 до примерно 12 атомов углерода в цепи, причем более предпочтительным является низший алкил, определенный в настоящем документе. Разветвленный означает, что к линейной алкильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкил» означает от примерно 1 до примерно 4 атомов углерода в цепи, которая может быть неразветвленной или разветвленной. «Замещенный алкил» означает алкильную группу определенную выше, которая замещена одним или несколькими «заместителями алифатических групп» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе.
«Алкилсульфинил» означает группу алкил-SO-, где алкильная группа определена выше. Предпочтительными являются группы, в которых алкильной группой является низший алкил.
«Алкилсульфонил» означает группу алкил-SO2-, где алкильная группа определена выше. Предпочтительными являются группы, в которых алкильной группой является низший алкил.
«Алкилсульфонилкарбамоил» означает группу алкил-SO2-NH-C(=O)-, где алкильная группа описана в настоящем документе. Предпочтительными являются алкилсульфонилкарбамоильные группы, в которых алкильной группой является низший алкил.
«Алкилтио» означает группу алкил-S-, где алкильная группа описана в настоящем документе. Примеры алкилтиогрупп включают метилтио, этилтио, изопропилтио и гептилтио.
«Алкинил» означает алифатическую углеводородную группу с тройной углерод-углеродной связью, которая может быть неразветвленной или разветвленной и которая содержит от примерно 2 до примерно 15 атомов углерода в цепи. Предпочтительные алкинильные группы содержат от 2 до примерно 12 атомов углерода в цепи; и более предпочтительно от примерно 2 до примерно r атомов углерода в цепи. Разветвленный означает, что к линейной алкинильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкинил» означает от примерно 2 до примерно 4 атомов углерода в цепи, которая может быть неразветвленной или разветвленной. Алкинильная группа может быть замещена одним или несколькими галогенами. Примеры алкинильных групп включают этинил, пропинил, н-бутинил, 2-бутинил, 3-метилбутинил, н-пентинил, гептинил, октинил, децинил и им подобные. «Замещенный алкинил» означает алкинил, определенный выше, который замещен одним или несколькими «заместителями алифатических групп» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе.
«Защитная для аминной функции группа» («аминозащитная группа») означает легко удаляемую группу, которая, как известно специалистам в данной области, защищает азотную функцию аминогруппы от нежелательной реакции в процессе синтеза и которая может быть селективно удалена. Использование аминозащитных групп хорошо известно специалистам в данной области защитных групп, предотвращающих нежелательные реакции в процессе синтеза, и существует множество подобных групп, см., например, публикацию T.W. Greene and P.G.M. Wuts, Protective groups in Organic synthesis, 2nd edition, John Wiley & Sons, New York (1991), включенную в настоящее описание посредством ссылки. Аминозащитные группы также включают «кислотонеустойчивые аминозащитные группы» и «нестабильные при гидрировании аминозащитные группы». Примерами аминозащитных групп являются ацил, включая формил, ацетил, хлорацетил, трихлорацетил, о-нитрофенилацетил, о-нитрофеноксиацетил, трифторацетил, ацетоацетил, 4-хлорбутирил, изобутирил, о-нитроциннамоил, пиколиноил, ацилизотиоцианат, аминокапроил, бензоил и им подобные, и ацилокси, включая метоксикарбонил, 9-флуоренилметоксикарбонил, 2,2,2-трифторэтоксикарбонил, 2-триметилсилилэтоксикарбонил, винилоксикарбонил, аллилоксикарбонил, трет-бутилоксикарбонил (BOC), 1,1-диметилпропинилоксикарбонил, бензилоксикарбонил (CBZ), п-нитробензилоксикарбонил, 2,4-дихлорбензилоксикарбонил и им подобные.
«Защитная для амидной функции группа» («амидозащитная группа») означает легко удаляемую группу, которая, как известно специалистам в данной области, защищает азотную функцию амидной группы от нежелательной реакции в процессе синтеза и которая может быть селективно удалена после ее преобразования в амид. Использование амидозащитных групп хорошо известно специалистам в данной области защитных групп, предотвращающих нежелательные реакции в процессе синтеза, и существует множество подобных групп, см., например, публикацию T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd edition, John Wiley & Sons, New York (1991), включенную в настоящее описание посредством ссылки. Амидозащитные группы также включают «кислотонеустойчивые амидозащитные группы» и «нестабильные при гидрировании амидозащитные группы». Примерами амидозащитных групп являются о-нитроциннамоил, пиколиноил, аминокапроил, бензоил и им подобные, и ацилокси, включая метоксикарбонил, 9-флуоренилметоксикарбонил, 2,2,2-трифторэтоксикарбонил, 2-триметилсилилэтоксикарбонил, винилоксикарбонил, аллилоксикарбонил, трет-бутилоксикарбонил (BOC), 1,1-диметилпропинилоксикарбонил, бензилоксикарбонил (CBZ), п-нитробензилоксикарбонил, 2,4-дихлорбензилоксикарбонил и им подобные.
«Аминокислота», как определено в настоящем документе, выбирается из группы, состоящей из природных и неприродных аминокислот. К аминокислотам также относятся аминокислоты с L- или D-стереохимией при α-углероде. Предпочтительными являются аминокислоты, содержащие α-аминогруппу. Аминокислоты могут быть нейтральными, положительными или отрицательными, в зависимости от заместителей в боковой цепи. «Нейтральная аминокислота» означает аминокислоту, содержащую незаряженные заместители в боковой цепи. Примеры нейтральных аминокислот включают аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин, глицин, серин, треонин и цистеин. «Положительная аминокислота» означает аминокислоту, в которой заместители в боковой цепи положительно заряжены при физиологических значениях рН. Примеры положительных аминокислот включают лизин, аргинин и гистидин. «Отрицательная аминокислота» означает аминокислоту, в которой заместители в боковой цепи несут полный отрицательный заряд при физиологических значениях рН. Примеры отрицательных аминокислот включают аспарагиновую кислоту и глутаминовую кислоту. Примерами природных аминокислот являются изолейцин, пролин, фенилаланин, триптофан, метионин, глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин, лизин, аргинин, гистидин, аспарагиновая кислота и глутаминовая кислота. «Неприродная аминокислота» означает аминокислоту, для которой отсутствует соответствующий кодон нуклеиновой кислоты. Примерами неприродных аминокислот являются D-изомеры природных α-аминокислот, как указано выше; Aib (аминомасляная кислота), βAib (3-аминоизомасляная кислота), Nva (норвалин), β-Ala, Aad (2-аминоадипиновая кислота), βAad (3-аминоадипиновая кислота), Abu (2-аминомасляная кислота), Gaba (γ-аминомасляная кислота), Acp (6-аминокапроновая кислота), Dbu (2,4-диаминопропионовая кислота), α-аминопимелиновая кислота, TMSA (триметилсилил-Ala), alle (аллоизолейцин), Nle (норлейцин), тери-Leu, Cit (цитруллин), Orn, Dpm (2,2'-диаминопимелиновая кислота), α- или β-Nal, Cha (циклогексил-Ala), гидроксипролин, Sar (саркозин) и им подобные; циклические аминокислоты; Na-алкилированные аминокислоты, такие как MeGly, (Na-метилглицин), EtGly (Na-этилглицин) и EtAsn (Na-этиласпарагин); и аминокислоты, в которых α-углерод несет два заместителя в боковой цепи. Наименования природных и неприродных аминокислот и их остатков, используемые в настоящем документе, следуют правилам наименования, предложенным комиссией ИЮПАК по номенклатуре органической химии и комиссией ИЮПАК-ИЮБ по биохимической номенклатуре и описанным в "Nomenclature of a-Amino Acids (Recommendations, 1974)" Biochemistry, 14(2), (1975). Если названия и сокращения аминокислот и аминокислотных остатков, используемых в настоящем описании и прилагаемой формуле изобретения, отличаются от упомянутых, отличающиеся наименования будут разъяснены.
«Защитная группа аминокислоты» означает группу, которая защищает кислотную или аминную функцию аминокислоты или другой реактивной функции боковой цепи аминокислоты, например, гидрокси или тиола. Примеры «соответствующих защищенных производных» боковых цепей аминокислот см. в публикации T.W. Green and P.G.M. Wuts в "Protective Groups in Organic Chemistry," John Wiley and Sons, 1991. Защитные группы для кислотной группы в аминокислоте описаны в настоящем документе, например, в разделах «кислотная функциональная группа» и «нестабильная при гидрировании кислотная защитная группа». Защитные группы для аминогруппы в аминокислоте описаны в настоящем документе, например, в разделах «аминозащитная группа», «кислотонеустойчивая аминозащитная группа» и «нестабильная при гидрировании аминозащитная группа».
«Аминокислотный остаток» означает отдельные аминокислотные звенья, включенные в соединение по настоящему изобретению.
«Аминокислотная боковая цепь» означает заместитель при углероде между аминогруппой и карбоксигруппой в α-аминокислотах. Примерами боковых цепей аминокислот являются изопропил, метил и карбоксиметил для валина, аланина и аспарагиновой кислоты, соответственно.
«Эквивалентная аминокислота» означает аминокислоту, которая может быть замещена другой аминокислотой в пептидах в соответствии с настоящим изобретением без какой-либо значительной утраты функций. При проведении подобных изменений замены подобных аминокислот производят на основе относительного сходства заместителей в боковой цепи, например, по размеру, заряду, гидрофильности, индексу гидрофильности и гидрофобности, как описано в настоящем документе.
«Ароматическая группа означает арил или гетероарил, как определено в настоящем документе. Примеры ароматических групп включают фенил, галоген-замещенный фенил, азагетероарил и им подобные.
«Ароил» означает группу арил-CO-, где арильная группа описана в настоящем документе. Примеры ароильных групп включают бензоил, 1- и 2-нафтоил и им подобные.
«Арил» означает ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от примерно 6 до примерно 14 атомов углерода, предпочтительно от примерно 6 до 10 атомов углерода. Арил включает конденсированный циклоалкениларил, конденсированный циклоалкиларил, конденсированный гетероциклениларил и конденсированный гетероциклиларил, определенные в настоящем документе, когда они связаны посредством своей арильной группы. Арил является необязательно замещенным одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3 заместителей), которые могут быть одинаковыми или различными и которые определены в настоящем документе. «Замещенный арил» означает арильную группу, которая замещена, как определено выше. Примеры арильных групп включают фенил или нафтил, или замещенный фенил, или замещенный нафтил.
«Арилдиазо» означает группу арил-диазо-, где арильная группа и диазогруппа определены в настоящем документе.
«Арилен» означает необязательно замещенную 1,2-, 1,3-, 1,4-, бивалентную арильную группу, где арильная группа определена в настоящем документе. «Замещенный алилен» означает ариленовую группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры ариленовых групп включают необязательно замещенный фенилен, нафтилен и инданилен. Конкретным примером арилена является необязательно замещенный фенилен.
«Арилокси» означает группу арил-O-, где арильная группа определена в настоящем документе. Примеры арилоксигрупп включают фенокси и 2-нафтилокси.
«Арилоксикарбонил» означает группу арил-O-CO-, где арильная группа определена в настоящем документе. Примеры арилоксикарбонильных групп включают феноксикарбонил и нафтоксикарбонил.
«Арилсульфонил» означает группу арил-SO2-, где арильная группа определена в настоящем документе.
«Арилсульфонилкарбамоил» означает группу арил-SO2-NH-C(=O)-, где арильная группа описана в настоящем документе. Примером арилсульфонилкарбамоильной группы является фенилсульфонилкарбамоил.
«Арилсульфинил» означает группу арил-SO-, где арильная группа определена в настоящем документе.
«Арилтио» означает группу арил-S-, где арильная группа описана в настоящем документе. Примеры арилтиогрупп включают фенилтио и нафтилтио.
«Основной атом азота» означает sp2 или sp3 гибридизованный атом азота, имеющий несвязанную пару электронов, который способен протонироваться. Примеры основных атомов азота включают необязательно замещенные имино-, необязательно замещенные амино- и необязательно замещенные амидиногруппы.
«Карбокси» означает группу HO(O)C-, группу (карбоновая кислота).
«Агент реакции сочетания» означает соединение, которое взаимодействует с гидроксильной частью карбоксигруппы, тем самым, делая ее восприимчивой к нуклеофильной атаке. Примеры агентов реакции сочетания включают DIC, EDCI, DCC и им подобные.
«Циклоалкенил» означает необязательно замещенную неароматическую моно- или полициклическую кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, предпочтительно от примерно 5 до примерно 10 атомов углерода, которая содержит по меньшей мере одну двойную углерод-углеродную связь, и которая может быть необязательно конденсирована с ароматической группой, как определено в настоящем документе. «Конденсированный (ароматический) циклоалкенил», означает конденсированный арилциклоалкенил и конденсированный гетероарилциклоалкенил, определенные в настоящем документе, связанные через их циклоалкенильную группу. Предпочтительные размеры колец кольцевой системы составляют от примерно 5 до примерно 6 атомов в кольце; такие кольца предпочтительного размера также называют «низшими». «Замещенный циклоалкенил», означает циклоалкенильную группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры моноциклических циклоалкенилов включают циклопентенил, циклогексенил, циклогептенил и им подобные. Примером полициклического циклоалкенила является норборниленил.
«Циклоалкил» означает неароматическую моно- или полициклическую кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, предпочтительно от примерно 5 до примерно 10 атомов углерода, которая может быть необязательно конденсирована с ароматической группой, как определено в настоящем документе. Предпочтительные размеры колец кольцевой системы составляют от примерно 5 до примерно 6 атомов в кольце; такие кольца предпочтительного размера также обозначаются как «низшие». «Конденсированный (ароматический) циклоалкил» означает конденсированный арилциклоалкил и конденсированный гетероарилциклоалкил, определенные в настоящем документе, связанные через их циклоалкильную группу. «Замещенный циклоалкил» означает циклоалкильную группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры моноциклического циклоалкила включают циклопентил, циклогексил, циклогептил и им подобные. Примеры полициклического циклоалкила включают 1-декалин, норборнил, адамант-(1- или 2-)ил и им подобные.
«Циклоалкилен» означает бивалентную циклоалкильную группу, определенную в настоящем документе, имеющую от примерно 4 до примерно 8 атомов углерода. Предпочтительные размеры колец циклоалкилена составляют от примерно 5 до примерно 6 атомов в кольце; такие кольца предпочтительного размера также обозначаются как «низшие». Точки связывания циклоалкиленовой группы включают положения 1,1-, 1,2-, 1,3- или 1,4, причем, когда это применимо, стереохимическая конфигурация точек образования связей может быть цис или транс. Примеры моноциклических циклоалкиленовых групп включают (1,1-, 1,2- или 1,3-)циклогексилен и (1,1- или 1,2-)циклопентилен. «Замещенный циклоалкилен», означает циклоалкиленовую группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе.
«Циклический» или «циклил» означает циклоалкил, циклоалкенил, гетероциклил или гетероцикленил, как определено в настоящем документе. Термин «низший», используемый в связи с термином «циклический», имеет то же значение, которое отмечено в настоящем документе в отношении циклоалкила, циклоалкенила, гетероциклила или гетероцикленила.
«Циклилокси» означает группу циклил-O-, где циклильная группа описана в настоящем документе. Примеры циклоалкоксигрупп включают циклопентилокси, циклогексилокси, хинуклидилокси, пентаметиленсульфидокси, тетрагидропиранилокси, тетрагидротиофенилокси, пирролидинилокси, тетрагидрофуранилокси или 7-оксабицикло[2.2.1]гептанилокси, гидрокситетрагидропиранилокси, гидрокси-7-оксабицикло[2.2.1]гептанилокси и им подобные.
«Циклилсульфинил» означает группу циклил-S(O)-, где циклильная группа описана в настоящем документе.
«Циклилсульфонил» означает группу циклил-S(O)2-, где циклильная группа описана в настоящем документе.
«Циклилтио» означает группу циклил-S-, где циклильная группа описана в настоящем документе.
«Диазо» означает бивалентный радикал -N=N-.
«Замещаемая группа» означает группу, которая, являясь связанной с L, как определено в настоящем документе, может быть замещена при нуклеофильной атаке моно- или дизамещенной аминной группой в присутствии или в отсутствие агента, который способствует такой атаке, например, агента реакции сочетания. Примеры замещаемых групп включают гидроксигруппу, алифатическую оксигруппу, галоген, N-оксисукцинимид, ацилоксигруппу и им подобные.
«Эффективное количество» означает количество соединения/композиции в соответствии с настоящим изобретением, эффективное для получения желаемого терапевтического эффекта.
«Конденсированный арилциклоалкенил» означает конденсированные арил и циклоалкенил, определенные в настоящем документе. Предпочтительными являются конденсированные арилциклоалкенилы, в которых арилом является фенил, а циклоалкенил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный арилциклоалкенил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. «Замещенный конденсированный арилциклоалкенил» означает группу конденсированного арилциклоалкенила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры конденсированного арилциклоалкенила включают 1,2-дигидронафтилен, инден и им подобные.
«Конденсированный арилциклоалкил» означает конденсированные арил и циклоалкил, определенные в настоящем документе. Предпочтительными являются конденсированные арилциклоалкилы, в которых арилом является фенил, а циклоалкил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный арилциклоалкил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. «Замещенный конденсированный арилциклоалкил» означает группу конденсированного арилциклоалкила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Примеры конденсированного арилциклоалкила включают 1,2,3,4-тетрагидронафтилен и тому подобное.
«Конденсированный арилгетероцикленил» означает конденсированные арил и гетероцикленил, определенные в настоящем документе. Предпочтительными являются конденсированные арилгетероцикленилы, в которых арилом является фенил, а гетероцикленил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный арилгетероцикленил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероцикленильной частью конденсированного арилгетероцикленила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный конденсированный арилгетероцикленил» означает группу конденсированного арилгетероцикленила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота конденсированного арилгетероцикленила может быть основным атомом азота. Атом азота или серы гетероцикленильной части конденсированного арилгетероцикленила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примеры конденсированного арилгетероцикленила включают 3H-индолинил, 1H-2-оксохинолил, 2H-1-оксоизохинолил, 1,2-дигидрохинолинил, 3,4-дигидрохинолинил, 1,2-дигидроизохинолинил, 3,4-дигидроизохинолинил и им подобные.
«Конденсированный арилгетероциклил» означает конденсированные арил и гетероциклил, определенные в настоящем документе. Предпочтительными являются конденсированные арилгетероциклилы, в которых арилом является фенил, а гетероциклил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный арилгетероциклил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероциклильной частью конденсированного арилгетероциклила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный конденсированный арилгетероциклил» означает группу конденсированного арилгетероциклила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота конденсированного арилгетероциклила может быть основным атомом азота. Атом азота или серы гетероциклильной части конденсированного арилгетероциклила также может быть также необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примеры кольцевых систем конденсированных арилгетероциклилов включают индолинил, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 1H-2,3-дигидроизоиндол-2-ил, 2,3-дигидробенз[f]изоиндол-2-ил, 1,2,3,4-тетрагидробенз[g]-изохинолин-2-ил и им подобные.
«Конденсированный гетероарилциклоалкенил» означает конденсированные гетероарил и циклоалкенил, определенные в настоящем документе. Предпочтительными являются конденсированные гетероарилциклоалкенилы, в которых гетероарилом является фенил, а циклоалкенил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный гетероарилциклоалкенил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероарильной частью конденсированного гетероарилциклоалкенила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный конденсированный гетероарилциклоалкенил» означает группу конденсированного гетероарилциклоалкенила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота конденсированного гетероарилциклоалкенила может быть основным атомом азота. Атом азота гетероарильной части конденсированного гетероарилциклоалкенила также может быть необязательно окислен до соответствующего N-оксида. Примеры конденсированных гетероарилциклоалкенилов включают 5,6-дигидрохинолил, 5,6-дигидроизохинолил, 5,6-дигидрохиноксалинил, 5,6-дигидрохиназолинил, 4,5-дигидро-1H-бензимидазолил, 4,5-дигидробензоксазолил и им подобные.
«Конденсированный гетероарилциклоалкил» означает конденсированные гетероарил и циклоалкил, определенные в настоящем документе. Предпочтительными являются конденсированные гетероарилциклоалкилы, в которых гетероарил состоит из примерно 5 до примерно 6 атомов в кольце, и циклоалкил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный гетероарилциклоалкил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероарильной частью конденсированного гетероарилциклоалкила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный конденсированный гетероарилциклоалкил» означает группу конденсированного гетероарилциклоалкила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота конденсированного гетероарилциклоалкила может быть основным атомом азота. Атом азота гетероарильной части конденсированного гетероарилциклоалкила также может быть необязательно окислен до соответствующего N-оксида. Примеры конденсированного гетероарилциклоалкила включают 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолил, 5,6,7,8-тетрагидрохиноксалинил, 5,6,7,8-тетрагидрохиназолил, 4,5,6,7-тетрагидро-1H-бензимидазолил, 4,5,6,7-тетрагидробензоксазолил, 1H-4-окса-1,5-диазанафтален-2-онил, 1,3-дигидроимидазол-[4,5]-пиридин-2-онил и им подобные.
«Конденсированный гетероарилгетероцикленил» означает конденсированные гетероарил и гетероцикленил, определенные в настоящем документе. Предпочтительными являются конденсированные гетероарилгетероцикленилы, в которых гетероарил состоит из примерно 5 до примерно 6 атомов в кольце, и гетероцикленил состоит из примерно 5 до примерно 6 атомов в кольце. Конденсированный гетероарилгетероцикленил в качестве переменной может связываться посредством любого атома его кольцевой системы, обладающей такой способностью. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероарильной или гетероцикленильной частью конденсированного гетероарилгетероцикленила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный конденсированный гетероарилгетероцикленил» означает группу конденсированного гетероарилгетероцикленила, определенного выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота конденсированного гетероарилгетероцикленила может быть основным атомом азота. Атом азота или серы гетероарильной части конденсированного гетероарилгетероциклила также может быть необязательно окислен до соответствующего N-оксида. Атом азота или серы гетероарильной или гетероциклильной части конденсированного гетероарилгетероциклила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примеры конденсированного гетероарилгетероцикленила включают 7,8-дигидро[1,7]нафтиридинил, 1,2-дигидро[2,7]-нафтиридинил, 6,7-дигидро-3H-имидазо[4,5-c]пиридил, 1,2-дигидро-1,5-нафтиридинил, 1,2-дигидро-1,6-нафтиридинил, 1,2-дигидро-1,7-нафтиридинил, 1,2-дигидро-1,8-нафтиридинил, 1,2-дигидро-2,6-нафтиридинил и им подобные.
«Гало» или «галоген» означает фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром, и более предпочтительными являются фтор или хлор.
«Гетероароил» означает группу гетероарил-CO-, где гетероарильная группа описана в настоящем документе. Примеры гетероароильных групп включают тиофеноил, никотиноил, пиррол-2-илкарбонил, 1- и 2-нафтоил, пиридиноил и им подобные.
«Гетероарил» означает ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от примерно 5 до примерно 14 атомов углерода, предпочтительно от примерно 5 до примерно 10 атомов углерода, в которой один или несколько атомов углерода в кольцевой системе являются гетероэлементами, отличными от углерода, например, азотом, кислородом или серой. Предпочтительно кольцевая система включает от 1 до 3 гетероатомов. Предпочтительны кольцевые системы размером от примерно 5 до примерно 6 атомов в кольце. Гетероарил включает конденсированный гетероарилциклоалкенил, конденсированный гетероарилциклоалкил, конденсированный гетероарилгетероцикленил и конденсированный гетероарилгетероциклил, определенные в настоящем документе, когда они связаны посредством их гетероарильной группы. «Замещенный гетероарил» означает гетероарильную группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероарилом означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. Атом азота гетероарила может быть основным атомом азота и также может быть необязательно окислен до соответствующего N-оксида. Примеры гетероарильной и замещенной гетероарильной групп включают пиразинил, тиенил, изотиазолил, оксазолил, пиразолил, фуразанил, пирролил, 1,2,4-тиадиазолил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-a]пиридин, имидазо[2,1-b]тиазолил, бензофуразанил, азаиндолил, бензимидазолил, бензотиенил, тиенопиридил, тиенопиримидил, пирролопиридил, имидазопиридил, бензоазаиндолил, 1,2,4-триазинил, бензтиазолил, фуранил, имидазолил, индолил, индолизинил, изоксазолил, изохинолинил, изотиазолил, оксадиазолил, пиразинил, пиридазинил, пиразолил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, 1,3,4-тиадиазолил, тиазолил, тиенил, триазолил и им подобные. Предпочтительной гетероарильной группой является пиразинил.
«Гетероарилдиил» означает бивалентный радикал, полученный от гетероарила, где гетероарил описан в настоящем документе. Примером гетероарилдиильного радикала является необязательно замещенный пиридиндиил.
«Гетероарилсульфонилкарбамоил» означает группу гетероарил-SO2-NH-C(=O)-, где гетероарильная группа описана в настоящем документе.
«Гетероцикленил» означает неароматическую моноциклическую или полициклическую углеводородную кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, предпочтительно от примерно 5 до примерно 10 атомов углерода, в которой один или несколько атомов углерода в кольцевой системе являются гетероэлементами, отличными от углерода, например, азотом, кислородом или серой, и которая содержит по меньшей мере одну двойную углерод-углеродную связь или двойную углерод-азотную связь. Предпочтительно кольцевая система включает от 1 до 3 гетероатомов. Предпочтительны кольцевые системы размером от примерно 5 до примерно 6 атомов в кольце, причем такие предпочтительные кольцевые системы также обозначаются как «низшие». Гетероцикленил включает конденсированный арилгетероцикленил и конденсированный гетероарилгетероцикленил, определенные в настоящем документе, когда они связаны посредством их гетероцикленильной группы. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероцикленилом означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный гетероцикленил» означает гетероцикленильную группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота гетероцикленила может быть основным атомом азота. Атом азота или серы гетероцикленила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-оксида. Примеры моноциклических азагетероцикленильных групп включают 1,2,3,4-тетрагидропиридин, 1,2-дигидропиридил, 1,4-дигидропиридил, 1,2,3,6-тетрагидропиридин, 1,4,5,6-тетрагидропиримидин, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил и им подобные. Примеры оксагетероцикленильных групп включают 3,4-дигидро-2H-пиран, дигидрофуранил и фтордигидрофуранил. Примером полициклической оксагетероцикленильной группы является 7-оксабицикло[2,2,1]гептенил. Примеры моноциклических тиагетероцикленильных колец включают дигидротиофенил и дигидротиопиранил.
«Гетероциклил» означает неароматическую насыщенную моноциклическую или полициклическую кольцевую систему, имеющую примерно от 3 до примерно 10 атомов углерода, предпочтительно примерно от 5 до примерно 10 атомов углерода, в которой один или несколько атомов углерода в кольцевой системе являются гетероэлементами, отличными от углерода, например азотом, кислородом или серой. Предпочтительно кольцевая система содержит от 1 до 3 гетероатомов. Предпочтительны кольцевые системы размером от примерно 5 до примерно 6 атомов в кольце, причем такие предпочтительные кольцевые системы также обозначаются как «низшие». Гетероциклил включает конденсированный арилгетероциклил и конденсированный гетероарилгетероциклил, определенные в настоящем документе, когда они связаны посредством их гетероциклильной группы. Обозначения «аза», «окса» или «тиа» в качестве приставки перед гетероциклилом означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы, соответственно. «Замещенный гетероциклил» означает гетероциклильную группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе. Атом азота гетероциклила может быть основным атомом азота. Атом азота или серы гетероциклила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примеры моноциклических гетероциклильных колец включают пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и им подобные.
«Гетероциклилен» означает бивалентную гетероциклильную группу, определенную в настоящем документе, имеющую от примерно 4 до примерно 8 атомов углерода. Предпочтительны кольцевые системы гетероциклилена размером от примерно 5 до примерно 6 атомов в кольце, причем такие предпочтительные кольцевые системы также обозначаются как «низшие». Точки связывания циклоалкиленовой группы включают положения 1,1-, 1,2-, 1,3- или 1,4, причем, когда это применимо, стереохимическая конфигурация точек образования связей может быть цис или транс. Примеры гетероциклиленовых групп включают (1,1-, 1,2- или 1,3-)пиперидинилен и (1,1- или 1,2-)тетрагидрофуранилен. «Замещенный гетероциклилен» означает гетероциклиленовую группу, определенную выше, которая замещена одним или несколькими «заместителями кольцевой группы» (предпочтительно от 1 до 3), которые могут быть одинаковыми или различными и которые определены в настоящем документе.
«Гидрат» означает сольват, в котором молекулы растворителя являются водой.
«N-оксид» означает группу, имеющую следующую структуру.
«Пациент» означает человека и других млекопитающих.
«Фармацевтически приемлемый сложный эфир» означает сложные эфиры, которые гидролизуются in vivo и включают такие эфиры, которые легко расщепляются в организме человека на исходное соединение или его соль. Подходящие сложноэфирные группы включают, например, группы, полученные из фармацевтически приемлемых алифатических карбоновых кислот, в частности, алкановой, алкеновой, циклоалкановой и алкандионовой кислот, в которых алкильная или алкенильная группа предпочтительно имеет не более 6 атомов углерода. Примеры сложных эфиров включают формиаты, ацетаты, пропионаты, бутираты, акрилаты, этилсукцинаты и им подобные.
Используемый в настоящем документе термин «фармацевтически приемлемые пролекарства» означает пролекарства соединений по настоящему изобретению, которые в соответствии с компетентным медицинским заключением считаются подходящими для использования в контакте с тканями пациента, при этом нежелательная токсичность, раздражение или аллергическая реакция и тому подобное находятся в пределах разумного соотношения пользы и риска, а также являются эффективными для их использования при назначении соединений по настоящему изобретению. Термин «пролекарства» означает соединения, которые быстро преобразуются in vivo в исходное соединение приведенной выше формулы, например, в результате гидролиза в крови. Функциональные группы, которые могут подвергаться быстрым преобразованиям путем метаболического распада in vivo, образуют класс групп, способных вступать в реакцию с карбоксильной группой соединений по настоящему изобретению. Они включают, но не ограничиваются ими, такие группы, как алканоил (например, ацетил, пропаноил, бутаноил и им подобные), незамещенный и замещенный ароил (например, бензоил и замещенный бензоил), алкоксикарбонил (например, этоксикарбонил), триалкилсилил (например, триметил- и триэтилсилил), моноэфиры, образуемые дикарбоновыми кислотами (например, сукцинил), и им подобные. Вследствие легкости, с которой подверженные метаболическому распаду группы соединений по настоящему изобретению расщепляются in vivo, соединения с такими группами действуют в качестве пролекарств. Соединения с подверженными метаболическому распаду группами обладают тем преимуществом, что они могут проявлять повышенную биодоступность в результате более высокой растворимости и/или скорости всасывания исходного соединения благодаря наличию подверженной метаболическому распаду группы. Подробный анализ представлен в публикациях Design of Prodrugs, H. Bundgaard, ed., Elsevier (1985); Methods in Enzymology; K. Widder et al, Ed., Academic Press, 42, 309-396 (1985); A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bandaged, ed., Chapter 5; "Design and Applications of Prodrugs" 113-191 (1991); Advanced Drug Delivery Reviews, H. Bundgard, 8, 1-38, (1992); J. Pharm. Sci., 77, 285 (1988); Chem. Pharm. Bull., N. Nakeya et al, 32, 692 (1984); Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, 14 A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, E.B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987, которые включены в настоящий документ посредством ссылки.
«Фармацевтически приемлемые соли» означают относительно нетоксичные, неорганические и органические соли присоединения кислоты (кислотно-аддитивные соли) и соли присоединения основания (основно-аддитивные соли) соединений по настоящему изобретению,. Эти соли могут быть получены in situ на конечной стадии выделения и очистки соединений. В частности, кислотно-аддитивные соли могут быть получены отдельно путем взаимодействия очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Примеры кислотно-аддитивных солей включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты, лактиобионаты, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы, лаурилсульфонаты и им подобные. См., например, публикацию S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm. Sci., 66, 1-19 (1977), которая включена в настоящее описание посредством ссылки. Основно-аддитивные соли можно также получить независимым образом путем взаимодействия очищенного соединения в его кислой форме с подходящим органическим или неорганическим основанием и выделения полученной таким образом соли. Основно-аддитивные соли включают фармацевтически приемлемые соли металлов и аминов. Подходящие соли металлов включают соли натрия, калия, кальция, бария, цинка, магния и алюминия. Предпочтительными являются соли натрия и калия. Подходящие неорганические основно-аддитивные соли получают из оснований металлов, которые включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния, гидроксид цинка и им подобные. Подходящие аминные соли присоединения основания получают из аминов, основность которых достаточна для образования стабильной соли, и предпочтительно из аминов, часто используемых в медицинской химии по причине их низкой токсичности и пригодности для использования в медицинских целях, таких как аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенетиламин, диэтиламин, пиперазин, трис(гидроксиметил)аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дегидроабиетиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например, лизин и аргинин, дициклогексиламин и им подобные.
«Заместители кольцевой группы» означают заместители, присоединенные к ароматическим и неароматическим кольцевым системам, включая арил, гетероарил, гидрокси, алкокси, циклилокси, арилокси, гетероарилокси, ацил или его тиоксоаналог, циклилкарбонил или его тиоксоаналог, ароил или его тиоксоаналог, гетероароил или его тиоксоаналог, ацилокси, циклилкарбонилокси, ароилокси, гетероароилокси, галоген, нитро, циано, карбокси (кислота), -C(O)-NHOH -C(O)-CH2OH, -C(O)-CH2SH-C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, 3,5-диоксо-1,2,4-оксадиазолидинил или гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3-гидрокси-1-метилпиразолил, алкоксикарбонил, циклилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, алкилсульфонил, циклилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфинил, циклилсульфинил, арилсульфинил, гетероарилсульфинил, алкилтио, циклилтио, арилтио, гетероарилтио, циклил, арилдиазо, гетероарилдиазо, тиол, Y1Y2N-, Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3- или Y1Y2NSO2-, где Y1, Y2 и Y3 являются независимо водородом, алкилом, арилом или гетероарилом, или если заместителем является Y1Y2N-, тогда один из Y1 и Y2 может быть ацилом, циклилкарбонилом, ароилом, гетероароилом, алкоксикарбонилом, циклилоксикарбонилом, арилоксикарбонилом или гетероарилоксикарбонилом, как определено в настоящем документе, а другой член пары Y1 и Y2 является таким, как определено ранее, или если заместителем является Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3- или Y1Y2NSO2-, то Y1 и Y2 могут также быть взяты вместе с атомом азота, посредством которого Y1 и Y2 связаны, образуя 4-7-членный азагетероциклил или азагетероцикленил. Когда кольцевая система насыщена или частично насыщена, «заместители кольцевой группы» дополнительно включают метилен (H2C=), оксо (O=) и тиоксо (S=). Заместителями кислотной/амидной кольцевой группы являются карбокси (кислота), -C(O)-NHOH, -C(O)CH2OH, -C(O)-CH2SH, -C(O)-NH-CN, сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил, N-метоксикарбамоил, гетероарилсульфонилкарбамоил, 3-гидрокси-3-циклобутен-1,2-дион, 3,5-диоксо-1,2,4-оксадиазолидинил или гидроксигетероарил, такой как 3-гидроксиизоксазолил, 3-гидрокси-1-метилпиразолил и Y1Y2NCO-. Заместителями некислотной полярной кольцевой группы являются гидрокси, оксо (O=), тиоксо (S=), ацил или его тиоксоаналог, циклилкарбонил или его тиоксоаналог, ароил или его тиоксоаналог, гетероароил или его тиоксоаналог, алкоксикарбонил, циклилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, ацилокси, циклилкарбонилокси, ароилокси, гетероароилокси, алкилсульфонил, циклилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфинил, циклилсульфинил, арилсульфинил, гетероарилсульфинил, тиол, Y1Y2N-, Y1Y2NC(O)-, Y1Y2NC(O)O-, Y1Y2NC(O)NY3- или Y1Y2NSO2-.
«Сольват» означает соединение по настоящему изобретению, физически связанное с одной или несколькими молекулами растворителя. К физическому связыванию относится, в частности, образование водородной связи. В определенных случаях сольват может быть выделен, например, когда одна или более молекул растворителя включены в кристаллическую решетку твердого кристаллического вещества. Термин «сольват» распространяется как на фазу раствора, так и на выделяемые сольваты. Примеры сольватов включают гидраты, этанолаты, метанолаты и им подобные.
Фармакология
Экспериментальные методы и/или анализы, использованные для определения активности:
Анализ FLIPR - CXCR5 человека:
Изменения внутриклеточной концентрации Ca2+ измеряют в клеточной линии RBL, стабильно трансфицированной ДНК CXCR5 человека. До проведения анализа 9000 клеток/ячейку помещают в планшет и инкубируют при 37°C, 5% CO2 в течение 20 часов. На следующий день клетки однократно промывают аналитическим буфером, содержащим раствор Хэнкса (Invitrogen, 14025-092) с 20 мМ HEPES, pH 7,4, и добавляют краситель при инкубировании в течение 30 минут при 37°C с 2 мкМ fluo-4/AM (Molecular Probes, F14202) в аналитическом буфере с добавлением 2,5 мМ пробенецида. Клетки трижды промывают аналитическим буфером, затем соединения в аналитическом буфере с 0,1% BSA добавляют к клеткам. Клетки трижды промывают аналитическим буфером, затем стимулируют 10 нМ CXCL13 человека (R&D, 801-CX/CF). Изменения в концентрации внутриклеточного Ca2+ регистрируют с помощью 384-B FLIPR (Molecular Devices).
Анализ FLIPR - мышиный CXCR5
Изменения внутриклеточной концентрации Ca2+ измеряют в клеточной линии RBL, стабильно трансфицированной ДНК мышиного CXCR5. До проведения анализа 9000 клеток/ячейку помещают в планшет и инкубируют при 37°C, 5% CO2 в течение 20 часов. На следующий день клетки однократно промывают аналитическим буфером, содержащим раствор Хэнкса (Invitrogen, 14025-092) с 20 мМ HEPES, pH 7,4, и добавляют краситель при инкубировании в течение 30 минут при 37°C с 2 мкМ fluo-4/AM (Molecular Probes, F14202) в аналитическом буфере с добавлением 2,5 мМ пробенецида. Клетки трижды промывают аналитическим буфером, затем соединения в аналитическом буфере с 0,1% BSA добавляют к клеткам. Клетки трижды промывают аналитическим буфером, затем стимулируют 6 нМ мышиного CXCL13 (R&D, 470-BC). Изменения в концентрации внутриклеточного Ca2+ регистрируют с помощью 384-B FLIPR (Molecular Devices).
Анализ GTPγS:
Анализ связывания с [35S]-GTPγS для CXCR5 проводят с использованием мембран, приготовленных из клеточной линии RBL, стабильно трансфицированной ДНК CXCR5 человека. 2,5 мкМ GDP, испытуемое соединение при нужной концентрации (или ДМСО в контрольных образцах), 10 мкМ немеченого GTPγS (или буфер в контрольных образцах) и 7,5 мкг клеточных мембран/ячейку смешивают вместе (планшетный шейкер) в течение 15 минут при комнатной температуре. Добавляют 750 нМ CXCL13 человека и 400 пМ [35S]-GTPγS и планшет встряхивают в течение 5 минут при комнатной температуре. Затем добавляют гранулы полиакрилата натрия по 1,134 мг/ячейку и планшет встряхивают в течение 45 минут при комнатной температуре. Реакцию останавливают центрифугированием при 230g в течение 10 минут и измеряют радиоактивность на бета-счетчике Wallac Microbeta Trilux.
Анализ хемотаксиса:
Ячейки в аналитическом планшете предварительно покрывают 150 мкл RPMI (без фенолового красного), содержащего 1% BSA, в течение 2 часов при комнатной температуре. Буфер с предварительным покрытием удаляют и ячейки дважды промывают аналитическим буфером CTX (см. ниже). Клетки CXCR5+ HS Sultan (ATCC кат. № CRL 1484) добавляют в верхнюю камеру планшета с перекрестными ячейками (Millipore кат. № MAMI C5S 10) с 0,6×105 клеток/ячейку и инкубируют с испытуемым соединением в течение 15 минут при комнатной температуре. CXCL13 лиганд в концентрации 100 нМ (R&D, кат. № 801-cx/cf) или CTX-буфер (RPMI без фенолового красного с добавкой 0,02% BSA, 1 мМ пирувата натрия) добавляют в нижнюю камеру. Две камеры собирают и инкубируют при 37°C в течение 2 часов. Верхнюю камеру затем удаляют и считают клетки в нижней камере после добавления колориметрического агента (Promega кат. № G3581) и считывания показаний при OD490. Специфическая миграция CXCR5 = сумма всех мигрирующих клеток - спонтанно мигрирующие клетки (ячейки, содержащие буфер CTX без лиганда).
Приведенные ниже экспериментальные данные содержат информацию по ингибирующей активности, которая определяется значениями IC50 в приведенных в настоящем документе примерах. Приведенные ниже конкретные варианты осуществления изобретения носят иллюстративный характер и не ограничивают связанных с изобретением эквивалентных приложений.
|
|
|
Получение соединений по настоящему изобретению
Исходные вещества и промежуточные соединения по настоящему изобретению могут быть получены путем применения или адаптации известных способов, описанных ниже, их очевидных химических эквивалентов или способов, описанных в литературе, например в публикации R.C. Larock in Comprehensive Organic Transformations, VCH publishers (1989).
Очистка методом ВЭЖХ относится к препаративной высокоэффективной жидкостной хроматографии с использованием следующих условий: [колонка C18, размер частиц 10 микрон, градиентное элюирование: 20-100% CH3CN (0,1% ТФУК) в H2O (0,1% ТФУК)].
ПРИМЕРЫ
ПРИМЕР 1
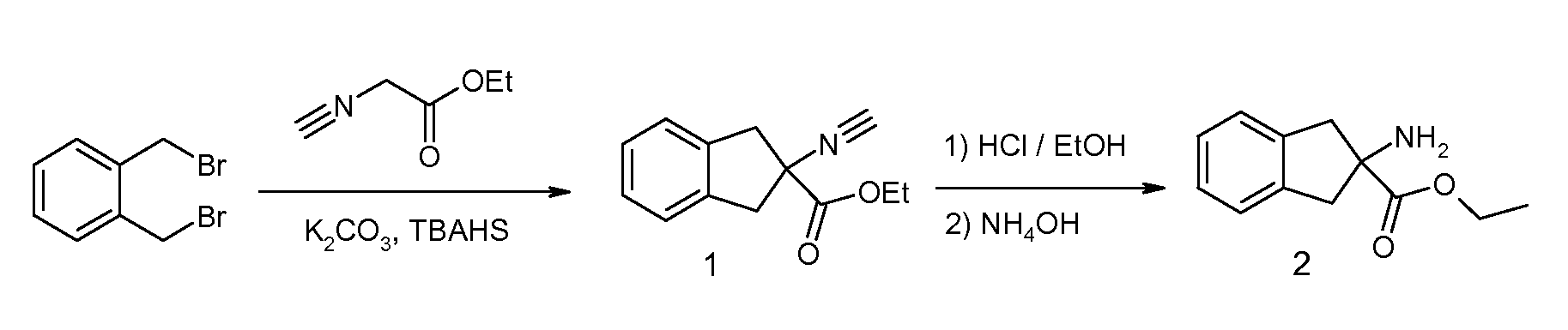
Этиловый эфир изоцианоиндан-2-карбоновой кислоты (1):
К раствору этилизоцианоацетата (4,29 г, 37,9 ммоль) в безводном ACN (400 мл) добавляют безводный K2CO3 (K2SO4, 31,4 г, 227 ммоль), TBAHS (гидросульфат тетрабутиламмония, 2,57 г, 7,58 ммоль) и 1,2-бисбромметилбензол (10,0 г, 37,9 ммоль). Полученную гетерогенную смесь перемешивают при температуре 75°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления нежелательных солей. Осадок на фильтре промывают ACN (20 мл) и фильтрат концентрируют в вакууме. Остаток растворяют в этиловом эфире (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (3×10 мл). Органический слой сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (400 г силикагеля; градиентное элюирование: 20-100% EtOAc в гептане) с получением чистого продукта в виде твердого вещества белого цвета (8,0 г, 49%).
1H ЯМР (CDCl3, 300МГц): δ 1,35 (т, 3H), 3,47 (д, 2H), 3,71 (д, 2H), 4,32 (кв, 2H), 7,25 (с, 4H)
ЖХ/МС (ES+) m/z=449,25
ПРИМЕР 2
Этиловый эфир 2-аминоиндан-2-карбоновой кислоты (2):
К раствору этилового эфира 2-изоцианоиндан-2-карбоновой кислоты (1) (8,0 г, 37,2 ммоль) в абсолютном EtOH (200 мл) по каплям добавляют концентрированную HCl (5 мл). Полученный раствор перемешивают при комнатной температуре в течение 5 часов. После удаления EtOH в вакууме остающуюся гидрохлоридную соль растворяют в воде (100 мл) и экстрагируют этиловым эфиром (3×5 мл) для удаления нежелательных органических примесей. Кислотность водного слоя доводят до pH 10, добавляя раствор NH4OH и затем экстрагируя этилацетатом (3×50 мл). Объединенные EtOAc-слои промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над Na2SO4 и концентрируют в вакууме с получением чистого продукта в виде твердого вещества белого цвета (4,7 г, 62%).
1H ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,88 (д, 2H), 3,57 (д, 2H), 4,23 (кв, 2H), 7,16-7,23 (м, 4H)
ЖХ/МС (EZ+) m/z=206,08
ПРИМЕР 3
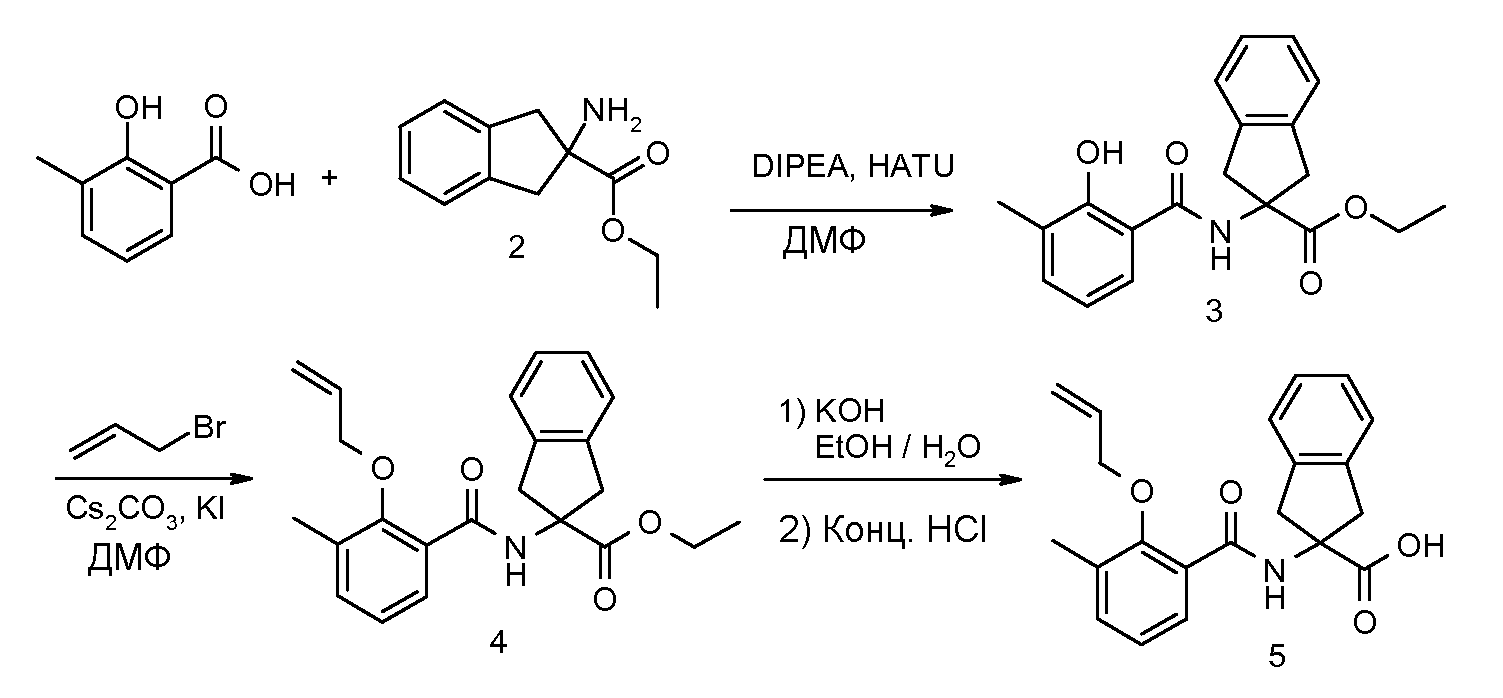
Этиловый эфир 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3):
К раствору 2-гидрокси-3-метилбензойной кислоты (3,65 г, 24 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (5,00 г, 24 ммоль), HATU [O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний PF6] (11,0 г, 29 ммоль) в безводном ДМФА (30 мл) добавляют DIPEA (8,30 мл, 50 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (400 г силикагеля, градиентное элюирование: 10-80% EtOAc в гептане) с получением чистого продукта (3) в виде твердого вещества белого цвета (5,5 г, 67%).
1H ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 2,23 (с, 3H), 3,40 (д, 2H), 3,74 (д, 2H), 4,25 (кв, 2H), 6,70 (т, 1H), 6,84 (с, 1H), 7,15-7,25 (м, 6H), 12,21 (с, 1H)
ЖХ/МС (ES+) m/z=340,15
ПРИМЕР 4
Этиловый эфир 2-(2-аллилокси-3-метилбензоиламино)индан-2-карбоновой кислоты (4):
К суспензии этилового эфира 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3) (300 мг, 0,88 ммоль), безводного Cs2CO3 (573 мг, 1,76 ммоль) и KI (30 мг, 0,18 ммоль) в ДМФА (8 мл) добавляют 3-бромпропан (90 мкл, 1,06 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-30% EtOAc в гептане) с получением чистого продукта (4) в виде твердого вещества белого цвета (303 мг, 91%).
1H ЯМР (CDCl3, 300МГц): δ 1,25 (т, 3H), 2,26 (с, 3H), 3,33 (д, 2H), 3,75 (д, 2H), 4,25 (кв, 2H), 5,21 (д, 1H), 5,33 (д, 1H), 5,86 (м, 1H), 7,09 (т, 1H), 7,19 (уш.с, 4H), 7,27 (д, 1H), 7,88 (д, 1H), 8,43 (с, 1H)
ЖХ/МС (ES+) m/z=380,20
ПРИМЕР 5
2-(2-Аллилокси-3-метилбензоиламино)индан-2-карбоновая кислота (5):
Смесь этилового эфира 2-(2-аллилокси-3-метилбензоиламино)индан-2-карбоновой кислоты (4) (168 мг, 0,44 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (5) в виде твердого вещества белого цвета (150 мг, 97%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 2,26 (с, 3H), 3,34 (д, 2H), 3,77 (д, 2H), 4,23 (д, 2H), 5,20 (д, 1H), 5,32 (д, 1H), 5,84 (м, 1H), 7,10 (т, 1H), 7,16-7,23 (м, 4H), 7,29 (д, 1H), 7,83 (дд, 1H), 8,57 (с, 1H)
ЖХ/МС (ES+) m/z=352,15
ПРИМЕР 6
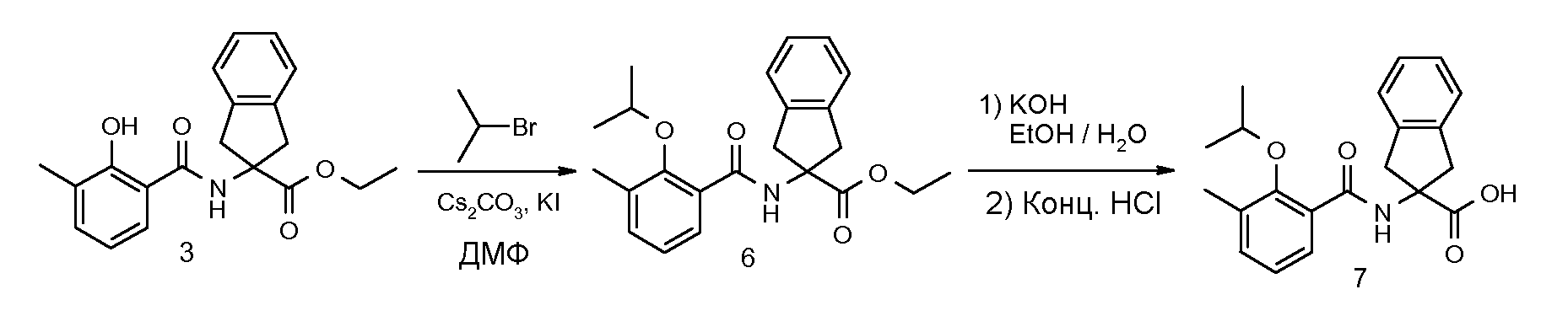
Этиловый эфир 2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (6):
К суспензии этилового эфира 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3) (300 мг, 0,88 ммоль), безводного Cs2CO3 (573 мг, 1,76 ммоль) и KI (30 мг, 0,18 ммоль) в ДМФА (10 мл) добавляют 2-бромпропан (330 мкл, 3,52 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (6) в виде твердого вещества белого цвета (174 мг, 52%).
1Н ЯМР (CDCl3, 300МГц): δ 1,03 (д, 6H), 1,24 (т, 3H), 2,25 (с, 3H), 3,34 (д, 2H), 3,77 (д, 2H), 4,21 (м, 1H), 4,25 (кв, 2H), 7,07 (т, 1H), 7,17-7,26 (м, 5H), 7,85 (дд, 1H), 8,31 (с, 1H)
ЖХ/МС (ES+) m/z=382,18
ПРИМЕР 7
2-(2-Изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота (7):
Смесь этилового эфира 2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (6) (265 мг, 0,69 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (6 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и раствор подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (7) в виде твердого вещества белого цвета (244 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,98 (д, 6H), 2,24 (с, 3H), 3,41 (д, 2H), 3,85 (д, 2H), 4,14 (м, 1H), 7,08 (т, 1H), 7,18-7,30 (м, 5H), 7,88 (д, 1H), 8,52 (с, 1H)
ЖХ/МС (ES+) m/z=354,16
ПРИМЕР 8
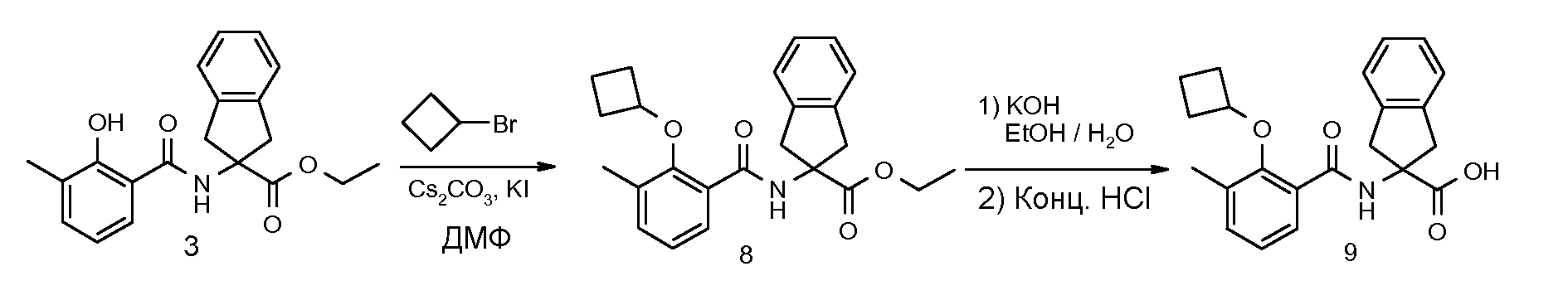
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (8):
К суспензии этилового эфира 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3) (400 мг, 1,18 ммоль), безводного Cs2CO3 (769 мг, 2,36 ммоль) и KI (40 мг, 0,24 ммоль) в ДМФА (10 мл) добавляют бромциклобутан (130 мкл, 1,42 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (8) в виде твердого вещества белого цвета (320 мг, 69%).
1Н ЯМР (CDCl3, 300МГц): δ 1,25 (т, 3H), 1,18-1,34 (м, 1H), 1,41-1,52 (м, 1H), 1,87-2,07 (м, 4H), 2,26 (с, 3H), 3,36 (д, 2H), 3,78 (д, 2H), 4,22-4,29 (м, 1H), 4,24 (кв, 2H), 7,07 (т, 1H), 7,17-7,27 (м, 5H), 7,86 (дд, 1H), 8,33 (с, 1H)
ЖХ/МС (ES+) m/z=394,19
ПРИМЕР 9
2-(2-Циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (9):
Смесь этилового эфира 2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (8) (250 мг, 0,64 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и раствор подкисляют концентрированной HCl до pH~3 с получением осадка. Осадок фильтруют с получением чистого продукта (9) в виде твердого вещества белого цвета (190 мг, 81%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,24 (м, 1H), 1,45 (м, 1H), 1,87-2,01 (м, 4H), 2,26 (с, 3H), 3,40 (д, 2H), 3,81 (д, 2H), 4,26 (м, 1H), 7,08 (т, 1H), 7,18-7,29 (м, 5H), 7,82 (дд, 1H), 8,48 (с, 1H)
ЖХ/МС (ES+) m/z=366,16
ПРИМЕР 10

Этиловый эфир 2-(2-циклопропилметокси-3-метилбензоиламино)индан-2-карбоновой кислоты (10):
К суспензии этилового эфира 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3) (400 мг, 1,18 ммоль), безводного Cs2CO3 (769 мг, 2,36 ммоль) и KI (40 мг, 0,24 ммоль) в ДМФА (10 мл) добавляют бромметилциклопропан (229 мкл, 2,36 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (10) в виде твердого вещества белого цвета (330 мг, 71%).
1Н ЯМР (CDCl3, 300МГц): δ 0,17 (м, 2H), 0,50 (м, 2H), 0,91 (м, 1H), 1,24 (т, 3H), 2,26 (с, 3H), 3,36 (д, 2H), 3,54 (д, 2H), 3,79 (д, 2H), 4,24 (кв, 2H), 7,08 (т, 1H), 7,15-7,27 (м, 5H), 7,86 (дд, 1H), 8,44 (с, 1H)
ЖХ/МС (ES+) m/z=394,18
ПРИМЕР 11
2-(2-Циклопропилметокси-3-метилбензоиламино)индан-2-карбоновая кислота (11):
Смесь этилового эфира 2-(2-циклопропилметокси-3-метилбензоиламино)индан-2-карбоновой кислоты (10) (240 мг, 0,61 ммоль) и KOH (500 мг, 8,93 ммоль) растворяют в EtOH (6 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (11) в виде твердого вещества белого цвета (223 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,11 (м, 2H), 0,51 (м, 2H), 0,84 (м, 1H), 2,26 (с, 3H), 3,46 (дд, 4H), 3,88 (д, 2H), 7,11 (т, 1H), 7,17-7,32 (м, 5H), 7,89 (д, 1H), 8,74 (с, 1H)
ЖХ/МС (ES+) m/z=366,17
ПРИМЕР 12
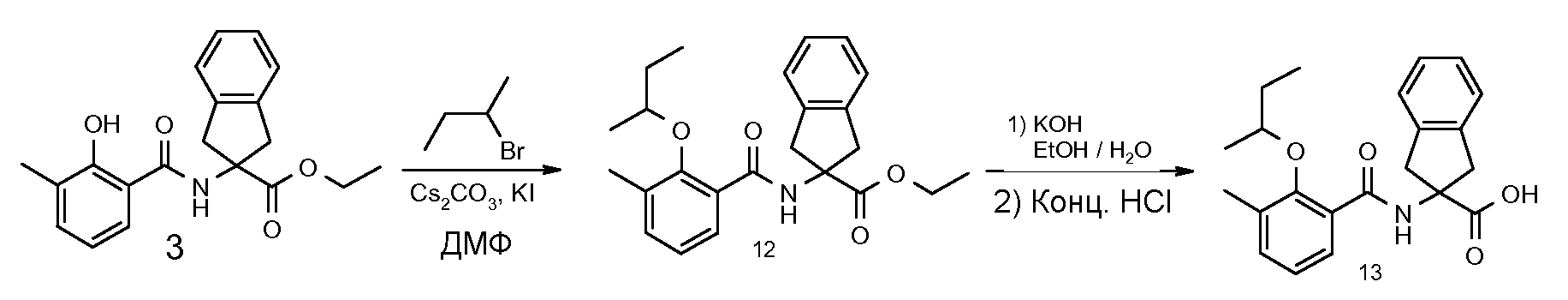
Этиловый эфир 2-(2-втор-бутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (12):
К суспензии этилового эфира 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3) (400 мг, 1,18 ммоль), безводного Cs2CO3 (574 мг, 2,36 ммоль) и KI (40 мг, 0,24 ммоль) в ДМФА (10 мл) добавляют 2-бромбутан (508 мкл, 4,72 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (12) в виде твердого вещества белого цвета (395 мг, 85%).
1Н ЯМР (CDCl3, 300МГц): δ 0,80 (т, 3H), 0,93 (д, 3H), 1,22-1,30 (м, 4H), 1,48 (м, 1H), 2,25 (с, 3H), 3,33 (дд, 2H), 3,76 (дд, 2H), 3,97 (м, 1H), 4,25 (кв, 2H), 7,01 (т, 1H), 7,17-7,26 (м, 5H), 7,87 (дд, 1H), 8,35 (с, 1H)
ЖХ/МС (ES+) m/z=396,19
ПРИМЕР 13
2-(2-втор-Бутокси-3-метилбензоиламино)индан-2-карбоновая кислота (13):
Смесь этилового эфира 2-(2-втор-бутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (12) (176 мг, 0,44 ммоль) и KOH (500 мг, 8,93 ммоль) растворяют в EtOH (6 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (13) в виде твердого вещества белого цвета (162 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,79 (т, 3H), 0,86 (д, 3H), 1,18 (м, 1H), 1,49 (м, 1H), 2,25 (с, 3H), 3,42 (т, 2H), 3,86 (дд, 2H), 3,91 (м, 1H), 7,09 (т, 1H), 7,19-7,31 (м, 5H), 7,90 (д, 1H), 8,59 (с, 1H)
ЖХ/МС (ES+) m/z=368,17
ПРИМЕР 14
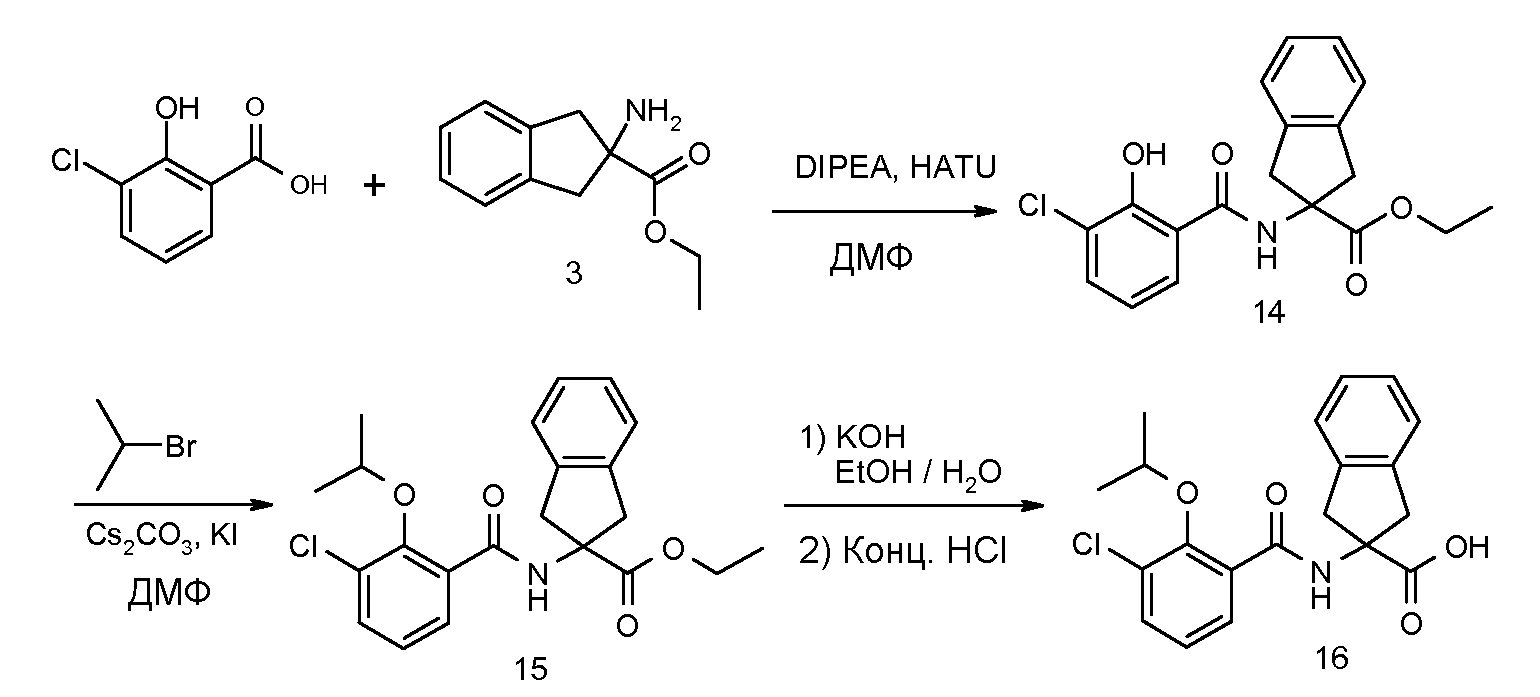
Этиловый эфир 2-(3-хлор-2-гидроксибензоиламино)индан-2-карбоновой кислоты (14):
К раствору 3-хлор-2-гидроксибензойной кислоты (413 мг, 2,4 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,4 ммоль), HATU (1,1 г, 2,9 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (0,88 мл, 5,3 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-80% EtOAc в гептане) с получением чистого продукта (14) в виде твердого вещества белого цвета (420 мг, 49%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 3,42 (д, 2H), 3,73 (д, 2H), 4,25 (кв, 2H), 6,76 (т, 1H), 6,97 (с, 1H), 7,23-7,29 (м, 5H), 7,47 (дд, 1H), 12,5 (с, 1H)
ЖХ/МС (ES+) m/z=360,07, 362,08
ПРИМЕР 15
Этиловый эфир 2-(3-хлор-2-изопропоксибензоиламино)индан-2-карбоновой кислоты (15):
К суспензии этилового эфира 2-(3-хлор-2-гидроксибензоиламино)индан-2-карбоновой кислоты (14) (150 мг, 0,42 ммоль), безводного Cs2CO3 (274 мг, 0,84 ммоль) и KI (13 мг, 0,08 ммоль) в ДМФА (7 мл) добавляют 3-бромпропан (237 мкл, 2,52 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (80 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (15) в виде твердого вещества белого цвета (137 мг, 81%).
1Н ЯМР (CDCl3, 300МГц): δ 1,05 (д, 6H), 1,24 (т, 3H), 3,33 (д, 2H), 3,76 (д, 2H), 4,25 (кв, 2H), 4,56 (м, 1H), 7,11 (т, 1H), 7,19-7,26 (м, 4H), 7,46 (дд, 1H), 7,95 (дд, 1H), 8,28 (с, 1H)
ЖХ/МС (ES+) m/z=402,13, 404,14
ПРИМЕР 16
2-(3-Хлор-2-изопропоксибензоиламино)индан-2-карбоновая кислота (16):
Смесь этилового эфира 2-(3-хлор-2-изопропоксибензоиламино)индан-2-карбоновой кислоты (15) (122 мг, 0,30 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (16) в виде твердого вещества белого цвета (119 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,01 (д, 6H), 3,40 (д, 2H), 3,84 (д, 2H), 4,55 (м, 1H), 7,13 (т, 1H), 7,19-7,26 (м, 4H), 7,48 (дд, 1H), 7,98 (дд, 1H), 8,43 (с, 1H)
ЖХ/МС (ES+) m/z=374,11, 376,13
ПРИМЕР 17
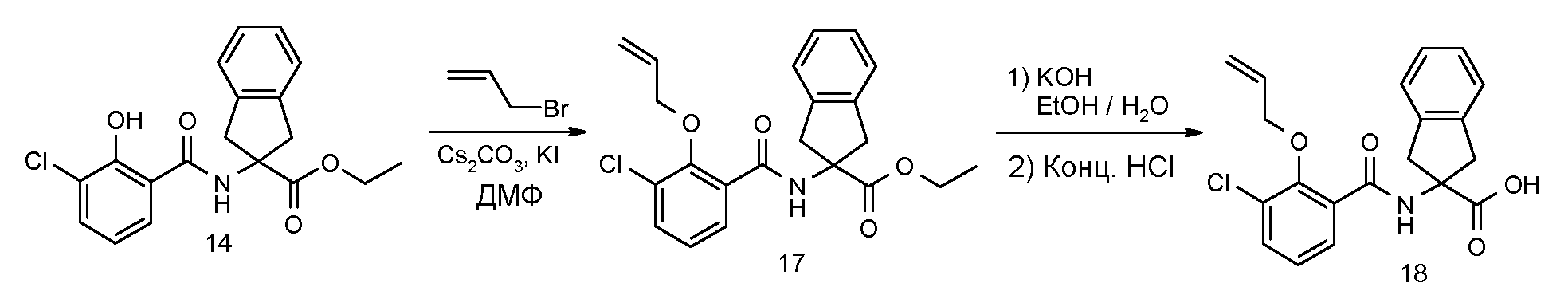
Этиловый эфир 2-(2-аллилокси-3-хлорбензоиламино)индан-2-карбоновой кислоты (17):
К суспензии этилового эфира 2-(3-хлор-2-гидроксибензоиламино)индан-2-карбоновой кислоты (14) (250 мг, 0,69 ммоль), безводного Cs2CO3 (453 мг, 1,39 ммоль) и KI (23 мг, 0,14 ммоль) в ДМФА (10 мл) добавляют 3-бромпропан (70 мкл, 0,83 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (80 г силикагеля, градиентное элюирование: 10-40% EtOAc в гептане) с получением чистого продукта (17) в виде твердого вещества белого цвета (160 мг, 58%).
1Н ЯМР (CDCl3, 300МГц): δ 1,25 (т, 3H), 3,32 (д, 2H), 3,75 (д, 2H), 4,25 (кв, 2H), 4,41 (д, 2H), 5,20-5,34 (м, 2H), 5,88 (м, 1H), 7,13-7,26 (м, 5H), 7,49 (дд, 1H), 7,97 (дд, 1H), 8,36 (с, 1H)
ЖХ/МС (ES+) m/z=402,13, 404,14
ПРИМЕР 18
2-(2-Аллилокси-3-хлорбензоиламино)индан-2-карбоновая кислота (18):
Смесь этилового эфира 2-(2-аллилокси-3-хлорбензоиламино)индан-2-карбоновой кислоты (17) (140 мг, 0,35 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и раствор подкисляют концентрированной HCl до pH~3. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (18) в виде твердого вещества белого цвета (88 мг, 68%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,35 (д, 2H), 3,78 (д, 2H), 4,41 (д, 2H), 5,21-5,34 (м, 2H), 5,87 (м, 1H), 7,13-7,30 (м, 5H), 7,50 (дд, 1H), 7,93 (дд, 1H), 8,49 (с, 1H)
ЖХ/МС (ES+) m/z=372,09, 374,10
ПРИМЕР 19
Этиловый эфир 2-амино-5-фториндан-2-карбоновой кислоты
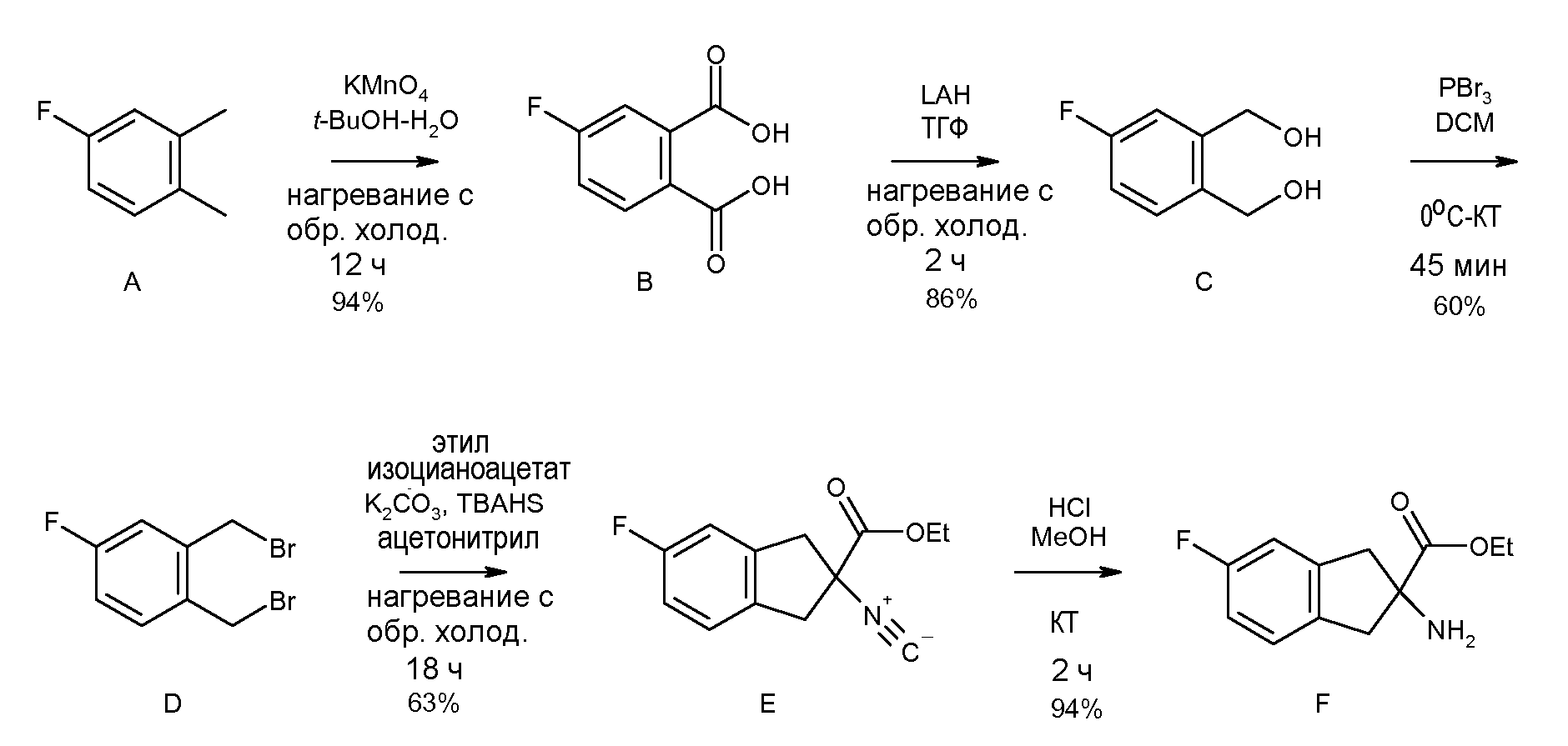
Получение соединения B: 4-фтор-1,2-диметилбензол (соединение A) (50,0 г, 402,7 ммоль) и большой избыток KMnO4 (400 г, 2,54 моль) растворяют в 1500 мл смеси воды и трет-бутанола (70/30%, об./об.). Реакционную смесь нагревают при кипении с обратным холодильником в течение ночи. Для удаления не вступившего в реакцию KMnO4 добавляют EtOH (900 мл), после чего отгоняются спирты. Полученную суспензию коричневого цвета фильтруют через слой целита. Бесцветный раствор концентрируют и подкисляют концентрированной HCl до pH 1. Продукт фильтруют, водную фазу экстрагируют EtOAc и сушат над Na2SO4. Получают 70,0 г (94%) твердого вещества B белого цвета после выпаривания при пониженном давлении.
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,39 (м, 1H), 7,63 (уш.с, 1H), 7,99 (уш.с, 1H).
Получение соединения C: LAH (37,5 г, 989 ммоль) добавляют к ТГФ (850 мл). Смесь охлаждают на ледяной бане и добавляют по каплям 4-фторфталевую кислоту (соединение B) (70,0 г, 380 ммоль) в ТГФ (420 мл). После добавления реакционную смесь нагревают при кипении с обратным холодильником в течение 2 часов. Смесь охлаждают в ледяной бане и воде (35 мл), добавляют по каплям 15% водный раствор NaOH (35 мл) и воду (70 мл). Твердое вещество отделяют фильтрованием, промывают DCM и объединенные органические растворы сушат над Na2SO4 и выпаривают при пониженном давлении с получением 51,2 г (86%) соединения C.
1H-ЯМР (400 МГц, CDCl3): 4,71 (т, J=4,5 Гц, 4H), 6,98 (м, 1H), 7,08 (м, 1H), 7,29 (м, 1H).
Получение соединения D: К раствору 2-гидроксиметил-5-фторфенилметанола (соединения C) (51,2 г, 327,8 ммоль) в 520 мл DCM добавляют по каплям трибромид фосфора (37,3 мл, 393,5 ммоль) в DCM (520 мл) при 0°C в атмосфере N2 и перемешивают в течение 45 мин. Реакционную смесь гасят медленным добавления воды (70 мл) и экстрагируют EtOAc, промывают водой, насыщенным раствором Na2SO4 и насыщенным раствором соли. Органический слой выпаривают при пониженном давлении с получением неочищенного продукта, который очищают на колонке с силикагелем (100-200 меш), элюируя гексаном, с получением 55,8 г (60%) соединения D.
1H-ЯМР (400 МГц, CDCl3): 4,61 (м, 4H), 6,99 (м, 1H), 7,07 (м, 1H), 7,33 (м, 1H).
Получение соединения E: Раствор 5-фтор-1,2-бисбромметилбензола (20,4 г, 72,3 ммоль), этилизоцианоацетата (5,7 мл, 51 ммоль), гидросульфата тетрабутиламмония (6,7 г, 19,7 ммоль) и сухого K2SO4 (41,8 г, 303 ммоль) в ACN (1500 мл) нагревают при кипении с обратным холодильником в течение 18 ч. После завершения реакции смесь охлаждают и фильтруют. Фильтрат концентрируют при пониженном давлении и растворяют EtOAc. Органический слой промывают водой и насыщенным раствором соли, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученную неочищенную массу очищают на колонке с силикагелем (100-200 меш), элюируя 5% EtOAc-гексана, с получением 10,8 г (63%) соединения E.
1H-ЯМР (400 МГц, CDCl3): 1,32 (м, 3H), 3,43 (м, 2H), 3,66 (м, 2H), 4,32 (м, 2H), 6,94 (м, 2H), 7,17 (м, 1H).
Получение соединения F: Раствор концентрированной HCl в метаноле (35%) (9,3 мл в 110 мл MeOH) добавляют по каплям к раствору этилового эфира 5-фтор-2-изоцианоиндан-2-карбоновой кислоты (соединения E) в метаноле (17,6 г, 75,4 ммоль) при комнатной температуре и смесь перемешивают в течение 2 ч. Смесь затем нейтрализуют насыщенным раствором NaHCO3 и экстрагируют DCM (500 мл). Органический слой промывают водой, насыщенным раствором соли, сушат над Na2SO4 и концентрируют при пониженном давлении с получением 16,0 г (94%) соединения F в виде полутвердого вещества желтоватого цвета.
1H-ЯМР (400 МГц, CDCl3): 1,26 (кв, 3H), 1,62 (уш.с, 2H), 2,84 (м, 2H), 3,50 (кв, 2H), 4,20 (м, 2H), 6,88 (м, 2H), 7,12 (т, J=7,6 Гц, 1H).
1H-ЯМР (400 МГц, обмен D2O, CDCl3): 1,26 (кв, 3H), 2,83 (м, 2H), 3,49 (кв, 2H), 4,20 (м, 2H), 6,88 (м, 2H), 7,12 (т, J=7 Гц, 1H).
13C-ЯМР (100 МГц, CDCl3): 13,98, 45,14, 45,83, 61,21, 65,28, 111,82, 113,59, 125,54, 135,70, 142,44, 163,35, 176,05, IR (чистый): 1728 см-1, FIA-МС: 234 [M+H]+, качественный GC-FID показал, что чистота соединения примера 19 составляет 96,32% (% нормализации участка).
ПРИМЕР 20
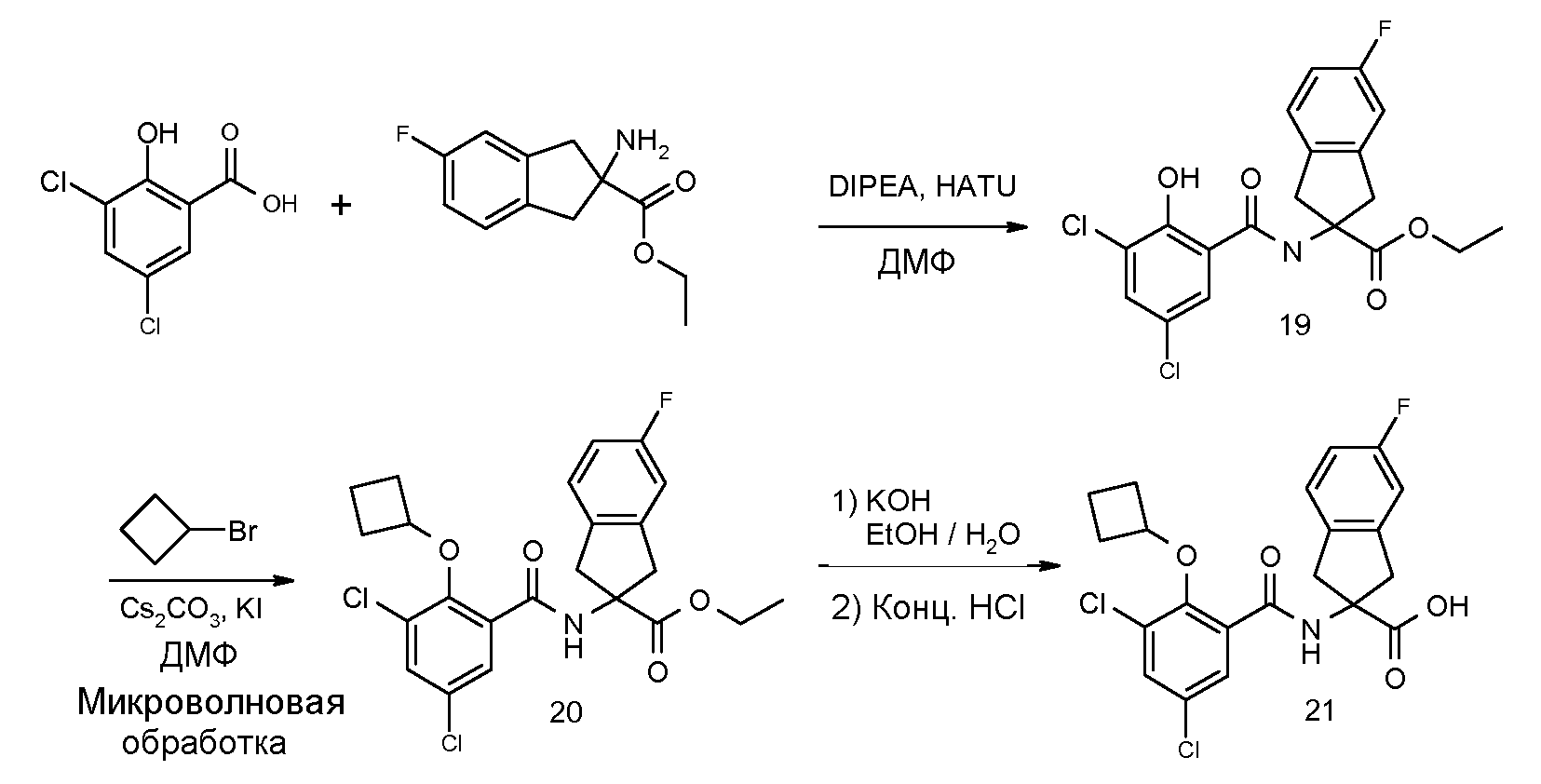
Этиловый эфир 2-(3,5-дихлор-2-гидроксибензоиламино)-5-фториндан-2-карбоновой кислоты (19):
К раствору 3,5-дихлор-2-гидроксибензойной кислоты (500 мг, 2,42 ммоль), этилового эфира 2-амино-5-фториндан-2-карбоновой кислоты (соединения F) (1,08 г, 4,84 ммоль), HATU (1,10 г, 2,89 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (599 мкл, 3,63 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-80% EtOAc в гептане) с получением чистого продукта (A) в виде твердого вещества белого цвета (779 мг, 78%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,24 (т, 3H), 3,39 (дд, 2H), 3,68 (дд, 2H), 4,24 (кв, 2H), 6,91-6,94 (м, 2H), 7,14-7,18 (м, 1H), 7,46 (д, 1H), 7,52 (д, 1H), 7,92 (с, 1H).
ЖХ/МС (ES+) m/z=412,06, 414,06
ПРИМЕР 20
Этиловый эфир 2-(3,5-дихлор-2-циклобутоксибензоиламино)-5-фториндан-2-карбоновой кислоты (20):
К суспензии этилового эфира 2-(3,5-дихлор-2-гидроксибензоиламино)-5-фториндан-2-карбоновой кислоты (19) (624 мг, 1,51 ммоль), безводного Cs2CO3 (984 мг, 3,02 ммоль) и KI (50 мг, 0,30 ммоль) в ДМФА (20 мл) добавляют бромциклобутан (711 мкл, 7,55 ммоль). Полученную реакционную суспензию насыщают аргоном и подвергают микроволновой реакции: 110°C, 2 ч. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-50% EtOAc в гептане) с получением чистого продукта (20) в виде твердого вещества белого цвета (365 мг, 52%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,23-1,38 (м, 4H), 1,51-1,55 (м, 1H), 1,94-2,07 (м, 4H), 3,32 (т, 2H), 3,73 (дд, 2H), 4,26 (кв, 2H), 4,58 (м, 1H), 6,88-6,96 (м, 2H), 7,18 (уш.с, 1H), 7,47 (с, 1H), 7,93 (с, 1H), 8,27 (с, 1H),
ЖХ/МС (ES+) m/z=466,12, 468,12
ПРИМЕР 21
2-(3,5-Дихлор-2-циклобутоксибензоиламино)-5-фториндан-2-карбоновая кислота (21):
Смесь этилового эфира 2-(3,5-дихлор-2-циклобутоксибензоиламино)-5-фториндан-2-карбоновой кислоты (20) (300 мг, 0,64 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 6 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и раствор подкисляют концентрированной HCl до pH~3. Осадок фильтруют с получением чистого продукта (21) в виде твердого вещества белого цвета (200 мг, 71%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,32 (м, 1H), 1,50 (м, 1H), 1,92-2,09 (м, 4H), 3,36 (т, 2H), 3,75 (дд, 2H), 4,56 (м, 1H), 6,91-6,96 (м, 2H), 7,16-7,20 (м, 1H), 7,48 (дд, 1H), 7,90 (дд, 1H), 8,37 (с, 1H),
ЖХ/МС (ES+) m/z=438,09, 440,08
ПРИМЕР 22

Метиловый эфир 2-(2-гидрокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (22):
К раствору 2-гидрокси-3-метилбензойной кислоты (1,12 г, 7,4 ммоль), метилового эфира 2-амино-2,3-дигидро-1H-фенален-2-карбоновой кислоты (2,05 г, 7,4 ммоль), HATU (3,38 г, 8,9 ммоль) в безводном ДМФА (28 мл) добавляют DIPEA (4,89 мл, 29,6 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (300 г силикагеля, градиентное элюирование: 10%-80% EtOAc в гептане) с получением чистого продукта (22) в виде твердого вещества белого цвета (353 мг, 13%).
1Н ЯМР (CDCl3, 300МГц): δ 2,18 (с, 1H), 3,70 (с, 4H), 3,85 (с, 3H), 6,30 (с, 1H), 6,48 (т, 1H), 6,58 (д, 1H), 7,13 (д, 1H), 7,33 (д, 2H), 7,44 (т, 2H), 7,75 (д, 2H), 12,08 (с, 1H)
ЖХ/МС (ES+) m/z=376,14
ПРИМЕР 23
Этиловый эфир 2-(2-аллилокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (23):
К суспензии метилового эфира 2-(2-гидрокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (22) (175 мг, 0,47 ммоль), безводного Cs2CO3 (306 мг, 0,94 ммоль) и KI (15,6 мг, 0,09 ммоль) в ДМФА (8 мл) добавляют 3-бромпропан (199 мкл, 2,35 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (23) в виде твердого вещества белого цвета (107 мг, 55%).
1Н ЯМР (CDCl3, 300МГц): δ 2,08 (с, 3H), 3,68-3,73 (м, 6H), 3,84 (с, 3H), 5,02-5,11 (м, 2H), 5,28-5,40 (м, 1H), 6,70 (т, 1H), 7,16 (дд, 1H), 7,28 (дд, 1H), 7,39 (т, 2H), 7,69 (д, 2H), 7,79 (дд, 1H), 8,10 (с, 1H)
ЖХ/МС (ES+) m/z=416,23
ПРИМЕР 24
2-(2-Аллилокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновая кислота (24):
Смесь этилового эфира 2-(2-аллилокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (23) (107 мг, 0,26 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (24) в виде твердого вещества белого цвета (98 мг, 94%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 2,09 (с, 3H), 3,71-3,74 (м, 6H), 5,06-5,11 (м, 2H), 5,28-5,41 (м, 1H), 7,01 (т, 1H), 7,18 (дд, 1H), 7,30 (дд, 1H), 7,41 (т, 2H), 7,70 (д, 2H), 7,75 (дд, 1H), 8,20 (с, 1H)
ЖХ/МС (ES+) m/z=402,16
ПРИМЕР 25
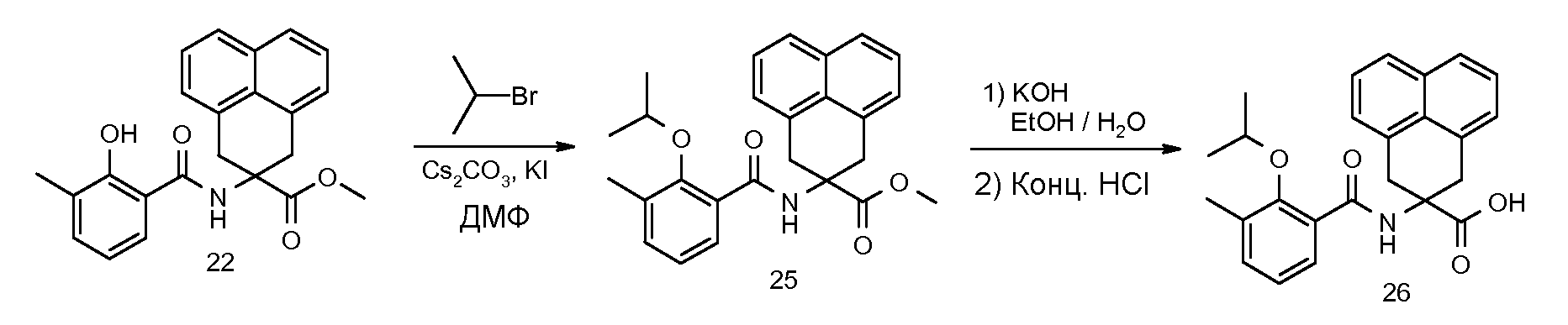
Метиловый эфир 2-(2-изопропокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (25):
К суспензии метилового эфира 2-(2-гидрокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (22) (175 мг, 0,47 ммоль), безводного Cs2CO3 (306 мг, 0,94 ммоль) и KI (16 мг, 0,09 ммоль) в ДМФА (8 мл) добавляют 2-бромпропан (220 мкл, 2,35 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (25) в виде твердого вещества белого цвета (143 мг, 73%).
1Н ЯМР (CDCl3, 300МГц): δ 0,51 (д, 6H), 2,10 (с, 3H), 3,71 (с, 4H), 3,81 (с, 3H), 3,81-3,89 (м, 1H), 6,98 (т, 1H), 7,16 (дд, 1H), 7,31 (д, 2H), 7,41 (т, 2H), 7,71 (д, 2H), 7,82 (дд, 1H), 8,04 (с, 1H)
ЖХ/МС (ES+) m/z=418,23
ПРИМЕР 26
2-(2-Аллилокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновая кислота (26):
Смесь метилового эфира 2-(2-изопропокси-3-метилбензоиламино)-2,3-дигидро-1H-фенален-2-карбоновой кислоты (25) (143 мг, 0,34 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (26) в виде твердого вещества белого цвета (127 мг, 93%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,49 (д, 6H), 2,10 (с, 3H), 3,71 (с, 4H), 3,81 (м, 1H), 6,99 (т, 1H), 7,16 (д, 1H), 7,33 (д, 2H), 7,42 (т, 2H), 7,72 (д, 2H), 7,79 (дд, 1H), 8,12 (с, 1H)
ЖХ/МС (ES+) m/z=404,17
ПРИМЕР 27
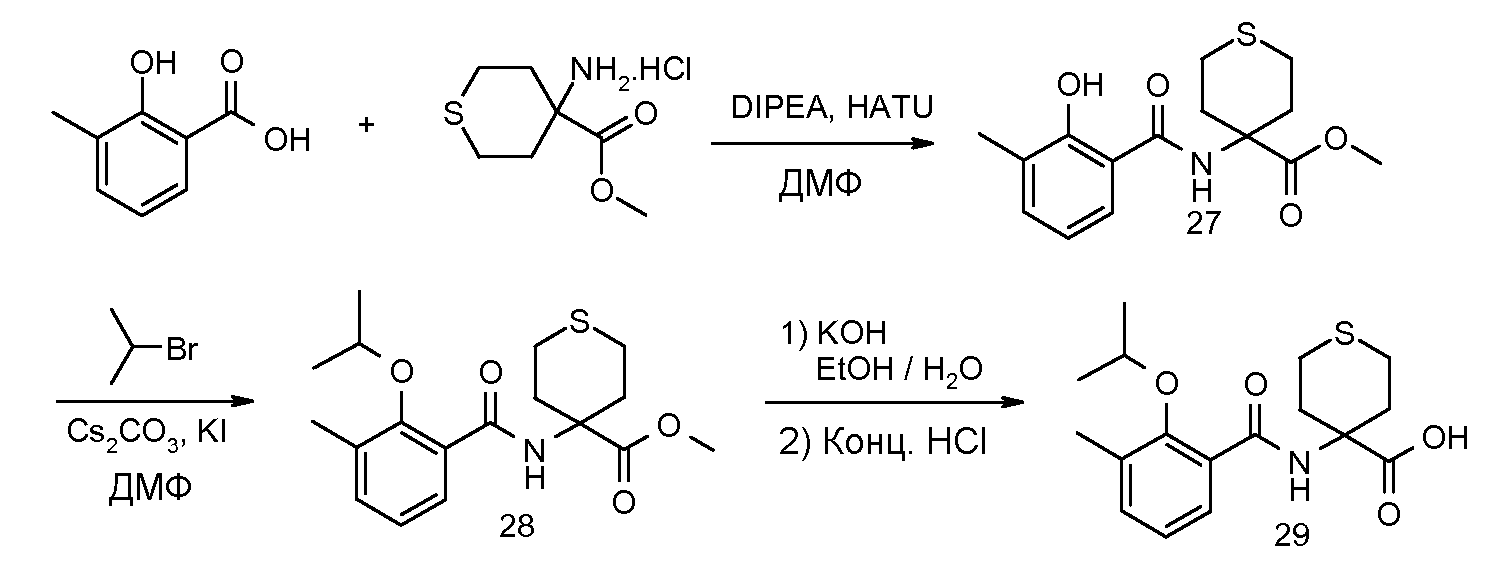
Метиловый эфир 4-(2-гидрокси-3-метилбензоиламино)тетрагидротиопиран-4-карбоновой кислоты (27):
К раствору соли HCl метилового эфира 4-аминотетрагидротиопиран-4-карбоновой кислоты (529 г, 2,5 ммоль), 2-гидрокси-3-метилбензойной кислоты (380 мг, 2,5 ммоль), HATU (1,14 г, 3,0 ммоль) в безводном ДМФА (20 мл) добавляют DIPEA (1,66 мл, 10 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 10-80% EtOAc в гептане) с получением чистого продукта (27) в виде твердого вещества белого цвета (102 мг, 13%).
1Н ЯМР (CDCl3, 300МГц): δ 2,41 (м, 4H), 2,72-2,80 (м, 4H), 3,74 (с, 3H), 6,36 (с, 1H), 6,78 (т, 1H), 7,25-7,30 (м, 2H), 12,00 (с, 1H)
ЖХ/МС (ES+) m/z=310,17
ПРИМЕР 28
Метиловый эфир 4-(2-изопропокси-3-метилбензоиламино)тетрагидротиопиран-4-карбоновой кислоты (28):
К суспензии метилового эфира 4-(2-гидрокси-3-метилбензоиламино)тетрагидротиопиран-4-карбоновой кислоты (27) (98 мг, 0,32 ммоль), безводного Cs2CO3 (208 мг, 0,64 ммоль) и KI (11 мг, 0,06 ммоль) в ДМФА (5 мл) добавляют 2-бромпропан (150 мкл, 1,6 ммоль). Полученную реакционную суспензию перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (80 г силикагеля, градиентное элюирование: 5-40% EtOAc в гептане) с получением чистого продукта (28) в виде твердого вещества белого цвета (92 мг, 81%).
1Н ЯМР (CDCl3, 300МГц): δ 1,35 (д, 6H), 2,33 (с, 3H), 2,33-2,40 (м, 4H), 2,63-2,69 (м, 2H), 2,76-2,81 (м, 2H), 3,76 (с, 3H), 4,39 (м, 1H), 7,10 (т, 1H), 7,31 (д, 1H), 7,84 (дд, 1H), 8,28 (с, 1H)
ЖХ/МС (ES+) m/z=352,13
ПРИМЕР 29
4-(2-Изопропокси-3-метилбензоиламино)тетрагидротиопиран-4-карбоновая кислота (29):
Смесь метилового эфира 4-(2-изопропокси-3-метилбензоиламино)тетрагидротиопиран-4-карбоновой кислоты (28) (75 мг, 0,21 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (29) в виде твердого вещества бледно-желтого цвета (68 мг, 94%).
1Н ЯМР (CDCl3, 300МГц): δ 1,32 (д, 6H), 2,33 (с, 3H), 2,41-2,43 (м, 4H), 2,64-2,74 (м, 4H), 4,37 (м, 1H), 7,11 (т, 1H), 7,33 (д, 1H), 7,86 (дд, 1H), 8,42 (с, 1H), 9,07 (уш.с, 1H)
ЖХ/МС (ES+) m/z=338,11
ПРИМЕР 30
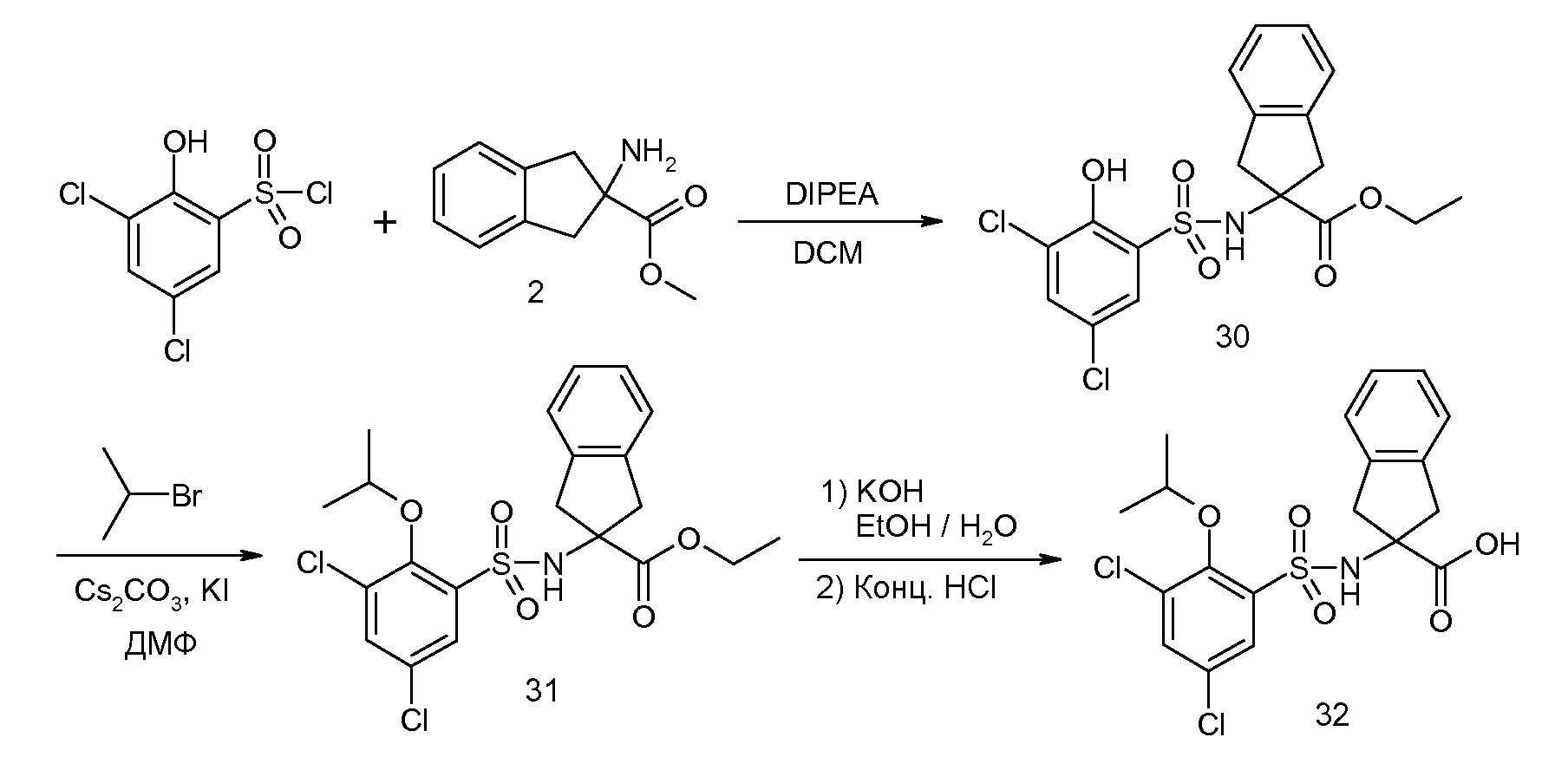
Этиловый эфир 2-(3,5-дихлор-2-гидроксибензолсульфониламино)индан-2-карбоновой кислоты (30):
К раствору этилового эфира 2-аминоиндан-2-карбоновой кислоты (3,14 г, 15,3 ммоль) и 3,5-дихлор-2-гидроксибензолсульфонилхлорида (1 г, 3,82 ммоль) в безводном DCM (дихлорметан, 20 мл) добавляют DIPEA (631 мкл, 3,82 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор растворяют в DCM (50 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (30) в виде твердого вещества белого цвета (450 мг, 27%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 3,25 (д, 2H), 3,57 (д, 2H), 4,18 (кв, 2H), 5,60 (с, 1H), 7,04-7,07 (м, 2H), 7,14-7,17 (м, 2H), 7,43 (д, 1H), 7,49 (д, 1H), 8,30 (уш.с, 1H)
ЖХ/МС (ES+) m/z=447,04, 449,04, 430,01
ПРИМЕР 31
Этиловый эфир 2-(3,5-дихлор-2-изопропоксибензолсульфониламино)индан-2-карбоновой кислоты (31):
К суспензии этилового эфира 2-(3,5-дихлор-2-гидроксибензолсульфониламино)индан-2-карбоновой кислоты (30) (226 мг, 0,53 ммоль), безводного Cs2CO3 (300 мг, 0,92 ммоль) и KI (15 мг, 0,09 ммоль) в ДМФА (15 мл) добавляют 2-бромпропан (432 мкл, 4,60 ммоль). Полученную реакционную суспензию насыщают аргоном и подвергают микроволновой реакции: 110°C, 2,5 ч. После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-60% EtOAc в гептане) с получением чистого продукта (31) в виде полутвердого вещества белого цвета (248 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,23 (т, 3H), 1,27 (д, 6H), 3,19 (д, 2H), 3,50 (д, 2H), 4,10 (кв, 2H), 5,12 (м, 1H), 5,75 (с, 1H), 6,98-7,01 (м, 2H), 7,12-7,15 (м, 2H), 7,47 (дд, 1H), 7,58 (дд, 1H)
ЖХ/МС (ES+) m/z=494,0
ПРИМЕР 32
2-(3,5-Дихлор-2-изопропоксибензолсульфониламино)индан-2-карбоновая кислота (32):
Смесь этилового эфира 2-(3,5-дихлор-2-изопропоксибензолсульфониламино)индан-2-карбоновой кислоты (31) (248 мг, 0,52 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (32) в виде твердого вещества белого цвета (230 мг, 100%).
1H ЯМР (CDOD, 300МГц): δ 1,27 (д, 6H), 3,23 (д, 2H), 3,48 (д, 2H), 5,05 (м, 1H), 6,98-7,01 (м, 2H), 7,08-7,12 (м, 2H), 7,44 (д, 1H), 7,60 (д, 1H)
ЖХ/МС (ES-) m/z=442,08, 444,08
ПРИМЕР 33
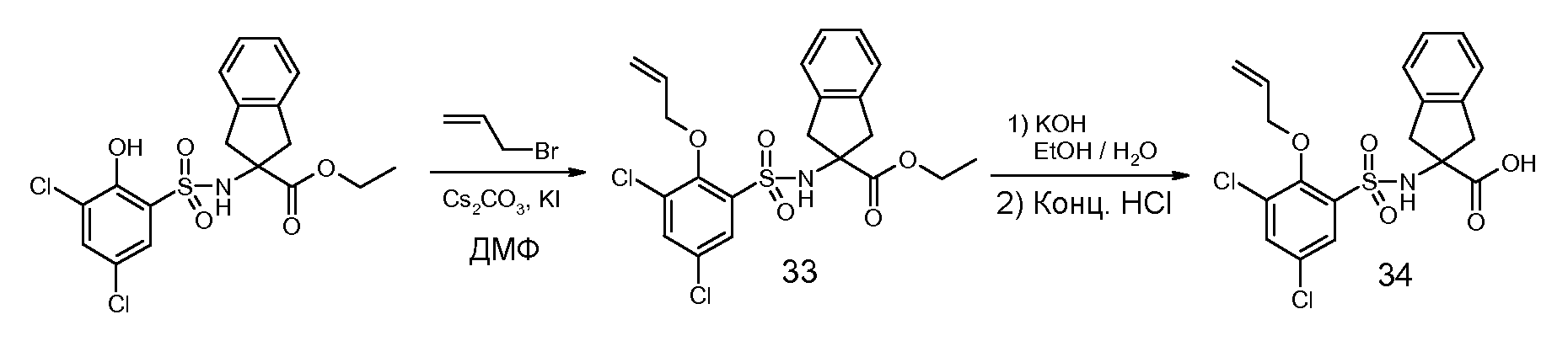
Этиловый эфир 2-(2-аллилокси-3,5-дихлорбензолсульфониламино)индан-2-карбоновой кислоты (33):
К суспензии этилового эфира 2-(3,5-дихлор-2-гидроксибензоиламино)индан-2-карбоновой кислоты (10) (200 мг, 0,46 ммоль), безводного Cs2CO3 (300 мг, 0,92 ммоль) и KI (15 мг, 0,09 ммоль) в ДМФА (15 мл) добавляют 3-бромпропан (390 мкл, 4,6 ммоль). Полученную реакционную суспензию насыщают аргоном и подвергают микроволновой реакции: 110°C, 2 ч. После удаления ДМФА в вакууме остаток растворяют в EtOAc (20 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-60% EtOAc в гептане) с получением чистого продукта (33) в виде твердого вещества белого цвета (162 мг, 75%).
1Н ЯМР (CDCl3, 300МГц): δ 1,22 (т, 3H), 3,21 (д, 2H), 3,52 (д, 2H), 4,09 (кв, 2H), 4,55 (д, 2H), 5,36 (дд, 2H), 5,68 (с, 1H), 6,05 (м, 1H), 6,99-7,02 (м, 2H), 7,12-7,14 (м, 2H), 7,52 (д, 1H), 7,58 (д, 1H)
ЖХ/МС (ES-) m/z=468,10, 470,10
ПРИМЕР 34
2-(2-Аллилокси-3,5-дихлорбензолсульфониламино)индан-2-карбоновая кислота (34):
Смесь этилового эфира 2-(2-аллилокси-3,5-дихлорбензолсульфониламино)индан-2-карбоновой кислоты (33) (143 мг, 0,30 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~3. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (34) в виде твердого вещества белого цвета (91 мг, 69%).
1Н ЯМР (CDCl3, 300МГц): δ 3,24 (д, 2H), 3,58 (д, 2H), 4,53 (д, 2H), 5,36 (дд, 2H), 5,72 (с, 1H), 6,03 (м, 1H), 7,02-7,04 (м, 2H), 7,13-7,17 (м, 2H), 7,34 (д, 1H), 7,60 (д, 1H)
ЖХ/МС (ES+) m/z=459,03, 461,02, 442,00
ПРИМЕР 35
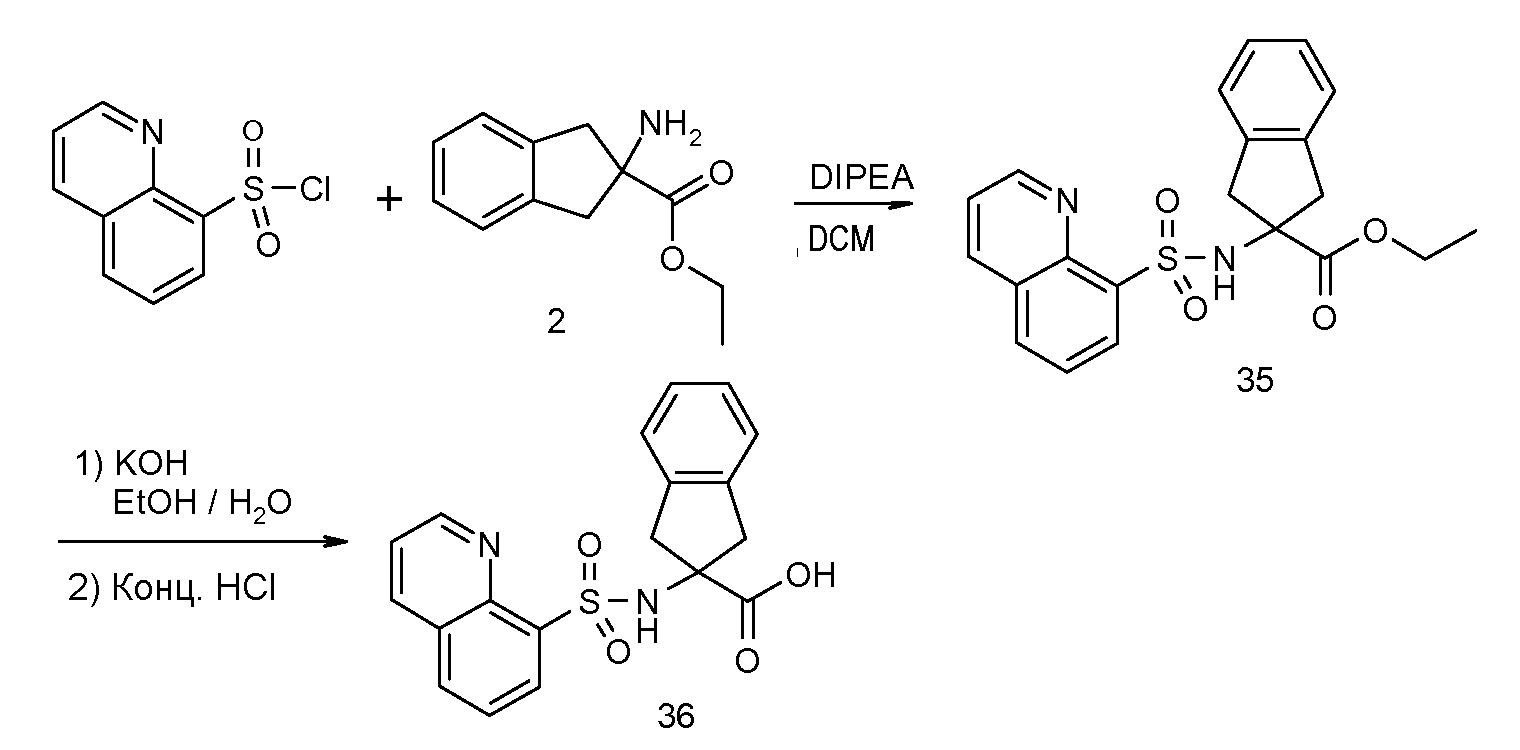
Этиловый эфир 2-(хинолин-8-сульфониламино)индан-2-карбоновой кислоты (35):
К раствору хинолин-8-сульфонилхлорида (400 мг, 1,76 ммоль) и этилового эфира 2-аминоиндан-2-карбоновой кислоты (361 мг, 1,76 ммоль) в безводном DCM (8 мл) добавляют DIPEA (291 мкл, 1,76 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционный раствор растворяют в DCM (40 мл), промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (35) в виде твердого вещества белого цвета (245 мг, 35%).
1Н ЯМР (CDCl3, 300МГц): δ 1,08 (т, 3H), 3,20 (д, 2H), 3,46 (д, 2H), 3,94 (кв, 2H), 6,74-6,78 (м, 2H), 6,86-6,90 (м, 2H), 7,32 (с, 1H), 7,39 (дд, 1H), 7,64 (т, 1H), 8,01 (дд, 1H), 8,18 (дд, 1H), 8,34 (дд, 1H), 8,67 (дд, 1H)
ЖХ/МС (ES+) m/z=397,11
ПРИМЕР 36
2-(Хинолин-8-сульфониламино)индан-2-карбоновая кислота (36):
Смесь этилового эфира 2-(хинолин-8-сульфониламино)индан-2-карбоновой кислоты (35) (210 мг, 0,53 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (36) в виде твердого вещества белого цвета (195 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,18 (д, 2H), 3,46 (д, 2H), 6,66-6,69 (м, 2H), 6,81-6,84 (м, 2H), 7,40 (дд, 1H), 7,65 (т, 1H), 8,02 (д, 1H), 8,18 (дд, 1H), 8,34 (дд, 1H), 8,64 (дд, 1H)
ЖХ/МС (ES+) m/z=369,10
ПРИМЕР 37
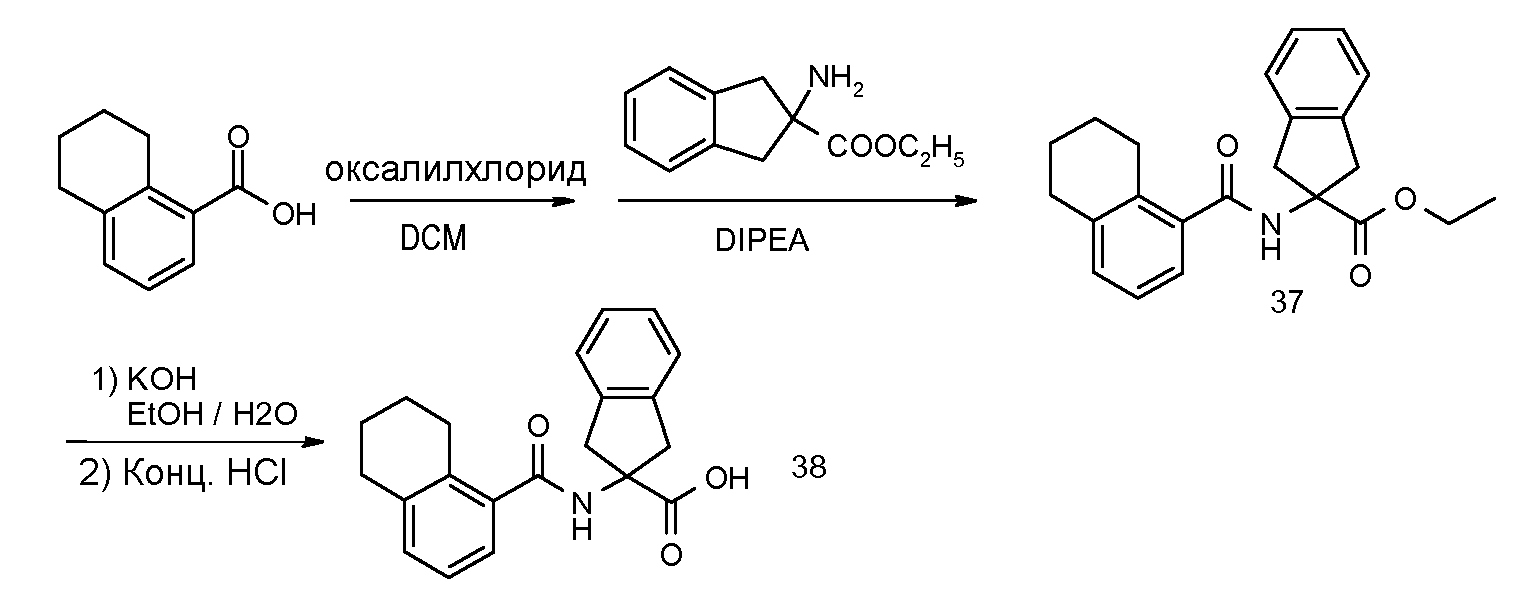
Этиловый эфир 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (37):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (500 мг, 2,84 ммоль) в DCM (10 мл) добавляют по каплям оксалилхлорид (0,50 мл, 5,68 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 2 часов. После удаления DCM и избыточного оксалилхлорида остаток, этиловый эфир 2-аминоиндан-2-карбоновой кислоты (583 мг, 2,84 ммоль) и DIPEA (1,88 мл, 11,3 ммоль) растворяют в DCM (20 мл). Полученный раствор перемешивают в течение ночи. Реакционный раствор растворяют в DCM (30 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (37) в виде твердого вещества белого цвета (610 мг, 59%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,74 (м, 4H), 2,76 (м, 2H), 2,84 (м, 2H), 3,34 (д, 2H), 3,75 (д, 2H), 4,72 (кв, 2H), 6,20 (с, 1H), 7,02-7,12 (м, 3H), 7,18-7,25 (м, 4H)
ЖХ/МС (ES+) m/z=364,18
ПРИМЕР 38
2-[(5,6,7,8-Тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (38):
Смесь этилового эфира 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (37) (400 мг, 1,1 ммоль) и KOH (1 г, 17,8 ммоль) растворяют в EtOH (10 мл) и воде (2 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (38) в виде твердого вещества белого цвета (300 мг, 82%).
1H ЯМР (CD3OD, 300МГц): δ 1,74 (м, 4H), 2,76 (м, 2H), 3,38 (д, 2H), 3,68 (д, 2H), 4,85 (с, 1H), 7,02-7,08 (м, 3H), 7,14-7,23 (м, 4H)
ЖХ/МС (ES+) m/z=336,15
ПРИМЕР 39
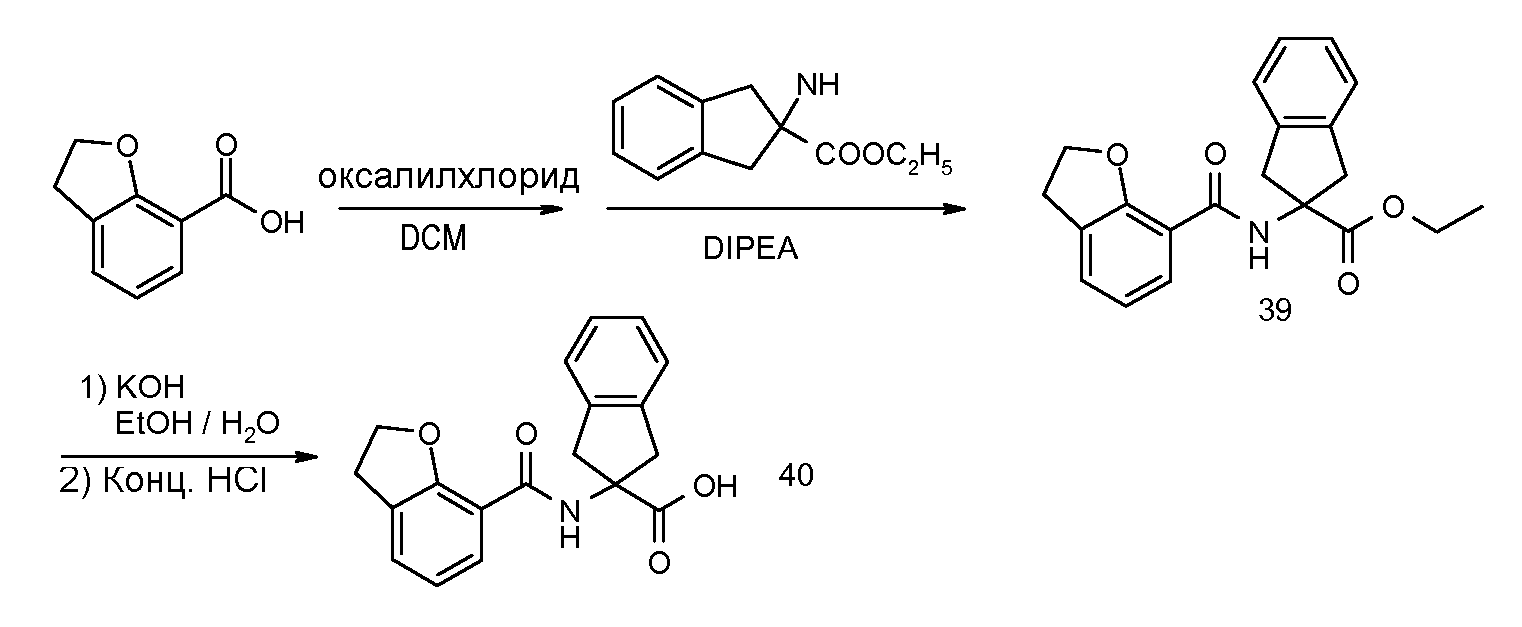
Этиловый эфир 2-[(2,3-дигидробензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (39):
К раствору 2,3-дигидробензофуран-7-карбоновой кислоты (394 мг, 2,4 ммоль) в DCM (10 мл) добавляют оксалилхлорид (0,85 мл, 9,6 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 2 часов. После удаления DCM и избыточного оксалилхлорида остаток, этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,4 ммоль) и DIPEA (3,17 мл, 19,2 ммоль) растворяют в DCM (20 мл). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционный раствор растворяют в DCM (40 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (39) в виде твердого вещества белого цвета (635 мг, 75%).
1Н ЯМР (CDCl3, 300МГц): δ 1,23 (т, 3H), 3,22 (т, 2H), 3,40 (д, 2H), 3,77 (д, 2H), 4,26 (кв, 2H), 4,67 (т, 2H), 6,93 (т, 1H), 7,17-7,30 (м, 6H), 7,87 (д, 1H), 8,18 (с, H)
ЖХ/МС (ES+) m/z=352,12
ПРИМЕР 40
2-[(2,3-Дигидробензофуран-7-карбонил)амино]индан-2-карбоновая кислота (40):
Смесь этилового эфира 2-[(2,3-дигидробензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (39) (250 мг, 0,71 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (5 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (40) в виде твердого вещества белого цвета (200 мг, 87%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,22 (т, 2H), 3,40 (д, 2H), 3,82 (д, 2H), 4,68 (т, 2H), 6,94 (т, 1H), 7,17-7,25 (м, 4H), 7,30 (д, 1H), 7,83 (д, 1H), 8,28 (с, 1H)
ЖХ/МС (ES+) m/z=324,11
ПРИМЕР 41
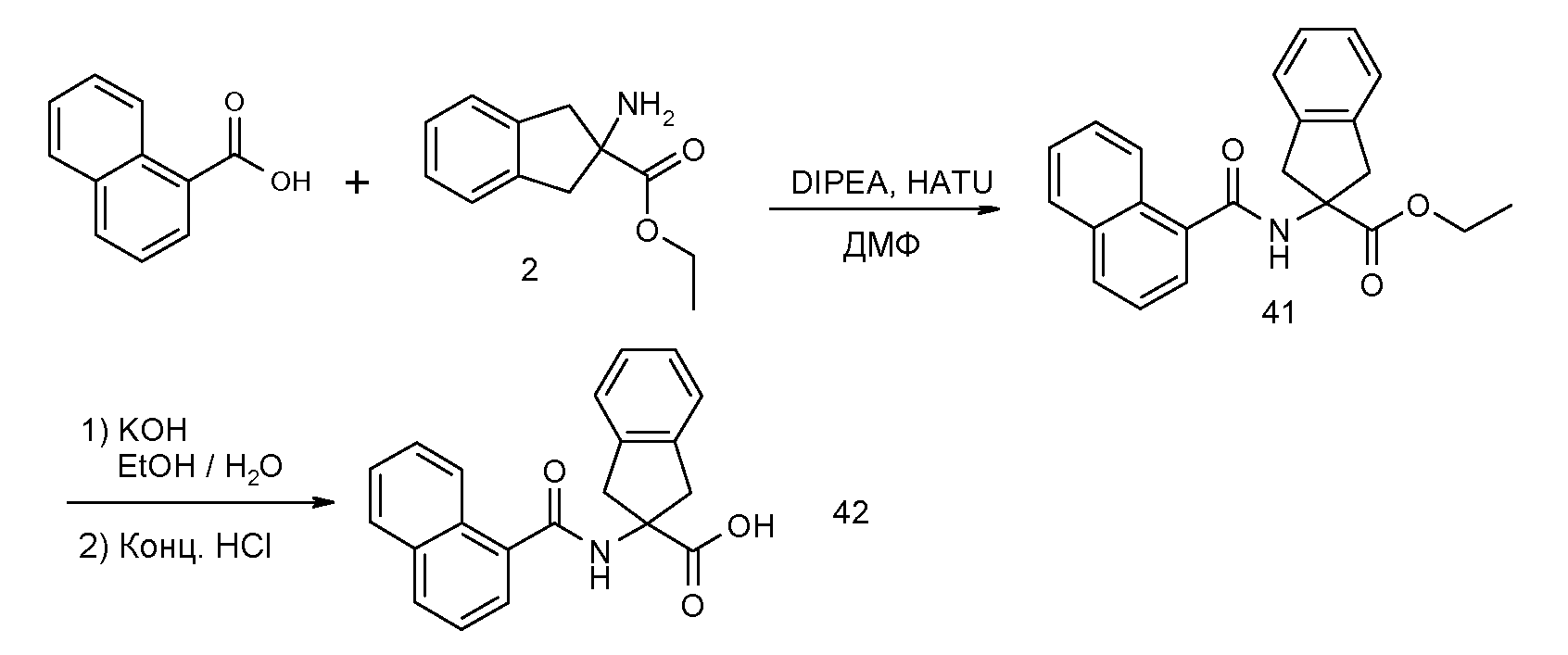
Этиловый эфир 2-[(нафталин-1-карбонил)амино]индан-2-карбоновой кислоты (41):
К раствору нафталин-1-карбоновой кислоты (300 мг, 1,74 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (357 мг, 1,74 ммоль) и HATU (992 мг, 2,61 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (431 мкл, 2,61 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (41) в виде твердого вещества белого цвета (383 мг, 61%).
1Н ЯМР (CDCl3, 300МГц): δ 1,30 (т, 3H), 3,40 (д, 2H), 3,77 (д, 2H), 4,29 (кв, 2H), 6,59 (с, 1H), 7,20-7,24 (м, 4H), 7,34 (т, 1H), 7,46-7,52 (м, 3H), 7,79-7,85 (м, 2H), 8,28-8,31 (м, 1H)
ЖХ/МС (ES+) m/z=360,19
ПРИМЕР 42
2-[(Нафталин-1-карбонил)амино]индан-2-карбоновая кислота (42):
Смесь этилового эфира 2-[(нафталин-1-карбонил)амино]индан-2-карбоновой кислоты (41) (220 мг, 0,61 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (42) в виде твердого вещества белого цвета (196 мг, 97%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,47 (д, 2H), 3,82 (д, 2H), 6,93 (м, 1H), 7,19-7,28 (м, 4H), 7,37-7,50 (м, 4H), 7,81-7,89 (м, 2H), 8,23-8,27 (м, 1H)
ЖХ/МС (ES+) m/z=332,11
ПРИМЕР 43
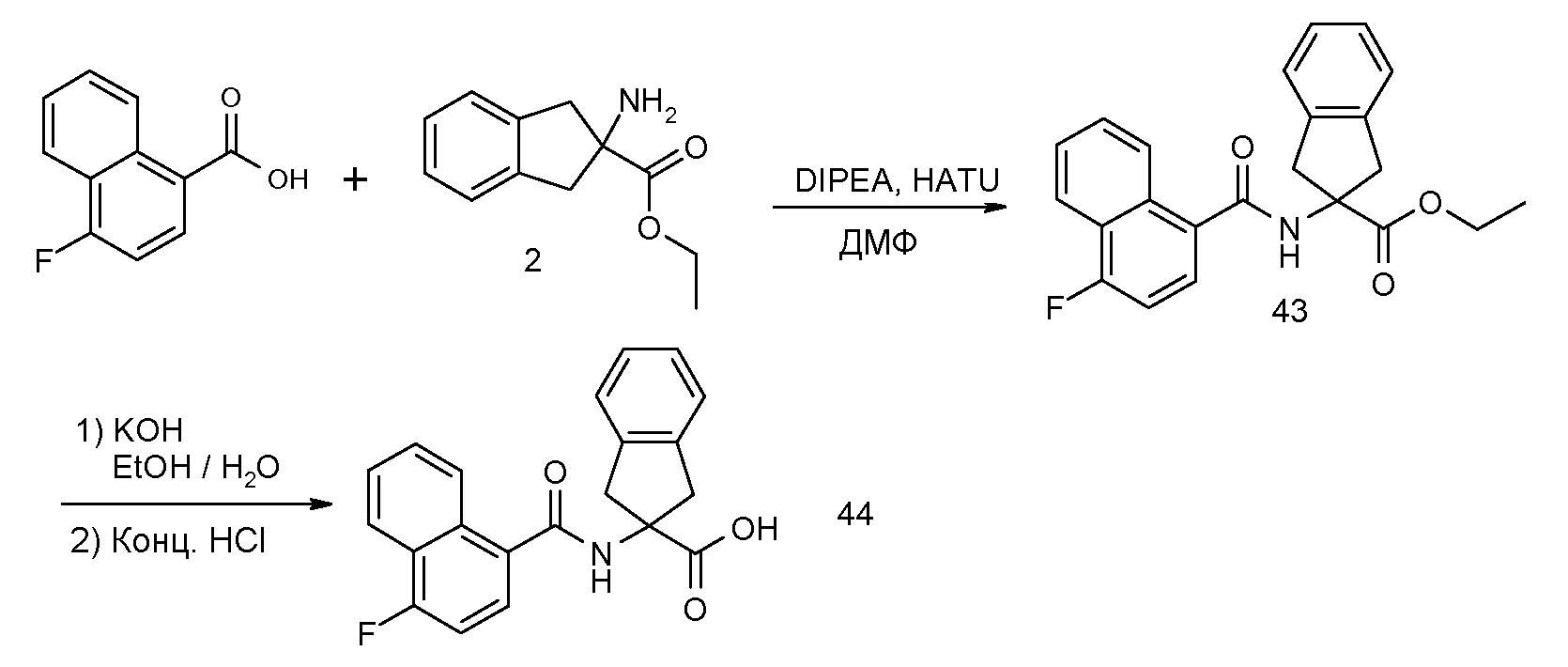
Этиловый эфир 2-[(4-фторнафталин-1-карбонил)амино]индан-2-карбоновой кислоты (43):
К раствору 4-фторнафталин-1-карбоновой кислоты (232 мг, 1,22 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (250 мг, 1,22 ммоль) и HATU (696 мг, 1,83 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (302 мкл, 1,83 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (43) в виде твердого вещества белого цвета (340 мг, 74%).
1Н ЯМР (CDCl3, 300МГц): δ 1,31 (т, 3H), 3,42 (д, 2H), 3,80 (д, 2H), 4,31 (кв, 2H), 6,53 (с, 1H), 7,03 (дд, 1H), 7,19-7,26 (м, 4H), 7,47-7,82 (м, 3H), 8,07-8,10 (м, 1H), 8,31-8,35 (м, 1H)
ЖХ/МС (ES+) m/z=378,12
ПРИМЕР 44
2-[(4-Фторнафталин-1-карбонил)амино]индан-2-карбоновая кислота (44):
Смесь этилового эфира 2-[(4-фторнафталин-1-карбонил)амино]индан-2-карбоновой кислоты (43) (180 мг, 0,48 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 6 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (44) в виде твердого вещества белого цвета (174 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,46 (д, 2H), 3,81 (д, 2H), 6,99-7,06 (м, 2H), 7,19-7,26 (м, 4H), 7,48-7,54 (м, 3H), 8,06-8,09 (м, 1H), 8,24-8,28 (м, 1H)
ЖХ/МС (ES+) m/z=350,09
ПРИМЕР 45
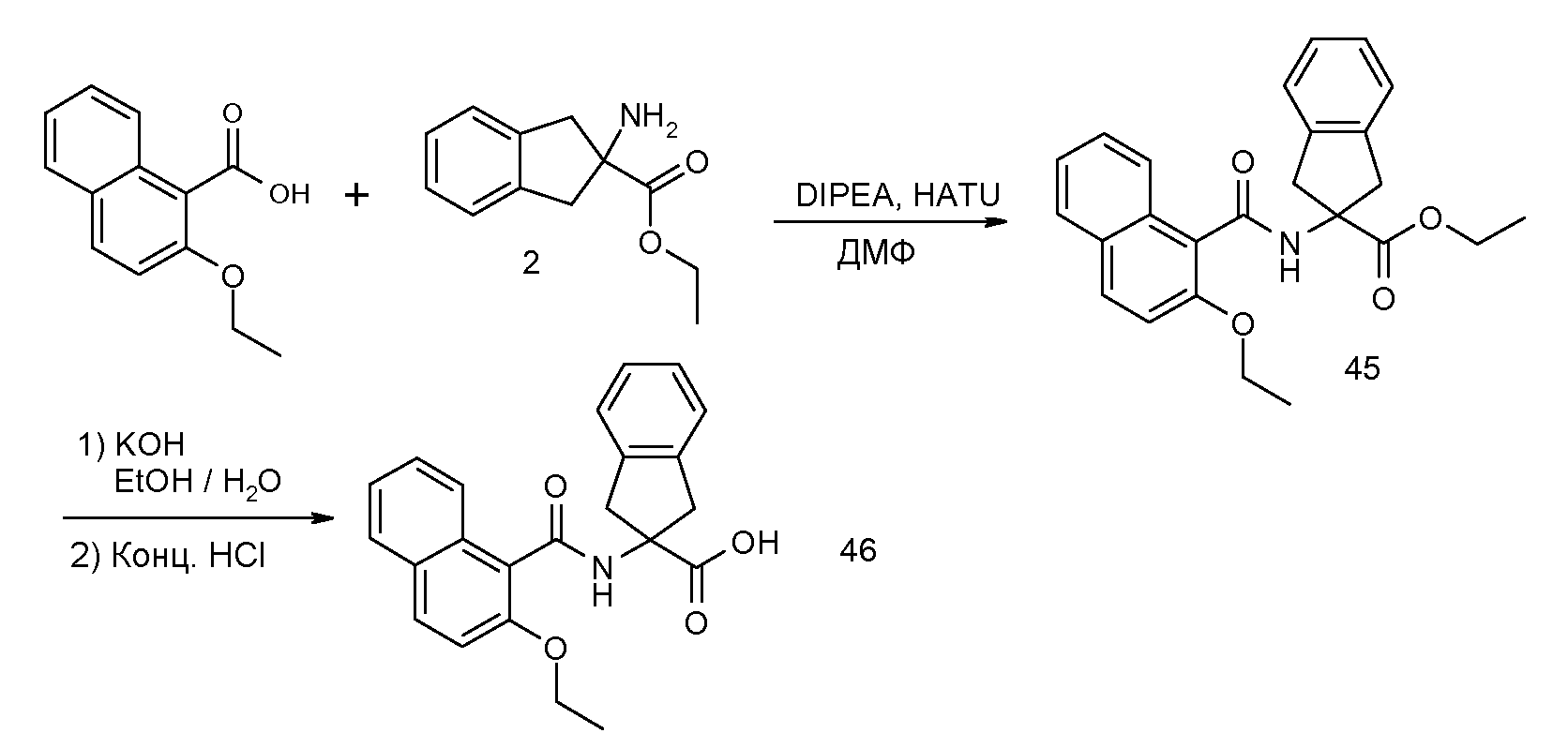
Этиловый эфир 2-[(2-этоксинафталин-1-карбонил)амино]индан-2-карбоновой кислоты (45):
К раствору 2-этоксинафталин-1-карбоновой кислоты (335 мг, 1,55 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (318 мг, 1,55 ммоль) и HATU (886 мг, 2,33 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (385 мкл, 2,33 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (45) в виде твердого вещества белого цвета (420 мг, 67%).
1Н ЯМР (CDCl3, 300МГц): δ 1,12 (т, 3H), 1,35 (т, 3H), 3,40 (д, 2H), 3,76 (д, 2H), 3,98 (кв, 2H), 4,32 (кв, 2H), 6,73 (с, 1H), 7,19 (д, 1H), 7,16-7,23 (м, 4H), 7,29-7,34 (м, 1H), 7,42-7,48 (м, 1H), 7,73 (дд, 2H), 8,16 (д, 1H)
ЖХ/МС (ES+) m/z=404,18
ПРИМЕР 46
2-[(2-Этоксинафталин-1-карбонил)амино]индан-2-карбоновая кислота (46):
Смесь этилового эфира 2-[(2-этоксинафталин-1-карбонил)амино]индан-2-карбоновой кислоты (45) (270 мг, 0,67 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~4. Осадок фильтруют с получением чистого продукта (46) в виде твердого вещества белого цвета (170 мг, 68%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,18 (т, 3H), 3,47 (д, 2H), 3,82 (д, 2H), 4,04 (кв, 2H), 7,09 (с, 1H), 7,15-7,37 (м, 7H), 7,47 (т, 1H), 7,78 (дд, 2H), 8,07 (д, 1H)
ЖХ/МС (ES+) m/z=376,19
ПРИМЕР 47
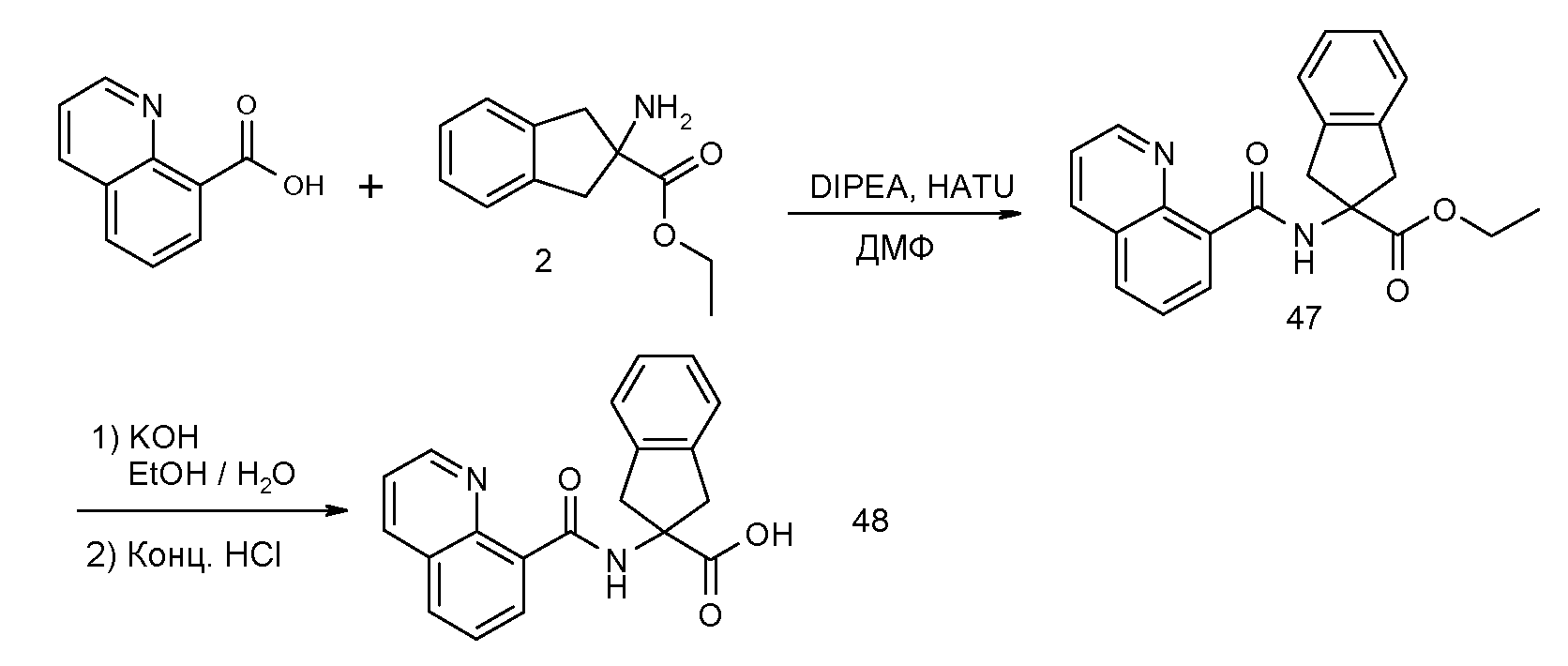
Этиловый эфир 2-[(хинолин-8-карбонил)амино]индан-2-карбоновой кислоты (47):
К раствору хинолин-8-карбоновой кислоты (421 мг, 2,43 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,43 ммоль) и HATU (1,39 г, 3,65 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (603 мкл, 3,65 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (47) в виде твердого вещества белого цвета (281 мг, 32%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 3,54 (д, 2H), 3,86 (д, 2H), 4,27 (кв, 2H), 7,17-7,27 (м, 4H), 7,44 (дд, 1H), 7,65 (т, 1H), 7,94 (дд, 1H), 8,24 (дд, 1H), 8,80-8,84 (м, 2H), 12,00 (с, 1H)
ЖХ/МС (ES+) m/z=361,13
ПРИМЕР 48
2-[(Хинолин-8-карбонил)амино]индан-2-карбоновая кислота (48):
Смесь этилового эфира 2-[(хинолин-8-карбонил)амино]индан-2-карбоновой кислоты (47) (190 мг, 0,53 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (48) в виде твердого вещества белого цвета (152 мг, 86%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,50 (д, 2H), 3,83 (д, 2H), 7,17-7,24 (м, 4H), 7,44-7,49 (м, 1H), 7,64 (т, 1H), 7,98 (д, 1H), 8,28 (дд, 1H), 8,69 (д, 1H), 8,83 (с, 1H)
ЖХ/МС (ES+) m/z=333,08
ПРИМЕР 49
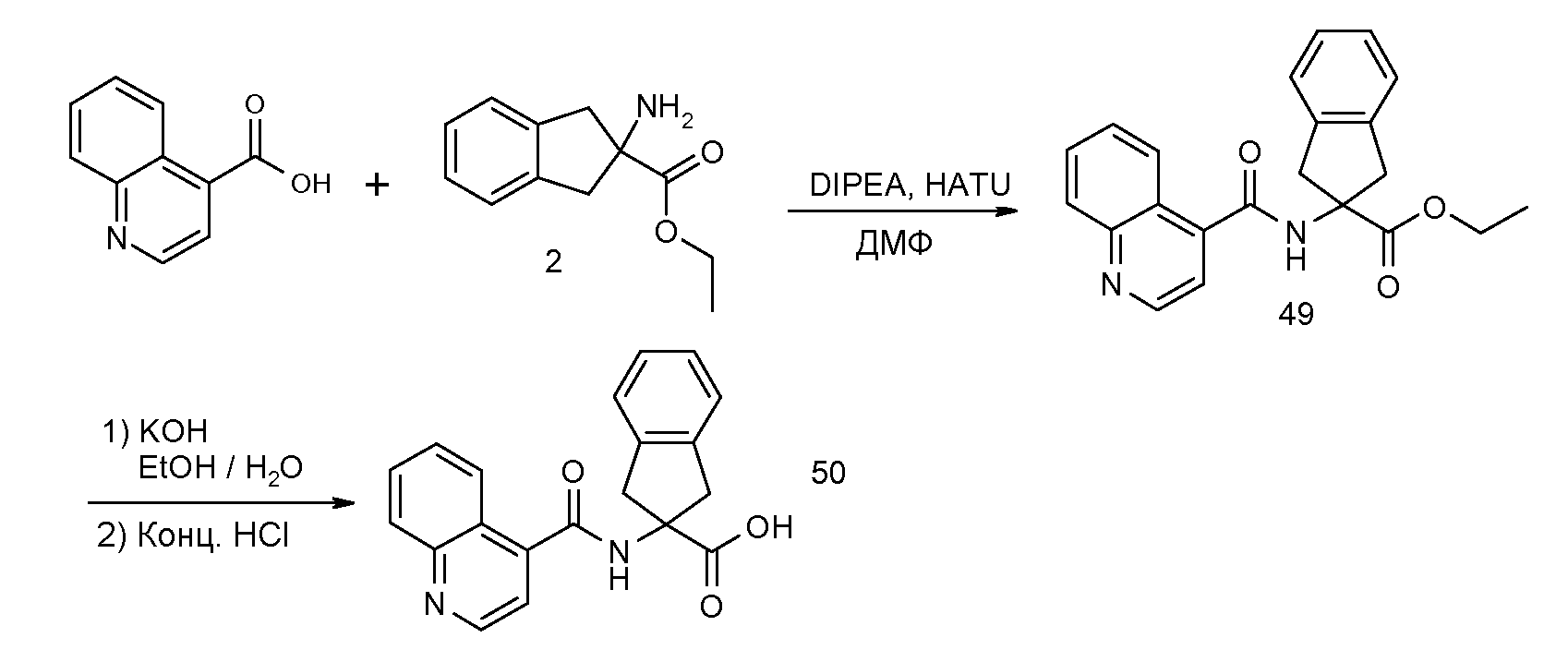
Этиловый эфир 2-[(хинолин-4-карбонил)амино]индан-2-карбоновой кислоты (49):
К раствору хинолин-4-карбоновой кислоты (301 мг, 1,74 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (357 мг, 1,74 ммоль) и HATU (992 мг, 2,61 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (431 мкл, 2,61 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5-70% EtOAc в гептане) с получением чистого продукта (49) в виде твердого вещества бледно-желтого цвета (370 мг, 59%).
1Н ЯМР (CDCl3, 300МГц): δ 1,34 (т, 3H), 3,48 (д, 2H), 3,82 (д, 2H), 4,34 (кв, 2H), 6,86 (с, 1H), 7,21-7,29 (м, 5H), 7,51-7,56 (м, 1H), 7,65-7,71 (м, 1H), 7,98 (д, 1H), 8,18 (д, 1H), 8,73 (д, 1H)
ЖХ/МС (ES+) m/z=361,14
ПРИМЕР 50
2-[(Хинолин-4-карбонил)амино]индан-2-карбоновая кислота (50):
Смесь этилового эфира 2-[(хинолин-4-карбонил)амино]индан-2-карбоновой кислоты (49) (220 мг, 0,61 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~4. Осадок фильтруют с получением чистого продукта (50) в виде твердого вещества бледно-желтого цвета (98 мг, 48%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,49 (д, 2H), 3,83 (д, 2H), 7,20-7,28 (м, 4H), 7,50 (д, 1H), 7,61 (т, 1H), 7,79 (т, 1H), 8,13 (д, 1H), 8,24 (д, 1H), 8,86 (д, 1H)
ЖХ/МС (ES+) m/z=333,13
ПРИМЕР 51
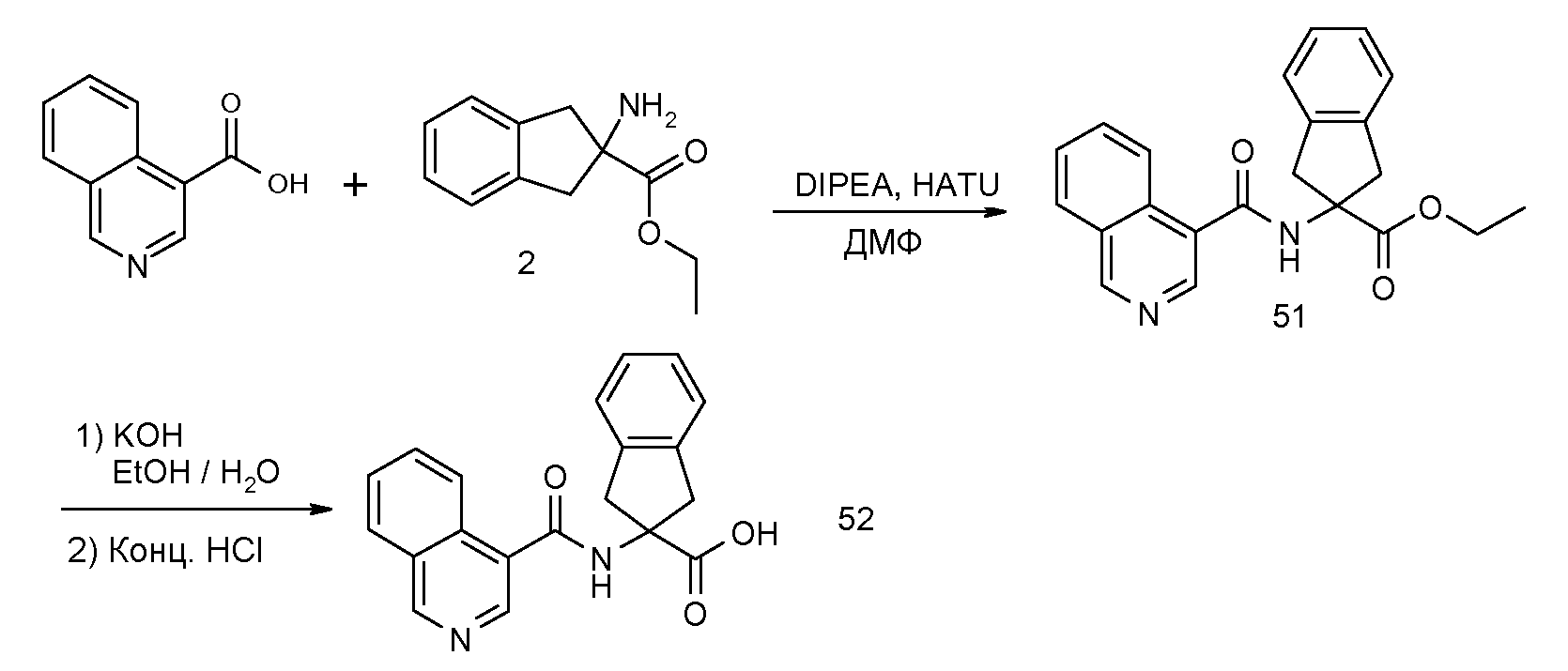
Этиловый эфир 2-[(изохинолин-4-карбонил)амино]индан-2-карбоновой кислоты (51):
К раствору изохинолин-4-карбоновой кислоты (211 мг, 1,22 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (250 мг, 1,22 ммоль) и HATU (696 мг, 1,83 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (302 мкл, 1,83 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (51) в виде твердого вещества белого цвета (359 мг, 82%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 3,49 (д, 2H), 3,79 (д, 2H), 4,28 (кв, 2H), 6,96 (с, 1H), 7,20-7,27 (м, 4H), 7,57-7,62 (м, 1H), 7,76-7,82 (м, 1H), 7,86 (д, 1H), 8,12 (д, 1H), 8,54 (д, 1H), 9,22 (д, 1H)
ЖХ/МС (ES+) m/z=361,15
ПРИМЕР 52
2-[(Изохинолин-4-карбонил)амино]индан-2-карбоновая кислота (52):
Смесь этилового эфира 2-[(изохинолин-4-карбонил)амино]индан-2-карбоновой кислоты (51) (200 мг, 0,55 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (52) в виде твердого вещества белого цвета (170 мг, 93%).
1Н ЯМР (CDCl3 + CD3OD, 300МГц): δ 3,38 (д, 2H), 3,53 (д, 2H), 7,19-7,27 (м, 4H), 7,64 (т, 1H), 7,83 (т, 1H), 7,94 (д, 1H), 8,09 (д, 1H), 8,40 (с, 1H), 8,71 (д, 1H), 9,22 (д, 1H)
ЖХ/МС (ES+) m/z=333,06
ПРИМЕР 53
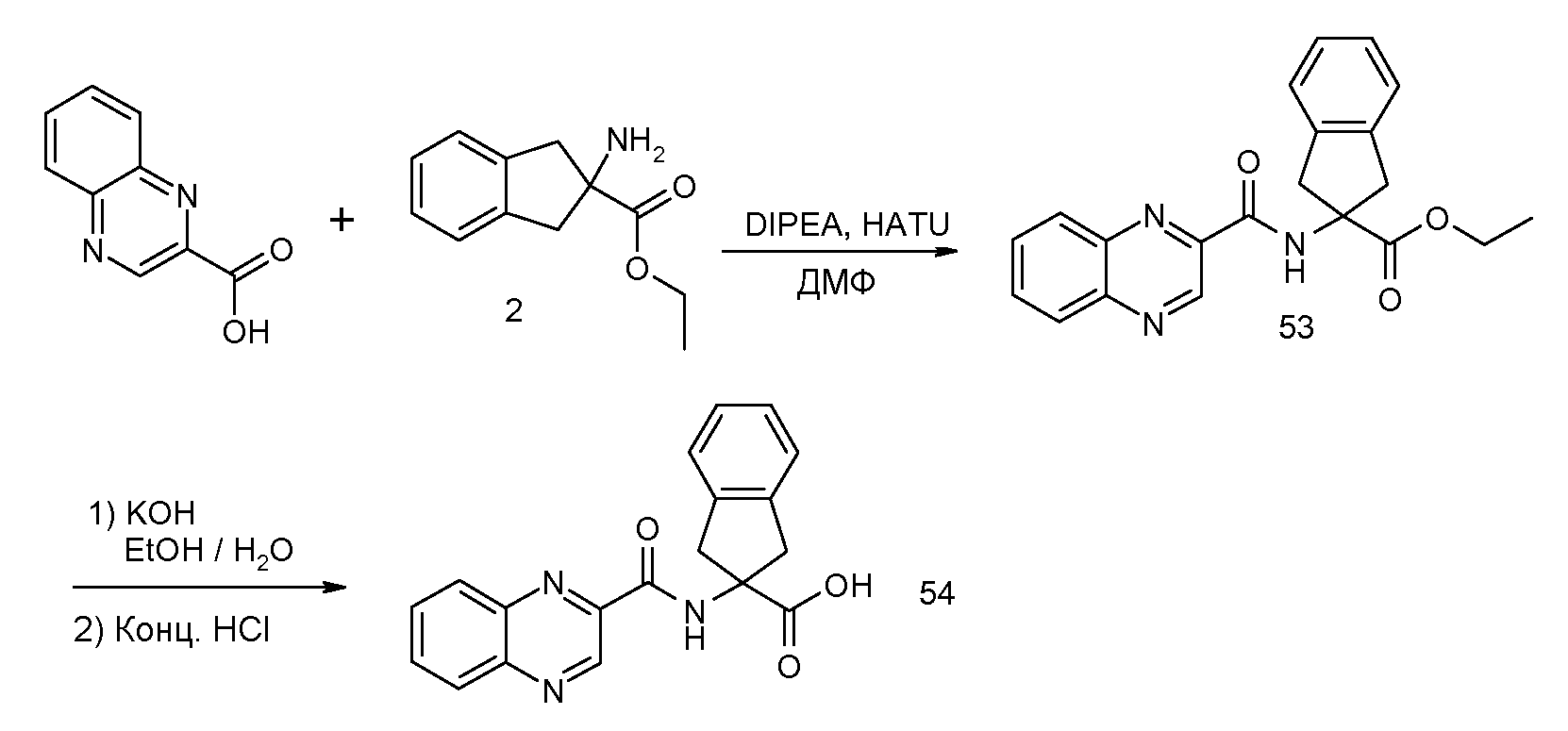
Этиловый эфир 2-[(хиноксалин-2-карбонил)амино]индан-2-карбоновой кислоты (53):
К раствору хиноксалин-5-карбоновой кислоты (400 мг, 2,3 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (471 мг, 2,3 ммоль) и HATU (1,3 г, 3,45 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (570 мкл, 3,45 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-40% EtOAc в гептане) с получением чистого продукта (56) в виде твердого вещества оранжевого цвета (605 мг, 73%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 3,55 (д, 2H), 3,84 (д, 2H), 4,28 (кв, 2H), 7,21-7,29 (м, 4H), 7,79-7,89 (м, 2H), 8,08-8,18 (м, 2H), 8,46 (с, 1H), 9,64 (с, 1H)
ЖХ/МС (ES+) m/z=361,12
ПРИМЕР 54
2-[(Хиноксалин-2-карбонил)амино]индан-2-карбоновая кислота (54):
Смесь этилового эфира 2-[(хиноксалин-5-карбонил)амино]индан-2-карбоновой кислоты (56) (480 мг, 1,33 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (13 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (40 мл) и подкисляют концентрированной HCl по каплям до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (54) в виде твердого вещества коричневого цвета (444 мг, 100%).
1Н ЯМР (CDCl3 + CD3OD, 300МГц): δ 3,58 (д, 2H), 3,86 (д, 2H), 7,21-7,30 (м, 4H), 7,81-7,90 (м, 2H), 8,10-8,18 (м, 2H), 8,58 (с, 1H), 9,61 (с, 1H)
ЖХ/МС (ES+) m/z=361,12
ПРИМЕР 55
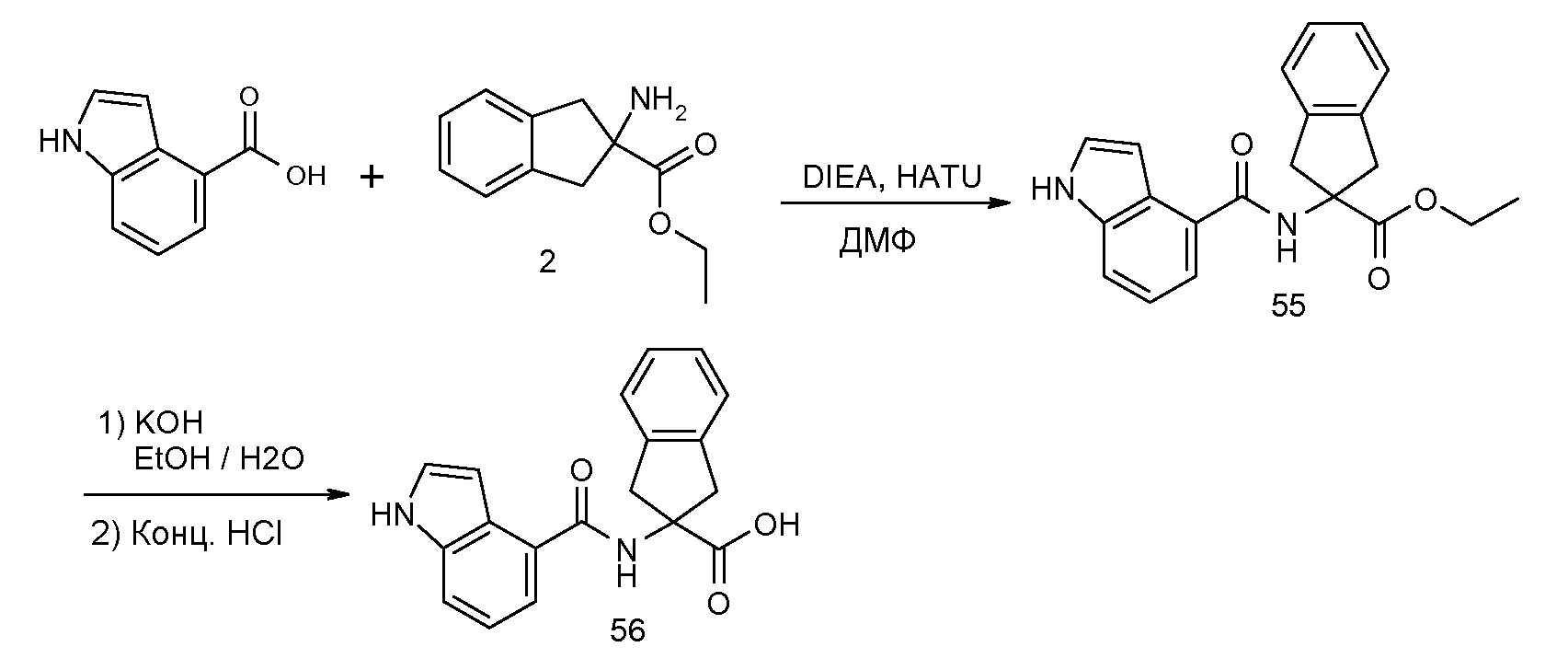
Этиловый эфир 2-[(1H-индол-4-карбонил)амино]индан-2-карбоновой кислоты (55):
К раствору 1H-индол-4-карбоновой кислоты (250 мг, 1,55 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (318 мг, 1,55 ммоль) и HATU (886 мг, 2,33 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (385 мкл, 2,33 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-60% EtOAc в гептане) с получением чистого продукта (55) в виде твердого вещества белого цвета (278 мг, 52%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 3,46 (д, 2H), 3,78 (д, 2H), 4,26 (кв, 2H), 6,78 (м, 1H), 7,14-7,25 (м, 6H), 7,46-7,49 (м, 2H), 8,65 (с, 1H)
ЖХ/МС (ES+) m/z=349,14
ПРИМЕР 56
2-[(1H-Индол-4-карбонил)амино]индан-2-карбоновая кислота (56):
Смесь этилового эфира 2-[(1H-индол-4-карбонил)амино]индан-2-карбоновой кислоты (55) (200 мг, 0,57 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (56) в виде твердого вещества белого цвета (162 мг, 89%).
1Н ЯМР (CDCl3 = CD3OD, 300МГц): δ 3,50 (д, 2H), 3,80 (д, 2H), 6,68 (м, 1H), 7,15-7,29 (м, 6H), 7,46 (д, 1H), 7,53 (дд, 1H), 9,79 (с, 1H)
ЖХ/МС (ES+) m/z=321,15
ПРИМЕР 57
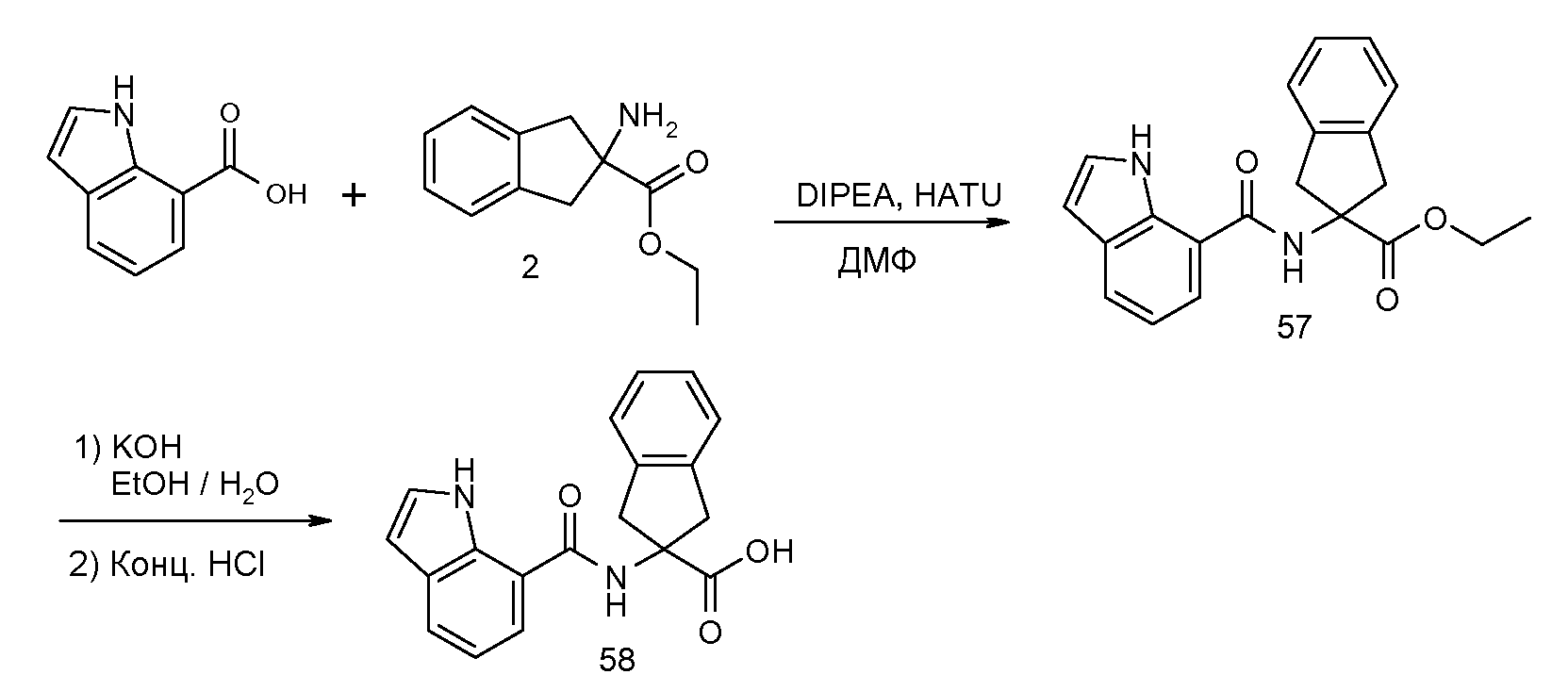
Этиловый эфир 2-[(1H-индол-7-карбонил)амино]индан-2-карбоновой кислоты (57):
К раствору 1H-индол-7-карбоновой кислоты (250 мг, 1,55 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (318 мг, 1,55 ммоль) и HATU (886 мг, 2,33 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (385 мкл, 2,33 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-60% EtOAc в гептане) с получением чистого продукта (57) в виде твердого вещества белого цвета (378 мг, 70%).
1Н ЯМР (CDCl3, 300МГц): δ 1,22 (т, 3H), 3,44 (д, 2H), 3,78 (д, 2H), 4,25 (кв, 2H), 6,53 (т, 1H), 6,93 (с, 1H), 7,03 (т, 1H), 7,18-7,27 (м, 5H), 7,32 (д, 1H), 7,77 (д, 1H), 10,25 (с, 1H)
ЖХ/МС (ES+) m/z=349,21
ПРИМЕР 58
2-[(1H-Индол-7-карбонил)амино]индан-2-карбоновая кислота (58):
Смесь этилового эфира 2-[(1H-индол-7-карбонил)амино]индан-2-карбоновой кислоты (57) (220 мг, 0,63 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (58) в виде твердого вещества не совсем белого цвета (186 мг, 92%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,50 (д, 2H), 3,79 (д, 2H), 6,54 (м, 2H), 7,06 (т, 1H), 7,19-7,31 (м, 5H), 7,42 (д, 1H), 7,78 (д, 1H), 10,25 (с, 1H)
ЖХ/МС (ES+) m/z=325,15
ПРИМЕР 59
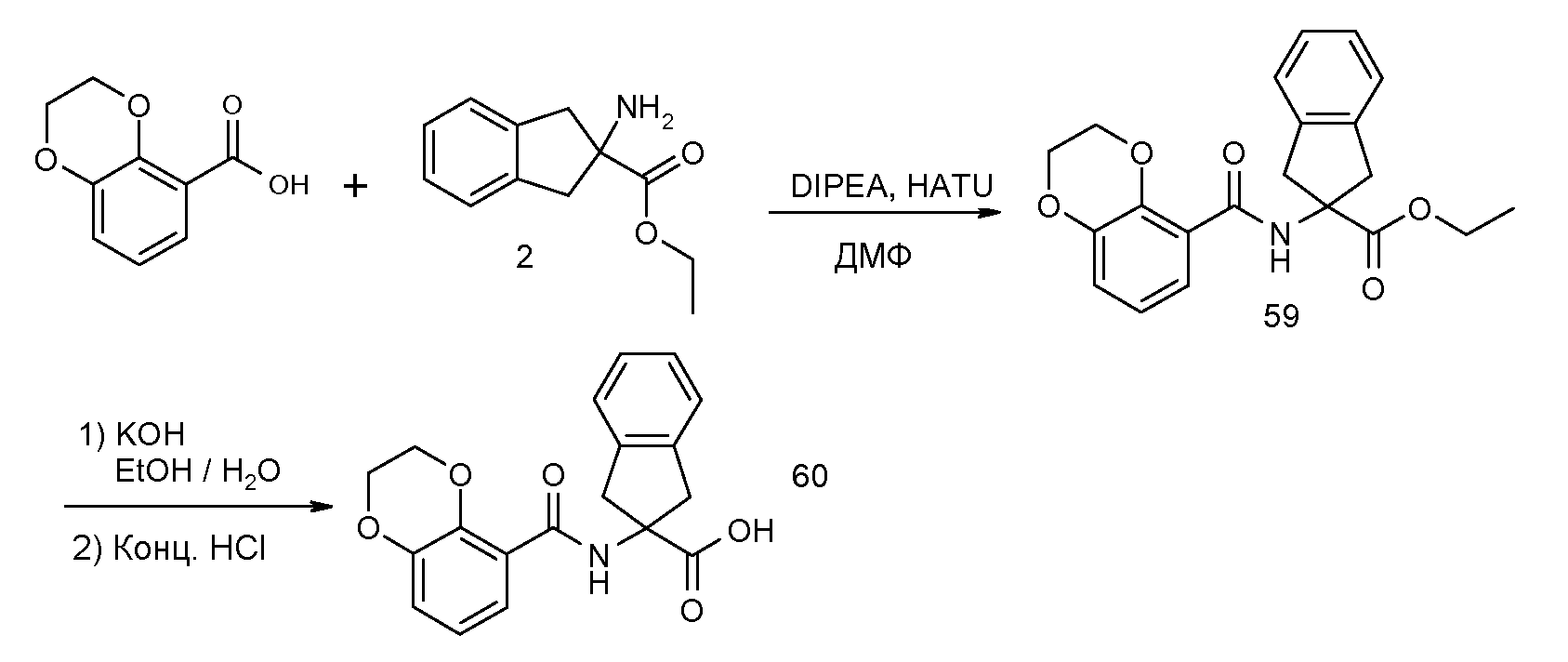
Этиловый эфир 2-[(2,3-дигидробензо[1,4]диоксин-5-карбонил)амино]индан-2-карбоновой кислоты (59):
К раствору 2,3-дигидробензо[1,4]диоксин-5-карбоновой кислоты (351 мг, 1,95 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (400 мг, 1,95 ммоль) и HATU (1,11 мг, 2,93 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (484 мкл, 2,93 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (70 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (59) в виде твердого вещества белого цвета (650 мг, 91%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 3,39 (д, 2H), 3,74 (д, 2H), 4,21-4,33 (м, 6H), 6,90 (т, 1H), 6,98 (дд, 1H), 7,17-7,24 (м, 4H), 7,69 (дд, 1H), 8,25 (с, 1H)
ЖХ/МС (ES+) m/z=368,15
ПРИМЕР 60
2-[(2,3-Дигидробензо[1,4]диоксин-5-карбонил)амино]индан-2-карбоновая кислота (60):
Смесь этилового эфира 2-[(2,3-дигидробензо[1,4]диоксин-5-карбонил)амино]индан-2-карбоновой кислоты (59) (495 мг, 1,35 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (60) в виде твердого вещества белого цвета (440 мг, 96%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 3,40 (д, 2H), 3,78 (д, 2H), 4,26-4,33 (м, 4H), 6,91 (т, 1H), 7,49 (дд, 1H), 7,18-7,25 (м, 4H), 7,65 (дд, 1H), 8,39 (с, 1H)
ЖХ/МС (ES+) m/z=340,11
ПРИМЕР 61
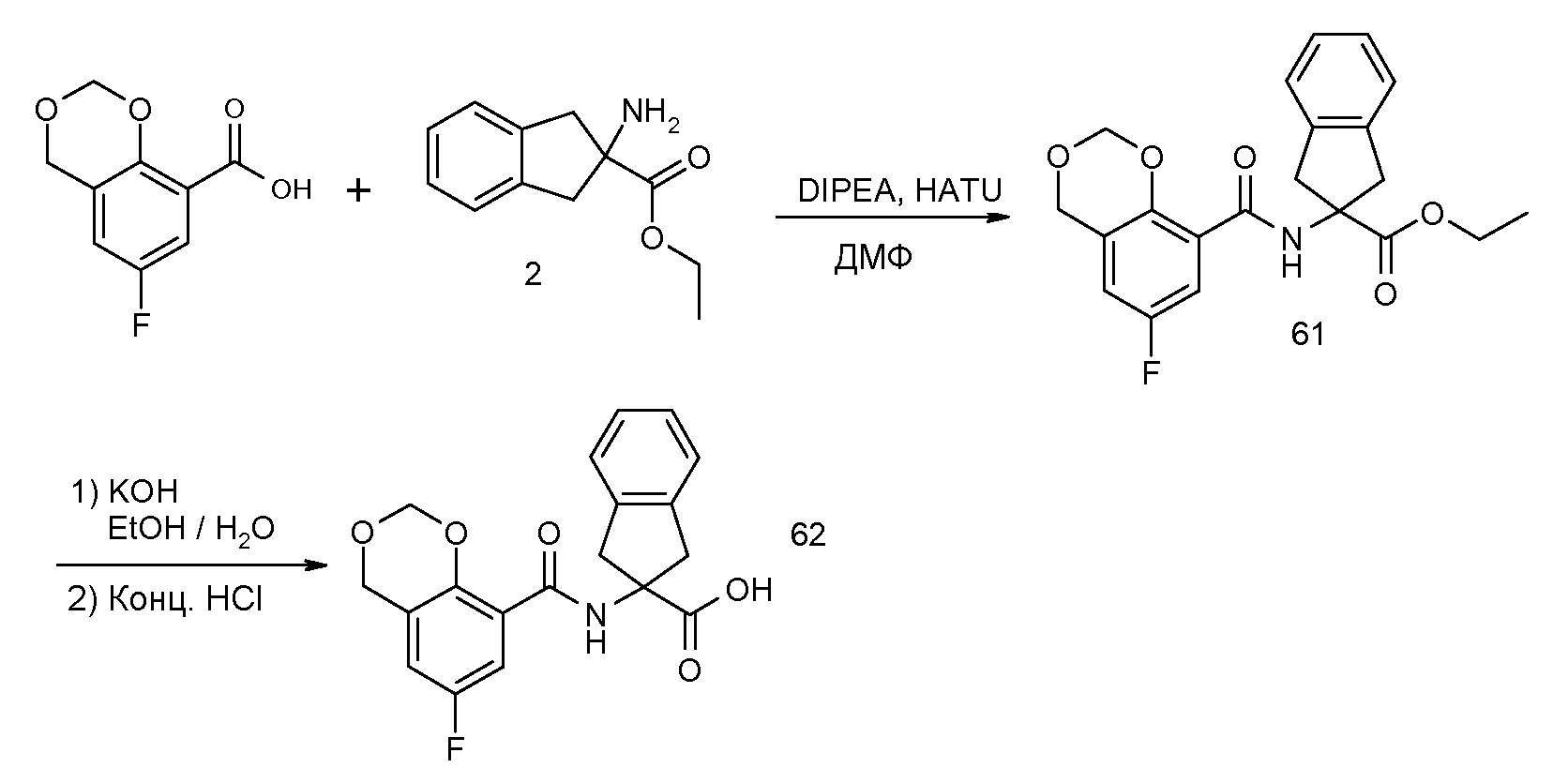
Этиловый эфир 2-[(6-фтор-4H-бензо[1,3]диоксин-8-карбонил)амино]индан-2-карбоновой кислоты (61):
К раствору 6-фтор-4H-бензо[1,3]диоксин-8-карбоновой кислоты (386 мг, 1,95 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (400 мг, 1,95 ммоль) и HATU (1,11 г, 2,93 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (484 мкл, 2,93 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (70 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (61) в виде твердого вещества белого цвета (720 мг, 6%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 3,38 (д, 2H), 3,74 (д, 2H), 4,24 (кв, 2H), 4,90 (с, 2H), 5,27 (с, 2H), 6,79 (дд, 1H), 7,17-7,24 (м, 4H), 7,74 (дд, 1H), 8,25 (с, 1H)
ЖХ/МС (ES+) m/z=386,11
ПРИМЕР 62
2-[(6-Фтор-4H-бензо[1,3]диоксин-8-карбонил)амино]индан-2-карбоновая кислота (62):
Смесь этилового эфира 2-[(6-фтор-4H-бензо[1,3]диоксин-8-карбонил)амино]индан-2-карбоновой кислоты (61) (560 мг, 1,45 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (62) в виде твердого вещества белого цвета (520 мг, 100%).
1Н ЯМР (CDCl3 + CD3OD, 300МГц): δ 3,39 (д, 2H), 3,75 (д, 2H), 4,92 (с, 2H), 5,30 (с, 2H), 6,85 (дд, 1H), 7,18-7,25 (м, 4H), 7,64 (дд, 1H), 8,49 (с, 1H)
ЖХ/МС (ES-) m/z=356,10
ПРИМЕР 63
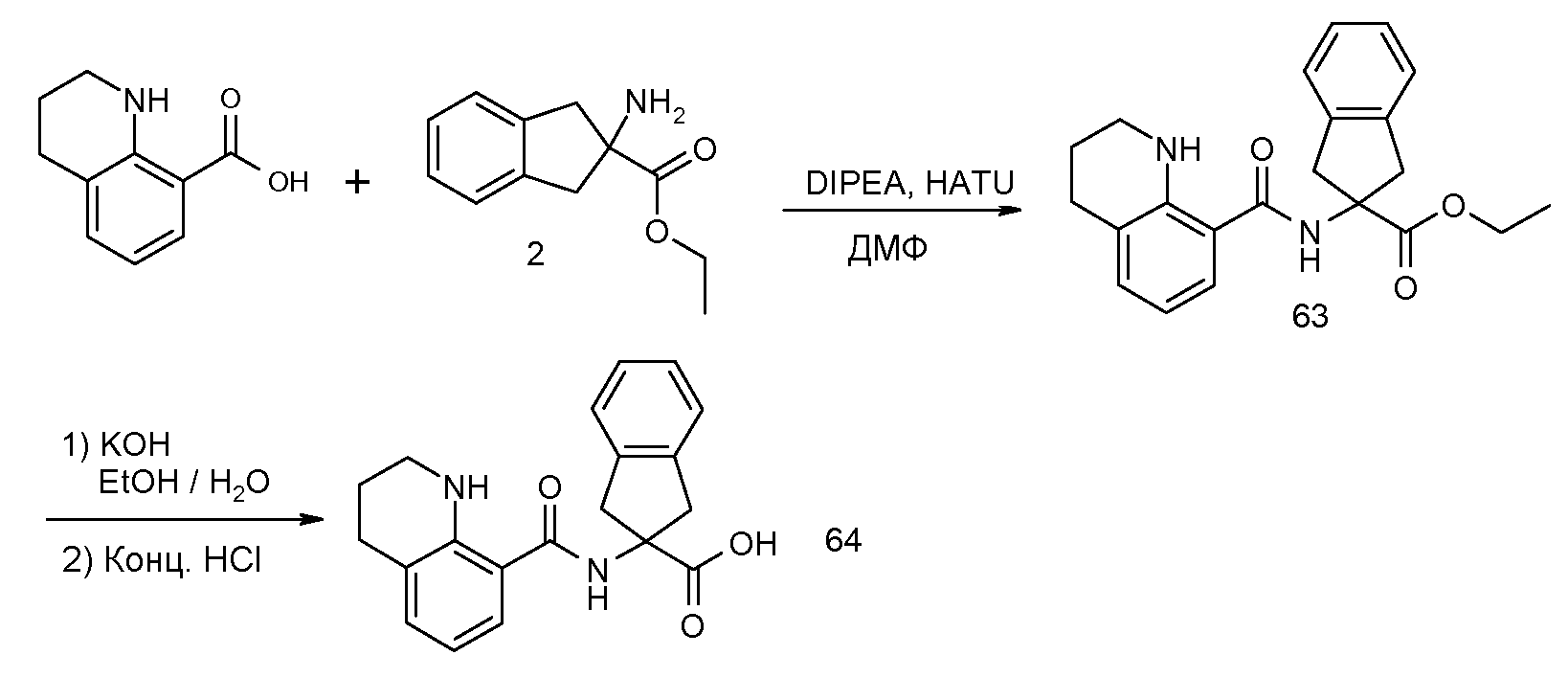
Этиловый эфир 2-[(1,2,3,4-тетрагидрохинолин-8-карбонил)амино]индан-2-карбоновой кислоты (63):
К раствору 1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (173 мг, 0,97 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (200 мг, 0,97 ммоль) и HATU (553 мг, 1,46 ммоль) в безводном ДМФА (20 мл) добавляют DIPEA (241 мкл, 1,46 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (63) в виде твердого вещества белого цвета (300 мг, 85%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 1,87 (м, 2H), 2,74 (т, 2H), 3,31-3,36 (м, 4H), 3,73 (д, 2H), 4,24 (кв, 2H), 6,38 (т, 2H), 6,50 (с, 1H), 6,95 (д, 1H), 7,09 (д, 1H), 7,17-7,24 (м, 4H), 7,67 (уш.с, 1H)
ЖХ/МС (ES+) m/z=365,18
ПРИМЕР 64
2-[(1,2,3,4-Тетрагидрохинолин-8-карбонил)амино]индан-2-карбоновая кислота (64):
Смесь этилового эфира 2-[(1,2,3,4-тетрагидрохинолин-8-карбонил)амино]индан-2-карбоновой кислоты (63) (259 мг, 0,71 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (15 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до выделения осадка из воды. После фильтрования твердое вещество промывают водой и собирают. Фильтрат постепенно снова подкисляют концентрированной HCl для проверки на выделение дополнительного осадка. Объединенное твердое вещество сушат в вакууме с получением чистого продукта (64) в виде твердого вещества желтого цвета (205 мг, 86%).
1Н ЯМР (CDCl3, 300МГц): δ 1,87 (м, 2H), 2,74 (т, 2H), 3,40-3,45 (м, 4H), 3,81 (д, 2H), 6,36 (т, 1H), 6,48 (с, 1H), 6,98 (т, 2H), 7,18-7,26 (м, 4H)
ЖХ/МС (ES+) m/z=337,17
ПРИМЕР 65
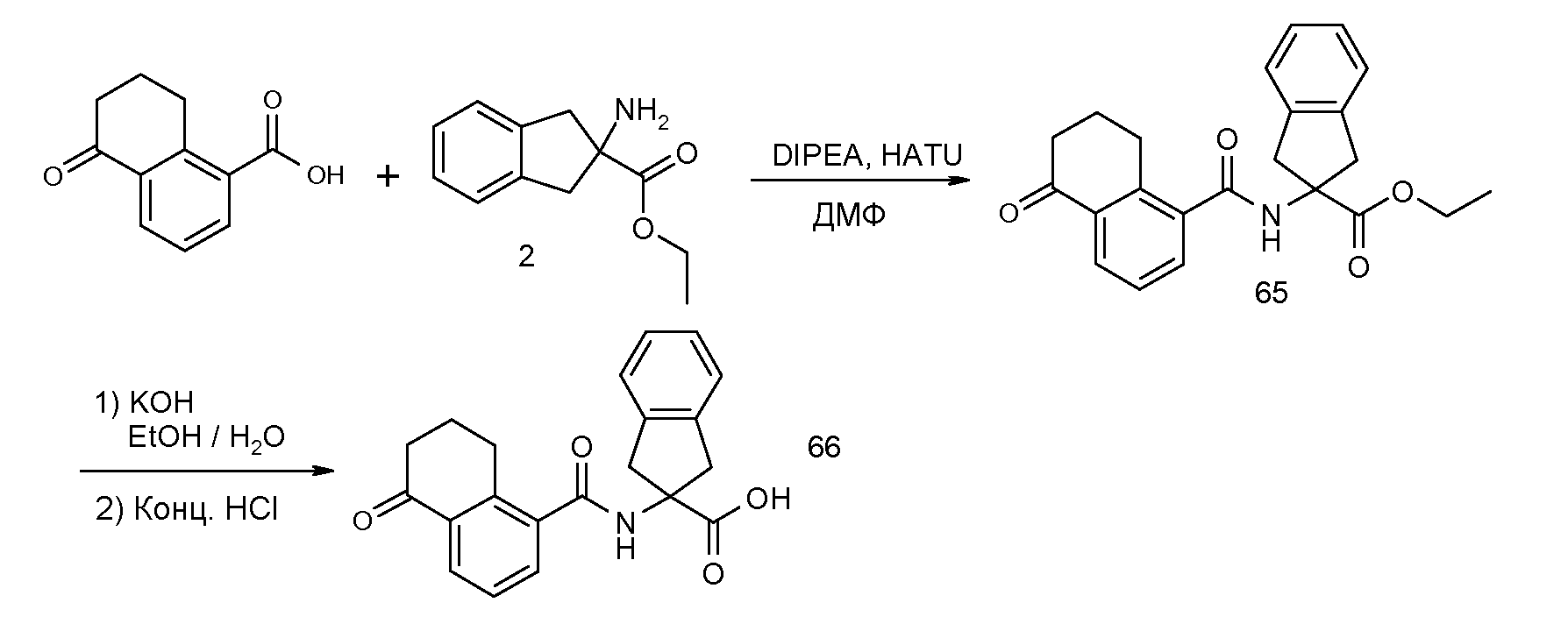
Этиловый эфир 2-[(5-оксо-5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (65):
К раствору 5-оксо-5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (430 мг, 2,26 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (464 мг, 2,26 ммоль) и HATU (1 г, 2,70 ммоль) в безводном ДМФА (20 мл) добавляют DIPEA (446 мкл, 2,70 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (65) в виде твердого вещества белого цвета (828 мг, 97%).
1Н ЯМР (CDCl3, 300МГц): δ 1,30 (т, 3H), 2,09 (м, 2H), 2,63 (т, 2H), 3,07 (т, 2H), 3,38 (д, 2H), 3,77 (д, 2H), 4,29 (кв, 2H), 6,31 (т, 2H), 7,20-7,26 (м, 4H), 7,30 (д, 1H), 7,50 (дд, 1H), 8,05 (дд, 1H)
ЖХ/МС (ES+) m/z=378,13
ПРИМЕР 66
2-[(5-Оксо-5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (66):
Смесь этилового эфира 2-[(5-оксо-5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (65) (250 мг, 0,66 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (66) в виде твердого вещества белого цвета (150 мг, 65%).
1Н ЯМР (CDCl3 + CD3OD, 300МГц): δ 1,98 (м, 2H), 2,60 (т, 2H), 2,97 (т, 2H), 3,34 (д, 2H), 3,58 (д, 2H), 7,15-7,25 (м, 4H), 7,38 (д, 1H), 7,48 (т, 1H), 7,94 (дд, 1H), 9,02 (с, 1H)
ЖХ/МС (ES+) m/z=350,16
ПРИМЕР 67
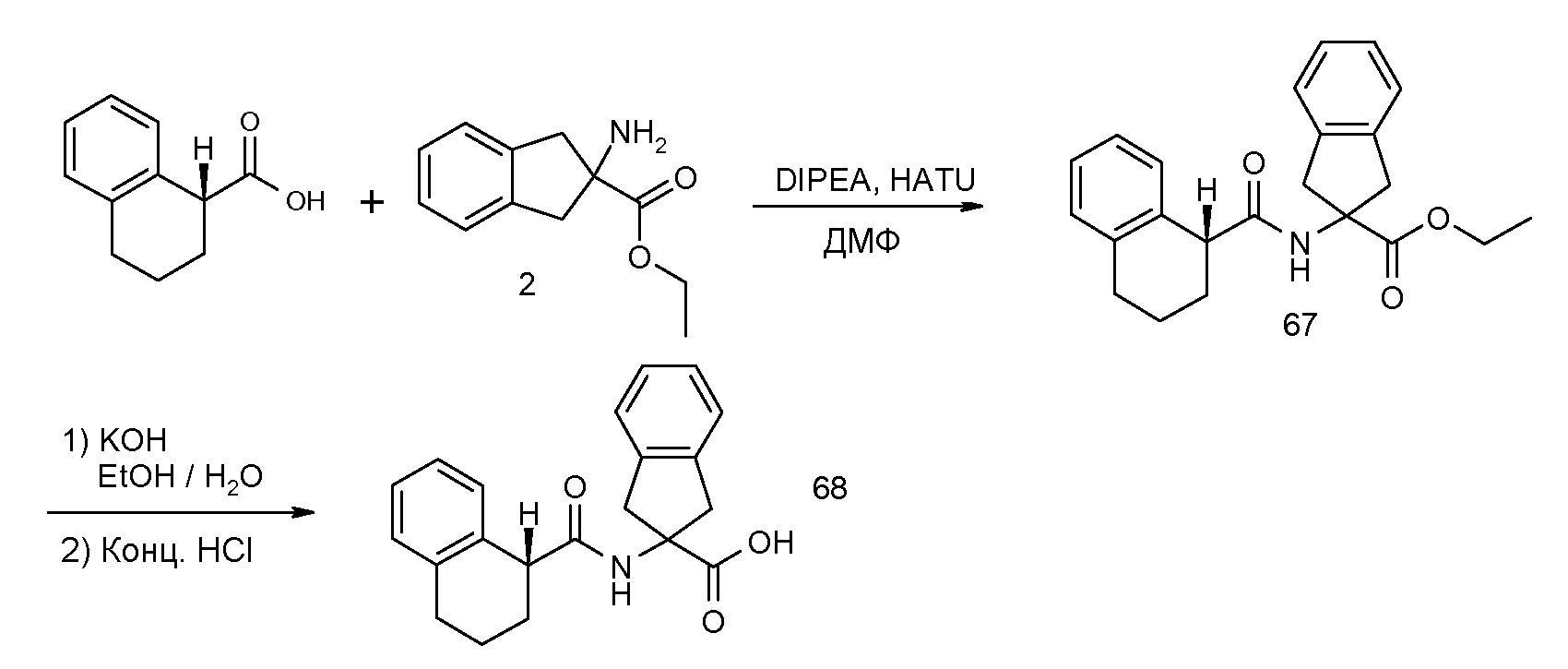
Этиловый эфир 2-[((R)-1,2,3,4-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (67):
К раствору (R)-1,2,3,4-тетрагидронафталин-1-карбоновой кислоты (300 мг, 1,7 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (349 мг, 1,7 ммоль) и HATU (760 мг, 2,0 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (330 мкл, 2,0 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-50% EtOAc в гептане) с получением чистого продукта (67) в виде твердого вещества белого цвета (615 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 1,57-2,00 (м, 3H), 2,17-2,26 (м, 1H), 2,76 (м, 2H), 3,10 (дд, 2H), 3,57-3,68 (м, 3H), 4,19 (кв, 2H), 5,87 (с, 1H), 7,03-7,18 (м, 8H)
ЖХ/МС (ES+) m/z=364,16
ПРИМЕР 68
2-[((R)-1,2,3,4-Тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (68):
Смесь этилового эфира 2-[((R)-1,2,3,4-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (67) (440 мг, 1,21 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (68) в виде твердого вещества белого цвета (391 мг, 96%).
1Н ЯМР (CDCl3, 300МГц): δ 1,65-1,73 (м, 2H), 1,93-1,96 (м, 1H), 2,17-2,27 (м, 1H), 2,69 (т, 2H), 3,12 (т, 2H), 3,63-3,70 (м, 3H), 5,84 (с, 1H), 6,86 (д, 1H), 7,00 (т, 1H), 7,07 (д, 1H), 7,13-7,20 (м, 5H)
ЖХ/МС (ES-) m/z=334,14
ПРИМЕР 69
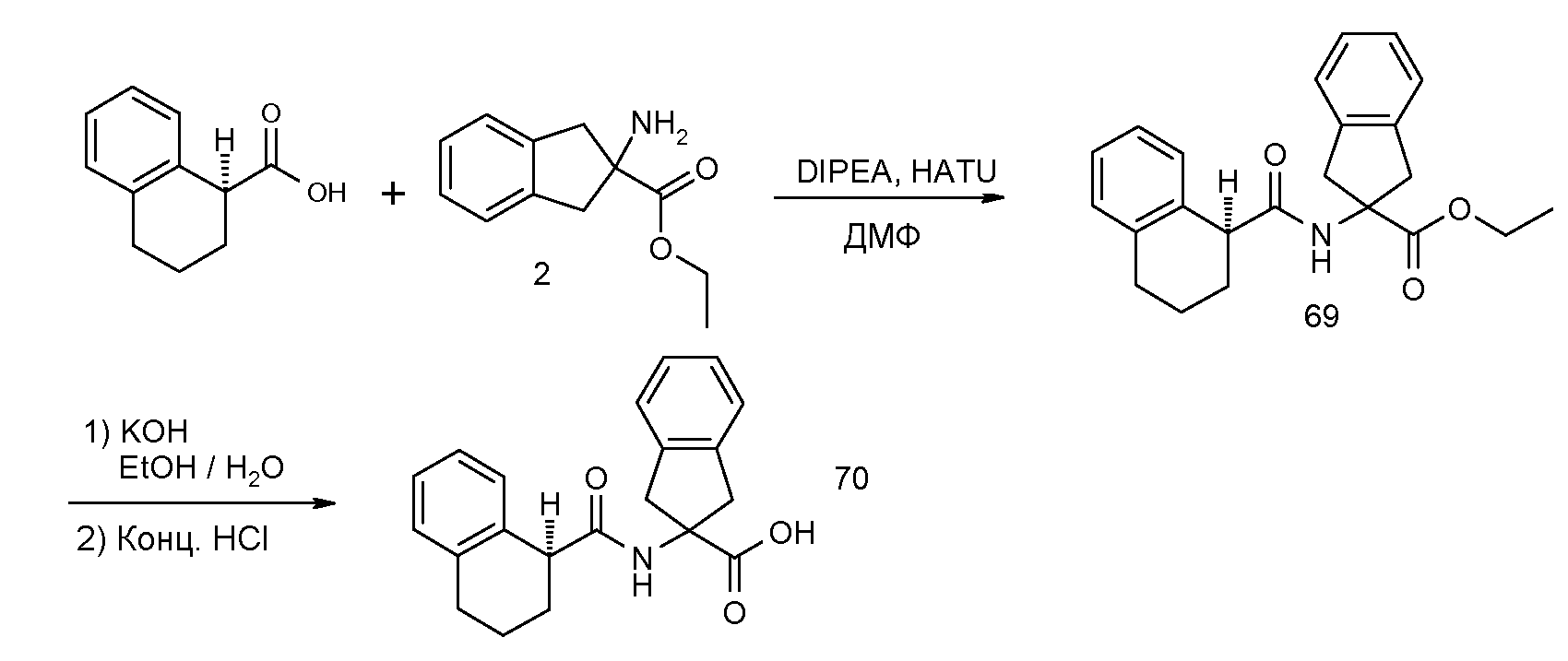
Этиловый эфир 2-[((S)-1,2,3,4-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (69):
К раствору (S)-1,2,3,4-тетрагидронафталин-1-карбоновой кислоты (300 мг, 1,7 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (349 мг, 1,7 ммоль) и HATU (760 мг, 2 ммоль) в безводном ДМФА (8 мл) добавляют DIPEA (330 мкл, 2 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-50% EtOAc в гептане) с получением чистого продукта (69) в виде твердого вещества белого цвета (615 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,24 (т, 3H), 1,58-2,00 (м, 3H), 2,17-2,26 (м, 1H), 2,76 (м, 2H), 3,10 (дд, 2H), 3,57-3,68 (м, 3H), 4,19 (кв, 2H), 5,87 (с, 1H), 7,05-7,26 (м, 8H)
ЖХ/МС (ES+) m/z=364,19
ПРИМЕР 70
2-[((S)-1,2,3,4-Тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (70):
Смесь этилового эфира 2-[((S)-1,2,3,4-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (69) (440 мг, 1,21 ммоль) и KOH (800 мг, 14,2 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 4 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (70) в виде твердого вещества белого цвета (405 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,66-1,73 (м, 2H), 1,93-1,96 (м, 1H), 2,20-2,22 (м, 1H), 2,69 (т, 2H), 3,12 (т, 2H), 3,17-3,71 (м, 3H), 5,82 (с, 1H), 6,87 (д, 1H), 7,01 (т, 1H), 7,07 (д, 1H), 7,13-7,21 (м, 5H)
ЖХ/МС (ES+) m/z=336,13
ПРИМЕР 71
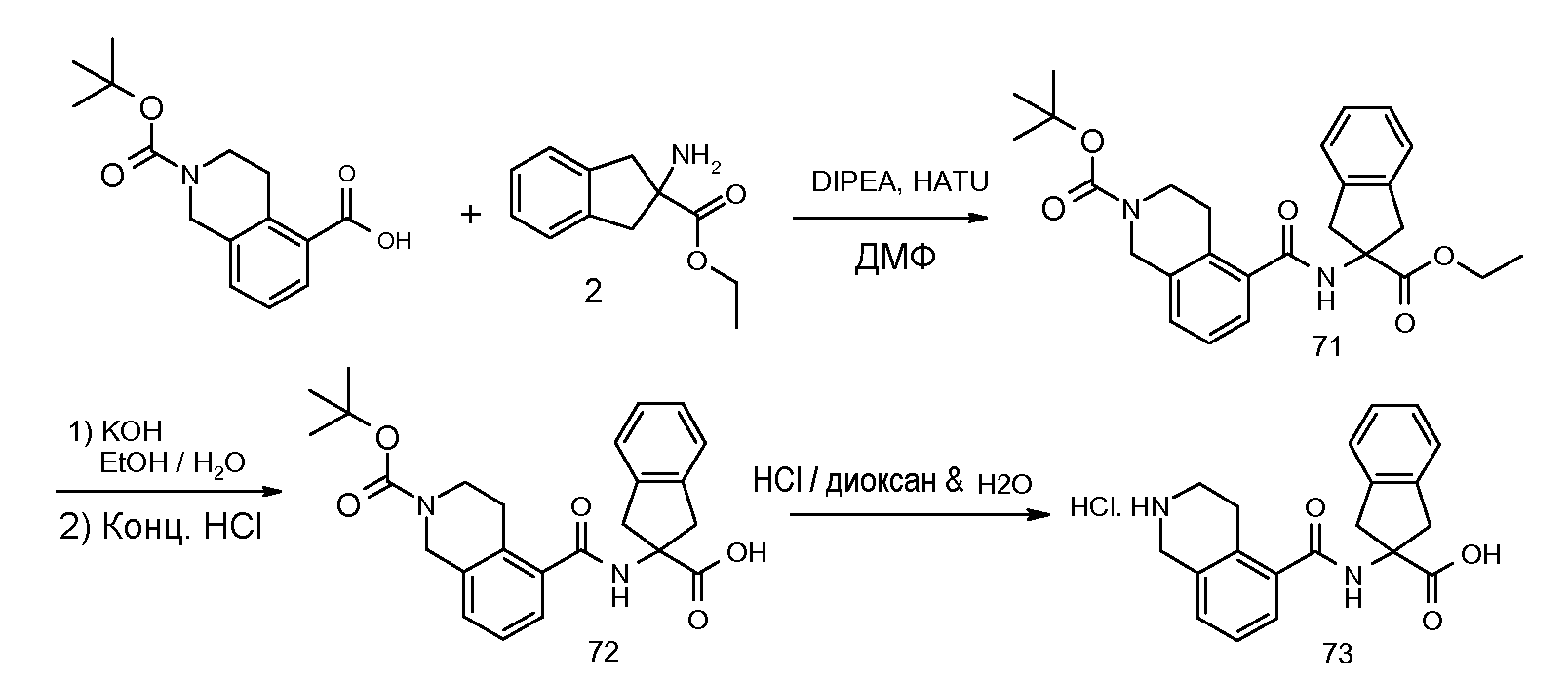
трет-Бутиловый эфир 5-(2-этоксикарбонилиндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (71):
К раствору 2-трет-бутилового эфира 3,4-дигидро-1H-изохинолин-2,5-дикарбоновой кислоты (2 г, 7,2 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (1,5 г, 7,2 ммоль) и HATU (3,27 г, 8,6 ммоль) в безводном ДМФА (20 мл) добавляют DIPEA (1,42 мл, 8,6 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×20 мл) и насыщенным раствором соли (2×20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (71) в виде твердого вещества белого цвета (1,02 г, 30%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,48 (с, 9H), 2,95 (т, 2H), 3,35 (д, 2H), 3,57 (т, 2H), 3,75 (д, 2H), 4,27 (кв, 2H), 4,55 (с, 2H), 6,26 (с, 1H), 7,14-7,26 (м, 7H)
ЖХ/МС (ES+) m/z=465,26
ПРИМЕР 72
трет-Бутиловый эфир 5-(2-карбоксииндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (72):
Смесь трет-бутилового эфира 5-(2-этоксикарбонилиндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (71) (882 мг, 1,78 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (15 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (50 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (72) в виде твердого вещества белого цвета (680 мг, 88%).
1Н ЯМР (CDCl3, 300МГц): δ 1,46 (с, 9H), 2,84 (т, 2H), 3,36 (д, 2H), 3,48 (т, 2H), 3,74 (д, 2H), 4,49 (с, 2H), 6,57 (уш.с, 1H), 7,10-7,19 (м, 7H)
ЖХ/МС (ES+) m/z=381,17, 437,23
ПРИМЕР 73
Гидрохлоридная соль 2-[(1,2,3,4-тетрагидроизохинолин-5-карбонил)амино]индан-2-карбоновой кислоты (73):
трет-Бутиловый эфир 5-(2-карбоксииндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (72) (650 мг, 1,49 ммоль) растворяют в 30% растворе ТФУК в DCM (10 мл) и полученный раствор перемешивают при комнатной температуре в течение 2 часов. Раствор концентрируют с получением соли ТФУК 2-[(1,2,3,4-тетрагидроизохинолин-5-карбонил)амино]индан-2-карбоновой кислоты (670 мг, 100%). Данную соль ТФУК (250 мг, 0,56 ммоль) растворяют в 6 н. водном растворе HCl (20 мл). Полученную суспензию перемешивают в течение ночи с получением прозрачного раствора. Раствор концентрируют с получением чистого продукта (73) в виде твердого вещества белого цвета (130 мг, 62%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,05 (т, 2H), 3,32-3,37 (м, 4H), 3,57 (д, 2H), 4,27 (с, 2H), 7,15-7,29 (м, 7H), 8,98 (с, 1H), 9,42 (с, 2H), 12,51 (уш.с, 1H)
ЖХ/МС (ES+) m/z=337,17
ПРИМЕР 74
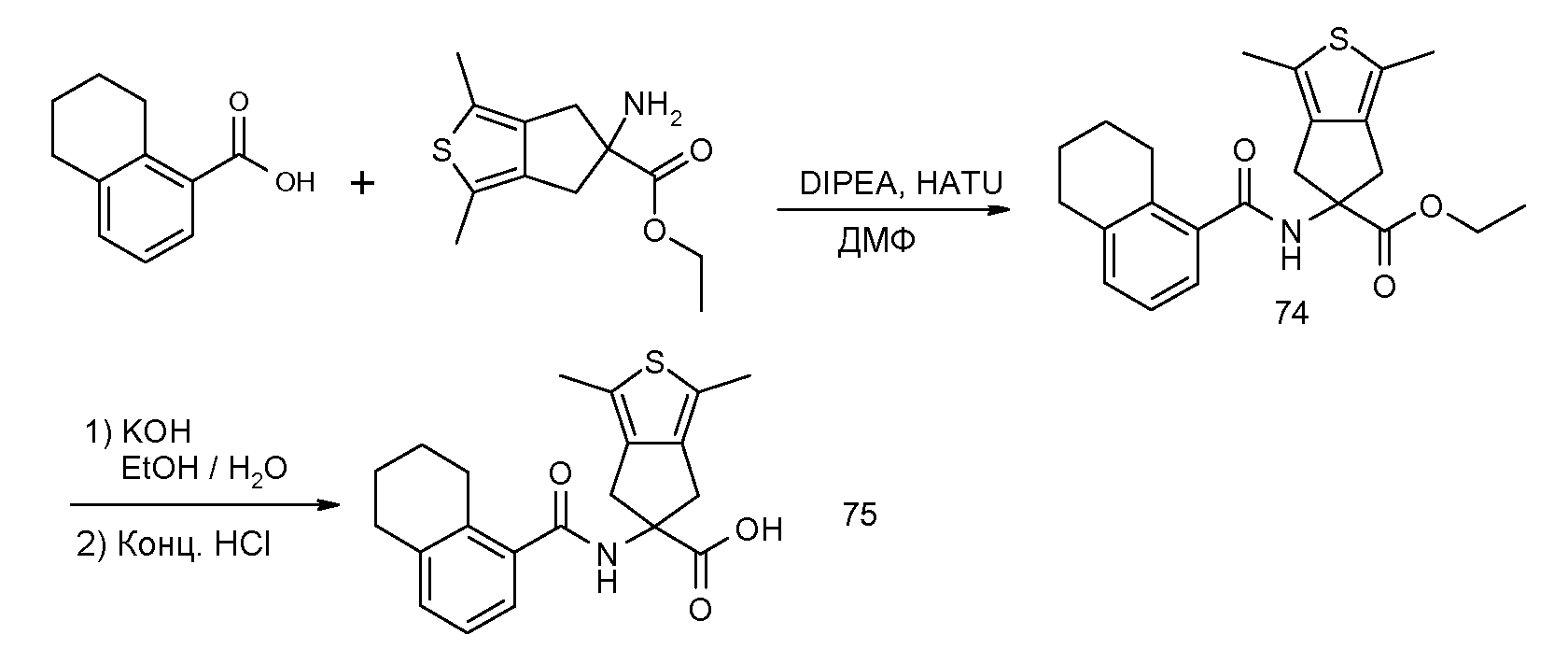
Этиловый эфир 1,3-диметил-5-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (74):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (500 мг, 2,84 ммоль), этилового эфира 5-амино-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (816 мг, 3,41 ммоль) и HATU (1,62 г, 4,26 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (704 мкл, 4,26 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (74) в виде твердого вещества белого цвета (1,10 г, 97%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,76 (м, 4H), 2,25 (с, 6H), 2,80 (м, 4H), 2,97 (д, 2H), 3,31 (д, 2H), 4,26 (кв, 2H), 6,22 (с, 1H), 7,15-7,15 (м, 3H)
ЖХ/МС (ES+) m/z=398,16
ПРИМЕР 75
1,3-Диметил-5-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновая кислота (75):
Смесь этилового эфира 1,3-диметил-5-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (74) (942 мг, 2,37 ммоль) и KOH (3 г, 23 ммоль) растворяют в EtOH (20 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (75) в виде твердого вещества бледно-коричневого цвета (832 мг, 95%).
1Н ЯМР (CDCl3, 300МГц): δ 1,75 (м, 4H), 2,25 (с, 6H), 2,75 (м, 4H), 3,03 (д, 2H), 3,36 (д, 2H), 6,26 (с, 1H), 7,08-7,16 (м, 3H)
ЖХ/МС (ES+) m/z=370,12
ПРИМЕР 76
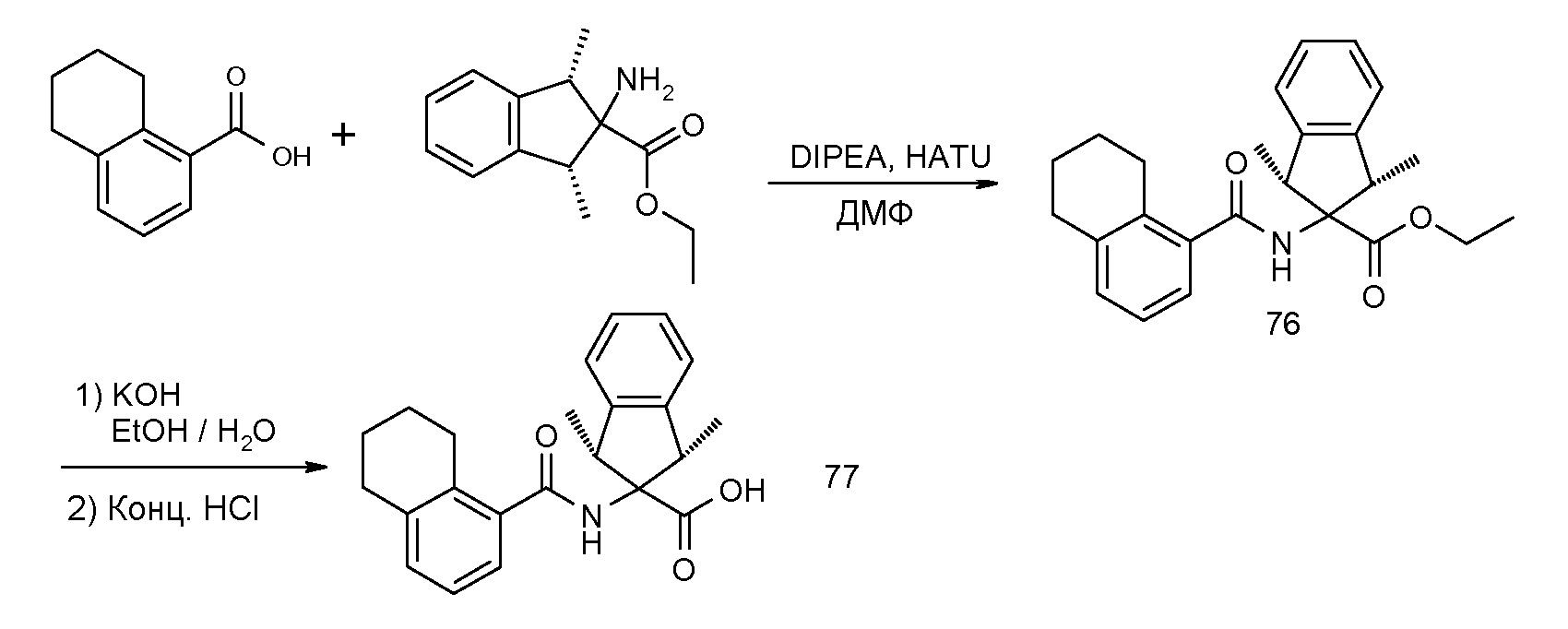
Этиловый эфир (цис)-1,3-диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (76):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (400 мг, 2,27 ммоль), этилового эфира (цис)-2-амино-1,3-диметилиндан-2-карбоновой кислоты (636 мг, 2,72 ммоль) и HATU (1,3 г, 3,41 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (563 мкл, 3,41 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 50-50% EtOAc в гептане) с получением чистого продукта (76) в виде твердого вещества белого цвета (79 мг, 9%).
1Н ЯМР (CDCl3, 300МГц): δ 1,32 (т, 3H), 1,50 (д, 6H), 1,75 (м, 4H), 2,75 (уш.с, 2H), 2,88 (уш.с, 2H), 3,80 (кв, 2H), 4,31 (кв, 2H), 5,73 (с, 1H), 7,00-7,25 (м, 7H)
ЖХ/МС (ES+) m/z=392,22
ПРИМЕР 77
(цис)-1,3-Диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (77):
Смесь этилового эфира (цис)-1,3-диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (76) (62 мг, 1,2 ммоль) и KOH (300 мг, 5,4 ммоль) растворяют в EtOH (3 мл) и воде (0,3 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~4. Осадок фильтруют с получением чистого продукта (77) в виде твердого вещества белого цвета (44 мг, 75%).
1Н ЯМР (CDCl3, 300МГц): δ 1,51 (д, 6H), 1,74 (м, 4H), 2,75 (уш.с, 2H), 2,86 (уш.с, 2H), 3,88 (кв, 2H), 5,81 (с, 1H), 7,01-7,26 (м, 7H)
ЖХ/МС (ES+) m/z=364,23
ПРИМЕР 78
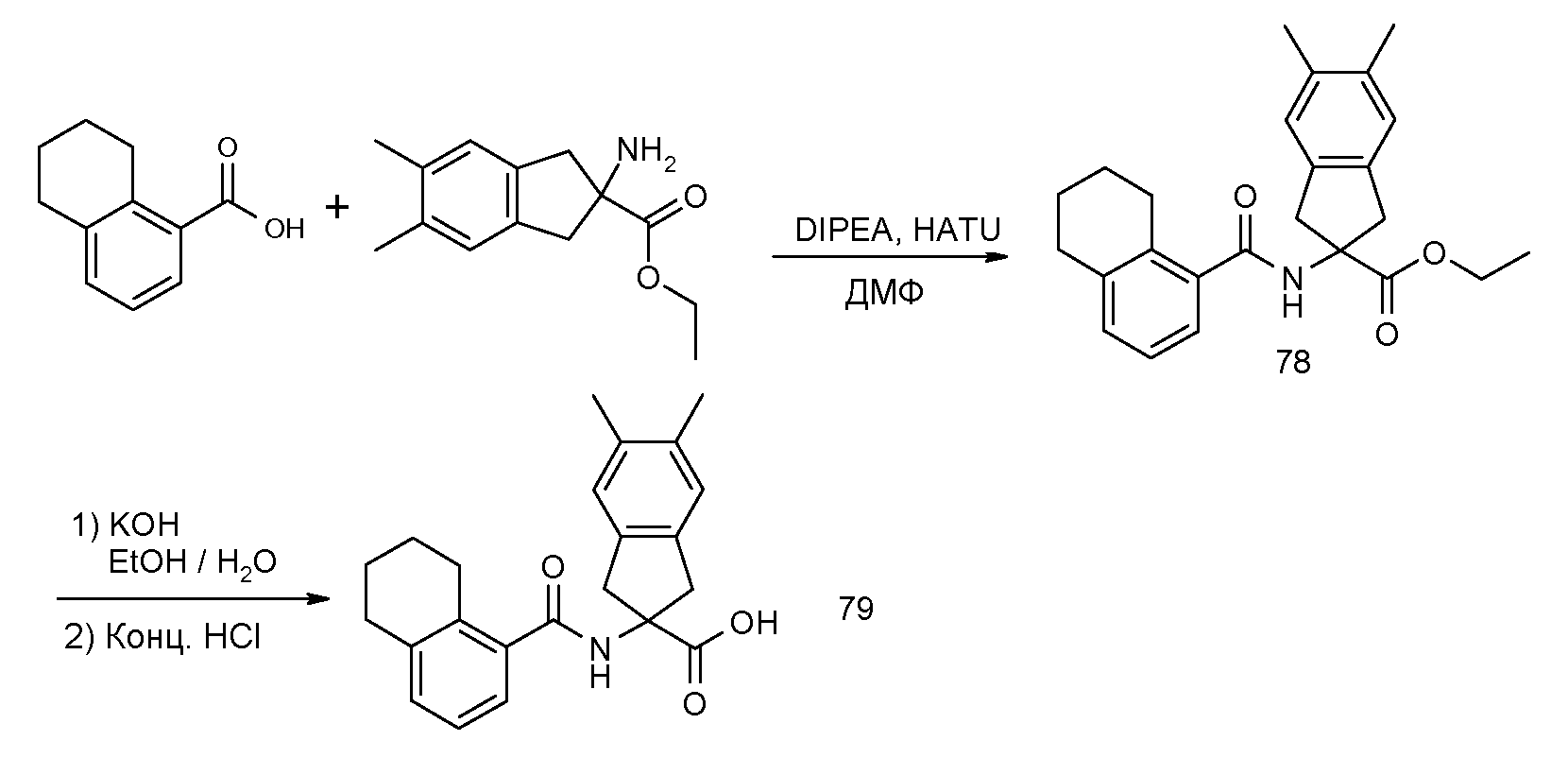
Этиловый эфир 5,6-диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (78):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (400 мг, 2,27 ммоль), этилового эфира 2-амино-5,6-диметилиндан-2-карбоновой кислоты (636 мг, 2,72 ммоль) и HATU (1,30 г, 3,41 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (563 мкл, 3,41 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (78) в виде твердого вещества белого цвета (817 мг, 92%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,74 (м, 4H), 2,23 (с, 6H), 2,75 (уш.с, 2H), 2,84 (уш.с, 2H), 3,25 (д, 2H), 3,69 (д, 2H), 4,26 (кв, 2H), 6,20 (с, 1H), 6,99-7,11 (м, 5H)
ЖХ/МС (ES+) m/z=392,20
ПРИМЕР 79
5,6-Диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (79):
Смесь этилового эфира 5,6-диметил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (78) (438 мг, 1,11 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (79) в виде твердого вещества бледно-коричневого цвета (390 мг, 97%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,73 (м, 4H), 2,23 (с, 6H), 2,74-2,80 (м, 4H), 3,29 (д, 2H), 3,69 (д, 2H), 6,60 (с, 1H), 6,99-7,08 (м, 5H)
ЖХ/МС (ES+) m/z=364,23
ПРИМЕР 80
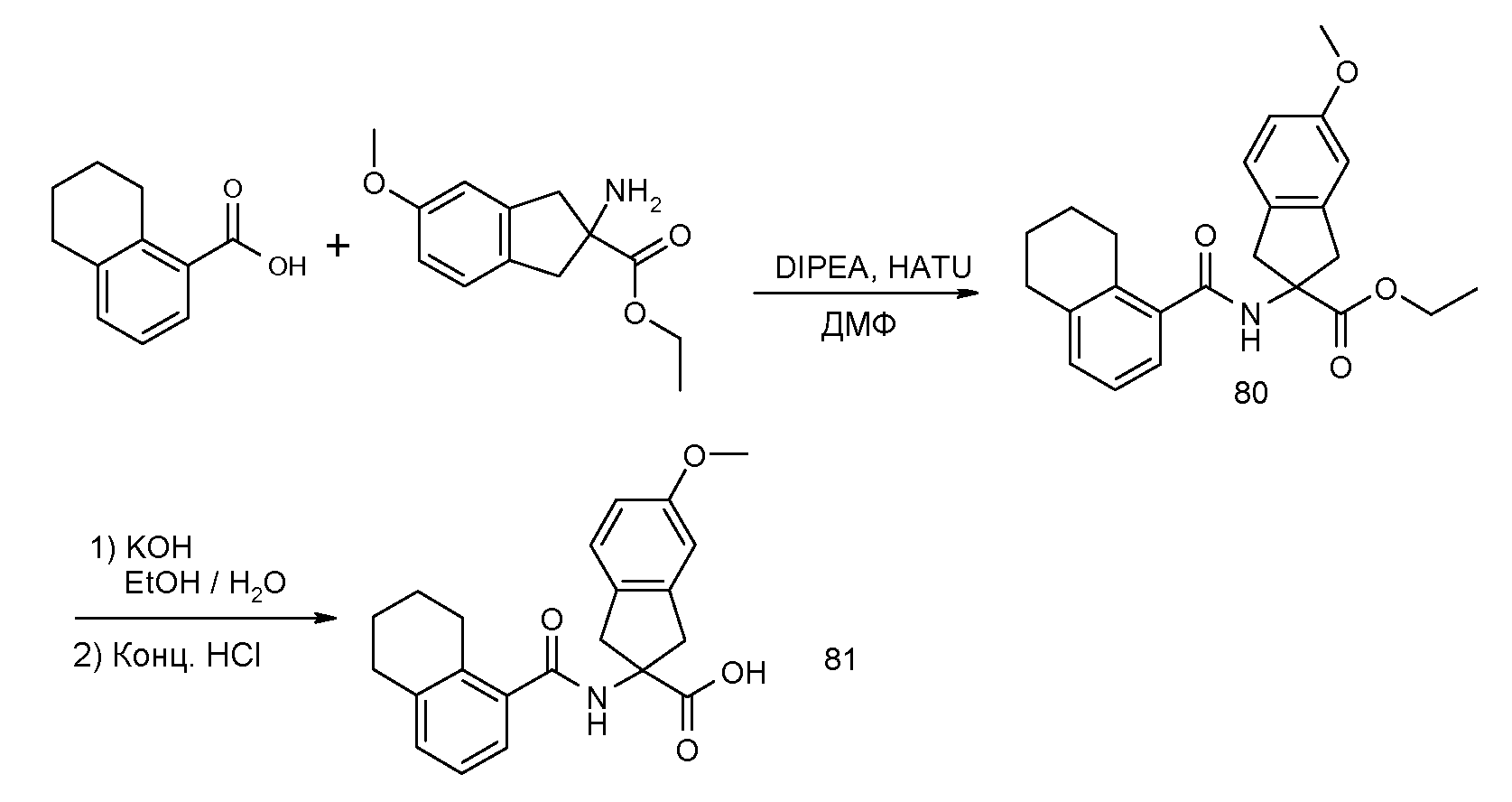
Этиловый эфир 5-метокси-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (80):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (400 мг, 2,27 ммоль), этилового эфира 2-амино-5-метоксииндан-2-карбоновой кислоты (639 мг, 2,72 ммоль) и HATU (1,3 г, 3,41 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (563 мкл, 3,41 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (52) в виде твердого вещества белого цвета (622 мг, 70%).
1Н ЯМР (CDCl3, 300МГц): δ 1,28 (т, 3H), 1,74 (м, 4H), 2,75 (уш.с, 2H), 2,84 (уш.с, 2H), 3,27 (дд, 2H), 3,69 (дд, 2H), 3,78 (с, 3H), 4,25 (кв, 2H), 6,26 (с, 1H), 6,72-6,76 (м, 2H), 7,01-7,11 (м, 4H)
ЖХ/МС (ES+) m/z=394,21
ПРИМЕР 81
5-Метокси-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (81):
Смесь этилового эфира 5-метокси-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (80) (458 мг, 1,2 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (81) в виде твердого вещества бледно-коричневого цвета (448 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,72 (м, 4H), 2,75-2,78 (м, 4H), 3,32 (дд, 2H), 3,78 (дд, 2H), 3,78 (с, 3H), 6,45 (с, 1H), 6,73-6,77 (м, 2H), 7,03-7,11 (м, 4H)
ЖХ/МС (ES+) m/z=366,20
ПРИМЕР 82
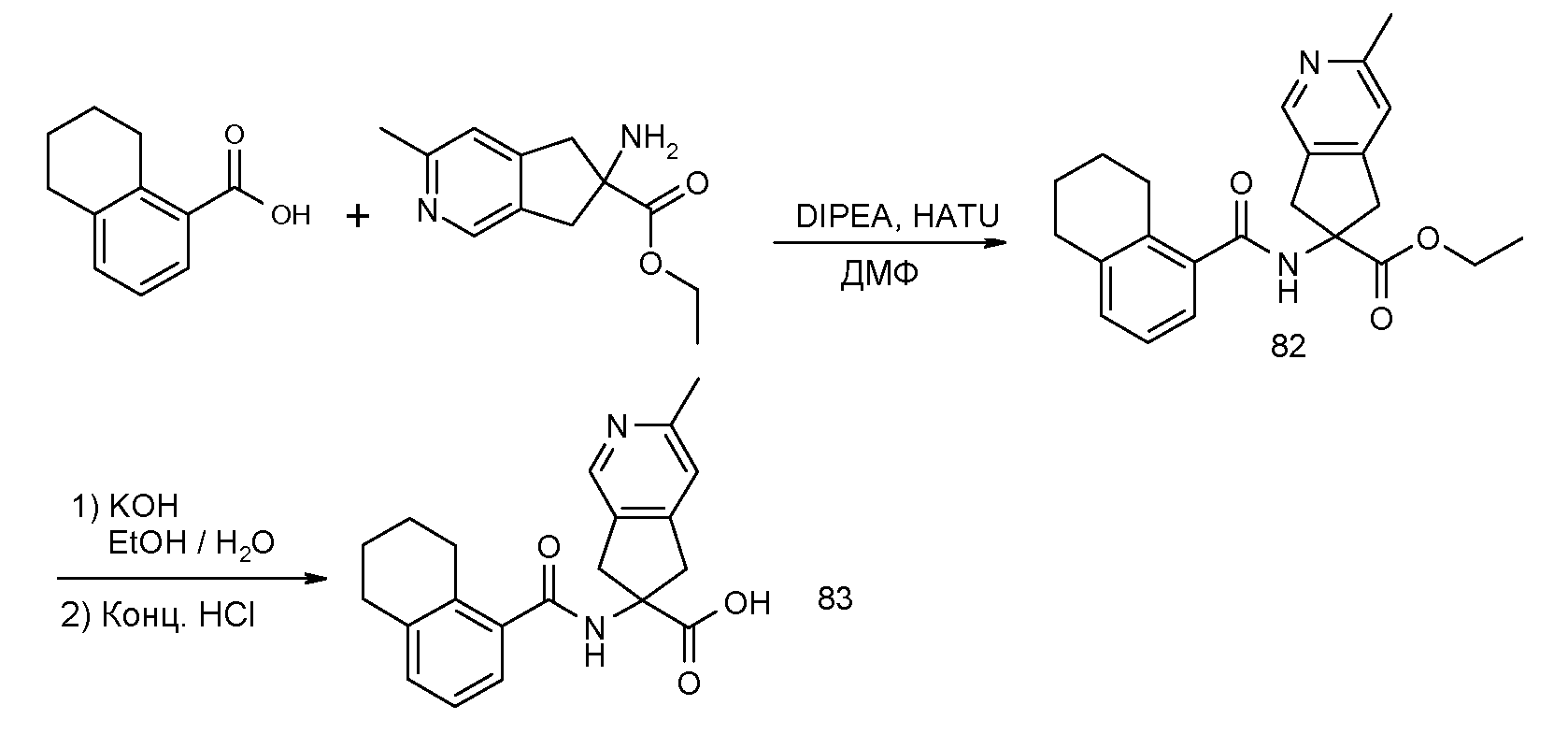
Этиловый эфир 3-метил-6-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-6,7-дигидро-5H-[2]пириндин-6-карбоновой кислоты (82):
К раствору 1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (240 мг, 1,36 ммоль), этилового эфира 6-амино-3-метил-6,7-дигидро-5H-[2]пириндин-6-карбоновой кислоты (неочищенного, 300 мг, 1,36 ммоль) и HATU (608 мг, 1,60 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (264 мкл, 1,60 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (40 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением продукта (82) в виде бесцветного масла (100 мг, 19%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 1,75 (уш.с, 4H), 2,76 (уш.с, 2H), 3,68 (с, 2H), 3,86 (кв, 2H), 4,26 (кв, 2H), 7,02-7,12 (м, 3H), 7,32 (с, 1H), 7,52 (с, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=379,22
ПРИМЕР 83
3-Метил-6-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-6,7-дигидро-5H-[2]пириндин-6-карбоновая кислота (83):
Смесь этилового эфира 3-метил-6-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-6,7-дигидро-5H-[2]пириндин-6-карбоновой кислоты (82) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (5 мл) и воде (0,3 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl по каплям до прекращения выделения из воды осадка. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (83) в виде бесцветного масла (20 мг, 22%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,77 (уш.с, 4H), 2,79 (уш.с, 2H), 3,69 (м, 2H), 3,88 (кв, 2H), 7,06-7,15 (м, 3H), 7,53 (с, 1H), 8,56 (с, 1H)
ЖХ/МС (ES+) m/z=351,11
ПРИМЕР 84
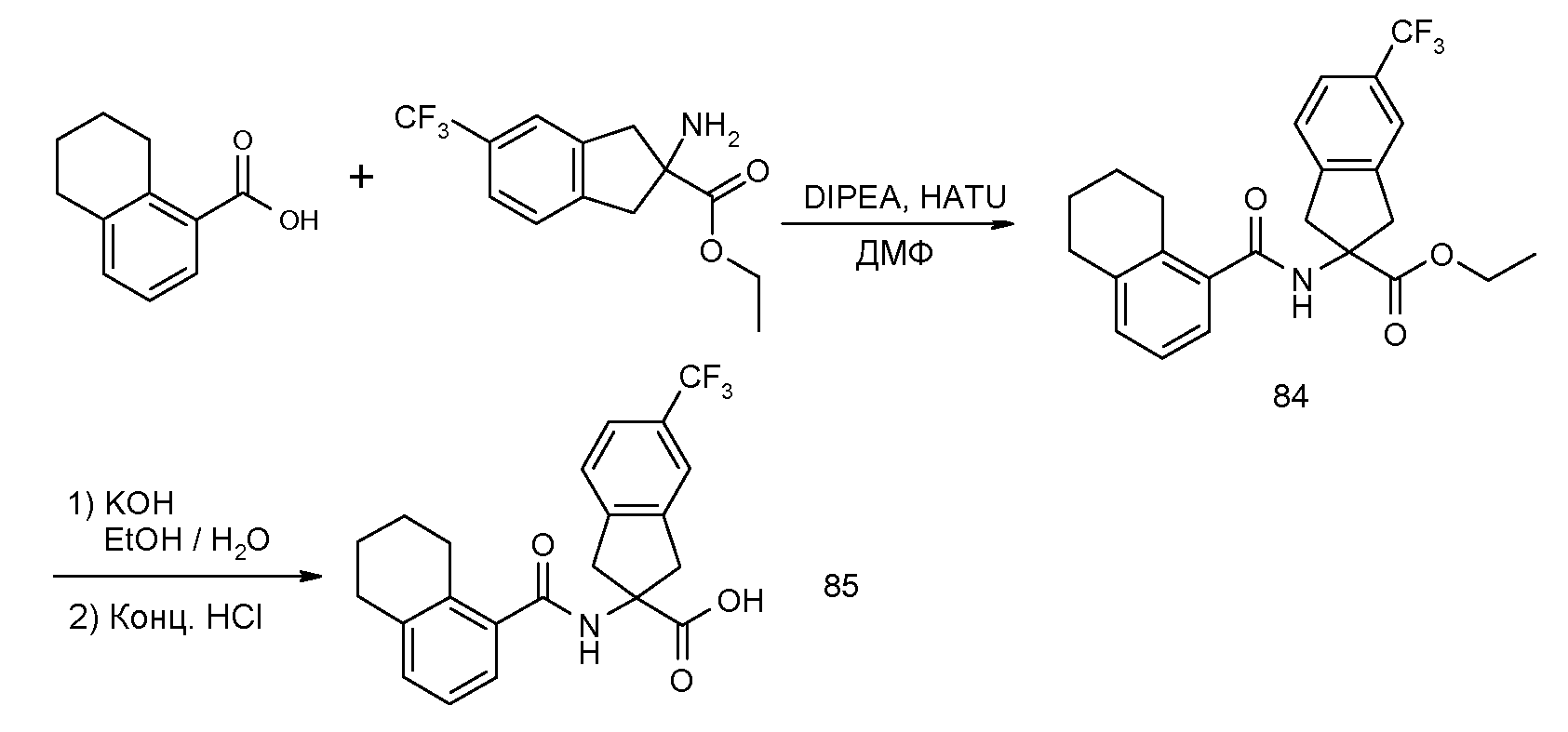
Этиловый эфир 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5-трифторметилиндан-2-карбоновой кислоты (84):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (306 мг, 1,74 ммоль), этилового эфира 2-амино-5-трифториндан-2-карбоновой кислоты (583 мг, 2,13 ммоль) и HATU (992 мг, 2,61 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (431 мкл, 2,61 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (80 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-70% EtOAc в гептане) с получением чистого продукта (84) в виде твердого вещества белого цвета (589 мг, 78%).
1Н ЯМР (CDCl3, 300МГц): δ 1,27 (т, 3H), 1,75 (м, 4H), 2,76 (уш.с, 2H), 2,83 (уш.с, 2H), 3,44 (дд, 2H), 3,74 (дд, 2H), 4,26 (кв, 2H), 6,35 (с, 1H), 7,02-7,12 (м, 3H), 7,32 (д, 1H), 7,46 (уш.с, 2H)
ЖХ/МС (ES+) m/z=432,17
ПРИМЕР 85
2-[(5,6,7,8-Тетрагидронафталин-1-карбонил)амино]-5-трифторметилиндан-2-карбоновая кислота (85):
Смесь этилового эфира 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-5-трифторметилиндан-2-карбоновой кислоты (84) (437 мг, 1,0 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (50 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (85) в виде твердого вещества белого цвета (408 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,74 (м, 4H), 2,78 (м, 4H), 3,49 (дд, 2H), 3,76 (дд, 2H), 6,69 (с, 1H), 7,03-7,13 (м, 3H), 7,32 (д, 1H), 7,47 (дд, 2H)
ЖХ/МС (ES+) m/z=404,15
ПРИМЕР 86
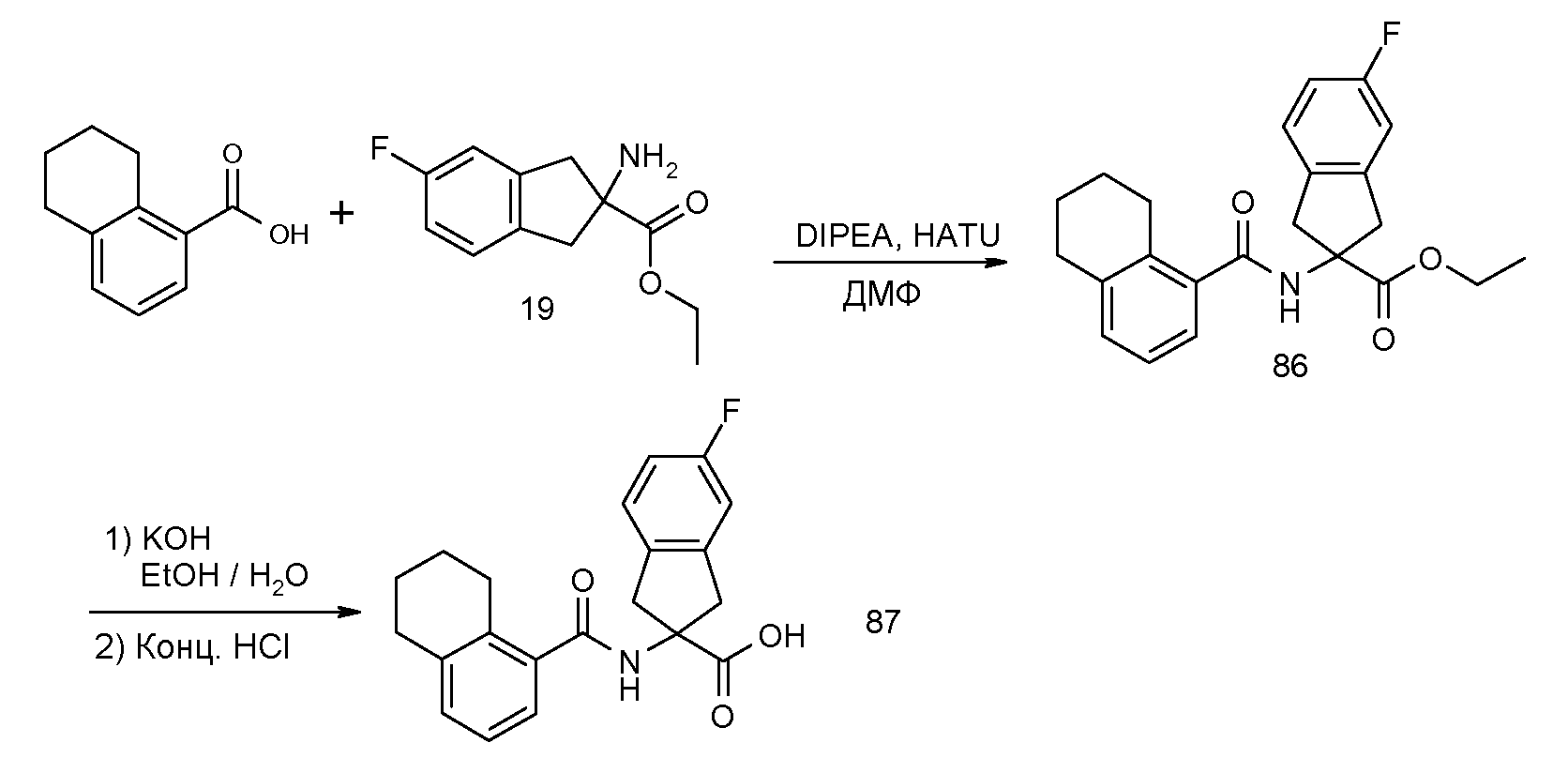
Этиловый эфир 5-фтор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (86):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (400 мг, 2,27 ммоль), этилового эфира 2-амино-5-фториндан-2-карбоновой кислоты (610 мг, 2,72 ммоль) и HATU (1,30 г, 3,41 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (563 мкл, 3,41 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (70 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (86) в виде твердого вещества белого цвета (345 мг, 40%).
1Н ЯМР (CDCl3, 300МГц): δ 1,28 (т, 3H), 1,75 (м, 4H), 2,76 (уш.с, 2H), 2,83 (уш.с, 2H), 3,33 (дд, 2H), 3,69 (дд, 2H), 4,25 (кв, 2H), 6,29 (с, 1H), 6,85-6,93 (м, 2H), 7,02-7,16 (м, 4H)
ЖХ/МС (ES+) m/z=382,16
ПРИМЕР 87
5-Фтор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (87):
Смесь этилового эфира 5-фтор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (86) (190 мг, 0,50 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (87) в виде твердого вещества бледно-коричневого цвета (178 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,75 (м, 4H), 2,76-2,81 (м, 4H), 3,40 (дд, 2H), 3,72 (дд, 2H), 6,65 (с, 1H), 6,86-6,94 (м, 2H), 7,03-7,18 (м, 4H)
ЖХ/МС (ES+) m/z=382,16
ПРИМЕР 88
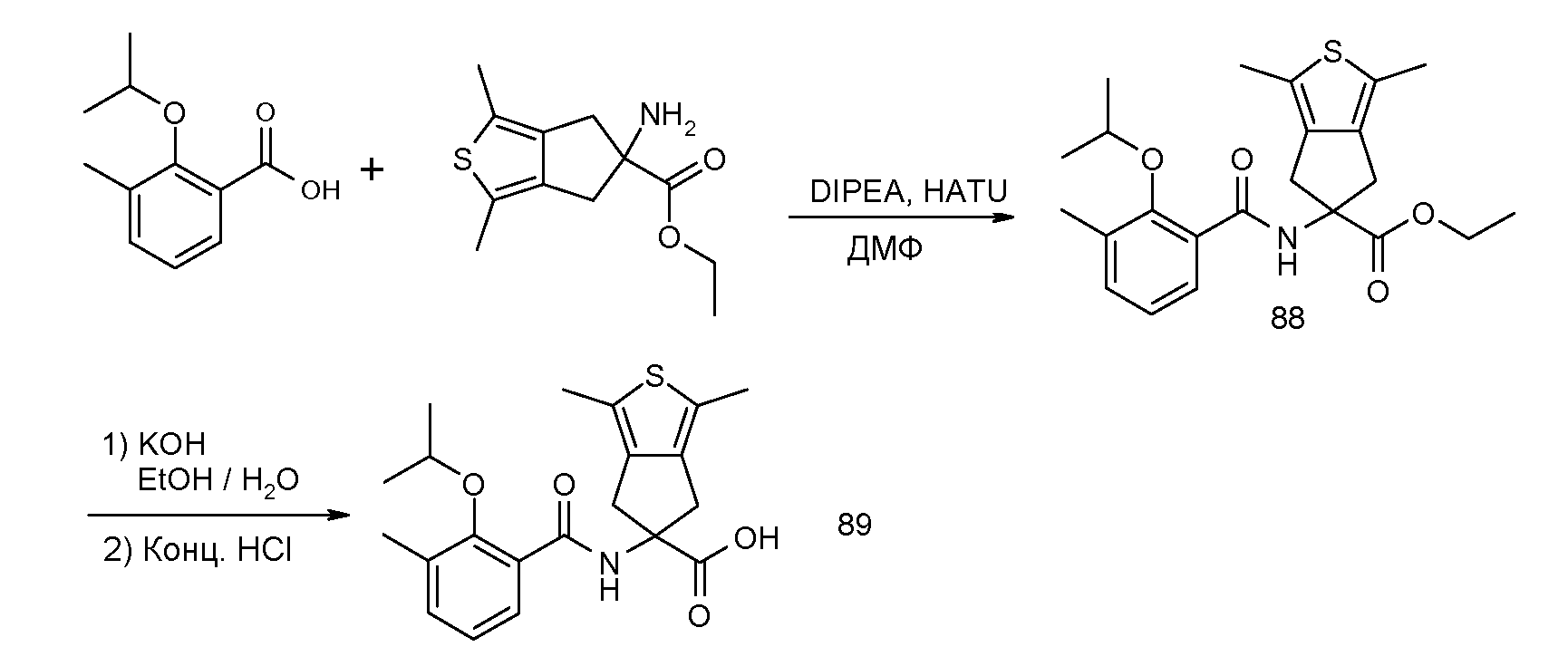
Этиловый эфир 5-(2-изопропокси-3-метилбензоиламино)-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (88):
К раствору 2-изопропокси-3-метилбензойной кислоты (300 мг, 1,54 ммоль), этилового эфира 5-амино-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (443 мг, 1,85 ммоль) и HATU (878 мг, 2,31 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (382 мкл, 2,31 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (70 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (88) в виде твердого вещества бледно-желтого цвета (599 мг, 95%).
1Н ЯМР (CDCl3, 300МГц): δ 1,09 (д, 6H), 1,23 (т, 3H), 2,25 (с, 6H), 2,28 (с, 3H), 2,98 (д, 2H), 3,33 (д, 2H), 4,20-4,24 (м, 3H), 7,08 (т, 1H), 7,28 (д, 1H), 7,87 (д, 1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=416,17
ПРИМЕР 89
5-(2-Изопропокси-3-метилбензоиламино)-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновая кислота (89):
Смесь этилового эфира 5-(2-изопропокси-3-метилбензоиламино)-1,3-диметил-5,6-дигидро-4H-циклопента[c]тиофен-5-карбоновой кислоты (88) (448 мг, 1,08 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (89) в виде твердого вещества коричневого цвета (360 мг, 86%).
1Н ЯМР (CDCl3, 300МГц): δ 1,06 (д, 6H), 2,26 (с, 6H), 2,28 (с, 3H), 3,09 (д, 2H), 3,43 (д, 2H), 4,17 (м, 1H), 7,12 (т, 1H), 7,32 (д, 1H), 7,91 (д, 1H), 8,61 (с, 1H)
ЖХ/МС (ES+) m/z=388,14
ПРИМЕР 90
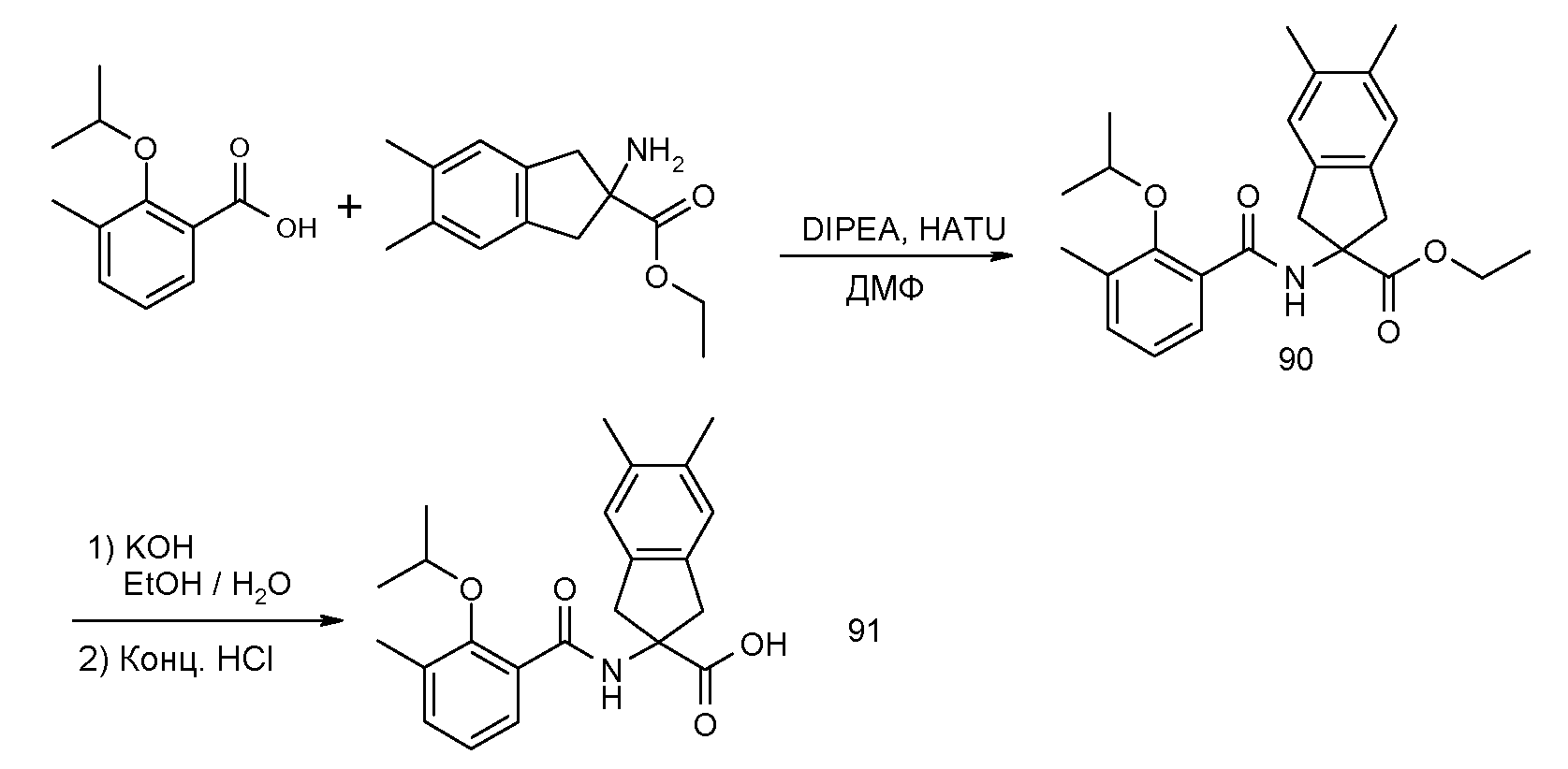
Этиловый эфир 2-(2-изопропокси-3-метилбензоиламино)-5,6-диметилиндан-2-карбоновой кислоты (90):
К раствору 2-изопропокси-3-метилбензойной кислоты (300 мг, 1,54 ммоль), этилового эфира 2-амино-5,6-диметилиндан-2-карбоновой кислоты (432 мг, 1,85 ммоль) и HATU (878 мг, 2,31 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (382 мкл, 2,31 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5-40% EtOAc в гептане) с получением чистого продукта (90) в виде твердого вещества белого цвета (591 мг, 94%).
1Н ЯМР (CDCl3, 300МГц): δ 1,08 (д, 6H), 1,24 (т, 3H), 2,22 (с, 6H), 2,24 (с, 3H), 3,25 (д, 2H), 3,70 (д, 2H), 4,20-4,28 (м, 3H), 7,00-7,08 (м, 3H), 7,24 (д, 1H), 7,83 (д, 1H), 8,27 (с, 1H)
ЖХ/МС (ES+) m/z=410,21
ПРИМЕР 91
2-(2-Изопропокси-3-метилбензоиламино)-5,6-диметилиндан-2-карбоновая кислота (91):
Смесь этилового эфира 2-(2-изопропокси-3-метилбензоиламино)-5,6-диметилиндан-2-карбоновой кислоты (90) (440 мг, 1,07 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (91) в виде твердого вещества бледно-коричневого цвета (374 мг, 92%).
1Н ЯМР (CDCl3, 300МГц): δ 1,02 (д, 6H), 2,22 (с, 6H), 2,25 (с, 3H), 3,34 (д, 2H), 3,80 (д, 2H), 4,14 (м, 1H), 7,01 (с, 2H), 7,09 (т, 1H), 7,29 (д, 1H), 7,87 (дд, 1H), 8,52 (с, 1H)
ЖХ/МС (ES+) m/z=382,19
ПРИМЕР 92
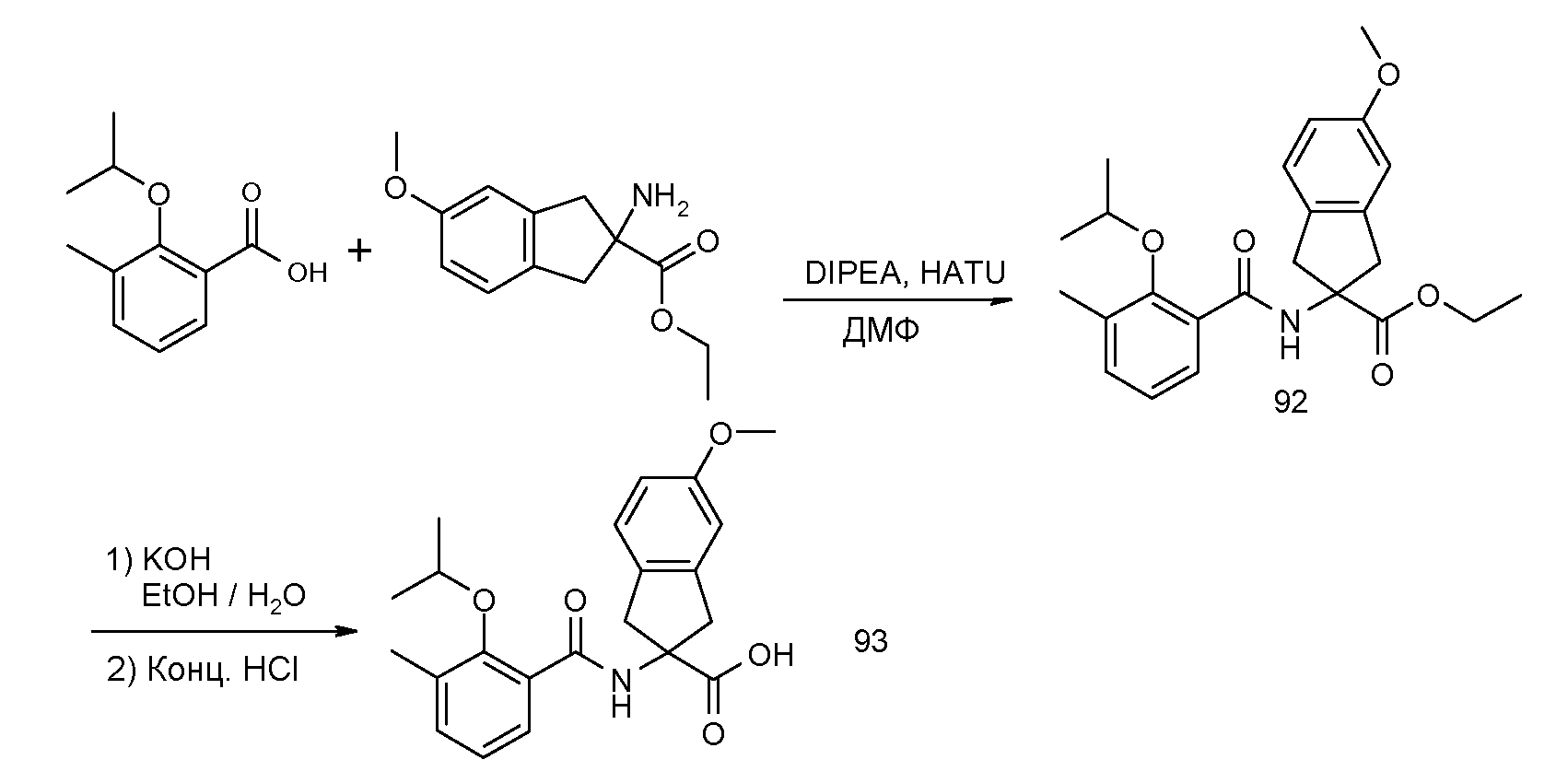
Этиловый эфир 2-(2-изопропокси-3-метилбензоиламино)-5-метоксииндан-2-карбоновой кислоты (92):
К раствору 2-изопропокси-3-метилбензойной кислоты (300 мг, 1,54 ммоль), этилового эфира 2-амино-5-метоксииндан-2-карбоновой кислоты (435 мг, 1,85 ммоль) и HATU (878 мг, 2,31 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (382 мкл, 2,31 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (92) в виде масла бледно-желтого цвета (569 мг, 90%).
1Н ЯМР (CDCl3, 300МГц): δ 1,07 (д, 6H), 1,24 (т, 3H), 2,25 (с, 3H), 3,28 (д, 2H), 3,72 (дд, 2H), 3,78 (с, 3H), 4,21-4,25 (м, 3H), 6,73-6,78 (м, 2H), 7,04-7,13 (м, 2H), 7,26 (д, 1H), 7,85 (д, 1H), 8,32 (с, 1H)
ЖХ/МС (ES+) m/z=412,18
ПРИМЕР 93
2-(2-Изопропокси-3-метилбензоиламино)-5-метоксииндан-2-карбоновая кислота (93):
Смесь этилового эфира 2-(2-изопропокси-3-метилбензоиламино)-5-метоксииндан-2-карбоновой кислоты (92) (410 мг, 1 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (93) в виде твердого вещества белого цвета (400 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,02 (м, 6H), 2,25 (с, 3H), 3,34 (д, 2H), 3,78 (с, 3H), 3,80 (дд, 2H), 4,16 (м, 1H), 6,73-6,78 (м, 2H), 7,05-7,14 (м, 2H), 7,27-7,30 (м, 1H), 7,88 (дд, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=384,17
ПРИМЕР 94
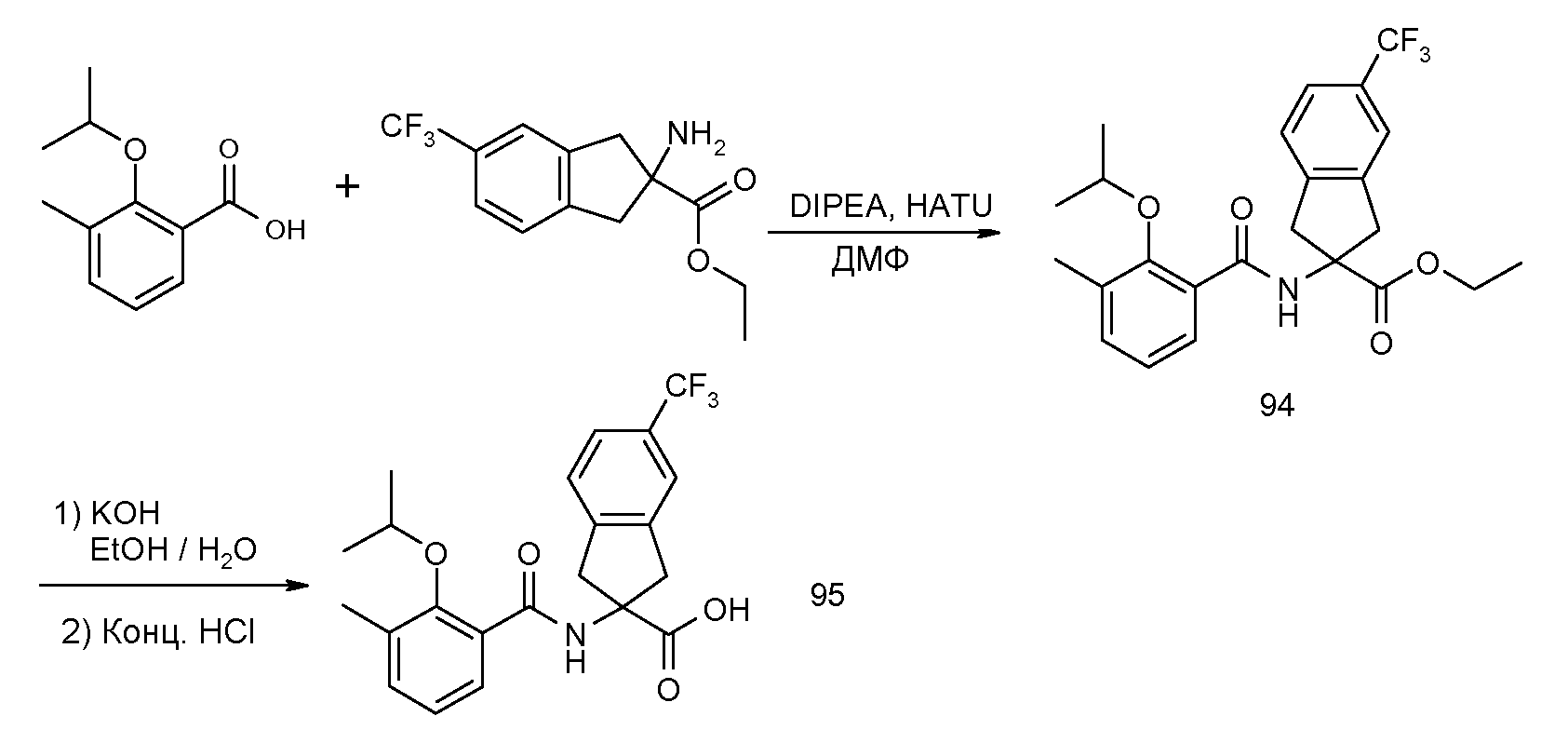
Этиловый эфир 2-(2-изопропокси-3-метилбензоиламино)-5-трифторметилиндан-2-карбоновой кислоты (94):
К раствору 2-изопропокси-3-метилбензойной кислоты (377 мг, 1,94 ммоль), этилового эфира 2-амино-5-трифториндан-2-карбоновой кислоты (650 мг, 2,38 ммоль) и HATU (1,11 г, 2,91 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (480 мкл, 2,91 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-70% EtOAc в гептане) с получением чистого продукта (94) в виде твердого вещества белого цвета (842 мг, 97%).
1Н ЯМР (CDCl3, 300МГц): δ 1,06 (д, 6H), 1,24 (т, 3H), 2,26 (с, 3H), 3,43 (д, 2H), 3,78 (дд, 2H), 4,16-4,29 (м, 1H), 4,25 (кв, 2H), 7,08 (т, 1H), 7,26-7,35 (м, 2H), 7,47 (д, 2H), 7,85 (дд, 1H), 8,39 (с, 1H)
ЖХ/МС (ES+) m/z=450,18
ПРИМЕР 95
2-(2-Изопропокси-3-метилбензоиламино)-5-трифторметилиндан-2-карбоновая кислота (95):
Смесь этилового эфира 2-(2-изопропокси-3-метилбензоиламино)-5-трифторметилиндан-2-карбоновой кислоты (94) (690 мг, 1,5 ммоль) и KOH (1,5 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH. Полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до pH~4. Осадок фильтруют с получением чистого продукта (95) в виде твердого вещества бледно-коричневого цвета (495 мг, 78%).
1Н ЯМР (CDCl3, 300МГц): δ 0,99 (д, 6H), 2,25 (с, 3H), 3,48 (д, 2H), 3,89 (д, 2H), 4,15 (м, 1H), 7,10 (т, 1H), 7,29-7,37 (м, 2H), 7,49 (д, 2H), 7,88 (дд, 1H), 8,57 (с, 1H)
ЖХ/МС (ES+) m/z=422,15
ПРИМЕР 96

Этиловый эфир 5-фтор-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (96):
К раствору 2-изопропокси-3-метилбензойной кислоты (400 мг, 2,06 ммоль), этилового эфира 2-амино-5-фториндан-2-карбоновой кислоты (554 мг, 2,47 ммоль) и HATU (1,17 г, 3,09 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (511 мкл, 3,09 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-50% EtOAc в гептане) с получением чистого продукта (96) в виде твердого вещества белого цвета (709 мг, 86%).
1Н ЯМР (CDCl3, 300МГц): δ 1,07 (м, 6H), 1,24 (т, 3H), 2,26 (с, 3H), 3,32 (т, 2H), 3,72 (дд, 2H), 4,23 (м, 3H), 6,85-6,94 (м, 2H), 7,05-7,28 ((м, 3H), 7,85 (дд, 1H), 8,36 (с, 1H)
ЖХ/МС (ES+) m/z=400,18
ПРИМЕР 97
5-Фтор-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота (97):
Смесь этилового эфира 5-фтор-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (96) (544 мг, 1,36 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (97) в виде твердого вещества белого цвета (460 мг, 91%).
1Н ЯМР (CDCl3, 300МГц): δ 1,02 (м, 6H), 2,26 (с, 3H), 3,38 (дд, 2H), 3,82 (дд, 2H), 4,16 (м, 1H), 6,87-6,95 (м, 2H), 7,07-7,31 (м, 3H), 7,88 (дд, 1H), 8,56 (с, 1H)
ЖХ/МС (ES+) m/z=372,16
ПРИМЕР 98
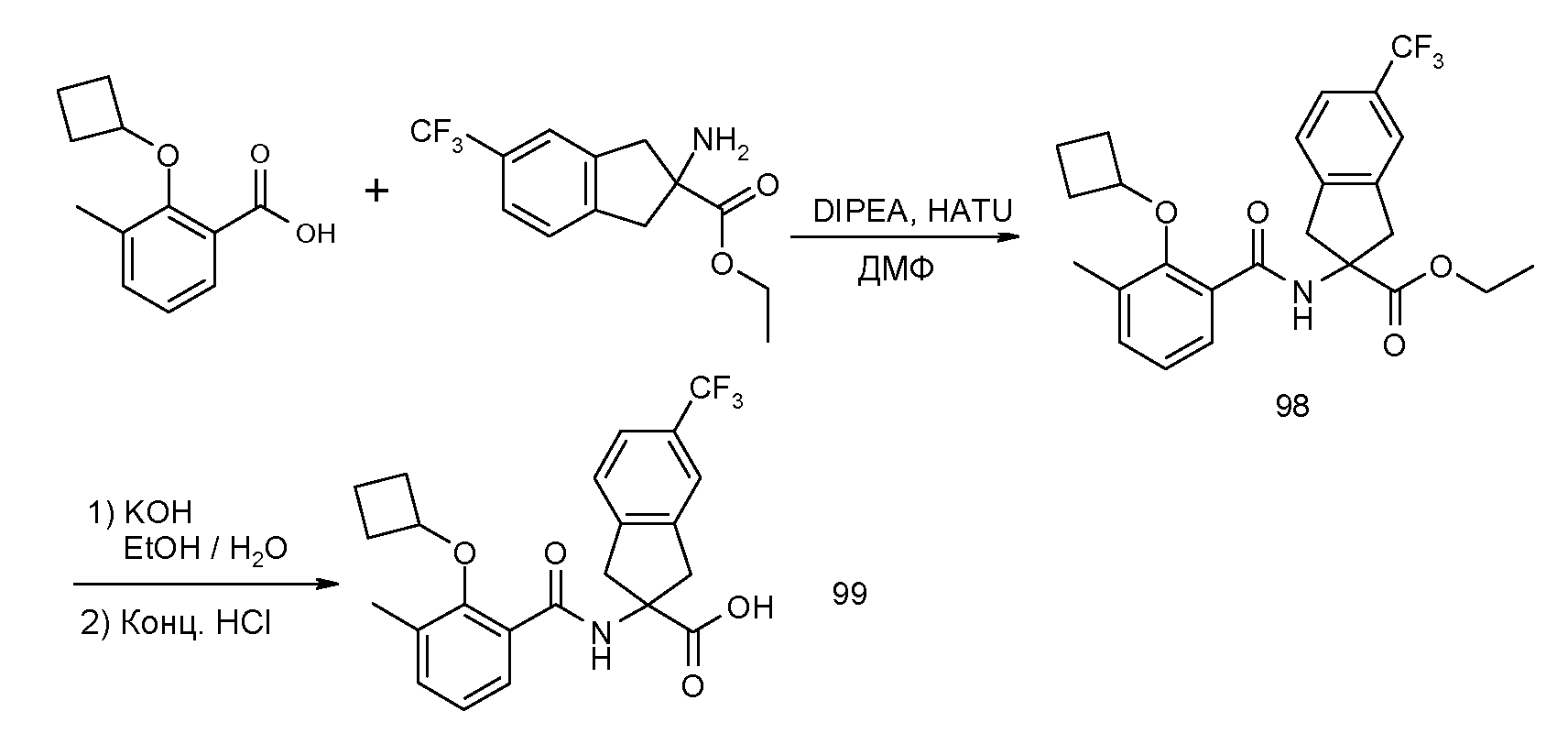
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-5-трифториндан-2-карбоновой кислоты (98):
К раствору 2-циклобутокси-3-метилбензойной кислоты (400 мг, 1,94 ммоль), этилового эфира 2-амино-5-трифториндан-2-карбоновой кислоты (650 мг, 2,38 ммоль) и HATU (1,11 г, 2,91 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (480 мкл, 2,91 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-60% EtOAc в гептане) с получением чистого продукта (98) в виде твердого вещества белого цвета (800 мг, 89%).
1Н ЯМР (CDCl3, 300МГц): δ 1,25 (т, 3H), 1,26-1,38 (м, 1H), 1,45-1,55 (м, 1H), 1,89-2,17 (с, 3H), 2,27 (с, 3H), 3,44 (дд, 2H), 3,80 (дд, 2H), 4,22-4,35 (м, 3H), 7,08 (т, 1H), 7,27 (д, 1H), 7,34 (д, 1H), 7,47 (д, 2H), 7,85 (д, 1H), 8,41 (с, 1H)
ЖХ/МС (ES+) m/z=462,18
ПРИМЕР 99
2-(2-Циклобутокси-3-метилбензоиламино)-5-трифториндан-2-карбоновая кислота (99):
Смесь этилового эфира 2-(2-циклобутокси-3-метилбензоиламино)-5-трифториндан-2-карбоновой кислоты (98) (648 мг, 1,4 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (99) в виде твердого вещества бледно-коричневого цвета (595 мг, 98%).
1Н ЯМР (CDCl3, 300МГц): δ 1,21-1,32 (м, 1H), 1,41-1,51 (м, 1H), 1,85-2,08 (с, 3H), 2,25 (с, 3H), 3,48 (дд, 2H), 3,89 (дд, 2H), 4,26 (м, 1H), 7,09 (т, 1H), 7,26-7,36 (м, 2H), 7,49 (д, 2H), 7,87 (дд, 1H), 8,55 (с, 1H)
ЖХ/МС (ES+) m/z=434,16
ПРИМЕР 100
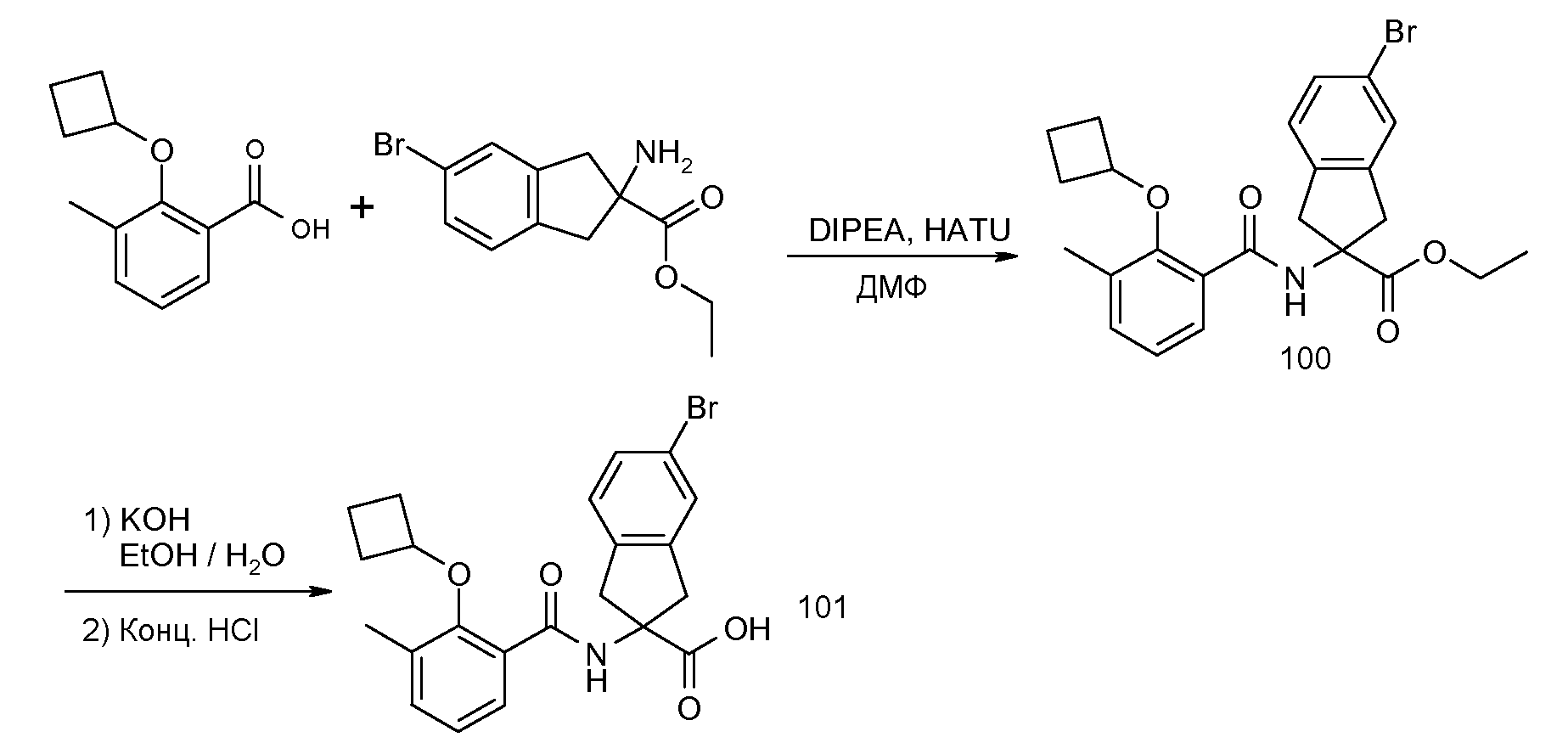
Этиловый эфир 5-бром-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (100):
К раствору 2-циклобутокси-3-метилбензойной кислоты (250 мг, 1,21 ммоль), этилового эфира 2-амино-5-броминдан-2-карбоновой кислоты (344 мг, 1,21 ммоль) и HATU (551 мг, 1,45 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (240 мкл, 1,45 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-70% EtOAc в гептане) с получением чистого продукта (100) в виде бесцветного масла (520 мг, 91%).
1Н ЯМР (CDCl3, 300МГц): δ 1,22-1,40 (м, 4H), 1,48-1,63 (м, 1H), 1,90-2,12 (м, 4H), 2,27 (с, 3H), 3,44 (дд, 2H), 3,72 (дд, 2H), 4,21-4,35 (м, 3H), 7,05-7,12 (м, 2H), 7,26-7,27 (м, 3H), 7,85 (дд, 1H), 8,38 (с, 1H)
ЖХ/МС (ES+) m/z=472,14, 474,13
ПРИМЕР 101
5-Бром-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (101):
Смесь этилового эфира 5-бром-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (100) (442 мг, 0,94 ммоль) и KOH (700 мг, 12 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (101) в виде твердого вещества белого цвета (390 мг, 93%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (м, 1H), 1,49 (м, 1H), 1,83-2,00 (м, 4H), 2,22 (с, 3H), 3,31-3,61 (м, 4H), 4,33 (м, 1H), 7,04 (т, 1H), 7,21 (д, 1H), 7,28-7,37 (м, 3H), 7,46 (с, 1H), 8,67 (с, 1H), 12,65 (с, 1H)
ЖХ/МС (ES+) m/z=444,07, 446,06
ПРИМЕР 102
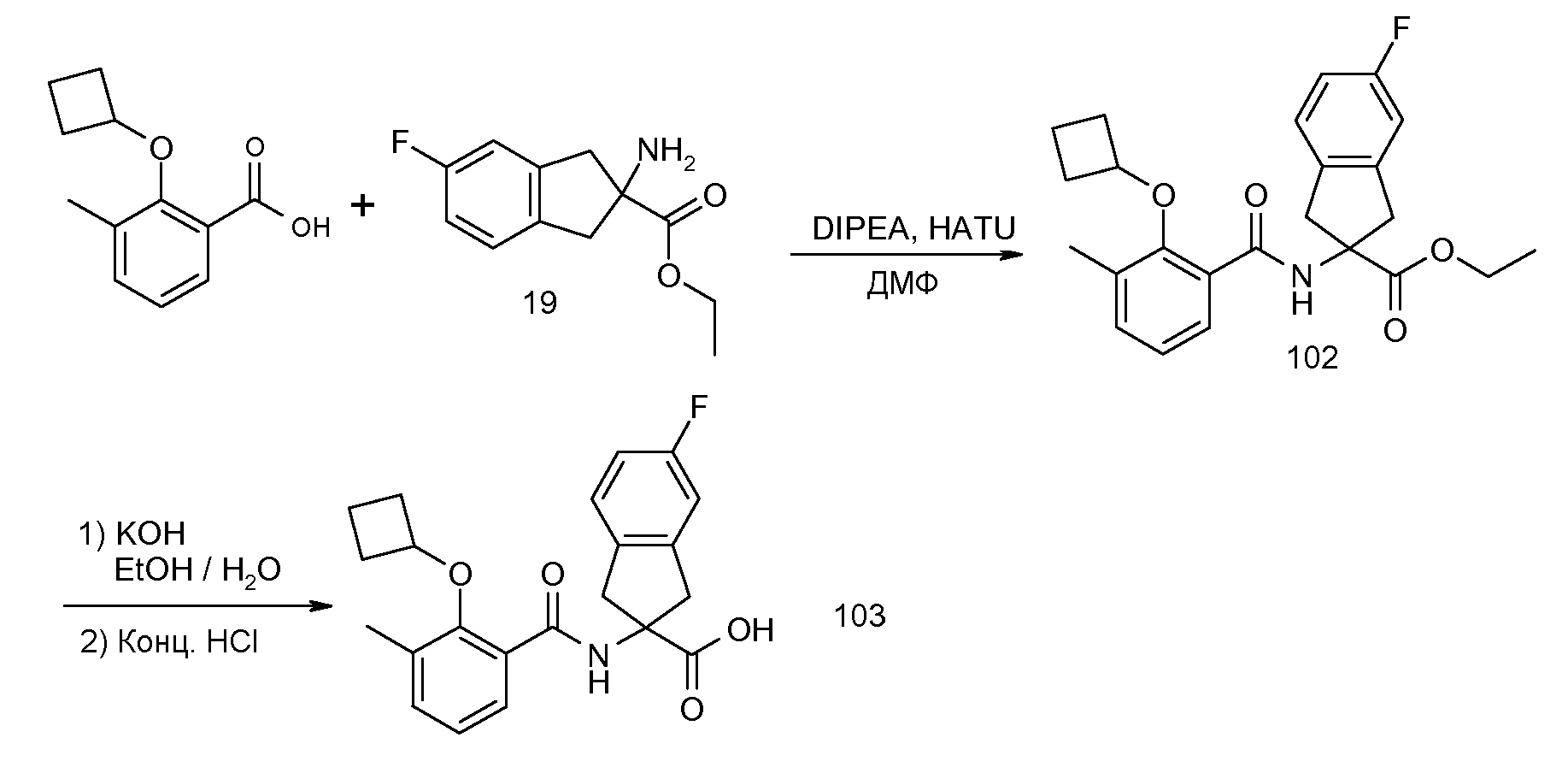
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (102):
К раствору 2-циклобутокси-3-метилбензойной кислоты (400 мг, 1,94 ммоль), этилового эфира 2-амино-5-фториндан-2-карбоновой кислоты (523 мг, 2,33 ммоль) и HATU (1,11 г, 2,91 ммоль) в безводном ДМФА (18 мл) добавляют DIPEA (480 мкл, 2,91 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 5%-40% EtOAc в гептане) с получением чистого продукта (102) в виде твердого вещества белого цвета (681 мг, 85%).
1Н ЯМР (CDCl3, 300МГц): δ 1,21-1,36 (м, 4H), 1,50-1,56 (м, 1H), 1,96-2,09 (м, 4H), 2,27 (с, 3H), 3,44 (т, 2H), 3,73 (дд, 2H), 4,21-4,33 (м, 3H), 6,85-6,94 (м, 2H), 7,08 (т, 1H), 7,14-7,19 (м, 1H), 7,27 (д, 1H), 7,85 (дд, 1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=412,19
ПРИМЕР 103
2-(2-Циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота (103):
Смесь этилового эфира 2-(2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (102) (510 мг, 1,24 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (103) в виде твердого вещества белого цвета (469 мг, 99%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,21-1,36 (м, 1H), 1,50 (м, 1H), 1,92-2,14 (м, 4H), 2,26 (с, 3H), 3,38 (т, 2H), 3,73 (дд, 2H), 4,29 (м, 1H), 6,86-6,95 (м, 2H), 7,11 (т, 1H), 7,15-7,20 (м, 1H), 7,29 (д, 1H), 7,83 (дд, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=384,15
ПРИМЕР 104
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-5,6-дифториндан-2-карбоновой кислоты (104):
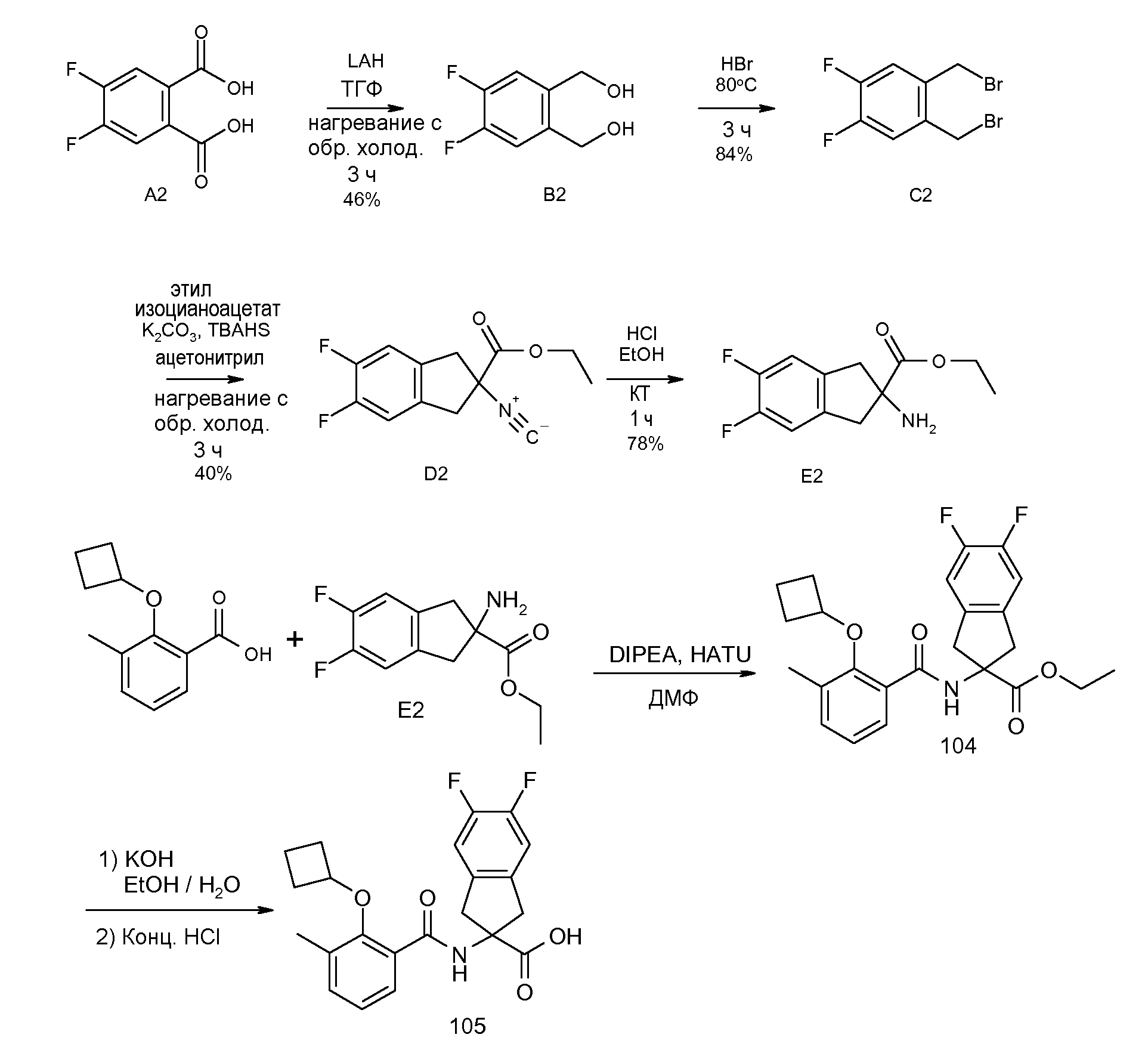
Получение соединения B2: К суспензии LAH (375 мг, 9,9 ммоль) в ТГФ (5 мл) добавляют по каплям раствор 4,5-дифторфталевой кислоты A2 (1 г, 4,95 ммоль) в ТГФ (15 мл) при 0°C. Полученную смесь нагревают при кипении с обратным холодильником в течение 3 часов, после чего ее охлаждают до 0°C и гасят постепенным добавлением EtOAc. Реакционную массу фильтруют через слой целита и фильтрующий слой промывают метанолом. Объединенный фильтрат концентрируют с получением неочищенного продукт, который очищают на силикагеле, элюируя 5% MeOH в DCM, с получением соединения B2 (400 мг, 46%).
1H-ЯМР (400 МГц, CDCl3): 4,69 (с, 4H), 7,19 (т, J=9,2 и 2 Гц, 2H); FIA-MS: m/z 173 (M+H)
Получение соединения C2: Перемешиваемую суспензию соединения B2 (1 г, 5,74 ммоль) в водном растворе HBr (47%, 10 мл) перемешивают при 80°C в течение 3 часов. Ход реакции контролируют при помощи ТСХ. После использования всего количества исходного продукта реакционную смесь охлаждают до комнатной температуры и экстрагируют с помощью DCM. Объединенные органические слои промывают насыщенным раствором соли, сушат и концентрируют с получением соединения C2 (1,4 г, 84%). Дибромид является довольно нестабильным, в связи с чем его немедленно используют на следующей стадии.
1H-ЯМР (400 МГц, CDCl3): 4,59 (с, 4H), 7,19 (т, J=9 и 2 Гц, 2H); FIA-MS: m/z 201 (M+H)
Получение соединения D2: Смесь дибромида C2 (5,5 г, 18,33 ммоль), этилцианоацетата (2,07 г, 18,33 ммоль), K2CO3 (14 г, 106,3 ммоль) и гидросульфата тетрабутиламмония (1,8 г, 5,33 ммоль) в CH3CN (150 мл) нагревают при кипении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют. Остаток растворяют в эфире, промывают водой, насыщенным раствором соли, сушат и концентрируют с получением вязкой массы, которую очищают на силикагеле, элюируя 10% EtOAc в гексане, с получением соединения D2 (1,8 г, 40%).
1H-ЯМР (400 МГц, CDCl3): 1,32 (т, J=7,2 и 3 Гц, 3H), 3,40 (д, J=16,3 Гц, 2H), 3,60 (д, J=16,3 Гц, 2H), 4,30 (кв, J=7,2 и 2 Гц, 2H), 7,04 (т, J=8,6 и 2 Гц, 2H)
Получение соединения E2: К перемешиваемому раствору соединения D2 (2 г, 7,96 ммоль) в EtOH (50 мл) добавляют концентрированную HCl (1 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют, разбавляют водой и экстрагируют эфиром. Органический слой отбрасывают, а водный слой доводят до pH 9-10 при помощи водного раствора аммиака, поддерживая внутреннюю температуру ниже 10°C. Полученный раствор экстрагируют EtOAc (3×50 мл). Объединенные органические слои промывают водой, насыщенным раствором соли, сушат и концентрируют с получением вязкой массы, которую очищают на силикагеле, элюируя 10% EtOAc в гексане, с получением соединения E2 (1,5 г, 78%) в виде твердого вещества не совсем белого цвета с т.пл. 69-71°C.
1H-ЯМР (400 МГц, CDCl3): 1,26 (т, J=7,1 и 3 Гц, 3H), 2,80 (д, J=15,9 Гц, 2H), 4,22 (кв, J=7,1 Гц, 2H), 6,99 (т, J=8,8 и 2 Гц, 2H), 13C-ЯМР (100 МГц, CDCl3): 175,7, 150,7, 150,5, 148,2, 148,1, 136,3, 136,26, 136,22, 113,24, 113,17, 113,11, 113,05, 65,2, 61,2, 45,2, 13,8; FIA-MS: m/z 242 (M+H); чистота по ВЭЖХ: 94,28% (качественная)
Получение соединения 104:
К раствору 2-циклобутокси-3-метилбензойной кислоты (250 мг, 1,21 ммоль), этилового эфира 2-амино-5,6-дифториндан-2-карбоновой кислоты E2 (292 мг, 1,21 ммоль) и HATU (551 мг, 1,45 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (240 мкл, 1,45 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (50 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10%-70% EtOAc в гептане) с получением чистого продукта (104A) в виде твердого вещества белого цвета (420 мг, 81%).
1Н ЯМР (CDCl3, 300МГц): δ 1,25 (т, 3H), 1,30-1,41 (м, 1H), 1,52-1,62 (м, 1H), 1,96-2,16 (м, 4H), 2,28 (с, 3H), 3,34 (д, 2H), 3,70 (д, 2H), 4,21-4,39 (м, 3H), 6,99-7,11 (м, 3H), 7,28 (д, 1H), 7,85 (дд, 1H), 8,43 (с, 1H)
ЖХ/МС (ES+) m/z=430,22
ПРИМЕР 105
2-(2-Циклобутокси-3-метилбензоиламино)-5,6-дифториндан-2-карбоновая кислота (105):
Смесь этилового эфира 2-(2-циклобутокси-3-метилбензоиламино)-5,6-дифториндан-2-карбоновой кислоты (104) (367 мг, 0,85 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (105) в виде твердого вещества белого цвета (300 мг, 88%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,28 (м, 1H), 1,48 (м, 1H), 1,85-2,00 (м, 4H), 2,21 (с, 3H), 3,34 (д, 2H), 3,51 (д, 2H), 4,33 (м, 1H), 7,02 (т, 1H), 7,28-7,34 (м, 4H), 8,69 (с, 1H)
ЖХ/МС (ES+) m/z=430,22
ПРИМЕР 106
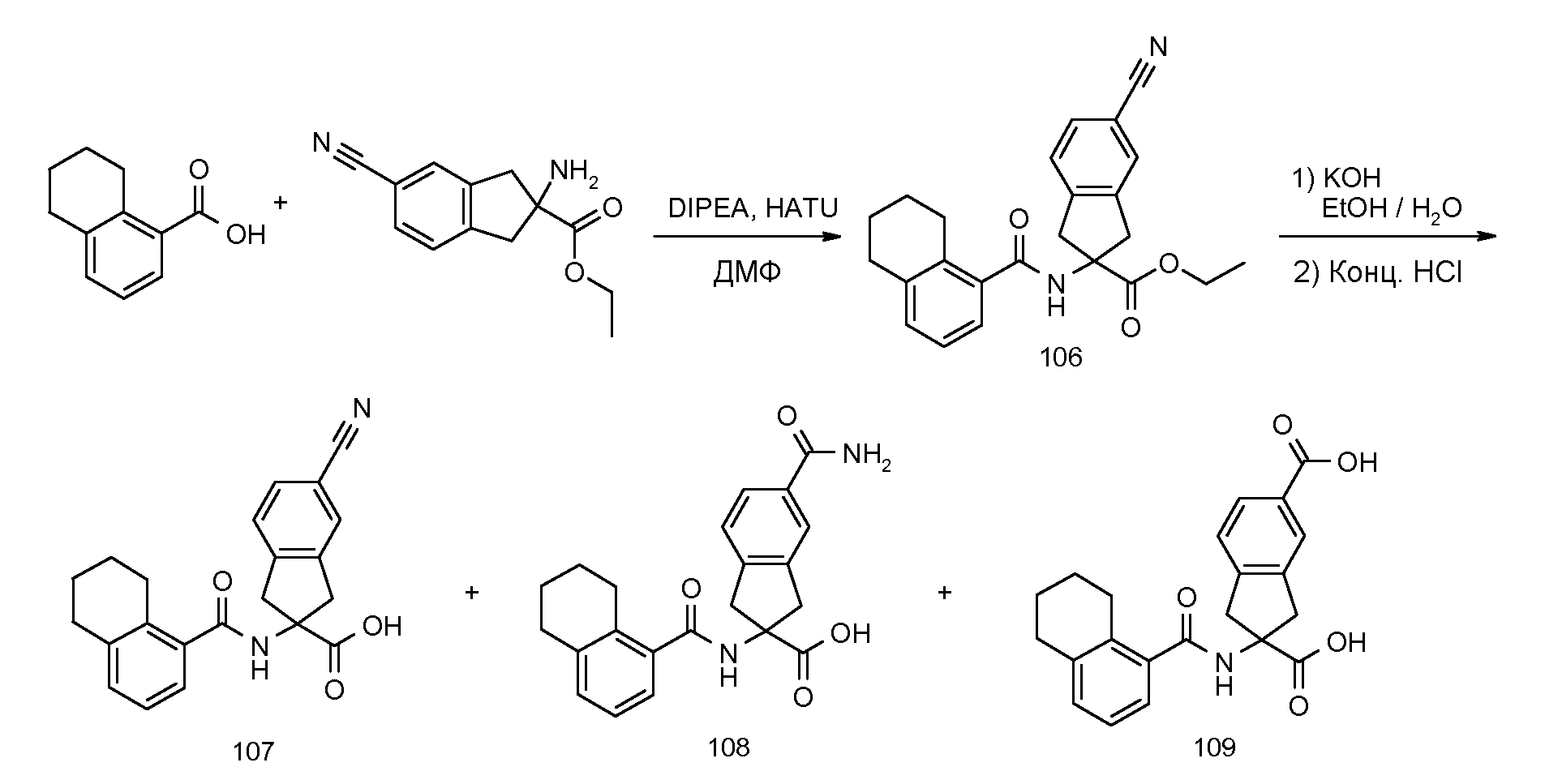
Этиловый эфир 5-циано-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (106):
К раствору 5,6,7,8-тетрагидронафталин-1-карбоновой кислоты (306 мг, 1,74 ммоль), этилового эфира 2-амино-5-цианоиндан-2-карбоновой кислоты (601 мг, 2,61 ммоль) и HATU (992 мг, 2,61 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (431 мкл, 2,61 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (70 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-80% EtOAc в гептане) с получением чистого продукта (106) в виде твердого вещества белого цвета (473 мг, 70%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 1,74 (м, 4H), 2,76 (уш.с, 2H), 2,82 (уш.с, 2H), 3,47 (дд, 2H), 3,72 (т, 2H), 4,25 (кв, 2H), 6,47 (с, 1H), 7,03-7,12 (м, 3H), 7,31 (д, 1H), 7,49 (д, 2H)
ЖХ/МС (ES+) m/z=389,18
ПРИМЕРЫ 107, 108, 109
5-Циано-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (107):
5-Карбамоил-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (108):
и 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2,5-дикарбоновая кислота (109):
Смесь этилового эфира 5-циано-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (106) (320 мг, 0,82 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH. Полученный реакционный раствор нагревают до 50°C и перемешивают при этой температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до pH~2. После фильтрования твердое вещество очищают ВЭЖХ с получением 3 чистых продуктов: (107) в виде твердого вещества белого цвета (44 мг, 15%), (108) в виде твердого вещества белого цвета (154 мг, 50%) и (109) в виде твердого вещества белого цвета (28 мг, 9%).
(107): 1H ЯМР (CD3OD, 300МГц): δ 1,75 (м, 4H), 2,77 (уш.с, 4H), 3,49 (дд, 2H), 3,75 (т, 2H), 7,04-7,12 (м, 3H), 7,41 (д, 1H), 7,54-7,59 (м, 2H), 8,87 (с, 1/3H)
ЖХ/МС (ES+) m/z=361,15
(108): 1H ЯМР (CD3OD, 300МГц): δ 1,74 (м, 4H), 2,76 (м, 4H), 3,44 (д, 2H), 3,73 (дд, 2H), 7,04-7,11 (м, 3H), 7,32 (д, 1H), 7,72 (д, 2H), 8,87 (с, 1/2H)
ЖХ/МС (ES+) m/z=379,17
(109): 1H ЯМР (CD3OD, 300МГц): δ 1,74 (м, 4H), 2,77 (м, 4H), 3,45 (дд, 2H), 3,74 (т, 2H), 7,04-7,09 (м, 3H), 7,33 (д, 1H), 7,88 (д, 2H), 8,88 (с, 1/2H)
ЖХ/МС (ES+) m/z=380,16
ПРИМЕР 110
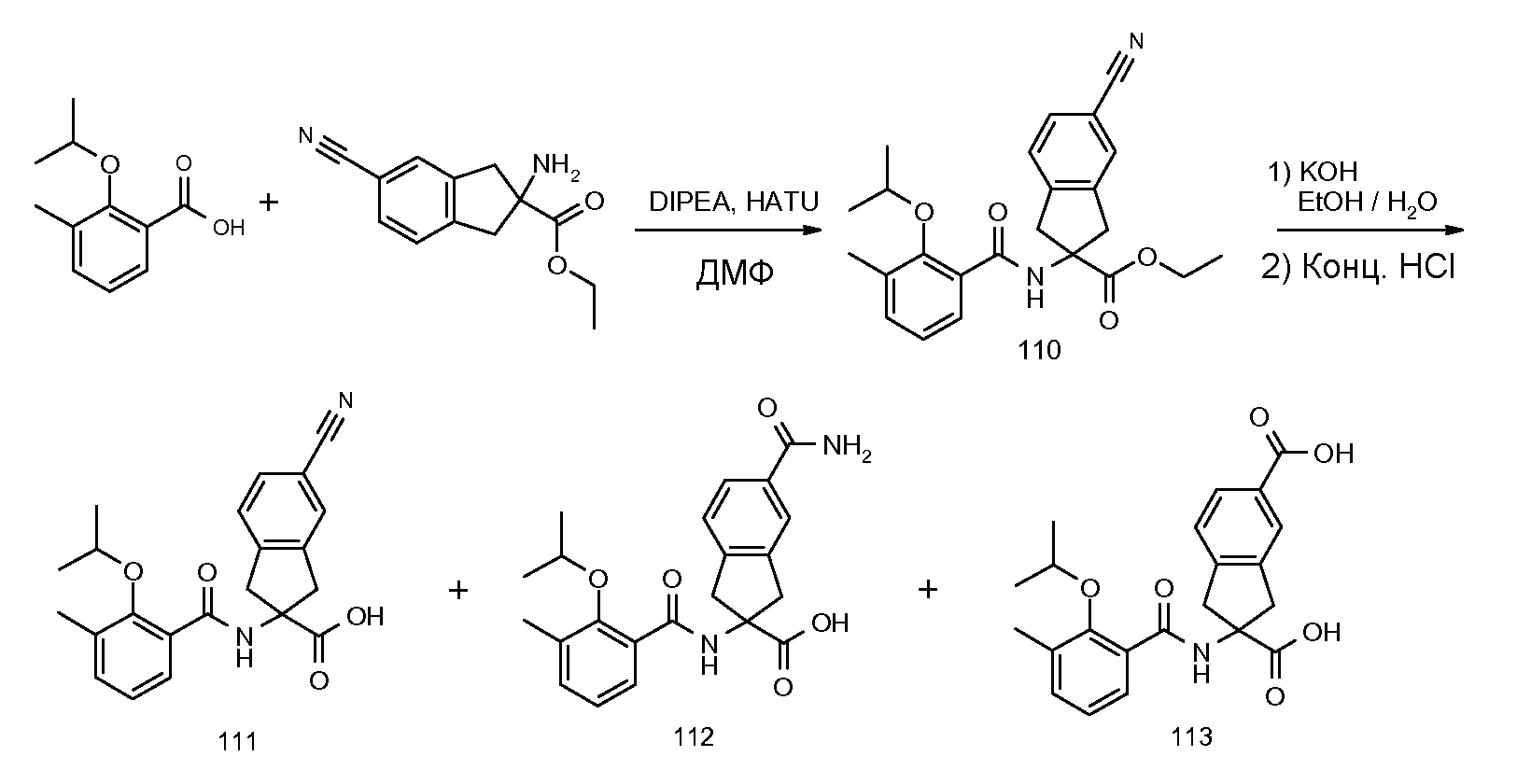
Этиловый эфир 5-циано-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (110):
К раствору 2-изопропокси-3-метилбензойной кислоты (377 мг, 1,94 ммоль), этилового эфира 2-амино-5-цианоиндан-2-карбоновой кислоты (670 мг, 2,91 ммоль) и HATU (1,11 г, 2,91 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (480 мкл, 2,91 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-70% EtOAc в гептане) с получением чистого продукта (110) в виде желеобразного вещества белого цвета (680 мг, 86%).
1Н ЯМР (CDCl3, 300МГц): δ 1,12 (м, 6H), 1,23 (т, 3H), 2,27 (с, 3H), 3,47 (дд, 2H), 3,77 (т, 2H), 4,21-4,26 (м, 3H), 7,08 (т, 1H), 7,28-7,35 (м, 2H), 7,51 (д, 2H), 7,84 (д, 1H), 8,47 (с, 1H)
ЖХ/МС (ES+) m/z=407,19
ПРИМЕРЫ 111, 112, 113
5-Циано-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота (111):
5-Карбамоил-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновая кислота (112):
2-(2-Изопропокси-3-метилбензоиламино)индан-2,5-дикарбоновая кислота (113):
Смесь этилового эфира 5-циано-2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (110) (527 мг, 1,3 ммоль) и KOH (1,3 г, 23 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH. Полученный реакционный раствор нагревают до 50°C и перемешивают при этой температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до pH~2. После фильтрования твердое вещество очищают ВЭЖХ с получением 3 чистых продуктов: (111) в виде твердого вещества белого цвета (37 мг, 8%), (112) в виде твердого вещества белого цвета (295 мг, 57%) и (113) в виде твердого вещества белого цвета (62 мг, 12%).
(111): 1Н ЯМР (CDCl3, 300МГц): δ 1,06 (м, 6H), 2,27 (с, 3H), 3,49 (дд, 2H), 3,90 (дд, 2H), 4,19 (м, 1H), 7,11 (т, 1H), 7,34 (т, 2H), 7,53 (д, 2H), 7,88 (дд, 1H), 8,65 (с, 1H)
ЖХ/МС (ES+) m/z=379,16
(112): 1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,08 (дд, 6H), 2,26 (с, 3H), 3,43 (дд, 2H), 3,80 (дд, 2H), 4,20 (м, 1H), 7,08 (т, 1H), 7,28-7,32 (м, 2H), 7,67-7,77 (м, 2H), 7,79 (дд, 1H), 8,58 (с, 1/4H)
ЖХ/МС (ES+) m/z=397,18
(113): 1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,04 (м, 6H), 2,26 (с, 3H), 3,45 (дд, 2H), 3,81 (т, 2H), 4,18 (м, 1H), 7,08 (т, 1H), 7,27-7,32 (м, 2H), 7,80 (д, 1H), 7,92 (дд, 2H), 8,53 (с, 1H)
ЖХ/МС (ES+) m/z=398,16
ПРИМЕР 114
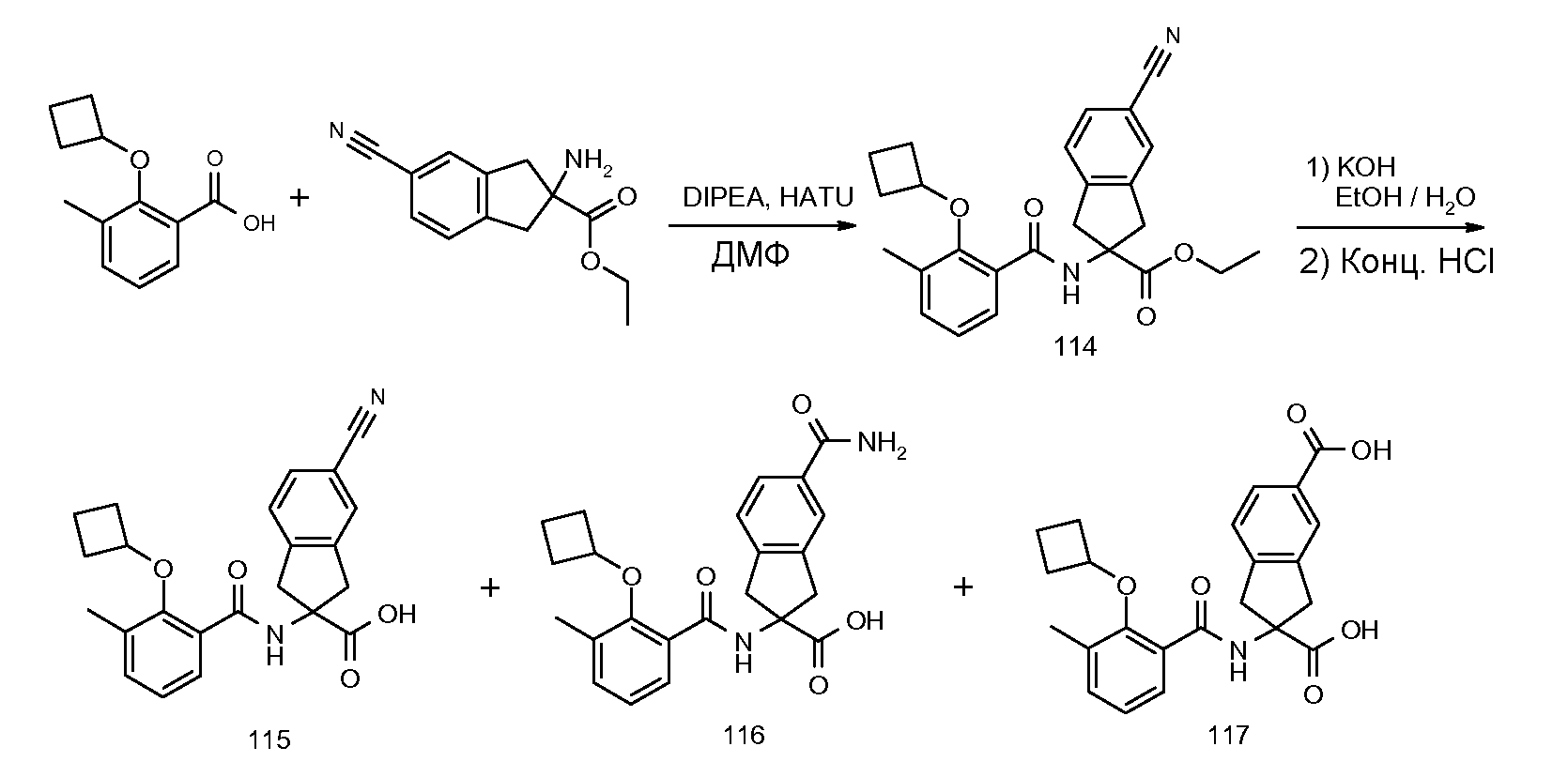
Этиловый эфир 5-циано-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (114):
К раствору 2-циклобутокси-3-метилбензойной кислоты (400 мг, 1,94 ммоль), этилового эфира 2-амино-5-цианоиндан-2-карбоновой кислоты (670 мг, 2,91 ммоль) и HATU (1,11 г, 2,91 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (480 мкл, 2,91 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-60% EtOAc в гептане) с получением чистого продукта (114) в виде желеобразного вещества белого цвета (682 мг, 84%).
1Н ЯМР (CDCl3, 300МГц): δ 1,27 (т, 3H), 1,30-1,43 (м, 1H), 1,51-1,65 (м, 1H), 1,98-2,12 (м, 4H), 2,28 (с, 3H), 3,47 (дд, 2H), 3,78 (т, 2H), 4,22-4,33 (м, 3H), 7,08 (т, 1H), 7,27-7,35 (м, 2H), 7,51 (д, 2H), 7,85 (д, 1H), 8,47 (с, 1H)
ЖХ/МС (ES+) m/z=419,19
ПРИМЕРЫ 115, 116, 117
5-Циано-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (115):
5-Карбамоил-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (116):
2-(2-Циклобутокси-3-метилбензоиламино)индан-2,5-дикарбоновая кислота (117):
Смесь этилового эфира 5-циано-2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (114) (530 мг, 1,3 ммоль) и KOH (1,3 г, 23 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH. Полученный реакционный раствор нагревают до 50°C и перемешивают при этой температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до pH~2. После фильтрования полученное твердое вещество очищают ВЭЖХ с получением 3 чистых продуктов: (115) в виде твердого вещества белого цвета (167 мг, 33%), (116) в виде твердого вещества белого цвета (239 мг, 45%) и (117) в виде твердого вещества белого цвета (21 мг, 4%).
(115): 1Н ЯМР (CDCl3, 300МГц): δ 1,24-1,39 (м, 1H), 1,46-1,56 (м, 1H), 1,89-2,13 (м, 4H), 2,10 (с, 3H), 3,47 (дд, 2H), 3,89 (дд, 2H), 4,29 (м, 1H), 7,09 (т, 1H), 7,26-7,36 (м, 2H), 7,52 (д, 2H), 7,85 (д, 2H), 8,60 (с, 1H)
ЖХ/МС (ES+) m/z=391,13
(116): 1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,22-1,38 (м, 1H), 1,46-1,56 (м, 1H), 1,92-2,09 (м, 4H), 2,26 (с, 3H), 3,47 (дд, 2H), 3,82 (дд, 2H), 4,30 (м, 1H), 7,08 (т, 1H), 7,27-7,32 (м, 2H), 7,66-7,72 (м, 2H), 7,81 (д, 1H), 8,57 (с, 1H)
ЖХ/МС (ES+) m/z=409,14
(117): 1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,22-1,35 (м, 1H), 1,42-1,52 (м, 1H), 1,87-2,06 (м, 4H), 2,26 (с, 3H), 3,47 (дд, 2H), 3,83 (дд, 2H), 4,28 (м, 1H), 7,08 (т, 1H), 7,27-7,33 (м, 2H), 7,82 (д, 1H), 7,93 (д, 2H), 8,53 (с, 1H)
ЖХ/МС (ES+) m/z=410,17
ПРИМЕР 118
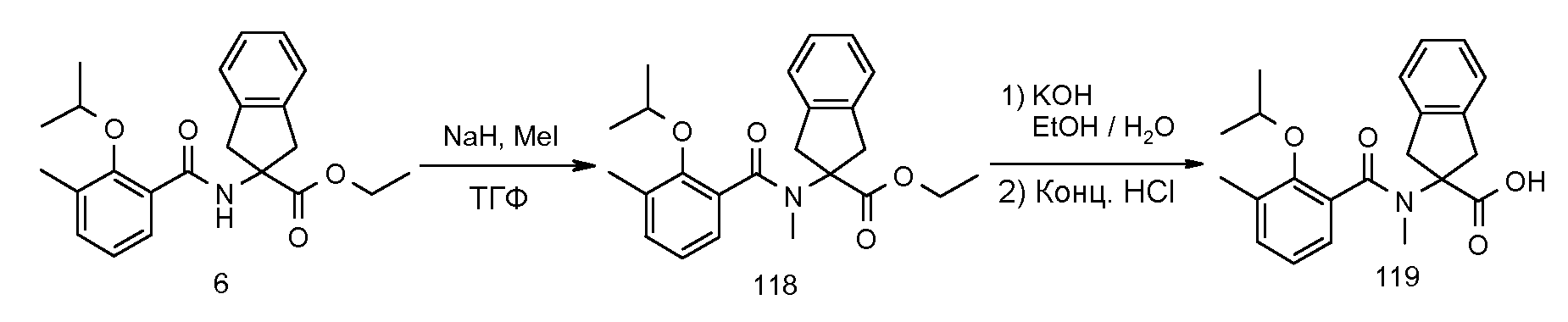
Этиловый эфир 2-[(2-изопропокси-3-метилбензоил)метиламино]индан-2-карбоновой кислоты (118):
К раствору NaH (гидрид натрия, 60% дисперсия, 86,0 мг, 2,15 ммоль) в безводном ТГФ (20 мл) по каплям добавляют раствор этилового эфира 2-(2-изопропокси-3-метилбензоиламино)индан-2-карбоновой кислоты (6) (410 мг, 1,07 ммоль) в ТГФ (5 мл) при 0°C. После перемешивания в течение 20 минут добавляют по каплям метилйодид (452 мкл, 7,26 ммоль) и полученную суспензию нагревают до комнатной температуры, продолжая перемешивать в течение ночи. После гашения насыщенным водным раствором хлорида аммония (5 мл) реакционную смесь разбавляют EtOAc (50 мл). Органический слой отделяют, промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 0%-30% EtOAc в гептане) с получением чистого продукта (118) в виде бесцветного масла (240 мг, 57%).
1Н ЯМР (CDCl3, 300МГц): δ 1,18 (уш.д, 6H), 1,28 (т, 3H), 2,24 (с, 3H), 2,85 (с, 3H), 3,44 (д, 2H), 3,62 (уш.д, 1H), 4,02 (уш.д, 1H), 4,18-4,36 (м, 3H), 7,00 (т, 1H), 7,09 (д, 1H), 7,18-7,20 (м, 5H)
ЖХ/МС (ES+) m/z=396,21
ПРИМЕР 119
2-[(2-Изопропокси-3-метилбензоил)метиламино]индан-2-карбоновая кислота (119):
Смесь этилового эфира 2-[(2-изопропокси-3-метилбензоил)метиламино]индан-2-карбоновой кислоты (118) (200 мг, 0,51 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (119) в виде твердого вещества бледно-оранжевого цвета (170 мг, 91%).
1Н ЯМР (CDCl3, 300МГц): δ 1,15 (уш.д, 6H), 2,24 (с, 3H), 2,86 (с, 3H), 3,46 (д, 2H), 3,74 (уш.д, 1H), 4,02 (уш.д, 1H), 4,26 (м, 1H), 6,99 (т, 1H), 7,15-7,26 (м, 6H), 8,79 (уш.с, 1H)
ЖХ/МС (ES+) m/z=368,20
ПРИМЕР 120
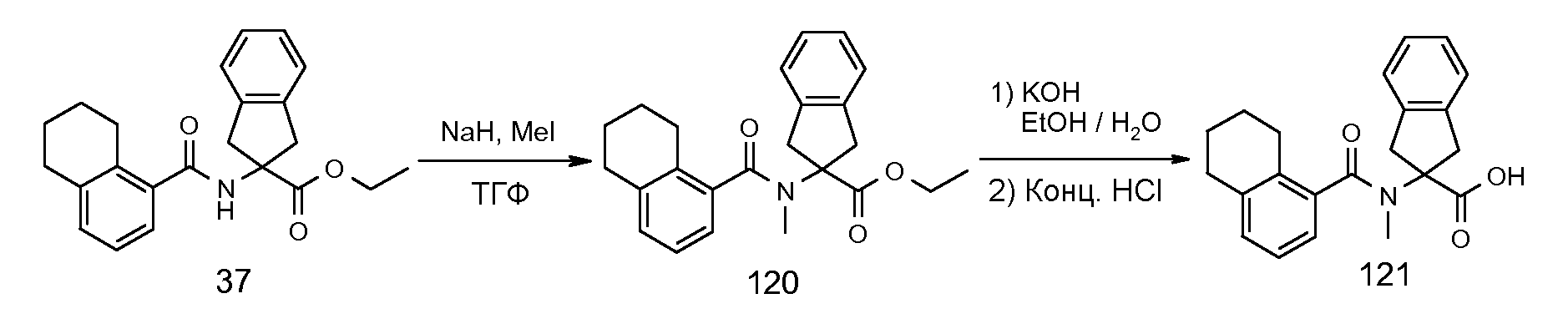
Этиловый эфир 2-[метил-(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (120):
К раствору NaH (гидрид натрия, 60% дисперсия, 124 мг, 3,08 ммоль) в безводном ТГФ (20 мл) по каплям добавляют раствор этилового эфира 2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (37) (280 мг, 0,77 ммоль) в ТГФ (5 мл) при 0°C. После перемешивания в течение 20 минут добавляют по каплям метилйодид (377 мкл, 6,05 ммоль) и полученную суспензию нагревают до комнатной температуры, продолжая перемешивать в течение ночи. После гашения насыщенным водным раствором хлорида аммония (5 мл) реакционную смесь разбавляют EtOAc (50 мл). Органический слой отделяют, промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 0%-30% EtOAc в гептане) с получением чистого продукта (120) в виде бесцветного желеобразного вещества (250 мг, 86%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,76 (уш.с, 4H), 2,47 (уш.с, 1H), 2,76 (уш.с, 2H), 2,82 (с, 3H), 2,82 (уш.с, 1H), 3,45 (д, 2H), 3,83 (д, 2H), 4,24 (м, 2H), 6,92 (д, 1H), 7,05-7,08 (м, 2H), 7,17-7,23 (м, 4H)
ЖХ/МС (ES+) m/z=378,22
ПРИМЕР 121
2-[Метил-(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновая кислота (121):
Смесь этилового эфира 2-[метил-(5,6,7,8-тетрагидронафталин-1-карбонил)амино]индан-2-карбоновой кислоты (120) (226 мг, 0,60 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (5 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют раствор концентрированной HCl до pH~3. Осадок фильтруют с получением чистого продукта (121) в виде твердого вещества бледно-оранжевого цвета (150 мг, 72%).
1Н ЯМР (CDCl3, 300МГц): δ 1,74 (уш.с, 4H), 2,45 (уш.с, 1H), 2,76-2,84 (м, 3H), 2,85 (с, 3H), 3,48 (д, 2H), 3,90 (д, 2H), 4,24 (м, 2H), 6,96-7,26 (м, 7H)
ЖХ/МС (ES+) m/z=350,16
ПРИМЕР 122
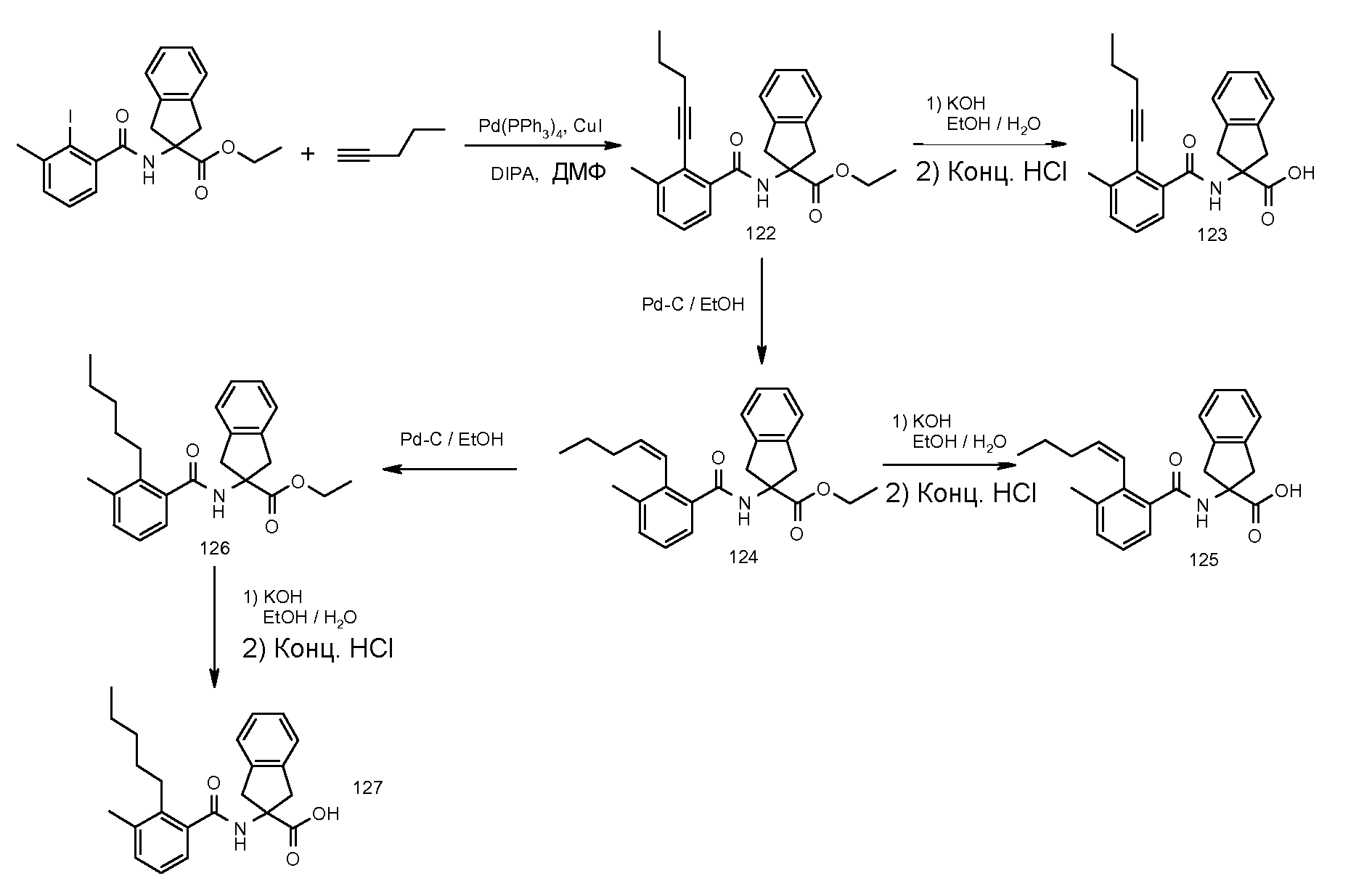
Этиловый эфир 2-(3-метил-2-пент-1-инилбензоиламино)индан-2-карбоновой кислоты (122):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (693 мг, 1,54 ммоль) в безводном ДМФА (5 мл) и DIPA (диизопропиламин, 10 мл) добавляют Pd(PPh3)4 (89 мг, 7,7% ммоль), CuI (29 мг, 0,154 ммоль) и пент-1-ин (1,5 мл, 15,4 ммоль). Полученный раствор насыщают аргоном и подвергают микроволновой реакции: 110°C, 35 минут. После удаления ДМФА и DIPA в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 0%-40% EtOAc в гептане) с получением чистого продукта (122) в виде твердого вещества бледно-желтого цвета (144 мг, 24%).
1Н ЯМР (CDCl3, 300 МГц): δ 0,99 (т, 3H), 1,25 (т, 3H), 1,51 (м, 2H), 2,14 (т, 1H), 2,39 (с, 3H), 3,35 (д, 2H), 3,77 (д, 2H), 4,25 (кв, 2H), 7,17-7,30 (м, 6H), 7,84 (д, 1H), 8,21 (с, 1H)
ЖХ/МС (ES+) m/z=390,18
ПРИМЕР 123
2-(3-Метил-2-пент-1-инилбензоиламино)индан-2-карбоновая кислота (123):
Смесь этилового эфира 2-(3-метил-2-пент-1-инилбензоиламино)индан-2-карбоновой кислоты (122) (180 мг, 0,46 ммоль) и KOH (1 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~4. После фильтрования твердое вещество очищают ВЭЖХ с получением чистого продукта (123) в виде твердого вещества белого цвета (114 мг, 69%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,99 (т, 3H), 1,53 (м, 2H), 2,14 (т, 1H), 2,40 (с, 3H), 3,39 (д, 2H), 3,82 (д, 2H), 7,18-7,32 (м, 6H), 7,83 (д, 1H), 8,39 (с, 1H)
ЖХ/МС (ES+) m/z=362,17
ПРИМЕР 124
Этиловый эфир 2-[3-метил-2-((Z)-пент-1-енил)бензоиламино]индан-2-карбоновой кислоты (124):
К раствору этилового эфира 2-(3-метил-2-пент-1-инилбензоиламино)индан-2-карбоновой кислоты (122) (300 мг, 0,77 ммоль) в абсолютном EtOH (18 мл) добавляют катализатор Pd-C (50% увлажненного порошка, 10% Pd, 30 мг, 1,4% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, комнатной температуре, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор EtOH концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта в виде твердого вещества белого цвета (168 мг, 56%).
1Н ЯМР (CDCl3, 300МГц): δ 0,72 (т, 3H), 1,13-1,30 (м, 5H), 1,64 (м, 2H), 2,16 (с, 3H), 3,29 (д, 2H), 3,69 (д, 2H), 4,25 (кв, 2H), 5,56 (дт, 1H), 6,29 (д, 1H), 6,78 (с, 1H), 7,17-7,26 (м, 6H), 7,57 (д, 1H)
ЖХ/МС (ES+) m/z=392,12
ПРИМЕР 125
2-[3-Метил-2-((Z)-пент-1-енил)бензоиламино]индан-2-карбоновая кислота (125):
Смесь этилового эфира 2-[3-метил-2-((Z)-пент-1-енил)бензоиламино]индан-2-карбоновой кислоты (124) (69 мг, 0,18 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 5 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~4. Осадок фильтруют с получением чистого продукта (125) в виде твердого вещества белого цвета (42 мг, 64%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,73 (т, 3H), 1,11-1,25 (м, 2H), 1,62 (кв, 2H), 2,16 (с, 3H), 3,33 (д, 2H), 3,72 (д, 2H), 5,54 (дт, 1H), 6,25 (д, 1H), 7,01 (с, 1H), 7,18-7,28 (м, 6H), 7,57 (д, 1H)
ЖХ/МС (ES+) m/z=364,18
ПРИМЕР 126
Этиловый эфир 2-(3-метил-2-пентилбензоиламино)индан-2-карбоновой кислоты (126):
К раствору этилового эфира 2-[3-метил-2-((Z)-пент-1-енил)бензоиламино]индан-2-карбоновой кислоты (124) (92 мг, 0,23 ммоль) в абсолютном EtOH (10 мл) добавляют катализатор Pd-C (50% увлажненного порошка, 10% Pd, 30 мг, 1,4% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, комнатной температуре, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор EtOH концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (126) в виде твердого вещества белого цвета (80 мг, 89%).
1Н ЯМР (CDCl3, 300МГц): δ 0,88 (т, 3H), 1,26-1,33 (м, 7H), 1,42-1,47 (м, 2H), 2,29 (с, 3H), 2,64-2,69 (м, 2H), 3,34 (д, 2H), 3,74 (д, 2H), 4,28 (кв, 2H), 6,18 (с, 1H), 7,02-7,26 (м, 7H)
ЖХ/МС (ES+) m/z=394,23
ПРИМЕР 127
2-(3-Метил-2-пентилбензоиламино)индан-2-карбоновая кислота (127):
Смесь этилового эфира 2-(3-метил-2-пентилбензоиламино)индан-2-карбоновой кислоты (126) (68 мг, 0,17 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (127) в виде твердого вещества бледно-коричневого цвета (63 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,88 (т, 3H), 1,26-1,30 (м, 4H), 1,41-1,43 (м, 2H), 2,30 (с, 3H), 2,62-2,67 (м, 2H), 3,40 (д, 2H), 3,83 (д, 2H), 6,22 (с, 1H), 7,01-7,07 (м, 2H), 7,17-7,26 (м, 5H)
ЖХ/МС (ES+) m/z=366,20
ПРИМЕР 128
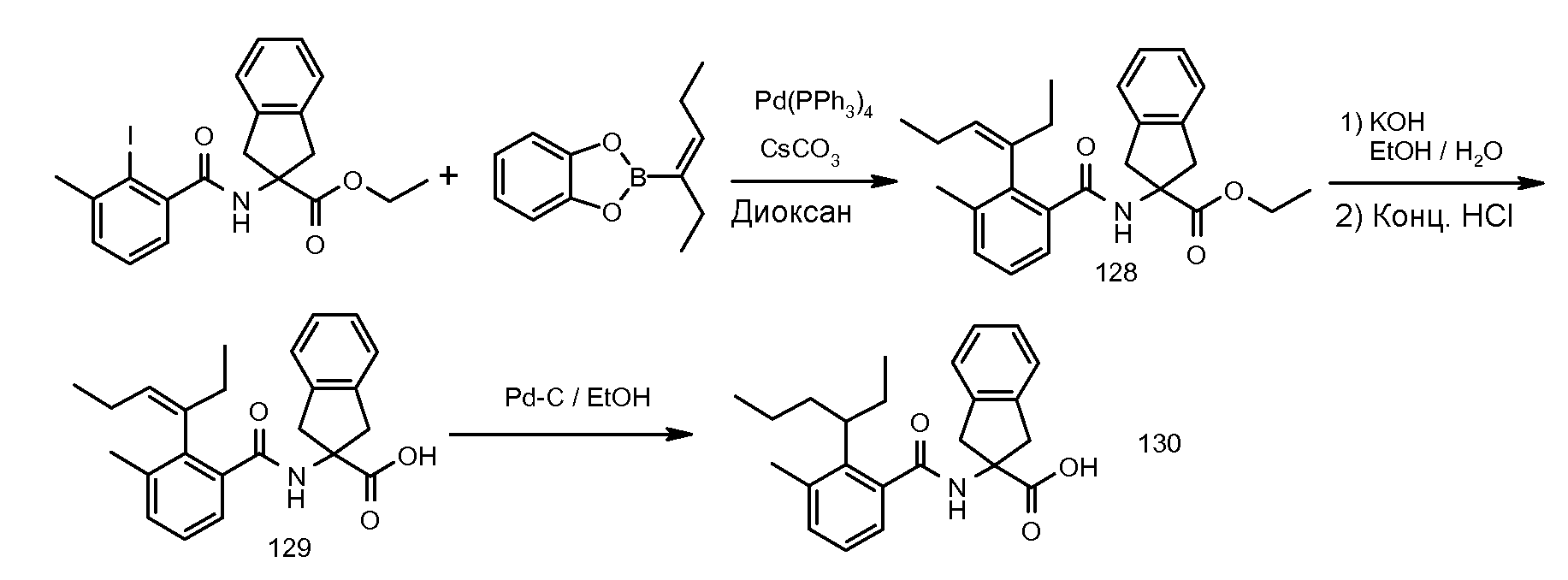
Этиловый эфир 2-[2-(1-этилбут-1-енил)-3-метилбензоиламино]индан-2-карбоновой кислоты (128):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,89 ммоль) и 2-(1-этилбут-1-енил)бензо[1,3,2]диоксаборола (709 мкл, 3,56 ммоль) в диоксане (15 мл) добавляют Pd(PPh3)4 (103 мг, 8,9% ммоль) и 2М водный раствор Cs2CO3 (1,34 мл, 2,67 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 2 часа. После концентрирования в вакууме остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5%-50% EtOAc в гептане) с получением чистого продукта (128) в виде полутвердого вещества коричневого цвета (530 мг, 73%).
1Н ЯМР (CDCl3, 300МГц): δ 0,71 (т, 3H), 0,99 (т, 3H), 1,27 (т, 3H), 1,75-2,05 (м, 3H), 2,11-2,25 (м, 1H), 2,21 (с, 3H), 3,11 (д, 1H), 3,33 (д, 1H), 3,37 (дд, 2H), 4,25 (кв, 2H), 5,54 (т, 1H), 7,16-7,27 (м, 6H), 7,66 (д, 1H)
ЖХ/МС (ES+) m/z=406,25
ПРИМЕР 129
2-[2-(1-Этилбут-1-енил)-3-метилбензоиламино]индан-2-карбоновая кислота (129):
Смесь этилового эфира 2-[2-(1-этилбут-1-енил)-3-метилбензоиламино]индан-2-карбоновой кислоты (128) (503 мг, 1,24 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (10 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (40 мл) и подкисляют концентрированной HCl до pH~3. Осадок фильтруют с получением чистого продукта (129) в виде твердого вещества коричневого цвета (452 мг, 97%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,68 (т, 3H), 0,99 (т, 3H), 1,83 (м, 2H), 1,95-2,18 (м, 2H), 2,20 (с, 3H), 3,11 (д, 1H), 3,39 (д, 1H), 3,72 (дд, 2H), 5,54 (т, 1H), 7,16-7,35 (м, 6H), 7,63 (д, 1H)
ЖХ/МС (ES+) m/z=378,21
ПРИМЕР 130
2-[2-(1-Этилбутил)-3-метилбензоиламино]индан-2-карбоновая кислота (130):
К раствору этилового эфира 2-[2-(1-этилбут-1-енил)-3-метилбензоиламино]индан-2-карбоновой кислоты (129) (270 мг, 0,72 ммоль) в абсолютном EtOH (15 мл) добавляют катализатор Pd-C (50% увлажненного порошка, 10% Pd, 46 мг, 2,2% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, 70°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор EtOH концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (130) в виде твердого вещества белого цвета (75 мг, 28%).
1Н ЯМР (CDCl3, 300МГц): δ 0,66-0,75 (м, 6H), 0,83-1,26 (м, 2H), 1,56-1,69 (м, 4H), 2,34 (с, 3H), 2,87 (м, 1H), 3,34-3,43 (м, 2H), 3,72 (д, 2H), 6,15 (с, 1H), 7,00-7,25 (м, 7H), 8,83 (уш.с, 1H)
ЖХ/МС (ES+) m/z=380,22
ПРИМЕР 131
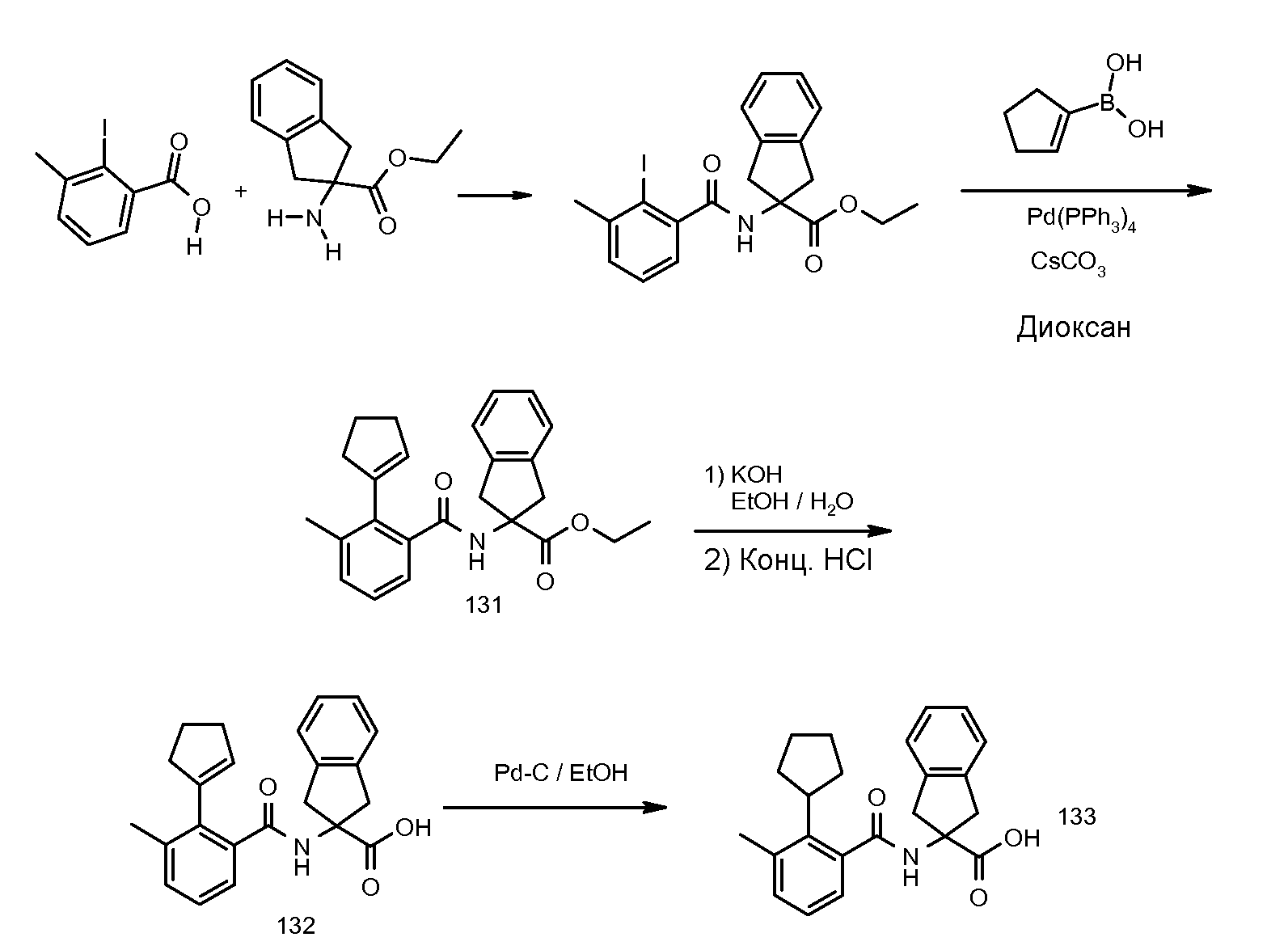
Этиловый эфир 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты
В круглодонную колбу объемом 100 мл помещают 2-йод-3-метилбензойную кислоту (1,92 г, 7,31 ммоль) и сухой DCM (25 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 5 минут добавляют HBTU (2,37 г, 7,31 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1,50 г, 7.31 ммоль) и затем DIPEA (3,2 мл, 18,37 ммоль). Реакционную смесь перемешивают в течение 118 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/дихлорметан) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (70 мл). Смесь промывают разбавленным водным раствором HCl (3%, 2×30 мл), насыщенным водным раствором NaHCO3 (2×30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 2,04 г твердого вещества белого цвета. Полученный продукт растворяют в DCM (15 мл). Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 50% EtOAC пропускают через 10 объемов колонки. Отбирают фракции по 27 мл УФ-активного элюента. Фракции 10-15 объединяют и выпаривают в вакууме до постоянного веса, получая этиловый эфир 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты в виде 1,04 г твердого вещества белого цвета.
Этиловый эфир 2-(2-циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновой кислоты (131):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (800 мг, 1,78 ммоль) и циклопентен-1-илбороновой кислоты (796 мг, 7,11 ммоль) в диоксане (20 мл) добавляют Pd(PPh3)4 (412 мг, 0,36 ммоль) и 2М водный раствор Cs2CO3 (5,34 мл, 10,7 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 2,7 часа. После концентрирования в вакууме остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5-40% EtOAc в гептане) с получением чистого продукта (131) в виде твердого вещества коричневого цвета (589 мг, 85%).
1Н ЯМР (CDCl3, 300МГц): δ 1,27 (т, 3H), 1,72 (м, 2H), 2,19 (с, 3H), 2,33-2,43 (м, 4H), 3,23 (д, 2H), 3,70 (дд, 2H), 4,25 (кв, 2H), 5,57 (м, 1H), 6,99 (с, 1H), 7,16-7,26 (м, 6H), 7,58 (д, 1H)
ЖХ/МС (ES+) m/z=390,22
ПРИМЕР 132
2-(2-Циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновая кислота (132):
Смесь этилового эфира 2-(2-циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновой кислоты (131) (560 мг, 1,43 ммоль) и KOH (1 г, 17,9 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH~3. Осадок фильтруют с получением чистого продукта (132) в виде твердого вещества бледно-желтого цвета (518 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,73 (м, 2H), 2,19 (с, 3H), 2,36-2,39 (м, 4H), 3,27 (д, 2H), 3,73 (дд, 2H), 5,57 (м, 1H), 7,16-7,29 (м, 6H), 7,53 (д, 1H)
ЖХ/МС (ES+) m/z=362,17
ПРИМЕР 133
2-(2-Циклопентил-3-метилбензоиламино)индан-2-карбоновая кислота (133):
К раствору 2-(2-циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновой кислоты (132) (365 мг, 1,01 ммоль) в абсолютном EtOH (15 мл) добавляют катализатор Pd-C (50% увлажненного порошка, 10% Pd, 192 мг, 9% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, 50°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор EtOH концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (133) в виде твердого вещества белого цвета (184 мг, 50%).
1Н ЯМР (CDCl3, 300МГц): δ 1,55-1,77 (м, 8H), 2,33 (с, 3H), 3,22 (м, 1H), 3,27 (д, 2H), 3,77 (дд, 2H), 6,22 (м, 1H), 7,101-7,26 (м, 7H)
ЖХ/МС (ES+) m/z=364,22
ПРИМЕР 134
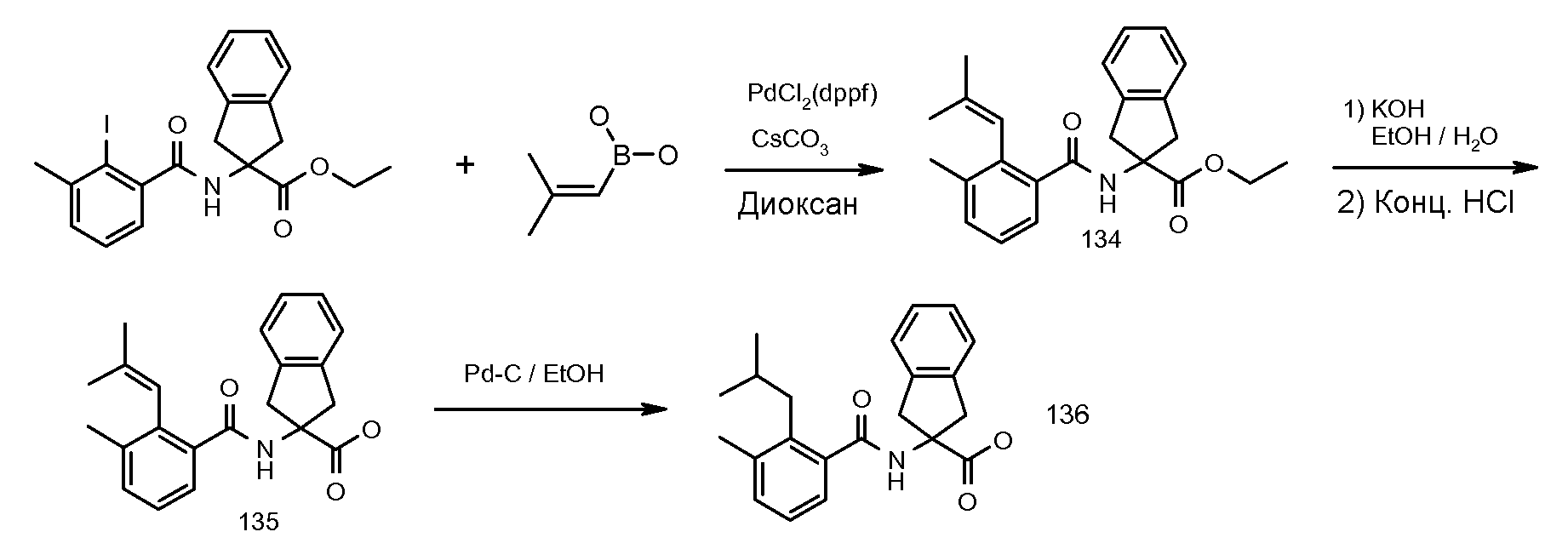
Этиловый эфир 2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (134):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,89 ммоль) и 2,2-диметилэтиленбороновой кислоты (133 мг, 1.34 ммоль) в диоксане (15 мл) добавляют PdCl2(dppf) ([1,1'-бис(дифенилфосин)ферроцен]дихлорпалладий(II), 73 мг, 8,9% ммоль) и 2М водный раствор Cs2CO3 (1,34 мл, 2,67 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 2 часа. После концентрирования в вакууме остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (134) в виде твердого вещества бледно-желтого цвета (523 мг, 78%).
1Н ЯМР (CDCl3, 300МГц): δ 1,27 (т, 3H), 1,30 (с, 3H), 1,65 (с, 3H), 2,14 (с, 3H), 3,24 (уш.д, 2H), 3,70 (уш.д, 2H), 4,25 (кв, 2H), 6,10 (с, 1H), 7,02 (с, 1H), 7,17-7,26 (м, 6H), 7,69 (д, 1H)
ЖХ/МС (ES+) m/z=378,22
ПРИМЕР 135
2-[3-Метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (135):
Смесь этилового эфира 2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (134) (283 мг, 0,75 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. Осадок фильтруют с получением чистого продукта (135) в виде твердого вещества белого цвета (250 мг, 95%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,28 (т, 3H), 1,68 (с, 3H), 2,14 (с, 3H), 3,28 (д, 2H), 3,74 (д, 2H), 6,09 (с, 1H), 7,17-7,29 (м, 6H), 7,66 (д, 1H)
ЖХ/МС (ES+) m/z=350,19
ПРИМЕР 136
2-(2-Изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (136):
К раствору 2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (135) (120 мг, 0,34 ммоль) в уксусной кислоте (15 мл) добавляют катализатор Pd-C (5% Pd по весу, 72 мг, 3,4% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, 95°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (136) в виде твердого вещества белого цвета (65 мг, 54%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,80 (д, 6H), 1,75-1,78 (м, 1H), 2,30 (с, 3H), 2,68 (д, 2H), 3,38 (д, 2H), 3,76 (д, 2H), 6,53 (с, 1H), 7,03-7,25 (м, 7H)
ЖХ/МС (ES+) m/z=352,15
ПРИМЕР 137
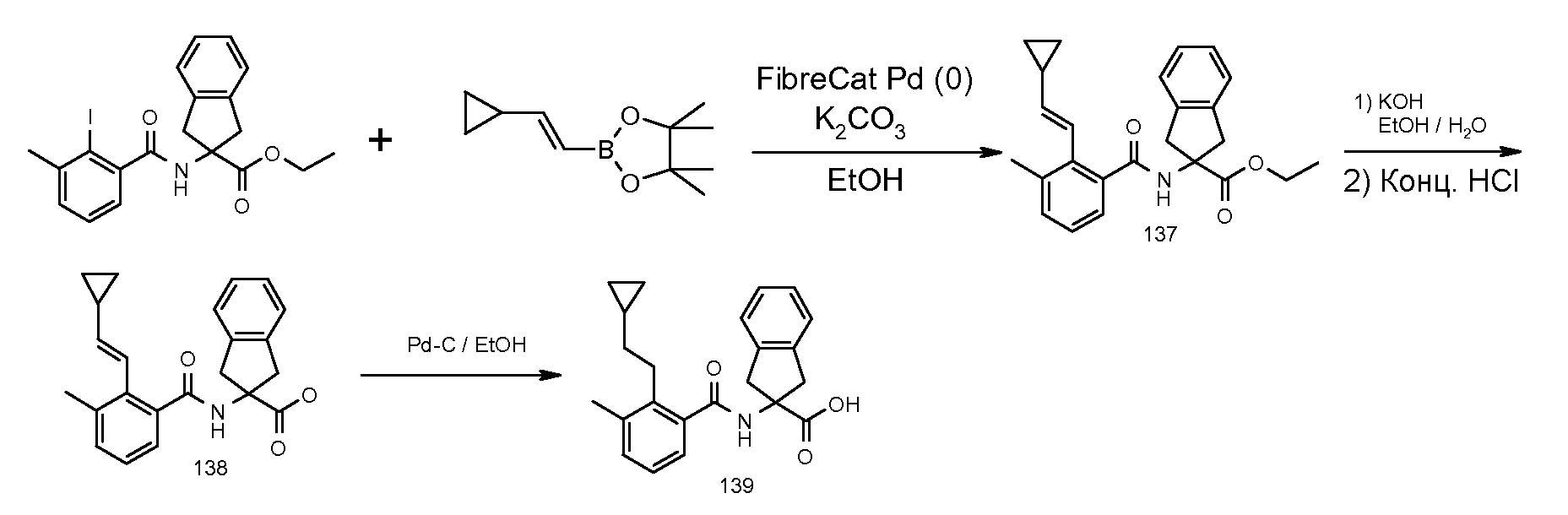
Этиловый эфир 2-[2-(2-циклопропилвинил)-3-метилбензоиламино]индан-2-карбоновой кислоты (137):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (600 мг, 1,34 ммоль) и 2-(2-циклопропилвинил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (1,11 мл, 5,36 ммоль) в EtOH (10 мл) и диоксане (10 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 285 мг, 0,13 ммоль) и 2М водный раствор K2SO4 (2,68 мл, 5,36 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 8 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (137) в виде твердого вещества белого цвета (250 мг, 49%).
1Н ЯМР (CDCl3, 300МГц): δ 0,47-0,50 (м, 2H), 0,76-0,82 (м, 2H), 1,29 (т, 3H), 1,45 (м, 1H), 2,27 (с, 3H), 3,32 (д, 2H), 3,72 (д, 2H), 4,27 (кв, 2H), 5,30 (дд, 1H), 6,45 (дд, 1H), 6,52 (с, 1H), 7,09-7,23 (м, 6H), 7,39 (д, 1H)
ЖХ/МС (ES+) m/z=390,20
ПРИМЕР 138
2-[2-(2-Циклопропилвинил)-3-метилбензоиламино]индан-2-карбоновая кислота (138):
Смесь этилового эфира 2-[2-(2-циклопропилвинил)-3-метилбензоиламино]индан-2-карбоновой кислоты (137) (220 мг, 0,56 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (138) в виде твердого вещества белого цвета (209 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,47-0,50 (м, 2H), 0,78-0,84 (м, 2H), 1,43 (м, 1H), 2,26 (с, 3H), 3,38 (д, 2H), 3,83 (д, 2H), 5,24 (дд, 1H), 6,34 (д, 1H), 6,68 (с, 1H), 7,11-7,26 (м, 6H), 7,41 (д, 1H)
ЖХ/МС (ES+) m/z=362,17
ПРИМЕР 139
2-[2-(2-Циклопропилэтил)-3-метилбензоиламино]индан-2-карбоновая кислота (139):
К раствору 2-[2-((E)-2-циклопропилвинил)-3-метилбензоиламино]индан-2-карбоновой кислоты (138) (120 мг, 0,33 ммоль) в абсолютном EtOH (10 мл) добавляют катализатор Pd-C (5% Pd по весу, 28 мг, 1,3% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, комнатной температуре, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (139) в виде твердого вещества белого цвета (30 мг, 25%).
1Н ЯМР (CDCl3, 300МГц): δ 0,00 (м, 2H), 0,35-0,41 (м, 2H), 0,66 (м, 1H), 1,32-1,39 (м, 2H), 2,30 (с, 3H), 2,76-2,82 (м, 2H), 3,40 (д, 2H), 3,82 (д, 2H), 6,23 (с, 1H), 7,03-7,04 (м, 2H), 7,16-7,26 (м, 4H)
ЖХ/МС (ES+) m/z=364,13
ПРИМЕР 140
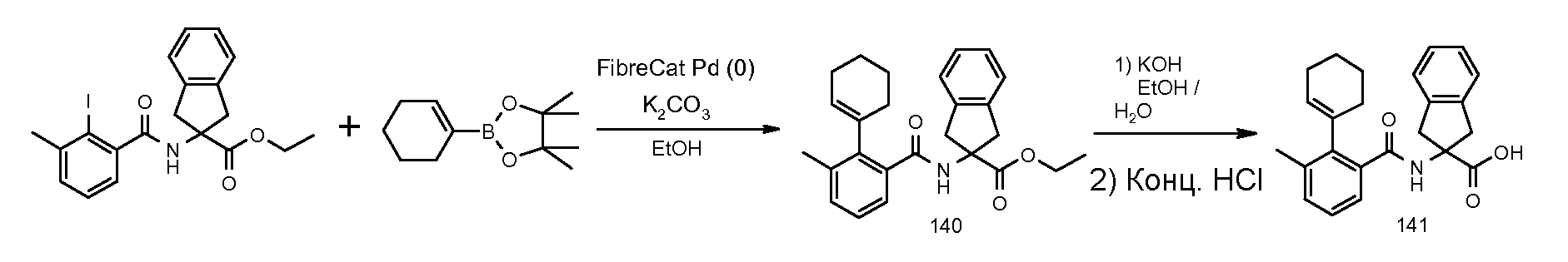
Этиловый эфир 2-(2-циклогекс-1-енил-3-метилбензоиламино)индан-2-карбоновой кислоты (140):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (491 мг, 1,09 ммоль) и 2-циклогекс-1-енил-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (937 мкл, 4,36 ммоль) в EtOH (10 мл) и диоксане (10 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 240 мг, 0,11 ммоль) и 2М водный раствор K2SO4 (2,18 мл, 4,36 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 8 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (140) в виде твердого вещества белого цвета (95 мг, 22%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 1,55 (уш.т, 4H), 2,01-2,34 (м, 4H), 2,21 (с, 3H), 3,27 (уш.т, 2H), 3,74 (уш.д, 2H), 4,22-4,27 (м, 2H), 5,56 (с, 1H), 7,16-7,29 (м, 7H), 7,63 (д, 1H)
ЖХ/МС (ES+) m/z=404,22
ПРИМЕР 141
2-(2-Циклогекс-1-енил-3-метилбензоиламино)индан-2-карбоновая кислота (141):
Смесь этилового эфира 2-(2-циклогекс-1-енил-3-метилбензоиламино)индан-2-карбоновой кислоты (141) (80 мг, 0,20 ммоль) и KOH (300 мг, 5,36 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (141) в виде твердого вещества белого цвета (71 мг, 95%).
1Н ЯМР (CDCl3, 300МГц): δ 1,41-1,56 (м, 4H), 2,03-2,24 (м, 4H), 2,21 (с, 3H), 3,32 (м, 2H), 3,83 (д, 2H), 5,56 (с, 1H), 7,16-7,34 (м, 6H), 7,61 (д, 1H)
ЖХ/МС (ES+) m/z=376,22
ПРИМЕР 142
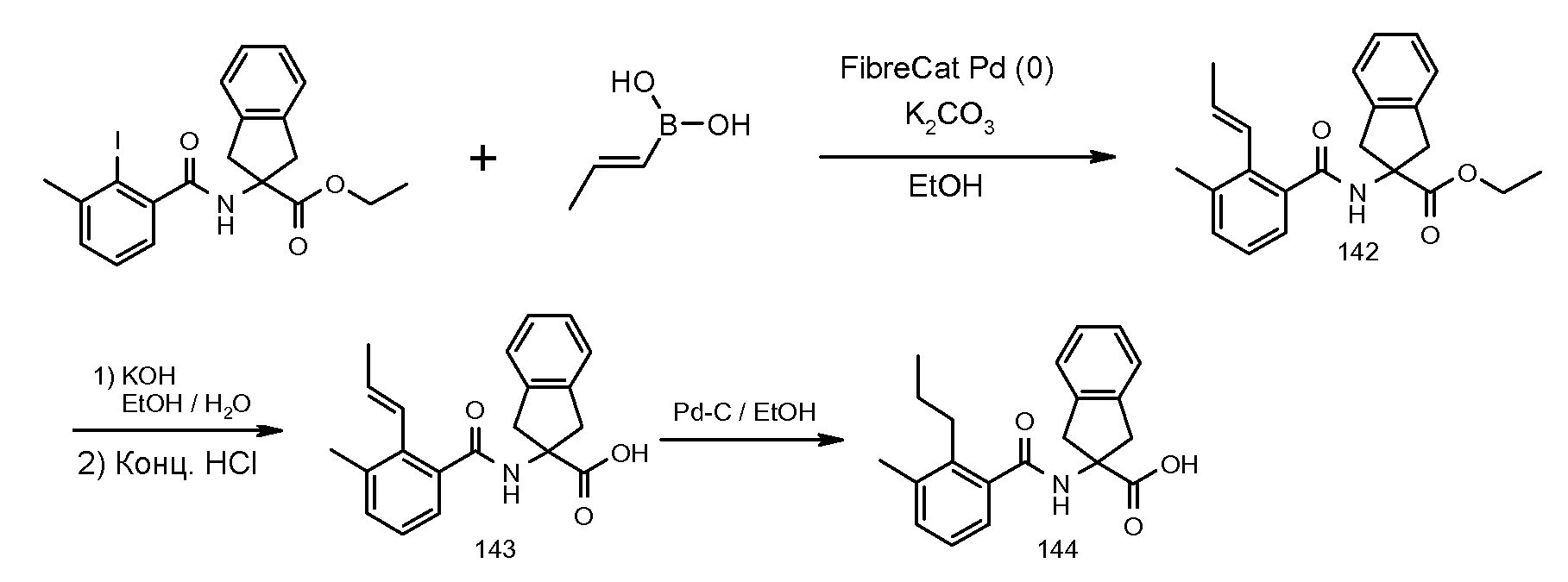
Этиловый эфир 2-[3-метил-2-(1-пропенил)бензоиламино]индан-2-карбоновой кислоты (142):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (600 мг, 1,34 ммоль) и транс-1-пропен-1-илбороновой кислоты (460 мг, 5,36 ммоль) в EtOH (10 мл) и диоксане (10 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 285 мг, 0,13 ммоль) и 2М водный раствор K2SO4 (2,68 мл, 5,36 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 8 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (142) в виде твердого вещества белого цвета (300 мг, 63%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 1,74 (дд, 3H), 2,25 (с, 3H), 3,28 (д, 2H), 3,71 (д, 2H), 4,27 (кв, 2H), 5,75 (дкв, 1H), 6,37 (д, 1H), 7,10-7,26 (м, 6H), 7,36 (д, 1H)
ЖХ/МС (ES+) m/z=364,18
ПРИМЕР 143
2-[3-Метил-2-(1-пропенил)бензоиламино]индан-2-карбоновая кислота (143):
Смесь этилового эфира 2-[3-метил-2-(1-пропенил)бензоиламино]индан-2-карбоновой кислоты (142) (340 мг, 0,94 ммоль) и KOH (700 мг, 12,5 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (143) в виде твердого вещества белого цвета (315 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,75 (дд, 3H), 2,25 (с, 3H), 3,32 (д, 2H), 3,73 (д, 2H), 5,75 (дкв, 1H), 6,36 (дд, 1H), 6,76 (с, 1H), 7,10-7,24 (м, 6H), 7,31 (д, 1H)
ЖХ/МС (ES+) m/z=336,16
ПРИМЕР 144
2-(3-Метил-2-пропилбензоиламино)индан-2-карбоновая кислота (144):
К раствору 2-[3-метил-2-(1-пропенил)бензоиламино]индан-2-карбоновой кислоты (143) (220 мг, 0,65 ммоль) в абсолютном EtOH (10 мл) добавляют катализатор Pd-C (5% Pd по весу, 55 мг, 2,6% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, комнатной температуре, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (144) в виде твердого вещества белого цвета (128 мг, 58%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,91 (т, 3H), 1,45 (м, 2H), 2,45 (с, 3H), 2,61-2,66 (д, 2H), 3,40 (д, 2H), 3,82 (д, 2H), 6,22 (с, 1H), 7,04 (д, 2H), 7,17-7,26 (м, 5H)
ЖХ/МС (ES+) m/z=338,17
ПРИМЕРЫ 145-146:
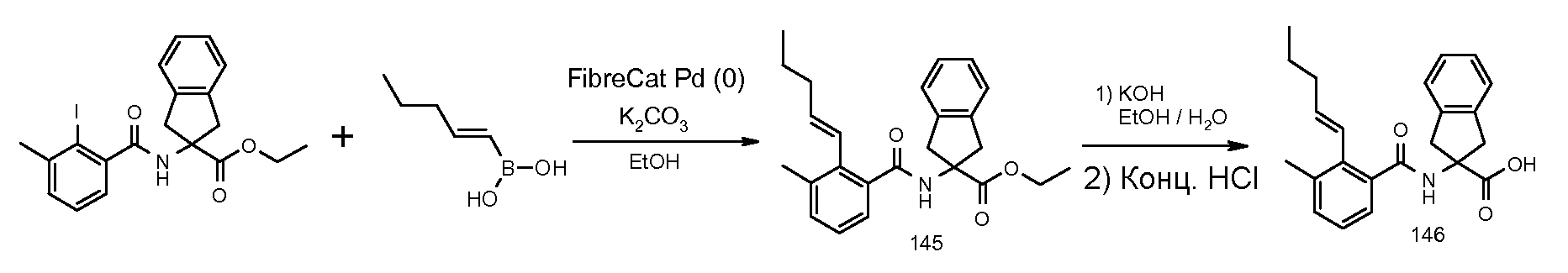
Этиловый эфир 2-[3-метил-2-((E)-пент-1-енил)бензоиламино]индан-2-карбоновой кислоты (145):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (200 мг, 0,45 ммоль) и транс-1-пентен-1-илбороновой кислоты (205 мг, 1,80 ммоль) в EtOH (10 мл) и диоксане (10 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 96 мг, 0,045 ммоль) и 2М водный раствор K2SO4 (0,90 мл, 1,80 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 8 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (145) в виде твердого вещества белого цвета (107 мг, 60%).
1Н ЯМР (CDCl3, 300МГц): δ 0,93 (т, 3H), 1,28 (т, 3H), 1,42 (м, 2H), 2,03 (кв, 3H), 2,26 (с, 3H), 3,29 (д, 2H), 3,70 (д, 2H), 4,25 (кв, 2H), 5,75 (дт, 1H), 6,37 (д, 1H), 6,43 (с, 1H), 7,09-7,25 (м, 6H), 7,37 (д, 1H)
ЖХ/МС (ES+) m/z=392,0
ПРИМЕР 146
2-[3-Метил-2-((E)-пент-1-енил)бензоиламино]индан-2-карбоновая кислота (146):
Смесь этилового эфира 2-[3-метил-2-((E)-пент-1-енил)бензоиламино]индан-2-карбоновой кислоты (145) (170 мг, 0,43 ммоль) и KOH (60 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (146) в виде твердого вещества белого цвета (160 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 0,93 (т, 3H), 1,42 (м, 2H), 2,05 (кв, 3H), 2,26 (с, 3H), 3,33 (д, 2H), 3,74 (д, 2H), 4,25 (кв, 2H), 5,73 (дт, 1H), 6,35 (д, 1H), 6,68 (с, 1H), 7,11-7,21 (м, 6H), 7,34 (д, 1H)
ЖХ/МС (ES+) m/z=364,18
ПРИМЕРЫ 147-150
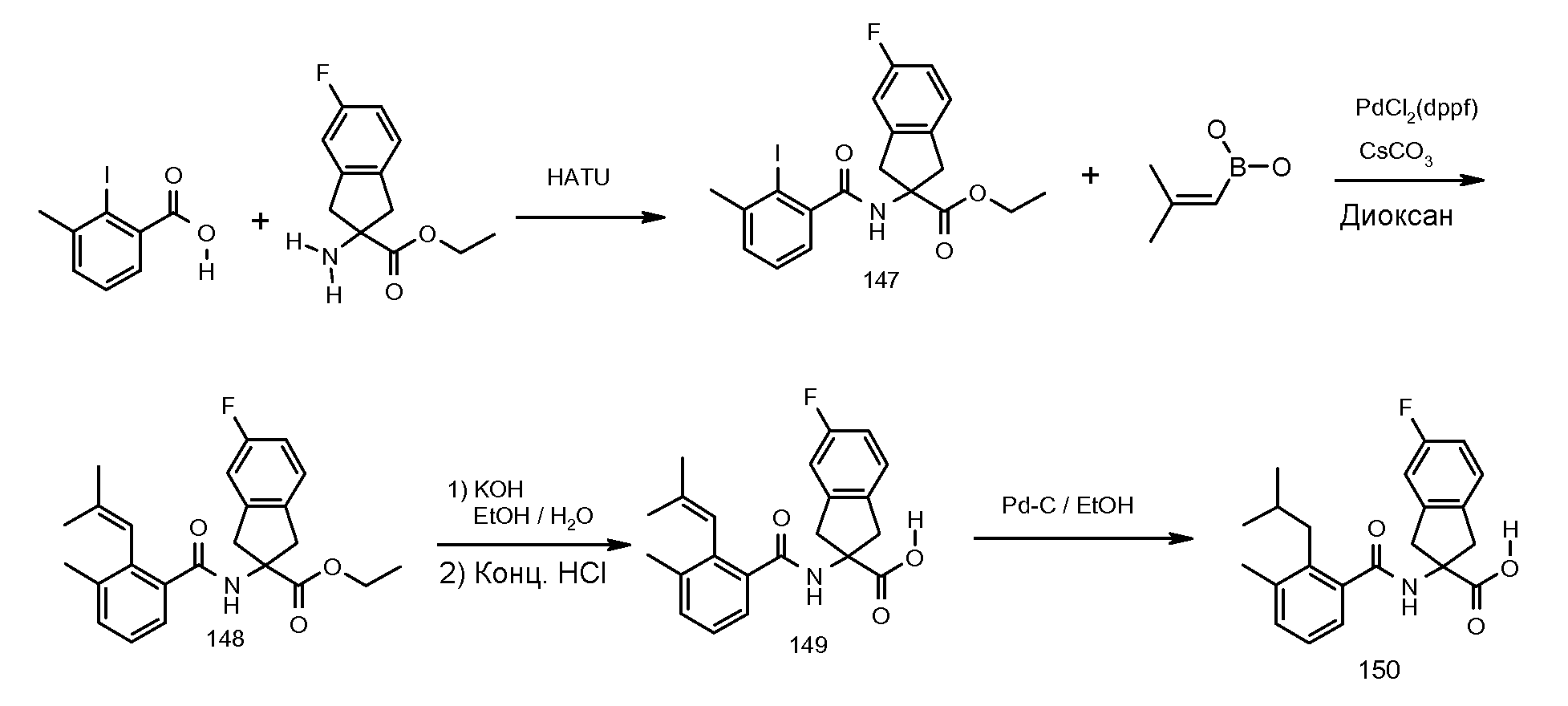
ПРИМЕР 147
Этиловый эфир 5-фтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (147):
К раствору 2-йод-3-метилбензойной кислоты (3,85 г, 14,7 ммоль), этилового эфира 2-амино-5-фториндан-2-карбоновой кислоты (3,00 г, 13,4 ммоль) и HATU (6,10 г, 16,1 ммоль) в безводном ДМФА (6 мл) добавляют DIPEA (3,30 мл, 20,1 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток перекристаллизовывают из EtOAc с получением чистого продукта (147) в виде твердого вещества белого цвета (3,90 г, 62%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,44 (с, 3H), 3,45-3,67 (м, 4H), 4,28 (кв, 2H), 6,32 (с, 1H), 6,85-6,94 (м, 2H), 7,12-7,26 (м, 4H)
ЖХ/МС (ES+) m/z=468,03
ПРИМЕР 148
Этиловый эфир 5-фтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (148):
К раствору этилового эфира 5-фтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,85 ммоль) и 2,2-диметилэтиленбороновой кислоты (342 мг, 3,42 ммоль) в EtOH (10 мл) и диоксане (5 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 186 мг, 8,5% ммоль) и 2М водный раствор K2SO4 (1,71 мл, 3,42 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 120°C, 7 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (148) в виде бесцветного масла (245 мг, 73%).
1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 1,34 (д, 3H), 1,71 (дд, 3H), 2,15 (с, 3H), 3,25 (уш.дд, 2H), 3,65 (уш.дд, 2H), 4,24 (кв, 2H), 6,12 (с, 1H), 6,86-6,92 (м, 2H), 7,19-7,26 (м, 4H), 7,65 (д, 1H)
ЖХ/МС (ES+) m/z=396,18
ПРИМЕР 149
5-Фтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (149):
Смесь этилового эфира 5-фтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (148) (245 мг, 0,62 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (149) в виде твердого вещества белого цвета (230 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,32 (с, 3H), 1,73 (с, 3H), 2,15 (с, 3H), 3,27 (т, 2H), 3,68 (дд, 2H), 6,12 (с, 1H), 6,86-6,93 (м, 2H), 7,13-7,30 (м, 4H), 7,61 (д, 1H)
ЖХ/МС (ES+) m/z=368,10
ПРИМЕР 150
5-Фтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (150):
К раствору 2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (149) (230 мг, 0,63 ммоль) в уксусной кислоте (10 мл) добавляют катализатор Pd-C (5% Pd по весу, 134 мг, 6,3% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 55 фунт/кв. дюйм, 95°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (150) в виде твердого вещества белого цвета (200 мг, 86%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,81 (дд, 6H), 1,78 (м, 1H), 2,30 (с, 3H), 2,68 (д, 2H), 3,37 (т, 2H), 3,69 (дд, 2H), 6,88-6,93 (м, 3H), 7,13-7,30 (м, 4H), 7,32 (с, 1H)
ЖХ/МС (ES+) m/z=370,19
ПРИМЕРЫ 151-152
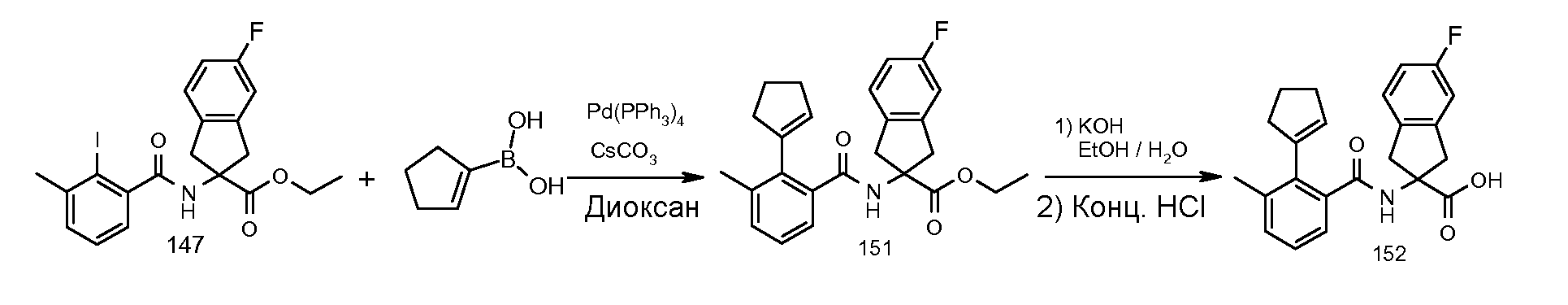
Этиловый эфир 2-(2-циклопент-1-енил-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (151):
К раствору этилового эфира 5-фтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,85 ммоль) и циклопентен-1-илбороновой кислоты (383 мг, 3,42 ммоль) в EtOH (10 мл) и диоксане (5 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 186 мг, 8,5% ммоль) и 2М водный раствор K2SO4 (1,71 мл, 3,42 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 8 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (151) в виде твердого вещества белого цвета (240 мг, 69%).
1Н ЯМР (CDCl3, 300МГц): δ 1,27 (т, 3H), 1,76 (м, 2H), 2,20 (с, 3H), 2,38-2,41 (м, 4H), 3,25 (дд, 2H), 3,66 (дд, 2H), 4,25 (кв, 2H), 5,62 (т, 1H), 6,87-6,93 (м, 2H), 7,12-7,30 (м, 4H), 7,53 (д, 1H), 8,39 (уш.с, 1H)
ЖХ/МС (ES+) m/z=408,22
ПРИМЕР 152
2-(2-Циклопент-1-енил-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота (152):
Смесь этилового эфира 2-(2-циклопент-1-енил-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (151) (190 мг, 0,47 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования осадка. Осадок фильтруют с получением чистого продукта (152) в виде твердого вещества белого цвета (182 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): δ 1,72 (м, 2H), 2,18 (с, 3H), 2,34 (т, 4H), 3,20 (т, 2H), 3,66 (дд, 2H), 5,55 (с, 1H), 6,84-6,89 (м, 2H), 7,07-7,26 (м, 4H), 7,56 (д, 1H)
ЖХ/МС (ES+) m/z=380,19
ПРИМЕР 153
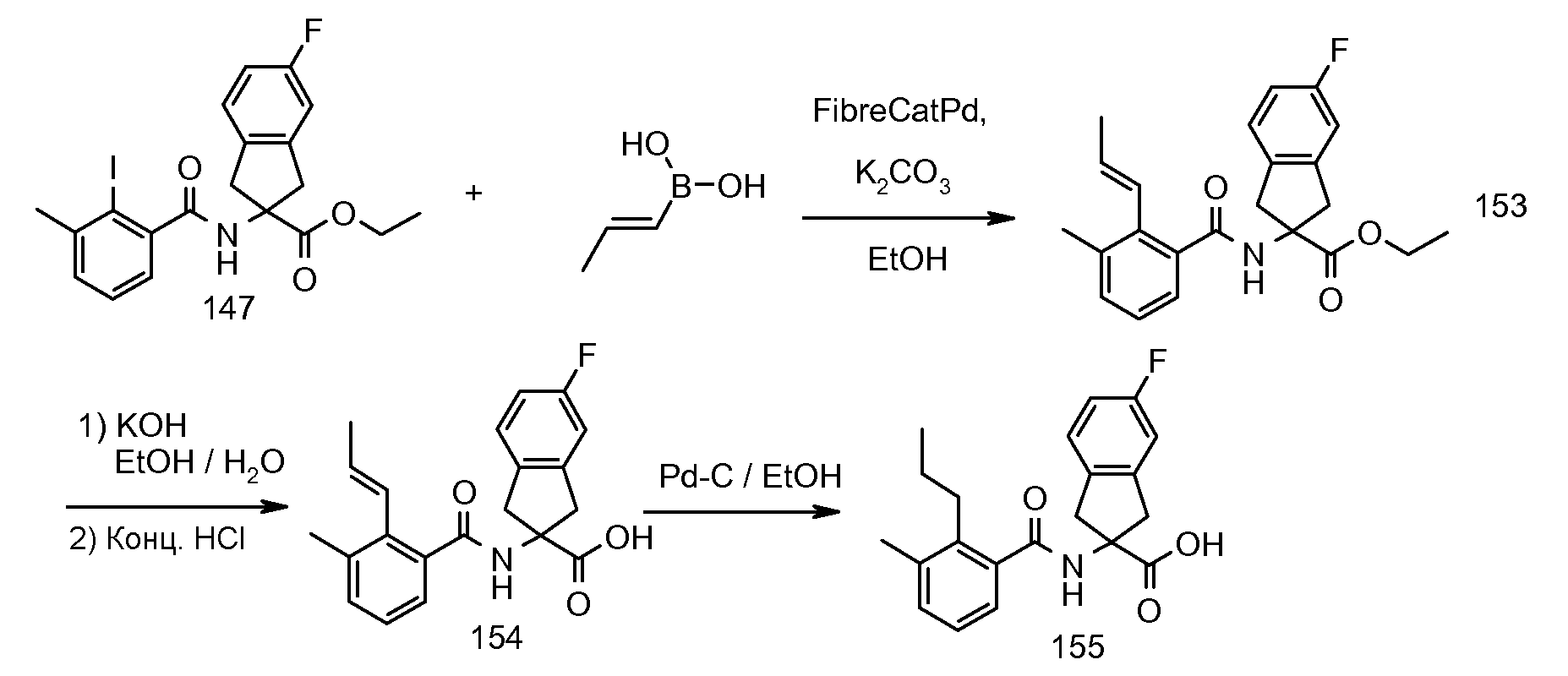
Этиловый эфир 5-фтор-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновой кислоты (153):
К раствору этилового эфира 5-фтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,85 ммоль) и транс-1-пропен-1-илбороновой кислоты (294 мг, 3,42 ммоль) в EtOH (10 мл) и диоксане (5 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 186 мг, 8,5% ммоль) и 2М водный раствор K2SO4 (1,71 мл, 3,42 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 7 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (153) в виде твердого вещества белого цвета (165 мг, 51%).
1Н ЯМР (CDCl3, 300МГц): δ 1,28 (т, 3H), 1,75 (м, 3H), 2,26 (с, 3H), 3,27 (дд, 2H), 3,62 (дд, 2H), 4,26 (кв, 2H), 5,76 (дкв, 1H), 6,38 (д, 1H), 6,44 (с, 1H), 6,85-6,91 (м, 2H), 7,11-7,22 (м, 3H), 7,35 (д, 1H)
ЖХ/МС (ES+) m/z=382,21
ПРИМЕР 154
5-Фтор-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновая кислота (154):
Смесь этилового эфира 5-фтор-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновой кислоты (153) (260 мг, 0,68 ммоль) и KOH (600 мг, 10,7 ммоль) растворяют в EtOH (8 мл) и воде (0,2 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 2,5 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Отфильтрованное соединение очищают ВЭЖХ с получением чистого продукта (154) в виде твердого вещества белого цвета (267 мг, 100%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,76 (м, 3H), 2,26 (с, 3H), 3,31 (т, 2H), 3,65 (дд, 2H), 5,76 (дкв, 1H), 6,38 (д, 1H), 6,80 (с, 1H), 6,85-6,93 (м, 2H), 7,10-7,22 (м, 3H), 7,31 (д, 1H)
ЖХ/МС (ES+) m/z=354,18
ПРИМЕР 155
5-Фтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (155):
5-Фтор-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновую кислоту (154) (270 мг, 0,76 ммоль) растворяют в абсолютном EtOH (15 мл) путем нагревания. Полученный раствор охлаждают до комнатной температуры в атмосфере аргона и затем добавляют катализатор Pd-C (5% Pd по весу, 125 мг, 5,9% ммоль). Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 50 фунт/кв. дюйм, 50°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (155) в виде твердого вещества белого цвета (210 мг, 78%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,92 (т, 3H), 1,46 (м, 2H), 2,30 (с, 3H), 2,65-2,68 (м, 2H), 3,36 (т, 2H), 3,71 (дд, 2H), 6,85-6,93 (м, 2H), 7,03-7,18 (м, 4H)
ЖХ/МС (ES+) m/z=356,14
ПРИМЕР 156
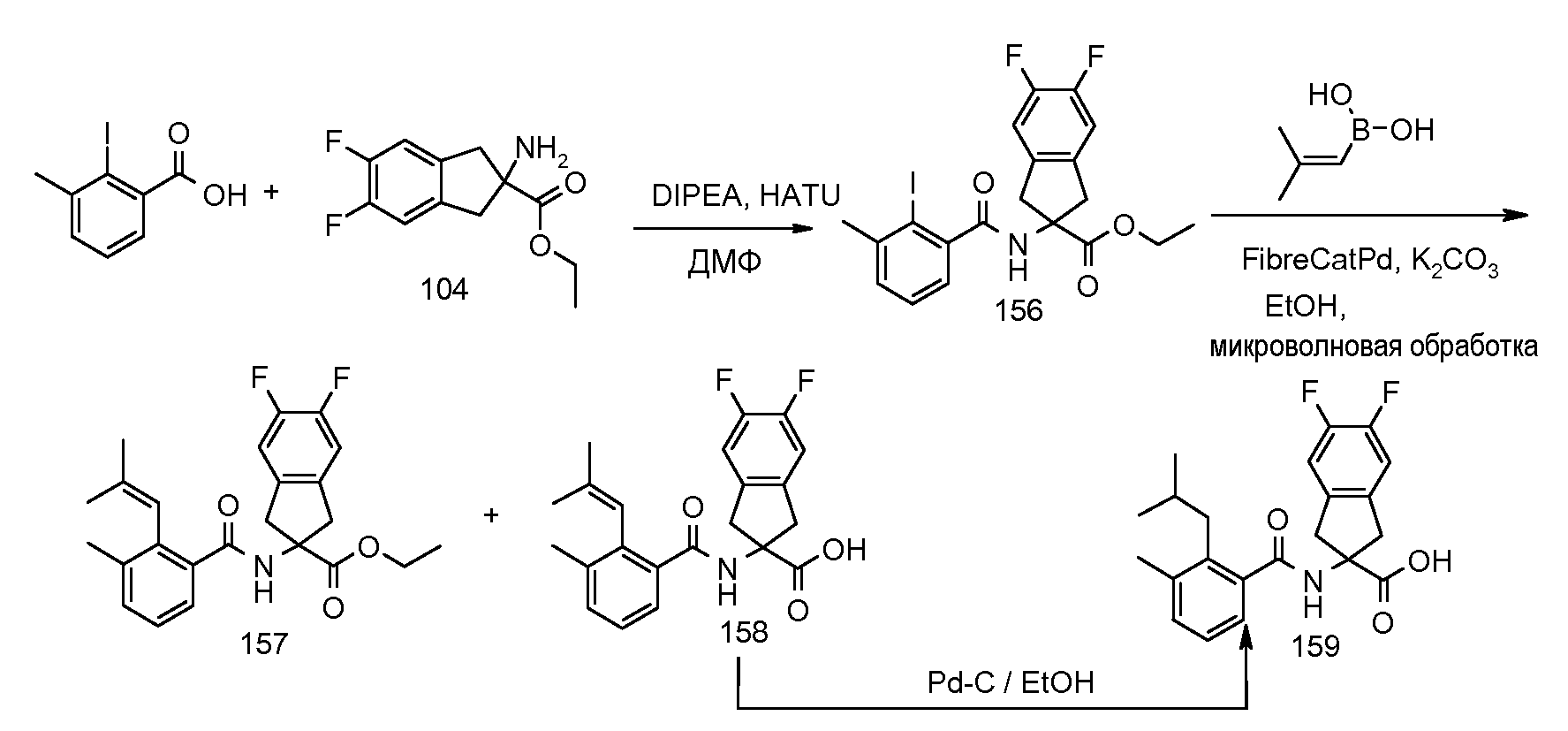
Этиловый эфир 5,6-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (156):
К раствору 2-йод-3-метилбензойной кислоты (1,50 г, 5,75 ммоль), этилового эфира 2-амино-5,6-дифториндан-2-карбоновой кислоты (1,39 г, 5,75 ммоль) и HATU (2,63 г, 6,90 ммоль) в безводном ДМФА (6 мл) добавляют DIPEA (1,14 мл, 6,90 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (200 мл) и промывают водой (1×20 мл) и насыщенным раствором соли (2×20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (400 г силикагеля, градиентное элюирование: 10%-80% EtOAc в гептане) с получением чистого продукта (156) в виде твердого вещества белого цвета (2,32 г, 83%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,45 (с, 3H), 3,48 (д, 2H), 3,63 (д, 2H), 4,27 (кв, 2H), 6,38 (с, 1H), 7,04 (т, 2H), 7,10-7,13 (м, 1H), 7,24-7,27 (м, 2H)
ЖХ/МС (ES+) m/z=486,02
ПРИМЕРЫ 157 и 158
Этиловый эфир 5,6-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (157) и 5,6-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (158):
К раствору этилового эфира 5,6-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,82 ммоль) и 2,2-диметилэтиленбороновой кислоты (328 мг, 3,28 ммоль) в EtOH (10 мл) и диоксане (5 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 180 мг, 8,2% ммоль) и 2М водный раствор K2SO4 (1,64 мл, 3,28 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 120°C, 6 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением двух чистых продуктов: (157) в виде твердого вещества белого цвета (100 мг, 29%) и (158) также в виде твердого вещества белого цвета (120 мг, 38%).
(157): 1Н ЯМР (CDCl3, 300МГц): δ 1,26 (т, 3H), 1,38 (д, 3H), 1,76 (с, 3H), 2,15 (с, 3H), 3,27 (д, 2H), 3,59 (д, 2H), 4,24 (кв, 2H), 6,14 (с, 1H), 6,98-7,31 (м, 5H), 7,61 (д, 1H)
ЖХ/МС (ES+) m/z=414,20
(158): 1Н ЯМР (CDCl3, 300МГц): δ 1,34 (д, 3H), 1,79 (с, 3H), 2,15 (с, 3H), 3,26 (д, 2H), 3,75 (д, 2H), 6,09 (с, 1H), 7,02 (т, 2H), 7,21-7,34 (м, 3H), 7,77 (д, 1H)
ЖХ/МС (ES+) m/z=386,19
ПРИМЕР 159
5,6-Дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (159):
5,6-Дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновую кислоту (158) (200 мг, 0,63 ммоль) растворяют в уксусной кислоте (15 мл) путем нагревания. Полученный раствор охлаждают до комнатной температуры и затем в атмосфере аргона добавляют катализатор Pd-C (5% Pd по весу, 134 мг, 6,3% ммоль). Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 55 фунт/кв. дюйм, 95°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (159) в виде твердого вещества белого цвета (170 мг, 84%).
(159): 1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,83 (д, 6H), 1,80 (м, 1H), 2,32 (с, 3H), 2,68 (д, 2H), 3,39 (д, 2H), 7,00-7,20 (м, 5H), 7,44 (с, 1H)
ЖХ/МС (ES+) m/z=388,17
ПРИМЕРЫ 160-161
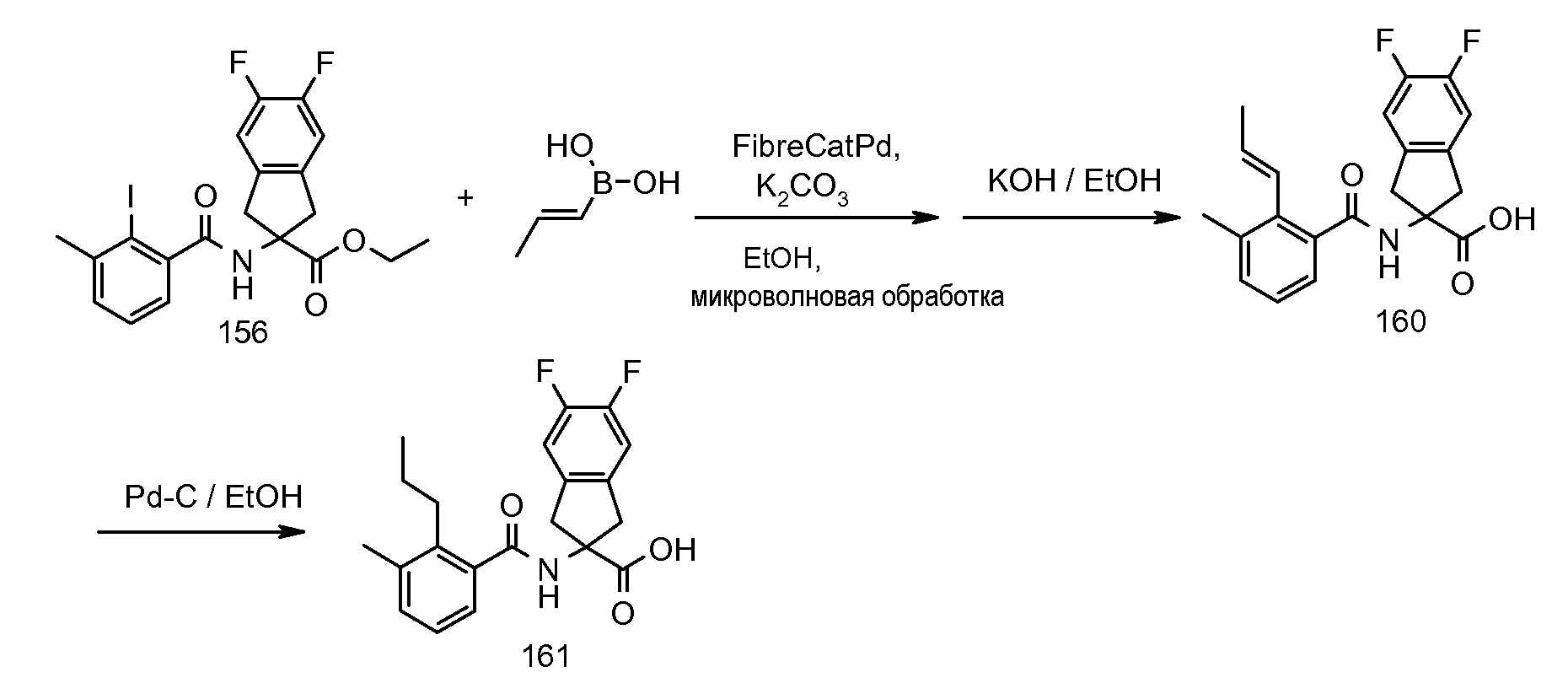
5,6-Дифтор-2-(3-метил-2-пропенилбензоиламино)индан-2-карбоновая кислота (160):
К раствору этилового эфира 5,6-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,82 ммоль) и транс-1-пропен-1-илбороновой кислоты (282 мг, 3,28 ммоль) в EtOH (10 мл) и диоксане (5 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 180 мг, 8,2% ммоль) и 2М водный раствор K2SO4 (1,64 мл, 3,28 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 120°C, 5 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением твердого вещества белого цвета (160 мг), которое растворяют в EtOH (5 мл) и воде (0,2 мл) вместе с KOH (600 мг, 10,7 ммоль) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Фильтрат очищают ВЭЖХ с получением чистого продукта (160) в виде твердого вещества белого цвета (полный выход 127 мг, 42%).
1Н ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,80 (дд, 3H), 2,27 (с, 3H), 3,36 (д, 2H), 3,63 (д, 2H), 5,77 (дкв, 1H), 6,40 (д, 1H), 7,01 (т, 2H), 7,10-7,29 (м, 4H)
ЖХ/МС (ES+) m/z=372,15
ПРИМЕР 161
5,6-Дифтор-2-(3-метил-2-пропилбензоиламино)индан-2-карбоновая кислота (161):
5,6-Дифтор-2-[3-метил-2-(пропенил)бензоиламино]индан-2-карбоновую кислоту (160) (110 мг, 0,30 ммоль) растворяют в абсолютном EtOH (15 мл) путем нагревания. Полученный раствор охлаждают до комнатной температуры и добавляют в атмосфере аргона катализатор Pd-C (5% Pd по весу, 64 мг, 3,0% ммоль). Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 55 фунт/кв. дюйм, 50°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный раствор EtOH концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (161) в виде твердого вещества белого цвета (80 мг, 71%).
1H ЯМР (ДМСО-d6, 300МГц): δ 0,86 (кв, 3H), 1,40 (м, 2H), 2,27 (с, 3H), 2,58 (м, 2H), 3,29 (д, 2H), 3,52 (д, 2H), 7,00 (д, 1H), 7,08 (т, 1H), 7,18 (д, 1H), 7,29 (т, 2H), 8,87 (с, 1H), 12,58 (с, 1H)
ЖХ/МС (ES+) m/z=374,14
ПРИМЕР 162
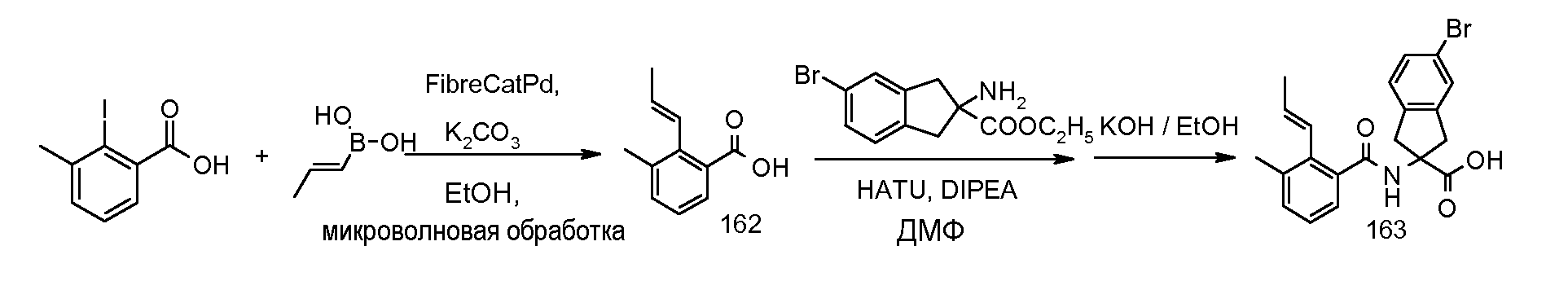
3-Метил-2-((E)-пропенил)бензойная кислота (162):
К раствору 2-йод-3-метилбензойной кислоты (708 мг, 2,70 ммоль) и транс-1-пропен-1-илбороновой кислоты (526 мг, 6,12 ммоль) в EtOH (10 мл) добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 235 мг, 0,15 ммоль) и 2М водный раствор K2SO4 (3,06 мл, 6,12 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 7 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением чистого продукта (162) в виде твердого вещества бледно-желтого цвета (500 мг, 93%).
1Н ЯМР (CDCl3, 300МГц): δ 1,90 (дд, 3H), 2,34 (с, 3H), 5,68 (дкв, 1H), 6,67 (д, 1H), 7,20 (т, 1H), 7,35 (д, 1H), 7,70 (д, 1H)
ЖХ/МС (ES+) m/z=177,10, 218,13
ПРИМЕР 163
5-Бром-2-[3-метил-2-((E)-пропенил)бензоиламино]индан-2-карбоновая кислота (163):
К раствору 3-метил-2-((E)-пропенил)бензойной кислоты (162) (470 мг, 2,67 ммоль), этилового эфира 2-амино-5-броминдан-2-карбоновой кислоты (835 мг, 2,94 ммоль) и HATU (1,22 мг, 3,20 ммоль) в безводном ДМФА (12 мл) добавляют DIPEA (529 мкл, 3,20 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (300 г силикагеля, градиентное элюирование: 5-60% EtOAc в гептане) с получением твердого вещества белого цвета (1,12 г), которое растворяют в EtOH (15 мл) и воде (1 мл) вместе с KOH (1,20 г, 21 ммоль) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 4 часов. После концентрирования в вакууме остаток растворяют в воде (100 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Отфильтрованное соединение очищают ВЭЖХ с получением чистого продукта (163) в виде твердого вещества белого цвета (полный выход 1,03 г, 93%).
1Н ЯМР (CDCl3, 300МГц): δ 1,74 (дд, 3H), 2,25 (с, 3H), 3,30 (дд, 2H), 3,74 (дд, 2H), 5,73 (дкв, 1H), 6,32 (д, 1H), 6,51 (с, 1H), 7,08-7,38 (м, 6H)
ЖХ/МС (ES+) m/z=414,09, 416,09
ПРИМЕР 164
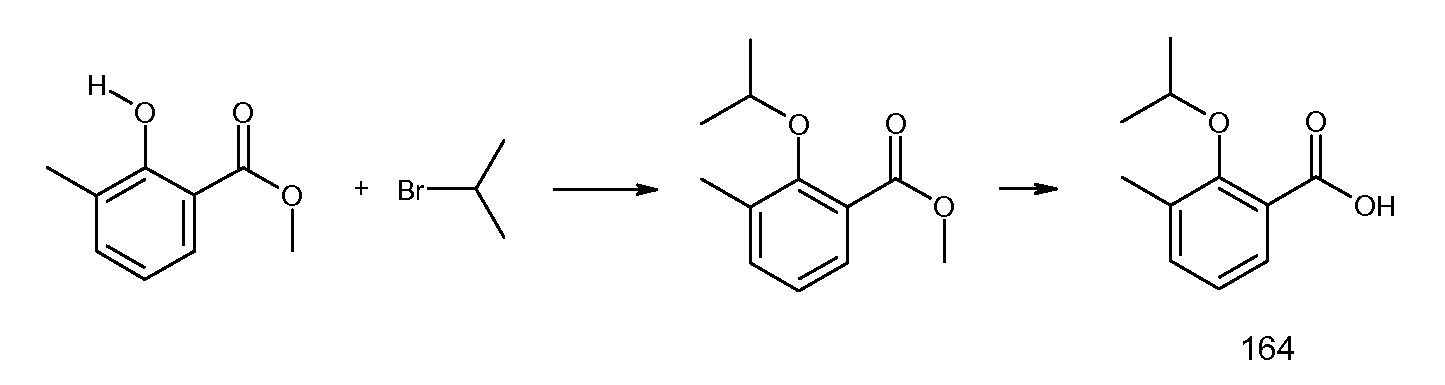
2-Изопропокси-3-метилбензойная кислота (164):
В круглодонную колбу объемом 250 мл помещают метил 2-гидрокси-3-метилбензоат (10 г, 60,18 ммоль) и сухой N,N-диметилформамид (ДМФА, 120 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 2 минуты добавляют 2-бромпропан (8,1 мл, 86,65 ммоль) через шприц. Последовательно добавляют KI (20 мг, кат.) и Cs2CO3 (44,42 г, 136,32 ммоль). Реакционную смесь герметизируют. На реакционную колбу устанавливают колбонагреватель и доводят температуру до 43°C. По истечении 4 дней анализ ТСХ (силикагель, 1:3 EtOAc:гептан) показывает, что исходный фенол израсходован и обращен в единую точку, наблюдаемую при УФ-анализе. Источник тепла удаляют от реакционной колбы. После дополнительного перемешивания в течение 2 часов при комнатной температуре содержимое реакционной колбы фильтруют через слой целита. Слой целита промывают смесью EtOAc:гептан (1:1, 200 мл). Фильтрат переносят в делительную воронку и промывают насыщенным раствором соли (100 мл), водой (100 мл) и насыщенным водным раствором NaHCO3 (100 мл). Данную последовательность промывания повторяют (1 раз) и завершают промыванием насыщенным раствором соли (50 мл). Органический слой сушат над MgSO4, фильтруют и выпаривают в вакууме. Откачиванием до постоянного веса получают 11,88 г масла бледно-желтого цвета. В колбу объемом 250 мл, содержащую вышеуказанный продукт, помещают 1,4-диоксан (50 мл) и MeOH (100 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (50 мл) и затем гидрат LiOH (5,7 г, 135,8 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, 55 мл). Содержимое колбы переносят в делительную воронку, содержащую EtOAc (100 мл). Слои разделяют. Водный слой экстрагируют EtOAc (50 мл). Объединенные органические экстракты промывают водой (50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Откачиванием до постоянного веса получают 10,19 г (52,46 ммоль, 87,18%) твердого вещества не совсем белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,18 (д, 6H), 2,22, (с, 3H), 4,19 (м, 1H), 7,03 (дд, 1H), 7,38, (дд, 1H), 7,48 (дд, 1H)
ЖХ/МС m/z=195
ПРИМЕР 165
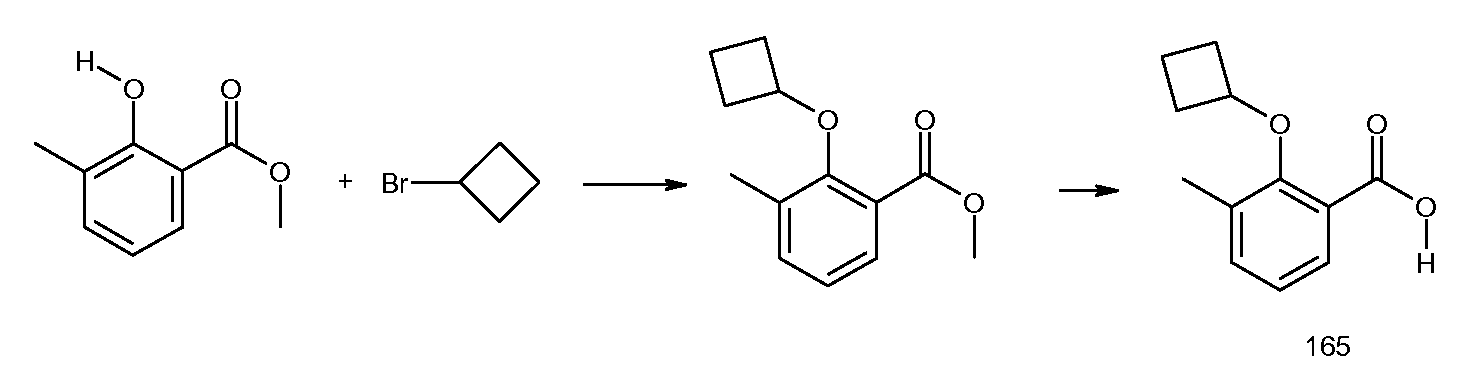
2-Циклобутокси-3-метилбензойная кислота (165):
В круглодонную колбу объемом 100 мл помещают метил 2-гидрокси-3-метилбензоат (5 г, 30,09 ммоль) и сухой N,N-диметилформамид (ДМФА, 60 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 2 минуты добавляют бромциклобутан (5 г, 37,04 ммоль) через шприц. Последовательно добавляют йодид калия (10 мг, кат.) и Cs2CO3 (22,21 г, 68,16 ммоль). Реакционную смесь герметизируют. На реакционную колбу устанавливают колбонагреватель и доводят температуру до 43°C. По истечении 4 дней анализ ТСХ (силикагель, 1:3 EtOAc:гептан) показывает, что исходный фенол израсходован и обращен в единую точку, наблюдаемую при УФ-анализе. Источник тепла удаляют от реакционной колбы. После дополнительного перемешивания в течение 16 часов при комнатной температуре содержимое реакционной колбы фильтруют через слой целита. Слой целита промывают смесью EtOAc:гептан (1:1, 200 мл). Фильтрат переносят в делительную воронку и промывают насыщенным раствором соли (50 мл), водой (50 мл) и насыщенным водным раствором NaHCO3 (50 мл). Данную последовательность промывания повторяют (1 раз) и завершают промыванием насыщенным раствором соли (50 мл). Органический слой сушат над MgSO4, фильтруют и выпаривают в вакууме. Откачиванием до постоянного веса получают 5,94 г масла бледно-желтого цвета. В колбу объемом 100 мл, содержащую вышеуказанный продукт, помещают 1,4-диоксан (30 мл) и MeOH (30 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (10 мл) и затем гидрат LiOH (2,80 г, 66,78 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, 30 мл). Содержимое колбы переносят в делительную воронку, содержащую EtOAc (80 мл). Слои разделяют. Водный слой экстрагируют EtOAc (40 мл). Объединенные органические экстракты промывают водой (50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Откачиванием до постоянного веса получают 5,3 г (25,70 ммоль, 85,40%) твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,37 (м, 1H), 1,42 (м, 1H), 2,02-2,26, (м, 4H), 2,22 (с, 3H) 4,35 (м, 1H), 7,03 (дд, 1H), 7,36, (дд, 1H), 7,47 (дд, 1H)
ЖХ/МС m/z=207
ПРИМЕР 166
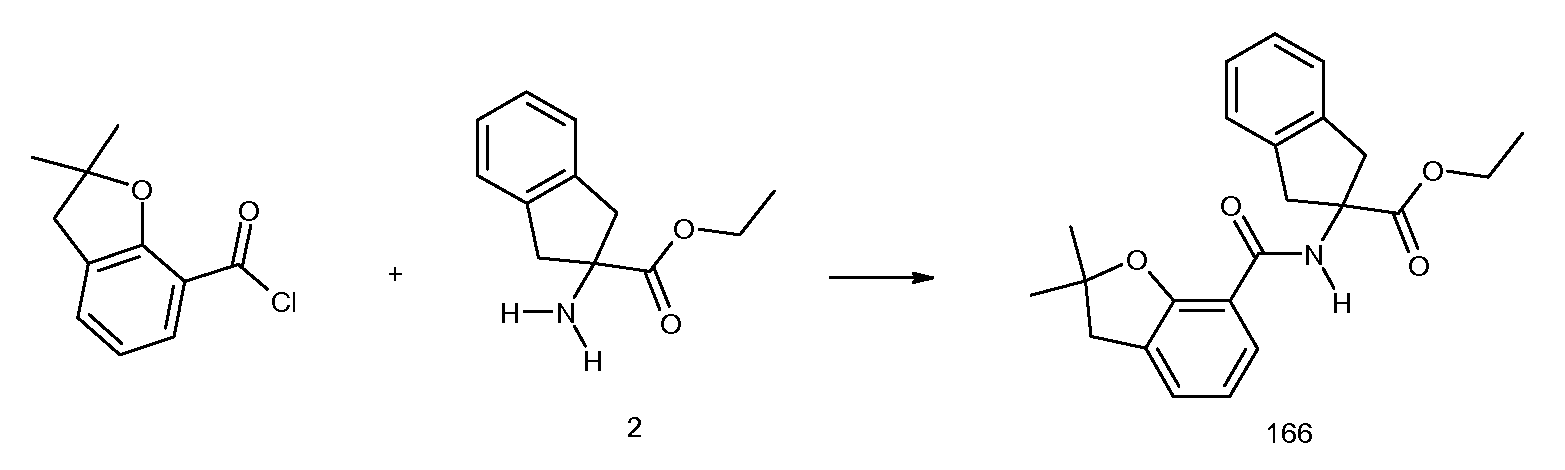
Этиловый эфир 2-[(2,2-диметил-2,3-дигидробензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (166):
В пробирку (25×150 мм), содержащую магнитную мешалку и этиловый эфир 2-аминоиндан-2-карбоновой кислоты (0,5 г, 2,436 ммоль), помещают сухой DCM (3 мл). Начинают перемешивать. После растворения добавляют DIPEA (1,50 мл, 8,6 ммоль) и 4-диметиламинопиридин (2 мг, 17 мкмоль). В пробирку добавляют раствор 2,2-диметил-2,3-дигидро-1-бензофуран-7-карбонилхлорида (0,73 г, 3,47 ммоль) в сухом DCM (4 мл). После перемешивания в течение 18 часов анализ ТСХ (силикагель, 10% CH3OH в DCM) показывает полный расход исходного амина. Реакционную смесь разбавляют DCM (10 мл), промывают 5% водным раствором HCl (2×5 мл), насыщенным раствором соли (5 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 0,72 г светло-коричневого смолистого вещества. Это вещество очищают хроматографией (силикагель, от 0% до 20% EtOAc в DCM) на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Фракции 17-22 объединяют, выпаривают и откачивают до постоянного веса, получая 0,62 г (67%) стекловидного твердого вещества.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,14 (т, 3H), 1,37 (с, 6H), 3,03, (с, 2H), 3,43 (дд, 4H), 4,12 (кв, 2H), 6,91 (дд, 1H), 7,16-7,27 (м, 4H), 7,35 (дд, 1H), 7,56 (д, 1H), 8,32 (с, 1H)
ЖХ/МС m/z=380
ПРИМЕР 167
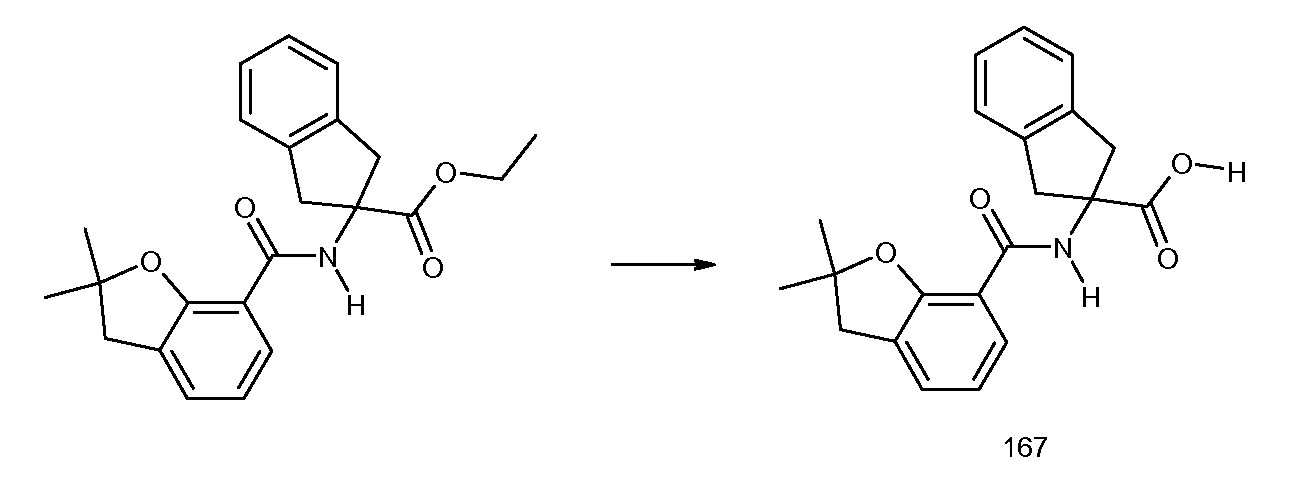
2-[(2,2-Диметил-2,3-дигидробензофуран-7-карбонил)амино]индан-2-карбоновая кислота (167):
В круглодонную колбу объемом 50 мл, содержащую этиловый эфир 2-[(2,2-диметил-2,3-дигидробензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (0,45 г, 1,179 ммоль), помещают MeOH (25 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют воду (8 мл) и LiOH (108 мг, 2,58 ммоль). По истечении 56 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 3, постепенно добавляя разбавленный водный раствор HCl (3%, ~20 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (30 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 460 мг продукта. Образец очищают колоночной хроматографией (силикагель, от 2% до 15% CH3OH в DCM), используя систему очистки ISCO Companion и 12 г картридж. Фракцию 3 собирают и выпаривают. После откачивания до постоянного веса получают 375 мг (90%) сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,36 (с, 6H) 2,99, (с, 2H), 3,40 (дд, 4H), 6,88 (дд, 1H), 7,11-7,20 (м, 4H), 7,30 (дд, 1H), 7,57 (д, 1H), 8,34 (с, 1H)
ЖХ/МС m/z=352
ПРИМЕР 168
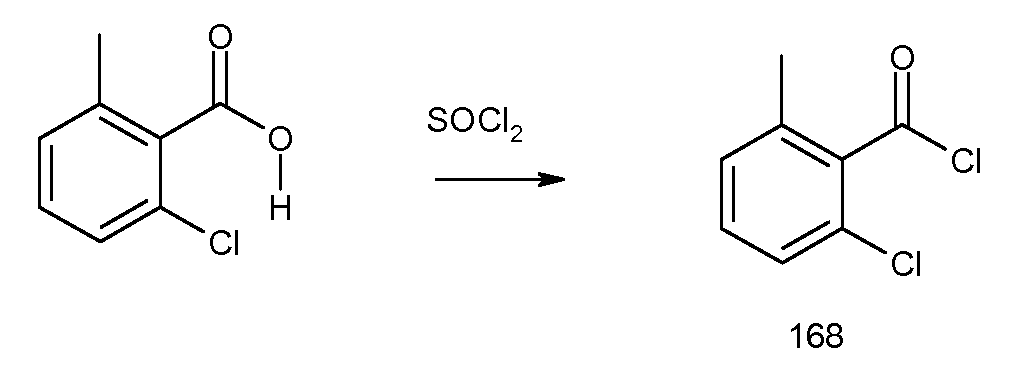
2-Хлор-6-метилбензоилхлорид (168):
В круглодонную колбу, содержащую 2-хлор-6-метилбензойную кислоту (1,5 г, 8,79 ммоль) и магнитную мешалку, помещают сухой DCM (10 мл). Начинают перемешивать. По истечении нескольких минут добавляют через шприц раствор тионилхлорида (в DCM (2M), 6,6 мл, 13,2 ммоль). Затем добавляют 2 капли ДМФА. Реакция сразу начинает слегка кипеть. Через 2 часа кипение прекращается. Через 3 часа растворитель удаляют из реакционной смеси в вакууме. Маслянистый остаток повторно растворяют в DCM (6 мл) и растворитель вновь удаляют в вакууме. Остаток растворяют в сухом DCM (6 мл) и используют без дальнейшей очистки на следующей стадии реакции.
ПРИМЕР 169
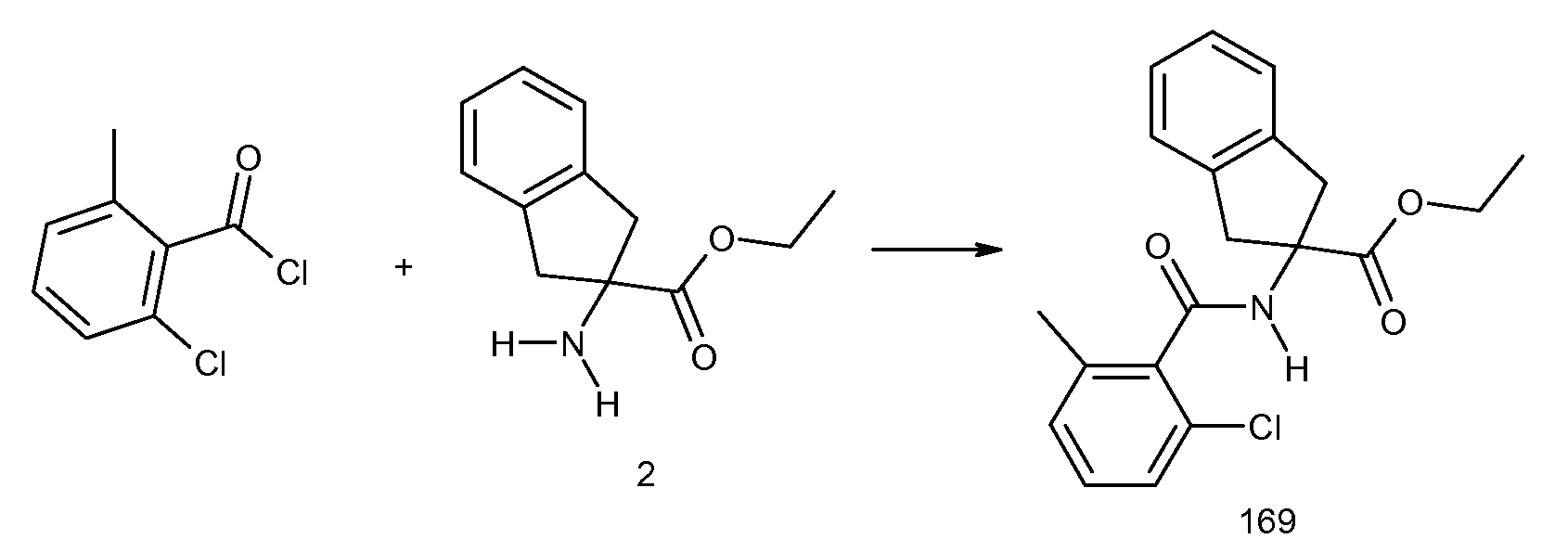
Этиловый эфир 2-[(2-хлор-6-метилбензоил)амино]индан-2-карбоновой кислоты (169):
В пробирку (25×150 мм), содержащую магнитную мешалку и этиловый эфир 2-аминоиндан-2-карбоновой кислоты (0,53 г, 2,58 ммоль), помещают сухой DCM (3 мл). Начинают перемешивать. После растворения добавляют DIPEA (1,50 мл, 8,6 ммоль) и 4-диметиламинопиридин (2 мг, 17 мкмоль). В реакционную пробирку добавляют раствор 2-хлор-6-метилбензоилхлорида (5,8 ммоль) в сухом DCM (4 мл) согласно описанному выше способу. После перемешивания в течение 18 часов анализ ТСХ (силикагель, 10% CH3OH в DCM) показывает полный расход амина. Реакционную смесь разбавляют DCM (10 мл), промывают 5% водным раствором HCl (2×5 мл), насыщенным раствором соли (5 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 1,07 г светло-коричневого твердого вещества. Это вещество очищают хроматографией (силикагель, от 2% до 20% EtOAc в DCM) на 40 г картридже, используя систему очистки ISCO Companion. Фракции 6-10 объединяют, выпаривают и откачивают до постоянного веса 550 мг аморфного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,19 (т, 3H) 3,33, (с, 3H), 3,45 (дд, 4H), 4,13 (кв, 2H), 6,88 (дд, 1H), 7,12-7,47 (м, 7H), 9,11 (с, 1H)
ЖХ/МС m/z=358
ПРИМЕР 170
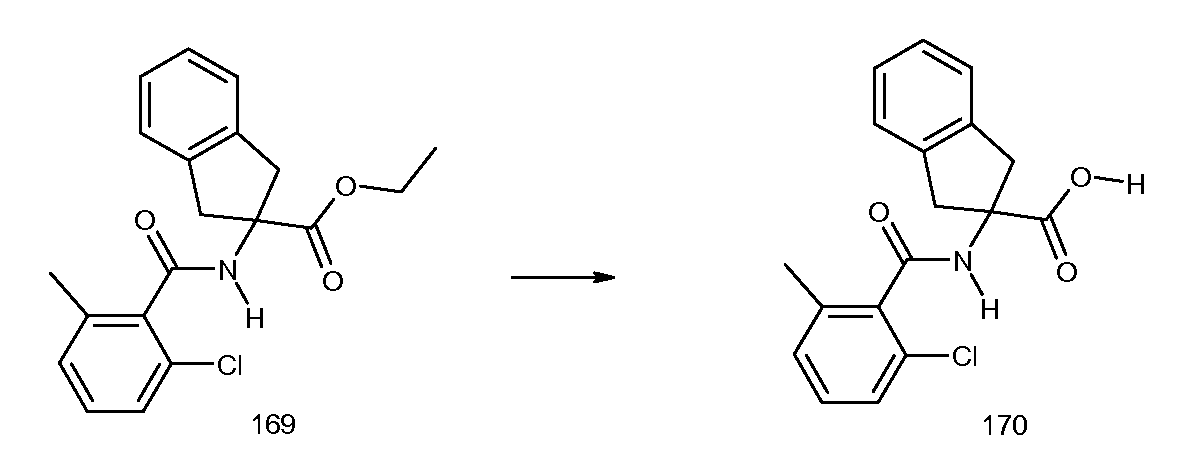
2-[(2-Хлор-6-метилбензоил)амино]индан-2-карбоновая кислота (170):
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-(2-хлор-6-метилбензоиламино)индан-2-карбоновой кислоты (0,255 г, 0,712 ммоль), помещают MeOH (15 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют воду (5 мл), и начинает осаждаться исходный продукт. Для повторного растворения исходного продукта добавляют тетрагидрофуран. Добавляют LiOH (90 мг, 2,14 ммоль). По истечении 16 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 3, постепенно добавляя разбавленный водный раствор HCl (3%, ~20 мл). Содержимое колбы сливают в капельную воронку, содержащую DCM (30 мл). Слои разделяют. Водный слой экстрагируют DCM (20 мл). Объединенные органические экстракты промывают водой (30 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют с получением 280 мг продукта. Продукт очищают колоночной хроматографией (силикагель, от 2% до 15% CH3OH в DCM) на 12 г картридже, используя систему очистки ISCO Companion. Фракцию 2 собирают и выпаривают. Откачиванием до постоянного веса получают 130 мг сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,27, (с, 3H), 3,45 (дд, 4H), 7,14-7,39 (м, 7H), 8,96 (с, 1H)
ЖХ/МС m/z=330
ПРИМЕР 171
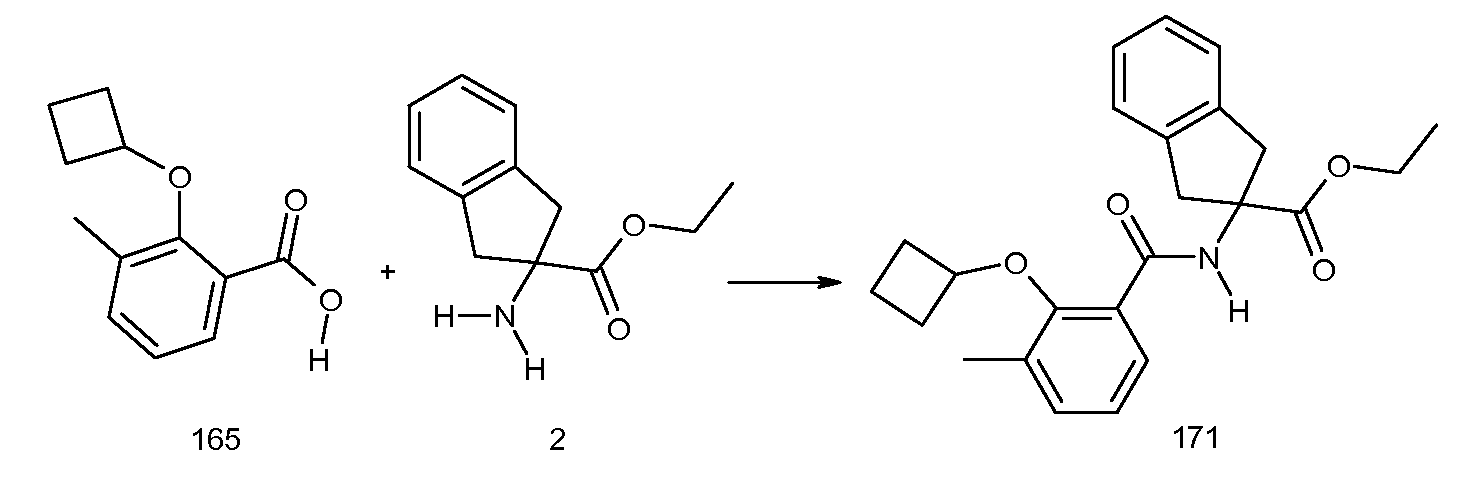
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (171):
В колбу объемом 25 мл, содержащую магнитную мешалку, помещают 2-циклобутокси-3-метилбензойную кислоту (1,01 г, 4,87 ммоль) и сухой DCM (14 мл). Начинают перемешивать. Добавляют HBTU (1,84 г, 4,86 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1 г, 4,87 ммоль) и затем DIPEA (1,9 мл, 10,92 ммоль). Реакционную смесь перемешивают в течение 12 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) показывает полный расход исходного амина. Содержимое реакционной колбы разбавляют EtOAc (70 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (3%, 35 мл), насыщенным водным раствором NaHCO3 (35 мл) и насыщенным раствором соли (35 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 2,56 г твердого вещества не совсем белого цвета. Данный продукт растворяют в 15 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 10 объемов колонки и затем 100% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 7-22 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 1,73 г аморфного вещества белого цвета.
ПРИМЕР 172
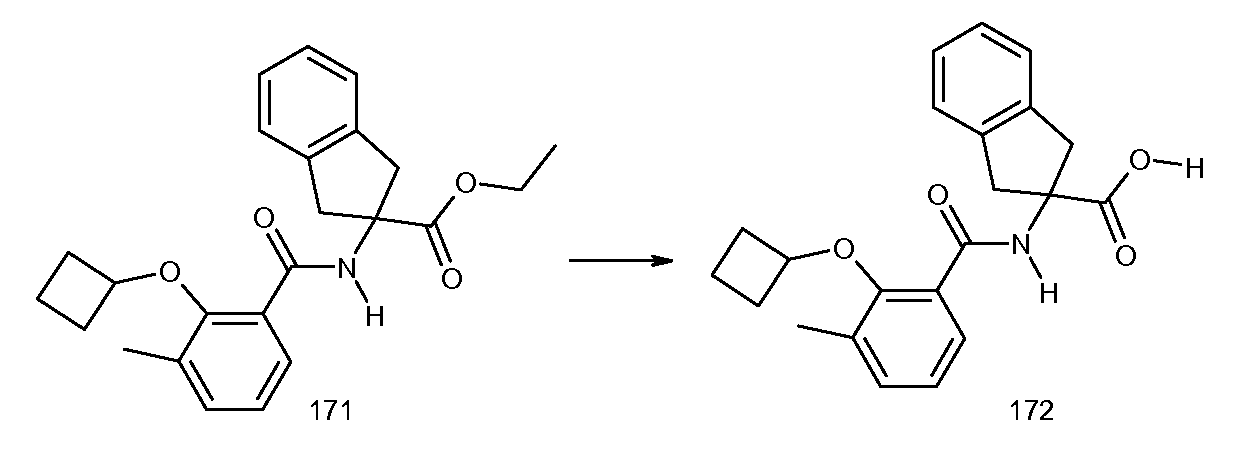
2-(2-Циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (172):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(2-циклобутокси-3-метилбензоил)амино]индан-2-карбоновой кислоты (1,72 г, 4,37 ммоль), помещают 1,4-диоксан (16 мл) и MeOH (16 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (8 мл) и затем LiOH (458 мг, 10,91 ммоль). По истечении 20 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~25 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (60 мл). Слои разделяют. Водный слой экстрагируют EtOAc (30 мл). Объединенные органические экстракты промывают водой (35 мл) и насыщенным раствором соли (35 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 1,58 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,16-1,27 (м, 1H), 1,38-1,53 (м, 1H), 1,78-2,03 (м, 4H), 2,23, (с, 3H), 3,44 (дд, 4H), 4,34 (м, 1H), 7,03 (дд, 1H), 7,17-7,37 (м, 6H), 8,64 (с, 1H), 12,59 (уш.с, 1H)
ЖХ/МС m/z=364
ПРИМЕР 173
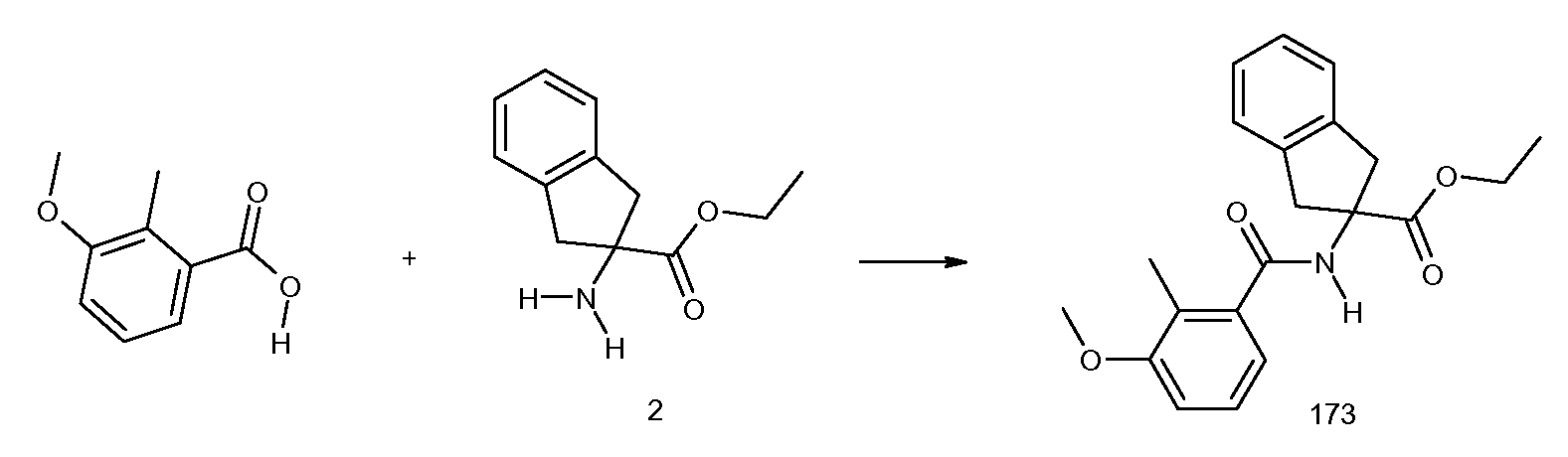
Этиловый эфир 2-(3-метокси-2-метилбензоиламино)индан-2-карбоновой кислоты (173):
В круглодонную колбу объемом 100 мл помещают этиловый эфир 2-аминоиндан-2-карбоновой кислоты (750 мг, 3,65 ммоль) и сухой DCM (10 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют HBTU (1,38 г, 3,65 ммоль). Через 2 минуты добавляют 2-метил-3-метоксибензойную кислоту (0,61 г, 3,65 ммоль) и DIPEA (1,5 мл, 8,6 ммоль). Реакционную смесь перемешивают в течение 36 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) показывает полный расход исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,1 г густого смолистого вещества коричневатого цвета. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 15% EtOAc в гептане пропускают через 2 объема колонки, затем ступенчатый градиент 30% EtOAc, затем 50% и затем 70% EtOAc через 3 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 35 мл. Фракции 15-21 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают твердое вещество белого цвета (1,15 г).
1H ЯМР (300 МГц, ДМСО-d6): δ 1,19 (т, 3H), 2,12 (с, 3H), 3,54 (дд, 4H), 3,78 (с, 3H), 4,12 (кв, 2H), 6,79 (д, 1H), 6,99 (д, 1H), 7,14-7,24 (м, 6H), 8,97 (с, 1H)
ЖХ/МС m/z=354
ПРИМЕР 174
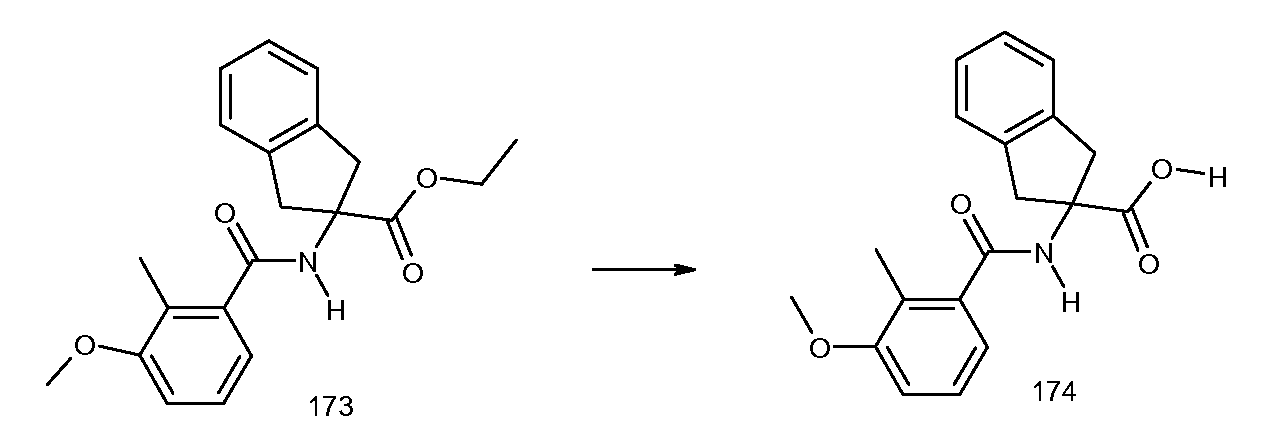
2-(3-Метокси-2-метилбензоиламино)индан-2-карбоновая кислота (174):
В колбу объемом 40 мл, содержащую этиловый эфир 2-(3-метокси-2-метилбензоиламино)индан-2-карбоновой кислоты (0,65 г, 1,84 ммоль), помещают ТГФ (10 мл), MeOH (10 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют воду (5 мл) и затем LiOH (267 мг, 6,36 ммоль). По истечении 36 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в капельную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют с получением 620 мг аморфного вещества белого цвета. Образец очищают колоночной хроматографией (силикагель, от 2% до 15% CH3OH в DCM) на 40 г картридже, используя систему очистки ISCO Companion. Фракции 14-16 объединяют и выпаривают при откачивании до постоянного веса, получая 380 мг сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,11, (с, 3H), 3,44 (дд, 4H), 3,77, (с, 3H), 6,79 (д, 1H), 6,97 (д, 1H), 7,13-7,23 (м, 5H), 8,82 (с, 1H), 12,49 (с, 1H)
ЖХ/МС m/z=326
ПРИМЕР 175
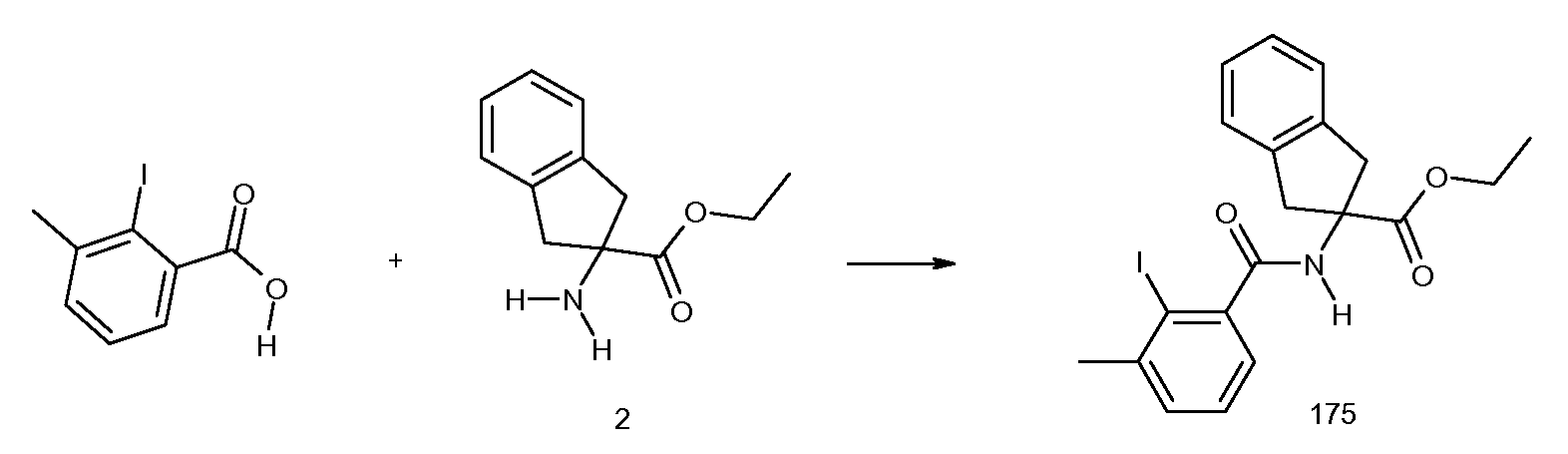
Этиловый эфир 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (175):
В круглодонную колбу объемом 100 мл помещают 2-йод-3-метилбензойную кислоту (1,92 г, 7,31 ммоль) и сухой DCM (25 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 5 минут добавляют HBTU (2,37 г, 7,31 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1,5 г, 7,31 ммоль) и затем N,N-диизопропилэтиламин (3,2 мл, 18,37 ммоль). Реакционную смесь перемешивают в течение 118 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/DCM) показывает полный расход исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (70 мл). Смесь промывают разбавленным водным раствором HCl (3%, 2×30 мл), насыщенным водным раствором NaHCO3 (2×30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 2,04 г твердого вещества белого цвета. Данный продукт растворяют в 15 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 10 объемов колонки. Отбирают фракции по 27 мл УФ-активного элюента. Фракции 10-15 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 1,04 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,20 (т, 3H), 2,39 (с, 3H), 3,52 (дд, 4H), 4,15 (кв, 2H), 6,79 (д, 1H), 6,97 (д, 1H), 7,16-7,24 (м, 4H), 7,28-7,38 (м, 2H), 9,15 (с, 1H)
ЖХ/МС m/z=450
ПРИМЕР 176
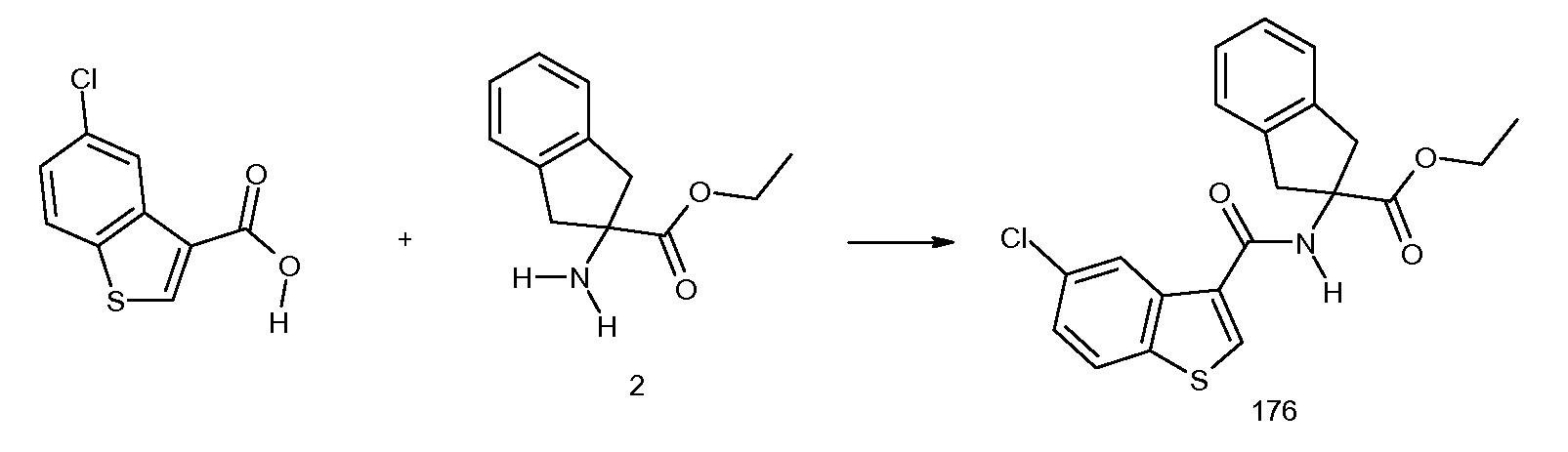
Этиловый эфир 2-[(5-хлорбензо[b]тиофен-3-карбонил)амино]индан-2-карбоновой кислоты (176):
В колбу объемом 40 мл, содержащую магнитную мешалку и 5-хлорбензо[b]тиофен-3-карбоновую кислоту (518 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль) и DIPEA (0,95 мл, 8,0 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль). Реакционную смесь перемешивают в течение 20 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) показывает полный расход исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,64 г твердого вещества не совсем белого цвета. Данное вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 20% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 7-31 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,94 г аморфного вещества белого цвета.
ПРИМЕР 177
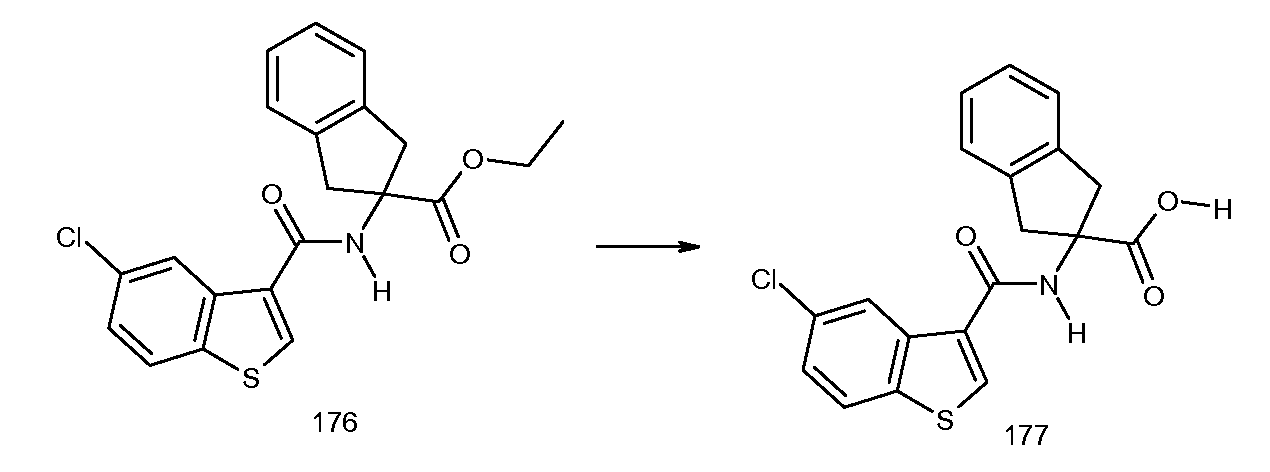
2-[(5-Хлорбензо[b]тиофен-3-карбонил)амино]индан-2-карбоновая кислота (177):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(5-хлорбензо[b]тиофен-3-карбонил)амино]индан-2-карбоновой кислоты (0,66 г, 1,65 ммоль), помещают 1,4-диоксан (10 мл) и MeOH (10 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (5 мл) и затем LiOH (173 мг, 4,13 ммоль). По истечении 15 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 590 мг сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,52 (дд, 4H), 7,15-7,27 (м, 4H), 7,46 (дд, 1H), 8,09 (д, 1H), 8,44 (д, 1H), 8,52 (с, 1H), 8,99 (с, 1H), 12,55 (уш.с, 1H)
ЖХ/МС m/z=372
ПРИМЕР 178
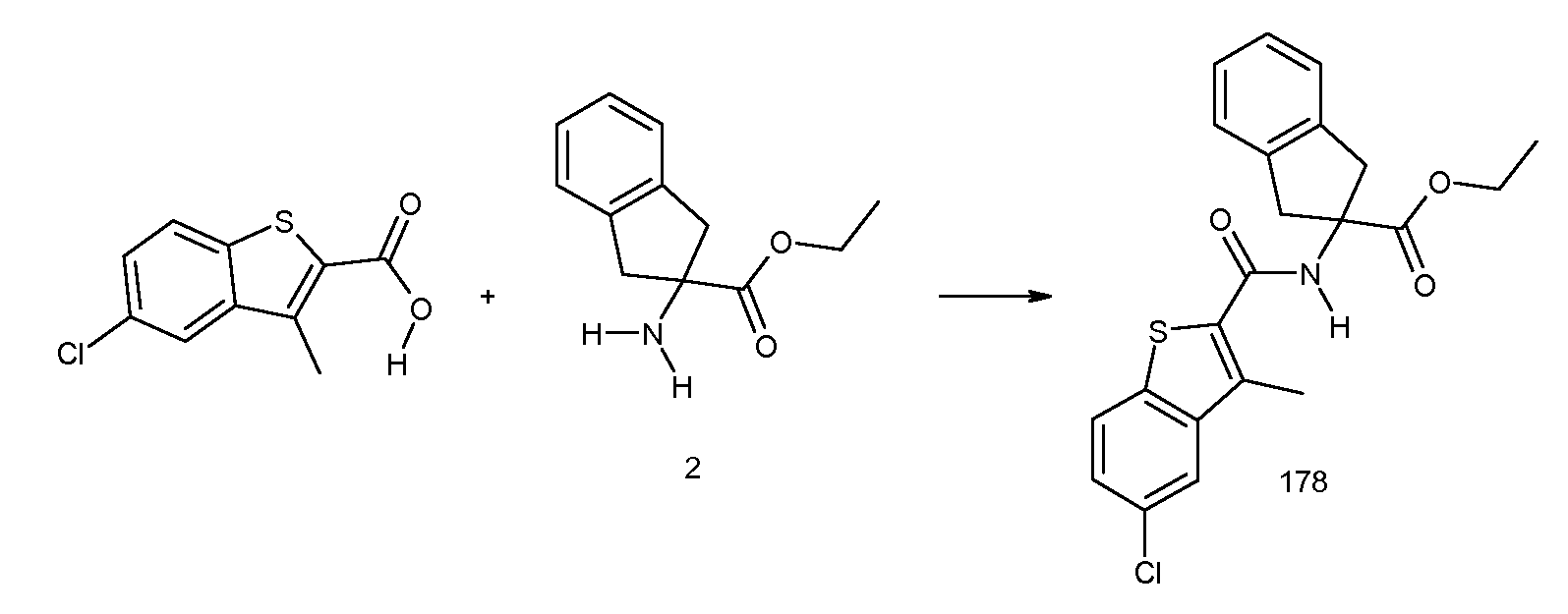
Этиловый эфир 2-[(5-хлор-3-метилбензо[b]тиофен-2-карбонил)амино]индан-2-карбоновой кислоты (178):
В колбу объемом 40 мл, содержащую магнитную мешалку и 5-хлор-3-метилбензо[b]тиофен-2-карбоновую кислоту ([50451-84-8], 0,81 г, 3,53 ммоль), помещают сухой DCM (10 мл). Начинают перемешивать. Добавляют HBTU (1,34 г, 3,54 ммоль) и DIPEA (1,4 мл, 8,0 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (0,725 г, 3,53 ммоль). Реакционную смесь перемешивают в течение 240 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (80 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,26 г твердого вещества не совсем белого цвета. Данное вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 20% EtOAc в гептане пропускают через 3 объема колонки, затем ступенчатый градиент 30% EtOAc, затем 50% и затем 70% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 22-60 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,78 г аморфного вещества белого цвета.
ПРИМЕР 179
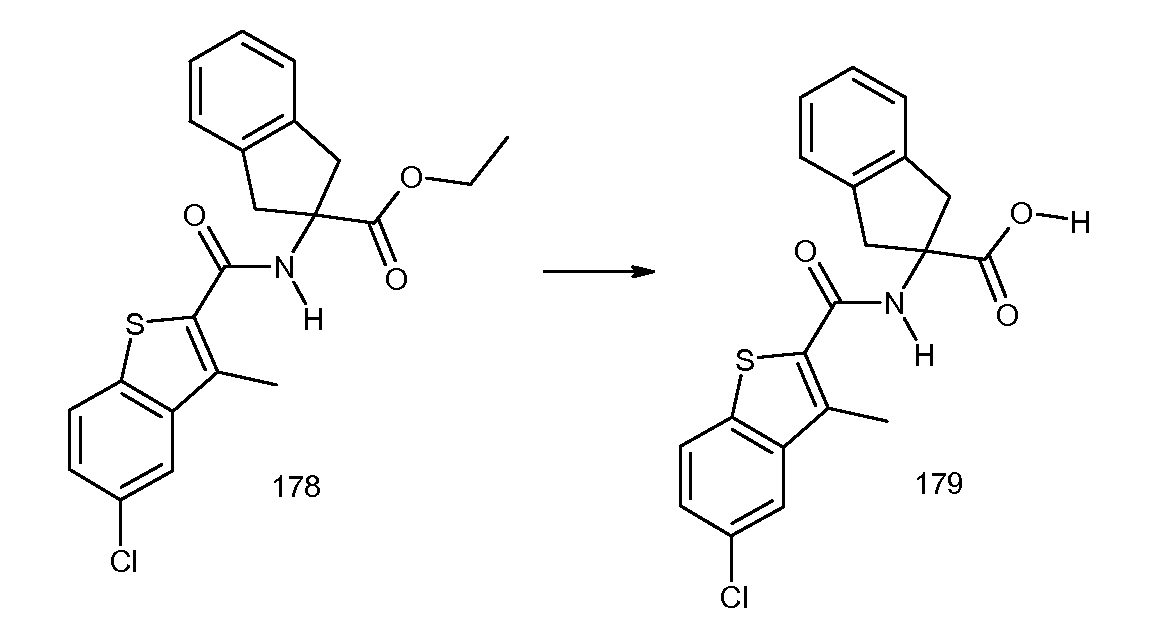
2-[(5-Хлор-3-метилбензо[b]тиофен-2-карбонил)амино]индан-2-карбоновая кислота (179):
В колбу объемом 40 мл, содержащую этиловый эфир 2-[(5-хлор-3-метилбензо[b]тиофен-2-карбонил)амино]индан-2-карбоновой кислоты (0,53 г, 1,28 ммоль), помещают MeOH (7,5 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют воду (3,8 мл) и затем LiOH (134 мг, 3,20 ммоль). По истечении 36 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют с получением 360 мг аморфного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,45 (с, 3H) 3,49 (дд, 4H), 7,15-7,29 (м, 4H), 7,48 (дд, 1H), 7,92 (д, 1H), 8,02 (д, 1H), 8,96 (с, 1H)
ЖХ/МС m/z=386
ПРИМЕР 180
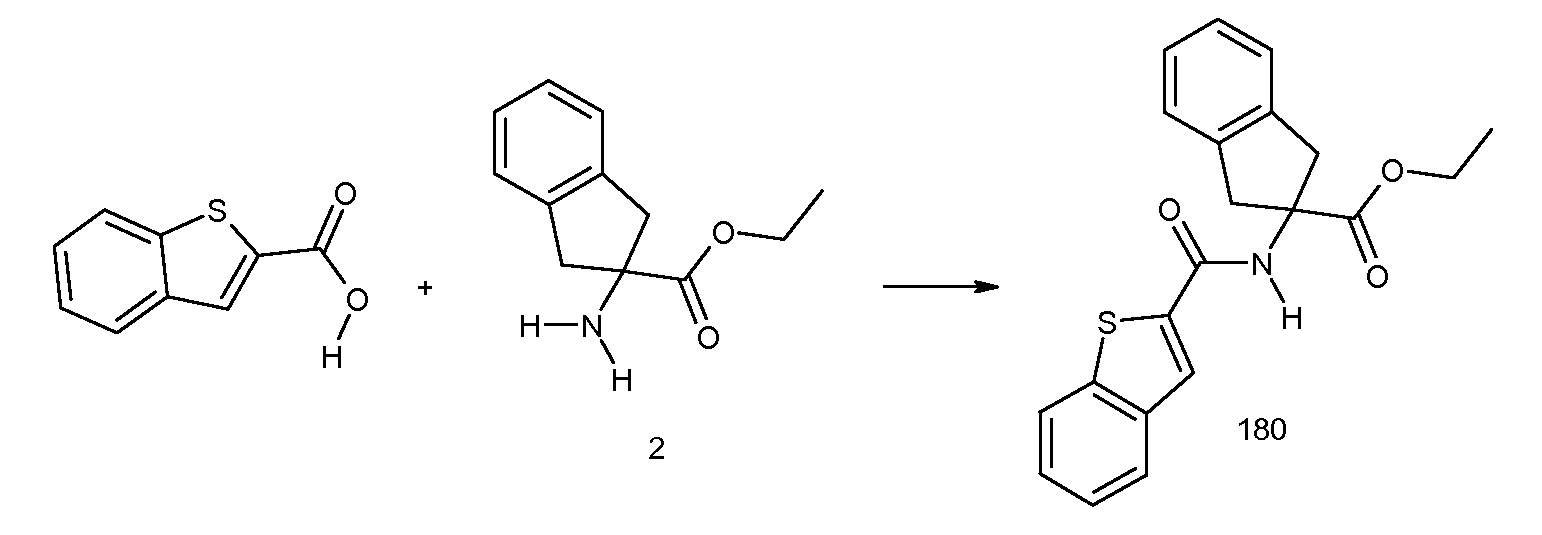
Этиловый эфир 2-[(бензо[b]тиофен-2-карбонил)амино]индан-2-карбоновой кислоты (180):
В колбу объемом 40 мл, содержащую магнитную мешалку и бензо[b]тиофен-2-карбоновую кислоту (518 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль) и DIPEA (0,95 мл, 8,0 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль). Реакционную смесь перемешивают в течение 110 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,54 г твердого вещества не совсем белого цвета. Данное вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 20% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 10 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 13-27 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,62 г аморфного вещества белого цвета.
ПРИМЕР 181
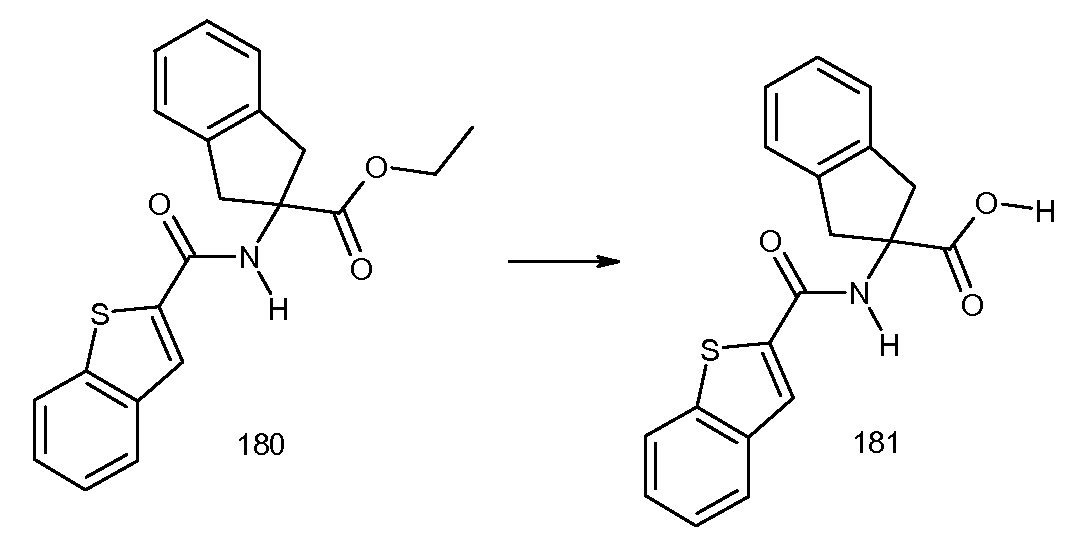
2-[(Бензо[b]тиофен-2-карбонил)амино]индан-2-карбоновая кислота (181):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(бензо[b]тиофен-2-карбонил)амино]индан-2-карбоновой кислоты (0,37 г, 1,01 ммоль), помещают 1,4-диоксан (6 мл) и MeOH (6 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (3,0 мл) и затем LiOH (106 мг, 2,53 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 290 мг (89%) сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,57 (дд, 4H), 7,15-7,32 (м, 4H), 7,45-7,48 (м, 2H) 7,91 (дд, 1H), 8,01 (дд, 1H), 8,18 (с, 1H), 9,11 (с, 1H), 12,58 (уш.с, 1H)
ЖХ/МС m/z=338
ПРИМЕР 182
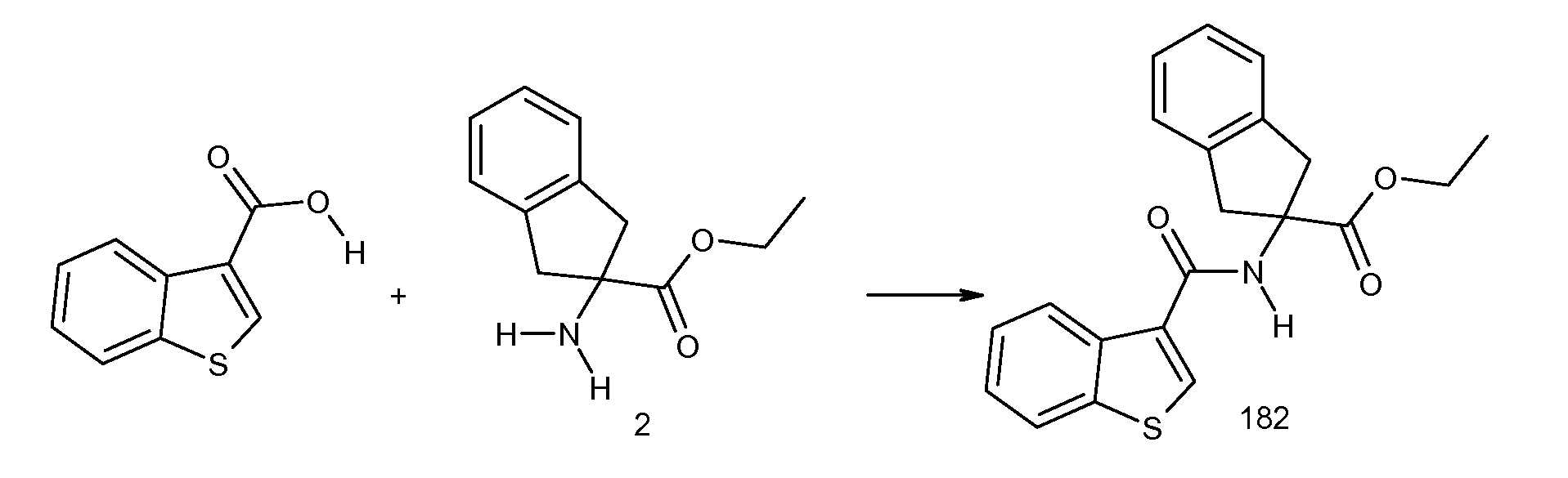
Этиловый эфир 2-[(бензо[b]тиофен-3-карбонил)амино]индан-2-карбоновой кислоты (182):
В колбу объемом 40 мл, содержащую магнитную мешалку и бензо[b]тиофен-3-карбоновую кислоту ([5381-25-9], 434 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль) и DIPEA (0,95 мл, 8,0 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль). Реакционную смесь перемешивают в течение 20 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,64 г твердого вещества не совсем белого цвета. Данное вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 20% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 4-16 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,69 г аморфного вещества белого цвета.
ПРИМЕР 183
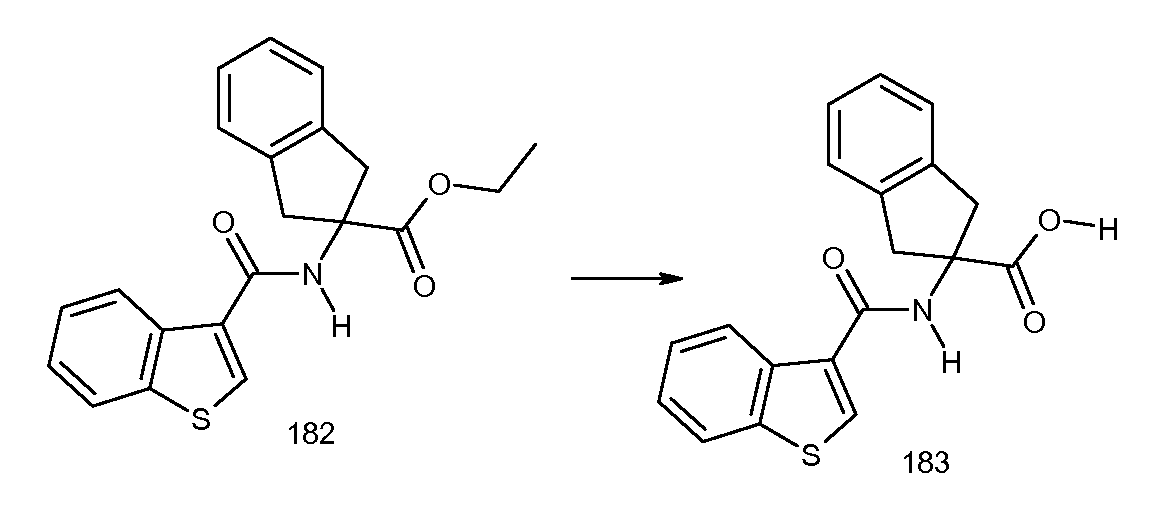
2-[(Бензо[b]тиофен-3-карбонил)амино]индан-2-карбоновая кислота (183):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(бензо[b]тиофен-3-карбонил)амино]индан-2-карбоновой кислоты (182, 0,40 г, 1,10 ммоль), помещают 1,4-диоксан (10 мл) и MeOH (10 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (5,0 мл) и затем LiOH (115 мг, 2,74 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют разбавленный водный раствор HCl (3%, ~15 мл) и EtOAc (25 мл). После перемешивания в течение 10 минут содержимое колбы сливают в делительную воронку. Слои разделяют. Водный слой экстрагируют EtOAc (30 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 450 мг сухого порошкообразного вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,52 (дд, 4H), 7,18-7,28 (м, 4H), 7,38-7,43 (м, 2H) 8,03X (дд, 1H), 8,37-8,41 (м, 2H), 8,92 (с, 1H), 13,53 (уш.с, 1H)
ЖХ/МС m/z=338
ПРИМЕР 184
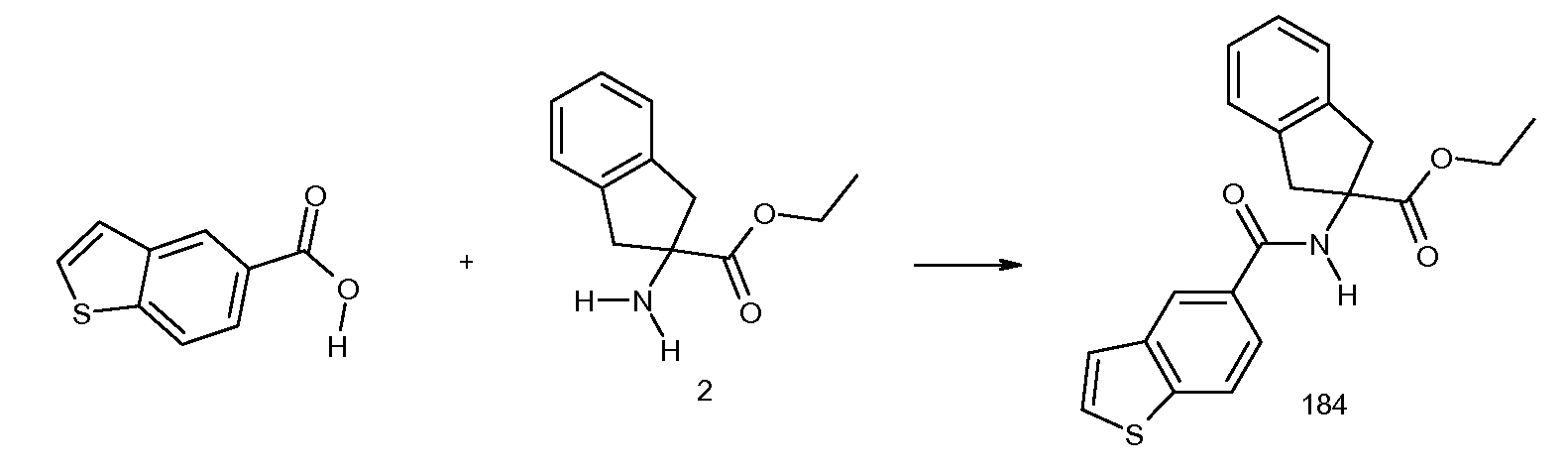
Этиловый эфир 2-[(бензо[b]тиофен-5-карбонил)амино]индан-2-карбоновой кислоты (184):
В колбу объемом 40 мл, содержащую магнитную мешалку и бензо[b]тиофен-5-карбоновую кислоту (434 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль) и DIPEA (0,95 мл, 8 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль). Реакционную смесь перемешивают в течение 64 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,4 г твердого вещества не совсем белого цвета. Данное вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 4-16 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,79 г аморфного вещества белого цвета.
ПРИМЕР 185
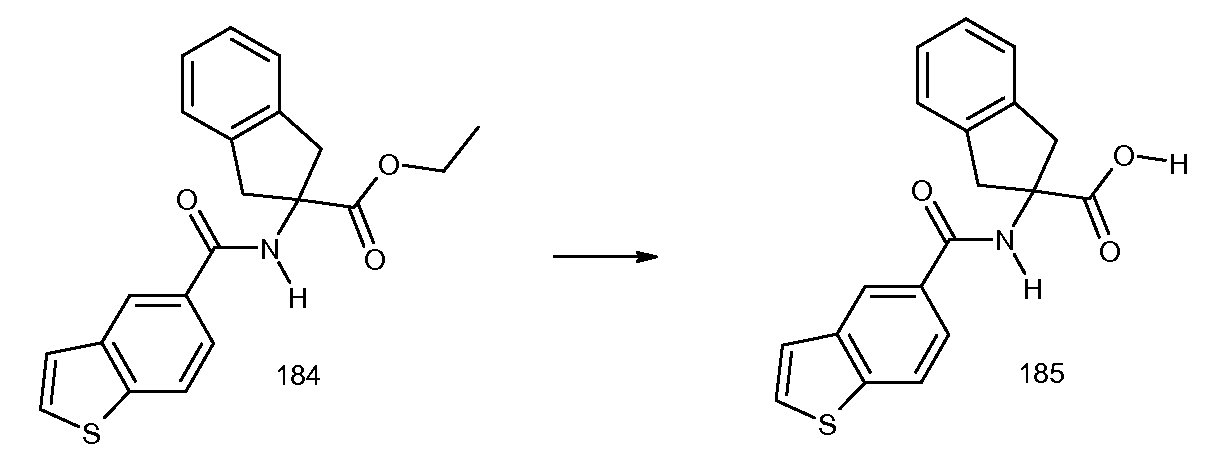
2-[(Бензо[b]тиофен-5-карбонил)амино]индан-2-карбоновая кислота (185):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(бензо[b]тиофен-5-карбонил)амино]индан-2-карбоновой кислоты (184, 0,45 г, 1,25 ммоль), помещают 1,4-диоксан (8 мл) и MeOH (8 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (4,0 мл) и затем LiOH (131 мг, 3,11 ммоль). По истечении 114 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 0,42 г твердого вещества не совсем белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,57 (дд, 4H), 7,18-7,28 (м, 5H), 7,59 (д, 1H), 7,78-7,93 (м, 2H), 8,08 (д, 1H), 8,41 (с, 1H), 8,91 (с, 1H)
ЖХ/МС m/z=338
ПРИМЕР 186
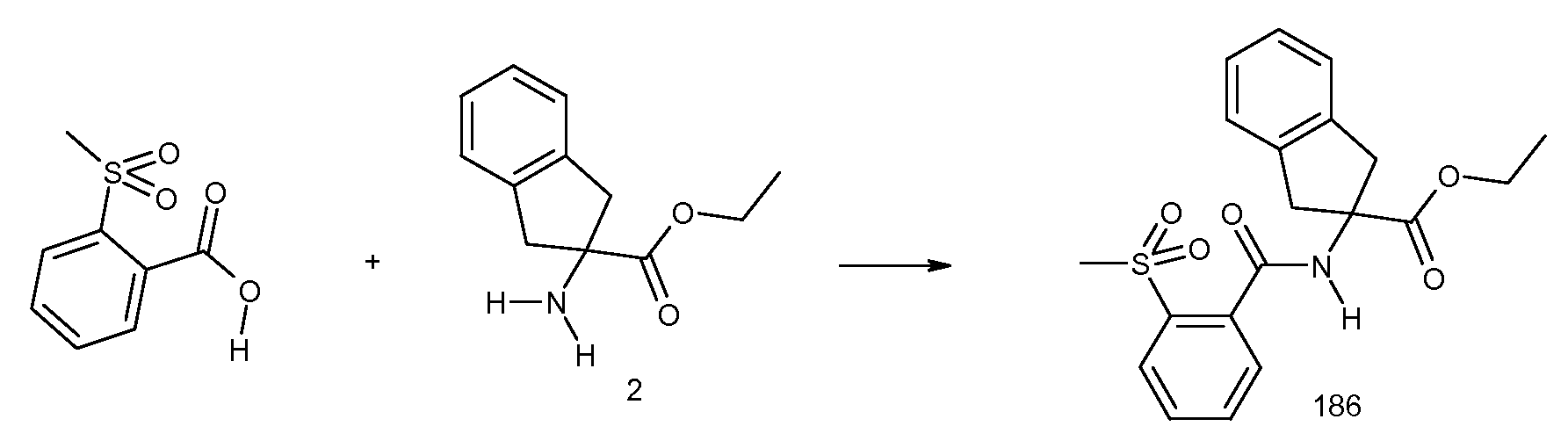
Этиловый эфир 2-[(2-метилсульфонилбензол-1-карбонил)амино]индан-2-карбоновой кислоты (186):
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-(метилсульфонил)бензойную кислоту (0,4 г, 2,88 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и затем DIPEA (0,95 мл, 8 ммоль). Реакционную смесь перемешивают в течение 36 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,32 г твердого вещества белого цвета. Данное вещество растворяют в 10 мл DCM и очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 15% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 5-8 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,71 г аморфного вещества белого цвета.
ПРИМЕР 187
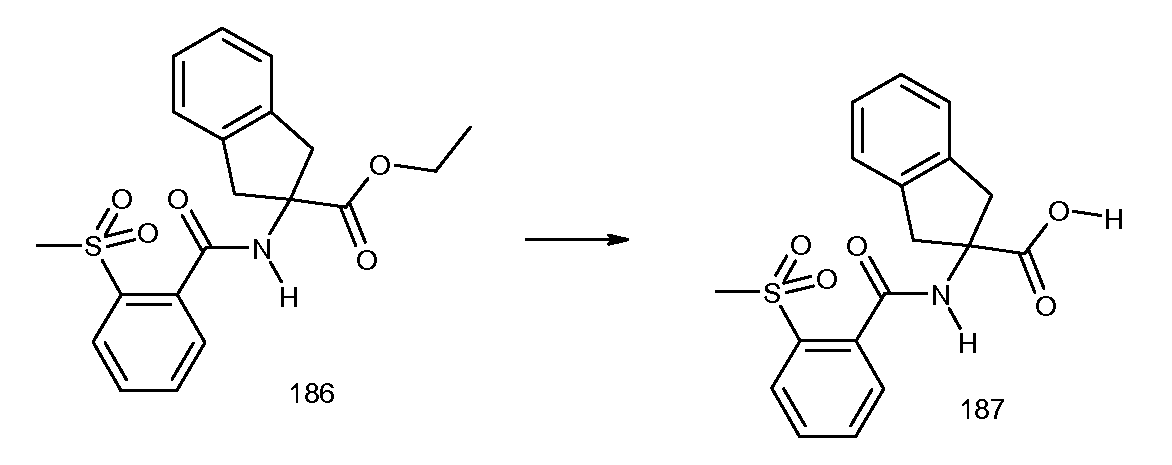
2-[(2-Метилсульфонилбензол-1-карбонил)амино]индан-2-карбоновая кислота (187):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(2-метилсульфонилбензол-1-карбонил)амино]индан-2-карбоновой кислоты (186, 0,50 г, 1,27 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем LiOH (133 мг, 3,17 ммоль). По истечении 69 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 0,46 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,37-3,61 (м, 7H), 7,16-7,23 (м, 4H), 7,54 (д, 1H), 7,69 (дд, 1H), 7,79 (дд, 1H), 7,93 (д, 1H), 9,25 (с, 1H), 12,55 (с, 1H)
ЖХ/МС m/z=360
ПРИМЕР 188
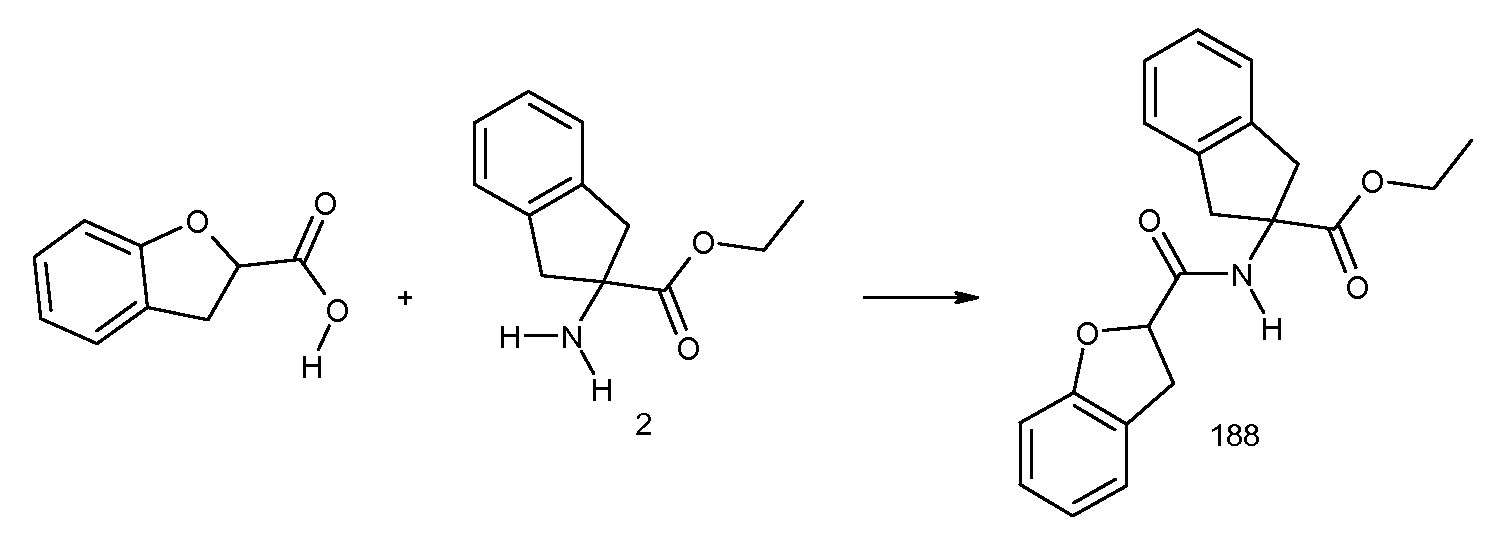
Этиловый эфир 2-[(2,3-дигидробензофуран-2-карбонил)амино]индан-2-карбоновой кислоты (188):
В колбу объемом 40 мл, содержащую магнитную мешалку и 2,3-дигидро-1-бензофуран-2-карбоновую кислоту (0,4 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль) и DIPEA (0,95 мл, 8,0 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль). Реакционную смесь перемешивают в течение 16 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,47 г вязкого масла желтого цвета. Данный продукт растворяют в 10 мл DCM и очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 15% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 3-6 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,68 г аморфного вещества белого цвета.
ПРИМЕР 189
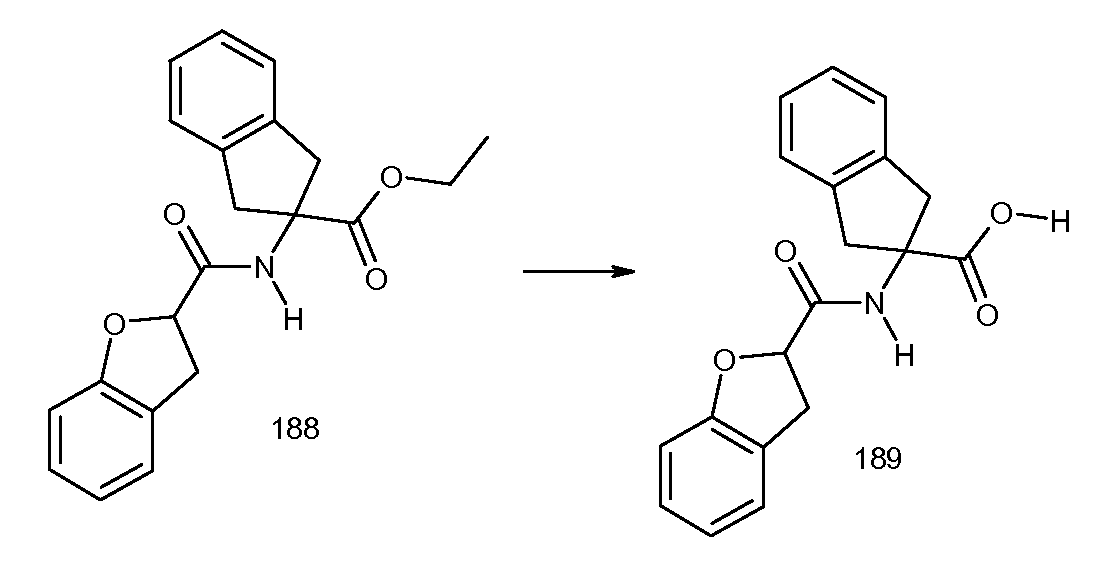
2-[(2,3-Дигидробензофуран-2-карбонил)амино]индан-2-карбоновая кислота (189):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(2,3-дигидробензофуран-2-карбонил)амино]индан-2-карбоновой кислоты (0,447 г, 1,39 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем гидрат LiOH (133 мг, 3,17 ммоль). По истечении 19 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный материал полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 0,43 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,17 (дд, 1H), 3,21-3,58 (м, 5H), 5,13 (дд, 1H), 6,79 (дд, 1H), 6,84 (дд, 1H), 7,03-7,28 (м, 6H) 8,64 (с, 1H), 12,55 (уш.с, 1H)
ЖХ/МС m/z=324
ПРИМЕР 190
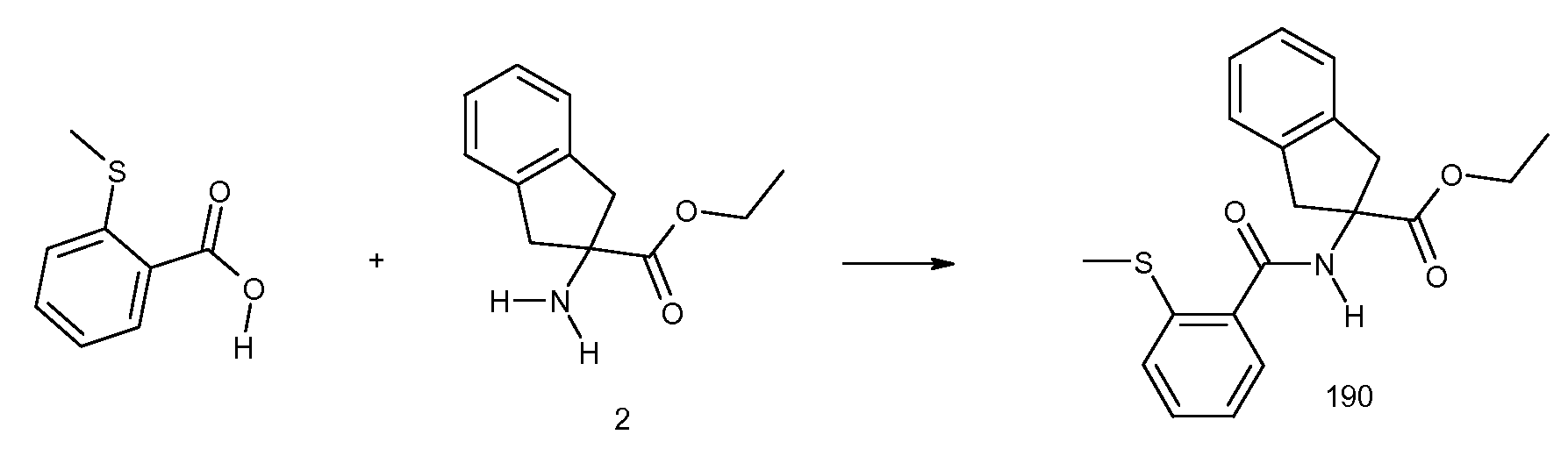
Этиловый эфир 2-[(2-метилтиобензол-1-карбонил)амино]индан-2-карбоновой кислоты (190):
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-(метилтио)бензойную кислоту ([3724-10-5], 0,410 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль). Через 2 минуты добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и затем DIPEA (0,95 мл, 8,0 ммоль). Реакционную смесь перемешивают в течение 38 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (3%, 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,49 г вязкого масла желтого цвета. Данный продукт растворяют в 10 мл DCM и очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 15% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 50% EtOAc через 8 объемов колонки и затем 90% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 8-15 объединяют и выпаривают в вакууме. Откачиванием до постоянного веса получают 0,69 г аморфного вещества белого цвета.
ПРИМЕР 191
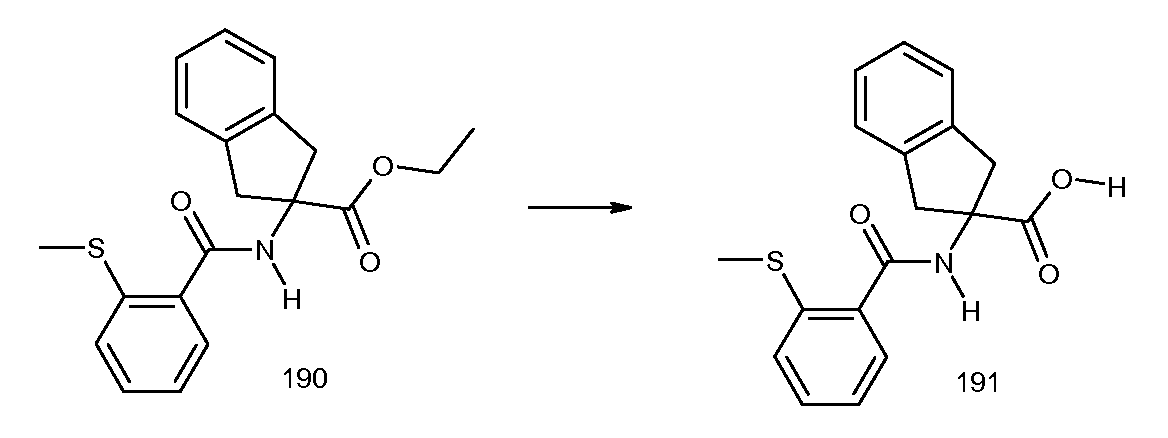
2-[(2-Метилтиобензол-1-карбонил)амино]индан-2-карбоновая кислота (191):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(2-метилтиобензол-2-карбонил)амино]индан-2-карбоновой кислоты (0,510 г, 1,44 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем гидрат LiOH (150 мг, 3,58 ммоль). По истечении 96 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 0,34 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,37 (с, 3H), 3,47 (дд, 4H), 7,14- 7,21 (м, 5H), 7,22-7,44 (м, 3H), 8,88 (с, 1H), 12,46 (с, 1H)
ЖХ/МС m/z=328
ПРИМЕР 192
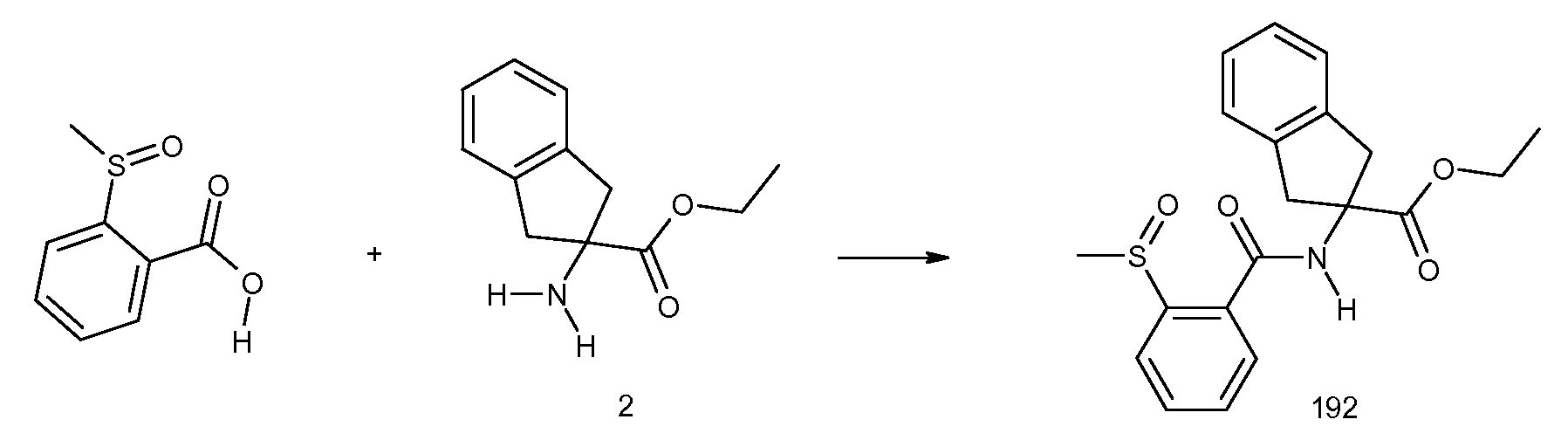
Этиловый эфир 2-[(2-метилсульфинилбензоил)амино]индан-2-карбоновой кислоты (192):
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-(метилсульфинил)бензойную кислоту (0,449 г, 2,44 ммоль), помещают сухой DCM (7 мл). Начинают перемешивать. Добавляют HBTU (922 мг, 2,43 ммоль). Затем добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и затем DIPEA (0,95 мл, 8,0 ммоль). Реакционную смесь перемешивают в течение 94 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,2 г вещества в виде желтой пены. Данный продукт растворяют в 10 мл DCM и очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 100% EtOAc пропускают через 8 объемов колонки и держат в 5 объемах колонки. Отбирают фракции по 25 мл. Фракции 9-18 объединяют и выпаривают в вакууме до постоянного веса, получая 0,75 г аморфного вещества не совсем белого цвета.
ПРИМЕР 193
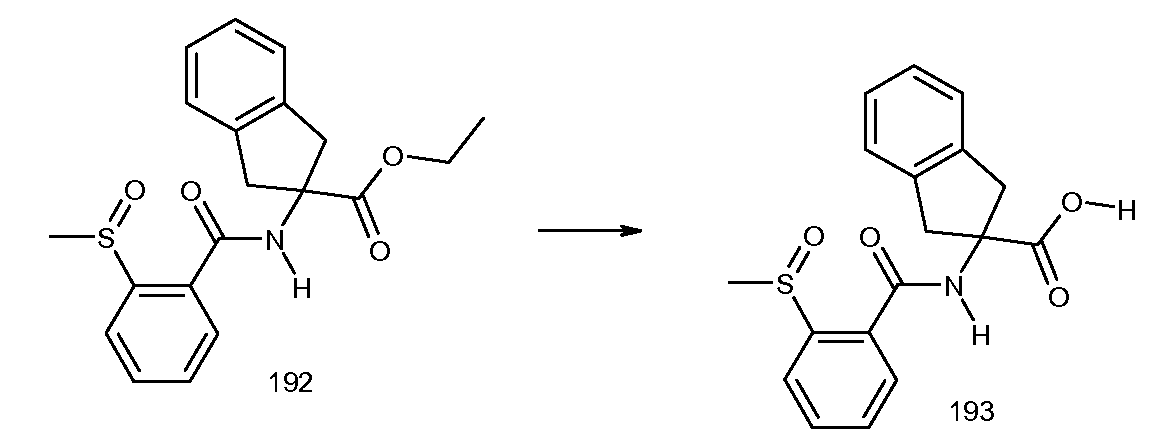
2-[(2-Метилсульфинилбензоил)амино]индан-2-карбоновая кислота (193):
В колбу объемом 50 мл, содержащую этиловый эфир 2-(2-метилсульфинилбензоиламино)индан-2-карбоновой кислоты (0,50 г, 1,34 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем LiOH (141 мг, 3,36 ммоль). По истечении 39 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме до постоянного веса 0,39 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 3,35 (с, 3H), 3,48 (дд, 4H), 7,16-7,27 (м, 4H), 7,60 (дд, 1H), 7,67-7,84, (м, 2H), 8,07 (д, 1H), 9,22 (с, 1H), 12,63 (уш.с, 1H)
ЖХ/МС m/z=344
ПРИМЕР 194
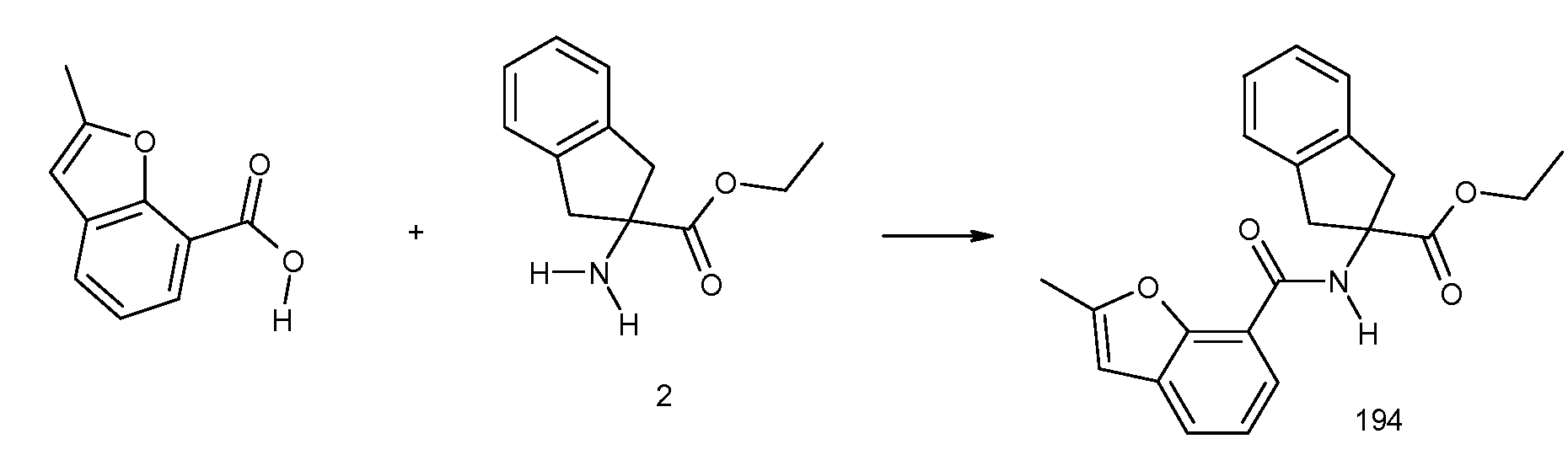
Этиловый эфир 2-[(2-метилбензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (194):
В колбу объемом 25 мл, содержащую магнитную мешалку и 2-метилбензофуран-7-карбоновую кислоту (0,343 г, 1,95 ммоль), помещают сухой DCM (6 мл). Начинают перемешивать. Добавляют HBTU (738 мг, 1,95 ммоль). Добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (400 мг, 1,95 ммоль), а затем DIPEA (0,75 мл, 4,31 ммоль). Реакционную смесь перемешивают в течение 16 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% EtOH/дихлорметан) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (3%, 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 0,97 г желтого масла. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 15% EtOAc в гептане пропускают через 3 объема колонки, затем линейный градиент 90% EtOAc через 15 объемов колонки и затем 100% EtOAc через 2 объема колонки, каждый с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 2-7 объединяют и выпаривают в вакууме до постоянного веса, получая 0,63 г аморфного вещества белого цвета.
ПРИМЕР 195
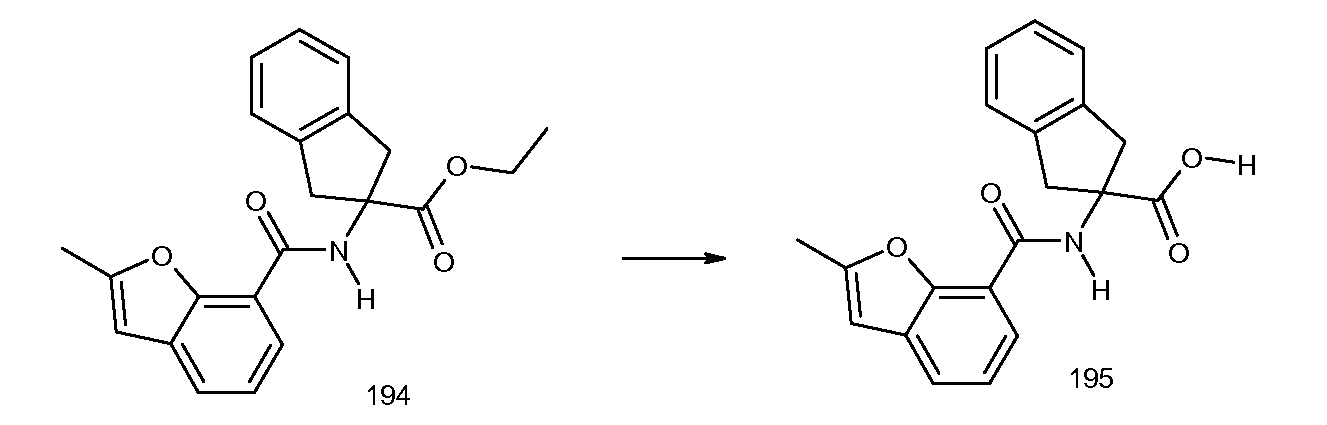
2-[(2-Метилбензофуран-7-карбонил)амино]индан-2-карбоновая кислота (195):
В колбу объемом 50 мл, содержащую этиловый эфир 2-[(2-метилбензофуран-7-карбонил)амино]индан-2-карбоновой кислоты (0,40 г, 1,10 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем LiOH (115 мг, 2,75 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме до постоянного веса, получая 0,37 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,42, (с, 3H), 3,47 (дд, 4H), 6,68, (с, 1H), 7,17-7,27 (м, 5H) 7,57 (дд, 1H), 7,67 (дд, 1H), 8,68 (с, 1H), 12,63 (с, 1H)
ЖХ/МС m/z=336
ПРИМЕР 196
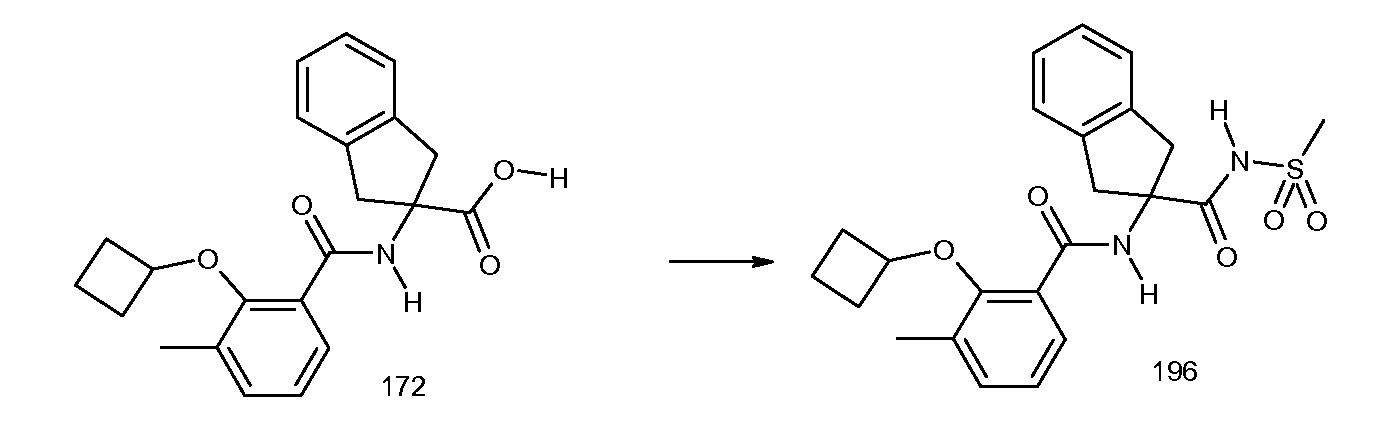
2-Циклобутокси-N-(2-метансульфониламинокарбонилиндан-2-ил)-3-метилбензамид (196):
В колбу объемом 30 мл помещают 2-[(2-циклобутокси-3-метилбензоил)амино]индан-2-карбоновую кислоту (245 мг, 0,67 ммоль) и сухой DCM (5,0 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют метансульфонамид (89 мг, 0,936 ммоль). К полученной суспензии добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (120 мг, 0,624 ммоль) и 4-диметиламинопиридин (76 мг, 0,62 ммоль). По истечении 6 дней анализ ТСХ (силикагель, 10% MeOH в DCM) показывает, что исходная кислота израсходована. Реакционную смесь разбавляют EtOAc (50 мл), переносят в делительную воронку, промывают разбавленным водным раствором HCl (3 н, 3×20 мл), насыщенным раствором соли, сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 0,26 г аморфной пены белого цвета. Полученный продукт растворяют в DCM (5 мл) и загружают в 12 г колонку (силикагель), используя систему очистки ISCO Companion. Колонку элюируют 1% iPrOH в DCM, пропуская через 3 объема колонки, после чего линейный градиент 30% iPrOH в DCM пропускают через 15 объемов колонки. Отбирают фракции по 12 мл УФ-активного элюента. Фракции 4-9 объединяют и выпаривают до постоянного веса, получая 0,2 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,01-1,31 (м, 2H), 1,45-1,68 (м, 2H), 1,72-1,83 (м, 2H), 2,21 (с, 3H), 3,18 (с, 3H), 3,42 (м, 4H), 4,18 (м, 1H), 7,16 (т, 1H), 7,19-7,22 (м, 2H), 7,27-7,36 (м, 2H), 7,38 (д, 1H), 7,62 (д, 1H), 8,43 (с, 1H), 11,59 (с, 1H)
ЖХ/МС m-/z=441
ПРИМЕР 197
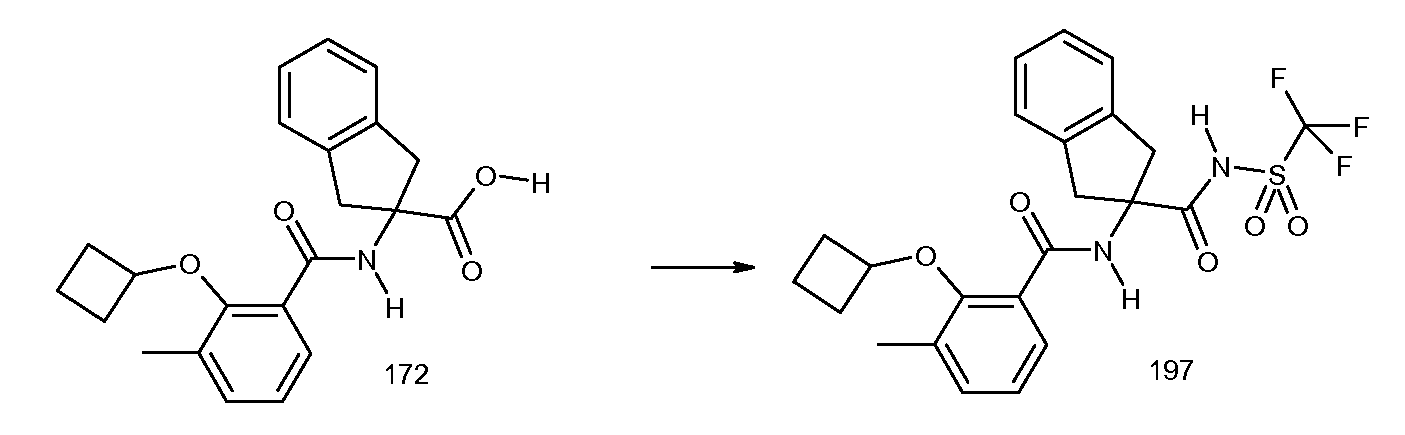
2-Циклобутокси-3-метил-N-(2-трифторметансульфониламинокарбонилиндан-2-ил)бензамид (197):
В колбу объемом 30 мл помещают 2-[(2-циклобутокси-3-метилбензоил)амино]индан-2-карбоновую кислоту (323 мг, 0,884 ммоль) и сухой DCM (7,0 мл). Добавляют магнитную мешалку и начинают перемешивать, а затем добавляют трифторметансульфонамид (198 мг, 1,33 ммоль). К полученной суспензии добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (170 мг, 0,88 ммоль) и 4-диметиламинопиридин (108 мг, 0,88 ммоль). По истечении 8 дней анализ ТСХ (силикагель, 10% MeOH в DCM) показывает, что исходная кислота израсходована. Реакционную смесь разбавляют EtOAc (50 мл), переносят в делительную воронку, промывают разбавленным водным раствором HCl (3 н, 2×20 мл) и насыщенным раствором соли, сушат над MgSO4, фильтруют и выпаривают до постоянного веса, получая 0,51 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,21-1,38 (м, 1H), 1,41-1,56 (м, 1H), 1,91-2,04 (м, 4H), 2,23 (с, 3H), 3,42 (м, 4H), 4,37 (м, 1H), 7,04 (т, 1H), 7,14-7,21 (м, 4H), 7,31 (д, 1H), 7,51 (д, 1H), 8,66 (с, 1H), 8,95 (с, 1H)
ЖХ/МС m/z=497
ПРИМЕР 198
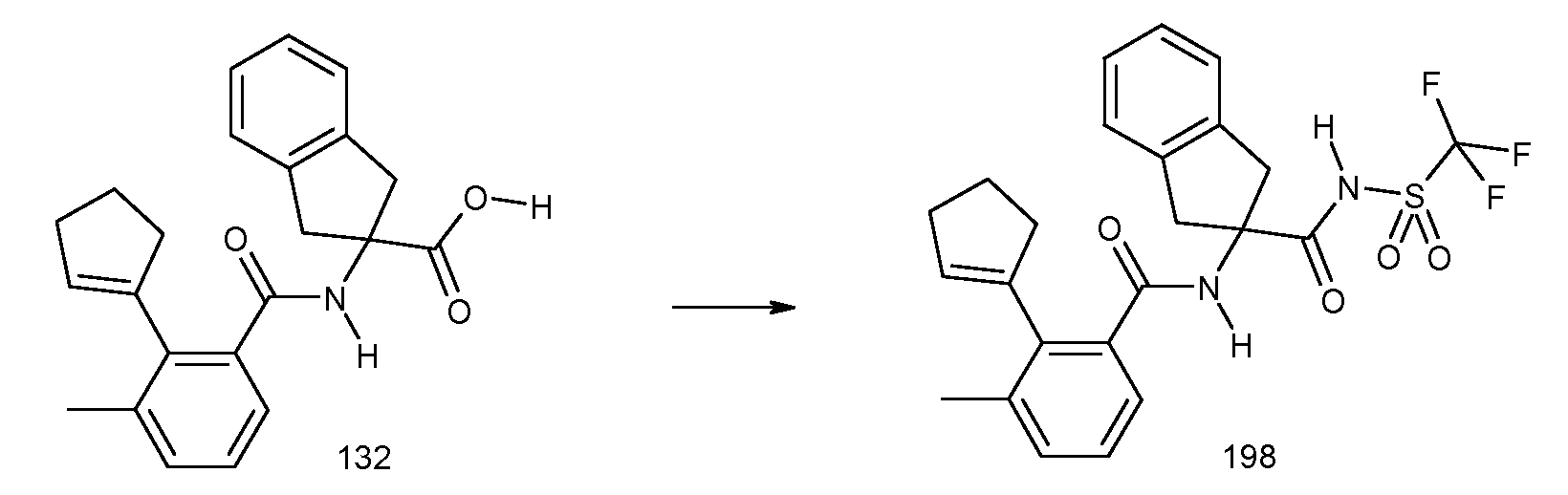
2-Циклопент-1-енил-3-метил-N-(2-трифторметансульфониламинокарбонилиндан-2-ил)бензамид (198):
В колбу объемом 50 мл помещают 2-(2-циклопент-1-енил-3-метилбензоиламино)индан-2-карбоновую кислоту (323 мг, 0,884 ммоль) и сухой DCM (7,0 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют трифторметансульфонамид (198 мг, 1,33 ммоль). К полученной суспензии добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (170 мг, 0,88 ммоль) и 4-диметиламинопиридин ([MFCD00006418], 108 мг, 0,88 ммоль). По истечении 80 часов анализ ТСХ (силикагель, 10% MeOH в DCM) показывает, что исходная кислота израсходована. Реакционную смесь разбавляют EtOAc (50 мл), переносят в делительную воронку, промывают разбавленным водным раствором HCl (3 н, 2×20 мл) и насыщенным раствором соли, сушат над MgSO4, фильтруют и выпаривают до постоянного веса, получая 0,50 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,76 (м, 2H), 2,17 (с, 3H), 2,22-2,42 (м, 4H), 3,38 (дд, 4H), 5,39, (с, 1H), 7,04-7,29 (м, 7H), 8,02 (с, 1H), 8,94 (с, 1H)
ЖХ/МС m/z=493
ПРИМЕР 199
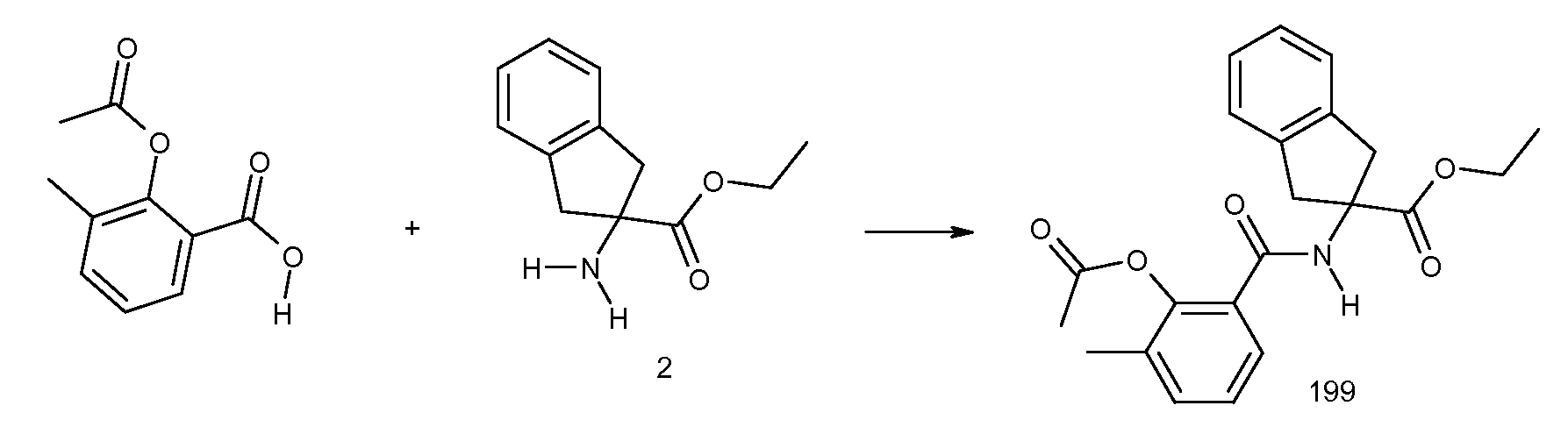
Этиловый эфир 2-(2-ацетокси-3-метилбензоиламино)индан-2-карбоновой кислоты (199):
В колбу объемом 40 мл, содержащую магнитную мешалку, помещают 2-ацетокси-3-метилбензойную кислоту (1 г, 4,87 ммоль) и сухой DCM (14 мл) и начинают перемешивать. После полного растворения добавляют HBTU (1,85 г, 4,87 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1 г, 4,87 ммоль), а затем DIPEA (2,1 мл, 12,18 ммоль). Реакционную смесь перемешивают в течение 110 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (100 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 40 мл), насыщенным водным раствором NaHCO3 (50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 3 г твердого вещества светло-оранжевого цвета. Данный продукт растворяют в 15 мл DCM. Этот продукт очищают на 80 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 12 объемов колонки. Фракции 19-27 объединяют и выпаривают в вакууме, получая 1,38 г твердого вещества белого цвета.
ПРИМЕР 200
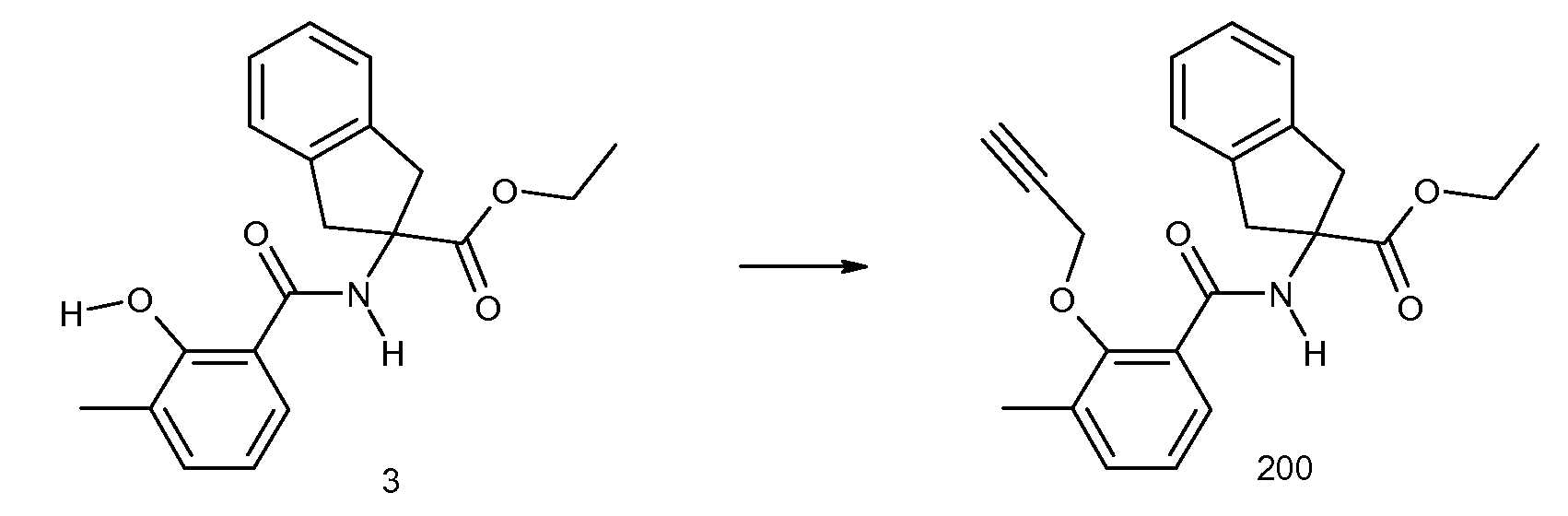
Этиловый эфир 2-(3-метил-2-проп-2-инилоксибензоиламино)индан-2-карбоновой кислоты (200):
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-(гидрокси-3-метилбензоил)индан-2-карбоновой кислоты (3) (0,29 г, 0,855 ммоль), помещают ДМФА (4 мл) и магнитную мешалку. После растворения исходного продукта добавляют K2SO4 (0,3 г, 2,17 ммоль) и затем пропаргилбромид в толуоле (11,59 M, 240 мкл, 2,78 ммоль). После перемешивания в течение 62 часов анализ ТСХ (силикагель, 1:1 EtOAc/гептан) показывает, что исходный продукт полностью израсходован. Продукт преобразуется без остатка в УФ-положительную точку с более низким Rf. Реакционную смесь разбавляют EtOAc (80 мл) и фильтруют через слой целита. Фильтрат переносят в делительную воронку. Смесь повторно промывают насыщенным водным раствором NaHCO3 (2×50 мл) и насыщенным раствором соли (50 мл), сушат над Na2SO4, фильтруют и выпаривают в вакууме с получением 2,09 г светло-коричневого масла. Данный продукт очищают (силикагель, 40 г, колонка ISCO, 10% EtOAc в гептане через 3 объема колонки, после чего линейный градиент 50% EtOAc в гептане через 10 объемов колонки). Отбирают фракции по 17 мл УФ-положительного элюента. Фракции 4-10 объединяют, выпаривают в вакууме и откачивают до постоянного веса, получая 0,21 г твердого вещества белого цвета.
ПРИМЕР 201
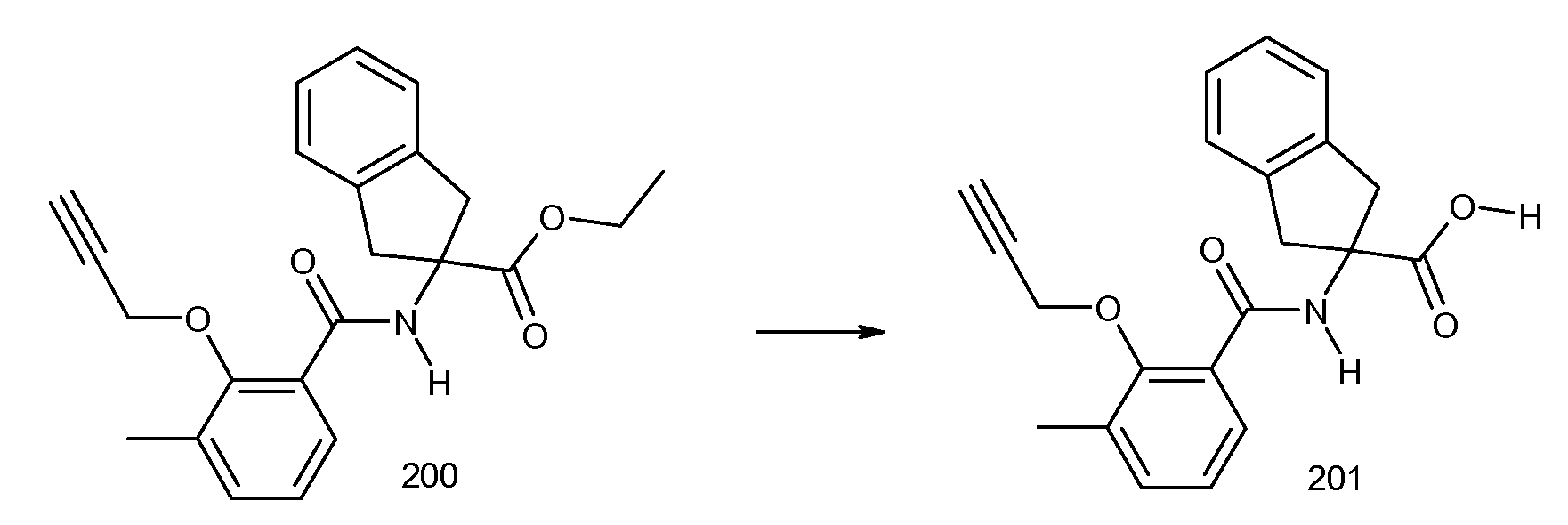
2-(3-Метил-2-проп-2-инилоксибензоиламино)индан-2-карбоновая кислота (201):
В колбу объемом 50 мл, содержащую этиловый эфир 2-(3-метил-2-проп-2-инилоксибензоиламино)индан-2-карбоновой кислоты (0,20 г, 0,53 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем LiOH (56 мг, 1,35 ммоль). По истечении 108 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют до постоянного веса, получая 0,2 г твердого вещества не совсем белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 2,26 (с, 3H), 3,43 (дд, 4H), 4,52 (с, 2H), 7,08 (дд, 1H), 7,12-7,38 (м, 6H), 8,79 (с, 1H), 12,53 (уш.с, 1H)
ЖХ/МС m/z=350
ПРИМЕР 202
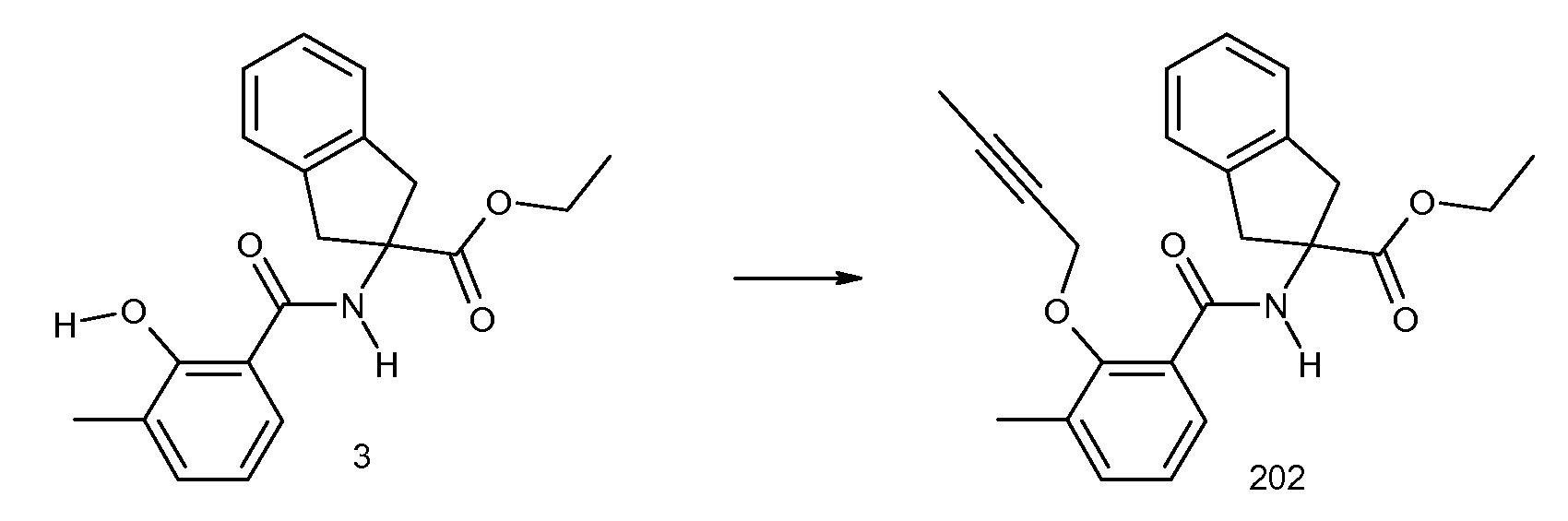
Этиловый эфир 2-(3-метил-2-бут-2-инилоксибензоиламино)индан-2-карбоновой кислоты (202):
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-(гидрокси-3-метилбензоил)индан-2-карбоновой кислоты (0,62 г, 1,87 ммоль), помещают ДМФА (3 мл) и магнитную мешалку. После растворения исходного продукта добавляют K2SO4 (0,791 г, 5,95 ммоль) и затем раствор 1-бром-2-бутина (537 мкл, 5,95 ммоль). После перемешивания в течение 110 часов анализ ТСХ (силикагель, 1:1 EtOAc/гептан) показывает, что исходный продукт израсходован. Продукт преобразуется без остатка в УФ-положительную точку с более низким Rf. Реакционную смесь разбавляют EtOAc (80 мл) и фильтруют через слой целита. Фильтрат переносят в делительную воронку. Смесь повторно промывают насыщенным водным раствором NaHCO3 (2×50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 0,75 г светло-коричневого масла. Данный продукт очищают (силикагель, 40 г, колонка ISCO, 10% EtOAc в гептане через 3 объема колонки, затем линейный градиент 50% EtOAc в гептане через 10 объемов колонки). Отбирают фракции по 17 мл УФ-положительного элюента. Фракции 2-8 объединяют, выпаривают в вакууме и откачивают, получая 0,79 г твердого вещества белого цвета.
ПРИМЕР 203
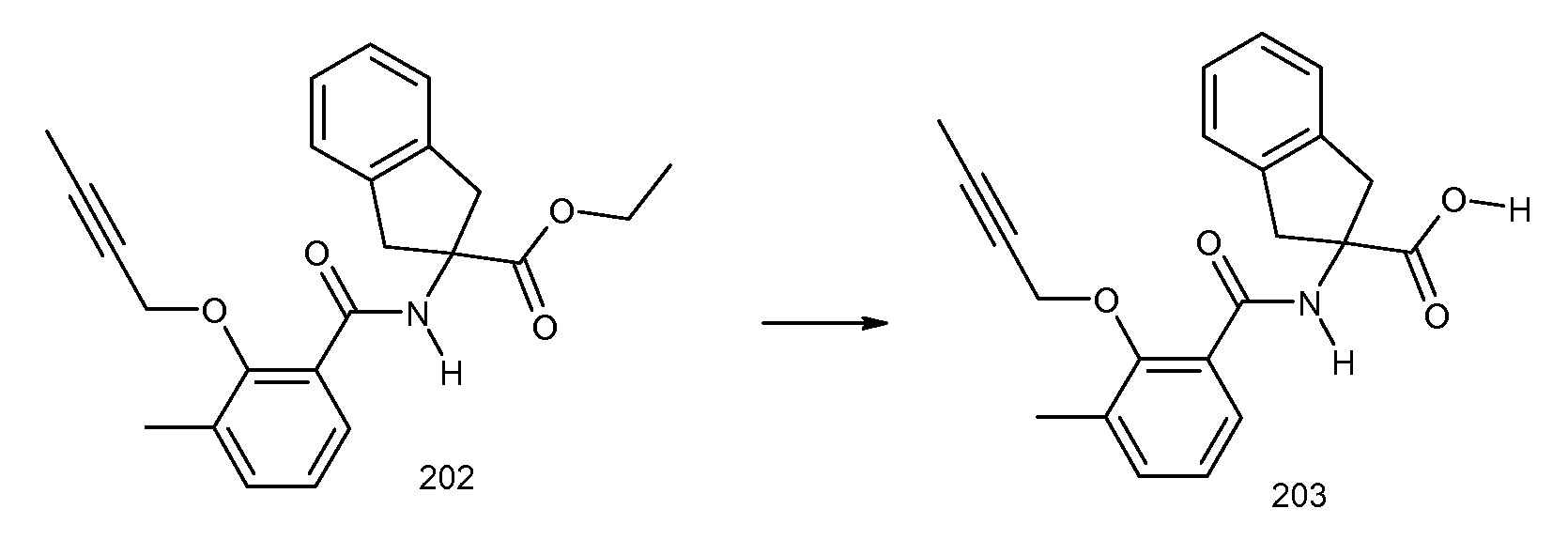
2-(3-Метил-2-бут-2-инилоксибензоиламино)индан-2-карбоновая кислота (203):
В колбу объемом 100 мл, содержащую этиловый эфир 2-(3-метил-2-бут-2-инилоксибензоиламино)индан-2-карбоновой кислоты (0,30 г, 0,77 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем LiOH (81 мг, 1,93 ммоль). По истечении 14 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая 0,25 г твердого вещества не совсем белого цвета
1H ЯМР (300 МГц, ДМСО-d6): δ 1,77 (с, 3H), 2,24 (с, 3H), 3,44 (дд, 4H), 4,42 (с, 2H), 7,08 (дд, 1H), 7,14-7,23 (м, 4H), 7,31 (д, 2H), 8,75 (с, 1H), 12,52 (уш.с, 1H)
ЖХ/МС m/z=364
ПРИМЕР 204
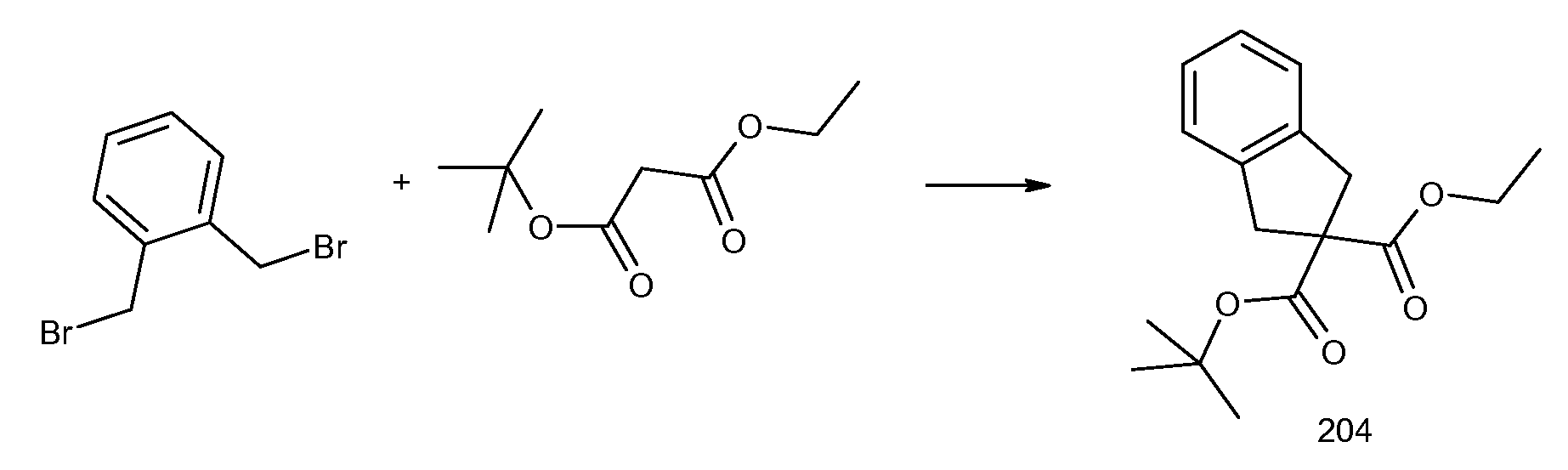
Этиловый эфир трет-бутилового эфира индан-2,2-дикарбоновой кислоты (204):
Трехгорлую колбу, содержащую магнитную мешалку, снабжают капельной воронкой и продувают азотом. В колбу помещают NaH (60% дисперсия в масле, 3,38 г, 84,48 ммоль) и сухой ТГФ (50 мл) и затем начинают перемешивать. Добавляют по каплям через шприц в течение 5 минут трет-бутилэтилмалонат (8 мл, 42,24 ммоль).Через полчаса капельную воронку наполняют раствором о-ксилолдибромида (11,15 г, 42,24 ммоль) в сухом тетрагидрофуране (ТГФ, 50 мл). Раствор добавляют к реакционной смеси на протяжении 30 минут. В конце этого периода капельную воронку промывают сухим ТГФ (10 мл). То, что получено после промывки, также добавляют к реакционной смеси. Реакционную смесь перемешивают в течение 6 дней. Затем реакционную смесь помещают в круглодонную колбу и растворитель удаляют при пониженном давлении. Полученное полутвердое вещество белого цвета растворяют в смеси EtOAc (200 мл) и воды (150 мл) и помещают в делительную воронку. Слои разделяют. Водный слой экстрагируют EtOAc (150 мл). Органические экстракты объединяют, промывают насыщенным раствором соли (150 мл), сушат над MgSO4, фильтруют и выпаривают до постоянного веса, получая 12,44 г вязкого масла. Данный продукт разбавляют гептаном (30 мл) и загружают в силикагелевую колонку (300 г). Продукт элюируют смесью EtOAc/гептан (5% через 5 объемов колонки), после чего линейный градиент 75% EtOAc в гептане пропускают через 7 объемов колонки. Отбирают фракции по 43 мл УФ-положительного элюента. Фракции 11-20 объединяют и выпаривают при откачивании до постоянного веса, получая 9,82 г прозрачного вязкого масла.
ПРИМЕР 205
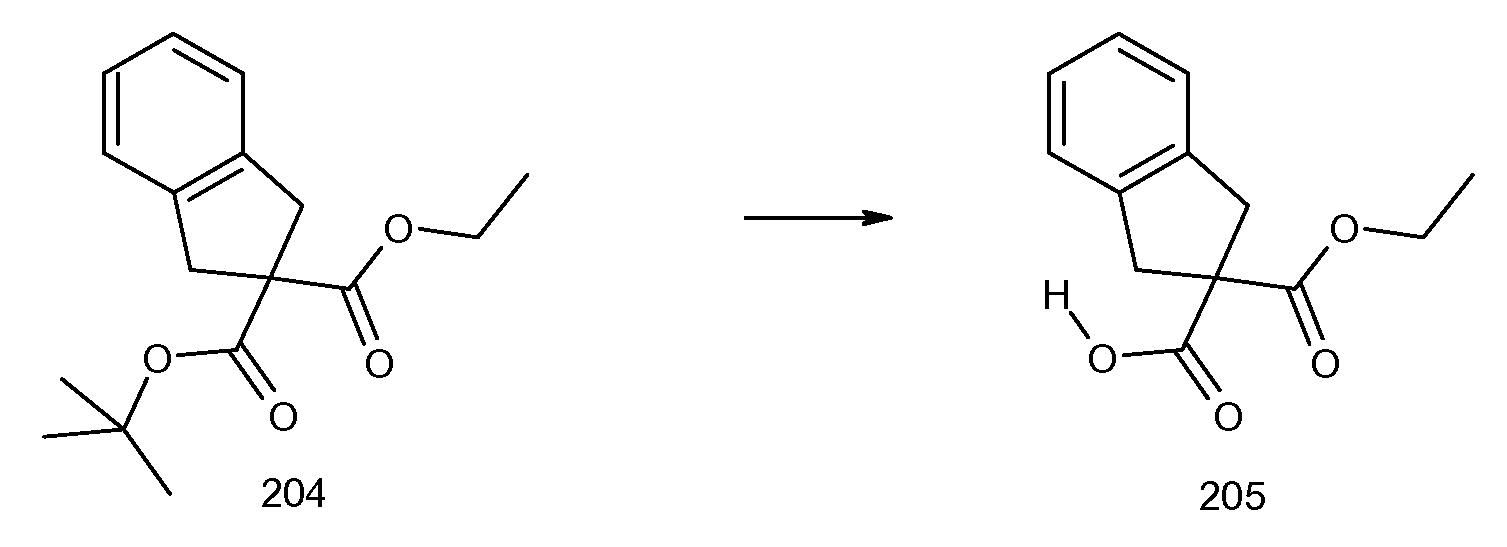
Этиловый эфир индан-2,2-дикарбоновой кислоты (205):
В круглодонную колбу объемом 200 мл помещают этиловый эфир трет-бутилового эфира индан-2,2-дикарбоновой кислоты (8,69 г, 29,93 ммоль). Добавляют DCM (40 мл) и магнитную мешалку. Начинают перемешивать. Добавляют трифторуксусную кислоту (20,0 мл, 269 ммоль). По истечении 20 часов анализ ТСХ (силикагель, 1:1 этилацетат/гептан) показывает, что исходный продукт полностью израсходован. Реакционную смесь разбавляют DCM (50 мл) и выпаривают при пониженном давлении. Полученное масло разбавляют DCM (55 мл) и выпаривают при пониженном давлении. Полученное масло разбавляют толуолом (50 мл) и выпаривают при пониженном давлении, откачивая до постоянного веса, с получением 6,78 г твердого вещества белого цвета.
ПРИМЕР 206
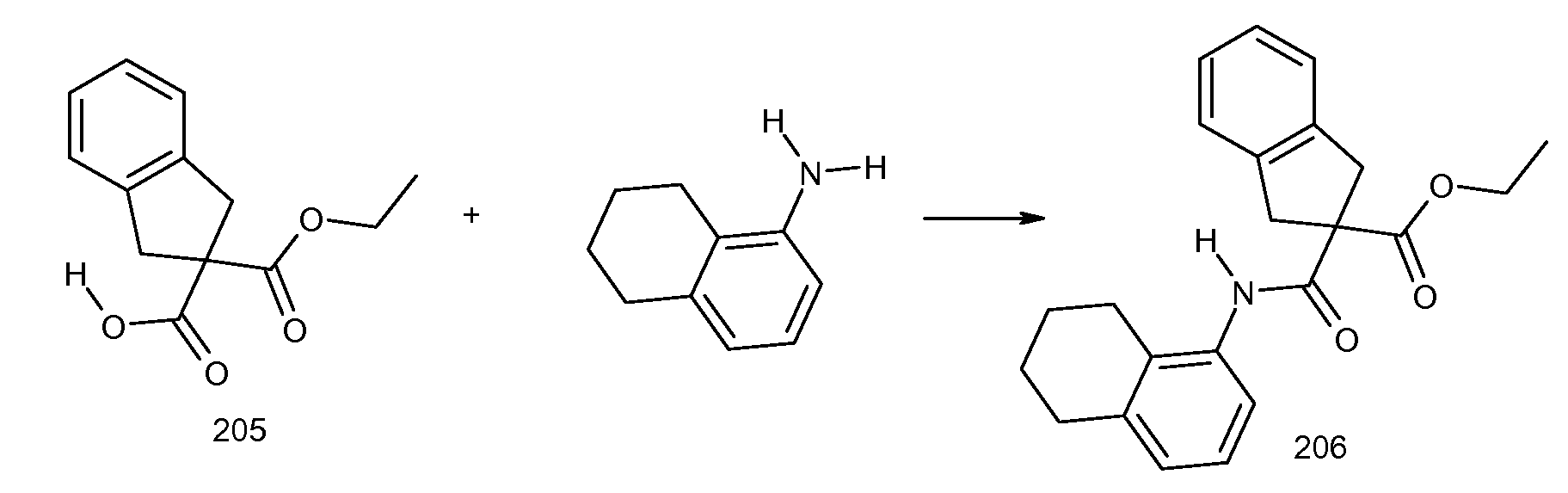
Этиловый эфир 2-(5,6,7,8-тетрагидронафталин-1-илкарбамоил)индан-2-карбоновой кислоты (206):
В реакционную колбу объемом 25 мл, содержащую магнитную мешалку, помещают этиловый эфир индан-2-карбоновой кислоты (0,48 г, 1,79 ммоль) и сухой DCM (7 мл). Начинают перемешивать. После полного растворения добавляют HBTU (0,68 г, 1,79 ммоль). Через 5 минут добавляют 5,6,7,8-тетрагидро-1-нафтиламин (0,26 мл, 1,79 ммоль) и затем DIPEA (0,72 мл, 4,12 ммоль). Реакционную смесь перемешивают в течение 68 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходной кислоты. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (40 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 20 мл), насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 0,50 г твердого вещества светло-пурпурного цвета. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 12 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 11-16 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая 0,41 г твердого вещества белого цвета.
ПРИМЕР 207
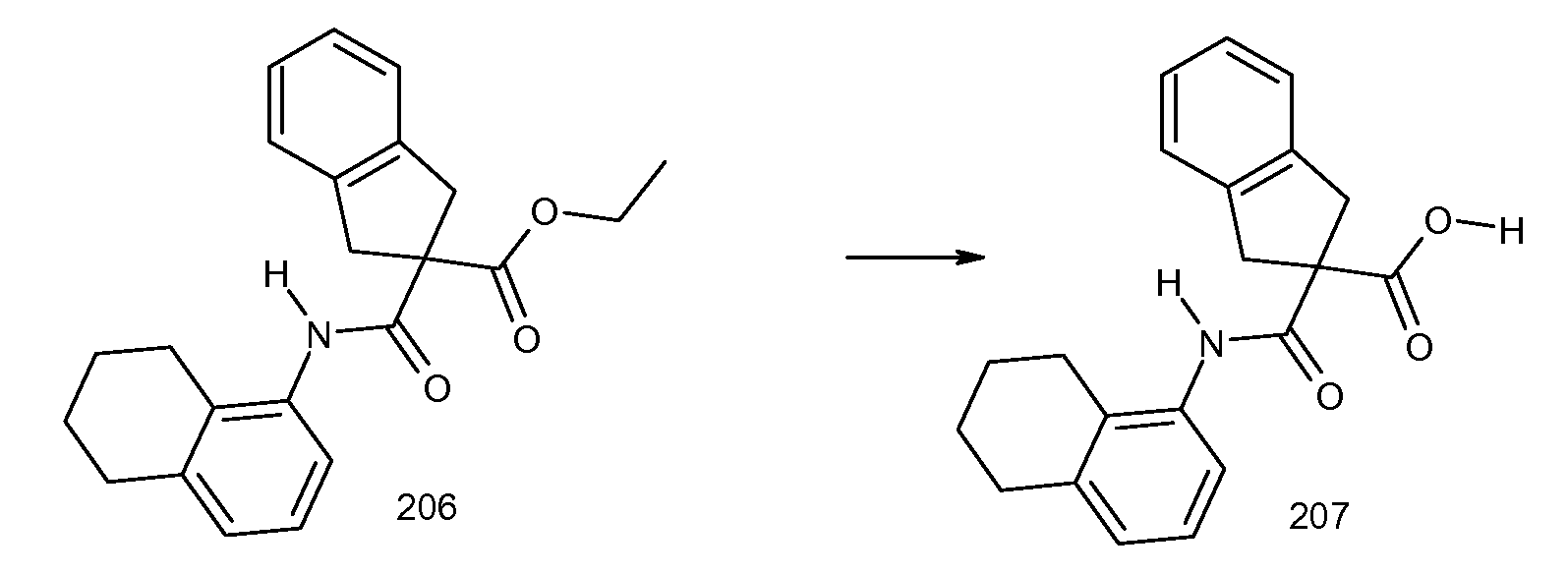
2-(5,6,7,8-Тетрагидронафталин-1-илкарбамоил)индан-2-карбоновая кислота (207):
В колбу объемом 100 мл, содержащую этиловый эфир 2-(5,6,7,8-тетрагидронафталин-1-илкарбамоил)индан-2-карбоновой кислоты (0,23 г, 0,63 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем LiOH (67 мг, 1,58 ммоль). По истечении 14 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая 0,18 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,58-1,78 (м, 4H), 2,43-2,58 (м, 2H), 2,63-2,78 (м, 2H), 3,57 (дд, 4H), 6,96 (дд, 1H), 6,98-7,08 (м, 2H), 7,09-7,19 (м, 2H), 7,20-7,28 (м, 2H), 9,15 (с, 1H), 12,82 (уш.с, 1H)
ЖХ/МС m/z=336
ПРИМЕР 208
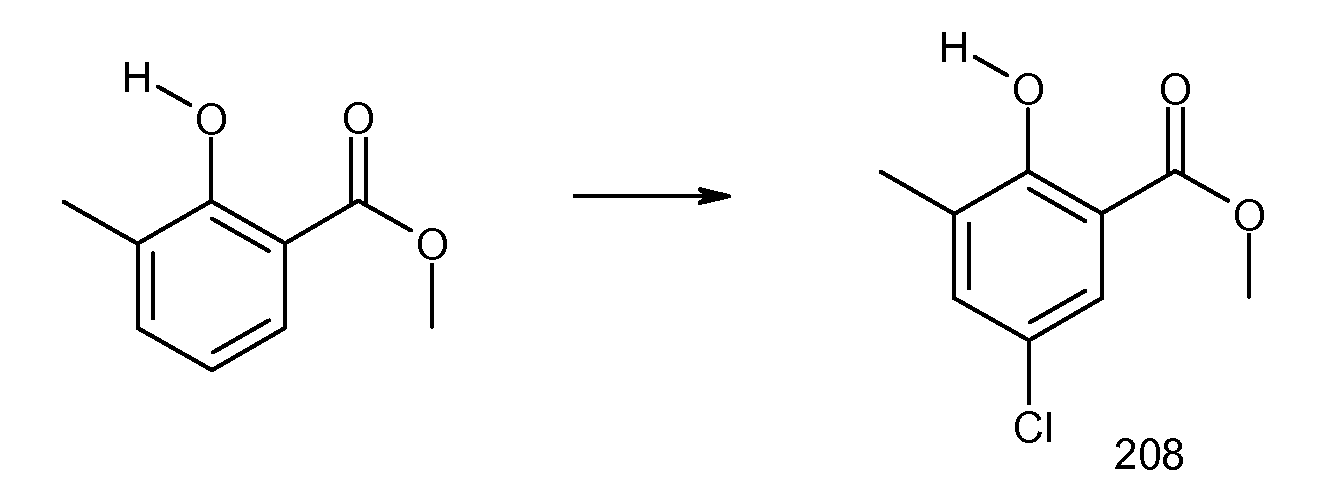
Метиловый эфир 2-гидрокси-3-метил-5-хлорбензойной кислоты (208):
В трехгорлую круглодонную колбу объемом 250 мл помещают метиловый эфир 2-гидрокси-3-метил-5-бензойной кислоты (5 г, 30,1 ммоль) и сухой DCM (50 мл). Добавляют магнитную мешалку и колбу погружают в водяную баню со льдом. Через 10 минут добавляют через шприц сульфурилхлорид (2,9 мл, 36,1 ммоль) на протяжении 5 минут. Через 0,5 часа водяную баню со льдом удаляют. Еще через 2 дополнительных часа анализ ТСХ (силикагель, 40% EtOAc/гептан) показывает отсутствие реакции.
Через 27 дней анализ ТСХ (силикагель, 40% EtOAc/гептан) продолжает показывать отсутствие реакции. К реакционной смеси добавляют MeOH (50 мл). Начинает осаждаться кристаллическое твердое вещество белого цвета. Осадок собирают фильтрованием с отсасыванием, получая 2,1 г твердого вещества белого цвета. При повторении процесса из фильтрата было отобрано 1,25 г дополнительного твердого вещества белого цвета.
ПРИМЕР 209
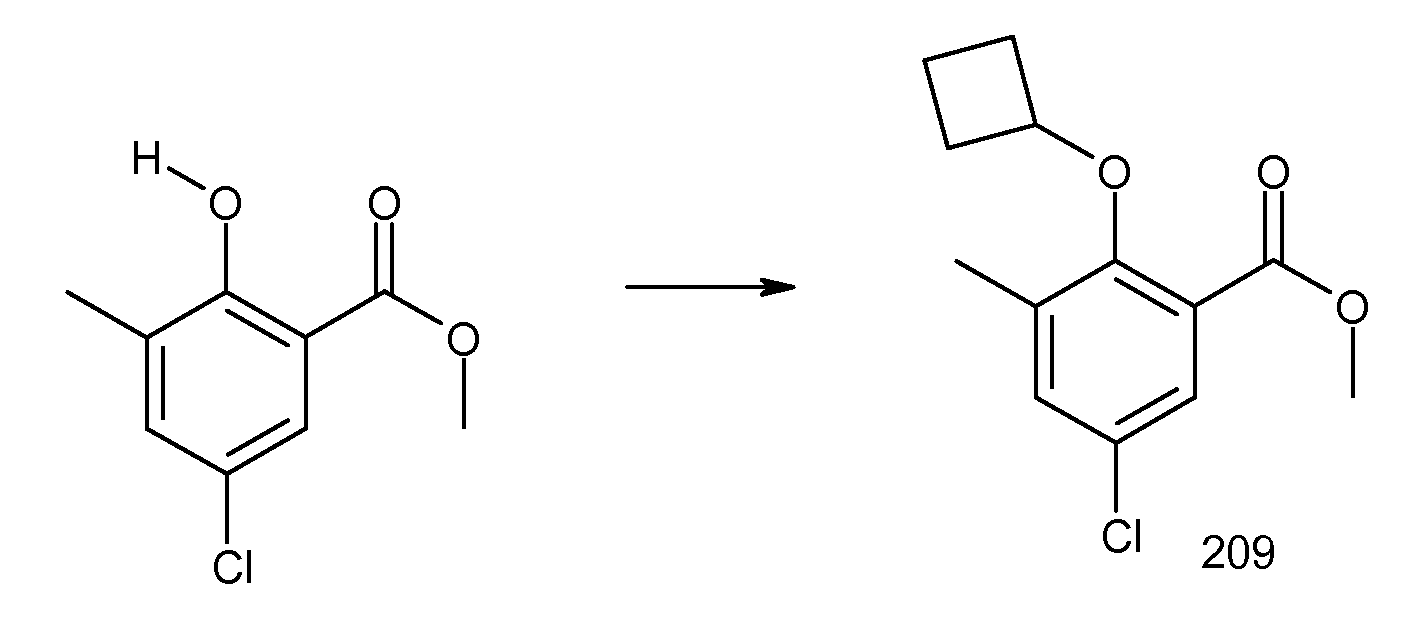
Метиловый эфир 5-хлор-2-циклобутокси-3-метилбензойной кислоты (209):
В круглодонную колбу объемом 100 мл помещают метиловый эфир 5-хлор-2-гидрокси-3-метилбензойной кислоты (0,92 г, 4,59 ммоль). Добавляют сухой N,N-диметилформамид (ДМФА, 15 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют K2SO4 (1,90 г, 13,76 ммоль) и бромциклобутан (0,65 мл, 6,88 ммоль). По истечении 12 дней анализ ТСХ (силикагель, 25% EtOAc/гептан) показывает некоторый расход исходного продукта и появление УФ-положительной точки с несколько более высоким значением Rf. На реакционную колбу устанавливают колбонагреватель и доводят температуру до 37°C. Еще через 3 дня анализ ТСХ (силикагель, 25% EtOAc/гептан) показывает некоторый расход исходного продукта и полное преобразование в УФ-положительную точку с несколько более высоким значением Rf. Реакционную смесь фильтруют через слой целита. Фильтрат разбавляют EtOAc (100 мл) и переносят в делительную воронку. Раствор EtOAc промывают насыщенным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 0,79 г желеобразного продукта.
ПРИМЕР 210
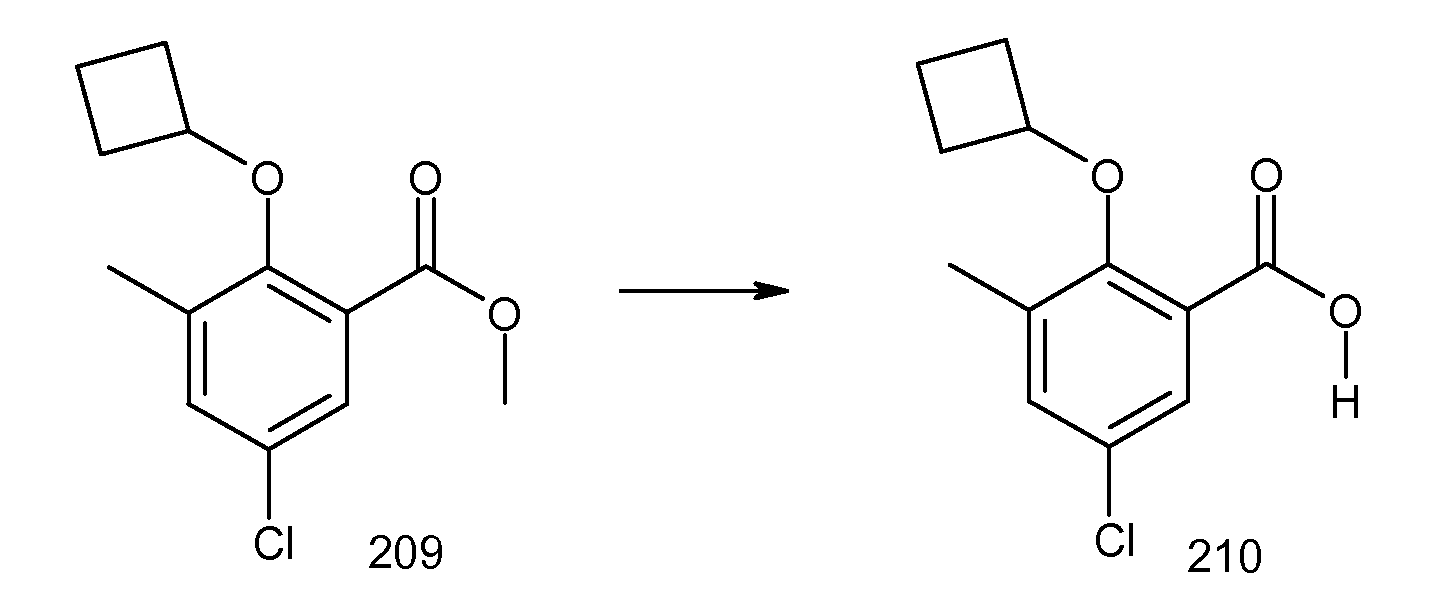
5-Хлор-2-циклобутокси-3-метилбензойная кислота (210):
В колбу объемом 100 мл, содержащую метиловый эфир 5-хлор-2-циклобутокси-3-метилбензойной кислоты (0,57 г, 2,23 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем LiOH (237 мг, 5,65 ммоль). По истечении 39 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая 0,53 г твердого вещества белого цвета.
ПРИМЕР 211
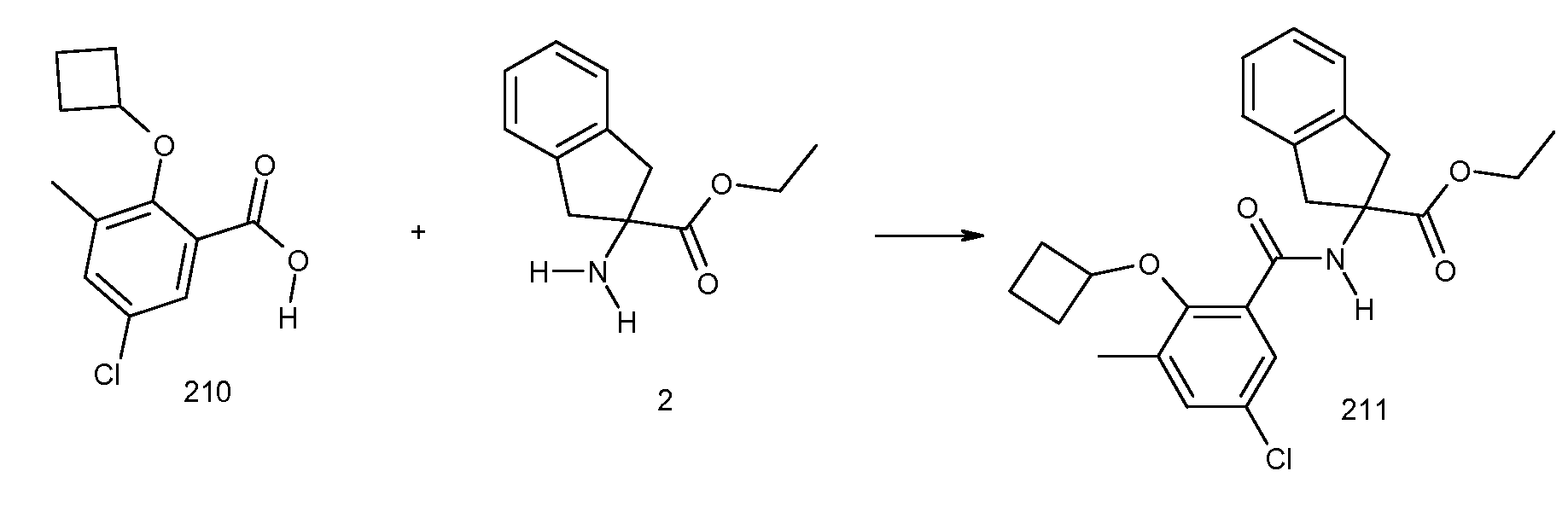
Этиловый эфир 2-(5-хлор-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (211):
В круглодонную колбу объемом 100 мл, содержащую магнитную мешалку, помещают 2-циклобутокси-3-метил-5-хлорбензойную кислоту (0,36 г, 1,5 ммоль) и сухой DCM (7 мл). Начинают перемешивать. После полного растворения добавляют HBTU (567 мг, 1,5 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (307 мг, 1,50 ммоль) и затем DIPEA (0,74 мл, 3,74 ммоль). Реакционную смесь перемешивают в течение 39 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (100 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 40 мл), насыщенным водным раствором NaHCO3 (50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 0,8 г твердого вещества светло-оранжевого цвета. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 70% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 8-11 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая 0,48 г твердого вещества белого цвета.
ПРИМЕР 212
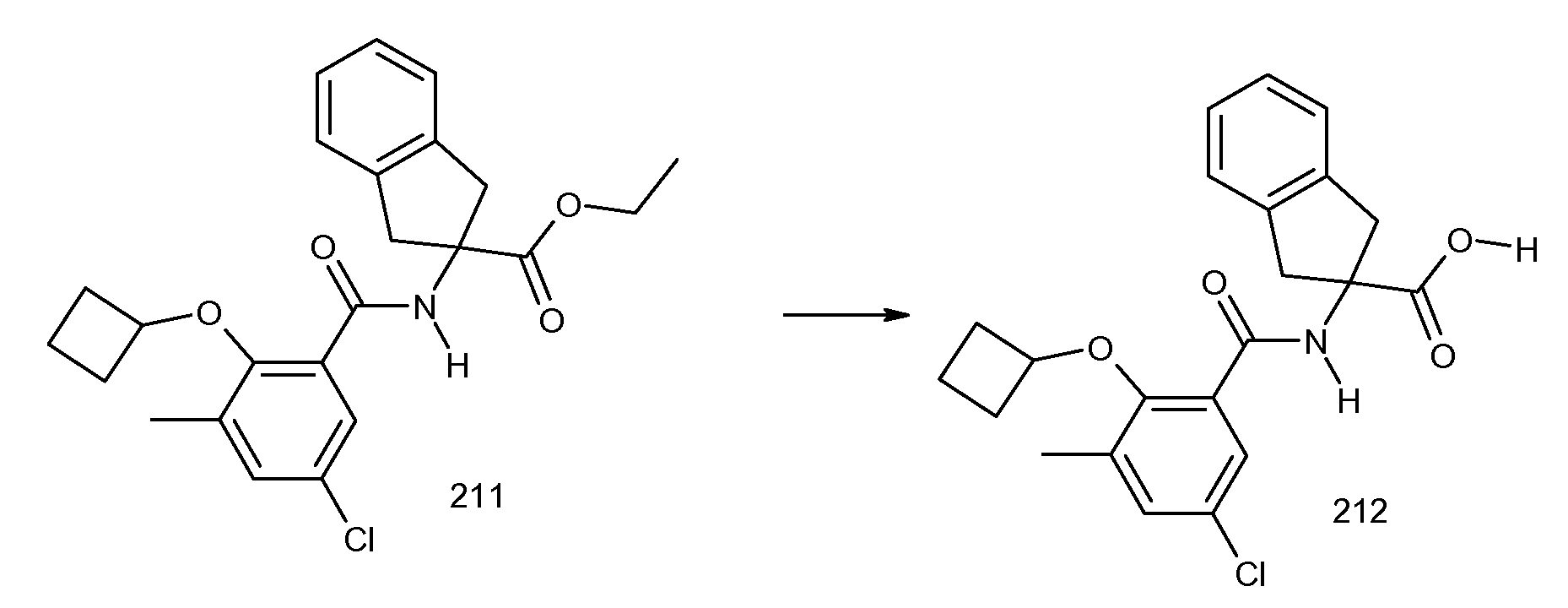
2-(5-Хлор-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (212):
В колбу объемом 100 мл, содержащую этиловый эфир 2-(5-хлор-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (0,3 г, 0,7 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем LiOH (74 мг, 1,77 ммоль). По истечении 20 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают 0,21 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,17-1,28 (м, 1H), 1,49 (м, 1H), 1,78-1,95 (м, 2H), 1,96-2,04 (м, 2H), 3,46 (дд, 4H), 4,28 (м, 1H), 7,15-7,26 (м, 5H), 7,39 (д, 1H), 8,78 (с, 1H), 12,62 (уш.с, 1H)
ЖХ/МС m/z=400
ПРИМЕР 213
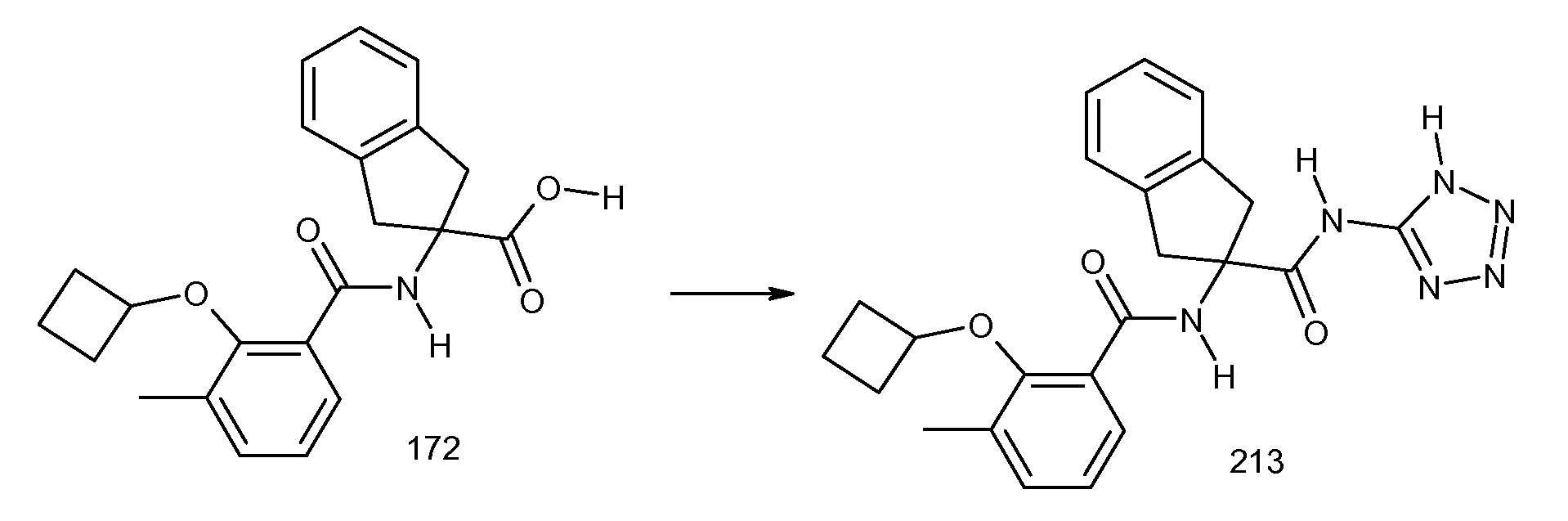
(1H-Тетразол-5-ил)амид 2-(2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (213):
В колбу объемом 40 мл помещают 2-[(2-циклобутокси-3-метилбензоил)амино]индан-2-карбоновую кислоту (323 мг, 0,884 ммоль) и сухой DCM (7 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют 5-амино-1H-тетразол (113 мг, 1,33 ммоль). К полученной суспензии добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (170 мг, 0,88 ммоль) и 4-диметиламинопиридин (108 мг, 0,88 ммоль). По истечении 11 1/2 дней анализ ТСХ (силикагель, 10% MeOH в DCM) показывает, что исходная кислота израсходована. Реакционную смесь разбавляют EtOAc (50 мл) и переносят в колбу Эрленмейера, содержащую насыщенный водный раствор хлорида аммония (50 мл). Данную смесь перемешивают. По истечении 16 часов перемешивания данная смесь содержит твердое вещество белого цвета, которое собирают фильтрованием с отсасыванием и промывают водой (2×25 мл). После сушки на воздухе получают 0,26 г твердого вещества белого цвета.
1H ЯМР (300 МГц, ДМСО-d6): δ 1,01-1,31 (м, 2H), 1,62 (м, 2H), 1,73-1,93 (м, 2H), 2,22 (с, 3H), 3,39 (дд, 4H), 4,19 (м, 1H), 7,08 (т, 1H), 7,19-7,51 (м, 5H), 7,57 (дд, 1H), 8,61 (с, 1H), 12,01 (уш.с, 1H)
ЖХ/МС m/z=433
ПРИМЕР 214
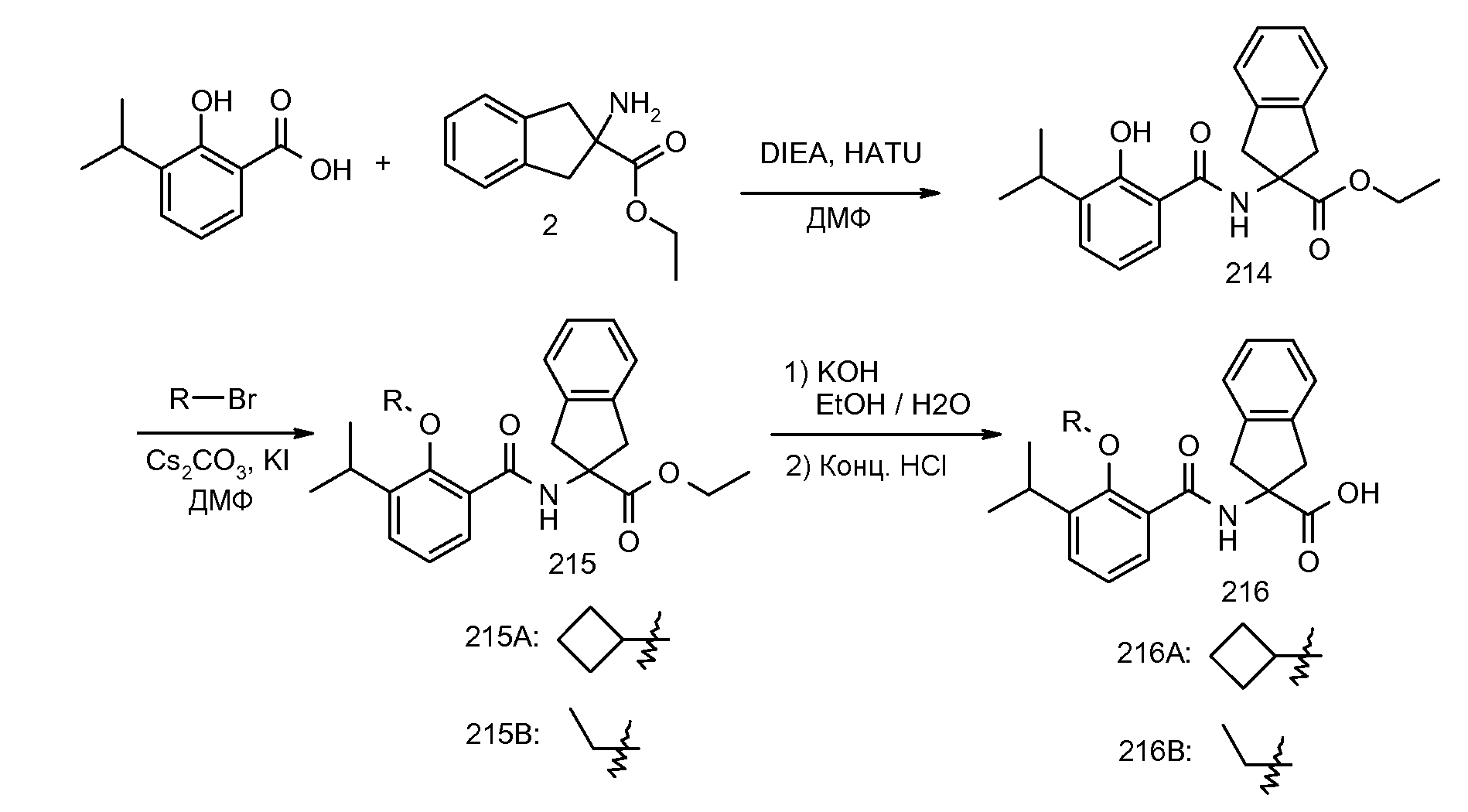
Этиловый эфир 2-(2-гидрокси-3-изопропилбензоиламино)индан-2-карбоновой кислоты (214):
К раствору 2-гидрокси-3-изопропилбензойной кислоты (539 мг, 2,99 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (737 мг, 3,59 ммоль), HATU (1,36 г, 3,59 ммоль) в безводном ДМФА (30 мл) добавляют DIPEA (0,59 мл, 3,59 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (222) в виде твердого вещества белого цвета (920 мг, 84%).
1H ЯМР (CDCl3, 300МГц): δ 1,21 (д, 6H), 1,24 (т, 3H), 3,32-3,44 (м, 1H), 3,41 (д, 2H), 3,74 (д, 2H), 4,25 (кв, 2H), 6,74-6,81 (м, 2H), 7,16 (д, 1H), 7,18-7,25 (м, 3H), 7,32 (д, 1H), 12,26 (с, 1H)
ЖХ/МС (ES+) m/z=368,17
ПРИМЕРЫ 215A и 215B
Этиловый эфир 2-(2-циклобутокси-3-изопропилбензоиламино)индан-2-карбоновой кислоты (215A) и этиловый эфир 2-(2-этокси-3-изопропилбензоиламино)индан-2-карбоновой кислоты (215B):
К суспензии этилового эфира 2-(2-гидрокси-3-изопропилбензоиламино)индан-2-карбоновой кислоты (214) (1 экв., 0,82 ммоль), безводного Cs2CO3 (2 экв., 1,64 ммоль) и KI (0,2 экв., 0,16 ммоль) в ДМФА (15 мл) добавляют RBr (4 экв., 3,28 ммоль). Полученную реакционную суспензию нагревают в сосуде для микроволновой обработки (215A: 130°C, 2 часа; 215B: 50°C, 30 мин). После удаления ДМФА в вакууме остаток растворяют в EtOAc (30 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (2×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 10-50% EtOAc в гептане) с получением чистого продукта (215) в виде твердого вещества белого цвета (215A: 340 мг, 98%; 215B: 300 мг, 93%).
215A: 1H ЯМР (CDCl3, 300МГц): δ 1,19 (д, 6H), 1,26 (т, 3H), 1,16-1,57 (м, 2H), 1,87-2,07 (м, 4H), 3,24-3,38 (м, 1H), 3,36 (д, 2H), 3,78 (д, 2H), 4,26 (кв, 2H), 4,15-4,30 (м, 1H), 7,12-7,26 (м, 5H), 7,35 (дд, 1H), 7,83 (дд, 1H), 8,20 (с, 1H)
ЖХ/МС (ES+) m/z=422,24
215B: 1H ЯМР (CDCl3, 300МГц): δ 1,13 (т, 3H), 1,20 (д, 6H), 1,26 (т, 3H), 3,24 (м, 1H), 3,35 (д, 2H), 3,72 (кв, 2H), 3,78 (д, 2H), 4,26 (кв, 2H), 7,14-7,26 (м, 5H), 7,36 (дд, 1H), 7,82 (дд, 1H), 8,36 (с, 1H)
ЖХ/МС (ES+) m/z=396,22
ПРИМЕРЫ 216A и 216B
2-(2-Циклобутокси-3-изопропилбензоиламино)индан-2-карбоновая кислота (216A) и 2-(2-этокси-3-изопропилбензоиламино)индан-2-карбоновая кислота (216B):
Смесь (215) (1 экв., 0,69 ммоль) и KOH (13 экв., 8,9 ммоль) растворяют в EtOH (10 мл) и воде (0,5 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 4 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (216) в виде твердого вещества белого цвета (216A: 190 мг, 70%; 216B: 220 мг, 91%).
216A: 1H ЯМР (CDCl3, 300МГц): δ 1,17 (д, 6H), 1,13-1,30 (м, 1H), 1,41 (м, 1H), 1,78-2,02 (м, 4H), 3,27 (м, 1H), 3,38 (д, 2H), 3,81 (д, 2H), 4,13 (м, 1H), 7,09 (т, 1H), 7,13-7,23 (м, 4H), 7,34 (дд, 1H), 7,81 (дд,1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=394,19
216B: 1H ЯМР (CDCl3, 300МГц): δ 1,08 (т, 3H), 1,19 (д, 6H), 3,20 (м, 1H), 3,46 (д, 2H), 3,55 (кв, 2H), 3,88 (д, 2H), 7,18-7,27 (м, 5H), 7,42 (дд, 1H), 7,89 (дд, 1H), 8,63 (с, 1H)
ЖХ/МС (ES+) m/z=368,19
ПРИМЕР 217
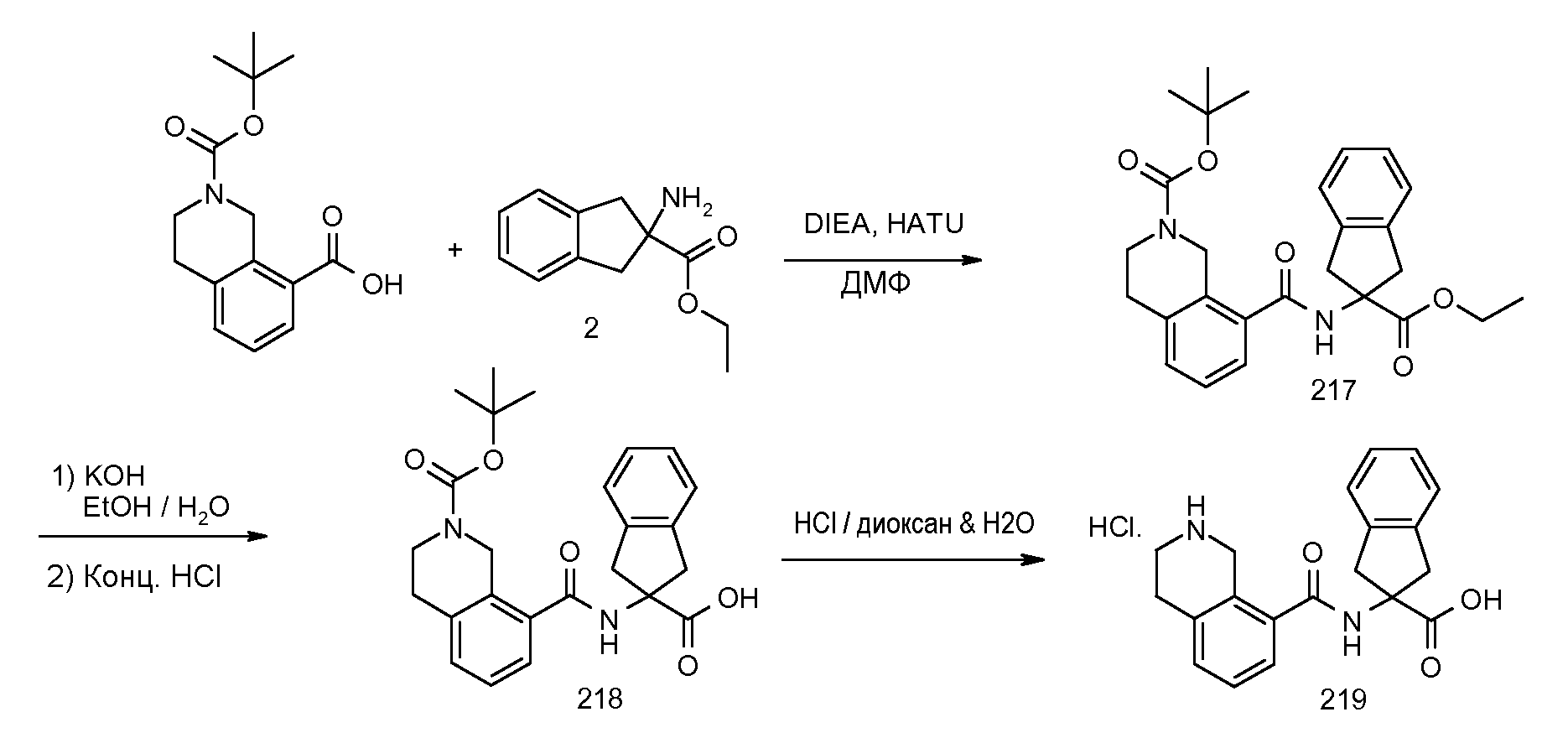
трет-Бутиловый эфир 8-(2-этоксикарбонилиндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (217):
К раствору 2-трет-бутилового эфира 3,4-дигидро-1H-изохинолин-2,8-дикарбоновой кислоты (2,0 г, 7,2 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (1,5 г, 7,2 ммоль) и HATU (3,3 г, 8,6 ммоль) в безводном ДМФА (70 мл) добавляют DIPEA (1,4 мл, 8,6 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (200 г силикагеля, градиентное элюирование: 5-50% EtOAc в гептане) с получением чистого продукта (217) в виде твердого вещества белого цвета (3,3 г, 99%).
ПРИМЕР 218
трет-Бутиловый эфир 8-(2-карбоксииндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (218):
Продукт (217) (2,46 г, 5,3 ммоль) и KOH (2,5 г, 45 ммоль) растворяют в EtOH (20 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (50 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. Осадок фильтруют с получением чистого продукта (218) в виде твердого вещества белого цвета (1,4 г, 61%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,40 (с, 9H), 2,79 (т, 2H), 3,34 (д, 2H), 3,52 (т, 2H), 3,57 (д, 2H), 4,59 (с, 2H), 7,10-7,31 (м, 7H), 8,88 (с,1H), 11,56-12,92 (уш.с, 1H)
ЖХ/МС (ES+) m/z=437,26
ПРИМЕР 219
2-[(1,2,3,4-Тетрагидроизохинолин-8-карбонил)амино]индан-2-карбоновая кислота (219):
К раствору трет-бутилового эфира 8-(2-карбоксииндан-2-илкарбамоил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (226) (128 мг, 0,29 ммоль) в 6 мл диоксана по каплям добавляют 4 н. раствор HCl в смеси диоксан/вода (0,72 мл) и полученный раствор перемешивают при комнатной температуре в течение 4 часов. Концентрирование дает соль HCl (219) в виде твердого вещества белого цвета (246 мг, 100%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,04 (т, 3H), 3,28-3,41 (м, 4H), 3,58 (д, 2H), 4,31 (с, 2H), 7,13-7,27 (м, 4H), 7,32 (с, 3H), 9,05 (с, 1H), 9,30-9,57 (уш.с, 1H), 12,46-12,77 (уш.с, 1H)
ЖХ/МС (ES+) m/z=337,18
ПРИМЕР 220
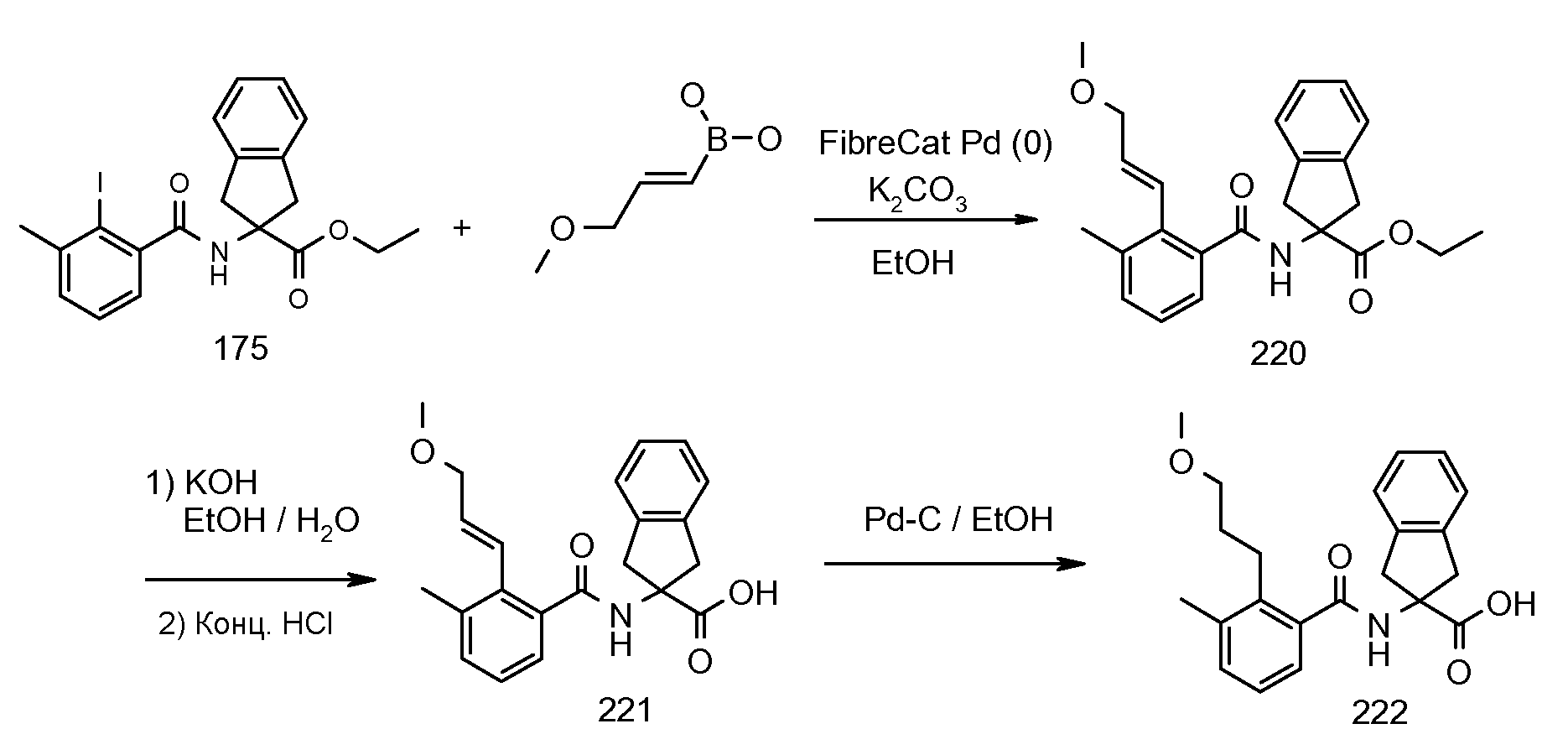
Этиловый эфир 2-[2-(3-метоксипропенил)-3-метилбензоиламино]индан-2-карбоновой кислоты (220):
К раствору этилового эфира 2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (400 мг, 0,89 ммоль) и 3-метоски-1-пропенилбороновой кислоты (206 мг, 1,78 ммоль) в 10 мл EtOH/10 мл диоксана добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 195 мг, 0,089 ммоль) и 2М водный раствор K2SO4 (1,78 мл, 3,56 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 4 часа. После концентрирования в вакууме остаток очищают ВЭЖХ с получением продукта (220) в виде масла бледно-желтого цвета.
ПРИМЕР 221
2-[2-(3-Метоксипропенил)-3-метилбензоиламино]индан-2-карбоновая кислота (221):
Продукт (220) и KOH (1,0 г, 18 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. После фильтрования полученное твердое вещество коричневого цвета очищают ВЭЖХ с получением продукта (221) в виде твердого вещества белого цвета (200 мг, 62%).
1H ЯМР (CDCl3, 300МГц): δ 2,28 (с, 3H), 3,31 (с, 1H), 3,37 (с, 4H), 3,78 (д, 2H), 3,93 (дд, 2H), 5,83 (дт, 1H), 6,44 (с, 1H), 6,64 (д, 1H), 7,10-7,35 (м, 7H)
ЖХ/МС (ES+) m/z=366,15
ПРИМЕР 222
2-[2-(3-Метоксипропил)-3-метилбензоиламино]индан-2-карбоновая кислота (222):
К раствору 2-[2-(3-метоксипропенил)-3-метилбензоиламино]индан-2-карбоновой кислоты (229) (120 мг, 0,34 ммоль) в абсолютном EtOH (15 мл) добавляют катализатор Pd-C (5% Pd по весу, 93 мг, 4,4% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 55 фунт/кв. дюйм, 50°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (222) в виде твердого вещества белого цвета (80 мг, 49%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,64 (м, 2H), 2,27 (с, 3H), 2,59-2,69 (м, 2H), 3,16-3,40 (м, 7H), 3,56 (д, 2H), 6,97-7,24 (м, 7H), 8,84 (с, 1H), 12,48 (с, 1H)
ЖХ/МС (ES+) m/z=368,18
ПРИМЕР 223
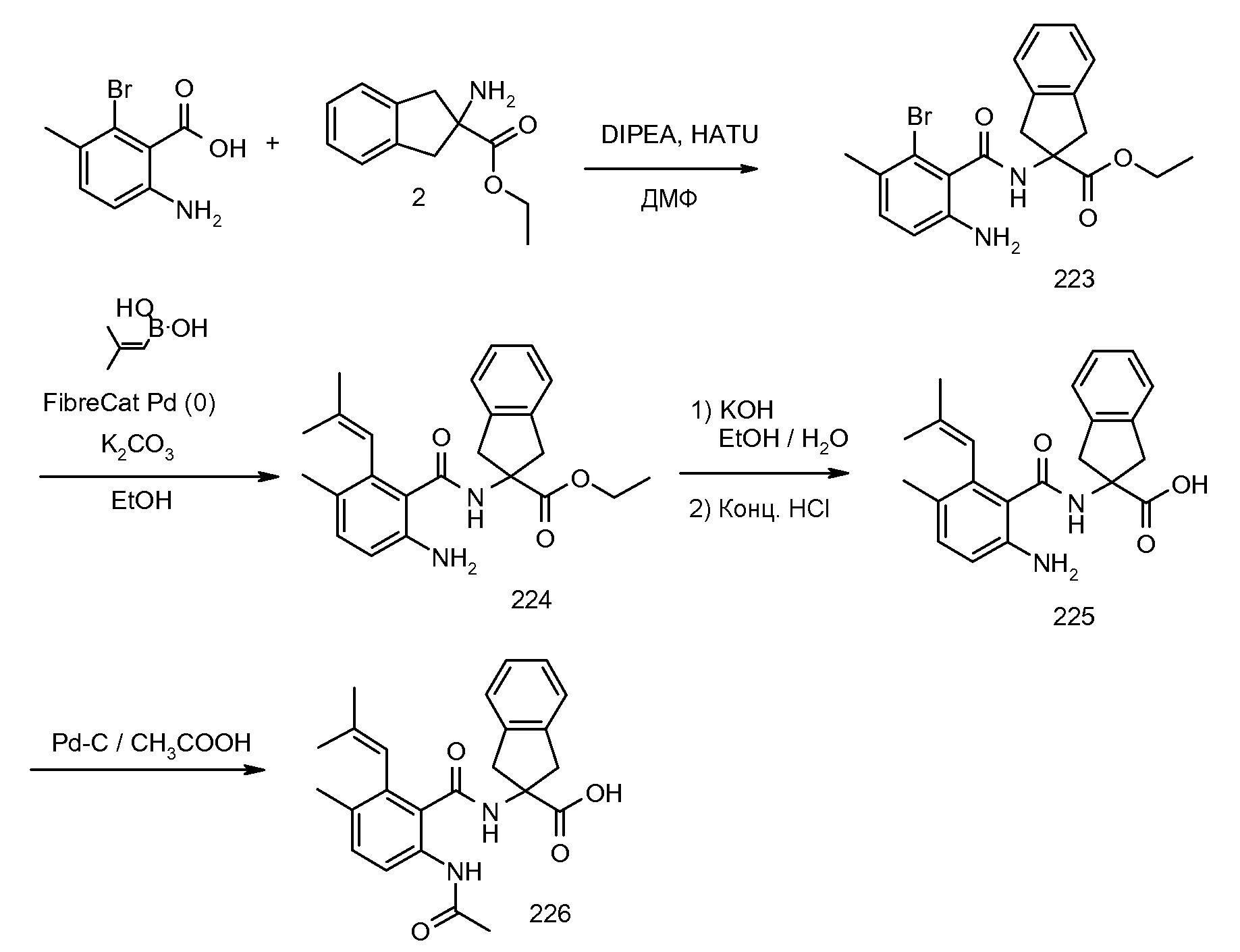
2-[6-Ацетиламино-3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (223):
К раствору 6-амино-2-бром-3-метилбензойной кислоты (688 мг, 2,99 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (737 мг, 3,59 ммоль), HATU (1,36 г, 3,59 ммоль) в безводном ДМФА (30 мл) добавляют DIPEA (0,59 мл, 3,59 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (150 мл) и промывают водой (1×10 мл) и насыщенным раствором соли (2×10 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением 278 мг коричневого масла (223).
ПРИМЕР 224
Этиловый эфир 2-[6-амино-3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (224):
К раствору (223) (278 мг, 0,67 ммоль) и 2,2-диметилэтиленбороновой кислоты (134 мг, 1,34 ммоль) в 10 мл EtOH добавляют нанесенный палладиевый гомогенный катализатор FibreCatPd(0) (4,84% Pd, 195 мг, 0,089 ммоль) и 2М водный раствор K2SO4 (1,78 мл, 3,56 ммоль). Полученную реакционную смесь насыщают аргоном и подвергают микроволновой реакции: 110°C, 5 часов. После концентрирования в вакууме остаток очищают ВЭЖХ с получением 380 мг полутвердого вещества коричневого цвета (224).
ПРИМЕР 225
2-[6-Амино-3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (225):
Смесь (224) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (8 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 4 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения образования белого осадка. После фильтрования неочищенное твердое вещество очищают ВЭЖХ с получением 48 мг твердого вещества коричневого цвета (225).
ПРИМЕР 226
2-[6-Ацетиламино-3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (226):
К раствору (225) (48 мг, 0,1 ммоль) в уксусной кислоте (10 мл) добавляют катализатор Pd-C (5% Pd по весу, 21 мг, 1% ммоль) в атмосфере аргона. Полученную реакционную смесь переносят для гидрирования в аппарат Парра: при давлении 55 фунт/кв. дюйм, 90°C, в течение ночи. Катализатор удаляют путем фильтрования через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (226) в виде твердого вещества белого цвета (35 мг, 86%).
1H ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 1,17 (с, 3H), 1,70 (с, 3H), 2,08 (д, 3H), 2,16 (д, 3H), 3,26 (д, 2H), 3,72 (д, 2H), 5,89 (с, 1H), 7,12-7,25 (м, 5H), 7,48 (с, 1H), 7,74 (д, 1H)
ЖХ/МС (ES+) m/z=407,18
ПРИМЕР 227
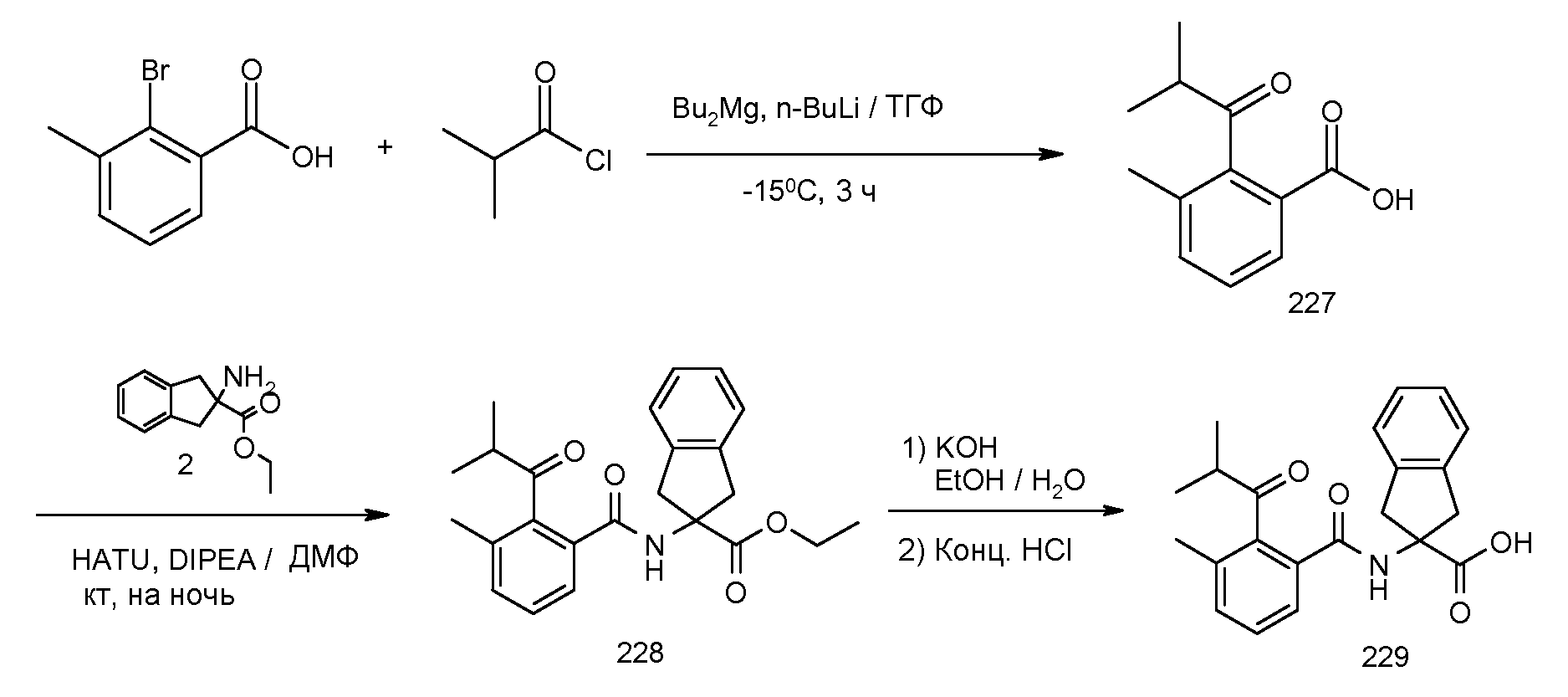
2-Иобутирил-3-метилбензойная кислота (227):
Раствор 2-бром-3-метилбензойной кислоты (1,5 г, 6,98 ммоль) в 10 мл ТГФ обрабатывают 1M раствором Bu2Mg/гептан при -15°C в атмосфере аргона. После перемешивания в течение 30 минут добавляют по каплям 1,6M раствор н-BuLi/гексан при -15°C и смесь оставляют на 1 час. Затем по каплям добавляют изобутирилхлорид (2,95 мл, 27,9 ммоль). Через 30 минут дополнительного перемешивания реакцию гасят 2 н. водным раствором HCl (2 мл). После концентрирования остаток очищают ВЭЖХ с получением чистого продукта (227) в виде твердого вещества белого цвета (840 мг, 58%).
1H ЯМР (CDCl3 + капли CD3OD, 300МГц): δ 0,62 (д, 3H), 1,31 (д, 3H), 2,51 (с, 3H), 2,61 (с, 1H), 7,42-7,50 (м, 2H), 7,68 (м, 1H)
ЖХ/МС (ES-) m/z=205,06
ПРИМЕР 228
Этиловый эфир 2-(2-изобутирил-3-метилбензоиламино)индан-2-карбоновой кислоты (228):
К раствору 2-изобутирил-3-метилбензойной кислоты (227) (200 мг, 0,97 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (220 мг, 1,07 ммоль) и HATU (441 мг, 1,16 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (192 мкл, 1,16 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в DCM (50 мл) и промывают водой (1×5 мл) и насыщенным раствором соли (1×5 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают ВЭЖХ с получением чистого продукта (228) в виде твердого вещества бледно-желтого цвета (340 мг, 89%).
1H ЯМР (CDCl3, 300МГц): δ 1,06 (д, 6H), 1,25 (т, 3H), 2,24 (с, 3H), 2,86 (м, 1H), 3,30 (д, 2H), 3,72 (д, 2H), 4,23 (кв, 2H), 6,47 (с, 1H), 7,14-7,43 (м, 7H)
ЖХ/МС (ES+) m/z=394,23
ПРИМЕР 229
2-(2-Изобутирил-3-метилбензоиламино)индан-2-карбоновая кислота (229):
Смесь этилового эфира 2-(2-изобутирил-3-метилбензоиламино)индан-2-карбоновой кислоты (228) (170 мг, 0,43 ммоль) и KOH (500 мг, 8,9 ммоль) растворяют в EtOH (20 мл) и воде (1 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до прекращения выделения из воды осадка. Осадок фильтруют с получением чистого продукта (229) в виде твердого вещества белого цвета (140 мг, 89%).
1H ЯМР (CDCl3, 300МГц): δ 1,07 (д, 6H), 2,25 (с, 3H), 2,87 (м, 1H), 3,35 (д, 2H), 3,74 (д, 2H), 7,16-7,42 (м, 7H)
ЖХ/МС (ES+) m/z=366,16
ПРИМЕР 230
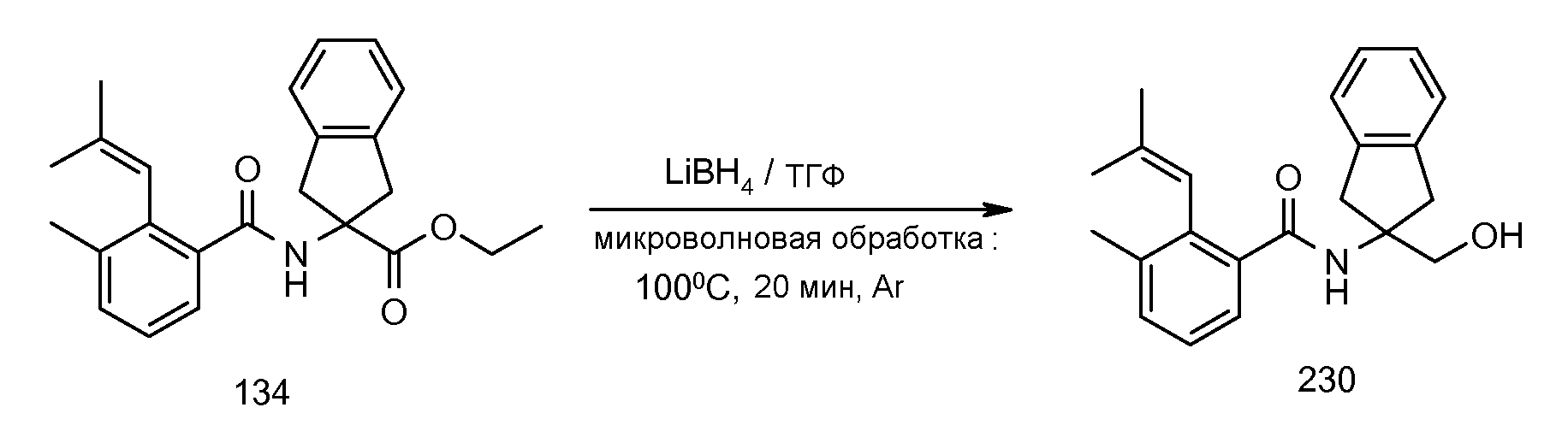
N-(2-Гидроксиметилиндан-2-ил)-3-метил-2-(2-метилпропенил)бензамид (230):
К раствору 2-[3-метил-2-(2-метилпропенил)бензоиламино)индан-2-карбоновой кислоты (80 мг, 0,21 ммоль) в безводном ТГФ (1 мл) по каплям добавляют 2M LiBH4/ТГФ (0,84 мл, 1,68 ммоль) при комнатной температуре в атмосфере аргона. Полученный раствор нагревают при 100°C в течение 20 минут при помощи микроволнового излучения. После охлаждения до комнатной температуры реакционный раствор вливают в ледяную воду и насыщенный водный раствор NH4Cl до достижения pH 7. Раствор экстрагируют EtOAc (50 мл × 3). Объединенную фазу EtOAc промывают насыщенным раствором соли (10 мл × 2), сушат над Na2SO4 и концентрируют. Остаток очищают ВЭЖХ с получением чистого продукта (230) в виде твердого вещества белого цвета (58 мг, 82%).
1H ЯМР (CDCl3, 300МГц): δ 1,38 (с, 3H), 1,80 (с, 1H), 2,16 (с, 1H), 3,11 (д, 2H), 3,33 (д, 2H), 3,88 (с, 2H), 6,11 (с, 1H), 6,71 (уш.с, 1H), 7,13-7,33 (м, 6H), 7,60 (д, 1H)
ЖХ/МС (ES+) m/z=336,21
ПРИМЕРЫ 231 и 232
Хиральное разделение примера 150 на примеры 231 и 232
|
|
|
Фракция 1 (-) (231):
1H ЯМР (ДМСО-d6, 300МГц): δ 0,76 (д, 6H), 1,74 (м, 1H), 2,27 (с, 3H), 2,62 (д, 2H), 3,24-3,38 (м, 2H), 3,43-3,62 (м, 2H), 6,90-7,28 (м, 6H), 8,83 (с, 1H), 12,51 (с, 1H)
ЖХ/МС (ES+) m/z=370,18
Фракция 2 (+) (232):
1H ЯМР (ДМСО-d6, 300МГц): δ 0,76 (д, 6H), 1,74 (м, 1H), 2,27 (с, 3H), 2,62 (д, 2H), 3,24-3,38 (м, 2H), 3,43-3,62 (м, 2H), 6,90-7,28 (м, 6H), 8,83 (с, 1H), 12,51 (с, 1H)
ЖХ/МС (ES+) m/z=370,18
Энантиомеры имеют следующие структуры:
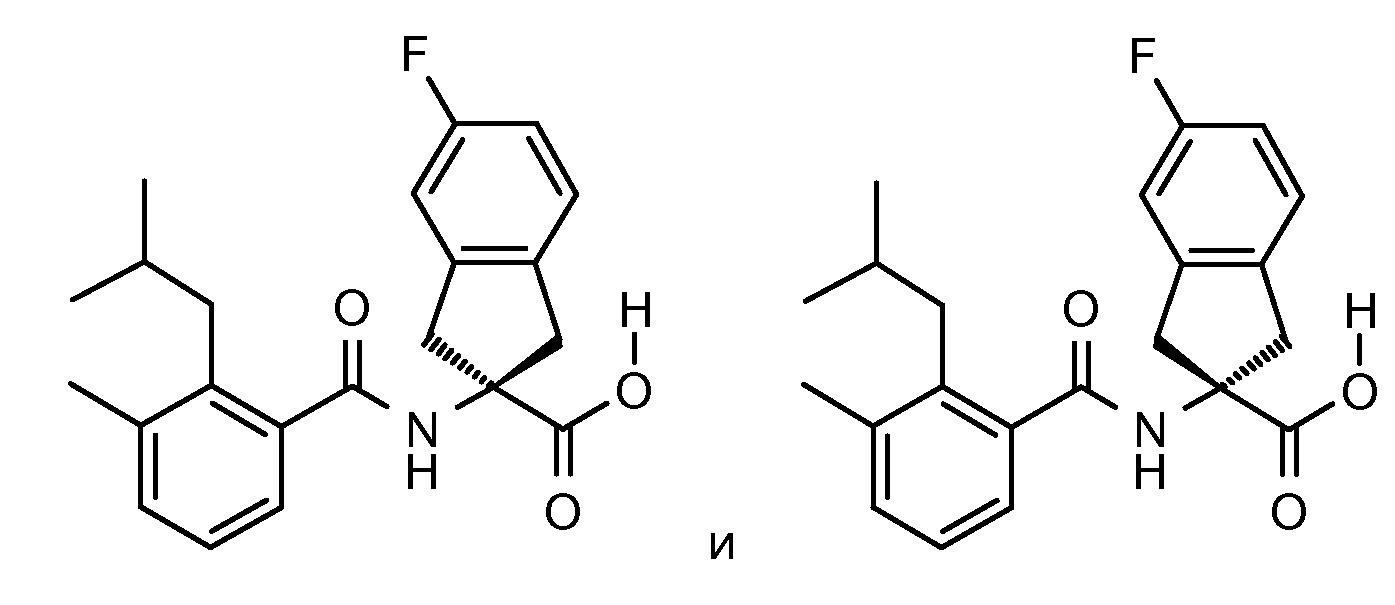
Однако данные структуры не относятся к любой из конкретных элюированных фракций.
ПРИМЕР 233
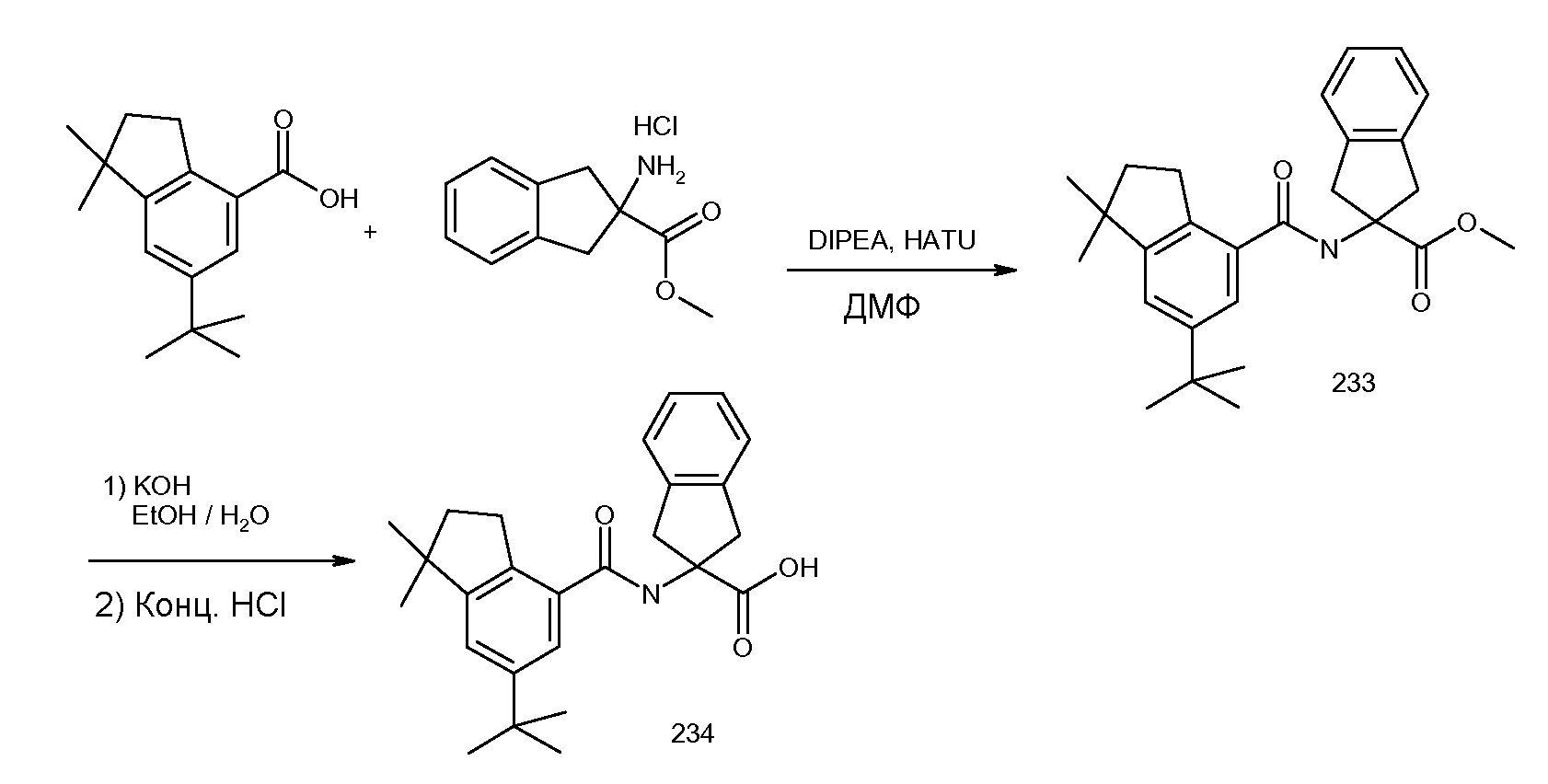
Метиловый эфир 2-[(6-трет-бутил-1,1-диметилиндан-4-карбонил)амино]индан-2-карбоновой кислоты (233):
К раствору 6-трет-бутил-1,1-диметилиндан-4-карбоновой кислоты (1 г, 4,1 ммоль), соли HCl метилового эфира 2-аминоиндан-2-карбоновой кислоты (924 мг, 4,1 ммоль) и HATU (1,85 г, 4,9 ммоль) в безводном ДМФА (15 мл) добавляют DIPEA (2,5 мл, 14,4 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают водой (1×100 мл), 1 н. HCl (1×100 мл) и насыщенным раствором соли (1×100 мл). Органический слой сушат над безводным MgSO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (60 г силикагеля; градиентное элюирование: 10-60% EtOAc в гептане) с получением чистого продукта в виде твердого вещества белого цвета (660 мг, 39%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,20 (с, 6H), 1,27 (с, 9H), 1,80 (т, 2H), 2,87 (т, 2H), 3,37 (с, 2H), 3,57 (с, 2H), 3,63 (с, 1H), 3,64 (с, 3H), 7,15-7,29 (м, 6H), 8,78 (с, 1H)
ЖХ/МС (ES+) m/z=420,24
ПРИМЕР 234
2-[(6-трет-Бутил-1,1-диметилиндан-4-карбонил)амино]индан-2-карбоновая кислота (234):
Смесь метилового эфира 2-[(6-трет-бутил-1,1-диметилиндан-4-карбонил)амино]индан-2-карбоновой кислоты (600 мг, 1,4 ммоль) и KOH (1,8 г, 30,8 ммоль) растворяют в EtOH (25 мл) и воде (2 мл) на водяной бане. Водяную баню удаляют после полного растворения KOH и полученный реакционный раствор перемешивают при комнатной температуре в течение 8 часов. После концентрирования в вакууме остаток нейтрализуют 1 н. HCl и экстрагируют EtOAc (3×150 мл), промытые органические фракции объединяют и концентрируют в вакууме. Остаток очищают препаративной ВЭЖХ (колонка C18, 10 микрон, градиентное элюирование: 20-100% ACN 0,1% ТФУК в H2O 0,1% ТФУК). Продукт кристаллизуется из отобранных фракций после отстаивания. В результате фильтрования и сушки получают чистый продукт в виде твердого вещества белого цвета (454 мг, 78%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,20 (с, 6H), 1,27 (с, 9H), 1,79 (т, 2H), 2,87 (т, 2H), 3,37 (с, 2H), 3,55 (с, 2H), 3,61 (с, 1H), 7,12-7,29 (м, 6H), 8,62 (с, 1H)
ЖХ/МС (ES+) m/z=406,22
ПРИМЕР 235
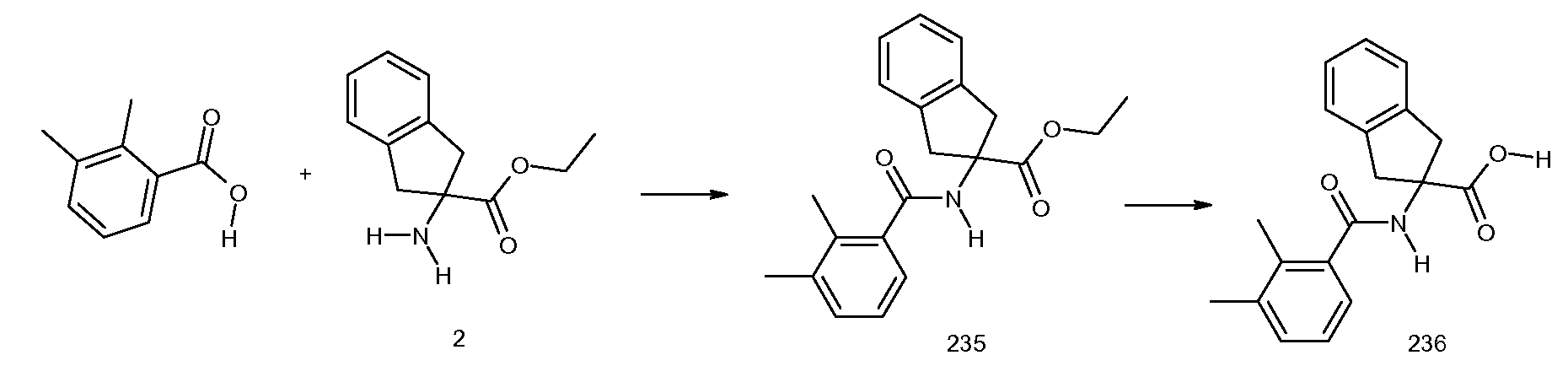
Этиловый эфир 2-(2,3-диметилбензоиламино)индан-2-карбоновой кислоты (235):
Этиловый эфир 2-аминоиндан-2-карбоновой кислоты (250 мг, 1,2 ммоль), 2,3-диметилбензойную кислоту (183 мг, 1,2 ммоль) и HATU (555 мг, 1,46 ммоль) помещают в пробирку, откачивают воздух и снова заполняют азотом. Добавляют безводный ДМФА (2 мл) и начинают перемешивать. Через несколько минут добавляют DIPEA (0,302 мл, 1,82 ммоль) и перемешивают при комнатной температуре в течение ночи. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) свидетельствует о полном расходе исходного амина. Добавляют воду (10 мл), экстрагируют EtOAc (3×5 мл), сушат над Na2SO4, концентрируют и неочищенный продукт хроматографируют на колонке с 25 г силикагеля, используя в качестве градиента 20-50% EtOAc в гептане, с получением этилового эфира 2-(2,3-диметилбензоиламино)индан-2-карбоновой кислоты (350 мг, 87%).
1Н ЯМР (CDCl3, 300 МГц,): δ 1,3 (т, 3H), 2,26 (с, 3H), 2,29 (с, 3H), 3,55 (дд, 4H), 4,28 (кв, 2H), 6,19 (с, 1H), 7,04-7,22 (м, 7H)
ЖХ/МС m/z=338,17
ПРИМЕР 236
2-(2,3-Диметилбензоиламино)индан-2-карбоновая кислота (236):
Смесь этилового эфира 2-(2,3-диметилбензоиламино)индан-2-карбоновой кислоты (235) (290 мг, 0,86 ммоль) и KOH (50% водного раствора, 1,92 г, 17,2 ммоль), EtOH (10 мл) и воды (1 мл) перемешивают в колбе объемом 20 мл при 50°C в течение 30 минут. После концентрирования в вакууме остаток растворяют в воде (5 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. В результате фильтрования получают 2-(2,3-диметилбензоиламино)индан-2-карбоновую кислоту (236) в виде твердого вещества белого цвета (240 мг, 90%).
1Н ЯМР (CDCl3, 300МГц): δ 2,22 (с, 3H), 2,25 (с, 3H), 3,61 (дд, 4H), 6,24 (с, 1H), 7,06 (м, 2H), 7,18-7,23 (м, 5H)
ЖХ/МС m/z=310,13
ПРИМЕР 237
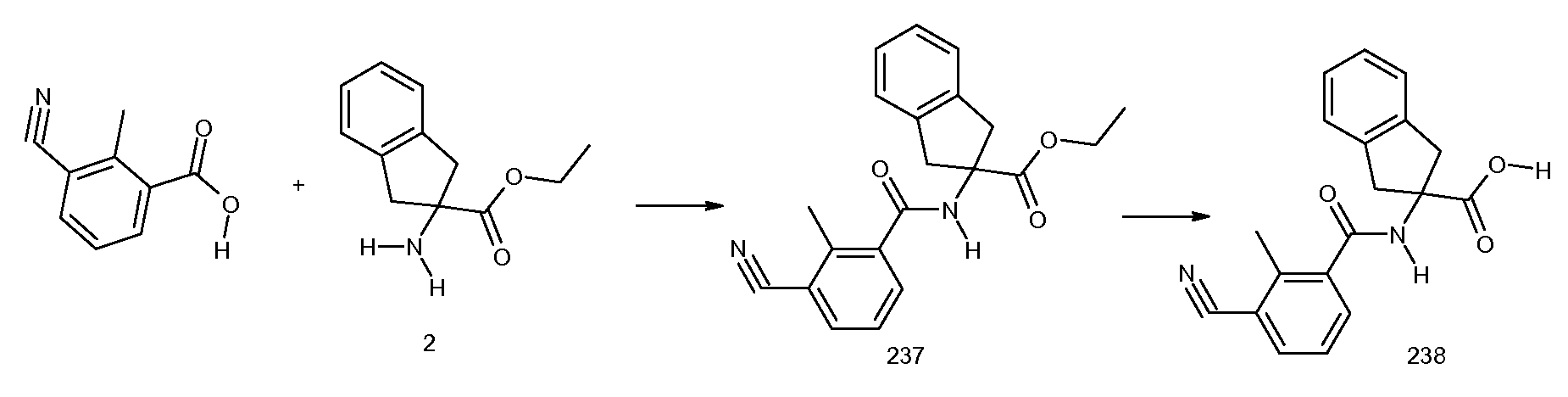
Этиловый эфир 2-(3-циано-2-метилбензоиламино)индан-2-карбоновой кислоты (237):
Этиловый эфир 2-аминоиндан-2-карбоновой кислоты (250 мг, 1,2 ммоль), 3-циано-2-метилбензойную кислоту (196 мг, 1,2 ммоль) и HATU (555 мг, 1,46 ммоль) помещают в колбу, вакуумируют и снова заполняют азотом. Добавляют безводный ДМФА (2 мл) и начинают перемешивать. Через несколько минут добавляют DIPEA (0,302 мл, 1,82 ммоль) и перемешивают при комнатной температуре в течение ночи. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) свидетельствует о полном расходе исходного амина. Добавляют воду (10 мл), экстрагируют EtOAc (3×5 мл), сушат над Na2SO4, концентрируют и неочищенный продукт хроматографируют на колонке с 25 г силикагеля, используя в качестве градиента 20-50% EtOAc в гептане, с получением этилового эфира 2-(3-циано-2-метилбензоиламино)индан-2-карбоновой кислоты (373 мг, 89%).
1Н ЯМР (CDCl3, 300 МГц,): δ 1,3 (т, 3H), 2,6 (с, 3H), 3,57 (дд, 4H), 4,29 (кв, 2H), 6,23 (с, 1H), 7,23-7,30 (м, 5H), 7,51 (д, 1H), 7,64 (д, 1H)
ЖХ/МС m/z=349,16
ПРИМЕР 238
2-(3-Циано-2-метилбензоиламино)индан-2-карбоновая кислота (238):
Смесь этилового эфира 2-(3-циано-2-метилбензоиламино)индан-2-карбоновой кислоты (3) (310 мг, 0,89 ммоль), KOH (50% водного раствора, 2 г, 17,8 ммоль), EtOH (10 мл) и воды (1 мл) перемешивают в колбе объемом 20 мл при 50°C в течение 30 минут. После концентрирования в вакууме остаток растворяют в воде (5 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. В результате фильтрования получают 2-(3-циано-2-метилбензоиламино)индан-2-карбоновую кислоту (238) в виде твердого вещества белого цвета (270 мг, 95%).
1Н ЯМР (CDCl3, 300МГц): δ 2,56 (с, 3H), 3,62 (дд, 4H), 6,30 (с, 1H), 7,22-7,31 (м, 5H), 7,51 (д, 1H), 7,65 (д, 1H)
ЖХ/МС m/z=321,12
ПРИМЕР 239
2-Бензил-4-бромбензойная кислота (239):
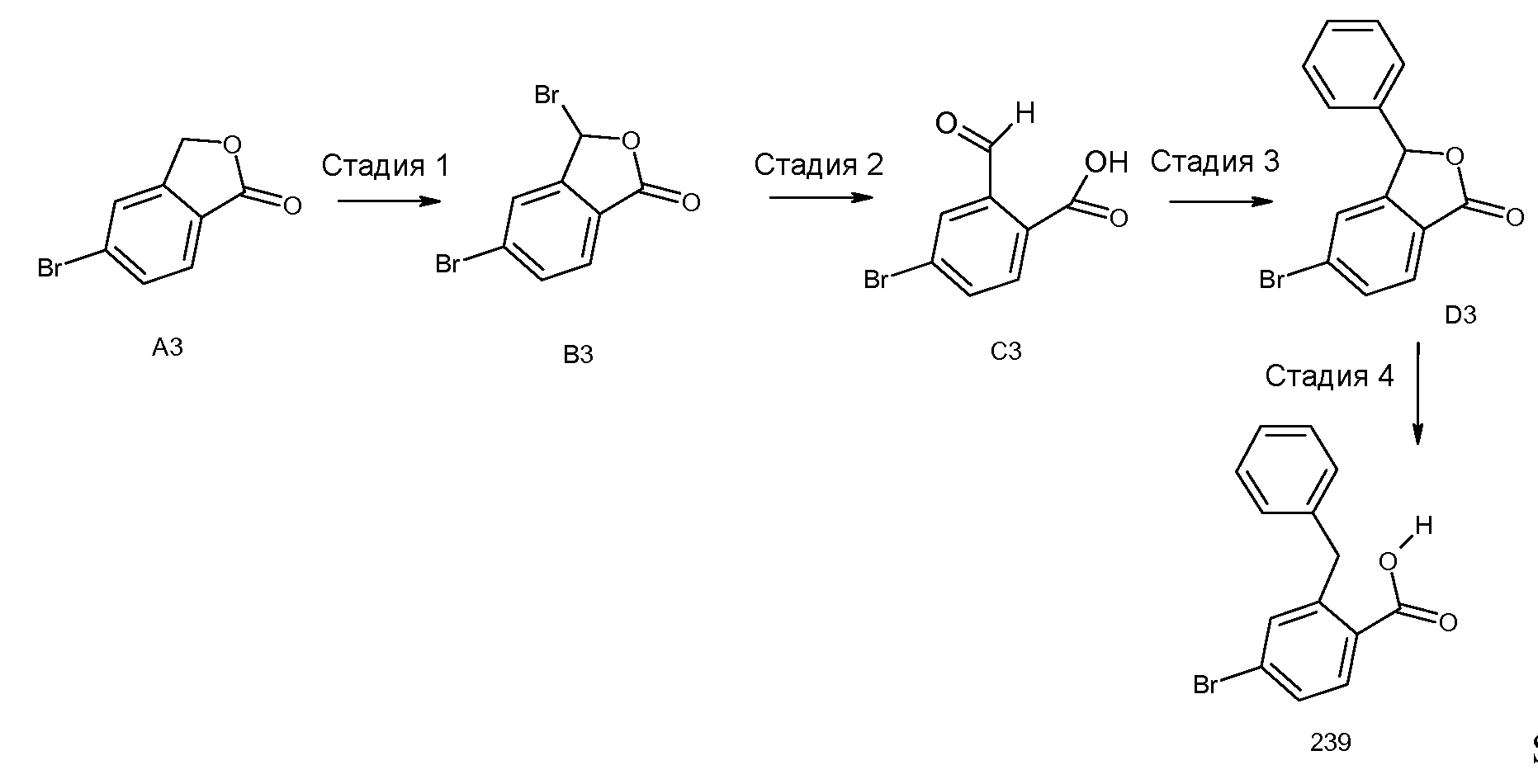
Стадия 1
3,5-Дибром-3H-изобензофуран-1-он (B3): Смесь 5-бром-3H-изобензофуран-1-она (A3) (51,5 г, 242 ммоль) в бромбензоле (100 мл) нагревают до 158°C. К смеси по каплям добавляют бром (18,8 мл, 363 ммоль) в течение 2 часов. Смесь перемешивают еще 30 минут при 158°C. Бромбензол удаляют путем вакуумной перегонки. Остаток сушат в вакууме в течение 1 часа при 120°C с получением кристаллического остатка черного цвета. Перекристаллизация: остаток растворяют в горячем изопропиловом эфире (300 мл), добавляют активированный уголь (1 г), перемешивают и отфильтровывают в горячем состоянии. Фильтрат охлаждают на бане с ледяной водой (0°C) в течение ночи. Твердое вещество отфильтровывают, промывают охлажденным изопропиловым эфиром (2×10 мл) и сушат в вакууме над KOH (KOH) с получением 3,5-дибром-3H-изобензофуран-1-она (B3) (38 г, 54%, т.пл.: 100°C).
Стадия 2
4-Бром-2-формилбензойная кислота (C3): Смесь 3,5-дибром-3H-изобензофуран-1-она (B3) (38 г, 130 ммоль) в растворе 10 н. NaOH (28,6 мл, 286 ммоль) и воды (240 мл) нагревают в течение 2 часов при 80°C. Добавляют активированный уголь (2 г) и смесь кипятят с обратным холодильником в течение еще 1 часа. Смесь фильтруют в горячем состоянии и подкисляют 2 н. метансульфоновой кислотой (100 мл). Полученную смесь охлаждают на бане с ледяной водой в течение 1 часа. Твердое вещество отфильтровывают, промывают водой (4×25 мл) и сушат в вакууме с использованием KOH, получая 4-бром-2-формилбензойную кислоту (C3) (26,5 г, 89%, т.пл.: 202°C). Перекристаллизация: 4-бром-2-формилбензойную кислоту (C3) растворяют в горячем EtOH (220 мл) и смесь охлаждают на бане с ледяной водой в течение 4 часов. Твердое вещество отфильтровывают и промывают холодным EtOH (3×20 мл). Затем твердое вещество сушат в вакууме над KOH с получением 4-бром-2-формилбензойной кислоты (16,8 г, 63%, т.пл.: 204-205°C).
Стадия 3
5-Бром-3-фенил-3H-изобензофуран-1-он (D3): Трехгорлую колбу объемом 1 л, оборудованную холодильником и капельной воронкой, продувают N2 и добавляют магниевые стружки (5 г, 206 ммоль) в тетрагидрофуране (80 мл). Добавляют по каплям бромбензол (32 г, 206 ммоль) в тетрагидрофуране (80 мл) в течение 1¼ часа, поддерживая температуру смеси 30°C. Полученную смесь перемешивают в течение 45 минут при 30°C. Добавляют по каплям 4-бром-2-формилбензойную кислоту (C3) (18,9 г, 83 ммоль) в безводном тетрагидрофуране (200 мл) в течение 45 минут. Смесь перемешивают в течение 2 часов при 30°C. Смесь охлаждают на бане с ледяной водой и водой (120 мл) и добавляют 5 н. раствор HCl (80 мл). Смесь перемешивают в течение ночи. ТГФ удаляют в вакууме и экстрагируют DCM (3×100 мл). Объединенные органические экстракты промывают водой (2×100 мл), сушат над Na2SO4, фильтруют и растворитель удаляют в вакууме с получением 5-бром-3-фенил-3H-изобензофуран-1-она (22,5 г, 94%). Перекристаллизация: 5-бром-3-фенил-3H-изобензофуран-1-он растворяют в горячем ацетоне (250 мл) и смесь охлаждают на бане с ледяной водой в течение ночи. Полученное твердое вещество отфильтровывают, промывают охлажденным ACN (2×15 мл) и затем сушат в вакууме над KOH с получением 5-бром-3-фенил-3H-изобензофуран-1-она (D3) (14,4 г, 61%, т.пл.: 189°C).
Стадия 4
2-Бензил-4-бромбензойная кислота (239): Смесь 5-бром-3-фенил-3H-изобензофуран-1-она (D3) (14,4 г, 50 ммоль), йода (9 г, 70 ммоль), аморфного красного фосфора (7,8 г, 250 ммоль), уксусной кислоты (125 мл) и дистиллированной воды (15 мл) в указанном порядке помещают в трехгорлую колбу, снабженную механической мешалкой и холодильником. После перемешивания в течение ночи при 50°C (90% продукта и 10% исходного вещества), реакцию гасят вливанием в воду (500 мл), добавляют эфир (200 мл) и отфильтровывают фосфор. Водный слой экстрагируют эфиром (3×100 мл) и объединенные органические слои промывают раствором бисульфита натрия (100 мл) и водой (2×100 мл). Органическую фазу экстрагируют с использованием 1 н. водного раствора NaOH (4×100 мл), снова промывают водой (4×100 мл), сушат над Na2SO4 и выпаривают с получением нейтральной фракции (2 г, т.пл. 180°C). Основную фазу подкисляют 5 н. HCl (150 мл) и экстрагируют DCM (4×100 мл). Объединенные экстракты промывают водой (3×100 мл), сушат над Na2SO4 и выпаривают с получением продукта (12 г, т.пл. 137°C). Продукт далее перекристаллизовывают из кипящего ACN (50 мл) с получением 2-бензил-4-бромбензойной кислоты (239) (10 г, 83%, т.пл. 145°C).
ПРИМЕР 240
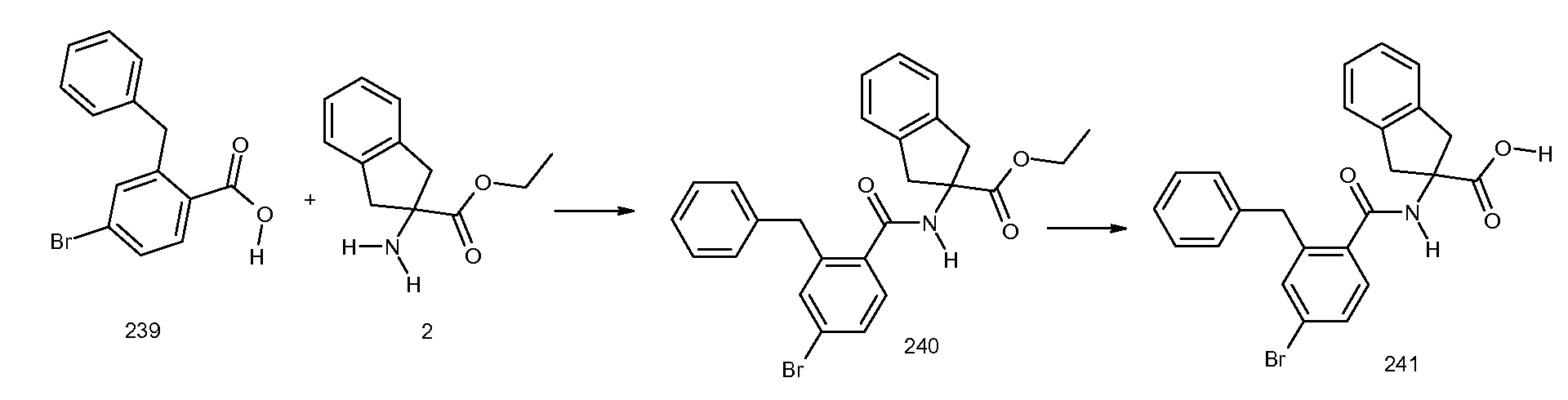
Этиловый эфир 2-(2-бензил-4-бромбензоиламино)индан-2-карбоновой кислоты (240):
Этиловый эфир 2-аминоиндан-2-карбоновой кислоты (2) (250 мг, 1,2 ммоль), 2-бензил-4-бромбензойную кислоту (239) (354 мг, 1,2 ммоль) и HATU (555 мг, 1,46 ммоль) помещают в колбу, вакуумируют и снова заполняют азотом. Добавляют безводный ДМФА (2 мл) и начинают перемешивать. Через несколько минут добавляют DIPEA (0,302 мл, 1,82 ммоль) и перемешивают при комнатной температуре в течение ночи. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) свидетельствует о полном расходе исходного амина. Добавляют воду (10 мл), экстрагируют EtOAc (3×5 мл), сушат над Na2SO4, концентрируют и неочищенный продукт хроматографируют на колонке с 25 г силикагеля, используя в качестве градиента 20-50% EtOAc в гептане, с получением этилового эфира 2-(2-бензил-4-бромбензоиламино)индан-4-карбоновой кислоты (495 мг, 86%).
1Н ЯМР (CDCl3, 300 МГц,): δ 1,26 (т, 3H), 3,35 (дд, 4H), 4,14 (с, 3H), 4,24 (кв, 2H), 6,12 (с, 1H), 7,05-7,39 (м, 12H)
ЖХ/МС m/z=478,13
ПРИМЕР 241
2-(2-Бензил-4-бромбензоиламино)индан-2-карбоновая кислота (241):
Смесь этилового эфира 2-(2-бензил-4-бромбензоиламино)индан-2-карбоновой кислоты (240) (339 мг, 0,71 ммоль), KOH (50% водного раствора, 1,58 г, 14,14 ммоль), EtOH (10 мл) и воды (1 мл) перемешивают в колбе объемом 20 мл при 50°C в течение 30 минут. После концентрирования в вакууме остаток растворяют в воде (5 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. В результате фильтрования получают 2-(2-бензил-4-бромбензоиламино)индан-2-карбоновую кислоту (241) в виде твердого вещества белого цвета (310 мг, 97%).
1Н ЯМР (CDCl3, 300МГц): δ 3,37 (дд, 4H), 4,10 (с, 2H), 6,23 (с, 1H), 7,01-7,38 (м, 12H)
ЖХ/МС m/z=450,06
ПРИМЕР 242
4-Дифторметокси-2-метилбензойная кислота (242):
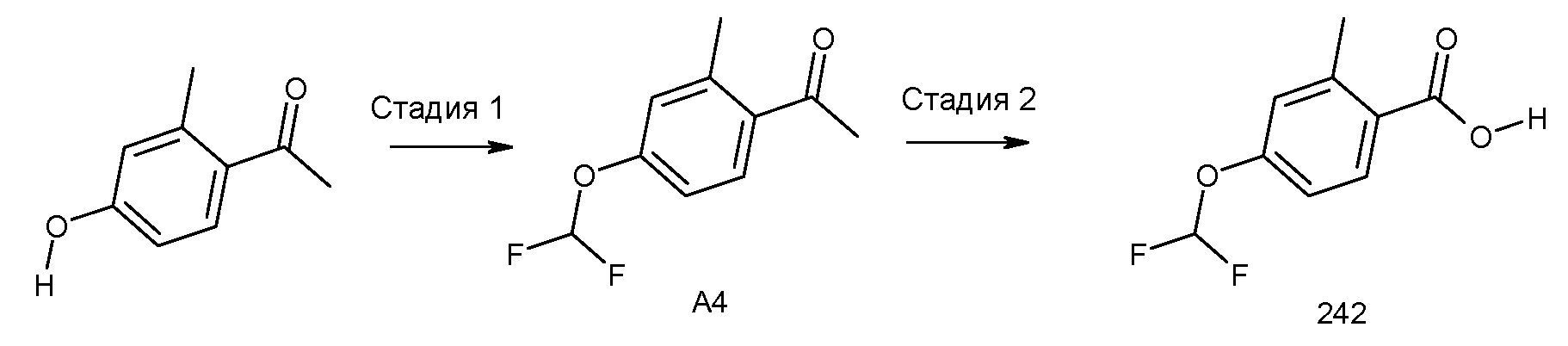
Стадия 1
1-(4-Дифторметокси-2-метилфенил)этанон (A4): К перемешиваемой суспензии 1-(4-гидрокси-2-метилфенил)этанона (15 г, 100 ммоль) в диоксане (30 мл) добавляют воду (25 мл), с последующим добавлением NaOH (20 г, 500 ммоль). Реакционную смесь нагревают до 65°C и пропускают через нее газообразный хлордифторметан (30 г, 150 ммоль) с использованием стеклянной трубочки, кончик которой погружают в раствор на 75 минут. Перемешивают в течение дополнительных 30 минут и оставляют при комнатной температуре на выходные дни. После переноса в делительную воронку добавляют воду (100 мл) и эфир (40 мл). Через некоторое время в нижней части водного слоя осаждается полужелатинообразный продукт. Нижнюю часть водного слоя сливают и экстрагируют эфиром (2×40 мл). Объединенные эфирные слои промывают водой (5×25 мл), сушат над твердым K2SO4, выпаривают и перегоняют (0,04 мм рт. ст., 61-64°C) с получением 1-(4-дифторметокси-2-метилфенил)этанона (A4) (16,2 г, 81%). Rf в ТСХ 0,60 с эфиром.
Стадия 2
4-Дифторметокси-2-метилбензойная кислота (242): Перемешиваемый раствор гипохлорита натрия (5,25% водный раствор, 204 мл, 143 ммоль) и 2 н. водный раствор KOH (22 мл, 44 ммоль) нагревают до 50°C и добавляют 1-(4-дифторметокси-2-метилфенил)этанон (A4) (5,8 г, 29 ммоль). После отстаивания при температуре 50-70°C в течение 3 часов и при комнатной температуре в течение ночи реакционную смесь нагревают до 50°C и добавляют метабисульфит натрия (4,5 г) тремя порциями. Затем реакцию подкисляют 12 н. HCl и тщательно перемешивают. Осажденное твердое вещество белого цвета отфильтровывают, промывают небольшим количеством воды и сушат на воздухе с получением 4-дифторметокси-2-метилбензойной кислоты (242) (5,4 г, 92%). Продукт перекристаллизовывают из смеси 1:1 ACN и воды, т.пл.: 117-119°C. Элементный анализ: Фактически: C (53,23), H (3,88), F (18,66). Теоретически: C (53,47), H (3,99), F (18,80).
ПРИМЕР 243
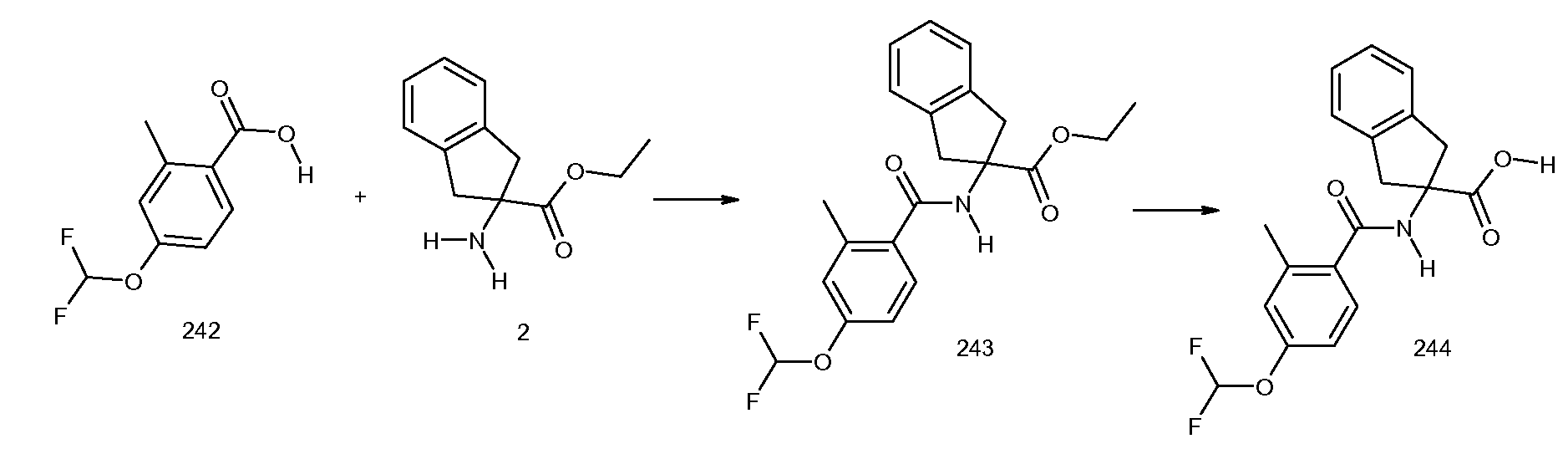
Этиловый эфир 2-(4-дифторметокси-2-метилбензоиламино)индан-2-карбоновой кислоты (243):
Этиловый эфир 2-аминоиндан-2-карбоновой кислоты (2) (250 мг, 1,2 ммоль), 4-дифторметокси-2-метилбензойную кислоту (242) (246 мг, 1,2 ммоль) и HATU (555 мг, 1,46 ммоль) помещают в колбу, вакуумируют и снова заполняют азотом. Добавляют безводный ДМФА (2 мл) и начинают перемешивать. Через несколько минут добавляют DIPEA (0,302 мл, 1,82 ммоль) и перемешивают при комнатной температуре в течение ночи. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) свидетельствует о полном расходе исходного амина. Добавляют воду (10 мл), экстрагируют EtOAc (3×5 мл), сушат над Na2SO4, концентрируют и неочищенный продукт хроматографируют на колонке с 25 г силикагеля, используя в качестве градиента 20-50% EtOAc в гептане, с получением этилового эфира 2-(4-дифторметокси-2-метилбензоиламино)индан-2-карбоновой кислоты (415 мг, 89%).
1Н ЯМР (CDCl3, 300 МГц,): δ 1,29 (т, 3H), 2,42 (с, 3H), 3,56 (дд, 4H), 4,27 (кв, 2H), 6,21 (с, 1H), 6,91 (м, 2H), 7,22 (м, 4H), 7,33 (д, 1H)
ЖХ/МС m/z=390,16
ПРИМЕР 244
2-(4-Дифторметокси-2-метилбензоиламино)индан-2-карбоновая кислота (244):
Смесь этилового эфира 2-(4-дифторметокси-2-метилбензоиламино)индан-2-карбоновой кислоты (243) (301 мг, 0,77 ммоль), KOH (50% водного раствора, 1,73 г, 15,5 ммоль), EtOH (10 мл) и воды (1 мл) перемешивают в колбе объемом 20 мл при 50°C в течение 30 минут. После концентрирования в вакууме остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения выделения из воды белого осадка. В результате фильтрования получают 2-(4-дифторметокси-2-метилбензоиламино)индан-2-карбоновую кислоту (244) в виде твердого вещества белого цвета (245 мг, 88%).
1Н ЯМР (CDCl3, 300МГц): δ 2,37 (с, 3H), 3,62 (дд, 4H), 6,23 (с, 1H), 6,92 (м, 2H), 7,24 (м, 5H).
ЖХ/МС m/z=362,10.
ПРИМЕР 245
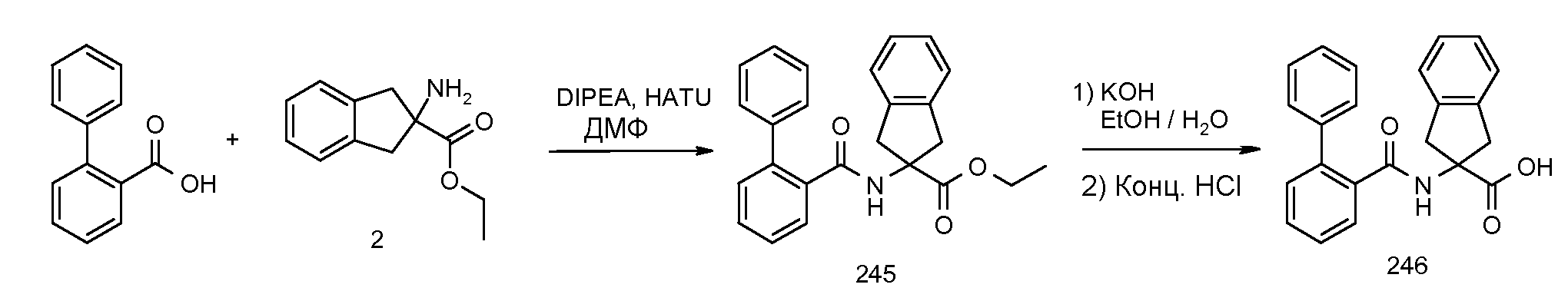
Этиловый эфир 2-[(бифенил-2-карбонил)амино]индан-2-карбоновой кислоты (245):
К раствору бифенил-2-карбоновой кислоты (289 мг, 1,46 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (300 мг, 1,46 ммоль) и HATU (666 мг, 1,75 ммоль) в безводном ДМФА (1,8 мл) добавляют DIPEA (381 мкл, 2,19 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (10 мл) и экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме и остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (245) в виде твердого вещества не совсем белого цвета (525 мг, 93%).
ПРИМЕР 246
2-[(Бифенил-2-карбонил)амино]индан-2-карбоновая кислота (246):
Этиловый эфир 2-[(бифенил-2-карбонил)амино]индан-2-карбоновой кислоты (525 мг, 1,36 ммоль) растворяют в EtOH (15 мл) и добавляют твердый KOH (1,42 г, 24,7 ммоль) и воду (1,5 мл) Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (246) в виде твердого вещества белого цвета (453 мг, 93%).
1Н ЯМР (CDCl3, 300МГц): δ 2,92 (д, 2H), 3,63 (д, 2H), 5,84 (с, 1H), 7,08-7,12 (м, 2H), 7,15-7,19 (м, 2H), 7,24 (с, 4H), 7,30 (дд, 2H), 7,40-7,54 (м, 2H), 7,85 (дд, 1H)
ЖХ/МС (ES+) m/z=358,14
ПРИМЕР 247
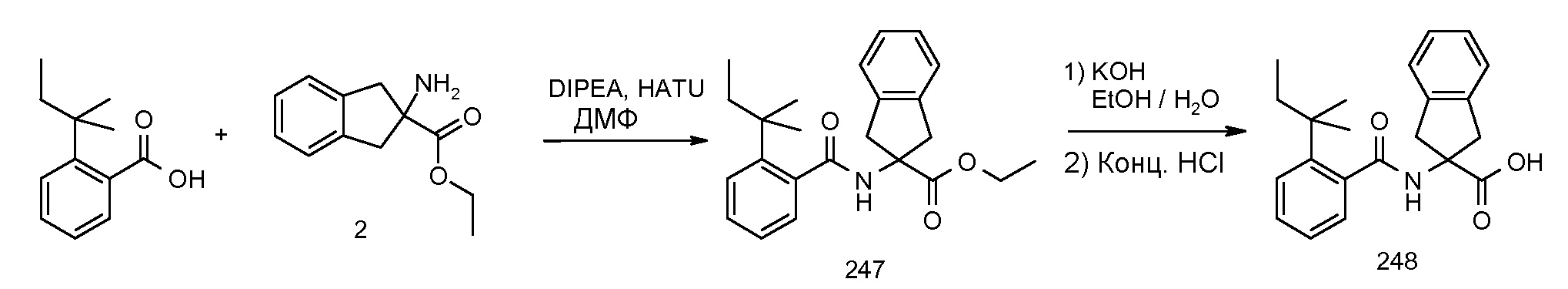
Этиловый эфир 2-[2-(1,1-диметилпропил)бензоиламино]индан-2-карбоновой кислоты (247):
К раствору 2-(1,1-диметилпропил)бензойной кислоты (140 мг, 0,73 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (150 мг, 0,73 ммоль) и HATU (333 мг, 0,87 ммоль) в безводном ДМФА (1 мл) добавляют DIPEA (190 мкл, 1,1 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Затем в реакционную смесь вливают воду (10 мл) и реакционную смесь экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля; градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (247) в виде желтого масла (220 мг, 89%).
ПРИМЕР 248
2-[2-(1,1-Диметилпропил)бензоиламино]индан-2-карбоновая кислота (248):
Этиловый эфир 2-[2-(1,1-диметилпропил)бензоиламино]индан-2-карбоновой кислоты (220 мг, 0,58 ммоль) растворяют в EtOH (8 мл) и добавляют твердый KOH (600 г, 10 ммоль) и воду (0,8 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (248) в виде твердого вещества белого цвета (158 мг, 78%).
1Н ЯМР (CDCl3, 300МГц): δ 0,53 (т, 3H), 1,29 (с, 6H), 1,66-1,73 (кв, 2H), 3,44 (д, 2H), 3,80 (д, 2H), 6,14 (с, 1H), 7,13-7,14 (м, 1H), 7,15 (д, 1H), 7,22 (д, 4H), 7,32 (д, 1H), 7,34 (т, 1H), 7,37 (дд, 1H)
ЖХ/МС (ES+) m/z=352,17
ПРИМЕР 249
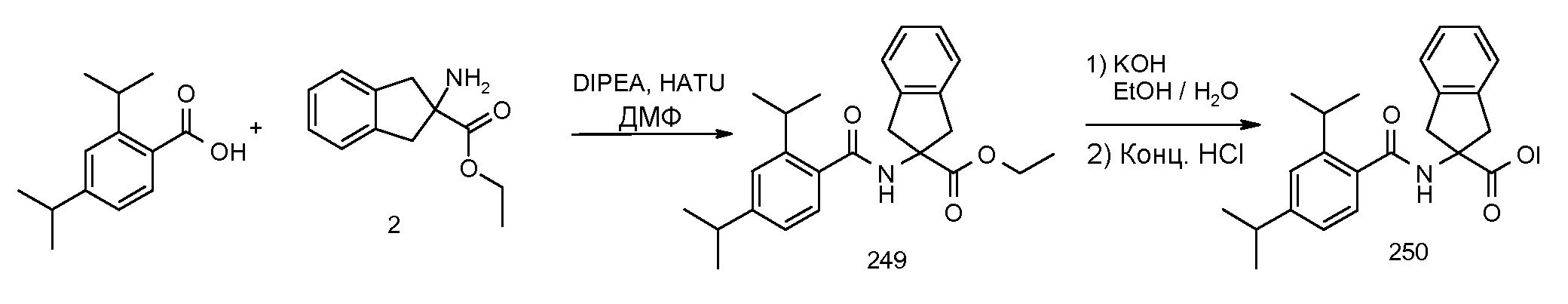
Этиловый эфир 2-(2,4-диизопропилбензоиламино)индан-2-карбоновой кислоты (249):
К раствору 2,4-диизопропилбензойной кислоты (150 мг, 0,73 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (150 мг, 0,73 ммоль) и HATU (333 мг, 0,87 ммоль) в безводном ДМФА (1 мл) добавляют DIPEA (190 мкл, 1,10 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (10 мл) и экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (249) в виде твердого вещества не совсем белого цвета (211 мг, 73%).
ПРИМЕР 250
2-(2,4-Диизопропилбензоиламино)индан-2-карбоновая кислота (250):
Этиловый эфир 2-(2,4-диизопропилбензоиламино)индан-2-карбоновой кислоты (211 мг, 0,54 ммоль) растворяют в EtOH (8 мл) и добавляют твердый KOH (823 мг, 14 ммоль) и воду (0,8 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (250) в виде твердого вещества белого цвета (188 мг, 95%).
1Н ЯМР (CDCl3, 300МГц): 1,12 (д, 6H), 1,21 (д, 6H), 2,83-2,92 (м, 1H), 3,10-3,19 (м, 1H), 3,41 (д, 2H), 3,82 (д, 2H), 6,18 (с, 1H), 7,00-7,10 (м, 2H), 7,16 (с, 1H), 7,22-7,31 (м, 4H)
ЖХ/МС (ES+) m/z=366,20
ПРИМЕР 251
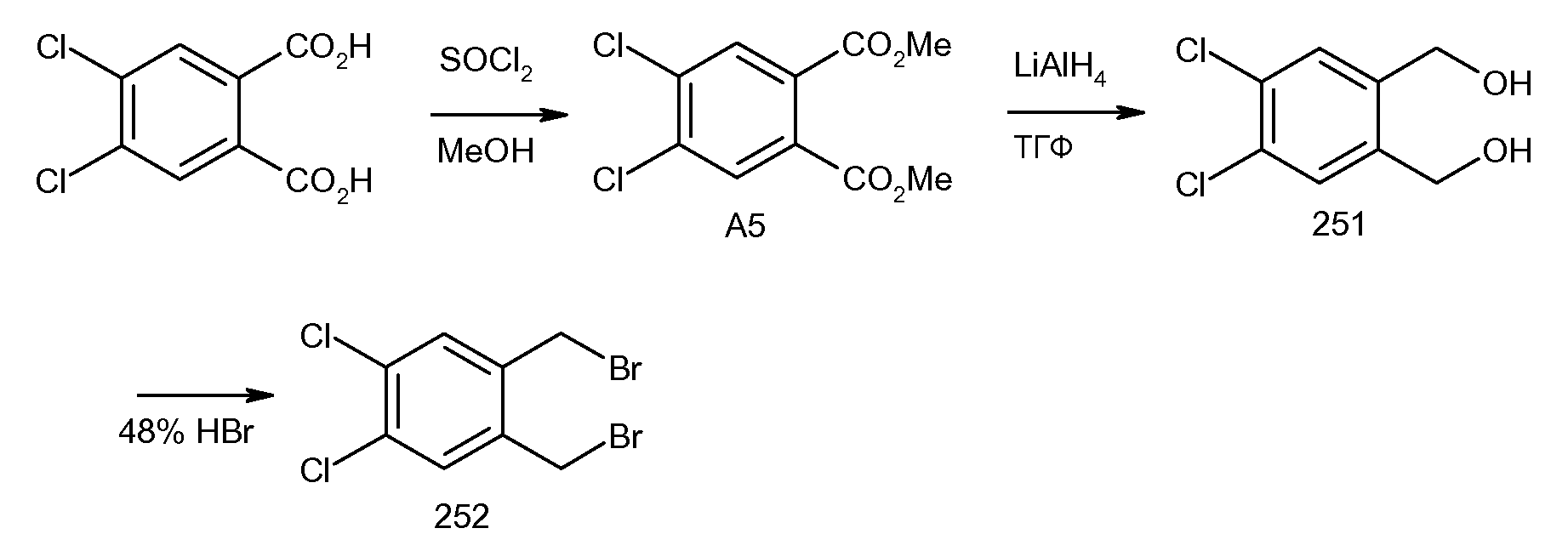
Диметил 4,5-дихлорфталат (A5):
Тионилхлорид (150 мл, 2,05 моль) добавляют по каплям в течение 2 часов к перемешиваемому на магнитной мешалке раствору 4,5-дихлорфталевой кислоты (110,43 г, 469,8 ммоль) в MeOH (1 л) при комнатной температуре. После перемешивания в течение ночи МеОН удаляют в вакууме на роторном испарителе. Остаток растворяют в EtOAc (750 мл) и экстрагируют водой (1×500 мл) и насыщенным водным раствором NaHCO3 (1×500 мл). Органический слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме на роторном испарителе с получением A5 (122,8 г) в виде жидкости бледно-желтого цвета. [A. Rosowsky, C. M. Vaidya, H. Bader, J. E. Wright, B. A. Teicher, J. Med. Chem. 40, 286-299 (1997); E.J. Hennessy, S.L. Buchwald, J. Org. Chem., 70, 7371-7375 (2005).]
1Н ЯМР (CDCl3, 300МГц): δ 3,92 (с, 3H), 7,82 (с, 1H)
4,5-Дихлор-1,2-бис(гидроксиметил)бензол (251):
Раствор диметил 4,5-дихлорфталата (A5) (98,86 г, 375,78 ммоль) в тетрагидрофуране (150 мл) добавляют по каплям в течение 1 часа к механически перешиваемой суспензии LAH (20,8 г, 548,1 ммоль) в тетрагидрофуране (1,5 л). В процессе добавления реакционную смесь охлаждают на бане с ледяной водой. По завершении добавления реакционную смесь перемешивают в течение ночи при комнатной температуре. Избыточный LAH разлагают, осторожно добавляя воду (20 мл), 10% водный раствор NaOH (40 мл) и воду (20 мл). Твердые вещества удаляют путем фильтрования через слой целита и промывают тетрагидрофураном. Объединенный фильтрат и промывочный раствор концентрируют в вакууме на роторном испарителе с получением неочищенного продукта 251 в виде твердого вещества белого цвета, которое очищают кристаллизацией из ацетона (150 мл)-гептана (150 мл). Кристаллы собирают фильтрованием, промывают гептаном и сушат с получением 4,5-дихлор-1,2-бис(гидроксиметил)бензола (37,2 г). Из объединенного фильтрата и промывочной жидкости получают вторую порцию 251 (18,8 г, 24,1%) [L. A. Levy, Synth. Commun., 13, 639-648 (1983); O. Farooq, Synthesis, 1035-1036 (1994)].
1H ЯМР (ДМСО-d6, 300МГц): δ 4,49 (д, 2H), 5,32 (т, 1H), 7,57 (с, 1H)
EI-MS m/z 209, 207
Аналитически вычислено для C8H8Cl2O2: C, 46,41; H, 3,89. Найдено: C, 46,50; H, 3,83
ПРИМЕР 252
1,2-бис(Бромметил)-4,5-дихлорбензол (252):
Смесь 4,5-дихлор-1,2-бис(гидроксиметил)бензола (251, 32,87 г, 158,75 ммоль) и 48% водного раствора бромистоводородной кислоты (160 мл) нагревают при кипении с обратным холодильником в течение 6 часов. Реакционную смесь охлаждают и экстрагируют диэтиловым эфиром (1×450 мл + 2×200 мл). Объединенные органические экстракты промывают обратной струей воды (1×200 мл) и насыщенным раствором соли (1×200 мл). Органический слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме на роторном испарителе с получением твердого вещества светло-желтого цвета, которое растворяют в смеси гептан-0,5% EtOAc при нагревании, помещают на колонку с силикагелем (7,2 см × 23 см), приготовленную в смеси гептана-0,5% EtOAc, и подвергают флэш-хроматографии, отбирая фракции по 500 мл и элюируя смесью гептан-0,5% EtOAc (1,6 л) и гептан-1% EtOAc (4 л). Содержащие продукт фракции (5-14) объединяют и концентрируют в вакууме на роторном испарителе с получением 1,2-бис(бромметил)-4,5-дихлорбензола (250, 50,01 г) в виде бесцветной жидкости. [L. A. Levy, Synth. Commun., 13, 639-648 (1983).]
1Н ЯМР (CDCl3, 300МГц): δ 4,55 (с, 2H), 7,46 (с, 1H)
EI-MS m/z 330, 332, 334, 336
Аналитически вычислено для C8H6Br2Cl2: C, 28,87; H, 1,82. Найдено: C, 28,84; H, 1,68
ПРИМЕР 253
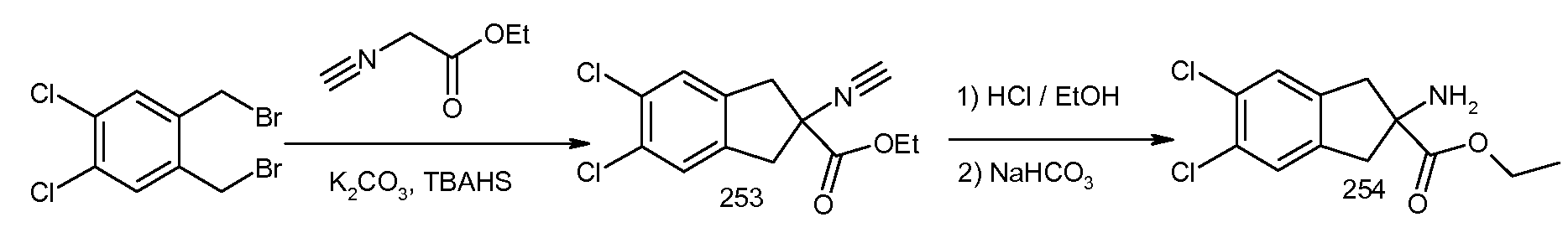
Этиловый эфир 4,5-дихлоризоцианоиндан-2-карбоновой кислоты (253):
К раствору этилизоцианоацетата (3,85 мл, 35 ммоль) в безводном ACN (300 мл) добавляют тонкоизмельченный безводный K2CO3 (29 г, 210 ммоль), TBAHS (гидросульфат тетрабутиламмония, 2,34 г, 7 ммоль) и 1,2-бис(бромметил)-4,5-дихлорбензол (11,6 г, 35 ммоль). Полученную гетерогенную смесь перемешивают при 80°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления нежелательных солей. Фильтрат концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (200 г силикагеля; градиентное элюирование: 0-25% EtOAc в гептане) с получением чистого продукта в виде порошкообразного вещества белого цвета (6,63 г, 66%).
1Н ЯМР (CDCl3, 300МГц): δ 1,35 (т, 3H), 3,47 (д, 2H), 3,71 (д, 2H), 4,32 (кв, 2H), 7,46 (с, 2H)
ЖХ/МС (ES+) m/z=286,14
ПРИМЕР 254
Этиловый эфир 2-амино-4,5-дихлориндан-2-карбоновой кислоты (254):
К раствору этилового эфира 4,5-дихлоризоцианоиндан-2-карбоновой кислоты (253) (6,63 г, 23,2 ммоль) в абсолютном EtOH (200 мл) по каплям добавляют концентрированную HCl (10 мл). Полученный раствор перемешивают при комнатной температуре в течение 24 часов. После удаления EtOH в вакууме остающуюся гидрохлоридную соль растворяют в воде (100 мл) и экстрагируют этиловым эфиром (3×50 мл) для удаления нежелательных органических примесей. Водный слой доводят до pH 9, добавляя насыщенный раствор NaHCO3, и затем экстрагируют EtOAc (3×100 мл). Объединенный слой EtOAc промывают насыщенным раствором соли (100 мл). Органический слой сушат над Na2SO4 и концентрируют в вакууме с получением чистого продукта в виде твердого вещества белого цвета (5,2 г, 82%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,88 (д, 2H), 3,57 (д, 2H), 4,23 (кв, 2H), 7,46 (с, 2H)
ЖХ/МС (EZ+) m/z=275,18
ПРИМЕР 255
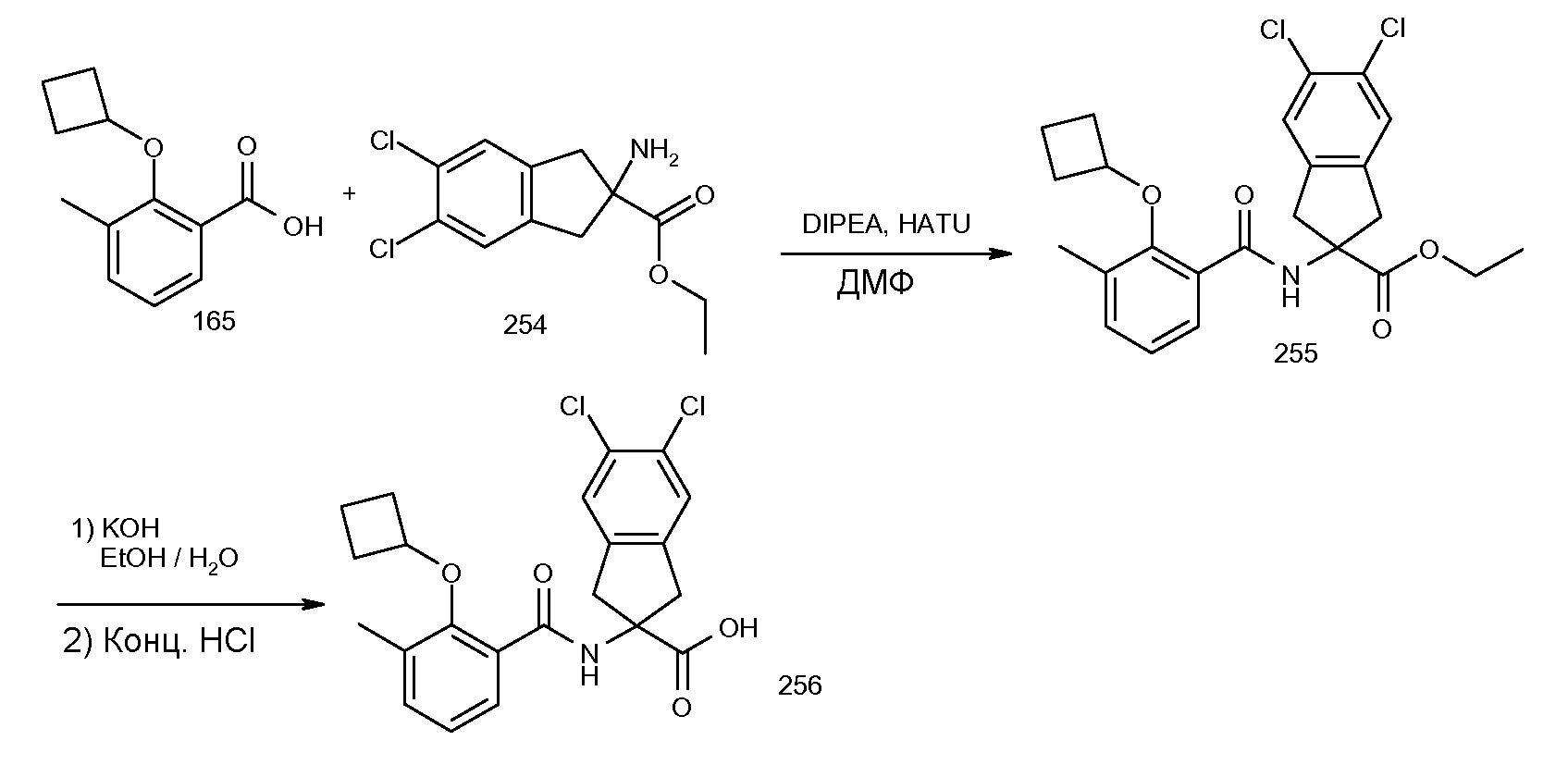
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-4,5-дихлориндан-2-карбоновой кислоты (255):
К раствору 2-циклобутокси-3-метилбензойной кислоты (225 мг, 1,1 ммоль), этилового эфира 2-амино-4,5-дихлориндан-2-карбоновой кислоты (254) (360 мг, 1,31 ммоль) и HATU (622 мг, 1,64 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (360 мкл, 2,20 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток суспендируют в H2O (50 мл) и промывают EtOAc (3×50 мл). Органические слои объединяют и последовательно промывают NaHCO3 и насыщенным раствором соли и затем органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (255) в виде порошкообразного вещества белого цвета (460 мг, 90%).
1Н ЯМР (CDCl3, 300МГц): δ 1,21-1,36 (м, 4H), 1,50-1,56 (м, 1H), 1,96-2,09 (м, 4H), 2,27 (с, 3H), 3,44 (т, 2H), 3,73 (дд, 2H), 4,21-4,33 (м, 3H), 6,85-6,94 (м, 2H), 7,08 (т, 1H), 7,14-7,19 (м, 1H), 7,27 (д, 1H), 7,85 (дд, 1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=428,93
ПРИМЕР 256
2-(2-Циклобутокси-3-метилбензоиламино)-4,5-дихлориндан-2-карбоновая кислота (256):
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-4,5-дихлориндан-2-карбоновой кислоты (255) (460 мг, 0,99 ммоль) растворяют в EtOH (50 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH 2. Полученную смесь промывают EtOAc (3×100 мл). Органические слои объединяют и промывают насыщенным раствором соли, затем сушат над безводным Na2SO4 и концентрируют в вакууме. Желаемый продукт (256) получают в виде твердого вещества белого цвета (405 мг, 94%).
1H ЯМР (d-ДМСО-d6, 300МГц): δ 1,21-1,36 (м, 1H), 1,50 (м, 1H), 1,92-2,14 (м, 4H), 2,26 (с, 3H), 3,38 (т, 2H), 3,73 (дд, 2H), 4,29 (м, 1H), 6,86-6,95 (м, 2H), 7,11 (т, 1H), 7,15-7,20 (м, 1H), 7,29 (д, 1H), 7,83 (дд, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=434,32
ПРИМЕР 257
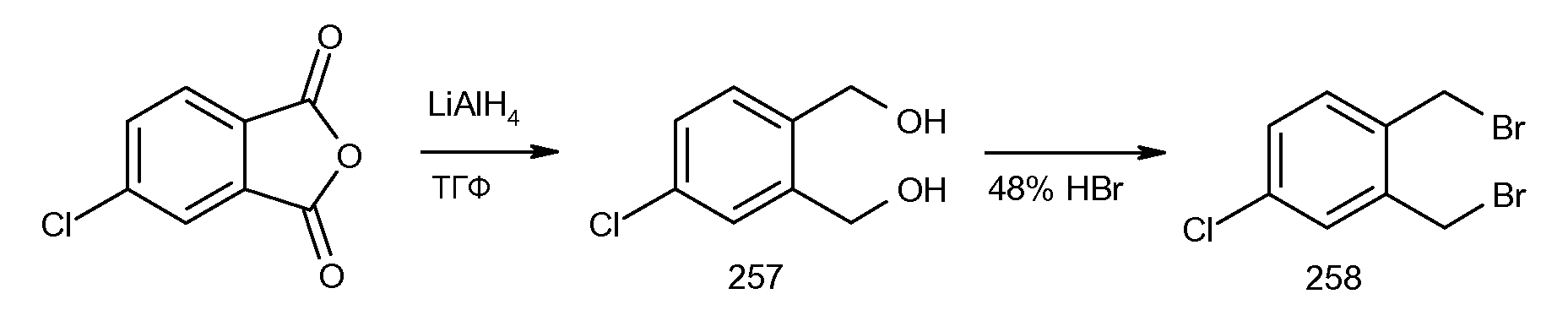
4-Хлор-1,2-бис(гидроксиметил)бензол (257):
Раствор 4-хлорфталевого ангидрида (24,83 г, 136,01 ммоль) в тетрагидрофуране (100 мл) добавляют по каплям к механически перемешиваемой суспензии LAH (8,72 г, 229,78 ммоль) в тетрагидрофуране (500 мл). После перемешивания в течение ночи при комнатной температуре избыточный LAH разлагают, осторожно добавляя воду (8,5 мл), 10% водный раствор NaOH (17 мл) и воду (8,5 мл). Реакционную смесь разбавляют тетрагидрофураном (300 мл) и твердые вещества удаляют фильтрованием через слой целита и промывают тетрагидрофураном. Объединенный фильтрат и промывочный раствор концентрируют в вакууме на роторном испарителе с получением диола 257 в виде бесцветной жидкости (22,16 г), которая кристаллизуется при отстаивании. Кристаллизацию осуществляют в бензоле. [O. Farooq, Synthesis, 1035-1036 (1994); R. F. Bird, E. E. Turner, J. Chem. Soc. 5050-5051 (1952); J. Tirouflet, Compt. rend., 238, 2246-2247 (1954).]
1H ЯМР (ДМСО-d6, 300МГц): δ 4,48 (т, 2H), 4,52 (т, 2H), 5,15 (т, 1H), 5,24 (т, 1H), 7,27 (дд, 1H), 7,38 (с, 1H), 7,41 (т, 1H)
ПРИМЕР 258
1,2-бис(Бромметил)-4-хлорбензол (258):
Смесь 4-хлор-1,2-бис(гидроксиметил)бензола (257, 20,57 г, 119,7 ммоль) и 48% водного раствора бромистоводородной кислоты (140 мл) нагревают при 137°C в течение 4,5 часов. Реакционную смесь охлаждают до комнатной температуры, затем разбавляют холодной водой (250 мл) и экстрагируют диэтиловым эфиром (1×400 мл + 2×200 мл). Объединенные органические экстракты промывают водой (1×200 мл) и насыщенным раствором соли (1×200 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме на роторном испарителе с получением неочищенного дибромида 258 в виде жидкости желтого цвета. Данный продукт растворяют в смеси гептан-0,5% EtOAc, помещают на колонку с силикагелем (7,2 см × 22 см) и очищают флэш-хроматографией, отбирая фракции по 400 мл и элюируя смесью гептан-0,5% EtOAc (1,6 л) и гептан-1% EtOAc (3 л). Содержащие продукт фракции (5-9) объединяют и концентрируют в вакууме на роторном испарителе с получением дибромида 258 в виде бесцветной жидкости (34,46 г). [D. R. Lyon, F.G. Mann, G. H. Cookson, J. Chem. Soc., 662-670 (1947).]
1Н ЯМР (CDCl3, 300МГц): δ 4,58 + 4,61 (с + с, 4H), 7,28-7,32 (м, 2H), 7,36 (д, 1H)
EI-MS 298, 300
Аналитически вычислено для C8H7Br2Cl: C, 32,20; H, 2,36. Найдено: C, 32,30; H, 2,22
Альтернативный способ:
Перемешиваемую на магнитной мешалке смесь 4-хлорортоксилола (5 г, 35,56 ммоль), N-бромсукцинимида (12,65 г, 71,07 ммоль), AIBN (0,55 г) и CCl4 (150 мл) нагревают при кипении с обратным холодильником в течение 3,5 часов и затем охлаждают до комнатной температуры. Твердые вещества удаляют фильтрованием и промывают CCl4. Объединенный фильтрат и промывочный раствор концентрируют в вакууме на роторном испарителе с получением неочищенного дибромида 10 в виде бесцветной жидкости, которую растворяют в смеси гептан-1% EtOAc, помещают на колонку с силикагелем (7,2 см × 18 см), приготовленную в смеси гептан-1% EtOAc, и подвергают флэш-хроматографии, отбирая фракции по 200 мл и элюируя смесью гептан-1% EtOAc. Содержащие продукт фракции (7-11) объединяют и концентрируют в вакууме на роторном испарителе с получением содержащего примеси соединения 258 в виде бесцветной жидкости.
1Н ЯМР (CDCl3, 300МГц): δ 4,46 (с, 0,3H), 4,51 (с, 0,6H), 4,58 + 4,61 (пр. с, 4H), 7,26-7,29 (м, 2,5H), 7,36 (д, 1,2H)
ПРИМЕР 259
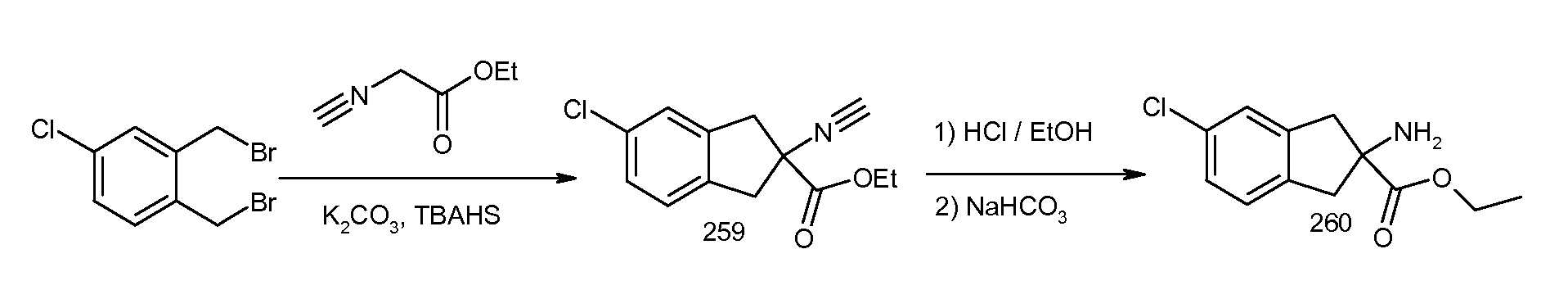
Этиловый эфир 4-хлоризоцианоиндан-2-карбоновой кислоты (259):
К раствору этилизоцианоацетата (3,85 мл, 35,0 ммоль) в безводном ACN (300 мл) добавляют тонкоизмельченный безводный K2CO3 (29 г, 210 ммоль), TBAHS (гидросульфат тетрабутиламмония, 2,34 г, 7 ммоль) и 1,2-бис(бромметил)-4-хлорбензол (10,4 г, 35 ммоль). Полученную гетерогенную смесь перемешивают при 80°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления нежелательных солей. Фильтрат концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (200 г силикагеля, градиентное элюирование: 0-25% EtOAc в гептане) с получением чистого продукта в виде бесцветного масла (5,06 г, 58%).
1Н ЯМР (CDCl3, 300МГц): δ 1,35 (т, 3H), 3,47 (д, 2H), 3,71 (д, 2H), 4,32 (кв, 2H), 7,28-7,32 (м, 2H), 7,36 (д, 1H)
ЖХ/МС (ES+) m/z=250,56
ПРИМЕР 260
Этиловый эфир 2-амино-4-хлориндан-2-карбоновой кислоты (260):
К раствору этилового эфира 4-хлоризоцианоиндан-2-карбоновой кислоты (259) (5,06 г, 20,2 ммоль) в абсолютном EtOH (200 мл) по каплям добавляют концентрированную HCl (10 мл). Полученный раствор перемешивают при комнатной температуре в течение 24 часов. После удаления EtOH в вакууме остающуюся гидрохлоридную соль растворяют в воде (100 мл) и экстрагируют этиловым эфиром (3×50 мл) для удаления нежелательных органических примесей. Водный слой доводят до pH 9, добавляя насыщенный раствор NaHCO3, и затем экстрагируют EtOAc (3×100 мл). Объединенный слой EtOAc промывают насыщенным раствором соли (100 мл). Органический слой сушат над Na2SO4 и концентрируют в вакууме с получением чистого продукта в виде твердого вещества белого цвета (4,2 г, 87%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,88 (д, 2H), 3,57 (д, 2H), 4,23 (кв, 2H), 7,28-7,32 (м, 2H), 7,36 (д, 1H)
ЖХ/МС (EZ+) m/z=239,58
ПРИМЕР 261
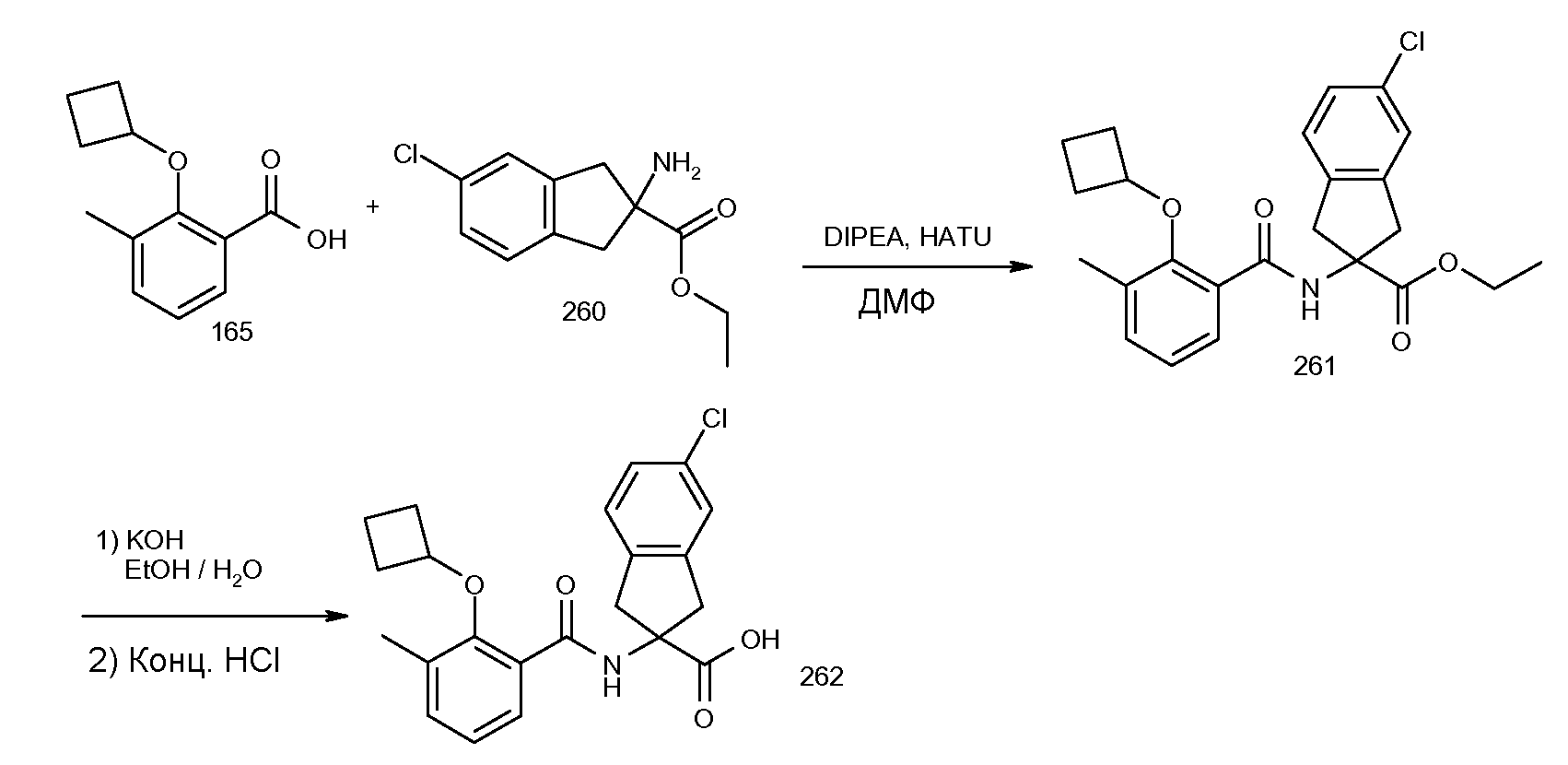
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-5-хлориндан-2-карбоновой кислоты (261):
К раствору 2-циклобутокси-3-метилбензойной кислоты (213 мг, 1,04 ммоль), этилового эфира 2-амино-4-хлориндан-2-карбоновой кислоты (260) (298 мг, 1,24 ммоль) и HATU (591 мг, 1,55 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (345 мкл, 2,07 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток суспендируют в H2O (50 мл) и промывают EtOAc (3×50 мл). Органические слои объединяют и последовательно промывают NaHCO3 и насыщенным раствором соли и затем органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (261) в виде порошка белого цвета (370 мг, 83%).
1Н ЯМР (CDCl3, 300МГц): δ 1,21-1,36 (м, 4H), 1,50-1,56 (м, 1H), 1,96-2,09 (м, 4H), 2,27 (с, 3H), 3,44 (т, 2H), 3,73 (дд, 2H), 4,21-4,33 (м, 3H), 6,85-6,94 (м, 2H), 7,08 (т, 1H), 7,14-7,19 (м, 1H), 7,27 (д, 1H), 7,85 (дд, 1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=428,93
ПРИМЕР 262
2-(2-Циклобутокси-3-метилбензоиламино)-5-хлориндан-2-карбоновая кислота (262):
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-5-хлориндан-2-карбоновой кислоты (261) (370 мг, 0,86 ммоль) растворяют в EtOH (50 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH 2. Полученную смесь промывают EtOAc (3×100 мл). Органические слои объединяют и промывают насыщенным раствором соли, затем сушат над безводным Na2SO4 и концентрируют в вакууме. Желаемый продукт (262) получают в виде твердого вещества белого цвета (320 мг, 93%).
1H ЯМР (d-ДМСО-d6, 300МГц): δ 1,21-1,36 (м, 1H), 1,50 (м, 1H), 1,92-2,14 (м, 4H), 2,26 (с, 3H), 3,38 (т, 2H), 3,73 (дд, 2H), 4,29 (м, 1H), 6,86-6,95 (м, 2H), 7,11 (т, 1H), 7,15-7,20 (м, 1H), 7,29 (д, 1H), 7,83 (дд, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=399,93
ПРИМЕР 263
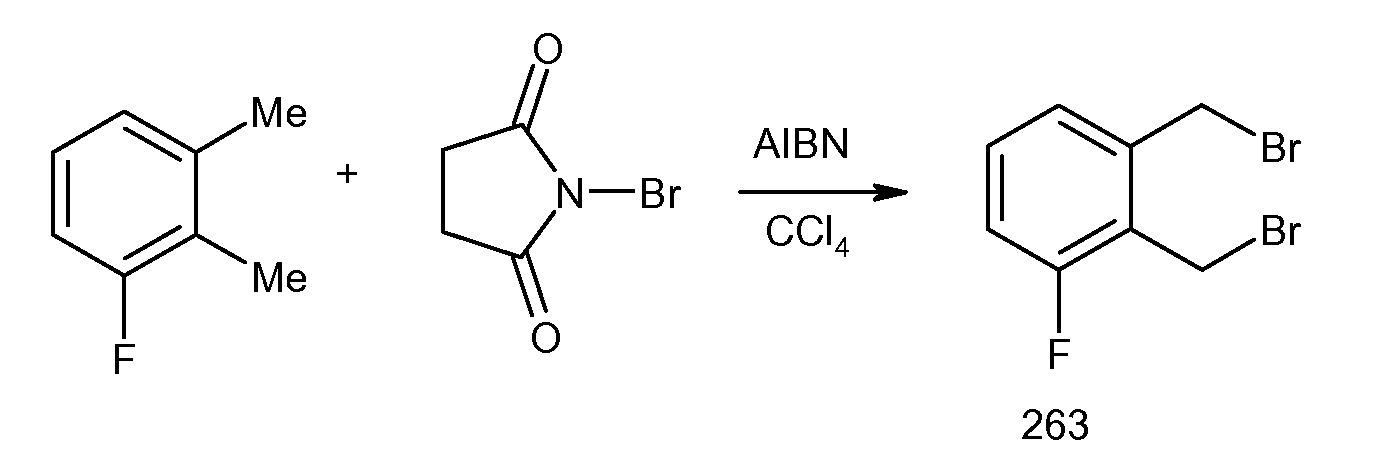
1,2-бис(Бромметил)-3-фторбензол (263):
Перемешиваемую на магнитной мешалке смесь 3-фторортоксилола (5,05 г, 40,67 ммоль), N-бромсукцинимида (15,23 г, 85,56 ммоль), AIBN (78 мг) и CCl4 (75 мл) нагревают при кипении с обратным холодильником в течение 1,75 часа, затем охлаждают до комнатной температуры. Твердые вещества удаляют фильтрованием и промывают CCl4. Объединенный фильтрат и промывочный раствор концентрируют в вакууме на роторном испарителе с получением неочищенного дибромида 263 в виде жидкости желтого цвета, которую растворяют в смеси гептан-0,5% EtOAc, помещают на колонку с силикагелем (7,2 см × 18 см), приготовленную в смеси гептан-0,5% EtOAc, и подвергают флэш-хроматографии, отбирая фракции по 200 мл и элюируя смесью гептан-0,5% EtOAc. Содержащие продукт фракции объединяют и концентрируют в вакууме на роторном испарителе с получением бесцветной жидкости. После отстаивания в жидкости образуются кристаллы. Жидкость отделяют при помощи пипетки. Процесс повторяют еще один раз. Полученная жидкость представляет собой чистый 1,2-бис(бромметил)-3-фторбензол. [J. E. Rice, A. Czech, N, Hussain, E. J. La Voie, J. Org. Chem., 53, 1775-1779 (1988); R. A. Aitken, P. K. G. Hodgson, M. J. Morrison, A. O. Oyewale, J. Chem. Soc. (Perkin 1), 402-415 (2002).]
1Н ЯМР (CDCl3, 300МГц): δ 4,63 (с, 3H), 4,70 (с, 3H), 7,05 (ддд, 1H), 7,17 (д, 1H), 7,29 (ддд, 1H)
F ЯМР (CDCl3, 300МГц): δ 115,26 (д)
ЖХ/МС 3,23 (без исходного иона)
Аналитически вычислено для C8H7Br2F: C, 34,08; H, 2,50; F, 6,74. Найдено: C, 34,11; H, 2,28; F, 6,88
ПРИМЕР 264
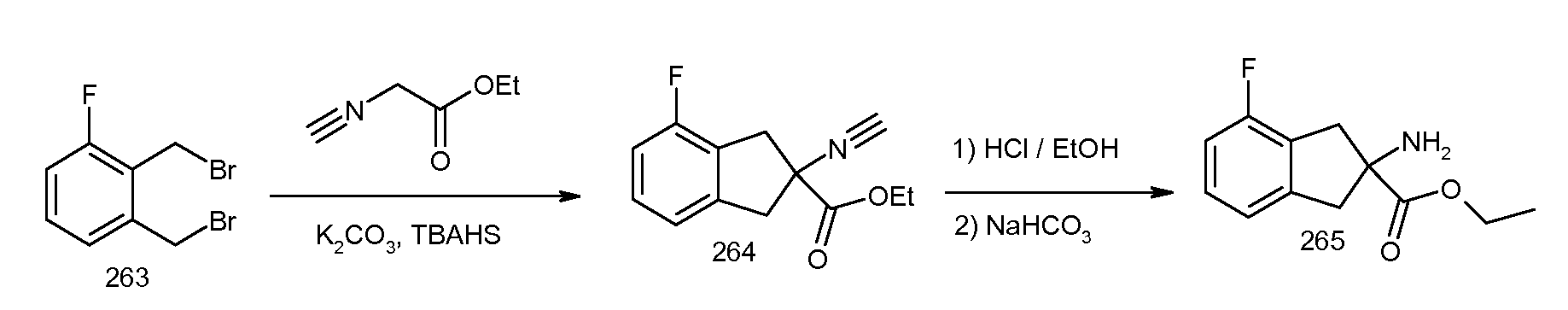
Этиловый эфир 3-фторизоцианоиндан-2-карбоновой кислоты (264):
К раствору этилизоцианоацетата (3,85 мл, 35,0 ммоль) в безводном ACN (300 мл) добавляют тонкоизмельченный безводный K2CO3 (K2SO4, 29 г, 210 ммоль), TBAHS (гидросульфат тетрабутиламмония, 2,34 г, 7,0 ммоль) и 1,2-бис(бромметил)-3-фторбензол (9,87 г, 35 ммоль). Полученную гетерогенную смесь перемешивают при 80°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления нежелательных солей. Фильтрат концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (200 г силикагеля, градиентное элюирование: 0-25% EtOAc в гептане) с получением чистого продукта в виде бесцветного масла (4,5 г, 55%).
1Н ЯМР (CDCl3, 300МГц): δ 1,35 (т, 3H), 3,47 (д, 2H), 3,71 (д, 2H), 4,32 (кв, 2H), 7,05 (ддд, 1H), 7,17 (д, 1H), 7,29 (ддд, 1H)
ЖХ/МС (ES+) m/z=234,26
ПРИМЕР 265
Этиловый эфир 2-амино-3-фториндан-2-карбоновой кислоты (265):
К раствору этилового эфира 2-изоцианоиндан-2-карбоновой кислоты (264) (4,5 г, 19,3 ммоль) в абсолютном EtOH (200 мл) по каплям добавляют концентрированную HCl (10 мл). Полученный раствор перемешивают при комнатной температуре в течение 24 часов. После удаления EtOH в вакууме остающуюся гидрохлоридную соль растворяют в воде (100 мл) и экстрагируют этиловым эфиром (3×50 мл) для удаления нежелательных органических примесей. Водный слой доводят до pH 9, добавляя насыщенный раствор NaHCO3 и затем экстрагируют EtOAc (3×100 мл). Объединенный слой EtOAc промывают насыщенным раствором соли (100 мл). Органический слой сушат над Na2SO4 и концентрируют в вакууме с получением чистого продукта в виде твердого вещества белого цвета (2,3 г, 53%).
1Н ЯМР (CDCl3, 300МГц): δ 1,29 (т, 3H), 2,88 (д, 2H), 3,57 (д, 2H), 4,23 (кв, 2H), 7,05 (ддд, 1H), 7,17 (д, 1H), 7,29 (ддд, 1H)
ЖХ/МС (EZ+) m/z=223,08
ПРИМЕР 266
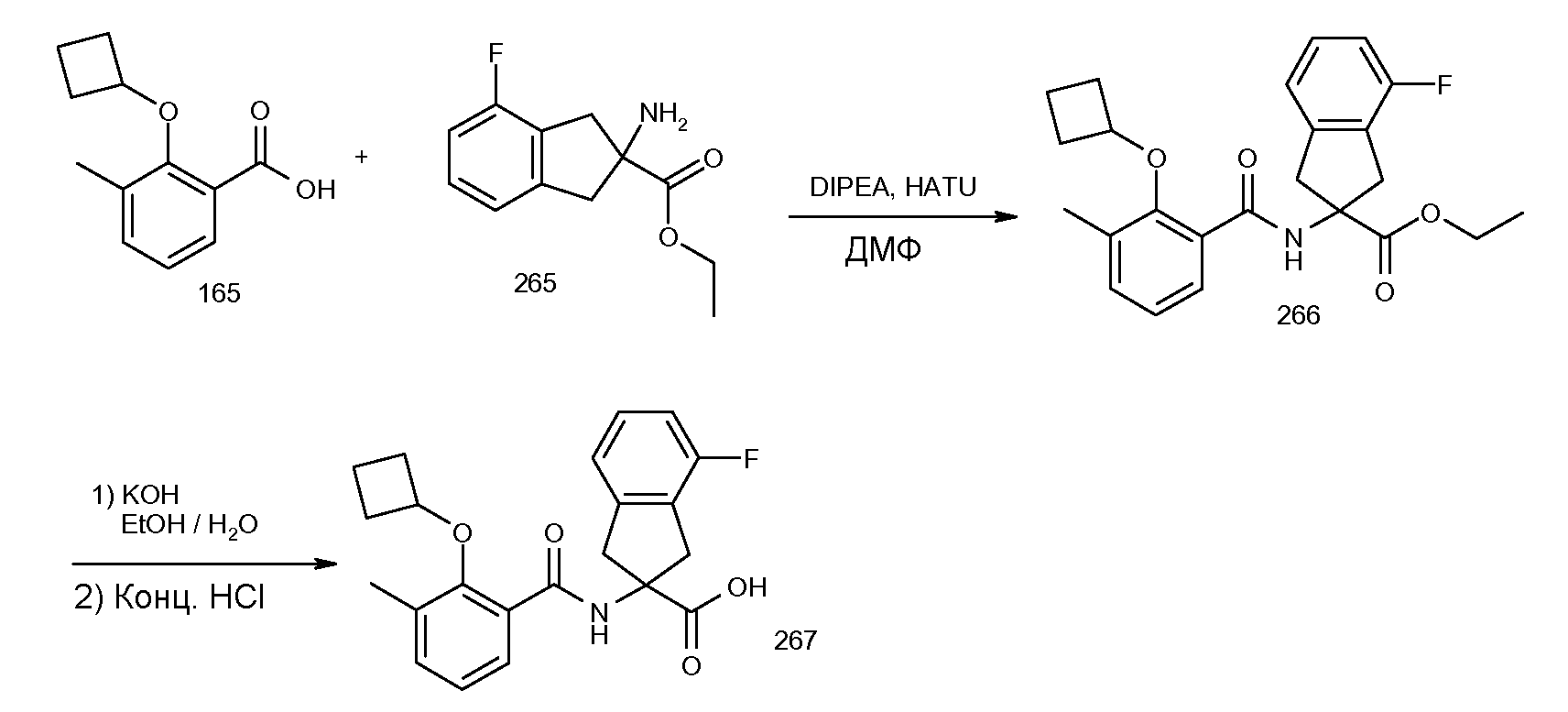
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-4-фториндан-2-карбоновой кислоты (266):
К раствору 2-циклобутокси-3-метилбензойной кислоты (127 мг, 0,61 ммоль), этилового эфира 2-амино-3-фториндан-2-карбоновой кислоты (265) (165 мг, 0,74 ммоль) и HATU (352 мг, 0,93 ммоль) в безводном ДМФА (10 мл) добавляют DIPEA (204 мкл, 1,23 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток суспендируют в H2O (50 мл) и промывают EtOAc (3×50 мл). Органические слои объединяют и последовательно промывают NaHCO3 и насыщенным раствором соли, а затем органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (266) в виде бесцветного масла (210 мг, 84%).
1Н ЯМР (CDCl3, 300МГц): δ 1,21-1,36 (м, 4H), 1,50-1,56 (м, 1H), 1,96-2,09 (м, 4H), 2,27 (с, 3H), 3,44 (т, 2H), 3,73 (дд, 2H), 4,21-4,33 (м, 3H), 6,85-6,94 (м, 2H), 7,08 (т, 1H), 7,14-7,19 (м, 1H), 7,27 (д, 1H), 7,85 (дд, 1H), 8,37 (с, 1H)
ЖХ/МС (ES+) m/z=412,19
ПРИМЕР 267
2-(2-Циклобутокси-3-метилбензоиламино)-4-фториндан-2-карбоновая кислота (267):
Этиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-4-фториндан-2-карбоновой кислоты (7) (210 мг, 0,51 ммоль) растворяют в EtOH (50 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (20 мл) и подкисляют концентрированной HCl до pH 2. Полученную смесь промывают EtOAc (3×100 мл). Органические слои объединяют и промывают насыщенным раствором соли, затем сушат над безводным Na2SO4 и концентрируют в вакууме. Желаемый продукт (267) получают в виде твердого вещества белого цвета (168 мг, 86%).
1H ЯМР (d-ДМСО-d6, 300МГц): δ 1,21-1,36 (м, 1H), 1,50 (м, 1H), 1,92-2,14 (м, 4H), 2,26 (с, 3H), 3,38 (т, 2H), 3,73 (дд, 2H), 4,29 (м, 1H), 6,86-6,95 (м, 2H), 7,11 (т, 1H), 7,15-7,20 (м, 1H), 7,29 (д, 1H), 7,83 (дд, 1H), 8,51 (с, 1H)
ЖХ/МС (ES+) m/z=384,15
ПРИМЕР 268
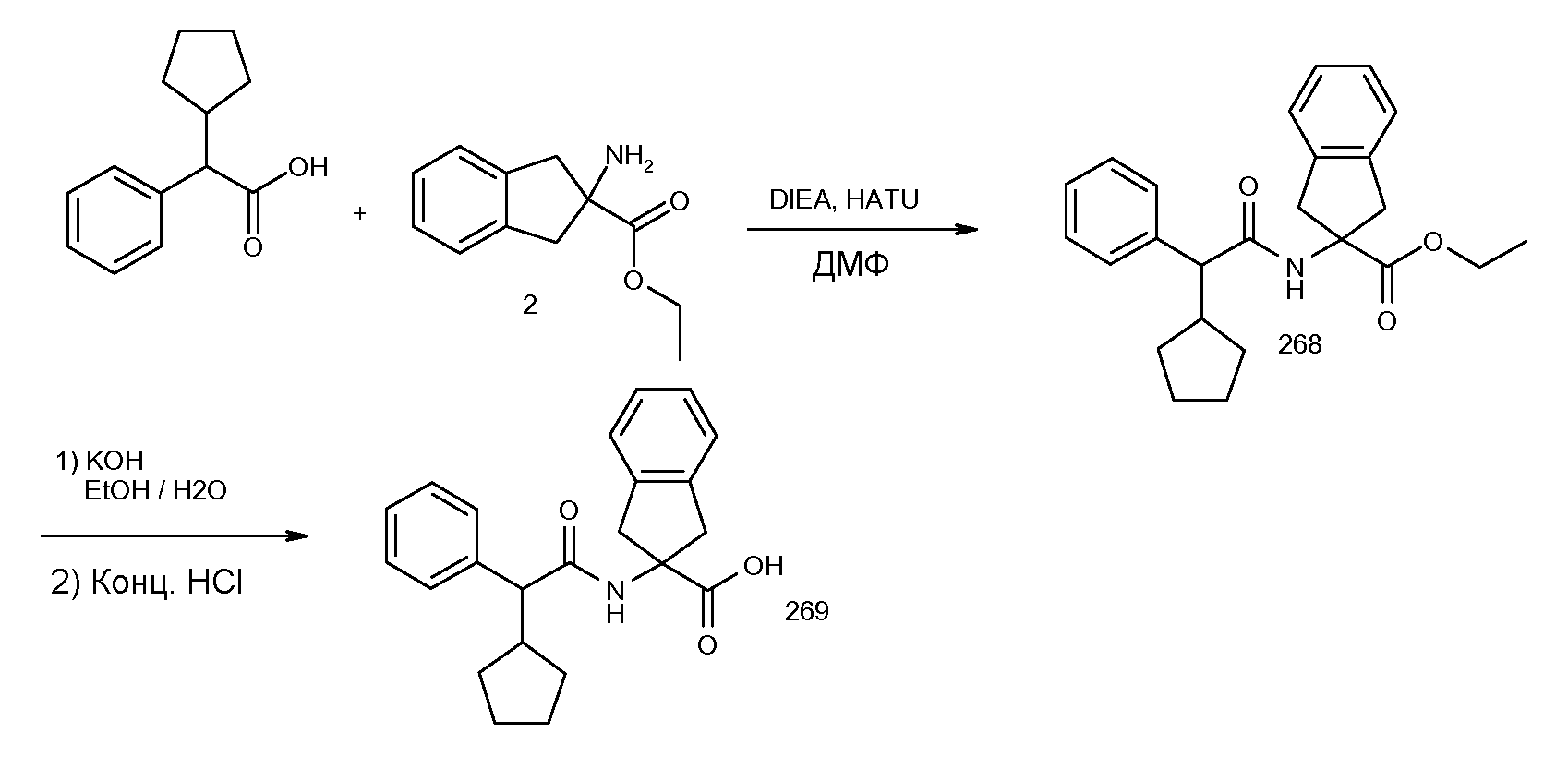
Этиловый эфир 2-(2-циклопентил-2-фенилацетиламино)индан-2-карбоновой кислоты (268):
К раствору α-фенилциклопентануксусной кислоты (2,04 г, 10 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (2,05 г, 10 ммоль) и HATU (7,60 г, 20 ммоль) в безводном ДМФА (50 мл) добавляют DIPEA (3,30 мл, 20 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (100 мл) и промывают насыщенным NaHCO3 (1×100 мл), водой (1×100 мл) и насыщенным раствором соли (1×100 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 0%-20% EtOAc в гептане) с получением чистого продукта (268) в виде твердого вещества (3,16 г, 82%).
1H ЯМР (d-ДМСО-d6, 300МГц): δ 0,91 (м, 1H), 1,23 (м, 2H), 1,29 (т, 3H), 1,35-1,64 (м, 4H), 1,65-1,81 (м, 1H), 2,34-2,49 (м, 1H), 2,78 (д, 2H), 2,89-3,03 (д, 1H), 3,13-3,23 (м, 2H), 3,42-3,52 (м, 2H), 7,1-7,35 (м, 9H)
ЖХ/МС (ES+) m/z=392,19
ПРИМЕР 269
2-(2-Циклопентил-2-фенилацетиламино)индан-2-карбоновая кислота (269):
Этиловый эфир 2-(2-циклопентил-2-фенилацетиламино)индан-2-карбоновой кислоты (268) (1 г, 2,56 ммоль) растворяют в EtOH (50 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме остаток растворяют в воде (20 мл) и промывают EtOAc (20 мл). Фазы разделяют и водную фазу подкисляют концентрированной HCl до pH 2. Твердый осадок собирают фильтрованием и сушат в вакууме. Желаемый продукт (269) получают в виде твердого вещества белого цвета (710 мг, 71%).
1H ЯМР (d-ДМСО-d6, 300МГц): δ 0,91 (м, 1H), 1,23 (м, 2H), 1,35-1,64 (м, 4H), 1,65-1,81 (м, 1H), 2,34-2,49 (м, 1H), 2,89-3,03 (д, 1H), 3,13-3,23 (м, 2H), 3,42-3,52 (м, 2H), 7,1-7,35 (м, 9H), 8,57 (с, 1H)
ЖХ/МС (ES+) m/z=364,46
ПРИМЕР 270
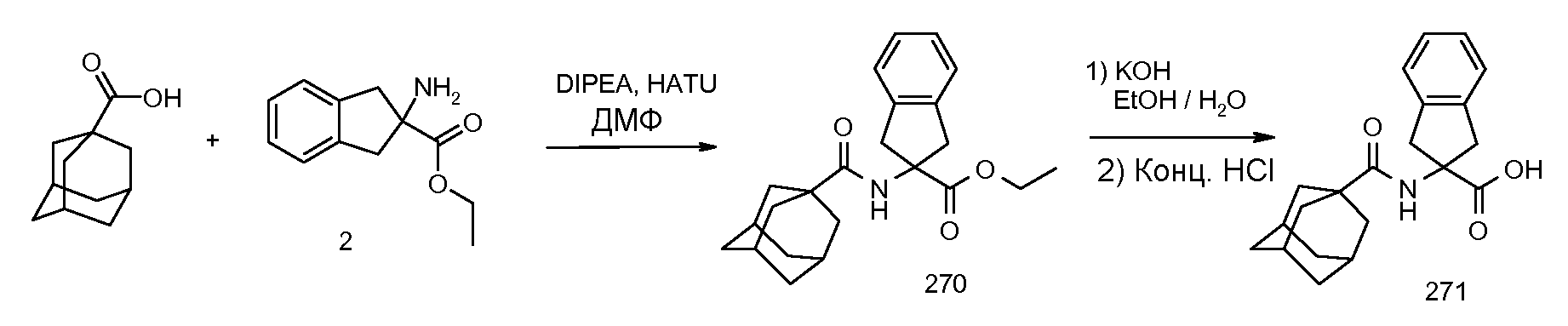
Этиловый эфир 2-[(адамантан-1-карбонил)амино]-индан-2-карбоновой кислоты (270):
К раствору адамантан-1-карбоновой кислоты (131 мг, 0,73 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (150 мг, 0,73 ммоль) и HATU (333 мг, 0,87 ммоль) в безводном ДМФА (1 мл) добавляют DIPEA (190 мкл, 1,1 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (10 мл) и экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (270) в виде твердого вещества белого цвета (261 мг, 97%).
ПРИМЕР 271
2-[(Адамантан-1-карбонил)амино]индан-2-карбоновая кислота (271):
Этиловый эфир 2-[(адамантан-1-карбонил)амино]индан-2-карбоновой кислоты (261 мг, 0,71 ммоль) растворяют в EtOH (8 мл) и добавляют твердый KOH (823 мг, 14 ммоль) и воду (0,8 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (271) в виде твердого вещества белого цвета (159 мг, 66%).
1Н ЯМР (CDCl3, 300МГц): 1,62-1,76 (кв, 6H), 1,76 (д, 6H), 2,02 (с, 3H), 3,25 (д, 2H), 3,79 (д, 2H), 6,04 (с, 1H), 7,15 (д, 1H), 7,21 (с, 4H)
ЖХ/МС (ES+) m/z=340,18
ПРИМЕР 272
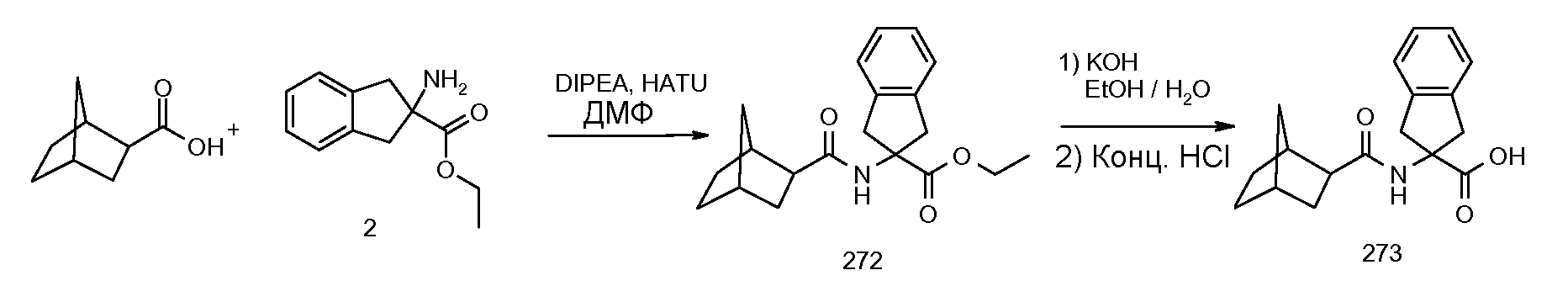
Этиловый эфир 2-[(бицикло[2.2.1]гептан-2-карбонил)амино]индан-2-карбоновой кислоты (272):
К раствору бицикло[2.2.1]гептан-2-карбоновой кислоты (102 мг, 0,73 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (150 мг, 0,73 ммоль) и HATU (333 мг, 0,87 ммоль) в безводном ДМФА (1 мл) добавляют DIPEA (190 мкл, 1,10 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. В реакционную смесь вливают воду (10 мл) и затем экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля; градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (272) в виде желтого масла (148 мг, 62%).
ПРИМЕР 273
2-[(Бицикло[2.2.1]гептан-2-карбонил)амино]индан-2-карбоновая кислота (273):
Этиловый эфир 2-[(бицикло[2.2.1]гептан-2-карбонил)амино]индан-2-карбоновой кислоты (148 мг, 0,45 ммоль) растворяют в EtOH (8 мл) и добавляют твердый KOH (600 мг, 10 ммоль) и воду (0,8 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (273) в виде твердого вещества белого цвета (105 мг, 77%).
1Н ЯМР (CDCl3, 300МГц): 1,14 (д, 1H), 1,26-1,40 (м, 4H), 1,44-1,54 (кв, 2H), 1,57-1,67 (м, 1H), 2,27 (д, 2H), 2,58-2,64 (м, 1H), 3,27 (т, 2H), 3,75 (д, 2H), 5,97 (с, 1H), 7,20 (с, 4H)
ЖХ/МС (ES+) m/z=300,13
ПРИМЕР 274
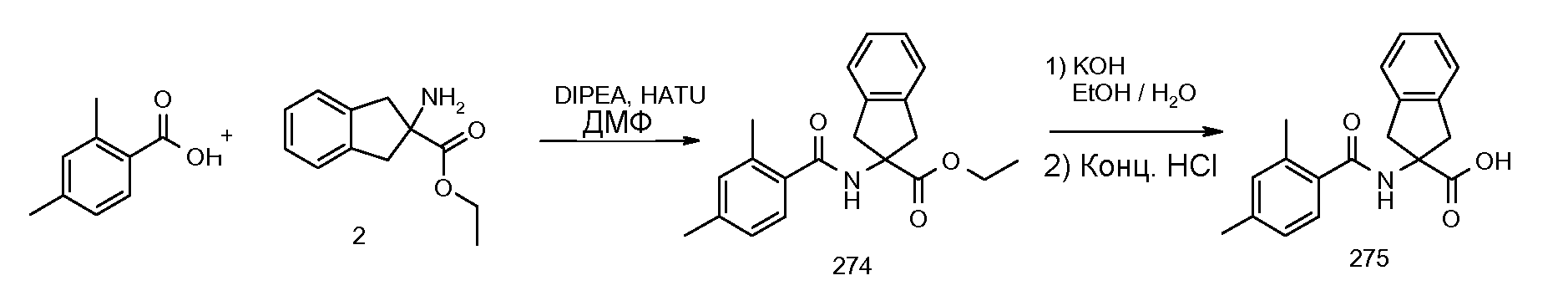
Этиловый эфир 2-(2,4-диметилбензоиламино)индан-2-карбоновой кислоты (274):
К раствору 2,4-диметилбензойной кислоты (219 мг, 1,46 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (300 мг, 1,46 ммоль) и HATU (666 мг, 1,75 ммоль) в безводном ДМФА (1,8 мл) добавляют DIPEA (381 мкл, 2,19 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. В реакционную смесь вливают воду (10 мл) и затем экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (274) в виде твердого вещества белого цвета (414 мг, 84%).
ПРИМЕР 275
2-(2,4-Диметилбензоиламино)индан-2-карбоновая кислота (275):
Этиловый эфир 2-(2,4-диметилбензоиламино)индан-2-карбоновой кислоты (414 мг, 1,23 ммоль) растворяют в EtOH (15 мл) и добавляют твердый KOH (1,42 г, 24,7 ммоль) и воду (1,5 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (275) в виде твердого вещества белого цвета (350 мг, 92%).
1Н ЯМР (CDCl3, 300 МГц): 2,30 (с, 6H), 3,41 (д, 2H), 3,84 (д, 2H), 6,20 (с, 1H), 6,96 (д, 1H), 7,00 (с, 1H), 7,13 (д, 1H), 7,24 (д, 4H)
ЖХ/МС (ES+) m/z=310,14
ПРИМЕР 276
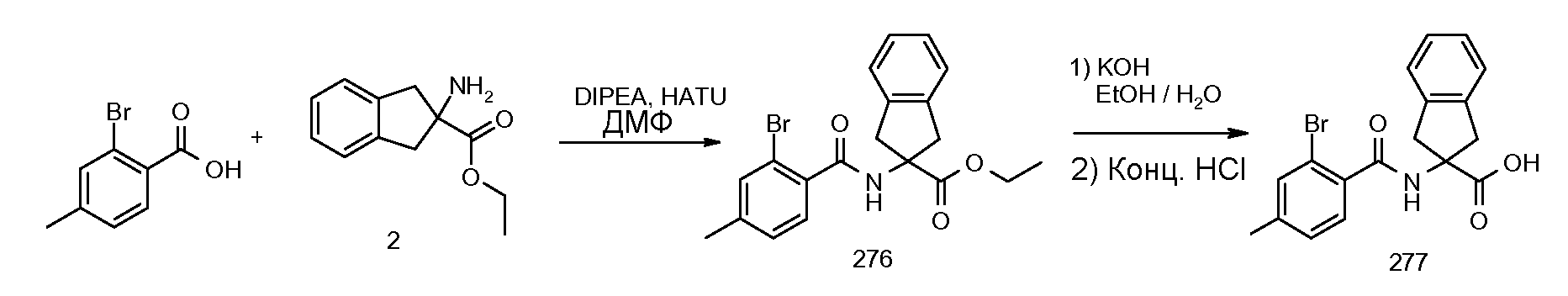
Этиловый эфир 2-(2-бром-4-метилбензоиламино)индан-2-карбоновой кислоты (276):
К раствору 2-бром-4-метилбензойной кислоты (314 мг, 1,46 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (300 мг, 1,46 ммоль) и HATU (666 мг, 1,75 ммоль) в безводном ДМФА (1,8 мл) добавляют DIPEA (381 мкл, 2,19 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (10 мл) и экстрагируют EtOAc (3×5 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0-30% EtOAc в гептане) с получением продукта (276) в виде твердого вещества не совсем белого цвета (445 мг, 76%).
ПРИМЕР 277
2-(2-Бром-4-метилбензоиламино)индан-2-карбоновая кислота (277):
Этиловый эфир 2-(2-бром-4-метилбензоиламино)индан-2-карбоновой кислоты (445 мг, 1,11 ммоль) растворяют в EtOH (15 мл) и добавляют твердый KOH (1,42 г, 24,7 ммоль) и воду (1,5 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Твердое вещество собирают вакуумным фильтрованием с получением продукта (277) в виде твердого вещества белого цвета (415 мг, 100%).
1Н ЯМР (CDCl3, 300МГц): 2,33 (с, 3H), 3,45 (д, 2H), 3,83 (д, 2H), 6,70 (с, 1H), 7,15 (д, 1H), 7,19-7,25 (м, 4H), 7,35 (с, 1H), 7,51 (д, 1H)
ЖХ/МС (ES+) m/z=374,04, 376,04
ПРИМЕР 278
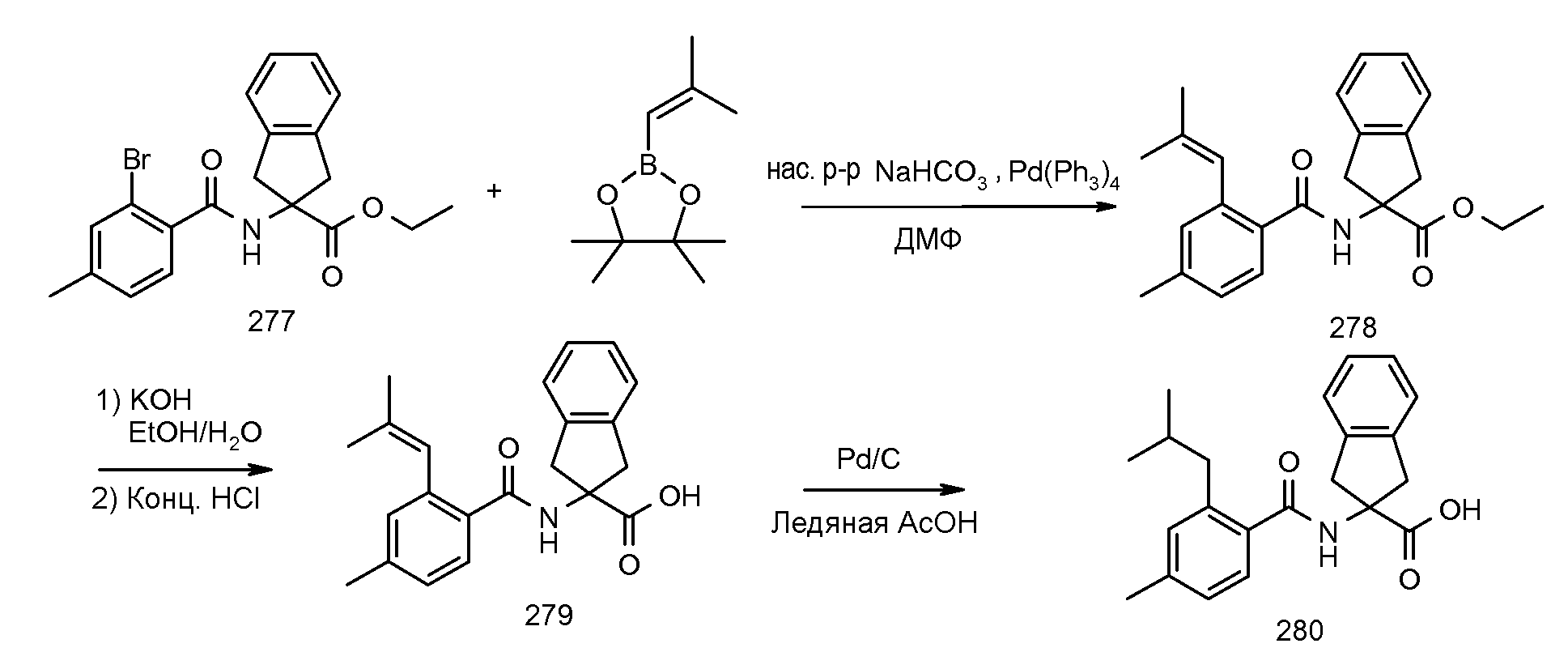
Этиловый эфир 2-[4-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (278):
Смесь этилового эфира 2-(2-бром-4-метилбензоиламино)индан-2-карбоновой кислоты (880 мг, 2,2 ммоль), 4,4,5,5-тетраметил-2-(2-метилпропенил)-[1,3,2]диоксаборолана (903 мкл, 4,4 ммоль) и насыщенного раствора NaHCO3 (4,4 мл) в безводном ДМФА (20 мл) дегазируют N2. В атмосфере N2 добавляют тетракис(трифенилфосфин)палладий (196 мг, 10 мол%) и реакционную смесь нагревают на масляной бане при 110°C в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, вливают в воду (40 мл) и экстрагируют EtOAc (2×30 мл). Объединенные органические слои промывают водой (15 мл) и насыщенным раствором соли (20 мл), затем концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (24 г силикагеля; градиентное элюирование: 0-50% EtOAc в гептане) с получением продукта (278) в виде красновато-коричневого вязкого масла (764 мг, 92%).
ПРИМЕР 279
2-[4-Метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (279):
Этиловый эфир 2-[4-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (764 мг, 2,02 ммоль) растворяют в EtOH (25 мл) и добавляют твердый KOH (2,32 г, 40 ммоль) и воду (2,5 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в смеси воды (40 мл) и EtOAc (20 мл) и органический слой отделяют. Водный слой доводят до приблизительно pH 7 концентрированной HCl и затем экстрагируют EtOAc (2×15 мл). Объединенные органические слои концентрируют в вакууме с получением продукта (279) в виде твердого вещества не совсем белого цвета (544 мг, 78%).
1Н ЯМР (CDCl3, 300МГц): 1,49 (с, 3H), 1,70 (с, 3H), 2,34 (с, 3H), 3,34 (д, 2H), 3,82 (д, 2H), 6,01 (с, 1H), 6,87 (с, 1H), 7,14 (д, 1H), 7,22 (с, 4H), 7,31 (д, 1H), 7,91 (д, 1H)
ЖХ/МС (ES+) m/z=350,17
ПРИМЕР 280
2-(2-Изобутил-4-метилбензоиламино)индан-2-карбоновая кислота (280):
К раствору 2-[4-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (510 мг, 1,45 ммоль) в ледяной уксусной кислоте (65 мл) в атмосфере N2 добавляют Pd/C (10% Pd, 138 мг, 10 мол.%). Реакционную смесь гидрируют при давлении H2 60 фунт/кв. дюйм и 90°C в течение ночи. Реакцию охлаждают до комнатной температуры и фильтруют через слой целита, промывая осадок на фильтре водой (2×15 мл) и MeOH (2×15 мл); фильтрат концентрируют в вакууме. Остаток растворяют в воде (75 мл) и экстрагируют EtOAc (2×30 мл). Объединенные органические слои промывают 5% раствором NaHCO3 (3×20 мл), водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над безводным Na2SO4. Органический слой концентрируют в вакууме с получением продукта (280) в виде твердого вещества белого цвета (350 мг, 69%).
1Н ЯМР (CDCl3, 300МГц): 0,78 (д, 6H), 1,72-1,81 (м, 1H), 2,30 (с, 3H), 2,55 (д, 2H), 3,38 (д, 2H), 3,77 (д, 2H), 6,30 (с, 1H), 6,94 (д, 1H), 6,95 (с, 1H), 7,16 (д, 1H), 7,20 (с, 4H)
ЖХ/МС (ES+) m/z=352,22
ПРИМЕР 281
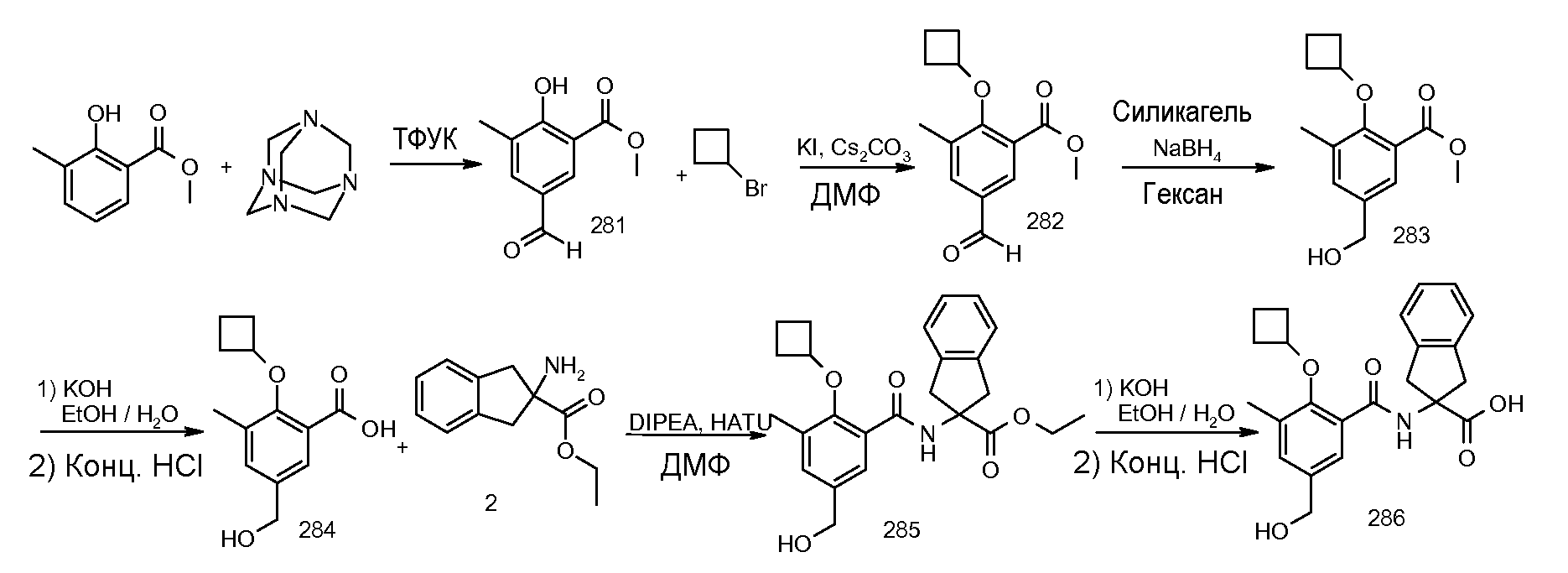
Метиловый эфир 5-формил-2-гидрокси-3-метилбензойной кислоты (281):
К раствору HMTA (1,3,5,7-тетраазатрицикло[3.3.1.13,7]декана (8,43 г, 60,2 ммоль) в ТФУК (100 мл) добавляют метиловый эфир 2-гидрокси-3-метилбензойной кислоты (5 г, 30,1 ммоль) и реакционную смесь нагревают при кипении с обратным холодильником (78°C) в течение ночи. Реакционную смесь охлаждают до 50°C и добавляют воду (400 мл) при перемешивании. Смесь перемешивают при 50°C в течение 2 часов, затем охлаждают до комнатной температуры и экстрагируют EtOAc (2×200 мл). Объединенные органические слои промывают насыщенным раствором соли (75 мл), сушат над безводным MgSO4 и концентрируют в вакууме. Остаток очищают колоночной флэш-хроматографией (120 г силикагеля, градиентное элюирование: 0-50% EtOAc в гептане) с получением продукта (281) в виде твердого вещества не совсем белого цвета (5,05 г, 86%).
ПРИМЕР 282
Метиловый эфир 2-циклобутокси-5-формил-3-метилбензойной кислоты (282):
К смеси бромциклобутана (1,39 г, 10,3 ммоль), йодида калия (43 мг, 5 мол%) и Cs2CO3 (3,84 г, 11,84 ммоль) в ДМФА (18 мл) добавляют метиловый эфир 5-формил-2-гидрокси-3-метилбензойной кислоты (1,0 г, 5,15 ммоль). Реакционную смесь помещают в микроволновый реактор и нагревают при 110°C в течение 6 часов. К реакционной смеси добавляют воду (50 мл) и раствор экстрагируют EtOAc (3×40 мл). Объединенные органические слои сушат над безводным MgSO4 и концентрируют в вакууме с получением продукта (282) в виде масла оранжево-желтого цвета (1,20 г, 94%).
ПРИМЕР 283
Метиловый эфир 2-циклобутокси-5-гидроксиметил-3-метилбензойной кислоты (283):
Смесь метилового эфира 2-циклобутокси-5-формил-3-метилбензойной кислоты (676 г, 2,7 ммоль), силикагеля (5,15 г) и NaBH4 (103 мг, 2,7 ммоль) в гексане (30 мл) нагревают при 40°C в течение ночи. Смесь охлаждают до комнатной температуры, фильтруют, промывают твердые вещества EtOAc (15 мл) и диэтиловым эфиром (15 мл). Фильтрат концентрируют в вакууме с получением продукта (283) в виде вязкого масла желтого цвета (556 мг, 84%).
ПРИМЕР 284
2-Циклобутокси-5-гидроксиметил-3-метилбензойная кислота (284):
Метиловый эфир 2-циклобутокси-5-гидроксиметил-3-метилбензойной кислоты (410 мг, 1,64 ммоль) растворяют в EtOH (15 мл) и добавляют твердый KOH (1,90 г, 32,8 ммоль) и воду (1,5 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем концентрируют в вакууме. Остаток растворяют в воде (10 мл), подкисляют концентрированной HCl и затем экстрагируют EtOAc (3×10 мл). Объединенные органические слои сушат над безводным MgSO4 и концентрируют в вакууме с получением продукта (284) в виде вязкого масла желтого цвета (387 мг, 100%).
ПРИМЕР 285
Этиловый эфир 2-(2-циклобутокси-5-гидроксиметил-3-метилбензоиламино)индан-2-карбоновой кислоты (285):
К раствору 2-циклобутокси-5-гидроксиметил-3-метилбензойной кислоты (410 мг, 1,7 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (425 мг, 1,7 ммоль) и HATU (760 мг, 2 ммоль) в безводном ДМФА (5 мл) добавляют DIPEA (435 мкл, 2,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. В реакционную смесь вливают воду (10 мл) и затем экстрагируют EtOAc (3×7 мл). Объединенные органические слои концентрируют в вакууме. Остаток очищают хроматографией с обращенной фазой (градиентное элюирование: 20-100% ACN в воде) с получением продукта (285) в виде бесцветного масла (70 мг, 10%).
1Н ЯМР (CDCl3, 300МГц): 1,14-1,24 (м, 1H), 1,34-1,44 (кв, 1H), 1,80-1,86 (м, 2H), 1,90-1,99 (м, 2H), 2,20 (с, 3H), 3,37 (д, 2H), 3,81 (д, 2H), 4,13-4,24 (м, 1H), 4,55 (с, 2H), 7,17-7,24 (м, 4H), 7,26 (д, 1H), 7,78 (д, 1H), 8,45 (с, 1H)
ЖХ/МС (ES+) m/z=396,16
ПРИМЕР 286
2-(2-Циклобутокси-5-гидроксиметил-3-метилбензоиламино)индан-2-карбоновая кислота (286):
Этиловый эфир 2-(2-циклобутокси-5-гидроксиметил-3-метилбензоиламино)индан-2-карбоновой кислоты (70 мг, 0,16 ммоль) растворяют в этаноле (1,5 мл) и добавляют твердый KOH (191 мг, 3,3 ммоль) и воду (150 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. Остаток растворяют в воде (1,5 мл) и подкисляют концентрированной HCl до прекращения осаждения твердого вещества белого цвета. Смесь экстрагируют этилацетатом (2×8 мл) и объединенные органические слои концентрируют в вакууме с получением продукта (286) в виде твердого вещества белого цвета (60 г, 95%).
1Н ЯМР (CDCl3, 300МГц): δ 1,14-1,24 (м, 1H), 1,34-1,44 (кв, 1H), 1,80-1,86 (м, 2H), 1,90-1,99 (м, 2H), 2,20 (с, 3H), 3,37 (д, 2H), 3,81 (д, 2H), 4,13-4,24 (м, 1H), 4,55 (с, 2H), 7,17-7,24 (м, 4H), 7,26 (д, 1H), 7,78 (д, 1H), 8,45 (с, 1H)
ЖХ/МС (ES+) m/z=396,16
ПРИМЕР 287
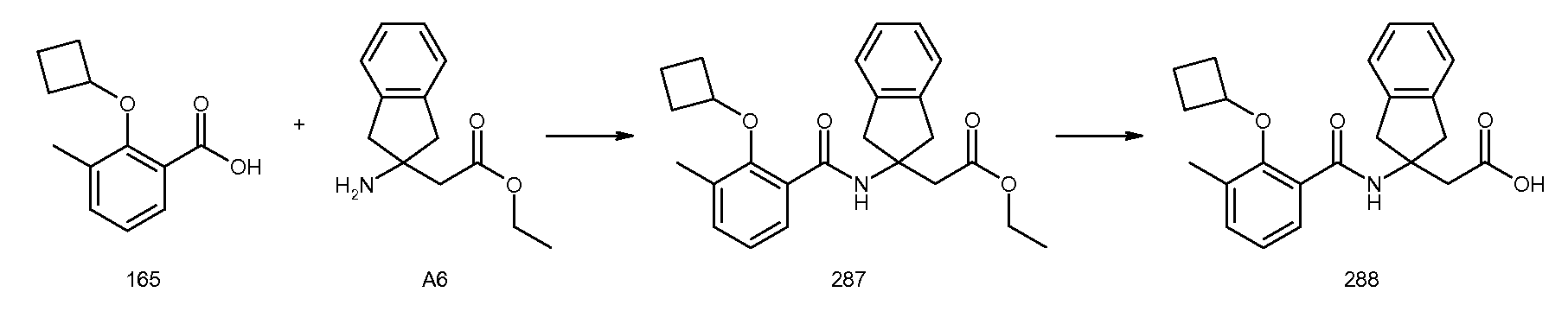
Этиловый эфир 2-аминоиндан-2-уксусной кислоты (A6)
Данное соединение получают в соответствии с патентом США WDF2006/134111.
Этиловый эфир 2-(2-циклобутилокси-3-метилбензоиламино)индан-2-уксусной кислоты (287)
К раствору 2-циклобутилокси-3-метилбензойной кислоты (210 мг, 1,02 ммоль), этилового эфира 2-аминоиндан-2-уксусной кислоты (A6) (260 мг, 1,02 ммоль) и HATU (470 мг, 1,224 ммоль, 1,2 экв.) в сухом ДМФА (10 мл) добавляют диизопропилэтиламин (0,36 мл, 2,24 ммоль, 2,2 экв.) и полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме остаток растворяют в EtOAc (60 мл) и промывают водой (2×20 мл) и насыщенным раствором соли (2×20 мл). Органический слой сушат над MgSO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (120 г силикагеля, 0,15% EtOAc в гептане) с получением чистого продукта в виде бесцветного масла (400 мг, 96%).
ЖХ/МС (ES+) m/z 408
ПРИМЕР 288
2-(2-Циклобутилокси-3-метилбензоиламино)индан-2-уксусная кислота (288)
Раствор этилового эфира 2-(2-циклобутилокси-3-метилбензоиламино)индан-2-уксусной кислоты (288) (400 мг, 1 ммоль) в смеси EtOH (15 мл) и воды (1 мл) обрабатывают гранулами NaOH (800 мг, 20 ммоль) и перемешивают при комнатной температуре в течение 24 часов. После концентрирования в вакууме остаток растворяют в воде (30 мл) и подкисляют HCl до pH 2-3. Продукт экстрагируют EtOAc (3×20 мл) и объединенные экстракты промывают водой (2×10 мл) и насыщенным раствором соли (2×15 мл). Органический слой сушат над MgSO4 и концентрируют в вакууме. Остаток растирают с гептаном и чистый продукт выделяют фильтрованием с получением твердого вещества белого цвета (350 мг, 92%).
ЖХ/МС (ES+) m/z 380
ПРИМЕР 289
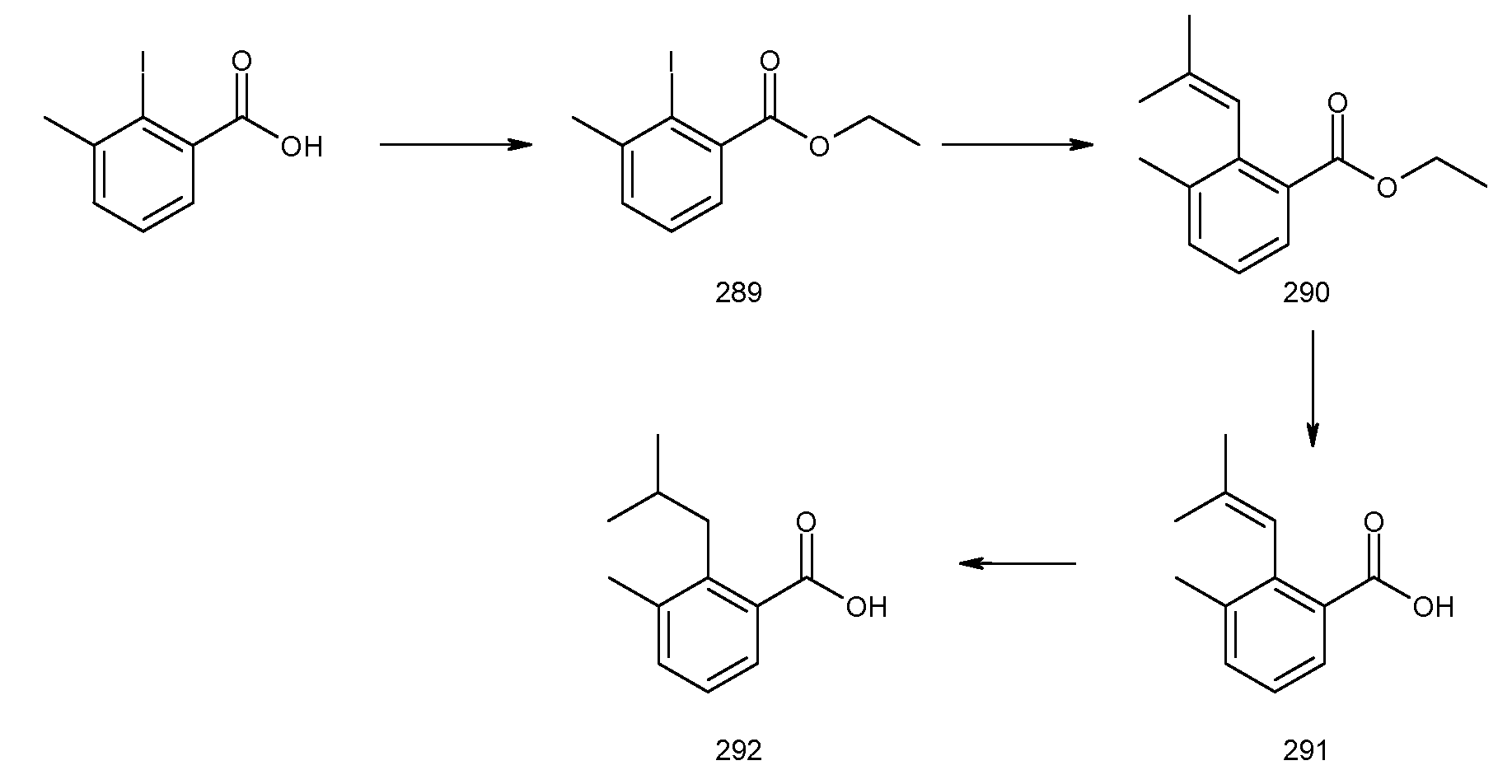
Этиловый эфир 2-йод-3-метилбензойной кислоты (289)
Раствор 2-йод-3-метилбензойной кислоты (6 г, 0,023 моль) в EtOH (150 мл) обрабатывают концентрированной HCl (20 мл) и нагревают при кипении с обратным холодильником в течение 48 часов. После удаления EtOH в вакууме остаток разбавляют водой (125 мл) и охлаждают до 0°C в ледяной бане. Значение pH доводят до 10 с помощью гранул NaOH и экстрагируют EtOAc (3×75 мл). Органические экстракты промывают водой (2×50 мл) и насыщенным раствором соли (2×50 мл), сушат над MgSO4 и концентрируют в вакууме с получением продукта в виде масла бледно-желтого цвета (6 г, 90%).
ЖХ/МС (ES+) m/z 291
ПРИМЕР 290
Этиловый эфир 3-метил-2-(2-метил-1-пропенил)бензойной кислоты (290)
Суспензию этилового эфира 2-йод-3-метилбензойной кислоты (289) (2,9 г, 0,01 моль) и пинаколового эфира 2-метил-1-пропенилбороновой кислоты (3,64 г, 0,02 моль, 2 экв.) в сухом ДМФА (50 мл) и насыщенном NaHCO3 (10 мл) дегазируют в течение 10 минут и затем обрабатывают тетракис(трифенилфосфин)палладием(0) (400 мг). Смесь перемешивают при 110°C в течение ночи. Реакционную смесь охлаждают, ДМФА удаляют в вакууме и остаток разбавляют водой (120 мл). Водный раствор фильтруют через фильтр Hyflo и экстрагируют EtOAc (3×75 мл). Органические экстракты промывают водой (2×50 мл) и насыщенным раствором соли (2×50 мл) и сушат над MgSO4. Органические экстракты концентрируют в вакууме и очищают флэш-хроматографией (400 г силикагеля, 5% EtOAc в гептане) с получением продукта в виде масла бледно-желтого цвета (1,85 г, 85%).
ЖХ/МС (ES+) m/z 218
ПРИМЕР 291
3-Метил-2-(2-метил-1-пропенил)бензойная кислота (291)
Раствор этилового эфира 3-метил-2-(2-метил-1-пропенил)бензойной кислоты (290) (3 г, 0,014 моль) в MeOH (50 мл) обрабатывают 2 н. NaOH (10 мл) и нагревают при кипении с обратным холодильником в течение 6 часов. Растворитель удаляют в вакууме и остаток разбавляют водой (75 мл). Водную фазу экстрагируют EtOAc (30 мл) и затем отделяют и подкисляют до pH 2-3 концентрированной HCl. Осажденное твердое вещество экстрагируют EtOAc (3×50 мл). Экстракты промывают водой (2×30 мл) и насыщенным раствором соли (2×30 мл), сушат над MgSO4 и концентрируют в вакууме с получением продукта в виде твердого вещества белого цвета (2,0 г, 75%).
1Н ЯМР (CDCl3, 300МГц): 1,43 (с, 3H), 1,91 (с, 3H), 2,24 (с, 3H), 6,35 (с, 1H), 7,2-7,27 (т, 1H), 7,37-7,44 (м, 1H), 7,79-7,81 (д, 1H)
ЖХ/МС (ES+) m/z 191
ПРИМЕР 292
2-Изобутил-3-метилбензойная кислота (292)
Раствор 3-метил-2-(2-метил-1-пропенил)бензойной кислоты (291) (2 г, 10,5 ммоль) в MeOH (40 мл) гидрируют в течение 48 часов, используя в качестве катализатора палладий на углероде (10%), при давлении 45 бар и при температуре 30°C, с применением реактора H-Cube производства Thales Nanotechnology. MeOH концентрируют в вакууме с получением продукта в виде бесцветного масла (1,85 г, 90%).
1Н ЯМР (CDCl3, 300МГц): 0,92 (д, 6H), 1,78-1,90 (м, 1H), 2,38 (с, 3H), 7,1-7,2 (т, 1H), 7,35-7,38 (д, 1H), 7,75-7,80 (д, 1H)
ЖХ/МС (E/S+) m/z 193
ПРИМЕР 293
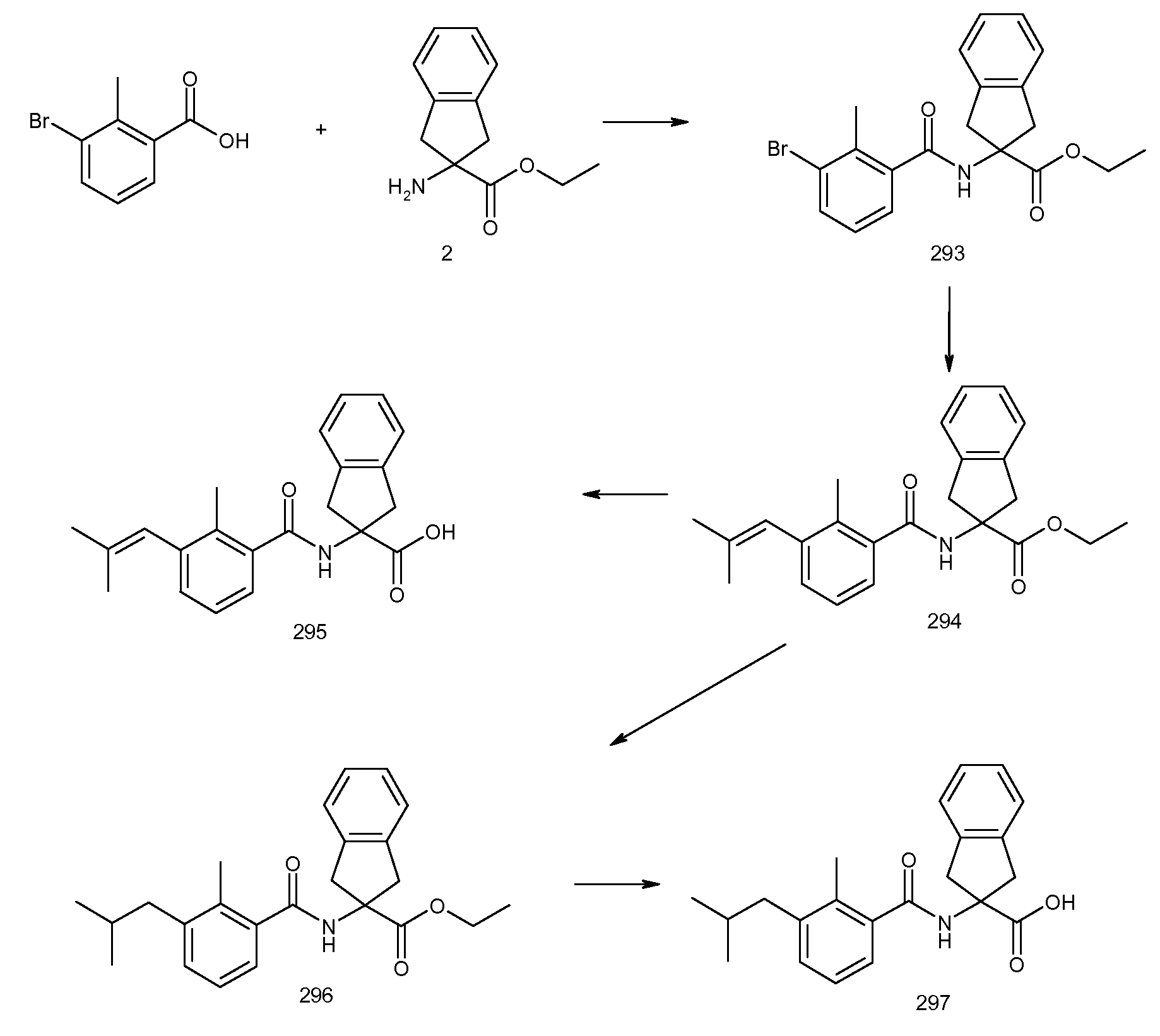
Этиловый эфир 2-(3-бром-2-метилбензоиламино)индан-2-карбоновой кислоты (293)
Данное соединение получают способом, аналогичным описанному в примере 287. Полученный неочищенный продукт очищают флэш-хроматографией (120 г силикагеля, 20% EtOAc в гептане) с получением чистого продукта в виде твердого вещества белого цвета (1,9 г, 91%).
1Н ЯМР (CDCl3, 300МГц): 1,20-1,25 (т, 3H), 3,30-3,40 (д, 2H), 3,40 (с, 3H), 3,70-3,80 (д, 2H), 4,25-4,40 (м, 2H), 6,30-6,40 (с, 1H), 6,95-7,05 (т, 1H), 7,20-7,30 (м, 2H), 7,55-7,60 (д, 1H).
ЖХ/МС (ES+) m/z 403
ПРИМЕР 294
Этиловый эфир 2-[2-метил-3-(2-метил-1-пропенил)бензоиламино]индан-2-карбоновой кислоты (294)
Суспензию этилового эфира 2-(3-бром-2-метилбензоиламино)индан-2-карбоновой кислоты (293) (402 мг, 1 ммоль) и 2-метил-1-пропенилбороновой кислоты (200 мг, 2 ммоль, 2 экв.) в сухом ДМФА (20 мл) и насыщенном NaHCO3 (5 мл) дегазируют в течение 10 минут и затем обрабатывают тетракис(трифенилфосфин)палладием(0) (400 мг). Смесь перемешивают при 110°C в течение 5 часов. Реакционную смесь охлаждают, ДМФА удаляют в вакууме и остаток разбавляют водой (80 мл). Водный раствор фильтруют через целит и экстрагируют EtOAc (3×50 мл). Органические экстракты промывают водой (2×30 мл) и насыщенным раствором соли (2×30 мл) и сушат над MgSO4. Органическую фазу затем концентрируют в вакууме и очищают флэш-хроматографией (120 г силикагеля, 30% EtOAc в гептане) с получением масла бледно-желтого цвета (350 мг, 92%).
ЖХ/МС (E/S+) m/z 378
ПРИМЕР 295
2-[2-Метил-3-(2-метил-1-пропенил)бензоиламино]индан-2-карбоновая кислота (295)
Данное соединение получают способом, аналогичным описанному в примере 288. В результате очистки методом флэш-хроматографии (120 г силикагеля, 20% EtOAc в гептане) получают твердое вещество белого цвета (20 мг, 6%).
ЖХ/МС (E/S+) m/z 350
ПРИМЕР 296
Этиловый эфир 2-(2-метил-3-изобутилилбензоиламино)индан-2-карбоновой кислоты (296)
Раствор этилового эфира 2-[2-метил-3-(2-метил-1-пропенил)бензоиламино]индан-2-карбоновой кислоты (294) (700 мг, 1,86 ммоль) в ледяной AcOH (125 мл) обрабатывают катализатором, Pd-C (10% Pd по весу, 360 мг) в атмосфере азота. Полученную реакционную смесь затем гидрируют в аппарате Парра при давлении 55 фунт/кв. дюйм и температуре 75°C в течение ночи. Катализатор удаляют фильтрованием через предколонку (10 г силикагеля) и промывают EtOH. Объединенный органический раствор концентрируют в вакууме. Остаток растворяют в EtOAc (75 мл) и промывают водой (30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют в вакууме с получением продукта в виде твердого вещества белого цвета (660 мг, 94%).
ЖХ/МС (E/S+) m/z 380
ПРИМЕР 297
2-(2-Метил-3-изобутилилбензоиламино)индан-2-карбоновая кислота (297)
Данное соединение получают способом, аналогичным описанному в примере 288. В результате очистки методом флэш-хроматографии (120 г силикагеля, 50% EtOAc в гептане) получают продукт в виде твердого вещества белого цвета (130 мг, 21%).
1H ЯМР (ДМСО-d6, 300МГц): 0,87-0,89 (д, 6H), 1,73-1,82 (м, 1H), 2,21 (с, 3H), 2,40-2,45 (м, 2H), 3,32-3,36 (д, 2H), 3,53-3,59 (д, 2H), 7,00-7,23 (м, 7H), 8,83 (с, 1H), 11,0 (с, 1H)
ЖХ/МС (E/S+) m/z 353
ПРИМЕР 298
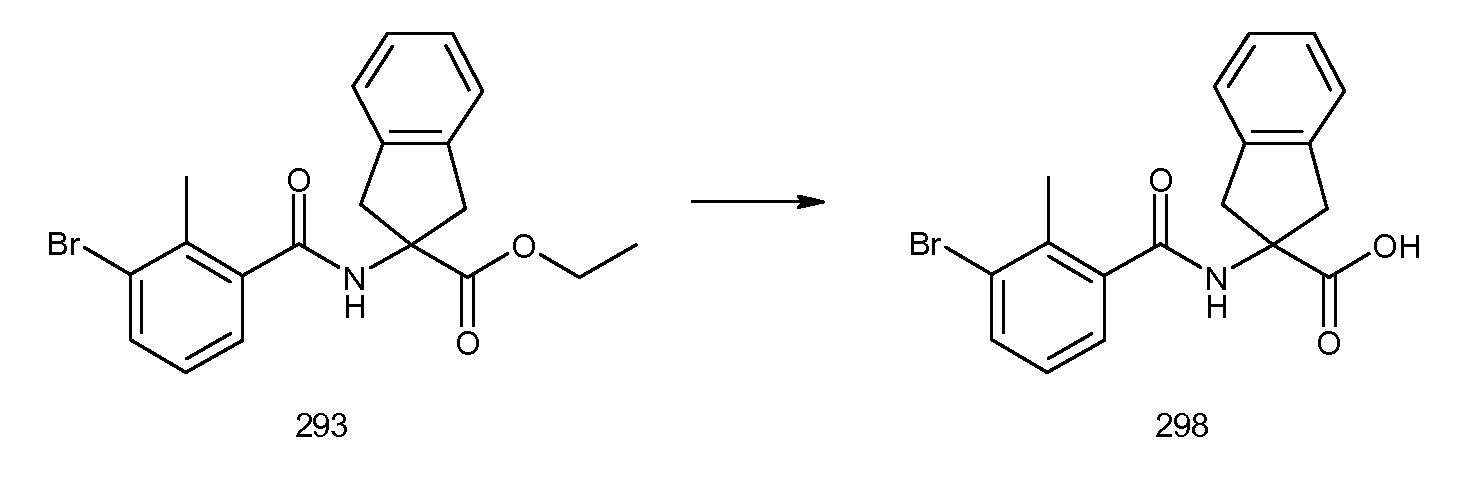
2-(3-Бром-2-метилбензоиламино)индан-2-карбоновая кислота (298)
Данное соединение получают способом, аналогичным описанному в примере 288. Органический экстракт выпаривают в вакууме с получением продукта в виде твердого вещества белого цвета (270 мг, 96%).
1H ЯМР (ДМСО-d6, 300МГц): 2,33 (с, 3H), 2,29-3,35 (д, 2H), 3,54-3,60 (д, 2H), 7,13-7,24 (м, 6H), 7,63-7,66 (д, 1H), 8,99 (с, 1H), 12,55-12,60 (с, 1H)
ЖХ/МС (E/S+) m/z 376
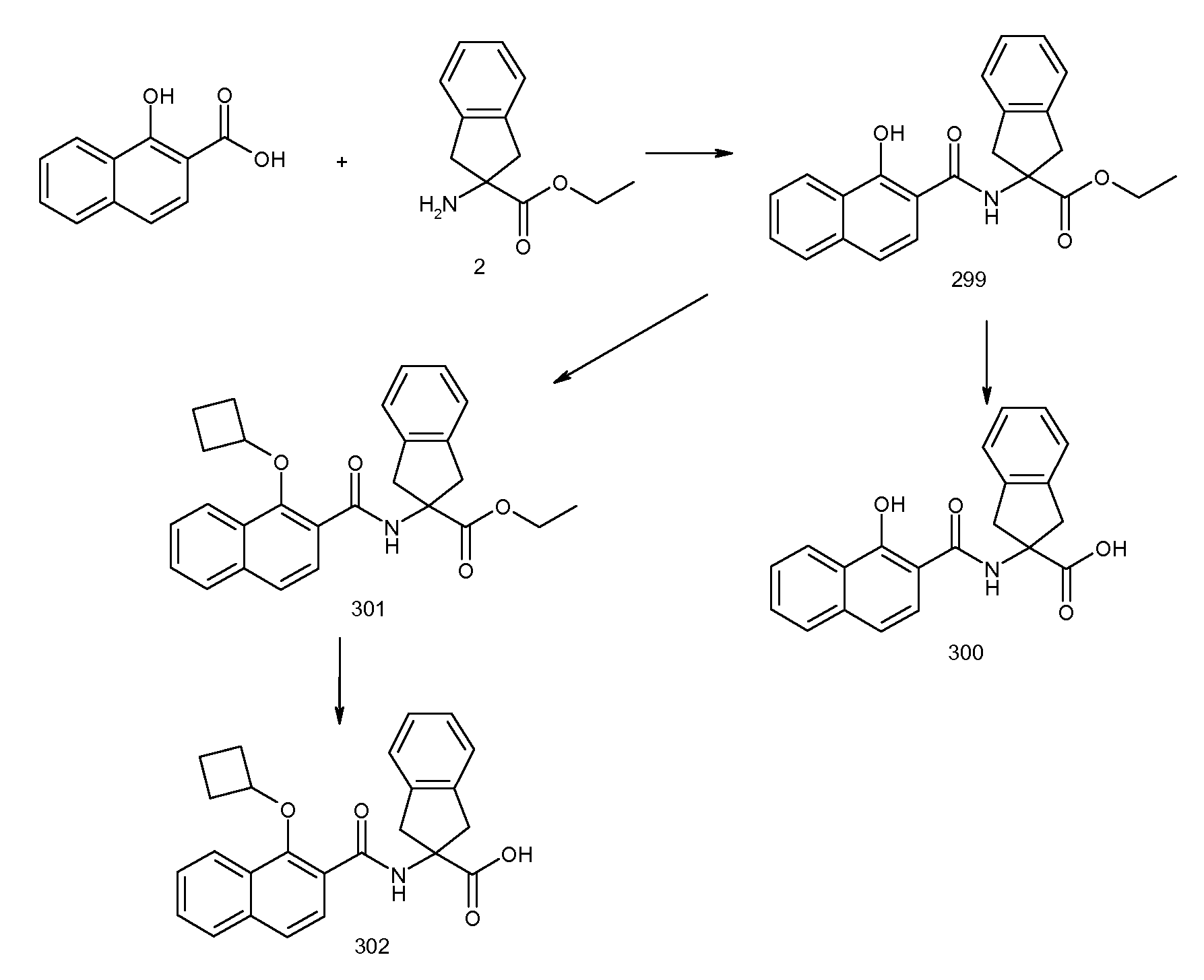
ПРИМЕР 299
Этиловый эфир 2-[(1-гидроксинафталин-2-карбонил)амино]индан-2-карбоновой кислоты (299)
Данное соединение получают способом, аналогичным описанному в примере 287. В результате очистки методом флэш-хроматографии (400 г силикагеля, 30% EtOAc в гептане) получают масло оранжевого цвета (1,75 г, 93%).
ЖХ/МС (E/S+) m/z 376
ПРИМЕР 300
2-[(1-Гидроксинафталин-2-карбонил)амино]индан-2-карбоновая кислота (300)
Данное соединение получают способом, аналогичным описанному в примере 288. Органический экстракт выпаривают в вакууме с получением твердого вещества белого цвета (280 мг, 99%).
1H ЯМР (ДМСО-d6, 300МГц): 3,48-3,53 (д, 2H), 3,63-3,69 (д, 2H), 7,17-7,28 (м, 5H), 7,34-7,37 (д, 1H), 7,53-7,66 (м, 2H), 7,85-7,88 (д, 1H), 7,96-7,99 (д, 1H), 8,26-8,28 (д, 1H), 9,22 (с, 1H)
ЖХ/МС (E/S+) m/z 376
ПРИМЕР 301
Этиловый эфир 2-[(1-циклобутилоксинафталин-2-карбонил)амино]индан-2-карбоновой кислоты (301)
Раствор этилового эфира 2-[(1-гидроксинафталин-2-карбонил)амино]индан-2-карбоновой кислоты (289) (560 мг, 1,5 ммоль) в сухом ДМФА обрабатывают масляной дисперсией NaH (60%, 100 мг, 2,25 ммоль, 1,5 экв.) и перемешивают в течение 10 минут. Добавляют циклобутилбромид (405 мг, 3 ммоль, 2 экв.) и реакционную смесь нагревают и перемешивают в микроволновом реакторе при 150°C в течение 3 часов. После удаления ДМФА в вакууме остаток растворяют в EtOAc (75 мл) и промывают водой (2×30 мл) и насыщенным раствором соли (30 мл). Органический слой сушат над MgSO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (200 г силикагеля, 10% EtOAc в гептане) с получением твердого вещества белого цвета (290 мг, 45%).
ЖХ/МС (E/S+) m/z 430
ПРИМЕР 302
2-[(1-Циклобутилоксинафталин-2-карбонил)амино]индан-2-карбоновая кислота (302)
Данное соединение получают способом, аналогичным описанному в примере 288. В результате очистки методом флэш-хроматографии (400 г силикагеля, градиентное элюирование: 25-60% EtOAc в гептане) получают продукт в виде твердого вещества белого цвета (20 мг, 9%).
ЖХ/МС (E/S+) m/z 402
ПРИМЕР 303
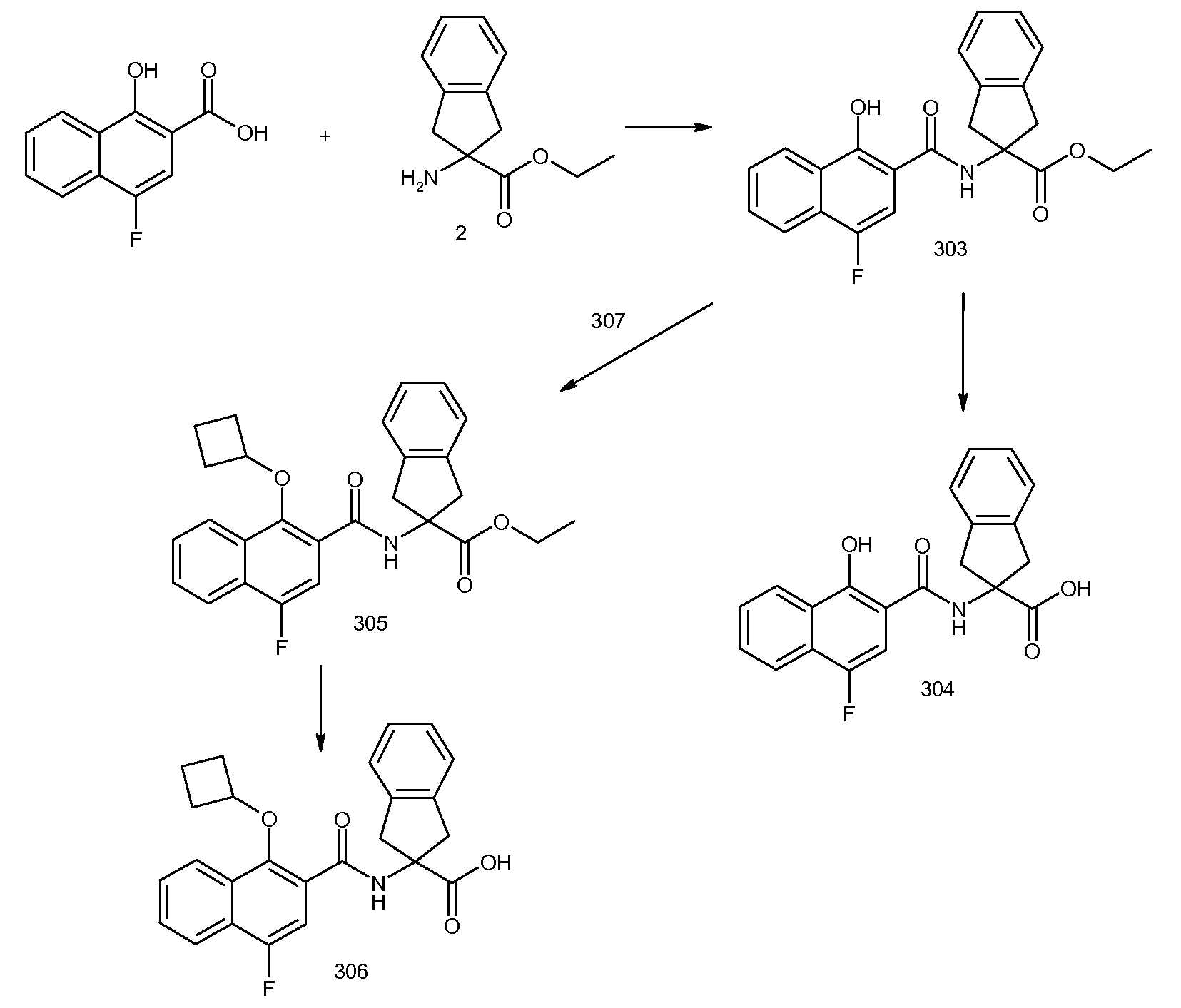
Этиловый эфир 2-[(4-фтор-1-гидроксинафталин-2-карбонил)амино]индан-2-карбоновой кислоты (303)
Данное соединение получают способом, аналогичным описанному в примере 287. В результате очистки методом флэш-хроматографии (400 г силикагеля, 30% EtOAc в гептане) получают масло оранжевого цвета (1,67 г, 85%).
1H ЯМР (ДМСО-d6, 300МГц): 1,13-1,16 (т, 3H), 3,46-3,52 (д, 2H), 3,64-3,69 (д, 2H), 4,11-4,18 (кв, 2H), 7,19-7,29 (м, 4H), 7,69-7,72 (т, 1H), 7,76-7,81 (т, 1H), 7,93-8,01 (м, 2H), 8,31-8,34 (д, 1H), 9,26 (с, 1H), 13,90 (с, 1H)
ЖХ/МС (E/S+) m/z 394
ПРИМЕР 304
2-[(4-Фтор-1-гидроксинафталин-2-карбонил)амино]индан-2-карбоновая кислота (304)
Данное соединение получают способом, аналогичным описанному в примере 288. Органический экстракт выпаривают в вакууме с получением продукта в виде твердого вещества белого цвета (270 мг, 97%).
1H ЯМР (ДМСО-d6, 300МГц): 3,47-3,58 (д, 2H), 3,64-3,75 (д, 2H), 7,18-7,29 (м, 5H), 7,66-7,75 (м, 1H), 7,77-7,85 (м, 1H), 7,95-8,01 (м, 1H), 8,31-8,34 (д, 1H), 9,16 (с, 1H), 12,75 (с, 1H)
ЖХ/МС (E/S-) m/z 364
ПРИМЕР 305
Этиловый эфир 2-[(1-циклобутилокси-4-фторнафталин-2-карбонил)амино]индан-2-карбоновой кислоты (305)
Раствор этилового эфира 2-[(4-фтор-1-гидроксинафталин-2-карбонил)амино]индан-2-карбоновой кислоты (303) (197 мг, 0,5 ммоль) и 3,3-диметил-1,2,5-тиадиазолидин-5 трифенилфосфин-1,1-диоксида (пример 307, 245 мг, 0,6 ммоль, 1,2 экв.) в DCM (6 мл) обрабатывают циклобутанолом (44 мг, 0,6 ммоль, 1,2 экв.) и перемешивают при комнатной температуре в течение 6 дней. Неочищенную реакционную смесь очищают флэш-хроматографией (100 г силикагеля, 100% DCM) с получением бесцветного масла (120 мг, 54%).
ЖХ/МС (E/S+) m/z 448
ПРИМЕР 306
2-[(1-Циклобутилокси-4-фторнафталин-2-карбонил)амино]индан-2-карбоновая кислота (306)
Данное соединение получают способом, аналогичным описанному в примере 288. Органический экстракт выпаривают в вакууме с получением твердого вещества белого цвета (95 мг, 84%).
1H ЯМР (ДМСО-d6, 300МГц): 1,20-1,33 (м, 1H), 1,44-1,54 (м, 1H), 3,42-3,47 (д, 2H), 3,58-3,63 (д, 2H), 4,49-4,57 (м, 1H), 7,17-7,36 (м, 6H), 7,69-7,75 (м, 2H), 8,03-8,06 (м, 1H), 8,17-8,19 (м, 1H), 8,88 (с, 1H), 12,70 (с, 1H)
ЖХ/МС (E/S+) m/z 420
ПРИМЕР 307
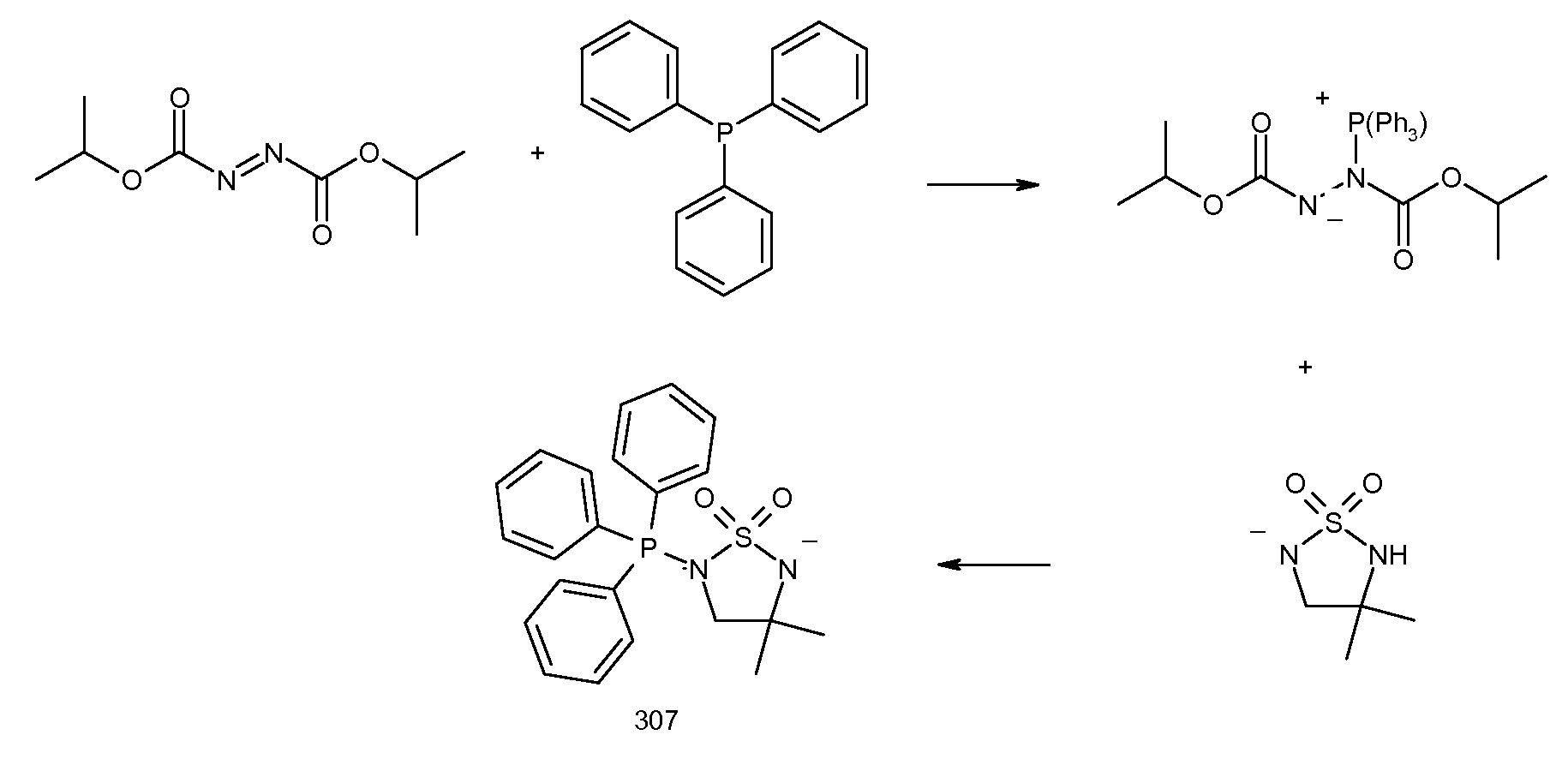
3,3-Диметил-1,2,5-тиадиазолидин-5 трифенилфосфин-1,1-диоксид (307)
Раствор трифенилфосфина (4,4 г, 0,016 моль) и 3,3-диметил-1,2,5-тиадиазолидин-1,1-диоксида (2,5 г, 0,016 моль) в сухом ТГФ (50 мл) обрабатывают по каплям диизопропилдиазодикарбоксилатом (3,3 г, 0,016 моль). Осажденное твердое вещество белого цвета продолжают перемешивать при комнатной температуре в течение дополнительных 4 часов. Затем продукт собирают фильтрованием и промывают диэтиловым эфиром (5,7 г, 86%).
ПРИМЕР 308
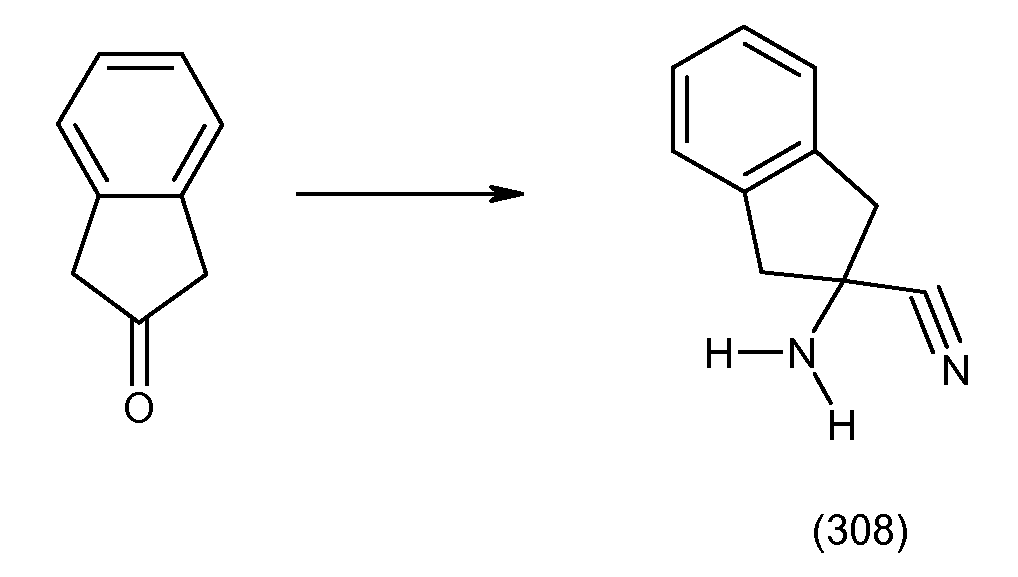
2-Аминоиндан-2-карбонитрил (308)
В круглодонную колбу объемом 250 мл помещают 2-инданон (2,64 г, 19,98 ммоль) и iPrOH (40 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют водный раствор гидроксида аммония (29%, 8,3 M 16 мл, 132,3 ммоль). Добавляют хлорид аммония ((2,14 г, 39,96 ммоль) и NaCN (1,96 г, 39,96 ммоль). По истечении 11 дней анализ ТСХ (силикагель, 2:1 гептан:EtOAc) показывает, что исходный индон израсходован. Органический растворитель удаляют в вакууме. Полученный продукт переносят в делительную воронку и распределяют между DCM (200 мл) и водой (100 мл). Фазы разделяют. Водную фазу экстрагируют DCM (100 мл). Органические экстракты объединяют и промывают насыщенным раствором соли (100 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 2,6 г твердого вещества темно-коричневого цвета. Полученный продукт растворяют в DCM (15 мл). Данный раствор загружают в колонку (40 г силикагеля), оборудованную системой очистки ISCO Companion. Градиент 1% iPrOH в DCM пропускают через 4 объема колонки, после чего линейный градиент 20% iPrOH в DCM пропускают через 10 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 15-32 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-бежевого цвета (0,82 г, 26%).
ПРИМЕР 309
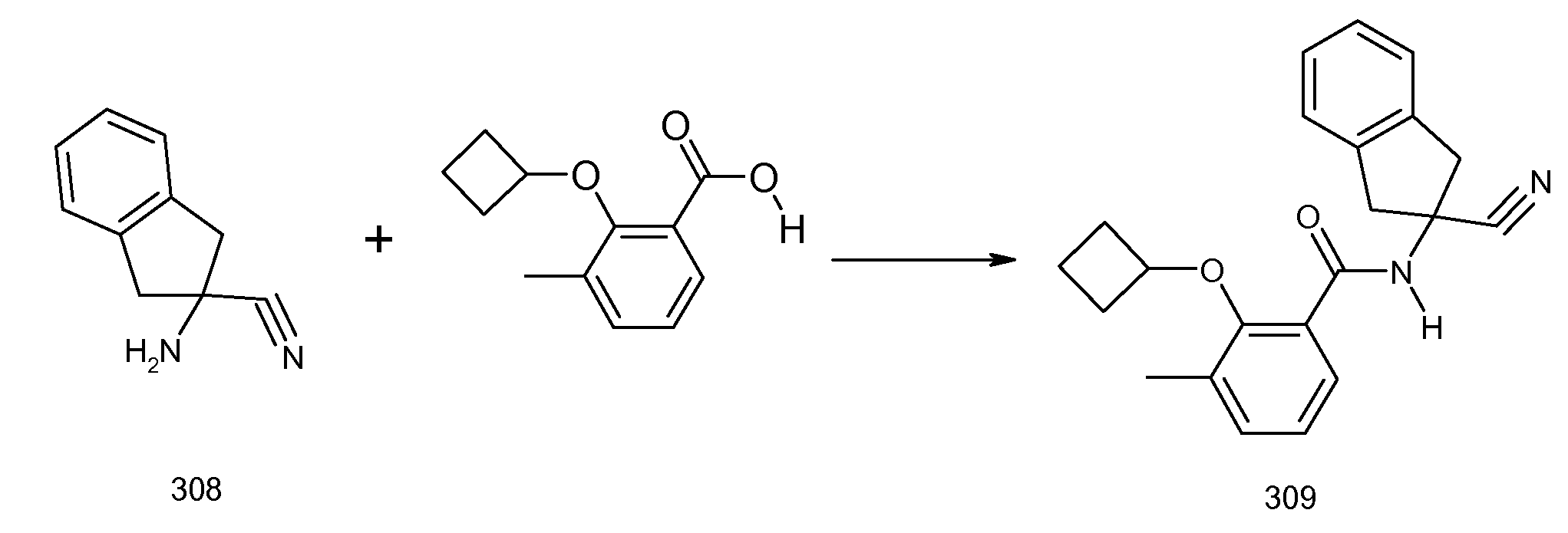
N-(2-Цианоиндан-2-ил)-2-циклобутокси-3-метилбензамид (309)
В колбу объемом 30 мл помещают 2-циклобутокси-3-метилбензойную кислоту (734 мг, 3,56 ммоль) и сухой DCM (10 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 5 минут добавляют HBTU (1,35 г, 3,56 ммоль). Через 5 минут добавляют 2-аминоиндан-2-карбонитрил (308, 563 мг, 3,56 ммоль), затем DIPEA (1,5 мл, 8,95 ммоль). Реакционную смесь перемешивают в течение 38 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (60 мл). Смесь промывают насыщенным водным раствором NaHCO3 (2×20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,2 г густого масла черного цвета. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 8 объемов колонки и затем 90% EtOAc в гептане пропускают через 2 объема колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 27-30 объединяют и выпаривают в вакууме, получая твердое вещество белого цвета (0,51 г, 41%).
ПРИМЕР 310
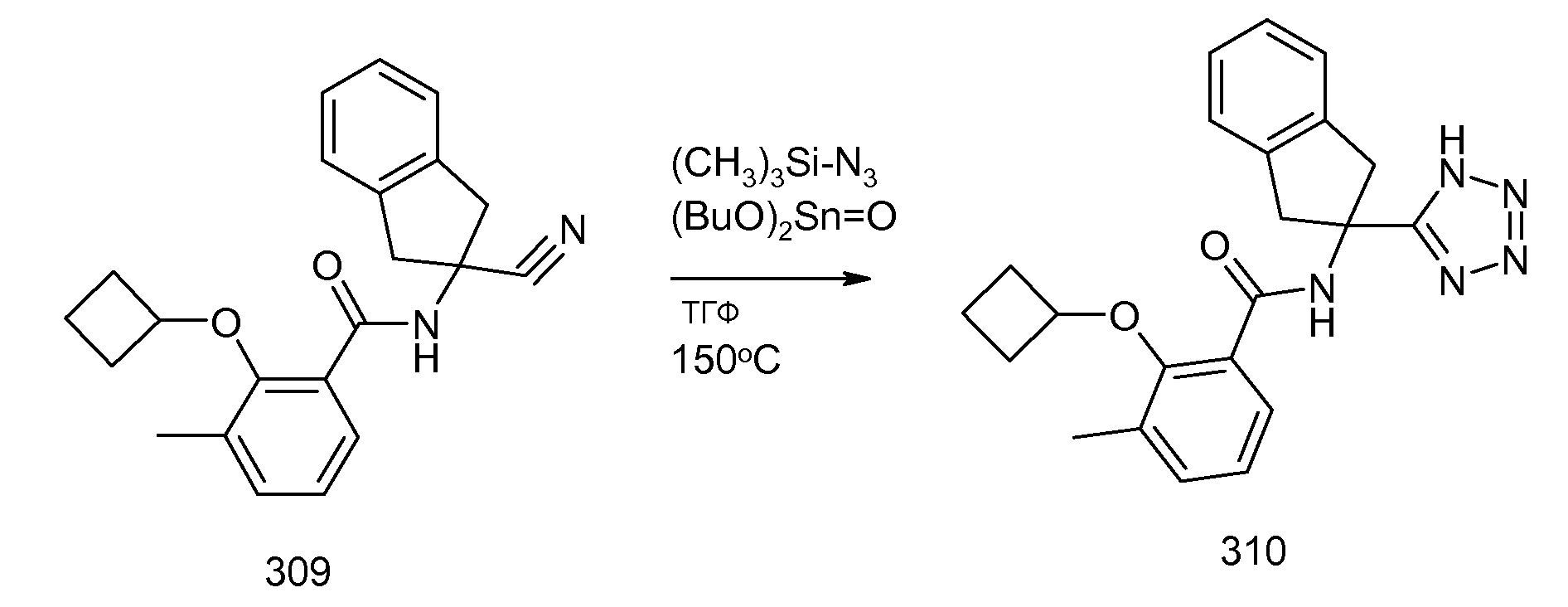
2-Циклобутокси-3-метил-N-[2-(1H-тетразол-5-ил)индан-2-ил]бензамид (310)
В пробирку микроволнового реактора объемом 10 мл помещают N-(2-цианоиндан-2-ил)-2-циклобутокси-3-метилбензамид (309, 300 мг, 0,87 ммоль) и сухой тетрагидрофуран (ТГФ, 4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 1 минуту в реакционную пробирку добавляют триметилсилилазид (228 мкл, 1,73 ммоль) и ди-н-бутилолова оксид (22 мг, 0,087 ммоль). Реакционную пробирку закрывают и помещают в микроволновый аппарат Emrys Optimizer. Реакционную смесь в пробирке предварительно перемешивают в течение 10 секунд. Температуру устанавливают на уровне 150°C в течение 10 минут. В конце этого процесса в реакционную пробирку добавляют дополнительные аликвоты триметилсилилазида (228 мкл, 1,73 ммоль) и ди-н-бутилолова оксида (22 мг, 0,087 ммоль). Реакционную пробирку закрывают и помещают в микроволновый аппарат Emrys Optimizer. Реакционную смесь в пробирке предварительно перемешивают в течение 10 секунд. Температуру устанавливают на 150°C в течение 10 минут. Анализ ТСХ (силикагель, 10% MeOH в DCM) показывает, что исходный продукт полностью израсходован. Содержимое реакционной пробирки растворяют в DCM (8 мл) и iPrOH (4 мл). Данный раствор перемешивают в течение 10 минут и фильтруют через слой целита. Фильтрат выпаривают при пониженном давлении, при откачивании до постоянного веса, с получением 0,4 г пены светло-желтого цвета. Пену растворяют в DCM (10 мл) и загружают в систему очистки ISCO Companion (40 г силикагеля). Используется следующий градиент: 1% iPrOH в DCM пропускают через 4 объема колонки, после чего линейный градиент 50% изопропанола в DCM пропускают через 10 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 2-6 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,31 г, 92%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,08-1,25 (м, 2H), 1,38-1,51 (м, 1H), 1,71-1,96 (м, 4H), 2,22 (с, 3H) 3,79-3,93 (м, 4H), 4,35 (м, 1H), 7,03 (дд, 1H), 7,1-7,37 (м, 6H), 8,98 (с, 1H)
ЖХ/МС (ES+) m/z=390,16
ПРИМЕР 311
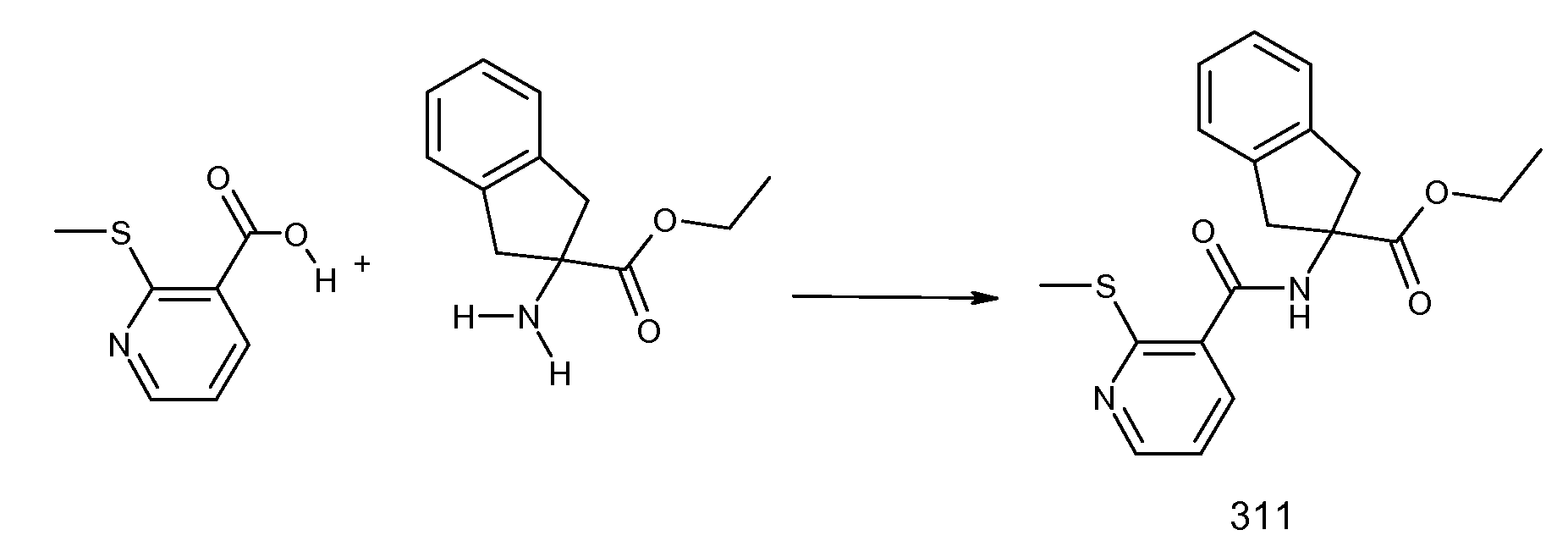
Этиловый эфир 2-[(2-метилсульфамилпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (311)
В колбу объемом 40 мл помещают 2-(метилтио)никотиновую кислоту (0,37 г, 2,19 ммоль) и сухой DCM (8 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения через 5 минут добавляют HBTU (831 мг, 2,19 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (450 мг, 2,19 ммоль), затем DIPEA (0,96 мл, 5,48 ммоль). Реакционную смесь перемешивают в течение 14 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,23 г пены светло-желтого цвета. Пену растворяют в 10 мл DCM. Данный раствор очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 8-12 объединяют и выпаривают в вакууме при откачивании до постоянного веса при пониженном давлении, получая твердое вещество белого цвета (0,47 г, 60%).
ПРИМЕР 312
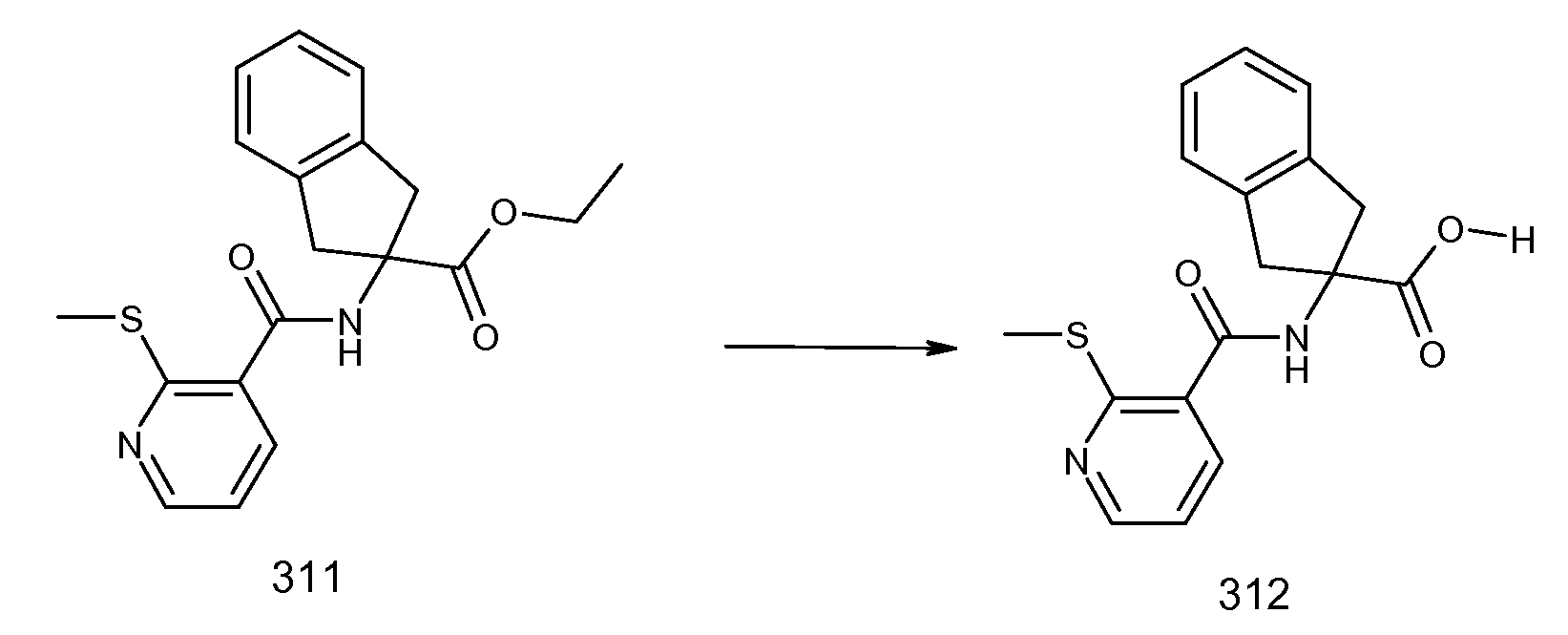
2-[(2-Метилсульфамилпиридин-3-карбонил)амино]индан-2-карбоновая кислота (312)
В колбу объемом 100 мл, содержащую этиловый эфир 2-[(2-метилсульфамилпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (311, 490 мг, 1,38 ммоль), добавляют 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем LiOH (146 мг, 3,5 ммоль). По истечении 40 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое колбы разбавляют iPrOH (30 мл). Добавляют сильнокислую ионообменную смолу Dowex (10 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 7 дней в реакционную колбу добавляют дополнительное количество iPrOH (35 мл). Содержимое реакционной колбы фильтруют через слой целита и концентрируют при пониженном давлении откачиванием до постоянного веса, получая твердое вещество белого цвета (0,44 г, 97%).
1H ЯМР (ДМСО-d6, 300МГц): δ 2,41 (с, 3H), 3,26-3,48 (м, 4H), 7,16-7,25 (м, 5H), 7,71 (дд, 1H), 8,51 (дд, 1H), 9,01 (с, 1H)
ЖХ/МС (ES+) m/z=329,14
ПРИМЕР 313
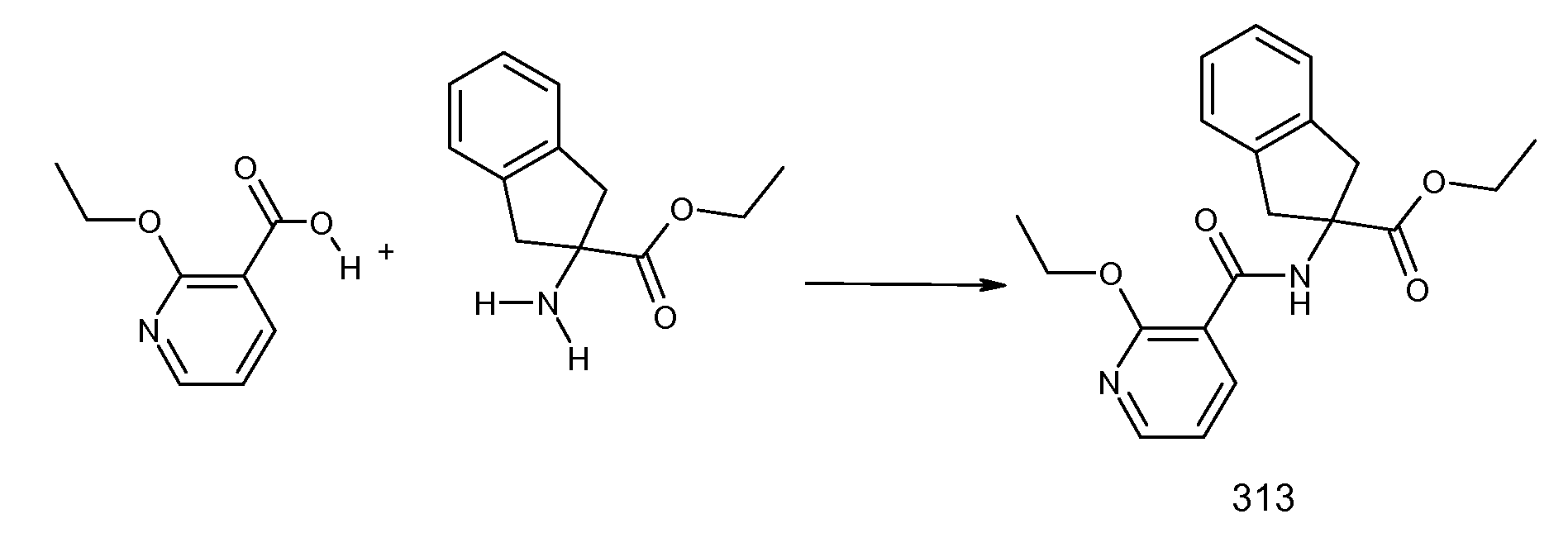
Этиловый эфир 2-[(2-этоксипиридин-3-карбонил)амино]индан-2-карбоновой кислоты (313)
В колбу объемом 40 мл помещают 2-этоксиникотиновую кислоту (366 мг, 2,19 ммоль) и сухой DCM (7 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения через 5 минут добавляют HBTU (831 мг, 2,19 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (450 мг, 2,19 ммоль) и затем DIPEA (0,96 мл, 5,48 ммоль). Реакционную смесь перемешивают в течение 17 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 2,38 г сиропа светло-желтого цвета. Сироп растворяют в 10 мл DCM. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 1% iPrOH/DCM пропускают через 4 объема колонки, после чего линейный градиент 30% iPrOH/DCM пропускают через 10 объемов колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 5-10 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая твердое вещество белого цвета (0,34 г, 44%).
ПРИМЕР 314
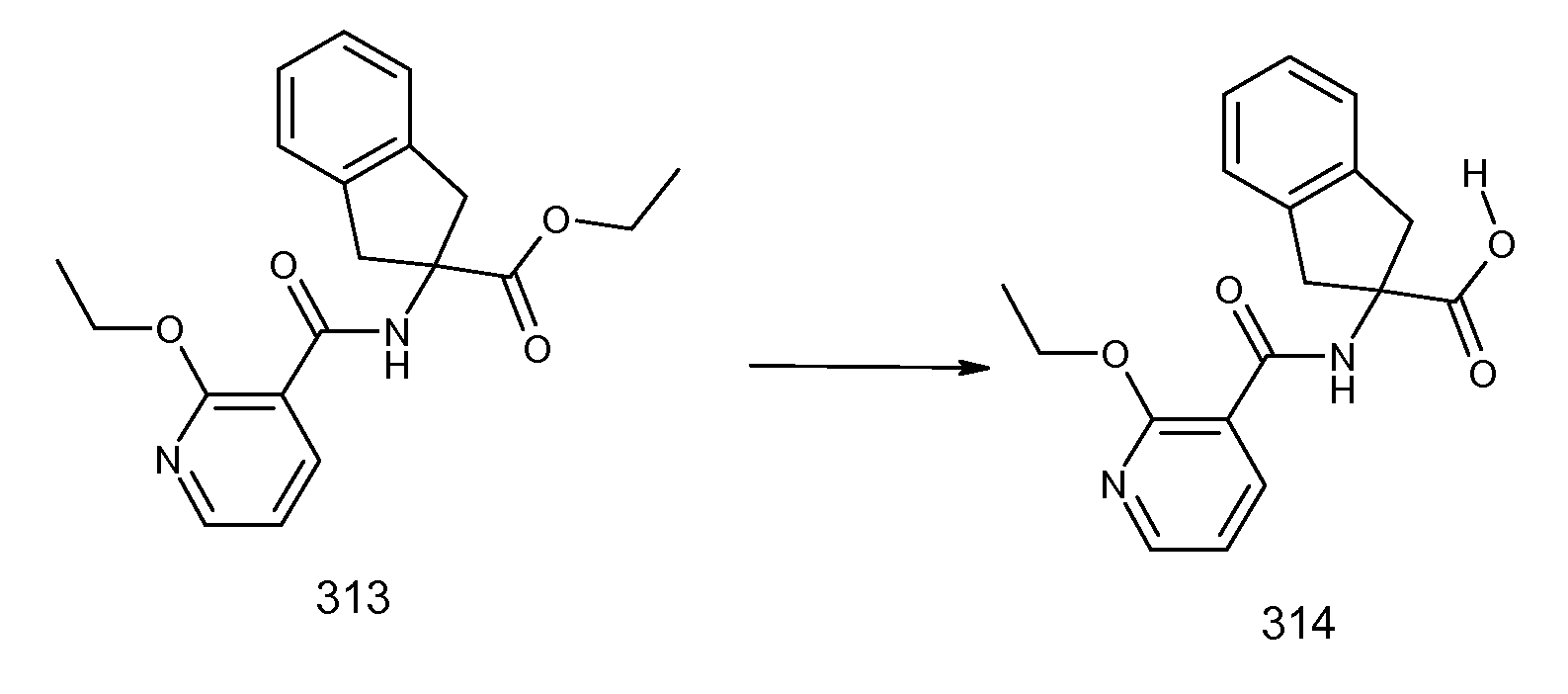
2-[(2-Этоксипиридин-3-карбонил)амино]индан-2-карбоновая кислота (314)
В колбу объемом 100 мл, содержащую этиловый эфир 2-[(2-этоксипиридин-3-карбонил)амино]индан-2-карбоновой кислоты ([313], 340 мг, 0,96 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем моногидрат LiOH (102 мг, 2,42 ммоль). Через 13 дней анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое колбы разбавляют iPrOH (30 мл). Добавляют сильнокислую ионообменную смолу Dowex (2 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 18 часов в реакционную колбу добавляют дополнительное количество iPrOH (35 мл). Содержимое реакционной колбы фильтруют через слой целита и концентрируют при пониженном давлении откачиванием до постоянного веса, получая 0,44 г твердого вещества белого цвета. Данный продукт растворяют в смеси DCM (10 мл) и iPrOH (3 мл). В колбу добавляют целит (15 г). Растворитель удаляют при пониженном давлении. Остающийся продукт переносят в пластмассовый шприц объемом 40 мл, снабженный пористым диском. Шприц подсоединяют к системе очистки ISCO Companion с 40 г колонкой (силикагель). Используется следующий градиент: 1% iPrOH/DCM через 4 объема колонки. Затем линейный градиент 50% iPrOH/DCM через 10 объемов колонки. Удерживают при 50% iPrOH/DCM через 2 объема колонки. Отбирают фракции по 14 мл. Фракции 39-41 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,28 г, 89%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,22 (т, 3H), 3,26-3,63 (м, 4H), 4,36 (кв, 2H), 7,14-7,25 (м, 5H), 8,13 (дд, 1H), 8,28 (дд, 1H), 8,76 (с, 1H)
ЖХ/МС (ES+) m/z=327,11
ПРИМЕР 315
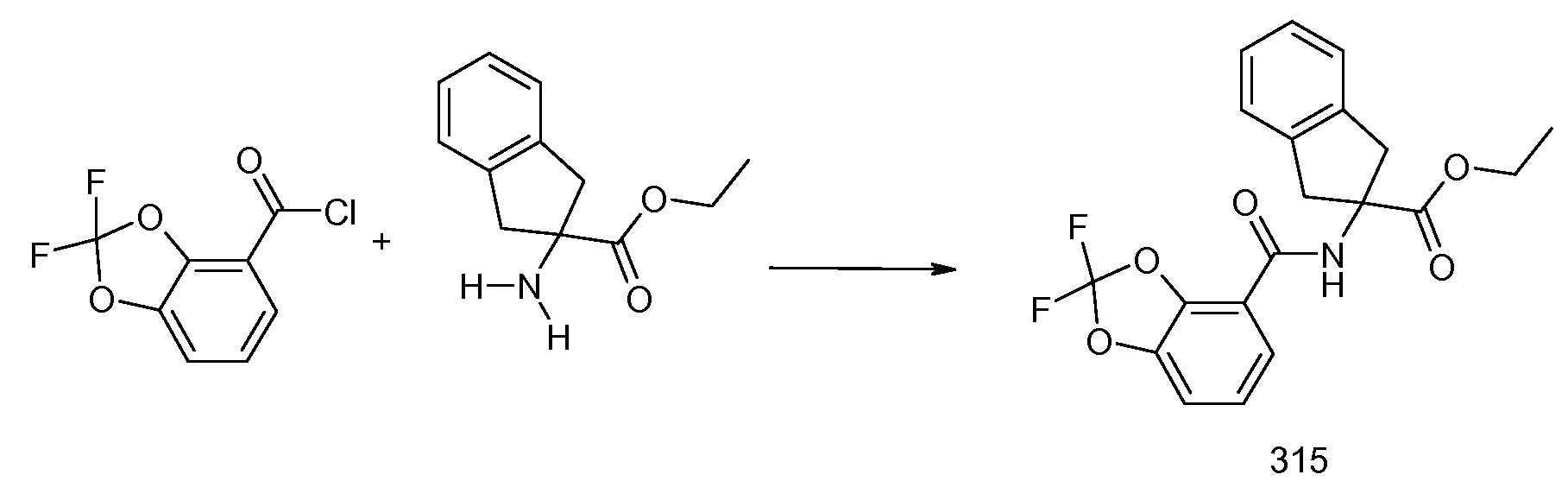
Этиловый эфир 2-[(2,2-дифторбензо[1,3]диоксол-4-карбонил)амино]индан-2-карбоновой кислоты (315)
В круглодонную колбу объемом 100 мл помещают 2-аминоиндан-2-карбоновую кислоту (340 мг, 1,66 ммоль) и сухой DCM (6 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют DIPEA (0,46 мл, 2,65 ммоль). Добавляют 2-[(2,2-дифторбензо[1,3]диоксол-4-карбонил)хлорид (438 мг, 1,99 ммоль). Добавляют 4-диметиламинопиридин ([MFCD0006418], 2 мг, кат.). Реакционную смесь герметизируют. Через 18 дней анализ ТСХ (силикагель, 5% iPrOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (60 мл). Смесь промывают разбавленным водным раствором HCl (2×25 мл), насыщенным водным раствором NaHCO3 (2×25 мл), насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 0,73 пены темно-коричневого цвета. Полученный продукт разбавляют DCM и загружают в силикагелевую колонку (40 г) системы очистки ISCO Companion. Колонку элюируют 3 объемами колонки смеси 10% EtOAc в гептане, после чего линейный градиент 50% EtOAc в гептане пропускают через 10 объемов колонки. Затем 90% EtOAc в гептане пропускают через 2 объема колонки. Отбирают фракции по 17 мл УФ-положительного элюента. Фракции 8-10 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-оранжевого цвета (0,57 г, 88%).
ПРИМЕР 316
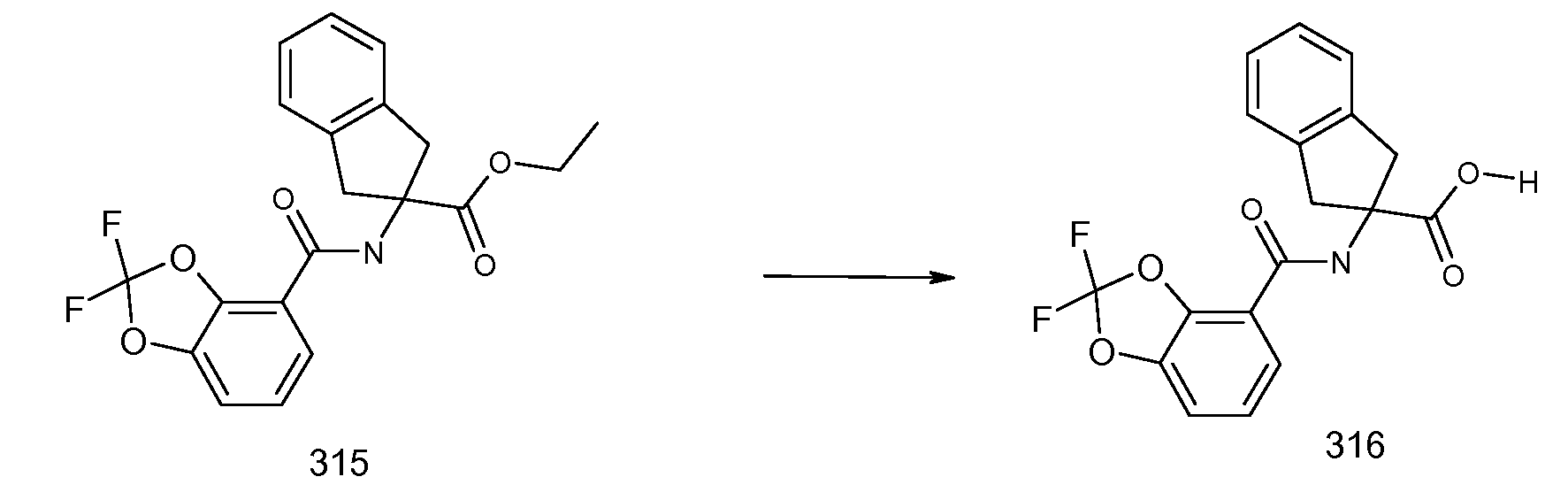
2-[(2,2-Дифторбензо[1,3]диоксол-4-карбонил)амино]индан-2-карбоновая кислота (316)
В колбу объемом 100 мл, содержащую этиловый эфир 2-[(2,2-дифтор-1,3-бензодиоксол-4-карбонил)амино]индан-2-карбоновой кислоты (0,38 г, 0,98 ммоль), помещают 1,4-диоксан (6 мл) и MeOH (6 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (3 мл) и затем моногидрат LiOH (103 мг, 2,46 ммоль). По истечении 70 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество не совсем белого цвета (0,33 г, 94%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,26-3,63 (м, 4H), 7,13-7,32 (м, 5H), 7,48 (дд, 1H), 7,55 (дд, 1H), 8,97 (с, 1H), 12,63 (уш.с, 1H)
ЖХ/МС (ES+) m/z=362,05
ПРИМЕР 317
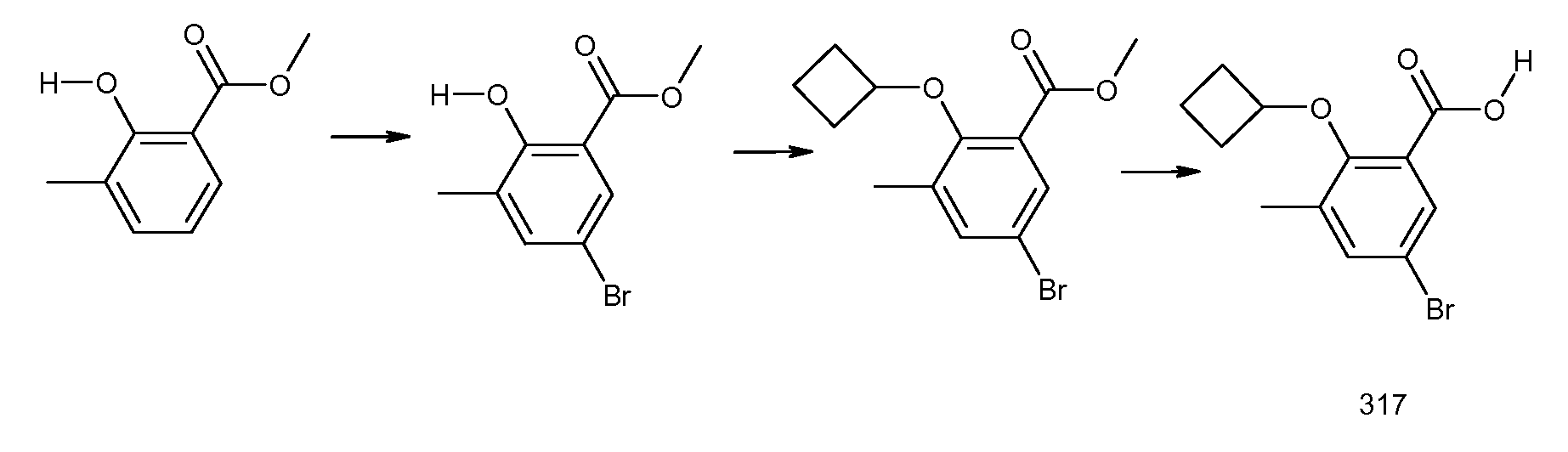
5-Бром-2-циклобутокси-3-метилбензойная кислота (317)
В трехгорлую круглодонную колбу объемом 250 мл, снабженную капельной воронкой, входным клапаном N2 и пробкой, помещают бром (3,6 мл, 70,11 ммоль) и DCM (40 мл). Добавляют магнитную мешалку и начинают перемешивать. Реакционную колбу погружают в баню с ледяной водой. После перемешивания в течение 15 минут капельную воронку заполняют раствором метил 2-гидрокси-3-метилбензоата (10 г, 60,18 ммоль) в 1,4-диоксане (40 мл). Данный раствор добавляют по каплям к перемешиваемой реакционной смеси в течение 30 минут. Капельную воронку затем промывают 1,4-диоксаном (10 мл). То, что получено после промывки, также добавляют к реакционной смеси. Реакционной смеси затем дают медленно нагреться до комнатной температуры. Через 18 дней содержимое реакционной колбы переносят в круглодонную колбу. Растворитель удаляют при пониженном давлении откачиванием до постоянного веса, получая 17,66 г твердого вещества светло-желтого цвета. Данное твердое вещество обрабатывают ледяным MeOH. Полученные кристаллы собирают фильтрованием с отсасыванием. В результате сушки на воздухе получают твердое вещество белого цвета (14,26 г, 97%).
В круглодонную колбу объемом 100 мл помещают метиловый эфир 5-бром-2-гидрокси-3-метилбензойной кислоты (4,05 г, 16,53 ммоль) согласно способу, описанному выше. Добавляют сухой ДМФА (20 мл) и магнитную мешалку. Начинают перемешивать. После растворения добавляют K2SO4 (6,85 г, 49,59 ммоль) и бромциклобутан (2,35 мл, 24,8 ммоль). На реакционную колбу устанавливают колбонагреватель. Температуру колбонагревателя устанавливают на 35°C. По истечении 8 дней анализ ТСХ (силикагель, 25% EtOAc/гептан) показывает некоторый расход исходного продукта и появление УФ-положительной точки с несколько более высоким значением Rf. На реактивную колбу устанавливают колбонагреватель и нагревают до 37°C. Еще через 3 дня анализ ТСХ (силикагель, 25% EtOAc/гептан) показывает расход исходного продукта и полное обращение в УФ-положительную точку с несколько более высоким значением Rf. Реакционную смесь фильтруют через слой целита. Фильтрат разбавляют EtOAc (100 мл) и переносят в делительную воронку. Раствор EtOAc промывают насыщенным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая полутвердое вещество белого цвета (2,09 г, 42%). Данный продукт используется на следующей стадии.
В колбу объемом 100 мл, содержащую полученный выше метиловый эфир 5-бром-2-циклобутокси-3-метилбензойной кислоты (2,07 г, 7,25 ммоль), помещают 1,4-диоксан (12 мл) и MeOH (12 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (6 мл) и затем LiOH (768 мг, 18,31 ммоль). Через 18 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~11 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (50 мл). Слои разделяют. Водный слой экстрагируют EtOAc (40 мл). Объединенные органические фазы промывают водой (40 мл) и насыщенным раствором соли (40 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество белого цвета (1,82 г, 88%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,16-1,25 (м, 2H), 1,38-1,51 (м, 1H), 1,71-2,12 (м, 3H), 2,23 (с, 3H), 4,37 (м, 1H), 7,53-7,62 (м, 2H)
ЖХ/МС (ES+) m/z=390,16
ПРИМЕР 318
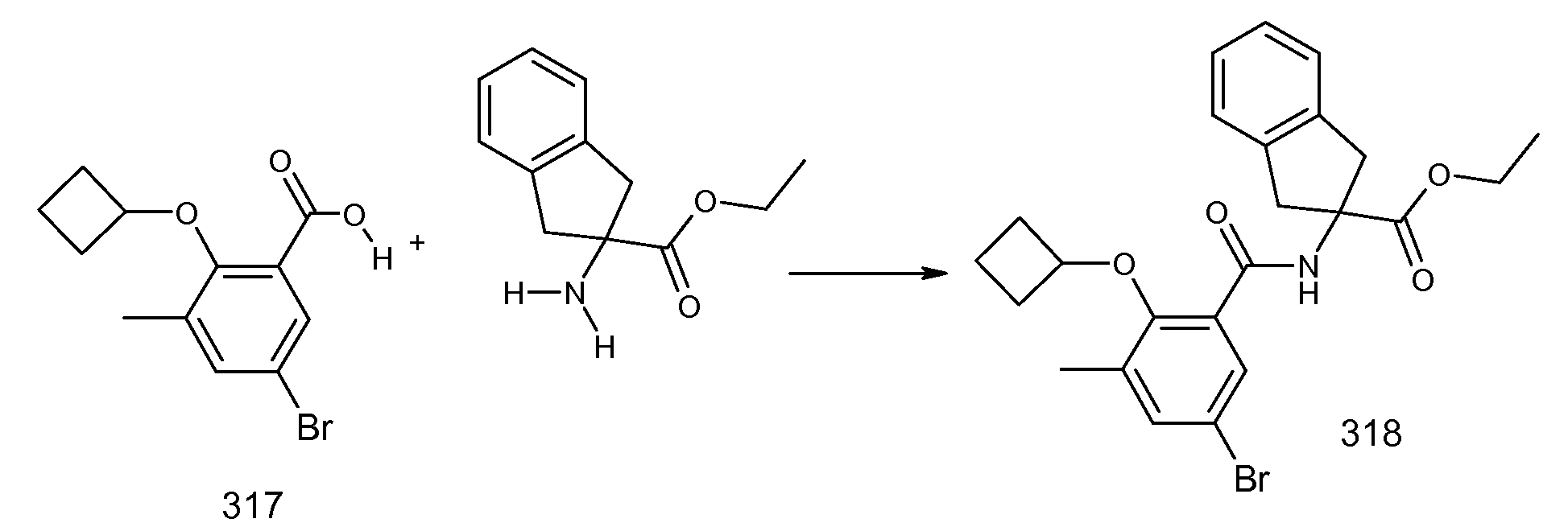
Этиловый эфир 2-(5-бром-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (318)
В круглодонную колбу объемом 100 мл, содержащую магнитную мешалку, помещают 2-циклобутокси-3-метил-5-бромбензойную кислоту 317 (695 мг, 2,44 ммоль) и сухой DCM (8 мл). Начинают перемешивать. После полного растворения добавляют HBTU (924 мг, 2,44 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и затем DIPEA (1,1 мл, 6,1 ммоль). Реакционную смесь перемешивают в течение 15 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Органическую фазу последовательно промывают разбавленным водным раствором HCl (3%, 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,42 г твердого вещества светло-оранжевого цвета. Данное вещество растворяют в 10 мл DCM. Это вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 60% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 4-9 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (0,8 г, 70%).
ПРИМЕР 319
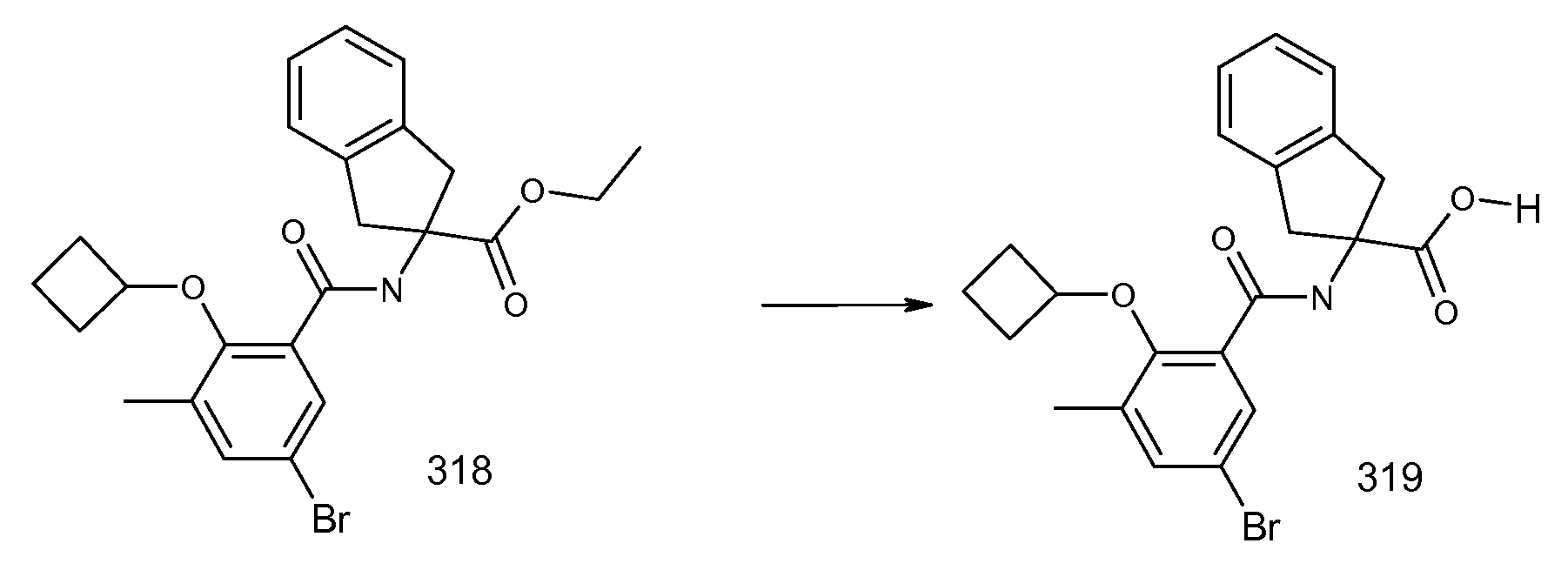
2-(5-Бром-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновая кислота (319)
В реакционную колбу объемом 30 мл, содержащую этиловый эфир 2-(5-бром-2-циклобутокси-3-метилбензоиламино)индан-2-карбоновой кислоты (0,29 г, 0,61 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем моногидрат LiOH (65 мг, 1,55 ммоль). Через 38 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~6 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические фазы промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество не совсем белого цвета (0,26 г, 95%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,11-1,27 (м, 2H), 1,43-1,57 (м, 1H), 1,79-1,99 (м, 4H), 2,21 (с, 3H), 3,55-3,84 (м, 4H), 4,37 (м, 1H), 7,18-7,33 (м, 4H), 7,35 (д, 1H), 7,51 (д, 1H), 8,78 (с, 1H), 12,62 (с, 1H)
ЖХ/МС (ES+) m/z=446,11
ПРИМЕР 320
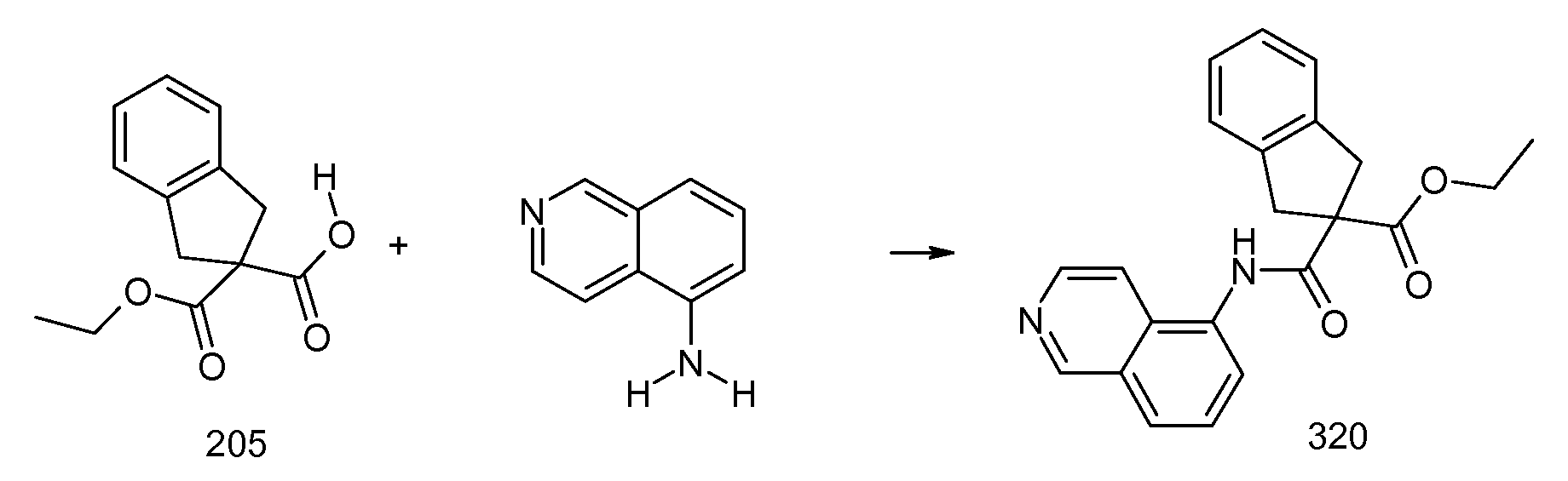
Этиловый эфир 2-(изохинолин-5-илкарбамоил)индан-2-карбоновой кислоты (320)
В реакционную колбу объемом 25 мл, содержащую магнитную мешалку, помещают этиловый эфир индан-2-карбоновой кислоты (205, 1,0 г, 4,27 ммоль) и сухой DCM (15 мл). Начинают перемешивать. После полного растворения добавляют HBTU (1,62 г, 4,27 ммоль). Через 5 минут добавляют 5-аминоизохинолин (616 мг, 4,27 ммоль) и затем DIPEA (1,72 мл, 9,8 ммоль). Реакционную смесь перемешивают в течение 63 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходной кислоты. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (40 мл). Органическую фазу последовательно промывают разбавленным водным раствором HCl (3%, 20 мл), насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором соли (20 мл) и затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 3,13 г твердого вещества светло-оранжевого цвета. Данное вещество растворяют в 15 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 90% EtOAc пропускают через 12 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 17-31 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (1,39 г, 90%).
ПРИМЕР 321
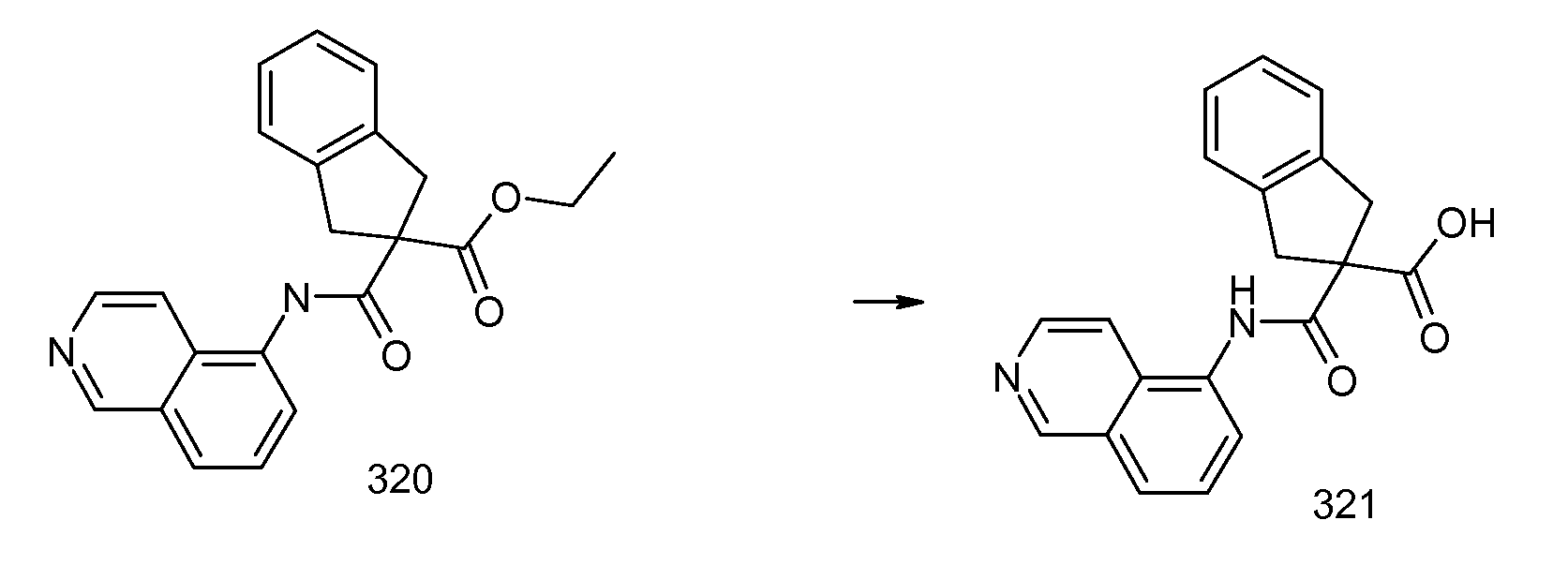
2-(Изохинолин-5-илкарбамоил)индан-2-карбоновая кислота (321)
В реакционную колбу объемом 30 мл, содержащую этиловый эфир 2-(изохинолин-5-илкарбамоил)индан-2-карбоновой кислоты (320, 354 мг, 0,98 ммоль), помещают 1,4-диоксан (6 мл) и MeOH (6 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (3 мл) и затем моногидрат LiOH (104 мг, 252 ммоль). По истечении 20 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (1 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 64 часа содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата откачиванием до постоянного веса, получая 0,29 г твердого вещества не совсем белого цвета. Полученный продукт обрабатывают DCM (15 мл). Твердые вещества собирают фильтрованием с отсасыванием и промывают DCM (20 мл). В результате вакуумной сушки получают твердое вещество не совсем белого цвета (280 мг, 86%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,55-3,76 (м, 4H), 4,37 (м, 1H), 7,02-7,19 (м, 4H), 7,61 (дд, 1H), 7,78 (д, 1H), 8,06 (д, 1H), 8,46 (д, 1H), 8,57 (д, 1H), 9,30 (с, 1H), 13,77 (с, 1H)
ЖХ/МС (ES+) m/z=333,11
ПРИМЕР 322
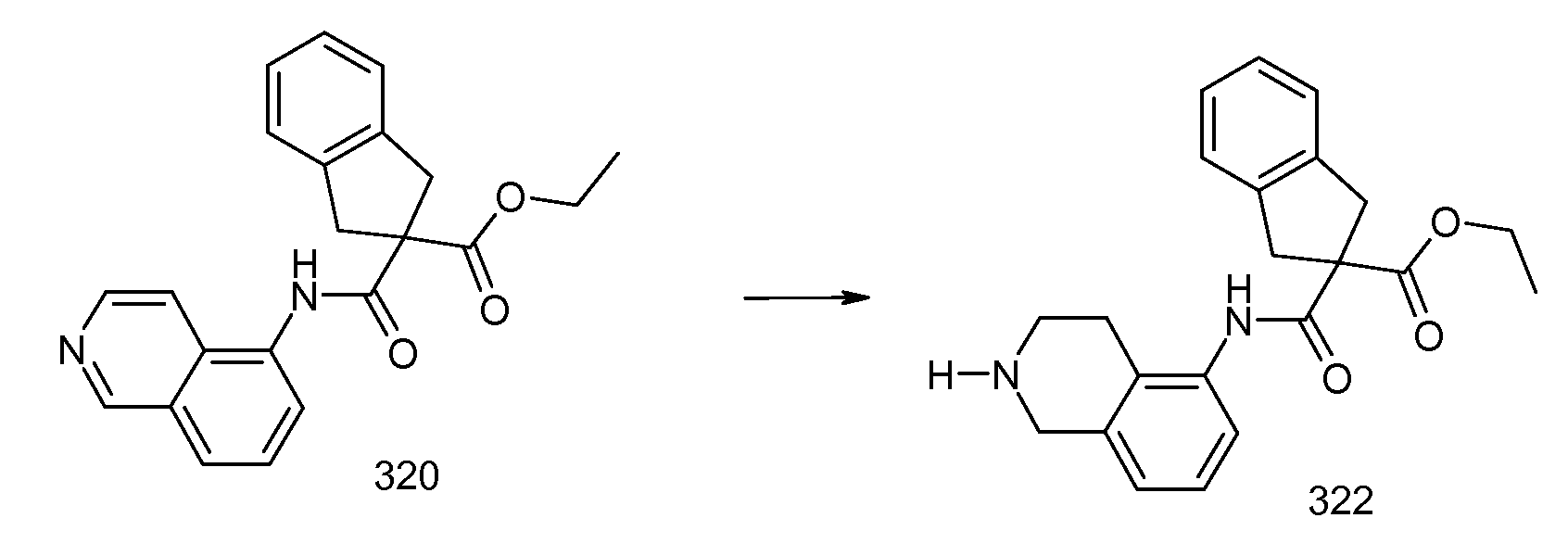
Этиловый эфир 2-(1,2,3,4-тетрагидроизохинолин-5-илкарбамоил)индан-2-карбоновой кислоты (322)
В реакционный сосуд Парра объемом 100 мл помещают этиловый эфир 2-(изохинолин-5-илкарбамоил)индан-2-карбоновой кислоты (320, 500 мг, 1,39 ммоль) и EtOH (10 мл). Содержимое реакционного сосуда перемешивают вращательным движением до растворения. Добавляют уксусную кислоту (10 мл) и оксид платины(IV) (117 мг, 0,52 ммоль). Сосуд помещают в аппарат гидрирования Парра, продувают N2 и вакуумируют. Сосуд наполняют водородом до 50 фунт/кв. дюйм. Аппарат устанавливают на режим перемешивания. Через 4 часа перемешивание завершается. Реакционный сосуд вакуумируют и продувают азотом. Данный процесс повторяют. Содержимое реакционного сосуда разбавляют iPrOH (50 мл) и фильтруют через слой целита. Растворитель удаляют из фильтрата при пониженном давлении. Полученный остаток растворяют в iPrOH (15 мл) и толуоле (15 мл). Растворитель удаляют при пониженном давлении. Данный процесс повторяют. Откачиванием до постоянного веса получают твердое вещество светло-бежевого цвета (0,5 г, 99%).
ПРИМЕР 323
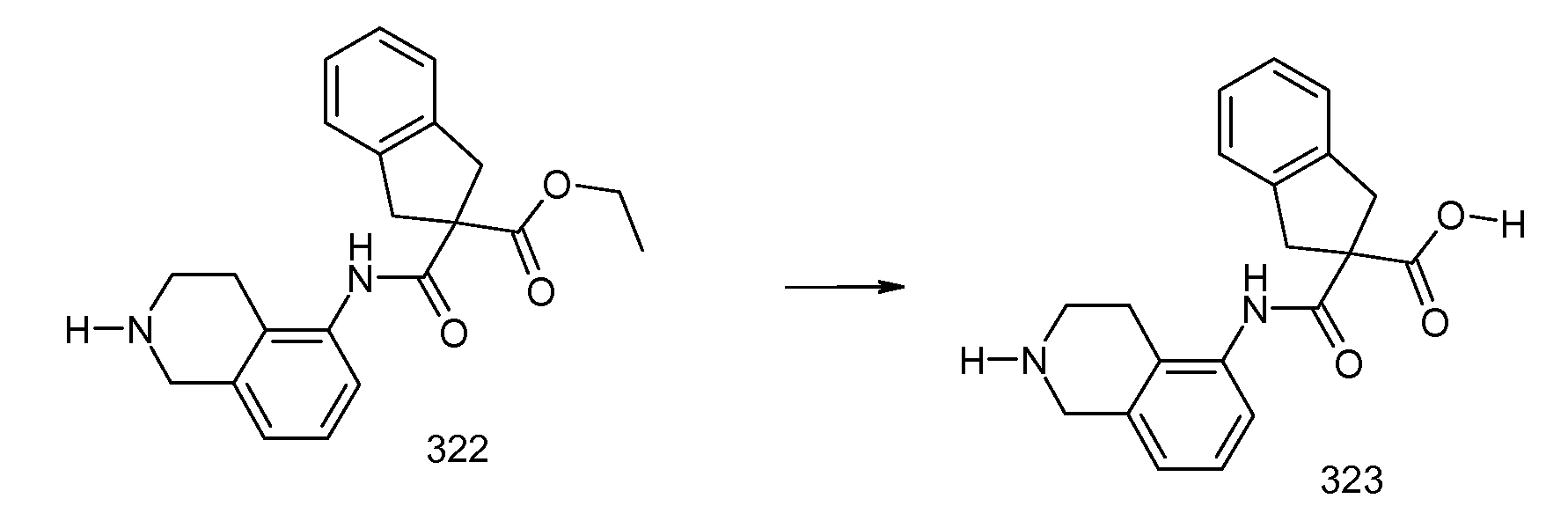
2-(1,2,3,4-Тетрагидроизохинолин-5-илкарбамоил)индан-2-карбоновая кислота (323)
В круглодонную колбу объемом 250 мл, содержащую этиловый эфир 2-(1,2,3,4-тетрагидроизохинолин-5-илкарбамоил)индан-2-карбоновой кислоты (322, 440 мг, 1,21 ммоль), помещают 1,4-диоксан (7 мл) и MeOH (7 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (3,5 мл) и затем моногидрат LiOH (128 мг, 3,05 ммоль). Через 18 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (1 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 24 часа содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Полученный остаток растворяют в смеси iPrOH/толуол (1:1, 25 мл). Растворитель удаляют в вакууме. Данный процесс повторяют два раза. Откачиванием до постоянного веса получают твердое вещество не совсем белого цвета (400 мг, 99%).
1H ЯМР (ДМСО-d6, 300МГц): δ 2,58 (м, 1H), 2,99 (м, 1H), 3,43-3,71 (м, 4H), 3,81 (м, 1H), 6,72 (д, 1H), 7,01 (дд, 1H), 7,04-7,18 (м, 4H), 7,84 (д, 1H), 11,82 (с, 1H)
ЖХ/МС (ES+) m/z=337,15
ПРИМЕР 324
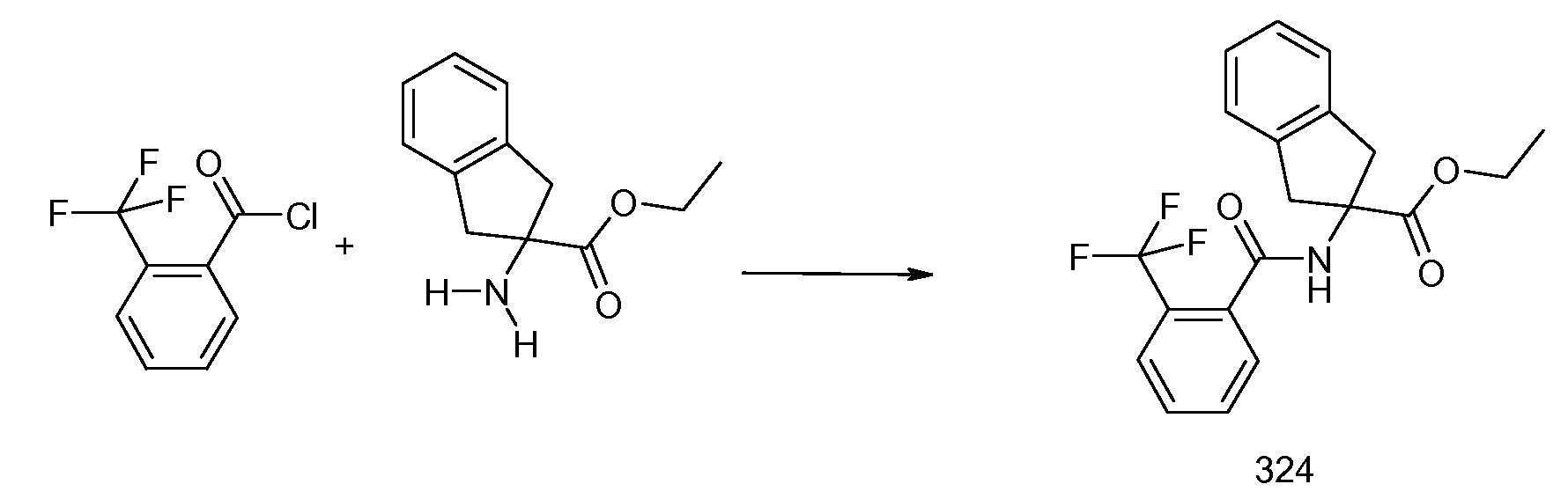
Этиловый эфир 2-(2-трифторметилбензоиламино)индан-2-карбоновой кислоты (324)
В колбу объемом 30 мл помещают 2-аминоиндан-2-карбоновую кислоту (450 мг, 2,19 ммоль) и сухой DCM (5 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют DIPEA (0,61 мл, 3,51 ммоль). Добавляют 2-(трифторметил)бензоилхлорид (388 мкл, 2,63 ммоль) и ДМАП (3 мг, кат.). Реакционную смесь герметизируют. Через 38 дней анализ ТСХ (силикагель, 10% iPrOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (60 мл). Органическую фазу промывают разбавленным водным раствором HCl (2×25 мл), насыщенным водным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 0,84 г твердого вещества светло-оранжевого цвета. Полученный продукт разбавляют DCM и загружают в силикагелевую колонку (24 г) системы очистки ISCO Companion. Отбирают фракции по 14 мл УФ-положительного элюента. Фракции 4-10 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-желтого цвета (0,76 г, 92%).
ПРИМЕР 325
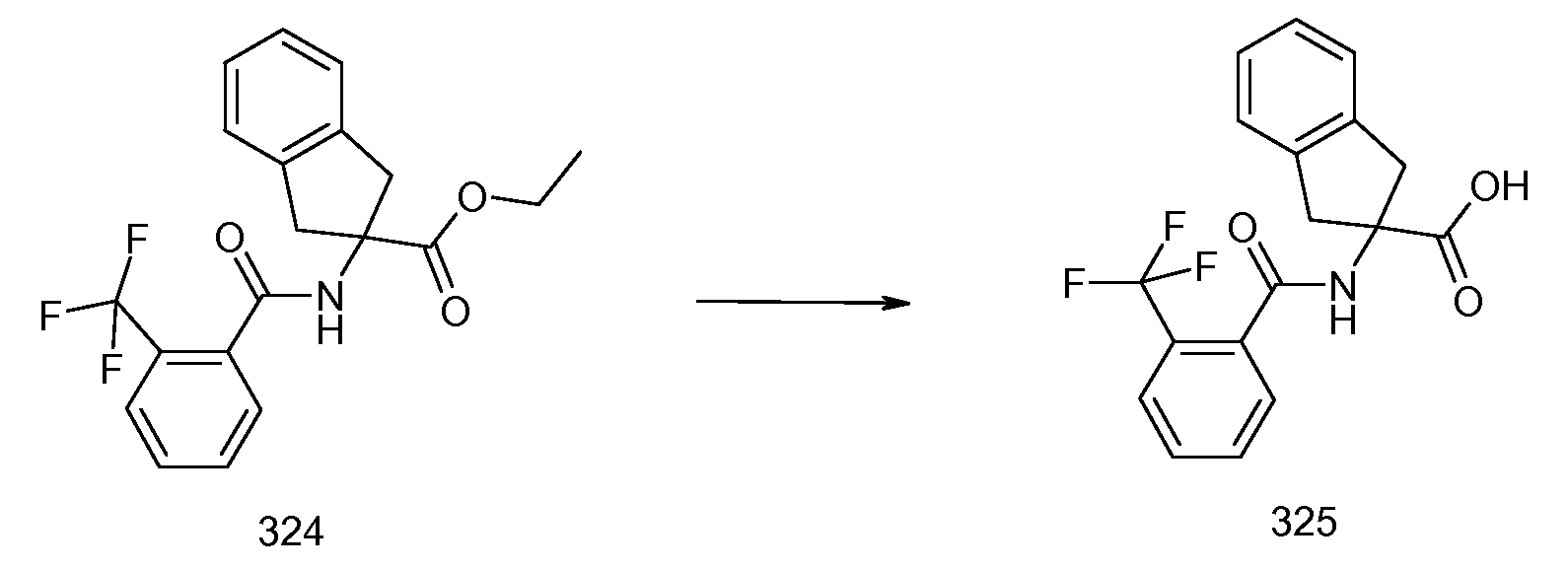
2-(2-Трифторметилбензоиламино)индан-2-карбоновая кислота (325)
В колбу объемом 100 мл, содержащую этиловый эфир 2-(2-трифторметилбензоиламино)индан-2-карбоновой кислоты (324, 0,57 г, 1,51 ммоль), помещают 1,4-диоксан (9 мл) и MeOH (9 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (4,5 мл) и затем моногидрат LiOH (160 мг, 3,81 ммоль). Через 110 часов анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~9 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (40 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические фазы промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество не совсем белого цвета (0,51 г, 97%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,23-3,63 (м, 4H), 7,11-7,23 (м, 4H), 7,47 (д, 1H), 7,60-7,76 (м, 3H), 9,12 (с, 1H), 12,55 (с, 1H)
ЖХ/МС (ES+) m/z=350,11
ПРИМЕР 326
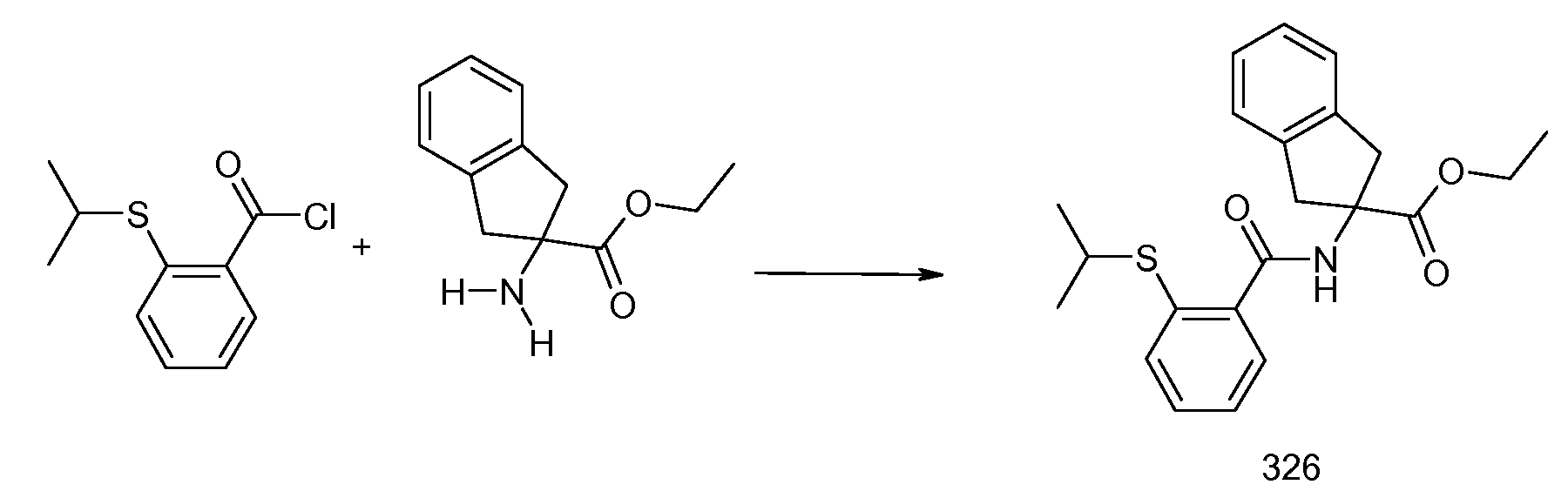
Этиловый эфир 2-(2-изопропилсульфанилбензоиламино)индан-2-карбоновой кислоты (326)
В реакционную колбу объемом 30 мл помещают 2-изопропилсульфанилбензойную кислоту (430 мг, 2,19 ммоль) и сухой DCM (7 мл). Добавляют магнитную мешалку. Начинают перемешивать. После полного растворения добавляют HBTU (831 мг, 2,19 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (450 мг, 2,19 ммоль) и затем DIPEA (0,96 мл, 5,48 ммоль). Реакционную смесь перемешивают в течение 3 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 0,87 г твердого вещества светло-желтого цвета. Данное вещество растворяют в 10 мл DCM. Это вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 32-40 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (0,69 г, 82%).
ПРИМЕР 327
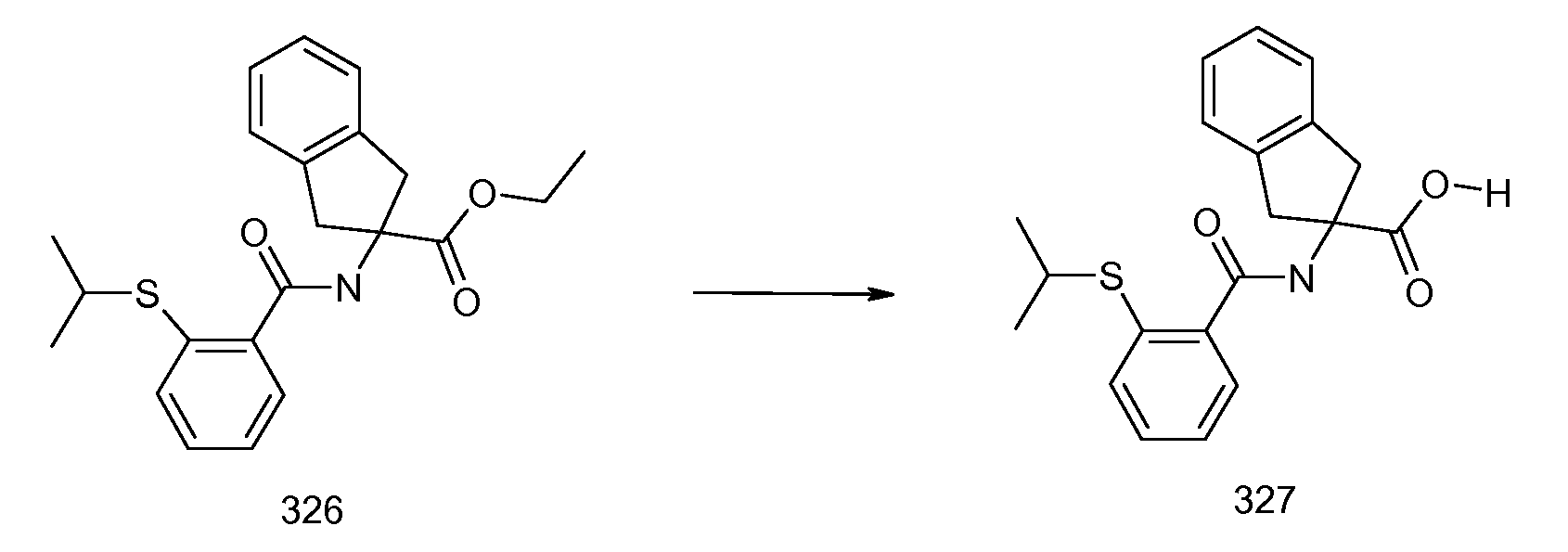
2-(2-Изопропилсульфанилбензоиламино)индан-2-карбоновая кислота (327)
В колбу объемом 100 мл, содержащую этиловый эфир 2-(2-изопропилсульфанилбензоиламино)индан-2-карбоновой кислоты (326, 0,52 г, 1,45 ммоль), помещают 1,4-диоксан (8 мл) и MeOH (8 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (4 мл) и затем моногидрат LiOH (145 мг, 3,46 ммоль). Через 20 дней анализ ТСХ (силикагель, 10% iPrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~9 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (40 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические фазы промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество не совсем белого цвета (0,45 г, 93%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,14 (д, 6H), 3,24-3,623 (м, 5H), 7,12-7,44 (м, 8H), 8,85 (с, 1H), 12,92 (с, 1H)
ЖХ/МС (ES+) m/z=356,15
ПРИМЕР 328
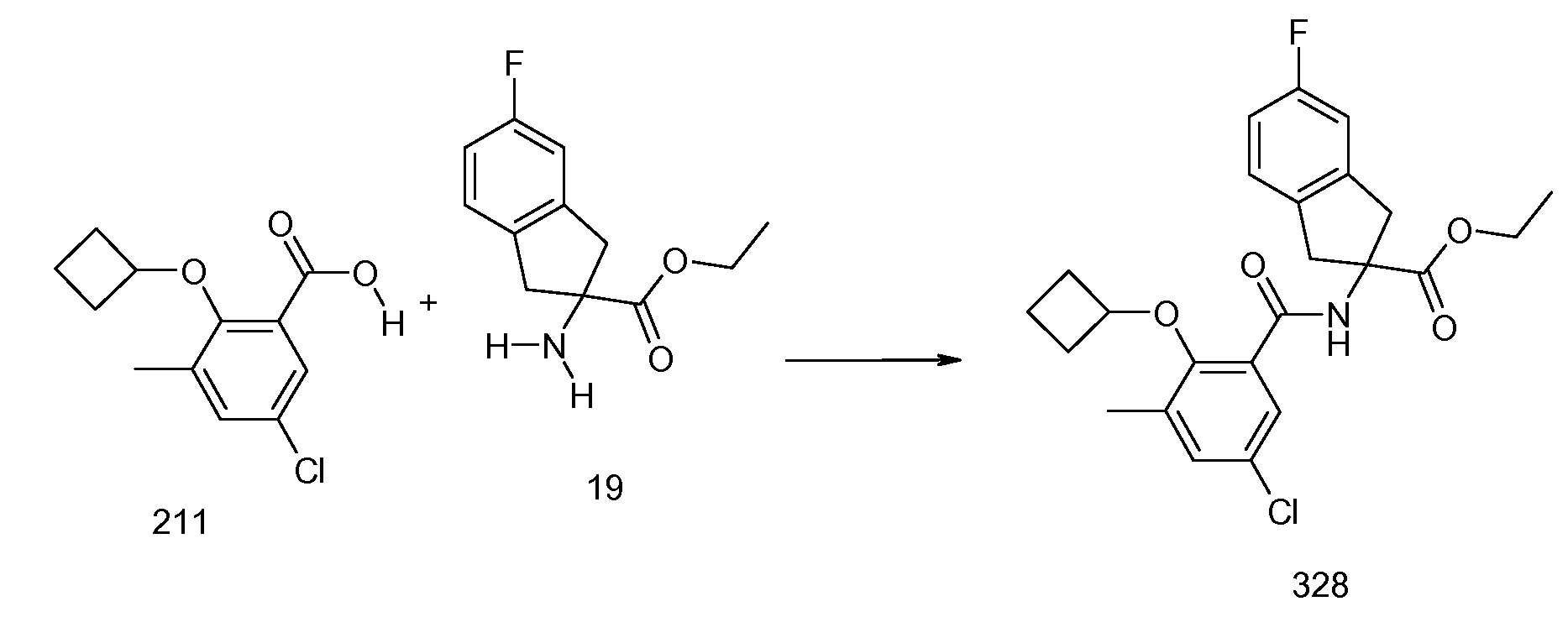
Этиловый эфир 2-(5-хлор-2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (328)
В реакционную колбу объемом 40 мл помещают 2-циклобутокси-3-метил-5-хлорбензойную кислоту (221, 0,40 г, 1,62 ммоль) и сухой DCM (5 мл). Добавляют магнитную мешалку. Начинают перемешивать. После полного растворения добавляют HBTU (630 мг, 1,66 ммоль). Через 5 минут добавляют этиловый эфир 2-амино-5-фториндан-2-карбоновой кислоты (19, 371 мг, 1,66 ммоль) и затем DIPEA (0,74 мл, 4,16 ммоль). Реакционную смесь перемешивают в течение 5 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 20 мл), насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1 г светло-желтого масла. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 24 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 70% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл. Фракции 22-28 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая твердое вещество белого цвета (0,65 г, 88%).
ПРИМЕР 329
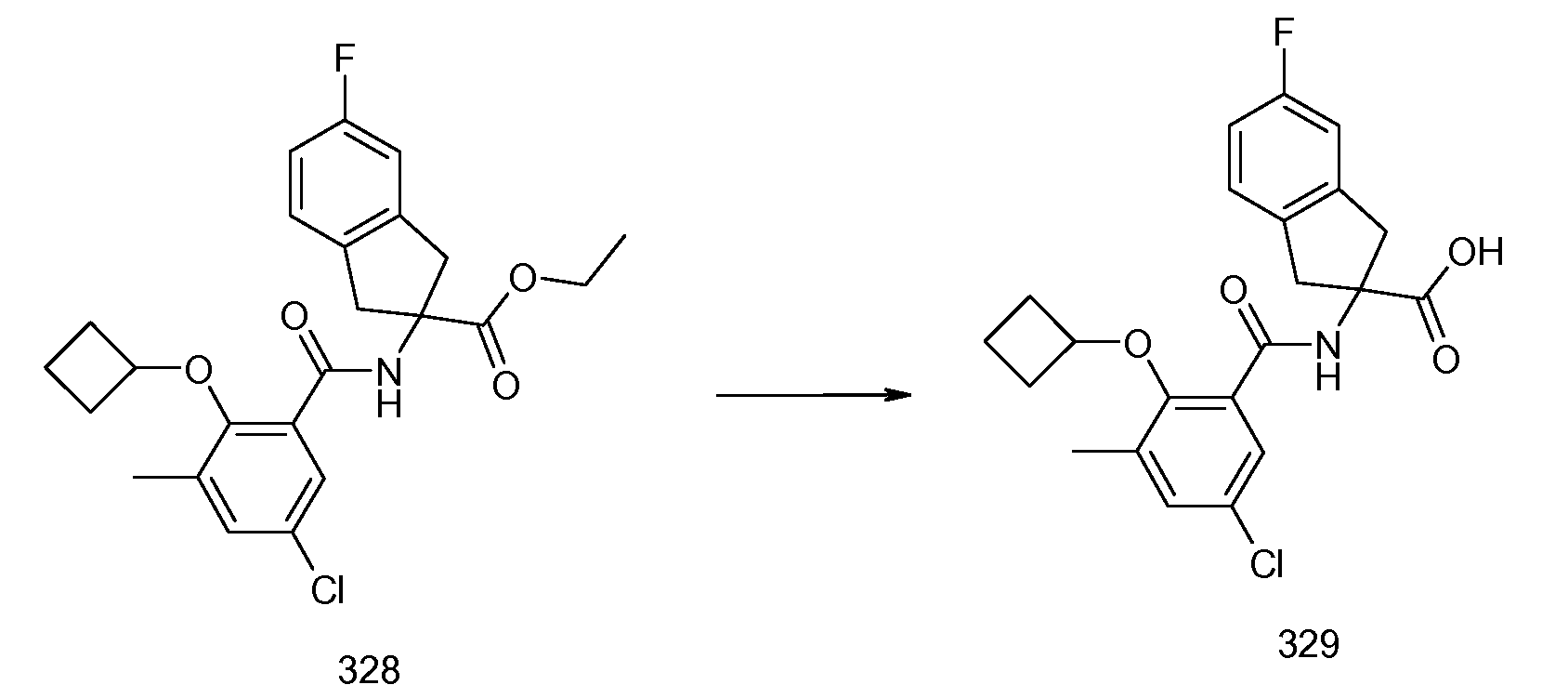
2-(5-Хлор-2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновая кислота (329)
В колбу объемом 100 мл, содержащую этиловый эфир 2-(5-хлор-2-циклобутокси-3-метилбензоиламино)-5-фториндан-2-карбоновой кислоты (328, 0,49 г, 1,09 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем LiOH (117 мг, 2,78 ммоль). Через 1 день анализ ТСХ (силикагель, 10% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~8 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (25 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические фазы промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество белого цвета (0,45 г, 98%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,22-1,37 (м, 1H), 1,43-1,57 (м, 1H), 1,78-1,95 (м, 4H), 2,03 (с, 3H), 3,285-3,63 (м, 5H), 4,37 (м, 1H), 6,98 (м, 1H), 7,06-7,11 (м, 1H), 7,20-7,27 (м, 2H), 7,385 (д, 1H), 8,82 (с, 1H), 12,67 (с, 1H)
ЖХ/МС (ES+) m/z=418,18
ПРИМЕР 330
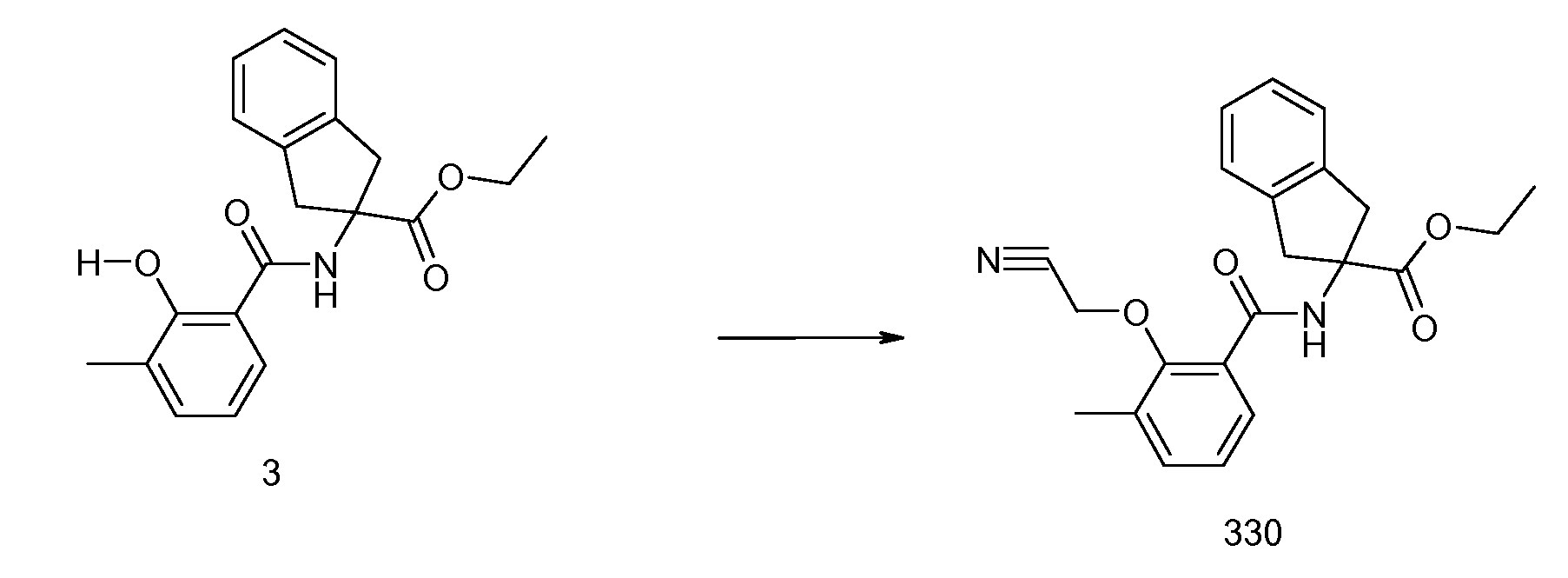
Этиловый эфир 2-(2-цианометокси-3-метилбензоиламино)индан-2-карбоновой кислоты (330)
В реакционную колбу объемом 30 мл помещают этиловый эфир 2-(2-гидрокси-3-метилбензоиламино)индан-2-карбоновой кислоты (3, 400 мг, 1,18 ммоль) и сухой ДМФА (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют последовательно K2SO4 (326 мг, 2,36 ммоль) и бромацетонитрил (164 мкл, 2,36 ммоль). Реакционную колбу закрывают и помещают в нагревательное устройство, расположенное наверху орбитального шейкера. Нагревательное устройство устанавливают на 55°C. Через 16 часов анализ ТСХ (силикагель, 1:1 EtOAc в гептане) показывает, что исходный продукт полностью израсходован. Нагревание прекращают. После отстаивания при комнатной температуре в течение суток содержимое колбы фильтруют через слой целита. Фильтрат переносят в делительную воронку, содержащую EtOAc (40 мл). Слои разделяют. Органическую фазу промывают водой (20 мл), насыщенным водным раствором NaHCO3 и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество темно-коричневого цвета (0,42 г). Данное вещество растворяют в 10 мл DCM. Это вещество очищают на 25 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 4-6 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (0,26 г, 58%).
ПРИМЕР 331
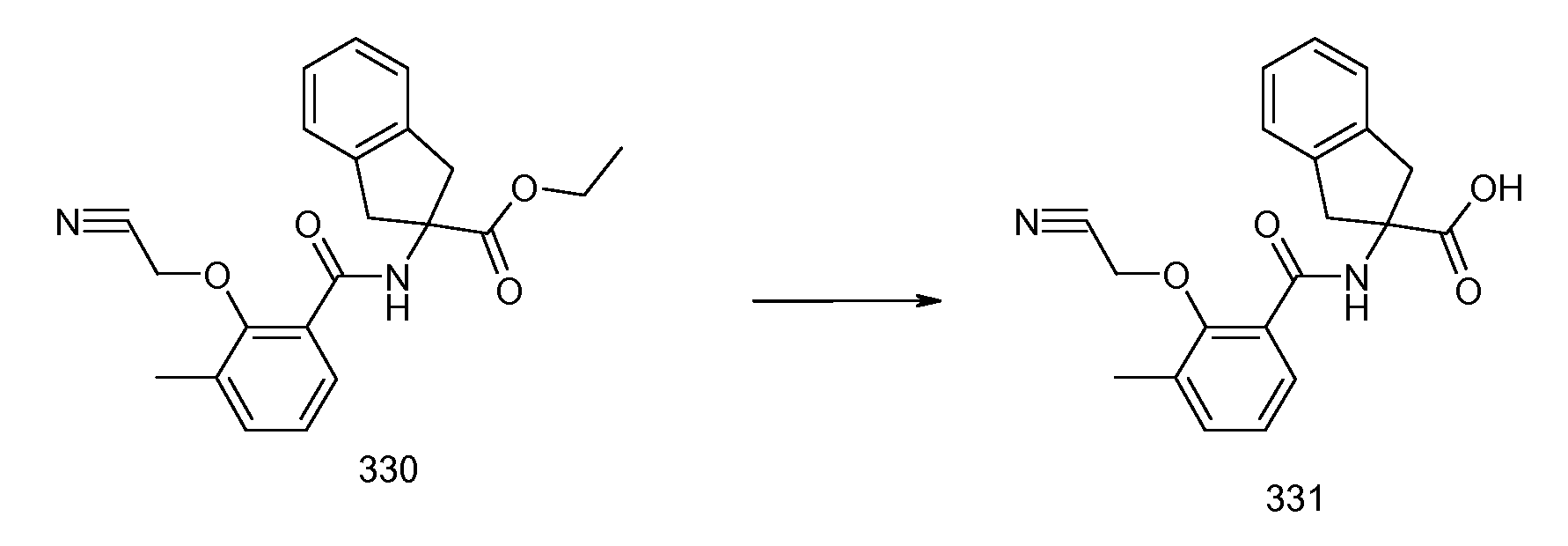
2-(2-Цианометокси-3-метилбензоиламино)индан-2-карбоновая кислота (331)
В колбу объемом 100 мл, содержащую этиловый эфир 2-(2-цианометокси-3-метилбензоиламино)индан-2-карбоновой кислоты (330, 0,25 г, 0,66 ммоль), помещают 1,4-диоксан (2 мл) и MeOH (2 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1 мл) и затем моногидрат LiOH (71 мг, 1,67 ммоль). Через 18 часов анализ ТСХ (силикагель, 5% MeOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~8 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (25 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют откачиванием до постоянного веса, получая твердое вещество белого цвета (0,23 г, 99%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,26-3,63 (м, 4H), 3,43 (с, 3H), 4,56 (с, 2H), 7,07 (дд, 1H), 7,14-7,23 (м, 5H), 7,29 (дд, 1H), 8,81 (с, 1H), 12,55 (уш.с, 1H)
ЖХ/МС (ES+) m/z=351,14
ПРИМЕР 332
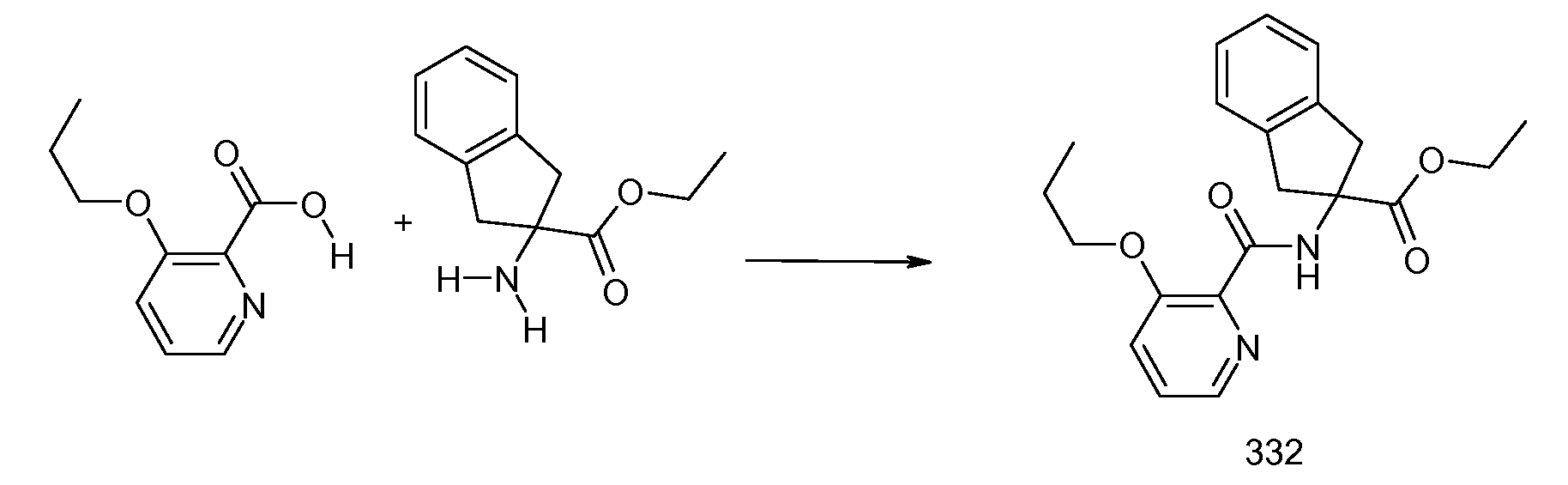
Этиловый эфир 2-[(3-пропоксипиридин-2-карбонил)амино]индан-2-карбоновой кислоты (332)
В реакционную колбу объемом 40 мл, содержащую магнитную мешалку, помещают 3-н-пропоксипиколиновую кислоту (397 мг, 2,19 ммоль) и сухой DCM (6 мл). Начинают перемешивать. Через 2 минуты добавляют HBTU (831 мг, 2,195 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (450 мг, 2,19 ммоль) и затем DIPEA (0,96 мл, 5,48 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 дней анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Смесь последовательно промывают разбавленным водным раствором HCl (3%, 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,23 г твердого вещества светло-оранжевого цвета. Данное вещество растворяют в 10 мл DCM. Это вещество очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 60% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 57-67 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая твердое вещество белого цвета (0,8 г, 99%).
ПРИМЕР 333
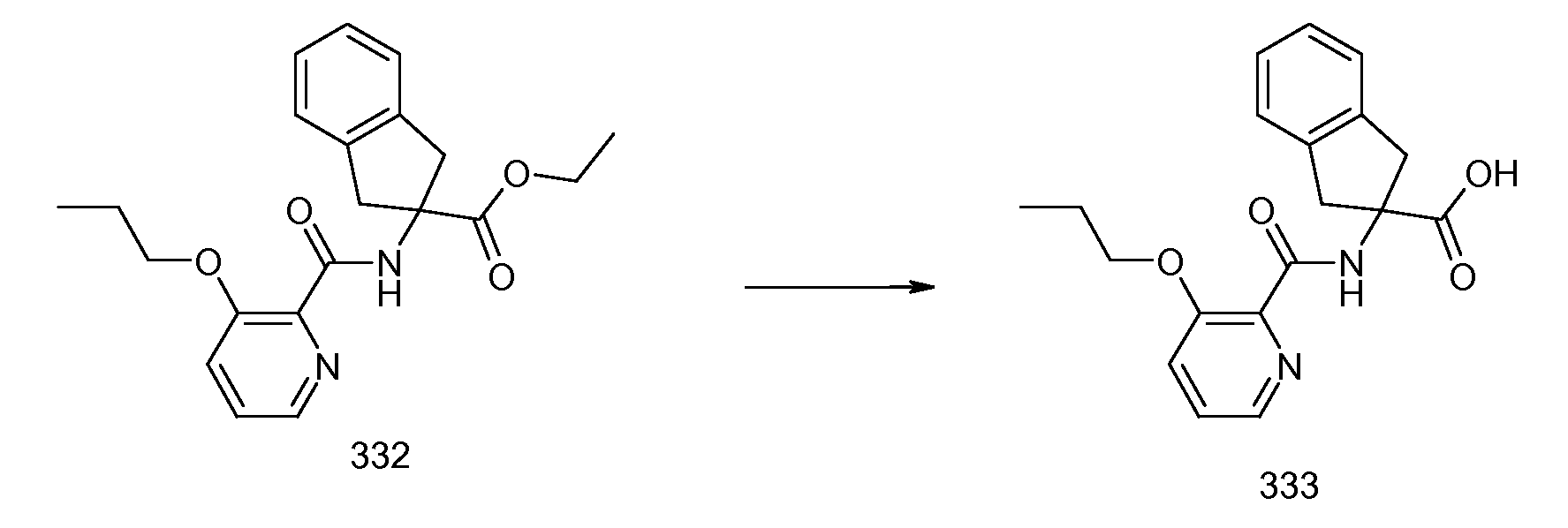
2-[(3-Пропоксипиридин-2-карбонил)амино]индан-2-карбоновая кислота (333)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-[(3-пропоксипиридин-2-карбонил)амино]индан-2-карбоновой кислоты (332, 620 мг, 1,68 ммоль), помещают 1,4-диоксан (6 мл) и MeOH (6 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (3 мл) и затем моногидрат LiOH (178 мг, 4,25 ммоль). По истечении 22 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 125 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 10 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают 0,58 г твердого вещества белого цвета.
1H ЯМР (ДМСО-d6, 300МГц): δ 0,76 (т, 3H), 1,71 (дт, 2H), 3,17-3,53 (м, 4H), 3,98 (т, 2H), 7,03-7,12 (м, 4H), 7,43 (дд, 1H), 7,55 (дд, 1H), 7,43 (дд, 1H), 8,12 (дд, 1H), 8,86 (с, 1H)
ЖХ/МС (ES+) m/z=341,14
ПРИМЕР 334
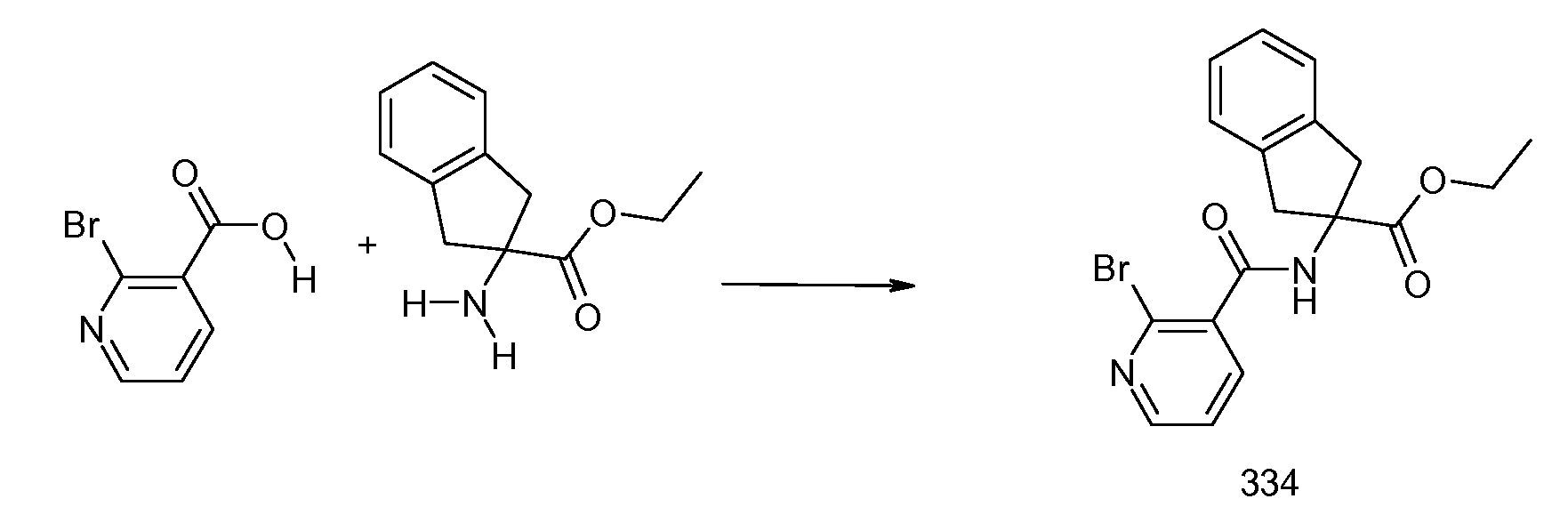
Этиловый эфир 2-[(2-бромпиридинил-3-карбонил)амино]индан-2-карбоновой кислоты (334)
В реакционную колбу объемом 40 мл, содержащую магнитную мешалку, помещают 2-бромникотиновую кислоту (1,18 г, 5,85 ммоль) и сухой DCM (15 мл). Начинают перемешивать. Через 2 минуты добавляют HBTU (2,22 г, 5,85 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1,2 г, 5,25 ммоль) и затем DIPEA (2,55 мл, 14,62 ммоль). Реакционную смесь перемешивают в течение 32 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Данную смесь последовательно промывают водой (3%, 25 мл), насыщенным водным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 3,1 г твердого вещества светло-оранжевого цвета. Данный продукт растворяют в 15 мл DCM. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 5% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 60% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 17 мл элюента. Фракции 30-43 объединяют и выпаривают в вакууме, получая твердое вещество белого цвета (1,62 г, 72%).
ПРИМЕР 335
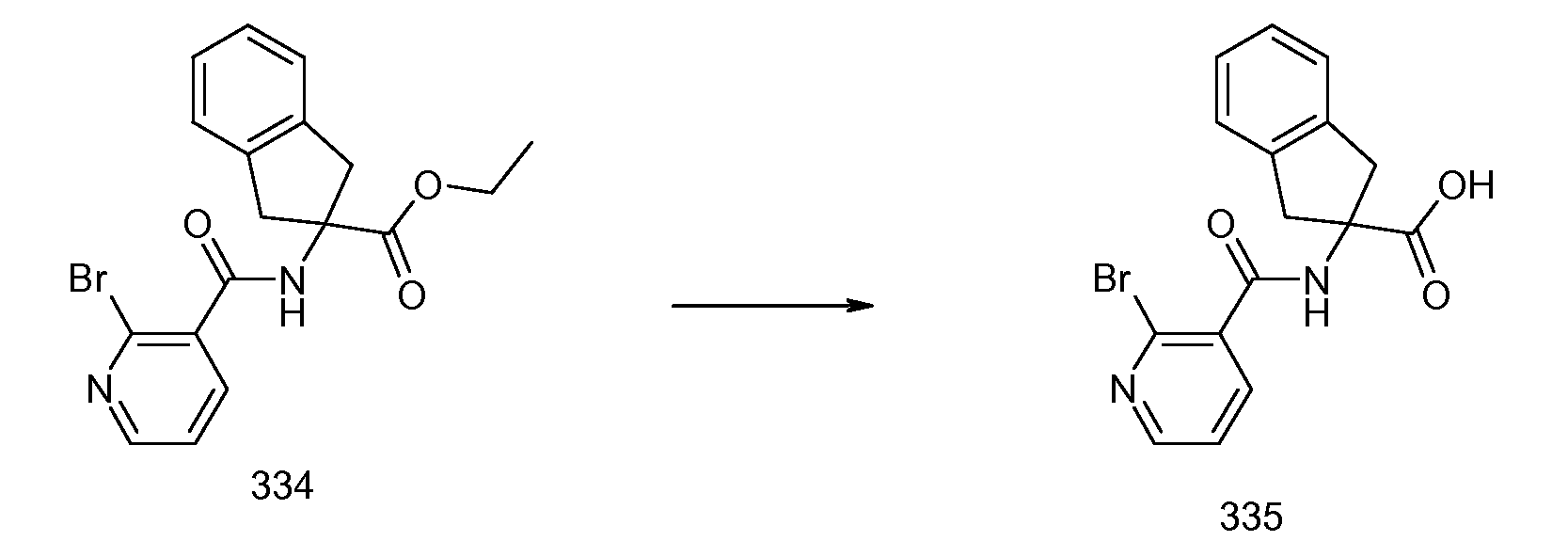
2-[(2-Бромпиридинил-3-карбонил)амино]индан-2-карбоновая кислота (335)
В круглодонную колбу объемом 50 мл, содержащую этиловый эфир 2-[(2-бромпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (335, 356 мг, 0,92 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем LiOH (97 мг, 2,31 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 6 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,32 г, 97%).
1H ЯМР (ДМСО-d6, 300МГц): δ 3,23-3,53 (м, 4H), 7,03-7,18 (м, 4H), 7,49 (дд, 1H), 7,86 (дд, 1H), 8,40-8,51 (м, 2H)
ЖХ/МС (ES+) m/z=361,02
ПРИМЕР 336
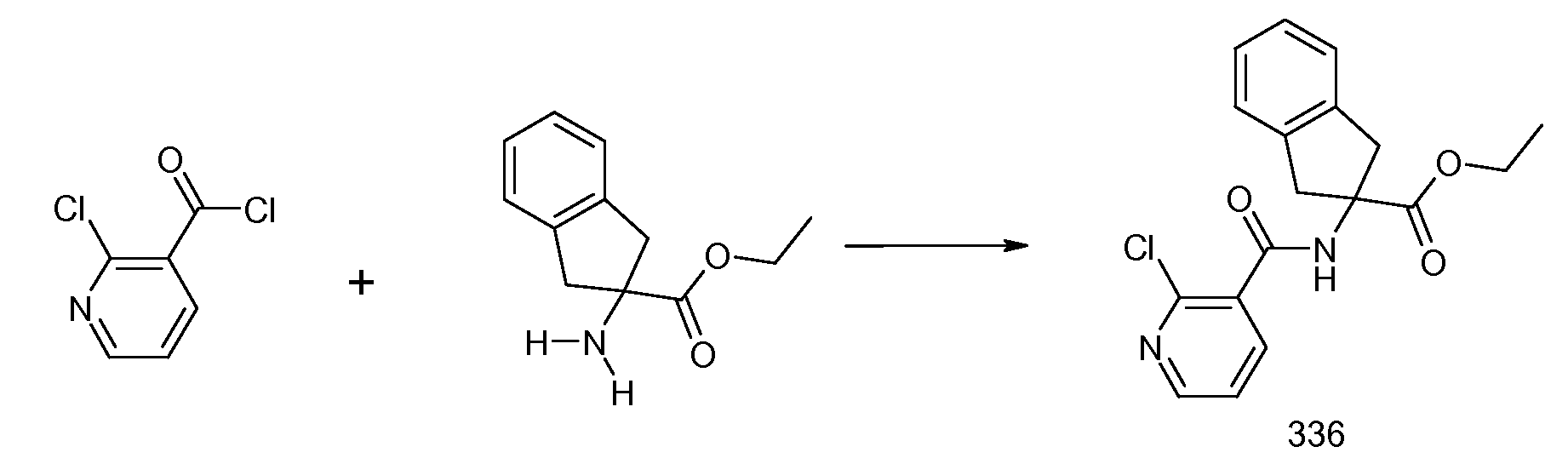
Этиловый эфир 2-[(2-хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (336)
В круглодонную колбу объемом 100 мл помещают 2-аминоиндан-2-карбоновую кислоту (1,5 г, 7,31 ммоль) и сухой DCM (15 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют DIPEA (2 мл, 11,69 ммоль). Добавляют 2-хлорникотиноилхлорид (1,54 г, 8,77 ммоль) и ДМАП (8 мг, кат.). Реакционную смесь герметизируют. Через 2 дня анализ ТСХ (силикагель, 10% iPrOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (60 мл). Смесь промывают водой (2×25 мл), насыщенным водным раствором NaHCO3 (2×25 мл), насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 2,15 г твердого вещества не совсем белого цвета. Полученное вещество растворяют в DCM (20 мл) и загружают в силикагелевую колонку (80 г) системы очистки ISCO Companion. Колонку элюируют 10% EtOAc в гептане, пропуская через 3 объема колонки, после чего линейный градиент 75% EtOAc в гептане пропускают через 12 объемов колонки. Отбирают фракции по 17 мл УФ-положительного элюента. Фракции 14-20 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-желтого цвета (2 г, 79%).
ПРИМЕР 337
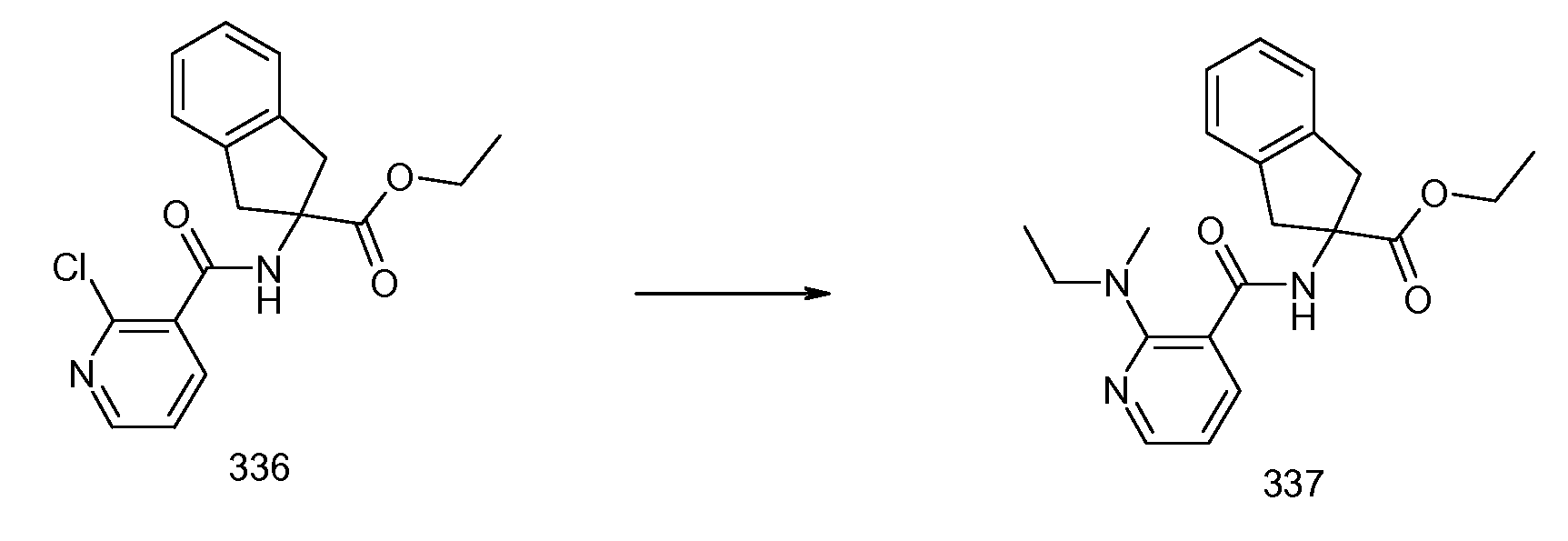
Этиловый эфир 2-{[2-(этилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (337)
В реакционный сосуд для микроволновой обработки объемом 25 мл помещают этиловый эфир 2-[(2-хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (336, 400 мг, 1,16 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют DIPEA (2,1 мл, 11,6 ммоль) и N-метилизопропиламин (1,2 мл, 11,6 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционный сосуд помещают в масляную баню, которую нагревают до 80°C. Через 6 дней анализ ТСХ (силикагель, 2:1 EtOAc/гептан) показывает, что исходный продукт израсходован, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 0,78 г вязкого масла желтого цвета. Продукт растворяют в DCM (10 мл) и помещают в колонку для хроматографии ISCO (силикагель, 40 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 4-13 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество не совсем белого цвета (0,41 г, 93%).
ПРИМЕР 338
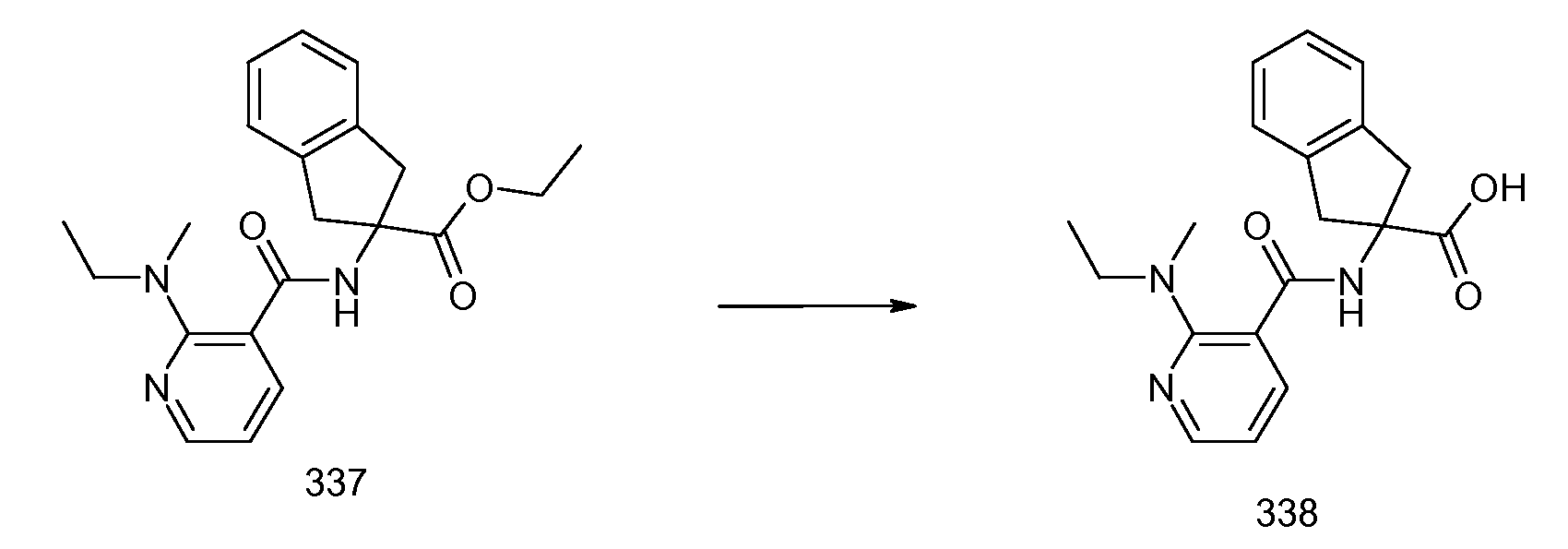
2-{[2-(Этилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота (338)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[2-(этилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (337, 650 мг, 1,77 ммоль), помещают 1,4-диоксан (10 мл) и MeOH (10 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (5 мл) и затем моногидрат LiOH (187 мг, 4,46 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (1 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 18 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют при пониженном давлении. Данный процесс повторяют 1 раз. Откачиванием до постоянного веса получают твердое вещество бежевого цвета (0,58 г, 97%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,07 (т, 3H), 3,18-3,48 (м, 4H), 3,37 (кв, 2H), 6,75 (дд, 1H), 7,03-7,13 (м, 4H), 7,63 (дд, 1H), 8,15 (дд, 1H), 8,77 (с, 1H)
ЖХ/МС (ES+) m/z=340,17
ПРИМЕР 339
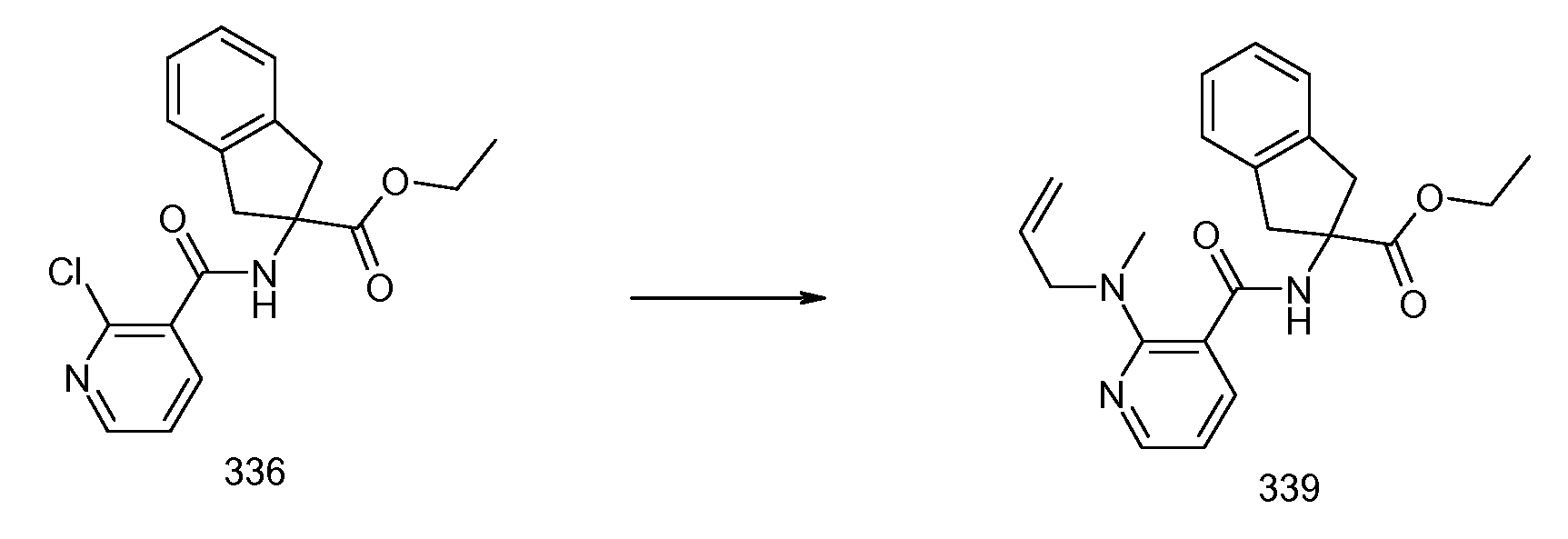
Этиловый эфир 2-{[2-(аллилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (339)
В реакционный сосуд для микроволновой обработки объемом 25 мл помещают этиловый эфир 2-[(2-хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (336, 400 мг, 1,16 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют DIPEA (2,1 мл, 11,6 ммоль) и N-аллилметиламин (1,1 мл, 11,6 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционный сосуд помещают в масляную баню, которую нагревают до 80°C. Через 21 день анализ ТСХ (силикагель, 2:1 EtOAc:гептан) показывает, что исходный продукт израсходован, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 0,85 г продукта темно-коричневого цвета. Этот продукт растворяют в DCM и помещают в колонку для хроматографии ISCO (силикагель, 25 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 2-8 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество не совсем белого цвета (0,43 г, 98%).
ПРИМЕР 340
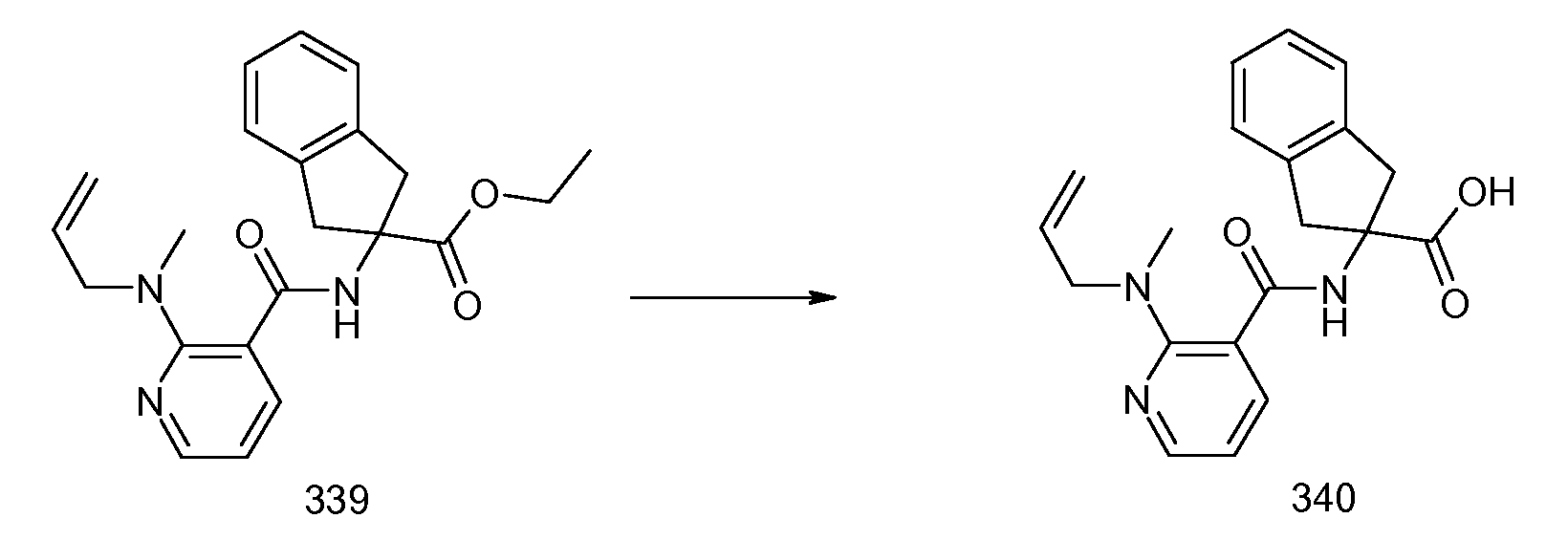
2-{[2-(Аллилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота (340)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[2-(аллилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (339, 280 мг, 0,74 ммоль), помещают 1,4-диоксан (2 мл) и MeOH (2 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1 мл) и затем моногидрат LiOH (78 мг, 1,86 ммоль). По истечении 38 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 15 дней содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,26 г, 100%).
1H ЯМР (ДМСО-d6, 300МГц): δ 2,82 (с, 3H), 3,18-3,48 (м, 4H), 3,92 (дд,2H), 5,04-5,22 (м, 2H), 5,86-6,02 (м, 1H), 6,79 (дд, 1H), 7,04-7,11 (м, 4H), 7,67 (дд, 1H), 8,16 (дд, 1H), 8,77 (с, 1H)
ЖХ/МС (ES+) m/z=352,20
ПРИМЕР 341
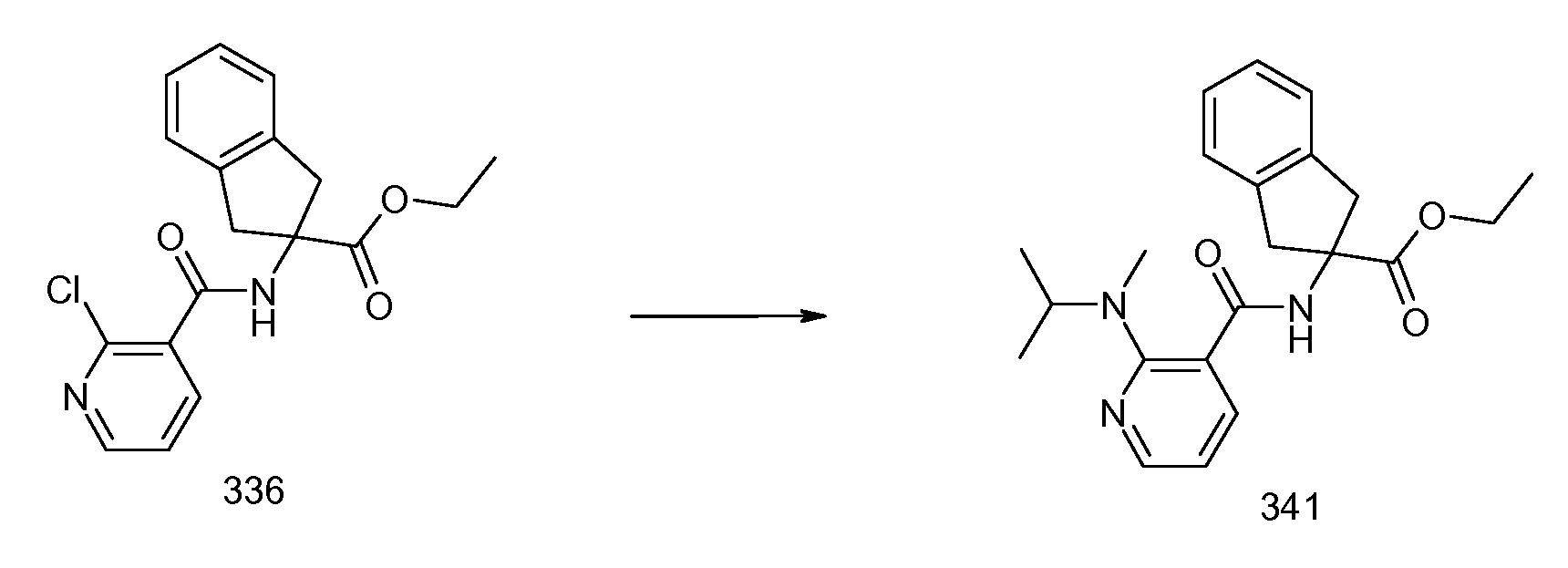
Этиловый эфир 2-{[2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (341)
В реакционный сосуд для микроволновой обработки объемом 25 мл помещают этиловый эфир 2-[2-(хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (341, 400 мг, 1,16 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют DIPEA (2,1 мл, 11,6 ммоль) и N-метилэтиламин (1,2 мл, 11,6 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционный сосуд помещают в масляную баню, которую нагревают до 80°C. Через 6 дней анализ ТСХ (силикагель, 2:1 EtOAc/гептан) показывает, что исходный продукт израсходован, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 0,78 г вязкого желтого масла. Этот продукт растворяют в DCM и помещают в колонку для хроматографии ISCO (силикагель, 40 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 4-13 объединяют и выпаривают при откачивании до постоянного веса, получая 0,41 г твердого вещества не совсем белого цвета.
ПРИМЕР 342
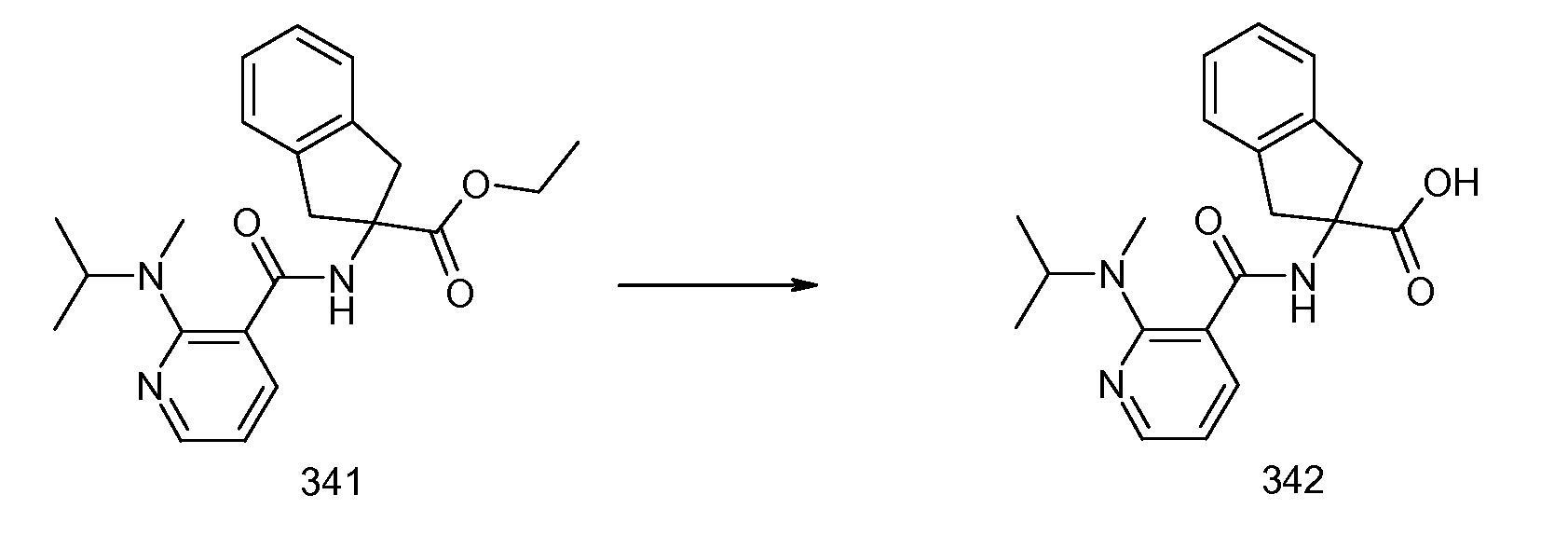
2-{[2-(Изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота (342)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (341, 220 мг, 0,58 ммоль), помещают 1,4-диоксан (2 мл) и MeOH (2 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1 мл) и затем моногидрат LiOH (61 мг, 1,46 ммоль). По истечении 16 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 4 дня содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,2 г, 98%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 1,15 (д, 6H), 2,48 (с, 3H), 3,18-3,42 (м, 4H), 4,18 (септет, 1H), 6,78 (дд, 1H), 7,05-7,12 (м, 4H), 7,67 (дд, 1H), 8,16 (дд, 1H), 8,81 (с, 1H)
ЖХ/МС (ES+) m/z=354,17
ПРИМЕР 343
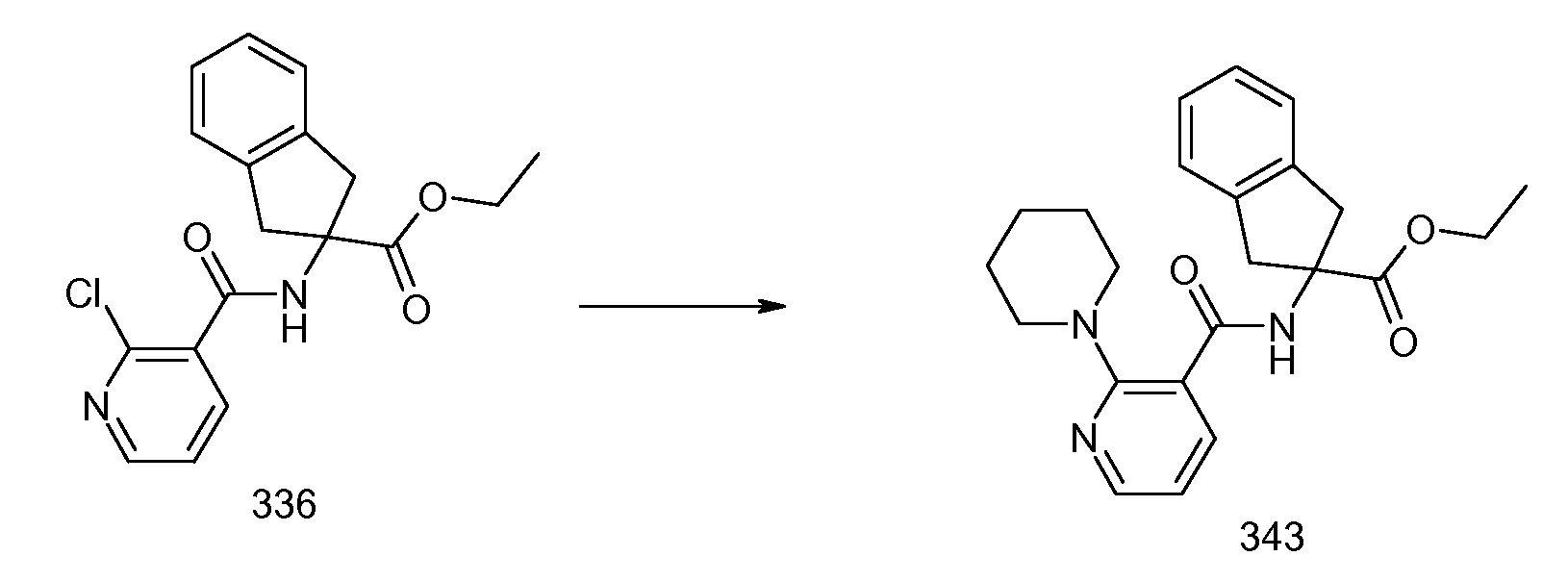
Этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-3'-карбонил)амино]индан-2-карбоновой кислоты (343)
В реакционный сосуд для микроволновой обработки объемом 25 мл помещают этиловый эфир 2-[2-(хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (336, 400 мг, 1,16 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют DIPEA (2,1 мл, 11,6 ммоль) и N-метилизопропиламин (1,2 мл, 11,6 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционный сосуд помещают в масляную баню, которую нагревают до 80°C. Через 6 дней анализ ТСХ (силикагель, 2:1 EtOAc:гептан) показывает, что исходный продукт израсходован, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 0,78 г вязкого желтого масла. Этот продукт растворяют в DCM и помещают в колонку для хроматографии ISCO (силикагель, 40 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 4-13 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество не совсем белого цвета (0,41 г, 90%).
ПРИМЕР 344
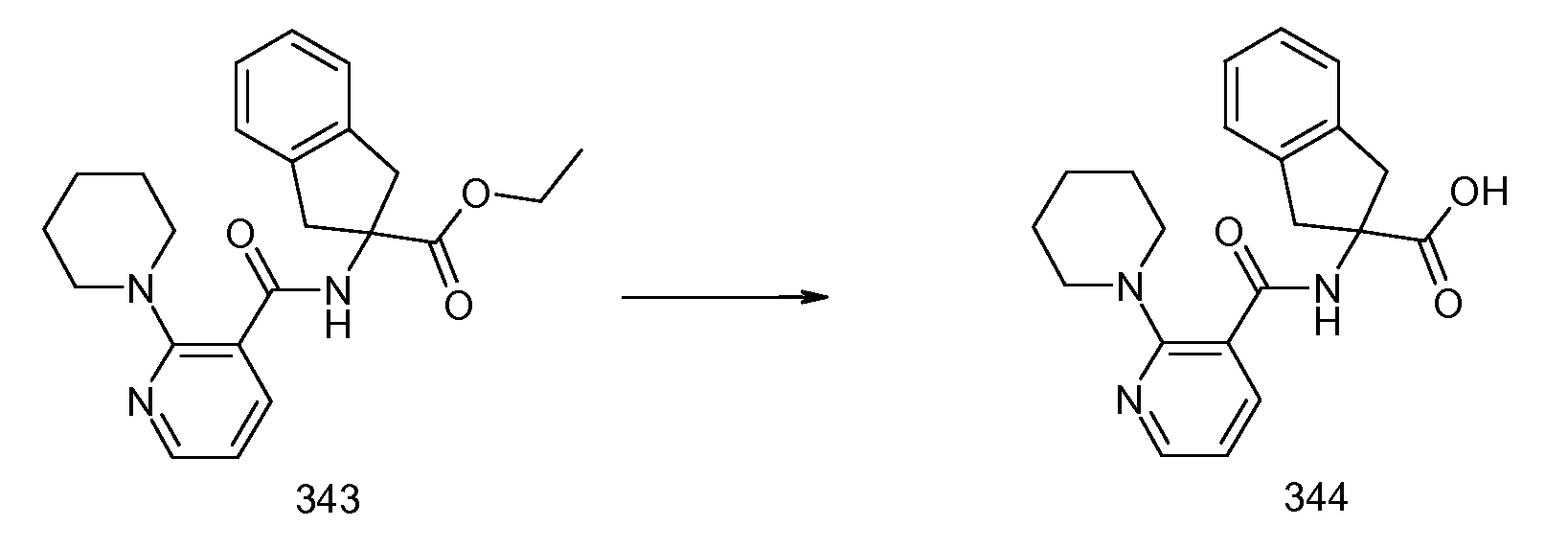
2-[(3,4,5,6-Тетрагидро-2H-[1,2']бипиридинил-3'-карбонил)амино]индан-2-карбоновая кислота (344)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-3'-карбонил)амино]индан-2-карбоновой кислоты (343, 330 мг, 0,84 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем моногидрат LiOH (89 мг, 2,12 ммоль). По истечении 62 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 38 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают 0,3 г твердого вещества белого цвета.
1H ЯМР (ДМСО-d6, 300МГц): δ 1,52 (м, 2H), 1,76 (м, 4H), 3,13 (м, 4H), 3,18-3,43 (м, 4H), 3,92 (дд, 2H), 6,94 (дд, 1H), 7,05-7,12 (м, 4H), 7,81 (дд, 1H), 8,24 (дд, 1H), 9,35 (с, 1H)
ЖХ/МС (ES+) m/z=366,17
ПРИМЕР 345
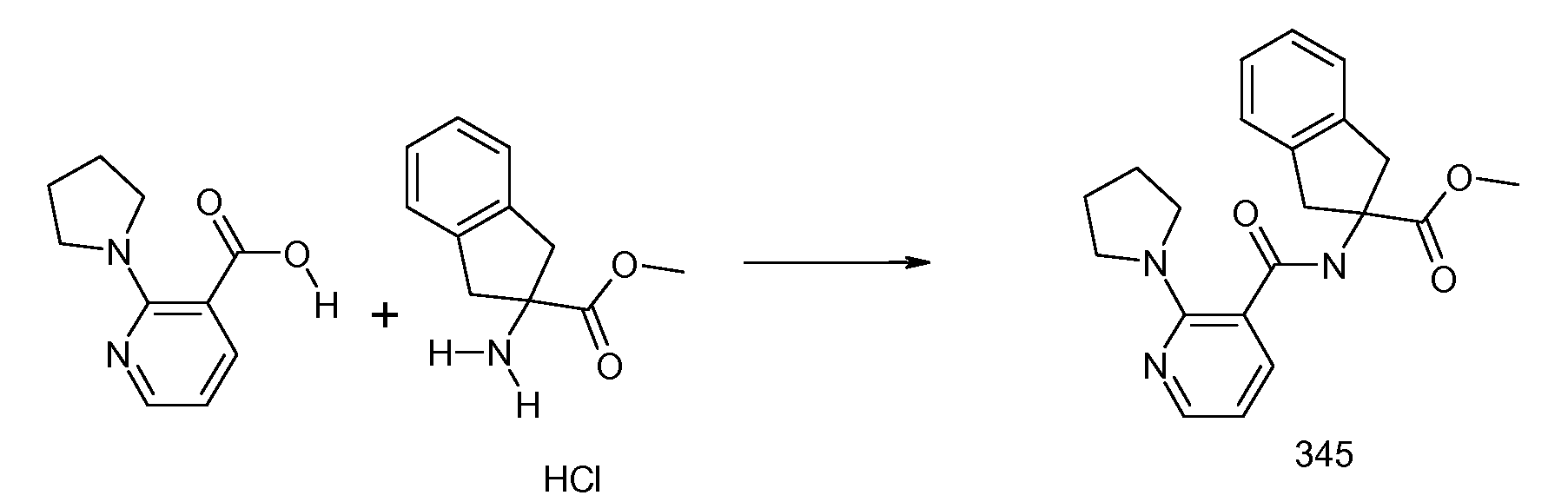
Метиловый эфир 2-[(2-пирролидин-1-ил-3-карбонил)амино]индан-2-карбоновой кислоты (345)
В реакционную колбу объемом 40 мл, содержащую магнитную мешалку, помещают 2-(1-пирролидинил)никотиновую кислоту (422 мг, 2,2 ммоль) и сухой DCM (6 мл). Начинают перемешивать. Через 2 минуты добавляют HBTU (833 мг, 2,2 ммоль). Через 5 минут добавляют соль HCl метилового эфира 2-аминоиндан-2-карбоновой кислоты (0,5 г, 2,2 ммоль), а затем DIPEA (1,17 мл, 6,7 ммоль). Реакционную колбу закрывают и перемешивают при комнатной температуре. По истечении 18 часов анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Смесь последовательно промывают водой (3%, 25 мл), насыщенным водным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,05 г твердого вещества светло-желтого цвета. Данный продукт растворяют в 10 мл DCM. Этот продукт очищают на 24 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 5% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 60% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 6-12 объединяют и выпаривают в вакууме, получая твердое вещество белого цвета (0,73 г, 91%).
ПРИМЕР 346
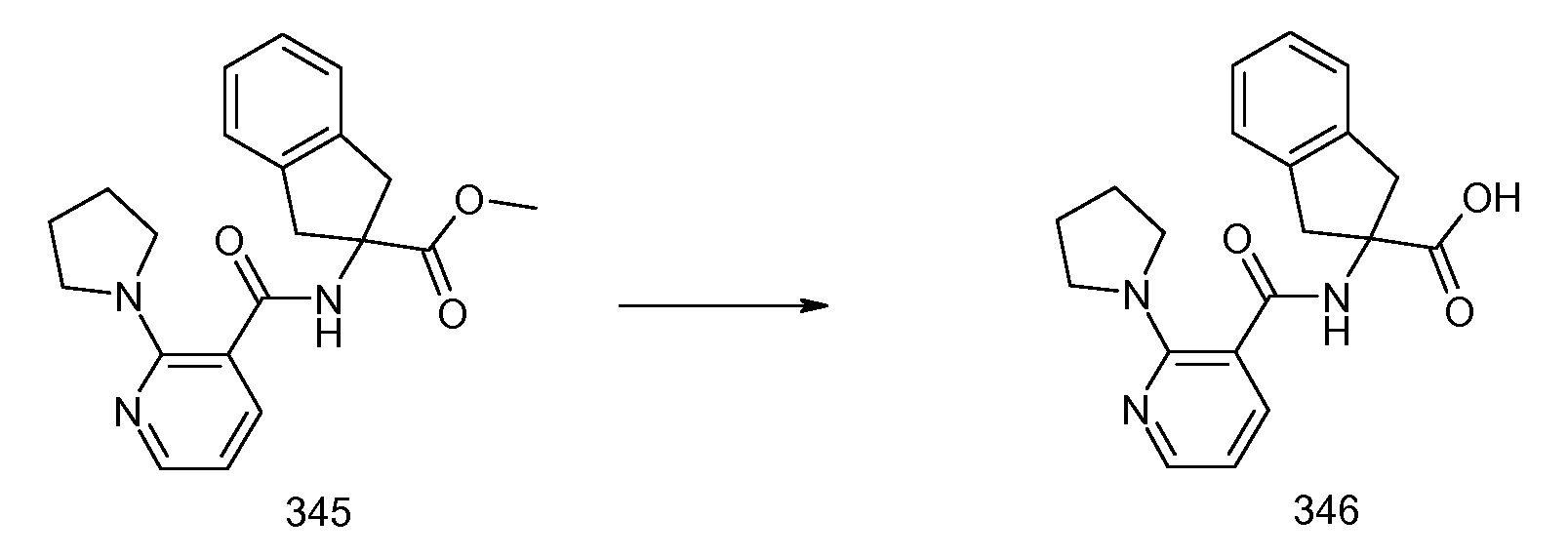
2-[(2-Пирролидин-1-ил-3-карбонил)амино]индан-2-карбоновая кислота (346)
В круглодонную колбу объемом 100 мл, содержащую метиловый эфир 2-[(2-пирролидин-1-ил-3-карбонил)амино]индан-2-карбоновой кислоты (345, 440 мг, 1,20 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем моногидрат LiOH (128 мг, 3,05 ммоль). По истечении 30 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 18 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают 0,38 г твердого вещества белого цвета.
1H ЯМР (ДМСО-d6, 300МГц): δ 1,82 (м, 4H), 3,21-3,48 (м, 8H), 3,92 (дд, 2H), 6,59 (дд, 1H), 7,04-7,11 (м, 4H), 7,46 (дд, 1H), 8,08 (дд, 1H), 8,22 (уш.с, 1H)
ЖХ/МС (ES+) m/z=352,14
ПРИМЕР 347
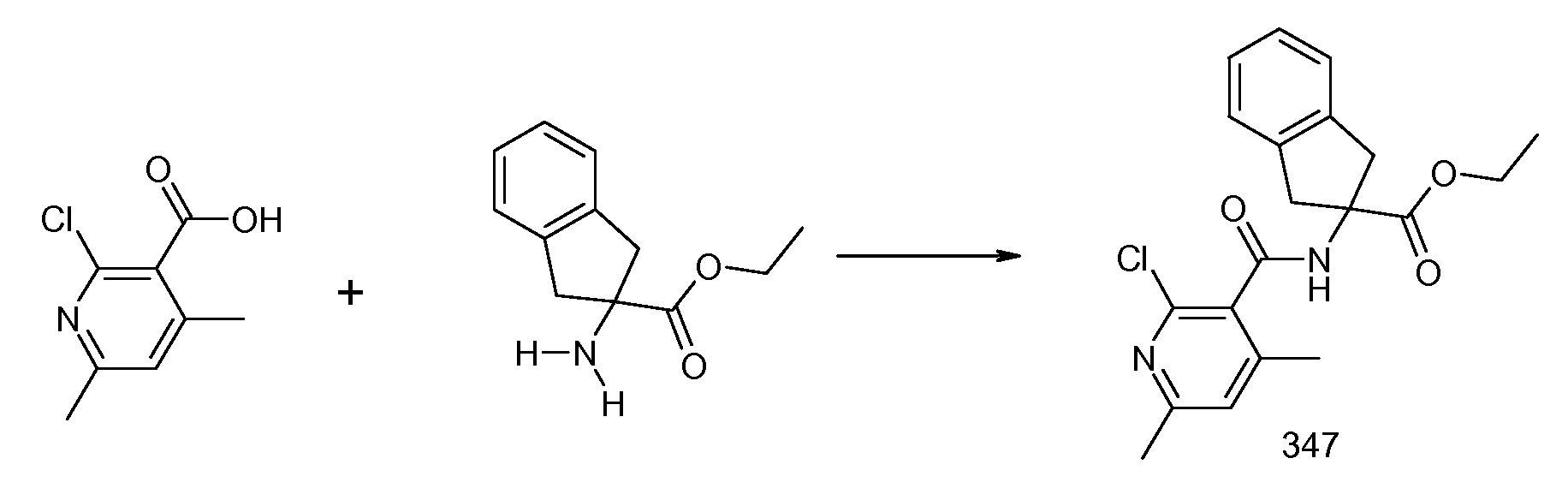
Этиловый эфир 2-[(2-хлор-4,6-диметилпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (347)
В колбу объемом 40 мл помещают 2-хлор-4,6-диметилникотиновую кислоту (497 мг, 2,68 ммоль) и сухой DCM (9 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 2 минуты добавляют HBTU (1,02 г, 2,68 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (550 мг, 2,68 ммоль) и затем DIPEA (1,2 мл, 6,74 ммоль). Реакционную смесь перемешивают в течение 14 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 15% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (70 мл). Смесь промывают разбавленным водным раствором HCl (3%, 2×30 мл), насыщенным водным раствором NaHCO3 (2×30 мл) и насыщенным раствором соли (30 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,6 г желтой пены. Данный продукт растворяют в 15 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 10 объемов колонки. Отбирают фракции по 27 мл УФ-активного элюента. Фракции 32-40 объединяют и выпаривают в вакууме, получая полутвердое вещество желтого цвета (0,67 г, 67%).
ПРИМЕР 348
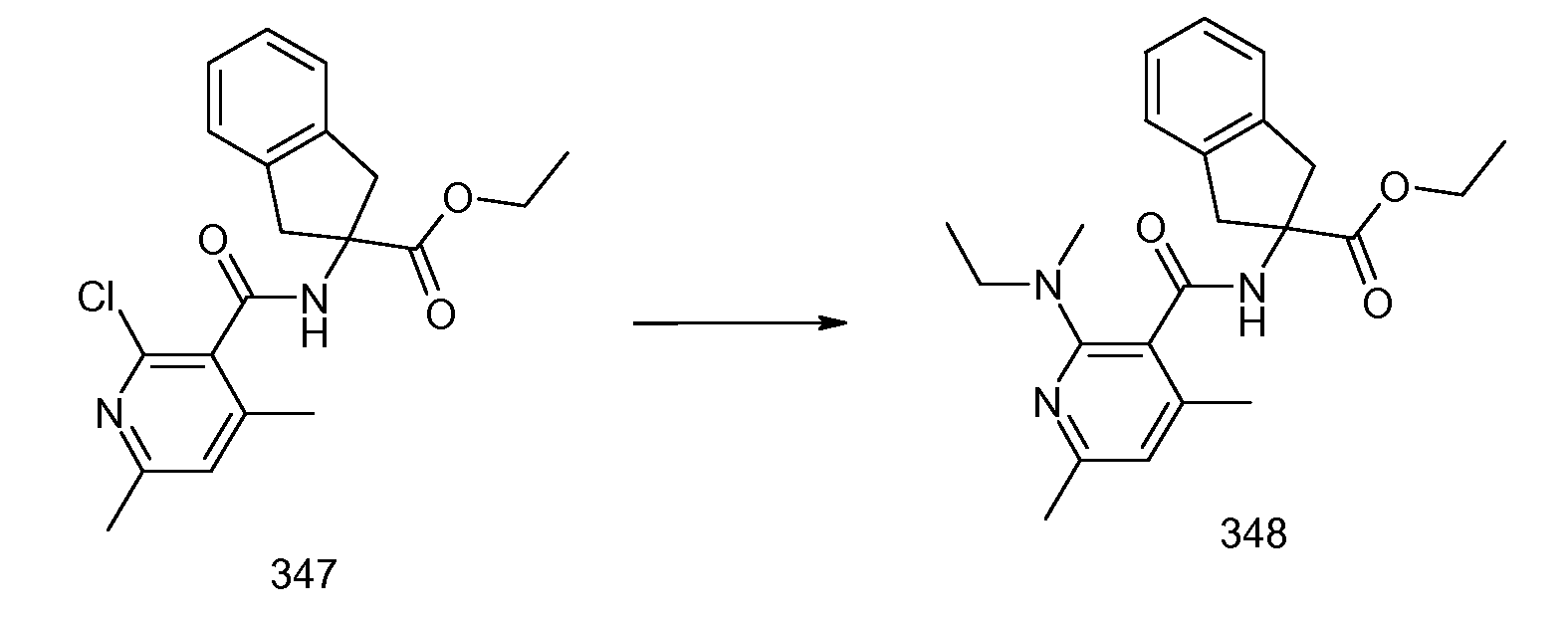
Этиловый эфир 2-{[2-(этилметиламино)-4,6-диметилпиридин-3-карбонил]амино}индан-2-карбоновой кислоты (348)
В реакционный сосуд для микроволновой обработки объемом 25 мл помещают этиловый эфир 2-[2-(хлор-4,6-диметилпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (347, 480 мг, 1,29 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют N-этилметиламин (2 мл, 23,28 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционный сосуд помещают в микроволновый аппарат Smith Optimizer. После предварительного перемешивания в течение 20 секунд смесь нагревают до 100°C. Время выдерживания устанавливают на 18 минут. Анализ ТСХ (силикагель, 2:1 EtOAc:гептан) показывает, что появляется новая точка с более высоким значением Rf, как свидетельствует УФ-анализ. Исходный продукт продолжает присутствовать. Добавляют N-этилметиламин (506 мкл, 5,89 ммоль). Реакционный сосуд герметично закрывают обжимной крышкой. Реакционную колбу погружают в масляную баню, которую нагревают до 80°C. Через 5 дней анализ ТСХ (силикагель, 2:1 EtOAc/гептан) показывает, что исходный продукт обращен в более высокую перемещающуюся точку, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 1,3 г вязкого желтого масла. Продукт растворяют в DCM (10 мл) и помещают в колонку для хроматографии ISCO (силикагель, 40 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 4-9 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,41 г, 83%).
ПРИМЕР 349
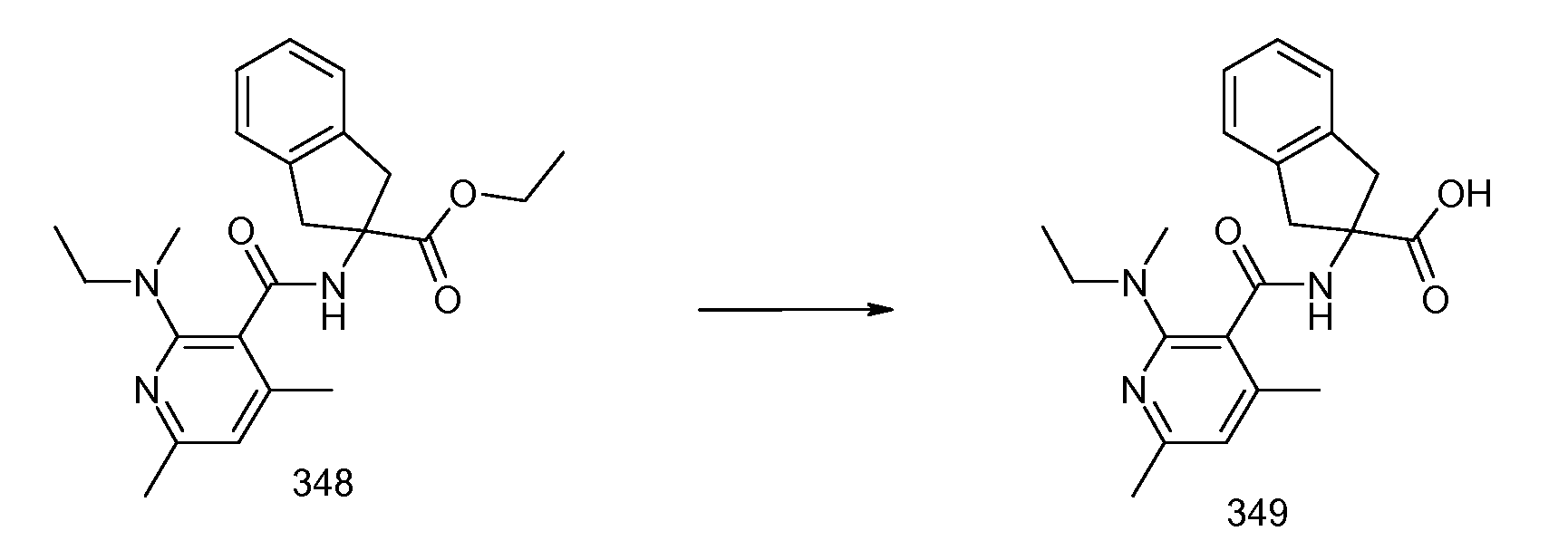
2-{[2-(Этилметиламино)-4,6-диметилпиридин-3-карбонил]амино}индан-2-карбоновая кислота (349)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[2-(этилметиламино)-4,6-диметилпиридин-3-карбонил]амино}индан-2-карбоновой кислоты (348, 260 мг, 0,66 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем моногидрат LiOH (70 мг, 1,66 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 38 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,18 г, 75%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,03 (т, 3H), 3,17-3,53 (м, 6H), 6,41 (с, 1H), 7,05-7,12 (м, 4H), 8,05 (с, 1H)
ЖХ/МС (ES+) m/z=368,25
ПРИМЕР 350
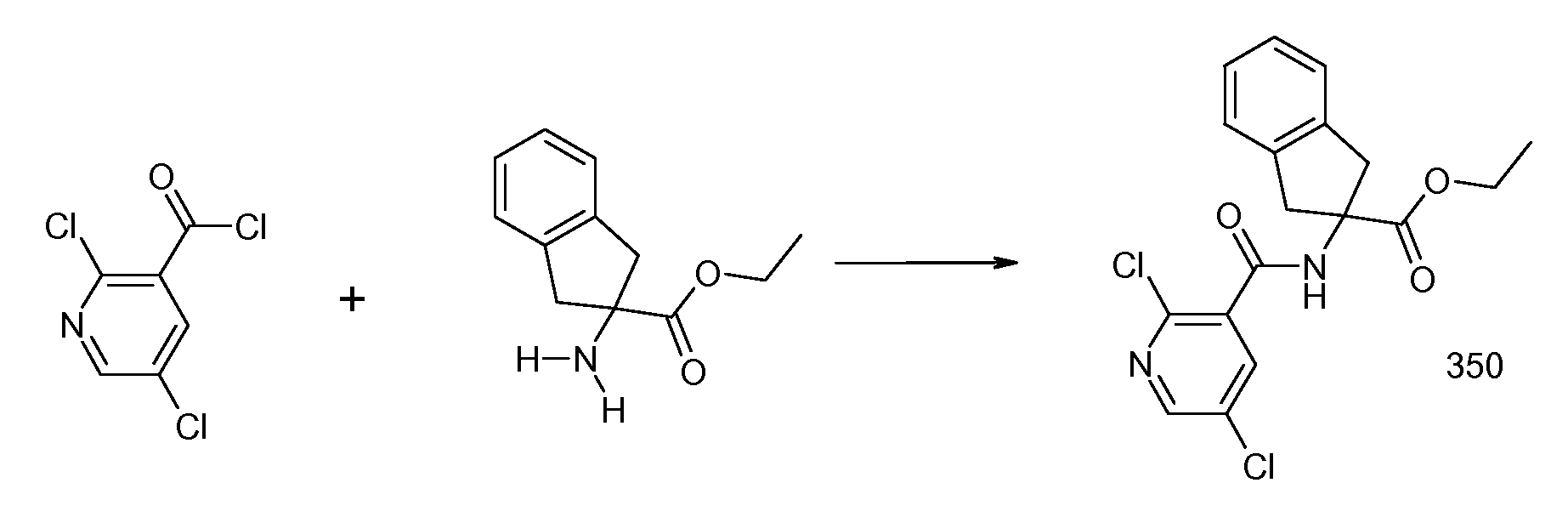
Этиловый эфир 2-[(2,5-дихлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (350)
В реакционную колбу объемом 30 мл помещают этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1 г, 4,87 ммоль) и сухой DCM (5 мл). Добавляют магнитную мешалку и начинают перемешивать. Добавляют DIPEA (1,35 мл, 7,8 ммоль). Добавляют 2,5-дихлорпиридин-3-карбонилхлорид (1,23 г, 5,85 ммоль) и ДМАП (8 мг, кат.). Реакционную смесь герметизируют. Через 57 дней анализ ТСХ (силикагель, 10% iPrOH/DCM) показывает, что исходный продукт полностью израсходован. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (60 мл). Смесь промывают водой (2×25 мл), насыщенным водным раствором NaHCO3 (2×25 мл), насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая 1,99 г твердого вещества не совсем белого цвета. Полученный продукт растворяют в DCM (20 мл) и загружают в силикагелевую колонку (80 г) системы очистки ISCO Companion. Колонку элюируют 5% EtOAc в гептане, пропуская через 3 объема колонки, после чего линейный градиент 75% EtOAc в гептане пропускают через 12 объемов колонки. Отбирают фракции по 17 мл УФ-положительного элюента. Фракции 12-16 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-желтого цвета (1,39 г, 75%).
ПРИМЕР 351
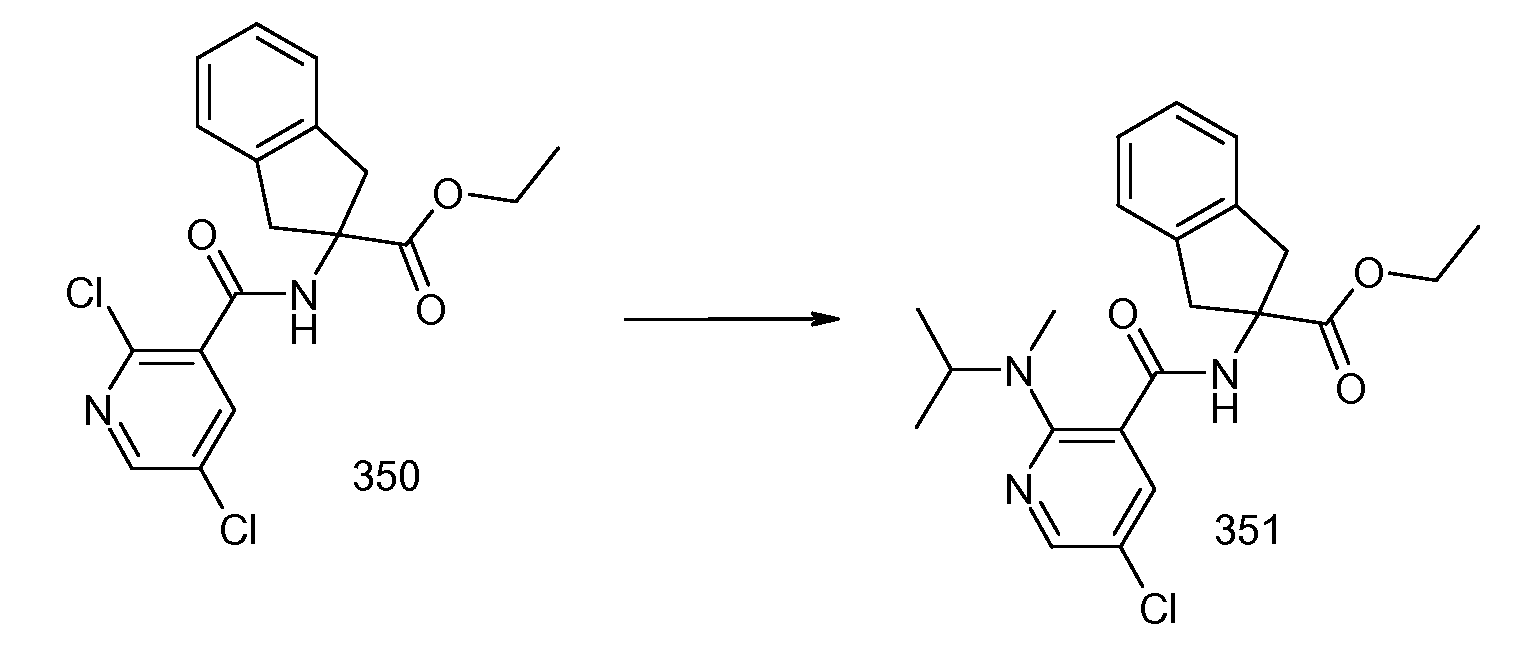
Этиловый эфир 2-{[5-хлор-2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (351)
В реакционную колбу объемом 40 мл помещают этиловый эфир 2-[2-(хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (350, 400 мг, 1,16 ммоль) и сухой 1,4-диоксан (4 мл). Добавляют магнитную мешалку и начинают перемешивать. Через 30 секунд добавляют DIPEA (2,1 мл, 11,6 ммоль) и N-метилизопропиламин (1,2 мл, 11,6 ммоль). Реакционный сосуд герметично закрывают крышкой с тефлоновым покрытием. Реакционный сосуд помещают в масляную баню, которую нагревают до 80°C. Через 7 дней анализ ТСХ (силикагель, 2:1 EtOAc/гептан) показывает, что исходный продукт израсходован, как свидетельствует УФ-анализ. Содержимое реакционной колбы переносят в круглодонную колбу и растворитель удаляют в вакууме откачиванием до постоянного веса, получая 0,84 г вязкого масла желтого цвета. Продукт растворяют в DCM и помещают в колонку для хроматографии ISCO (силикагель, 40 г). Градиент 5% EtOAc в гептане пропускают через 3 объема колонки, с последующим линейным увеличением до 60% EtOAc в гептане через 12 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 2-5 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество светло-желтого цвета (0,42 г, 85%).
ПРИМЕР 352
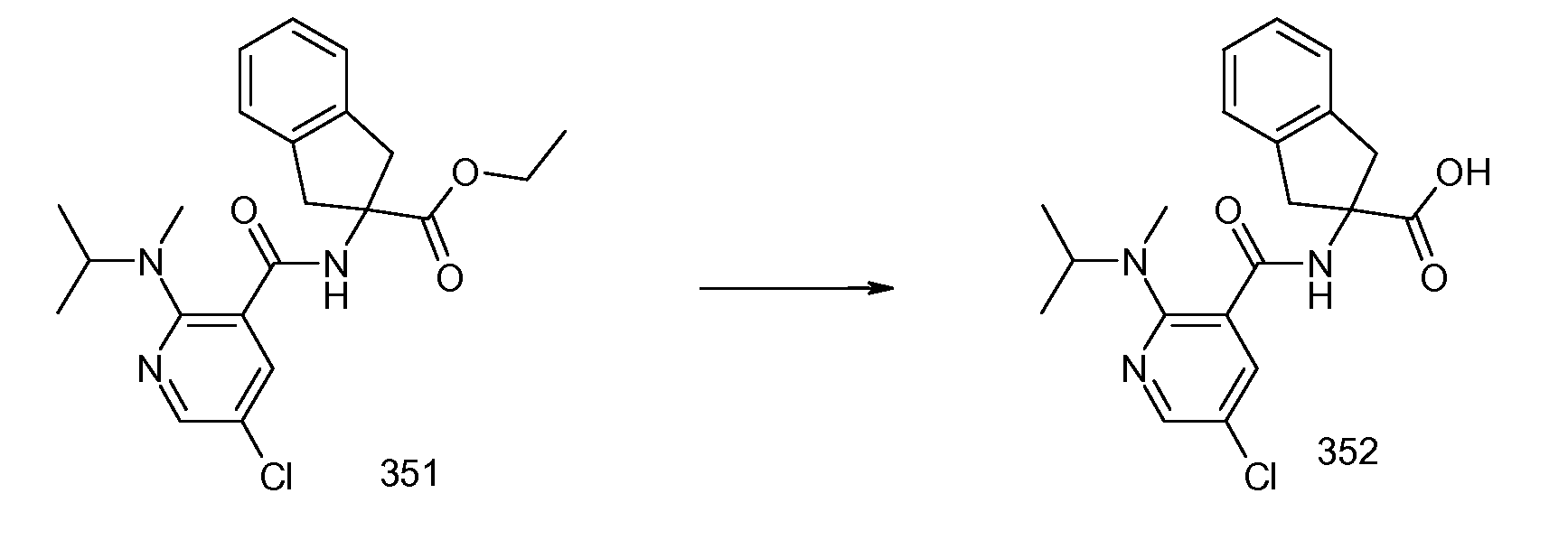
2-{[5-Хлор-2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновая кислота (352)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[5-хлор-2-(изопропилметиламино)пиридин-3-карбонил]амино}индан-2-карбоновой кислоты (351, 270 мг, 0,58 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем LiOH (62 мг, 1,48 ммоль). По истечении 18 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 20 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,21 г, 94%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,09 (т, 3H), 2,71 (с, 3H), 3,22-3,48 (м, 4H), 4,18 (септет, 1H), 7,04-7,11 (м, 4H), 7,65 (с, 1H), 8,17 (с, 1H), 8,48 (с, 1H), 8,72 (уш.с, 1H)
ЖХ/МС (ES+) m/z=390,10
ПРИМЕР 353
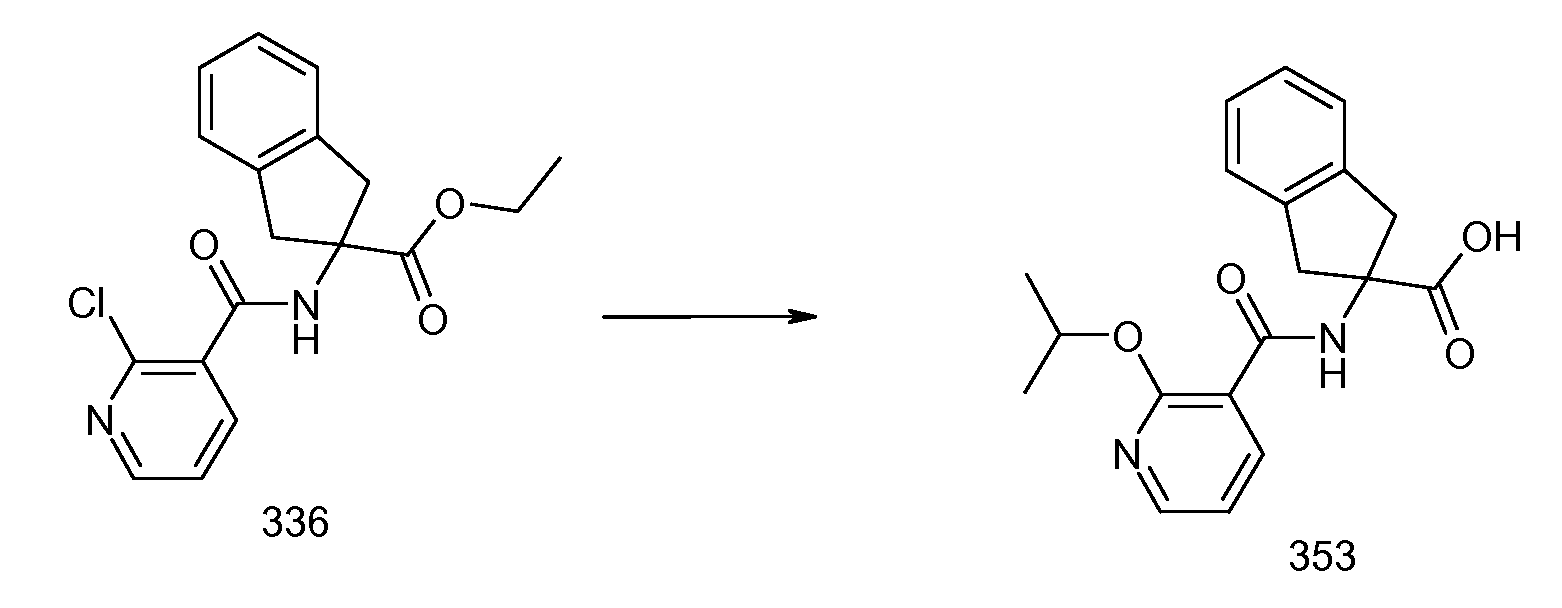
2-[(2-Изопропоксипиридин-3-карбонил)амино]индан-2-карбоновая кислота (353)
В реакционную колбу для микроволновой обработки объемом 10 мл помещают iPrOH (4 мл, 51,9 ммоль). Добавляют магнитную мешалку и начинают перемешивать. Добавляют суспензию NaH в масле (104 мг, 2,61 ммоль). Через 2 минуты добавляют этиловый эфир 2-[(2-хлорпиридин-3-карбонил)амино]индан-2-карбоновой кислоты (336, 450 мг, 1,31 ммоль). Реакционную колбу неплотно закрывают и перемешивают при комнатной температуре. По истечении 7 дней анализ ТСХ (силикагель, 2:1 EtOAc/гептан) показывает, что исходный продукт израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Dowex (0,5 г). Смесь в колбе перемешивают при комнатной температуре. Через 1 неделю реакционную смесь разбавляют iPrOH (20 мл) и фильтруют через слой целита. Фильтрат переносят в круглодонную колбу и выпаривают при пониженном давлении. Остаток растворяют в iPrOH (10 мл) и толуоле (10 мл). Растворитель удаляют при пониженном давлении. Стадии растворения и выпаривания повторяют. Откачиванием до постоянного веса получают аморфное вещество белого цвета (0,40 г). Полученный продукт растворяют в DCM (5 мл). Этот раствор загружают в систему ISCO Companion, оборудованную 12 г колонкой (силикагель). Колонку элюируют 5% ACN/DCM, пропуская через 5 объемов колонки, после чего линейный градиент 90% ACN/DCM пропускают через 10 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 6-9 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,1 г, 12%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,21 (д, 6H), 3,23-3,58 (м, 4H), 5,33 (септет, 1H), 7,13 (дд, 1H), 7,20-7,26 (м, 4H), 8,17 (дд, 1H), 8,29 (дд, 1H), 8,77 (с, 1H), 13,77 (уш.с, 1H)
ЖХ/МС (ES+) m/z=341,10
ПРИМЕР 354
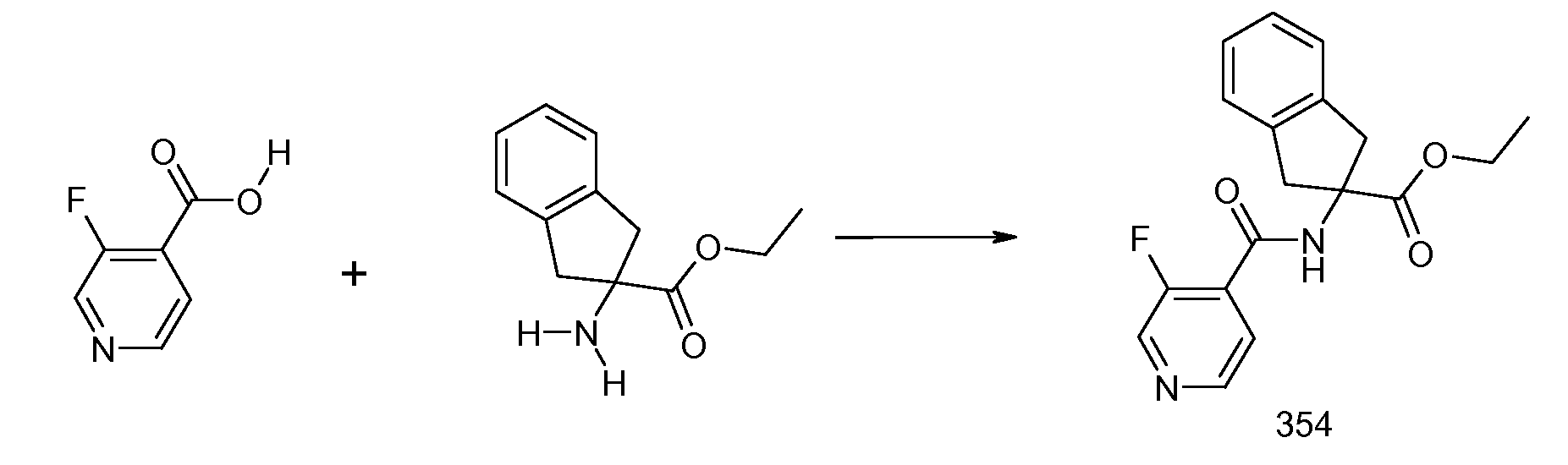
Этиловый эфир 2-[(2-фторпиридин-4-карбонил)амино]индан-2-карбоновой кислоты (354)
В реакционную колбу объемом 40 мл, содержащую магнитную мешалку, помещают 3-фторизоникотиновую кислоту (825 мг, 5,85 ммоль) и сухой DCM (15 мл). Начинают перемешивать. Через 2 минуты добавляют HBTU (2,22 г, 5,85 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1,2 г, 5,25 ммоль) и затем DIPEA (2,55 мл, 14,62 ммоль). Реакционную смесь перемешивают в течение 7 дней. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (75 мл). Смесь последовательно промывают насыщенным раствором соли (25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 3,93 г твердого вещества светло-желтого цвета. Данный продукт растворяют в 15 мл DCM. Этот продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 5% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 65% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 4-9 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (1,5 г, 94%).
ПРИМЕР 355
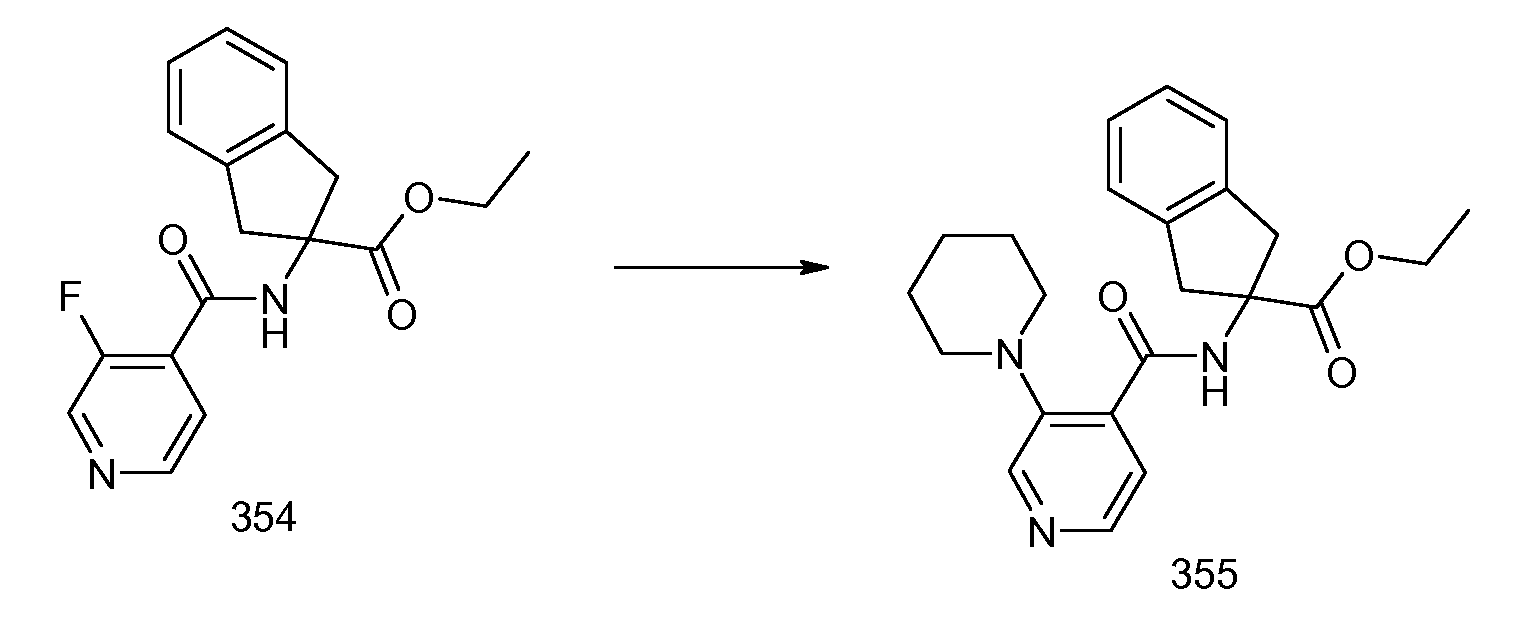
Этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-4'-карбонил)амино]индан-2-карбоновой кислоты (355)
В реакционный сосуд для микроволновой обработки объемом 10 мл помещают этиловый эфир 2-[(3-фторпиридин-4-карбонил)амино]индан-2-карбоновой кислоты (354, 500 мг, 1,52 ммоль), 1,4-диоксан (1,51 мл) и пиперидин (1,51 мл, 15,23 ммоль). Добавляют магнитную мешалку. Реакционный сосуд герметично закрывают. Реакционный сосуд помещают в микроволновый реактор Smith. Температуру устанавливают на 150°C с временем выдержки 10 минут. Время предварительного перемешивания устанавливают 20 секунд. Реакционный сосуд удаляют из реактора. Вынимают магнитную мешалку. Содержимое колбы переносят в круглодонную колбу и растворитель удаляют при пониженном давлении. Откачиванием до постоянного веса получают 1,2 г полутвердого вещества желтого цвета. Остаток растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют смесью EtOAc/гептан (5%), пропуская через 4 объема колонки, после чего линейный градиент 65% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл. Фракции 42-50 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,56 г, 93%).
ПРИМЕР 356
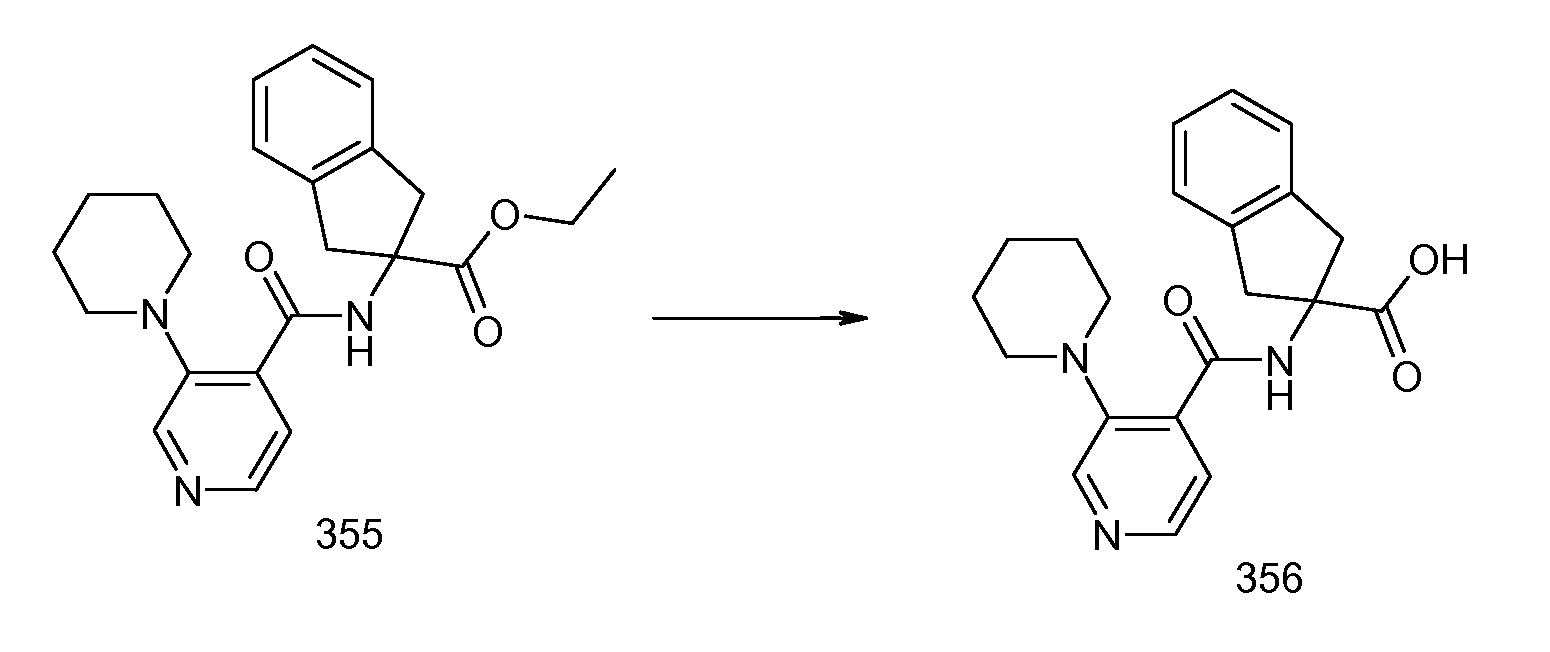
2-[(3,4,5,6-Тетрагидро-2H-[1,3']бипиридинил-4'-карбонил)амино]индан-2-карбоновая кислота (356)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-4'-карбонил)амино]индан-2-карбоновой кислоты (355, 370 мг, 0,94 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем моногидрат LiOH (100 мг, 2,38 ммоль). По истечении 68 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 20 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,35 г, 96%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,43 (м, 2H), 1,78 (м, 4H), 2,96 (м, 4H), 3,22-3,46 (м, 4H), 7,05-7,12 (м, 4H), 7,46 (д, 1H), 8,28 (д, 1H), 8,40 (с, 1H), 9,83 (уш.с, 1H)
ЖХ/МС (ES+) m/z=366,16
ПРИМЕР 357
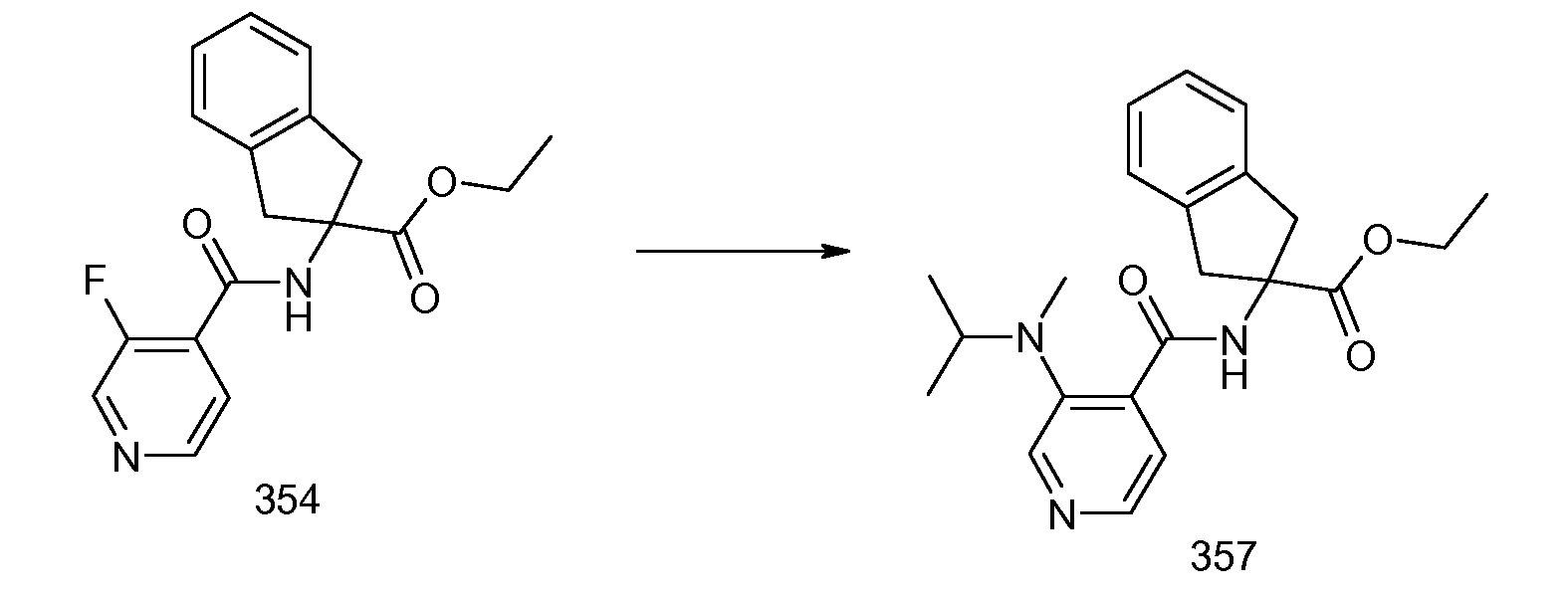
Этиловый эфир 2-{[3-(изопропилметиламино)пиридин-4-карбонил]амино}индан-2-карбоновой кислоты (357)
В реакционный сосуд для микроволновой обработки объемом 10 мл помещают этиловый эфир 2-[(3-фторпиридин-4-карбонил)амино]индан-2-карбоновой кислоты (354, 500 мг, 1,52 ммоль), 1,4-диоксан (2 мл) и пиперидин (2 мл, 29,5 ммоль). Добавляют магнитную мешалку. Реакционную колбу герметично закрывают. Реакционную колбу помещают в микроволновый реактор Smith. Температуру устанавливают на 150°C с временем выдержки 10 минут. Время предварительного перемешивания устанавливают 20 секунд. После завершения данной стадии реакционный сосуд удаляют из реактора. Вынимают магнитную мешалку. Содержимое колбы переносят в круглодонную колбу и растворитель удаляют при пониженном давлении. Откачиванием до постоянного веса получают 0,71 г коричневого сиропа. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют смесью EtOAc/гептан (5%), пропуская через 4 объема колонки, после чего линейный градиент 65% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 5-11 объединяют и выпаривают при откачивании до постоянного веса, получая 0,29 г аморфного вещества белого цвета (0,29 г, 51%).
ПРИМЕР 358
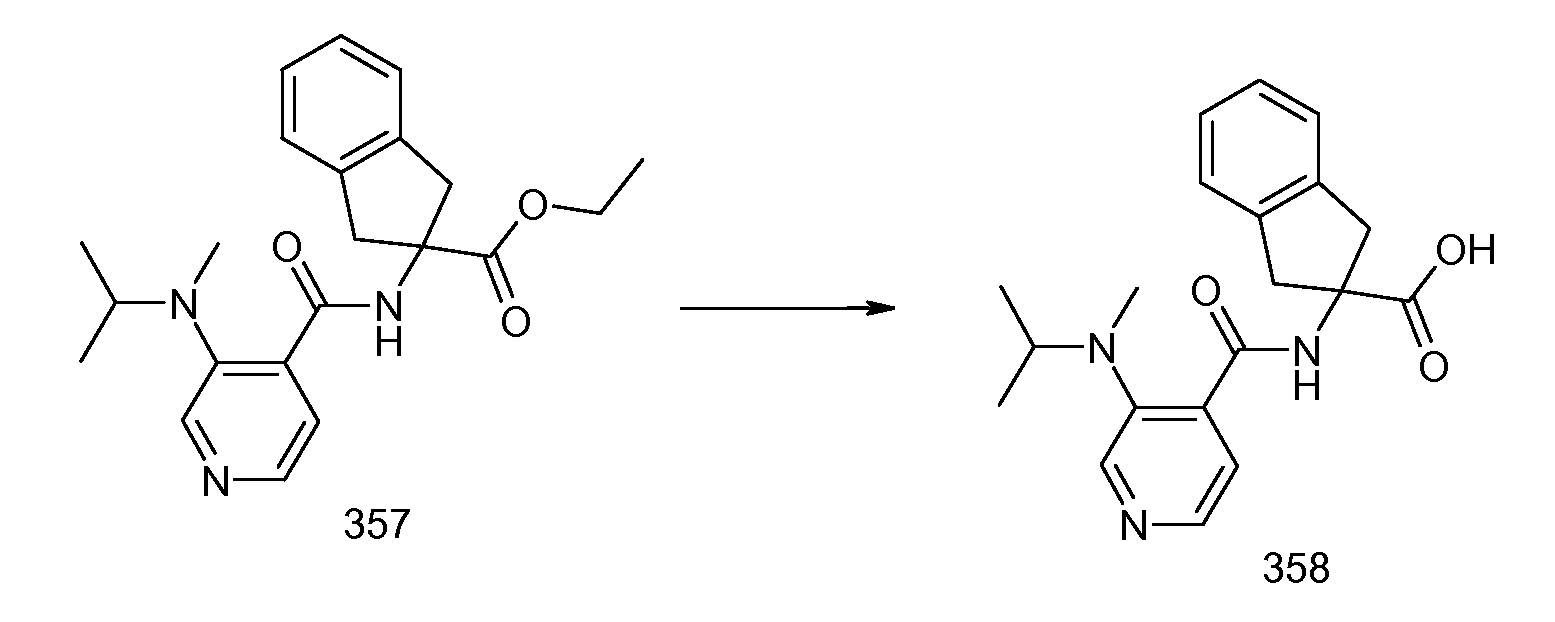
2-{[3-(Изопропилметиламино)пиридин-4-карбонил]амино}индан-2-карбоновая кислота (358)
В этиловый эфир 2-{[3-(изопропилметиламино)пиридин-4'-карбонил]амино]индан-2-карбоновой кислоты (357, 270 мг, 0,71 ммоль) помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем моногидрат LiOH (75 мг, 1,94 ммоль). Через 4 дня анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 3 часа содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,22 г, 88%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,03 (д, 6H), 2,69 (с, 3H), 3,77 (септет, 1H), 7,05-7,12 (м, 4H), 7,43 (д, 1H), 8,21 (д, 1H), 8,39 (с, 1H)
ЖХ/МС (ES+) m/z=354,19
ПРИМЕР 359
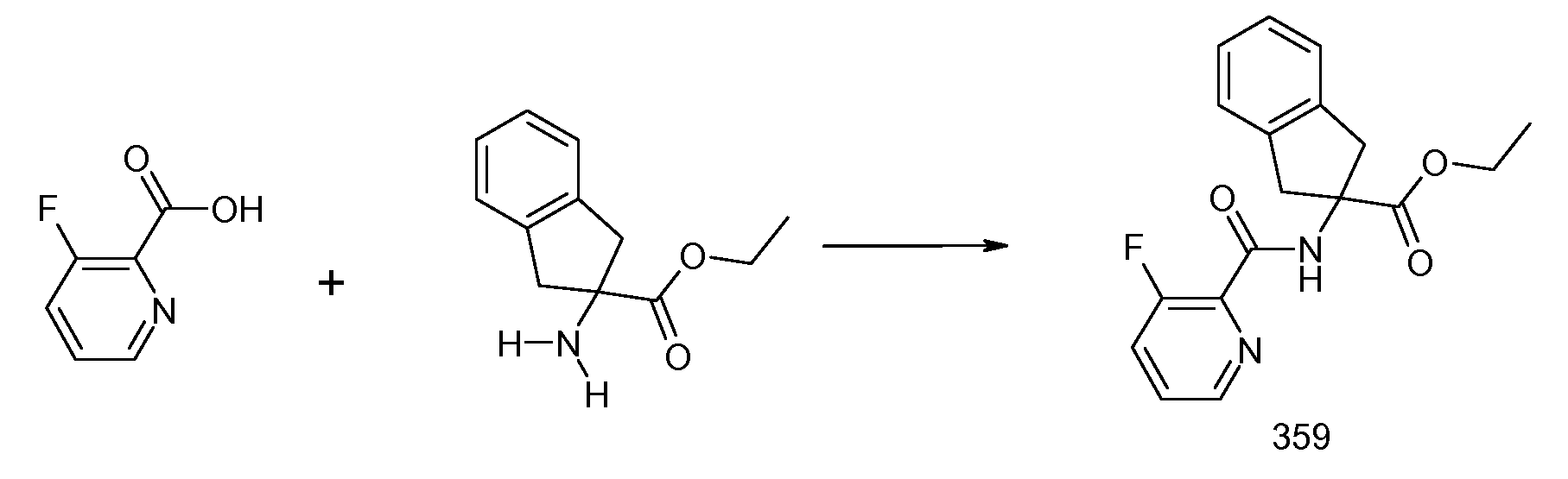
Этиловый эфир 2-[(3-фторпиридин-2-карбонил)амино]индан-2-карбоновой кислоты (359)
В реакционную колбу объемом 40 мл, содержащую магнитную мешалку, помещают 3-фторпиридин-2-карбоновую кислоту (997 мг, 7,07 ммоль) и сухой DCM (15 мл). Начинают перемешивать. Через 2 минуты добавляют HBTU (2,7 г, 7,07 ммоль). Через 5 минут добавляют этиловый эфир 2-аминоиндан-2-карбоновой кислоты (1,45 г, 7,07 ммоль) и затем DIPEA (2,50 мл, 14,5 ммоль). Реакционную смесь перемешивают в течение 18 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 5% iPrOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы переносят в делительную воронку и разбавляют EtOAc (50 мл). Смесь последовательно промывают водой (3%, 25 мл), насыщенным водным раствором NaHCO3 (2×25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 4,15 г твердого вещества светло-оранжевого цвета. Данный продукт растворяют в 20 мл DCM. Этот продукт очищают на 80 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 5% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 60% EtOAc в гептане пропускают через 10 объемов колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 6-14 объединяют и выпаривают в вакууме. В результате получают твердое вещество белого цвета (2,04 г, 88%).
ПРИМЕР 360
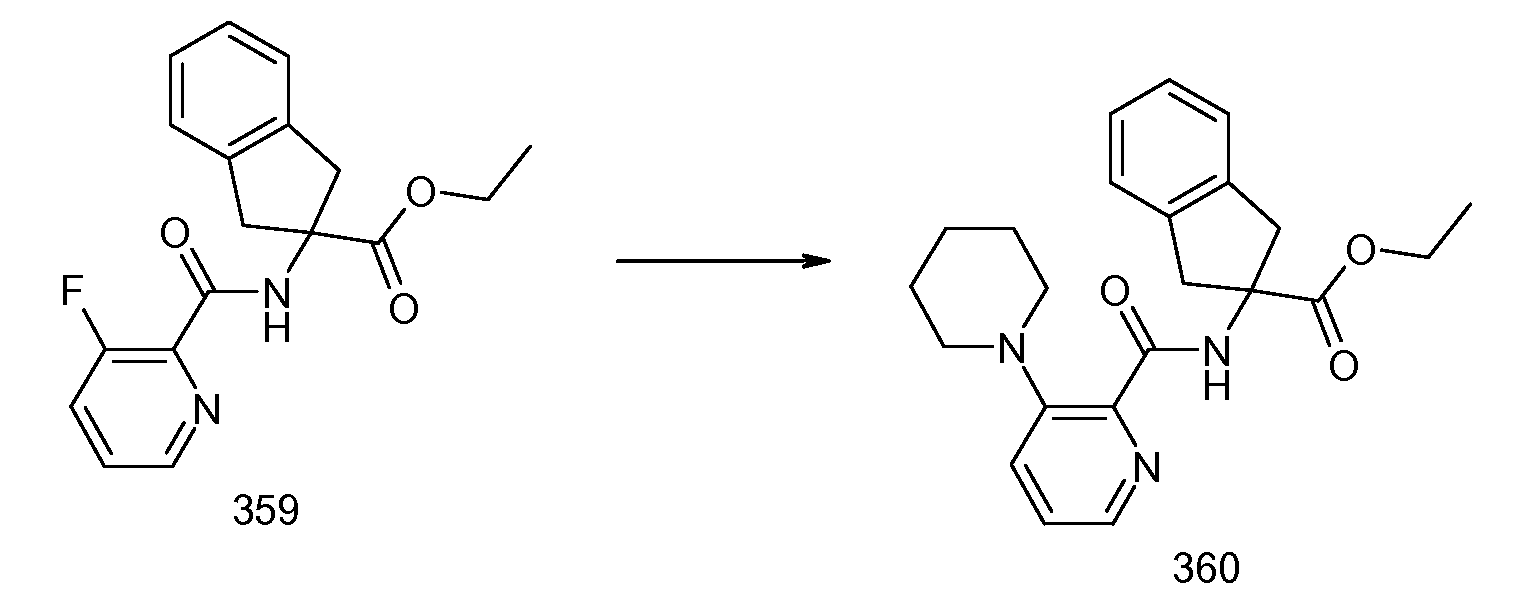
Этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-2'-карбонил)амино]индан-2-карбоновой кислоты (360)
В реакционный сосуд для микроволновой обработки объемом 10 мл помещают этиловый эфир 2-[(3-фторпиридин-2-карбонил)амино]индан-2-карбоновой кислоты (359, 488 мг, 1,49 ммоль), 1,4-диоксан (1,5 мл) и пиперидин (1,51 мл, 15,23 ммоль). Добавляют магнитную мешалку. Реакционную колбу герметично закрывают. Реакционную колбу помещают в микроволновый реактор Smith. Температуру устанавливают на 150°C с временем выдержки 10 минут. Время предварительного перемешивания устанавливают 20 секунд. Реакционную колбу удаляют из реактора. Вынимают магнитную мешалку. Содержимое колбы переносят в круглодонную колбу и растворитель удаляют при пониженном давлении. Откачиванием до постоянного веса получают 1,02 г твердого вещества не совсем белого цвета. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют смесью EtOAc/гептан (5%), пропуская через 4 объема колонки, после чего линейный градиент 65% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 2-10 объединяют и выпаривают при откачивании до постоянного веса, получая твердое вещество белого цвета (0,5 г, 86%).
ПРИМЕР 361
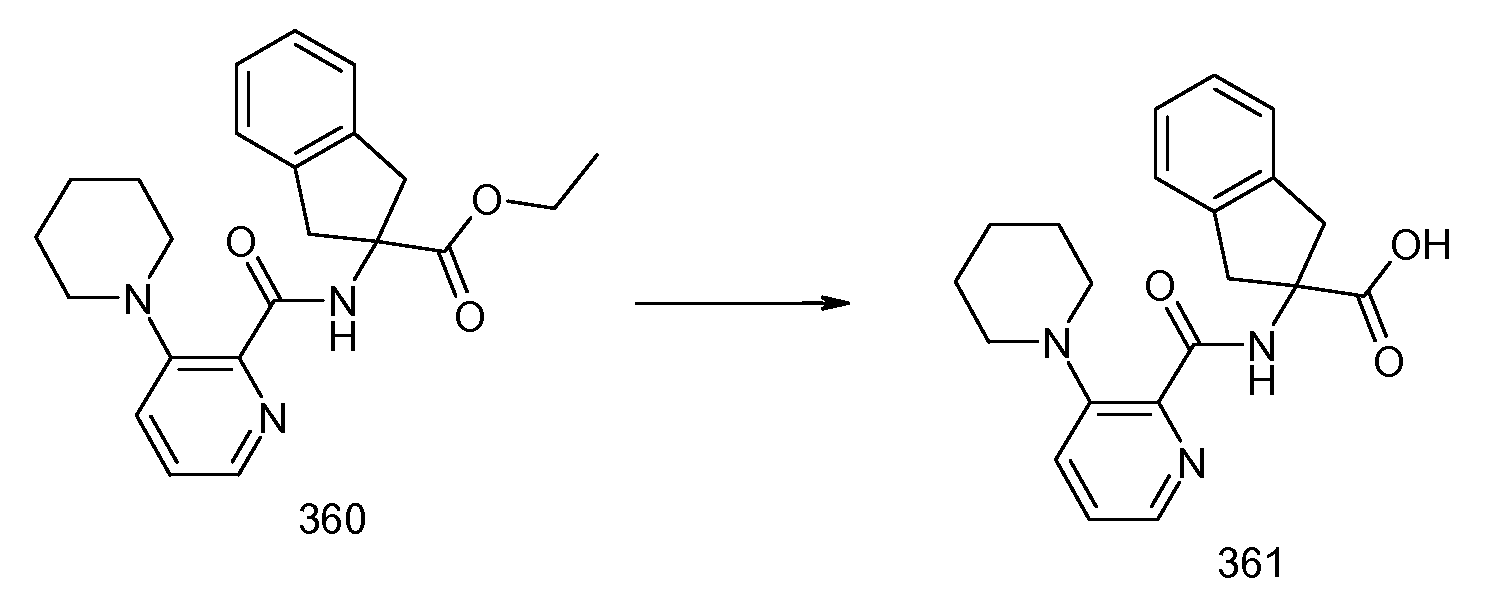
2-[(3,4,5,6-Тетрагидро-2H-[1,3']бипиридинил-2'-карбонил)амино]индан-2-карбоновая кислота (361)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-[(3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-2'-карбонил)амино]индан-2-карбоновой кислоты (360, 370 мг, 0,94 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем моногидрат LiOH (100 мг, 2,38 ммоль). По истечении 38 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 4 часа содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,29 г, 84%).
1H ЯМР (300МГц): δ 1,43 (м, 2HH), 1,78 (м, 4H), 2,96 (м, 4H), 3,22-3,46 (м, 4H), 7,05-7,12 (м, 4H), 7,46 (д, 1H), 8,28 (д, 1H), 8,40 (с, 1H), 9,83 (уш.с, 1H)
ЖХ/МС (ES+) m/z=366,16
ПРИМЕР 362
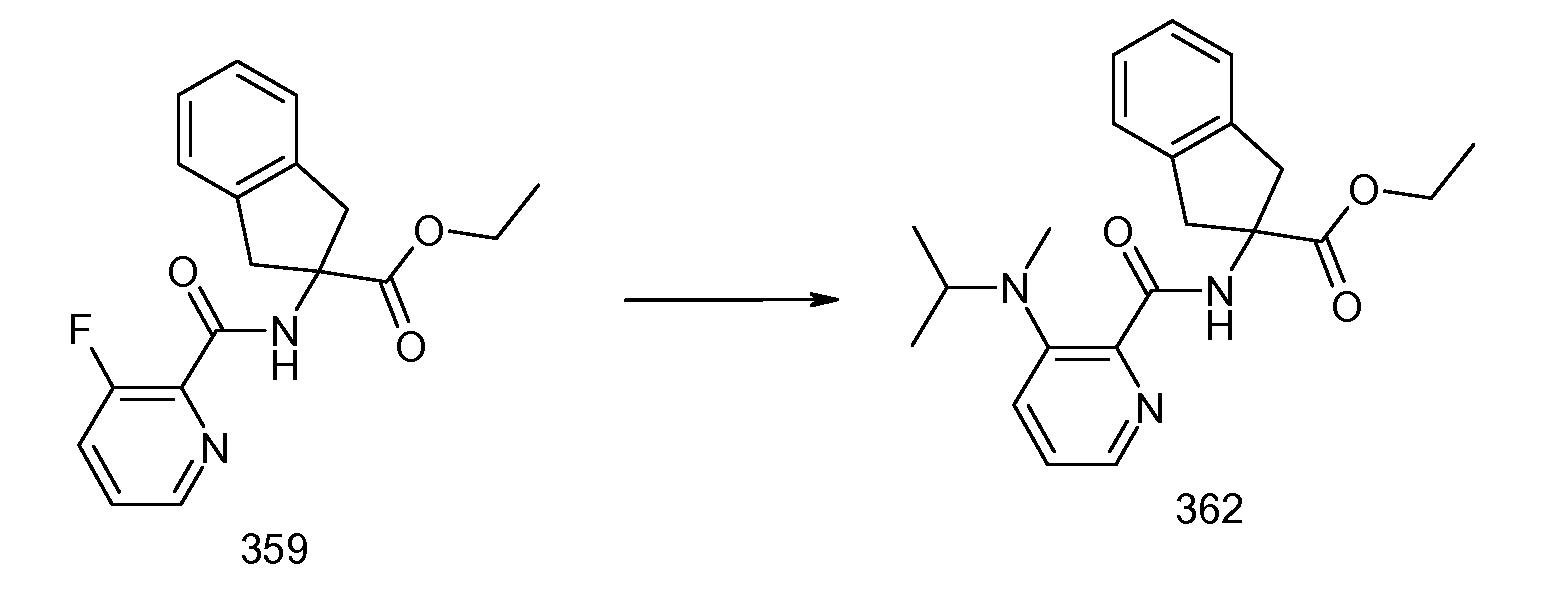
Этиловый эфир 2-{[3-(изопропилметиламино)пиридин-2-карбонил]амино}индан-2-карбоновой кислоты (362)
В реакционный сосуд для микроволновой обработки объемом 10 мл, содержащий этиловый эфир 2-[(3-фторпиридин-2-карбонил)амино]индан-2-карбоновой кислоты (359, 492 мг, 1,5 ммоль), добавляют 1,4-диоксан (1,5 мл), N-метилизопропиламин (2 мл, 19,25 ммоль) и DIPEA (2 мл, 11,48 ммоль). Добавляют магнитную мешалку. Реакционную колбу герметично закрывают. Реакционную колбу помещают в микроволновый реактор Smith. Температуру устанавливают на 155°C с временем выдержки 90 минут. Время предварительного перемешивания устанавливают 20 секунд. Реакционный сосуд удаляют из реактора. Вынимают магнитную мешалку. Содержимое колбы переносят в круглодонную колбу и растворитель удаляют при пониженном давлении. Откачиванием до постоянного веса получают 0,75 г коричневого сиропа. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют смесью EtOAc/гептан (5%), пропуская через 4 объема колонки, после чего линейный градиент 65% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 7-15 объединяют и выпаривают при откачивании до постоянного веса, получая аморфное вещество белого цвета (0,38 г, 67%).
ПРИМЕР 363
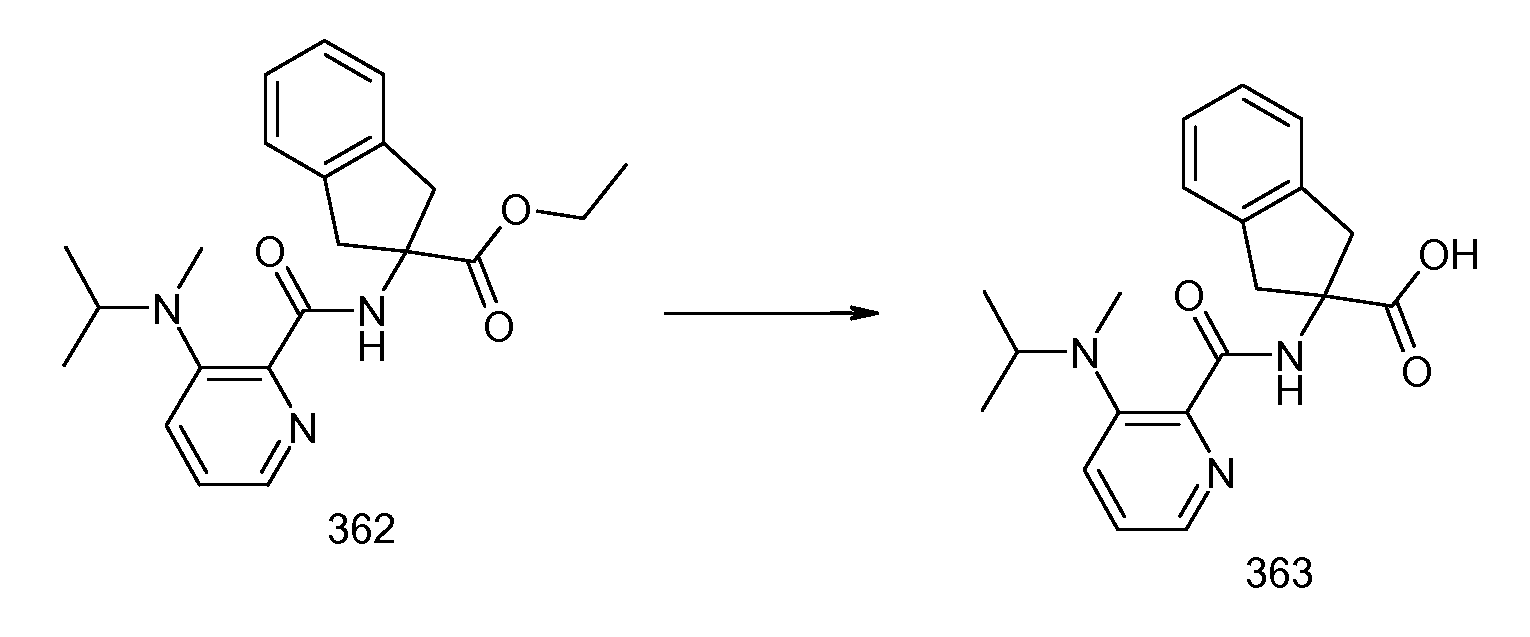
2-{[3-(Изопропилметиламино)пиридин-2-карбонил]амино}индан-2-карбоновая кислота (363)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-{[3-(изопропилметиламино)пиридин-2-карбонил]амино}индан-2-карбоновой кислоты (362, 370 мг, 0,97 ммоль), помещают 1,4-диоксан (4 мл) и MeOH (4 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2 мл) и затем моногидрат LiOH (103 мг, 2,46 ммоль). По истечении 62 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,7 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 4 часа содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,33 г, 96%).
1H ЯМР (300МГц): δ 1,04 (д, 6H), 2,39 (с, 3H), 3,18-3,53 (м, 4H), 3,64 (септет, 1H), 7,02-7,12 (м, 4H), 7,28 (дд, 1H), 7,36 (дд, 1H), 7,98 (дд, 1H), 8,84 (с, 1H)
ЖХ/МС (ES+) m/z=354,17
ПРИМЕР 364
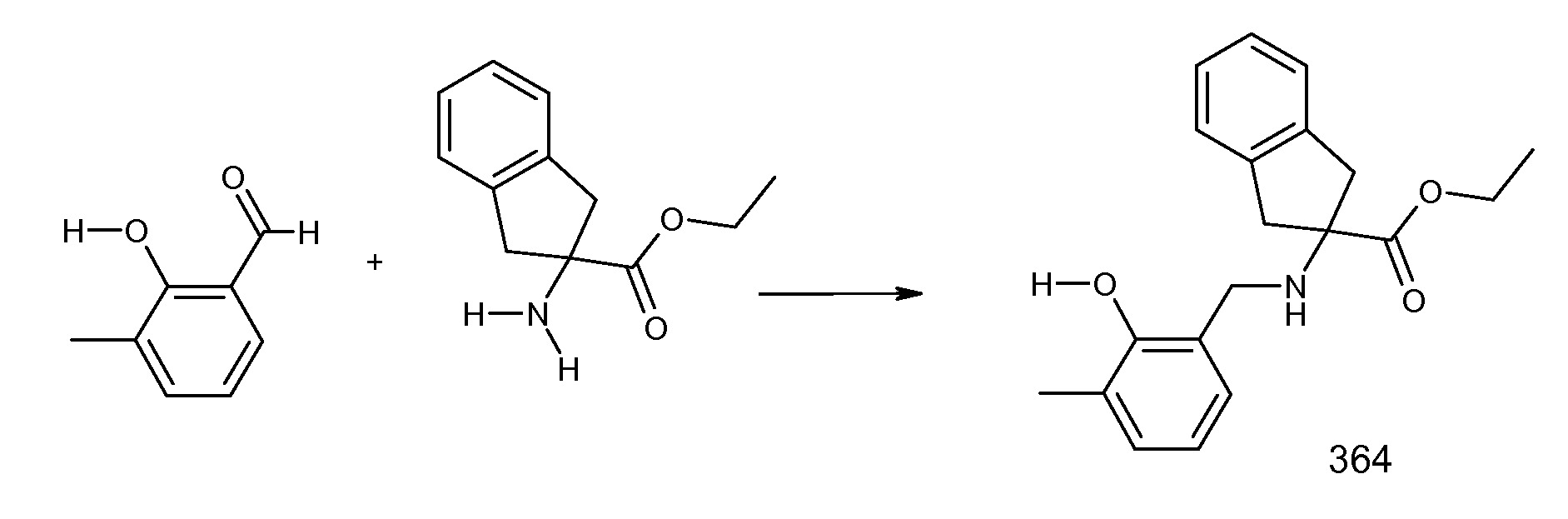
Этиловый эфир 2-(2-гидрокси-3-метилбензиламино)индан-2-карбоновой кислоты (364)
В реакционный сосуд для микроволновой обработки объемом 10 мл помещают этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и сухой тетрагидрофуран (ТГФ, 5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют 2-гидрокси-3-метилбензальдегид (0,3 мл, 2,43 ммоль). Перемешивание продолжают. Добавляют фенилсилан (0,61 мл, 4,87 ммоль) и дибутилоловодихлорид (53 мкл, 244 мкМ). Реакционный сосуд герметично закрывают и помещают в микроволновый реактор Smith. Время предварительного перемешивания устанавливают 10 секунд. Нагревание устанавливают при 100°C в течение 10 минут. Содержимое реакционного сосуда переносят в круглодонную колбу и выпаривают при откачивании до постоянного веса, получая 1,67 г твердого вещества светло-желтого цвета. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г)). Колонку элюируют 5% EtOAc/гептана, пропуская через 3 объема колонки, после чего линейный градиент 50% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 5-8 объединяют и выпаривают при откачивании до постоянного веса, получая 0,59 г твердого вещества белого цвета (0,59 г, 74%).
ПРИМЕР 365
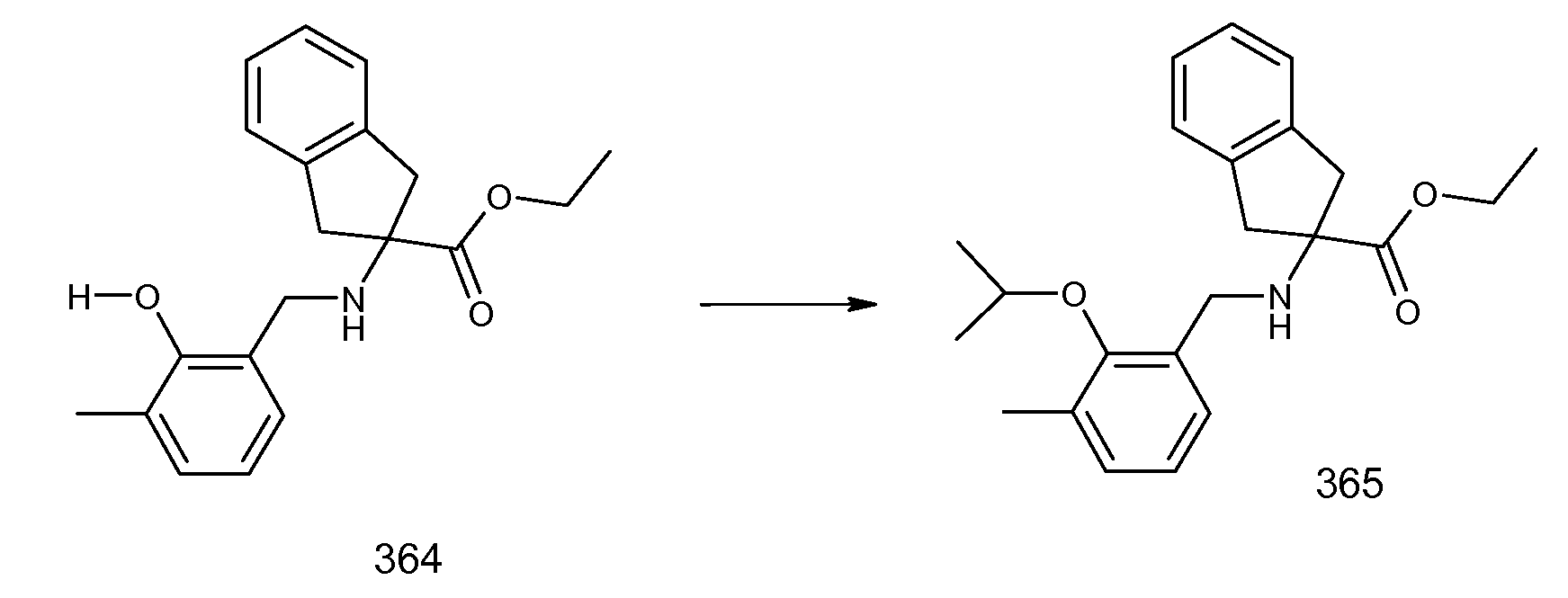
Этиловый эфир 2-(2-изопропокси-3-метилбензиламино)индан-2-карбоновой кислоты (365)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-(2-гидрокси-3-метилбензиламино)индан-2-карбоновой кислоты (364, 1,01 г, 3,10 ммоль), помещают сухой тетрагидрофуран (ТГФ, 10 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют последовательно iPrOH ([67-63-0], 0,47 мл, 6,21 ммоль) и трефенилфосфин ([603-35-0], 1,63 г, 6,21 ммоль). После растворения трефенилфосфина добавляют диизопропилазодикарбоксилат (1,20 мл, 6,21 ммоль). Реакционную колбу закрывают и перемешивают при комнатной температуре в течение ночи. Через 24 часа анализ ТСХ (силикагель, 1:2 EtOAc/гептан) показывает, что исходный продукт полностью израсходован и обращен в более высокую перемещающуюся точку, как свидетельствует УФ-анализ. Из реакционной колбы удаляют магнитную мешалку и растворитель удаляют при пониженном давлении. Откачиванием до постоянного веса получают 2,06 г вязкого масла желтого цвета. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют смесью EtOAc/гептан (5%), пропуская через 4 объема колонки, после чего линейный градиент 60% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 17 мл УФ-активного элюента. Фракции 5-14 объединяют и выпаривают при откачивании до постоянного веса, получая вязкий остаток (0,42 г, 37%).
1H ЯМР (300МГц): δ 1,18 (д, 6H), 1,22 (т, 3H), 2,18 (с, 3H), 2,98-3,41 (м, 4H), 3,61 (д, 2H), 4,16 (кв, 1H), 6,90 (дд, 1H), 7,04 (дд, 1H), 7,11-7,20 (м, 4H)
ЖХ/МС (ES+) m/z=368,24
ПРИМЕР 366
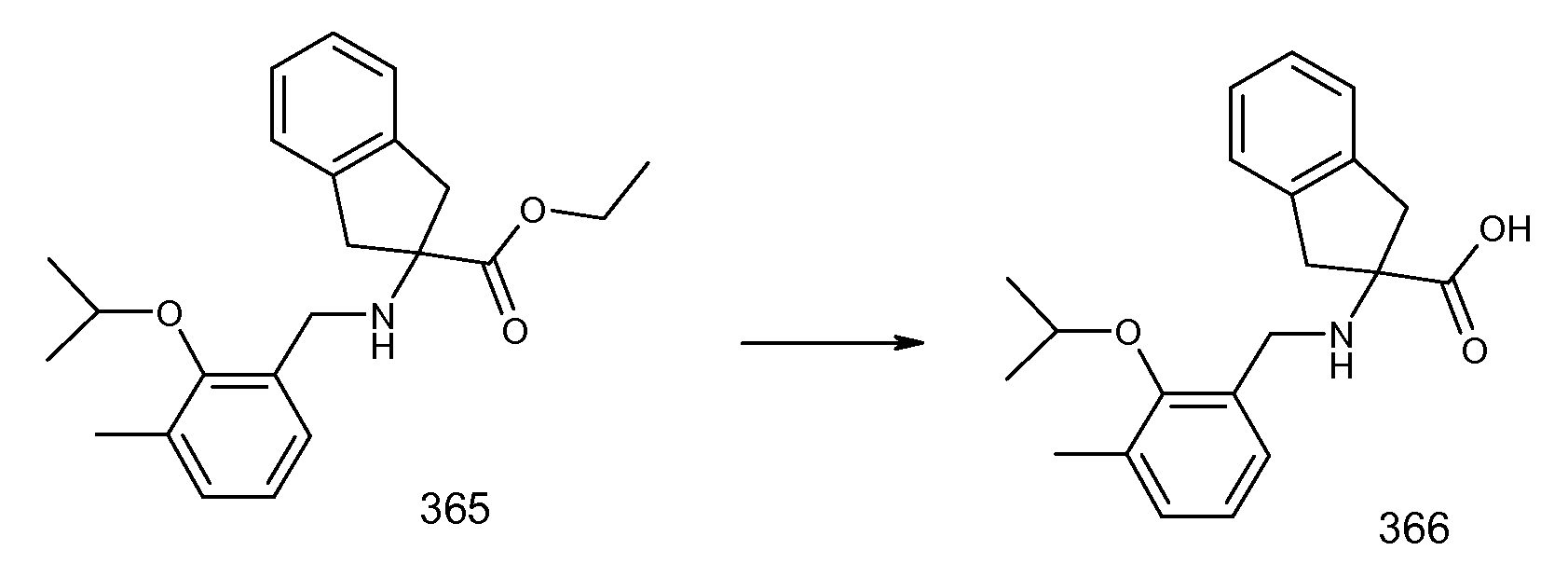
2-(2-Изопропокси-3-метилбензиламино)индан-2-карбоновая кислота (366)
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-(2-изопропокси-3-метилбензиламино)индан-2-карбоновой кислоты (365, 360 мг, 0,98 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем моногидрат LiOH (104 мг, 2,47 ммоль). По истечении 39 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 15 дней содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,24 г, 72%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,12 (д, 6H), 2,17 (с, 3H), 2,77-3,68 (м, 6H), 4,16 (септет, 1H), 6,84 (дд, 1H), 6,97-7,22 (м, 6H)
ЖХ/МС (ES+) m/z=340,20
ПРИМЕР 367
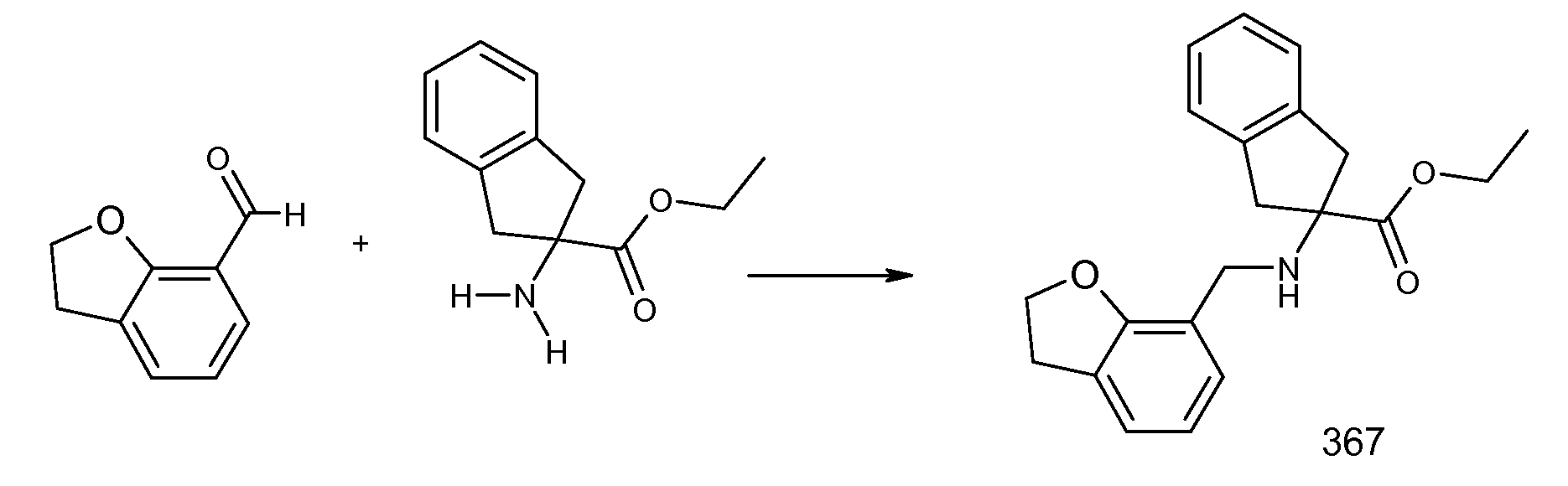
Этиловый эфир 2-[(2,3-дигидробензофуран-7-илметил)амино]индан-2-карбоновой кислоты (367)
В реакционный сосуд для микроволновой обработки объемом 10 мл помещают этиловый эфир 2-аминоиндан-2-карбоновой кислоты (500 мг, 2,44 ммоль) и сухой тетрагидрофуран (ТГФ, 5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют 2,3-дигидро-1-бензофуран-7-карбальдегид (361 мг, 2,43 ммоль). Перемешивание продолжают. Добавляют фенилсилан ([694-18-1], 0,61 мл, 4,87 ммоль) и дибутилоловодихлорид (53 мкл, 244 мкМ). Реакционный сосуд герметично закрывают и помещают в микроволновый реактор Smith. Время предварительного перемешивания устанавливают 10 секунд. Нагревание устанавливают при 100°C в течение 10 минут. Содержимое реакционного сосуда переносят в круглодонную колбу и выпаривают при откачивании до постоянного веса, получая 1,56 г светло-желтого масла. Данный продукт растворяют в DCM (10 мл) и загружают в колонку для хроматографии ISCO Companion (силикагель, 40 г). Колонку элюируют 5% EtOAc/гептана, пропуская через 3 объема колонки, после чего линейный градиент 50% EtOAc/гептан пропускают через 10 объемов колонки и затем 90% EtOAc/гептан пропускают через 2 объема колонки. Отбирают фракции по 14 мл УФ-активного элюента. Фракции 7-11 объединяют и выпаривают при откачивании до постоянного веса, получая 0,59 г твердого вещества белого цвета (0,52 г, 63%).
ПРИМЕР 368
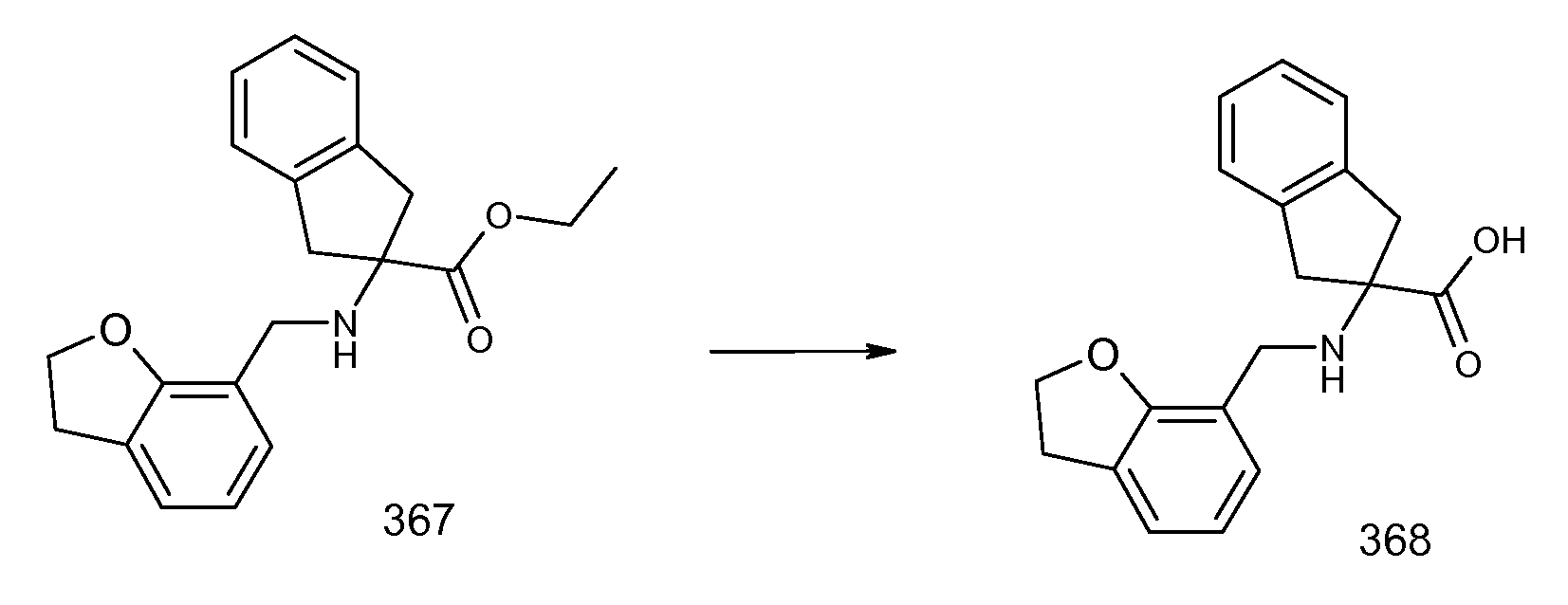
2-[(2,3-Дигидробензофуран-7-илметил)амино]индан-2-карбоновая кислота (368):
В круглодонную колбу объемом 100 мл, содержащую этиловый эфир 2-[(2,3-дигидробензофуран-7-илметил)амино]индан-2-карбоновой кислоты (367, 350 мг, 1,037 ммоль), помещают 1,4-диоксан (3 мл) и MeOH (3 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (1,5 мл) и затем моногидрат LiOH (110 мг, 2,52 ммоль). По истечении 16 часов анализ ТСХ (силикагель, 50% EtOAc/гептан) показывает, что исходный продукт полностью израсходован. В реакционную колбу добавляют сильнокислую ионообменную смолу Amberlyst (0,5 г). Реакционную колбу закрывают и перемешивают при комнатной температуре. Через 6 часов содержимое колбы фильтруют через слой целита. Растворитель удаляют из фильтрата. Остаток растворяют в смеси iPrOH/толуол (20 + 20 мл) и растворитель удаляют. Данный процесс повторяют еще 1 раз. Откачиванием до постоянного веса получают твердое вещество белого цвета (0,31 г, 99%).
1H ЯМР (ДМСО-d6, 300МГц): δ 2,77-3,58 (м, 6H), 3,11 (т, 2H), 4,45 (т, 2H), 6,70 (дд, 1H), 7,02-7,11 (м, 6H)
ЖХ/МС (ES+) m/z=310,14
Этиловые эфиры 2-амино-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты 369, 370, 371, 372 и 373 синтезируют по методу Майкла Кокса (Michael Cox) в Eur. Pat. Appl. EP 82-304382.
ПРИМЕР 369
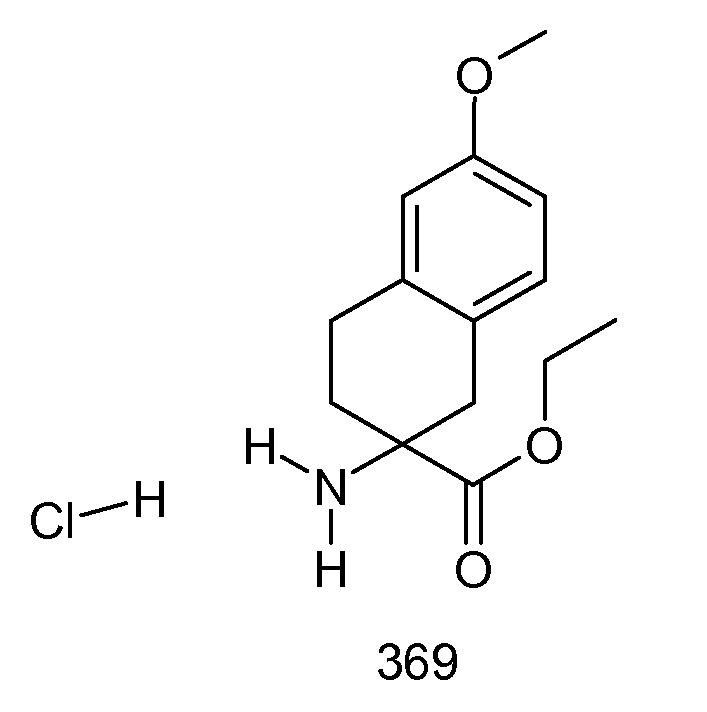
Гидрохлоридная соль этилового эфира 2-амино-6-метокси-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (369)
ЖХ/МС (ES+) m/z=250,18
ПРИМЕР 370
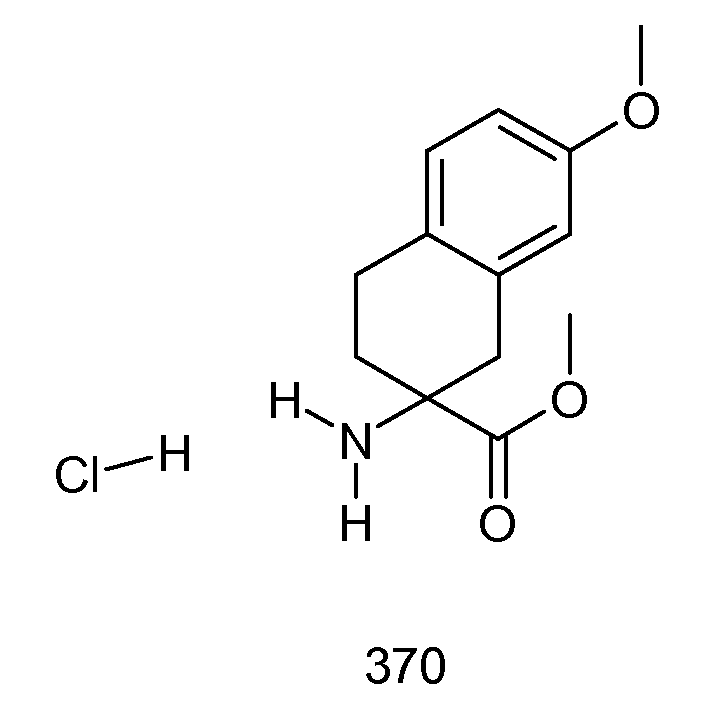
ПРИМЕР 370
Гидрохлорид метилового эфира 2-амино-7-метокси-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (370)
ЖХ/МС (ES+) m/z=336,16
ПРИМЕР 371
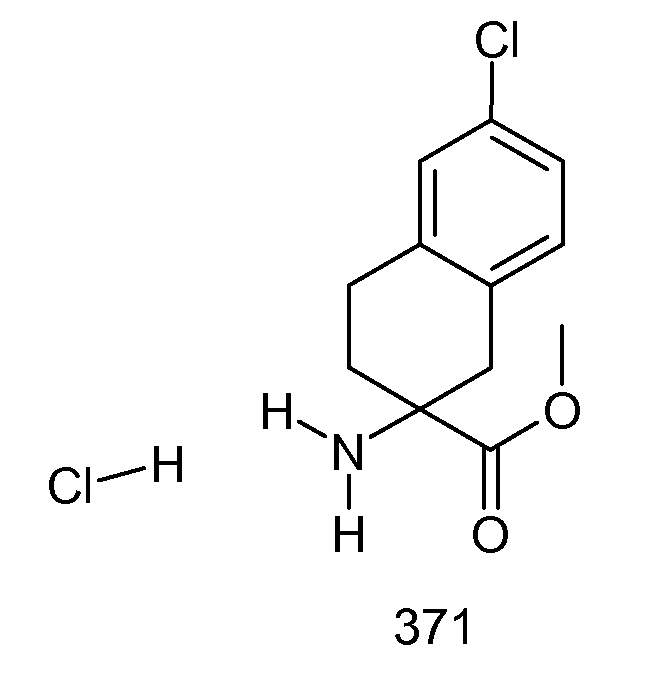
Гидрохлоридная соль метилового эфира 2-амино-6-хлор-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (371)
ЖХ/МС (ES+) m/z=340,11
ПРИМЕР 372
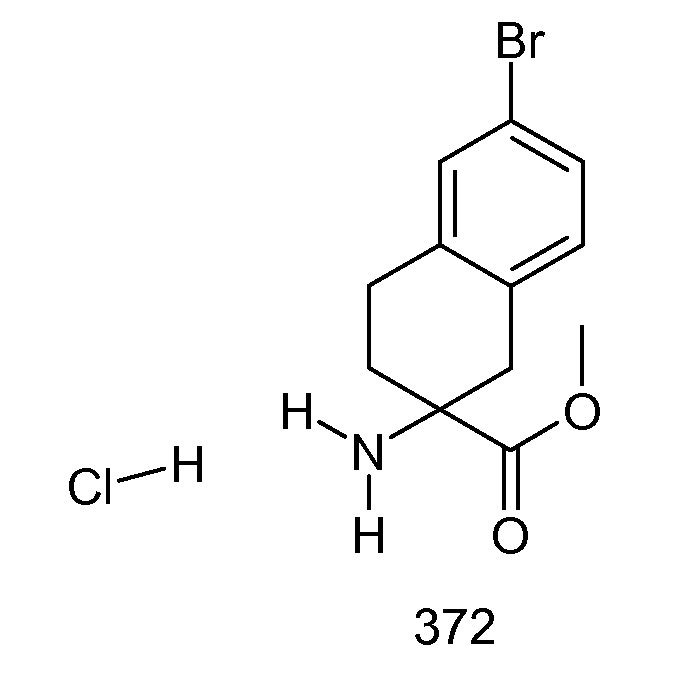
Гидрохлоридная соль метилового эфира 2-амино-6-бром-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (372)
ЖХ/МС (ES+) m/z=340,11
ПРИМЕР 373
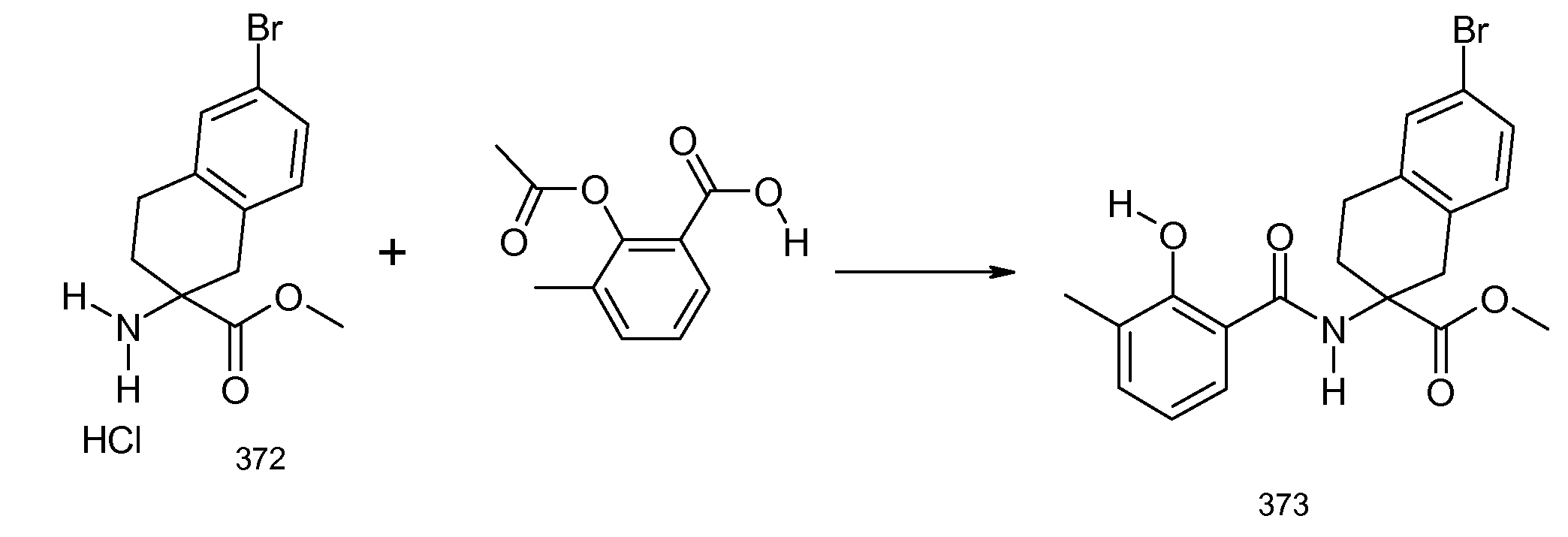
Метиловый эфир 2-(2-гидрокси-3-метилбензоил)-6-бром-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (373)
В колбу объемом 40 мл, содержащую магнитную мешалку, помещают 2-ацетокси-3-метилбензойную кислоту ([2386-93-4], 1,69 г, 8,7 ммоль) и сухой DCM (10 мл). Начинают перемешивать. После полного растворения добавляют HBTU (3,29 г, 8,7 ммоль). Через 5 минут добавляют гидрохлоридную соль 2-амино-6-бром-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (372, 1,25 г, 3,9 ммоль) и затем DIPEA (3,4 мл, 19,5 ммоль). Добавляют дополнительную аликвоту сухого DCM (4 мл). Реакционную смесь перемешивают в течение 36 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 50% EtOAc/гептан) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (100 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором NaHCO3 (50 мл) и насыщенным раствором соли (50 мл), сушат над Na2SO4, фильтруют и выпаривают в вакууме с получением 5,2 г густого смолистого вещества коричневатого цвета. Данный продукт очищают, используя систему очистки ISCO Companion, на 120 г картридже на основе диоксида кремния. Градиент 2% EtOAc в гептане пропускают через 4 объема колонки, после чего линейный градиент 30% EtOAc пропускают через 10 объемов колонки и затем 100% EtOAc пропускают через 12 объемов колонки. Отбирают фракции по 170 мл УФ-активного элюента. Фракции 13-23 объединяют и выпаривают в вакууме. В результате получают пенистое вещество (0,42 г, 26%).
ПРИМЕР 374
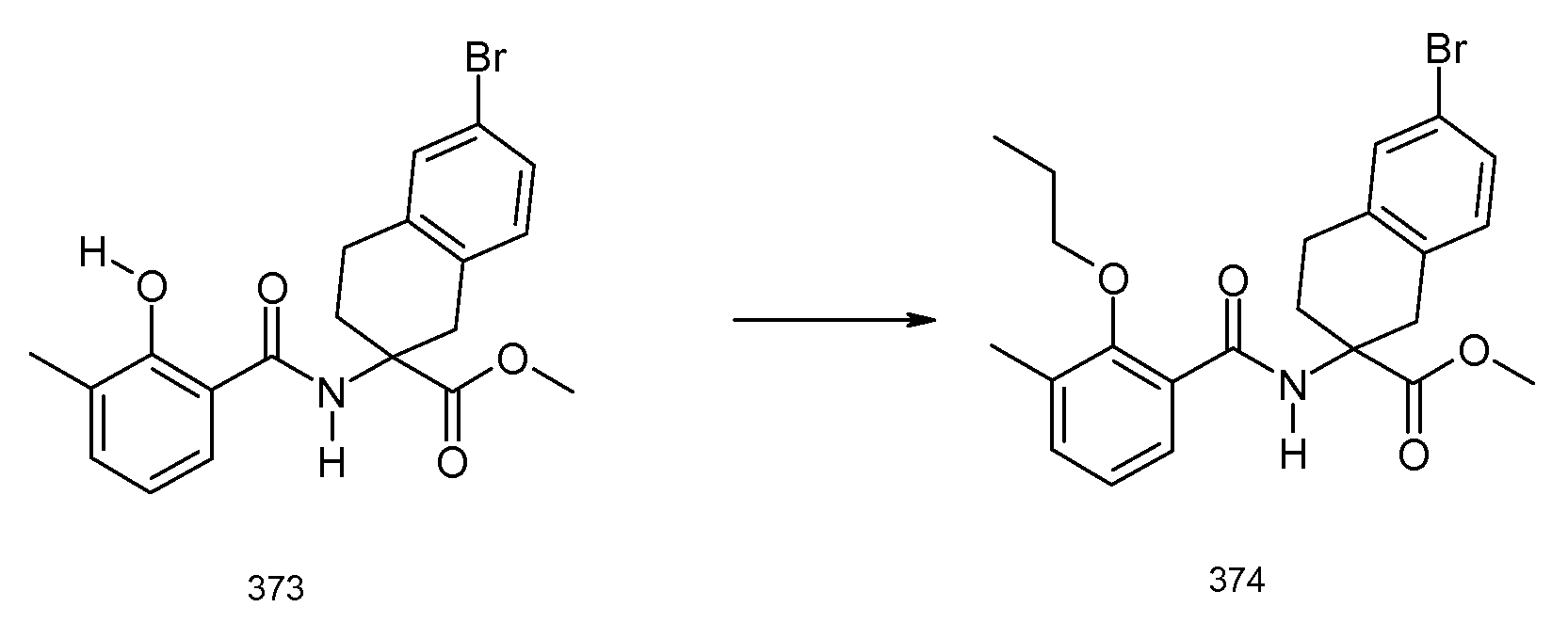
Метиловый эфир 2-(2-пропокси-3-метилбензоил)-6-бром-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (374)
В круглодонную колбу объемом 100 мл, содержащую метиловый эфир 6-бром-(2-гидрокси-3-метилбензоиламино)-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (373, 0,39 г, 0,932 ммоль) и магнитную мешалку, помещают сухой ДМФА (10 мл). Начинают перемешивать. Последовательно добавляют K2SO4 (0,258 мг, 1,86 ммоль), KI (1 мг, 6 мкМ) и 1-бромпропан (0,2 мл, 2,24 ммоль). Реакционную колбу, снабженную обратным холодильником, погружают в масляную баню. Масляную баню нагревают до 79°C. Реакционную смесь перемешивают при заданной температуре в течение 2 часов и затем масляную баню выключают. После 16 часов при комнатной температуре возобновляют нагревание при 53°C в течение еще одного часа. Анализ ТСХ (силикагель, 1:1 EtOAc/гептан) показывает расход исходного продукта и появление точки с несколько более низким значением Rf. Реакционную смесь снова охлаждают до комнатной температуры и фильтруют через слой целита. Полученный раствор разбавляют EtOAc (60 мл) и повторно промывают насыщенным раствором соли (4×40 мл), сушат над MgSO4, фильтруют и выпаривают при откачивании до постоянного веса, получая продукт в виде масла светло-желтого цвета (0,42 г, 98%).
ПРИМЕР 375
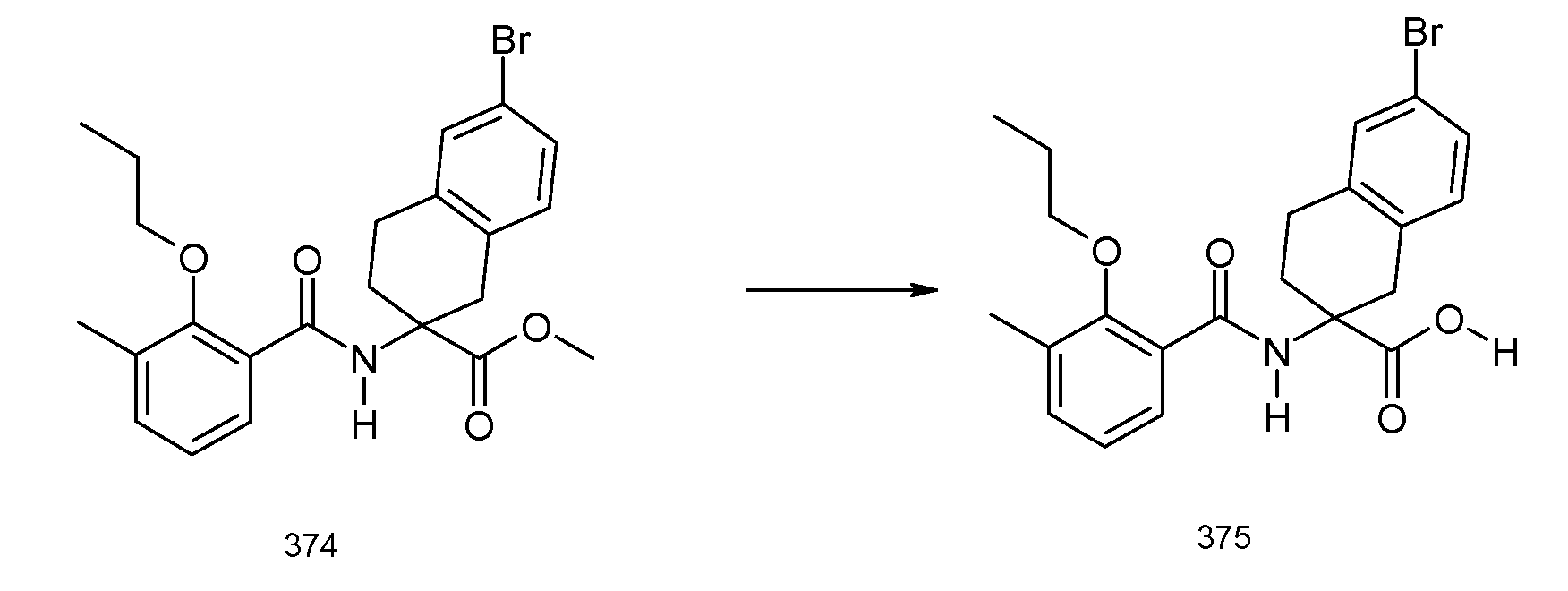
2-(2-Пропокси-3-метилбензоил)-6-бром-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота (375)
В колбу объемом 50 мл, содержащую этиловый эфир 6-бром-2-(2-пропокси-3-метилбензоиламино)-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (374, 0,34 г, 0,74 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем моногидрат LiOH (77 мг, 1,44 ммоль). По истечении 16 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~12 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают твердое вещество кремового цвета (0,30 г, 91%).
1H ЯМР (300 МГц, ДМСО-d6): δ 0,82 (т, 3H), 1,43 (м, 1H), 1,96-2,08 (м, 1H), 2,19 (с, 3H), 2,38-2,91 (м, 1H), 2,73-2,91 (м, 2H), 3,02-3,38 (м, 5H), 3,58-3,64 (м, 3H), 7,03-7,09 (м, 2H), 7,27-7,36 (м, 3H), 8,36 (с, 1H), 12,56 (уш.с, 1H)
ЖХ/МС m/z=448,10
ПРИМЕР 376
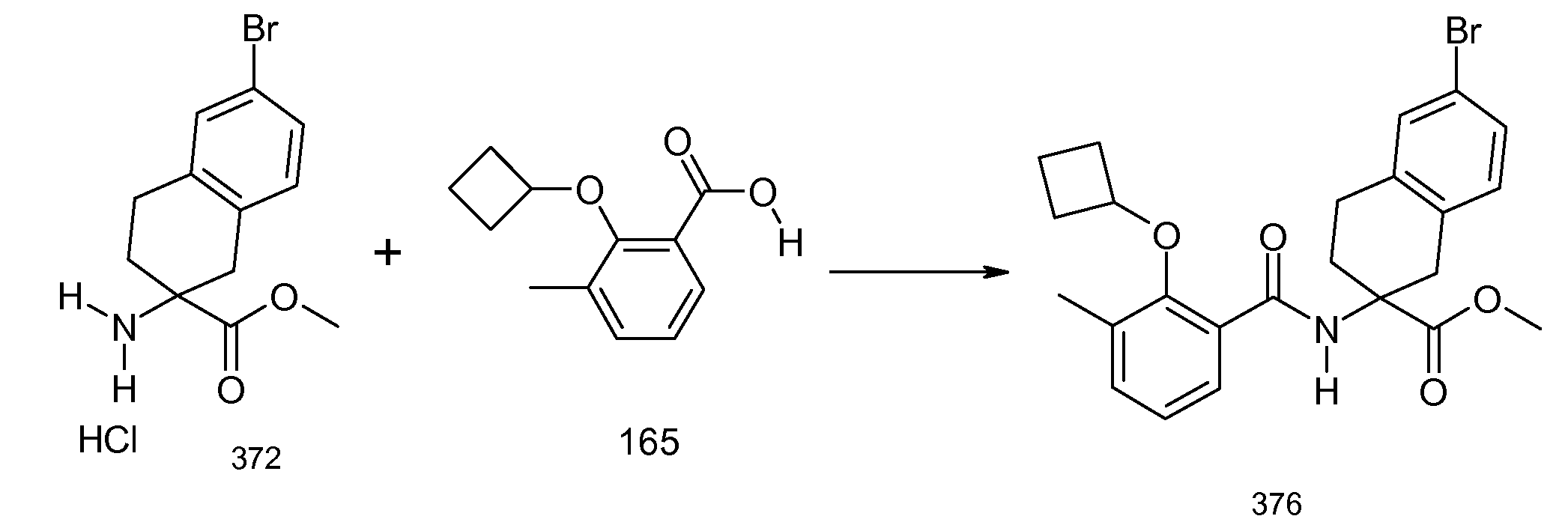
Метиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-6-бром-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (376)
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-циклобутокси-3-метилбензойную кислоту (165, 447 г, 2,17 ммоль), помещают сухой DCM (6,5 мл). Начинают перемешивать. Добавляют HBTU (824 мг, 2,17 ммоль). Добавляют гидрохлоридную соль метилового эфира 2-амино-6-бром-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (372, 590 мг, 2,17 ммоль) и затем DIPEA (1,1 мл, 6,35 ммоль). Реакционную смесь перемешивают в течение 18 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (1 н., 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,18 г твердого вещества не совсем белого цвета. Продукт растворяют в 10 мл DCM. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 10 объемов колонки и затем 90% EtOAc пропускают через 2 объема колонки с увеличением на один объем колонки. Отбирают фракции по 25 мл. Фракции 9-15 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая аморфное вещество белого цвета (0,81 г, 79%).
ПРИМЕР 377
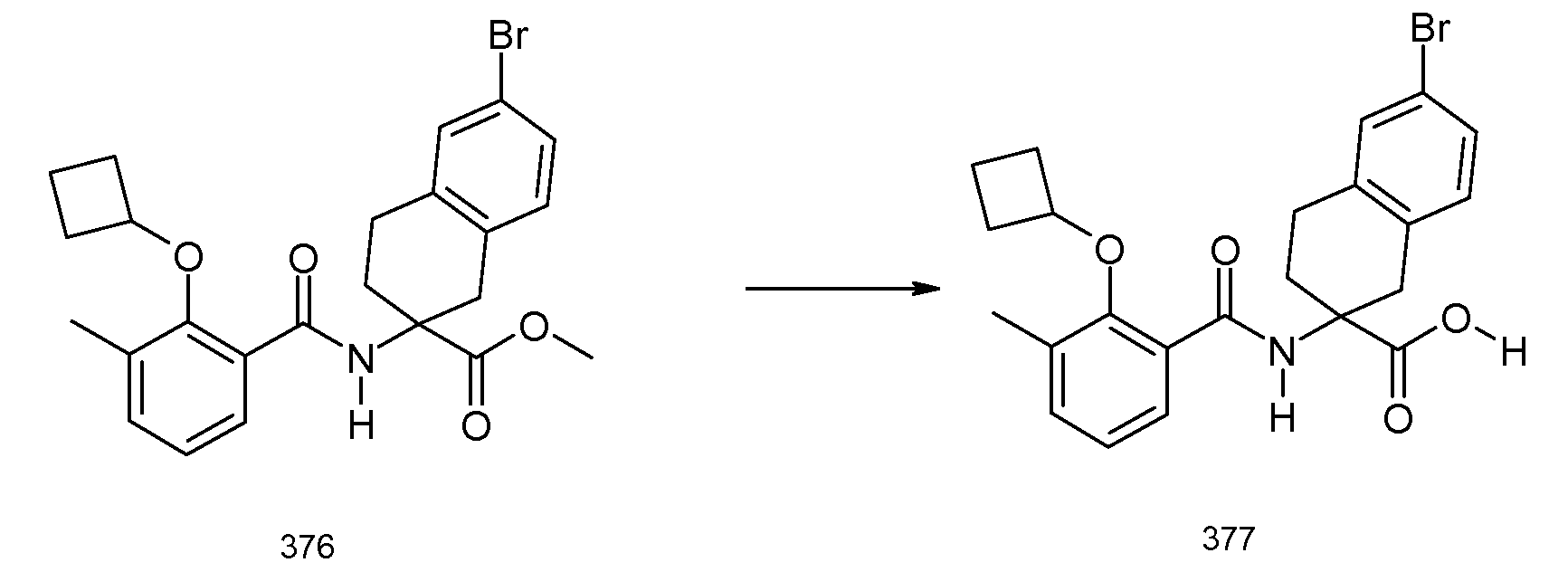
2-(2-Циклобутокси-3-метилбензоиламино)-6-бром-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновая кислота (377)
В колбу объемом 50 мл, содержащую метиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-6-бром-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (376, 0,44 г, 0,93 ммоль), помещают 1,4-диоксан (9 мл) и MeOH (9 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (4,5 мл) и затем моногидрат LiOH (173 мг, 4,12 ммоль). По истечении 64 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают твердое вещество не совсем белого цвета (0,40 г, 98%).
1H ЯМР (300 МГц, ДМСО-d6): δ 1,17-1,34 (м, 1H), 1,39-1,57 (м, 1H), 1,78-2,16 (м, 4H), 2,21 (с, 3H), 2,37-2,42(м, 1H), 2,74-2,98 (м, 2H), 3,15-3,27 (м, 3H), 4,34 (м, 1H), 7,01-7,11 (м, 2H), 7,25-7,35 (м, 3H), 8,34 (с, 1H), 12,53 (уш.с, 1H)
ЖХ/МС m/z=460,05
ПРИМЕР 378
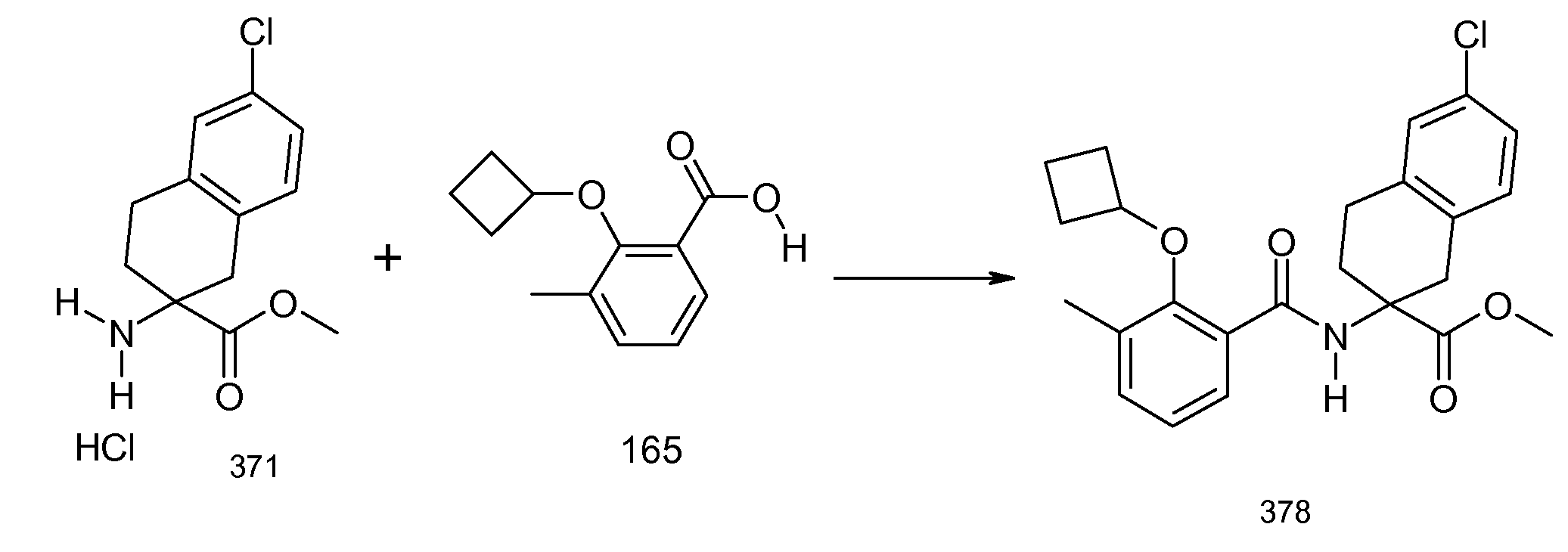
Метиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (375)
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-циклобутокси-3-метилбензойную кислоту (165, 447 г, 2,17 ммоль), помещают сухой DCM (6,5 мл). Начинают перемешивать. Добавляют HBTU (824 мг, 2,17 ммоль). Добавляют гидрохлоридную соль метилового эфира 2-амино-6-хлор-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (371, 590 мг, 2,17 ммоль) и затем DIPEA (1,1 мл, 6,35 ммоль). Реакционную смесь перемешивают в течение 18 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (1 н., 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), затем сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,18 г твердого вещества не совсем белого цвета. Продукт растворяют в 10 мл DCM. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 10 объемов колонки и затем 90% EtOAc пропускают через 2 объема колонки с увеличением на один объем колонки. Отбирают фракции по 25 мл УФ-активного элюента. Фракции 2-11 объединяют и выпаривают при откачивании до постоянного веса, получая аморфное вещество белого цвета (0,65 г, 70%).
ПРИМЕР 379
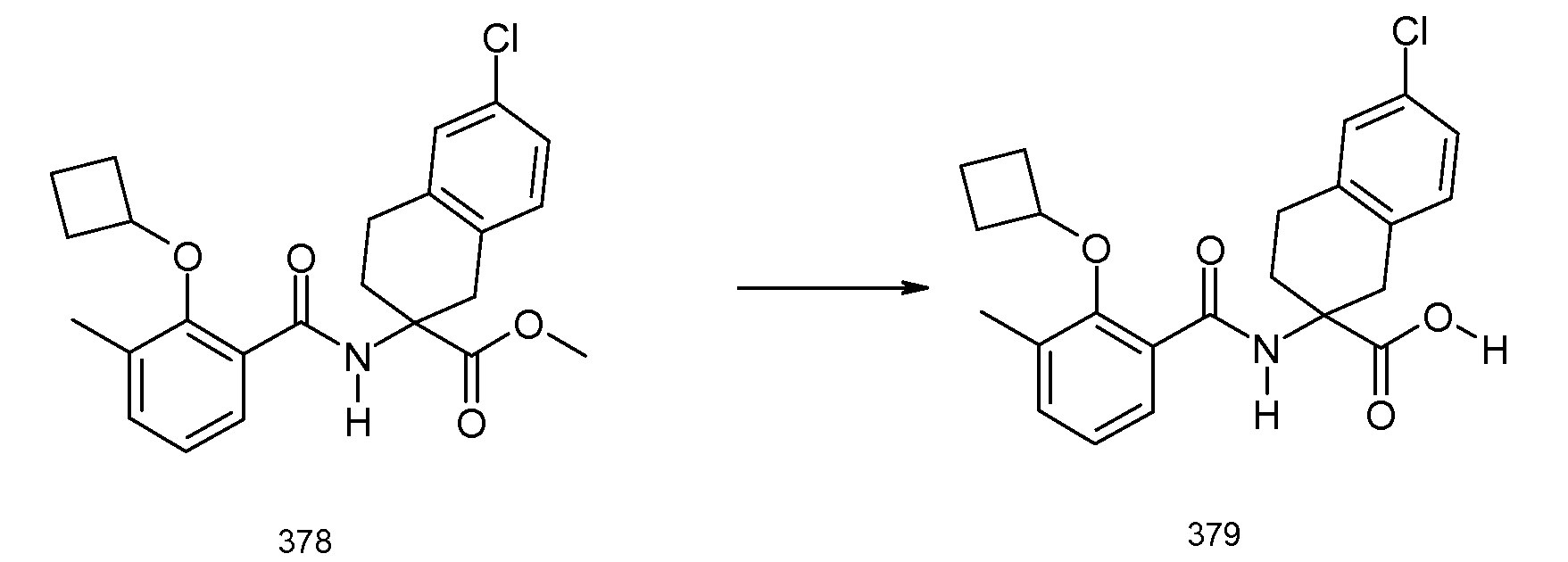
2-(2-Циклобутокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновая кислота (379)
В колбу объемом 50 мл, содержащую метиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (378, 0,42 г, 0,98 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем моногидрат LiOH (103 мг, 2,45 ммоль). По истечении 260 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают твердое вещество не совсем белого цвета (0,38 г, 93%).
1H ЯМР (300 МГц, ДМСО-d6): δ 1,08-1,17 (м, 1H), 1,21-1,36 (м, 1H), 1,78-2,13 (м, 4H), 2,21 (с, 3H), 2,37-2,43 (м, 1H), 2,77-2,98 (м, 2H), 3,17-3,37 (м, 3H), 4,34 (м, 1H), 7,02 (дд, 1H), 7,10-7,35 (м, 5H), 8,35 (с, 1H), 12,57 (уш.с, 1H)
ЖХ/МС m/z=414,15
ПРИМЕРЫ 380 и 381
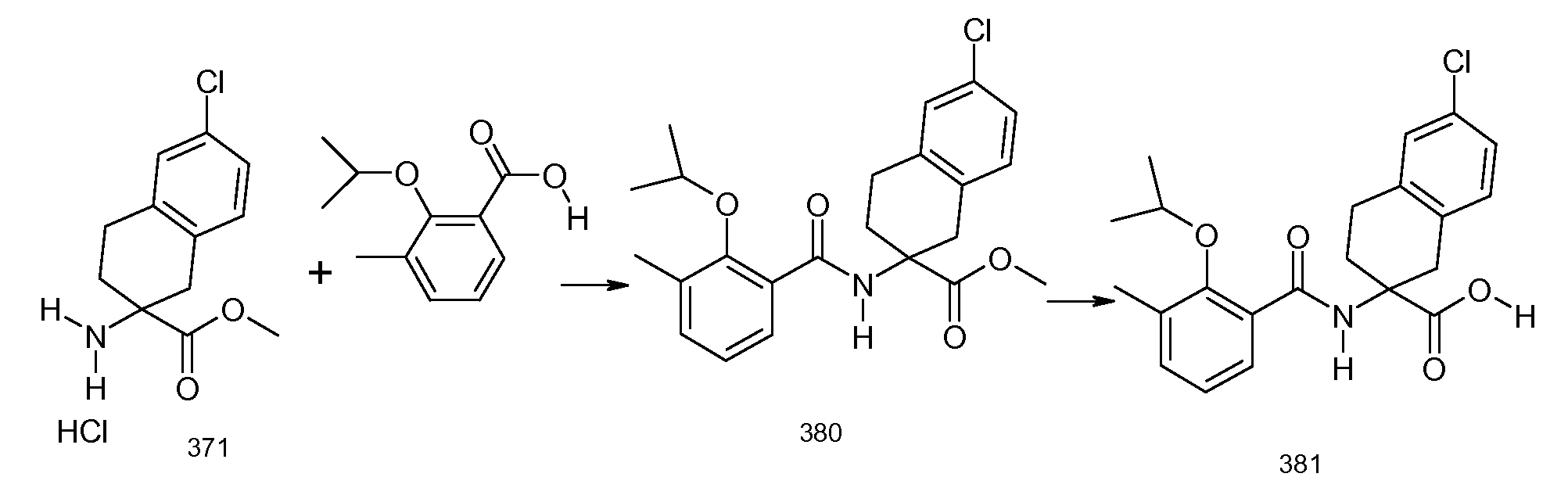
Метиловый эфир 2-(2-изопропокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (380)
2-(2-Изопропокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновая кислота (381)
2-(2-Изопропокси-3-метилбензоиламино)-6-хлор-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновую кислоту (381) синтезируют по методу, предложенному для продукта 379 выше, за исключением того, что 2-изопропокси-3-метилбензойной кислотой замещают 2-циклобутокси-3-метилбензойную кислоту на стадии образования амидных связей. Выход=94% на стадии 1. На стадии 2 получают твердое вещество белого цвета (0,43 г, 81%).
1H ЯМР (300 МГц, ДМСО-d6): δ 0,98 (д, 3H), 1,03 (д, 3H), 1,97-2,07 (м, 1H), 2,21 (с, 3H), 2,38-2,42 (м, 1H), 2,76-2,93 (м, 2H), 3,08-3,41 (м, 3H), 4,19 (м, 1H), 7,03 (дд, 1H), 7,11-7,20 (м, 3H), 7,27-7,35 (м, 2H), 8,35 (с, 1H), 12,52 (уш.с, 1H)
ЖХ/МС m/z=414,15
ПРИМЕРЫ 382 и 383
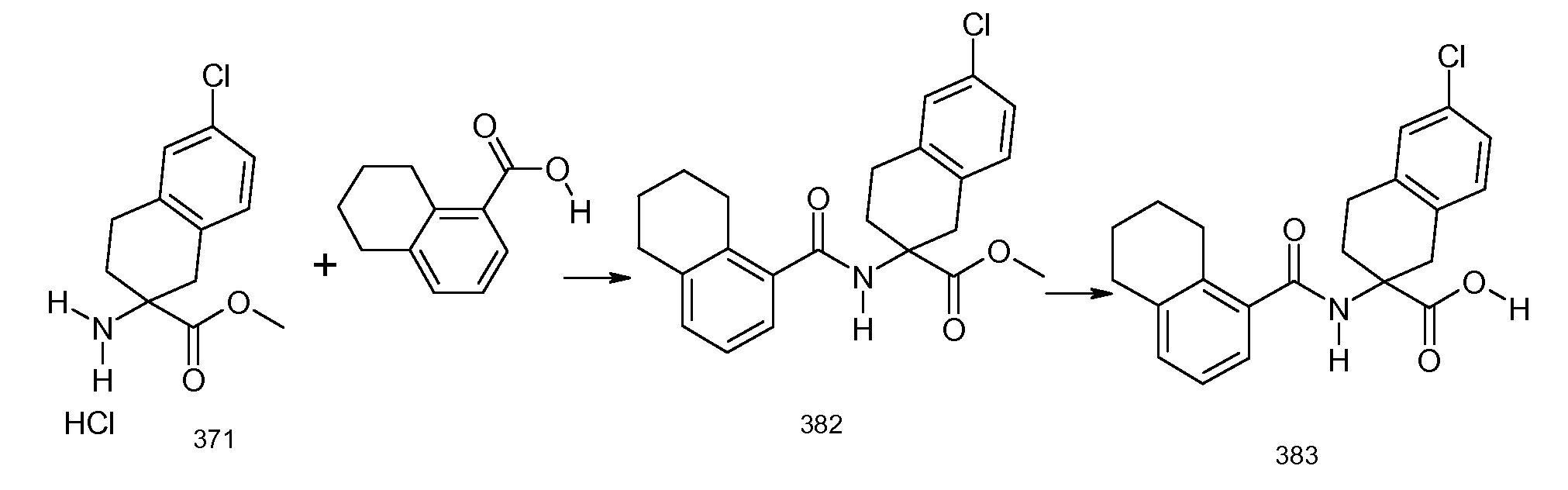
6-Хлор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-1,2,3,4-тетрагидронафталин-2-карбоновая кислота (383)
6-Хлор-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-1,2,3,4-тетрагидронафталин-2-карбоновую кислоту (383) синтезируют по методу, предложенному для продукта 379 выше, за исключением того, что 5,6,7,8-тетрагидро-1-нафталинкарбоновой кислотой замещают 2-циклобутокси-3-метилбензойную кислоту на стадии образования амидных связей. Выход=83% на стадии 1. На стадии 2 получают твердое вещество белого цвета (0,42 г, 99%).
1H ЯМР (300 МГц, ДМСО-d6): δ 1,56-1,78 (м, 4H), 1,88-2,08 (м, 1H), 2,33-2,41 (м, 1H), 2,48-3,07 (м, 8H), 6,92 (дд, 1H), 7,03-7,18 (м, 5H), 8,72 (с, 1H), 12,49 (уш.с, 1H)
ЖХ/МС m/z=384,11
ПРИМЕР 384
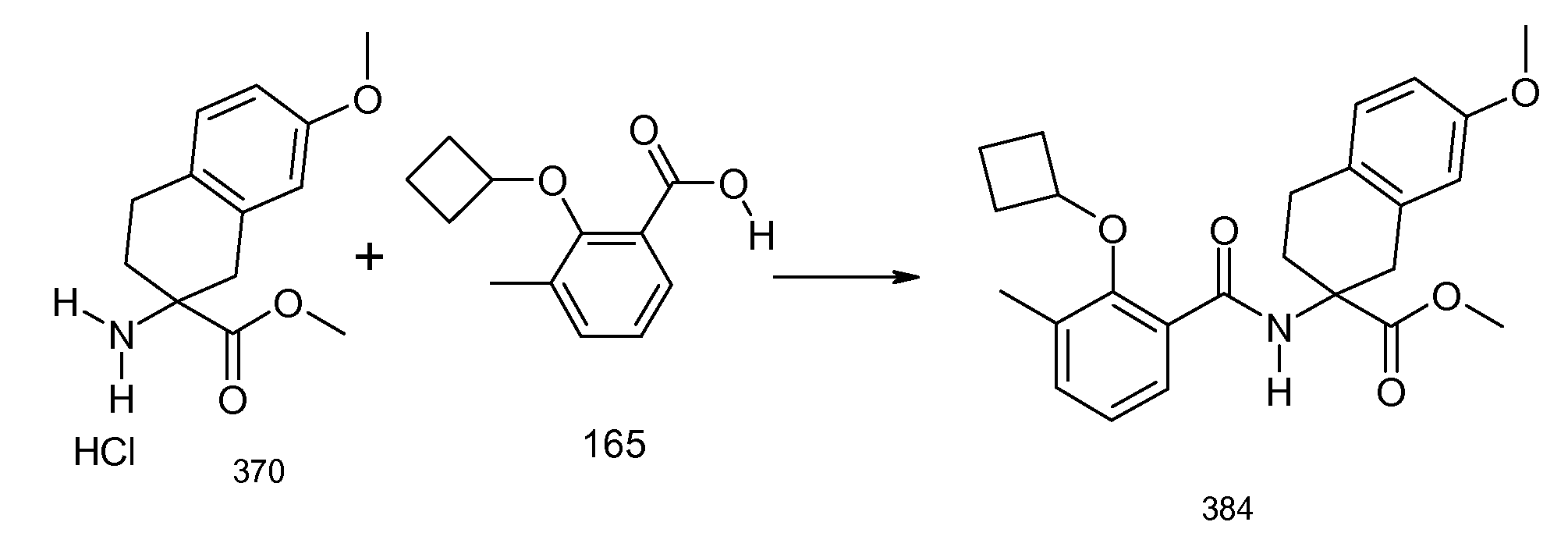
Метиловый эфир 6-метокси-2-[(5,6,7,8-тетрагидронафталин-1-карбонил)амино]-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (384)
В колбу объемом 40 мл, содержащую магнитную мешалку и 2-циклобутокси-3-метилбензойную кислоту (165, 447 г, 2,17 ммоль), помещают сухой DCM (6,5 мл). Начинают перемешивать. Добавляют HBTU (824 мг, 2,17 ммоль). Добавляют гидрохлоридную соль метилового эфира 2-амино-7-метокси-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (370, 590 мг, 2,17 ммоль) и затем DIPEA (1,1 мл, 6,35 ммоль). Реакционную смесь перемешивают в течение 18 часов. Анализ реакционной смеси при помощи ТСХ (силикагель, 10% MeOH/DCM) свидетельствует о полном расходе исходного амина. Содержимое реакционной колбы разбавляют EtOAc (50 мл) и переносят в делительную воронку. Смесь последовательно промывают разбавленным водным раствором HCl (1 н., 25 мл), насыщенным водным раствором NaHCO3 (25 мл) и насыщенным раствором соли (25 мл), сушат над MgSO4, фильтруют и выпаривают в вакууме с получением 1,2 г твердого вещества не совсем белого цвета. Продукт растворяют в 10 мл DCM. Данный продукт очищают на 40 г картридже на основе диоксида кремния, используя систему очистки ISCO Companion. Градиент 10% EtOAc в гептане пропускают через 3 объема колонки, после чего линейный градиент 50% EtOAc пропускают через 10 объемов колонки и затем 90% EtOAc пропускают через 2 объема колонки с увеличением на один объем колонки. Отбирают фракции по 25 мл УФ-активного элюента. Фракции 9-15 объединяют и выпаривают в вакууме при откачивании до постоянного веса, получая аморфное вещество белого цвета (0,86 г, 83%).
ПРИМЕР 385
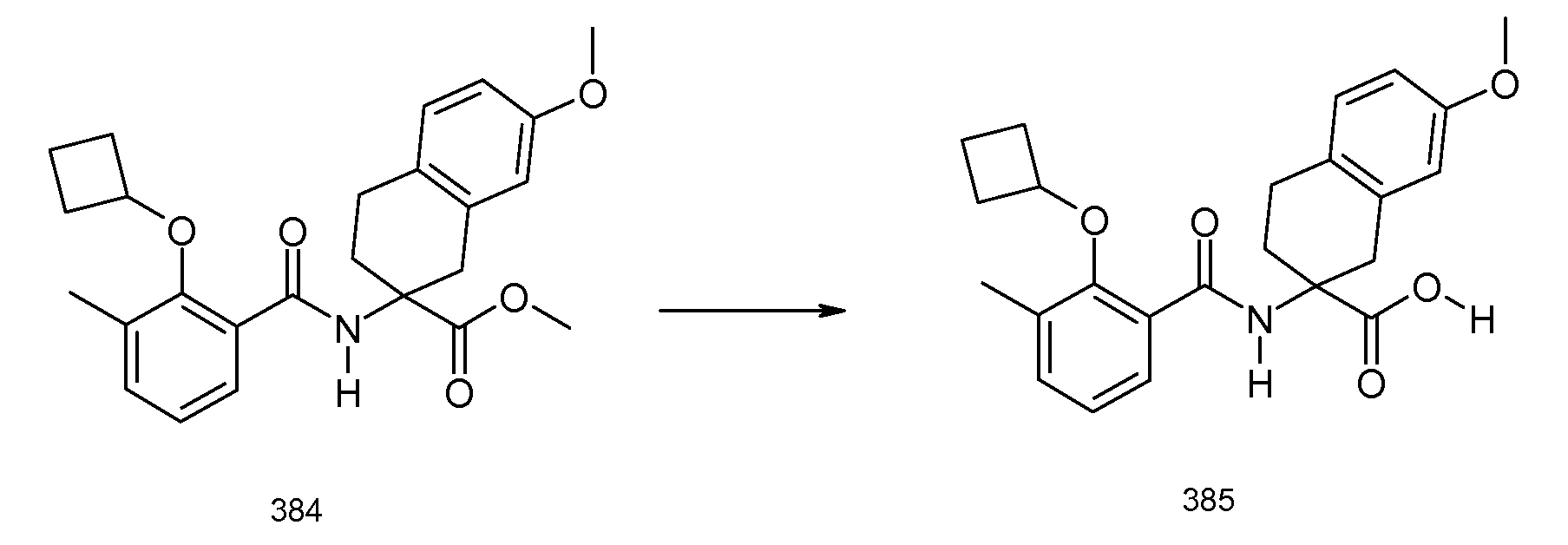
2-(2-Циклобутокси-3-метилбензоиламино)-6-метокси-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновая кислота (385)
В колбу объемом 50 мл, содержащую метиловый эфир 2-(2-циклобутокси-3-метилбензоиламино)-6-метокси-(5,6,7,8-тетрагидронафталин-1-карбонил)-2-карбоновой кислоты (384, 0,45 г, 1,06 ммоль), помещают 1,4-диоксан (5 мл) и MeOH (5 мл). Добавляют магнитную мешалку и начинают перемешивать. После растворения добавляют воду (2,5 мл) и затем моногидрат LiOH (111 мг, 2,65 ммоль). По истечении 37 часов анализ ТСХ (силикагель, 5% i-PrOH/DCM) показывает, что исходный продукт полностью израсходован. Значение pH реакционной смеси осторожно доводят до pH 2, постепенно добавляя разбавленный водный раствор HCl (3%, ~10 мл). Содержимое колбы сливают в делительную воронку, содержащую EtOAc (30 мл). Слои разделяют. Водный слой экстрагируют EtOAc (20 мл). Объединенные органические экстракты промывают водой (20 мл) и насыщенным раствором соли (20 мл), затем сушат над MgSO4, фильтруют и концентрируют. Откачиванием до постоянного веса получают твердое вещество не совсем белого цвета (0,43 г, 99%).
1H ЯМР (300 МГц, ДМСО-d6): δ 1,18-1,33 (м, 1H), 1,41-1,57 (м, 1H), 1,79-2,11 (м, 4H), 2,21 (с, 3H), 2,37-2,43 (м, 1H), 2,63-2,91 (м, 2H), 3,07-3,37 (м, 3H), 3,41 (с, 3H), 4,37 (м, 1H), 6,69-6,72 (м, 2H), 7,00-7,05 (м, 2H), 7,26-7,35 (м, 2H), 8,31 (с, 1H), 12,49 (уш.с, 1H)
ЖХ/МС m/z=410,15
ПРИМЕРЫ 386-389
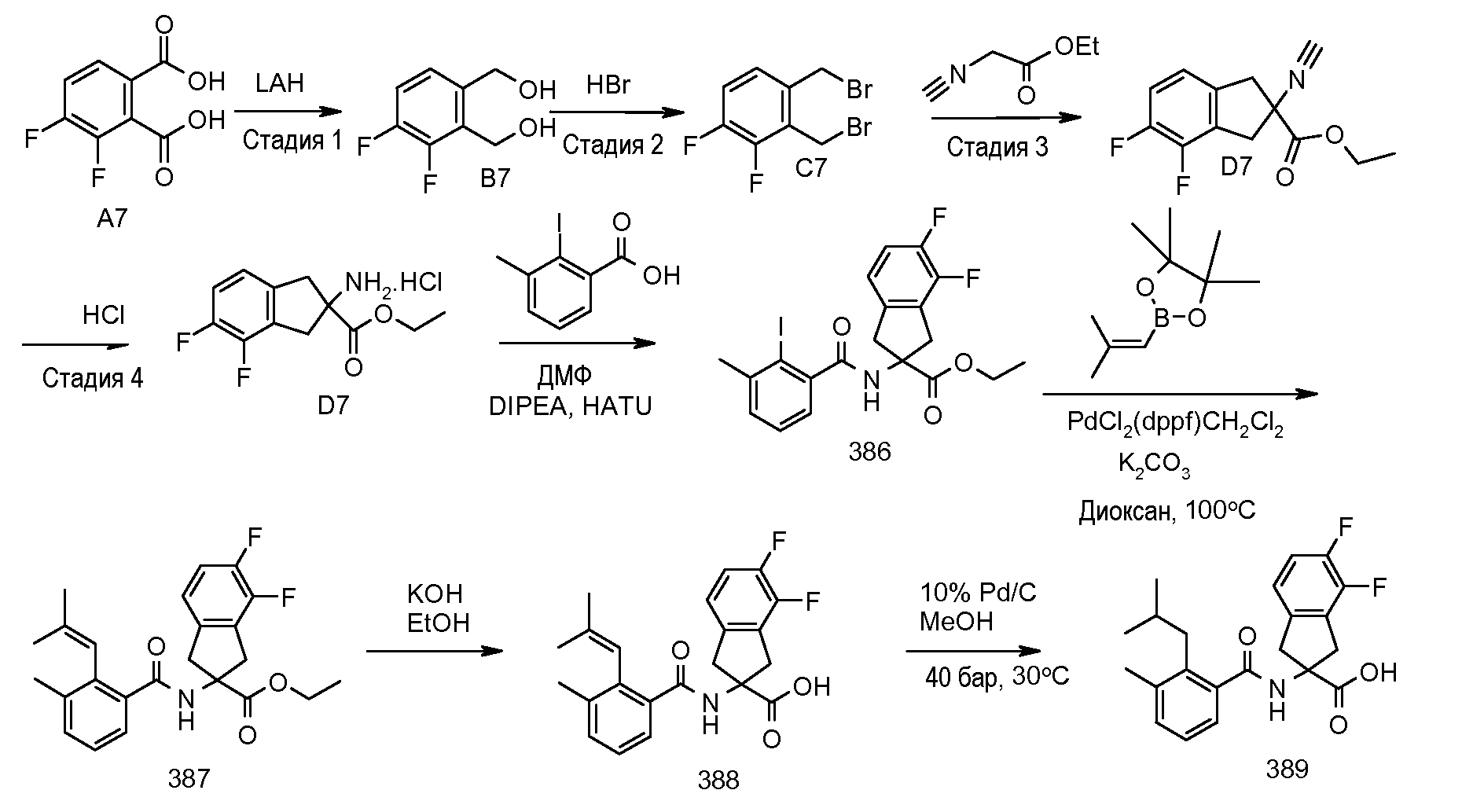
(2,3-Дифтор-6-гидроксиметилфенил)метанол (A7)
К суспензии LAH (6,2 г, 0,163 моль) в сухом ТГФ (100 мл) добавляют по каплям раствор 3,4-дифторфталевой кислоты (15 г, 0,074 моль) в ТГФ (75 мл) при 0°C. Полученную смесь нагревают при кипении с обратным холодильником в течение 3 часов. Через 3 часа реакционную смесь охлаждают и гасят насыщенным раствором Na2SO4. Затем реакционную массу фильтруют через слой целита и фильтрующий слой промывают MeOH. Объединенный фильтрат концентрируют, получая неочищенный продукт, который очищают колоночной флэш-хроматографией (силикагель, 5% MeOH в DCM). После объединения соответствующих фракций и удаления растворителя получают твердое вещество белого цвета (7 г, 54,2%).
1,2-Бисбромметил-3,4-дифторбензол (B7)
Суспензию (2,3-дифтор-6-гидроксиметилфенил)метанола (8 г, 0,046 моль) в 80 мл водного раствора HBr (47%) перемешивают при 80°C в течение 3 часов. После использования всего количества исходного продукта реакционную смесь охлаждают до комнатной температуры и экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли, сушат и концентрируют с получением твердого вещества темно-коричневого цвета (13 г, 94,2%), которое используют без дальнейшей очистки.
Этиловый эфир 4,5-дифтор-2-изоцианоиндан-2-карбоновой кислоты (C7)
Смесь соединения 1,2-бисбромметил-3,4-дифторбензола (8 г, 0,027 моль), этилизоцианоацетата (3,01 г, 0,0266 моль), K2CO3 (22,07 г, 0,159 моль) и гидросульфата тетрабутиламмония (5,45 г, 0,016 моль) в ACN (200 мл) нагревают при кипении с обратным холодильником в течение ночи. После использования всего количества исходного продукта реакционную смесь охлаждают до комнатной температуры и удаляют ACN при пониженном давлении. К неочищенной массе добавляют воду (300 мл) и затем экстрагируют EtOAc (3×250 мл). Объединенные органические экстракты промывают водой, сушат и концентрируют с получением неочищенного продукта. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель, 3% EtOAc в гексане) и растворитель удаляют, получая вязкую жидкость (1,6 г, 23,7%).
Гидрохлоридная соль этилового эфира 4,5-дифтор-2-аминоиндан-2-карбоновой кислоты (D7)
Перемешиваемый раствор этилового эфира 4,5-дифтор-2-изоцианоиндан-2-карбоновой кислоты (6 г, 0,0237 моль) в EtOH (100 мл) погружают в баню с ледяной водой и охлаждают. После охлаждения добавляют концентрированную HCl (5 мл). Реакционную смесь удаляют из ледяной бани, доводят до комнатной температуры и перемешивают в течение 3 часов. Затем реакционную смесь концентрируют, разбавляют водой и экстрагируют эфиром (2×50 мл). Органический слой отбрасывают, а водный слой охлаждают и доводят pH до 9-10, используя водный раствор аммиака. Полученный раствор экстрагируют EtOAc (3×100 мл). Объединенные экстракты промывают водой, сушат и концентрируют с получением вязкой массы (4,5 г, 78%). Данную неочищенную массу немедленно охлаждают до 5°C, подкисляют метанольным раствором HCl и концентрируют с получением гидрохлоридной соли этилового эфира 4,5-дифтор-2-аминоиндан-2-карбоновой кислоты.
Этиловый эфир 4,5-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (386):
К раствору 2-йод-3-метилбензойной кислоты (1,31 г, 5 ммоль), гидрохлоридной соли этилового эфира 2-амино-4,5-дифториндан-2-карбоновой кислоты (D7, 1,38 г, 5 ммоль), HATU [O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония PF6, 3,8 г, 10 ммоль] в безводном ДМФА (20 мл) добавляют DIPEA (N,N-диизопропилэтиламин, 3,3 мл, 15 ммоль). Полученный раствор перемешивают при комнатной температуре двое суток. После удаления ДМФА в вакууме полученный остаток растворяют в этилацетате (200 мл) и промывают насыщенным NaHCO3 (1×100 мл) и насыщенным раствором соли (2×100 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Полученный остаток очищают колоночной флэш-хроматографией (24 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (386) в виде твердого вещества белого цвета (1,93 г, 79%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,15 (т, 3H), 1,20 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 7,13-7,30 (м, 3H), 7,52 (м, 2H)
ЖХ/МС (ES+) m/z=486,1
Этиловый эфир 4,5-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (387):
К раствору этилового эфира 6-(4,5-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (386) (2,55 г, 5,25 ммоль) и пинаколового эфира 2-метил-1-пропенилбороновой кислоты (364 мг, 10,5 ммоль) в диоксане (100 мл) добавляют аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и дихлорметана (350 мг, 8,2% ммоль) и 2М водный раствор K2CO3 (7,87 мл, 15,75 ммоль). Полученную реакционную смесь продувают N2, нагревают до 100°C и непрерывно перемешивают в течение 6 часов. Реакционную смесь фильтруют, концентрируют в вакууме и полученный остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (387) в виде твердого вещества светло-коричневого цвета (1,24 г, 57%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,10 (т, 3H), 1,16 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 6,06 (с, 1H), 7,13-7,30 (м, 3H), 7,52 (м, 2H)
ЖХ/МС (ES+) m/z=414,47
4,5-Дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (388):
Этиловый эфир 4,5-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (387) (650 мг, 1,57 ммоль) растворяют в EtOH (50 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме полученный остаток растворяют в воде (20 мл) и промывают EtOAc (20 мл). Фазы разделяют и водную фазу подкисляют концентрированной HCl до pH 2. Твердый осадок собирают фильтрованием, сушат в вакууме и затем очищают методом ВЭЖХ. Желаемый продукт (388) получают в виде твердого вещества белого цвета (440,0 мг, 73%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,16 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 6,06 (с, 1H), 7,08-7,36 (м, 5H)
ЖХ/МС (ES+) m/z=386,3
4,5-Дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (389)
Раствор 4,5-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино)индан-2-карбоновой кислоты (388) (220 мг, 0,57 ммоль) в метаноле (40 мл) гидрируют в течение 24 часов, используя в качестве катализатора палладий на углероде (10%), при давлении 40 бар и температуре 30°C, с применением реактора H-Cube производства Thales Nanotechnology. Метанол концентрируют досуха в вакууме с получением продукта (389) в виде порошкообразного вещества белого цвета.
1H ЯМР (ДМСО-d6, 300МГц): δ 0,77 (д, 6H), 1,74 (м, 1H), 2,27 (с, 3H), 2,62 (д, 2H), 3,31 (д, 2H), 3,48 (д, 2H), 7,00-7,39 (м, 5H)
ЖХ/МС (ES+) m/z=388,3
ПРИМЕРЫ 390-393
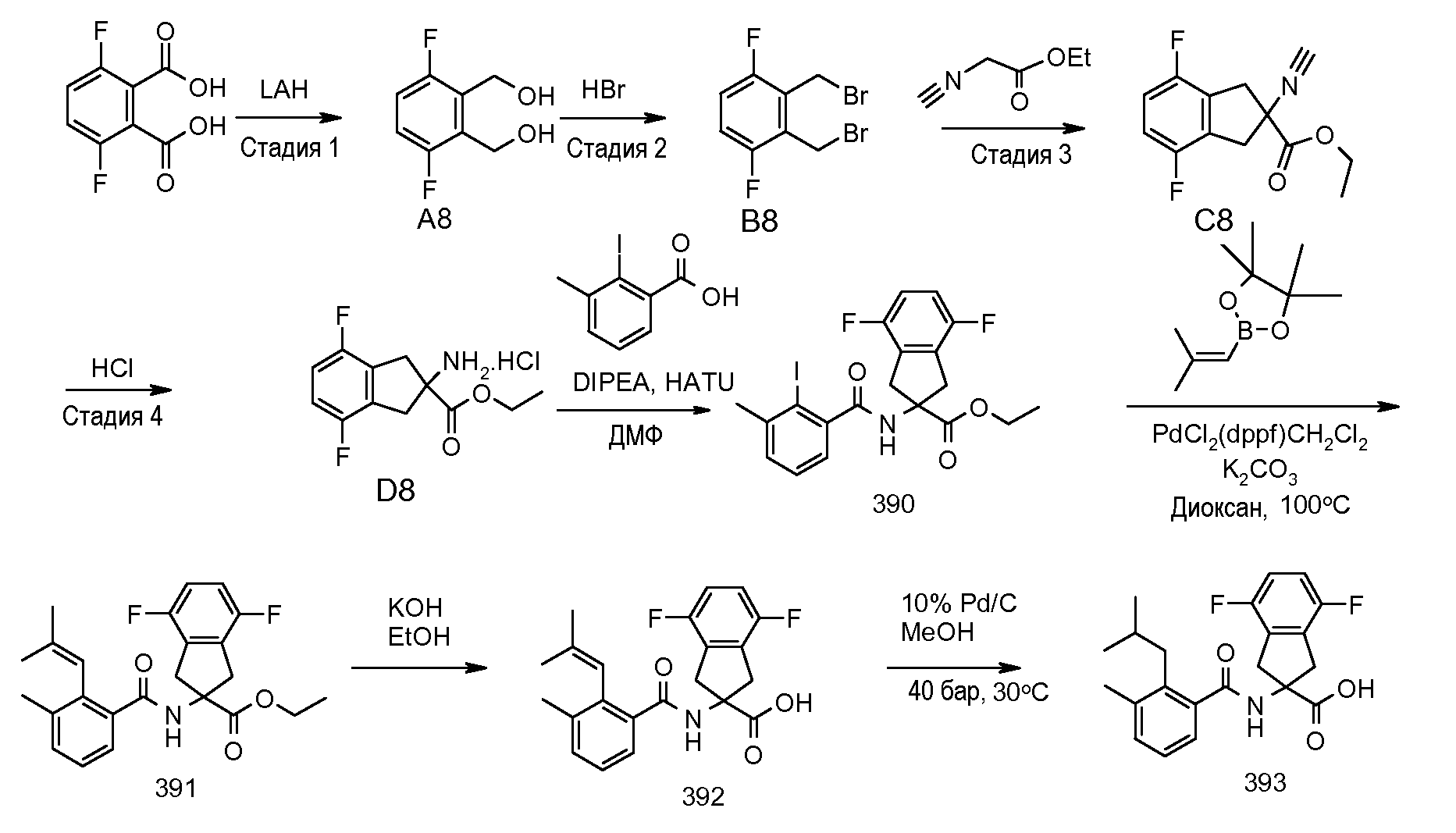
Гидрохлоридную соль этилового эфира 2-амино-4,7-дифториндан-2-карбоновой кислоты получали из 3,6-дифторфталевой кислоты, как показано на приведенной выше схеме применительно к A7-D7, с использованием таких же методов, как и для синтеза гидрохлоридной соли этилового эфира 2-амино-4,5-дифториндан-2-карбоновой кислоты.
Этиловый эфир 4,7-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (390):
К раствору 2-йод-3-метилбензойной кислоты (1,31 г, 5 ммоль), гидрохлоридной соли этилового эфира 2-амино-4,7-дифториндан-2-карбоновой кислоты (1,38 г, 5 ммоль), HATU [O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония PF6, 3,80 г, 10 ммоль] в безводном ДМФА (20 мл) добавляют DIPEA (N,N-диизопропилэтиламин, 3,3 мл, 15 ммоль). Полученный раствор перемешивают при комнатной температуре в течение двух суток. После удаления ДМФА в вакууме полученный остаток растворяют в EtOAc (200 мл) и промывают насыщенным NaHCO3 (1×100 мл) и насыщенным раствором соли (2×100 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Полученный остаток очищают колоночной флэш-хроматографией (40 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (390) в виде твердого вещества белого цвета (1,83 г, 75%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,15 (т, 3H), 1,20 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 7,13-7,30 (м, 5H)
ЖХ/МС (ES+) m/z=486,1
Этиловый эфир 4,7-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (391):
К раствору этилового эфира 4,7-дифтор-2-(2-йод-3-метилбензоиламино)индан-2-карбоновой кислоты (390) (451 мг, 1 ммоль) и пинаколового эфира 2-метил-1-пропенилбороновой кислоты (364 мг, 2 ммоль) в диоксане (20 мл) добавляют аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и дихлорметана (65 мг, 8,2% ммоль) и 2М водный раствор K2CO3 (1,5 мл, 3 ммоль). Полученную реакционную смесь продувают N2, нагревают до 100°C и непрерывно перемешивают в течение 4 часов. Реакционную смесь фильтруют, концентрируют в вакууме и полученный остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (391) в виде масла светло-коричневого цвета (150 мг, 36%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,10 (т, 3H), 1,16 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 6,06 (с, 1H), 7,13-7,30 (м, 5H)
ЖХ/МС (ES+) m/z=414,47
4,7-Дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (392):
Этиловый эфир 4,7-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (391) (133 мг, 0,32 ммоль) растворяют в EtOH (20 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (2 мл). Реакционную смесь перемешивают при комнатной температуре. После концентрирования в вакууме полученный остаток растворяют в воде (20 мл) и промывают EtOAc (20 мл). Фазы разделяют и водную фазу подкисляют концентрированной HCl до pH 2. Водную фазу промывают 100 мл EtOAc. Органические фазы собирают, концентрируют досуха и затем полученный остаток очищают методом ВЭЖХ. Желаемый продукт (392) получают в виде твердого вещества белого цвета (38 мг, 28%).
1H ЯМР (ДМСО-d6, 300МГц): δ 1,21 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 6,06 (с, 1H), 7,08-7,36 (м, 5H)
ЖХ/МС (ES+) m/z=386,3
4,7-Дифтор-2-(2-изобутил-3-метилбензоиламино)индан-2-карбоновая кислота (393)
Раствор 4,7-дифтор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (392) (82 мг, 0,21 ммоль) в MeOH (40 мл) гидрируют в течение 5 часов, используя в качестве катализатора палладий на углероде (10%), при давлении 40 бар и температуре 30°C, с применением реактора H-Cube производства Thales Nanotechnology. MeOH концентрируют досуха в вакууме с получением продукта (393) в виде порошкообразного вещества белого цвета.
1H ЯМР (ДМСО-d6, 300МГц): δ 0,76 (д, 6H), 1,72 (м, 1H), 2,28 (с, 3H), 2,61 (д, 2H), 3,42 (д, 2H), 3,51 (д, 2H), 6,93-7,30 (м, 5H)
ЖХ/МС (ES+) m/z=388,3
ПРИМЕРЫ 394-395
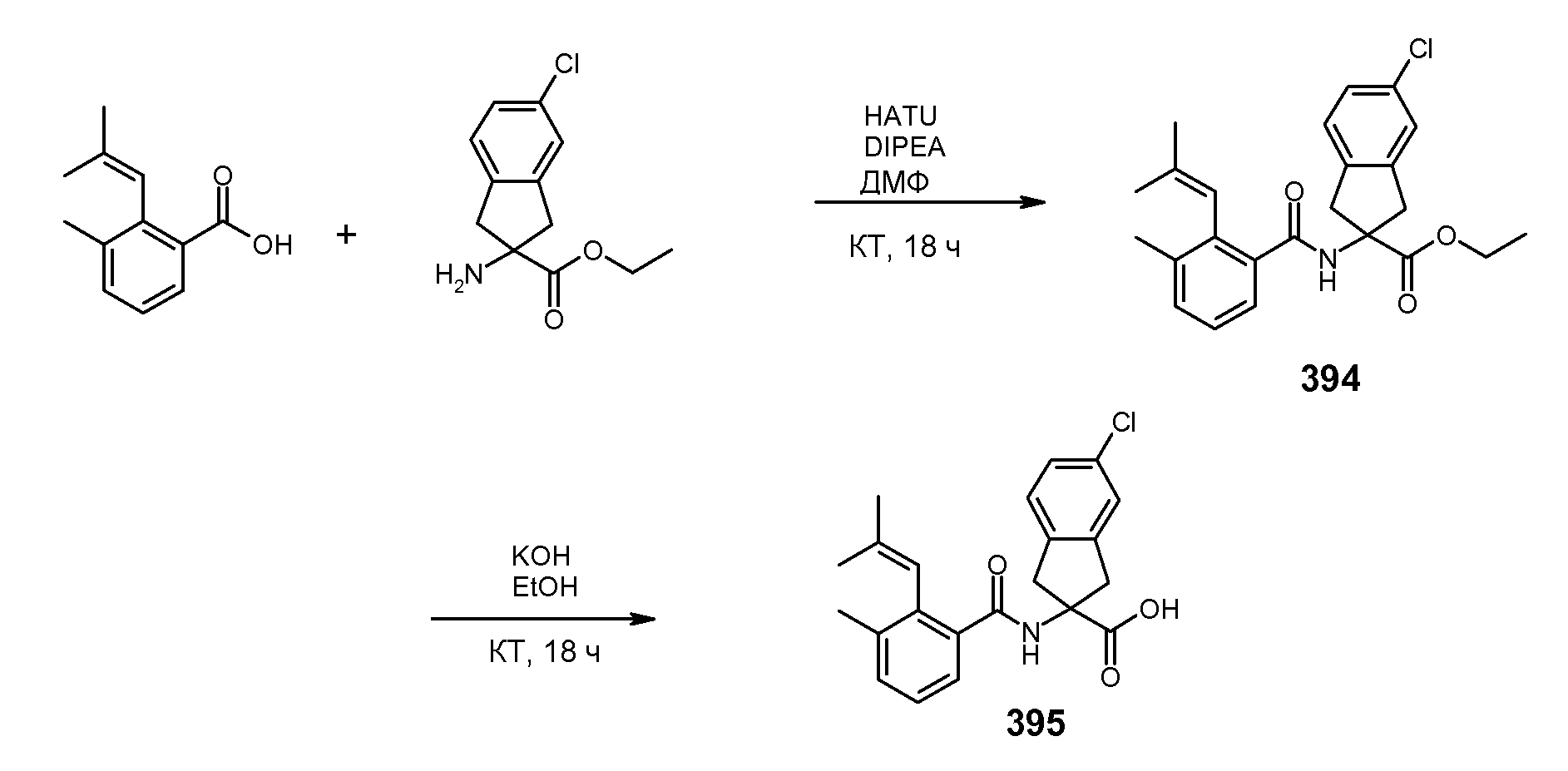
Этиловый эфир 5-хлор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (394):
К раствору 3-метил-2-(2-метилпропенил)бензойной кислоты (95 мг, 0,50 ммоль), этилового эфира 5-хлор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (120 мг, 0,5 ммоль), HATU [O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония PF6, 380 мг, 1 ммоль] в безводном ДМФА (10 мл) добавляют DIPEA (N,N-диизопропилэтиламин, 0,25 мл, 1,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 18 часов. После удаления ДМФА в вакууме полученный остаток растворяют в EtOAc (200 мл) и промывают насыщенным NaHCO3 (1×100 мл) и насыщенным раствором соли (2×100 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Полученный остаток очищают колоночной флэш-хроматографией (40 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (394) в виде твердого вещества белого цвета (120 мг, 58%).
1H ЯМР (d-ДМСО, 300МГц): δ 1,10 (т, 3H), 1,16 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 6,06 (с, 1H), 7,13-7,30 (м, 6H)
ЖХ/МС (ES+) m/z=411,93
5-Хлор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновая кислота (395):
Этиловый эфир 5-хлор-2-[3-метил-2-(2-метилпропенил)бензоиламино]индан-2-карбоновой кислоты (394) (120 мг, 0,3 ммоль) растворяют в EtOH (20 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После концентрирования в вакууме полученный остаток растворяют в воде (20 мл) и промывают EtOAc (20 мл). Фазы разделяют и водную фазу подкисляют концентрированной HCl до pH 2. Водную фазу промывают 100 мл EtOAc. Органические фазы собирают, концентрируют досуха и затем полученный остаток очищают методом ВЭЖХ. Желаемый продукт (395) получают в виде твердого вещества белого цвета (73 мг, 63%).
1H ЯМР (d-ДМСО, 300МГц): δ 1,21 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 6,06 (с, 1H), 7,08-7,36 (м, 6H)
ЖХ/МС (ES+) m/z=383,88
ПРИМЕРЫ 396-397
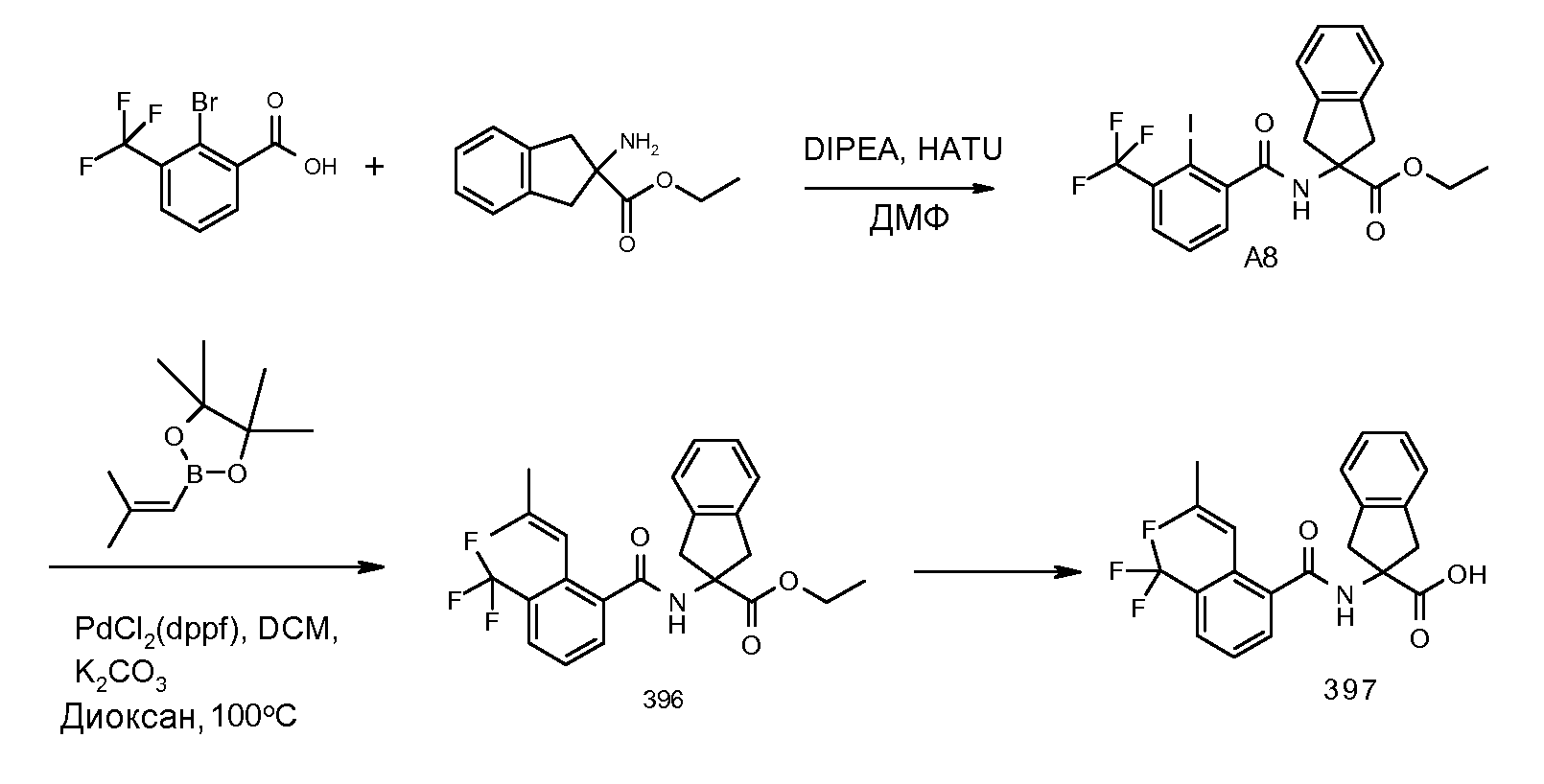
Этиловый эфир 2-(2-йод-3-трифторметилбензоиламино)индан-2-карбоновой кислоты (A8):
К раствору 2-бром-3-(трифторметил)бензойной кислоты (5 г, 18,59 ммоль), этилового эфира 2-аминоиндан-2-карбоновой кислоты (3,82 г, 18,59 ммоль) и HATU (14,14 г, 37,19 ммоль) в безводном ДМФА (75 мл) добавляют DIPEA (6,15 мл, 37,19 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи. После удаления ДМФА в вакууме полученный остаток растворяют в EtOAc (100 мл) и промывают насыщенным NaHCO3 (1×100 мл) и насыщенным раствором соли (2×100 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Полученный остаток очищают колоночной флэш-хроматографией (115 г силикагеля, градиентное элюирование: 0%-50% этилацетата в гептане) с получением чистого продукта (A8) в виде твердого вещества светло-коричневого цвета (4,9 г, 58%).
1H ЯМР (d-ДМСО, 300МГц): 1,15 (т, 3H), 1,20 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 7,12-7,28 (м, 4H), 7,55 (м, 2H), 7,75 (д, 1H)
ЖХ/МС (ES+) m/z=455,1
Этиловый эфир 2-[2-(2-метилпропенил)-3-трифторметилбензоиламино]индан-2-карбоновой кислоты (396)
К раствору этилового эфира 2-(2-йод-3-трифторметилбензоиламино)индан-2-карбоновой кислоты (A8) (500 г, 1,10 ммоль) и пинаколового эфира 2-метил-1-пропенилбороновой кислоты (400 мг, 2,20 ммоль) в диоксане (20 мл) добавляют аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и DCM (71,8 мг, 8,2% ммоль) и 2М водный раствор K2CO3 (1,65 мл, 3,30 ммоль). Полученную реакционную смесь продувают N2, нагревают до 100°C и непрерывно перемешивают в течение ночи. Реакционную смесь фильтруют, концентрируют в вакууме и полученный остаток очищают колоночной флэш-хроматографией (12 г силикагеля, градиентное элюирование: 0%-50% EtOAc в гептане) с получением чистого продукта (396) в виде масла светло-коричневого цвета (100 мг, 21%).
1H ЯМР (d-ДМСО, 300МГц): 1,10 (т, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 4,25 (м, 2H), 6,06 (с, 1H), 7,12-7,28 (м, 4H), 7,55 (м, 2H), 7,75 (д, 1H)
ЖХ/МС (ES+) m/z=431,27
2-[2-(2-Метилпропенил)-3-трифторметилбензоиламино]индан-2-карбоновая кислота (397):
Этиловый эфир 2-[2-(2-метилпропенил)-3-трифторметилбензоиламино]индан-2-карбоновой кислоты (2) (100 мг, 0,32 ммоль) растворяют в EtOH (20 мл) и перемешивают при комнатной температуре. В этот раствор добавляют 5M KOH (2 мл). Реакционную смесь нагревают при кипении с обратным холодильником и перемешивают в течение 1 часа. После концентрирования в вакууме полученный остаток растворяют в воде (10 мл) и промывают EtOAc (20 мл). Фазы разделяют и водную фазу подкисляют концентрированной HCl до pH 2. Водную фазу промывают три раза 50 мл эфира. Органические фазы собирают, концентрируют досуха и затем полученный остаток очищают методом ВЭЖХ. Желаемый продукт (397) получают в виде твердого вещества белого цвета (40,0 мг, 43%).
1H ЯМР (d-ДМСО, 300МГц): 1,21 (с, 3H), 1,66 (с, 3H), 2,12 (с, 3H), 3,24 (д, 2H), 3,48 (д, 2H), 6,06 (с, 1H), 7,12-7,28 (м, 4H), 7,55 (м, 2H), 7,75 (д, 1H)
ЖХ/МС (ES+) m/z=403,13