Результат интеллектуальной деятельности: УСИЛЕННЫЙ ИММУННЫЙ ОТВЕТ У ВИДОВ ПТИЦ
Вид РИД
Изобретение
Данное изобретение относится к способу активации иммунной системы у видов птиц. В частности, данное изобретение включает способы вызывания респираторного и системного, неспецифического и антиген-специфического ответов, которые полезны для иммунизации, вакцинации и лечения животных от инфекционной болезни.
Вакцины используются для предотвращения инфекционной болезни и для лечения выявленных болезней. Инфекционные болезни вызываются инфекционными агентами, включающими такие агенты, как вирусы, бактерии, паразиты и грибы. Для профилактики и лечения инфекционных болезней было разработано множество активных веществ и способов для всех видов, включая млекопитающих, птиц, рыб и приматов.
Программы вакцинации особенно важны для выращиваемых в коммерческих целях животных, применяемых в пищевой промышленности. Птицы являются основными мишенями для многих типов инфекций. Племенных и промышленных кур, индеек и другую птицу обычно вакцинируют, чтобы защитить от патогенов из окружающей среды. Одним из наиболее экономически важных болезней в птицеводстве является болезнь Марека, которая представляет собой лимфопролиферативное заболевание, которое возникает в природе у кур. Болезнь вызывается высокозаразным вирусом герпеса, который распространяется горизонтально, и отвечает за основные экономические потери в птицеводстве. Симптомы болезни Марека значительно проявляются в нервах, гениталиях, внутренних органах, глазах и на коже инфицированных птиц, вызывая двигательный паралич, пониженное функционирование органов и хроническое недоедание, которое обязательно приводит к смерти.
Вылупившиеся птенцы подвергаются действию патогенных микроорганизмов сразу же после вылупления. Хотя птенцы изначально защищены от патогенов антителами, полученными от матери, эта защита является только временной, и собственная незрелая иммунная система птицы должна начать защищать птицу от патогенов. Часто является желательным предотвращать у молодых птиц инфекции, которым они наиболее восприимчивы. Также желательно предотвращать инфекции у более взрослых птиц, особенно когда птиц содержат в тесном соседстве, что приводит к быстрому распространению болезни.
В большинстве промышленных стад только что вылупившимся птенцам вводят определенные вакцины парентерально при вылуплении. Так как атака патогенов часто происходит в совсем юном возрасте, их необходимо вакцинировать перед тем, как их поместят в помещение для молодняка или брудер. Такая схема вакцинации требует обработки каждой птицы и включает возможный риск случайного самозаражения. Кроме того, эти вакцины не всегда эффективны. Молодые цыплята могут быть подвержены вирулентной форме болезни слишком быстро после вакцинации, еще перед тем, как у них появится возможность развить адекватный защитный иммунитет.
Некоторые живые вирусные вакцины могут быть введены в яйца перед вылуплением птиц. Эту методику называют "вакцинация in ovo". У вакцинированных in ovo птиц развивается резистентность к целевому заболеванию. Однако многие вакцины, применяемые для вылупившихся птиц, не могут применяться для вакцинации in ovo из-за эмбриональной патогенности агентов вакцины. Эмбрионы на поздней стадии высоко восприимчивы к заражению большинством исследованных вирусов в вакцинах. Не все вирусы в вакцинах, которые не патогенны для вылупившихся птенцов, также безопасны для эмбрионов на поздней стадии. Например, штаммы для вакцин вируса инфекционного бронхита (IBV) и вируса болезни Ньюкасла (NDV), которые обычно применяют в качестве вакцин для только что вылупившихся цыплят, являются летальными для эмбрионов после инокуляции in ovo. Эти вирусы были модифицированы для того, чтобы сделать их безопасными для применения in ovo. Модификация вирусов ослабляет вызываемый иммунный ответ, и, следовательно, такая вакцина является менее эффективным вакцинирующим агентом для защиты эмбрионов на поздней стадии.
Программа вакцинации, полученная из таких в корне отличных вакцин, необходимых для обеспечения защиты от инфекционных болезней и экономических потерь, является комплексной. Поэтому существует необходимость в способе вызывания антиген-неспецифического иммунного ответа, который усилит защиту птиц от инфекционных болезней и будет простым в применении. Кроме того, желательно иметь способ вызывания иммунного ответа, который обеспечивает защитную функцию от более чем одного инфекционного агента. Далее, существует необходимость в способе вызывания иммунного ответа, который является более длительным или не требует ревакцинации. В данном изобретении представлен способ вызывания антиген-неспецифического иммунного ответа у видов птиц, который также снижает заболеваемость стада, обеспечивает защитную функцию от более чем одного инфекционного агента и обеспечивает защиту в течение более длительного периода времени по сравнению с другими продуктами, известными из уровня техники.
Краткое описание фигур
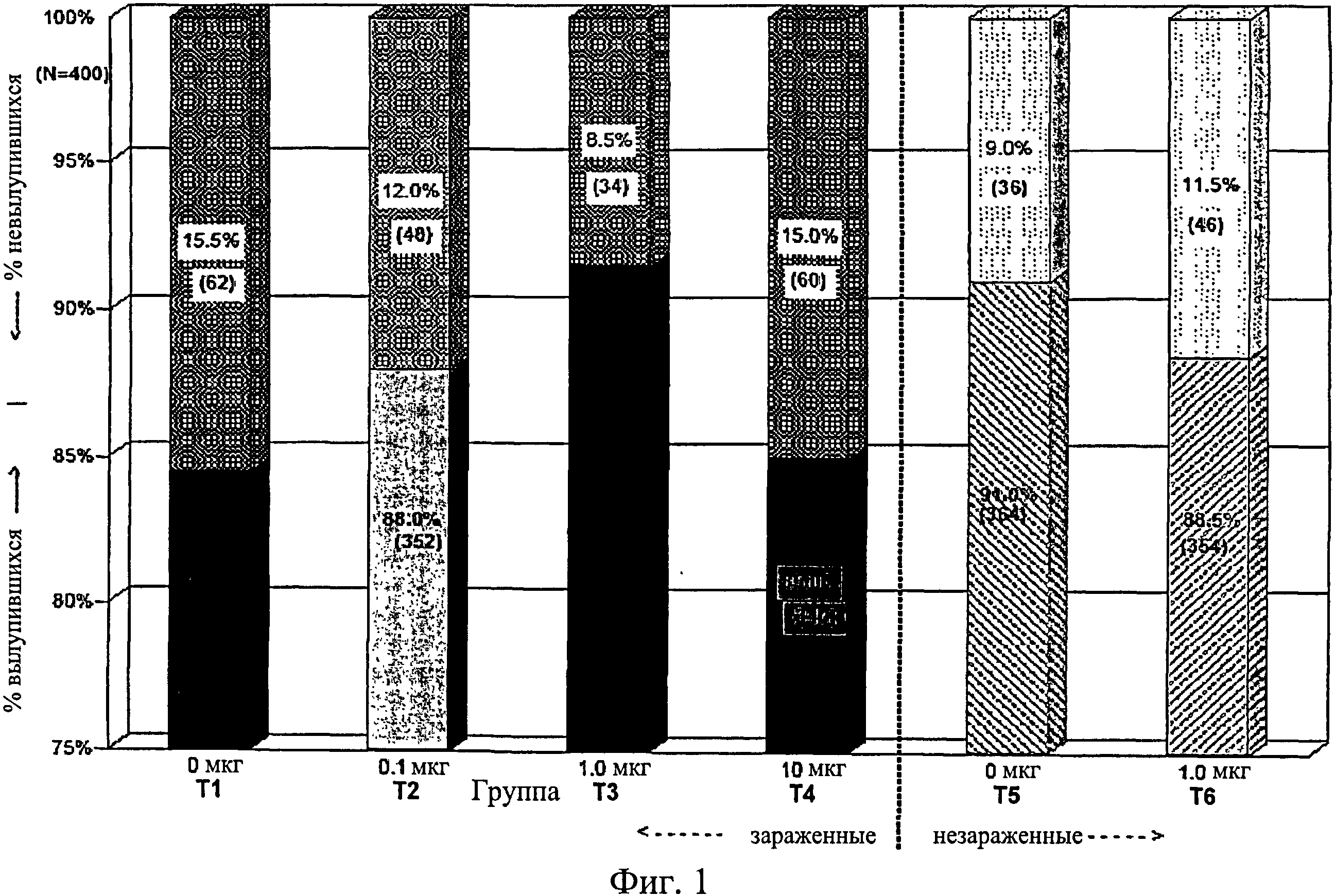
На фиг.1 графически изображена скорость вылупления цыплят между различно обработанными группами оплодотворенных куриных яиц. Анализируемые в исследовании группы включают Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
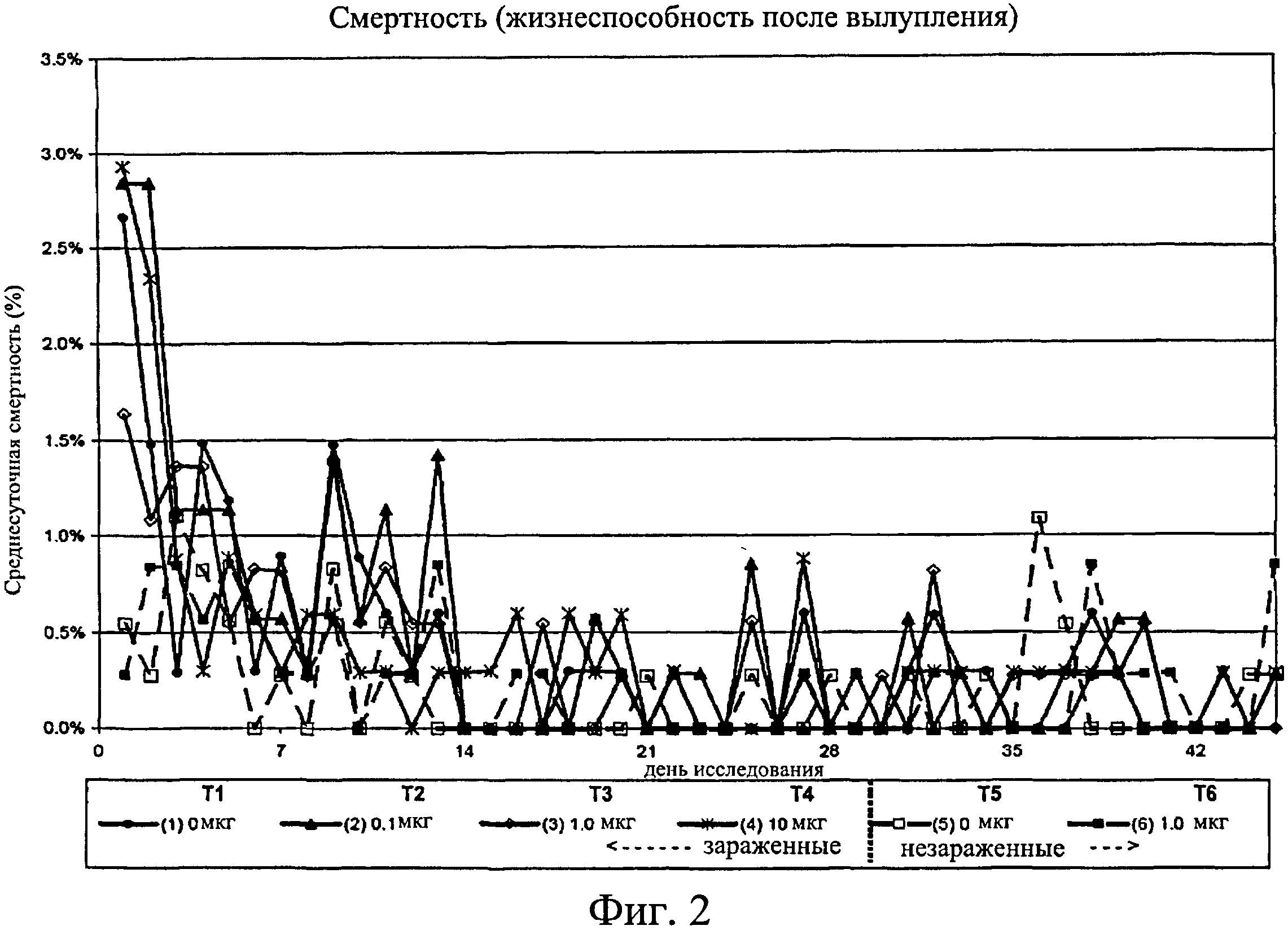
На фиг.2 графически изображена среднесуточная смертность после вылупления на отсек в день. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
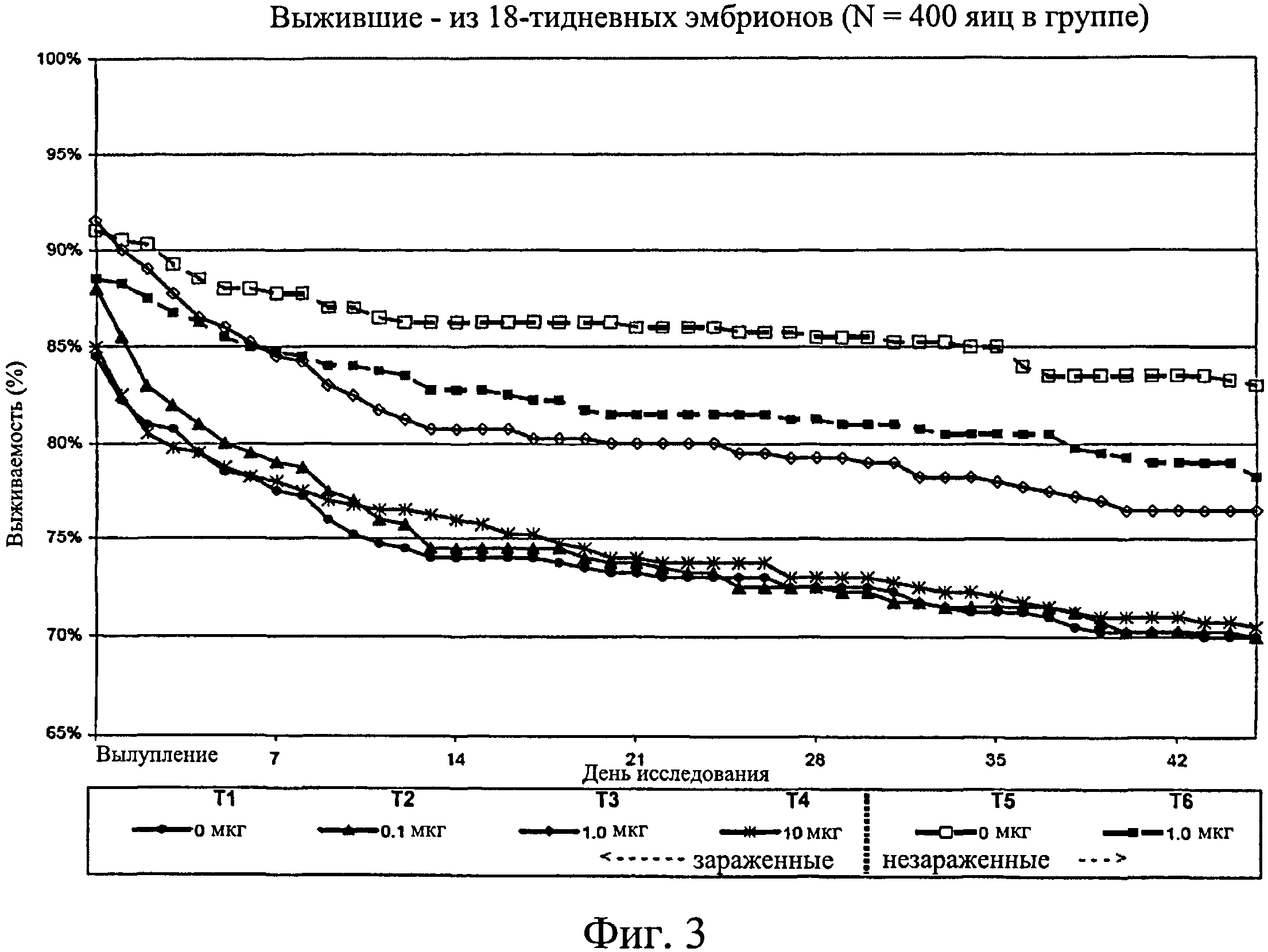
На фиг.3 графически изображено соотношение птиц, выживших на любой конкретный день на отсек, по отношению к исходному количеству оплодотворенных яиц. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
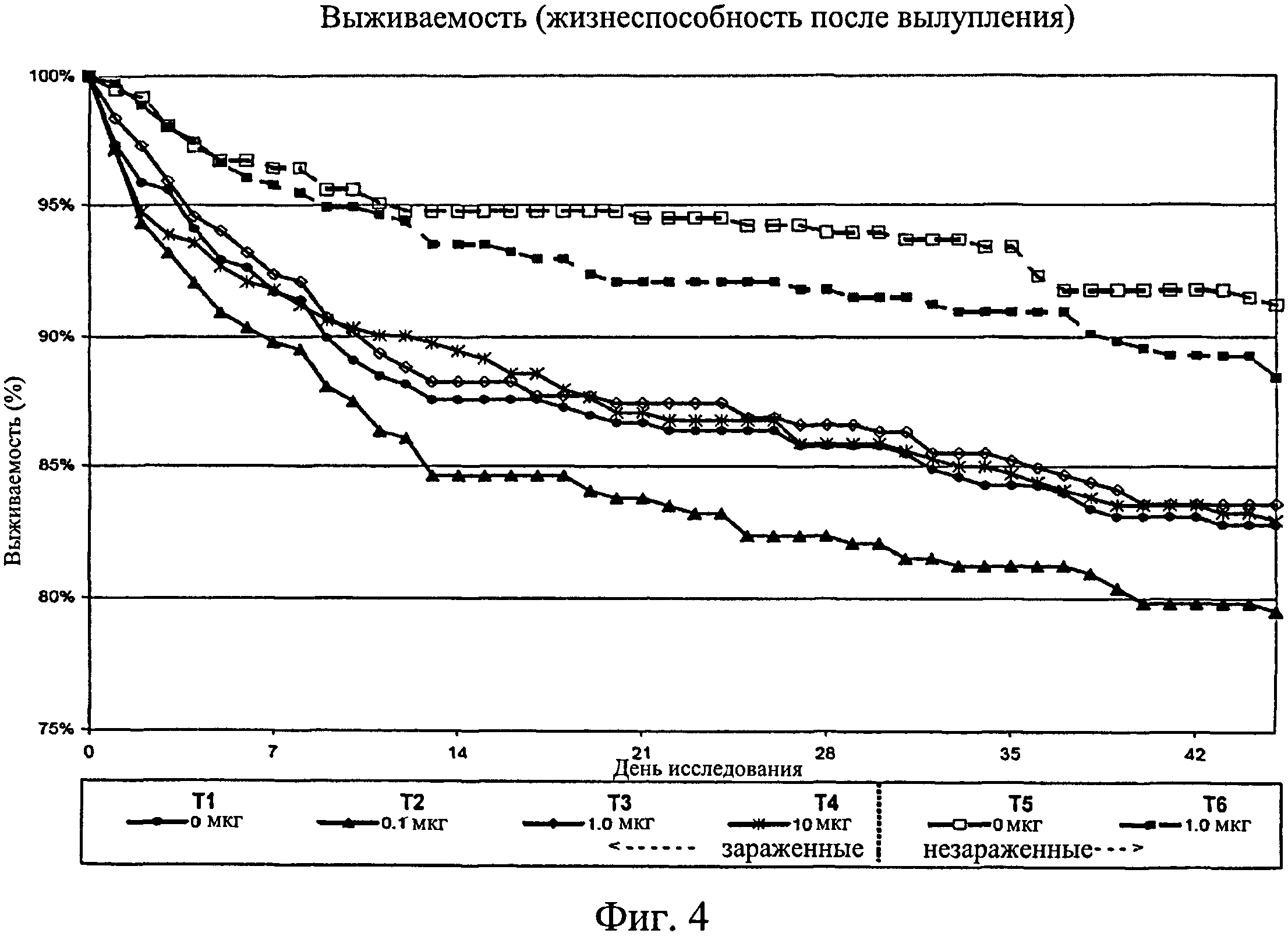
На фиг.4 графически изображена выживаемость птиц после вылупления. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; ТЗ, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
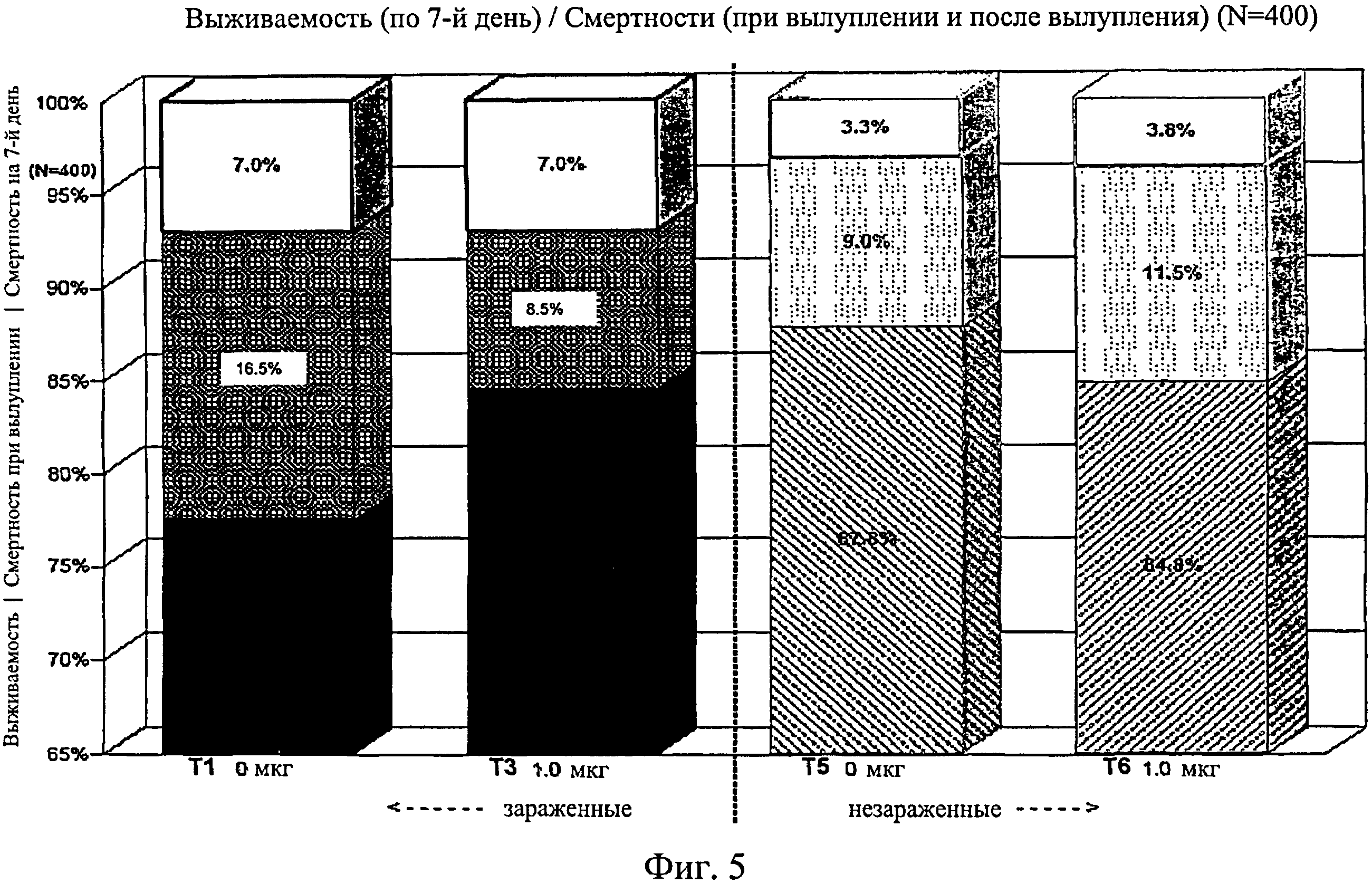
На фиг.5 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3. 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
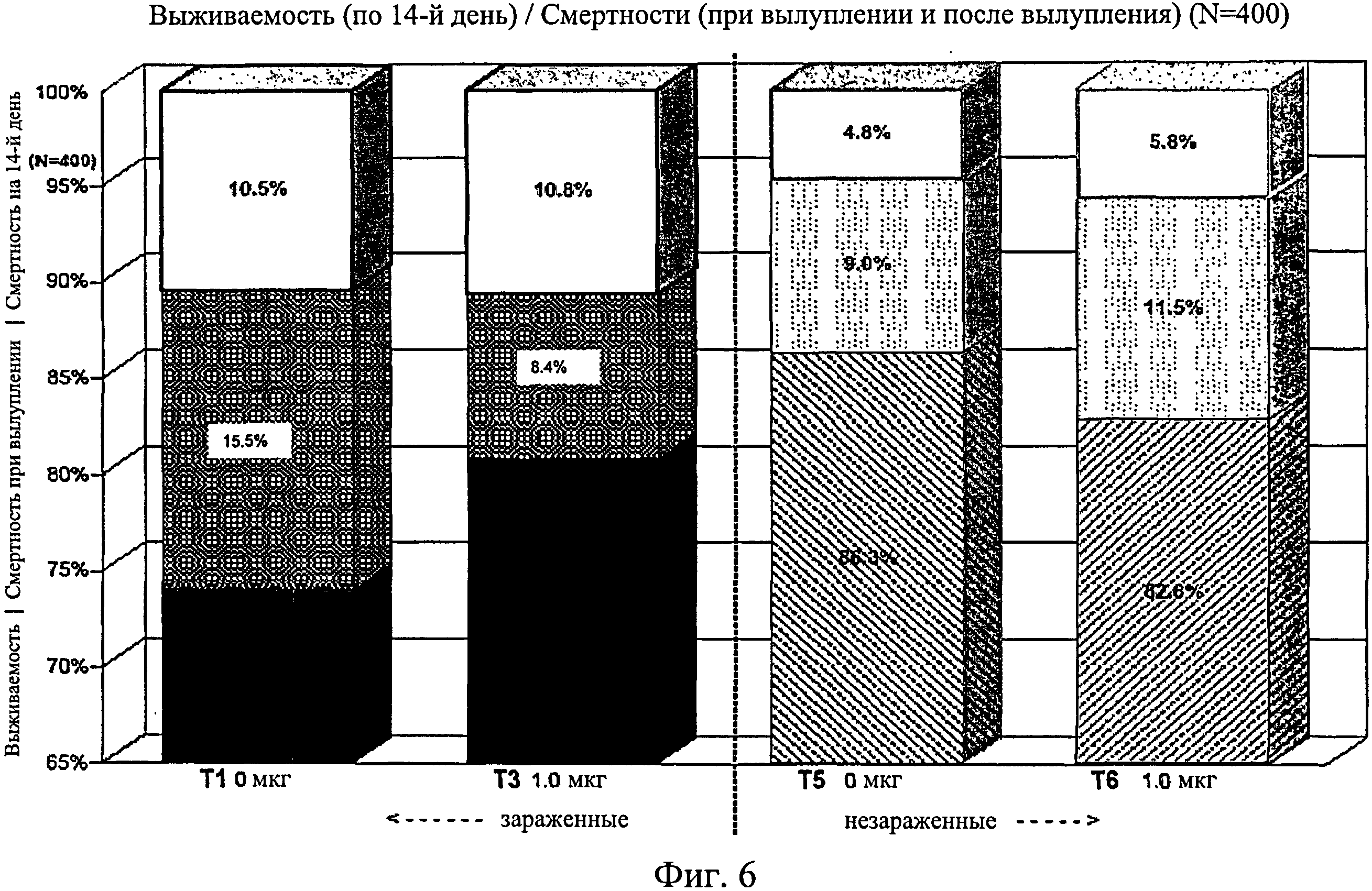
На фиг.6 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 14-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3. 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
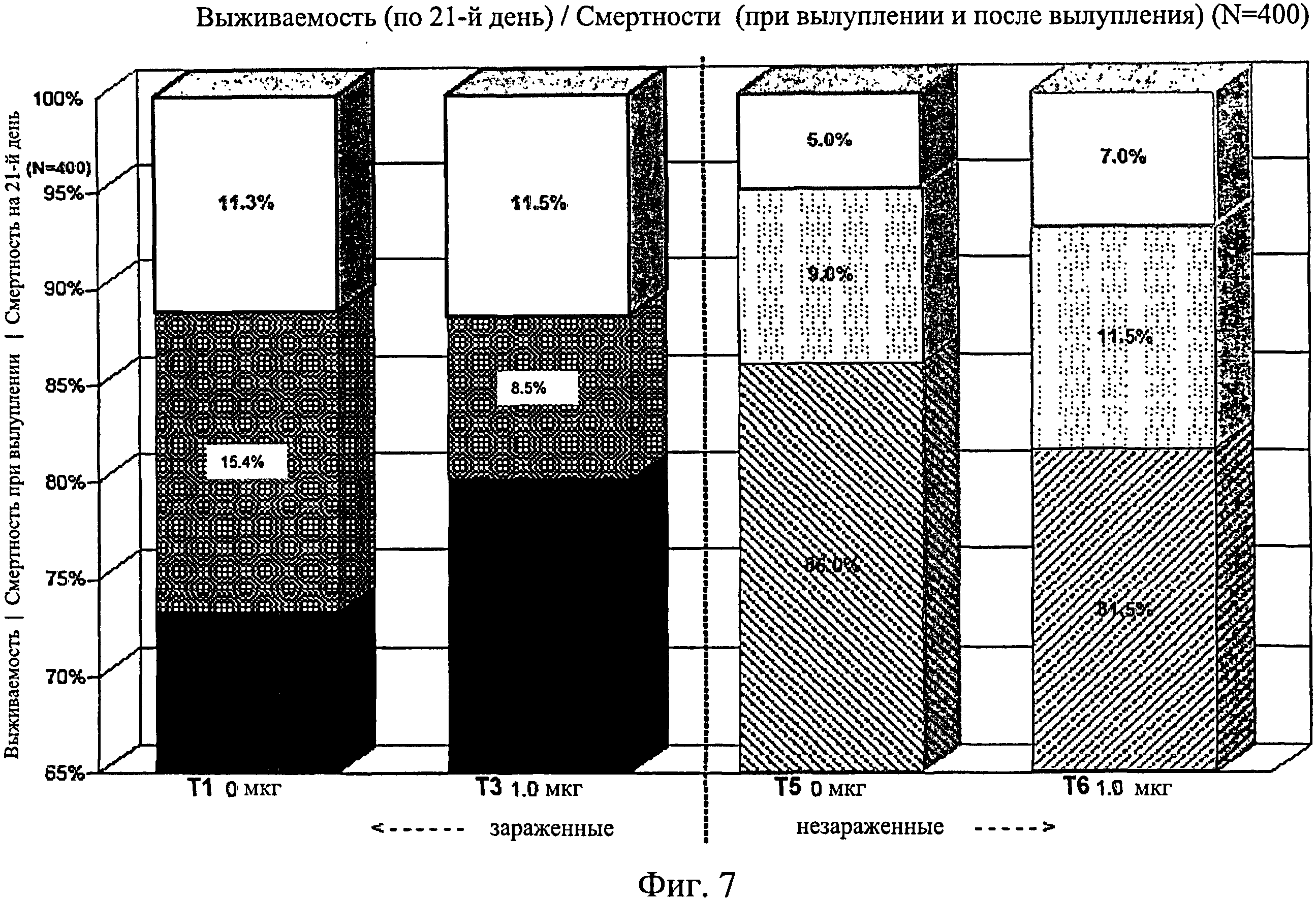
На фиг.7 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 21-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
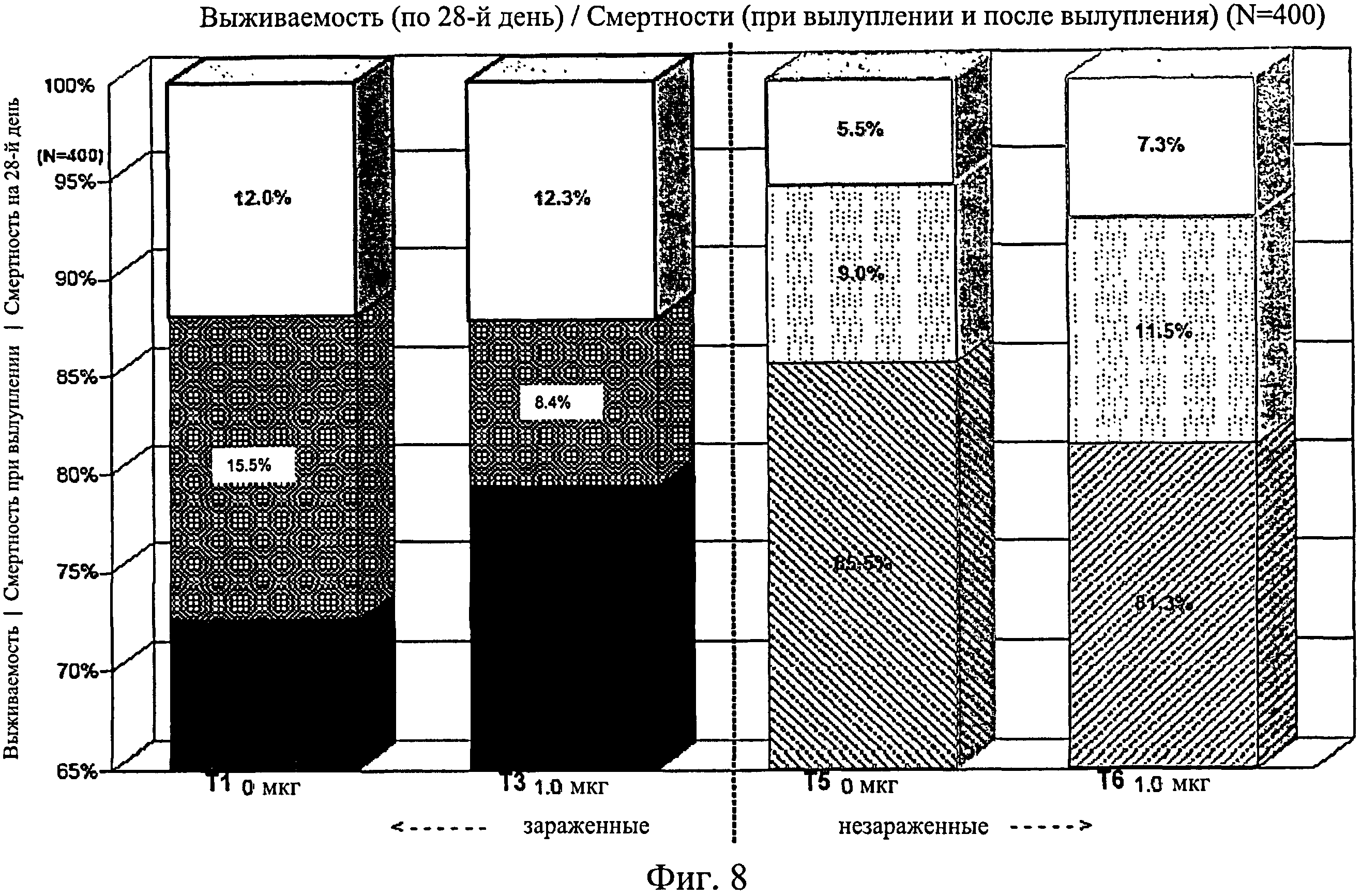
На фиг.8 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 28-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
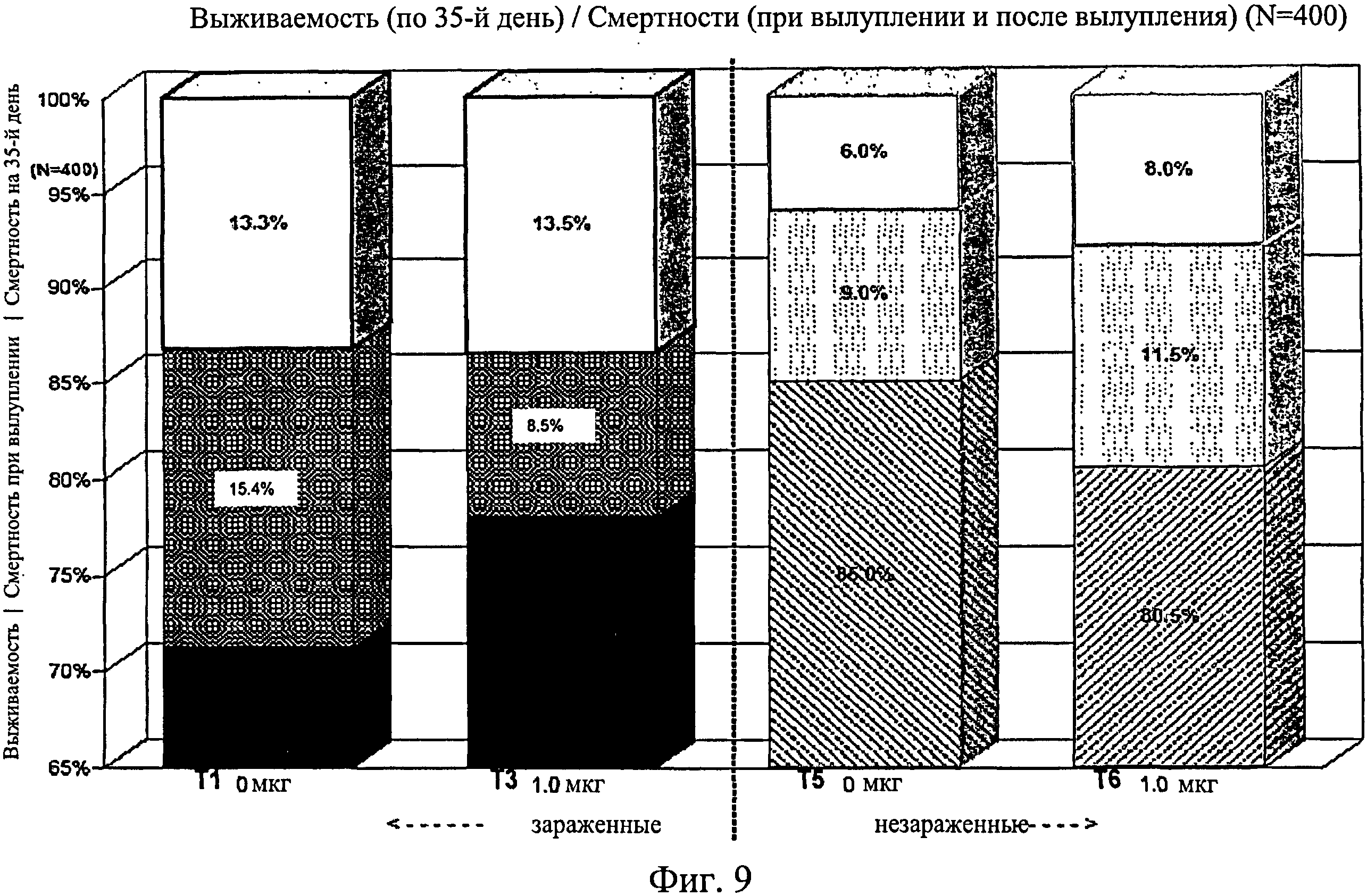
На фиг.9 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 35-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
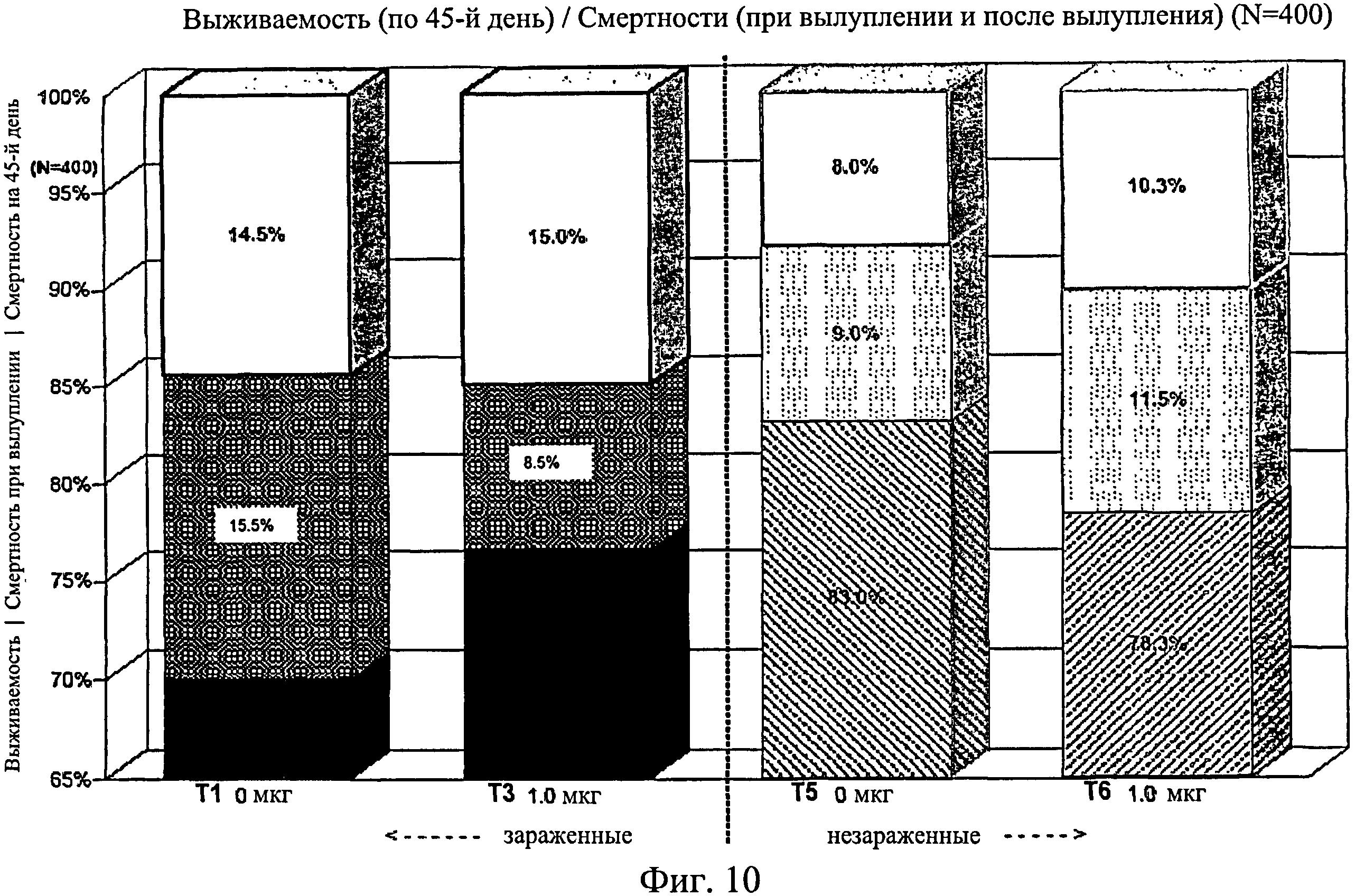
На фиг.10 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 45-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
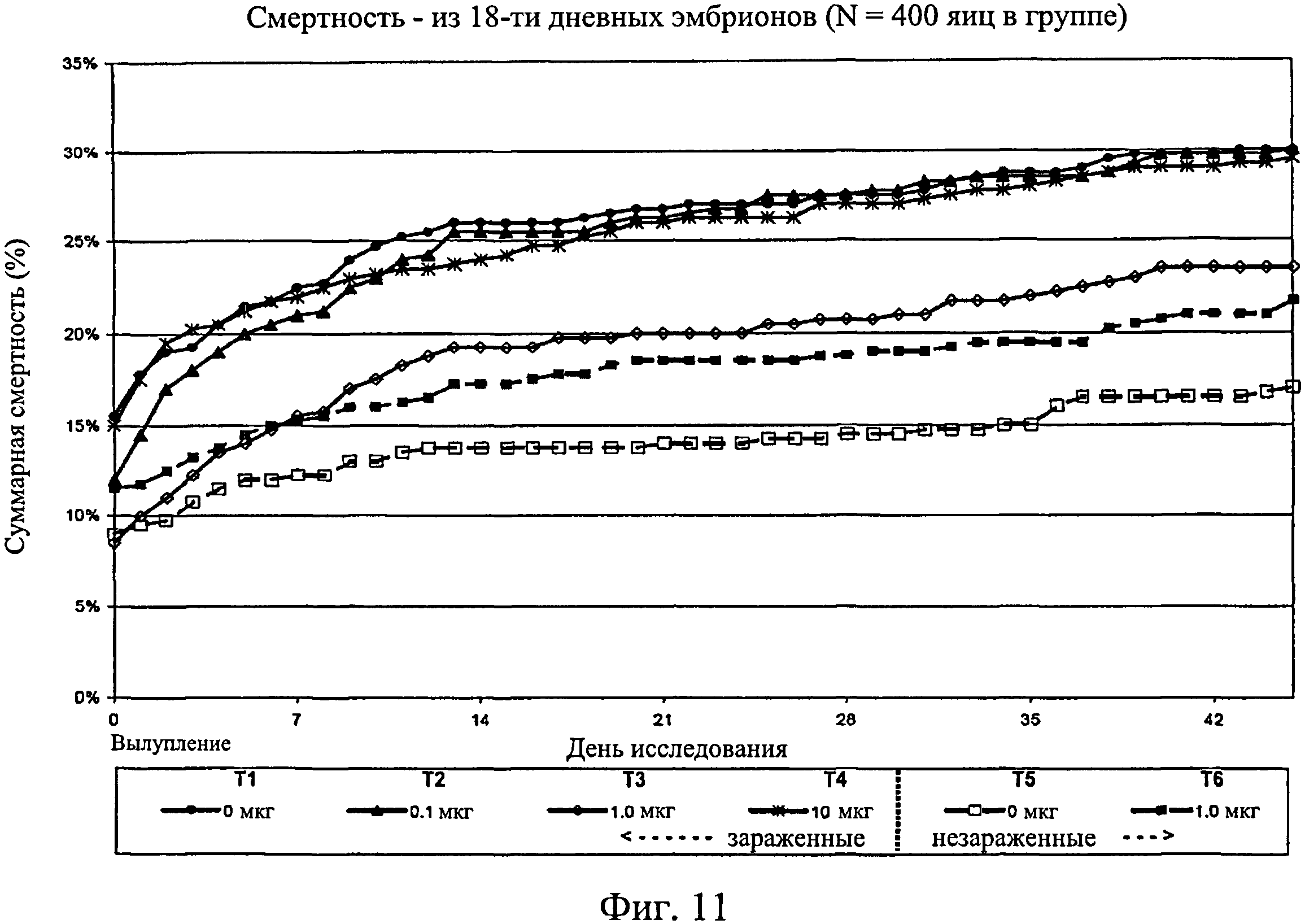
На фиг.11 показана суммарная смертность на группу 18-дневных эмбрионов по 45-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
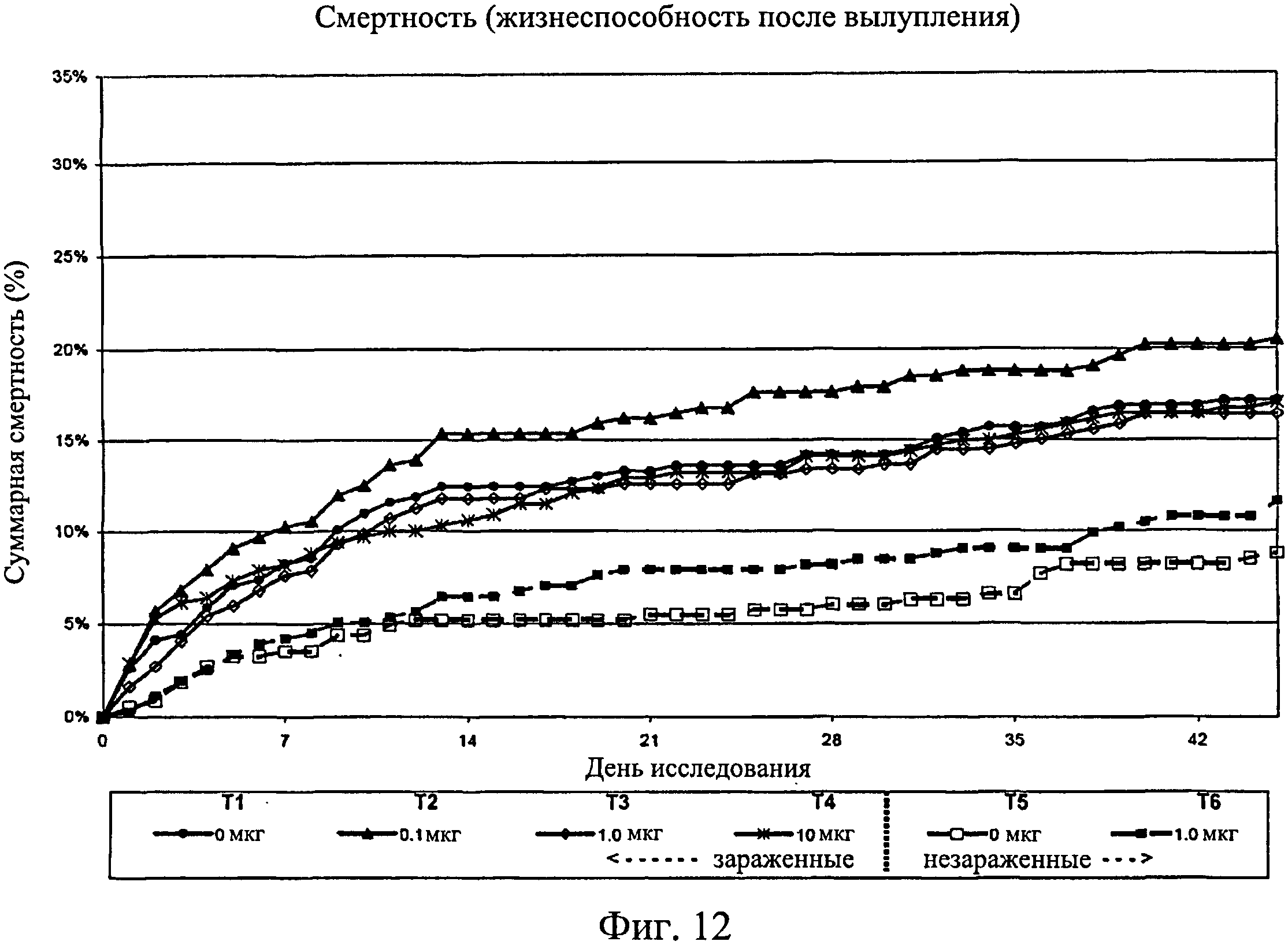
На фиг.12 показана суммарная смертность на группу после вылупления, с 0-го дня исследования по 45-й день. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
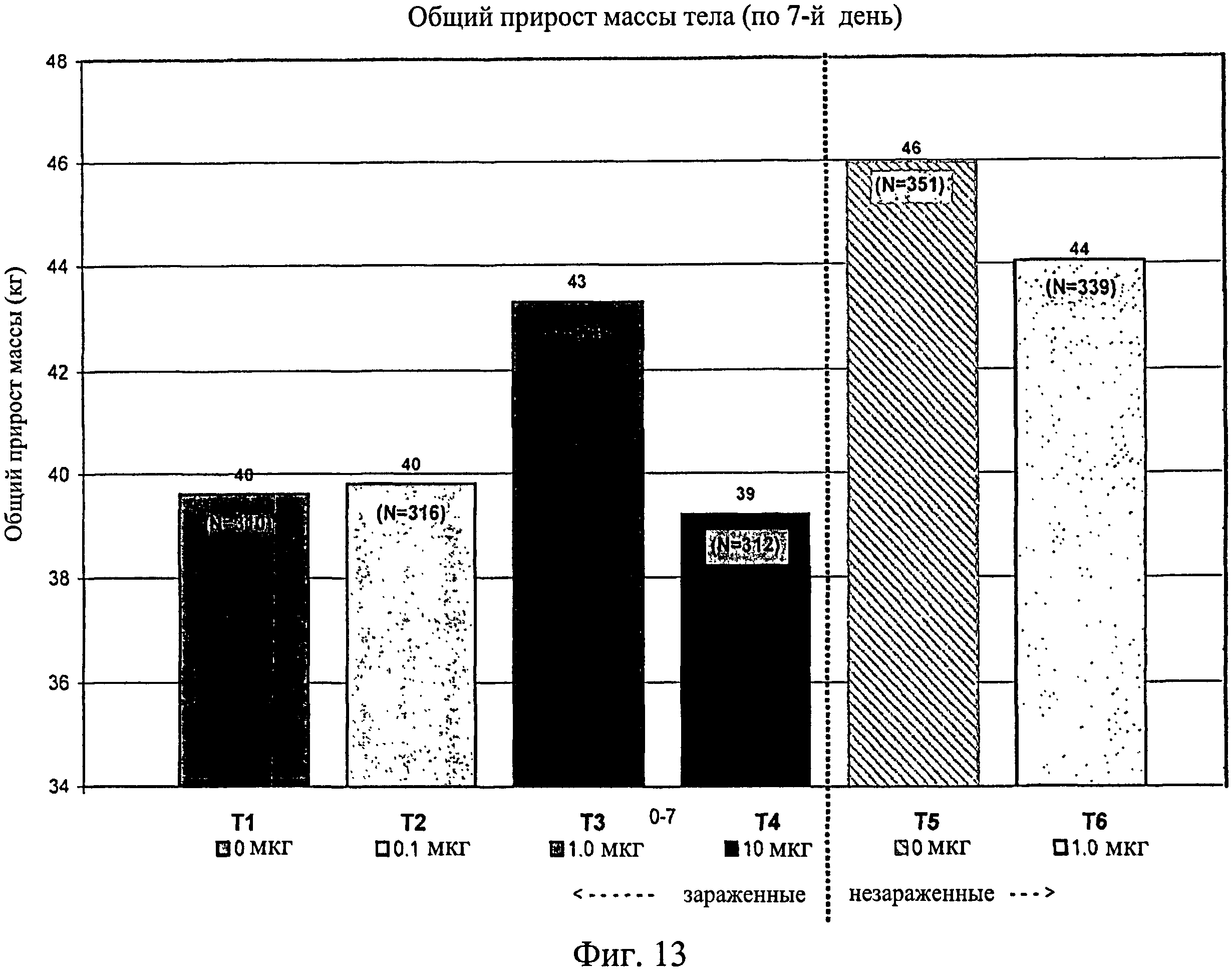
На фиг.13 показан общий средний прирост массы тела, наблюдаемый с 0-го до 7-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
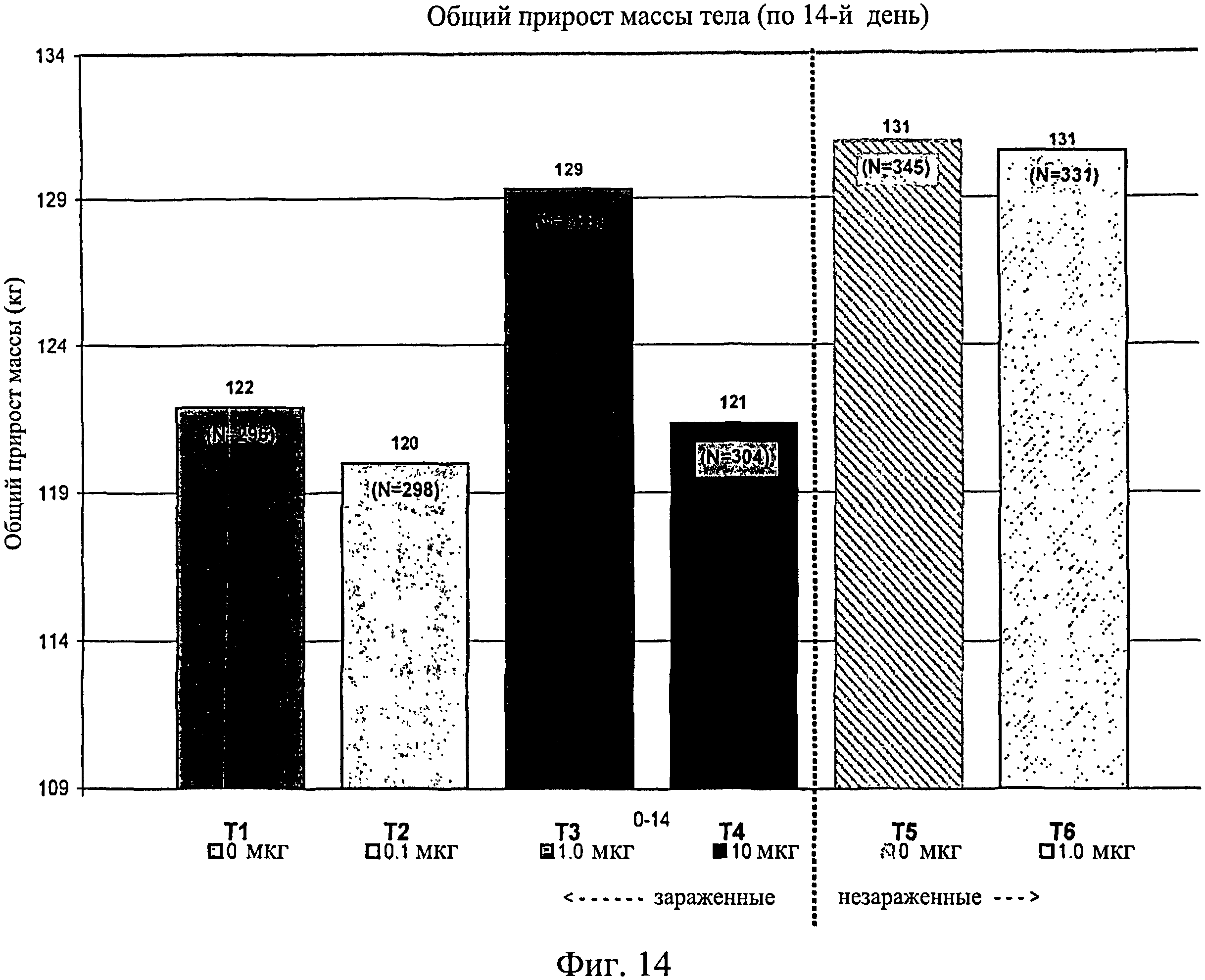
На фиг.14 показан общий средний прирост массы тела, наблюдаемый с 0-го до 14-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
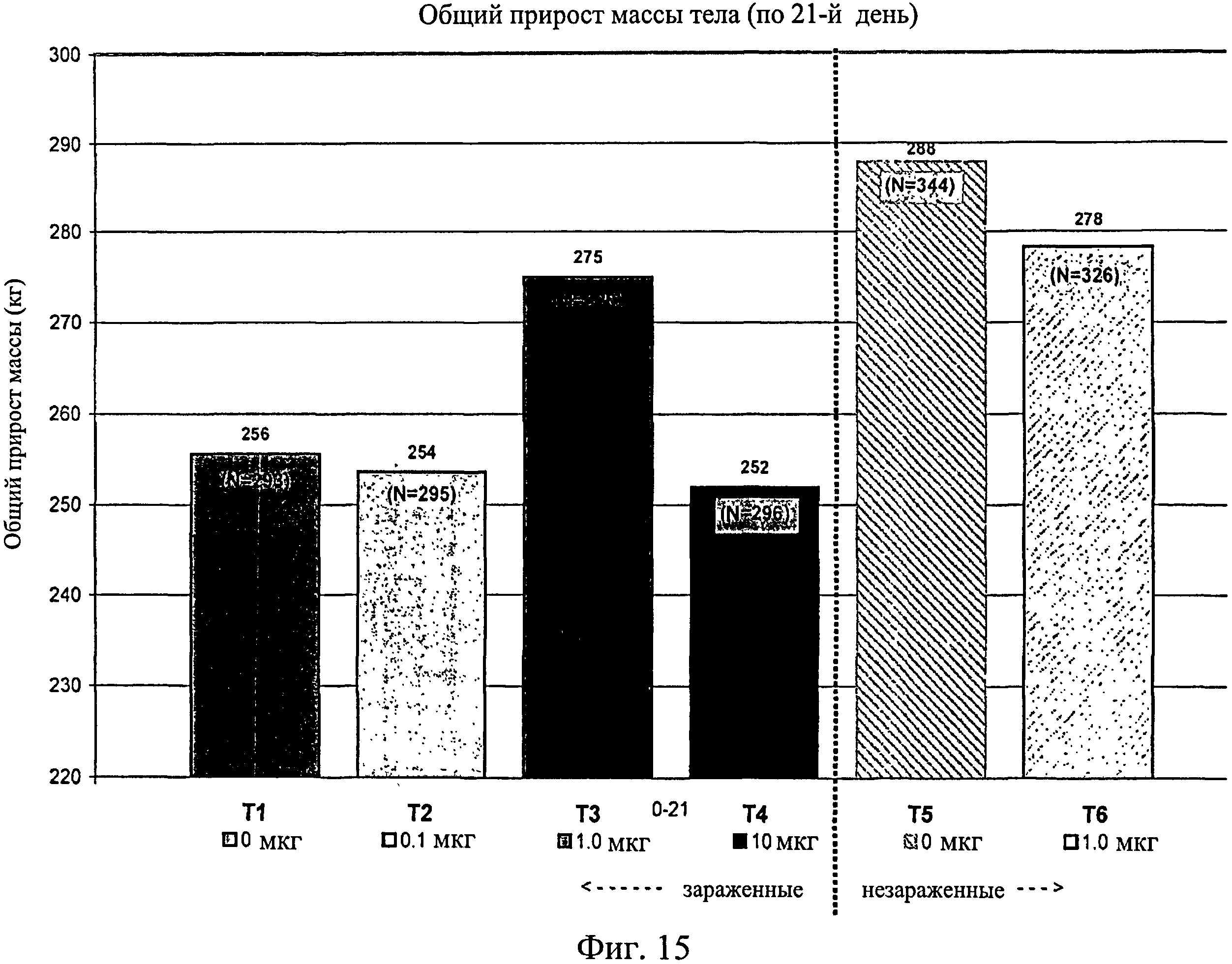
На фиг.15 показан общий средний прирост массы тела, наблюдаемый с 0-го до 21-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
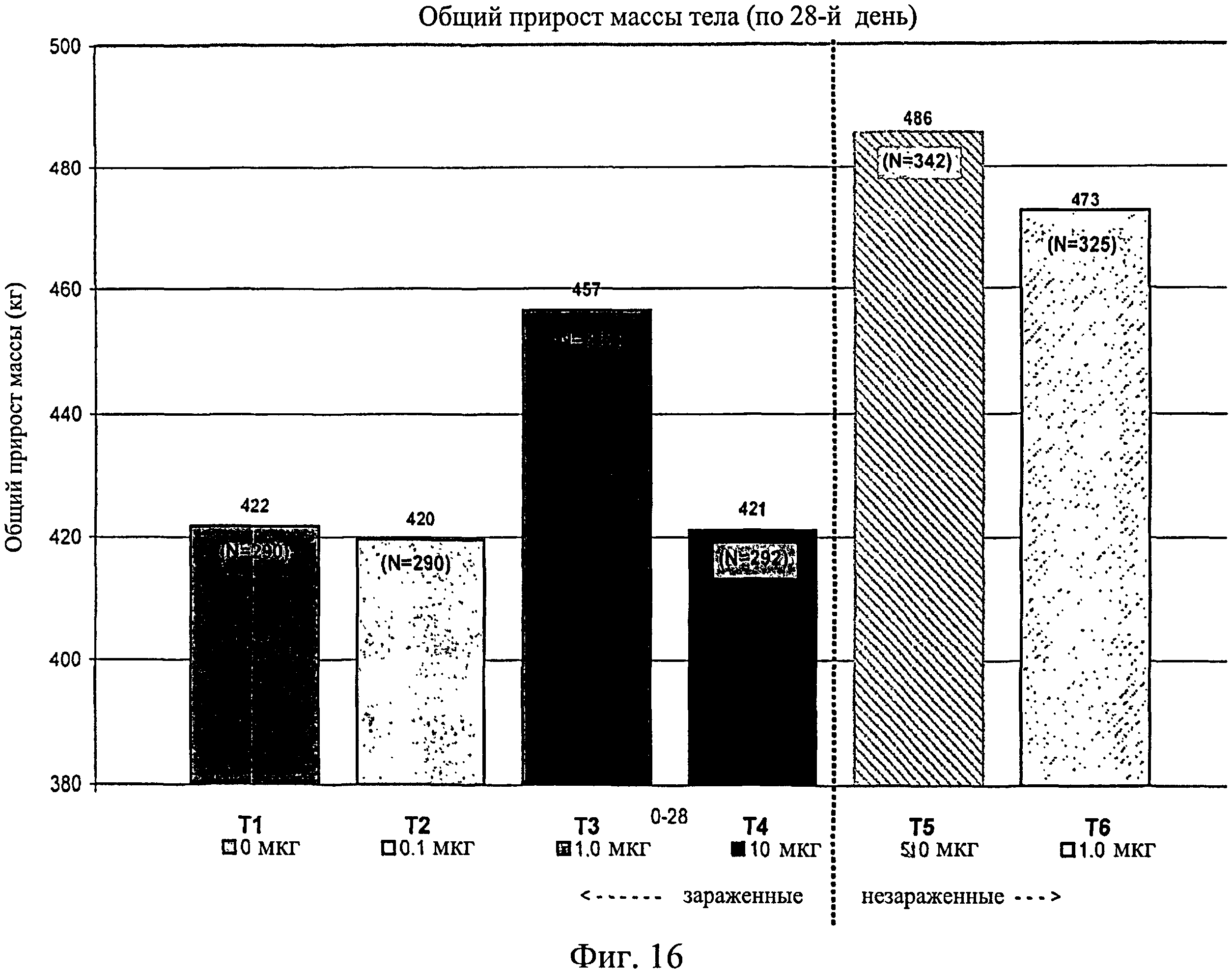
На фиг.16 показан общий средний прирост массы тела, наблюдаемый с 0-го до 28-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
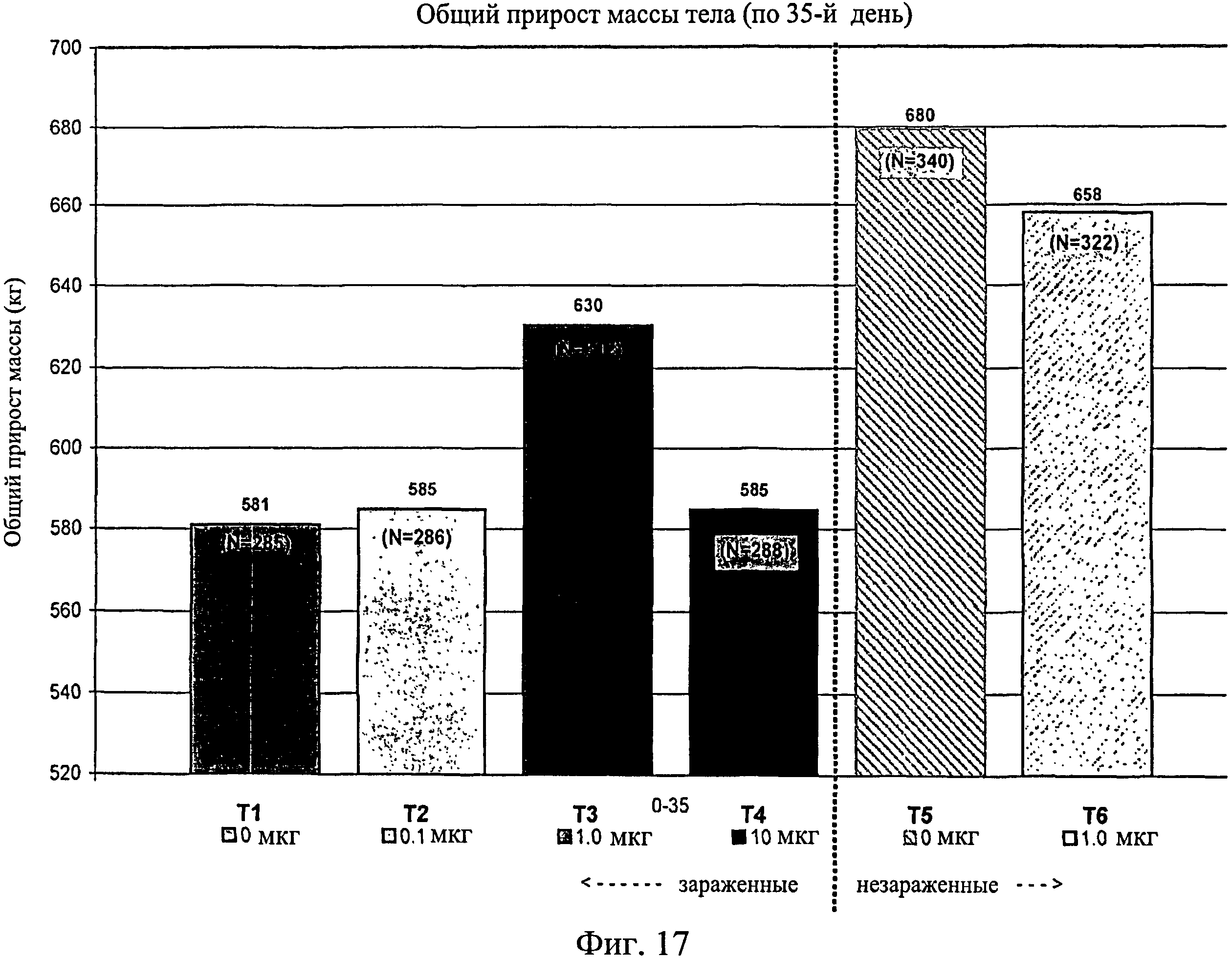
На фиг.17 показан общий средний прирост массы тела, наблюдаемый с 0-го до 35-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
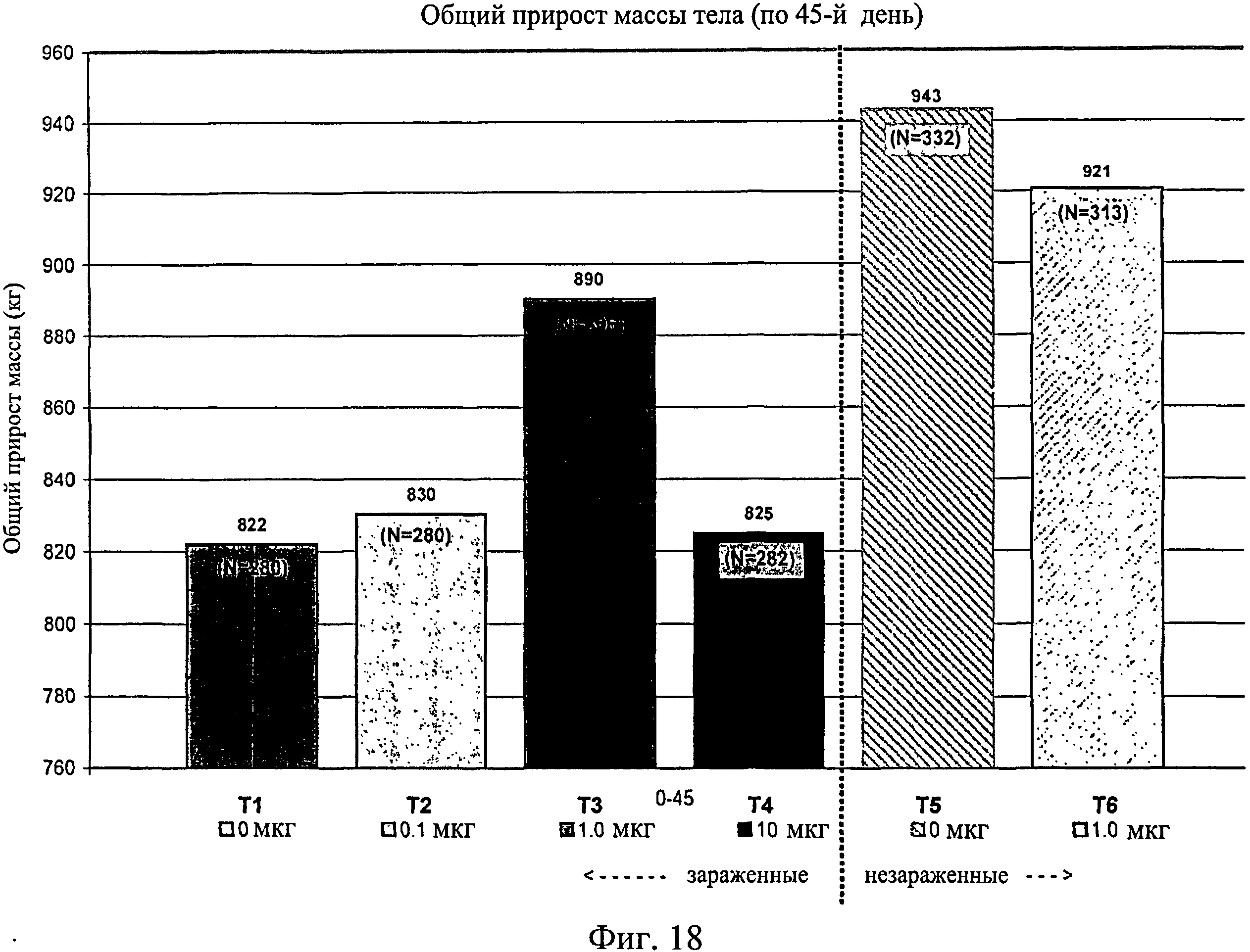
На фиг.18 показан общий средний прирост массы тела, наблюдаемый с 0-го до 45-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
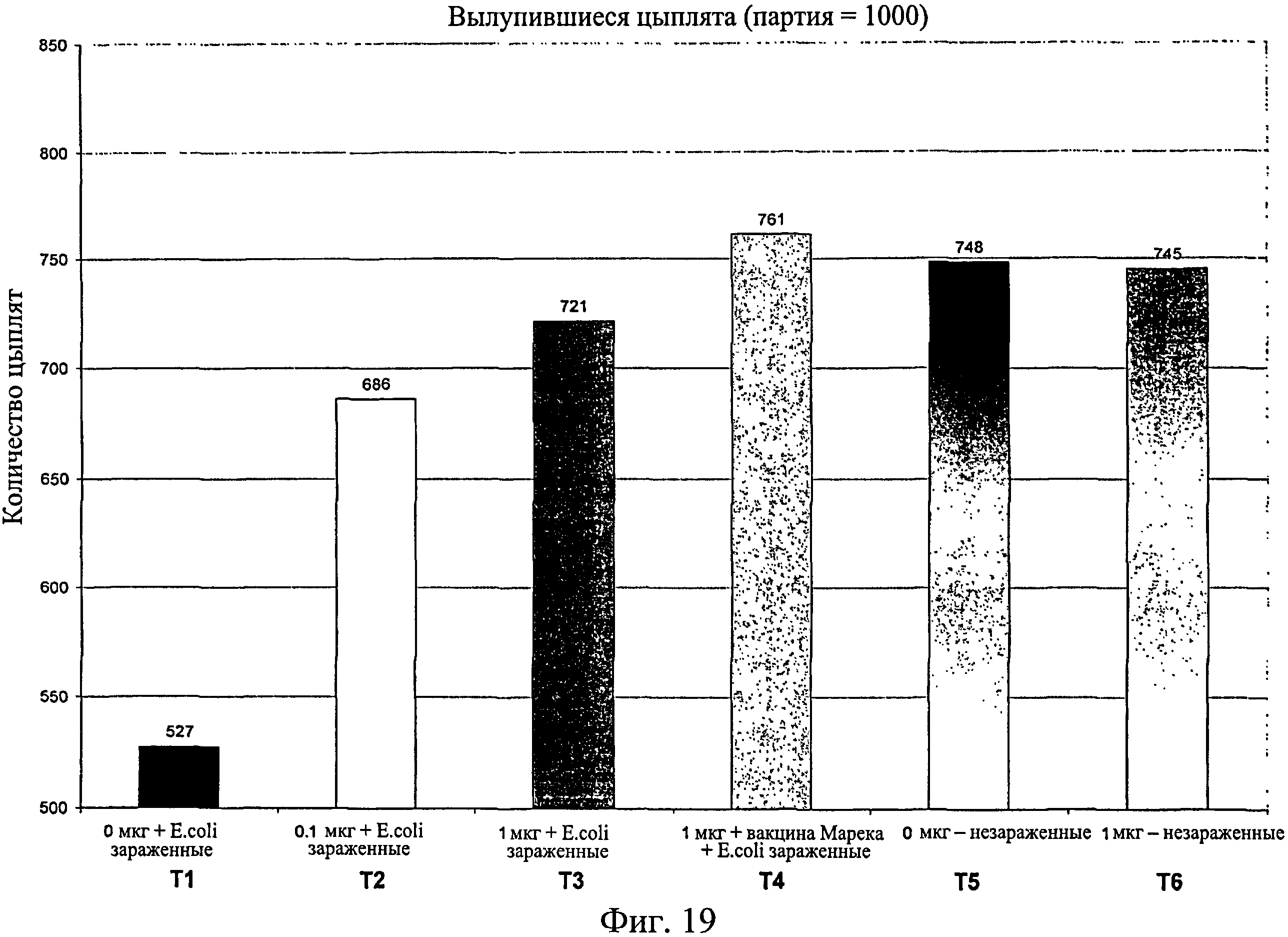
На фиг.19 графически изображено количество цыплят, вылупившихся на исследуемую группу оплодотворенных куриных яиц. Анализируемые исследуемые группы включают Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
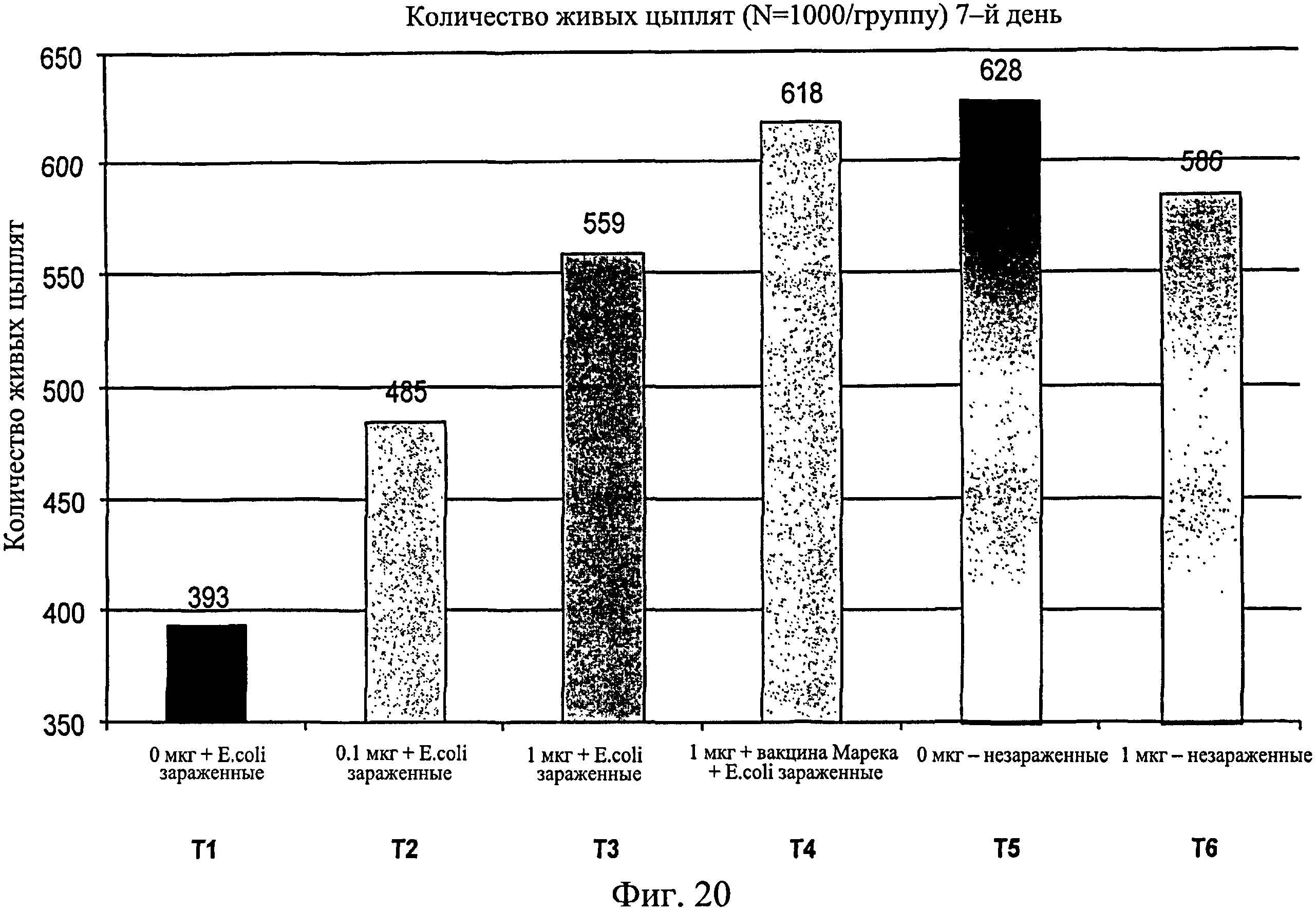
На фиг.20 графически изображено количество живых цыплят на группу на 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4.1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.21 показано сравнение живых цыплят и мертвых цыплят на группу на 7-й день исследования.
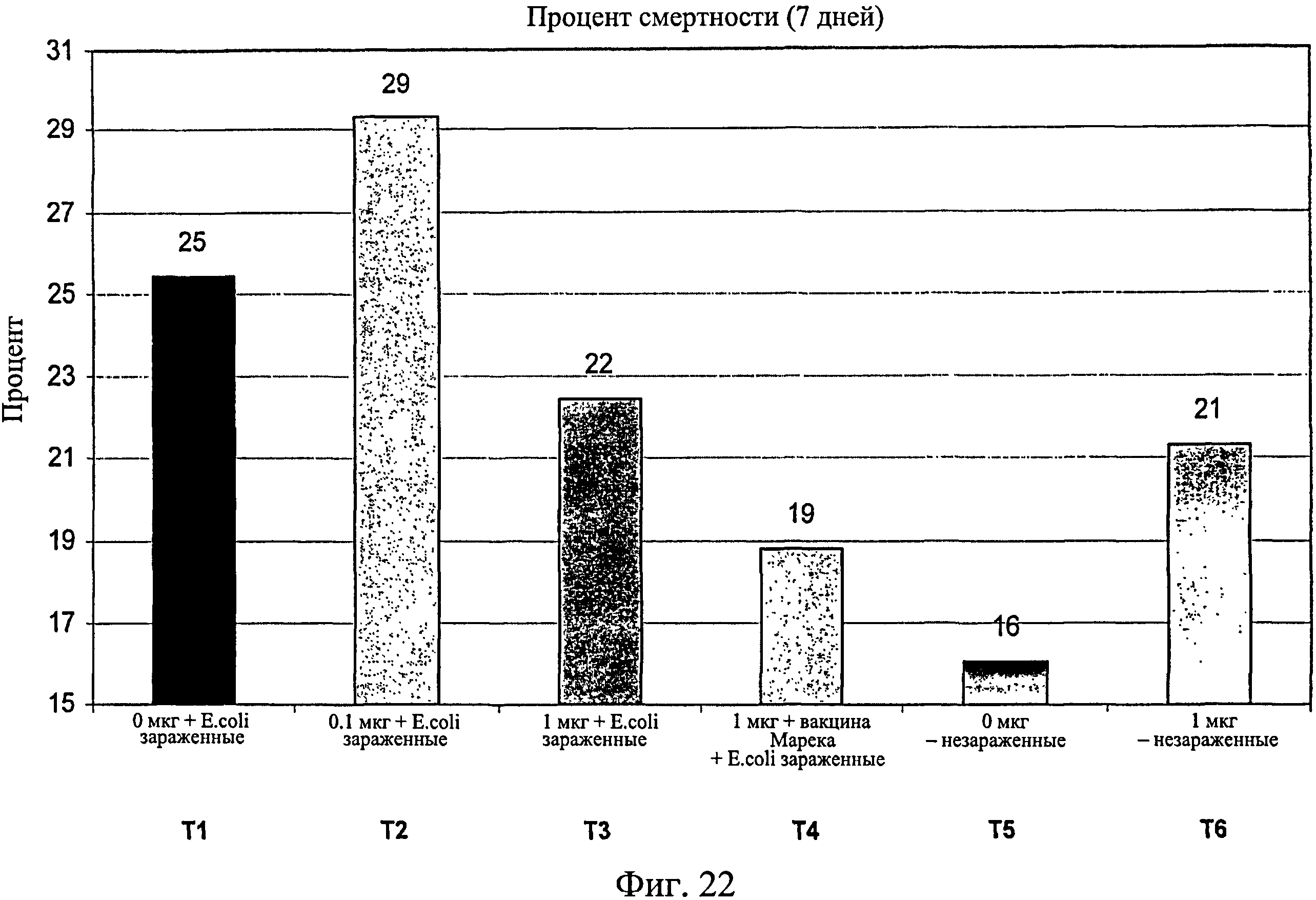
На фиг.22 показан процент смертности на исследуемую группу по 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
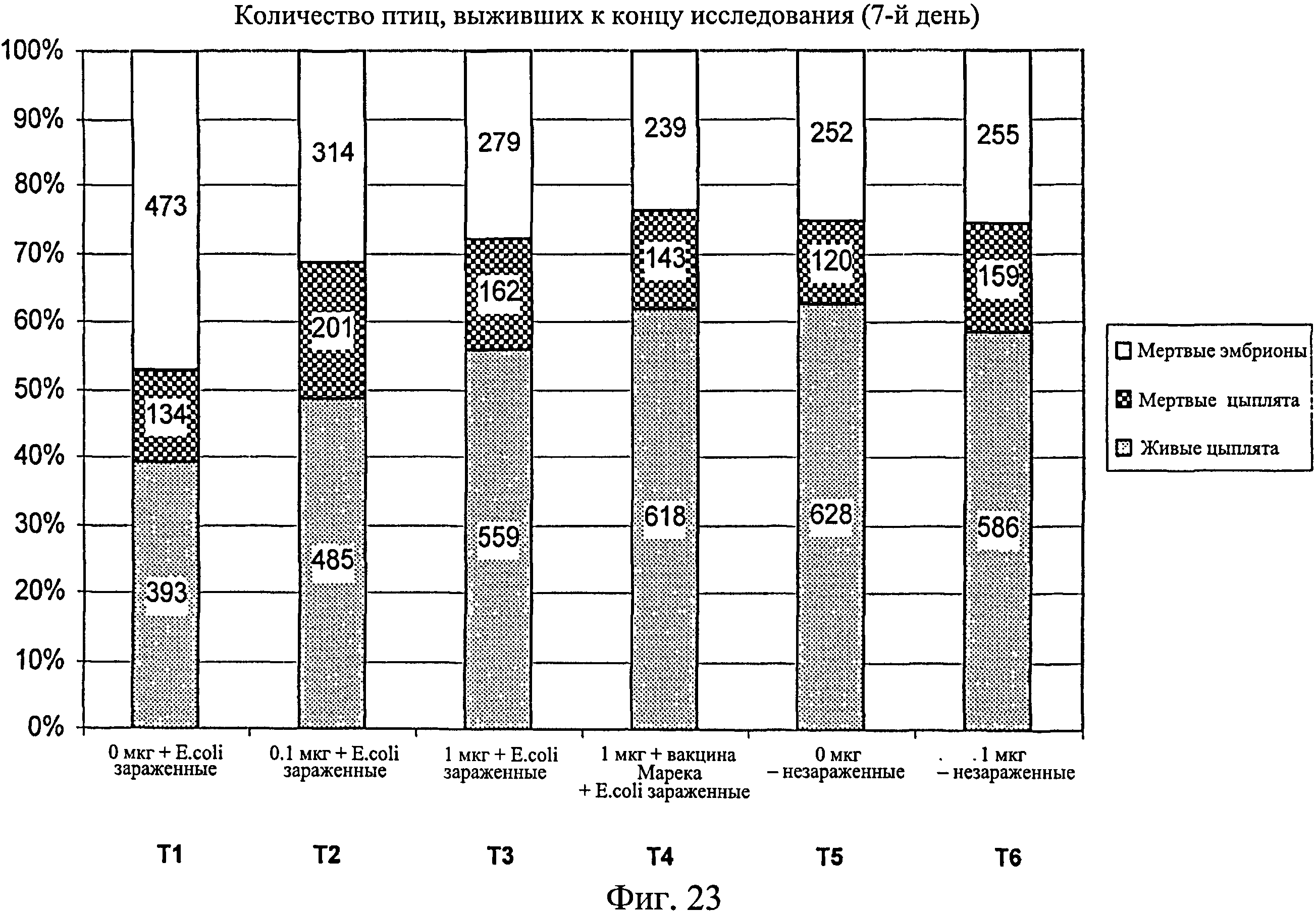
На фиг.23 графически показано количество птиц, выживших к концу исследования (7-й день) для каждой группы, включая мертвых эмбрионов, мертвых цыплят и живых цыплят (зеленый). Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
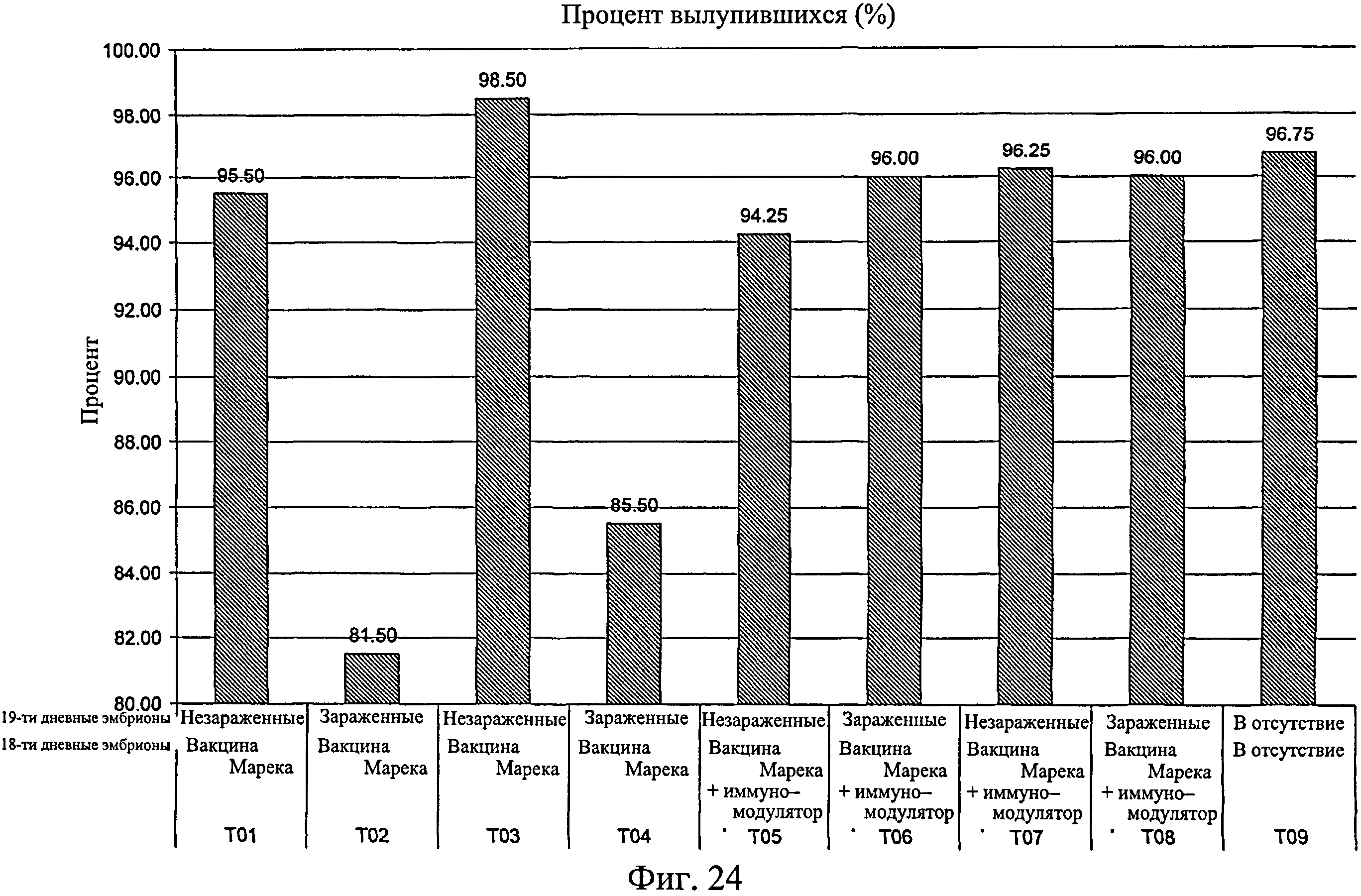
На фиг.24 графически показан процент цыплят, вылупившихся на исследуемую группу оплодотворенных яиц. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
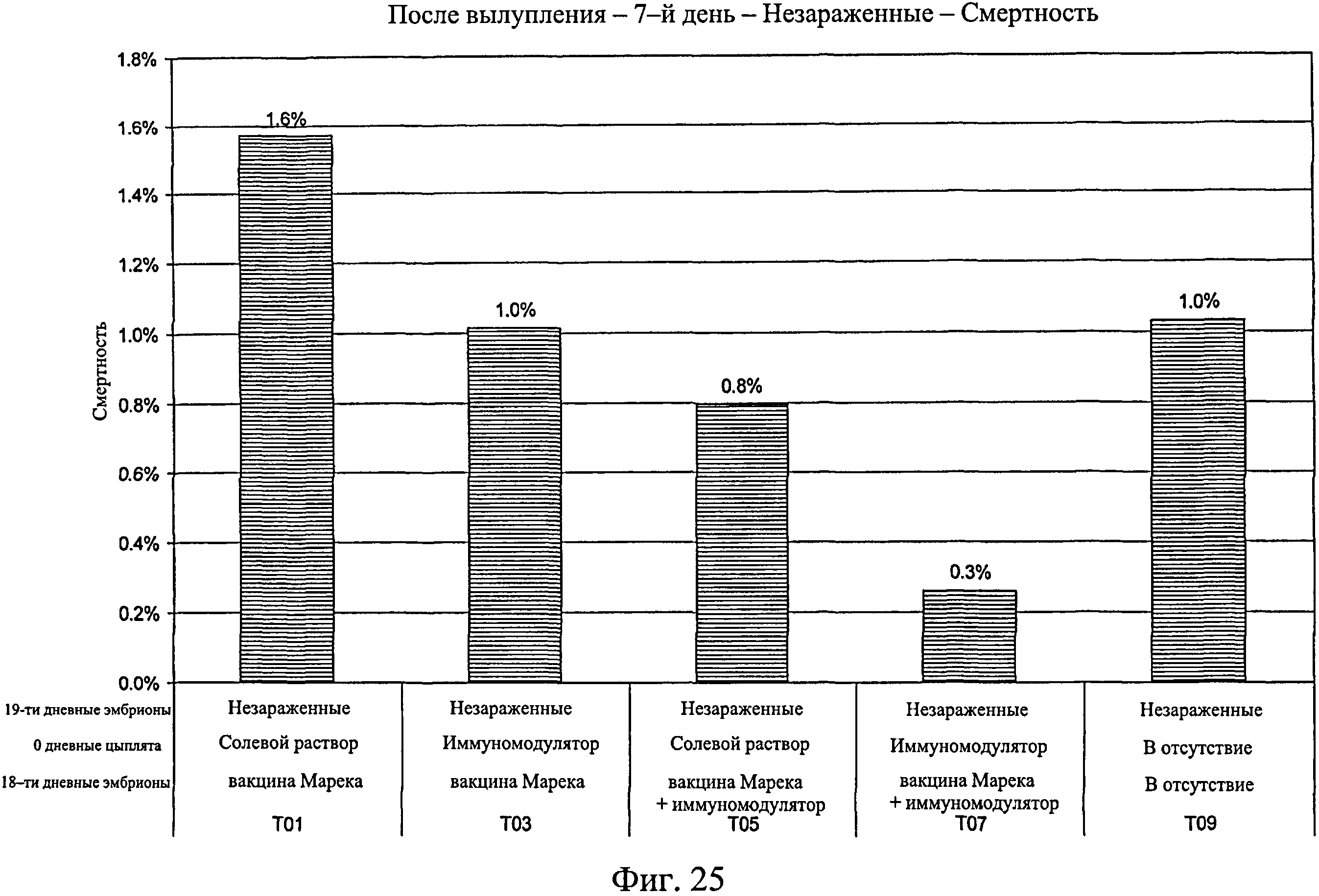
На фиг.25 показан процент смертности для исследуемых групп, не зараженных Е. coli, после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
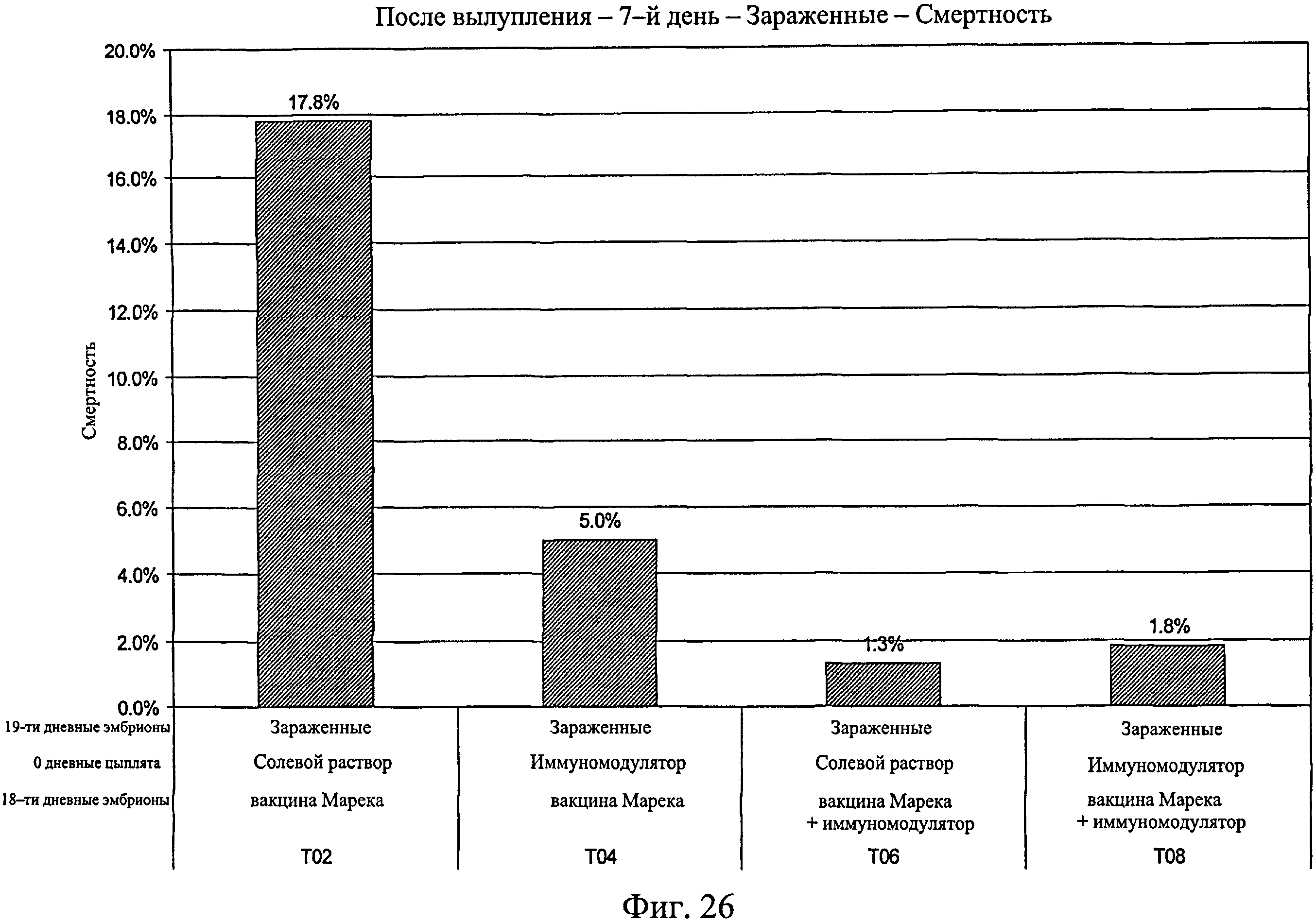
На фиг.26 показан процент смертности для исследуемых групп, зараженных Е. coli, после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
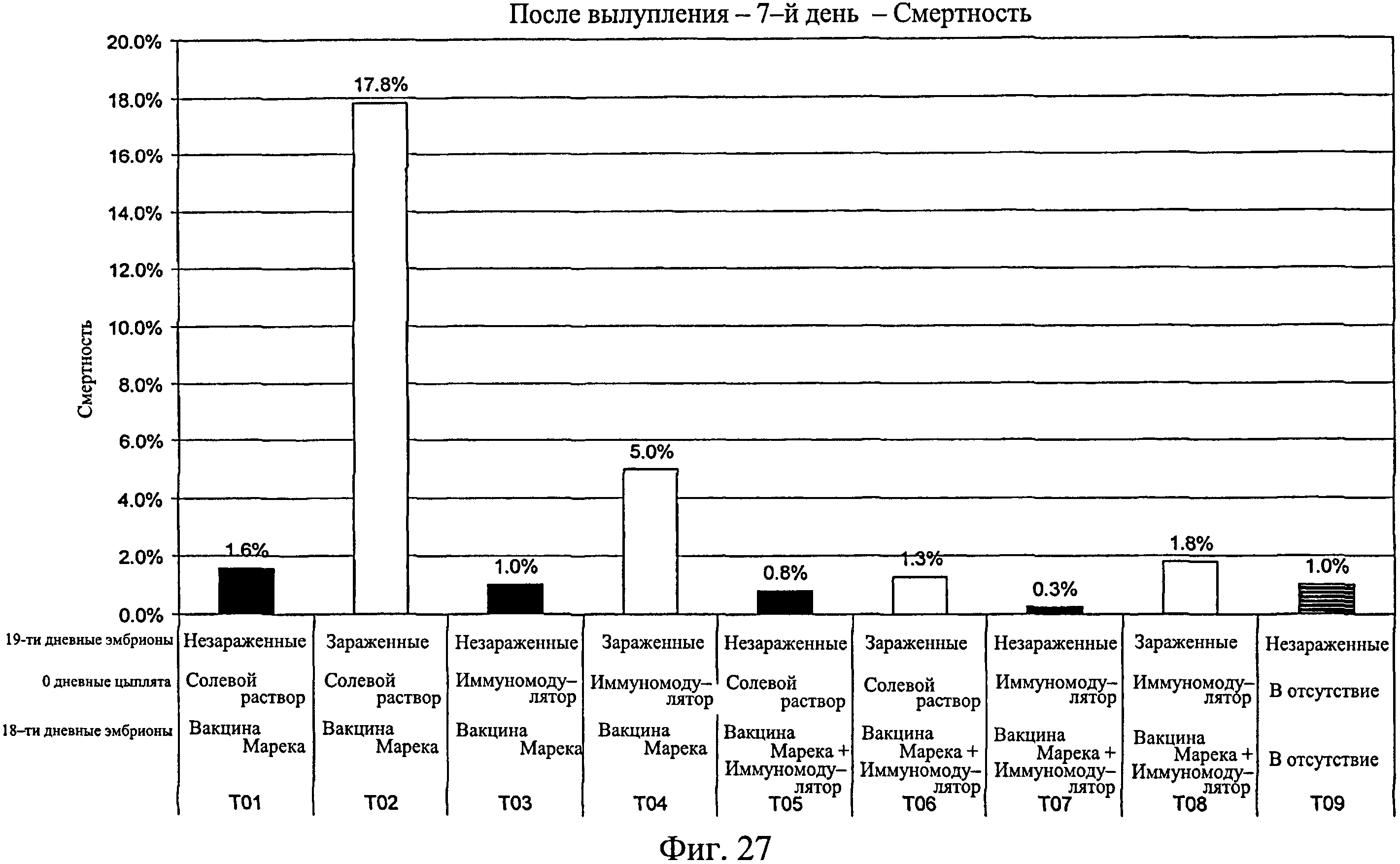
На фиг.27 графически показан процент смертности для каждой исследуемой группы после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
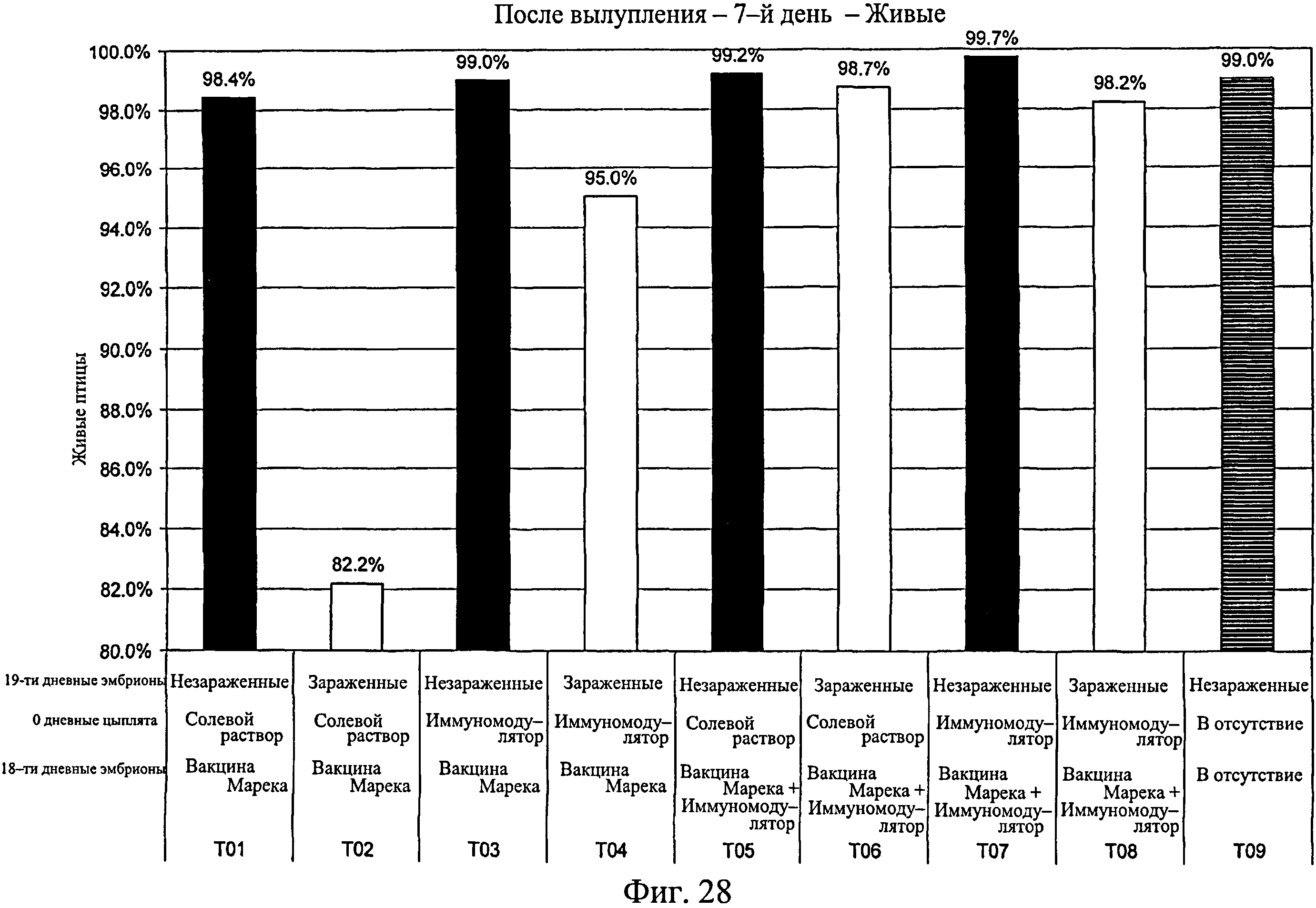
На фиг.28 показан процент выживания для каждой исследуемой группы после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
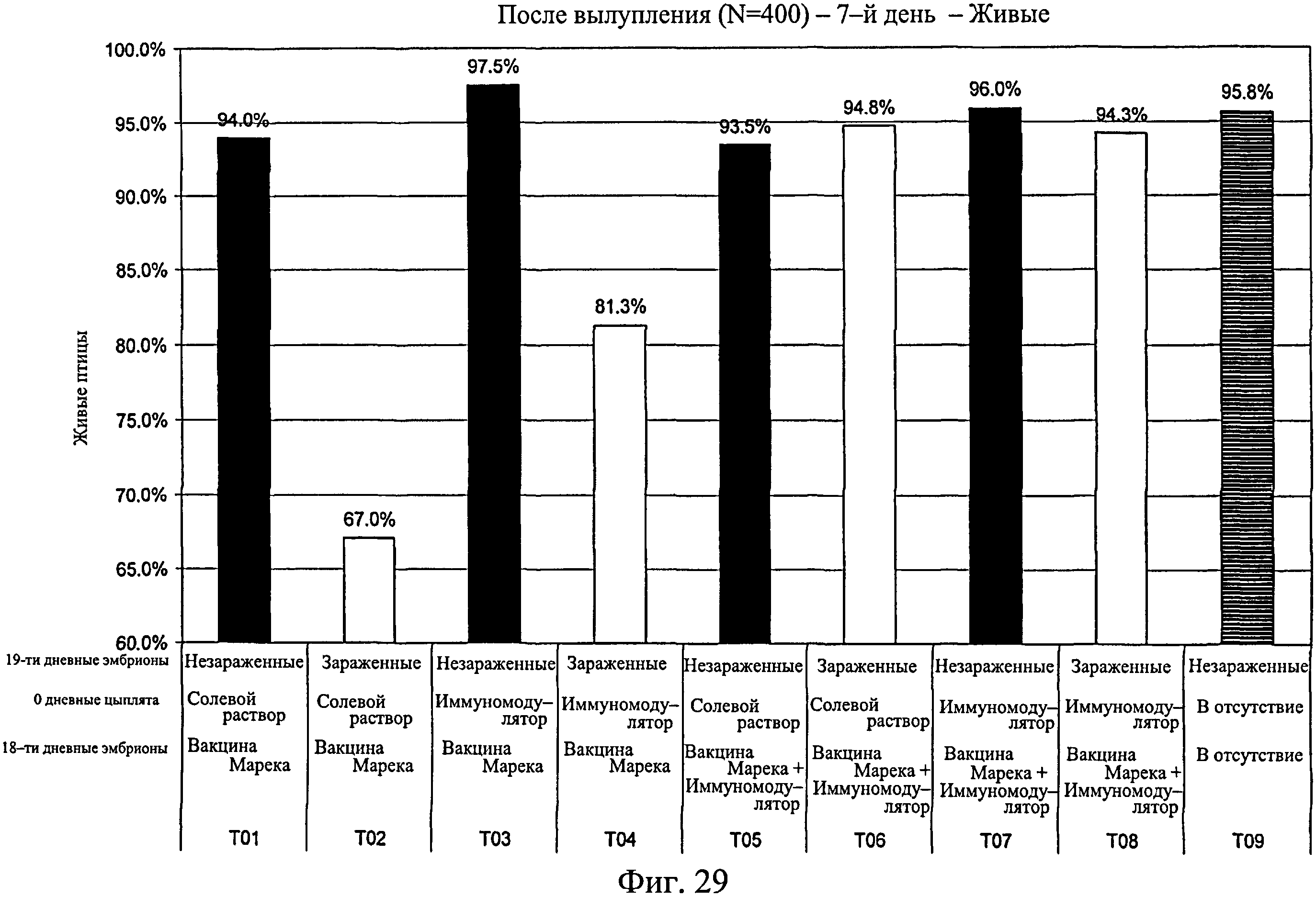
На фиг.29 показан процент выживания для каждой исследуемой группы на 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
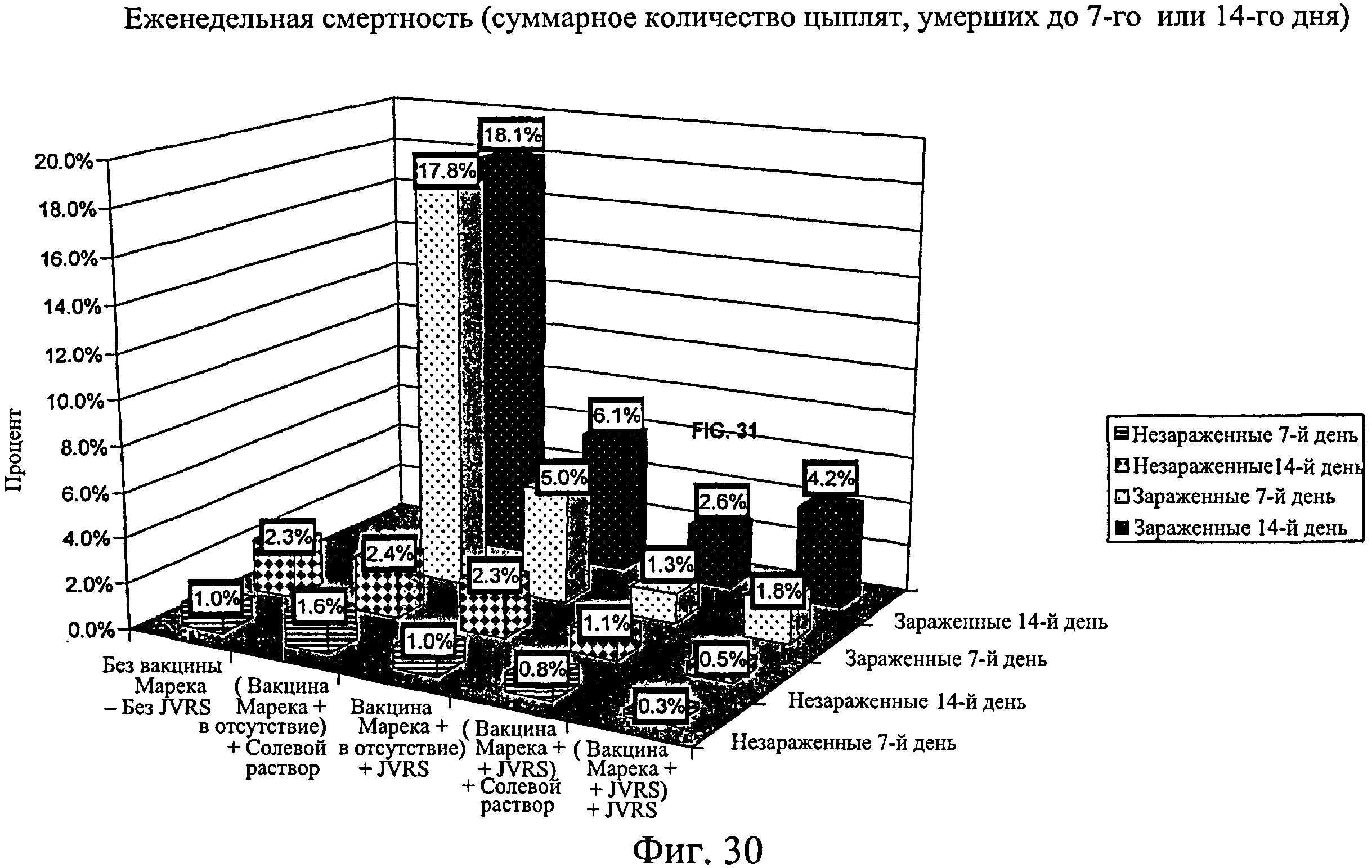
На фиг.30 показана еженедельная смертность для каждой исследуемой группы по 7-й и 14-й день. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
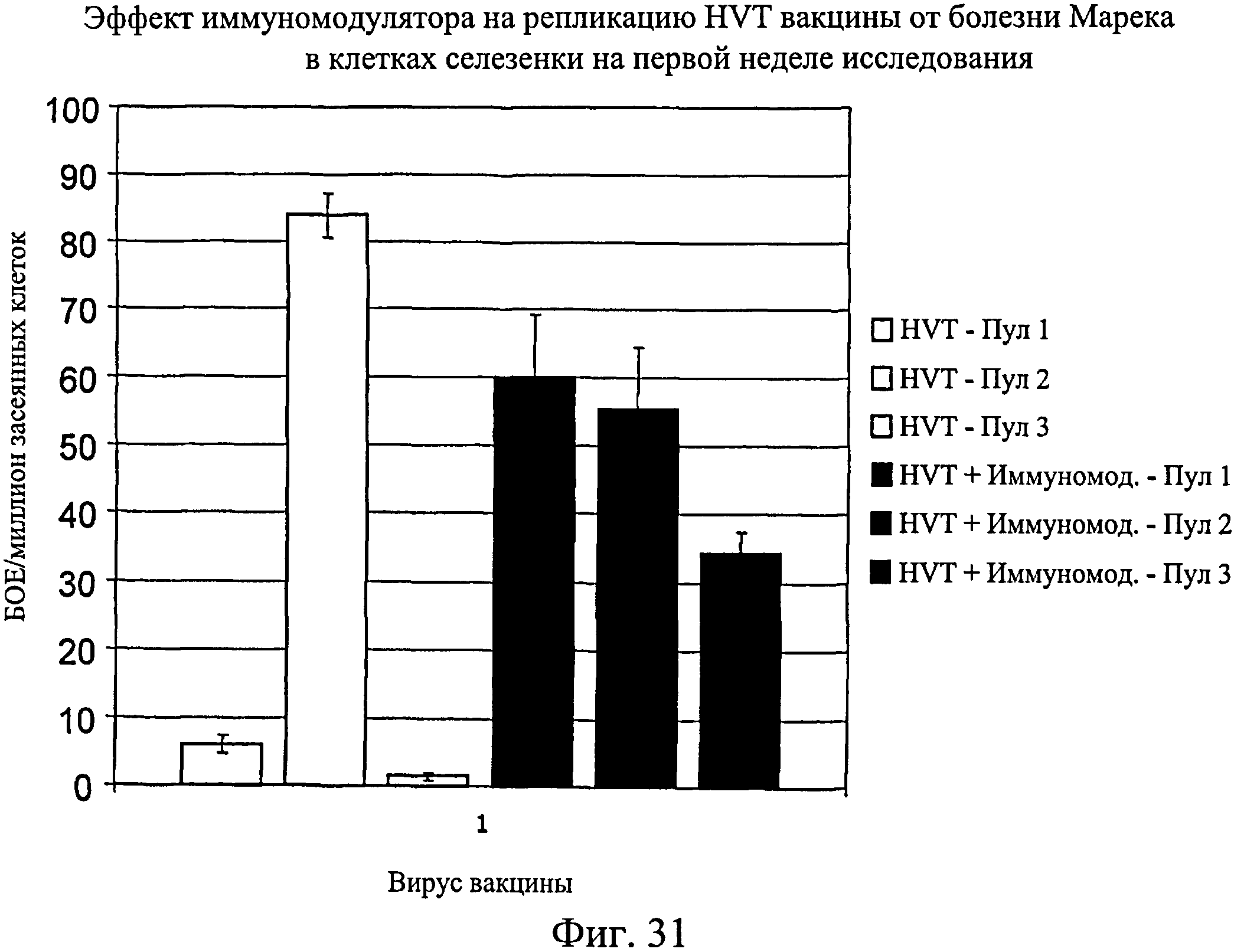
На фиг.31 графически показан эффект иммуномодулятора на репликацию HVT (вирус герпеса индейки) вакцины от болезни Марека в клетках селезенки на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
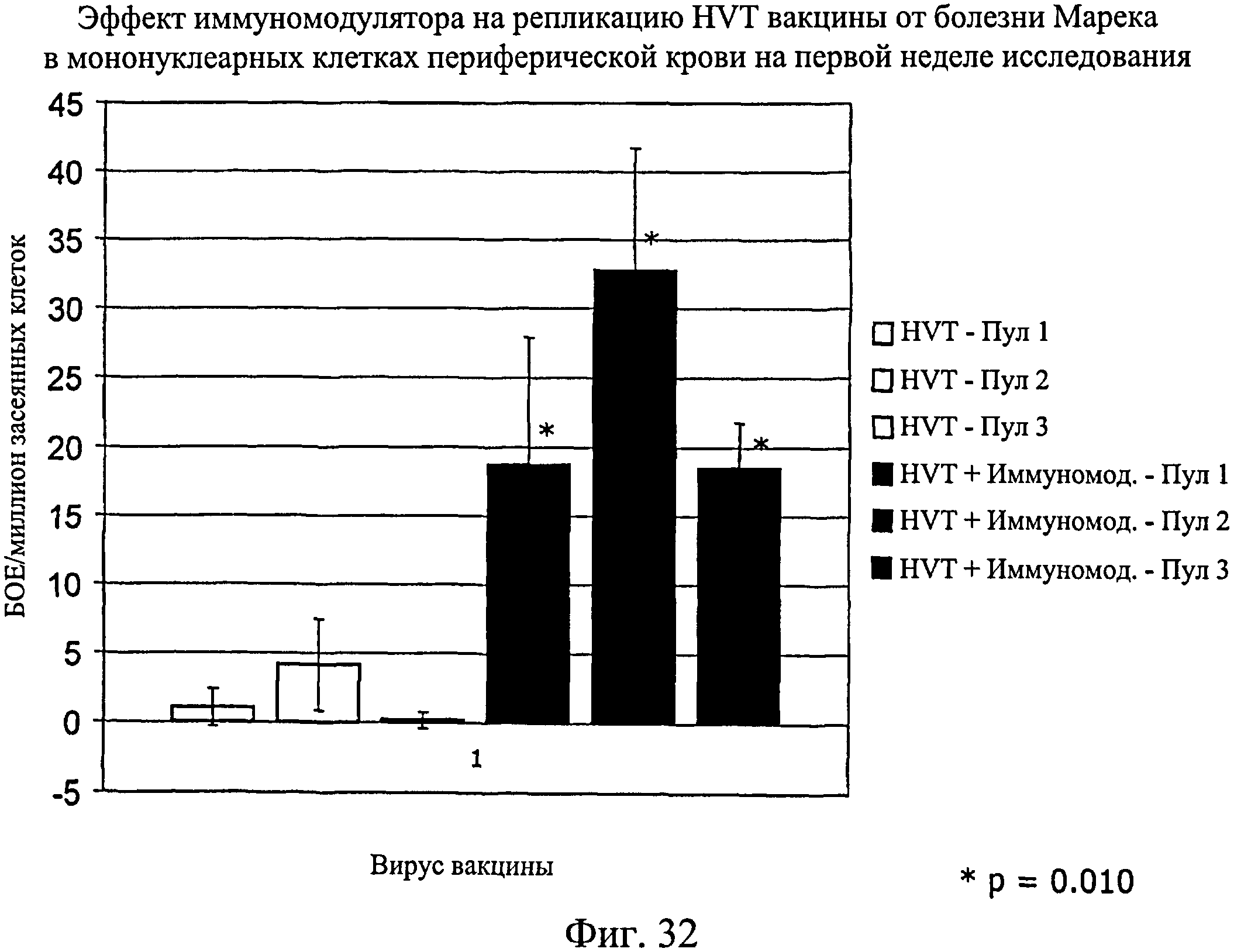
На фиг.32 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.33 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.34 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
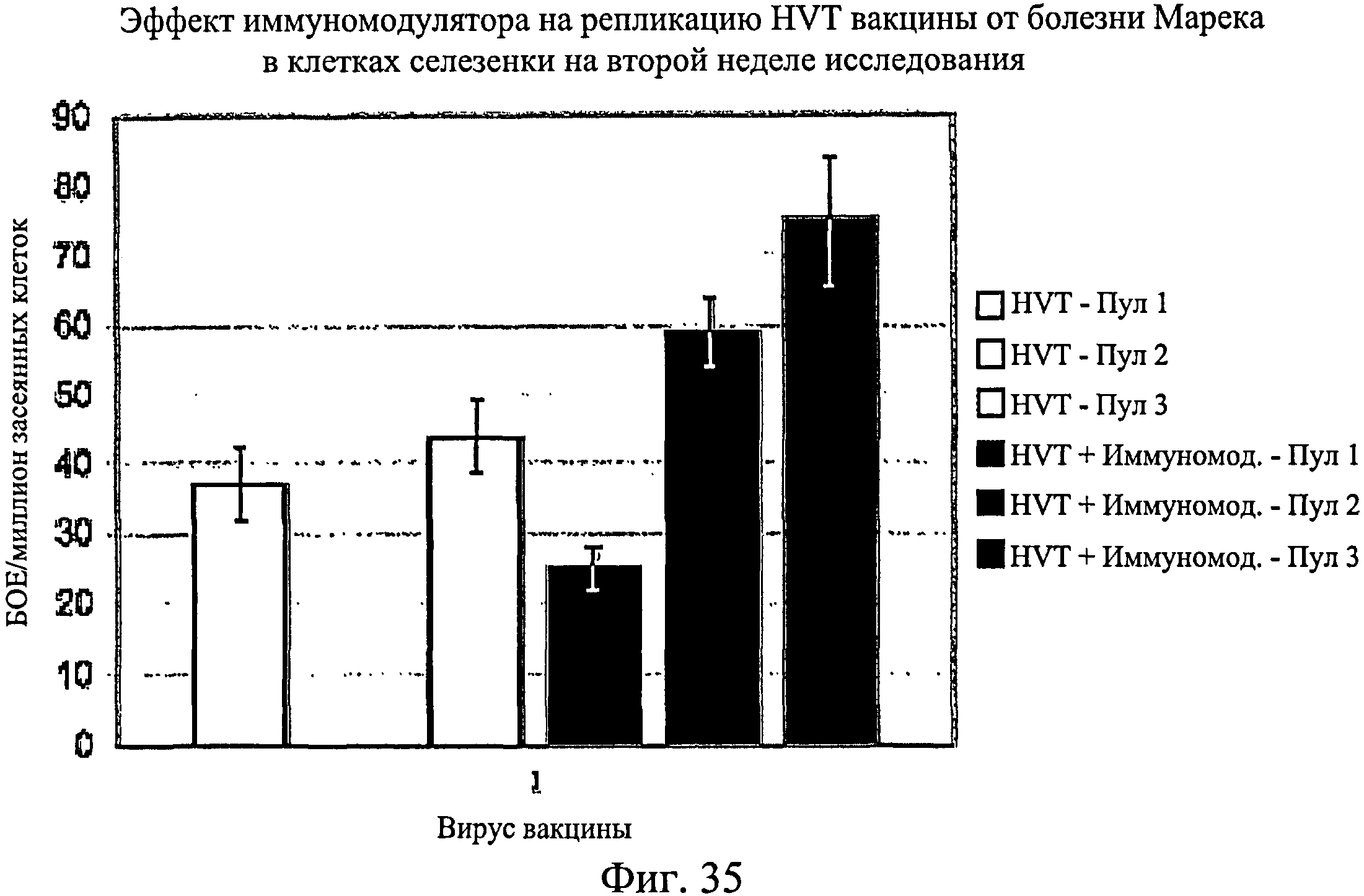
На фиг.35 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.36 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
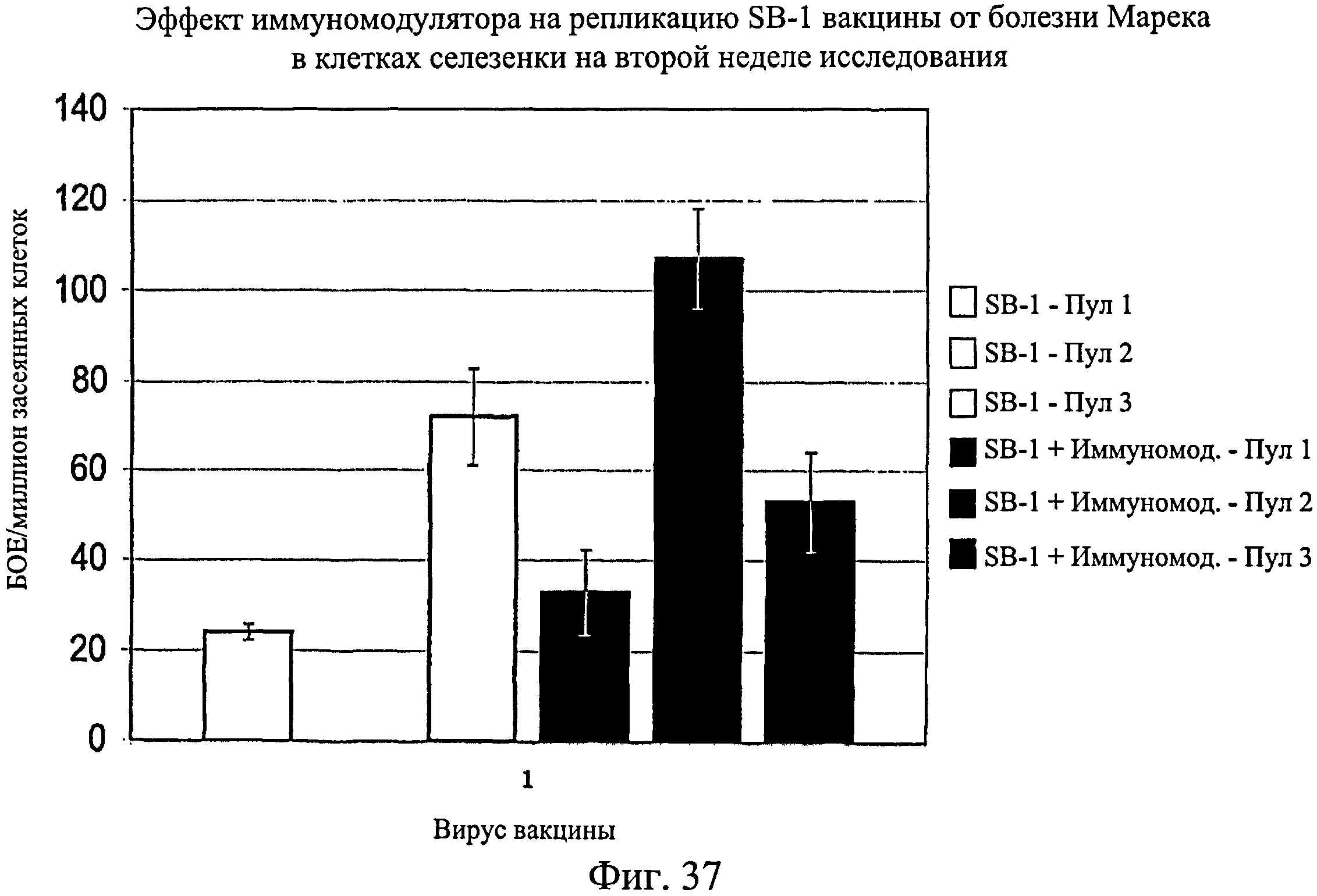
На фиг.37 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
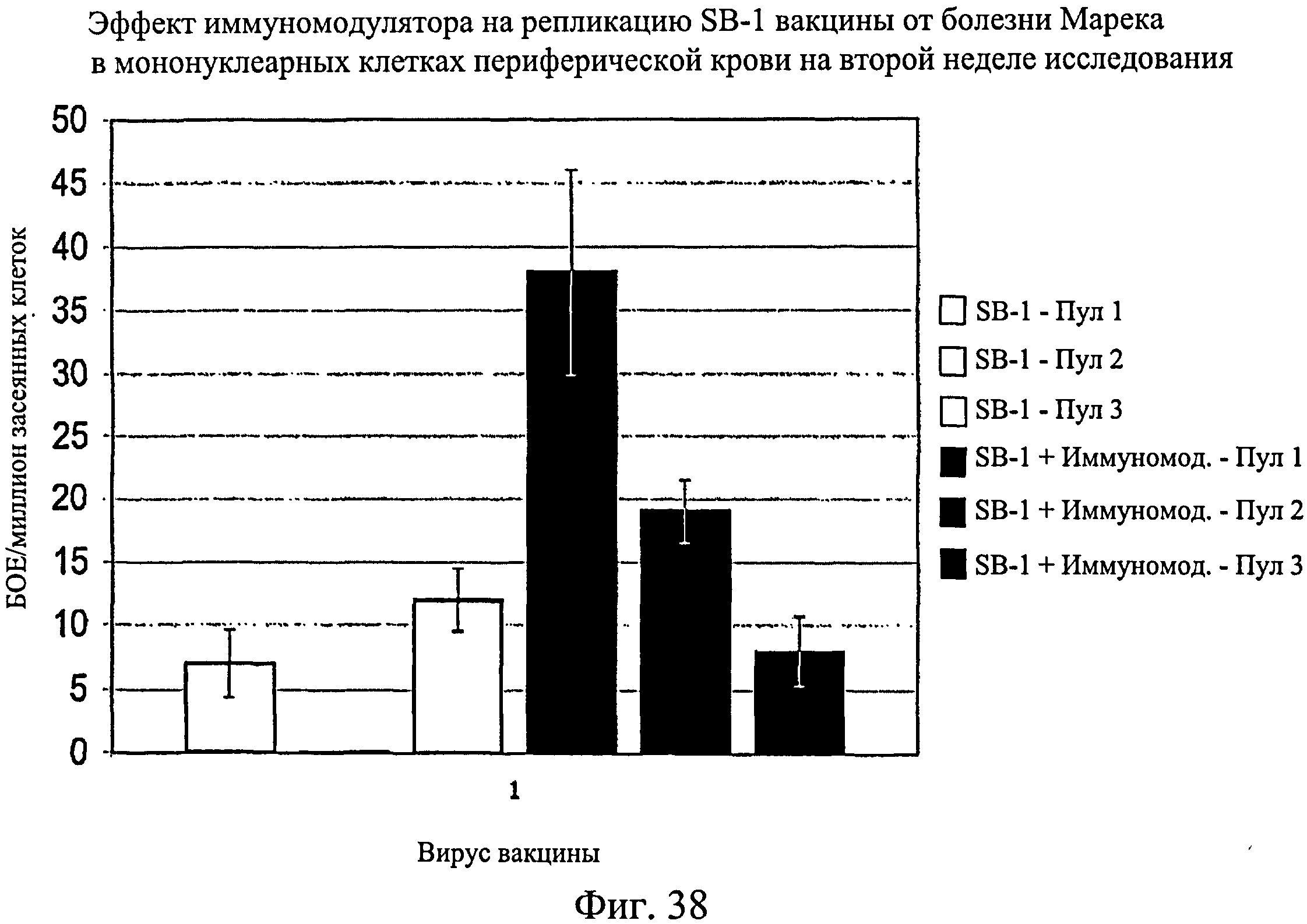
На фиг.38 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.39 графически изображено снижение аэросаккулита у цыплят, которые получали иммуномодулятор in ovo, были вакцинированы от болезни Ньюкасла и заражены. Анализируемые группы изучения включают группы, перечисленные в таблице 7.
На фиг.40 графически изображен анализ ELISA на 26-й день для исследуемых групп, перечисленных в таблице 7.
На фиг.41 графически изображена выживаемость цыплят в исследуемых группах, перечисленных в таблице 8.
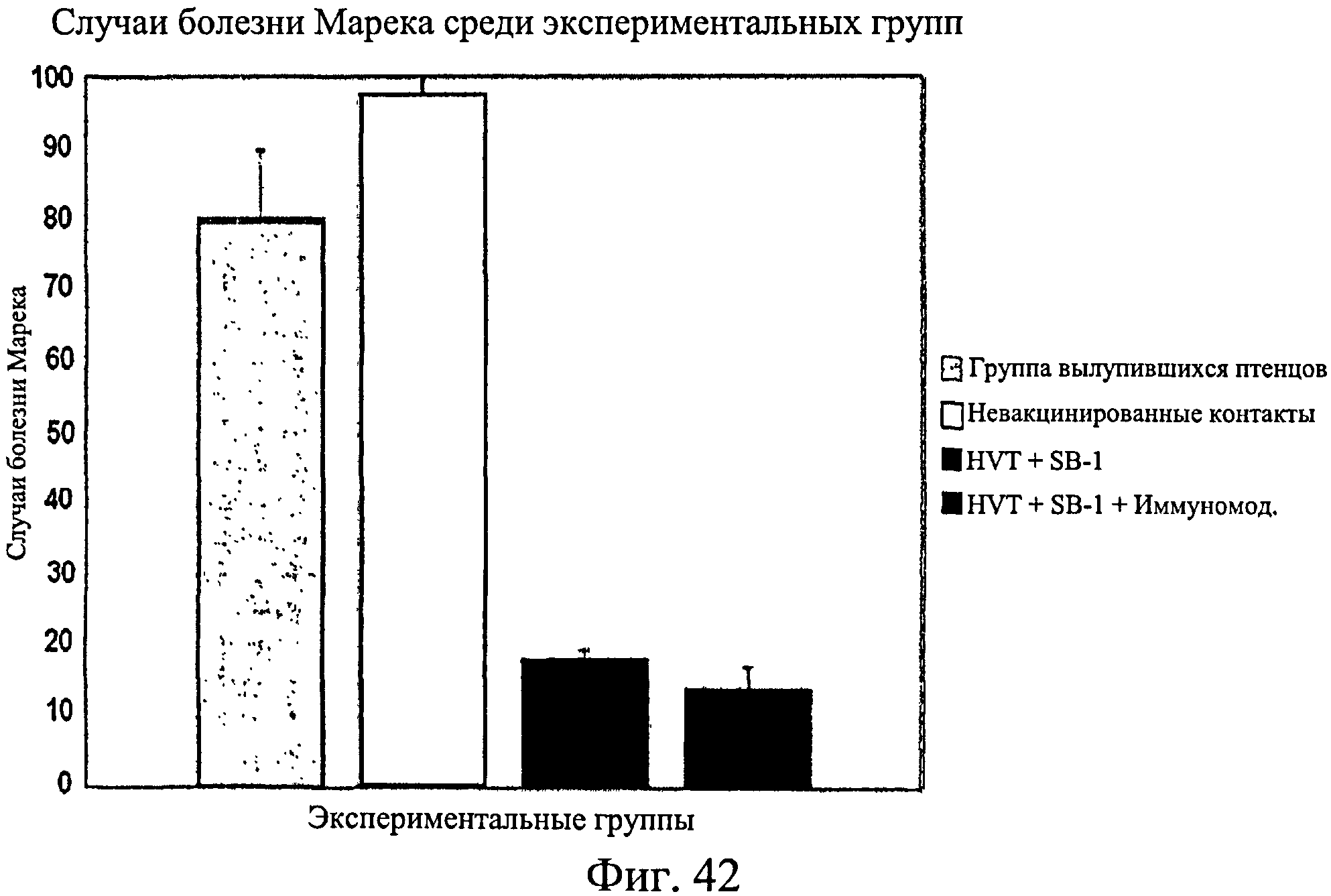
На фиг.42 графически изображены случаи болезни Марека среди исследуемых групп, перечисленных в таблице 8.
Подробное описание изобретения
Способ вызывания иммунного ответа у представителя вида птиц согласно настоящему изобретению включает введение представителю вида птиц эффективного количества композиции иммуномодулятора для вызывания иммунного ответа у представителя вида птиц. Композиция иммуномодулятора включает липосомальное средство доставки и, по меньшей мере, одну молекулу нуклеиновой кислоты. В частности, иммуномодулятор вызывает антиген-неспецифический иммунный ответ, который далее усиливается при введении, по меньшей мере, одного биологического агента, такого как вакцина.
Способы представляют новые стратегии лечения для защиты видов птиц от инфекционных болезней и лечения популяций, имеющих инфекционную болезнь. Кроме того, при применении композиции иммуномодулятора согласно настоящему изобретению отсутствует снижение вылупляемости или степени выживания после вылупления, когда иммуномодулятор вводится in ovo, и отсутствует снижение вылупляемости или степени выживания при совместном введении с вакциной. Далее, предварительное введение иммуномодулятора до введения вакцины усиливает антиген-неспецифический иммунный ответ. Способы согласно настоящему изобретению также обеспечивают безопасное применение вакцин in ovo, ранее доступных только для введения после вылупления. Кроме того, способ согласно настоящему изобретению позволяет сочетать более чем одну вакцину с композицией иммуномодулятора. Наконец, способ согласно настоящему изобретению обеспечивает более длительную защиту от болезни, когда иммуномодулятор применяется в комбинации с вакциной.
I. Композиция
а. Иммуномодулятор
В одном варианте выполнения изобретения композиция иммуномодулятора включает липосомальное средство доставки и, по меньшей мере, одну молекулу нуклеиновой кислоты, как описано в патенте США №6693086, который включен сюда в качестве ссылки.
Подходящее липосомальное средство доставки включает липидную композицию, которая способна доставлять молекулы нуклеиновой кислоты в ткани обработанного субъекта. Липосомальное средство доставки предпочтительно способно оставаться стабильным в субъекте в течение достаточного количества времени для доставки молекулы нуклеиновой кислоты и/или биологического агента. В одном варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 30 минут. В другом варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 1 часа. В еще одном варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 24 часов.
Липосомальное средство доставки согласно настоящему изобретению включает липидную композицию, которая способна сливаться с плазматической мембраной клетки для доставки молекулы нуклеиновой кислоты в клетку. В одном варианте выполнения изобретения при доставке комплекса нуклеиновая кислота: липосома согласно настоящему изобретению представляет собой, по меньшей мере, около 1 пикограмма (пг) экспрессированного белка на миллиграмм (мг) суммарного белка ткани на микрограмм (мкг) доставленной нуклеиновой кислоты. В другом варианте выполнения изобретения эффективность трансфекции комплексом нуклеиновая кислота: липосома представляет собой, по меньшей мере, около 10 пг экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты; и в еще одном варианте выполнения изобретения, по меньшей мере, около 50 пг экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты. Эффективность трансфекции комплекса может быть такой низкой, как 1 фемтограмм (фг) экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты, где указанные выше количества более предпочтительны.
Предпочтительное липосомальное средство доставки согласно настоящему изобретению в диаметре составляет между около 100 и 500 нанометров (нм), в другом варианте выполнения между около 150 и 450 нм, и в еще одном варианте выполнения между около 200 и 400 нм.
Подходящие липосомы включают любые липосомы, такие как широко применяемые, например, в способах доставки генов, известных специалистам в данной области техники. Предпочтительные липосомальные средства доставки включают липиды в виде мультиламеллярных везикул (МЛВ) и липиды, полученные экструзией. Способы получения МЛВ хорошо известны в данной области техники. Более предпочтительные липосомальные средства доставки включают липосомы, имеющие поликатионную липидную композицию (т.е. катионные липосомы), и/или липосомы, имеющие холестериновую основную цепь, конъюгированную с полиэтиленгликолем. Примеры катионных липосомальных композиций включают, но не ограничены ими, N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония хлорид (DOTMA) и холестерин, N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония хлорид (DOTAP) и холестерин, 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния хлорид (DOTIM) и холестерин, диметилдиоктадециламмония бромид (DDAB) и холестерин и их комбинации. Наиболее предпочтительной липосомальной композицией для применения в качестве средства доставки является DOTIM и холестерин.
Подходящая молекула нуклеиновой кислоты включает любую последовательность нуклеиновой кислоты, такую как кодирующая или некодирующая последовательность, и ДНК или РНК. Кодирующие последовательности нуклеиновой кислоты кодируют, по меньшей мере, часть белка или пептида, в то время как некодирующая последовательность не кодирует какую-либо часть белка или пептида. Согласно настоящему изобретению "некодирующие" нуклеиновые кислоты могут включать регуляторные участки транскрипционной единицы, такие как промоторный участок. Термин "пустой вектор" может применяться взаимозаменяемо с термином "некодирующий" и, в частности, относится к последовательности нуклеиновой кислоты, в которой отсутствует участок, кодирующий белок, как, например, плазмидный вектор без вставки гена. Экспрессия белка, закодированного молекулой нуклеиновой кислоты, не требуется для вызывания антиген-неспецифического иммунного ответа; поэтому молекула нуклеиновой кислоты не должна быть обязательно функциональна связана с последовательностью, контролирующей транскрипцию. Однако могут быть получены другие преимущества (т.е. антиген-специфический и усиленный иммунитет) посредством включения в композицию последовательности нуклеиновой кислоты (ДНК или РНК), которая кодирует иммуноген и/или цитокин.
Образование комплекса липосомы с молекулой нуклеиновой кислоты может быть достигнуто путем применения способов, стандартных в данной области техники или описанных в патенте США №6693086, включенном сюда в виде ссылки. Подходящая концентрация молекулы нуклеиновой кислоты для добавления к липосоме включает концентрацию, эффективную для доставки достаточного количества молекулы нуклеиновой кислоты субъекту, чтобы вызвать системный иммунный ответ. Если молекула нуклеиновой кислоты кодирует иммуноген или цитокин, подходящая концентрация молекулы нуклеиновой кислоты для добавления к липосоме включает концентрацию, эффективную для доставки достаточного количества молекулы нуклеиновой кислоты в клетку, так чтобы клетка могла вырабатывать достаточное количество иммуногена и/или цитокина для регулирования клеточно-опосредованного иммунитета желательным образом. В одном варианте выполнения изобретения от около 0,1 мкг до около 10 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом, в другом варианте выполнения от около 0,5 мкг до около 5 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом, и в еще одном варианте около 1,0 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом. В одном варианте выполнения изобретения соотношение нуклеиновых кислот к липидам (мкг нуклеиновой кислоты: нмоль липидов) в композиции составляет, по меньшей мере, около 1:1 нуклеиновая кислота: липид по массе (т.е. 1 мкг нуклеиновой кислоты: 1 нмоль липида), и в другом варианте выполнения, по меньшей мере, около 1:5, и в еще одном варианте выполнения, по меньшей мере, около 1:10, и в еще одном варианте выполнения, по меньшей мере, около 1:20. Указанные здесь соотношения основаны на количестве катионного липида в композиции, а не на общем количестве липида в композиции. В другом варианте выполнения изобретения, соотношение нуклеиновых кислот к липидам в композиции согласно настоящему изобретению составляет от около 1:1 до около 1:64 нуклеиновая кислота: липид по массе; и в другом варианте выполнения от около 1:5 до около 1:50 нуклеиновая кислота: липид по массе; и в еще одном варианте выполнения от около 1:10 до около 1:40 нуклеиновая кислота: липид по массе; и в еще одном варианте выполнения от около 1:15 до около 1:30 нуклеиновая кислота: липид по массе. Другое соотношение нуклеиновая кислота: липид составляет от около 1:8 до 1:16, при этом предпочтительным является соотношение от около 1:8 до 1:32.
b. Биологический агент
В другом варианте выполнения данного изобретения иммуномодулятор включает липосомальное средство доставки, молекулу нуклеиновой кислоты и, по меньшей мере, один биологический агент.
Подходящими биологическими агентами являются агенты, которые эффективны для предотвращения или лечения болезней птиц. Такие биологические агенты включают повышающие иммунитет белки, иммуногены, вакцины или любую их комбинацию. Подходящими повышающими иммунитет белками являются белки, известные в качестве повышающих иммунитет. Неограничивающим примером является цитокин, который представляет собой известное семейство белков, повышающих иммунитет. Подходящими иммуногенами являются белки, которые вызывают гуморальный и/или клеточный иммунный ответ такой, что введение иммуногена субъекту повышает иммуноген-специфический иммунный ответ против тех же или подобных белков, которые встречаются в тканях субъекта. Иммуноген может включать патогенный антиген, экспрессируемый бактерией, вирусом, паразитом или грибом. Предпочтительные антигены включают антигены, которые вызывают инфекционную болезнь у субъекта. Согласно настоящему изобретению иммуногеном может быть любая часть белка, природная или синтетическая, которая вызывает гуморальный и/или клеточный иммунный ответ. Как таковой размер антигена или иммуногена может быть таким малым, как около 5-12 аминокислот, и таким большим, как полная длина белка, включая размеры между указанными. Антигеном может быть мультимерный белок или слитой белок. Антигеном могут быть очищенные пептидные антигены, полученные из нативных или рекомбинантных клеток. Последовательности нуклеиновой кислоты улучшающих иммунитет белков и иммуногенов функционально связываются с последовательностью, контролирующей транскрипцию, так что иммуноген экспрессируется в ткани субъекта, тем самым вызывая иммуноген-специфический иммунный ответ у субъекта в дополнение к неспецифическому иммунному ответу.
В другом варианте выполнения изобретения биологическим агентом является вакцина. Вакцина может включать живую, инфекционную, вирусную вакцину или убитую инактивированную вирусную вакцину. В одном варианте выполнения изобретения одна или более вакцин, живые или убитые вирусные вакцины могут применяться в комбинации с композицией иммуномодулятора согласно настоящему изобретению. Подходящие вакцины включают вакцины, известные в данной области техники для видов птиц. Примеры вакцин без ограничений включают вакцины, применяемые в данной области техники для защиты от вируса болезни Марека (MDV), вируса болезни Ньюкасла (NDV), вируса анемии цыплят (CAV), вируса инфекционного бурсита (IBDV), вируса инфекционного бронхита (IBV), вируса герпеса индейки (HVT), вируса инфекционного ларинготрахеита (ILTV), вирус энцефаломиелита птиц (AEV), вируса оспы птиц (FPV), птичьей холеры, вируса птичьего гриппа (AIV), реовируса, вируса лейкоза птиц (ALV), вируса ретикулоэндотелиоза (REV), птичьего аденовируса и вируса геморрагического энтерита (HEV), кокцидий и других болезней, известных в данной области техники. В другом примере вакциной может быть вакцина, описанная в патентах США №5427791, 6048535 и 6406702. В варианте выполнения изобретения, представленном для примера, вакцина для защиты от болезни Марека может применяться в комбинации с композицией иммуномодулятора согласно настоящему изобретению.
II. Способы
а. Способы иммунной стимуляции
В одном варианте выполнения данного изобретения иммунный ответ вызывается у представителя вида птиц путем введения эффективного количества композиции иммуномодулятора представителю вида птиц.
Эффективное количество является достаточным для вызывания иммунного ответа у представителя вида птиц. Иммуномодулятор включает липосомальное средство доставки и молекулу нуклеиновой кислоты.
В одном варианте выполнения изобретения, эффективное количество иммуномодулятора составляет от около 0,05 микрограмма до около 10 микрограммов. В другом варианте эффективное количество иммуномодулятора составляет от около 0,1 микрограмма до около 5 микрограммов.
В другом варианте выполнения данного изобретения иммунный ответ вызывается у представителя вида птиц путем введения эффективного количества композиции иммуномодулятора, которая включает липосомальное средство доставки, выделенную молекулу нуклеиновой кислоты и биологический агент. Предполагается, что биологический агент может вводиться совместно с иммуномодулятором или независимо от него. Независимое введение может осуществляться до или после введения иммуномодулятора. Также предполагается, что можно использовать более одного введения иммуномодулятора или биологического агента для продления усиленного иммунитета. Кроме того, более одного биологического агента может вводиться совместно с иммуномодулятором, вводиться до иммуномодулятора или вводиться после введения иммуномодулятора, как описано в Примерах. В одном варианте выполнения изобретения эффективное количество иммуномодулятора составляет от около 0,05 микрограмма до около 5 микрограммов липосомального средства доставки и выделенной молекулы нуклеиновой кислоты и от около 300 до около 30000 TCID50 (доза, инфицирующая 50% культуры ткани) вирусного биологического агента. В другом варианте выполнения изобретения эффективное количество иммуномодулятора составляет от около 0,1 микрограмма до около 3 микрограммов липосомального средства доставки и выделенной молекулы нуклеиновой кислоты и от около 100 до около 1000 EID50 (доза, инфицирующая 50% эмбрионов) вирусного биологического агента.
b. Болезни
Способы согласно изобретению вызывают такой иммунный ответ у субъекта, что субъект становится защищенным от болезни, то есть восприимчивым к вызыванию иммунного ответа. В данном описании фраза "защищенный от болезни" относится к снижению симптомов болезни; снижению случаев наступления болезни и снижению тяжести болезни. Защита субъекта может относиться к способности терапевтической композиции согласно настоящему изобретению при введении пациенту предотвращать наступление болезни и/или лечить или облегчать симптомы, признаки или причины болезни. Как таковая защита представителя вида птиц от болезни включает предотвращение наступления болезни (профилактическое лечение) и лечение представителя вида птиц, который уже заболел (терапевтическое лечение). В частности, защита пациента от болезни достигается путем вызывания иммунного ответа у представителя вида птиц через вызывание благотворного или защитного иммунного ответа, который может в некоторых случаях дополнительно подавлять, снижать, ингибировать или блокировать сверхактивный или вредный иммунный ответ. Термин "болезнь" относится к любому отклонению от нормального состояния здоровья представителя вида птиц и включает состояние, когда присутствуют симптомы болезни, а также состояния, при которых уже имеется отклонение (например, инфекция, мутация гена, генетический дефект и т.д.), но симптомы еще не видны.
Способы согласно изобретению могут применяться для профилактики болезней, стимулирования клеточно-опосредованного иммунитета от болезни, устранения болезни, облегчения болезни и профилактики вторичной болезни, развивающейся из первичной болезни.
Способы согласно изобретению включают введение композиции для защиты от заражения широким спектром патогенов. Введенная композиция может включать или не включать специфический антиген для вызывания специфического к нему ответа. Предполагается, что способы согласно изобретению защищают субъекта от болезни, вызванной инфекционными микробными агентами, включающими, без ограничений, вирусы, бактерии, грибы и паразиты. Примеры вирусных инфекционных болезней, без ограничений, включают болезни, возникающие при заражении вирусом инфекционной анемии кур (CIAV), вирусом болезни Марека (MDV), вирусом герпеса кур (HCV), вирусом герпеса индейки (HTV), вирусом инфекционного бурсита (IBDV), вирусом болезни Ньюкасла (NDV), вирусом инфекционного бронхита (IBV), вирусом инфекционного ларинготрахеита (ILTV), парамиксовирусом типа 3, вирусом энцефаломиелита птиц (AEV), вирусом оспы птиц (FPV), птичьей холерой, вирусом птичьего гриппа (AIV), реовирусом, вирусом лейкоза птиц (ALV), вирусом ретикулоэндотелиоза (REV), птичьим аденовирусом, вирусом геморрагического энтерита (HEV), пневмовирусом, голубиным поксвирусом, их рекомбинантными формами и другими вирусами, известными в данной области техники. Примеры бактериальных инфекций без ограничений включают инфекции грамположительными или грамотрицательными бактериями и грибами, как, например, Eschen'chia coli, Mycoplasma gallisepticum, Mycoplasma meleagn'dis, Mycoplasma synoviae, Bordetella Sp, Pasteurella multocida, Clostridium perfn'ngens, Clostridium colinum, Campylobacter jejuni, Salmonella sp, Salmonella enteritidis, Salmonella pullorum, Salmonella gallinarum, Clostridium botulinum, Hemophilus gallinarum, Erysipelothrix insidiosa, riemerella anatipestifer (RA) и другими бактериями, известными в данной области техники. Примеры грибковых или плесневых инфекций без ограничения включают инфекции, которые вызваны Aspergillus fumigates, Aspergillus flavus, Candida albicans и другими инфекционными грибами или плесенью, известными в данной области техники. Примеры болезней без ограничений включают болезни, вызванные токсинами грамположительных или грамотрицательных бактерий и грибов, как, например, токсин Clostridium perfringens, токсин Clostridium botulinum, энтеротоксин Е. coli, токсины стафилококка, лейкотоксин pasteurella и микотоксины fusarium, и другими токсинами, известными в данной области техники. Примеры паразитов включают без ограничений Eimeria meleagridis, coccidia sp, Ascaridia galli, Heterakis gallinae, Capillaria annulata, Capillaria contorta, Capillaria obsignata, Syngamus trachea и другие паразиты, известные в данной области техники.
с. Субъекты
Способы согласно изобретению могут применяться к любому субъекту или представителю видов птиц, домашних или диких. В частности, они могут применяться к субъектам, которых выращивают в коммерческих целях для разведения, производства мяса или яиц. Подходящие виды птиц включают без ограничений кур, индеек, гусей, уток, фазанов, перепелов, голубей, страусов, птиц, содержащихся в клетках, птиц в зоологических коллекциях и вольерах и тому подобное. В одном варианте выполнения изобретения представителя вида птиц выбирают из группы, состоящей из курицы или индейки. Специалист в данной области техники поймет, что способы согласно изобретению будут в основном полезны для птиц, выращиваемых в брудерах с высокой плотностью содержания, таких как бройлерные куры и курицы-несушки, так как они особенно подвержены атаке инфекционных агентов из окружающей среды.
d. Введение
Доступно множество способов введения. Конкретный выбранный способ зависит, конечно, от конкретных выбранных биологических агентов, возраста и общего состояния здоровья пациента, конкретного состояния, которое подвергается лечению, и дозы, требуемой для терапевтической эффективности. Способы согласно настоящему изобретению могут быть использованы на практике путем применения любого способа введения, который обеспечивает эффективные уровни иммунного ответа, не вызывая клинически неприемлемых побочных эффектов. Композиции для удобства могут быть представлены в виде единичных дозированных форм и могут быть получены любыми способами, известными в данной области техники.
Вакцинация птиц может проводиться в любом возрасте. Обычно вакцинацию проводят 18-дневным эмбрионам (in ovo) и старше в случае живых микроорганизмов и 3-недельным и старше - в случае инактивированных микроорганизмов или другого типа вакцины. В случае вакцинации in ovo вакцинацию проводят в последнюю четверть развития эмбриона. Вакцина может вводиться подкожно, в фолликул пера, распылением, перорально, внутрь глаза, интратекально, назально, in ovo или другими способами, известными в данной области техники. Пероральная вакцина может вводиться с питьевой водой. Кроме того, считается, что способы согласно изобретению могут применяться по стандартной схеме вакцинации. В одном варианте выполнения изобретения композицию иммуномодулятора согласно настоящему изобретению вводят in ovo. В другом варианте выполнения изобретения композицию иммуномодулятора вводят в виде спрея после заражения Е. coli.
Другие системы доставки могут включать пролонгированное выделение, отсроченное выделение или замедленное выделение. Такие системы позволяют избежать повторного введения композиций, тем самым повышая удобство применения. Многие типы высвобождающих систем доставки доступны и известны специалистам в данной области техники. Они включают системы на основе полимеров, таких как поли(лактид-гликолид), сополиоксалаты, поликапролактоны, сложные полиэфирамиды, сложные полиортоэфиры, полигидроксимасляная кислота и полиангидриды. Микрокапсулы указанных выше полимеров, содержащие лекарственные средства, описаны, например, в патенте США №5075109. Системы доставки также включают неполимерные системы, которые представляют собой липиды, включая стерины, такие как холестерин, сложные эфиры холестерина и жирных кислот, или нейтральные жиры, такие как моно-, ди- и триглицериды; гидрогелевые системы высвобождения; силастические системы; системы на основе пептидов; восковые покрытия; прессованные таблетки с применением обычных связывающих веществ и наполнителей; частично сшитые импланты; и тому подобное. Конкретные примеры включают, но не ограничены ими, эрозионные системы, в которых агент согласно изобретению содержится в форме внутри матрицы, такие как описаны в патентах США №4452775, 4675189 и 5736152, и диффузионные системы, в которых активный компонент высвобождается с контролируемой скоростью из полимера, такие как описаны в патентах США №3854480, 5133974 и 5407686. Кроме того, могут применяться аппаратные системы доставки на основе насоса, некоторые из которых адаптированы для имплантации.
Поскольку различные изменения могут быть сделаны в указанной выше композиции, продуктах и способах, не выходя за рамки объема данного изобретения, подразумевается, что все содержание указанного выше описания и представленных ниже примеров будет рассматриваться как иллюстративное и не имеющее ограничительного характера.
Определения
Термин "эффективное количество" относится к количеству, необходимому или достаточному для реализации желательного биологического эффекта. Например, эффективным количеством иммуномодулятора для лечения или профилактики инфекционной болезни является количество, необходимое для вызывания антиген-специфического иммунного ответа при микробной атаке, что приводит к снижению количества микробов у пациента и, предпочтительно, уничтожению микробов. Эффективное количество для любого конкретного способа применения может варьироваться в зависимости от таких факторов, как подвергающиеся лечению болезнь или состояние, размер пациента или тяжесть заболевания или состояния. Специалист в данной области техники может, исходя из своего опыта, определить эффективное количество иммуномодулятора без проведения неоправданного экспериментирования.
Термин "цитокин" относится к семейству белков, повышающих иммунитет. Семейство цитокинов включает гематопоэтический фактор роста, интерлейкины, интерфероны, молекулы суперсемейства иммуноглобулинов, молекулы семейства фактора некроза опухолей и хемокины (т.е. белки, которые регулируют миграцию и активацию клеток, особенно фагоцитов). Примеры цитокинов включают без ограничений интерлейкин-2 (ИЛ-2), интерлейкин-12 (ИЛ-12), интерлейкин-15 (ИЛ-15), интерлейкин-18 (ИЛ-18), интерферон-α (ИФНα), интерферон-β (ИФНβ) и интерферон-γ (ИФНγ).
Термин "вызывает" может применяться взаимозаменяемо с терминами активирует, стимулирует, генерирует или повышающе регулирует.
Термин "вызывание иммунного ответа" у пациента относится к особому контролю или влиянию на активность иммунного ответа и может включать активацию иммунного ответа, повышающее регулирование иммунного ответа, усиление иммунного ответа и/или изменение иммунного ответа (как, например, вызывание такого типа иммунного ответа, который, в свою очередь, изменяет преобладающий тип иммунного ответа у пациента с такого, который является вредным или неэффективным, на такой, который является полезным или защитным).
Термин "функционально связанный" относится к связыванию молекулы нуклеиновой кислоты с последовательностью, контролирующей транскрипцию, таким образом, что молекула способна экспрессироваться при трансфекции (т.е. трансформации, трансдукции или трансфекции) в клетку хозяина. Последовательностями, контролирующими транскрипцию, являются последовательности, которые контролируют инициацию, элонгацию и терминацию транскрипции. Особенно важными последовательностями, контролирующими транскрипцию, являются такие, которые контролируют инициацию транскрипции, как, например, последовательности промотора, энхансера, оператора и репрессора. Множество таких последовательностей, контролирующих транскрипцию, известно специалистам в данной области техники. Предпочтительные последовательности, контролирующие транскрипцию, включают такие, которые функционируют в клетках птиц, рыб, млекопитающих, бактерий, растений и насекомых. Хотя согласно изобретению могут применяться любые последовательности, контролирующие транскрипцию, последовательности могут включать встречающиеся в природе последовательности, контролирующие транскрипцию, естественным образом связанные с последовательностью, кодирующей иммуноген или белок, стимулирующий иммунитет.
Термины "молекула нуклеиновой кислоты" и "последовательность нуклеиновой кислоты" могут применяться взаимозаменяемо и включают ДНК, РНК или производные ДНК или РНК. Термины также включают олигонуклеотиды и более длинные последовательности, включая как молекулы нуклеиновой кислоты, которые кодируют белок или его фрагмент, так и молекулы нуклеиновой кислоты, которые содержат регуляторные участки, интроны или другие некодирующие ДНК или РНК. Обычно олигонуклеотид имеет последовательность нуклеиновой кислоты от около 1 до около 500 нуклеотидов и более предпочтительно, по меньшей мере, около 5 нуклеотидов в длину. Молекула нуклеиновой кислоты может быть получена из любого источника, включая млекопитающих, рыб, бактерии, насекомых, вирусы, растения или искусственные источники. Молекула нуклеиновой кислоты может быть получена способами, общеизвестными в данной области техники, такими как технология рекомбинантных ДНК (например, полимеразная цепная реакция (ПЦР), амплификация, клонирование) или химический синтез. Молекулы нуклеиновых кислот включают природные молекулы нуклеиновых кислот и их гомологи, включая, но не ограничиваясь ими, природные аллельные варианты и модифицированные молекулы нуклеиновых кислот, в которых вставлены, удалены, замещены или инвертированы нуклеотиды таким образом, что модификации практически не препятствуют способности молекулы нуклеиновой кислоты кодировать иммуноген или белок, стимулирующий иммунитет, полезные в способах согласно изобретению. Гомолог нуклеиновой кислоты может быть получен множеством способов, известных специалистам в данной области техники (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Labs Press, 1989), которая включена сюда в качестве ссылки. Методики скрининга на иммуногенность, как, например, иммуногенность патогенного антигена или активность цитокина, известны специалистам в данной области техники и включают множество анализов in vitro и in vivo.
Примеры
Представленные ниже примеры иллюстрируют различные варианты выполнения изобретения.
Пример 1. Материалы и методы
Иммуномодулятор
Иммуномодулятор, применяемый в этом исследовании, представлял собой композицию, содержащую катионный липид и некодирующую ДНК. Для получения липосом диаметром приблизительно 200 нм применяют синтетические липидные компоненты иммуномодулятора [1-[2-[9-(Z)-октадеценоилокси]]-2-[8](Z)-гептадеценил]-3-[гидроксиэтил]имидазолиния хлорид (DOTIM) и синтетический нейтральный липид холестерин (см. патент США 6693086). Компонент ДНК представлял собой некодирующую ДНК-плазмиду длиной 4292 пары оснований (рМВ 75.6), продуцируемую бактериями Е. coli, которая, будучи отрицательно заряженной, связывается с положительно заряженными (катионными) липосомами (см. патент США 6693086).
|
Исследуемые животные
Коммерчески доступные куриные яйца (мясные бройлеры) проверяли на свет для установления жизнеспособности на 18-й день инкубации. Здоровых эмбрионов включали в исследование, а неоплодотворенных, мертвых и нездоровых эмбрионов отбраковывали. Цыплят помещали в обычный занавешенный с боковых сторон птичник калифорнийского типа. Каждый отсек имел 50 птиц, не сортированных по полу, помещенных туда в 0-й день. Цыплята получали рацион, который соответствует рекомендациям Совета медицинских исследований (Medical Research Council, MRC) для возраста и массы тела исследуемых животных, также цыплята имели неограниченный доступ к воде, подаваемой через поилку в виде колокола, подключенную к источнику воды для каждого отсека.
Экспериментальное инфицирование и заражение
Цыплят заражали организмами для определения эффективности иммунного ответа. Заражение, или экспериментальное инфицирование, включало контакт с инокулятом организмов, таких как Eschenchia coli (E. coli). Организмы применялись в концентрации 2,63×105 и вводились распылением 0,15 мл инокулята на каждое оплодотворенное яйцо, находящееся в выводковом лотке.
Пример 2. Введение иммуномодулятора повышает вылупляемость
Исследование проводили для определения эффективности иммуномодулятора, описанного в примере 1 и введенного 18-дневным оплодотворенным куриным яйцам после обработки Eschenchia coli (E. coli). Исследование включало две группы (Таблица 2), одна из которых заражена E. coli (Т1-4) и другая группа не заражена (Т5 и Т6). В зараженной E. coli группе было четыре подгруппы, каждой из которых вводят различную дозу иммуномодулятора, включая отсутствие дозы (Т1), 0,1 мкг (Т2), 1,0 мкг (Т3) и 10,0 мкг (Т4). Незараженная группа включала две подгруппы, которым либо не вводили иммуномодулятор (Т5), либо вводили 1,0 мкг иммуномодулятора (Т6).
|
В 0-й день исследования 18-дневным оплодотворенным яйцам, получающим иммуномодулятор, делали впрыскивание in ovo. В 1-й день на каждое 19-дневное оплодотворенное яйцо в заражаемых группах (Т1-Т4) распыляют 0,15 мл инокулята, содержащего Е. coli в концентрации 2,63×105.
Анализ всех групп показал статистически значимый эффект обработки на вылупляемость оплодотворенных яиц. Не было никаких значительных различий между двумя незараженными контрольными группами (Т5, О м кг/кг - вылупляемость 91%, а Т6, 1,0 мкг/кг - вылупляемость 89%). Кроме того, сравнение необработанных групп (Т1 - зараженной и Т5 - незараженной) говорит о большем количестве оплодотворенных яиц, вылупившихся в незараженной группе (85% против 91% соответственно). Таким образом, модель заражения была подтверждена как эффективная модель для оценки степени вылупляемости.
Из четырех групп, обработанных иммуномодулятором, в группе Т3 (1,0 мкг/кг обработанных яиц) вылупилось больше птиц (91,5%), чем в необработанной/зараженной группе Т1 (84,5%) или в группе Т4 (10,0 мкг/кг обработанных яиц) (85%) (Фиг.1). Похожие различия наблюдались между необработанной/незараженной контрольной группой (Т5) и теми же двумя экспериментальными группами (Т1, как указано выше, и Т4). Никаких других значительных результатов не наблюдалось при проведении любых оставшихся попарных групповых сравнений (Фиг.1).
Не было никаких существенных различий в доле птиц, погибших на отсек, на группу, на день исследования (Фиг.2). Доля птиц, выживших на любой конкретный день исследования, не показала статистически значимой взаимосвязи между обработкой и временем, но продемонстрировала существенный эффект от обработки (Фиг.3). Птиц в группах Т3, Т5 и Т6 было значительно больше на любой день исследования по сравнению с группами Т1, Т2 и Т4. Кроме того, в группе Т5 было значительно больше выживших птиц, чем в группе Т3. Оценка жизнеспособности птиц после вылупления привела к значительным результатам, схожим с указанными выше (Фиг.4 - Фиг.12).
Не было никаких существенных различий в массе тела в отсеках на 7-й, 14-й, 21-й или 28-й день (Фиг.13 - Фиг.16). Анализы общей массы в отсеке на 35-й день показали существенное различие между группами Т5 и Т2 (в среднем 87 кг против 75 кг соответственно) (Фиг.17). Масса тела в отсеке в конце исследования (45-й день) была больше для групп Т5 (120 кг) и Т6 (117 кг) по сравнению с Т1 (105 кг) и для группы Т5 по сравнению с Т2 (106 кг) и Т4 (105 кг) (Фиг.18).
В общем, оценивали эффект иммуномодулятора при введении in ovo до заражения Е. coli у коммерчески доступных бройлеров. Из групп, обработанных иммуномодулятором, в группе Т3 вылупилось больше птиц (92%), чем в необработанной/зараженной группе Т1 (85%) или группе Т4 (85%). Схожие различия наблюдались между необработанной/незараженной контрольной группой (Т5) и теми же экспериментальными группами Т1 и Т4. Не было существенных различий в смертности (Фиг.2 - Фиг.12) и массе тела (Фиг.13 - Фиг.18). В этом исследовании иммуномодулятор показал себя эффективным для повышения вылупляемости коммерчески доступных яиц бройлеров, зараженных Е. coli до вылупления, особенно в дозе 1,0 мкг, что подтверждает усиленный иммунитет в группах, получавших иммуномодулятор.
Пример 3. Введение иммуномодулятора повышает антиген-неспецифический иммунитет
Исследование проводили для определения эффекта иммуномодулятора, описанного в примере 1, на вакцинированных от болезни Марека цыплятах, зараженных Е. coli. Исследование включало две группы, одна из которых заражена Е. coli (T1-T4) и другая группа не заражена (Т5 и Т6). В зараженной Е. coli группе было четыре подгруппы, каждой из которых вводили различные дозы иммуномодулятора, включая отсутствие дозы (Т1), 0,1 мкг (Т2), 1,0 мкг (Т3) и 1,0 мкг плюс 1 доза вакцины Марека (Т4) (Таблица 3). Незараженная группа включала две подгруппы, которым либо не вводили иммуномодулятор (Т5), либо вводили 1,0 мкг иммуномодулятора (Т6).
|
Коммерчески доступные яйца бройлеров инкубировали в течение 18-ти дней, проверяли на свет для установления жизнеспособности и затем 18-дневным оплодотворенным яйцам, предназначенным для получения иммуномодулятора, делали впрыскивание in ovo. Затем на 19-дневные оплодотворенные яйца в зараженных группах распыляли 0,15 мл инокулята, содержащего Е. coli в концентрации 2,8×107 на миллилитр. Яйца вылуплялись на 0-й день исследования, длившегося 45 дней.
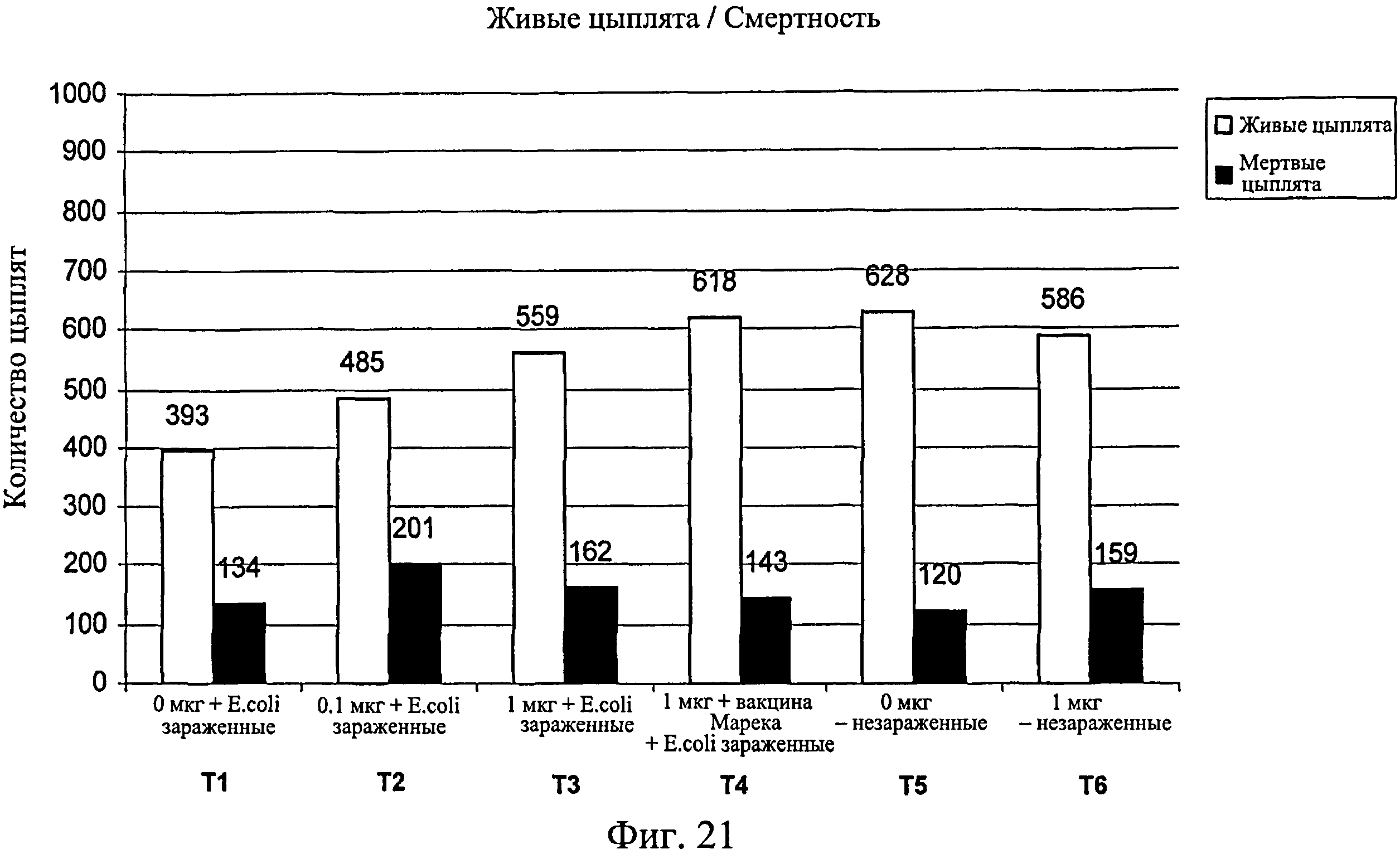
Количество вылупившихся оплодотворенных яиц записывалось для каждой группы (n=1000 на группу или выводковый лоток) (Фиг.19). Из вылупившихся цыплят записывали количество цыплят, выживших на 7-й день после вылупления (Фиг.20). Также записывали количество живых/мертвых цыплят на группу на 7-й день после вылупления (Фиг.21).
Процент смертности понижался при повышении количества иммуномодулятора в зараженных группах, а совместное введение вакцины Марека с иммуномодулятором дополнительно снижало процент смертности (Фиг.22).
Данные демонстрируют, что в незараженных Е. coli группах не было снижения вылупляемости при сравнении обработанных и необработанных иммуномодулятором групп (Фиг.23). В зараженных Е. coli группах вылупляемость была значительно выше в группах, обработанных иммуномодулятором, по сравнению с необработанными. Вылупляемость оплодотворенных яиц, получавших иммуномодулятор и дозу вакцины Марека, была схожей с вылупляемостью в необработанном и незараженном контроле. Суммируя изложенное, иммуномодулятор повышает вылупляемость в условиях заражения, и защитный эффект иммуномодулятора усиливается при совместном введении с вакциной Марека. Результаты свидетельствуют о том, что антиген-неспецифический иммунный ответ вызывается при введении иммуномодулятора или иммуномодулятора и вакцины от болезни Марека.
Пример 4. Введение иммуномодулятора вызывает антиген-неспецифический иммунный ответ, который усиливается при дополнительном введении биологического агента
Исследование проводили для определения эффекта иммуномодулятора на вакцинированных от болезни Марека цыплят, зараженных E. coli. Исследование включало девять групп, которые дифференцированно обрабатывались так, как показано в таблице 4.
|
Коммерчески доступные яйца бройлеров инкубировали в течение 18-ти дней, проверяли на свет для установления жизнеспособности и затем 18-дневным оплодотворенным яйцам, получающим иммуномодулятор, делали впрыскивание in ovo. Затем на каждое 19-дневное оплодотворенное яйцо из зараженных групп распыляли 0,15 мл инокулята, содержащего E. coli в концентрации 2,63×105 на миллилитр. Яйца вылуплялись на 0-й день исследования, длившегося 45 дней.
Процент вылупившихся оплодотворенных яиц рассчитывали для каждой группы (Фиг.24). Для вылупившихся цыплят процент смертности подсчитывали на 7-й день после вылупления для зараженных (Фиг.26) и незараженных (Фиг.25) групп. В зараженных группах наблюдался более высокий процент смертности, чем в таким же образом обработанных незараженных группах (Фиг.27). Процент живых цыплят на группу подсчитывали на 7-й день после вылупления (Фиг.28), а также в дни с 3-го (18-дневный живой эмбрион) до 7-го (Фиг.29, n=400). Наблюдалась значительно более высокая степень выживаемости для птиц, обработанных иммуномодулятором до заражения (>98,2%, Фиг.28), по сравнению с контрольной группой, которая была заражена (82,2%, Фиг.28). Также наблюдалась значительно более высокая степень выживания на 7-й день для птиц, обработанных при вылуплении иммуномодулятором до и после заражения на 7-й день (95%, Фиг.28), по сравнению с зараженными контрольными группами (82,2%, Фиг.28). Эти результаты повторно наблюдались при использовании партии из 400 яиц на группу (Фиг.29). Наблюдалась более высокая степень выживания на 7-й день для эмбрионов, обработанных до заражения (партия из 400 яиц) (>94,3%, Фиг.29), по сравнению с контрольной группой (67,0%, Фиг.29). Подобным образом наблюдалось значительно более высокая степень выживания для птиц, обработанных иммуномодулятором in ovo (97,4%, Фиг.30, без второй обработки, на 14-й день) по сравнению с зараженной контрольной группой (81,9%, Фиг.30). Наблюдалось значительно большее количество живых птиц на 14-й день в группе, обработанной иммуномодулятором в 1-й день жизни, после заражения, 93,9% (Фиг.30), никакой первой обработки по сравнению с контрольной группой 81,9% (Фиг.30). Также наблюдалось значительно больше живых птиц на 14-й день в группе, обработанной иммуномодулятором in ovo и затем в 1-й день жизни, 95,8% (Фиг.30), по сравнению с контрольной группой, 81,9% (Фиг.30). На Фиг.30 показана смертность в неделю зараженных и незараженных групп с различной обработкой.
Данные демонстрируют, что в незараженных Е. coli группах не было снижения вылупляемости среди групп, обработанных иммуномодулятором (обработанных один или два раза) и необработанных иммуномодулятором. Вылупляемость была выше в группах, которые до заражения Е. coli были обработаны иммуномодулятором. Этот эффект усиливался, когда иммуномодулятор вводился совместно с вакциной от болезни Марека. Также обработка иммуномодулятором коррелировала со снижением смертности среди незараженных групп. Смертность дополнительно снижалась при совместном введении вакцины от болезни Марека, а также при наличии предварительной обработки иммуномодулятором до введения иммуномодулятора с вакциной от болезни Марека. Эти результаты повторялись в зараженных группах. В общем, иммуномодулятор повышает вылупляемость в условиях заражения, и защитный эффект иммуномодулятора усиливается при совместном введении вакцины от болезни Марека. Результаты свидетельствуют о том, что антиген-неспецифический иммунный ответ, вызываемый введением иммуномодулятора, усиливается, когда введение сопровождается вакциной от болезни Марека. Совместное введение иммуномодулятора с вакциной от болезни Марека также усиливает антиген-неспецифический иммунный ответ.
Пример 5. Введение иммуномодулятора после заражения вызывает антиген-неспецифический иммунный ответ, который усиливается при дополнительном введении биологического агента
Наблюдалась значительно более высокая степень выживания у птиц, обработанных иммуномодулятором после заражения (95%, Фиг.28) по сравнению с зараженными контрольными группами (82,2%, Фиг.28). Эти результаты повторялись и с партией, содержащей 400 яиц на группу (Фиг.29).
Результаты свидетельствуют о том, что антиген-неспецифический иммунный ответ, вызываемый введением иммуномодулятора после заражения Е. coli, усиливается, если его введение сопровождается вакциной от болезни Марека. Введение иммуномодулятора после вакцины от болезни Марека усилило антиген-неспецифический иммунный ответ.
Пример 6. Введение иммуномодулятора с двухвалентным биологическим агентом не ингибирует раннюю репликацию двухвалентного биологического агента.
Исследование проводили на предмет того, будет ли иммуномодулятор отрицательно влиять на раннюю репликацию бивалентной вакцины от болезни Марека. Двухвалентная вакцина от болезни Марека включает HVT (вирус герпеса индейки) и SB1 (вирус герпеса кур).
Коммерчески доступные яйца бройлеров инкубировали в течение 18 дней, просвечивали на жизнеспособность. Яйца разделили на 3 группы А-С по 20 яиц в группе. Каждое яйцо вакцинировали так, как показано в таблице 5.
|
Для оценки эффекта иммуномодулятора на репликацию вакцинного вируса in vivo повторное выделение вируса проводят на 7-й и 14-й дни после внесения из клеток селезенки (КС) и мононуклеарных клеток периферической крови (МКПК).
Поскольку известно, что вирусная инфекция вакцины от болезни Марека варьируется от птицы к птице по уровню репликации вируса, повторное выделение проводили с применением трех пулов цыплят (2 цыпленка на пул, 3 пула на точку выборки).
Несмотря на вариабельность среди пулов, имеется четкая тенденция репликации HVT и SB-1 в присутствии иммуномодулятора. Эти данные были наиболее значимыми для репликации SB-1 в течение первой недели, но общие тенденции для HVT и SB-1 были схожи для обеих тканей в оба момента времени (7 и 14 дни после вылупления). Данные суммированы на Фиг.31 - Фиг.38. На Фиг.31 показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в клетках селезенки на 1-й неделе. На Фиг.32 показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на 1-й неделе. На Фиг.33 показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на 1-й неделе. На Фиг.34 показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на 1-й неделе. На Фиг.35 показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в клетках селезенки на 2-й неделе. На Фиг.36 показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на 2-й неделе. На Фиг.37 показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на 2-й неделе. На Фиг.38 показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на 2-й неделе.
Иммуномодулятор не оказывает негативное действие на репликацию вакцины от болезни Марека. По-видимому, иммуномодулятор обладает адъювантным действием, которое увеличивает репликацию HVT и SB-1 в первые две недели после инфекции. Эти данные позволяют предположить, что иммуномодулятор будет иметь положительное действие на эффективность вакцины от болезни Марека.
Пример 7. Введение иммуномодулятора с модифицированным живым биологическим агентом не вступает в конфликт с модифицированным живым биологическим агентом
Исследование проводилось для определения эффекта иммуномодулятора на цыплят, вакцинированных модифицированной живой вакциной от болезни Ньюкасла и зараженных болезнью Ньюкасла. Исследование включало девять групп, которые дифференцированно обрабатывали так, как указано в таблице 6.
|
Коммерчески доступные яйца бройлеров инкубировали в течение 18-ти дней, просвечивали на жизнеспособность. Яйца разделили на 9 групп, Т1-Т9, по 60 яиц в группе. Группа Т9 подверглась атаке вредителей в 1-ю ночь после вылупления, и в ходе исследования произошло несколько смертей по неизвестным причинам. Во время выбраковки количество птиц в группах было таким, как перечислено в таблице 7.
|
В 18-дневные оплодотворенные яйца в группах Т4-Т6 впрыскивали иммуномодулятор in ovo. Группам Т1-ТЗ и Т7-Т9 впрыскивали физиологический раствор. На 0-й день яйца вылуплялись, и на цыплят в группах Т1-Т2 распыляли физиологический раствор, группы Т3-Т6 получали вакцину от болезни Ньюкасла, Newhatch-C2, выпускаемую Intervet/Schering-Plough Animal Health, на группы Т7-Т9 распыляли иммуномодулятор и проводили вакцинацию.
Сыворотку на титры anti-NDV брали на 7-й, 14-й и 21-й дни после вылупления. На 21-й день цыплят из групп Т2-Т9 заражали вирусом болезни Ньюкасла со сниженной вирулентностью. На 26-й день цыплят выбраковывали, брали кровь, исследовали на макропатологию аэросаккулита и проводили анализ сыворотки.
Данные говорят о том, что не было существенных отличий в серологии между группами на 7-й, 14-й и 21-й дни. Однако на 26-й день, который был через 5 дней после заражения, у птиц, получивших иммуномодулятор in ovo, наблюдалось резко повышенное количество титров anti-NDV по сравнению со всеми другими группами, включая получивших только вакцину (Фиг.40).
Аэросаккулит был резко сниженным в группах Т2-Т5, цыплята которых получали иммуномодулятор in ovo (Фиг.39). Результаты свидетельствуют о том, что введение иммуномодулятора in ovo не препятствует вакцинации от болезни Ньюкасла.
Пример 8. Эффективность введения иммуномодулятора с биологическим агентом при вирулентном заражении
Исследование проводили для оценки влияния единичной дозы иммуномодулятора на обычную вакцинацию от болезни Марека 18-дневных оплодотворенных яиц. В исследовании сравнивали эффективность вакцинации от болезни Марека с вирулентным заражением.
160 оплодотворенных яиц разделили на 8 групп. Каждого птенца при вылуплении заражали вирусом болезни Марека, 0-й день исследования. Количество вылупившихся птенцов составляло 148 из 160 (см. таблицу 8 ниже с исходным количеством яиц/птиц в сравнении с фактическим количеством птиц в конце исследования (указано в скобках)). Через три недели в каждую группу добавили еще по 80 птиц, 15 невакцинированных и необработанных птиц (контакты) и 65 обработанных птиц (вакцинаты) (обработку каждой группы см. в таблице 8 ниже).
|
На 42-й день исследования выживших птенцов вынимали и вскрывали. На 63-й день исследования (42-й день для контактных и вакцинированных птиц) выживших исследуемых птиц вынимали и вскрывали.
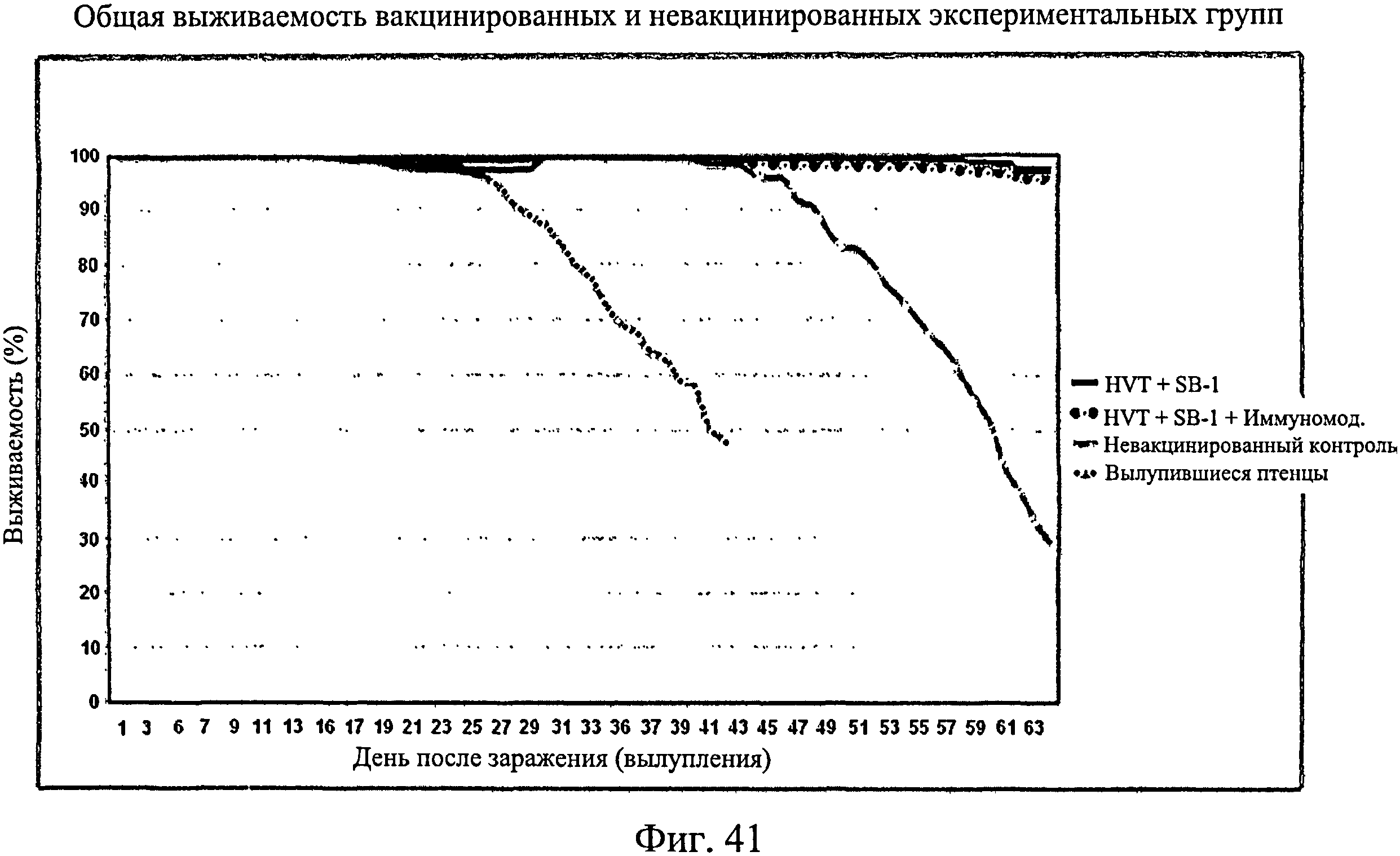
На Фиг.41 показаны кривые выживаемости инокулированных птенцов, невакцинированных контактных птиц, только вакцинированных птиц, птиц, получивших вакцину/иммуномодулятор. Данные для невакцинированных контактов являются средними для 8 отсеков, а для каждой вакцинированной группы являются средними для 4 отсеков каждый. Как можно видеть, имеется сходство в наклоне кривых выживаемости для птиц, получивших только вакцину, и птиц, получивших вакцину/иммуномодулятор.
На Фиг.42 показано среднее количество случаев болезни Марека у инокулированных птенцов, невакцинированных контактных птиц, только вакцинированных птиц, птиц, получивших вакцину/иммуномодулятор. Данные для птенцов и контактных птиц являются средними для 8 отсеков, а для вакцинированных групп являются средними для 4 отсеков каждый. Как можно увидеть, в группе, подвергнутой только вакцинации, и группе, получавшей вакцину/иммуномодулятор, было намного меньше случаев болезни Марека. В группе, получившей вакцину/иммуномодулятор, было меньше случаев болезни Марека, чем в группе, подвергнутой только вакцинации.
Как можно видеть из Фиг.41 - Фиг.42, иммуномодулятор не оказывает неблагоприятного действия на вакцинную защиту от болезни Марека. Фактически он усиливает эффективность вакцины.