Результат интеллектуальной деятельности: СПОСОБ ИЗГОТОВЛЕНИЯ ТВЕРДОГО, ОРАЛЬНО ПРИМЕНИМОГО ФАРМАЦЕВТИЧЕСКОГО СОСТАВА
Вид РИД
Изобретение
Настоящее изобретение относится к способу изготовления твердого, орально применимого фармацевтического состава, содержащего гидрофилизованную форму 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида, а также к его применению для профилактики и/или лечения заболеваний.
5-Хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазоли-дин-5-ил}метил)-2-тиофенкарбоксамид (I) является низкомолекулярным, орально применимым ингибитором фактора свертывания крови Ха, который может использоваться для профилактики и/или лечения различных тромбоэмболических заболеваний (смотри, например, международную заявку на патент WO-A 01/47919, описание которой включено в настоящую заявку в качестве ссылки). В нижеследующем описании под действующим веществом (I) подразумеваются любые модификации 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида (I), a также соответствующие гидраты.
Действующее вещество (I) сравнительно плохо растворимо в воде (около 7 мг/л). В связи с этим могут возникать проблемы, обусловленные недостаточной оральной биологической доступностью этого действующего вещества, а также повышенной биологической нестабильностью скорости его всасывания.
Ранее были описаны различные концепции повышения оральной биологической доступности действующих веществ.
Так, например, часто используют растворы действующих веществ, которые можно фасовать, например, в состоящие из мягкой желатины капсулы. Однако в связи с плохой растворимостью действующего вещества (I) в пригодных для этой цели растворителях подобный вариант повышения оральной биологической доступности неприемлем для рассматриваемого случая, поскольку для создания обладающих необходимым потенциалом лекарственных доз потребовались бы капсулы столь большого размера, что их невозможно было бы проглотить.
Альтернативой является метод аморфизации действующего вещества. Однако при этом возникают такие же проблемы, как и для указанного выше метода растворения, поскольку действующее вещество (I) также плохо растворимо в фармацевтически пригодных растворителях, таких как этанол или ацетон. В связи с высокой температурой плавления действующего вещества (около 230 °C) неприемлемой является также его аморфизация методом плавления, поскольку в процессе изготовления соответствующих препаратов образуются недопустимо высокие количества продуктов деструкции.
Кроме того, описан метод гидрофилизации гидрофобных действующих веществ на примере гексобарбитала и фенитоина (Lerk, Lagas, Fell, Nauta, Journal of Pharmaceutical Sciences, том 67, №7, июль 1978, 935-939: "Effect of Hydrophilization of Hydrophobic Drugs on Release Rate from Capsules"; Lerk, Lagas, Lie-A-Huen, Broersma, Zuurman, Journal of Pharmaceutical Sciences, том 68, №5, май 1979, 634-638: "In Vitro and in Vivo Availability of Hydrophilized Phenytoin from Capsules"). Согласно описанному методу частицы действующего вещества перемешивали в смесителе с раствором метилцеллюлозы, соответственно гидроксиэтилцеллюлозы, в максимальной степени избегая их агломерирования. Затем полученное указанным образом действующее вещество без дополнительной обработки фасовали в состоящие из твердой желатины капсулы.
Неожиданно было обнаружено, что особая обработка поверхности действующего вещества (I), выполняемая в процессе увлажнительного гранулирования, обеспечивает повышение его способности к всасыванию. Использование гидрофилизованной формы действующего вещества (I) для изготовления твердых, орально применимых фармацевтических составов обеспечивает значительное повышение биологической доступности соответствующих препаратов.
Объектом настоящего изобретения является способ изготовления твердого, орально применимого фармацевтического состава, содержащего гидрофилизованную форму 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфоли-нил)фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида, причем
(а) сначала путем увлажнительного гранулирования изготавливают гранулят, содержащий гидрофилизованную форму действующего вещества (I),
(b) затем гранулят при необходимости при добавлении фармацевтически пригодных добавок преобразуют в фармацевтический состав.
Увлажнительное гранулирование на стадии (а) можно осуществлять в смесителе (гранулирование в смесителе) или псевдоожиженном слое (гранулирование в псевдоожиженном слое), причем предпочтительным является гранулирование в псевдоожиженном слое.
При увлажнительном гранулировании действующее вещество (I) может быть введено в виде твердого продукта в премикс, либо подвергнуто суспендированию в гранулирующей жидкости. Действующее вещество (I) предпочтительно вводят на стадию увлажнительного гранулирования в виде суспензии в гранулирующей жидкости (суспензионный метод).
В одном из предпочтительных вариантов осуществления настоящего изобретения действующее вещество (I) используют в кристаллической форме.
В одном из особенно предпочтительных вариантов осуществления настоящего изобретения кристаллическое действующее вещество (I) используют в микрокристаллической форме. При этом средний размер частиц действующего вещества (I) X50 предпочтительно составляет менее 10 мкм, прежде всего от 1 до 8 мкм, а X90 (средний размером 90% частиц) составляет менее 20 мкм, прежде всего менее 15 мкм.
Используемая согласно изобретению гранулирующая жидкость содержит растворитель, гидрофильное связующее и при необходимости смачивающее средство. При этом гидрофильное связующее диспергировано в гранулирующей жидкости или предпочтительно растворено в ней.
В качестве входящего в состав гранулирующей жидкости растворителя могут использоваться такие органические растворители, как, например, этанол или ацетон, вода или смеси органических растворителей с водой. В качестве растворителя предпочтительно используют воду.
В качестве входящего в состав гранулирующей жидкости гидрофильного связующего используют фармацевтически пригодные гидрофильные добавки, предпочтительно растворимые в растворителе гранулирующей жидкости.
При этом предпочтительно используют такие гидрофильные полимеры, как, например, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу (натриевую и калиевую соли), этилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, этилгидроксиэтил-целлюлозу, гидроксипропилцеллюлозу, низкозамещенную гидроксипропилцеллюлозу, поливинилпирролидон, поливиниловый спирт, полимеры акриловой кислоты и их соли, сополимеры винилпирролидона с винилацетатом (например, Kollidon® VA64 фирмы BASF), желатину, гуаровую смолу, частично гидролизованный крахмал, альгинаты или ксантан. В качестве гидрофильного связующего особенно предпочтительно используют гидроксипропилметилцеллюлозу.
При этом содержание гидрофильного связующего может составлять от 1 до 15% (в пересчете на общую массу фармацевтического состава), предпочтительно от 1 до 8%.
В качестве смачивающего средства, при необходимости вводимого в состав гранулирующей жидкости, используют фармацевтически пригодные смачивающие агенты (поверхностно-активные вещества). Примерами пригодных смачивающих средств являются:
натриевые соли алкилсульфатов, такие как лаурилсульфат натрия, сульфосукцинаты, такие как диоктилсульфосукцинат натрия, неполные сложные эфиры жирных кислот и многоатомных спиртов, такие как моностеарат глицерина, неполные сложные эфиры жирных кислот и сорбитана, такие как монолаурат сорбитана, неполные сложные эфиры жирных кислот и полигидроксиэтиленсорбитана, такие как монолаурат, моностеарат или моноолеат полиэтиленгликольсорбитана, простые эфиры полигидроксиэтиленовых алифатических спиртов, сложные эфиры полигидроксиэтиленовых жирных кислот, блок-сополимеры этиленоксида с пропиленоксидом (Pluronic®) или этоксилированные триглицериды. В качестве смачивающего средства предпочтительно используют лаурилсульфат натрия.
Смачивающее средство в зависимости от потребности используют в концентрации от 0,1 до 5% (в пересчете на общую массу фармацевтического состава), предпочтительно от 0,1 до 2%.
В премиксе стадии увлажнительного гранулирования содержатся другие фармацевтически пригодные добавки. Примерами подобных добавок являются:
- наполнители и сухие связующие, такие как порошок целлюлозы, микрокристаллическая целлюлоза, силифицированная микрокристаллическая целлюлоза, дикальцийфосфат, трикальцийфосфат, трисиликат магния, маннит, мальтит, сорбит, ксилит, лактоза (безводная или в форме гидрата, например, моногидрата), декстроза, мальтоза, сахароза, глюкоза, фруктоза или мальтодекстрин,
- средства, способствующие диссоциации (разделительные средства), такие как карбоксиметилцеллюлоза, кроскармеллоза (структурированная карбоксиметилцеллюлоза), кросповидон (структурированный поливинилпирролидон), низкозамещенная гидроксипропилцеллюлоза, натрийкарбоксиметилкрахмал, глюкозат натрия на основе картофельного крахмала, частично гидролизованный крахмал, пшеничный крахмал, кукурузный крахмал, рисовый крахмал или картофельный крахмал.
В случае препаратов в форме таблеток с модифицированным (замедленным) высвобождением действующего вещества вместо средств, способствующих диссоциации (разделительных средств), могут содержаться вещества, оказывающие влияние на скорость высвобождения действующего вещества. Примерами подобных веществ являются гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза, галактоманнан, ксантан, глицериды, воска, сополимеры сложных эфиров акриловой и/или метакриловой кислоты с триметиламмонийметилакрилатом, сополимеры диметиламинометакриловой кислоты с нейтральными сложными эфирами метакриловой кислоты, полимеры метакриловой кислоты или сложных эфиров метакриловой кислоты, сополимеры сложного этилового эфира акриловой кислоты со сложным метиловым эфиром метакриловой кислоты или сополимеры метакриловой кислоты со сложным метиловым эфиром акриловой кислоты.
Полученный на стадии (а) гранулят на последующей стадии (b) преобразуют в предлагаемый в изобретении фармацевтический состав.
Стадией (b), например, может быть таблетирование, расфасовка в капсулы, предпочтительно в капсулы из твердой желатины, или расфасовка в пакетики-саше, осуществляемая обычными, известным специалистам методами при необходимости с добавлением других фармацевтически пригодных добавок.
Фармацевтически пригодными добавками являются, например, следующие вещества:
- лубриканты, вещества, придающие скользкость, регуляторы текучести, такие как фумаровая кислота, стеариновая кислота, стеарат магния, стеарат кальция, стеарилфумарат натрия, высокомолекулярные алифатические спирты, полиэтиленгликоли, крахмалы (пшеничный, рисовый, кукурузный или картофельный), тальк, высокодисперсный (коллоидный) диоксид кремния, оксид магния или силикат кальция,
- средства, способствующие диссоциации (разделительные средства), такие как карбоксиметилцеллюлоза, кроскармеллоза (структурированная карбоксиметилцеллюлоза), кросповидон (структурированный поливинилпирролидон), низкозамещенная гидроксипропилцеллюлоза, натрийкарбоксиметилкрахмал, частично гид рол изо ванны и крахмал, пшеничный крахмал, кукурузный крахмал, рисовый крахмал или картофельный крахмал.
Другим объектом настоящего изобретения является твердый, орально применимый фармацевтический состав, содержащий гидрофилизованную форму 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-3-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида.
Примерами предлагаемого в изобретении предпочтительного твердого, орально применимого фармацевтического состава являются грануляты, заполненные гранулятом капсулы из твердой желатины или пакетики-саше, а также таблетки, которые быстро или модифицированным образом (медленно) высвобождают действующее вещество (I). Предпочтительными являются таблетки, прежде всего таблетки, быстро высвобождающие действующее вещество (I). Согласно настоящему изобретению таблетками, быстро высвобождающими действующее вещество (I), являются прежде всего таблетки, которые обладают показателем Q (30 минут), составляющим 75% (измерен в приборе 2 (Paddle) в соответствии с методикой высвобождения действующих веществ, приведенной в разделе 5.2.2 экспериментальной части Американской фармакопеи).
Концентрация действующего вещества (I) в предлагаемом в изобретении фармацевтическом составе может составлять от 0,1 до 60%, предпочтительно от 1 до 40% в пересчете на общую массу препарата. При этом доза действующего вещества (I) составляет предпочтительно от 1 до 100 мг.
При необходимости предлагаемые в изобретении грануляты или таблетки могут быть подвергнуты лакированию, осуществляемому на дополнительной стадии в обычных, известных специалистам условиях. Лакированно может быть выполнено при добавлении обычных, известных специалистам лакирующих и пленкообразующих средств, таких как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, этил-целлюлоза, поливинилпирролидон, сополимеры винилпирролидона с винилацетатом (например, Kollidon® VA64 фирмы BASF), шеллак, сополимеры сложных эфиров акриловой и/или метакриловой кислоты с триметиламмонийметилакрилатом, сополимеры диметиламинометакриловой кислоты с нейтральными сложными эфирами метакриловой кислоты, полимеры метакриловой кислоты или сложных эфиров метакриловой кислоты, сополимеры сложного этилового эфира акриловой кислоты со сложным метиловым эфиром метакриловой кислоты, сополимеры метакриловой кислоты со сложным метиловым эфиром акриловой кислоты, пропиленгликоль, полиэтиленгликоль, глицеринтриацетат, триэтилцитрат и/или такие цветовые добавки/пигменты, как, например, диоксид титана, оксид железа, индиготин или пригодные цветные лаки.
Другим объектом настоящего изобретения является применение предлагаемого в изобретении фармацевтического состава для профилактики и/или лечения заболеваний, прежде всего тромбоэмболических заболеваний, таких как инфаркт миокарда, стенокардия (включая непостоянную стенокардию), реоккпюзии и рестенозы после пластических операций на сосудах или аортокоронарного шунтирования, кровоизлияние в мозг, транзиторные ишемические приступы, периферийные облитерирующие эндартерииты, эмболии легочной артерии или глубокие венозные тромбозы.
Ниже изобретение более подробно рассмотрено на примере некоторых предпочтительных вариантов его осуществления, которые, однако, не ограничивают объема изобретения. В отсутствие особых указаний все приведенные ниже количественные данные приведены в массовых процентах.
Экспериментальная часть
1. Изготовление таблеток способом гранулирования в псевдоожиженном слое из гранулята. содержащего гидрофилизованную форму действующего вещества (I)
1.1 Состав таблеток (в мг/таблетка)
|
1.2 Изготовление
Гидроксипропилметилцеллюлозу (5 сПЗ) и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют микронизированное действующее вещество (I). Приготовленной указанным образом суспензией, используемой в качестве гранулирующей жидкости, на стадии реализуемого в псевдоожиженном слое гранулирования орошают премикс, состоящий из микрокристаллической целлюлозы, моногидрата лактозы и кросмеллозы. К образовавшемуся после сушки и просеивания (ширина ячеек 0,8 мм) грануляту добавляют стеарат магния и осуществляют перемешивание. Готовую для прессования смесь прессуют, получая таблетки диаметром 6 мм, предел прочности которых составляет от 50 до 100 H. Последующее лакирование таблеток осуществляют с использованием диоксида титана, суспендированного в водном растворе гидроксипропилметилцеллюлозы (15 сПЗ) и полиэтиленгликоля.
2. Изготовление таблеток способом гранулирования в быстроходном смесителе из гранулята, содержащего гидрофилизованную форму действующего вещества (I)
2.1 Состав таблеток (в мг/таблетка)
|
|
2.2 Изготовление
Исходные вещества (микрокристаллическую целлюлозу, моногидрат лактозы и кроскармеллозу) смешивают в быстроходной мешалке, получая премикс гранулята. Гидроксипропилметилцеллюлозу (3 сПЗ) и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют микронизированное действующее вещество (I). Приготовленную указанным образом суспензию, используемую в качестве гранулирующей жидкости, добавляют к премиксу гранулята и перемешивают компоненты вращающейся с высокой скоростью мешалкой до образования однородной смеси. По завершении перемешивания влажный гранулят просеивают (ширина ячеек 4 мм) и подвергают сушке в псевдоожиженном слое. К высушенному грануляту после просеивания (ширина ячеек 0,8 мм) добавляют стеарат магния и осуществляют перемешивание. Готовую для прессования смесь прессуют, получая таблетки диаметром 6 мм, предел прочности которых составляет от 50 до 100 H, Последующее лакирование таблеток осуществляют с использованием диоксида титана и оксида железа желтого, причем пигменты предварительно суспендируют в водном растворе гидроксипропилметилцеллюлозы (15 сПЗ) и полиэтиленгликоля.
3. Изготовление гранулятов, содержащих гидрофилизованную форму действующего вещества (I), и расфасовка в пакетики-саше
3.1 Состав гранулята (в мг/пакетик-саше)
|
|
3.2 Изготовление
Гидроксипропилметилцеллюлозу (5 сПЗ) и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют микронизированное действующее вещество (I). Приготовленной указанным образом суспензией, используемой в качестве гранулирующей жидкости, на стадии реализуемого в псевдоожиженном слое гранулирования орошают премикс, состоящий из маннита и кросмеллозы. К образующемуся после сушки и просеивания (ширина ячеек 0,8 мм) грануляту добавляют высокодисперсный диоксид кремния (Aerosil®) и ароматизатор с запахом земляники и осуществляют перемешивание. Полученную указанным образом смесь фасуют в пакетики-саше по 750 мг на специальной расфасовочной машине.
4. Изготовление гранулятов, содержащих гидрофилизованную форму действующего вещества (I), и расфасовка в капсулы из твердой желатины
4.1 Состав гранулята (в мг/капсула)
|
4.2 Изготовление
Гидроксипропилметилцеллюлозу (5 сПЗ) и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют микронизированное действующее вещество (I).
Приготовленной указанным образом суспензией, используемой в качестве гранулирующей жидкости, на стадии реализуемого в псевдоожиженном слое гранулирования орошают премикс, состоящий из микрокристаллической целлюлозы, моногидрата лактозы и кукурузного крахмала. К образующемуся после сушки и просеивания (ширина ячеек 0,8 мм) грануляту добавляют высокодисперсный диоксид кремния (Aerosil®) и осуществляют перемешивание. Полученную указанным образом смесь фасуют по 160 мг в капсулы из твердой желатины с размером 2.
5. Сравнение таблеток, содержащих гидрофилизованное и негидрофилизованное действующее вещество (I)
5.1 Состав таблеток и их изготовление
Для исследования свойств таблеток и улучшенной биологической доступности препаратов с гидрофилизованным действующим веществом (I) изготавливали нелакированные таблетки, содержащие 10 мг действующего вещества (I), которые обладали следующим составом (в мг/таблетка):
|
Таблетка А изготовлена путем непосредственного таблетирования без предварительного гранулирования.
Таблетка В изготовлена описанным в п.1.2 суспензионным методом гранулирования в псевдоожиженном слое.
Исходную смесь для изготовления таблетки А и гранулят для изготовления таблетки В прессовали, получая соответствующие таблетки диаметром 6 мм, предел прочности которых составлял от 70 до 80 H.
5.2. Свойства таблеток
5.2.1 Время диссоциации в воде (контрольный прибор фирмы Eweka в соответствии с требованиями Американской фармакопеи)
|
5.2.2 Высвобождение действующего вещества in-vitro
В нижеследующей таблице приведены количества высвобожденного действующего вещества в процентах от общего заявленного содержания в таблетках:
|
5.2.3 Биологическая доступность
Для исследования биологической доступности действующего вещества (I) трем собакам поочередно давали по три таблетки А, соответственно по три таблетки В. Соответствующие фармакологические параметры действующего вещества (I) после орального приема 3 мг приведены в таблице 2.
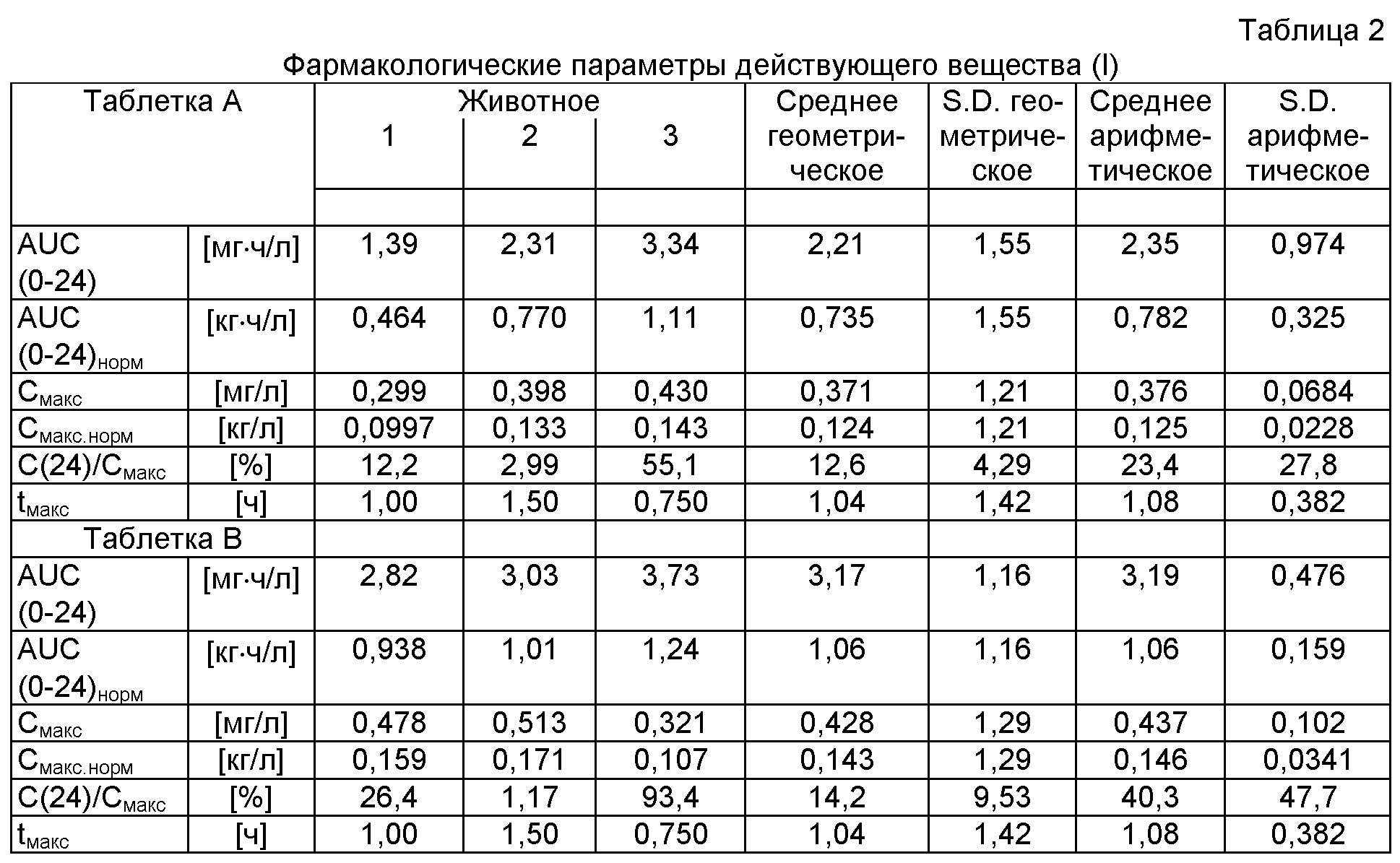
Результаты
Несмотря на более медленную диссоциацию таблетки В по сравнению с таблеткой А (смотри п.5.2.1) и очень близкие показатели высвобождения действующего вещества in-vitro (смотри п.5.2.2) таблетка В обладает явными преимуществами с точки зрения рассасывания, а, следовательно, примерно на 35% более высокой биологической доступностью. Одновременно следует констатировать явное уменьшение нестабильности таблетки В. Единственная разница между таблеткой А и таблеткой В состоит в гидрофилизации входящего в состав таблетки В действующего вещества (I), осуществляемая суспензионным методом в соответствии с техникой увлажнительного гранулирования.

