Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ПИРИДОПИРАЗИНЫ КАК НОВЫЕ ИНГИБИТОРЫ Syk
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым пиридопиразиновым соединениям, их фармацевтическим композициям и способам их применения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Протеинкиназы, самое большое семейство ферментов человека, охватывают свыше 500 белков. Селезеночная тирозинкиназа (Syk) является членом семейства Syk тирозинкиназ и регулятором развития ранних B-клеток, а также активации, передачи сигнала и выживания зрелых B-клеток.
Syk является нерецепторной тирозинкиназой, которая играет важную роль в опосредованной иммунорецепторами и интегрином передаче сигнала в различных типах клеток, включая B-клетки, макрофаги, моноциты, тучные клетки, эозинофилы, базофилы, нейтрофилы, дендритные клетки, T-клетки, клетки-природные киллеры, тромбоциты и остеокласты. Иммунорецепторы, описанные в настоящем документе, включают классические иммунорецепторы и подобные иммунорецепторам молекулы. Классические иммунорецепторы включают B-клеточные и T-клеточные антигенные рецепторы, а также различные иммуноглобулиновые рецепторы (Fc-рецепторы). Подобные иммунорецепторам молекулы либо являются структурно родственными иммунорецепторам, либо участвуют в подобных путях передачи сигнала, и в основном включены в неприобретенные иммунные функции, включающие, например, активацию нейтрофилов, распознавание у клеток-природных киллеров и активность остеокластов. Интегрины являются рецепторами клеточной поверхности, которые играют ключевую роль в контроле адгезии и активации лейкоцитов как при врожденном, так и приобретенном иммунитете.
Связывание лигандов приводит к активации как иммунорецепторов, так и интегринов, в результате чего активируются киназы семейства Src, и к фосфорилированию активационных тирозинсодержащих мотивов иммунорецепторов (ITAM) на цитоплазматической поверхности ассоциированных с рецепторами трансмембранных адаптеров. Связывание Syk с фосфорилированными мотивами ITAM адаптеров приводит к активации Syk и последующим фосфорилированию и активации путей передачи сигнала вниз по каскаду.
Syk важна для активации B-клеток через передачу сигнала рецепторами B-клеток (BCR). Syk активируется при связывании с фосфорилированным BCR и, таким образом, вызывает события ранней передачи сигнала после активации BCR. B-клеточная передача сигнала через BCR может привести к широкому диапазону биологических результатов, которые, в свою очередь, зависят от стадии развития B-клетки. Интенсивность и длительность сигналов BCR должна тщательно контролироваться. Аберрантная опосредованная BCR передача сигнала может вызывать неконтролируемую активацию B-клеток и/или образование патогенных аутоантител, что приводит к многочисленным аутоиммунным и/или воспалительным заболеваниям. У мышей с недостаточностью Syk проявляются ухудшенное созревание B-клеток, пониженное продуцирование иммуноглобулинов, нарушенные независимые от T-клеток иммунные ответы и заметное ослабление установившегося кальциевого сигнала при стимуляции BCR.
Большое количество доказательств подтверждает роль B-клеток и гуморальной иммунной системы в патогенезе аутоиммунных и/или воспалительных заболеваний. Терапевтические средства на основе белка (такие как ритуксан), разработанные для истощения B-клеток, представляют подход для лечения ряда аутоиммунных и воспалительных заболеваний. Как известно, аутоантитела и полученные с ними иммунные комплексы участвуют в патогенезе аутоиммунного заболевания и/или воспалительного заболевания. Патогенная реакция на эти антитела зависит от передачи сигнала через Fc-рецепторы, которые, в свою очередь, зависят от Syk. Из-за роли Syk в активации B-клеток, а также зависимой от FcR передачи сигнала, ингибиторы Syk могут быть применимы в качестве ингибиторов опосредованной B-клетками патогенной активности, в том числе продуцирования аутоантител. Следовательно, ингибирование ферментативной активности Syk в клетках предполагается в качестве лечения аутоиммунного заболевания посредством его влияния на продуцирование аутоантител.
Также Syk играет ключевую роль в опосредованной FCεRI дегрануляции тучных клеток и активации эозинофилов. Таким образом, Syk участвует в аллергических расстройствах, в том числе в астме. Syk связывается с фосфорилированной цепью гамма FCεRI с помощью своих доменов SH2 и является важной для передачи сигнала вниз по каскаду. Лишенные Syk тучные клетки демонстрируют дефектную дегрануляцию, а также секрецию арахидоновой кислоты и цитокина. Это также показали для фармакологических средств, которые ингибируют активность Syk в тучных клетках. Антисмысловые олигонуклеотиды Syk ингибируют индуцированную антигеном инфильтрацию эозинофилов и нейтрофилов в животной модели астмы. Лишенные Syk эозинофилы также проявляют ухудшенную активацию в ответ на стимуляцию FCεRI. Следовательно, низкомолекулярные ингибиторы Syk могут быть применимыми в лечении индуцированных аллергией воспалительных заболеваний, в том числе астмы.
Syk также экспрессируется в тучных клетках и моноцитах и, как показали, важна для функционирования этих клеток. Например, дефицит Syk у мышей ассоциируется с ухудшенной опосредованной IgE активацией тучных клеток, что вызывает заметное снижение высвобождения TNF-альфа и других воспалительных цитокинов. Кроме того, ингибиторы Syk, как показали, ингибируют индуцированную антигеном пассивную кожную анафилаксию, бронхоконстрикцию и отек бронхов у крыс.
Таким образом, ингибирование активности Syk может быть применимо в лечении аллергических расстройств, аутоиммунных заболеваний и воспалительных заболеваний, таких как SLE, ревматоидный артрит, множественный васкулит, идиопатическая тромбоцитопеническая пурпура (ITP), миастения гравис, аллергический ринит, хроническое обструктивное заболевание легких (COPD), синдром дыхательной недостаточности у взрослых (ARD) и астма. Кроме того, Syk, как сообщали, играет важную роль в независимой от лиганда тонической передаче сигнала через B-клеточный рецептор, что, как известно, является важным сигналом выживания у B-клеток. Таким образом, ингибирование активности Syk может быть применимо в лечении некоторых типов рака, в том числе B-клеточной лимфомы и лейкоза.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
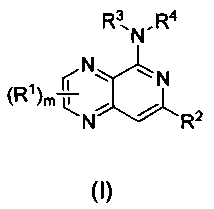
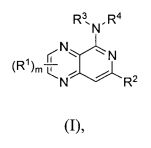
Представлено по меньшей мере одно соединение формулы (I),
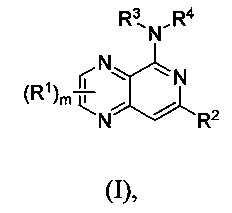
и/или его рацемическая смесь, энантиомеры, диастереомеры, таутомеры, или смеси в необязательном соотношении, или по меньшей мере одна его фармацевтически приемлемая соль, где
R1 независимо выбран из водорода, галогена, -CN, гидроксила, необязательно замещенного C1-C6алкила, необязательно замещенного C3-C6циклоалкила, необязательно замещенного амино и необязательно замещенного C1-C6алкокси,
R2 представляет собой -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -S(O)nNR5R6, необязательно замещенный низший алкил, необязательно замещенный алкенил и необязательно замещенный алкинил;
или представляет собой циклоалкил, гетероцикл, арил, гетероарил, который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R3 и R4 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых за исключением водорода необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
или R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 4-12-членное моноциклическое, слитое бициклическое или спироциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и S, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
m равняется 0, 1 или 2,
n равняется 1 или 2,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых за исключением водорода необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
где каждая вышеупомянутая необязательно замещенная группа, для которой заместитель(и) конкретно не обозначен, может быть незамещенной или независимо замещенной, например, одним или несколькими, например, одним, двумя или тремя, заместителями, независимо выбранными из C1-C4алкила, циклоалкила, арила, гетероцикла, гетероарила, арил-C1-C4алкила-, гетероарил-C1-C4алкила-, -C1-C4галогеналкила-, -OC1-C4алкила, -OC1-C4алкилфенила, -C1-C4алкил-OH, -C1-C4алкил-O-C1-C4алкила, -OC1-C4галогеналкила, галогена, -OH, -NH2, -C1-C4алкил-NH2, -N(C1-C4алкил)(C1-C4алкила), -NH(C1-C4алкила), -N(C1-C4алкил)(C1-C4алкилфенила), -NH(C1-C4алкилфенила), циано, нитро, оксо, -CO2H, -C(O)OC1-C4алкила, -CON(C1-C4алкил)(C1-C4алкила), -CONH(C1-C4алкила), -CONH2, -NHC(O)(C1-C4алкила), -NHC(O)(фенила), -N(C1-C4алкил)C(O)(C1-C4алкила), -N(C1-C4алкил)C(O)(фенила), -C(O)C1-C4алкила, -C(O)C1-C4фенила, -C(O)C1-C4галогеналкила, -OC(O)C1-C4алкила, -SO2(C1-C4алкила), -SO2(фенила), -SO2(C1-C4галогеналкила), -SO2NH2, -SO2NH(C1-C4алкила), -SO2NH(фенила), -NHSO2(C1-C4алкила), -NHSO2(фенила) и -NHSO2(C1-C4галогеналкила), при этом каждый из фенила, арила, гетероцикла и гетероарила необязательно замещен одной или несколькими группами, выбранными из галогена, циклоалкила, гетероцикла, C1-C4алкила, C1-C4галогеналкила-, -OC1-C4алкила, C1-C4алкил-OH, -C1-C4алкил-O-C1-C4алкила, -OC1-C4галогеналкила, циано, нитро, -NH2, -CO2H, -C(O)OC1-C4алкила, -CON(C1-C4алкил)(C1-C4алкила), -CONH(C1-C4алкила), -CONH2, -NHC(O)(C1-C4алкила), -N(C1-C4алкил)C(O)(C1-C4алкила), -SO2(C1-C4алкила), -SO2(фенила), -SO2(C1-C4галогеналкила), -SO2NH2, -SO2NH(C1-C4алкила), -SO2NH(фенила), -NHSO2(C1-C4алкила), -NHSO2(фенила) и -NHSO2(C1-C4галогеналкила).
Также представлена фармацевтическая композиция, содержащая по меньшей мере одно соединение и/или по меньшей мере одну его фармацевтически приемлемую соль, описанную в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель.
Также представлен способ ингибирования активности киназы Syk, включающий ингибирование указанной активности эффективным количеством по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящем документе.
Также представлен способ лечения субъекта с установленным воспалительным заболеванием, отвечающим на ингибирование Syk, предусматривающий введение указанному субъекту, при установленной необходимости этого, эффективного для лечения указанного заболевания количества по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящем документе.
Используемые в настоящем описании следующие слова, фразы и символы, как правило, предназначены характеризоваться установленными ниже значениями, за исключением случаев, когда в контексте, в котором они используются, указано иное. Следующие аббревиатуры и термины характеризуются указанными ниже значениями.
Тире ("-"), которое расположено не между двумя буквами или символами, применяется для указания точки присоединения заместителя. Например, -CONH2 присоединяется через атом углерода.
Термин "алкил" в настоящем документе относится к прямому или разветвленному углеводороду, содержащему 1-18, предпочтительно 1-12, более предпочтительно 1-6 атомов углерода. Примеры алкильных групп включают без ограничения метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил и трет-бутил. "Низший алкил" относится к прямому или разветвленному углеводороду, содержащему 1-6, предпочтительно 1-4 атома углерода.
"Алкокси" означает прямую или разветвленную алкильную группу, содержащую 1-18, предпочтительно 1-12, более предпочтительно 1-6 атомов углерода, присоединенных через кислородный мостик, такую как, например, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, пентокси, 2-пентилокси, изопентокси, неопентокси, гексокси, 2-гексокси, 3-гексокси, 3-метилпентокси и т.п. Алкоксигруппы, как правило, будут содержать от 1 до 6 атомов углерода, присоединенных через кислородный мостик. "Низший алкокси" относится к прямому или разветвленному алкокси, где алкильная часть содержит 1-6, предпочтительно 1-4 атома углерода.
Термин "алкенил" в настоящем документе относится к прямому или разветвленному углеводороду, содержащему одну или несколько двойных связей C=C и 2-10, предпочтительно 2-6 атомов углерода. Примеры алкенильных групп включают без ограничения винил, 2-пропенил и 2-бутенил.
Термин "алкинил" в настоящем документе относится к прямому или разветвленному углеводороду, содержащему одну или несколько тройных связей C≡C и 2-10, предпочтительно 2-6 атомов углерода. Примеры алкинильных групп включают без ограничения этинил, 2-пропинил и 2-бутинил.
Термин "циклоалкил" относится к насыщенным и частично ненасыщенным циклическим углеводородным группам, содержащим 3-12, предпочтительно 3-8 атомов углерода. Примеры циклоалкильных групп включают без ограничения циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил. Кольцо может быть насыщенным или может содержать одну или несколько двойных связей (т.е. быть частично ненасыщенным), но не полностью сопряженным и не арилом, определенным в настоящем документе.
"Арил" охватывает
5- и 6-членные карбоциклические ароматические кольца, например, бензол;
бициклические кольцевые системы, где по меньшей мере одно кольцо является карбоциклическим и ароматическим, например, нафталин, индан и 1,2,3,4-тетрагидрохинолин; и
трициклические кольцевые системы, где по меньшей мере одно кольцо является карбоциклическим и ароматическим, например, флуорен.
Например, арил включает 5- и 6-членные карбоциклические ароматические кольца, слитые с 5-7-членным гетероциклическим кольцом, содержащим один или несколько гетероатомов, выбранных из N, O и S, при условии, что точка присоединения находится на карбоциклическом ароматическом кольце. Двухвалентные радикалы, образованные из замещенных бензольных производных и имеющие свободные валентности на кольцевых атомах, называются замещенными фениленовыми радикалами. Двухвалентные радикалы, полученные из одновалентных полициклических углеводородных радикалов, название которых заканчивается на "-ил", путем отщепления одного атома водорода от атома углерода со свободной валентностью, называют с добавлением "-иден" к названию соответствующего одновалентного радикала, например, нафтильная группа с двумя точками присоединения называется нафтилиденом. Арил, однако, не охватывает или не перекрывает каким-либо образом гетероарил, отдельно определенный ниже. Следовательно, если один или несколько карбоциклических ароматических колец сливаются с гетероциклическим ароматическим кольцом, полученная кольцевая система является гетероарилом, а не арилом, определенным в настоящем документе.
Термин "галоген" включает фтор, хлор, бром и йод.
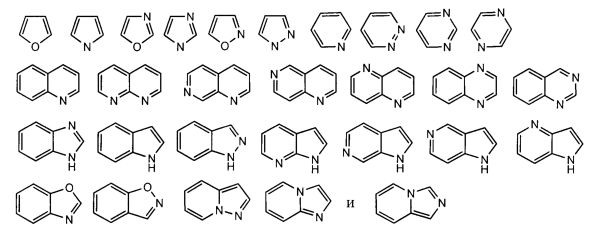
Термин "гетероарил" относится к 5-8-членным ароматическим, моноциклическим кольцам, содержащим один или несколько, например, от 1 до 4, или в некоторых вариантах осуществления от 1 до 3 гетероатомов, выбранных из N, O и S, при этом остальными кольцевыми атомами является углерод;
8-12-членным бициклическим кольцам, содержащим один или несколько, например, от 1 до 4, или в некоторых вариантах осуществления от 1 до 3 гетероатомов, выбранных из N, O и S, при этом остальными кольцевыми атомами является углерод, и где по меньшей мере один гетероатом присутствует в ароматическом кольце; и
11-14-членным трициклическим кольцам, содержащим один или несколько, например, от 1 до 4, или в некоторых вариантах осуществления от 1 до 3 гетероатомов, выбранных из N, O и S, при этом остальными кольцевыми атомами является углерод, и где по меньшей мере один гетероатом присутствует в ароматическом кольце.
Например, гетероарил включает 5-7-членное гетероциклическое ароматическое кольцо, слитое с 5-7-членным циклоалкильным кольцом. Для таких слитых, бициклических гетероарильных кольцевых систем, где только одно из колец содержит один или несколько гетероатомов, точка присоединения находится на гетероароматическом кольце.
Если общее число атомов S и O в гетероарильной группе превышает 1, то гетероатомы расположены не рядом друг с другом. В некоторых вариантах осуществления общее число атомов S и O в гетероарильной группе составляет не более 2. В некоторых вариантах осуществления общее число атомов S и O в ароматическом гетероцикле составляет не более 1.
Примеры гетероарильных групп включают без ограничения (как пронумеровано от положения связи, принимаемого за 1, по очередности) 2-пиридил, 3-пиридил, 4-пиридил, 2,3-пиразинил, 3,4-пиразинил, 2,4-пиримидинил, 3,5-пиримидинил, 1-пиразолил, 2,3-пиразолил, 2,4-имидазолинил, изоксазолил, оксазолил, тиазолил, тиадиазолил, тетразолил, тиенил, бензотиенил, фурил, бензофурил, бензоимидазолинил, индолинил, пиридизинил, триазолил, хинолинил, пиразолил и 5,6,7,8-тетрагидроизохинолин.
Двухвалентные радикалы, полученные из одновалентных гетероарильных радикалов, чьи названия заканчиваются на "-ил", путем отщепления одного атома водорода от атома со свободной валентностью, называют путем добавления "-иден" к названию соответствующего одновалентного радикала, например, пиридильная группа с двумя точками присоединения является пиридилиденом. Гетероарил не охватывает и не включает в себя арил, определенный выше.
Замещенный гетероарил также включает кольцевые системы, замещенные одним или несколькими оксидными (-O-) заместителями, такие как пиридинил-N-оксиды.
"Гетероцикл" означает 4-12-членное моноциклическое, бициклическое или трициклическое насыщенное или частично ненасыщенное кольцо, содержащее по меньшей мере 2 атома углерода вдобавок к 1-3 гетероатомам, независимо выбранным из кислорода, серы и азота. "Гетероцикл" также относится к 5-7-членному гетероциклическому кольцу, содержащему один или несколько гетероатомов, выбранных из N, O и S, слитому с 5-, 6- и/или 7-членным циклоалкильным, гетероциклическим, карбоциклическим ароматическим или гетероароматическим кольцом, при условии, что точка присоединения находится на гетероциклическом кольце. "Гетероцикл" также относится к алифатическому спироциклическому кольцу, содержащему один или несколько гетероатомов, выбранных из N, O и S, при условии, что точка присоединения находится на гетероциклическом кольце. Кольца могут быть насыщенными или могут иметь одну или несколько двойных связей (т.е. быть частично ненасыщенными). Гетероцикл может быть замещенным оксо. Точкой присоединения может быть углерод или гетероатом в гетероциклическом кольце. Гетероцикл не является гетероарилом, определенным в настоящем документе.
Приемлемые гетероциклы включают, например (как пронумеровано от положения связи, принимаемой за 1, по очередности), 1-пирролидинил, 2-пирролидинил, 2,4-имидазолидинил, 2,3-пиразолидинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил и 2,5-пиперазинил. Также предполагаются морфолинильные группы, в том числе 2-морфолинил и 3-морфолинил (как пронумеровано от кислорода, принимаемого за 1, по очередности). Замещенный гетероцикл также включает кольцевые системы, замещенные одним или несколькими оксо фрагментами, такие как пиперидинил-N-оксид, морфолинил-N-оксид, 1-оксо-1-тиоморфолинил и 1,1-диоксо-1-тиоморфолинил.
"Необязательный" или "необязательно" означает, что в дальнейшем описываемые событие или факт могут происходить или могут не происходить, и что описание включает случаи, когда событие или факт происходит, и случаи, когда это не происходит. Например, "необязательно замещенный алкил" охватывает как "незамещенный алкил", так и "замещенный алкил", определенные ниже. Предполагается, что специалистам в данной области будет понятно по отношению к любой группе, содержащей один или несколько заместителей, что такие группы не включают какое-либо замещение или паттерны замещения, которые являются стерически невозможными, синтетически неосуществимыми и/или нестабильными по своей природе.
Термин "замещенный", как используется в настоящем документе, означает, что любой один или несколько водородов на определенных атоме или группе замещены выбранными из указанной группы, при условии, что не превышена нормальная валентность определенного атома. Если заместителем является оксо (т.е. =O), то на атоме замещаются 2 водорода. Комбинации заместителей и/или переменных являются допустимыми, только если такие комбинации дают стабильные соединения или применимые синтетические промежуточные соединения. Стабильное соединение или стабильная структура означает соединение, которое достаточно устойчиво, чтобы выдержать выделение из реакционной смеси и последующее составление в качестве средства, обладающего по меньшей мере практической применимостью. Если не указано иное, заместителей называют в основной структуре. Например, должно быть понятно, что если в качестве возможного заместителя упоминается (циклоалкил)алкил, то точка присоединения этого заместителя к основной структуре находится на алкильной части.
В некоторых вариантах осуществления "замещенный одним или несколькими группами" относится к двум водородам на определенных атоме или группе, независимо замещенным двумя выбранными заместителями из указанной группы. В некоторых вариантах осуществления "замещенный одной или несколькими группами" относится к трем водородам на определенных атоме или группе, независимо замещенным тремя выбранными заместителями из указанной группы. В некоторых вариантах осуществления "замещенный одной или несколькими группами" относится к четырем водородам на определенных атоме или группе, независимо замещенным четырьмя выбранными заместителями из указанной группы.
Соединения, описанные в настоящем документе, включают без ограничения, когда это возможно, те, которые могут быть получены специалистом в данной области без излишнего эксперимента, их региоизомеры, их производные N-оксида, их оптические изомеры, такие как энантиомеры и диастереомеры, смеси энантиомеров, в том числе рацематы, смеси диастереомеров и другие их смеси, те, которые могут быть получены специалистом в данной области путем стандартного эксперимента. В таких ситуациях отдельные энантиомеры или диастереомеры, т.е. оптически активные формы, могут быть получены асимметрическим синтезом или разделением рацематов или смесей энантиомеров или диастереомеров. Разделение рацематов или смесей диастереомеров, если возможно, может быть выполнено, например, общепринятыми способами, такими как кристаллизация в присутствии разделяющего средства или хроматография с использованием, например, колонки для хиральной высокоэффективной жидкостной хроматографии (HPLC). Кроме того, если возможно, такие соединения включают Z- и E-формы (или цис- и транс-формы) соединений с двойными связями углерод-углерод. Если соединения, описанные в настоящем документе, существуют в различных таутомерных формах, термин "соединение" предназначен включать все таутомерные формы соединения, которые могут быть получены без излишнего эксперимента. Такие соединения также включают кристаллические формы, в том числе полиморфы и клатраты, при условии, что они могут быть получены специалистом данной области без излишнего эксперимента. Подобным образом, термин "соль" предназначен включать все изомеры, рацематы, другие смеси, Z-и E-формы, таутомерные формы и кристаллические формы соли соединения, при условии, что они могут быть получены специалистом данной области без излишнего эксперимента.
"Фармацевтически приемлемые соли" включают без ограничения соли неорганических кислот, такие как гидрохлорат, фосфат, дифосфат, гидробромат, сульфат, сульфинат, нитрат и подобные соли; а также соли органической кислоты, такие как малат, малеат, фумарат, тартрат, сукцинат, цитрат, ацетат, лактат, метансульфонат, п-толуолсульфонат, 2-гидроксиэтилсульфонат, бензоат, салицилат, стеарат и алканоат, такой как ацетат, соли HOOC-(CH2)n-COOH, где n равняется 0-4, и подобные соли. Подобным образом, фармацевтически приемлемые катионы включают без ограничения катионы натрия, калия, кальция, алюминия, лития и аммония.
Кроме того, если соединение, описанное в настоящем документе, получают как кислотно-аддитивную соль, свободное основание может быть получено повышением основности раствора кислой соли. Наоборот, если продукт является свободным основанием, аддитивная соль, особенно фармацевтически приемлемая аддитивная соль, может быть получена путем растворения свободного основания в приемлемом органическом растворителе и обработки раствора кислотой согласно традиционным процедурам получения кислотно-аддитивных солей из основных соединений. Специалисты в данной области определят различные методы синтеза, которые могут быть применимы без излишнего эксперимента для получения нетоксичных фармацевтически приемлемых аддитивных солей.
"Сольват", такой как "гидрат", образуется путем взаимодействия растворителя и соединения. Термин "соединение" предназначен включать сольваты, в том числе гидраты, соединений, при условии, что они могут быть получены специалистом данной области путем стандартного эксперимента. Подобным образом "соли" включают сольваты, такие как гидраты, солей, при условии, что они могут быть получены специалистом данной области путем стандартного эксперимента. Приемлемыми сольватами являются фармацевтически приемлемые сольваты, такие как гидраты, в том числе моногидраты и полугидраты, при условии, что они могут быть получены специалистом данной области путем стандартного эксперимента.
"Хелат" образуется путем координации соединения с ионом металла по двум (или более) точкам. Термин "соединение" предназначен включать хелаты соединений, при условии, что они могут быть получены специалистом данной области путем стандартного эксперимента. Подобным образом, "соли" включают хелаты солей.
"Нековалентный комплекс" образуется путем взаимодействия соединения с другой молекулой, при этом между соединением и молекулой не образуется ковалентная связь. Например, комплексообразование может происходить через ван-дер-ваальсовы взаимодействия, водородную связь и электростатические взаимодействия (также называемые ионной связью). Такие нековалентные комплексы предусмотрены термином "соединение", при условии, что они могут быть получены специалистом данной области путем стандартного эксперимента.
Термин "водородная связь" относится к образованию ассоциации между электроотрицательным атомом (также известным как акцептор водородной связи) и атомом водорода, присоединенным ко второму относительно электроотрицательному атому (также известному как донор водородной связи). Приемлемые донор и акцепторы водородной связи хорошо известны в медицинской химии (G.С. Pimentel and A.L. McClellan, The Hydrogen Bond, Freeman, San Francisco, 1960; R. Taylor and O. Kennard, "Hydrogen Bond Geometry in Organic Crystals", Accounts of Chemical Research, 17, pp. 320-326 (1984)).
Используемые в настоящем документе термины "группа", "радикал" или "фрагмент" являются синонимами и предназначены включать функциональные группы или фрагменты молекул, присоединяемые по связи или к другим фрагментам молекул.
Термин "активное средство" применяется для обозначения химического вещества, обладающего биологической активностью. В некоторых вариантах осуществления "активным средством" выступает химическое вещество, являющееся фармацевтически полезным.
"Терапия", "лечение", или "обработка", или "облегчение" относится к введению по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, субъекту, страдающему заболеванием или нарушением, или проявляющему симптом заболевания или нарушения, или предрасположенному к заболеванию или нарушению, с целью излечения, подлечивания, облегчения, ослабления, изменения, лечения, устранения, достижения положительной динамики или воздействия по отношению к раку, симптомам заболевания или нарушения, или предрасположенности к заболеванию или нарушению. В некоторых вариантах осуществления заболеванием или нарушением может быть рак. В некоторых вариантах осуществления заболеванием или нарушением может быть воспалительное заболевание.
Термин "эффективное количество" относится к количеству по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, эффективному для "лечения", как определено выше, заболевания или нарушения у субъекта, отвечающего на ингибирование Syk. Эффективное количество может вызывать любое из изменений, наблюдаемых или измеряемых у субъекта, как описано выше в определении "терапии", "лечения", "обработки" и "облегчение". Например, в случае рака эффективное количество может уменьшать число раковых или опухолевых клеток; уменьшать размер опухоли; ингибировать или останавливать инфильтрацию опухолевых клеток в периферические органы, в том числе, например, распространение опухоли в мягкую ткань и кость; ингибировать и останавливать метастазирование опухоли; ингибировать и останавливать рост опухоли; ослаблять до некоторой степени один или несколько симптомов, ассоциированных с раком, уменьшать заболеваемость и смертность; улучшать качество жизни или характеризоваться комбинацией таких эффектов. Эффективным количеством может быть количество, достаточное для смягчения симптомов заболевания, отвечающего на ингибирование киназы Syk.
Термин "эффективное количество" также может относиться к количеству по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанным в настоящем документе, эффективному для ингибирования активности Syk у субъекта, отвечающего на ингибирование Syk.
Термин "ингибирование" означает снижение исходной активности биологической активности или процесса. "Ингибирование Syk" относится к снижению активности киназы Syk как прямому или опосредованному ответу на присутствие по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, относительно активности киназы Syk в отсутствие по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли. Снижение активности может быть вызвано прямым взаимодействием по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, с киназой Syk или вызвано взаимодействием по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, с одним или несколькими другими факторами, которые в свою очередь влияют на активность по меньшей мере одной киназы. Например, присутствие по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанных в настоящем документе, может снижать активность по меньшей мере одной киназы путем прямого связывания с киназой Syk, путем обеспечения (прямо или опосредованно) другого фактора для снижения активности по меньшей мере одной киназы или путем (прямо или опосредованно) снижения количества по меньшей мере одной киназы, присутствующей в клетке или организме.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Представлено по меньшей мере одно соединение формулы (I),
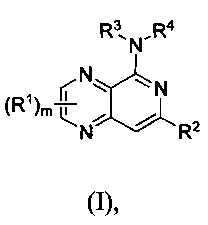
и/или его рацемическая смесь, энантиомеры, диастереомеры, таутомеры, или смеси в произвольном соотношении, или по меньшей мере одна его фармацевтически приемлемая соль, где
R1 независимо выбран из водорода, галогена, -CN, гидроксила, необязательно замещенного C1-C6алкила, необязательно замещенного C3-C6циклоалкила, необязательно замещенного амино и необязательно замещенного C1-C6алкокси,
R2 представляет собой -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -S(O)nNR5R6, необязательно замещенный низший алкил, необязательно замещенный алкенил и необязательно замещенный алкинил;
или представляет собой циклоалкил, гетероцикл, арил, гетероарил, который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R3 и R4 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
или R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 4-12-членное моноциклическое, слитое бициклическое или спироциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и S, которые необязательно замещены одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
m равняется 0, 1 или 2,
n равняется 1 или 2,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида;
где каждая вышеупомянутая необязательно замещенная группа, для которой заместитель(и) конкретно не обозначен, может быть незамещенной или независимо замещенной, например, одним или несколькими, например, одним, двумя или тремя, заместителями, независимо выбранными из C1-C4алкила, циклоалкила, арила, гетероцикла, гетероарила, арил-C1-C4алкила-, гетероарил-C1-C4алкила-, C1-C4галогеналкила-, -OC1-C4алкила, -OC1-C4алкилфенила, -C1-C4алкил-OH, -C1-C4алкил-O-C1-C4алкила, -OC1-C4галогеналкила, галогена, -OH, -NH2, -C1-C4алкил-NH2, -N(C1-C4алкил)(C1-C4алкил), -NH(C1-C4алкил), -N(C1-C4алкил)(C1-C4алкилфенил), -NH(C1-C4алкилфенил), циано, нитро, оксо, -CO2H, -C(O)OC1-C4алкила, -CON(C1-C4алкил)(C1-C4алкил), -CONH(C1-C4алкил), -CONH2, -NHC(O)(C1-C4алкил), -NHC(O)(фенил), -N(C1-C4алкил)C(O)(C1-C4алкил), -N(C1-C4алкил)C(O)(фенил), -C(O)C1-C4алкила, -C(O)C1-C4фенила, -C(O)C1-C4галогеналкила, -OC(O)C1-C4алкила, -SO2(C1-C4алкил), -SO2(фенил), -SO2(C1-C4галогеналкил), -SO2NH2, -SO2NH(C1-C4алкил), -SO2NH(фенил), -NHSO2(C1-C4алкил), -NHSO2(фенил) и -NHSO2(C1-C4галогеналкил), у которых каждый из фенила, арила, гетероцикла и гетероарила необязательно замещен одной или несколькими группами, выбранными из галогена, циклоалкила, гетероцикла, C1-C4алкила, C1-C4галогеналкила-, -OC1-C4алкила, C1-C4алкил-OH, -C1-C4алкил-O-C1-C4алкила, -OC1-C4галогеналкила, циано, нитро, -NH2, -CO2H, -C(O)OC1-C4алкила, -CON(C1-C4алкил)(C1-C4алкил), -CONH(C1-C4алкил), -CONH2, -NHC(O)(C1-C4алкил), -N(C1-C4алкил)C(O)(C1-C4алкил), -SO2(C1-C4алкил), -SO2(фенил), -SO2(C1-C4галогеналкил), -SO2NH2, -SO2NH(C1-C4алкил), -SO2NH(фенил), -NHSO2(C1-C4алкил), -NHSO2(фенил) и -NHSO2(C1-C4галогеналкил).
В некоторых вариантах осуществления R1 независимо выбран из водорода, галогена, гидроксила, -CN, необязательно замещенного C1-C6алкила, необязательно замещенного C3-C6циклоалкила, необязательно замещенного амино и необязательно замещенного C1-C6алкокси.
В некоторых вариантах осуществления R1 независимо выбран из водорода, галогена, -CN, гидроксила или выбран из метила, этила, н-пропила, изо-пропила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, N-метиламино, N-этиламино, N-н-пропиламино, N-изо-пропиламино, метокси, этокси, пропокси, изопропокси, каждый из которых необязательно замещен.
В некоторых вариантах осуществления R1 независимо выбран из водорода, гидроксила и алкила.
В некоторых вариантах осуществления m равняется 1.
В некоторых вариантах осуществления R2 представляет собой С5-С10арил, 3-8-членный гетероцикл или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного С1-С6алкила, необязательно замещенного С3-С8циклоалкила, необязательно замещенного 3-8-членного гетероцикла, необязательно замещенного 5-10-членного гетероарила, необязательно замещенного С5-С10арила, необязательно замещенного С2-С6алкенила и необязательно замещенного С2-С6алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R2 независимо выбран из фенила, нафтила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила.
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R2 выбран из
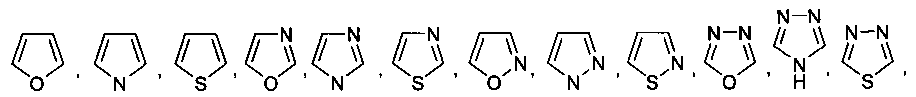



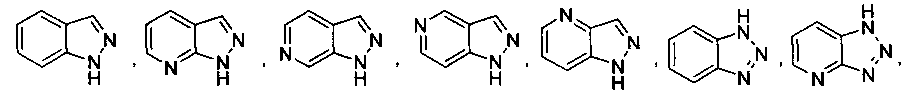
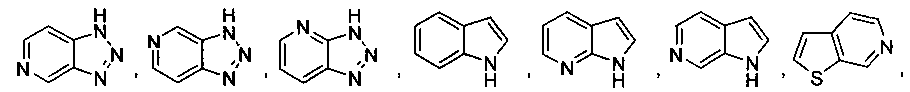

 и
и 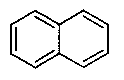 ,
,
который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила.
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
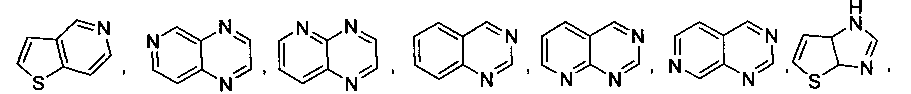
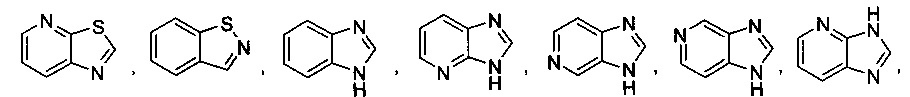
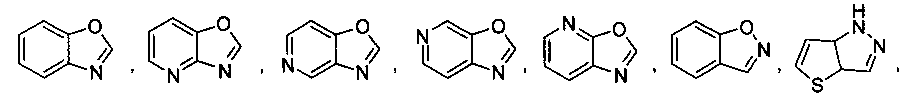
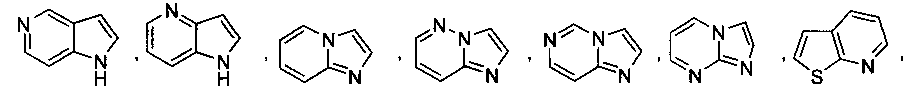
В некоторых вариантах осуществления R2 выбран из
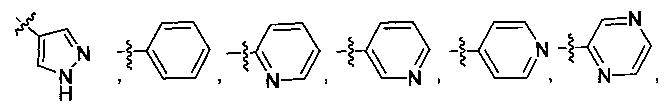
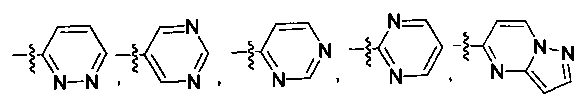 и
и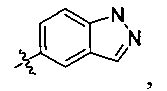
который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила.
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
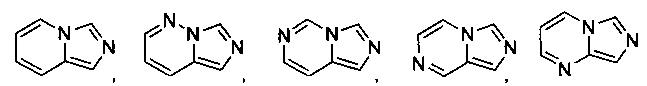
В некоторых вариантах осуществления R2 представляет собой
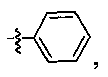
который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила.
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R2 представляет собой
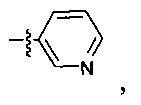
который необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбран из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила.
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R3 и R4 независимо выбраны из водорода, C1-C6алкила, C3-C8циклоалкила, C5-C10арила, 5-10-членного гетероарила и 3-8-членного гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного C1-C6алкила, необязательно замещенного C3-C8циклоалкила, необязательно замещенного 3-8-членного гетероцикла, необязательно замещенного 5-10-членного гетероарила, необязательно замещенного C5-C10арила, необязательно замещенного C2-C6алкенила и необязательно замещенного C2-C6алкинила,
или R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 4-12-членное моноциклическое, слитое бициклическое или спироциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и S, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного C1-C6алкила, необязательно замещенного C3-C8циклоалкила, необязательно замещенного 3-8-членного гетероцикла, необязательно замещенного 5-10-членного гетероарила, необязательно замещенного C5-C10арила, необязательно замещенного C2-C6алкенила и необязательно замещенного C2-C6алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R3 и R4 независимо выбраны из водорода, метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, фенила, нафтила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила и пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбраны из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, фенила, нафтила, C2-C6алкенила, C2-C6алкинила, каждый из которых необязательно замещен,
или R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 4-12-членное моноциклическое, слитое бициклическое или спироциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и S, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, или выбраны из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила и трет-бутила, необязательно замещенного циклопропила, циклобутила, циклопентила, циклопентенила, циклогексила, циклогексенила, необязательно замещенного пирролидинила, тетрагидрофурила, пиперидинила, пиперазинила, морфолинила, гомоморфолинила, тиоморфолинила, диазепанила, оксазепанила, необязательно замещенного пиридила, пиримидинила, пиразинила, пиридазинила, пиразолила, имидазолинила, оксазолила, изоксазолила, тиазолила, тиенила, фурила, бензофурила, бензотиенила, бензоимидазолинила, индолила, хинолинила, необязательно замещенного фенила, нафтила, необязательно замещенного C2-C6алкенила и необязательно замещенного C2-C6алкинила, каждый из которых необязательно замещен,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R4 представляет собой H, a R3 представляет собой низший алкил, который необязательно замещен одной или несколькими группами, выбранными из алкила, циклоалкила, гетероцикла и гетероарила, каждый из которых необязательно замещен одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 4-12-членное моноциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и N, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 7-14-членное слитое бициклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и N, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления R3 и R4 вместе с атомом N, к которому они присоединяются, могут образовывать 7-14-членное спироциклическое кольцо, необязательно содержащее дополнительные 1-3 гетероатома, выбранные из N, O и N, которое необязательно замещено одной или несколькими группами, выбранными из галогена, -NR5R6, -OR7, -S(O)nR8, -C(O)R9, -C(O)OR7, -CN, -C(O)NR5R6, -NR5C(O)R9, -NR5S(O)nR8, -NR5S(O)nNR10R11, -NR5C(O)OR7, -NR5C(O)NR10R11, -NO2, -S(O)nNR5R6, необязательно замещенного низшего алкила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного гетероарила, необязательно замещенного арила, необязательно замещенного алкенила и необязательно замещенного алкинила,
R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода, алкила, циклоалкила, арила, гетероарила и гетероцикла, каждый из которых, за исключением водорода, необязательно замещен одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида,
или R5 и R6, R5 и R7, R5 и R8, R5 и R9, а также R5 и R10 вместе с атомом(ами), к которому они присоединяются, могут образовывать кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, гидроксила, циано, необязательно замещенного низшего алкила, необязательно замещенного низшего алкоксила, необязательно замещенного низшего алкилсульфонила, необязательно замещенного низшего алкилацила, необязательно замещенного циклоалкила, необязательно замещенного гетероцикла, необязательно замещенного амино и необязательно замещенного амида, необязательно замещенного сульфонамида.
В некоторых вариантах осуществления необязательно замещенный низший алкил выбран из CF3, CF2H, аминоалкила, гидроксиалкила, алкоксиалкила и галогеналкила.
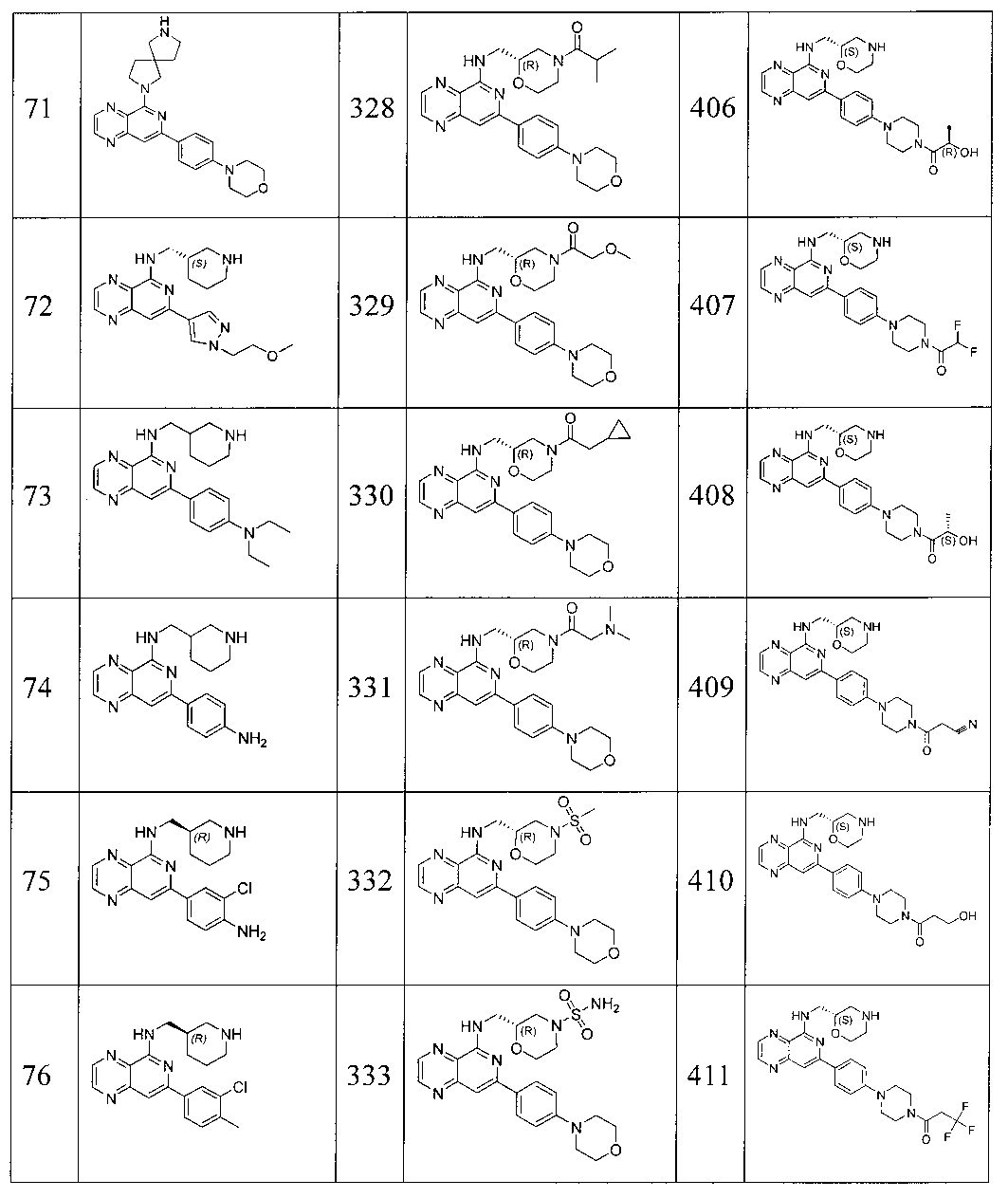
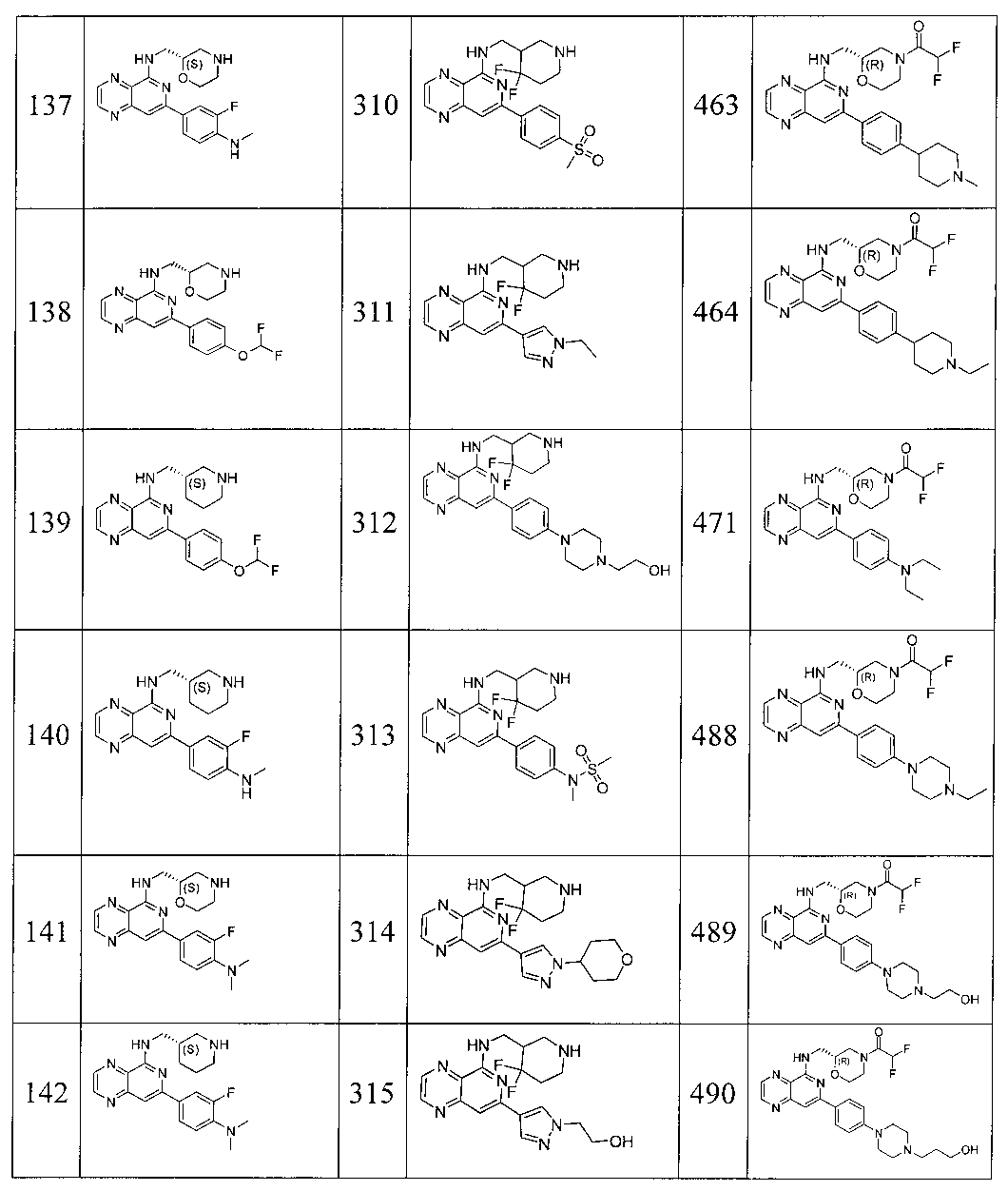
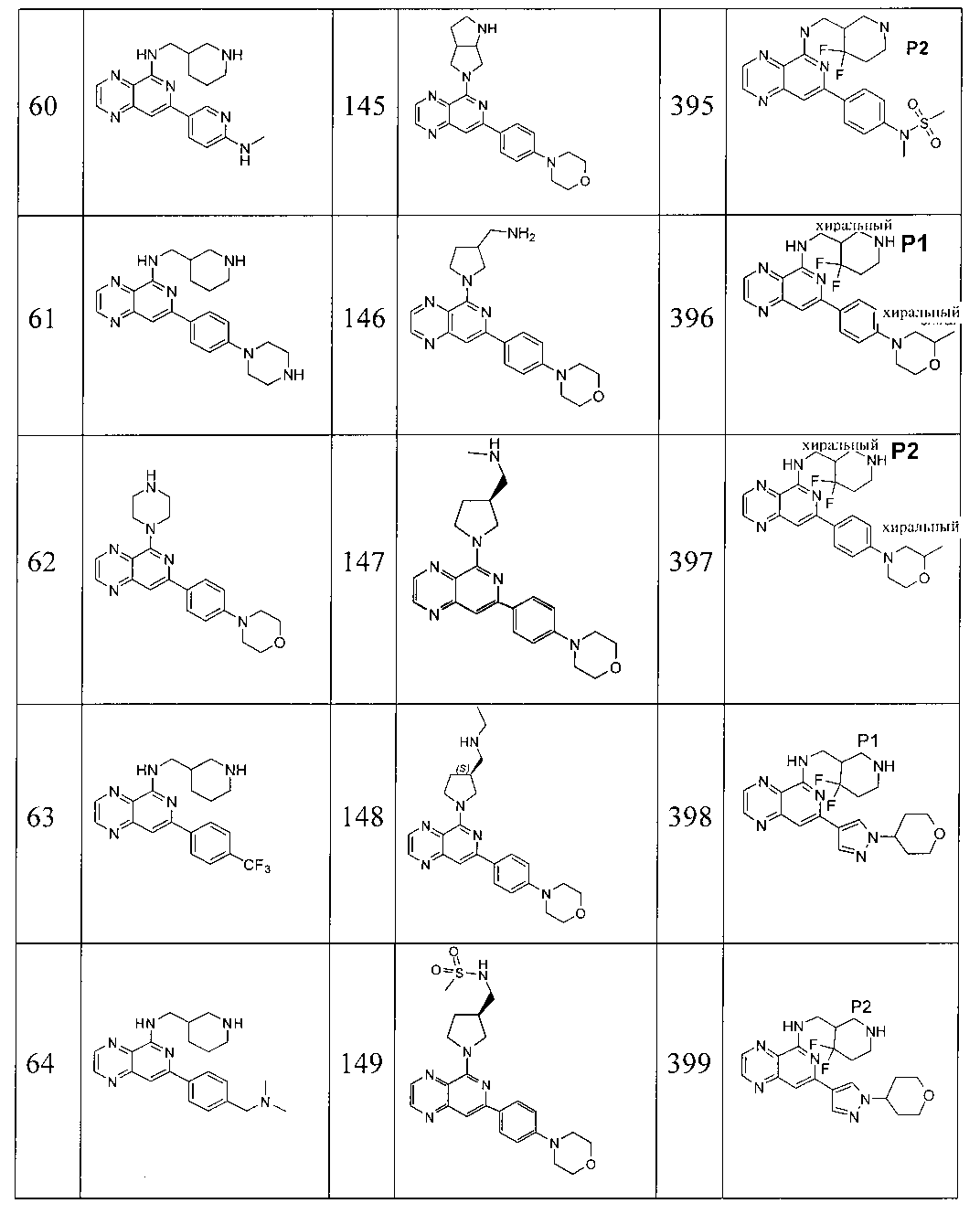
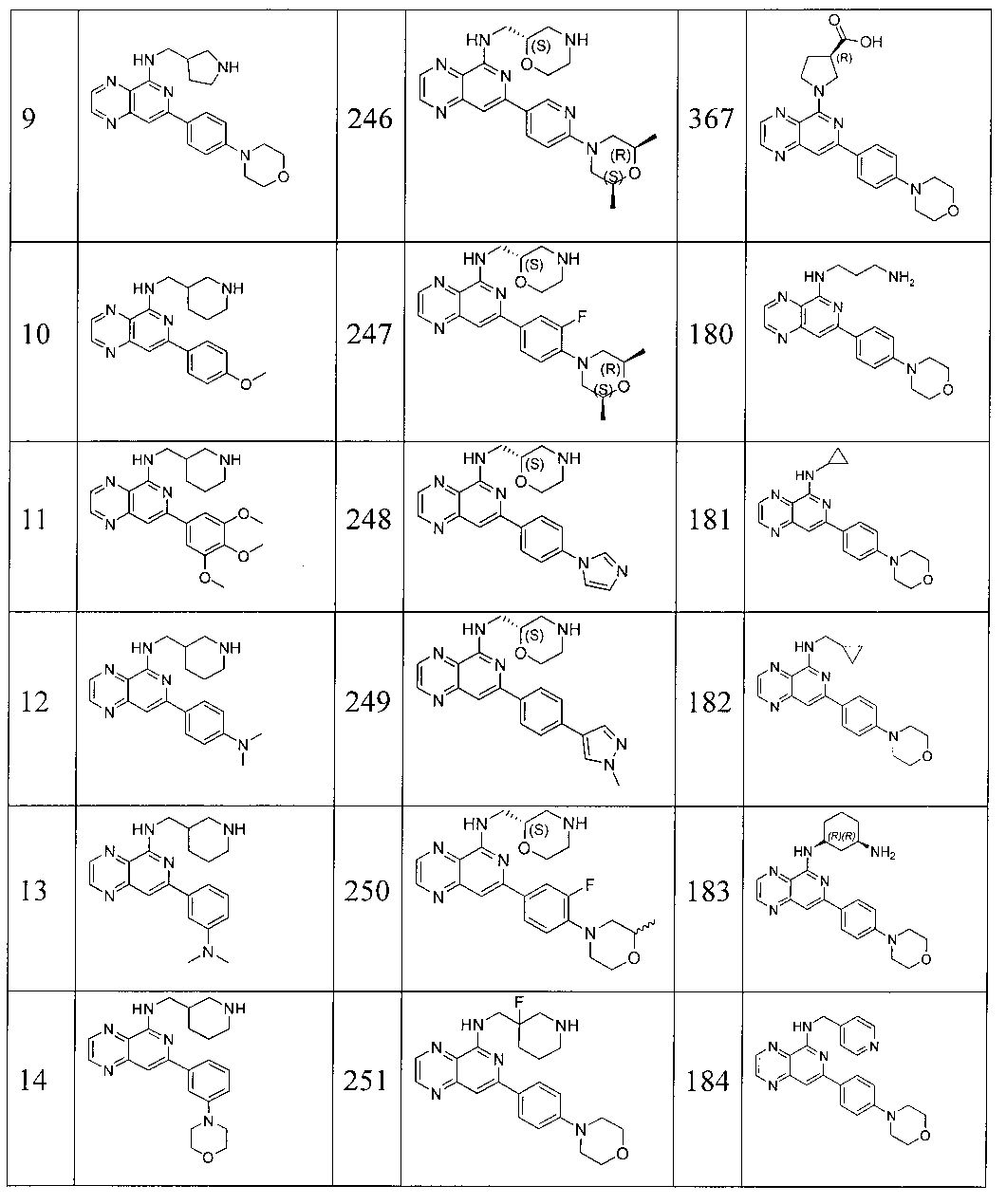
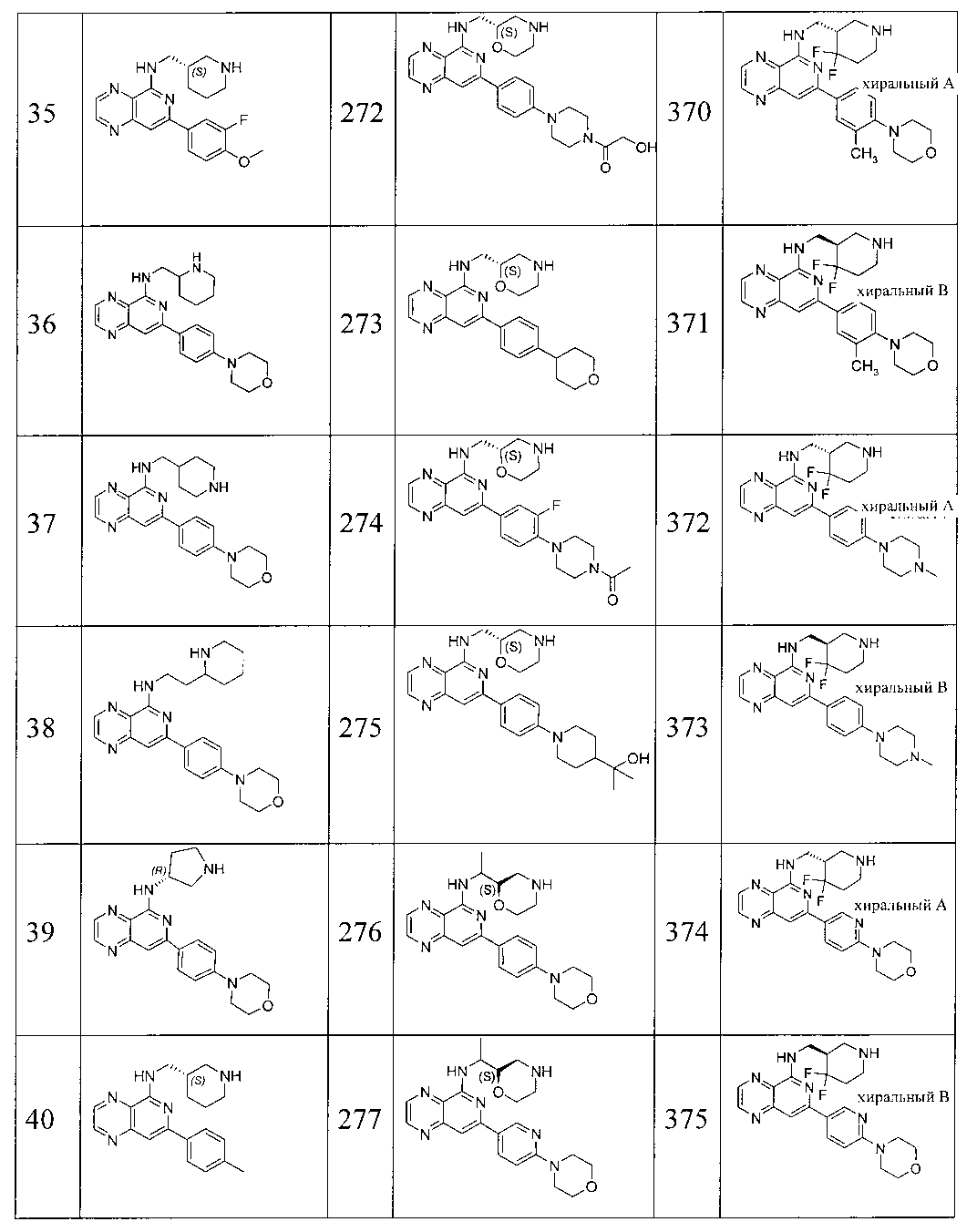
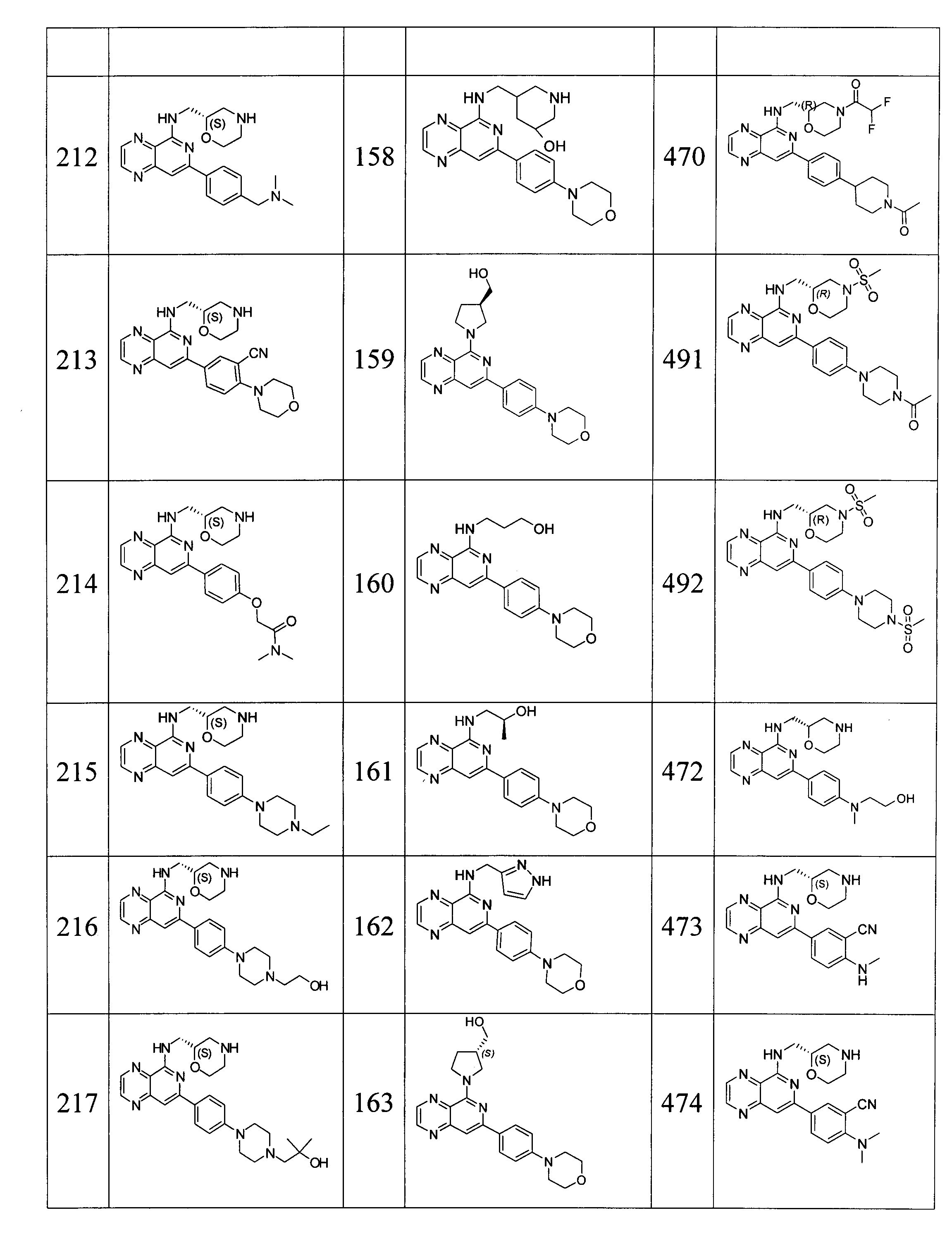
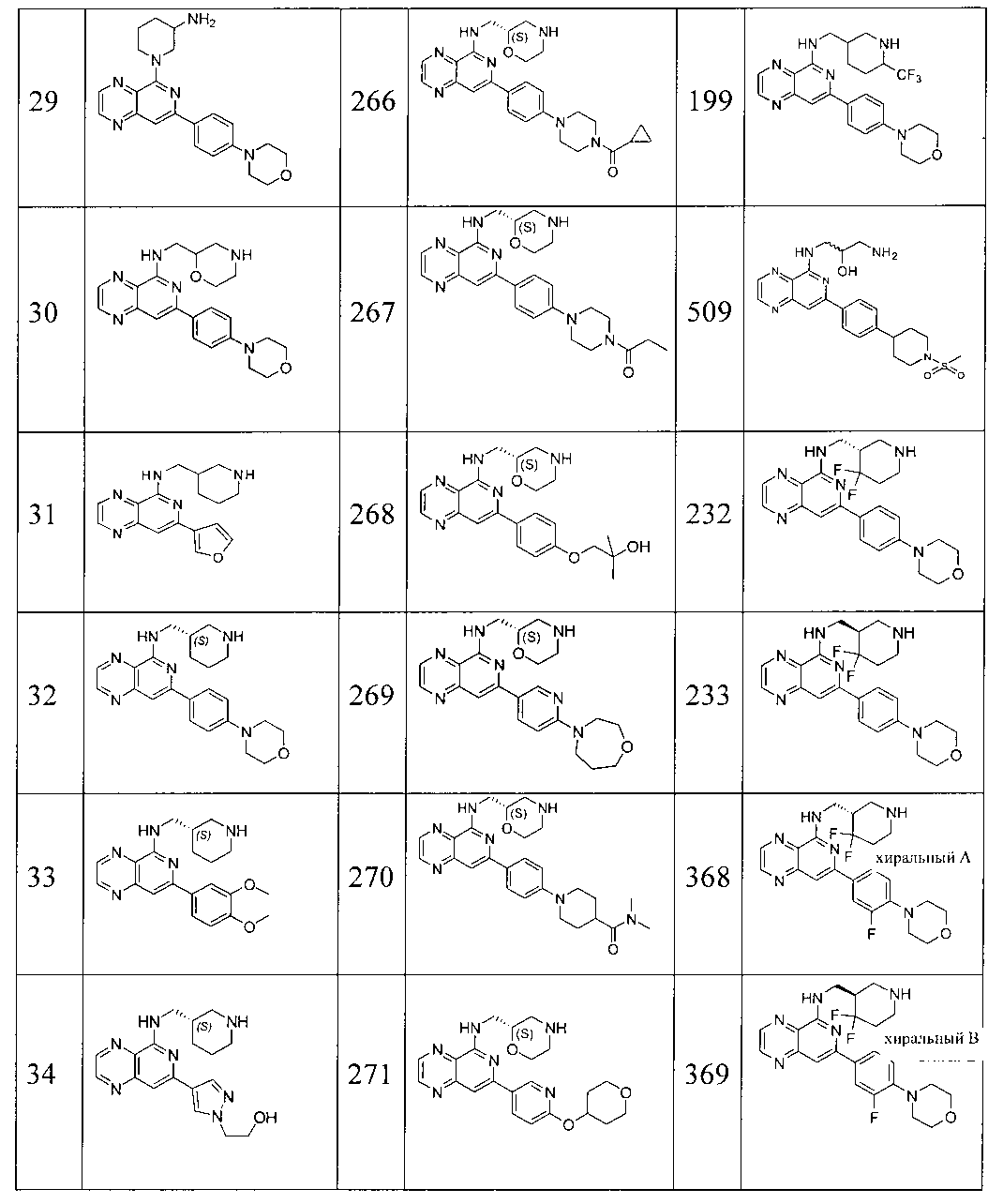
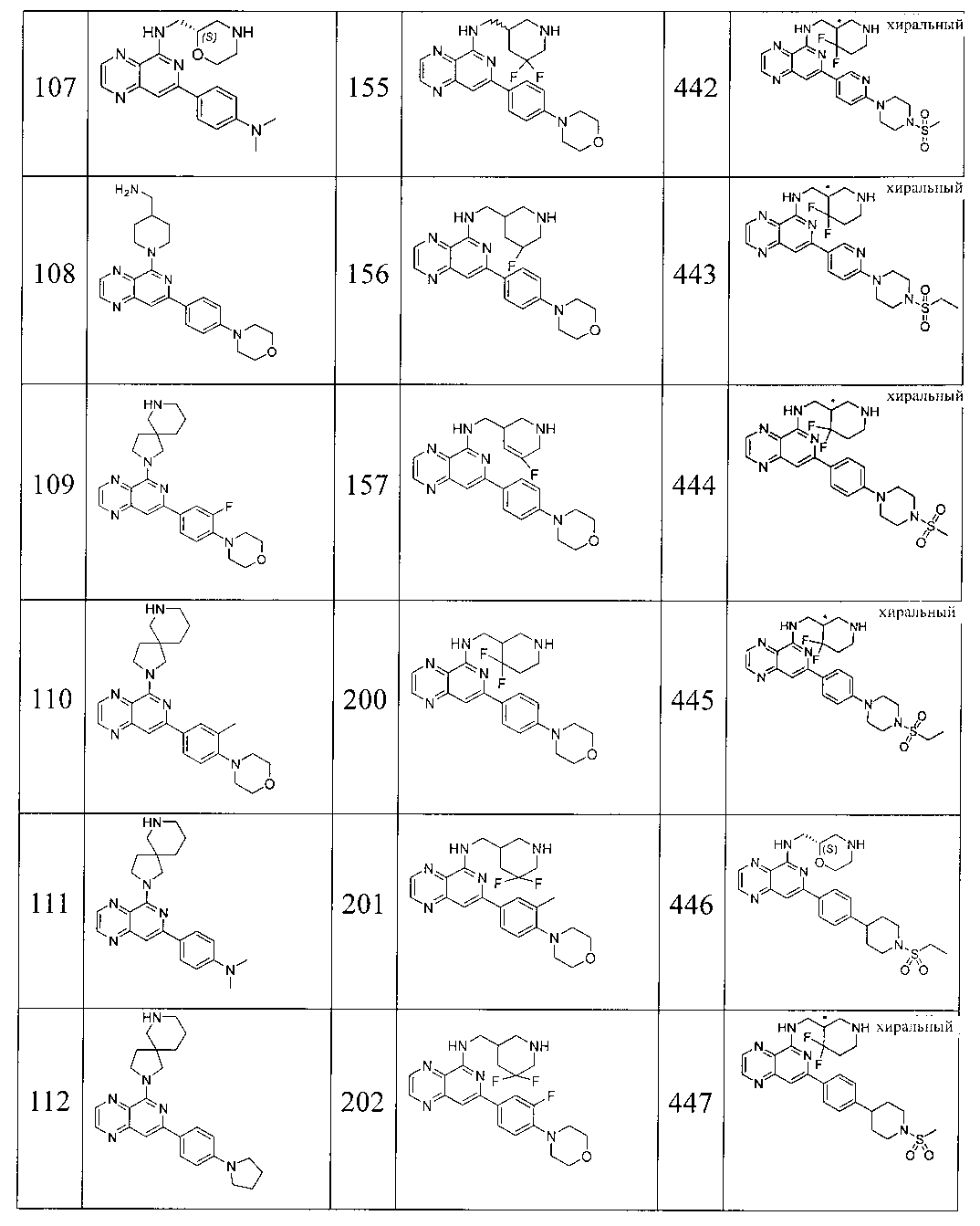
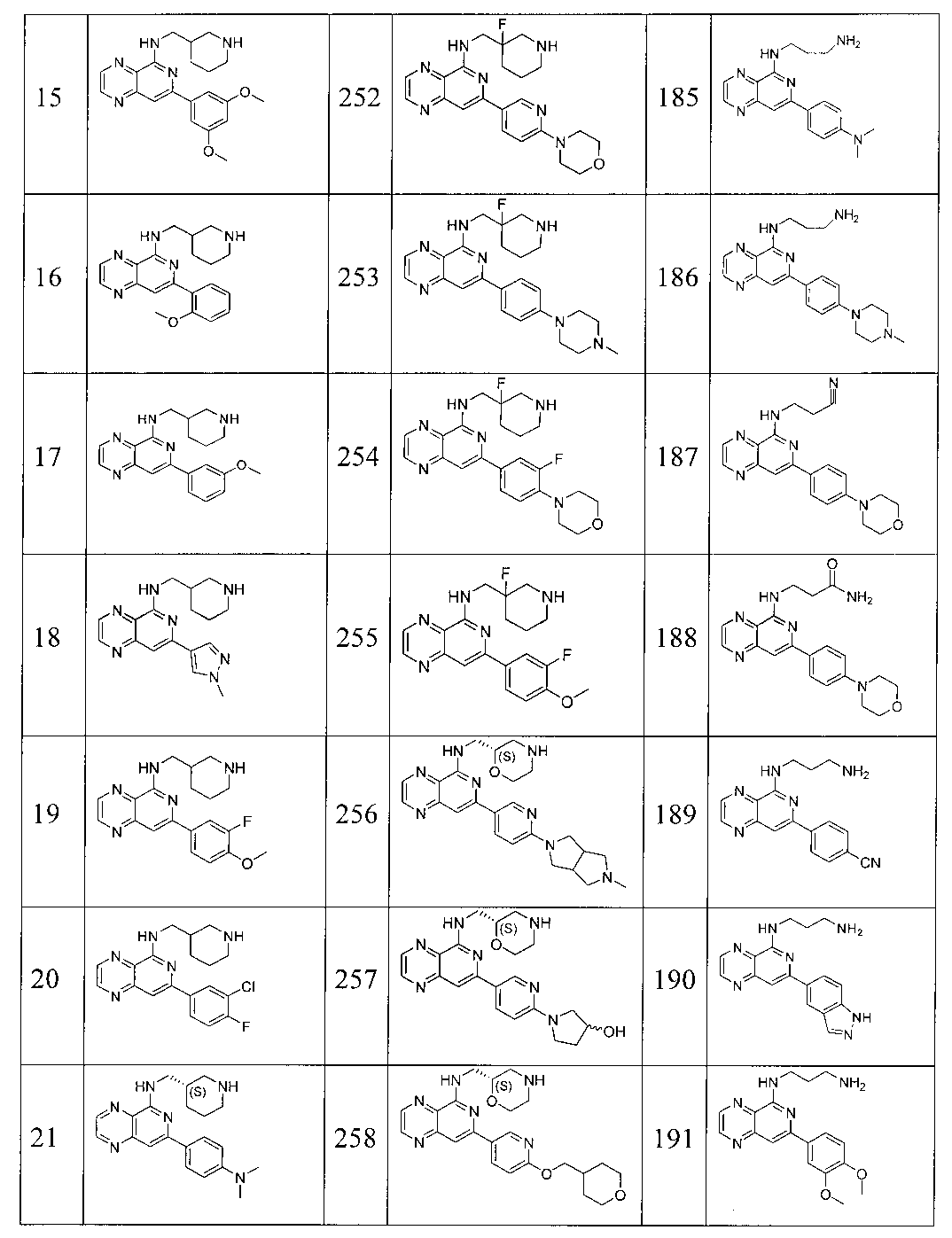
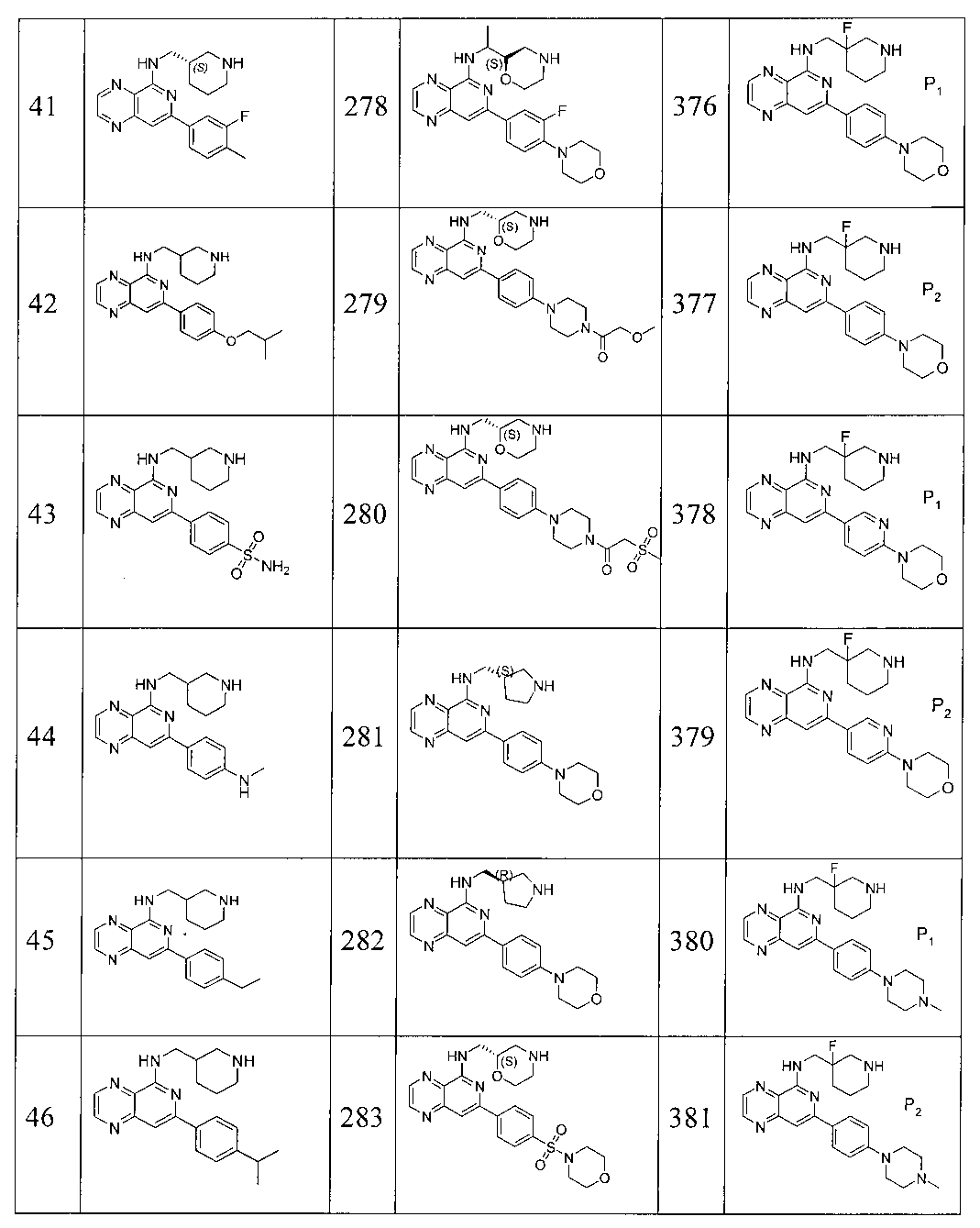
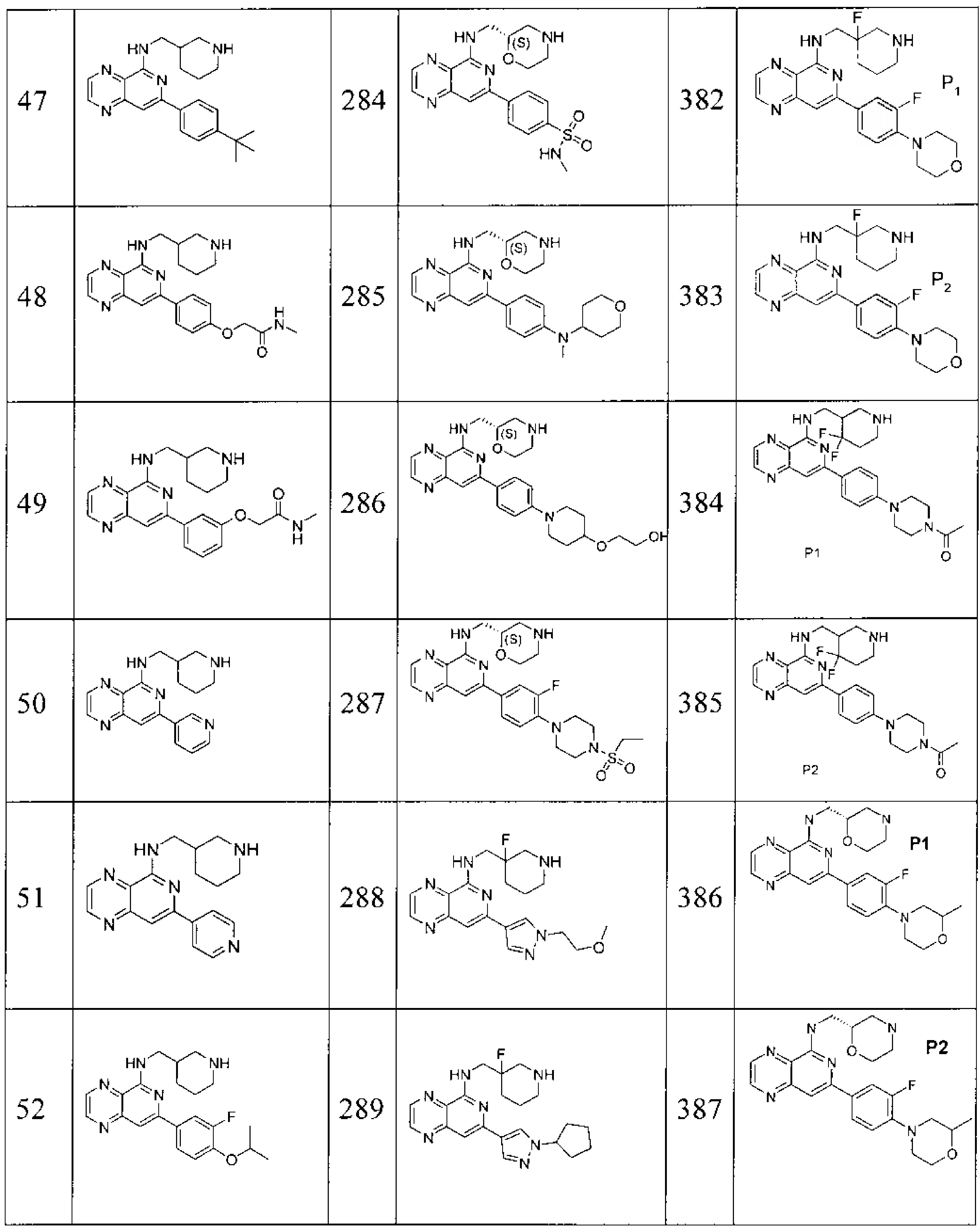
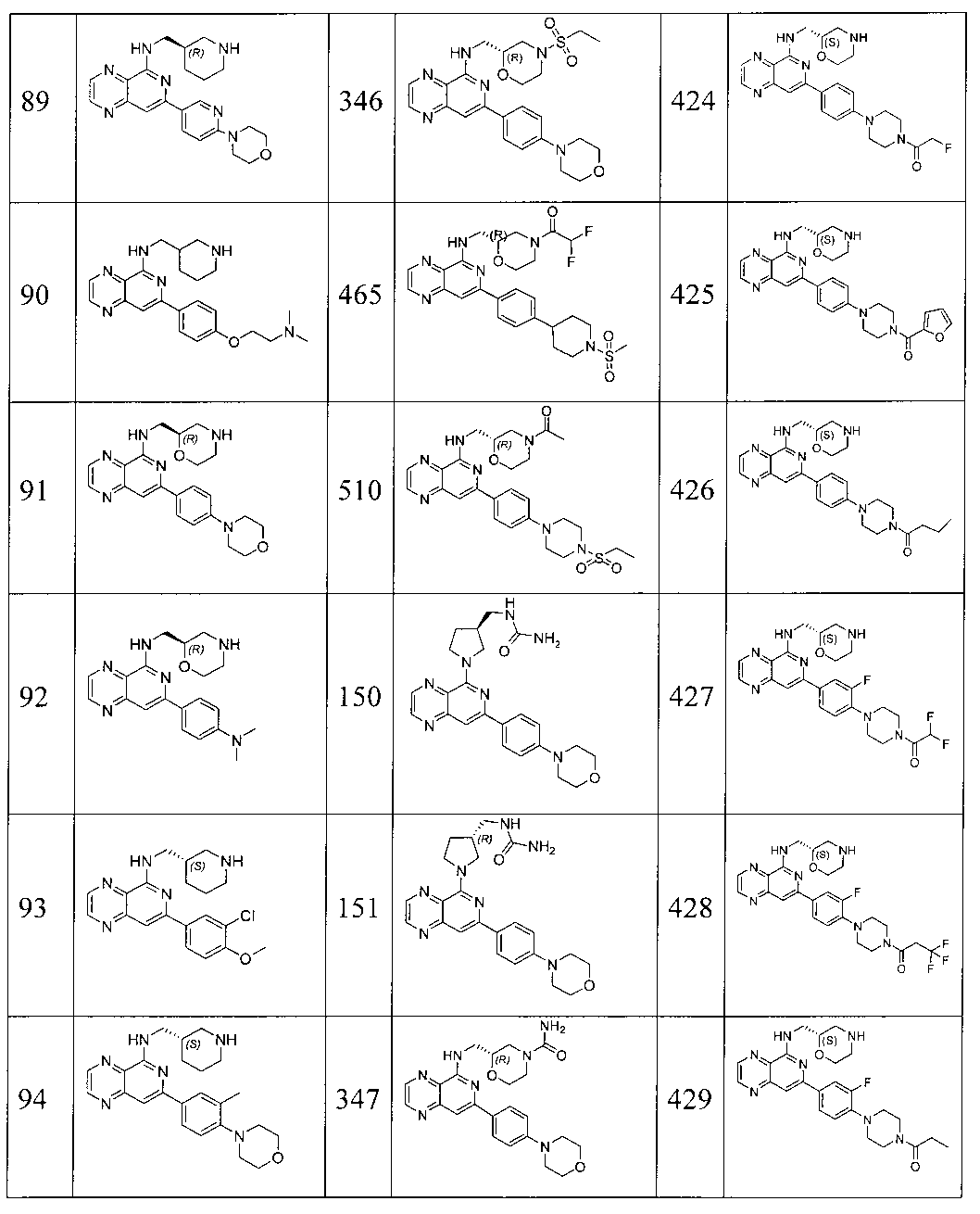
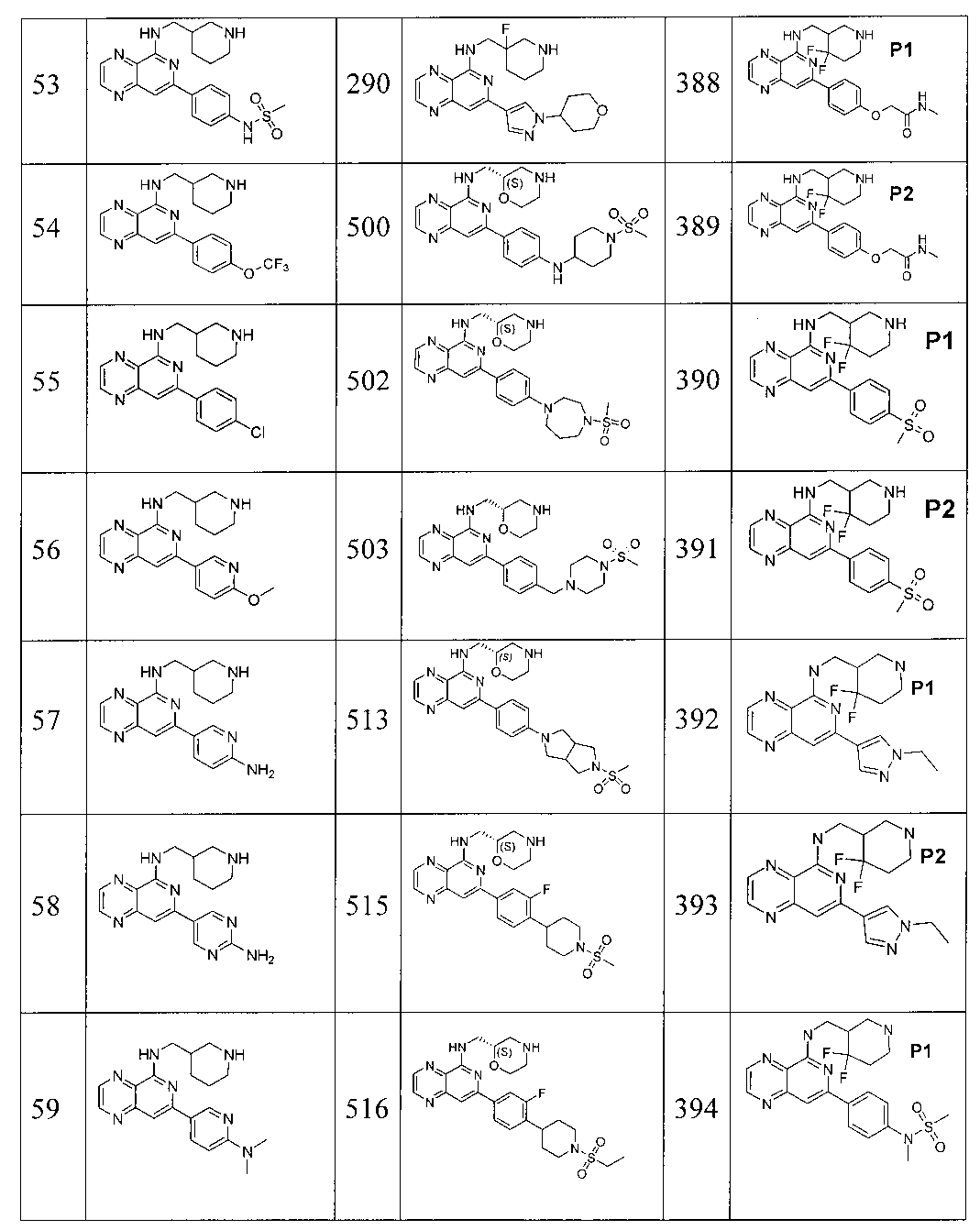
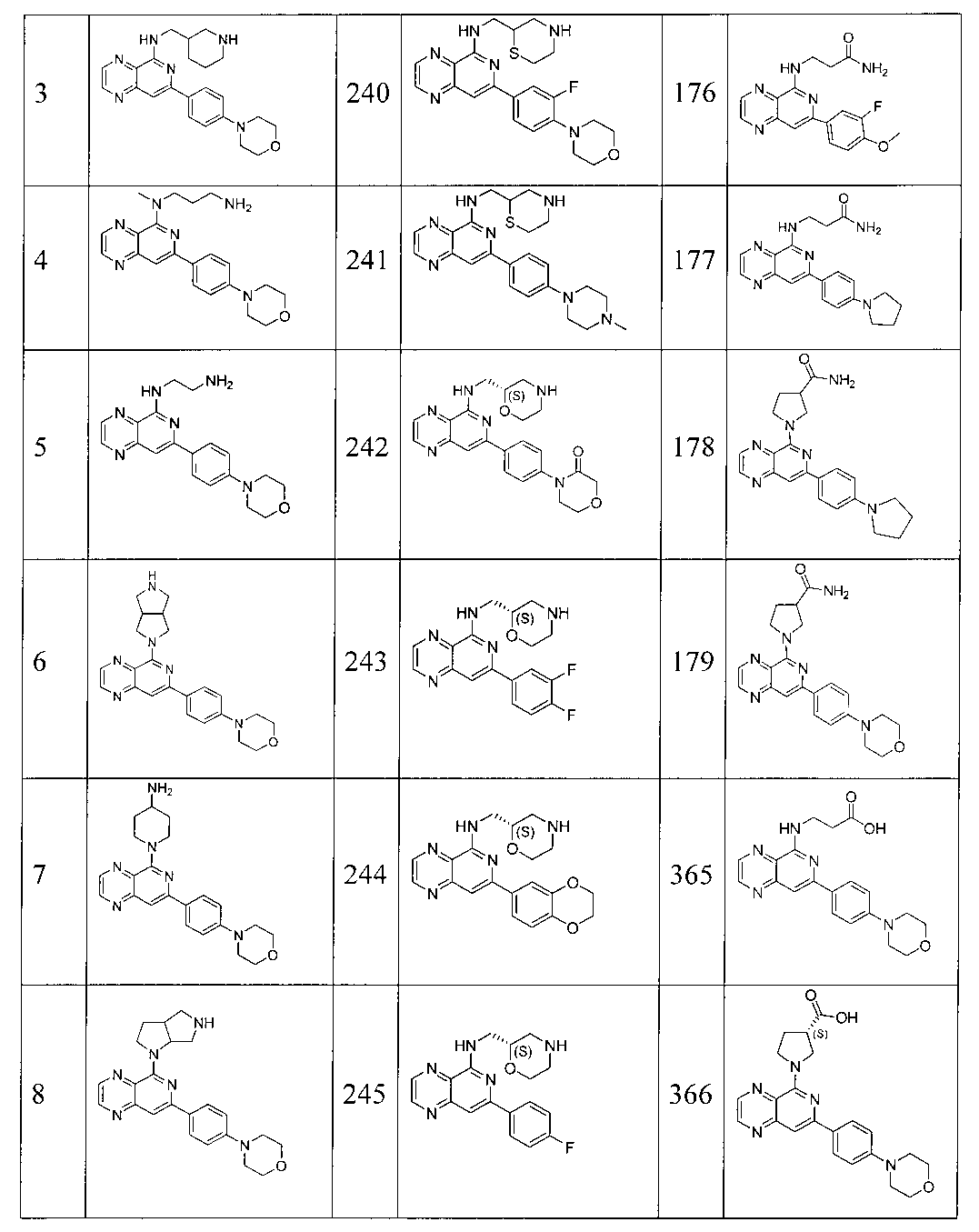
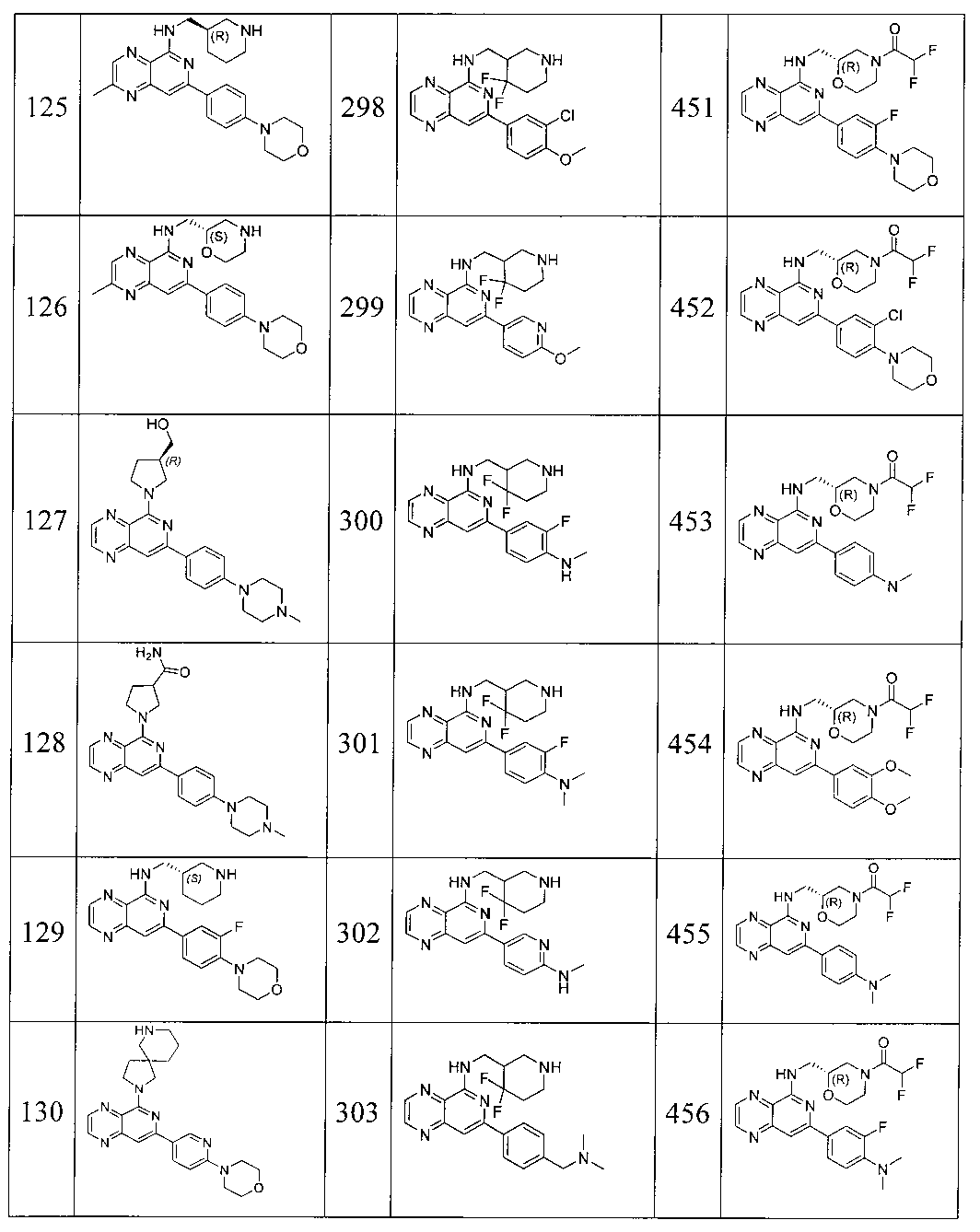
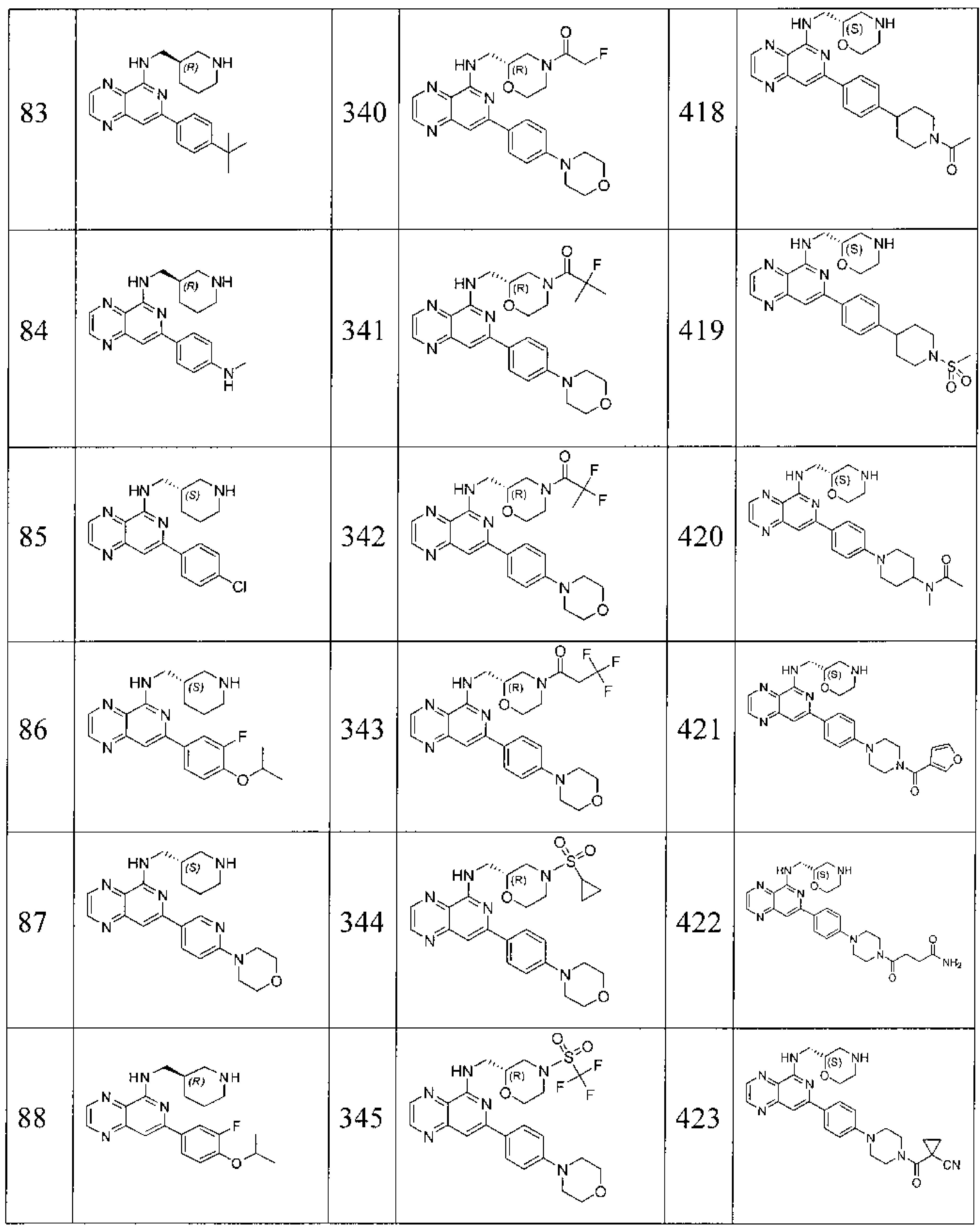
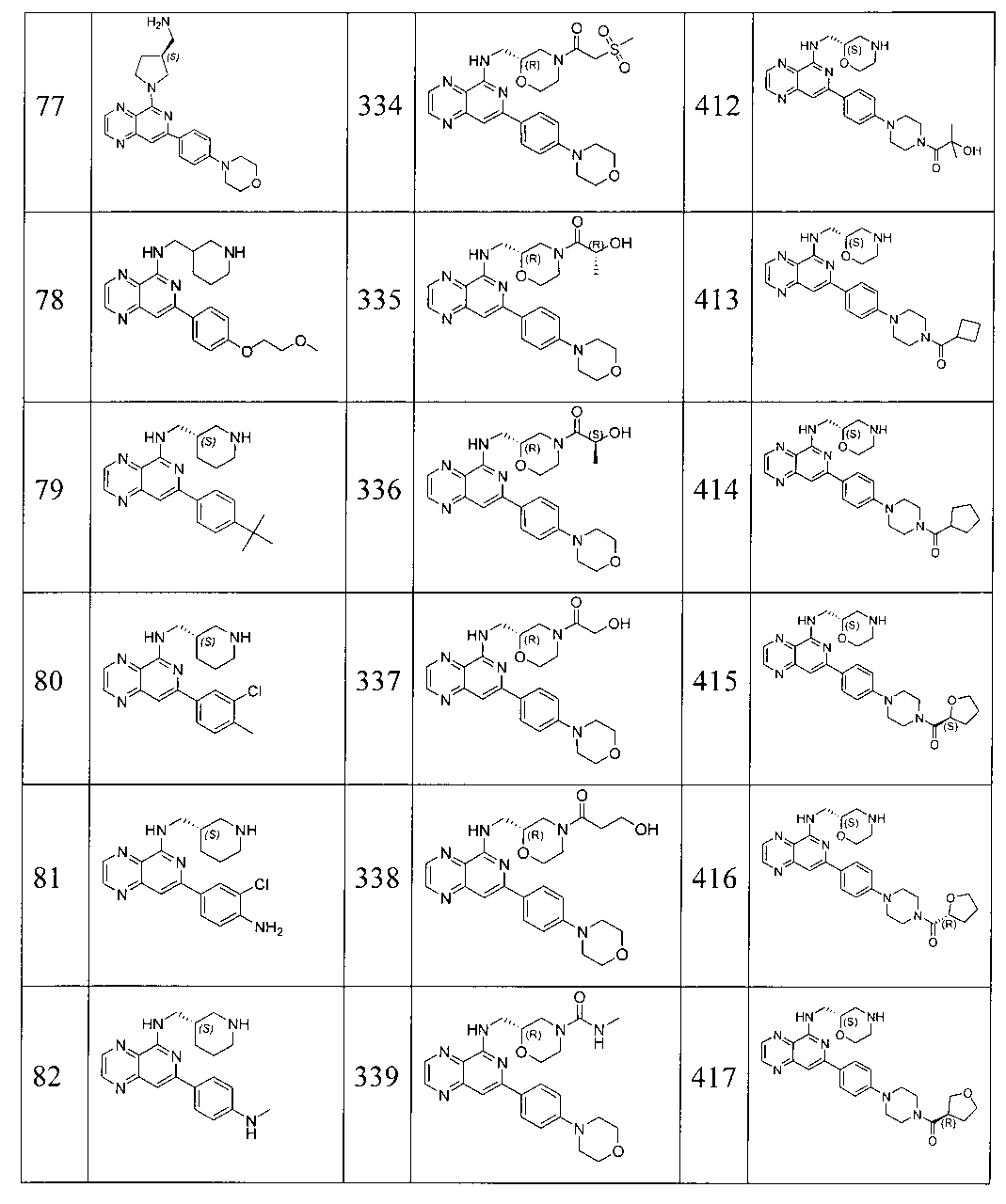
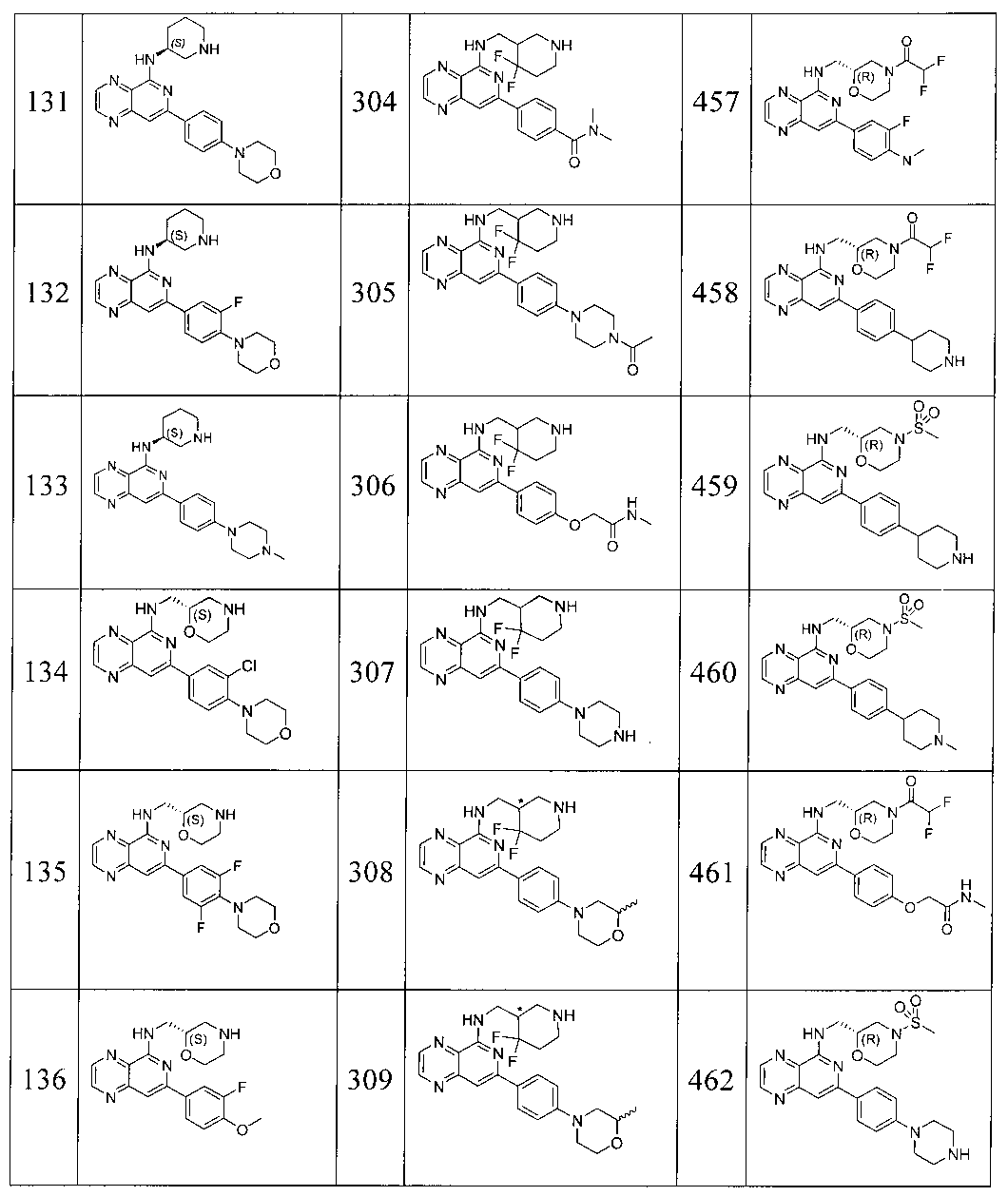
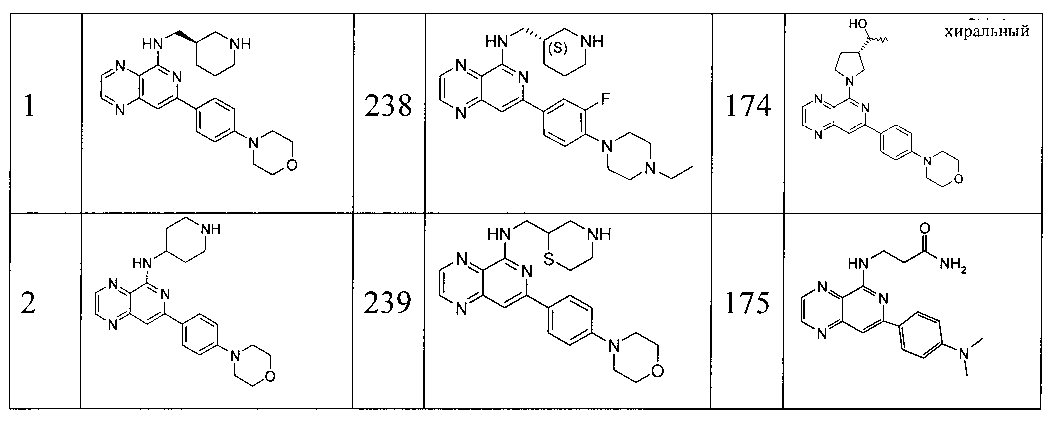
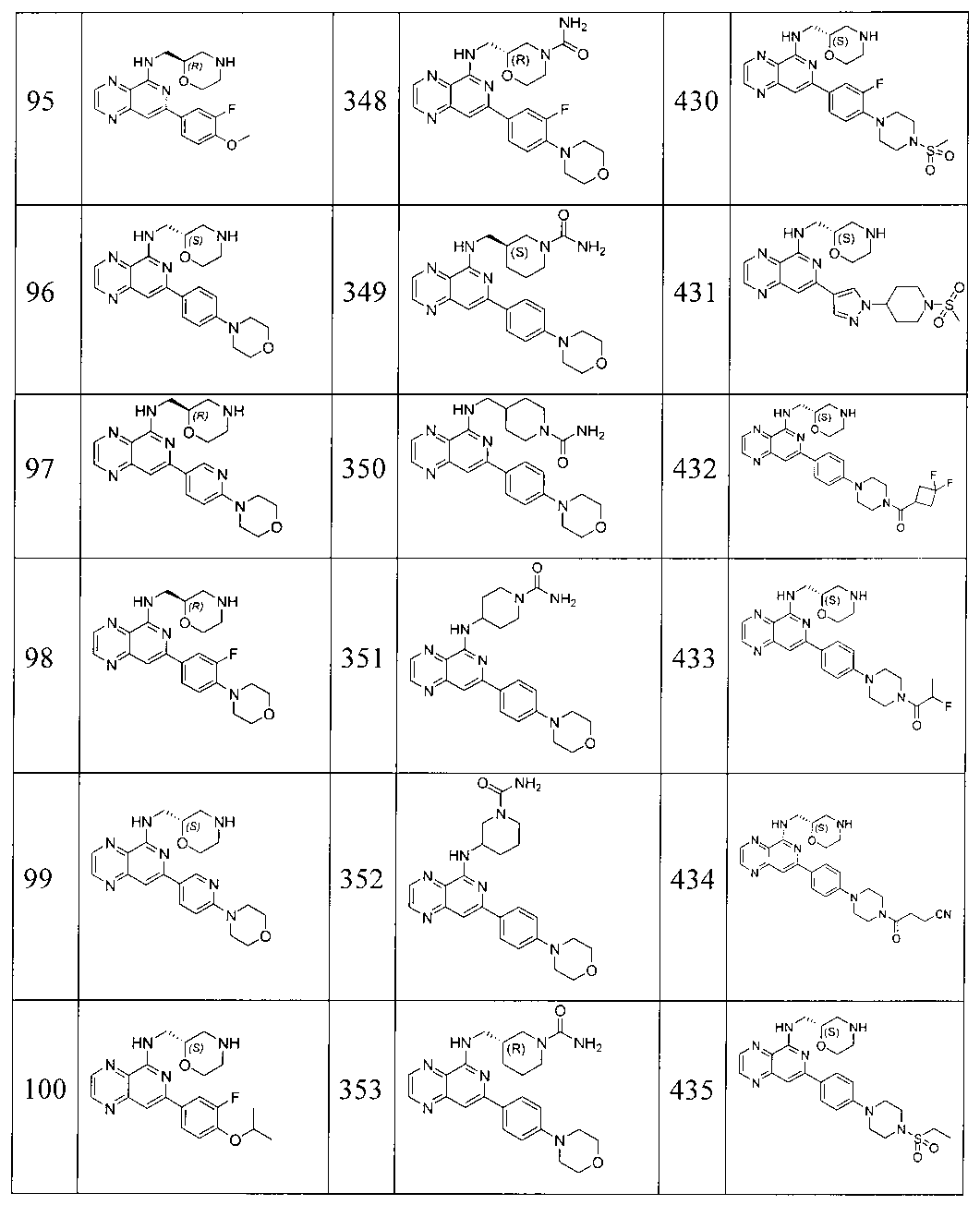
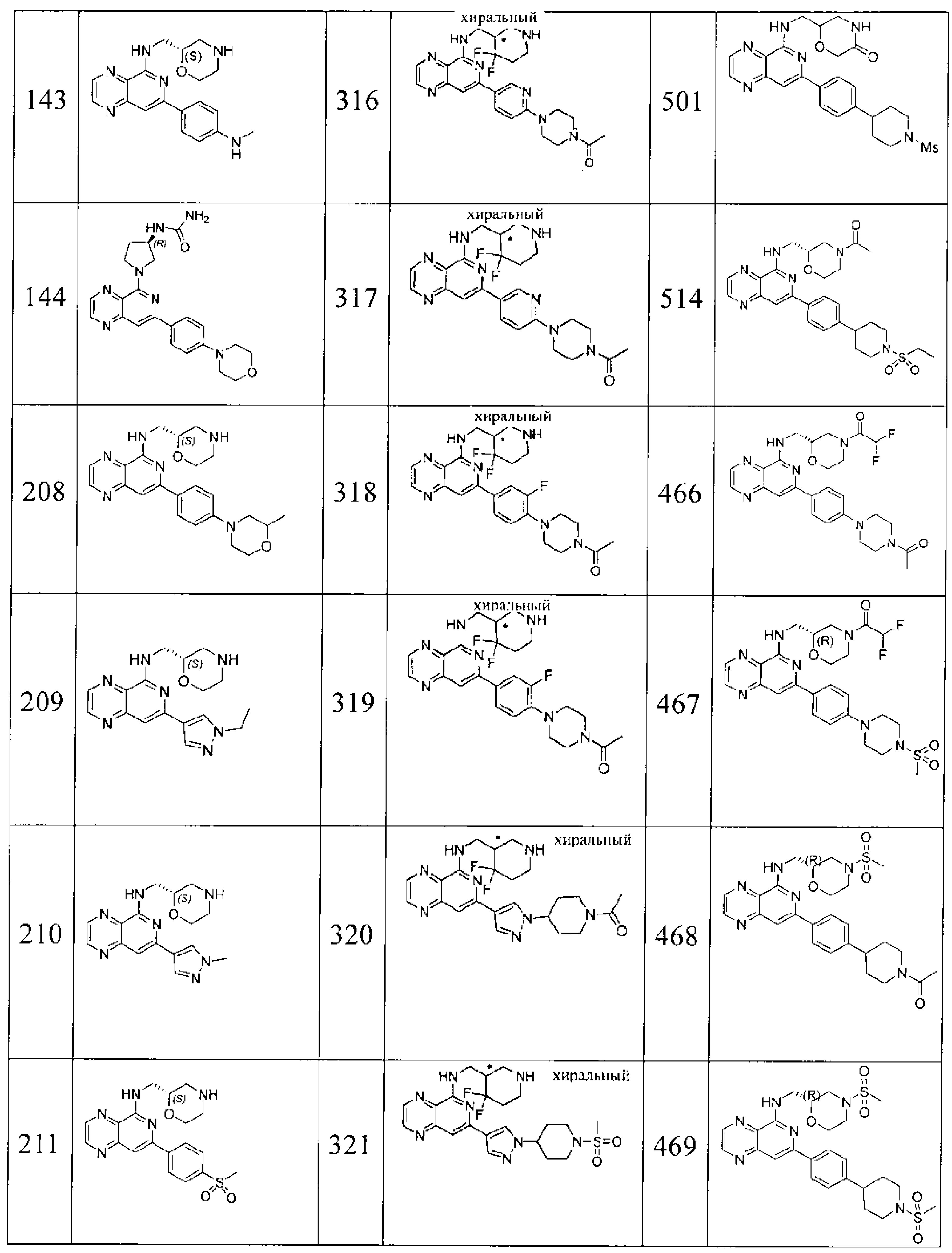
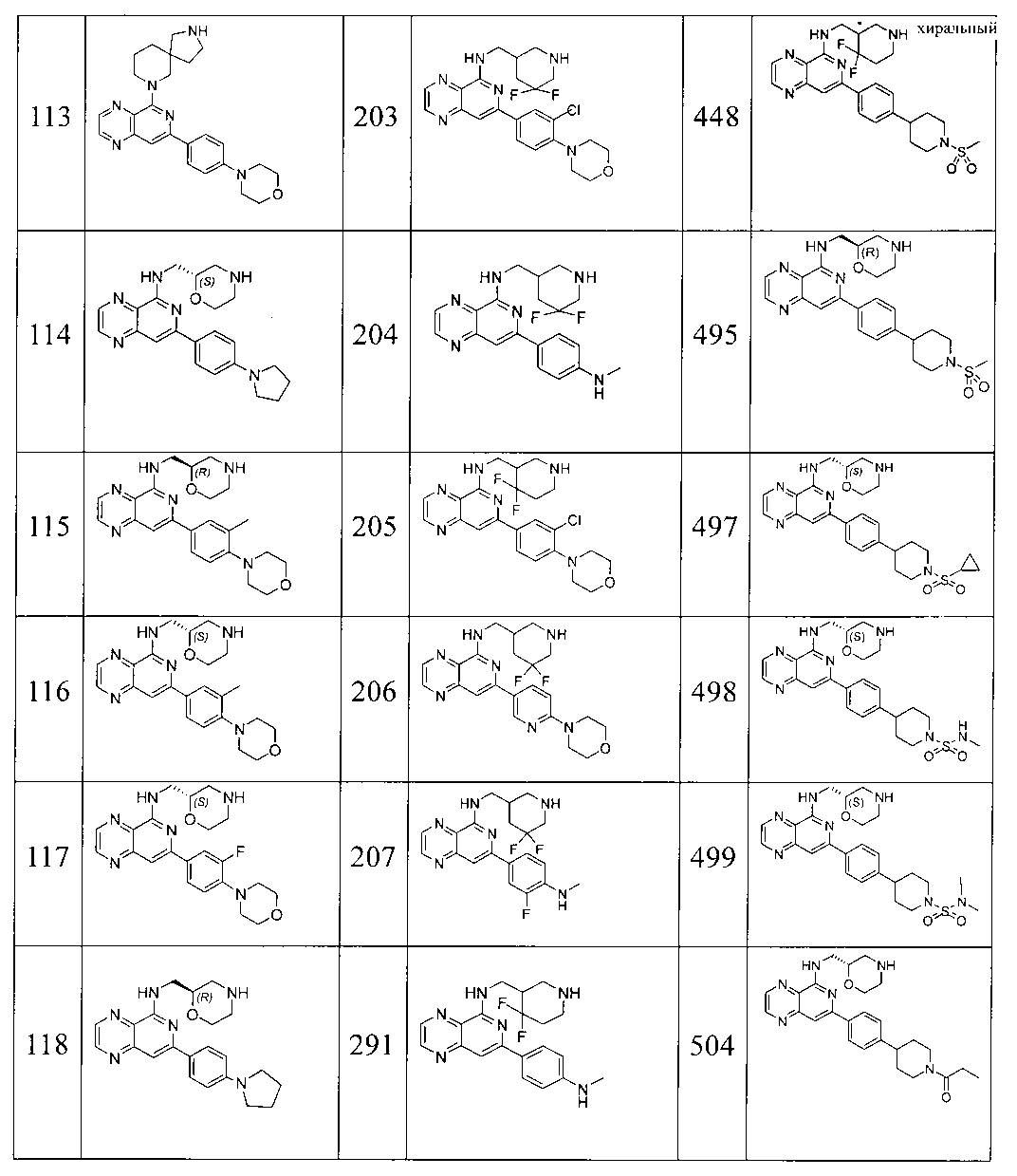
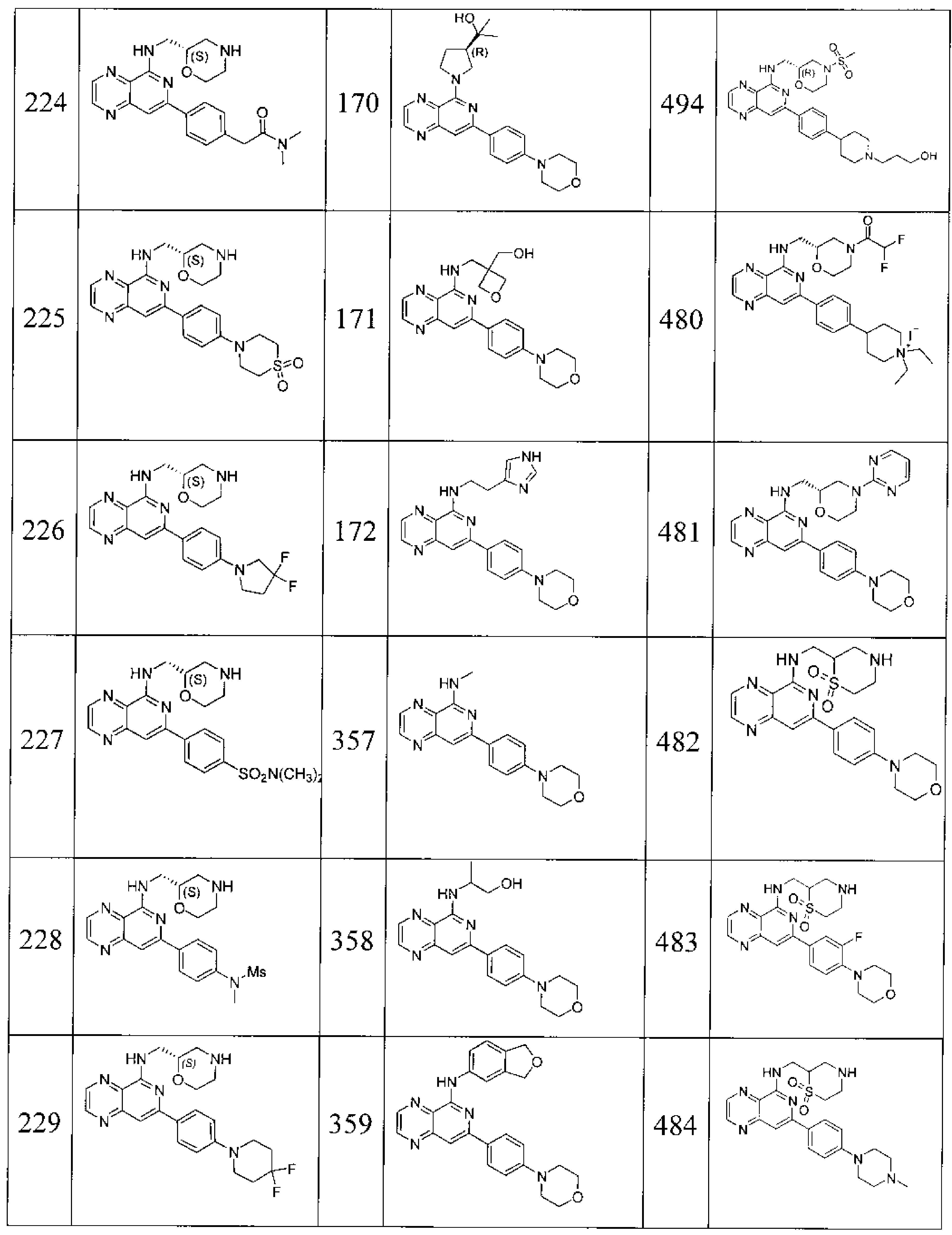
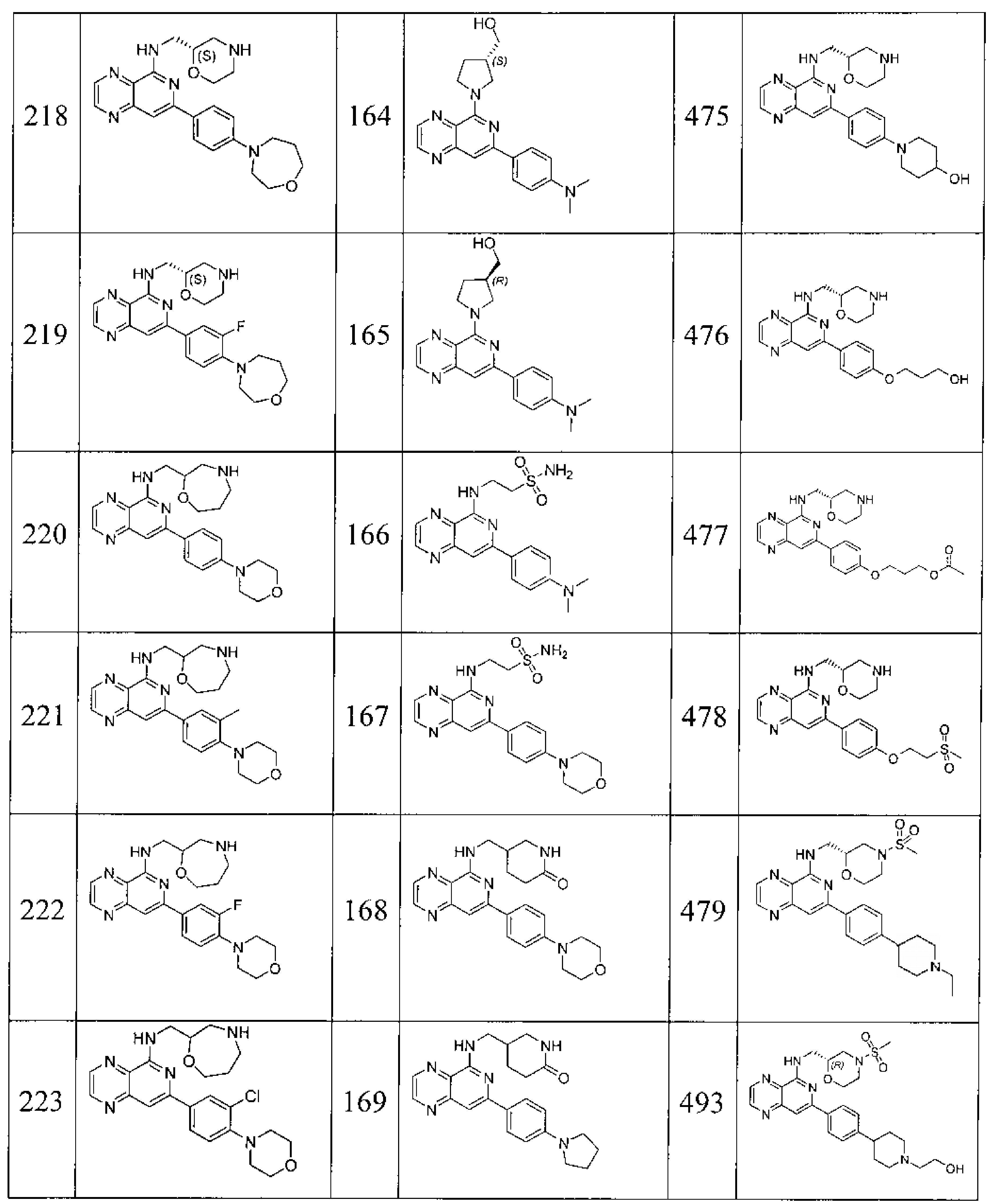
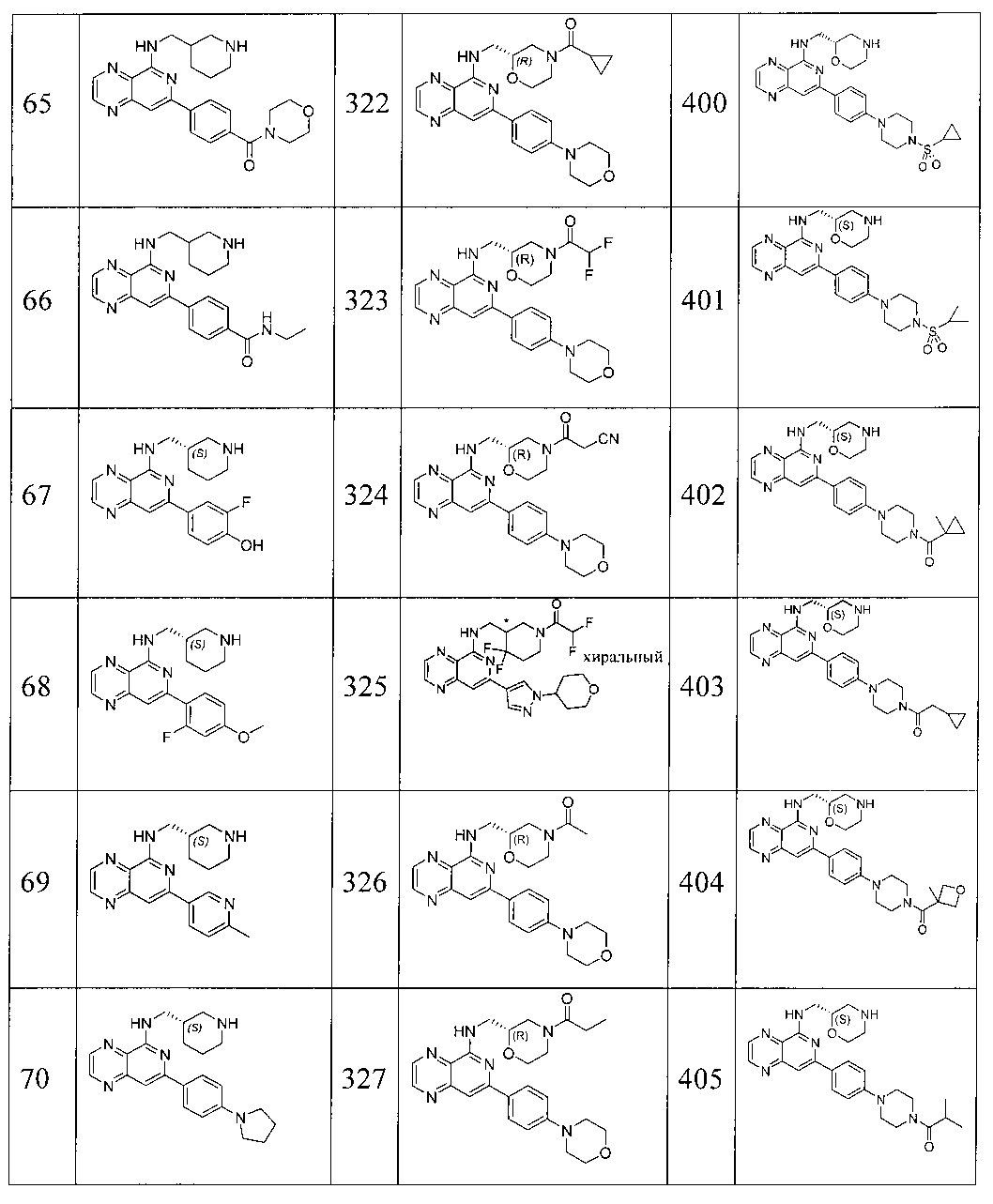
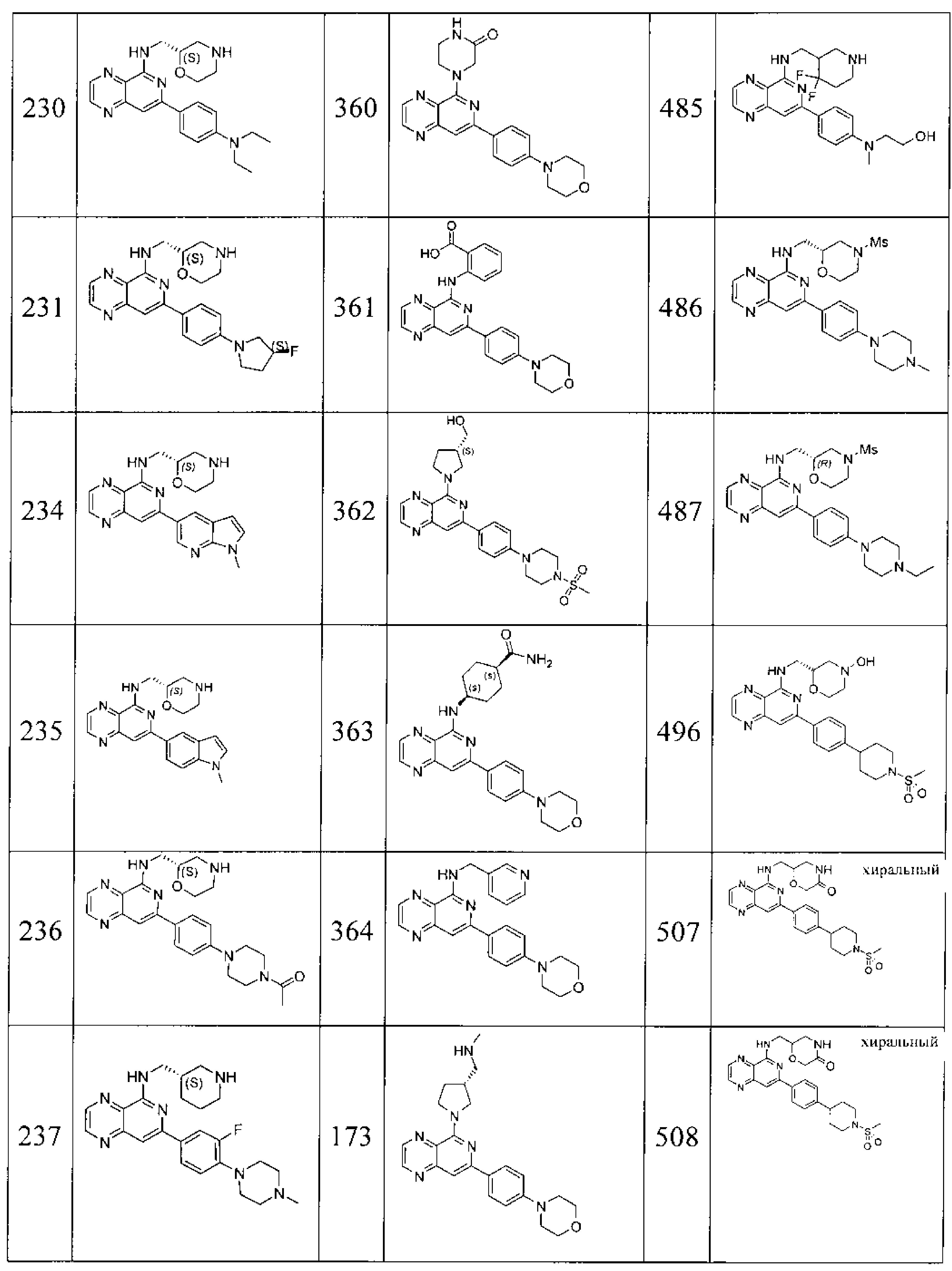
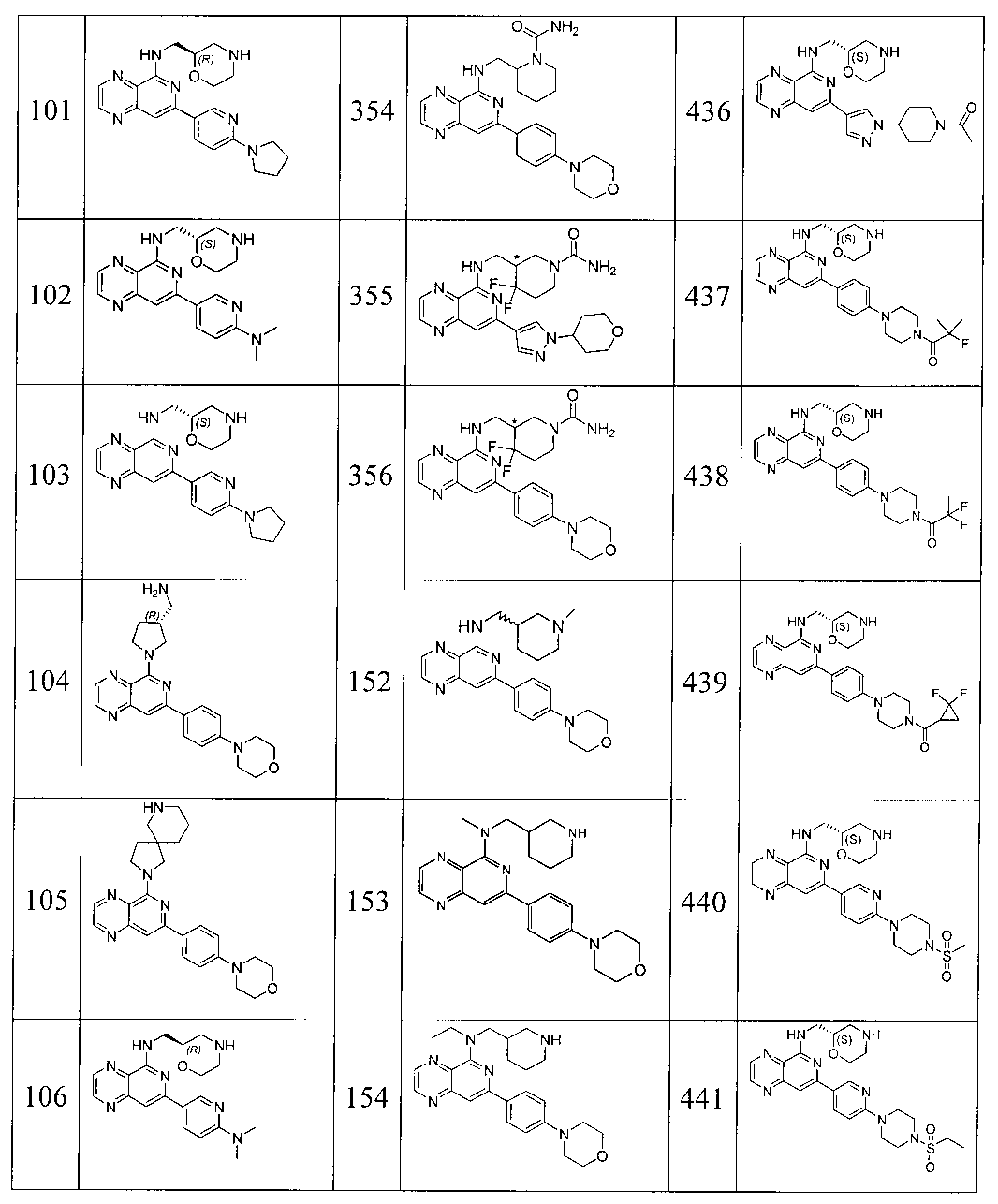
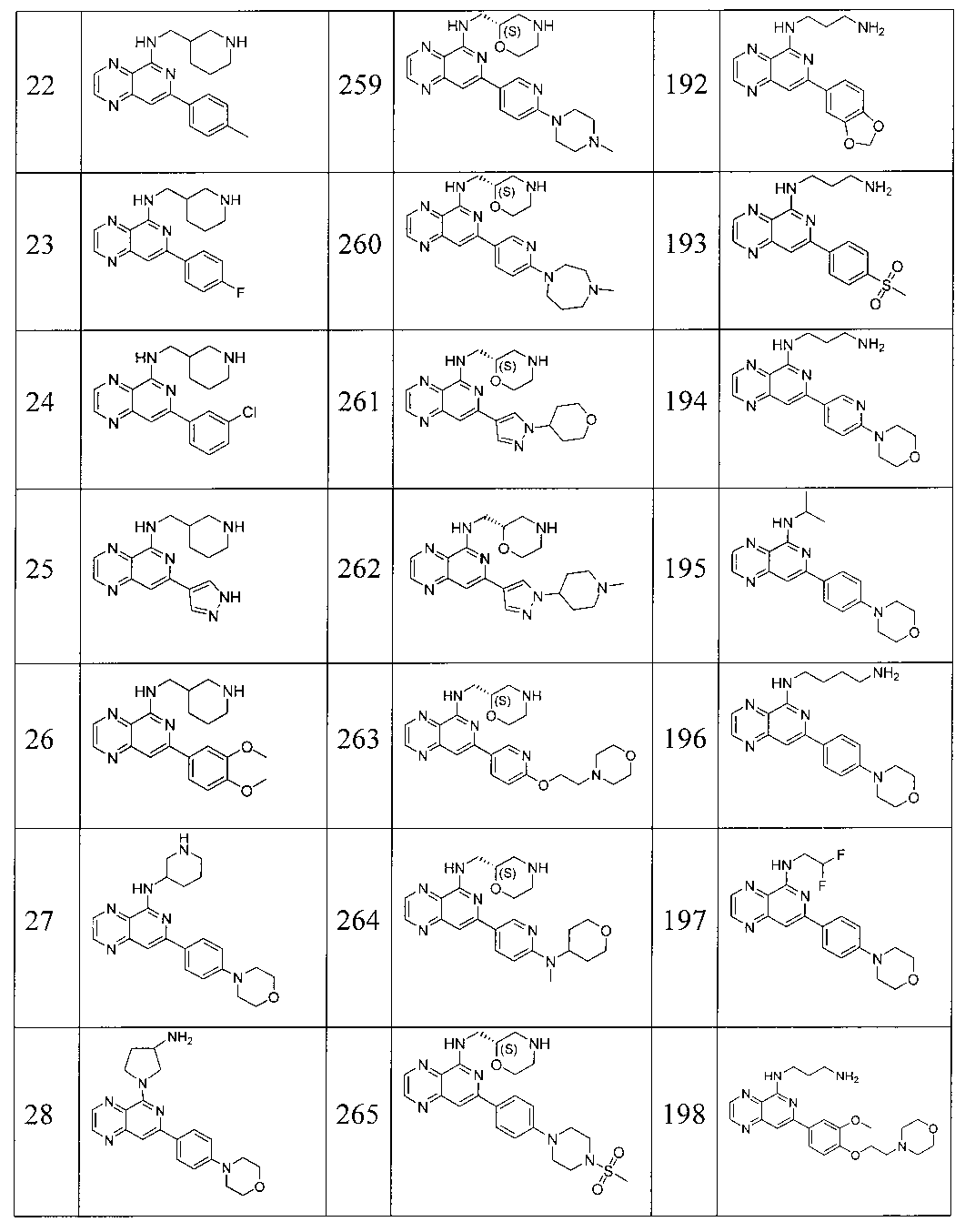
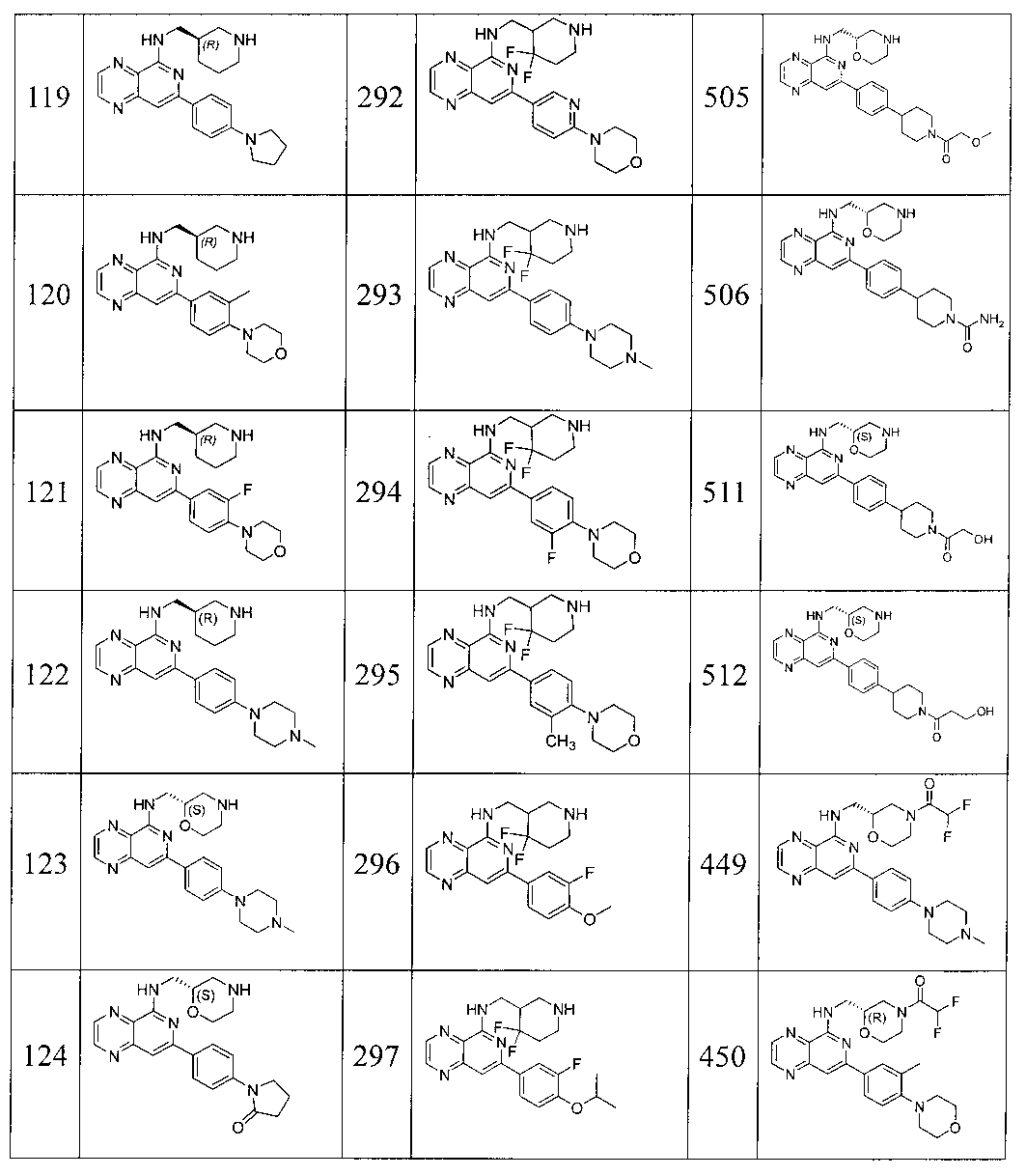
Также представлены по меньшей мере одно соединение, выбранное из соединений 1-516, и/или по меньшей мере одна его фармацевтически приемлемая соль.
Соединения, описанные в настоящем документе, и/или их фармацевтически приемлемые соли могут быть синтезированы из коммерчески доступных исходных материалов способами, хорошо известными в данной области, вместе с раскрытием настоящей патентной заявки. Следующие схемы иллюстрируют способы получения большинства соединений, раскрытых в настоящем документе.
Схема I
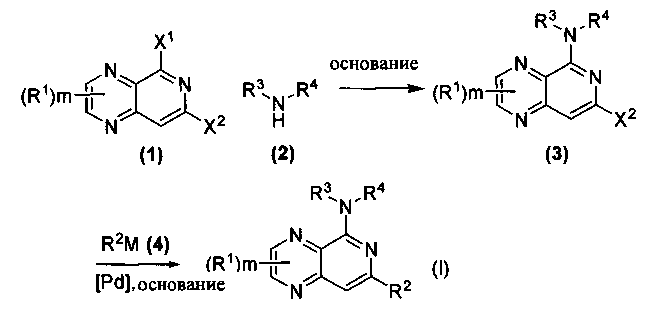
Как показано на схеме I, соединения формулы (1) могут реагировать с соединениями формулы (2), где n, R1, R2 и R3 определены в настоящем документе, X1 и X2 представляют собой галоген, выбранный из Cl, Br или I, в присутствии основания, такого как без ограничения K2CO3, Na2CO3, NaH, Et3N или диизопропилэтиламин (DIPEA), с образованием соединений формулы (3), которые могут реагировать с соединениями формулы (4), где R2 определен в настоящем документе, M выбран из бороновой кислоты/сложного эфира или олова, замещенных C1-C4алкильными группами, при катализе палладиевым реагентом, таким как без ограничения PdCl2, Pd(OAc)2 Pd2(dba)3 или Pd(PPh3)4, и лигандом, таким как без ограничения Ph3P, tBu3P, 2,2′-бис(дифенилфосфино)-1,1′-бинафтален (BINAP), 1,1′-бис(дифенилфосфино)ферроцен (dppf) или 1,3-бис(2,6-дипропилфенил)-1H-имидазол-3-ия хлорид, в присутствии основания, такого как без ограничения K2CO3, Na2CO3, Cs2CO3, NaH, t-BuONa, t-BuOK, Et3N или диизопропилэтиламин (DIPEA), с образованием соединения формулы (I).
Полученные таким образом соединения далее могут быть модифицированы по их периферическим положениям с получением желаемых соединений. Синтетические химические трансформации описаны, например, в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3-е изд., Lohn Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser′s Reagent for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и в последующих их изданиях.
Перед применением по меньшей мере одно соединение и/или по меньшей мере одна фармацевтически приемлемая соль, описанные в настоящем документе, могут быть очищены колоночной хроматографией, высокоэффективной жидкостной хроматографией, кристаллизацией или другими приемлемыми способами.
Также представлена композиция, содержащая по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель.
Композиция, содержащая по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, может быть введена различными известными путями, такими как пероральный, парентеральный, ингаляционное распыление или через имплантированный резервуар. Термин "парентеральный", как используется в настоящем документе, включает техники подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, внутриартериальной, внутрисиновиальной, интрастернальной, интратекальной, внутрь повреждения и внутричерепной инъекции или инфузии.
Пероральная композиция может быть любой перорально приемлемой лекарственной формой, включая без ограничения таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Традиционно применяемые носители для таблеток включают лактозу и кукурузный крахмал. Как правило, в таблетки также добавляют смазывающие средства, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и сухой кукурузный крахмал. Если водные суспензии или эмульсии вводятся перорально, то активный ингредиент может быть суспендирован или растворен в масляной фазе, комбинированной с эмульгирующим или суспендирующим средством. При необходимости могут быть добавлены определенные подсластители, ароматизаторы или красители.
Стерильная инъецируемая композиция (например, водная или маслосодержащая суспензия) может быть составлена согласно техникам, известным в данной области, с использованием приемлемых диспергирующих или смачивающих средств (таких как, например, Tween 80) и суспендирующих средств. Стерильное инъецируемое промежуточное соединение также может быть стерильным инъецируемым раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Как фармацевтически приемлемые среды и растворители можно применять маннит, воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются применимыми в промежуточных продуктах инъецируемых препаратов, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Такие масляные растворы или суспензии также могут содержать длинноцепочечные спиртовые разбавители или дисперсанты, или карбоксиметилцеллюлозу, или подобные диспергирующие средства.
Ингаляционная композиция может быть получена согласно техникам, хорошо известным в области фармацевтического состава, и может быть получена в виде растворов в солевом растворе с использованием бензилового спирта или других приемлемых консервантов, стимуляторов абсорбции для усиления биодоступности, фторуглеродов и/или других растворяющих или диспергирующих средств, известных в данной области техники.
Местнодействующая композиция может быть составлена в форме масла, крема, лосьона, мази и т.п. Приемлемые носители для композиции включают растительные или минеральные масла, медицинский вазелин (белый мягкий парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (более C12). В некоторых вариантах осуществления фармацевтически приемлемым носителем является носитель, в котором растворяется активный ингредиент. Также могут быть включены эмульгаторы, стабилизаторы, увлажняющие средства и антиоксиданты, а также средства, придающие цвет или аромат, при необходимости. Кроме того, в таких местных составах могут быть использованы усилители чрескожной проницаемости. Примеры таких усилителей можно найти в патентах США №№3989816 и 4444762.
Крема могут быть составлены из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, в которую подмешана смесь активного ингредиента, растворенного в небольшом количестве масла, такого как миндальное масло. Пример такого крема включает приблизительно 40 частей воды, приблизительно 20 частей пчелиного воска, приблизительно 40 частей минерального масла и приблизительно 1 часть миндального масла. Мази могут быть составлены путем смешивания раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и обеспечения остывания смеси. Пример такой мази включает приблизительно 30 вес.% миндального масла и приблизительно 70 вес.% белого мягкого парафина.
Фармацевтически приемлемый носитель относится к носителю, который является совместимым с активными ингредиентами композиции (а в некоторых вариантах осуществления, способным стабилизировать активные ингредиенты) и не вредным для субъекта, подлежащего лечению. Например, растворяющие средства, такие как циклодекстрины (которые образуют специфичные, более растворимые комплексы по меньшей мере с одним соединением и/или по меньшей мере с одной фармацевтически приемлемой солью, описанными в настоящем документе), могут быть использованы в качестве фармацевтических наполнителей для доставки активных ингредиентов. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и красители, такие как D&C Yellow №10.
Приемлемые in vitro анализы могут использоваться для предварительной оценки эффективности по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанных в настоящем документе, в ингибировании активности киназы Syk. По меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, можно дополнительно проверить на эффективность лечения воспалительного заболевания с помощью in vivo анализов. Например, соединения, описанные в настоящем документе, и/или их фармацевтически приемлемые соли можно ввести животному (например, мышиной модели), страдающему воспалительным заболеванием, и оценить их терапевтические эффекты. На основе результатов также можно определить надлежащий диапазон дозировки и путь введения для животных, таких как люди.
Также представлен способ ингибирования активности киназы Syk. Способ предусматривает контакт по меньшей мере одной киназы с количеством по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанных в настоящем документе, эффективным для ингибирования активности киназы Syk.
Для достижения благоприятного терапевтического или профилактического эффекта, например у субъектов с воспалительным заболеванием или воспалительным нарушением, можно использовать по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе. Термин "воспалительное заболевание" или "воспалительное нарушение" относится к патологическим состояниям, приводящим к воспалению, как правило, вызванным хемотаксисом нейтрофилов. Примеры таких нарушений включают воспалительные кожные заболевания, в том числе псориаз и атопический дерматит; системную склеродермию и склероз; реакции, ассоциированные с воспалительным заболеванием кишечника (IBD) (такие как болезнь Крона и язвенный колит); ишемически-реперфузионные нарушения, в том числе хирургическое реперфузионное повреждение ткани, миокардиальные ишемические состояния, такие как инфаркт миокарда, остановка сердца, реперфузия после хирургического вмешательства на сердце и сужение после чрескожной транслюминальной коронарной ангиопластики, удар и аневризма брюшной аорты; отек мозга на фоне удара; травму черепа, гиповолемический шок; асфиксию; синдром дыхательной недостаточности у взрослых; острое легочное повреждение; болезнь Бехчета; дерматомиозит; полимиозит; рассеянный склероз (MS); дерматит; менингит; энцефалит; увеит; остеоартрит; волчаночный нефрит; аутоиммунные заболевания, такие как ревматоидный артрит (RA), синдром Шегрена, васкулит; заболевания, включающие лейкоцитарный диапедез; воспалительное нарушение центральной нервной системы (CNS), синдром повреждения нескольких органов на фоне сепсиса или травмы; алкогольный гепатит; бактериальную пневмонию; заболевания, опосредованные комплексом антиген-антитело, в том числе гломерулонефрит; сепсис; саркоидоз; иммунопатологические реакции на трансплантацию ткани/органа; воспаления легких, в том числе плеврит, альвеолит, васкулит, пневмонию, хронический бронхит, бронхоэктаз, диффузный панбронхиолит, гиперчувствительный пневмонит, идиопатический легочный фиброз (IPF), кистозный фиброз и т.п. Предпочтительные показания включают без ограничения хроническое воспаление, аутоиммунный диабет, ревматоидный артрит (RA), ревматоидный спондилит, подагрический артрит и другие состояния, связанные с артритом, рассеянный склероз (MS), астму, системную красную волчанку, синдром дыхательной недостаточности у взрослых, болезнь Бехчета, псориаз, хроническое легочное воспалительное заболевание, реакцию "трансплантат против хозяина", болезнь Крона, язвенный колит, воспалительное заболевание кишечника (IBD), болезнь Альцгеймера и лихорадку, наряду с каким-либо заболеванием или нарушением, которое относится к воспалению и родственным нарушениям.
По меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, можно использовать для достижения благоприятного терапевтического или профилактического эффекта, например, у субъектов с аутоиммунным заболеванием. Термин "аутоиммунное заболевание" относится к заболеванию или нарушению, возникающему в собственных тканях или органах индивидуума и/или направленному против них, или к их косегрегации или проявлению, или обусловленному ними состоянию. Примеры аутоиммунных заболеваний включают без ограничения волчанку, миастению гравис, рассеянный склероз (MS), ревматоидный артрит (RA), псориаз, воспалительное заболевание кишечника, астму и идиопатическую тромбоцитопеническую пурпуру, а также миелоидное пролиферативное нарушение, такое как миелофиброз, PV/ET (миелофиброз на фоне истинной полицитемии или эссенциальной тромбоцитемии).
В некоторых вариантах осуществления по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, вводят в сочетании с другим терапевтическим средством. В некоторых вариантах осуществления другим терапевтическим средством является средство, которое обычно вводят пациентам с заболеванием или состоянием, которое лечат. Например, другим терапевтическим средством может быть противовоспалительное средство или противоопухолевое средство в зависимости от заболевания или состояния, которое лечат. По меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, можно вводить с другим терапевтическим средством в одной лекарственной форме или в виде отдельной лекарственной формы. При введении в виде отдельной лекарственной формы, другое терапевтическое средство можно вводить до, одновременно или после введения по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанных в настоящем документе.
В некоторых вариантах осуществления по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящем документе, вводят в сочетании с противовоспалительным средством. Неограничивающие примеры противовоспалительных средств включают кортикостероиды (например, флутиказона пропионат, беклометазона дипропионат, мометазона фуроат, триамцинолона ацетонид или будезонид), модифицирующие заболевание средства (например, противомалярийные средства, метотрексат, сульфасалазин, мезаламин, азатиоприн, 6-меркаптопурин, метронидазол, инъецируемое и пероральное золото или D-пеницилламин), нестероидные противовоспалительные лекарственные средства (например, ацетоминофен, аспирин, салицилат натрия, кромогликат натрия, салицилат магния, холинмагний салицилат, салицилсалициловую кислоту, ибупрофен, напроксен, диклофенак, дифлунисал, этодолак, фенопрофен кальция, флурипрофен, пироксикам, индометацин, кетопрофен, кеторолака трометамин, меклофенамат, меклофенамат натрия, мефенамовую кислоту, набуметон, оксапрозин, фенилбутилнитрон (PBN), сулиндак или толметин), ингибиторы COX-2, ингибиторы синтеза/высвобождения цитокина (например, антитела против цитокина, антитела против рецептора цитокина и т.п.).
ПРИМЕРЫ
Нижеприведенные примеры предназначены исключительно для иллюстрации и не должны рассматриваться как ограничивающие каким-либо образом. Были предприняты усилия для обеспечения точности в отношении применяемых чисел (например, количеств, температуры и т.п.), но должны учитываться некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются весовыми частями, температура дана в градусах Цельсия, а давление является атмосферным или близким к этому. Все данные MS проверены с помощью Agilent 6120 и/или Agilent 1100. Все реагенты, за исключением промежуточных соединений, применяемые в настоящем изобретении, являются коммерчески доступными. Все названия соединений, за исключением реагентов, образованы с помощью Chemdraw 8.0.
В следующих примерах применяются нижеприведенные аббревиатуры:
|
Промежуточное соединение 1
5,7-Дихлорпиридо[4,3-b]пиразин
(A) N-(2,6-дихлорпиридин-4-ил)нитрамид
2,6-Дихлорпиридин-4-иламин (10,0 г, 61 ммоль) медленно добавляли в концентрированную серную кислоту (64 мл) со скоростью, поддерживающей внутреннюю температуру реакции <10°C. Затем смесь охлаждали до -5°C и каплями добавляли азотную кислоту (90%, 30 мл) для поддерживания температуры реакции ниже 0°C в течение 40 минут. Реакционную смесь взбалтывали при 0°C в течение 2 часов, а затем выливали в ледяную воду (500 мл). Названное соединение выделяли путем фильтрации и сушили in vacuo для следующей стадии.
(B) 2,6-Дихлор-3-нитропиридин-4-амин
N-(2,6-Дихлорпиридин-4-ил)нитрамид из предыдущей стадии медленно добавляли в концентрированную серную кислоту (64 мл) при скорости, достаточной для поддерживания внутренней температуры реакции <40°C. Затем реакционную смесь взбалтывали при 100°C в течение 1 часа, выливали в ледяную воду (300 мл) и подщелачивали 6 M раствором NaOH (приблизительно 190 мл) для достижения pH=9,5. Осадок собирали путем фильтрации и сушили in vacuo с получением названного соединения.
(C) 2,6-Дихлорпиридин-3,4-диамин
К раствору 2,6-дихлор-3-нитропиридин-4-амина в этаноле (150 мл) добавляли порошок железа (14,3 г, 0,255 моль), воду (46 мл), а затем концентрированную HCl (28 мл). Затем реакционную смесь взбалтывали при 95°C в течение 16 часов, охлаждали до комнатной температуры и нейтрализовали. Осадок собирали путем фильтрации и сушили in vacuo. Затем неочищенный продукт обрабатывали водой (200 мл) и экстрагировали с помощью EtOAc (3×200 мл). Объединенные экстракты сушили над безводным Na2SO4, фильтровали и концентрировали с получением 7,85 г названного соединения (86,5% выход).
(D) 5,7-Дихлорпиридо[4,3-b]пиразин
Смесь раствора 2,6-дихлорпиридин-3,4-диамина (7,85 г, 0,044 моль) в этаноле и 40% раствора глиоксаля в воде (26 г, 0,178 моль) нагревали с обратным холодильником в течение ночи. Затем ее охлаждали до температуры окружающей среды, собирали осадок, промывали EtOH и сушили in vacuo с получением названного соединения (7,32 г, 83% выход).
Промежуточное соединение 2
N,N′-Диметил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метанамин
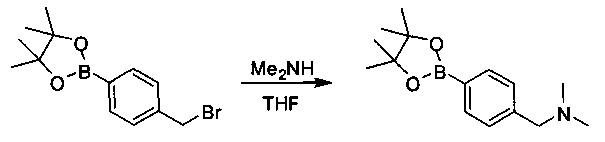
Смесь 2-(4-(бромметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (200 мг, 0,673 ммоль) и водного Me2NH (4 мл) в THF (10 мл) взбалтывали при комнатной температуре в течение ночи. Затем ее концентрировали при пониженном давлении с получением названного соединения. MS (масса/заряд): 262 (M+H)+.
Промежуточное соединение 3
Морфолино(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метанон
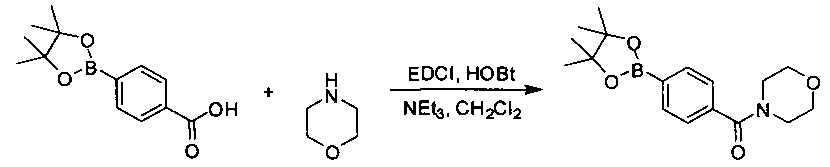
К раствору 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты (200 мг, 0,806 ммоль) в CH2Cl2 (10 мл) последовательно добавляли EDCI (232 мг, 1,21 ммоль), HOBt (163 мг, 1,21 ммоль), морфолин (0,11 мл, 1,21 ммоль) и Et3N (0,22 мл, 1,61 ммоль). Смесь взбалтывали при комнатной температуре в течение ночи, обрабатывали EtOAc/H2O и экстрагировали с помощью EtOAc. Объединенные экстракты промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией с получением названного соединения (207 мг, 81% выход). MS (масса/заряд): 318 (M+H)+.
Промежуточное соединение 4
N-этил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензамид
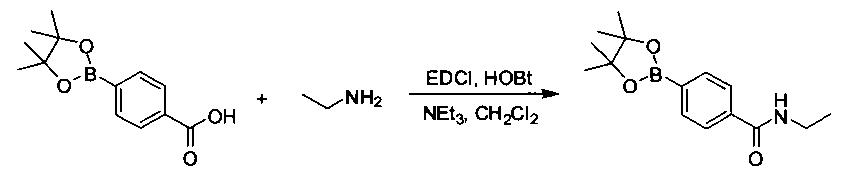
Названное соединение получали согласно процедурам для промежуточного соединения 3 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты и этиламина. MS (масса/заряд): 276 (M+H)+.
Промежуточное соединение 5
2-(4-(2-Метоксиэтокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
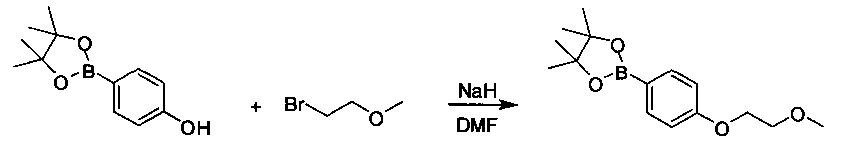
К раствору 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенола (150 мг, 0,682 ммоль) в DMF (5 мл) добавляли 60% NaH (136 мг, 3,41 ммоль) и 2-бромэтилметиловый эфир (0,13 мл, 1,363 ммоль). Полученный раствор взбалтывали при 50°C в течение ночи, охлаждали до температуры окружающей среды, гасили водой и экстрагировали с помощью EtOAc. Объединенные экстракты промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией с получением названного соединения (114 мг, 60% выход).
Промежуточное соединение 6
N,N′-Диметил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)этанамин
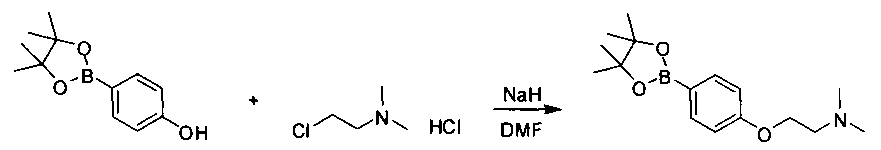
К раствору 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенола (258 мг, 0,509 ммоль) в DMF (10 мл) добавляли 60% NaH (204 мг, 5,09 ммоль) и 2-хлор-N,N-диметилэтиламин (220 мг, 1,527 ммоль). Полученный раствор взбалтывали при 60°C в течение ночи, охлаждали до температуры окружающей среды, гасили водным NH4Cl и экстрагировали с помощью EtOAc. Объединенные экстракты промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией с получением названного соединения (100 мг, 29% выход).
Промежуточное соединение 7
Трет-бутил-пиперидин-4-илметилкарбамат
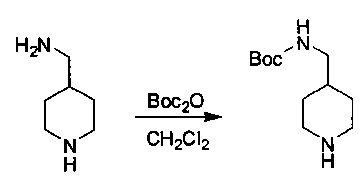
Раствор 4-аминометилпиперидина (242 мг, 2,12 ммоль) и ди-трет-бутил-дикарбоната (Boc2O) (463 мг, 2,12 ммоль) в CH2Cl2 (5 мл) взбалтывали при комнатной температуре в течение ночи. Затем раствор разбавляли CH2Cl2, промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением названного соединения.
Промежуточное соединение 8
N-Метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин
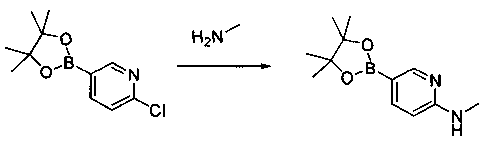
Смесь 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (200 мг, 0,84 ммоль), метанамина (277 мг, 8,4 ммоль) и DIPEA (0,35 мл, 2,01 ммоль) в диоксане (5 мл) взбалтывали при комнатной температуре в течение 16 часов. Затем ее концентрировали при пониженном давлении и остаток обрабатывали в EtOAc. Нерастворимое твердое вещество удаляли путем фильтрации и органический раствор концентрировали при пониженном давлении с получением названного соединения.
Промежуточное соединение 9
N,N-Диметил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин
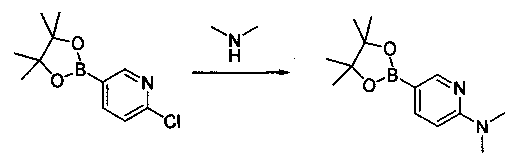
Названное соединение получали согласно процедурам для промежуточного соединения 8, за исключением использования 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина и диметиламина.
Промежуточное соединение 10
N,N-Диэтил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоламин
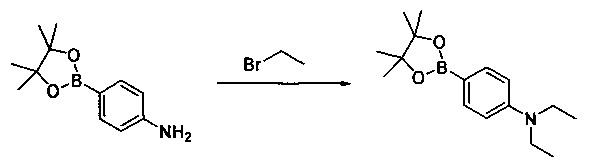
Смесь 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоламина (100 мг, 0,45 ммоль) и бромэтана (200 мг, 1,8 ммоль), NaH (100 мг, 1,8 ммоль) в THF взбалтывали при комнатной температуре в течение ночи и концентрировали in vacuo с получением неочищенного названного соединения, применяемого для следующей стадии. MS (масса/заряд): 276 (M+H)+.
Промежуточное соединение 11
1-(2-Метоксиэтил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол
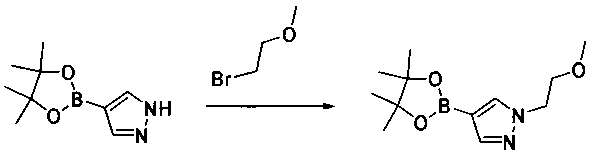
Смесь 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (200 мг, 1,03 ммоль), 1-бром-2-метоксиэтана (280 мг, 2,01 ммоль) и NaH (200 мг, 4 ммоль) в THF (15 мл) взбалтывали при нагревании с обратным холодильником в течение 24 часов, охлаждали до температуры окружающей среды и концентрировали in vacuo. Остаток обрабатывали HCl (водн.) и экстрагировали с помощью EtOAc. Нерастворимое твердое вещество удаляли путем фильтрации и органический раствор концентрировали с получением названного соединения. MS (масса/заряд): 253 (M+H)+.
Промежуточное соединение 12
6-(Диметиламино)пиридин-3-илбороновая кислота
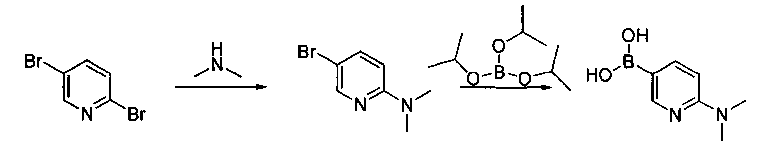
(A) 5-Бром-N,N-диметилпиридин-2-амин
Раствор 2,5-дибромпиридина (10 г, 42,3 ммоль) в водном диметиламине (50 мл) нагревали с обратным холодильником в течение ночи. Летучие компоненты удаляли in vacuo и остаток обрабатывали EtOAc/PE. Осадок собирали путем фильтрации и сушили с получением названного соединения. MS (масса/заряд): 201 (M+H)+, 203 (M+H)+.
(B) 6-(Диметиламино)пиридин-3-илбороновая кислота
Раствор 5-бром-N,N-диметилпиридин-2-амина (500 мг, 2,5 ммоль) в THF (10 мл) обрабатывали n-BuLi (1,2 мл, 3 ммоль) при -72°C в течение 2 часов. Затем каплями добавляли триизопропилборат (705 мг, 3,75 ммоль). После завершения добавления смесь взбалтывали при -72°C еще 1 час, медленно нагревали и взбалтывали при температуре окружающей среды в течение ночи. Осторожно добавляли MeOH и удаляли летучие компоненты при пониженном давлении с получением названного соединения. MS (масса/заряд): 167 (M+H)+.
Промежуточное соединение 13
6-(Пирролидин-1-ил)пиридин-3-илбороновая кислота
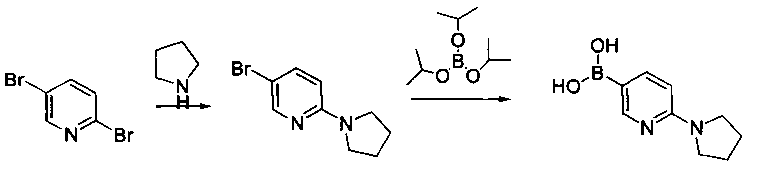
Названное соединение получали согласно процедурам для промежуточного соединения 12 с использованием соответствующих реагентов при надлежащих условиях, которые будут понятны специалисту данной области. MS (масса/заряд): 193 (M+H)+.
Промежуточное соединение 14
4-(3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)морфолин
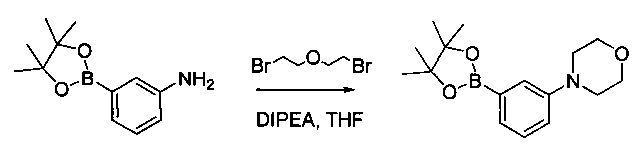
Раствор 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоламина (164 мг, 0,75 ммоль), 1-бром-2-(2-бромэтокси)этана (418 мг, 1,8 ммоль) и DIPEA (0,64 мл, 3,6 ммоль) в THF (2 мл) взбалтывали при нагревании с обратным холодильником в течение ночи. Смесь концентрировали, разбавляли водой и экстрагировали с помощью EtOAc. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали препаративной тонкослойной хроматографией с получением названного соединения. MS (масса/заряд): 290 (M+H)+.
Промежуточное соединение 15
N-Метил-2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)ацетамид
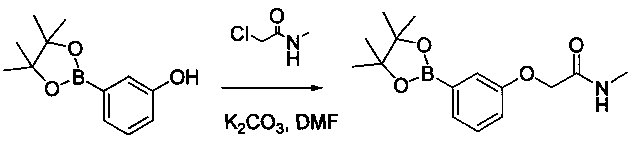
Смесь 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенола (220 мг, 1,0 ммоль), 2-хлор-N-метилацетамида (129 мг, 1,2 ммоль) и K2CO3 (207 мг, 1,5 ммоль) в DMF (1,5 мл) взбалтывали при 80°C в течение ночи. Смесь выливали в воду и экстрагировали с помощью EtOAc. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией с получением названного соединения с выходом 72%. MS (масса/заряд): 292 (M+H)+.
Промежуточное соединение 16
N-Метил-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)ацетамид
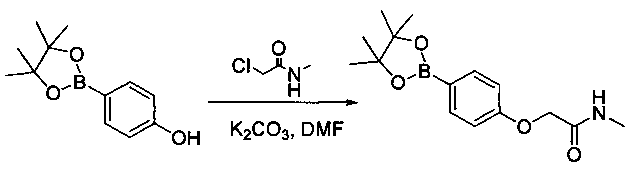
Названное соединение получали согласно процедурам для промежуточного соединения 15 с использованием соответствующих реагентов при надлежащих условиях, которые будут понятны специалисту данной области. MS (масса/заряд): 292 (M+H)+.
Промежуточное соединение 17
3-Метокси-4-(2-морфолиноэтокси)фенилбороновая кислота
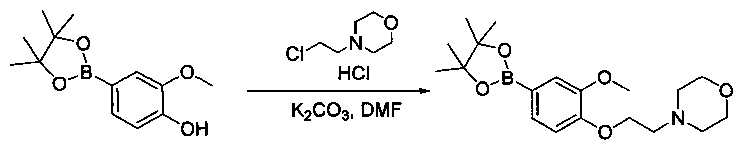
Названное соединение получали согласно процедурам для промежуточного соединения 15 с использованием соответствующих реагентов при надлежащих условиях, которые будут понятны специалисту данной области. MS (масса/заряд): 364 (M+H)+.
Промежуточное соединение 18
Трет-бутил-метил(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)карбамат
Под N2 к раствору трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (500 мг, 1,57 ммоль) в безводном THF (4 мл) медленно добавляли гидрид натрия (94 мг, 2,35 ммоль) при 0°C. Смесь взбалтывали при комнатной температуре в течение 20 минут, затем охлаждали до 0°C. Медленно добавляли CH3I (445 мг, 3,13 ммоль). После завершения добавления реакционную смесь взбалтывали при комнатной температуре в течение ночи, гасили H2O и экстрагировали с помощью EtOAc. Объединенные экстракты концентрировали и остаток очищали флэш-хроматографией с получением названного соединения. MS (масса/заряд): 278 (M-56)+.
Промежуточное соединение 19
1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пирролидин-2-он
Под N2 к раствору 1-(4-бромфенил)пирролидин-2-она (300 мг, 1,25 ммоль) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (381 мг, 1,50 ммоль) в диоксане/H2O (10:1,5 мл) добавляли комплекс Pd(dppf)Cl2·CH2Cl2 (102 мг, 0,125 ммоль) и карбонат цезия (489 мг, 1,5 ммоль). Реакционную смесь взбалтывали при нагревании с обратным холодильником в течение 24 часов. Затем ее концентрировали и остаток очищали хроматографией с получением названного соединения с 86% выходом. MS (масса/заряд): 288 (M+H)+.
Промежуточное соединение 20
Трет-бутил-2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил(метил)карбамат
Названное соединение получали согласно процедурам для промежуточного соединения 18 с использованием трет-бутил-2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата. MS (масса/заряд): 296 (M-56)+.
Промежуточное соединение 21
2-Фтор-N,N-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
Смесь 2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (474 мг, 2 ммоль), K2CO3 (828 мг, 6 ммоль) и MeI (710 мг, 5 ммоль) в DMF (10 мл) взбалтывали при 100°C в течение ночи. Затем ее охлаждали и экстрагировали с помощью EA/H2O, органический слой объединяли, промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали с получением неочищенного соединения с 93% выходом. MS (масса/заряд):266 (M+H)+.
Промежуточное соединение 22
2-(4-(Дифторметокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
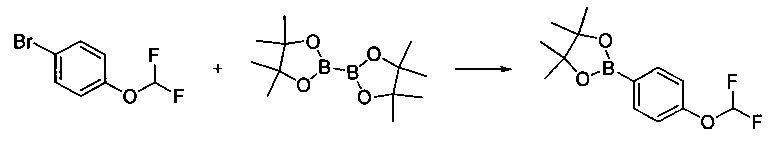
Смесь 1-бром-4-(дифторметокси)бензола (230 мг, 1,05 ммоль), 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолана) (402 мг, 1,58 ммоль), PdCl2 (dppf) (20 мг) и Cs2CO3 (682 мг, 2,1 ммоль) в диоксане закрывали в реакционной пробирке для микроволнового реактора и осуществляли реакцию при 180°C в течение 2 часов в микроволновом реакторе. Затем ее очищали колоночной флэш-хроматографией (PE/EA) с получением неочищенного соединения.
Промежуточное соединение 23
5,7-Дихлор-2-метилпиридо[4,3-b]пиразин
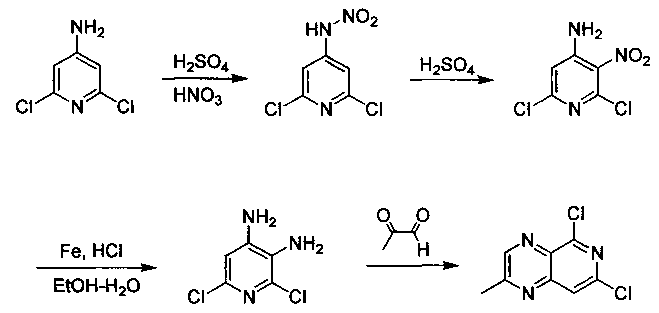
(A) 2,6-Дихлорпиридин-3,4-диамин
Названное соединение получали согласно процедурам для промежуточного соединения 1.
(B) 5,7-Дихлор-2-метилпиридо[4,3-b]пиразин
Названное соединение получали согласно процедуре в ссылке (HETEROCYCLES, Vol. 60, No. 4, 2003, pp. 925-932) с использованием соответствующих реагентов при надлежащих условиях, которые будут понятны специалисту данной области. MS (масса/заряд): 214 (M+H)+, 216 (M+H)+.
Промежуточное соединение 24
Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилат
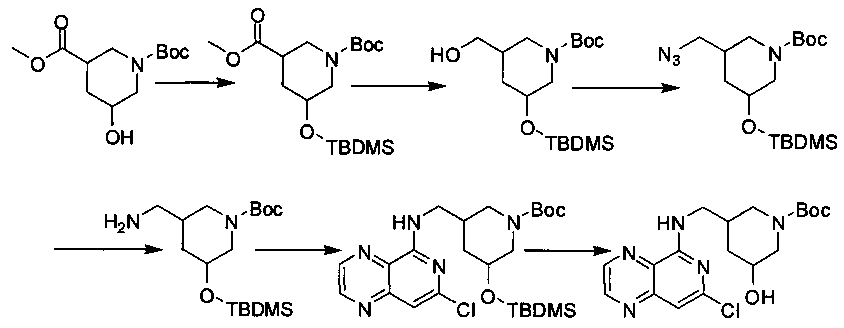
(A) 1-Трет-бутил-3-метил-5-(трет-бутилдиметилсилилокси)пиперидин-1,3-дикарбоксилат
К раствору 1-трет-бутил-3-метил-5-гидроксипиперидин-1,3-дикарбоксилата (4,00 г, 15,4 ммоль) в дихлорметане (40 мл) последовательно добавляли имидазол (1,26 г, 18,5 ммоль), DMAP (0,38 г, 3,1 ммоль) и TBDMS-Cl (2,79 г, 18,5 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение 40 часов. Смесь последовательно промывали раствором HCl (1 н), насыщенным бикарбонатом натрия и солевым раствором и сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением названного соединения. MS (масса/заряд): 274 (M-Boc+H)+.
(B) Трет-бутил-3-(трет-бутилдиметилсилилокси)-5-(гидроксиметил)пиперидин-1-карбоксилат
Раствор 1-трет-бутил-3-метил-5-(трет-бутилдиметилсилилокси)пиперидин-1,3-дикарбоксилата из стадии A в THF (100 мл) обрабатывали LiBH4 (0,84 г, 38,5 ммоль) при 0°C, взбалтывая в течение 2 часов, нагревали до комнатной температуры, а затем обрабатывали лимонной кислотой (1 М) до pH=4. Летучие компоненты удаляли in vacuo и остаток растворяли в этилацетате, промывали водой и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением названного соединения. MS (масса/заряд): 246 (M-Boc+H)+.
(C) Трет-бутил-3-(азидометил)-5-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилат
К раствору трет-бутил-3-(трет-бутилдиметилсилилокси)-5-(гидроксиметил)пиперидин-1-карбоксилата из стадии B в дихлорметане (50 мл) добавляли триэтиламин (4,67 г, 46,2 ммоль) и метансульфонилхлорид (2,65 г, 23,1 ммоль) при 0°C. Реакционную смесь взбалтывали при комнатной температуре в течение 1,5 часа, затем разбавляли диэтиловым эфиром, промывали насыщенным раствором бикарбоната натрия и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный остаток растворяли в NMP. Добавляли азид натрия (3,00 г, 46,2 ммоль) и полученную суспензию взбалтывали при 80°C в течение ночи. Реакционную смесь разбавляли EtOAc/гексаном, промывали солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением названного соединения. MS (масса/заряд): 271 (M-Boc+H)+.
(D) Трет-бутил-3-(аминометил)-5-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилат
Раствор трет-бутил-3-(трет-бутилдиметилсилилокси)-5-((метилсульфонилокси)метил)пиперидин-1-карбоксилата из стадии С в EtOAc гидрогенизировали в атмосфере водорода с 10% Pd/C (500 мг) в течение ночи. Катализатор удаляли путем фильтрации, а фильтрат концентрировали при пониженном давлении с получением названного соединения. MS (масса/заряд): 345 (M+H)+.
(E) Трет-бутил-3-(трет-бутилдиметилсилилокси)-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Раствор трет-бутил-3-(аминометил)-5-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилата (4,74 г, 13,7 ммоль), 5,7-дихлорпиридо[4,3-b]пиразина (2,75 г, 13,7 ммоль) и DIPEA (2,12 г, 16,4 ммоль) в THF (20 мл) взбалтывали при комнатной температуре в течение 48 часов. Летучие компоненты удаляли при пониженном давлении и остаток обрабатывали этилацетатом, промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением названного соединения.
(F) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилат
Раствор трет-бутил-3-(трет-бутилдиметилсилилокси)-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилата из стадии E в THF (16 мл) обрабатывали TBAF (5,17 г, 16,4 ммоль) при комнатной температуре в течение 2 часов, затем разбавляли этилацетатом, промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 394 (M+H)+.
Промежуточное соединение 25
Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-фторпиперидин-1-карбоксилат
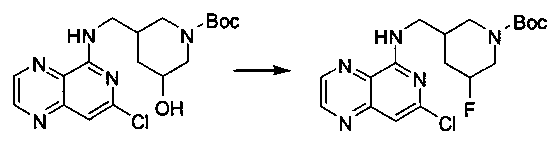
К раствору трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилата (1,97 г, 5,0 ммоль) в дихлорметане добавляли DAST (4,03 г, 25 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение 2 часов, затем разбавляли этилацетатом, промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 396 (M+H)+.
Промежуточное соединение 26
Трет-бутил-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-3,3-дифторпиперидин-1-карбоксилат
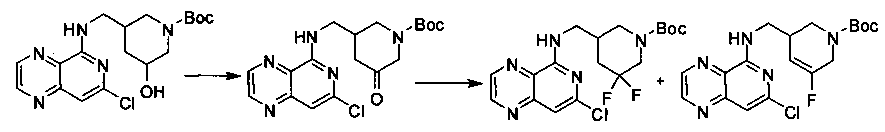
(A) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-оксопиперидин-1-карбоксилат
К раствору трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилата (1,97 г, 5,0 ммоль) в дихлорметане добавляли периодинан Десса-Мартина (2,54 г, 6,0 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при комнатной температуре в течение ночи, затем разбавляли этилацетатом, промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo с получением названного соединения.
(B) Трет-бутил-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-3,3-дифторпиперидин-1-карбоксилат
К раствору трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-оксопиперидин-1-карбоксилата из стадии A в дихлорметане добавляли DAST (8,06 г, 50 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение 2 часов, затем разбавляли этилацетатом, промывали солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный остаток очищали хроматографией с получением названного соединения (866 мг), MS (масса/заряд): 414 (M+H)+.
Промежуточное соединение 27
Трет-бутил-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-3-фтор-5,6-дигидропиридин-1(2H)-карбоксилат
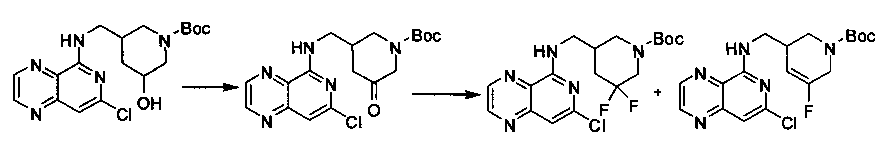
Названное соединение получали хроматографической очисткой неочищенного остатка из реакции промежуточного соединения 26 (B) (214 мг), MS (масса/заряд): 394 (M+H)+.
Промежуточное соединение 28
(R)-1-(Пирролидин-3-ил)мочевина
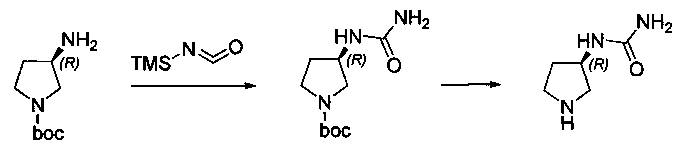
(A) (R)-Трет-бутил-3-уреидопирролидин-1-карбоксилат
К раствору (R)-трет-бутил-3-аминопирролидин-1-карбоксилата (180 мг, 1 ммоль) в дихлорметане добавляли TMS-NCO (1 г, 8,7 ммоль) и DIPEA (1,2 г, 10 ммоль). Смесь взбалтывали при комнатной температуре в течение ночи, затем концентрировали in vacuo. Остаток обрабатывали EtOAc/H2O, органический слой объединяли, промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного названного соединения.
(B) (R)-1-(Пирролидин-3-ил)мочевина
(R)-Трет-бутил-3-уреидопирролидин-1-карбоксилат из стадии A обрабатывали раствором HCl (в EtOAc, 30 мл) в течение 2 часов. Смесь концентрировали in vacuo с получением неочищенного названного соединения. MS (масса/заряд): 130 (M+H)+.
Промежуточное соединение 29
Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилат
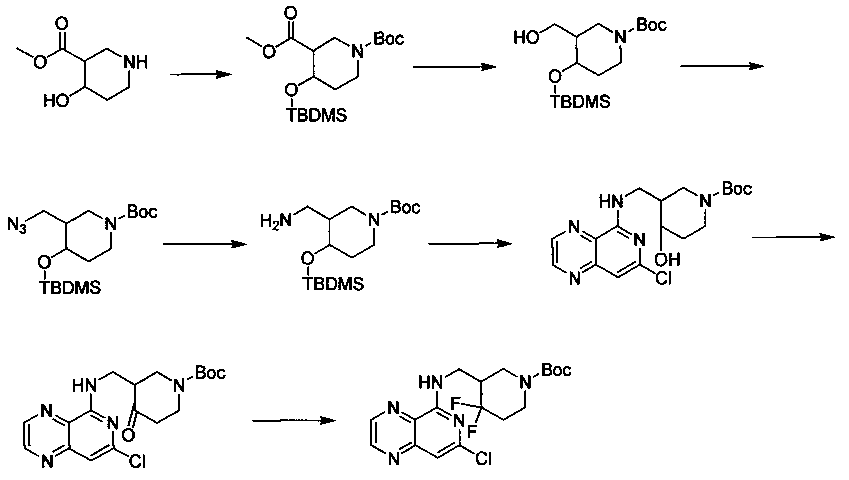
(A) 1-Трет-бутил-3-метил-4-(трет-бутилдиметилсилилокси)пиперидин-1,3-дикарбоксилат
Смесь метил-4-гидроксипиперидин-3-карбоксилата (3,18 г, 20 ммоль), водного гидрокарбоната натрия (30 мл, 1 М), ди-трет-бутилдикарбоната (4,37 г, 20 ммоль) и дихлорметана (30 мл) взбалтывали в течение 15 часов. Фазы разделяли, дихлорметановую фазу сушили над безводным сульфатом натрия и фильтровали. Фильтрат разбавляли до 200 мл. К полученному раствору последовательно добавляли имидазол (1,64 г, 24 ммоль), DMAP (0,488 г, 4 ммоль) и TBDMSCl (3,62 г, 24 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение 40 часов. Смесь последовательно промывали 1 н. раствором HCl, раствором NaHCO3 и солевым раствором и сушили над безводным сульфатом натрия. Фильтрацией и концентрированием получали неочищенное соединение, которое применяли непосредственно в следующей стадии. MS (масса/заряд): 274 (M-Boc+H)+.
(B) Трет-бутил-4-(трет-бутилдиметилсилилокси)-3-(гидроксиметил)пиперидин-1-карбоксилат
Раствор 1-трет-бутил-3-метил-4-(трет-бутилдиметилсилилокси)пиперидин-1,3-дикарбоксилата из стадии A в THF (100 мл) охлаждали при 0°C, а затем добавляли LiBH4 (1,10 г, 50 ммоль). После взбалтывания в течение 2 часов раствор нагревали до комнатной температуры, величину pH регулировали до 4 с помощью 1 M лимонной кислоты. После удаления летучих компонентов in vacuo продукт экстрагировали в этилацетате, промывали водой и солевым раствором, сушили над безводным сульфатом натрия. После фильтрации и удаления летучих компонентов in vacuo получали трет-бутил-4-(трет-бутилдиметилсилилокси)-3-(гидроксиметил)пиперидин-1-карбоксилат (8,82 г, 100% выход), который применяли непосредственно в следующей стадии. MS (масса/заряд): 246 (M-Boc+H)+.
(C) Трет-бутил-3-(азидометил)-4-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилат
К раствору трет-бутил-4-(трет-бушпдиметилсилилокси)-3-(гидроксиметил)пиперидин-1-карбоксилата из стадии B в дихлорметане (50 мл) добавляли триэтиламин (6,06 г, 60 ммоль) и метансульфонилхлорид (3,43 г, 30 ммоль) при 0°C. Реакционной смеси взбалтывали при комнатной температуре в течение 1,5 часа. Неочищенную смесь разбавляли диэтиловым эфиром, промывали насыщ. водн. бикарбонатом натрия, солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный остаток растворяли в NMP (30 мл). Добавляли азид натрия (3,90 г, 60 ммоль) и полученную суспензию взбалтывали при 80°C в течение ночи. Реакционную смесь разбавляли EtOAc и гексанами, промывали водой, солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного соединения. MS (масса/заряд): 271 (M-Boc+H)+.
(D) Трет-бутил-3-(аминометил)-4-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилат
Раствор трет-бутил-3-(азидометил)-4-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилата в этилацетате из стадии C гидрогенизировали в атмосфере водорода с 10% Pd/C (500 мг) в течение ночи. Катализатор отфильтровывали, а фильтрат концентрировали при пониженном давлении с получением названного соединения (6,2 г, 90% выход). MS (масса/заряд): 345 (M+H)+.
(E) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4-гидроксипиперидин-1-карбоксилат
5,7-Дихлорпиридо[4,3-b]пиразин (3,6 г, 18 ммоль) и DIPEA (2,8 г, 21,6 ммоль) добавляли к раствору трет-бутил-трет-бутил-3-(аминометил)-4-(трет-бутилдиметилсилилокси)пиперидин-1-карбоксилата (6,2 г, 18 ммоль) в THF (20 мл) и смесь нагревали с обратным холодильником в течение ночи. Летучие компоненты выпаривали и остаток экстрагировали с помощью этилацетата. Этилацетат промывали солевым раствором и сушили. Растворитель удаляли, остаток повторно растворяли в THF (16 мл) и добавляли TBAF. Реакционную смесь взбалтывали при комнатной температуре в течение 2 часов. Смесь разбавляли этилацетатом, промывали солевым раствором, затем сушили, фильтровали и концентрировали in vacuo. Неочищенный остаток очищали флэш-хроматографией с получением названного соединения (3,35 г, 47% выход). MS (масса/заряд): 394 (M+H)+.
(F) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4-оксопиперидин-1-карбоксилат
К раствору трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилата (3,35 г, 8,5 ммоль) в дихлорметане (50 мл) добавляли периодинан Десса-Мартина (4,33 г, 10,2 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при этой температуре в течение ночи. Смесь разбавляли этилацетатом, промывали солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Остаток применяли непосредственно в следующей стадии. MS (масса/заряд): 392 (M+H)+.
(G) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилат
К раствору трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4-оксопиперидин-1-карбоксилата из стадии F в дихлорметане (30 мл) добавляли DAST (13,7 г, 85 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение 2 часов. Смесь разбавляли этилацетатом, промывали солевым раствором, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный остаток очищали флэш-хроматографией (этилацетат/петролейный эфир) с получением названного соединения (497 мг, 14% выход). MS (масса/заряд): 414 (M+H)+.
Промежуточные соединения 30 и 31
(S)-Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилат и (R)-трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилат
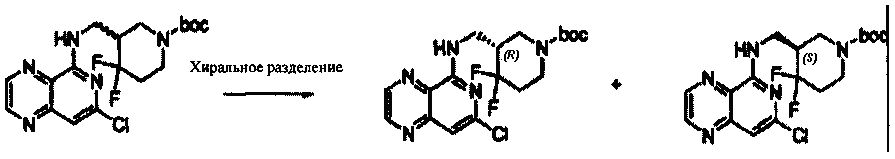
Рацемическое промежуточное соединение 29 разделяли хиральной HPLC с получением оптически чистых энантиомеров промежуточных соединений 30 и 31 (условия HPLC: колонка : CHIRALCEL AD-H 0,46×15 см; подвижная фаза: CO2/MeOH=85/15; объемная скорость потока = 2 мл/мин; детектор: UV 254 нм). Первый элюент (промежуточное соединение 30, Rf=6,79 мин) составлял 98% ее, MS (масса/заряд): 414 (M+H)+, а второй элюент (промежуточное соединение 31, Rf=7,06 мин) составлял 98,7% ее, MS (масса/заряд): 414 (M+H)+.
Промежуточное соединение 32
2-(Тетрагидро-2H-пиран-4-илокси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин
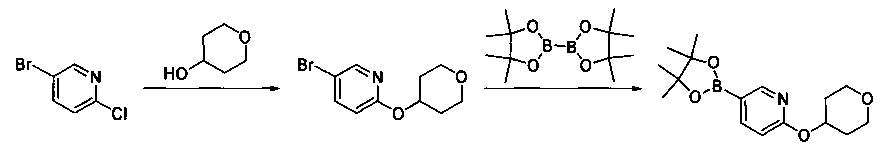
(A) 5-Бром-2-(тетрагидро-2H-пиран-4-илокси)пиридин
Тетрагидро-2H-пиран-4-ол (850 мг, 8,32 ммоль) растворяли в DMF (10 мл), охлаждали до 0°C, добавляли NaH (500 мг, 10,4 ммоль) и взбалтывали в течение 45 минут при комнатной температуре, затем добавляли 5-бром-2-хлорпиридин (2 г, 10,4 ммоль) и смесь взбалтывали в течение ночи при 60°C. Смесь выливали в воду, экстрагировали с помощью EA, органический слой промывали солевым раствором, сушили над Na2SO4, концентрировали и очищали флэш-хроматографией, получали 1,7 г белого твердого вещества. MS (масса/заряд): 258 (M-H)+, 260 (M+H)+.
(B) 2-(Тетрагидро-2H-пиран-4-илокси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин
5-Бром-2-(тетрагидро-2H-пиран-4-илокси)пиридин (500 мг, 1,93 ммоль) и 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (600 мг, 2,32 ммоль) растворяли в диоксане (100 мл), добавляли Cs2CO3 (941 мг, 2,90 ммоль) и dppf(PdCl2) (10 мг), затем смесь заполняли N2, взбалтывали при 80°C в течение ночи. Растворитель удаляли in vacuo и остаток применяли непосредственно в следующей стадии. MS (масса/заряд): 306 (M+H)+.
Промежуточное соединение 33
6-((Тетрагидро-2H-пиран-4-ил)метокси)пиридин-3-илбороновая кислота
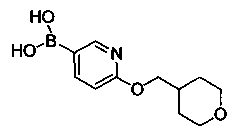
Названное соединение получали согласно процедурам для промежуточного соединения 32 с использованием 5-бром-2-хлорпиридина.
MS (масса/заряд): 238 (M+H)+.
Промежуточное соединение 34
4-(2-(5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-илокси)этил)морфолин
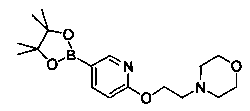
Названное соединение получали согласно процедурам для промежуточного соединения 32 с использованием 5-бром-2-хлорпиридина.
Промежуточное соединение 35
6-(3-Гидроксипирролидин-1-ил)пиридин-3-илбороновая кислота
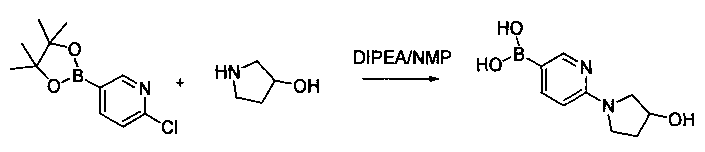
6-(3-Гидроксипирролидин-1-ил)пиридин-3-илбороновая кислота
К раствору 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (239 мг, 1 ммоль) в NMP (2 мл) добавляли пирролидин-3-ол (174 мг, 2 ммоль) и DIPEA (500 мкл, 3 ммоль), затем смесь закрывали в пробирке для микроволнового реактора и нагревали в микроволновом реакторе при 180°C в течение 1,5 часа. TLC и LC-M показывали завершение реакции, и выявляли желаемое соединение. Реакционную смесь выливали в 30 мл H2O и экстрагировали с помощью n-BuOH, промывали водой и солевым раствором, концентрировали и очищали на TLC (CH2Cl2:MeOH = 10:1) с получением белого твердого вещества. MS (масса/заряд): 209 (M+H)+.
Промежуточное соединение 36
2-Метил-5-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)-октагидропирроло[3,4-c]пиррол
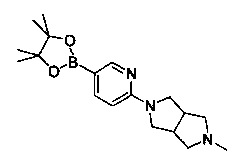
Названное соединение получали согласно процедурам для промежуточного соединения 35 с использованием 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. MS (масса/заряд): 248 (M+H)+.
Промежуточное соединение 37
6-((2S,6R)-2,6-Диметилморфолино)пиридин-3-илбороновая кислота
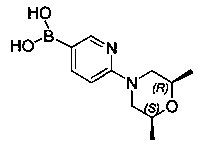
Названное соединение получали согласно процедурам для промежуточного соединения 35 с использованием 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. MS (масса/заряд): 237 (M+H)+.
Промежуточное соединение 38
N-Метил-N-(тетрагидро-2H-пиран-4-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин
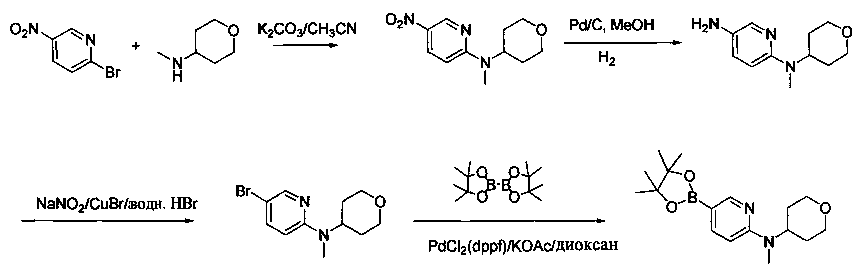
(A) N-Метил-5-нитро-N-(тетрагидро-2H-пиран-4-ил)пиридин-2-амин
К раствору N-метилтетрагидро-2H-пиран-4-амина (172,5 мг, 1,5 ммоль) в CH3CN (5 мл) добавляли K2CO3 (207 мг, 1,5 ммоль) и 2-бром-5-нитропиридин (203 мг, 1 ммоль). Реакционную смесь взбалтывали при 80°C в течение 16 часов. TLC и LC-M показывали завершение реакции, и реакционную смесь выливали в воду, экстрагировали с помощью EA, промывали водой и солевым раствором, сушили и концентрировали с получением желтого твердого вещества. MS (масса/заряд): 238 (M+H)+.
(B) N-Метил-N2-(тетрагидро-2H-пиран-4-ил)пиридин-2,5-диамин
К раствору N-метил-5-нитро-N-(тетрагидро-2H-пиран-4-ил)пиридин-2-амина (217 мг, 0,92 ммоль) в MeOH (30 мл) добавляли Pd/C (0,5 г). Смесь взбалтывали в течение 3 часов при 20°C под 1 атм H2. Реакционную смесь фильтровали и концентрировали с получением темно-красного масла. MS (масса/заряд): 208 (M+H)+.
(C) 5-Бром-N-метил-N-(тетрагидро-2H-пиран-4-ил)пиридин-2-амин
К раствору N2-метил-N2-(тетрагидро-2H-пиран-4-ил)пиридин-2,5-диамина (150 мг, 0,73 ммоль) в 2 мл водн. HBr добавляли раствор NaNO2 (55 мг, 0,80 ммоль) в 1 мл H2O при 0°C. Затем смесь взбалтывали при 0°C в течение 40 минут. После этого смесь выливали в раствор CuBr (220 мг, 1,53 ммоль) в 2 мл водн. HBr при 0°C, реакционную смесь нагревали до 60°C и взбалтывали в течение 2 часов. После охлаждения смесь подщелачивали 2 М NaOH до pH=8~9 и экстрагировали с помощью EA, промывали H2O и солевым раствором, сушили и концентрировали, очищали на TLC (EA:PE = 1:1) с получением белого твердого вещества. MS (масса/заряд): 273 (M+H)+.
(D) N-Метил-N-(тетрагидро-2H-пиран-4-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин
К раствору 5-бром-N-метил-N-(тетрагидро-2H-пиран-4-ил)пиридин-2-амина (125 мг, 0,46 ммоль) в диоксане (5 мл) добавляли KOAc (135 мг, 1,38 ммоль), PdCl2(dppf) (50,5 мг, 0,069 ммоль) и 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (234 мг, 0,92 ммоль). Смесь взбалтывали при 80°C в течение ночи. Реакционную смесь фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали на TLC (EA:PE = 1:1) с получением белого твердого вещества. MS (масса/заряд): 319 (M+H)+.
Промежуточное соединение 39
2-Метил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропан-2-ол
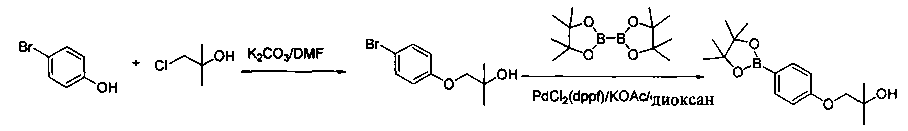
(A) 1-(4-Бромфенокси)-2-метил пропан-2-ол
К раствору 1-хлор-2-метилпропан-2-ола (434,4 мг, 4 ммоль) в DMF (10 мл) добавляли K2CO3 (552 мг, 4 ммоль) и 4-бромфенол (346 мг, 2 ммоль), реакционную смесь взбалтывали при 140°C в течение 48 часов. Оставалось приблизительно 10% 4-бромфенола, и реакционную смесь выливали в 30 мл воды, экстрагировали с помощью EA (20 мл × 3), промывали 30 мл воды и солевого раствора, концентрировали и очищали на TLC (EA:PE = 1:3) с получением желтого твердого вещества. MS (масса/заряд): 196 (M-50)+.
(B) 2-Метил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пропан-2-ол
К раствору 1-(4-бромфенокси)-2-метилпропан-2-ола (437 мг, 1,78 ммоль) в диоксане (15 мл) добавляли KOAc (526 мг, 5,35 ммоль), PdCl2(dppf) (196 мг, 0,27 ммоль) и 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (906 мг, 3,57 ммоль). Смесь взбалтывали при 100°C в течение ночи. Реакционную смесь фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали на TLC (EA:PE = 1:4) с получением белого твердого вещества. MS (масса/заряд): 292 (M)+.
Промежуточное соединение 40
N-Метил-N-(1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-ил)ацетамид
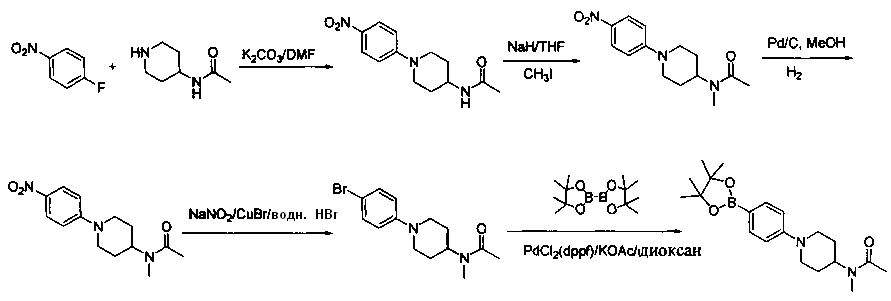
(A) N-(1-(4-Нитрофенил)пиперидин-4-ил)ацетамид
К раствору N-(пиперидин-4-ил)ацетамида (341 мг, 2,4 ммоль) в DMF (15 мл) добавляли K2CO3 (331 мг, 2,4 ммоль) и 1-фтор-4-нитробензол (282 мг, 2 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при 80°C в течение 24 часов. После этого реакционную смесь выливали в 50 мл воды и экстрагировали с помощью EA (3×25 мл), промывали H2O (25 мл) и солевым раствором (25 мл), сушили над Na2SO4 и концентрировали с получением желтого твердого вещества. MS (масса/заряд): 264 (M+H)+.
(B) N-Метил-N-(1-(4-нитрофенил)пиперидин-4-ил)ацетамид
К раствору N-(1-(4-нитрофенил)пиперидин-4-ил)ацетамида (568 мг, 2 ммоль) в THF (15 мл) добавляли NaH (60%, 200 мг, 5 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при 20°C в течение 15 минут. После этого в реакционную смесь каплями добавляли йодметан (300 мг, 4 ммоль) и взбалтывали при 60°C в течение 18 часов. Реакционную смесь обрабатывали насыщ. раствором NH4Cl и экстрагировали с помощью n-BuOH, промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением желтого твердого вещества. MS (масса/заряд): 278 (M+H)+.
(C) N-(1-(4-Аминофенил)пиперидин-4-ил)-N-метилацетамид
К раствору N-метил-N-(1-(4-нитрофенил)пиперидин-4-ил)ацетамида (2 ммоль) в MeOH (30 мл) добавляли Pd/C (0,5 г), затем смесь взбалтывали в течение 4 часов при 20°C под 1 атм. H2. Реакционную смесь фильтровали и концентрировали с получением серо-желтого масла. MS (масса/заряд): 248 (M+H)+.
(D) N-(1-(4-Бромфенил)пиперидин-4-ил)-N-метилацетамид
К раствору N-(1-(4-аминофенил)пиперидин-4-ил)-N-метилацетамида (479,7 мг, 1,94 ммоль) в 6 мл водн. HBr добавляли раствор NaNO2 (147 мг, 2,13 ммоль) в 2 мл H2O при 0°C, затем смесь взбалтывали при 0°C в течение 40 минут. После этого смесь выливали в раствор CuBr (584 мг, 4,07 ммоль) в 6 мл водн. HBr при 0°C, реакционную смесь нагревали до 60° и взбалтывали в течение 2 часов. После охлаждения смесь подщелачивали 2 M NaOH до pH=8~9 и экстрагировали с помощью EA, промывали H2O и солевым раствором, сушили и концентрировали с получением черного твердого вещества. MS (масса/заряд): 313 (M+H)+.
(E) N-Метил-N-(1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-ил)ацетамид
К раствору N-(1-(4-бромфенил)пиперидин-4-ил)-N-метилацетамида (~40%, 160 мг, 0,63 ммоль) в диоксане (15 мл) добавляли KOAc (185 мг, 1,89 ммоль), PdCl2(dppf) (69 мг, 0,095 ммоль) и 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (320 мг, 1,26 ммоль). Смесь взбалтывали при 110°C в течение ночи. Реакционную смесь фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали на TLC (CH2Cl2:MeOH = 50:1) с получением белого твердого вещества. MS (масса/заряд): 359 (M+H)+.
Промежуточное соединение 41
1-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин
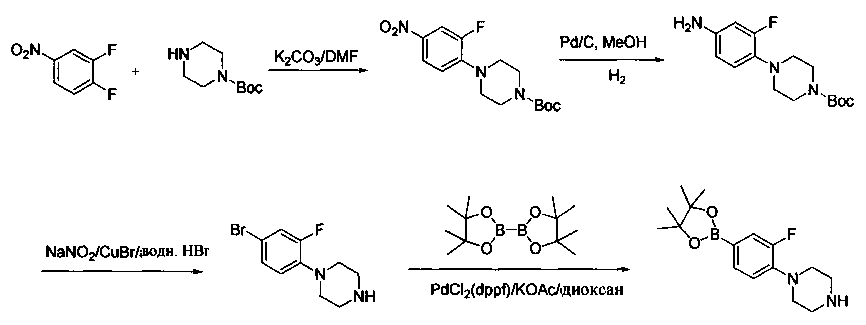
(A) Трет-бутил-4-(2-фтор-4-нитрофенил)пиперазин-1-карбоксилат
К раствору трет-бутил-пиперазин-1-карбоксилата (1120 мг, 6 ммоль) в DMF (25 мл) добавляли K2CO3 (828 мг, 6 ммоль) и 1,2-дифтор-4-нитробензол (795 мг, 5 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при 80°C в течение 24 часов. После этого реакционную смесь выливали в 50 мл воды и экстрагировали с помощью EA (3×25 мл), промывали H2O (25 мл) и солевым раствором (25 мл), сушили над Na2SO4 и концентрировали с получением желтого твердого вещества. MS (масса/заряд): 226 (M-99)+.
(B) Трет-бутил-4-(4-амино-2-фторфенил)пиперазин-1-карбоксилат
К раствору трет-бутил-4-(2-фтор-4-нитрофенил)пиперазин-1-карбоксилата (5 ммоль) в MeOH (30 мл) добавляли Pd/C (1 г), затем смесь взбалтывали в течение 18 часов при 20°C под 1 атм H2. Реакционную смесь фильтровали и концентрировали с получением серо-желтого масла. MS (масса/заряд): 296 (M+H)+.
(C) 1-(4-Бром-2-фторфенил)пиперазин
К раствору трет-бутил-4-(4-амино-2-фторфенил)пиперазин-1-карбоксилата (885 мг, 3 ммоль) в 8 мл водн. HBr добавляли раствор NaNO2 (228 мг, 3,3 ммоль) в 2 мл H2O при 0°C, затем смесь взбалтывали при 0°C в течение 40 минут. После этого смесь выливали в раствор CuBr (905 мг, 6,3 ммоль) в 8 мл водн. HBr при 0°C. Реакционную смесь нагревали до 60°C и взбалтывали в течение 2 часов. После охлаждения смесь подщелачивали 2 М NaOH до pH=8~9 и экстрагировали с помощью EA, промывали H2O и солевым раствором, сушили и концентрировали с получением черного твердого вещества. MS (масса/заряд): 261 (M+H)+.
(D) 1-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин
К раствору 1-(4-бром-2-фторфенил)пиперазина (309 мг, 1,2 ммоль) в диоксане (15 мл) добавляли KOAc (353 мг, 3,6 ммоль), PdCl2(dppf) (132 мг, 0,18 ммоль) и 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (610 мг, 2,4 ммоль). Смесь взбалтывали при 80°C в течение ночи. Реакционную смесь фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали на TLC (CH2Cl2:MeOH = 20:1) с получением черного твердого вещества. MS (масса/заряд): 307 (M+H)+.
Промежуточное соединение 42
2-Метил-4-(4-(4,4,5,5-тетраметил-1,3,2-Диоксаборолан-2-ил)фенил)морфолин
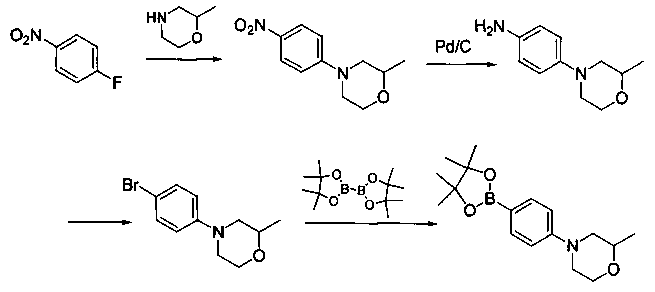
(A) 4-(2-Метилморфолино)анилин
К смеси 1-фтор-4-нитробензола (5,64 г, 40,0 ммоль) и карбоната калия (11,1 г, 80,0 ммоль) в DMSO (30 мл) добавляли 2-метилморфолин (4,05 г, 40,0 ммоль), затем смесь нагревали при 100°C в течение 4 часов. Этот раствор выливали в воду (300 мл) и экстрагировали с помощью EA (3×100 мл). Объединенную органическую фазу промывали солевым раствором и сушили. Фильтровали и к фильтрату добавляли Pd/C (1,0 г), наполняли H2 и взбалтывали при комнатной температуре в течение ночи. Катализатор фильтровали и фильтрат концентрировали с получением продукта в виде светло-красного твердого вещества. MS (масса/заряд): 193 (M+H)+.
(B) 4-(4-Бромфенил)-2-метилморфолин
К раствору 4-(2-метилморфолино)анилина (7,21 г, 37,5 ммоль) в 100 мл HBr в воде (40%) медленно добавляли раствор NaNO2 (2,59 г, 37,5 ммоль) в 15 мл воды при -10°C ~ 0°C. Смесь взбалтывали в течение 30 минут и каплями добавляли к раствору CuBr (2,96 г, 20,6 ммоль) в 30 мл HBr в воде (40%). Полученную смесь взбалтывали и нагревали при 60°C в течение 2 часов. Затем pH реакционного раствора регулировали 2 н раствором NaOH до pH>7. Экстрагировали с помощью EA, объединенную органическую фазу промывали солевым раствором, сушили и концентрировали с получением неочищенного продукта в виде черного масла. MS (масса/заряд): 256 (M+H)+; 258 (M+3)+.
(C) 2-Метил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)морфолин
Раствор 4-(4-бромфенил)-2-метилморфолина (8,0 г, <31 ммоль), 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолана) (10,3 г, 40,6 ммоль), [1,1′-бис(дифенилфосфино)ферроцен]палладия(II) хлорида (2,26 г, 3,1 ммоль) и ацетата калия (4,6 г, 46,5 ммоль) в DMSO (80 ммоль) нагревали при 70°C в N2 в течение 4 часов. После охлаждения реакционную смесь разделяли на EA и воду. Объединенную органическую фазу сушили и концентрировали. Очищали хроматографией на силикагеле, элюировали с помощью EA/PE = 5/1 с получением продукта в виде светло-желтого твердого вещества. MS (масса/заряд): 304 (M+H)+.
Промежуточное соединение 43
4-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2-метилморфолин
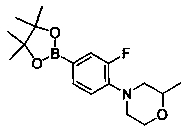
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1,2-дифтор-4-нитробензола. MS (масса/заряд): 322 (M+H)+.
Промежуточное соединение 44
1-(4-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон
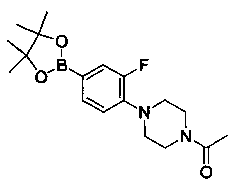
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1,2-дифтор-4-нитробензола. MS (масса/заряд): 349 (M+H)+.
Промежуточное соединение 45
1-(Этилсульфонил)-4-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин
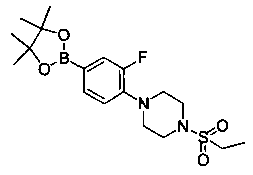
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1,2-дифтор-4-нитробензола. MS (масса/заряд): 399 (M+H)+.
Промежуточное соединение 46
(2S,6R)-4-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2,6-диметилморфолин
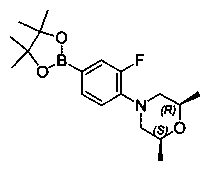
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1,2-дифтор-4-нитробензола. MS (масса/заряд): 336 (M+H)+.
Промежуточное соединение 47
1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1H-имидазол
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1-фтор-4-нитробензола. MS (масса/заряд): 271 (M+H)+.
Промежуточное соединение 48
N-Метил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-тетрагидро-2H-пиран-4-амин
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1-фтор-4-нитробензола. MS (масса/заряд): 318 (M+H)+.
Промежуточное соединение 49
1-(2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4-метилпиперазин
Названное соединение получали согласно процедурам для промежуточного соединения 42 с использованием 1,2-дифтор-4-нитробензола.
Промежуточное соединение 50
4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенилсульфонил)морфолин
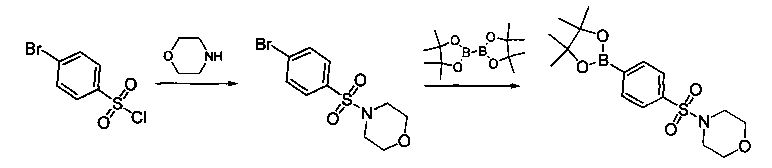
(A) 4-(4-Бромфенилсульфонил)морфолин
К раствору 4-бромбензол-1-сульфонилхлорида (2,56 г, 10,0 ммоль) и триэтиламина (1,82 мл, 13 ммоль) в DCM (50 мл) каплями добавляли морфолин (960 мг, 11,0 ммоль) и смесь взбалтывали в течение 30 минут при комнатной температуре. Затем смесь концентрировали и экстрагировали с помощью EA, промывали с помощью 0,1 М водного раствора HCl (2×100 мл), раствора NaHCO3 (2×100 мл) и солевого раствора, сушили и концентрировали с получением продукта в виде белого твердого вещества.
(B) 4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенилсульфонил)морфолин
К раствору 4-(4-бромфенилсульфонил)морфолина (3,06 г, 10 ммоль) в DMSO (20 мл) добавляли 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би(1,3,2-диоксаборолан) (3,3 г, 13,0 ммоль), [1,1′-бис(дифенилфосфино)ферроцен]палладия(II) хлорид (730 мг, 1,0 ммоль) и ацетат калия (1,47 г, 15 ммоль). Затем смесь нагревали до 70°C в течение 4 часов. После охлаждения смесь экстрагировали с помощью EA, промывали солевым раствором, сушили и очищали хроматографией на силикагеле, элюировали с помощью PE/EA = 1/1 с получением продукта в виде желтого твердого вещества. MS (масса/заряд): 354 (M+H)+.
Промежуточное соединение 51
N-Метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамид
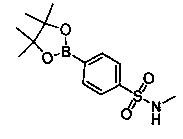
Названное соединение получали согласно процедурам для промежуточного соединения 50 с использованием 4-бромбензол-1-сульфонилхлорида. MS (масса/заряд): 298 (M+H)+.
Промежуточное соединение 52
2-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанол
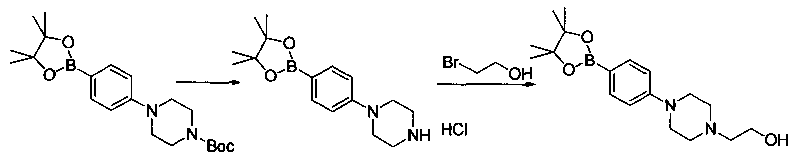
(A) 1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорид
Раствор трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-карбоксилата (5,0 г, 12,9 ммоль) в 5 н HCl в EA (30 мл) взбалтывали при комнатной температуре в течение ночи, затем концентрировали с получением продукта в виде грязно-белого твердого вещества, которое использовали непосредственно для следующей стадии.
(B) 2-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанол
К раствору 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорида (500 мг, 1,54 ммоль) и карбоната калия (430 мг, 3,1 ммоль) в ацетонитриле (20 мл) добавляли 2-бромэтанол (388 мг, 3,1 ммоль), затем смесь нагревали при 60°C в течение ночи в атмосфере азота. Затем смесь фильтровали через целит и промывали DCM, концентрировали с получением продукта в виде светло-коричневого твердого вещества. MS (масса/заряд): 333 (M+H)+.
Промежуточное соединение 53
2-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)этанол
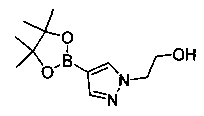
Названное соединение получали согласно процедурам для промежуточного соединения 52 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. MS (масса/заряд): 239 (M+H)+.
Промежуточное соединение 54
1-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон

(A) 1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорид
Раствор трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-карбоксилата (500 мг, 1,29 ммоль) в 5 н. HCl в EA (20 мл) взбалтывали при комнатной температуре в течение 2 часов, затем концентрировали с получением неочищенного продукта в виде белого твердого вещества.
(B) 1-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон
К раствору 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорида (419 мг, 1,29 ммоль) и карбоната цезия (1,27 г, 3,9 ммоль) в THF (30 мл) добавляли ацетилхлорид (0,5 мл, 6,5 ммоль). Затем смесь взбалтывали при комнатной температуре в течение ночи, экстрагировали с помощью EA, промывали раствором NaHCO3 и солевым раствором. Органический раствор концентрировали и очищали колоночной флэш-хроматографией, элюировали PE/EA с получением продукта в виде белого твердого вещества. MS (масса/заряд): 331 (M+H)+.
Промежуточное соединение 55
1-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)пропан-1-он
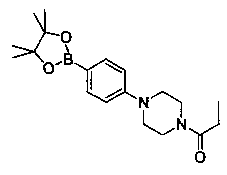
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 345 (M+H)+.
Промежуточное соединение 56
2-(Метилсульфонил)-1-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 409 (M+H)+.
Промежуточное соединение 57
2-Метокси-1-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 361 (M+H)+.
Промежуточное соединение 58
2-Гидрокси-1-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)этанон
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 347 (M+H)+.
Промежуточное соединение 59
Циклопропил(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)метанон
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 357 (M+H)+.
Промежуточное соединение 60
1-(Метилсульфонил)-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин
Названное соединение получали согласно процедурам для промежуточного соединения 54 с использованием 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина. MS (масса/заряд): 367 (M+H)+.
Промежуточное соединение 61
1-(Метилсульфонил)-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин
1-(Метилсульфонил)-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин
К раствору 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидина гидрохлорида (315 мг, 1,0 ммоль) и триэтиламина (303 мг, 3,0 ммоль) в DCM (15 мл) каплями добавляли метансульфонилхлорид (230 мг, 2,0 ммоль), смесь взбалтывали при комнатной температуре в течение 1 часа. Затем смесь экстрагировали с помощью EA, промывали солевым раствором, сушили и очищали колоночной флэш-хроматографией, элюировали с помощью EA/MeOH с получением продукта в виде светло-желтого твердого вещества. MS (масса/заряд): 356 (M+H)+.
Промежуточное соединение 62
1-(4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин-1-ил)этанон
Названное соединение получали согласно процедурам для промежуточного соединения 51 с использованием 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидина. MS (масса/заряд): 320 (M+H)+.
Промежуточное соединение 63
6-(4-Ацетилпиперазин-1-ил)пиридин-3-илбороновая кислота
Названное соединение получали согласно процедурам для промежуточного соединения 35 с использованием 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина. MS (масса/заряд): 250 (M+H)+.
Промежуточное соединение 64
6-(4-Метилпиперазин-1-ил)пиридин-3-илбороновая кислота
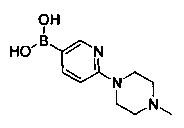
Названное соединение получали согласно процедурам для промежуточного соединения 35 с использованием 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина.
Промежуточное соединение 65
6-(4-Метил-1,4-диазепан-1-ил)пиридин-3-илбороновая кислота
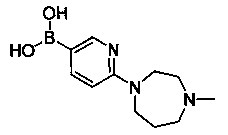
Названное соединение получали согласно процедурам для промежуточного соединения 35 с использованием 2-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина.
Промежуточное соединение 66
N-Метил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метансульфонамид
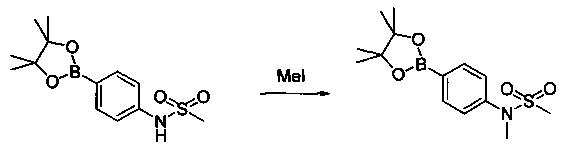
N-Метил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метансульфонамид
К суспензии N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)метансульфонамида (0,5 г, 1,7 ммоль) и карбоната калия (0,28 г, 2,0 ммоль) в ацетоне (10 мл) добавляли метилйодид (0,12 мл, 2,0 ммоль). Смесь взбалтывали при комнатной температуре в течение 18 часов в атмосфере азота, затем разбавляли CH2Cl г (20 мл), фильтровали через прокладку диатомовой земли, смывали с помощью CH2Cl2 и выпаривали с получением продукта в виде грязно-белого твердого вещества. MS (масса/заряд): 312 (M+H)+.
Промежуточное соединение 67
1-Этил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин
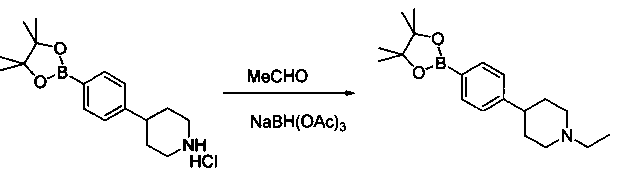
1-Этил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин
К раствору 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидина в THF добавляли MeCHO (40%, 0,17 мл, 1,48 ммоль) и AcOH (45 мг, 0,74 ммоль), смесь взбалтывали при комнатной температуре в течение 20 минут. Затем добавляли NaBH(OAc)3 (157 мг, 0,74 ммоль) и взбалтывали в течение ночи. Реакционный раствор выливали в NaHCO3, экстрагировали с помощью EA, сушили и концентрировали с получением продукта в виде белого твердого вещества. MS (масса/заряд): 316 (M+H)+.
Промежуточное соединение 68
1-Метил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин
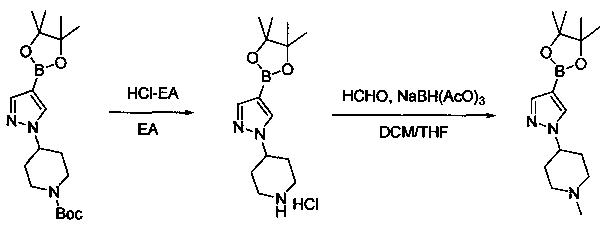
(A) 4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидина гидрохлорид
Раствор трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилата (8,2 г, 21,73 ммоль) и 30 мл HCl-EA (5,0 н.) в 15 мл EA взбалтывали при комнатной температуре в течение 2 часов. Летучие компоненты удаляли in vacuo с получением 7,3 г названного соединения.
(B) 1-Метил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин
Раствор 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола гидрохлорида (740 мг, 2,36 ммоль) и формалина (1,0 г, 11,80 ммоль) в 10 мл DCM и 2 мл THF под N2 взбалтывали при комнатной температуре в течение 1 часа. Затем к смеси добавляли NaBH(AcO)3 (1,0 г, 4,72 ммоль) при 0°C. Смесь взбалтывали при комнатной температуре в течение ночи. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:20~10:1) с получением 620 мг названного соединения. MS (масса/заряд) = 292 (M+H)+.
Промежуточное соединение 69
6-(1,4-Оксазепан-4-ил)пиридин-3-илбороновая кислота
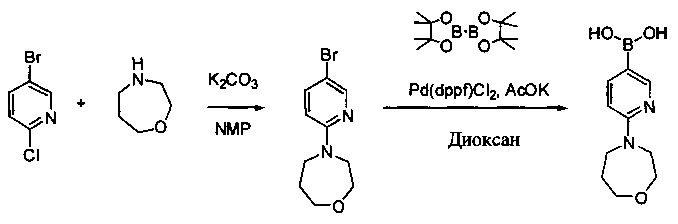
(A) 4-(5-Бромпиридин-2-ил)-1,4-оксазепан
Раствор 5-бром-2-хлорпиридина (1,5 г, 7,8 ммоль), 1,4-оксазепана (1,29 г, 9,36 ммоль) и K2CO3 в 15 мл NMP взбалтывали при 120°C в течение ночи. Смесь добавляли к 150 мл воды, промывали с помощью EA, сушили над Na2SO4 и летучие компоненты удаляли in vacuo с получением 1,86 г 4-(5-бромпиридин-2-ил)-1,4-оксазепана. MS (масса/заряд) = 259 (M+H)+.
(B) 6-(1,4-Оксазепан-4-ил)пиридин-3-илбороновая кислота
Раствор 4-(5-бромпиридин-2-ил)-1,4-оксазепана (600 мг, 2,33 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (1,18 г, 4,67 ммоль), Pd(dppf)Cl2 (286 мг, 0,35 ммоль) и KOAc (687 мг, 6,99 ммоль) в 30 мл диоксана под N2 взбалтывали при 110°C в течение 3 часов. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с EA/MeOH (20:1~5:1) с получением 165 мг 6-(1,4-оксазепан-4-ил)пиридин-3-илбороновой кислоты. MS (масса/заряд) = 223 (M+H)+.
Промежуточное соединение 70
N,N-Диметил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-карбоксамид
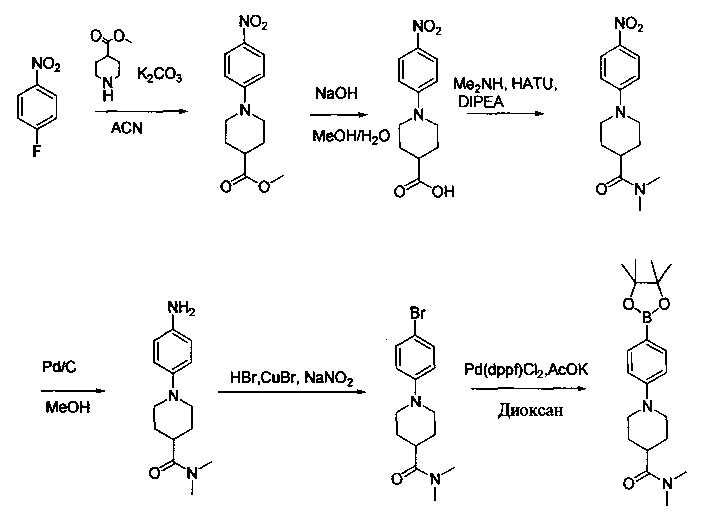
(A) Метил-1-(4-нитрофенил)пиперидин-4-карбоксилат
Раствор 1-фтор-4-нитробензола (3,5 г, 24,81 ммоль), метил-пиперидин-4-карбоксилата (4,26 г, 29,77 ммоль) и K2CO3 в 40 мл ACN взбалтывали при нагревании с обратным холодильником в течение ночи. Смесь добавляли к 150 мл воды, экстрагировали с помощью EA, сушили над Na2SO4. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с PE/EA (10:1~2:1) с получением 3,84 г метил-1-(4-нитрофенил)пиперидин-4-карбоксилата.
(B) N,N-Диметил-1-(4-нитрофенил)пиперидин-4-карбоксамид
Раствор метил-1-(4-нитрофенил)пиперидин-4-карбоксилата (3,84 г, 14,53 ммоль) и NaOH (0,87 г, 21,79 ммоль) в 15 мл MeOH и 5 мл воды взбалтывали при комнатной температуре в течение 3 часов. Летучие компоненты удаляли in vacuo с получением 1-(4-нитрофенил)пиперидин-4-карбоновой кислоты.
Раствор 1-(4-нитрофенил)пиперидин-4-карбоновой кислоты, (CH3)2NH (2,37 г, 29,06 ммоль), NATU (11,05 г, 29,06 ммоль) и DIPEA (7,51 г, 58,12 ммоль) в 30 мл THF взбалтывали при комнатной температуре в течение ночи. Смесь добавляли к 20 мл воды, экстрагировали с помощью EA, промывали водой и солевым раствором, сушили над Na2SO4. Летучие компоненты удаляли in vacuo с получением 4,2 г N,N-диметил-1-(4-нитрофенил)пиперидин-4-карбоксамида. MS (масса/заряд) = 278 (M+H)+.
(C) 1-(4-Аминофенил)-N,N-диметилпиперидин-4-карбоксамид
Раствор N,N-диметил-1-(4-нитрофенил)пиперидин-4-карбоксамида (2,5 г, 9,01 ммоль) и 0,3 г Pd/C в 20 мл МеОН под H2 взбалтывали при комнатной температуре в течение 5 часов. Смесь фильтровали и летучие компоненты удаляли in vacuo с получением 1,9 г 1-(4-аминофенил)-N,N-диметилпиперидин-4-карбоксамида.
(D) 1-(4-Бромфенил)-N,N-диметилпиперидин-4-карбоксамид
В раствор 1-(4-аминофенил)-N,N-диметилпиперидин-4-карбоксамида (4,2 г, 16,98 ммоль) в 25 мл HBr в 20 мл воды медленно добавляли раствор NaNO2 (1,17 г, 16,98 ммоль) в воде (2 мл). Смесь взбалтывали при -10°C ~ 0°C в течение 30 минут и каплями добавляли к раствору CuBr (1,34 г, 9,34 ммоль) в 12 мл HBr в воде (10 мл). Затем смесь взбалтывали при нагревании с обратным холодильником в течение 2 часов. Смесь разделяли между 2 н. NaOH и EA, промывали с помощью EA, сушили над Na2SO4. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с PE/EA (15:1~2:1) с получением 2,5 г 1-(4-бромфенил)-N,N-диметилпиперидин-4-карбоксамида.
(E) N,N-Диметил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-карбоксамид
Раствор 1-(4-бромфенил)-N,N-диметилпиперидин-4-карбоксамида (500 мг, 1,61 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (916 мг, 3,21 ммоль), Pd(dppf)Cl2 (177 мг, 0,24 ммоль) и KOAc (475 мг, 4,83 ммоль) в 20 мл диоксана под N2 взбалтывали при 110°C в течение ночи. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с PE/EA (10:1~1:4) с получением 326 мг N,N-диметил-1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-карбоксамида. MS (масса/заряд)=359 (M+H)+.
Промежуточное соединение 71
4,4,5,5-Тетраметил-2-(4-(тетрагидро-2H-пиран-4-ил)фенил)-1,3,2-диоксаборолан
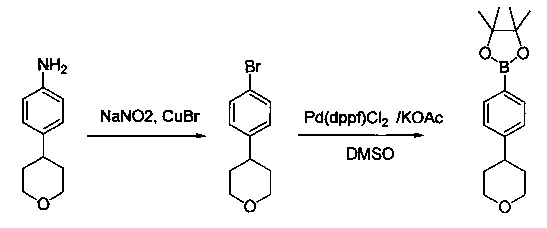
(A) 4-(4-Бромфенил)-тетрагидро-2H-пиран
Раствор 4-(тетрагидро-2H-пиран-4-ил)бензоламина (1,79 г, 10,10 ммоль) в 15 мл HBr и 5 мл воды взбалтывали при 0°C в течение 10 минут, затем к смеси добавляли 0,77 г NaNO2 при -5°C ~ 0°C. Смесь взбалтывали при -5°C в течение 30 минут. Затем раствор CuBr в 3 мл HBr добавляли к смеси, после чего смесь нагревали при 100°C в течение 2 часов. Смесь охлаждали до комнатной температуры, разделяли между 2 н. NaOH и EA, промывали водой и водным NaCl, сушили над Na2SO4. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с PE/EA (10:1~4:1) с получением 1,11 г названного соединения.
(B) 4,4,5,5-Тетраметил-2-(4-(тетрагидро-2H-пиран-4-ил)фенил)-1,3,2-диоксаборолан
Раствор 4-(4-бромфенил)-тетрагидро-2H-пирана (500 мг, 2,07 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (842 мг, 3,32 ммоль), Pd(dppf)Cl2 (303 мг, 0,41 ммоль) и KOAc (610 мг, 6,21 ммоль) в 20 мл DMSO под N2 взбалтывали при 90°C в течение ночи. Смесь добавляли к 100 мл воды, экстрагировали с помощью EA, сушили над Na2SO4. Летучие компоненты удаляли in vacuo, а остатки очищали хроматографией с PE/EA (30:1~5:1) с получением 57 мг названного соединения.
Промежуточное соединение 72
4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидина гидрохлорид
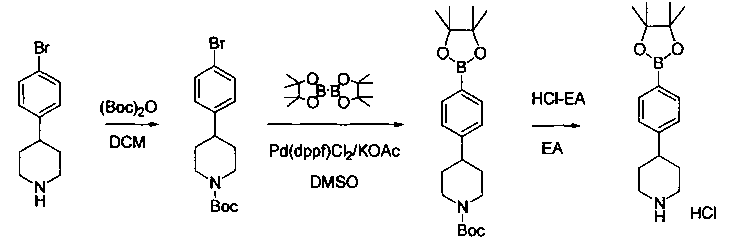
(A) Трет-бутил-4-(4-бромфенил)пиперидин-1-карбоксилат
Раствор 4-(4-бромфенил)пиперидина (2,7 г, 11,25 ммоль) и ди-трет-бутил-дикарбоната (2,5 г, 11,47 ммоль) в 20 мл DCM взбалтывали при комнатной температуре в течение 2 часов. Летучие компоненты удаляли in vacuo с получением 4,6 г трет-бутил-4-(4-бромфенил)пиперидин-1-карбоксилата.
(B) Трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-1-карбоксилат
Раствор трет-бутил-4-(4-бромфенил)пиперидин-1-карбоксилата (3,38 г, 11,25 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (4,57 г, 18 ммоль), Pd(dppf)Cl2 (2,47 г, 3,38 ммоль) и KOAc (3,32 г, 33,75 ммоль) в 60 мл DNSO под N2 взбалтывали при 80°C в течение ночи. Летучие компоненты удаляли in vacuo, а остаток очищали хроматографией с PE/EA (40:1~1:1) с получением 3,81 г названного соединения.
(C) 4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидина гидрохлорид
Раствор трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-1-карбоксилата (3,0 г, 7,75 ммоль) и 10 мл HCl-EA (5,0 н.) в 20 мл EA взбалтывали при комнатной температуре в течение 2 часов. Летучие компоненты удаляли in vacuo с получением 2,6 г названного соединения. MS (масса/заряд) = 288 (M+H)+.
Промежуточное соединение 73
Трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилат
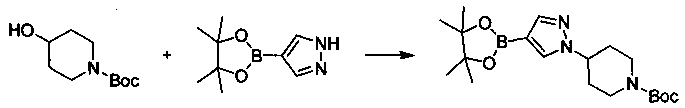
Трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилат
К трет-бутил-4-гидроксипиперидин-1-карбоксилату (402 мг, 2,0 ммоль) в метиленхлориде (20 мл) и триэтиламину (303 мг, 3,0 ммоль) при 4°C каплями добавляли метансульфонилхлорид (274 мг, 2,4 ммоль). Реакционную смесь доводили до температуры окружающей среды и взбалтывали в течение 1 часа. Реакционную смесь концентрировали in vacuo и разбавляли в диэтиловом эфире (20 мл). Раствор промывали с помощью 1 н. хлористоводородной кислоты (3 мл), воды (3 мл) и насыщенного бикарбоната натрия (3 мл). Органические слои сушили (сульфат натрия) и концентрировали in vacuo с получением трет-бутил-4-(метилсульфонилокси)пиперидин-1-карбоксилата с количественным выходом. Продукт применяли непосредственно в следующей стадии без дополнительной очистки. Смесь 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (427 мг, 2,2 ммоль), трет-бутил-4-(метилсульфонилокси)пиперидин-1-карбоксилата (2,0 ммоль) и карбоната цезия (847 мг, 2,6 ммоль) в DMF (5 мл) взбалтывали при 100°C в течение ночи. Смесь разбавляли насыщенным водным NaHCO3 и экстрагировали с помощью EtOAc (3 x). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением 884 мг неочищенного светло-желтого масла. MS (масса/заряд): 378 (M+H)+.
Промежуточное соединение 74
1-Циклопентил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол
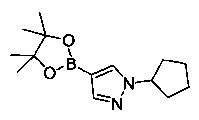
Названное соединение получали согласно процедурам для промежуточного соединения 73 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. MS (масса/заряд): 263 (M+H)+.
Промежуточное соединение 75
1-(Тетрагидро-2H-пиран-4-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол
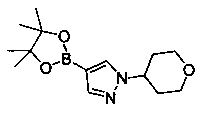
Названное соединение получали согласно процедурам для промежуточного соединения 73 с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. MS (масса/заряд): 279 (M+H)+.
Промежуточное соединение 76
Трет-бутил-3-((7-хлорпиридо[3,4-b]пиразин-5-иламино)метил)-3-фторпиперидин-1-карбоксилат
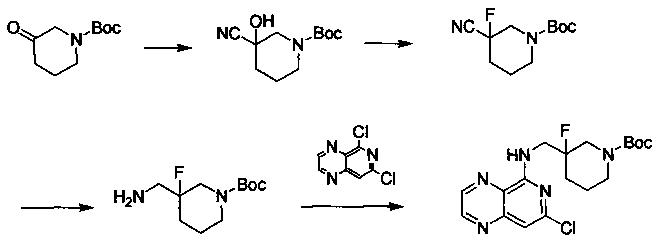
(A) Трет-бутил-3-циано-3-гидроксипиперидин-1-карбоксилат
К раствору N-Boc-3-пиперидона (5,00 г, 25,1 ммоль) и THF (15 мл) добавляли KCN (2,34 г, 37,6 ммоль) и H2O (15 мл) и полученный раствор охлаждали до 0°C. К полученному гомогенному оранжевому раствору добавляли раствор NaHSO3 (1,25 г, 37,6 ммоль) и H2O (15 мл). Полученный раствор взбалтывали при 0°C в течение 1 часа. Раствор дважды экстрагировали DCM и объединенные экстракты сушили с помощью Na2SO4, фильтровали и выпаривали с получением 5,7 г названного соединения в виде белого твердого вещества. MS (масса/заряд): 127 (M+H-Boc)+.
(B) Трет-бутил-3-циано-3-фторпиперидин-1-карбоксилат
К раствору трет-бутил-3-циано-3-гидроксипиперидин-1-карбоксилата (5,7 г, 25,1 ммоль) в DCM (50 мл), охлажденному до -78°C, каплями добавляли DAST (4,85 г, 30,1 ммоль) и полученный раствор взбалтывали при -78°C в течение 1 часа. Реакционную смесь нагревали до 0°C и взбалтывали еще 1 час. Реакционную смесь разбавляли DCM и гасили насыщ. водн. NaHCO3. Объединенные экстракты сушили с помощью Na2SO4, фильтровали и концентрировали in vacuo с получением 5,5 г неочищенного названного соединения в виде светло-желтого масла. MS (масса/заряд): 129 (M+H-Boc)+.
(C) Трет-бутил-3-(аминометил)-3-фторпиперидин-1-карбоксилат
К взболтанной и охлажденной (0°С) суспензии алюмогидрида лития (1,02 г, 26,8 ммоль) в сухом THF (50 мл) каплями добавляли раствор трет-бутил-3-циано-3-фторпиперидин-1-карбоксилата (5,50 г, 24,0 ммоль) в сухом THF (30 мл). Реакционную смесь взбалтывали при 0°C в течение 1 часа, а затем при комнатной температуре в течение 3 часов. Смесь гасили водой (1,0 мл) при 0°C и взбалтывали при комнатной температуре в течение 20 минут. Затем добавляли 15% водный раствор гидроксида натрия (2,0 мл) и взбалтывали при комнатной температуре в течение 20 минут. Под конец добавляли воду (1,0 мл) и взбалтывали при комнатной температуре в течение 20 минут. Смесь фильтровали через прокладку целита, промывая тетрагидрофураном (25 мл). Фильтрат концентрировали с получением 3,86 г названного продукта в виде светло-желтого масла. MS (масса/заряд): 233 (M+H)+.
(D) Трет-бутил-3-((7-хлорпиридо[3,4-b]пиразин-5-иламино)метил)-3-фторпиперидин-1-карбоксилат
Трет-бутил-3-(аминометил)-3-фторпиперидин-1-карбоксилат (3,86 г, 16,6 ммоль) и DIPEA (3,22 г, 24,9 ммоль) добавляли к раствору 5,7-дихлорпиридо[3,4-b]пиразина (3,32 г, 16,6 ммоль) в THF (60 мл) и смесь нагревали с обратным холодильником в течение ночи. Летучие компоненты выпаривали и остаток экстрагировали с помощью этилацетата. Этилацетат промывали солевым раствором и сушили. Растворитель удаляли in vacuo. Неочищенный остаток очищали хроматографией на силикагеле, элюируя с градиентом гексан-50% EtOAc/гексан, затем пропуская через колонку C18 с получением 1,76 г названного в подзаголовке соединения в виде светло-желтого твердого вещества. MS (масса/заряд): 396 (M+H)+.
Промежуточное соединение 77
Трет-бутил-2-(аминометил)тиоморфолин-4-карбоксилат
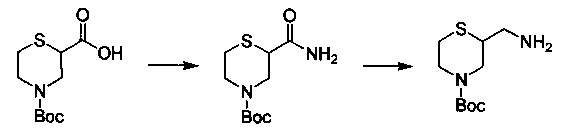
(A) Трет-бутил-2-карбамоилтиоморфолин-4-карбоксилат
4-(Трет-бутоксикарбонил)тиоморфолин-2-карбоновую кислоту (2,47 г, 10 ммоль) и HOBt (1,62 г, 12 ммоль) растворяли в DMF (20 мл) и добавляли EDCI (2,11 г, 11 ммоль). Реакционную смесь взбалтывали в течение 1 часа, добавляли 25% водный аммиак (5 мл) и реакционную смесь взбалтывали еще 2 часа. Затем реакционную смесь разбавляли EtOAc (200 мл) и разделяли с водой (100 мл). Органический слой промывали насыщенным водн. NaHCO3 (2×100 мл), а затем сушили с Na2SO4. Растворитель удаляли in vacuo с получением 2,46 г названного соединения в виде белого твердого вещества. MS (масса/заряд): 147 (M+H-Boc)+.
(B) Трет-бутил-2-(аминометил)тиоморфолин-4-карбоксилат
Раствор трет-бутил-2-карбамоилтиоморфолин-4-карбоксилата (2,46 г, 10 ммоль) в THF (80 мл) охлаждали до 0°C. Раствор борана в THF (1,0 M, 40 мл, 40 ммоль) добавляли за 15 минут посредством капельной воронки и смесь взбалтывали при температуре окружающей среды в течение 72 часов. Реакцию гасили капельным добавлением метанола/уксусной кислоты (18 мл, 9:1 объем/объем). Растворитель удаляли при пониженном давлении и остаток разделяли между этилацетатом и насыщ. водным Na2CO3. Водный слой экстрагировали с помощью этилацетата и объединенные экстракты промывали водой, солевым раствором и сушили над сульфатом натрия. Удалением растворителя при пониженном давлении получали 2,11 г неочищенного желаемого материала, который применяли непосредственно в следующей стадии. MS (масса/заряд): 233 (M+H)+.
Промежуточное соединение 78
(2S)-Трет-бутил-2-(1-(7-хлорпиридо[3,4-b]пиразин-5-иламино)этил)морфолин-4-карбоксилат
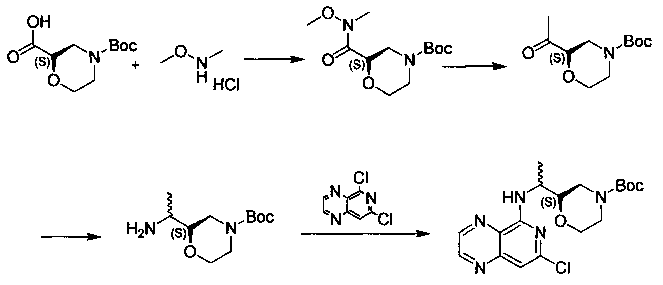
(A) (5)-7рет-бутил-2-(метокси(метил)карбамоил)морфолин-4-карбоксилат
Смесь (S)-4-(трет-бутоксикарбонил)морфолин-2-карбоновой кислоты (3,46 г, 15 ммоль), DIPEA (7,75 г, 60 ммоль) и N,O-диметилгидроксиламина HCl (4,39 г, 45 ммоль) в DCM (100 мл) обрабатывали EDCI (9,63 г, 45 ммоль) при комнатной температуре. Реакционную смесь взбалтывали в течение 16 часов, а затем выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали с помощью CH2Cl2. Объединенные экстракты сушили над MgSO4, фильтровали и концентрировали с получением 3,5 г светло-желтого масла. MS (масса/заряд): 175 (M+H-Boc)+.
(B) (5)-Трет-бутил-2-ацетилморфолин-4-карбоксилат
Полученный ранее (S)-трет-бутил-2-(метокси(метил)карбамоил)морфолин-4-карбоксилат растворяли в THF (60 мл) при комнатной температуре под азотом и охлаждали до 0°C. Порциями добавляли бромид метилмагния (3,0 М раствор в диэтиловом эфире, 15 мл, 45 ммоль). Реакционную смесь взбалтывали при 0°C в течение 1 часа, обеспечивали нагревание до комнатной температуры, а затем взбалтывали в течение 16 часов. Смесь снова охлаждали до 0°C и медленно добавляли насыщенный водный раствор хлорида аммония. Смесь экстрагировали с помощью EtOAc и экстракты промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали с получением 2,29 г неочищенного (S)-трет-бутил-2-ацетилморфолин-4-карбоксилата в виде желтого масла, которое применяли без дополнительной очистки. MS (масса/заряд): 130 (M+H-Boc)+.
(C) (25)-Трет-бутил-2-(1-(7-хлорпиридо[3,4-b]пиразин-5-иламино)этил)морфолин-4-карбоксилат
Смесь (S)-трет-бутил-2-ацетилморфолин-4-карбоксилата (2,29 г, 10,0 ммоль), ацетата аммония (7,70 г, 100 ммоль), цианоборгидрида натрия (0,94 г, 15,0 ммоль) и 5-ангстремных молекулярных сит (10 г) в метаноле (50 мл) взбалтывали при комнатной температуре под азотом в течение 16 часов. Сита удаляли путем фильтрации и фильтрат концентрировали. Добавляли 1 н. раствор NaOH до достижения pH 12. Смесь экстрагировали с помощью CH2Cl2 и объединенные экстракты сушили над MgSO4, фильтровали и концентрировали. Полученное светло-желтое масло (2,17 г) растворяли в THF (40 мл) и добавляли 5,7-дихлорпиридо[3,4-b]пиразин (2,00 г, 10,0 ммоль) и DIPEA (1,94 г, 15,0 ммоль). Смесь нагревали с обратным холодильником в течение 48 часов. Летучие компоненты выпаривали и остаток экстрагировали с помощью этилацетата. Этилацетат промывали солевым раствором и сушили. Растворитель удаляли in vacuo. Неочищенный остаток очищали хроматографией на силикагеле, элюируя с градиентом гексан-50% EtOAc/гексан, затем пропуская через колонку C18 с получением 450 мг названного в подзаголовке соединения в виде коричневого масла. MS (масса/заряд): 394 (M+H)+.
Промежуточное соединение 79
2-(1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-ил)пропан-2-ол
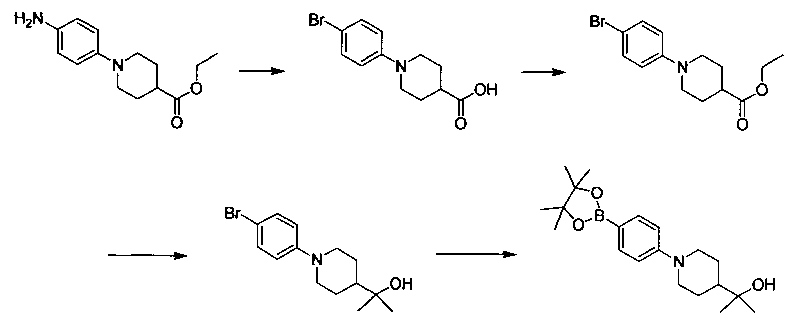
(A) 1-(4-Бромфенил)пиперидин-4-карбоновая кислота
К раствору этил-1-(4-аминофенил)пиперидин-4-карбоксилата (2,48 г, 10 ммоль) в 40 мл HBr, 40%, медленно добавляли раствор NaNO2 (0,69 г, 10 ммоль) в 7 мл воды при 0°C. Смесь взбалтывали в течение 15 минут и добавляли к раствору CuBr (0,79 г, 5,5 ммоль) в 30 мл HBr, 40%. Полученную смесь взбалтывали и нагревали с обратным холодильником в течение 2 часов. Суспензию, полученную таким образом, разделяли между 2 н. NaOH и этилацетатом. Органический слой промывали с помощью водного NaCl, сушили над Na2SO4 и концентрировали с получением 1,56 г неочищенного названного соединения. MS (масса/заряд): 286 (M+2)+.
(B) Этил-1-(4-бромфенил)пиперидин-4-карбоксилат
Взбалтываемый раствор 1-(4-бромфенил)пиперидин-4-карбоновой кислоты (1,56 г, 5,5 ммоль) в абсолютном этаноле (30 мл) охлаждали до 0°C и к нему каплями добавляли SOCl2 (1,18 г, 10 ммоль). Смесь взбалтывали, доводя до комнатной температуры, и нагревали с обратным холодильником в течение 3 часов. Реакционную смесь выпаривали in vacuo и остаток растворяли в насыщенном водном растворе NaHCO3 (50 мл). Водный раствор экстрагировали с помощью EtOAc (3×30 мл). Органические экстракты сушили над Na2SO4, фильтровали и выпаривали in vacuo. Остаток очищали колоночной хроматографией на силикагеле (элюент; этилацетат : гексан = 1:1) с выходом 1,08 г названного соединения в виде светло-коричневого масла. MS (масса/заряд): 314 (M+2)+.
(C) 2-(1-(4-Бромфенил)пиперидин-4-ил)пропан-2-ол
Этил-1-(4-бромфенил)пиперидин-4-карбоксилат (1,08 г, 3,5 ммоль) растворяли в THF (20 мл) в атмосфере азота; каплями добавляли бромид метилмагния (3,0 M раствор в диэтиловом эфире, 3,5 мл, 10,5 ммоль) при охлаждении в бане с ледяной водой; и реакционную смесь взбалтывали при комнатной температуре в течение ночи. Реакционную смесь разделяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли in vacuo с выходом желаемого соединения (1,0 г) в виде белого твердого вещества. MS (масса/заряд): 300 (M+2)+.
(D) 2-(1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-ил)пропан-2-ол
К раствору 2-(1-(4-бромфенил)пиперидин-4-ил)пропан-2-ол (1,0 г, 3,3 ммоль) в DMSO (20 мл) добавляли бис-пинаколатодибор (1,15 г, 4,5 ммоль) и KOAc (515 мг, 5,3 ммоль). Реакционную смесь дегазировали под вакуумом в течение 30 минут. Затем колбу продували N2. Добавляли Pd(dppf)Cl2 (292 мг, 0,4 ммоль), затем реакционную смесь нагревали до 70°C в течение 20 часов. После охлаждения реакционную смесь разделяли между этилацетатом и водой. Водный слой экстрагировали с помощью дополнительного этилацетата. Органические слои объединяли, сушили, фильтровали и концентрировали in vacuo. Остаток очищали колонкой с силикагелем с получением 590 мг названного соединения в виде светло-желтого твердого вещества. MS (масса/заряд): 346 (M+H)+.
Промежуточное соединение 80
2-(1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-4-илокси)этанол
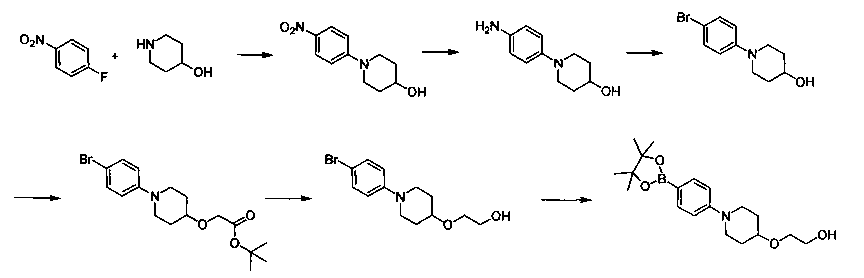
(A) 1-(4-Аминофенил)пиперидин-4-ол
К смеси 1-фтор-4-нитробензола (2,82 г, 20 ммоль) и K2CO3 (6,92 г, 50 ммоль) в диметилсульфоксиде (20 мл) добавляли пиперидин-4-ол (2,22 г, 22 ммоль) и реакционную смесь нагревали до 100°C в течение 4 часов. Этот раствор выливали в 200 мл воды и экстрагировали с помощью этилацетата (30 мл × 3). Органическую фазу объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Твердое вещество фильтровали, к фильтрату добавляли 10% Pd/C (100 мг) и смесь взбалтывали в атмосфере водорода при температуре окружающей среды в течение ночи. Катализатор отфильтровывали, а фильтрат концентрировали с получением 3,7 г коричневого твердого вещества. MS (масса/заряд): 193 (M+H)+.
(B) 1-(4-Бромфенил)пиперидин-4-ол
К раствору 1-(4-аминофенил)пиперидин-4-ола (3,7 г, 319 ммоль) в 60 мл HBr, 48%, медленно добавляли раствор NaNO2 (1,38 г, 20 ммоль) в 15 мл воды при 0°C. Смесь взбалтывали в течение 30 минут и добавляли к раствору CuBr (1,57 г, 11 ммоль) в 50 мл HBr, 48%. Полученную смесь взбалтывали и нагревали с обратным холодильником в течение 2 часов. Суспензию, полученную таким образом, разделяли между 2 н. NaOH и этилацетатом. Органический слой промывали с помощью водного NaCl, сушили над Na2SO4 и концентрировали с получением 4,6 г неочищенного соединения в виде серого твердого вещества. MS (масса/заряд): 256 (M)+.
(C) Трет-6утил-2-(1-(4-бромфенил)пиперидин-4-илокси)ацетат
Тетрабутиламмония бромид (1,06 г, 3,3 ммоль) добавляли к раствору 1-(4-бромфенил)пиперидин-4-ола (2,56 г, 10 ммоль) в толуоле (30 мл). Реакционную смесь охлаждали до 0°C и добавляли водн. 35% гидроксид натрия (30 мл) с последующим добавлением каплями трет-бутилбромацетата (2,92 г, 15 ммоль). Затем обеспечивали достижение смесью комнатной температуры и взбалтывали в течение 17 часов при этой же температуре. Слои разделяли и органический слой промывали дважды водой (4 мл), сушили над сульфатом натрия, концентрировали под вакуумом и совместно выпаривали с петролейным эфиром. Очистка неочищенного материала колоночной флэш-хроматографией на силикагеле (0-20% этилацетат в петролейном эфире) давала 3,08 г материала желаемой чистоты в виде светло-желтого твердого вещества. MS (масса/заряд): 372 (M+2)+.
(D) 2-(1-(4-Бромфенил)пиперидин-4-илокси)этанол
К взбалтываемому раствору трет-бутил-2-(1-(4-бромфенил)пиперидин-4-илокси)ацетата (3,08 г, 8,3 ммоль) в THF (20 мл) при -10°C под азотом добавляли алюмогидрид лития (0,57 г, 15 ммоль). Через 2 часа реакционную смесь гасили последовательным добавлением воды (0,6 мл), 15 процентного водного раствора гидроксида натрия (1,8 мл) и воды (0,6 мл). Полученную смесь фильтровали и концентрировали под вакуумом с получением 2,16 г неочищенного 2-(1-(4-бромфенил)пиперидин-4-илокси)этанола. MS (масса/заряд): 302 (M+2)+.
(E) 2-(1-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин- 4-илокси)этанол
К раствору 2-(1-(4-бромфенил)пиперидин-4-илокси)этанола (2,16 г, 7,2 ммоль) в DMSO (50 мл) добавляли бис-пинаколатодибор (2,54 г, 10 ммоль) и KOAc (1,17 г, 12 ммоль). Реакционную смесь дегазировали под вакуумом в течение 30 минут. Затем колбу продували N2. Добавляли Pd(dppf)Cl2 (732 мг, 1,0 ммоль), затем реакционную смесь нагревали до 70°C в течение 20 часов. После охлаждения реакционную смесь разделяли между этилацетатом и водой. Водный слой экстрагировали с помощью дополнительного этилацетата. Органические слои объединяли, сушили, фильтровали и концентрировали in vacuo. Остаток очищали колонкой с силикагелем (0-70% этилацетат в петролейном эфире) с получением 920 мг названного соединения в виде светло-желтого твердого вещества. MS (масса/заряд): 348 (M+H)+.
Промежуточное соединение 81
(R)-1-(2-((7-Хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанон
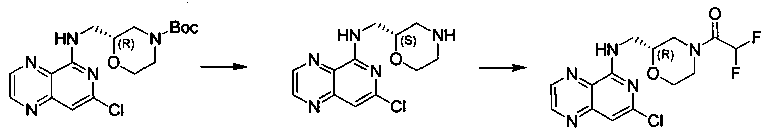
(R)-1-(2-((7-Хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанон
(R)-Трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (3,00 г, 8,0 ммоль) растворяли в растворе HCl в этилацетате (20 мл) и смесь взбалтывали при комнатной температуре в течение 2 часов, пока TLC не показала удаление группы Boc. Летучие материалы удаляли in vacuo, а остаток растворяли в дихлорметане. К раствору последовательно добавляли дифторуксусную кислоту (1,15 г, 12 ммоль), HATU (7,60 г, 20,0 ммоль) и DIPEA (6,20 г, 48,0 ммоль) и взбалтывали при комнатной температуре в течение ночи. Смесь очищали колоночной хроматографией C18 с получением желаемого амида в виде желтого твердого вещества (2,1 г). MS (масса/заряд): 358 (M+H)+.
Промежуточное соединение 82
(R)-7-Хлор-N-((4-(метилсульфонил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
Названное соединение получали согласно процедурам для промежуточного соединения 81 с использованием того же исходного материала. MS (масса/заряд): 358 (M+H)+.
Промежуточное соединение 83
6-((7-Хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-3-он
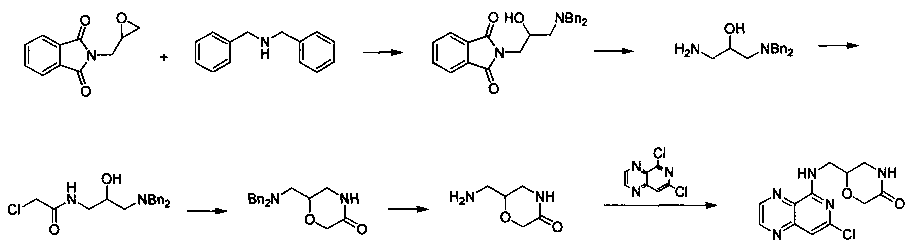
(A) 2-(3-(Дибензиламино)-2-гидроксипропил)изоиндолин-1,3-дион
Смесь 2-(оксиран-2-илметил)изоиндолин-1,3-диона (4,06 г, 20,0 ммоль) и дибензиламина (5,0 г, 25,4 ммоль) взбалтывали при 80°C в течение ночи. Добавляли EtOH (50 мл) и взбалтывали при комнатной температуре. Смесь фильтровали с получением белого твердого вещества (4,5 г).
(B) 1-Амино-3-(дибензиламино)пропан-2-ол
Раствор 2-(3-(дибензиламино)-2-гидроксипропил)изоиндолин-1,3-диона (4,5 г, 11,25 ммоль) в конц. HCl (50 мл) взбалтывали при 120°C в течение ночи. После охлаждения до комнатной температуры смесь фильтровали, а фильтрат экстрагировали с помощью CHCl3. В водный слой добавляли водн. 30% NaOH до достижения pH более 7, затем раствор экстрагировали с помощью CH2Cl2, сушили над Na2SO4 и концентрировали с получением желтого твердого вещества (3,0 г).
(C) 2-Хлор-N-(3-(дибензиламино)-2-гидроксипропил)ацетамид
Раствор 2-хлорацетилхлорида (1,25 г, 10,96 ммоль) в CHCl3 добавляли в раствор 1-амино-3-(дибензиламино)пропан-2-ола (2,5 г, 9,26 ммоль) в CHCl3 (50 мл) в ледяной бане. Смесь взбалтывали в течение 1 часа, затем взбалтывали при комнатной температуре в течение 2 часов. Органический слой концентрировали, остаток очищали колонкой с получением белого твердого вещества.
(D) 6-((Дибензиламино)метил)морфолин-3-он
Раствор 2-хлор-N-(3-(дибензиламино)-2-гидроксипропил)ацетамида (1,0 г, 2,49 ммоль), t-BuOK (0,39 г, 3,57 ммоль) в t-BuOH (30 мл) взбалтывали при нагревании с обратным холодильником в течение ночи. После концентрирования остаток очищали колоночной хроматографией с получением продукта в виде белого твердого вещества.
(E) 6-(Аминометил)морфолин-3-он
Раствор 6-((дибензиламино)метил)морфолин-3-она (340 мг, 1,09 ммоль), Pd(OH)2/C (170 мг) в EtOH (30 мл) взбалтывали в оснащенной подачей H2 камере в течение ночи. Раствор фильтровали и концентрировали с получением белого масла. Неочищенный продукт использовали непосредственно для следующей стадии без очистки.
(F) 6-((7-Хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-3-он
Раствор 6-(аминометил)морфолин-3-она (130 мг, 1 ммоль), 5,7-дихлорпиридо[4,3-b]пиразина (200 мг, 1 ммоль) и DIEA (260 мг, 2 ммоль) в THF (20 мл) взбалтывали при нагревании с обратным холодильником в течение ночи. После концентрирования остаток очищали колоночной хроматографией с получением продукта в виде желтого твердого вещества (100 мг).
Пример 1
Синтез соединений 1-516
Соединение 1
((R)-7-(4-Морфолинофенил)-N-(пиперидин-3-илметил)пиридо[4,3-b]пиразин-5-амин
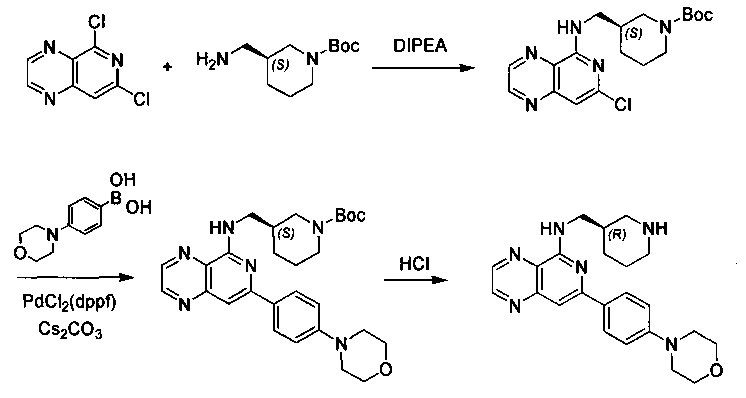
(A) (S)-Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Раствор (S)-трет-бутил-3-(аминометил)пиперидин-1-карбоксилата (100 мг, 0,5 ммоль), 5,7-дихлорпиридо[4,3-b]пиразина (100 мг, 0,5 ммоль) и DIPEA (77 мг, 0,6 ммоль) в THF (5 мл) взбалтывали при комнатной температуре в течение 4 часов. Летучие компоненты удаляли при пониженном давлении и остаток обрабатывали этилацетатом, солевым раствором и концентрировали с получением неочищенного названного соединения.
(B) (S)-Трет-бутил-3-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Смесь (S)-трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилата (0,15 ммоль), 4-морфолинофенилбороновой кислоты (0,23 ммоль), PdCl2 (dppf) (0,015 ммоль) и Cs2CO3 (0,30 ммоль) в диметоксиэтане/этаноле закрывали в реакционной пробирке для микроволнового реактора и взбалтывали при 160°C в течение 45 минут в микроволновом реакторе. Смесь охлаждали до комнатной температуры, концентрировали и очищали хроматографией с получением названного соединения (73% выход). MS (масса/заряд): 505 (M+H)+.
(C) ((R)-7-(4-Морфолинофенил)-N-(пиперидин-3-илметил)пиридо[4,3-b]пиразин-5-амин
(S)-Трет-бутил-3-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат (0,11 ммоль) обрабатывали раствором HCl (в EtOAc, 4 н., 3 мл) при комнатной температуре до завершения реакции. Осадок собирали путем фильтрации, а затем очищали хроматографией с получением названного соединения. MS (масса/заряд): 405 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 1 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
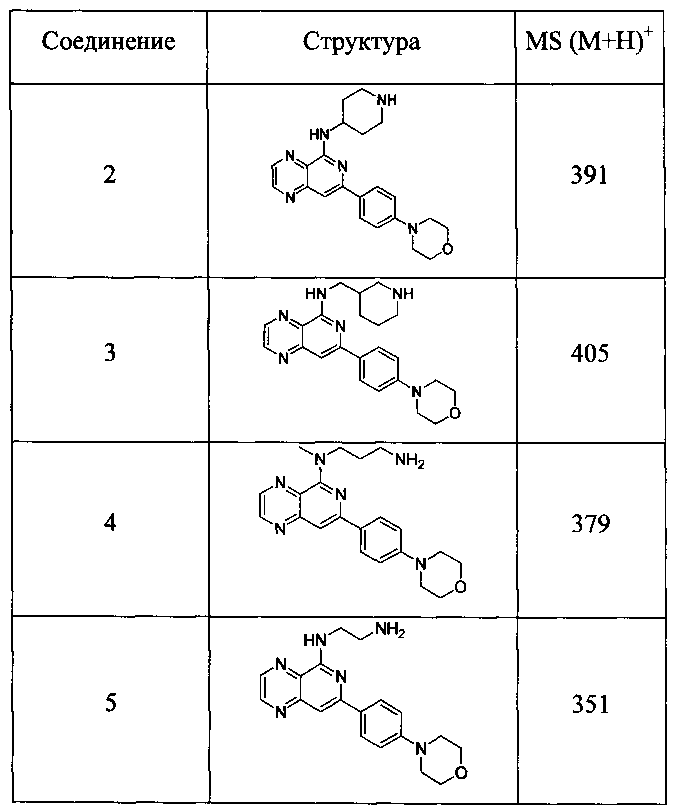
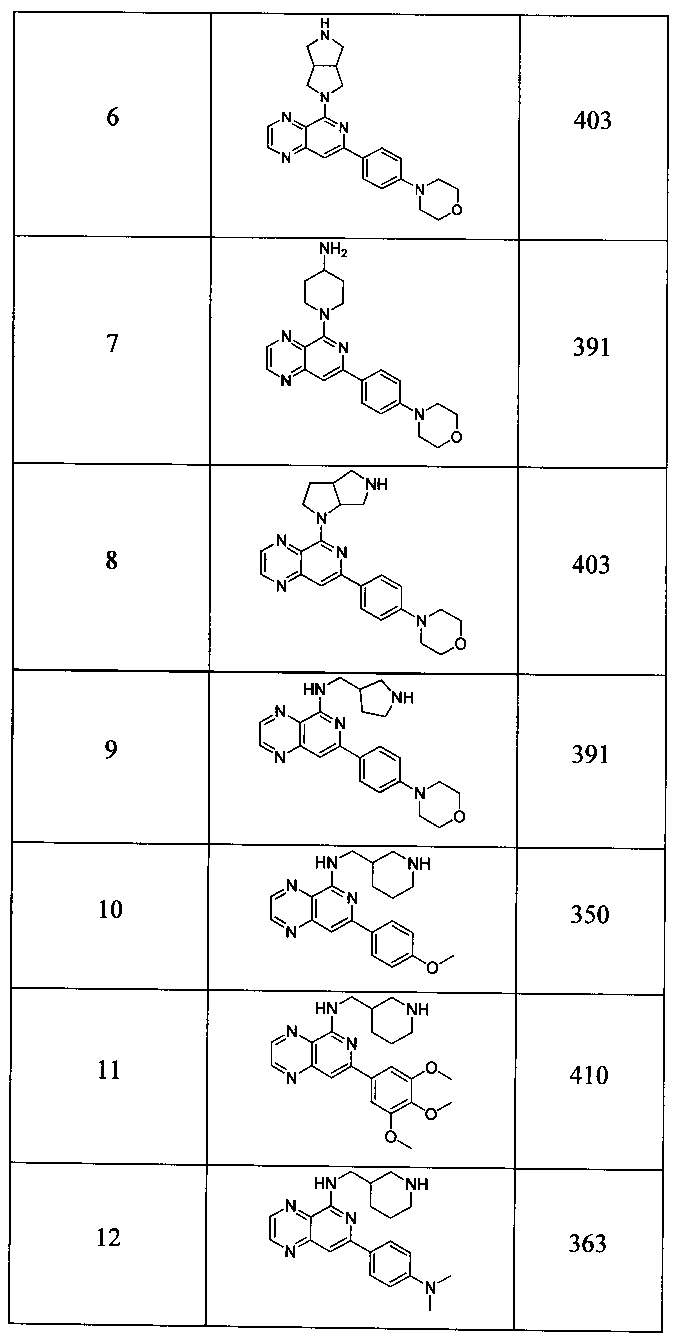
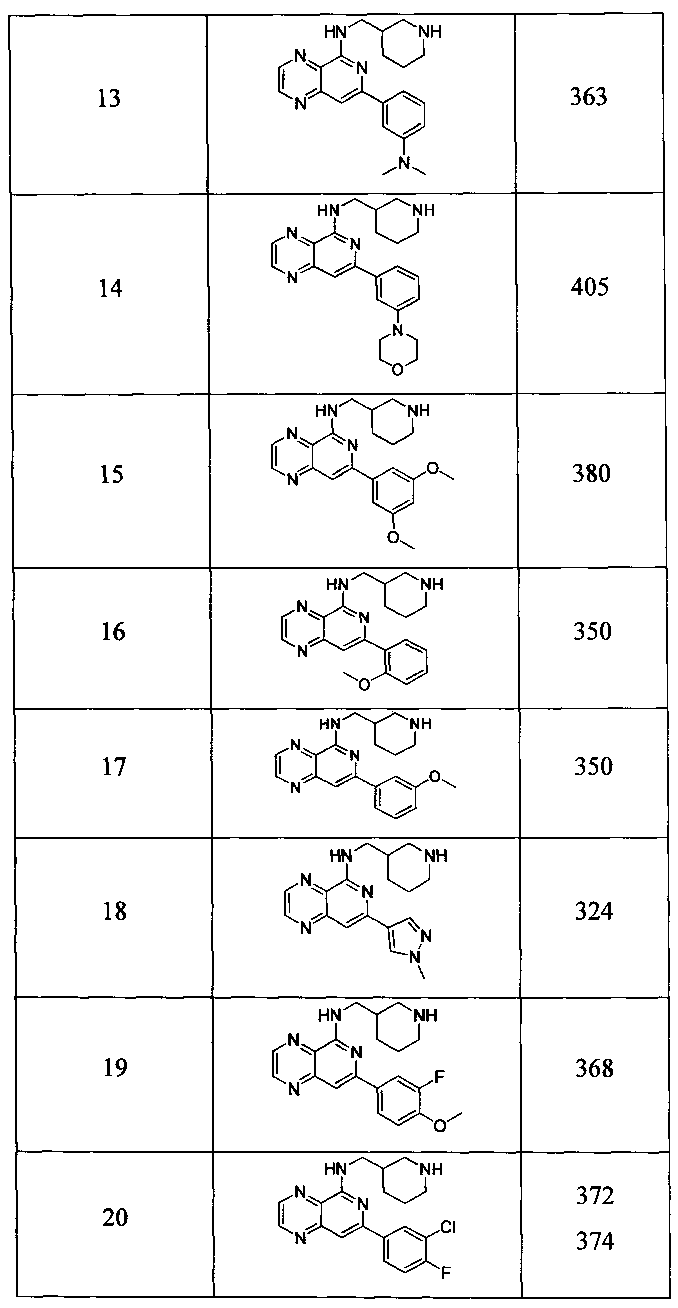
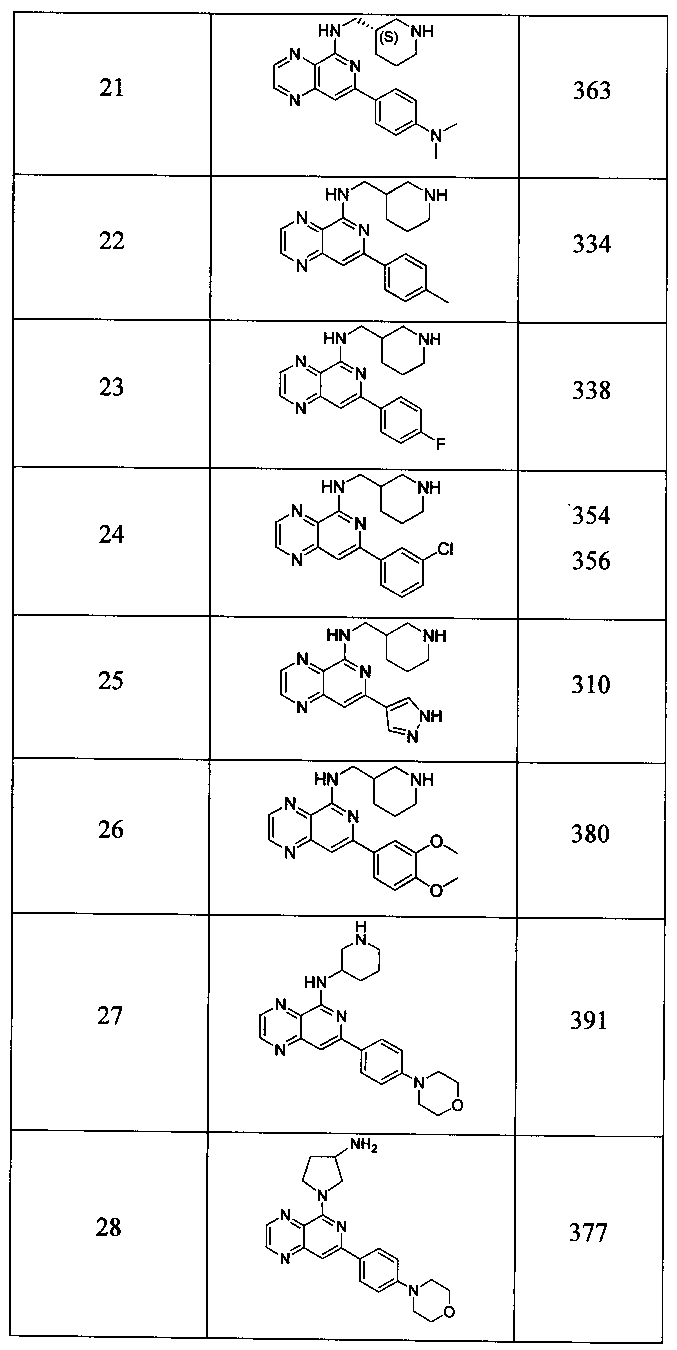
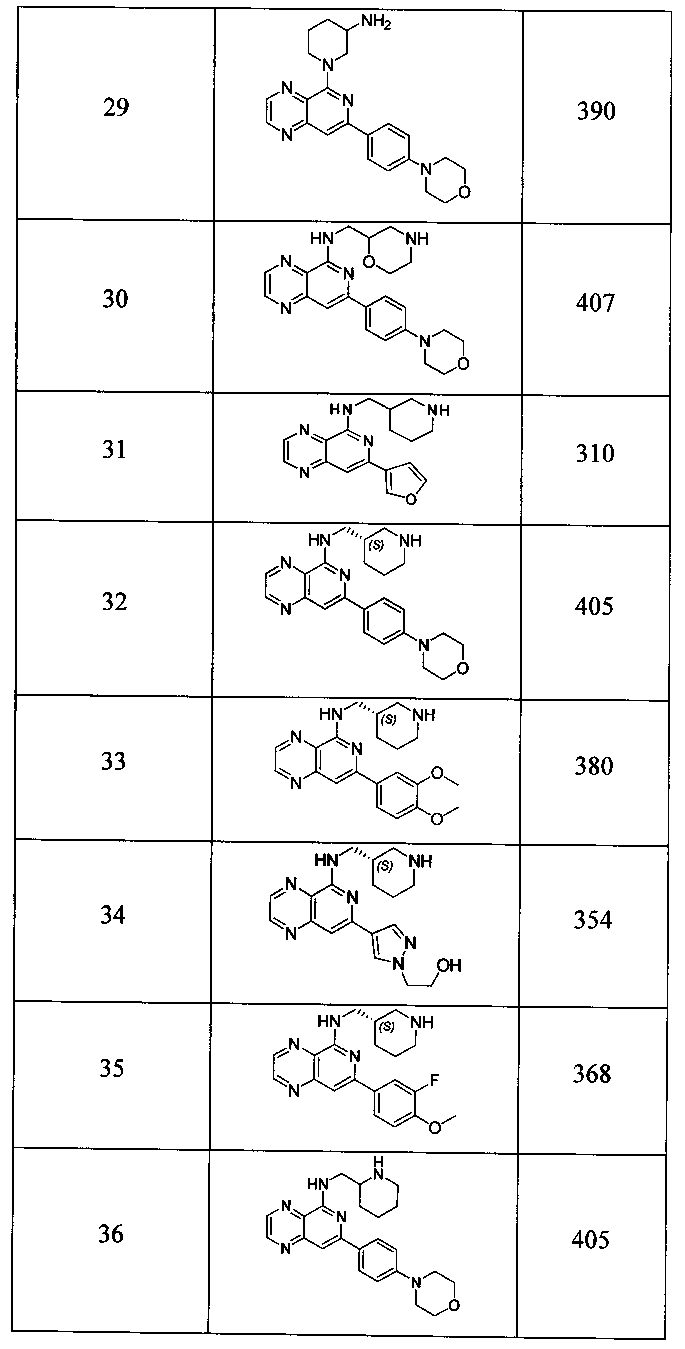
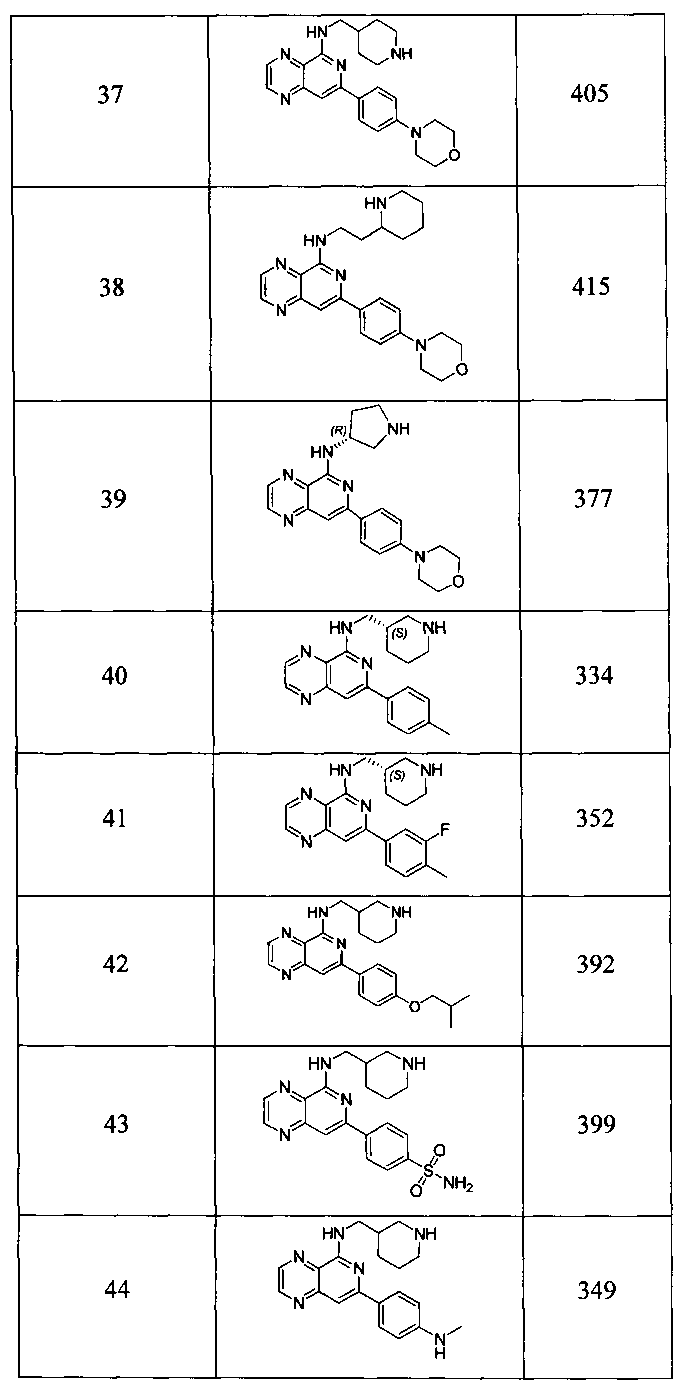
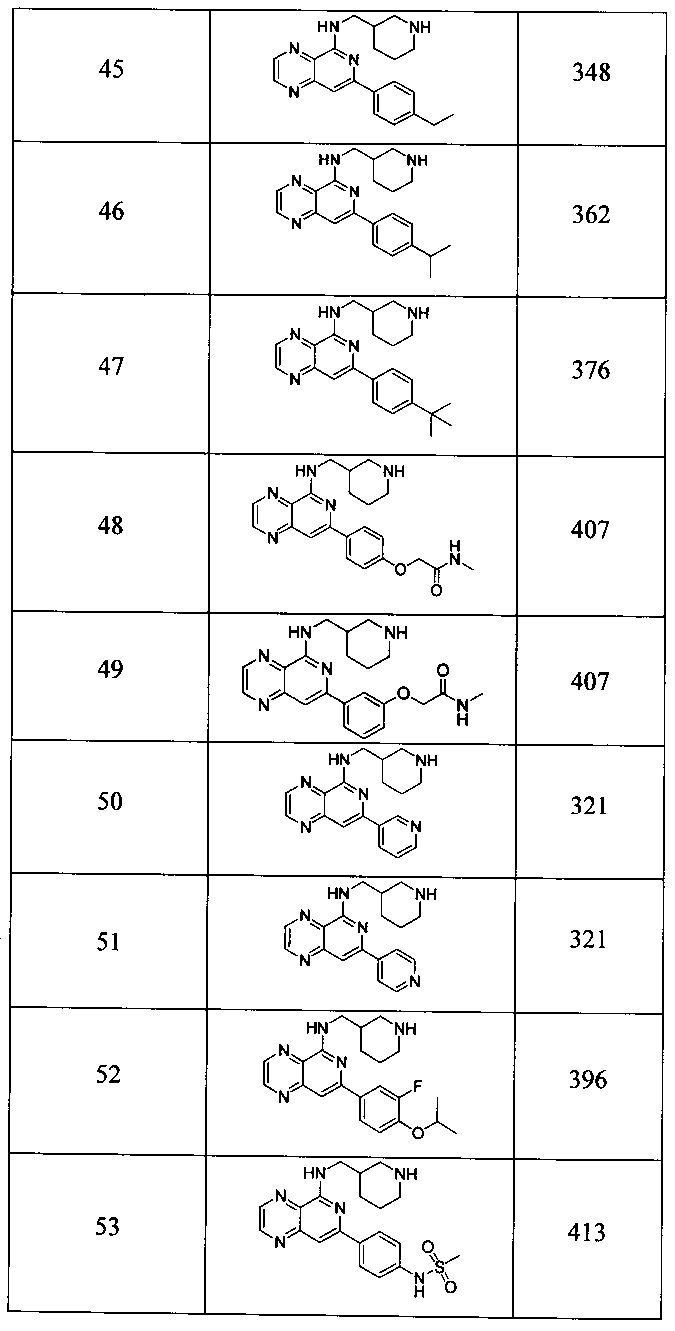
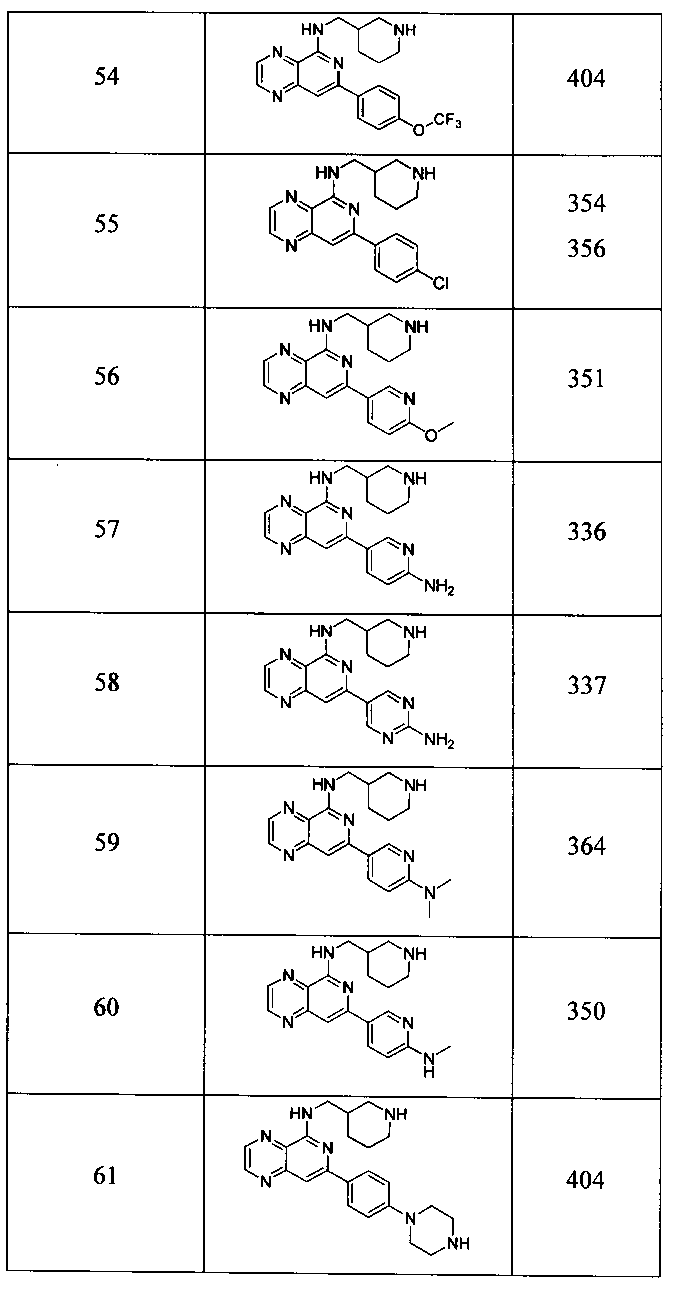
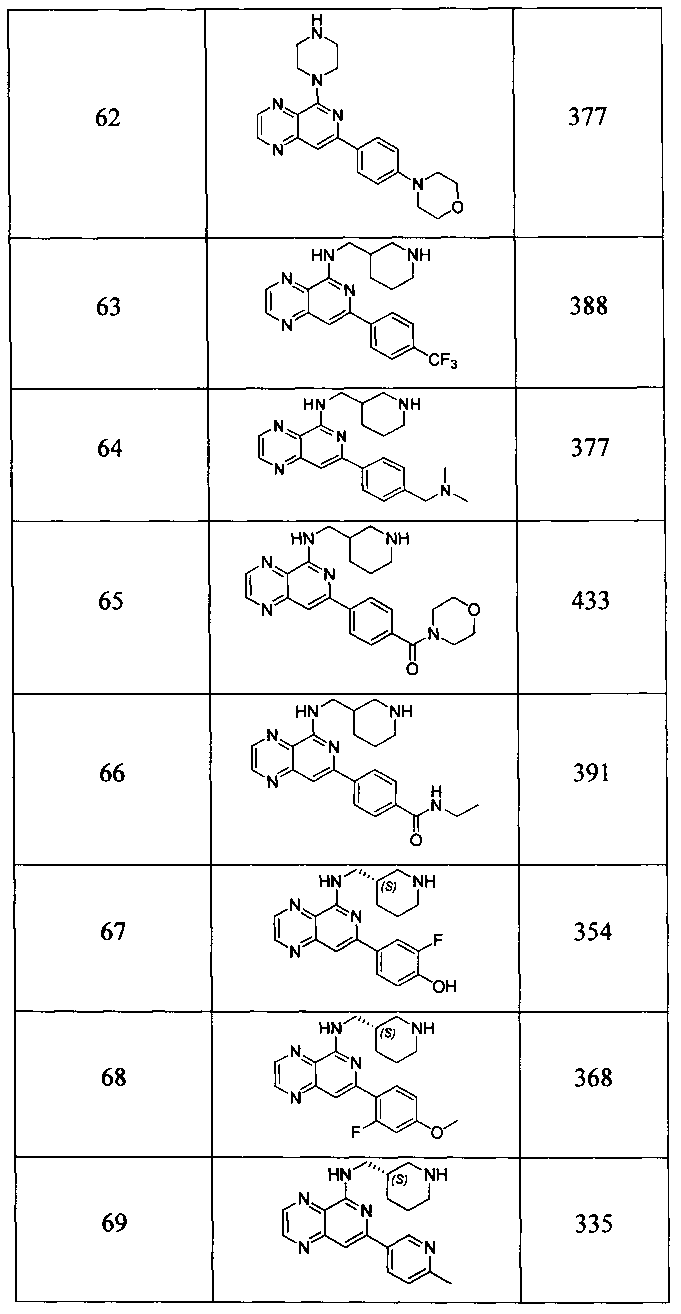
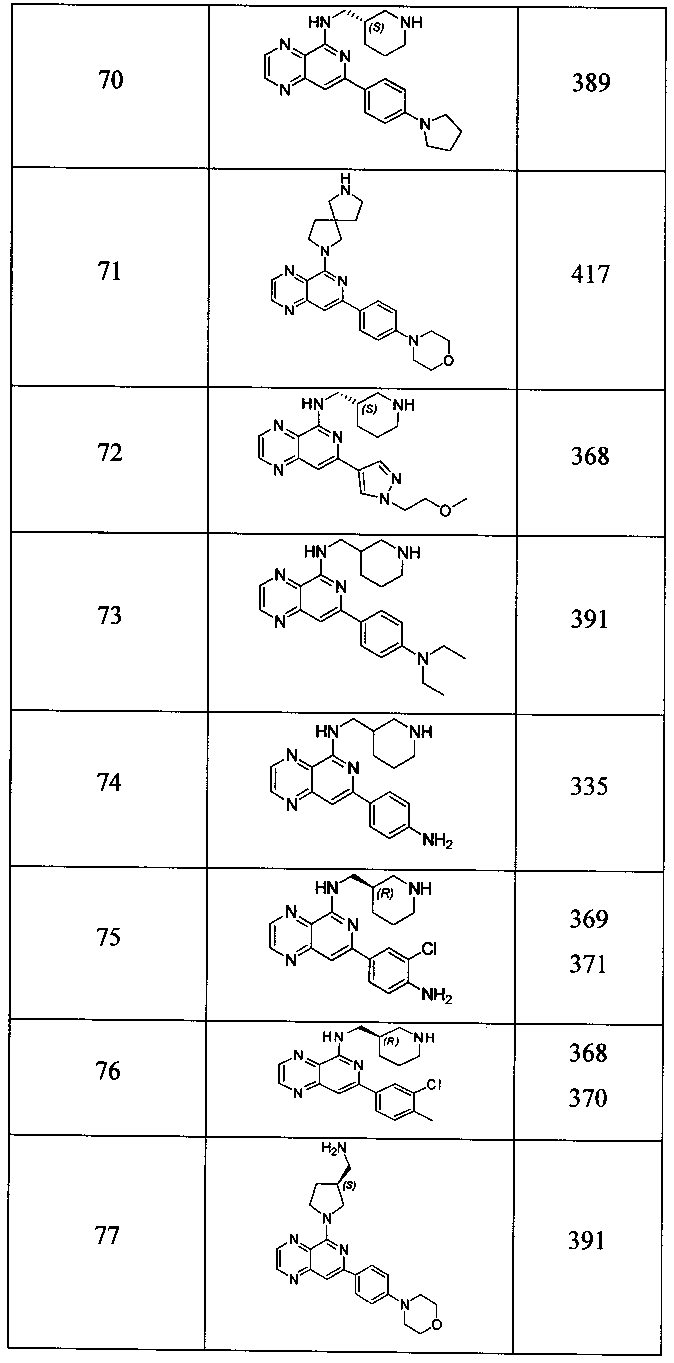
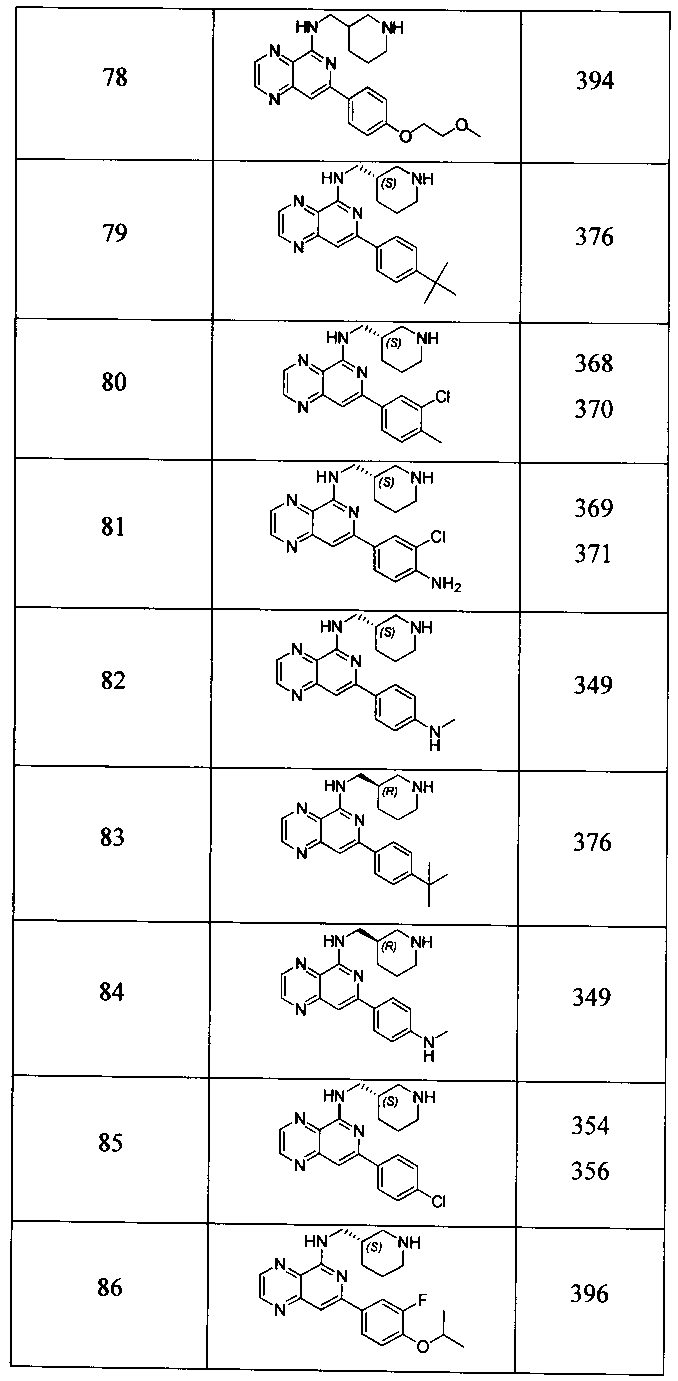
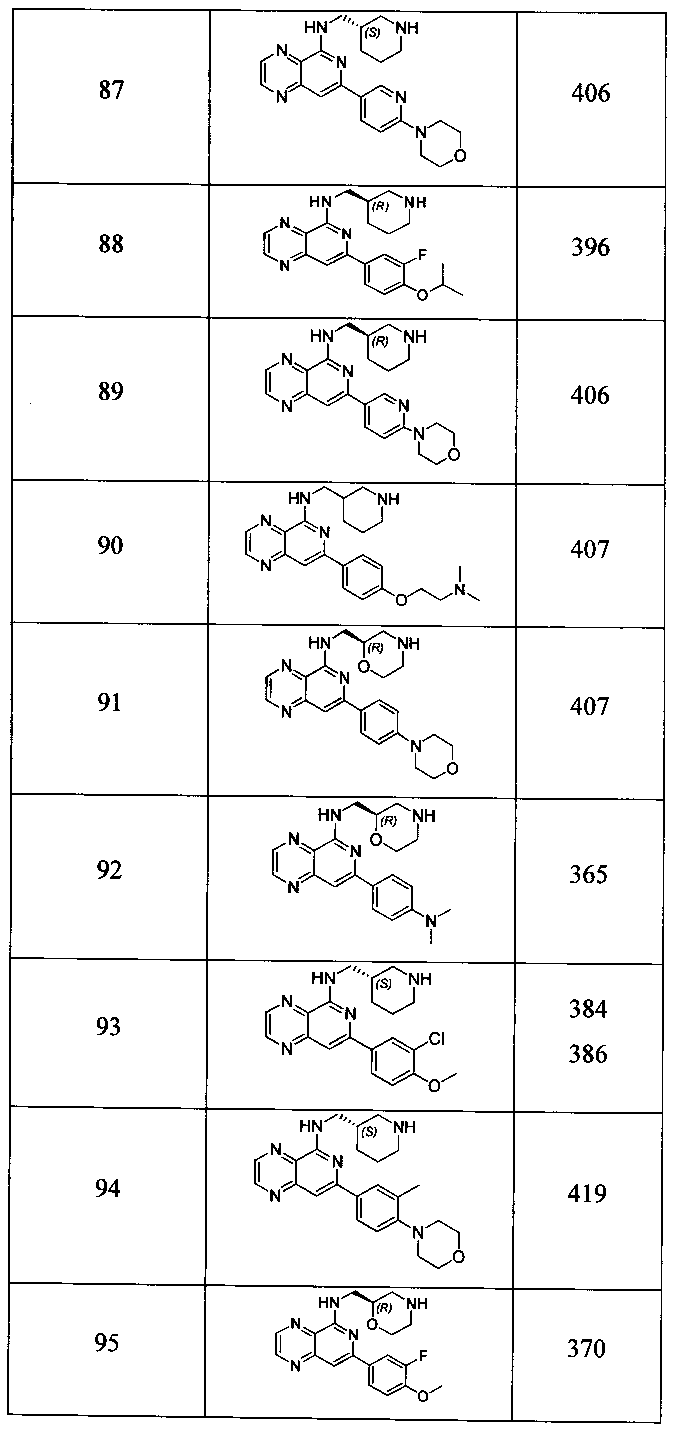
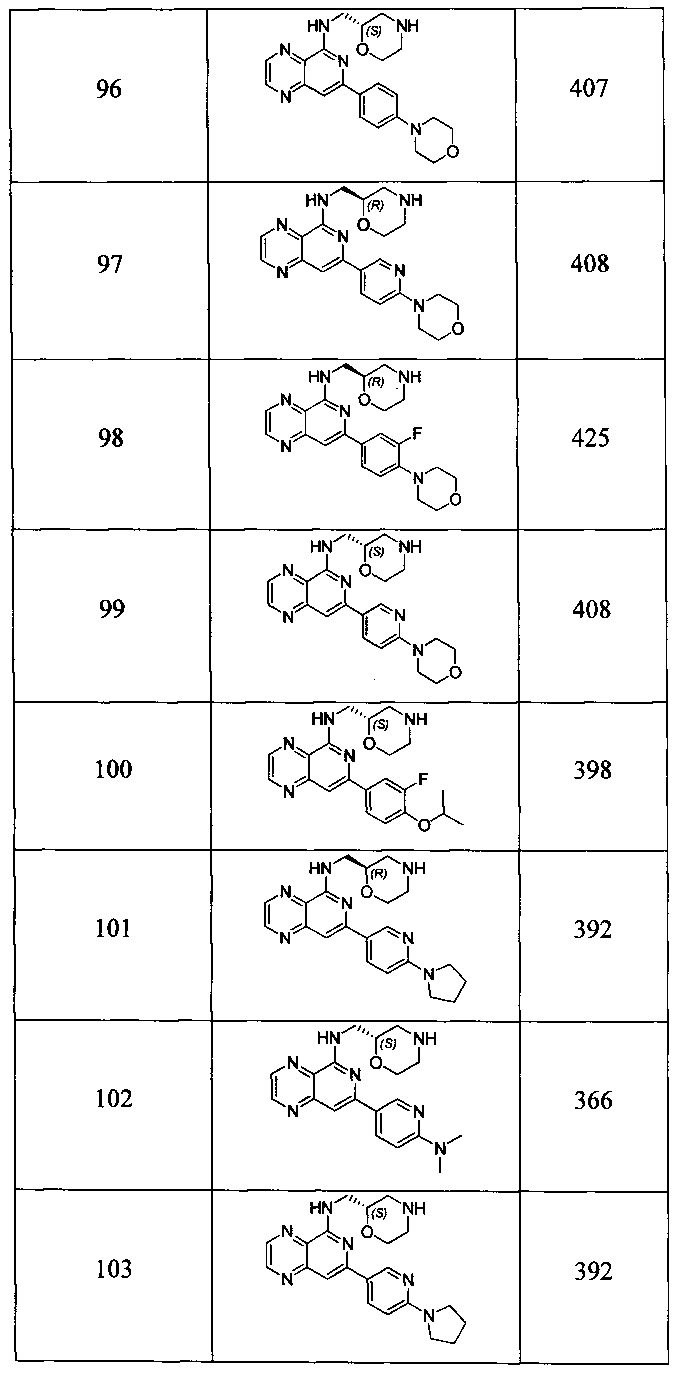
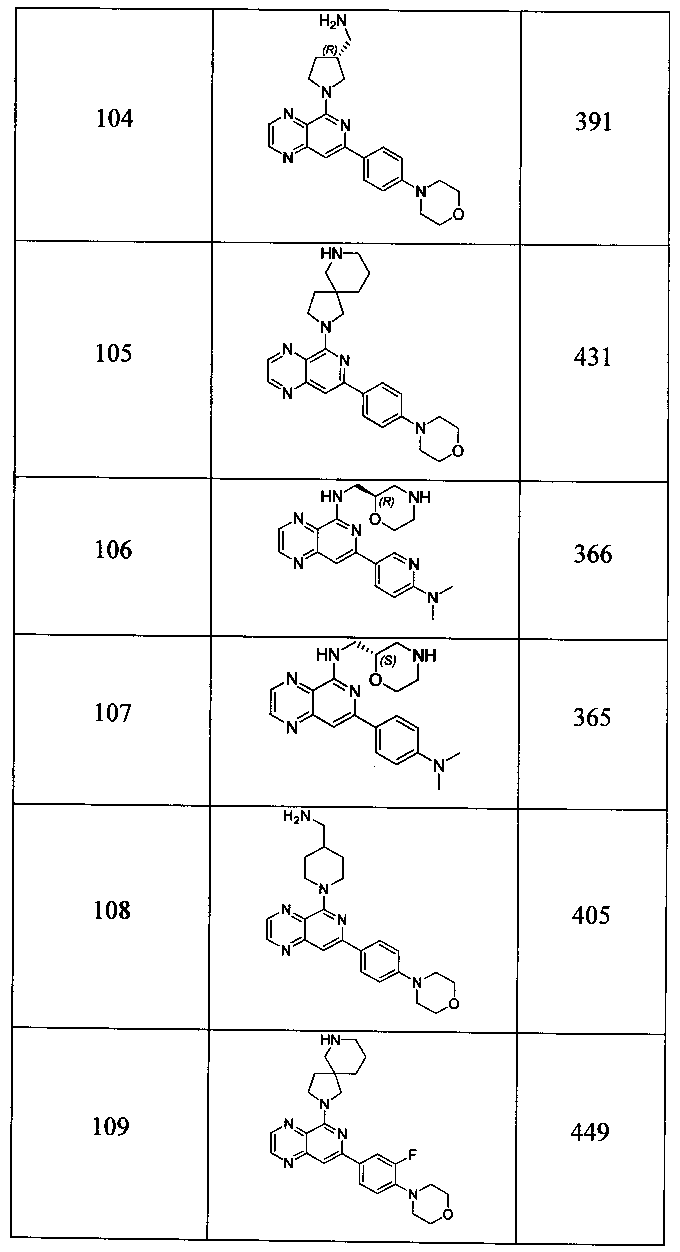
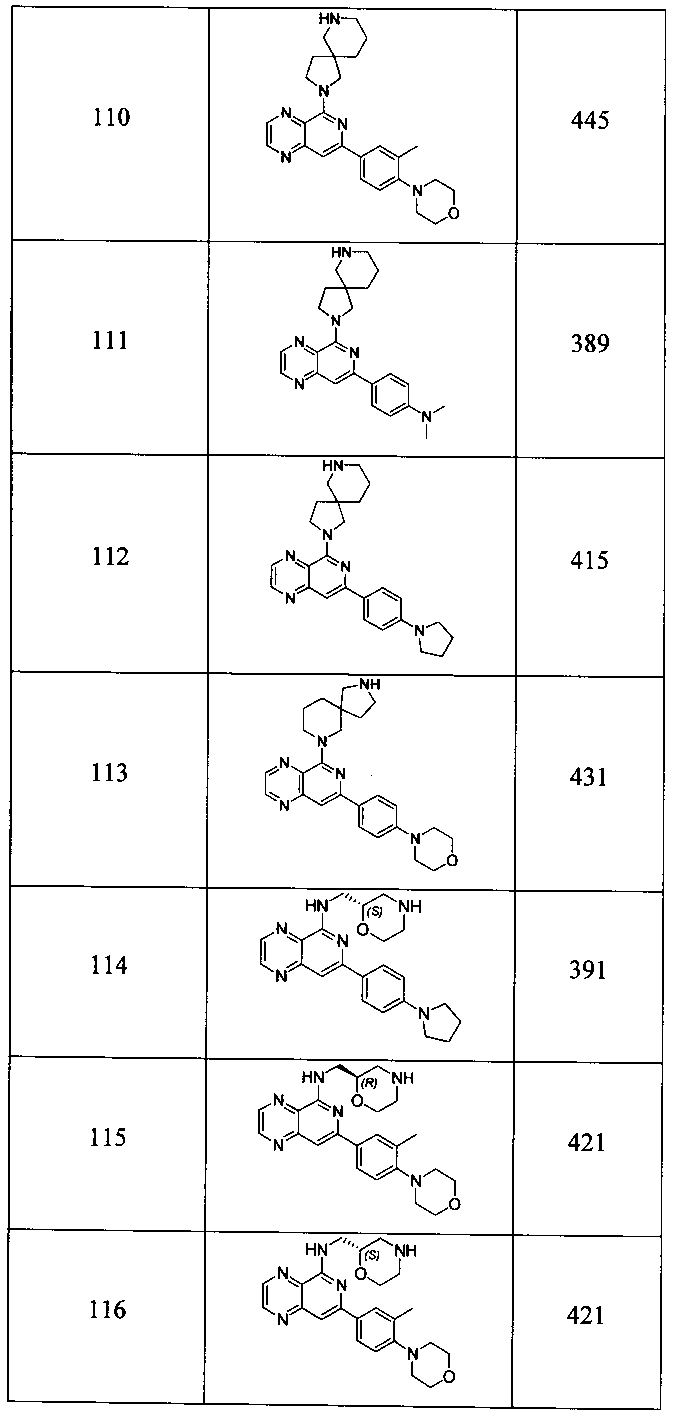
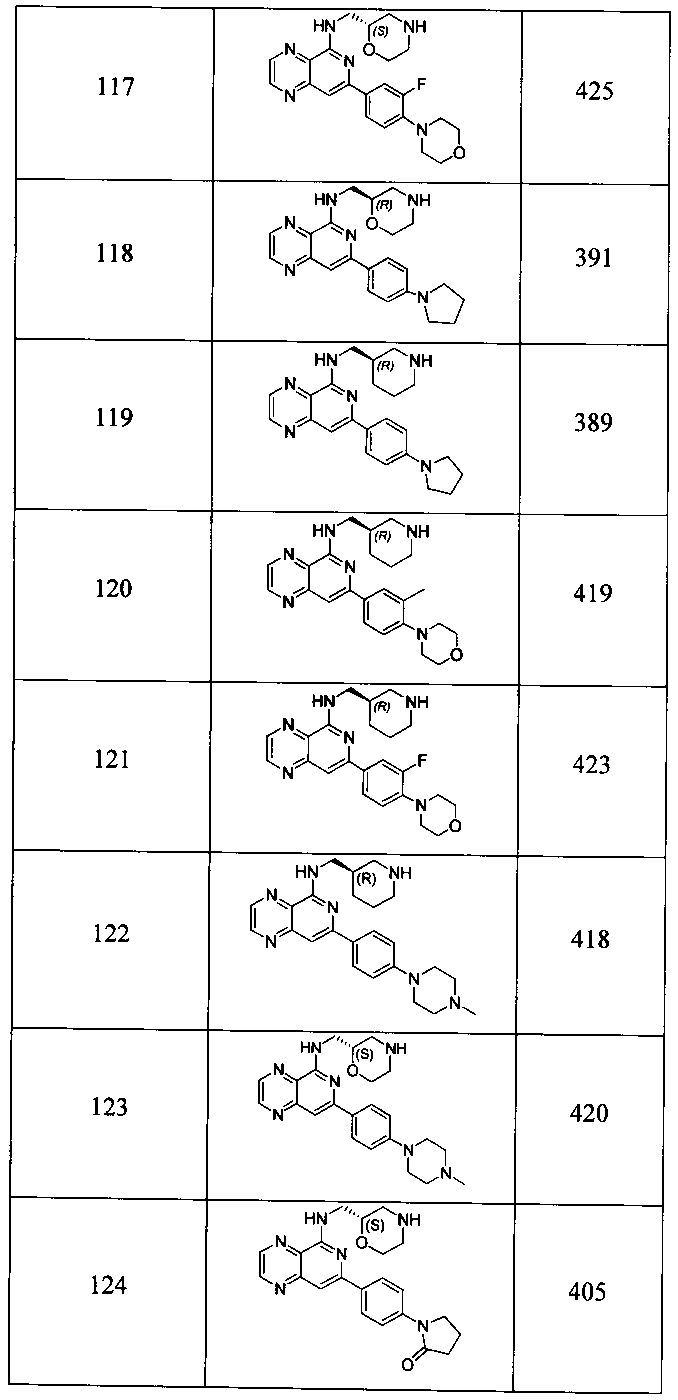
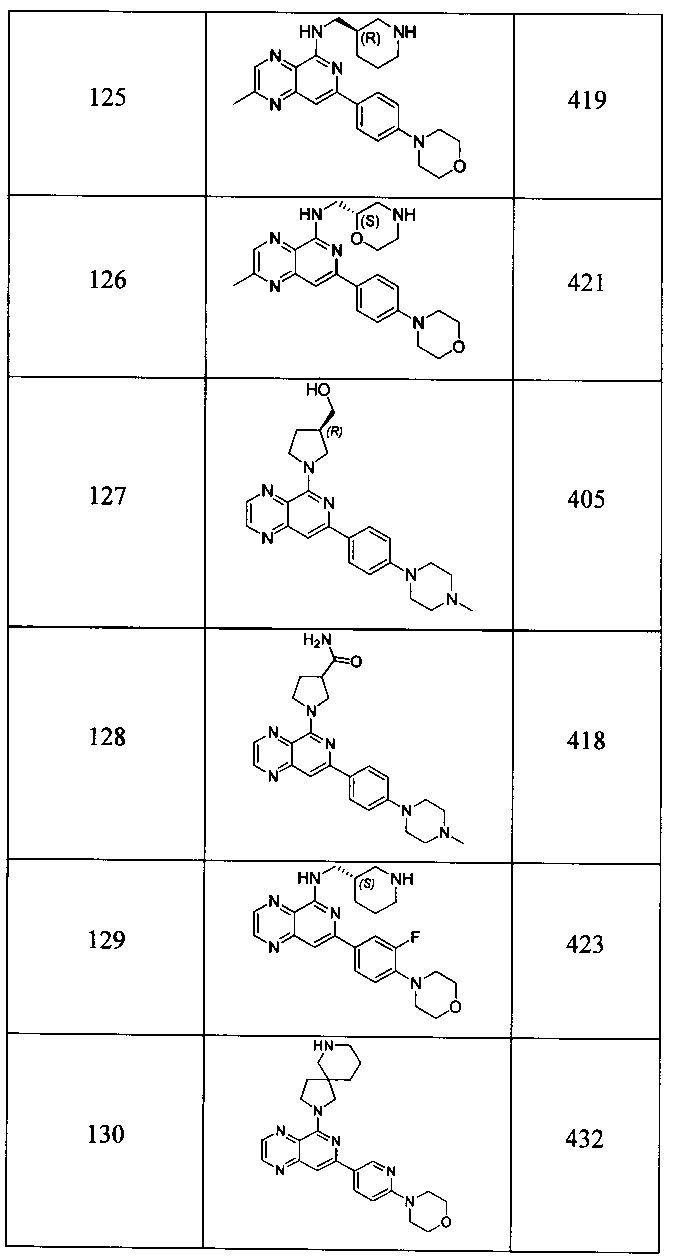
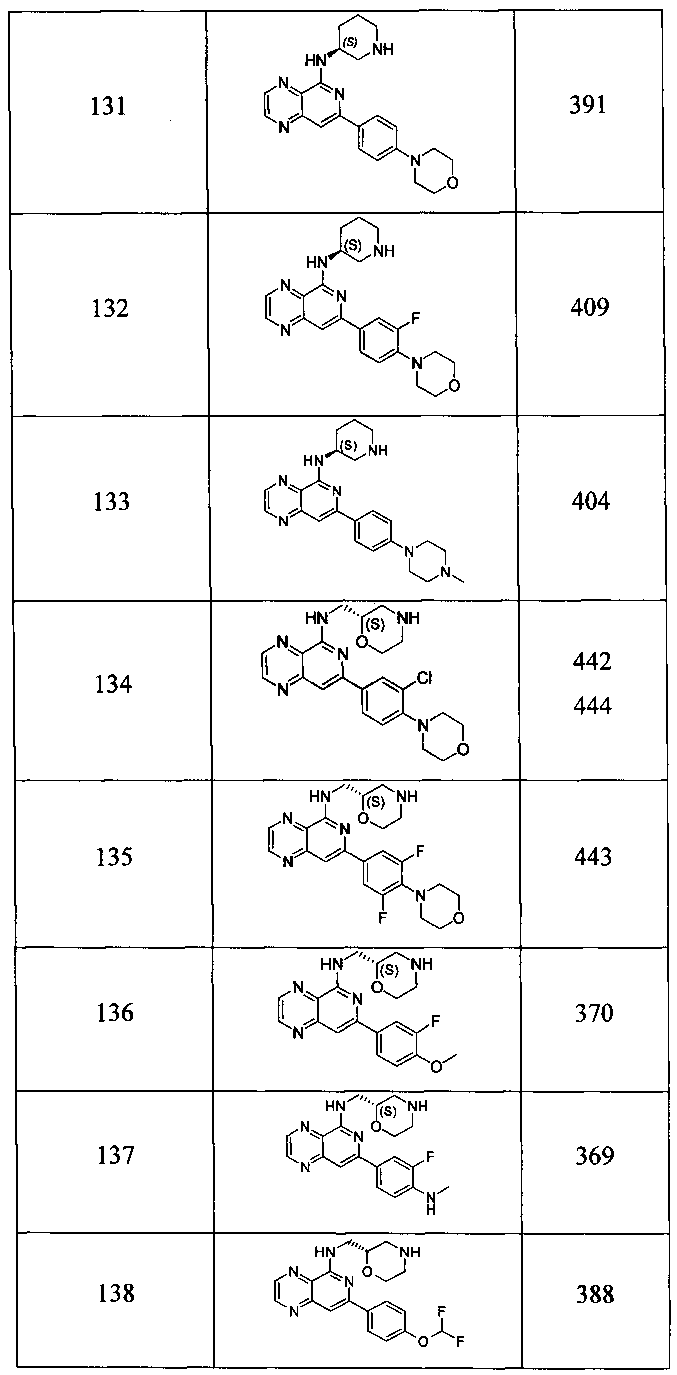
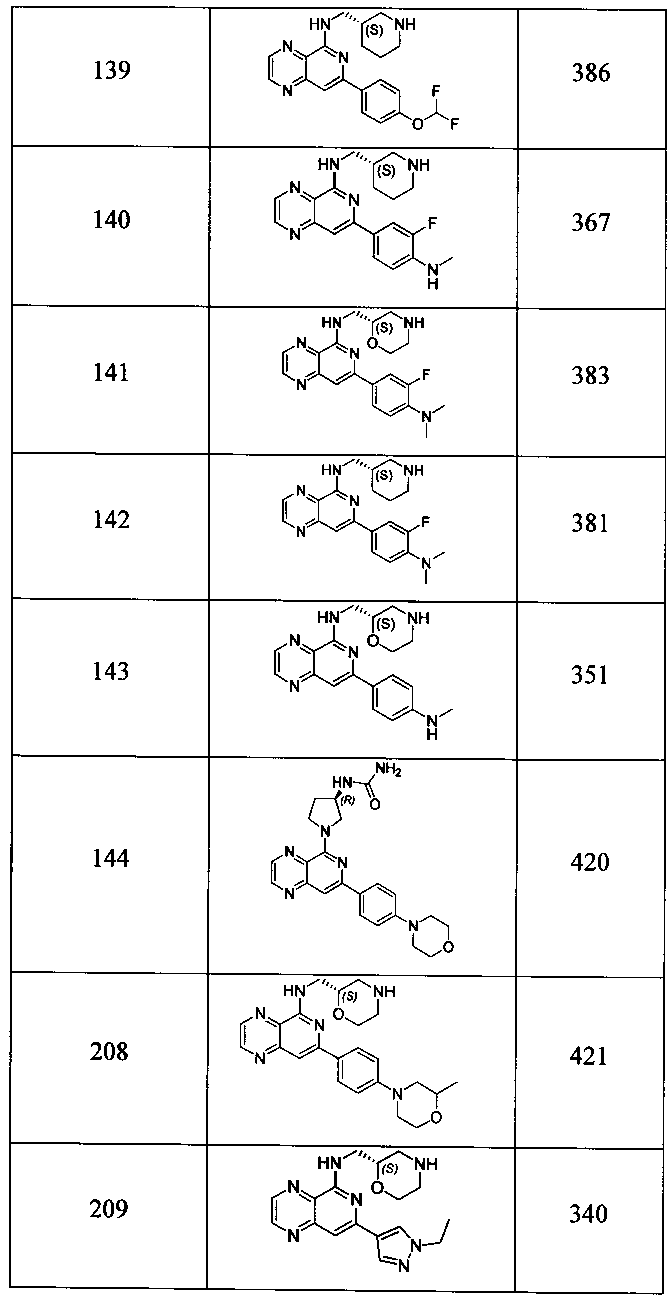
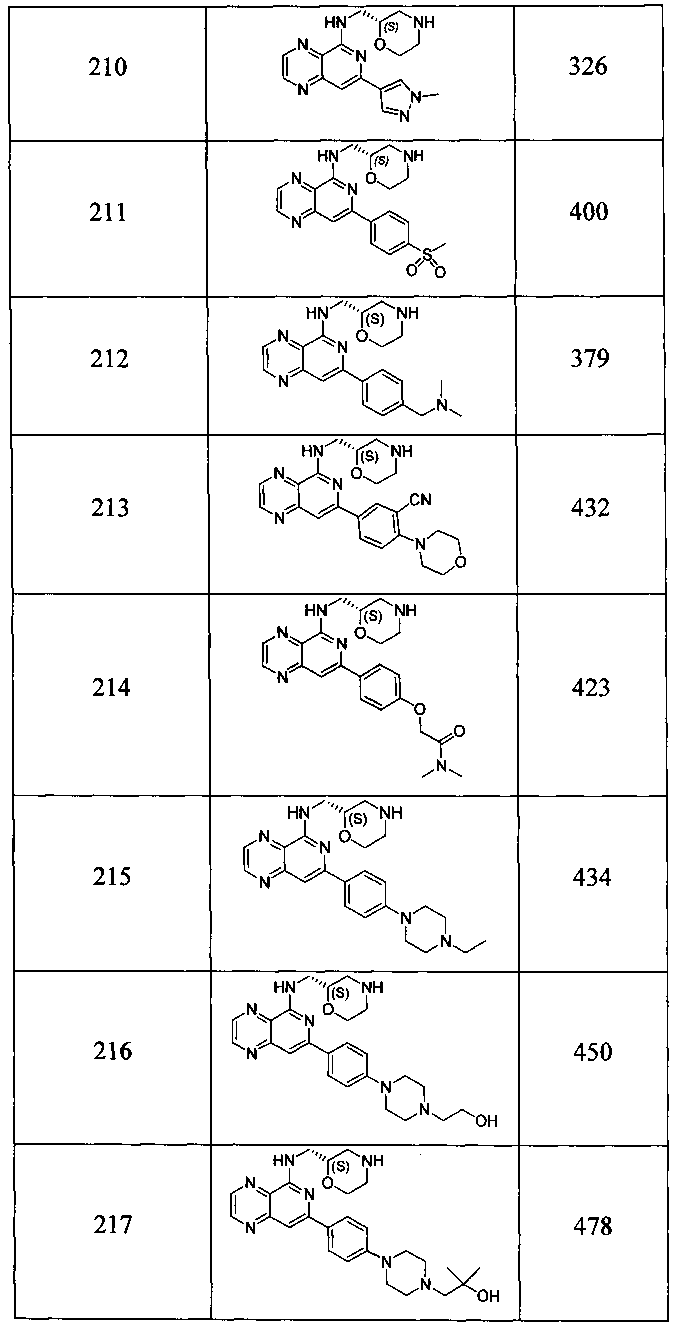
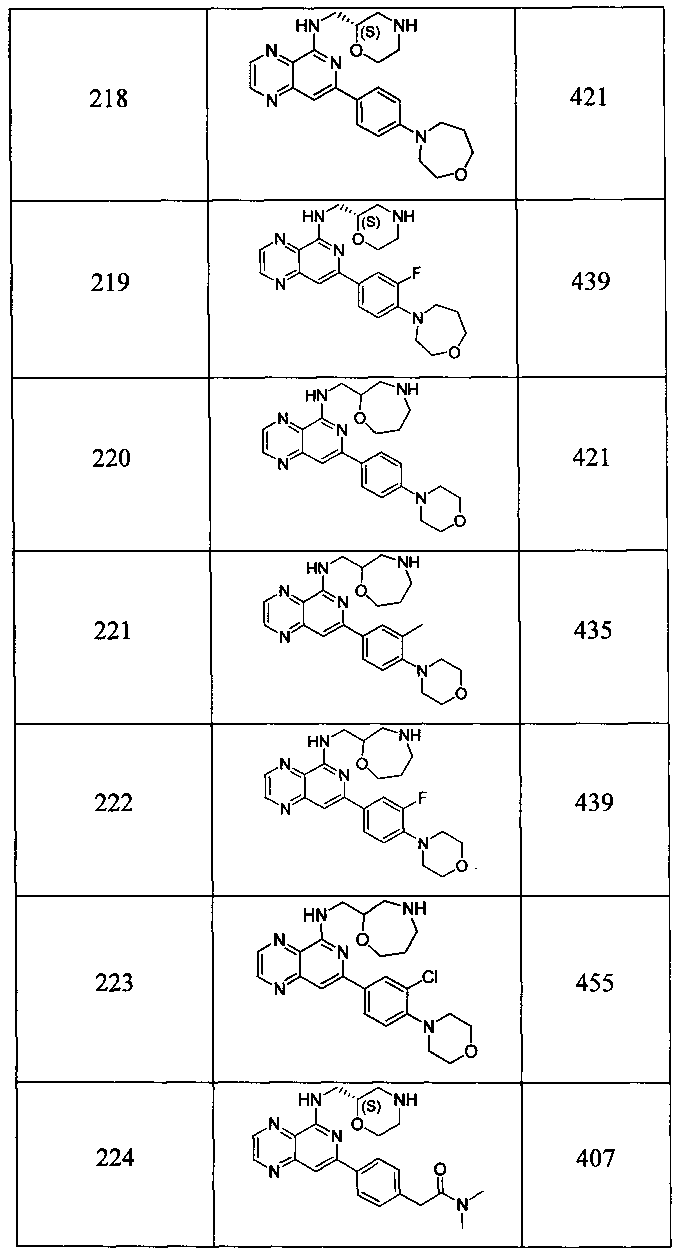
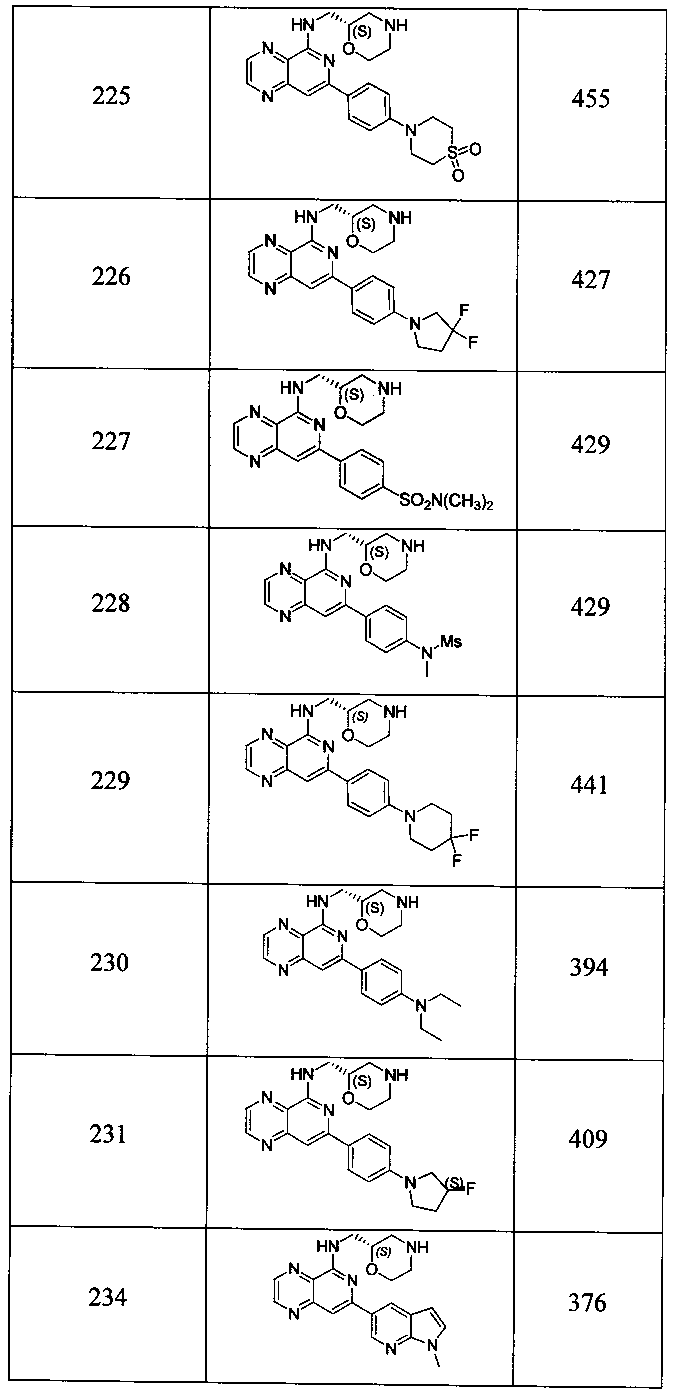
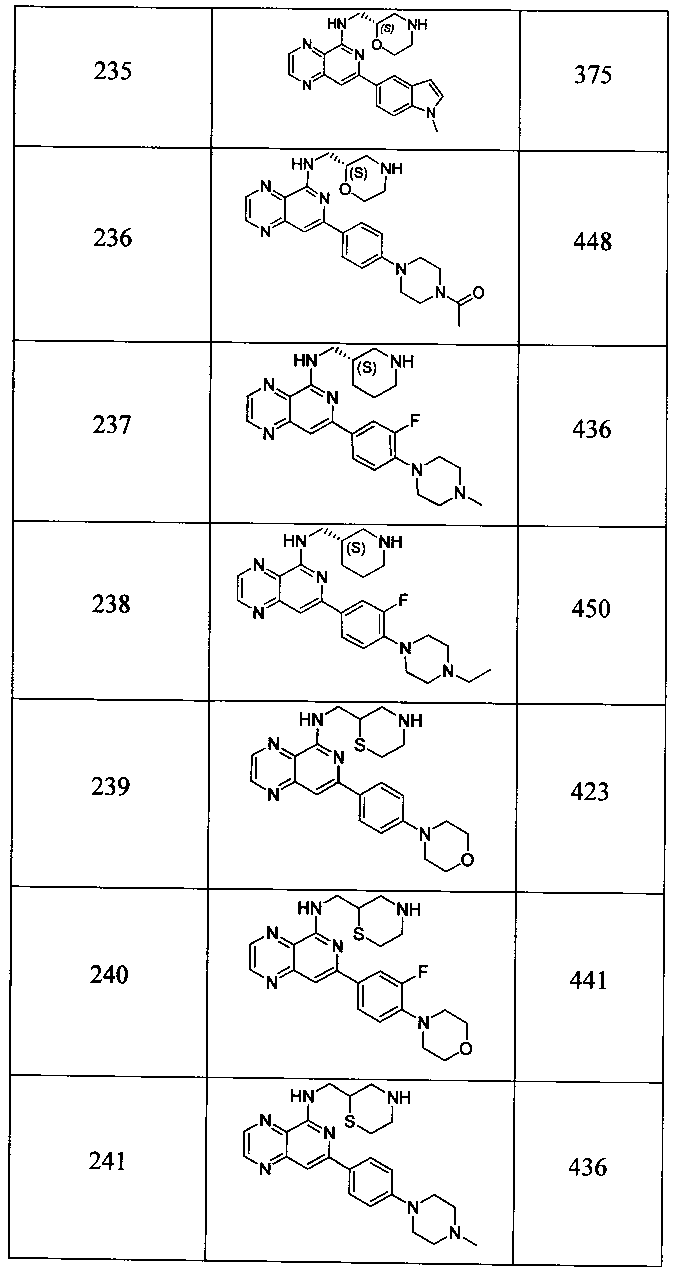
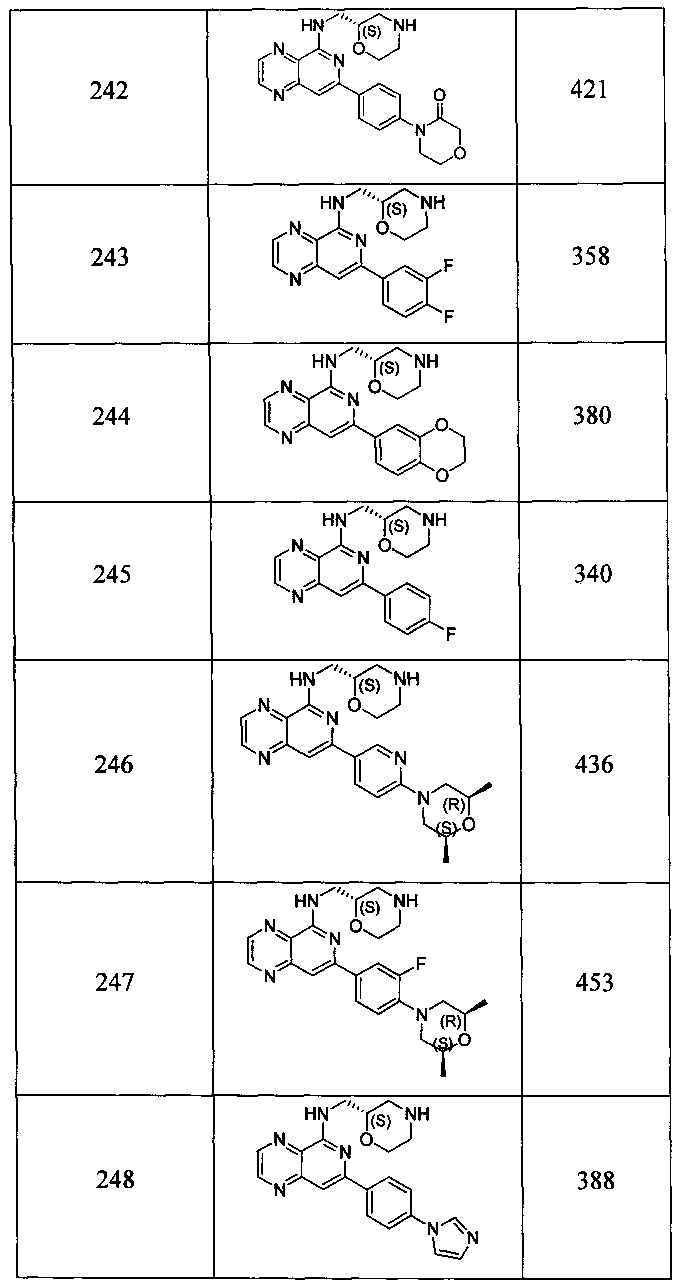
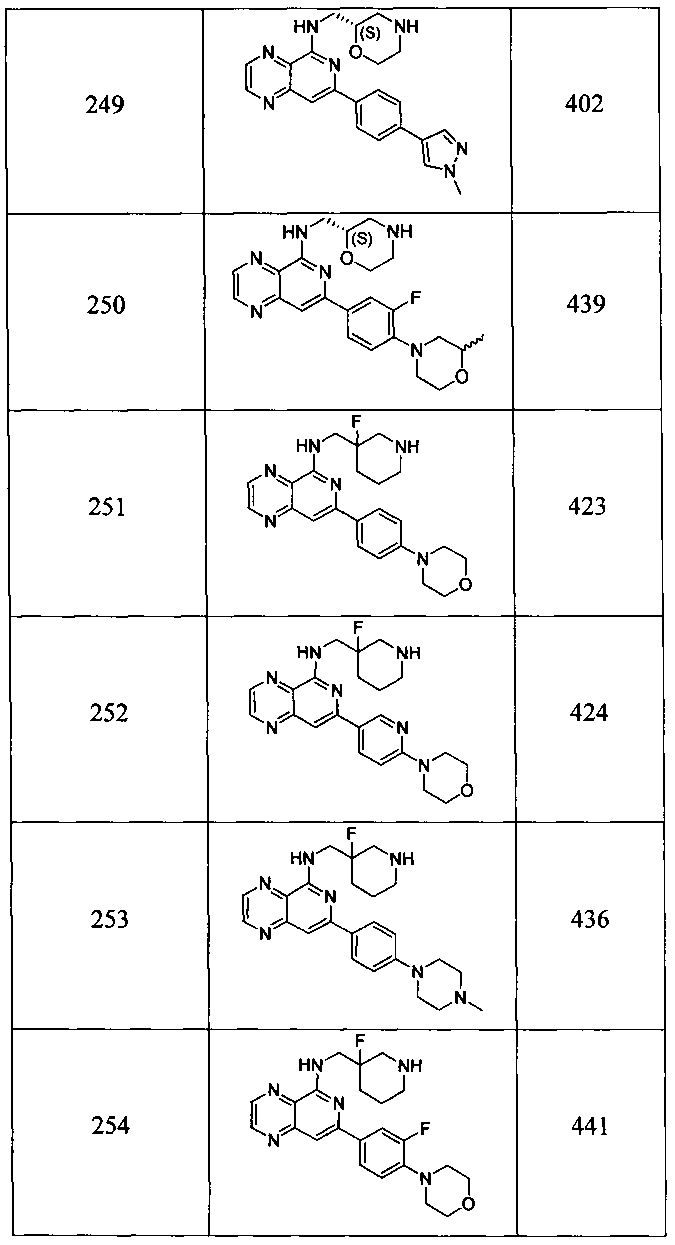
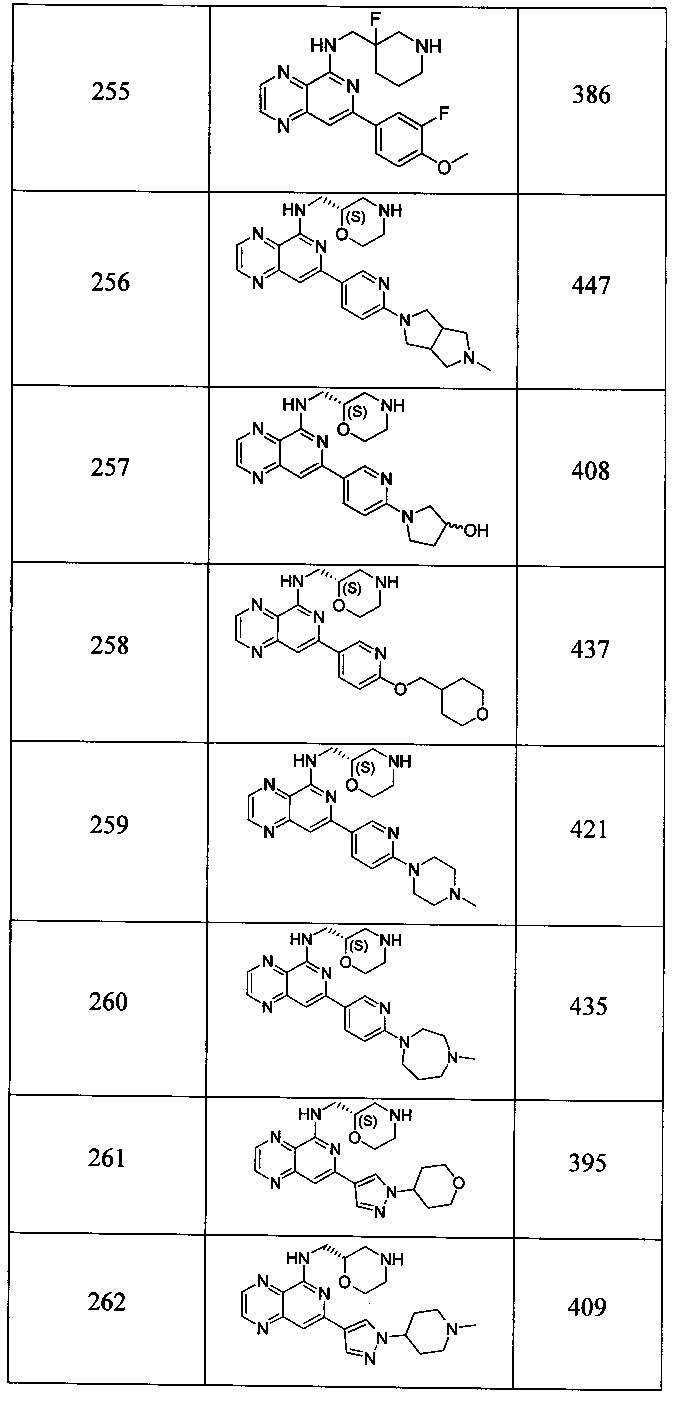
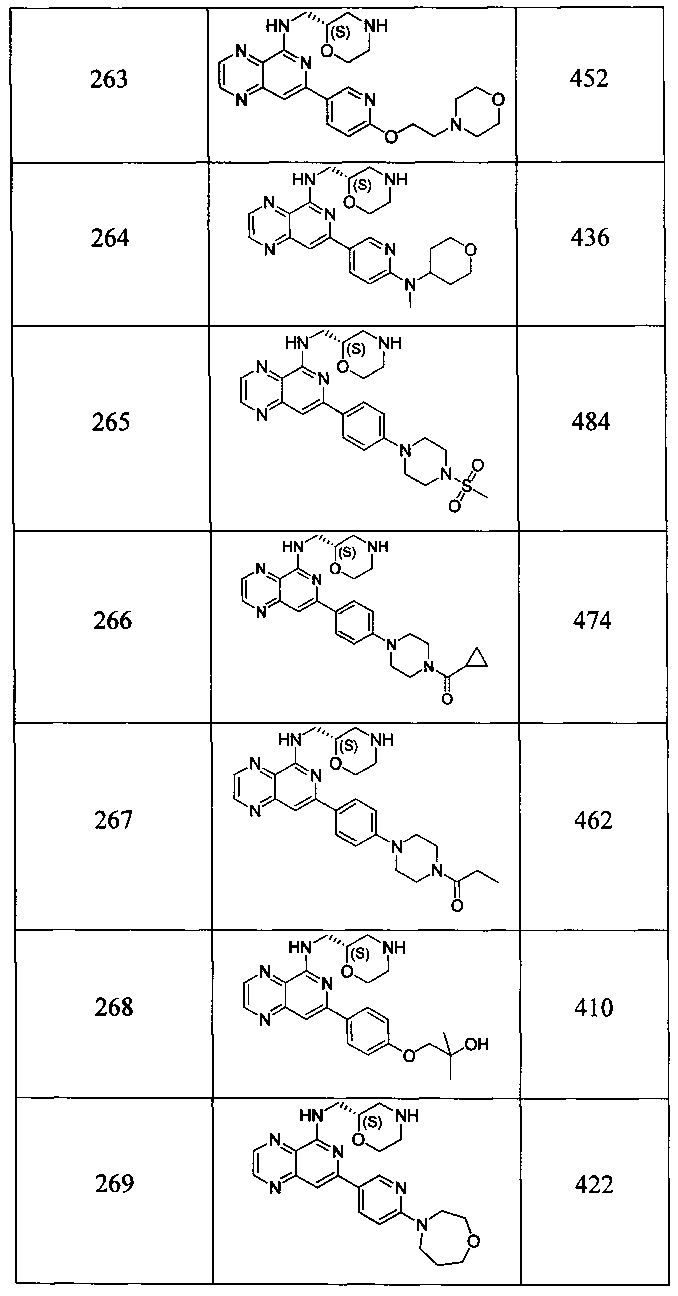
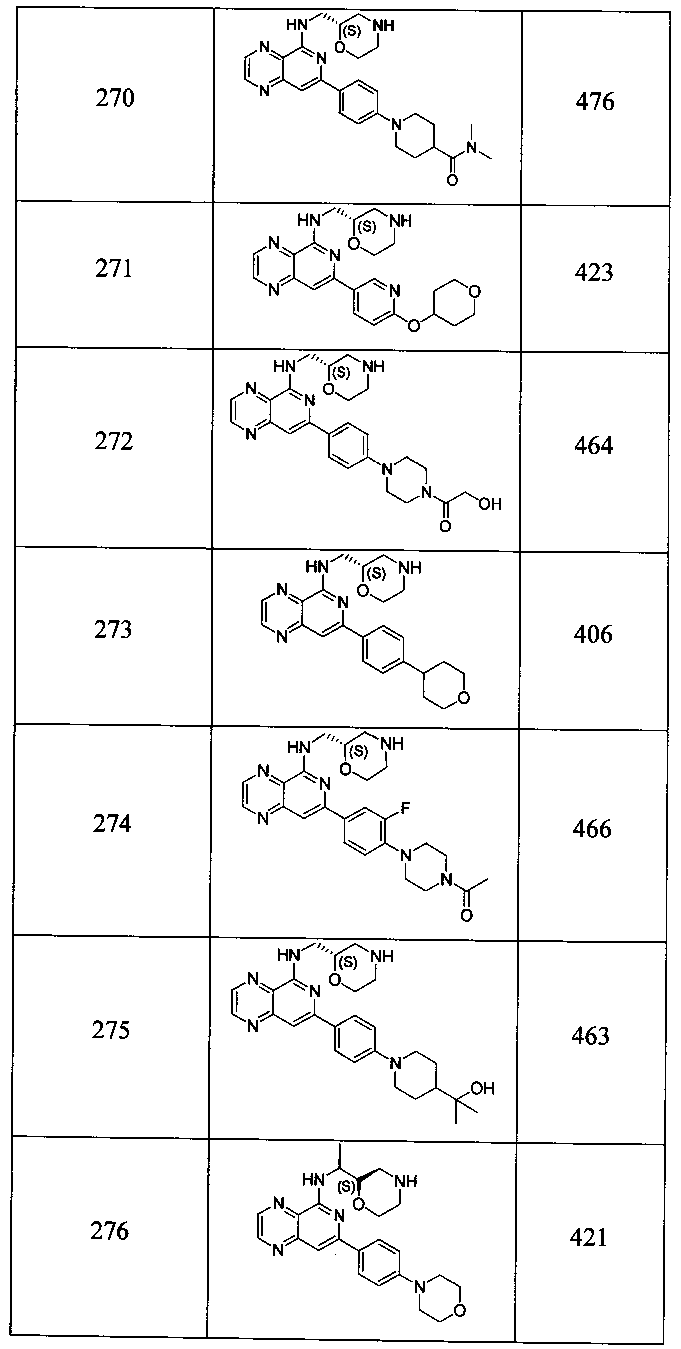
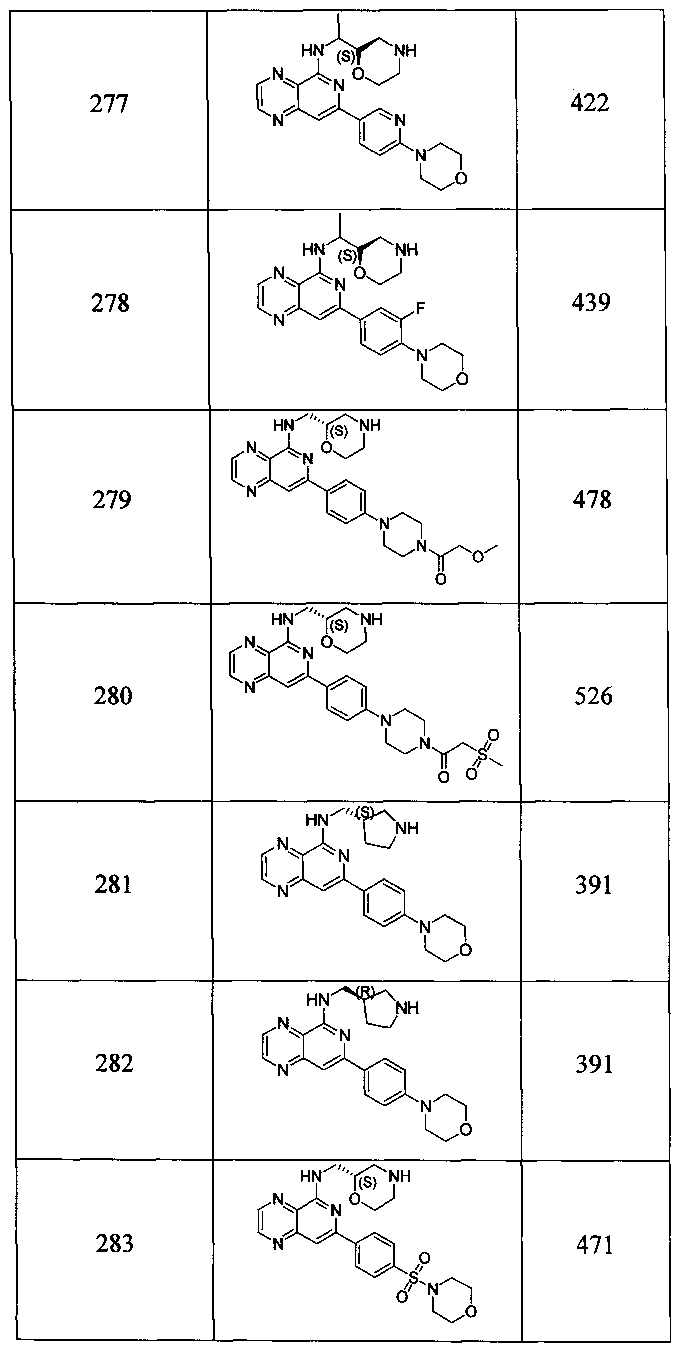
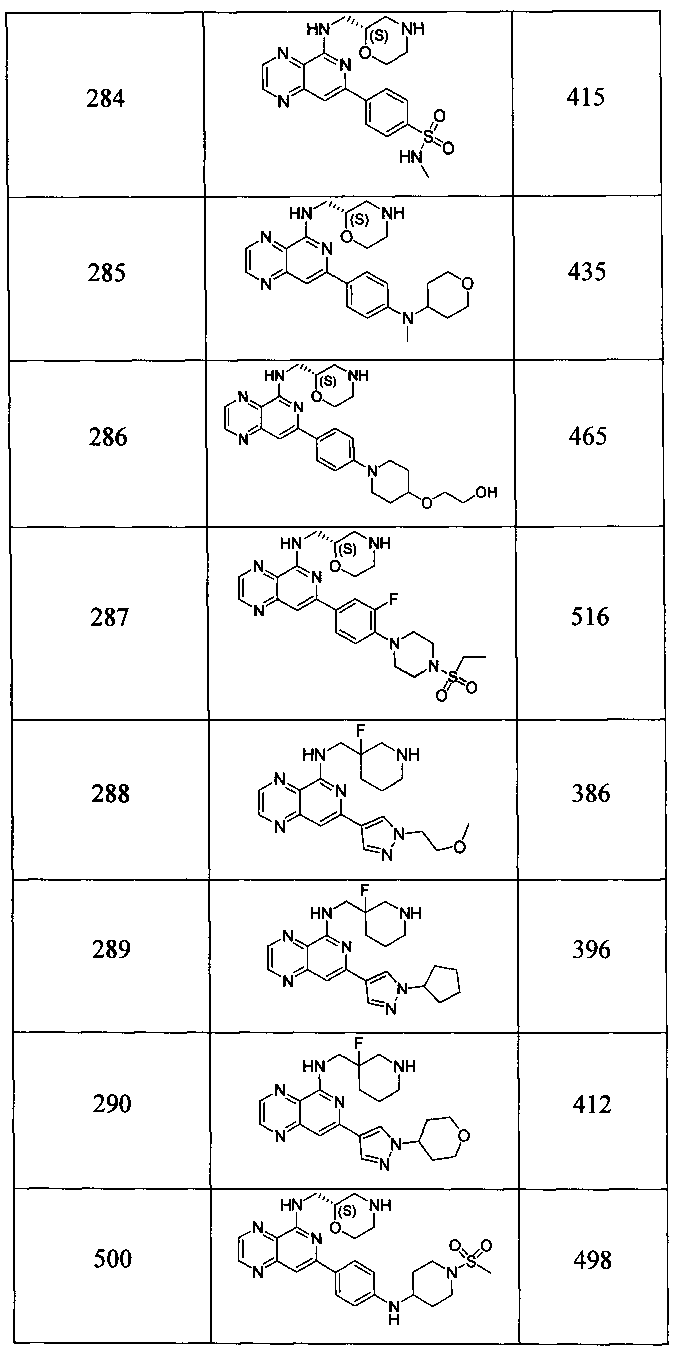
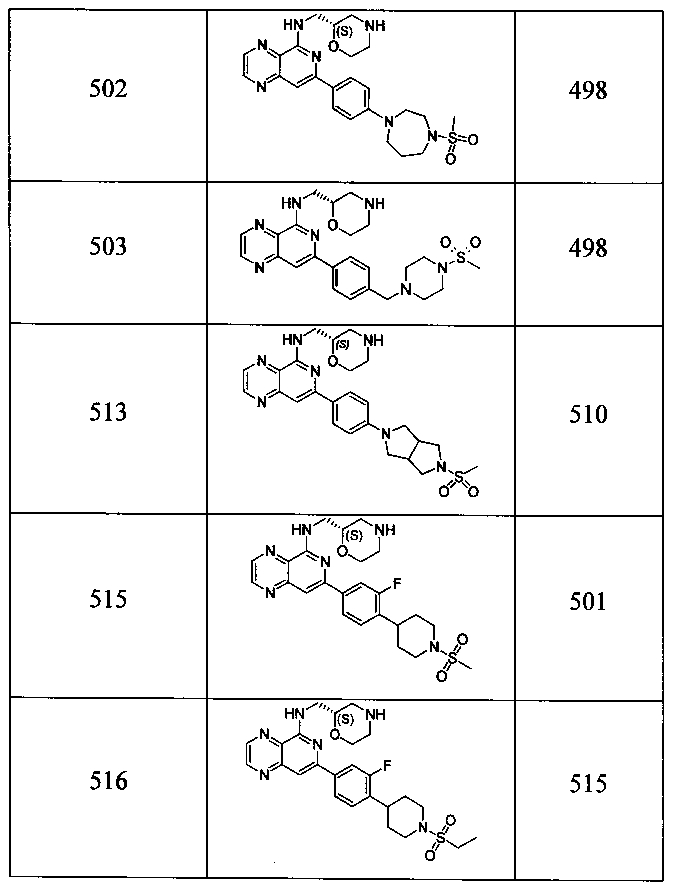
Соединение 145
4-(4-(5-(Гексагидропирроло[3,4-b]пиррол-5(1H)-ил)пиридо[4,3-b]пиразин-7-ил)фенил)морфолин
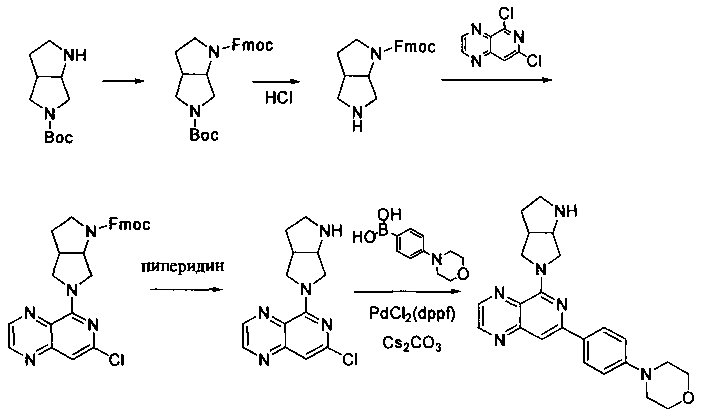
(A) 1-(9H-Флуорен-9-ил)метил-5-трет-бутил-гексагидропирроло[3,4-b]пиррол-1,5-дикарбоксилат
Раствор трет-бутил-гексагидропирроло[3,4-b]пиррол-5(1H)-карбоксилата (424 мг, 2 ммоль), N-(9-флуоренилметоксикарбонилокси)сукцинимида (600 мг, 1,8 ммоль) и DIPEA (310 мг, 2,4 ммоль) в диоксане (20 мл) взбалтывали при комнатной температуре в течение ночи, а затем концентрировали in vacuo. Остаток обрабатывали EtOAc/H2O, разделяли и водный слой экстрагировали с помощью EtOAc. Объединенные экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением названного соединения. MS (масса/заряд): 355 (M-boc+H)+.
(B) (9H-Флуорен-9-ил)метил-гексагидропирроло[3,4-b]пиррол-1(2H)-карбоксилат хлористоводородной кислоты
1-(9H-Флуорен-9-ил)метил-5-трет-бутил-гексагидропирроло[3,4-b]пиррол-1,5-дикарбоксилат (810 мг, 1,86 ммоль) обрабатывали HCl в MeOH (5 мл) в течение 2 часов, а затем концентрировали in vacuo с получением названного соединения.
(C) (9H-Флуорен-9-ил)метил-5-(7-хлорпиридо[4,3-b]пиразин-5-ил)гексагидропирроло[3,4-b]пиррол-1(2H)-карбоксилат
Смесь (9H-флуорен-9-ил)метил-гексагидропирроло[3,4-b]пиррол-1(2H)-карбоксилата (100 мг, 0,5 ммоль) и 5,7-дихлорпиридо[4,3-b]пиразина (600 мг, 1,8 ммоль) в диоксане взбалтывали при 0°C в течение 30 минут, а затем при комнатной температуре в течение 4 часов. Смесь концентрировали и остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 498 (M+H)+.
(D) 7-Хлор-5-(гексагидропирроло[3,4-b]пиррол-5(1H)-ил)пиридо[4,3-b]пиразин
Раствор (9H-флуорен-9-ил)метил-5-(7-хлорпиридо[4,3-b]пиразин-5-ил)гексагидропирроло[3,4-b]пиррол-1(2H)-карбоксилата (140 мг) и пиперидина (2 мл) в CH2Cl2 (8 мл) взбалтывали при комнатной температуре в течение 3 часов. Летучие компоненты удаляли при пониженном давлении. Остаток обрабатывали EtOAc/H2O, разделяли и водный раствор экстрагировали с помощью EtOAc. Объединенные экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 276 (M+H)+.
(E) 4-(4-(5-(Гексагидропирроло[3,4-b]пиррол-5(1H)-ил)пиридо[4,3-b]пиразин-7-ил)фенил)морфолин
Смесь 7-хлор-5-(гексагидропирроло[3,4-b]пиррол-5(1H)-ил)пиридо[4,3-b]пиразина (47 мг, 0,17 ммоль), 4-морфолинофенилбороновой кислоты (105 мг, 0,51 ммоль) и PdCl2(dppf) (10 мг), Cs2CO3 (130 мг, 0,51 ммоль) в диоксане (5 мл) закрывали в реакционной пробирке для микроволнового реактора, взбалтывали при 180°C в течение 60 минут в микроволновом реакторе, охлаждали до температуры окружающей среды, концентрировали при пониженном давлении и остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 403 (M+H)+.
Следующее соединение получали согласно процедурам для соединения 145 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
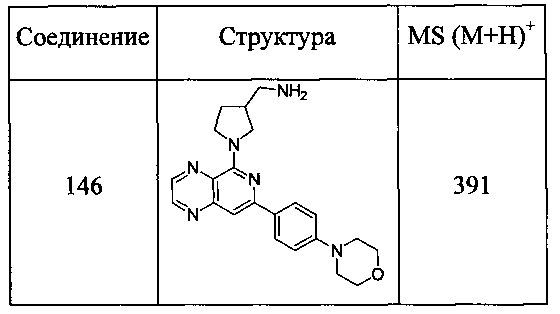
Соединение 147
(S)-N-Метил(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамин
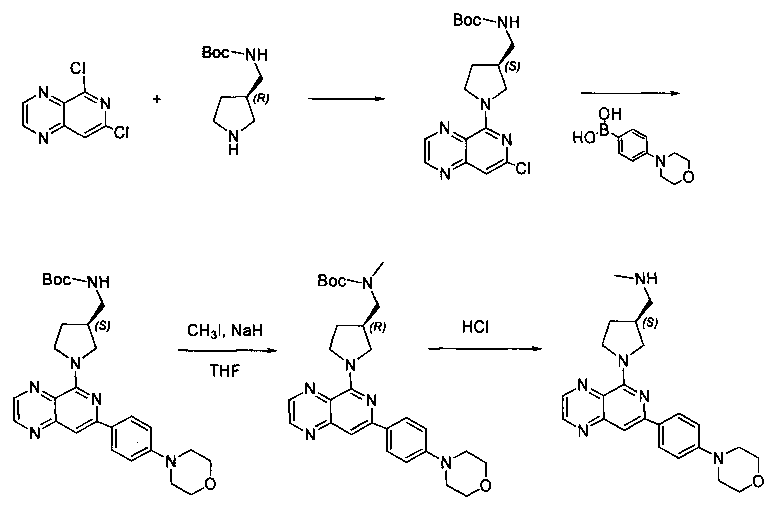
(A) (S)-Трет-бутил-(1-(7-хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилкарбамат
Названное соединение получали согласно процедуре для соединения 1 (A) с использованием (R)-трет-бутил-пирролидин-3-илметилкарбамата. MS (масса/заряд): 364 (M+H)+.
(B) (S)-Трет-бутил-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилкарбамат
Названное соединение получали согласно процедуре для соединения 1 (B) с использованием (S)-трет-бутил-(1-(7-хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилкарбамата. MS (масса/заряд): 491 (M+H)+.
(C) (R)-Трет-бутил-метил((1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метил)карбамат
Под N2 к раствору (S)-трет-бутил-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилкарбамата (150 мг, 0,31 ммоль) в безводном THF (10 мл) медленно добавляли гидрид натрия (49 мг, 1,22 ммоль) при 0°C. Смесь нагревали и взбалтывали при комнатной температуре в течение 0,5 часа. Реакционную смесь затем охлаждали до 0°C и медленно добавляли CH3I (174 мг, 1,22 ммоль). После завершения добавления реакционную смесь взбалтывали при нагревании с обратным холодильником в течение 4 часов, охлаждали до температуры окружающей среды, гасили H2O и экстрагировали с помощью EtOAc. Объединенные экстракты сушили и концентрировали с получением названного соединения. MS (масса/заряд): 505 (M+H)+.
(D) (S)-N-Метил(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамин
Названные соединения получали согласно процедуре для соединения 1 (C) с использованием (R)-трет-бутил-метил((1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метил)карбамата. MS (масса/заряд): 405 (M+H)+.
Следующее соединение 148 получали согласно процедурам для соединения 147 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
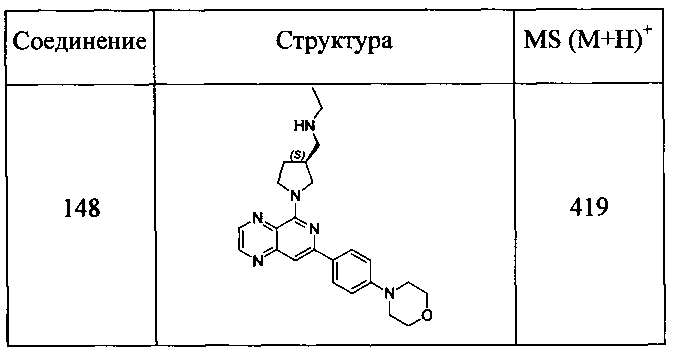
Соединение 149
(R)-N-((1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метил)метансульфонамид
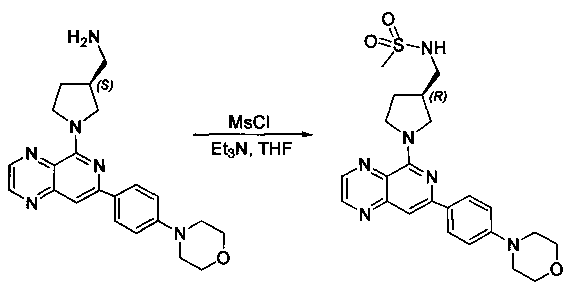
((R)-N-((1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метил)метансульфонамид
Под N2 к раствору (S)-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамина (соединения 77, 51 мг, 0,13 ммоль) и Et3N (0,04 мл, 0,26 ммоль) в безводном THF (3 мл) добавляли MsCl (30 мг, 0,26 ммоль) при 0°C. Реакционную смесь взбалтывали при температуре окружающей среды в течение 0,5 часа, затем гасили H2O и экстрагировали с помощью EtOAc. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией с получением названного соединения. MS (масса/заряд): 469 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 149 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
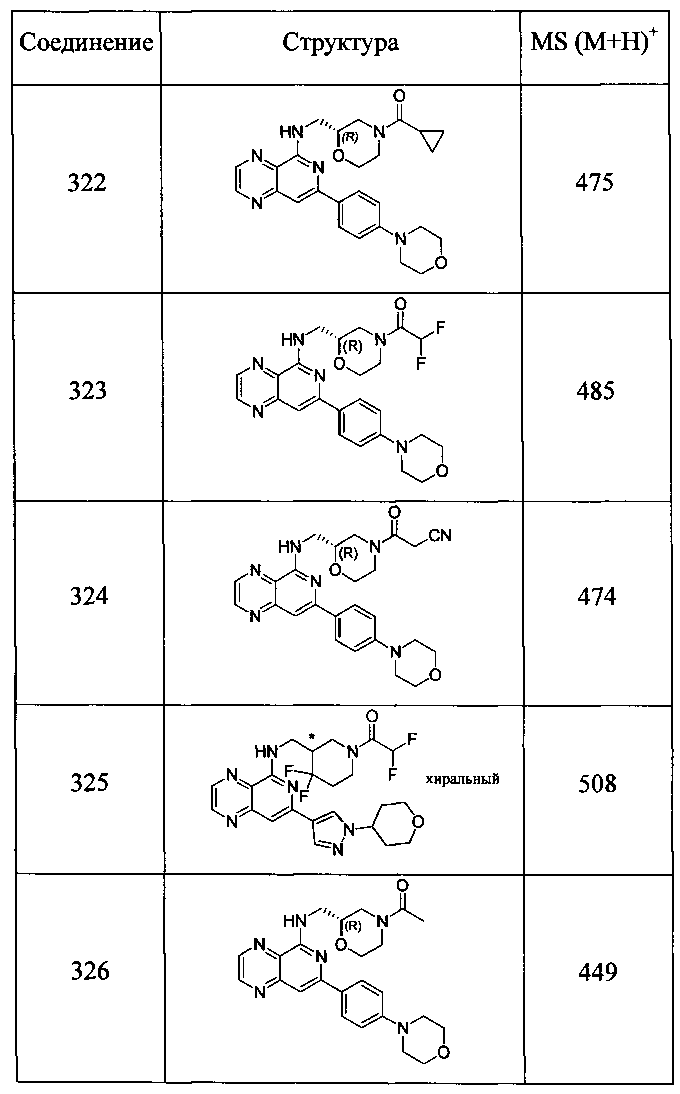
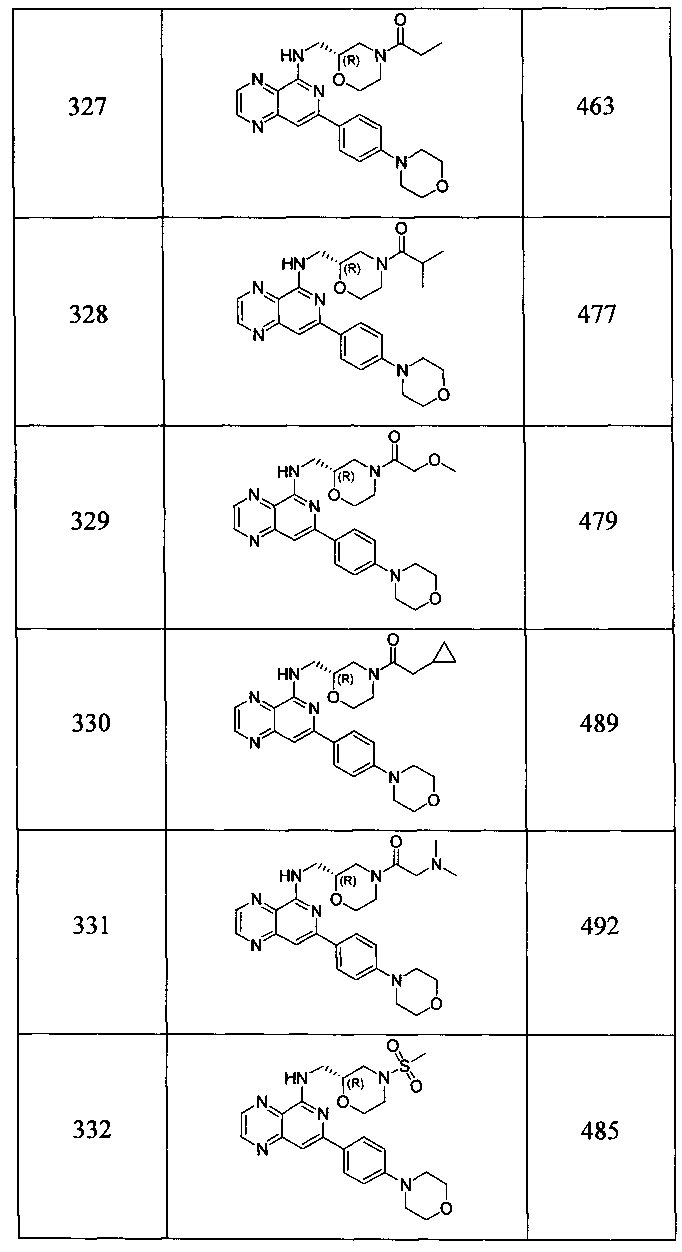
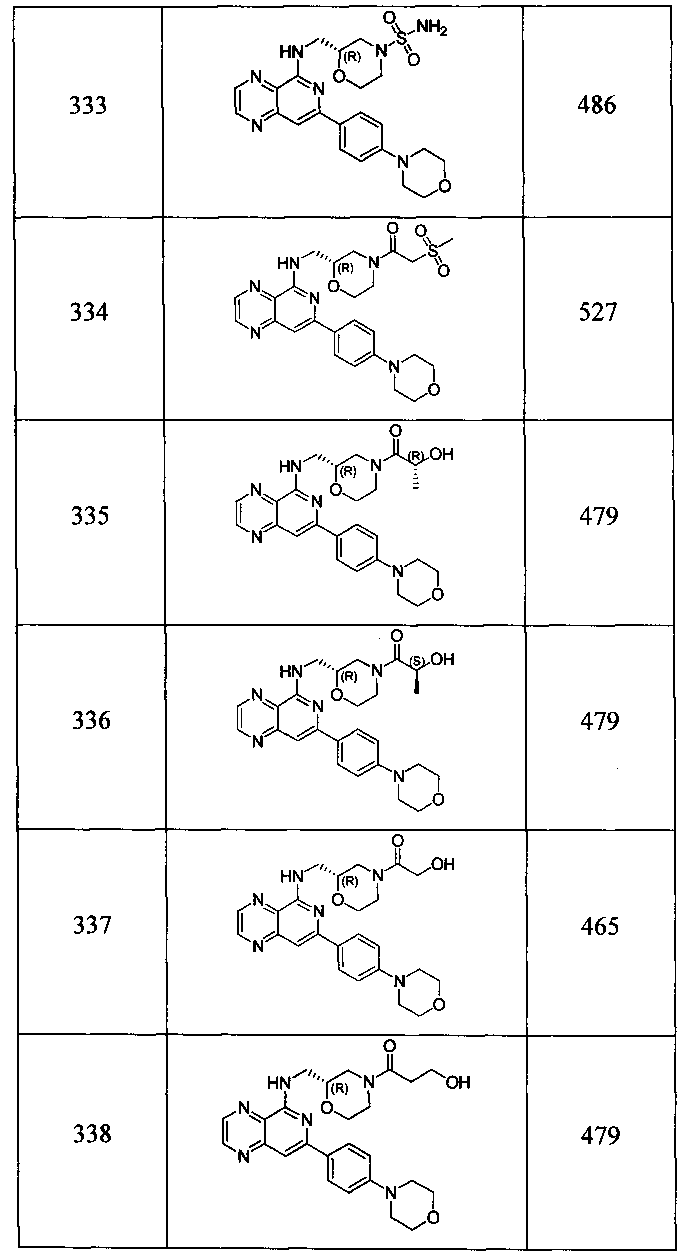
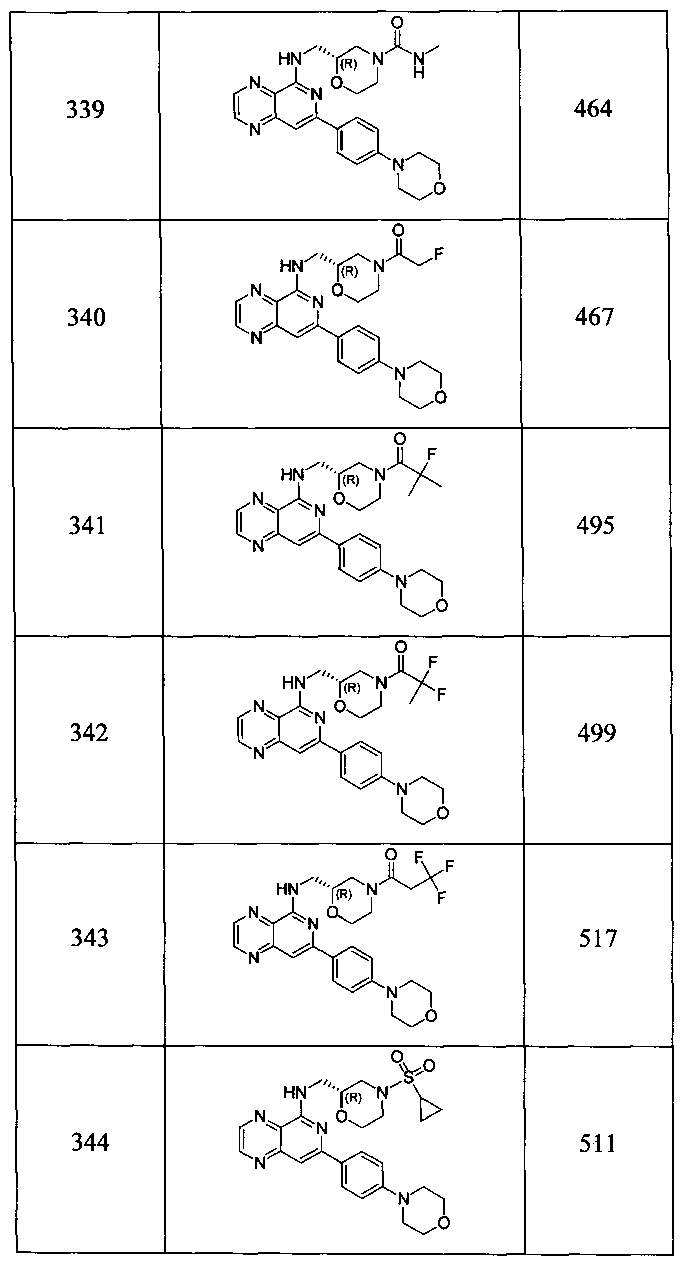
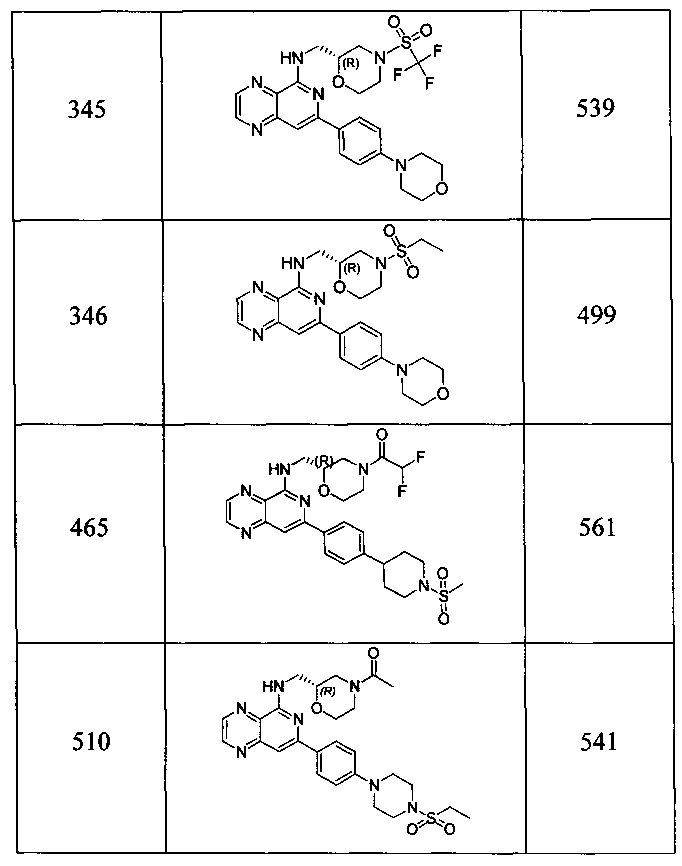
Соединение 150
(S)-1-((1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метил)мочевина
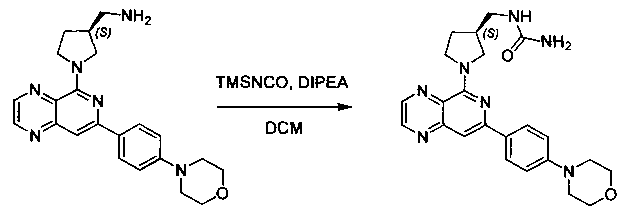
Раствор (S)-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамина (соединения 77, 0,16 ммоль), DIPEA (207 мг, 1,6 ммоль) и TMSNCO (184 мг, 1,6 ммоль) в безводном CH2Cl2 (5 мл) взбалтывали при комнатной температуре в течение 70 часов. Реакционную смесь выливали в насыщенный водный NaHCO3 и экстрагировали с помощью CH2Cl2. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 434 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 150 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
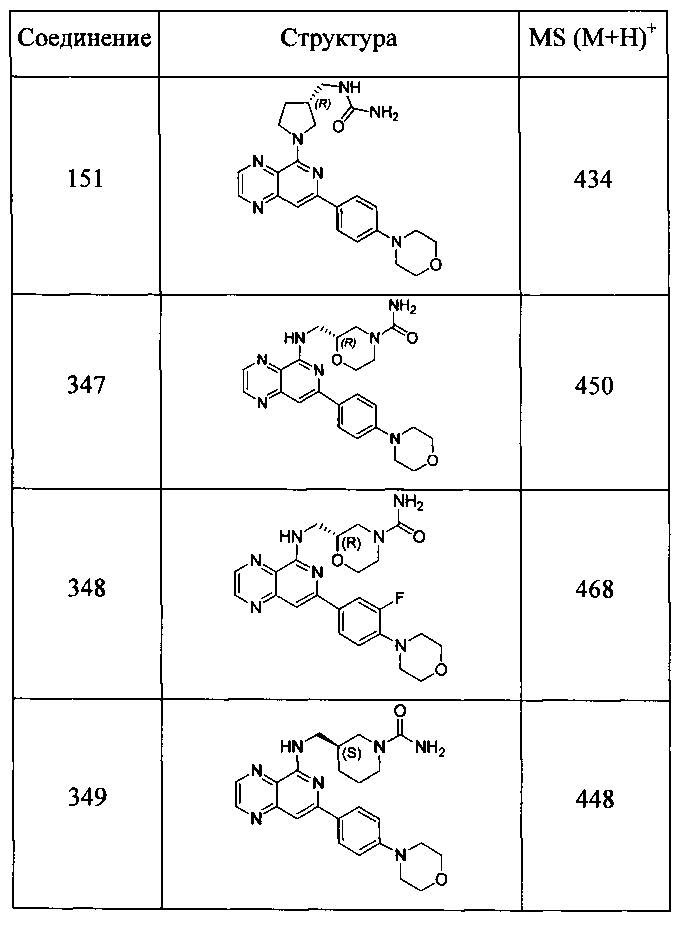
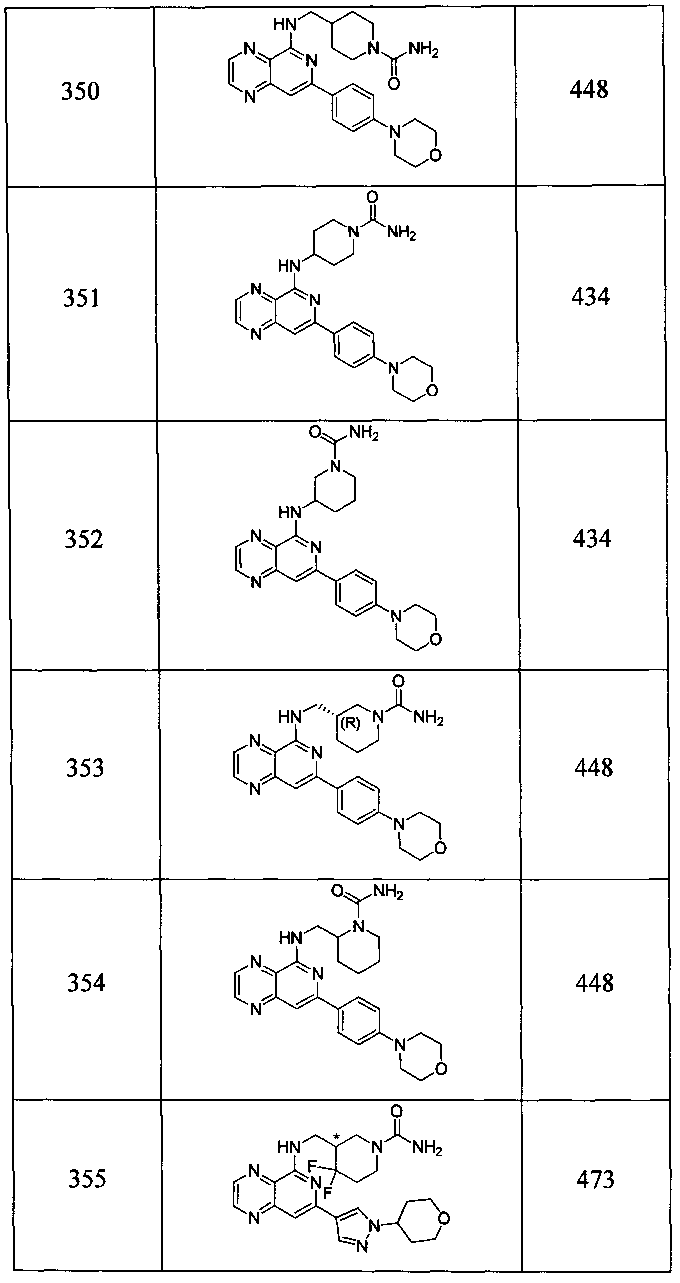
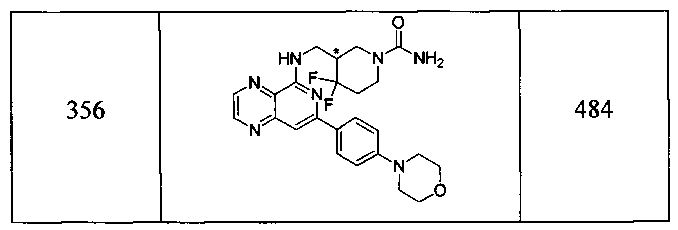
Соединение 152
N-((1-Метилпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
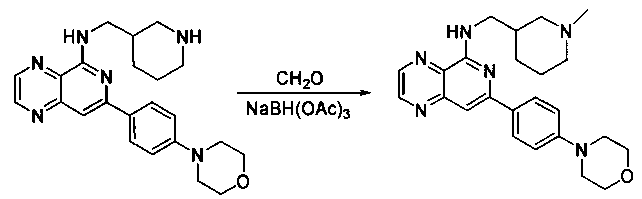
Раствор 7-(4-морфолинофенил)-N-(пиперидин-3-илметил)пиридо[4,3-b]пиразин-5-амина (соединения 3, 40 мг, 0,1 ммоль) и формальдегида (60 мг, 2,0 ммоль), NaBH(OAc)3 (25 мг, 0,15 ммоль) в THF (20 мл) взбалтывали при температуре окружающей среды в течение ночи, затем концентрировали при пониженном давлении. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 419 (M+H)+.
Соединение 153
N-Метил-7-(4-морфолинофенил)-N-(пиперидин-3-илметил)пиридо[4,3-b]пиразин-5-амин
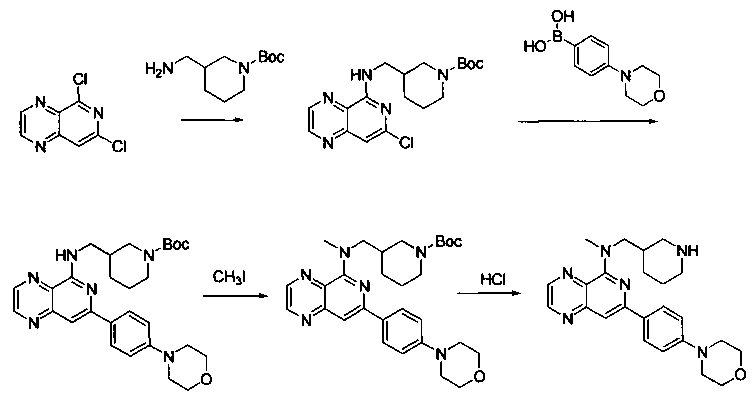
(A) Трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Названное соединение получали согласно процедуре для соединения 1 (A) с использованием трет-бутил-3-(аминометил)пиперидин-1-карбоксилата. MS (масса/заряд): 378 (M+H)+.
(B) Трет-бутил-3-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Названное соединение получали согласно процедуре для соединения 1 (B). MS (масса/заряд): 505 (M+H)+.
(C) Трет-бутил-3-((метил(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)амино)метил)пиперидин-1-карбоксилат
К раствору трет-бутил-3-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилата (100 мг, 0,2 ммоль) в THF (20 мл) добавляли NaH (30 мг, 0,6 ммоль). Смесь взбалтывали в течение 2~3 часов при 0°C, а затем каплями добавляли йодметан (142 мг, 1 ммоль). Реакционную смесь взбалтывали при комнатной температуре в течение ночи, гасили водой и концентрировали при пониженном давлении. Остаток очищали хроматографией с получением названного соединения.
(D) N-Метил-7-(4-морфолинофенил)-N-(пиперидин-3-илметил)пиридо[4,3-b]пиразин-5-амин
Названные соединения получали согласно процедуре для соединения 1 (C) с использованием трет-бутил-3-((метил(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)амино)метил)пиперидин-1-карбоксилата. MS (масса/заряд): 419 (M+H)+.
Следующее соединение 154 получали согласно процедурам для соединения 153 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
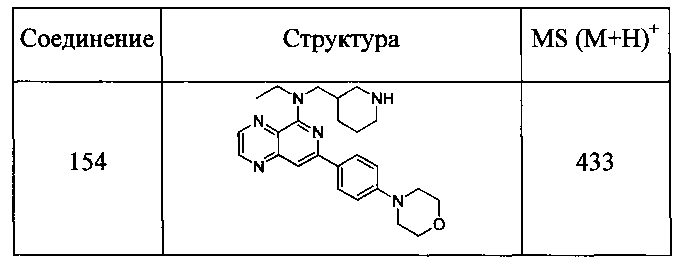
Соединение 155
N-((5,5-Дифторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
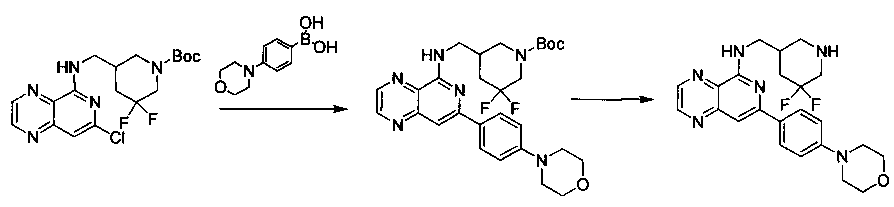
(A) Трет-бутил-3,3-дифтор-5-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Смесь трет-бутил-5-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-3,3-дифторпиперидин-1-карбоксилата (206 мг, 0,5 ммоль), 4-морфолинофенилбороновой кислоты (207 мг, 1,0 ммоль), три(циклогексил)фосфина (56 мг, 0,2 ммоль), Pd2(dba)3 (91 мг, 0,1 ммоль) и Cs2CO3 (325 мг, 2,0 ммоль) в диметоксиэтане/H2O закрывали в реакционной пробирке для микроволнового реактора и взбалтывали при 160°C в течение 80 минут в микроволновом реакторе. Смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 541 (M+H)+.
(B) N-((5,5-Дифторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
Трет-бутил-3,3-дифтор-5-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат из стадии A (227 мг, 0,42 ммоль) обрабатывали раствором HCl (в EtOAc, 5 н) при комнатной температуре до завершения реакции. Летучие компоненты удаляли при пониженном давлении, растворяли в дихлорметане (5 мл) и нейтрализовали гидроксидом аммония. Дихлорметановую фазу концентрировали с получением N-((5,5-дифторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амина. MS (масса/заряд): 441 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 155 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
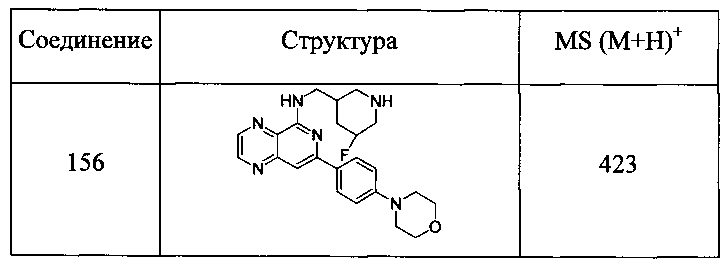
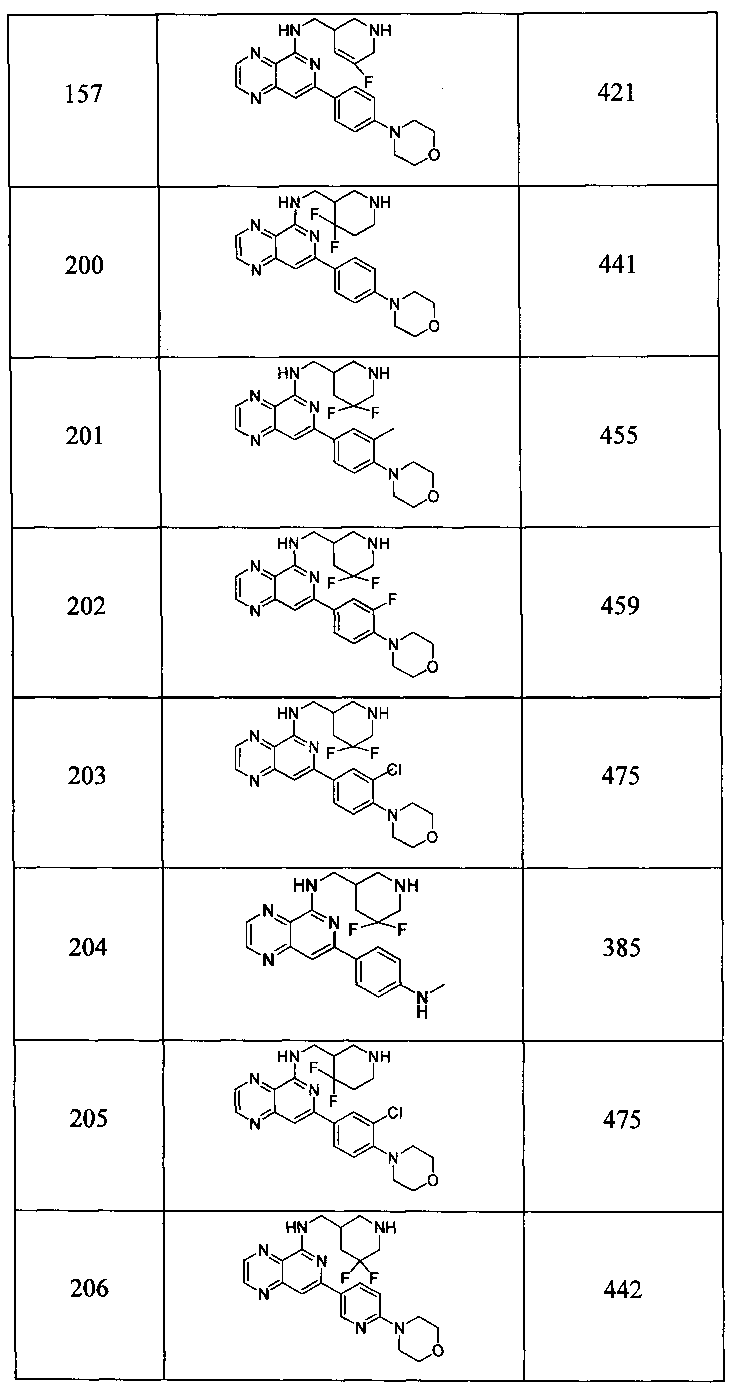
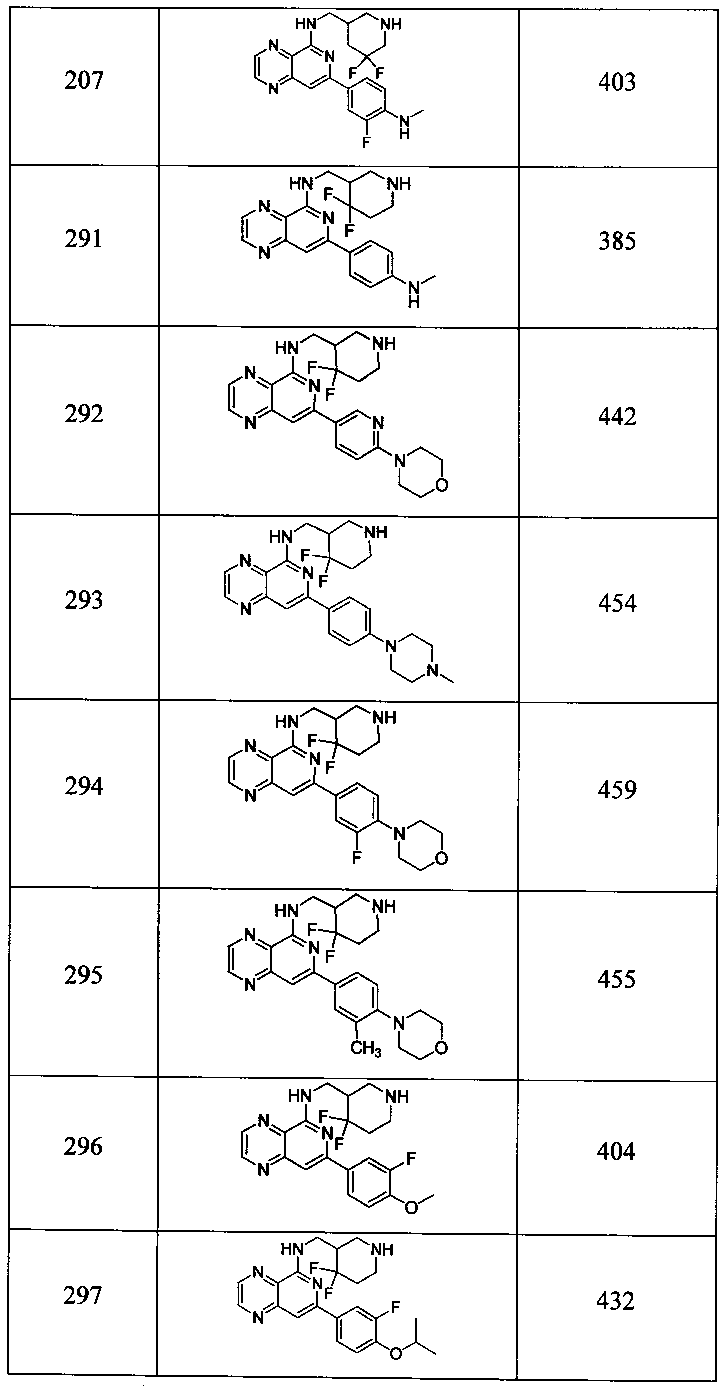
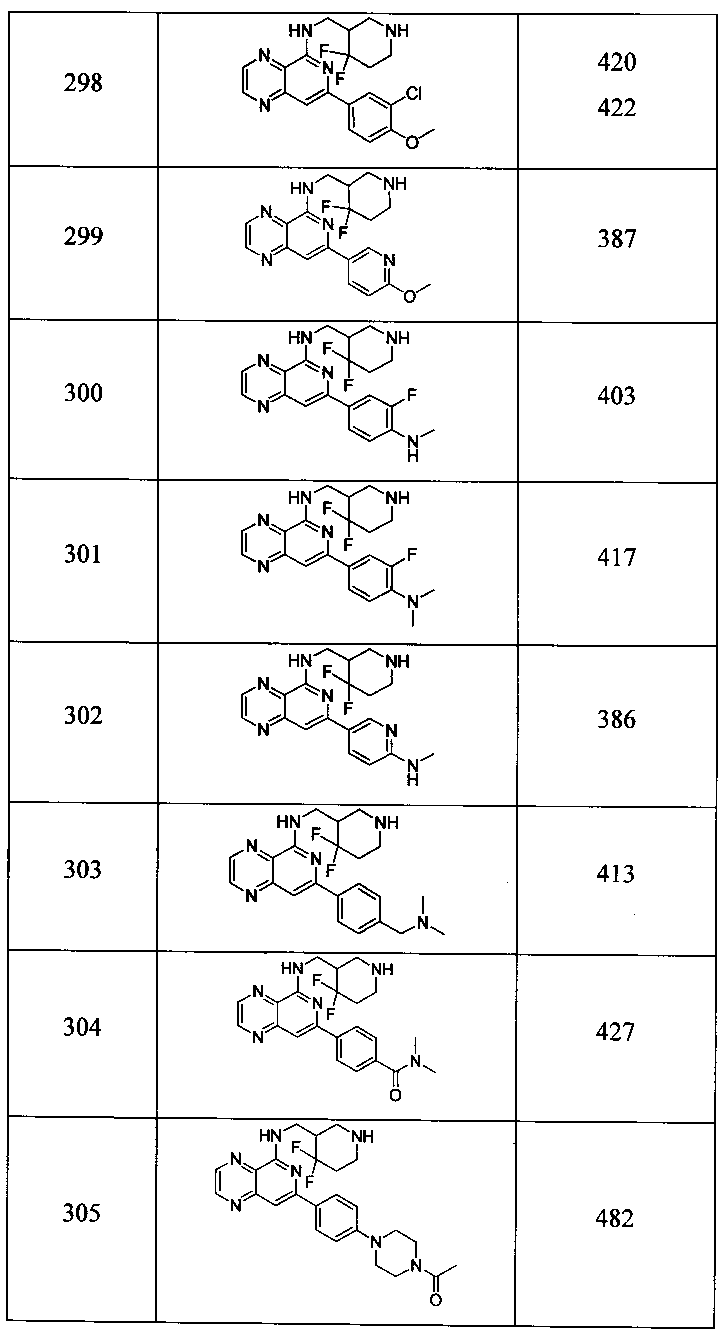
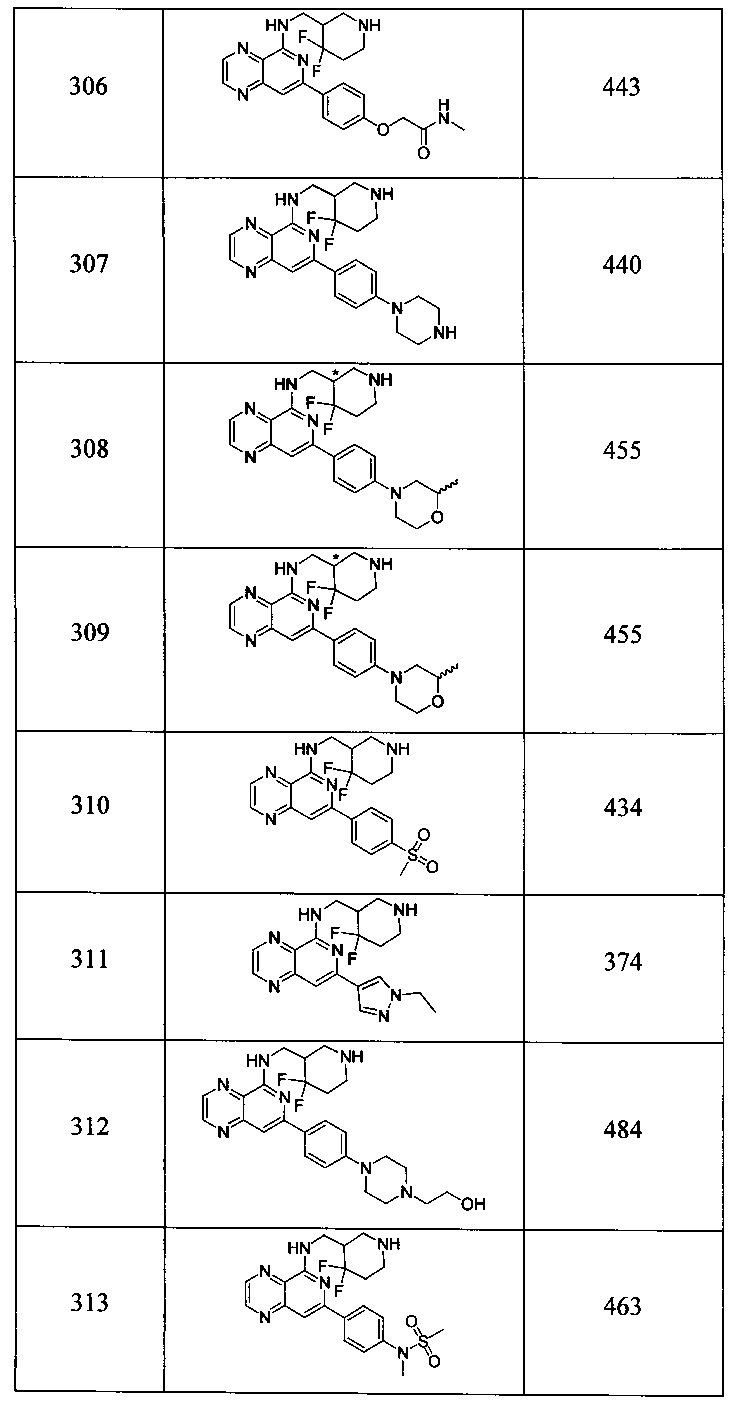
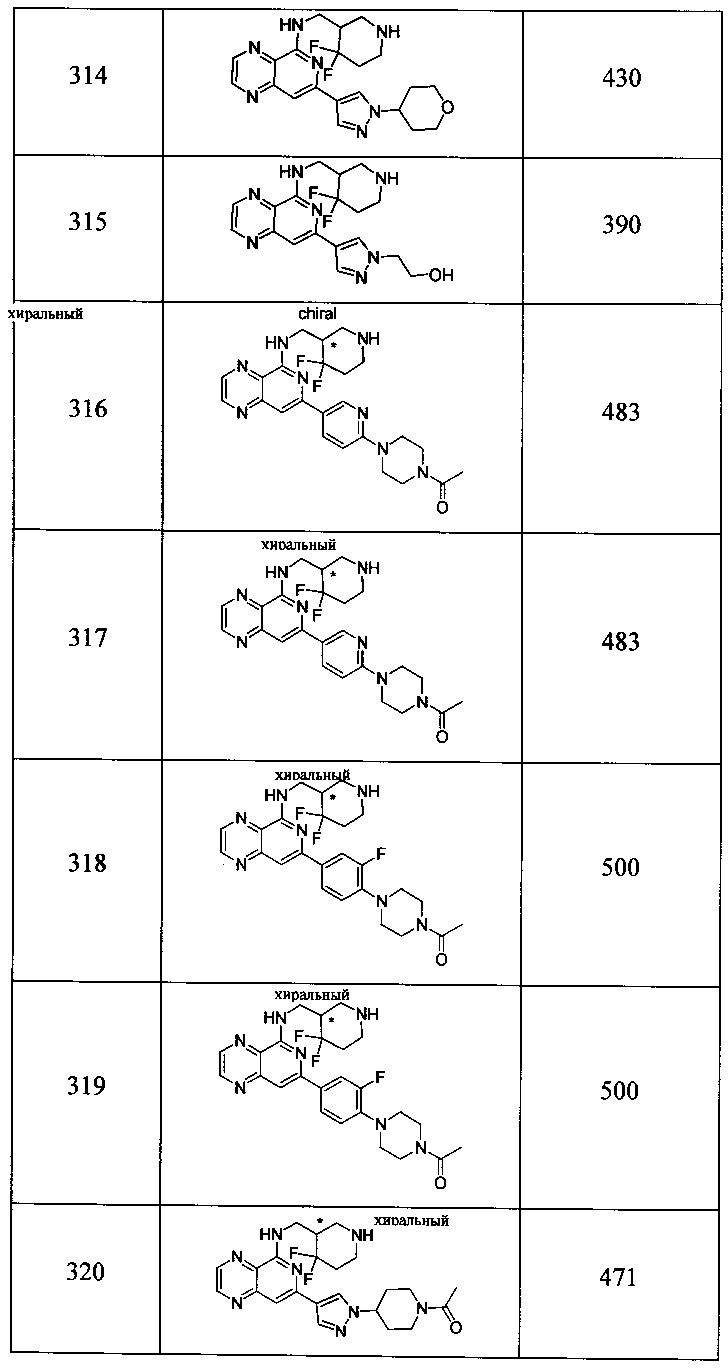
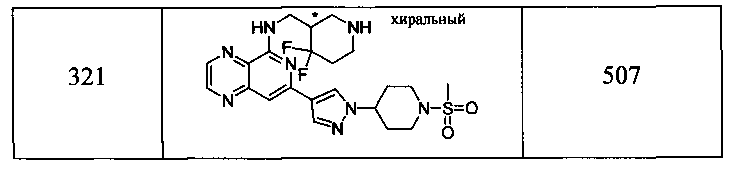
Соединение 158
5-((7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-3-ол
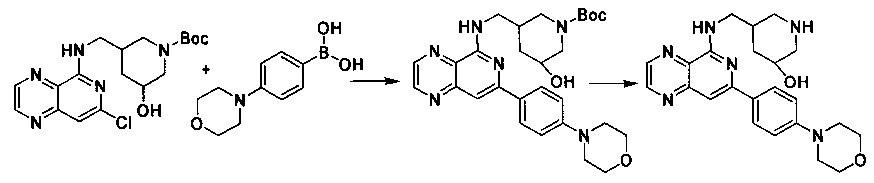
(A) Трет-бутил-3-гидрокси-5-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Названное соединение получали согласно процедурам для соединения 1 (B) с использованием трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-5-гидроксипиперидин-1-карбоксилата и 4-морфолинофенилбороновой кислоты. MS (масса/заряд): 521 (M+H)+.
(B) 5-((7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-3-ол
Названное соединение получали согласно процедурам для соединения 155 (B) с использованием трет-бутил-3-гидрокси-5-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилата. MS (масса/заряд): 421 (M+H)+.
Соединение 159
(R)-(1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанол
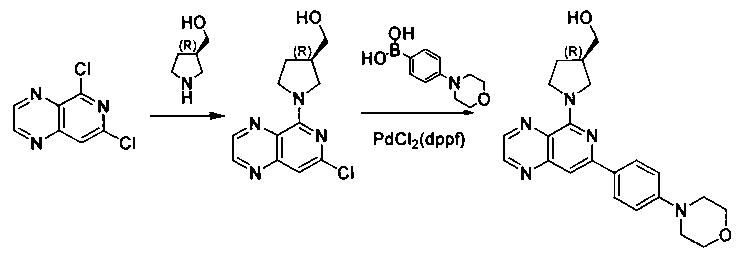
(A) (R)-(1-(7-Хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанол
Названное соединение получали согласно процедуре для соединения 1 (A) с использованием (R)-пирролидин-3-илметанола и 5,7-дихлорпиридо[4,3-d]пиразина. MS (масса/заряд): 265 (M+H)+.
(B) (R)-(1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанол
Названное соединение получали согласно процедуре для соединения 145 (E) с использованием (R)-(1-(7-хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанола. MS (масса/заряд): 392 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 159 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
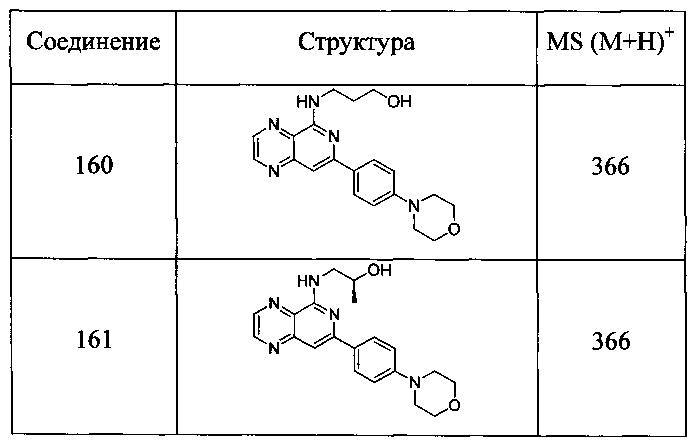
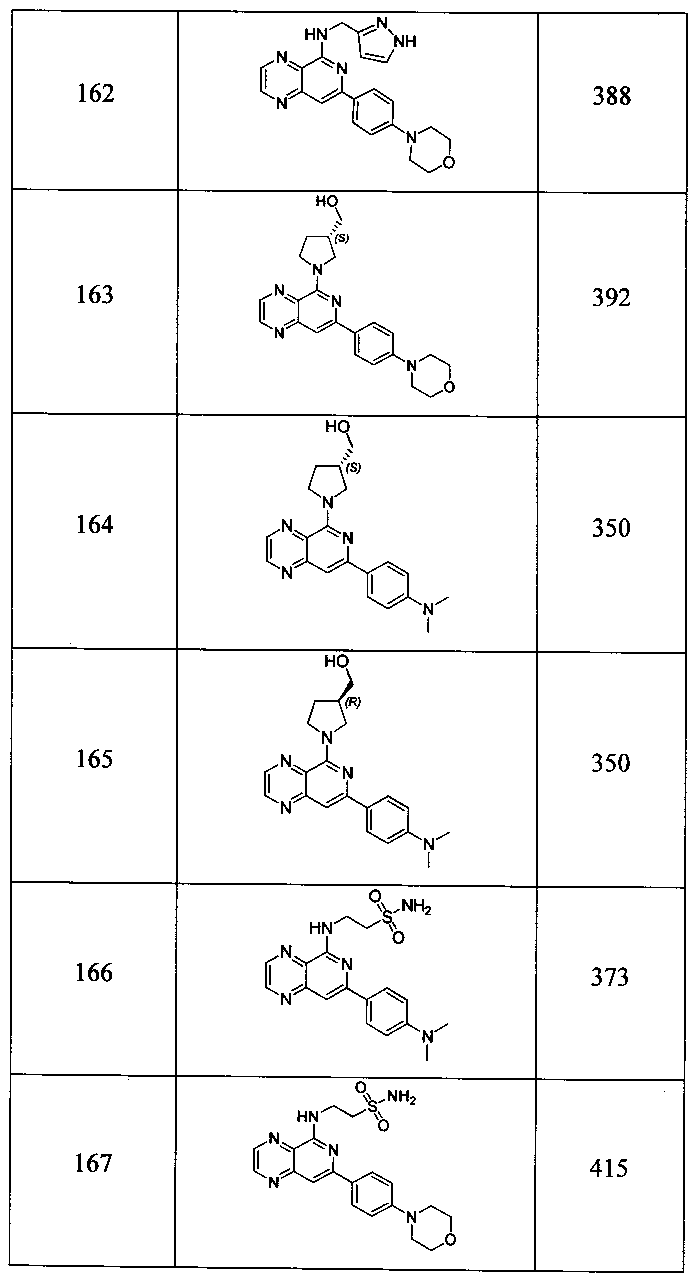
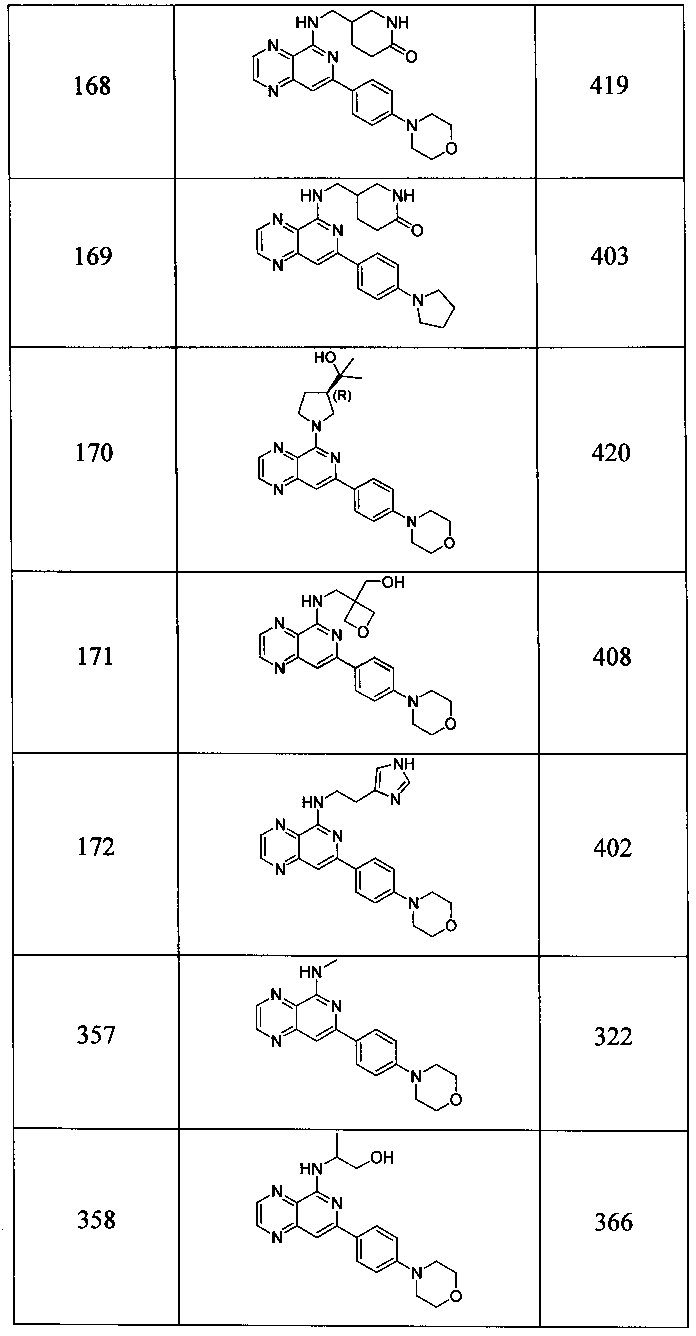
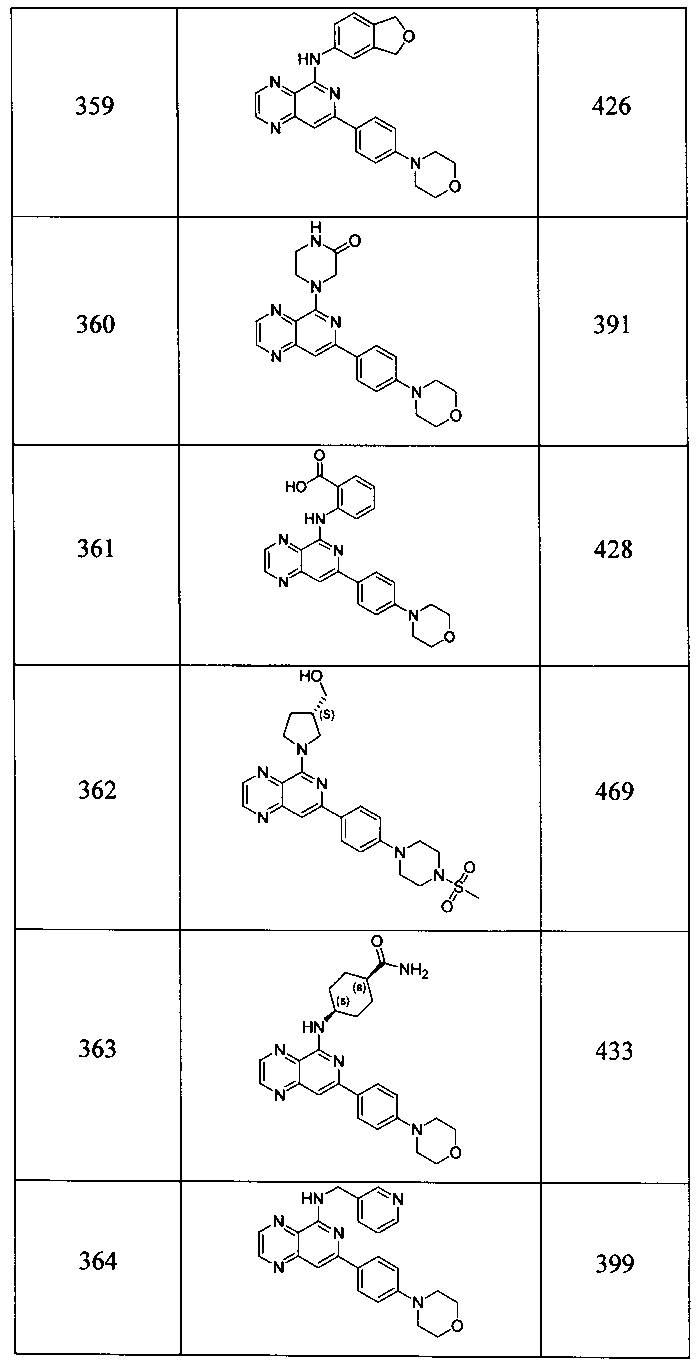
Соединение 173
(R)-N-Метил(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамин
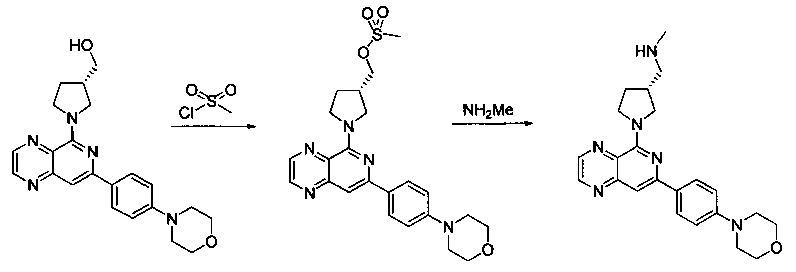
(A) (S)-(1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилметансульфонат
К раствору (S)-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанола (соединения 163, 500 мг, 1,27 ммоль) в THF (15 мл) добавляли MsCl (200 мг, 1,6 ммоль) и TEA (370 мг, 3,7 ммоль). Смесь взбалтывали в течение 4 часов при комнатной температуре и концентрировали in vacuo. Остаток промывали H2O и EtOAc с получением названного соединения. MS (масса/заряд):470 (M+H)+.
(B) (R)-N-Метил(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метанамин
Смесь (S)-(1-(7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)метилметансульфоната (100 мг, 0,21 ммоль) и раствора MeNH2 (33% в воде, 5 мл) нагревали с обратным холодильником в течение ночи, концентрировали и очищали хроматографией с получением названного соединения. MS (масса/заряд):405 (M+H)+.
Соединение 174
(S)-1-(1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)этанол
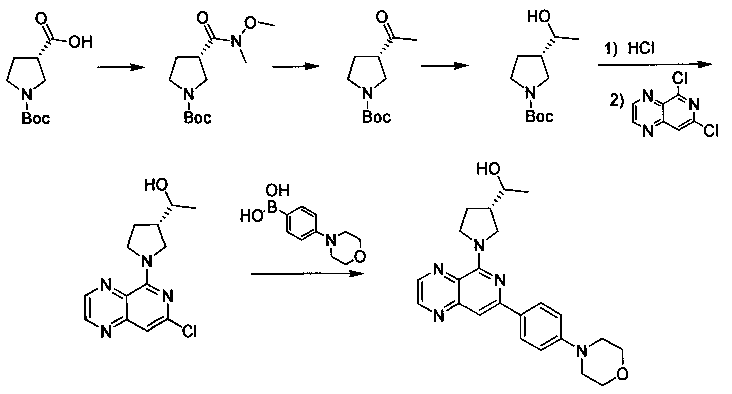
(A) (S)-Трет-бутил-3-(метокси(метил)карбамоил)пирролидин-1-карбоксилат
К раствору (S)-1-(трет-бутоксикарбонил)пирролидин-3-карбоновой кислоты (430 мг, 2,0 ммоль) в CH2Cl2 (20 мл) добавляли CDI (356 мг, 2,2 ммоль). Смесь взбалтывали при комнатной температуре в течение 20 минут, затем последовательно добавляли N,O-диметилгидроксиламина гидрохлорид (234 мг, 2,4 ммоль) и DIPEA (258 мг, 2,6 ммоль) при 0°C. Смесь взбалтывали при 0°C в течение 0,5 часа, затем нагревали и взбалтывали при температуре окружающей среды в течение ночи. Смесь промывали с помощью HCl (1 н), насыщенного водного NaHCO3 и воды, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением названного соединения для следующей стадии.
(B) (S)-Трет-бутил-3-ацетилпирролидин-1-карбоксилат
К раствору (S)-трет-бутил-3-(метокси(метил)карбамоил)пирролидин-1-карбоксилата в THF (18 мл) добавляли метилмагния бромид (в эфире, 3 М, 2,7 мл) при 0°C. Смесь взбалтывали при 0°C в течение 2 часов, затем гасили насыщенным водным NH4Cl и экстрагировали с помощью Et2O. Объединенные экстракты промывали с помощью насыщенного водного NaHCO3, сушили над Na2SO4, фильтровали и концентрировали с получением названного соединения для следующей стадии.
(C) (S)-Трет-бутил-3-(1-гидроксиэтил)пирролидин-1-карбоксилат
К раствору (S)-трет-бутил-3-ацетилпирролидин-1-карбоксилата в метаноле (10 мл) добавляли боргидрид натрия (114 мг, 3,0 ммоль) при 0°C. Реакционную смесь взбалтывали при температуре окружающей среды в течение 2 часов, затем гасили насыщенным раствором хлорида аммония и экстрагировали с помощью дихлорметана. Объединенные экстракты сушили над сульфатом магния, фильтровали и концентрировали с получением названного соединения для следующей стадии.
(D) (S)-1-(1-(7-Хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)этанол
(S)-Трет-бутил-3-(1-гидроксиэтил)пирролидин-1-карбоксилат обрабатывали раствором HCl (в EtOAc, 5 мл) при комнатной температуре в течение 2 часов. Летучие компоненты удаляли при пониженном давлении и остаток растворяли в безводном THF (10 мл). К полученному раствору THF добавляли DIPEA (570 мг, 4,4 ммоль) и 5,7-дихлорпиридо[4,3-b]пиразин (400 мг, 2,0 ммоль) и реакционную смесь взбалтывали при комнатной температуре в течение ночи. Летучие компоненты удаляли при пониженном давлении и остаток растворяли в этилацетате, промывали солевым раствором и сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 279 (M+H)+.
(E) (S)-1-(1-(7-(4-Морфолинофенил)пиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)этанол
Названное соединение получали согласно процедуре для соединения 1 (B) с использованием (S)-1-(1-(7-хлорпиридо[4,3-b]пиразин-5-ил)пирролидин-3-ил)этанола и 4-морфолинофенилбороновой кислоты. MS (масса/заряд): 406 (M+H)+.
Соединение 175
3-(7-(4-(Диметиламино)фенил)пиридо[4,3-b]пиразин-5-иламино)пропанамид
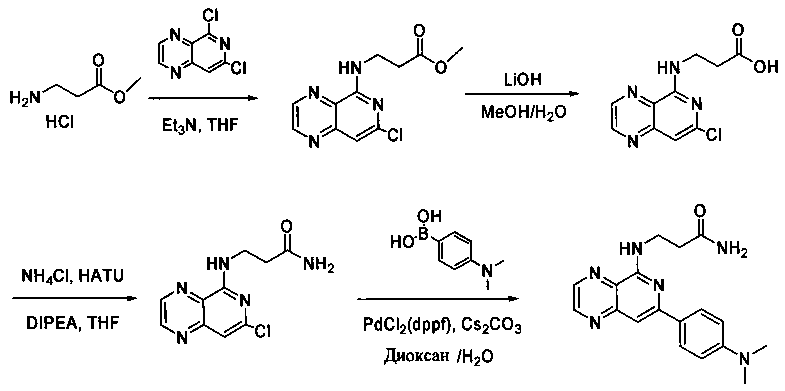
(A) Метил-3-(7-хлорпиридо[4,3-b]пиразин-5-иламино)пропаноат
Раствор метил-3-аминопропаноата гидрохлорида (4,88 ммоль), Et3N (6,50 ммоль) и 5,7-дихлорпиридо[4,3-b]пиразина (3,25 ммоль) в THF (10 мл) взбалтывали при комнатной температуре в течение ночи. Летучие компоненты удаляли при пониженном давлении, остаток обрабатывали водой и экстрагировали с помощью EtOAc. Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 267 (M+H)+.
(B) 3-(7-Хлорпиридо [4,3-b]пиразин-5-иламино)пропановая кислота
Раствор метил-3-(7-хлорпиридо[4,3-b]пиразин-5-иламино)пропаноата (545 мг, 2,04 ммоль) и LiOH·H2O (172 мг, 4,09 ммоль) в MeOH/H2O (об. 20:1, 40 мл/2 мл) взбалтывали при комнатной температуре в течение 20 часов. Летучие компоненты удаляли при пониженном давлении и остаток подкисляли раствором HCl (1 н.) до pH=2~3. Осадок собирали путем фильтрации и сушили с получением названного соединения. MS (масса/заряд): 253 (M+H)+.
(C) 3-(7-Хлорпиридо [4,3-b]пиразин-5-иламино)пропанамид
Раствор 3-(7-хлорпиридо[4,3-b]пиразин-5-иламино)пропановой кислоты (2,22 ммоль), HATU (2,66 ммоль), DIPEA (6,65 ммоль) и NH4Cl (4,43 ммоль) в THF (10 мл) взбалтывали при комнатной температуре в течение ночи. Летучие компоненты удаляли при пониженном давлении и остаток обрабатывали водой. Осадок собирали путем фильтрации и сушили с получением названного соединения. MS (масса/заряд): 252 (M+H)+.
(D) 3-(7-(4-(Диметиламино)фенил)пиридо[4,3-b]пиразин-5-иламино)пропанамид
Названное соединение получали согласно процедуре для соединения 1 (B) с использованием полученных ранее 3-(7-хлорпиридо[4,3-b]пиразин-5-иламино)пропанамида и 4-(диметиламино)фенилбороновой кислоты. MS (масса/заряд): 337 (M+H)+.
Следующие соединения 176-178 получали согласно процедурам для соединения 175 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
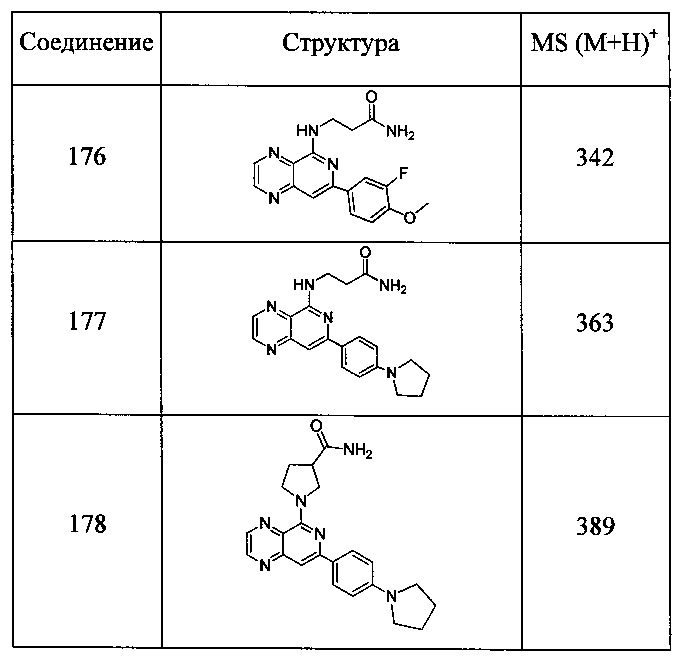
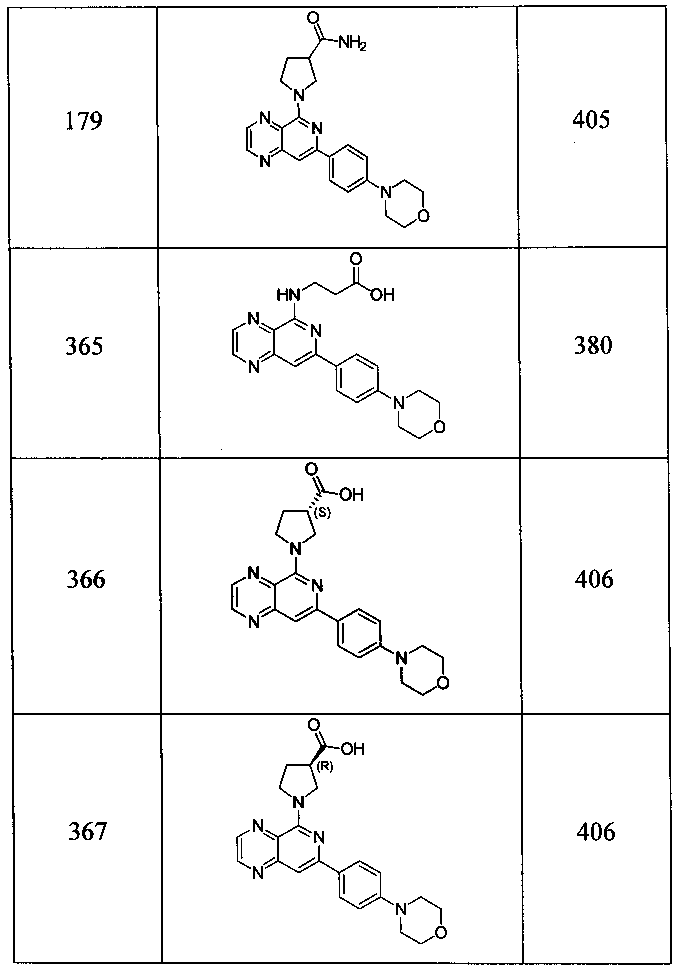
Соединение 180
N-(3-Аминопропил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
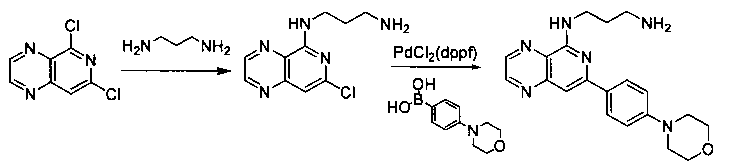
(A) N-(3-Аминопропил)-7-хлорпиридо[4,3-b]пиразин-5-амин
Раствор пропан-1,3-диамина (890 мг, 12 ммоль) и 5,7-дихлорпиридо[4,3-b]пиразина (600 мг, 3 ммоль) в метаноле (10 мл) взбалтывали при комнатной температуре в течение 4 часов. Летучие компоненты выпаривали и остаток очищали хроматографией с получением названного соединения. MS (масса/заряд): 238 (M+H)+.
(B) N-(3-Аминопропил)-7-(4-морфолинофенил)пиридо[43-b]пиразин-5-амин
Названное соединение получали согласно процедуре для соединения 145 (E) с использованием полученного выше N-(3-аминопропил)-7-хлорпиридо[4,3-b]пиразин-5-амина. MS (масса/заряд): 365 (M+H)+.
Следующие соединения 181-199 получали согласно процедурам для соединения 180 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
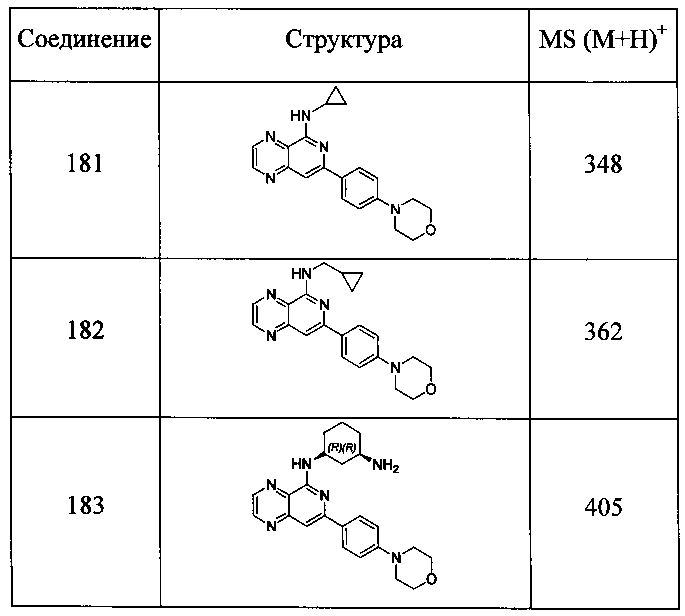
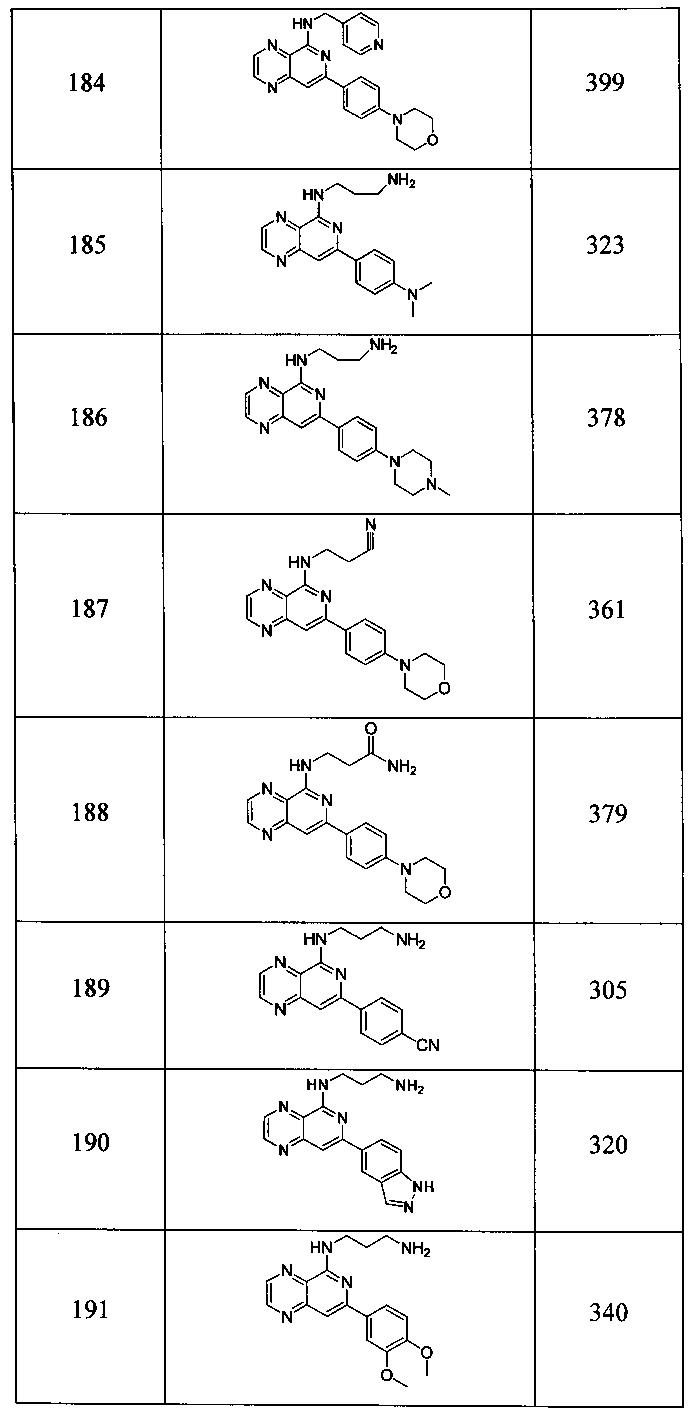
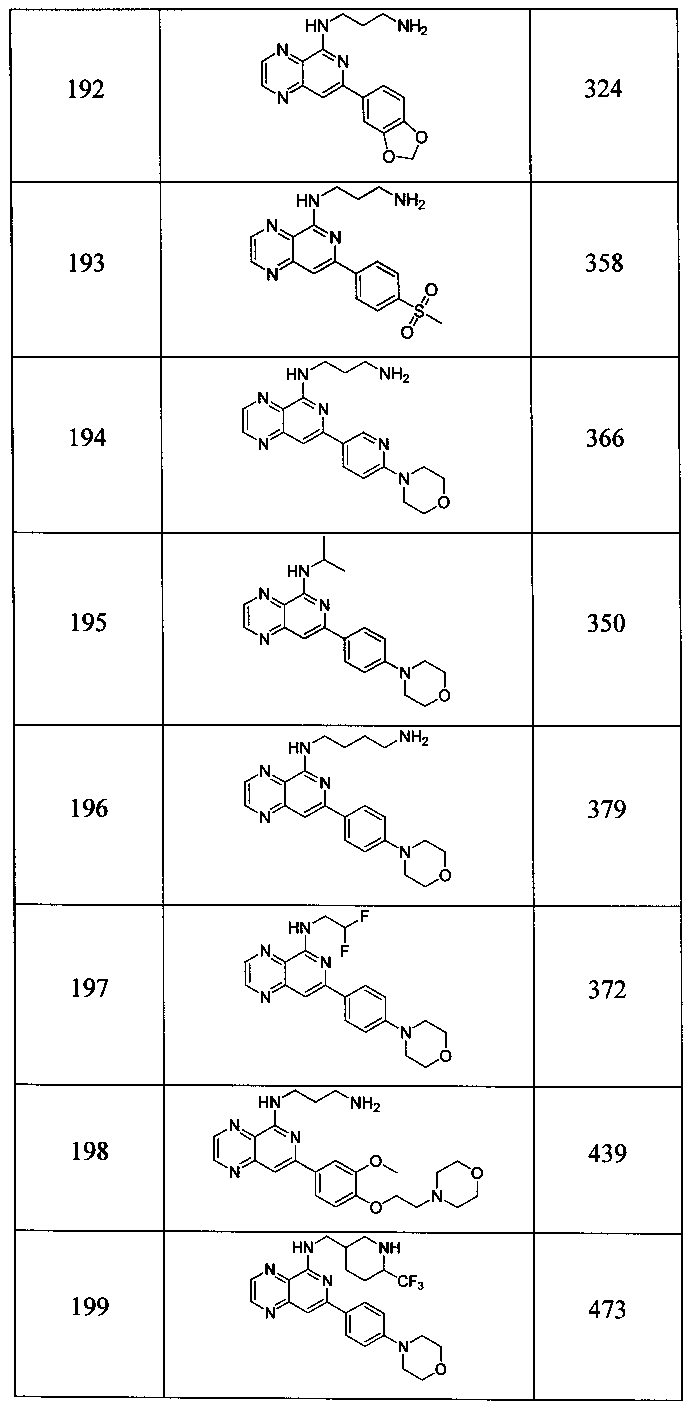
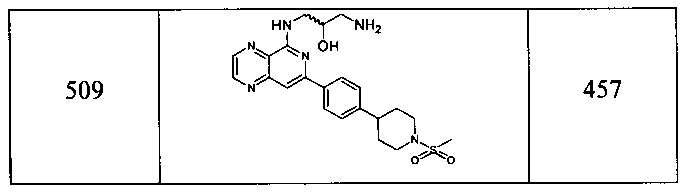
Соединения 232 и 233
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
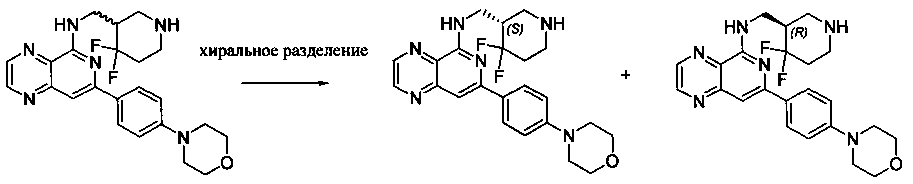
Рацемическое соединение 200 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 232 и 233 (условия HPLC: колонка: CHIRALPAK IA 20×250 мм; подвижная фаза: CH3CN/MeOH/DEA = 9/1/0,01; объемная скорость потока = 10 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 232, Rf=9,62 минуты) составлял 99% ее, MS (масса/заряд): 441 (M+H)+, а второй элюент (соединение 233, Rf=13,60 минуты) составлял 95,5% ее, MS (масса/заряд): 441 (M+H)+.
Соединения 368 и 369
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(3-фтор-4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(3-фтор-4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
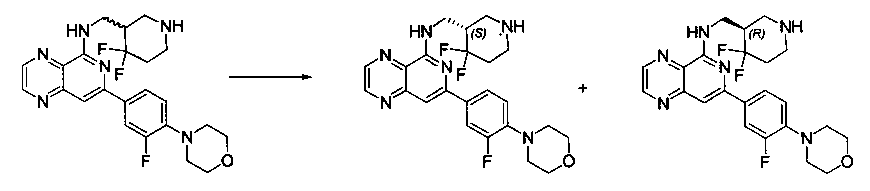
Рацемическое соединение 294 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 368 и 369 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CH3CN/MeOH/DEA = 9/1/0,01; объемная скорость потока = 1,0 мл/мин; детектор: UV 220 нм). Первый элюент (соединение 368, Rf=11,36 минуты) составлял 100% ее, MS (масса/заряд): 459 (M+H)+, и второй элюент (соединение 369, Rf=14,72 минуты) составлял 100% ее, MS (масса/заряд): 459 (M+H)+.
Соединения 370 и 371
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(3-метил-4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(3-метил-4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
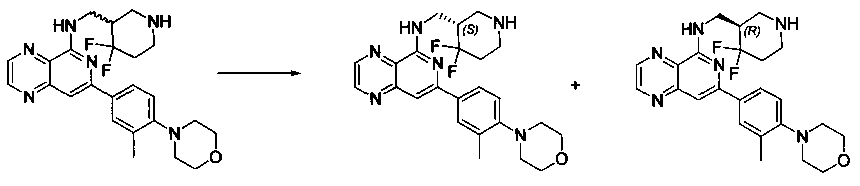
Рацемическое соединение 295 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 370 и 371 (условия HPLC: колонка: CHIRALCEL OJH 0,46×15 см; подвижная фаза: EtOH/DEA = 100/0,001; объемная скорость потока = 1,0 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 370, Rf=6,20 минуты) составлял 100% ее, MS (масса/заряд): 455 (M+H)+, и второй элюент (соединение 371, Rf=6,32 минуты) составлял 100% ее, MS (масса/заряд): 455 (M+H)+.
Соединения 372 и 373
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-амин и (R)-N((4,4-дифторпиперидин-3-ил)метил)-7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-амин
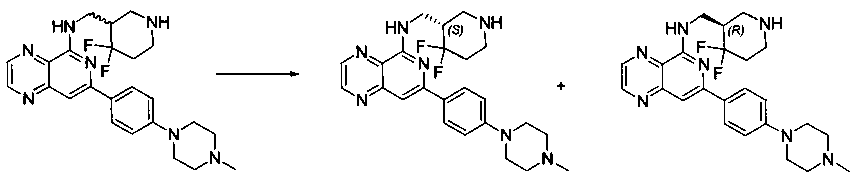
Рацемическое соединение 293 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 372 и 373 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: MeOH/EtOH/DEA = 50/50/0,1; объемная скорость потока = 1,0 мл/мин.; детектор: UV 220 нм). Первый элюент (соединение 372, Rf=10,89 минуты) составлял 100% ее, MS (масса/заряд): 454 (M+H)+, и второй элюент (соединение 373, Rf=14,23 минуты) составлял 100% ее, MS (масса/заряд): 454 (M+H)+.
Соединения 374 и 375
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(6-морфолинопиридин-3-ил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(6-морфолинопиридин-3-ил)пиридо[4,3-b]пиразин-5-амин
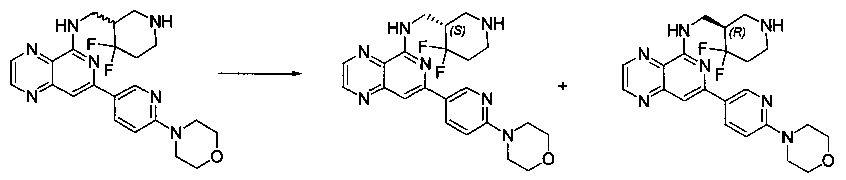
Рацемическое соединение 292 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 374 и 375 (условия HPLC: колонка: CHIRALCEL OJH 0,46×15 см; подвижная фаза: EtOH/DEA = 100/0,001; объемная скорость потока = 1 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 374, Rf=8,60 минуты) составлял 100% ее, MS (масса/заряд): 442 (M+H)+, а второй элюент (соединение 375, Rf=12,10 минуты) составлял 97,37% ее, MS (масса/заряд): 442 (M+H)+.
Соединения 376 и 377
(S)-N-((3-Фторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин и (R)-N((3-фторпиперидин-3-ил)метил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амин
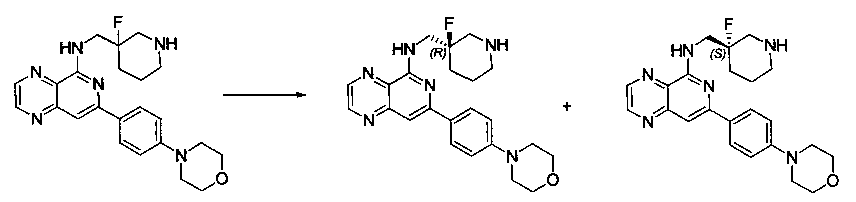
Рацемическое соединение 251 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 376 и 377 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CH3CN/EtOH/DEA = 90/10/0,1; объемная скорость потока = 10,0 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 376, Rf=7,45 минуты) составлял 100% ее, MS (масса/заряд): 423 (M+H)+, а второй элюент (соединение 377, Rf=14,97 минуты) составлял 96,07% ее, MS (масса/заряд): 423 (M+H)+.
Соединения 378 и 379
(S)-N-((3-Фторпиперидин-3-ил)метил)-7-(6-морфолинопиридин-3-ил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((3-фторпиперидин-3-ил)метил)-7-(6-морфолинопиридин-3-ил)пиридо[4,3-b]пиразин-5-амин
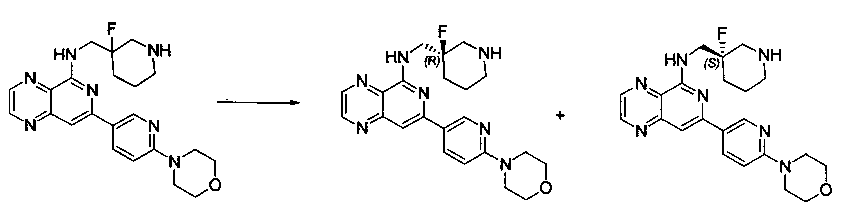
Рацемическое соединение 252 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 378 и 379 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CH3CN/EtOH/DEA = 90/10/0,1; объемная скорость потока = 10,0 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 378, Rf=9,17 минуты) составлял 100% ее, MS (масса/заряд): 424 (M+H)+, а второй элюент (соединение 379, Rf=16,65 минуты) составлял 92,59% ее, MS (масса/заряд): 424 (M+H)+.
Соединения 380 и 381
(S)-N((3-Фторпиперидин-3-ил)метил)-7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((3-фторпиперидин-3-ил)метил)-7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-амин
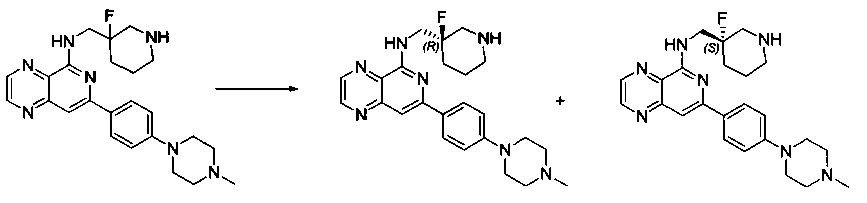
Рацемическое соединение 253 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 380 и 381 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CH3CN/EtOH/DEA = 90/10/0,1; объемная скорость потока = 10,0 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 380, Rf=10,46 мин.) составлял 100% ее, MS (масса/заряд): 436 (M+H)+, а второй элюент (соединение 381, Rf=20,42 мин.) составлял 94,93% ее, MS (масса/заряд): 436 (M+H)+.
Соединения 382 и 383
(S)-7-(3-Фтор-4-морфолинофенил)-N-((3-фторпиперидин-3-ил)метил)пиридо[4,3-b]пиразин-5-амин и (R)-7-(3-фтор-4-морфолинофенил)-N-((3-фторпиперидин-3-ил)метил)пиридо[4,3-b]пиразин-5-амин
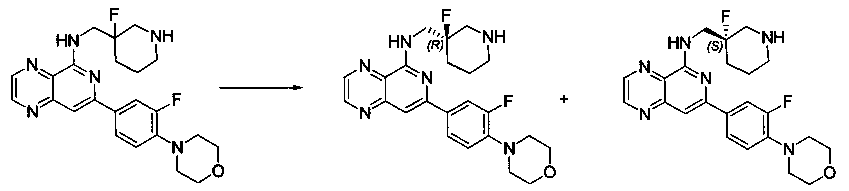
Рацемическое соединение 254 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 382 и 383 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CH3CN/EtOH/DEA = 90/10/0,1; объемная скорость потока = 10,0 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 382, Rf=7,14 мин) составлял 98,75% ее, MS (масса/заряд): 441 (M+H)+, а второй элюент (соединение 383, Rf=14,97 минуты) составлял 96,07% ее, MS (масса/заряд): 441 (M+H)+.
Соединения 384 и 385
(S)-1-(4-(4-(5-((4,4-Дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)пиперазин-1-ил)этанон и (R)-1-(4-(4-(5-((4,4-дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)пиперазин-1-ил)этанон
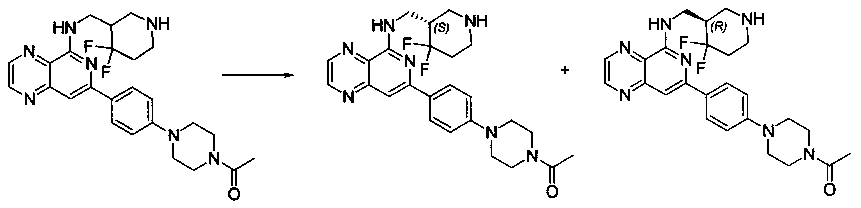
Рацемическое соединение 305 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 384 и 385 (условия HPLC: колонка: CHIRALPAK IA 0,46×25 см; подвижная фаза: CAN/DEA = 100/0,1; объемная скорость потока = 1,0 мл/мин; детектор: UV 365 нм). Первый элюент (соединение 384, Rf=10,09 мин.) составлял 98% ее, MS (масса/заряд): 482 (M+H)+, и второй элюент (соединение 385, Rf=13,39 минуты) составлял 98% ее, MS (масса/заряд): 482 (M+H)+.
Соединения 386 и 387
7-(3-Фтор-4-((S)-2-метилморфолино)фенил)-N-((S)-морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин и 7-(3-фтор-4-((R)-2-метилморфолино)фенил)-N-((S)-морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
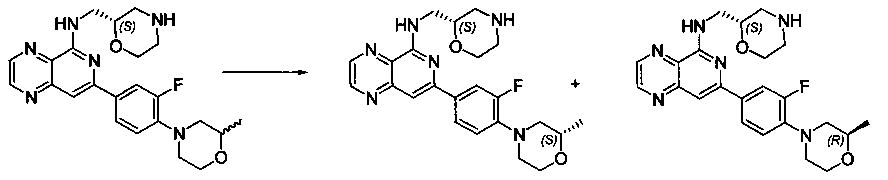
Рацемическое соединение 250 разделяли хиральной HPLC с получением оптически чистых изомеров соединений 386 и 387 (условия HPLC: колонка: CHIRALPAK AD-H 0,46×15 см; подвижная фаза: EtOH/ACN/DEA = 95/5/0,1; объемная скорость потока = 0,5 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 386, Rf=13,40 мин) составлял 99,83% ее, MS (масса/заряд): 439 (M+H)+, а второй элюент (соединение 387, Rf=16,30 мин) составлял 98,9% ее, MS (масса/заряд): 439 (M+H)+.
Соединения 388 и 389
(S)-2-(4-(5-((4,4-Дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)-N-метилацетамид и (R)-2-(4-(5-((4,4-дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)-N-метилацетамид
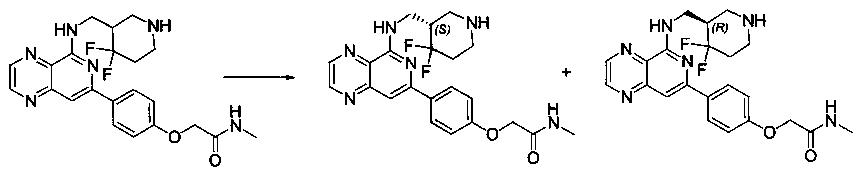
Рацемическое соединение 306 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 388 и 389 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: ACN/DEA = 100/0,1; объемная скорость потока = 10 мл/мин; детектор: UA 254 нм). Первый элюент (соединение 388, Rf=12,58 мин) составлял 100% ее, MS (масса/заряд): 443 (M+H)+, а второй элюент (соединение 389, Rf=23,88 мин) составлял 93,9% ее, MS (масса/заряд): 443 (M+H)+.
Соединения 390 и 391
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(4-(метилсульфонил)фенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(4-(метилсульфонил)фенил)пиридо[4,3-b]пиразин-5-амин
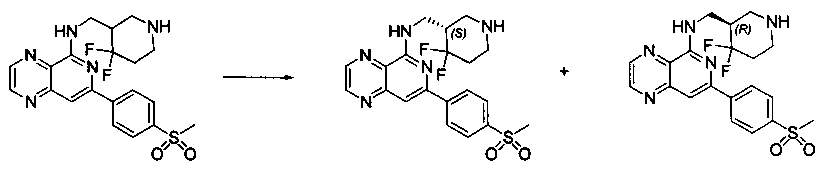
Рацемическое соединение 310 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 390 и 391 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: ACN/DEA = 100/0,1; объемная скорость потока = 10 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 390, Rf=12,05 мин) составлял 98,17% ее, MS (масса/заряд): 434 (M+H)+, а второй элюент (соединение 391, Rf=13,11 мин) составлял 97,51% ее, MS (масса/заряд): 434 (M+H)+.
Соединение 392 и 393
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(1-этил-1H-пиразол-4-ил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(1-этил-1H-пиразол-4-ил)пиридо[4,3-b]пиразин-5-амин
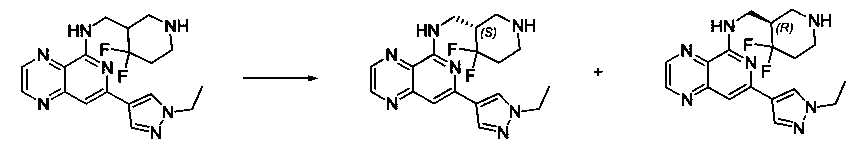
Рацемическое соединение 311 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 392 и 393 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: ACN/DEA = 100/0,1; объемная скорость потока = 10 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 392, Rf=7,64 мин) составлял 100% ее, MS (масса/заряд): 374 (M+H)+, а второй элюент (соединение 393, Rf=13,11 мин) составлял 97,47% ее, MS (масса/заряд): 374 (M+H)+.
Соединения 394 и 395
(S)-N-(4-(5-((4,4-Дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)-N-метилметансульфонамид и (R)-N-(4-(5-((4,4-дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)-N-метилметансульфонамид
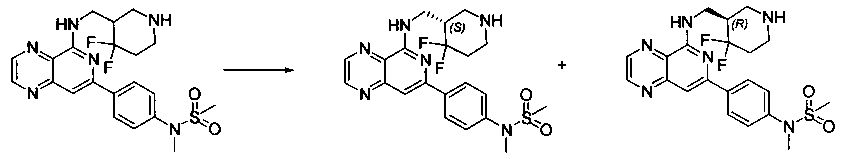
Рацемическое соединение 313 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 394 и 395 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: ACN/DEA = 100/0,1; объемная скорость потока = 10 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 394, Rf=8,03 мин) составлял 100% ее, MS (масса/заряд): 463 (M+H)+, а второй элюент (соединение 395, Rf=11,54 мин) составлял 95,7% ее, MS (масса/заряд): 463 (M+H)+.
Соединения 396 и 397
N-((4,4-Дифторпиперидин-3-ил)метил)-7-(4-((S)-2-метилморфолино)фенил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(4-((S)-2-метилморфолино)фенил)пиридо[4,3-b]пиразин-5-амин
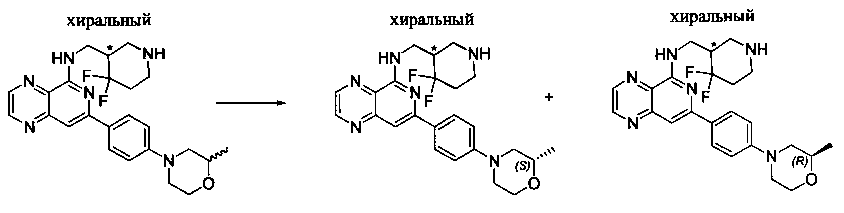
Рацемическое соединение 309 разделяли хиральной HPLC с получением оптически чистых изомеров соединений 396 и 397 (условия HPLC: колонка: CHIRALPAK AD-H 0,46×15 см; подвижная фаза: MeOH/DEA = 100/0,1; объемная скорость потока = 1,0 мл/мин.; детектор: UV 254 нм). Первый элюент (соединение 396, Rf=11,37 мин) составлял 99,44% ее, MS (масса/заряд): 455 (M+H)+, а второй элюент (соединение 397, Rf=14,69 мин) составлял 98,36% ее, MS (масса/заряд): 455 (M+H)+.
Соединения 398 и 399
(S)-N-((4,4-Дифторпиперидин-3-ил)метил)-7-(1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-ил)пиридо[4,3-b]пиразин-5-амин и (R)-N-((4,4-дифторпиперидин-3-ил)метил)-7-(1-(тетрагидро-2H-пиран-4-ил)-1H-пиразол-4-ил)пиридо[4,3-b]пиразин-5-амин
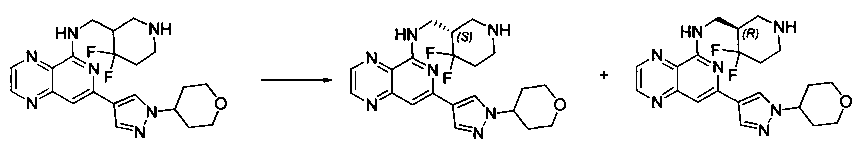
Рацемическое соединение 314 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 398 и 399 (условия HPLC: колонка: CHIRALPAK IA 0,46×15 см; подвижная фаза: CAN/EtOH/DEA = 100/10/0,1; объемная скорость потока = 10 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 398, Rf=7,42 мин) составлял 100% ее, MS (масса/заряд): 430 (M+H)+, а второй элюент (соединение 399, Rf=10,74 мин) составлял 93,0% ее, MS (масса/заряд): 430 (M+H)+.
Соединение 400
(S)-7-(4-(4-(Циклопропилсульфонил)пиперазин-1-ил)фенил)-N-(морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
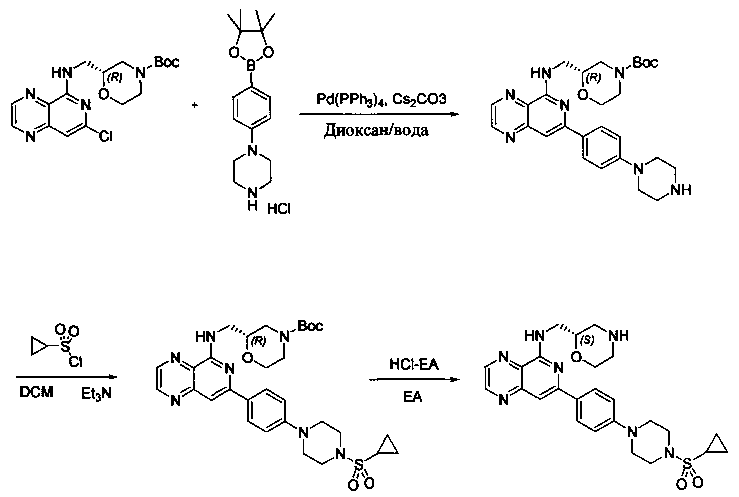
(A) (S)-Трет-бутил-2-((7-(4-(пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
Раствор (S)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (3,96 г, 10,43 ммоль), 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорида (4,4 г, 13,55 ммоль), Pd(PPh3)4 (2,41 г, 2,09 ммоль) и Cs2CO3 (10,19 г, 31,29 ммоль) в 150 мл диоксана и 3 мл воды под N2 взбалтывали при 110°C в течение ночи. Летучие компоненты удаляли in vacuo и остатки очищали хроматографией с MeOH/H2O (1:20~5:1) с получением 4,747 г названного соединения. MS (масса/заряд) = 506 (M+H)+.
(B) (5)-Трет-бутил-2-((7-(4-(4-(циклопропилсульфонил)пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
Раствор (S)-Трет-бутил-2-((7-(4-(пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (100 мг, 0,20 ммоль), циклопропансульфонила хлорида (33 мг, 0,24 ммоль) и Et3N (41 мг, 0,40 ммоль) в 5 мл DCM при 0°C взбалтывали при комнатной температуре в течение 1 часа. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с помощью PE/EA (1:2~1:10) с получением 52 мг названного соединения.
(C) (S)-7-(4-(4-(Циклопропилсульфонил)пиперазин-1-ил)фенил)-N-(морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
Раствор (S)-трет-бутил-2-((7-(4-(4-(циклопропилсульфонил)пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (52 мг, 0,09 ммоль) и 2 мл HCl-EA (5,0 н) в 5 мл EA взбалтывали при комнатной температуре в течение 1 часа. Летучие компоненты удаляли in vacuo и остаток добавляли к 5 мл MeOH и 0,5 мл NH3·H2O, взбалтывали при комнатной температуре в течение 10 минут. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:6~5:1) с получением 18 мг названного соединения. MS (масса/заряд) = 510 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 400 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
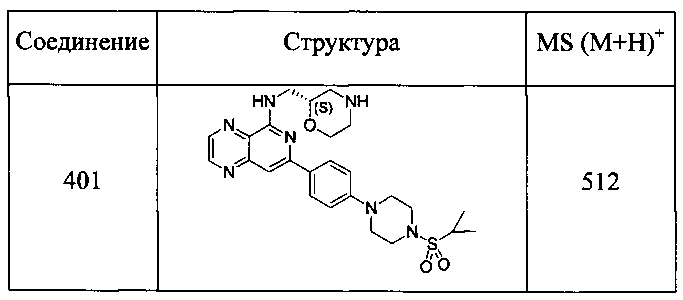
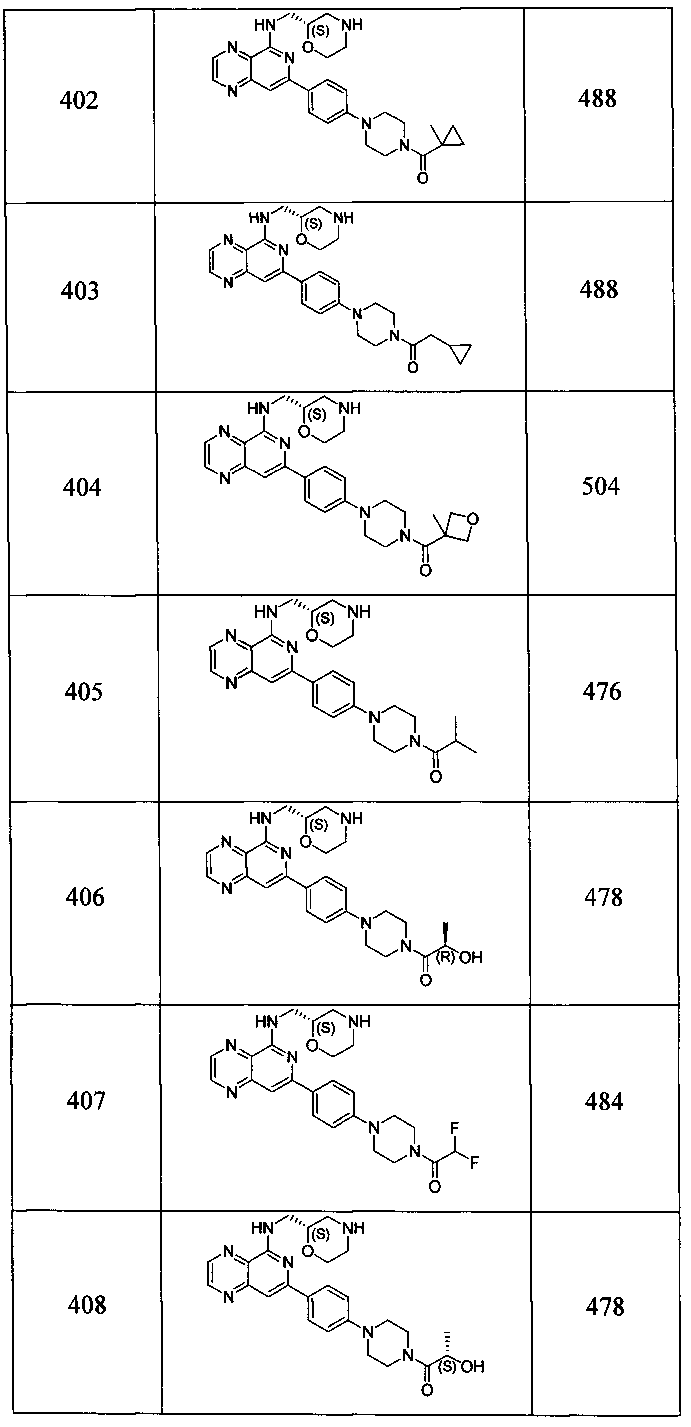
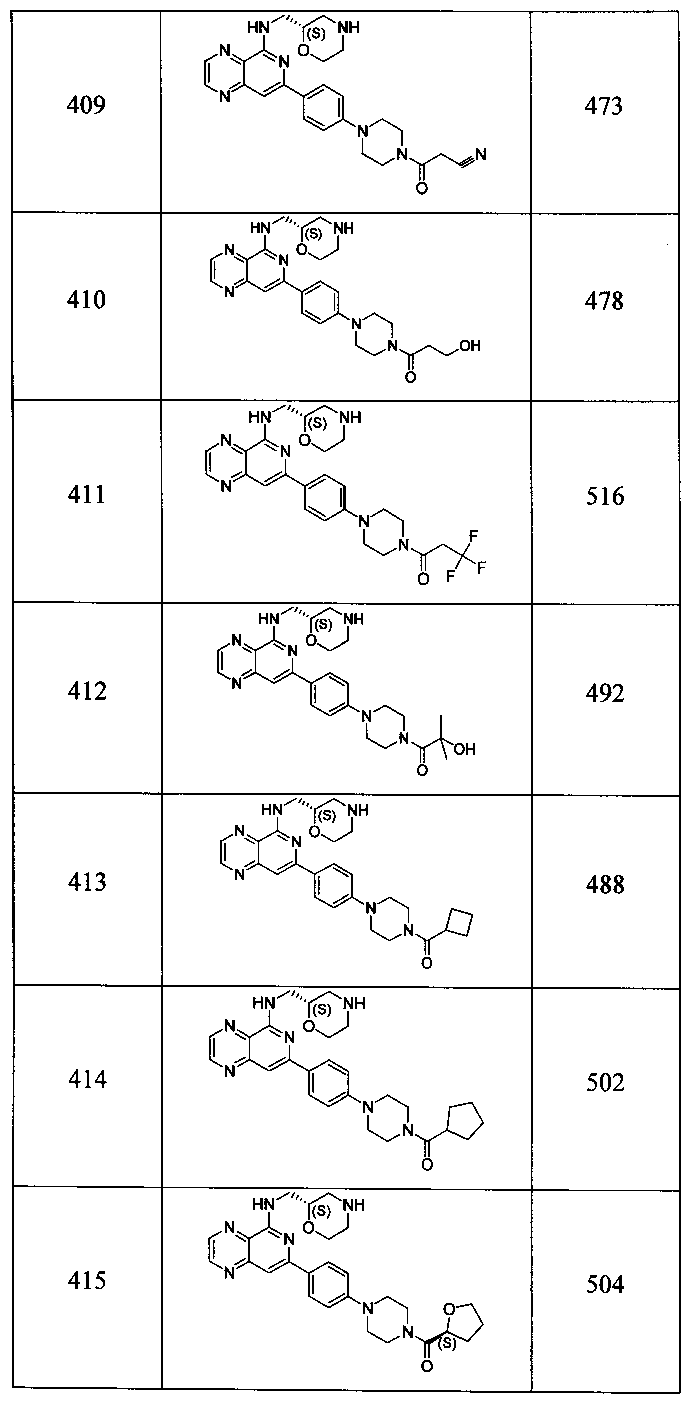
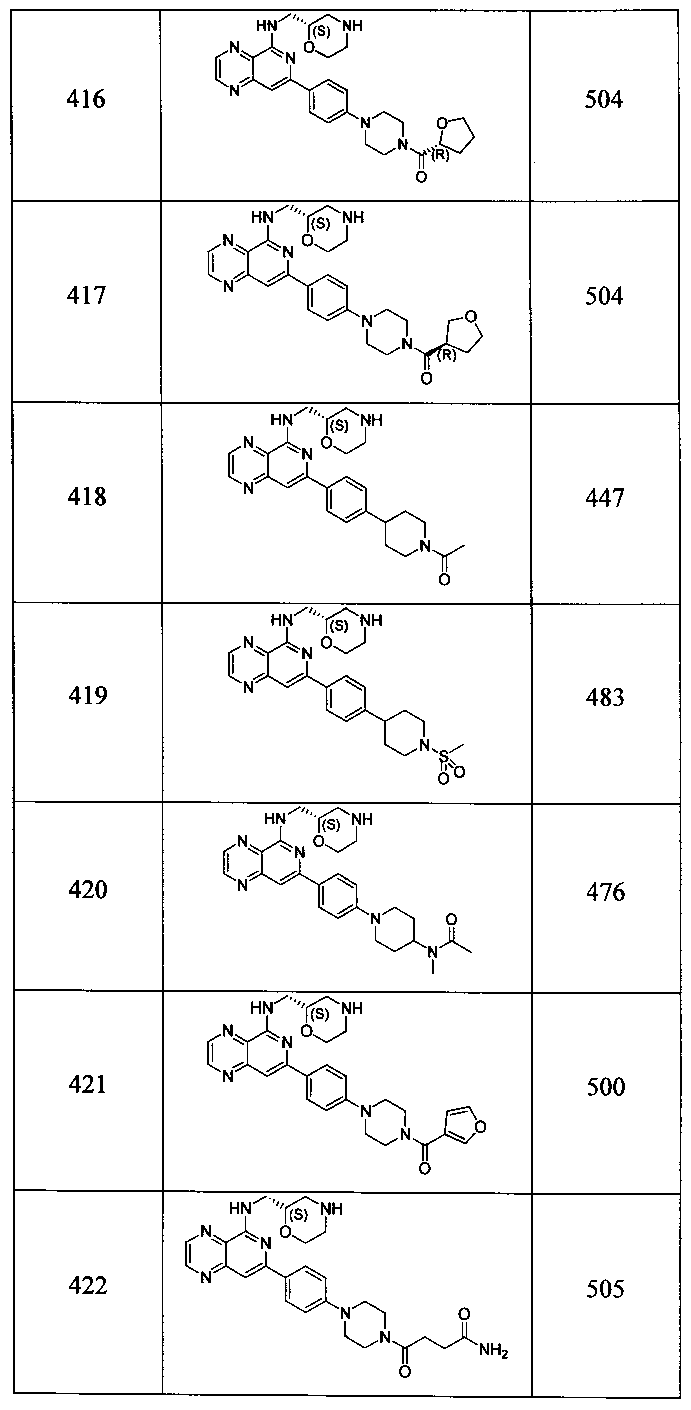
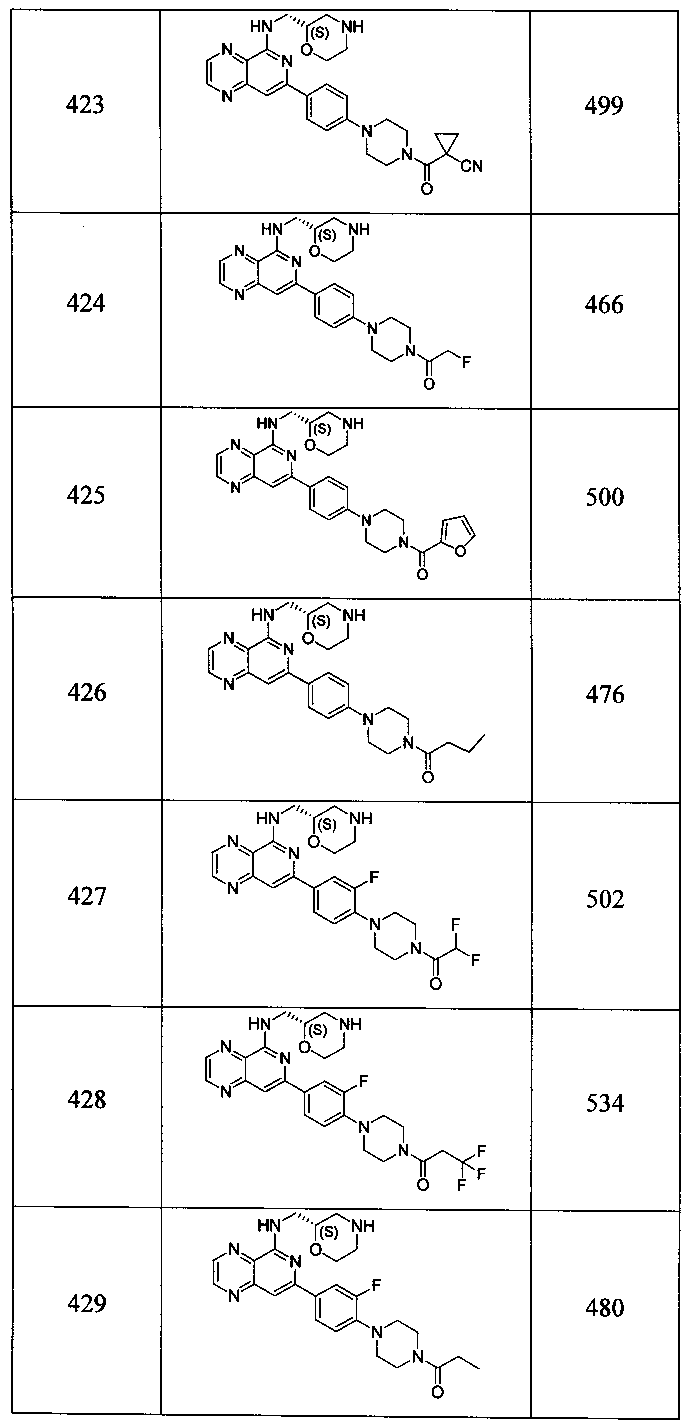
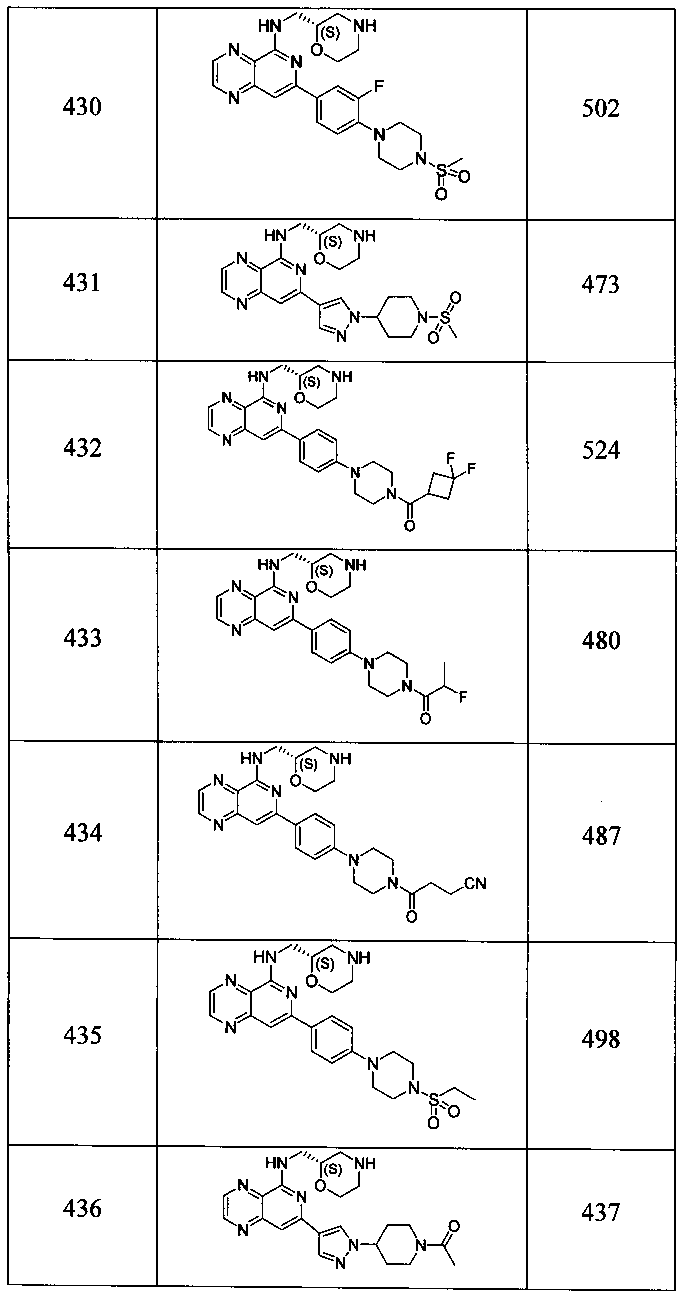
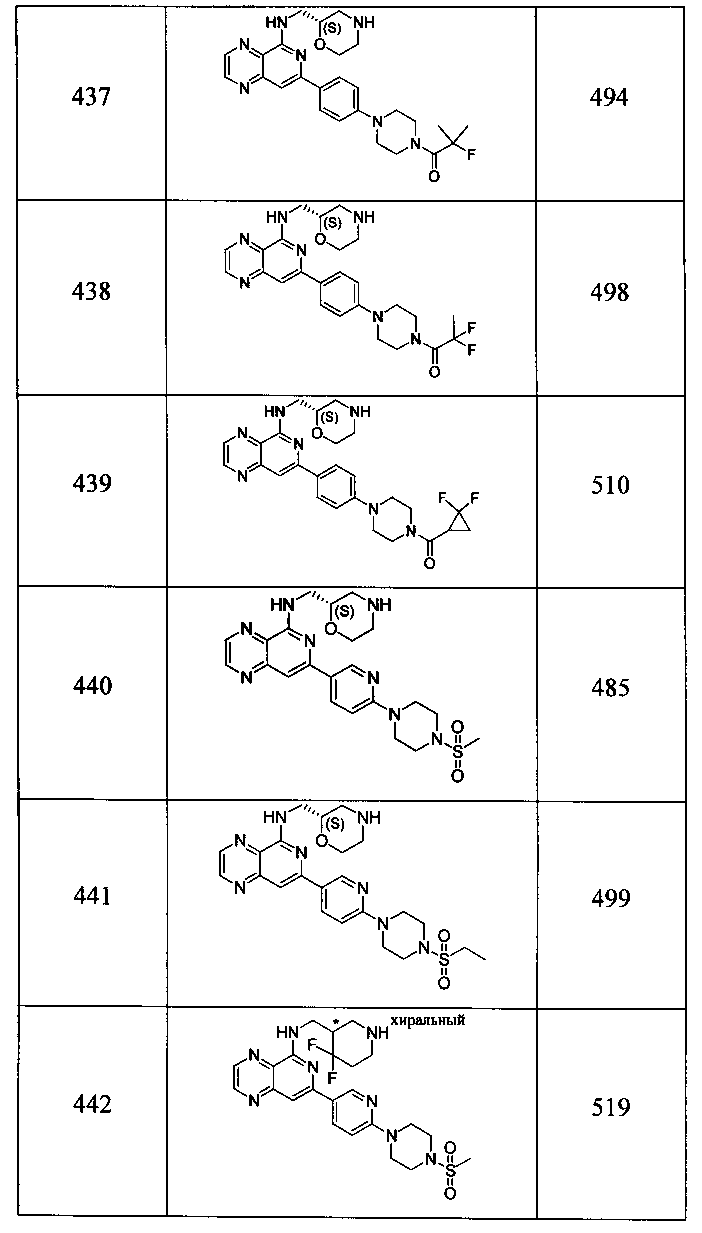
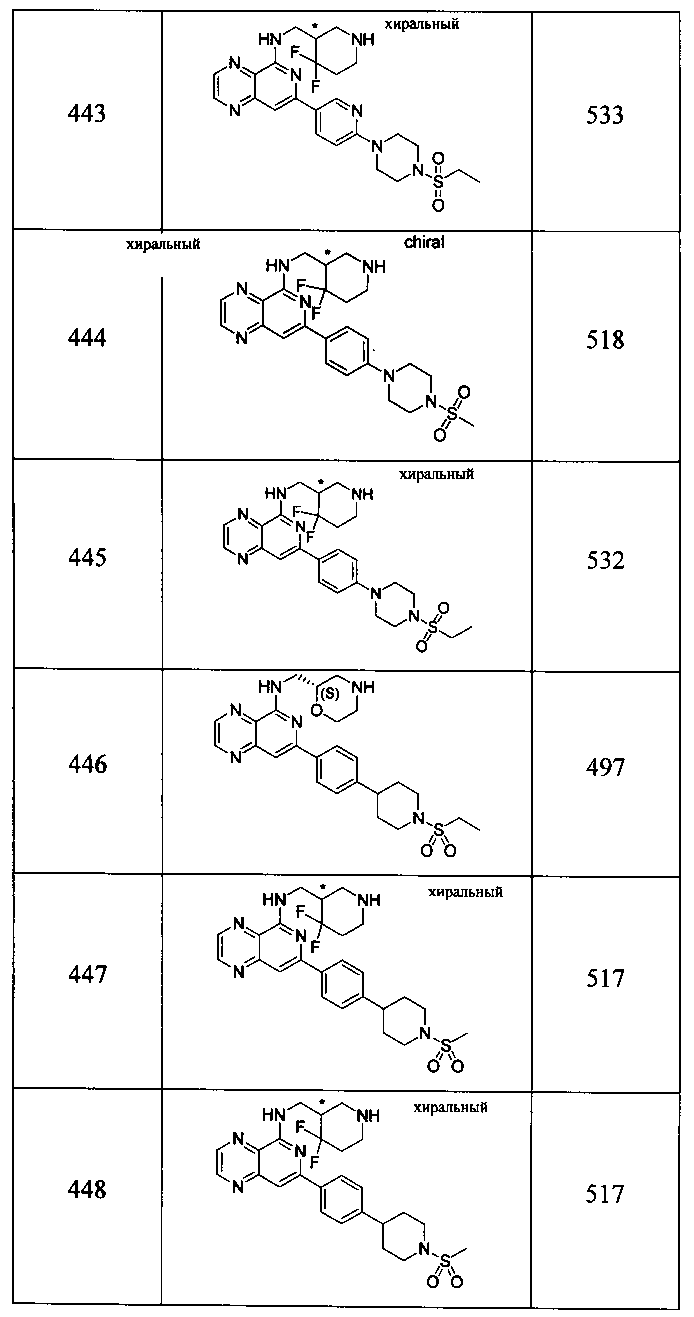
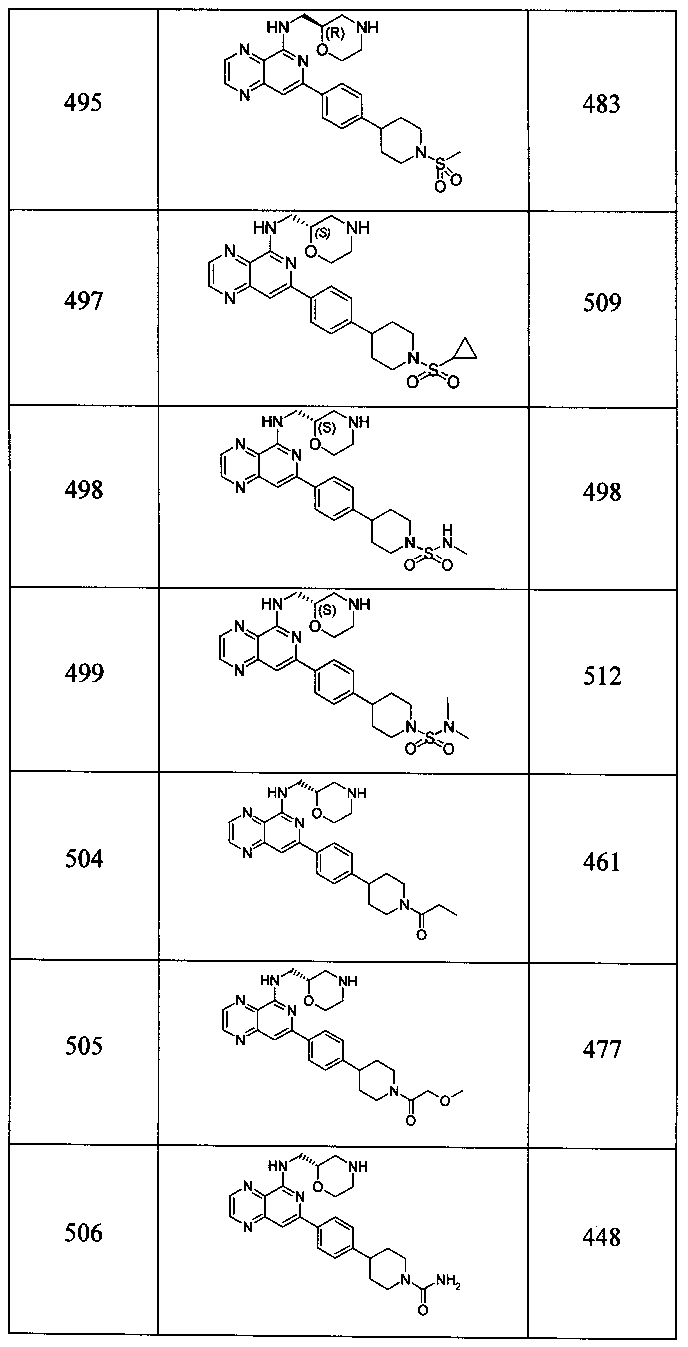
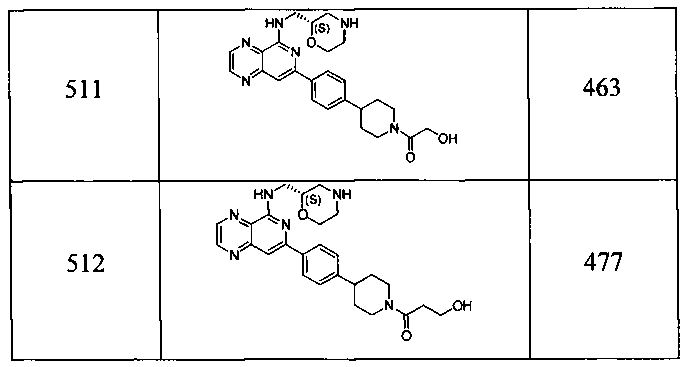
Соединение 449
(R)-2,2-Дифтор-1-(2-((7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолино)этанон
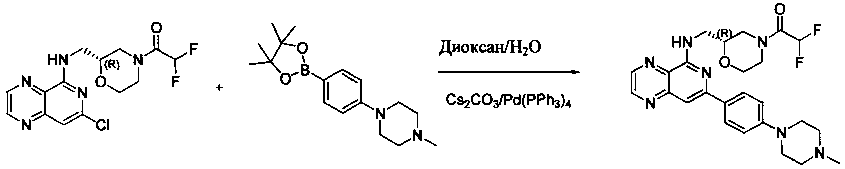
(R)-2,2-Дифтор-1-(2-((7-(4-(4-метилпиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолино)этанон
К раствору (R)-1-(2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанона (72 мг, 0,2 ммоль) в диоксане/H2O (5 мл/0,5 мл) добавляли Cs2CO3 (98 мг, 0,3 ммоль), Pd(PPh3)4 (46,2 мг, 0,04 ммоль) и 1-метил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин (72,5 мг, 0,24 ммоль). Смесь взбалтывали при 110°C в течение 24 часов под N2. Реакционную смесь фильтровали, концентрировали и очищали на колонке (CH2Cl2:MeOH = 20:1) с получением желтого твердого вещества. MS (масса/заряд): 498 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 449 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
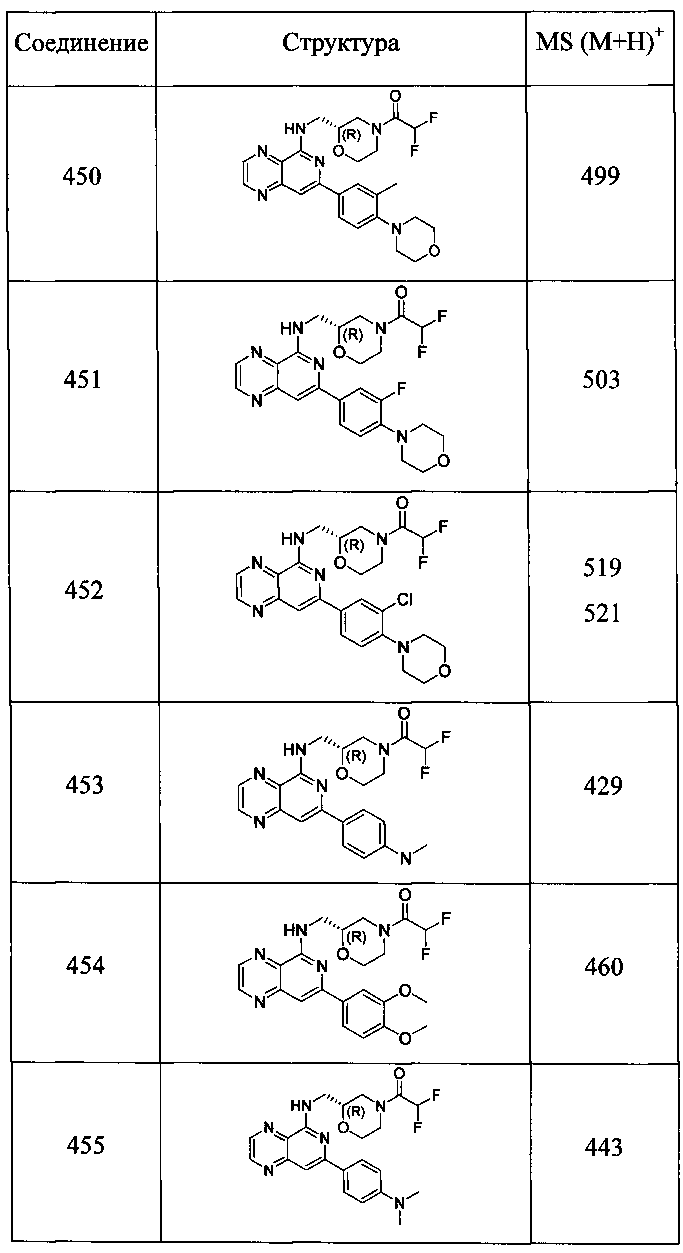
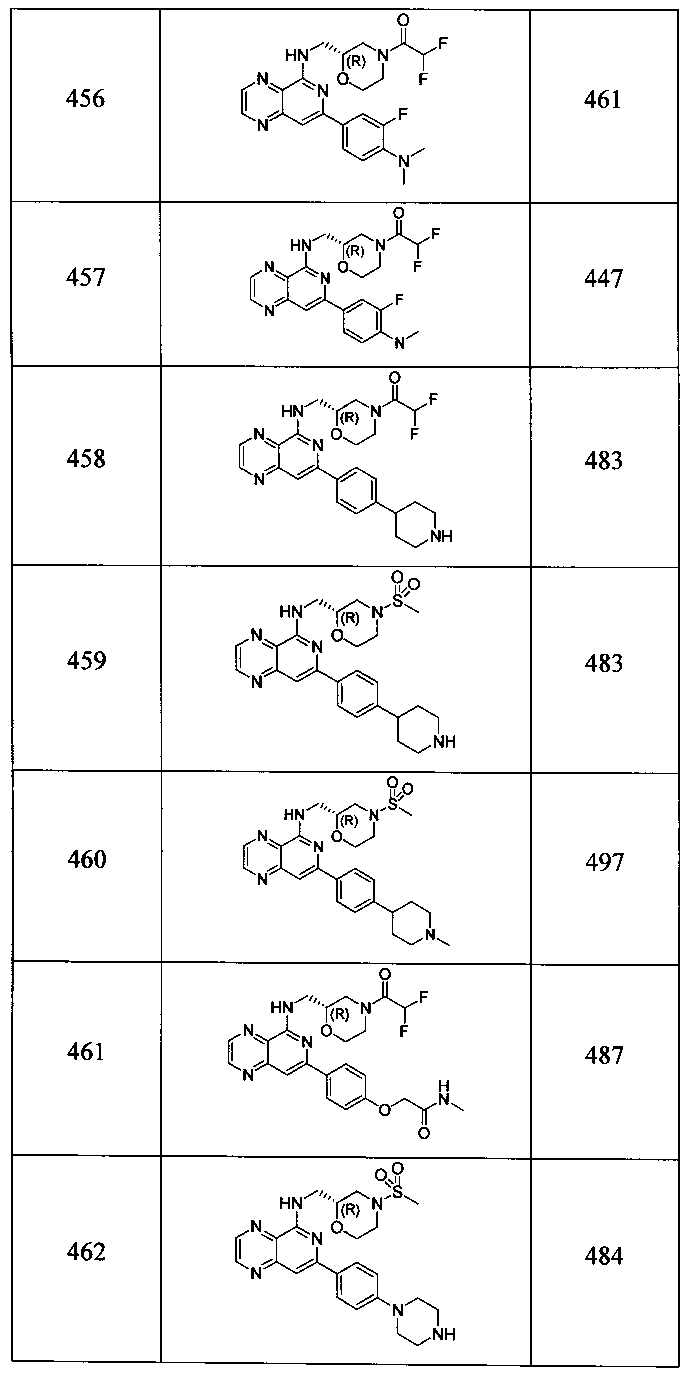
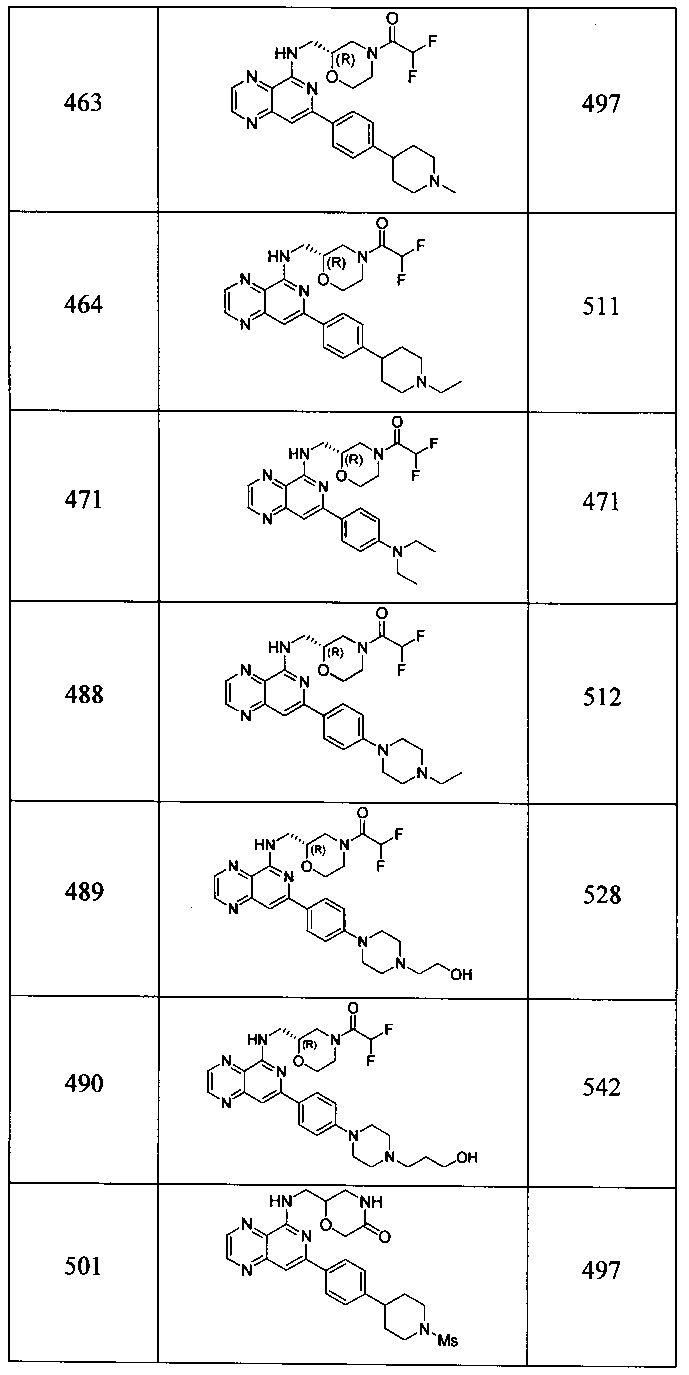
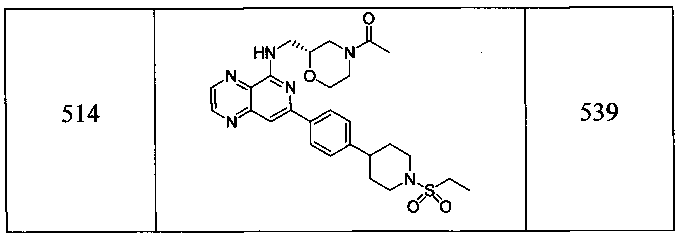
Соединение 466
(S)-1-(2-((7-(4-Фенилпиперазин-1-ил)этанон[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанон
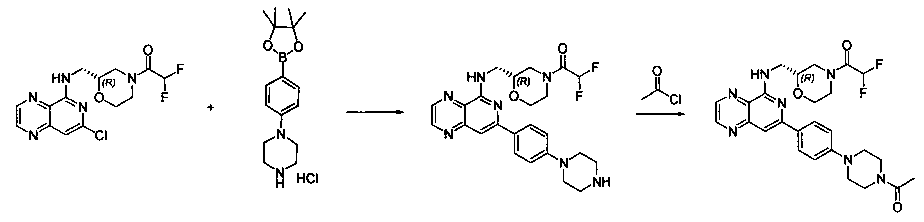
(A) (S)-2,2-Дифтор-1-(2-((7-(4-(пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолино)этанон
Раствор (S)-1-(2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанона (70 мг, 0,19 ммоль), 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазина гидрохлорида (96 мг, 0,29 ммоль), Pd(PPh3)4 (45 мг, 0,04 ммоль) и Cs2CO3 (191 мг, 0,59 ммоль) в 8 мл диоксана и 0,1 мл воды под N2 взбалтывали при 110°C в течение ночи. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:10~8:1) с получением 100 мг названного соединения.
(B) (S)-1-(2-((7-(4-Фенилпиперазин-1-ил)этанон[4,3-b]пиразин-5-иламино)метил)морфолино)-2,2-дифторэтанон
Раствор (S)-2,2-дифтор-1-(2-((7-(4-(пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолино)этанона (50 мг, 0,10 ммоль), ацетилхлорида (12 мг, 0,16 ммоль) и Et3N (31 мг, 0,3 ммоль) в 5 мл DCM взбалтывали при комнатной температуре в течение 1 часа. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:10~10:1) с получением 24 мг названного соединения. MS (масса/заряд) = 526 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 466 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
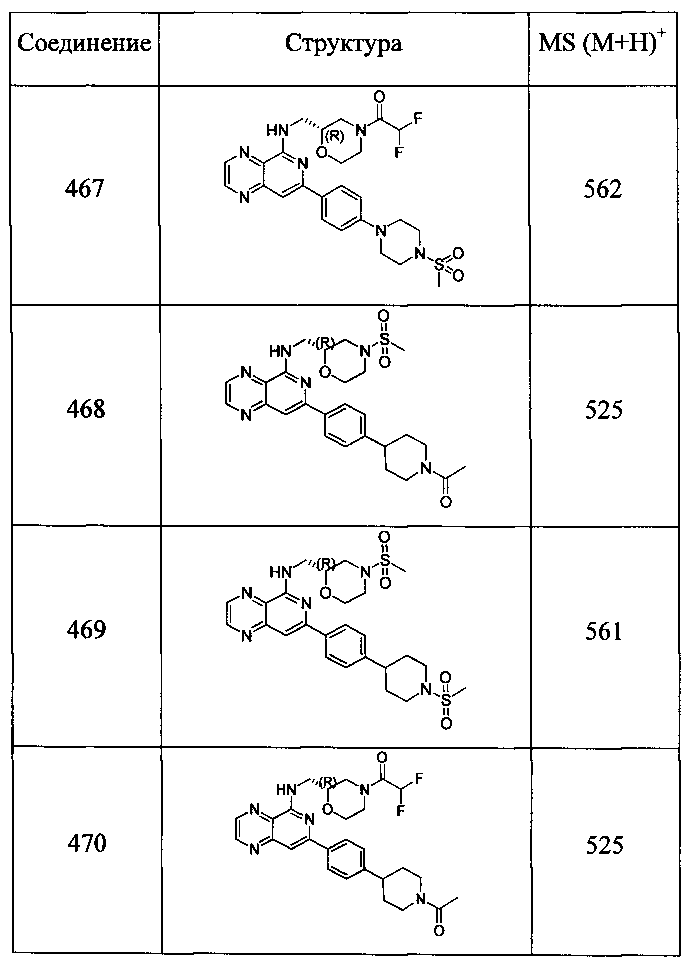
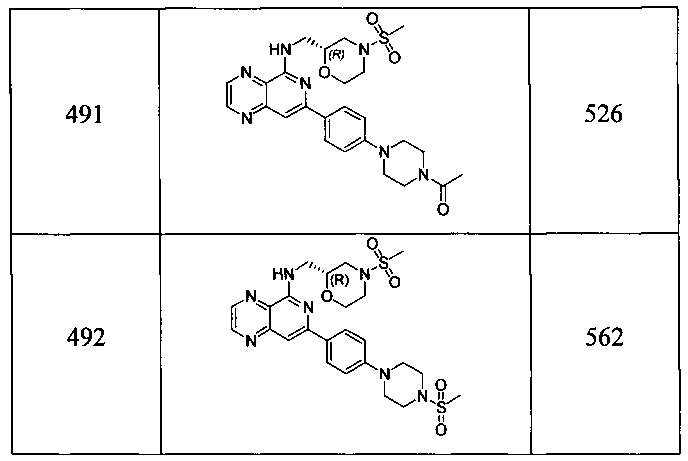
Соединение 472
(S)-2-(Метил(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенил)амино)этанол
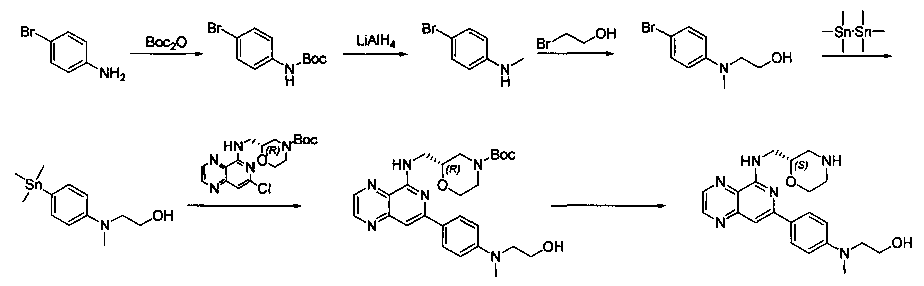
(A) Трет-бутил-4-бромфенилкарбамат
4-Броманилин (4,0 г, 23,25 ммоль) растворяли в CH2Cl2 (100 мл), добавляли DMAP (0,284 г), Et3N (6,5 мл), Boc2O (8,0 мл), смесь взбалтывали при комнатной температуре в течение ночи. Экстрагировали CH2Cl2 и водой, затем смесь промывали водой, сушили над Na2SO4, концентрировали и очищали флэш-хроматографией (PE:EA = 10:1) с получением 5,5 г белого твердого вещества.
(B) 4-Бром-N-метиланилин
Трет-бутил-4-бромфенилкарбамат (5,5 г, 20,21 ммоль) растворяли в THF, добавляли алюмогидрид лития (2,301 г, 60,63 ммоль) и взбалтывали его при 60°C в течение ночи. Затем его гасили с помощью EA, а затем H2O, концентрировали и добавляли CH2Cl2 и 1 M NaOH, промывали с помощью CH2Cl2, экстрагировали CH2Cl2, сушили над Na2SO4, концентрировали, очищали флэш-хроматографией (PE:EA = 40:3) с получением 2,1 г желтого масла.
(C) 2-((4-Бромфенил)(метил)амино)этанол
4-Бром-N-метиланилин (700 мг, 3,76 ммоль) растворяли в DMF (20 мл), добавляли K2CO3 (1,56 г, 11,29 ммоль) и 2-бромэтанол (1,41 г, 11,29 ммоль). Осуществляли реагирование смеси при 100°C в течение 2 дней. Затем ее экстрагировали с помощью EA и солевого раствора, промывали солевым раствором, сушили над Na2SO4, концентрировали и очищали флэш-хроматографией (PE:EA = 10:1-3:1) с получением 164 мг коричневого масла.
(D) 2-(Метил(4-(триметилстаннил)фенил)амино)этанол
2-((4-Бромфенил)(метил)амино)этанол (164 мг, 0,713 ммоль) растворяли в толуоле, добавляли тетракис(трифенилфосфин)палладий (164 мг, 0,143 ммоль) и 1,1,1,2,2,2-гексаметилдистаннан (377 мг, 1,07 ммоль) и осуществляли реакцию при 100°C в течение 3,5 часа. Затем реакционную смесь непосредственно применяли в следующей стадии.
(E) (R)-Трет-бутил-2-((7-(4-((2-гидроксиэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
2-(Метил(4-(триметилстаннил)фенил)амино)этанол (223 мг, 0,713 ммоль), (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (246 мг, 0,648 ммоль), тетракис(трифенилфосфин)палладий (150 мг, 0,13 ммоль) смешивали в толуоле, осуществляли реакцию при 100°C в течение ночи. Затем реакционную смесь фильтровали и концентрировали, очищали флэш-хроматографией (PE:EA = 2:1-1:1) с получением неочищенного продукта в виде красновато-коричневого масла и применяли его без дополнительной очистки.
(F) (S)-2-(Метил(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенил)амино)этанол
(R)-Трет-бутил-2-((7-(4-((2-гидроксиэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат растворяли в EA (20 мл), добавляли 5 М HCl в EA (10 мл), смесь взбалтывали при комнатной температуре в течение ночи. Ее концентрировали, обрабатывали NH3·H2O, концентрировали, очищали препаративной TLC с получением 10 мг красновато-коричневого твердого вещества. MS (масса/заряд): 395 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 472 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
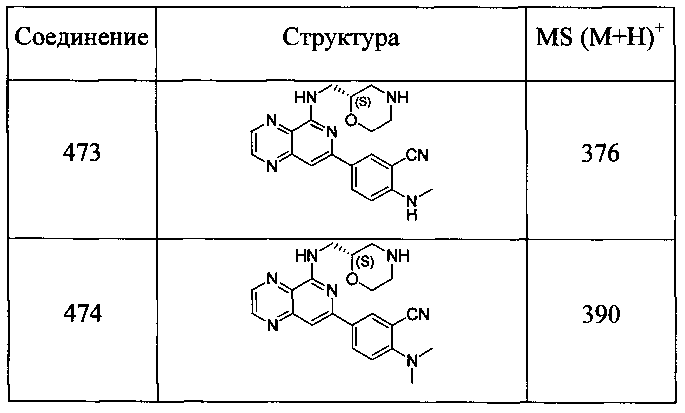
Соединение 475
(S)-1-(4-(5-(Морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенил)пиперидин-4-ол
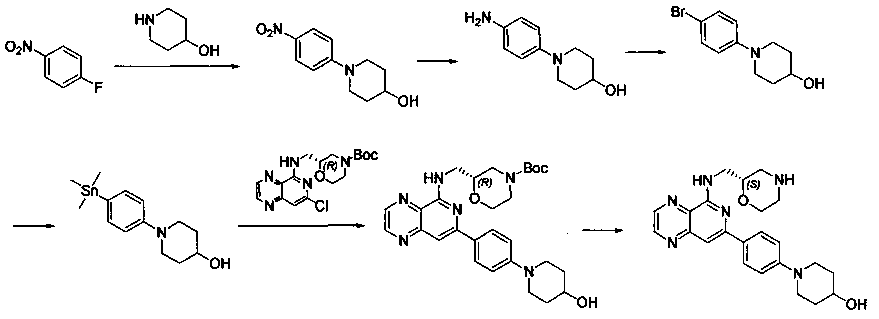
(A) 1-(4-Нитрофенил)пиперидин-4-ол
1-Фтор-4-нитробензол (3,0 г, 21,26 ммоль), пиперидин-4-ол (2,26 г, 22,32 ммоль), K2CO3 (4,4 г, 31,89 ммоль) смешивали в 20 мл DMF, осуществляли реакцию при 80°C в течение 2,5 часа. Затем смесь экстрагировали с помощью EA и солевого раствора, промывали солевым раствором, а затем водой, сушили над Na2SO4, концентрировали. Неочищенный продукт применяли непосредственно в следующей стадии без дополнительной очистки.
(B) 1-(4-Аминофенил)пиперидин-4-ол
Смешивали 1-(4-нитрофенил)пиперидин-4-ол (4,725 г, 21,26 ммоль), Fe (11,87 г, 212,6 ммоль), NH4Cl (11,41 г, 212,6 ммоль), EtOH (100 мл) и воду (50 мл). Смесь взбалтывали при 100°C в течение ночи. Затем добавляли Fe (5,9 г, 106,3 ммоль) и осуществляли реакцию при 100°C в течение 7 часов. Фильтровали и жидкость концентрировали, очищали флэш-хроматографией с получением 1,8 г желтого твердого вещества.
(C) 1-(4-Бромфенил)пиперидин-4-ол
1-(4-Аминофенил)пиперидин-4-ол (600 мг, 3,12 ммоль), HBr (14 мл, 48%) смешивали и охлаждали до 0°C, добавляли раствор NaNO2 (215 мг, 3,12 ммоль) в 2,3 мл воды. Смесь взбалтывали в течение 15 минут, добавляли раствор CuBr (246 мг, 1,72 ммоль) в HBr (4,4 мл 4,8%) и осуществляли реакцию при 100°C в течение 3 часов. Добавляли 2 М раствор NaOH, экстрагировали с помощью EA, промывали 2 М NaOH, сушили над Na2SO4, концентрировали и очищали флэш-хроматографией (PE:EA = 3:1) с получением 520 мг светло-коричневого твердого вещества.
(D) 1-(4-(Триметилстаннил)фенил)пиперидин-4-ол
1-(4-Бромфенил)пиперидин-4-ол (300 мг, 1,17 ммоль), тетракис(трифенилфосфин)палладий (270 мг, 0,23 ммоль), 1,1,1,2,2,2-гексаметилдистаннан (499 мг, 1,52 ммоль) смешивали в толуоле (20 мл), осуществляли реакцию при 100°C в течение 5 часов. Смесь применяли непосредственно в следующей стадии.
(E) (R)-Трет-бутил-2-((7-(4-(4-гидроксипиперидин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
1-(4-(Триметилстаннил)фенил)пиперидин-4-ол (398 мг, 1,17 ммоль), (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (297 мг, 0,78 ммоль), тетракис(трифенилфосфин)палладий (180 мг, 0,15 ммоль) смешивали в 5 мл толуола. Осуществляли реагирование смеси при 100°C в течение ночи. Фильтровали и концентрировали, очищали флэш-хроматографией (PE:EA = 1:2) с получением 112 мг красноватого твердого вещества.
(F) (S)-1-(4-(5-(Морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенил)пиперидин-4-ол
(R)-Трет-бутил-2-((7-(4-(4-гидроксипиперидин-1-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (112 мг, 0,21 ммоль) растворяли в 20 мл EA, затем добавляли 15 мл 5 M HCl в EA. Смесь взбалтывали при комнатной температуре в течение ночи, концентрировали, обрабатывали аммиаком, очищали препаративной TLC с получением 40 мг красноватого твердого вещества. MS: (масса/заряд): 421(M+H)+.
Соединения 476 и 477
(S)-3-(4-(5-(Морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропан-1-ол и (S)-3-(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропилацетат
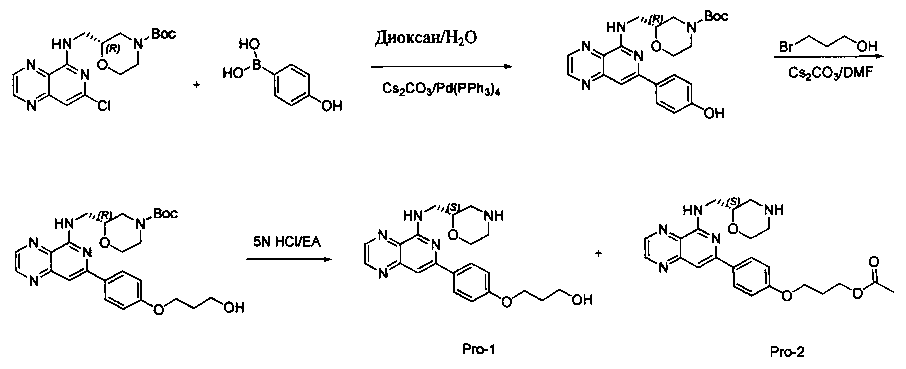
(A) (R)-Трет-бутил-2-((7-(4-гидроксифенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
К раствору (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (380 мг, 1 ммоль) в диоксане/H2O (20 мл/2 мл) добавляли Cs2CO3 (652 мг, 2 ммоль), Pd(PPh3)4 (231 мг, 0,2 ммоль) и 4-гидроксифенилбороновую кислоту (207 мг, 1,5 ммоль). Смесь закрывали в пробирке и нагревали в микроволновом реакторе при 160°C в течение 1,5 часа под N2. Расходовали (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат и реакционную смесь фильтровали, концентрировали и очищали на TLC (CH2Cl2:MeOH = 30:1) с получением желтого твердого вещества. MS (масса/заряд): 438 (M+H)+.
(B) (R)-Трет-бутил-2-((7-(4-(3-гидроксипропокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
К раствору (R)-трет-бутил-2-((7-(4-гидроксифенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (115 мг, 0,26 ммоль) в DMF (5 мл) добавляли Cs2CO3 (128 мг, 0,39 ммоль) и 3-бромпропан-1-ол (55 мг, 0,39 ммоль). Реакционную смесь взбалтывали при 80°C в течение 0,5 часа. TLC и LC-MS показывали завершение реакции и реакционную смесь выливали в воду, экстрагировали с помощью EA, промывали водой и солевым раствором, сушили и концентрировали, очищали на TLC (CH2Cl2:MeOH = 30:1) с получением желтого твердого вещества. MS (масса/заряд): 496 (M+H)+.
(C) (S)-3-(4-(5-(Морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропан-1-ол и (S)-3-(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропилацетат
(R)-Трет-бутил-2-((7-(4-(3-гидроксипропокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (98 мг, 0,20 ммоль) растворяли в растворе HCl/EA (5 н, 5 мл) и взбалтывали в течение 4 часов при 20°C. Реакционную смесь концентрировали и промывали насыщ. NaHCO3, водой и солевым раствором, концентрировали и очищали на TLC (CH2Cl2:MeOH = 5:1) с получением двух желтых твердых веществ. Pro-1 представляет собой (S)-3-(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропан-1-ол, MS (масса/заряд): 396 (M+H)+. Pro-2 представляет собой (S)-3-(4-(5-(морфолин-2-илметиламино)пиридо[4,3-b]пиразин-7-ил)фенокси)пропилацетат, MS (масса/заряд): 438 (M+H)+.
Соединение 478
(S)-7-(4-(2-(Метилсульфонил)этокси)фенил)-N-(морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
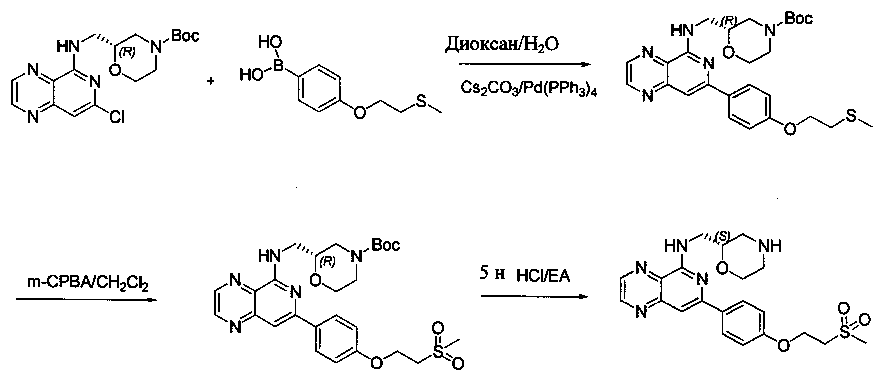
(A) (R)-Трет-бутил-2-((7-(4-(2-(метилтио)этокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
К раствору (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (114 мг, 0,3 ммоль) в диоксане/H2O (5 мл/1 мл) добавляли Cs2CO3 (195 мг, 0,6 ммоль), Pd(PPh3)4 (69 мг, 0,06 ммоль) и 4-(2-(метилтио)этокси)фенилбороновую кислоту (127 мг, 0,6 ммоль). Смесь закрывали в пробирке и нагревали в микроволновом реакторе при 160°C в течение 1,5 часа под N2. Расходовали (R)-трет-бутил-2-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат и реакционную смесь фильтровали, концентрировали и очищали на TLC (EA:PE = 1:1) с получением желтого твердого вещества. MS (масса/заряд): 512 (M+H)+.
(B) (R)-Трет-бутил-2-((7-(4-(2-(метилсульфонил)этокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат
К раствору (R)-трет-бутил-2-((7-(4-(2-(метилтио)этокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилата (150 мг, 0,29 ммоль) в CH2Cl2 (5 мл) добавляли m-CPBA (125 мг, 0,73 ммоль) при 0°C. После чего реакционную смесь взбалтывали при комнатной температуре в течение 24 часов. TLC и LC-MS показывали завершение реакции и реакционную смесь промывали насыщ. Na2S2O3, насыщ. NaHCO3, водой и солевым раствором, концентрировали и очищали на TLC (CH2Cl2:MeOH = 30:1) с получением желтого твердого вещества. MS (масса/заряд): 544 (M+H)+.
(C) (S)-7-(4-(2-(Метилсульфонил)этокси)фенил)-N-(морфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
(R)-Трет-бутил-2-((7-(4-(2-(метилсульфонил)этокси)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-4-карбоксилат (76 мг, 0,14 ммоль) растворяли в растворе HCl/EA (5 н., 5 мл) и взбалтывали в течение 4 часов при 20°C. Реакционную смесь концентрировали и промывали насыщ. NaHCO3, водой и солевым раствором, концентрировали и очищали на TLC (CH2Cl2:MeOH = 5:1) с получением желтого твердого вещества. MS (масса/заряд):444 (M+H)+
Соединение 479
(R)-7-(4-(1-Этилпиперидин-4-ил)фенил)-N-((4-(метилсульфонил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
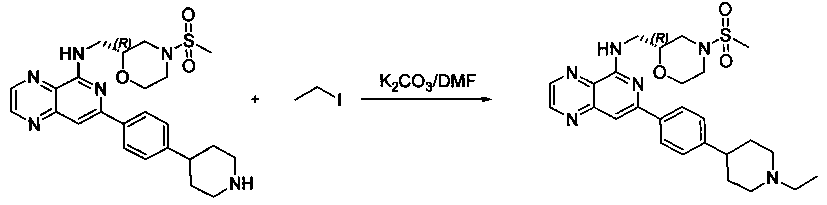
(R)-7-(4-(1-Этилпиперидин-4-ил)фенил)-N-((4-(метилсульфонил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
К раствору (R)-N-((4-(метилсульфонил)морфолин-2-ил)метил)-7-(4-(пиперидин-4-ил)фенил)пиридо[4,3-b]пиразин-5-амина (39,5 мг, 0,082 ммоль) в DMF (5 мл) добавляли K2CO3 (22,6 мг, 0,164 ммоль) и йодэтан (25,5 мг, 0,164 ммоль) при комнатной температуре. Реакционную смесь взбалтывали при 100°C в течение 18 часов. После чего реакционную смесь растворяли в 50 мл EA, промывали H2O (25 мл) и солевым раствором (25 мл), сушили над Na2SO4 и концентрировали, очищали на TLC (CH2Cl2:MeOH = 20:1) с получением желтого твердого вещества. MS (масса/заряд): 511 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 479 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
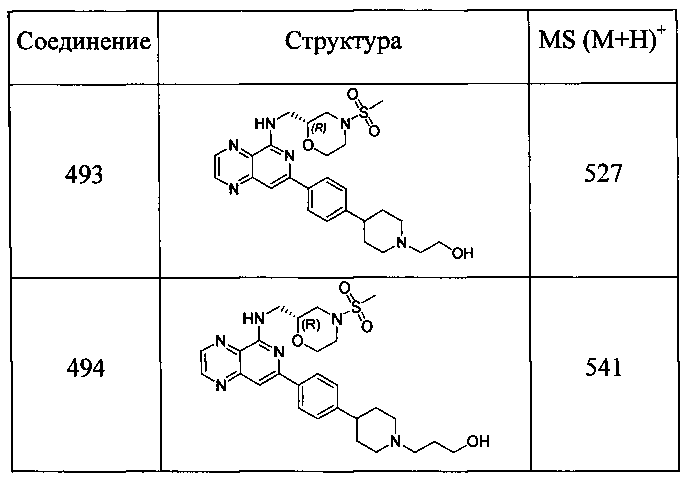
Соединение 480
(R)-4-(4-(5-((4-(2,2-Дифторацетил)морфолин-2-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)-1,1-диэтилпиперидиния йодид
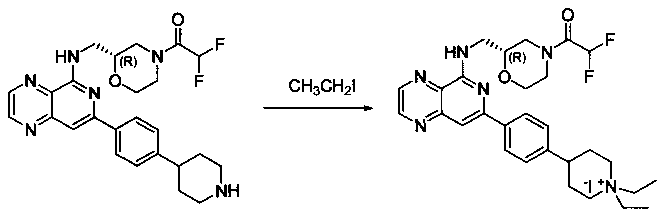
(R)-4-(4-(5-((4-(2,2-Дифторацетил)морфолин-2-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)-1,1-диэтилпиперидиния йодид
Раствор (R)-2,2-дифтор-1-(2-((7-(4-(пиперидин-4-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолино)этанона (85 мг, 0,175 ммоль), йодэтана (82 мг, 0,52 ммоль) и карбоната калия (97 мг, 0,70 ммоль) в DMF (15 мл) нагревали в закрытой пробирке при 100°C в течение 4 часов. Затем смесь экстрагировали с помощью DCM, промывали солевым раствором, сушили и очищали препаративной TLC (DCM/MeOH = 10/1) с получением продукта в виде желтого твердого вещества. MS (масса/заряд): 539 (M+H-I-)+.
Соединение 481
(R)-7-(4-Морфолинофенил)-N-((4-(пиримидин-2-ил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
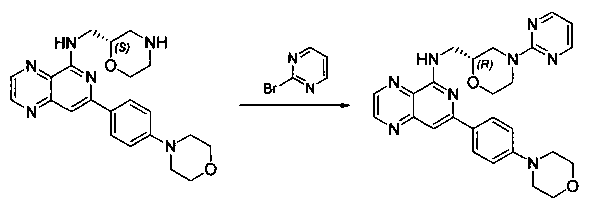
(R)-7-(4-Морфолинофенил)-N-((4-(пиримидин-2-ил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
Раствор (S)-N-(морфолин-2-илметил)-7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-амина (100 мг, 0,246 ммоль), 2-бромпиримидина (59 мг, 0,37 ммоль) и карбоната цезия (193 мг, 0,592 ммоль) в DMF (2 мл) нагревали при 100°C в закрытой пробирке в течение ночи. Затем смесь экстрагировали с помощью EA, промывали солевым раствором, концентрировали и очищали колоночной флэш-хроматографией, элюировали с DCM/MeOH с получением продукта в виде светло-желтого твердого вещества. MS (масса/заряд): 485 (M+H)+.
Соединение 482
7-(4-Морфолинофенил)-N-(1,1-диоксо-тиоморфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
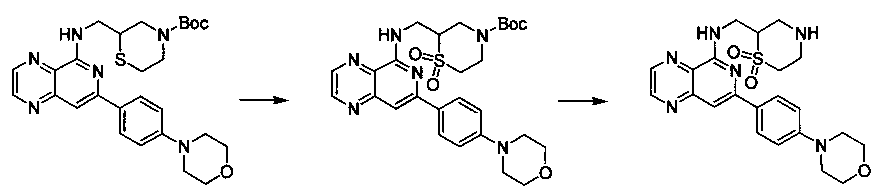
(A) Трет-бутил-2-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)-1,1-диоксо-тиоморфолин-4-карбоксилат
К раствору трет-бутил-2-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)тиоморфолин-4-карбоксилата (178 мг, 0,34 ммоль) в CH2Cl2 (5 мл) добавляли 3-хлорпероксибензойную кислоту (70%, 251 мг, 1,02 ммоль) при 0°C. Полученную смесь взбалтывали при комнатной температуре в течение 3 часов, а затем добавляли насыщенный водный раствор тиосульфата натрия и смесь взбалтывали еще 30 минут. Слои разделяли и водный слой дважды экстрагировали EtOAc. Объединенные EtOAc слои промывали дважды водным раствором Na2CO3. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали in vacuo с получением 52 мг названного соединения. MS (масса/заряд): 555 (M+H)+.
(B) 7-(4-Морфолинофенил)-N-(1,1-диоксо-тиоморфолин-2-илметил)пиридо[4,3-b]пиразин-5-амин
Трет-бутил-2-((7-(4-морфолинофенил)пиридо[4,3-b]пиразин-5-иламино)метил)-1,1-диоксо-тиоморфолин-4-карбоксилат (52 мг, 0,094 ммоль) растворяли в растворе HCl в этилацетате (3 мл) и смесь взбалтывали при комнатной температуре в течение 2 часов, пока TLC не показала удаление группы Boc. Летучие материалы удаляли, остаток нейтрализовали гидроксидом аммония (25%, 1 мл) и очищали колонкой C18 с получением 33 мг желтого твердого вещества. MS (масса/заряд): 455 (M+H)+.
Следующие соединения получали согласно процедурам для соединения 482 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
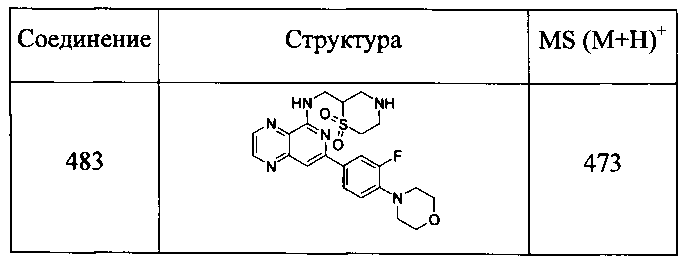
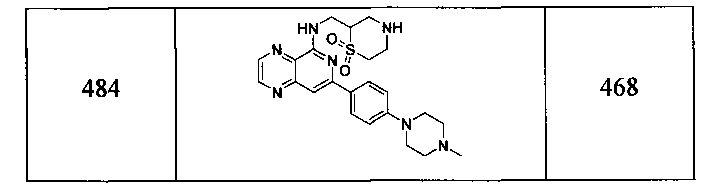
Соединение 485
2-((4-(5-((4,4-Дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)(метил)амино)этанол
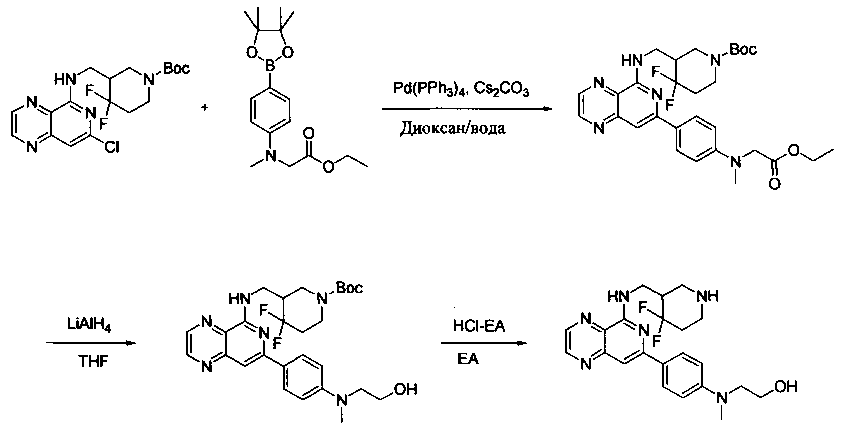
(A) Трет-бутил-3-((7-(4-((2-этокси-2-оксоэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилат
Раствор трет-бутил-3-((7-хлорпиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилата (173 мг, 0,42 ммоль), этил-2-(метил(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)амино)ацетата (200 мг, 0,63 ммоль), Pd(PPh3)4 и Cs2CO3 в 4 мл диоксана и 0,5 мл воды взбалтывали при 160°C в течение 1 часа. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:8~5:1) с получением 373 мг названного соединения.
(B) Трет-бутил-4,4-дифтор-3-((7-(4-((2-гидроксиэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилат
Раствор трет-бутил-3-((7-(4-((2-этокси-2-оксоэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)-4,4-дифторпиперидин-1-карбоксилата (120 мг, 0,21 ммоль) и LiAlH4 (10 мг, 0,25 ммоль) в 5 мл THF при 0°C, под N2, взбалтывали при 0°C в течение 1 часа. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:8~5:1) с получением 25 мг названного соединения.
(C) 2-((4-(5-((4,4-Дифторпиперидин-3-ил)метиламино)пиридо[4,3-b]пиразин-7-ил)фенил)(метил)амино)этанол
Раствор трет-бутил-4,4-дифтор-3-((7-(4-((2-гидроксиэтил)(метил)амино)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)пиперидин-1-карбоксилата (25 мг, 0,05 ммоль) и 2 мл HCl-EA (5,0 н.) в 4 мл EA взбалтывали при комнатной температуре в течение 1,5 часа. Летучие компоненты удаляли in vacuo и остаток добавляли в 5 мл MeOH и 0,5 мл NH3·H2O. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:10~5:1) с получением 14 мг названного соединения. MS (масса/заряд) = 429 (M+H)+.
Соединение 486
(S)-7-(4-(4-Метилпиперазин-1-ил)фенил)-N-((4-(метилсульфонил)морфолин-2-ил)метил)пиридо[4,3-b]пиразин-5-амин
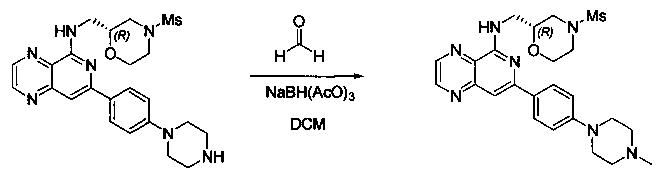
Раствор (S)-N-((4-(метилсульфонил)морфолин-2-ил)метил)-7-(4-(пиперазин-1-ил)фенил)пиридо[4,3-b]пиразин-5-амина (60 мг, 0,12 ммоль), формалина (48 мг, 0,48 ммоль) и NaBH(AcO)3 в 5 мл DCM взбалтывали при комнатной температуре в течение 2 часов. Летучие компоненты удаляли in vacuo и остаток очищали хроматографией с MeOH/H2O (1:10~10:1) с получением 46 мг названного соединения. MS (масса/заряд) = 498 (M+H)+.
Следующее соединение получали согласно процедурам для соединения 486 с использованием соответствующих промежуточных соединений и реагентов при надлежащих условиях, которые будут понятны специалисту данной области.
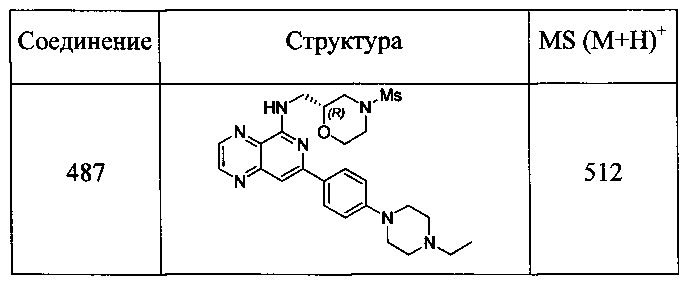
Соединение 496
(R)-2-((7-(4-(1-(Метилсульфонил)пиперидин-4-ил)фенил)пиридо[4,3-d]пиразин-5-иламино)метил)морфолин-4-ол
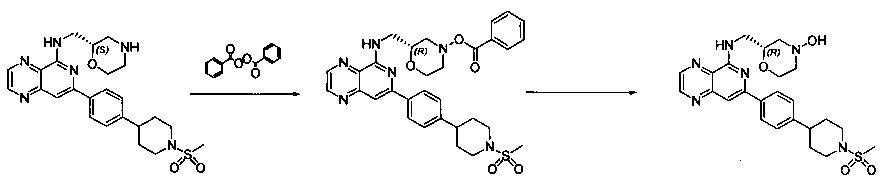
К раствору бензоил пероксида (430 мг, 1,78 ммоль) в DMF при -5°C добавляли K2HPO4 (360 мг, 2,07 ммоль), затем добавляли раствор соединения 419 (833 мг, 1,73 ммоль) в DMF. Смесь взбалтывали при комнатной температуре в течение ночи. Реакционный раствор выливали в ледяную воду, фильтровали, фильтрационный осадок промывали водой и PE, сушили с получением неочищенного продукта в виде желтого твердого вещества. Неочищенный продукт растворяли в метаноле и THF, охлаждали до -5°C, каплями добавляли LiOH (15 мл), смесь взбалтывали в течение 1 часа. В реакционный раствор добавляли 100 мл воды, экстрагировали с помощью DCM (50 мл × 4), промывали солевым раствором, сушили безводным Na2SO4. Растворитель удаляли с получением неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией (DCM:MeOH = 100:1~50:1), промывали 5 мл EA и 1 мл метанола с получением названного соединения в виде желтого твердого вещества (145 мг). MS (масса/заряд) = 499 (M+H)+.
Соединения 507 и 508
(S)-6-((7-(4-(1-(Метилсульфонил)пиперидин-4-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-3-он и (R)-6-((7-(4-(1-(метилсульфонил)пиперидин-4-ил)фенил)пиридо[4,3-b]пиразин-5-иламино)метил)морфолин-3-он
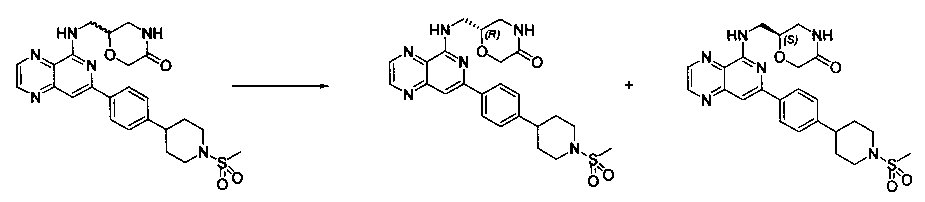
Рацемическое соединение 501 разделяли хиральной HPLC с получением оптически чистых энантиомеров соединений 507 и 508 (условия HPLC: колонка: CHIRALPAK IA 0,20×25 см; подвижная фаза: CH3CN/EtOH = 90/10; объемная скорость потока = 10,0 мл/мин; детектор: UV 254 нм). Первый элюент (соединение 507, Rf=9,759 мин) составлял 100% ее, MS (масса/заряд): 497 (M+H)+, и второй элюент (соединение 508, Rf=10,916 мин.) составлял 100% ее, MS (масса/заряд): 497 (M+H)+.
Пример 2
Ферментативный анализ
Анализ киназы SYK выполняли in vitro с использованием Kit-Tyr 2 Peptide (Invitrogen, № по каталогу PV3191) и в 384-луночном аналитическом планшете. Все реакции (40 мкл) начинали путем добавления 0,8 мкл тестируемого соединения в 100% растворе DMSO, 10 мкл субстратной смеси киназы и пептида или раствора фосфо-пептида (Invitrogen, № по каталогу PV3192, разбавленного 1,33х киназным буфером), 5 мкл раствора АТФ (100 мкМ) или 1,33х киназного буфера (Invitrogen, № по каталогу PV3189, разбавленного дистиллированной водой 5х), 4,2 мкл дистиллированной воды. Содержимое 384-луночного аналитического планшета (Corning, № по каталогу 3575) смешивали и инкубировали при комнатной температуре в течение 1 часа. Затем в каждую лунку добавляли 10 мкл Development Solution (полученного путем разведения Development Reagent A (№ по каталогу PV3297) до 1/32 с помощью Development Buffer (№ по каталогу PV3127)), смешивали и инкубировали при комнатной температуре еще 1 час. Затем реакции останавливали путем добавления 10 мкл стоп-реагента (Invitrogen, № по каталогу PV3094) и планшет считывали с помощью Wallac 1420 VICTOR3 Multilabel Counter (PerkinElmer™) при 445 нм и 520 нм флуоресценции. Все соединения тестировали при 8 концентрациях (от 1 мкМ до 0,0003 мкМ) с использованием схемы серийных разведений 1:3.
Ниже представлены значения IC50 некоторых соединений.
IC50: ферментативная активность
Значения IC50 соединений 1, 3, 9, 10, 12, 19, 21, 22, 26, 30, 32, 33, 34, 35, 40, 41, 42, 44, 46, 47, 48, 52, 53, 54, 55, 59, 60, 61, 63, 64, 67, 70, 71, 73, 74, 77, 78, 79, 80, 81, 82, 83, 85, 86, 87, 90, 93, 94, 96, 99, 102, 103, 104, 105, 107, 109, 110, 111, 112, 114, 116, 117, 119, 120, 121, 122, 123, 127, 128, 129, 130, 134, 136, 137, 139, 140, 141, 142, 143, 146, 156, 157, 158, 173, 179, 185, 186, 200, 205, 208, 213, 215, 216, 217, 218, 219, 221, 225, 226, 228, 229, 230, 231, 232, 233, 235, 236, 237, 238, 239, 240, 241, 251, 253, 254, 264, 265, 266, 267, 269, 270, 272, 273, 274, 275, 276, 278, 279, 280, 281, 285, 286, 287, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 300, 301, 302, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 332, 333, 340, 346, 347, 362, 368, 370, 371, 372, 374, 376, 377, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 392, 394, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 455, 456, 458, 459, 460, 462, 463, 464, 465, 466, 467, 468, 469, 470, 473, 474, 475, 476, 479, 480, 485, 486, 487, 488, 489, 490, 493, 494, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 510, 511, 512 находились в диапазоне от 0,001 до менее 0,1 мкМ.
Значения IC50 соединений 4, 6, 7, 8, 11, 13, 14, 15, 17, 18, 20, 23, 24, 25, 27, 28, 31, 37, 39, 43, 45, 49, 57, 65, 66, 68, 69, 72, 75, 76, 84, 88, 89, 91, 92, 95, 97, 98, 100, 101, 106, 108, 115, 124, 135, 138, 144, 145, 147, 148, 149, 150, 151, 154, 155, 159, 161, 162, 163, 164, 165, 166, 167, 168, 172, 174, 175, 176, 177, 180, 188, 191, 194, 195, 196, 198, 201, 202, 203, 204, 206, 207, 209, 210, 211, 212, 214, 220, 222, 223, 224, 227, 234, 242, 244, 245, 246, 247, 248, 249, 250, 252, 255, 256, 257, 258, 259, 260, 261, 262, 263, 268, 271, 277, 283, 284, 288, 299, 303, 304, 325, 326, 327, 328, 337, 339, 341, 342, 343, 344, 348, 349, 350, 353, 354, 355, 356, 356, 357, 358, 360, 361, 363, 364, 369, 373, 375, 378, 379, 391, 393, 395, 452, 453, 454, 457, 461, 471, 472, 477, 478, 482, 483, 484, 491, 492, 495, 496, 509 составляли от 0,1 мкМ до менее 1 мкМ.
Пример 3
Клеточные анализы
Для определения индуцированной IgE секреции бета-гексозаминидазы клетки RBL-2H3 (SIBS) высевали в 96-луночные планшеты при 4×104 клеток на лунку, инкубировали в среде MEM с 15% FBS и глутамином (2 нМ) в течение 4 часов и сенсибилизировали с 0,5 мкг/мл SPE-7 в течение ночи. Клетки промывали 3 раза буфером Тироде и инкубировали в присутствии или отсутствие тестируемого соединения в разных концентрациях в течение 20 минут при 37°C, 5% CO2. Клетки стимулировали добавлением в каждую лунку 10 мкл раствора DNP-BSA (150 нг/мл) и инкубировали в течение 45 минут при 37°C, 5% CO2. Затем отбирали 45 мкл супернатанта и инкубировали с 100 мкл 1 мМ 4-нитрофенил-N-ацетил-β-D-глюкозаминида (Sigma, № по каталогу N9376), который разбавляли в 0,05 M цитратном буфере (pH 4,5), в течение 1,5 часа при 37°C. Реакции гасили добавлением 185 мкл 0,05 M натрий-карбонатного буфера (pH 10,0). Планшеты считывали при 405 нм на Multiskan (MK 3).
Значения IC50 соединений 1, 3, 12, 19, 21, 22, 30, 32, 35, 44, 70, 77, 82, 93, 96, 99, 102, 104, 105, 107, 109, 110, 111, 114, 115, 116, 117, 123, 129, 130, 134, 136, 137, 139, 140, 141, 142, 143, 146, 155, 156, 157, 159, 163, 165, 173, 177, 188, 196, 200, 205, 208, 213, 215, 216, 217, 218, 219, 221, 226, 229, 230, 231, 232, 233, 235, 236, 237, 239, 240, 247, 250, 251, 254, 255, 264, 265, 266, 267, 269, 272, 273, 274, 275, 276, 278, 279, 285, 286, 287, 289, 290, 291, 292, 294, 295, 296, 297, 298, 300, 301, 302, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 323, 324, 332, 333, 340, 346, 347, 362, 368, 370, 371, 374, 376, 377, 380, 382, 383, 384, 385, 387, 388, 389, 390, 392, 393, 394, 395, 396, 397, 398, 399, 400, 402, 405, 407, 411, 413, 414, 415, 416, 418, 419, 421, 423, 424, 425, 426, 427, 428, 429, 430, 432, 433, 435, 437, 438, 439, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 455, 456, 460, 465, 466, 467, 469, 470, 473, 474, 476, 477, 479, 485, 486, 488, 489, 490, 497, 498, 499, 501, 504, 505, 511 находились в диапазоне от 0,001 до менее 0,1 мкМ.
Значения IC50 соединений 4, 9, 10, 13, 15, 17, 18, 23, 24, 25, 26, 28, 33, 37, 39, 40, 41, 42, 45, 46, 47, 52, 54, 55, 60, 63, 67, 68, 69, 71, 73, 74, 75, 76, 78, 79, 80, 81, 83, 84, 85, 86, 87, 88, 89, 91, 92, 94, 95, 97, 98, 100, 103, 106, 108, 112, 119, 120, 121, 122, 124, 127, 128, 135, 138, 144, 147, 148, 149, 150, 151, 158, 160, 161, 162, 164, 166, 167, 168, 170, 171, 172, 174, 175, 176, 179, 180, 181, 184, 185, 186, 187, 194, 197, 199, 220, 222, 223, 225, 228, 234, 238, 241, 253, 259, 260, 261, 270, 280, 281, 293, 303, 322, 372, 373, 381, 386, 401, 403, 404, 406, 408, 409, 410, 412, 417, 420, 434, 440, 441, 458, 462, 463, 464, 468, 475, 487, 493, 494, 500, 502, 503, 506, 510, 512 составляли от 0,1 мкМ до менее 1 мкМ.
Для определения индуцированного IgE фосфорилирования LAT из бедра самки мышей BALB/C (возрастом 6-8 недель) выделяли тучные клетки костного мозга (BMMC) и культивировали в среде RPMI 1640 с 10% FBS, L-глутамином (2 нМ) и IL-3 (10 нг/мл) в течение 4-6 недель. BMMC оставляли в RPMI 1640 с 10% FBS, L-глутамином (2 нМ), но без IL-3, на всю ночь. Клетки сенсибилизировали с 1 мкг/мл SPE-7 (1×107 клеток/мл) в течение 4 часов. Клетки промывали 3 раза буфером Тироде и высевали в 96-луночные планшеты (3×105/лунка). Затем клетки инкубировали в присутствии или отсутствие тестируемого соединения в разных концентрациях в течение 20 минут при 37°C, 5% CO2. Клетки стимулировали добавлением в каждую лунку 10 мкл раствора DNP-BSA (100 нг/мл) и инкубировали в течение 5 минут при 37°C, 5% CO2. Центрифугировали планшеты и удаляли среду. Затем в каждую лунку планшетов добавляли 80 мкл 1х буфера для клеточного лизиса, которые замораживали при -80°C в течение ночи. В каждую лунку новых 96-луночных планшетов добавляли 100 мкл 1 мкг/мл поликлонального антитела против LAT (Abcam, разбавленного в PBS) и инкубировали при RT в течение ночи. После промывки с помощью 200 мкл/лунка промывочного раствора планшеты блокировали добавлением в каждую лунку 200 мкл PBS, содержащего 1,0% BSA, и инкубировали при комнатной температуре в течение 2 часов. В планшеты добавляли 50 мкл клеточного лизата, разбавленного 50 мкл разбавителей образца, и инкубировали при комнатной температуре в течение 2 часов. После промывки добавляли выявляющее антитело против фосфотирозина, конъюгированное с HRP (R&D, разбавленное в PBS с 0,1% BSA, 1:2000), и планшеты инкубировали при комнатной температуре в течение 1 часа. После промывки в каждую лунку добавляли 100 мкл TMB и планшеты оставляли на 20 минут в темноте. Реакцию останавливали добавлением 100 мкл стоп-буфера. Планшеты считывали при 450 нм и 570 нм на Multiskan (MK3).
Значения IC50 соединений 1, 3, 10, 12, 32, 35, 44, 70, 71, 77, 81, 82, 93, 94, 96, 99, 104, 105, 107, 116, 117, 134, 137, 140, 156, 159, 160, 161, 163, 181, 184, 185, 188, составляли от 0,1 мкМ до менее 1 мкМ.