Результат интеллектуальной деятельности: ИНГИБИТОРЫ ЦИТОКИНОВ
Вид РИД
Изобретение
Перекрестная ссылка
Настоящая заявка испрашивает приоритет в соответствии с заявкой США, порядковый номер 11/934154, поданной 2 ноября 2007 г., содержание которой включено в настоящее описание посредством ссылки.
Уровень техники
Фактор некроза опухолей альфа (TNFα, ФНОα), цитокин мононуклеаров, продуцирует преимущественно моноциты и макрофаги. Ему присущи различные виды биологической активности: (1) уничтожение раковых клеток или ингибирование роста раковых клеток, (2) активация фагоцитоза нейтрофильных гранулоцитов, (3) активация продуцирования пероксида и (4) уничтожение инфекционных патогенов.
Интерлейкин-1 бета (IL-1β, ИЛ-1β), цитокин, секретируемый клетками, такими как моноциты-макрофаги и дендритные клетки, выступает в качестве медиатора в иммунных и воспалительных реакциях.
Ядерный фактор каппа B (NF-кB) является провоспалительным фактором транскрипции. Он активирует цитокины, включая ФНОα и ИЛ-1β, и таким образом играет роль медиатора воспалительной реакции.
Индуцибельная синтаза оксида азота (iNOS) индуцируется эндотоксинами или цитокинами (например, ФНОα). Она катализирует образование оксида азота, который оказывает важное плейотропное действие, из L-аргинина и кислорода.
ФНОα, ИЛ-1β, NF-κB и iNOS играют важные роли во многих ключевых физиологических и патологических процессах, связанных с широким диапазоном заболеваний, например, таких как аутоиммунные заболевания, рак, атеросклероз и диабет. Поэтому модулирование экспрессии или активности ФНОα, ИЛ-1β, NF-κB или iNOS может оказать лечебный эффект в отношении этих заболеваний. См., например, Ogata H, Hibi T. et al Curr Pharm Des. 2003; 9(14): 1107-13; Taylor PC. et al Curr Pharm Des. 2003; 9(14): 1095-106; Fan C., et al. J. Mol. Med 1999, 77, 577-592; and Alcaraz et al., Current Pharmaceutical Design, 2002: 8, 215.
Сущность изобретения
Настоящее изобретение основано на неожиданно обнаруженном факте, заключающемся в том, что соединения имидазола в существенной степени ингибируют продукцию цитокинов, включая ФНОα, и интерлейкин (например, ИЛ-1β, ИЛ-2 или ИЛ-6), у мышей и крыс. Эти соединения потенциально полезны для лечения нарушений, опосредуемых патологическими уровнями цитокинов, таких как воспаления, аутоиммунные заболевания, диабеты, атеросклероз и рак.
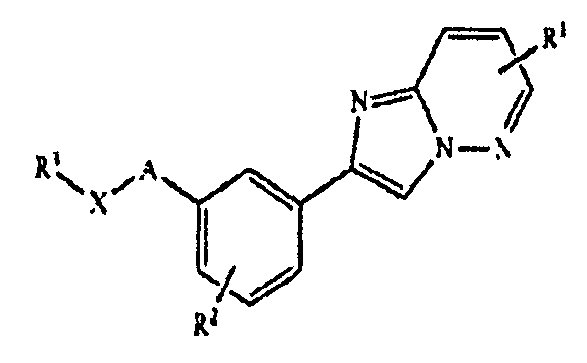
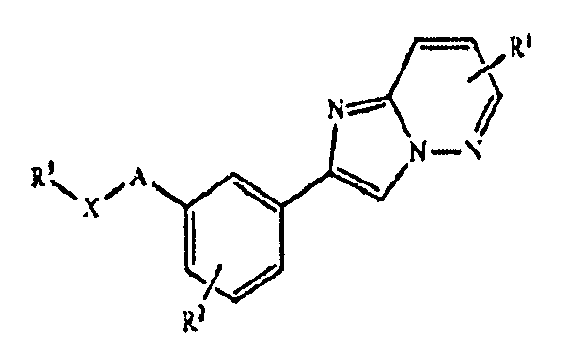
Соответственно, в одном из аспектов настоящего изобретения предложены соединения имидазола формулы I:

В этой формуле A отсутствует или представляет собой (CR'R”)n, где n является 1, 2, 3, 4 или 5, или гетероарил, выбранный из группы, состоящей из:

при этом каждый из R' и R” независимо представляет собой H или C1-10 алкил, и R”' представляет собой H или C1-10 алкил, при этом C1-10 алкил необязательно замещен галогеном, C(O)Ra, ORb, SRb, S(O)2Rb, NRcRd, C(O)NRcNRd, при этом каждый из Ra и Rb независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил или гетероарил, и каждый из Rc и Rd независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, или Rc и Rd совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу; B представляет собой 5-6-членный гетероарил; X отсутствует или представляет собой (CRa'Rb')m, где m является 1, 2, 3, 4 или 5, SO, SO2, CO, COO, CONRc', NRc' или NRc'CONRd', при этом каждый из Ra', Rb', Rc' и Rd' независимо представляет собой H или C1-10 алкил; каждый из R1 и R2 независимо представляет собой H, галоген, NRc1C(O)Ra1, ORb1, NRc1Rd1, NRc1C(O)ORb1, NRc1S(O)2Rb1, C1-10 алкил или C1-10 галогеналкил, при этом каждый из Ra1 и Rb1 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил или гетероарил, и каждый из Rc1 и Rd1 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, или Rc1 и Rd1 совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу; а R3 представляет собой H, галоген, OC(O)Ra2, C(O)ORb2, ORb2, SRb2, SO2Rb2, C(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Ra2, NRc2C(O)C(O)ORa2, NRc2S(O)2Rb2, C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены галогеном, C1-4 алкилом, C1-4 галогеналкилом, арилом, гетероарилом, CN, NO2, ORb2, C(O)ORb2, C(O)NRc2Rd2 или NRc2Rd2, при этом каждый из Ra2 и Rb2 независимо представляет собой H, C1-6 алкил, C1-6 галогеналкил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил или гетероарилалкил, при этом C1-6 алкил, C1-6 галогеналкил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил или гетероарилалкил необязательно замещены OH, C1-6 алкоксилом, CN, NO2 или галогеном, и каждый из Rc2 и Rd2 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены C1-6 алкоксилом, OH, амино, C1-4 алкиламино, C2-8 диалкиламино, S(O)2Rb2, C1-6 алкилом, C1-6 галогеналкилом, C1-6 галогеналкилом, арилом, арилалкилом, гетероарилом, гетероарилалкилом, циклоалкилом или гетероциклоалкилом, или Rc2 и Rd2 совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу.
В рамках формулы I подгруппа описанных выше соединений индазола представляет собой те соединения, в которых удаляют все A, CH2 или .
.
В этих соединениях B может представлять собой  или
или  .
.
X может отсутствовать или представлять собой (CRa'Rb')m, CO, COO, NRc', CONRc', или NRc'CONRd'. Более конкретно, X может представлять собой CH2, NH, CO, COO, CONH или NHCONH.
В настоящем описании термин «алкил» относится к линейному или разветвленному углеводороду, содержащему, например, 1-20 атомов углерода. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил, но не ограничиваются перечисленными. Термин «алкоксил» относится к -O-алкилу. Термин «галогеналкил» относится к алкильной группе, имеющей один или более заместителей-галогенов. Примеры галогеналкильных групп включают CF3, C2F5, CHF2, CCl3, CHCl2, C2Cl5 и т.п. Термин «арилалкил» (или «гетероарилалкил») относится к алкилу, содержащему в качестве заместителя арил (или гетероарил), а «циклоалкилалкил» (или «гетероциклоалкилалкил») относится к алкилу, содержащему в качестве заместителя циклоалкил (или гетероциклоалкил). Примером арилалкильной группы является бензил. Термин «циклоалкил» относится к насыщенному циклическому углеводородному фрагменту, такому как циклогексил. Термин «гетероциклоалкил» относится к насыщенному циклическому фрагменту, имеющему, по меньшей мере, один гетероатом в кольце (например, N, O или S), такой как 4-тетрагидропиранил. Термин «арил» относится к углеводородному фрагменту, включающему одно или более ароматических колец. Примеры арильных фрагментов включают фенил (Ph), фенилен, нафтил, нафтилен, пиренил, антрил и фенантрил. Термин «галогенарил» относится к арильной группе, имеющей один или более заместителей галогенов. Термин «гетероарил» относится к фрагменту, включающему одно или более ароматических колец, которые содержат, по меньшей мере, один гетероатом (например, N, O или S). Примеры гетероарильных фрагментов включают фурил, фурилен, флуоренил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридил, пиримидинил, хиназолинил, хинолил, изохинолил и индолил. Термин «галоген» включает фтор, хлор, бром и йод. Термин «алкиламино» относится к аминогруппе, содержащей в качестве заместителя алкильную группу. Термин «диалкиламино» относится к аминогруппе, содержащей в качестве заместителей две алкильные группы.
Алкил, галогеналкил, алкоксил, арилалкил, гетероарилалкил, циклоалкилалкил, гетероциклоалкилалкил, циклоалкил, гетероциклоалкил, арил и гетероарил, упомянутый в настоящем документе, включают как замещенные, так и незамещенные фрагменты, если не указано иное. Возможные заместители циклоалкила, циклоалкенила, гетероциклоалкила, гетероциклоалкенила, арила и гетероарила включают, не ограничиваясь перечисленными: C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, C3-C20 циклоалкил, C3-C20 циклоалкенил, C1-C20 гетероциклоалкил, C1-C20 гетероциклоалкенил, C1-C10 алкокси, арил, арилокси, гетероарил, гетероарилокси, амино, C1-C10 алкиламино, C1-C20 диалкиламино, ариламино, диариламино, C1-C10 алкилсульфонамино, арилсульфонамино, C1-C10 алкилимино, арилимино, C1-C10 алкилсульфонимино, арилсульфонимино, гидроксил, галоген, тио, C1-C10 алкилтио, арилтио, C1-C10 алкилсульфонил, арилсульфонил, ациламино, аминоацил, аминотиоацил, амидо, амидино, гуанидин, уреидо, тиоуреидо, циано, нитро, нитрозо, азидо, ацил, тиоацил, ацилокси, карбоксил и эфир карбоновой кислоты. С другой стороны, возможные заместители алкила, алкенила или алкинила включают все вышеупомянутые заместители, кроме C1-C10 алкила. Циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил и гетероарил также могут быть конденсированы друг с другом.
Другой аспект настоящего изобретения относится к способу снижения уровня цитокина (например, ФНОα или интерлейкина) посредством приведения цитокина (например, ФНОα или интерлейкина) в контакт с эффективным количеством одного или более соединений имидазола формулы I. Интерлейкин включает, не ограничиваясь перечисленными: ИЛ-1β, ИЛ-2 и ИЛ-6.
Еще один аспект настоящего изобретения относится к способу лечения нарушений, опосредуемых повышенной продукцией цитокина (например, ФНОα или интерлейкина), таких как воспалительные заболевания кишечника (включая болезнь Крона и неспецифический язвенный колит), хроническая сердечная недостаточность, сахарный диабет, системная красная волчанка, полимиозит/дерматомиозит, псориаз, острый миелобластный лейкоз, деменция при синдроме СПИД, септицемия, септический шок, реакция «трансплантат против хозяина», увеит, астма, острый панкреатит, аллергия, атеросклероз, рассеянный склероз или периодонтит. Способ включает введение субъекту, нуждающемуся в лечении, эффективного количества одного или более соединений имидазола формулы I.
Соединения формулы I, описанные выше, включают сами соединения, а также соли, пролекарства и сольваты таких соединений, если это возможно. Соль, например, может быть образована между анионом и положительно заряженной группой (например, аммонием) в соединении формулы I. Соответствующие анионы включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, ацетат, малат, тозилат, тартрат, фумурат, глутамат, глюкуронат, лактат, глутарат и малеат. Аналогично, соль может быть также образована между катионом и отрицательно заряженной группой (например, карбоксилатом) в соединении формулы I. Соответствующие катионы включают ион натрия, ион калия, ион магния, ион кальция, а также катион аммония, например, ион тетраметиламмония. Соединения также включают соли, содержащие четверичные атомы азота. Примеры пролекарств включают сложные эфиры и другие фармацевтически приемлемые производные, которые после введения субъекту могут выделять активные соединения формулы I. Сольватом называют комплекс, образованный между активным соединением формулы I и фармацевтически приемлемым растворителем. Примеры фармацевтически приемлемых растворителей включают воду, этанол, изопропанол, этилацетат, уксусную кислоту и этаноламин.
В еще одном аспекте настоящего изобретения предложен химический способ получения указанных соединений (включая их соли и сольваты) и/или соответствующих промежуточных продуктов.
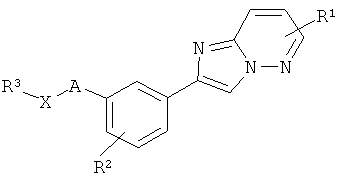
В одном из вариантов воплощения способ включает взаимодействие соединения следующей формулы:

где B представляет собой 5-6-членный гетероарил, и каждый из R1 и R2 независимо представляет собой H, галоген, NRc1C(O)Ra1, ORb1, NRc1Rd1, NRc1C(O)ORb1, NRc1S(O)2Rb1, C1-10 алкил или C1-10 галогеналкил, при этом каждый из Ra1 и Rb1 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил или гетероарил, и каждый из Rc1 и Rd1 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, или Rc1 и Rd1 совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу; с соединением следующей формулы:
R 3a -X 1 -C(O)-L,
при этом L является уходящей группой (например, хлор или OC(O)R), X1 отсутствует или представляет собой (CRa'Rb')m, где m является 1, 2, 3, 4 или 5, и каждый из Ra' и Rb' независимо представляет собой H или C1-10 алкил, и R3a представляет собой H, галоген, OC(O)Ra2, C(O)ORb2, C(O)NRc2Rd2, C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены галогеном, C1-4 алкилом, C1-4 галогеналкилом, арилом, гетероарилом, CN, NO2, ORb2, C(O)ORb2, C(O)NRc2Rd2 или NRc2Rd2, при этом каждый из Ra2 и Rb2 независимо представляет собой H, C1-6 алкил, C1-6 галогеналкил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил или гетероарилалкил, при этом C1-6 алкил, C1-6 галогеналкил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил или гетероарилалкил необязательно замещены OH, C1-6 алкоксилом, CN, NO2 или галогеном, и каждый из Rc2 и Rd2 независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены C1-6 алкоксилом, OH, амино, C1-4 алкиламино, C2-8 диалкиламино, S(O)2Rb2, C1-6 алкилом, C1-6 галогеналкилом, C1-6 галогеналкилом, арилом, арилалкилом, гетероарилом, гетерарилалкилом, циклоалкилом или гетероциклоалкилом, или Rc2 и Rd2 совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу.
В еще одном варианте реализации процесс включает сочетание соединения следующей формулы:

где A отсутствует или представляет собой (CR'R”)n, где n является 1, 2, 3, 4 или 5, и каждый из R' и R” независимо представляет собой H или C1-10 алкил, B, R1 и R2 определены выше; с соединением следующей формулы:
L-X 2 -R 3b ,
где L является уходящей группой, X2 отсутствует или представляет собой SO, SO2 или CO и R3b представляет собой NRc2Rd2, C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены галогеном C1-4 алкилом, C1-4 галогеналкилом, арилом, гетероарилом, CN, NO2, ORb2, C(O)ORb2, C(O)NRc2Rd2 или NRc2Rd2, при этом Rc2 и Rd2 определены выше.
В еще одном варианте реализации способ включает осуществление сочетания соединения следующей формулы:

где L является уходящей группой, A' представляет собой гетероарил, выбранный из группы, состоящей из:

при этом каждый из R' и R” независимо представляет собой H или C1-10 алкил, и R”' представляет собой H или C1-10 алкил, при этом C1-10 алкил необязательно замещен галогеном, C(O)Ra, ORb, SRb, S(O)2Rb, NRcRd, C(O)NRcNRd, при этом каждый из Ra и Rb независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил или гетероарил, и каждый из Rc и Rd независимо представляет собой H, C1-10 алкил, C1-10 галогеналкил, арил, гетероарил, или Rc и Rd совместно с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу; B, R1 и R2 определены выше; с соединением следующей формулы:
H-R 3c ,
при этом R3c представляет собой OC(O)Ra2, ORb2, SRb2, SO2Rb2, NRc2Rd2, NRc2C(O)Ra2, NRc2C(O)C(O)ORa2, NRc2S(O)2Rb2, C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил, при этом C1-10 алкил, C1-10 галогеналкил, арил, галогенарил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно замещены галогеном, C1-4 алкилом, C1-4 галогеналкилом, арилом, гетероарилом, CN, NO2, ORb2, C(O)ORb2, C(O)NRc2Rd2 или NRc2Rd2, при этом Ra2, Rb2, Rc2 и Rd2 определены выше.
После каждой реакции сочетания, описанной выше, способ может также включать получение фармацевтически приемлемой соли или сольвата полученного соединения формулы I.
Получение соединений может включать защиту и снятие защиты различных химических групп. Определение необходимости в защите и снятии защиты, выборе приемлемых защитных групп могут легко быть осуществлены любым специалистом в данной области. Информация о химии защитных групп может быть найдена, например, в Greene, et al., Protective Groups in Organic Synthesis, 2d. Ed., Wiley & Sons, 1991, которая полностью включена в настоящее описание посредством ссылки.
Также в объем настоящего изобретения входит фармацевтическая композиция, содержащая одно или более соединений имидазола формулы I, для применения при лечении любого указанного выше заболевания и также для применения одного или более соединений имидазола для производства лекарственных средств для такого лечения.
Подробности одного или более вариантов реализации настоящего изобретения представлены в сопутствующем описании, представленном ниже. Другие признаки, назначения и преимущества изобретения станут очевидными из описания и формулы изобретения.
Подробное описание
Ниже показаны типичные соединения, соединения 1-106, согласно настоящему изобретению.





Описанные выше соединения могут быть получены способами, хорошо известными в данной области техники. В представленных ниже примерах 1-106 подробно описано фактическое получение соединений 1-106.
Описанные выше соединения включают одну или более неароматических двойных связей и один или более центров асимметрии. Указанные соединения могут существовать в виде рацематов, рацемических смесей, отдельных энантиомеров, отдельных диастереомеров, диастереомерных смесей и цис- или транс- или E- или Z-парных изомерных форм. Соединения согласно изобретению также включают таутомерные формы, такие как кето-енольные таутомеры. Соединения согласно изобретению могут также включать все изотопы атомов, встречающиеся в промежуточных соединениях или конечных соединениях. Изотопы включают атомы, имеющие одинаковый атомный номер, но различные массовые числа. Например, изотопы водорода включают тритий и дейтерий.
Согласно одному из аспектов настоящего изобретения предложен способ снижения уровня цитокина (например, ФНОα или ИЛ-1β), например, посредством ингибирования продукции цитокина у субъекта. Субъектом называют любое животное, включая млекопитающих, предпочтительно мышей, крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, лошадей или приматов и, наиболее предпочтительно, человека. Способ включает введение субъекту эффективного количества одного или более описанных выше соединений. Термин «эффективное количество» относится к количеству соединения, которое необходимо для достижения желаемого эффекта. Эффективные количества могут варьировать, что очевидно для специалистов в данной области, в зависимости от пути введения, использования инертного наполнителя и возможности совместного использования других средств.
Поскольку описанные выше соединения снижают уровень цитокина у субъекта, их можно применять для лечения нарушений, вызванных повышенной продукцией цитокина. Таким образом, в объем настоящего изобретения также входит способ лечения заболеваний, связанных с повышенной продукцией цитокина, то есть воспалительных заболеваний, аутоиммунных заболеваний, рака, диабетов, аллергии или атеросклероза. Аутоиммунные заболевания включают ревматический артрит, воспалительные заболевания кишечника (включая болезнь Крона и неспецифический язвенный колит), рассеянный склероз, псориаз или септический шок, но не ограничивается перечисленными. Способ включает введение субъекту, нуждающемуся в лечении, эффективного количества одного из описанных выше соединений.
Термин «терапия» или «лечение» относится к применению или введению композиции, содержащей соединение, субъекту, который страдает одним из вышеупомянутых заболеваний, проявляет симптом такого заболевания или имеет предрасположенность к этому заболеванию, с целью лечения, вылечивания, облегчения, ослабления, изменения, устранения, снижения выраженности, улучшения или оказания воздействия на заболевание, симптомы заболевания или предрасположенность к этому заболеванию.
Для осуществления способа лечения согласно настоящему изобретению одно или более из описанных выше соединений смешивают с фармацевтически приемлемым носителем и затем вводят перорально, ректально, парентерально, в форме аэрозоля для ингаляции или при помощи имплантированного резервуара. В настоящем описании термин «парентерально» включает подкожную, внутрикожную, внутривенную, внутримышечную, внутрисуставную, внутриартериальную, внутрисиновиальную, в подложечную область, интратекальную, в очаг поражения и внутричерепную инъекцию или инфузию.
Композиция для перорального приема может быть представлена в любой лекарственной форме, подходящей для перорального введения, включая таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы, но не ограничивается перечисленными. Обычно используемые носители для таблеток включают лактозу и кукурузный крахмал. В таблетки также обычно добавляют смазывающие вещества, такие как стеарат магния. Для перорального приема в виде капсул пригодные разбавители включают лактозу и сухой кукурузный крахмал. Если водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендирован или растворен в масляной фазе, объединенной с эмульгирующими или суспендирующими агентами. Если желательно, можно добавить подслащивающие, ароматизирующие или окрашивающие вещества.
Стерильная композиция для инъекций (например, водная или маслянистая суспензия) может быть изготовлена согласно методикам, известным в данной области, с использованием соответствующих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и с помощью суспендирующих агентов. Стерильный состав для инъекций может также представлять собой стерильный раствор для инъекций или суспензию в нетоксичном разбавителе или растворителе, подходящем для парентерального введения, например, в виде раствора в 1,3-бутандиоле. К приемлемым средам и растворителям, которые можно использовать, относятся следующие: маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, часто в качестве растворителя или суспендирующей среды используют стерильные, нелетучие масла (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота, и ее глицеридные производные можно применять в приготовлении средств для инъекций, поскольку они являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, в частности, в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать разбавитель или диспергирующий агент на основе длинноцепочечного спирта, или карбоксилметилцеллюлозу или подобные диспергирующие агенты.
Композицию для ингаляции можно приготовить согласно методикам, хорошо известным в области технологии приготовления фармацевтического состава, и можно представить в виде растворов в физиологическом растворе с использованием бензилового спирта или других соответствующих консервирующих средств, активаторов всасывания, улучшающих биодоступность, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области.
Одно или более активных соединений можно вводить ректально. Одним из примеров может служить суппозиторий, который включает активные соединения с основой для суппозиториев. Пригодными основами для суппозиториев являются, например, природные или синтетические триглицериды или углеводороды парафинового ряда. Еще одним примером является желатиновая капсула для ректального введения, которая включает активные соединения и основу. Возможные материалы основы включают, например, жидкие триглицериды, полиэтиленгликоли или углеводороды парафинового ряда.
Композиция для нанесения на кожу может быть представлена в виде масла, крема, лосьона, мази и т.п. Приемлемые носители для композиции включают растительные или минеральные масла, белый вазелин (белый мягкий парафин), жиры или масла с разветвлённой цепью, животные жиры и высокомолекулярные спирты (более C12). Предпочтительными носителями являются те носители, в которых активный ингредиент является растворимым. Также можно включить в состав эмульгаторы, стабилизаторы, увлажнители и антиоксиданты, а также средства, придающие цвет или запах, если это необходимо. Дополнительно, в таких составах для местного применения можно использовать усилители проникновения через кожу. Примеры таких усилителей можно найти в патентах США 3989816 и 4444762.
Кремы предпочтительно получают из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, к которым добавляют активный ингредиент, растворенный в малом количестве масла, таком как миндальное масло. Примером такого крема является крем, который включает приблизительно 40 частей воды, приблизительно 20 частей пчелиного воска, приблизительно 40 частей минерального масла и приблизительно 1 часть миндального масла.
Мази можно получить посредством добавления раствора активного ингредиента в растительное масло, такое как миндальное масло, с добавлением теплого мягкого парафина и охлаждением смеси. Примером такой мази служит мазь, которая включает приблизительно 30% миндаля и приблизительно 70% по массе белого мягкого парафина.
Носитель в фармацевтической композиции должен быть «приемлемым» в том смысле, что он должен быть совместим с активным ингредиентом состава (и предпочтительно обладать способностью к стабилизации активного ингредиента) и быть не вредным для субъекта, которого подвергают лечению. Например, солюбилизирующие агенты, такие как циклодекстрины (которые образуют специфические комплексы с активными соединениями, обладающие лучшей растворимостью), можно применять в качестве фармацевтических инертных наполнителей для доставки активных соединений. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Желтый № 10.
Для предварительной оценки эффективности любого из вышеописанных соединений в снижении уровня цитокина (например, ФНОα или ИЛ-1β) можно провести соответствующее исследование in vitro. Соединения, которые демонстрируют высокую активность в предварительном скрининге, можно подвергать дальнейшему скринингу с использованием тестов in vivo (представленный ниже пример 107). Например, исследуемое соединение вводят животному (например, мыши в качестве модели), а затем оценивают его влияние на снижение уровня цитокина. Соединения можно дополнительно исследовать для проверки их эффективности в лечении нарушений, опосредуемых повышенной продукцией цитокина. Например, соединение можно вводить животному (например, мыши в качестве модели), страдающему воспалительным заболеванием кишечника, а затем оценивают его терапевтические эффекты. На основе результатов можно также определить соответствующие диапазоны дозы и пути введения.
Конкретные примеры, представленные ниже, следует рассматривать как исключительно иллюстративные, они никоим образом не ограничивают оставшуюся часть раскрытия. Предполагается, что любой специалист в данной области на основании представленного описания может использовать настоящее изобретение в полном объеме без дополнительных усилий. Все упомянутые в настоящем документе публикации полностью включены в настоящее описание посредством ссылки.
Пример 1
Соединение 1: 2-(3-(5-метил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали в соответствии с представленной ниже схемой и описанием.

1 ммоль 3-(2-бромацетил)бензонитрила и 1 ммоль 6-хлорпиридазин-3-амина в 10 мл EtOH нагревали с обратным холодильником в течение 12 часов, а затем охлаждали до комнатной температуры. Оранжево-красный осадок собрали посредством фильтрации, промывали холодным EtOH и сушили на воздухе с получением 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)бензонитрила (125 мг, 50%).
2,5 мг 10% Pd-C добавляли в раствор 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)бензонитрила (50 мг, 0,2 ммоль) в 25 мл ТГФ/MeOH. Реакционную смесь интенсивно перемешивали при комнатной температуре в течение 4 часов в атмосфере водорода, а затем удаляли Pd-C. Концентрировали фильтрат в вакууме с получением 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрила в виде твердого вещества желто-белого цвета.
Смесь 0,5 ммоль 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрила, 1 ммоль NH2OH·HCl и 1 ммоль Et3N в EtOH перемешивали с обратным холодильником в течение 4 часов, а затем охлаждали. Избыток растворителя удаляли в вакууме с получением неочищенного продукта. Уксусный ангидрид (2 ммоль) добавляли в раствор смеси неочищенного продукта, ТГФ (15 мл) и DMAP (кат.) при комнатной температуре, а затем нагревали с обратным холодильником в течение 12 часов. Концентрировали смесь в вакууме и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле с получением 2-(3-(5-метил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазина.
1H ЯМР (MeOD, 400 МГц): δ 8,676~8,650 (м, 1H), 8,606 (c, 1H), 8,444~8,424 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,150~8,113 (м, 1H), 8,041~7,988 (м, 2H), 7,631~7,580 (т, J=6,0 Гц, 1H), 7,266~7,220 (дд, J=6,0 Гц, 2,0 Гц, 1H); МС (m/e): 278,4 (М+1).
Пример 2
Соединение 2: 1-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-3-(2-морфолиноэтил)мочевину получали в соответствии с представленной ниже схемой и описанием.

Катализатор никель Ренея (кат.) и NH3·H2O (4~5 капель) добавляли в раствор 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрила (25 мг) в MeOH. Смесь интенсивно перемешивали при комнатной температуре в течение 1 часа в атмосфере водорода, а затем удаляли катализатор никель Ренея. Концентрировали фильтрат в вакууме с получением (3-(имидазо[1,2-b]пиридазин-2-ил)фенил)метанамина.
0,2 ммоль (3-(имидазо[1,2-b]пиридазин-2-ил)фенил)метанамина и 1 ммоль K2CO3 в сухом толуоле перемешивали в течение 30 мин при температуре 30°C, добавляли CDI (0,2 ммоль) и продолжали перемешивание в течение 2 часов. Затем добавляли 0,2 ммоль 2-морфолиноэтанамина и DMAP (кат.) и нагревали раствор до 60°C в течение 2 часов. Концентрировали реакционную смесь в вакууме и удаляли осадок посредством колоночной хроматографии на силикагеле с получением 1-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-3-(2-морфолиноэтил)мочевины.
1H ЯМР (MeOD, 400 МГц): δ 8,526 (с, 1H), 8,430~8,409 (дд, J=6,0 Гц, 2,4 Гц, 1H), 8,001~7,971 (д, J=12 Гц, 1H), 7,910 (с, 1H), 7,866~7,847 (д, J=8 Гц, 1H), 7,445~7,394 (т, J=10 Гц, 1H), 7,325~7,301 (д, J=10,0 Гц, 1H), 7,251~7,206 (дд, J=12,0 Гц, 5,6 Гц, 1H), 3,733~3,666 (м, 4H), 3,336~3,268 (м, 4H), 2,615~2,543 (м, 6H); МС (m/e): 381,4 (M+1).
Пример 3
Соединение 3: 1-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-3-(2-метоксиэтил)мочевину получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,533 (c, 1H), 8,429~8,411 (дд, J=6,0 Гц, 1,2 Гц, 1H), 8,005~7,970 (дд, J=12,4 Гц, 2,0 Гц, 1H), 7,897 (c, 1H), 7,874~7,850 (д, J=10,4 Гц, 1H), 7,444~7,394 (т, J=9,6~10,4 Гц, 1H), 7,321~7,298 (д, J=9,2 Гц, 1H), 7,251~7,206 (дд, J=12,4 Гц, 1,6 Гц, 1H), 3,694~3,662 (м, 3H), 3,440~3,402 (т, J=7,6 Гц, 2H), 3,329 (c, 2H), 3,277~3,240 (т, J=6,8~8,0 Гц, 2H); МС (m/e): 326,3 (M+1).
Пример 4
Соединение 4: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)-2-метоксиэтанамин получали в соответствии с представленной ниже схемой и описанием.
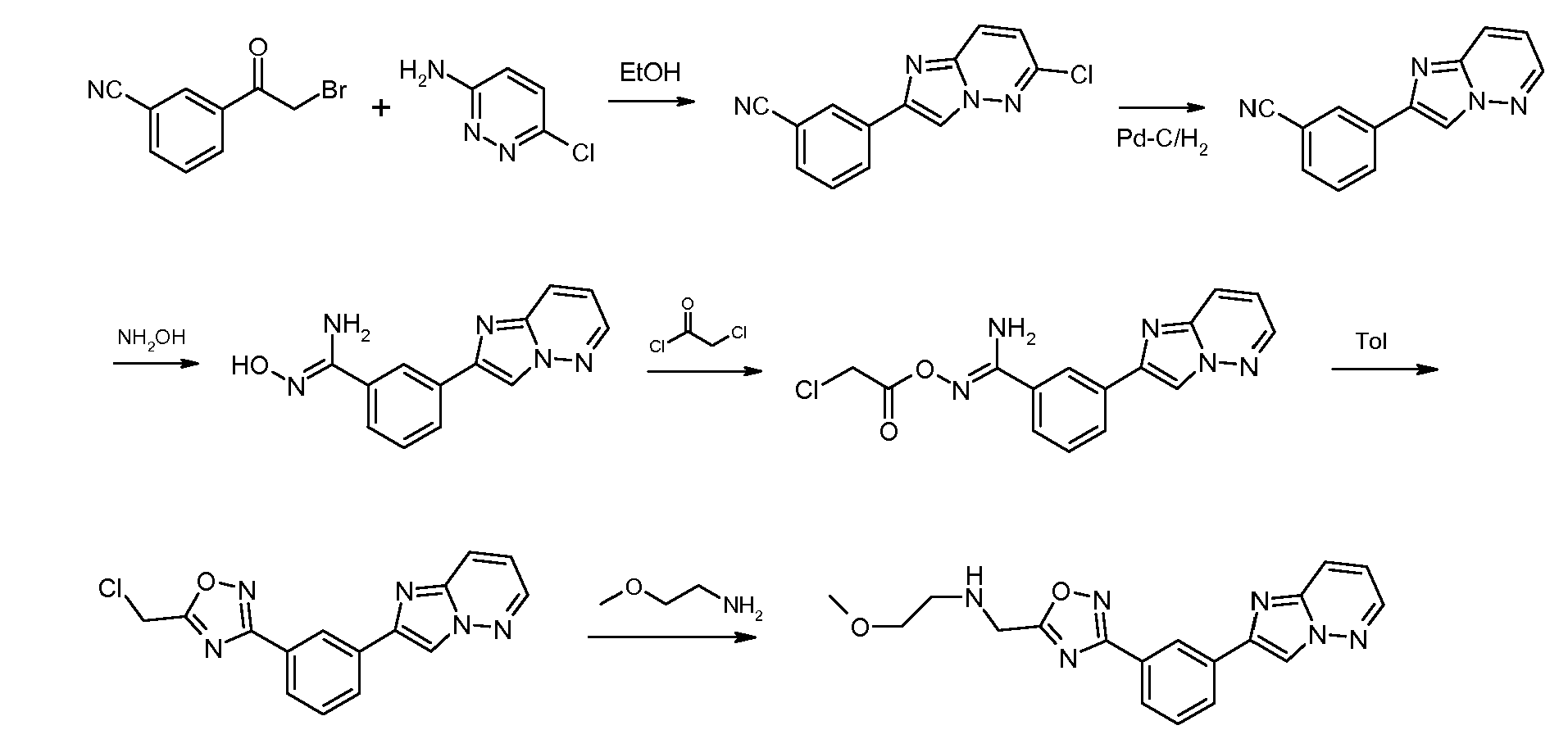
Смесь 0,5 ммоль 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрила, 1 ммоль NH2OH·HCl и 1 ммоль Et3N в EtOH перемешивали с обратным холодильником в течение 4 часов, а затем охлаждали. Избыток растворителя удаляли в вакууме с получением неочищенного продукта. 2-хлорацетил хлорид (2 ммоль) добавляли в раствор смеси неочищенного продукта в толуоле (15 мл) при комнатной температуре, а затем нагревали с обратным холодильником в течение 5 часов. Концентрировали смесь в вакууме и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле с получением 2-(3-(5-(хлорметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазина.
Смесь 2-(3-(5-(хлорметил)-1,2,4-оксадиазол-3-ил) фенил)имидазо[1,2-b]пиридазина (1,5 ммоль), йодида натрия (кат.) и 2-метоксиэтанамин (3 ммоль) в 25 мл EtOH перемешивали с обратным холодильником в течение 2 часов. Концентрировали смесь в вакууме и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле с получением N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)-2-метоксиэтанамина.
1H ЯМР (CDCl3, 400 МГц): δ 8,667 (c, 1H), 8,386 (c, 1H), 8,326~8,306 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,211~8,181 (дд, J=10,4 Гц, 1,6 Гц, 1H), 8,109~8,080 (дд, J=10,4 Гц, 1,6 Гц, 1H), 7,999~7,969 (д, J=12 Гц, 1H), 7,619~7,566 (т, J=10,4 Гц, 1H), 7,082~7,037 (дд, J=11,6 Гц, 6,0 Гц, 1H), 4,188 (c, 2H), 3,577~3,544 (т, J=6~7,2 Гц, 2H), 3,378 (c, 3H), 2,967~2,935 (т, J=6,4 Гц, 2H); МС (m/e): 351,4 (M+1).
Пример 5
Соединение 5: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)-2-морфолиноэтанамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,663 (c, 1H), 8,370 (c, 1H), 8,323~8,303 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,177~8,146 (дд, J=6,4 Гц, 2,0 Гц, 1H), 8,077~8,052 (д, J=10,0 Гц, 1H), 8,000~7,967 (д, J=13,2 Гц, 1H), 7,612~7,560 (т, J=10,4 Гц, 1H), 7,082~7,038 (дд, J=12,0 Гц, 6,0 Гц, 1H), 4,188 (c, 2H), 3,811~3,781 (т, J=6,0 Гц, 4H), 2,914~2,875 (т, J=7,2 Гц, 2H), 2,662~2,536 (м, 6H); МС (m/e): 406,4 (M+1).
Пример 6
Соединение 6: 2-(3-(5-(морфолинометил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,670 (c, 1H), 8,383 (c, 1H), 8,326~8,307 (дд, J=6,0 Гц, 1,6 Гц, 1H), 8,209~8,180 (дд, J=10,4 Гц, 1,2 Гц, 1H), 8,114~8,084 (дд, J=8,8 Гц, 1,6 Гц, 1H), 7,997~7,962 (дд, J=12,0 Гц, 2,0 Гц, 1H), 7,620~7,568 (т, J=10~10,8 Гц, 1H), 7,085~7,040 (дд, J=12,0 Гц, 6,0 Гц, 1H), 3,948 (c, 2H), 3,803~3,772 (м, 4H), 2,704~2,674 (м, 4H); МС (m/e): 363,4 (M+1).
Пример 7
Соединение 7: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)-N,N-диметилметанамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,682~8,671 (т, J=2,0 Гц, 1H), 8,382 (c, 1H), 8,318~8,297 (дд, J=6,0 Гц, 2,4 Гц, 1H), 8,210~8,176 (дд, J=14,0 Гц, 2,0 Гц, 1H), 8,125~8,094 (дд, J=8,8 Гц, 2,0 Гц, 1H), 7,990~7,955 (дд, J=12,0 Гц, 2,0 Гц, 1H), 7,614~7,563 (т, J=10~12,0 Гц, 1H), 7,073~7,029 (дд, J=12,0 Гц, 6,0 Гц, 1H), 3,895 (c, 2H), 2,451 (c, 6H); МС (m/e): 321,3 (M+1).
Пример 8
Соединение 8: 2-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метиламино)этанол получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,656 (c, 1H), 8,376 (c, 1H), 8,318~8,298 (дд, J=10,0 Гц, 2,0 Гц, 1H), 8,190~8,164 (д, J=10,4 Гц, 1H), 8,083~8,057 (д, J=10,4 Гц, 1H), 7,993~7,960 (д, J=12,0 Гц, 1H), 7,613~7,561 (т, J=10,4 Гц, 1H), 7,078~7,032 (дд, J=12,0 Гц, 6,0 Гц, 1H), 4,184 (c, 2H), 3,751~3,718 (т, J=6,0 Гц, 2H), 2,968~2,934 (т, J=6,4~7,8 Гц, 2H); МС (m/e): 337,3 (M+1).
Пример 9
Соединение 9: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)этанамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,669~8,659 (т, J=2,0 Гц, 1H), 8,382 (c, 1H), 8,321~8,301 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,202~8,176 (д, J=10,4 Гц, 1H), 8,101~8,075 (д, J=10,4 Гц, 1H), 7,996~7,965 (д, J=12,0 Гц, 1H), 7,615~7,567 (т, J=9,6 Гц, 1H), 7,080~7,033 (дд, J=12,8 Гц, 6,0 Гц, 1H), 4,152 (c, 2H), 2,834~2,762 (кв, J=9,6 Гц, 2H), 1,213~1,166 (т, J=9,6 Гц, 3H); МС (m/e): 321,3 (M+1).
Пример 10
Соединение 10: 2-(3-(5-((4-фторфенокси)метил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,660 (c, 1H), 8,378 (c, 1H), 8,330~8,315 (д, J=6,0 Гц, 1H), 8,211~8,182 (д, J=10,4 Гц, 1H), 8,106~8,079 (д, J=9,2 Гц, 1H), 7,996~7,963 (д, J=11,2 Гц, 1H), 7,625~7,569 (т, J=11,2 Гц, 1H), 7,088~6,764 (м, 5H), 5,340 (c, 2H); МС (m/e): 388,3 (M+1).
Пример 11
Соединение 11: 2-(3-(5-(этоксиметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,675 (c, 1H), 8,381 (c, 1H), 8,339~8,305 (м, 1H), 8,216~8,180 (дд, J=10,4 Гц, 2,4 Гц, 1H), 8,117~8,088 (дд, J=9,2 Гц, 8,0 Гц, 1H), 8,000~7,971 (д, J=11,6 Гц, 1H), 7,619~7,568 (т, J=10,4 Гц, 1H), 7,082~7,038 (дд, J=12 Гц, 5,6 Гц, 1H), 4,819 (c, 2H), 3,776~3,707 (кв, J=8,8 Гц, 2H), 1,343~1,278 (т, J=9,2 Гц, 3H); МС (m/e): 322,3 (M+1).
Пример 12
Соединение 12: 2-(3-(5-(метоксиметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,673 (c, 1H), 8,378 (c, 1H), 8,317~8,298 (дд, J=5,6 Гц, 2,0 Гц, 1H), 8,210~8,183 (д, J=10,8 Гц, 1H), 8,113~8,088 (д, J=10,0 Гц, 1H), 7,988~7,958 (д, J=12,0 Гц, 1H), 7,618~7,566 (т, J=10,4 Гц, 1H), 7,074~7,030 (дд, J=12,0 Гц, 5,6 Гц, 1H), 4,778 (c, 2H), 3,579 (c, 3H); МС (m/e): 308,4 (M+1).
Пример 13
Соединение 13: 2-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,712 (c, 1H), 8,386 (c, 1H), 8,332~8,313 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,237~8,207 (дд, J=10,4 Гц, 1,6 Гц, 1H), 8,127~8,098 (дд, J=10,0 Гц, 1,6 Гц, 1H), 8,007~7,977 (д, J=12,0 Гц, 1H), 7,653~7,603 (т, J=10,0 Гц, 1H), 7,095~7,050 (дд, J=12,0 Гц, 6,0 Гц, 1H); МС (m/e): 332,2 (M+1).
Пример 14
Соединение 14: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метилацетат получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,663 (с, 1H), 8,381(с, 1H), 8,327~8,307 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,214~8,184 (дд, J=12,0 Гц, 2,4 Гц, 1H), 8,096~8,065 (дд, J=10,4 Гц, 2,0 Гц, 1H), 7,999~7,968 (д, J=12,4 Гц, 1H), 7,624~7,571 (т, J=10,4 Гц, 1H), 7,087~7,040 (дд, J=12,8 Гц, 6,0 Гц, 1H), 5,388 (с, 2H), 2,241 (с, 3H); МС (m/e): 336,3 (M+1).
Пример 15
Соединение 15: 2-(3-(5-изопропил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,647 (c, 1H), 8,385 (c, 1H), 8,313 (c, 1H), 8,207~8,166 (м, 1H), 8,094~8,068 (д, J=10,4 Гц, 1H), 7,998~7,966 (д, J=12,8 Гц, 1H), 7,652~7,564 (м, 1H), 7,112~7,066 (м, 1H), 3,339~3,292 (м, 1H), 1,496~1,473 (д, J=7,2 Гц, 6H); МС (m/e): 306,3 (M+1).
Пример 16
Соединение 16: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метанол получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,979 (c, 1H), 8,735 (c, 1H), 8,522~8,507 (дд, J=6,0 Гц, 2,0 Гц, 1H), 8,251~8,229 (д, J=8,8 Гц, 1H), 8,174~8,140 (д, J=12,4 Гц, 1H), 7,996~7,969 (д, J=12,0 Гц, 1H), 7,677~7,623 (т, J=10,8 Гц, 1H), 7,274~7,229 (дд, J=12,0 Гц, 6,0 Гц, 1H), 5,733 (c, 2H); МС (m/e): 294,2 (M+1).
Пример 17
Соединение 17: 2-(3-(5-циклопропил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,611~8,602 (т, J=2,0 Гц, 1H), 8,374 (c, 1H), 8,318~8,297 (дд, J=6,0 Гц, 2,4 Гц, 1H), 8,185~8,149 (дт, J=10,0 Гц, 2,0 Гц, 1H), 8,058~8,024 (дт, J=10,0 Гц, 2,0 Гц, 1H), 7,994~7,958 (дд, J=12,0 Гц, 2,0 Гц, 1H), 7,595~7,543 (т, J=10,4 Гц, 1H), 7,075~7,029 (дд, J=12,4 Гц, 2,0 Гц, 1H), 3,308~3,253 (м, 1H), 1,376~1,229 (м, 4H); МС (m/e): 304,3 (M+1).
Пример 18
Соединение 18: 2-(3-(5-(фторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,684 (с, 1H), 8,382 (с, 1H), 8,327~8,312 (дд, J=10,0 Гц, 2,0 Гц, 1H), 8,222~8,193 (дд, J=10,0 Гц, 2,0 Гц, 1H), 8,111~8,084 (д, J=10,4 Гц, 1H), 7,999~7,958 (м, 1H), 7,635~7,582 (т, J=10,4 Гц, 1H), 7,249~7,192 (дд, J=10,0 Гц, 6,0 Гц, 1H), 5,729~5,717 (д, J=4,8 Гц, 1H), 5,573~5,562 (д, J=4,4 Гц, 1H); МС (m/e): 296,2 (M+1).
Пример 19
Соединение 19: 2-(3-(5-этил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,613 (с, 1H), 8,438~8,424 (д, J=6,4 Гц, 1H), 8,397(с, 1H), 8,314~8,287 (д, J=10,8 Гц, 1H), 8,241~8,213 (д, J=11,2 Гц, 1H), 8,132~8,106 (д, J=10,4 Гц, 1H), 7,659~7,606 (т, J=10,8 Гц, 1H), 7,249~7,165 (м, 1H), 3,044~2,969 (кв, J=10,0 Гц, 1H), 1,504~1,463 (т, J=10,0 Гц, 3H); МС (m/e): 292,3 (M+1).
Пример 20
Соединение 20: N-метил-2-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин-6-амин получали в соответствии с представленной ниже схемой и описанием.

Смесь 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)бензонитрила (0,25 ммоль) и 10 мл раствора метиламинметанола нагревали при температуре 125°C в микроволновом синтезаторе в течение 30 мин. После очистки получали 3-(6-(метиламино)имидазо[1,2-b]пиридазин-2-ил)бензонитрил.
Смесь 0,2 ммоль 3-(6-(метиламино)имидазо[1,2-b]пиридазин-2-ил)бензонитрила, 0,8 ммоль NH2OH·HCl и 1 ммоль Et3N в EtOH перемешивали с обратным холодильником в течение 4 часов, а затем охлаждали. Избыток растворителя удаляли в вакууме с получением неочищенного продукта. Трифторуксусный ангидрид (2 ммоль) добавляли в раствор смеси неочищенного продукта, ТГФ (15 мл) и DMAP (кат.) при комнатной температуре, а затем нагревали с обратным холодильником в течение 12 часов. Концентрировали смесь в вакууме и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле с получением 2,2,2-трифтор-N-метил-N-(2-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин-6-ил)ацетамида.
Смесь 2,2,2-трифтор-N-метил-N-(2-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин-6-ил)ацетамида (0,15 ммоль) и K2CO3 (0,3 ммоль) в 20 мл метанол-вода (4:1) нагревали при 60°C в течение 1 часа. Концентрировали смесь в вакууме и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле с получением N-метил-2-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин-6-амина.
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,636~8,626 (т, J=2,0 Гц, 1H), 8,513 (c, 1H), 8,166~8,130 (дт, J=10,4 Гц, 2,0 Гц, 1H), 7,947~7,916 (дд, J=10,4 Гц, 2,0 Гц, 1H), 7,714~7,682 (д, J=12,8 Гц, 1H), 7,652~7,600 (т, J=10,4 Гц, 1H), 6,707~6,674 (д, J=10,0 Гц, 1H), 7,095~7,050 (дд, J=13,2 Гц, 1H), 3,350 (c, 3H); МС (m/e): 360,92 (M+1).
Пример 21
Соединение 21: этил 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксилат получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,013 (с, 1H), 8,765 (с, 1H), 8,522~8,511 (д, J=4,4 Гц, 1H), 8,287~8,267 (д, J=8,0 Гц, 1H), 8,173~8,151 (д, J=8,8 Гц, 1H), 8,034~8,015 (д, J=7,6 Гц, 1H), 7,702~7,662 (т, J=8,0 Гц, 1H), 7,273~7,239 (дд, J=9,2 Гц, 4,4 Гц, 1H), 4,492~4,438 (кв, J=6,4 Гц, 2H), 1,394~1,359 (т, J=6,8 Гц, 3H); МС (m/e): 336,0 (M+1).
Пример 22
Соединение 22: этил 2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)ацетат получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,007 (с, 1H), 8,743~8,736 (т, J=1,6 Гц, 1H), 8,538~8,522 (дд, J=4,8 Гц, 1,6 Гц, 1H), 8,277~8,254 (дд, J=7,6 Гц, 1,6 Гц, 1H), 8,187~8,162 (дд, J=9,6 Гц, 0,8 Гц, 1H), 8,004~7,981 (дд, J=8,0 Гц, 1,6 Гц, 1H), 7,693~7,655 (т, J=7,6 Гц, 1H), 7,288~7,253 (дд, J=9,6 Гц, 4,8 Гц, 1H), 4,408 (с, 2H), 4,218~4,165 (кв, J=7,2 Гц, 2H), 1,146~1,210 (т, J=7,2 Гц, 3H); МС (m/e): 350,0 (M+1).
Пример 23
Соединение 23: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоновую кислоту получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,991 (с, 1H), 8,525~8,515 (д, J=4,0 Гц, 1H), 8,452 (с, 1H), 8,378~8,359 (д, J=7,6 Гц, 1H), 8,154~8,131 (д, J=9,2 Гц, 1H), 8,808~7,788 (д, J=8,0 Гц, 1H), 7,689~7,650 (т, J=8,0 Гц, 1H), 7,273~7,239 (дд, J=8,8 Гц, 4,0 Гц, 1H); МС (m/e): 307,8 (M+1).
Пример 24
Соединение 24: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,985 (c, 1H), 8,775 (c, 1H), 8,524~8,514 (д, J=4,0 Гц, 1H), 8,275~8,256 (д, J=7,6 Гц, 1H), 8,161~8,139 (д, J=8,8 Гц, 1H), 8,026~8,006 (д, J=8,0 Гц, 1H), 7,701~7,661 (т, J=8,0 Гц, 1H), 7,273~7,240 (дд, J=8,8 Гц, 4,0 Гц, 1H); МС (m/e): 307,0 (M+1).
Пример 25
Соединение 25: 2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)уксусную кислоту получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,003 (c, 1H), 8,739 (c, 1H), 8,535~8,520 (дд, J=4,4 Гц, 1,6 Гц, 1H), 8,269~8,249 (д, J=8,0 Гц, 1H), 8,186~8,163 (дд, J=9,2 Гц, 1H), 7,999~7,980 (д, J=7,6 Гц, 1H), 7,688~7,649 (т, J=8,0 Гц, 1H), 7,284~7,251 (дд, J=8,8 Гц, 4,4 Гц, 1H), 4,277 (c, 2H); МС (m/e): 321,8 (M+1).
Пример 26
Соединение 26: 2-(3-(5-(метилтиометил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО-д6, 400 МГц): δ 8,881 (c, 1H), 8,728 (c, 1H), 8,484~8,469 (дд, J=4,4 Гц, 1,6 Гц, 1H), 8,228~8,221 (м, 1H), 8,128~8,105 (д, J=9,2 Гц, 1H), 7,999~7,980 (д, J=7,6 Гц, 1H), 7,646~7,607 (т, J=8,0 Гц, 1H), 7,245~7,211 (дд, J=9,2 Гц, 4,4 Гц, 1H), 4,112 (c, 2H); МС (m/e): 323,8 (M+1).
Пример 27
Соединение 27: 2-(3-(5-(метилсульфонилметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,776 (c, 1H), 8,522 (c, 1H), 8,302~8,286 (дд, J=4,8 Гц, 1,6 Гц, 1H), 8,051~8,031 (д, J=8,0 Гц, 1H), 7,962~7,936 (д, J=8,8 Гц, 1H), 7,789~7,770 (д, J=7,6 Гц, 1H), 7,470~7,431 (т, J=8,0 Гц, 1H), 7,050~7,016 (дд, J=9,2 Гц, 4,4 Гц, 1H), 4,112 (c, 2H); МС (m/e): 355,9 (M+1).
Пример 28
Соединение 28: (3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)метанамин получали в соответствии с представленной ниже схемой и описанием.
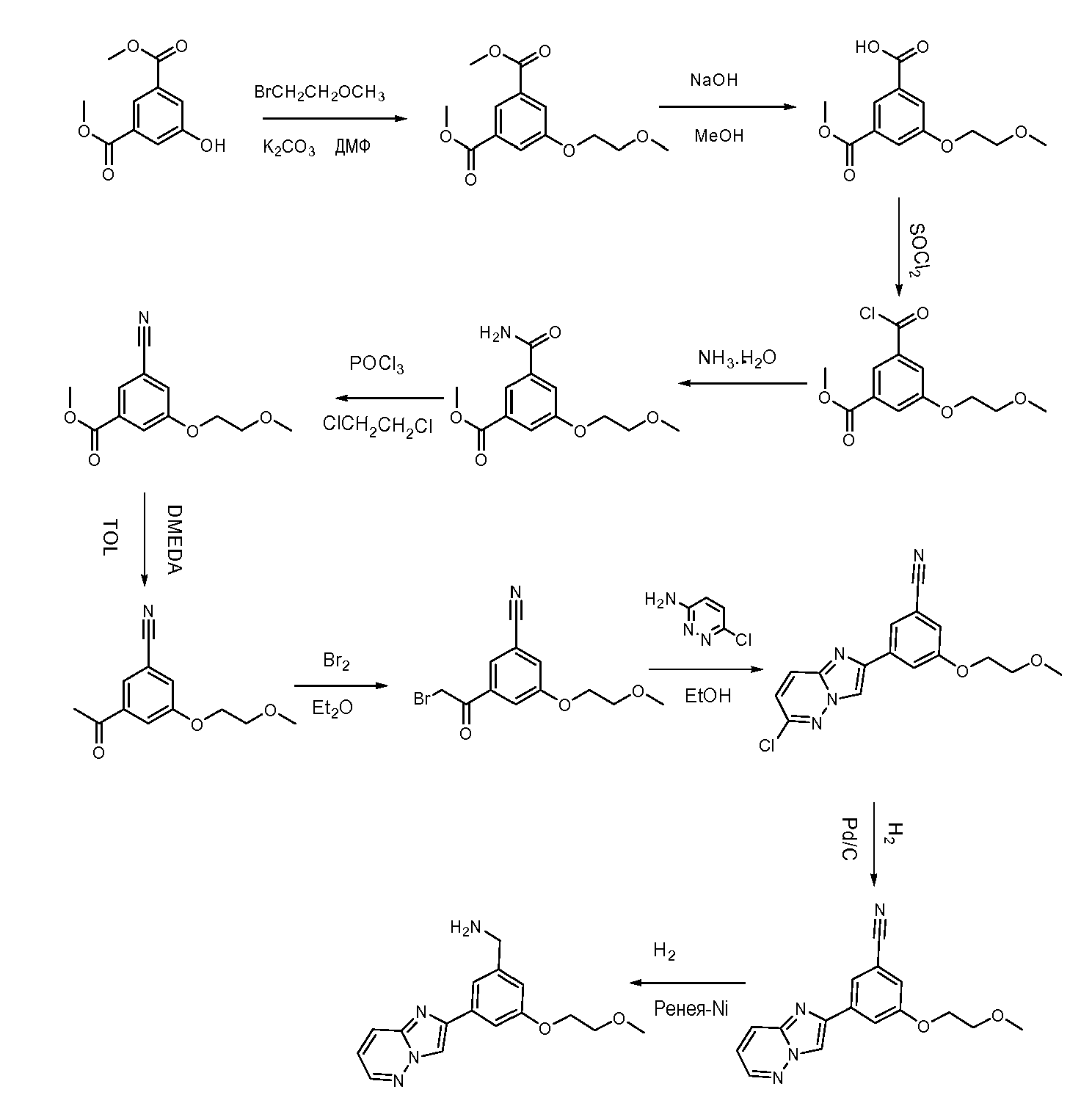
1-Бром-2-метоксиэтан (5,8 ммоль), диметил 5-гидроксиизофталат (5 мл), K2CO3 (6 ммоль) в ДМФ (10 мл) перемешивали в течение 12 часов при температуре 60°C, а затем раствор вливали в воду, а водную фазу экстрагировали EtOAc. Органическую фазу промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали с получением диметил 5-(2-метоксиэтокси)изофталата (93,7%).
Добавляли NaOH (45 ммоль) в раствор диметил 5-(2-метоксиэтокси)изофталата (30 ммоль) в 50 мл EtOH и перемешивали в течение 4 часов при температуре 40°C. Избыток растворителя удаляли в вакууме, а осадок обрабатывали 1 н. HCl (водный) и экстрагировали с помощью EtOAc. Органическую фазу промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали с получением 3-(метоксикарбонил)-5-(2-метоксиэтокси)бензойной кислоты (87,3%).
3-(метоксикарбонил)-5-(2-метоксиэтокси)бензойную кислоту (30 ммоль) в 20 мл SOCl2 перемешивали с обратным холодильником в течение 4 часов. Избыток SOCl2 удаляли в вакууме, а осадок растворяли в ТГФ. Добавляли раствор гидрата аммиака и перемешивали смесь при комнатной температуре в течение 2 часов. Раствор вливали в воду и экстрагировали с помощью EtOAc. Органическую фазу промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали с получением метил 3-карбамоил-5-(2-метоксиэтокси)бензоата (69,8%).
Добавляли POCl3 (20 ммоль) в раствор метил 3-карбамоил-5-(2-метоксиэтокси)бензоата (15 ммоль) в 35 мл 1,2-дихлорэтана и перемешивали в течение 5 часов с обратным холодильником. Затем раствор охлаждали до комнатной температуры, вливали в ледяную воду и экстрагировали с помощью EtOAc. Объединенную органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением метил 3-циано-5-(2-метоксиэтокси)бензоата (90,5%).
Раствор AlMe3 в гексане (19 ммоль) медленно накапали в раствор DMEDA (24 ммоль) в 60 мл сухого толуола при температуре 0°C под N2. Затем продолжали перемешивать раствор при комнатной температуре в течение еще 1 часа, добавляли метил 3-циано-5-(2-метоксиэтокси)бензоат (17,3 ммоль) и перемешивали с обратным холодильником в течение 8 часов. Смесь вливали в воду и экстрагировали с помощью EtOAc. Объединенную органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением 3-ацетил-5-(2-метоксиэтокси)бензонитрила (58,6%).
Br2 (31,5 ммоль) накапали в раствор 3-ацетил-5-(2-метоксиэтокси)бензонитрила (30 ммоль) в 150 мл эфира при температуре 0°C, а затем перемешивали при комнатной температуре в течение 5 часов. Раствор промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали с получением 3-(2-бромацетил)-5-(2-метоксиэтокси)бензонитрила (94,2%).
3-(2-бромацетил)-5-(2-метоксиэтокси)бензонитрил (15,3 ммоль) и 6-хлорпиридазин-3-амин (18 ммоль) в 100 мл EtOH перемешивали с обратным холодильником в течение 5 часов, а затем охлаждали, фильтровали. Осадок на фильтре представлял собой 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензонитрил (85,7%).
В 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензонитрил (10 ммоль) в 100 мл MeOH добавляли Pd/C (1 ммоль) и перемешивали при комнатной температуре в течение 4 часов. Удаляли Pd-C и концентрировали фильтрат с получением 3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензонитрила (98,9%).
В 3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензонитрил (6 ммоль) в 40 мл MeOH и 30 мл ТГФ добавляли никелевый катализатор Ренея (0,6 ммоль) и 1 мл раствора гидрата аммиака и перемешивали при комнатной температуре в течение 4 часов. Удаляли никелевый катализатор Ренея и концентрировали фильтрат с получением (3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)метанамина (70,2%).
1H ЯМР (CDCl3, 400 МГц): δ 3,441 (c, 3H), 3,792 (т, J=4,2 Гц, 2H), 4,092 (c, 2H), 4,241 (т, J=4,2 Гц, 2H), 7,034 (c, 1H), 7,243 (м, 1H), 7,601 (c, 2H), 7,993 (д, 1H), 8,438 (м, 1H), 8,581 (c, 1H); МС (m/e): 299,7 (M+1).
Пример 29
Соединение 29: 2-(3-(2-метоксиэтокси)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,358 (с, 3H), 3,756 (т, J=4,4 Гц, 2H), 4,302 (т, J=4,4 Гц, 2H), 7,256 (м, 1H), 7,567 (м, 1H), 7,954 (м, 1H), 8,200 (м, 1H), 8,397 (с, 1H), 8,567 (с, 1H), 9,103 (с, 1H); МС (m/e): 406,2 (M+1).
Пример 30
Соединение 30: 2-(3-(2-метоксиэтокси)-5-(5-метил-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 2,7532 (с, 3H), 3,397 (с, 3H), 3,793(т, J=4,4 Гц, 2H), 4,283 (т, J=4,4 Гц, 2H), 7,245 (м, 1H), 7,489 (с, 1H), 7,803 (с, 1H), 8,183 (м, 1H), 8,384 (с, 1H), 8,653 (м, 1H), 9,019 (с, 1H); МС (m/e): 352,2 (M+1).
Пример 31
Соединение 31: 2-(3-(5-(фторметил)-1,2,4-оксадиазол-3-ил)-5-(2-метоксиэтокси)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,489 (с, 3H), 3,822 (т, J=4,4 Гц, 2H), 4,305 (т, J=4,4 Гц, 2H), 4,771 (с, 2H), 7,055 (м, 1H), 7,667 (м, 1H), 7,807 (м, 1H), 7,988 (м, 1H), 8,308 (м, 1H), 8,323 (м, 1H), 8,359 (с, 1H); МС (m/e): 370,9 (M+1).
Пример 32
Соединение 32: 2-(3-(2-метоксиэтокси)-5-(5-(метоксиметил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,330 (с, 3H), 3,487 (с, 3H), 3,714 (т, J=4,4 Гц, 2H), 4,270 (т, J=4,4 Гц, 2H), 4,900 (с, 2H), 7,260 (дд, J 1=3,6 Гц, J 2=8,8 Гц, 1H), 7,471 (с, 1H), 7,834 (с, 1H), 8,155 (д, J=8,8 Гц, 1H), 8,349 (с, 1H), 8,515 (д, J=3,6 Гц, 1H), 9,040 (с, 1H); МС (m/e): 382,2 (M+1).
Пример 33
Соединение 33: 2-(3-(5-(этоксиметил)-1,2,4-оксадиазол-3-ил)-5-(2-метоксиэтокси)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 1,189 (с, 3H), 3,340 (с, 3H), 3,364 (м, 2H), 3,716 (т, J=4,4 Гц, 2H), 4,271 (т, J=4,4 Гц, 2H), 4,881 (с, 2H), 7,269 (дд,J 1=3,6 Гц, J 2=8,8 Гц, 1H), 7,488 (с, 1H), 7,845 (с, 1H), 8,165 (д, J=8,8 Гц, 1H), 8,354 (с, 1H), 8,525 (д, J=3,6 Гц, 1H), 9,034 (с, 1H); МС (m/e): 396,4 (M+1).
Пример 34
Соединение 34: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)-1,2,4-оксадиазол-5-ил)метанол получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,329 (c, 3H), 3,713 (т, J=4,4 Гц, 2H), 4,259 (т, J=4,4 Гц, 2H), 4,815 (c, 2H), 7,251 (дд, J 1=3,6 Гц, J 2=8,8 Гц, 1H), 7,469 (c, 1H), 7,829 (c, 1H), 8,150 (д, J=8,8 Гц, 1H), 8,347 (c, 1H), 8,513 (д, J=3,6 Гц, 1H), 9,027 (c, 1H); МС (m/e): 368,3 (M+1).
Пример 35
Соединение 35: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)-1,2,4-оксадиазол-5-карбоновую кислоту получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,325 (с, 3H), 3,702 (т, J=4,4 Гц, 2H), 4,254 (т, J=4,4 Гц, 2H), 7,272 (дд, J=4 Гц, 8,4 Гц, 1H), 7,432 (с, 1H), 7,940 (с, 1H), 8,058 (с, 1H), 8,160 (д, J=8,4 Гц, 1H), 8,536 (д, J=4 Гц, 1H), 9,035 (с, 1H); МС (m/e): 382,3 (M+1).
Пример 36
Соединение 36: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,359 (с, 3H), 3,747 (т, J=4,4 Гц, 2H), 4,291 (т, J=4,4 Гц, 2H), 7,281 (дд, J=4 Гц, 8,4 Гц, 1H), 7,552 (с, 1H), 7,883 (с, 1H), 8,169 (с, 1H), 8,420 (д, J=8,4 Гц, 1H), 8,540 (д, J=4 Гц, 1H), 9,054 (с, 1H); МС (m/e): 381,3 (M+1).
Пример 37
Соединение 37: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)-N-(пиридин-2-ил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,333 (c, 3H), 3,704 (т, J=4,4 Гц, 2H), 4,262 (т, J=4,4 Гц, 2H), 5,877 (м, 3H), 6,451 (м, 1H), 7,280 (дд, J=4 Гц, 8,4 Гц, 1H), 7,425 (c, 1H), 7,952 (c, 1H), 8,059 (c, 1H), 8,160 (д, J=8,4 Гц, 1H), 8,547 (д, J=4 Гц, 1H), 9,047 (c, 1H); МС (m/e): 458,4 (M+1).
Пример 38
Соединение 38: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)фенил)-N-(2,2,2-трифторэтил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,362 (с, 3H), 3,750 (т, J=4,4 Гц, 2H), 4,171 (м, 2H), 4,304 (т, J=4,4 Гц, 2H), 7,284 (дд, J=4 Гц, 8,4 Гц, 1H), 7,571 (с, 1H), 7,899 (с, 1H), 8,176 (д, J=8,4 Гц, 1H), 8,546 (д, J=4 Гц, 1H), 9,066 (с, 1H); МС (m/e): 463,2 (M+1).
Пример 39
Соединение 39: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)ацетамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 1,845 (м, 3H), 3,546 (c, 3H), 3,726 (д, J=4,4 Гц, 2H), 4,140 (д, J=4,4 Гц, 2H), 4,278 (м, 2H), 7,815 (c, 1H), 7,210 (м, 1H), 7,546 (м, 2H), 8,143 (м, 1H), 8,514 (м, 1H), 8,846 (c, 1H); МС (m/e): 341,4 (M+1).
Пример 40
Соединение 40: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-2,2,2-трифторацетамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,389 (c, 3H), 3,678 (д, J=4,4 Гц, 2H), 4,178 (д, J=4,4 Гц, 2H), 4,453 (м, 2H), 6,843 (c, 1H), 7,243 (м, 1H), 7,630 (м, 2H), 8,102 (м, 1H), 8,513 (м, 1H), 8,874 (c, 1H); МС (m/e): 395,3 (M+1).
Пример 41
Соединение 41: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-2-хлорацетамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,325 (c, 3H), 3,689 (д, J=4,4 Гц, 2H), 4,193 (м, 4H), 4,348 (м, 2H), 7,813 (c, 1H), 7,212 (м, 1H), 7,547 (м, 2H), 8,144 (м, 1H), 8,511 (м, 1H), 8,843 (c, 1H); МС (m/e): 375,2 (M+1).
Пример 42
Соединение 42: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-4-хлорбензамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,448 (c, 3H), 3,784 (д, J=4,4 Гц, 2H), 4,238 (д, J=4,4 Гц, 2H), 4,702 (м, 2H), 6,954 (c, 1H), 7,084 (м, 1H), 7,430 (м, 3H), 7,600 (c, 1H), 7,901 (м, 3H), 8,304 (м, 2H); МС (m/e): 438,2 (M+1).
Пример 43
Соединение 43: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-3-нитробензолсульфонамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,447 (с, 3H), 3,785 (д, J=4,4 Гц, 2H), 4,178 (д, J=4,4 Гц, 2H), 4,354 (м, 2H), 5,403 (м, 1H), 6,783 (с, 1H), 7,105 (м, 1H), 7,314 (м, 2H), 7,608 (м, 1H), 7,945 (м, 1H), 7,600 (с, 1H), 8,189 (м, 2H), 8,389 (м, 2H), 8,732 (с, 1H); МС (m/e): 484,3 (M+1).
Пример 44
Соединение 44: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-4-цианобензамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,410 (с, 3H), 3,800 (д, J=4,4 Гц, 2H), 4,223 (д, J=4,4 Гц, 2H), 4,704 (м, 2H), 7,083 (м, 2H), 7,492 (с, 1H), 7,600 (с, 1H), 7,763 (м, 2H), 7,845 (м, 1H), 7,904 (м, 1H), 8,154 (м, 1H), 8,304 (м, 2H); МС (m/e): 428,4 (M+1).
Пример 45
Соединение 45: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-3-бромбензамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,454 (c, 3H), 3,783 (д, J=4,4 Гц, 2H), 4,225 (д, J=4,4 Гц, 2H), 4,674 (м, 2H), 6,945 (c, 1H), 7,083 (м, 1H), 7,324 (м, 1H), 7,483 (c, 1H), 7,587 (c, 1H), 7,613 (м, 1H), 7,735 (м, 1H), 8,034 (м, 2H), 8,225 (c, 1H), 8,300 (м, 1H); МС (m/e): 482,3 (M+1).
Пример 46
Соединение 46: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-4-фторбензолсульфонамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,456 (c, 3H), 3,800 (д, J=4,4 Гц, 2H), 4,206 (м, 4H), 5,034 (м, 1H), 6,800 (c, 1H), 7,107 (м, 1H), 7,203 (м, 2H), 7,453 (м, 2H), 7,904 (м, 3H), 8,200 (c, 1H), 8,367 (м, 1H); МС (m/e): 457,3 (M+1).
Пример 47
Соединение 47: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-3-хлорбензолсульфонамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,453 (c, 3H), 3,782 (д, J=4,4 Гц, 2H), 4,187 (д, J=4,4 Гц, 2H), 4,213 (м, 2H), 5,934 (м, 1H), 6,800 (c, 1H), 7,083 (м, 1H), 7,425 (м, 2H), 7,500 (м, 1H), 7,760 (м, 1H), 7,900 (м, 1H), 7,968 (м, 1H), 8,200 (c, 1H), 8,324 (м, 1H); МС (m/e): 473,9 (M+1).
Пример 48
Соединение 48: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-4-метилбензолсульфонамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 2,400 (c, 3H), 3,456 (c, 3H), 3,753 (д, J=4,4 Гц, 2H), 4,134 (м, 4H), 5,532 (м, 1H), 6,800 (c, 1H), 7,086 (м, 1H), 7,300 (м, 2H), 7,400 (c, 1H), 7,805 (м, 2H), 7,913 (м, 1H), 8,200 (c, 1H), 8,315 (м, 1H); МС (m/e): 453,4 (М+1).
Пример 49
Соединение 49: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(2-метоксиэтокси)бензил)-2-фторбензолсульфонамид получали способом, аналогичным описанному в примере 28.
1H ЯМР (CDCl3, 400 МГц): δ 3,478 (c, 3H), 3,782 (д, J=4,4 Гц, 2H), 4,187 (д, J=4,4 Гц, 2H), 4,232 (м, 2H), 6,800 (c, 1H), 7,058 (м, 1H), 7,160 (м, 1H), 7,287 (м, 1H), 7,400 (м, 2H), 7,545 (м, 1H), 7,964 (м, 2H), 8,200 (c, 1H), 8,342 (м, 1H); МС (m/e): 457,4 (M+1).
Пример 50
Соединение 50: N-(2-(диэтиламино)этил)-2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 1,007 (м, 6H), 1,244 (м, 2H), 2,607 (м, 4H), 3,241 (м, 2H), 4,086 (с, 2H), 7,280 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,674 (т, 1H, J=8 Гц), 7,984 (д, 1H, J=8 Гц), 8,177 (д, 1H, J=8,4 Гц), 8,263 (д, 1H, J=8 Гц), 8,540 (дд, 1H, J 1=J 2=8 Гц), 8,742 (с, 1H), 9,014 (с, 1H); МС (m/e): 420,3 (M+1).
Пример 51
Соединение 51: N-бутил-2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 0,898 (т, 3H, J=7,2 Гц), 1,338 (м, 2H), 1,443 (м, 2H), 3,125 (м, 2H), 4,050 (c, 2H), 7,280 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,674 (т, 1H, J=8 Гц), 7,984 (д, 1H, J=8 Гц), 8,177 (д, 1H, J=8,4 Гц), 8,263 (д, 1H, J=8 Гц), 8,540 (дд, 1H, J 1=J 2=8 Гц), 8,742 (c, 1H), 9,014 (c, 1H); МС (m/e): 377,3 (M+1).
Пример 52
Соединение 52: 2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)-N-(((S)-тетрагидрофуран-2-ил)метил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 1,844 (м, 4H), 3,209 (м, 3H), 3,651 (м, 2H), 4,105 (c, 2H), 7,279 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,670 (т, 1H, J=8 Гц), 7,984 (д, 1H, J=8 Гц), 8,176 (д, 1H, J=8,4 Гц), 8,260 (д, 1H, J=8 Гц), 8,538 (дд, 1H, J 1=J 2=8 Гц), 8,741 (c, 1H), 9,011 (c, 1H); МС (m/e): 350,2 (M+1).
Пример 53
Соединение 53: N-циклопентил-2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 1,491 (м, 4H), 1,658 (м, 2H), 1,821 (м, 2H), 4,031 (м, 1H), 4,067 (c, 2H), 7,279 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,669 (т, 1H, J=8 Гц), 7,983 (д, 1H, J=8 Гц), 8,186 (д, 1H, J=8,4 Гц), 8,263 (д, 1H, J=8 Гц), 8,540 (дд, 1H, J 1=J 2=8 Гц), 8,731 (c, 1H), 9,018 (c, 1H); МС (m/e): 389,3 (M+1).
Пример 54
Соединение 54: 2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)-N-(2-метоксиэтил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 3,423 (с, 3H), 3,572 (м, 4H), 4,020 (с, 2H), 7,100 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,629 (т, 1H, J=8 Гц), 8,004 (д, 1H, J=8 Гц), 8,110 (д, 1H, J=8,4 Гц), 379,2 (M+1).
Пример 55
Соединение 55: 2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)-1-морфолинэтанон получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 3,594 (м, 8H), 4,443 (с, 2H), 7,266 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,668 (т, 1H, J=8 Гц), 7,979 (д, 1H, J=8 Гц), 8,170 (д, 1H, J=8,4 Гц), 8,254 (д, 1H, J=8 Гц), 8,526 (дд, 1H, J 1=J 2=8 Гц), 8,736 (с, 1H), 8,991 (с, 1H); МС (m/e): 391,4 (M+1).
Пример 56
Соединение 56: N-циклопропил-2-(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)ацетамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 0,631 (м, 2H), 0,864(м, 2H), 2,820 (м, 1H), 3,986 (с, 2H), 7,100 (дд, 1H, J=8 Гц, J=8,4 Гц), 7,636 (т, 1H, J=8 Гц), 8,014 (д, 1H, J=8 Гц), 8,077 (д, 1H, J=8,4 Гц), 8,213 (д, 1H, J=8 Гц), 8,351 (дд, 1H, J 1=J 2=8 Гц), 8,396 (с, 1H), 8,680 (с, 1H); МС (m/e): 361,2 (M+1).
Пример 57
Соединение 57: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-N-(2-морфолинэтил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CD3Cl3, 400 МГц): δ 8,769 (т, J=1,6 Гц, 1H), 8,406 (с, 1H), 8,354 (дд, J=1,6-4,4 Гц, 1H), 8,199 (дт, J=1,2-7,6 Гц, 1H), 8,143 (дт, J=1,2-7,6 Гц, 1H), 8,016 (м, 1H), 7,644 (т, J=8 Гц,1H), 7,099 (дд, J=4,4 Гц,1H), 3,811 (т, J=4,4 Гц, 4H), 3,656 (дд, J=6-12 Гц, 2H), 2,682 (т, J=6 Гц, 2H), 2,577 (м, 4H); МС (m/e): 420 (M+1).
Пример 58
Соединение 58: N-этил-3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,020 (д, J=0,8 Гц, 1H), 8,820 (дд, J=1,2, 1,6 Гц, 1H), 8,550 (дд, J=1,6, 4,8 Гц, 1H), 8,300 (м, 1H), 8,186 (м, 1H), 8,063 (м, 1H), 7,712 (м, 1H), 7,290 (дд, J=4,8, 9,6 Гц, 1H), 3,323 (м, 2H), 1,180 (т, J=7,2 Гц, 3H); МС (m/e): 335,3 (M+1).
Пример 59
Соединение 59: N-циклопентил-3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,737 (c, 1H), 8,409 (c, 1H), 8,350 (д, J=4,4 Гц, 1H), 8,180 (д, J=8,4 Гц, 1H), 8,136 (д, J=7,2 Гц, 1H), 8,016 (д, J=8,8 Гц, 1H), 7,626 (т, J=8,0 Гц, 1H), 7,098 (дд, J=4,4, 9,6 Гц, 1H), 1,802 (м, 2H), 1,674 (м, 6H); МС (m/e): 375,4 (M+1).
Пример 60
Соединение 60: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)(морфолино)метанон получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,717 (т, J=1,6 Гц, 1H), 8,400 (c, 1H), 8,347 (дд, J=1,6, 4,4 Гц, 1H), 8,228 (м, 1H), 8,136 (м, 1H), 7,996 (м, 1H), 7,639 (т, J=7,6 Гц, 1H), 7,096 (дд, J=4,4, 9,2 Гц, 1H), 3,983 (м, 2H), 3,899 (м, 4H), 3,828 (м, 2H); МС (m/e): 377,3 (M+1).
Пример 61
Соединение 61: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-N-(2-метоксиэтил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,746 (т, J=1,6 Гц, 1H), 8,420 (c, 1H), 8,355 (дд, J=1,6, 4,4 Гц, 1H), 8,189 (м, 1H), 8,154 (м, 1H), 8,021 (дд, J=1,6, 9,2 Гц, 1H), 7,639 (т, J=8,0 Гц, 1H), 7,107 (дд, J=4,8, 9,6 Гц, 1H), 3,747 (дд, J=4,8, 10,4 Гц, 2H), 3,639 (т, J=5,6 Гц, 2H), 3,467 (c, 3H); МС (m/e): 365,3 (M+1).
Пример 62
Соединение 62: N-(2-(диметиламино)этил)-3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CD3OD, 400 МГц): δ 8,774 (с, 1H), 8,665 (с, 1H), 8,478 (дд, J=2,0, 4,8 Гц, 1H), 8,218 (д, J=8,0 Гц, 1H), 8,155 (д, J=8,0 Гц, 1H), 8,058 (м, 1H), 7,676 (т, J=8,0 Гц, 1H), 7,280 (дд, J=4,0, 8,8 Гц, 1H), 3,666 (т, J=6,4 Гц, 2H), 2,790 (т, J=6,4 Гц, 2H), 2,472 (с, 6H); МС (m/e): 378,4 (M+1).
Пример 63
Соединение 63: (4-этилпиперазин-1-ил)(3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метанон получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,034 (c, 1H), 8,757 (т, J=1,6 Гц, 1H), 8,549 (дд, J=1,6, 4,8 Гц, 1H), 8,315 (м, 1H), 8,157 (м, 1H), 8,046 (м, 1H), 7,712 (т, J=8,0 Гц, 1H), 7,290 (дд, J=4,4, 8,8 Гц, 1H), 3,741 (м, 4H), 2,487 (м, 4H), 2,398 (дд, J=7,2, 14 Гц, 2H), 2,091 (с, 3H); МС (m/e): 404,4 (M+1).
Пример 64
Соединение 64: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-N-(тиофен-2-илметил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (CDCl3, 400 МГц): δ 8,703 (c, 1H), 8,388 (c, 1H), 8,344 (м, 1H), 8,186 (д, J=8,0 Гц, 1H), 8,113 (д, J=8,0 Гц, 1H), 8,007 (д, J=8,4 Гц, 1H), 7,611 (т, J=8,0 Гц, 1H), 7,336 (д, J=5,6 Гц, 1H), 7,154 (д, J=3,6 Гц, 1H), 7,084 (дд, J=4,4, 8,8 Гц, 1H), 7,040 (дд, J=3,6, 5,2 Гц, 1H), 4,914 (д, J=5,2 Гц, 2H); МС (m/e): 403,4 (M+1).
Пример 65
Соединение 65: N-(2-гидроксиэтил)-3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,034 (с, 1H), 8,757 (с, 1H), 8,549 (с, 1H), 8,315 (с, 1H), 8,157 (с, 1H), 8,046 (с, 1H), 7,712 (с, 1H), 7,290 (с, 1H), 3,625 (м, 2H), 3,380 (м, 2H); МС (m/e): 351,3 (M+1).
Пример 66
Соединение 66: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-N,N-диметил-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,100 (с, 1H), 8,757 (с, 1H), 8,549 (с, 1H), 8,315 (с, 1H), 8,157 (с, 1H), 8,046 (с, 1H), 7,712 (с, 1H), 7,290 (с, 1H), 3,100 (с, 3H), 3,281(с, 3H); МС (m/e): 335,3 (M+1).
Пример 67
Соединение 67: (3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)(пирролидин-1-ил)метанон получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,034 (с, 1H), 8,757 (с, 1H), 8,549 (с, 1H), 8,315 (с, 1H), 8,157 (с, 1H), 8,046 (с, 1H), 7,712 (с, 1H), 7,290 (с, 1H), 3,952 (м, 2H), 3,590 (м, 2H), 1,967 (м, 4H); МС (m/e): 361,1 (M+1).
Пример 68
Соединение 68: 3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-N-метил-1,2,4-оксадиазол-5-карбоксамид получали способом, аналогичным описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,034 (с, 1H), 8,757 (с, 1H), 8,549 (с, 1H), 8,315 (с, 1H), 8,157 (с, 1H), 8,046 (с, 1H), 7,712 (с, 1H), 7,290 (с, 1H), 2,875 (с, 3H); МС (m/e): 321,3 (M+1).
Пример 69
Соединение 69: 2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)никотинамид получали в соответствии с представленной ниже схемой и описанием.

Добавляли Br2 (1 ммоль) каплями в раствор 3-ацетилбензонитрила (1 ммоль) в Et2O (15 мл) при температуре 0°C, а затем перемешивали смесь при комнатной температуре в течение 4 часов. Добавляли воду и экстрагировали смесь с помощью EtOAc. Органическую фазу сушили над Na2SO4 и концентрировали с получением масла, то есть 3-(2-бромацетил)бензонитрила, который непосредственно используют в следующем этапе без очистки.
Раствор 3-(2-бромацетил)бензонитрила и 6-хлорпиридазин-3-амина (1 ммоль) в EtOH нагревали с обратным холодильником в течение ночи. Затем смесь охлаждали до комнатной температуры и фильтровали осадок с получением 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)бензонитрила с выходом 52,8%.
Смесь 3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)бензонитрила (1 ммоль) и Pd/C (20 мг) в ДМФ/ТГФ (10 мл/10 мл) перемешивали при комнатной температуре в течение 6 часов с использованием баллона H2. Затем удаляли растворитель под пониженным давлением и получали 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрил с выходом 88,5%.
Раствор 3-(имидазо[1,2-b]пиридазин-2-ил)бензонитрила (1 ммоль) и 6M NaOH (2 мл) в EtOH нагревали с обратным холодильником в течение 2 часов. Затем смесь разбавляют водой и подкисляют с помощью HCl. Осадок фильтровали с получением 3-(имидазо[1,2-b]пиридазин-2-ил)бензойной кислоты с выходом 60%.
Раствор 3-(имидазо[1,2-b]пиридазин-2-ил)бензойной кислоты (1 ммоль), DPPA (3 ммоль) и Et3N (3 ммоль) в толуоле нагревали с обратным холодильником в течение 4 часов. Затем добавляли t-BuOH (1 мл) и продолжали нагрев с обратным холодильником в течение ночи. Добавляли воду и экстрагировали смесь с помощью EtOAc. Органическую фазу промывали разбавленной HCl, соляным раствором и NaHCO3 (водный раствор) и концентрировали с получением твердого вещества. После очистки посредством хроматографии получали трет-бутил 3-(имидазо[1,2-b]пиридазин-2-ил)фенилкарбамат с выходом 38,5%.
Раствор трет-бутил 3-(имидазо[1,2-b]пиридазин-2-ил)фенилкарбамата (1 ммоль) и TFA (4 ммоль) в CH2Cl2 (10 мл) перемешивали при температуре 35°C в течение ночи. Затем добавляли 1M NaOH (4 мл) и экстрагировали смесь с помощью EtOAc. Концентрировали органическую фазу с получением 3-(имидазо[1,2-b]пиридазин-2-ил)анилина с выходом 75%.
В раствор 3-(имидазо[1,2-b]пиридазин-2-ил)анилина (1 ммоль) и 2-хлорникотинамида (1,2 ммоль) в C4H9OH добавляли TsOH (1,2 ммоль). Смесь перемешивали при температуре 160°C в течение ночи. Затем добавляли воду и экстрагировали реакционный раствор с помощью EtOAc. Органическую фазу промывали соляным раствором и удаляли растворитель. 2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)никотинамид очищали посредством тонкослойной хроматографии с выходом 31%.
1H ЯМР (ДМСО, 400 МГц): δ 11,287 (с, 1H), 8,854 (с, 1H), 8,506 (дд, J=2, 4,4 Гц, 1H), 8,363 (дд, J=1,6, 4,8 Гц, 1H), 8,227 (т, J=2 Гц, 1H), 8,163 (м, 2H), 7,859 (дд, J=1,2, 4 Гц, 1H), 7,650 (д, J=8,0 Гц, 1H), 7,394 (т, J=8,0 Гц, 1H), 7,242 (дд, J=4,4, 9,2 Гц, 1H), 6,871 (дд, J=4,8, 8,0 Гц, 1H); МС (m/e): 331,3 (M+1).
Пример 70
Соединение 70: (2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)пиридин-3-ил)(пирролидин-1-ил)метанон получали способом, аналогичным описанному в примере 69.
1H ЯМР (CD3OD, 400 МГц): δ 8,544 (c, 1H), 8,264 (м, 1H), 8,146 (c, 1H), 8,029 (д, J=9,2 Гц, 1H), 7,765 (м, 1H), 7,663 (д, J=6,8 Гц, 1H), 7,572 (м, 1H), 7,418 (т, J=8 Гц, 1H), 7,263 (дд, J=4,8, 8,8 Гц, 1H), 6,944 (c, 1H), 6,907 (дд, J=5,2, 7,6 Гц, 1H), 3,619 (м, 2H), 3,552 (м, 2H), 1,952 (м, 4H); МС (m/e): 385,4 (M+1).
Пример 71
Соединение 71: N-(2-гидроксиэтил)-2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)никотинамид получали способом, аналогичным описанному в примере 69.
1H ЯМР (CD3OD, 400 МГц): δ 8,541 (c, 1H), 8,447 (дд, J=1,2, 4,4 Гц, 1H), 8,318 (м, 2H), 8,056 (дд, J=1,6, 7,6 Гц, 1H), 8,016 (д, J=9,6 Гц, 1H), 8,687 (дд, J=1,6, 8,0 Гц, 1H), 7,640 (д, J=7,6 Гц, 1H), 7,422 (т, J=8,0 Гц, 1H), 7,253 (дд, J=4,4, 9,2 Гц, 1H), 6,943 (c,1H), 6,851 (дд, J=4,4, 7,6 Гц, 1H), 3,764 (т, J=6 Гц, 2H), 3,554 (т, J=6 Гц, 2H); МС (m/e): 375,4 (M+1).
Пример 72
Соединение 72: этил 2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)никотинат получали способом, аналогичным описанному в примере 69.
1H ЯМР (ДМСО, 400 МГц): δ 10,261 (c, 1H), 8,872 (д, J=4 Гц, 1H), 8,484 (м, 2H), 8,307 (м, 2H), 8,149 (д, J=9,2 Гц, 1H), 7,864 (д, J=8,0 Гц, 1H), 7,728 (д, J=8,0 Гц, 1H), 7,430 (т, J=8,4 Гц, 1H), 7,248 (дд, J=4,8, 9,2 Гц, 1H), 6,937 (дд, J=4,4, 8,0 Гц, 1H), 4,414 (м, 2H), 1,384 (т, J=6,8 Гц, 3H); МС (m/e): 360,3 (M+1).
Пример 73
Соединение 73: N-циклопропил-2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)никотинамид получали способом, аналогичным описанному в примере 69.
1H ЯМР (CD3OD, 400 МГц): δ 8,545 (с, 1H), 8,456 (д, J=4,4 Гц, 1H), 8,322 (м, 2H), 8,030 (дд, J=0,8, 8,8 Гц, 1H), 7,981 (м, 1H), 7,667 (м, 2H), 7,429 (т, J=8,0 Гц, 1H), 7,248 (м, 1H), 6,943 (с, 1H), 6,826 (м, 1H), 2,892 (м, 1H), 0,901 (м, 2H), 0,682 (м, 2H); МС (m/e): 371,4 (M+1).
Пример 74
Соединение 74: (2-(3-(имидазо[1,2-b]пиридазин-2-ил)фениламино)пиридин-3-ил)(морфолино)метанон получали способом, аналогичным описанному в примере 69.
1H ЯМР (CD3OD, 400 МГц): δ 8,539 (с, 1H), 8,452 (дд, J=1,6, 4,4 Гц, 1H), 8,273 (дд, J=2, 4,8 Гц, 1H), 8,112 (м, 1H), 8,024 (м, 1H), 7,666 (м, 2H), 7,555 (м, 1H), 7,420 (т, J=8,4 Гц, 1H), 7,263 (дд, J=4,4, 9,2 Гц, 1H), 6,937 (м, 2H), 3,704 (м, 4H), 3,633 (м, 4H); МС (m/e): 401,4 (M+1).
Пример 75
Соединение 75: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(5-(морфолинометил)-1,2,4-оксадиазол-3-ил)фенил)метансульфонамид получали в соответствии с представленной ниже схемой и описанием.

Смесь 3-метоксикарбонил-5-нитробензойной кислоты (44 ммоль), SOCl2 (40 мл) и ДМФ (1 мл) нагревали с обратным холодильником в течение 2 часов. Затем удаляли избыточный SOCl2 под пониженным давлением. Осадок растворяли в ДХМ (80 мл) и добавляли NH3·H2O (15 мл) каплями после охлаждения ледяной водой. После добавления продолжали перемешивание в течение 5 мин. Полученную смесь фильтровали с получением метил-3-карбамоил-5-нитробензоата с выходом 85%.
Добавляли POCl3 (33 ммоль) в раствор метил-3-карбамоил-5-нитробензоата (30 ммоль) в 1,2-дихлорэтане (100 мл). Затем раствор нагревали с обратным холодильником в течение 3 часов. После охлаждения его вливали в воду. Органическую фазу промывали последовательно насыщенным раствором NaHCO3 и соляным раствором, сушили над безводным Na2SO4 и концентрировали с получением метил-3-циано-5-нитробензоата с выходом 90%.
Добавляли 10% Pd/C (0,9 г) в раствор метил-3-циано-5-нитробензоата (25 ммоль) в MeOH (200 мл) и ТГФ (100 мл). Затем раствор перемешивали при комнатной температуре в течение 4 часов. После фильтрации концентрировали его с получением метил-3-амин-5-цианобензоат с выходом 95%.
CH3SO2Cl (40 ммоль) добавляли в раствор метил-3-амин-5-цианобензоата (10 ммоль), пиридина (50 ммоль) и DMAP (1 ммоль) в ДХМ (150 мл). Затем раствор нагревали с обратным холодильником в течение 4 часов. После охлаждения в раствор вливали разбавленную соляную кислоту. Органическую фазу промывали последовательно водой и соляным раствором, сушили над безводным Na2SO4 и концентрировали. Неочищенный продукт очищали посредством колоночной хроматографии с получением метил-3-циано-5-(метилсульфонамидо)бензоата с выходом 70%.
Al(CH3)3 (20 ммоль) добавляли каплями в раствор DMEDA, охлажденный ледяной водой, (4,4 ммоль) в сухом толуоле (60 мл) под азотом. После добавления продолжали перемешивание в течение 2 часов при комнатной температуре. Затем добавляли метил-3-циано-5-(метилсульфонамидо)бензоат (4 ммоль) и нагревали реакционную смесь с обратным холодильником в течение ночи. После охлаждения вливали ее в разбавленную соляную кислоту, экстрагировали смесь с помощью EtOAc, объединенные органические фазы промывали последовательно водой и соляным раствором, сушили над безводным Na2SO4 и концентрировали с получением N-(3-ацетил-5-цианофенил)метансульфонамида с выходом 35%.
Добавляли Br2 (1,2 ммоль) каплями в раствор N-(3-ацетил-5-цианофенил)метансульфонамида (1 ммоль) в Et2O (50 мл). После добавления продолжали перемешивание в течение 1,5 часов. Затем реакционную смесь промывали последовательно водой и соляным раствором, сушили над безводным Na2SO4 и концентрировали с получением N-(3-(2-бромацетил)-5-цианофенил)метансульфонамида с выходом 85%.
Смесь N-(3-(2-бромацетил)-5-цианофенил)метансульфонамида (0,8 ммоль) и 6-хлорпиридазин-3-амина (0,8 ммоль) в EtOH (8 мл) нагревали с обратным холодильником в течение 4 часов. После охлаждения полученную смесь фильтровали с получением N-(3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)-5-цианофенил)метансульфонамида с выходом 50%.
10% Pd/C (20 мг) добавляли в раствор N-(3-(6-хлоримидазо[1,2-b]пиридазин-2-ил)-5-цианофенил)метансульфонамида (0,3 ммоль) в ТГФ (25 мл). Затем его перемешивали при комнатной температуре в течение 4 часов. После фильтрации раствор концентрировали с получением N-(3-циано-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамида с выходом 95%.
Смесь N-(3-циано-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамида (0,25 ммоль), гидрохлорида гидроксиламина (0,75 ммоль) и триэтиламина (1 ммоль) в EtOH (12 мл) нагревали с обратным холодильником в течение 4 часов. После удаления растворителя в вакууме осадок растворяли в ТГФ (12 мл), добавляли (ClCH2CO)2O (0,75 ммоль) и триэтиламин (1 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Затем смесь нагревали с обратным холодильником в течение еще 8 часов. После удаления растворителя в вакууме и добавления воды смесь экстрагировали с помощью EtOAc. Объединенную органическую фазу промывали последовательно водой и соляным раствором, сушили над безводным Na2SO4 и концентрировали. Полученный осадок очищали посредством колоночной хроматографии с получением N-(3-(5-(хлорметил)-1,2,4-оксадиазол-3-ил)-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамида с выходом 90%.
Смесь N-(3-(5-(хлорметил)-1,2,4-оксадиазол-3-ил)-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамида (0,1 ммоль), морфолина (0,4 ммоль) и K2CO3 (0,2 ммоль) в ДМФ (2 мл) перемешивали при температуре 80°C в течение 1,5 часов. После охлаждения ее вливали в воду и экстрагировали с помощью CH2Cl2. Объединенные органические фазы промывали соляным раствором, сушили над безводным Na2SO4 и концентрировали. Полученный осадок очищали посредством колоночной хроматографии с получением соответствующего продукта с выходом 60%.
1H ЯМР (ДМСО, 400 МГц): δ 8,933 (c, 1H), 8,547 (д, J=4,4 Гц, 1H), 8,334 (c, 1H), 8,204 (д, J=10,0 Гц, 1H), 8,075 (c, 1H), 7,862 (c, 1H), 7,295 (дд, J 1=9,2 Гц, J 2=4,4 Гц, 1H), 4,015 (c, 2H), 3,634 (т, J=4,4 Гц, 4H), 3,043 (c, 3H), 2,591 (т, J=4,4 Гц, 4H); МС (m/e): 456,3 (M+1).
Пример 76
Соединение 76: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(5-(пиперидин-1-илметил)-1,2,4-оксадиазол-3-ил)фенил)метансульфонамид получали способом, аналогичным описанному в примере 75.
1H ЯМР (ДМСО, 400 МГц): δ 8,959 (с, 1H), 8,551 (м, 1H), 8,386 (с, 1H), 8,207 (д, J=9,2 Гц, 1H), 8,125 (с, 1H), 7,888 (с, 1H), 7,302 (дд, J 1=9,6 Гц, J 2=4,8 Гц, 1H), 3,958 (с, 2H), 3,089 (с, 3H), 2,528 (м, 4H), 1,555 (м, 4H), 1,393 (м, 2H); МС (m/e): 454,3 (M+1).
Пример 77
Соединение 77: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(5-((2-метоксиэтиламино)метил)-1,2,4-оксадиазол-3-ил)фенил)метансульфонамид получали способом, аналогичным описанному в примере 75.
1H ЯМР (ДМСО, 400 МГц): δ 10,178 (c, 1H), 9,002 (c, 1H), 8,587 (м, 1H), 8,451 (c, 1H), 8,246 (д, J=9,2 Гц, 1H), 8,163 (c, 1H), 7,930 (c, 1H), 7,341 (дд, J 1=9,2 Гц, J 2=4,4 Гц, 1H), 4,192 (c, 2H), 3,491 (т, J=5,6 Гц, 2H), 3,295 (c, 3H), 3,142 (c, 3H), 2,866 (т, J=5,6 Гц, 2H); МС (m/e): 444,3 (M+1).
Пример 78
Соединение 78: N-(3-(5-((2-(диметиламино)этиламино)метил)-1,2,4-оксадиазол-3-ил)-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамид получали способом, аналогичным описанному в примере 75.
1H ЯМР (ДМСО, 400 МГц): δ 8,971 (c, 1H), 8,557 (м, 1H), 8,416 (c, 1H), 8,211 (д, J=9,2 Гц, 1H), 8,117 (c, 1H), 7,898 (c, 1H), 7,308 (дд, J 1=9,2 Гц, J 2=5,2 Гц, 1H), 4,175 (c, 2H), 3,107 (c, 3H), 2,855 (м, 2H), 2,789 (м, 2H), 2,488 (c, 6H); МС (m/e): 457,3 (M+1).
Пример 79
Соединение 79: N-(3-(имидазо[1,2-b]пиридазин-2-ил)-5-(5-(пиперазин-1-илметил)-1,2,4-оксадиазол-3-ил)фенил)метансульфонамид получали способом, аналогичным описанному в примере 75.
1H ЯМР (ДМСО, 400 МГц): δ 8,949 (с, 1H), 8,547 (м, 1H), 8,337 (с, 1H), 8,203 (д, J=8,8 Гц, 1H), 8,100 (с, 1H), 7,875 (с, 1H), 7,297 (дд, J 1=8,8 Гц, J 2=4,4 Гц, 1H), 3,973 (с, 2H), 3,080 (с, 3H), 2,760 (м, 4H), 2,511 (м, 4H); МС (m/e): 455,3 (M+1).
Пример 80
Соединение 80: N-(3-(5-(аминометил)-1,2,4-оксадиазол-3-ил)-5-(имидазо[1,2-b]пиридазин-2-ил)фенил)метансульфонамид получали способом, аналогичным описанному в примере 75.
1H ЯМР (CD3OD, 400 МГц): δ 8,540 (с, 1H), 8,382 (м, 1H), 8,351 (с, 1H), 7,956 (д, J=9,2 Гц, 1H), 7,908 (м, 2H), 7,203 (дд, J 1=9,2 Гц, J 2=4,4 Гц, 1H), 4,124 (с, 2H), 3,007 (с, 3H); МС (m/e): 386,3 (M+1).
Пример 81
Соединение 81: 2-(3-(5-(морфолинометил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО, 400 МГц): δ 9,211 (с, 1H), 8,777 (с, 1H), 8,695-8,710 (м, 1H), 8,313 (т, J=9,6 Гц, 1H), 8,082 (д, J=8,4 Гц, 1H), 7,740 (т, J=7,8 Гц, 1H), 7,457-7,491 (м, 1H), 4,433 (с, 1H), 3,244 (ушир.с, 4H), 3,164 (ушир.с, 4H); МС (m/e): 362,3 (M+1).
Пример 82
Соединение 82: N1-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)этан-1,2-диамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CD3OD, 400 МГц): δ 8,749 (т, J=1,8 Гц, 1H), 8,705 (с, 1H), 8,514-8,529 (м, 1H), 8,180-8,206 (м, 1H), 8,110-8,137 (м, 1H), 8,071-8,100 (м, 1H), 7,678 (т, J=7,8 Гц, 1H),7,324-7,358 (м, 1H), 4,369 (с, 2H), 3,191 (ушир.с, 2H), 1,306 (ушир.с, 2H); МС (m/e): 336,2 (M+1).
Пример 83
Соединение 83: N1-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)-N2,N2-диметилэтан-1,2-диамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CD3OD, 400 МГц): δ 8,782 (т, J=1,6 Гц, 1H), 8,696 (c, 1H), 8,509-8,524 (м, 1H), 8,207-8,234 (м, 1H), 8,114-8,140 (м, 1H), 8,075-8,104 (м, 1H), 7,699 (т, J=7,8 Гц, 1H),7,312-7,346 (м, 1H), 4,275 (c, 2H), 3,307-3,339 (м, 2H), 3,164-3,192 (м, 2H), 2,983 (c, 6H); МС (m/e): 364,2 (M+1).
Пример 84
Соединение 84: 2-(3-(5-(морфолинометил)-1,2,4-оксадиазол-3-ил)фенил)имидазо[1,2-b]пиридазин получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО, 400 МГц): δ 8,686 (т, J=1,4 Гц, 1H), 8,397 (c, 1H), 8,320-8,335 (м, 1H), 8,192-8,219 (м, 1H), 8,097-8,124 (м, 1H), 7,977-8,002 (м, 1H), 7,607 (т, J=7,8 Гц, 1H),7,056-7,089 (м, 1H), 3,953 (c,2H), 3,801 (т, J=4,8 Гц, 1H), 2,705 (т, J=4,6 Гц, 1H); МС (m/e): 363,2 (M+1).
Пример 85
Соединение 85: 2,2,2-трифтор-N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)ацетамид получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО, 400 МГц): δ 10,447 (ушир.с, 1H), 9,001 (с, 1H), 8,732 (т, J=1,6 Гц, 1H), 8,545-8,530 (м, 1H), 8,282-8,256 (м, 1H), 8,202-8,174 (м, 1H), 8,000-7,974 (м, 1H), 7,682 (т, J=7,6 Гц, 1H), 7,295-7,260 (м, 1H), 4,878 (д, J=4,0 Гц, 2H); МС (m/e): 389,2 (M+1).
Пример 86
Соединение 86: этил 2-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метиламино)-2-оксоацетат получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,654 (т, J=1,4 Гц, 1H), 8,386 (c, 1H), 8,332-8,317 (м, 1H), 8,195-8,172 (м, 1H), 8,078-8,055 (м, 1H), 8,012-7,987 (м, 1H), 7,596 (т, J=7,8 Гц, 1H),7,091-7,057 (м, 1H), 4,900 (д, J=6,0 Гц, 2H), 4,453-4,400 (м, 2H), 1,428 (т, J=7,0 Гц, 3H); МС (m/e): 393,2 (M+1).
Пример 87
Соединение 87: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)-2-метоксиацетамид получали способом, аналогичным описанному в примере 4.
1H ЯМР (ДМСО, 400 МГц): δ 8,995 (с, 1H), 8,727 (т, J=1,6 Гц, 1H), 8,543-8,528(м, 1H), 8,271-8,245 (м, 1H), 8,197-8,171 (м, 1H), 7,994-7,968 (м, 1H), 7,672 (т, J=7,8 Гц, 1H),7,294-7,259 (м, 1H), 4,701 (д, J=6,0 Гц, 2H), 3,955 (с, 2H), 3,389 (с, 3H); МС (m/e): 365,2 (M+1).
Пример 88
Соединение 88: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)циклопентанкарбоксамид получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,647 (т, J=1,4 Гц, 1H), 8,370 (c, 1H), 8,329-8,314(м, 1H), 8,177-8,150 (м, 1H), 8,065-8,040 (м, 1H), 8,006-7,980 (м, 1H), 7,585 (т, J=7,8 Гц, 1H), 7,089-7,055 (м, 1H), 6,548 (ушир.c, 1H), 4,809 (д, J=5,2 Гц, 2H), 2,771-2,690 (м, 1H), 1,973-1,592 (м, 8H); МС (m/e): 389,2 (M+1).
Пример 89
Соединение 89: этил 3-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метиламино)-3-оксопропаноат получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,654 (c, 1H), 8,390 (c, 1H), 8,337-8,322 (м, 1H), 8,192 (д, J=7,6 Гц, 1H), 8,118 (ушир.c, 1H), 8,077 (д, J=8,0 Гц, 1H), 8,002 (д, J=9,6 Гц, 1H), 8,192 (т, J=7,8 Гц, 1H), 7,096-7,061 (м, 1H), 4,855 (д, J=5,6 Гц, 2H), 4,248-4,301 (м, 2H), 3,487 (c, 2H), 1,337 (т, J=7,2 Гц, 3H); МС (m/e): 407,2 (M+1).
Пример 90
Соединение 90: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)циклопропанкарбоксамид получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,691 (c, 1H), 8,397 (c, 1H), 8,337 (д, J=4,4 Гц, 1H), 8,193 (д, J=7,6 Гц, 1H), 8,092 (д, J=8,0 Гц, 1H), 8,008 (д, J=9,2 Гц, 1H), 7,610 (т, J=8,0 Гц, 1H), 7,101-7,067 (м, 1H), 4,849 (д, J=5,6 Гц, 2H), 1,608-1,557 (м, 1H), 1,113-1,075 (м, 2H), 0,897-0,849 (м, 2H); МС (m/e): 361,2 (M+1).
Пример 91
Соединение 91: N-((3-(3-(имидазо[1,2-b]пиридазин-2-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)изобутирамид получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,653 (т, J=1,6 Гц, 1H), 8,373 (с, 1H), 8,311-8,327 (м, 1H), 8,169-8,196 (м, 1H), 8,052-8,078 (м, 1H), 7,969-7,996 (м, 1H), 7,594 (т, J=8,0 Гц, 1H), 7,050-7,083 (м, 1H), 6,198 (ушир.с, 1H), 4,798 (д, J=5,2 Гц, 2H), 2,511-2,564 (м, 1H), 1,259 (д, J=7,2 Гц, 1H); МС (m/e): 363,2 (M+1).
Пример 92
Соединение 92: 3-((3-(имидазо[1,2-b]пиридазин-2-ил)бензиламино)метил)бензонитрил получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,566 (c, 1H), 8,445 (д, J=2,4 Гц, 1H), 7,946~8,425 (м, 3H), 7,225~7,839 (м, 5H), 6,105~6,132 (т, 1H), 5,600 (м, 1H), 4,090 (c, 2H), 4,079 (c, 2H); МС (m/e): 340 (M+1).
Пример 93
Соединение 93: N-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-4-хлорбензамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,535 (c, 1H), 8,430~8,415 (кв, J 1=4,6 Гц, J 2=1,6 Гц, 1H), 7,980~7,960 (т, J=6,0 Гц, 2H), 7,888 (д, J=8,4 Гц, 2H), 7,494~7,428 (м, 4H), 7,393 (д, J=7,2 Гц, 1H), 7,248 (м, 1H), 4,658 (c, 2H); МС (m/e): 363 (M+1).
Пример 94
Соединение 94: N-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-2-метоксиацетамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,510 (c, 1H), 8,413 (c, 1H), 7,986~7,866 (м, 3H), 7,413 (м, 3H), 4,503 (c, 2H), 3,971 (c, 2H), 3,429 (c, 3H); МС (m/e): 297 (M+1).
Пример 95
Соединение 95: N-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-3-цианобензолсульфонамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,4580 (с, 1H), 8,456 (с, 1H), 7,982~8,012 (м, 3H), 7,700~7,715 (м, 3H), 7,534~7,563 (т, 1H), 7,215~7,309 (м, 3H), 4,257 (с, 2H); МС (m/e): 390 (M+1).
Пример 96
Соединение 96: 1-(3-(имидазо[1,2-b]пиридазин-2-ил)бензил)-3-(тиофен-2-илметил)мочевину получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 8,497 (c, 1H), 8,432 (д, J=3,2 Гц, 1H), 7,998 (д, J=9,2 Гц, 1H), 7,886 (c, 1H), 7,975 (д, J=7,6 Гц, 2H), 7,417 (т, 1H), 7,319 (д, J=7,6 Гц, 1H), 7,249(м, 2H), 6,960 (c, 1H), 6,925 (т, J=5,2 Гц, 1H), 4,523 (c, 2H), 4,423 (с, 2H); МС (m/e): 364 (M+1).
Пример 97
Соединение 97: 3-бром-N-((3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)метил)бензамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 7,949 (c, 1H), 7,819 (c, 1H), 7,640 (м, 4H), 7,359 (т, J=10,0 Гц, 1H), 7,265 (м, 2H), 7,128 (c, 1H), 4,645 (д, J=7,6 Гц, 2H), 2,414 (c, 3H); МС (m/e): 427 (M+1).
Пример 98
Соединение 98: 4-хлор-N-((3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)метил)бензамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 7,835 (с, 1H), 7,726 (м, 3H), 7,640 (с, 1H), 7,388 (м, 3H), 7,270 (ушир.с, 1H), 7,143 (д, J=1,6 Гц, 1H), 4,670(д, J=6,4 Гц, 2H), 2,430 (с, 3H); МС (m/e): 383 (M+1).
Пример 99
Соединение 99: N-((3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)метил)бутирамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 7,738 (с, 1H), 7,670 (д, J=7,8 Гц, 1H), 7,616 (с, 1H), 7,337 (т, J=7,8 Гц, 1H), 7,180 (д, J=8,0 Гц, 1H), 7,133 (с, 1H), 4,464 (д, J=6,4 Гц, 2H), 2,419 (с, 3H), 2,192(т, J=8,0 Гц, 2H), 1,689 (м, 2H), 0,951 (т, J=7,8 Гц, 2H); МС (m/e): 314 (M+1).
Пример 100
Соединение 100: N-((3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)метил)циклопропанкарбоксамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CD3OD, 400 МГц): δ 7,773 (c, 1H), 7,684 (д, J=8,0 Гц, 1H), 7,634 (c, 1H), 7,353 (т, J=8,0 Гц, 1H), 7,207 (д, J=8,0 Гц, 1H), 7,142 (c, 1H), 4,492 (д, J=6,4 Гц, 2H), 2,427 (c, 3H), 1,355 (м, 1H), 1,013 (м, 2H), 0,755 (м, 2H); МС (m/e): 312 (M+1).
Пример 101
Соединение 101: N-((3-(3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)(4-(метилсульфонил)фенил)метанамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,447 (с, 1H), 7,943-7,995 (м, 2H), 7,896 (д, J=8,4 Гц, 2H), 7,711 (с, 1H), 7,851 (д, J=8,4 Гц, 2H), 7,486 (т, J=7,6-8,0 Гц, 1H), 7,153 (с, 1H), 4,123 (с, 2H), 4,017 (с, 2H), 3,017 (с, 3H), 2,418 (с, 3H); МС (m/e): 480 (M+1).
Пример 102
Соединение 102: 2-метокси-N-((3-(3-(2-метилимидазо[2,1-b]тиазол-6-ил)фенил)-1,2,4-оксадиазол-5-ил)метил)этанамин получали способом, аналогичным описанному в примере 4.
1H ЯМР (CDCl3, 400 МГц): δ 8,444 (c, 1H), 7,730 (c, 1H), 7,954-8,019 (м, 2H), 7,715 (c, 1H), 7,477 (т, J=7,6-8,0 Гц, 1H), 7,137 (c, 1H), 4,158 (c, 2H), 3,540 (т, J=5,2, 2H), 3,364 (c, 3H), 2,972 (т, J=4,8, 2H), 2,413 (c, 3H); МС (m/e): 370 (M+1).
Пример 103
Соединение 103: N-((3-(H-имидазо[1,2-a]пиридин-2-ил)фенил)метил)-2-метоксиацетамид получали способом, аналогичным описанному в примере 2.
1H ЯМР (CDCl3, 300 МГц): δ 8,118 (д, J=6,6 Гц, 1H), 7,806~7,902 (м, 3H), 7,681 (д, J=9,3 Гц, 1H), 7,387 (т, J=15,3-7,5 Гц, 1H), 7,253 (c, 1H), 7,183 (т, J=15,6-7,8 Гц, 1H), 6,785 (т, J=13,8-5,7 Гц, 1H), 4,544 (д, J=5,7 Гц, 2H), 3,953 (c, 2H), 3,390 (c, 3H); МС (m/e): 296,3 (M+1).
Пример 104
Соединение 104: этил 2-((3-(H-имидазо[1,2-a]пиридин-2-ил)фенил)метиламино)никотинат получали способом, аналогичным описанному в примере 2.
1H ЯМР (CDCl3, 400 МГц): δ 8,303 (м, 1H), 8,292 (м, 1H), 8,154~8,092 (м, 2H), 7,960 (с, 1H), 7,846 (с, 1H), 7,637 (д, J=10 Гц, 1H), 7,390~7,355 (м, 2H), 7,156 (м, 1H), 6,562 (м, 1H), 4,819 (д, J=5,2 Гц, 2H), 4,326 (м, 2H), 1,351 (т, J=14,4-6,8 Гц, 3H); МС (m/e): 373,4 (M+1).
Пример 105
Соединение 105: 1-((3-(H-имидазо[1,2-a]пиридин-2-ил)фенил)метил)-3-(2-хлор-4-фторфенил)мочевину получали способом, аналогичным описанному в примере 2.
1H ЯМР (CDCl3, 400 МГц): δ 8,273 (д, J=9,2 Гц, 1H), 8,078 (д, J=6,8 Гц, 1H), 7,923~7,795 (м, 3H), 7,655 (д, J=8,4 Гц, 1H), 7,448~7,169 (м, 5H), 6,796 (т, J=13,6-6,4 Гц, 1H), 4,706 (с, 2H); МС (m/e): 395,8 (M+1).
Пример 106
Соединение 106: 1-((3-(H-имидазо[1,2-a]пиридин-2-ил)фенил)метил)-3-(4-хлор-3-(трифторметил)фенил)мочевину получали способом, аналогичным описанному в примере 2.
1H ЯМР (d-ДМСО, 400 МГц): δ 9,496 (с, 1H), 8,544 (д, J=10,4 Гц, 1H), 8,401 (с, 1H), 8,114 (с, 1H), 7,968 (с, 1H), 7,560-7,194 (м, 6H), 6,892 (т, 1H), 4,373 (д, 2H); МС (m/e): 445,8 (M+1).
Пример 107
Исследования in vivo
Использовали мышей линии Balb/c (самки, вес тела 18-20 г). Суспензию исследуемого соединения в 0,25% Tween 80 и 1% карбоксиметилцеллюлозы (CMC) вводили перорально или парентерально. Группе отрицательного контроля вводили только среду, а группе положительного контроля вводили преднизон (10 мг/кг). Полчаса спустя всем мышам внутрибрюшинно вводили липополисахарид (LPС) путем инъекции (15 мг/кг, 10 мл/кг). Спустя два часа после инъекции липополисахарида (LPС) у мышей отбирали кровь для получения сыворотки. Концентрации ФНОα и ИЛ-1β в сыворотке, хранящейся при температуре -20°C в течение ночи, определяли посредством иммуноферментного анализа (ELIСA). Исследуемые соединения из настоящего изобретения демонстрировали значительное ингибирование продуцирования ФНОα и ИЛ-1β в дозе, варьирующейся в диапазоне от 1 до 1000 мг/кг.
Другие примеры осуществления
Все признаки, раскрытые в настоящем описании, можно объединять в любой комбинации. Каждый признак, раскрытый в настоящем описании, может быть заменен альтернативным признаком, имеющим то же самое, эквивалентное или аналогичное назначение. Таким образом, если явно не указано иначе, каждый раскрытый признак является только примером родового ряда эквивалентных или подобных признаков.
Из приведенного выше описания любой специалист в данной области техники может легко определить существенные характеристики настоящего изобретения и, не отходя от его идеи и не выходя за рамки объема, сможет вносить различные изменения и модифицировать изобретение для его адаптации к различным приложениям и условиям. Например, соединения, структурно аналогичные соединениям формулы I, могут быть получены, отсортированы по способности ингибировать продукцию цитокина (например, ФНОα или интерлейкин), а также применимости в лечении нарушений, связанных с повышенной продукцией цитокина, и применены для реализации настоящего изобретения. Таким образом, другие примеры осуществления также входят в объем формулы настоящего изобретения.