Результат интеллектуальной деятельности: СПОСОБ ДИАГНОСТИКИ НАСЛЕДСТВЕННОЙ ОПТИЧЕСКОЙ НЕЙРОПАТИИ
Вид РИД
Изобретение
Предлагаемое изобретение относится к офтальмологии и предназначено для диагностики наследственной оптической нейропатии Лебера и аутосомно-доминантной оптической нейропатии с целью последующего прогнозирования течения заболевания зрительного нерва и прогноза для потомства пробанда.
Уровень техники
Наследственные оптические нейропатии (НОН) являются причиной двустороннего поражения зрительного нерва с развитием слепоты и слабовидения преимущественно у людей молодого и среднего возраста.
Аутосомно-доминантная оптическая нейропатия (АДОН), возникающая в результате мутаций в ядерной ДНК, и наследственная оптическая нейропатия Лебера (НОНЛ), связанная с мутациями в митохондриальной ДНК, как наиболее часто встречающиеся наследственные оптические нейропатии, характеризуются полиморфизмом степени и характера потерн зрительных функций, что затрудняет клиническую дифференциальную диагностику этих заболеваний между собой и с оптическими нейропатиями иного генеза (Mati-Bonneau P., Milea D., Bonneau D., et al. OPA1-associated disorders: phenotypes and pathophysiology // Int. J. Biochem. Cell Biol. - 2009. - Vol. 41. - P. 1855-1865).
Кроме того, такие особенности наследственных заболеваний как неполная пенетрантность и вариабельная экспрессия, а также трудности получения информации о родственниках пациентов и их заболеваниях, часто приводят к сложностям в распознавании и диагностировании наследственного характера оптических нейропатии.
В то же время накопленные на сегодняшний день молекулярно-генетические данные об особенностях спектра и частот мутаций при НОН не достаточны для формирования высокоэффективных диагностических алгоритмов.
Мутации гена ОРА1 (3q28-q29) ядерной ДНК были идентифицированы только в 2000 году (Delettre С., Lenaeis G., Griffoin J.M., et al. Nuclear gene OPA1, encoding a mitochondrial dynamin-relaied protein, is mutated in dominant optic atrophy // Nat. Genet. - 2000. - Vol. 26. - P. 207-210). В настоящее время известно более 200 мутаций гена OPA1, кодирующего белок внутренней мембраны митохондрий (http://lbbma.univ-angers.fr/lbbma.php?id=21&type=s). Однако по данным литературы, эти изменения удается обнаружить у 32-60% пациентов с АДОН (Yu-Wai-Man P., Griffiths P.G., Chinnery P.F. Mitochondrial optic neuropathies - disease mechanisms and therapeutic strategies // Prog. Retin. Eye Res. - 2011. - Vol. 30. - P. 81-114). Значительная доля отрицательных результатов при исследовании точечных мутаций гена ОРА1 подтверждает, что АДОН - генетически гетерогенное заболевание. В настоящее время идентифицированы мутации гена ОРА3 (19q13.2-13.2), ответственные за развитие АДОН в сочетании с врожденной катарактой. Однако доля выявленных мутаций в этом гене среди больных невелика и составляет около 3% случаев [Ferré М., Bonneau D., Milea D., et al. Molecular screening of 980 cases of suspected hereditary optic neuropathy with a report on 77 novel OPA1 mutations // Hum. Mutat. - 2009. - Vol. 30. - P. 692-705]. Другие локусы для этого заболевания - это ОРА4 (8q12.2-q12.3) (Kerrison J.B., Arnould V.J., Ferraz Sallum J.M., et al. Genetic heterogeneity of dominant optic atrophy, Kjer type: Identification of a second locus on chromosome 18ql2.2-12.3 // Arch. Ophthalmol. - 1999. - Vol. 117. - P. 805-810) и OPA5 (Barbet F., J. Hakiki S., Orssaud C., et al. A third locus for dominant optic atrophy on chromosome 22q // J. Med. Genet. - 2005. - Vol. 42. - P. e1). Гены в них еще не известны. Описаны также альтернативные типы генетических дефектов, например, крупные структурные перестройки - делеции нескольких экзонов и даже всей кодирующей области гена ОРА1, встречающиеся в 10% случаев (Almind G. J., Gronskov K., Milea D., et al. Genomic deletions in OPA1 in Danish patients with autosomal dominant optic atrophy // BMC Med. Genet. - 2011. - Vol. 12. - P. 49), которые не могут быть зарегистрированы в гетерозиготном состоянии с помощью секвенирования.
Точечные первичные мутации митохондриальной ДНК - G11778A в гене ND4, G3460A в гене ND1 и Т14484С в гене ND6, обуславливающие НОНЛ (Brown M.D., Voljavec A.S., Lott М.Т., et al. Mitochondrial DNA complex I and III mutations associated with Leber′s hereditary optic neuropathy // Genetics. - 1992. - Vol. 130. - P. 163-173), также были выявлены относительно недавно - впервые в 1988 году (Wallace D.C., Singh G., Lott M.T., et al. Mitochondrial DNA mutation associated with Leber′s hereditary optic neuropathy // Science. - 1988. - Vol. 242. - P. 1427-1430).
В настоящее время известно еще 11 первичных, но более редких мутаций (m.3635G>A, m.3733 G>A, m.4171 C>A, m.10663 T>C, m.14459 G>A, m.14482 С>A, m.l4482 C>G, m.14495 A>G, m.14568 C>T), а также большое число условно патогенных мутаций мтДНК, патогенность которых в настоящее время не окончательно доказана в силу единичных случаев наблюдения (http://www.mitomap.org/bin/view.pl/MITOMAP/MutationsLHON).
Как видно, НОН отличаются широкой молекулярно-генетической вариабельностью. Большое разнообразие мутаций в митохондриальном и ядерном геноме затрудняет поиск патологических изменений митохондриальной ДНК и ядерной ДНК, являющихся причиной НОН. В целом, по данным литературы молекулярно-генетическое исследование наиболее часто встречающихся мутаций ядерной и митохондриальной ДНК при подозрении на НОН позволяет верифицировать заболевание в 45% случаев (Férre М., Bonneau D., Milea D., et al. Molecular screening of 980 cases of suspected hereditary optic neuropathy with a report on 77 novel OPA1 mutations // Hum. Mutat. - 2009. - Vol. 30. - P. 692-705).
Клинические характеристики НОН имеют свои особенности, однако специфичность их подчас условна, подобные изменения могут встречаться и при оптических нейропатиях другого генеза. В то же время определение этиологии заболевания глаза важно не только для офтальмологического, но терапевтического и неврологического прогноза, так как НОН может сопровождаться неврологической и системной патологией. Кроме того, диагностика данных заболеваний важна для осуществления корректного лечения, последующего прогнозирования течения заболевания зрительного нерва и определения прогноза для потомства.
В основе развития НОН лежит генетически детерминированное нарушение активности комплексов дыхательной цепи митохондрий, что сопряжено со снижением продукции АТФ. В результате у больных наблюдаются нарушения функций митохондрий, которые обусловливают повреждение и гибель ганглиозных клеток сетчатки.
Для выявления и дифференциальной диагностики НОН способ исследования должен быть максимально безопасным для пациента и обладать высокой степенью информативности.
Известен способ диагностики НОН с помощью компьютерной статической периметрии с выявлением центральных и центро-цекальных скотом. Однако таким способом выявляются изменения ноля зрения, свойственные оптическим нейропатиям различной этиологии (Kedar S., Ghate D., Corbett J.J. Visual fields in neuro-ophthalmology // Indian J. Ophthalmol., 2011. - Vol. 59. - P. 103-109).
Известен способ диагностики НОН с помощью электрофизиологических методов с определением зрительных вызванных потенциалов. Однако это исследование также не позволяет идентифицировать этиологию заболевания (Holder G.E. Electrophysiological assessment of optic nerve disease // Eye. - 2004. - Vol. 18. - P. 1133-1143).
Известен способ выявления НОН с помощью обнаружения классических симптомов и семейного анамнеза (Newman N.J., Biousse V. Hereditary optic neuropathies // Eye. - 2004. - Vol. 18. - P. 1144-1160) Однако наследственный характер заболевания часто не представляется возможным подтвердить, так как реконструкция расширенных родословных у пациентов зачастую затруднена, а заболевание отличается неполной пенетрантностью. Это приводит к тому, что большой процент наследственных ОН представлен спорадическими случаями.
Известен способ молекулярно-генетической диагностики НОН, в основе которой лежит мультиплексная проба - зависимая лигазная реакция с последующей амплификацией и полимеразная цепная реакция. Однако данный способ позволяет выявить лишь основные мутации, регистрируемые при НОН. Расширенные исследования митохондриальной и ядерной ДНК - дорогостоящие методы, выполняются на высоко технологичном оборудовании специалистами, которые должны обладать большим опытом, навыками и знаниями (Man P.Y.W., Turnbull D. М., Chinnery P.F. Leber hereditary optic neuropathy // J. Med. Genet., 2002. - Vol. 39. - P. 162-169).
НОН может быть заподозрена на основании совокупности данных анамнеза заболевания и наследственного анамнеза: медленно прогрессирующее двустороннее снижение остроты зрения, наличие родственников пробанда с частичной атрофией зрительного нерва. Дополнительные методы исследования помогают выявить характерные для наследственного заболевания зрительного нерва признаки. Исследование цветового зрения по таблицам Рабкина (Ишихара) выявляет различной степени дисхроматопсию; поле зрения характеризуется наличием центральных или центроцекальных скотом. Электрофизиологические методы исследования показывают снижение лабильности аксиального пучка зрительного нерва и увеличение латентности Р100 ЗВКП на вспышку или паттерн. Оптическая когерентная томография демонстрирует истончение слоя нервных волокон различной степени выраженности, преимущественно с височной стороны. Ряд дополнительных методов позволяет исключить другую, не наследственную этиологию ОН. Для подтверждения наследственной природы возможно проведение молекулярно-генетического исследования - мультиплексной проба-зависимой лигазной реакции с последующей амплификацией и полимеразной ценной реакции. Однако при этом выявляются лишь основные мутации, регистрируемые при НОНЛ или частые мутации при АДОН.
Таким образом, существующие способы диагностики НОН требуют совершенствования, так как не позволяют во всех случаях выявить этиологию заболевания.
Ближайшим аналогом предлагаемого изобретения является способ того же назначения, включающий биохимические исследования на культуре фибробластов кожи пациентов для определения нарушения функционирования отдельных компонентов дыхательной цепи митохондрий (Janssen A.J., Smeitink J.A., van den Heuvel L.P. Some practical aspects of providing a diagnostic service for respiratory chain defects // Ann. Clin. Biochem., 2003. - Vol. 40 (Pt 1). - P. 3-8; Ye F., Hoppel C.L. Measuring oxidative phosphorylation in human skin fibroblasts // Anal. Biochem., 2013. - Vol. 437, №1. - P. 52-58).
Однако этот способ диагностики митохондриальных нарушений является технически сложно выполнимым, дорогостоящим, зависящим от уровня подготовки персонала и качества используемых реагентов.
Раскрытие изобретения
Задачей изобретения является определение мембранного потенциала митохондрий в фибробластах кожи пациентов для определения этиологии оптической нейропатии как НОН.
Техническим результатом предлагаемого изобретения является повышение точности диагностики заболевания для осуществления корректного лечения, прогнозирования течения заболевания у пробанда, прогноза для родственников и потомства пробанда, а также упрощение способа.
Технический результат достигается за счет измерения интенсивности митохондриальных потенциалзависимых флуоресцентных красителей, накапливающихся в митохондриях фибробластов кожи пациентов.
Чем выше потенциал митохондрий, тем больше красителя войдет внутрь митохондрий, и тем ярче будет окрашивание.
В предлагаемом способе при исследовании культуры фибробластов пациентов, в отличие от ближайшего аналога, не проводят длительное изучение функционирования отдельных компонентов дыхательной цепи митохондрий, а определяют, есть ли нарушение работы дыхательной цепи митохондрий.
Нами было проведено исследование функций митохондрий у пациентов с НОНЛ и АДОН, которое определило наличие изменений по сравнению с группой контроля, и позволило разработать методику для выявления митохондриальной патологии в группе пациентов с неверифицированным генетическим дефектом.
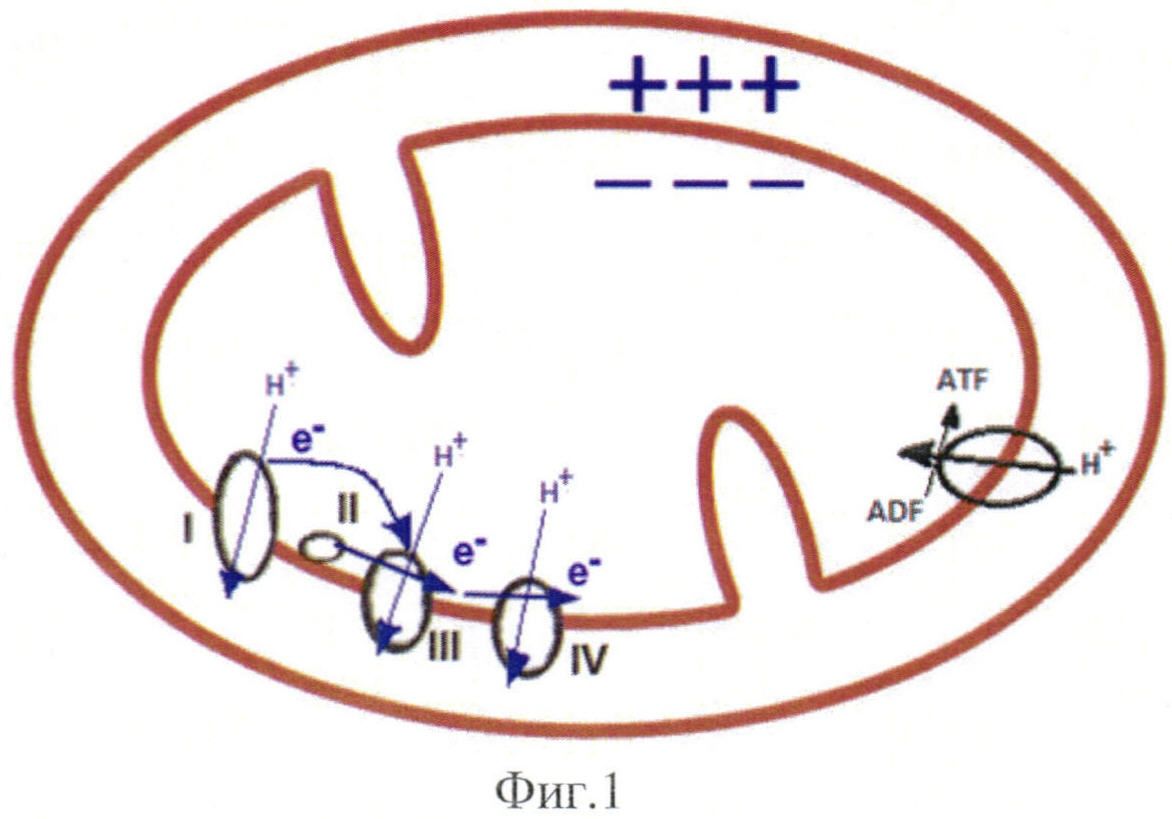
Важнейшим свойством митохондрий является их способность поддерживать мембранный электрохимический потенциал, от которого зависит практически все многочисленные функции митохондрий. Потенциал митохондрий образуется в результате работы комплексов дыхательной цепи, вдоль которых происходит транспорт электронов. Энергия, выделяемая при транспорте электронов, используется для выкачивания протонов из матрикса митохондрий в межмембранное пространство. В результате этого внутренняя мембрана митохондрий оказывается отрицательно заряженной изнутри и положительно заряженной снаружи. На Фиг. 1 представлено схематическое изображение структуры митохондрии: наружная и внутренняя мембрана с кристами, комплексы дыхательной цепи (I-IV, V-АТФ-синтаза), транспорт электронов е-, выкачивание протонов Н+ из матрикса митохондрий в межмембранное пространство, синтез АТФ на V комплексе.
Уровень потенциала можно измерить при помощи флюоресцентных красителей, которые несут положительный заряд и накапливаются в митохондриях. Чем выше потенциал митохондрий, тем больше красителя войдет внутрь митохондрий, и тем ярче будет окрашивание.
Энергия потенциала митохондрий расходуется протонной АТФазой для синтеза АТФ, поэтому ингибирование этого фермента останавливает основной расход энергии, в то время как дыхательная цепь продолжает работать, и уровень потенциала растет. Чтобы определить, сколько энергии потенциала митохондрий расходуется на синтез АТФ, мы использовали ингибитор АТФ-синтазы олигомицин. Рост электрохимического потенциала при добавлении олигомицина может косвенно свидетельствовать о работоспособности дыхательной цепи митохондрий и позволяет оценить ее вклад в синтезе АТФ.
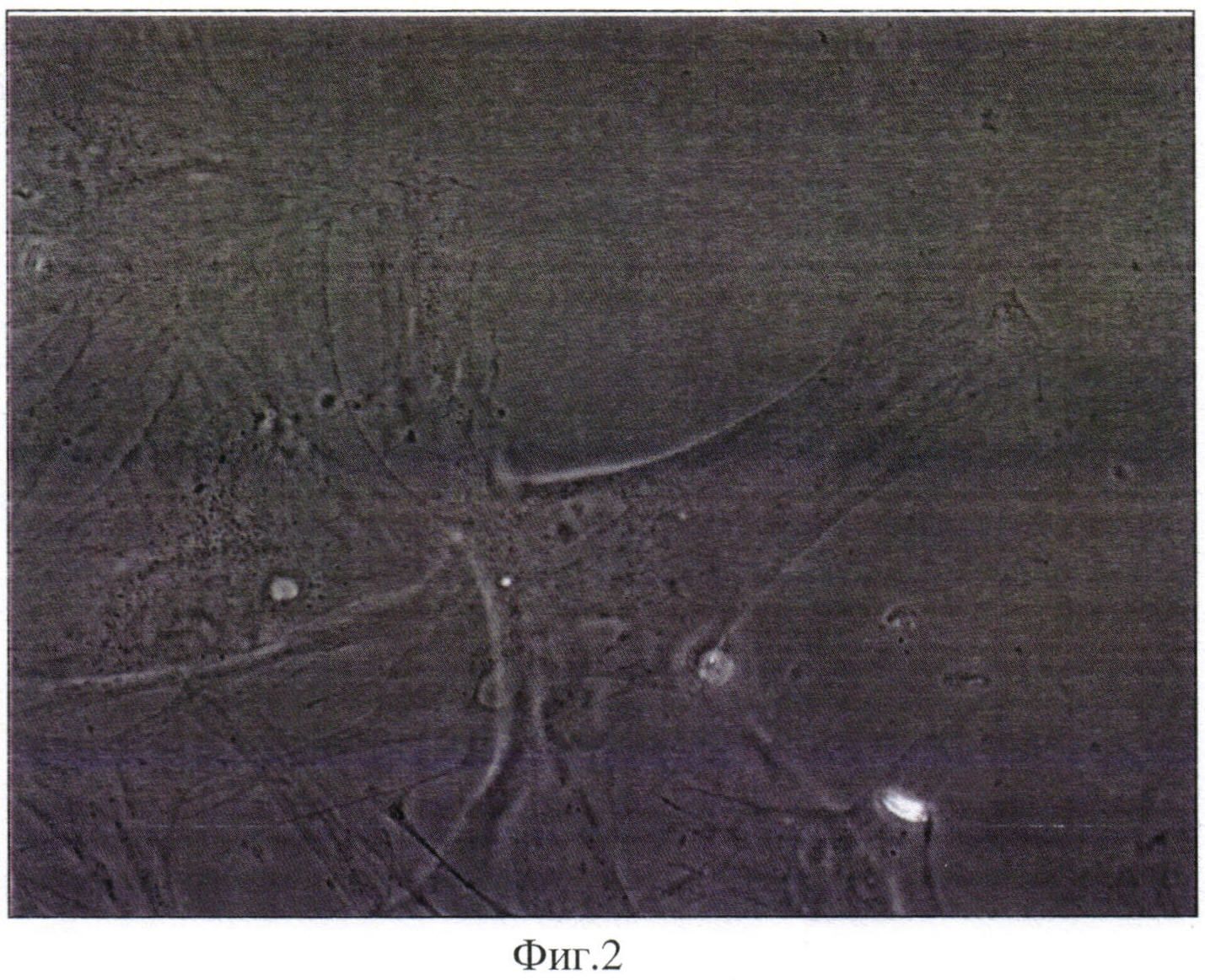
В работе для анализа дыхательной активности митохондрий в клетках больных и здоровых людей мы использовали предложенную еще в 1992 году клеточную модель культуры фибробластов кожи (Robinson В. Н., Petrova-Benedict R., Buncic J. R., Wallace D.C. Nonviability of Cells with Oxidative Defects in Galactose Medium: A Screening Test for Affected Patient Fibroblasts // Biochem. Med. Metab. Biol. - 1992. - Vol. 48. - P. 122-126). Ha Фиг. 2 представлены фибробласты кожи пациента с НОНЛ (фазово-контрастная микроскопия).
Поскольку нарушение функций митохондрий у таких больных обнаруживают не только в нейронах, но и в других тканях, эта модель живой культуры клеток является наиболее удобной для диагностики и изучения механизмов митохондриальной патологии.
На Фиг. 3 представлены фибробласты кожи здорового человека (1) и пациентов с НОНЛ (2) и АДОН (3), окрашенные митохондриальным потенциалзависимым флюоресцентным красителем (TMRE). Видны окрашенные в красный цвет митохондрии, имеющие нитевидную форму, морфология которых визуально не отличается у больного и здорового человека.
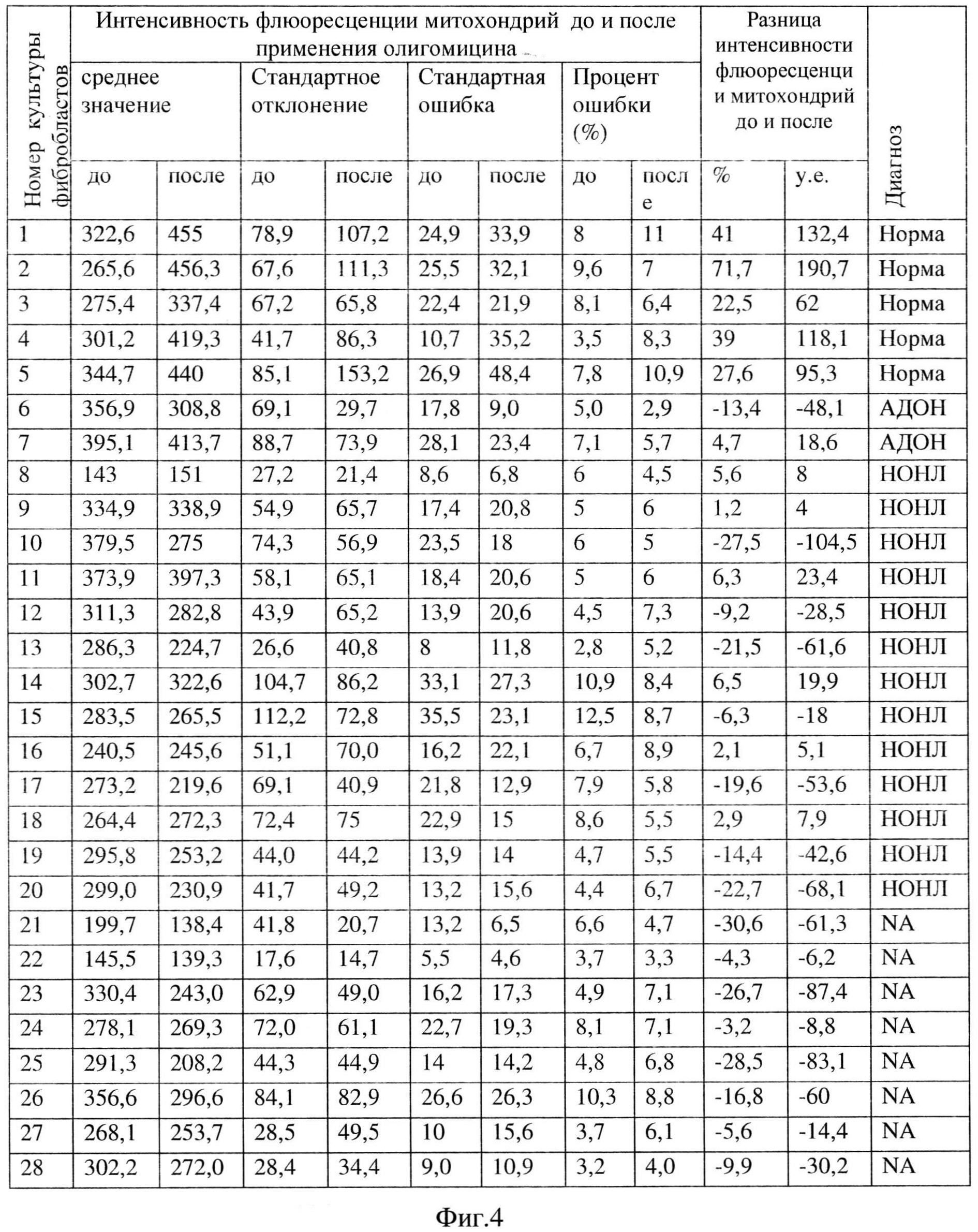
Для определения доли энергии потенциала митохондрий, расходуемой на синтез АТФ, к фибробластам добавляли олигомицин и измеряли интенсивность флуоресценции митохондрий до и после действия олигомицина. Материалом для исследования служили фибробласты кожи 23 пациентов, в том числе 13 пациентов с НОНЛ, 2 пациента с АДОН, 8 пациентов с клиническим диагнозом НОН, но без выявленных мутаций, а также 6 здоровых людей группы контроля. Пациентам с клиническим диагнозом НОН и генетически не верифицированным диагнозом проводили поиск наиболее частых мутаций яДНК и 12 первичных мутаций мтДНК, расширенный поиск мутаций не был осуществлен в связи с дороговизной исследований.
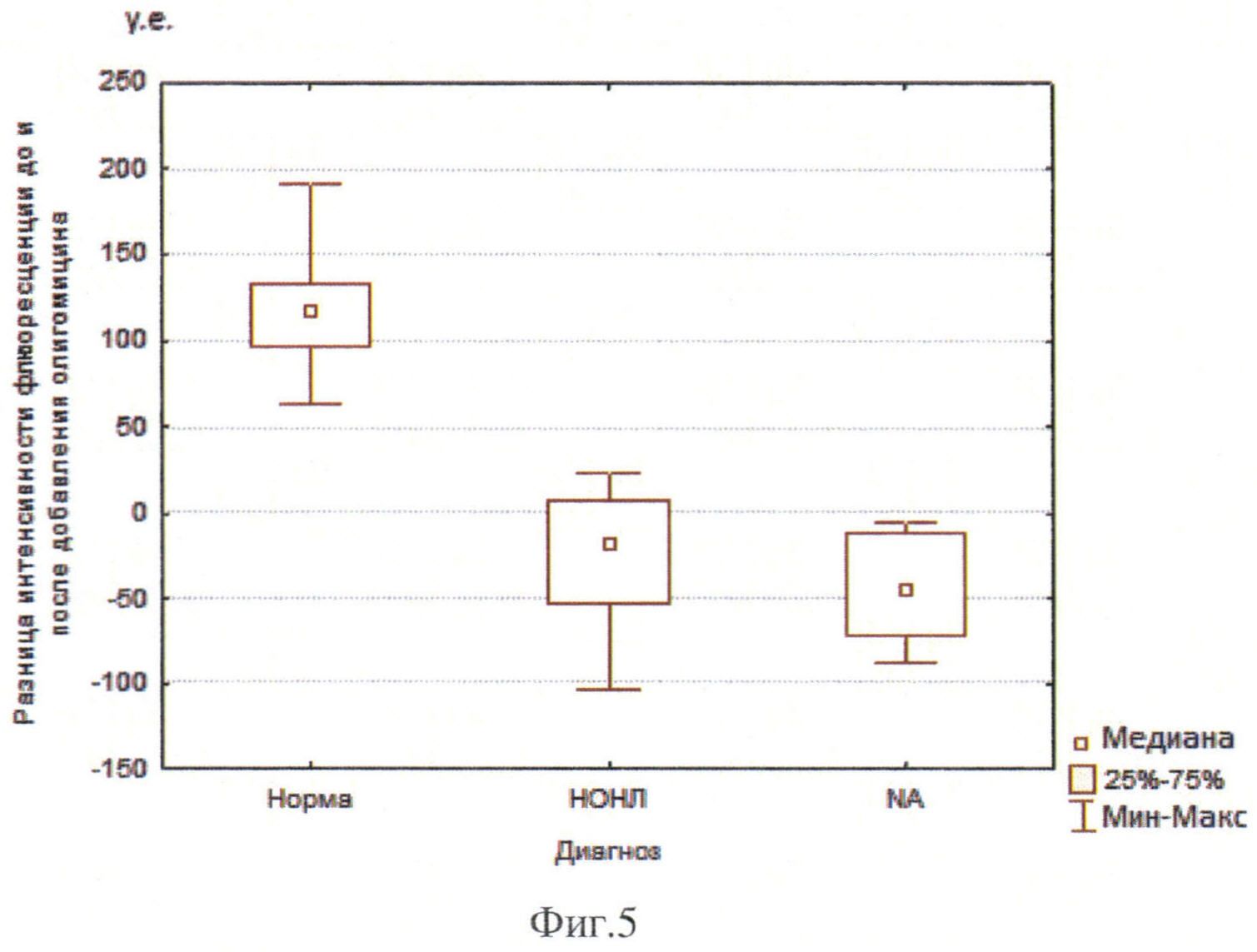
Изменение интенсивности флюоресценции митохондрий до и через 30 мин после добавления олигомицина у пациентов с АДОН и НОНЛ, пациентов с НОН без генетической верификации (NA) и контрольной группе представлено на Фиг. 4. и Фиг. 5.
В линии фибробластов кожи здоровых людей олигомицин вызывает увеличение интенсивности флюоресценции митохондрий на 118,1 у.е. (39%), минимум и максимум соответственно 62,0/190,7 у.е. (22,5%/71,7%).
В то же время у пациентов с НОНЛ отмечалось снижение интенсивности флюоресценции митохондрий на 18 у.е. (-6,3%), минимум и максимум соответственно -100,4/23,4 у.е. (-27,5%/6,5%), обусловленных влиянием олигомицина. Таким образом, в культуре фибробластов больных с НОНЛ интенсивность флюоресценции митохондрий через 30 мин после добавления олигомицина увеличивается не более чем на 7% или снижается.
Та же тенденция отмечена и у двух пациентов с АДОН, выявлено снижение интенсивности флюоресценции митохондрий под действием олигомицина в одном случае на 48,1 у.е. (13,4%), во втором случае небольшое увеличение на 18,6 у.е. (4,7%). Таким образом, в культуре фибробластов больных с АДОН интенсивность флюоресценции митохондрий через 30 мин. после добавления олигомицина увеличивается в пределах 7% или снижается.
У всех 8 нацистов с клиническим диагнозом НОН и не выявленным генетическим дефектом также было выявлено снижение интенсивности флюоресценции на 45,1 у.е. (13,4%), минимум и максимум соответственно -87,4/-6,2 у.е. (-30,6%/-3,2%). Таким образом, в культуре фибробластов больных с клиническим диагнозом НОН и не выявленным генетическим дефектом интенсивность флюоресценции митохондрий через 30 мин. после добавления олигомицина снижается.
Анализ полученных данных выявил статистически достоверное различие изменения показателей интенсивности флюоресценции митохондрий после добавления олигомицина у пациентов с НОНЛ, а также пациентов с НОН без генетической верификации в сравнении с группой контроля (p<0,005).
На основании полученных результатов можно заключить, что изменение потенциала митохондрий под действием олигомицина, отражающее их способность синтезировать АТФ, в клеточных линиях пациентов, страдающих НОНЛ и АДОН, а также в группе обследованных пациентов с не верифицированной мутацией митохондриального или ядерного генома, снижена по сравнению со здоровыми людьми. Таким образом, предлагаемая клеточная модель может быть использована для дифференциальной диагностики митохондриальных нарушений.
Способ осуществляют следующим образом. У больного, у которого заподозрена НОН на основании совокупности клинических данных, осуществляют биопсию кожи.
Для забора биопсии кожи проводят обработку небольшого участка кожи, например, с внутренней стороны предплечья (примерно 3 см в диаметре) анестезирующей мазью («ЭМЛА»). Через 20 мин после местной анестезии обрабатывают участок спиртовой салфеткой (или спиртом). При помощи стерильного офтальмологического пинцета производят зажим кожи. Одноразовым скальпелем срезают участок кожи (размером, примерно, с булавочную головку, диаметр ~0,5 см).
Полученный биоптат кожи помещают в питательную среду, содержащую DMEM (Dulbecco′s modified Eagle′s medium) (ПанЭко, Россия) с добавлением 10% эмбриональной бычьей сыворотки («Биолот», Россия). Далее производят ферментативную обработку коллагеназой (0,4 мкг на 1 мл среды) и инкубируют в термостате на 37°C 16 часов. После ресуспендирования пипеткой, промывают средой (для отделения коллагена). Далее полученный субстрат помещают на культуральный матрас с питательной средой (DMEM с глютамином, 20% сыворотка крупного рогатого скота, пенициллин 100 мкг/мл, стрептомицин 100 мкг/мл, гентамицин), клетки выращивают по стандартной методике для адгезивных клеток (Hayflick L., Moorhead P. The serial cultivation of human diploid cell strains // Exp. Cell Res. - 1961. - Vol. 25. - P. 585-621).
Культуры инкубируют в термостате при 37°C в течение двух-трех недель до полного заполнения клетками площади матраса, периодически сменяя культуральную среду.
Для снятия клеток с подложки при пересаживании в течение 2-3 минут обрабатывают культуру раствором, содержащим 0,68 мМ Na-ЭДТА и 0,125% трипсина в PBS (8,1 мМ Na2HPO4; 1,45 мМ KН2РO4; 0,11 М NaCl; 3,42 мМ KCl, pH 7,4), после чего добавляют 5 мл стерильной среды DMEM. Клетки суспендируют пипетированием. Около 1-2 мл суспензии клеток переносят в чашки Петри с 3-4 мл среды DMEM. Для экспериментов клетки выращивают на стерильных покровных стеклах в течение суток. Клетки плотностью 5000-10000 клеток на 1 см2 (всего 50000-100000 клеток на площади 10 см2) инкубируют при температуре 37°C во влажной атмосфере с 5%-ным содержанием СO2. Для приготовления растворов и сред используют дистиллированную воду, очищенную на системе Milli-Q (Millipore, США).
Для окрашивания митохондрий используют флюоресцентный митохондриальный потенциалзависимый краситель (TMRE) (Molecular Probes, США). Живые клетки, растущие па покровном стекле, инкубируют в течение 1 часа при 37°C в среде, содержащей 25 нМ красителя. Чтобы исключить выброс красителей из клеток Р-гликопротеином, продуктом гена множественной лекарственной устойчивости, в среду инкубации добавляют ингибитор Р-гликопротеина верапамил в концентрации 2,2 µМ.
Чтобы определить изменение потенциала внутренней мембраны митохондрий, к клеткам добавляют олигомицин до конечной концентрации 10 мкМ. Оценку действия олигомицина проводят через 30 минут после его добавления.
Для измерения интенсивности флюоресценции митохондрий используют микроскоп (Axiovert 200 М) (Zeiss, Германия), снабженный инкубатором для наблюдения живых клеток, в котором поддерживается температура 36±2°С (PeCon, Германия). Съемку поводят при помощи объектива PlanApo 63х, 12-битной цифровой CCD камеры AxioCam MR3 (Zeiss, Германия) и программного обеспечения AxioVision (Zeiss, Германия). При съемке живых клеток флюоресценцию возбуждают при помощи 100-ватной галогеновой лампы с переменным сопротивлением, чтобы снизить фототоксический эффект. Флуоресценцию TMRE снимают при λех=579 нм, λеm=600 нм.
Изображение передается на компьютер и сохраняется в виде 12-битных графических файлов. Для получения достоверных результатов делают по 10 снимков до добавления олигомицина и через 30 минут после добавления олигомицина. При этом каждый раз фотографируют новые клетки, поскольку при длительном наблюдении во флюоресцентном микроскопе клеток, окрашенных TMRE, происходит образование АФК, нарушающих их нормальную жизнедеятельность.
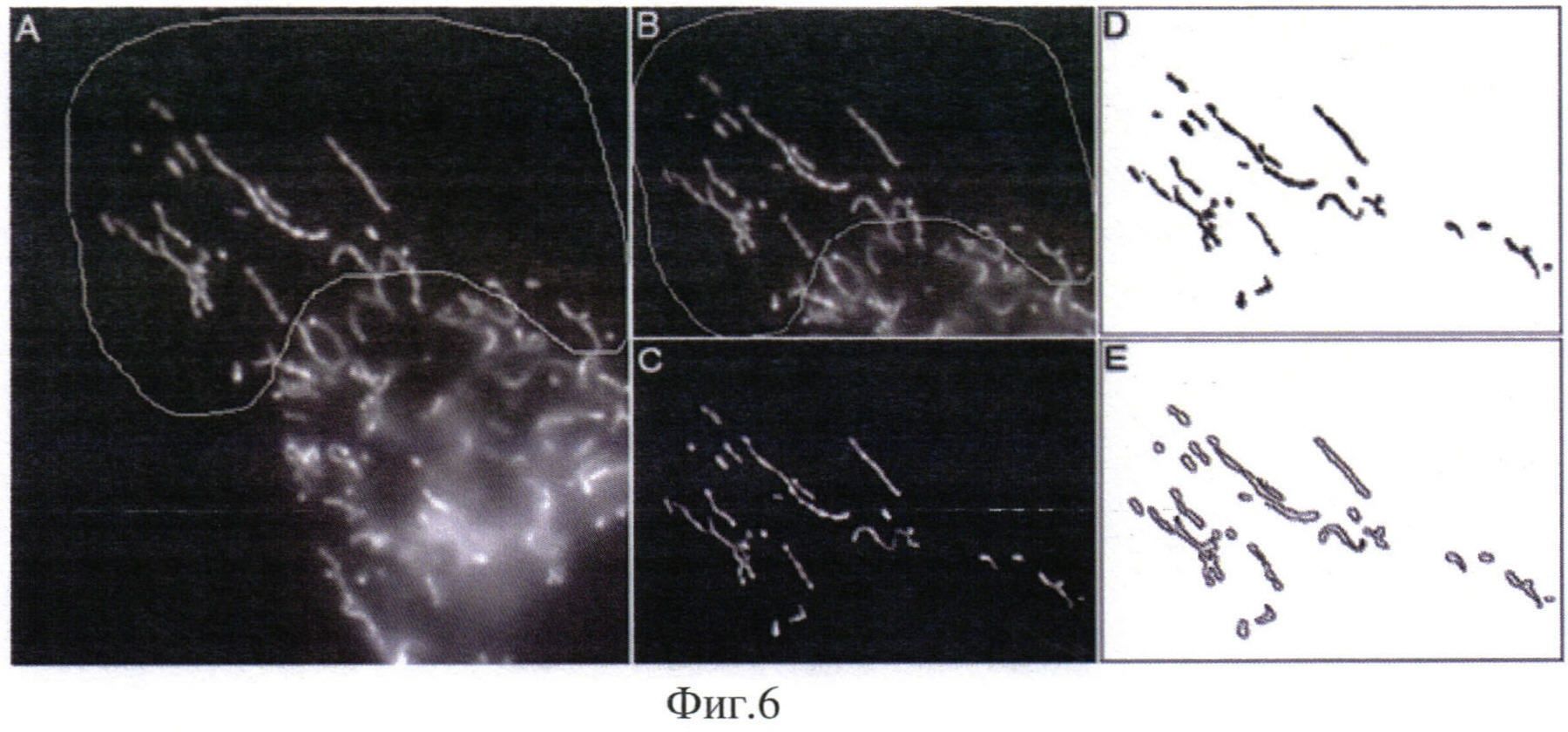
Уровень трансмембранного потенциала митохондрий оценивают по интенсивности флюоресценции митохондрий в клетках, окрашенных TMRE. Для этого определяют среднюю яркость индивидуальных митохондрий на полученных при микроскопии изображениях. Поскольку в использованных нами культурах клеток REF-52, MFT-6 и MFT-16 митохондрии часто образуют скопления вокруг ядра, что может вносить серьезные ошибки в определение их яркости, для определения яркости окрашивания митохондрий выбирают только те участки клеток, в которых митохондрии располагаются в один слой и не перекрываются между собой (Фиг. 6А).
Чтобы определить яркость отдельных митохондрий, сначала определяют их границы при помощи программы ImageJ, находящейся в свободном доступе. Для определения 1раниц отдельных митохондрий исходное изображение (Фиг. 6В) конвертируют в бинарное (Фиг. 6D). Для этого к исходному изображению применяют фильтр (Gaussian blur) с диаметром размытия 7 пикселей (этот показатель соответствует средней ширине митохондрий на полученных нами изображениях). В результате получают «размытое» изображение, которое затем вычитают из исходного. Такое преобразование позволяет сделать границы митохондрий более контрастными и уменьшить уровень шума на изображении (Фиг. 6С). Полученное изображение далее конвертируют в бинарное (Фиг. 60) при помощи введения порога (thresholding) по алгоритму IsoData. Этот метод разделяет изображение на объекты и фон при помощи введения первоначального порога. Затем рассчитывают средние значения яркости всех пикселей имеющих значение яркости на границе или выше порога и всех пикселей, имеющих значение яркости ниже порога. Далее рассчитывают среднее из этих двух значений, значение порога увеличивается и процесс повторяется до тех пор, пока значение порога не достигнет этого среднего значения, т.е. до тех пор, пока значение порога = (среднее значение фона + среднее значение объектов).
На полученном бинарном изображении определяют контуры каждой митохондрии (Фиг. 6Е) с помощью анализатора частиц (Particle analyzer) из программы ImageJ. По полученным границам митохондрий определяют их яркость как среднее значение интенсивности флуоресценции по всем пикселям, попавшим в каждый контур. Рассчитанные значения яркости корректируют с учетом уровня фона, который определяют как среднее значение яркости пикселей в области, свободной от клеток. В каждом эксперименте обсчитывают 10-15 участков, содержащих по 15-40 митохондрий. Данные представляют как средние значения интенсивности флуоресценции всех митохондрий с указанием стандартной ошибки. И при увеличении интенсивности флуоресценции не более чем на 10% или ее снижении диагностируют НОН.
Пример 1.
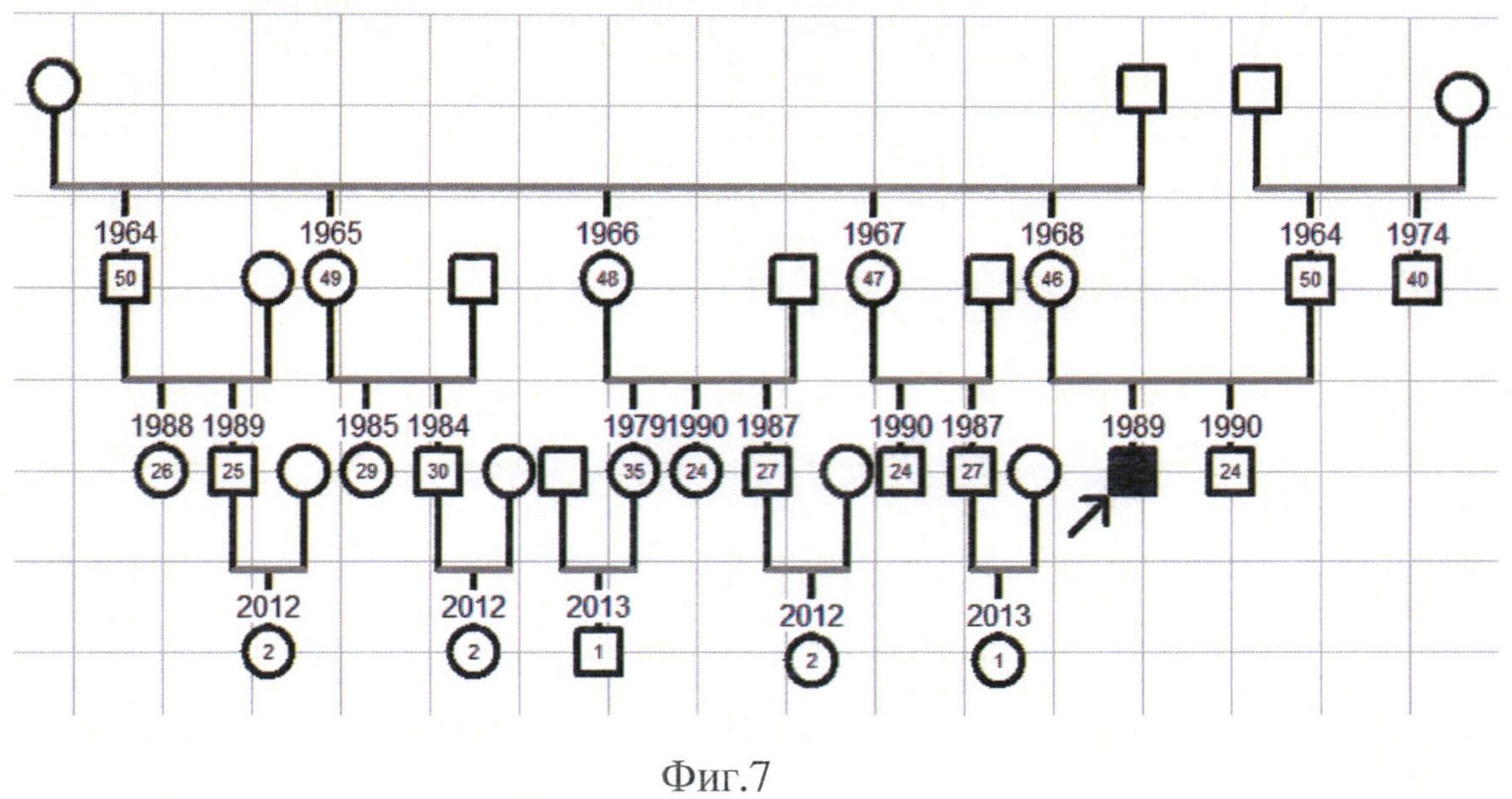
Пациент К., 24 года, обратился с жалобами на постепенное двустороннее безболезненное снижение зрения, которое возникло 2 месяца назад. Наличие предрасполагающих факторов, которые бы предшествовали ухудшению зрения (травмы, прием алкоголя, прием лекарственных средств, перенесенные инфекционные заболевания) пациент отрицал. Наследственный анамнез по атрофии зрительного нерва со слов пациента не отягощен (Фиг. 7).
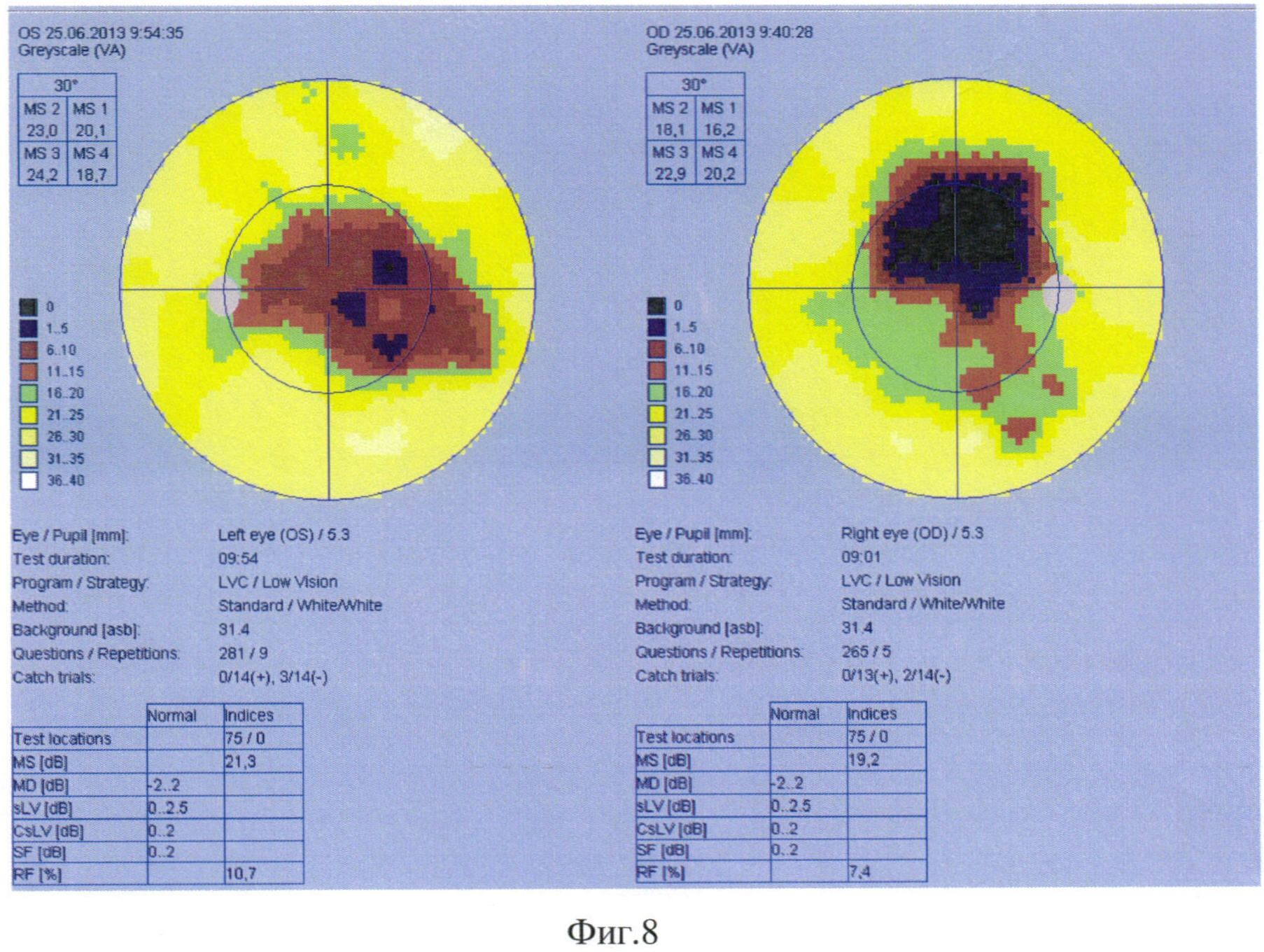
На момент осмотра Vis OD=0,02, Vis OS=0,02. Проведенная компьютерная периметрия выявила центральную (относительную и абсолютную) скотому на двух глазах, снижение световой чувствительности, более выраженное на правом глазу (Фиг. 8).
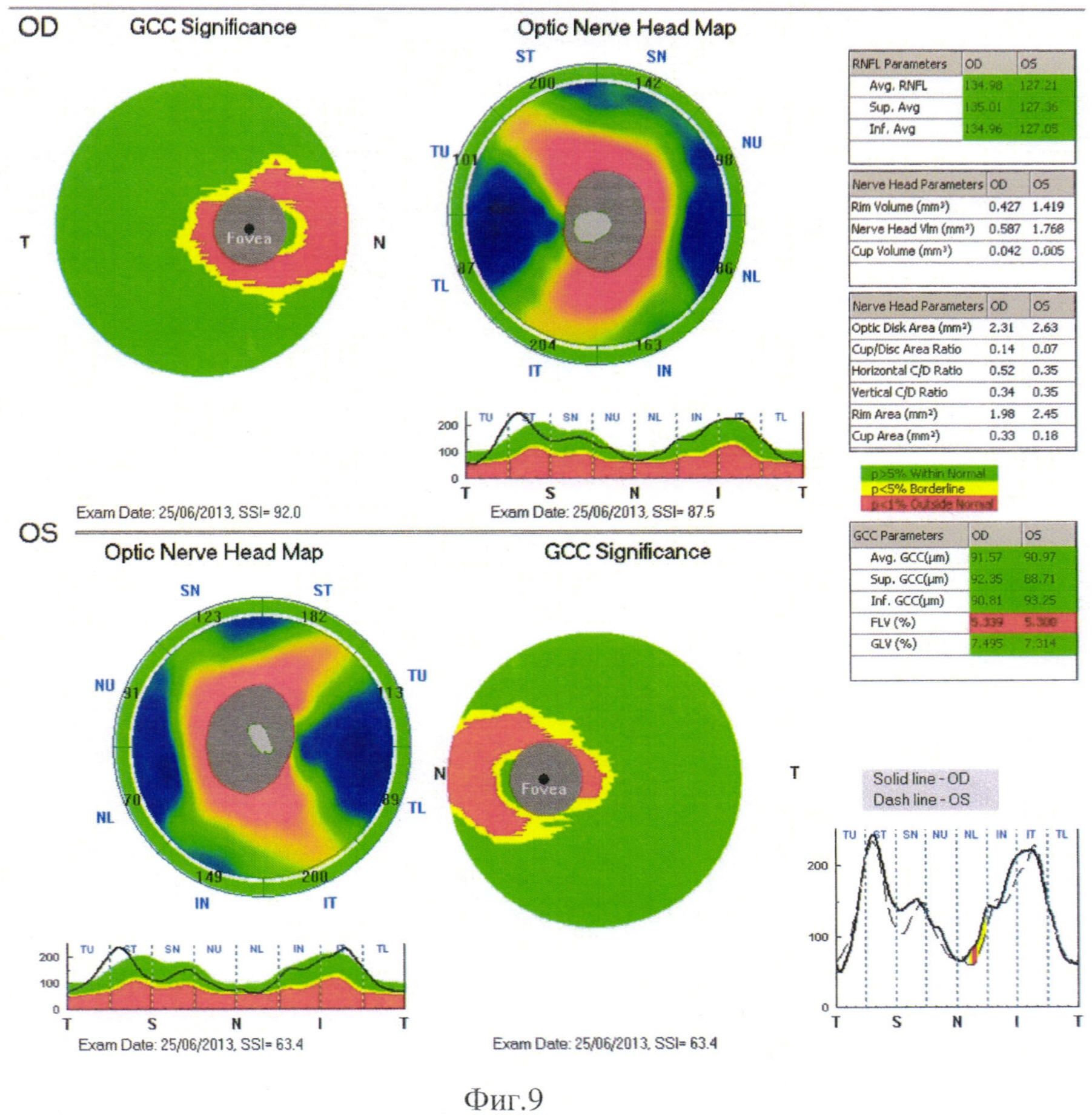
Проведение оптической когерентной томографии (ОКТ) макулярной зоны и перипапиллярной зоны на 2-м месяце, в ранней стадии заболевания выявило истончение внутренних слоев сетчатки (КГК), увеличение толщины СНВС обоих глаз преимущественно в височных секторах (Фиг. 9).
На момент осмотра пациенту было проведено клиническое обследование, МРТ головного мозга и орбит, пациент консультирован терапевтом, стоматологом, отоларингологом, неврологом, что позволило исключить внеглазную патологию.
У пациента была заподозрена НОНЛ, рекомендовано генетическое исследование крови.
При молекулярно-генегическом исследовании пациента 12 первичных мутаций мтДПК и мутаций в «горячих» участках (экзонах 8, 14, 15, 16, 18, 27, 28) гена ОРА1 яДНК не обнаружено.
Повторные ОКТ через 3 месяца выявили прогрессирующее истончение внутренних слоев сетчатки, истончение СНВС в височных секторах, обоих глаз, увеличение FLV, GLV (Фиг. 10), уменьшение общей толщины сетчатки, преимущественно в носовых, верхних и нижних секторах пара- и перифовеально, при интактной фовеа. ОКТ картина была характерна для НОН.
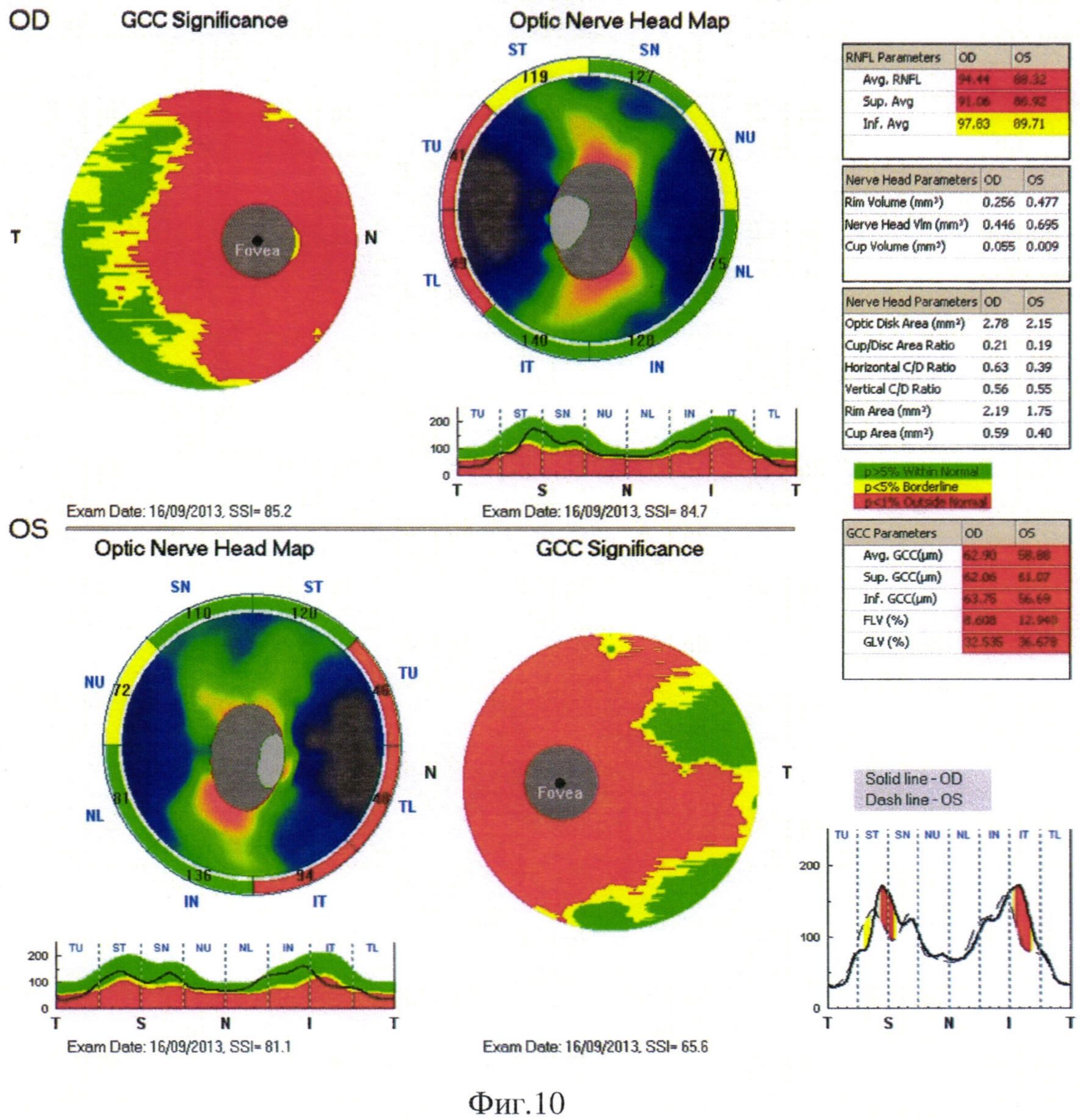
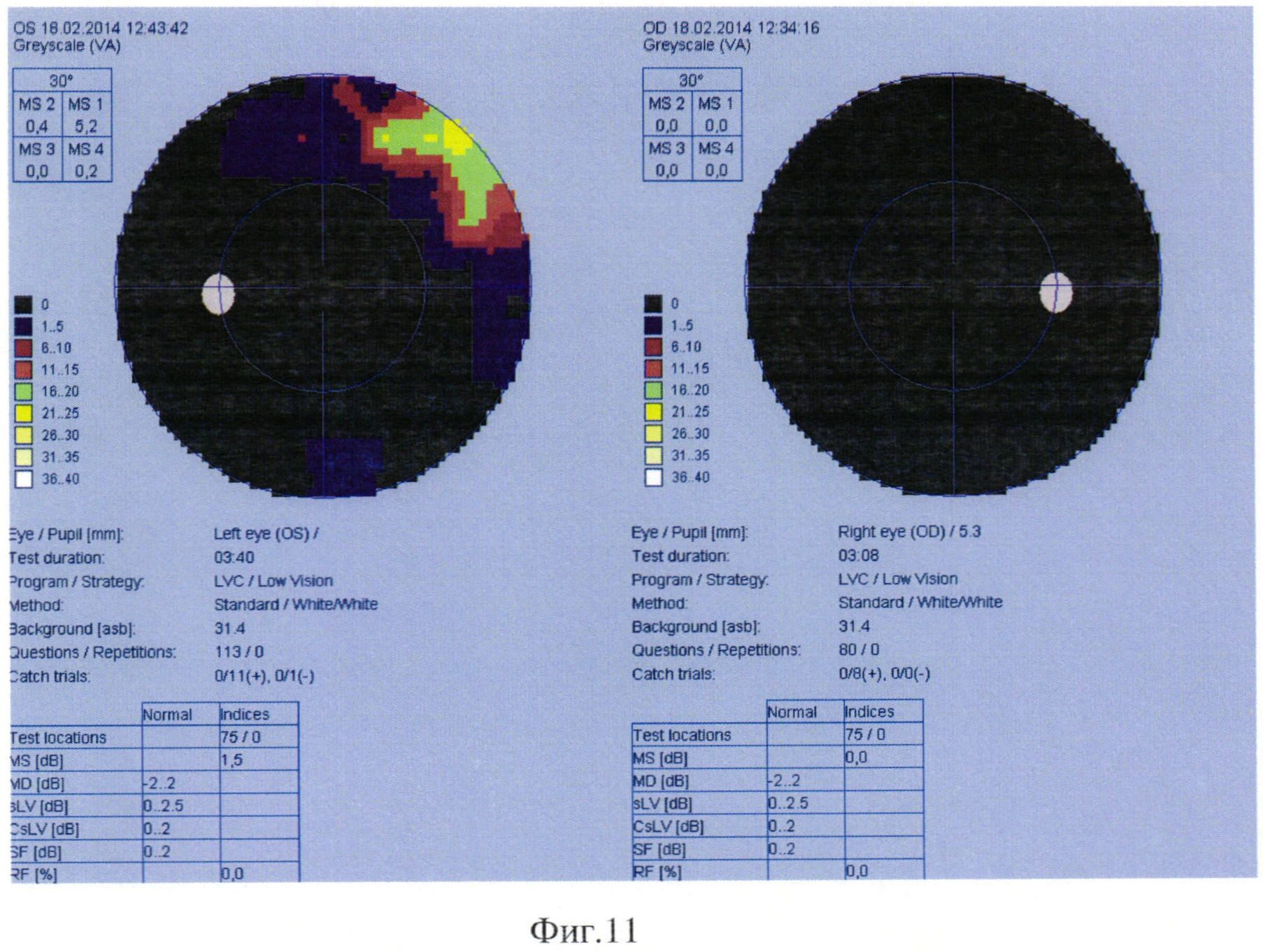
Через 10 месяцев после начала заболевания острота зрения обоих глаз снизилась до счета пальцев с расстояния 10 см. При повторном исследовании полей зрения были выявлены грубые изменения, с отрицательной динамикой по сравнению с предыдущим исследованием: скотома значительно увеличилась в размерах, прогрессировало снижение световой чувствительности (Фиг. 11).
Повторно выполненная ОКТ через 10 месяцев после начала заболевания выявила выраженные атрофическими изменениями КГК во всех секторах макулярной зоны, значительное снижение объема фокальных и глобальных потерь, уменьшения общей толщины сетчатки. Наблюдалось выраженное истончение СНВС по всем секторам.
Клиническая картина в сочетании с результатами дополнительных методов исследования, несмотря на отсутствие мутаций наиболее частых мтДНК и яДНК, указывала на наследственную природу оптической нейропатии.
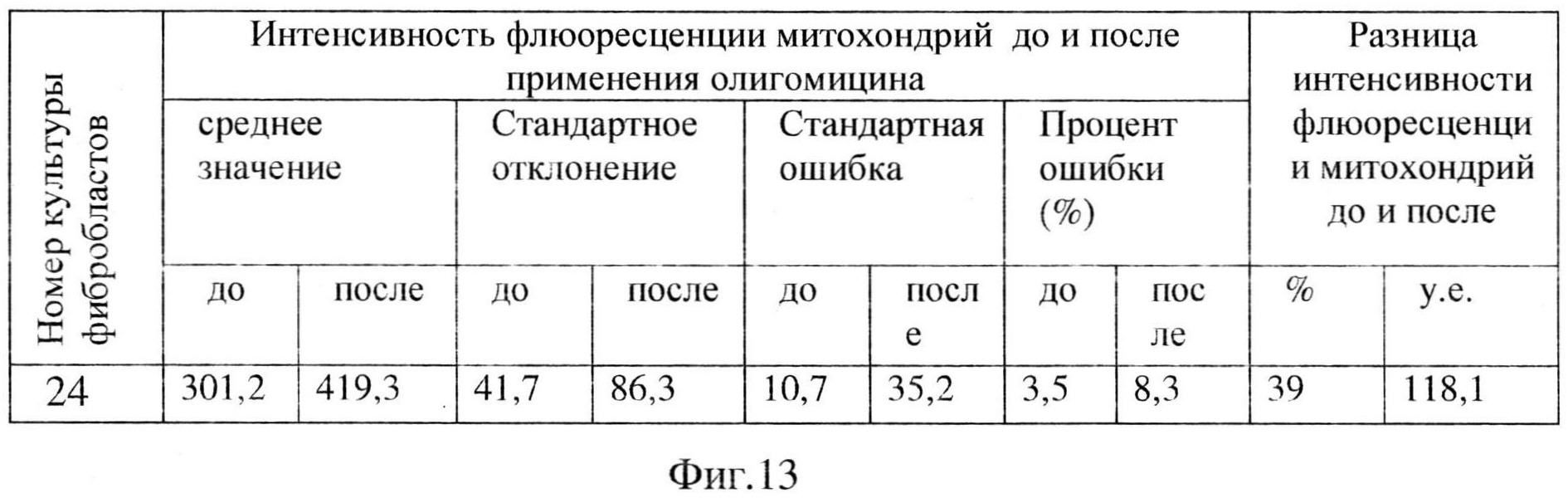
Для выявления или исключения нарушений функций митохондрий, было проведено цитологическое исследование фибробластов кожи пациентов. В результате было выявлено снижение интенсивности флюоресценции митохондрий после добавления олигомицина на 26,7%, что характерно для митохондриальной патологии (Фиг. 12).
Данное исследование подтверждает наследственную природу заболевания пациента К., пациенту рекомендовано расширенное генетическое обследование.
Таким образом, предлагаемый способ диагностики посредством клинического и цитологического исследования позволил верифицировать генез заболевания пациента - установить НОН. Согласно выявленному заболеванию пациенту назначено соответствующее лечение, включающее антиоксидантные, нейропротекторные препараты, препараты, стимулирующие метаболические процессы, рекомендовано периодическое наблюдение офтальмолога, а также, учитывая возможность возникновения неврологической симптоматики при НОН, указано на необходимость консультации у невролога. Пациенту даны рекомендации по изменению образа жизни и ограничению влияния некоторых лекарственных препаратов и других провоцирующих факторов на усугубление течения наследственного заболевания. Кроме того, пациенту рекомендовано пройти расширенное молекулярно-генетическое исследование мтДПК и яДНК для выявления мутации.
Пример 2.
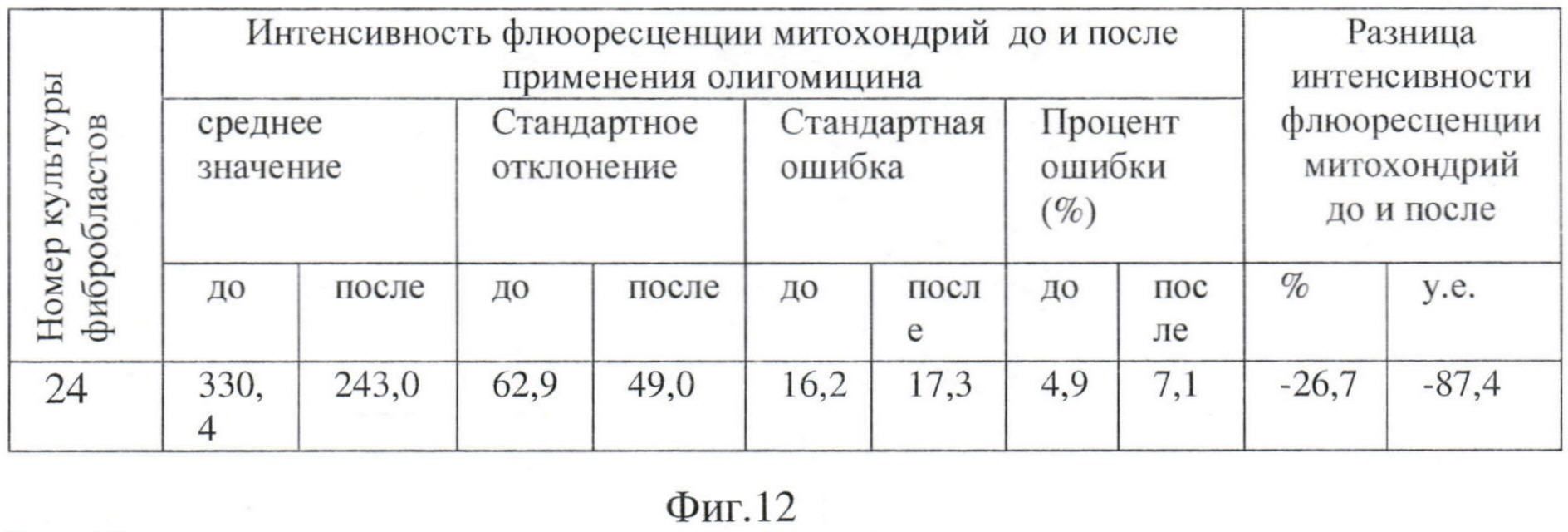
Молодой человек, 25 лет, из контрольной группы, соматически здоров. Данные офтальмологического обследования соответствуют норме. Было проведено цитологическое исследование фибробластов кожи, в результате которого выявлено повышение интенсивности флюоресценции митохондрий после добавления олигомицина на 39%, что характерно для нормы (Фиг. 13).
Пример 3.
Пациент К., 15 лет, без отягощенного семейного анамнеза, обратился с жалобами на двустороннее снижение зрения: Vis OD=0,1, Vis OS=0,1, не корр. Выявлена выраженная двусторонняя дисхроматопсия, отмечена живая реакция зрачков на свет, а также пастозность ДЗН, извитость ретинальных сосудов при офтальмоскопии глазного дна. Проведенная компьютерная периметрия определила центральную относительную скотому на двух глазах. Проведение ОКТ макулярной зоны и перипапиллярной зоны с помощью ретипотомографа OCT Stratus 3000 («Carl Zeiss») на 1-м месяце, в ранней острой стадии заболевания выявило уменьшение общей толщины сетчатки на обоих глазах, а также увеличение толщины СНВС в перипапилляной зоне. У пациента была заподозрена НОНЛ, рекомендовано генетическое исследование крови, в результате которого была выявлена мутация m.4171 С>А, что позволило генетически подтвердить диагноз НОНЛ.
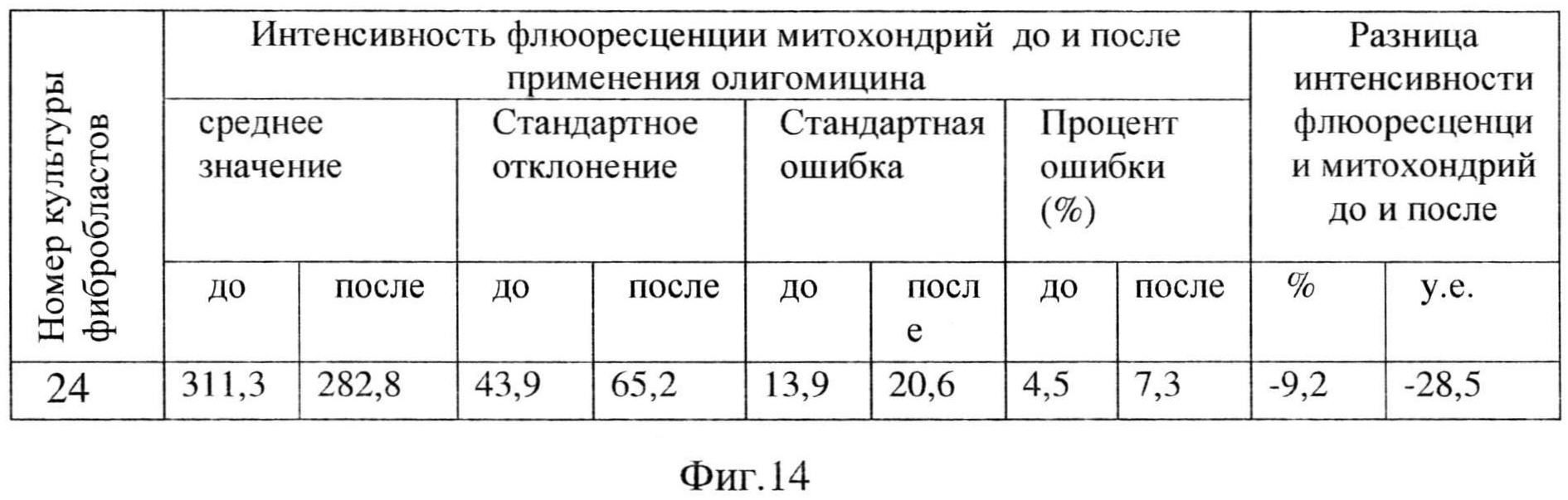
Проведенное цитологическое исследование фибробластов кожи, выявило снижение интенсивности флюоресценции митохондрий после добавления олигомицина на 9,2%, что характерно для НОН (Фиг. 14).
Пример 4.
Пациент П., 25 лет, обратился с жалобами на двустороннее снижение зрения год назад: Vis OD=0,06, Vis OS=0,04, не корр. Два двоюродных брата по материнской линии больны НОНЛ. У пациента выявлена выраженная двусторонняя дисхроматопсия, отмечена живая реакция зрачков на свет, а также бледность ДЗН при офтальмоскопии глазного дна. Проведенная компьютерная периметрия определила центральную относительную скотому на двух глазах. Генетическое исследование крови подтвердило наличие мутации m.3460 G>A.
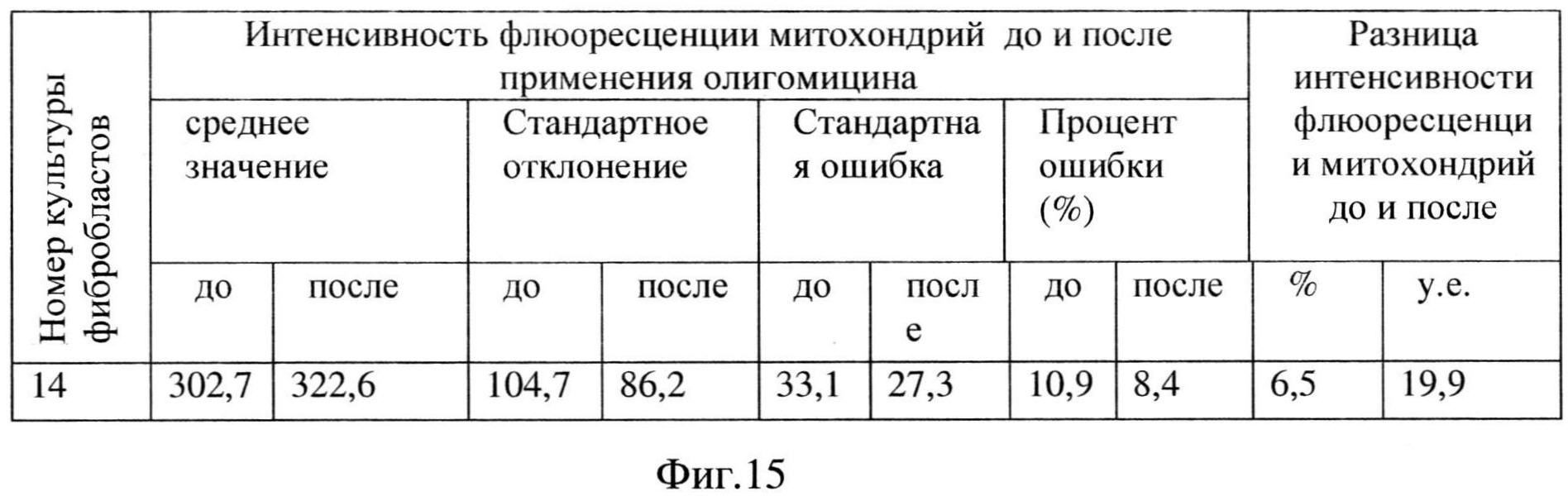
Проведенное цитологическое исследование фибробластов кожи, выявило увеличение интенсивности флюоресценции митохондрий после добавления олигомицина на 6,5%, что характерно для НОН (Фиг. 15).
Таким образом, предложенный способ дифференциальной диагностики выявляет наследственную этиологию оптической нейропатии, что дает возможность последующего прогнозирования течения заболевания зрительного нерва, позволяет рекомендовать пациенту адекватные способы лечения. Кроме того, рекомендовано пройти молекулярно-генетическое обследование детям и родственникам пациента но отцовской линии с целью выявления наличия соответствующей мутации, а также с целью прогнозирования заболевания у будущего потомства обращаться в медико-генетическое консультирование. Данный способ диагностики позволяет также определять наличие митохондриальной патологии у потомства пробанда до начала клинических проявлений заболевания с дальнейшей постановкой на учет к офтальмологу для периодического диспансерного наблюдения, лечения, проведения разъяснительных мероприятий с рекомендациями по изменению образа жизни и ограничению влияния провоцирующих факторов на возникновение наследственного заболевания.
Способ диагностики наследственной оптической нейропатии (НОН), включающий клинические и цитологические исследования, отличающийся тем, что дополнительно из кожи пациента получают культуру фибробластов плотностью 5000-10000 клеток на см, окрашивают митохондриальным потенциалзависимым флюоресцентным красителем TMRE до конечной концентрации 25 нМ, измеряют в культуре интенсивность флюоресценции митохондрий до и через 30 мин после добавления олигомицина до конечной концентрации 10 мкМ и при ее увеличении не более чем на 7% или снижении диагностируют НОН.