Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ КИШЕЧНОГО ИЕРСИНЕОЗА У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Вид РИД
Изобретение
Изобретение относится к экспериментальной медицине и может быть использовано для моделирования кишечного иерсиниоза у мелких животных, для изучения влияния антигенов данного возбудителя на макроорганизм.
Иерсиниоз является зооантропонозной инфекцией и самые разные виды животных являются естественными хозяевами его возбудителя, однако моделирование этой инфекции не всегда удается, так как вызвать острый инфекционный процесс у экспериментальных животных сложно несмотря на различные методы введения (пероральный, внутрибрюшинный), использование больших доз возбудителя, а также при применении препаратов, которые снижают естественную резистентность макроорганизма.
Известен способ моделирования кишечной инфекции у мелких лабораторных животных (см. №2279721, кл. G09B 23/28, от 09.01.2004 г.), заключающийся в том, что животным в желудок через зонд вводят культуру Klebsiella pneumonia (штамм NCTC-5054) в дозе 109 микробных клеток на 1 кг массы тела через 6 суток после создания иммунодефицитного состояния подкожной инъекцией 2,5%-ной эмульсии гидрокортизона ацетата в дозе 0,125 мг/100 г массы тела трижды с интервалом в 2 дня.
Однако использовать этот метод не представляется возможным для кишечного иерсиниоза ввиду того, что гидрокортизон ацетат снижает иммунитет или естественную резистентность организма, поэтому не сможет смоделировать клиническую картину течения данной инфекции.
За прототип выбран способ создания биомодели кишечного иерсиниоза на морских свинках (см. Сладкова Н.В. «Морская свинка как биомодель кишечного иерсиниоза», журнал «Биотехнология, иммунология и биохимия особо опасных инфекций», Саратов, 1989 г., стр. 163-165), включающий предварительную сенсибилизацию животных, заключающуюся в подкожном введении 6×103 м.к. двухсуточных культур штаммов Yersinia enterocolitica 908(03) и 682(09), выращенных на агаре Хоттингера при 37°C и инактивированных на водяной бане в течение двух часов.
Недостатком прототипа является то, что внутрибрюшинное введение возбудителя кишечного иерсиниоза морским свинкам не дает возможности создать модель естественного заражения этой инфекцией.
Кроме того, хранение в музее на питательных средах штаммов возбудителя кишечного иерсиниоза приводит к потерям факторов патогенности, что затрудняет моделирование этой инфекции на экспериментальных животных.
Техническая задача предлагаемого изобретения состояла в разработке нового способа, позволяющего моделировать кишечный иерсиниоз с полным воспроизведением патогенетических механизмов у морских свинок и белых мышей при пероральном введении живой культуры.
Поставленная задача достигается тем, что способ моделирования кишечного иерсиниоза у экспериментальных животных, включает следующие стадии:
a) штамм Yersinia enterocolitica выращивают при температуре 24-26°C на агаре Хоттингера;
b) готовят 3 млрд взвесь полученной культуры в хлориде натрия, которую соединяют в соотношении 1:1 с 0,2% раствором агара Нобля;
c) вводят морским свинкам внутрибрюшинно взвесь в объеме 0,5 мл, которая содержит 3×108 микробных клеток Y. enterocolitica в агаризованном растворе хлорида натрия;
d) животных забивают через пять дней, вскрывают, делают мазки-отпечатки из брызжеечных лимфоузлов и выделяют из них пассированную культуру;
e) перед заражением животных пассированной культурой проводят снижение кислотности желудочного сока опытным мышам и морским свинкам путем перорального введения 7,5% раствора пищевой соды, белым мышам - 0,1 мл, морским свинкам - 0,5 мл;
f) заражают опытных животных пассированной культурой Y. enterocolitica перорально, причем белым мышам вводят 3×109 микробных клеток, разведенных в 0,2 мл физиологического раствора, а морским свинкам 3×109 микробных клеток, разведенных в 0,5 мл физиологического раствора;
g) подтверждают кишечный иерсиниоз методом ПЦР после высева внутренних органов животных на агар Хоттингера с pH 7,2.
Для проведения способа были использованы штаммы Y. enterocolitica №5515 и №2000, хранящиеся в музее живых культур Ростовского противочумного института.
Способ осуществляется в несколько стадий:
Первоначально на агаре Хоттингера (pH 7,2) выращивают Y. enterocolitica при температуре 24-26°C. Затем готовят 3 млрд взвесь полученной культуры в хлориде натрия по стандарту мутности и соединяют в соотношении 1:1 с агаром Нобля («Difco», США). Агар Нобля в количестве 200 мг растворяют в 100 мл дистиллированной воды, чтобы его конечная концентрация была 0,2%. Раствор кипятят в течение 30 минут на водяной бане при постоянном помешивании, а затем охлаждают до 45°C.
Следующая стадия заключается в том, что полученную взвесь Y. enterocolitica в агаризованном растворе хлорида натрия вводят морским свинкам внутрибрюшинно в объеме 0,5 мл, где содержится 3×108 микробных клеток. Через пять суток животных забивают, вскрывают, делают мазки-отпечатки из брызжееечных лимфоузлов для выделения пассированной культуры. Выделяют чистую культуру возбудителя, что подтверждают методом ПЦР, который осуществляют согласно инструкции к наборам для ПЦР «Амплисенс® Yersinia enterocolitica». Для учета результатов ПЦР проводят электрофорез в 1,5% агарозном геле. После окрашивания этидий бромидом, гель просматривают в трансиллюминаторе с длиной волны ультрафиолетового излучения 310 нм. Образовавшиеся в результате реакции амплифицированные фрагменты ДНК (полосы в геле, светящиеся в УФ-лучах) идентифицируют по размеру, сравнивая с маркером молекулярного веса или положительным контролем.
Для моделирования кишечного иерсиниоза опытным группам животных перед заражением пассированной культурой перорально с помощью зонда вводят 7,5% раствора пищевой соды: белым мышам по 0,1 мл, морским свинкам по 0.5 мл для понижения кислотности желудочного сока, так как известно, что кишечными инфекциями чаще страдают люди с пониженной кислотностью желудочного сока.
Заключительная стадия моделирования включает следующие операции: животных перорально заражают пассированной культурой Y. enterocolitica: белых мышей 3×109 м.к. в 0,2 мл физиологического раствора, а морских свинок 3×109 м.к. в 0,5 мл физиологического раствора.
О развитии заболевания у зараженных перорально пассированной культурой Y. enterocolitica судят по нарастанию симптомов заболевания: у заболевших животных снижается двигательная активность и масса тела, шерсть становится тусклой и взъерошенной, развивается энтерит и обезвоживание организма. Часть животных гибнет. При вскрытии обнаруживают увеличенные паховые и забрюшинные лимфоузлы, увеличены печень (в некоторых случаях с гнойными очагами), почки, вздутый кишечник, легкие (могут быть с кровоизлияниями). Для подтверждения диагноза проводят высев из внутренних органов животных на агар Хоттингера (pH 7,2) с целью выделения культуры возбудителя кишечного иерсиниоза. Чистоту выделенной культуры возбудителя контролируют методом ПЦР.
Эффективность предложенного способа подтверждается следующими примерами:
Пример 1. Моделирование экспериментального кишечного иерсиниоза при пероральном заражении животных штаммом Y. Enterocolitica №5515, выделенным от заболевшего человека.
Пероральное заражение экспериментальных животных (белых мышей и морских свинок) осуществляют согласно вышеописанной технологии, после предварительного пассирования штамма через внутрибрюшинное заражение морских свинок и после введения содового раствора для понижения кислотности их желудочного сока.
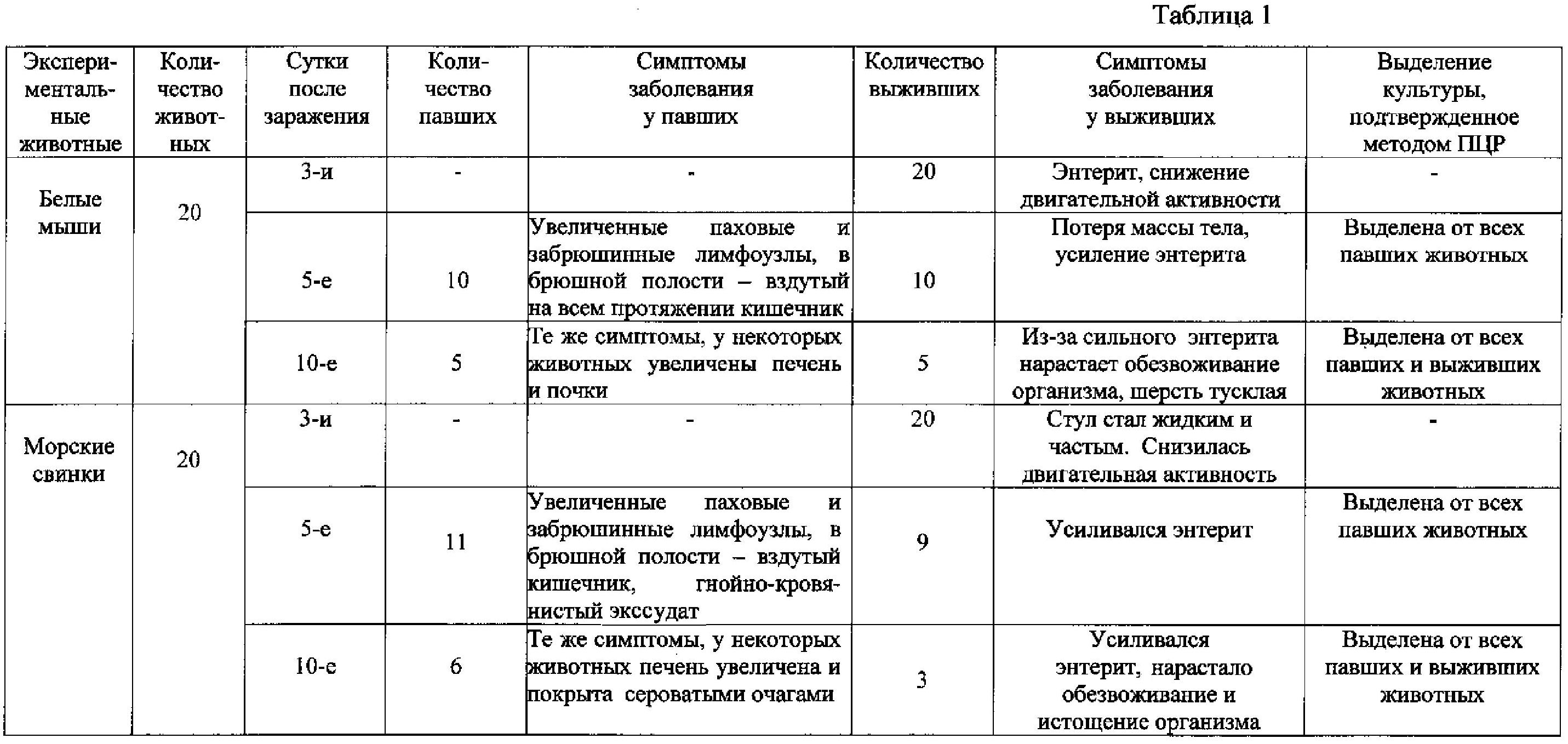
Наблюдение за зараженными животными показали (см. таблицу 1), что уже с 3-их суток после заражения у них появляются симптомы заболевания: ухудшение внешнего вида, снижение двигательной активности, энтерит. На 5-е сутки погибло около половины животных, а у выживших нарастали расстройство стула, потеря массы тела. К 10-м суткам после заражения выживали около 25% белых мышей и 15% морских свинок. У выживших наблюдались сильный энтерит, обезвоживание и истощение организма, у павших - патогенетическая картина, свидетельствующая о развитии кишечного иерсиниоза: увеличенные паховые и забрюшинные лимфоузлы, в брюшной полости - вздутый кишечник, гнойно-кровянистый экссудат, у некоторых животных печень увеличена и покрыта сероватыми очагами, почки и легкие с патологиями.
После высева внутренних органов погибших и выживших животных во всех случаях была выделена культура возбудителя кишечного иерсиниоза, что дополнительно было подтверждено методом ПЦР.
Пример 2. Моделирование экспериментального кишечного иерсиниоза при пероральном заражении животных штаммом Y. Enterocolitica №2000, выделенным от заболевшей шиншиллы.
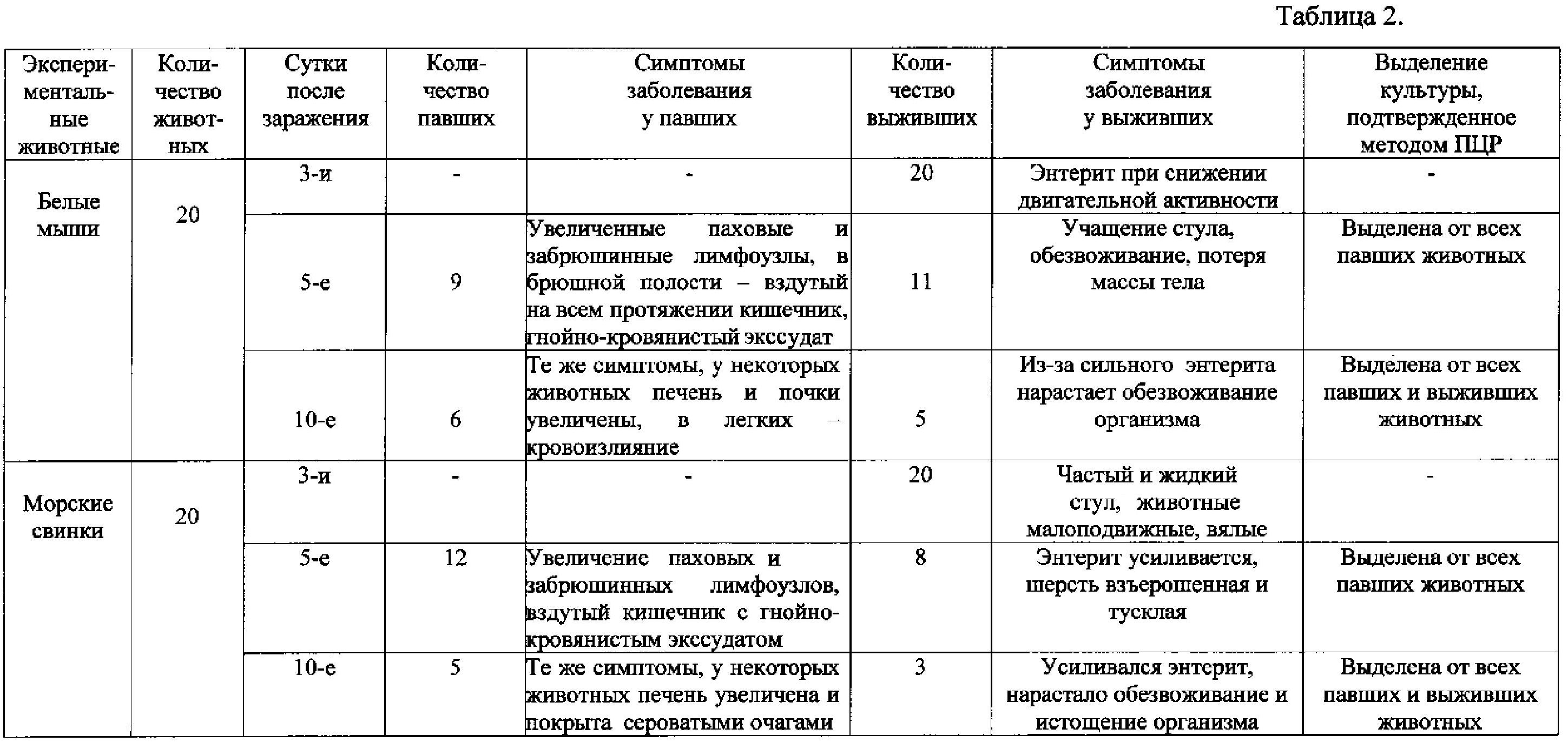
Пероральное заражение белых мышей и морских свинок осуществляли согласно предложенному пособу так же, как в примере 1. Наблюдение за опытными животными в течение 10 суток выявило схожую картину развития заболевания у них с развитием таких же симптомов инфекции (см. таблицу 2). Наличие кишечного иерсиниоза было подтверждено выделением культуры от павших и выживших в течение срока наблюдения экспериментальных животных и подтверждено методом ПЦР.
Таким образом, патоморфологические изменения и выделение чистой культуры, подтвержденное методом ПЦР, свидетельствуют о развитии кишечного иерсиниоза у всех зараженных предложенным способом разными штаммами возбудителя экспериментальных животных. Предварительное пассирование возбудителя иерсиниоза через организм морских свинок и снижение кислотности желудочного сока экспериментальных животных позволяют создать модель перорального заражения иерсиниозом с полным воспроизведением патогенетических механизмов заболевания.