Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ДИОКСИДА ТИТАНА
Вид РИД
Изобретение
Изобретение относится к способу приготовления наноразмерного диоксида титана со структурами анатаза и рутила или их смеси в разном соотношении, применяемому преимущественно для фотокаталитической и сорбционной очистки воды, загрязненной молекулярными примесями органического и неорганического происхождения.
Известны фотокатализаторы на основе различных модификаций диоксида титана, активные при УФ-облучении [Kazuhito Hashimoto, Hiroshi Irie, and Akira Fujishima, TiO2 Photocatalysis: A Historical Overview and Future Prospects, AAPPS Bulletin December 2007, vol.17, No.6, 12-29]. Из устойчивых модификаций диоксида титана (рутил, анатаз, брукит) наибольшей фотокаталитической и сорбционной способностью обладает анатаз.
Нередко для получения наноразмерного диоксида титана в качестве исходного реагента используют сульфат титанила TiOSO4. Например, описан способ получения фотокатализатора на основе диоксида титана, заключающийся в приготовлении водного раствора сульфата титанила с концентрацией 0,1-1,0 моль/л, добавлении в раствор кислоты до конечной концентрации 0,15-1 моль/л с последующим гидролизом полученного раствора в гидротермальных условиях при температуре в диапазоне 100-250°C в течение 0,5-24 ч и последующим высушиванием полученной суспензии пористого диоксида титана. Способ позволяет получить пористый фотокатализатор в форме мезопористых частиц с высокой удельной поверхностью, что усиливает его фотокаталитическую активность [Зверева И.А., Чурагулов Б.Р., Иванов В.К., Баранчиков А.Е., Шапорев А.С., Миссюль А.Б. Способ получения фотокатализатора на основе диоксида титана. Патент РФ №2408427, 2009]. Конкретные данные о фотокаталитической активности не приведены.
Описанный способ получения адсорбента на основе диоксида титана со структурой анатаза сульфатным методом включает смешивание порошкообразного сольватированного сульфата титанила, титана (IV) оксисульфат - серная кислота гидрата, (TiOSO4·xH2SO4·yH2O) с водой в массовом соотношении 1:(5,5-6,8), нагрев в течение 60 мин без перемешивания при температуре 90-98°C, охлаждение, отделение осадка фильтрованием; далее проводят обработку 0,1-0,4 М раствором гидроксида щелочного металла, промывку дистиллированной водой и ацетоном и сушку в сушильном шкафу при температуре 90-95°C в течение одного часа [Оболенская Л.Н., Натыкан А.А., Яковенко А.Г., Савинкина Е.В., Кузьмичева Г.М., Доморощина Е.Н. Способ получения адсорбента на основе наноразмерного диоксида титана со структурой анатаза, патент РФ №2463252].
Описанный в патенте [Воронцов А.В., Козлов Д.В., Колинько П.А., Козлова Е.А. Способ получения диоксида титана, Патент РФ №2494045] способ получения диоксида титана анатазной модификации заключается в приготовлении водного раствора сульфата титанила и серной кислоты и его последующего гидролиза в гидротермальных условиях с одновременной обработкой раствора микроволновым излучением; процесс гидролиза проводят непрерывно в проточных условиях при объемном расходе 0,01-1 л/мин, концентрации сульфата титанила 0,01-1 моль/л путем воздействия микроволнового излучения мощностью 100-1500 Вт на протекающий по кварцевой трубке раствор.
Известно использование пероксотитановой кислоты в качестве прекурсора для получения тонких пленок титаноксидного фотокатализатора [Lei Ge and Mingxia Xu, Fabrication and characterization of TiO2 photocatalytic thin film prepared from peroxo titanic acid sol, Chemistry and Materials Science, Journal of Sol-Gel Science and Technology, Volume 43, Number 1, 1-7, 2007; Lei Ge, Mingxia Xu, Lei E, Yuming Tian and Haibo Fang, Preparation of TiO2 Thin Films Using Inorganic Peroxo Titanic Complex and Autoclaved Sols as Precursors, Key Engineering Materials, Vols. 280-283, 809-812 (2005)]. Для получения пероксотитановой кислоты использовали сульфат титанила, аммиак и пероксид водорода. В присутствии полученного фотокатализатора степень разложения метилового оранжевого (концентрация 10 мг/л) при УФ-облучении в течение 180 мин составила 98,9%.
Недостатками описанных методов являются многостадийность процессов и необходимость выделения полученного диоксида титана из жидкой реакционной смеси.
Известен процесс получения анатазной фазы диоксида титана, включающий стадию обработки гидратированного диоксида титана пероксидом водорода в водном растворе с образованием золя, который далее переводят в гель при 50°C; последний высушивают при температуре около 100°C и полученный ксерогель прокаливают при температуре до 1000°C [Etacheri V., Pillai S., Seery M., High temperature stable anatase phase titanium dioxide, Patent WO 2010/064225 A1]. Получен термически устойчивый (до 900°C) анатаз со средним размером кристаллитов (областей когерентного рассеяния - ОКР) около 50 нм.
К недостаткам данного метода следует отнести необходимость предварительного получения гидратированного диоксида титана путем гидролиза тетрахлорида титана, перевода полученного золя в гель и последующее высушивание геля для получения ксерогеля.
Известен способ получения наноразмерного анатаза (28-50 нм) взаимодействием в водном растворе сульфата титанила и пероксида водорода с последующим формированием геля (в течение нескольких часов при комнатной температуре), центрифугированием, промывкой, сушкой в печи в течение нескольких часов, отжигом при 200-550°C в течение 1 ч [Subbian KARUPPUCHAMY, Jae Mun JEONG, Synthesis of nano-particles of TiO2 by simple aqueous route, Journal of Oleo Science 55 (5), 263-266, 2006]. В данном методе также требуется длительное время для формирования и высушивания геля.
Наиболее близким техническим решением является синтез диоксида титана в виде рутила и анатаза с помощью механохимической реакции между TiOSO4·xH2O и безводным Na2CO3 в мольном отношении 1:1 с последующим удалением побочного продукта Na2SO4·xH2O путем отмывания водой [Р. Billik, G. Plesch, Mechanochemical synthesis of anatase and rutile nanopowders from TiOSO4, Materials Letters, Volume 61, Issues 4-5, February 2007, Pages 1183-1186]. Нанокристаллический рутил со средним размером кристаллитов 15 нм получен после перемалывания в шаровой мельнице в течение 60 мин, а анатаз со средним размером 5-35 нм - после перемалывания в течение 5 мин и отжиге при 300-600°C.
К недостаткам данного метода следует отнести необходимость удаления побочного продукта промыванием водой, а, следовательно, последующее выделение диоксида титана из жидкости. Помимо этого происходит загрязнение продукта железом, входящим в состав шаров мельницы. Кроме того, прокаливание продукта при температуре ниже 600°C приводит к образованию продукта с недостаточно высокой степенью кристалличности, а при более высокой температуре наряду с анатазом образуется значительное количество рутила, обладающего меньшей, чем анатаз, фотокаталитической активностью.
Технический результат изобретения заключается в упрощении процесса получения образцов с наноразмерным диоксидом титана со структурами анатаза и рутила или их смеси в разном соотношении и уменьшении его стадийности.
Технический результат достигается диспергированием порошкообразного гидратированного сульфата титанила с пероксосоединениями (пероксодисульфатом аммония, либо с аддуктом карбамида с пероксидом водорода, либо с 30%-ным водным раствором пероксида водорода) с последующим отжигом.
Образцы наноразмерного диоксида титана получали смешиванием дигидрата сульфата титанила с 30%-ным водным раствором пероксида водорода либо растиранием с твердыми пероксодисульфатом аммония либо аддуктом карбамида с пероксидом водорода с последующим отжигом при температуре 600-1000°C в течение 1-60 мин. В этих условиях образуется диоксид титана в форме анатаза, в ряде случаев с примесью рутила. При более низких температурах еще не происходит разложения сульфата титанила, а при более высоких температурах анатаз переходит в рутил. Для сравнения вместо гидратированного сульфата титанила использовали гидратированный цитрат титанила, а вместо перексосоединений - этилендиаминтетрауксусную кислоту (цитрат- и этилендиаминацетат-ионы способны, подобно пероксид-иону, образовывать хелатные комплексы с TiIV). Кроме того, проведено термическое разложение гидрата сульфата титанила в отсутствие добавок.
Фазовый состав контролировали традиционным рентгенографическим методом (фиг.1-4). Показано, что они содержат анатаз (2θ~25.3°, 37.8°, 48° [JCPDS №89-4921]), рутил [JCPDS №89-8304], смесь анатаза и рутила, а также в очень небольшом количестве (на уровне ~1%), вероятно, TinO2n-1 с n=9 и 10 (2θ~29°, ~30°), и гидратированный диоксид титана TiO2·nH2O (2θ~12-13°). Для определения размеров областей когерентного рассеяния (ОКР) использовалась формула Шеррера: D=kλ/βcosΘ: λ - длина волны, 2Θ~25° (для анатаза) и 2Θ~27,5° (для рутила) β - интегральная ширина пика, эмпирический коэффициент k принимали равным 0,9. Стандартное отклонение ±5%.
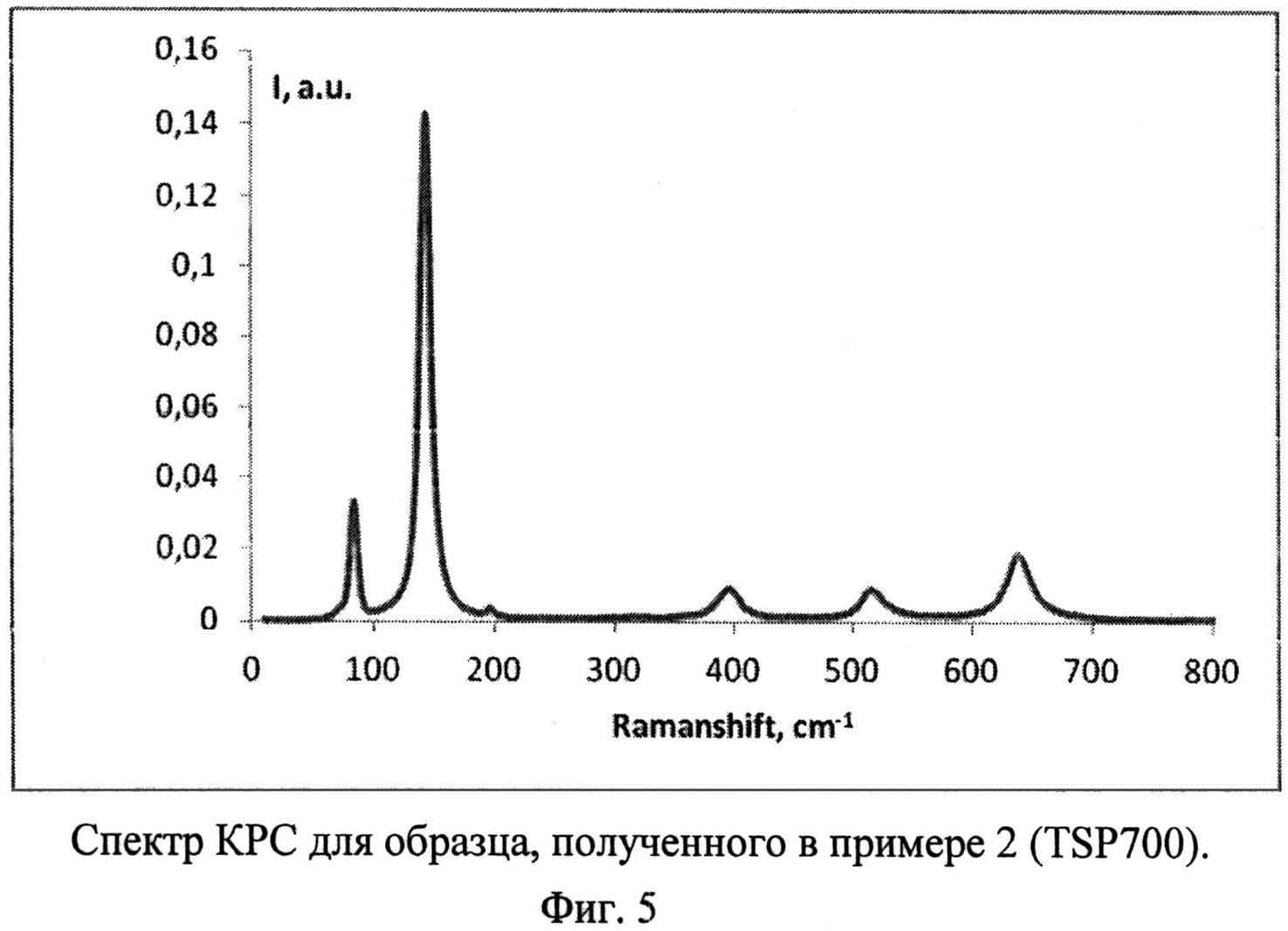
Кроме того, для определения фазового состава использовали спектроскопию комбинационного рассеяния с помощью Фурье-Раман спектрометра RFS 100/S фирмы Bruker с использованием 1060 нм линии неодимового лазера (плотность мощности излучения на образце не превышает 50 Вт/см2) со спектральным разрешением не хуже 2 см-1 (фиг.5).
Фотокаталитическую активность продуктов (образцов с наноразмерным диоксидом титана) контролировали по скорости фоторазложения в их присутствии индикатора метилового оранжевого (MeO). Реакцию проводили при перемешивании в открытом сосуде; начальная концентрация индикатора - c0=0,05 ммоль/л, массовое содержание фотокатализатора 0,4 г/л, pH≈3, объем реакционной смеси 50 мл, облучение ультрафиолетовым или видимым светом; расстояние от источника излучения до поверхности реакционной смеси 2 см, толщина слоя реакционной смеси - 1,5 см, площадь облучения 0,09 м2. Контроль концентрации MeO осуществляли по интенсивности полосы поглощения при длине волны 490-510 нм спектрофотометром Аквилон СФ 103.
Реакция фоторазложения MeO имеет псевдопервый порядок [G.Т. Brown and J.R. Darwent, J. Chem. Soc., Faraday Trans. 1 80, 1631 (1984)]. Поэтому константу скорости реакции (один из основных показателей активности фотокатализатора) вычисляли как тангенс угла наклона графика зависимости изменения концентрации субстрата от времени облучения в спрямляющих полулогарифмических координатах.
В присутствии полученных образцов происходит полное или частичное обесцвечивание раствора метилового оранжевого, что свидетельствует об их фотокаталитической активности (фиг.6-11, таблица 1). Наиболее высокую фотокаталитическую активность показали образцы с наноразмерным диоксидом титана, полученные обработкой сульфата титанила пероксидом водорода или пероксодисульфатом аммония (мольное отношение 1:1) с последующим отжигом при 800 и 700°C соответственно. При этом время отжига в случае пероксодисульфата аммония может быть сокращено до 1 мин.
Образцы, проявившие наиболее высокую фотокаталитическую активность, были также использованы для фотокаталитического разложения фунгицида пропиконазола под УФ и видимым облучением. Контроль концентрации пропиконазола осуществляли по интенсивности полосы поглощения при длине волны 219-220 нм спектрофотометром Аквилон СФ 103. Показано, что данный фунгицид разлагается до ПДК в течение 70 мин под УФ-облучением. Ниже приведены примеры получения образцов с наноразмерным диоксидом титана в различных условиях и их фотокаталитическая активность.
Пример 1.
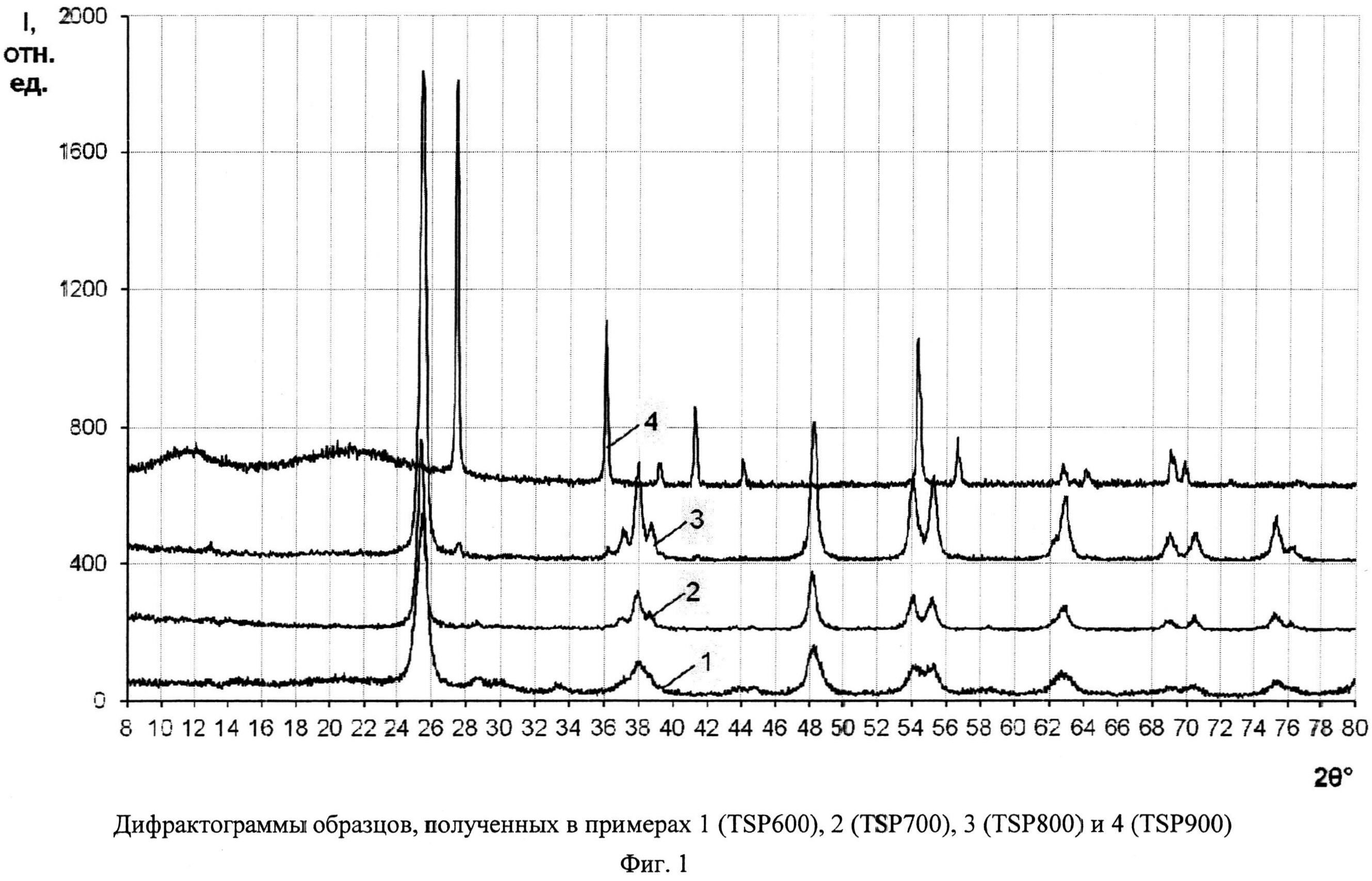
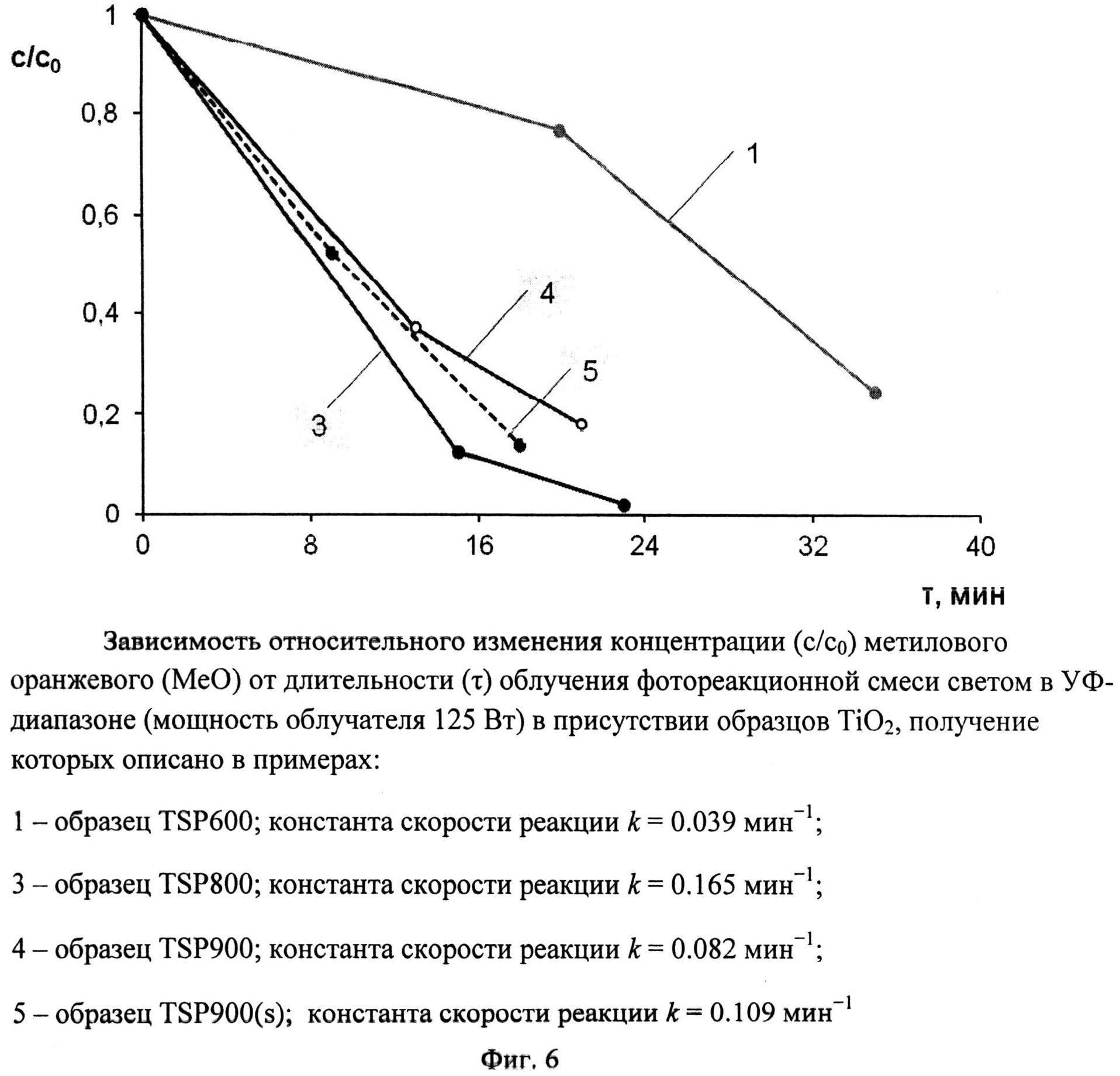
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,2 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 600°C (образец TSP 600). Дифрактограмма TSP 600 (фиг.1) показывает, что образец представляет собой анатаз (с незначительной примесью, вероятно, TinO2n-1 с n=9 и 10) со средними размерами ОКР около 12 нм. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.6) составила 0,039 мин-1.
Пример 2.
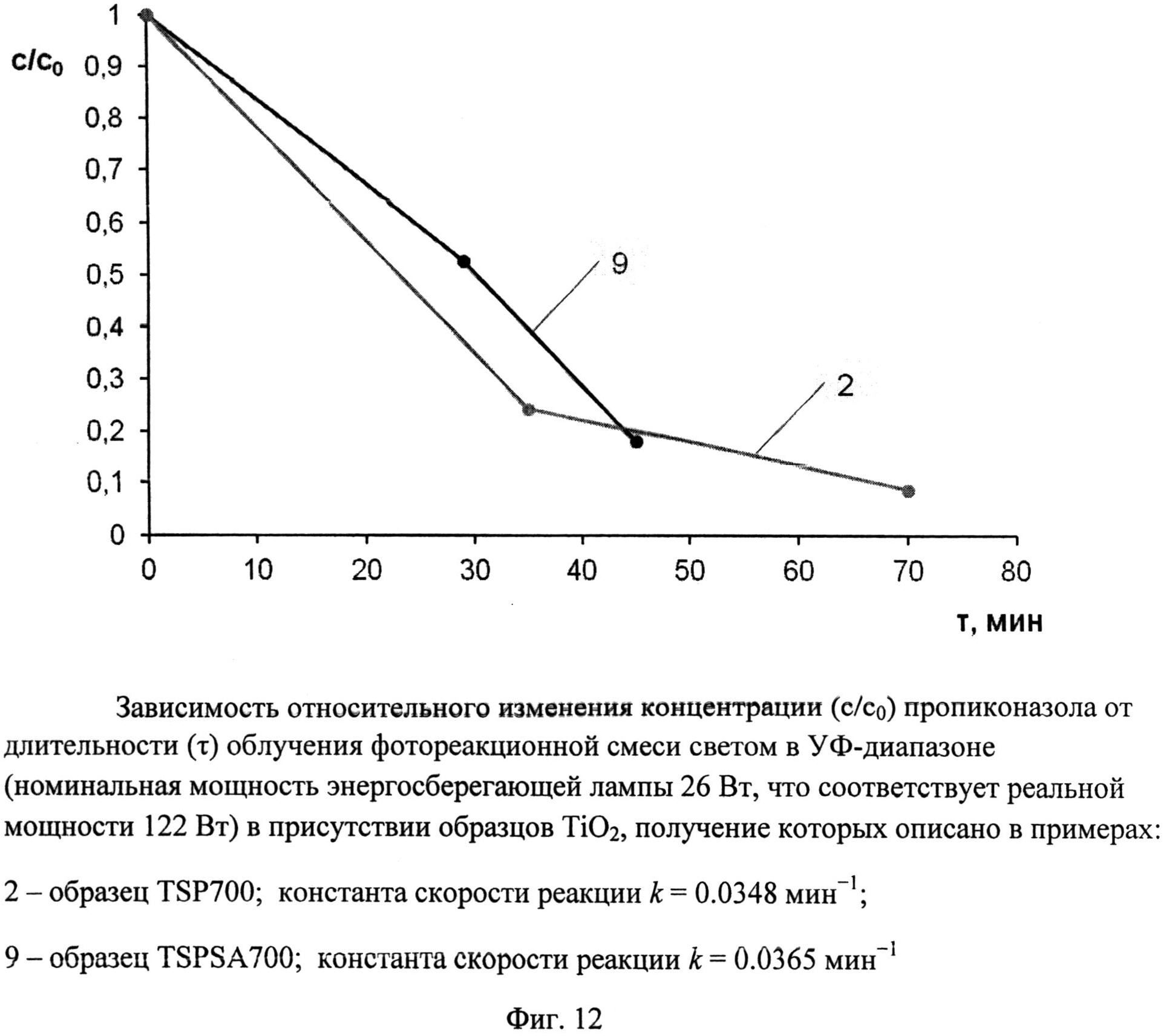
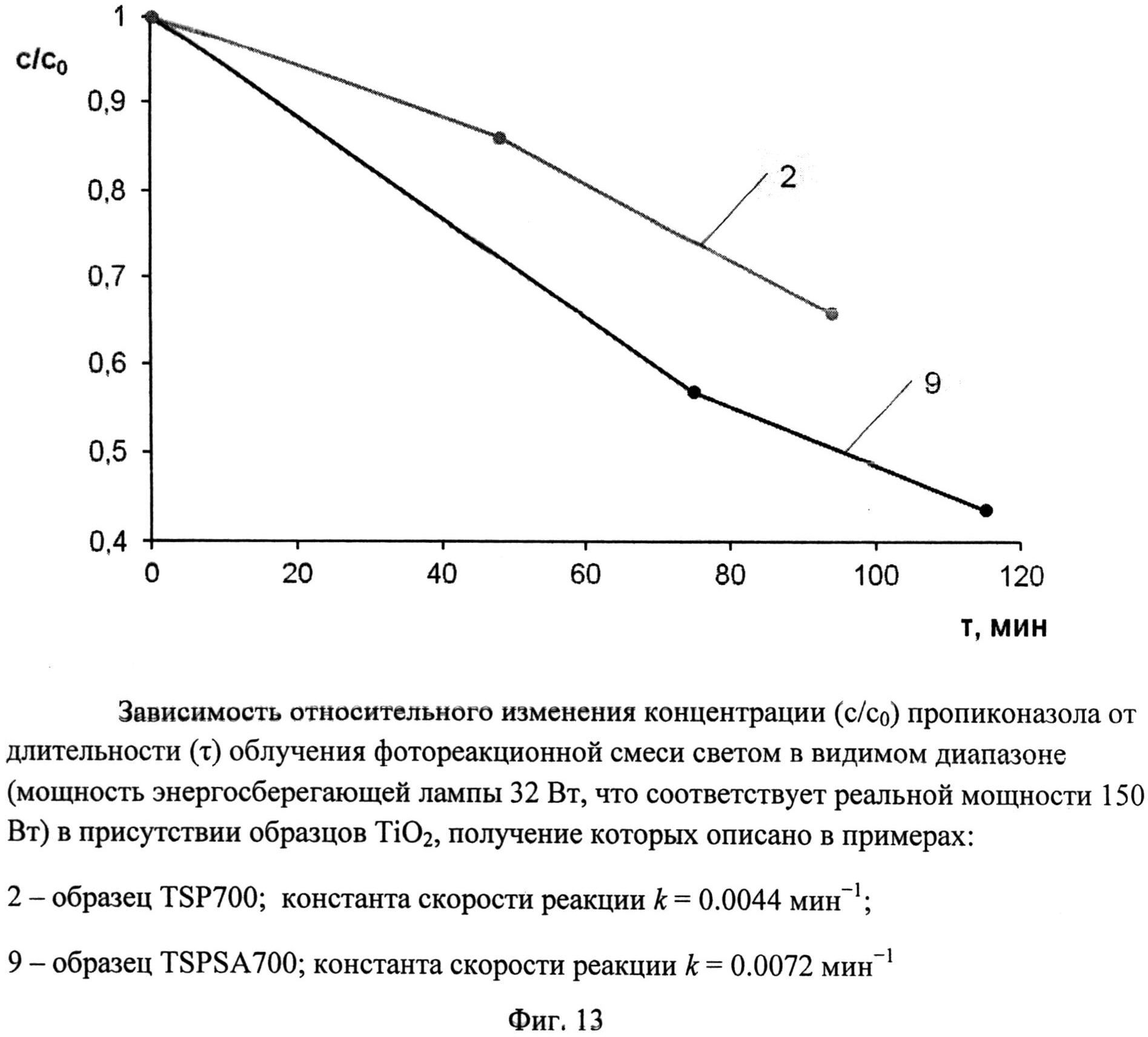
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,2 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 700°C (образец TSP 700). Дифрактограмма TSP 700 (фиг.1) показывает, что это анатаз (с незначительной примесью, вероятно, TinO2n-1 с n=9 и 10) со средними размерами ОКР около 16,5 нм. В спектре комбинационного рассеяния (фиг.5) наблюдаются полосы при 144 (точнее: 143,56) (Eg), 197 (Eg), 396 (Blg), 516 (Blg), 639 нм (Eg), характерные для анатаза. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность энергосберегающей лампы 26 Вт, что соответствует реальной мощности 122 Вт) в присутствии полученного образца (фиг.9) составила 0,018 мин-1. Константа скорости реакции фотокаталитического разложения пропиконазола под УФ-облучением (мощность энергосберегающей лампы 26 Вт, что соответствует реальной мощности 122 Вт) составила 0,035 мин-1 (фиг.12); константа скорости реакции фотокаталитического разложения пропиконазола под видимым облучением (номинальная мощность энергосберегающей лампы 32 Вт, что соответствует реальной мощности 150 Вт) составила 0,0044 мин-1 (фиг.13).
Пример 3.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,2 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 800°C (образец TSP 800). Дифрактограмма TSP 800 (фиг.1) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 97,5%, размеры ОКР около 20 нм) и рутила (содержание 2,5%, размеры ОКР около 25 нм) с небольшой примесью гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.6) составила 0,165 мин-1.
Пример 4.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,2 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 40 мин при 900°C (образец TSP 900). Дифрактограмма TSP 900 (фиг.1) показывает, что образец представляет собой рутил с размерами ОКР около 45 нм с небольшой примесью аморфного гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.6) составила 0,082 мин-1.
Пример 5.
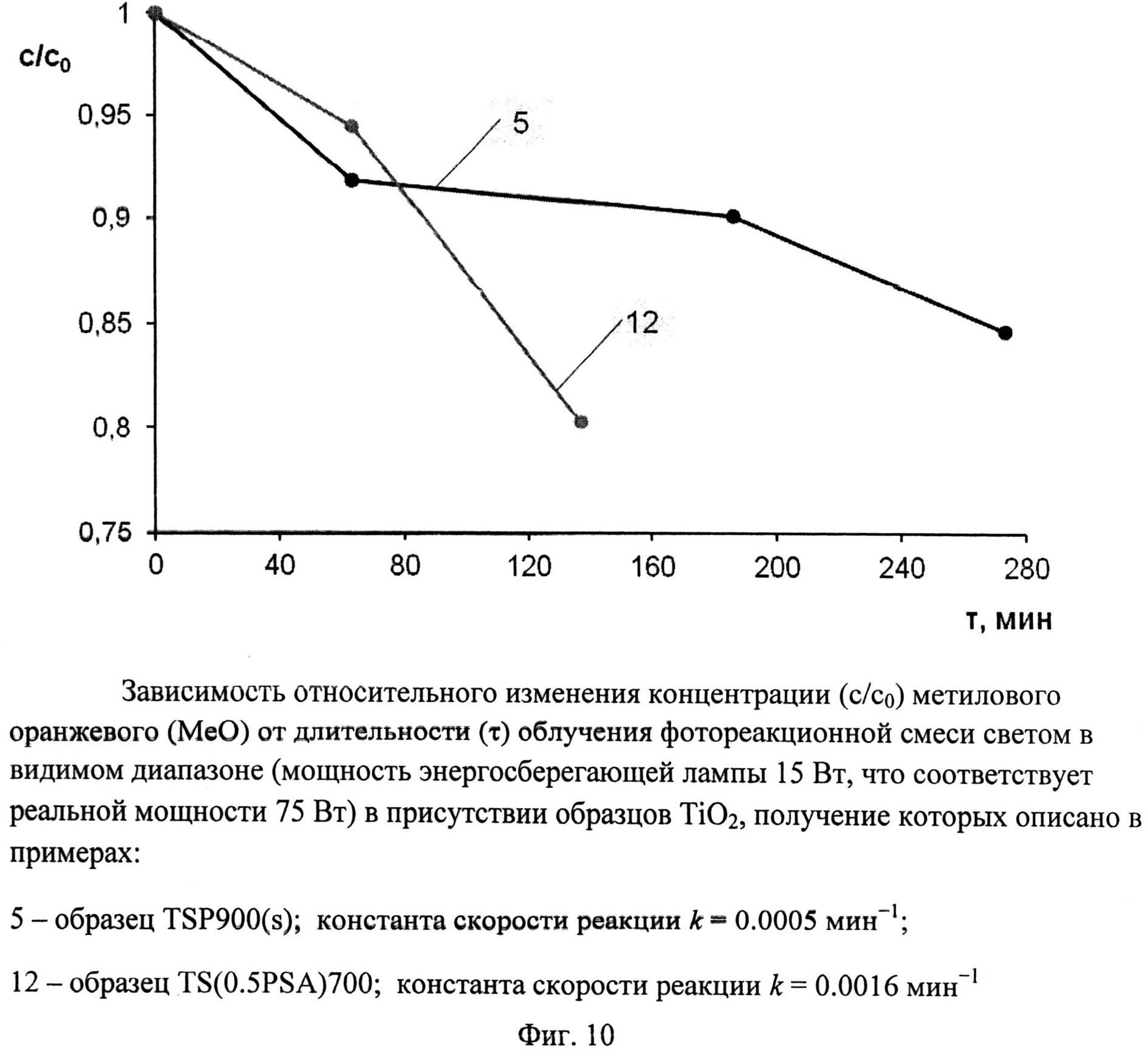
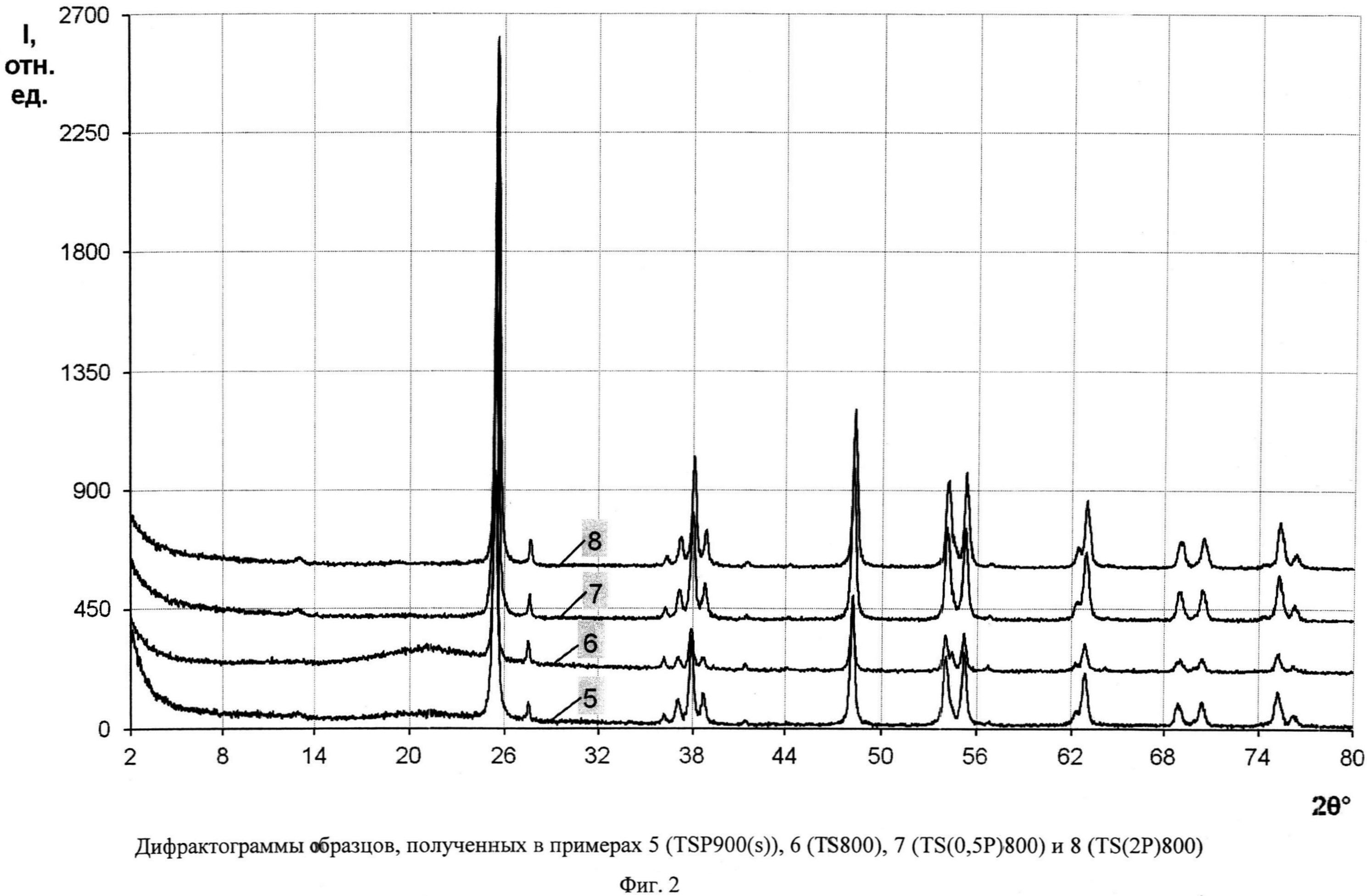
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,2 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 мин при 900°C (образец TSP 900(s)). Дифрактограмма TSP 900(s) (фиг.2) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 97%, размеры ОКР около 25 нм) и рутила (содержание 3%, размеры ОКР около 40 нм) с небольшой примесью гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца составила 0,082 мин-1 (фиг.6), а константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (номинальная мощность энергосберегающей лампы 15 Вт, что соответствует реальной мощности 75 Вт - фиг.10) составила 0,0005 мин-1.
Пример 6.
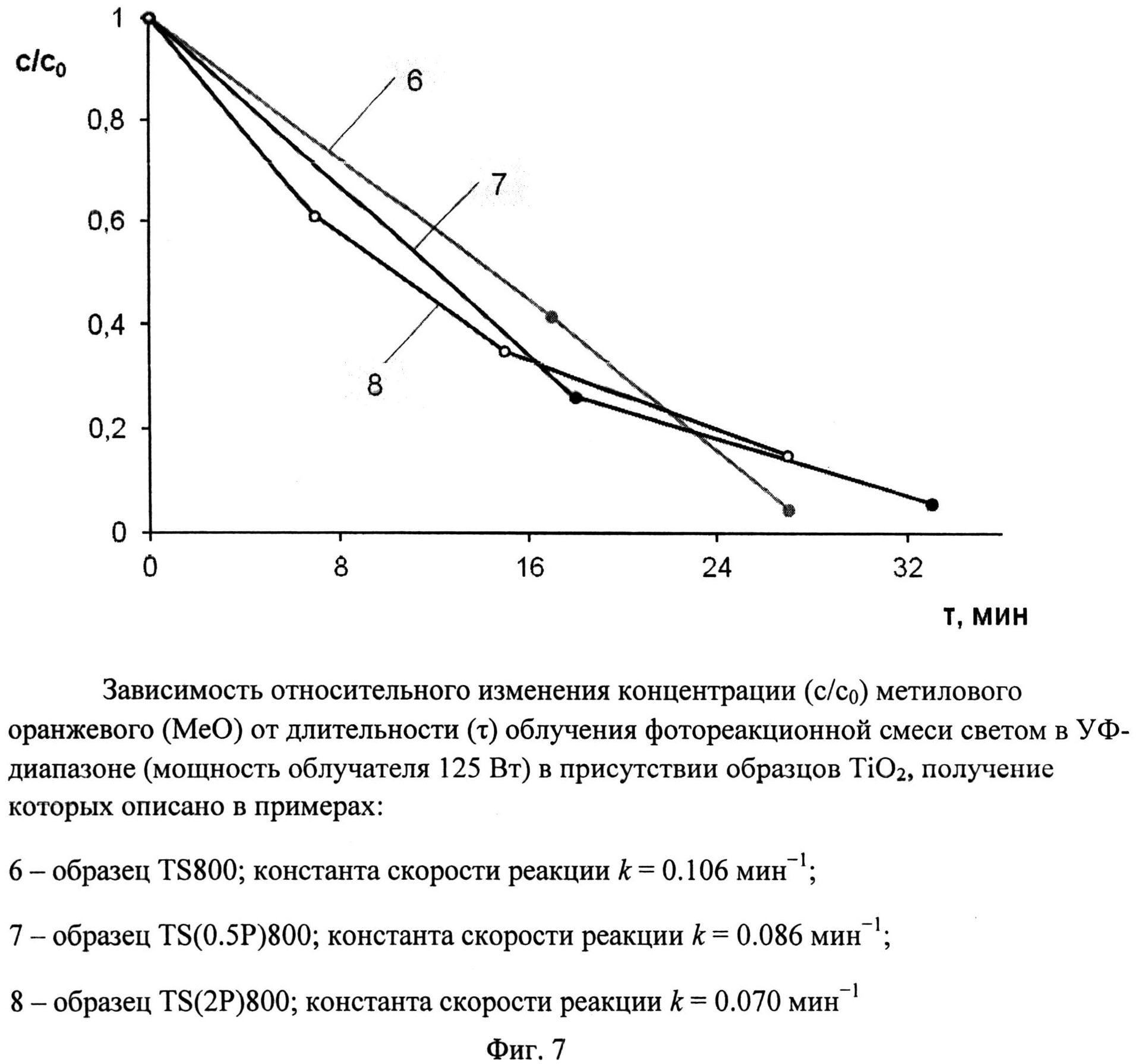
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) отожгли на воздухе в течение 1 ч при 800°C (образец TS 800). Дифрактограмма TS 800 (фиг.2) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 90,5%, размеры ОКР около 30 нм) и рутила (содержание 9.5%, размеры ОКР около 35 нм). Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.7) составила 0,106 мин-1.
Пример 7.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,1 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 800°C (образец TS(0.5P)800). Дифрактограмма TS(0.5P)800 (фиг.2) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 96,9%, размеры ОКР около 26 нм) и рутила (содержание 3,1%, размеры ОКР около 40 нм) с небольшой примесью гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.7) составила 0,086 мин-1.
Пример 8.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) обработали 0,4 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 800°C (образец TS(2P)800). Дифрактограмма TS(2P)800 (фиг.2) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 96%, размеры ОКР около 25 нм) и рутила (содержание 4%, размеры ОКР около 30 нм) с небольшой примесью гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.7) составила 0,070 мин-1.
Пример 9.
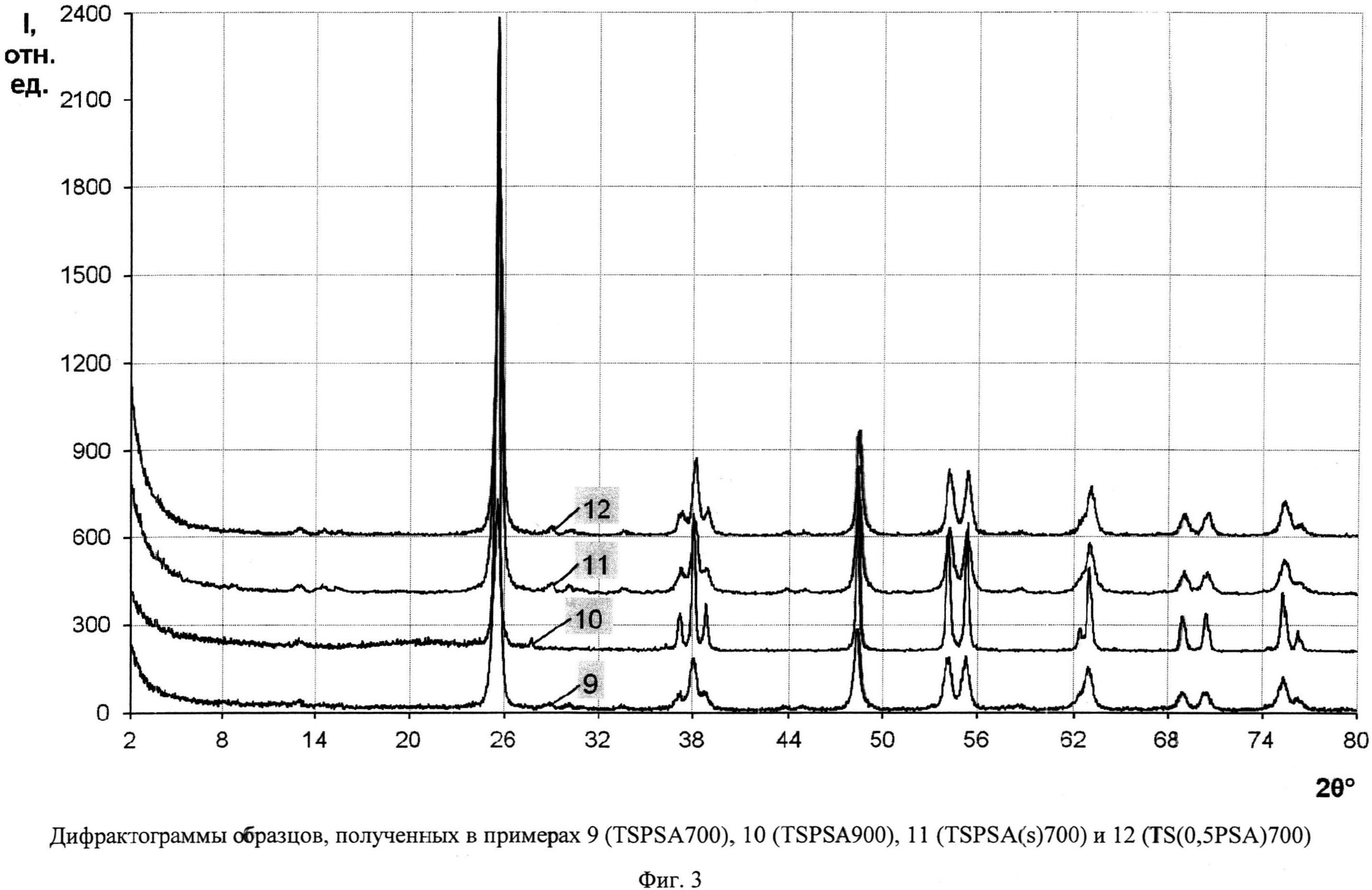
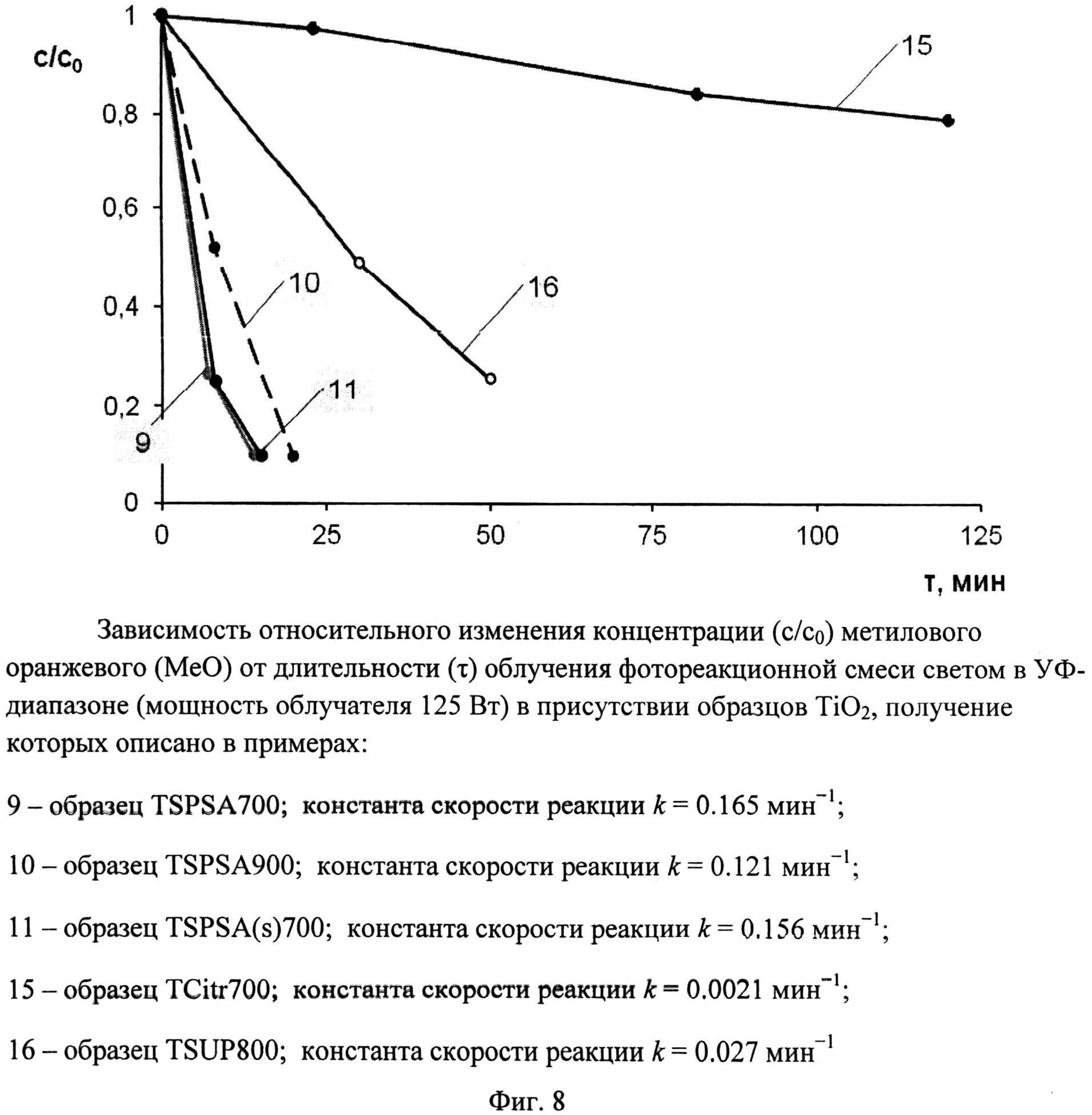
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с (NH4)2S2O6(O2) (ХЧ, ГОСТ 20478-75) (0,46 г). Продукт отожгли на воздухе в течение 20 мин при 700°C (образец TSPSA 700). Дифрактограмма TSPSA 700 (фиг.3) показывает, что образец представляет собой нанокристаллический анатаз с размерами ОКР около 15 нм с небольшой примесью гидратированного диоксида титана и вероятно, TinO2n-1 с n=9 и 10. Константа скорости реакции фотокаталитического разложения MeO в присутствии полученного образца под УФ-облучением при мощности лампы 125 Вт составила 0.165 мин-1 (фиг.8), а при мощности энергосберегающей лампы 26 Вт, что соответствует номинальной мощности 122 Вт, составила 0,0311 мин-1 (фиг.9). Константа скорости реакции фотокаталитического разложения пропиконазола под УФ-облучением (мощность энергосберегающей лампы 26 Вт, что соответствует реальной мощности 122 Вт) составила 0,037 мин-1 (фиг.12); константа скорости реакции фотокаталитического разложения пропиконазола под видимым облучением (номинальная мощность энергосберегающей лампы 32 Вт, что соответствует реальной мощности 150 Вт) составила 0,0072 мин-1 (фиг.13).
Пример 10.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с (NH4)2S2O6(O2) (ХЧ, ГОСТ 20478-75) (0,46 г). Продукт отожгли на воздухе в течение 40 мин при 900°C (образец TSPSA 900). Дифрактограмма TSPSA 900 (фиг.3) показывает, что он содержит 98,5% анатаза и 1,5% рутила со средними размерами ОКР соответственно 30 нм и 31,5 нм. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.8) составила 0,121 мин-1.
Пример 11.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с (NH4)2S2O6(O2) (ХЧ, ГОСТ 20478-75) (0,46 г). Продукт отожгли на воздухе в течение 1 мин при 700°C (образец TSPSA(s)700). Дифрактограмма TSPSA(s)700 (фиг.3) показывает, что образец представляет собой нанокристаллический анатаз с размерами ОКР около 17 нм с небольшой примесью гидратированного диоксида титана и, вероятно, TinO2n-1 с n=9 и 10. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.8) составила 0,156 мин-1.
Пример 12.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с (NH4)2S2O6(O2) (ХЧ, ГОСТ 20478-75) (0,23 г). Продукт отожгли на воздухе в течение 20 мин при 700°C (образец TS(0.5PSA)700). Дифрактограмма TS(0.5PSA)700 (фиг.3) показывает, что образец представляет собой нанокристалический анатаз с размерами ОКР около 17.5 нм с небольшой примесью гидратированного диоксида титана и, вероятно, TinO2n-1 с n=9 и 10. Константа скорости реакции фотокаталитического разложения MeO под видимым облучением (номинальная мощность энергосберегающей лампы 15 Вт, что соответствует реальной мощности 75 Вт) в присутствии полученного образца (фиг.10) составила 0.0016 мин-1.
Пример 13.
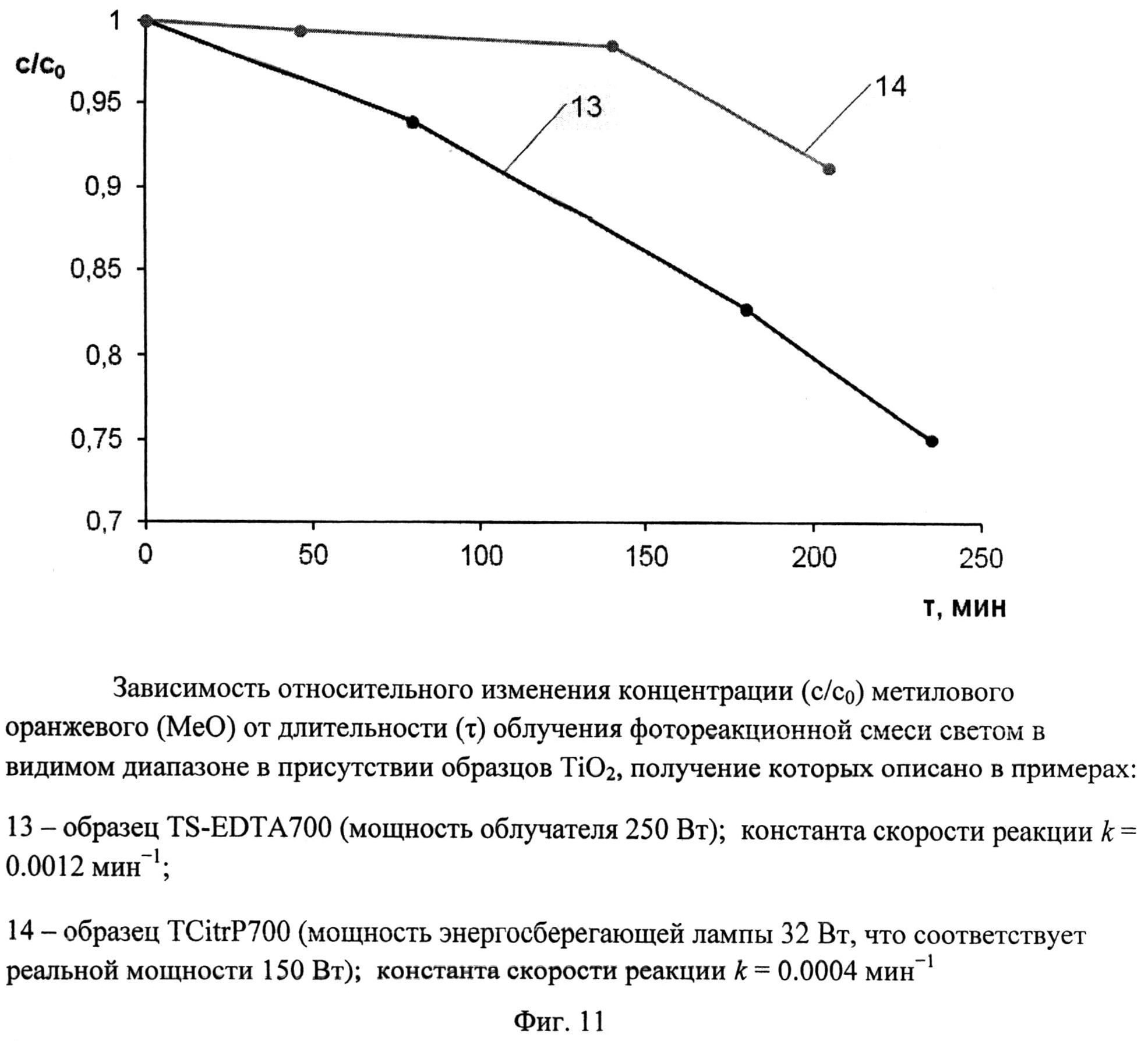
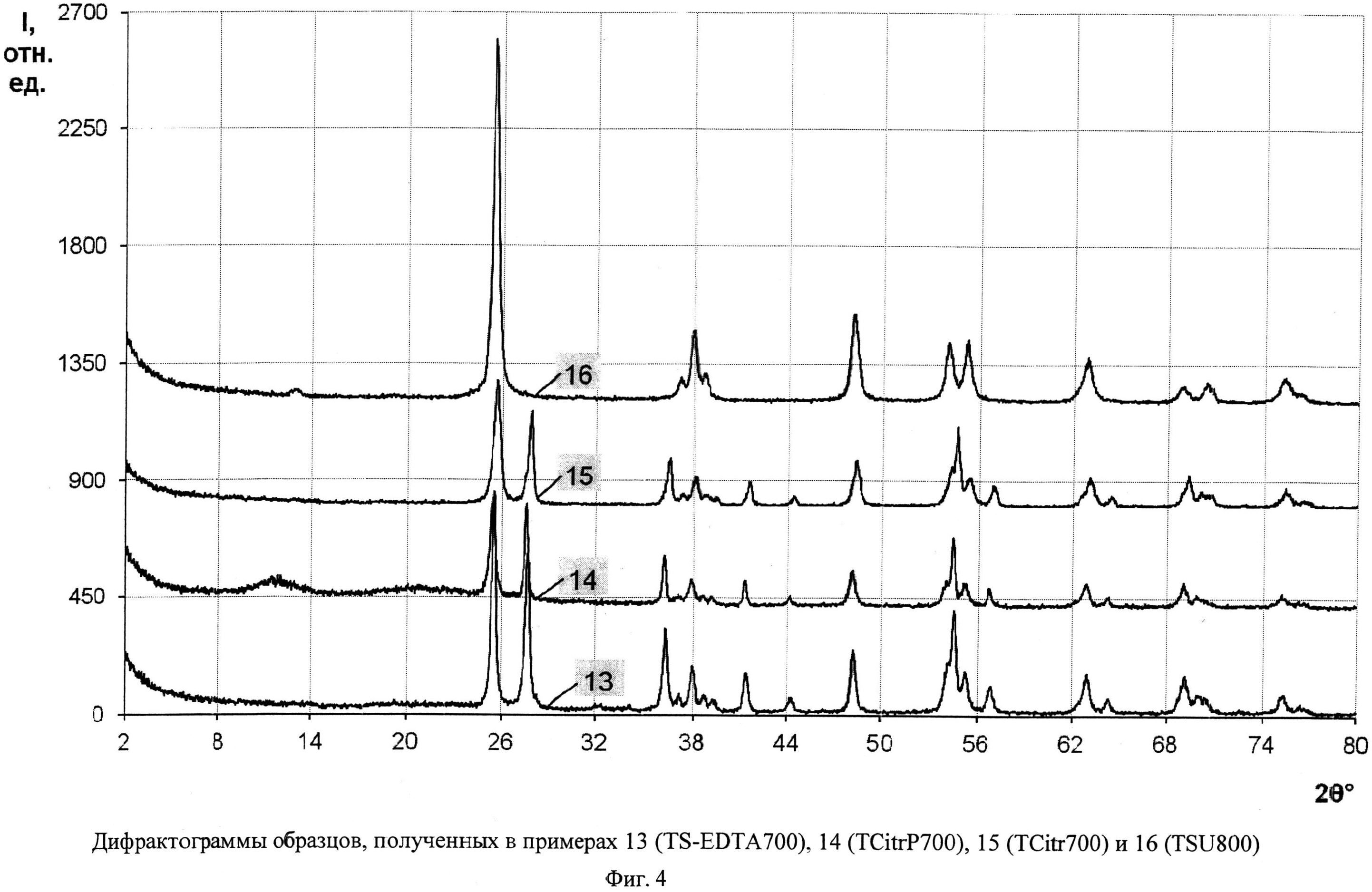
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с этилендиамитетрауксусной кислотой (получена подкислением серной кислотой 8%-ного водного раствора этилендиаминтетраацетата натрия) (0,68 г). Продукт отожгли на воздухе в течение 1 ч при 700°C (образец TS-EDTA700). Дифрактограмма TS-EDTA700 (фиг.4) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 56%, размеры ОКР около 20 нм) и рутила (содержание 44%, размеры ОКР около 20 нм). Константа скорости реакции фотокаталитического разложения MeO под видимым облучением (мощность 250 Вт) в присутствии полученного образца (фиг.11) составила 0,0012 мин-1.
Пример 14.
Порошок TiO(C6H6O7)·nH2O (Ч, ТУ 6-09-01-359-76) (0,73 г) обработали 0,4 мл 30%-ного водного раствора H2O2. Продукт отожгли на воздухе в течение 1 ч при 700°C (образец TCitrP700). Дифрактограмма TCitrP700 (фиг.4) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 63%, размеры ОКР около 17,5 нм) и рутила (содержание 37%, размеры ОКР около 30 нм) с небольшой примесью аморфного гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под видимым облучением (номинальная мощность энергосберегающей лампы 32 Вт, что соответствует реальной мощности 150 Вт) в присутствии полученного образца (фиг.11) составила 0,0004 мин-1.
Пример 15.
Порошок TiO(C6H6O7)·nH2O (Ч, ТУ 6-09-01-359-76) (0,73 г) отожгли на воздухе в течение 1 ч при 700°C (образец TCitr700). Дифрактограмма TCitr700 (фиг.4) показывает, что образец представляет собой смесь нанокристаллических анатаза (содержание 67,5%, размеры ОКР около 15 нм) и рутила (содержание 32,5%, размеры ОКР около 25 нм). Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.8) составила 0,0021 мин-1.
Пример 16.
Порошок TiOSO4·2H2O (technical, Sigma Aldrich) (0,4 г) перемешали с (NH2)2CO·H2O2 (for synthesis, Sigma Aldrich) (1 г). Продукт отожгли на воздухе в течение 1 ч при 800°C (образец TSUP 800). Дифрактограмма TSUP 800 (фиг.4) показывает, что образец представляет собой анатаз с размерами ОКР около 16,5 нм с небольшой примесью гидратированного диоксида титана. Константа скорости реакции фотокаталитического разложения MeO под УФ-облучением (мощность лампы 125 Вт) в присутствии полученного образца (фиг.8) составила 0,027 мин-1.


Фиг.1. Дифрактограммы образцов, полученных в примерах 1 (TSP 600), 2 (TSP 700), 3 (TSP 800) и 4 (TSP 900)
Фиг.2. Дифрактограммы образцов, полученных в примерах 5 (TSP 900(s)), 6 (TS 800), 7 (TS(0,5P)800) и 8 (TS(2P)800)
Фиг.3. Дифрактограммы образцов, полученных в примерах 9 (TSPSA 700), 10 (TSPSA 900), 11 (TSPSA(s)700) и 12 (TS(0,5PSA)700)
Фиг.4. Дифрактограммы образцов, полученных в примерах 13 (TS-EDTA700), 14 (TCitrP700), 15(TCitr700) и 16(TSU800)
Фиг.5. Спектр КРС для образца, полученного в примере 2 (TSP 700).
Фиг.6. Зависимость относительного изменения концентрации (c/c0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в УФ-диапазоне (мощность облучателя 125 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
1 - образец TSP 600; константа скорости реакции k=0,039 мин-1;
3 - образец TSP 800; константа скорости реакции k=0,165 мин-1;
4 - образец TSP 900; константа скорости реакции k=0,082 мин-1;
5 - образец TSP900(s); константа скорости реакции k=0,109 мин-1
Фиг.7. Зависимость относительного изменения концентрации (c/c0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в УФ-диапазоне (мощность облучателя 125 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
6 - образец TS 800; константа скорости реакции k=0,106 мин-1;
7 - образец TS(0.5P)800; константа скорости реакции k=0,086 мин-1
8 - образец TS(2P)800; константа скорости реакции k=0,070 мин-1
Фиг.8. Зависимость относительного изменения концентрации (c/c0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в Уф-диапазоне (мощность облучателя 125 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
9 - образец TSPSA 700; константа скорости реакции k=0,165 мин-1;
10 - образец TSPSA 900; константа скорости реакции k=0,121 мин-1;
11 - образец TSPSA(s)700; константа скорости реакции k=0,156 мин-1;
15 - образец TCitr 700; константа скорости реакции k=0,0021 мин-1;
16 - образец TSUP 800; константа скорости реакции k=0,027 мин-1
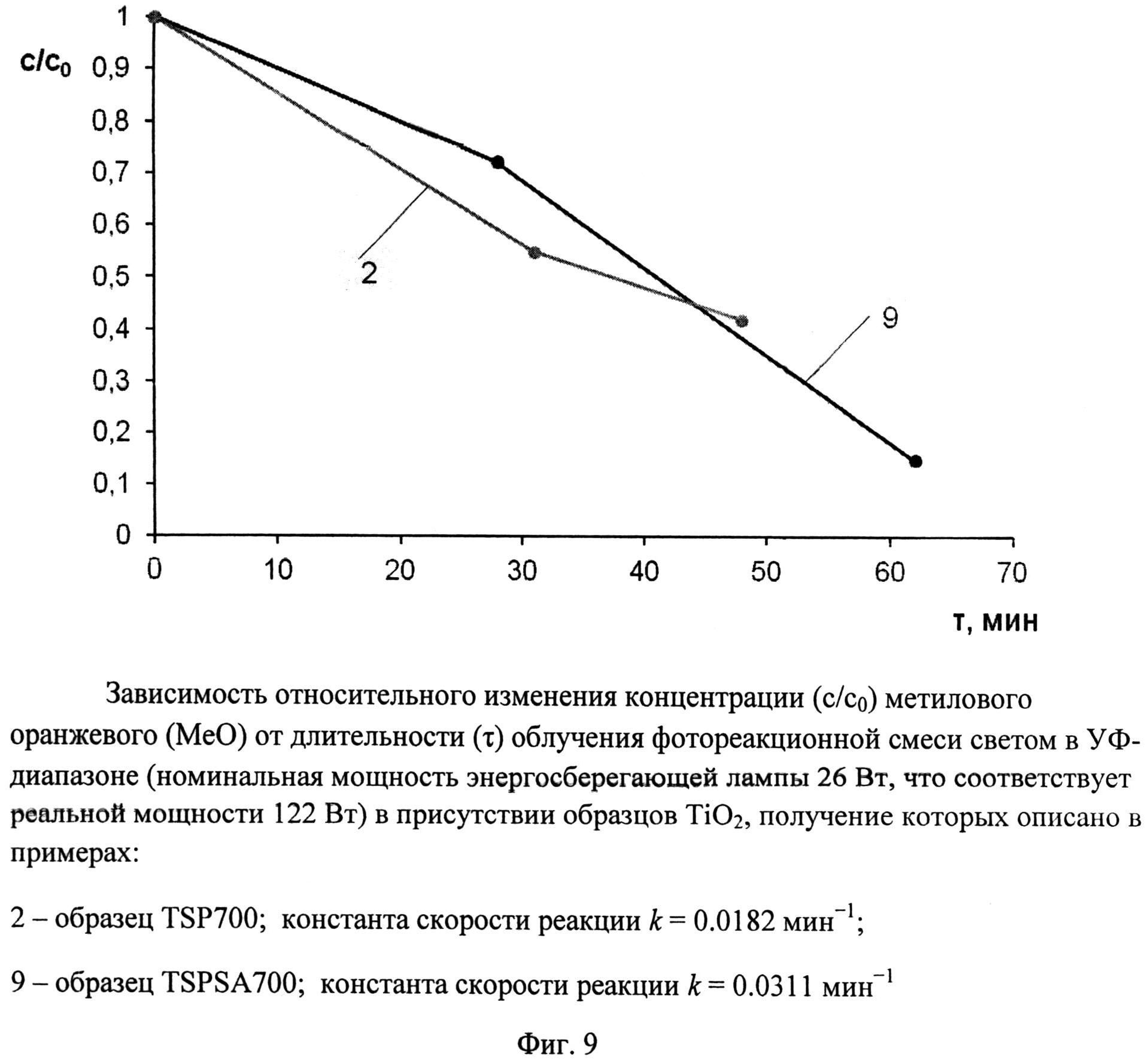
Фиг.9. Зависимость относительного изменения концентрации (с/с0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в УФ-диапазоне (номинальная мощность энергосберегающей лампы 26 Вт, что соответствует реальной мощности 122 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
2 - образец TSP 700; константа скорости реакции k=0,0182 мин-1;
9 - образец TSPSA 700; константа скорости реакции k=0,0311 мин-1
Фиг.10. Зависимость относительного изменения концентрации (c/c0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в видимом диапазоне (мощность энергосберегающей лампы 1 5 Вт, что соответствует реальной мощности 75 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
5 - образец TSP900(s); константа скорости реакции k=0,0005 мин-1;
12 - образец TS(0.5PSA)700; константа скорости реакции k==0,0016 мин-1
Фиг.11. Зависимость относительного изменения концентрации (c/c0) метилового оранжевого (MeO) от длительности (τ) облучения фотореакционной смеси светом в видимом диапазоне в присутствии образцов TiO2, получение которых описано в примерах:
13 - образец TS-EDTA 700 (мощность облучателя 250 Вт); константа скорости реакции k=0,0012 мин-1;
14 - образец TCitrP 700 (мощность энергосберегающей лампы 32 Вт, что соответствует реальной мощности 150 Вт); константа скорости реакции k=0,0004 мин-1
Фиг.12. Зависимость относительного изменения концентрации (c/c0) пропиконазола от длительности (τ) облучения фотореакционной смеси светом в УФ-диапазоне (номинальная мощность энергосберегающей лампы 26 Вт, что соответствует реальной мощности 122 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
2 - образец TSP 700; константа скорости реакции k=0,0348 мин-1;
9 - образец TSPSA 700; константа скорости реакции k=0,0365 мин-1
Фиг.13. Зависимость относительного изменения концентрации (c/c0) пропиконазола от длительности (τ) облучения фотореакционной смеси светом в видимом диапазоне (мощность энергосберегающей лампы 32 Вт, что соответствует реальной мощности 150 Вт) в присутствии образцов TiO2, получение которых описано в примерах:
2 - образец TSP 700; константа скорости реакции k=0,0044 мин-1;
9 - образец TSPSA 700; константа скорости реакции k=0,0072 мин-1