Результат интеллектуальной деятельности: СМЕСЬ НА ОСНОВЕ ФЕРМЕНТИРОВАННОЙ СОИ, СОДЕРЖАЩАЯ ИЗОФЛАВОНЫ-АГЛИКОНЫ, ЭКВОЛ И ЛУНАЗИН, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ В ПИЩЕВОЙ, МЕДИЦИНСКОЙ И КОСМЕТИЧЕСКОЙ ОБЛАСТЯХ
Вид РИД
Изобретение
Настоящее изобретение касается смеси на основе ферментированной сои, содержащей изофлавоны-агликоны, эквол и луназин, способа ее приготовления и применения в пищевой, медицинской и косметической областях.
В частности, настоящее изобретение касается смеси, содержащей изофлавоны-агликоны, такие как даидзеин, генистеин и глицитеин, вдобавок к экволу и луназину, причем упомянутая смесь основана на сое, ферментированной с помощью молочнокислых бактерий, выделенных из пищевых матриц, и использования упомянутой смеси для защиты кожи и прилежащих органов и клеток кишечника человека с особой целью предотвращать воспаление, защищать барьерные функции и лечить потерю волос.
Изофлавоны являются дифенольными соединениями, встречающимися в природе в различных растениях и, в частности, в сое. (Tsangalis et al., 2002. Enzymatic transformation of isoflavone phytoestrogens in soymilk by β-glucosidase producing bifidobacteria. Food Res. Int. Sci. 67:3104-3113). Изофлавоны из сои и пищевые продукты на основе сои относятся к 4 классам соединений: агликонам, малонил-, ацетил- и β-глюкозид-конъюгатам (Tsangalis et al., 2002. Enzymatic transformation of isoflavone phytoestrogens in soymilk by β-glucosidase producing bifidobacteria. Food Res. Int. Sci. 67:3104-3113). Более 90% полной концентрации соевых изофлавонов находится в форме производных β-глюкозидов. Ввиду исключительно гидрофобного характера и большой молекулярной массы производные β-глюкозидов не потребляются человеком. Поэтому для того чтобы быть биодоступными и соответственно метаболизироваться, упомянутые соединения должны подвергнуться гидролизу до агликонов. Гидролиз до агликонов, таких как даидзеин, генистеин и глицитеин, происходит при прохождении через кишечник в результате активности кишечной и бактериальной β-глюкозидазы. В свободной форме такие агликоны структурно аналогичны эстрогенам и имитируют функцию эстрадиола в организме человека (Setchell and Cassidi, 1999. Dietary isoflavones: biological effects and relevance to human health. J. Nutr. 131:758-767). В основном поглощение изофлавонов-агликонов связано со снижением риска гормональных патологий (Kruzer 2000. Hormon effects of soy isoflavones: studies in premenopausal and postmenopausal women. J. Nutr. 130: 660-661) и с меньшим количеством случаев остеопороза, менопауз и смертности от сердечно-сосудистых патологий и рака (Nagata et al. 1998. Decreased serum total cholesterol concentration is associated with high intake of soy products in Japanase men and women. J. Nutr. 128:209-213).
Эквол является эстрогеном нестероидной природы, принадлежащим к классу изофлавонов. У людей основным источником эквола являются продукты из сои, представляющие наиболее распространенный резерв даиздеина и его непосредственного предшественника агликона даиздеина (Axelson et al., 1984. Soya a dietary source of the nonsteroidal oestrogen equol in man and animals. J. Endocrinol. 102:49-56). В отличие от других изофлавонов-агликонов только эквол имеет центральное хиральное ядро вследствие отсутствия двойной связи в гетерогенном кольце (Setchell et al., 2002. The clinical importance of the metabolite equol a clue to the effectiveness of soy and its isoflavones. Am. Soc. Nutr. Sci. 125: 3577-3583). Вообще говоря, эквол легко проходит через стенку кишечника и является метаболически инертным (Setchell et al., 2002. The clinical importance of the metabolite equol a clue to the effectiveness of soy and its isoflavones. Am. Soc. Nutr. Sci. 125: 3577-3583). По сравнению со своим предшественником даиздеином эквол демонстрирует интересный набор: более высокая эстрогенная активность (Muthyala et al., 2004. Equol, a natural estrogenic metabolita from soy isoflavones: convenient preparation and resolution of R- and S-equols and their differing binding and biological activity through estrogen receptors alpha and beta. Bioorg. Med. Chem. 12:1559-1567), антиоксидантная активность (Mitchell et al, 1998. Antioxidant efficacy of phytoestrogens in chemical and biological model systems. Arch. Biochem. Biophys. 360:142-148) и антиандрогенная активность (Lund et al., 2004. Equol is a novel anti-androgen that inhibits prostate growth and hormone feedback. Bio. Reprod. 70:1188-1195).
Изофлавоновый метаболизм сои у человека широко изучен (Axelson et al., 1984. Soya a dietary source of the non-steroidal oestrogen equol in man and animals. J. Endocrinol. 102:49-56; Bannwart et al., 1984. Identification of o-desmethylangolensin, a metabolita of daidzein and of matairesinol, one likely plant precursor of the animal lignan enterolactone in human urine. Finn. Chem. Lett. 5:120-125). Способность метаболизировать гликозиды изофлавоны до агликонов и агликоны до эквола в способе прохождения через кишечник наблюдается только у 30-50% населения западных стран (Frankefeld, et al. 2005. High concordance of daidzein-metabilizing phenotypes in individuals measured 1 to 3 years apart. Brit. J. Nutr. 94:873-876). Для повышения биодоступности изофлавонов из сои могут применяться две основные стратегии: обогащение агликоном и экволом перед приемом или изменение кишечной микробиоты путем проглатывания жизнеспособных и живых бактерий, способных синтезировать in situ такие соединения (Tsangalis et al., 2004. Development о fan isoflavone aglycone-enriched soymilk using soy germ, soy protein isolate and bifidobacteria. Food Res. Intern. 37:301-312). Различные исследования (Chun et al., 2007. Conversion of isoflavone glucoside to aglycones in soymilk by fermentation with lactic acid bacteria. J. Food Sci. 72:39-44; Donkor and Shah 2008. Production of β-glucosidase and hydrolysis of isoflavone phytoestrogens by Lactobacillus acidophilus, Bifidobacterium lactis and Lactobacillus casei in soymilk. J. Food Sci. 73:15-20; Pham and Shah 2007. Biotransformation of isoflavone glycosides by Bifidobacterium animalis in soymilk supplemented with skim milk powder. J. Food Sci. 72:316-324; Tsangalis et al., 2002; Tsangalis et al., 2004; Wei et al., 2007. Using Lactobacillus and Bifidobacterium to product the isoflavone algycones in fermented soymilk. Int. J. Food Microbiol. 117:120-124) были посвящены использованию бифидобактерий и молочнокислых бактерий для превращения гликозидов изофлавонов в агликоны и/или эквол в способе ферментирования соевого молока. Однако в этих исследованиях имеются некоторые ограничения: (i) рассмотрено очень ограниченное число биотипов/штаммов бактерий; (ii) источником бактерий, использованных для способов ферментации, является исключительно фекальный материал человека; (iii) рассмотрено очень небольшое число субстратов ферментации и ни один из них не включает соевую органическую муку; (iv) препараты основаны исключительно на изофлавоне / агликонах или экволе, и в случае образования эквола максимальная концентрация составляет 0,521 мг/100 мл (Tsangalis et al., 2002. Enzymatic transformation of isoflavone phytoestrogens in soymilk by β-glucosidase producing bifidobacteria. Food Res. Int. Sci. 67:3104-3113); (v) не было исследований, посвященных тестированию биологической эффективности препаратов, в частности, для защиты кожи и (vi) не было исследований, посвященных разработке препарата, содержащего изофлавоны-агликоны, эквол и луназин.
Луназин - биоактивный пептид (43 аминокислотных остатка с молекулярным весом приблизительно 5400 Da), идентифицированный впервые в сое (Galvez et al., 2001. Chemopreventive property of a soybean peptide (Lunasin) that binds to deacetylated histones and inhibits acetylation. Cancer Res. 61:7473-7478) и успешно найденный также в ячмене. (Jeong et al. 2002. Barley lunasin suppresses ras-induced colony formation and inhibits core histone acetylation in mammalian cells. J. Agric. Food Chem. 50:5903-5908), пшенице (Jeong et al. 2007. The cancer preventive peptide lunasin from wheat inhibits core histone acetylation. Cancer Lett. 255:42-48), и амаранте (Silva-Sanchez et al., 2008. Bioactive peptides in amaranth (Amaranthus hypochondriacus) seed. J. Agric. Food Chem. 56:1233-1240). Концентрация луназина в сое может изменяться в зависимости от сорта, культуральной педоклиматической атмосферы и от технологических способов, которым подвергались зерна после сбора. Очень высокая концентрация луназина была найдена в сорте Loda (приблизительно 11 мг/г), в то время как в других разновидностях сои (например, Imari) содержание луназина не превышает 5-6 мг/г (Wang et al. 2008. Analysis of soybean protein derived peptides and the effect of cultivar, environmental conditions, and processing of lunasin concentration in soybean and soy products. J. AOAC Intern. 91:936-944). Луназин содержит 9 остатков аспарагиновой кислоты на С-конце полипептидной цепи. Этот состав способствует повышенному сродству к участкам с гипоацетилированным хроматином, с которыми пептид может связываться, ингибируя таким образом динамику ацетилирования-деацетилирования и действуя поэтому как суппрессор опухоли при канцерогенезе. Сообщалось также, что луназин может предотвращать явления канцерогенеза благодаря ингибированию клеточной пролиферации, индуцированному геном ras, и ингибированию ацетилирования гистона Н3 (Jeong et al., 2003. Characterization of lunasin isolated from soybean. J Agric Food Chem. 51: 7901-7906). Из литературных данных следует, что вплоть до настоящего времени не рассматривались исследования обогащения луназином производных сои путем способов ферментации с помощью молочнокислых бактерий.
На основе изложенных выше соображений возникают некоторые моменты заметно инновационного характера: (i) использовать субстраты на основе сои, возможно, органического происхождения; (ii) использовать молочнокислые бактерии, выделенные из пищевых матриксов, а не фекального происхождения; (iii) оптимизировать биотехнологический способ, способствующий созданию препарата, содержащего большее количество функциональных молекул, таких как изофлавоны-агликоны, эквлол и луназин; (iv) с помощью исследований in vitro и ex vivo продемонстрировать влияние результирующего препарата на защиту клеток кожи и кишечника человека с особенным учетом ингибирования воспалительного состояния и сохранения барьерной функции.
В настоящее время авторы данного изобретения разработали новый способ для создания смеси на основе ферментированной сои, обогащенной изофлавонами, агликонами, экволом и луназином. Смесь по данному изобретению получена путем ферментации сои с помощью определенной смеси молочнокислых бактерий, получаемых из пищевых матриксов, а не из фекалий. Благодаря высокому содержанию изофлавина-агликона, эквола и луназина, особенно луназина, смесь по настоящему изобретению демонстрирует особенную эффективность в отношении защиты клеток кожи и кишечника от воспалительного состояния и сохранения барьерной функции.
Авторы данного изобретения установили, что: (i) отбор 103 выделенных молочнокислых бактерий, полученных исключительно из пищевых матриксов в соответствии с β-глюкозидазной активностью при действии на р-нитрофенил-β-D-глюкопиранозид (pNPG), позволил выбрать 4 штамма молочнокислых бактерий, а именно: L. plantarum DPPMA24W (выделенный из DSMZ 8 July 2010 DSM, номер 23756) и DPPMASL33 (выделенный из DSMZ 8 July 2010 DSM, номер 23755), L. fermentum DPPMA114 (выделенный из DSMZ 8 July 2010 DSM, номер 23757) и L. rhamnosus DPPMAAZ1 (выделенный из DSMZ 8 July 2010 DSM, номер 23758), чтобы использовать их как смешанный стартер для ферментации субстратов на основе соевой муки; (ii) использование 14 различных субстратов на основе сои позволило выбрать в качестве оптимального препарат на основе соевой муки для ферментации с помощью смешанного стартера; (iii) оптимизация способа ферментации субстрата органической соевой муки позволила разработать препарат, содержащий 1,45 мг/100 мл (57,0 мкМ) даидезина, 3,9 мг/100 мл (140,3 мкМ) генистеина, 0,58 мг/100 мл (20,4 мкМ) глицитеина, 0,9 мг/100 мл (37.3 мкМ) эквола и 8,4 мг/100 мл луназина; (iv) препарат, основанный на вышеупомянутых функциональных соединениях, оказывает защитное действие на кожный эпидермис и положительный эффект на ингибирование воспалительного состояния и барьерные функции клеток кишечника.
Молочнокислые бактерии по данному изобретению принадлежат к видам Lactobacillus и выделены из природных дрожжей, применяемых для хлебопечения в Центральной и Южной Италии, и из выдержанных сыров "pasta filata" типа Pecorino из области Puglia. Как правило, молочнокислые бактерии, выделенные из таких пищевых матриксов, обнаруживают свойства адаптироваться к метаболизму и среде, не слишком отличающимся от свойств микроорганизмов, населяющих желудочно-кишечный тракт людей и животных. Были выделены и использованы L. plantarum DPPMA24W (выделенные из DSMZ 8 июля 2010 DSM, номер 23756) и L. plantarum DPPMASL33 (выделенные из DSMZ 8 июля 2010 DSM, номер 23755), L. fermentum DPPMA114 (выделенные из DSMZ 8 июля 2010 DSM, номер 23757) и L. rhamnosus DPPMAAZ1 (выделенные из DSMZ 8 июля 2010 DSM, номер 23758).
Был стандартизирован и оптимизирован биотехнологический протокол, включающий ферментацию четырех различных субстратов на основе соевой муки, с помощью упомянутых четырех видов молочнокислых бактерий, предпочтительно органического происхождения в течение 48-96 часов при 30-37°C. В конце способа ферментации клетки можно удалять или не удалять из культуральной среды путем центрифугирования и подвергать супернатант способу дегидратации с помощью высушивания или лиофильного высушивания.
Ниже описан биотехнологический протокол для ферментации органического препарата на основе сои.
Культивирование выбранных 4 культур молочнокислых бактерий при 30°C в течение 24 часов, промывание, суспензирование при плотности 9,0 log КОЕ/мл и инокулум (1-4%) соевого молока (различные виды соевой муки, предпочтительно, органической сои)
В результате ферментации различных препаратов из соевого молока было синтезировано от 3,9 до 57,0 мкМ даидзеина, от 7,8 до 140,3 мкМ генистеина, 6,7-20,4 мкМ глицитеина, 7,6-37,3 мкМ эквола и около 8,4 мг/100 мл луназина. Верхние границы приведенных выше концентраций относятся к ферментации соевого молока, полученного из органической соевой муки. Согласно одной из возможных рецептур использование ферментированных продуктов из органической сои приводит к следующим последствиям: (i) оно защищает эпидермис и повышает его барьерные функции; (ii) ингибирует воспалительное состояние клеток Сасо-2/ТС7, вызванное индукцией γ-интерфероном (IFN-γ) и липополисахаридом (LPS); (iii) стимулирует барьерные функции, как показано с помощью теста Трансэпителиального Электрического Сопротивления (TEER); и (iv) ингибирует синтез интерлейкина-8 (IL-8).
Как показано с помощью комплементарного анализа методом микробиологической хроматографической техники и исследования клеточных культур in vitro и ex vivo, ферментация органической соевой муки с помощью смешанной закваски, состоящей из видов молочнокислых бактерий, выделенных из пищевых матриксов и не использованных в предыдущих исследованиях, по настоящему изобретению позволяет: (i) призвести одновременный синтез агликонов, эквола и луназина, не обнаруженных в предыдущих исследованиях, и (ii) оказать защитный эффект от воспалительного состояния, повышения барьерной функции эпидермиса и клеток кишечника человека.
Таким образом, специфическая цель данного изобретения - способ приготовления ферментированной смеси на основе сои, содержащей изофлавоны-агликоны, эквол и луназин путем ферментации сои с помощью смеси следующих четырех видов молочнокислых бактерий: Lactobacillus plantarum DSM 23755, Lactobacillus plantarum DSM 23756, Lactobacillus fermentum DSM 23757 и Lactobacillus rhamnosus DSM 23758. Смесь, полученная согласно способу изобретения, - это смесь, обогащенная изофлавонами-агликонами, луназином, экволом, содержащая большее процентное содержание этих соединений по сравнению с известными смесями с помощью способов с использованием молочнокислых бактерий, отличающихся от используемых в настоящем изобретении.
Способ по данному изобретению включает или состоит из следующих этапов:
а) культивирование упомянутых четырех видов Lactobacillus plantarum DSM 23755, Lactobacillus plantarum DSM 23756, Lactobacillus fermentum DSM 23757 и Lactobacillus rhamnosus DSM 23758 молочнокислых бактерий;
b) инокуляция основанных на сое субстратов водной суспензией упомянутых молочнокислых бактерий; предпочтительно субстраты инокулируют водной суспензией молочнокислых бактерий в количестве от 1 до 4% полного объема субстрата, причем упомянутая водная суспензия имеет плотность клеток приблизительно log 9,0 КОЕ/мл для каждого биотипа;
c) инкубация при 30-37°C, предпочтительно, при 30°C в течение 48-96 час, предпочтительно 96 час.
Пригодные для использования субстраты на основе сои - это, например, соевая мука, предпочтительно органическая соевая мука, соевое молоко и другие коммерческие продукты, описанные в настоящей заявке.
Способ по настоящему изобретению может, кроме того, включать этап d) центрифугирования культуральной среды для отделения клеток от молочнокислых бактерий. В частности, центрифугирование культуральной среды может выполняться при 10000×g в течение 15 мин при 4°C.
Способ по настоящему изобретению может, кроме того, включать этап е) дегидратации супернатанта, полученного на этапе d), путем высушивания или диофильного высушивания. Согласно одному из воплощений можно пропустить этап d), и препарат может содержать жизнеспособные, живые молочнокислые бактерии. Приготовление композиции может включать в конце способа дегидратации добавление подходящего наполнителя для приготовления форм, пригодных для орального или местного применения в зависимости от обстоятельств.
Дополнительный объект настоящего изобретения - смесь, содержащая изофлавоны-агликоны, эквол и луназин, основанная на ферментированной сое, полученной в соответствии с описанным выше способом без этапа d) удаления молочнокислых бактерий. Упомянутая смесь, таким образом, содержит вышеупомянутые молочнокислые бактерии по настоящему изобретению. Как сообщено выше, смесь по изобретению являются смесью, обогащенной изофлавонами-агликонами, экволом и луназином, которые она содержит при более высоком процентном содержании, чем известные смеси, полученные с помощью молочнокислых бактерий, отличающихся от бактерий по настоящему изобретению.
Настоящее изобретение, кроме того, касается фармацевтической или косметической композиции, включающей или состоящей из смеси, определенной ранее, вместе с одним или несколькими фармацевтически или косметически приемлемыми наполнителями и/или адъювантами.
Согласно следующему воплощению смесь по данному изобретению может быть использована как пищевой интегратор. Например, смесь могла бы быть использована для традиционных пищевых продуктов, например выпечки или макаронных продуктов.
Кроме того, смесь или композицию по данному изобретению можно использовать для лечения нарушений или заболеваний кожи или кишечника. В частности, упомянутая смесь или композиция может использоваться против изменения барьерной функции кожи, например для предотвращения или лечения чувствительной кожи, сухой кожи, псориаза, атопических дерматитов, себоррейных дерматитов, перхоти, воспалительных дерматозов, язв, акне, старения кожи. Кроме того, смесь или композиция по данному изобретению может применяться в случае модификации функции кишечного барьера, например для лечения или предотвращения желудочных заболеваний, пищевой непереносимости, болезни Крона.
Смесь или композиция по данному изобретению может применяться для косметических целей, например для лечения потери волос или в медицине для лечения алопеции или диффузного облысения (telogen defluvium).
В частности, смесь или композицию по данному изобретению можно вводить локально, например в форме кремов, лосьонов, паст, мазей, гелей, растворов, эмульсий суспензий или системно, например орально, например в виде капель, жевательных таблеток, пилюль, пакетиков и т.д.
Кроме того, несомненно, что смесь, полученная по данному изобретению, включающему этап d -) удаление молочнокислых бактерий, или содержащая его фармацевтическая или косметическая композиция может быть выгодно использована для описанных выше показаний, поскольку она содержит изофлавоны-агликоны, эквол и луназин в больших концентрациях, чем известные смеси, полученные с помощью обработки молочнокислыми бактериями, иными, чем в данном изобретении.
Кроме того, смесь следующих четырех видов молочнокислых бактерий: Lactobacillus plantarum DSM 23755, Lactobacillus plantarum DSM 23756, Lactobacillus fermentum DSM 23757 и Lactobacillus rhamnosus DSM 23758 - это предмет настоящего изобретения. Наконец, Lactobacillus plantarum DSM 23755 или Lactobacillus plantarum DSM 23756 или Lactobacillus fermentum DSM 23757 или Lactobacillus rhamnosus DSM 23758 - это предмет настоящего изобретения.
Описание настоящего изобретения иллюстративно, но не является ограничивающим, будучи таким образом предпочтительными воплощениями со специальными ссылками на вложенные фигуры.
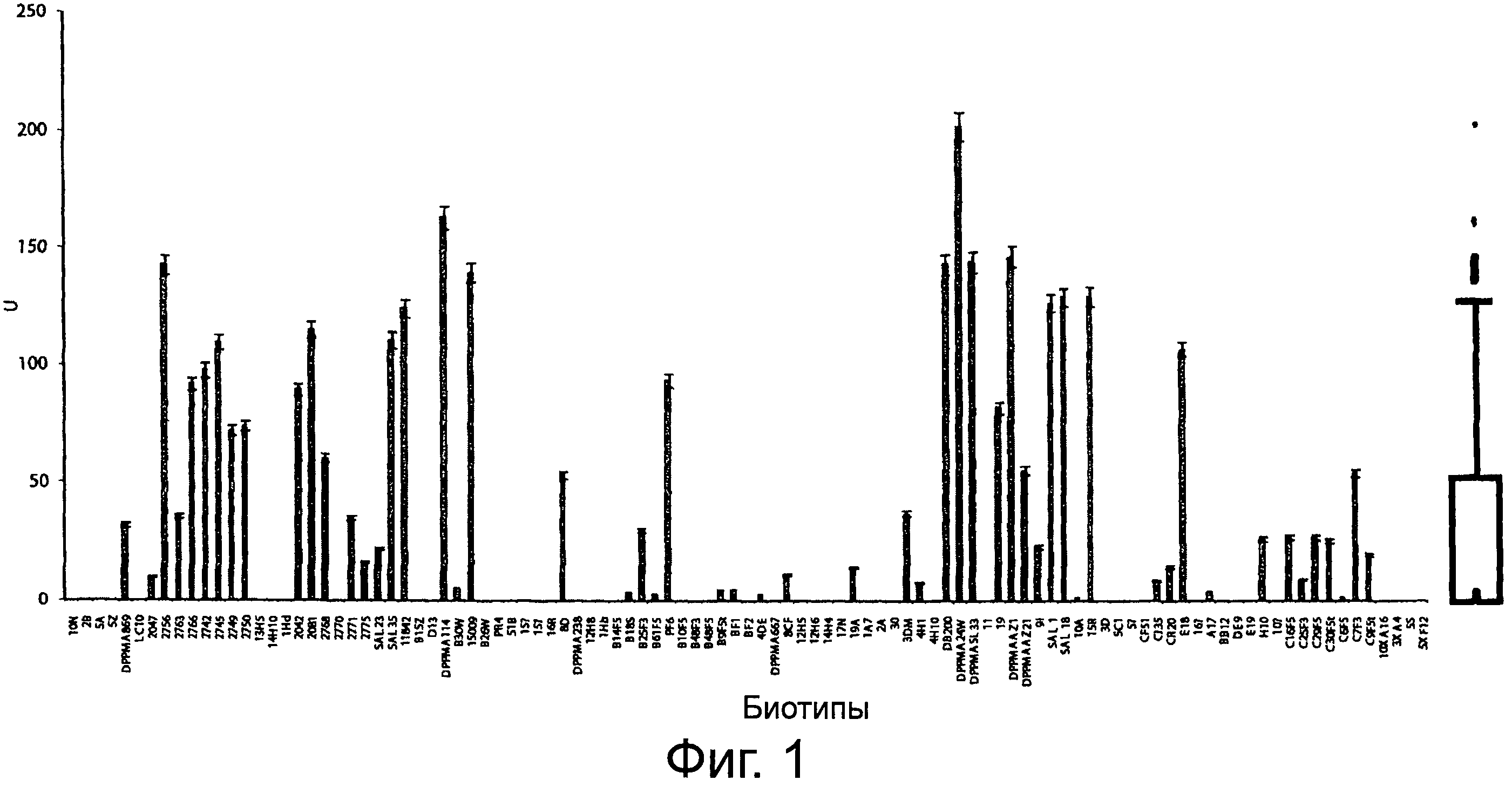
Фигура 1 демонстрирует β-глюкозидазную активность 103 биотипов молочнокислых бактерий, относящихся к различным видам на pNPG синтетическом субстрате. Все молочнокислые бактерии, использованные в исследовании, были предварительно выделены абсолютно новаторским методом только из пищевых матриксов. Биотипы молочнокислых бактерий обозначены кодом, чтобы идентифицировать их соответствие видам, см. описание протокола в тексте (Пример 1). Приведенные данные - средние из трех трижды повторенных экспериментов. Приведена статистическая обработка с помощью коробчатой диаграммы.
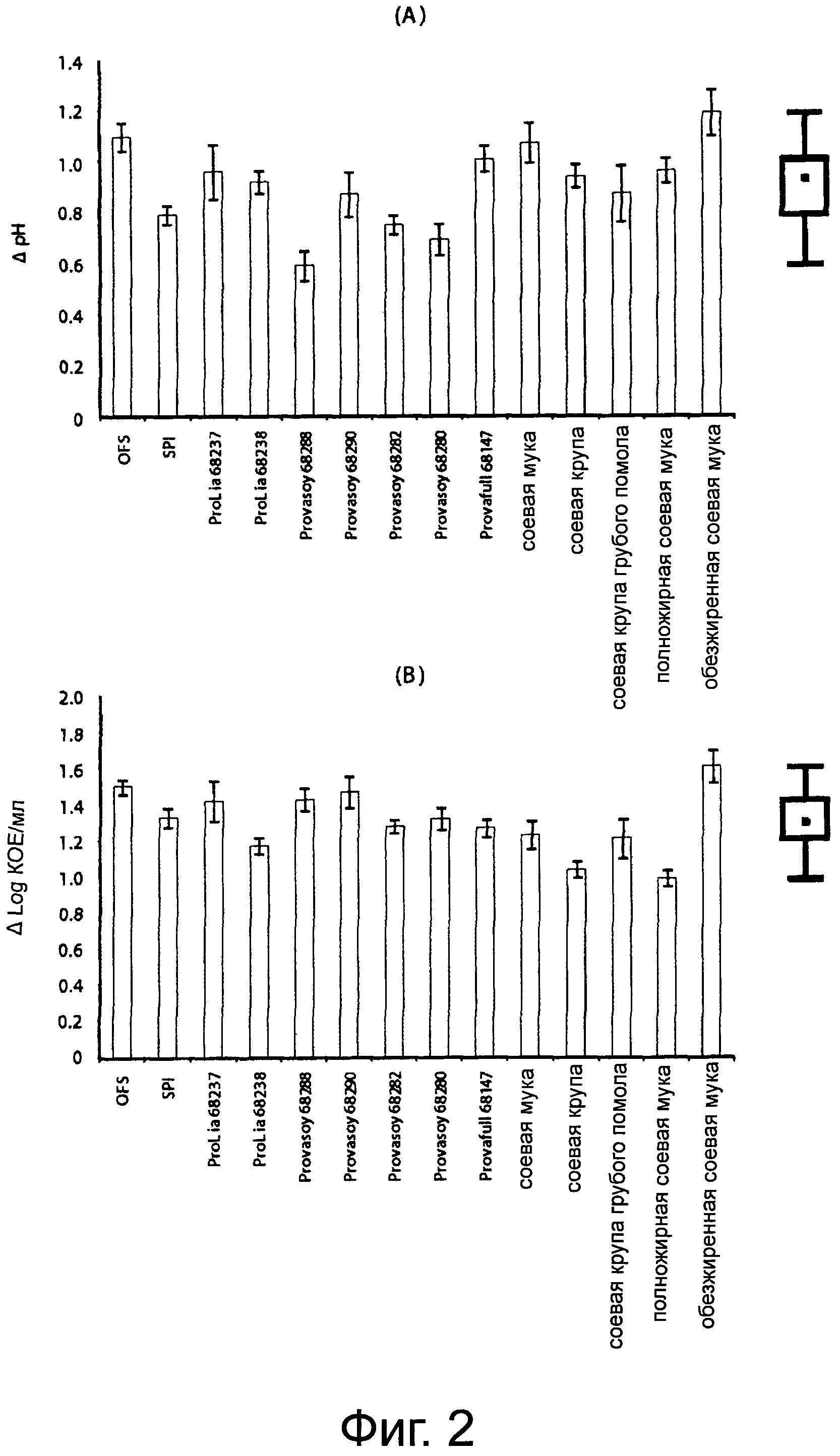
Фигура 2А демонстрирует способ молочнокислого закисления под действием смешанной закваски, выбранной в присутствии соевого молока на основе 14 разных сортов муки. Фигура 2В демонстрирует плотность клеток биотипов молочнокислых бактерий, включающих смешанную закваску, выбранную в присутствии соевого молока на основе 14 разных сортов муки. Приведенные данные - это среднее из трех повторенных трижды экспериментов. Приведена статистическая обработка с помощью коробчатой диаграммы.
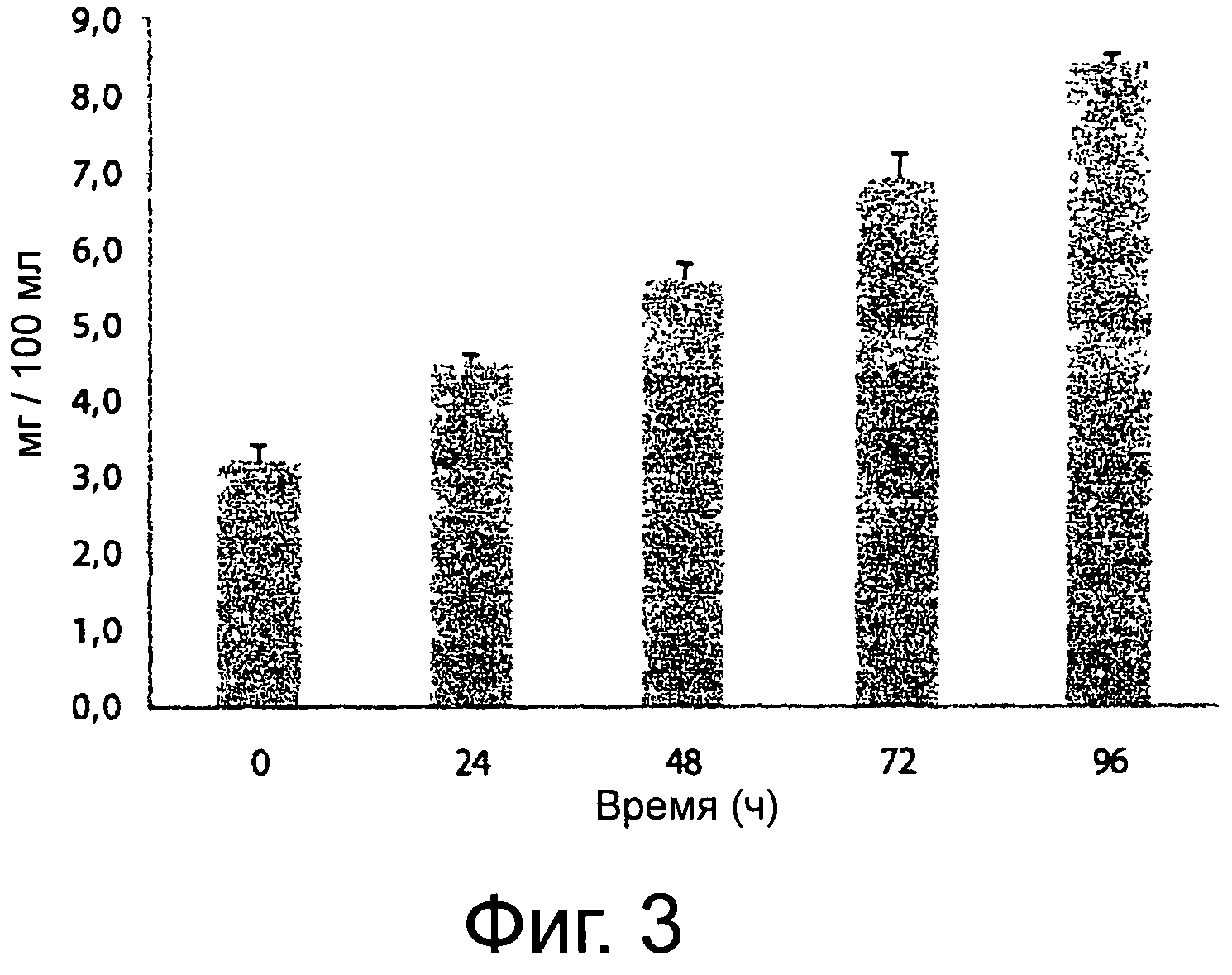
Фигура 3 демонстрирует синтез луназина (мг/100 мл) в продолжение ферментации соевого молока, полученного из органической соевой муки (OFS), используя выбранную смешанную закваску. Приведенные данные являются средними из трех трижды повторенных экспериментов.
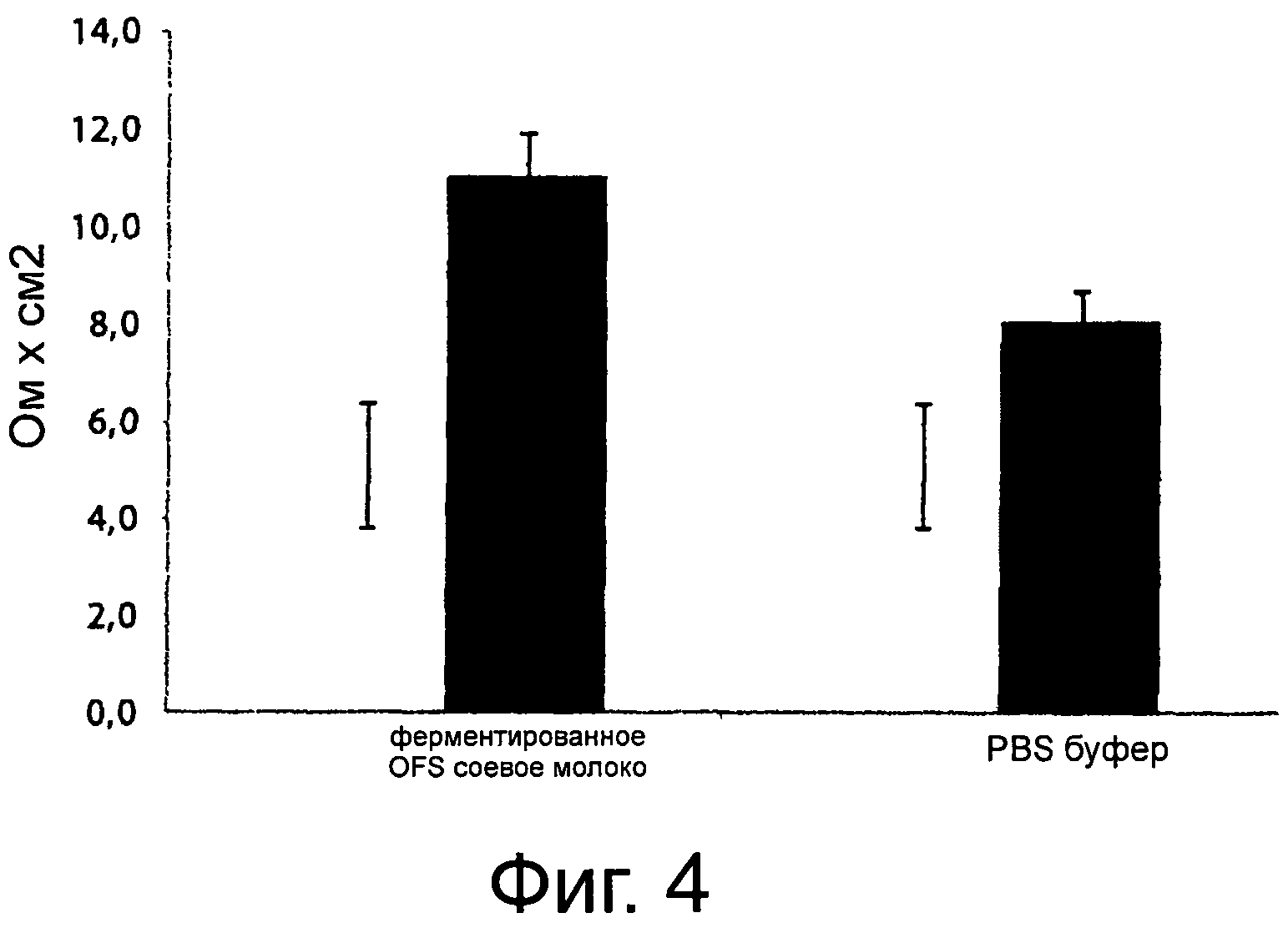
Фигура 4 демонстрирует трансэпителиальное электрическое сопротивление (TEER) (ом×см2) реконструированного эпидермиса (SkinEthic®) после выдерживания от 0 до 24 часов с органическим ферментированным соевым молоком (OFS), используя выбранную смешанную закваску и PBS буфер. Приведенные данные являются средними из трех трижды повторенных экспериментов.
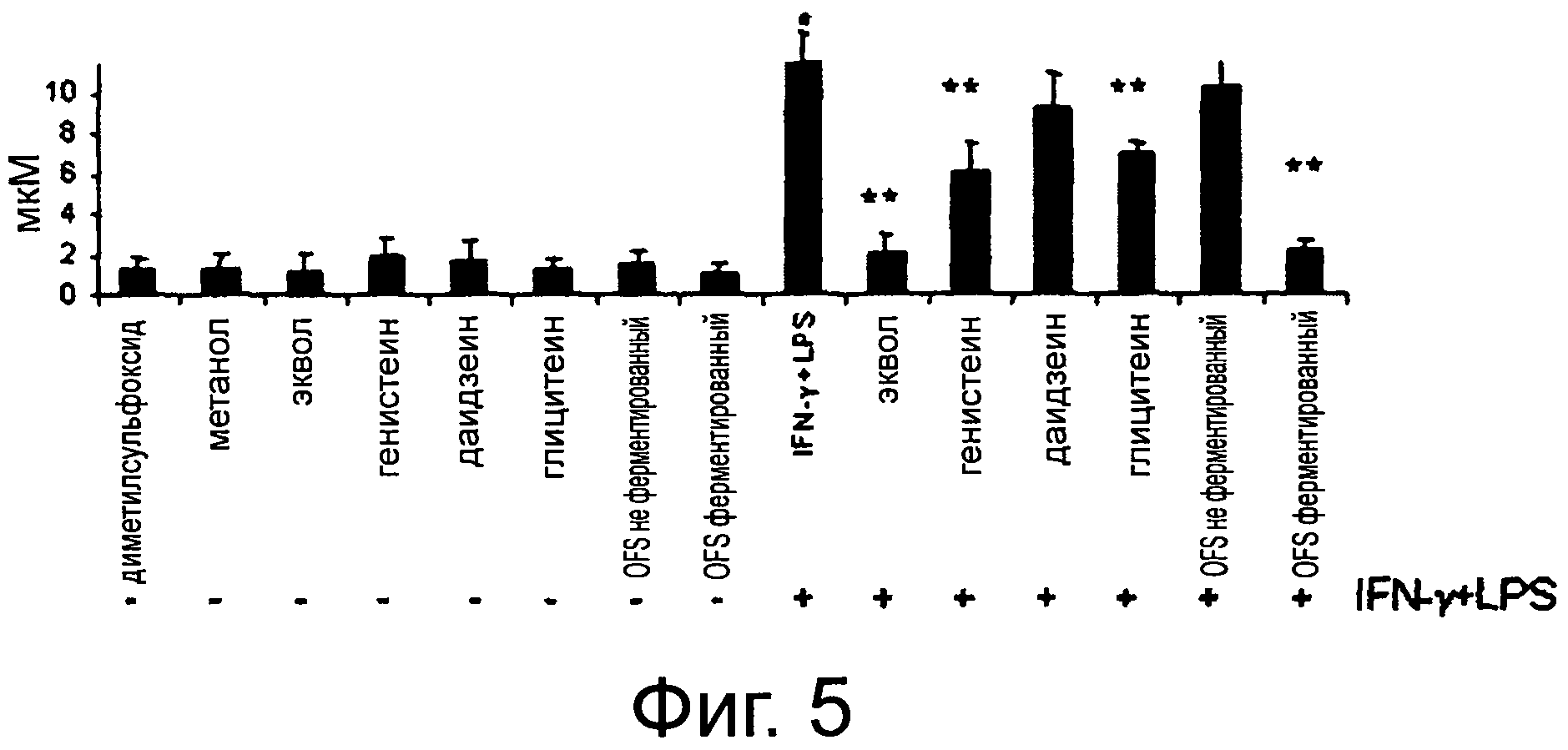
Фигура 5 демонстрирует высвобождение окиси азота (мкМ) (NO) из клеток Сасо-2/ТС7. Клетки были предварительно обработаны в течение 24 часов химическими соединениями (10 мкМ), использованными в качестве стандартов (эквол, даидзеин, генистеин и глицитеин), и соевым молоком, полученным из органической соевой муки, не ферментированным или ферментированным с помощью смешанной выбранной закваски, разбавленной до конечной концентрации эквола 10 мкМ и отфильтрованной в стерильных условиях. Затем клетки стимулировали γ-интерфероном (IFN-γ) (1000 ед/мл) и липополисахаридом (LPS) (100 нг/мл) в течение 24 час.В качестве отрицательного контроля использовали культуральную среду DMEM, содержащую DMSO (1%, v/v) или метанол (0,5%, v/v). Приведенные данные являются средними из трех трижды повторенных экспериментов. Звездочки указывают на значимые отличия (Р<0.01) от отрицательного контроля.
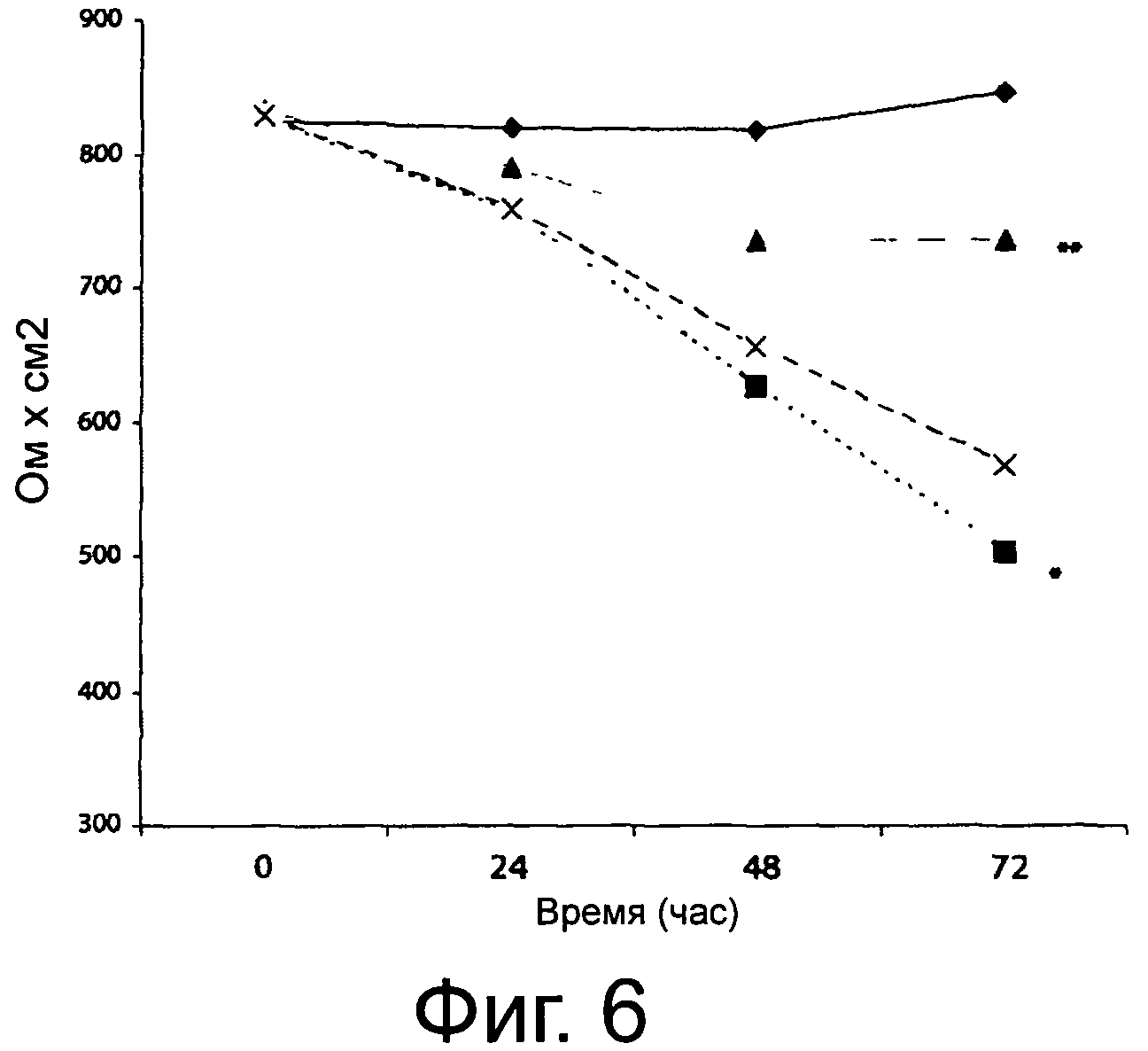
Фигура 6 демонстрирует трансэпителиальное электрическое сопротивление (TEER) (ом×см2) клеток Сасо-2/ТС7 после 24, 48 и 72 часов инкубации. Инкубацию выполняли в присутствии γ-интерферона (IFN-γ) (1000 ед/мл (- ■-); IFN-γ и соевого молока, полученного из органической соевой муки, не ферментированного (- ▲-) или ферментированного выбранной смешанной закваской, разбавленного до конечной концентрации эквола 10 мкМ и отфильтрованного в стерильных условиях (-х-). Культуральную среду DMEM использовали в качестве отрицательного контроля (- ♦-). Приведенные данные - это среднее из трех повторенных трижды экспериментов. Звездочки указывают на значимые отличия (Р<0.01) от отрицательного контроля.
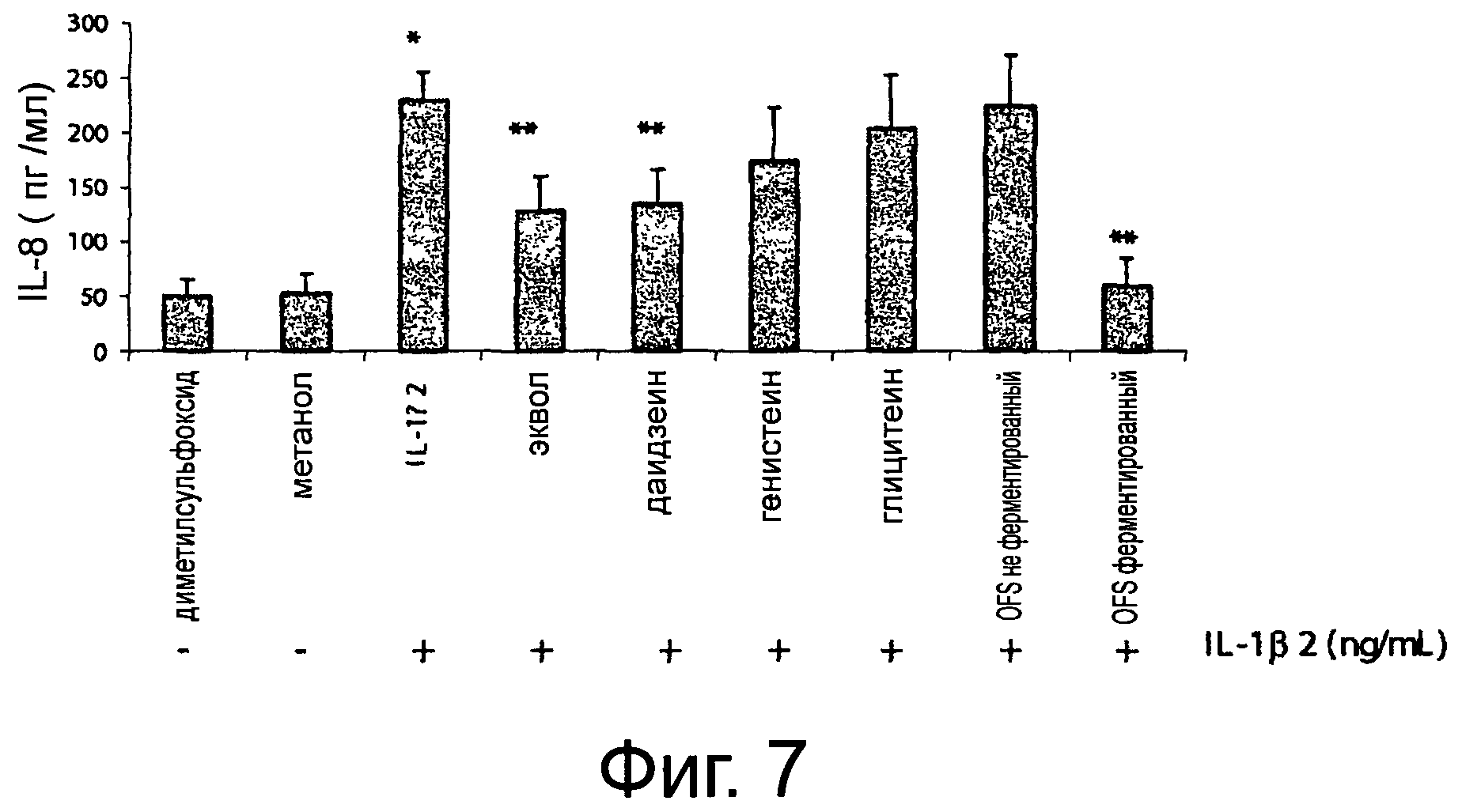
Фигура 7 демонстрирует высвобождение (пг/мл) интерлейкина-8 (IL-8) из клеток Сасо-2/ТС7, стимулированных в течение 24 часов интерлейкином-1β (IL-1β) (2 нг/мл) и затем обрабатываемых (24 часа) химическими соединениями (10 мкМ), использованными в качестве стандарта (эквол, даидзеин, генистеин и глицитеин), и соевым молоком, полученным из органической соевой муки, неферментированным или ферментированным выбранным смешанным стартером, разбавленным до конечной концентрации эквола 10 мкМ и отфильтрованным в стерильных условиях (-х-). Культуральную среду DMEM использовали в качестве отрицательного контроля (- ♦-). Приведенные данные - это среднее из трех повторенных трижды экспериментов. Звездочки указывают на значимые отличия (Р<0.01) от отрицательного контроля.
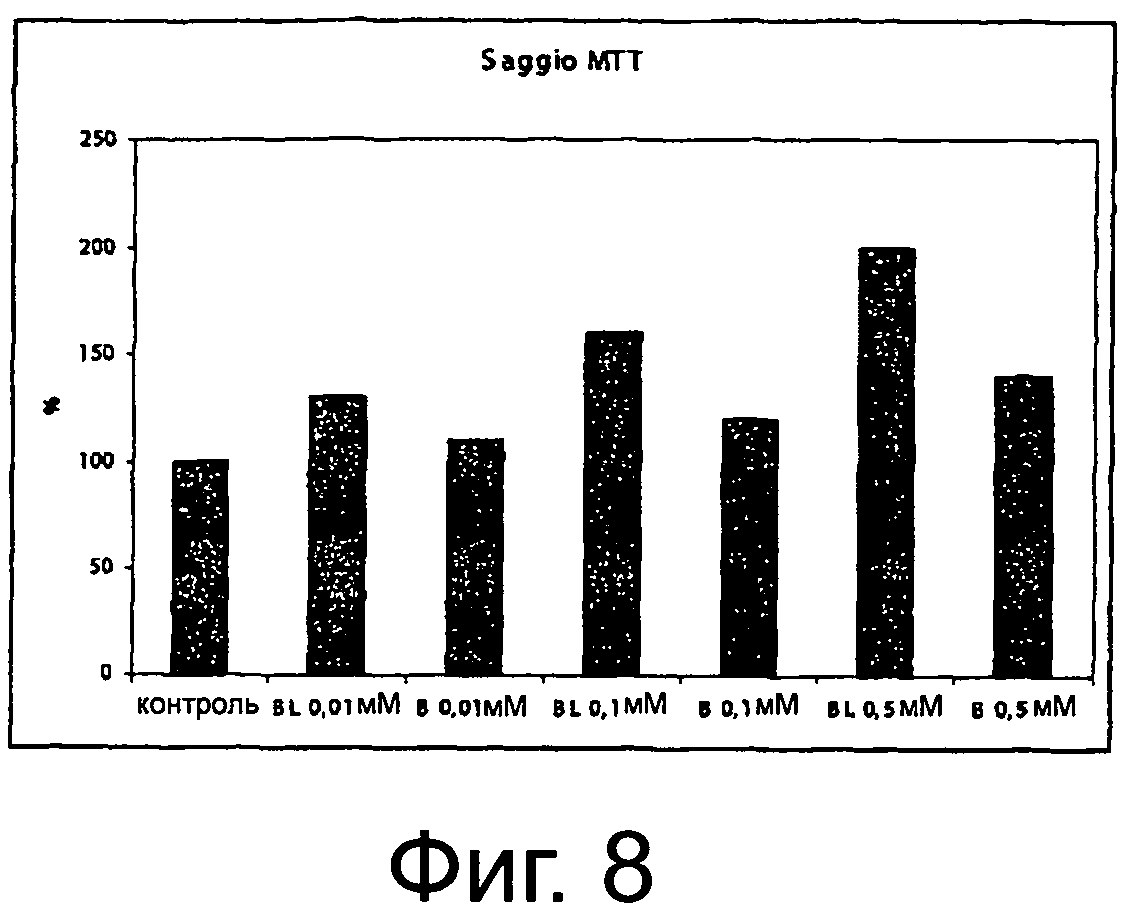
Фигура 8 демонстрирует влияние биомассы, содержащей луназин, и без луназина на пролиферацию клеток.
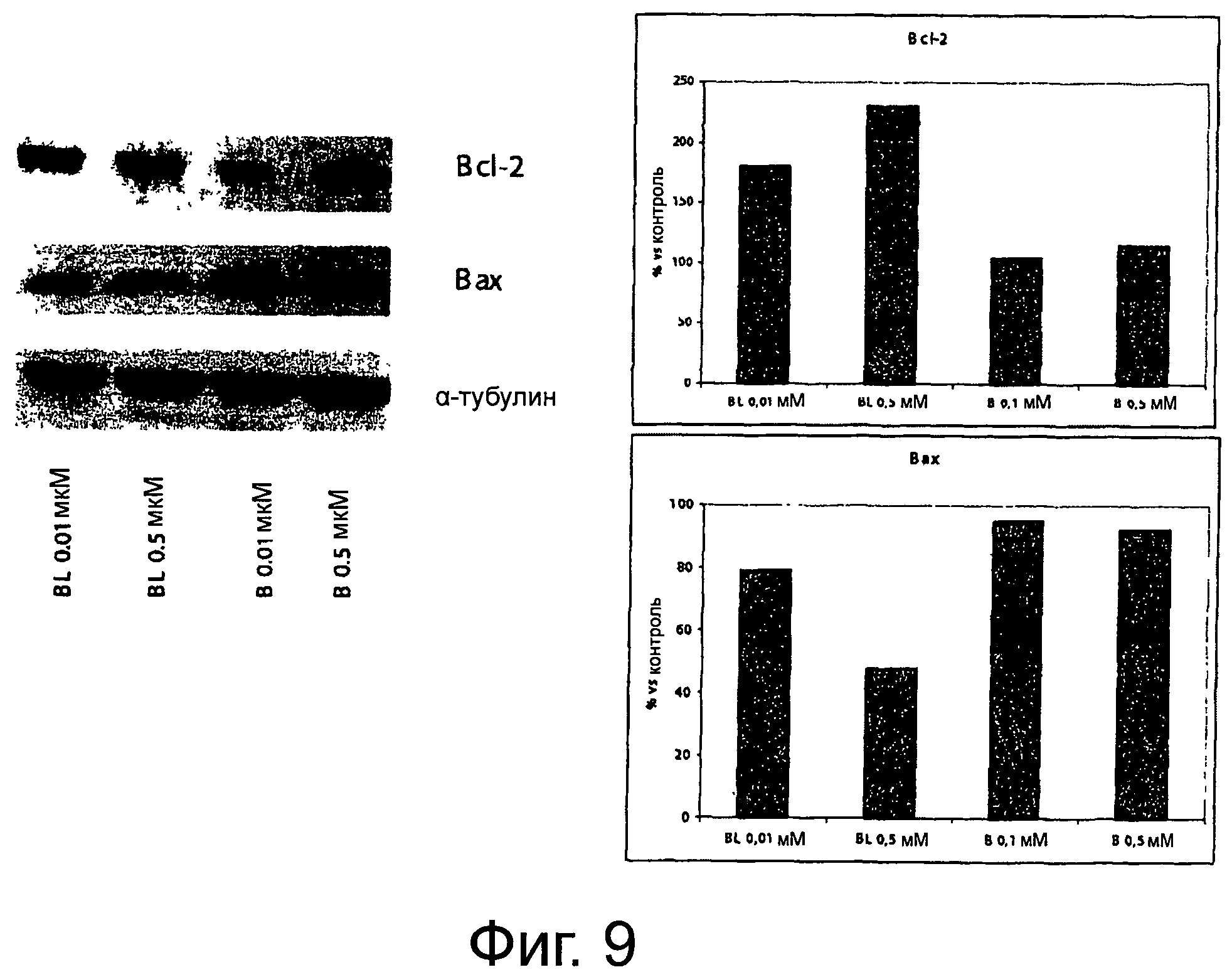
Фигура 9 демонстрирует влияние биомассы, содержащей луназин, и без луназина на экспрессию белков Bcl-2 и Вах.
Пример 1. β-глюкозидазная активность 103 биотипов молочнокислых бактерий, выделенных из пищевых матриксов
В настоящем исследовании использовали сто три биотипа молочнокислых бактерий, принадлежащих к штаммам Lactobacillus alimentarius (10N, 2В, 5А), Lactobacillus brevis (5Z, DPPMA869), Lactobacillus casei (LC10), Lactobacillus casei subsp.casei (2047, 2756, 2763, 2766), Lactobacillus casei subsp.pseudoplantarum (2742, 2745, 2749, 2750), Lactobacillus curvatus (13H5, 14H10, 1Hd, 2042, 2081, 2768, 2770, 2771, 2775, SAL23, SAL35), Lactobacillus delbrueckii subsp. bulgaricus (11842, B15Z), Lactobacillus fermentum (DPPMA114, D13), Lactobacillus gasseri (B30W), Lactobacillus helveticus (15009, B26W, PR4), Lactobacillus hilgardii (51B), Lactobacillus par alimentarius (15α, 15β, 16R, 8D, DPPMA238), Lactobacillus paracasei (12H8, 1Hb, B14F5, B18S, B25F3, PF6, B61F5), Lactobacillus pacarbuckneri (B10F5, B48F3, B48F5, B9F5t, BF1, BF2), Lactobacillus paraplantarum (4DE, DPPMA667), Lactobacillus pentosus (8CF, 12H5, 12H6), Lactobacillus plantarum (14H4, 17N, 19A, 1A7, 2A, 30, 3DM, 4H1, 4H10, DB200, DPPMASL33, DPPMA24W), Lactobacillus rhamnosus (11, 19, DPPMAAZ1, DPPMAAZ21), Lactobacillus sakei (9I, SAL1, SAL18), Lactobacillus rossiae (10A, 15R, 3D, 5C1, 5α, CF51, CI35, CR20, E18), Lactobacillus sanfranciscensis (16α, A17, BB12, DE9, E19, H10), Lactococcus lactis subsp.lactis (10γ), Pediococcus pentosaceus (C16F5, C25F3, C30F5t, C6F5, C7F3, C9F5t, C29F5) and Weissella cibaria (10XA16, 3XA4, 5S, 5XF12). Все биотипы принадлежат к Collezione di Colture del Dipartimento di Protezione delle Piante e Microbiologia Applicata deU′Universita degli Studi di Bari и были предварительно выделены из пищевых матриксов (натуральных дрожжей для выпекания хлеба и изготовления сыров). Биотипы молочнокислых бактерий выдерживали при 30°C в течение 24 часов в среде MRS (Oxoid, Basingstoke, United Kingdom) при 30 или 37°C в течение 24 часов.
Клетки, культивированные в течение 24 часов, собранные центрифугированием (10000×g в течение 15 мин при 4°C), дважды отмытые 50 мМ фосфатным буфером, pH 7,0 и ресуспендированные в воде при плотности log 9,0 КОЕ/мл, использовали для оценки β-глюкозидазной активности. β-глюкозидазную активность определяли как количество β-нитрофенола, высвобождаемого из р-нитрофенол-β-D-глюкопиранозидного (pNPG) субстрата (Sigma Aldrich Chemical Corporate, St. Louis, Missouri, USA). Для измерений использовали 900 мкл pNPG (конечная концентрация) в 0,5 М фосфатном буфере, pH 7,5, и 100 мкл клеточной суспензии of cell. Смесь инкубировали при 40°C и реакцию останавливали нагреванием при 95°C в течение 5 мин. Измеряли поглощение при 410 нм. Одну единицу (U) β-глюкозидазной активности определяли как количество фермента, необходимое для того, чтобы высвобождался 1 нмоль/мин р-нитрофенола в условиях исследования (De Angelis et al., 2005. Purification and characterization of an intracellular family 3 β-glucosidase from Lactobacillus sanfranciscensis CB1. Ital. J. Food Sci. 17:131-142).
Пример 2. Приготовление и ферментация соевого молока
Для производства соевого молока использовали органическую сою (органические выращенные соевые бобы, OFS) (ECorNaturaSi, Verona, Italy), соевый белковый изолят (SPI) (Supro Soja 80 Aptonia, Villeneuve d′ Ascq, France) и различные коммерческие препараты соевой муки (Cargill Texturizing Solutions Soy Protein, Gent, Belgium). OFS отмывали и оставляли на ночь в дистиллированной воде. С сырой и набухшей сои вручную удаляли шелуху, разбавляли теплой водой (около 90°C) в соотношении 1:10 и гомогенизировали PBI International homogeniser (Milan, Italy). Гомогенизацию выполняли при 10000×g в течение 2 мин и после 1-минутной паузы вновь центрифугировали при 14000×g в течение 2 минут. Суспензию центрифугировали (7000×g, 10 минут при 4°C), и соевое молоко в стерильных условиях фильтровали через фильтр с порами диаметром 0,22 мкм (Millipore Corporation, Bedford). Значение pH составляло 6,2. SPI разбавляли дистиллированной водой (40°C) в соотношении 0,4:10 и подвергали термической обработке приблизительно при 55°C в течение 30 мин при размешивании (120 оборотов в мин). После охлаждения при комнатной температуре pH доводили до 6,7 с помощью 5 М NaOH (Tsangalis et al. 2002). Стерилизацию осуществляли в автоклаве при 121°C в течение 15 мин. Коммерческие препараты соевой муки разбавляли дистиллированной водой (40°C) в соотношении 1:10 по способу, описанному Chun et al. (Chun et al., 2007. Conversion of isoflavone glucoside to aglycones in soymilk by fermentation with lactic acid bacteria. J. Food Sci. 72:39-44). Значение pH было приблизительно равно 6,3. Стерилизацию выполняли в автоклаве при 121°C в течение 15 мин.
В различные типы соевого молока инокулировали (1-4 объемных %) смешанную суспензию 4 молочнокислых бактерий, выбранных на основе β-глюкозидазной активности. Исходная клеточная плотность каждого биотипа молочнокислых бактерий составляла log 7,0 КОЕ/мл. Ферментацию выполняли при 30°C в течение 96 часов при размешивании (120 оборотов в мин). Для исследования клеток кишечника человека соевое молоко лиофильно высушивали, ресуспендировали в культуральной среде DMEM и фильтровали в стерильных условиях.
Пример 3. Мониторинг молочнокислых бактерий, определение изофлавонов-агликонов, эквола и луназина
Мониторинг молочнокислых бактерий, использованных в качестве смешанной закваски (Lactobacillus plantarum DSM 23755, соответствующий DPPMASL 33, Lactobacillus plantarum DSM 23756, соответствующий DPPMA24W, Lactobacillus fermentum DSM 23757, соответствующий DPPMA114, и Lactobacillus rhamnosus DSM 23758, соответствующий DPPMAAZ1) в способе ферментации различных типов соевого молока осуществляли с помощью технологии RAPD-PCR. Для типирования использовали два праймера (Invitrogen, Milan, Italy) с произвольно выбранными последовательностями (Р7 5′ AGCAGCGTGG 3′(SEQ ID No: 1), и М13, 5′ GAGGGTGGCGGTTCT 3′ (SEQ ID NO: 2)), произвольно амплифицируя разные участки плазмиды и хромосомной бактериальной DNA (De Angelis et al., 2001. Characterization of non-starter lactic acid bacteria (NSLAB) from ewes′ Italian cheeses based on phenotypic, genotypic and cell-wall protein analyses. Appl. Environ. Microbiol. 67:2011-2020; Rossetti e Giraffa, 2005. Rapid identification of dairy lactic acid bacteria by M13-generated, RAPD-PCR fingerprint databases. J. Microbiol. Met. 63:135-144).
Экстракцию изофлавонов-агликонов и эквола из образцов ферментированного соевого молока осуществляли по способу, описанному Otieno and Shah (Otieno and Shah, 2007. A comparison of changes in the transformation of isoflavones in soymilk using varying concentrations of exogenous and prebiotic-derived endogenous β-glucosidases. J. Appl. Microbiol. 103:601-612). Анализ с помощью хроматографии высокого давления для определения соединений осуществляли по способу, описанному Maubach et al. (Maubach et al., 2003. Quantitation of soy-derived phytoestrogens in human breast tissue and biological fluids by high-performance liquid chromatography. J. Chromatogr. 784:137-144).
Определение луназина в соевом молоке, полученном из органической соевой муки до и в способе ферментации, осуществляли с помощью хроматографии высокого давления с использованием системы АКТА очистителя (GE Healthcare), оборудованного колонкой С18 Xterra Waters и ультрафиолетовым детектором на 214 нм, элюируемой смесью растворителей, состоящей из 5% ACN+0.05% TFA (элюент А) и ACN+0.05% TFA (элюент В) (Wang et al. 2008. Analysis of soybean protein derived peptides and the effect of cultivar, environmental conditions, and processing of lunasin concentration in soybean and soy products. J. AOAC Intern. 91:936-944). В качестве стандарта использовали синтетический луназин (EZBiolab Inc., Carmel, IN, USA).
Пример 4. Тесты на восстановленном эпидермисе и измерение TEER (трансэпителиального электрического сопротивления)
Восстановленный эпидермис человека SkinEthic® (Reconstructed Human Epidermis) состоит из нормальных кератиноцитов эпидермиса человека в виде мультислоя. Он представляет собой полностью дифференцированный эпидермис после культивирования кератиноцитов человека в химически определенной среде (MCDM 153) без добавления фетальной бычьей сыворотки на инертной поликарбонатной пористой подложке на границе воздух-жидкость в течение 17 дней. На этой стадии роста морфологический анализ демонстрирует жизнеспособный многослойный эпидермис и роговой слой, содержащий более десяти компактных клеточных слоев. Восстановленный эпидермис человека SkinEthic® использовали с помощью описанных ранее процедур (Di Cagno et al., 2009. Synthesis of γ-amino butyric acid (GABA) by Lactobacillus plantarum DSMZ19463: functional grape must beverage and dermatological application. Appl Biotechnol Microbiol DOI: 10.1007/s00253-009-23704).
Определение TEER выполняли с помощью Millicell-ERS Volthommeter (Millipore, Billerica, MA). Результаты выражали в ом×см2.
Пример 5. Тесты на клетках Сасо-2/ТС7
Клетки Сасо-2 человеческого происхождения (клон ТС7) культивировали в среде Дубеко (DMEM) с добавлением фетальной бычьей сыворотки (10%), неэссенциальных аминокислот (1%), гентамицин/стрептомицина (50 мкг/мл), глутамина (2 мМ) и 4-2-гидроксиэтил-1-пиперазинил-этансульфоновой кислоты (1%) (Di Cagno et al., 2010. Quorum sensing in sourdough Lactobacillus plantarum DC400: induction of plantaricin A (PlnA) under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells. Proteomics в печати). Жизнеспособность клеток определяли по поглощению красителя нейтрального красного (Balls et al., 1987. Approaches to validation alternative methods in toxicology. In: Goldber A.M. (Ed). N.Y. Academic Press pp.45-58). После обработки в течение 24-72 часов различными препаратами клетки отмывали PBS буфером и инкубировали в течение 4 часов при 37°C раствором нейтрального красного (33 мг/л). Затем клетки отмывали еще раз PBS буфером и обрабатывали лизирующим раствором (50% этанола в воде, содержащей 1% уксусной кислоты). Измерения плашки выполняли с помощью Novapath reader (Biorad, Hercules, CA) (Di Cagno et al., 2010).
Высвобождение окиси азота (NO) из клеток Сасо-2/ТС7 определяли путем измерения продуктов окисления, то есть нитрита и нитрата. После инкубации с разными препаратами супернатант клеточных культур смешивали с равным объемом реагента Грисса (1%, p/v, сульфаниловой кислоты в 0,5 М HCl и 0,1%, p/v, N-1-нафтилендиамингидрохлорида). После 30 мин инкубации при комнатной температуре измеряли поглощение при 540 нм. Концентрацию нитрита определяли с помощью стандартной кривой, построенной на основе нитрита натрия.
Для определения TEER клетки Сасо-2/ТС7 инокулировали (7,5×104 клеток/мл) в микропланшечный контейнер с 24 ячейками и полиэтиленовый фильтр (с диаметром пор 0,4 мкм). Перед обработкой клетки культивировали 21 день при 37°C. Обработку различными препаратами осуществляли в течение 18, 24 и 48 часов. Затем целостность клеточного слоя определяли с помощью измерений TEER.
Для измерения высвобожденного интерлейкина-8 (IL-8) клетки Сасо-2/ТС7 преинкубировали (24 часа) с интерлейкином -1β и затем стимулировали еще 24 часа разными препаратами. Синтез провоспалительного IL-8 определяли методом ELISA (Bender MedSystems). Количественные результаты получали с помощью стандартной кривой согласно инструкциям, приложенным к набору.
Результаты
(1) Выбор молочнокислых бактерий на основе β-глюкозидазной активности
Предварительно определяли β-глюкозидазную активность 103 биотипов молочнокислых бактерий, выделенных из пищевых матриксов на синтетическом субстрате pNPG. Активность изменялась от 0 до 202,3 ед. (Фигура 1). Сорок восемь биотипов, относящихся, главным образом, к видам L. alimentarius, L. brevis, L. casei, L. delbrueckii subsp.bulgaricus, L. helveticus, L. hilgardiii, L. paralimentarius, L. paraplantarum, L. pentosus, L. sanfranciscensis, Lc. lactis subsp.lactis, L. parabuchneri e W. Cibaria, не обнаруживали β-глюкозидазной активности. Среднее значение активности составляло 3 ед. и значения, соответствующие 25° и 75° персентилям, равнялись 0 и 45,5 ед. Двадцать пять биотипов, относящихся к разным видам молочнокислых бактерий, обнаруживали β-глюкозидазную активность выше 55 ед. L. plantarum DPPMA24W, L. fermentum DPPMA114, L. rhamnosus DPPMAAZ1 и L. plantarum DPPMASL33 обнаруживали более высокую активность (202,35±7,08, 163,15±6,52, 146,60±5,84 и 144,34±7,19 ед. соответственно). Значения β-глюкозидазной активности для этих биотипов находились за пределами ошибки коробчатой диаграммы. На основе этих результатов были отобраны четыре вида молочнокислых бактерий, использованные для разработки смешанной закваски для ферментации различных типов соевого молока.
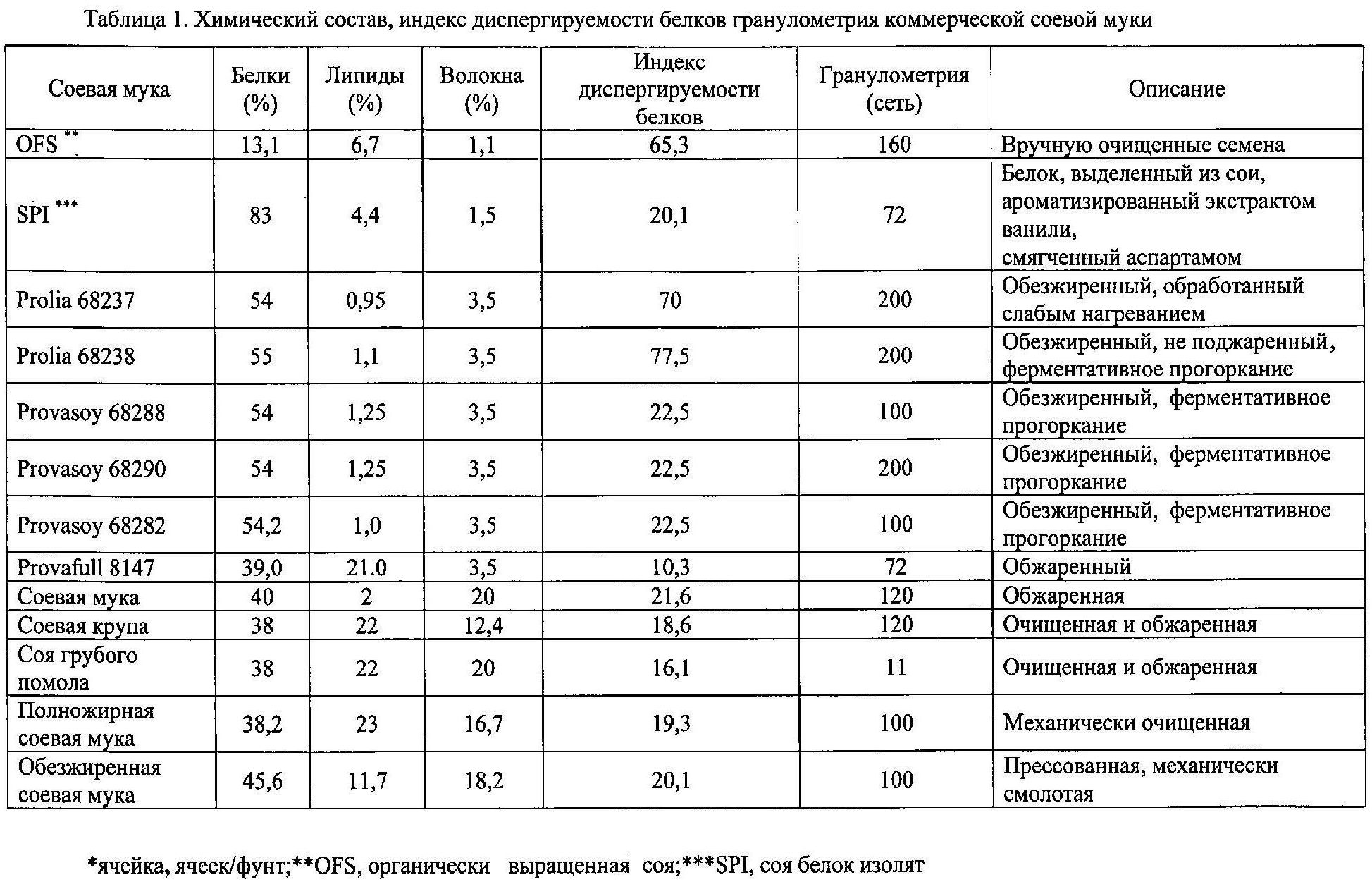
(2) Ферментация соевого молока и синтез функциональных соединений
Химический состав, индекс диспергируемости белков и размер частиц различных типов соевой муки для приготовления соевого молока представлены в таблице 1. Таблица 1 показывает химический состав, индекс диспергируемости белков и размер частиц 14 сортов соевой муки для производства функциональных соединений с помощью выбранной смешанной закваски, содержащей Lactobacillus plantarum DSM 23756, соответствующий corresponding to DPPMA24W, Lactobacillus fermentum DSM 23757, соответствующий DPPMA114, и Lactobacillus rhamnosus DSM 23758, соответствующий DPPMAAZ1.
Четырнадцать типов соевого молока ферментировали с помощью выбранной смешанной закваски, содержащей L. plantarum DPPMA24W и DPPMASL33, L. fermentum DPPMA114 и L. rhamnosus DPPMAAZ1. Все субстраты подвергались способу молочнокислого закисления (Фигура 2А). После 96 часов ферментации значения ΔpH изменялись от 0,59±0,06 до 1,19±0,09 для типов соевого молока, полученных из Provasoy 68288 и обезжиренной соевой муки соответственно. Среднее значение ΔpH равнялось 0,93, а интервал, соответствующий 25° и 75° перцентилям, равнялся 0,79 и 1,01. После ферментации значения pH для всех типов соевого молока находились в интервале значений 5,1-5,3.
Молочнокислые бактерии росли в способе ферментации всех типов соевого молока. (Фигура 2В). Значения Δlog КОЕ/мл изменялись от 0,99±0,29 до 1,61±0,30 для соевого молока из полножирной и обезжиренной соевой муки соответственно. Среднее значение увеличения плотности клеток равнялось 1,31 Δlog КОЕ/мл, что соответствует абсолютному значению плотности клеток log 8.31 КОЕ/мл. Интервал, соответствующий 25° и 75° перцентилям, равнялся 1.21 и 1,43. Рост молочнокислых бактерий полностью заканчивался за 24 - 36 часов инкубации. Как было показано с помощью RAPD-PCR типирования, все четыре биотипа молочнокислых бактерий, используемых в смешанной закваске, росли на различных типах соевого молока до одной и той же плотности клеток.
Исходная концентрация конъюгированных изофлавонов в различных типах соевого молока изменялась от 142,3±12,5 до 171,5±10,8, 102,2±8,6 до 123,0±11,3 и от 10,5±1,1 до 18,0±0,9 мМ для даидзина, генистина и глицитина соответственно. Напротив, низкие концентрации (от 0 до 7,8±0,5 мкМ) агликонов наблюдались в различных типах соевого молока (таблица 2). Таблица 2 демонстрирует концентрацию (мкМ) изофлавонов-агликонов.
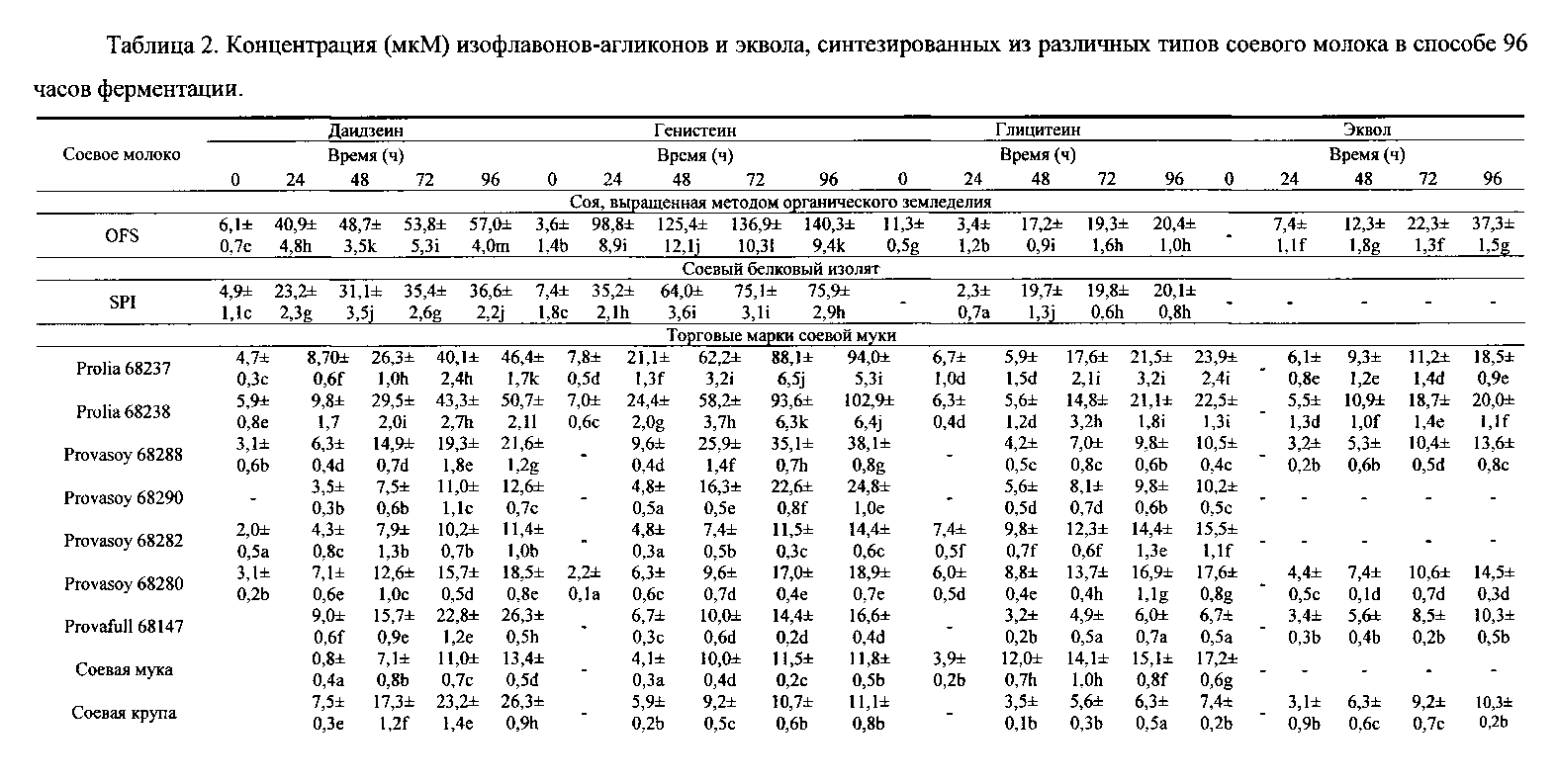

За исключением соевого молока, полученного из полножирной соевой муки, концентрация агликонов увеличивалась в способе инкубации всех типов соевого молока. После 96 часов инкубации наибольшая концентрация даидзеина наблюдалась в OFS соевом молоке (57,0±4,0 мкМ, что соответствует 1,45 мг/100 мл) в Prolia 68238 (50,7±2,1 мкМ) и Prolia 68237 (46,4±1,7 мкМ). Кроме того, окончательная конечная концентрация генистеина в вышеупомянутых трех типах соевого молока составляла (140,3±9,4 - 3,9 мг/100 мл, 102,9±6,4 и 94,0±5,3 мкМ для OFS, Prolia 68238 и 68237 соответственно). По сравнению с другими агликонами концентрация глицитеина была ниже во всех типах соевого молока. Наибольшая концентрация глицетеина была в соевом молоке Prolia 68237 и 68238 и OFS (23,9±2,4, 22,5±1,3 и 20,4±1,0 мкМ - 0,58 мг/100 мл соответственно). В случае соевого молока, полученного из органической соевой муки (OFS), скорость превращения конъюгированных изофлавонов в соответствующие агликоны равнялась 0,72, 0,85 и 0,98 для превращения даидзина в даидзеина, генистина в генистеин и глицитина в глицитеин. Хотя концентрация агликонов увеличивалась в способе инкубации, через 24 часа скорость гидролиза всех трех конъюгированных изофлавонов находилась в интервале значений 1,0-0,95.
До инкубации присутствие эквола не отмечалось ни в одном типе соевого молока (таблица 2). Различные типы соевого молока были не способны синтезировать эквол в способе ферментации. После 96 часов инкубации наибольшая концентрация эквола определялась в типах соевого молока Prolia 68238 и 68237 (20,0±1.1 и 18,5±0,9 мкМ соответственно) и самая высокая в соевом молоке OFS (37,3±1,5 мкМ, что соответствует 0,9 мг/100 мл). Благодаря одновременному синтезу даидзеина было возможно определить скорость его превращения в эквол. Различные исследования были посвящены использованию потенциально пробиотических бактерий, выделенных из фекалий человека, чтобы обогатить соевое молоко изофлавонами-агликонами (Chun et al., 2007. Conversion of isoflavone glucoside to aglycones in soymilk by fermentation with lactic acid bacteria. J. Food Sci. 72:39-44; Donkor and Shah 2008. Production of β-glucosidase and hydrolysis of isoflavone phytoestrogens by Lactobacillus acidophilus, Bifidobacterium lactis and Lactobacillus casei in soymilk. J. Food Sci. 73:15-20; Pham and Shah 2007. Biotransformation of isoflavone glycosides by Bifidobacterium animalis in soymilk supplemented with skim milk powder. J. Food Sci. 72:316-324; Tsangalis et al., 2002; Tsangalis et al, 2004; Wei et al., 2007. Using Lactobacillus and Bifidobacterium to product the isoflavone algycones in fermented soymilk. Int. J. Food Microbiol.117:120-124). Использованные микроорганизмы представляли собой исключительно бифидобактерии или различные молочнокислые бактерии, относящиеся к различным видам. В настоящем изобретении выбраны четыре новых биотипа, соответствующих L. plantarum DPPMA24W и DPPMASL33, L. fermentum DPPMA114 и L. rhamnosus DPPMAAZ1, никогда не применявшиеся ранее для синтеза изофлавонов-агликонов и эквола. Только в ограниченном количестве исследований рассматривали синтез эквола при ферментации соевого молока. Эквол синтезировался в соевом молоке, ферментированном с бифидобактериями (Tsangalis et al., 2002. Enzymatic transformation of isoflavone phytoestrogens in soymilk by β-glucosidase producing bifidobacteria. Food Res. Int. Sci. 67:3104-3113). После 24 часов ферментации наивысшую концентрацию эквола (0,521 мг/100 мл) синтезировали Bifidobacterium animalis по сравнению с образованием 0,338 и 0,433 мг/100 мл, получаемым с помощью биотипов Bifidobacterium pseudolongum и Bifidobacterium longum. Соевое молоко OFS, ферментированное смешанной закваской, выбранной согласно данным исследований, демонстрирующим более высокие концентрации эквола, а именно 37,3 мкМ, что соответствует 0,9 мг/100 мл.
На основе приведенных ранее результатов соевое молоко из органической соевой муки (OFS) считается наилучшим субстратом для синтеза изофлавонов-агликонов и эквола. Насколько нам известно, нет предварительного исследования, касающегося использования соевого молока, полученного на основе муки из органически культивированной сои для синтеза изофлавонов-агликонов и эквола.
Таким образом, концентрация луназина была определена методом HPLC (Wang et al. 2008. Analysis of soybean protein derived peptides and the effect of cultivar, environmental conditions, and processing of lunasin concentration in soybean and soy products. J. AOAC Intern. 91:936-944) до инкубации концентрация луназина равнялась приблизительно 3,2 мг/100 мл (фигура 3). В способе ферментации выбранная смешанная закваска способствовала постоянному увеличению луназина, уровень которого после 96 часов инкубации составлял приблизительно 8,4 мг/100 мл. Насколько нам известно, нет предварительного исследования сопутствующего синтеза изофлавонов-агликонов, эквола и луназина в одном и том же препарате, состоящем из соевого молока, ферментированного молочнокислыми бактериями. Физиологические эффекты этого биоактивного пептида (луназина) широко описаны в литературе (Jeong et al., 2003. Characterization of lunasin isolated from soybean. J Agric Food Chem. 51: 7901-7906; Jeong et al. 2007. The cancer preventive peptide lunasin from wheat inhibits core histone acetylation. Cancer Lett. 255:42-48).
На основе полученных ранее результатов ферментированное OFS соевое молоко использовали для оценки защитного действия на кожные покровы и на клетки кишечника человека.
(3) Тесты на восстановленном эпидермисе и измерение TEER (Трансэпитальное электрическое сопротивление)
Соевое молоко OFS, полученное из органической соевой муки и ферментированное выбранной смешанной закваской, использовали при конечной концентрации эквола 10 мкМ для обработки восстановленного эпидермиса согласно модели SkinEthic®. Эта модель широко исследовалась и была принята научным сообществом (Di Cagno et al., 2009. Synthesis of γ-amino butyric acid (GABA) by Lactobacillus plantarum DSMZ19463: functional grape must beverage and dermatological application. Appl Biotechnol Microbiol DOI: 10.1007/s00253-009-23704). После обработки в течение 24 часов выполняли измерения TEER. Этот тип анализа, широко принятый международным научным сообществом, оценивает коррозионную емкость ткани, используя в качестве репера целостность рогового слоя и его барьерную функцию. В частности, с помощью этой регистрации можно получить информацию о присутствии на уровне рогового слоя компактной ламеллярной структуры, интегральных жестких соединений и эпидермального утолщения. Эти факторы в целом определяют эффективную барьерную функцию. Фигура 4 показывает, как в присутствии ферментированного OFS соевого молока наблюдается значительное увеличение (Р<0,05) величины TEER, демонстрируя защитное действие этой молекулы на уровне кожи. Такой же результат получался со смесью химически синтезированных эквола и луназина.
В настоящее время считают, что это - первый пример прикладного применения препарата на основе соевого молока, содержащего изофлавоны-агликоны, эквол и луназин, демонстрирующий стимуляцию барьерной функции кожи.
(4) Тесты на клетках Сасо-2/ТС7
Для тестирования иммуномодулирующих свойств изофлавонов-агликонов, содержащихся в соевом молоке, образованном из органической соевой муки (OFS), сначала оценивали их цитотоксичность против клеток Сасо-2/ТС7 с помощью стандартных химических соединений (эквола, даидзеина, генистеина и глицетеина) при концентрациях 5-100 мкМ, используя оценку поглощения нейтрального красного (NR). Показано, что генестеин, глицитеин и эквол ведут себя аналогично метанолу и DMSO (отрицательный контроль) и не влияют существенно на пролиферацию клеток. После 72 часов обработки даидзеин заметно ингибировал (Р<0,03) пролиферацию клеток при концентрации выше 100 мкМ.
Предварительно клетки Сасо-2/ТС7 обрабатывали в течение 24 часов OFS ферментированным соевым молоком или неферментированным соевым молоком концентрации 10 мкМ и разбавляли до конечной концентрации эквола 10 мкМ. Эти соединения или препараты не вызывали индукции высвобождения NO, свидетельствуя о поведении, аналогичном отрицательному контролю, то есть метанолу и DMSO (Фигура 5). Затем клетки Сасо-2/ТС7 стимулировали INF-γ(1000 ед/мл) LPS (100 нг/мл) в течение 24 часов. Эта обработка значительно увеличивала высвобождение (Р<0,05) NO, стимулируя таким образом воспалительное состояние Сасо-2/ТС7 клеток, предварительно обработанных отрицательным контролем, даидзеином или неферментированным OFS соевым молоком. Напротив, обработка экволом или ферментированным OFS соевым молоком, достоверно (Р<0,002 и Р<0,007, соответственно) ингибировала высвобождение NO. Значительное ингибирование высвобождения NO наблюдалось также при обработке генистеином и глицитеином (Р<0,05). Поскольку ранее было показано, что использованная в тесте концентрация изофлавонов-агликонов (10 мкМ) нетоксична, гибель клеток Сасо-2/ТС7 не была достоверно связана с высвобождением NO.
При условиях культивирования, использованных в данном исследовании, в клетках Сасо-2/ТС7 проявляются морфологические и функциональные характеристики энтероцитов, в том числе образуются прочные межклеточные связи, целостность которых измеряли путем определения TEER. Предварительно TEER определяли в присутствии стандартных химических соединений (10-100 мкМ), ферментированного OFS соевого молока, разбавленного до концентрации эквола 10 мкМ, или неферментированного OFS соевого молока. За исключением химического соединения эквола в концентрации 100 мкМ (1000 ед./мл) влияние на TEER в результате 72 часов инкубации не наблюдалось. Обработка клеток Сасо-2/ТС7 INF-γ(1000 ед./мл) приводила к заметному снижению (Р<0,003) от величины TEER (Фигура 6). Если клетки Сасо-2/ТС7, стимулированные INF-γ, обрабатывали также ферментированным OFS соевым молоком, отрицательный эффект INF-γ заметно уменьшался (Р<0,007). Отрицательный эффект наблюдался в присутствии неферментированного OFS соевого молока. Генистеин, глицитеин и, в первую очередь, эквол действовали аналогично ферментированному OFS соевому молоку. Даидзеин не влиял на отрицательный эффект, вызванный INF-γ.
Интерлейкин-8 (IL-8) - это член семейства хемокинов С-Х-С, играющий фундаментальную роль в активации нейтрофилов и инициирующих воспалительную реакцию. Когда клетки Сасо-2/ТС7 подвергались обработке интерлейкином-1β (2 нг/мл), наблюдалось достоверное возрастание (Р<0,001) синтеза IL-8 (Фигура 7). Когда клетки Сасо-2/ТС7, стимулированные интерлейкином-1β, подвергались обработке экволом и даидзеином, наблюдалось достоверное снижение (Р<0,005) синтеза IL-8. Наибольшее ингибирование синтеза IL-8 (Р<0,001) наблюдалось при обработке неферментированным OFS соевым молоком. Напротив, обработка генстеином, глицитеином или ферментированным OFS соевым молоком не приводила к снижению синтеза IL-8 (Р<0,10).
Приведенные результаты ясно показывают, что противовоспалительное и стимулирующее действие ферментированного OFS соевого молока на барьерные функции клеток кишечника человека является, главным образом, результатом присутствия эквола и некоторых изофлавонов-агликонов. Возможен дополнительный эффект луназина.
(5) Разработка биотехнологического протокола для синтеза даидзеина, генистеина, глицитеина, эквола и луназина и использование их в области дерматологии
Как указывалось ранее в другой части данного текста, был разработан биотехнологический способ синтеза изофлавонов-агликонов (даидзеина, генистеина и глицитеина), эквола и луназина и использования их в области дерматологии. Упомянутый способ включает:
a) культивирование L. plantarum DPPMA24W и DPPMASL33, L. fermentum DPPMA114 и L. rhamnosus DPPMAAZ1 в чистой культуре на культуральной среде MRS;
b) сбор, отмывание и инокуляция суспензии клеток в различные типы соевого молока, предпочтительно стерильного соевого молока, приготовленного из соевой муки, полученной согласно агрономическим органическим методам после лабораторного удаления шелухи;
c) ферментация соевого молока с помощью выбранной смешанной закваски в течение 48-96 часов, предпочтительно 96 часов при 30-37°C, предпочтительно при 30°C;
d) отделение клеток центрифугированием. Согласно варианту способа приготовление может включать также клетки молочнокислых бактерий;
e) дегидратация препарата с помощью способа высушивания или лиофильного высушивания;
f) приготовление композиции путем добавления подходящих наполнителей для получения лекарственных форм, пригодных для использования путем орального или местного применения в зависимости от ситуации.
Пример 6. Сравнительная оценка влияния in vitro биомассы, содержащей луназин, и биомассы без луназина на стимуляцию роста волос
Сравнительное исследование in vitro биомассы, содержащей луназин (BL) и не содержащей луназин (В) в качестве стимулятора роста волос.
Материалы и методы
Клетки кожных волосяных сосочков (DPCs) культивировали в среде (Дубеко, модифицированной среде Игла, DMEM), содержащей 2 мМ L-глутамина, 1x антимикотического и антибиотического раствора (1000 ед./мл стрептомицина сульфата, 1000 ед./мл пенициллина G и 2,5 мкг/мл амфотерицина В) и 10% бычьей эмбриональной сыворотки. После слияния клетки культивировали 24 часа в среде DMEM без сыворотки и затем обрабатывали различными концентрациями биомассы, содержащей или не содержащей луназин.
Пролиферацию клеток определяли методом МТТ (Mosmann, 1983). DPCs засевали в 96 ячеечную плашку (104 клеток/ячейку) и инкубировали 24 часа, добавляя исследуемые соединения. Поглощение измеряли при 570 нм с помощью ридера ELISA.
Затем осуществляли western blot на Bcl2. Белки экстрагировали буфером, содержащим Tris-HCl 50 мМ, pH 7,4, EDTA 2 мМ, лептин 100 мкг/мл и 100 мМ NaCl.
Загружали 50 мкг белка и разделяли его на SDS-PAGE. Моноклональные антитела против Bcl-2, Вах и актина разбавляли 1:500, определяли комплекс антиген-антитело с помощью системы ECL и анализировали результат, используя визуальную денситометрию (Bio-Rad GS-700).
Результаты и обсуждение
В интервале исследуемых концентраций (0,01-0,5 мкМ) биомасса, содержащая луназин, индуцирует увеличение in vitro DPCs, зависящей от дозы пролиферации (р<0,05) (фигура 1).
Влияние биомассы, содержащей луназин, в отличие от биомассы без луназина, индуцирует увеличение экспрессии белка Bcl-2 и уменьшение экспрессии белка Вах (фигура 2).
Эти данные позволяют предположить, что биомасса, содержащая луназин, стимулирует рост волос, оказывая пролиферативное и антиапоптотическое действие на DPCs, расширяя таким образом анагенную фазу.