Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ИНЪЕКЦИОННОЙ ФОРМЕ С АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ)
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к фармации, и касается фармацевтических композиций, проявляющих анальгетическую активность.
Известны анальгетики с большой рецепторной селективностью и минимальными морфиноподобными побочными эффектами - препараты смешанного типа действия агониты-антагонисты опиоидных рецепторов. Фармакология этих препаратов является комплексной. Синтетические производные фенантрена (налбуфин, бупренорфин) и морфинана (буторфанол) относятся к агонистам-антагонистам, опиоидным анальгетикам смешанного типа действия с аффинитетом к мю-, дельта-, и каппа-подтипам опиоидных рецепторов. Многочисленные фармакологические исследования, работы по лиганд-рецепторному связыванию привели к заключению, что налбуфин действует как κ-агонист и парциальный мю-антагонист, бупренорфин-парциальный мю-агонист и антагонист каппа-опиоидных рецепторов, буторфанол-парциальный агонист мю-, агонист каппа-опиоидных рецепторов, а также обладает свойствами дельта-антагониста [Редькин А.Н., Бунятян А.А., Насонов Е.Л., Никода В.В., 2004].
Препараты смешанного типа действия (налбуфин, бупренорфин и буторфанол) нашли ограниченное применение в качестве обезболивающих средств в практической медицине. Синтезированные агонисты-антагонисты, по ряду показателей значительно превосходившие традиционные опиаты, сохранили большинство негативных свойств и, прежде всего, их наркогенность, что послужило основанием внесения их в списки психотропных препаратов, оборот которых в РФ ограничен.
Наиболее близкий по выполнению дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола является представителем структурного класса веществ с каппа-рецепторным профилем фармакологической активности, то есть без влияния на мю- и дельта-опиоидные рецепторы, а следовательно, без наркогенного потенциала (патент на изобретение РФ №2413512, МПК A61K 31/4188, 2011 г. ).
При купировании сильного болевого синдрома, возникающего как следствие травмы или заболевания, необходимо быстрое действие препарата. Наиболее быстрый фармакологический эффект развивается, например, при парентеральном пути введения, при котором происходит попадание лекарственного вещества сначала в кровь, а затем в зону рецепторов. Чаще всего парентерально вводят инъекционные растворы, обеспечивающие быстрое поступление лекарственного вещества в кровяное русло.
Задачей изобретения является создание фармацевтической композиции с каппа-опиоидной агонистической активностью, обеспечивающей быстрое развитие фармакологического эффекта с быстрым купированием болевого синдрома при различного рода повреждениях.
Техническим результатом является фармацевтическая композиция в инъекционной лекарственной форме с каппа-опиоидной агонистической активностью, без наркогенного потенциала, проявляющая анальгетический эффект.
Технический результат достигается фармацевтической композицией, содержащей в качестве действующего начала дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола, а в качестве вспомогательных веществ корригент изотоничности, обеспечивающий изотоничность инъекционного раствора, представляющий собой по меньшей мере одно вещество, выбранное из группы: соли органических или неорганических кислот (натрия цитрат, натрия бензоат, натрия хлорид, натрия метабисульфит, натрия бромид, натрия гидрокарбонат, калия йодид, калия хлорид, кальция хлорид, магния сульфат, меди сульфат), полиолы (глюкоза, маннит, сорбит, лактоза, галактоза), аминокислоты (пролин, глицин), при следующем соотношении компонентов, мас.%:
|
При необходимости композиция может содержать дополнительно сорастворитель, корригент pH раствора, криопротектор, антиоксидант при следующем соотношении компонентов, мас.%:
|
Технический результат достигается также фармацевтической композицией, содержащей в качестве действующего начала дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола, а в качестве вспомогательных веществ сорастворитель, обеспечивающий солюбилизацию дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола в растворителе, используемом для приготовления инъекционных растворов, представляющий собой по меньшей мере одно вещество, выбранное из группы: спирт этиловый, глицерин, пропиленгликоль, бензилбензоат, бензиловый спирт, жирные масла (оливковое масло, персиковое масло), этилолеат, при следующем соотношении компонентов, мас.%:
|
При необходимости композиция может содержать дополнительно корригент изотоничности, корригент pH раствора, криопротектор, антиоксидант при следующем соотношении, мас.%:
|
В качестве корригентов изотоничности инъекционного раствора дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола в варианте 2, как и в варианте 1, может быть использовано по меньшей мере одно вещество, выбранное из группы: соли органических или неорганических кислот (натрия цитрат, натрия бензоат, натрия хлорид, натрия метабисульфит, натрия бромид, натрия гидрокарбонат, калия йодид, калия хлорид, кальция хлорид, магния сульфат, меди сульфат), полиолы (глюкоза, манит, сорбит, лактоза, галактоза); аминокислоты (пролин, глицин). Вспомогательные вещества, обеспечивающие изотоничность инъекционного раствора, позволяют получить инъекционный раствор с осмотическим давлением, равным осмотическому давлению плазмы крови. При парентеральном введении изотонического раствора минимизируется повреждение тканей, лежащих вокруг места инъекции.
В качестве корригентов pH раствора инъекционного раствора дигидрохлорида 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола в обоих вариантах может быть использовано по меньшей мере одно вещество, выбранное из группы: неорганические кислоты (хлористоводородная кислота), органические кислоты (аскорбиновая кислота, уксусная кислота, лимонная кислота), соли органических кислот (натрия цитрат, натрия ацетат).
В качестве криопротекторов инъекционного раствора дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола в обоих вариантах может быть использовано по меньшей мере одно вещество, выбранное из группы: полиолы (манит, сахароза, лактоза), глицерин, диметилсульфоксид, полиэтиленоксид, циклодекстрины (γ и β-циклодекстрины). Введение криопротекторов в состав фармацевтических композиций инъекционной лекарственной формы дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола позволяет сохранить целостность структуры молекулы действующего начала при получении лекарственной формы.
В качестве антиоксиданта инъекционного раствора дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола в обоих вариантах может быть использовано по меньшей мере одно вспомогательное вещество, выбранное из группы: соли неорганических кислот (натрия сульфит, натрия бисульфит, натрия метабисульфит, натрия сульфоксилат), серосодержащие вспомогательные вещества (тиоглицерол, тиомочевину, тиосорбитол, гидрохлорид цистеина); унитиол, формальдегид, аскорбиновую кислоту, изоаскорбиновую кислоту, гидрохинон, пропилгаллат, лецитин, токоферолы, эфиры аскорбиновой и галловой кислот. Антиоксиданты способствуют связыванию свободных радикалов и замедлению окислительно-восстановительных процессов.
В качестве сорастворителя инъекционного раствора дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола в варианте 1, как и в варианте 2, может быть использовано по меньшей мере одно вещество, выбранное из группы: спирт этиловый, глицерин, пропиленгликоль, бензилбензоат, бензиловый спирт, жирные масла (оливковое масло, персиковое масло), этилолеат. Сорастворители способствуют солюбилизации дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола в растворителе, используемом для приготовления инъекционных растворов.
Способ получения композиции заключается в смешении стерилизованных компонентов в растворителе для инъекционных растворов, например воде. В качестве метода стерилизации применяют либо ионизирующее излучение, либо ультрафильтрацию. Для получения лиофилизата раствор подвергается сушке. Лиофилизат композиции представляет собой порошок белого цвета.
Ниже приведены примеры получения фармацевтической композиции.
Пример 1. Получение композиции (лиофилизата - композиции в виде лиофилизированного порошка для инъекций), содержащей корригент изотоничности
1а. В мерную колбу объемом 1000 мл помещают 1,0 г дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 53,0 г маннита (апирогенного для приготовления инъекционных растворов). В колбу до метки наливают воду для инъекций и перемешивают. Полученный раствор фильтруют через фильтр с диаметром отверстий 0,11 мкм и одновременно разливают во флаконы темного стекла, например, объемом 2 мл. Флаконы помещают в лиофильную сушилку для получения лиофилизата для приготовления инъекционного раствора. После высушивания флаконы укупориваются резиновыми пробками, алюминиевыми колпачками под обкатку и маркируются.
Содержание действующего начала (дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола) в одном 2 мл флаконе составляет 2 мг. Раствор для инъекций из лиофилизата готовится экстемпорально. В качестве растворителя для получения раствора для инъекций используется вода для инъекций. Концентрация дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола после добавления растворителя составляет 1 мг/мл.
Соотношение компонентов в мас.% во флаконе (лиофилизат):
|
Масса лиофилизата для приготовления раствора для инъекций в одном флаконе составляет 0,108 г.
1б. Аналогично получена композиция при соотношении во флаконе, мас.%: 0,1 дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 99,90 маннита.
1в. Аналогично получена композиция при соотношении компонентов во флаконе соответственно, мас.% 99,99 дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 0,01 маннита.
Аналогично получены композиции, используя в качестве корригента изотоничности соли по меньшей мере одно вещество, выбранное из группы: органических или неорганических кислот (натрия цитрат, натрия бензоат, натрия хлорид, натрия метабисульфит, натрия бромид, натрия гидрокарбонат, калия йодид, калия хлорид, кальция хлорид, магния сульфат, меди сульфат); полиолы (глюкоза, маннит, сорбит, лактоза, галактоза); аминокислоты (пролин, глицин).
Пример 2. Получение инъекционного раствора композиции, содержащей сорастворитель, и его лиофилизата (композиции в виде лиофилизированного порошка для инъекций)
2а. В мерную колбу на 1000 мл помещают 1,0 г дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 28,9 мл пропиленгликоля (плотность при 20°C - 1,0363 г/см3). Содержимое колбы заливают водой для инъекций до метки и перемешивают. Полученный раствор барбатируют аргоном и фильтруют через фильтр с диаметром отверстий 0,11 мкм (ультрафильтрация) и одновременно расфасовывают с помощью дозатора в ампулы темного стекла сорта для инъекций. Ампулы запаивают и маркируют.
Соотношение компонентов в мас.% в ампуле:
|
Объем инъекционного раствора в одной ампуле составляет 2 мл, концентрация дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола - 1 мг/мл. Введение в состав инъекционного раствора пропиленгликоля способствует солюбилизации дигидрохлорид-2-(4-фторенил) 9-морфолиноэтилимидазо-[1,2-α]бензимидазола.
Получение лиофилизата: в мерную колбу на 1000 мл помещают 1,0 г дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 28,9 мл пропиленгликоля (плотность при 20°С - 1,0363 г/см3). Содержимое колбы заливают водой для инъекций до метки и перемешивают. Полученный раствор фильтруют через фильтр с диаметром отверстий 0,11 мкм и одновременно разливают во флаконы темного стекла объемом 2 мл. Флаконы помещают в лиофильную сушилку для получения лиофилизата для приготовления инъекционного раствора. После высушивания флаконы укупориваются резиновыми пробками, алюминиевыми колпачками под обкатку и маркируются.
Соотношение компонентов в мас.% во флаконе после высушивания - дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола: пропиленгликоль (сорастворитель) - 3,23:96,77 мас.%.
2б. Аналогично получена композиция при соотношении компонентов (действующее начало: пропиленгликоль) соответственно мас.% 0,1:99,90.
2в. Аналогично получена композиция при соотношении компонентов (действующее начало: пропиленгликоль) соответственно мас.% 99,99:0,01.
Аналогично получены композиции, используя вместо пропиленгликоля в качестве сорастворителя по меньшей мере одно вещество, выбранное из группы: спирт этиловый, глицерин, бензилбензоат, бензиловый спирт, жирные масла (оливковое масло, персиковое масло), этилолеат.
Пример 3. Получение инъекционного раствора композиции, содержащей корригент рН и антиоксидант, и его лиофилизата
В мерную колбу на 1000 мл помещают 1,0 г дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола, 9,0 г натрия хлорида, 1,0 г унитиола. Содержимое колбы наполовину заливают свежепрокипяченой водой для инъекций и встряхиваем до полного растворения кристаллов лекарственного вещества, затем приливают 1 мл 10% раствора хлористоводородной кислоты, перемешивают. Свежепрокипяченой водой для инъекций доливают содержимое колбы до метки. Полученный раствор барбатируют аргоном и фильтруют через фильтр с диаметром отверстий 0,11 мкм (ультрафильтрация) и расфасовывают с помощью дозатора в ампулы темного стекла сорта для инъекций. Ампулы запаивают и маркируют.
Соотношение компонентов в мас.% в ампуле:
|
Объем инъекционного раствора в одном флаконе составляет 2 мл, концентрация дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола - 1 мг/мл. Введение в состав инъекционного раствора натрия хлорида приводит к получению изотоничного инъекционного раствора. Хлористоводородная кислота понижает рН раствора, что стабилизирует структуру дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и предотвращает образование примесей. Унитиол является антиоксдантом и способствует замедлению окислительных процессов дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола при хранении.
Получение лиофилизата: Аналогично вышеописанному полученный раствор разливают не в ампулы, а во флаконы темного стекла объемом 2 мл. Флаконы помещают в лиофильную сушилку для получения лиофилизата для приготовления инъекционного раствора. После высушивания флаконы укупориваются резиновыми пробками, алюминиевыми колпачками под обкатку и маркируются.
Соотношение компонентов во флаконе после высушивания в мас.%:
|
Аналогично получают композицию при соотношении компонентов во флаконе после высушивания в мас.%:
|
Аналогично получены композиции, используя вместо натрия хлорида в качестве корригента изотоничности по меньшей мере одно вещество, выбранное из группы: соли органических или неорганических кислот (натрия цитрат, натрия бензоат, натрия хлорид, натрия метабисульфит, натрия бромид, натрия гидрокарбонат, калия йодид, калия хлорид, кальция хлорид, магния сульфат, меди сульфат); полиолы (глюкоза, маннит, сорбит, лактоза, галактоза); аминокислоты (пролин, глицин).
Аналогично получены композиции, используя вместо хлористоводородной кислоты в качестве корригента рН по меньшей мере одно вещество, выбранное из группы: органические кислоты (аскорбиновая кислота, уксусная кислота, лимонная кислота), соль органической кислоты (натрия цитрат, натрия ацетат).
Аналогично получены композиции, используя вместо унитиола в качестве антиоксиданта по меньшей мере одно вспомогательное вещество, выбранное из группы: соли неорганических и органических кислот (натрия сульфит, натрия бисульфит, натрия метабисульфит, натрия сульфоксилат); серосодержащее вспомогательное вещество (тиоглицерол, тиомочевину, тиосорбитол, гидрохлорид цистеина); формальдегид; аскорбиновую кислоту; изоаскорбиновую кислоту; гидрохинон; пропилгаллат; лецитин; токоферолы; эфиры аскорбиновой и галловой кислот.
Пример 4. Получение лиофилизата композиции, содержащей криопротектор
В мерную колбу на 1000 мл помешают 1,0 г дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола и 0,5 г гидроксипропилированного β-циклодекстрина (1:1 в мольном соотношение компонентов), заливают водой для инъекций до метки. Полученный раствор оставляют на несколько суток, затем фильтруют через фильтр с диаметром отверстий 0,11 мкм и одновременно фасуют во флаконы темного стекла объемом 2 мл. Флаконы подвергают лиофильному высушиванию до значения влаги в лиофилизате не превышающего 1%. Затем в каждый флакон добавляют 0,106 г маннита. Флаконы укупоривают (резиновыми пробками и алюминиевыми колпачками под обкатку) и маркируют.
Соотношение компонентов в мас.% во флаконе после высушивания:
|
Масса содержимого одного флакона составляет 0,109 г. Раствор готовится экстемпорально перед применением. β-циклодекстрин является стерическим стабилизатором молекулы дигидрохлорида 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола и способствует его устойчивости в растворе за счет образования комплекса включения.
Аналогично получена композиция при соотношении компонентов в мас.% во флаконе после высушивания:
|
Аналогично получены композиции, используя вместо ГП-β-циклодекстрина в качестве криопротектора по меньшей мере одно вещество, выбранное из группы: полиолы (маннит, сахароза, лактоза); глицерин; диметилсульфоксид; полиэтиленоксид; циклодекстрины (γ-циклодекстрин).
Фармакокинетические свойства соединения в инъекционной лекарственной форме
Методы исследования фармакокинетических свойств соединения
В процессе изучения фармакокинетических свойств соединения использовался физико-химический метод определения в биоматериале концентрации исследуемого вещества - высокоэффективная жидкостная хроматография. Эксперименты проводились на кроликах породы «Шиншилла» массой 2-2,5 кг. Субстанция и лекарственная форма вводились внутривенно и подкожно. За двенадцать часов до проведения экспериментов животные лишались доступа к пище без ограничения потребления воды.
Количественное определение изучаемого соединения проводилось с помощью высокоэффективной жидкостной хроматографии на компьютеризованной системе Shimadzu (Япония) с УФ-детектором при λ=205 нм на аналитической колонке SUPELCOSIL LC-18 (5 мкм; 100 мм × 4,6 мм). Мобильная фаза включала ацетонитрил (J.T. Baker, США) и буферную систему, состоящую из однозамещенного фосфата калия 50 мМ pH=5,0. в соотношении 1:1 [Смирнова Л.А., Ращенко А.И,. Рябуха А.Ф, Кузнецов К.А, Сучков Е.А. // Количественное определение соединения РУ-1205 в биологических пробах/ Волгоградский научно-медицинский журнал, 2/2012. - С. 15-17].
Зависимость площадей пиков от концентрации изучаемого соединения анализировались методом регрессионного анализа. Статистическая обработка результатов проводилась при помощи компьютерной программы Excel [Фирсов А.А., Жердев В.П. и др. // Методические рекомендации по изучению анальгетической активности лекарственных средств / Руководство по проведению доклинических исследований лекарственных средств под ред. В.П. Фисенко. М., 2012. - С. 843-851].
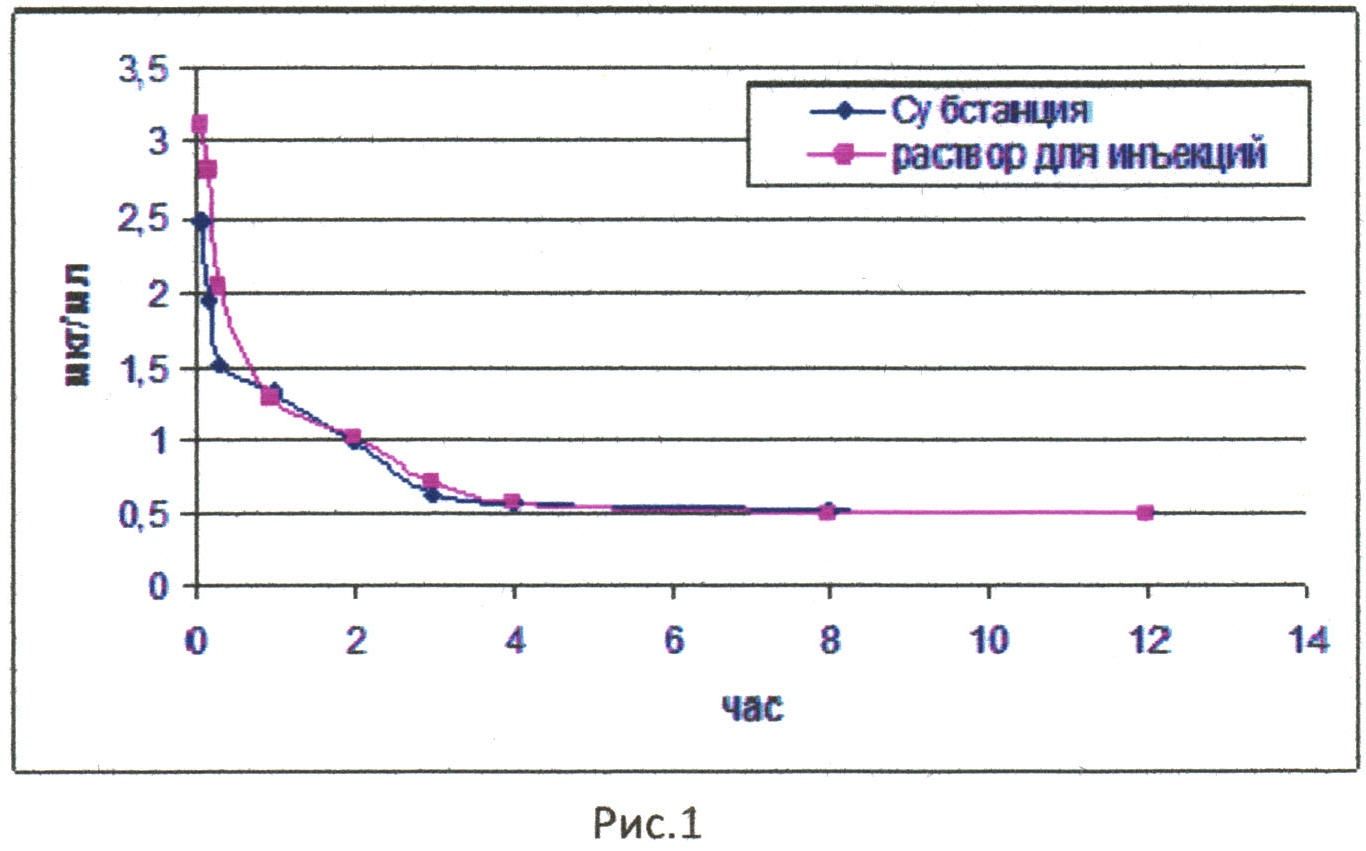
Фармакокинетические свойства субстанции и инъекционной лекарственной формы соединения при однократном внутривенном введении представлены на рис. 1. По оси ординат показаны значения содержания соединения в крови кроликов после внутривенного введения субстанции и раствора для инъекций в дозе 25 мг/кг (раствор для инъекций изготовлен в соответствии с примером 1а). По оси абсцисс указано время с момента введения изучаемых веществ.
В таблице 1 представлены фармакокинетические параметры соединения у кроликов при внутривенном введении субстанции и раствора для инъекций в дозе 10 мг/кг.
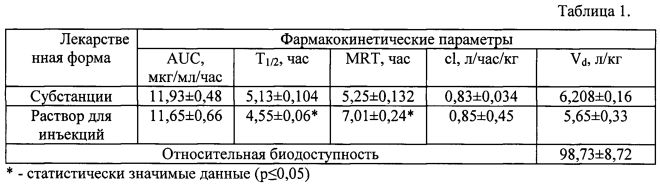
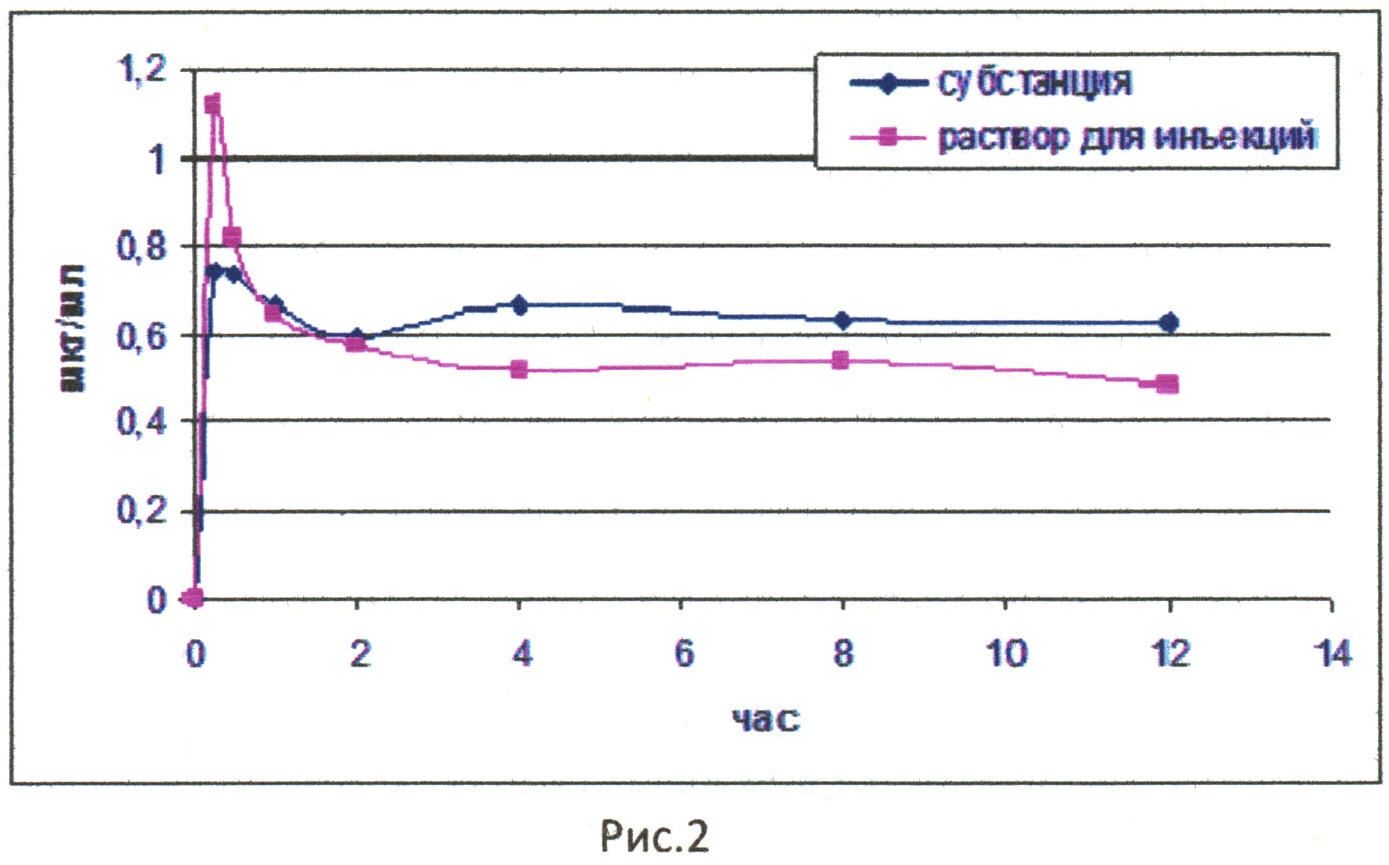
При проведении исследования раствора для инъекций при внутривенном введении не выявлено различий между фармакокинетическими кривыми (рис. 1). Раствор для инъекций дольше циркулирует в крови кроликов по сравнению с субстанцией, о чем свидетельствует статистически значимое (р≤0,01) увеличение периода полувыведения и среднего времени удерживания одной молекулы препарата в организме животного. При этом относительная биодоступность близка к 100% (табл. 1). На основании приведенных данных установлено, что значение площади под кривой после введения лекарственной формы не значительно уступает данному показателю после введения субстанции (рис. 2).
Фармакокинетические свойства субстанции и инъекционной лекарственной формы соединения при однократном подкожном введении представлены на рис. 2, где отражено содержание соединения в крови кроликов после подкожного введения раствора для инъекций по сравнению с субстанцией.
Фармакокинетические параметры соединения у кроликов при подкожном введении субстанции и раствора для инъекций в дозе 25 мг/кг представлены в таблице 2.
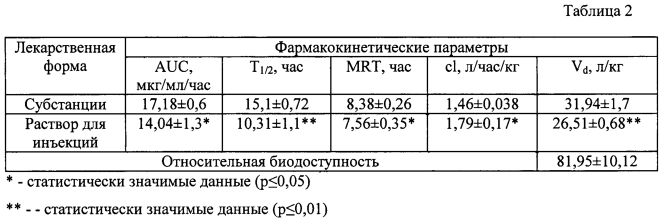
На основании исследования фармакокинетических свойств раствора для инъекций при подкожном введении были выявлены некоторые различия между субстанцией и лекарственной формой (рис. 2). Так, было выявлено, что площадь под кривой соединения в виде лекарственной формы незначительно уступает данному показателю соединения в виде субстанции. Период полувыведения, характерный для субстанции соединения, выше приблизительно на 30% относительно лекарственной формы. Среднее время удерживания, клиренс и кажущийся объем распределения статистически значимо отличаются у субстанции и лекарственной формы, но абсолютные значения данных параметров практически одинаковы. Выявлено, что для инъекционной лекарственной формы при подкожном введении характерна высокая относительная биодоступность.
ОБЕЗБОЛИВАЮЩИЕ СВОЙСТВА СОЕДИНЕНИЯ В ИНЪЕКЦИОННОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ.
Методы исследования анальгетической активности соединения
Тест горячей пластины [Kitchen I. Assessment of the hot-plate antinociceptive test in mice. A new method for the statistical treatment of graded data. / Kitchen I, Crowder M. // J Pharmacol Methods. - 1985. Vol. 13, №1. - P. 1-7] позволяет оценить наличие центрального механизма обезболивающего действия и основан на поведенческих реакциях, контролируемых супраспинальными структурами, в ответ на болевое воздействие [Воронина Т.А., Гузеватых Л.С. // Методические рекомендации по изучению анальгетической активности лекарственных средств / Руководство по проведению доклинических исследований лекарственных средств под ред. В.П. Фисенко. М., 2012. - С. 202]. Экспериментальное исследование проводили на мышах-самцах. Изучаемое соединение вводили в дозах 1 мг/кг. Через различные временные интервалы после введения изучаемого соединения животное помещали на разогретую до 55°C медную пластину, окруженную пластиковым цилиндром. Фиксировали латентное время ноцицептивной реакции в виде облизывания задних лап, которая появляется у животных с достижением порога болевой чувствительности [D. le Bars, М. Gozariu. Animal models of nociception / D. le Bars, M. Gozariu, S.W. Cadden. //, Pharmacol. Rev. - 2001. Vol. 53 №4 - Р. 611]. Критерием анальгетического эффекта считали статистически значимое увеличение латентного периода реакции после введения вещества. Статистическую обработку данных проводили с использованием критериев Краскела-Уоллиса и Манна-Уитни.
В таблице 3 представлено влияние соединения дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола при подкожном введении в дозе 1 мг/кг на антиноцицептивные эффекты в тесте «Горячая пластина» (М±m) в виде субстанции и инъекционной формы, полученной по примеру 1а.
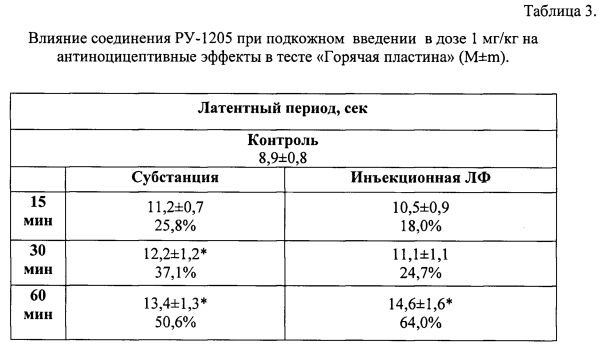
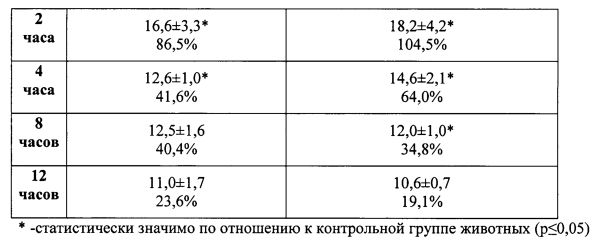
Для примера 1б латентный период через 60 мин составляет 14,8±1,2 (66,3%), через 120 мин 18,6±1,4 (109,0%).
Для примера 1в латентный период через 60 мин составляет 14,1±0,9 (58,4%), через 120 мин 18,0±1,2 (102,2%).
Для примера 2б латентный период через 60 мин составляет 14,7±1,4 (65,2%), через 120 мин 18,4±1,0 (106,7%).
Для примера 2в латентный период через 60 мин составляет 13,9±1,1 (56,2%), через 120 мин 18,1±1,3 (103,4%).
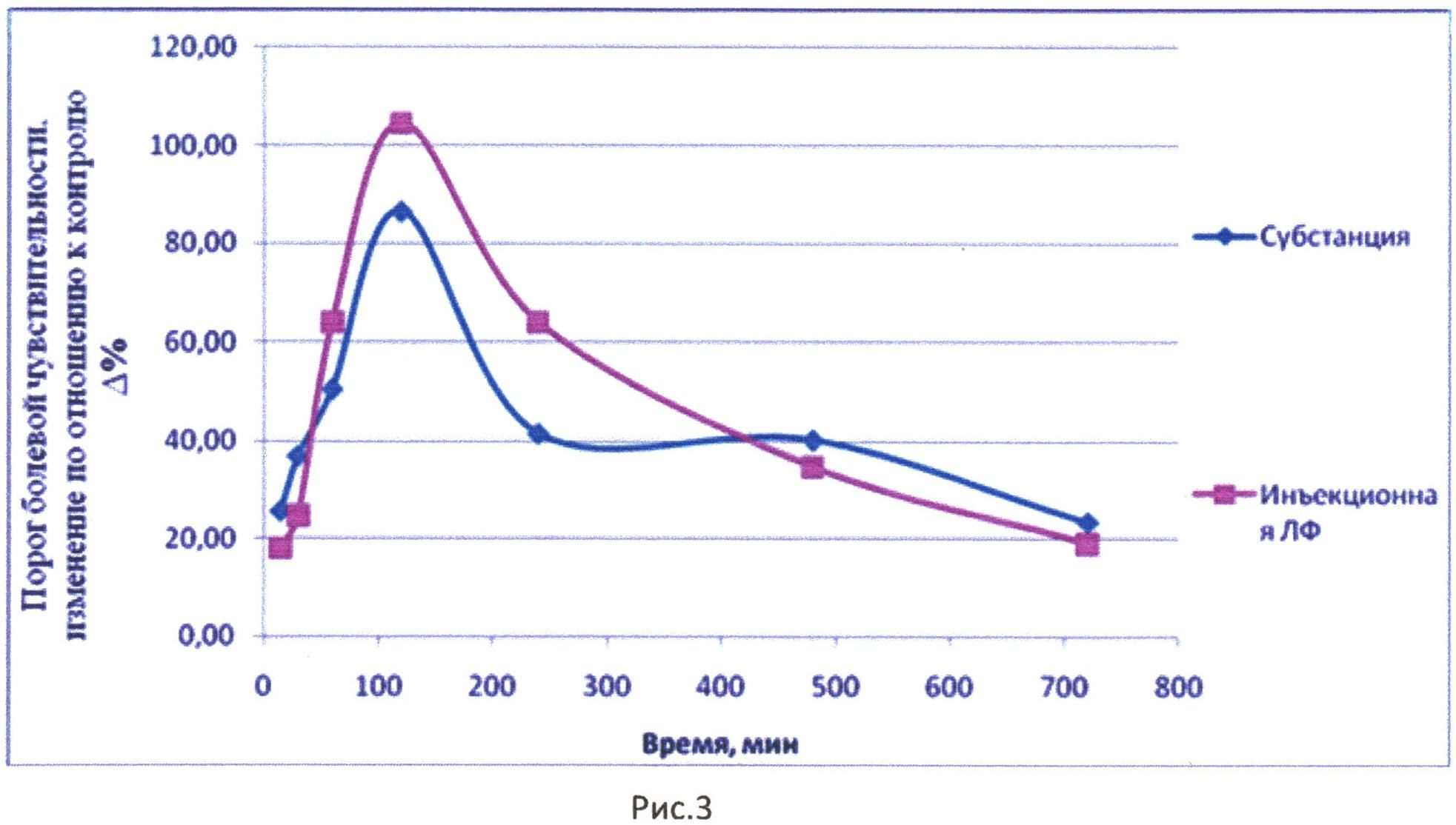
На рис. 3 представлена продолжительность обезболивающего действия соединения при подкожном введении в дозе 1 мг/кг в тесте «Горячая пластина».
При введении субстанции и инъекционной лекарственной формы соединения наблюдалось медленное возрастание обезболивающей активности с пиком максимального эффекта через 2 часа после их введения. Далее следовало медленное снижение анальгетической активности субстанции и инъекционной лекарственной формы. Продолжительность действия лекарственной формы сохранялась до 8 часов.
По фармакодинамическим показателям статистически значимых различий в анальгетической активности между субстанцией и инъекционной лекарственной формой выявлено не было.
ЗАВИСИМОСТЬ ФАРМАКОДИНАМИЧЕСКИХ СВОЙСТВ СОЕДИНЕНИЯ ОТ ФАРМАКОКИНЕТИКИ ПРИ ОДНОКРАТНОМ ПОДКОЖНОМ ВВЕДЕНИИ.
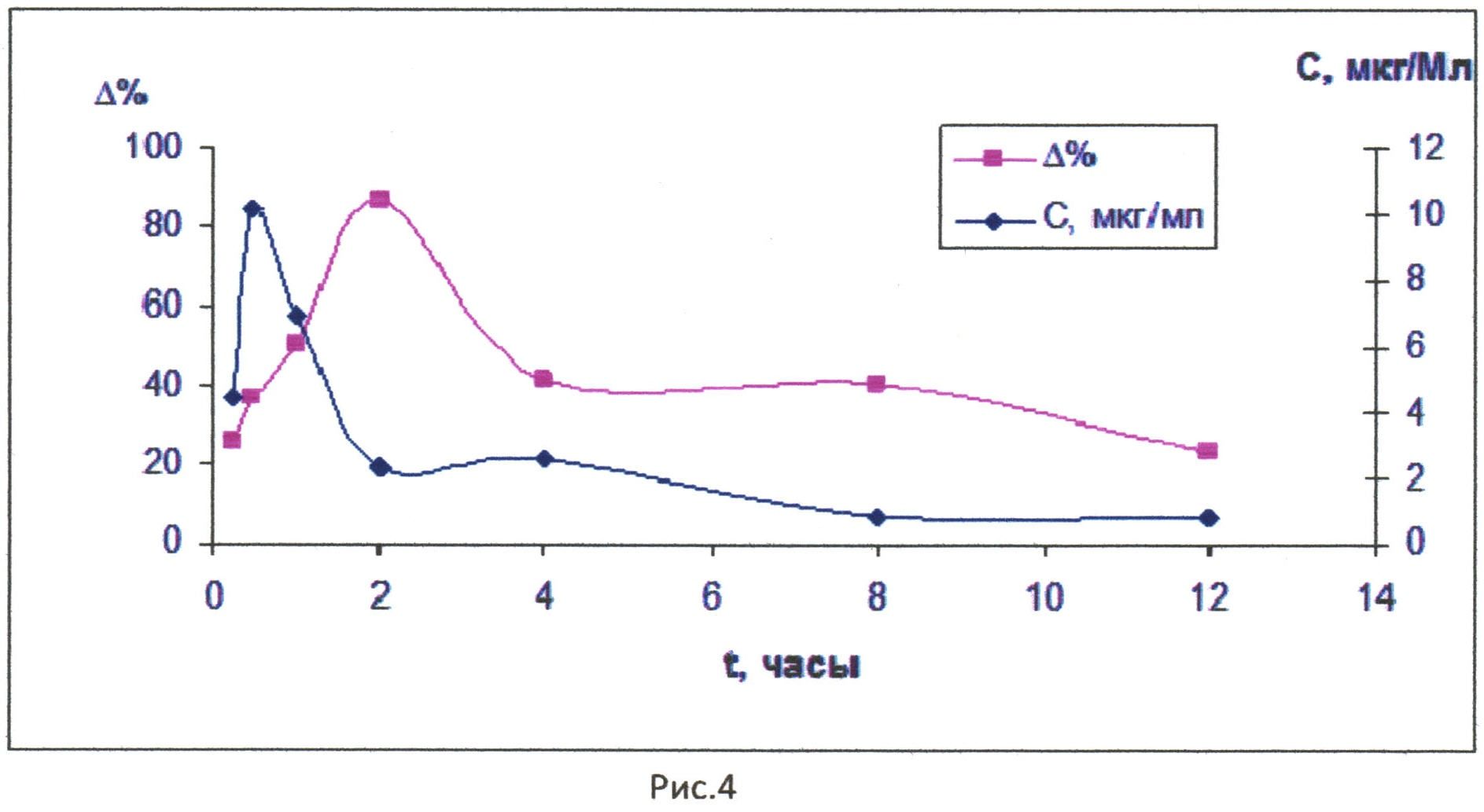
При сопоставлении фармакокинетических свойств и фармакодинамических кривых следует отметить, что не наблюдается прямой зависимости изменения порога болевой чувствительности от концентрации соединения при подкожном введении. Возможно, это связано с тем, что при подкожном введении изучаемого соединения наблюдается резкое падение его концентрации в крови в первые минуты после введения, что может объясняться как его быстрым распределением в органы с высокой степенью васкуляризации, так и активным метаболизмом. Падение концентрации соединения в крови сопровождается нарастанием фармакологического эффекта. Это следует из рис. 4, на котором представлена зависимость порога болевой чувствительности (в % по отношению к контролю) от содержания соединения в плазме крови от времени после подкожного введения. По оси абсцисс представлено время (часы), по левой оси ординат - концентрация соединения в плазме крови (мкг/мл), по правой оси ординат - изменение порога болевой чувствительности (Δ % по отношению к контролю).
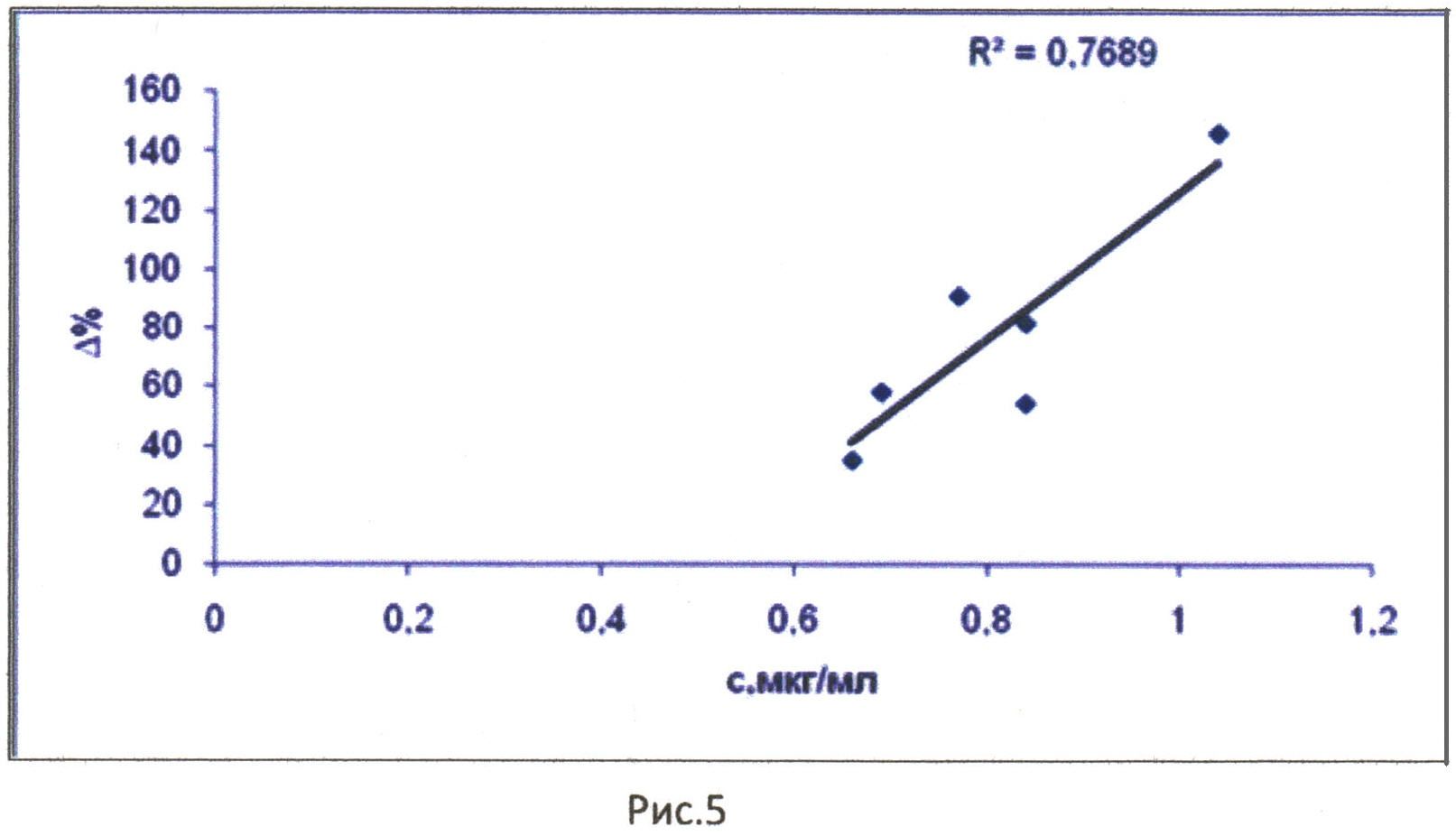
На рис. 5 представлена зависимость изменения порога болевой чувствительности (в % по отношению к контролю) от концентрации соединения в плазме крови после подкожного введения. R2 - величина достоверности аппроксимации. По оси абсцисс - концентрация соединения в плазме крови (мкг/мл), по оси ординат - изменение порога болевой чувствительности.
Корреляционная зависимость имеет сложный вид, коэффициент достоверности аппроксимации составляет 0,7689 (рис. 5). После 4-го часа характер корреляционной кривой меняется. Наблюдается зависимость между изменением порога болевой чувствительности и концентрацией соединения в плазме крови. Это можно объяснить наступлением равновесия между процессами распределения и элиминации (рис. 4).
Аналогичные результаты получены для композиций состава, мас.%:
* дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола - 7,50, натрия хлорид (корригент изотоничности) - 90,17, хлористоводородная кислота (корригент рН) - 0,045, унитиол (антиоксидант) - 2,25, полученной по примеру 3 (лиофилизат),
* дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)-имидазо[1,2-α]бензимидазола - 1,83, ГП-β-циклодекстрин (криопротектор) - 48,00, маннит (корригент изотоничности) - 50,17, полученной по примеру 4 (лиофилизат).
Таким образом, предлагаемая композиция проявляет анальгетический эффект.