Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ 4-{ [4-(3,3-ДИОКСИДО-1,3-БЕНЗОКСАТИОЛ-6-ИЛ)АРИЛОКСИ]МЕТИЛ} ПИПЕРИДИНЫ КАК АГОНИСТЫ РЕЦЕПТОРОВ GPR119, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Изобретение относится к новым физиологически активным веществам, новым агонистам рецепторов GPR119, активным компонентам для фармацевтических композиций, к фармацевтическим композициям и лекарственным средствам, содержащим замещенные 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидины в качестве агонистов рецепторов GPR119, которые стимулируют синтез и выделение инкритинов и повышают выделение инсулина; способу лечения метаболических заболеваний, таких как диабет, ожирение, метаболический синдром, а также сопутствующих им кардиоваскулярных и нейродегенеративных заболеваний.
По данным Всемирной Организации Здравоохранения в 2008 г. 347 миллионов человек во всем мире были больны диабетом [Информационный бюллетень ВОЗ №312. Сентябрь 2012 г.], при этом число больных более чем удвоилось по сравнению со 153 миллионами в 1980 году [Danaei G. et al. National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2-7 million participants. Lancet. 2011; 378(9785): 31-40]. Распространение диабета происходит ускоряющимися темпами. В 2010 году диабет был зарегистрирован у 6.4% мирового населения, в 2030 прогнозируется 7.7% больных в мире. [Farag Y, Gaballa M. Diabesity: an overview of a rising epidemic. Nephrol Dial Transplant 2011; 26: 28-35]. Особую опасность представляет диабет в сочетании с избыточным весом (ожирением или тучностью), который является ежегодной причиной смерти более 280 тысяч человек в США. Общепризнанным стал новый научно-медицинский термин "Diabesity" (в русском варианте - «Диабетучность»), означающий сочетание двух взаимосвязанных патологий: диабета и ожирения. В настоящее время диабетучность рассматривается как одна из самых серьезных медицинских проблем человечества, ставшая, фактически, первой неинфекционной эпидемией [Schmidt MI, Duncan ВВ. Diabesity: an inflammatory metabolic condition. Clin Chem Lab Med. 2003; 41: 1120-1130], [DangMN, Hashem BE-S. The epidemiology of obesity. Gastroenterol Clin North Am. 2010; 39: 1-7]. Широкое распространение диабетучность приобрела и стала стремительно распространяться в течение прошлого столетия. Основными причинами этой эпидемии считают малоподвижный образ жизни и неправильную диету [Zimmet Ρ., Alberti KG, Shaw J. Global and societal implications of the diabetes epidemic. Nature 2001; 414: 782-787], а также генетическую предрасположенность [Ling С., Groop L. Epigenetics: a molecular link between environmental factors and type 2 diabetes. Diabetes 2009; 58: 2718-2725]. Диабетучность является также интегральной составляющей метаболического синдрома.
В настоящее время такие простые способы лечения диабетучности, как специальные диеты, не приводят к решению проблемы - 98% потерявших вес приобретают его с избытком в течение 5 лет. Заметный эффект имеют различные хирургические операции в борьбе с диабетучностью (bariatric surgery), однако они сопряжены с большим числом побочных эффектов, связанных с нарушением гормонального гомеостаза [Tharakan G., Tan Τ., Bloom S. Emerging therapies in the treatment of ′diabesity′: beyond GLP-1. Trend Pharm Sci. 2011; 32: 8-15]. Многочисленные усилия фармацевтических компаний по созданию высокоэффективных средств лечения диабета (диабетучности) до настоящего времени не привели к заметным успехам. Несмотря на то, что в настоящее время более 130 новых лекарственных кандидатов проходят различные испытания, к применению допущены не более десяти препаратов. Клинические испытания большого числа кандидатов были приостановлены из-за оказываемых ими серьезных побочных эффектов. Так, например, самое многообещающее антидиабетическое лекарство "Avandia" (Rosiglitazone - агонист PPARgamma рецепторов), оказалось, увеличивает риск сердечного приступа и остановки сердца [Avorn J. Two centuries of assessing drug risks. New Engl J Med. 2012; 193-197]. Основные причины постоянных неудач исследователей заключаются в недостаточном понимании сложнейшей картины заболевания, в особенности, наличия его многочисленных сигнальных механизмов. Воздействие только на одну эффекторную мишень приводит к «ускользанию» патологического процесса за счет активизации других механизмов. Поэтому одним из основных направлений в разработке антидиабетических лекарств в настоящее время является поиск фармакологических агентов, способных приостановить развитие патологии.
Недавно были выделены несколько непептидных G-протеин сдвоенных рецепторов (GPCRs). Среди них особое внимание привлек G-протеин сдвоенный рецептор 119 (GPR.119), эспрессия которого отмечается на клетках, продуцирующих инкритины, и поэтому он рассматривается как возможная мишень для разработки лекарств по терапии диабета второго типа. Активация GPR.119 увеличивает внутриклеточное накопление сАМР, ведущее к увеличению секреции инсулина β-клетками поджелудочной железы в ответ на нагрузку глюкозой и выработку инкритинов К и L-клетками. Предклинические и клинические исследования агонистов GPR119 поддерживают мнение, что агонисты GPR119 могут быть приемлемы в качестве кандидатов на терапию диабета второго типа. Эти ислледования указывают на то, что орально-биодоступный, активный, селективный синтетический агонист GPR119 может:
а) Понижать сахар крови без выраженной гипогликемии
б) Замедлять развитие диабета второго типа
в) Снижать аппетит и вес тела. [Fyfe (2008) GPR119 agonists as potential new oral agents for the treatment of type 2 diabetes and obesity. Expert Opin Drug Discov. j. 3:403-413].
В последние годы появились многочисленные патенты от различных фармкомпаний на агонисты GPR119, и несколько компаний инициировало клинические испытания по терапии диабета второго типа, см. Таблицу 1.
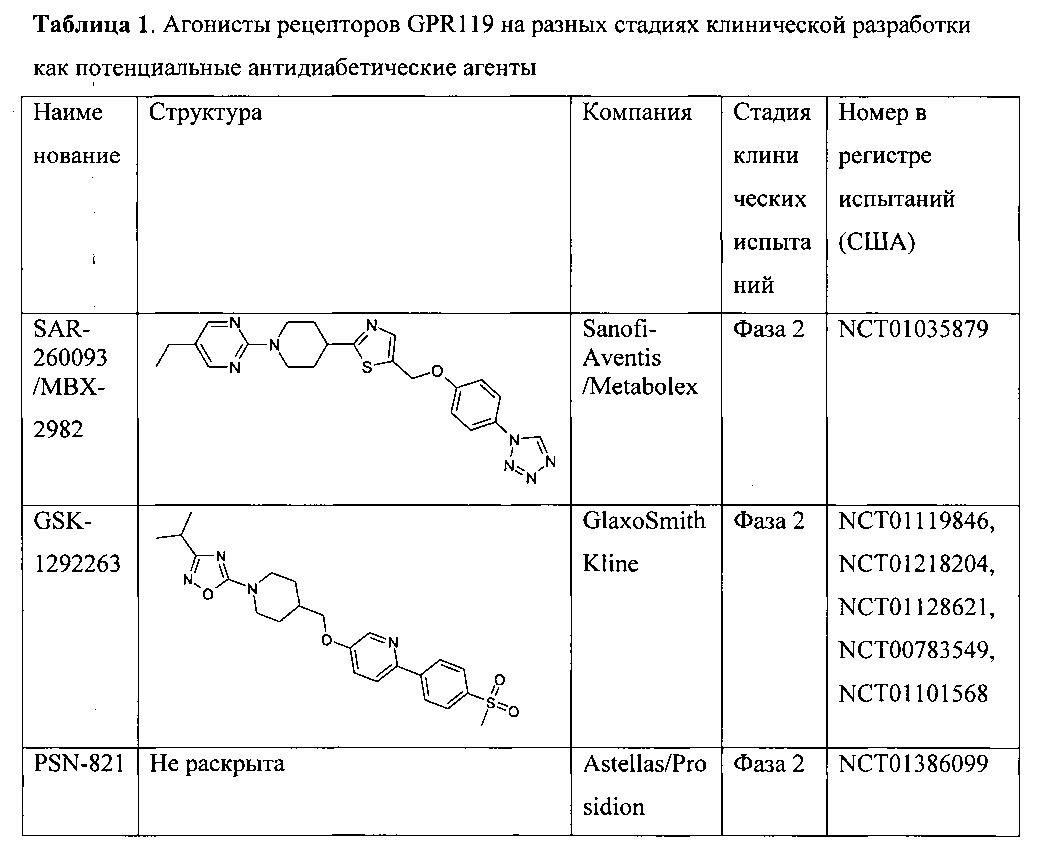
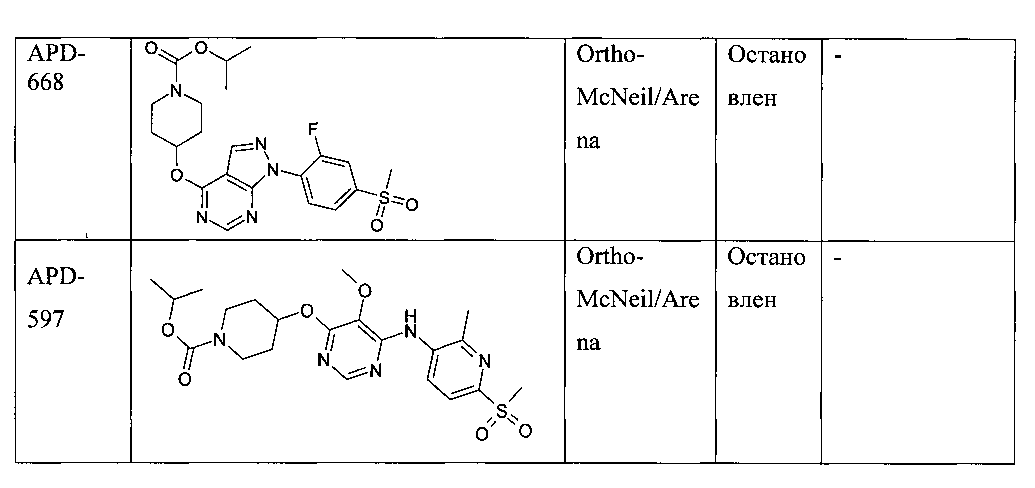
Таким образом, поиск эффективных агонистов рецепторов GPR119 представляется исключительно важной, актуальной и многообещающей задачей.
С целью разработки новых высокоэффективных антидиабетических препаратов авторами данного изобретения выполнены широкие скрининговые исследования in vitro низкомолекулярных соединений различных классов, были обнаружены соединения-хиты и соединения-лидеры, относящиеся к нескольким семействам гетероциклических соединений, затем проводились направленные модификации многих позиций обнаруженных структур и их тестирование, установлена взаимосвязь «структура-активность» и выбраны наиболее перспективные ряды. В результате синтезирована серия новых производных, которые являются оригинальными и высокоэффективными агонистами рецепторов GPR119. Полученные физиологически активные гетероциклические соединения включают новые производные 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидинов, которые ранее не были описаны в литературе. До настоящего времени способность указанных соединений проявлять агонистические свойства по отношению к GPR119 рецепторам также не была известной.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Агонисты» означают соединения, которые, связываясь с рецепторами определенного типа, активно способствуют передаче этими рецепторами свойственного им специфического сигнала и тем самым вызывают биологический ответ клетки.
«Азагетероцикл» означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. «Разветвленная» означает, что алкильная цепь имеет один или несколько «низших алкильных» (С1-С5)алкильных заместителей. Алкил может иметь заместители. Предпочтительными алкильными группами являются низший (С1-С5) алкил или метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, циклопропилметил, циклобутилметил, циклопентилметил, н-пентил, 2-пентил, 3-пентил, неопентил, н-гексил, циклогексил.
«Алифатический» радикал означает радикал, полученный удалением атома водорода из неароматической С-Н связи. Алифатический радикал может дополнительно содержать заместители - алифатические или ароматические радикалы, определенные в данном разделе. Представители радикалов включают алкил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероциклил, гетероцикленил, аралкенил, аралкилоксиалкил, аралкилоксикарбонилалкил, аралкил, аралкинил, аралкилоксиалкенил, гетероаралкенил, гетероаралкил, гетероаралкилоксиалкенил, гетероаралкилоксиалкил, аннелированный арилциклоалкил, аннелированный гетероарилциклоалкил, аннелированный арилциклоалкенил, аннелированный гетероарилциклоалкенил, аннелированный арилгетероциклил, аннелированный гетероарилгетероциклил, аннелированный арилгетероцикленил, аннелированный гетероарилгетероцикленил.
«Алкенил» означает алифатическую линейную или разветвленную углеводородную группу, содержащую от 2 до 12 атомов углерода и включающую углерод-углеродную двойную связь. «Разветвленная» означает, что к линейной алкенильной цепи присоединены один или несколько низших алкильных групп, таких как метил, этил или пропил. К алкенильной группе может быть присоединена одна или нексолько ароматических, циклических или гетероциклических систем.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Антагонисты» означают лиганды, которые связываются с рецепторами определенного типа и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами и тем самым блокируют передачу специфического рецепторного сигнала.
«Алкилокси» или «Алкокси» означает АлкилО- группу, в которой алкил определен в данном разделе. Предпочтительными алкоксигруппами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси.
«Аминогруппа» означает R′R′′N- группу, замещенную или незамещенную необязательно одинаковыми заместителями R′ и R′′.
«Алкилтио» означает алкил-S группу, в которой алкильная группа определена в данном разделе.
«Аминокарбонил» означает C(=O)N Rk aRk+1 a - группу, незамещенную или замещенную необязательно одинаковыми заместителями карбамоильными Rk a и Rk+1 a, включая водород, метил, циклоалкил, который с атомом азота образует пирролидиновый цикл.
«Аннелированный цикл» (конденсированный цикл) означает би- или полициклическую систему, в которой аннелированный цикл и цикл или полицикл, с которым он аннелирован, имеют как минимум два общих атома. Аннелированными могут быть ароматические, неароматические системы и гетероциклические системы.
«Аралкил» означает алкильную группу, замещенную одним или несколькими арильными группами, в которой значения арил и алкил определены в данном разделе. Примерами аралкильных групп являются необязательно замещенные бензил, фенетил, фенпропил.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимуществено от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными.
«Ароматический цикл» (ароматическая система) означает планарную циклическую систему, в которой все атомы цикла участвуют в образовании единой системы сопряжения, включающей, согласно правилу Хюккеля, (4n+2) π-электронов (n - целое неотрицательное число). Примерами ароматических циклов являются бензол, нафталин, антрацен и т.п. В случае «гетероароматических циклов» в системе сопряжения участвуют π-электроны и р-электроны гетероатомов, их суммарное число также равняется (4n+2). Примерами таких циклов являются пиридин, тиофен, пиррол, фуран, тиазол и т.п. Ароматический цикл может иметь один или более «заместителей циклической системы» и может быть аннелирован с неароматическим циклом, гетероароматической или гетероциклической системой.
«Ацильная группа» (Ацил) означает Н-С(=O)-, необязательно замещенные C1-С5алкил-С(=O)-, С1-С5алкенил-С(=O)-, С1-С5циклоалкил-С(=О)-, (предпочтительно циклопропил-С(=О)-, циклобутил-С(=О)-); гетероциклил-С(=О)-, (предпочтительно 2-метилфуран), арил-С(=О)- (ароил), аралкил-С(=О)-, (предпочтительно 3-фенилпентан-С(=О)-), гетероарил-С(=О)- (гетероароил), гетероарилалкил-С(=О)- группы, в которых С1-С5алкил-, С1-С5алкенил-, С1-С5циклоалкил-, гетероциклил-, арил-, аралкил, гетероарил-, гетероарилалкил, метокси-группа могут иметь заместители, см. «заместители циклической системы», «замещенный алкил», «замещенный алкенил», «заместители гетероциклической системы», определенные в данном разделе.
«Гетероарил» (гетарил) означает ароматическую моноциклическую или полициклическую систему, включающую от 5 до 14 атомов углерода, предпочтительно от 5 до 10, в которой один или больше атомов углерода замещены гетероатомом или гетероатомами, такими как азот, сера или кислород. Приставка «аза», «окса» или «тиа» перед «гетероарил» означает наличие в циклической системе атома азота, атома кислорода или атома серы, соответственно. Атом азота, находящийся в гетероариле может быть окислен до N-оксида. Гетероарил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Предпочтительно пирролил, фуранил, тиенил, пиридинил, пирролидин, имидазолил, оксазолил, бензотиадиазол, индолил, азаиндолил, бензимидазолил, бензотиазолил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидинил, пирролопиридинил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, тиенопирролил, фуропирролил и др.
«Гетероциклил» означает ароматическую или неароматическую насыщенную или частично насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 4 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера, фосфор. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы, соответственно. Гетероциклил может иметь один или несколько заместителей, которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидинил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксан-2-ил, тетрагидрофурил, тетрагидротиенил и др.
«Замещенный алкенил» - замещенный алкенил может также иметь один или несколько одинаковых или различных заместителей, включая галоген, алкенилокси, ароил, гетероароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонил, гетероаралкилокси и т.д. Предпочтительными алкенильными группами являются этенил, пропенил, н-бутенил, изобутенил, 3-метилбут-2-енил, н-пентенил и н-гексенил.
«Замещенный алкил» - замещенный алкил может иметь один или несколько одинаковых или различных заместителей, включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, гетероароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонил, гетероаралкилокси, Rk aRk+1 aN-, где Rk a и Rk+1 a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например, атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a и Rk+1 a вместе с атомом N, с которым они связаны, образуют через Rk a и Rk+1 a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными «алкильными заместителями» являются арил, гетероарил, гетероциклил, гидрокси, С1-С5 алкокси, С1-С5 алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. А именно: гидроксигруппа, замещенная фторфенилом оксигруппа, моно- и диС1-С5алкиламиногруппа (диметиламиногруппа, метиламиногруппа), C1-С5алкилоксикарбонильная группа (этилоксикарбонил), фенил, хлорфенил, фторфенил, C1-С5алкил (метил) замещенный фенил, С1-С5циклоалкил (циклопентил) замещенный фенил, С1-С5алкокси замещенный фенил (метоксифенил), тиофенил, фуранил, пирролидин.
«Заместители циклической системы» могут быть представителями арильных групп, предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. Предпочтительно заместителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный С1-С5алкил, необязательно замещенный циклоС1-С5алкил, С1-С5алкен, гидроксигруппа, С1-С5алкилоксигруппа (метокси, этокси, пропокси, диэфир этиленгликоль, диэфир метандиола), цианогруппа, С1-С5алкилоксикарбонил (метил, этил), алкилтиогруппа (метилтио), карбоксигруппа, аминокарбонил (см. «аминокарбонил»), фенил аннелированный с 5-7-членным насыщенным циклом, содержащим 1-3 гетероатома (атомы азота, кислорода и серы предпочтительно).
«Заместители гетероциклила» могут быть представителями арильных групп предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. Предпочтительно земестителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный С1-С5алкил, необязательно замещенный цикло С1-С5алкил, С1-С5алкен, гидроксигруппа, С1-С5алкилоксигруппа (метокси, этокси, пропокси, диэфир этиленгликоля, диэфир метандиола), цианогруппа, С1-С5алкилоксикарбонил (метил, этил), алкилтиогруппа (метилтио), карбоксигруппа, аминокарбонил (см. «аминокарбонил»), фенил аннелированный с 5-7-членным насыщенным циклом, содержащим 1-3 гетероатома (атомы азота, кислорода и серы предпочтительно).
«Заместитель» означает химический радикал, который присоединяется к молекулярному остову (скэффолду, фрагменту), например, «заместитель алкильный», «заместитель аминогруппы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определено в данном разделе.
«Замещенная амидиновая группа» означает R′R′′N-(C=NR′′′)- группу, в которой заместители R′, R′′ и R′′′ могут быть представлены необязательно замещенными алкилом, алкенилом, алкинилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. R′R′′N-фрагмент амидиновой группы может представлять неароматический азагетероцикл, предпочтительно азетидин, пирролидин, пиперидин, морфолин, тиоморфолин, пиперазин, гомопиперидин, гомопиперазин.
«Замещенная аминокарбонильная группа» (аминокарбонил) означает R′R′′N-С(=O)- группу, в которой заместители R′ и R′′ могут быть представлены необязательно замещенными алкилом, алкенилом, алкинилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными заместителями аминокарбонильной группы являются необязательно замещенный C1-С5алкил, C1-С5алкенил, C1-С5циклоалкил, необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель гетероциклила) или аминогруппой R′R′′N.
«Замещенная аминотиокарбонильная группа» (аминотиокарбонил) означает R′R′′N-C(=S)- группу, в которой заместители R′ и R′′ могут быть представлены необязательно замещенными алкилом, алкенилом, алкинилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными аминокарбонильными группами являются алкиламинотиокарбонил, циклоалкиламинотиокарбонил, ариламинотиокарбонил, гетариламинотиокарбонил и бензил аминотиокарбонил.
«Замещенная оксигруппа» означает гидроксигруппу, в которой водород может быть замещен C1-С5алкилом, C1-С5алкенилом, C1-С5циклоалкилом, арилом, гетарилом и гетероциклилом, образуя простые эфиры, или ацилом, образуя сложные эфиры, или аминокарбонильной группой, образуя карбаматы, или оксикарбонильной группой, образуя карбонаты.
«Замещенная оксикарбонильная группа» (оксикарбонил) означает R-О-С(=О)- группу, в которой заместитель R может быть представлен необязательно замещенными алкилом, алкенилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными оксикарбонильными группами являются метоксикарбонил, этоксикарбонил, трет-бутилоксикарбонил и бензилоксикарбонил.
«Заместитель карбамоильный» означает заместитель, присоединенный к аминокарбонильной группе, значение которой определено в данном разделе. Заместитель карбамоильный представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилокси-карбонилалкил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-алкил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительными «заместителями карбамоильными» являются алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилокси-карбонилалкил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-алкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Карбоксил» означает группу -СО2Н.
«Лекарственное комбинированное средство (препарат)» - комбинация нескольких лекарственных веществ для одновременного использования в виде таблеток, капсул, инъекций, мазей, ректальных суспензий и гелей и др. готовых форм, предназначенных для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего. Лекарственные вещества в одном комплекте могут быть представлены в виде различных готовых форм, предназначенных для введения в организм животного или человека различными способами, например перорально и ректально.
«Метаболические заболевания» - группа заболеваний, связанных с нарушениями обмена веществ. Эти заболевания могут быть вызваны наследственной предрасположенностью, сбоями в эндокринной и нервной системах, а также нарушениями в работе метаболически активных органов. В настоящее время насчитывается большое количество метаболических нарушений, однако в данном изобретении рассматриваются главным образом болезни, связанные с сигнальным каскадом рецепторов GPR119, в частности такие как диабет, ожирение, диабетучность, метаболический синдром, гиперхолестеринемия, дислипидемия и т.д.
«Низший алкил» означает линейный или разветвленный алкил с 1-5 атомами углерода (С1-С5алкил).
«Нейродегенеративное заболевание» означает специфическое состояние и заболевание, характеризующиеся повреждением и первичной гибелью популяций нервных клеток в определенных областях центральной нервной системы. Нейродегенеративные заболевания включают, но не ограничивают болезни Альцгеймера и Паркинсона; болезнь (хорею) Хантингтона; рассеянный склероз; мозжечковую дегенерацию; амиотрофический латеральный склероз; деменцию с тельцами Леви; спинальную мускульную атрофию; периферическую нейропатию; губчатый энцефалит («коровье бешенство», Creutzfeld-Jakob Disease); СПИД-ассоциированную деменцию; мультиинфарктную деменцию; лобно-височную деменцию; лейкоэнцефалопатию (болезнь исчезающей белого вещества); хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсию; церебральную ишемию; глаукому; черепно-мозговую травму; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластому; шизофрению; депрессию. Кроме того, нейродегенеративные заболевания включают патологические состояния и расстройства, развивающиеся при гипоксии, злоупотреблении веществами, вызывающими зависимость, при воздействии нейротоксинов, инфекционных и онкологических заболеваниях головного мозга, а также нейрональные повреждения, ассоциированные с аутоиммунными и эндокринными заболеваниями; и прочие нейродегенеративные процессы.
«Рецепторы» (от латинского recipere - получать, узнавать) представляют собой биологические макромолекулы, расположенные на цитоплазматической мембране клетки или внутриклеточно, способные специфически взаимодействовать с ограниченным набором физиологически активных веществ (лигандов) и трансформировать сигнал об этом взаимодействии в определенный клеточный ответ.
«Рецепторы TGR5» (известные также как GPBAR1, M-BAR, AXOR 109 и GPCR19) являются GPCR-рецепторами, связанными с Gs-белками. Они экспрессированы главным образом в желчном пузыре, желудочно-кишечном тракте, селезенке, легких, плаценте, некоторых отделах ЦНС, а также в иммунных клетках (моноцитах и дендритных клетках).
«Сигнальный каскад» (сигнальная система, каскад передачи сигнала) означает совокупность взаимосвязанных последовательных и параллельных молекулярных процессов регуляции клеточного метаболизма внешними (первичными) сигналами, несущими в клетку информацию, что принципиально отличает их от других поступающих в клетку химических соединений, служащих для нее источником материи и энергии. Молекулярные механизмы передачи (трансдукции) внешних сигналов в клетку подразумевают не только передачу сигналов как таковую, но и весь комплекс событий, с ней сопряженных, в том числе усиление, ослабление и подавление (или выключение) сигналов.
«Сульфонил» означает R-SO2- группу, в которой заместитель R может быть представлен необязательно замещенными C1-С5алкилом, C1-С5алкенилом, C1-С5циклоалкилом, необязательно замещенным арилом (см. заместитель циклической системы), необязательно замещенным гетарилом (см. заместитель циклической системы), необязательно замещенным гетероциклилом (см. заместитель циклической системы) или аминогруппой R′R′′N, значение которых определено в данном разделе.
«Тиоацильная группа» (Тиоацил) означает необязательно замещенные алкил-C(=S)-, алкенил-С(=S)-, циклоалкил-С(=S)-, гетероциклил-С(=S)-, арил-C(=S)- аралкил-C(=S)-, гетероарил-С(=S)-, гетероарилалкил-С(=S)- группы.
«Циклоалкил» означает неароматическую моно- или полициклическую систему, включающую от 3 до 10 атомов углерода. Циклоалкил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил, декалин, норборнил, адамант-1-ил и т.п. Предпочтительными «заместителями циклической системы» являются алкил, алкокси, гидрокси или аминогруппа, значение которых определено в данном разделе.
«Циклоалкенил» означает неароматическую моно- или полициклическую систему, включающую от 3 до 10 атомов углерода и содержащую одну или более двойную углерод-углеродную связь. Представителями циклоалкенильных групп являются циклопентенил и циклогексенил.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем. Для изготовления суппозиториев помимо активных компонентов используют также масло какао, сплавы его с парафином и гидрогенизированными жирами, растительные и животные гидрогенизированные жиры, твердый жир, ланоль, сплавы гидрогенизированных жиров с воском, твердым парафином и другие основы, разрешенные для медицинского применения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные. (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
«Фармацевтически приемлемые эксципиенты» под фармацевтически приемлимыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители.
Цель настоящего изобретения заключается в создании новых селективных агонистов GPR119 рецепторов как потенциальных антидиабетичеких препаратов.
Поставленная цель достигается 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидинами общей формулы I в виде свободных оснований, а также в виде их фармацевтически приемлемых солей.
Предметом настоящего изобретения являются новые агонисты рецепторов GPR119, представляющие собой производные замещенных 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидинов общей формулы I в виде свободных оснований, а также в виде их фармацевтически приемлемых солей,
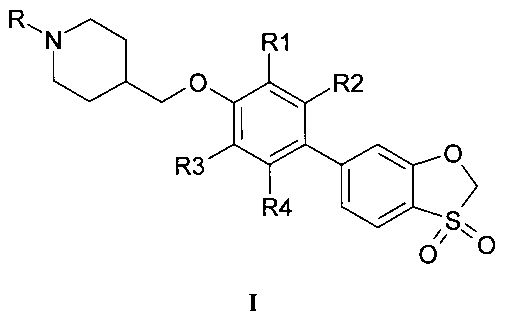
где R=Н, (С1-С5) алкил, замещенный (С1-С5) алкил, ацил, выбранный из группы C1-С5алкилС(=O)- или фенил(С=O)-, замещенный гетероарил, представляющий собой ароматическую моноциклическую группу с двумя атомами азота, которая замещена атомом галогена или С1-С5алкилом, (С1-С3) алкилсульфонил, фенилсульфонил; R1, R2, R3, R4 представляют собой водород или один или два заместителя одновременно, выбранные из галогена, (С1-С3) алкила, галогензамещенного (С1-С3) алкила, (С1-С3) алкилсульфонила, цианогруппы.
Предпочтительными являются производные 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил} пиперидинов общей формулы I.1 в виде свободных оснований, рацемических смесей или индивидуальных оптических изомеров, а также их фармацевтически приемлемые соли,
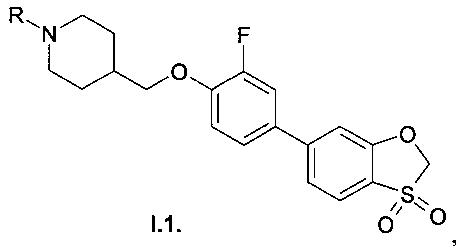
где R=Н, (С1-С5) алкил, галогензамещенный (С1-С5) алкил, ацил, выбранный из группы С1-С5алкилС(=O)- или фенил(С=O)-,, замещенный гетероарил, представляющий собой ароматическую моноциклическую группу с двумя атомами азота, которая замещена атомом галогена или С1-С5алкилом, (С1-С3) алкилсульфонил, фенилсульфонил.
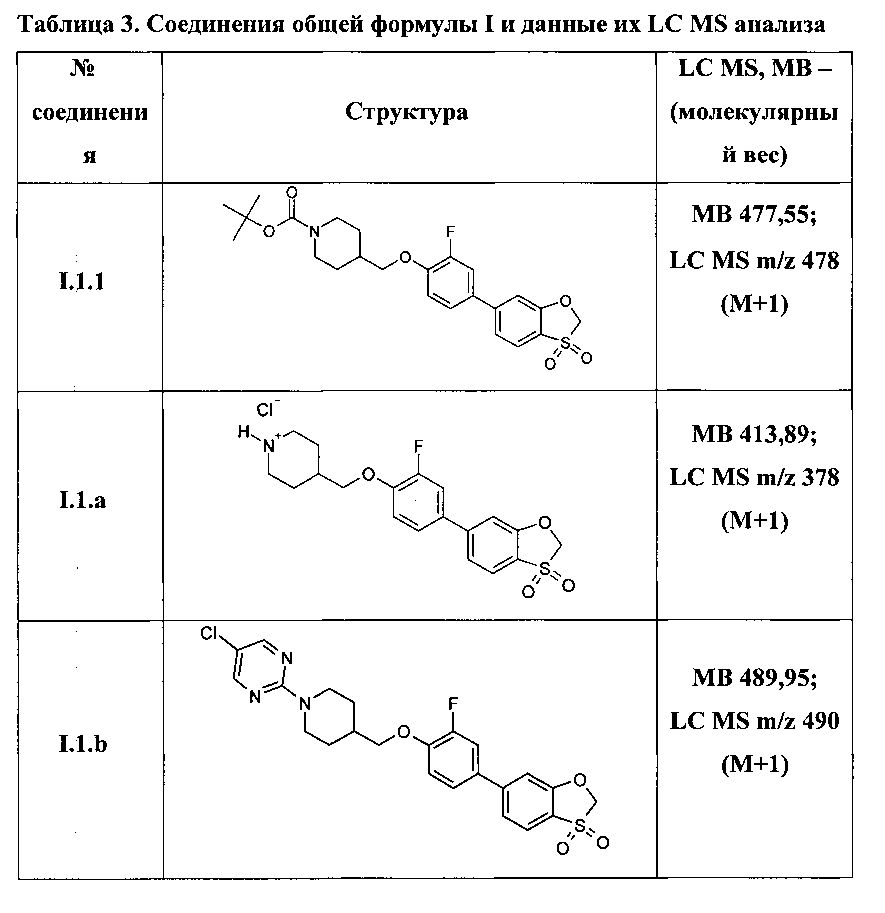
Более предпочтительными соединениями являются:
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-карбоксилат (I.1.1);
4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин гидрохлорид (I.1.a);
5-хлор-2-(4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-ил)пиримидин (I.1.b);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2,6-дифторфенокси]метил}пиперидин-1-карбоксилат (I.2.1);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-(метилсульфонил)фенокси]метил}пиперидин-1-карбоксилат (I.3.1);
Трет-бутил 4-{[2-хлоро-4-(3,3-Диоксидо-1,3-бензоксатиол-6-ил)фенокси]метил}пиперидин-1-карбоксилат (I.4.1);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-метилфенокси]метил}пиперидин-1-карбоксилат (I.5.1);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-3-фторфенокси]метил}пиперидин-1-карбоксилат (I.6.1);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-(трифторметил)фенокси]метил}пиперидин-1-карбоксилат (I.7.1);
Трет-бутил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-3,5-дифторфенокси]метил}пиперидин-1-карбоксилат (I.8.1);
Трет-бутил 4-{[2-циано-4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)фенокси]метил}пиперидин-1-карбоксилат (I.9.1);
Трет-бутил 4-{[4-(3,3-Диоксидо-1,3-бензоксатиол-6-ил)-2-изопропилфенокси]метил}пиперидин-1-карбоксилат (I.10.1);
2-(4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-ил)-5-фторпиримидин (I.1.c);
5-бром-2-(4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-ил)пиримидин (I.1.d);
2-(4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-ил)-5-этилпиримидин (I.1.e);
Изопропил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-карбоксилат (I.1.f);
4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}-1-(метилсульфонил)пиперидин (I.1.g);
4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}-1-(фенилсульфонил)пиперидин (I.1.h);
1-(2,2-диметилпропаноил)-4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил} пиперидин (I.1.i);
1-бензоил-4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин (I.1.j);
4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}-1-(3,3,3-трифторпропил)пиперидин (I.1.k);
(1R)-1-метилпропил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-карбоксилат (I.1.l);
(1S)-1-метилпропил 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)-2-фторфенокси]метил}пиперидин-1-карбоксилат (I.1.m);
Предметом данного изобретения являются фармацевтически приемлемые соли соединений общей формулы I. Часть соединений настоящего изобретения являются нейтральными молекулами и не образуют солей, другая часть содержит ионогенные группы (вторичные, третичные амины или карбоновые кислоты) и может образовывать соли, которые были получены способами, известными в данной области техники.
Предметом данного изобретения являются рацемические смеси и индивидуальные оптические изомеры соединений общей формулы I, поскольку ряд соединений общей формулы I имеет асимметрический центр, и вещества могут существовать в виде рацемических смесей и изомерных форм.
Предметом данного изобретения является способ получения производных 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидинов общей формулы I, исходя из синтона А (схема 1). Арилирование синтона А подходящим арилборным эфиром В в присутствие палладиевого катализатора (предпочтительно Pd[dppf]C12) в присутствии основания (предпочтительно ацетата калия) приводит к серии веществ I.
Схема 1
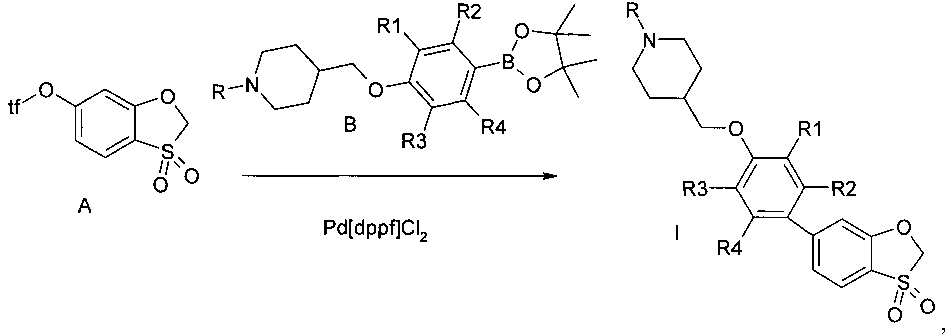
где tf - трифторметилсульфонил.
В случае R=boc или другой защитной группы возможно снятие защитной группы и последующее алкилирование, арилирование, гетарилирование, ацилирование, карбомоилирование, сульфонилирование вторичного амида пиперидина (Схема 2).
Схема 2
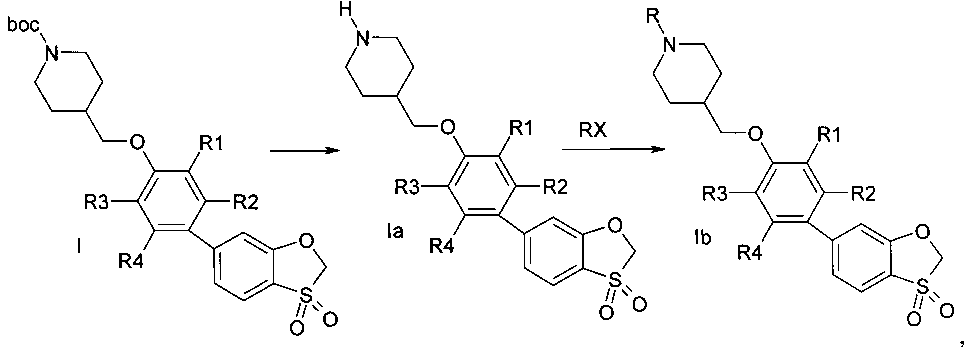
где R=Н, (С1-С5) алкил, галогензамещенный (С1-С5) алкил, ацил, выбранный из группы С1-С5алкилС(=O)- или фенил(С=O)-, замещенный гетероарил, представляющий собой ароматическую моноциклическую группу с двумя атомами азота, которая замещена атомом галогена или С1-С5алкилом, (С1-С3) алкилсульфонил, фенилсульфонил; R1, R2, R3, R4 представляют собой водород или один или два заместителя одновременно, выбранные из галогена, (С1-С3) алкила, галогензамещенного (С1-С3) алкила, (С1-С3) алкилсульфонила, цианогруппы, Х-реакционноспособная группа.
Предметом настоящего изобретения является активный компонент, обладающий свойством агониста рецепторов GPR119, представляющий собой производные 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидина общей формулы I.
Агонисты рецепторов GPR119 специфически связываются с рецепторами GPR119 и стимулируют выработку инкретинов, которые в свою очередь стиммулируют продукцию инсулина β-клетками поджелудочной железы в ответ на нагрузку глюкозой.
Предметом данного изобретения является фармацевтическая композиция, предназначенная для профилактики и лечения метаболических заболеваний и связанных с ними кардиоваскулярных и нейродегенеративных заболеваний, содержащая в эффективном количестве активный компонент, обладающий свойством агониста рецепторов GPR119, а также любая из вышеуказанных фармацевтических композиций в форме таблеток, капсул и инъекций, помещенных в фармацевтически приемлемую упаковку.
Предметом данного изобретения является комбинированное лекарственное средство, предназначенное для профилактики и лечения метаболических заболеваний и связанных с ними кардиоваскулярных и нейродегенеративных заболеваний, содержащее в эффективном количестве агонист GPR119 - производное 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил}пиперидина общей формулы I и одно или несколько антидиабетических лекарственных веществ для одновременного использования.
Под метаболическими заболеваниями понимаются: метаболичекий синдром, сахарный диабет, ожирение.
Предметом данного изобретения является комбинированная фармацевтическая композиция, предназначенная для профилактики и лечения метаболических заболеваний, содержащая в эффективном количестве активный компонент (агонист рецептора GPR119 - производное 4-{[4-(3,3-диоксидо-1,3-бензоксатиол-6-ил)арилокси]метил} пиперидина общей формулы I) и одно или несколько антидиабетических лекарственных веществ, таких как ингибиторы дипептидилпептидазы-IV, ингибиторы альфа-глюкозидазы, производные сульфонилмочевины, бигуаниды, модуляторы активности рецепторов, активирующих пролиферацию пероксисом, ингибиторы протеинтирозинфосфатазы 1В, инкретиномиметикидля одновременного использования в виде таблеток, капсул, инъекций и других готовых форм.
Предметом данного изобретения являются вышеуказанные фармацевтические композиции в форме таблеток, капсул, мазей, гелей, инъекций и других готовых форм, помещенных в фармацевтически приемлемую упаковку.
Фармацевтическая композиция может включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с активным компонентом по настоящему изобретению может включать и другие активные ингредиенты, при условии, что они не вызывают нежелательных эффектов, например, аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как растворы или суспензии для инъекций или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Новая фармацевтическая композиция может быть получена смешением с инертным наполнителем и/или растворителем активного компонента, представляющего собой, по крайней мере, одно из соединений общей формулы I, а также их свободных оснований, рацемических смесей или индивидуальных оптических изомеров, а также их фармацевтически приемлемых солей и/или гидратов.
Предметом данного изобретения является лекарственное средство.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно, местно или ректально). Клиническая дозировка активного компонента (субстанции), фармацевтической композиции или лекарственного комбинированного средства, включающих фармацевтически эффективное количество активного компонента, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10-300 мг, предпочтительно - 50-200 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 5-300 мг, предпочтительно - 10-200 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Предметом данного изобретения является способ профилактики и лечения метаболических заболеваний и связанных с ними кардиоваскулярных и нейродегенеративных заболеваний введением в эффективном количестве нового активного компонента или новой фармацевтической композиции.
Предметом данного изобретения является способ профилактики и лечения метаболических заболеваний и связанных с ними кардиоваскулярных и нейродегенеративных заболеваний введением в эффективном количестве комбинированного лекарственного средства или комбинированной фармацевтической композиции.
Данное изобретение поясняется следующим чертежом:
Рис. 1. Уровень глюкозы (ммоль/л) в крови животных с аллоксановым сахарным диабетом до и после введения соединения ZB40-0016.
Обозначения: «контроль» - контрольная группа животных с аллоксановым сахарным диабетом, получавшая физиологический раствор; «ZB40-0016» - группы животных с аллоксановым сахарным диабетом, получавшие соединение ZB40-0016 в дозах 0,1 или 1 мг/кг; достоверность отличий: * - р<0,05 - относительно исходного уровня гликемии.
Представленные ниже примеры иллюстрируют, но не ограничивают изобретение.
Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа.
Пример 1. Метод синтеза синтона A (схема 1 и схема 3).
Синтон А получали в соответствии со схемой 3:
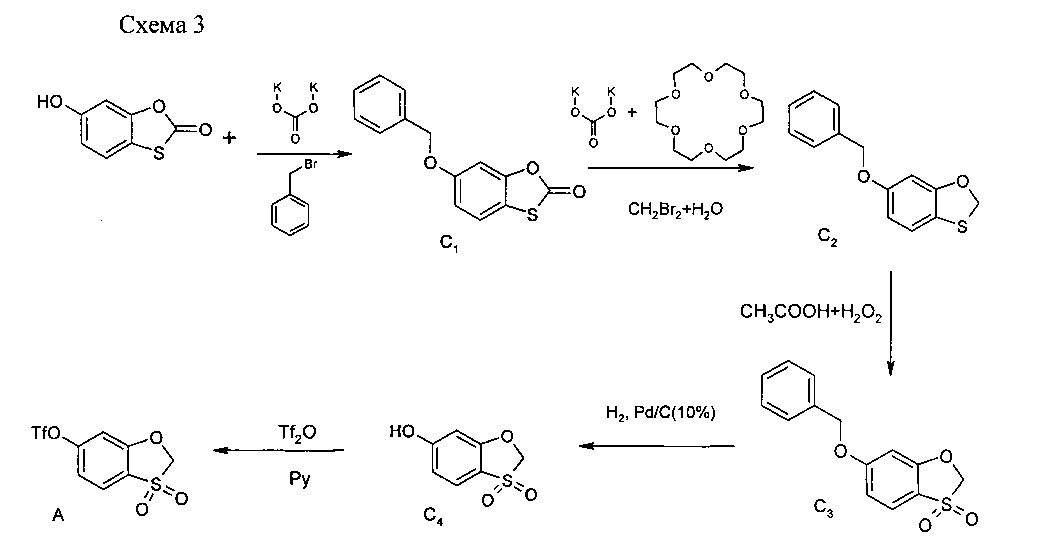
Соединение С1.
100 г (0.6 моль) Исходного 6-гидрокси-1,3-бензокситиол-2-он было растворено в 1000 мл абс. ацетонитрила, последовательно в реакционную массу было добавлено 165 г (1,2 моль, 2 экв.) поташа прокаленного и 77,8 мл (0,66 моль, 1.1 экв) бензилбромида. Реакционная масса перемешивалась в течение ночи при 70°С. После охлаждения неорганические соли были отфильтрованы и фильтрат был упарен до объема 150 мл, выпавший осадок был отфильтрован и промыт 150 мл холодного диэтилового эфира. После сушки на воздухе выход 6-[(фенилметил)окси]-1,3-бензокситиол-2-он 123.3 г (80%).
Соединение С2.
78.2 г (0,3 моль) 6-[(Фенилметил)окси]-1,3-бензокситиол-2-он было растворено в 235 мл дибромметана и 16 мл воды, после чего последовательно было добавлено 125.5 г поташа (0,9 моль, 3 экв.) и 2 г 18-краун-6-эфира (0,0075 моль, 0.025 экв.). Реакционная масса кипятилась под аргоном при перемешивании в течение 48 ч с ТСХ контролем завершения реакции. После охлаждения реакционная масса была отфильтрована от неорганики, и основное количество растворителя было упарено в вакууме. Остаток был залит 400 мл хлористого метилена. Слой хлористого метилена был отделен, промыт насыщенным раствором хлорида натрия (2×100 мл), высушен над сульфатом натрия, профильтрован, и фильтрат был упарен в вакууме. Остаток после упаривания был залит 200 мл абс. диэтилового эфира при охлаждении сухим льдом и перемешивался 30 мин, затем осадок был быстро отфильтрован и промыт на фильтре 100 мл сухого холодного диэтилового эфира. После сушки на воздухе выход 6-[(фенилметил)окси]-1,3-бензокситиола 62.5 г (85%).
Соединение С3.
62,5 г (0,26 моль) 6-[(Фенилметил)окси]-1,3-бензокситиола было растворено в 625 мл уксусной кислоты. Было добавлено 125 мл 30% перекиси водорода и реакционная масса перемешивалась в течение ночи при 70°С. После охлаждения в реакционную массу было добавлено 625 мл воды. Выпавший после перемешивания в течение 10 мин осадок был отфильтрован и промыт водой 2×100 мл. После сушки на воздухе выход 6-[(фенилметил)окси]-1,3-бензокситиол 3,3-диоксида 61.7 г (87%).
Соединение С4.
68 г (0,25 моль) 6-[(Фенилметил)окси]-1,3-бензокситиол 3,3-диоксида было растворено в 816 мл ТГФ и был добавлен Pd/C (10%) 6.8 г в мин кол-ве дист. воды. Реакционная масса перемешивалась при комнатной температуре в течение ночи под подушкой с водородом с ТСХ-контролем завершенности реакции. Реакционная масса была профильтрована через слой целлита, и фильтрат был упарен под вакуумом. Осадок был отфильтрован и промыт 100 мл диэтилового эфира. После сушки на воздухе выход 1,3-бензокситиол-6-ол 3,3-диоксида 39.2 г (86%).
Соединение (синтон) А.
Раствор 39.2 г (0,21 моль) 1,3-бензокситиол-6-ол 3,3-диоксида в 392 мл абс. пиридина был охлажден до 0°С и по каплям было добавлено 39 мл (0,23 моль, 1.1 экв) ангидрида трифторметансульфокислоты. Реакционная масса перемешивалась 30 минут при 0°С и ночь при комн. т-ре. Реакционная масса была упарена досуха, остаток залит 400 мл этилацетата. Слой этилацетата был промыт 100 мл 10% водного раствора лимонной кислоты, 100 мл насыщенного раствора хлорида натрия и затем 100 мл воды. Органический слой был высушен над сульфатом натрия, профильтрован, и фильтрат был упарен в вакууме. Осадок был отфильтрован и три раза промыт диэтиловым эфиром. Затем технический продукт был растворен в хлористом метилене и пропущен через слой силикагеля (элюент - хлористый метилен). После упаривания хлористого метилена продукт был промыт эфиром, 2×50 мл. После высушивания на воздухе выход 3,3-диоксидо-1,3-бензокситиол-6-ил трифторметансульфоната 54.5 г (85%).
Синтез синтонов В производится по общей схеме 4.
Схема 4
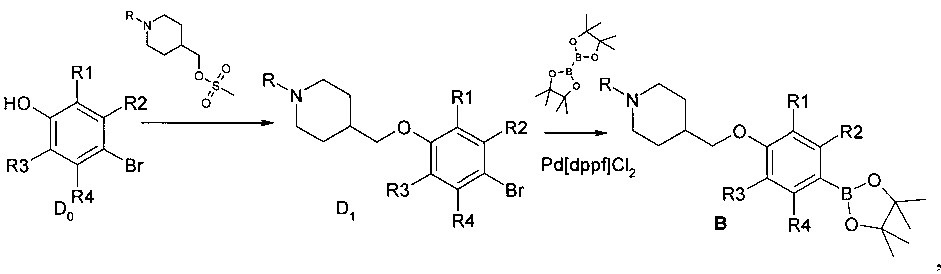 где
где
R=третбутилоксикарбонил или другая защитная группа;
R1, R2, R3, R4 представляют собой водород или один или два заместителя одновременно, выбранные из галогена, (C1-С3) алкила, галогензамещенного (С1-С3) алкила, (С1-С3) алкилсульфонила, цианогруппы.
Пример 2. Синтез синтона В1.
Соединение D1.1 получают по Схеме 5.
Схема 5
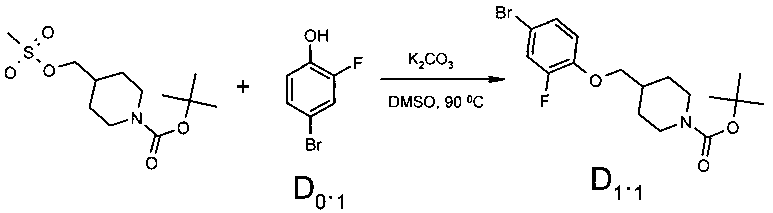
80.0 г (0.27 моль) трет-бутил 4-{[(метилсульфонил)окси]метил}пиперидин-1-карбоксилата, 62.5 г (0.33 моль) 4-бром-2-фторфенола (D 0.1) и 75.38 г (0.55 моль) прокаленного поташа при перемешивании были нагреты до 110°C в диметилсульфоксиде (800 мл) в течение 16 ч с ТСХ мониторингом прогресса реакции. По завершении реакции диметилсульфоксид был отогнан в вакууме и остаток был залит водой (800 мл). Выпавший осадок был отфильтрован и перекристаллизован из изопропанола. Выход трет-бутил 4-[(4-бром-2-фторфенокси)метил]пиперидин-1-карбоксилата - 88.0 г (83.1%).
1Н NMR (400 MHz, DMSO-D6) δ 7.50 (dd, J=10.85, 2.30 Hz, 1 H), 7.30 (m, 1 H), 7.15 (m, 1 H), 3.96 (d, J=10.74 Hz, 2 H), 3.90 (d, J=6.36 Hz, 2 H), 2.66-2.79 (m, 2 H), 1.89-1.98 (m, 1 H), 1.72 (d, J=10.96 Hz, 2 H), 1.39 (s, 9 H), 1.09-1.23 (m, 2 H).
Синтон B1 получают по Схеме 6.
Схема 6
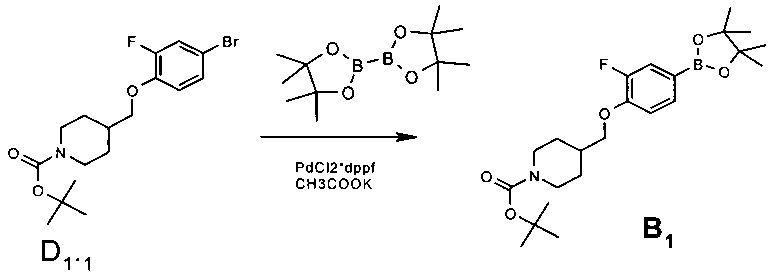

60.0 г (0.15 моль) трет-бутил 4-[(4-бром-2-фторфенокси)метил]пиперидин-1-карксилата (D 1.1.), 51.0 г (0.2 моль) 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-би-1,3,2-диоксоборолана, 5.63 г (0.008 моль) Pd DPPF и 45.5 г (0.46 моль) ацетата калия перемешивались в ацетонитриле (1000 мл) под аргоном при 65-70°C в течение 16 ч. По завершении реакции реакционная смесь была разбавлена этилацетатом, промыта насыщенным раствором хлорида натрия. Органический слой был отделен, высушен над сульфатом натрия, профильтрован, и фильтрат был упарен в вакууме. Остаток после упаривания подвергался очистке на колонке с силикагелем, элюент - смесь гексан-этилацетат. Выход трет-бутил 4-{[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенокеси]метил}пиперидин-1-карбоксилата 50.0 г (74.3%).
1Н NMR (400 MHz, DMSO-D6) δ ppm 7.42 (d, J=8.11 Hz, 1H), 7.31 (m, 1H), 7.15 (m, 1H), 3.91-4.02 (m, 4 H), 2.66-2.80 (m, 2H), 1.89-2.02 (m, 1H), 1.73 (d, J=11.18 Hz, 2 H), 1.39 (s, 9 H), 1.27 (s, 12 H), 1.07-1.22 (m, 2H).
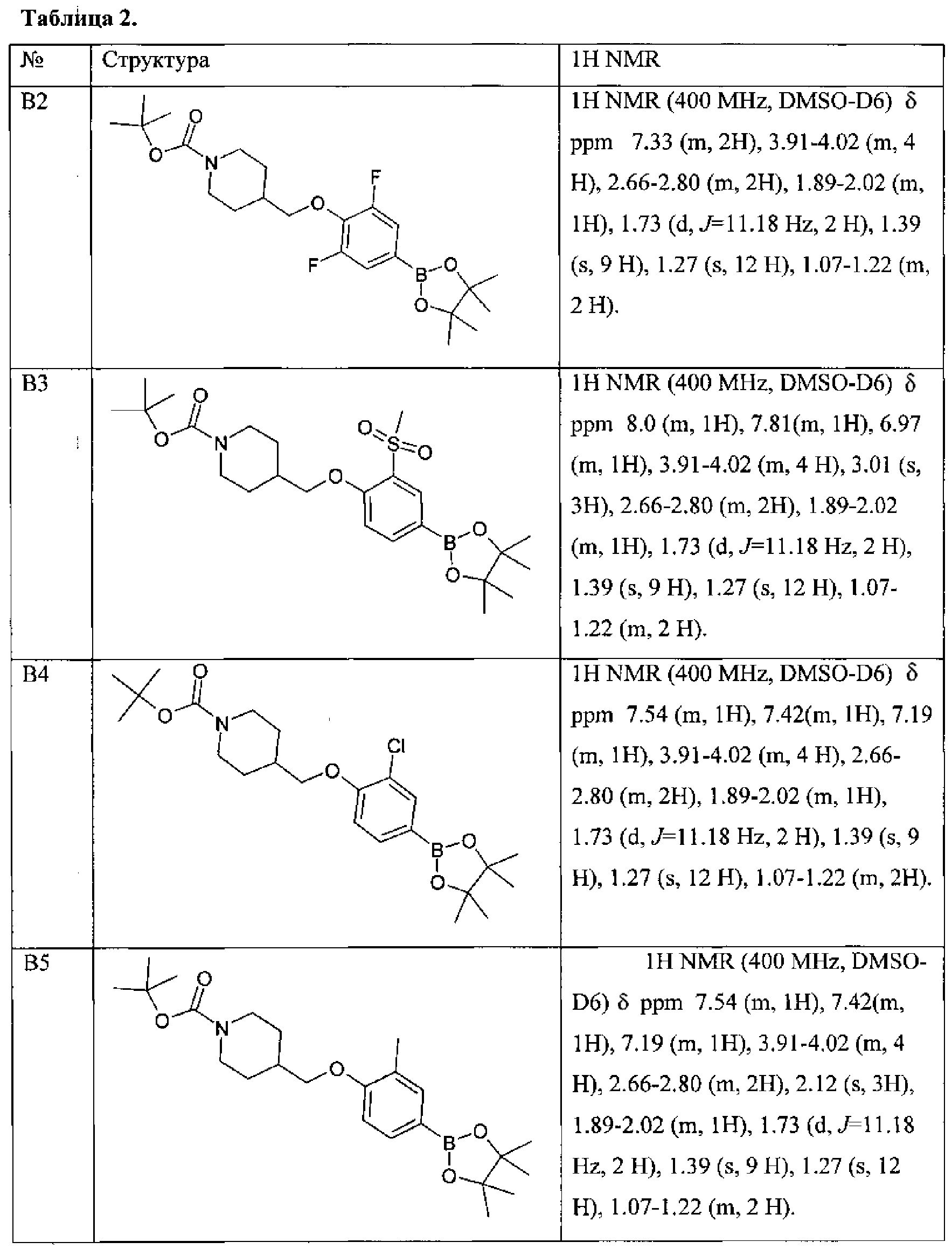
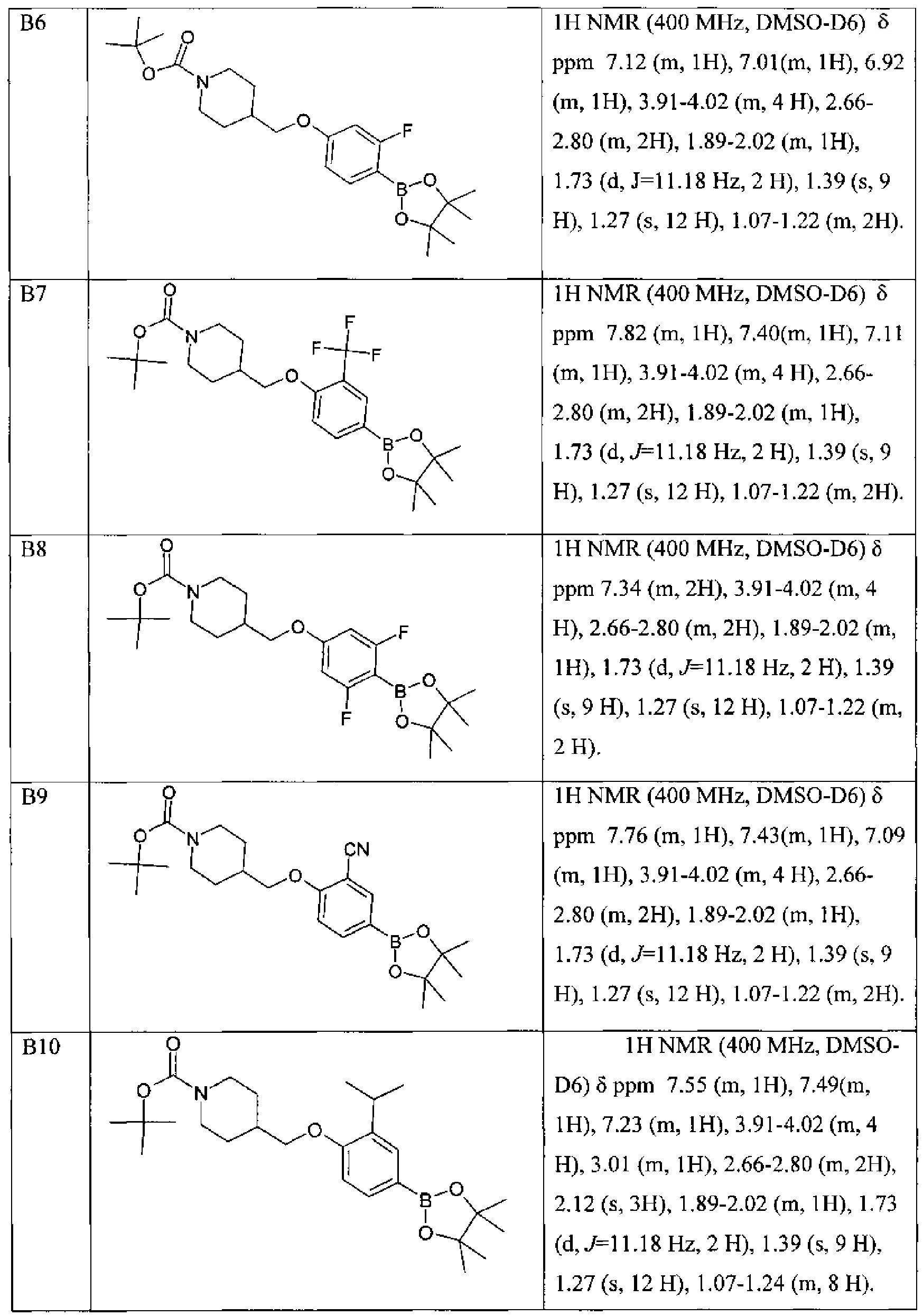
По данной схеме синтеза получены и другие синтоны В2-В10.
Другие синтоны В, полученные по подобной схеме приведены в Таблице 2.
Пример 3. Синтез соединения 1.1.1. (Схема 7).
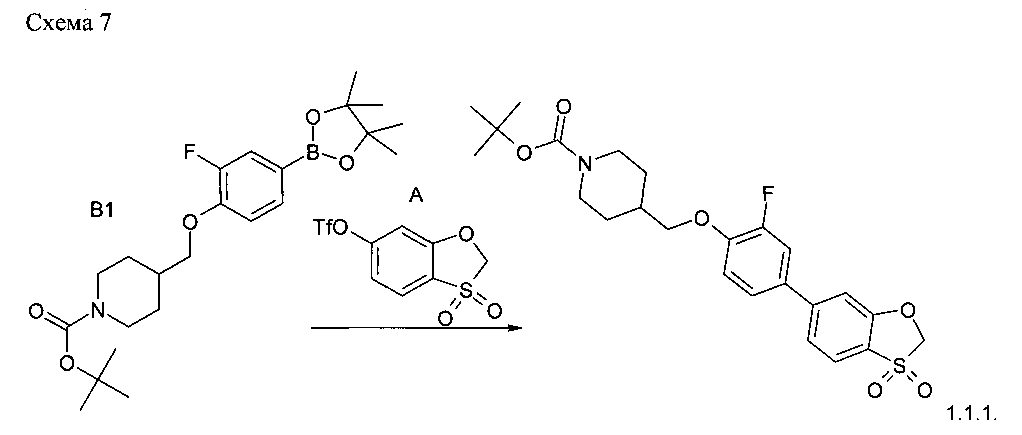
36.1 г (83 ммоль) трет-бутил 4-{[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенокеси]метил}пиперидин-1-карбоксилата (синтон В1), 26.5 г (83 ммоль) 3,3-диоксид-1,3-бензокситиол-6-ил трифторметансульфонат (синтон А), 69.0 г (0.5 ммоль) поташа и 3.1 г (4 ммоль) PdDPPFCl2 были смешаны в 0.5 литра воды и 0.5 литра диоксана (поташ был предварительно растворен в воде, катализатор добавлялся после дегазации под аргоном). Реакционная масса перемешивалась под аргоном в течение 1 ч. Выпавший осадок был отфильтрован и подвергался очистке путем хроматографии на колонке с силикагелем.
Полученный продукт очищался путем перемешивания со смолой Lewatit mono plus SP-112 - 5.0 г в диоксане (200 мл). После фильтрации и упаривания выход трет-бутил 4-{[4-(3,3-диоксид-1,3-бензоксотиол-6-ил)-2-фторофенокси]метил}пиперидин-1-карбоксилата 28.4 г (71.5%).
1H NMR (400 MHz, DMSO-D6) δ ppm 7.89 (d, J=8.11 Hz, 1H), 7.71 (dd, J=12.94, 1.97 Hz, 1H), 7.62 (s, 1H), 7.58 (d, J=8.11 Hz, 2H), 7.28 (t, J=8.77 Hz, 1H), 5.43 (s, 2H), 3.94-4.02 (m, 4H), 2.67-2.85 (m, 2H), 1.93 (m, 1H), 1.74 (d, J=11.62 Hz, 2H), 1.40 (s, 9H), 1.11-1.24 (m, 2H).
Пример 4. Синтез соединения 1.1.a. (Схема 8).
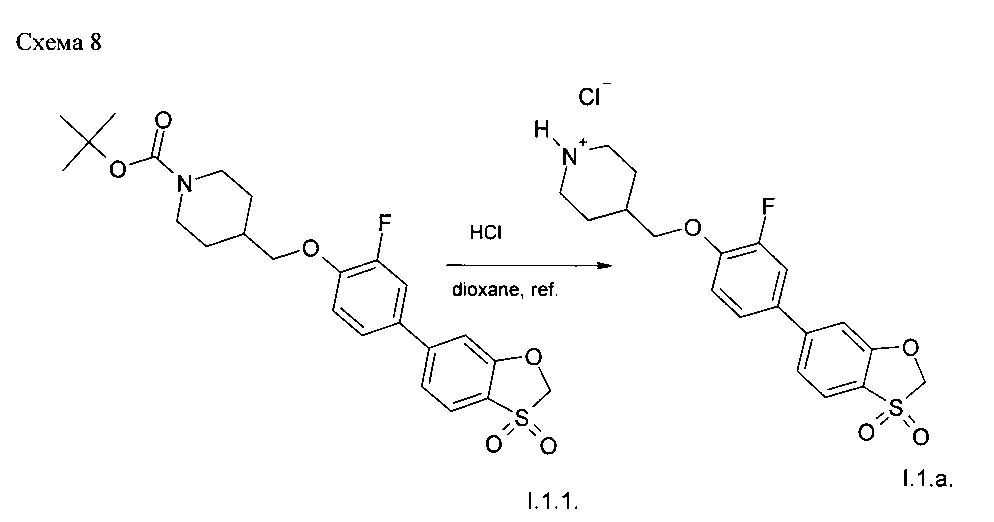
24.0 г (50 ммоль) трет-бутил 4-{[4-(3,3-диоксид-1,3-бензоксотиол-6-ил)-2-фторофенокси]метил}пиперидин-1-карбоксилата (I.1.1.) было растворено в диоксане (350 мл), и в реакционную смесь был добавлен насыщенный раствор хлористого водорода в диоксане. Реакционная масса нагревалась до 70°С в течение 24 часов. После охлаждения выпавший осадок был отфильтрован и высушен в вакууме. Выход 4-{[4-(3,3-диоксид-1,3-бензоксотиол-6-ил)-2-фторофенокси]метил}пиперидингидрохлорида 19.5 г (93.7%).
1H NMR (400 MHz, DMSO-D6) δ ppm 9.01 (br.s, 1Н), 8.69 (br.s, 1Н), 7.90 (d, J=8.11 Hz, 1H), 7.73 (dd, J=12.83, 2.30 Hz, 1H), 7.62 (s, 1H), 7.59 (d, J=8.11 Hz, 2H), 7.31 (t, J=8.88 Hz, 1H), 5.44 (s, 2H), 4.02 (d, J=6.36 Hz, 2H), 3.29 (d, J=12.50 Hz, 2H), 2.90 (m, 2H), 2.11 (br.s, 1H), 1.92 (d, J=12.72 Hz, 2 H), 1.57 (m, 2 H).
Пример 5. Синтез соединения 1.1.b. (Схема 9).
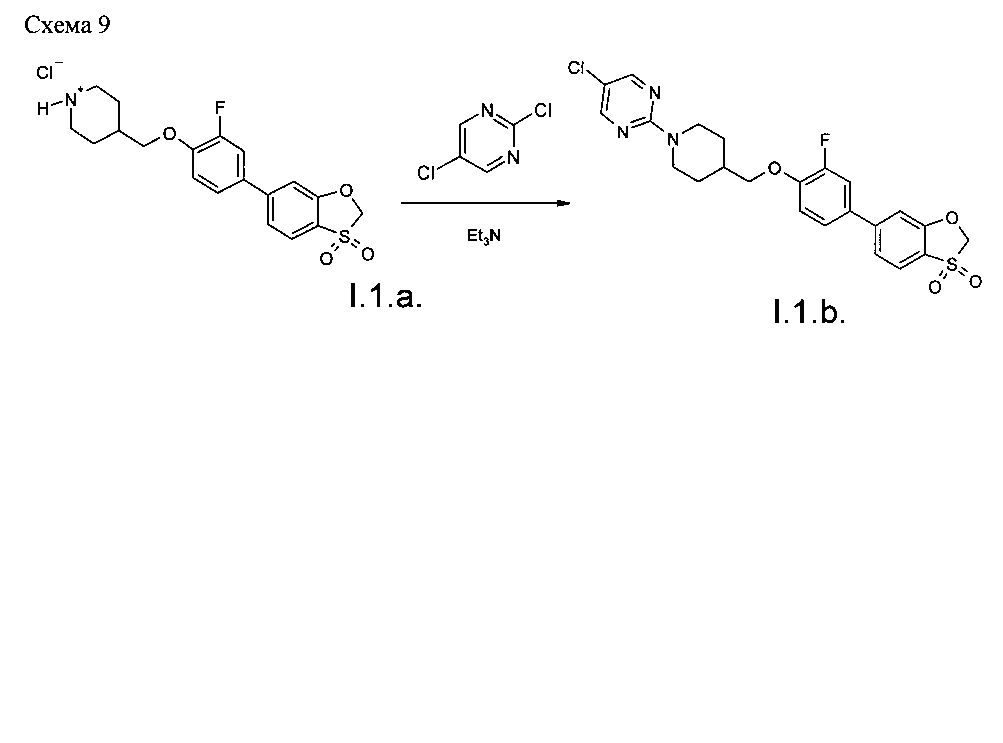
23.4 г (57 ммоль) 4-{[4-(3,3-диоксид-1,3-бензоксотиол-6-ил)-2-фторофенокси]метил}пиперидингидрохлорида (I.1.а), 10.1 г (68 ммоль) 2,5-дихлорпиримидина и 22.9 г (0.23 моль) триэтиламина были смешаны в ацетонитриле (500 мл), и реакционная масса кипятилась в течение 16 ч. По завершении реакции реакционная масса была охлаждена до комнатной температуры, и выпавший осадок был отфильтрован и последовательно промыт водой, ацетонитрилом, эфиром и гексаном. После сушки в вакууме выход 5-хлор-2-(4-{[4-(3,3-диоксид-1,3-бензоксотиол-6-ил)-2-фторофенокси]метил}пиперидин-1-ил)пиримидина 26.1 г (94.3%).
1H NMR (400 MHz, DMSO-D6) δ ppm 8.39 (s, 2Н), 7.89 (d, J=8.33 Hz, 1H), 7.71 (dd, J=12.83, 1.64 Hz, 1H), 7.61 (s, 1H), 7.58 (dd, J=8.33, 1.10 Hz, 2H), 7.28 (t, J=8.77 Hz, 1H), 5.43 (s, 2H), 4.63 (d, J=12.94 Hz, 2H), 4.01 (d, J=6.36 Hz, 2H), 2.96 (t, J=11.84 Hz, 2H), 2.04-2.18 (m, 1H), 1.86 (d, J=12.28 Hz, 2H), 1.20-1.35 (m, 2H).
Таким образом, по методам, описанным в примерах 3-5 были получены соединения I.1.1, I.2.1-I.9.1, а также соединения I.1.a-I.1.m, представленные в Таблице 3.
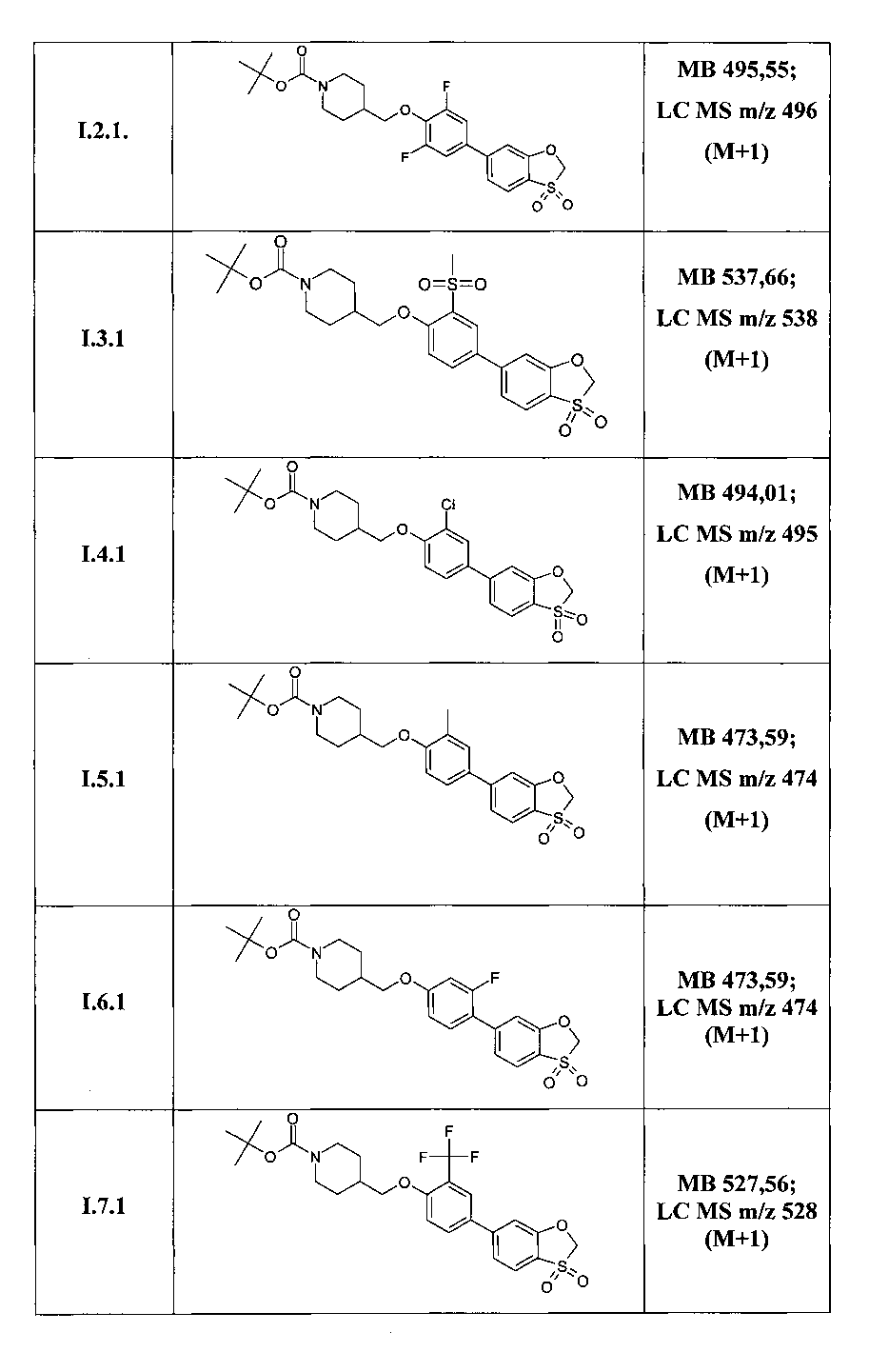
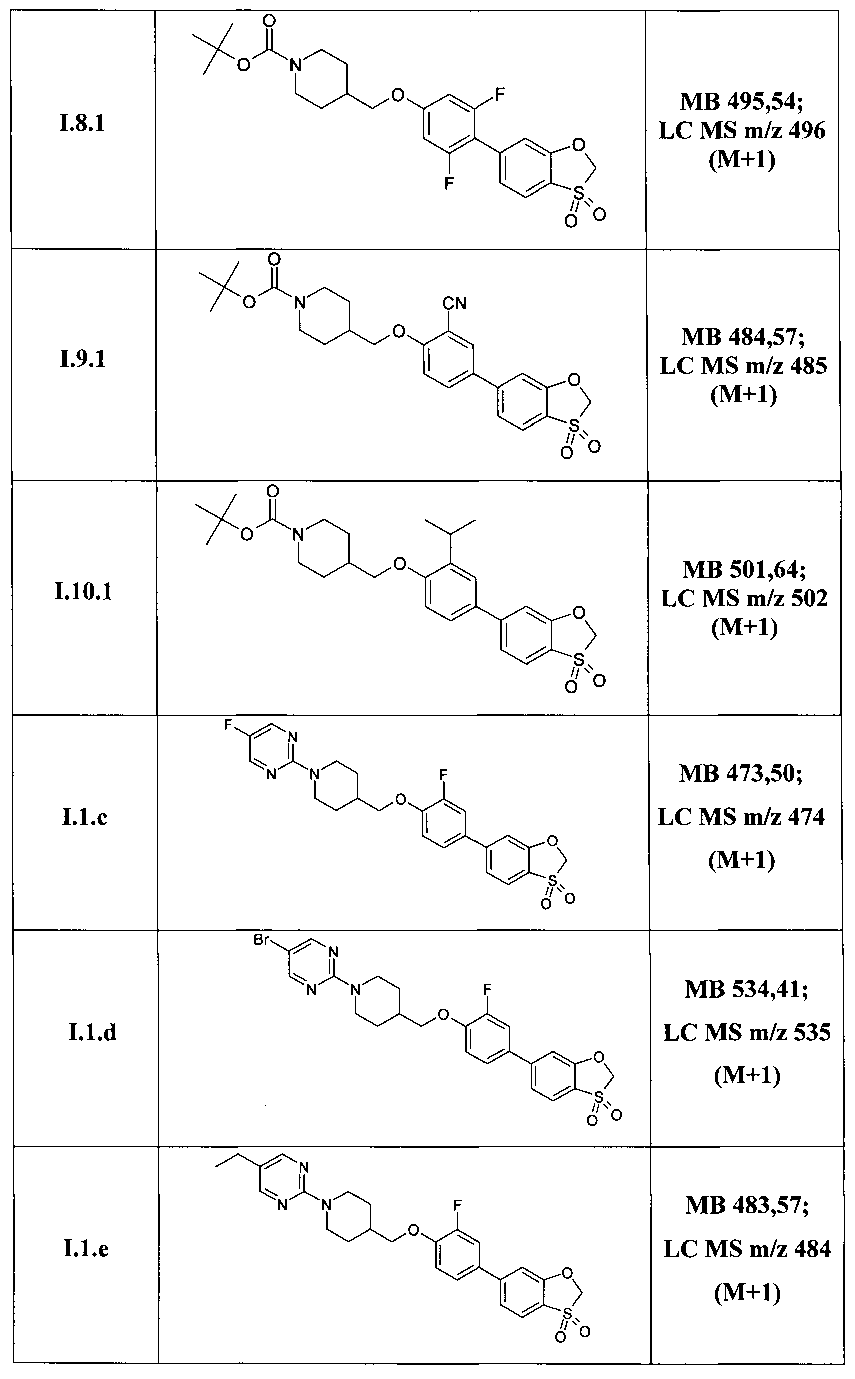

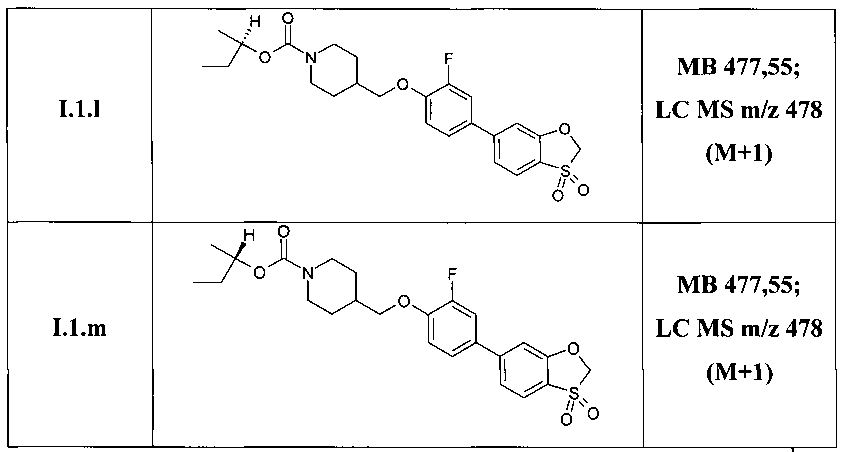
Структура ряда соединений 1.1.1 подтверждена также методом 1Н ЯМР (DMSO-D6, 400 MHz).
Пример 9. Общий метод синтеза солей соединений общей формулы I.
Часть соединений настоящего изобретения содержит ионогенные группы (вторичные и третичные амины или карбоновые кислоты) и может образовывать соли, которые получают способами, известными в данной области техники. Для этого, например, к раствору основания в инертном растворителе (спирт, ацетон, хлороформ, эфир, этилацетат) добавляли раствор эквивалентного количества (иногда - избытка) органической или неорганической кислоты в инертном растворителе и добивались осаждения искомой соли. Неорганическая кислота может представлять собой хлороводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, бромоводородную кислоту или йодоводородную кислоту. Органическая кислота может представлять собой метансульфокислоту, п-толуолсульфокислоту, уксусную кислоту, трифторуксусную кислоту, малеиновую кислоту, янтарную кислоту, щавелевую кислоту, бензойную кислоту, винную кислоту, фумаровую кислоту, миндальную кислоту, пропионовую кислоту, лимонную кислоту, молочную кислоту, гликолевую кислоту, глюконовую кислоту, галактуроновую кислоту, глютаминовую кислоту, глутаровую кислоту, глюкуроновую кислоту, аспарагиновую кислоту, аскорбиновую кислоту, карбоновую кислоту или ванилиновую кислоту, но не ограничиваясь ими.
Другим вариантом синтеза солей соединений I является снятие защитной группы в кислой среде (например, снятие трет-бутилоксикарбонильной группы) с одновременным образованием соли амина. В качестве примера такой реакции приведен Пример 4 Синтез соединения 1.1.а.
Пример 10. Определение агонистической активности соединений по отношению к рецептору hGPR119.
Тестирование соединений осуществляли с использованием линии клеток СНО-К1, в которых был стабильно экспрессирован человеческий рецептор GPR119 (hGPR119). Агонистическая активность соединений оценивалась по возрастанию внутриклеточной концентрации сАМР, так как из литературы известно, что активация рецептора hGPRl 19 путем последующей активации клеточной аденилатциклазы, ведет к повышению внутриклеточного содержания сАМР. В качестве экспериментальной платформы была выбрана тест-система Lance Ultra сАМР (Perkin Elmer). Известные агонисты рецептора hGPRl 19 были использованы в качестве положительного контроля и для определения абсолютной величины максимального сигнала эксперимента. Для всех соединений проводили анализ зависимости агонистической активности вещества от концентрации вещества. Из полученных графиков зависимости определялись значения ЕС50 (концентрация вещества в мкмолях, которая вызывает 50% от максимального эффекта).
Клеточная линия: иммортализованная линия СНО-К1, стабильно экспрессирующая hGPRl 19, Cambrex, каталожный номер А633. Культуральная среда для клеток представляла собой смесь DMEM/F-12, 10% эмбриональной бычьей сыворотки, 1% заменимых аминокислот, 2 мМ L-глутамина, а также 400 мкг/мл G418 качестве селективного антибиотика.
Подготовка клеток к эксперименту. Клетки размораживали в водяной бане при 37°С, ресуспендировали в 5 мл р-ра Хенкса, центрифугировали и еще раз ресуспендировали в 6 мл раствора Хенкса. Таким образом, осуществлялась отмывка клеток от сыворотки и культуральной среды. Повторяли шаг центрифугирования и ресуспендировали клетки в стимулирующем буфере тест-системы (SB). Финальная концентрация клеток была 8.00Е+05 клеток/мл, что давало 4000 клеток на лунку. сАМР-антитела добавляли к суспензии клеток в пропорции 1:150.
Подготовка планшетов с веществами. Вещества растворяли в DMSO до концентрации 3 мМ. Далее готовили серийное разведение веществ в DMSO с шагом 3.16. Планшеты с веществами в DMSO хранили при -20°С.
Протокол эксперимента
1. В день эксперимента готовили буфер для эксперимента (SB): 1x HBSS, 5 тМ HEPES, 0.1% BSA, рН 7.4. Смешивали 45 мл HBSS, 225 мкл 1М HEPES and 600 мкл 7.5% BSA.
2. Суспензию клеток, включающую 4-кратный раствор антител к AMP добавляли в 384-луночные планшеты для эксперимента, по 5 мкл в лунку с использованием автоматизированной системы Biomek 2000 (Beckman Coulter). Центрифугировали при 300 rpm 1 минуту.
3. 2-кратную смесь [SB+вещества] добавляли к клеточной суспензии с использованием роботизированной системы Biomek FX 384. Для приготовления 2-кратной смеси [SB+вещества], SB переносили в 384 луночный планшет, по 99 мкл/лунку. 1 мкл 200-кратного рабочего раствора веществ в DMSO переносили в тот же 384-луночный планшет. Полученную смесь тщательно перемешивали. 5 мкл 2-кратной смеси [SB+вещества] добавляли к клеточной суспензии по 5 мкл на лунку. Экспериментальный планшет центрифугировали при 300 rpm 1 минуту. Далее клеточную суспензию инкубировали с веществами в течение 30 мин при комнатной температуре на шейкере, 300 rpm.
4. Исходный раствор Eu-cAMP трейсера разводили 1:100 в буфере для детекции сигнала, получая 2-кратный рабочий раствор трейсера. Далее растовр добавляли в экспериментальный планшет по Юмкл, используя роботизированную систему Biomek 2000. Клеточную суспензию инкубировали с раствором для детекции сигнала 60 минут на шейкере, 300 rpm.
5. Сигнал эссея измеряли на многофункциональном ридере Wallac 1420 Victor3 (Perkin Elmer), используя длину волны 665 нм, протокол LANCE High Count_665_OptiPlate.
6. Агонистическую активность веществ рассчитывали с использованием скрипта для обработки данных Grand CaLculate_0.1.1. В качестве минимального сигнала эксперимента использовали усредненные данные лунок 23 столбца экспериментального планшета, содержащие нестимулированные клетки. В качестве максимального сигнала эксперимента использовали усредненные данные всех лунок 24 столбца экспериментального планшета, содержащие клетки, стимулированные известным агонистом hGPR119.
Пример 11. Определение ЕС50 для наиболее активных веществ.
Данные анализировали в программе GraphPad Prizm (GraphPad Software, Inc., San Diego, CA). Для построения концентрационной зависимости было выбрано уравнение
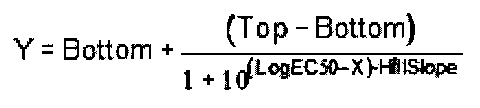
ЕС50 определялось исходя из построенного графика, как концентрация вещества, которая вызывает 50% от максимального эффекта. Диапазоны агонистической активности по отношению к GPR119 некоторых синтезированных соединений приведены в Таблице 4.
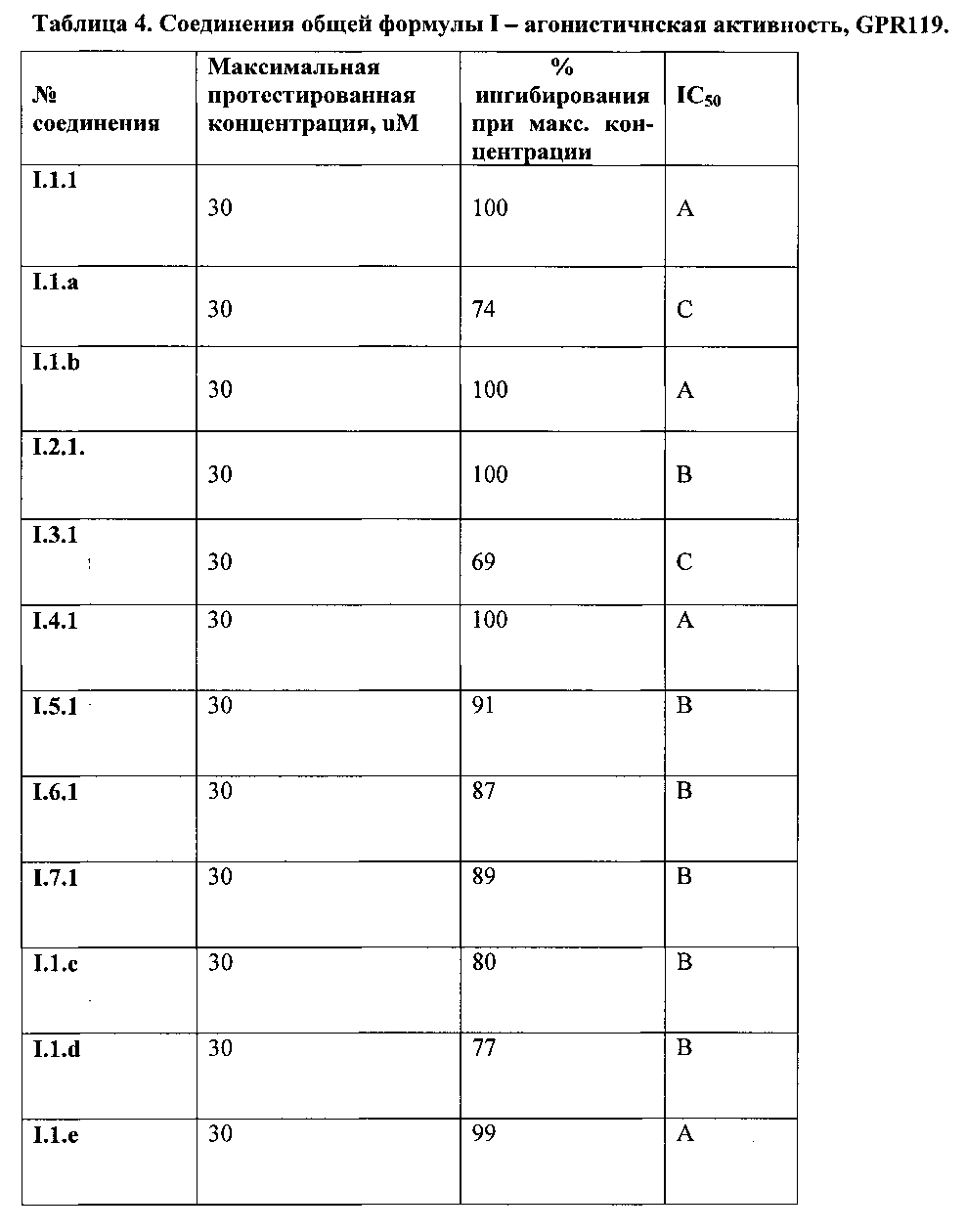
Фармакологические свойства заявленного соединения
Пример 12. Исследование фармакологического действия соединения ZB40-0016 (I.1.b) на метаболизм глюкозы (тест толерантности к глюкозе - ПГТТ).
Исследуемое соединение вводили перорально в дозах 0,1 и 1 мг/кг интактным половозрелым беспородным крысам-самкам 200-220 г, 3,5-4-месячного возраста. Пероральный глюкозотолерантный тест проводили после 6-ти часового голодания животных при интрагастральном введении раствора глюкозы в дозе 3 г/кг. Измерения уровня гликемии проводили до введения глюкозы и через 30, 60 и 120 мин после ее введения. Содержание глюкозы в крови крыс определяли глюкозооксидазным методом с измерением величины оптической плотности надосадочной жидкости в кюветах с длиной оптического пути 10 мм при длине волны 500 (490-540) нм на спектрофотометре (ПЭ-5400 В, ЭКРОС) с использованием наборов «Глюкоза ФКД» (Россия). В качестве контроля вводили эквивалентное количество физиологического раствора.
Результаты исследований влияния соединения ZB40-0016 (I.1.b) на метаболизм глюкозы у интактных животным в условиях перорального глюкозотолерантного теста представлены в таблице 5.

Примечание: n - количество животных в группе; (%) - процент изменения содержания глюкозы в крови относительно исходного уровня гликемии; достоверность отличий: * - ρ<0,05 - относительно исходного уровня гликемии; ^ - p<0,05 - относительно группы «интакт».
Как видно из данных, представленных в таблице 5, при пероральном введении раствора глюкозы интактным животным (интакт) ее уровень в крови начал увеличиваться через 30 мин после введения раствора глюкозы, достигая максимума через 60 мин (прирост относительно исходных показателей составил 33%) и снижаясь практически до исходного уровня через два часа после введения глюкозы. На фоне предварительного однократного введения соединения ΖΒ40-0016 (I.1.b) в дозе 0,1 мг/кг наблюдалось незначительное, по сравнению с контрольной группой, снижение «сахарной кривой». Однако в дозе 1 мг/кг это вещество вызывало уже достоверное снижение гипергликемии по сравнению с интактными животными в течение всего периода наблюдения (таблица 5).
Таким образом, в условиях перорального глюкозотолерантного теста установлено, что соединения ΖΒ40-0016 (I.1.b) в дозе 1 мг/кг при однократном внутрижелудочном введении проявляет гипогликемические свойства.
Пример 13. Влияние предварительного профилактического введения соединения ΖΒ40-0016 (I.1.b) на чувствительность животных к диабетогенному действию аллоксана.
Исследование влияние профилактического применения соединения ZB40-0016 (I.1.b) в дозах 0,1 мг/кг и 1 мг/кг на выживаемость животных и уровень их гликемии выполнено на фоне введения аллоксана крысам. Заявляемое соединение вводили перорально за два часа до инъекции аллоксана в дозе 150 мг/кг и далее в течение 21-го дня после нее. Показатели уровня гликемии сопоставляли с соответствующими показателями животных интактной (без инъекции аллоксана, но получавшие в течение 21 дня физиологический раствор) и контрольной групп (инъекции аллоксана в дозе 150 мг/кг и далее в течение 21 дня физиологический раствор).
Введение аллоксана в дозе 150 мг/кг способствовало развитию сахарного диабета, осложненного токсическим повреждением ряда жизненно важных органов и систем, что приводило к летальности 33,3% контрольных животных уже на 3 сутки. Летальность животных, которые профилактически за 2 часа до инъекции аллоксана и далее в течение 21-го дня получали исследуемое соединение в дозах 0,1 и 1 мг/кг, была меньше, чем в контрольной группе и составила соответственно 12,5% и 25%. Необходимо также отметить, что при курсовом профилактическом введении соединения ZB40-0016 (I.1.b) внешний вид животных данных групп был также существенно лучше, чем в группе «контроль-диабет» без фармакологической поддержки.
Предварительное введение соединения ZB40-0016 (I.1.b) в исследуемых дозах способствовало уменьшению гипергликемии на фоне аллоксанового диабета. Так у крыс, которым за два часа до инъекции аллоксана и далее в течение 21 дня после инъекции вводили исследуемое соединение в дозах 0,1 и 1 мг/кг, уровень гликемии был значительно ниже по сравнению с контрольными животными, получавшими в тех же условиях физиологический раствор (таблица 6).
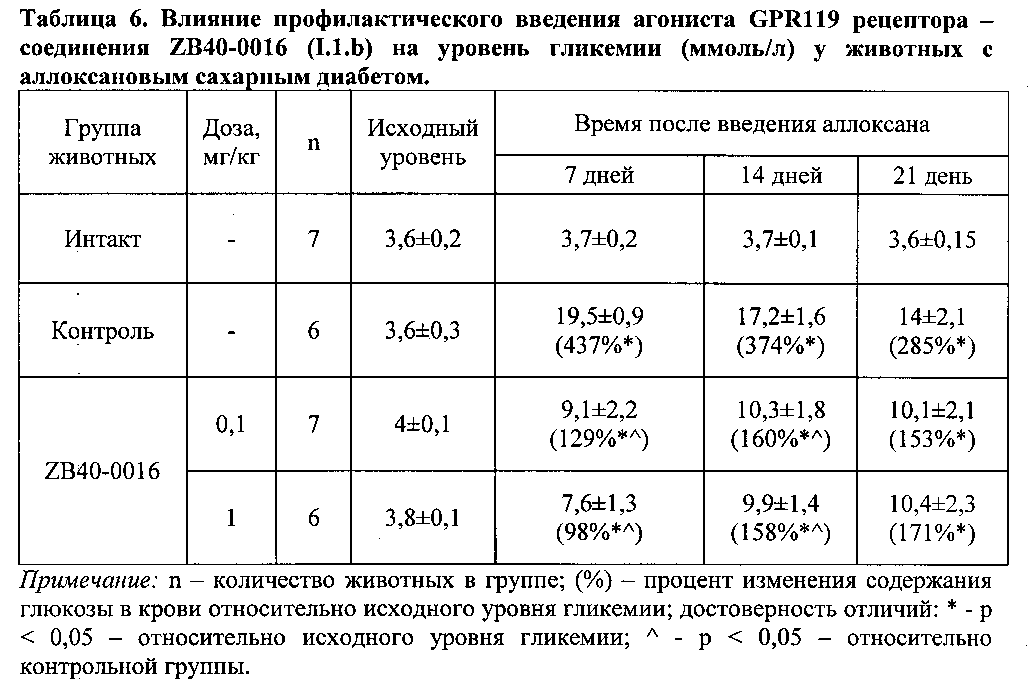
Пероральный глюкозотолерантный тест у животных с аллоксановым сахарным диабетом проводили на 21-е сутки после введения аллоксана.
К 21 суткам у животных, получавших исследуемое соединение, отмечалась тенденция к улучшению переносимости глюкозной нагрузки (таблица 7). Так, через 30 мин после внутрижелудочного введения соединения ZB40-0016 в дозе 0,1 и 1 мг/кг регистрировалось уменьшение уровня гликемии на 46% и 49% по сравнению с контролем-диабет. Спустя час после введения глюкозы ее уровень в крови также продолжал снижаться. При исследовании образцов крови второго часа было выявлено, что уровень глюкозы в крови крыс, получавших ZB40-0016 в дозе 0,1 и 1 мг/кг, составил соответственно 11±1,5 и 10,9±2,1 ммоль/л, что существенно ниже значений полученных для группы контроль-диабет. Кроме того, было зарегистрировано сокращение площади под кривой концентрация «глюкоза-время» в среднем на 37-41% в группах крыс, получавших исследуемое соединение по сравнению с контролем.
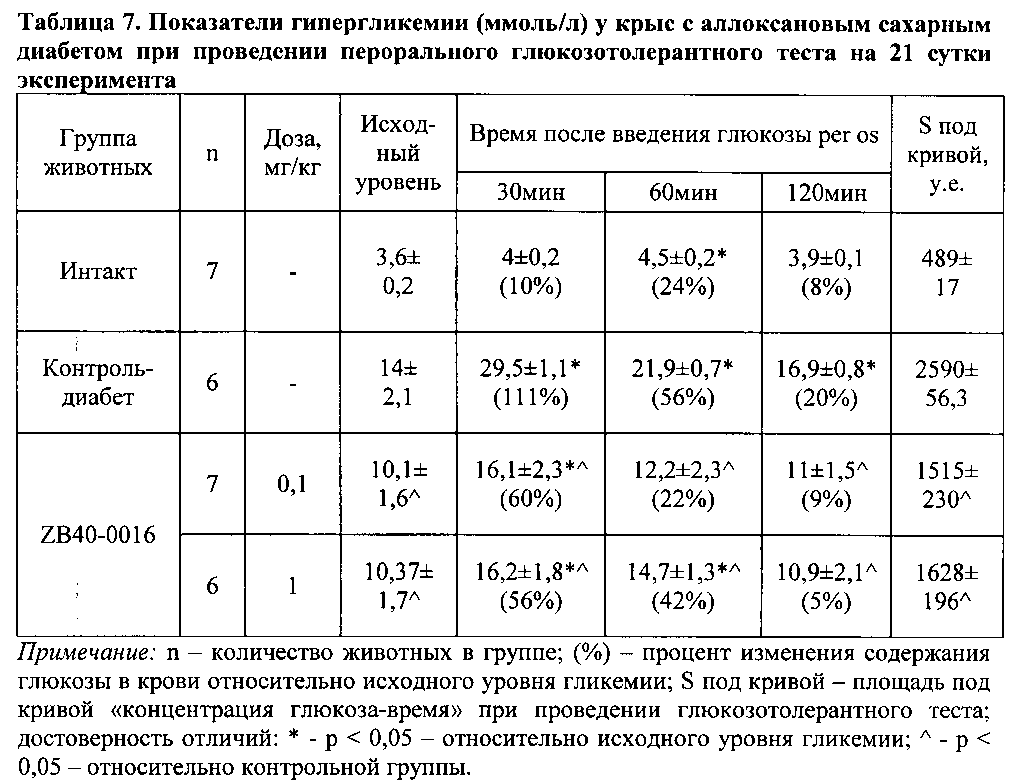
Таким образом, предварительное профилактическое курсовое введение соединения ZB40-0016 в дозах 0,1 и 1 мг/кг на фоне развивающегося аллоксанового диабета замедляет его развитие, уменьшая выраженность гипергликемии у экспериментальных животных.
Пример 14. Гипогликемическая активность соединения ZB40-0016 при однократном введении крысам с аллоксановым сахарным диабетом.
Изучена гипогликемическая активность соединение ZB40-0016 при его однократном введении крысам с аллоксановым сахарным диабетом. Для этого животным через 7 дней после инъекции аллоксана вводили исследуемое соединение. Пробы крови для измерения уровня гликемии брали до введения ZB40-0016 и далее каждый час в течение 3-х часов.
Установлено, что однократное внутрижелудочное введение исследуемого соединения в дозах 0,1 и 1 мг/кг способствовало снижению уровня глюкозы крови в среднем на 21-22% (рисунок 1).
Пример 15. Гипогликемическая активность соединения ZB40-0016 при курсовом введении крысам с аллоксановым сахарным диабетом.
Изучено влияние курсового внутрижелудочного введения соединения ZB40-0016 при курсовом 14-дневном введении крысам с аллоксановым сахарным диабетом.
После введения крысам аллоксана у животных отмечалось значительное повышение уровня глюкозы в крови: на седьмые сутки после введения аллоксана уровень сахара в крови у крыс был выше в среднем в 6,7-7 раза (p<0,05), чем аналогичные показатели у группы интактного контроля.
Далее в течение 14 дней уровень гликемии в группе «контроль-диабет» оставался повышенным в среднем в 6,3-6,7 раза по сравнению с интактной группой (p<0,05) (таблица 8). Такая длительная стойкая гипергликемия привела к гибели части животных у группы с экспериментальным сахарным диабетом. При внешнем осмотре животных данной группы было выявлено значительное повышение числа эрозивных повреждений на коже, инфицирование микротравм, шерсть была серой, тусклой, отмечалось ее выпадение.

Под влиянием исследуемого вещества происходило снижение уровня глюкозы крови. В группе животных, получавших в качестве лечения соединение ZB40-0016 в дозе 1 мг/кг, наблюдалось более выраженное снижение гипергликемии, чем при введении того же соединения в дозе 0,1 мг/кг (таблица 8).
Так уже после недельного применения ZB40-0016 в дозе 1 мг/кг уровень глюкозы снизился на 20% (р<0,05) по сравнению с негативным контролем - группой «контроль-диабет». В течение следующих 7 дней, т.е. до 14 дня, данный эффект сохранялся.
В группе животных, получавших исследуемое соединение в дозе 0,1 мг/кг наблюдалась следующая тенденция: снижение гипергликемии в большей степени было отмечено на 7 сутки (на 13% (р<0,05)) по сравнению с группой с «контроль-диабет», далее на 14 сутки лечения наблюдался уже статистически не значимый гипогликемический эффект (уровень глюкозы был ниже на 7% по сравнению с группой с «контроль-диабет»).
Таким образом, курсовое 14-дневное внутрижелудочное введение соединение ZB40-0016 в дозе 1 мг/кг способно снижать тяжесть течения сахарного диабета, уменьшая выраженность гипергликемии.
![ЗАМЕЩЕННЫЕ 4-{ [4-(3,3-ДИОКСИДО-1,3-БЕНЗОКСАТИОЛ-6-ИЛ)АРИЛОКСИ]МЕТИЛ} ПИПЕРИДИНЫ КАК АГОНИСТЫ РЕЦЕПТОРОВ GPR119, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/4d/62/69/0fa3a42c750f41e915657123cbe743e5.jpg)
![ЗАМЕЩЕННЫЕ 4-{ [4-(3,3-ДИОКСИДО-1,3-БЕНЗОКСАТИОЛ-6-ИЛ)АРИЛОКСИ]МЕТИЛ} ПИПЕРИДИНЫ КАК АГОНИСТЫ РЕЦЕПТОРОВ GPR119, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/4d/62/69/e6212fc9c352669b3e71931706b7bad3.png)
![ЗАМЕЩЕННЫЕ 4-{ [4-(3,3-ДИОКСИДО-1,3-БЕНЗОКСАТИОЛ-6-ИЛ)АРИЛОКСИ]МЕТИЛ} ПИПЕРИДИНЫ КАК АГОНИСТЫ РЕЦЕПТОРОВ GPR119, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ](https://fips.edrid.ru/images/rid/4d/62/69/bbafe9da9d06d8b163b5e379ef5a1b4a.png)

