Результат интеллектуальной деятельности: РАСТЕНИЯ КУКУРУЗЫ, ОТЛИЧАЮЩИЕСЯ ЛОКУСАМ КОЛИЧЕСТВЕННЫХ ПРИЗНАКОВ QTL
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Тематика настоящего изобретения касается растений, в частности растений кукурузы с геномом, содержащим уникальный набор аллелей, связанных с соответствующими локусами количественных признаков (QTL), участвующими в экспрессии целого ряда фенотипических признаков, представляющих экономический интерес, выбранных из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания, стеблевого полегания, частоты головни обыкновенной, частоты вызванного Fusarium загнивания початков (фузариоза початков), устойчивости к Sulcotrione и строения метелки.
Изобретение также касается способа получения таких растений, а также способов анализа и скрининга для идентификации растений с требуемым профилем.
Уровень техники
Селекционное разведение столетиями применялось для улучшения или в попытке улучшения фенотипических признаков, представляющих агрономический и экономический интерес у растений, как-то: урожайность, содержание масла в зерне и др. Вообще говоря, селекционное разведение включает отбор особей для того, чтобы они служили в качестве родителей нового поколения на основе одного или нескольких представляющих интерес фенотипических признаков. Однако такая селекция по фенотипу зачастую осложняется негенетическими факторами, способными повлиять на искомый фенотип. Негенетические факторы, способные давать такие эффекты, включают такие экологические воздействия, как тип и качество почвы, количество осадков, диапазон температур и др.
Большинство фенотипических признаков контролируются более чем одним генетическим локусом, каждый из которых обычно влияет на данный признак в большей или меньшей степени. Например, U.S. Patent No.6399855 на Beavis свидетельствует, что подавляющее большинство имеющих экономическое значение фенотипических признаков у домашних растений представляют собой так называемые количественные признаки. Обычно термин "количественный признак" применяется для описания такого фенотипа, который проявляет непрерывную изменчивость при экспрессии и является конечным результатом взаимодействия нескольких генетических локусов предположительно друг с другом и/или со средой. Также широко применялся термин "сложный признак" для описания признаков, не проявляющих классического менделевского наследования, которое обычно относится к одному генетическому локусу (Lander & Schork (1994) 265 Science 2037-2048).
Одним из последствий многофакторного профиля наследования является то, что может оказаться затруднительным картирование локусов, способствующих экспрессии таких признаков. Однако разработка множества полиморфных генетических маркеров (напр., RFLP, SNP, SSR и др.), охватывающих весь геном, дает возможность изучать то, что Edwards et al. (1987) 115 Genetics 113-125 назвали "локусами количественных признаков" (QTL), а также их количество, величину и распределение. Локусы QTL содержат гены, в той или иной степени контролирующие качественные и количественные фенотипические признаки, которые могут быть дискретными или иметь непрерывное распределение в семействе особей, а также в популяции семейств особей.
Были разработаны различные экспериментальные подходы для идентификации и анализа QTL (напр., см. U.S. Patent Nos.5,385,835, 5,492,547 и 5,981,831). Один из таким подходов заключается в скрещивании двух инбредных линий с получением простого гибридного потомства F1, самоопылении гибридного потомства F1 с получением расходящегося потомства F2, генотипировании множественных маркерных локусов и оценки одного или нескольких количественных фенотипических признаков среди расходящегося потомства. Затем проводится идентификация QTL на основе значимых статистических связей между генотипическими величинами и фенотипической изменчивостью среди расходящегося потомства. Такой экспериментальный принцип является идеальным в том смысле, что родительские линии поколения F1 имеют известные фазы сцепления, все расщепляющиеся локусы у потомства являются информативными, а неравновесность сцепления между маркерными локусами и генетическими локусами, затрагивающими фенотипические признаки, достигает максимума.
В настоящем изобретении применяли распространенную методику продвижения поколений для создания растений кукурузы, проявляющих уникальный профиль аллелей по специфическим локусам QTL.
Определения
В настоящем описании и формуле изобретения формы единственного числа включают значения множественного числа, если только контекст четко не предписывает иначе. Так, например, просто растение включает одно или несколько растений, а просто клетка включает смеси клеток, тканей и т.п.
"Аллель" в рамках изобретения служит для обозначения альтернативных форм различных генетических единиц, связанных с различными формами гена или любого иного отдельного генетического элемента, которые при наследовании являются альтернативными потому, что они располагаются в одном и том же локусе гомологичных хромосом. В диплоидных клетках или организмах две аллели данного гена (или маркера) обычно занимают соответствующие локусы на паре гомологичных хромосом.
Аллель, связанная с количественным признаком, может составлять один ген либо несколько генов или же ген, кодирующий генетический фактор, вносящий вклад в фенотип, представленный данным QTL.
В настоящем изобретении термин "разведение" и его грамматические варианты относятся к любым процессам, создающим особей потомства. Разведение может быть половым или бесполым либо комбинированным. Неограничивающие примеры типов разведения включают скрещивание, самоопыление, получение двойных гаплоидов и их комбинации.
В настоящем изобретении выражение "устойчивая селекционная популяция" относится к совокупности потенциальных партнеров для скрещивания, полученных от или используемых в качестве родителей в селекционной программе, напр., коммерческой селекционной программе. Представители устойчивой селекционной популяции, как правило, хорошо изучены в отношении генетики и/или фенотипа. Например, могли быть изучены несколько представляющих интерес фенотипических признаков, напр., при различных экологических условиях, в различных местностях и/или в разное время. С другой стороны, могли быть идентифицированы один или несколько генетических локусов, связанных с экспрессией фенотипических признаков, и один или несколько представителей популяции могли быть генотипированы в отношении одного или нескольких генетических локусов, а также в отношении одного или нескольких генетических маркеров, связанных с одним или несколькими генетическими локусами.
В настоящем изобретении выражение "диплоидная особь" относится к особям, имеющим два набора хромосом, обычно по одному от каждого из родителей. Однако следует иметь в виду, что в некоторых воплощениях диплоидная особь может получить свои "материнские" и "отцовские" наборы хромосом из одного и того же организма, как-то при самоопылении растений для получения следующего поколения растений.
"Гомозиготные" в рамках изобретения служит для обозначения одинаковых аллелей в одном или нескольких соответствующих локусах на гомологичных хромосомах.
"Гетерозиготные" в рамках изобретения служит для обозначения неодинаковых аллелей в одном или нескольких соответствующих локусах на гомологичных хромосомах.
"Возвратное скрещивание" в рамках изобретения служит для обозначения процесса, в котором гибридное потомство неоднократно подвергается скрещиванию обратно с одним из родителей.
"Генетическое сцепление" в рамках изобретения служит для обозначения связи между признаками при наследовании из-за того, что гены располагаются рядом на одной и той же хромосоме, которое измеряется как процент рекомбинации между локусами (сантиморган, сМ).
В настоящем изобретении выражение "количественный признак" относится к таким фенотипическим признакам, которые могут быть описаны в числовом выражении (т.е. количественно). Количественный признак, как правило, проявляет непрерывную изменчивость между особями популяции; то есть различия в численном значении фенотипического признака являются небольшими и переходят друг в друга. Зачастую распределение по частоте количественного фенотипического признака в популяции выражается колоколообразной кривой (т.е. проявляет нормальное распределение между двумя крайними значениями). Количественный признак, как правило, является результатом взаимодействия генетического локуса с окружающей средой или взаимодействия нескольких генетических локусов (QTL) друг с другом и/или с окружающей средой. Примеры количественных признаков включают высоту и урожайность растений.
В настоящем изобретении термины "локус количественного признака" (QTL) и "связь с маркерным признаком" относятся к связи между генетическим маркером и участком хромосомы и/или геном, затрагивающим фенотип данного признака. Как правило, это определяется статистически, напр., на основе одного или нескольких методов, опубликованных в литературе. Локус QTL может представлять собой участок хромосомы и/или генетический локус как минимум с двумя аллелями, по-разному влияющими на экспрессию фенотипического признака (количественного либо качественного признака).
В настоящем изобретении выражения "скрещивание половым путем" и "половое размножение" в контексте тематики настоящего изобретения относятся к слиянию гамет для получения потомства (напр., при оплодотворении, как-то при опылении растений для получения семян). "Половое скрещивание" или "перекрестное оплодотворение" в некоторых воплощениях означает оплодотворение одной особи другой особью (напр., перекрестное опыление у растений). Термин "самоопыление" в некоторых воплощениях означает получение семян при самооплодотворении или самоопылении, т.е. пыльца и семяпочка происходят из одного и того же растения.
В настоящем изобретении выражение "генетический маркер" относится к какой-то особенности генома особи (напр., последовательности нуклеотидов или полинуклеотидов, находящейся в геноме особи), которая связана с одним или несколькими нужными локусами. В некоторых воплощениях генетический маркер может быть полиморфным в данной популяции или же локус занят полиморфными формами, в зависимости от контекста. Генетические маркеры включают, к примеру, полиморфизмы по одному нуклеотиду (SNP), индели (т.е. вставки/делеции), простые повторы последовательности (SSR), полиморфизмы по длине рестрикционных фрагментов (RFLP), амплифицированные случайным образом полиморфные участки ДНК (RAPD), маркеры типа расщепленных амплифицированных полиморфных последовательностей (CAPS), маркеры по технологии матриц разнообразия (DArT) и полиморфизмы по длине амплифицированных фрагментов (AFLP), среди многих других примеров. Генетические маркеры, к примеру, могут использоваться для локализации генетических локусов, содержащих аллели, способствующие вариабельности при экспрессии фенотипических признаков на хромосоме. Выражение "генетический маркер" также может относиться к последовательности полинуклеотида, комплементарного геномной последовательности, как-то последовательности нуклеиновой кислоты, используемой в качестве зонда.
Генетический маркер может физически располагаться в таком положении на хромосоме, которое находится внутри или вне того генетического локуса, с которым он связан (т.е. внутри гена или вне гена, соответственно). Иными словами, в то время как генетические маркеры обычно используются тогда, когда не установлена локализация на хромосоме гена, соответствующего искомому локусу, и при этом степень рекомбинации между генетическим маркером и данным локусом не равна нулю, в тематике настоящего изобретения могут использоваться и такие генетические маркеры, которые физически находятся в пределах генетического локуса (напр., внутри геномной последовательности, соответствующей гену, как-то при полиморфизме внутри интрона или экзона гена). В некоторых воплощениях тематики настоящего изобретения один или несколько генетических маркеров составляют от одного до десяти генетических маркеров, а в некоторых воплощениях один или несколько генетических маркеров составляют более десяти генетических маркеров.
В настоящем изобретении термин "генотип" относится к генетическому составу клетки или организма. "Генотип по набору генетических маркеров" особи включает специфические аллели для одного или нескольких локусов генетических маркеров у этой особи. Как известно, генотип может относиться к одному локусу или к нескольким локусам, связанным или не связанным и/или сцепленным или не сцепленным друг с другом. В некоторых воплощениях генотип особи относится к одному или нескольким генам, связанным в том смысле, что они участвуют в экспрессии искомого фенотипа (напр., определенного количественного признака). Так, в некоторых воплощениях генотип слагается из одной или нескольких аллелей, представленных у особи в одном или нескольких генетических локусах количественного признака. В некоторых воплощениях генотип выражается в переводе на гаплотип (который определен ниже).
В настоящем изобретении термин "идиоплазма" относится к совокупности генотипов у популяции или иной группы особей (напр., вида). Термин "идиоплазма" может относиться и к растительному материалу, напр., группе растений, служащих хранилищем различных аллелей. Выражение "адаптированная идиоплазма" относится к растительному материалу с доказанным генетическим преимуществом, напр., для данной среды или географической зоны, тогда как выражения "неадаптированная идиоплазма", "сырая идиоплазма" и "экзотическая идиоплазма" относятся к растительному материалу с неизвестной или недоказанной генетической ценностью, напр., для данной среды или географической зоны; при этом в некоторых воплощениях выражение "неадаптированная идиоплазма" относится к такому растительному материалу, который не входит в состав устойчивой селекционной популяции и не имеет известного родства с представителями устойчивой селекционной популяции.
В настоящем изобретении термин "гаплотип" относится к тому набору аллелей, который особь унаследовала от одного из родителей. При этом диплоидная особь имеет два гаплотипа. Термин "гаплотип" может применяться в более узком смысле для обозначения физически сцепленных и/или не сцепленных генетических маркеров (напр., полиморфизмов последовательности), связанных с фенотипическим признаком. Выражение "гаплотипный блок" (что иногда в литературе также именуется просто гаплотипом) относится к группе из двух или нескольких генетических маркеров, физически сцепленных на одной хромосоме (или ее части). Как правило, каждый блок содержит несколько общих гаплотипов, причем можно выбрать подгруппу генетических маркеров (т.е. "метку гаплотипа"), которая однозначно идентифицирует каждый из этих гаплотипов.
В настоящем изобретении термины "гибрид", "гибридное растение" и "гибридное потомство" относятся к особям, полученным от генетически разных родителей (напр., генетически гетерозиготным или почти гетерозиготным особям).
Если две особи обладают одинаковыми аллелями в определенном локусе, то эти аллели называются "идентичными по происхождению", если они унаследованы от одного общего предка (т.е. являются копиями одной и той же родительской аллели). Альтернатива состоит в том, что аллели являются "идентичными по состоянию" (т.е. они кажутся одинаковыми, но происходят из двух разных копий этой аллели). Информация об идентичности по происхождению полезна для опытов по сцеплению, а информация об идентичности по происхождению и идентичности по состоянию может использоваться в опытах по ассоциации типа тех, что описаны в настоящем изобретении, хотя особенно полезной может оказаться информация об идентичности по происхождению.
В настоящем изобретении выражение "F1-гибрид от однократного скрещивания" относится к F1-гибридам, полученным от скрещивания между двумя инбредными линиями.
В настоящем изобретении выражение "инбредная линия" относится к генетически гомозиготной или почти гомозиготной популяции. Инбредная линия, к примеру, может быть получена посредством нескольких циклов скрещивания между братьями/сестрами или самоопыления. В некоторых воплощениях инбредные линии разводят по одному или нескольким заданным фенотипическим признакам. "Инбредный", "инбредная особь" или "инбредное потомство" представляют собой особи, отобранные из инбредной линии.
В настоящем изобретении термин "сцепление" и его грамматические варианты относятся к тенденции аллелей в различных локусах на одной и той же хромосоме к совместному расщеплению более часто, чем это было бы случайным образом, если бы они передавались независимо, а в некоторых воплощениях вследствие их физического соседства.
В настоящем изобретении выражение "неравновесное сцепление" (а также "аллельная ассоциация") относится к явлению, при котором определенные аллели в двух или нескольких локусах стремятся остаться вместе в группах сцепления при расщеплении от родителей к потомкам с большей частотой, чем это можно ожидать из их индивидуальных частот в данной популяции. Например, аллель генетического маркера и аллель QTL могут проявлять неравновесное сцепление, если они встречаются вместе с большей частотой, чем это можно предсказать из частот индивидуальных аллелей. Неравновесное сцепление может происходить по нескольким причинам, в том числе вследствие их физического соседства на хромосоме.
В настоящем изобретении термин "локус" относится к положению на хромосоме, в котором содержится ген, вносящий вклад в признак, генетический маркер и т.п.
В настоящем изобретении выражение "нуклеиновая кислота" относится к любой физической цепочке звеньев мономера, которая может соответствовать цепочке нуклеотидов, включая полимеры нуклеотидов (напр., типичные полимеры ДНК или РНК), модифицированные олигонуклеотиды (напр., олигонуклеотиды, содержащие необычные для биологической РНК или ДНК основания, как-то 2'-O-метилированные олигонуклеотиды) и др. В некоторых воплощениях нуклеиновая кислота может быть одноцепочечной, двухцепочечной, многоцепочечной или комбинированной. Если не указано иначе, последовательность определенной нуклеиновой кислоты по настоящему изобретению необязательно включает или охватывает комплементарные последовательности, наряду с последовательностями, указанными в явном виде.
В настоящем изобретении выражение "фенотип" или "фенотипический признак" относится к внешнему виду или иной отличительной и заметной характеристике особи, вытекающей из взаимодействия генома с окружающей средой.
В настоящем изобретении термин "большинство" означает больше, чем один. Так, "большинство особей" означает по меньшей мере две особи. В некоторых воплощениях термин "большинство" означает больше, чем половину целого. Например, в некоторых воплощениях "большинство популяции" означает больше, чем половину представителей этой популяции.
В настоящем изобретении термин "потомство" относится к потомкам от определенного скрещивания. Как правило, потомство образуется от скрещивания двух особей, хотя некоторые виды (в частности, некоторые растения и гермафродитные животные) могут скрещиваться сами с собою (т.е. одно и то же растение служит донором как мужских, так и женских гамет). Потомки могут принадлежать, например, к поколению F1, F2 или любому последующему поколению.
В настоящем изобретении выражение "количественный признак" относится к такому фенотипическому признаку, который контролируется одним или несколькими генами, проявляющими большие фенотипические эффекты. Вследствие этого количественные признаки, как правило, имеют простое наследование. Примеры у растений включают окраску цветков, окраску стержня початка и устойчивость к заболеваниям, как-то устойчивость к увяданию листьев кукурузы типа Northern.
"Селекция по маркерам" в рамках изобретения означает применение генетических маркеров для выявления одной или нескольких нуклеиновых кислот у растения, причем нуклеиновая кислота связана с требуемым признаком для идентификации растений, несущих гены желательных (или нежелательных) признаков с тем, чтобы использовать (или отбросить) эти растения в программе селекционного разведения.
"Микросателлитный маркер или простые повторы последовательности (SSR)" в рамках изобретения означает такой тип генетического маркера, который состоит из многочисленных повторов коротких последовательностей оснований ДНК, которые встречаются повсеместно в ДНК растения и могут быть сильно полиморфными.
"ПЦР (полимеразная цепная реакция)" в рамках изобретения означает способ получения сравнительно большого количества определенных участков ДНК, что делает возможным различные анализы на основе этих участков.
"Праймер для ПЦР" в рамках изобретения означает сравнительно короткий фрагмент одноцепочечной ДНК, используемый при амплификации методом ПЦР определенных участков ДНК.
"Полиморфизм" в рамках изобретения означает наличие в популяции двух или нескольких различных форм гена, генетического маркера или наследуемого признака.
"Селекционное разведение" в рамках изобретения означает программу разведения, в которой в качестве родителей используются растения, обладающие или проявляющие желательные признаки.
"Растение-анализатор" в рамках изобретения означает растение, используемое для генетической характеристики признака у подлежащего анализу растения. Как правило, подлежащее анализу растение скрещивают с растением-анализатором и определяют коэффициент расщепления признака в потомстве от этого скрещивания.
В настоящем изобретении термин "анализатор" относится к линии или особи со стандартным генотипом, известными характеристиками и установленной продуктивностью. "Родитель-анализатор" - это особь из линии-анализатора, которая используется в качестве родителя при половом скрещивании. Как правило, родитель-анализатор не связан родством и генетически отличается от той особи, с которой его скрещивают. Анализатор обычно используется для получения потомства F1 при скрещивании с особями или инбредными линиями для фенотипической оценки.
В настоящем изобретении выражение "комплексное скрещивание" относится к процессу скрещивания одной линии-анализатора с множественными линиями. Целью такого скрещивания является определение фенотипической продуктивности гибридного потомства, то есть оценка способности каждой из множественных линий к выработке желательного фенотипа у гибридного потомства, полученного от этой линии при аналитическом скрещивании.
"Гомологичность последовательностей или идентичность последовательностей" в настоящем изобретении применяются взаимозаменяемым образом. Термины "идентичные" или "идентичность" на столько-то процентов в контексте двух или нескольких последовательностей нуклеиновых кислот или белков означают, что две или несколько последовательностей одинаковы или имеют определенный процент одинаковых аминокислотных остатков или нуклеотидов при сравнении и совмещении их по максимальному соответствию, что измеряется при помощи одного из следующих алгоритмов сравнения последовательностей или при визуальном осмотре. Если две последовательности, которые нужно сравнить друг с другом, отличаются по длине, то идентичность последовательностей предпочтительно относится к проценту нуклеотидных остатков более короткой последовательности, идентичных нуклеотидным остаткам более длинной последовательности. Идентичность последовательностей можно определить стандартным образом с помощью таких компьютерных программ, как программа Bestfit (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, 575 Science Drive Madison, WI 53711). В программе Bestfit используется алгоритм локальной гомологии по Smith and Waterman, Advances in Applied Mathematics 2 (1981), 482-489, чтобы найти отрезок с наибольшей идентичностью между двумя последовательностями. При использовании Bestfit или другой программы совмещения последовательностей для определения того, что определенная последовательность, к примеру, на 95% идентична сравниваемой последовательности настоящего изобретения, параметры предпочтительно выставляются таким образом, чтобы процент идентичности вычислялся по всей длине контрольной последовательности, и были разрешены разрывы гомологии вплоть до 5% от общего числа нуклеотидов в контрольной последовательности. При использовании Bestfit так называемые произвольные параметры лучше оставить на предварительно заданном уровне ("по умолчанию"). Отклонения, возникающие при сравнении между данной последовательностью и вышеописанными последовательностями изобретения, могут быть вызваны, к примеру, добавлением, делецией, заменой, вставкой или рекомбинацией. Такое сравнение последовательностей предпочтительно также можно проводить и с помощью программы "Fasta20u66" (version 2.0u66, September 1998 by William R. Pearson and the University of Virginia; также см. W.R.Pearson (1990), Methods in Enzymology 183, 63-98, приведенные примеры и http://workbench.sdsc.edu/). Для этой цели можно использовать настройки параметров "по умолчанию".
Другим признаком того, что две последовательности нуклеиновых кислот по существу идентичны, является то, что эти две молекулы гибридизуются друг с другом в строгих условиях. Выражение "гибридизуется специфически с" относится к связыванию, образованию двойного комплекса (дуплекса) или гибридизации молекулы только с определенной последовательностью нуклеотидов в строгих условиях, если такая последовательность присутствует в сложной смеси (напр., тотальном препарате) ДНК или РНК клеток. "Связывается существенно" относится к комплементарной гибридизации между нуклеиновой кислотой зонда и нуклеиновой кислотой мишени и охватывает небольшие несоответствия, которые можно устранить снижением строгости среды гибридизации для достижения нужного выявления последовательности нуклеиновой кислоты мишени.
Термин "гибридизуется" в настоящем изобретении относится к стандартным условиям гибридизации, предпочтительно таким условиям гибридизации, при которых в качестве раствора используется раствор 5xSSPE, 1% SDS, 1храствор Денхардта, а температура гибридизации составляет от 35°С до 70°С, предпочтительно 65°С.После гибридизации проводится отмывка, предпочтительно сначала с помощью 2×SSC, 1% SDS, а затем 0,2×SSC при температуре от 35°С до 75°С, в частности от 45°С до 65°С, но особенно предпочтительно при 59°С (касательно определения SSPE, SSC и раствора Денхардта см. Sambrook et al., loc. cit). Особенно предпочтительны строгие условия гибридизации, например, как описано в Sambrook et al., supra. Строгие условия гибридизации особенно предпочтительны тогда, когда гибридизация и отмывка проводятся при 65°С, как указано выше. Менее предпочтительны нестрогие условия гибридизации, например, проведение гибридизации и отмывки при 45°С, еще менее - при 35°С.
"Строгие условия гибридизации" и "строгие условия отмывки при гибридизации" в контексте таких экспериментов по гибридизации нуклеиновых кислот, как southern- и northern-гибридизация, зависят от последовательности и отличаются при различных параметрах среды. Более длинные последовательности специфически гибридизуются при более высоких температурах. Исчерпывающее руководство по гибридизации нуклеиновых кислот представлено в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes part I chapter 2 "Overview of principles of hybridization and the strategy of nucleic acid probe assays" Elsevier, New York. В общем, условия высокой строгости при гибридизации и отмывке выбирают на 5°С меньше, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и рН. Как правило, в "строгих условиях" зонд будет гибридизоваться со своей мишенью, но не с другими последовательностями.
Tm - это температура (при определенной ионной силе и рН), при которой 50% последовательностей мишени гибридизуются с идеально соответствующим зондом. Очень строгие условия выбирают равными значению Тщ для данного зонда. Примером строгих условий при гибридизации комплементарных нуклеиновых кислот, имеющих более 100 комплементарных остатков, на фильтре методом southern- или northern-гибридизации является 50% формамида с 1 мг гепарина при 42°С, с проведением гибридизации в течение ночи. Примером очень строгих условий отмывки является 0,15 М NaCl при 72°С в течение 15 минут. Примером строгих условий отмывки является раствор 0,2×SSC при 65°С в течение 15 минут (см. описание буфера SSC в Sambrook, infra). Часто перед отмывкой при высокой строгости проводится отмывка при низкой строгости для устранения фонового сигнала зонда. Примером отмывки при средней строгости для двойного комплекса, напр., из более чем 100 нуклеотидов, является 1×SSC при 45°С в течение 15 минут. Примером отмывки при низкой строгости для двойного комплекса, напр., из более чем 100 нуклеотидов, является 4-6×SSC при 40°С в течение 15 минут. Для коротких зондов (напр., от 10 до 50 нуклеотидов) строгие условия обычно включают концентрацию соли менее чем 1,0 М иона Na, обычно от 0,01 до 1,0 М иона Na (или другой соли) при рН от 7,0 до 8,3, а температура обычно составляет как минимум 30°С. Строгие условия также достигаются добавлением дестабилизирующих веществ, как-то формамида. В общем случае отношение сигнал-шум в 2 раза (или больше), чем это наблюдается для постороннего зонда в данном опыте по гибридизации, означает выявление специфической гибридизации. Нуклеиновые кислоты, не гибридизующиеся друг с другом в строгих условиях, все равно считаются существенно идентичными, если кодируемые ими белки являются существенно идентичными. Это происходит, напр., при создании копии нуклеиновой кислоты с использованием максимальной вырожденности кодонов, допускаемой генетическим кодом.
"Растение" означает любое растение на любой стадии развития, в частности семенное растение.
"Растительная клетка" - это структурная и физиологическая единица растения, включающая протопласт и клеточную стенку. Растительная клетка может иметь вид изолированной одиночной клетки или культуры клеток, либо входить в состав более высокоорганизованной единицы, такой, к примеру, как растительная ткань, растительный орган или целое растение. Термин растительная клетка также охватывает растительные протопласты, у которых удалена только часть или вся клеточная стенка.
"Культура растительных клеток" означает культуру составных частей растений, таких, к примеру, как протопласты, клетки клеточной культуры, клетки растительных тканей, пыльцы, пыльцевых трубок, семяпочек, зародышевых мешков, зигот и зародышей на различных стадиях развития.
"Растительный материал" относится к листьям, стеблям, корням, цветкам или частям цветков, плодам, пыльце, яйцеклеткам, зиготам, семенам, черенкам, клеточным или тканевым культурам или любым иным частям или продуктам растений.
"Растительный орган" - это отдельная, имеющая видимую структуру и дифференцированная часть растения, как-то корень, стебель, лист, цветочная почка или зародыш.
"Растительная ткань" в настоящем изобретении означает группу растительных клеток, образующих структурную и функциональную единицу, включая любые ткани растений в самих растениях или в культуре. Этот термин охватывает целые растения, органы растений, семена растений, культуры тканей и любые группы растительных клеток, образующих структурные и/или функциональные единицы. Применение этого термина в сочетании с или без указания конкретного типа растительной ткани, приведенного выше или иным образом охваченного этим определением, не должно исключать любого иного типа растительных тканей.
Раскрытие изобретения
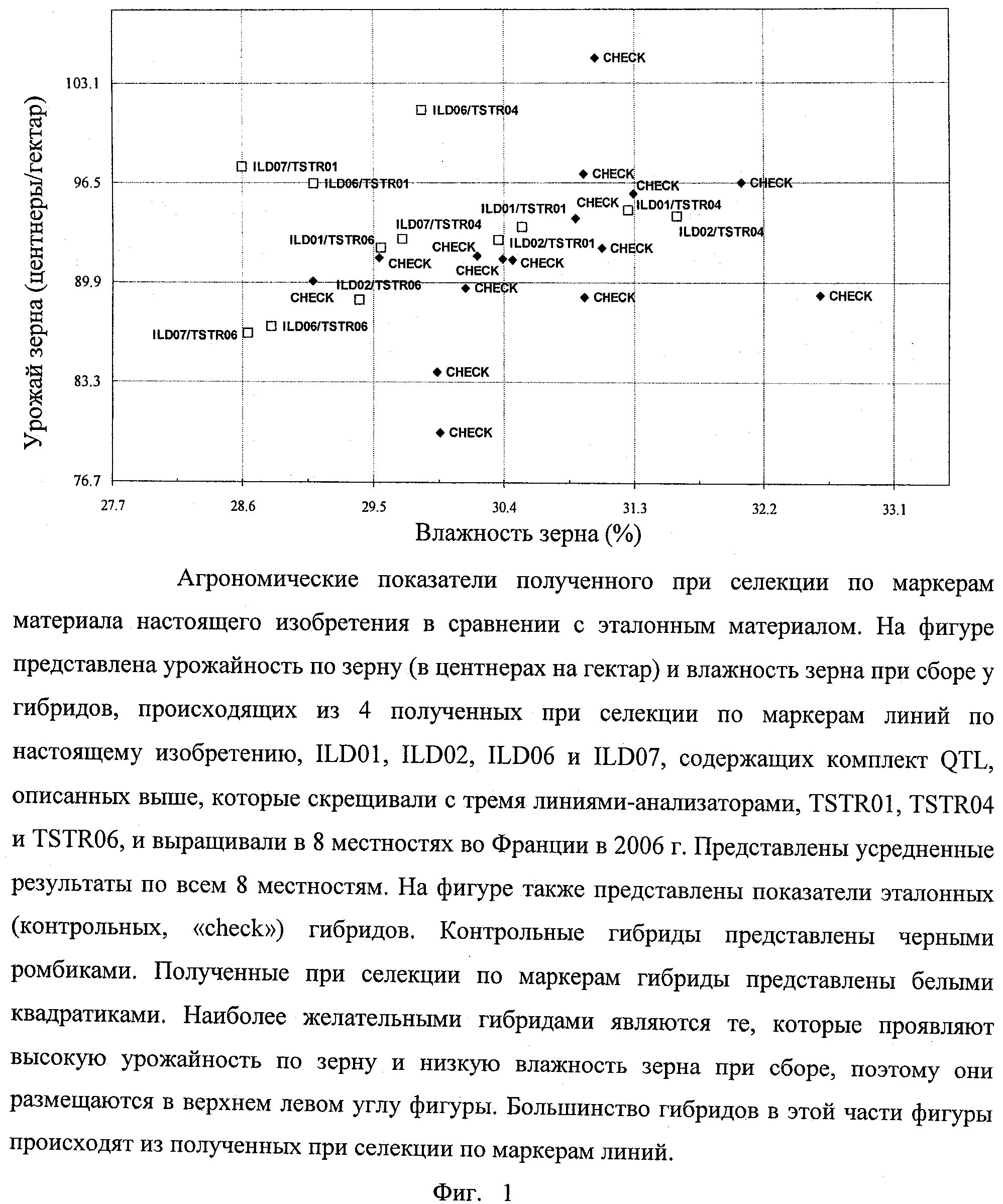
В одном воплощении изобретение касается растений кукурузы, у которых геном содержит набор аллелей, связанных с соответствующим набором локусов количественных признаков (QTL), имеющих экономическое значение и генетически сцепленных с соответствующими маркерами, представленными в табл.A-G, причем данный набор локусов QTL включает по меньшей мере два QTL, предпочтительно по меньшей мере 5, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 20 и вплоть до 37 QTL, вносящих вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания, стеблевого полегания, частоты головни обыкновенной, частоты вызванного Fusarium загнивания початков (фузариоза початков), устойчивости к Sulcotrione и строения метелки.
В частности, изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор аллелей по соответствующему набору локусов QTL, каждый из которых вносит вклад в фенотипический признак, имеющий экономическое значение, при этом:
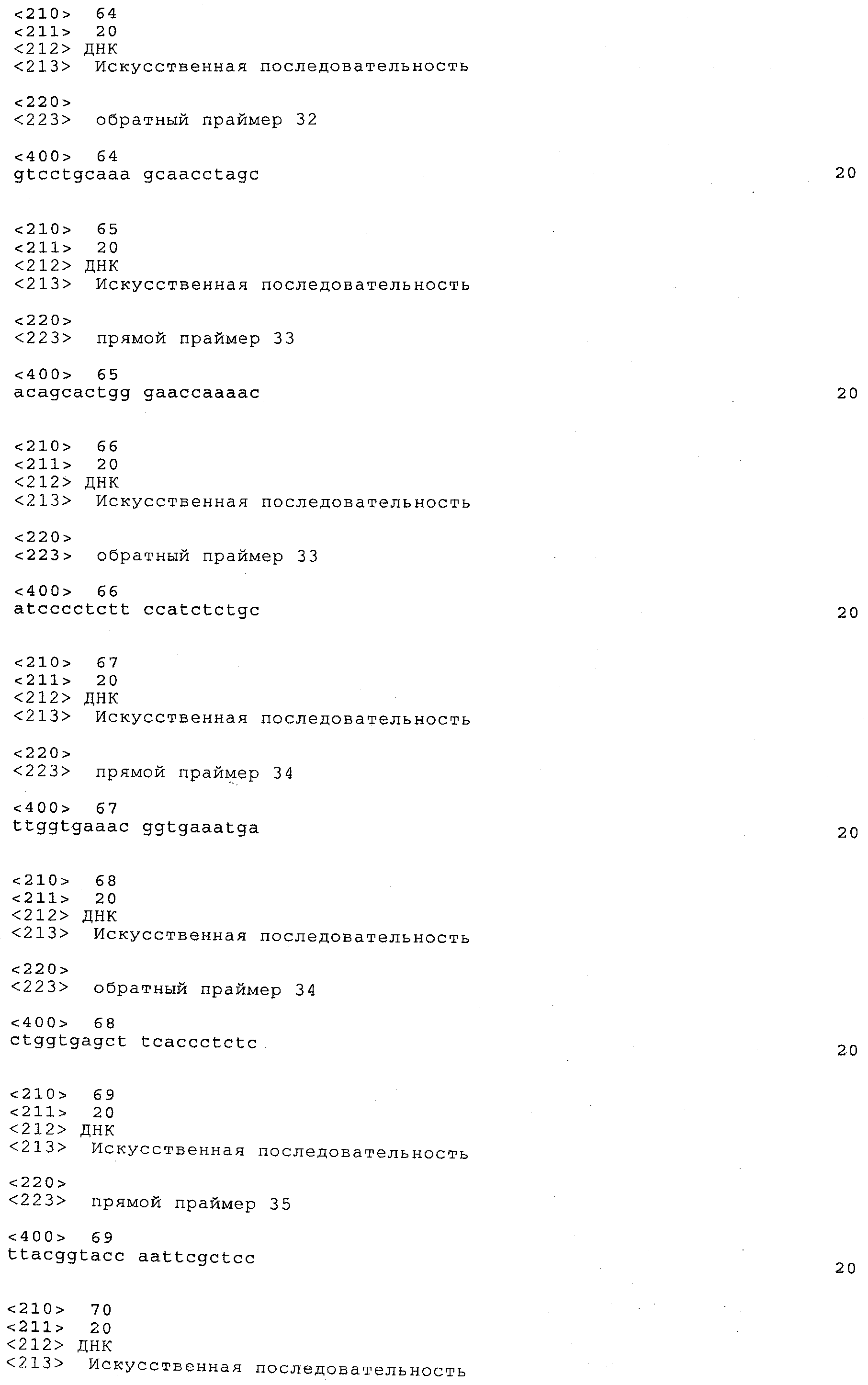
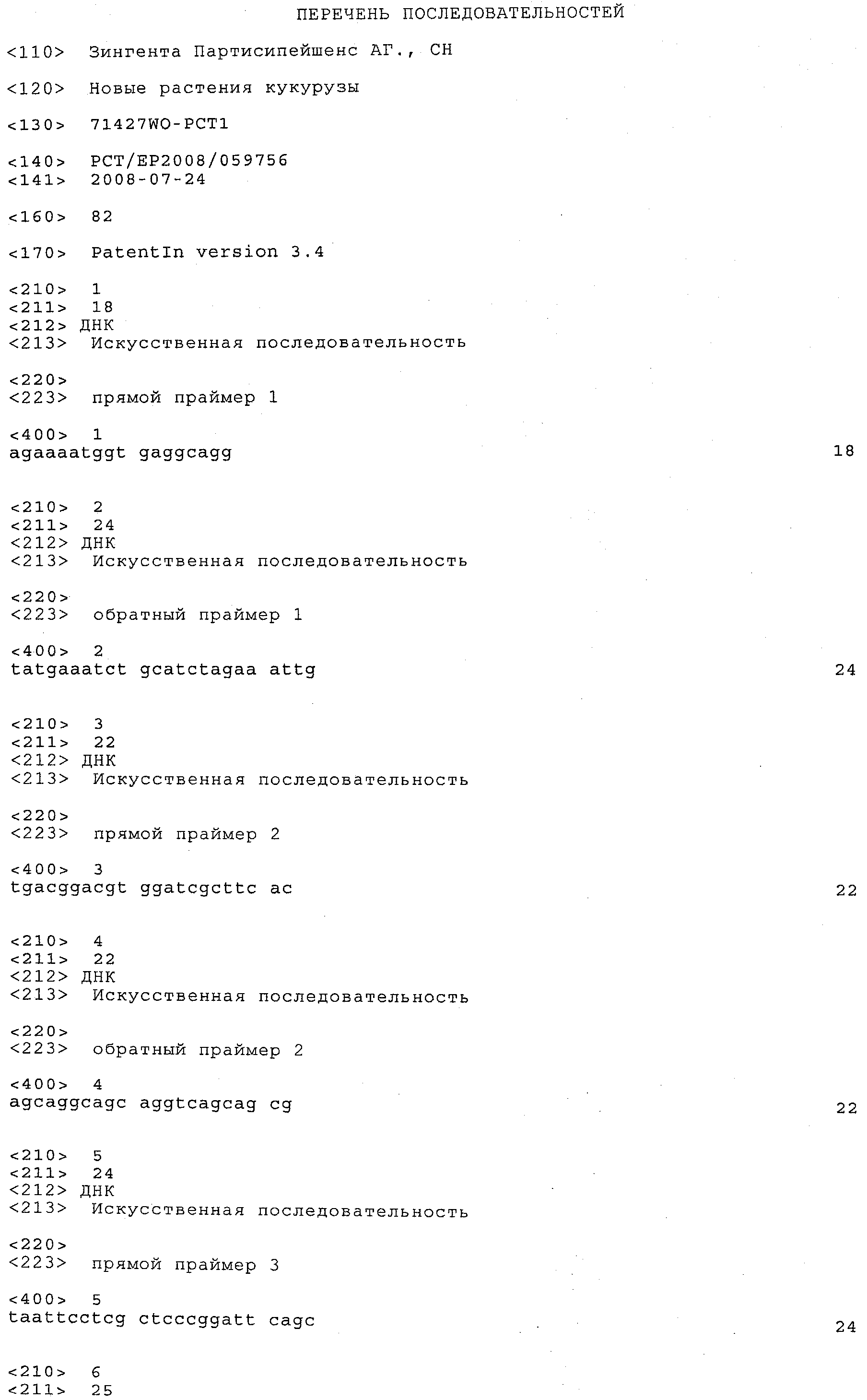
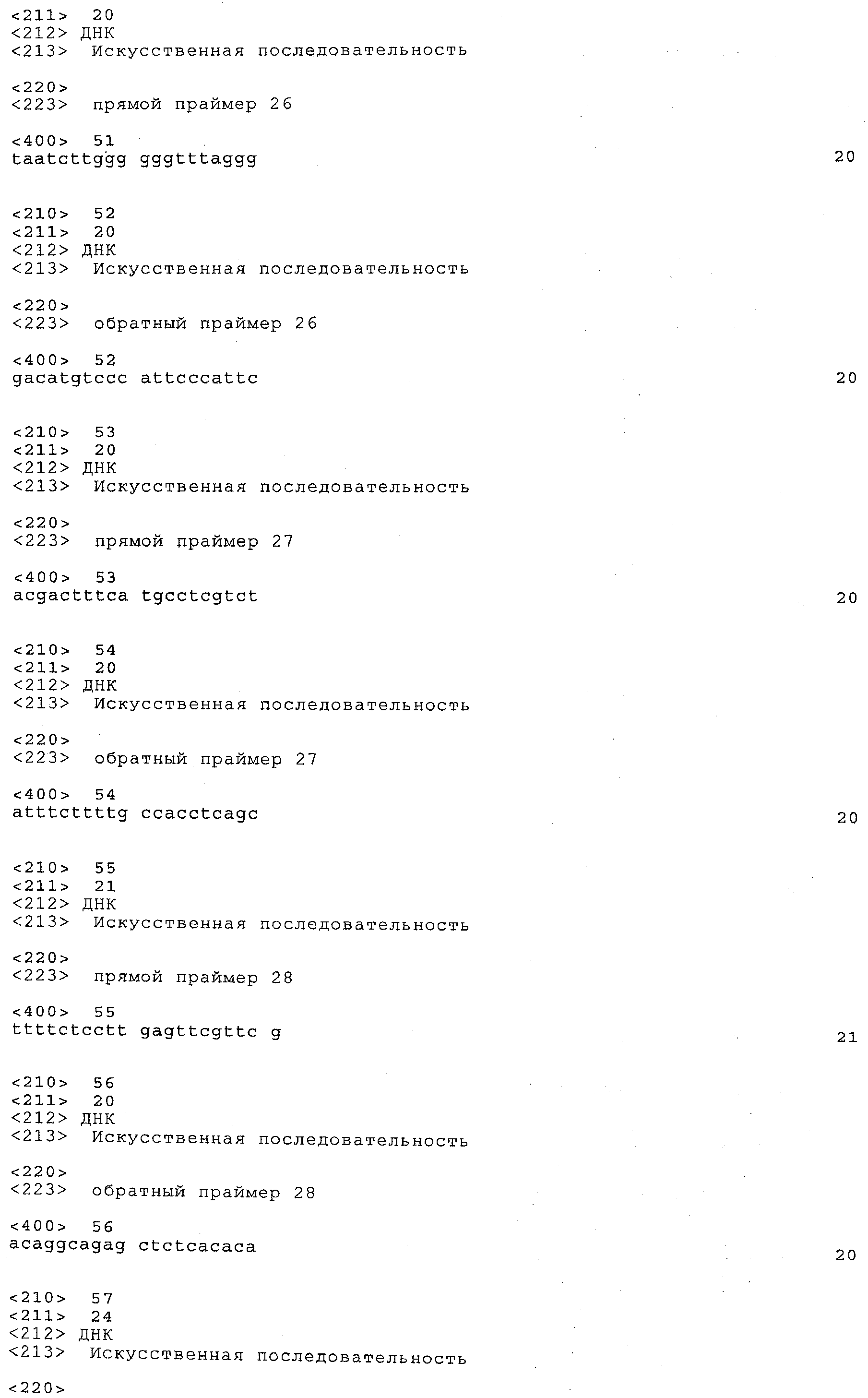
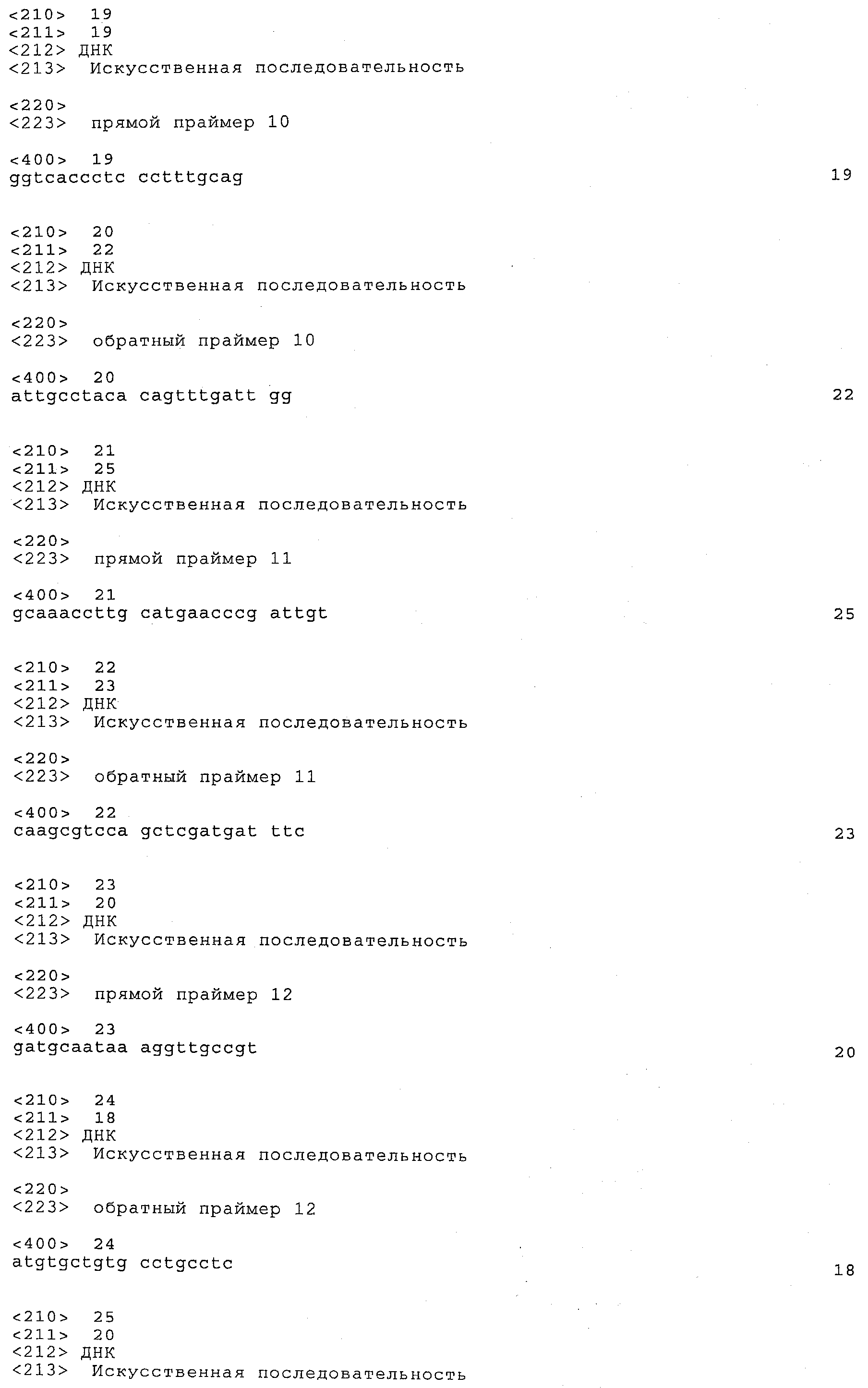
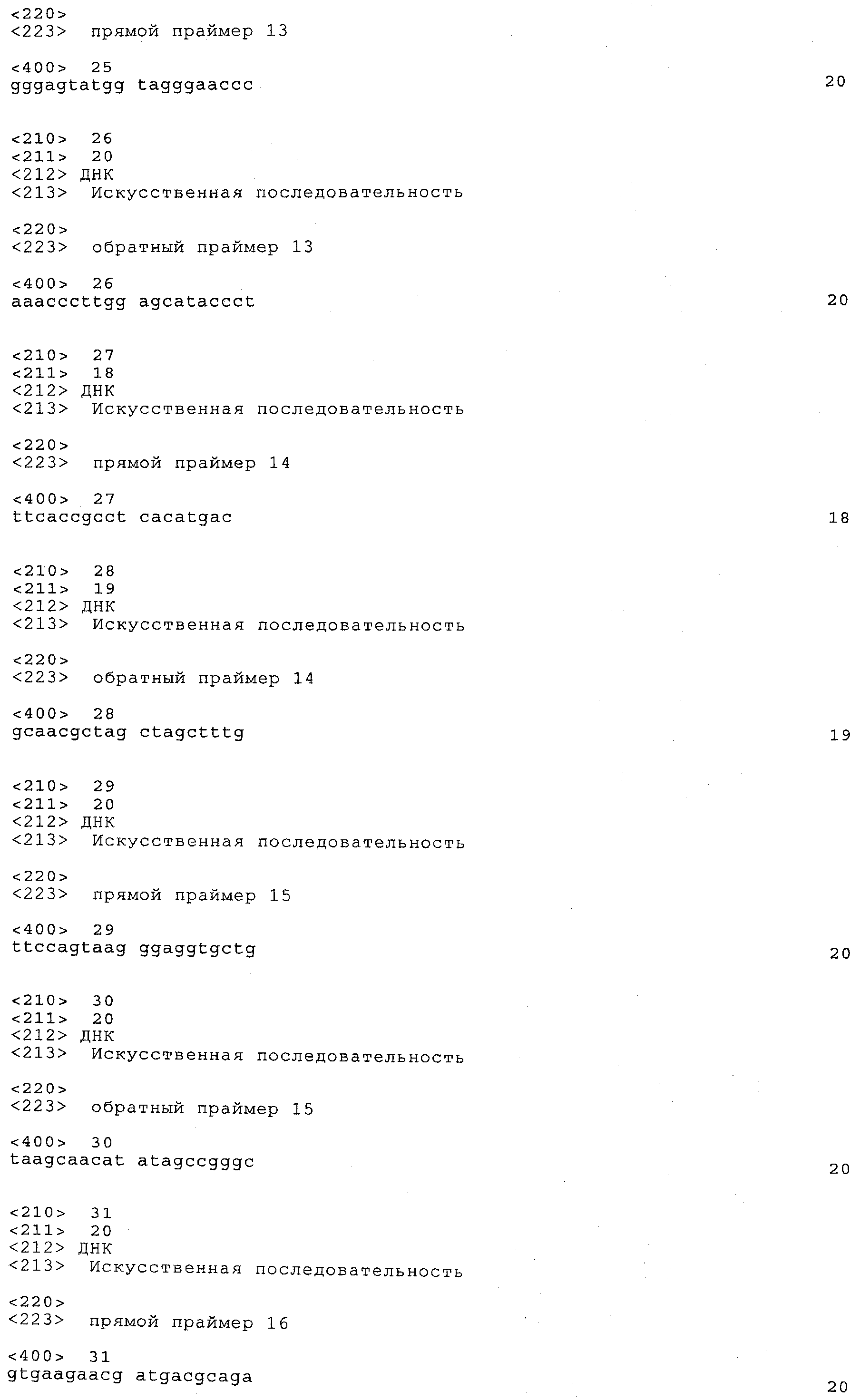
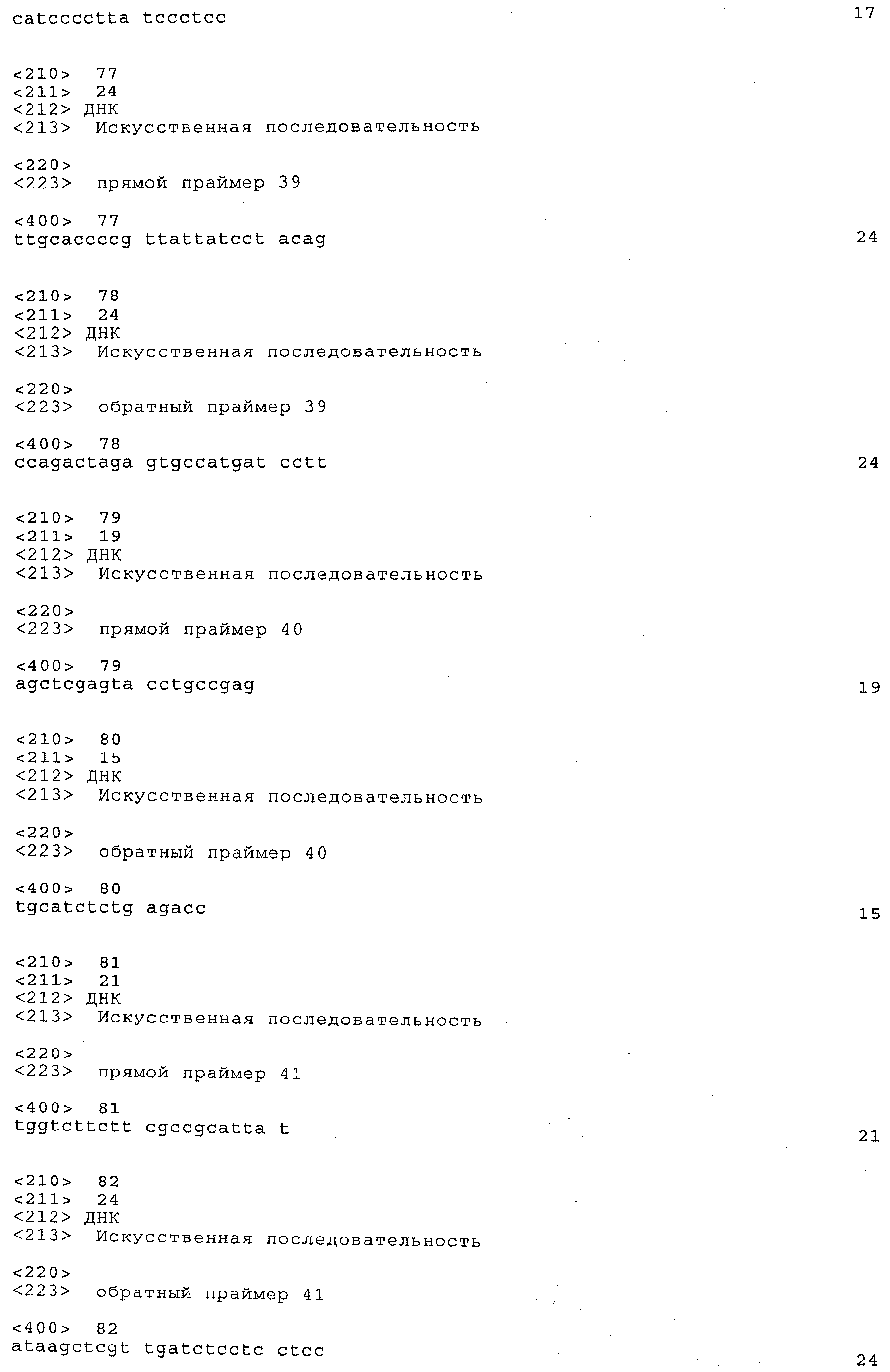
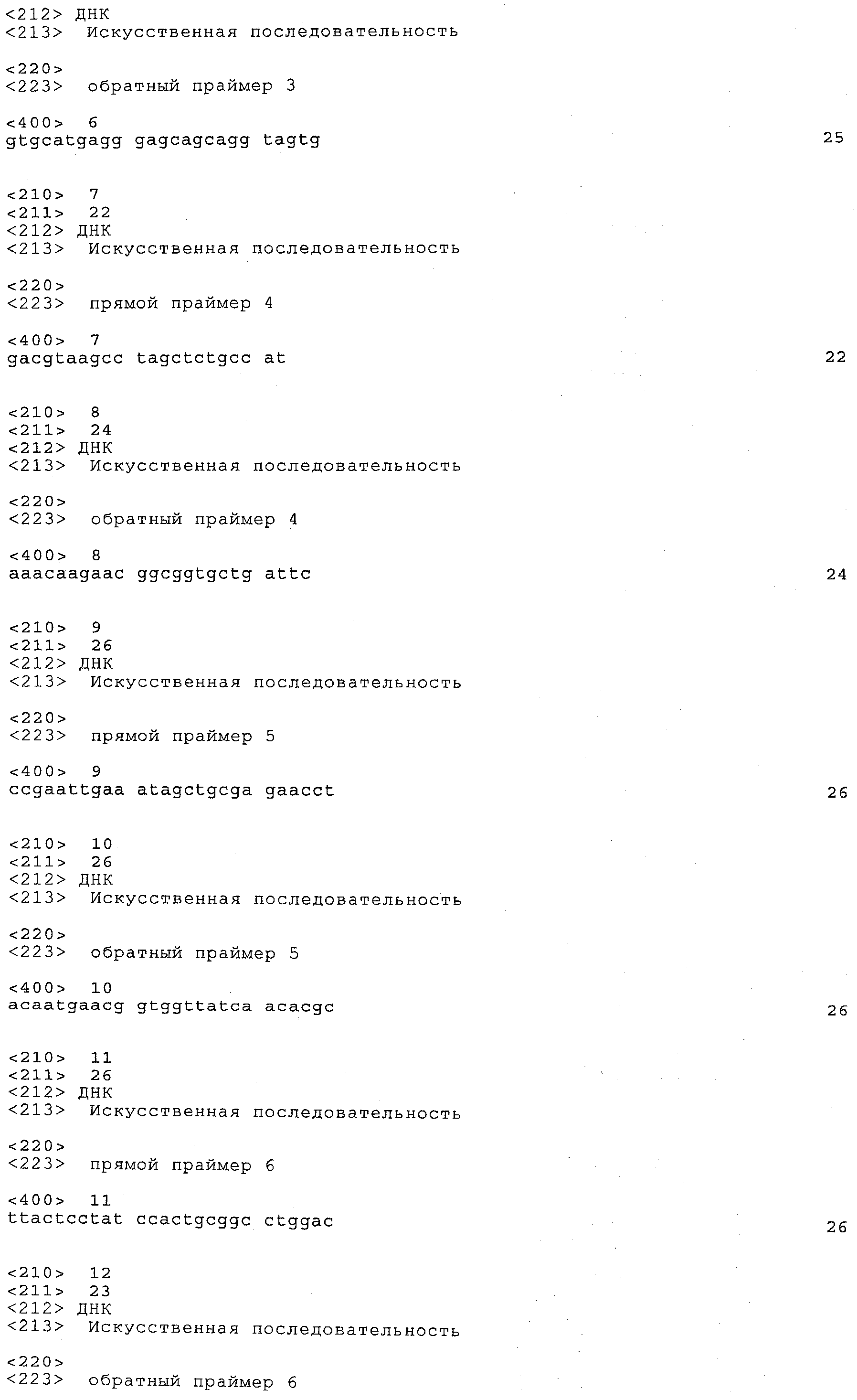
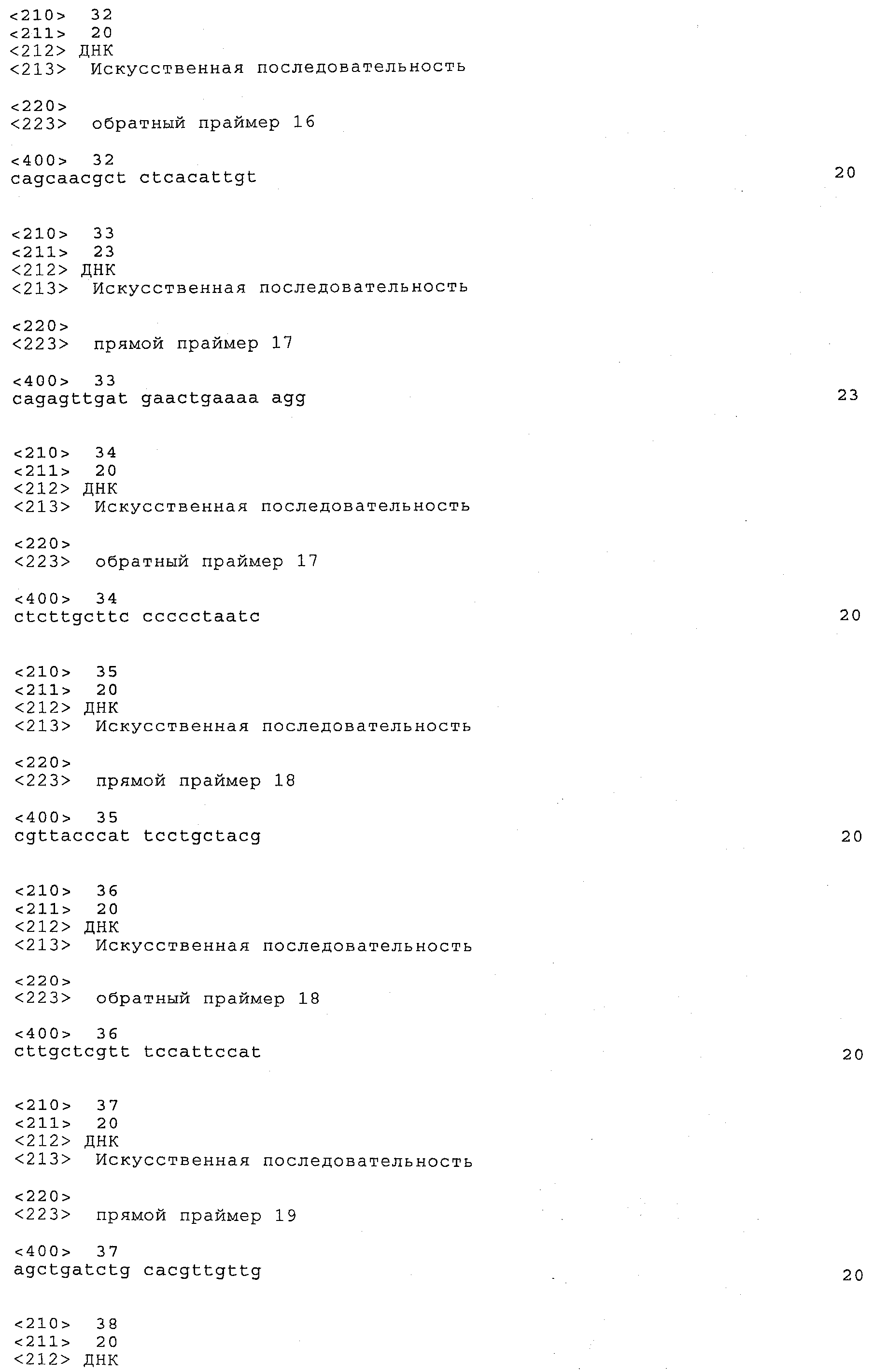
a) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.A-G;
b) каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации, полученным при реакции ПЦР с помощью соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров;
причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL.
Пары праймеров, указанные выше в пунктах а) и b), состоят из прямого праймера с нечетным номером SEQ ID и обратного праймера со следующим за ним четным номером SEQ ID. Например, прямой праймер с SEQ ID NO:1 и обратный праймер с SEQ ID NO:2 составляют пару праймеров, равно как SEQ ID NO:3 и SEQ ID NO:4; SEQ ID NO:5 и SEQ ID NO:6 и т.д.
Продукт ПЦР-амплификации, указанный выше в пункте Ь), полученный при реакции ПЦР с помощью пары олигонуклеотидных праймеров, приведенных в табл.A-G, может быть идентифицирован по молекулярному весу или по нуклеотидной последовательности, которые по существу идентичны молекулярному весу или нуклеотидной последовательности соответствующего продукта ПЦР-амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, причем данный набор локусов QTL включает по меньшей мере 5, предпочтительно по меньшей мере 8, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 14 различных QTL, вносящих вклад в фенотипический признак урожайности по зерну, а сами QTL локализуются на хромосомах 1, 2, 4, 5 и 7, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном аспекте изобретения растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, причем данный набор локусов QTL включает 14 различных QTL, вносящих вклад в фенотипический признак урожайности по зерну, а сами QTL локализуются на хромосомах 1, 2, 4, 5 и 7, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, причем данный набор локусов QTL включает по меньшей мере 5, предпочтительно по меньшей мере 7, более предпочтительно по меньшей мере 9, еще более предпочтительно по меньшей мере 11 различных QTL, вносящих вклад в фенотипический признак влажности зерна при сборе, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. В, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном аспекте изобретения растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, причем данный набор локусов QTL включает 11 различных QTL, вносящих вклад в фенотипический признак влажности зерна при сборе, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.В, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, причем данный набор локусов QTL включает по меньшей мере 4 различных QTL, но предпочтительно 3 QTL, вносящих вклад в фенотипический признак раннего и позднего прикорневого полегания/стеблевого полегания, а сами QTL локализуются на хромосоме 1, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.С, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, причем данный набор локусов QTL включает по меньшей мере 4 различных QTL, но предпочтительно 4 QTL, вносящих вклад в фенотипический признак строения метелки, а сами QTL локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, соответственно, причем данный набор локусов QTL включает по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 4 различных QTL, вносящих вклад в фенотипический признак устойчивости к грибковым заболеваниям или их частоты, который выбирается из группы, состоящей из устойчивости к Sulcotrione, частоты фузариоза початков и частоты головни обыкновенной, а сами QTL локализуются на хромосомах 3, 5 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.D, F и G, соответственно, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном аспекте изобретения растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, соответственно, причем данный набор локусов QTL включает 2 различных QTL, вносящих вклад в фенотипический признак частоты фузариоза початков и локализующихся на хромосоме 5, 2 различных QTL, вносящих вклад в фенотипический признак устойчивости к Sulcotrione и локализующихся на хромосомах 3 и 9, и 1 QTL, вносящий вклад в фенотипический признак частоты головни обыкновенной и локализующийся на хромосоме 3, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.D, F и G, соответственно, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, и приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну и влажности зерна при сборе, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А и В, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, и приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, причем данный набор локусов QTL включает 25 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, а 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А и В, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, и приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл. С, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 28 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе и раннего и позднего прикорневого полегания/стеблевого полегания, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А-С, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном аспекте изобретения растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, и приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, причем данный набор локусов QTL включает 28 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, а 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-С, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 29 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/ стеблевого полегания и частоты головни обыкновенной, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В частности, изобретением предусмотрены растения кукурузы по изобретению, описанные выше, характеризующиеся набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает 29 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, а 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 26 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе и частоты головни обыкновенной, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А, В и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В частности, изобретением предусмотрены растения кукурузы по изобретению, описанные выше, характеризующиеся набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 7 5/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает 26 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, а 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А, В и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30. 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает по меньшей мере 8, предпочтительно по меньшей мере 12, более предпочтительно по меньшей мере 15, но особенно предпочтительно по меньшей мере 18 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, позднего прикорневого полегания/стеблевого полегания и частоты головни обыкновенной, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5 и 7, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А, С и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В частности, изобретением предусмотрены растения кукурузы по изобретению, описанные выше, характеризующиеся набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает 18 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, а 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А, С и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает по меньшей мере 8, предпочтительно по меньшей мере 12, более предпочтительно по меньшей мере 15, но особенно предпочтительно по меньшей мере 15 различных QTL, вносящих вклад в фенотипические признаки влажности зерна при сборе, раннего и позднего прикорневого полегания/ стеблевого полегания и частоты головни обыкновенной, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. В, С и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В частности, изобретением предусмотрены растения кукурузы по изобретению, описанные выше, характеризующиеся набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем данный набор локусов QTL включает 15 различных QTL, 11 из которых вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, а 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. В, С и D, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 33 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной и строения метелки, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонукеотидных праймеров, приведенных в табл. А-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, причем данный набор локусов QTL включает 33 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, а 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР. состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает по меньшей мере 8, предпочтительно по меньшей мере 12, более предпочтительно по меньшей мере 15, но особенно предпочтительно по меньшей мере 19 различных QTL, вносящих вклад в фенотипические признаки влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной и строения метелки, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.В-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает 19 различных QTL, из которых 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосомах 1 и 5, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, а 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.В-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, но особенно предпочтительно по меньшей мере 22 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной и строения метелки, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А и С-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает 22 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, а 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А и С-Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, частоты головни обыкновенной и строения метелки, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В, D и Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID N0: 11 и 12, представленных в табл. D, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, причем данный набор локусов QTL включает 30 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, а 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В, D и Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 32 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания и строения метелки, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А-С и Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, и приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, причем данный набор локусов QTL включает 32 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, а 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-С и Е, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24,29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 35 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. A-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6. 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID N0: 3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает 35 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, но особенно предпочтительно по меньшей мере 21 различных QTL, вносящих вклад в фенотипические признаки влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.B-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает 21 различных QTL, из которых 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.B-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52. 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, но особенно предпочтительно по меньшей мере 24 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А и C-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает 24 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосомах 1 и 5, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А и C-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 32 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, частоты головни обыкновенной, строения метелки и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В и D-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает 32 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В и D-F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62. 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 34 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-С, Е и F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID N0: 3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ IDNO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, причем данный набор локусов QTL включает 34 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А-С, Е и F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 31 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной и устойчивости к Sulcotrione, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-D и F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл. С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, и приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, причем данный набор локусов QTL включает 31 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, а 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-D и F, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62. 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает 37 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл. С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, но особенно предпочтительно по меньшей мере 23 различных QTL, вносящих вклад в фенотипические признаки влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.B-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл. В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл. С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл. F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает 23 различных QTL, из которых 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.B-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл. Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, но особенно предпочтительно по меньшей мере 25 и вплоть до 26 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, строения метелки, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А и C-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42. 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл. А, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл. С, приведенные в SEQ ID NO:11 и 12, представленных в табл. D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID N0: 7/8, 43/44 и 81/82, представленных в табл. F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает 26 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А и C-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 34 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, частоты головни обыкновенной, строения метелки, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В и D-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44. 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает 34 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А, В и D-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 36 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, строения метелки, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-С и E-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID N0: 3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает 37 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-С и E-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен с маркерами, приведенными в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 33 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, устойчивости к Sulcotrione и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7 и 8, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-D, F и G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 43/44 и 81/82, представленных в табл.F, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает 33 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 2 QTL вносят вклад в устойчивость к Sulcotrione и локализуются на хромосомах 3 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-D, F и G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл.G, причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 35 различных QTL, вносящих вклад в фенотипические признаки урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/ стеблевого полегания, частоты головни обыкновенной, строения метелки и частоты фузариоза початков, а сами QTL локализуются на хромосомах 1, 2, 3, 4, 5, 6, 7, 8 и 9, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.А-Е и G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном аспекте растения кукурузы по изобретению, описанные выше, характеризуются набором аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9/10, 13/14, 17/18, 19/20, 25/26, 27/28, 29/30, 35/36, 41/42, 47/48, 49/50, 51/52, 59/60, 61/62, 63/64, 65/66, 69/70, 73/74, 75/76 и 77/78, представленных в табл.А, приведенные в SEQ ID NO:3/4, 5/6, 9/10, 13/14, 21/22, 23/24, 29/30, 31/32, 33/34, 37/38, 39/40, 43/44, 53/54, 57/58, 65/66, 67/68, 69/70 и 71/72, представленных в табл.В, приведенные в SEQ ID NO:3/4, 27/28, 45/46, 47/48 и 59/60, представленных в табл.С, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7/8, 11/12, 31/32, 39/40, 55/56 и 81/82, представленных в табл.Е, и приведенные в SEQ ID NO:1/2, 15/16 и 79/80, представленных в табл. G, причем данный набор локусов QTL включает 35 различных QTL, 14 из которых вносят вклад в урожайность по зерну и локализуются на хромосомах 1, 2, 4, 5 и 7, 11 QTL вносят вклад во влажность зерна и локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8, 3 QTL вносят вклад в прикорневое и стеблевое полегание и локализуются на хромосоме 1, 1 QTL вносит вклад в частоту головни обыкновенной и локализуется на хромосоме 3, 4 QTL вносят вклад в строение метелки и локализуются на хромосомах 3, 6, 7 и 9, а 2 QTL вносят вклад в частоту фузариоза початков и локализуются на хромосоме 5, при этом каждая аллель в соответствующем QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл. А-Е и G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор аллелей по соответствующему набору локусов QTL, каждый из которых вносит вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания, стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки, при этом:
a) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл. A-G;
b) каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров;
причем данный набор локусов QTL включает 37 различных QTL, приведенных в табл.A-G; а предпочтительны такие растения кукурузы, у которых по меньшей мере часть данных QTL получена из инбредных линий кукурузы М3047/2 (NCIMB 41460) и М3047/1 (NCIMB 41459), соответственно.
В одном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору из по меньшей мере 10, предпочтительно по меньшей мере 11, более предпочтительно по меньшей мере 12, но особенно предпочтительно по меньшей мере 13 локусов QTL, каждый из которых вносит вклад в фенотипический признак урожайности по зерну, при этом:
а) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:59/60 и 77/78, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:77/78 и 27/28, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:47/48 и 75/76, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:73/74 и 25/26, соответственно, идентифицирующих пару маркеров, сцепленных с QTL6;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:41/42 и 49/50, соответственно, идентифицирующих пару маркеров, сцепленных с QTL10;
SEQ ID NO:49/50 и 61/62, соответственно, идентифицирующих пару маркеров, сцепленных с QTL11;
SEQ ID NO:17/18 и 51/52, соответственно, идентифицирующих пару маркеров, сцепленных с QTL12;
SEQ ID NO:51/52 и 19/20, соответственно, идентифицирующих пару маркеров, сцепленных с QTL13;
SEQ ID NO:29 и 30, идентифицирующих маркер, сцепленный с QTL14; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.А, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих полный набор благоприятных аллелей по соответствующим 14 локусам QTL.
В одном воплощении изобретение касается растений кукурузы, описанных в изобретении, у которых:
локусы QTL1-4 локализуются на хромосоме 1,
локусы QTL5 и 6 локализуются на хромосоме 2,
локусы QTL7-9 локализуются на хромосоме 4,
локусы QTL10-13 локализуются на хромосоме 5,
локус QTL14 локализуется на хромосоме 7,
В одном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору из по меньшей мере 7 локусов QTL, каждый из которых вносит вклад в фенотипический признак влажности зерна при сборе, при этом:
a) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который характеризуется по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору из по меньшей мере 9 локусов QTL, предпочтительно по меньшей мере 10 QTL, но особенно предпочтительно по меньшей мере 11 QTL, каждый из которых вносит вклад в фенотипический признак влажности зерна при сборе, при этом:
a) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл. В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору из по меньшей мере 9 локусов QTL, предпочтительно по меньшей мере 10 QTL, но особенно предпочтительно по меньшей мере 11 QTL, каждый из которых вносит вклад в фенотипический признак влажности зерна при сборе, при этом:
a1) 7 локусов QTL генетически сцеплены по меньшей мере с одним маркерным локусом, который характеризуется по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9; а
а2) остальные 2 локуса QTL генетически сцеплены по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
Ь) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации; который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, описанных выше, при этом:
а) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который характеризуется по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, описанных выше, у которых:
локусы QTL1 и 2 локализуются на хромосоме 1,
локусы QTL3-5 локализуются на хромосоме 2,
локус QTL6 локализуется на хромосоме 3,
локус QTL7 локализуется на хромосоме 4,
локус QTL8 локализуется на хромосоме 5,
локусы QTL9 и 10 локализуются на хромосоме 7, а
локус QTL11 локализуется на хромосоме 8.
В одном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор благоприятных аллелей из соответствующего набора локусов QTL, предпочтительно набора из по меньшей мере 19 локусов QTL,
А1) из которых 10, предпочтительно 11, предпочтительно 12, предпочтительно 13, но особенно предпочтительно 14 вносят вклад в фенотипический признак урожайности по зерну, при этом каждый локус QTL, вносящий вклад в урожайность по зерну, генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:59/60 и 77/78, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:77/78 и 27/28, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:47/48 и 75/76, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:73/74 и 25/26, соответственно, идентифицирующих пару маркеров, сцепленных с QTL6;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:41/42 и 49/50, соответственно, идентифицирующих пару маркеров, сцепленных с QTL10;
SEQ ID NO:49/50 и 61/62, соответственно, идентифицирующих пару маркеров, сцепленных с QTL11;
SEQ ID NO:17/18 и 51/52, соответственно, идентифицирующих пару маркеров, сцепленных с QTL12;
SEQ ID NO:51/52 и 19/20, соответственно, идентифицирующих пару маркеров, сцепленных с QTL13;
SEQ ID NO:29 и 30, идентифицирующих маркер, сцепленный с QTL14; а
а2) 9 из них, предпочтительно 10, но особенно предпочтительно 11 из них вносят вклад в фенотипический признак влажности зерна при сборе, при этом каждый локус QTL, вносящий вклад во влажность зерна, генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.А и В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пункте а).
В одном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору локусов QTL, предпочтительно набору из по меньшей мере 17 локусов QTL,
a1) из которых 10, предпочтительно 11, предпочтительно 12, предпочтительно 13, но особенно предпочтительно 14 вносят вклад в фенотипический признак урожайности по зерну, при этом каждый локус QTL, вносящий вклад в урожайность по зерну, генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:59/60 и 77/78, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:77/78 и 27/28, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:47/48 и 75/76, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:73/74 и 25/26, соответственно, идентифицирующих пару маркеров, сцепленных с QTL6;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:41/42 и 49/50, соответственно, идентифицирующих пару маркеров, сцепленных с QTL10;
SEQ ID NO:49/50 и 61/62, соответственно, идентифицирующих пару маркеров, сцепленных с QTL11;
SEQ ID NO:17/18 и 51/52, соответственно, идентифицирующих пару маркеров, сцепленных с QTL12;
SEQ ID NO:51/52 и 19/20, соответственно, идентифицирующих пару маркеров, сцепленных с QTL13;
SEQ ID NO:29 и 30, идентифицирующих маркер, сцепленный с QTL14; а
а2) 7 из них вносят вклад во влажность зерна при сборе, при этом каждый локус QTL, вносящий вклад во влажность зерна, генетически сцеплен по меньшей мере с одним маркерным локусом, который характеризуется по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.А и В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB
41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пунктах a1) и а2).
В одном воплощении изобретение касается растений кукурузы, содержащих ядерный геном, включающий набор благоприятных аллелей по соответствующему набору локусов QTL, предпочтительно набору из по меньшей мере 19 локусов QTL,
a1) из которых 10, предпочтительно 11, предпочтительно 12, предпочтительно 13, но особенно предпочтительно 14 вносят вклад в фенотипический признак урожайности по зерну, при этом каждый локус QTL, вносящий вклад в урожайность по зерну, генетически сцеплен по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:59/60 и 77/78, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:77/78 и 27/28, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:47/48 и 75/76, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:73/74 и 25/26, соответственно, идентифицирующих пару маркеров, сцепленных с QTL6;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:41/42 и 49/50, соответственно, идентифицирующих пару маркеров, сцепленных с QTL10;
SEQ ID NO:49/50 и 61/62, соответственно, идентифицирующих пару маркеров, сцепленных с QTL11;
SEQ ID NO:17/18 и 51/52, соответственно, идентифицирующих пару маркеров, сцепленных с QTL12;
SEQ ID NO:51/52 и 19/20, соответственно, идентифицирующих пару маркеров, сцепленных с QTL13;
SEQ ID NO:29 и 30, идентифицирующих маркер, сцепленный с QTL14; а
а2) 9 из них, предпочтительно 10, но особенно предпочтительно 11 из них вносят вклад в фенотипический признак влажности зерна при сборе, при этом
a2.1) 7 из этих локусов QTL генетически сцеплены по меньшей мере с одним маркерным локусом, который характеризуется по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9; а
а2.2) остальные 2 локуса QTL генетически сцеплены по меньшей мере с одним маркерным локусом, выбранным из группы локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11; и
b) каждая аллель в соответствующем локусе QTL определяется по продукту ПЦР-амплификации, который по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.А и В, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью пары праймеров, идентифицированных в пунктах a1) и а2).
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих полный набор благоприятных аллелей по соответствующим 14 локусам QTL, вносящим вклад в урожайность по зерну.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих полный набор благоприятных аллелей по соответствующим 11 локусам QTL, вносящим вклад во влажность зерна при сборе.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих полный набор благоприятных аллелей по соответствующим 14 локусам QTL, вносящим вклад в урожайность по зерну, и 11 локусам QTL, вносящим вклад во влажность зерна при сборе.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих по меньшей мере один дополнительный набор благоприятных аллелей по соответствующим локусам QTL, вносящим вклад в прикорневое и стеблевое полегание, причем эти QTL генетически сцеплены по меньшей мере с одним дополнительным маркерным локусом, выбранным из группы маркерных локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:3/4 и 59/60, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:27/28 и 47/48, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:45/46, идентифицирующих маркер, сцепленный с QTL3;
предпочтительно таких растений, у которых локусы QTL1, 2 и 3 локализуются на хромосоме 1.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих по меньшей мере одну дополнительную благоприятную аллель по соответствующему локусу QTL, вносящему вклад в частоту головни обыкновенной, причем этот QTL генетически сцеплен по меньшей мере с одним дополнительным маркерным локусом, характеризующимся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:11/12, идентифицирующих маркер, сцепленный с QTL1;
предпочтительно таких растений, у которых локус QTL1 локализуется на хромосоме 3.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих по меньшей мере один дополнительный набор благоприятных аллелей по соответствующим локусам QTL, вносящим вклад в строение метелки, причем эти QTL генетически сцеплены по меньшей мере с одним дополнительным маркерным локусом, выбранным из группы маркерных локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:11/12, идентифицирующих маркер, сцепленный с QTL1;
SEQ ID NO:55/56, идентифицирующих маркер, сцепленный с QTL2;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:81/82 и 7/8, соответственно, идентифицирующих пару
маркеров, сцепленных с QTL4;
предпочтительно таких растений, у которых:
локус QTL1 локализуется на хромосоме 3,
локус QTL2 локализуется на хромосоме 6,
локус QTL3 локализуется на хромосоме 7, а
локус QTL4 локализуется на хромосоме 9.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих по меньшей мере один дополнительный набор благоприятных аллелей по соответствующим локусам QTL, вносящим вклад в устойчивость к Sulcotrione, причем эти QTL генетически сцеплены по меньшей мере с одним дополнительным маркерным локусом, выбранным из группы маркерных локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL1;
SEQ ID NO:81/82 и 7/8, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
предпочтительно таких растений, у которых:
локус QTL1 локализуется на хромосоме 3, а
локус QTL2 локализуется на хромосоме 9.
В одном воплощении изобретение касается растений кукурузы, описанных выше, содержащих по меньшей мере один дополнительный набор благоприятных аллелей по соответствующим локусам QTL, вносящим вклад в частоту фузариоза початков, причем эти QTL генетически сцеплены по меньшей мере с одним дополнительным маркерным локусом, выбранным из группы маркерных локусов, характеризующихся по меньшей мере одной парой сцепленных маркеров, каждый из которых можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:1/2 и 79/80, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:79/80 и 15/16, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
предпочтительно таких растений, у которых локусы QTL1 и 2 локализуются на хромосоме 5.
В одном воплощении изобретение касается растений кукурузы, описанных выше, причем они всегда содержат наиболее благоприятную аллель в маркерных локусах, сцепленных с QTL, и/или проявляют показатель LOT, приведенный в табл.A-G.
В одном воплощении изобретение касается растений кукурузы, описанных выше, причем они содержат по меньшей мере одну копию наиболее благоприятной аллели в каждом локусе.
В одном воплощении изобретение касается растений кукурузы, описанных выше, у которых по меньшей мере часть указанных локусов QTL получена из инбредных линий кукурузы М3047/2 и М3047/1, соответственно, депонированных в NCIMB под номерами доступа NCIMB 41460 и NCIMB 41459.
В одном воплощении растения по изобретению, описанные выше, представляют собой инбредные растения.
В другом воплощении растения по изобретению, описанные выше, представляют собой гибриды, предпочтительно F1-гибриды от однократного скрещивания.
Настоящее изобретение также предусматривает улучшенные инбредные и гибридные растения кукурузы и их потомство, в геном которых внедрен генетический материал из по меньшей мере одного, предпочтительно более чем одного, а наиболее предпочтительно всех описанных выше локусов количественных признаков, в частности такие улучшенные инбредные и гибридные растения кукурузы и их потомство, которые проявляют признаки высокой урожайности по зерну и низкой влажности зерна при сборе.
В одном конкретном воплощении изобретения предусмотрены растения кукурузы, описанные выше, причем они всегда несут наиболее благоприятную аллель в маркерных локусах, сцепленных с QTL.
В частности, изобретение касается растений кукурузы, описанных выше, у которых данная благоприятная аллель находится в гомозиготном состоянии.
В другом конкретном воплощении предусмотрены растения кукурузы по изобретению, описанные выше, причем они несут наиболее благоприятную аллель в маркерных локусах, сцепленных с QTL, приведенных в табл.A-G.
В конкретном воплощении настоящего изобретения родительские генотипы происходят от твердозерновой гетерозисной группы, предпочтительно происходят из инбредных линий кукурузы, обладающих существенными для изобретения свойствами инбредной линии NP1902, депонированной под номером в коллекции NCIMB 41577, или инбредной линии NP1941, депонированной под номером в коллекции NCIMB 41576, или инбредной линии NPNW0351, депонированной под номером в коллекции NCIMB 41578, особенно обоюдно комплементарного набора аллелей по настоящему изобретению, особенно обоюдно комплементарного набора аллелей, представленных в табл.J.
В конкретном воплощении настоящего изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы несет благоприятную аллель в 13 из 14 QTL для урожая зерна, особенно в гомозиготном состоянии.
В частности предусмотрено растение кукурузы по настоящему изобретению и описанное в настоящем изобретении выше, которое обладает в связи с урожаем зерна композицией аллельных QTL линии Zea mays NP1902, депонированной под номером в коллекции NCIMB 41577, или линии Zea mays NP1941, депонированной под номером в коллекции NCIMB 41576.
В конкретном воплощении настоящего изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы несет благоприятную аллель для всех 14 QTL для урожая зерна, особенно в гомозиготном состоянии.
В частности, предусмотрено растение кукурузы по настоящему изобретению и согласно приведенному выше описанию указанное растение кукурузы, которое обладает в связи с урожаем зерна аллельной композицией QTL линии Zea mays line NPNW0351, депонированной в коллекции под номером NCIMB 41578.
В конкретном воплощении настоящего изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы несет благоприятную аллель в 9 из 11 QTL для влажности зерна, особенно в гомозиготном состоянии.
В частности предусмотрено растение кукурузы по настоящему изобретению и описанное в настоящем изобретении выше, которое обладает в связи с влажностью зерна композицией аллельных QTL линии Zea mays NPNW0351, депонированной под номером в коллекции NCIMB 41578, или линии Zea mays NP1902, депонированной под номером в коллекции NCIMB 41577.
В конкретном воплощении настоящего изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы несет благоприятную аллель в 10 из 11 QTL для влажности зерна, особенно в гомозиготном состоянии.
В частности в настоящем изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы для влажности зерна несет аллельную композицию QTL линии Zea mays NP1941, депонированной в коллекции под номером NCIMB 41576.
В частности в настоящем изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы для урожая зерна и влажности зерна, соответственно, несет аллельную композицию QTL линии Zea mays NP1902, депонированной в коллекции под номером NCIMB 41577 и показанной в табл.J.
В частности в настоящем изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы для урожая зерна и влажности зерна, соответственно, несет аллельную композицию QTL линии Zea mays NP1941, депонированной в коллекции под номером NCIMB 41576 и показанной в табл.J.
В частности в настоящем изобретения предусмотрено растение кукурузы по настоящему изобретению и, согласно приведенному выше описанию, указанное растение кукурузы для урожая зерна и влажности зерна, соответственно, несет аллельную композицию QTL линии Zea mays NPNW0351, депонированной в коллекции под номером NCIMB 41578 и показанной в табл.J.
В одном аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 41 маркера, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.A-G, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В другом аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 20 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9, 10, 13, 14, 17-20, 25-30, 35, 36, 41, 42, 47-52, 59-66, 69, 70 и 73-78, представленных в табл.А, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 18 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3-6, 9, 10, 13, 14, 21-24, 29-34, 37-40, 43, 44, 53, 54, 57, 58 и 65-72, представленных в табл. В, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 41 маркера, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3, 4, 27, 28, 45-48, 59 и 60, представленных в табл.С, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 5 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 6 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:7, 8, 11, 12, 31, 32, 39, 40, 55, 56, 81 и 82, представленных в табл.Е, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 3 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:7, 8, 43, 44, 81 и 82, представленных в табл.F, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 3 маркеров, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1, 2, 15, 16, 79 и 80, представленных в табл.G, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном конкретном воплощении изобретение касается набора маркеров, который можно выбрать из табл.A-G и составить таким образом, чтобы он был в состоянии детектировать любые из различных подгрупп аллелей, идентифицированных выше.
Пары праймеров по изобретению, описанные выше, предназначенные для реакции ПЦР для амплификации фрагментов ДНК, обладающих характеристиками маркерных аллелей по изобретению, состоят из прямого праймера с нечетным номером SEQ ID и обратного праймера со следующим за ним четным номером SEQ ID. Например, прямой праймер с SEQ ID NO:1 и обратный праймер с SEQ ID NO:2 составляют пару праймеров, равно как SEQ ID NO:3 и SEQ ID NO:4; SEQ ID NO:5 и SEQ ID NO:6 и т.д.
В частности, изобретение касается набора маркеров или пар маркеров, состоящего из комплекта пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, способных идентифицировать маркер, сцепленный с локусом QTL, вносящим вклад в урожайность по зерну, причем эти праймеры проявляют нуклеотидные последовательности, приведенные в:
SEQ ID NO:59/60 и 77/78, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:77/78 и 27/28, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:47/48 и 75/76, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:73/74 и 25/26, соответственно, идентифицирующих пару маркеров, сцепленных с QTL6;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:35/36 и 63/64, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:41/42 и 49/50, соответственно, идентифицирующих пару маркеров, сцепленных с QTL10;
SEQ ID NO:49/50 и 61/62, соответственно, идентифицирующих пару маркеров, сцепленных с QTL11;
SEQ ID NO:17/18 и 51/52, соответственно, идентифицирующих пару маркеров, сцепленных с QTL12;
SEQ ID NO:51/52 и 19/20, соответственно, идентифицирующих пару маркеров, сцепленных с QTL13;
SEQ ID NO:29 и 30, идентифицирующих маркер, сцепленный с QTL14;
причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном воплощении изобретение касается набора маркеров или пар маркеров, состоящего из комплекта пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, способных идентифицировать маркер, сцепленный с локусом QTL, вносящим вклад во влажность зерна при сборе, причем эти праймеры проявляют нуклеотидные последовательности, приведенные в:
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном воплощении изобретения такой набор маркеров содержит дополнительные пары олигонуклеотидных праймеров для ПЦР, включающие по меньшей мере одну дополнительную пару олигонуклеотидных праймеров для ПЦР, выбранную из группы праймеров, состоящей из прямых праймеров и обратных праймеров, проявляющих нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11.
В одном воплощении изобретение касается набора маркеров или пар маркеров, состоящего из комплекта пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, способных идентифицировать маркер, сцепленный с локусом QTL, вносящим вклад во влажность зерна при сборе, причем эти праймеры проявляют нуклеотидные последовательности, приведенные в:
SEQ ID NO:23/24 и 3/4, соответственно, идентифицирующих пару маркеров, сцепленных с QTL1;
SEQ ID NO:65/66 и 9/10, соответственно, идентифицирующих пару маркеров, сцепленных с QTL2;
SEQ ID NO:69/70 и 13/14, соответственно, идентифицирующих пару маркеров, сцепленных с QTL3;
SEQ ID NO:71/72 и 53/54, соответственно, идентифицирующих пару маркеров, сцепленных с QTL4;
SEQ ID NO:53/54 и 57/58, соответственно, идентифицирующих пару маркеров, сцепленных с QTL5;
SEQ ID NO:43/44, идентифицирующих маркер, сцепленный с QTL6;
SEQ ID NO:5/6 и 37/38, соответственно, идентифицирующих пару маркеров, сцепленных с QTL7;
SEQ ID NO:21/22 и 33/34, соответственно, идентифицирующих пару маркеров, сцепленных с QTL8;
SEQ ID NO:31/32 и 39/40, соответственно, идентифицирующих пару маркеров, сцепленных с QTL9;
SEQ ID NO:29/30, идентифицирующих маркер, сцепленный с QTL10;
SEQ ID NO:67/68, идентифицирующих маркер, сцепленный с QTL11;
причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
Условия, используемые при реакции ПЦР-амплификации, являются стандартными условиями, хорошо известными специалистам в этой области, в том числе буфер для ПЦР и солевые растворы, dNTPs, подходящая полимераза, в частности полимераза Taq, и соответствующие прямые и обратные праймеры в подходящих концентрациях.
Амплификация методом ПЦР включает от 20 до 100 циклов амплификации, предпочтительно от 30 до 80 циклов амплификации, более предпочтительно от 40 до 60 циклов амплификации, но особенно предпочтительно 40 циклов амплификации от 40 сек до 5 мин, предпочтительно от 50 сек до 2 мин, более предпочтительно от 60 сек до 90 сек, но особенно предпочтительно 60 сек.
В таком цикле амплификации ДНК сначала подвергается нагреванию при температуре от 90°С до 98°С, предпочтительно от 92°С до 96°С, но особенно предпочтительно при 94°С в течение от 5 сек до 30 сек, предпочтительно от 10 сек до 20 сек, но особенно предпочтительно в течение 15 сек. Процесс продолжается при температуре от 35°С до 65°С, предпочтительно от 40°С до 60°С, но особенно предпочтительно при 59°С, после чего необязательно следует инкубация ДНК в течение от 1 до 5 мин, предпочтительно от 2 до 3 мин, но особенно предпочтительно в течение 2 мин при температуре от 65°С до 80°С, предпочтительно от 70°С до 75°С, но особенно предпочтительно при 72°С.
Продукты ПЦР-амплификации по изобретению, описанные выше, полученные при реакции ПЦР с помощью пар олигонуклеотидных праймеров, приведенных в любой из табл.A-G, можно идентифицировать по их молекулярному весу или нуклеотидной последовательности, которые по существу идентичны молекулярному весу или нуклеотидной последовательности соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В одном воплощении изобретение касается растительного материала, получаемого из растений по изобретению, описанных выше, в том числе листьев, стеблей, корней, цветков или частей цветков, плодов, пыльцы, яйцеклеток, зигот, семян, черенков, клеточных или тканевых культур или любых иных частей или продуктов растений. Изобретение также касается частей растений, получаемых из растений по изобретению, описанных выше, в том числе семян растений, органов растений, таких, к примеру, как корни, стебли, листья, цветочные почки или зародыши и др., семяпочек, пыльцевых зерен, растительных клеток, растительных тканей, культур растительных клеток, таких, к примеру, как протопласты, клетки клеточных культур, клетки в растительных тканях, пыльца, пыльцевые трубки, семяпочки, зародышевые мешки, зиготы и зародыши на различных стадиях развития.
Изобретение также касается продуктов переработки кукурузы, в частности продуктов, получаемых при мокром или сухом помоле зерен кукурузы, в том числе молотых зерен, муки, жмыха, продуктов брожения и др., а также зерен или зернышек, используемых при получении кормов для животных, к примеру, в процессе дробления зерен или производства хлопьев.
В одном воплощении изобретение касается способа получения растений по настоящему изобретению, описанных выше, который включает стадии:
i) скрещивания двух или нескольких родительских растений, имеющих генетический фон, способный вносить вклад в развитие растений по изобретению, описанных выше, предпочтительно скрещивания двух родительских растений, содержащих благоприятный набор локусов QTL, в частности родительских растений, содержащих большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с соответствующими локусами QTL, к примеру, таких родительских растений, которые имеют генетический фон, представленный инбредными линиями кукурузы М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) либо их предками или источниками;
ii) скрининга потомства от скрещивания, произведенного на стадии i), на наличие растений, содержащих в своем геноме комбинированный набор наиболее благоприятных аллелей по соответствующему набору локусов QTL из родительских растений, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, в частности маркерным локусом, приведенным в табл.A-G, при этом данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL, причем каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, путем:
1. идентификации по меньшей мере одного маркерного локуса при реакции ПЦР с помощью пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.А-G;
2. идентификации маркерной аллели путем определения молекулярного веса продукта ПЦР-амплификации, полученного на стадии 1;
iii) отбора растений с требуемым профилем.
В одном воплощении изобретение касается способа получения растений по настоящему изобретению, описанных выше, который включает стадии:
i) скрещивания двух или нескольких родительских растений, имеющих генетический фон, способный вносить вклад в развитие растений по изобретению, описанных выше, предпочтительно скрещивания двух родительских растений, содержащих заданный набор локусов QTL, в частности родительских растений, содержащих большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с данным большинством локусов QTL, к примеру, таких родительских растений, которые имеют генетический фон, представленный инбредными линиями кукурузы М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) либо их предками или источниками;
и) скрининга потомства от скрещивания, произведенного на стадии i), на наличие растений, содержащих в своем геноме комбинированный набор наиболее благоприятных аллелей по соответствующему набору локусов QTL из родительских растений, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, в частности маркерным локусом, приведенным в табл.A-G, при этом данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL, причем каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, путем:
1) получения растительного материала из растений потомства и экстрагирования ДНК из данного материала;
2) анализа образца ДНК, полученного на стадии 1), чтобы определить аллельные варианты по меньшей мере по 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере по 30 и вплоть до 37 маркерным локусам, генетически сцепленным с соответствующим QTL, вносящим вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки, в частности по маркерным локусам, приведенным в табл.A-G, путем:
a) идентификации маркерных локусов при реакции ПЦР с помощью пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.A-G, предпочтительно всего набора пар праймеров, приведенных в SEQ ID NO:1-82;
b) идентификации маркерных аллелей путем определения молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации, полученных на стадии а);
c) сравнения определенных на стадии b) молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации с молекулярными весами и/или нуклеотидными последовательностями соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичного набора пар праймеров, использовавшихся на стадии а), и идентификации продуктов ПЦР с по существу идентичными молекулярными весами и/или нуклеотидными последовательностями;
iii) идентификации и отбора растений с требуемым профилем по данным анализа маркеров, в частности растений, содержащих большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с заданным набором локусов QTL.
В одном воплощении изобретение касается способа получения растений по изобретению, описанных выше, который включает стадии:
a) скрещивания двух или нескольких родительских растений, из которых по меньшей мере одно содержит большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с большинством соответствующих локусов QTL, вносящих вклад в урожайность по зерну или влажность зерна при сборе, как изложено выше, или их сочетание;
b) скрининга потомства от скрещивания, произведенного на стадии а), на наличие растений, содержащих в своем геноме весь набор наиболее благоприятных аллелей по соответствующему набору из по меньшей мере 10, предпочтительно по меньшей мере 11, предпочтительно по меньшей мере 12, предпочтительно по меньшей мере 13, но особенно предпочтительно по меньшей мере 14 локусов QTL, вносящих вклад в фенотипический признак урожайности по зерну, представленных в табл. А, или растений, содержащих в своем геноме весь набор наиболее благоприятных аллелей по соответствующему набору из по меньшей мере 9, предпочтительно по меньшей мере 10, но особенно предпочтительно по меньшей мере 11 локусов QTL, вносящих вклад в фенотипический признак влажности зерна при сборе, представленных в табл. В, или растений, содержащих в своем геноме комбинацию из обоих наборов наиболее благоприятных аллелей, путем:
i. получения растительного материала из растений потомства и экстрагирования ДНК из данного материала;
ii. анализа образца ДНК, полученного на стадии i), чтобы определить аллельные варианты по маркерным локусам, генетически сцепленным с соответствующими локусами QTL, при помощи набора маркеров по изобретению, описанных выше, при реакции ПЦР-амплификации;
iii. идентификации маркерных аллелей путем определения молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации, полученных на стадии ii);
c) сравнения определенных на стадии iii) молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации с молекулярными весами и/или нуклеотидными последовательностями соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичного набора пар праймеров, использовавшихся на стадии ii), и идентификации продуктов ПЦР с по существу идентичными молекулярными весами и/или нуклеотидными последовательностями;
d) идентификации и отбора растений с требуемым профилем по данным анализа маркеров.
В одном воплощении изобретение касается способа, описанного выше, в котором на стадии а) одно из родительских растений имеет генетический фон, представленный инбредной линией кукурузы М3047/1 (NCIMB 41459) или М3047/2 (NCIMB 41460).
В одном воплощении изобретение касается способа, описанного выше, в котором оба родительских растения, используемые при скрещивании на стадии а), являются инбредными, предпочтительно инбредными, имеющими генетический фон, представленный инбредными линиями кукурузы М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460).
В одном воплощении изобретение касается способа, описанного выше, в котором родительские растения, используемые при скрещивании на стадии а), представлены инбредными линиями М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460).
В одном воплощении изобретение касается способа, описанного выше, в котором родительские генотипы, используемые при скрещивании на стадии а), представлены твердозерной гетерозиготной группой и предусматривают общую комбинирующую активность.
В одном воплощении изобретение касается способа, описанного выше, в котором родительские генотипы, используемые при скрещивании на стадии а), представлены инбредной линией, которая обладает генетической базой, особенно QTL для урожая зерна и/или влажности зерна, предоставляемой инбредной линией кукурузы NPNW0351, депонированной в коллекции под номером NCIMB 41578 и показанной в табл.J.
В одном воплощении изобретение касается способа, описанного выше, в котором по меньшей мере одно из родительских растений при скрещивании на стадии а), представлено инбредной линией, которая обладает генетической базой, особенно QTL для урожая зерна и/или влажности зерна, предоставляемой инбредной линией кукурузы NP1941, депонированной в коллекции под номером NCIMB 41576 и показанной в табл.J.
В одном воплощении изобретение касается способа, описанного выше, в котором по меньшей мере одно из родительских растений при скрещивании на стадии а), представлено инбредной линией, которая обладает генетической базой, особенно QTL для урожая зерна и/или влажности зерна, предоставляемой инбредной линией кукурузы NP1902, депонированной в коллекции под номером NCIMB 41577 и показанной в табл. J.
В одном воплощении изобретение касается инбредных линий, применяемых в качестве мужского или женского партнера.
В одном воплощении изобретение касается инбредных линий, применяемых в качестве мужского партнера.
В одном воплощении изобретение касается способа по настоящему изобретению и описанного в настоящем изобретении для получения гибридов.
В одном воплощении изобретение касается гибридов, получаемых таким способом, предпочтительно F1-гибридов от однократного скрещивания.
В одном воплощении изобретение касается гибридов, получаемых по настоящему изобретению и описанных в настоящем изобретении как имеющих генетическое преимущество для широкого круга условий внешней среды или географических зон. В частности гибрид по настоящему изобретению показывает генетическое преимущество, выраженное в комбинации признаков урожая силосной массы и содержания сухого вещества.
В частности, изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей, связанных с соответствующей подгруппой локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл. A-G, при этом данная подгруппа локусов QTL включает по меньшей мере 2, предпочтительно по меньшей мере 5, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 15, но особенно предпочтительно 20 и вплоть до 30-37 QTL, вносящих вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки.
В одном конкретном воплощении изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей, связанных с соответствующей подгруппой локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:9, 10, 13, 14, 17-20, 25-30, 35, 36, 41, 42, 47-52, 59-66, 69, 70 и 73-78, представленных в табл.А, при этом данная подгруппа локусов QTL включает по меньшей мере 5, предпочтительно по меньшей мере 8, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 14 различных QTL, вносящих вклад в фенотипический признак урожайности по зерну, причем эти QTL локализуются на хромосомах 1, 2, 4, 5 и 7.
В одном конкретном воплощении изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей, связанных с соответствующей подгруппой локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3-6, 9, 10, 13, 14, 21-24, 29-34, 37-40, 43, 44, 53, 54, 57, 58 и 65-72, представленных в табл.В, при этом данная подгруппа локусов QTL включает по меньшей мере 5, предпочтительно по меньшей мере 7, более предпочтительно по меньшей мере 9, еще более предпочтительно по меньшей мере 11 различных QTL, вносящих вклад в фенотипический признак влажности зерна при сборе, причем эти QTL локализуются на хромосомах 1, 2, 3, 4, 5, 7 и 8.
В следующем конкретном воплощении изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей, связанных с соответствующей подгруппой локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:3, 4, 27, 28, 45-48, 59 и 60, представленных в табл.С, при этом данная подгруппа локусов QTL включает по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 3, но особенно предпочтительно по меньшей мере 4 различных QTL, вносящих вклад в фенотипический признак раннего и позднего прикорневого полегания/стеблевого полегания, причем эти QTL локализуются на хромосомах 1 и 5.
В следующем конкретном воплощении изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей, связанных с соответствующей подгруппой локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:11 и 12, представленных в табл.D, приведенные в SEQ ID NO:7, 8, 43, 44, 81 и 82, представленных в табл.F, и приведенные в SEQ ID NO:1, 2, 15, 16, 79 и 80, представленных в табл.G, при этом данная подгруппа локусов QTL включает по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 4 различных QTL, вносящих вклад в фенотипический признак устойчивости к грибковым заболеваниям или их частоты, выбранный из группы, состоящей из устойчивости к Sulcotrione, частоты фузариоза початков и частоты головни обыкновенной, причем эти QTL локализуются на хромосомах 3, 5 и 9.
В одном воплощении изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий любую из подгрупп аллелей по соответствующему набору локусов QTL, определенных выше.
В одном конкретном воплощении изобретение касается способа получения гибридных растений кукурузы по настоящему изобретению, описанных выше, который включает стадии:
i) скрещивания инбредных растений по изобретению, описанных выше, с инбредной линией кукурузы, проявляющей требуемые свойства, которые проявляются через явственные фенотипические признаки, получая расходящуюся популяцию растений;
ii) скрининга растений из этой расходящейся популяции на наличие растений, имеющих в своем геноме набор аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, при этом данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL, причем каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, путем:
а. идентификации по меньшей мере одного маркерного локуса при реакции ПЦР с помощью пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл. А-G;
b. идентификации маркерной аллели путем определения молекулярного веса продукта ПЦР-амплификации, полученного на стадии а);
iii) отбора гибридных растений из расходящейся популяции с профилем локусов QTL, указанным выше в пункте ii).
В конкретном воплощении настоящего изобретения предусмотрен способ получения гибридного растения кукурузы, описанного выше, в котором используют родительские генотипы в скрещивании на стадии а), которые взяты из твердозерной гетерозиготной группы и обеспечивают хорошую общую комбинирующую активность.
В конкретном воплощении настоящего изобретения предусмотрен способ получения гибридного растения кукурузы по приведенному выше описанию, в котором по меньшей мере одно из родительских растений, используемое в скрещивании на стадии а), представляет инбредную линию, которая имеет генетическую основу, особенно по QTL для урожая зерна и/или влажности зерна, предоставляемую инбредной линией кукурузы NPNW0351, депонированной под номером NCIMB 41578 и представленной в табл.J.
В конкретном воплощении настоящего изобретения предусмотрен способ получения гибридного растения кукурузы по приведенному выше описанию, в котором по меньшей мере одно из родительских растений, используемое в скрещивании на стадии а), представляет инбредную линию, которая имеет генетическую основу, особенно по QTL для урожая зерна и/или влажности зерна, предоставляемую инбредной линией кукурузы NP1941, депонированной под номером NCIMB 41576 и представленной в табл.J.
В конкретном воплощении настоящего изобретения предусмотрен способ получения гибридного растения кукурузы по приведенному выше описанию, в котором по меньшей мере одно из родительских растений, используемое в скрещивании на стадии а), представляет инбредную линию, которая имеет генетическую основу, особенно по QTL для урожая зерна и/или влажности зерна, предоставляемую инбредной линией кукурузы NP1902, депонированной под номером NCIMB 41577 и представленной в табл.J.
В одном воплощении изобретение касается инбредных линий, применяемых в качестве мужского или женского партнера.
В одном воплощении изобретение касается инбредных линий, применяемых в качестве мужского партнера.
В одном воплощении изобретение касается способа по настоящему изобретению и описанного в настоящем изобретении для получения гибридов.
В одном воплощении изобретение касается инбредной линии кукурузы, выбранной из группы, состоящей из линии NP1902, депонированной к коллекции под номером NCIMB 41577, линии NP1941, депонированной к коллекции под номером NCIMB 41576, и линии NPNW0351, депонированной к коллекции под номером NCIMB 41578, которую используют в гибридном скрещивании в качестве мужского и женского партнера.
В одном воплощении изобретение касается гибрида, полученного таким способом, особенно простого гибрида F1.
В одном воплощении изобретение касается гибрида, полученного способом по настоящему изобретению и описанного в настоящем изобретении, имеющего генетический приоритет для широкого круга внешний условий или географических зон. В частности гибрид по настоящему изобретению показывает генетический приоритет в виде комбинированных признаков урожая силоса и содержания сухого вещества.
В частности, изобретение касается F1-гибридов от однократного скрещивания.
В одном воплощении изобретение касается способа применения набора маркеров-нуклеиновых кислот при селекции по маркерам для внедрения набора аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данного набора аллелей, при этом данные аллели вносят вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки, а нуклеиновые кислоты-маркеры выбраны из группы маркеров, представленных в табл.A-G.
В другом воплощении изобретение касается способа применения набора маркеров-нуклеиновых кислот при селекции по маркерам для внедрения набора аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данного набора аллелей, при этом данные аллели вносят вклад в фенотипический признак урожайности по зерну, а набор нуклеиновых кислот-маркеров выбирается из группы маркеров, приведенных в SEQ ID NO:9, 10, 13, 14, 17-20, 25-30, 35, 36, 41, 42, 47-52, 59-66, 69, 70 и 73-78, представленных в табл.А, причем эти маркеры представлены полинуклеотидными фрагментами, которые (i) амплифицированы в результате реакции ПЦР с помощью пар праймеров, состоящих из прямого и обратного праймера с нуклеотидными последовательностями, приведенными в табл. А, и (ii) имеют такие молекулярные веса или нуклеотидные последовательности, которые по существу идентичны таковым у соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении изобретение касается способа применения набора маркеров-нуклеиновых кислот при селекции по маркерам для внедрения набора аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данного набора аллелей, при этом данные аллели вносят вклад в фенотипический признак раннего и позднего прикорневого полегания/стеблевого полегания, а данный набор нуклеиновых кислот-маркеров выбирается из группы маркеров, приведенных в SEQ ID NO:3, 4, 27, 28, 45-48, 59 и 60, представленных в табл.С, причем эти маркеры представлены полинуклеотидными фрагментами, которые (i) амплифицированы при реакции ПЦР с помощью пар праймеров, состоящих из прямого и обратного праймера с нуклеотидными последовательностями, приведенные в табл.С, и (ii) имеют такие молекулярные веса или нуклеотидные последовательности, которые по существу идентичны таковым у соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении изобретение касается способа применения набора маркеров-нуклеиновых кислот при селекции по маркерам для внедрения набора аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данного набора аллелей, при этом данные аллели вносят вклад в фенотипический признак строения метелки, а данный набор нуклеиновых кислот-маркеров выбирается из группы маркеров, приведенных в SEQ ID NO:7, 8, 11, 12, 31, 32, 39, 40, 55, 56, 81 и 82, представленных в табл.Е, причем эти маркеры представлены полинуклеотидными фрагментами, которые (i) амплифицированы при реакции ПЦР с помощью пар праймеров, состоящих из прямого и обратного праймера с нуклеотидными последовательностями, приведенные в табл.Е, и (ii) имеют такие молекулярные веса или нуклеотидные последовательности, которые по существу идентичны таковым у соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В следующем воплощении изобретение касается способа применения набора маркеров-нуклеиновых кислот при селекции по маркерам для внедрения набора аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данного набора аллелей, при этом данные аллели вносят вклад в фенотипический признак устойчивости к грибковым заболеваниям или их частоты, выбранный из группы, состоящей из устойчивости к Sulcotrione, частоты фузариоза початков и частоты головни обыкновенной, а данный набор нуклеиновых кислот-маркеров выбирается из группы маркеров, приведенных в SEQ ID NO:11 и 12, представленных в табл.D, приведенных в SEQ ID NO:7, 8, 43, 44, 81 и 82, представленных в табл.F, и приведенных в SEQ ID NO:1, 2, 15, 16, 79 и 80, представленных в табл.G, соответственно, причем эти маркеры представлены полинуклеотидными фрагментами, которые (i) амплифицированы при реакции ПЦР с помощью пар праймеров, состоящих из прямого и обратного праймера с нуклеотидными последовательностями, приведенные в табл.D, F и G, соответственно, и (ii) имеют такие молекулярные веса или нуклеотидные последовательности, которые по существу идентичны таковым у соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
В частности, изобретение касается способа применения одного из наборов маркеров-нуклеиновых кислот, определенных выше, в частности набора маркеров, который можно выбрать из табл.A-G и составить таким образом, чтобы он был в состоянии детектировать любые из различных подгрупп аллелей, приведенных выше, при селекции по маркерам для внедрения данной подгруппы аллелей, связанных с соответствующим набором локусов QTL, в идиоплазму кукурузы, не содержащую данной подгруппы аллелей.
В следующем воплощении растения кукурузы по изобретению можно использовать в качестве партнеров для скрещивания в селекционной программе для получения новых линий растений с благоприятными свойствами. Одного или нескольких других партнеров для скрещивания можно получить из устойчивой селекционной популяции, полученной и/или используемой в качестве родителей в селекционной программе, напр., коммерческой селекционной программе. Представители устойчивой селекционной популяции, как правило, хорошо изучены в отношении генетики и/или фенотипа. Например, могли быть изучены несколько представляющих интерес фенотипических признаков, напр., при различных экологических условиях, в различных местностях и/или в разное время. С другой стороны, могли быть идентифицированы один или несколько генетических локусов, связанных с экспрессией этих фенотипических признаков, а один или несколько представителей селекционной популяции могли быть генотипированы в отношении одного или нескольких генетических локусов, а также в отношении одного или нескольких генетических маркеров, связанных с одним или несколькими генетическими локусами.
В одном воплощении изобретение касается способа идентификации растений кукурузы по изобретению, описанных выше, содержащих благоприятный набор локусов GTL, в частности растений кукурузы, содержащих большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с данными локусами QTL, который включает следующие стадии:
i) получения растительного материала из исследуемых растений или популяции растений и экстрагирования ДНК из данного материала;
ii) анализа образца ДНК, полученного на стадии i), чтобы определить аллельные варианты по меньшей мере по 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере по 30 и вплоть до 37 маркерным локусам, генетически сцепленным с соответствующим QTL, вносящим вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки, в частности по маркерным локусам, приведенным в табл. A-G, путем:
а) идентификации по меньшей мере одного маркерного локуса при реакции ПЦР с помощью пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.А-G, предпочтительно всего набора пар праймеров, приведенных в SEQ ID NO:1-82;
b) идентификации маркерных аллелей путем определения молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации, полученных на стадии а);
iii) сравнения определенных на стадии b) молекулярных весов и/или нуклеотидных последовательностей продуктов ПЦР-амплификации с молекулярными весами и/или нуклеотидными последовательностями соответствующих продуктов ПЦР-амплификации, полученных из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичного набора пар праймеров, использовавшихся на стадии а), и идентификации продуктов ПЦР с по существу идентичными молекулярными весами и/или нуклеотидными последовательностями;
iv) идентификации и отбора растений с требуемым профилем по данным анализа маркеров, в частности растений, содержащих большинство наиболее благоприятных аллелей в маркерных локусах, сцепленных с заданным набором локусов QTL.
В другом воплощении изобретения из растений кукурузы с другим генетическим фоном, чем у инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), получают образцы ДНК и тестируют на наличие или отсутствие амплифицированной ДНК, полученной при ПЦР-амплификации с помощью пар праймеров, указанных в табл.A-G, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82. Используя селекционные методы, известные специалистам в этой области, растения кукурузы с другим генетическим фоном, чем у инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), служат источником набора аллелей по соответствующему набору локусов QTL, каждый из которых вносит вклад в фенотипический признак, имеющий экономическое значение, как изложено и описано выше, при этом:
а) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл. A-G;
b) каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров; причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL.
В одном конкретном воплощении изобретения набор аллелей, полученный из растений кукурузы с другим генетическим фоном, может быть внедрен в родительский материал методами селекции с помощью маркеров, которые известны специалистам в этой области. В качестве примера, при возвратном скрещивании с использованием маркеров (МАВС) применяются ДНК-маркеры, дающие возможность идентифицировать потомство от исходного материала, содержащее нужные рекомбинантные хромосомы и донорский-родительский геном (Fehr 1987). Методики возвратного скрещивании с использованием маркеров описаны в Ragot et al. (1995).
Различные другие методы с использованием маркеров для селекции локусов QTL, связанных с желательными признаками, известны специалистам в этой области. Так, были предложены и внедрены в практику селекции кукурузы методы "опережающей селекции" с помощью ДНК-маркеров. Главным преимуществом современных рекуррентных методов селекции является доступность генетических данных по всему потомству и по каждому поколению, интеграция генотипических и фенотипических данных, быстрая цикличность поколений и информационно-направленное спаривание во внесезонных питомниках.
Описаны две различные формы опережающей селекции с помощью маркеров: однократная крупномасштабная селекция с помощью маркеров (SLS-MAS) (Ribaut and Betran 1999) и рекуррентная селекция с помощью маркеров (MARS) (Edwards and Johnson 1994; Lee 1995; Stam 1995; van Berloo and Stam 1998).
Рекуррентная селекция с помощью маркеров (MARS) затрагивает все важные признаки в селекционной программе, по которым может быть получена генетическая информация. Генетическую информацию обычно получают при анализе локусов QTL на экспериментальных популяциях, и она поступает в виде карт локусов QTL вместе с соответствующими эффектами. При этом предполагается, что целью является получение особей со столькими накопленными благоприятными аллелями, насколько это возможно (Gallais et al. 1997; Gimelfarb and Lande 1994; Lande and Thompson 1990; Moreau et al. 1998; Xie and Xu 1998). Такая селекционная схема может включать несколько последовательных поколений скрещиваемых особей (Peleman and Van Der Voort 2003; Stam 1995) и поэтому будет составлять то, что именуется рекуррентной селекцией с помощью маркеров (MARS) или конструированием генотипа. Эта идея может быть распространена на ситуации, при которых благоприятные аллели происходят от более чем двух родителей (Peleman and Van Der Voort 2003; Stam 1995).
Согласно изобретению, маркерная и фенотипическая селекция может быть реализована многими разными способами, относительно друг друга, в маркерных схемах селекции с помощью маркеров. Селекция по маркерам и/или фенотипическая селекция могут применяться либо одновременно, либо последовательно для селекции из растений кукурузы с другим генетическим фоном, чем у инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), одной или нескольких аллелей из набора аллелей по соответствующему набору локусов QTL, каждый из которых вносит вклад в фенотипический признак, имеющий экономическое значение, при этом:
а) каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, который можно идентифицировать при помощи пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.A-G;
b) каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, причем маркерная аллель характеризуется продуктом ПЦР-амплификации от соответствующей пары олигонуклеотидных праймеров, приведенных в табл.A-G, а продукт амплификации по существу идентичен соответствующему продукту амплификации благоприятной аллели, указанной в табл.A-G, полученной из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров;
причем данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL.
Еще один способ, который может использоваться для получения растений по изобретению, описанных выше, изложен в находящейся пока на рассмотрении заявке ЕР 07290060.8 от 17 января 2007 г., содержание которой включено в настоящее изобретение путем ссылки во всей полноте.
Растения по изобретению, описанные выше, содержащие ядерный геном, включающий набор аллелей по соответствующему набору локусов QTL, каждый из которых вносит вклад в фенотипический признак, имеющий экономическое значение, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки, могут быть получены способом, включающим стадии:
i) скрещивания двух или нескольких родительских растений, имеющих генетический фон, способный вносить вклад в развитие растений по изобретению, описанных выше, предпочтительно скрещивания двух родительских растений, имеющих генетический фон, представленный инбредными линиями кукурузы М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) либо их предками или источниками;
ii) скрининга на наличие растений, имеющих в своем геноме набор аллелей по соответствующему набору локусов QTL, причем каждый локус QTL генетически сцеплен по меньшей мере с одним маркерным локусом, в частности маркерным локусом, при этом данный набор локусов QTL включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, еще более предпочтительно по меньшей мере 25, но особенно предпочтительно по меньшей мере 30 и вплоть до 37 различных QTL, причем каждая аллель в соответствующем локусе QTL определяется по меньшей мере одной маркерной аллелью в данном по меньшей мере одном маркерном локусе, сцепленном с этим QTL, путем:
1. идентификации по меньшей мере одного маркерного локуса при реакции ПЦР с помощью пары олигонуклеотидных праймеров для ПЦР, состоящей из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.А-G;
2. идентификации маркерной аллели путем определения молекулярного веса и/или нуклеотидной последовательности продукта ПЦР-амплификации, полученного на стадии 1;
iii) отбора растений с требуемым профилем.
В частности, изобретение касается способа, в котором по меньшей мере одно из родительских растений имеет геном, содержащий подгруппу аллелей по соответствующей подгруппе локусов QTL, генетически сцепленных с маркерными локусами, которые можно идентифицировать при реакции ПЦР с помощью пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.А-G, при этом данная подгруппа локусов QTL включает по меньшей мере 2, предпочтительно по меньшей мере 5, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 15, но особенно предпочтительно 20 и вплоть до 30-37 QTL, вносящих вклад в фенотипический признак, выбранный из группы урожайности по зерну, влажности зерна при сборе, раннего и позднего прикорневого полегания/стеблевого полегания, частоты головни обыкновенной, частоты фузариоза початков, устойчивости к Sulcotrione и строения метелки.
Растения по изобретению могут быть получены при скрещивании двух или нескольких генотипов, каждый из которых может содержать подгруппу аллелей по соответствующей подгруппе локусов QTL, причем эта подгруппа аллелей отсутствует в генотипе другого родителя или комплементарна другому генотипу, получая при этом растения по изобретению, описанные выше. Если два исходных родительских генотипа не содержат весь набор аллелей, то в селекционную популяцию можно включить другие источники.
В одном конкретном воплощении изобретения родительские генотипы происходят из твердозерновой гетерозисной группы, но предпочтительно происходят из инбредных линий кукурузы, обладающих существенными для изобретения свойствами инбредных линий М3047/1 и М3047/2, соответственно, в частности взаимно комплементарным набором аллелей по изобретению. Образцы семян инбредных линий М3047/1 и М3047/2 депонированы в NCIMB под номерами доступа NCIMB 41459 и NCIMB 41460.
Эти родительские генотипы можно скрещивать друг с другом, получая семена потомства. Родительские генотипы могут представлять собой инбредные линии, созданные путем самоопыления отборных гетерозиготных растений из полей с бесконтрольным или открытым опылением и применения рекуррентных методов селекции. Самые лучшие растения подвергают самоопылению и отбору в нескольких поколениях. В ряду поколений гетерозиготное состояние уступает место однородным линиям в результате самоопыления и отбора. При нескольких поколениях инбридинга растения становятся все более гомозиготными и однородными среди растений потомства. Как правило, практикуется от 5 до 7 и больше поколений (F1-F2; F3-F4; F4-F5) от самоопыления и отбора потомства для получения инбредных линий, однородных по характеристикам растений и семян, которые останутся однородными при продолжении самоопыления.
При инбридинге многие нежелательные рецессивные аллели в гетерозиготных локусах будут заменены доминантными аллелями, а рецессивные аллели будут удалены из потомства. Более того, посредством селекции по маркерам число благоприятных аллелей в определенном наборе аллелей по настоящему изобретению может быть доведено до максимума тем, что менее благоприятные аллели будут идентифицированы и успешно заменены более благоприятными аллелями, что в конечном счете приведет к получению растений, содержащих наиболее предпочтительные аллели в каждом из заданных локусов в геноме этих растений.
Локусы QTL характеризуются по их положению на генетической карте и эффектам прироста и доминантности. Положения показывают генетические расстояния между наиболее вероятными позициями этих локусов QTL (обычно позициями пиковых значений показателя LOD) и боковых маркерных локусов (в сантиморганах). Эффекты прироста и доминантности определяются как отклонения от среднего значения и выражаются в тех же единицах, что и относящиеся к ним признаки. Величина прироста определяет, какая из родительских линий несет благоприятную аллель в данном QTL.
Источник (тип) благоприятной аллели можно определить в каждом локусе QTL по знаку эффекта этого QTL (положительного или отрицательного) и желательности данного признака. Это дает возможность идентифицировать благоприятные аллели по каждому сцепленному маркеру. Затем эту информацию можно использовать для отбора особей в процессе селекции по маркерам с тем, чтобы максимизировать количество благоприятных аллелей у одной особи.
Например, в случае скрещивания двух родительских инбредных линий, в частности инбредных линий, содержащих взаимно комплементарный набор аллелей по изобретению, таких, к примеру, как инбредные линии М3047/2 (NCIMB 41460) и М3047/1 (NCIMB 41459), величина прироста представляет эффект аллели одной из родительских линий, служащей эталоном, к примеру, аллели М3047/2 (NCIMB 41460), который может быть положительным или отрицательным. Для такого признака, как урожайность по зерну, если желательным эффектом будет большее значение этого признака, то положительная величина прироста означает, что эталонная линия, к примеру, линия М3047/2 (NCIMB 41460), несет благоприятную аллель, тогда как отрицательная величина прироста означает, что благоприятную аллель несет другая родительская линия, например, линия М3047/1 (NCIMB 41459). Это позволяет идентифицировать благоприятные аллели по каждому сцепленному маркеру. Они представлены в табл.A-G.
Селекция на ранних фазах процесса инбридинга в основном основывается на фенотипических характеристиках, которые определяются визуально и связаны с главными показателями качества, такими, к примеру, как жизнестойкость растений, устойчивость к полеганию, урожайность и качество семян, подверженность к насекомым и грибковым заболеваниям, важным для пригодности растений к использованию при коммерческом производстве гибридов.
В одном воплощении изобретения при фенотипическом анализе регистрируют урожайность по зерну, влажность зерна при сборе, раннее и позднее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, устойчивость к Sulcotrione, частоту фузариоза початков и строение метелки.
В более поздних поколениях, предпочтительно в поколениях F3-F6, более предпочтительно в поколении F4, применяется селекция по маркерам с последующей фенотипической селекцией для идентификации тех особей, у которых все относящиеся к изобретению локусы, описанные выше, содержат гомозиготные благоприятные генотипы,
Существует несколько типов молекулярных маркеров, которые можно использовать при селекции по маркерам, в том числе полиморфизм по длине рестрикционных фрагментов (RFLP), случайная амплификация полиморфных участков ДНК (RAPD), полиморфизм по длине амплифицированных фрагментов (AFLP), простые повторы последовательности (SSR) и полиморфизм по одному нуклеотиду (SNP).
RFLP включает использование рестрикционных ферментов для расщепления хромосомной ДНК по специфическим коротким рестрикционным сайтам, а полиморфизм возникает при удвоении или делениях между сайтами или мутациях в рестрикционных сайтах.
RAPD включает амплификацию методом полимеразной цепной реакции (ПНР) при низкой строгости с помощью одиночных праймеров с произвольной последовательностью для создания штаммоспецифичных наборов анонимных фрагментов ДНК. Метод требует очень небольших образцов ДНК и анализирует большое число полиморфных локусов.
AFLP требует расщепления клеточной ДНК рестрикционным ферментом, а затем применения ПЦР и селективных нуклеотидов в праймерах для амплификации специфических фрагментов. Этим методом можно анализировать вплоть до 100 полиморфных локусов, а для каждого анализа нужен лишь относительно небольшой образец ДНК.
Метод SSR основывается на микросателлитных последовательностях (коротких повторах) ДНК, широко рассеянных по всему геному эукариот, которые подвергаются избирательной амплификации для выявления вариантов по простым повторам последовательности. Для метода SSR требуются очень небольшие образцы ДНК. В методе SNP применяется реакция ПЦР-наращивания, которая эффективно обнаруживает точечные мутации. Метод требует небольшого количества ДНК в образце. Один-два из вышеприведенных методов можно использовать в типичной селекционной программе селекции по маркерам.
Наиболее предпочтительным методом осуществления такой амплификации нуклеотидных фрагментов, которая охватывает полиморфный участок генома растений, является метод полимеразной цепной реакции (ПЦР) (Mullis et al., Cold Spring Harbor Symp. Quant. Biol. 51: 263-273 (1986)) с использованием пары праймеров, включающей обратный праймер и прямой праймер, которые способны гибридизоваться с близкими последовательностями, определяющими полиморфизмы в двухцепочечной форме.
Для амплификации таких фрагментов можно использовать альтернативные методы, как-то метод лигазной цепной реакции (ЛЦР) (Barany, Proc. Natl. Acad. Sci. USA 88: 189-193 (1991)), в котором применяются две пары олигонуклеотидных зондов для экспоненциальной амплификации специфической мишени. Последовательности каждой пары олигонуклеотидов выбираются таким образом, чтобы они позволяли гибридизацию этой пары с примыкающими последовательностями одной и той же нити мишени. При такой гибридизации образуется субстрат для зависящей от матрицы лигазы. Как и при ПЦР, образующиеся при этом продукты служат матрицами в следующих циклах, и получается экспоненциальная амплификация требуемой последовательности.
ЛЦР может выполняться с олигонуклеотидами, содержащими проксимальные и дистальные последовательности одной и той же нити полиморфного сайта. В одном воплощении один из олигонуклеотидов должен включать действительный полиморфный сайт данного полиморфизма. В таком воплощении условия реакции выбираются таким образом, чтобы олигонуклеотиды могли лигироваться друг с другом только в том случае, если молекула мишени либо содержит, либо не содержит тот специфический нуклеотид, который комплементарен полиморфному сайту на этом олигонуклеотиде. С другой стороны, можно выбирать олигонуклеотиды таким образом, чтобы они не содержали этот полиморфный сайт (см. Segev, PCT Application WO 90/01069).
Следующий метод, который можно использовать в качестве альтернативы, это "метод лигирования олигонуклеотидов" (OLA) (Landegren et al., Science 241: 1077-1080 (1988)). В методе OLA используются два олигонуклеотида, которые должны гибридизоваться с примыкающими последовательностями одной и той же нити мишени. Метод OLA, как и LCR, особенно подходит для выявления точечных мутаций. Но в отличие от LCR метод OLA приводит к "линейной", а не экспоненциальной амплификации последовательности мишени.
Nickerson et al. описали метод обнаружения нуклеиновых кислот, в котором сочетаются особенности ПЦР и OLA (Nickerson et al., Proc. Natl. Acad. Sci. USA 87: 8923-8927 (1990)). В этом методе ПЦР применяется для экспоненциальной амплификации ДНК мишени, которую затем детектируют методом OLA. Наряду с тем, что это требует множественных и раздельных стадий обработки, одна из проблем, связанных с такими комбинациями, состоит в том, что им присущи все проблемы, связанные с ПЦР и OLA.
Также известны схемы, основанные на лигировании двух (или нескольких) олигонуклеотидов в присутствии нуклеиновой кислоты, содержащей последовательность образующегося при этом "диолигонуклеотида", так что происходит амплификация этого диолигонуклеотида (Wu et al., Genomics 4: 560-569 (1989)), которую можно легко адаптировать к целям настоящего изобретения.
В одном воплощении молекулярный маркер представляет собой фрагмент ДНК, амплифицированный методом ПЦР, напр., маркер SSR или маркер RAPD. В одном воплощении наличие или отсутствие амплифицированного фрагмента ДНК указывает на наличие или отсутствие самого признака или определенной аллели этого признака. В одном воплощении различие по длине амплифицированного фрагмента ДНК указывает на наличие определенной аллели признака и тем самым позволяет отличать различные аллели признака.
В одном конкретном воплощении изобретения используются маркеры типа простых повторов последовательности (SSR) для идентификации относящихся к изобретению аллелей у родительских растений и/или их предков, а также у потомства, происходящего от скрещивания данных родительских растений. Простые повторы последовательности представляют собой короткие, повторяющиеся последовательности ДНК, которые есть в геноме всех эукариот и состоят из нескольких и даже сотен повторов мотивов из 1-4 нуклеотидов. Поскольку число повторов SSR в определенном месте в геноме часто отличается среди растений, то их можно анализировать для определения отсутствия или наличия определенных аллелей.
В одном аспекте изобретение касается маркера или набора из двух и больше маркеров, вплоть до 41 маркера, включающих пару олигонуклеотидных праймеров для ПЦР, состоящую из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл.A-G, причем эти праймеры при реакции ПЦР дают продукт амплификации, проявляющий такой молекулярный вес или нуклеотидную последовательность, которые по существу идентичны таковым у соответствующего продукта ПЦР-амплификации, полученного из инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460) при реакции ПЦР с помощью идентичной пары праймеров.
На первой стадии получают образцы ДНК из подходящего растительного материала типа ткани листьев путем экстрагирования ДНК известными методами. Затем с помощью праймеров, фланкирующих участок, содержащий повторы SSR в относящихся к изобретению локусах QTL, приведенных выше, проводят амплификацию образца ДНК методом полимеразной цепной реакции (ПЦР), который хорошо известен специалистам.
В своей основе метод ПЦР-амплификации включает применение пары праймеров, содержащих последовательности двух коротких олигонуклеотидов, фланкирующих с двух сторон подлежащий амплификации сегмент ДНК. За повторными циклами нагревания и денатурации ДНК следует отжиг праймеров для отжига их на комплементарные им последовательности при низкой температуре и наращивание отожженных праймеров с помощью ДНК-полимеразы. Праймеры гибридизуются с противоположными нитями ДНК последовательностей мишени. Гибридизация означает отжиг комплементарных нитей ДНК, а комплементарность означает то, что последовательность нуклеотидов одной нити может образовать связь с нуклеотидами противоположной нити с образованием двухцепочечных структур, Праймеры располагаются таким образом, что синтез ДНК под действием полимеразы протекает в обоих направлениях вдоль последовательности нуклеотидов между праймерами. При этом за один цикл количество ДНК этого сегмента эффективно удваивается. Поскольку продукты ПЦР комплементарны праймерам и могут связываться с ними, то при каждом следующем цикле количество ДНК, синтезированной в предыдущем цикле, удваивается. Результатом этого процесса является экспоненциальное накапливание определенного фрагмента-мишени приблизительно как 2n, где n означает количество циклов,
При амплификации методом ПЦР образуются миллионы копий сегмента ДНК, фланкированного праймерами. Различия в числе повторов последовательности между фланкирующими праймерами в различных аллелях отражаются в колебаниях длины амплифицированных фрагментов ДНК. Эти различия по длине можно детектировать путем электрофоретического разделения амплифицированных фрагментов ДНК в геле. Путем анализа геля можно установить, что растение содержит нужную аллель в гомозиготном или гетерозиготном состоянии либо что нужная аллель отсутствует в геноме растения.
Маркерный анализ можно проводить на ранней стадии развития растений, используя образцы ДНК, экстрагированной из ткани листьев очень молодых растений. Это позволяет идентифицировать растения с требуемым генетическим строением на ранней стадии селекции и отбрасывать растения, не содержащие нужных, относящихся к изобретению аллелей, перед опылением и тем самым уменьшить размер селекционной популяции.
Кроме того, с помощью молекулярных маркеров можно отличить гомозиготные рецессивные растения, несущие две копии нужной, относящейся к изобретению аллели, от гетерозиготных растений, несущих только одну копию.
В одном воплощении изобретения маркерные локусы можно идентифицировать при помощи пар олигонуклеотидных праймеров для ПЦР, состоящих из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, представленных в табл. A-G, либо нуклеиновых кислот или их фрагментов, комплементарных последовательностям, приведенным в SEQ ID NO:1-82, включая пары олигонуклеотидных праймеров, состоящие из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, которые на 90-99%, предпочтительно на 95-98% идентичны нуклеотидным последовательностям, приведенным в SEQ ID NO:1-82.
Также в рамках изобретения можно использовать пары олигонуклеотидных праймеров, состоящие из прямого праймера и обратного праймера, проявляющих нуклеотидные последовательности, которые гибридизуются с нуклеотидными последовательностями прямых и обратных праймеров, приведенных в SEQ ID NO:1-82, представленных в табл. A-G, в условиях высокой строгости.
В частности, в условиях высокой строгости реакция гибридизации проводится с использованием в качестве раствора 5×SSPE, 1% SDS, 1х раствора Денхардта, а температура гибридизации составляет от 35°С до 70°С и вплоть до 72°С, предпочтительно 65°С.После гибридизации проводится отмывка, предпочтительно сначала с помощью 2×SSC, 1% SDS, а затем 0,2×SSC при температуре от 35°С до 70°С и вплоть до 72°С, предпочтительно при 65°С (касательно определения SSPE, SSC и раствора Денхардта см. Sambrook et al., loc. cit.).
Можно разработать и использовать альтернативные маркеры для идентификации и отбора растений, содержащих аллель или набор аллелей локуса количественного признака по настоящему изобретению, как изложено выше.
Например, специалисты могут определить нуклеотидную последовательность продукта амплификации, полученного при реакции ПЦР с помощью пары праймеров, приведенных в табл.A-G, проявляющих нуклеотидные последовательности, приведенные в SEQ ID NO:1-82, и составить новые праймеры или пары праймеров, исходя из как раз установленной нуклеотидной последовательности этого продукта ПЦР-амплификации.
Для определения пригодности инбредной линии и возможности ее генетического вклада в гибридное потомство делают проверочное скрещивание с другой инбредной линией, предпочтительно с инбредной линией из другой гетерозисной группы, и проводят фенотипическую оценку полученного потомства. Признаки, которые можно регистрировать, обычно включают признаки, связанные с жизнестойкостью и продуктивностью растений, включая урожайность по зерну, влажность зерна при сборе, раннее и позднее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, частоту фузариоза початков, устойчивость к Sulcotrione и строение метелки, но предпочтительно урожайность по зерну, влажность зерна при сборе, позднее прикорневое полегание и стеблевое полегание.
В одном конкретном воплощении растения по изобретению, описанные выше, получают при скрещивании двух родителей из инбредных линий, предпочтительно инбредных линий, содержащих относящиеся к изобретению аллели линий М3047/2 (NCIMB 41460) и М3047/1 (NCIMB 41459). Собирают и высаживают зерна F1. Полученные при этом растения F1 выращивают до зрелости и подвергают самоопылению, получая семена F2.
Снова высаживают определенное ограниченное количество зерен F2, предпочтительно от 200 до 1000, более предпочтительно от 300 до 600, но особенно предпочтительно 500. Полученные при этом растения F2 опять выращивают до зрелости и подвергают самоопылению, получая семена F3.
После этого можно применять распространенную методику продвижения поколений типа той, что известна как потомство от одного зернышка (SKD). По этой методике от каждого растения F2 собирают только одно зернышко F3. Зернышки F3 собирают и высаживают, а полученные при этом растения F3 подвергают самоопылению, получая семена F4. Собирают все зерна F4, выросшие на каждом растении F3. и сортируют все собранные зерна F4, отдельно по исходным растениям F3, составляя при этом семейства F4.
Затем выращивают растения из каждого семейства F4. Часть полученных при этом растений позже используют для получения ткани листьев, предназначенной для экстракции ДНК и генотипирования. Другую часть этих растений скрещивают с растениями-анализаторами, предпочтительно инбредной линии кукурузы из другой гетерозисной группы, чем две родительские инбредные линии, предпочтительно инбредной линии из полегающей гетерозисной группы, такой, к примеру, как FSII434. У растений F4 удаляют метелки, поэтому их используют в качестве женских особей, а анализатор используется в качестве мужских особей для опыления всех растений F4. Семена от аналитического скрещивания собирают, сохраняя структуру семейств.
Семена от аналитического скрещивания из семейств F4 высаживают и оценивают в поле, предпочтительно при различных условиях роста и климатических условиях. В тех же опытах можно высадить и некоторые другие гибриды для проверки.
Регистрируемые признаки включают урожайность по зерну, влажность зерна при сборе, раннее и позднее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, частоту фузариоза початков, устойчивость к Sulcotrione и строение метелки. На участках с аналитическим скрещиванием регистрировали урожайность по зерну, влажность зерна при сборе, позднее прикорневое полегание и стеблевое полегание, в частности раннее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, устойчивость к Sulcotrione и строение метелки. Частоту фузариоза початков регистрировали и на участках с аналитическим скрещиванием, и на участках F4.
Отбирается подгруппа локусов QTL из всех идентифицированных QTL. Положение этих локусов QTL относительно соседних маркеров, вместе с их эффектами и благоприятными аллелями, представлено в табл.1-8. Эти QTL служат мишенями для селекции и используются для создания новых линий.
Для генотипирования и картирования локусов QTL проводится экстракция ДНК из подходящего растительного материала, такого, к примеру, как ткань листьев. В частности, у каждого семейства F4 собирают целые листья из большинства растений. Образцы ДНК подвергают генотипированию по большинству полиморфных SSR, охватывающих весь геном кукурузы, в частности от 80 до 250, предпочтительно от 90 до 200, более предпочтительно от 100 до 150, но особенно предпочтительно 112 повторов SSR.
Карту молекулярных маркеров можно составить с помощью общепринятых программ, таких, к примеру, как Mapmaker и Joinmap. Карта молекулярных маркеров имеет общую длину в 2187 сантиморганов (сМ), а плотность маркеров составляет один маркер на каждые 19,5 сМ.
Совместный анализ генотипических и фенотипических данных можно проводить с помощью стандартной программы, такой, к примеру, как QTLCartographer или PlabQTL. По всем признакам идентифицировано 130 локусов QTL. В частности, идентифицировано 23 локуса QTL для урожайности по зерну и 40 для влажности зерна. Локусы QTL характеризуются по их положению на генетической карте и эффектам прироста и доминантности. Положения определяются как генетические расстояния между наиболее вероятными позициями этих локусов QTL (обычно позициями пиковых значений показателя LOD) и боковых маркерных локусов (в сантиморганах). Эффекты прироста и доминантности определяются как отклонения от среднего значения и выражаются в тех же единицах, что и относящиеся к ним признаки. Величина прироста определяет, какая из двух родительских линий несет благоприятную аллель в данном QTL. В одном конкретном воплощении изобретения величина прироста представляет эффект аллели М3047/2 (NCIMB 41460), который может быть положительным или отрицательным. Для такого признака, как урожайность по зерну, если желательным эффектом будет большее значение этого признака, то положительная величина прироста означает, что линия М3047/2 (NCIMB 41460) несет благоприятную аллель, тогда как отрицательная величина прироста означает, что благоприятную аллель несет линия М3047/1 (NCIMB 41459).
Начиная с особей F4, происходящих от исходного скрещивания инбредных линий, проявляющих уникальный профиль QTL по изобретению, но предпочтительно инбредных линий М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), применяется селекция по маркерам с последующей фенотипической селекцией. Может быть создано несколько инбредных линий, у которых все вышеописанные локусы содержат гомозиготные благоприятные генотипы. Затем эти инбредные линии можно подвергнуть аналитическому скрещиванию, при котором их скрещивают с несколькими растениями-анализаторами и испытывают в поле при различных климатических и экологических условиях на предмет агрономических показателей и сравнивают с другими гибридами.
Наиболее желательными гибридами являются те, которые проявляют высокую урожайность по зерну и низкую влажность зерна при сборе.
Вошедшие в состав растений и идиоплазмы можно подвергнуть скринингу на аллели по соответствующим локусам QTL, приведенным в табл.1-8, исходя из нуклеотидной последовательности маркера в маркерном локусе, сцепленном с этим QTL, и молекулярного веса аллели, используя один или несколько методов, изложенных в настоящем изобретении либо известных специалистам в этой области.
Краткое описание фигур
Фигура 1. Агрономические показатели полученного при селекции по маркерам материала настоящего изобретения в сравнении с эталонным материалом. На фигуре представлена урожайность по зерну (в центнерах на гектар) и влажность зерна при сборе у гибридов, происходящих из 4 полученных при селекции по маркерам линий по настоящему изобретению, ILD01, ILD02, ILD06 и ILD07, содержащих комплект QTL, описанных выше, которые скрещивали с тремя линиями-анализаторами, TSTR01, TSTR04 и TSTR06, и выращивали в 8 местностях во Франции в 2006 г. Представлены усредненные результаты по всем 8 местностям. На фигуре также представлены показатели эталонных (контрольных) гибридов. Контрольные гибриды представлены черными ромбиками. Полученные при селекции по маркерам гибриды представлены белыми квадратиками. Наиболее желательными гибридами являются те, которые проявляют высокую урожайность по зерну и низкую влажность зерна при сборе, поэтому они размещаются в верхнем левом углу фигуры. Большинство гибридов в этой части фигуры происходят из полученных при селекции по маркерам линий.
Осуществление изобретения
Методы определения агрономических показателей исследуемого материала, в частности методы измерения урожайности и содержания сухого вещества в зернах кукурузы соответствуют стандартным методикам, известным в этой области и описанным, к примеру, в Arvalis Quality Manual, который можно получить из Arvalis, Institut du végétal (http://www.arvalisinstitutduvegetal.fr/fr/).
Депонирование
Репрезентативный образец семян инбредной линии кукурузы М3047/1 в соответствии с положениями Будапештского договора был депонирован 15 января 2007 г. в NCIMB, Aberdeen, AB21 9YA, Scotland под номером доступа NCIMB 41459.
Репрезентативный образец семян инбредной линии кукурузы МЗ 047/2 в соответствии с положениями Будапештского договора был депонирован 15 января 2007 г. в NCIMB, Aberdeen, AB21 9YA, Scotland под номером доступа NCIMB 41460.
Примеры
Идентификация и использование QTL для получения наилучших инбредных линий и гибридов
Пример 1. Растительный материал и история скрещивания
Исходный материал состоял из двух инбредных линий кукурузы: М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), обе из твердозерновой гетерозисной группы.
Эти линии скрещивали друг с другом, получая семена F1. Зерна F1 высаживали, а полученные при этом растения F1 подвергали самоопылению, получая семена F2.
Высаживали около 500 зерен F2. Полученные при этом растения F2 подвергали самоопылению, получая семена F2 по распространенной методике продвижения поколений, известной как потомство от одного зернышка (SKD). Собранные таким образом почти 500 зернышек высаживали, а полученные при этом растения F3 подвергали самоопылению, получая семена F4. Собирали все зерна F4, выросшие на каждом растении F3. и сортировали все собранные зерна F4 отдельно по исходным растениям F3, составляя при этом семейства F4.
Из каждого семейства F4 высаживали по 10 зерен для получения ткани листьев, используемой позже для экстрагирования ДНК и генотипирования.
По 25 зерен из 260 не подвергавшихся отбору семейств F4 высаживали на изолированном поле для скрещивания с анализатором (инбредной линией кукурузы из другой гетерозисной группы, чем две родительские инбредные линии данной программы), FSII434 из полегающей гетерозисной группы. У растений F4 удаляли метелки, поэтому их использовали в качестве женских особей, а анализатор использовали в качестве мужских особей для опыления всех растений F4. Семена от аналитического скрещивания собирали, сохраняя структуру семейств.
Пример 2. Фенотипическая оценка
Семена от аналитического скрещивания из 260 семейств F4 высаживали на поля в 6 местностях на двухрядных участках в 1998 г. Схема эксперимента: решеточный план с одним повтором. В тех же опытах высаживали несколько других гибридов, служивших в качестве контроля.
Семена из тех же 260 семейств F4 также высаживали на поля в 2 местностях на однорядных участках в 1998 г. В тех же местностях высаживали и несколько инбредных линий, служивших в качестве контроля.
Регистрируемые признаки включали урожайность по зерну, влажность зерна при сборе, мощность проростков, даты цветения мужских и женских особей, раннее и позднее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, частоту фузариоза початков, устойчивость к Sulcotrione и строение метелки. На участках с аналитическим скрещиванием регистрировали урожайность по зерну, влажность зерна при сборе, позднее прикорневое полегание и стеблевое полегание. На участках F4 регистрировали мощность прорастания, даты цветения мужских и женских особей, раннее прикорневое полегание, стеблевое полегание, частоту головни обыкновенной, устойчивость к Sulcotrione и строение метелки. Частоту фузариоза початков регистрировали и на участках с аналитическим скрещиванием, и на участках F4.
Пример 3. Генотипирование и картирование локусов QTL
Экстрагировали ДНК из целых листьев 10 растений F4 у каждого семейства F4. Образцы ДНК подвергали генотипированию по 112 повторам SSR, охватывающим весь геном кукурузы. Предварительно проверяли несколько сотен SSR у двух родителей данной расходящейся популяции, М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460), чтобы идентифицировать полиморфные повторы. Генотипы молекулярных маркеров, полученных при анализе образцов ДНК F4, представляли собой генотипы тех растений F3, из которых происходили семейства F4.
Карту молекулярных маркеров составляли с помощью общепринятых программ Mapmaker и Joinmap. Карта молекулярных маркеров имела общую длину в 2187 сантиморганов (сМ), а плотность маркеров составляла один маркер на каждые 19,5 сМ.
Совместный анализ генотипических и фенотипических данных проводили с помощью программ QTLCartographer и PlabQTL. По всем признакам идентифицировали 130 локусов QTL. В частности, идентифицировали 23 локуса QTL для урожайности по зерну и 40 для влажности зерна. Локусы QTL характеризуются по их положению на генетической карте и эффектам прироста и доминантности. Положения определяются как генетические расстояния между наиболее вероятными позициями этих локусов QTL(обычно позициями пиковых значений показателя LOD) и боковых маркерных локусов (в сантиморганах). Эффекты прироста и доминантности определяются как отклонения от среднего значения и выражаются в тех же единицах, что и относящиеся к ним признаки. Величина прироста определяет, какая из двух родительских линий несет благоприятную аллель в данном QTL. В данном случае величина прироста представляет эффект аллели М3047/2 (NCIMB 41460), который может быть положительным или отрицательным. Для такого признака, как урожайность по зерну, если желательным эффектом будет большее значение этого признака, то положительная величина прироста означает, что линия М3047/2 (NCIMB 41460) несет благоприятную аллель, тогда как отрицательная величина прироста означает, что благоприятную аллель несет линия М3047/1 (NCIMB 41459).
Пример 4. Селекция по маркерам
Была отобрана подгруппа локусов QTL из всех идентифицированных QTL. Положение этих локусов QTL относительно соседних маркеров, вместе с их эффектами и благоприятными аллелями, представлено в табл.1-8. Эти локусы QTL служили мишенями для селекции и использовались для создания новых линий.
Таблица 1. Локусы QTL для урожайности по зерну и сцепленные маркеры.
Каждому локусу QTL для урожайности по зерну присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец интервала достоверности, его эффект (величина прироста) как разность между эффектом аллели от М3047/2 (NCIMB 41460) и эффектом аллели от М3047/1 (NCIMB 41459) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
Например, первый QTL для урожайности по зерну располагается на хромосоме 1 в наиболее вероятном положении 115,6 сМ, а интервал достоверности простирается от 110,6 сМ до 120,6 сМ. Эффект этого QTL составляет 1,94, что означает, что аллель М3047/2 (NCIMB 41460) повышает урожайность по зерну на 194% по сравнению с аллелью от М3047/1 (NCIMB 41459). В данном случае благоприятная аллель исходит от М3047/2 (NCIMB 41460).
|
Таблица 2. Локусы QTL для влажности зерна при сборе и сцепленные маркеры
Каждому локусу QTL для влажности зерна присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL (тем самым указывающие на аллель, находящуюся в этом QTL).
|
Таблица 3. Локусы QTL для прикорневого и стеблевого полегания и сцепленные маркеры
Каждому локусу QTL для прикорневого и стеблевого полегания присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
|
Таблица 4. Локусы QTL для частоты головни обыкновенной и сцепленные маркеры
Каждому локусу QTL для частоты головни обыкновенной присвоен произвольный номер. По каждому QTL приводится следующая информация:
хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
|
Таблица 5. Локусы QTL для строения метелки и сцепленные маркеры Каждому локусу QTL для строения метелки присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
|
|
Таблица 6. Локусы QTL для устойчивости к Sulcotrione и сцепленные маркеры
Каждому локусу QTL для устойчивости к Sulcotrione присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
|
Таблица 7. Локусы QTL для частоты фузариоза початков и сцепленные маркеры
Каждому локусу QTL для частоты фузариоза початков присвоен произвольный номер. По каждому QTL приводится следующая информация: хромосома, на которой он располагается, наиболее вероятное положение на этой хромосоме, начало и конец его интервала достоверности, его эффект (величина прироста) и маркеры, сцепленные с этим QTL(тем самым указывающие на аллель, находящуюся в этом QTL).
|
Источник (тип) благоприятной аллели определяли в каждом локусе QTL по знаку эффекта этого QTL (положительному или отрицательному) и желательности данного признака. Это дало возможность идентифицировать благоприятные аллели по каждому сцепленному маркеру/Они представлены в табл.A-G. Эту информацию использовали для отбора особей в процессе селекции по маркерам, целью которой было доведение до максимума количества благоприятных аллелей у одной особи.
Пример 5. Показатели полученного при селекции по маркерам материала
Селекцию по маркерам с последующей фенотипической селекцией проводили, исходя из особей F4 от скрещивания между инбредными линиями М3047/1 (NCIMB 41459) и М3047/2 (NCIMB 41460). Было создано несколько инбредных линий, у которых все вышеописанные локусы содержат гомозиготные благоприятные генотипы. Эти инбредные линии подвергали аналитическому скрещиванию с несколькими анализаторами, испытывали в поле на предмет агрономических показателей и сравнивали с другими гибридами. На фиг.1 представлены результаты от 4 инбредных линий: ILD01, ILD02, ILD06 и ILD07. Полевые испытания проводили в 8 местностях во Франции в 2006 г.Аллельный состав этих 4 линий по маркерам, фланкирующим локусы QTL, представлен в табл.8.
Пример 6. Типичная методика определения характеристик (размера) аллелей с помощью агарозы
На 384-луночный планшет наносили по 3 мкл ДНК (концентрация 2 нг/мкл). В лунки также вносили по 3 мкл смеси для ПЦР. Состав этой смеси приведен в следующей таблице.
|
|
Амплификацию методом ПЦР проводили на термоциклере GeneAmp PCR System 9700 фирмы Applied Biosystems, причем она включала следующие стадии:
- 2 мин при 94°С
- 40 циклов по 15 сек при 94°С и по 45 сек при 59°С
- 2 мин при 72°С.
Продукты ПЦР-амплификации разделяли на агарозных гелях, используя агарозу с высокой разрешающей способностью в концентрации 3% в 1×ТВЕ (трис-борат/ЭДТА). Агарозу приобретали у фирмы Invitrogen (Agarose 100, кат. №10975). Электрофорез проводили при 400 вольт в течение 1 часа. Продукты ПЦР-амплификации проявляли после миграции с помощью бромида этидия и рассматривали под УФ.
Типичная методика определения характеристик (молекулярного веса) аллелей с помощью секвенатора
На 384-луночный планшет наносили по 5 мкл ДНК (концентрация 2 нг/мкл). В лунки также вносили по 5 мкл смеси для ПЦР. Состав этой смеси приведен в следующей таблице.
|
Амплификацию методом ПЦР проводили на термоциклере GeneAmp PCR System 9700 фирмы Applied Biosystems, причем она включала следующие стадии:
- 2 мин при 94°С
- 40 циклов по 15 сек при 94°С и по 45 сек при 59°С
- 2 мин при 72°С.
Продукты ПЦР-амплификации сначала подвергали денатурации формамидом в течение 3 мин при 96°С, а затем разделяли на секвенаторе AbiPrism 3700 фирмы Applied Biosystems. Миграция в секвенаторе происходит в капиллярах, заполненных полимером РОР6 (приобретали у фирмы Applied Biosystems, кат. №4311320) и 1×ТВЕ. Молекулярные веса ПЦР-амплифицированных фрагментов определяли с помощью программ Genescan и Genotyper.
Таблица 8. Молекулярные веса (в парах оснований) продуктов ПЦРамплификации благоприятных аллелей по молекулярным маркерам, сцепленным с локусами QTL
|
Приведенные молекулярные веса являются результатом одной ПЦР-амплификации с последующей миграцией в агарозном геле по вышеописанной методике.
Таким образом, эти молекулярные веса представляют собой оценки истинного молекулярного веса и следует ожидать, что будут наблюдаться колебания вокруг приведенных значений при повторении миграции в агарозе.
Пример 8: Композиция аллельных QTL линий NPNW0351 (NCIMB 41578); NP1902 (NCIMB 41577); NP1941 (NCIMB 41576)
NPNW0351 (NCIMB 41578); NP1902 (NCIMB 41577); NP1941 (NCIMB 41576) - три близкородственные линии, полученные из одного проекта по выведению, включающего родительские линии М3047/1 и М3047/2, описанные в примере 1.
Из табл.J следует, что 3 линии содержат композицию QTL по настоящему изобретению, причем две линии (NP1902 и NP1941) несут предпочтительную аллель по 13 из 14 QTL для урожая зерна. Линия NPNW0351 несет предпочтительную аллель по 14 QTL для урожая зерна.
В табл.J также показано, что линия NPNW0351 несет предпочтительную аллель по 9 из 11 QTL для влажности зерна; линии NP1902 несет предпочтительную аллель по 9 из 11 QTL; и линия NP1941 несет предпочтительную аллель по 10 QTL (нефиксированную по QTL n°10).
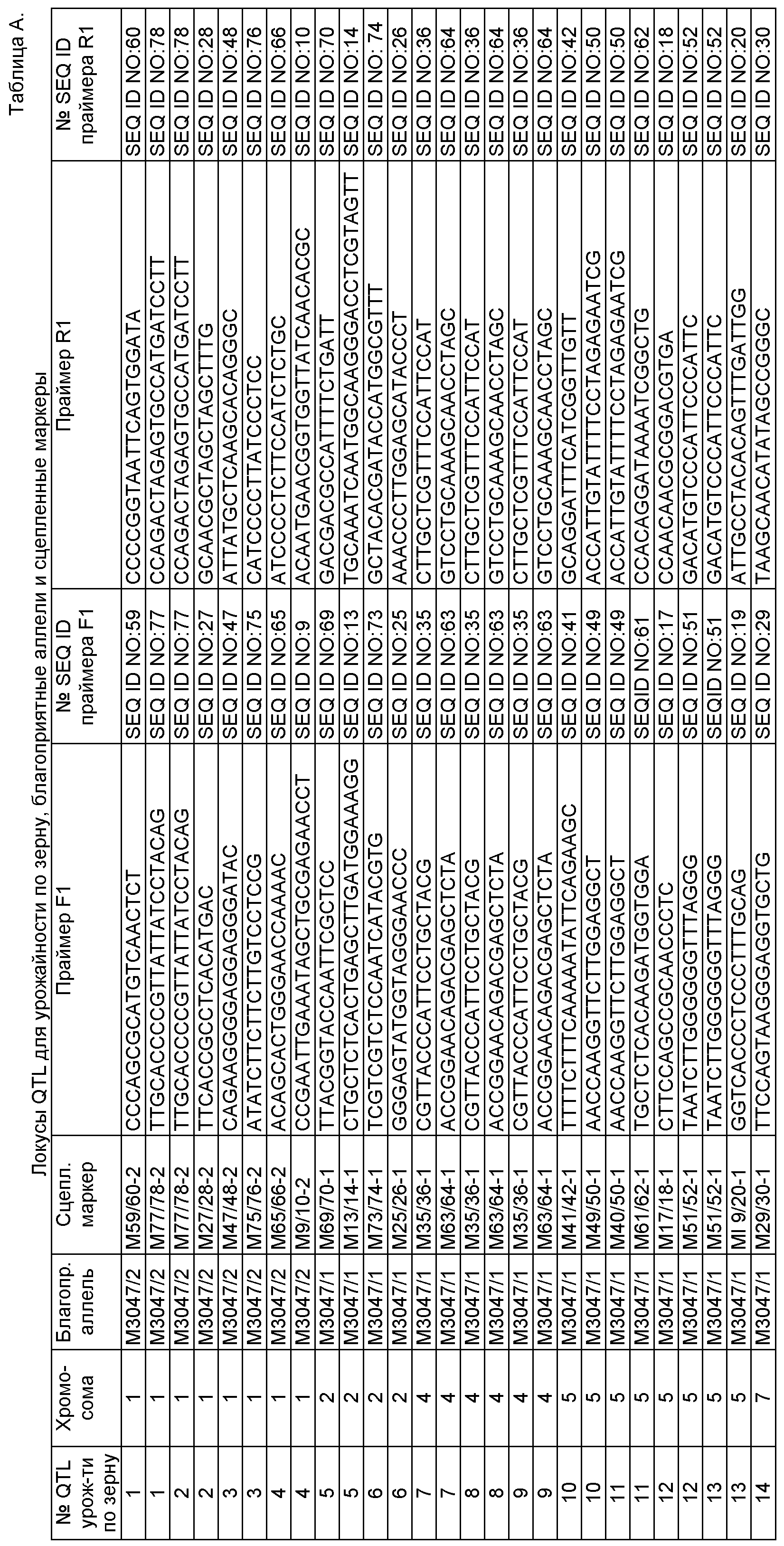
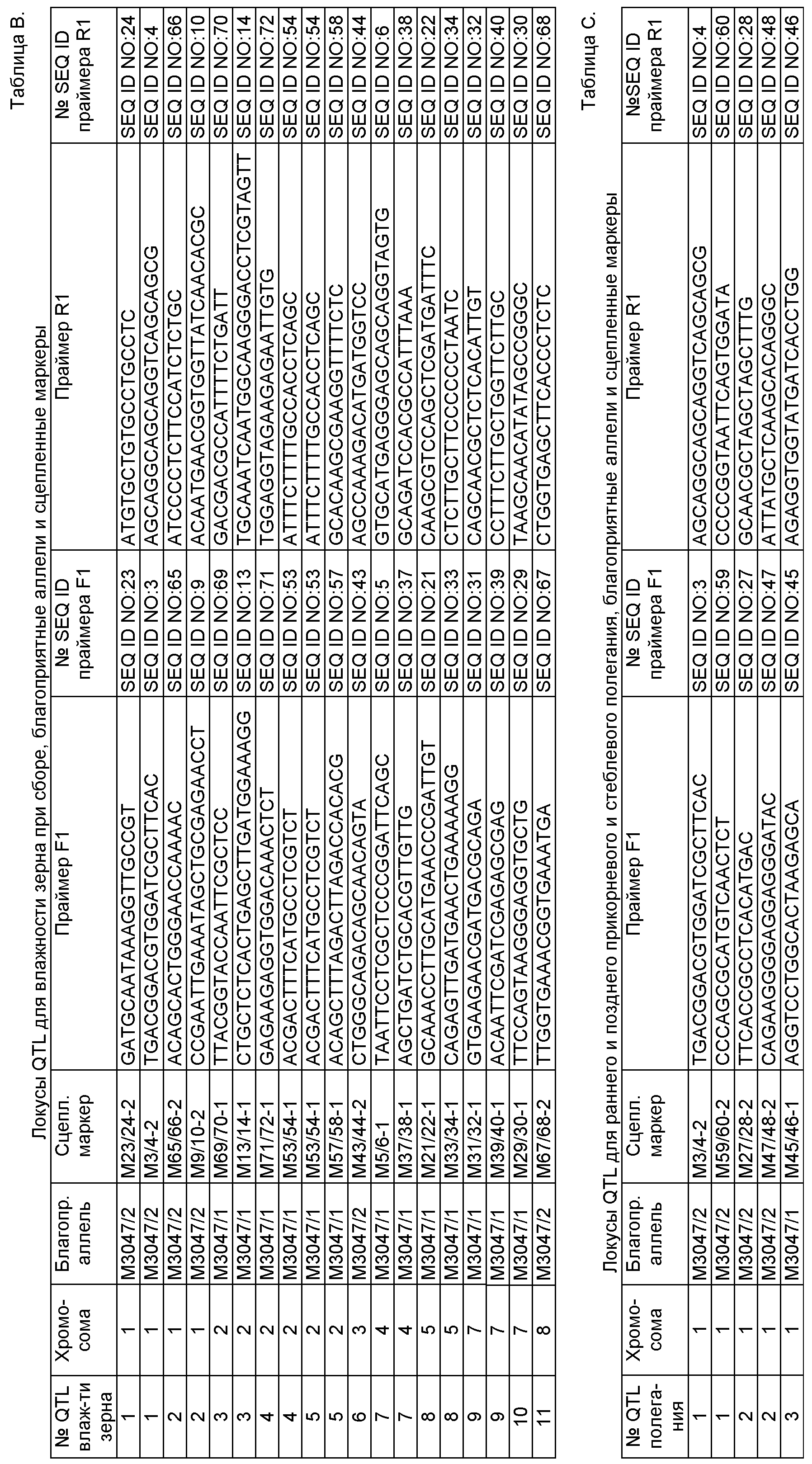
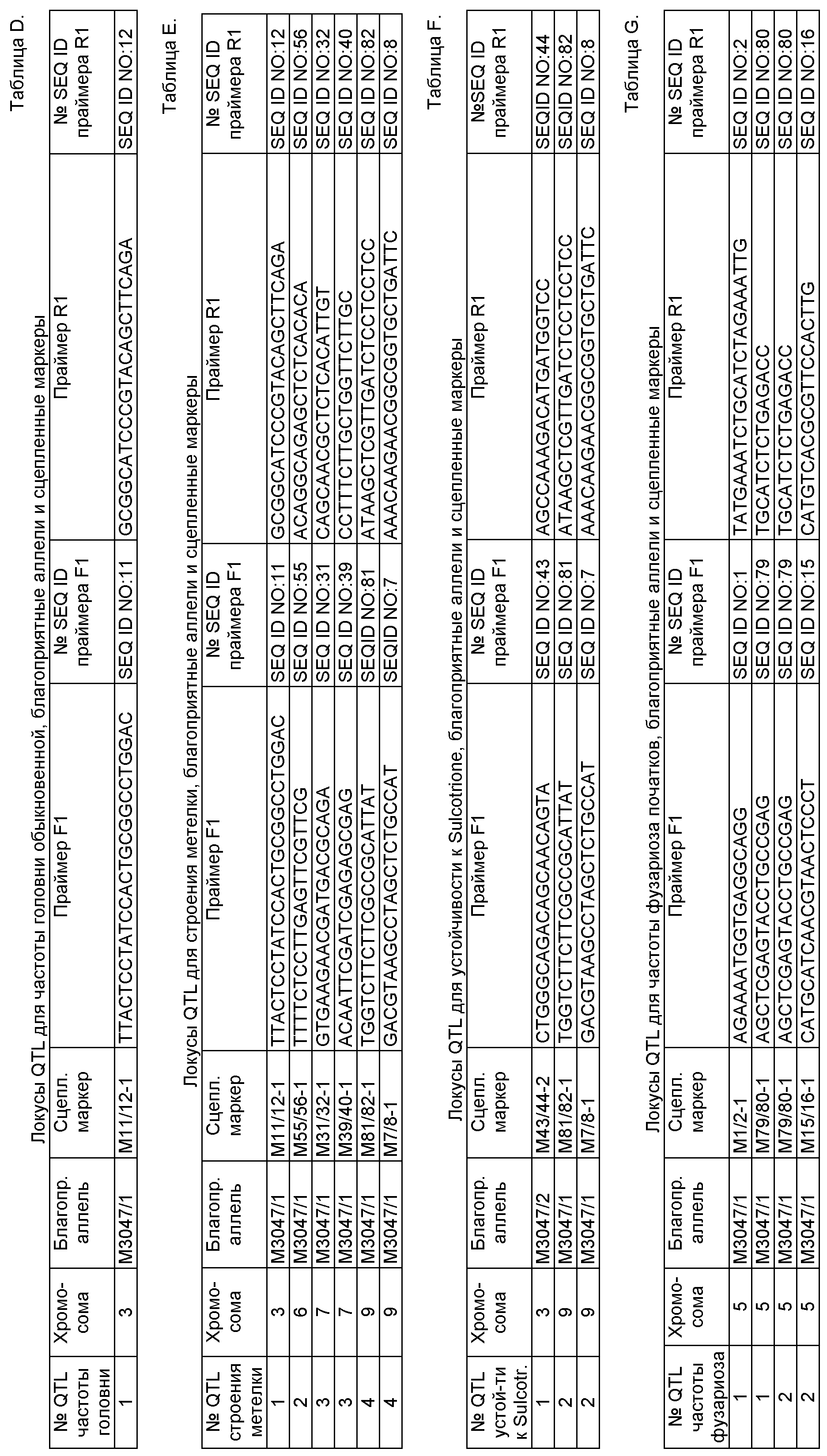
|
|
|
|
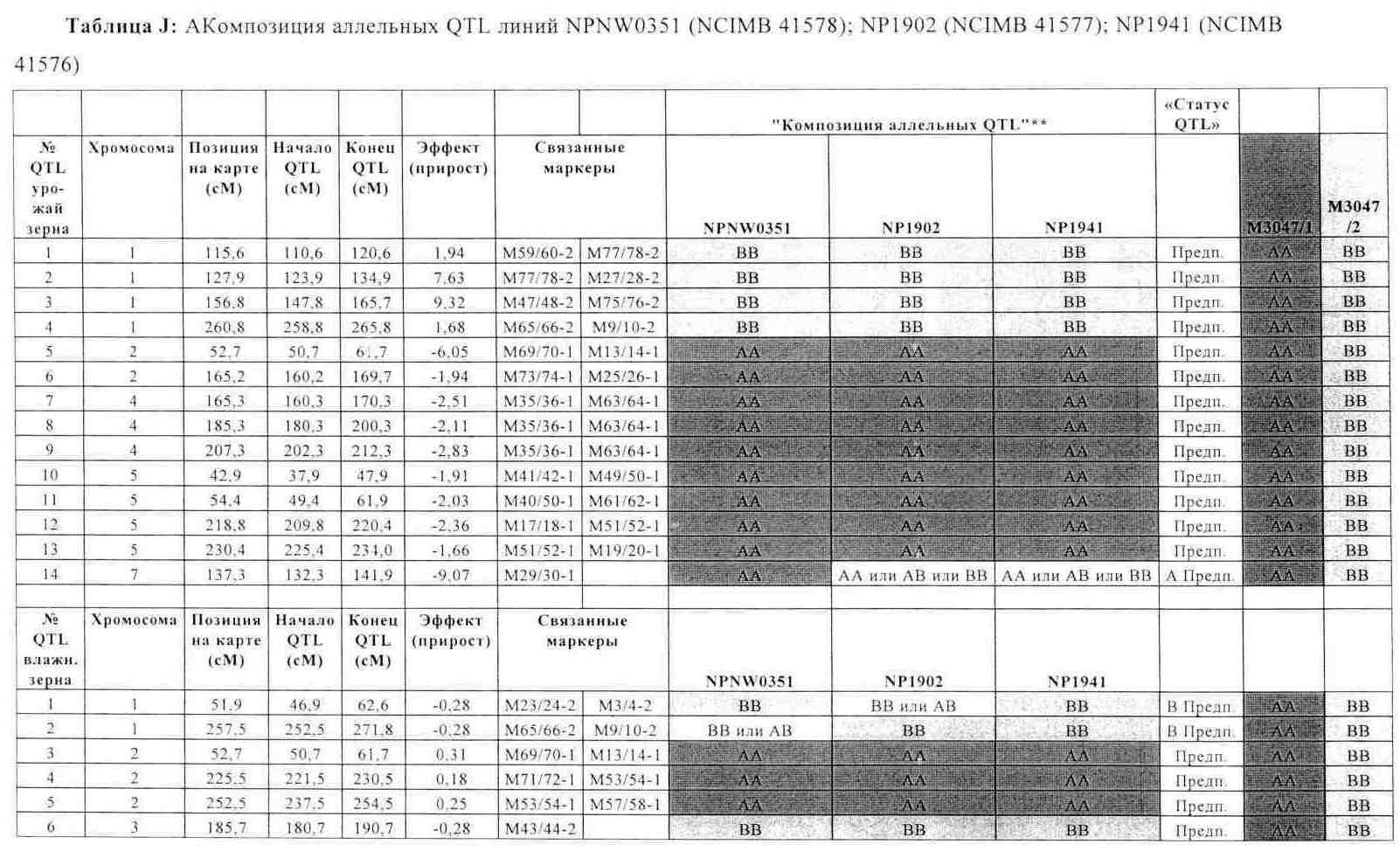
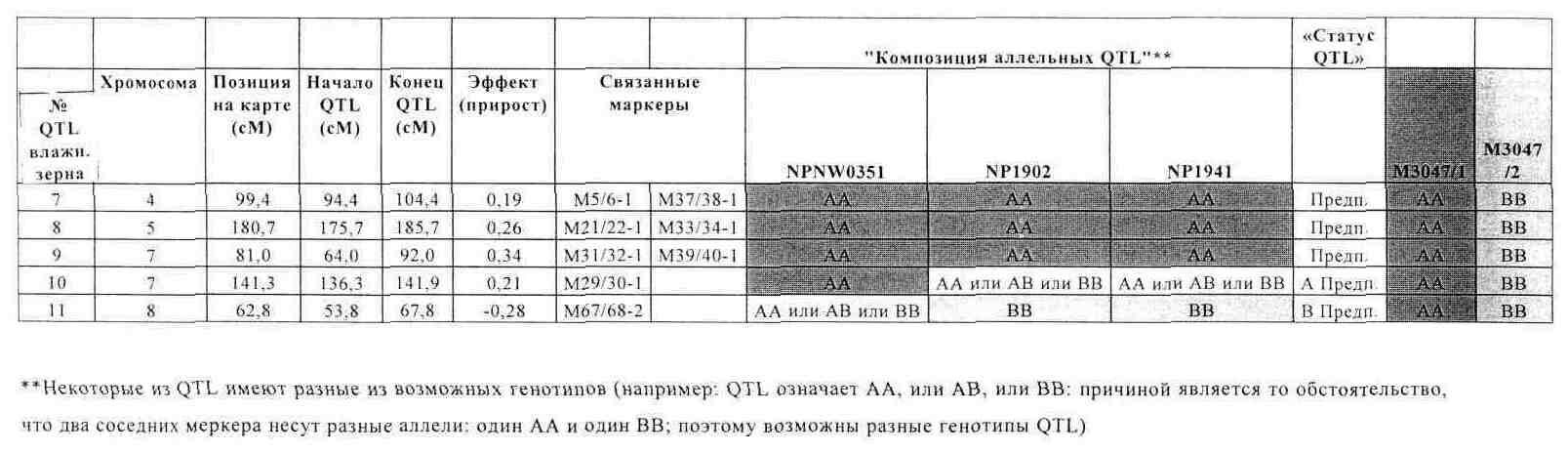
Депонирование
Приводимые ниже образцы семян линий Zea mays депонированы в коллекции NCIMB по адресу: Aberdeen AB21 9YA, Scotland, UK, 15 января 2008 года и 21 июля 2008 года, соответственно, по Будапештскому договору:
|
Библиография
Barany (1991) Proc. Natl. Acad. Sci. USA 88: 189-193.
Edwards et al. (1987) Genetics 115: 113-125.
Edwards M. & Johnson L. (1994) RFLPs for rapid recurrent selection. Proc. Symp. on Analysis of Molecular Marker Data, pp 33-40. Corvallis, Oregon, American Society of Horticultural Science and Crop Science Society of America.
Fehr W.R. (1987) Principles of Cultivar Development. Macmillan, New York, New York.
Gallais A., Dillmann C. & Hospital F. (1997) An analytical approach of marker assisted selection with selection on markers only. In; R. Krajewski & Z. Kaczmarek, eds. Advances in biometrical genetics. Proc. 10th Meeting of the EUCARPIA Section Biometrics in Plant Breeding, pp 111-116, Poznan, Institute of Plant Genetics, Polish Academy of Sciences.
Gimelfarb A. & Lande R. (1994) Simulation of marker-assisted selection in hybrid populations. Genet. Res, 63: 39-47.
Lande R. & Thompson R. (1990) Efficiency of marker-assisted selection in the improvement of quantitative traits. Genetics 124: 743-756.
Lander & Schork (1994) Science 265: 2037-2048
Landegren et al. (1988) Science 241: 1077-1080.
Lee M. (1995) DNA markers in plant breeding programs. Advances in Agronomy 55: 265-344.
Moreau L., Charcosset A., Hospital F. & Gallais A. (1998) Marker-assisted selection efficiency in populations of finite size. Genetics 148: 1353-1365.
Mullis et al, (1986) Cold Spring Harbor Symp.Quant. Biol. 51: 263-273.
Nickerson et al. (1990) Proc. Natl. Acad. Sci. USA 87: 8923-8927.
Pearson W.R. (1990) Methods in Enzymology 183: 63-98.
Peleman J.D. & Van Der Voort J.R. (2003) Breeding by design. Trends Plant Sci. 7: 330-334.
Ragot M., Biasiolli M., Delbut M.F., Dell'Orco A., Malgarini L., Thevenin P., Ribaut J-M. & Betrán J. (1999) Single large-scale marker-assisted selection (SLS-MAS). Mol. Breed. 5: 531-541.
Sambrook et al.
Smith and Waterman (1981) Advances in Applied Mathematics 2: 482-489.
Stam P. (1995) Marker-assisted breeding. In: J.W. Van Ooijen & J. Jansen, eds. Biometrics in plant breeding: applications of molecular markers. Proc. 9th meeting of the EUCARPIA Section Biometrics in Plant Breeding, pp 32-44. Wageningen, The Netherlands, CPRO-DLO.
Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology -Hybridization with Nucleic Acid Probes part I chapter 2 "Overview of principles of hybridization and the strategy of nucleic acid probe assays" Elsevier, New York.
Van Berloo R. & Stam P. (1998) Marker-assisted selection in autogamous RIL populations: a simulation study. Theor. Appl. Genet. 96: 147-154.
Vernoy J., Vivant J., Zimmermann R. & Gay G. (1995) Marker-assisted backcrossing: a practical example. In: A. Bervillé & M. Tersac, eds. Les Colloques, n°72, Techniques et utilisations des marqueurs moléculaires, pp 45-56. INRA, Paris.
Wu et al. (1989) Genomics 4: 560-569.
Xie С.& Xu S. (1998) Efficiency of multistage marker-assisted selection in the improvement of multiple quantitative traits. Heredity 80: 489-498.
U.S. Patent No.5,385,835.
U.S. Patent No.5,492,547.
U.S. Patent No.5,981,832.
U.S. Patent No.6,399,855.
WO 90/01069.