Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ДЛЯ КОНТРОЛЯ РАЗВИТИЯ РАСТЕНИЙ
Вид РИД
Изобретение
Настоящее изобретение относится к новым соединениям, новым композициям, а также способам их применения для стимуляции прорастания семян и выведения из покоя семян растений, тканей растений и растений.
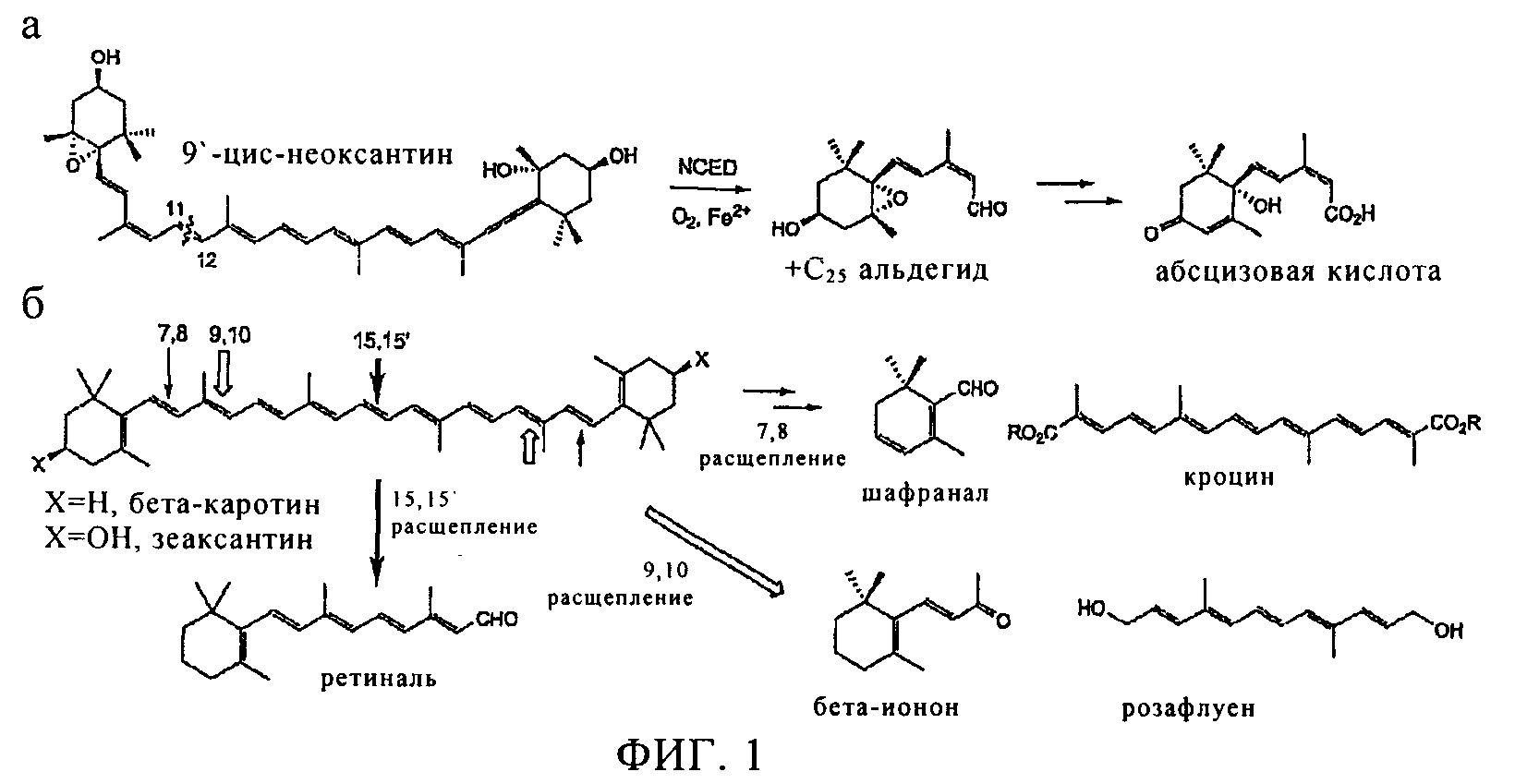
Каротиноиды, фотозащитные молекулы, синтезируются растениями и микроорганизмами и являются важными компонентами корма животных, примером которых, прежде всего, является β-каротин (провитамин А). Окислительное расщепление происходит в растениях, организме животных и микроорганизмах, в результате происходит высвобождение ряда каротиноидов, выполняющих функцию сигнальных молекул, а также и другие функции (1). Первым геном, кодирующим расщепляющий каротиноиды фермент каротиндиоксигеназу (CCD)1, является ген кукурузы Vp14, который требуется для синтеза абсцизовой кислоты (АБК), важного гормона, который опосредует ответ на засуху и некоторые стадии развития растений, такие как состояния покоя семян и почек (2). Ферментом VP14, который расщепляет эпоксикаротиноиды, 9'-цис-неоксантин и/или 9-цис-виолаксантин, в положении 11, 12 (фиг.1), является 9-цис-эпоксикаротиндиоксигеназа (NCED) (3), которая относится к подклассу многочисленного семейства CCD.
После открытия гена Vp14, также было установлено участие и других CCD в синтезе ряда апокаротиноидов (фиг.1). У насекомых, зрительный пигмент ретиналь образуется в результате окислительного расщепления β-каротина под действием β-каротин-15,15'-диоксигеназы (4). У позвоночных ретиналь образуется под действием ортологических ферментов и впоследствии превращается в ретиноевую кислоту, регулятор дифференциации в процессе эмбриогенеза (5). Предполагают, что различные CCD млекопитающих расщепляют каротиноиды асимметрично в положении 9, 10 (6) и хотя данный механизм расщепления до конца не выяснен, последние опубликованные данные свидетельствуют об их участии в метаболизме из пищевых продуктов ликопена (7). Летучие вещества растений, β-ионон и геранилацетон, образуются при расщеплении молекулы каротиноида ферментами в положении 9, 10 (8) и при расщеплении в положении 7, 8 образуется пигмент α-кроцин, обнаруженный в специи шафрана (9).
Идентифицированы и другие CCD, биологическая активность которых на сегодняшний день еще недостаточно исследована, например, в цианобактериях, для которых известна различная специфичность расщепления (10-12). В других случаях описаны апокаротиноиды с известными функциями, но их идентичность и участие ферментов CCD еще не описаны: кетон из тканей кузнечиков выполняет защитную функцию кобылки бескрылой (Romalea microptera) (13), микоррадицин продуцируется в корнях растений во время симбиоза с древовидной микоризой (14), а стриголактоны (15) являются метаболитами растений и выполняют сигнальную функцию для начала прорастания растений-паразитов, таких как Striga (стрига) и Orobanche (заразиха) (16).
Недавно было установлено, что стриголактоны также являются растительными гормонами, оказывающими влияние на ветвление растений (17, 18). Существование указанного гормона известно уже давно, но до сих пор он недостаточно изучен. Однако известно, что указанный гормон образуется в результате действия по крайней мере двух CCD, max3 и max4 (more axillary growth, предпочтительно аксиллярный рост) (19), так как делеция любого из этих двух генов у арабидопсиса (Arabidopsis thaliana) приводит к формированию фенотипа с повышенной ветвистостью (20,21). По данным анализа Е.coli установлено, что AtCCD7 (max3) расщепляет β-каротин в положении 9,10 и полученный в результате продукт апокаротиноид (10-апо-β-каротин) в дальнейшем расщепляется в положении 13, 14 диоксигеназой AtCCDS (max4) с образованием 13-апо-β-каротина (22). Кроме того, последние данные свидетельствуют о том, что AtCCD8 является высокоспецифичным ферментом и расщепляет только 10-апо-β-каротин (23). Однако неизвестен механизм образования 13-апо-β-каротина, который приводит к синтезу комплексов стриголактонов. Не исключено, что ферменты могут обладать различной специфичностью и активностью расщепления в полевых условиях. Установлено также, что фермент цитохром Р450 (24) принимает участие в синтезе стриголактона и проявляет активность в пути, расположенном за генами CCD. Предполагают, что стриголактон влияет на ветвление растений за счет регуляции транспорта ауксина (25). Так как CCD принимает участие в синтезе стриголактона, существует вероятность того, что активность CCD влияет на структуру растения и на взаимодействие с растениями-паразитами и микоризой.
Несмотря на значительные успехи, достигнутые в исследовании природной функции и субстратной специфичности CCD с использованием генной инженерии, прежде всего из различных видов растений с простыми генетическими системами или с генетической системой, подверженной трансгенезу, существует множество систем, в отношении которых применение генетических подходов затруднено или невозможно. Кроме того, при исследовании рекомбинантных CCD в условиях in vitro или в гетерологичных методах анализа in vivo, таких как рекомбинантные штаммы Е.Coli, были сконструированы, например, штаммы, в которых накапливаются каротиноиды (26), в большинстве случаев активные в отношении широкого круга субстратов (5, 21, 27), но истинный субстрат in vivo для конкретной CCD остается неизвестным. Следовательно, существует необходимость в разработке дополнительных экспериментальных инструментов для исследования функций как апокаротина, так и CCD в их естественном клеточном окружении.
Методами обратной генетики идентифицированы низкомолекулярные соединения, которые проявляют активность по отношению к известным белкам-мишеням, и их используют в биологических системах для исследования функции белков в условиях in vivo (28, 29). Такой подход сопоставим с общепринятыми генетическими методами, основанными на использовании низкомолекулярных соединений, так как такие низкомолекулярные соединения можно использовать простым способом для исследования множества видов, и их использование можно контролировать по концентрации, времени и распределению в пространстве, чтобы обеспечить подробное исследование биологических свойств, а, изменяя специфичность низкомолекулярных соединений, можно исследовать свойства, как индивидуальных белков, так и классов белков. Необходимо отметить, что функции таких растительных гормонов, как гиббереллин, брассиностероид и абсцизовая кислота, успешно исследованы с использованием такого подхода при модификации адаптирования триазолов для ингибирования цитохром Р450 монооксигеназ, принимающих участие в метаболизме указанных гормонов (30).
Установлено, что, в случае семейства CCD, третичные амины абамин (31) и более активный абамин SG (32) являются специфичными ингибиторами NCED, причем абамин использовали для исследования новых функций абсцизовой кислоты в образовании клубеньков на корнях бобовых (33).
В настоящем изобретении предлагается группа соединений, которые стимулируют прорастание и выведение тканей или органов растений из состояния покоя.
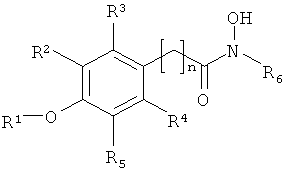
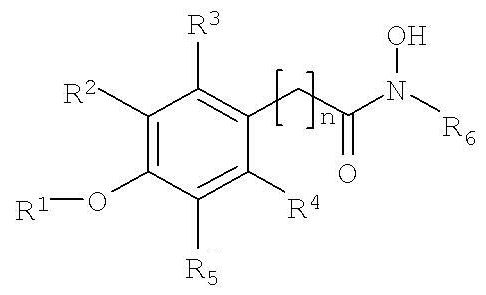
В настоящем изобретении предлагается способ стимуляции прорастания семян растений и/или выведения тканей растений из состояния покоя, который включает обработку семян, тканей, органов растений или растений соединением формулы I.
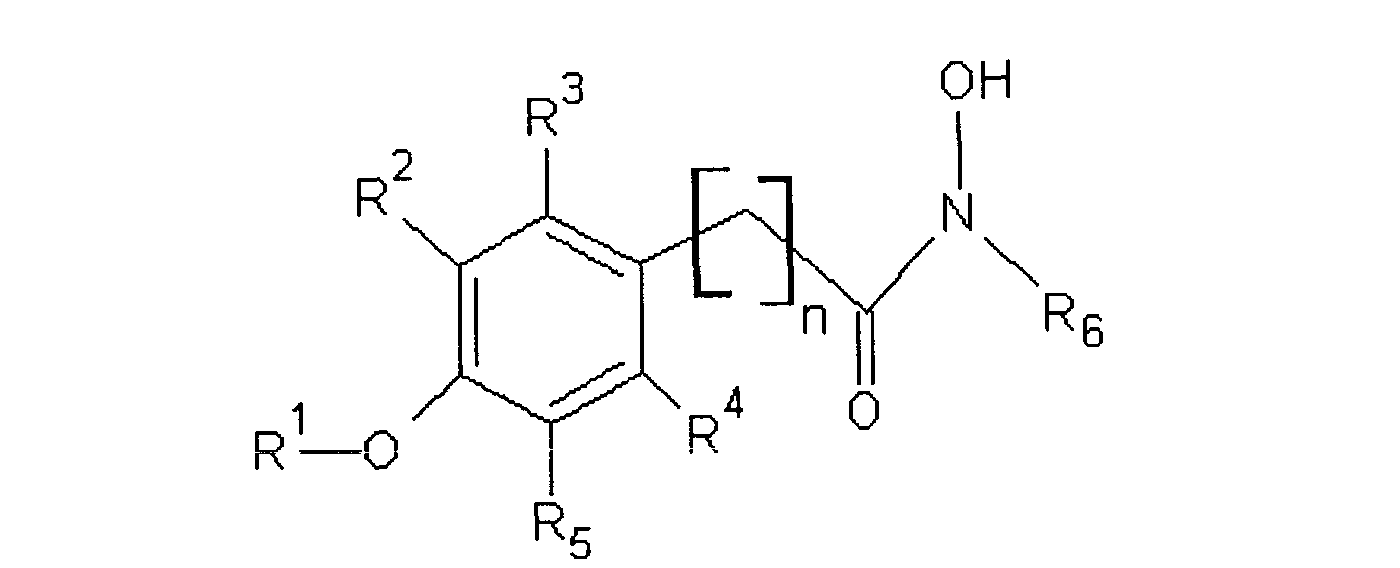
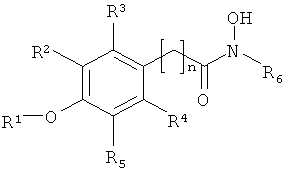
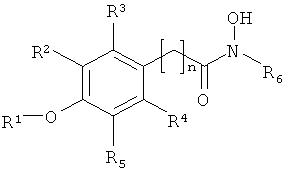
где:
R1 обозначает алкил или Н,
R2, R3, R4 и R5 независимо выбирают из H, галогена, -NO2, -SO2R', -OH, -O-алкил, где R' обозначает алкил или аминоалкил, и/или R1 и R5 вместе образуют
-O(CH2)m-группу (то есть группой, присоединенной к арилу, является
-O(CH2)mO-группа, где m равно 1, 2, 3 или 4, предпочтительно 1, присоединенную к арильной группе, где,
R6 обозначает гидрофобную группу, такую как, например, замещенный или незамещенный алкил, и/или замещенный или незамещенный арил, и n равен целому числу 1, 2, 3 или 4 и n, например, равен 1. Группа, связывающая арильную группу с карбонильной группой гидроксамовой кислоты, то есть группа -(CH2)n-, может также содержать заместители, например -OH, галоген или метил.
R1 предпочтительно обозначает C1-C4алкил, такой как метил, этил, пропил или бутил. R1 может обозначать H. R2, R3, R4 и R5 все могут обозначать H. В другом варианте, одна, две или три указанных боковых групп могут обозначать H, а остальные боковые группы обозначают другие боковые группы. Алкильный остаток в составе -O-алкильной группы предпочтительно обозначает C1-C4алкил, такой как метил, этил, пропил или бутил.
R5 обозначает O-метил. Остальные заместители, R2, R3 и R4, обозначают H, а R5 обозначает -O-метил.
R6 предпочтительно обозначает гидрофобную группу. R6 может обозначать C1-C12алкил, наиболее предпочтительно C5-C10алкил. R6 может обозначать любой из алкилов C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11 или C12алкил. R6 может также обозначать арильную группу или -(CH2)pарил, где p равен целому числу от 1 до 4, а арил является замещенным или незамещенным, и n предпочтительно равен 1.
R6 может обозначать замещенный алкил или замещенный арил. Указанные алкильные или арильные группы могут содержать один и более заместителей, например галоген, -OH, -NO2; или -SO2R'.
Указанное соединение предпочтительно включает группу R6 формулы II
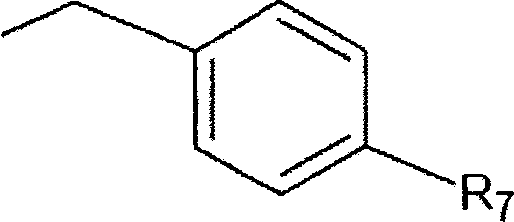
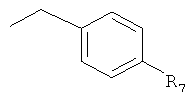
где R7 обозначает -H, -OH, -NO2, -SO2R' или галоген.
Используемый в данном контексте термин «галоген» включает фтор, хлор, бром или йод, наиболее предпочтительно фтор.
Установлено, что длина линкера, соединяющего гидроксамовую кислоту с гидрофобной группой, имеет важное значение и влияет на активность указанных соединений.
Указанные способы могут включать обработку указанным соединением одного или более семян до посева, причем в другом варианте семена можно обрабатывать in situ после посева в среде, такой как почва, компост или перегной.
Указанную композицию можно использовать для обработки семян сорняков для стимуляции прорастания, с тем чтобы затем их уничтожить при обработке гербицидами и очистить почву от сорняков перед посевом сельскохозяйственных культур. Сорняки также можно уничтожить при подготовке к посеву.
Другой растительный материал, такой как клубни, зерно или луковицы, также можно обработать для стимуляции роста до или после посадки.
Указанный способ может включать обработку тканей и органов растений, или растений для стимуляции плодоношения или цветения.
Применение указанных соединений характеризуется рядом преимуществ:
(1) Рост растений начинается раньше, так как ткани или органы растений выведены из состояния покоя раньше обычного, и при этом не оказывается влияния на синтез каротиноидов, как наблюдается в случае использования некоторых известных соединений.
(2) Можно стимулировать или равномерно контролировать развитие почек декоративных цветов и цветов плодовых деревьев.
(3) Можно стимулировать прорастание и рост семян, клубней, зерна, луковиц и других посадочных материалов. Такой подход можно использовать для выведения семян из периода первичного покоя и сокращения продолжительности периода вторичного покоя, который вызван неблагоприятными условиями, такими как повышенная температура или недостаточная влажность почвы.
(4) Равномерность прорастания увеличивает урожайность и однородность сельскохозяйственной культуры. Совершенствование системы полива наряду с увеличением урожайности повышает эффективность потребления воды за счет предотвращения потерь воды на полив оголенной почвы и подавления роста сорняков.
(5) Применение указанных соединений может влиять на селекцию растений.
Глубокий покой является недостатком при необходимости быстрой и однородной приживаемости и развития культуры. Однако продолжительный период покоя является положительным признаком для хранения заготовленного урожая, так как прорастание урожая влечет за собой мобилизацию резервов и метаболические изменения, что приводит к ухудшению качества и ценности продукции.
Селекционные работы часто направлены на сокращение естественного периода покоя (для ускорения смены циклов между поколениями), и впоследствии химические препараты используют для предотвращения прерывания периода покоя урожая при хранении. Например, длительное хранение клубней картофеля и лука требует более низкой температуры хранения и/или использования ингибиторов митотического роста с целью предотвращения прорастания. Семена зерновых в определенных условиях окружающей среды начинают прорастать в колосьях до сбора урожая (прорастание до сбора урожая), что приводит к снижению качества сельскохозяйственной культуры.
Указанные соединения можно применять для профилактики таких ситуаций, а длительный период покоя обеспечивает хранение в удовлетворительных условиях без использования химических препаратов, причем указанными соединениями необходимо обработать и растительные ткани в состоянии покоя (семена, клубнелуковицы, луковицы, почки) для того, чтобы повысить урожайность и рост растений. Указанный способ описан на примере семян томатов SP12 (модифицированные семена с повышенным содержанием АБК, см. ниже), характеризующихся продолжительным периодом покоя, который сокращали с использованием вышеуказанных соединений. Химическая обработка культуры на стадии развития, а не хранения, позволит снизить воздействие агрохимикатов на потребителя.
Растения генетически модифицируют (и получают стандартным методом селекции) с целью увеличения содержания АБК, что приводит к повышению эффективности потребления воды и/или повышению устойчивости к засухе (Thompson A.J. и др., Over-production of abscisic acid increases water-use efficiency and root hydraulic conductance and influences leaf expansion, Plant Physiology, T.143, cc.1905-1917,7, (2007)). Однако такие растения могут характеризоваться длительным периодом покоя. Использование указанных соединений позволит оптимизировать длительность периода покоя у растений, что повысит их ценность.
При селекции сельскохозяйственных культур с длительным периодом покоя указанные соединения могут ускорить селекционный процесс за счет их способности прерывать период покоя и таким образом сокращать время генерации (например, время от посева до посева) в процессе селекции.
В настоящем изобретении также предлагаются композиции для растений, включающие соединения формулы I, а также индивидуальные соединения формулы I, где указанное соединение обозначает соединение, представленное выше.
Указанные композиции и составы по настоящему изобретению дополнительно включают одно или более вспомогательных веществ. Вспомогательные вещества для использования в гербицидных композициях известны в данной области техники. Указанные вспомогательные вещества включают вспомогательные вещества и их смеси на масляной основе, кремнийорганические вспомогательные вещества и их смеси, неионогенные вспомогательные вещества и их смеси, вспомогательные вещества на полимерной основе и их смеси, вспомогательные вещества на основе жирных кислот и их смеси, а также их комбинации. Минеральное масло также можно использовать в качестве вспомогательных веществ. Указанные вспомогательные вещества добавляют в количестве 1 мас.%-95 мас.% в расчете на массу активного ингредиента.
Гербицидная композиция может включать или дополнительно включать твердый материал, такой как глина, кремнезем или другой инертный твердый носитель, общеизвестный в данной области техники.
Гербицидную композицию можно использовать в твердой или жидкой форме. Жидкая форма может включать, например, керосин, ксилен или спирт, такой как этанол, а также их смеси. Для усиления смачиваемости семян или растений указанные смеси можно использовать в смеси с ПАВ.
Указанная композиция может включать один или более инкапсулирующих агентов или пленкообразующих агентов. Такие агенты являются известными в данной области техники и их можно смешивать с указанным соединением формулы I или их можно использовать после обработки семян.
Семена можно обрабатывать указанным соединением при замачивании в барабанном смесителе при нанесении на семена покрытия известными методами.
Инкапсулирующие и пленкообразующие агенты включают гипс, диатомитовую землю и бертонитовый глинопорошок в смеси со связующими агентами. В качестве таких агентов известны полимеры и гели, такие как альгинаты и сополимеры поливинилпирролидона и винилацетата или нуклеиновой кислоты и алкилвинилового эфира.
Можно также проводить дражирование семян в матрицу наполнителя и связующего компонента. Известные дражирующие материалы включают суглинок, крахмал и сополимеры полиакрилата и полиакриламила. Можно также добавлять фунгициды, пестициды и/или наполнители.
В настоящем изобретении также предлагаются семена, ткани растений, органы растений и растения, обработанные композицией по настоящему изобретению.
Указанное растение может представлять собой однодольное или двудольное растение и предпочтительно выбрано из группы, включающей томаты, картофель, лук, пшеницу, ячмень, овес, сорго, кукурузу, рис, кочанную капусту семейства Brassicaceae, семена овощей и салатов, включающие пастернак, латук, шпинат, цикорий и лук-порей, а также любые виды деревьев и кустарников.
Гербицидный состав можно наносить непосредственно на растение или добавлять в почву.
Установлено, что композиции проявляют эффективность при концентрации, например, 1 мМ. Предпочтительно не следует использовать композиции при концентрации более 2 мМ, так как при этом может снизиться эффективность композиции.
Другим объектом настоящего изобретения является индивидуальное соединение формулы I, как представлено выше.
Настоящее изобретение описано в виде примеров со ссылкой на следующие фигуры.
Подписи на фигурах
Фигура 1
Реакции, катализируемые каротиндиоксигеназой: а, 11,12-окислительное расщепление 9'-цис-неоксантина ферментом NCED, б, реакции окислительного расщепления β-каротина и зеаксантина.
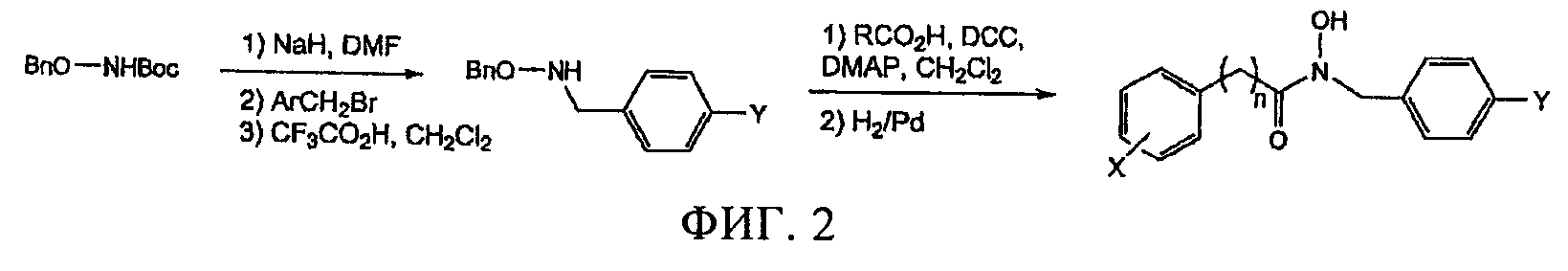
Фигура 2
Схема синтеза гидроксамовых кислот и ингибиторов.
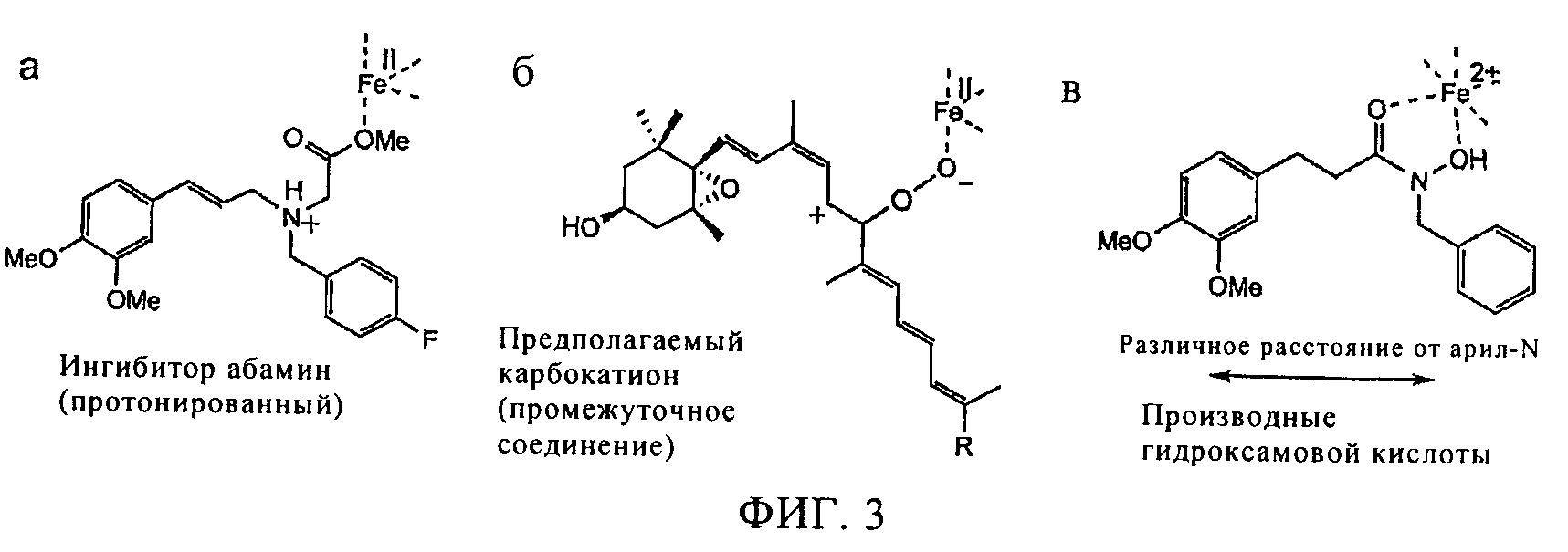
Фигура 3
Структура ингибиторов. Протонированный абамин (а), промежуточный карбокатион каротиноидов (б) и ингибитор гидроксамовой кислоты (в) присоединены к атому железа (II) в составе кофермента CCD.
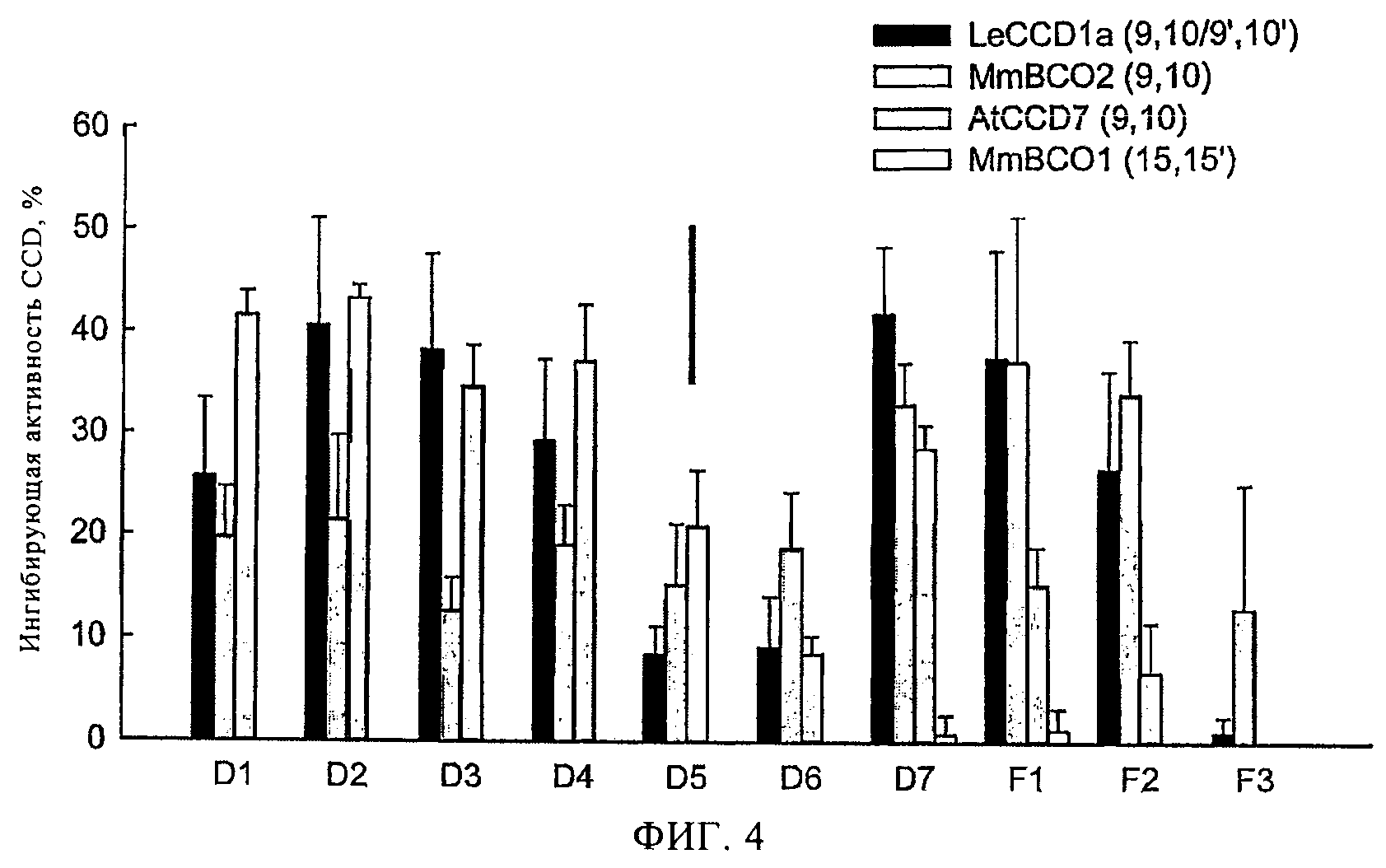
Фигура 4
Относительное ингибирование четырех CCD в Е.coli. Гены CCD экспрессировали в штаммы Е.coli., продуцирующие β-каротин. Указанные штаммы культивировали в присутствии или отсутствии ингибиторов (концентрация 100 мМ) в течение 16 ч. Указанная концентрация ингибитора находится в линейном диапазоне ответной реакции Е.coli. Относительное ингибирование CCD каждого типа определяли по увеличению накопления β-каротина в присутствии ингибитора, значение 0 обозначает уровень β-каротина в отсутствие ингибитора, а значение 100 обозначает максимальный уровень β-каротина, как в случае штаммов, не продуцирующих CCD (см. Экспериментальные методы, уравнение). Отрезки на диаграмме соответствуют стандартной средней ошибке, n=4. Сплошная черная линия в верхней части диаграммы обозначает наименьшее значимое различие (P<0,05) по результатам сравнения любых двух средних значений.
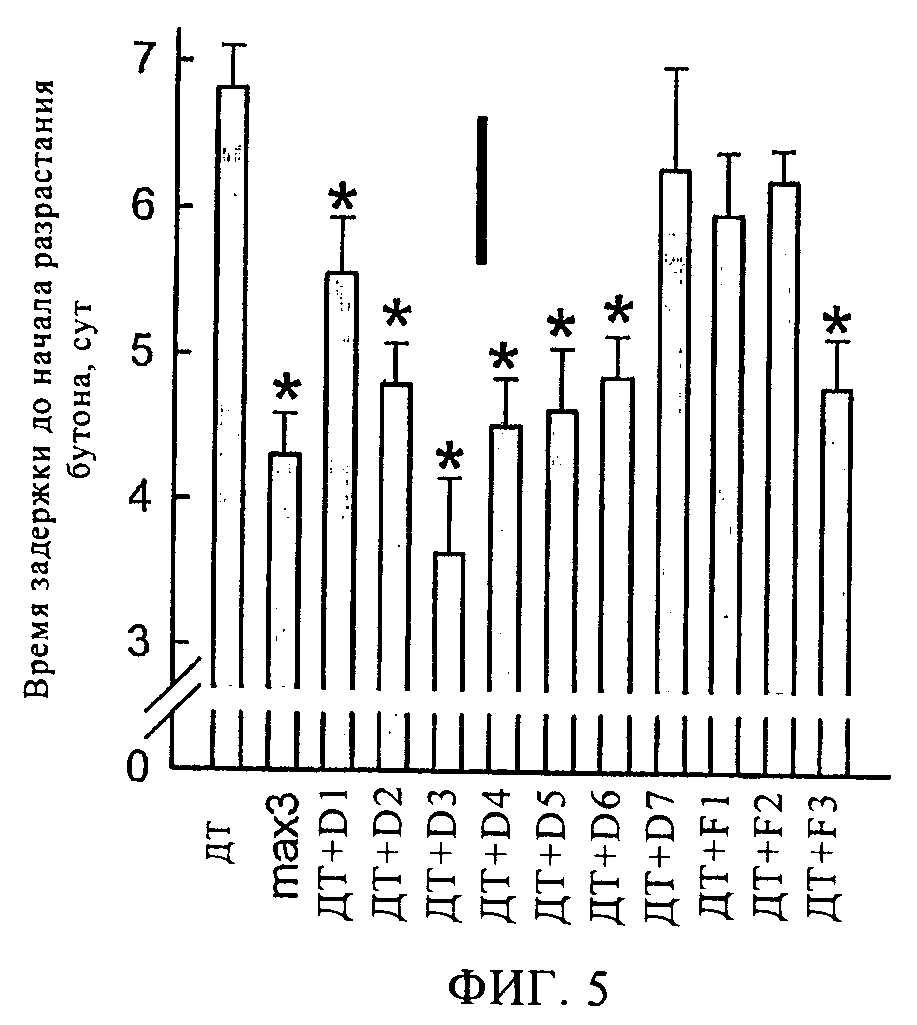
Фигура 5
Влияние ингибиторов на разрастание почек, вырезанных из узлов арабидопсиса в присутствии 1 мМ нафтилуксусной кислоты (НУК). На графике представлено время задержки до начала зарождения бутона для штамма Соl-0 (дикого типа, ДТ) в отсутствие или присутствии ингибитора при концентрации 100 мкМ. В качестве контроля использовали нулевой мутант AtCCD71 (max3) в отсутствие ингибитора. Средние значения получены по результатам пяти независимых экспериментов, n=35 (ДТ), n=18 (max3), n=14-16 (ДТ в присутствии ингибиторов). Сплошная черная линия в верхней части диаграммы обозначает наименьшее значимое различие при сравнении любых двух значений, и звездочками показаны значения, значительно отличающиеся от ДТ (P<0,05).
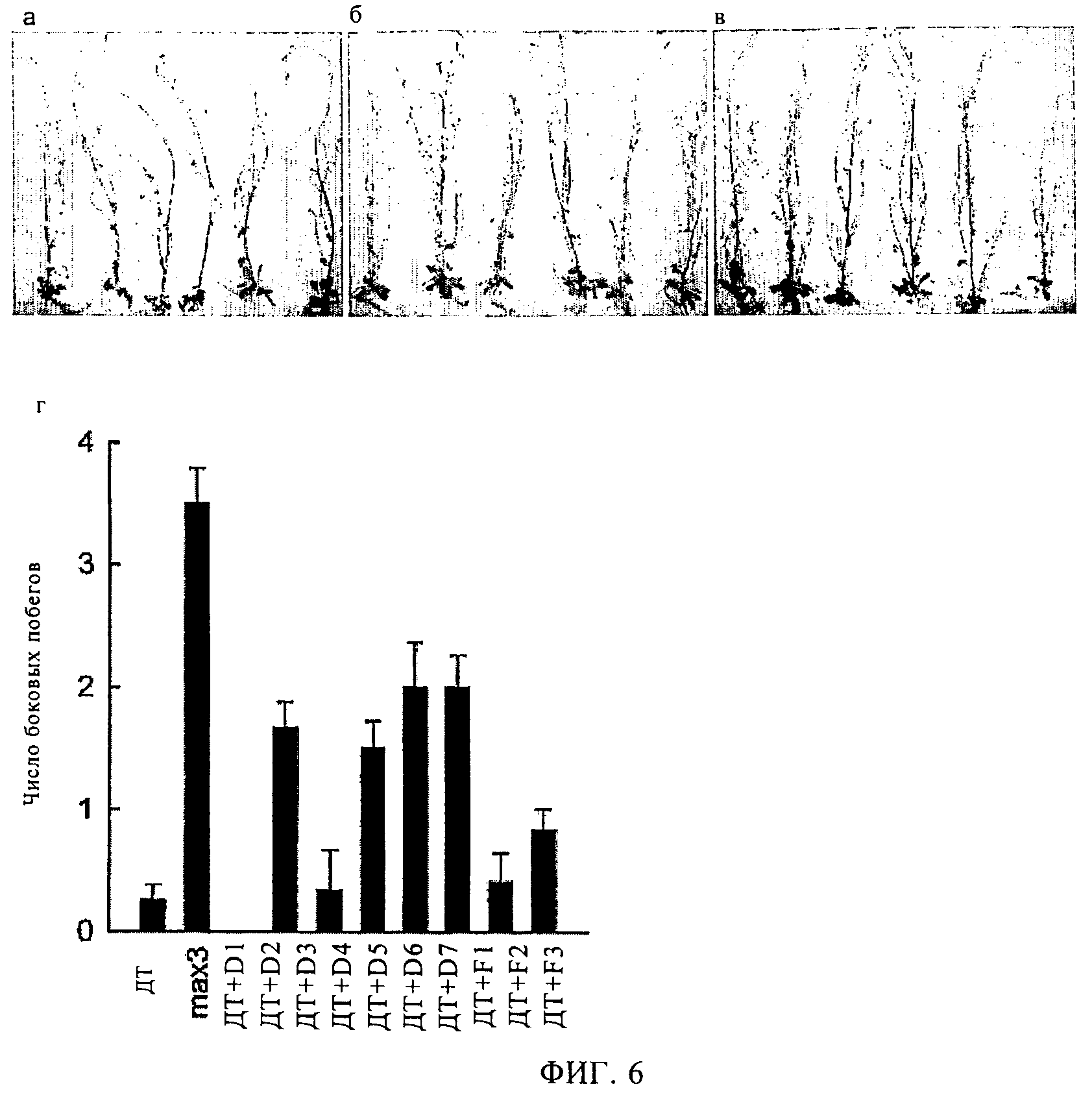
Фигура 6
Растения арабидопсис, с фенотипом обильного ветвления, выращивали в агаре в течение 45 сут с добавлением ингибитора D6. На фотографиях показаны:
(а) Соl-0 (ДТ) в отсутствие ингибитора, (б) мутант max3-9 в отсутствие ингибитора, (в) Соl-0 с добавлением D6 при концентрации 100 мкМ. Рассчитанное число (г) ветвей-розеток. Отрезки на диаграмме соответствуют стандартной средней ошибке, n=от 6 до 12.
Фигура 7
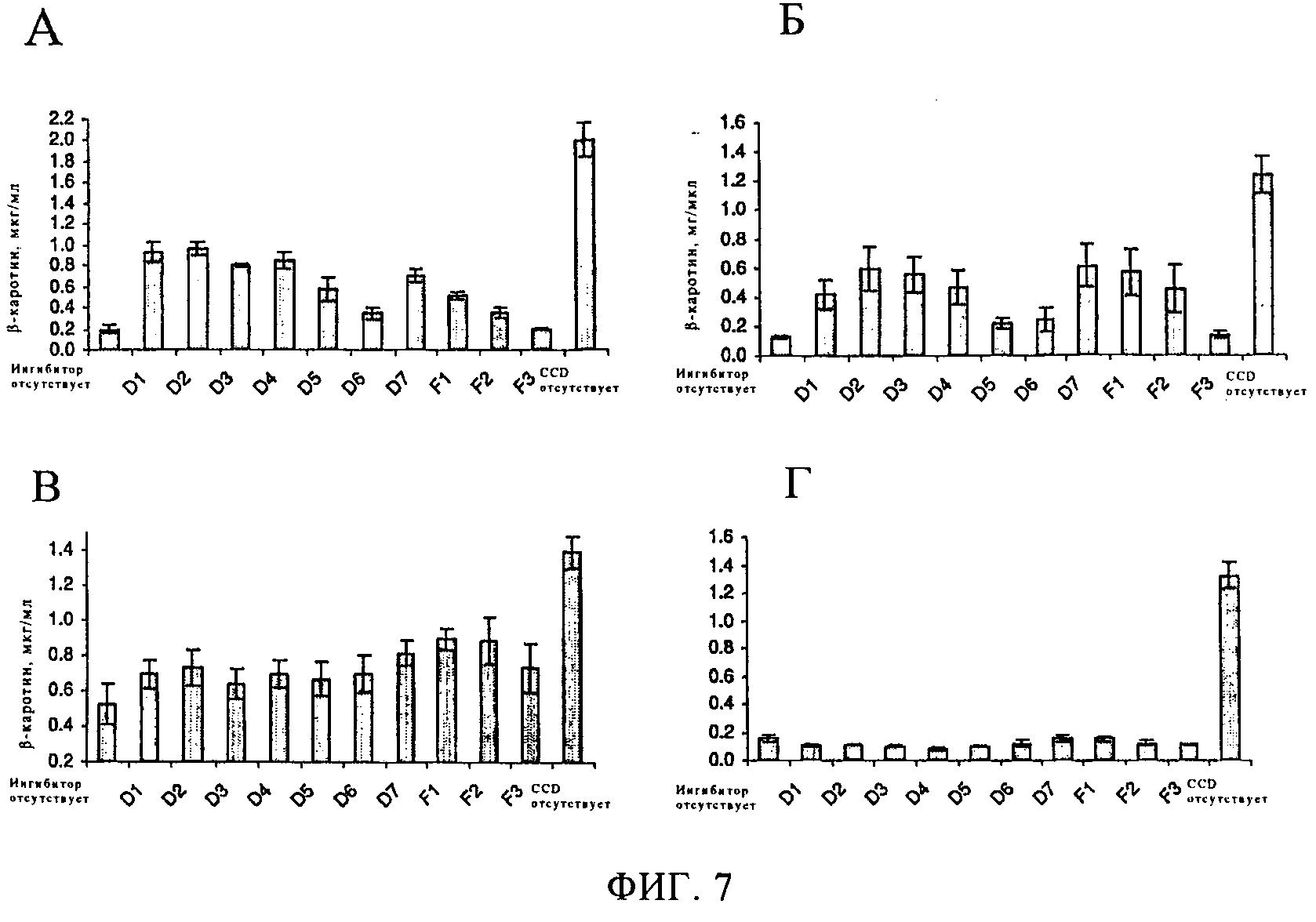
Количество β-каротина обозначает (в мкг/мл культуры) количество β-каротина в штаммах E.Coli, накапливающих β-каротин и экспрессирующих CCD, в присутствии ингибитора. Указанные штаммы культивировали в отсутствие или присутствии ингибиторов (100 мкМ) в течение 16 ч (см. раздел Методы). Отрезки на диаграмме соответствуют стандартной средней ошибке, n=4. (A) AtCCD7 (В) LeCCDl (С) MMBCO2 (D) MMBCO1.
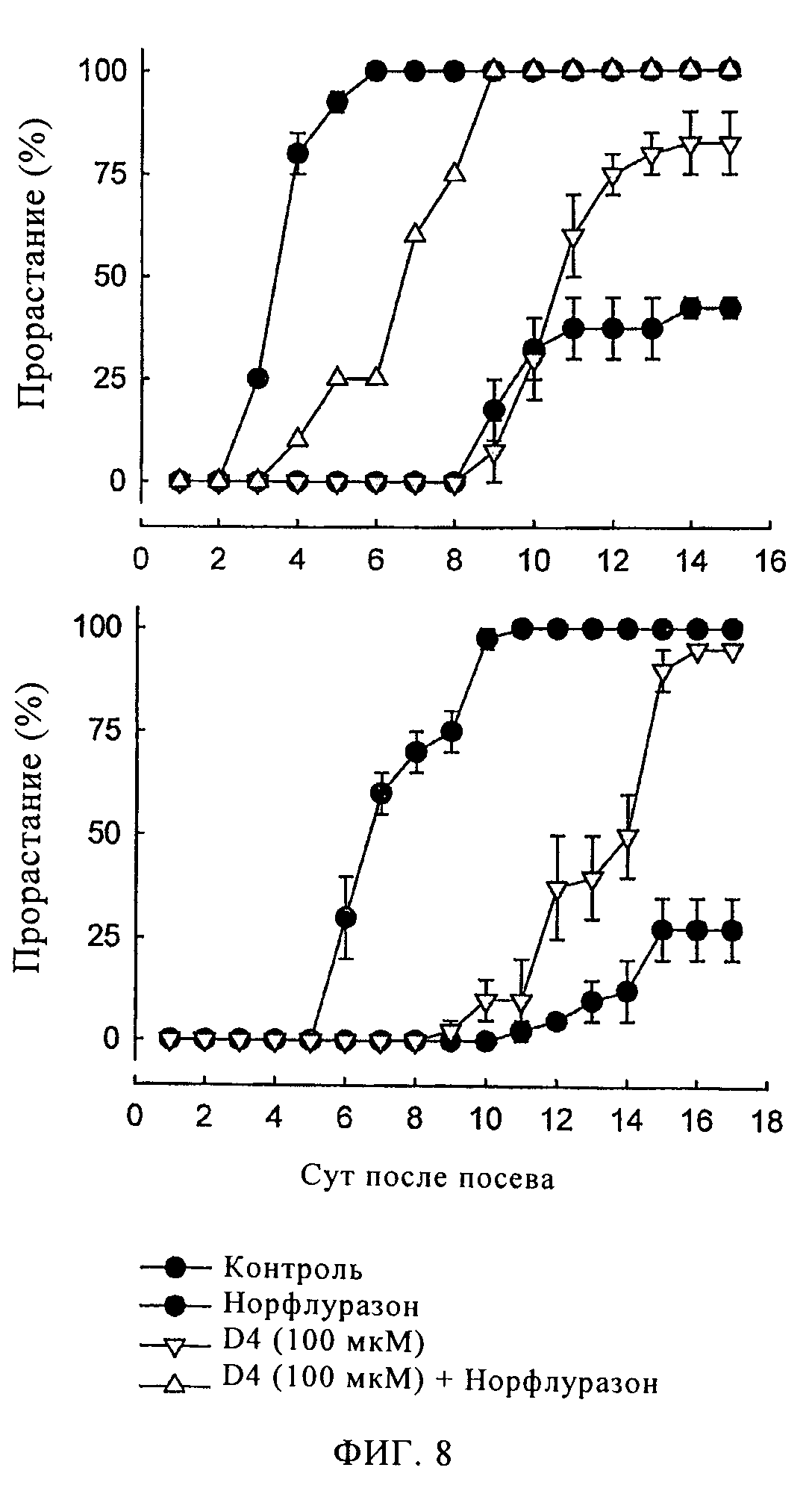
Фигура 8
Влияние соединения D4 при концентрации 100 мкМ на прорастание семян томатов, сверхэкспрессирующих NCED (линия SP12). Во время некоторых обработок добавляли норфлуразон при концентрации 3,3 мкМ. На верхнем и нижнем графике представлены два независимых эксперимента. Для каждого анализа в чашку Петри помещали по 20 семян. Отрезки на диаграмме обозначают диапазон различий между двумя чашками с одинаковыми образцами (два повтора). Раствор соединения D4 также включает 1% ДМСО, растворитель для исходного раствора D4. Контрольную обработку проводили 1% раствором ДМСО.
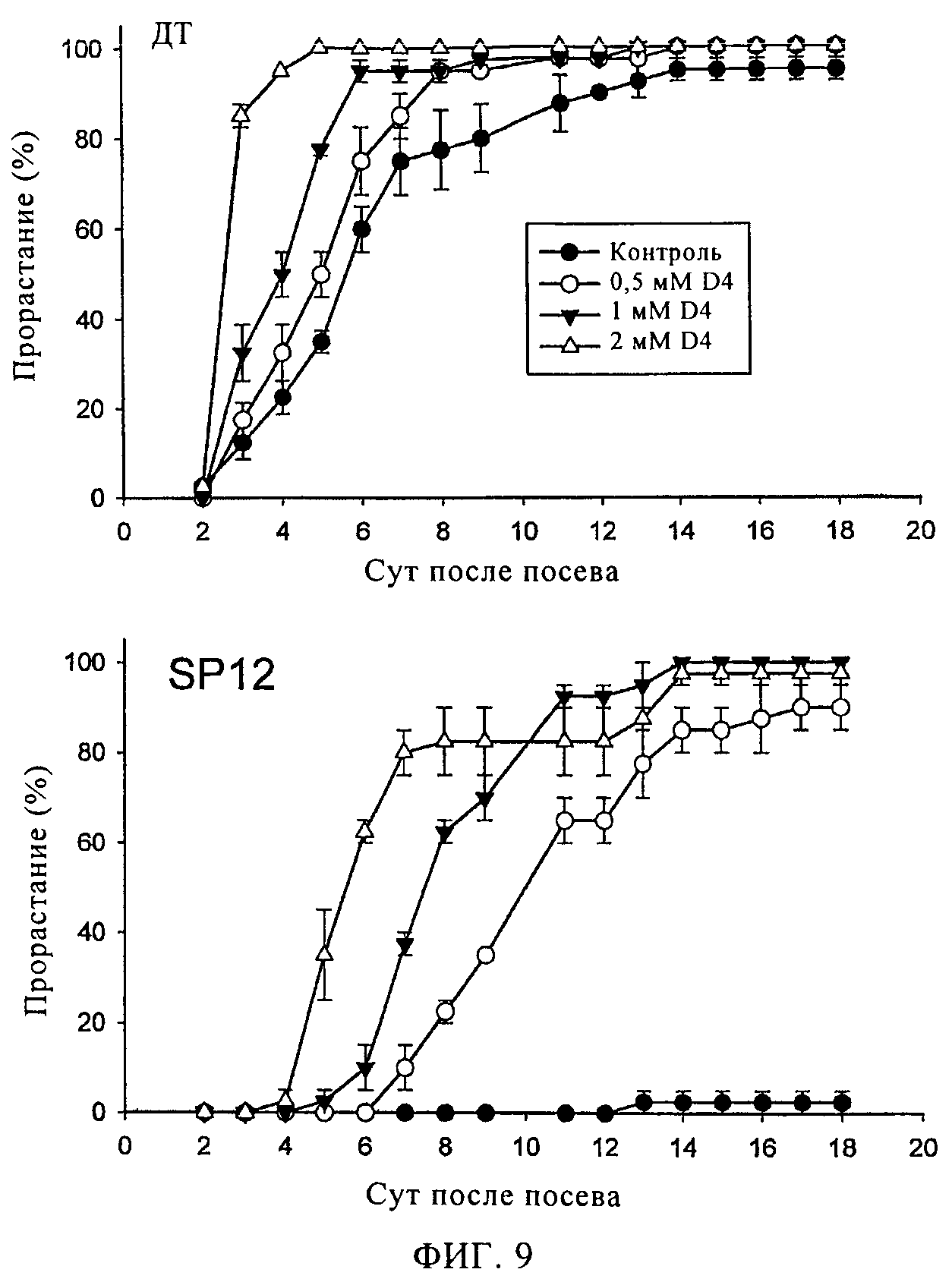
Фигура 9
Прорастание семян дикого типа (ДТ, Ailsa Craig Tm2a) или SP12 при различных концентрациях соединения D4. Для исследования прорастания в каждую чашку Петри помещали по 20 семян. Отрезки на диаграмме обозначают диапазон различий между двумя чашками с одинаковыми образцами. Все растворы D4 для обработки семян также содержали 1% раствор ДМСО. Контрольную обработку проводили 1% раствором ДМСО, не содержащем D4.
Экспериментальные методы
Синтез третичных аминов-ингибиторов
Абамин синтезировали согласно известным описанным методикам (31, 34).
Синтез ингибиторов на основе гидроксамовой кислоты.
Схема синтеза представлена на фиг.2, структура полученных продуктов представлена в таблице 1. В N-Вос,O-бензилгидроксиламин добавляли раствор гидрида натрия в ДМФА, затем в полученную смесь добавляли соответствующий бензил- или алкилбромид (35). Удаление защитной группы осуществляли при обработке 1% раствором трифторуксусной кислоты в дихлорметане, при этом получали N-замещенный гидроксиламин. Гидроксамовую кислоту получали в присутствии ДКК (1,1 экв.), 4-диметиламинопиридина (0,2 экв.) и раствора соответствующей карбоновой кислоты в дихлорметане. Неочищенный продукт, гидроксамовую кислоту, очищали хроматографией на колонке с силикагелем. Соединения B1, D12 и D13 получали после активации соответствующей кислоты смесью, содержащей метилхлорформиат и триэтиламин в ТГФ, и проводили реакцию с гидрохлоридом гидроксиламина. Промежуточный продукт для синтеза B1 синтезировали с использованием β-ионона (36), при этом B1 выделяли в виде смеси E/Z изомеров в соотношении 2:1. Спектроскопические данные и выход соединений D1-D13, F1-4, и B1 представлены в разделе Дополнительные материалы.
Определение ферментативной активности NCED в условиях in vitro Сверхэкспрессию LeNCED1 в Е.coli проводили в виде гибридного белка, содержащего N-концевой гистидиновый пептид His6 (дополнительные материалы). Бесклеточный экстракт, содержащий рекомбинантную LeNCED1, готовили в 100 мМ буферном растворе бис-трис (pH 6,7). Непосредственно перед использованием экстракт (объемом 15 мкл) предварительно активировали при добавлении сульфата железа (II) (20 мМ, 1 мкл) и аскорбиновой кислоты (20 мМ, 1 мкл) на ледяной бане в течение 2 мин. Затем аликвотную часть указанного фермента добавляли к анализируемому образцу (общий объем 150 мкл), содержащему 100 мМ буферный раствор бис-трис (pH 6,7), 0,05% об./об. тритон Х-100, 1,0 мг/мл каталазы и 3 мкг 9'-цис-неоксантина. Субстрат 9'-цис-неоксантин получали, как описано в разделе Дополнительные материалы. Реакционную смесь инкубировали в течение 15 мин в темноте при температуре 20°С, затем в реакционную смесь добавляли воду (700 мкл). Полученные продукты экстрагировали этилацетатом (3×1 мл). Органический растворитель удаляли при пониженном давлении, полученный остаток растворяли в метаноле (200 мкл), отбирали 100 мкл, которые анализировали обращено-фазовой ВЭЖХ на колонке с Phenomenex С18, градиент 5-10% метанол в смеси ацетонитрил/0,05% триэтиламин, скорость потока 0,5 мл/мин в течение 20 мин, детектирование проводили при длине волны 440 нм. Ингибирование фермента NCED определяли в присутствии 1-100 мкМ ингибитора, ингибирующую активность рассчитывали по образованию продукта через 15 мин, в качестве контроля использовали реакционную смесь в отсутствие ингибитора. Время удерживания: 9'-цис-неоксантин, 10,2 мин, C25 продукт, 6,5 мин.
Определение ферментативной активности LeCCD1a в условиях in vitro
Сверхэкспрессию LeCCD1a проводили в Е.coli в виде GST-гибридного белка (Дополнительные материалы). Метод определения активности LeCCD1a в условиях in vitro основан на известной методике (37). Общий объем реакционной смеси составлял 200 мкл в лунках 96-луночного микропланшета, сигнал регистрировали при длине волны 485 нм. Для получения раствора субстрата для каждой реакционной смеси, 5 мкл 4% раствора апо-8'-каротиналя (мас./об. в этаноле) (Sigma) добавляли в 25 мкл 4% раствора маc./об. в этаноле) β-октилглюкозида (Sigma), затем этанол упаривали в атмосфере азота и полученный остаток растворяли в 150 мкл фосфатного солевого буферного раствора (ФСБ), содержащего 10 мМ аскорбат натрия при температуре 20°С в течение 30 мин. Затем в полученный раствор добавляли 50 мкл бесклеточного экстракта, содержащего рекомбинантную LeCCD1a, и проводили реакцию при температуре 20°С в течение 30 мин.
Определение ферментативной активности в E.coli в условиях in vivo
Исследуемые гены (Дополнительные материалы, таблица S1) клонировали в векторе рЕТ30с (Novagen), встроенном непосредственно в исходный кодон ATG без маркерной последовательности, или в векторе pGEX-4T, содержащем маркерный N-концевой фрагмент GST. Все гены использовали в виде полноразмерной последовательности, за исключением AtCCD7, у которого удалена сигнальная последовательность хлоропластов (Дополнительные материалы). Было установлено, что указанный ген после встраивания в GST в векторе pGEX-4t (GE Healthcare) проявляет большую активность по сравнению с CCD, экспрессируемой в рЕТ векторе, не содержащем маркерную последовательность. Таким образом, в дальнейших исследованиях использовали указанную конструкцию. Плазмиды трансформировали в Е.Coli, штамм BL21(DE3), содержащий рАС-ВЕТА (38), таким образом клетки продуцировали β-каротин.
Для определения ингибирующей активности готовили среду LB объемом 2,5 мл, содержащую соответствующие антибиотики (25 мкг/мл хлорамфеникола и 50 мкг/мл канамицина или 100 мкг/мл ампицилина) и 2,5 мМ ИПТГ. Ингибиторы (0,1 М в 100% этаноле) добавляли в среду до конечной концентрации 100 мкМ. В питательную среду высевали 0,25 мл суточной культуры (культивировали при температуре 37°C с добавлением соответствующих антибиотиков) и инкубировали при встряхивании (200 об/мин) при 28°С в течение 16 ч. Затем отбирали 1 мл культуральной среды, центрифугировали на микроцентрифуге и осадок ресуспендировали в 1 мл этанола, содержащем 0,2% Тритон Х-100. Полученный раствор интенсивно встряхивали на мешалке Вортекс и полученный экстракт инкубировали при комнатной температуре в течение 3 ч в темноте, затем снова интенсивно встряхивали на мешалке Вортекс и центрифугировали на микроцентрифуге в течение 5 мин при 13000 об/мин. Супернатант отбирали и измеряли оптическую плотность при 453-550 нм. Количество β-каротина рассчитывали по калибровочной кривой, построенной с использованием серийных разведений стандартного раствора β-каротина (Sigma) в этаноле, содержащем 0,2% тритон Х-100, абсолютные значения β-каротина представлены на фиг.8. Относительное ингибирование рассчитывали по уравнению: (Ci-Cc)/(C1-Cc)×100, где Ci обозначает концентрацию каротиноида в присутствии ингибитора и CCD, Cc обозначает концентрацию каротиноида в присутствии CCD и отсутствии ингибитора, a C1 обозначает концентрацию каротиноида в штамме, в котором ген lacZ экспрессируется вместо CCD в отсутствие ингибитора. Таким образом, увеличение содержания β-каротина благодаря ингибированию CCD (Ci-Cc) рассчитывают относительно максимально возможного содержания β-каротина в отсутствие CCD (Ci-Cc).
Оценка разрастания пазушных почек в стеблях арабидопсиса
Анализ проводили в основном по описанной методике (40) с некоторыми модификациями. В чашки Петри малого размера (диаметр 50 мм, глубина 20 мм) помещали по 10 мл раствора ATS (39), содержащего 1% агар и 1% сахарозу. Предварительно в агар добавляли ингибиторы и β-нафталинуксусную кислоту (НУК) до конечных концентраций 100 мкМ и 1 мкМ, соответственно. Затем вырезали полоску агара из центральной части, содержащей как апикальную, так и базальную среды, содержащие НУК и ингибитор. Любые узлы, в которых апикальные участки выступали из среды или длина которых менее 2 мм, в эксперименте не учитывались. Длину побега измеряли каждые 24 ч, логистическую функцию строили для каждого анализа с использованием программного обеспечения Genstat (10-ая версия, международный серийный номер тома), аппроксимирующую кривую и продолжительность лаг-фазы рассчитывали при экстраполяции линейной части кривой и начального плато (см. Дополнительные материалы). Значение x, в котором пересекаются две линии, означало продолжительность лаг-фазы.
Статистический анализ. Результаты анализа, представленные на фиг.4 и 5, оценивали по ограниченному критерию максимального правдоподобия (ОКМП) с использованием программного обеспечения Genstat10, в обоих случаях F-критерий указывал на суммарный эффект обработки (P<0,001). Максимальное значение критерия наименьшей достоверной разницы рассчитывали при умножении максимальной среднеквадратичной ошибки событий на t-значение (P=0,05), как представлено на графиках. Прирост значения критерия наименьшей достоверной разницы (степень свободы) составлял 105 и 157% на фиг.4 и 5, соответственно. Использовали максимальное значение критерия наименьшей достоверной разности, так как индивидуальные критерии наименьшей достоверной разницы различались, однако если в данном случае различия между средними значениями были значительными, то они также отличались от индивидуальных значений для любого из двух выбранных средних значений в выборке.
Посадочный материал
Использовали семена томатов "дикого типа" (Solanum lycopersicum cv. Ailsa craig почти изогенной линии, содержащей ген Tm2a устойчивости к вирусу табачной мозаики). Кроме того, использовали трансгенные семена томатов (Solanum lycopersicum cv. Ailsa craig), трансформированные конструктом для сверхэкспрессии гена LeNCEDl, кодирующим 9-цис-эпоксикаротиндиоксигеназу. Такие трансгенные семена называются D9 (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid. Plant Journal, т.23(3), cc.363-74.5 (2000)), однако впоследствии были переименованы в SP12 (Thompson, A.J. и др., Regulation and manipulation of ABA biosynthesis in roots, Plant Cell and Environment, т.30, cc.67-78.6 (2007)), и, как было установлено, характеризовались замедленным, с низкой всхожестью, прорастанием по причине сверхэкспрессии абсцизовой кислоты, связанной со сверхэкспрессией LeNCEDl (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid. Plant Journal, т.23(3), cc. 363-74.5 (2000)).
Анализ на прорастание
Каждый анализ проводили в чашке Петри с диаметром 10 см, с отверстиями, в которую помещали диск фильтровальной бумаги диаметром 8,5 см (Whatman 1), фирма Whatman International Ltd, Maidstone, Великобритания), предварительно пропитанный 1 мл исследуемого раствора. Семена стерилизовали вымачиванием в 30% растворе хозяйственного отбеливателя в течение 30 мин, промывали дистиллированной водой, и затем семена по 20 штук помещали на диск фильтровальной бумаги в каждую чашку Петри. Чашки Петри инкубировали в условиях высокой относительной влажности (>95%) при температуре 25°C в темноте. Ежедневно проверяли прорастание семян, которое определяли визуально при появлении первичного корешка. Для каждой химической обработки использовали идентичные чашки.
Гидроксамовую кислоту растворяли в ДМСО, а водные растворы получали при конечной концентрации ДМСО 1% об./об. Контрольные растворы представляли собой 1% об./об. раствор ДМСО в воде. Готовили также исходный раствор норфлуразона в этаноле при концентрации 20 мг/мл и затем разбавляли водой до конечной концентрации 5 мг/л, содержание этанола в растворе составляло 0,025% об./об.
Дополнительные методы
Конструирование штамма
Плазмиды получали, используя набор (mini spin) для выделения плазмид фирмы Qiaprep, Продукты ПЦР и фрагменты вектора очищали на колонках QiaQuick (фирма Qiagen) по инструкциям фирмы-производителя. ПЦР проводили, используя ПЦР-систему HiFi Expand (фирма Roche) и ДНК полимеразу по инструкциям фирмы-производителя. Лигирование проводили с участием фермента ДНК лигазы фага Т4 (фирма Invitrogen) в течение 1 ч при температуре 25°С. Плазмидные конструкты трансформировали в клетки Е.coli штамма DH10B (фирма Stratagene) и секвинировали для того, чтобы исключить ошибки метода ПЦР.
Ген LeCCDla (AY576001) амплифицировали из cLET29I6 (предоставлен Институтом Геномных Исследований (TIGR), классификация гена томата TIGR) с использованием праймеров LeCCD1a-FC1:-TACGAATTCCATATGGGGAGAAAAGAAGATG и LeCCD1a-RC1:-TAGTCTCGAGTCACAGTTTGGCTTGTTC. Полученный продукт расщепляли рестриктазами NdeI и Xhol и лигировали с вектором рЕТ30с (фирма Novagen, VWR International, Ltd), расщепленным аналогичным методом. Кроме того, полученный продукт расщепляли рестриктазами EcoRl и Xhol и лигировали с вектором pGEX-4T (фирма GE Healthcare), расщепленным аналогичным методом.
Ген AtCCD7 амплифицировали из ПЦР2.1-AtCCD7, любезно предоставленной Ottoline Leyser (Университет г.Йорка), с использованием праймеров AtCCD7-FC3 TATGCTCGAGGAGATCTGGATTAATGGCCGCAATATCAATATC и AtCCD7-RC1 TAGTCTCGAGTCAGTCGCTAGCCCATAAAC. Полученный продукт ПЦР расщепляли рестриктазами Bg1II и Xho1 и трансформировали в BamHI/Sa1I-фрагмент pGEX-4T.
The MMBCO1 (AF294899) амплифицировали из клона IMGCLO2192191, предоставленного Geneservice Ltd. (Кембридж, Великобритания) с использованием праймеров MMBCO1-FC1 TACTGAATTCCATATGGAGATAATATTTGGC и MMBCO1-RC1 TACTCTCGAGTGAGTGTTAGGATTAAAG. Полученный продукт ПЦР расщепляли рестриктазами NdeI/XhoI и клонировали в расщепленный аналогичным образом вектор рЕТ30с.
Ген ММВСO2 (AJ290392) амплифицировали из клона IMGCLO2536812 (фирма Geneservice Ltd.) с использованием праймеров MMBCO2-FC1 TATCGGATCCCATATGTTGGGACCGAAGCAGAG и MMBCO2-RC1 TATCCTCGAG TCAGATAGGCACAAAGGT. Полученный продукт расщепляли рестриктазами NdeI/XhoI и клонировали в расщепленный аналогичным образом вектор рЕТ30с.
кДНК LeNCED1 (Z97215) была предоставлена Ian Taylor (Университет Ноттингема) и клонирована в участки NdeI и Bpu1102 вектора pET14b (фирма Novagen, VWR International, Ltd) для получения гибридного белка, содержащего N-концевой His6. Полученную плазмиду экпрессировали в клетки Е.coli Rosetta.
(DE3) (фирма Novagen, VWR International, Ltd).
Подробная информация о штаммах, использованных для оценки ингибирующей активности в E.coli также представлена в Дополнительных материалах в таблице S1, ниже.
Получение бесклеточных экстрактов
Для получения бесклеточных экстрактов LeCCD1a и LeNCED1 культуры выращивали до оптической плотности 0,6 при 37°С, затем добавляли 0,2 мМ изопропил-β-D-1-тиогалактопиранозид (ИПТГ) и культуральную среду выращивали в течение ночи при 20°С. Клетки (200 мл культуральной среды) собирали центрифугированием (5000 об/мин, 10 мин) и полученный осадок ресуспендировали в 4 мл ФСБ, 0,1% Тритон X 100. В полученный раствор добавляли лизоцим до конечной концентрации 25 мкг/мл, и раствор инкубировали при комнатной температуре в течение 15 мин на ледяной бане, а затем обрабатывали ультразвуком (3×30 с при 18 Ω). Затем полученный лизат центрифугировали (13000 об./мин, 15 мин, температура 4°С) и супернатант использовали для проведения анализа.
Расчет величины лаг-фазы для оценки эффективности роста побегов
Логистическую кривую, y=A+C/(1+e-B(t-m)), строили по данным для каждого побега с использованием программного обеспечения GenStat (10-ая версия). Затем рассчитывали лаг-фазу по формуле m-(2/B) и определяли значение t (время) по отрезку, отсекаемому экстраполированными линиями линейного участка кривой и начального плато.
Получение 9'-цис-неоксантина
Свежий шпинат (20 г) промывали и измельчали с помощью пестика и ступки с добавлением бутилгидрокситолуола (0,03 г) и бикарбоната натрия (0,3 г) в ледяном метаноле (30 мл) в течение 3 мин в темноте, затем полученную смесь фильтровали в вакууме. Процедуру повторяли 6 раз до получения практически бесцветного фильтрата. Экстракты объединяли и распределяли между ледяным диэтиловым эфиром и насыщенным раствором хлорида натрия. Полученный эфирный экстракт отделяли, водную фракцию повторно экстрагировали 2 раза ледяным диэтиловым эфиром. Полученные эфирные экстракты объединяли, растворитель упаривали на роторном испарителе при температуре не выше 32°C. Полученный остаток гидролизовали в присутствии 6% гидроксида калия в 9 мл метанола и 1 мл диэтилового эфира в темноте при температуре 4°C в течение 16 ч. Затем в полученную смесь добавляли насыщенный водный раствор хлорида натрия (объем 50 мл), полученную смесь трижды экстрагировали диэтиловым эфиром (100 мл×3), сушили над сульфатом натрия, и растворитель упаривали, как указано выше. 9'-Цис-неоксантин очищали хроматографией на колонке с дезактивированным оксидом алюминия (к 10 г оксида алюминия добавляли 1 мл дистиллированной воды и 10 мл петролейного эфира и выдерживали в течение 5 мин). Полученный твердый экстракт шпината растворяли в смеси диэтиловый эфир/петролейный эфир (1:5), наносили на колонку, которую промывали смесью диэтиловый эфир/петролейный эфир (1:1, 50 мл), диэтиловым эфиром (50 мл), 9'-цис-неоксантин элюировали 5% раствором этанола в диэтиловом эфире (50 мл). Выделенную фракцию 9'-цис-неоксантина сушили в атмосфере азота и хранили во флаконах, обернутых в фольгу, в атмосфере азота при температуре -20°С. Данные ТСХ: Rf 0,09 (силикагель, Et2O), 1макс. - 415, 439, 467 нм, МС: m/z (FAB+) найд. для C40H56O4 600,33, рассч. 600,87.
Результаты
Конструирование и синтез ингибитора NCED является диоксигеназой (3), а механизм ее действия включает образование промежуточного карбокатиона, с последующим образованием диоксетанового цикла или перегруппировкой Криге перед расщеплением (41), такой механизм был подтвержден результатами включения метки 18О в фермент AtCCDl (37) и практически аналогичные результаты были получены компьютерным моделированием кристаллической структуры АСО (42).
Было установлено, что третичный амин, абамин (см. фиг.3а, структура соединения) является обратимым ингибитором (Ki=39 мкМ) рекомбинантной NCED, ингибирующим продуцирование абсцизовой кислоты, которое происходит в растениях в концентрациях 50-100 мкМ (31). Было установлено, что абамин SG, содержащий в своей структуре дополнительный линкер из трех атомов углерода между метиловым эфиром и атомом азота, проявлял повышенную активность (Ki=18,5 мкМ) (32). Точный механизм действия абамина не установлен, однако можно предположить, что протонированный амин является миметиком промежуточного продукта карбокатиона в каталитическом процессе, в ходе которого образуется оксигенированный ароматический цикл, присоединенный вместо гидроксициклогексильного концевого фрагмента каротиноидного субстрата (41), как показано на фиг.3. Ингибирование может происходить в результате хелатирования необходимого кофактора иона металла метиловым эфиром абамина. Однако производное абамина, содержащее вместо метилового эфира кислотную группу (COOH), не проявляло активность (32), с теоретической точки зрения это соединение должно проявлять большую активность при связывании такого кофактора, как железо.
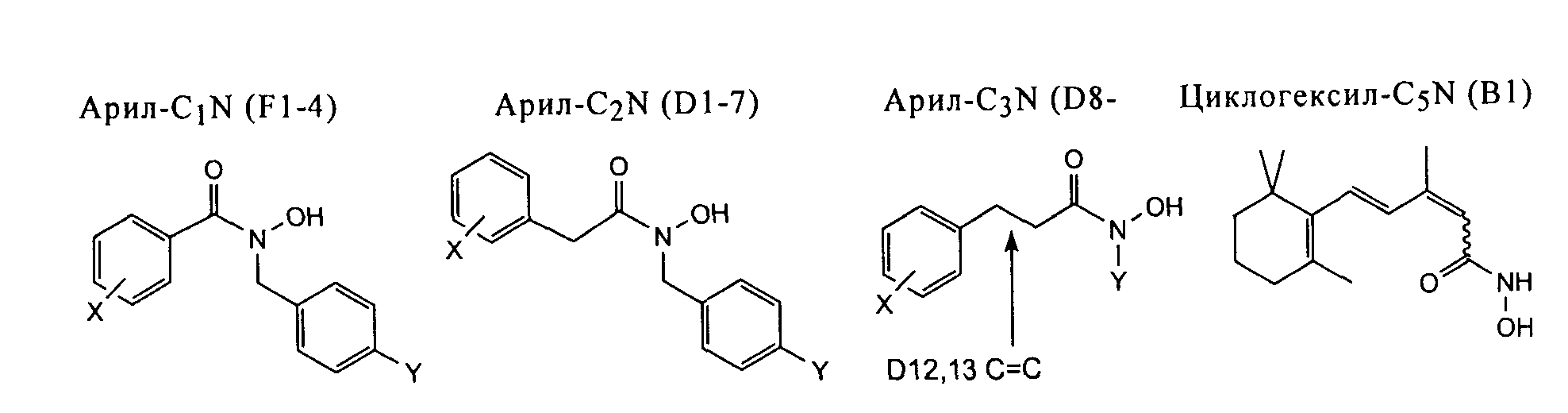
Известно, что гидроксамовые кислоты по механизму действия представляют собой ингибиторы металлоферментов различных семейств металлпротеиназ, например матриксных металлопротеиназ, и хелатируют необходимый кофактор иона металла (43). Были синтезированы аналоги гидроксамовой кислоты, в которых гидроксициклогексильная концевая группа каротиноидного субстрата заменена на миметик, который представляет собой указанный выше оксигенированный ароматический цикл, а функциональная группа гидроксамовой кислоты расположена на различном расстоянии от ароматического цикла. Таким образом, были синтезированы серии аналогов арил-C3N (D8-D13), аналогов арил-C2N (D1-D7) и аналогов арил-C1N (F1-F4), (табл.1). Было установлено, что 4-фторбензильный заместитель повышает активность серии производных абамина (31), такие производные были включены в состав серии производных гидроксамовых кислот. Способ синтеза, представленный на фиг.2, включает конденсацию соответствующей кислоты с замещенным О-бензилгидроксиламином, и последующее удаление защитной группы. Из β-ионона также синтезировали гидроксамовую кислоту, содержащую более длинный C5 линкер от циклогексильного остатка (В1). Для определения ингибирующей активности использовали серию из 18 гидроксамовых кислот, нумерация соединений указана в таблице 1.
Исследование ингибирующей активности в отношении рекомбинантных ферментов LeCCD1 и LeNCED1 в условиях in vitro. Ферментативный анализ проводили с использованием клеточных экстрактов E.coli., содержащих рекомбинантную CCD, при концентрации ингибитора 100 мкМ, степень ингибирования LeCCD1 указанными соединениями составила ≥90%, определяли также значения IC50, NT обозначает, что активность не определяли. Химические структуры ингибиторов, а именно производных гидроксамовой кислоты, представлены ниже, заместители Х и Y представлены в таблице. Структура абамина представлена на фиг.3.
|
Специфичность ингибирования in vitro генов LeNCED1 и LeCCD1a томатов
Для исследования ингибирующей активности ферментов, расщепляющих каротиноиды в положении 9, 10, использовали рекомбинантный фермент томатов LeCCD1a (44), так как указанный тип ферментов можно исследовать колориметрическим методом анализа in vitro с использованием в качестве субстрата β-апо-8'-каротиналя (37). Для исследования специфичности ингибиторов использовали рекомбинатный фермент томатов LeNCED1, который расщепляет 9-цис-каротиноиды в положении 11, 12 (45). Для указанного фермента, реакцию расщепления регистрировали методом обращенно-фазовой ЖХВР на колонке С18, в качестве субстрата использовали 9'-цис-неоксантин. Как указано в работе (46), было установлено, что ферменты характеризуются низкой стабильностью (период распада <24 ч) при хранении и очистке, таким образом, ферментативный анализ проводили с использованием рекомбинантного бесклеточного экстракта (в экстракте Е.coli, не содержащем рекомбинантный CCD ген, отсутствует ферментативная активность в отношении каротиноидов).
Некоторые производные гидроксамовой кислоты (а именно D8, D7 и D4) проявляют ингибирующую активность в отношении LeNCED1, в 1,5-2 раза превышающую ингибирующую активность по сравнению с ингибирующей активностью ингибитора NCED абамина (31), которая по данным авторов изобретения составила только 20% при концентрации ингибитора 100 мкМ (см. табл.1). В отношении LeCCD1, высокую ингибирующую активность проявляли все арил-C2N-гидроксамовые кислоты и некоторые другие производные гидроксамовых кислот. 4-Метоксиарилгидроксамовые кислоты проявляют высокую ингибирующую активность в каждой серии, однако наибольшую ингибирующую активность проявляли 4-гидроксиарилгидроксамовые кислоты D1, D2 и D3, значение IC50 которых составило 0,8-0,9 мкМ. Абамин характеризовался только 50% ингибирующей активностью в отношении LeCCD1 при концентрации абамина 100 мкМ.
При сравнении ингибирующей активности в отношении LeNCED1 и LeCCD1a было установлено, что все активные соединения проявляют специфичность в отношении LeCCD1, причем наибольшей специфичностью характеризуются соединения D3, F1 и F2, которые проявляют высокую эффективность ингибирующую активность в отношении LeCCD1 и низкую или практически с нулевую активность в отношении LeNCED1 (табл.1).
Определение ингибирующей активности в условиях in vivo в отношении штаммов E.coli, экспрессирующих CCD
Можно конструировать окрашенные штаммы E.coli, продуцирующие различные каротиноиды, которые экспрессируют ферменты для синтеза каротиноидов (26). В результате совместной экспрессии соответствующей CCD, бактерия обесцвечивается в результате расщепления каротиноидов с образованием неокрашенных продуктов (4, 6, 27). Данный метод был использован в настоящем эксперименте для дополнительного исследования специфичности ингибиторов и определения их активности в условиях in vivo. Содержание каротиноидов в каждом штамме, экспрессирующем CCD, сравнивали с содержанием каротиноидов в контрольном штамме, продуцирующем β-каротин, но в котором отсутствует ген CCD. Различие в содержании каротиноидов характеризует величину активности CCD, и ингибирование данной активности измеряли после добавления ингибиторов в питательную среду.
Ингибирующую активность ингибиторов определяли в отношении четырех штаммов E.coli, продуцирующих β-каротин (Дополнительные материалы, табл. S1). Три из указанных штаммов экспрессировали CCD различного типа, которые расщепляет каротиноиды в положении 9,10: AtCCD7 из семейства Arabidopsis (21) и MMBCO2 мыши (6), которые расщепляют только в одном положении (9,10 или 9', 10', но не в обоих положениях), и фермент томатов LeCCD1a (44), который расщепляет по обоим сайтам в одной молекуле субстрата (в положении 9, 10/9', 10'). Четвертый штамм экспрессирует другой тип CCD мыши, MMBCO1 (47), которая расщепляет в центральном положении 15,15'. Авторами настоящего изобретения, а также группой ученых (48) было установлено, что экспрессия различных CCD (и, вероятно, других белков) приводит к потере каротиноидов в результате неспецифических взаимодействий. Однако детектирование продуктов расщепления в клетках E.coli и питательной среды методом ЖХВР показало, что во всех четырех штаммах, которые использовали в работе, расщепление ферментом CCD связано с потерей каротиноидов. Активность в отношении NCED в клетках E.coli не исследовали, так как на настоящий момент не идентифицирован фермент, требуемый для продуцирования 9-цис-каротина, который является субстратом NCED. Были синтезированы гены CsZCD (9) и BoLCD (49), экспрессируемые в E.coli, и они были использованы для изучения эффективности расщепления в положении 5, 6 и 7, 8 как в условиях in vitro, так и в клетках E.coli. Однако активность расщепления не определяли, а поэтому не определяли активность ингибиторов в положениях 5, 6 и 7, 8.
Указанные соединения характеризовались различным профилем ингибирования в отношении 3 указанных ферментов, расщепляющих в положении 9, 10 (фиг.4). Указанные соединения проявляют аналогичную ингибирующую активность в отношении LeCCD1a in vivo (фиг.4) по сравнению с ингибирующей активностью в условиях in vitro (табл.1): D5 и D6 проявляли относительно слабую активность по сравнению с другими соединениями группы D, а соединение F3 практически не проявляет активности. Различная активность наблюдается в отношении AtCCD7 в системе E.coli (фиг.4), например, соединения F1 и F2, которые проявляют высокую активность в отношении LeCCD1a, проявляют низкую ингибирующую активность в отношении AtCCD7, в то время как F1 и F2 проявляют наиболее высокую ингибирующую активность в отношении MMBCO2 (фиг.4). Было установлено, что ни одно из указанных соединений не ингибирует расщепление в положении 15,15' ферментом MMBCO1 (фиг.4).
Стимуляция ветвления побегов Arabidopsis с использованием ингибитора
Ауксин ингибирует разрастание аксиллярных почек у растения семейства Arabidopsis дикого типа. В нулевых мутантах AtCCD7 и AtCCD8 (max3 и max4, соответственно) ответная реакция на действие ауксина снижается, вероятно, за счет блокирования синтеза гормона апокаротина (как показано недавно в работах (17, 18) на примере стриголактона или соответствующего соединения), который подавляет ветвление (19), и аксиллярные почки разрастаются раньше, что приводит к формированию боковых побегов. Был проведен анализ in vitro, разработанный ранее, в котором мутанты max оценивали по росту аксиллярных почек из выделенных участков стеблей Arabidopsis (40). По результатам анализов было установлено, что разрастание почек мутанта max4-l (AtCCD8) происходило на 2 сут раньше, чем у растения дикого типа (20) и схожий фенотип предполагается и у мутанта mах3-9, отличающегося высокой ветвистостью (21). Были исследованы ингибиторы на основе гидроксамовой кислоты при концентрации 100 мкМ и установлено, что все соединения D1-D6 и F3 значительно (P<0.05) снижают время разрастания почек у растений дикого типа, которое происходит во временном диапазоне от 1 (соединение D1) до 3 сут (соединение D3) (фиг.5). Раннее разрастание почек также было аналогично наблюдаемому разрастанию почек у AtCCD7 нулевого мутанта mах3-9 (фиг.5), и указывает на ингибирование AtCCD7 и/или возможно AtCCD8 в данной ткани растения. Действие ингибиторов в данном методе анализа только частично отражает активность ингибиторов при анализе с использованием E.coli, причем соединения F1 и F2 характеризуются относительно низкой активностью по результатам анализа AtCCD7 разрастания почек (фиг.5) и анализа с использованием E.coli (Фиг.4). Однако в случае ингибитора F3 получили противоположные результаты, так как указанное соединение оказалось неактивным в отношении AtCCD7 в клетках E.coli, но проявляло активность в анализе на разрастание почек. По всей видимости, в данном случае стимуляция ветвления происходила за счет ингибирования соединением F3 фермента AtCCD8 (не исследовали в анализах in vitro или в E.coli), а не AtCCD7.
Стимуляция ветвления стеблей целого растения семейства Arabidopsis
Было также исследовано влияние ингибиторов на рост целого растения семейства Arabidopsis, причем растение выращивали в стерильных условиях в агаре. Мутанты растений max3-9 (фиг.6б), а также обработанные соединениями D2, D4, D5 и D6 (на фиг.6в представлены результаты обработки растений соединением D6) характеризовались улучшенным ветвлением по сравнению с необработанными растениями дикого типа (фиг.6а). Такое повышенное ветвление происходит за счет увеличения числа боковых розеточных побегов из узлов, причем в присутствии ферментов max3-9 растения характеризуются наличием от 3 до 4 боковых побегов по сравнению с растениями дикого типа, для которых число боковых побегов составляет в среднем 0,25. Растения, обработанные ингибиторами, занимают промежуточное положение (в среднем примерно 2 побега) и таким образом характеризуются ветвлением, аналогичным растениям max3-9 (фиг.6г).
Такой фитогормон, как абсцизовая кислота (АБК), усиливает состояние покоя у многих структур растений, включая семена (Finch-Savage W.E. и G. Leubner-Metzger, Seed dormancy and the control of germination, New Phytologist, т.171(3), cc501-523 (2006)), клубни (Suttle J.C., Physiological regulation of potato tuber dormancy, American Journal of Potato Research, т.81(4), cc.253-262 (2004)), луковицы (Chope G.A., L.A. Terry и P.J. White, Effect of controlled atmosphere storage on abscisic acid concentration and other biochemical attributes of onion bulbs, Postharvest Biology и Technology, т.39(3), сс. 233-242 (2006)) и почки (Le Bris M. и др., Regulation of bud dormancy by manipulation of ABA in isolated buds of Rosa hybrida cultured in vitro, Australian Journal of Plant Physiology, т.26(3), cc273-281 (1999)). 9-цис-Эпоксикаротиндиоксигеназа (NCED) является важным агентом, лимитирующим биосинтез АБК (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes overproduction of abscisic acid, Plant Journal, т.23(3), cc.363-74.5 (2000)).
Результаты, представленные в табл.1, свидетельствуют о том, что множество производных гидроксамовой кислоты проявляют ингибирующую активность в отношении NCED в условиях in vitro, причем соединения D4, D7 и D8 проявляют наибольшую активность в отношении NCED в условиях in vitro.
Были получены трансгенные семена томатов SP12, которые характеризовались высоким содержанием АБК и продолжительным состоянием покоя (Thompson A.J. и др., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid, Plant Journal, 23(3), cc. 363-74 (2000)) и Thompson A.J. и др., Regulation and manipulation of ABA biosynthesis in roots, Plant Cell and Environment, 30, cc 67-78 (2007)). В экспериментах эти семена использовали в качестве системы для изучения ингибирующей активности соединений D1-D7 (добавление ингибиторов NCED должно приводить к ускорению прорастания) и было установлено, что соединения D4 и D7 являются самыми активными при стимуляции прорастания. Соединение D4 ускоряло прорастание семян SP12 (фиг.8) в зависимости от добавленного количества (фиг.9). Соединением D4 были также обработаны семена томатов дикого типа (cv. Ailsa Craig) и установлена зависимость прорастания семян от количества добавленного D4 (фиг.9). При добавлении D4 при концентрации менее 1 мкМ наблюдалось нормальное развитие семян дикого типа или SP12. Незначительная задержка в развитии растений наблюдалась при концентрации D4, равной 2 мкМ.
Коммерческие гербициды норфлуразон и флуридон подавляют фитоен-десатуразу и, следовательно, блокируют биосинтез АБК (АБК является производным каротиноидов) за счет блокирования синтеза всех каротиноидов. Норфлуразон и флуридон не предназначены для использования в коммерческих целях для выведения тканей растений из состояния покоя, так как в результате полностью подавляется синтез каротиноидов (следовательно, их действие подобно предвсходовым гербицидам, т.е. происходит ускорение прорастания семян, а затем проростки погибают вследствие обесцвечивания). Гербициды на основе норфлуразона пиразинона и флуридон пиридена запрещены к применению в Европе (с июля 2003 г.), включены в список запрещенных пестицидов, не подлежат регистрации и не производятся.
Дополнительные материалы
Спектроскопические данные для синтетических ингибиторов
D1. N-бензил-4-гидроксифенилацетилгидроксамовая кислота. Выход 0,59 г (выход реакции конденсации 54%, удаление защитной группы 74%). δH (400 МГц, CD3OD) 3,77 (2Н, s, CH2CO), 4,78 (2Н, s, CH2N), 6,77 (2H, d, J=8,0 Гц), 7,13 (2Н, d, J=8,0 Гц), 7,25-7,35 (5H, m), δC (100 МГц, CD3OD) 39,2, 53,1, 116,3, 127,5, 128,6, 129,3, 129,5, 131,6, 137,7, 157,2, 174,7, MC (ES): 280,1 (MNa+), MC-ВР: найд. для C15H15NO3Na 280,0949, рассч. 280,0944.
D2. N-(4-фторбензил)-4-гидроксифенилацетилгидроксамовая кислота. Выход 0,12 г (выход реакции конденсации 93%, удаление защитной группы 55%), δH (400 МГц, CD3OD) 3,72 (2Н, s, CH2CO), 4,78 (2Н, s, CH2N), 6,73 (2Н, d, J=8,0 Гц), 7,06 (2H, t, J=8,0 Гц), 7,11 (2Н, d, J=8,0 Гц), 7,30 (2Н, m), δC (100 МГц, CD3OD) 39,2, 52,3, 114,9, 116,0, 116,2, 128,5, 129,5, 131,3, 131,5, 142,4 (сигнал карбонила не детектируется). MC (ES): 298,1 (MNa+), MC-BP: найд. 298,0860, рассч. 298,0850 для C15H14NO3Na.
D3. N-(4-фторбензил)-3,4-дигидроксифенилацетилгидроксамовая кислота. Выход 0,08 г (выход реакции конденсации 50%, удаление защитной группы 78%), δH (300 МГц, CD3OD) 3,68 (2Н, s, СН2СО), 4,74 (2Н, s, CH2N), 6.60 (1H, dd, J=2,0,8,0 Гц), 6,72 (1H, d, J=8,0 Гц), 6,78 (1H, d, J=2,0 Гц), 7,03 (2Н, t, J=8,0 Гц), 7,28 (2Н, m), δC (75 МГц, CD3OD) 39,4, 52,3, 116,0, 116,3, 117,7, 121,9, 127,9, 131,3, 145,1, 146,2, 162,1, 165,3, 174,1, MC (ES): 314,3 (MNa+).
D4. N-(4-фторбензил)-4-метоксифенилацетилгидроксамовая кислота. Выход 0,24 г (выход реакции конденсации 78%, удаление защитной группы 83%), δH (400 МГц, CDCl3) 3,70 (2Н, s, CH2CO), 3,73 (3Н, s, СН3О) 4,69 (2Н, s, CH2N), 6,77 (2Н, d, J=8,0 Гц), 6,94 (2Н, t, J=8,0 Гц), 7,13 (2Н, d, J=8,0 Гц), 7,20 (2Н, m). δC (100 МГц, CDCl3) 38,9, 40,4, 52,0, 114,5, 115,7, 115,9, 128,2, 131,1, 131,3, 159,3, 163,7 (сигнал карбонила не детектируется). MC (ES): 312,2 (MNa+), MC-ВР: найд. 312,1004, рассч. 312,1006 для C16H16NO3FNa.
D5. N-бензил-3,4-диметоксифенилацетилгидроксамовая кислота. Выход 0,23 г (выход реакции конденсации 62%, удаление защитной группы 66%), δH (300 МГц, CDCl3) 3,64 (2Н, s, CH2CO), 3,70 (3Н, s, ОСН3), 3,76 (3H, s, ОСН3), 4,65 (2Н, s, CH2N), 6,63-6,73 (3Н, m), 7,15-7,30 (5H, m), δC (75 МГц, CDCl3) 38,0, 51,4, 55,1, 55,2, 110,5, 111,9, 121,0, 126,9, 127,1, 127,8, 128,3, 135,4, 147,1, 148,1, 172,1. MC (ES): 324,2 (MNa+), MC-BP: найд. для C17H19NO4Na 324,1216, рассч. 324,1206.
D6. N-(4-фторбензил)-3,4-диметоксифенилацетилгидроксамовая кислота. Выход 0,22 г (выход реакции конденсации 100%, удаление защитной группы 69%). δH (400 МГц, CD3OD) 3,40 (2Н, s, CH2CO), 3,80 (3Н, s, ОСН3), 3,84 (3Н, s, ОСН3), 4,76 (2Н, s, CH2N), 6,81 (1H, d, J=8,0 Гц), 6,89 (1H, d, J=8,0 Гц), 6,91 (1H, s), 7,04 (2Н, t, J=8,0 Гц), 7,30 (2Н, m). δC (100 МГц, CD3OD) 39,5, 52,3, 56,4, 56,6, 113,1, 114,4, 116,3, 123,0, 129,4, 131,5, 133,9, 149,4, 162,5, 164,9, 174,3. MC (ES): 342,2 (MNa+), MC-BP: найд. для C17H18NO4FNa 342,1110, рассч. 342,1112.
D7. N-(4-фторбензил)-3,4-метиленоксифенилацетилгидроксамовая кислота. Выход 0,26 г (выход реакции конденсации 51%, удаление защитной группы 100%). δH (400 МГц, CD3OD) 3,45 (2Н, s, СН3СО), 4,86 (2Н, s, CH2N), 6,05 (2Н, s, OCH2O), 6,85 (2H, s), 6,91 (1H, s), 7,08 (2H, t, J=8,0 Гц), 7,33 (2H, m). δC (100 МГц, CD3OD) 39,7, 52,5, 102,4, 109,2, 111,0, 116,3, 123,7, 130,3, 131,5, 133,6, 149,7, 162,7, 165,1, 175,0. MC (ES): 304,1 (MH+), MC-BP: найд. для C16H15NO4F 304,0980, рассч. 304,0980.
D8. N-бензил-3,4-диметоксифенилпропионилгидроксамовая кислота. Выход 0,15 г (выход реакции конденсации 71%, удаление защитной группы 94%). δH (400 МГц, CDCl3) 2,60 (4Н, m), 3,73 (6Н, s, 2×ОСН3), 4,68 (2H, s, CH2N), 6,63-6,73 (3H, m), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 30,4, 34,3, 51,9, 55,8, 55,9, 111,3, 111,9, 120,3, 126,9, 128,0, 128,8, 133,9, 136,2, 147,3, 148,8 (сигнал карбонила не детектируется). MC (ES): 316,2 (MH+), MC-BP: найд. для C18H21NO4 316,1547, рассч. 316,1549.
D9. N-бензил-4-метоксифенилпропионилгидроксамовая кислота. Выход 0,13 г (выход реакции конденсации 82%, удаление защитной группы 82%). δH (400 МГц, CDCl3) 2,82 (4Н, m), 3,68 (3H, s, ОСН3), 4,68 (2H, s, CH2N), 6,67 (2H, d, J=8,0 Гц), 7,01 (2H, d, J=8,0 Гц), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 28,0, 32,3, 50,9, 54,2, 112,9, 120,3, 126,6, 127,5, 128,3, 134,3, 136,3, 147,5 (сигнал карбонила не детектируется), MC (ES): 286,2 (MH+), MC-BP: найд. для C17H19NO3 286,1447, рассч. 286,1443.
D10. N-октил-3,4-диметоксифенилпропионилгидроксамовая кислота. Выход 0,10 г (выход реакции конденсации 57%, удаление защитной группы 85%). δH (400 МГц, CDCl3) 0,88 (3H, t, J=7,0 Гц), 1,25-1,35 (12Н, m), 2,61 (2H, t, J=7,0 Гц), 2,89 (2H, t, J=7,0 Гц), 3,39 (2H, t, J=7,0 Гц, CH2N), 3,88 (6Н, s, 2×ОСН3), 6,63-6,73 (3H, m), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 14,5, 23,0, 26,9, 28,0, 29,6, 31,0, 31,4, 32,2, 32,3, 36,4, 56,2, 56,3, 111,6, 112,1, 120,6, 133,4, 148,0, 149,3 (сигнал карбонила не детектируется), MC (ES): 338,2 (MH+), MC-BP: найд. для C19H31NO4 337,2262, рассч. 337,2253.
D11. N-октил-4-метоксифенилпропионилгидроксамовая кислота. Выход 0,12 г (выход реакции конденсации 62%, удаление защитной группы 92%). δH (400 МГц, CDCl3) 0,78 (3H, t, J=7,0 Гц), 1,20-1,35 (12Н, m), 2,60 (2H, t, J=7,0 Гц), 2,85 (2H, t, J=7,0 Гц), 3,53 (2H, t, J=7,0 Гц, CH2N), 3,72 (3H, s, ОСН3), 6,72 (2Н, d, J=8,0 Гц), 7,05 (2Н, d, J=8,0 Гц). δC (100 МГц, CDCl3) 13,7, 22,6, 26,8, 27,0, 29,1, 29,4, 31,3, 32,3, 32,3, 36,4, 55,1, 113,7, 129,2, 137,2, 156,7, 172,7. MC (ES): 308,2 (МН+), МС-ВР: найд. для C18H29NO3 308,2237, рассч. 308,2226.
F1. N-бензил-4-метоксибензоилгидроксамовая кислота. Выход 55 мг (13%). δH (300 МГц, CDCl3) 3,70 (3H, s, ОСН3), 4,75 (2Н, s, CH2N), 6,75 (2Н, d, J=8,0 Гц). 7,20-7,30 (5H, m), 7,45 (2Н, d, J=8,0 Гц), δC (100 МГц, CDCl3) 54,9, 55,4, 113,8, 124,3, 127,5, 128,6, 129,5, 130,1, 135,6, 161,8, 168,4. MC (ES): 258,2 (MH+), МС-ВР: найд. для C15H16NO3 258,1128, рассч. 258,1130.
F2. N-(4-фторбензил)-4-метоксибензоилгидроксамовая кислота. Выход 38 мг (выход реакции конденсации 50%, удаление защитной группы 60%). δH (300 МГц, CDCl3) 3,80 (3H, s, ОСН3), 4,75 (2Н, s, CH2N), 6,80 (2Н, d, J=8,0 Гц), 6,95 (2Н, t, J=9,0 Гц), 7,15 (2Н, m), 7,40 (2Н, d, J=8,0 Гц). δC (100 МГц, CDCl3) 54,5, 55,4, 113,7, 115,5, 121,3, 128,4, 129,1, 129,9, 159,9, 162,0, 169,6. MC (ES): 276,2 (МН+), МС-ВР: найд. для C15H15NO3F 276,1039, рассч. 276,1036.
F3. N-бензил-3,4-диметоксибензоилгидроксамовая кислота. Выход 0,23 г (53%). δH (300 МГц, CDCl3) 3,65 (3H, s, ОСН3), 3,85 (3H, s, ОСН3), 4,80 (2Н, s, CH2N), 6.80 (1Н, d, J=8,0 Гц), 7,03 (1H, d, J=2,0 Гц), 7,10 (1H, dd, J=2,0, 8,0 Гц), 7,25-7,35 (5H, m). δC (100 МГц, CDCl3) 55,2, 55,9, 56,0, 110,5, 111,1, 121,3, 123,9, 127,1, 128,6, 128,8, 135,6, 148,9, 151,5, 168,0. MC (ES): 288,2 (МН+), МС-ВР: найд. для C16H18NO4 288,1242, рассч. 288,1236.
F4. N-(4-фторбензил)-3,4-диметоксибензоилгидроксамовая кислота. Выход 9 мг (35%). δH (300 МГц, CDCl3) 3,45 (6Н, s, ОСН3), 4.55 (2Н, s, CH2N), 6,75 (1H, d, J=8,0 Гц), 6,95 (2Н, t, J=9,0 Гц), 7,25-7,35 (4Н, m). MC (ES): 306,2 (MH+), МС-ВР: найд. для C16H17NO4F 306,1140, рассч. 306,1136.
В1. (2Е)-3-метил-5-(2,6,6-триметилциклогексен-1-енил)пента-2,4-диеноилгидроксамовая кислота. 0,09 г (62%). δH (400 МГц, CDCl3) 1,02 (3H, s), 1,08 (3H, s), 1,48 (2Н, m), 1,62 (2Н, m), 1,71 (3H, s, E изомер), 1,78 (3H, s, Z изомер), 5,68 (1H, s, Z изомер), 5,78 (1H, s, E изомер), 6,12 (1H, d, J=15,0 Гц), 6,62 (1H, d, J=15,0 Гц), δC (100 МГц, CDCl3) 13,7, 18,9, 20,8, 21,5, 28,7, 32,9, 39,3, 115,0, 116,8, 129,8, 133,7, 134,5, 135,8 (сигнал карбонила не детектируется). МС (ES): 273,2 (MNa+).
D12. 3,4-диметоксифенилпропеноилгидроксамовая кислота. Выход 0,18 г (54%). δH (400 МГц, CDCl3) 3,79 (6Н, s, 2×OCH3), 6,25 (1Н, d, J=16,0 Гц), 6,85 (1Н, d, J=8,0 Гц), 7,03 (2Н, m), 7,42 (1Н, d, J=16,0 Гц). МС (ES): 246,1 (MNa+).
D13. 4-метоксифенилпропеноилгидроксамовая кислота. Выход 1,07 г (50%). δH (400 МГц, CD3OD) 3,78 (3Н, s, ОСН3), 6,38 (1Н, d, J=16,0 Гц), 6,89 (2Н, d, J=8,0 Гц), 7,48 (2Н, d, J=8,0 Гц), 7,56 (1Н, d, J=16,0 Гц). δC (100 МГц, CD3OD) 55,9, 115,5, 118,4, 128,8, 130,8, 141,6, 145,1, 167,0. МС (ES): 194,2 (МН+), МС-ВР: найд. для C10H12NO3 194,0816, рассч. 194,0818.
E1. Метиловый эфир N-бензил-N-(4-метоксибензил)глицина.
δH (300 МГц, CDCl3) 3,40 (2Н, s, CH2N), 3,81 (3Н, s, ОСН3), 3,86 (2Н, s, CH2N), 3,90 (3Н, s, CO2CH3), 6,97 (2Н, d, J=8,0 Гц), 7,25-7,50 (7Н, m), δC (75 МГц, CDCl3) 50,7, 52,6, 54,6, 56,5, 57,0, 113,1, 126,5, 127,7, 128,3, 129,5, 130,4, 135,3, 137,6, 171,4, m/z 322,1 (MNa+).
Дополнительные материалы
|
Обсуждение результатов
Сконструирован и исследован новый класс ингибиторов семейства каротиндиоксигеназ, структура которых является миметиком субстрата, который определяет положение хелатирующей железо группы гидроксамовой кислоты в составе активного центра. Положения указанной группы изменяли за счет изменения расстояния между гидроксамовой кислотой и ароматическим циклом таким образом, чтобы расстояние внутри каротиноидного субстрата соответствовало расстоянию между ближайшей концевой группой цикла и участком расщепления. Кристаллическая структура АСО, цианобактериальной CCD, свидетельствует о том, что положение участка расщепления, вероятно, определяется расстоянием между каталитическим активным центром, представляющим собой железо Fe(II), отверстием неполярного канала, который обеспечивает доступ к каротиноидным субстратам (11). Данная теория подтверждается на примере расщепления ферментом NosCCD (из Nostoc sp. PCC 7120) моноциклического γ-каротина, которое происходит в положении 7', 8', если вблизи расположен концевой линейный фрагмент, но в положении 9, 10, если соседний концевой фрагмент имеет более компактную циклическую группу (48). И действительно, можно предположить, что циклическая концевая группа может не пройти через отверстие в канале (48).
С учетом указанной кристаллической структуры и предложенной авторами модели расщепления (фиг.3), можно предположить, что соединения арил-C1N, арил-C2N и арил-C3N будут проявлять селективность при расщеплении в положениях 7, 8, 9, 10 и 11, 12, соответственно. Указанные соединения исследовали в отношении ферментов, обладающих специфичностью в положении 9, 10, 11, 12 и 15, 15'. Было установлено, что некоторые соединения арил-C1N (F1, F2) являются эффективными ингибиторами ферментов, расщепляющих в положении 9, 10, и не активны в отношении ферментов, расщепляющих в положении 11, 12 или 15, 15'. Соединения арил-C2N являются высокоэффективными ингибиторами ферментов, расщепляющих в положении 9, 10, но проявляют умеренную ингибирующую активность в отношении ферментов, расщепляющих в положении 11, 12. Соединения арил-C3N проявляли значительно меньшую активность в отношении ферментов, расщепляющих в положении 9, 10, и хотя наиболее эффективным ингибитором ферментов, расщепляющих в положении 11, 12, является соединение из указанной группы (соединение D8), все эти соединения проявляли несколько большую селективность в отношении положения 9, 10. Для сравнения, было установлено, что дополнительный аналог, абамин SG, более активен в отношении ферментов, расщепляющих в положении 11, 12, по сравнению с ферментами, расщепляющими в положении 9, 10, и при концентрации ингибитора 100 мкМ ингибирующая активность в отношении AtNCED3 составляла 78% и в отношении AtCCD1≤20% (32). Ни одно из исследованных соединений не ингибировало ферменты, расщепляющие в положении 15, 15', вероятно, по причине слишком малого пространства. Таким образом, можно заключить, что описанная стратегия изменения расположения групп гидроксамовой кислоты имела успех лишь частично, так как наблюдалась некоторая степень перекрывания классов друг с другом. Несмотря на это, было установлено, что индивидуальные соединения проявляют чрезвычайно высокую специфичность в отношении положения 9, 10 в условиях in vitro, например, значение IC50 для F1 составило 2, 0 мкМ, однако ингибирующая активность в отношении LeNCED1 не определяется.
Ингибиторы также характеризуются различным профилем активности в клетках E.coli в отношении трех различных ферментов, расщепляющих в положении 9, 10. Например, соединения F1 и F2 проявляли высокую ингибирующую активность в отношении LeCCD1 и MMBCO2, но относительно низкую активность в отношении AtCCD7. Такие различия можно объяснить, так как аминокислотная гомология MMBCO2 с двумя растительными ферментами, расщепляющими в положении 9, 10 (LeCCD1 а и AtCCD7), составляет лишь 17-23%, и эти два растительных фермента значительно отличаются друг от друга и характеризуются гомологией на уровне 19%. Это обозначает, что варианты ингибиторов на основе гидроксамовой кислоты, способны распознавать различные ферменты, обладающие аналогичной активностью, но отличающиеся по первичной структуре.
Известно, что клетки E.coli являются весьма эффективной системой для изучения активности ингибиторов в условиях in vivo. Например, в исследованиях на клетках Е. coli было установлено, что соединения F1 и F2 являются слабыми ингибиторами в отношении AtCCD7, что было подтверждено результатами анализа влияния на разрастание почек Arabidopsis (фиг.5), что в свою очередь является мерой активности AtCCD7 и/или AtCCD8. Однако, хотя соединения D5 и D6 характеризуются слабой ингибирующей активностью в исследованиях на клетках Е.coli, они оказывают значительный эффект на рост целого растения Arabidopsis, при этом наблюдается наибольшее число боковых ответвлений. Было также установлено, что соединения D1 и D3 являются эффективными ингибиторами ферментов, расщепляющих в положении 9, 10 в условиях in vitro (табл.1), по результатам анализа с использованием клеток Е.coli (фиг.4) и исследовании влияния на разрастание почек (фиг.5), однако D3 проявляет отрицательное воздействие на рост растения, что противоречит результатам анализа ветвления растения, в то время у растений, обработанных D1, наблюдается нормальный рост и без усиления степени ветвления. Арильные циклы соединений D1 и D3 содержат больше полярных гидроксильных групп, и, следовательно, указанные соединения более активно проникают в растение или быстрее подвергаются метаболизму.
Обработка целого растения Arabidopsis арил-C1N ингибиторами F1 и F2, структуры которых различаются только одним атомом фтора, приводила к обесцвечиванию листьев. Известно, что недостаток фотозащитных каротиноидов, который, например, связан с обработкой гербицидами, ингибиторами фитоендесатуразы (50), приводит к фотоокислительной деградации хлорофилла и, следовательно, к обесцвечиванию листьев. Кроме того, мутант Arabidopsis variegated 3 (var3), который, как описано, взаимодействует с AtCCD4 в условиях in vitro, характеризуется фенотипом с обесцвеченными листьями и замедлением образования хлоропластов (51). Арил-C1N соединения, как ожидалось, ингибировали ферменты CCD с активностью по положению 7, 8, а последовательность AtCCD4 является наиболее близкой последовательности фермента CsZCD, расщепляющего в положении 7, 8 (9), следовательно, возможным объяснением действия соединений F1 и F2 может служить тот факт, что указанные соединения ингибируют действие комплекса Var3/AtCCD4, что в свою очередь приводит к формированию фенотипа, аналогичного мутанту var3. Анализ мутантов Arabidopsis, устойчивых к обесцвечиванию соединениями F1 или F2, позволит идентифицировать белок-мишень, как уже описано для других низкомолекулярных соединений (52).
В целом, проведенные исследования и наблюдаемые различия по данным различных методов анализа свидетельствуют о том, что такие факторы, как поглощение клетками, метаболизм, влияние на нецелевые процессы, могут играть роль при определении пригодности и эффективности ингибиторов в полевых условиях. Полученные нами результаты свидетельствуют о необходимости проведения вторичных анализов в биологических системах с использованием соединений, описанных в настоящем изобретении. Было установлено, что соединения D2, D4, D5 и D6 ингибируют ферменты семейства CCD по данным всех проведенных анализов, включая исследования в полевых условиях, без проявления какого-либо отрицательного эффекта на целое растение. Описанные в настоящем изобретении соединения можно использовать в качестве генетических агентов для исследования функции ферментов CCD в растениях, в тканях животных и микроорганизмов.
Использование ингибиторов, описанных в настоящем изобретении, позволит снизить активность ферментов CCD, принимающих участие в процессах ветвления множества видов растений, и наблюдать за изменением содержания каротиноидов и апокаротинов - такой метод может стать эффективным инструментом для идентификации предшественников стриголактона, идентификации других активных стриголактон-подобных соединений, а также для дополнительного изучения путей биосинтеза. Ингибиторы также можно использовать для исследования функциональных различий стриголактона в различных видах растений. Соединения, ускоряющие ветвление, могут найти применение в садоводстве, где часто крайне необходимо получить компактную форму растения, например, при выращивании плодовых культур (53).
Другие биологические системы, в которых применение генетических технологий нельзя применять на практике, включают производство шафрана (9) и биксина (49) в растениях Crocus и Bixa, соответственно, в которых субстраты ферментов CCD in vivo, которые принимают участие в этих процессах, недостаточно изучены, а также исследование функций микоррадицина и стриголактона растений при взаимодействии с микоризой (54) и сорняками (15). Наконец, ингибиторы ВСO2 могут найти применение в фармацевтической промышленности, так как продукты, полученные в результате расщепления каротиноидов в положении 9, 10, способны разрушать ДНК и влиять на карциногенез (55, 56).
Список литературы
1. Auldridge М.Е., McCarty D.R., и Klee H.J., Curr. Opin. Plant BioL, т.9, cc315-321 (2006).
2. Zeevaart J.A.D. и Creelman R.A., Annu. Rev. Растение Physiol. Plant Mol. Biol., т.39, cc439-473 (1988).
3. Schwartz, S.H., Tan B.C., Gage D.A., Zeevaart J.A.D. и McCarty D.R., Plant Physiol., т.114, cc798-798 (1997).
4. von Lintig J. и Vogt K.J., Biol. Chem., т.275, cc11915-11920 (2000).
5. Wyss A., Wirtz G., Woggon W.D., Brugger R., Wyss М., Friedlein A., Bachmann H. и Hunziker W., Biochem. Biophys. Res. СомMun., т.271, cc 334-336 (2000).
6. Kiefer С., Hessel S., Lampert J.М., Vogt K., Lederer М.O., Breithaupt D.Е. и von Lintig J.J., Biol. Chem., т.276, cc14110-14116 (2001).
7. Hu K.Q., Liu C., Ernst H., Krinsky N.I., Russell R.М. и Wang X.D., J. Biol. Chem., т.281, cc19327-19338 (2006).
8. Dudareva N., Negre F., Nagegowda D.А. и Orlova I., Crit. Rev. Plant Sci., т.25, cc417-440 (2006).
9. Bouvier F., Suire C., Mutterer J. и Camara В., Plant Cell, т.15, cc47-62 (2003).
10. Juttner F. и Hoflacher В., Arch. Microbiol., т.141, cc337-343 (1985).
11. Kloer D.P., Ruch S., Al-Babili S., Beyer P. и Schuiz G.Е., Science, т.308, cc267-269 (2005).
12. Marasco Е.K., Vay K. и Schmidt-Dannert С., J. Biol. Chem., т.281, cc31583-31593 (2006).
13. Eisner Т. и Meinwald J., Science, т.53, cc1341-1350 (1966).
14. Fester Т., Schmidt D., Lohse S., Walter М.H., Giuliano G., Bramley P.М., Fraser P.D., Hause В. и Strack D., Planta, т.216, cc148-154 (2002).
15. Matusova R., Rani K., Verstappen F.W.A., Franssen М.C.R., Beale М.H. и Bouwmeester H.J., Plant Physiol., т.139, cc920-934 (2005).
16. Akiyama K. и Hayashi H., Ann. Bot., т.97, cc925-931 (2006).
17. Gomez-Roldan V., Fermas S., Brewer P.В., Puech-Pages V., Dun Е.A., Pillot J.P., Letisse F., Matusova R., Danoun S., Portais J.C., Bouwmeester H., Becard G., Beveridge C.A., Rameau С.и Rochange S.F., Nature, т.455, cc189-194 (2008).
18. Umehara M., Hanada A., Yoshida S., Akiyama K., Arite Т., Takeda-Kamiya N.? Magome H., Kamiya Y., Shirasu K., Yoneyama K., Kyozuka J., и Yamaguchi S., Nature, т.455, cc195-200 (2008).
19. Ward S.P. и Leyser O., Curr. Opin. Plant Biol., т.7, cc73-78 (2004).
20. Sorefan K., Booker J., Haurogne K., Goussot M., Bainbridge K., Foo E., Chatfield S., Ward S., Beveridge C., Rameau С. и Leyser O., Genes Dev., т.17, cc1469-1474(2003).
21. Booker J., Auldridge M., Wills S., McCarty D., Klee H. и Leyser C., Curr. Biol., т.14, cc1232-1238 (2004).
22. Schwartz S.H., Qin X.Q. и Loewen M.C., J. Biol. Chem., т.279, cc46940-46945 (2004).
23. Alder A., Holdermann I., Beyer P. и Al-Babili S., Biochem. J. BJ 20080568 (2008).
24. Booker J., Sieberer Т., Wright W., Williamson L., Willett В., Stirnberg P., Turnbull C., Srinivasan M., Goddard P. и Leyser O., Dev. Cell, т.8, cc443-449 (2005).
25. Bennett Т., Sieberer Т., Willett В., Booker J., Luschnig С. и Leyser O., Curr. Biol., т.16, cc553-563 (2006).
26. Cunningham F.X. и Gantt E., Photosynth. Res., т.92, cc245-259 (2007).
27. Schwartz S.H., Qin X.Q. и Zeevaart J.A.D., J. Biol. Chem., т.276, cc25208-25211 (2001).
28. Stockwell B.R., Nat. Rev. Genet., т.1, cc116-125 (2000).
29. Armstrong J.I., J. Sci. Food Agric., т.87, cc1985-1990 (2007).
30. Kaschani F. и van der Hoorn R., Curr. Opin. Chem. Biol., т.11, cc88-98 (2007).
31. Han S.Y., Kitahata N.. Sekimata K., Saito Т., Kobayashi M., Nakashima K., Yamaguchi-Shinozaki K., Shinozaki K., Yoshida S. и Asami Т., Plant Physiol., т.135, cc1574-1582 (2004).
32. Kitahata N., Han S.Y., Noji N., Saito Т., Kobayashi M., Nakano Т., Kuchitsu K., Shinozaki K., Yoshida S., Matsumoto S., Tsujimoto M. и Asami Т., Bioorg. Med. Chem., т.14, cc 5555-5561 (2006).
33. Suzuki A., Akune M., Kogiso M., Imagama Y., Osuki K., Uchiumi Т., Higashi S., Han S.Y., Yoshida S., Asami Т. и Abe M., Plant Cell Physiol., т.45, cc914-922 (2004).
34. Han S.Y., Kitahata N., Saito Т., Kobayashi M., Shinozaki K., Yoshida S. и Asami, Т., Bioorg. Med. Chem. Lett., т.14, cc3033-3036 (2004).
35. Bergeron R.J. и McManis J.S., Tetrahedron, т.45, cc4939-4944 (1989).
36. Kawase M. и Kikugawa Y., J. Chem. Soc., Perkin. Trans., t.1, cc643-645 (1979).
37. Schmidt H., Kurtzer R., Eisenreich W. и Schwab W., J.Biol. Chem., т.281, cc9845-9851 (2006).
38. Cunningham F.X., Pogson В., Sun Z.R., McDonald K.A., DellaPenna D. и Gantt E., Plant Cell. т.8, cc1613-1626 (1996).
39. Wilson A.K., Pickett F.В., Turner J.С.и Estelle M., Mol. Gen. Genet., т.222, cc377-383 (1990).
40. Chatfield S.P., Stirnberg P., Forde B.G. и Leyser O., Plant J., т.24, cc159-169 (2000).
41. Taylor I.В., Sonneveld Т., Bugg Т. D. H. и Thompson A.J., J. Plant Growth Regul, т.24, cc253-273 (2005).
42. Borowski Т., Bigomberg M.R.А. и Siegbahn P.E.M., Chem. Eur. J., т.14, cc2264-2276 (2008).
43. Kontogiorgis С.A., Papaioannou P. и Hadjipavlou-Litina D.J., Curr. Med. Chem., т.12, cc339-355 (2005).
44. Simkin A.J., Schwartz S.H., Auldridge M., Taylor M.G. и Klee H.J., Plant J., т.40, cc882-892 (2004).
45. Burbidge A., Grieve T.M., Jackson A., Thompson A., McCarty D.R. и Taylor I.В., Plant J., т.17, cc427-431 (1999).
46. Vogel J.Т., Tan В.С., McCarty D.R. и Klee H.J., J. Biol. Chem., т.283, cc11364-11373 (2008).
47. Paik J., During A., Harrison E.H., Mendelsohn C.L., Lai K. и Blaner W.S., J. Biol. Chem., т.276, cc32160-32168 (2001).
48. Scherzinger D. и Al-Babili S., Mol. Microbiol, т.69, cc231-244 (2008).
49. Bouvier F., Dogbo О. и Camara В., Science, т.300, cc2089-2091 (2003).
50. Sandmann G., Schmidt A., Linden H. и Boger P., Weed Sci., т.39, cc474-479 (1991).
51. Naested H., Holm A., Jenkins Т., Nielsen H. В., Harris C.A., Beale M.H., Andersen M., Mant A., Scheller H., Camara В., Mattsson О. и Mundy J., J. Cell Sci., т.117, cc4807-4818 (2004).
52. Walsh Т.A., Bauer Т., Neal R., Merlo A.O., Schmitzer P.R., Hicks G.R., Honma M., Matsumura W., Wolff K. и Davies J.P., Plant Physiol., т.144, cc1292-1304 (2007).
53. Quinlan, J.D. и Tobutt K.R., Hortscience, т.25, cc60-64 (1990).
54. Walter M.H., Floss D.S., Hans J., Fester Т. и Strack D., Phytochemistry, т.68, cc130-138 (2007).
55. Yeh S. L. и Wu S.H., Chem-Biol. Interact., т.163, cc199-206 (2006).
56. Alija A.J., Bresgen N., SomMerburg O., LanghanS C.D., Siems W. и Eckl P. M., Carcinogenesis, т.27, cc 1128-1133 (2006).
Примечания
Данная работа выполнена при поддержке Совета по научным исследованиям в области биологии и биотехнологии (Великобритания), инициативный проект SCIBS (Проект BB/D005787).
1. Использованные сокращения: CCD, каротиндиоксигеназа, NCED, 9-цис-эпоксикаротиндиоксигеназа, max, аксиллярный рост, IC50, концентрация ингибитора, при которой ингибирующая активность составляет 50%, ДТ, дикий тип, GST, глутатион S-трансфераза, ФСБ, фосфатно-солевой буферный раствор, ЖХВР, жидкостная хроматография высокого разрешения, ИПТГ, изопропил β-D-1-тиогалактопиранозид, НУК, α-нафталинуксусная кислота, АСО, апокаротин-15,15'-оксигенназа.