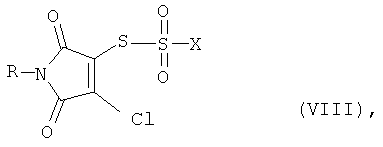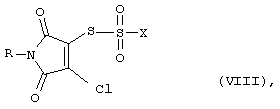Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ДИТИИН-ТЕТРАКАРБОКСИМИДОВ
Вид РИД
Изобретение
Настоящее изобретение относится к новому способу получения дитиин-тетракарбоксимидов.
Дитиин-тетракарбоксимиды как таковые известны. Также известно, что эти дитиин-тетракарбоксимиды можно применять в качестве противоглистных средств против внутренних паразитов в животных, в частности, против нематод, и что они имеют инсектицидное действие (см. US 3,364,229). Кроме того, известно, что определенные дитиин-карбоксимиды обладают антибактериальной активностью и определенным действием против возбудителей микозов в человеке (см. "II Farmaco" ["Лекарства"] 2005, 60, 944-947). Далее известно, что дитиин-тетракарбоксимиды можно использовать в качестве пигментов в электрофотографических фоторецепторах или в качестве красителей в лаках и полимерах (см. JP-A 10-251265, PL-B 143804).
Дитиин-тетракарбоксимиды формулы (I)
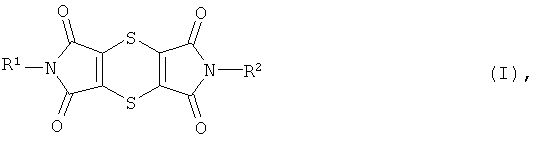
в которой R1 и R2 одинаковы или различны и означают водород, С1-С8-алкил, в случае необходимости однократно или многократно замещенный галогеном, группой -OR3 или группой -COR4, С3-С7-циклоалкил, в случае необходимости однократно или многократно замещенный галогеном, С1С4-алкилом или С1С4-галогеналкилом, арил или арил-(С1-С4-алкил), в случае необходимости однократно или многократно замещенные галогеном, С1С4-алкилом, С1С4-галогеналкилом, группой -COR4 или сульфониламино-группой,
R3 означает водород, С1С4-алкил, С1С4-алкилкарбонил или арил, в случае необходимости однократно или многократно замещенный галогеном, С1С4-алкилом или С1С4-галогеналкилом,
R4 означает гидрокси, С1С4-алкил или С1С4-алкокси,
можно получать разными известными способами.
Например, согласно одному из известных способов (см. US 3,364,229; "Chem. Ber." ["Химические доклады"] 1967, 100, 1559-1570) на первой стадии ангидрид дихлормалеиновой кислоты формулы (II) подвергают взаимодействию с амином формулы (III), в случае необходимости, в присутствии разбавителя. Затем полученные таким образом имиды дихлормалеиновой кислоты формулы (IV) подвергают взаимодействию с соединением серы (например, сероводородом или тиомочевиной). Получение дитиин-тетракарбоксимидов формулы (I) по этому способу можно представлять с помощью следующей схемы:
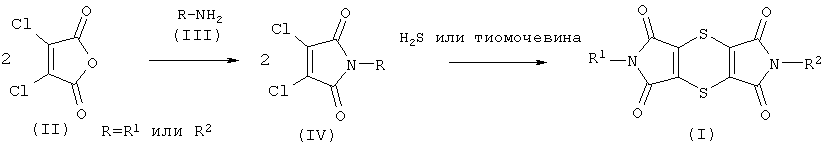 Недостаток данного способа заключается в том, что, например, обращение с высокотоксичным сероводородным газом является технически очень сложным и дорогим. При применении тиомочевины получают, кроме целевого продукта, нежелательные побочные продукты, удаление которых является сложным и которые снижают достигаемый выход (см. публикацию J. Heterocycl. Chem. 1988, 25, 901-906).
Недостаток данного способа заключается в том, что, например, обращение с высокотоксичным сероводородным газом является технически очень сложным и дорогим. При применении тиомочевины получают, кроме целевого продукта, нежелательные побочные продукты, удаление которых является сложным и которые снижают достигаемый выход (см. публикацию J. Heterocycl. Chem. 1988, 25, 901-906).
Согласно другому известному способу (см. публикацию "Synthetic Communications" 2006, 36, 3591-3597) на первой стадии ангидрид янтарной кислоты формулы (V) подвергают взаимодействию с амином формулы (III), в случае необходимости в среде разбавителя. Затем полученные таким образом моноамиды янтарной кислоты формулы (VI) при комнатной температуре в течение 6 часов подвергают взаимодействию с большим избытком тионилхлорида в присутствии диоксана в качестве разбавителя, причем в результате многочисленных реакционных стадий в конце получают дитиин-тетракарбоксимиды формулы (I), которые выделяют путем фильтрации или непосредственно из реакционной смеси, или после смешивания с водой. В зависимости от реакционных условий (разбавителя) и вида остатков R в некоторых случаях можно выделить дитиин-диизоимиды формулы (VII), которые затем переводят в дитиин-тетракарбоксимиды формулы (I). Этот способ получения дитиин-тетракарбоксимидов формулы (I) можно представлять с помощью следующей схемы:
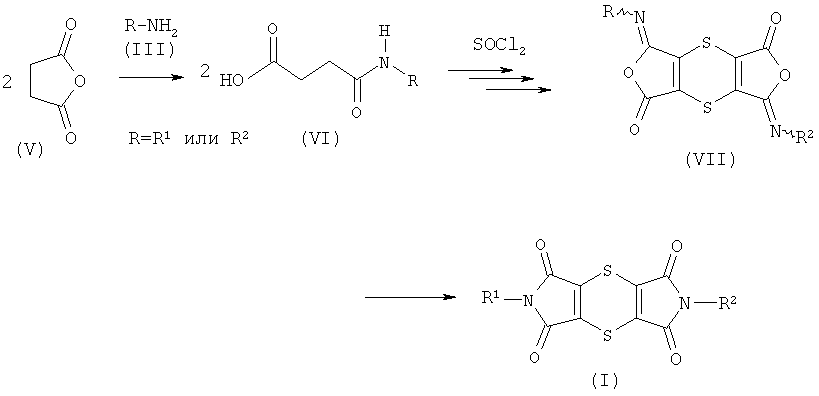
Недостатком этого способа является длинное время реакции, а также ее результат, что есть, или достигаемый выход, как правило, не превышает примерно 30-40% теории, или же чистота выделяемых продуктов является неудовлетворительной (см. сравнительные примеры). Кроме того, обработка реакционной смеси с использованием воды имеет тот недостаток, что при этом уничтожаются большие количества тионилхлорида, и необходимо устранять возникающие газы (SO2 и HCl). Дальнейший недостаток заключается в том, что, как показывает опыт (см. сравнительные примеры), продукт получают не в одной фракции. Во многих случаях после первого выделения продукта путем фильтрации после продолжительного отстаивания (например, в течение ночи) из фильтрата выпадает дальнейшее количество продукта, которое необходимо выделить путем дальнейшей фильтрации. Иногда приходится еще повторить эту стадию. Этот метод является очень сложным и требует много времени.
Далее известно, что дитиин-тетракарбоксимиды можно получать путем растворения N-замещенных амидов янтарной кислоты в сухом 1,4-диоксане с последующим добавлением тионилхлорида, после чего реакционную смесь нагревают, раствор сгущают в вакууме, продукт отделяют путем хроматографии на колонке и очищают (см. публикацию J. Heterocycl. Chem. 2010, 47, 188-193).
В связи с вышеизложенным имеется еще потребность в простом и экономичном способе получения дитиин-тетракарбоксимидов формулы (I).
Был найден новый способ получения дитиин-тетракарбоксимидов общей формулы (I)
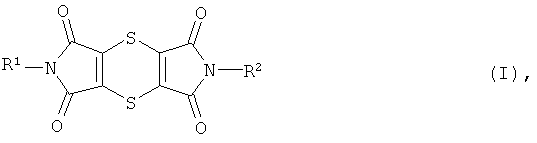
в которой R1 и R2 имеют вышеприведенные значения,
отличающийся тем, что
на первой стадии моноамиды янтарной кислоты формулы (VI)
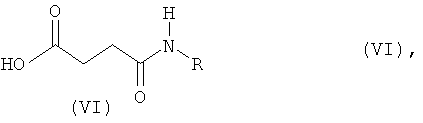
в которой R означает R1 или R2,
подвергают взаимодействию с избытком тионилхлорида, в случае необходимости в присутствии разбавителя, затем удаляют избыток тионилхлорида и полученную продуктовую смесь на второй стадии в среде органического растворителя переводят в дитиин-тетракорксимиды формулы (I).
Таким образом получают дитиин-тетракарбоксимиды формулы (I) в более высоком выходе, в более короткое время и с более высокой чистотой.
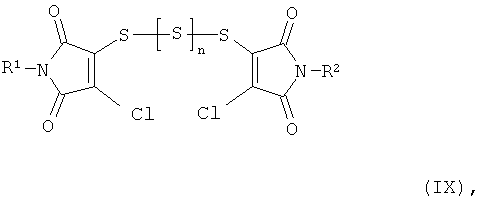
Получаемая на первой стадии предлагаемого способа продуктовая смесь содержит уже дитиин-тетракарбоксимиды формулы (I), однако в качестве главного компонента она содержит полисульфиды формулы (IX)
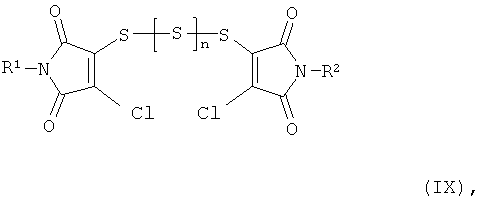
а также, в зависимости от метода переработки, производные тиосульфокислоты формулы (VIII)
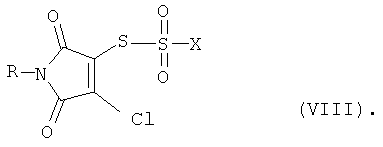
Производные тиосульфокислоты общей формулы (VIII) и полисульфиды общей формулы (IX) являются новыми и представляют собой также объекты настоящего изобретения.
В производных тиосульфокислоты общей формулы (VIII) R имеет вышеприведенные значения R1 или R2, а Х означает хлор или гидрокси-группу.
В полисульфидах общей формулы (IX) R1 и R2 имеют вышеприведенные значения, а n означает 0,1 или 2.
Соединения общей формулы (VIII) получают, наряду с другими продуктами, в результате сгущения реакционной смеси после взаимодействия соединений общей формулы (VI) с тионилхлоридом.
Соединения общей формулы (IX) получают наряду с другими продуктами в результате взаимодействия соединений общей формулы (VI) с тионилхлоридом, сгущения реакционной смеси, растворения в не смешивающемся с водой растворителе, например, метиленхлориде, и встряхивания с водой при комнатной температуре. После отделения органической фазы, сушки и сгущения получают смесь, которая наряду с дитиин-тетракарбоксимидами формулы (I) содержит в основном соединения общей формулы (IX).
Предлагаемый способ получения дитиин-тетракарбоксимидов формулы (I) можно представить с помощью следующей схемы:
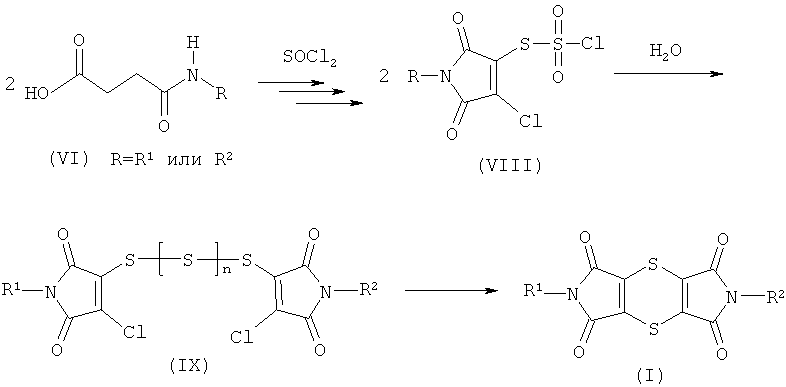 Используемые при проведении способа по изобретению в качестве исходных веществ моноамиды янтарной кислоты обобщенно обозначены формулой (VI). R имеет значения R1 или R2.
Используемые при проведении способа по изобретению в качестве исходных веществ моноамиды янтарной кислоты обобщенно обозначены формулой (VI). R имеет значения R1 или R2.
R1 и R2 предпочтительно одинаковы или различны и предпочтительно означают водород, C1-C6-алкил, в случае необходимости однократно или многократно замещенный фтором, хлором, бромом, группой -OR3 или группой -COR4, С3-С7-циклоалкил, в случае необходимости однократно или многократно замещенный хлором, метилом или трифторметилом, или фенил или фенил-(С1-C4-алкил), в случае необходимости однократно или многократно замещенные фтором, хлором, бромом, метилом, трифторметилом, группой -COR4 или сульфониламино-группой.
R1 и R2 более предпочтительно одинаковы или различны и более предпочтительно означают водород, C1-C4-алкил, в случае необходимости однократно или многократно замещенный фтором, хлором, гидрокси-группой, метокси-группой, этокси-группой, метилкарбонилокси-группой или карбоксилом, C3-C7-циклоалкил, в случае необходимости однократно или многократно замещенный хлором, метилом или трифторметилом, или фенил, бензил, 1-фенэтил, 2-фенэтил или 2-метил-2-фенэтил, в случае необходимости однократно или многократно замещенные фтором, хлором, бромом, метилом, трифторметилом, группой -COR4 или сульфониламино-группой.
R1 и R2 особенно предпочтительно одинаковы или различны и особенно предпочтительно означают водород, метил, этил, н-пропил, изопропил, 2,2-дифторэтил, 2,2,2-трифторэтил, или циклопропил или циклогексил, в случае необходимости замещенные хлором, метилом или трифторметилом.
R1 и R2 ,в частности, оба означают метил.
R3 предпочтительно означает водород, метил, этил, метилкарбонил, этилкарбонил или фенил, в случае необходимости однократно или многократно замещенный фтором, хлором, метилом, этилом, н-пропилом, изопропилом или трифторметилом.
R3 особенно предпочтительно означает водород, метил, метилкарбонил или фенил.
R4 предпочтительно означает гидрокси, метил, этил, метокси или этокси.
R4 особенно предпочтительно означает гидрокси или метокси.
Особенно предпочтительно в качестве исходного вещества используют метиламид янтарной кислоты, причем в качестве целевого продукта получают 2,6-диметил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']дипиррол-1,3,5,7(2Н,6Н)-тетрон (соединение (I-1)).
Если в качестве исходного вещества используют трет. бутиламид янтарной кислоты, то в качестве целевого продукта получают 2,6-ди-трет-бутил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']дипиррол-1,3,5,7(2Н,6Н)-тетрон (соединение (I-2)).
Если в качестве исходного вещества используют циклогексиламид янтарной кислоты, то в качестве целевого продукта получают 2,6-дициклогексил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']дипиррол-1,3,5,7(2Н,6Н)-тетрон (соединение (I-3)).
Если в качестве исходного вещества используют пропиламид янтарной кислоты, то в качестве целевого продукта получают 2,6-дипропил-1Н,5Н-[1,4]дитиино[2,3-с:5,6-с']-дипиррол-1,3,5,7(2Н,6Н)-тетрон (соединение (I-4)).
В качестве промежуточных соединений получают предпочтительно (VIII-1)S-(4-хлор-1-метил-2,5-диоксо-2,5-дигидро-1Н-пиррол-3-ил)хлортиосульфат (R=метил, Х=CI),
(IX-1) 3,3'-трисульфан-1,3-диилбис(4-хлор-1-метил-1Н-пиррол-2,5-дион) (R1=R2=метил, n=1)
(IX-2) 3,3'-дисульфандиилбис(4-хлор-1-метил-1Н-пиррол-2,5-дион) (R1=R2=метил, n=0)
(IX-3) 3,3'-дисульфандиилбис(1-трет-бутил-4-хлор-1Н-пиррол-2,5-дион) (R1=R2=трет. бутил, n=0)
(IX-4) 3,3'-трисульфан-1,3-диилбис(1-трет-бутил-4-хлор-1Н-пиррол-2,5-дион) (R1=R2=трет. бутил,n=1)
(IX-5) 3,3'-трисульфан-1,3-диилбис(4-хлор-1-циклогексил-1Н-пиррол-2,5-дион) (R1=R2=цикпогексил, n=1).
Количество тионилхлорида на первой стадии способа по изобретению составляет 2-100 моль на моль моноамида янтарной кислоты формулы (VI), а предпочтительно применяют 4-50 моль, особенно предпочтительно 10-40 моль на моль моноамида янтарной кислоты формулы (VI).
Температура реакции на первой стадии способа по изобретению можно варьировать в широких пределах, она составляет от 0°С до 150°С. Для получения удовлетворительного выхода по пространству и времени работают предпочтительно при температуре от 20°С до 120°С, особенно предпочтительно от 30°С до 100°С.
Время реакции на первой стадии предлагаемого способа составляет от 10 минут до 24 часов, предпочтительно от 30 минут до 6 часов, особенно предпочтительно от 1 часа до 4 часов.
Первую стадию предлагаемого способа можно осуществлять в среде разбавителя, который должен быть по возможности инертным в условиях реакции. В качестве такого разбавителя пригодны, например, алифатические углеводороды, такие как пентан, гексан, гептан, циклогексан, метилциклогексан, хлорированные углеводороды, такие как метиленхлорид, хлороформ, 1,2-дихлорэтан, ароматические углеводороды, такие как толуол, ксилол, мезитилен, хлорированные ароматические углеводороды, такие как хлорбензол, дихлорбензол, простые эфиры, такие как диэтиловый эфир, метил-трет.-бутиловый эфир, тетрагидрофуран, диоксан, нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил, сложные эфиры, такие как метиловый эфир уксусной кислоты и этиловый эфир уксусной кислоты. Предпочтительно используют метиленхлорид, хлороформ или 1,2-дихлорэтан или работают без разбавителя.
Удаление тионилхлорида можно осуществлять путем гидролиза водой, а предпочтительно тионилхлорид удаляют путем отгонки при пониженном давлении.
Имеющийся в случае необходимости разбавитель предпочтительно тоже отгоняют при пониженном давлении.
На второй стадии предлагаемого способа остаток, полученный в результате удаления избыточного тионилхлорида и, в случае необходимости, разбавителя, растворяют в свежем разбавителе и переводят в дитиин-тетракарбоксимиды формулы (I) в результате нагревания в этом разбавителе. Предпочтительно при этом реакционную смесь перемешивают.
На второй стадии предлагаемого способа используют органические растворители или смеси растворителей. Предпочтительно данные растворители смешиваются с водой, по меньшей мере, частично.
В качестве разбавителя для второй стадии предлагаемого способа пригодны, в частности, вода, диметилсульфоксид, сульфолан, спирты как, например, метанол, этанол, пропанол, изопропанол, 1-бутанол, 2-бутанол, изобутанол, трет. бутанол, 1-пентанол, циклопентанол, циклогексанол, этиленгликоль, простой монометиловый эфир этиленгликоля, углеводороды как, например, гексан, гептан, циклогексан, метилциклогексан, толуол, ксилол, мезитилен, хлорбензол, дихлорбензол, нитробензол, сложные эфиры как, например, сложный метиловый эфир уксусной кислоты, сложный этиловый эфир уксусной кислоты, амиды как, например, формамид, N,N-диметилформамид; N,N-диметилацетамид, N-метилпирролидон, простые эфиры как, например, метил-трет.-бутиловый эфир, тетрагидрофуран, 1,4-диоксан, нитрилы как, например, ацетонитрил, пропионитрил, бутиронитрил, бензонитрил, кетоны как, например, ацетон, метил-этилкетон, метил-изобутилкетон, пинаколон, карбоновые кислоты как, например, муравьиная кислота, уксусная кислота, пропионовая кислота, или смеси этих разбавителей.
Предпочтительно применяют воду, диметилсульфоксид, метанол, этанол, пропанол, изопропанол, 1-бутанол, 2-бутанол, изобутанол, трет. бутанол, 1-пентанол, циклогексанол, этиленгликоль, сложный метиловый эфир уксусной кислоты, N,N-диметилформамид; N,N-диметилацетамид, тетрагидрофуран, 1,4-диоксан, ацетонитрил, ацетон, метил-этилкетон, метил-изобутилкетон, уксусную кислоту или смеси этих разбавителей.
Особенно предпочтительно применяют смеси воды и метанола, этанола, пропанола, изопропанола, 1-бутанола, 2-бутанола, изобутанола, 1-пентанола, сложного метилового эфира уксусной кислоты, тетрагидрофурана, 1,4-диоксана, ацетонитрила, ацетона, уксусной кислоты.
Соотношение смеси воды и органического растворителя при этом можно варьировать в широких пределах; оно может составлять, например, от 9:1 до 1:9.
Температура реакции на второй стадии способа по изобретению можно варьировать в широких пределах, она составляет 0°С-200°С, предпочтительно 20°С-150°С, особенно предпочтительно 30°С-130°С.
Время реакции на второй стадии способа по изобретению составляет от 5 минут до 24 часов, предпочтительно от 30 минут до 12 часов, особенно предпочтительно от 1 до 6 часов.
Предлагаемый способ поясняется с помощью нижеследующих примеров, которые, однако, не ограничивают объем изобретения.
Пример 1
В реактор подают 5,24 г [40 ммоль] метиламида янтарной кислоты и при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Реакционную смесь сгущают на ротационном испарителе. Получают 9,9 г густого коричневого масла, которое согласно анализу путем высокопроизводительной жидкостной хроматографии (ВПЖХ) и жидкостной хроматографии/масс-спектрометрии (ЖХ/МС) содержит 19,2% площади пика (далее: площ.%) соединения (VIII-1), 36,1 площ.% соединения (I-1) и 19,1 площ.% соединения (IX-1).
Соединение (VIII-1) (R=метил):
ЖХ/МС (электроспрей отриц.): m/z=256 ([М-Н+], 35Cl; 65%), 176 ([M-H+]-80, 35Cl, 100%).
13С-ЯМР (CDCl3): δ=25,1 (N-СН3), 135,5, 138,1 (=C-Cl,=C-S), 162,9, 164,9 (-CO-CS, -CO-C-Cl) млн.ч.
Пример 2
К раствору 10,5 г [80 ммоль] метиламида янтарной кислоты в 100 мл метиленхлорида при температуре 15°С каплями добавляют 285,6 г [2400 ммоль] тионилхлорида. Дают нагреться до комнатной температуры, нагревают до 40°С и перемешивают при этой температуре в течение 16 часов. Охлаждают до комнатной температуры и реакционную смесь при размешивании добавляют к 800 г ледяной воды. После отстаивания при комнатной температуре в течение ночи органическую фазу отделяют, водную фазу экстрагируют метиленхлоридом, объединенные органические фазы сушат и сгущают на ротационном испарителе. Получают 11,8 г густого коричневого масла, которое согласно анализу путем ВПЖХ и ЖХ/МС содержит 25,7 площ.% соединения (I-1), 22,9 площ.% соединения (IX-2) и 37,7 площ.% соединения (IX-1).
Соединение (IX-2):
ЖХ/МС (электроспрей положительн.): m/z=353 (МН+, 2×35Cl).
13С-ЯМР (CD3CN): δ=25,4 (N-СН3), 136,1, 139,4 (=C-S,=C-Cl), 164,4, 166,2 (-CO-C-Cl,-CO-C-S) млн.ч.
Соединение (IX-1):
ЖХ/МС (электроспрей положительн.): m/z=385 (МН+, 2×35Cl).
13С-ЯМР (CDCl3): δ=25,3 (N-СН3), 136,1, 140,0 (=C-S,=C-CI), 164,3, 166,2 (-CO-C-CI,-CO-C-S) млн.ч.
Пример 3
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл метанола и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 61,1 площ.% соединения (I-1), 9,7 площ.% соединения (IX-2) и 2,5 площ.% соединения (IX-1).
Пример 4
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл смеси метанола и воды (1:1) и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 90,1 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) и <0,1 площ.% соединения (IX-1).
Пример 5
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл смеси 1,4-диоксана и воды (1:1) и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 84,6 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) и <0,1 площ.% соединения (IX-1).
Пример 6
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл диметил-формамида и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 71,1 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) и <0,1 площ.% соединения (IX-1).
Пример 7
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл смеси ацетонитрила и воды (1:1) и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 85,4 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) и <0,1 площ.% соединения (IX-1).
Пример 8
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл смеси ацетона и воды (1:1) и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 85,1 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) и <0,1 площ.% соединения (IX-1).
Пример 9
0,2 г полученной согласно примеру 2 продуктовой смеси растворяют в 10 мл смеси сложного метилового эфира уксусной кислоты и воды (1:1) и нагревают при 60°С в течение 4 часов. После удаления растворителя состав следующий: 89 площ.% соединения (I-1), <0,1 площ.% соединения (IX-2) und <0,1 площ.% соединения (IX-1).
Пример 10
К раствору 5,24 г [40 ммол] метиламида янтарной кислоты в 50 мл метиленхлорида при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Дают нагреться до комнатной температуры, нагревают до 40°С и перемешивают при этой температуре в течение часа. Затем охлаждают до комнатной температуры и сгущают на ротационном испарителе. Получают 12 г густого коричневого масла, которое растворяют в 100 мл этанола. Полученный раствор нагревают при температуре 60°С в течение 4 часов, после чего охлаждают до комнатной температуры. Выпавшее темно-зеленое твердое вещество отсасывают, промывают этанолом и водой и сушат. Получают 2,92 г твердого вещества, которое согласно анализу путем ВПЖХ состоит на 99,1 площ.% из соединения (I-1), что соответствует выходу 51,3% теории.
Пример 11
К раствору 5,24 г [40 ммоль] метиламида янтарной кислоты в 50 мл 1,4-диоксана при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Дают нагреться до комнатной температуры, затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Охлаждают до комнатной температуры и сгущают на ротационном испарителе. Получают 10,9 г густого коричневого масла, которое растворяют в 100 мл этанола. Полученный раствор нагревают при 60°С в течение 4 часов, затем охлаждают до комнатной температуры. Выпавшее темно-зеленое твердое вещество отсасывают, промывают этанолом и водой и сушат. Получают 2,66 г твердого вещества, которое согласно анализу путем ВПЖХ состоит на 99,4 площ.% из соединения (I-1), что соответствует выходу 46,8% теории.
Пример 12
К 5,24 г [40 ммоль] метиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Реакционную смесь сгущают на ротационном испарителе. Остаток (темно-коричневое густое масло) смешивают с 100 мл смеси метанола и воды (1:1) и нагревают при 60°С в течение 4 часов. После этого дают охлаждаться до комнатной температуры, выпавшее твердое вещество отсасывают и промывают водой и этанолом. После сушки получают 4,30 г темно-зеленого твердого вещества, которое согласно анализу ВПЖХ состоит на 94,7 площ.% из соединения (I-1), что соответствует выходу 72,1% теории.
Пример 13
К 5,24 г [40 ммоль] метиламида янтарной кислоты при температуре 15°С каплями добавляют 47,6 г [400 ммоль] тионилхлорида. Затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Реакционную смесь сгущают на ротационном испарителе. Остаток (темно-коричневое густое масло) смешивают с 100 мл смеси метанола и воды (1:1) и нагревают при 60°С в течение 4 часов. После этого дают охлаждаться до комнатной температуры, выпавшее твердое вещество отсасывают и промывают водой и метанолом. После сушки получают 4,05 г темно-зеленого твердого вещества, которое согласно анализу путем ВПЖХ состоит на 97,8 площ.% из соединения (I-1), что соответствует выходу 70,2% теории.
Сравнительный пример 1
К раствору 5,24 г [40 ммоль] метиламида янтарной кислоты в 50 мл 1,4-диоксана при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Дают нагреться до комнатной температуры и перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь при перемешивании добавляют к 400 г ледяной воды. Добавляют примерно 100 мл сложного этилового эфира уксусной кислоты, и выпавшее зеленое твердое вещество отсасывают, промывают водой и сложным этиловым эфиром уксусной кислоты и сушат. Получают 1,00 г твердого вещества чистотой 80,8 площ.%, что соответствует выходу 14,3% теории. Органическую фазу фильтрата отделяют и промывают водой. В результате на поверхности раздела фаз выпадает еще 0,40 г 99,1%-ного твердого вещества (7,2% теории). Фильтрат органической фазы сгущают, и остаток смешивают с простым метил-трет.-бутиловым эфиром (МТБЭ). Полученное таким образом твердое вещество отсасывают и сушат: 0,70 г, 51,0%-ное (6,3% теории). Объединенные водные фазы оставляют стоять при комнатной температуре в течение 2 дней, после чего выпавшее твердое вещество также выделяют: 0,50 г, 99,1%-ное (8,8% теории). В общей сложности полученный выход соединения (I-1) составляет 36,5% теории.
Сравнительный пример 2
К раствору 5,24 г [40 ммоль] метиламида янтарной кислоты в 50 мл диоксана при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Дают нагреться до комнатной температуры, нагревают до 80°С и перемешивают при этой температуре в течение часа. Охлаждают до комнатной температуры, при размешивании добавляют к примерно 400 г ледяной воды, оставляют стоять в течение ночи, выпавшее зеленое твердое вещество отсасывают, промывают водой и сложным эфиром уксусной кислоты и сушат. Получают 3,75 г твердого вещества чистотой лишь 76,5 площ.% (50,8% теории).
Пример 14
К 6,93 г [40 ммоль] трет. бутиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Реакционную смесь сгущают на ротационном испарителе. Полученное густое коричневое масло растворяют в метиленхлориде и промывают насыщенным водным раствором NaCl. Органическую фазу сушат над сульфатом натрия и сгущают. Получают 7,65 г коричневого остатка, который согласно анализу путем ВПЖХ и ЖХ/МС содержит 14,3 площ.% соединения (IX-3) и 9,7 площ.% соединения (IX-4).
Соединение (IX-3):
ЖХ/МС (электроспрей положительн.): m/z=437 ([МН+], 2×35Cl; 60%), 454 ([MH+]+NH3, 2×35Cl, 100%).
Соединение (IX-4):
ЖХ/МС (электроспрей положительн.): m/z=469 ([MH+], 2×35Cl; 20%), 486 ([MH+]+NH3, 2×35Cl, 100%).
Пример 15
К 6,93 г [40 ммоль] трет. бутиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 50°С и перемешивают при этой температуре в течение 4 часов. После этого реакционную смесь сгущают на ротационном испарителе. Полученное коричневое густое масло поглощают в 100 мл EtOH/H2O (1:1) и нагревают при 60°С в течение 4 часов. Охлаждают до комнатной температуры, твердое вещество отсасывают, промывают водой и этанолом и сушат. Получают 5,00 г коричневого твердого вещества, которое согласно анализу путем ВПЖХ содержит 99,6 площ.% соединения (I-3).
Пример 16
К 8 г [40 ммоль] циклогексиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 80°С и перемешивают при этой температуре в течение часа. Реакционную смесь сгущают на ротационном испарителе. Полученное густое коричневое масло растворяют в метиленхлориде и промывают насыщенным водным раствором NaCl. Органическую фазу сушат над сульфатом натрия и сгущают. Получают 10,8 г коричневого остатка, который согласно анализу путем ВПЖХ и ЖХ/МС содержит 19 площ.% соединения (IX-5).
Соединение (IX-5):
ЖХ/МС (электроспрей положительн.): m/z=521 ([MH+], 2×35Cl; 70%), 538 ([MH+]+NH3, 2×35Cl, 100%).
Пример 17
К 8 г [40 ммоль] циклогексиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 50°С и перемешивают при этой температуре в течение 4 часов. Реакционную смесь сгущают на ротационном испарителе. Полученное густое коричневое масло поглощают в 100 мл EtOH/H2O (1:1) и нагревают при 60°С в течение 4 часов. После этого охлаждают до комнатной температуры, твердое вещество отсасывают, промывают водой и этанолом и сушат. Получают 2,86 г коричневого твердого вещества, которое согласно анализу путем ВПЖХ содержит 92,1 площ.% соединения (I-3).
Пример 18
К 6,37 г [40 ммоль] пропиламида янтарной кислоты при температуре 15°С каплями добавляют 142,8 г [1200 ммоль] тионилхлорида. Затем нагревают до 50°С и перемешивают при этой температуре в течение 4 часов. Реакционную смесь сгущают на ротационном испарителе. Получаемое густое коричневое масло поглощают в 100 мл EtOH/H2O (1:1) и нагревают при 60°С в течение 4 часов. После этого охлаждают до комнатной температуры, твердое вещество отсасывают, промывают водой и этанолом и сушат. Получают 2,15 г зеленого твердого вещества, которое согласно анализу путем ВПЖХ содержит 99,4 площ.% соединения (I-4).
Общие сведения:
Условия анализа ВПЖХ: Zorbax Eclipse Plus C18 4,6*50 мм 1,8 мкм, элуент А: 0,1% H3PO4, элуент Б: ацетонитрил, градиент: 90/10, 20 %/мин., 5/95 (1,75), поток: 2 мл/мин., 55°С.