Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ВЫСОКО ВОДОРАСТВОРИМЫХ ФУЛЛЕРЕНОЛОВ
Вид РИД
Изобретение
Изобретение относится к способам получения водорастворимых гидроксилированных производных фуллеренов (фуллеренолов).
Известно несколько способов получения водорастворимых производных фуллеренов. К наиболее простым и широко используемым способам относятся способы гидроксилирования фуллеренов, растворенных в ароматическом растворителе (бензоле или толуоле) концентрированной щелочью в присутствии катализатора межфазового переноса тетрабутиламмоний гидроксида (ТБАГ) либо полиэтиленгликоля PEG 400 [1]: 1. Chinese Journal of Chemistry, 2004, 22, 1008-1011; [2]: J. Braz. Chem. Soc., 2006, vol. 17, No. 6, p.1186-1190).
Достоинствами способов щелочного гидроксилирования фуллеренов являются простота и быстрота синтеза. Например, согласно работе /1/ процесс проводится на воздухе следующим образом. Бензольный раствор C60 при энергичном перемешивании медленно добавлялся к NaOH и PEG 400 (20 мол. %) при комнатной температуре на воздухе (или в среде N2). При перемешивании наблюдается превращение изначально глубоко фиолетового бензольного раствора в бесцветный за счет перехода гидроксилировавшегося C60 в водную фазу с помощью катализатора фазового переноса PEG 400 и образование черной взвеси за счет того, что содержание образовавшегося фуллеренола превышает его растворимость в данном объеме воды (2 мл). Бензол удаляется упариванием при пониженном давлении. Затем добавляется вода при перемешивании для полного растворения черной взвеси. Для удаления нерастворимого в воде фуллеренола смесь фильтруется. Осадок, полученный после фильтрования, представляет собой низкогидроксилированный водонерастворимый фуллеренол, содержащий 8-9 гидроксильных групп. Фильтрат коричневого цвета упаривается и добавляется к метиловому спирту для осаждения высокогидроксилированного фуллеренола (коричневый цвет). Процесс осаждения повторяется до полного удаления PEG и NaOH. После высушивания при пониженном давлении получился твердый продукт высокогидроксилированного фуллеренола с растворимостью ~ 20 мг/мл, содержащего 27 гидроксильных групп коричневого цвета (выход 80,4% масс.).
Недостатки способа щелочного гидроксилирования описаны в работе [3]: J. Am. Chem. Soc. 2004, 126, 12055-12064). В работе показано, что продуктами щелочного гидроксилирования являются фуллеренолы в виде их солей с щелочными катионами, что предполагает проведение времязатратных процедур по переводу таких солей в бессолевую форму и длительную очистку получаемых препаратов от остатков катализаторов и щелочи. Это обстоятельство является существенным ограничением в широком применении способов щелочного гидроксилирования. Кроме того, наряду с растворимым в воде фуллеренолом образуется существенная доля нерастворимого фуллеренола, то есть фуллеренола с низкой степенью гидроксилирования. Фуллеренолы с числом гидроксильных групп ≤12 в воде практически нерастворимы. Их образование снижает общий выход целевого продукта и усложняет процедуры разделения и очистки.
Для применения фуллеренолов в медицине, биологии и фармацевтике требуются препараты с высокой растворимостью в воде и в бессолевой форме. Имеется несколько путей для синтеза таких фуллеренолов.
Известен способ получения водорастворимых фуллеренолов (с высокой степенью гидроксилирования), свободных от щелочных катионов, описанный в работе [4]: Fullerenes, Nanotubes and Carbon Nanostructures, 2009, vol. 17, issue 4, p.440-456. Способ заключается в следующем. Суспензия порошкообразного C60 в смеси 30% водной H2O2 и 28% водном NH3 перемешивается при 60°C на воздухе в течение 12 часов. В процессе реакции происходит изменение цвета смеси от черного до темно-желтого. После тщательного центрифугирования и декантации раствор был разделен на две части: чистый раствор A и оставшееся твердое вещество B. К раствору A добавлялся этанол для осаждения растворенного вещества. Повторная обработка полученного твердого осадка водой и затем этанолом имела целью повысить чистоту полученного продукта. Получено новое водорастворимое фуллереновое производное состава C60(OH)16(NH2)8(NO2)8 с растворимостью >200 мг/мл в виде порошка желтоватого цвета. Твердое вещество B высушивалось для удаления остаточного NH3 и растворялось в деионизованной воде. Чистый раствор, полученный после центрифугирования и декантации, смешивался с этанолом для осаждения фуллеренола. Получено другое водорастворимое фуллереновое производное состава C60(OH)18(NH2)2(NO2)6 с растворимостью 30 мг/мл в виде порошка желтоватого цвета (0,077 г).
В данной работе установлено, что реакция фуллерена C60 с водным раствором NH3 (28%) при перемешивании как при комнатной температуре, так и нагревании при 60°C не протекает даже в течение нескольких дней. Взаимодействие происходит только в присутствии водного раствора пероксида водорода.
Недостатком способа является образование смеси продуктов сложной структуры, имеющих в своем составе помимо гидроксильных и другие группы, такие как NH2 и NO2., т.е. сложный состав продуктов, что в конечном итоге приводит к низкой производительности способов по целевому компоненту. Кроме того, синтез фуллеренолов с высокой растворимостью в воде (высокогидроксилированных) характеризуется трудностями, связанными с тщательным удалением щелочных реагентов, длительными затратами времени на более глубокое гидроксилирование.
Известен способ получения высоко водорастворимых производных фуллерена C60, описанный в работе [5]: ACS Nano, 2(2), 327-333, 2008 - прототип.
Способ заключается в следующем. На первой стадии получают низкогидроксилированные - нерастворимые фуллеренолы, затем проводят процесс их гидроксилирования - переведение их в водорастворимую форму при нагревании с водным раствором пероксида водорода, после чего водорастворимые фуллеренолы осаждают из спиртового раствора.
Низкогидроксилированный фуллеренол, получают путем гидролиза циклосульфированного производного C60 [6]: J. Org. Chem. 1994, 59, 3960-3968. Циклосульфирование C60 (чистотой 99.9%) осуществляется в неразбавленной дымящей серной кислоте (олеуме) при 55-60°C под азотом N2 для получения полициклосульфированных фуллереновых производных. Гидролиз этих циклосульфированных производных либо в присутствии воды при 85-90°C, либо в растворе NaOH при окружающей температуре дает соответствующие низкогидроксилированные фуллеренолы с выходом, достигающим 80% от исходного C60. По этому способу присоединено в среднем от 10 до 12 гидроксильных групп к фуллерену C60. Полученный в бессолевой форме C60(OH)12 (100 мг) добавляют к 30%-ному раствору пероксида водорода (10 мл). Смесь размешивается в течение 4 дней при 60°C на воздухе, пока суспензия не превращается в прозрачный желтый раствор. После охлаждения раствора добавление смесевого растворителя 2-пропанола, диэтилового эфира и гексана (каждого по 50 мл) постепенно дает осадок белого цвета (стадия осаждения и промывания высокогидроксилированного фуллеренола). После центрифугирования и фильтрации твердый остаток промывался дважды диэтиловым эфиром, высушивался под вакуумом при комнатной температуре в течение 18 ч. Получен C60(OH)36·8H2O (97 мг, 67%) в виде порошка бледного желто-коричневого цвета с растворимостью в воде 17.5 мг/мл. Аналогичная обработка низкогидроксилированного C60(OH)12 (100 мг) 30%-ным раствором пероксида водорода в течение 2 недели при 60°C с последующим осаждением и промыванием дает фуллеренол C60(OH)40·9H2O (103 мг, 68%) в виде порошка молочно-белого цвета с растворимостью в воде 58,9 мг/мл.
Недостатками способа являются необходимость применения опасного реагента (олеума) и проведение дополнительной операции гидролиза щелочью или водой для получения низкогидроксилированного фуллеренола. Это требует длительных затрат времени на проведение этой операции и операций по отмывке продукта от щелочи.
Технический результат заключается в упрощении способа при сохранении качественных характеристик и полноты выделения конечного высокогидроксилированного фуллеренола.
Задачей данного изобретения является исключение опасных реагентов и обеспечение протекания процесса получения низкогидроксилированного фуллеренола без стадии гидролиза и связанных с этим сложностей по отмывке продуктов.
Указанная задача решается тем, что в известном способе получения высоко водорастворимых фуллеренолов, заключающемся в том, что на первой стадии проведения процесса получают низкогидроксилированные нерастворимые фуллеренолы, затем проводят процесс их гидроксилирования - переведение их в водорастворимую форму при нагревании с водным раствором пероксида водорода, после чего водорастворимые фуллеренолы осаждают из спиртового раствора, новым является то, что низкогидроксилированные нерастворимые фуллеренолы получают путем взаимодействия концентрированного раствора фуллерена в о-ксилоле с водным раствором аммиака в присутствии катализатора межфазового переноса тетрабутиламмониевый гидроксид при температуре 35-40°C.
Процесс гидроксилирования низкогидроксилированных нерастворимых фуллеренолов проводят при нагревании и перемешивании с 6-15%-ным водным раствором пероксида водорода в течение 4-5 часов при температуре 65°C.
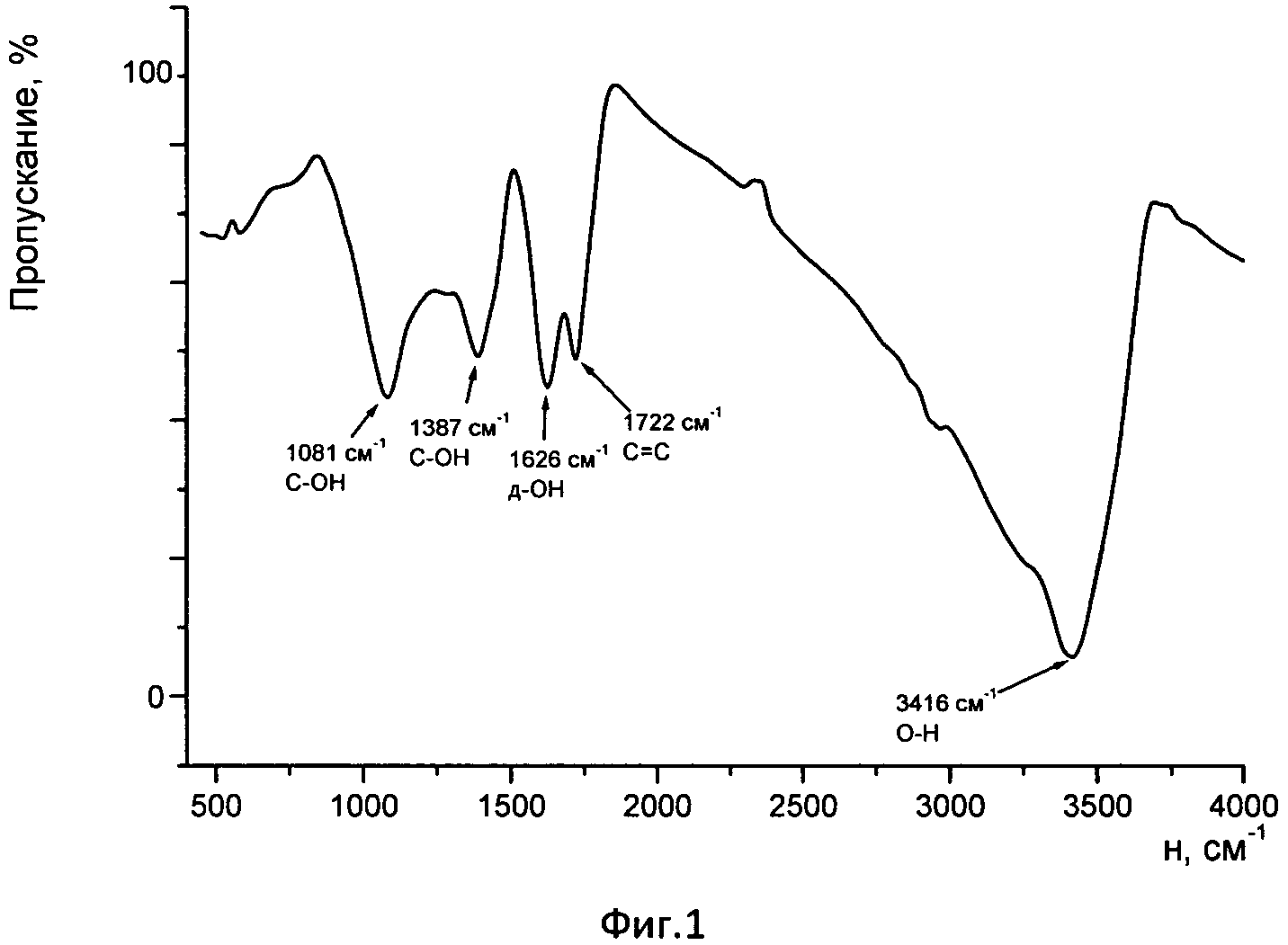
На фиг. 1 представлен FTIR-спектр полученного по заявляемому способу образца низкогидроксилированного фуллеренола по заявляемому способу.
Описание заявляемого способа.
В заявляемом способе низкогидроксилированный фуллеренол получают взаимодействием концентрированного раствора фуллеренов в о-ксилоле с концентрированным (28%-ным) водным раствором аммиака, включающего добавку 20% раствора тетрабутиламмонийгидроксида (ТБАГ) в качестве катализатора межфазового переноса, при перемешивании в анаэробной атмосфере при температуре 35-40°C до обесцвечивания органической фазы (конкретные режимы указаны в примерах реализации способа). Конечными продуктами процесса являются бесцветная или слабо окрашенная органическая фаза (о-ксилол), бесцветная минеральная фаза (водный раствор аммиака) и диспергированная в них твердая фракция. Осадок отделяется через бумажный фильтр, промывается чистым о-ксилолом для удаления непрореагировавшего фуллерена, а затем водой до нейтральной реакции и сушится под вакуумом при температуре 80°C в течение не менее 3 часов. Полученный продукт нерастворим в о-ксилоле и воде. ИК-спектр (KBr) полученного соединения представлен на фиг. 1. Выход продукта составляет 100% от веса исходного фуллерена. Техническим эффектом данного способа является количественный переход фуллерена в низкогидроксилированное состояние с переходом его в твердую фракцию, нерастворимую в воде и органическом растворителе (о-ксилоле). Как показано в работе [4], фуллерен не взаимодействует с аммиаком. Однако в заявляемом способе экспериментально обнаружены условия, при которых протекает гидроксилирование фуллерена в водно-аммиачной среде с образованием низкогидроксилированного фуллеренола. В способах получения фуллеренолов гидроксилированием фуллеренов, растворенных в органическом растворителе, концентрированным раствором щелочи, в качестве растворителей используется толуол, бензол [1], [2]. В них фуллерены имеют низкую растворимость. В заявляемом способе используется о-ксилол, в котором растворимость фуллеренов в несколько раз выше. Применение раствора аммиака вместо олеума упрощает проведение процесса. Поскольку водные растворы аммиака представляют собой газ, растворенный в воде, то аммиачная примесь легко удаляется из целевого продукта простыми приемами: например, сушкой на воздухе, промывкой теплой водой и др. В заявляемом способе твердая фракция, содержащая низкогидроксилированный фуллеренол, очень быстро и эффективно освобождалась от следов водного раствора аммиака и катализатора обычной промывкой дистиллированной водой, при этом устраняются трудности, связанные с тщательным удалением щелочных реагентов в способах-аналогах. Получение на данной стадии низкогидроксилированного фуллеренола позволяет избежать проведения дополнительной стадии гидролиза по сравнению со способом-прототипом. В заявляемом способе экспериментально определено и обосновано, что на полноту перехода фуллерена в низкогидроксилированное состояние под действием водного раствора аммиака влияют: температура и длительность процесса, концентрация 20%-ного водного раствора ТБАГ в минеральной фазе, а также соотношение минеральной и органической фаз в смеси. Полнота перехода фуллерена в низкогидроксилированное состояние определялась по отношению разницы концентраций фуллерена между исходным раствором в о-ксилоле и конечным раствором к концентрации исходного раствора, выраженной в процентах. Результаты исследований представлены в табл. 1-4.
|
|
|
|
Выводы: наибольшая полнота перехода C60 в низкогидроксилированное состояние происходит при температуре процесса 35-40°C, соотношении органической и минеральной фаз, равном 2÷4, концентрации 20%-ного водного раствора ТБАГ в минеральной фазе 20÷40% об., времени синтеза 36÷48 часов. Повышение температуры процесса выше 40°C нецелесообразно, поскольку приводит к интенсивному испарению аммиака из реакционной среды и потерям низкогидроксилированного фуллеренола за счет неконтролируемого его перехода в растворимую в воде часть. Поэтому вышеуказанные условия гидроксилирования фуллерена по заявляемому способу являются необходимыми и достаточными.
Таким образом, получение твердофазного нерастворимого низкогидроксилированного фуллеренола при действии на фуллерен водного раствора аммиака позволяет упростить и ускорить процесс, сохранив при этом полноту выделения продукта (1,5-2 суток против 5-6 суток в способе-прототипе).
Последующее гидроксилирование полученного низкогидроксилированного фуллеренола осуществляется в водном растворе перекиси водорода. В отличие от способа-прототипа нами экспериментально установлено, что гидроксилирование протекает количественно за сравнительно короткое время (1,5-4 часа) при температуре 65°C в интервале концентраций перекиси водорода 6÷15% вес. Это облегчает условия проведения процесса и позволяет избежать ненужных осложнений (катализируемое окисление органической фазы, вспенивание, повышенное газовыделение и т.д.), возникающих при работе с концентрированными (30%-ными) растворами перекиси водорода. Процедура проводится следующим образом. Суспензия полученного низкогидроксилированного фуллеренола в водном растворе H2O2 далее перемешивалась на магнитной мешалке при температуре 65°C в течение 4-5 часов для получения высоко растворимого в воде фуллеренола. Уже через 1-1,5 часа от начала процесса наблюдалось превращение темно-коричневой суспензии в прозрачный раствор коричневого цвета, что свидетельствует о протекании процесса гидроксилирования. По окончании перемешивания раствор отделялся от непрореагировавшего вещества посредством центрифугирования.
Негидроксилированный остаток, как правило, не наблюдался. Жидкая фаза коричневого цвета выливалась в 10-кратную по объему осадительную смесь ИПС-гептан (в объемном соотношении 70÷90/30÷10). Выпавшая взвесь желто-коричневого цвета отделялась центрифугированием, твердый осадок промывался 1-2 раза чистой осадительной смесью для удаления остатков перекиси водорода и сушился. Полученный твердый продукт светло-коричневого цвета представлял собой фуллеренол с высокой степенью гидроксилирования в бессолевой форме и с высокой растворимостью в воде (65,8 мг/мл), pH такого раствора ~ 3. Число гидроксильных групп, установленных методом термического анализа [7. Thermochimica Acta 419 (2004), 97-104], составляет ~ 30. Вследствие того, что получаемый фуллеренол частично растворим в осадительной смеси, не удается достигнуть 100%-ного выхода продукта. Данные ИК-анализа полученного нами продукта (матрица KBr), см-1: 1081, 1387, 1626, 1721, 3415. Фуллеренолы C60(OH)36 и C60(OH)44, полученные по способу-прототипу, имеют следующие характеристические полосы пропускания, см-1: 1080, 1370, 1620, 1720, 3400. Как следует из приведенных наборов характеристических полос, инфракрасные спектры фуллеренола, полученного по заявляемому способу, удовлетворительно согласуются с инфракрасными спектрами фуллеренолов из способа-прототипа.
Примеры воплощения заявляемого способа
Пример 1. 125 мл раствора фуллерена C60 (чистота 99,93%), полученного по способу [8]. пат. РФ №2456233, практически не содержащего оксидных примесей] в о-ксилоле, концентрацией 5,6 мг/мл добавлялись по каплям при интенсивном перемешивании к смеси 52 мл концентрированного водного аммиака и 13 мл 20%-ного ТБАГ в воде при температуре 40°C. Смесь перемешивалась в течение 1,5 суток. Полученная суспензия, состоящая из нерастворимой в воде и в о-ксилоле твердой фазы и смеси о-ксилола и воды, разделялась фильтрованием под разрежением через бумажный фильтр. Твердый осадок промывался дистиллированной водой до нейтральной реакции. Жидкая фаза разделялась на делительной воронке. Верхний органический слой был окрашен в бледный фиолетовый цвет. Концентрация фуллеренов в органической фазе составила 0,5 мг/мл. Нижняя водная фаза - практически бесцветная. Степень перехода C60 составила 91,1%. Вес твердого остатка коричневого цвета 1,08 г.
510,0 мг полученного низкогидроксилированного фуллеренола C60 перемешивались в 20 мл 15%-ной H2O2 в течение 4 часов при температуре 60-65°C. Приблизительно через 1 час черно-коричневая суспензия стала превращаться в темно-коричневый прозрачный раствор. Процесс гидроксилирования сопровождается интенсивным газовыделением и пенообразованием над поверхностью раствора. Газовыделение заканчивается в течение приблизительно 4 часов. После этого полученная смесь отделяется от непрореагировавшего вещества центрифугированием. Как правило, непрореагировавший остаток отсутствует. Жидкая фаза темно-коричневого цвета выливается в 10-кратный объем (200 мл) осадительной смеси растворителей ИПС: гептан (взятых в объемном соотношении 70:30). Сразу же образуется взвесь желтовато-коричневого цвета, которая отделяется от жидкой фазы центрифугированием. Жидкая фаза имеет прозрачный бледно-желтый цвет, что свидетельствует о частичной растворимости высокогидроксилированного фуллеренола в осадительной смеси (порядка 0,2 мг/мл). Твердый остаток промывается еще 1-2 раза чистой осадительной смесью (для удаления следов H2O2) и сушится под разрежением при 80°C. Получен фуллеренол светло-коричневого цвета, соответствующий формуле C60(OH)30 с растворимостью 65,8 мг/мл, в количестве 567 мг (Выход 83,6%). Данные ИК-анализа полученного продукта (матрица KBr), см-1: 1081, 1387, 1626, 1721,3415.
Пример 2. 330 мл о-ксилольного раствора фуллерена C70 (чистота 98, 94%) концентрацией 8,92 мг/мл добавлялись по каплям при интенсивном перемешивании к смеси 132 мл концентрированного водного аммиака и 33 мл 20%-ного ТБАГ в воде при температуре 40°C. Смесь перемешивалась в течение 72 часов до визуального обесцвечивания о-ксилольного раствора. После отделения твердой фазы фильтрованием через бумажный фильтр, промывки ее дистиллированной водой и сушки получен твердый остаток коричневого цвета в количестве 4,35 г. Остаточная концентрация фуллеренов в органической фазе составила 0,24 мг/мл. Полнота перехода фуллерена C70 в низкогидроксилированный продукт составила 97,3%. Методом термической оценки числа заместителей установлено, что полученный продукт соответствует формуле C70(OH)12-14.
2640 мг полученного низкогидроксилированного фуллеренола C70 перемешивались в 132 мл 15%-ной H2O2 при 65°C в течение 4 часов. Непрореагировавшего (негидроксилированного) остатка не обнаружено. Полученный раствор выливался в 10-кратную по объему осадительную смесь ИПС:гептан. Выпавшая суспензия оранжевого цвета отделялась центрифугированием. Твердый остаток сушился до постоянного веса при 70°C. Получено 2500 мг твердого вещества коричневого цвета (выход ~ 60%). Потери фуллеренола C70 за счет частичной растворимости в осадительной смеси составили 340 мг (~ 8%), остальное - за счет деструктивного окисления продукта пероксидом водорода при гидроксилировании. Полученный продукт соответствует формуле C70(OH)32, растворимость 67,0 мг/мл. Данные ИК-анализа полученного продукта (матрица KBr), см-1: 1063, 1380, 1642, 1721, 3423.
Пример 3. Раствор 6,8 мг фуллерена C78 (хроматографическая чистота ~ 95%) в 10 мл о-ксилола добавлялся по каплям к 5 мл минеральной фазы (4 мл концентрированного водного аммиака + 1 мл 20%-ного водного раствора ТБАГ) при интенсивном перемешивании при 40°C. Смесь перемешивалась в течение 72 часов, затем разделялась центрифугированием. Жидкая неорганическая фаза в виде суспензии, окрашенной в коричневый цвет, упаривалась досуха под разрежением и сушилась при 70°C в течение 3 часов. Получено 16 мг продукта коричневого цвета. Полнота перехода фуллерена C78 в низкогидроксилированный продукт составила ~ 100%.
16 мг полученного продукта перемешивали в 5 мл 8%-ной H2O2 при температуре 65°C. В течение 15 минут произошел переход суспензии темно-коричневого цвета, сопровождаемый пенообразованием, в прозрачный раствор. Раствор добавлен к 10-кратному объему осадительной смеси ИПС:гептан (объемное соотношение 25:75). Выпавшую взвесь коричневого цвета отделили центрифугированием, осадок высушили. Вес полученного продукта составил 20,7 мг. ИК-спектр (KBr) фуллеренола C78 показал следующие полосы пропускания, см-1: 1098,1397, 1619, 1721, 3421.
Список литературы
1. Zhang J.-M, Yang W., He P., Zhu S.-Z. Efficient and Convenient Preparation of Water-Soluble Fullerenol. Chinese Journal of Chemistry, 2004, 22, 1008-1011.
2. G.C. Alves′; L.O. Ladeira; A. Righi; K. Krambrock; H.D. Calado; R.P. de Freitas Gil; M.V.B. Pinheiro. Synthesis of C60(OH)18-20 in aqueous alkaline solution under O2-atmosphere. J. Braz. Chem. Soc., 2006, vol.17, No. 6, p.1186-1190.
3. L.O. Husebo, B. Sitharaman, K. Furukawa, T. Kato, and L.J. Wilson. Fullerenols Revisited as Stable Radical Anions. J.Am. Chem. Soc. 2004, 126, 12055-12064).
4. K. Matsubayshi, K. Kokubo, H. Tategaki, S. Kawarama, and T. Oshima. One-step Synthesis of Water-soluble Fullerenols bearing Nitrogen-containing Substituents. Fullerenes, Nanotubes and Carbon Nanostructures, 2009, vol. 17, issue 4, p.440-456.
5. K. Kokubo, K. Matsubayashi, H. Tategaki, H. Takada, and T. Oshima. Facile Synthesis of Highly Water-Soluble Fullerenes More Than Half-Covered by Hydroxyl Groups. ACS Nano, 2(2), 327-333, 2008 - прототип.
6. L.Y. Chiang, L.-Y.Wang, J.W. Swirczewski, S. Soled and S. Cameron. Efficient Synthesis of Polyhydroxylated Fullerene Derivatives via Hydrolysis of Polycyclosulfated Precursors. J. Org. Chem. 1994, 59, 3960-3968.
7. Т.H. Goswami, R. Singh, S. Alam, G.N. Mathur. Thermal analysis: a unique method to estimate the number of substituents in fullerene derivatives. Thermochimica Acta 419 (2004), 97-104.
8. Грушко Ю.С., Седов В.П., Колесник С.Г., пат. РФ №2456233, МПК C01B 31/02.