Результат интеллектуальной деятельности: Способ обработки опухолевых клеток
Вид РИД
Изобретение
Изобретение относится к области молекулярной биологии, исследующей новые возможности для селективной гибели опухолевых клеток без повреждения нормальных.
Предпосылки создания изобретения.
Нормальное развитие тканей поддерживается балансом между процессами клеточного деления и гибелью клеток. Нарушение баланса вызывает или быстрый рост нежелательных и потенциально опасных (вредных) клеток, и/или потерю клеток, необходимых для сохранения функций тканей. И то и другое может приводить к опасным для жизни заболеваниям. Несмотря на то, что молекулярная биология обеспечивает новые возможности для селективной гибели опухолевых клеток без повреждения нормальных, текущая клиническая химиотерапия все еще использует преимущественно агенты, которые убивают быстро делящиеся клетки без относительно того - нормальная эта клетка или опухолевая. Между тем, опухолевые клетки обладают уникальной биоэнергетической особенностью - аэробным гликолизом, который является привлекательной терапевтической мишенью при обработке опухолей. Реверсия гликолитического фенотипа может запускать апоптоз в опухолевых клетках. Известно, что натриевая соль дихлоруксусной кислоты (ДХА) ингибирует киназу пируватдегидрогеназы (PDK), увеличивает поток пирувата в митохондрии, снижает продукцию лактата и увеличивает уровень АФК и АТФ, это приводит к активации митохондриального апоптоза (програмированной клеточной гибели) в опухолях и ингибированию роста опухолей как in vitro, так и in vivo (Michelakis ED, Webster L, Mackey JR Br J Cancer. 2008; 99(7): 989-94) [l].
Известен способ обработки опухолевых клеток с использованием дихлорацетата, описанный в патенте WO 2006108276 «А Method of treating cancer using Dichloroacetate», приоритет 2005-04-11 [2]. Способность ДХА активировать пируватдегидрогеназный комплекс (PDC), ингибируя PDK в опухолевых клетках, обеспечило механистически рациональное обоснование антиопухолевой активности этого соединения. Его противоопухолевая активность в качестве индуктора апоптоза опухолевых клеток доказана в экспериментальных работах (Madhok ВМ, Yeluril S, Perry SL, et al. 2010. British Journal of Cancer. 102, 1746-52 [3]. При этом антипролиферативный эффект, прямым следствием которого является апоптоз, а следовательно, и протвопухолевая активность, наблюдается только при высоких дозах ДХА как in vitro, так и in vivo.
Терапевтически эффективные концентрации ДХА индуцируют нейрологическую токсичность, поэтому использование ДХА в качестве антиопухолевого препарата на людях ограничено. Кроме того, показано, что при высоких концентрациях селективность действия препарата снижается или исчезает (Stockwin LH, Yu SX, Borgel S. 2010. Int. J. Cancer; 127(11): 2510-9) [4].
Для повышения эффективности ДХА используют сочетанное воздействие его с различными препаратами. Показан синергический противоопухолевых эффект ДХА в сочетании с 5-флуороурацилом - химиотерапевтическим агентом, который так же, как и ДХА, имеет побочные эффекты при использовании в эффективных дозах. (Tong J, Xie G, He J, et. al. J Biomed Biotechnol. 2011: 740564) [5].
Кофеин является метилксантином (1,3,7-trimethylxanthine), ингибирует активность протеин киназ, включая ATM и ATR, вовлеченных в регуляцию прогрессии клеток по циклу и апоптоз, индуцированный повреждениями ДНК (Goodarzi et. al. Prog. Cell Cycle Res.; 5: 393-411 [6]. Известно, что кофеин потенциирует цитотоксичность ионизирующего излучения и ряда препаратов (Wang G *, Bhoopalan V, Wang D, et. al. 2015 Experimental Hematology & Oncology, 4:5) [7]. Показано также, что кофеин снимает радиационно-индуцированной блокирование клеток в S и G2 фазах цикла в цикле, но потенциирует цитотоксичность только в одной клеточной линии (Musk S.R.R. 1991. Rad. Res. 125. 262-266) [8]. Несмотря на то, что многие эффекты кофеина зарегистрированы, остается невыясненным, что вносит вклад в его фармакологический профиль.
В качестве прототипа рассмотрен способ обработки опухолевых клеток, описанный в патенте РФ 2484814 «Фармацевтическая композиция для лечения онкологических заболеваний» (Круглый Б.И., Тюляев А.И. Патент РФ 2484814 [9].
Способ заключается в том, что на опухолевые клетки действуют комбинированной композицией на основе дихлорацетата натрия, содержащей также метилксантины: такие как теобромин (3,7-диметилксантин), или кофеин (1,3,7-триметилксантин) или параксантин (1,7-диметилксантин). При этом отношение дихлорацетата натрия к выбранной из указанных метальной производной ксантина составляет 1:1-10:1. Фармацевтическая композиция обеспечивает синергетический эффект.
Оценка противоопухолевой активности (цитотоксичности) производилась по метаболической активности с использованием МТТ-теста, основанного на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в окрашенный формазан, который кристаллизуется внутри клетки. Растворение формазана с помощью диметилсульфоксида (ДМСО) позволяет осуществить фотометрию и фиксировать изменение оптического поглощения раствора, коррелирующее с метаболической активностью клеточной линии. МТТ-тест является индикатором функции митохондрий в жизнеспособных клетках, нарушение метаболической функции клеток, как правило, сопряжено с последующим снижением их жизнеспособности. Фармацевтическая композиция обеспечивает синергетический эффект, т.е усиление противоопухолевой активности ДХА метилксантинами.
Недостатки прототипа. Противоопухолевый эффект фармацевтической композиции достигается при довольно высоких концентрациях метилксантинов 16 мМ, которые могут убить неопухолевые клетки.
К тому же не доказано действие фармацевтической композиции на неопухолевые клетки.
Кроме того, оценка противоопухолевой активности, проводимая по нарушению метаболической функции клеток, сопряженной с последующим снижением их жизнеспособности, не обязательно связана с апоптотической формой гибели опухолевых клеток, например, это может быть некроз, который, в свою очередь, может приводить к интоксикации.
Технический результат заявляемого изобретения - создание способа, который щадил бы здоровые клетки и обеспечивал более высокую противоопухолевую активность и селективность действия ДХА за счет повышения уровня апоптоза опухолевых клеток при снижении токсических последствий в неопухолевых клетках.
Задача - достичь снижения концентраций метилкстантина в комбинированной обработке с ДХА и обеспечить адекватный метод оценки апоптотической гибели клеток в сравнительном исследовании на опухолевых и неопухолевых клеточных линиях человека.
Технический результат достигается тем, что в известном способе обработки опухолевых клеток, основанном на оценке эффективности комбинированного воздействия на опухолевые клетки композицией, обладающей противоопухолевой активностью, содержащей дихлорацетат натрия (ДХА) и метилксантины, и последующей оценке противоопухолевой активности, новым является то, что в качестве метилксантинов в композиции, комбинированно воздействующей на опухолевые клетки, используют кофеин бензоат натрия при следующем соотношении компонентов 20 мМ дихлорацетат натрия : 7 мМ кофеин бензоат натрия, а измерение противоопухолевой активности основано на регистрации распределения клеток по содержанию ДНК, подтверждающей апоптоз опухолевых клеток, причем эффективность комбинированного воздействия оценивается по уровню клеток с содержанием ДНК меньше диплоидного набора (суб-G1 популяция), появляющихся в результате фрагментации ядер апоптотически гибнущих клеток.
Заявляемая совокупность признаков не известна из открытых источников информации и обнаружена авторами экспериментально.
Для пояснения сущности изобретения представлены следующие графические материалы.
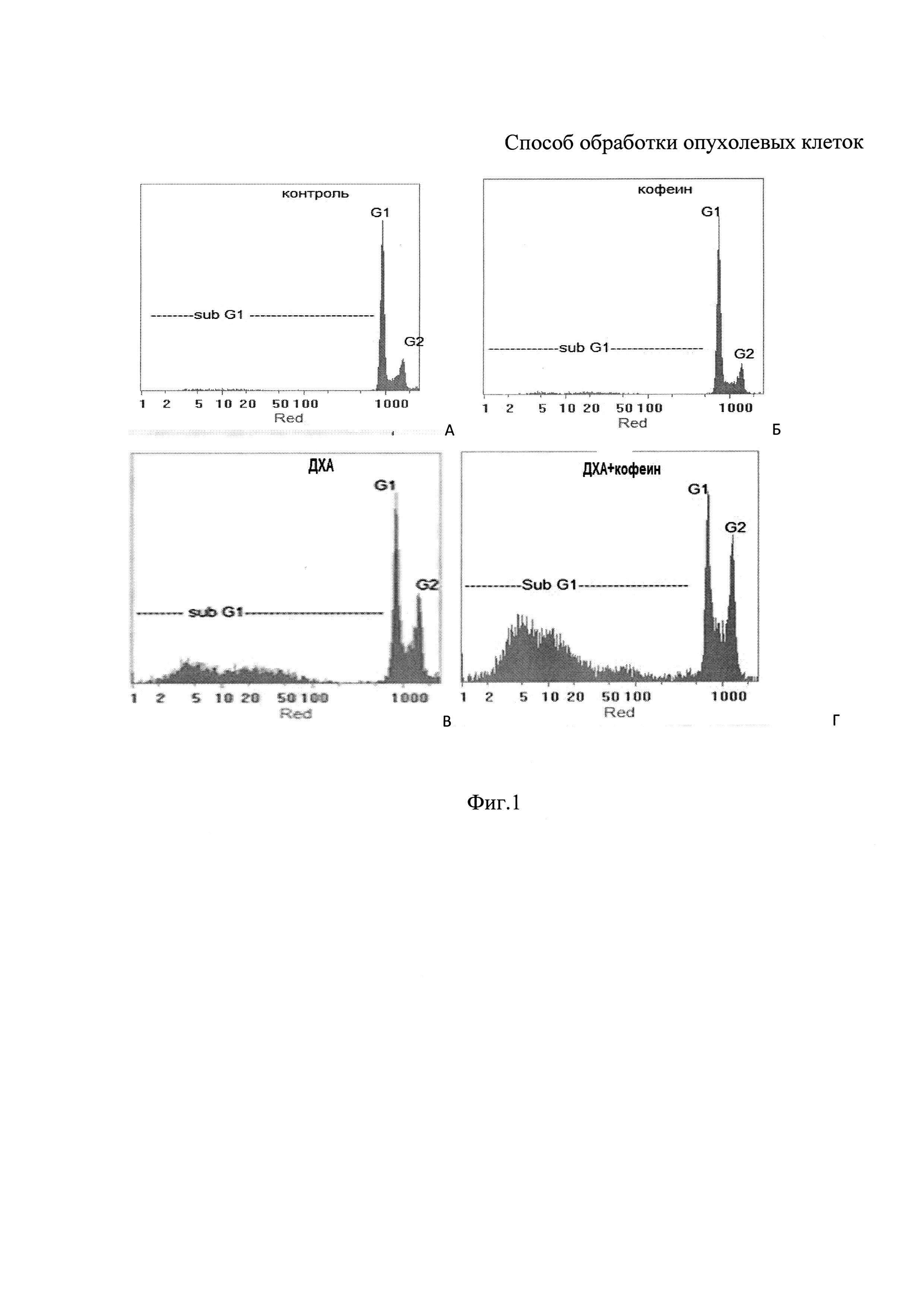
На фиг. 1 представлены гистограммы распределения клеток HeLa G 63 по содержанию ДНК, полученные при цитометрическом анализе состава клеточной популяции: без обработки клеток (контроль фиг. 1А), после 48 ч обработки 7 мМ кофеин бензоатом натрия (фиг. 1Б); 20 мМ ДХА натрия (фиг. 1В); 20 мМ/л ДХА натрия + 7 мМ/k кофеин бензоатом натрия (фиг. 1Г) - заявляемый способ.
Из гистограмм видно, по регистрации суб-G1 популяция, что обработка клеток кофеин бензоатом натрия в концентрации 7 мМ (Б) не индуцирует гибели клеток по сравнению к необработанному контролю (А). Обработка клеток ДХА в конц. 20 мМ (В) несколько увеличивает гибель, а при комбинированной обработке клеток ДХА натрия + кофеин бензоатом гибель клеток существенно возрастала (Г).
На фиг. 2 представлены диаграммы трех независимых экспериментов по оценке эффективности отдельных компонентов и комбинированной 45-часовой обработки клеток HeLa G 63: 20 мМ ДХА натрия; 7 мМ кофеин бензоатом натрия; ДХА натрия + кофеин бензоатом натрия. Из диаграмм видно, что уровень апоптотически гибнущих клеток HeLa G 63 после комбинированного воздействия возрастал более чем в 2 раза по сравнению раздельным воздействием либо ДХА, либо кофеин бензоатом натрия.
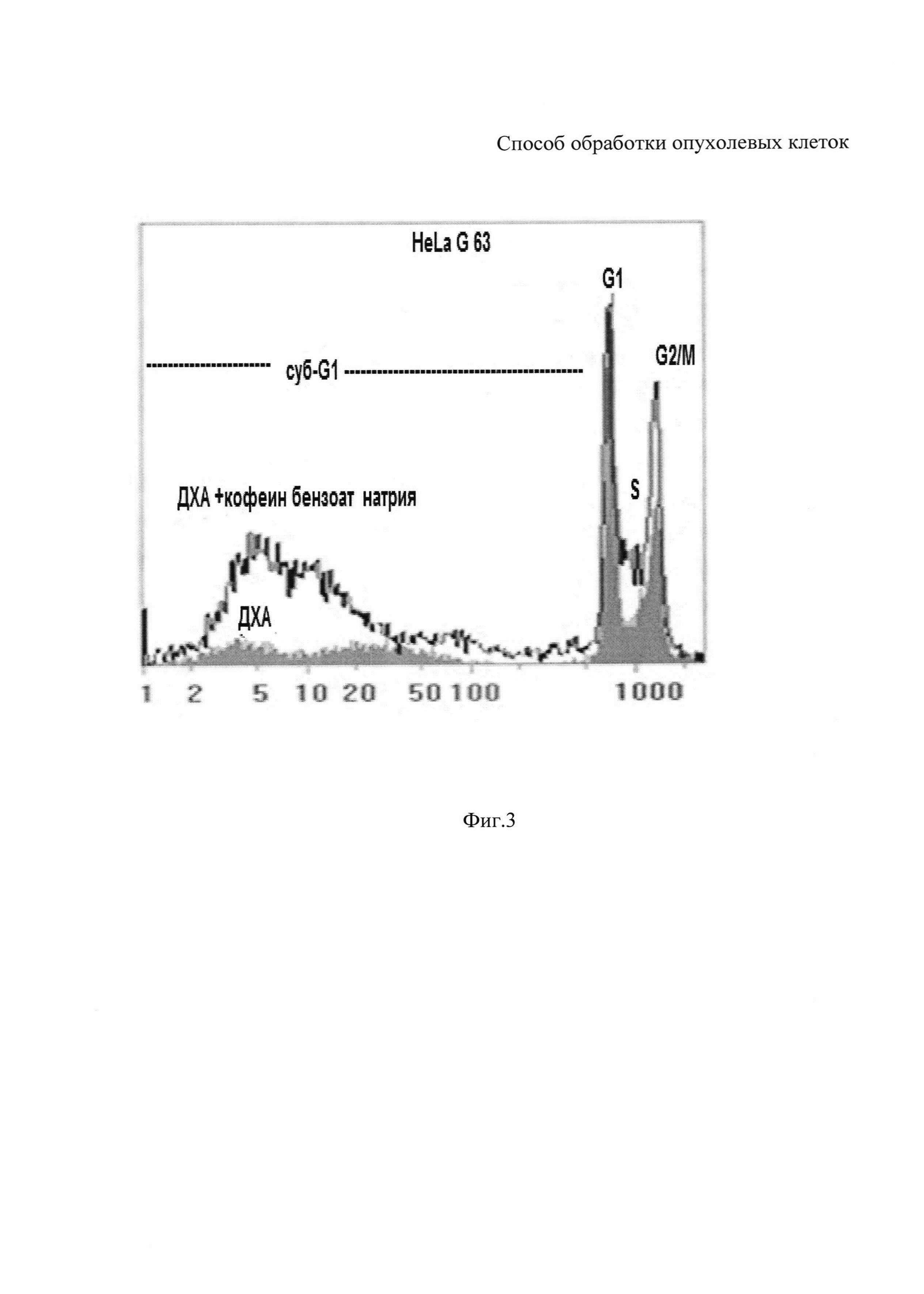
На фиг. 3 представлена гистограмма распределения клеток по содержанию ДНК после обработки клеток HeLa G 63 только 20 мМ ДХА натрия и после совместной обработки 20 мМ ДХА натрия + 7 мМ кофеина бензоата натрия. Комбинированная обработка клеток ДХА натрия и кофеин бензоатом натрия увеличивала суб-G1 (<2с) популяцию (долю апоптотически гибнущих клеток) и нарушала пролиферацию клеток, что проявлялось в увеличении доли клеток в S (3с) и G2/M (4с) фазах клеточного цикла.
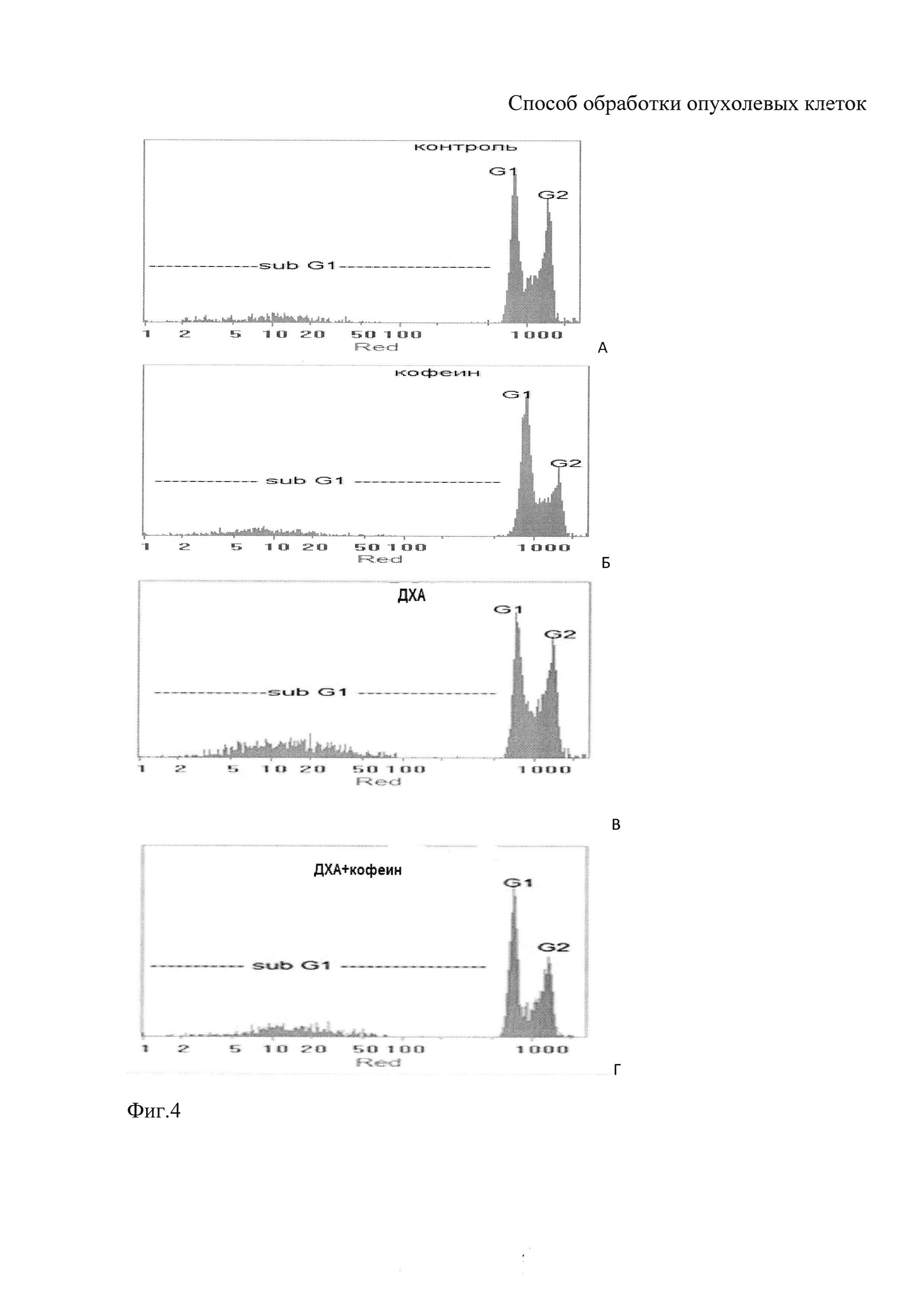
На фиг. 4 представлены гистограммы распределения клеток ECV 304 по содержанию ДНК, полученные при цитометрическом анализе состава клеточной популяции без обработки клеток (контроль фиг. 4А); после 48 ч обработки 7 мМ кофеин бензоатом натрия (фиг. 4Б): 20 мМ ДХА натрия (фиг. 4В); 20 мМ ДХА натрия + 7 мМ кофеин бензоатом натрия (фиг. 4Г).
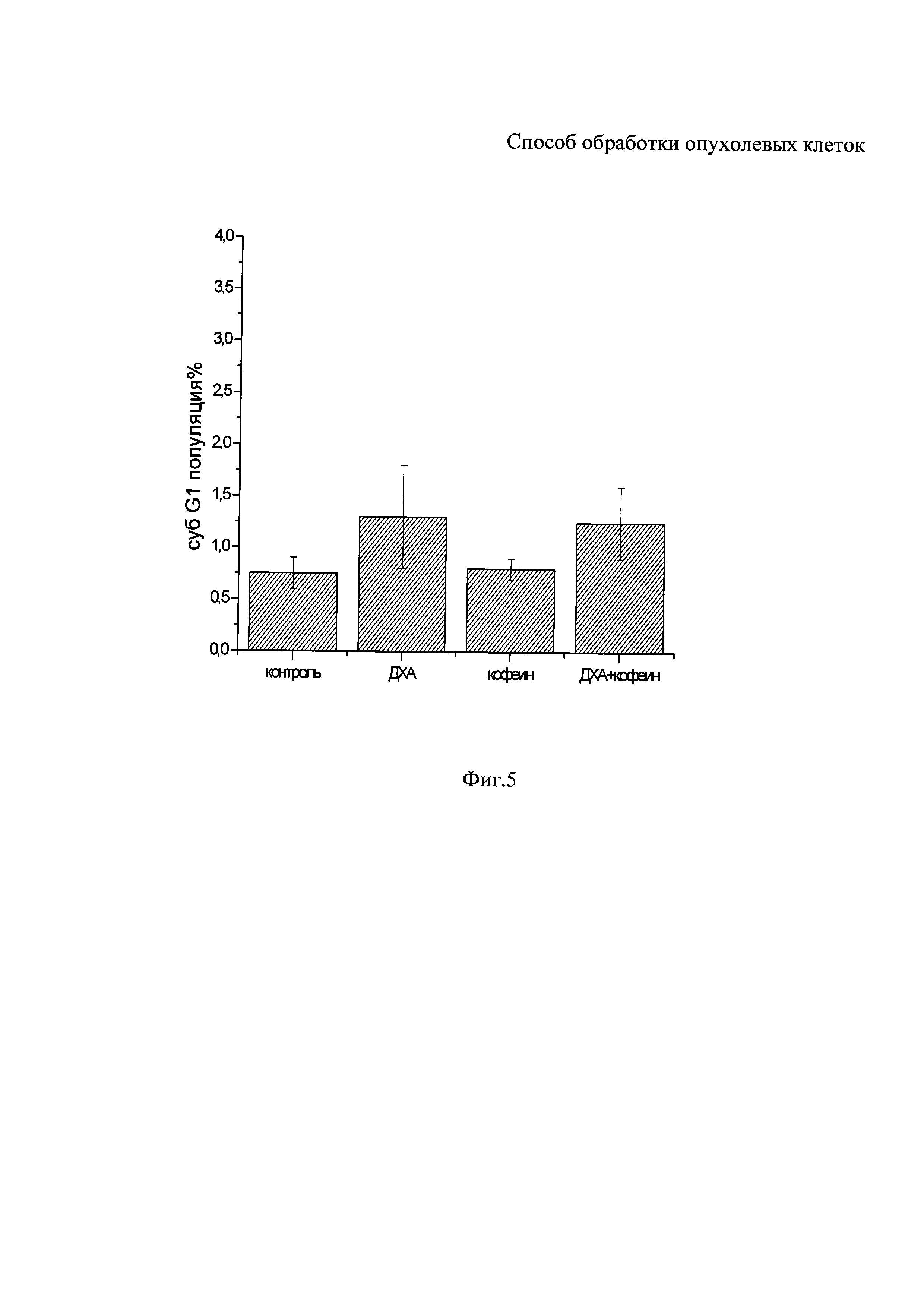
Как видно из гистограмм, несмотря на то, что базальный уровень (не индуцированный) суб-G1 популяции в этом эксперименте несколько выше, чем в аналогичном эксперименте на клетках HeLa G 63, обработка клеток 7 мМ кофеина бензоата натрия (Б) не увеличивала суб-G1 (<2с) популяцию, но комбинированная обработка клеток ДХА натрия + кофеин бензоатом натрия не приводит к увеличению уровня клеток с содержанием ДНК меньше 2с (Г), несмотря на то, что в этом эксперименте обработка клеток ДХА несколько увеличивала суб-G1 (В), очевидно, что синергетический эффект композиции не проявляется на неопухолевой клеточной линии эндотелиоцитов.
На фиг. 5 представлены диаграммы трех независимых экспериментов по оценке эффективности отдельной и комбинированной 45-часовой обработки клеток ECV 304: 20 мМ ДХА натрия, 7 мМ кофеин бензоатом натрия, и ДХА натрия + кофеин бензоатом натрия, из которых видно, что комбинированная обработка ДХА натрия + кофеин бензоатом натрия не приводит к увеличению апоптотической гибели эндотелиальных клеток ECV 304, в отличие от клеток карциномы HeLa G 63, что указывает на селективность действия данного способа обработки клеток.
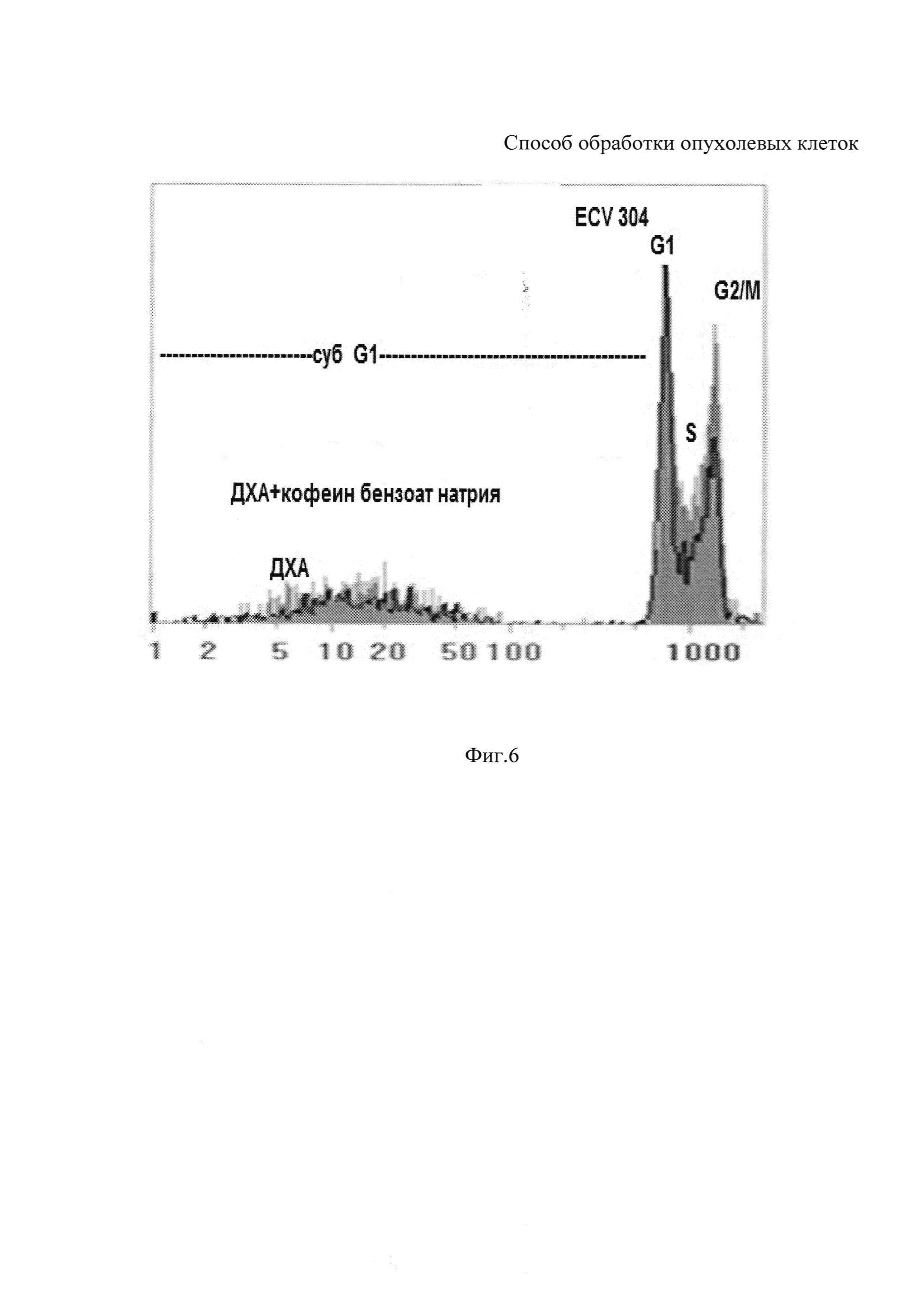
На фиг. 6. представлена гистограмма распределения клеток по содержанию ДНК после обработки клеток ECV 304: только 20 мМ ДХА натрия; и после комбинированной обработки 20 мМ ДХА натрия + 7 мМ кофеин бензоатом натрия. Комбинированная обработка клеток ДХА натрия + кофеин бензоатом натрия не приводила к увеличению уровня клеток с содержанием ДНК меньше 2с (суб-G1) популяцию (апоптоз), но ингибировала пролиферацию клеток ECV 304, снижая уровень клеток в S и G2/M фазах клеточного цикла. Это подтверждает, что заявляемый способ обработки проявляет селективность в отношении опухолевых клеток HeLa G 63 и не индуцирует апоптотической гибели неопухолевых клеток ECV 304.
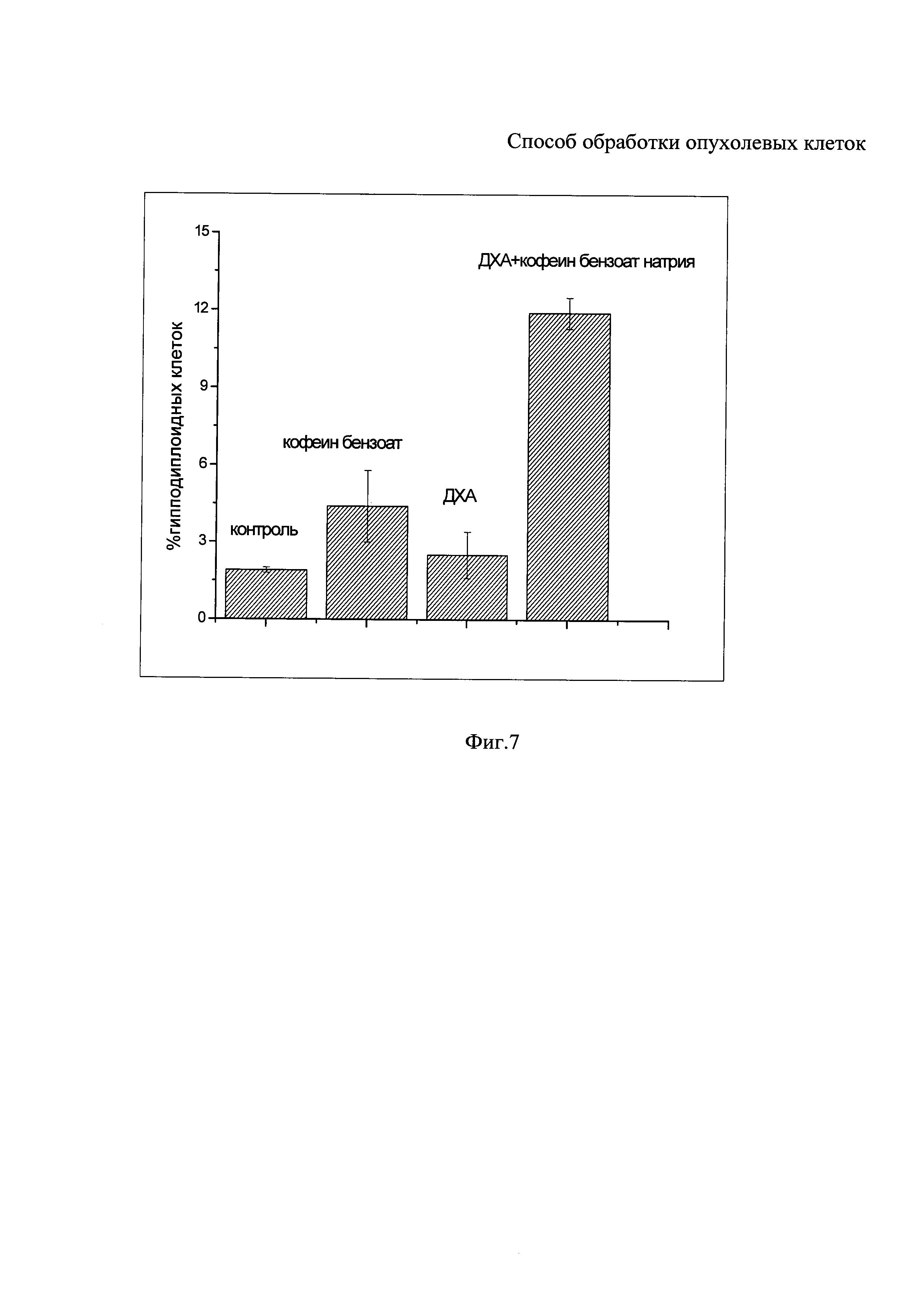
На фиг. 7 представлены диаграммы трех независимых экспериментов по оценке индукции апоптотической гибели клеток гепатомы человека линии HepG2 после 24-часовой инкубации отдельно с каждым из исследуемых агентов и после комбинированной обработке 20 мМ ДХА + 7 мМ кофеин бензоатом натрия. Клетки гепатомы человека линии HepG2 проявили большую чувствительность к комбинированной обработке, чем клетки HeLa G 63. Гибель клеток (суб-G1 популяция) наглядно проявлялась даже через 24 часа после комбинированной обработки клеток, что подтверждает противоопухолевую активность, т.е. эффективность заявляемого способа обработки опухолевых клеток.
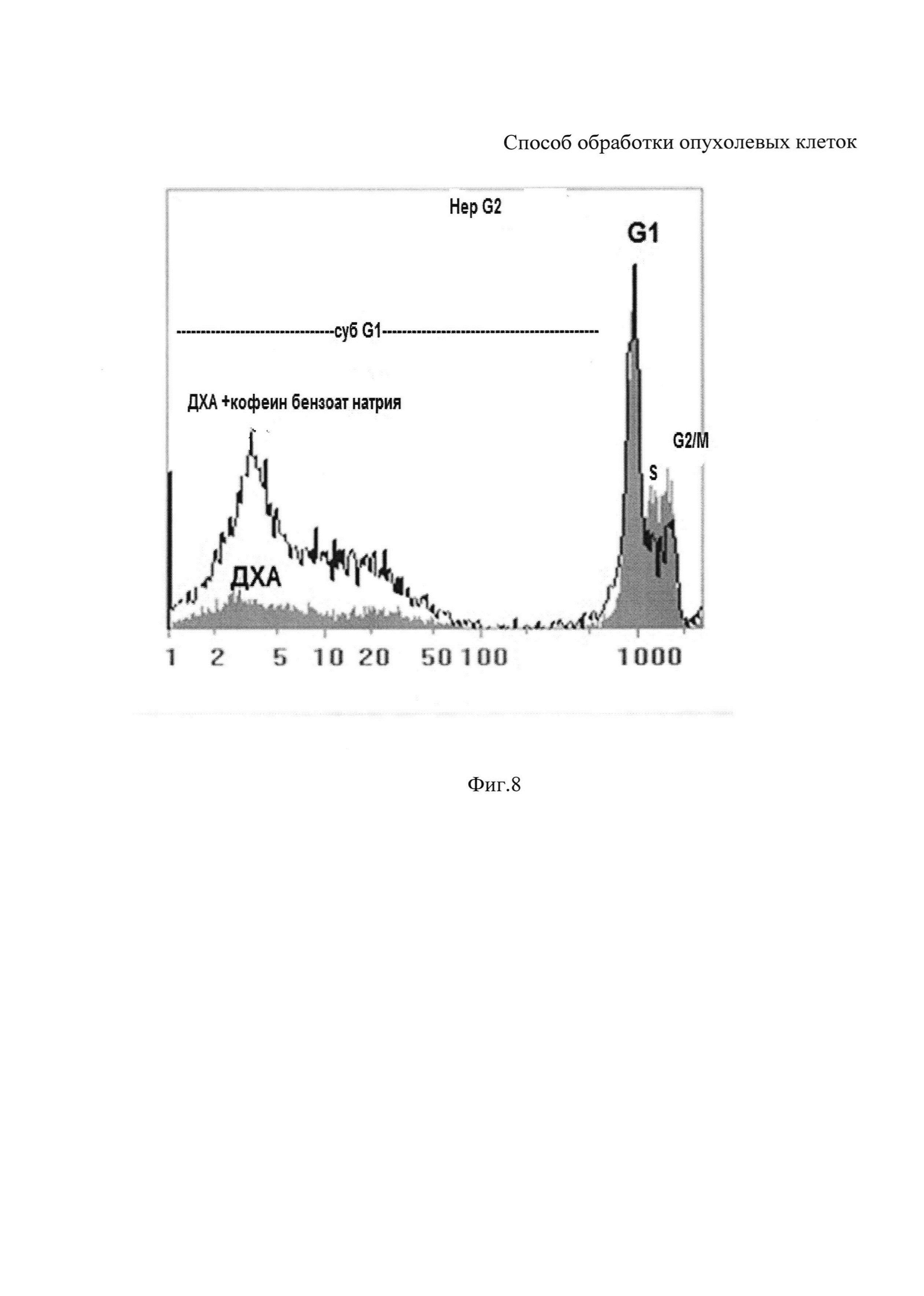
На фиг. 8 представлена гистограмма распределения клеток по содержанию ДНК после обработки клеток гепатомы человека линии HepG2 : 20 мМ ДХА натрия; после комбинированной обработки 20 мМ ДХА + 7 мМ кофеин бензоатом натрия. Комбинированная обработка клеток ДХА натрия + кофеин бензоатом натрия приводила к увеличению уровня клеток с содержанием ДНК меньше 2с (суб-G1 популяцию (апоптоз), и ингибировала пролиферацию клеток HepG2, снижая уровень клеток в S и G2/M фазах клеточного цикла. Данные, полученные на клетках гепатомы человека линии HepG2, также подтверждают выводы о более высокой селективной эффективности способа и предполагают варьирование продолжительностью воздействия в зависимости от типа опухолевых клеток.
На представленных диаграммах (фиг. 2, 5, 7) приводятся данные исследований, на трех линия клеток человека, подтверждающие выводы об усилении селективной эффективности ДХА при обработке опухолевых клеток.
Примеры конкретной реализации способа
Объекты исследования: клетки эпителиоидной карциномы шейки матки линии HeLa G 63, эндотелиальные клетки человека линия ECV 304, гепатомы человека линии Hep G2.
Режим воздействия на клетки: инкубации в течение 24 часов и/или 48 часов с 20 мМ дихлорацетатом натрия (отдельно), 7 мМ кофеин бензоатом натрия (отдельно), ДХА натрия и кофеин бензоатом натрия (совместно) и без этих агентов (контроль).
В отличие от кофеина кофеин бензонат натрия имеет еще преимущество в том, что лучше растворяется в питательной среде, да и сам бензоат натрия подавляет в клетках активность ферментов, ответственных за окислительно-восстановительные реакции, вызывает дисфункции митохондриальных ДНК, т.е. действует однонаправленно с ДХА.
Оценка противоопухолевой активности производилась с помощью проточно-цитометрического анализа состава клеточной популяции. Анализировали изменения в распределении клеток по содержанию ДНК после 24- и 48-часовой инкубации клеток отдельно с каждым из исследуемых агентов и при их совместной обработке. Клетки инкубировали в течение 10 минут в гипотоническом растворе этидиум бромида, который количественно связывается с ДНК клеток, и клеточную суспензию анализировали на проточном цитометре. Распределения клеток по содержанию ДНК позволяет проследить за прогрессией клеток по циклу: 2с - G1-фаза; 3с - S-фаза; 4с - G2/М-фазы. Оценка противоопухолевой активности проведена по уровню клеток с содержанием ДНК меньше диплоидного (<2с или sub-G1-популяцию), которые появляются в результате фрагментации ядра в процессе апоптотической гибели клеток (Watson J V. 2005) [10] в отличие от прототипа.
Таким образом, данный способ подтверждает, что совместное биологическое действие низких концентраций ДХА и кофеин бензоата натрия обеспечивает высокий (более чем в 2 раза) синергетический эффект и только в отношении опухолевых клеток (HeLa G 63 и Hep G2) в противоположность прототипу.
Наиболее эффективная концентрация метилксантинов в прототипе 16 мМ, в заявляемом способе 7 мМ, что позволяет значительно уменьшить терапевтическую дозу препарата и избежать возможных побочных эффектов. Противоопухолевая активность в заявляемом способе оценивалась по фрагментации ядер (последняя стадия апоптоза), а не по метаболической активности (как в прототипе), что более точно отражает апоптотическую гибель клеток, а селективность способа выражается в отсутствии синергетического эффекта при обработке неопухолевых эндотелиальных клеток человека линии ECV 304 (фиг. 4, 5, 6).
Заявляемый способ может быть применим в доклинических исследованиях и в научных разработках при изучении механизмов действия ингибиторов гликолиза.
Список литературы
1. Michelakis ED, Webster L, Mackey JR. 2008.. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer. 99(7): 989-942.
2. Archer S., Michelakis E. Патент WO/2006/108276 «A METHOD OF TREATING CANCER USING DICHLOROACETATE.
3. Madhok BM, Yeluri1 S, Perry SL, et al. 2010. Dichloroacetate induces apoptosis and cell-cycle arrest in colorectal cancer cells. British Journal of Cancer. 102, 1746-52.
4. Stockwin LH, Yu SX, Borgel S, et. al. 2010. Sodium Dichloroacetate (DCA) selectively targets cells with defects in the mitochondrial ETC. Int J Cancer; 127. 11, 2510-9.
5. Tong J, Xie G, He J, et. al. 2011. Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer. J Biomed Biotechnol.: 740564.
6. Goodarzi AA, Block WD, Lees-Miller SP. 2003. The role of ATM and ATR in DNA damage-induced cell cycle control. Prog Cell Cycle Res.; 5: 393-411.
7. Wang G *, Bhoopalan V, Wang D, et. al. 2015. The effect of caffeine on cisplatin-induced apoptosis of lung cancer cells. Experimental Hematology & Oncology, 4: 5.
8. Musk S.R.R. 1991. Reduction of Radiation-Induced cell Cycle blocks by caffeine does not necessarily lead to increased cell killing. Rad. Res. 125. 262-266.
9. Круглый Б.И., Тюляев А.И. патент РФ 2484814 «Фармацевтическая композиция для лечения онкологических заболеваний» - прототип.
10. Watson J V 2005. Flow Cytometry Data Analysis: Basic Concepts and Statistics).
Способ обработки опухолевых клеток, основанный на оценке эффективности комбинированного воздействия на опухолевые клетки композицией, обладающей противоопухолевой активностью, содержащей дихлорацетат натрия (ДХА) и метилксантины, и последующей оценке противоопухолевой активности, отличающийся тем, что в качестве метилксантинов в композиции, комбинированно воздействующей на опухолевые клетки, используют кофеин бензоат натрия при следующем соотношении компонентов 20 мМ дихлорацетат натрия: 7 мМ кофеин бензоат натрия, а измерение противоопухолевой активности основано на распределении клеток по содержанию ДНК, подтверждающему апоптоз опухолевых клеток, причем эффективность комбинированного воздействия оценивают по уровню клеток с содержанием ДНК меньше диплоидного набора (суб-G1 популяция), появляющихся в результате фрагментации ядер апоптотически гибнущих клеток.