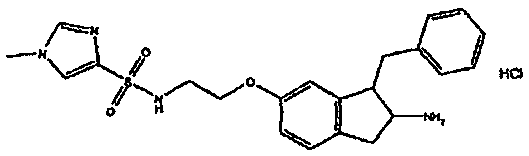
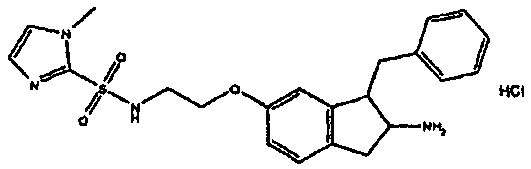
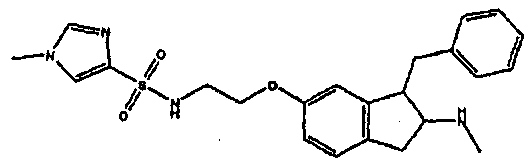
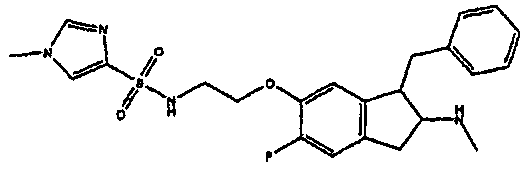
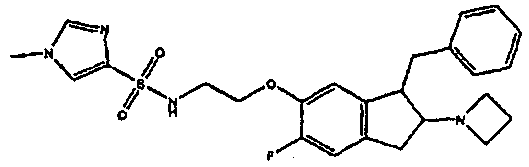
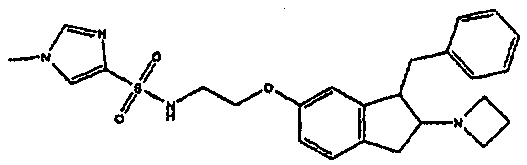
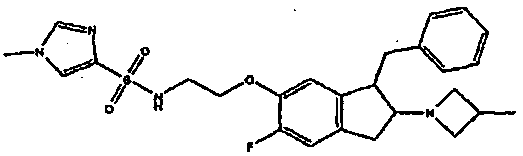
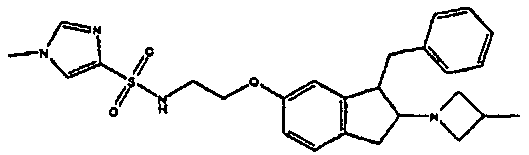
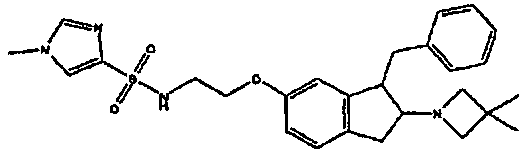
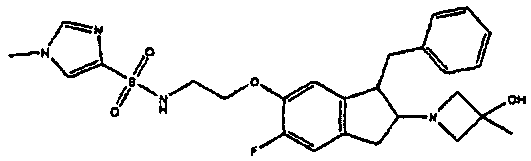
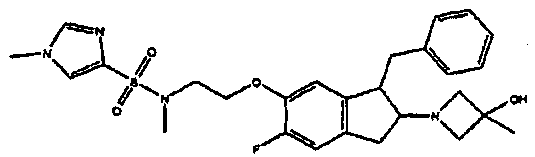
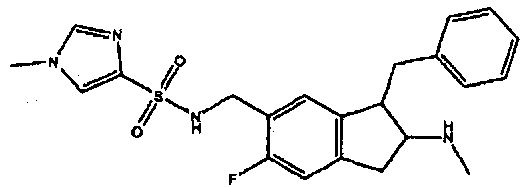
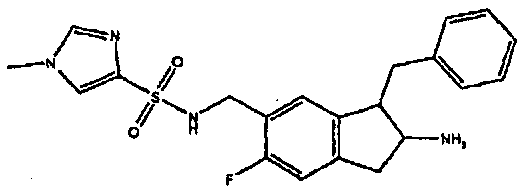
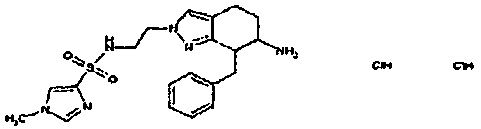
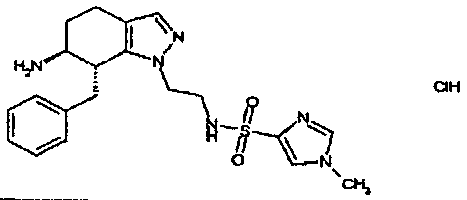
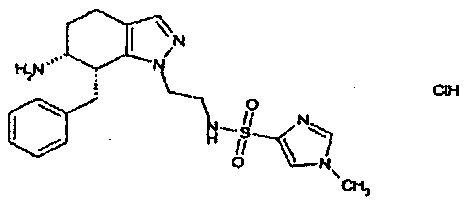
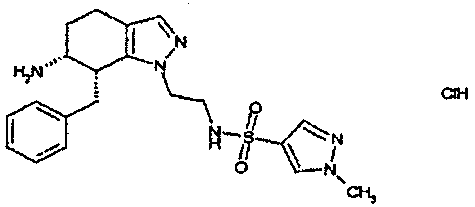
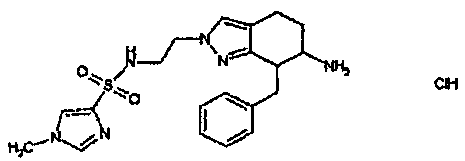
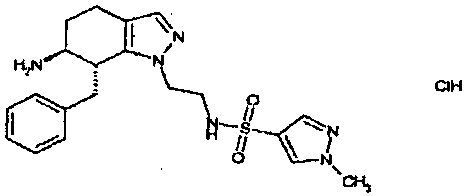
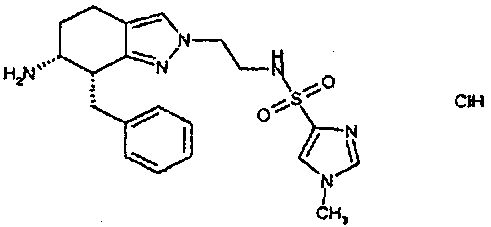
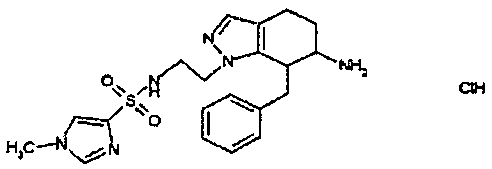
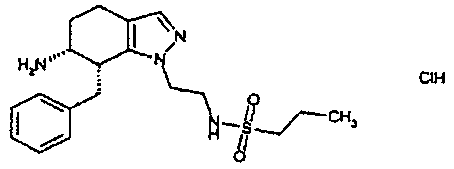
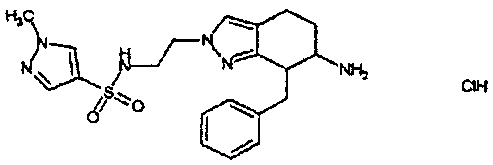
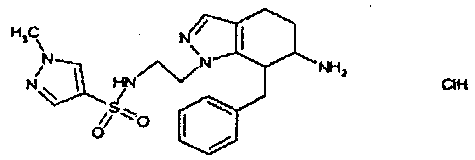
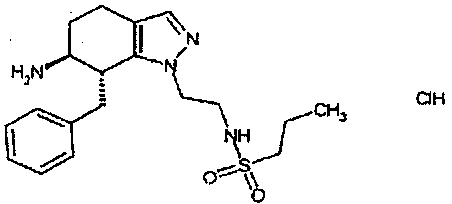
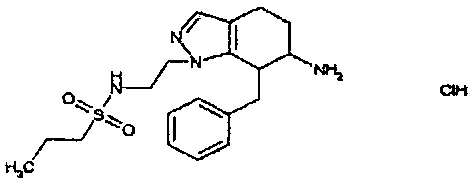
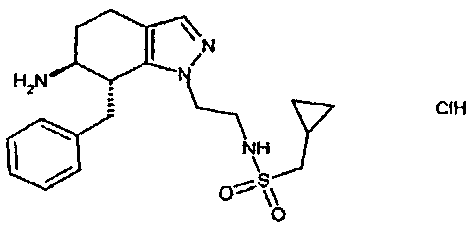
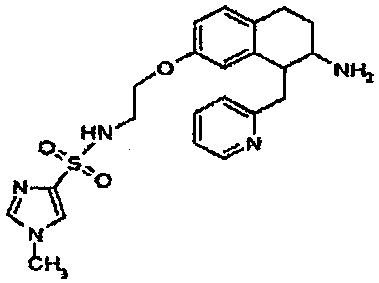
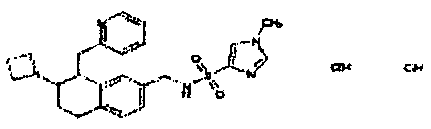
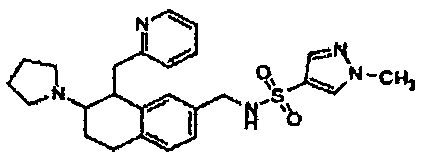
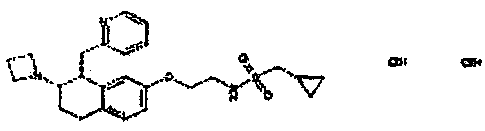
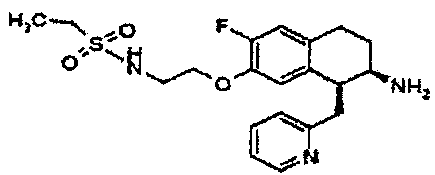
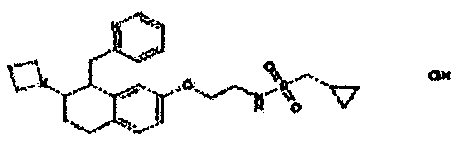
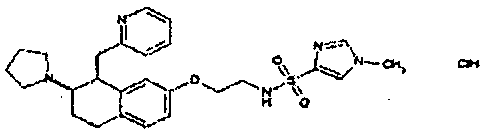
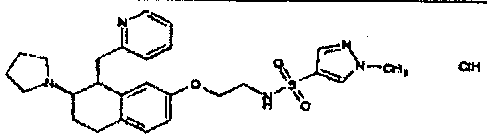
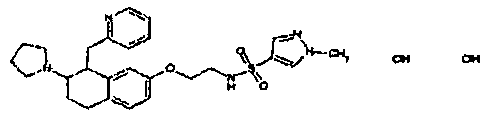
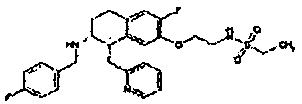
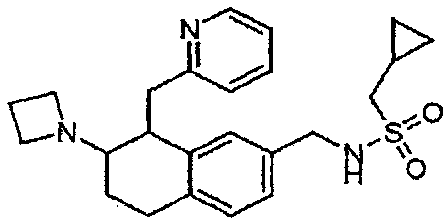
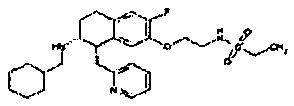
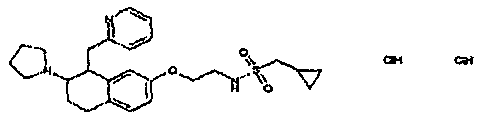
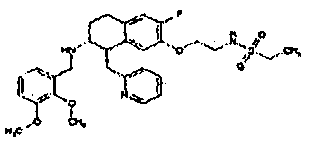
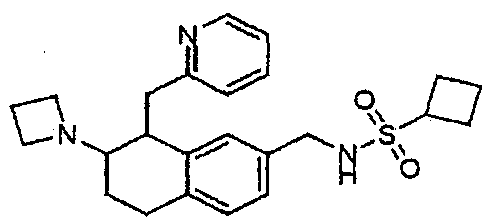
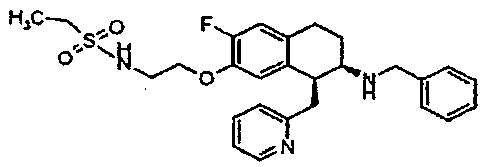
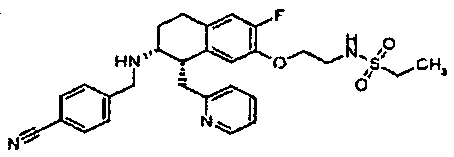
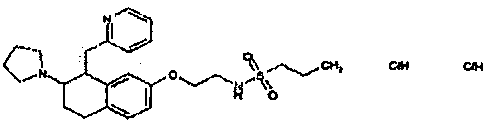
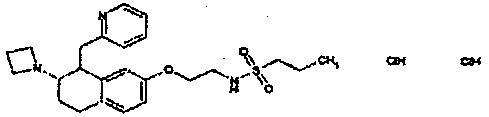
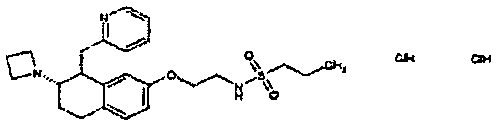
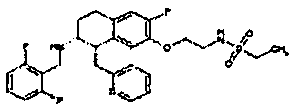
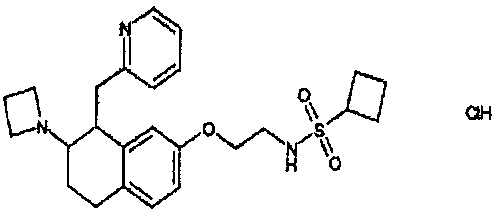
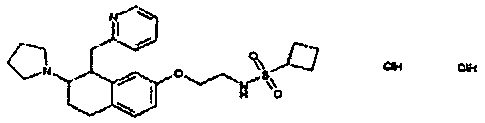
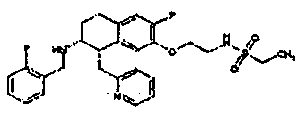
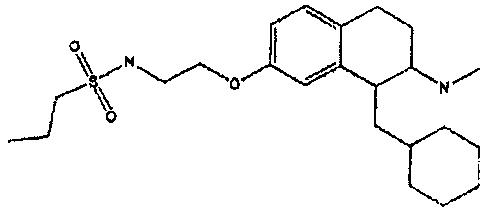
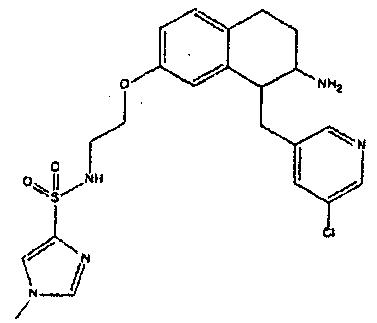
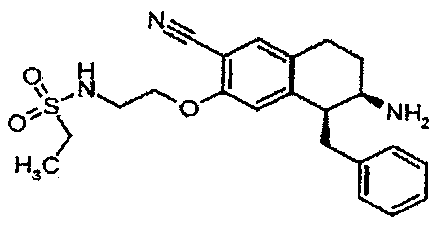
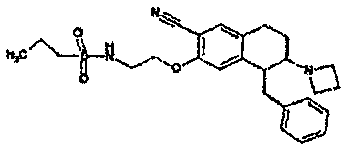
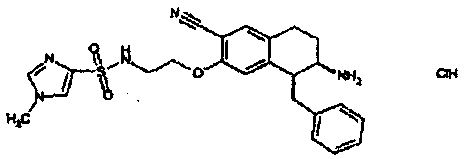
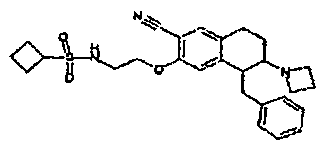
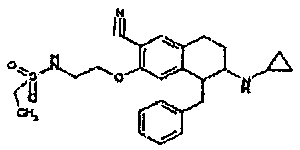
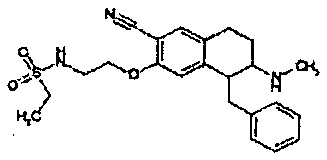
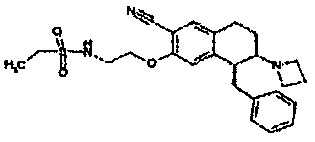
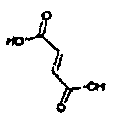
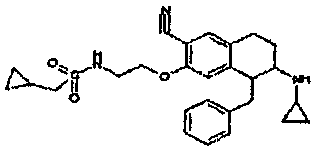
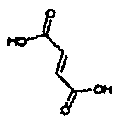
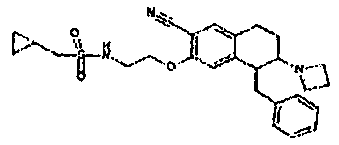
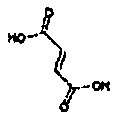
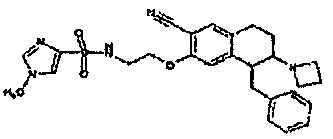
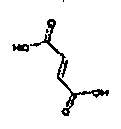
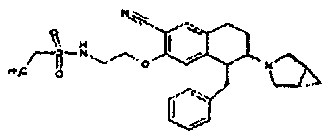
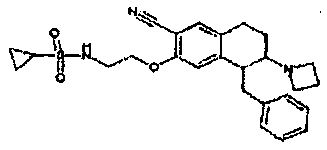
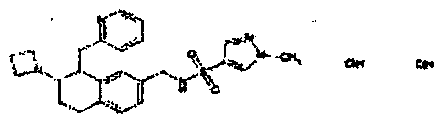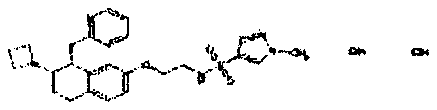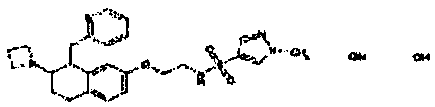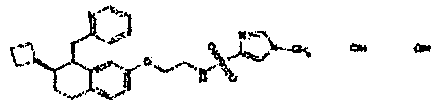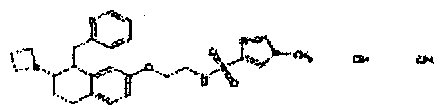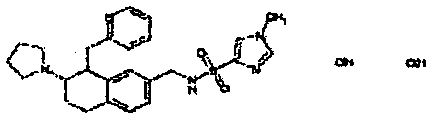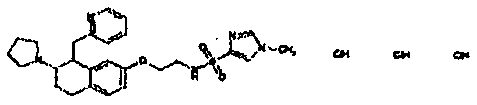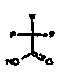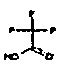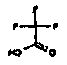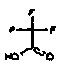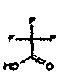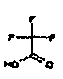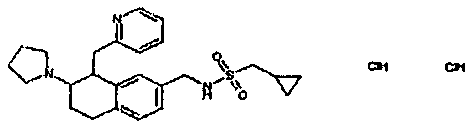Результат интеллектуальной деятельности: АМИНОТЕТРАЛИНОВЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ
Вид РИД
Изобретение
Уровень техники изобретения
Настоящее изобретение относится к аминотетралиновым производным, фармацевтическим композициям, содержащим такие аминотетралиновые производные, и к применению таких аминотетралиновых производных в терапевтических целях. Аминотетралиновые производные представляют собой ингибиторы GlyT1.
Нарушение функционирования глутаматергических путей участвует в развитии ряда болезненных состояний центральной нервной системы (ЦНС) человека, включающих, без ограничения, шизофрению, когнитивные расстройства, деменцию, болезнь Паркинсона, болезнь Альцгеймера и биполярное расстройство. Большое число исследований на животных моделях подтверждают гипотезу об участии гипофункции NMDA в развитии шизофрении.
Функцию рецептора NMDA можно модулировать путем изменения доступности со-агониста глицина. Данный подход имеет важное преимущество, заключающееся в поддержании активность-зависимой активации рецептора NMDA, поскольку увеличение синаптической концентрации глицина не вызывает активацию рецепторов NMDA в отсутствии глутамата. Поскольку уровни синаптического глутамата поддерживаются, в основном, механизмами высокоаффинного транспорта, повышенная активация глицинового участка лишь повышает уровень компонента NMDA в активированных синапсах.
Идентифицированы два специфических транспортера глицина, GlyT1 и GlyT2, которые относятся к Na/Cl-зависимому семейству транспортеров нейромедиаторов, включающих транспортеры таурина, гамма-аминомасляной кислоты (GABA), пролина, моноаминов и орфана. Показано, что GlyT1 и GlyT2, которые были выделены из разных видов, обладают только 50% идентичностью на аминокислотном уровне. Они характеризуются разным характером экспрессии в центральной нервной системе млекопитающих, причем GlyT2 экспрессируется в спинном мозге, мозговом стволе и мозжечке, а GlyT1, помимо указанных участков, присутствует в таких участках переднего мозга, как кора головного мозга, гиппокамп, септа и таламус. Показано, что на клеточном уровне GlyT2 экспрессируется глицинергическими нервными окончаниями в спинном мозге крыс, тогда как GlyT1 преимущественно экспрессируется глиальными клетками. Указанные исследования экспрессии позволяют предположить, что GlyT2 в основном отвечает за поглощение глицина в глицинергических синапсах, тогда как GlyT1 участвует в регуляции концентрации глицина в районе синапсов, экспрессирующих рецептор NMDA. Проведенные в последнее время на крысах функциональные исследования демонстрируют, что блокада GlyT1 эффективным ингибитором (N-[3-(4'-фторфенил)-3-(4'-фенилфенокси)пропил])саркозином (NFPS) повышает активность рецептора NMDA и вызывает рецептор NMDA-зависимое длительное потенциирование у крыс.
С помощью методов молекулярного клонирования обнаружили существование трех вариантов GlyT1, названных GlyT-1a, GlyT-1b и GlyT-1c, каждый из которых характеризуется уникальным распределением в мозге и периферических тканях. Варианты образуются в результате разного сплайсинга и разного использования экзонов, и различаются по N-концевым участкам.
Физиологические эффекты GlyT1 в участках переднего мозга наряду с клиническими отчетами, демонстрирующими благоприятные эффекты ингибитора GlyT1 саркозина, приводящие к улучшению симптомов у пациентов с шизофренией, позволяют предположить, что селективные ингибиторы GlyT1 представляют собой новый класс антипсихотических лекарственных средств.
Ингибиторы транспортера глицина известны в данной области и включают, например:
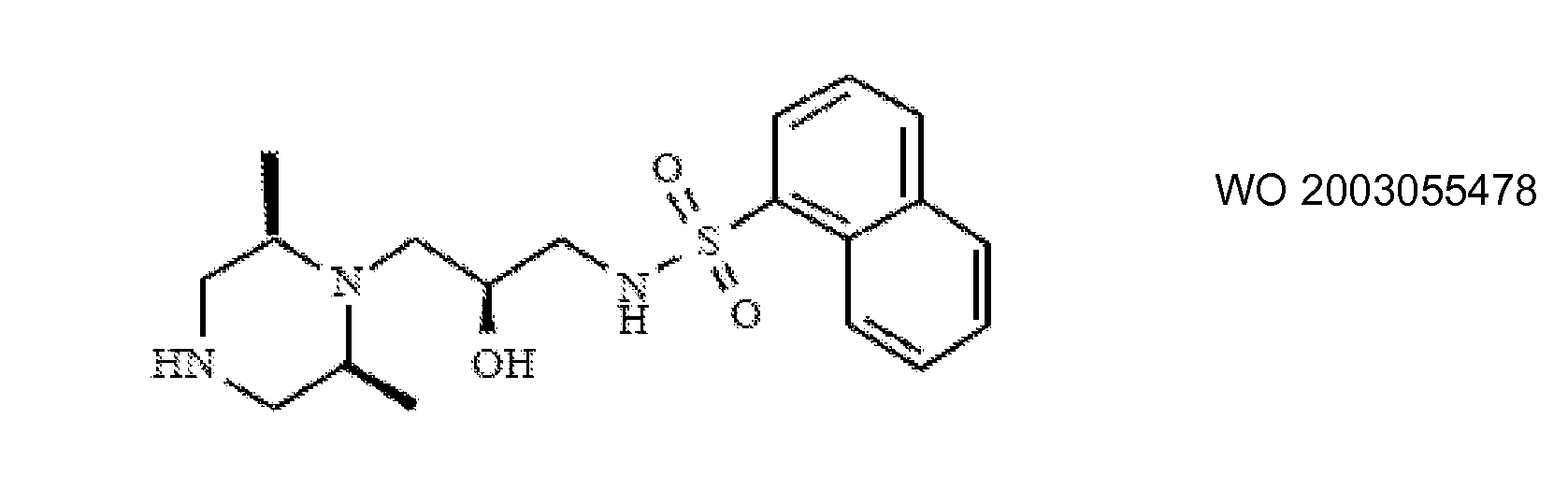
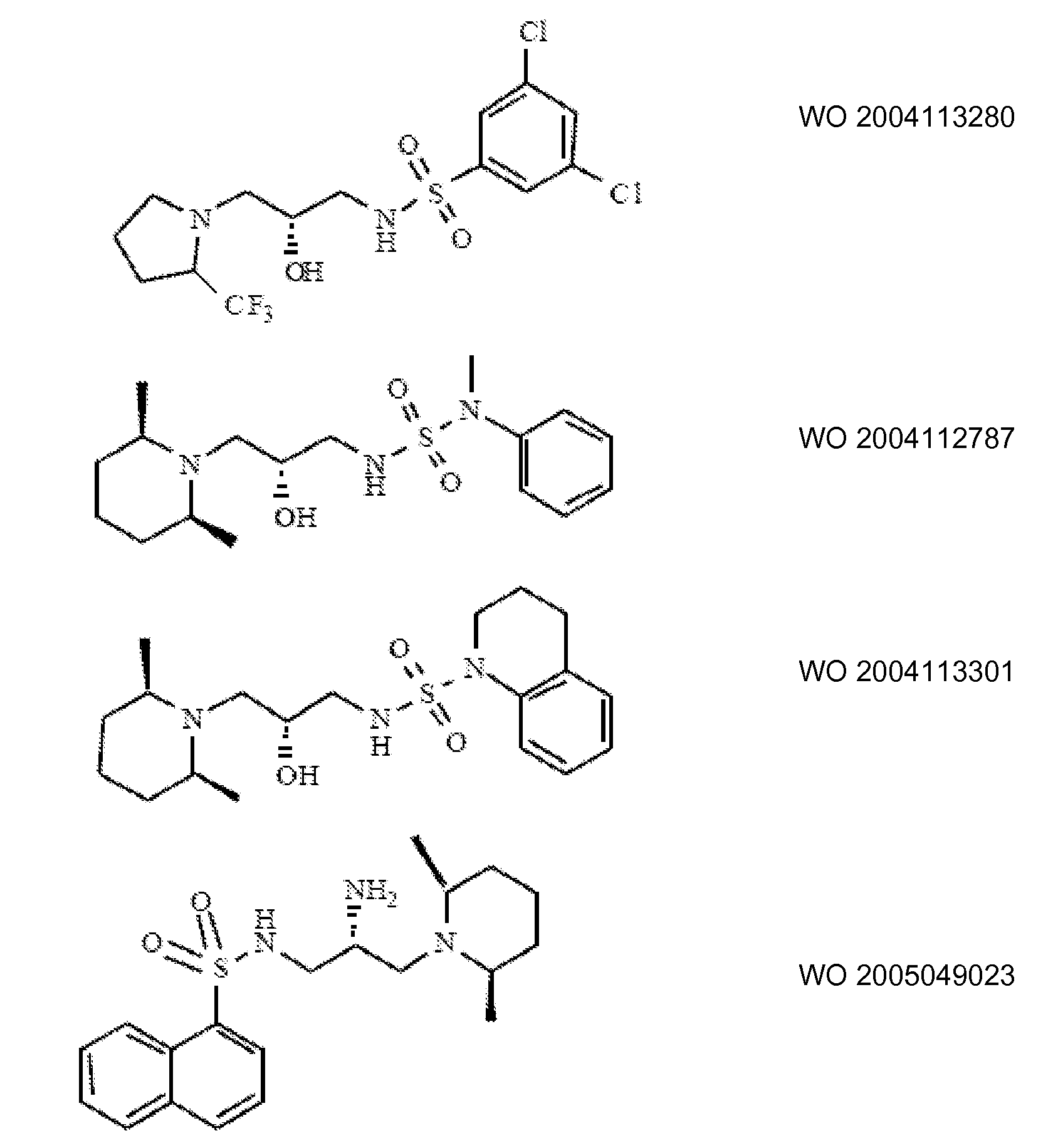
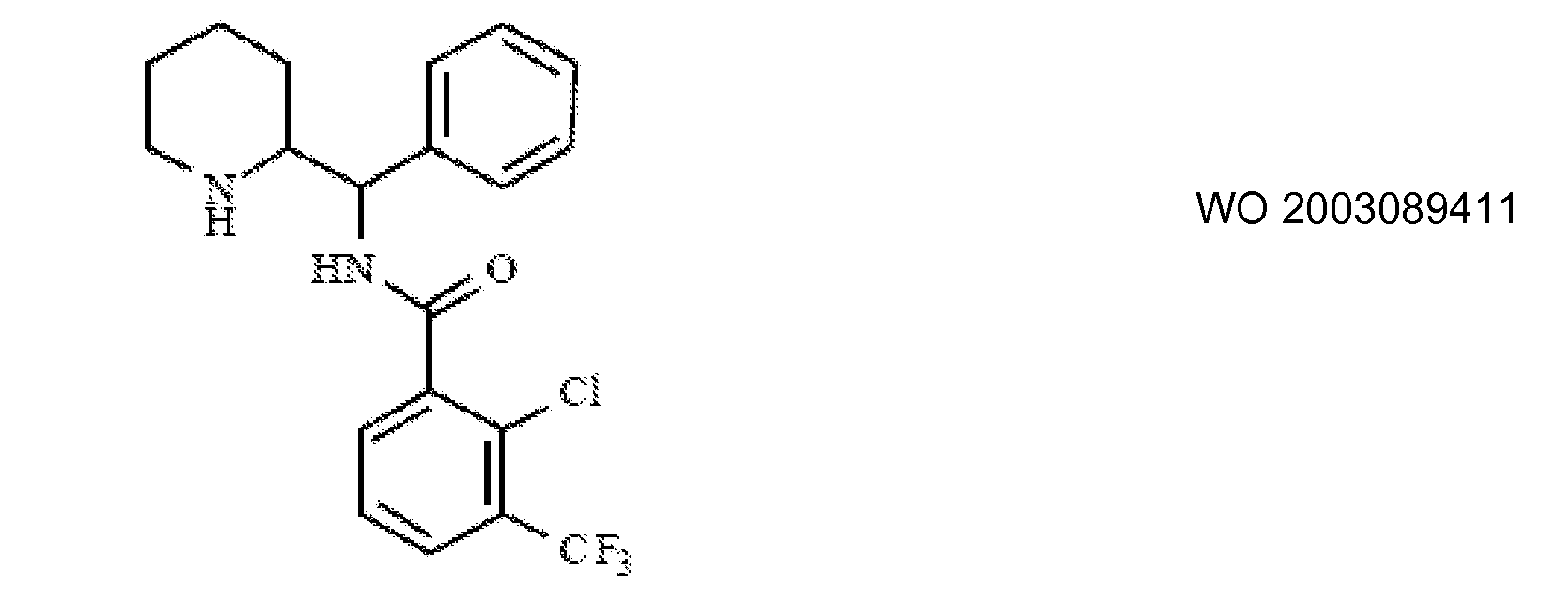
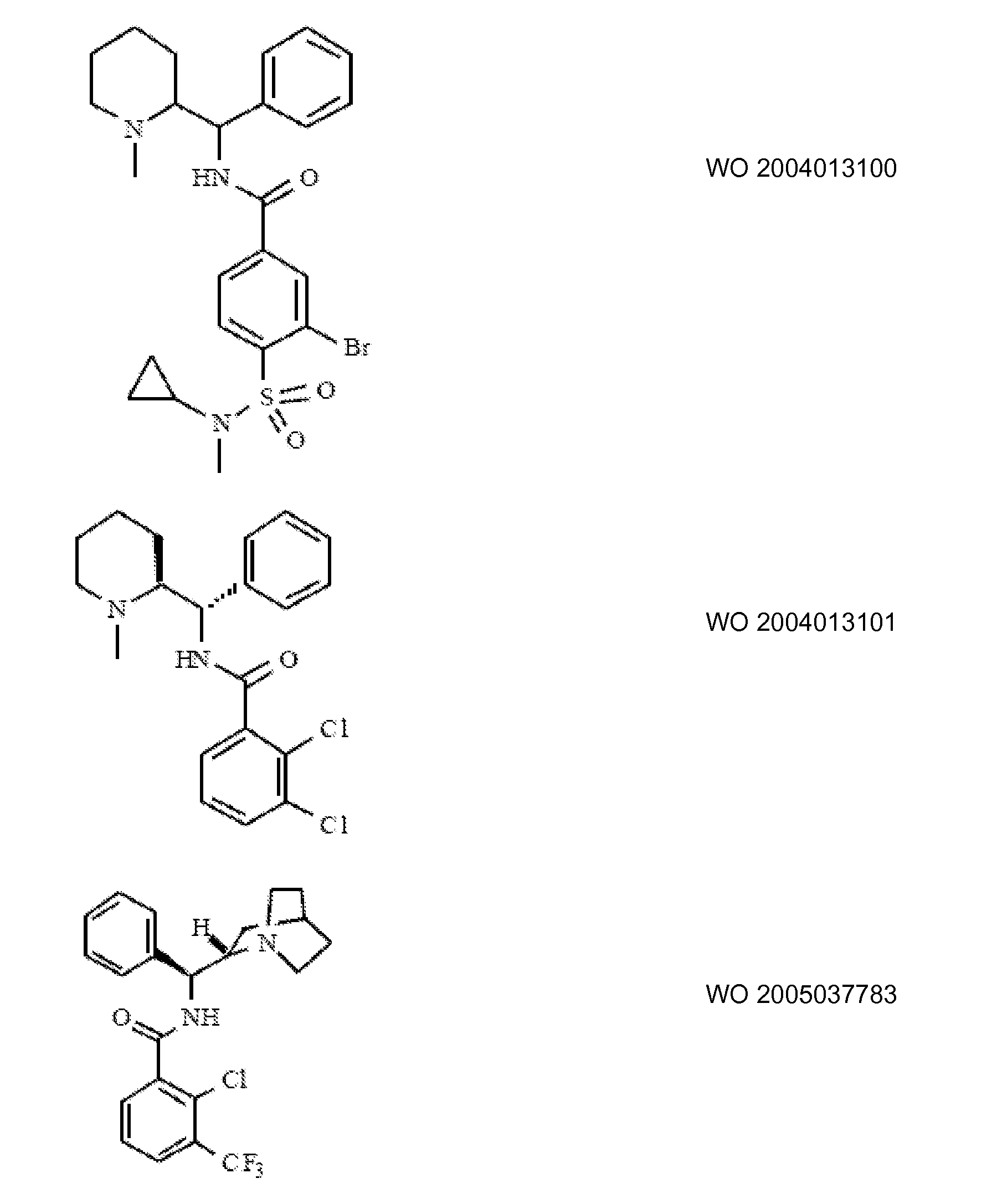
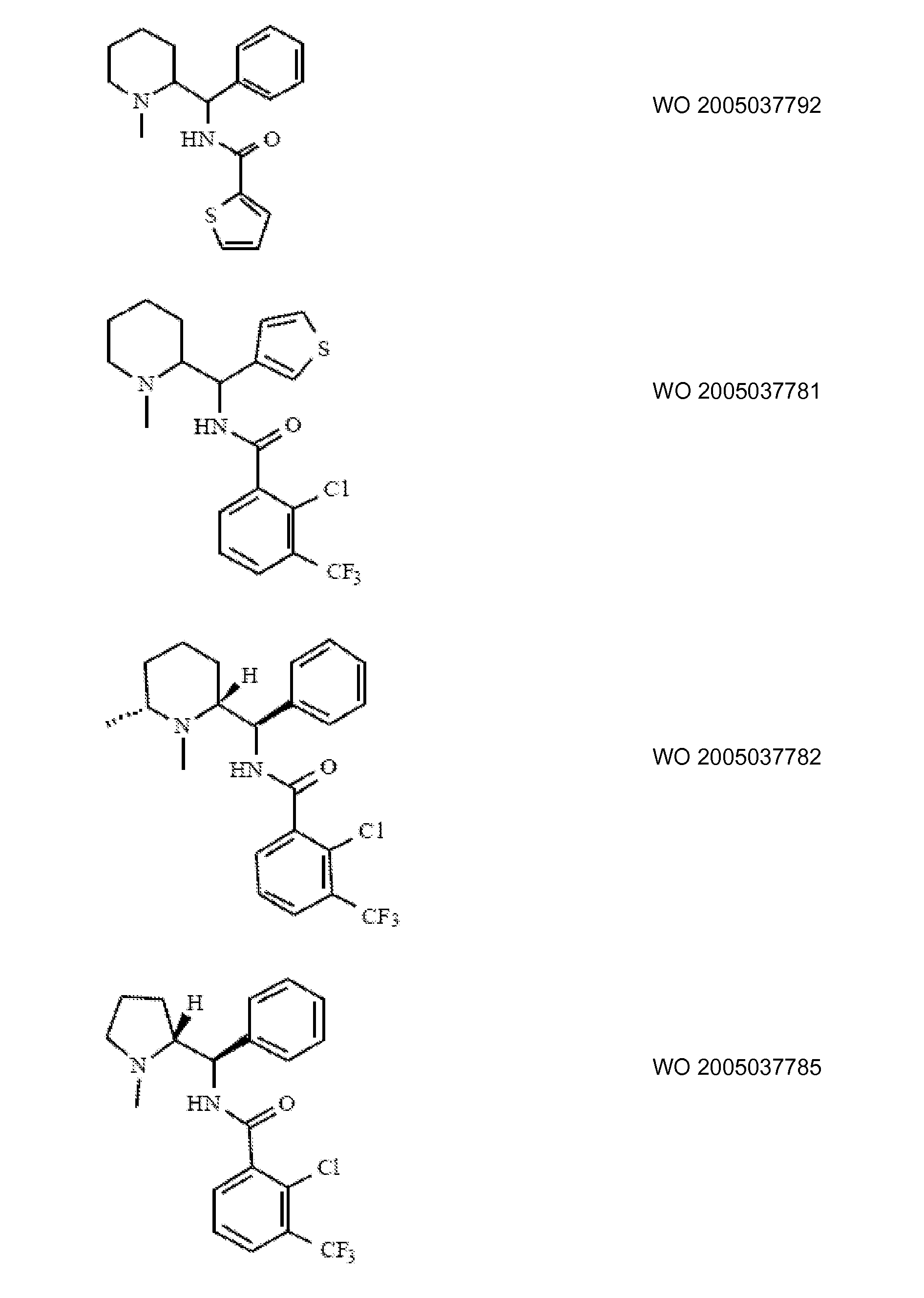

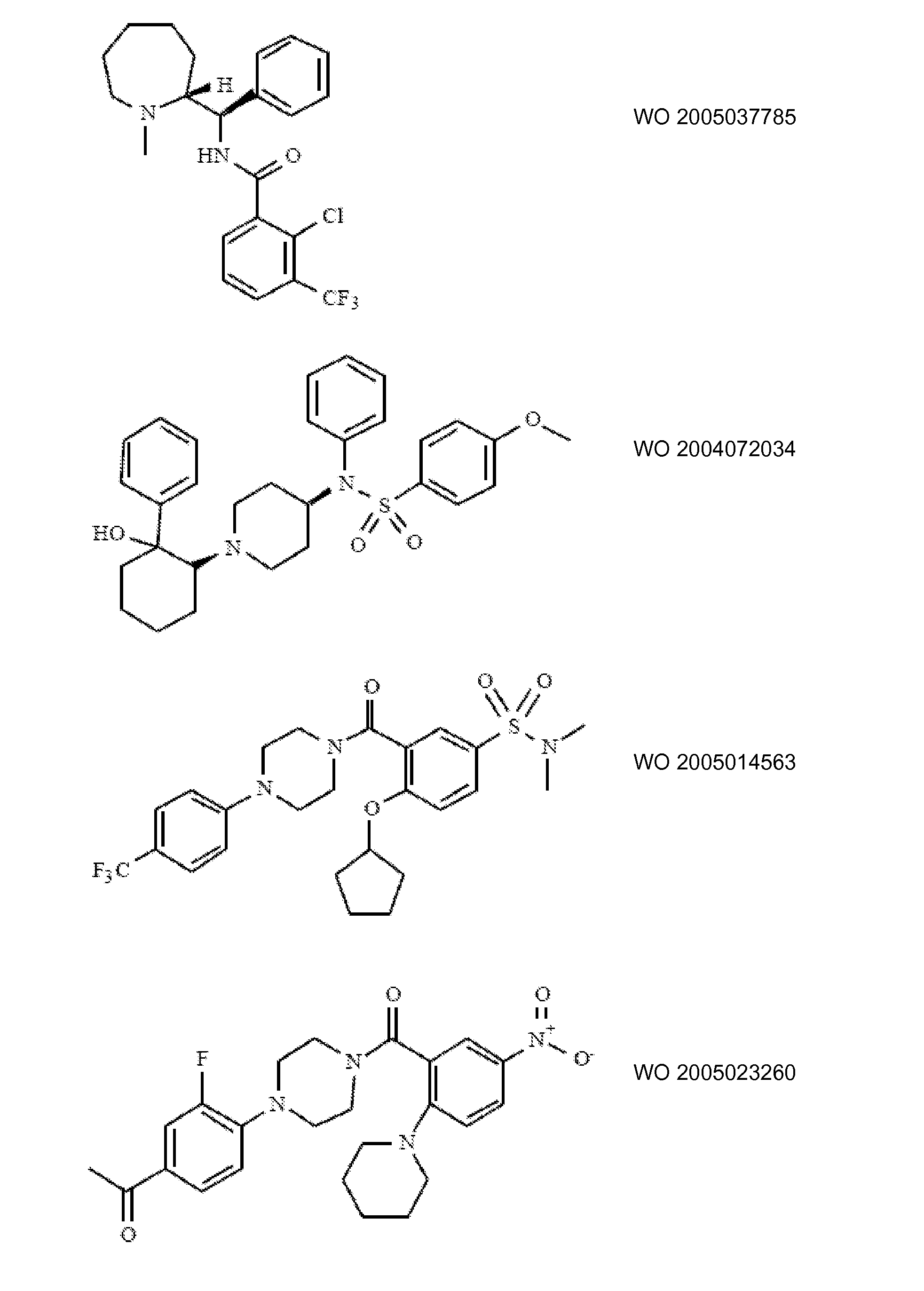

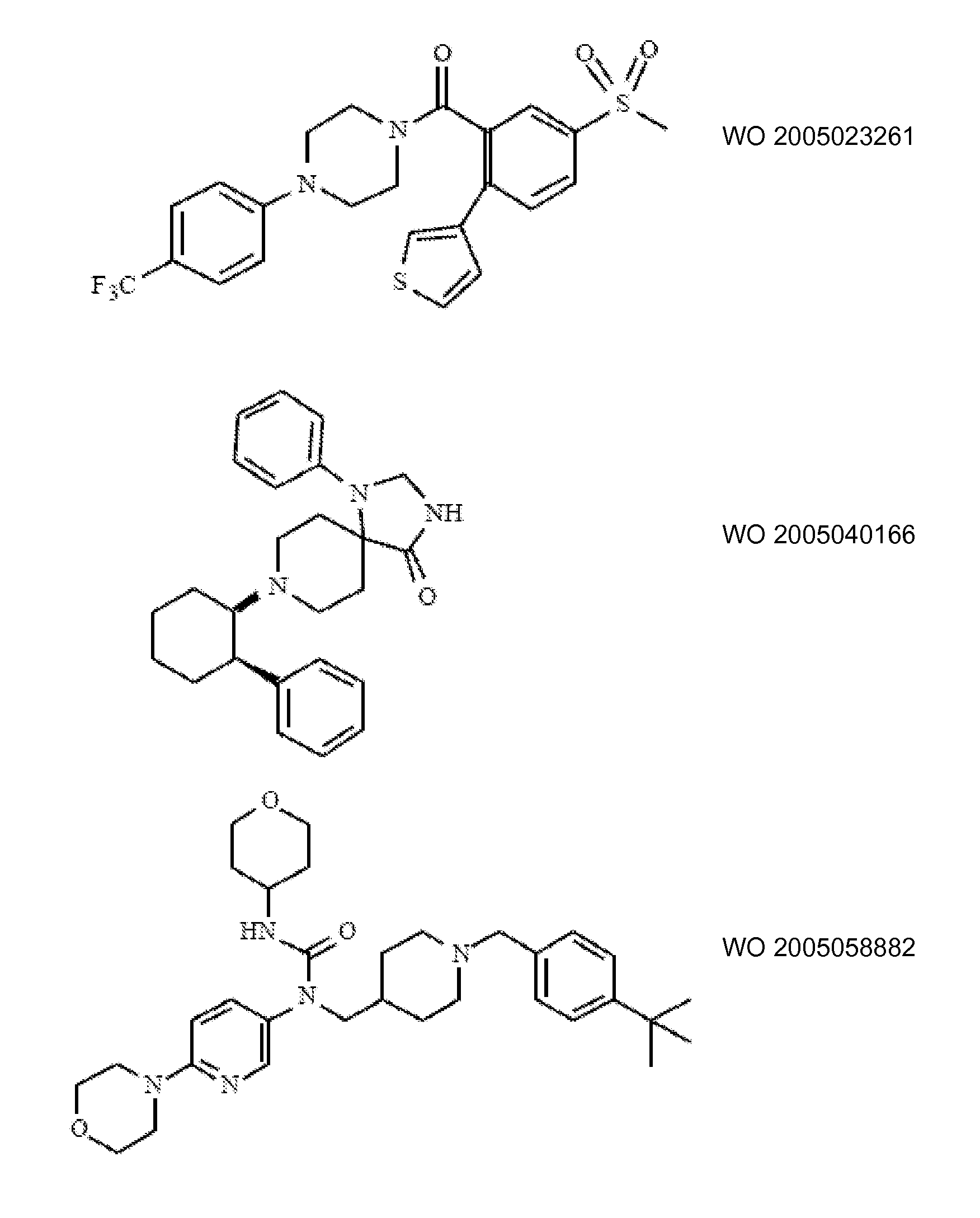

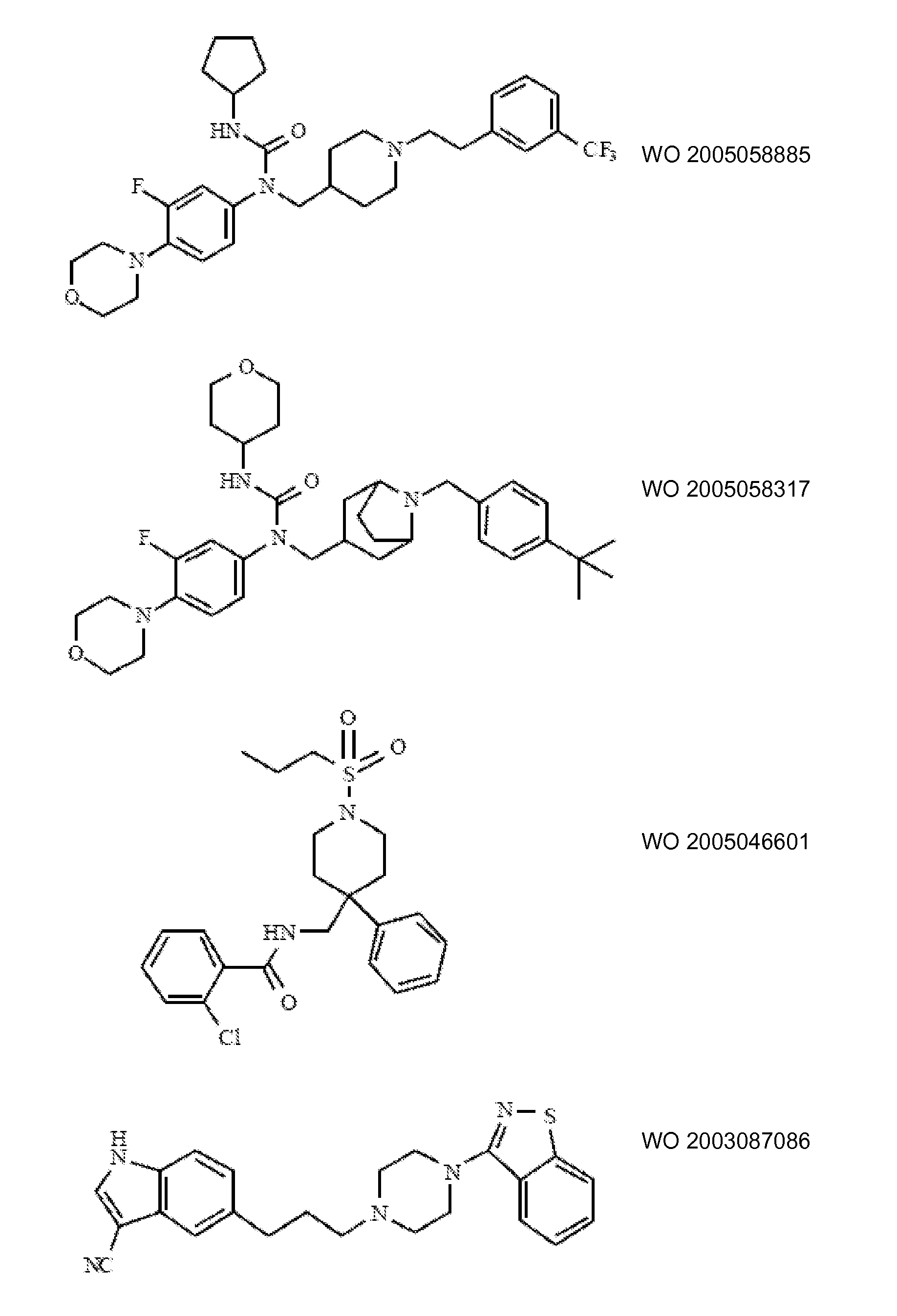

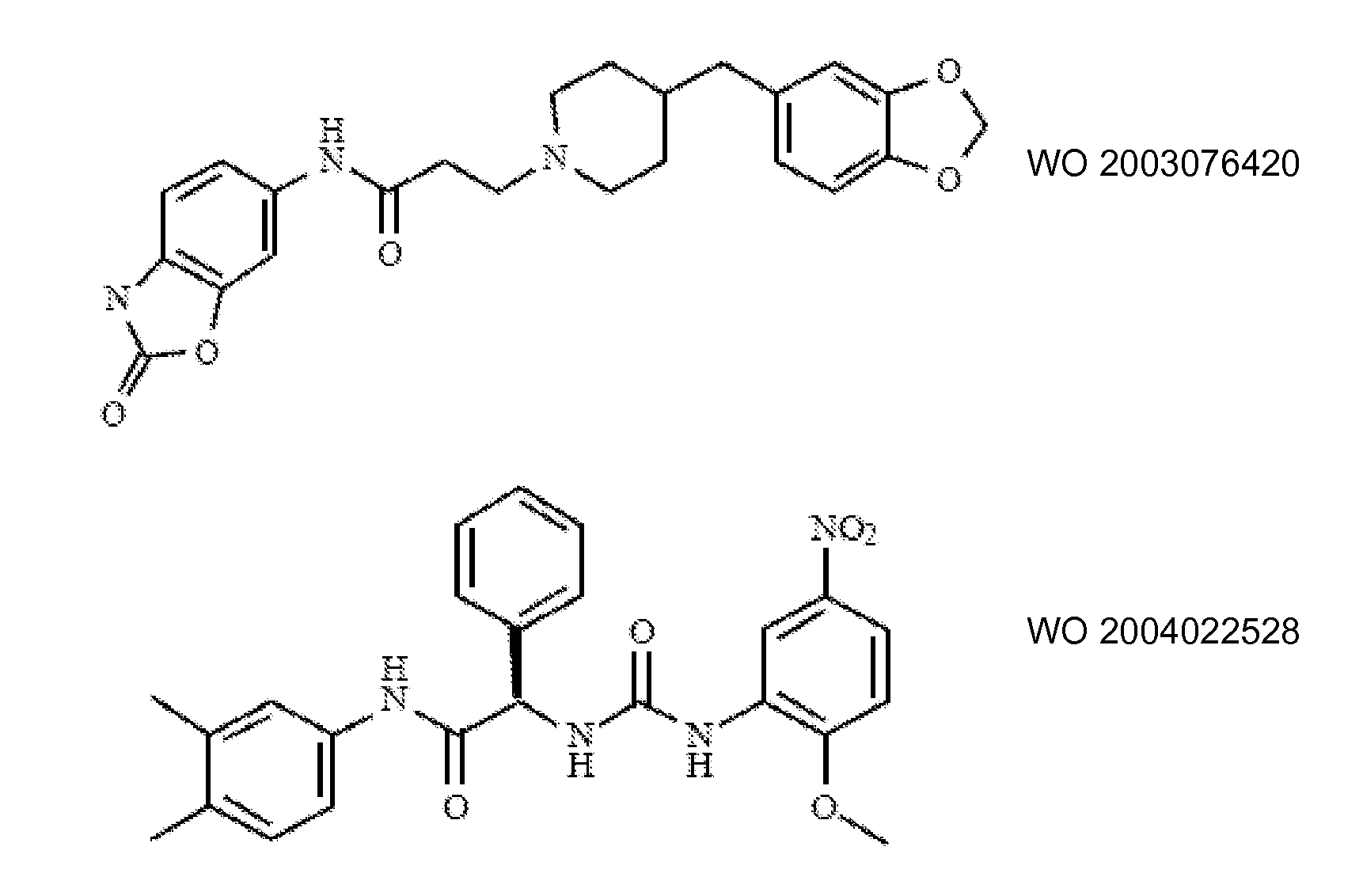
(см. также Hashimoto K., Recent Patents on CNS Drug Discovery, 2006, 1, 43-53; Harsing L. G. et al., Current Medicinal Chemistry, 2006, 13, 1017-1044; Javitt D. C, Molecular Psychiatry (2004) 9, 984-997; Lindsley, CW. et al., Current Topics in Medicinal Chemistry, 2006, 6, 771-785; Lindsley CW. et al., Current Topics in Medicinal Chemistry, 2006, 6, 1883-1896).
Целью настоящего изобретения является получение других ингибиторов транспортера глицина.
Сущность изобретения
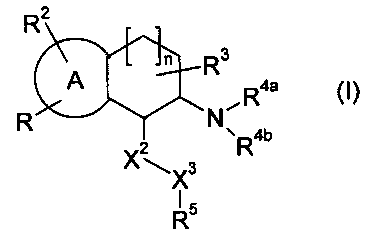
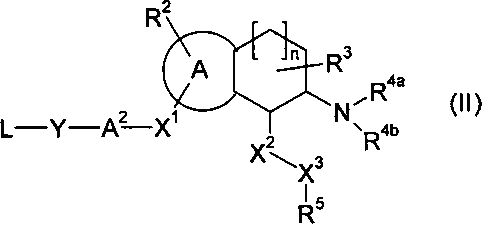
Настоящее изобретение относится к аминотетралиновым производным формулы (I)
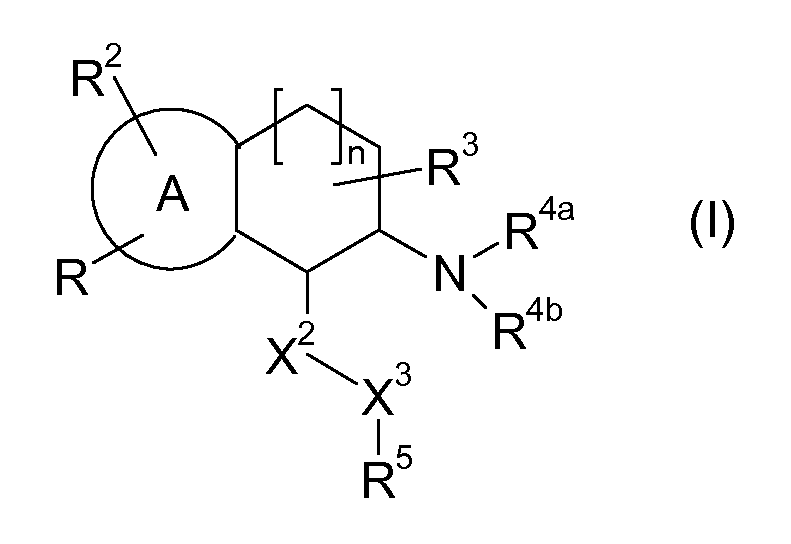
где
A обозначает 5- или 6-членное кольцо;
R обозначает R1-W-A1-Q-Y-A2-X1-;
R1 обозначает водород, алкил, циклоалкилалкил, галогенированный алкил, триалкилсилилалкил, гидроксиалкил, алкоксиалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, алкилкарбониламиноалкил, алкилоксикарбониламиноалкил, алкиламинокарбониламиноалкил, диалкиламинокарбониламиноалкил, алкилсульфониламиноалкил, (необязательно замещенный арилалкил), аминоалкил, необязательно замещенный арилалкил, необязательно замещенный гетероциклилалкил, циклоалкил, алкилкарбонил, алкоксикарбонил, галогенированный алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, (галогенированный алкил)аминокарбонил, ариламинокарбонил, алкенил, алкинил, необязательно замещенный арил, гидрокси, алкокси, галогенированный алкокси, гидроксиалкокси, алкоксиалкокси, аминоалкокси, алкиламиноалкокси, диалкиламиноалкокси, алкилкарбониламиноалкокси, арилкарбониламиноалкокси, алкоксикарбониламиноалкокси, арилалкокси, алкилсульфониламиноалкокси, (галогенированный алкил)сульфониламиноалкокси, арилсульфониламиноалкокси, (арилалкил)сульфониламиноалкокси, гетероциклилсульфониламиноалкокси, гетероциклилалкокси, арилокси, гетероциклилокси, алкилтио, галогенированный алкилтио, алкиламино, (галогенированный алкил)амино, диалкиламино, ди(галогенированный алкил)амино, алкилкарбониламино, (галогенированный алкил)карбониламино, арилкарбониламино, алкилсульфониламино, (галогенированный алкил)сульфониламино, арилсульфониламино или необязательно замещенный гетероциклил;
W обозначает -NR8- или связь;
A1 обозначает необязательно замещенный алкилен или связь;
Q обозначает -S(O)2- или -C(O)-;
Y обозначает -NR9- или связь;
A2 обозначает необязательно замещенный алкилен, алкилен-CO-, -CO-алкилен, алкилен-O-алкилен, алкилен-NR10-алкилен, необязательно замещенный алкенилен, необязательно замещенный алкинилен, необязательно замещенный арилен, необязательно замещенный гетероарилен или связь;
X1 обозначает -O-, -NR11-, -S-, необязательно замещенный алкилен, необязательно замещенный алкенилен, необязательно замещенный алкинилен;
R2 обозначает водород, галоген, алкил, галогенированный алкил, гидроксиалкил, -CN, алкенил, алкинил, необязательно замещенный арил, гидрокси, алкокси, галогенированный алкокси, алкоксикарбонил, алкенилокси, арилалкокси, алкилкарбонилокси, алкилтио, алкилсульфинил, алкилсульфонил, аминосульфонил, амино, алкиламино, алкениламино, нитро или необязательно замещенный гетероциклил, или два радикала R2 вместе с кольцевыми атомами A, к которым они присоединены, образуют 5- или 6-членное кольцо;
R3 обозначает водород, галоген, алкил или алкокси, или два радикала R3 вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу;
R4a обозначает водород, алкил, циклоалкилалкил, галогенированный алкил, гидроксиалкил, алкоксиалкил, аминоалкил, CH2CN, -CHO, алкилкарбонил, (галогенированный алкил)карбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, алкиламинокарбонил, алкенил, -C(=NH)NH2, -C(=NH)NHCN, алкилсульфонил, арилсульфонил, амино, -NO или гетероциклил;
R4b обозначает водород, алкил, галогенированный алкил, гидроксиалкил, алкоксиалкил, аминоалкил, CH2CN, -CHO, алкилкарбонил, (галогенированный алкил)карбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, алкиламинокарбонил, алкенил, -C(=NH)NH2, -C(=NH)NHCN, алкилсульфонил, арилсульфонил, амино, -NO или гетероциклил; или
R4a, R4b вместе обозначают необязательно замещенный алкилен, где один -CH2- алкилена может быть заменен атомом кислорода или -NR16;
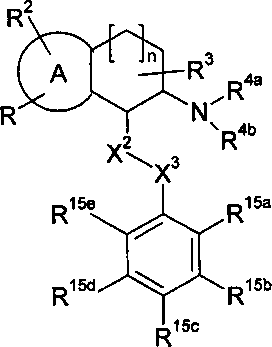
X2 обозначает -O-, -NR6-, -S-, >CR12aR12b или связь;
X3 обозначает -O-, -NR7-, -S-, >CR13aR13b или связь;
R5 обозначает необязательно замещенный арил, необязательно замещенный циклоалкил или необязательно замещенный гетероциклил;
n равен 0, 1 или 2;
R6 обозначает водород или алкил;
R7 обозначает водород или алкил;
R8 обозначает водород или алкил;
R9 обозначает водород, алкил, циклоалкил, аминоалкил, необязательно замещенный арилалкил или гетероциклил; или
R9, R1 вместе обозначают алкилен; или
R9 обозначает алкилен, связанный с атомом углерода A2, где A2 обозначает алкилен, или с атомом углерода X1, где X1 обозначает алкилен;
R10 обозначает водород, алкил или алкилсульфонил;
R11 обозначает водород или алкил, или
R9, R11 вместе обозначают алкилен,
R12a обозначает водород, необязательно замещенный алкил, алкиламиноалкил, диалкиламиноалкил, гетероциклилалкил, необязательно замещенный арил или гидрокси;
R12b обозначает водород или алкил, или
R12a, R12b вместе обозначают карбонил или необязательно замещенный алкилен, где один -CH2- алкилена может быть заменен атомом кислорода или -NR14-;
R13a обозначает водород, необязательно замещенный алкил, алкиламиноалкил, диалкиламиноалкил, гетероциклилалкил, необязательно замещенный арил или гидрокси;
R13b обозначает водород или алкил, или
R13a, R13b вместе обозначают карбонил или необязательно замещенный алкилен, где один -CH2- алкилена может быть заменен атомом кислорода или -NR15-;
R14 обозначает водород или алкил;
R15 обозначает водород или алкил; и
R16 обозначает водород или алкил, или
к их физиологически переносимым солям.
Таким образом, настоящее изобретение относится к аминотетралиновым производным, имеющим формулу (Ia)
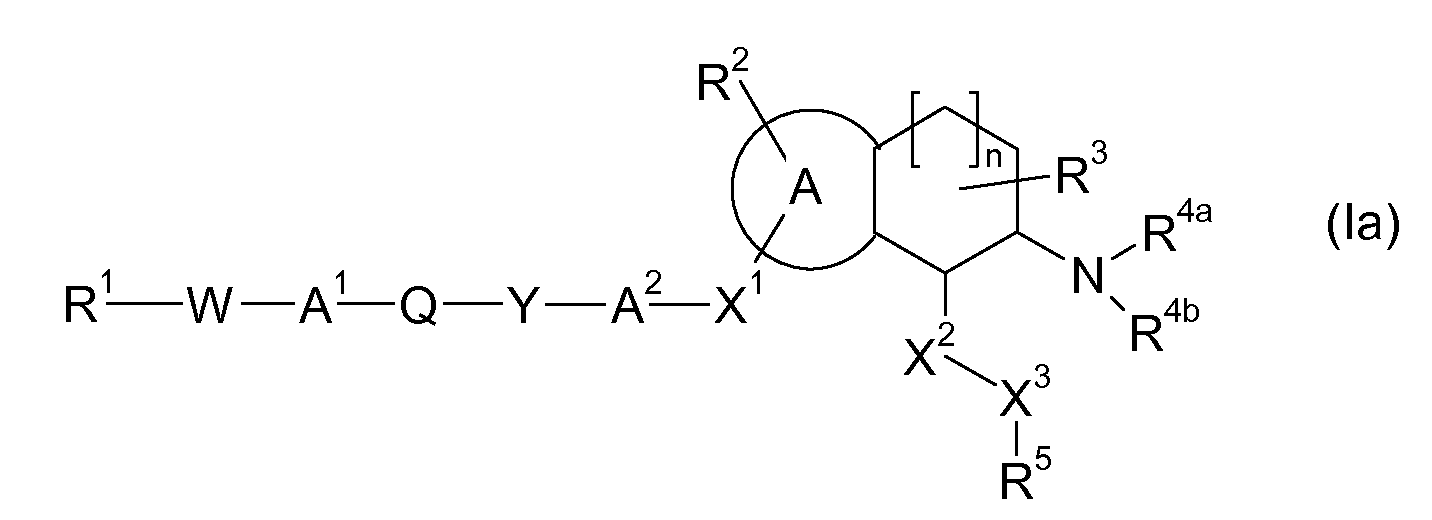
где A, R1, W, A1, Q, Y, A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
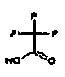
Кроме того, настоящее изобретение относится к аминотетралиновым производным формулы (I), где R обозначает -CN, т.е., к аминотетралиновым производным, имеющим формулу (Ib)
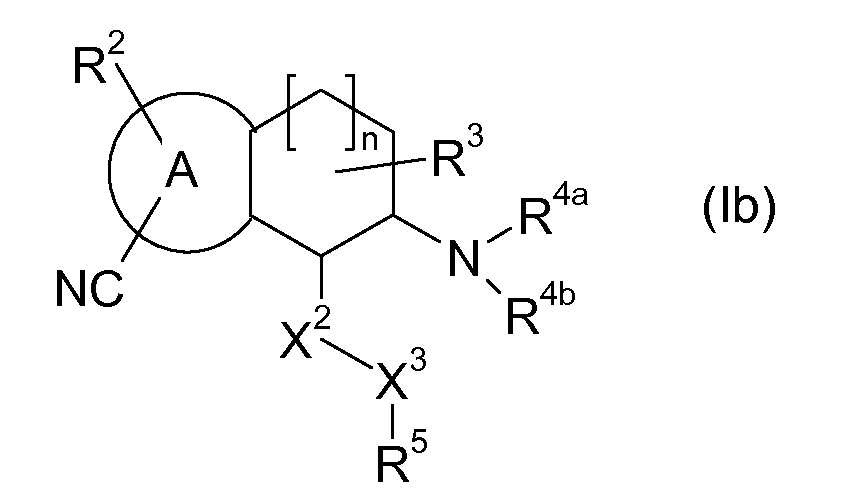
где A, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
Таким образом, термин "аминотетралиновое производное" используется в данном описании для обозначения, в частности, аминотетралинов (n=1) и сопряженных циклогексанов (n=1), где бензольное кольцо заменено 5- или 6-членным гетероциклом, а также гомологичных бициклических соединений, где n равен 0 или 2.
Указанные соединения формулы (I), т.е., аминотетралиновые производные формулы (I) и их физиологически переносимые кислотно-аддитивные соли, представляют собой ингибиторы транспортера глицина и, следовательно, могут использоваться в качестве фармацевтических средств.
Следовательно, настоящее изобретение далее относится к соединениям формулы (I), предназначенным для применения в терапии.
Настоящее изобретение также относится к фармацевтическим композициям, которые содержат носитель и соединение формулы (I).
В частности, указанные соединения, т.е., аминотетралиновые производные и их физиологически переносимые кислотно-аддитивные соли, являются ингибиторами транспортера глицина GlyT1.
Следовательно, настоящее изобретение далее относится к соединениям формулы (I), предназначенным для ингибирования транспортера глицина.
Настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственного средства для ингибирования транспортера глицина GlyT1 и к соответствующим способам ингибирования транспортера глицина GlyT1.
Известно, что ингибиторы транспорта глицина, в особенности ингибиторы транспортера глицина GlyT1, можно использовать для лечения ряда неврологических и психиатрических расстройств.
Следовательно, настоящее изобретение далее относится к соединениям формулы (I), предназначенным для лечения неврологического или психиатрического расстройства.
Настоящее изобретение также относится к соединениям формулы (I), предназначенным для лечения боли.
Настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственного средства для лечения неврологического или психиатрического расстройства и к соответствующим способам лечения указанных расстройств. Настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственного средства для лечения боли и к соответствующим способам лечения боли.
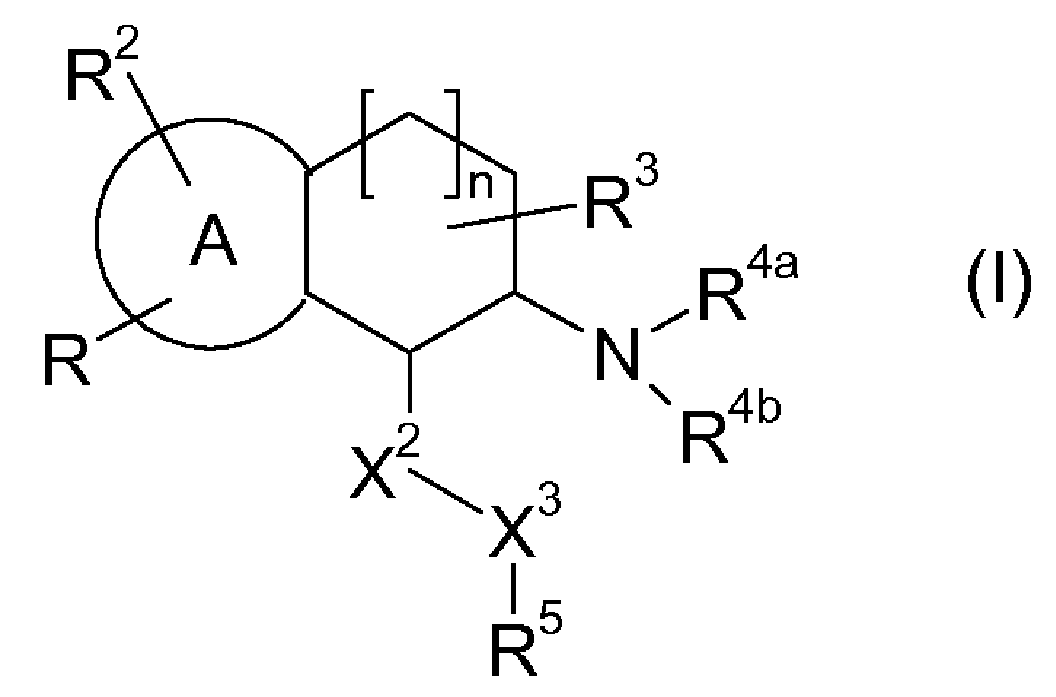
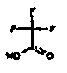
Настоящее изобретение также относится к аминотетралиновым производным формулы (II)
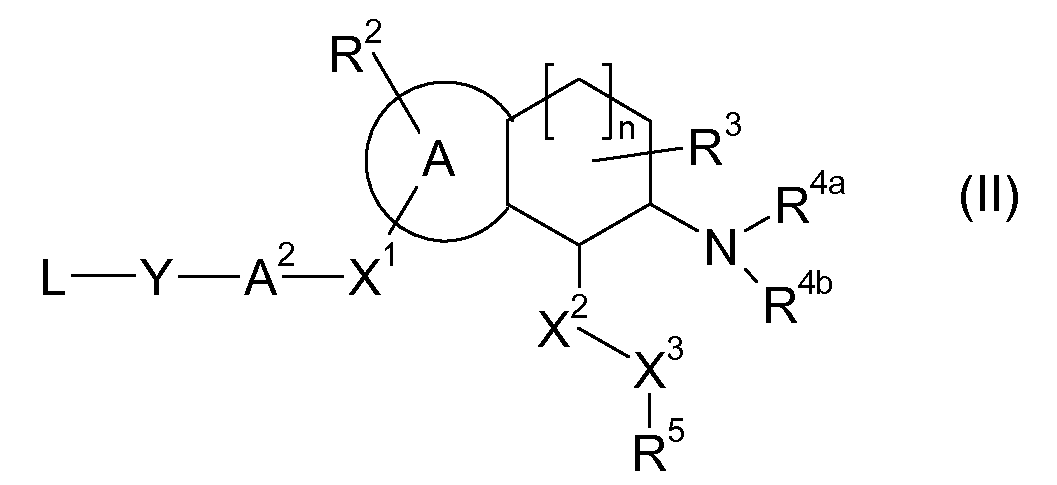
где L обозначает амино-защитную группу, Y обозначает NR9, и A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n и R9 имеют указанные выше значения.
Аминотетралиновые производные формулы (II) можно использовать в качестве промежуточных соединений для получения ингибиторов GlyT1, в частности, соединений формулы (I).
Подробное описание изобретения
Если аминотетралиновые производные формулы (I) или (II) с конкретной структурой могут существовать в разных пространственных конфигурациях, например, если они содержат один или несколько центров асимметрии, полизамещенные кольца или двойные связи, или в виде разных таутомеров, можно использовать смеси энантиомеров, в частности, рацематы, смеси диастереомеров и смеси таутомеров, однако предпочтительно использовать соответствующие практически чистые энантиомеры, диастереомеры и таутомеры соединений формулы (I) или (II) и/или их солей.
В соответствии с одним воплощением энантиомер аминотетралинового производного настоящего изобретения имеет следующую формулу:
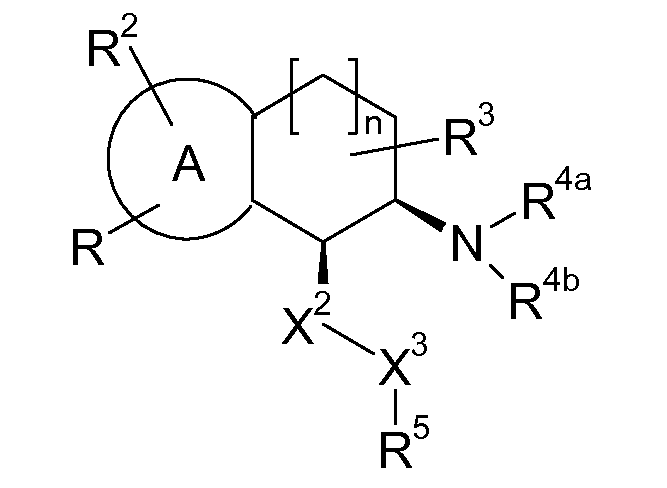
где A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
В соответствии с другим воплощением энантиомер аминотетралинового производного настоящего изобретения имеет следующую формулу:
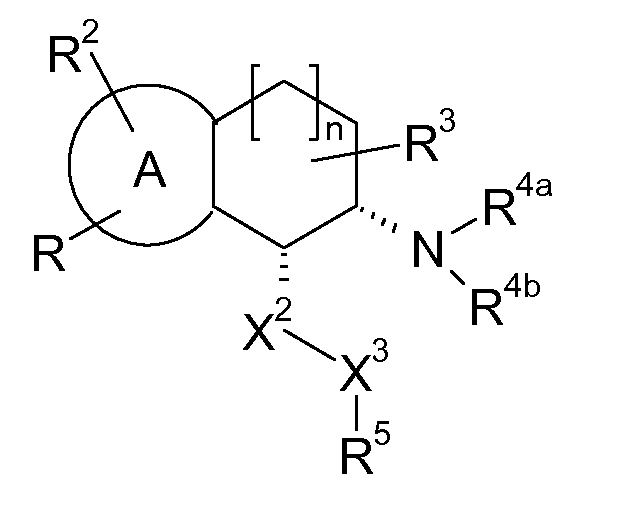
где A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
В соответствии с одним воплощением энантиомер аминотетралинового производного настоящего изобретения имеет следующую формулу:
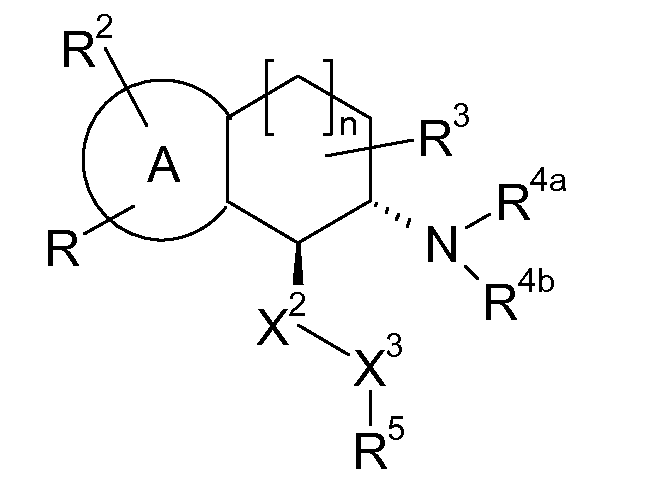
где A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
В соответствии с другим воплощением энантиомер аминотетралинового производного настоящего изобретения имеет следующую формулу:
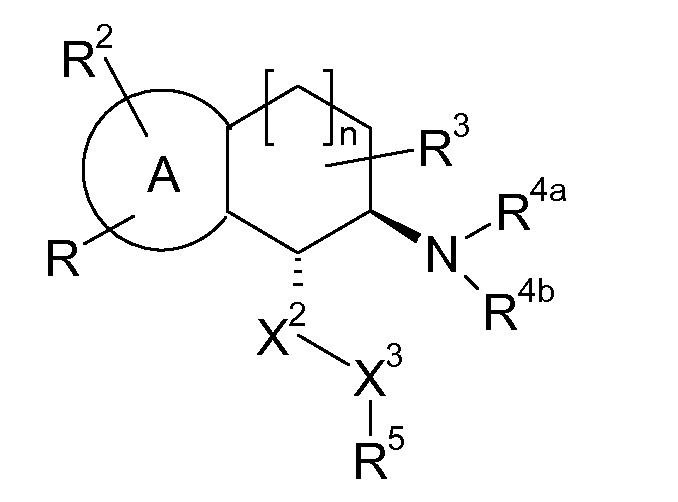
где A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
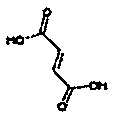
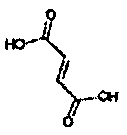
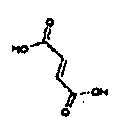
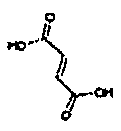
Физиологически переносимые соли аминотетралиновых производных формулы (I) или (II) представляют собой, главным образом, кислотно-аддитивные соли с физиологически переносимыми кислотами. Примерами подходящих физиологически переносимых органических и неорганических кислот являются хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, С1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, циклоалифатические сульфоновые кислоты, такие как S-(+)-10-камфорсульфоновая кислота, ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, ди- и трикарбоновые кислоты и гидроксикарбоновые кислоты, содержащие от 2 до 10 атомов углерода, такие как щавелевая кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, лимонная кислота, гликолевая кислота, адипиновая кислота и бензойная кислота. Другие подходящие кислоты описаны, например, в Fortschritte der Arzneimittelforschung [Advances in drug research], Volume 10, pages 224 ff., Birkhäuser Verlag, Basel and Stuttgart, 1966.
Настоящее изобретение также относится к соединениям формулы (I) или (II), описанным в данном документе, где, по меньшей мере, один из атомов заменен на свой стабильный нерадиоактивный изотоп (например, водород на дейтерий, 12C на 13C, 14N на 15N, 16O на 18O), предпочтительно, где, по меньшей мере, один атом водорода заменен на атом дейтерия.
Конечно, в таких соединениях концентрация соответствующего изотопа выше, чем в природе и, следовательно, чем обычно в соединениях (I) или (II).
Стабильные изотопы (например, дейтерий, 13C, 15N, 18O) представляют собой нерадиоактивные изотопы, которые содержат один или несколько дополнительных нейтронов по сравнению с самым распространенным изотопом соответствующего атома. Дейтерированные соединения используют в фармацевтических исследованиях для изучения метаболизма соединений путем определения механизма действия и метаболического пути недейтерированного исходного соединения (Blake et al. J. Pharm. Sci. 64, 3, 367-391 (1975)). Такие метаболические исследования играют важную роль в разработке безопасных, эффективных терапевтических средств, поскольку либо вводимое пациенту активное in vivo соединение, либо метаболиты, образующиеся из исходного соединения, могут быть токсическими или канцерогенными (Foster et al., Advances in Drug Research Vol. 14, pp. 2-36, Academic press, London, 1985; Kato et al., J. Labelled Comp. Radiopharmaceut, 36(10):927-932 (1995); Kushner et al., Can. J. Physiol. Pharmacol., 77, 79-88 (1999).
Введение тяжелого атома, в частности, замена водорода на дейтерий, может привести к изотопному эффекту, влияющему на фармакокинетику лекарственного средства. Данный эффект обычно является незначительным, если метка находится в метаболически инертном положении молекулы.
Мечение лекарственного средства стабильным изотопом может изменить его физико-химические свойства, такие как pKa и растворимость в липидах. Указанные изменения могут влиять на метаболизм лекарственного средства на разных стадиях, в том числе на его прохождение через организм. Изменения могут наблюдаться в абсорбции, распределении, метаболизме или экскреции. Абсорбция и распределение представляют собой процессы, которые, в первую очередь, зависят от размера молекулы и липофильности вещества. Указанные эффекты и изменения могут влиять на фармакодинамические характеристики молекулы лекарственного средства, если замена изотопа затрагивает зону, участвующую в лиганд-рецепторном взаимодействии.
Метаболизм лекарственного средства может обуславливать значительный изотопный эффект, если расщепление химической связи с атомом дейтерия является стадией, лимитирующей скорость процесса. Хотя некоторые физические свойства молекулы, меченной стабильным изотопом, отличаются от физических свойств немеченной молекулы, химические и биологические свойства указанных молекул могут совпадать, за исключением одного важного аспекта: поскольку тяжелый изотоп имеет более высокую массу, любая связь, образованная тяжелым изотопом и другим атомом, является более прочной, чем связь между легким изотопом и указанным атомом. Любая реакция, в которой разрыв такой связи является стадией, лимитирующей скорость процесса, протекает медленнее в случае молекулы, содержащей тяжелый изотоп, вследствие "кинетического изотопного эффекта". Реакция, включающая расщепление связи C-D, может протекать на 700 процентов медленнее, чем подобная реакция, включающая расщепление связи C-H. Если связь C-D не участвует в одной из стадий, приводящих к образованию метаболита, она не оказывает влияния на поведение лекарственного средства. Если дейтерий находится в положении, участвующем в метаболизме лекарственного средства, изотопный эффект наблюдается только в том случае, если расщепление связи C-D является стадией, лимитирующей скорость. Существуют данные, позволяющие предположить, что во всех случаях, когда происходит расщепление алифатической связи C-H, как правило, в результате окисления, катализируемого полифункциональной оксидазой, замена водорода на дейтерий приводит к наблюдаемому изотопному эффекту. Важно понимать, что введение дейтерия в положение, участвующее в метаболизме, замедляет скорость метаболизма так, что образование другого метаболита в результате атаки на атом углерода, не замещенный дейтерием, становится основным процессом, который называют "метаболическое переключение".
Здоровым людям всех возрастов, в том числе новорожденным и беременным женщинам, также можно вводить дейтерированные маркеры, такие как меченные дейтерием лекарственные средства, и дейтерированную воду в дозах, в некоторых случаях многократных, составляющих тысячи миллиграмов, при отсутствии подтвержденных побочных эффектов (например, Pons г и Rey E, Pediatrics 1999 104: 633; Coward W A et al., Lancet 1979 7: 13; Schwarcz H P, Control. Clin. Trials 1984 5(4 Suppl): 573; Rodewald L E et al., J. Pediatr. 1989 1 14: 885; Butte N F et al. Br. J. Nutr. 1991 65: 3; MacLennan A H et al. Am. J. Obstet Gynecol. 1981 139: 948). Таким образом, очевидно, что высвобождение каких-либо количеств дейтерия, например, в процессе метаболизма соединений данного изобретения, не представляет опасности для здоровья.
Исходя из массового процентного содержания водорода в организме млекопитающего (примерно 9%) и встречаемости дейтерия в природе (примерно 0,015%) можно рассчитать, что человек массой 70 кг обычно содержит около грамма дейтерия. Кроме того, у млекопитающих, включающих грызунов и собак, проводили замену вплоть до примерно 15% обычного водорода на дейтерий, которую поддерживали в течение периода от нескольких дней до нескольких месяцев, наблюдая при этом минимальные побочные эффекты (Czajka D M and Finkel A J, Ann. N.Y. Acad. Sci. 1960 84: 770; Thomson J F, Ann. New York Acad. Sci 1960 84: 736; Czakja D M et al., Am. J. Physiol. 1961 201: 357). Более высокие концентрации дейтерия, например, превышающие норму на 20%, могут быть токсичными для животных. Однако обнаружено, что кратковременная замена до 15%-23% водорода в жидкостях человеческого организма на дейтерий не вызывает токсичности (Blagojevic N et al. in "Dosimetry & Treatment Planning for Neutron Capture Therapy", Zamenhof R, Solares G and Harling O Eds. 1994. Advanced Medical Publishing, Madison Wis. pp.125-134; Diabetes Metab. 23: 251 (1997)).
Увеличение содержания дейтерия в соединении выше уровня, встречающегося в природе, называют обогащением или обогащением дейтерием. Примеры уровня обогащения включают значения, составляющие примерно от 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 16, 21, 25, 29, 33, 37, 42, 46, 50, 54, 58, 63, 67, 71, 75, 79, 84, 88, 92, 96 до 100 мольных %.
Атомы водорода, содержащиеся в конкретном органическом соединении, характеризуются разной способностью к замене на дейтерий. Некоторые атомы водорода легко заменяются в физиологических условиях и, в случае замены на атомы дейтерия, можно предположить, что они будут легко заменяться на протоны после введения пациенту. Некоторые атомы водорода можно заменить на атомы дейтерия путем воздействия дейтерированной кислоты, такой как D2SO4/D2O. Альтернативно, атомы дейтерия можно ввести в разных сочетаниях в процессе синтеза соединений данного изобретения. Некоторые атомы водорода трудно заменяются на атомы дейтерия. Однако в остальные положения атомы дейтерия можно ввести путем применения дейтерированных исходных веществ или промежуточных соединений в процессе получения соединений данного изобретения.
Дейтерированные и обогащенные дейтерием соединения данного изобретения можно получить с помощью известных способов, описанных в литературе. Такие способы включают получение описанных здесь соединений с использованием соответствующих дейтерированных и, необязательно, содержащих другие изотопы реагентов и/или промежуточных соединений, или известные в данной области стандартные синтетические способы введения изотопных атомов в структуру химического соединения. Соответствующие процедуры и промежуточные соединения описаны, например, в Lizondo, J et al., Drugs Fut, 21 (11), 1116 (1996); Brickner, S J et al., J Med Chem, 39(3), 673 (1996); Mallesham, B et al., Org Lett, 5(7), 963 (2003); публикациях PCT WO1997010223, WO2005099353, WO1995007271, WO2006008754; патентах США №№ 7538189; 7534814; 7531685; 7528131; 7521421; 7514068; 7511013; и публикациях патентных заявок США №№ 20090137457; 20090131485; 20090131363; 20090118238; 20090111840; 20090105338; 20090105307; 20090105147; 20090093422; 20090088416; 20090082471, таким образом, указанные способы включены в данное описание в качестве ссылки.
Органические фрагменты, упомянутые в приведенных выше определениях, представляют собой - подобно термину галоген - собирательные термины для индивидуальных списков отдельных членов группы. Префикс Cn-Cm указывает в каждом случае возможное число атомов углерода в группе.
Если не указано иное, термин "замещенный" означает, что радикал замещен 1, 2 или 3 заместителями, главным образом 1 заместителем, который, в частности, может быть выбран из группы, включающей галоген, С1-C4-алкил, гидрокси-С1-C4-алкил, C3-C12-гетероциклилалкил, С1-C4-алкокси-С1-C4-алкил, амино-С1-C4-алкил, С1-C4-алкенил, OH, SH, CN, CF3, О-CF3, COOH, О-CH2-COOH, С1-C6-алкокси, С1-C6-алкилтио, C3-C7-циклоалкил, COO-С1-C6-алкил, CONH2, CONH-С1-C6-алкил, SO2NH-С1-C6-алкил, CON-(С1-C6-алкил)2, SO2N-(С1-C6-алкил)2, NH2, NH-С1-C6-алкил, N-(С1-C6-алкил)2, NH-(С1-C4-алкил-C6-C12-арил), NH-CO-С1-C6-алкил, NH-SO2-С1-C6-алкил, SO2-С1-C6-алкил, C6-C12-арил, O-C6-C12-арил, O-CH2-C6-C12-арил, CONH-C6-C12-арил, SO2NH-C6-C12-арил, CONH-C3-C12-гетероциклил, SO2NH-C3-C12-гетероциклил, SO2-C6-C12-арил, NH-SO2-C6-C12-арил, NH-CO-C6-C12-арил, NH-SO2-C3-C12-гетероциклил, NH-CO-C3-C12-гетероциклил и C3-C12-гетероциклил, где арил и гетероциклил, в свою очередь, могут быть незамещенными, или они могут быть замещены 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-C4-алкила, С1-C4-галогеналкила, С1-C4-алкокси и С1-C4-галогеналкокси.
Термин "галоген" в каждом случае обозначает фтор, бром, хлор или иод, предпочтительно, фтор или хлор.
С1-C4-Алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами алкильной группы являются метил, C2-C4-алкил, такой как этил, н-пропил, изо-пропил, н-бутил, 2-бутил, изо-бутил или трет-бутил. C1-C2-Алкил представляет собой метил или этил, C1-C3-алкил дополнительно включает н-пропил или изопропил.
C1-C6-Алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода. Примеры включают метил, C2-C4-алкил, определенный в данном описании, а также пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
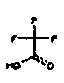
Галогенированный C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, где, по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена, такую как галогенметил, дигалогенметил, тригалогенметил, (R)-1-галогенэтил, (S)-1-галогенэтил, 2-галогенэтил, 1,1-дигалогенэтил, 2,2-дигалогенэтил, 2,2,2-тригалогенэтил, (R)-1-галогенпропил, (S)-1-галогенпропил, 2-галогенпропил, 3-галогенпропил, 1,1-дигалогенпропил, 2,2-дигалогенпропил, 3,3-дигалогенпропил, 3,3,3-тригалогенпропил, (R)-2-галоген-1-метилэтил, (S)-2-галоген-1-метилэтил, (R)-2,2-дигалоген-1-метилэтил, (S)-2,2-дигалоген-1-метилэтил, (R)-1,2-дигалоген-1-метилэтил, (S)-1,2-дигалоген-1-метилэтил, (R)-2,2,2-тригалоген-1-метилэтил, (S)-2,2,2-тригалоген-1-метилэтил, 2-галоген-1-(галогенметил)этил, 1-(дигалогенметил)-2,2-дигалогенэтил, (R)-1-галогенбутил, (S)-1-галогенбутил, 2-галогенбутил, 3-галогенбутил, 4-галогенбутил, 1,1-дигалогенбутил, 2,2-дигалогенбутил, 3,3-дигалогенбутил, 4,4-дигалогенбутил, 4,4,4-тригалогенбутил и др. Конкретные примеры включают фторированные C1-C4 алкильные группы, определенные выше, такие как трифторметил.
C6-C12-Арил-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C6-C12-арилом, такую как бензил.
Гидрокси-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, где один или два атома водорода замещены одной или двумя гидроксильными группами, такую как гидроксиметил, (R)-1-гидроксиэтил, (S)-1-гидроксиэтил, 2-гидроксиэтил, (R)-1-гидроксипропил, (S)-1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил, (R)-2-гидрокси-1-метилэтил, (S)-2-гидрокси-1-метилэтил, 2-гидрокси-1-(гидроксиметил)этил, (R)-1-гидроксибутил, (S)-1-гидроксибутил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил.
C1-C6-Алкокси-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, где один или два атома водорода замещены одной или двумя алкоксильными группами, содержащими от 1 до 6, предпочтительно от 1 до 4, в частности, 1 или 2 атома углерода, такую как метоксиметил, (R)-1-метоксиэтил, (S)-1-метоксиэтил, 2-метоксиэтил, (R)-1-метоксипропил, (S)-1-метоксипропил, 2-метоксипропил, 3-метоксипропил, (R)-2-метокси-1-метилэтил, (S)-2-метокси-1-метилэтил, 2-метокси-1-(метоксиметил)этил, (R)-1-метоксибутил, (S)-1-метоксибутил, 2-метоксибутил, 3-метоксибутил, 4-метоксибутил, этоксиметил, (R)-1-этоксиэтил, (S)-1-этоксиэтил, 2-этоксиэтил, (R)-1-этоксипропил, (S)-1-этоксипропил, 2-этоксипропил, 3-этоксипропил, (R)-2-этокси-1-метилэтил, (S)-2-этокси-1-метилэтил, 2-этокси-1-(этоксиметил)этил, (R)-1-этоксибутил, (S)-1-этоксибутил, 2-этоксибутил, 3-этоксибутил, 4-этоксибутил.
Амино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен аминогруппой, такую как аминометил, 2-аминоэтил.
C1-C6-Алкиламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C1-C6-алкиламиногруппой, в частности, C1-C4-алкиламиногруппой, такую как метиламинометил, этиламинометил, н-пропиламинометил, изо-пропиламинометил, н-бутиламинометил, 2-бутиламинометил, изо-бутиламинометил или трет-бутиламинометил.
Ди-C1-C6-Алкиламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен ди-C1-C6-алкиламиногруппой, в частности, ди-C1-C4-алкиламиногруппой, такую как диметиламинометил.
C1-C6-Алкилкарбониламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C1-C6-алкилкарбониламиногруппой, в частности, C1-C4-алкилкарбониламиногруппой, такую как метилкарбониламинометил, этилкарбониламинометил, н-пропилкарбониламинометил, изо-пропилкарбониламинометил, н-бутилкарбониламинометил, 2-бутилкарбониламинометил, изо-бутилкарбониламинометил или трет-бутилкарбониламинометил.
C1-C6-Алкиламинокарбониламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C1-C6-алкиламинокарбониламиногруппой, в частности, C1-C4-алкиламинокарбониламиногруппой, такую как метиламинокарбониламинометил, этиламинокарбониламинометил, н-пропиламинокарбониламинометил, изо-пропиламинокарбониламинометил, н-бутиламинокарбониламинометил, 2-бутиламинокарбониламинометил, изо-бутиламинокарбониламинометил или трет-бутиламинокарбониламинометил.
Ди-C1-C6-алкиламинокарбониламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен ди-C1-C6-алкиламинокарбониламиногруппой, в частности, ди-C1-C4-алкиламинокарбониламиногруппой, такую как диметиламинокарбониламинометил, диметиламинокарбониламиноэтил, диметиламинокарбониламино-н-пропил.
C1-C6-Алкилсульфониламино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C1-C6-алкилсульфониламиногруппой, в частности, C1-C4-алкилсульфониламиногруппой, такую как метилсульфониламинометил, этилсульфониламинометил, н-пропилсульфониламинометил, изо-пропилсульфониламинометил, н-бутилсульфониламинометил, 2-бутилсульфониламинометил, изо-бутилсульфониламинометил или трет-бутилсульфониламинометил.
(C6-C12-Арил-C1-C6-алкил)амино-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен (C6-C12-арил-C1-C6-алкил)аминогруппой, в частности, (C6-C12-арил-C1-C2-алкил)аминогруппой, такую как бензиламинометил.
C3-C12-Гетероциклил-C1-C4-алкил представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1 или 2 атома углерода, в частности, 1 или два атома углерода, где один атом водорода замещен C3-C12-гетероциклилом, такую как N-пирролидинилметил, N-пиперидинилметил, N-морфолинилметил.
C3-C12-Циклоалкил представляет собой циклоалифатический радикал, содержащий от 3 до 12 атомов углерода. В частности, 3-6 атомов углерода образуют циклическую структуру, такую как циклопропил, циклобутил, циклопентил и циклогексил. Циклическая структура может быть незамещенной, или она может нести 1, 2, 3 или 4 C1-C4-алкильных радикалов, предпочтительно один или несколько метильных радикалов.
Карбонил представляет собой >C=O.
C1-C6-Алкилкарбонил представляет собой радикал формулы R-C(O)-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4, в частности, 1 или 2 атома углерода, как определено в данном документе. Примеры включают ацетил, пропионил, н-бутирил, 2-метилпропионил, пивалоил.
Галогенированный C1-C6-алкилкарбонил представляет собой C1-C6-алкилкарбонил, определенный в данном описании, где, по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена. Примеры включают фторметилкарбонил, дифторметилкарбонил, трифторметилкарбонил. Другие примеры включают 1,1,1-трифторэт-2-илкарбонил, 1,1,1-трифторпроп-3-илкарбонил.
C6-C12-Арилкарбонил представляет собой радикал формулы R-C(O)-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают бензоил.
C1-C6-Алкоксикарбонил представляет собой радикал формулы R-O-C(O)-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4, в частности, 1 или 2 атома углерода, как определено в данном документе. Примеры включают метоксикарбонил и трет-бутилоксикарбонил.
Галогенированный C1-C6-алкоксикарбонил представляет собой C1-C6-алкоксикарбонил, определенный в данном документе, где, по меньшей мере один, например, 1, 2, 3, 4 или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
C6-C12-Арилоксикарбонил представляет собой радикал формулы R-O-C(O)-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают феноксикарбонил.
Циано представляет собой -C≡N.
Аминокарбонил представляет собой NH2C(O)-.
C1-C6-Алкиламинокарбонил представляет собой радикал формулы R-NH-C(O)-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4, в частности, 1 или 2 атома углерода, как определено в данном документе. Примеры включают метиламинокарбонил.
(Галогенированный C1-C4-алкил)аминокарбонил представляет собой C1-C4-алкиламинокарбонил, определенный в данном документе, где, по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов водорода.
C6-C12-Ариламинокарбонил представляет собой радикал формулы R-NH-C(O)-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают фениламинокарбонил.
C2-C6-Алкенил представляет собой однократно ненасыщенный углеводородный радикал, содержащий 2, 3, 4, 5 или 6 атомов углерода, например, винил, аллил (2-пропен-1-ил), 1-пропен-1-ил, 2-пропен-2-ил, металлил(2-метилпроп-2-ен-1-ил) и т.п. C3-C5-Алкенил представляет собой, в частности, аллил, 1-метилпроп-2-ен-1-ил, 2-бутен-1-ил, 3-бутен-1-ил, металлил, 2-пентен-1-ил, 3-пентен-1-ил, 4-пентен-1-ил, 1-метилбут-2-ен-1-ил или 2-этилпроп-2-ен-1-ил.
C2-C6-Алкинил представляет собой однократно ненасыщенный углеводородный радикал, содержащий 2, 3, 4, 5 или 6 атомов углерода, например, этинил, 2-пропин-1-ил, 1-пропин-1-ил, 2-пропин-2-ил и т.п. C3-C5-Алкинил представляет собой, в частности, 2-пропин-1-ил, 2-бутин-1-ил, 3-бутин-1-ил, 2-пентин-1-ил, 3-пентин-1-ил, 4-пентин-1-ил.
C1-C4-Алкилен представляет собой линейную или разветвленную алкиленовую группу, содержащую от 1 до 4 атомов углерода. Примеры включают метилен и этилен. Другим примером является пропилен.
C2-C4-Алкенилен представляет собой линейную или разветвленную алкениленовую группу, содержащую от 2 до 4 атомов углерода.
C2-C4-Алкинилен представляет собой линейную или разветвленную алкиниленовую группу, содержащую от 2 до 4 атомов углерода. Примеры включают пропинилен.
C6-C12-Арил представляет собой 6-12-членный, в частности, 6-10-членный ароматический циклический радикал. Примеры включают фенил и нафтил.
C3-C12-Арилен представляет собой арильный дирадикал. Примеры включают фен-1,4-илен и фен-1,3-илен.
Гидрокси представляет собой -OH.
C1-C6-Алкокси представляет собой радикал формулы R-O-, где R представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6, в частности, от 1 до 4 атомов углерода. Примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, 2-бутокси, изо-бутокси (2-метилпропокси), трет-бутокси, пентилокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 2,2-диметилпропокси, 1-этилпропокси, гексилокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 1-метилпентилокси, 2-метилпентилокси, 3-метилпентилокси, 4-метилпентилокси, 1,1-диметилбутилокси, 1,2-диметилбутилокси, 1,3-диметилбутилокси, 2,2-диметилбутилокси, 2,3-диметилбутилокси, 3,3-диметилбутилокси, 1-этилбутилокси, 2-этилбутилокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси и 1-этил-2-метилпропокси.
Галогенированный C1-C6-алкокси представляет собой линейную или разветвленную алкоксильную группу, содержащую от 1 до 6, предпочтительно от 1 до 4, в частности, 1 или 2 атома углерода, где, по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена, такую как галогенметокси, дигалогенметокси, тригалогенметокси, (R)-1-галогенэтокси, (S)-1-галогенэтокси, 2-галогенэтокси, 1,1-дигалогенэтокси, 2,2-дигалогенэтокси, 2,2,2-тригалогенэтокси, (R)-1-галогенпропокси, (S)-1-галогенпропокси, 2-галогенпропокси, 3-галогенпропокси, 1,1-дигалогенпропокси, 2,2-дигалогенпропокси, 3,3-дигалогенпропокси, 3,3,3-тригалогенпропокси, (R)-2-галоген-1-метилэтокси, (S)-2-галоген-1-метилэтокси, (R)-2,2-дигалоген-1-метилэтокси, (S)-2,2-дигалоген-1-метилэтокси, (R)-1,2-дигалоген-1-метилэтокси, (S)-1,2-дигалоген-1-метилэтокси, (R)-2,2,2-тригалоген-1-метилэтокси, (S)-2,2,2-тригалоген-1-метилэтокси, 2-галоген-1-(галогенметил)этокси, 1-(дигалогенметил)-2,2-дигалогенэтокси, (R)-1-галогенбутокси, (S)-1-галогенбутокси, 2-галогенбутокси, 3-галогенбутокси, 4-галогенбутокси, 1,1-дигалогенбутокси, 2,2-дигалогенбутокси, 3,3-дигалогенбутокси, 4,4-дигалогенбутокси, 4,4,4-тригалогенбутокси и др. Конкретные примеры включают фторированные C1-C4-алкоксильные группы, определенные в данном документе, такие как трифторметокси.
C1-C6-Гидроксиалкокси представляет собой алкоксильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе, где один или два атома водорода замещены гидроксильной группой. Примеры включают 2-гидроксиэтокси, 3-гидроксипропокси, 2-гидроксипропокси, 1-метил-2-гидроксиэтокси и т.п.
C1-C6-Алкокси-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4 атомов углерода, предпочтитлеьно 1 или 2 атома углерода, как определено в данном документе, где один или два атома водорода замещены одним или двумя алкоксильными радикалами, содержащими от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метоксиметокси, 2-метоксиэтокси, 1-метоксиэтокси, 3-метоксипропокси, 2-метоксипропокси, 1-метил-1-метоксиэтокси, этоксиметокси, 2-этоксиэтокси, 1-этоксиэтокси, 3-этоксипропокси, 2-этоксипропокси, 1-метил-1-этоксиэтокси и т.п.
Амино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен аминогруппой. Примеры включают 2-аминоэтокси.
C1-C6-Алкиламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен алкиламиногруппой, содержащей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метиламинометокси, этиламинометокси, н-пропиламинометокси, изо-пропиламинометокси, н-бутиламинометокси, 2-бутиламинометокси, изо-бутиламинометокси, трет-бутиламинометокси, 2-(метиламино)этокси, 2-(этиламино)этокси, 2-(н-пропиламино)этокси, 2-(изо-пропиламино)этокси, 2-(н-бутиламино)этокси, 2-(2-бутиламино)этокси, 2-(изо-бутиламино)этокси, 2-(трет-бутиламино)этокси.
Ди-C1-C6-алкиламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен ди-алкиламиногруппой, содержащей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают диметиламинометокси, диэтиламинометокси, N-метил-N-этиламино)этокси, 2-(диметиламино)этокси, 2-(диэтиламино)этокси, 2-(N-метил-N-этиламино)этокси.
C1-C6-Алкилкарбониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен алкилкарбониламиногруппой, где алкильная группа содержит от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метилкарбониламинометокси, этилкарбониламинометокси, н-пропилкарбониламинометокси, изо-пропилкарбониламинометокси, н-бутилкарбониламинометокси, 2-бутилкарбониламинометокси, изо-бутилкарбониламинометокси, трет-бутилкарбониламинометокси, 2-(метилкарбониламино)этокси, 2-(этилкарбониламино)этокси, 2-(н-пропилкарбониламино)этокси, 2-(изо-пропилкарбониламино)этокси, 2-(н-бутилкарбониламино)этокси, 2-(2-бутилкарбониламино)этокси, 2-(изо-бутилкарбониламино)этокси, 2-(трет-бутилкарбониламино)этокси.
C6-C12-Арилкарбониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен C6-C12-арилкарбониламиногруппой, как определено в данном документе. Примеры включают 2-(бензоиламино)этокси.
C1-C6-Алкоксикарбониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен алкоксикарбониламиногруппой, причем алкоксильная группа содержит от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метоксикарбониламинометокси, этоксикарбониламинометокси, н-пропоксикарбониламинометокси, изо-пропоксикарбониламинометокси, н-бутоксикарбониламинометокси, 2-бутоксикарбониламинометокси, изо-бутоксикарбониламинометокси, трет-бутоксикарбониламинометокси, 2-(метоксикарбониламино)этокси, 2-(этоксикарбониламино)этокси, 2-(н-пропоксикарбониламино)этокси, 2-(изо-пропоксикарбониламино)этокси, 2-(н-бутоксикарбониламино)этокси, 2-(2-бутоксикарбониламино)этокси, 2-(изо-бутоксикарбониламино)этокси, 2-(трет-бутоксикарбониламино)этокси.
C2-C6-Алкенилокси представляет собой радикал формулы R-O-, где R обозначает линейную или разветвленную алкенильную группу, содержащую от 2 до 6, в частности, от 2 до 4 атомов углерода. Примеры включают винилокси, аллилокси (2-пропен-1-илокси), 1-пропен-1-илокси, 2-пропен-2-илокси, металлилокси (2-метилпроп-2-ен-1-илокси) и т.п. C3-C5-Алкенилокси представляет собой, в частности, аллилокси, 1-метилпроп-2-ен-1-илокси, 2-бутен-1-илокси, 3-бутен-1-илокси, металлилокси, 2-пентен-1-илокси, 3-пентен-1-илокси, 4-пентен-1-илокси, 1-метилбут-2-ен-1-илокси или 2-этилпроп-2-ен-1-илокси.
C6-C12-Арил-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен C6-C12-арильной группой, как определено в данном документе. Примеры включают бензилокси.
C1-C6-Алкилсульфониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен алкилсульфониламиногруппой, содержащей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают 2-(метилсульфониламино)этокси, 2-(этилсульфониламино)этокси, 2-[(2-метилпропил)сульфониламино]этокси.
(Галогенированный C1-C6-алкил)сульфониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен алкилсульфониламиногруппой, содержащей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе, где алкильная группа является галогенированной. Примеры включают 2-(трифторметилсульфониламино)этокси.
C6-C12-Арилсульфониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен C6-C12-арилсульфониламиногруппой, как определено в данном документе. Примеры включают 2-(фенилсульфониламино)этокси, 2-(нафтилсульфониламино)этокси.
(C6-C12-Арил-C1-C6-алкил)сульфониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен (C6-C12-арил-C1-C6-алкил)сульфониламиногруппой, предпочтительно (C6-C12-арил-C1-C2-алкил)сульфониламиногруппой. Примеры включают 2-(бензилсульфониламино)этокси.
C3-C12-Гетероциклилсульфониламино-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен C3-C12-гетероциклилсульфониламиногруппой, определенной в данном документе. Примеры включают 2-(пиридин-3-ил-сульфониламино)этокси.
C3-C12-Гетероциклил-C1-C4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4, предпочтительно 1 или 2 атома углерода, как определено в данном документе, где один атом водорода замещен C3-C12-гетероциклильной группой, определенной в данном документе. Примеры включают 2-(N-пирролидинил)этокси, 2-(N-морфолинил)этокси и 2-(N-имидазолил)этокси.
C1-C2-Алкилендиоксо представляет собой радикал формулы -O-R-O-, где R обозначает линейную или разветвленную алкиленовую группу, содержащую 1 или 2 атома углерода, как определено в данном документе. Примеры включают метилендиоксо.
C6-C12-Арилокси представляет собой радикал формулы R-O-, где R обозначает арильную группу, содержащую от 6 до 12, в частности, 6 атомов углерода, как определено в данном документе. Примеры включают фенокси.
C3-C12-Гетероциклилокси представляет собой радикал формулы R-O-, где R обозначает C3-C12-гетероциклильную группу, содержащую от 3 до 12, в частности, от 3 до 7 атомов углерода, как определено в данном документе. Примеры включают пиридин-2-илокси.
C1-C6-Алкилтио представляет собой радикал формулы R-S-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метилтио, этилтио, пропилтио, бутилтио, пентилтио, 1-метилбутилтио, 2-метилбутилтио, 3-метилбутилтио, 2,2-диметилпропилтио, 1-этилпропилтио, гексилтио, 1,1-диметилпропилтио, 1,2-диметилпропилтио, 1-метилпентилтио, 2-метилпентилтио, 3-метилпентилтио, 4-метилпентилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 1,3-диметилбутилтио, 2,2-диметилбутилтио, 2,3-диметилбутилтио, 3,3-диметилбутилтио, 1-этилбутилтио, 2-этилбутилтио, 1,1,2-триметилпропилтио, 1,2,2-триметилпропилтио, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
Галогенированный C1-C6-алкилтио представляет собой радикал формулы R-S-, где R обозначает галогенированный алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают галогенметилтио, дигалогенметилтио, тригалогенметилтио, (R)-1-галогенэтилтио, (S)-1-галогенэтилтио, 2-галогенэтилтио, 1,1-дигалогенэтилтио, 2,2-дигалогенэтилтио, 2,2,2-тригалогенэтилтио, (R)-1-галогенпропилтио, (S)-1-галогенпропилтио, 2-галогенпропилтио, 3-галогенпропилтио, 1,1-дигалогенпропилтио, 2,2-дигалогенпропилтио, 3,3-дигалогенпропилтио, 3,3,3-тригалогенпропилтио, (R)-2-галоген-1-метилэтилтио, (S)-2-галоген-1-метилэтилтио, (R)-2,2-дигалоген-1-метилэтилтио, (S)-2,2-дигалоген-1-метилэтилтио, (R)-1,2-дигалоген-1-метилэтилтио, (S)-1,2-дигалоген-1-метилэтилтио, (R)-2,2,2-тригалоген-1-метилэтилтио, (S)-2,2,2-тригалоген-1-метилэтилтио, 2-галоген-1-(галогенметил)этилтио, 1-(дигалогенметил)-2,2-дигалогенэтилтио, (R)-1-галогенбутилтио, (S)-1-галогенбутилтио, 2-галогенбутилтио, 3-галогенбутилтио, 4-галогенбутилтио, 1,1-дигалогенбутилтио, 2,2-дигалогенбутилтио, 3,3-дигалогенбутилтио, 4,4-дигалогенбутилтио, 4,4,4-тригалогенбутилтио и др. Конкретные примеры включают фторированные C1-C4-алкилтиогруппы, как определено, такие как трифторметилтио.
C1-C6-Алкилсульфинил представляет собой радикал формулы R-S(O)-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил, пентилсульфинил, 1-метилбутилсульфинил, 2-метилбутилсульфинил, 3-метилбутилсульфинил, 2,2-диметилпропилсульфинил, 1-этилпропилсульфинил, гексилсульфинил, 1,1-диметилпропилсульфинил, 1,2-диметилпропилсульфинил, 1-метилпентилсульфинил, 2-метилпентилсульфинил, 3-метилпентилсульфинил, 4-метилпентилсульфинил, 1,1-диметилбутилсульфинил, 1,2-диметилбутилсульфинил, 1,3-диметилбутилсульфинил, 2,2-диметилбутилсульфинил, 2,3-диметилбутилсульфинил, 3,3-диметилбутилсульфинил, 1-этилбутилсульфинил, 2-этилбутилсульфинил, 1,1,2-триметилпропилсульфинил, 1,2,2-триметилпропилсульфинил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
C1-C6-Алкилсульфонил представляет собой радикал формулы R-S(O)2-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, пентилсульфонил, 1-метилбутилсульфонил, 2-метилбутилсульфонил, 3-метилбутилсульфонил, 2,2-диметилпропилсульфонил, 1-этилпропилсульфонил, гексилсульфонил, 1,1-диметилпропилсульфонил, 1,2-диметилпропилсульфонил, 1-метилпентилсульфонил, 2-метилпентилсульфонил, 3-метилпентилсульфонил, 4-метилпентилсульфонил, 1,1-диметилбутилсульфонил, 1,2-диметилбутилсульфонил, 1,3-диметилбутилсульфонил, 2,2-диметилбутилсульфонил, 2,3-диметилбутилсульфонил, 3,3-диметилбутилсульфонил, 1-этилбутилсульфонил, 2-этилбутилсульфонил, 1,1,2-триметилпропилсульфонил, 1,2,2-триметилпропилсульфонил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
(Галогенированный C1-C6-алкил)сульфонил представляет собой C1-C6-алкилсульфонил, как определено в данном документе, где, по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
C6-C12-Арилсульфонил представляет собой радикал формулы R-S(O)2-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают фенилсульфонил.
(C6-C12-Арил-C1-C4-алкил)сульфонил представляет собой радикал формулы R-S(O)2-, где R обозначает C6-C12-арил-C1-C4-алкильный радикал, в частности, C6-C12-арил-C1-C2-алкильный радикал, как определено в данном документе. Примеры включают бензилсульфонил.
C3-C12-Гетероциклилсульфонил представляет собой радикал формулы R-S(O)2-, где R обозначает C3-C12-гетероциклил, определенный в данном документе.
Аминосульфонил представляет собой NH2-S(O)2-.
C1-C6-Алкиламиносульфонил представляет собой радикал формулы R-NH-S(O)2-, где R обозначает алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метиламиносульфонил, этиламиносульфонил, н-пропиламиносульфонил, изо-пропиламиносульфонил, н-бутиламиносульфонил, 2-бутиламиносульфонил, изо-бутиламиносульфонил, трет-бутиламиносульфонил.
Ди-C1-C6-алкиламиносульфонил представляет собой радикал формулы RR'N-S(O)2-, где R и R' независимо друг от друга обозначают алкильный радикал, содержащий от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают диметиламиносульфонил, диэтиламиносульфонил, N-метил-N-этиламиносульфонил.
C6-C12-Ариламиносульфонил представляет собой радикал формулы R-NH-S(O)2-, где R обозначает арильный радикал, содержащий от 6 до 12, предпочтительно 6 атомов углерода, как определено в данном документе.
Амино представляет собой NH2.
C1-C6-Алкиламино представляет собой радикал формулы R-NH-, где R обозначает алкильный радикал, содержащий от 1 до 6, в частности, от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метиламино, этиламино, н-пропиламино, изо-пропиламино, н-бутиламино, 2-бутиламино, изо-бутиламино, трет-бутиламино.
(Галогенированный C1-C6-алкил)амино представляет собой C1-C6-алкиламино, как определено в данном документе, где, по меньшей мере, один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
Ди-C1-C6-алкиламино представляет собой радикал формулы RR'N-, где R и R' независимо друг от друга обозначают алкильный радикал, содержащий от 1 до 6, в частности, от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают диметиламино, диэтиламино, N-метил-N-этиламино.
Ди-(галогенированный C1-C6-алкил)амино представляет собой ди-C1-C6-алкиламино, как определено в данном документе, где по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
C1-C6-Алкилкарбониламино представляет собой радикал формулы R-C(O)-NH-, где R обозначает алкильный радикал, содержащий от 1 до 6, в частности, от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают ацетамидо (метилкарбониламино), пропионамидо, н-бутирамидо, 2-метилпропионамидо (изопропилкарбониламино), 2,2-диметилпропионамидо и т.п.
(Галогенированный C1-C6-алкил)карбониламино представляет собой C1-C6-алкилкарбониламино, как определено в данном документе, где по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
C6-C12-Арилкарбониламино представляет собой радикал формулы R-C(O)-NH-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают фенилкарбониламино.
C2-C6-Алкениламино представляет собой радикал формулы R-NH-, где R обозначает линейную или разветвленную алкенильную группу, содержащую от 2 до 6, в частности, от 2 до 4 атомов углерода. Примеры включают виниламино, аллиламино (2-пропен-1-иламино), 1-пропен-1-иламино, 2-пропен-2-иламино, металлиламино (2-метилпроп-2-ен-1-иламино) и т.п. C3-C5-Алкениламино представляет собой, в частности, аллиламино, 1-метилпроп-2-ен-1-иламино, 2-бутен-1-иламино, 3-бутен-1-иламино, металлиламино, 2-пентен-1-иламино, 3-пентен-1-иламино, 4-пентен-1-иламино, 1-метилбут-2-ен-1-иламино или 2-этилпроп-2-ен-1-иламино.
C1-C6-Алкилсульфониламино представляет собой радикал формулы R-S(O)2-NH-, где R обозначает алкильный радикал, содержащий от 1 до 6, в частности, от 1 до 4 атомов углерода, как определено в данном документе. Примеры включают метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изо-пропилсульфониламино, н-бутилсульфониламино, 2-бутилсульфониламино, изо-бутилсульфониламино, трет-бутилсульфониламино.
(Галогенированный C1-C6-алкил)сульфониламино представляет собой C1-C6-алкилсульфониламино, как определено в данном документе, где по меньшей мере один, например, 1, 2, 3, 4, или все атомы водорода замещены 1, 2, 3, 4 или соответствующим числом одинаковых или разных атомов галогена.
C6-C12-Арилсульфониламино представляет собой радикал формулы R-S(O)2-NH-, где R обозначает арильный радикал, содержащий от 6 до 12 атомов углерода, как определено в данном документе. Примеры включают фенилсульфониламино.
Нитро представляет собой -NO2.
C3-C12-Гетероциклил представляет собой 3-12-членный гетероциклический радикал, в том числе насыщенный гетероциклический радикал, который, как правило, содержит 3, 4, 5, 6 или 7 цикл-образующих атомов (циклических членов), ненасыщенный неароматический гетероциклический радикал, который, как правило, содержит 5, 6 или 7 цикл-образующих атомов, и гетероароматический радикал (гетероарил), который, как правило, содержит 5, 6 или 7 цикл-образующих атомов. Гетероциклические радикалы могут быть присоединены к остальной части молекулы через атом углерода (C-связанные) или атом азота (N-связанные). Предпочтительные гетероциклические радикалы содержат 1 атом азота в качестве циклического атома и, необязательно, 1, 2 или 3 других гетероатомов в качестве циклических членов, которые могут быть выбраны независимо друг от друга из O, S и N. Подобным образом предпочтительные гетероциклические радикалы содержат 1 гетероатом в качестве циклического члена, который может быть выбран из O, S и N, и, необязательно, 1, 2 или 3 других атомов азота в качестве циклических членов.
Примеры C3-C12-гетероциклила включают:
C- или N-связанные 3-4-членные, насыщенные циклы, такие как 2-оксиранил, 2-оксетанил, 3-оксетанил, 2-азиридинил, 3-тиетанил, 1-азетидинил, 2-азетидинил, 3-азетидинил;
C-связанные, 5-членные насыщенные циклы, такие как тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, тетрагидропиррол-2-ил, тетрагидропиррол-3-ил, тетрагидропиразол-3-ил, тетрагидропиразол-4-ил, тетрагидроизоксазол-3-ил, тетрагидроизоксазол-4-ил, тетрагидроизоксазол-5-ил, 1,2-оксатиолан-3-ил, 1,2-оксатиолан-4-ил, 1,2-оксатиолан-5-ил, тетрагидроизотиазол-3-ил, тетрагидроизотиазол-4-ил, тетрагидроизотиазол-5-ил, 1,2-дитиолан-3-ил, 1,2-дитиолан-4-ил, тетрагидроимидазол-2-ил, тетрагидроимидазол-4-ил, тетрагидрооксазол-2-ил, тетрагидрооксазол-4-ил, тетрагидрооксазол-5-ил, тетрагидротиазол-2-ил, тетрагидротиазол-4-ил, тетрагидротиазол-5-ил, 1,3-диоксолан-2-ил, 1,3-диоксолан-4-ил, 1,3-оксатиолан-2-ил, 1,3-оксатиолан-4-ил, 1,3-оксатиолан-5-ил, 1,3-дитиолан-2-ил, 1,3-дитиолан-4-ил, 1,3,2-диоксатиолан-4-ил;
C-связанные, 6-членные насыщенные циклы, такие как тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил, тетрагидротиопиран-4-ил, 1,3-диоксан-2-ил, 1,3-диоксан-4-ил, 1,3-диоксан-5-ил, 1,4-диоксан-2-ил, 1,3-дитиан-2-ил, 1,3-дитиан-4-ил, 1,3-дитиан-5-ил, 1,4-дитиан-2-ил, 1,3-оксатиан-2-ил, 1,3-оксатиан-4-ил, 1,3-оксатиан-5-ил, 1,3-оксатиан-6-ил, 1,4-оксатиан-2-ил, 1,4-оксатиан-3-ил, 1,2-дитиан-3-ил, 1,2-дитиан-4-ил, гексагидропиримидин-2-ил, гексагидропиримидин-4-ил, гексагидропиримидин-5-ил, гексагидропиразин-2-ил, гексагидропиридазин-3-ил, гексагидропиридазин-4-ил, тетрагидро-1,3-оксазин-2-ил, тетрагидро-1,3-оксазин-4-ил, тетрагидро-1,3-оксазин-5-ил, тетрагидро-1,3-оксазин-6-ил, тетрагидро-1,3-тиазин-2-ил, тетрагидро-1,3-тиазин-4-ил, тетрагидро-1,3-тиазин-5-ил, тетрагидро-1,3-тиазин-6-ил, тетрагидро-1,4-тиазин-2-ил, тетрагидро-1,4-тиазин-3-ил, тетрагидро-1,4-оксазин-2-ил, тетрагидро-1,4-оксазин-3-ил, тетрагидро-1,2-оксазин-3-ил, тетрагидро-1,2-оксазин-4-ил, тетрагидро-1,2-оксазин-5-ил, тетрагидро-1,2-оксазин-6-ил;
N-связанные, 5-членные насыщенные циклы, такие как тетрагидропиррол-1-ил (пирролидин-1-ил), тетрагидропиразол-1-ил, тетрагидроизоксазол-2-ил, тетрагидроизотиазол-2-ил, тетрагидроимидазол-1-ил, тетрагидрооксазол-3-ил, тетрагидротиазол-3-ил;
N-связанные, 6-членные насыщенные циклы, такие как пиперидин-1-ил, гексагидропиримидин-1-ил, гексагидропиразин-1-ил (пиперазин-1-ил), гексагидропиридазин-1-ил, тетрагидро-1,3-оксазин-3-ил, тетрагидро-1,3-тиазин-3-ил, тетрагидро-1,4-тиазин-4-ил, тетрагидро-1,4-оксазин-4-ил (морфолин-1-ил), тетрагидро-1,2-оксазин-2-ил;
C-связанные, 5-членные частично ненасыщенные циклы, такие как 2,3-дигидрофуран-2-ил, 2,3-дигидрофуран-3-ил, 2,5-дигидрофуран-2-ил, 2,5-дигидрофуран-3-ил, 4,5-дигидрофуран-2-ил, 4,5-дигидрофуран-3-ил, 2,3-дигидротиен-2-ил, 2,3-дигидротиен-3-ил, 2,5-дигидротиен-2-ил, 2,5-дигидротиен-3-ил, 4,5-дигидротиен-2-ил, 4,5-дигидротиен-3-ил, 2,3-дигидро-1H-пиррол-2-ил, 2,3-дигидро-1H-пиррол-3-ил, 2,5-дигидро-1H-пиррол-2-ил, 2,5-дигидро-1H-пиррол-3-ил, 4,5-дигидро-1H-пиррол-2-ил, 4,5-дигидро-1H-пиррол-3-ил, 3,4-дигидро-2H-пиррол-2-ил, 3,4-дигидро-2H-пиррол-3-ил, 3,4-дигидро-5H-пиррол-2-ил, 3,4-дигидро-5H-пиррол-3-ил, 4,5-дигидро-1H-пиразол-3-ил, 4,5-дигидро-1H-пиразол-4-ил, 4,5-дигидро-1H-пиразол-5-ил, 2,5-дигидро-1H-пиразол-3-ил, 2,5-дигидро-1H-пиразол-4-ил, 2,5-дигидро-1H-пиразол-5-ил, 4,5-дигидроизоксазол-3-ил, 4,5-дигидроизоксазол-4-ил, 4,5-дигидроизоксазол-5-ил, 2,5-дигидроизоксазол-3-ил, 2,5-дигидроизоксазол-4-ил, 2,5-дигидроизоксазол-5-ил, 2,3-дигидроизоксазол-3-ил, 2,3-дигидроизоксазол-4-ил, 2,3-дигидроизоксазол-5-ил, 4,5-дигидроизотиазол-3-ил, 4,5-дигидроизотиазол-4-ил, 4,5-дигидроизотиазол-5-ил, 2,5-дигидроизотиазол-3-ил, 2,5-дигидроизотиазол-4-ил, 2,5-дигидроизотиазол-5-ил, 2,3-дигидроизотиазол-3-ил, 2,3-дигидроизотиазол-4-ил, 2,3-дигидроизотиазол-5-ил, 4,5-дигидро-1H-имидазол-2-ил, 4,5-дигидро-1H-имидазол-4-ил, 4,5-дигидро-1H-имидазол-5-ил, 2,5-дигидро-1H-имидазол-2-ил, 2,5-дигидро-1H-имидазол-4-ил, 2,5-дигидро-1H-имидазол-5-ил, 2,3-дигидро-1H-имидазол-2-ил, 2,3-дигидро-1H-имидазол-4-ил, 4,5-дигидро-оксазол-2-ил, 4,5-дигидрооксазол-4-ил, 4,5-дигидрооксазол-5-ил, 2,5-дигидрооксазол-2-ил, 2,5-дигидрооксазол-4-ил, 2,5-дигидрооксазол-5-ил, 2,3-дигидрооксазол-2-ил, 2,3-дигидрооксазол-4-ил, 2,3-дигидрооксазол-5-ил, 4,5-дигидротиазол-2-ил, 4,5-дигидротиазол-4-ил, 4,5-дигидротиазол-5-ил, 2,5-дигидротиазол-2-ил, 2,5-дигидротиазол-4-ил, 2,5-дигидротиазол-5-ил, 2,3-дигидротиазол-2-ил, 2,3-дигидротиазол-4-ил, 2,3-дигидротиазол-5-ил, 1,3-диоксол-2-ил, 1,3-диоксол-4-ил, 1,3-дитиол-2-ил, 1,3-дитиол-4-ил, 1,3-оксатиол-2-ил, 1,3-оксатиол-4-ил, 1,3-оксатиол-5-ил;
C-связанные, 6-членные частично ненасыщенные циклы, такие как 2H-3,4-дигидропиран-6-ил, 2H-3,4-дигидропиран-5-ил, 2H-3,4-дигидропиран-4-ил, 2H-3,4-дигидропиран-3-ил, 2H-3,4-дигидропиран-2-ил, 2H-3,4-дигидротиопиран-6-ил, 2H-3,4-дигидротиопиран-5-ил, 2H-3,4-дигидротиопиран-4-ил, 2H-3,4-дигидротиопиран-3-ил, 2H-3,4-дигидротиопиран-2-ил, 1,2,3,4-тетрагидропиридин-6-ил, 1,2,3,4-тетрагидропиридин-5-ил, 1,2,3,4-тетрагидропиридин-4-ил, 1,2,3,4-тетрагидропиридин-3-ил, 1,2,3,4-тетрагидропиридин-2-ил, 2H-5,6-дигидропиран-2-ил, 2H-5,6-дигидропиран-3-ил, 2H-5,6-дигидропиран-4-ил, 2H-5,6-дигидропиран-5-ил, 2H-5,6-дигидропиран-6-ил, 2H-5,6-дигидротиопиран-2-ил, 2H-5,6-дигидротиопиран-3-ил, 2H-5,6-дигидротиопиран-4-ил, 2H-5,6-дигидротиопиран-5-ил, 2H-5,6-дигидротиопиран-6-ил, 1,2,5,6-тетрагидропиридин-2-ил, 1,2,5,6-тетрагидропиридин-3-ил, 1,2,5,6-тетрагидропиридин-4-ил, 1,2,5,6-тетрагидропиридин-5-ил, 1,2,5,6-тетрагидропиридин-6-ил, 2,3,4,5-тетрагидропиридин-2-ил, 2,3,4,5-тетрагидропиридин-3-ил, 2,3,4,5-тетрагидропиридин-4-ил, 2,3,4,5-тетрагидропиридин-5-ил, 2,3,4,5-тетрагидропиридин-6-ил, 4H-пиран-2-ил, 4H-пиран-3-ил-, 4H-пиран-4-ил, 4H-тиопиран-2-ил, 4H-тиопиран-3-ил, 4H-тиопиран-4-ил, 1,4-дигидропиридин-2-ил, 1,4-дигидропиридин-3-ил, 1,4-дигидропиридин-4-ил, 2H-пиран-2-ил, 2H-пиран-3-ил, 2H-пиран-4-ил, 2H-пиран-5-ил, 2H-пиран-6-ил, 2H-тиопиран-2-ил, 2H-тиопиран-3-ил, 2H-тиопиран-4-ил, 2H-тиопиран-5-ил, 2H-тиопиран-6-ил, 1,2-дигидропиридин-2-ил, 1,2-дигидропиридин-3-ил, 1,2-дигидропиридин-4-ил, 1,2-дигидропиридин-5-ил, 1,2-дигидропиридин-6-ил, 3,4-дигидропиридин-2-ил, 3,4-дигидропиридин-3-ил, 3,4-дигидропиридин-4-ил, 3,4-дигидропиридин-5-ил, 3,4-дигидропиридин-6-ил, 2,5-дигидропиридин-2-ил, 2,5-дигидропиридин-3-ил, 2,5-дигидропиридин-4-ил, 2,5-дигидропиридин-5-ил, 2,5-дигидропиридин-6-ил, 2,3-дигидропиридин-2-ил, 2,3-дигидропиридин-3-ил, 2,3-дигидропиридин-4-ил, 2,3-дигидропиридин-5-ил, 2,3-дигидропиридин-6-ил, 2H-5,6-дигидро-1,2-оксазин-3-ил, 2H-5,6-дигидро-1,2-оксазин-4-ил, 2H-5,6-дигидро-1,2-оксазин-5-ил, 2H-5,6-дигидро-1,2-оксазин-6-ил, 2H-5,6-дигидро-1,2-тиазин-3-ил, 2H-5,6-дигидро-1,2-тиазин-4-ил, 2H-5,6-дигидро-1,2-тиазин-5-ил, 2H-5,6-дигидро-1,2-тиазин-6-ил, 4H-5,6-дигидро-1,2-оксазин-3-ил, 4H-5,6-дигидро-1,2-оксазин-4-ил, 4H-5,6-дигидро-1,2-оксазин-5-ил, 4H-5,6-дигидро-1,2-оксазин-6-ил, 4H-5,6-дигидро-1,2-тиазин-3-ил, 4H-5,6-дигидро-1,2-тиазин-4-ил, 4H-5,6-дигидро-1,2-тиазин-5-ил, 4H-5,6-дигидро-1,2-тиазин-6-ил, 2H-3,6-дигидро-1,2-оксазин-3-ил, 2H-3,6-дигидро-1,2-оксазин-4-ил, 2H-3,6-дигидро-1,2-оксазин-5-ил, 2H-3,6-дигидро-1,2-оксазин-6-ил, 2H-3,6-дигидро-1,2-тиазин-3-ил, 2H-3,6-дигидро-1,2-тиазин-4-ил, 2H-3,6-дигидро-1,2-тиазин-5-ил, 2H-3,6-дигидро-1,2-тиазин-6-ил, 2H-3,4-дигидро-1,2-оксазин-3-ил, 2H-3,4-дигидро-1,2-оксазин-4-ил, 2H-3,4-дигидро-1,2-оксазин-5-ил, 2H-3,4-дигидро-1,2-оксазин-6-ил, 2H-3,4-дигидро-1,2-тиазин-3-ил, 2H-3,4-дигидро-1,2-тиазин-4-ил, 2H-3,4-дигидро-1,2-тиазин-5-ил, 2H-3,4-дигидро-1,2-тиазин-6-ил, 2,3,4,5-тетрагидропиридазин-3-ил, 2,3,4,5-тетрагидропиридазин-4-ил, 2,3,4,5-тетрагидропиридазин-5-ил, 2,3,4,5-тетрагидропиридазин-6-ил, 3,4,5,6-тетрагидропиридазин-3-ил, 3,4,5,6-тетрагидропиридазин-4-ил, 1,2,5,6-тетрагидропиридазин-3-ил, 1,2,5,6-тетрагидропиридазин-4-ил, 1,2,5,6-тетрагидропиридазин-5-ил, 1,2,5,6-тетрагидропиридазин-6-ил, 1,2,3,6-тетрагидропиридазин-3-ил, 1,2,3,6-тетрагидропиридазин-4-ил, 4H-5,6-дигидро-1,3-оксазин-2-ил, 4H-5,6-дигидро-1,3-оксазин-4-ил, 4H-5,6-дигидро-1,3-оксазин-5-ил, 4H-5,6-дигидро-1,3-оксазин-6-ил, 4H-5,6-дигидро-1,3-тиазин-2-ил, 4H-5,6-дигидро-1,3-тиазин-4-ил, 4H-5,6-дигидро-1,3-тиазин-5-ил, 4H-5,6-дигидро-1,3-тиазин-6-ил, 3,4,5,6-тетрагидропиримидин-2-ил, 3,4,5,6-тетрагидропиримидин-4-ил, 3,4,5,6-тетрагидропиримидин-5-ил, 3,4,5,6-тетрагидропиримидин-6-ил, 1,2,3,4-тетрагидропиразин-2-ил, 1,2,3,4-тетрагидропиразин-5-ил, 1,2,3,4-тетрагидропиримидин-2-ил, 1,2,3,4-тетрагидропиримидин-4-ил, 1,2,3,4-тетрагидропиримидин-5-ил, 1,2,3,4-тетрагидропиримидин-6-ил, 2,3-дигидро-1,4-тиазин-2-ил, 2,3-дигидро-1,4-тиазин-3-ил, 2,3-дигидро-1,4-тиазин-5-ил, 2,3-дигидро-1,4-тиазин-6-ил, 2H-1,3-оксазин-2-ил, 2H-1,3-оксазин-4-ил, 2H-1,3-оксазин-5-ил, 2H-1,3-оксазин-6-ил, 2H-1,3-тиазин-2-ил, 2H-1,3-тиазин-4-ил, 2H-1,3-тиазин-5-ил, 2H-1,3-тиазин-6-ил, 4H-1,3-оксазин-2-ил, 4H-1,3-оксазин-4-ил, 4H-1,3-оксазин-5-ил, 4H-1,3-оксазин-6-ил, 4H-1,3-тиазин-2-ил, 4H-1,3-тиазин-4-ил, 4H-1,3-тиазин-5-ил, 4H-1,3-тиазин-6-ил, 6H-1,3-оксазин-2-ил, 6H-1,3-оксазин-4-ил, 6H-1,3-оксазин-5-ил, 6H-1,3-оксазин-6-ил, 6H-1,3-тиазин-2-ил, 6H-1,3-оксазин-4-ил, 6H-1,3-оксазин-5-ил, 6H-1,3-тиазин-6-ил, 2H-1,4-оксазин-2-ил, 2H-1,4-оксазин-3-ил, 2H-1,4-оксазин-5-ил, 2H-1,4-оксазин-6-ил, 2H-1,4-тиазин-2-ил, 2H-1,4-тиазин-3-ил, 2H-1,4-тиазин-5-ил, 2H-1,4-тиазин-6-ил, 4H-1,4-оксазин-2-ил, 4H-1,4-оксазин-3-ил, 4H-1,4-тиазин-2-ил, 4H-1,4-тиазин-3-ил, 1,4-дигидропиридазин-3-ил, 1,4-дигидропиридазин-4-ил, 1,4-дигидропиридазин-5-ил, 1,4-дигидропиридазин-6-ил, 1,4-дигидропиразин-2-ил, 1,2-дигидропиразин-2-ил, 1,2-дигидропиразин-3-ил, 1,2-дигидропиразин-5-ил, 1,2-дигидропиразин-6-ил, 1,4-дигидропиримидин-2-ил, 1,4-дигидропиримидин-4-ил, 1,4-дигидропиримидин-5-ил, 1,4-дигидропиримидин-6-ил, 3,4-дигидропиримидин-2-ил, 3,4-дигидропиримидин-4-ил, 3,4-дигидропиримидин-5-ил или 3,4-дигидропиримидин-6-ил;
N-связанные, 5-членные частично ненасыщенные циклы, такие как 2,3-дигидро-1H-пиррол-1-ил, 2,5-дигидро-1H-пиррол-1-ил, 4,5-дигидро-1H-пиразол-1-ил, 2,5-дигидро-1H-пиразол-1-ил, 2,3-дигидро-1H-пиразол-1-ил, 2,5-дигидроизоксазол-2-ил, 2,3-дигидроизоксазол-2-ил, 2,5-дигидроизотиазол-2-ил, 2,3-дигидроизоксазол-2-ил, 4,5-дигидро-1H-имидазол-1-ил, 2,5-дигидро-1H-имидазол-1-ил, 2,3-дигидро-1H-имидазол-1-ил, 2,3-дигидрооксазол-3-ил, 2,3-дигидротиазол-3-ил;
N-связанные, 6-членные частично ненасыщенные циклы, такие как 1,2,3,4-тетрагидропиридин-1-ил, 1,2,5,6-тетрагидропиридин-1-ил, 1,4-дигидропиридин-1-ил, 1,2-дигидропиридин-1-ил, 2H-5,6-дигидро-1,2-оксазин-2-ил, 2H-5,6-дигидро-1,2-тиазин-2-ил, 2H-3,6-дигидро-1,2-оксазин-2-ил, 2H-3,6-дигидро-1,2-тиазин-2-ил, 2H-3,4-дигидро-1,2-оксазин-2-ил, 2H-3,4-дигидро-1,2-тиазин-2-ил, 2,3,4,5-тетрагидропиридазин-2-ил, 1,2,5,6-тетрагидропиридазин-1-ил, 1,2,5,6-тетрагидропиридазин-2-ил, 1,2,3,6-тетрагидропиридазин-1-ил, 3,4,5,6-тетрагидропиримидин-3-ил, 1,2,3,4-тетрагидропиразин-1-ил, 1,2,3,4-тетрагидропиримидин-1-ил, 1,2,3,4-тетрагидропиримидин-3-ил, 2,3-дигидро-1,4-тиазин-4-ил, 2H-1,2-оксазин-2-ил, 2H-1,2-тиазин-2-ил, 4H-1,4-оксазин-4-ил, 4H-1,4-тиазин-4-ил, 1,4-дигидропиридазин-1-ил, 1,4-дигидропиразин-1-ил, 1,2-дигидропиразин-1-ил, 1,4-дигидропиримидин-1-ил или 3,4-дигидропиримидин-3-ил;
C-связанные, 5-членные гетероароматические циклы, такие как 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, пиррол-2-ил, пиррол-3-ил, пиразол-3-ил, пиразол-4-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 1,2,3-оксадиазол-4-ил, 1,2,3-оксадиазол-5-ил, 1,2,4-оксадиазол-3-ил, 1,2,4,-оксадиазол-5-ил, 1,3,4-оксадиазол-2-ил, 1,2,3-тиадиазол-4-ил, 1,2,3-тиадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,3,4-тиадиазолил-2-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, тетразол-5-ил;
C-связанные, 6-членные гетероароматические циклы, такие как пиридин-2-ил, пиридин-3-ил, пиридин-4-ил (4-пиридил), пиридазин-3-ил, пиридазин-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, пиразин-2-ил, 1,3,5-триазин-2-ил, 1,2,4-триазин-3-ил, 1,2,4-триазин-5-ил, 1,2,4-триазин-6-ил, 1,2,4,5-тетразин-3-ил;
N-связанные, 5-членные гетероароматические циклы, такие как пиррол-1-ил, пиразол-1-ил, имидазол-1-ил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, тетразол-1-ил.
Гетероциклил также включает бициклические гетероциклы, которые содержат один из описанных 5- или 6-членных гетероциклов, конденсированный с насыщенным, ненасыщенным или ароматическим карбоциклом, таким как бензольное, циклогексановое, циклогексеновое или циклогексадиеновое кольцо, или с 5- или 6-членным гетероциклом, который может быть насыщенным, ненасыщенным или ароматическим. Примерами гетероциклила являются хинолинил, изохинолинил, индолил, индолизинил, изоиндолил, индазолил, бензофурил, бензотиенил, бензо[b]тиазолил, бензоксазолил, бензтиазолил и бензимидазолил. Примеры 5- или 6-членных гетероароматических соединений, содержащих конденсированный циклоалкенил, включают дигидроиндолил, дигидроиндолизинил, дигидроизоиндолил, дигидрохинолинил, дигидроизохинолинил, хроменил и хроманил.
C3-C12-Гетероарилен представляет собой гетероарильный дирадикал. Примеры включают пирид-2,5-илен и пирид-2,4-илен.
В соединениях, способных ингибировать транспортер глицина 1, переменные A, R, R1, W, A1, Q, Y, A2, X1, R2, R3, R4, X2, X3, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, n предпочтительно имеют указанные ниже значения, которые по отдельности или в сочетании составляют конкретные воплощения аминотетралиновых производных формулы (I), (II) или любой другой формулы, раскрытой в данном описании.
В указанных формулах (I) или (II) может присутствовать один или несколько заместителей R, R2 и/или R3. Более конкретно, может присутствовать до 3 заместителей R2 и до 6 заместителей R3. Предпочтительно, присутствует один заместитель R и 1, 2 или 3 заместителя R2. Следовательно, формулу (I) можно изобразить следующим образом:
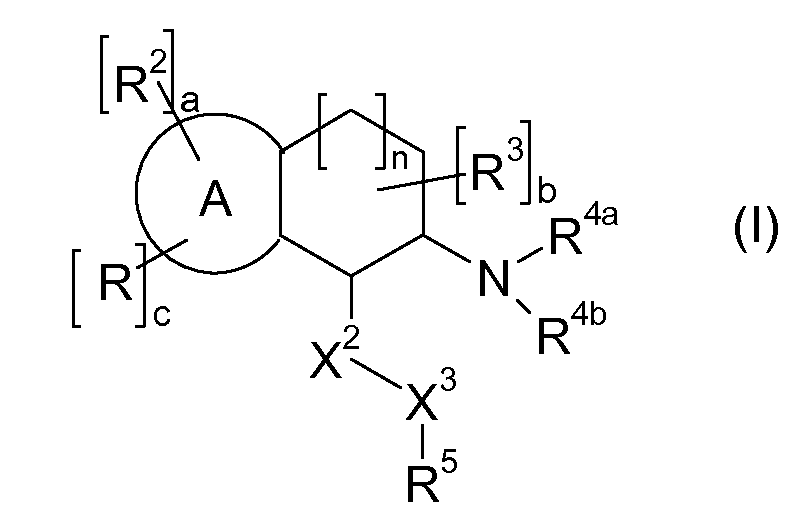
где a равен 1, 2 или 3, b равен 1, 2, 3, 4, 5 или 6, и c равен 1. Если присутствует несколько радикалов R2, они могут быть одинаковыми или разными. Если присутствует несколько радикалов R3, они могут быть одинаковыми или разными.
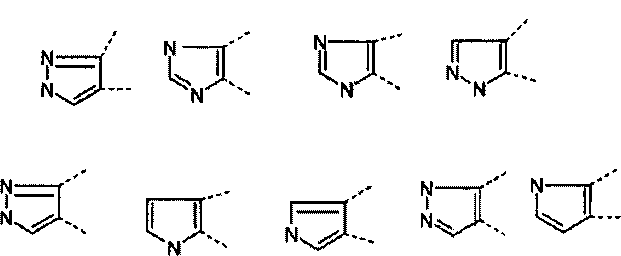
A представляет собой 5- или 6-членное кольцо, которое включает два атома углерода из циклопентанового, циклогексанового или циклогептанового фрагмента, с которым конденсируется A. A может представлять собой гомоциклическое или гетероциклическое кольцо. Кольцо может быть насыщенное, ненасыщенное, неароматическое или ароматическое. В соответствии с конкретным воплощением A представляет собой бензольное кольцо. Если А является гетероциклическим кольцом, оно может содержать 1, 2 или 3 гетероатома в качестве кольцевых атомов, которые могут быть выбраны, независимо друг от друга, из N, S и O. Предпочтительные гетероциклические кольца содержат 1 атом азота в качестве кольцевого атома и, необязательно, 1 или 2 других гетероатомов в качестве кольцевых членов, которые могут быть выбраны, независимо друг от друга, из O, S и N. Подобным образом, предпочтительные гетероциклические радикалы содержат 1 гетероатом в качестве кольцевого атома, который может быть выбран из O, S и N, и, необязательно, 1 или 2 дополнительных атома азота в качестве кольцевых членов. В соответствии с конкретным воплощением, A представляет собой гетероциклическое кольцо, выбранное из группы, включающей следующие 5- или 6-членные гетероциклы:
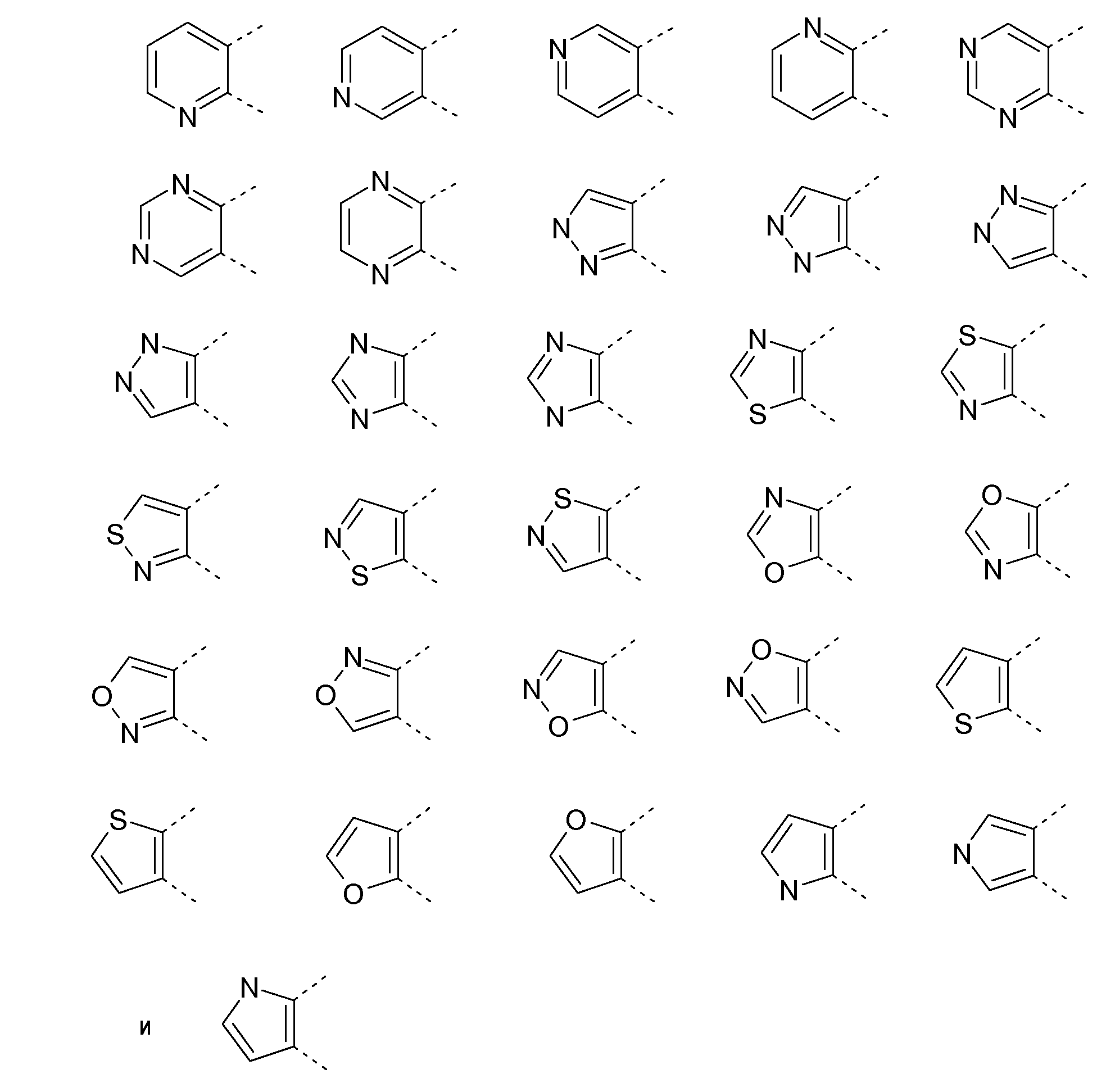
В указанных формулах атомы водорода не изображены. Это означает, что свободная валентность атома углерода или азота может быть занята атомом водорода, R или R2. Соответственно, R и R2 могут быть связаны с C или N в любом положении кольца A.
Для опытного специалиста будет очевидно, что некоторые изображенные выше кольца могут присутствовать в виде других структур, в которых атомы водорода находятся в положениях, отличных от положений приведенных выше структур, например, как показано ниже:
Предпочтительно, A представляет собой гетероцикл, выбранный из группы, включающей следующие 5- или 6-членные гетероциклы:
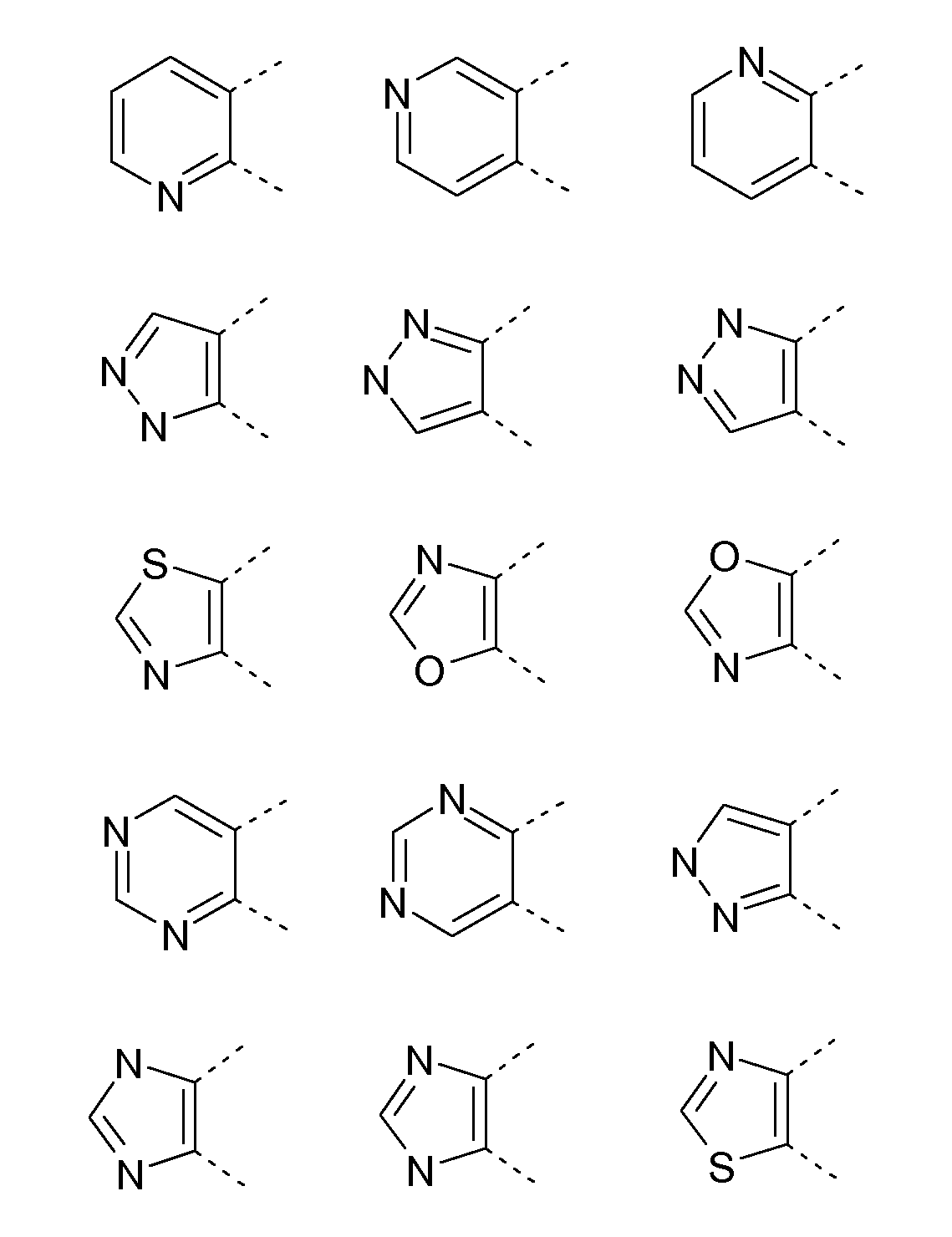
В соответствии с другим конкретным воплощением, A представляет собой гетероцикл, выбранный из группы, включающей следующие 5- или 6-членные гетероциклы:
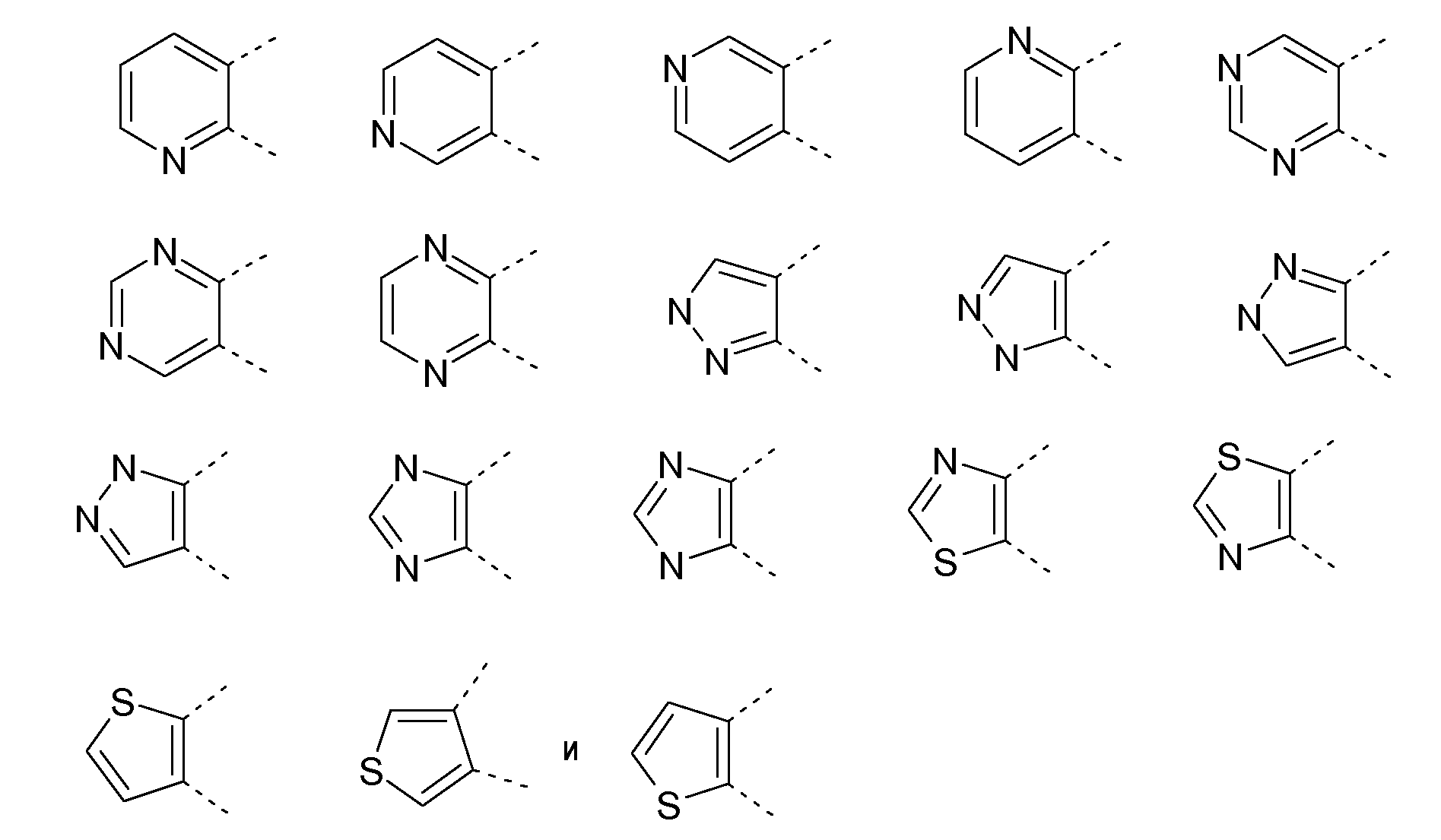
В соответствии с предпочтительным воплощением A представляет собой гетероцикл, выбранный из группы, включающей следующие 5- или 6-членные гетероциклы:
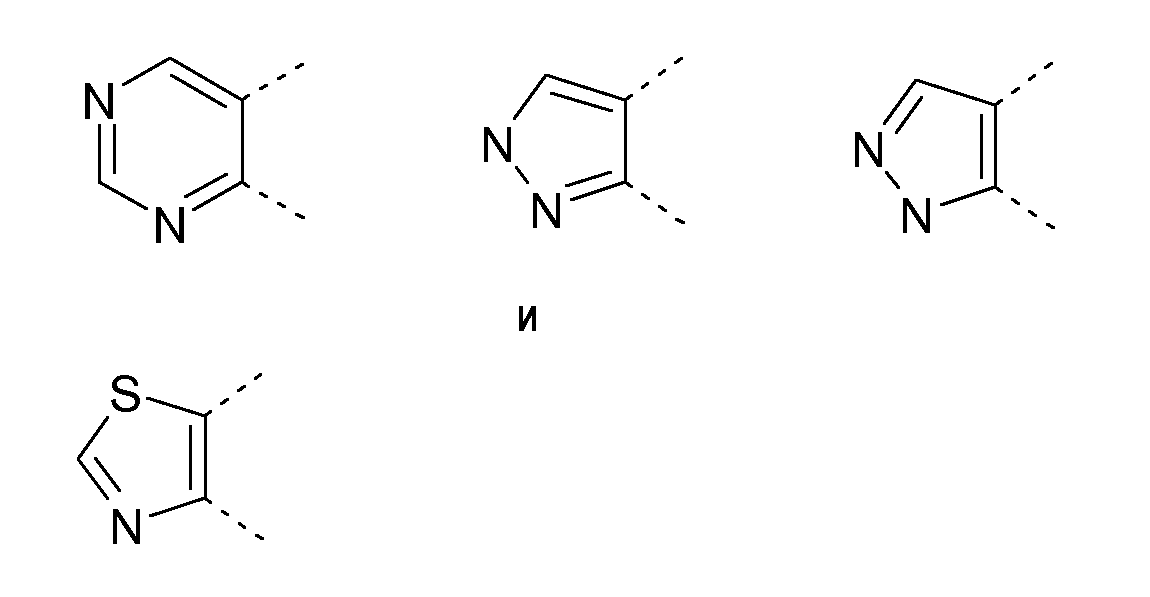
Если кольцо A представляет собой 5-членный гетероцикл, предпочтительно R связан с G1 или G2, в особенности, с G2:
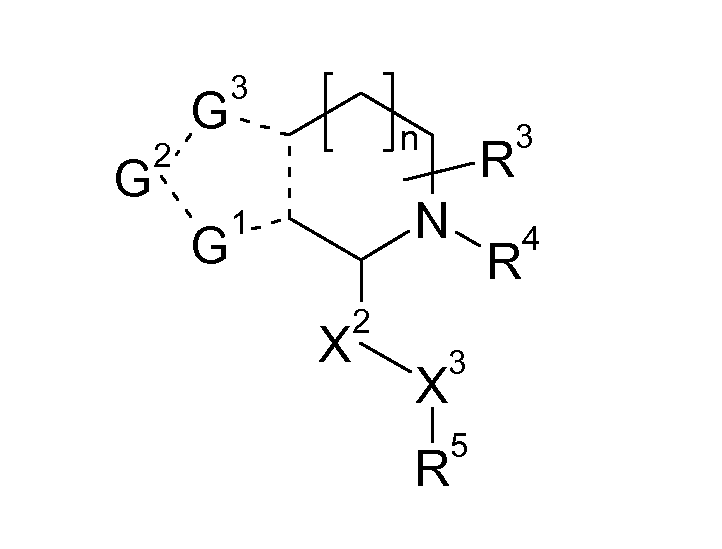
В указанной формуле G1, G2 и G3 независимо обозначают -CH=, -CH2-, -N=, -NH-, S или O, пунктирная линия означает, что связь может быть одинарной или двойной, и R3, R4, X2, X3, R5 имеют значения, указанные в данном документе.
Если кольцо A представляет собой 6-членный гетероцикл, предпочтительно R связан с G1 или G2, в особенности, с G2:
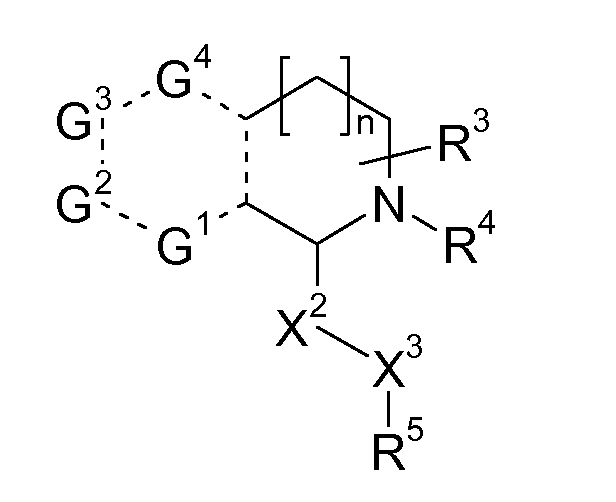
В указанной формуле G1, G2, G3 и G4 независимо обозначают -CH=, -CH2-, -N=, -NH-, S или O, пунктирная линия означает, что связь может быть одинарной или двойной, и R3, R4, X2, X3, R5 имеют значения, указанные в данном документе.
Гетероциклические соединения, содержащие следующие неполные структуры, являются предпочтительными:
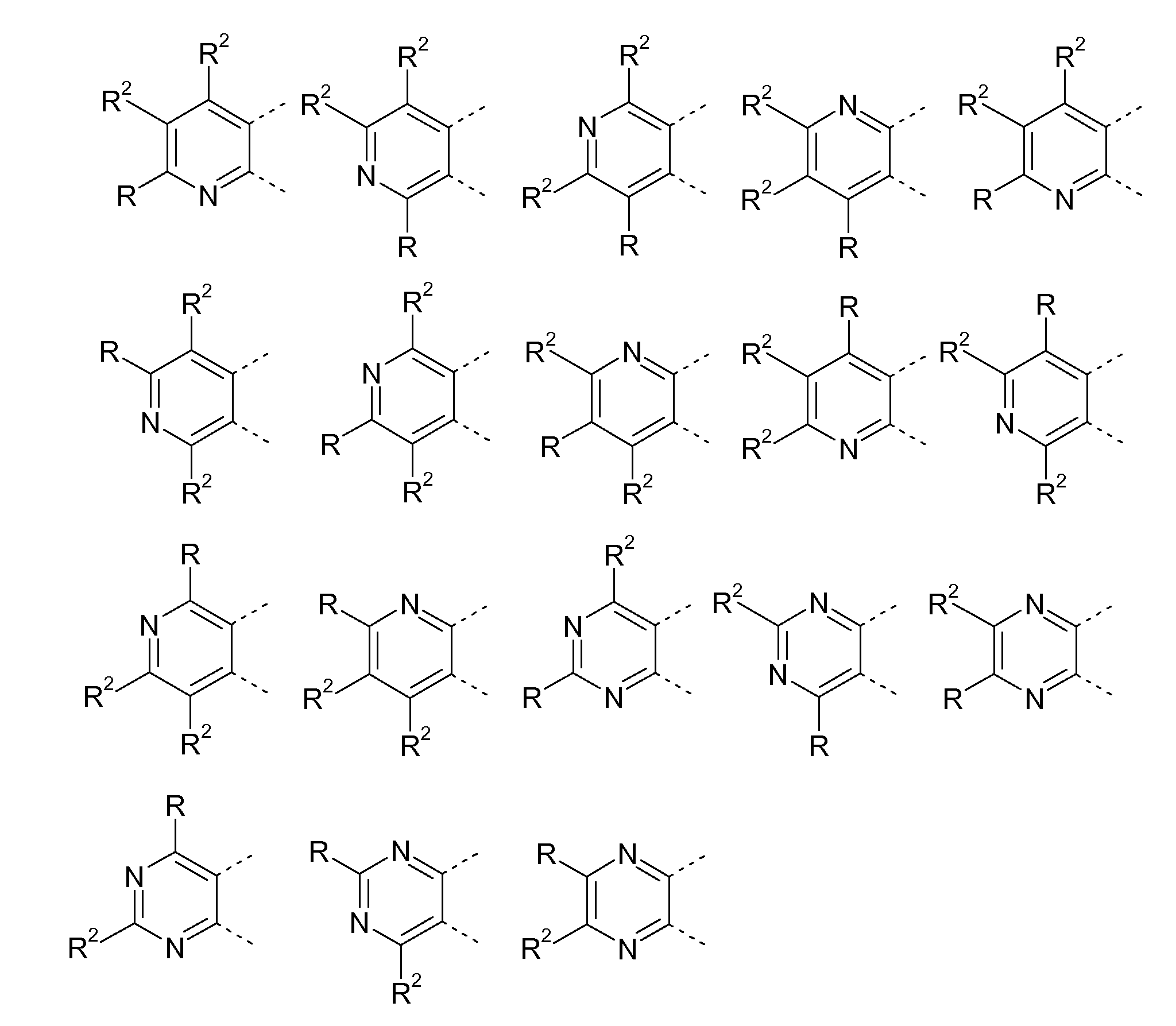

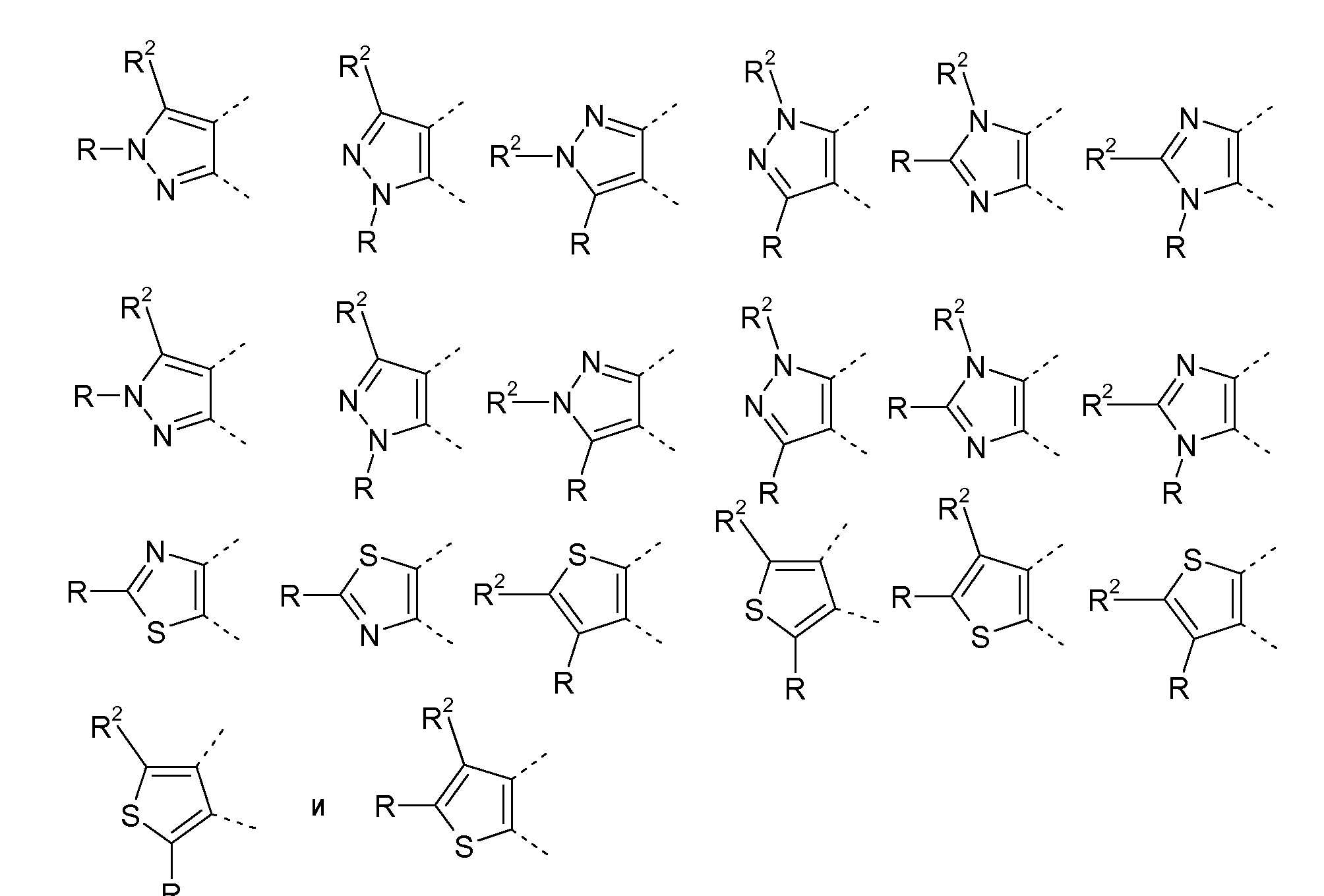
Гетероциклические соединения, содержащие следующие неполные структуры, являются особенно предпочтительными:
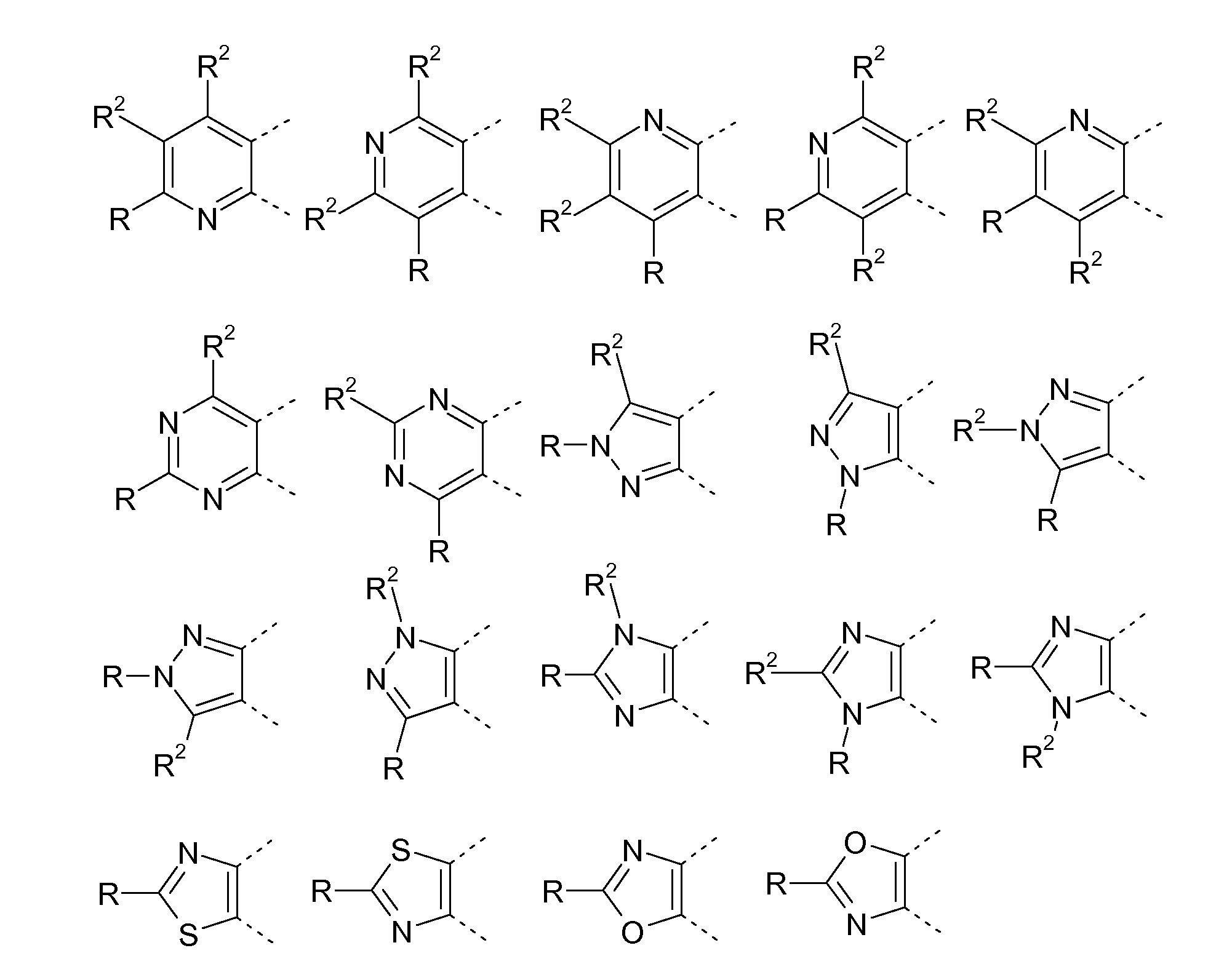

В приведенных формулах R и R2 имеют значения, указанные в данном документе. Если присутствует несколько радикалов R2, они могут быть одинаковыми или разными.
В соответствии с конкретным воплощением, изображенные выше неполные структуры конденсированы с циклогексановым фрагментом (т.е., n равен 1). Это относится к предпочтительным и конкретным воплощениям кольца A.
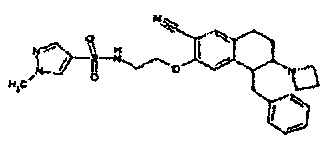
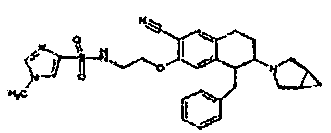
В соответствии с одним воплощением R обозначает циано.
Предпочтительно, R обозначает R1-W-A1-Q-Y-A2-X1-, и A, R1, W, A1, Q, Y, A2, X1, R2, R3, R4a, R4b, X2, X3, R5 имеют значения, указанные в данном документе.
R1 обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил, изопропил или втор-бутил, другим примером является н-бутил или н-пентил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопентилметил или циклогексилметил, другим примером является циклопропилметил), галогенированный C1-C6-алкил (например, 3-фторпроп-1-ил, 3-хлорпроп-1-ил или 3,3,3-трифторпроп-1-ил), гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил (например, этоксиэтил), амино-C1-C4-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C1-C6-алкилкарбониламино-C1-C4-алкил, C1-C6-алкилоксикарбониламино-C1-C4-алкил, C1-C6-алкиламинокарбониламино-C1-C4-алкил, ди-C1-C6-алкиламинокарбониламино-C1-C4-алкил, C1-C6-алкилсульфониламино-C1-C4-алкил, (необязательно замещенный C6-C12-арил-C1-C6-алкил)амино-C1-C4-алкил, необязательно замещенный C6-C12-арил-C1-C4-алкил, необязательно замещенный C3-C12-гетероциклил-C1-C4-алкил, C3-C12-циклоалкил (например, циклопропил или циклобутил), C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, галогенированный C1-C6-алкоксикарбонил, C6-C12-арилоксикарбонил, аминокарбонил, C1-C6-алкиламинокарбонил, (галогенированный C1-C4-алкил)аминокарбонил, C6-C12-ариламинокарбонил, C2-C6-алкенил (например, проп-1,2-ен-1-ил), C2-C6-алкинил, необязательно замещенный C6-C12-арил (например, фенил, другим примером является 2-метилфенил), гидрокси, C1-C6-алкокси (например, трет-бутилокси), галогенированный C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C4-алкокси, амино-C1-C4-алкокси, C1-C6-алкиламино-C1-C4-алкокси, ди-C1-C6-алкиламино-C1-C4-алкокси, C1-C6-алкилкарбониламино-C1-C4-алкокси, C6-C12-арилкарбониламино-C1-C4-алкокси, C1-C6-алкоксикарбониламино-C1-C4-алкокси, C6-C12-арил-C1-C4-алкокси, C1-C6-алкилсульфониламино-C1-C4-алкокси, (галогенированный C1-C6-алкил)сульфониламино-C1-C4-алкокси, C6-C12-арилсульфониламино-C1-C4-алкокси, (C6-C12-арил-C1-C6-алкил)сульфониламино-C1-C4-алкокси, C3-C12-гетероциклилсульфониламино-C1-C4-алкокси, C3-C12-гетероциклил-C1-C4-алкокси, C6-C12-арилокси, C3-C12-гетероциклилокси, C1-C6-алкилтио, галогенированный C1-C6-алкилтио, C1-C6-алкиламино, (галогенированный C1-C6-алкил)амино, ди-C1-C6-алкиламино (например, диметиламино), ди-(галогенированный C1-C6-алкил)амино, C1-C6-алкилкарбониламино, (галогенированный C1-C6)-алкил)карбониламино, C6-C12-арилкарбониламино, C1-C6-алкилсульфониламино, (галогенированный C1-C6-алкил)сульфониламино, C6-C12-арилсульфониламино или необязательно замещенный C3-C12-гетероциклил (например, 3-пиридил, 2-тиенил, 4-метил-2-тиенил, 5-метил-2-тиенил, 5-хлор-2-тиенил, 2,5-диметил-3-тиенил, 1,2-диазол-4-ил, 1-метил-1,2-диазол-4-ил, 1-этил-1,2-диазол-4-ил, 1-дифторметил-1,2-диазол-4-ил, 2-метил-1,3-диазол-4-ил, 1-метил-1,3-диазол-4-ил, 2-метил-1,3-тиазол-5-ил, 2,4-диметил-1,3-тиазол-5-ил или 3-пирролидинил, другими примерами являются 1-метил-пиррол-3-ил, 2-пиридил, 1-метил-1,2-диазол-3-ил, 1-метил-3-трифторметил-1,2-диазол-4-ил, 1,2-диметил-1,3-диазол-4-ил, 5-метилизоксазол-3-ил или 1-метил-1,2,4-триазол-3-ил). Кроме того, R1 также может обозначать три-(C1-C4-алкил)-силил-C1-C4-алкил (например, триметилсилилэтил). Предпочтительно, R1 обозначает C1-C6-алкил (например, метил, этил, н-пропил, изопропил или втор-бутил, другим примером является н-бутил или н-пентил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопентилметил или циклогексилметил, другим примером является циклопропилметил), галогенированный C1-C6-алкил (например, 3-фторпроп-1-ил, 3-хлорпроп-1-ил или 3,3,3-трифторпроп-1-ил), C1-C6-алкокси-C1-C4-алкил (например, этоксиэтил), амино-C1-C4-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C1-C6-алкилоксикарбониламино-C1-C4-алкил, C1-C6-алкиламинокарбониламино-C1-C4-алкил, C6-C12-арил-C1-C4-алкил, C3-C12-циклоалкил (например, циклопропил или циклобутил), C2-C6-алкенил (например, проп-1,2-ен-1-ил), необязательно замещенный C6-C12-арил (например, фенил), гидрокси, C1-C6-алкиламино, (галогенированный C1-C6-алкил)амино, ди-C1-C6-алкиламино или необязательно замещенный C3-C12-гетероциклил (например, 3-пиридил, 2-тиенил, 4-метил-2-тиенил, 5-метил-2-тиенил, 5-хлор-2-тиенил, 2,5-диметил-3-тиенил, 1,2-диазол-4-ил, 1-метил-1,2-диазол-4-ил, 1-этил-1,2-диазол-4-ил, 1-дифторметил-1,2-диазол-4-ил, 2-метил-1,3-диазол-4-ил, 1-метил-1,3-диазол-4-ил, 2-метил-1,3-тиазол-5-ил, 2,4-диметил-1,3-тиазол-5-ил или 3-пирролидинил). Более предпочтительно, R1 обозначает три-(C1-C4-алкил)-силил-C1-C4-алкил (например, триметилсилилэтил).
В частности, R1 обозначает C1-C6-алкил (например, метил, этил, н-пропил, изопропил или втор-бутил, другим примером является н-бутил или н-пентил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопентилметил или циклогексилметил, другим примером является циклопропилметил), галогенированный C1-C6-алкил (например, 3-фторпроп-1-ил, 3-хлорпроп-1-ил или 3,3,3-трифторпроп-1-ил), C3-C12-циклоалкил (например, циклопропил или циклобутил), C2-C6-алкенил (например, проп-1,2-ен-1-ил), необязательно замещенный C6-C12-арил (например, фенил), или необязательно замещенный C3-C12-гетероциклил (например, 3-пиридил, 2-тиенил, 4-метил-2-тиенил, 5-метил-2-тиенил, 5-хлор-2-тиенил, 2,5-диметил-3-тиенил, 1,2-диазол-4-ил, 1-метил-1,2-диазол-4-ил, 1-этил-1,2-диазол-4-ил, 1-дифторметил-1,2-диазол-4-ил, 2-метил-1,3-диазол-4-ил, 1-метил-1,3-диазол-4-ил, 2-метил-1,3-тиазол-5-ил, 2,4-диметил-1,3-тиазол-5-ил или 3-пирролидинил). В частности, R1 также может обозначать три-(C1-C4-алкил)силил-C1-C4-алкил (например, триметилсилилэтил).
Применительно к R1, замещенный C6-C12-арил, в частности, включает C6-C12-арил, такой как фенил или нафтил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил, циано, C1-C4-алкокси, C1-C4-галогеналкокси, амино, C1-C4-алкиламино, C1-C4-диалкиламино, морфолино и пиперидинил. Это относится и к замещенному C6-C12-арилу, входящему в состав замещенного C6-C12-арил-C1-C4-алкила.
Применительно к R1, замещенный C3-C12-гетероциклил, в частности, включает C3-C12-гетероциклил, такой как пиридил, тиенил, диазолил, хинолинил, пиперидинил, пиперазинил или морфолинил (другими примерами такого C3-C12-гетероциклила являются пирролил, изоксазолил и триазолил), замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил, C1-C4-алкоксикарбонил, циано, C1-C4-алкокси, C1-C4-галогеналкокси, C1-C4-алкилсульфонил, амино, C1-C4-алкиламино, C1-C4-диалкиламино, C6-C12-ариламино и C3-C12-гетероциклил (например, морфолино или пиперидинил). Это относится и к замещенному C3-C12-гетероарилу, входящему в состав замещенного C3-C12-гетероарил-C1-C4-алкила.
В соответствии с одним воплощением W обозначает -NR8-, и Y обозначает связь. В соответствии с альтернативным воплощением W обозначает связь, и Y обозначает -NR9-. В соответствии с другим альтернативным воплощением W обозначает связь и Y обозначает связь, особенно, если R1 обозначает радикал, связанный с атомом азота, например, связанный с атомом азота гетероциклил, такой как пиперазинил или морфолинил.
В соответствии с одним воплощением Q обозначает -S(O)2-. В соответствии с альтернативным воплощением Q обозначает -C(O)-.
В соответствии с конкретным воплощением -W-A1-Q-Y- обозначает -W-A1-S(O)2-NR9-, -NR8-S(O)2-, -A1-S(O)2- или -S(O)2-. В соответствии с другим конкретным воплощением -W-A1-Q-Y- обозначает -W-A1-CO-NR9- или -NR8-CO-.
A1 обозначает необязательно замещенный C1-C4-алкилен или связь. Применительно к A1, замещенный C1-C4-алкилен, в частности, включает C1-C4-алкилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил и циано. Предпочтительно, A1 обозначает связь. Если A1 обозначает C1-C4-алкилен, W предпочтительно обозначает -NR8-.
A2 обозначает необязательно замещенный C1-C4-алкилен (например, 1,2-этилен или 1,3-пропилен), C1-C4-алкилен-CO-, -CO-C1-C4-алкилен, C1-C4-алкилен-O-C1-C4-алкилен, C1-C4-алкилен-NR10-C1-C4-алкилен, необязательно замещенный C6-C12-арилен, необязательно замещенный C6-C12-гетероарилен или связь. Кроме того, A2 может представлять собой необязательно замещенный C2-C4-алкенилен или необязательно замещенный C2-C4-алкинилен. Предпочтительно, A2 обозначает необязательно замещенный C1-C4-алкилен (например, 1,2-этилен или 1,3-пропилен). Более предпочтительно, A2 обозначает C1-C4-алкилен (например, 1,2-этилен или 1,3-пропилен). Альтернативно, A2 предпочтительные обозначает необязательно замещенный C6-C12-арилен, в частности, C6-C12-арилен, выбранный из группы, включающей фен-1,4-илен и фен-1,3-илен, или необязательно замещенный C6-C12-гетероарилен, в частности, C6-C12-гетероарилен, выбранный из группы, включающей пирид-2,5-илен и пирид-2,4-илен. Если A2 обозначает связь, X1 предпочтительно обозначает необязательно замещенный C1-C4-алкилен. Альтернативно, если A2 обозначает связь, X1 обозначает, в частности, необязательно замещенный C2-C4-алкенилен или необязательно замещенный C2-C4-алкинилен.
Применительно к A2, замещенный C1-C4-алкилен, в частности, включает C1-C4-алкилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил и циано.
Применительно к A2, замещенный C2-C4-алкенилен или замещенный C2-C4-алкинилен, в частности, включает C2-C4-алкенилен или C2-C4-алкинилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил и циано.
Применительно к A2, замещенный C6-C12-арилен, в частности, включает C6-C12-арилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей C1-C4-алкил, C1-C4-галогеналкил, C1-C4-алкоксикарбонил, циано, C1-C4-алкокси, C1-C4-галогеналкокси, C1-C4-алкилсульфонил, амино, C1-C4-алкиламино, C1-C4-диалкиламино, C6-C12ариламино и C3-C12-гетероциклил (например, морфолино или пиперидинил).
Применительно к A2, замещенный C6-C12-гетероарилен, в частности, включает C6-C12-гетероарилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей C1-C4-алкил, C1-C4-галогеналкил, C1-C4-алкоксикарбонил, циано, C1-C4-алкокси, C1-C4-галогеналкокси, C1-C4-алкилсульфонил, амино, C1-C4-алкиламино, C1-C4-диалкиламино, C6-C12-ариламино и C3-C12-гетероциклил (например, морфолино или пиперидинил).
X1 обозначает -O-, -NR11-, -S- или необязательно замещенный C1-C4-алкилен (например, -CH2-, другим примером является 1,2-этилен и 1,3-пропилен). Применительно к X1, замещенный C1-C4-алкилен, в частности, включает C1-C4-алкилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил и циано. Кроме того, X1 может представлять собой необязательно замещенный C2-C4-алкенилен или необязательно замещенный C2-C4-алкинилен (например, пропинилен). Применительно к X1, замещенный C2-C4-алкенилен или замещенный C2-C4-алкинилен, в частности, включает C2-C4-алкенилен или C2-C4-алкинилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил и циано. Предпочтительно, X1 обозначает -O-, -NR11, -S-. Более предпочтительно, X1 обозначает -O-. Альтернативно, X1 предпочтительно обозначает необязательно замещенный C1-C4-алкилен (например, -CH2-, 1,2-этилен и 1,3-пропилен).
В соответствии с конкретным воплощением A2 обозначает связь, и X1 обозначает необязательно замещенный C1-C4-алкилен, необязательно замещенный C2-C4-алкенилен или необязательно замещенный C2-C4-алкинилен.
В соответствии с конкретным воплощением R1-W-A1-Q-Y-A2-X1- обозначает R1-S(O)2-NH-A2-X1-, R1-NH-S(O)2-A2-X1-, R1-C(O)-NH-A2-X1- или R1-NH-C(O)-A2-X1-.
В соответствии с конкретным воплощением структурный элемент -Y-A2-X1- содержит, по меньшей мере, 2, 3 или 4 атома в основной цепи. В соответствии с другим конкретным воплощением структурный элемент -Y-A2-X1- содержит до 4, 5 или 6 атомов в основной цепи, например, от 2 до 6, от 2 до 5 или от 2 до 4 атомов в основной цепи, предпочтительно 2, 3 или 4 атома в основной цепи.
В соответствии с другим конкретным воплощением -Y-A2-X1- обозначает C1-C4-алкилен-O- или -NR9-C1-C4-алкилен-O-, причем -Y-A2-X1- предпочтительно содержит от 2 до 6, от 3 до 5, особенно предпочтительно 4 атома в основной цепи. Конкретные примеры -Y-A2-X1- включают -(CH2)3-O- и -NR9-(CH2)2-O-. В данном конкретном воплощении R9 имеет значения, определенные в настоящем документе, и предпочтительно R9 обозначает водород, C1-C6-алкил (например, метил или этил) или C3-C12-циклоалкил (например, циклопропил), или R9 обозначает C1-C4-алкилен, связанный с атомом углерода A2, который обозначает C1-C4-алкилен.
В соответствии с другим конкретным воплощением -Y-A2-X1- обозначает -NR9-C1-C4-алкилен- (например, -NH-CH2-, другим примером является -NH-(CH2)2- или -NH-(CH2)3-), причем -Y-A2-X1- предпочтительно содержит от 2 до 6, от 2 до 5, от 2 до 4, особенно предпочтительно 2, 3 или 4 атома в основной цепи. В данном конкретном воплощении R9 имеет значения, определенные в настоящем документе, и предпочтительно R9 обозначает водород, C1-C6-алкил (например, метил или этил) или C3-C12-циклоалкил (например, циклопропил); или R9 обозначает C1-C4-алкилен, связанный с атомом углерода X1, который обозначает C1-C4-алкилен. Если A представляет собой гетероцикл, указанное воплощение -Y-A2-X1- является особенно предпочтительным.
В соответствии с другим конкретным воплощением -Y-A2-X1- обозначает -NR9-C2-C4-алкенилен- или -NR9-C2-C4-алкинилен- (например, -NH-CH2-C≡C-), причем -Y-A2-X1- предпочтительно содержит от 2 до 6, от 3 до 5, и особенно предпочтительно, 4 атома в основной цепи. В данном конкретном воплощении R9 имеет значения, определенные в данном документе, и предпочтительно R9 обозначает водород, C1-C6-алкил (например, метил или этил) или C3-C12-циклоалкил (например, циклопропил или циклобутил). Если A обозначает гетероцикл, данное воплощение -Y-A2-X1- является особенно предпочтительным.
В соответствии с другим конкретным воплощением -Y-A2-X1- обозначает C1-C4-алкилен- (например, -(CH2)2-), причем -Y-A2-X1- предпочтительно содержит от 2 до 6, от 2 до 5, от 2 до 4 и, особенно предпочтительно, 2 атома в основной цепи. Если A обозначает гетероцикл, данное воплощение -Y-A2-X1- является особенно предпочтительным.
В соответствии с другим конкретным воплощением структурный мотив -Y-A2-X1-, раскрытый в данном описании, связан с Q, образуя -S(O)2- или -C(O)-. Конкретные примеры данного воплощения включают гетероциклические соединения настоящего изобретения, где R обозначает R1-S(O)2-Y-A2-X1 или R1-C(О)-Y-A2-X1.
Радикал R и, в частности, радикал R1-W-A1-Q-Y-A2-X1-, в основном, может быть связан с 5, 6, 7 или 8 положением аминотетралинового скелета:
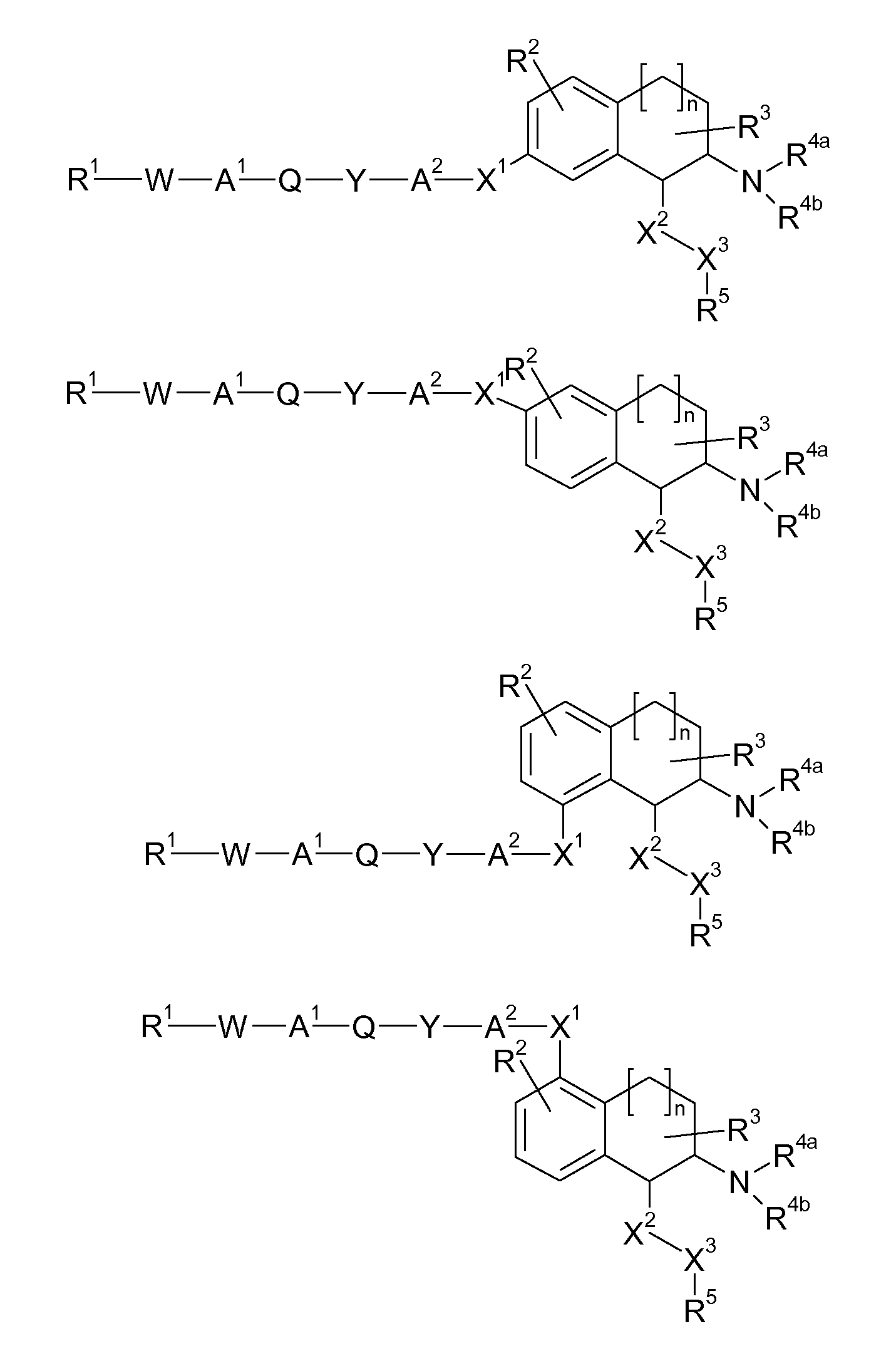
В приведенных формулах R1, W, A1, Q, Y, A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
Другие конкретные примеры включают гетероциклические соединения вышеуказанных формул, где радикал R1-W-A1-Q-Y-A2-X1- заменен радикалом -CN.
Аминотетралиновые производные, содержащие радикал R1-W-A1-Q-Y-A2-X1- (или радикал -CN) в 5, 6, 7 положении, являются предпочтительными.
Особенно предпочтительными являются аминотетралиновые производные, содержащие радикал R1-W-A1-Q-Y-A2-X1- (или радикал -CN) в 7 положении.
Помимо радикала R1-W-A1-Q-Y-A2-X1- (или радикала -CN) аминотетралиновые производные данного изобретения могут содержать один или несколько других заместителей, связанных с кольцом A. Так, в этих положениях скелет аминотетралиновых производных может быть замещен одним или несколькими радикалами R2. Если присутствует несколько радикалов R2, они могут быть одинаковыми или разными. В частности, в 5, 6, 7 и/или 8 положении аминотетралиновый скелет может быть замещен одним или несколькими радикалами R2. Таким образом, аминотетралиновые производные данного изобретения могут быть представлены одной из следующих формул:
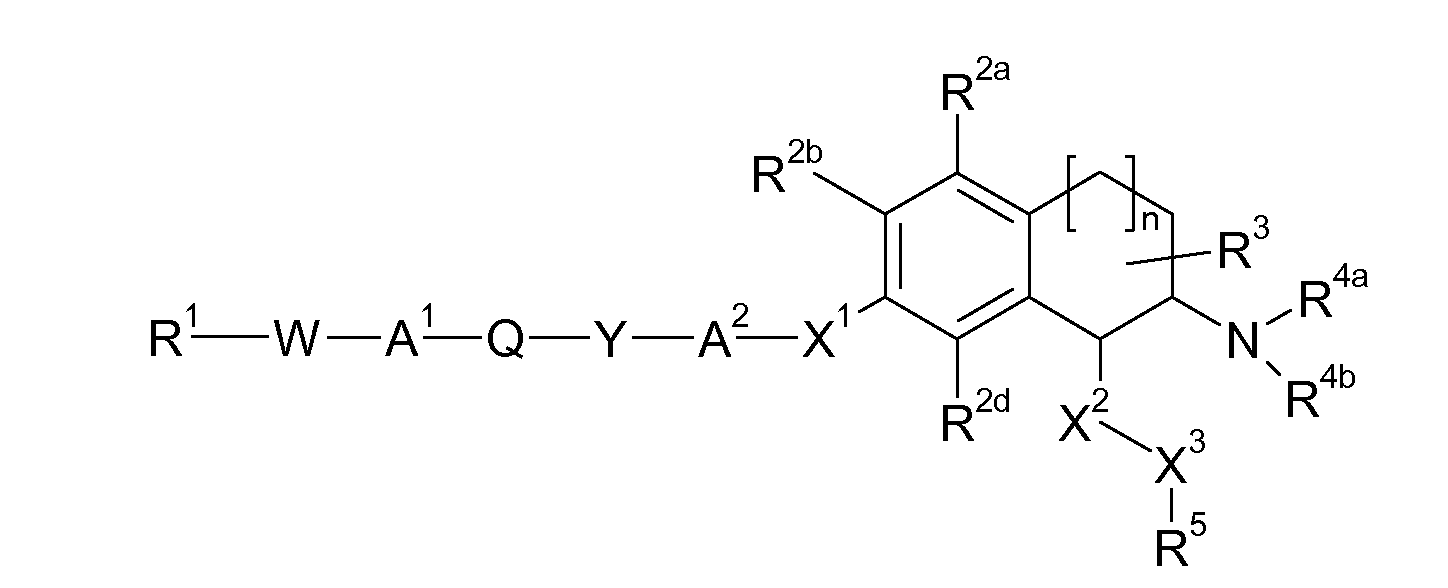
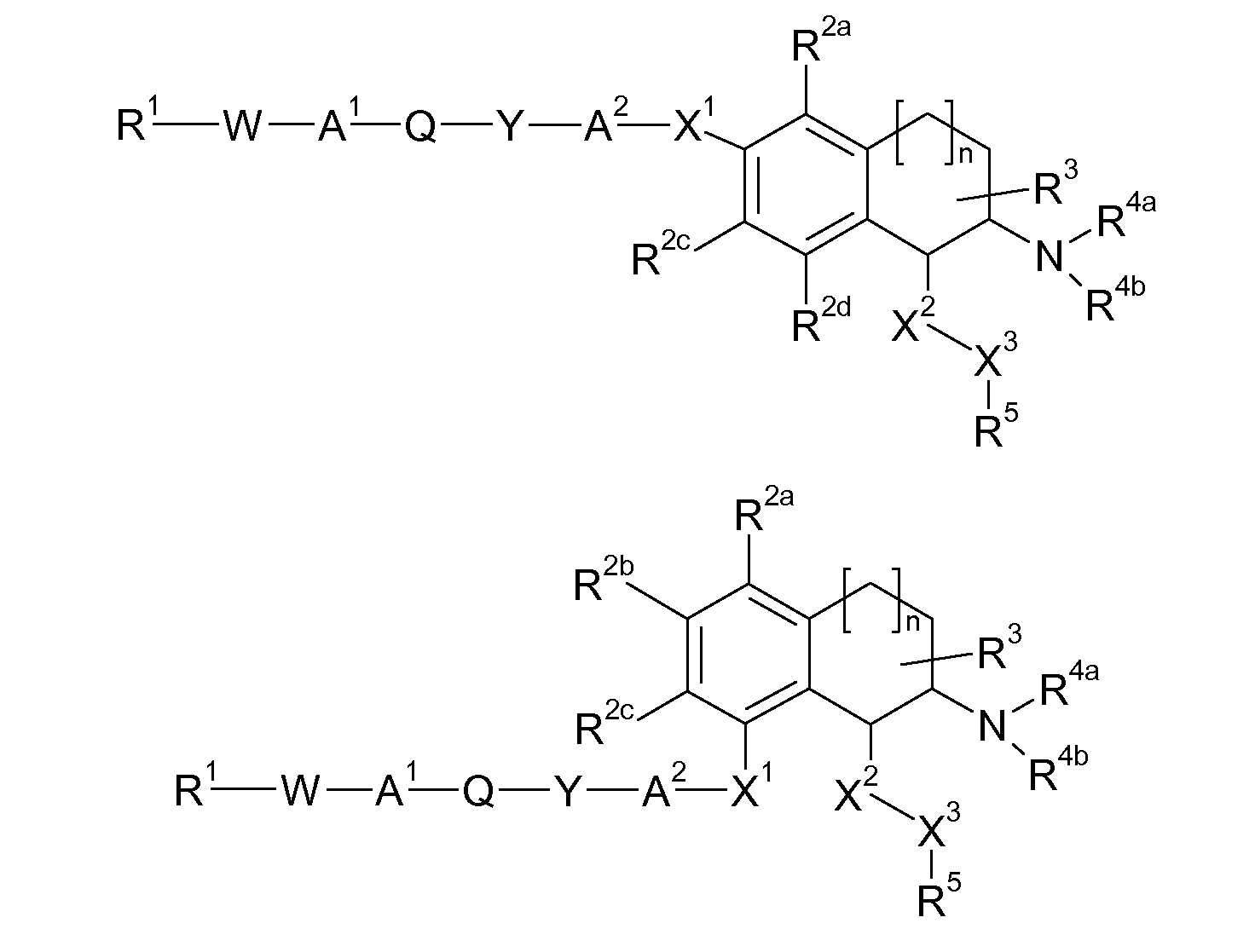

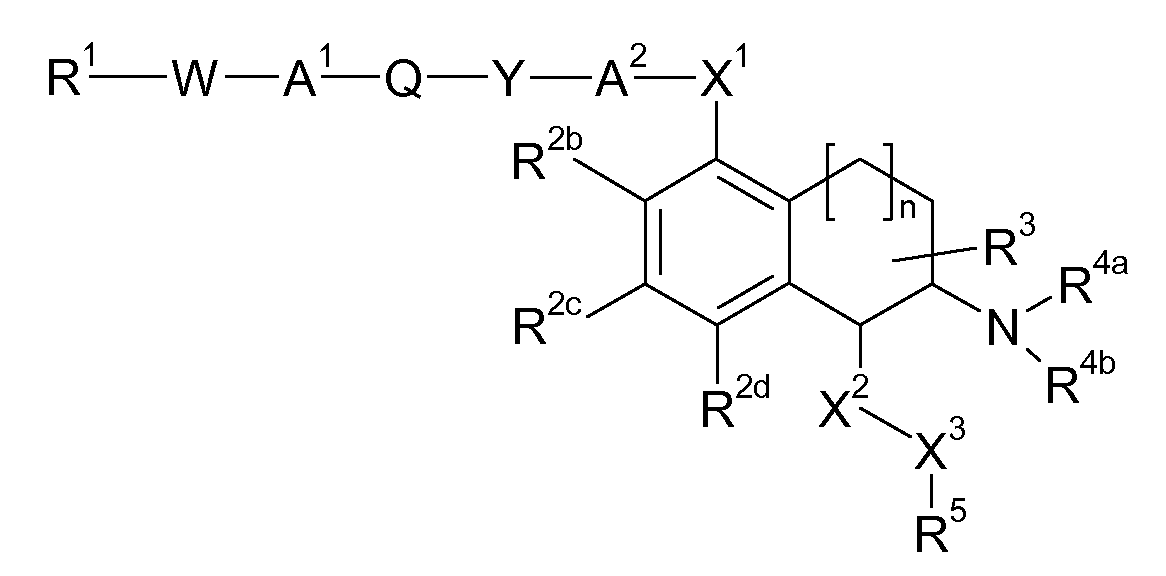
или соответствующими формулами, где радикал R1-W-A1-Q-Y-A2-X1- заменен радикалом -CN,
где R2a, R2b, R2c, R2d независимо имеют одно из значений, определенных для R2, и R1, W, A1, Q, Y, A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
R2 обозначает водород, галоген, C1-C6-алкил, галогенированный C1-C4-алкил, гидрокси-C1-C4-алкил, -CN, C2-C6-алкенил, C2-C6-алкинил, необязательно замещенный C6-C12-арил, гидрокси, C1-C6-алкокси, галогенированный C1-C6-алкокси, C1-C6-алкоксикарбонил, C2-C6-алкенилокси, C6-C12-арил-C1-C4-алкокси, C1-C6-алкилкарбонилокси, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, аминосульфонил, амино, C1-C6-алкиламино, C2-C6-алкениламино, нитро или необязательно замещенный C3-C12-гетероциклил, или два радикала R2 вместе с кольцевыми атомами A, к которым они присоединены, образуют 5- или 6-членное кольцо.
Необязательно замещенный 5- или 6-членное кольцо, образованное двумя радикалами R2 вместе с кольцевыми атомами A, с которыми они связаны, представляет собой, например, бензольное кольцо.
Применительно к R2, замещенный C6-C12-арил, в частности, включает C6-C12-арил, такой как фенил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген и C1-C4-алкил, C1-C4-галогеналкил, циано, C1-C4-алкокси и C1-C4-галогеналкокси.
Применительно к R2, замещенный C3-C12-гетероциклил, в частности, включает C3-C12-гетероциклил, такой как морфолинил, пирролидинил и пиперидинил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил, циано, C1-C4-алкокси и C1-C4-галогеналкокси.
Предпочтительно, R2 обозначает водород, галоген или C1-C6-алкокси. В частности, R2 обозначает водород.
В соответствии с конкретным воплощением, аминотетралиновые производные данного изобретения имеют одну из следующих формул:
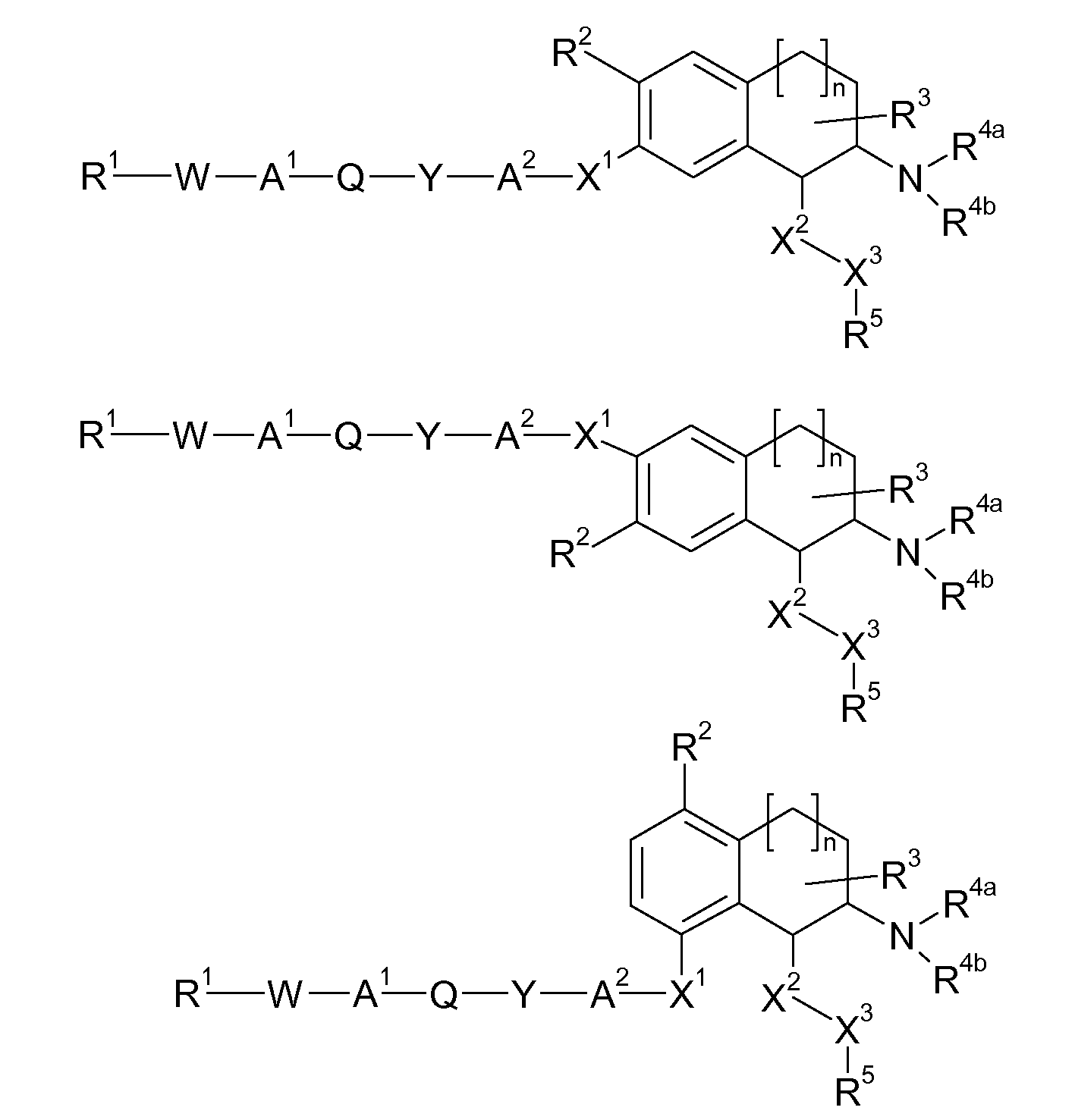

или они могут быть представлены соответствующими формулами, где радикал R1-W-A1-Q-Y-A2-X1- заменен радикалом -CN,
где R1, W, A1, Q, Y, A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
По 1, 2, 3, 4 и/или 5 положению аминотетралиновые производные данного изобретения могут быть замещены одним или несколькими радикалами R3. Если присутствует несколько радикалов R3, они могут быть одинаковыми или разными. Таким образом, аминотетралиновые производные данного изобретения могут быть представлены следующей формулой:
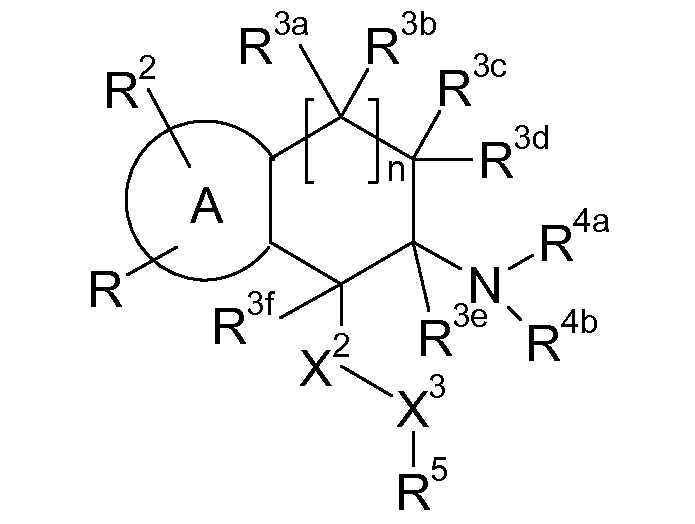
где R3a, R3b, R3c, R3d, R3e, R3f независимо имеют одно из значений, определенных для R3, и A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
В соответствии с конкретным воплощением, аминотетралиновые производные данного изобретения имеют одну из следующих формул:
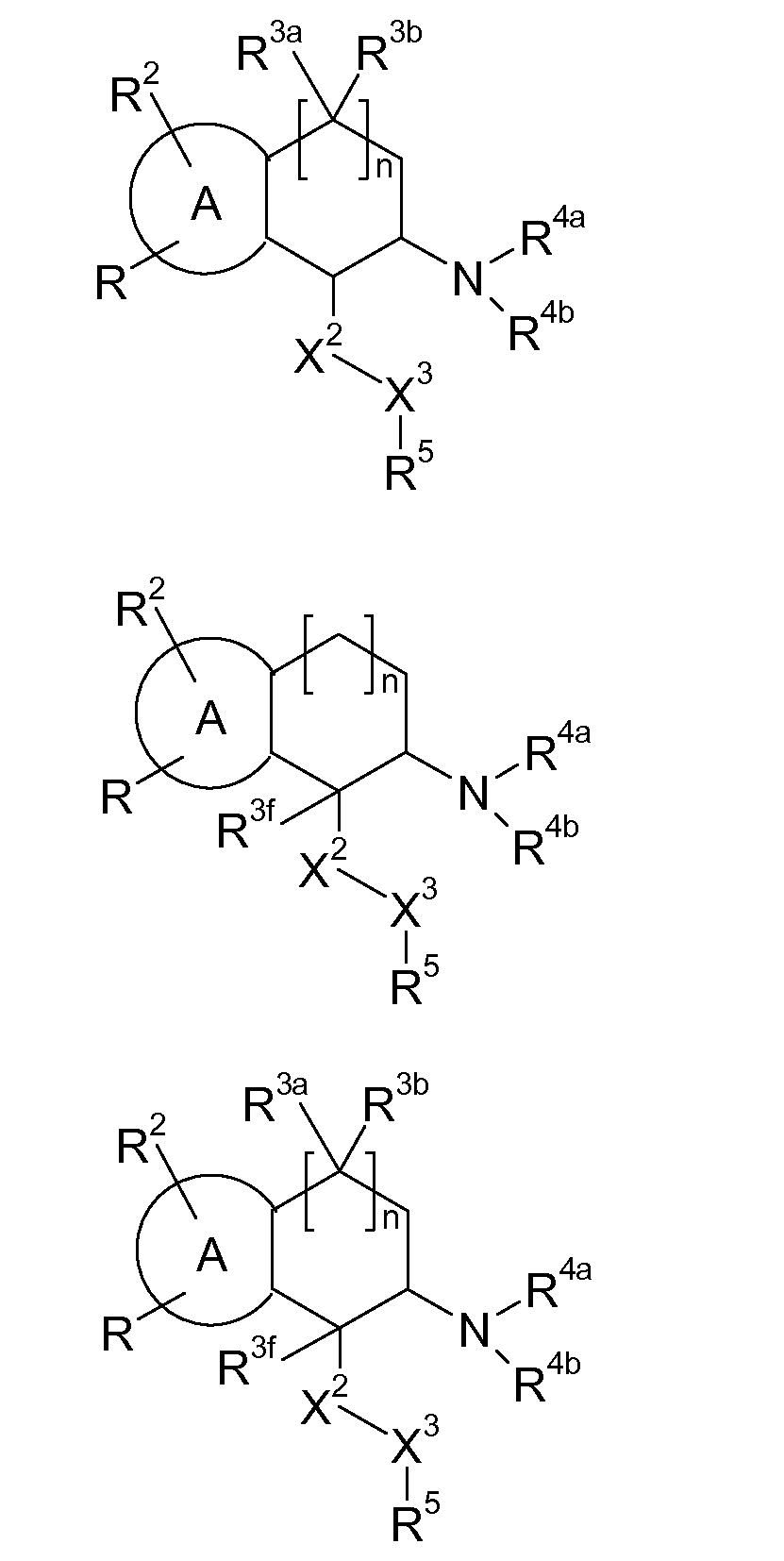
где R3a, R3b, R3f независимо имеют значения, определенные для R3, и A, R, R2, R3, R4a, R4b, X2, X3, R5, n имеют значения, указанные в данном документе.
R3 обозначает водород, галоген, C1-C6-алкил, C1-C6-алкокси, или два радикала R3 вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу.
Предпочтительно, R3 обозначает водород или C1-C6-алкил. В частности, R3 обозначает водород.
R4a обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил или изопропил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил), галогенированный C1-C4-алкил (например, 2-фторэтил или 2,2,2-трифторэтил), гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил, амино-C1-C4-алкил, CH2CN, -CHO, C1-C4-алкилкарбонил (например, метилкарбонил или изопропилкарбонил, другим примером является этилкарбонил), (галогенированный C1-C4-алкил)карбонил (например, фторметилкарбонил, дифторметилкарбонил или трифторметилкарбонил, другим примером является 1,1,1-трифторэт-2-илкарбонил или 1,1,1-трифторпроп-3-илкарбонил), C6-C12-арилкарбонил (например, фенилкарбонил), C1-C4-алкоксикарбонил (например, этоксикарбонил или трет-бутилоксикарбонил), C6-C12-арилоксикарбонил (например, феноксикарбонил), C1-C6-алкиламинокарбонил, C2-C6-алкенил, -C(=NH)NH2, -C(=NH)NHCN, C1-C6-алкилсульфонил, C6-C12-арилсульфонил, амино, -NO или C3-C12-гетероциклил.
Предпочтительно, R4a обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил или изопропил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил), галогенированный C1-C4-алкил (например, 2-фторэтил или 2,2,2-трифторэтил), амино-C1-C4-алкил, CH2CN, C1-C4-алкилкарбонил (например, метилкарбонил или изопропилкарбонил), (галогенированный C1-C4-алкил)карбонил (например, фторметилкарбонил, дифторметилкарбонил или трифторметилкарбонил), C6-C12-арилкарбонил (например, фенилкарбонил), C1-C4-алкоксикарбонил (например, этоксикарбонил или трет-бутилоксикарбонил), C6-C12-арилоксикарбонил (например, феноксикарбонил), -C(=NH)NH2, -C(=NH)NHCN, C1-C6-алкилсульфонил, амино, -NO или C3-C12-гетероциклил. Более предпочтительно, если R1 обозначает -CHO.
В частности R4a обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил или изопропил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил), галогенированный C1-C4-алкил (например, 2-фторэтил или 2,2,2-трифторэтил), C1-C4-алкилкарбонил (например, метилкарбонил или изопропилкарбонил), (галогенированный C1-C4-алкил)карбонил (например, фторметилкарбонил, дифторметилкарбонил или трифторметилкарбонил), C6-C12-арилкарбонил (например, фенилкарбонил), C1-C4-алкоксикарбонил (например, этоксикарбонил или трет-бутилоксикарбонил), C6-C12-арилоксикарбонил (например, феноксикарбонил). В частности, R4a также может обозначать -CHO.
R4b обозначает водород, C1-C6-алкил (например, метил, другим примером является этил), галогенированный C1-C4-алкил, гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил, амино-C1-C4-алкил, CH2CN, -CHO, C1-C4-алкилкарбонил, (галогенированный C1-C4-алкил)карбонил, C6-C12-арилкарбонил, C1-C4-алкоксикарбонил, C6-C12-арилоксикарбонил, C1-C6-алкиламинокарбонил, C2-C6-алкенил, -C(=NH)NH2, -C(=NH)NHCN, C1-C6-алкилсульфонил, C6-C12-арилсульфонил, амино, -NO или C3-C12-гетероциклил.
Предпочтительно, R4b обозначает водород, C1-C6-алкил (например, метил, другим примером является этил).
Альтернативно, R4a, R4b вместе обозначают необязательно замещенный C1-C6-алкилен (например, 1,4-бутилен, другим примером является 1,3-пропилен, 2-фторбут-1,4-илен или 1-оксобут-1,4-илен), где один -CH2- C1-C4-алкилена может быть заменен атомом кислорода (например, -CH2-CH2-О-CH2-CH2-) или -NR16.
X2 обозначает -O-, -NR6-, -S-, >CR12aR12b или связь. Предпочтительно, X2 обозначает >CR12aR12b.
X3 обозначает -O-, -NR7-, -S-, >CR13aR13b или связь. Предпочтительно, X3 обозначает связь.
Таким образом, предпочтительно, если X2 обозначает >CR12aR12b, и X3 обозначает связь.
R12a обозначает водород, необязательно замещенный C1-C6-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C3-C12-гетероциклил-C1-C6-алкил, необязательно замещенный C6-C12-арил или гидрокси. Предпочтительно, R12a обозначает водород или C1-C6-алкил.
R13a обозначает водород, необязательно замещенный C1-C6-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C3-C12-гетероциклил-C1-C6-алкил, необязательно замещенный C6-C12-арил или гидрокси. Предпочтительно, R13a обозначает водород или C1-C6-алкил.
Применительно к R12a и R13a, замещенный C1-C6-алкил, в частности, включает C1-C6-алкил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, гидрокси, C1-C4-алкокси и амино.
Применительно к R12a и R13a, замещенный C6-C12-арил, в частности, включает C6-C12-арил, такой как фенил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей C1-C4-алкил, C1-C4-галогеналкил, циано, C1-C4-алкокси и C1-C4-галогеналкокси.
R12b обозначает водород или C1-C6-алкил. В соответствии с конкретным воплощением R12b обозначает водород.
R13b обозначает водород или C1-C6-алкил. В соответствии с конкретным воплощением R13b обозначает водород.
Альтернативно, R12a и R12b или R13a и R13b, вместе обозначают карбонил или, предпочтительно, необязательно замещенный C1-C4-алкилен (например, 1,3-пропилен), где один -CH2- в C1-C4-алкилене может быть заменен атомом кислорода или -NR14-.
Применительно к R12a и R12b или R13a и R13b, замещенный C1-C4-алкилен, в частности, включает C1-C4-алкилен, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, C1-C4-алкил, C1-C4-галогеналкил, циано, C1-C4-алкокси и C1-C4-галогеналкокси.
В соответствии с конкретным воплощением R12a обозначает C1-C6-алкил, и R12b обозначает водород или C1-C6-алкил, или R13a обозначает C1-C6-алкил, и R13b обозначает водород или C1-C6-алкил.
В соответствии с другим конкретным воплощением, R12a обозначает водород, и R12b обозначает водород, или R13a обозначает водород, и R13b обозначает водород.
В соответствии с другим конкретным воплощением R12a и R12b вместе обозначают необязательно замещенный 1,3-пропилен, или R13a и R13b вместе обозначают необязательно замещенный 1,3-пропилен.
R5 обозначает необязательно замещенный C6-C12-арил (например, фенил, 3-хлорфенил, 3,4-дихлорфенил или 2,4-дихлорфенил, другим примером является 2-фторфенил, 2-хлорфенил, 3-фторфенил, 3-хлорфенил; 3-цианофенил, 3-метилфенил, 3-трифторметилфенил, 3-метоксифенил, 4-фторфенил, 4-хлорфенил, 4-метоксифенил, 3,4-дифторфенил, 3,5-дифторфенил, 3-фтор-5-хлорфенил, 3-хлор-4-фторфенил), необязательно замещенный C3-C12-циклоалкил (например, циклогексил) или необязательно замещенный C3-C12-гетероциклил.
Применительно к R5, замещенный C3-C12-циклоалкил, в частности, включает C3-C12-циклоалкил, такой как циклопропил или циклогексил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, необязательно замещенный C1-C6-алкил, галогенированный C1-C6-алкил, CN, гидрокси, C1-C6-алкокси, галогенированный C1-C6-алкокси, амино, C1-C6-алкиламино, ди-C1-C6-алкиламино и C3-C12-гетероциклил.
Применительно к R5, замещенный C6-C12-арил, в частности, включает C6-C12-арил, такой как фенил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген (например, F, Cl, Br), необязательно замещенный C1-C6-алкил (например, метил), галогенированный C1-C6-алкил (например, трифторметил), CN, гидрокси, C1-C6-алкокси (например, метокси), галогенированный C1-C6-алкокси, амино, C1-C6-алкиламино, ди-C1-C6-алкиламино и C3-C12-гетероциклил.
Применительно к R5, замещенный C3-C12-гетероциклил, в частности, включает C3-C12-гетероциклил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, необязательно замещенный C1-C6-алкил, галогенированный C1-C6-алкил, CN, гидрокси, C1-C6-алкокси, галогенированный C1-C6-алкокси, амино, C1-C6-алкиламино, ди-C1-C6-алкиламино и C3-C12-гетероциклил.
Применительно к R5, C3-C12-гетероциклил, в частности, обозначает C3-C12-гетероарил.
Предпочтительно, R5 обозначает необязательно замещенный C6-C12-арил, в частности, как в аминотетралиновых производных формулы:
где A, R, R2, R3, R4a, R4b, X2, X3, n имеют значения, указанные в данном документе, и R15a, R15b, R15c, R15d, R15e независимо обозначают водород, галоген (например, F, Cl или Br), необязательно замещенный C1-C6-алкил (например, метил), галогенированный C1-C6-алкил (например, трифторметил), CN, гидрокси, C1-C6-алкокси (например, метокси), амино, C1-C6-алкиламино, ди-C1-C6-алкиламино или C3-C12-гетероциклил.
В соответствии с конкретным воплощением настоящее изобретение относится к аминотетралиновым производным формулы:
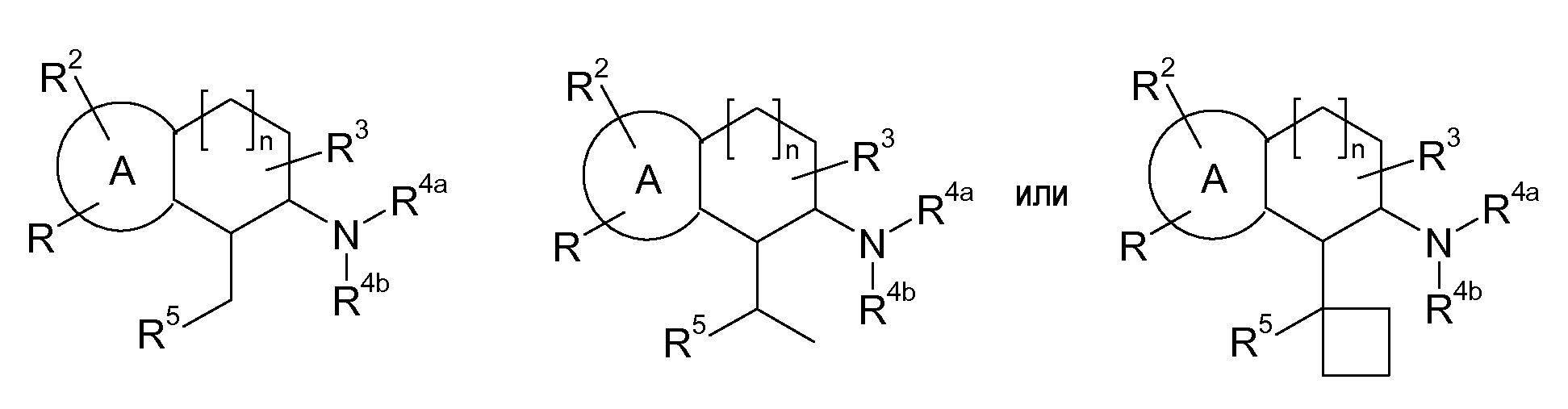
где A, R, R2, R3, R4a, R4b, R5, n имеют значения, указанные в данном документе, причем R5 предпочтительно обозначает необязательно замещенный арил, в частности, необязательно замещенный фенил, как описано в данном документе.
Применительно к R5, или R15a, R15b, R15c, R15d, R15e, замещенный C1-C6-алкил, в частности, включает C1-C6-алкил, особенно C1-C4-алкил, замещенный 1, 2 или 3 заместителями, выбранными из группы, включающей гидрокси, C1-C6-алкокси, амино, C1-C6-алкиламино, ди-C1-C6-алкиламино и C3-C12-гетероциклил (например, морфолинил или пиперидинил).
В соответствии с конкретным воплощением R15a, R15b, R15d, R15e обозначают водород, и R15c отличается от водорода (пара-моно-замещение).
В соответствии с другим конкретным воплощением R15a, R15c, R15d, R15e обозначают водород, и R15b отличается от водорода (мета-моно-замещение).
Применительно к R15a, R15b, R15c, R15d, R15e, C3-C12-гетероциклил, в частности, включает морфолинил, имидазолил и пиразолил.
Индекс n равен 0, 1 или 2. В соответствии с конкретным воплощением n равен 1.
R6 обозначает водород или C1-C6-алкил. Предпочтительно, R6 обозначает водород.
R7 обозначает водород или C1-C6-алкил. Предпочтительно, R7 обозначает водород.
R8 обозначает водород или C1-C6-алкил. Предпочтительно, R8 обозначает водород.
R9 обозначает водород, C1-C6-алкил (например, метил или этил), C3-C12-циклоалкил (например, циклопропил), амино-C1-C6-алкил, необязательно замещенный C6-C12-арил-C1-C4-алкил или C3-C12-гетероциклил (например, 3-азетидинил). Предпочтительно, R9 обозначает водород или C1-C6-алкил (например, метил или этил).
В соответствии с конкретным воплощением R9 и R1 вместе обозначают C1-C4-алкилен (например, 1,3-пропилен, другим примером является 1,2-этилен), так, что R9 и R1 вместе с атомом Q, с которым связан R1, и атомом азота, с которым связан R9, образуют гетероциклическое кольцо, содержащее, в частности, 4, 5 или 6 кольцевых атомов (включая атом азота и Q). С учетом того, что W и A1 оба обозначают связь, такое кольцо может быть представлено следующей неполной структурой:
где Q имеет значения, определенные в данном документе (например, представляет собой S(O)2), и n равен 0, 1, 2, 3 или 4.
В соответствии с другим конкретным воплощением R9 обозначает C1-C4-алкилен (например, метилен или 1,3-пропилен), связанный с атомом углерода A2, и A2 обозначает C1-C4-алкилен, так, что R9 и, по меньшей мере, часть A2 вместе с атомом азота, с которым связан R9, образуют N-содержащее гетероциклическое кольцо, состоящее, в частности, из 4, 5, 6 или 7 кольцевых атомов (включающих атом азота). Такое кольцо может быть представлено следующей неполной структурой:
где R1, W, A1, Q и X1 имеют значения, указанные в данном документе, p равен 1 или 2, r равен 0, 1 или 2, и q равен 0, 1 или 2. В данном конкретном воплощении X1 предпочтительно обозначает -O-. Конкретные сочетания p, r и q включают p=1, r=0, q=1; и p=1, r=0, q=0. Альтернативно p равен 0, r равен 3, и q равен 1, причем X1 предпочтительно обозначает -O-.
В соответствии с другим конкретным воплощением R9 обозначает C1-C4-алкилен (например, метилен или 1,3-пропилен), связанный с атомом углерода X1, и X1 обозначает C1-C4-алкилен (например, 1,2-этилен), так, что R9 и, по меньшей мере, часть X1 вместе с атомом азота, с которым связан R9, образуют N-содержащее гетероциклическое кольцо, состоящее, в частности, из 4, 5, 6 или 7 кольцевых атомов (включающих атом азота). С учетом того, что A2 обозначает связь, такое кольцо может быть представлено следующей неполной структурой:
где R1, W, A1, Q и X1 имеют значения, указанные в данном документе, p равен 1 или 2, r равен 0, 1 или 2, и q равен 0, 1 или 2. Конкретные сочетания p, r и q включают p=1, r=0, q=0.
R10 обозначает водород, C1-C6-алкил или C1-C6-алкилсульфонил. Предпочтительно, R10 обозначает водород.
R11 обозначает водород или C1-C6-алкил. Предпочтительно, R11 обозначает водород.
Альтернативно, R9, R11 вместе обозначают C1-C4-алкилен (например, этилен).
R14 обозначает водород или C1-C6-алкил. Предпочтительно, R14 обозначает водород.
R15 обозначает водород или C1-C6-алкил. Предпочтительно, R15 обозначает водород.
R16 обозначает водород или C1-C6-алкил. Предпочтительно, R16 обозначает водород.
В конкретных воплощениях аминотетралиновых производных данного изобретения
A обозначает 5- или 6-членное кольцо;
R обозначает R1-W-A1-Q-Y-A2-X1- или -CN;
R1 обозначает водород, C1-C6-алкил, C3-C12-циклоалкил-C1-C4-алкил, галогенированный C1-C6-алкил, гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил, амино-C1-C4-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C1-C6-алкилкарбониламино-C1-C4-алкил, C1-C6-алкилоксикарбониламино-C1-C4-алкил, C1-C6-алкиламинокарбониламино-C1-C4-алкил, ди-C1-C6-алкиламинокарбониламино-C1-C4-алкил, C1-C6-алкилсульфониламино-C1-C4-алкил, (необязательно замещенный C6-C12-арил-C1-C6-алкил)амино-C1-C4-алкил, необязательно замещенный C6-C12-арил-C1-C4-алкил, необязательно замещенный C3-C12-гетероциклил-C1-C4-алкил, C3-C12-циклоалкил, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, галогенированный C1-C6-алкоксикарбонил, C6-C12-арилоксикарбонил, аминокарбонил, C1-C6-алкиламинокарбонил, (галогенированный C1-C4-алкил)аминокарбонил, C6-C12-ариламинокарбонил, C2-C6-алкенил, C2-C6-алкинил, необязательно замещенный C6-C12-арил, гидрокси, C1-C6-алкокси, галогенированный C1-C6-алкокси, C1-C6-гидроксиалкокси, C1-C6-алкокси-C1-C4-алкокси, амино-C1-C4-алкокси, C1-C6-алкиламино-C1-C4-алкокси, ди-C1-C6-алкиламино-C1-C4-алкокси, C1-C6-алкилкарбониламино-C1-C4-алкокси, C6-C12-арилкарбониламино-C1-C4-алкокси, C1-C6-алкоксикарбониламино-C1-C4-алкокси, C6-C12-арил-C1-C4-алкокси, C1-C6-алкилсульфониламино-C1-C4-алкокси, (галогенированный C1-C6-алкил)сульфониламино-C1-C4-алкокси, C6-C12-арилсульфониламино-C1-C4-алкокси, (C6-C12-арил-C1-C6-алкил)сульфониламино-C1-C4-алкокси, C3-C12-гетероциклилсульфониламино-C1-C4-алкокси, C3-C12-гетероциклил-C1-C4-алкокси, C6-C12-арилокси, C3-C12-гетероциклилокси, C1-C6-алкилтио, галогенированный C1-C6-алкилтио, C1-C6-алкиламино, (галогенированный C1-C6-алкил)амино, ди-C1-C6-алкиламино, ди-(галогенированный C1-C6-алкил)амино, C1-C6-алкилкарбониламино, (галогенированный C1-C6-алкил)карбониламино, C6-C12-арилкарбониламино, C1-C6-алкилсульфониламино, (галогенированный C1-C6-алкил)сульфониламино, C6-C12-арилсульфониламино или необязательно замещенный C3-C12-гетероциклил;
W обозначает -NR8- или связь;
A1 обозначает необязательно замещенный C1-C4-алкилен или связь;
Q обозначает -S(O)2- или -C(O)-;
Y обозначает -NR9- или связь;
A2 обозначает необязательно замещенный C1-C4-алкилен, C1-C4-алкилен-CO-, -CO-C1-C4-алкилен, C1-C4-алкилен-O-C1-C4-алкилен, C1-C4-алкилен-NR10-C1-C4-алкилен, необязательно замещенный C6-C12-арилен, необязательно замещенный C6-C12-гетероарилен или связь;
X1 обозначает -O-, -NR11-, -S-, необязательно замещенный C1-C4-алкилен;
R2 обозначает водород, галоген, C1-C6-алкил, галогенированный C1-C4-алкил, гидрокси-C1-C4-алкил, -CN, C2-C6-алкенил, C2-C6-алкинил, необязательно замещенный C6-C12-арил, гидрокси, C1-C6-алкокси, галогенированный C1-C6-алкокси, C1-C6-алкоксикарбонил, C2-C6-алкенилокси, C6-C12-арил-C1-C4-алкокси, C1-C6-алкилкарбонилокси, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, аминосульфонил, амино, C1-C6-алкиламино, C2-C6-алкениламино, нитро или необязательно замещенный C3-C12-гетероциклил, или два радикала R2 вместе с кольцевыми атомами A, к которым они присоединены, образуют 5- или 6 членное кольцо;
R3 обозначает водород, галоген, C1-C6-алкил или C1-C6-алкокси, или два радикала R3 вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу;
R4a обозначает водород, C1-C6-алкил, C3-C12-циклоалкил-C1-C4-алкил, галогенированный C1-C4-алкил, гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил, амино-C1-C4-алкил, CH2CN, -CHO, C1-C4-алкилкарбонил, (галогенированный C1-C4-алкил)карбонил, C6-C12-арилкарбонил, C1-C4-алкоксикарбонил, C6-C12-арилоксикарбонил, C1-C6-алкиламинокарбонил, C2-C6-алкенил, -C(=NH)NH2, -C(=NH)NHCN, C1-C6-алкилсульфонил, C6-C12-арилсульфонил, амино, -NO или C3-C12-гетероциклил;
R4b обозначает водород, C1-C6-алкил, галогенированный C1-C4-алкил, гидрокси-C1-C4-алкил, C1-C6-алкокси-C1-C4-алкил, амино-C1-C4-алкил, CH2CN, -CHO, C1-C4-алкилкарбонил, (галогенированный C1-C4-алкил)карбонил, C6-C12-арилкарбонил, C1-C4-алкоксикарбонил, C6-C12-арилоксикарбонил, C1-C6-алкиламинокарбонил, C2-C6-алкенил, -C(=NH)NH2, -C(=NH)NHCN, C1-C6-алкилсульфонил, C6-C12-арилсульфонил, амино, -NO или C3-C12-гетероциклил; или
R4a, R4b вместе обозначают необязательно замещенный C1-C6-алкилен, где один -CH2-, входящий в состав C1-C4-алкилена, может быть заменен атомом кислорода или -NR16;
X2 обозначает -O-, -NR6-, -S-, >CR12aR12b или связь;
X3 обозначает -O-, -NR7-, -S-, >CR13aR13b или связь;
R5 обозначает необязательно замещенный C6-C12-арил, необязательно замещенный C3-C12-циклоалкил или необязательно замещенный C3-C12-гетероциклил;
n равен 0, 1 или 2;
R6 обозначает водород или C1-C6-алкил;
R7 обозначает водород или C1-C6-алкил;
R8 обозначает водород или C1-C6-алкил;
R9 обозначает водород, C1-C6-алкил, C3-C12-циклоалкил, амино-C1-C6-алкил, необязательно замещенный C6-C12-арил-C1-C4-алкил; или
R9, R1 вместе обозначают C1-C4-алкилен; или
R9 обозначает C1-C4-алкилен, связанный с атомом углерода A2, где A2 обозначает C1-C4-алкилен, или с атомом углерода X1, где X1 обозначает C1-C4-алкилен;
R10 обозначает водород, C1-C6-алкил или C1-C6-алкилсульфонил;
R11 обозначает водород или C1-C6-алкил, или
R9, R11 вместе обозначают C1-C4-алкилен,
R12a обозначает водород, необязательно замещенный C1-C6-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C3-C12-гетероциклил-C1-C6-алкил, необязательно замещенный C6-C12-арил или гидрокси;
R12b обозначает водород или C1-C6-алкил, или
R12a, R12b вместе обозначают карбонил или необязательно замещенный C1-C4-алкилен, где один -CH2-, входящий в состав C1-C4-алкилена, может быть заменен атомом кислорода или -NR14-;
R13a обозначает водород, необязательно замещенный C1-C6-алкил, C1-C6-алкиламино-C1-C4-алкил, ди-C1-C6-алкиламино-C1-C4-алкил, C3-C12-гетероциклил-C1-C6-алкил, необязательно замещенный C6-C12-арил или гидрокси;
R13b обозначает водород или C1-C6-алкил, или
R13a, R13b вместе обозначают карбонил или необязательно замещенный C1-C4-алкилен, где один -CH2-, входящий в состав C1-C4-алкилена, может быть заменен атомом кислорода или -NR15-;
R14 обозначает водород или C1-C6-алкил;
R15 обозначает водород или C1-C6-алкил; и
R16 обозначает водород или C1-C6-алкил,
или в данном описании могут быть указаны более точные определения одной или нескольких из указанных переменных A, R, R1, W, A1, Q, Y, A2, X1, R2, R3, R4, X2, X3, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, n.
В других конкретных воплощениях аминотетралиновых производных данного изобретения
A обозначает бензольное кольцо;
R обозначает R1-W-A1-Q-Y-A2-X1-;
R1 обозначает C1-C6-алкил (например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, н-пентил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил, циклопентилметил, циклогексилметил), галогенированный C1-C6-алкил (например, 3-фторпроп-1-ил, 3-хлорпроп-1-ил, 3,3,3-трифторпроп-1-ил), три-(C1-C4-алкил)силил-C1-C4-алкил (например, триметилсилилэтил), C1-C6-алкокси-C1-C4-алкил (например, этоксиэтил), C3-C12-циклоалкил (например, циклопропил, циклобутил, циклогексил), C2-C6-алкенил (например, проп-1,2-ен-1-ил), необязательно замещенный C6-C12-арил (например, фенил, 2-метилфенил) или необязательно замещенный C3-C12-гетероциклил (например, 1-метилпиррол-3-ил, 2-пиридил, 3-пиридил, 2-тиенил, 4-метил-2-тиенил, 5-метил-2-тиенил, 5-хлор-2-тиенил, 2,5-диметил-3-тиенил, 1,2-диазол-4-ил, 1-метил-1,2-диазол-3-ил, 1-метил-1,2-диазол-4-ил, 1-этил-1,2-диазол-4-ил, 1-дифторметил-1,2-диазол-4-ил, 1-метил-3-трифторметил-1,2-диазол-4-ил, 2-метил-1,3-диазол-4-ил, 1-метил-1,3-диазол-4-ил, 1,2-диметил-1,3-диазол-4-ил, 5-метилизоксазол-3-ил, 2-метил-1,3-тиазол-5-ил, 2,4-диметил-1,3-тиазол-5-ил, 1-метил-1,2,4-триазол-3-ил, 3-пирролидинил);
W обозначает связь;
A1 обозначает связь;
Q обозначает -S(O)2- или -C(O)-;
Y обозначает -NR9- или связь;
A2 обозначает C1-C4-алкилен (например, 1,2-этилен, 1,3-пропилен) или связь;
X1 обозначает -O- или необязательно замещенный C1-C4-алкилен (например, метилен, 1,2-этилен, 1,3-пропилен) или C2-C4-алкинилен (например, проп-1,2-ин-1,3-илен);
R2 обозначает водород;
R3 обозначает водород;
R4a обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил, изопропил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил), галогенированный C1-C4-алкил (например, 2-фторэтил, 2,2,2-трифторэтил), -CHO, C1-C4-алкилкарбонил (например, метилкарбонил, этилкарбонил, изопропилкарбонил), (галогенированный C1-C4-алкил)карбонил (например, фторметилкарбонил, дифторметилкарбонил, трифторметилкарбонил, 1,1,1-трифторэт-2-илкарбонил, 1,1,1-трифторпроп-3-илкарбонил), C6-C12-арилкарбонил (например, фенилкарбонил), C1-C4-алкоксикарбонил (например, этоксикарбонил, трет-бутилоксикарбонил), C6-C12-арилоксикарбонил (например, феноксикарбонил);
R4b обозначает водород или C1-C6-алкил (например, метил, этил); или
R4a, R4b вместе обозначают необязательно замещенный C1-C6-алкилен (например, 1,3-пропилен, 1,4-бутилен, 2-фторбут-1,4-илен, 1-оксо-бут-1,4-илен), где один -CH2-, входящий в состав C1-C4-алкилена, может быть заменен атомом кислорода (например, -CH2-CH2-O-CH2-CH2-);
X2 обозначает CR12aR12b;
X3 обозначает связь;
R5 обозначает необязательно замещенный фенил (например, фенил, 2-фторфенил, 2-хлорфенил, 3-фторфенил, 3-хлорфенил, 3-цианофенил, 3-метилфенил, 3-трифторметилфенил, 3-метоксифенил, 4-фторфенил, 4-хлорфенил, 4-метоксифенил, 3,4-дифторфенил, 3,5-дифторфенил, 3-фтор-5-хлорфенил, 3-хлор-4-фторфенил, 3,4-дихлорфенил, 2,4-дихлорфенил) или необязательно замещенный C3-C12-циклоалкил (например, циклогексил);
n равен 1;
R9 обозначает водород, C1-C6-алкил (например, метил, этил) или C3-C12-циклоалкил (циклопропил), или
R9, R1 вместе обозначают C1-C4-алкилен (например, 1,3-пропилен); или
R9 обозначает C1-C4-алкилен (например, метилен, 1,3-пропилен), связанный с атомом углерода A2, где A2 обозначает C1-C4-алкилен (например, 1,2-этилен, 1,3-пропилен), или с атомом углерода X1, где X1 обозначает C1-C4-алкилен (например, 1,2-этилен);
R12a обозначает водород; и
R12b обозначает водород.
В других конкретных воплощениях аминотетралиновых производных данного изобретения
A обозначает бензольное кольцо;
R обозначает R1-W-A1-Q-Y-A2-X1-;
R1 обозначает C1-C6-алкил (например, метил, этил, н-пропил, изопропил или втор-бутил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопентилметил или циклогексилметил), галогенированный C1-C6-алкил (например, 3-фторпроп-1-ил, 3-хлорпроп-1-ил или 3,3,3-трифторпроп-1-ил), C3-C12-циклоалкил (например, циклопропил или циклобутил), C2-C6-алкенил (например, проп-1,2-ен-1-ил), необязательно замещенный C6-C12-арил (например, фенил), или необязательно замещенный C3-C12-гетероциклил (например, 3-пиридил, 2-тиенил, 4-метил-2-тиенил, 5-метил-2-тиенил, 5-хлор-2-тиенил, 2,5-диметил-3-тиенил, 1,2-диазол-4-ил, 1-метил-1,2-диазол-4-ил, 1-этил-1,2-диазол-4-ил, 1-дифторметил-1,2-диазол-4-ил, 2-метил-1,3-диазол-4-ил, 1-метил-1,3-диазол-4-ил, 2-метил-1,3-тиазол-5-ил, 2,4-диметил-1,3-тиазол-5-ил или 3-пирролидинил);
W обозначает связь;
A1 обозначает связь;
Q обозначает -S(O)2- или -C(O)-;
Y обозначает -NR9- или связь;
A2 обозначает C1-C4-алкилен (например, метилен или 1,3-пропилен) или связь;
X1 обозначает -O- или необязательно замещенный C1-C4-алкилен (например, метилен);
R2 обозначает водород;
R3 обозначает водород;
R4a обозначает водород, C1-C6-алкил (например, метил, этил, н-пропил или изопропил), C3-C12-циклоалкил-C1-C4-алкил (например, циклопропилметил), галогенированный C1-C4-алкил (например, 2-фторэтил или 2,2,2-трифторэтил), C1-C4-алкилкарбонил (например, метилкарбонил или изопропилкарбонил), (галогенированный C1-C4-алкил)карбонил (например, фторметилкарбонил, дифторметилкарбонил или трифторметилкарбонил), C6-C12-арилкарбонил (например, фенилкарбонил), C1-C4-алкоксикарбонил (например, этоксикарбонил или трет-бутилоксикарбонил), C6-C12-арилоксикарбонил (например, феноксикарбонил);
R4b обозначает водород или C1-C6-алкил (например, метил);
X2 обозначает CR12aR12b;
X3 обозначает связь;
R5 обозначает необязательно замещенный фенил (например, фенил, 3-хлорфенил, 3,4-дихлорфенил или 2,4-дихлорфенил);
n обозначает 1;
R6 обозначает водород;
R7 обозначает водород;
R8 обозначает водород;
R9 обозначает водород или алкил (например, метил или этил); или
R9, R1 вместе обозначают C1-C4-алкилен (например, 1,3-пропилен); или
R9 обозначает C1-C4-алкилен (например, метилен или 1,3-пропилен), связанный с атомом углерода A2, где A2 обозначает C1-C4-алкилен;
R10 обозначает водород;
R11 обозначает водород;
R12a обозначает водород; и
R12b обозначает водород.
Конкретные соединения настоящего изобретения представляют собой аминотетралиновые производные, раскрытые в примерах получения, и их физиологически переносимые кислотно-аддитивные соли. Они включают соединение, приведенное в каждом примере получения, а также соответствующее свободное основание и любые другие физиологически переносимые кислотно-аддитивные соли свободного основания (если приведенное в примере соединение представляет собой соль), или любую физиологически переносимую кислотно-аддитивную соль свободного основания (если приведенное в примере соединение представляет собой свободное основание). Они также включают энантиомеры, диастереомеры, таутомеры и любые другие изомерные формы указанных соединений, независимо от того, раскрыты ли они в явной или неявной форме.
Соединения формулы (I) можно получить с помощью способов, аналогичных хорошо известным в данной области. Подходящие способы получения соединений формулы (I) описаны в нижеследующих схемах.
Способ, изображенный на схеме 1, можно использовать для получения аминотетралинов, в которых X1 обозначает -O- или -S-.
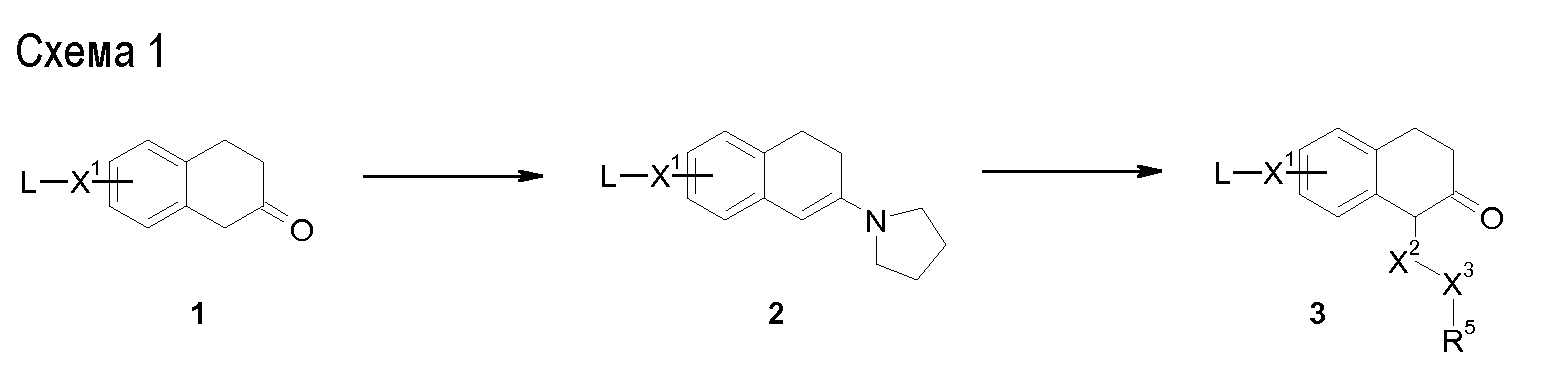
Как показано на схеме 1, соединение общей формулы 1 легко подвергается енаминовому алкилированию с получением соединения общей формулы 3.
На схеме 1 переменные X2, X3, R5 имеют значения, указанные в данном документе, и L обозначает подходящую защитную группу (например, L = Me). Способ, изображенный на схеме 1, также можно использовать для получения аминотетралинов, в которых X обозначает необязательно замещенный алкилен. В данном случае L обозначает группу, которая представляет собой требуемую боковую цепь R1-W-A1-Q-Y-A2- или может превращаться в нее.
Альтернативно, соединения формулы 3 можно получить по способу, описанному на схеме 2.
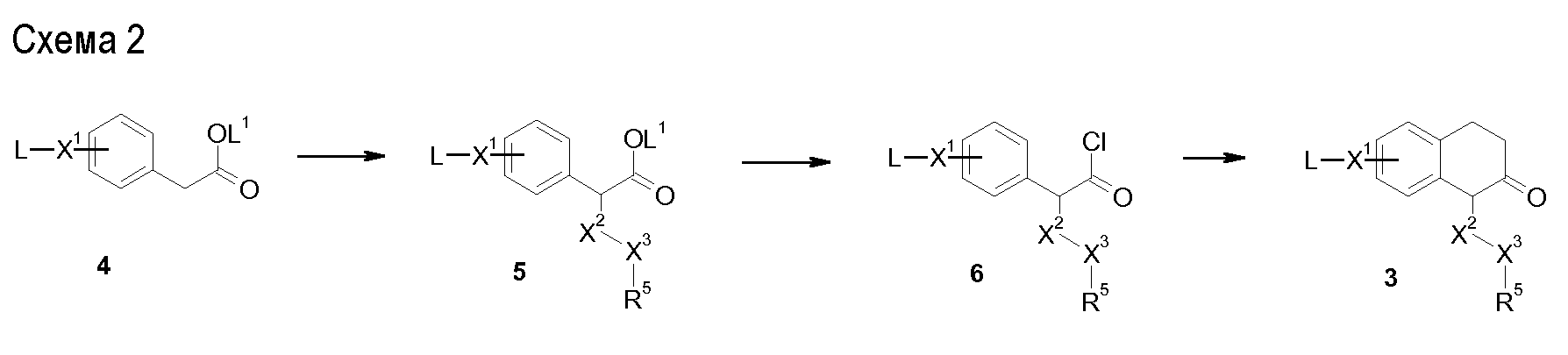
Как показано на схеме 2, соединение общей формулы 4 легко подвергается алкилированию с получением соединения общей формулы 5. Превращение в хлорангидрид и последующее замыкание кольца с этиленом в присутствии кислоты Льюиса (например, AlCl3) дает соединение 3 (например, J. Het. Chem., 23 (2), 343, 1986 и Bioorg. Med. Chem. Let, 17 (22), 6160, 2007).
Переменные X2, X3, R5 имеют значения, указанные в данном документе, и L, L1 обозначчают подходящие защитные группы (например, L, L1 = Me). Затем соединения 3 можно превратить в соединения общей формулы (I).
Способ, изображенный на схеме 3, можно использовать для получения аминотетралинов, в которых X1 обозначает O- или -S-, A2 обозначает необязательно замещенный алкилен, Y обозначает -NR9-, и Q обозначает -S(O)2.
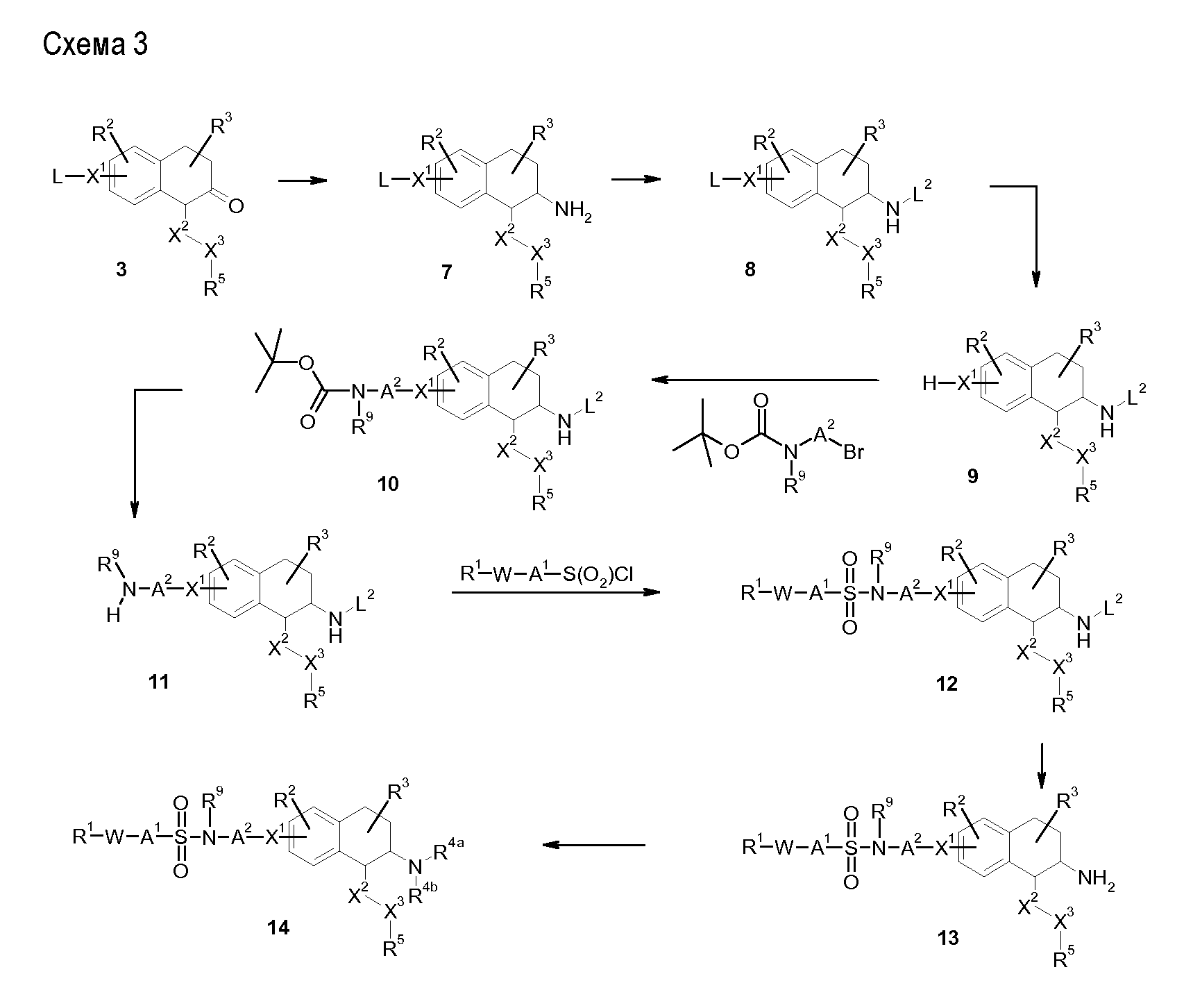
На схеме 3 переменные R1, W, A1, R2, R3, R4a, R4b, R5, R9, X2, X3 имеют значения, указанные в данном документе, и L2 обозначает подходящую защитную группу (например, L2 = COOEt).
Способ, изображенный на схеме 4, можно использовать для получения аминотетралинов, в которых X1 обозначает метилен, A2 обозначает связь, Y обозначает -NR9-, и Q обозначает -S(O)2.
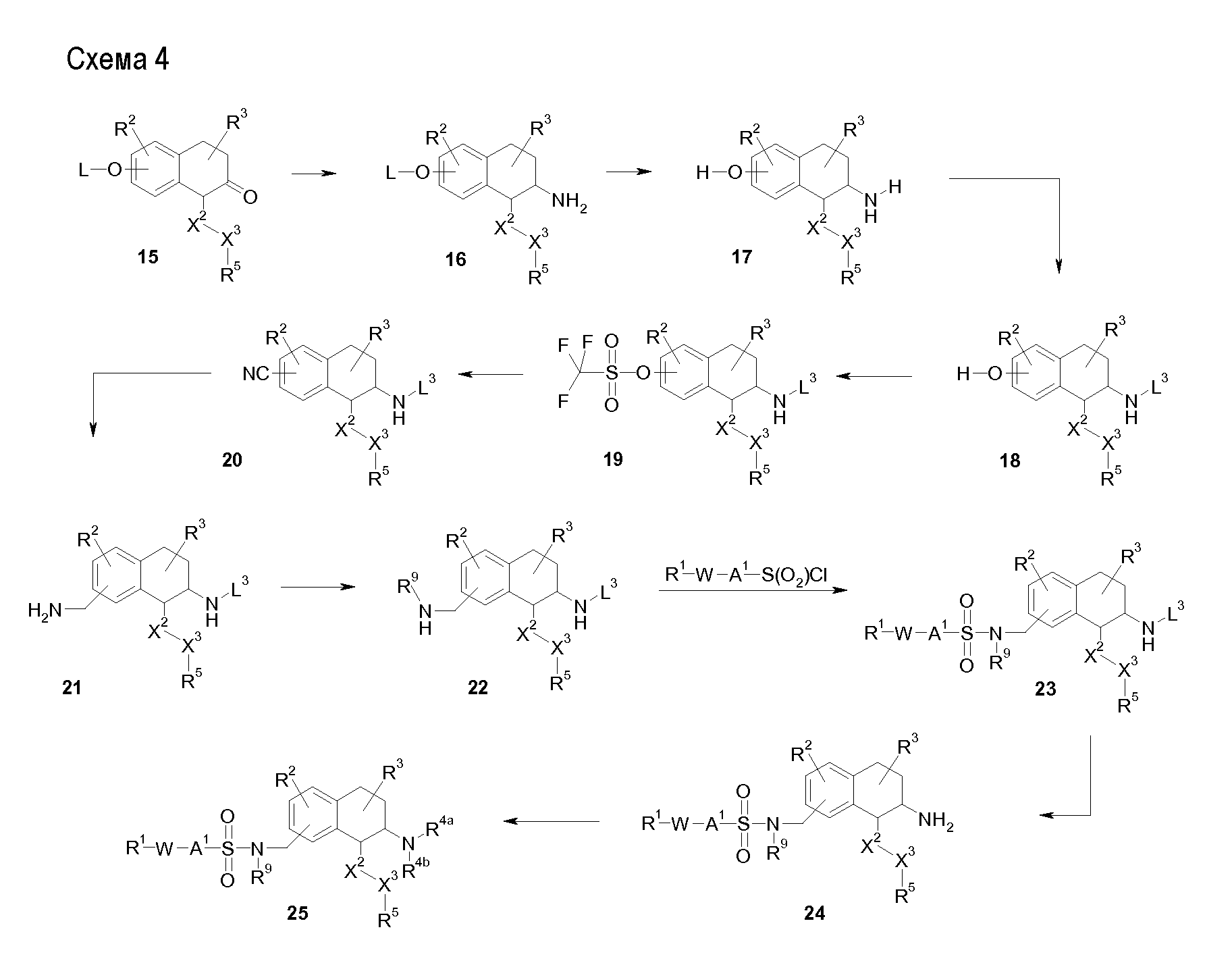
Для получения соединения 20 вместо трифлата 19 можно использовать соответствующий бромид или иодид.
На схеме 4 переменные R1, W, A1, R2, R3, R4a, R4b, R5, R9, X2, X3 имеют значения, указанные в данном документе, и L3 обозначает подходящую защитную группу (например, L3 = COOtBu).
Способ, изображенный на схеме 5, можно использовать для получения аминотетралинов, в которых X1 обозначает необязательно замещенный алкилен, A2 обозначает необязательно замещенный алкилен или связь, Y обозначает -NR9-, и Q обозначает -S(O)2.
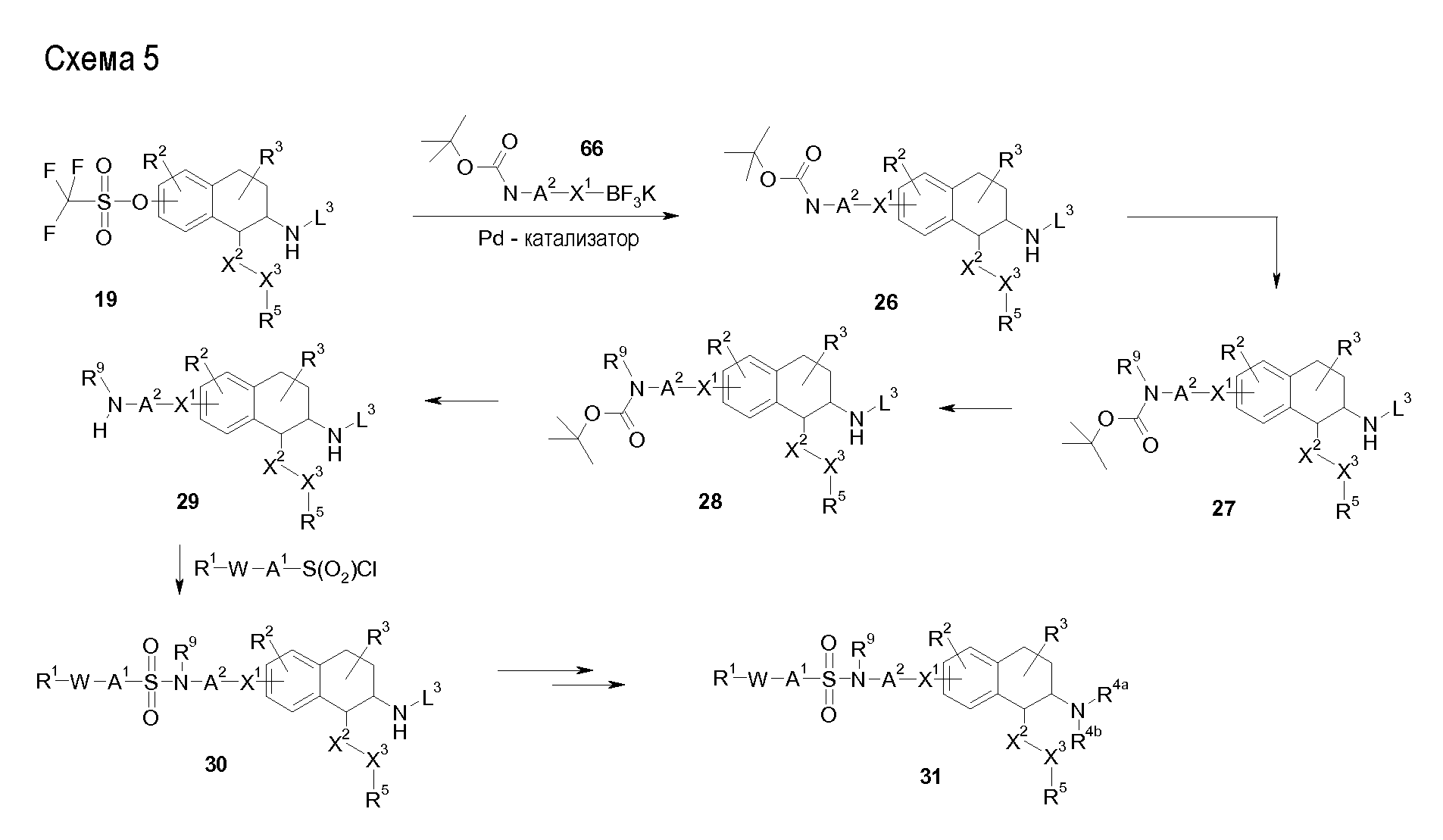
Для получения соединения 26 вместо трифторбората 66 можно использовать соответствующее 9-борабицикло[3.3.1]нон-9-ильное производное.
На схеме 5 переменные R1, W, A1, R2, R3, R4a, R4b, R5, R9, X2, X3, A2 имеют значения, указанные в данном документе, и L3 обозначает подходящую защитную группу (например, L3 = COOtBu).
Способ, изображенный на схеме 6, можно использовать для получения аминотетралинов, в которых X обозначает -NR11-, A2 обозначает необязательно замещенный алкилен, Y обозначает -NR9-, и Q обозначает -S(O)2.
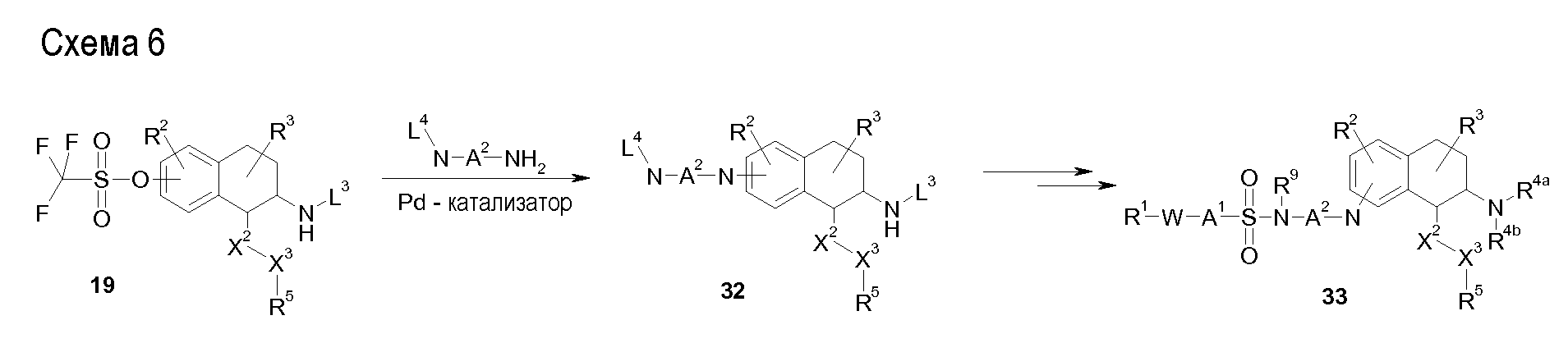
На схеме 6 переменные R1, W, A1, R2, R3, R4a, R4b, R5, R9, X2, X3, A2 имеют значения, указанные в данном документе, и L4 обозначает подходящую защитную группу.
Способ, изображенный на нижеследующих схемах, можно использовать для получения соединений общей формулы (I), в которых A обозначает гетероцикл.

Как показано на схеме 7, соединение общей формулы 34 легко подвергается конденсации с диметилацеталем диметилформамида с получением соединения общей формулы 35.
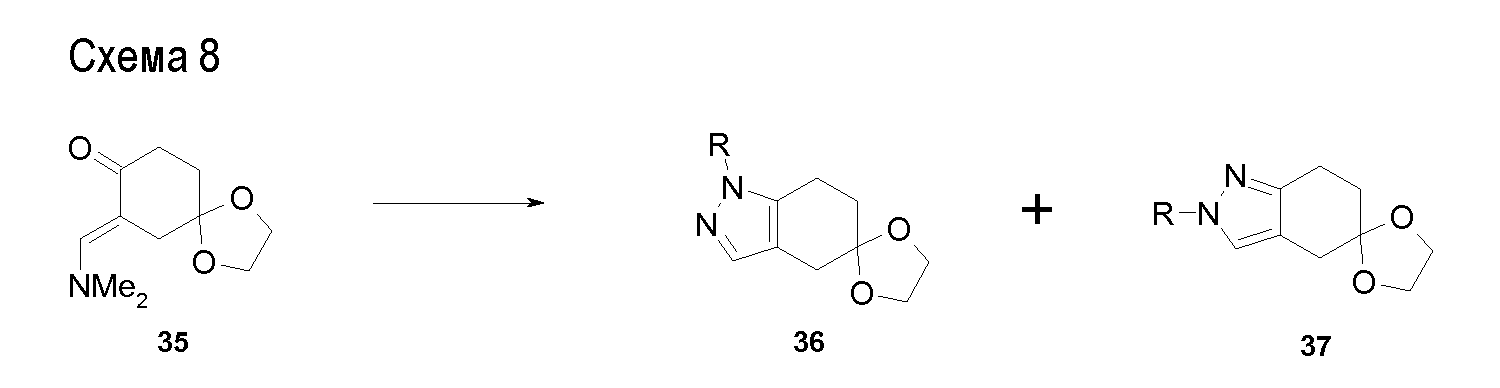
Как показано на приведенной выше схеме 8, промежуточное соединение общей формулы 35 взаимодействует с разными нуклеофилами общей формулы H2N-NH-R в спиртовом растворителе, предпочтительно, в метаноле или этаноле, при температуре примерно от 20° до 80°C с получением соединений общих формул 36 и 37. В случае монозамещенных гидразинов образуются региоизомерные продукты. Соединения 36 и 37 можно превратить в соединения общей формулы (I) по способу, изображенному на схеме 9.
На схеме 8 переменная R имеет значения, указанные в данном описании.
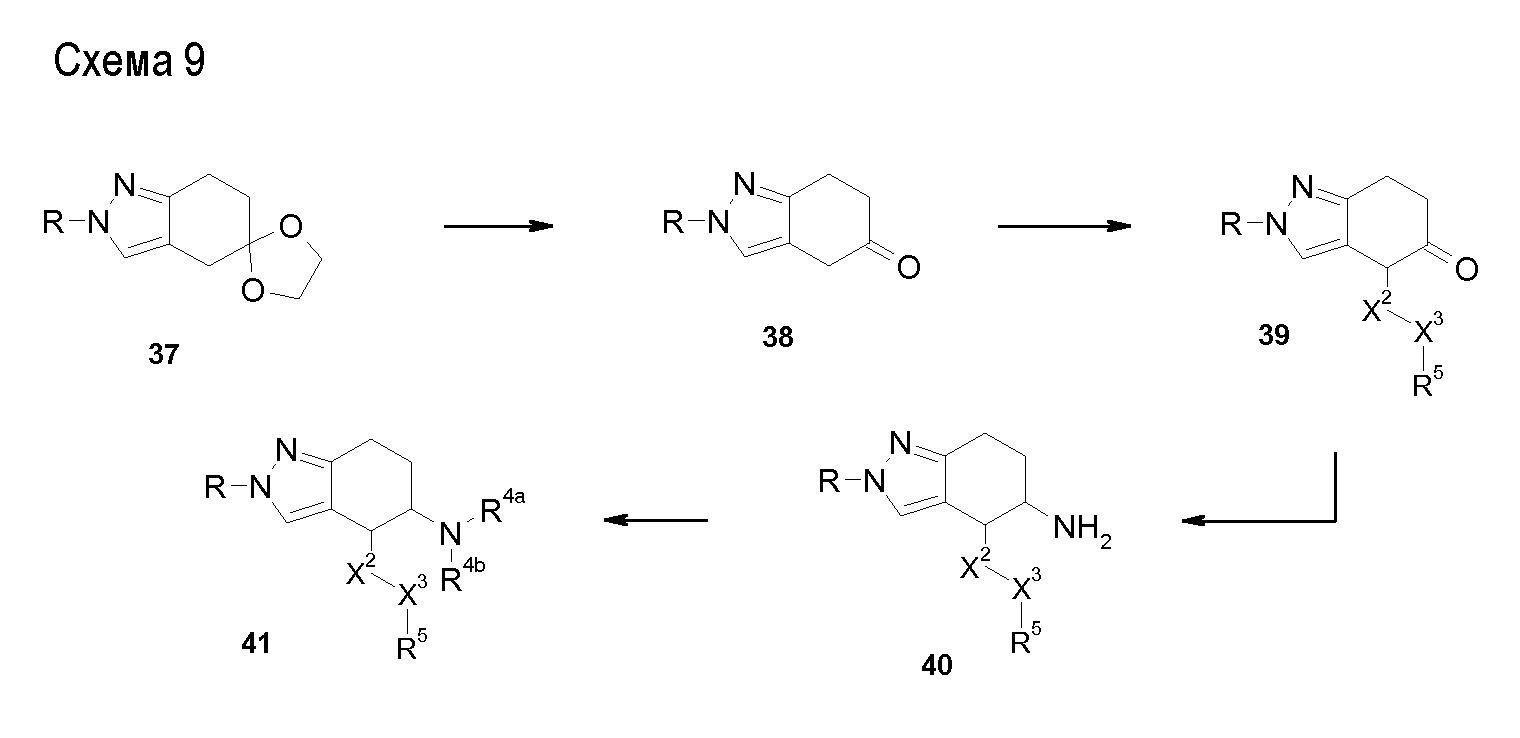
Алкилирование соединения 38 может протекать через енамин, как показано на схеме 1, или через енолят. Восстановительное аминирование соединения 39 дает соединение 40. После алкилирования или ацилирования соединения 40 получают соединение 41. На схеме 9 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
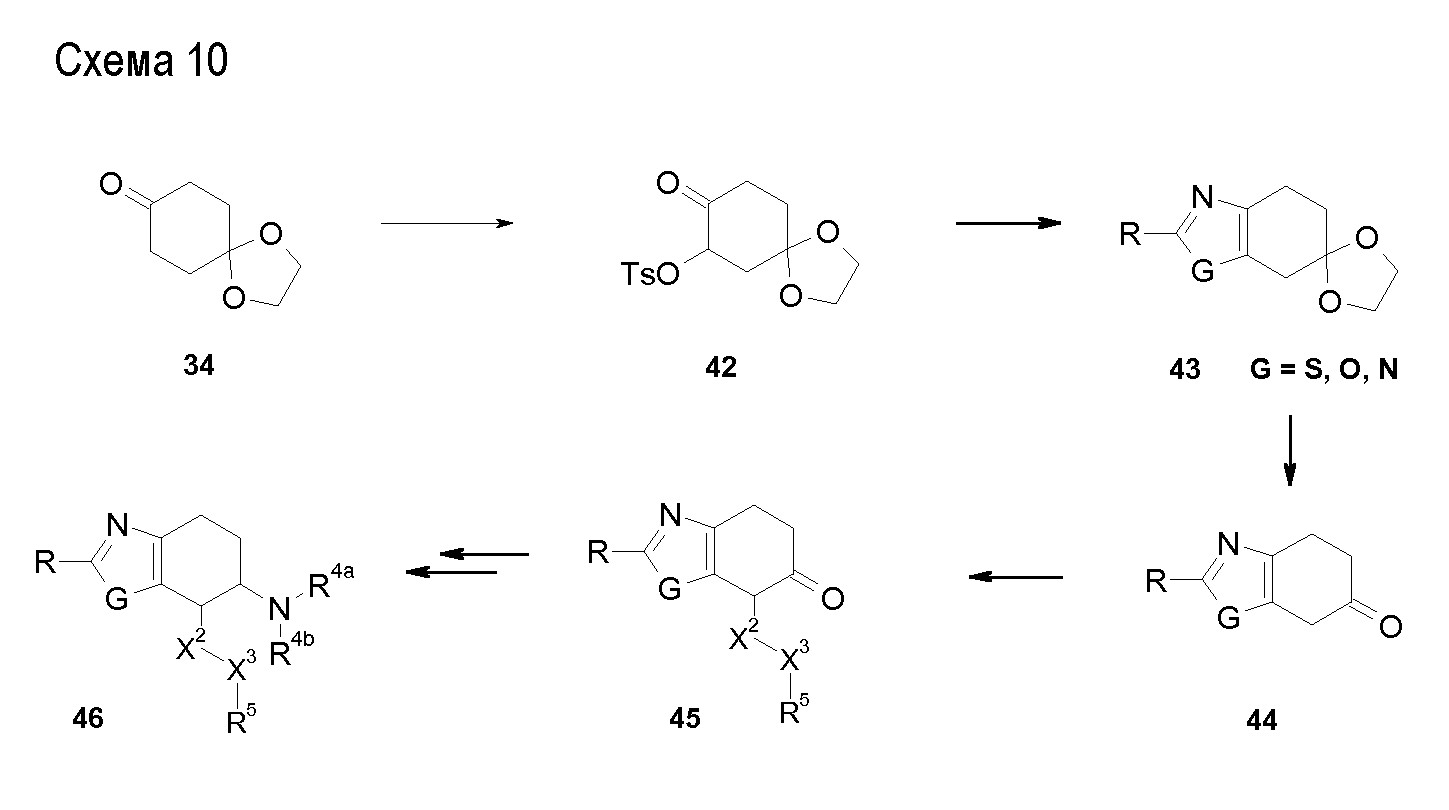
Как показано на схеме 10, взаимодействие соединения общей формулы 34 с гидроксил(тозилокси)иодбензолом дает соединение формулы 42. Взаимодействие соединения общей формулы 42 с 1,3-нуклеофилами в подходящих условиях дает соединение общей формулы 43. Последующее превращение в соединения общей формулы 46 проводят по способу, изображенному на схеме 9.
На схеме 10 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
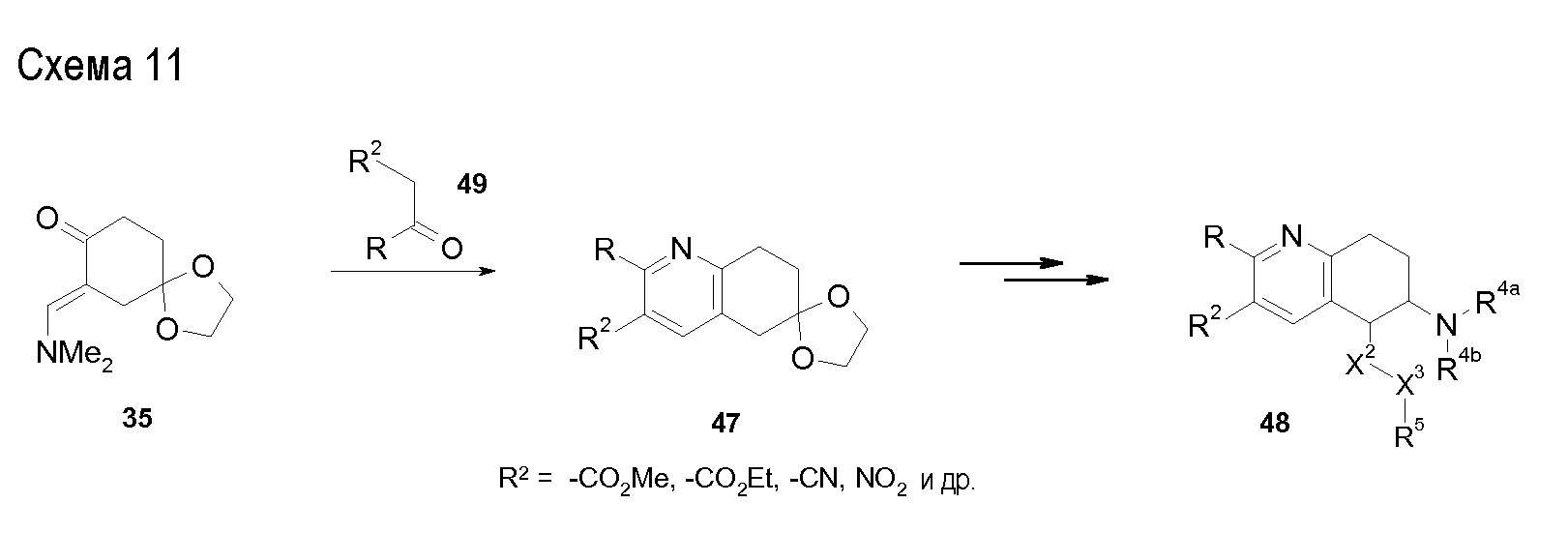
Как показано на схеме 11, конденсация соединения общей формулы 35 с реагентом общей формулы 49 и ацетатом аммония в кипящей с обратным холодильником уксусной кислоте дает соединение общей формулы 47, которое затем можно превратить в соединения общей формулы 48.
На схеме 11 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
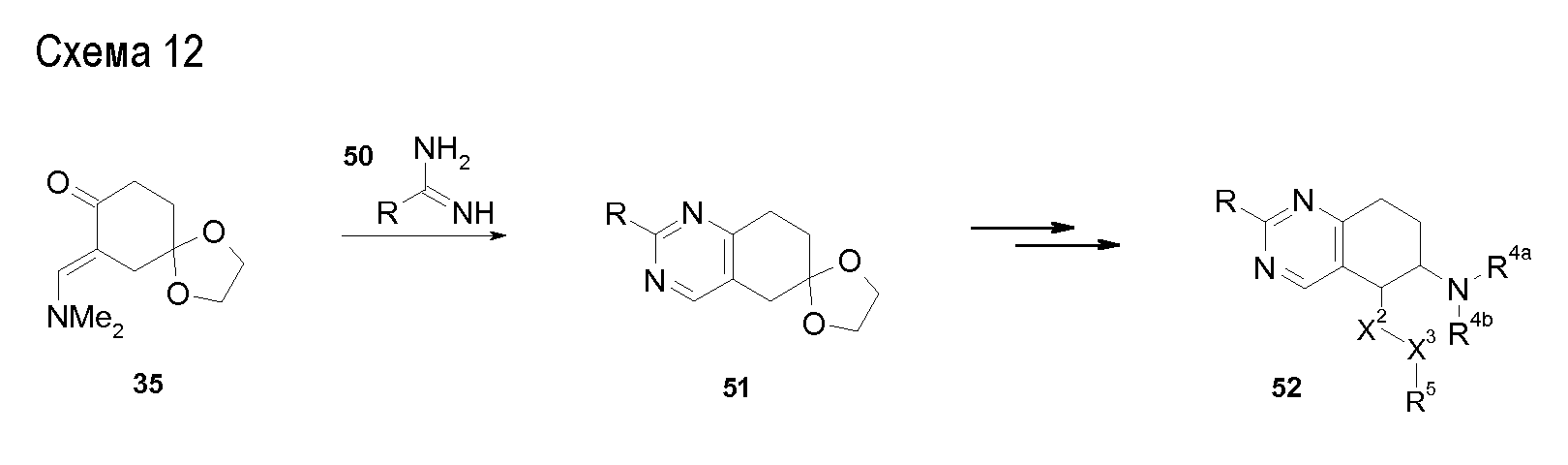
Как показано на схеме 12, циклоконденсация промежуточного соединения общей формулы 35 с 1,3-нуклеофилами общей формулы 50 в присутствии подходящих органических или неорганических оснований, таких как KOH, NaOH, NaHCO3, этоксид натрия, метоксид натрия, триэтиламин и диизопропилэтиламин, в спиртовом растворителе, предпочтительно, в этаноле или метаноле, при температуре примерно от 20° до 80°C дает соединение общей формулы 51, которое впоследствии можно превратить в соединения общей формулы 52.
На схеме 12 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
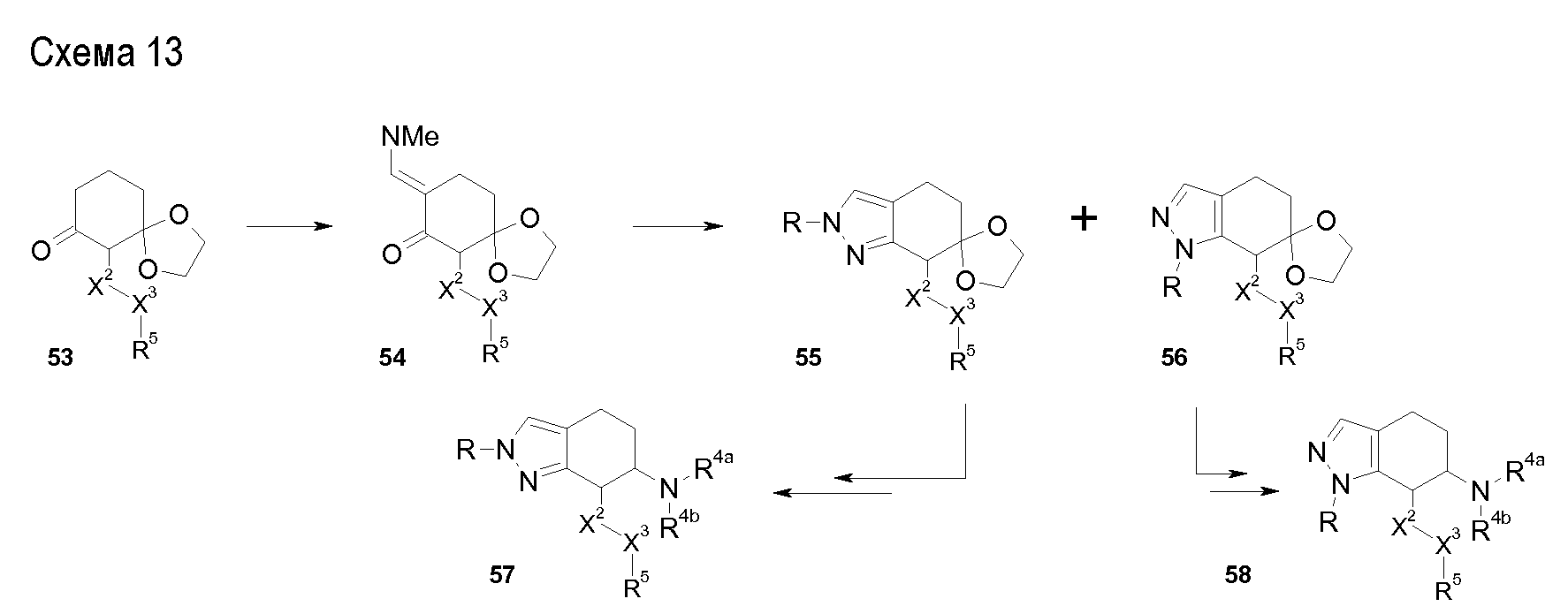
Как показано на схеме 13, промежуточное соединение общей формулы 53 может легко подвергаться конденсации с диметилацеталем диметилформамида с получением соединения общей формулы 54, которое может взаимодействовать с разными нуклеофилами общей формулы H2N-NH-R в спиртовом растворителе, предпочтительно, в метаноле или этаноле, при температуре от примерно 20° до 80°C с получением соединений общих формул 55 и 56. Соединения 55 и 56 можно превратить в соединения общей формулы (I), по способу, изображенному на предыдущих схемах. На схеме 13 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
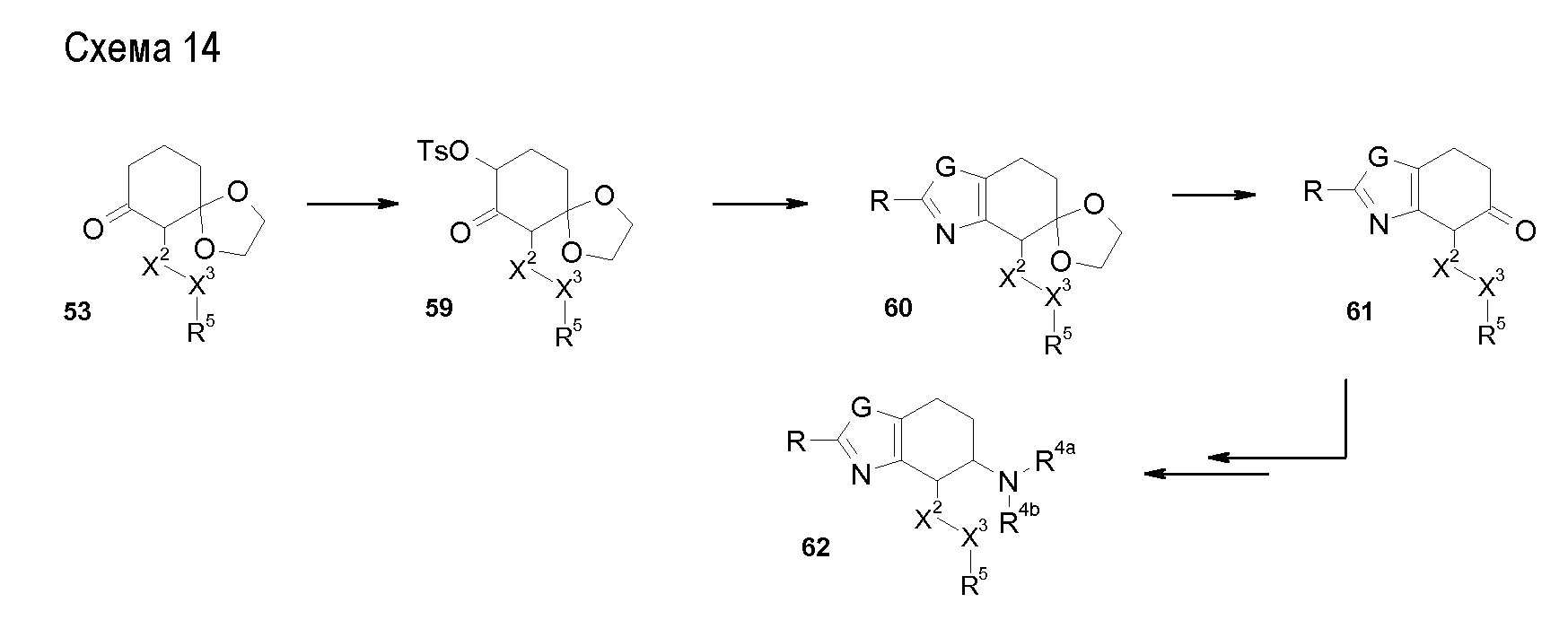
Как показано на схеме 14, взаимодействие соединения общей формулы 53 с гидроксил(тозилокси)иодбензолом дает соединение формулы 59, которое может взаимодействовать с 1,3-нуклеофилами в подходящих условиях с получением соединения общей формулы 60. Последующее превращение в соединения общей формулы 62 проводят по способам, описанным на предыдущих схемах.
На схеме 14 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
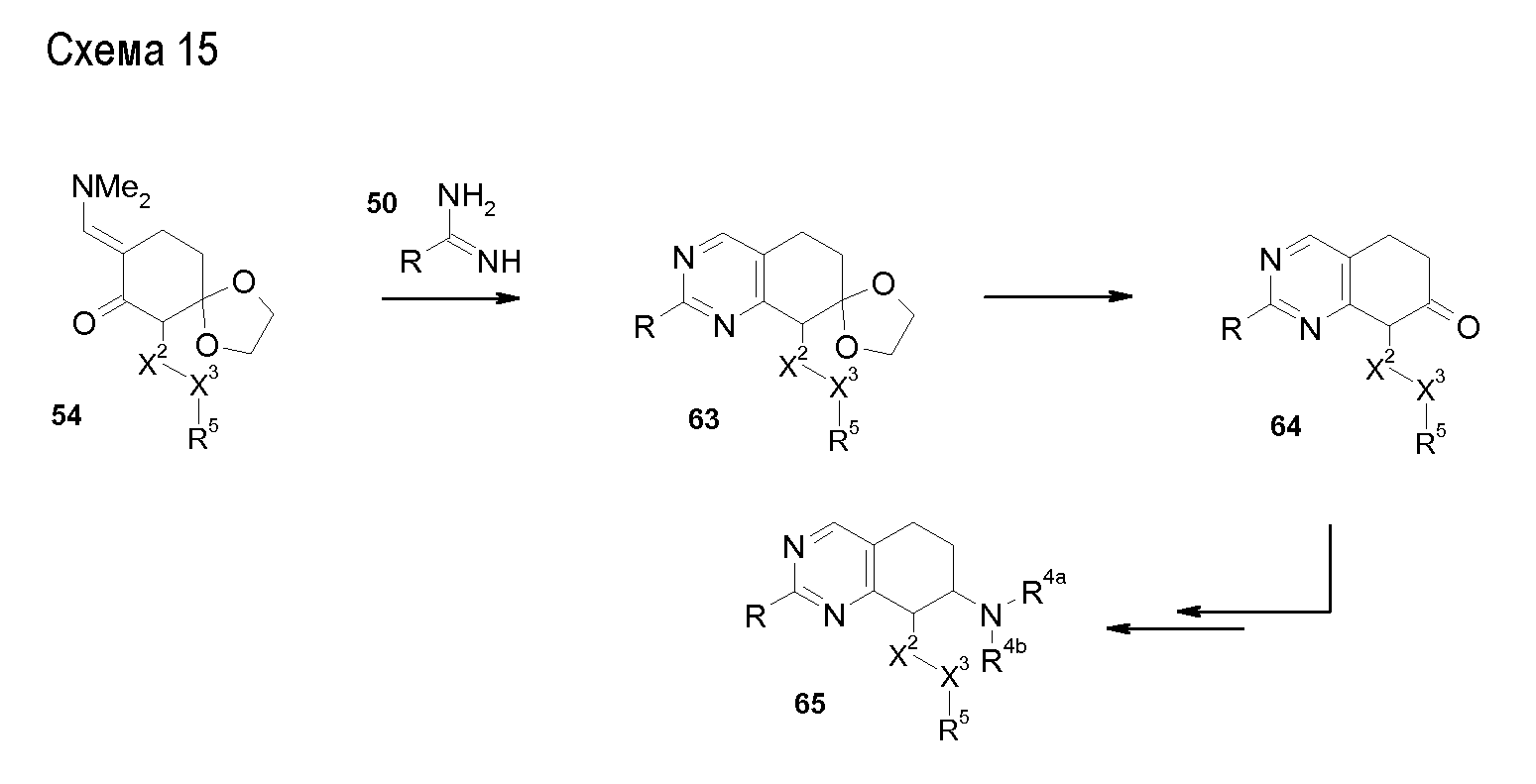
Как показано на схеме 15, циклоконденсация промежуточного соединения общей формулы 54 с 1,3-нуклеофилами общей формулы 50 в присутствии подходящих органических или неорганических оснований, таких как KOH, NaOH, NaHCO3, этоксид натрия, метоксид натрия, триэтиламин и диизопропилэтиламин, в спиртовом растворителе, предпочтительно, в этаноле или метаноле, при температуре от примерно 20° до 80°C дает соединение общей формулы 63, которое затем можно превратить в соединения общей формулы 65 с помощью способов, описанных на предыдущих схемах.
На схеме 15 переменные R, R4a, R4b, R5, X2, X3 имеют значения, указанные в данном документе.
Кислотно-аддитивные соли аминотетралиновых производных формулы (I) получают стандартным способом путем смешивания свободного основания с соответствующей кислотой, необязательно в растворе в органическом растворителе, например, низшем спирте, таком как метанол, этанол или пропанол, простом эфире, таком как метил трет-бутиловый эфир или диизопропиловый эфир, кетоне, таком как ацетон или метилэтилкетон, или сложном эфире, таком как этилацетат.
Аминотетралиновые производные формулы (II)
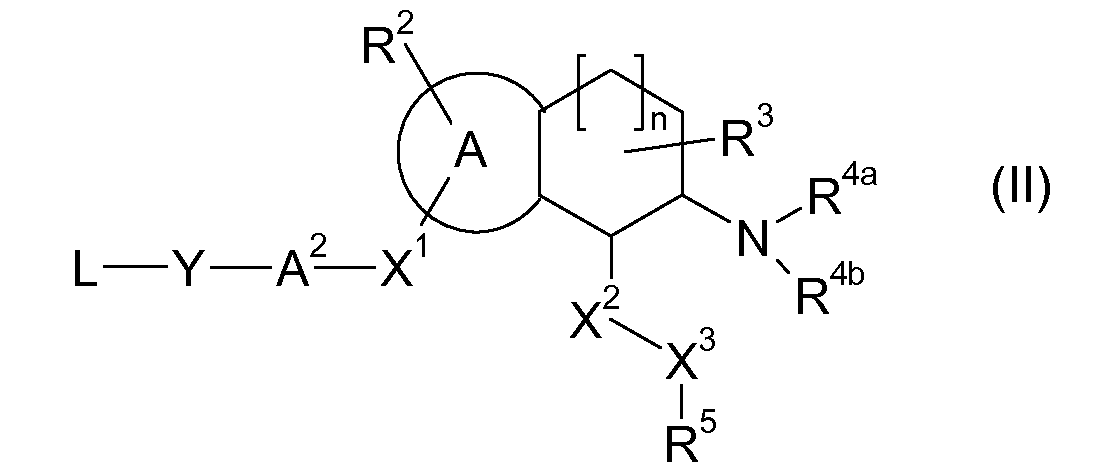
где L обозначает амино-защитную группу, Y обозначает NR9, и A2, X1, R2, R3, R4a, R4b, X2, X3, R5, n имеют указанные выше значения, можно использовать в качестве промежуточных соединений для получения ингибиторов GlyT1, в особенности, имеющих формулу (I).
Подходящие амино-защитные группы хорошо известны в данной области техники и описаны, например, в Protective Groups in Organic Chemistry, ed. J. F. W. McOmie, Plenum Press, 1973; и T. W. Greene & P. G. M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991.
В соответствии с конкретным воплощением L обозначает необязательно замещенный алкилкарбонил (например, трет-бутилкарбонил), необязательно замещенный арилкарбонил, необязательно замещенный арилалкилкарбонил (например, бензилкарбонил), необязательно замещенный алкоксикарбонил (например, метоксикарбонил или трет-бутилоксикарбонил), необязательно замещенный арилоксикарбонил (например, феноксикарбонил) или необязательно замещенный арилалкоксикарбонил.
Соединения формулы (I) способны ингибировать активность транспортера глицина, в особенности, транспортера глицина 1 (GlyT1).
Пригодность соединений настоящего изобретения для ингибирования активности транспортера глицина, в особенности, активности GlyT1, можно продемонстрировать с помощью известных в данной области способов. Например, для измерения поглощения глицина и его ингибирования (IC50) под действием соединения формулы (I) можно использовать рекомбинантные клетки hGlyT1c_5_CHO, экспрессирующие человеческий GlyT1c.
Предпочтительными являются соединения формулы (I), которые способны обеспечивать эффективное ингибирование в низких концентрациях. В частности, предпочтительными являются соединения формулы (I), способные ингибировать транспортер глицина 1 (GlyT1) с IC50<1 мкмоль, более предпочтительно с IC50<0,5 мкмоль, особенно предпочтительно с IC50<0,2 мкмоль и наиболее предпочтительно с IC50<0,1 мкмоль.
Таким образом, соединения формулы (I) настоящего изобретения можно использовать в качестве фармацевтических средств.
Следовательно, настоящее изобретение также относится к фармацевтическим композициям, которые содержат инертный носитель и соединение формулы (I).
Настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственного средства для ингибирования транспортера глицина GlyT1, и к соответствующим способам ингибирования транспортера глицина GlyT1.
Рецептор NMDA играет ключевую роль в широком диапазоне процессов, протекающих в ЦНС, и, как показано, участвует в развитии ряда заболеваний у людей и животных других видов. Ингибиторы GlyT1 замедляют удаление глицина из синапса, что приводит к повышению уровня синаптического глицина. Это, в свою очередь, увеличивает заполнение глицин-связывающих участков рецептора NMDA и усиливает активацию рецептора NMDA с последующим высвобождением глутамата из пресинаптических окончаний. Таким образом, известно, что ингибиторы транспорта глицина, и в особенности, ингибиторы транспортера глицина GlyT1, можно использовать для лечения ряда неврологических и психиатрических расстройств. Кроме того, рецепторы глицина A участвуют в развитии ряда заболеваний у людей и животных других видов. Повышение концентраций внеклеточного глицина в результате ингибирования транспорта глицина может приводить к увеличению активности рецепторов глицина A. Следовательно, ингибиторы транспорта глицина, и в особенности, ингибиторы транспортера глицина GlyT1, можно использовать для лечения ряда неврологических и психиатрических расстройств.
Таким образом, настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственного средства для лечения неврологического или психиатрического расстройства, и к соответствующим способам лечения указанных расстройств.
В соответствии с конкретным воплощением расстройство связано с дисфункцией глицинергической или глутаматергической нейропередачи.
В соответствии с другим конкретным воплощением расстройство включает одно или несколько из следующих состояний и заболеваний: шизофрения или психотическое расстройство, включающее шизофрению (параноидное, дезорганизованное, кататоническое или недифференцированное), шизофреноформное расстройство, шизоаффективное расстройство, бредовое расстройство, краткое психотическое расстройство, коллективное психотическое расстройство, психотическое расстройство вследствие общего состояния здоровья и психотическое расстройство, индуцированное наркотиками, включающее как позитивные, так и негативные симптомы шизофрении, и другие психозы; когнитивные расстройства, в том числе деменция (деменция, ассоциированная с болезнью Альцгеймера, ишемией, мультиинфарктная деменция, деменция, ассоциированная с травмой, сосудистыми нарушениями или инсультом, инфекцией ВИЧ, болезнью Паркинсона, болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельдта-Якоба, перинатальной гипоксией, другими общими состояниями здоровья или наркотической зависимостью); бредовое состояние, амнестические нарушения или когнитивное нарушение, включающее связанное с возрастом ухудшение когнитивных функций; тревожные расстройства, включающие острое стрессовое расстройство, агорафобия, генерализированное тревожное расстройство, обсессивно-компульсивное расстройство, приступ панического расстройства, паническое расстройство, посттравматическое стрессовое расстройство, сепарационное тревожное расстройство, социофобия, специфическая фобия, индуцированное наркотиками тревожное расстройство и тревожность вследствие общего состояния здоровья; связанные с наркотиками расстройства и поведение, обнаруживающее склонность к потреблению наркотиков (в том числе индуцированное наркотиками бредовое состояние, упорная деменция, упорное амнестическое расстройство, психотическое расстройство или тревожное расстройство; нечувствительность, зависимость или отвыкание от химических веществ, включающих спирт, амфетамины, каннабис, кокаин, галлюциногены, средства для ингаляции, никотин, опиоиды, фенилциклидин, успокоительные средства, гипнотики или анксиолитические средства); ожирение, нейрогенная булимия и компульсивное расстройство пищевого поведения; биполярные расстройства, аффективные расстройства, в том числе депрессивные расстройства; депрессия, включающая униполярную депрессию, сезонную депрессию и послеродовую депрессию, предменструальный синдром (PMS) и предменструальное дисфорическое расстройство (PDD), аффективные расстройства вследствие общего состояния здоровья, и индуцированные наркотиками аффективные расстройства; познавательные расстройства, общее расстройство психологического развития, в том числе аутистическое расстройство, синдром нарушения внимания, в том числе синдром дефицита внимания и гиперактивности (ADHD) и расстройство поведения; двигательные расстройства, включающие акинезию и акинетические ригидные синдромы (в том числе болезнь Паркинсона, индуцированный наркотиками паркинсонизм, постэнцефалитический паркинсонизм, прогрессирующий супрануклеарный паралич, множественная системная атрофия, кортикобазальная дегенерация, комплексная деменция, связанная с паркинсонизмом-ALS и кальцификация базальных ядер головного мозга), паркинсонизм, обусловленный лекарственными средствами (такой как паркинсонизм, индуцированный нейролептиками, злокачественный нейролептический синдром, индуцированная нейролептиками острая дистония, индуцированная нейролептиками острая акатизия, индуцированная нейролептиками поздняя дискинезия и обусловленный лекарствами постуральный тремор), синдром Жиля де ла Туретта, эпилепсия, мышечные спазмы и расстройства, связанные с мышечной спастичностью, или слабость, включающая треморы; дискинезии [в том числе тремор (такой как тремор покоя, постуральный тремор и интенционное дрожание), хорея (такая как хорея Сиденгама, болезнь Хантингтона, доброкачественная наследственная хорея, нейроакантоцитоз, симптоматическая виттова хорея, индуцированная наркотиками хорея и гемибаллизм), миоклонус (в том числе генерализованный миоклонус и фокальный миоклонус), тики (в том числе простой тик, комплексный тик и симптоматический тик) и дистония (в том числе генерализованная дистония, такая как идиопатическая дистония, индуцированная наркотиками дистония, симптоматическая дистония и пароксимальная дистония, а также фокальная дистония, такая как блефароспазм, оромандибулярная дистония, спазматическая дисфония, спастическая кривошея, аксиальная дистония, дистонический графоспазм и гемиплегическая дистония)]; недержание мочи; поражение нейронов, в том числе поражение зрения, ретинопатия или дегенерация желтого пятна глаза, шум в ушах, нарушение и потеря слуха и отек мозга; рвота; и нарушения сна, в том числе инсомния и нарколепсия.
В соответствии с другим конкретным воплощением расстройство представляет собой боль, в частности, хроническую боль и, особенно, невропатическую боль.
Боль можно подразделить на острую и хроническую боль. Острая и хроническая боль различаются по этиологии, патофизиологии, диагностике и лечению.
Острая боль, которая возникает после повреждения ткани, является самоограничивающейся, свидетельствет о продолжающемся повреждении ткани и после восстановления ткани обычно утихает. Существуют минимальные психологические симптомы, связанные с острой болью, за исключением умеренной тревоги. Острая боль является ноцицептивной по природе и возникает в результате химической, механической и термальной стимуляции A-дельта и C-полимодального болевого рецептора.
С другой стороны, хроническая боль не выполняет защитной биологической функции. Она скорее является симптомом не повреждения ткани, а отдельного заболевания. Хроническая боль не ослабевает, не является самомограничивающей и может длиться годами, возможно, десятилениями, после начального повреждения. Хроническая боль может быть устойчивой к разным режимам лечения. Психологические симптомы, связанные с хронической болью, включают хроническую тревогу, боязнь, депрессию, бессонницу и ухудшение социального взаимодействия. Хроническая доброкачественная боль преимущественно является невропатической по природе и включает поражение как периферической, так и центральной нервной системы.
Острая и хроническая боль вызываются разными нейро-физиологическими процессами и, следовательно, имеют тенденцию отвечать на разные типы лечения. Острая боль может быть соматической или висцеральной по природе. Соматическая боль зачастую представляет собой достаточно локализованную, постоянную боль и описывается как острая, ноющая, пульсирующая или постоянная ноющая боль. С другой стороны, висцеральная боль может иметь неопределенное распределение, зачастую бывает приступообразной по природе, и обычно характеризуется как глубокая, ноющая, сдавливающая или коликообразная. Примеры острой боли включают послеоперационную боль, боль, связанную с травмой, и артритическую боль. Острая боль обычно отвечает на лечение опиоидами или нестероидными противовоспалительными средствами.
Хроническая боль, в отличие от острой боли, описывается как жгучая, электрическая, покалывающая и стреляющая. Она может быть непрерывной или приступообразной. Отличительными признаками хронической боли являются хроническая аллодиния и гиперальгезия. Аллодиния представляет собой боль, возникающую под действием стимула, который обычно не вызывает болевого ответа, такого как легкое прикосновение. Гиперальгезия представляет собой повышенную чувствительность к обычным болезненным раздражителям. Первичная гиперальгезия встречается непосредственно в области повреждения. Вторичная гиперальгезия встречается в неповрежденной области, окружающей повреждение. Примеры хронической боли включают комплексный регионарный болевой синдром, боль, возникающую в результате периферической невропатии, послеоперационную боль, боль, связанную с синдромом хронической усталости, головную боль напряжения, боль, возникающую в результате механического повреждения нерва, и сильную боль, связанную с такими заболеваниями, как рак, болезнь обмена веществ, инфекция нейротропного вируса, нейротоксичность, воспаление, рассеянный склероз или любая боль, возникающая вследствие стресса или депрессивного синдрома, или связанная со стрессом или депрессивным синдромом.
Хотя опиоиды являются дешевыми и эффективными, при их применении наблюдаются серьезные побочные эффекты, которые могут представлять собой угрозу для жизни, что в основном касается угнетения дыхания и мышечной ригидности. Кроме того, вводимые дозы опиоидов ограничиваются тошнотой, рвотой, констипацией, пруритом и задержкой мочевыделения, которые часто приводят к тому, что пациенты предпочитают получить недосточное подавление боли, чем переносить указанные причиняющие страдание побочные эффекты. Кроме того, указанные побочные эффекты часто приводят к необходимости длительной госпитализации пациентов. Опиоиды вызывают сильное привыкание и во многих областях их применение строго регламентируется.
Соединения формулы (I) в особенности подходят для лечения таких заболеваний, как шизофрения, биполярное расстройство, депрессия, включающая монополярную депрессию, сезонную депрессию и послеродовую депрессию, предменструальный синдром (PMS) и предменструальное дисфорическое расстройство (PDD), расстройства способности к обучению, общее расстройство развития, включающее аутистическое расстройство, синдромы нарушения внимания, включающие синдром дефицита внимания с гиперактивностью, тиковые расстройства, включающие синдром Туретта, тревожные расстройства, включающие фобию и посттравматическое стрессовое расстройство, когнитивные расстройства, связанные с деменцией, обусловленная СПИДом деменция, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, спастическое состояние мышц, миоклонус, мышечный спазм, шум в ушах и ухудшение и потеря слуха.
Конкретными когнитивными расстройствами являются деменция, бредовое состояние, амнестические расстройства и когнитивное нарушение, включающее связанное с возрастом ухудшение когнитивной функции.
Конкретными тревожными расстройствами являются генерализированное тревожное расстройство, обсессивно-компульсивное расстройство и приступ панического расстройства.
Конкретными шизофреническими или психотическими патологиями являются параноидная, дезорганизованная, кататоническая или недифференцированная шизофрения и индуцированное наркотиками психотическое состояние.
Конкретные неврологические расстройства, которые можно лечить соединениями формулы (I), включают, в частности, когнитивное расстройство, такое как деменция, ухудшение когнитивной функции, синдром дефицита внимания с гиперактивностью.
Конкретные психиатрические расстройства, которые можно лечить соединениями формулы (I), включают, в частности, тревожное расстройство, аффективное расстройство, такое как депрессия, или биполярное расстройство, шизофрения, психотическое расстройство.
В контексте лечения применение соединений формулы (I) данного изобретения включает способ. В данном способе эффективное количество одного или нескольких соединений формулы (I), определенное в соответствии с фармацевтической и ветеринарной практикой, вводят субъекту, подлежащему лечению, предпочтительно млекопитающему, в особенности, человеку. Назначение такого лечения и его форма зависят от конкретного случая и обуславливаются медицинской оценкой (диагнозом) с учетом присутствующих признаков, симптомов и/или дисфункций, риска развития определенных признаков, симптомов и/или дисфункций, и других факторов.
Как правило, лечение проводят путем одного или нескольких введений в день, по необходимости одновременно или по очереди с другими лекарственными средствами или препаратами, содержащими лекарственные средства.
Изобретение также относится к промышленному получению фармацевтических композиций для лечения субъекта, предпочтительно млекопитающего, в особенности, человека. Так, соединения формулы (I) обычно вводят в составе фармацевтических композиций, которые содержат инертный носитель (например, фармацевтически приемлемый эксципиент) наряду, по меньшей мере, с одним соединением настоящего изобретения и, по необходимости, другими лекарственными средствами. Указанные композиции можно вводить, например, перорально, ректально, чрескожно, подкожно, внутривенно, внутримышечно или интраназально.
Примерами подходящих фармацевтических композиций являются твердые лекарственные формы, такие как порошки, гранулы, таблетки, в частности, пленочные таблетки, таблетки для рассасывания, саше, облатки, покрытые сахаром таблетки, капсулы, такие как твердые желатиновые капсулы и мягкие желатиновые капсулы, суппозитории или вагинальные лекарственные формы, полутвердые лекарственные формы, такие как мази, кремы, гидрогели, пасты или пластыри, а также жидкие лекарственные формы, такие как растворы, эмульсии, в частности, эмульсии масло в воде, суспензии, например, лосьоны, препараты для инъекций и препараты для инфузий, глазные капли и ушные капли. Для введения ингибиторов настоящего изобретения также можно использовать имплантируемые устройства, обеспечивающие их высвобождение. Кроме того, можно использовать липосомы или микросферы.
Для получения композиций соединения данного изобретения необязательно смешивают с одним или несколькими носителями (эксципиентами), или разбавляют одним или несколькими носителями (эксципиентами). Носители (эксципиенты) могут представлять собой твердые, полутвердые или жидкие вещества, которые используют в качестве основ, носителей или сред для активного соединения.
Подходящие носители (эксципиенты) перечислены в профильных медицинских монографиях. Кроме того, композиции могут содержать фармацевтически приемлемые вспомогательные вещества, такие как увлажняющие средства; эмульгирующие и суспендирующие средства; консерванты; антиоксиданты; противораздражающие средства; хелатирующие средства; вспомогательные средства для нанесения покрытий; стабилизаторы эмульсии; пленкообразователи; гелеобразующие средства; средства, маскирующие запах; средства, корригирующие вкус; смолы; гидроколлоиды; растворители; солюбилизаторы; нейтрализующие средства; средства, ускоряющие диффузию; пигменты; соединения четвертичного аммония; средства, обеспечивающие повторное обезжиривание и повышенное обезжиривание; исходные вещества для мазей, кремов и масел; производные силикона; вспомогательные средства для распределения; стабилизаторы; стерилизующие средства; основы для свечей; вспомогательные средства для таблеток, такие как связующие средства, наполнители, средства, способствующие скольжению, дезинтегрирующие средства или покрытия; пропелленты; осушители; замутнители; загустители; воски; пластификаторы и светлые минеральные масла. Способы получения композиций известны в данной области и описаны, например, в Fiedler, H. P., Lexikon der Hilfsstoffe fűr Pharmazie, Kosmetik und angrenzende Gebiete [Encyclopedia of auxiliary substances for pharmacy, cosmetics and related fields], 4th edition, Aulendorf: ECV-Editio-Cantor-Verlag, 1996.
Соединения формулы (I) также можно использовать в сочетании с другими терапевтическими средствами.
Следовательно, настоящее изобретение также предлагает:
i) сочетание соединения формулы (I) с одним или несколькими другими терапевтическими средствами;
ii) фармацевтическую композицию, содержащую сочетанный продукт, указанный выше в пункте i), и, по меньшей мере, один носитель, разбавитель или эксципиент;
iii) применение сочетания, указанного выше в пункте i), в производстве лекарственного средства для лечения или профилактики расстройства, заболевания или состояния, как определено в данном документе;
iv) сочетание, указанное выше в пункте i), для лечения или профилактики расстройства, заболевания или состояния, как определено в данном документе;
v) набор для лечения расстройства, заболевания или состояния, как определено в данном документе, в состав которого входит первая дозированная форма, содержащая соединение формулы (I), и одна или несколько других дозированных форм, каждая из которых содержит одно или несколько других терапевтических средств, для одновременного терапевтического введения,
vi) сочетание, указанное выше в пункте i), для применения в терапии;
vii) способ лечения или профилактики расстройства, заболевания или состояния, как определено в данном документе, включающий введение эффективного количества сочетания, указанного выше в пункте i);
viii) сочетание, указанное выше в пункте i), для лечения или профилактики расстройства, заболевания или состояния, как определено в данном документе.
Сочетанные терапии данного изобретения можно вводить дополнительно. Под дополнительным введением подразумевается смежное или перекрывающееся введение всех компонентов в виде отдельных фармацевтических композиций или устройств. Данный режим терапевтического введения двух или нескольких терапевтических средств в данной области и в настоящем описании называют дополнительное терапевтическое введение; он также известен как добавочное терапевтическое введение. Каждый и все терапевтические режимы, которые включают раздельное, но смежное или перекрывающееся терапевтическое введение соединений формулы (I) и, по меньшей мере, одного другого терапевтического средства, входят в объем настоящего изобретения. В одном воплощении описанного здесь дополнительного терапевтического введения, пациенту обычно вводят один или несколько компонентов в течение определенного периода времени и затем вводят другой компонент.
Сочетанные терапии данного изобретения также можно вводить одновременно. Под одновременным введением подразумевают режим лечения, при котором отдельные компоненты вводят вместе, либо в составе одной фармацевтической композиции или устройства, вмещающего или содержащего оба компонента, либо в составе разных композиций или устройств, каждое из которых содержит один из компонентов, которые вводят одновременно. Такие сочетания отдельных компонентов для одновременного введения могут предоставляться в виде набора.
В другом аспекте изобретение предлагает способ лечения психотического расстройства путем дополнительного терапевтического введения соединений формулы (I) пациенту, получающему терапевтическое введение, по меньшей мере, одного антипсихотического средства. В другом аспекте изобретение предлагает применение соединений формулы (I) в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения психотического расстройства у пациента, получающего терапевтическое введение, по меньшей мере, одного антипсихотического средства. Изобретение также предлагает соединения формулы (I) для дополнительного терапевтического введения с целью лечения психотического расстройства у пациента, получающего терапевтическое введение, по меньшей мере, одного антипсихотического средства.
В другом аспекте изобретение предлагает способ лечения психотического расстройства путем дополнительного терапевтического введения, по меньшей мере, одного антипсихотического средства пациенту, получающему терапевтическое введение соединений формулы (I). В другом аспекте изобретение предлагает применение, по меньшей мере, одного антипсихотического средства в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения психотического расстройства у пациента, получающего терапевтическое введение соединений формулы (I). Изобретение также предлагает, по меньшей мере, одно антипсихотическое средство для дополнительного терапевтического введения с целью лечения психотического расстройства у пациента, получающего терапевтическое введение соединений формулы (I).
В другом аспекте изобретение предлагает способ лечения психотического расстройства путем одновременного терапевтического введения сочетания соединений формулы (I) с, по меньшей мере, одним антипсихотическим средством. Изобретение также предлагает применение сочетания соединений формулы (I) с, по меньшей мере, одним антипсихотическим средством в производстве лекарственного средства для одновременного терапевтического введения с целью лечения психотического расстройства. Изобретение также предлагает сочетание соединений формулы (I) с, по меньшей мере, одним антипсихотическим средством для одновременного терапевтического введения с целью лечения психотического расстройства. Далее, изобретение предлагает применение соединений формулы (I) в производстве лекарственного средства для одновременного терапевтического введения с, по меньшей мере, одним антипсихотическим средством с целью лечения психотического расстройства. Изобретение также предлагает соединения формулы (I) для одновременного терапевтического введения с, по меньшей мере, одним антипсихотическим средством с целью лечения психотического расстройства. Изобретение также предлагает применение, по меньшей мере, одного антипсихотического средства в производстве лекарственного средства для одновременного терапевтического введения с соединениями формулы (I) с целью лечения психотического расстройства. Кроме того, изобретение предлагает, по меньшей мере, одно антипсихотическое средство для одновременного терапевтического введения с соединениями формулы (I) с целью лечения психотического расстройства.
В других аспектах изобретение предлагает способ лечения психотического расстройства путем одновременного терапевтического введения фармацевтической композиции, содержащей соединения формулы (I) и, по меньшей мере, одно средство, стабилизирующее настроение, или антиманиакальное средство, фармацевтической композиции, содержащей соединения формулы (I) и, по меньшей мере, одно средство, стабилизирующее настроение, или антиманиакальное средство, применение фармацевтической композиции, содержащей соединения формулы (I) и, по меньшей мере, одно средство, стабилизирующее настроение, или антиманиакальное средство, в производстве лекарственного средства для лечения психотического расстройства, и фармацевтической композиции, содержащей соединения формулы (I) и, по меньшей мере, одно средство, стабилизирующее настроение, или антиманиакальное средство, для лечения психотического расстройства.
Антипсихотические средства включают как типичные, так и атипичные антипсихотические средства. Примеры антипсихотических средств, подходящих для применения в настоящем изобретении, включают, без ограничения: бутирофеноны, такие как галоперидол, пимозид и дроперидол; фенотиазины, такие как хлорпромазин, тиоридазин, мезоридазин, трифлюоперазин, перфеназин, флюфеназин, тифлюпромазин, прохлорперазин и ацетофеназин; тиоксантены, такие как тиотиксен и хлорпротиксен; тиенобензодиазепины; дибензодиазепины; бензизоксазолы; дибензотиазепины; имидазолидиноны; бензизотиазолилпиперазины; триазин, такой как ламотригин; дибензоксазепины, такие как локсапин; дигидроиндолоны, такие как молиндон; арипипразол; и их производные, которые обладают антипсихотической активностью.
Ниже перечислены примеры торговых наименований и поставщиков некоторых антипсихотических средств: клозапин (доступный под торговым наименованием CLOZARIL®, Mylan, Zenith Goldline, UDL, Novartis); оланзапин (доступный под торговым наименованием ZYPREX®, Lilly); зипразидон (доступный под торговым наименованием GEODON®, Pfizer); рисперидон (доступный под торговым наименованием RISPERDAL®, Janssen); кветиапина фумарат (доступный под торговым наименованием SEROQUEL®, AstraZeneca); галоперидол (доступный под торговым наименованием HALDOL®, Ortho-McNeil); хлорпромазин (доступный под торговым наименованием THORAZINE®, SmithKline Beecham (GSK)); флуфеназин (доступный под торговым наименованием PROLIXIN®, Apothecon, Copley, Schering, Teva, и American Pharmaceutical Partners, Pasadena); тиотиксен (доступный под торговым наименованием NAVANE®, Pfizer); трифлуоперазин (10-[3-(4-метил-1-пиперазинил)пропил]-2-(трифторметил)фенотиазина дигидрохлорид, доступный под торговым наименованием STELAZINE®, Smith Klein Beckman); перфеназин (доступный под торговым наименованием TRILAFON®, Schering); тиоридазин (доступный под торговым наименованием MELLARIL®; Novartis, Roxane, HiTech, Teva и Alpharma); молиндон (доступный под торговым наименованием MOBAN®, Endo); и локсапин (доступный под торговым наименованием LOXITANE®, Watson). Кроме того, можно использовать бенперидол (Glianimon®), перазин (Taxilan®) или мелперон (Eunerpan®). Другие антипсихотические лекарственные средства включают промазин (доступный под торговым наименованием SPARINE®), трифлурпромазин (доступный под торговым наименованием VESPRIN®), хлорпротиксен (доступный под торговым наименованием TARACTAN®), дроперидол (доступный под торговым наименованием INAPSINE®), ацетофеназин (доступный под торговым наименованием TINDAL®), прохлорперазин (доступный под торговым наименованием COMPAZINE®), метотримепразин (доступный под торговым наименованием NOZINAN®), пипотиазин (доступный под торговым наименованием PIPOTRIL®), зипразидон и гоперидон.
В другом аспекте изобретение предлагает способ лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, путем дополнительного терапевтического введения соединений формулы (I) пациенту, получающему терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. В другом аспекте изобретение предлагает применение соединений формулы (I) в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, у пациента, получающего терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает соединения формулы (I) для дополнительного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, у пациента, получающего терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера.
В другом аспекте изобретение предлагает способ лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, путем дополнительного терапевтического введения, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, пациенту, получающему терапевтическое введение соединений формулы (I). В другом аспекте изобретение предлагает применение, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, у пациента, получающего терапевтическое введение соединений формулы (I). Изобретение также предлагает, по меньшей мере, одно средство, подходящее для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, для дополнительного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, у пациента, получающего терапевтическое введение соединений формулы (I).
В другом аспекте изобретение предлагает способ лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, путем одновременного терапевтического введения сочетания соединений формулы (I) с, по меньшей мере, одним средством, подходящим для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает применение сочетания соединений формулы (I) и, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, в производстве лекарственного средства для одновременного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает сочетание соединений формулы (I) и, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, для одновременного терапевтического введения с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает применение соединений формулы (I) в производстве лекарственного средства для одновременного терапевтического введения с, по меньшей мере, одним средством, подходящим для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает соединения формулы (I) для одновременного терапевтического введения с, по меньшей мере, одним средством, подходящим для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает применение, по меньшей мере, одного средства, подходящего для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, в производстве лекарственного средства для одновременного терапевтического введения с соединениями формулы (I) с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера. Изобретение также предлагает, по меньшей мере, одно средство, подходящее для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, для одновременного терапевтического введения с соединениями формулы (I) с целью лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера.
Примеры средств, подходящих для лечения нейродегенеративного расстройства, такого как болезнь Альцгеймера, которые можно использовать в настоящем изобретении, включают, без ограничения: ингибиторы холинэстеразы, средства, направленные на никотиновые или мускариновые ацетилхолиновые рецепторы, рецепторы NMDA, образование амилоидов, митохондриальные дисфункции, связанная с заболеванием активность кальпаина, воспаление нервов, рецепторы фактора некроза опухоли, NF-каппаB, рецептор гамма активатора пролиферации пероксисом, аполипопротеина E вариант 4 (ApoE4), связанное с заболеванием повышение активности гипоталамо-гипофизарно-надпочечниковой (HPA) системы, эпилептические разряды, сосудистая дисфункция, факторы сосудистого риска и окислительный стресс.
Ингибиторы холинэстеразы, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, такрин, донепезил, галантамин и ривастигмин.
Средства, направленные на рецепторы NMDA, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, мемантин.
Средства, повышающие активность гипоталамо-гипофизарно-надпочечниковой (HPA) системы, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, антагонисты CRF1 или антагонисты V1b.
Следовательно, в другом аспекте изобретение предлагает способ лечения боли путем дополнительного терапевтического введения соединений формулы (I) пациенту, получающему терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения боли. В другом аспекте изобретение предлагает применение соединений формулы (I) в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения боли у пациента, получающего терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения боли. Изобретение также предлагает соединения формулы (I) для дополнительного терапевтического введения с целью лечения боли у пациента, получающего терапевтическое введение, по меньшей мере, одного средства, подходящего для лечения боли.
В другом аспекте изобретение предлагает способ лечения боли путем дополнительного терапевтического введения, по меньшей мере, одного средства, подходящего для лечения боли, пациенту, получающему терапевтическое введение соединений формулы (I). В другом аспекте изобретение предлагает применение, по меньшей мере, одного средства, подходящего для лечения боли, в производстве лекарственного средства для дополнительного терапевтического введения с целью лечения боли у пациента, получающего терапевтическое введение соединений формулы (I). Изобретение также предлагает, по меньшей мере, одно средство, подходящее для лечения боли, для дополнительного терапевтического введения с целью лечения боли у пациента, получающего терапевтическое введение соединений формулы (I).
В другом аспекте изобретение предлагает способ лечения боли путем одновременного терапевтического введения соединений формулы (I) в сочетании с, по меньшей мере, одним средством, подходящим для лечения боли. Изобретение также предлагает применение сочетания соединений формулы (I) и, по меньшей мере, одного средства, подходящего для лечения боли, в производстве лекарственного средства для одновременного терапевтического введения с целью лечения боли. Изобретение также предлагает сочетание соединений формулы (I) и, по меньшей мере, одного средства, подходящего для лечения боли, для одновременного терапевтического введения с целью лечения боли. Изобретение также предлагает применение соединений формулы (I) в производстве лекарственного средства для одновременного терапевтического введения с, по меньшей мере, одним средством, подходящим для лечения боли, с целью лечения боли. Изобретение также предлагает соединения формулы (I) для одновременного терапевтического введения с, по меньшей мере, одним средством, подходящим для лечения боли, с целью лечения боли. Изобретение также предлагает применение, по меньшей мере, одного средства, подходящего для лечения боли, в производстве лекарственного средства для одновременного терапевтического введения с соединением формулы (I) с целью лечения боли. Изобретение также предлагает, по меньшей мере, одно средство, подходящее для лечения боли, для одновременного терапевтического введения с соединениями формулы (I), с целью лечения боли.
Примеры средств, подходящих для лечения боли, которые можно использовать в настоящем изобретении, включают, без ограничения: NSAID (нестероидные противовоспалительные лекарственные средства), противосудорожные лекарственные средства, такие как карбамазепин и габапентин, блокаторы натриевых каналов, антидепрессанты, каннабиноиды и анестезирующие средства местного действия.
Средства, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, целекоксиб, эторикоксиб, люмиракоксиб, парацетамол, трамадол, метадон, венлафаксин, имипрамин, дулоксетин, бупропион, габапентин, прегабалин, ламотридин, фентанил, парекоксиб, нефопам, ремифентанил, петидин, диклофенак, рофекоксиб, налбуфин, суфентанил, петидин, диаморфин и буторфанол.
Для специалистов в данной области будет очевидно, что соединения данного изобретения можно успешно использовать совместно с одним или несколькими другими терапевтическими средствами, такими как антидепрессанты, например, антагонисты 5HT3, агонисты серотонина, антагонисты NK-1, селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата норадреналина (SNRI), трициклические антидепрессанты, допаминергические антидепрессанты, антагонисты H3, антагонисты 5HT1A, антагонисты 5HT1B, антагонисты 5HT1D, агонисты D1, агонисты M1 и/или противоконвульсивные средства, а также средства, улучшающие когнитивную функцию.
Антагонисты 5HT3, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, ондансетрон, гранисетрон, метоклопрамид.
Агонисты серотонина, подходящие для применения в сочетании с соединениями данного изобретения, включают суматриптан, рауволсцин, йохимбин, метоклопрамид.
SSRI, подходящие для применения в сочетании с соединениями данного изобретения, включают флуоксетин, циталопрам, фемоксетин, флувоксамин, пароксетин, индалпин, сертралин, зимелдин.
SNRI, подходящие для применения в сочетании с соединениями данного изобретения, включают венлафаксин и ребоксетин.
Трициклические антидепрессанты, подходящие для применения в сочетании с соединениями данного изобретения, включают имипрамин, амитриптилин, кломипрамин и нортриптилин.
Допаминергические антидепрессанты, подходящие для применения в сочетании с соединениями данного изобретения, включают бупропион и аминептин.
Противоконвульсивные средства, подходящие для применения в сочетании с соединениями данного изобретения, включают, например, дивалпроэкс, карбамазепин и диазепам.
Нижеследующие примеры служат для разъяснения изобретения, не ограничивая его.
Соединения характеризуют методом масс-спектрометрии, как правило ВЭЖХ-МС, с использованием быстрого градиента на носителе C18 (ионизация электрораспылением (ESI)).
Примеры получения
Если не указано иначе, все конечные соединения имеют цис-конфигурацию в тетрагидронафталеновом ядре.
Пример 1: [7-(2-трет-бутоксикарбониламиноэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
1.1 1-(3,4-Дихлорбензил)-7-метокси-3,4-дигидронафтален-2(1H)-он
15 г (85 ммоль) 7-метокси-3,4-дигидронафтален-2(1H)-она растворяют в 200 мл сухого MeOH в атмосфере азота. Затем по каплям медленно добавляют 6,66 г (94 ммоль) пирролидина, при этом происходит изменение цвета. Смесь перемешивают в течение одного часа. Растворитель упаривают в вакууме, и остаток растворяют в MeCN. При 5°C добавляют 22,5 г (94 ммоль) 4-(бромметил)-1,2-дихлорбензола, растворенного в MeCN, и смесь перемешивают в течение ночи при комнатной температуре. Растворитель упаривают в вакууме, остаток смешивают с MeOH/CH2Cl2/H2O 1:1:1 (50 мл, 50 мл, 50 мл) и добавляют 10 мл ледяной уксусной кислоты. Смесь перемешивают в течение ночи. Обработка: Реакционную смесь помещают в воду со льдом и экстрагируют 3× CH2Cl2. Объединенные органические слои промывают 1× раствором NaHCO3 и 1× насыщенным раствором NaCl. Органическую фазу сушат над MgSO4, и растворитель упаривают. Остаток (31,5 г) очищают флэш-хроматографией на силикагеле, элюируя смесью гептан/EtOAc 2:1. Получают 24,1 г (71,7 ммоль, 84%) продукта.
ESI-MS [M+H+]=335,1, рассчитано для C18H16Cl2O2=334,05.
1.2 1-(3,4-Дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амина гидрохлорид
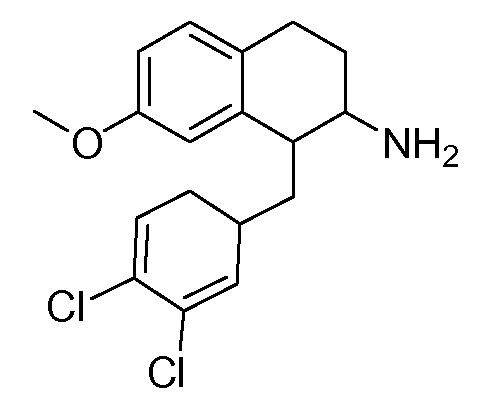
К 1-(3,4-дихлорбензил)-7-метокси-3,4-дигидронафтален-2(1H)-ону, 5,2 г (15,5 ммоль), в MeOH в атмосфере азота добавляют реагент ацетат аммония (12,0 г, 155 ммоль) и цианоборгидрид натрия (1,46 г, 23,3 ммоль). Смесь перемешивают в течение 4 дней при комнатной температуре. Растворитель упаривают в вакууме и после добавления воды экстрагируют EtOAc. Органический слой промывают NaCl, сушат над MgSO4, и растворитель удаляют. Остаток растворяют в iPrOH и добавляют HCl в iPrOH (6N). После кристаллизации в течение ночи соль HCl отделяют от маточного раствора и превращают в свободное основание, используя NaOH (1N). Получают масло, которое после обработки HCl и кристаллизации дает цис-продукт (1,95 г, 5,80 ммоль, 37,4%). Маточный раствор содержит смесь цис/транс-продуктов.
ESI-MS [M+H+]=336,2, рассчитано для C18H19Cl2NO=336,26.
1.3 Этил 1-(3,4-дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-илкарбамат
К 1-(3,4-дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амина гидрохлориду (1,95 г, 5,80 ммоль) в пиридине (10 мл) в атмосфере азота медленно добавляют этилхлорформиат (1,00 г, 9,28 ммоль). Смесь перемешивают в течение ночи при комнатной температуре. Растворитель упаривают в вакууме и после добавления HCl (1 N) экстрагируют CH2Cl2. Органический слой промывают HCl (1N), раствором NaHCO3 и раствором NaCl, затем сушат над MgSO4, и растворитель удаляют. Продукт получают в виде оранжевого масла, которое осаждается через несколько часов (2,10 г, 5,14 ммоль, 89%).
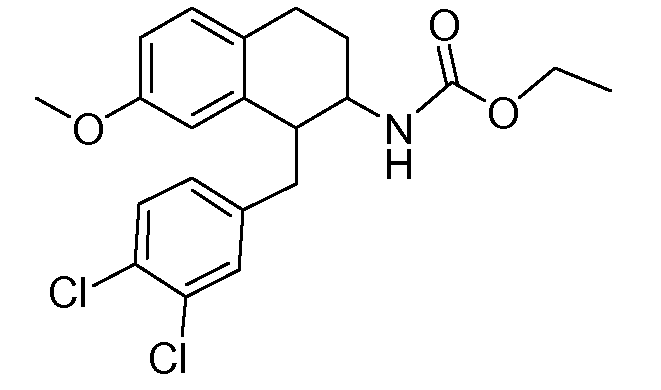
ESI-MS [M+H+]=408,2, рассчитано для C21H23ClN2O3=407,11.
1.4 Этил 1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамат
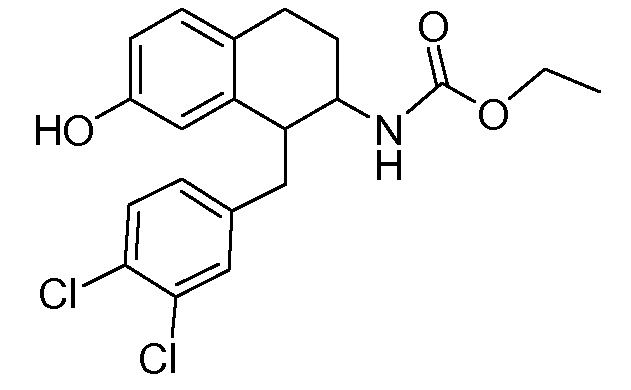
Этил 1-(3,4-дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-илкарбамат (2,1 г, 5,14 ммоль) растворяют в CH2Cl2 (50 мл) и добавляют BBr3 (3,87 г, 15,4 ммоль) при -10°C. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакционную смесь добавляют в воду со льдом и экстрагируют CH2Cl2. Органический слой промывают раствором NaHCO3 и раствором NaCl, затем сушат над MgSO4, и растворитель удаляют. Продукт получают в виде коричневого масла (2,05 г, 5,14 ммоль, 100%).
ESI-MS [M+H+]=394,1, рассчитано для C20H21Cl2NO3=393,09.
1.5 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
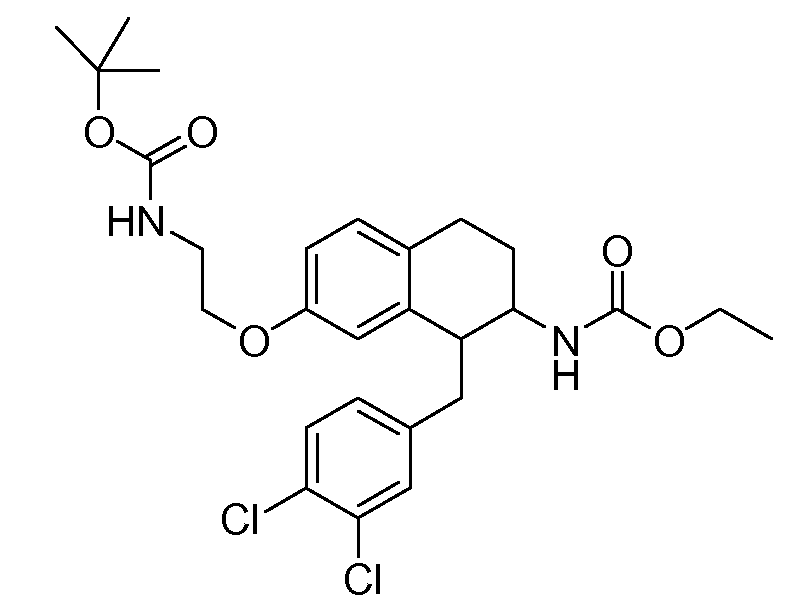
NaH (55% в парафине, 34,5 ммоль) суспендируют в DMA (80 мл) и добавляют этил 1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамат (6,80 г, 17,3 ммоль), растворенный в DMA (40 мл). Смесь перемешивают еще час. Затем порциями добавляют бромид, и смесь перемешивают в течение 3 дней при комнатной температуре. Реакционную смесь добавляют к полуконцентрированному раствору NaCl и экстрагируют EtOAc. Органический слой промывают H2O, раствором NaCl, затем сушат над MgSO4, и растворитель удаляют. Некоторое количество DMA удаляют на масляном насосе. Остаток очищают флэш-хроматографией на силикагеле, элюируя смесью CH2Cl2/MeOH 98:2. Продукт получают в виде желтого масла (9,27 г, 17,3 ммоль, 100%), которое становится твердым через несколько часов.
ESI-MS [M+H+]=481,1, рассчитано для C27H34Cl2N2O5=536,18.
Пример 2: Этил 1-(3,4-дихлорбензил)-7-(2-(1-метил-1H-имидазол-4-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат
2.1 Этил 7-(2-аминоэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамата гидрохлорид
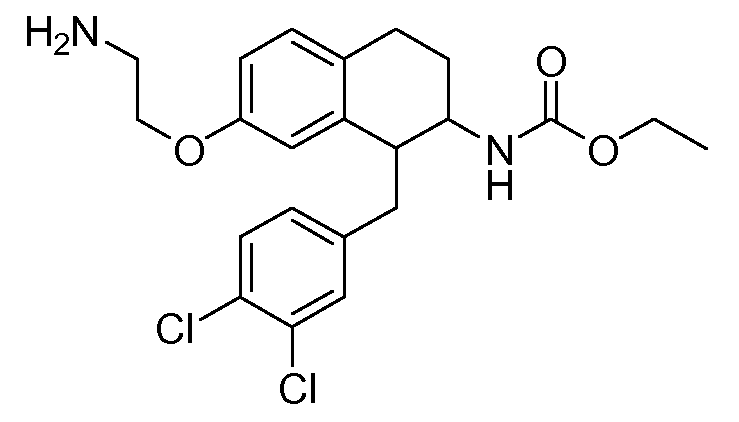
[7-(2-трет-Бутоксикарбониламиноэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир (9,27 г, 17,3 ммоль), пример 1, растворяют в CH2Cl2 (200 мл) и добавляют HCl в iPrOH (6N). Реакционную смесь перемешивают при комнатной температуре в течение ночи, после чего осаждается твердое вещество. К реакционной смеси добавляют диэтиловый эфир, и осажденную соль HCl отделяют фильтрацией, получая конечный продукт в виде твердого вещества (5,85 г, 12,3 ммоль, 72%).
ESI-MS [M+H+]=437,1, рассчитано для C22H26Cl2N2O3=436,13.
2.2 Этил 1-(3,4-дихлорбензил)-7-(2-(1-метил-1H-имидазол-4-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат
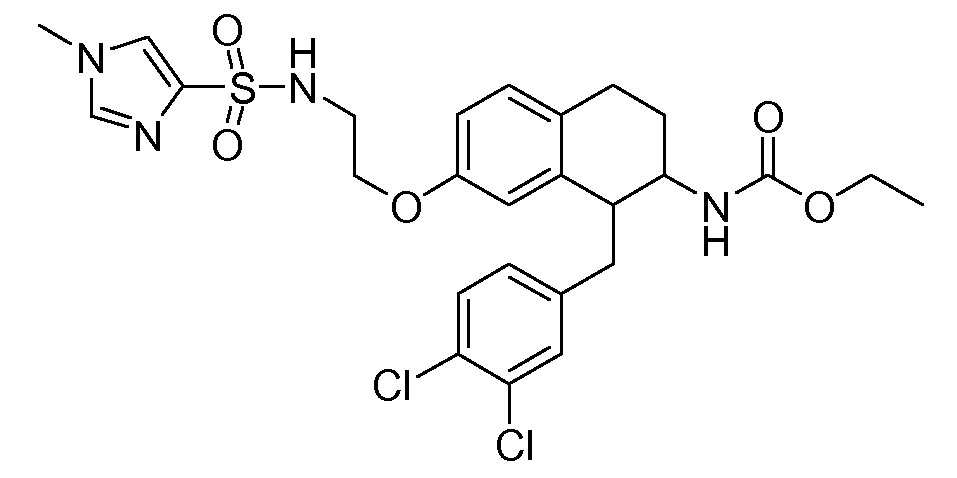
Этил 7-(2-аминоэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамата гидрохлорид (100 мг, 0,229 ммоль) и DMAP (27,9 мг, 0,229 ммоль) растворяют в CH2Cl2 (15 мл) и добавляют 1-метил-1H-имидазол-4-сульфонилхлорид (41,3 мг, 0,229 ммоль), растворенный в CH2Cl2 (15 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. После добавления H2O фазы разделяют, и водную фазу экстрагируют CH2Cl2. Органический слой промывают HCl (1N), раствором NaHCO3 и раствором NaCl, затем сушат над MgSO4, и растворитель удаляют. К остатку добавляют EtOAc/диэтиловый эфир (1:1), перемешивают, и осадок отделяют фильтрацией, получая продукт в виде коричневого твердого вещества (100 мг).
ESI-MS [M+H+]=581,5, рассчитано для C26H30Cl2N4O5S=580,13.
Пример 3: N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
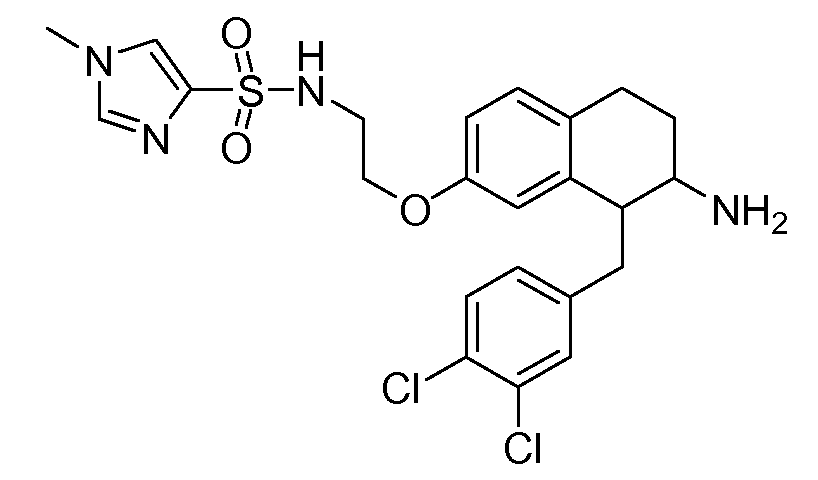
Этил 1-(3,4-дихлорбензил)-7-(2-(1-метил-1H-имидазол-4-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (1,00 г, 1,72 ммоль), пример 2, нагревают с обратным холодильником в 25 г смеси EtOH/20% KOH в течение 2 ч. К реакционной смеси добавляют полуконцентрированный раствор NaCl, и смесь экстрагируют этилацетатом. Органические слои объединяют и промывают раствором NaCl, затем сушат над MgSO4, и растворитель удаляют. Обнаружено, что значительное количество остается на MgSO4, поэтому проводят дополнительные стадии разделения/экстракции H2O/CH2Cl2, сушат над Na2SO4 и получают желтое масло (830 мг). Полученный остаток растворяют в небольшом количестве MeOH, добавляют HCl (1N), и конечный продукт (650 мг, 1,19 ммоль, 69%) отделяют фильтрацией.
ESI-MS [M+H+]=509,1, рассчитано для C23H26Cl2N4O3S=508,11.
Пример 4: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
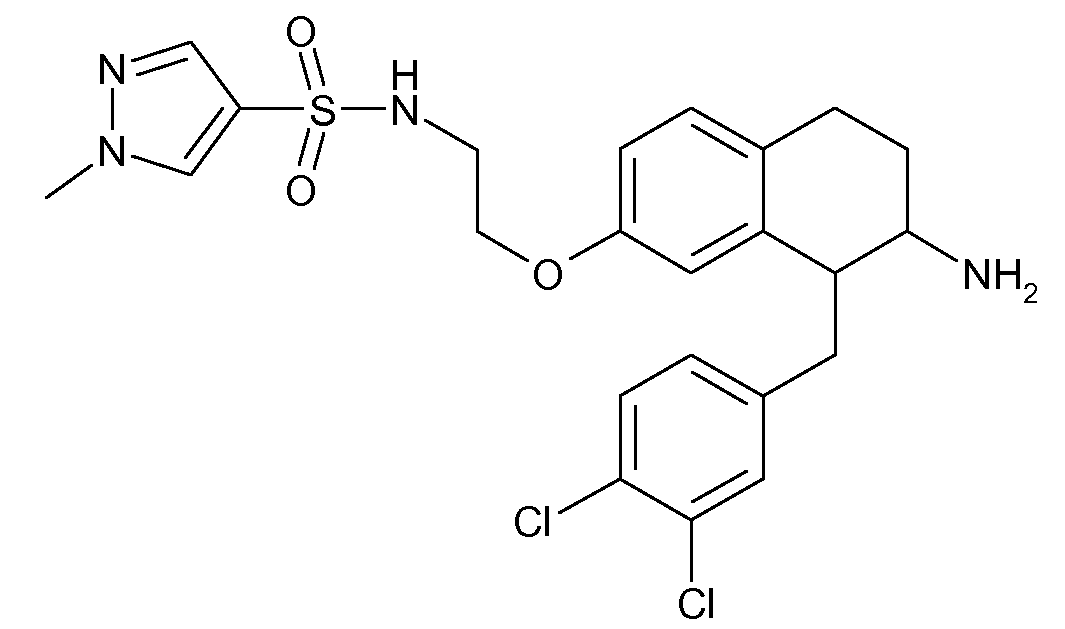
1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя 1-метил-1H-пиразол-4-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=509,1, рассчитано для C23H26Cl2N4O3S=508,11.
Пример 5: Пиридин-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
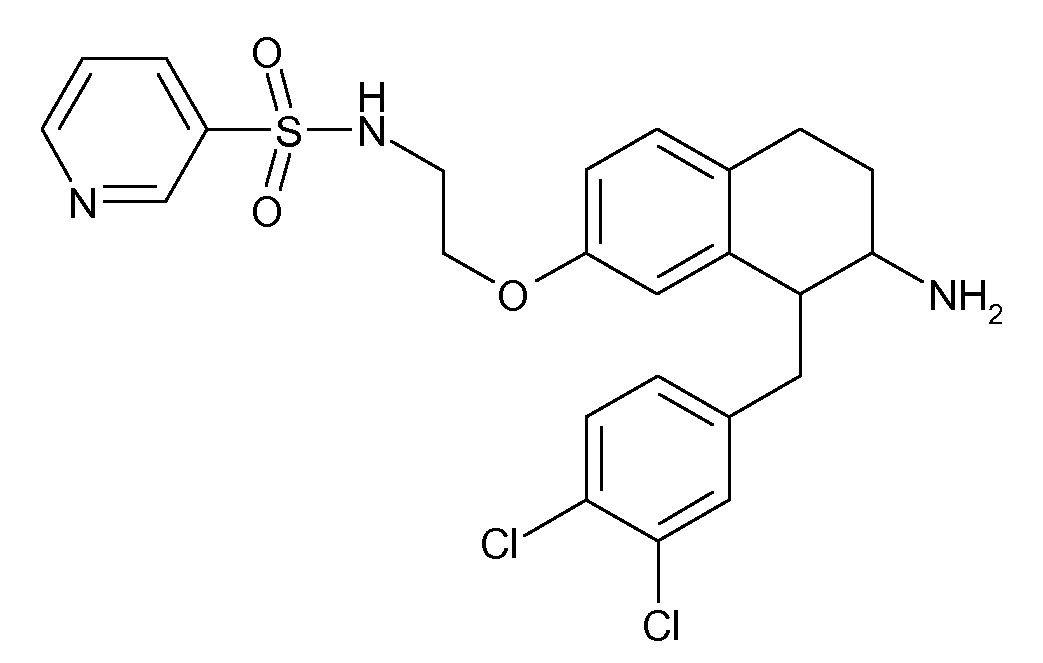
Пиридин-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя пиридил-3-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=506,1, рассчитано для C24H25Cl2N3O3S=505.
Пример 6:
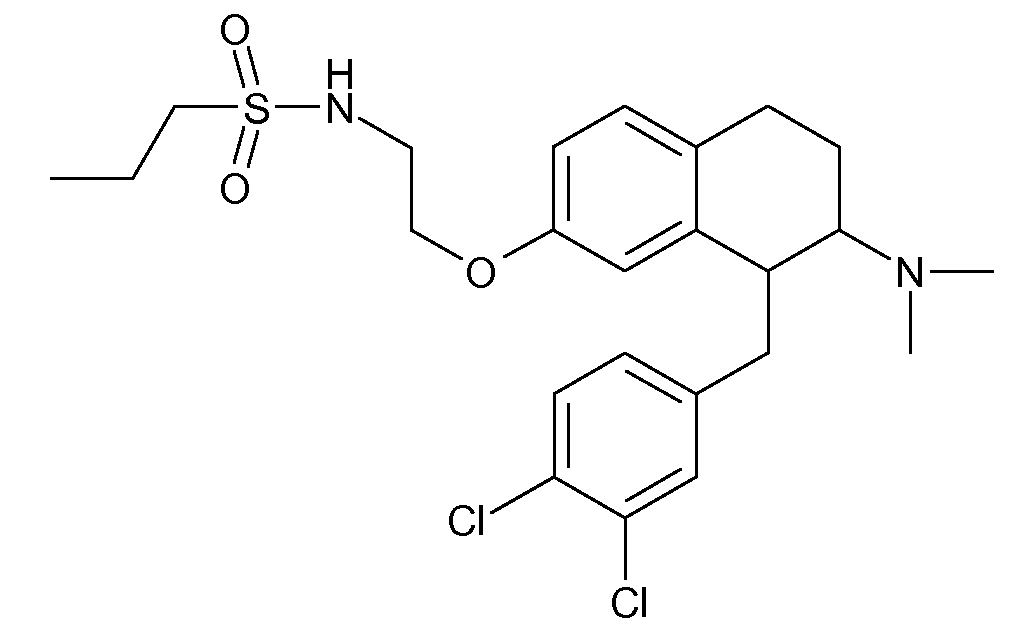
N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)пропан-1-сульфонамид (пример 8) (66,0 мг, 0,140 ммоль), параформальдегид (7,63 мг, 0,254 ммоль), и муравьиную кислоту (21,6 мг, 0,469 ммоль) растворяют в этаноле (5 мл) и нагревают с обратным холодильником в течение 4 ч. Растворитель упаривают и к остатку добавляют NaOH (1N). После экстракции CH2Cl2 органические слои промывают водой и насыщенным раствором NaCl, сушат над Na2SO4, фильтруют, и растворитель удаляют. Остаток очищают колоночной хроматографией (CH2Cl2/MeOH 97:7→95:5). Конечный продукт (15,0 мг, 0,028 ммоль, 20%) получают в виде коричневой твердой соли HCl из изопропанола после обработки HCl в изопропаноле (6N).
ESI-MS [M+H+]=499,1, рассчитано для C24H32Cl2N2O3S=498.
Пример 7: 1-(3,4-Дихлорбензил)-7-[2-(пропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
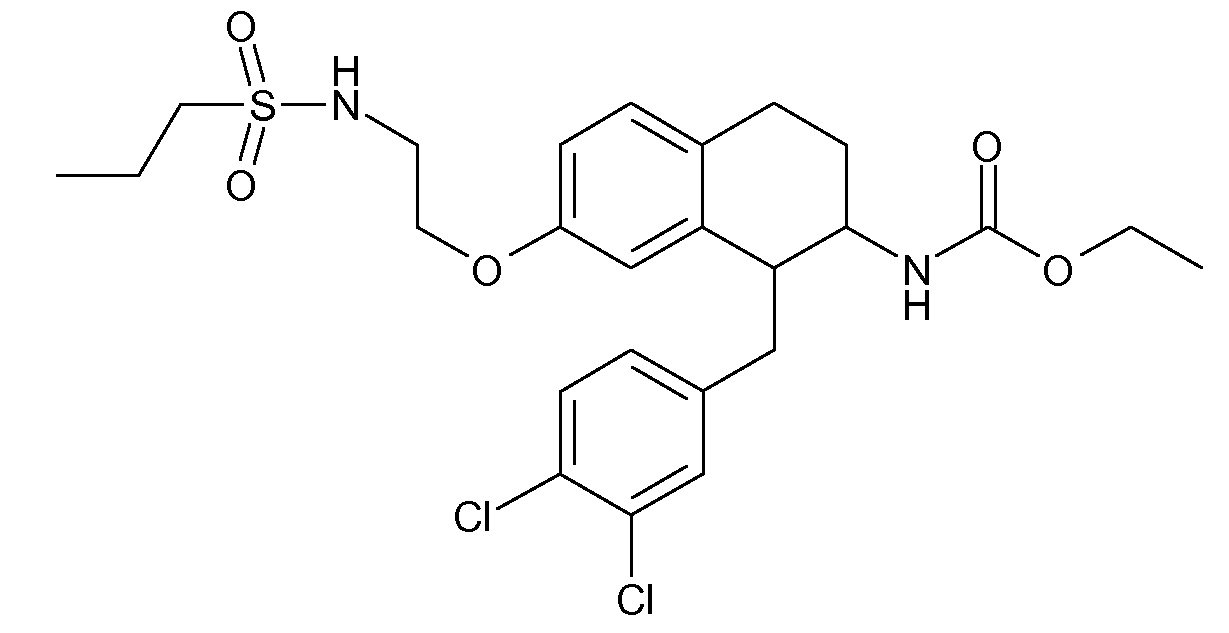
{1-(3,4-Дихлорбензил)-7-[2-(пропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя пропан-1-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=543,2, рассчитано для C25H32Cl2N2O5S=542.
Пример 8: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
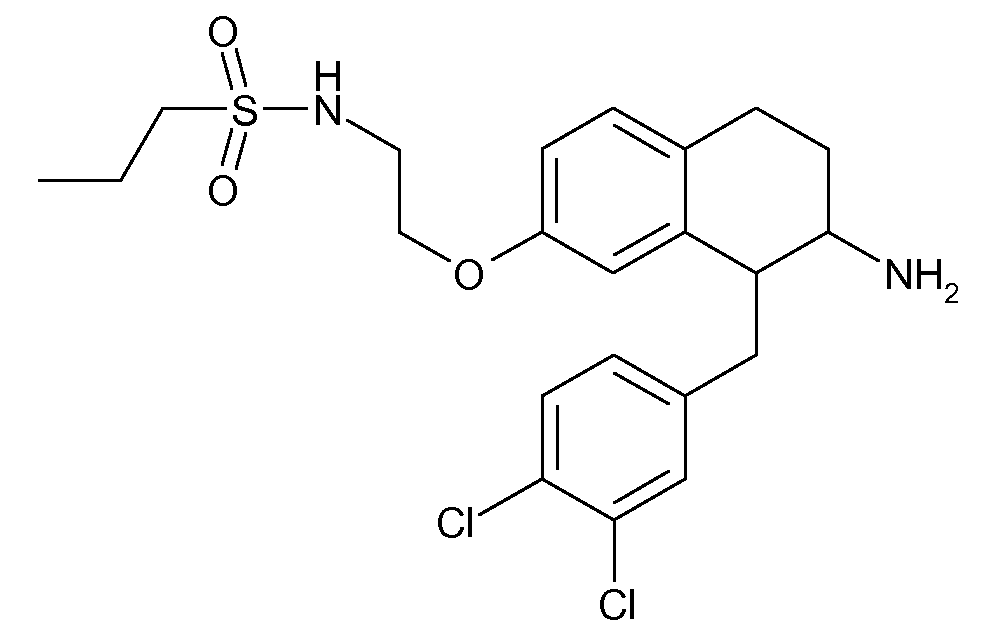
Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя пропан-1-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=471,1, рассчитано для C22H28Cl2N2O3S=470.
Пример 9: {1-(3,4-Дихлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
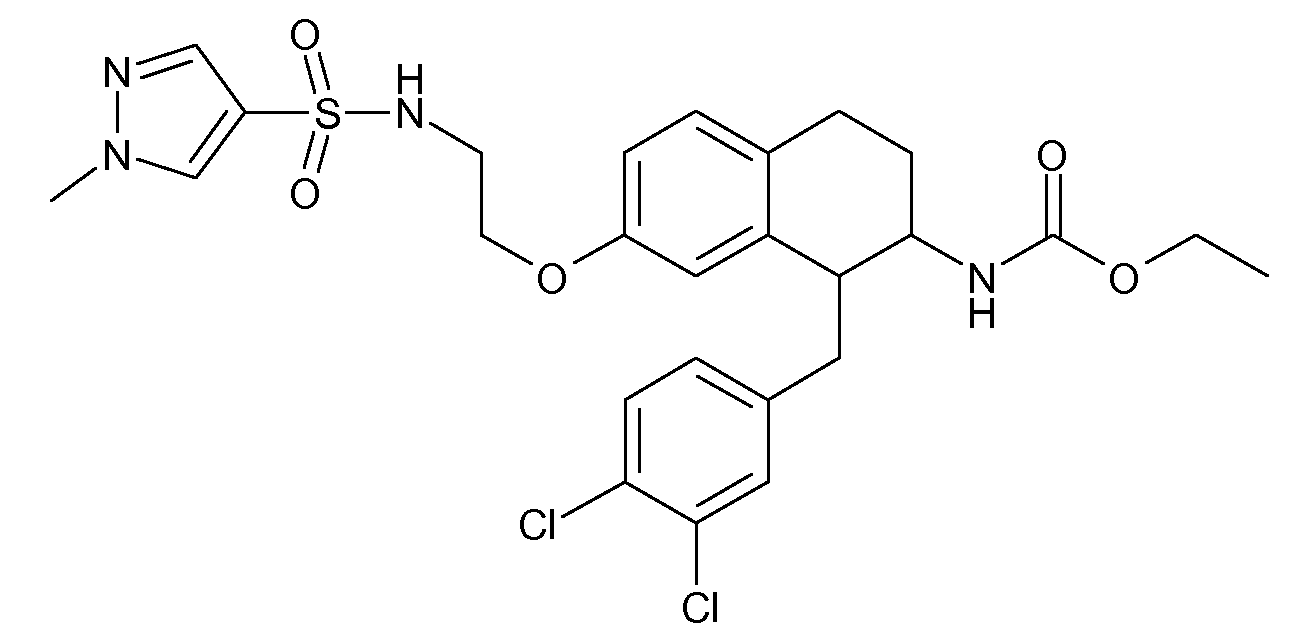
{1-(3,4-Дихлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя 1-метил-1H-пиразол-4-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=581,2, рассчитано для C26H30Cl2N4O5S=580.
Пример 10: {1-(3,4-Дихлорбензил)-7-[2-(пиридин-3-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
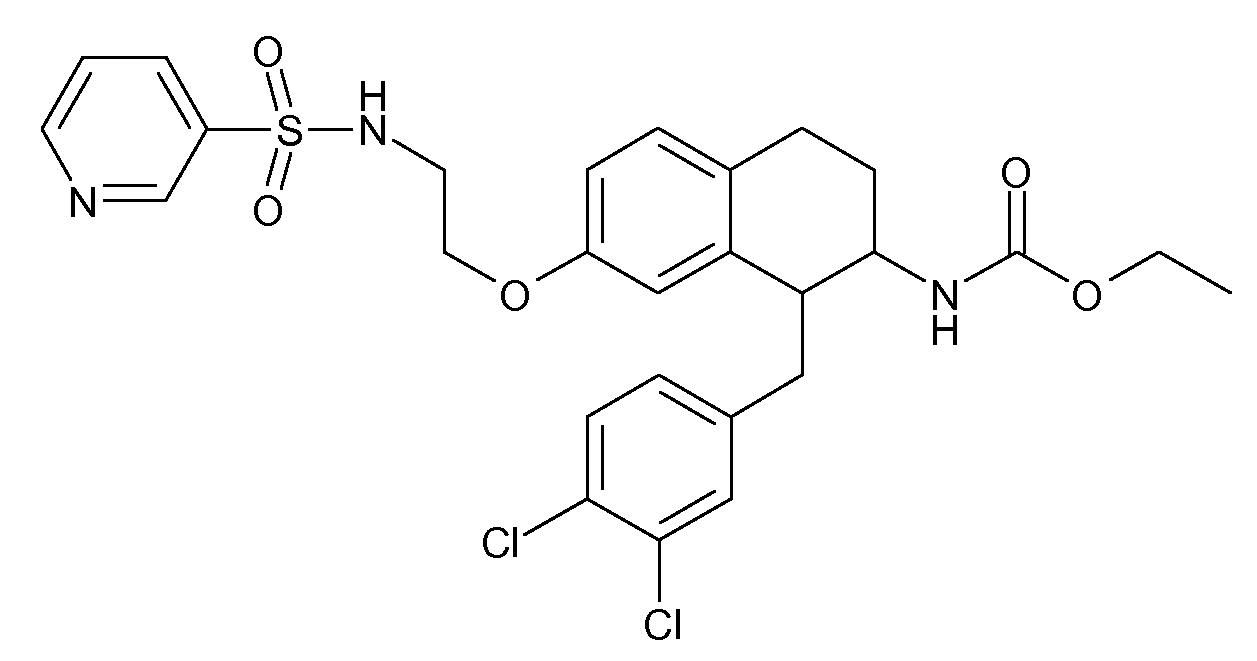
{1-(3,4-Дихлорбензил)-7-[2-(пиридин-3-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя пиридин-3-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=578,2, рассчитано для C27H29Cl2N3O5S=577.
Пример 11: N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-метилпропан-1-сульфонамида гидрохлорид
11.1 N-(1-(3,4-Дихлорбензил)-7-(2-(пропилсульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-ил)-2,2,2-трифторацетамид
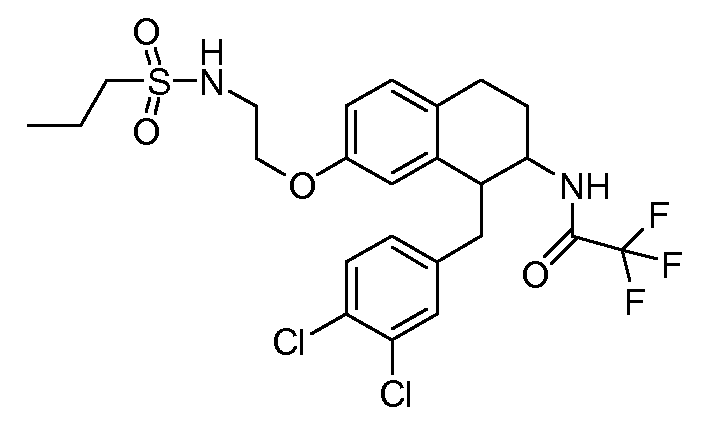
N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)пропан-1-сульфонамид (пример 3, 150 мг, 0,318 ммоль) и триэтиламин (32,2 мг, 0,318 ммоль) растворяют в ТГФ (10 мл) и добавляют трифторуксусный ангидрид (66,8 мг, 0,318 ммоль). Смесь перемешивают при комнатной температуре в течение 48 ч. Добавляют этилацетат, смесь экстрагируют водой и затем промывают раствором NaHCO3 и насыщенным раствором NaCl. После сушки над MgSO4 и удаления растворителя остаток очищают хроматографией на силикагеле, используя CH2Cl2/MeOH 98:2, и получают конечный продукт в виде бесцветного масла, которое через некоторое время становится твердым (80,0 мг, 0,141 ммоль, 44%).
11.2 N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-метилпропан-1-сульфонамида гидрохлорид
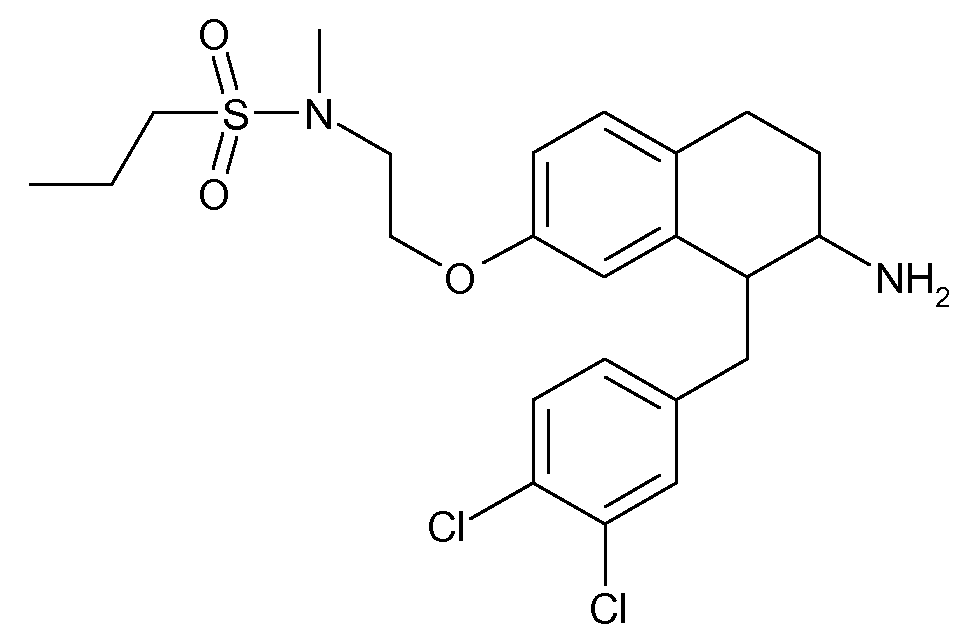
NaH (3,38 мг, 0,078 ммоль, 55% в масле) суспендируют в DMA (5 мл) и по каплям добавляют N-(1-(3,4-дихлорбензил)-7-(2-(пропилсульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-ил)-2,2,2-трифторацетамид (40 мг, 0,07 ммоль), растворенный в DMA (4 мл). После перемешивания в течение 1 ч добавляют иодметан (10,5 мг, 0,074 ммоль), растворенный в DMA (1 мл). После перемешивания в течение еще 14 ч реакционную смесь добавляют к полуконцентрированному раствору NaCl. После экстракции этилацетатом, промывания органических слоев водой и насыщенным раствором NaCl и сушки над Na2SO4 получают остаток, который промывают диизопропиловым эфиром. Расщепление амидной связи проводят путем перемешивания остатка с концентрированным раствором NaOH в воде с последующей экстракцией этилацетатом. Органический слой сушат над MgSO4 и упаривают. Остаток очищают методом препаративной ВЭЖХ (RP-18, ацетонитрил/вода, 0,01% TFA). После превращения продукта в соль HCl получают желтое твердое вещество (11,0 мг, 0,021 ммоль, 30%).
ESI-MS [M+H+]=485,2, рассчитано для C23H30Cl2N2O3S=484.
Пример 12: [1-(3,4-Дихлорбензил)-7-(2-метансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
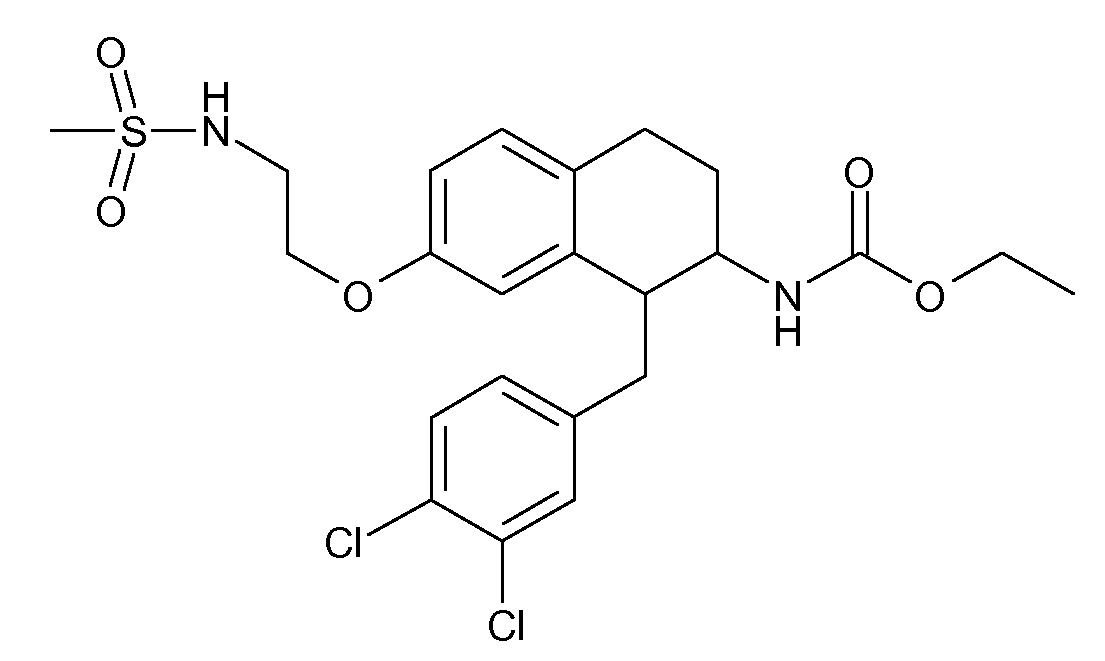
[1-(3,4-Дихлорбензил)-7-(2-метансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир получают по способу примера 3, используя метилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=515.1, рассчитано для C23H28Cl2N2O5S=514.
Пример 13: [7-(2-Бензолсульфониламиноэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
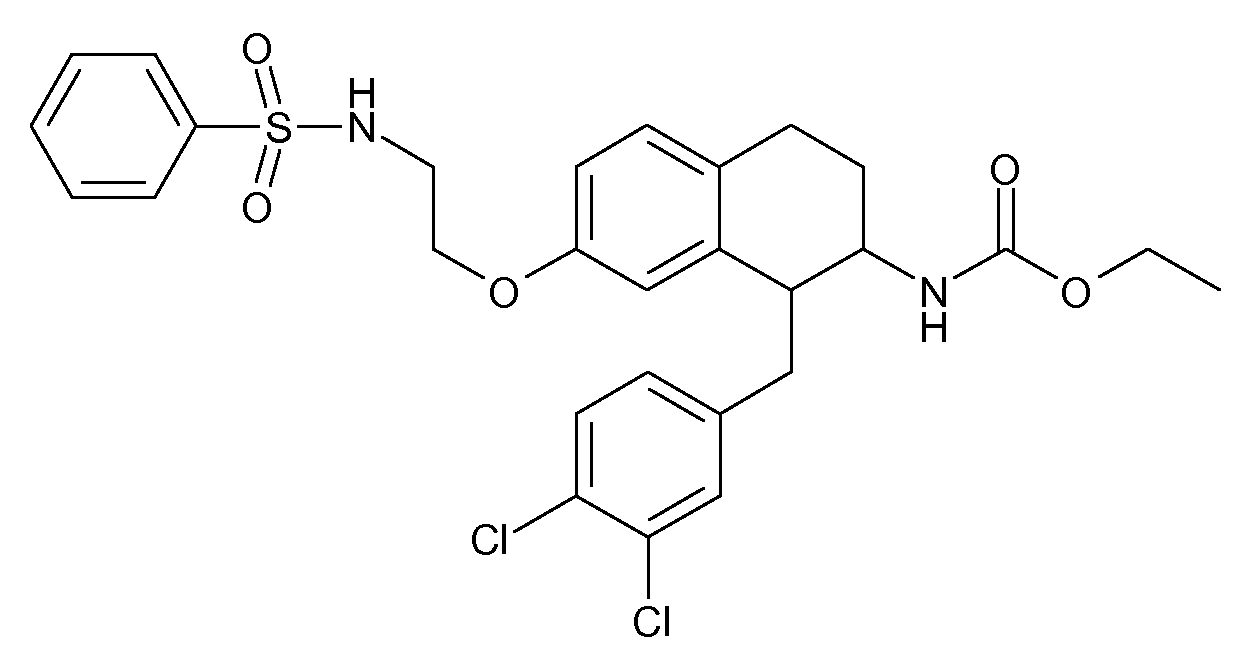
[7-(2-Бензолсульфониламиноэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир получают по способу примера 3, используя фенилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=577,2, рассчитано для C28H30Cl2N2O5S=576.
Пример 14: {1-(3,4-Дихлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
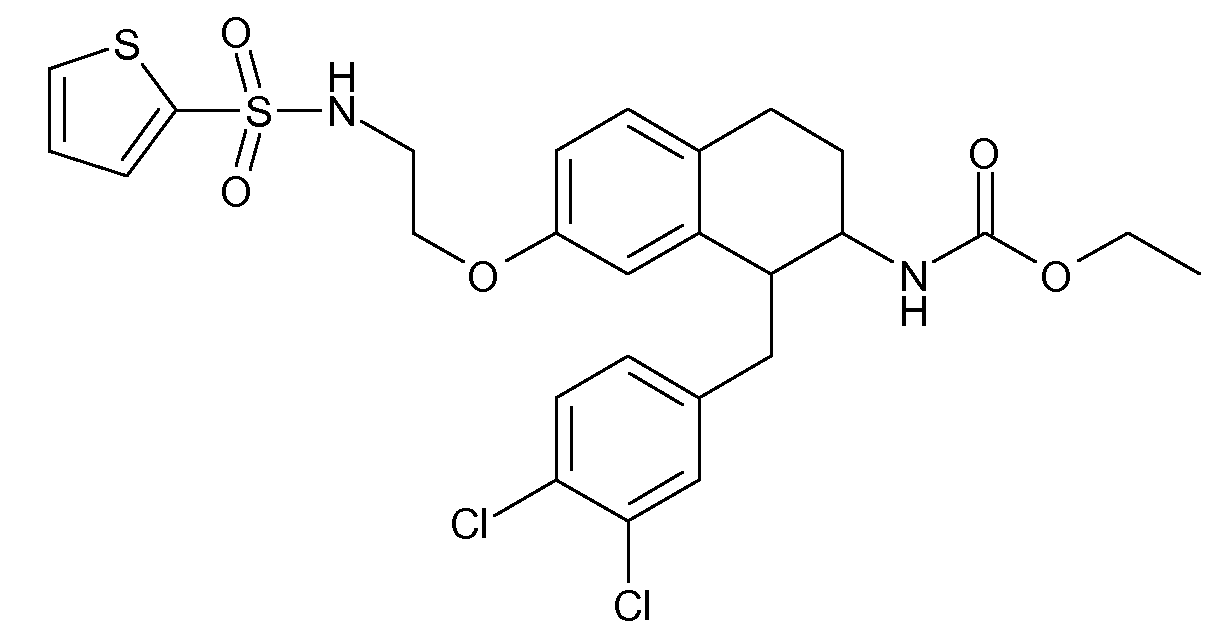
{1-(3,4-Дихлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя фенилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=583,1, рассчитано для C26H28Cl2N2O5S2=582.
Пример 15: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорид
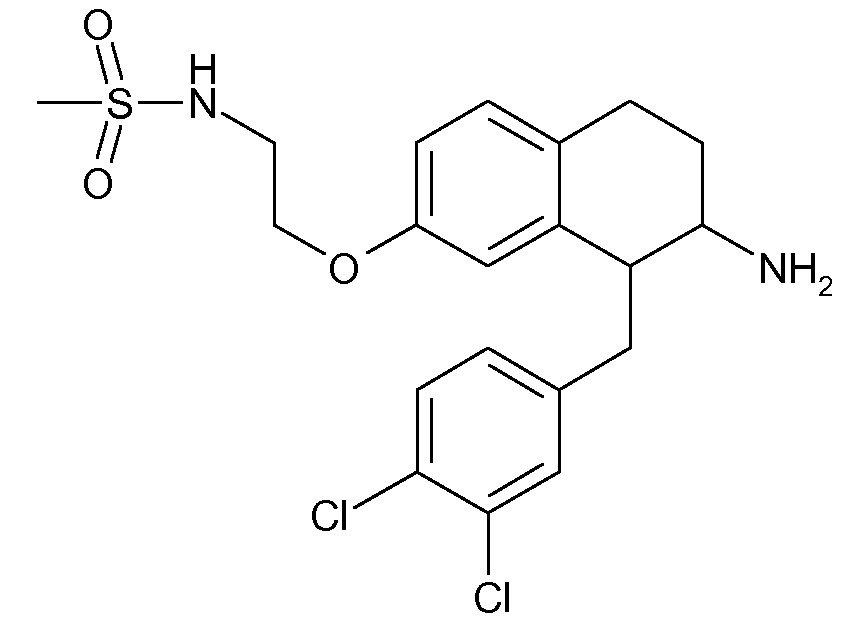
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамид получают по способу примера 3, используя метилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=443,1, рассчитано для C20H24Cl2N2O3S=442.
Пример 16: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}бензолсульфонамида гидрохлорид
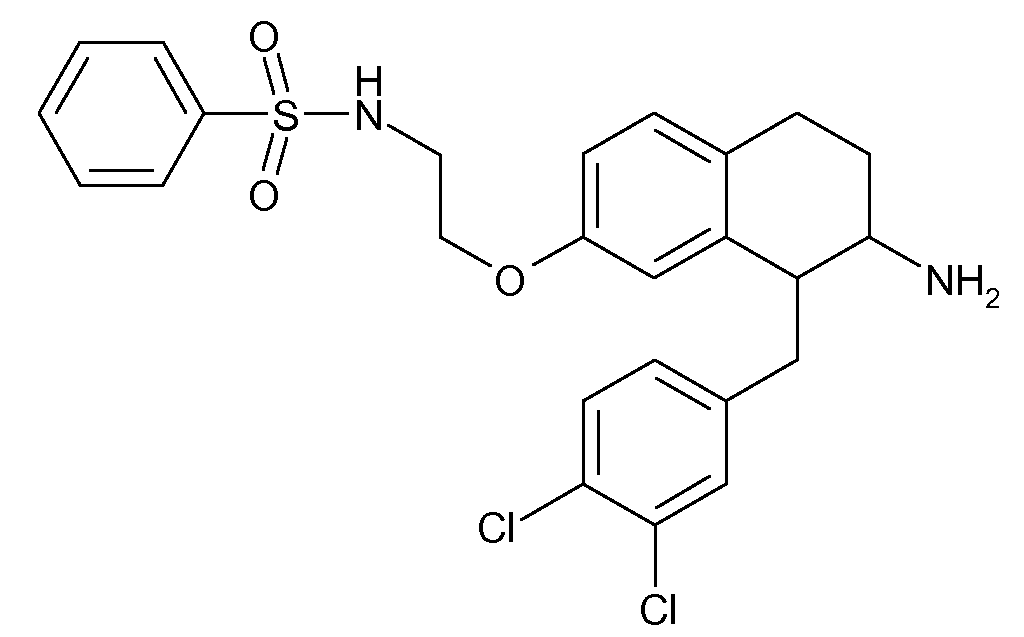
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}бензолсульфонамид получают по способу примера 3, используя фенилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=505,1, рассчитано для C25H26Cl2N2O3S=504.
Пример 17: Тиофен-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
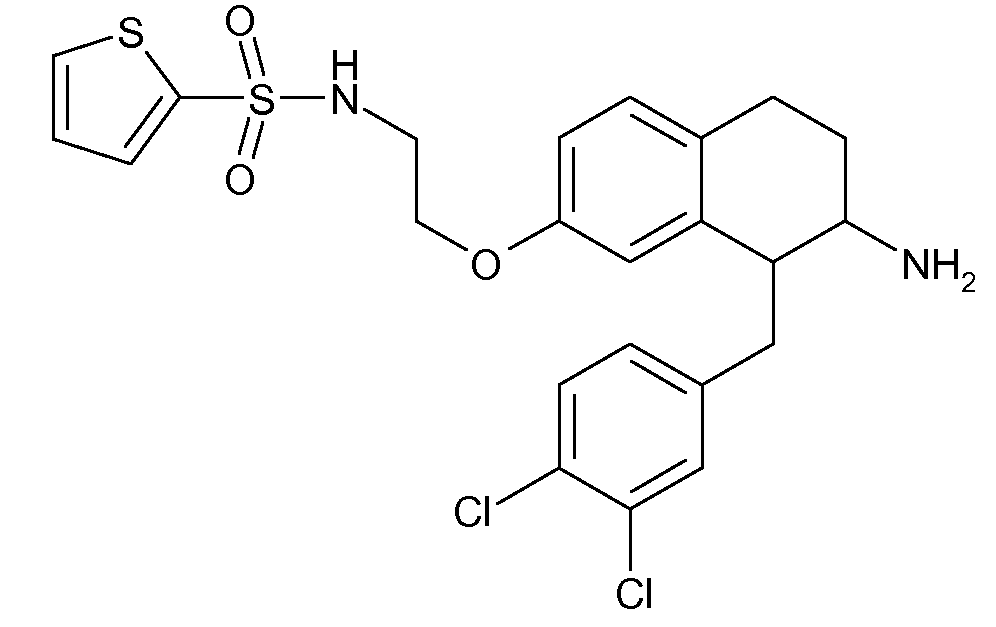
Тиофен-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид получают по способу примера 3, используя тиофенсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=511,1, рассчитано для C23H24Cl2N2O3S2=510.
Пример 18: N-{1-(3,4-Дихлорбензил)-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}-2,2,2-трифторацетамид
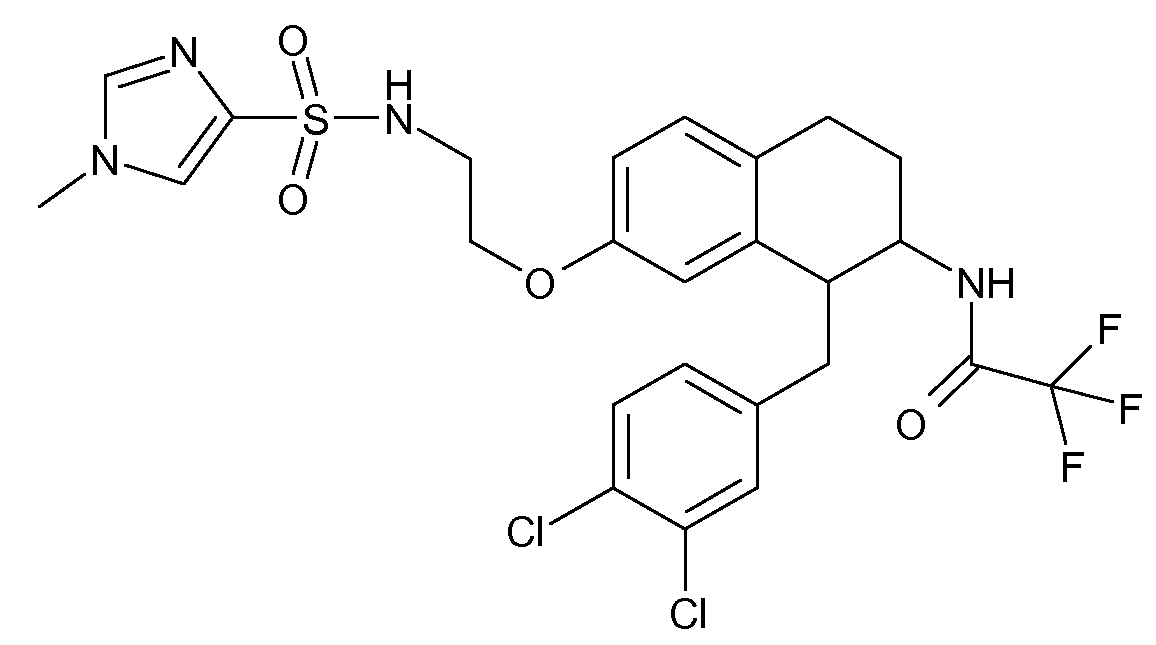
N-{1-(3,4-Дихлорбензил)-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}-2,2,2-трифторацетамид получают по способу примера 11, используя продукт примера 3 вместо продукта примера 8.
ESI-MS [M+H+]=605,1, рассчитано для C25H25Cl2F3N4O4S=604.
Пример 19: Пирролидин-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
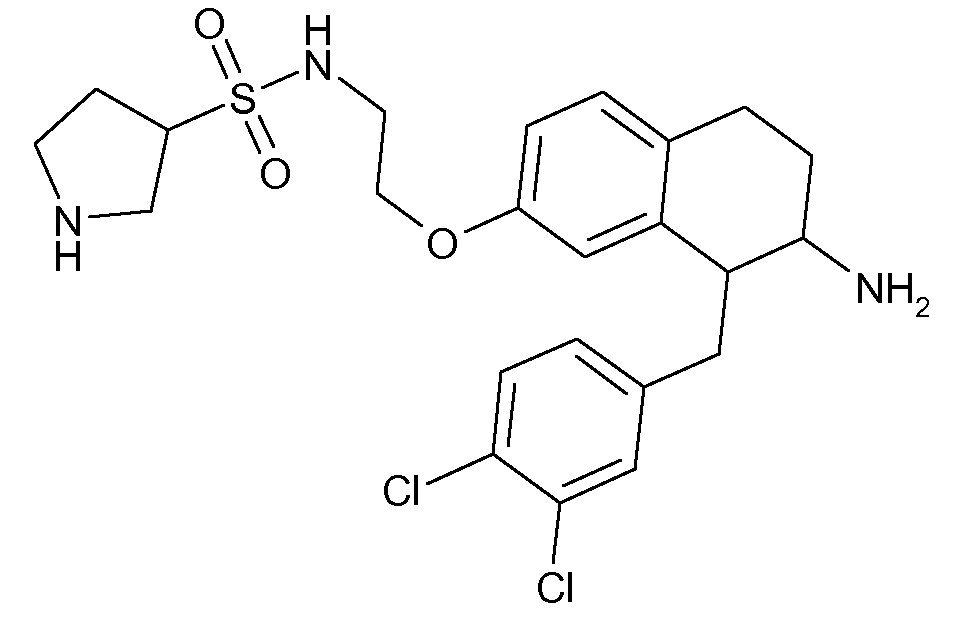
Пирролидин-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя бензил 3-(хлорсульфонил)пирролидин-1-карбоксилат (синтез описан в WO2008075070) вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=498,2, рассчитано для C23H29Cl2N3O3S=497.
Пример 20: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-формиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
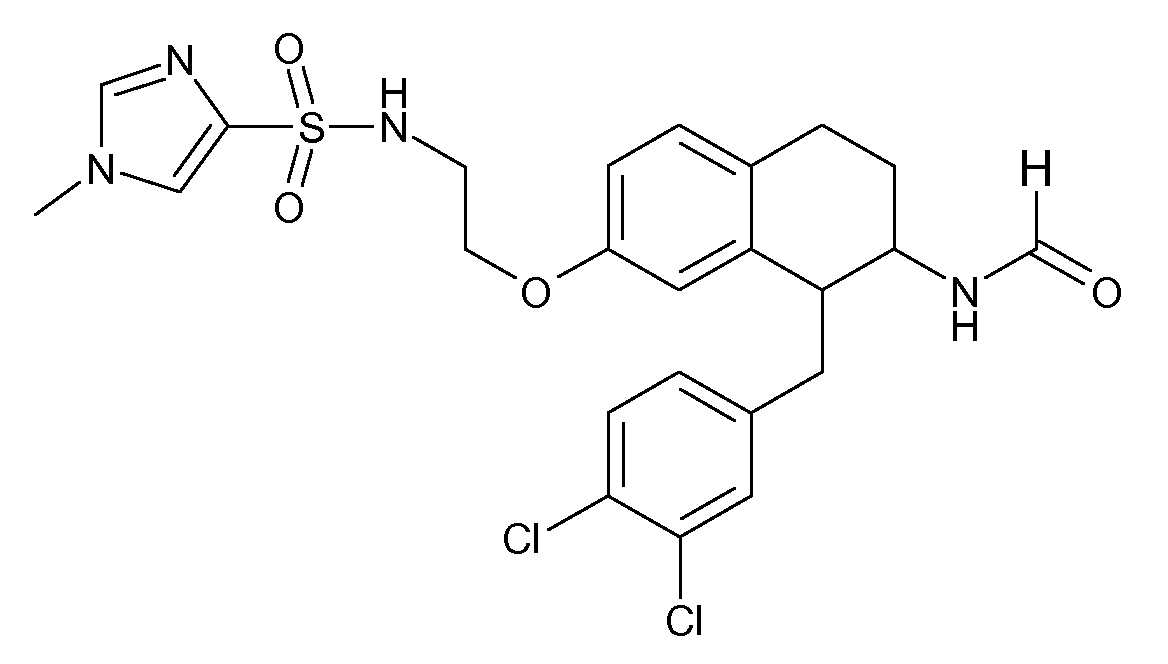
Этил 1-(3,4-дихлорбензил)-7-(2-(1-метил-1H-имидазол-4-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (пример 3, 60,0 мг, 0,103 ммоль) растворяют в ТГФ (5 мл) и при комнатной температуре добавляют LiAlH4 (7,83 мг, 0,206 ммоль). Остаток добавляют к 2N NaOH и экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором NaHCO3 и затем насыщенным раствором NaCl, сушат и упаривают. Продукт осаждают в виде соли HCl из раствора 6N HCl в изопропаноле и изопропиловом эфире с получением продукта в виде белой соли (36 мг, 61%).
ESI-MS [M+H+]=537,1, рассчитано для C24H26Cl2N4O4S=536.
Пример 21: 1-(3,4-Дихлорбензил)-7-[2-(4-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
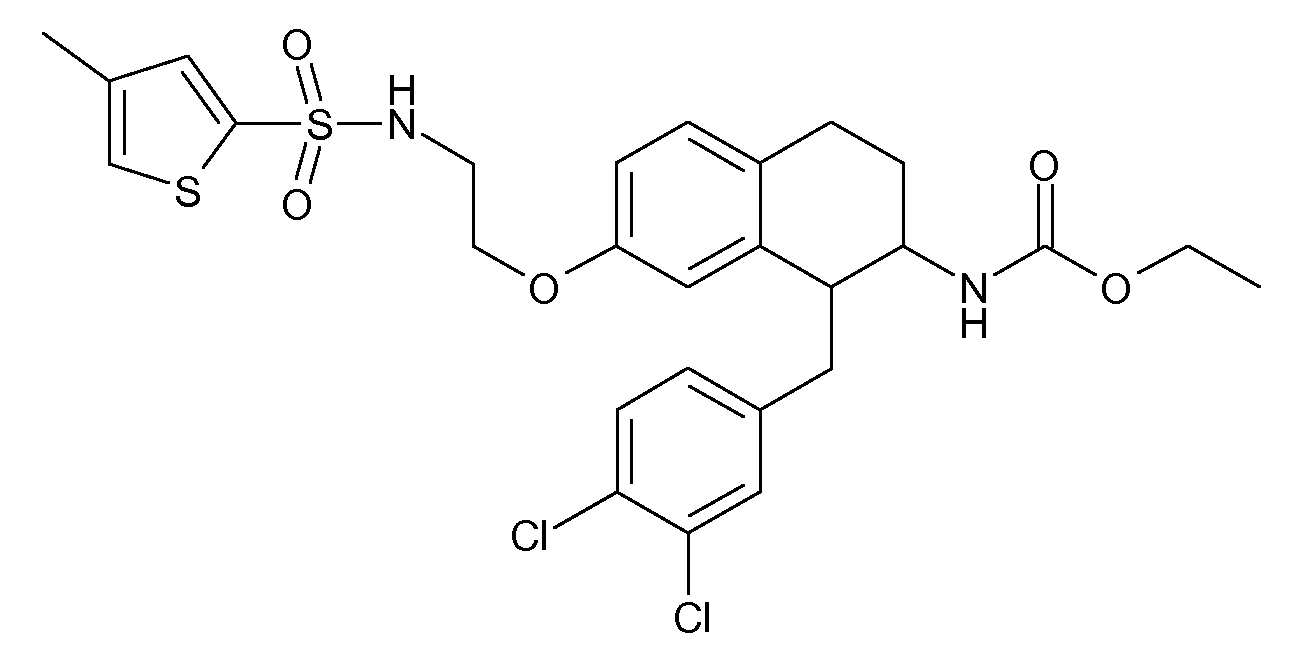
1-(3,4-Дихлорбензил)-7-[2-(4-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя 4-метилтиофен-2-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=597,1, рассчитано для C27H30Cl2N2O5S2=596.
Пример 22: {1-(3,4-Дихлорбензил)-7-[2-(3-фторпропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
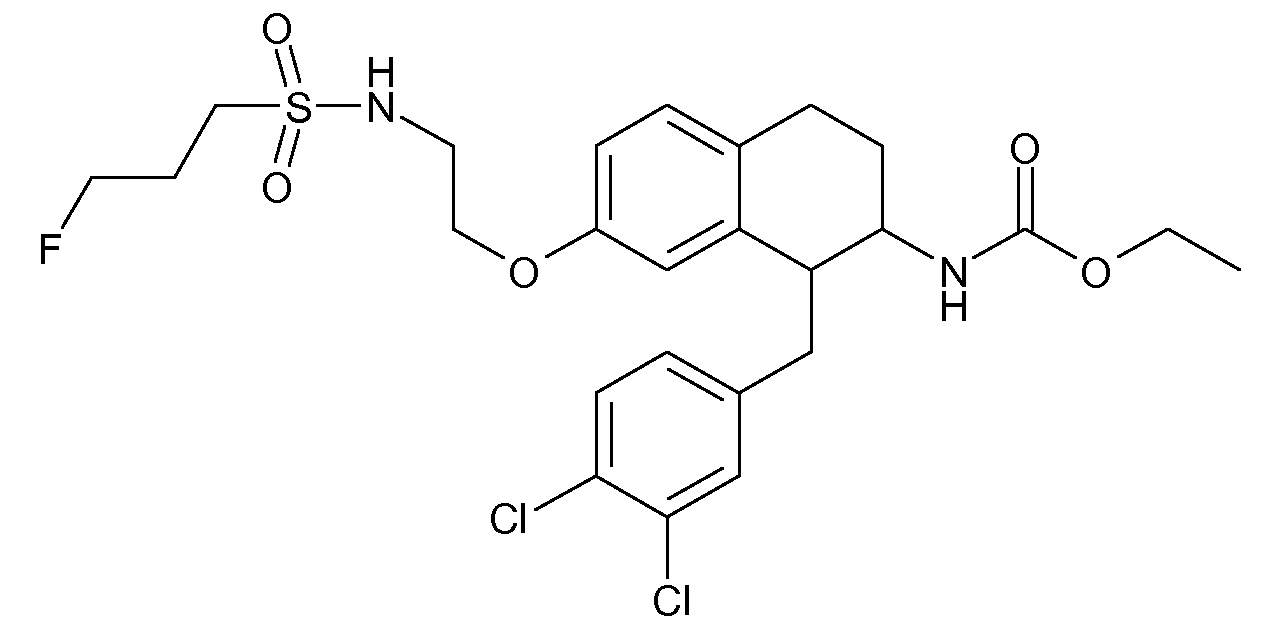
{1-(3,4-Дихлорбензил)-7-[2-(3-фторпропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя 3-фторпропан-1-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=561,2, рассчитано для C25H31Cl2FN2O5S=560.
Пример 23: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-этиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
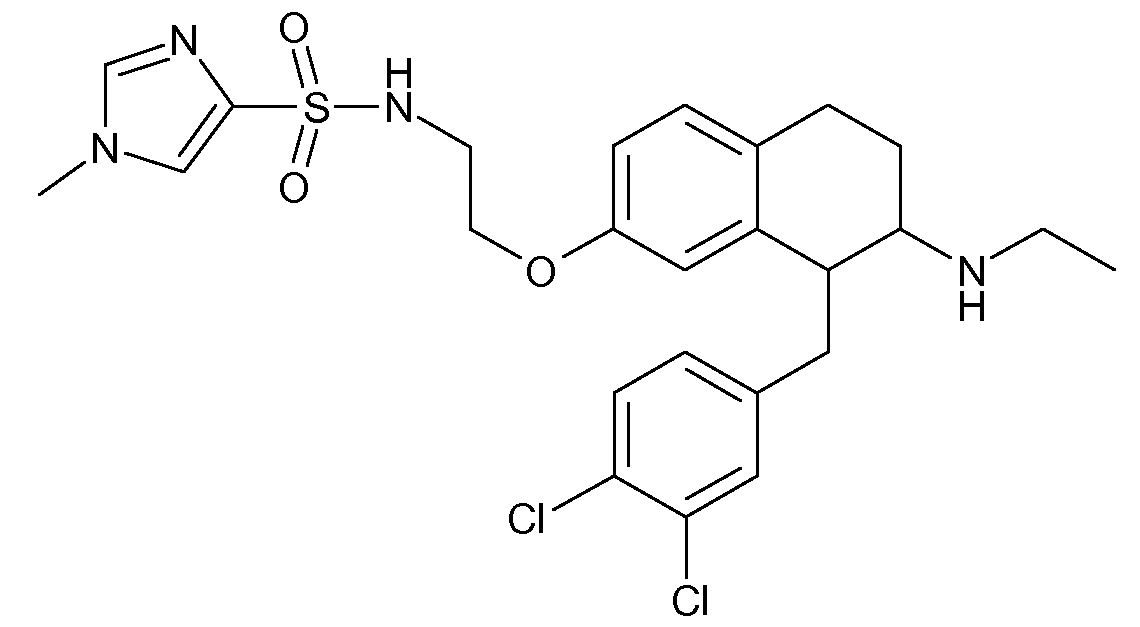
Этил 1-(3,4-дихлорбензил)-7-(2-(1-метил-1H-имидазол-4-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (пример 3, 60,0 мг, 0,103 ммоль) растворяют в дихлорметане (5 мл) и ацетальдегиде (5,45 мг, 0,124 ммоль мкл), добавляют молекулярные сита 3 Е, и смесь перемешивают в течение 3 ч. Добавляют уксусную кислоту (7,07 мг, 0,118 ммоль), и смесь перемешивают еще 3 ч. Затем добавляют MeOH (5 мл) и цианоборгидрид натрия (14,8 мг, 0,236 ммоль) и перемешивание продолжают в течение 14 ч. После добавления воды смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным раствором NaHCO3, промывают и упаривают. Остаток очищают колоночной хроматографией, используя SiO2 и CH2Cl2/MeOH 95:5→90:10. Продукт осаждают в виде соли HCl из 6N раствора HCl в изопропаноле и изопропиловом эфире с получением соли белого цвета (17 мг, 25%).
ESI-MS [M+H+]=537,2, рассчитано для C25H30Cl2N4O3S=536.
Пример 24: 4-Метилтиофен-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
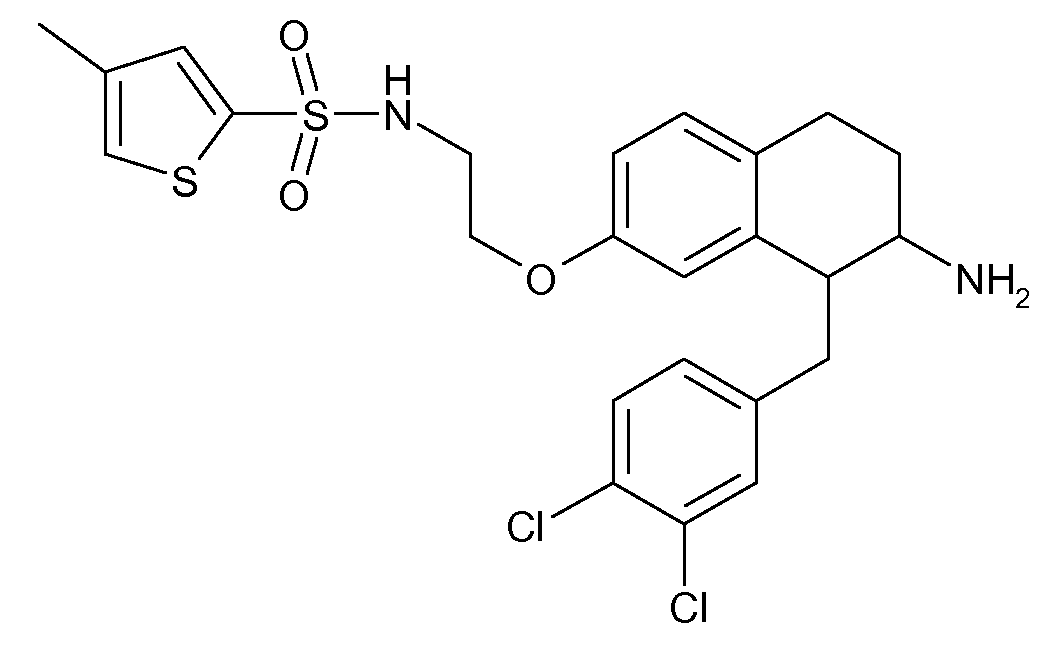
4-Метилтиофен-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя 4-метилтиофен-2-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=525,1, рассчитано для C24H26Cl2N2O3S2=524.
Пример 25: N'-(2-{[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N,N-диметилсерной кислоты диамида гидрохлорид
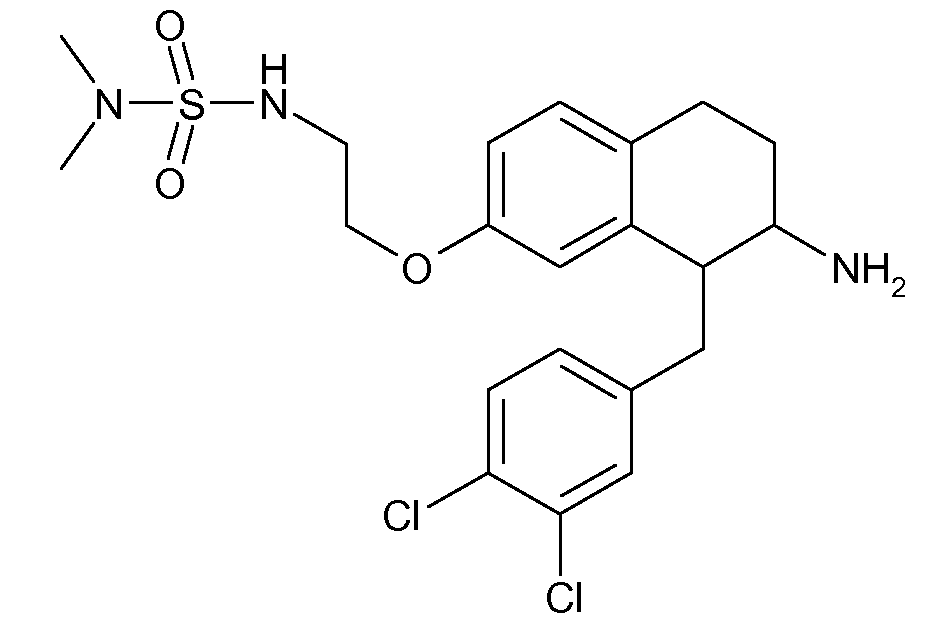
N'-(2-{[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N,N-диметилсерной кислоты диамида гидрохлорид получают по способу примера 3, используя ди- метилсульфамоилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=472,1, рассчитано для C21H27Cl2N3O3S=471.
Пример 26: {1-(3,4-Дихлорбензил)-7-[2-(3,3,3-трифторпропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
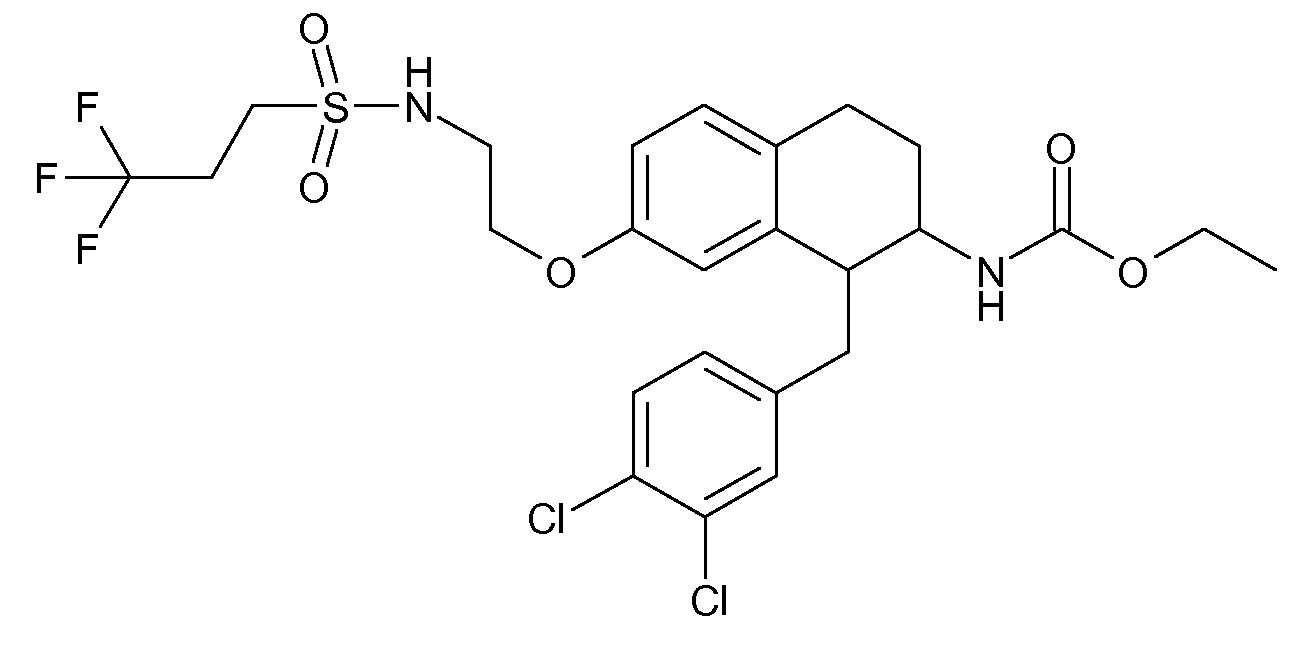
{1-(3,4-Дихлорбензил)-7-[2-(3,3,3-трифторпропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 3, используя диметилсульфамоилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=597,1, рассчитано для C25H29Cl2F3N2O5S=596.
Пример 27: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
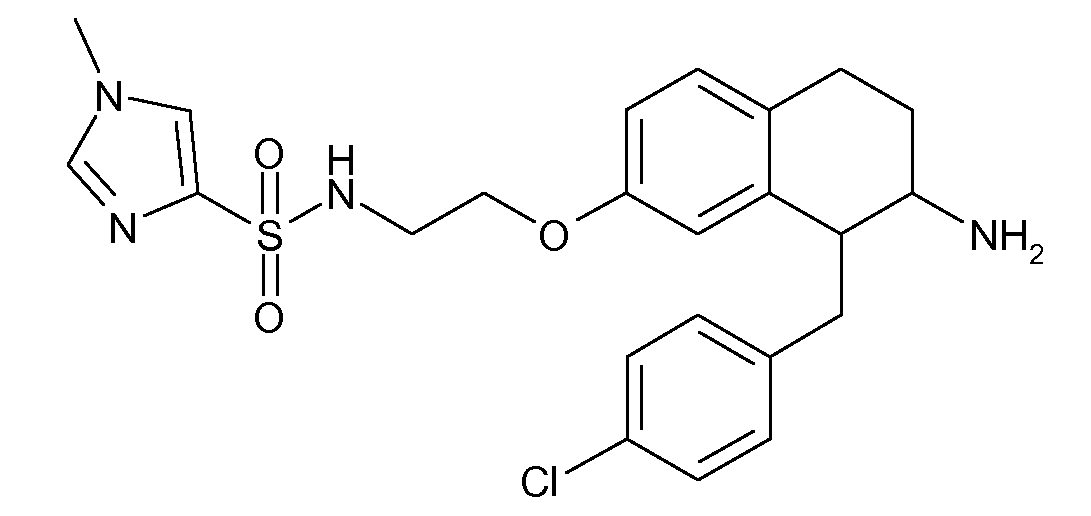
1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя 1-метил-1H-имидазол-4-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида и 4-(бромметил)-1-дихлорбензол вместо 4-(бромметил)-1,2-дихлорбензола.
ESI-MS [M+H+]=475,1, рассчитано для C23H27ClN4O3S=474.
Пример 28: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
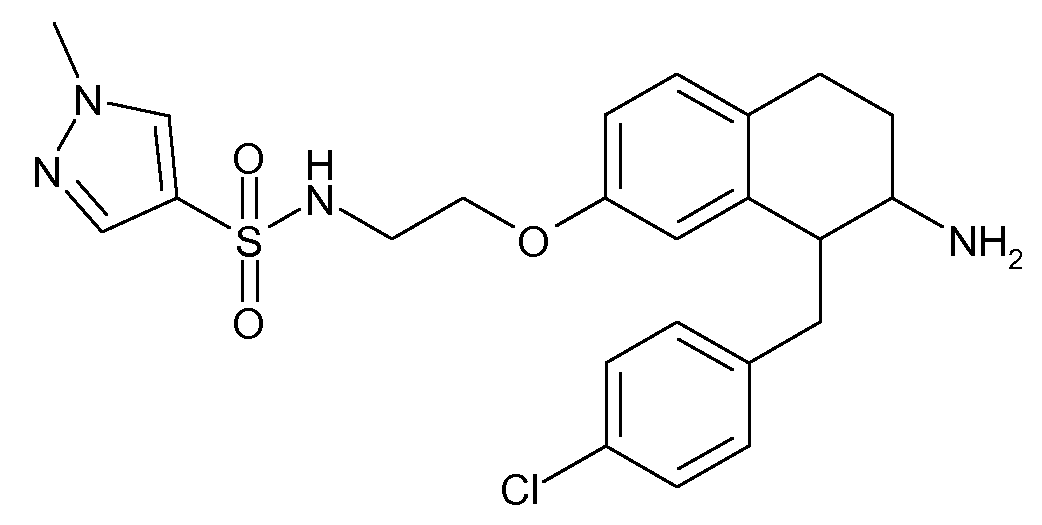
1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя 1-метил-1H-пиразол-4-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида и 4-(бромметил)-1-дихлорбензол вместо 4-(бромметил)-1,2-дихлорбензола.
ESI-MS [M+H+]=475,1, рассчитано для C23H27ClN4O3S=474.
Пример 29: 7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-карбонитрила трифторацетат
29.1 8-(3,4-Дихлорбензил)-7-[(этоксикарбонил)амино]-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат
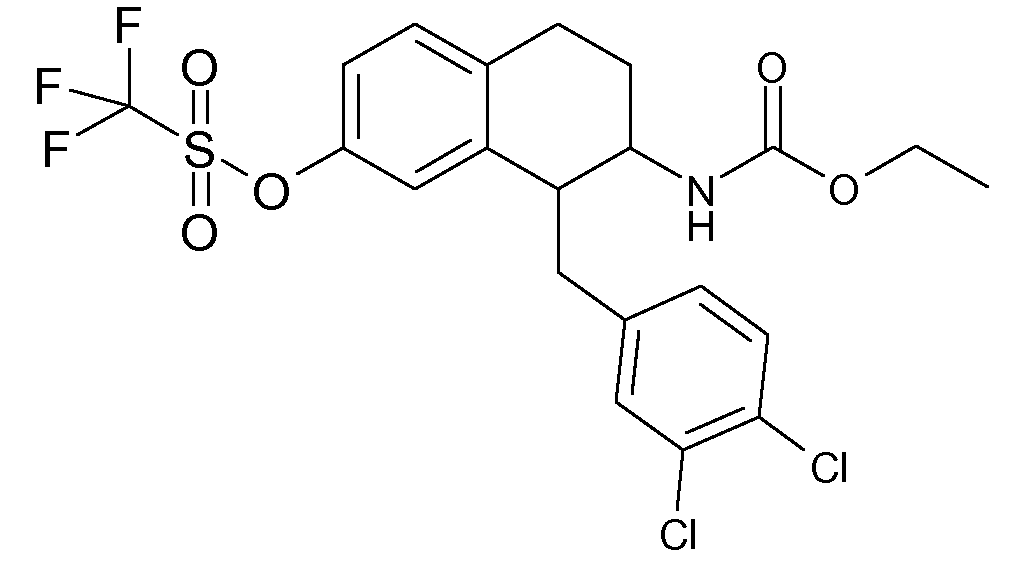
Этил 1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамат (700 мг, 1,775 ммоль, см. также пример 3d) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (761 мг, 2,13 ммоль) растворяют в дихлорметане (30 мл). Реакционную смесь охлаждают до 0°C, и по каплям добавляют раствор триэтиламина (0,495 мл, 3,55 ммоль) в дихлорметане (5 мл). Реакционную смесь оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение ночи. Растворитель упаривают в вакууме, и неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 934 мг (100%).
ESI-MS [M+H+]=526, рассчитано для C21H20Cl2F3NO5S=525.
29.2 Этил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
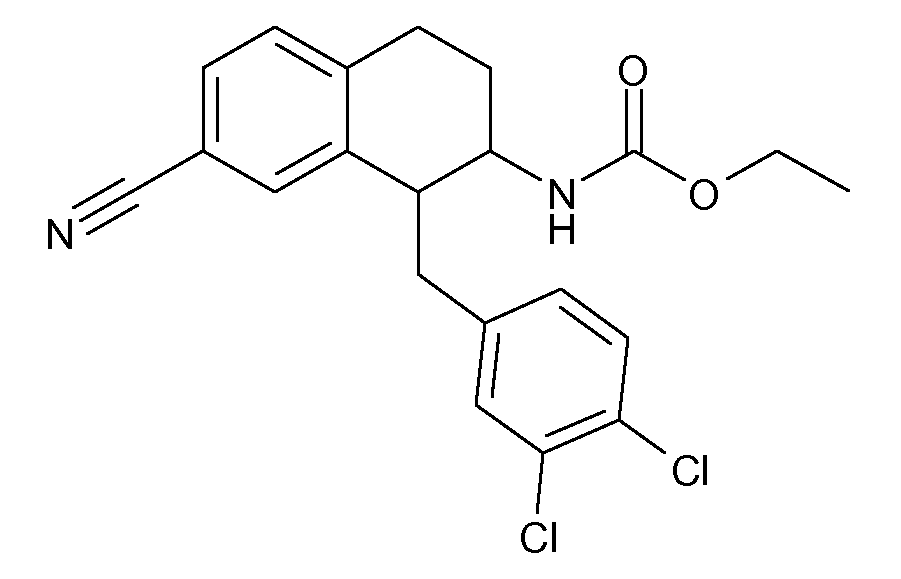
8-(3,4-Дихлорбензил)-7-[(этоксикарбонил)амино]-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (250 мг, 0,475 ммоль), цианид цинка (139 мг, 1,187 ммоль) и тетракистрифенил палладий (82 мг, 0,071 ммоль) в диметилформамиде (5 мл) нагревают в микроволновой печи при 120°C (100 Вт) при перемешивании в течение 35 мин. Растворитель упаривают в вакууме, и неочищенный продукт распределяют между этилацетатом (40 мл) и водой (30 мл). Водный слой экстрагируют этилацетатом еще раз (20 мл), и объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт (460 мг) очищают флэш-хроматографией (от дихлорметана до дихлорметан:метанол = 100:1, силикагель). Выход: 109 мг (0,270 ммоль, 57%, бесцветное твердое вещество).
ESI-MS [M+H+]=403, рассчитано для C21H20Cl2N2O2=402.
29.3 7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-карбонитрила трифторацетат
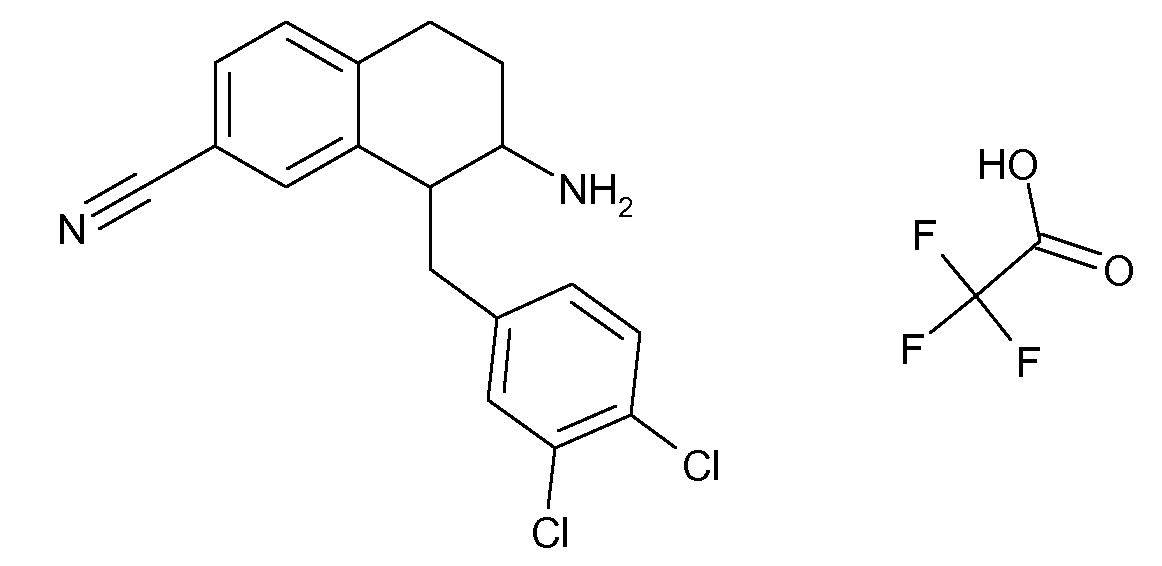
Этил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (50 мг, 0,124 ммоль), растворяют в 10% растворе гидроксида калия в этаноле (1,5 мл) и реакционную смесь перемешивают при 80°C в течение 2,5 ч. Растворитель упаривают в вакууме. К неочищенному продукту добавляют насыщенный соляной раствор (5 мл) и 2N хлористоводородную кислоту до достижения pH 7. Водный слой экстрагируют дихлорметаном три раза. Объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт (60 мг) очищают методом препаративной ВЭЖХ (колонка xTerra prep MS C18, 19Ч150 мм, 5 мкм; градиент: вода, ацетонитрил, содержащий 0.,1% трифторуксусной кислоты, скорость потока: 20 мл/мин). Выход: 6 мг (0,013 ммоль, 11%).
ESI-MS [M+H+]=331, рассчитано для C18H16Cl2N2=330.
Пример 30: 7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-карбонитрила гидрохлорид
30.1 7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ол
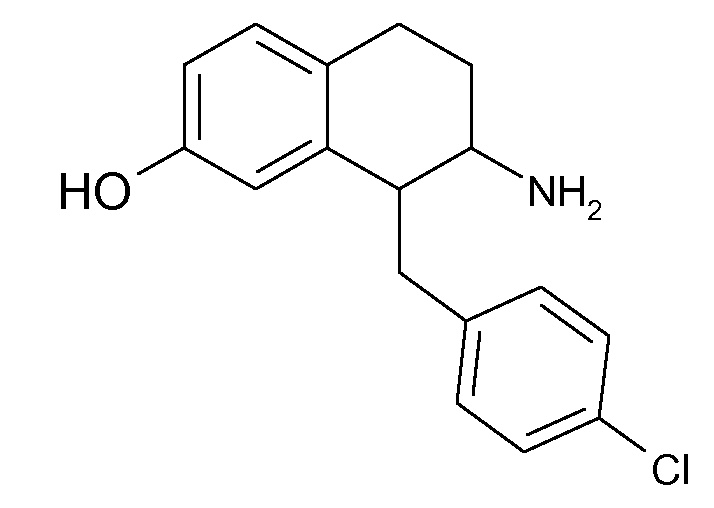
1-(4-хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амин (13,18 г, 43,7 ммоль, полученный аналогично 1-(3,4-дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амину, см. также пример 3) растворяют в дихлорметане (200 мл). Раствор охлаждают до -10°C и медленно добавляют 1 M раствор боронтрибромида в дихлорметане (131 мл, 131 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение 2 ч. Реакционную смесь выливают в воду со льдом и добавляют гидроксид натрия до достижения pH 8. Водный слой экстрагируют дихлорметаном. Объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт используют на следующей стадии без дополнительной очистки. Выход: 8,89 г (30,9 ммоль, 71%, бесцветное твердое вещество).
ESI-MS [M+H+]=288, рассчитано для C17H18ClNO=287.
30.2 Трет-бутил [1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат
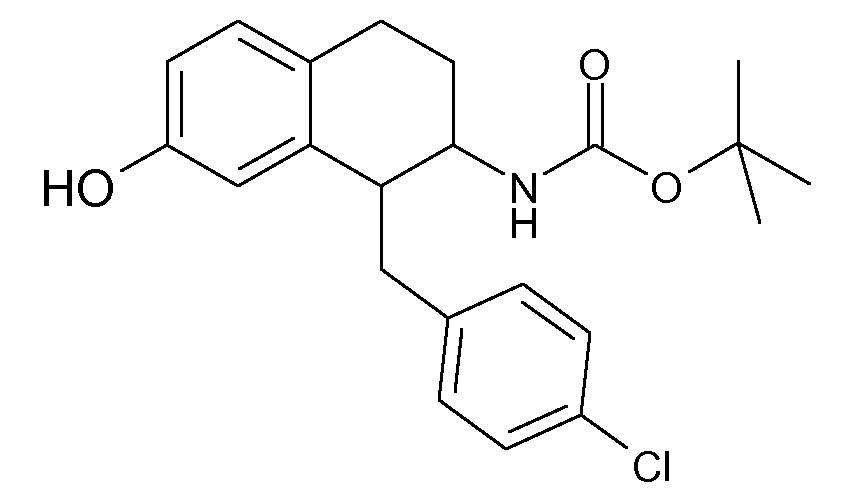
7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ол (2,0 г, 6,95 ммоль) растворяют в сухом тетрагидрофуране и добавляют ди-трет-бутилкарбонат (1,517 г, 6,95 ммоль) и триэтиламин (2,91 мл, 20,85 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Растворитель упаривают в вакууме. Добавляют воду, и водный слой экстрагируют дихлорметаном. Объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт перекристаллизовывают из н-гексана. Выход: 2,2 г (5,67 ммоль, 82%).
ESI-MS [M-изобутен+H+]=332, рассчитано для C22H26ClN2O3=387.
30.3 7-[(Трет-бутоксикарбонил)амино]-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат
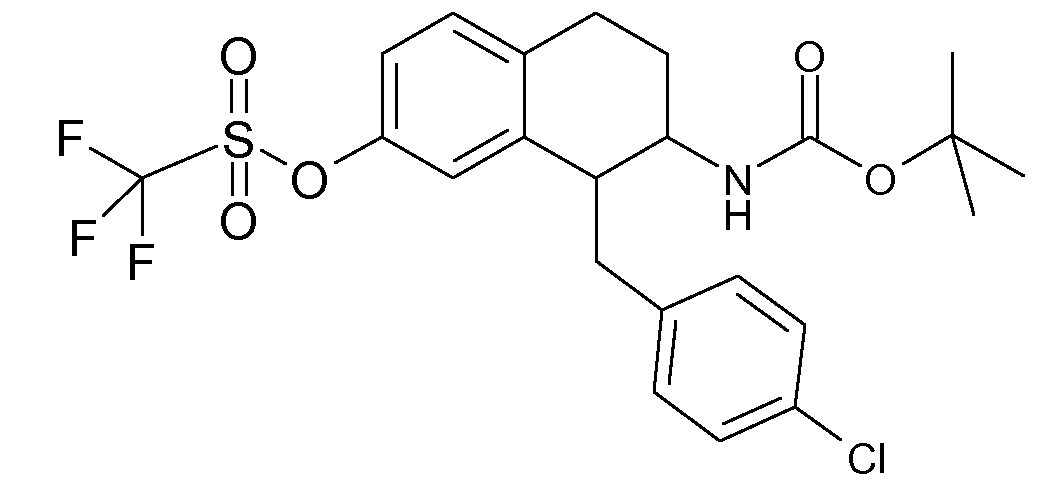
Трет-бутил [1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат (850 мг, 2,191 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (939 мг, 2,63 ммоль) растворяют в дихлорметане (45 мл). Бледно-желтый раствор охлаждают до 0°C, и по каплям добавляют раствор триэтиламина (0,611 мл, 4,38 ммоль) в дихлорметане (5 мл). Реакционную смесь оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение ночи. Растворитель упаривают в вакууме, и неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 1,03 г (1,981 ммоль, 90%, бесцветное твердое вещество).
ESI-MS [M-изобутен+CH3CN+H+]=505, рассчитано для C23H25ClF3NO5S=519.
30.4 Трет-бутил [1-(4-хлорбензил)-7-циано-1,2,3,4-тетрагидронафтален-2-ил]карбамат
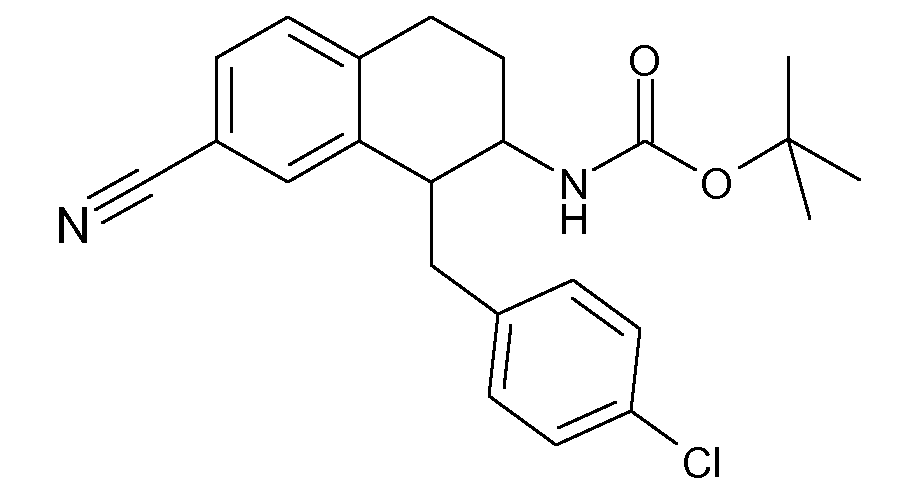
DPPF (8,1 мг, 0,015 ммоль) и Pd2dba3 (3,35 мг, 0,00365 ммоль) суспендируют в диметилформамиде (0,4 мл), и после перемешивания при комнатной температуре в инертной атмосфере азота в течение 20 мин добавляют 7-[(трет-бутоксикарбонил)амино]-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (38 мг, 0,073 ммоль) и цианид цинка (12,87 мг, 0,110 ммоль). Реакционную смесь перемешивают при 90°C в течение 1 ч. Растворитель упаривают в вакууме. К неочищенному продукту добавляют воду (10 мл), и водный слой экстрагируют этилацетатом (два раза по 10 мл). Объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 16 мг (0,040 ммоль, 55%).
ESI-MS [M-изобутен+CH3CN+H+]=382, рассчитано для C23H25ClN2O2 =396.
30.5 7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-карбонитрила гидрохлорид
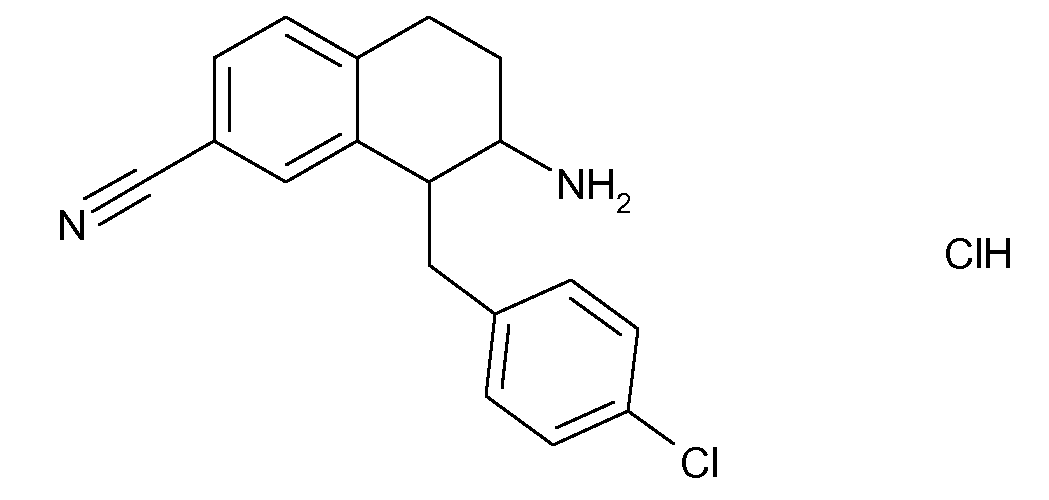
Трет-бутил [1-(4-хлорбензил)-7-циано-1,2,3,4-тетрагидронафтален-2-ил]карбамат (15 мг, 0,038 ммоль) растворяют в дихлорметане (1,5 мл) и добавляют 5 M раствор хлористоводородной кислоты в изопропаноле (0,3 мл). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Растворитель и избыток хлористоводородной кислоты упаривают в вакууме. Выход: 11 мг (0,033 ммоль, 87%, бесцветное твердое вещество).
ESI-MS [M+H+]=297, рассчитано для C18H17ClN2=296.
Пример 31: N-[(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил]-3-фторпропан-1-сульфонамида трифторацетат
31.1 Трет-бутил [7-(аминометил)-1-бензил-1,2,3,4-тетрагидронафтален-2-ил]карбамат
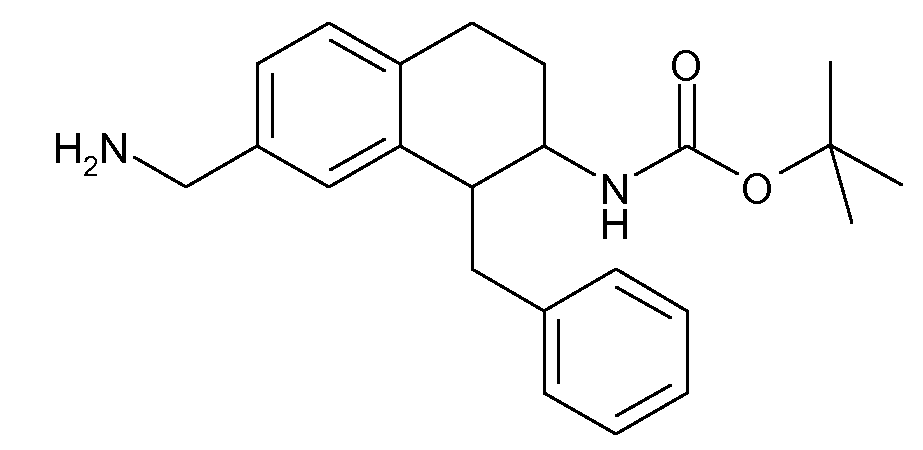
Трет-бутил [1-(4-хлорбензил)-7-циано-1,2,3,4-тетрагидронафтален-2-ил]карбамат (52 мг, 0,131 ммоль, см. также пример 30d) растворяют в метаноле (5 мл). Добавляют никель Ренея (примерно 30 мг), и реакционную смесь перемешивают при комнатной температуре в течение 4 ч в атмосфере водорода. Катализатор удаляют фильтрацией. Растворитель упаривают в вакууме. Неочищенный продукт используют на следующей стадии без дополнительной очистки. Выход: 32 мг (0,087 ммоль, 67%).
ESI-MS [M-изобутен+H+]=311, рассчитано для C23H30N2O2=366.
31.2 Трет-бутил [1-бензил-7-({[(3-фторпропил)сульфонил]амино}метил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
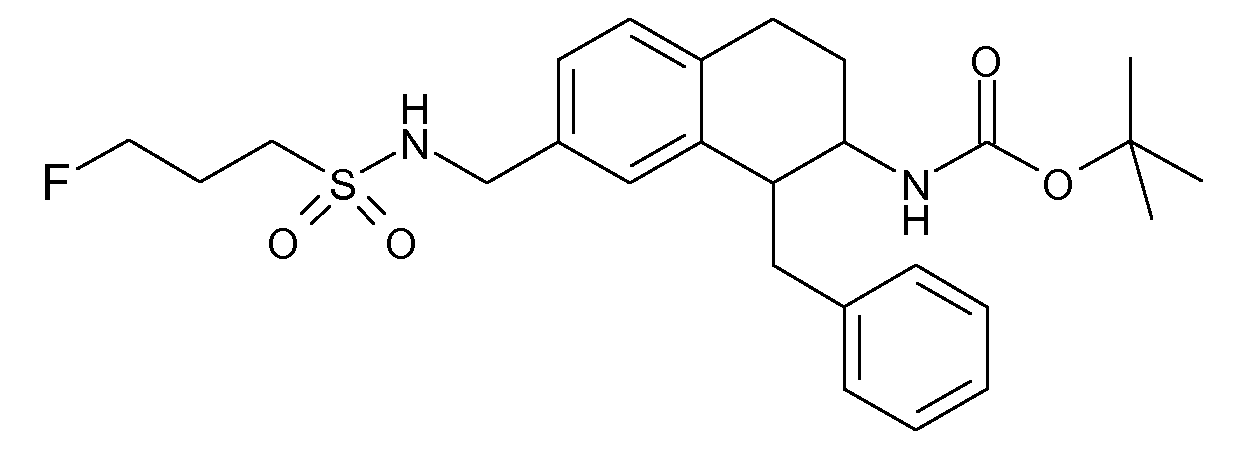
Трет-бутил [7-(аминометил)-1-бензил-1,2,3,4-тетрагидронафтален-2-ил]карбамат (32 мг, 0,87 ммоль) растворяют в дихлорметане (15 мл) и 4-диметиламинопиридине (12 мг, 0,096 ммоль) и добавляют 3-фторпропан-1-сульфонилхлорид (14 мг, 0,087 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор неочищенного продукта в дихлорметане промывают последовательно 1N водным раствором хлористоводородной кислоты и водным раствором NaHCO3, сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (дихлорметан, метанол, силикагель). Выход: 9,3 мг (0,019 ммоль, 22%).
ESI-MS [M-изобутен+H+]=435, рассчитано для C26H35FN2O4S=490.
31.3 N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-3-фторпропан-1-сульфонамида трифторацетат
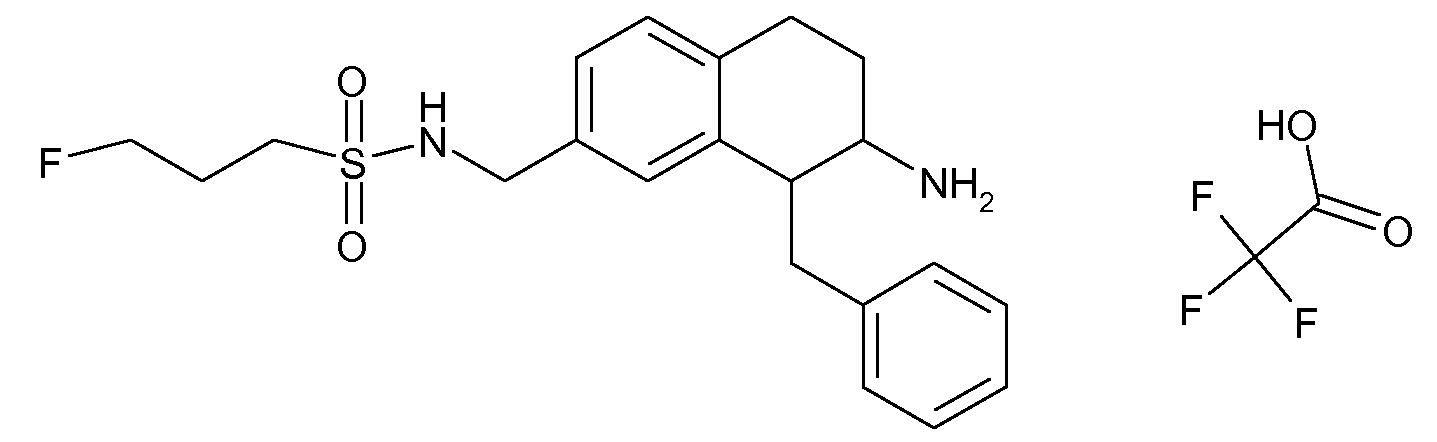
Трет-бутил [1-бензил-7-({[(3-фторпропил)сульфонил]амино}метил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (9,3 мг, 0,019 ммоль) растворяют в дихлорметане (10 мл) и добавляют трифторуксусную кислоту (избыток). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель упаривают в вакууме, и неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 4 мг (0,0079 ммоль, 42%).
ESI-MS [M+H+]=391, рассчитано для C21H27FN2O2S =390.
Пример 32: Этил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
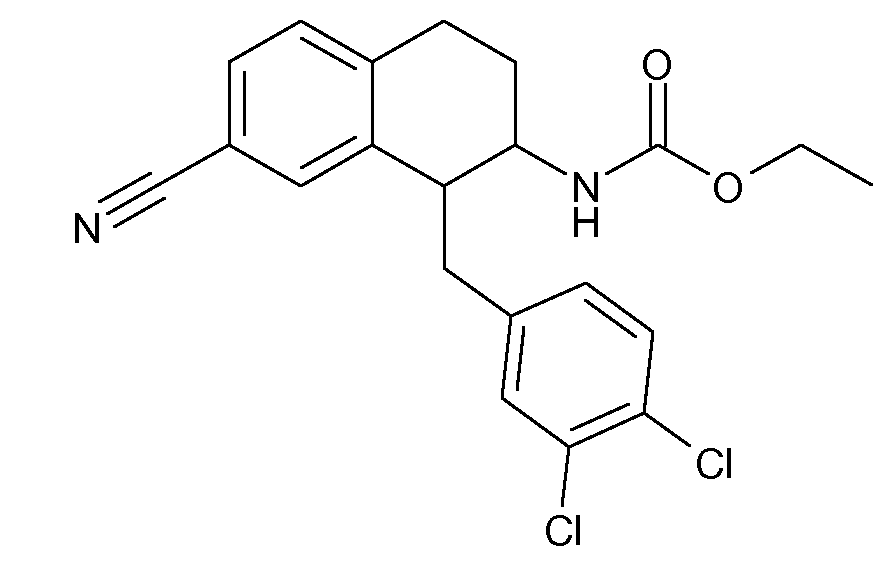
См. пример 29b.
ESI-MS [M+H+]=403, рассчитано для C21H20Cl2N2O2=402.
Пример 33: 1-(3-хлорбензил)-7-[2-(1,1-диоксидоизотиазолидин-2-ил)этокси]-1,2,3,4-тетрагидронафтален-2-амина гидрохлорид
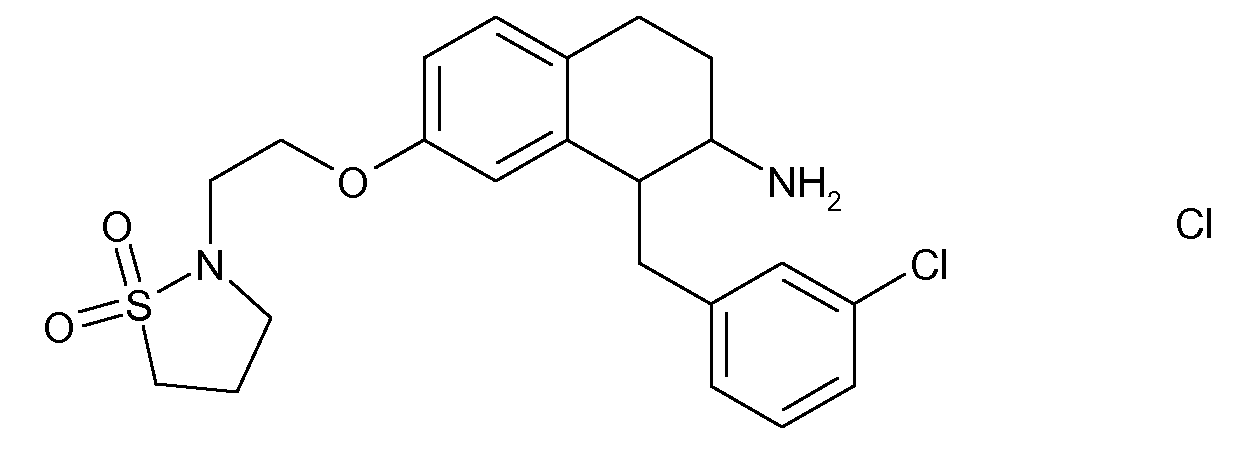
ESI-MS [M+H+]=435, рассчитано для C22H27ClN2O3S=434.
Пример 34: трет-Бутил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
34.1 7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ол
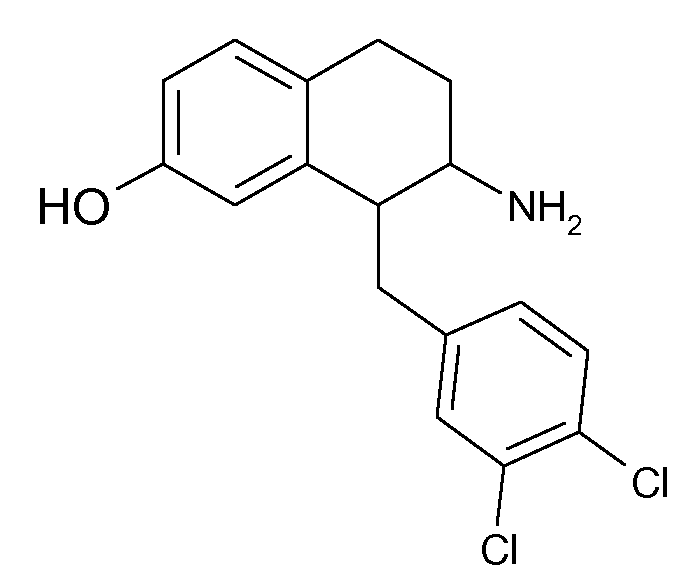
1-(3,4-Дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амин (10 г, 26,8 ммоль, см. также пример 3.2) растворяют в дихлорметане (240 мл). Суспензию охлаждают до -10°C и добавляют 1 M раствор бортрибромида в дихлорметане (80 мл, 80 ммоль). Раствор оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение 3 ч. Реакционную смесь выливают на лед (1 л). Водный слой подщелачивают (pH 10) 2N раствором гидроксида натрия. Слои разделяют. Водный слой экстрагируют дихлорметаном, и объединенные органические слои промывают насыщенным раствором NaHCO3 и водой. Органические слои сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт используют без дополнительной очистки на следующей стадии. Выход: 10,8 г
ESI-MS [M+H+]=322, рассчитано для C17H17Cl2NO=321.
34.2 трет-Бутил [1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат
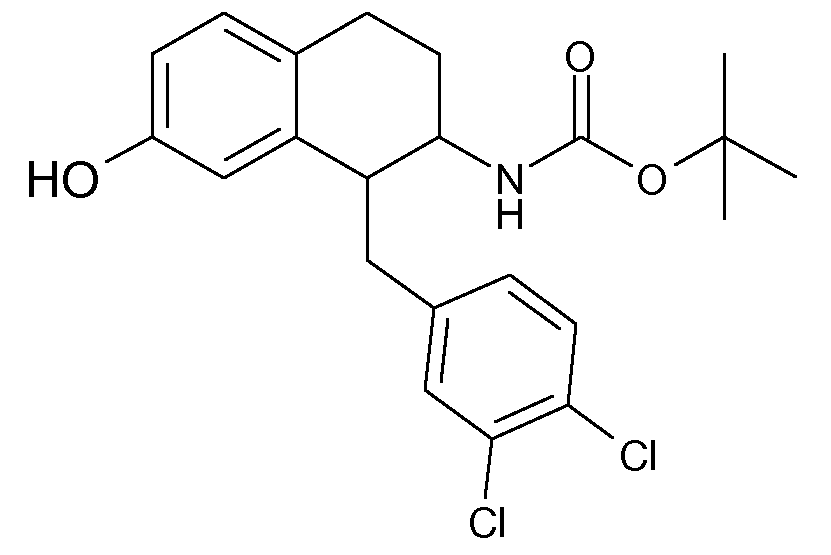
7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ол (10,8 г) и триэтиламин (14,01 мл, 101 ммоль) растворяют в сухом тетрагидрофуране (200 мл). Ди-трет-бутил карбонат (7,31 г, 33,5 ммоль) добавляют маленькими порциями при комнатной температуре. Реакционную смесь перемешивают в течение ночи. Растворитель упаривают в вакууме. Остаток растворяют в этилацетате (300 мл) и промывают водой (2Ч200 мл). Раствор неочищенного продукта в этилацетате сушат (Na2SO4). Растворитель упаривают в вакууме, и неочищенный продукт используют на следующей стадии без дополнительной очистки. Выход: 12,2 г.
ESI-MS [M-изобутен+CH3CN+H+]=407, рассчитано для C22H25Cl2NO3=421.
34.3 7-[(трет-бутоксикарбонил)амино]-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат
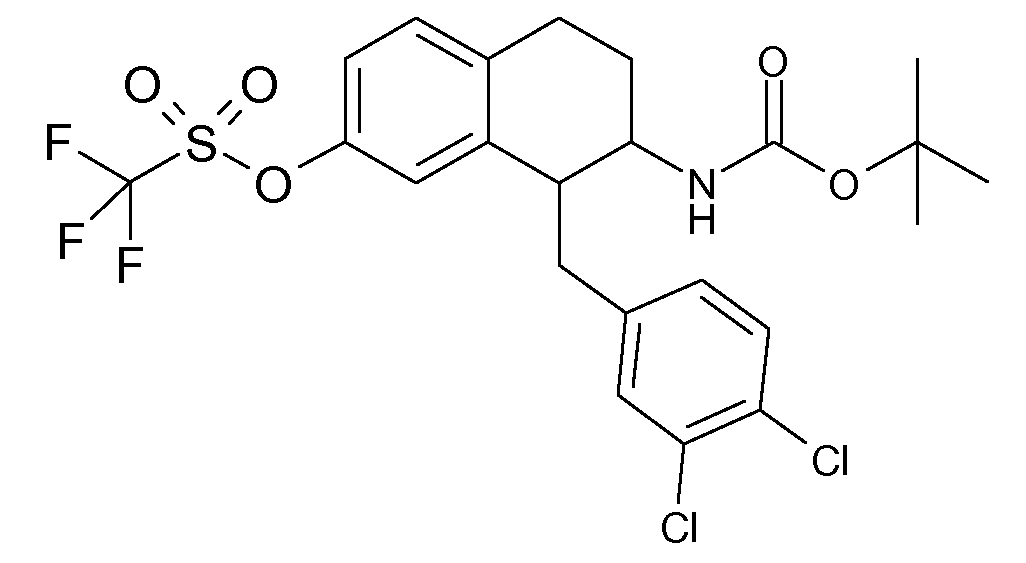
трет-Бутил [1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат (4,06 г, 9,66 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (4,14 г, 11,59 ммоль) растворяют в дихлорметане (190 мл). Светло-коричневый раствор охлаждают до 0°C, и по каплям добавляют раствор триэтиламина (2,69 мл, 19,32 ммоль) в дихлорметане (10 мл). Реакционную смесь оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение ночи. Растворитель упаривают в вакууме, и неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 3,2 г (5,77 ммоль, 60%).
34.4 трет-Бутил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
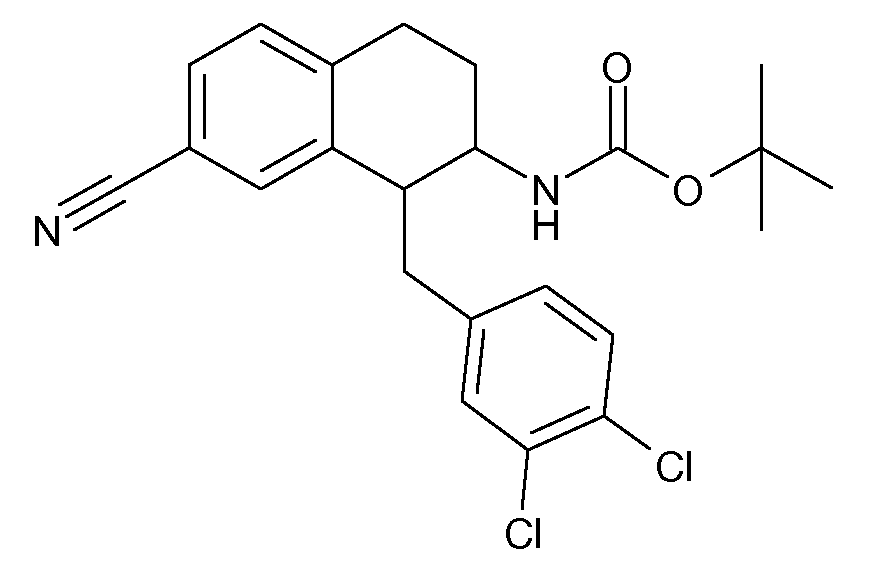
Дифенилфосфиноферроцен (100 мг, 0,18 ммоль) и дипалладия трисдибензилиденацетон (41 мг, 0,045 ммоль) суспендируют в атмосфере аргона в сухом диметилформамиде (5 мл). После перемешивания при комнатной температуре в течение 40 мин добавляют 7-[(трет-бутоксикарбонил)амино]-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (0,5 г, 0,902 ммоль), и реакционную смесь нагревают до 90°C. Через 30 мин маленькими порциями добавляют цианид цинка (159 мг, 1,353 ммоль). После завершения добавления перемешивание продолжают при 90°C в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют дихлорметаном (50 мл) и промывают насыщенным раствором NaHCO3 (3Ч10 мл). Органический слой сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 97 мг (0,225 ммоль, 25%).
ESI-MS [M+Na+]=453, рассчитано для C23H24Cl2N2O2=430.
Пример 35: 7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ол трифторацетат (соль)
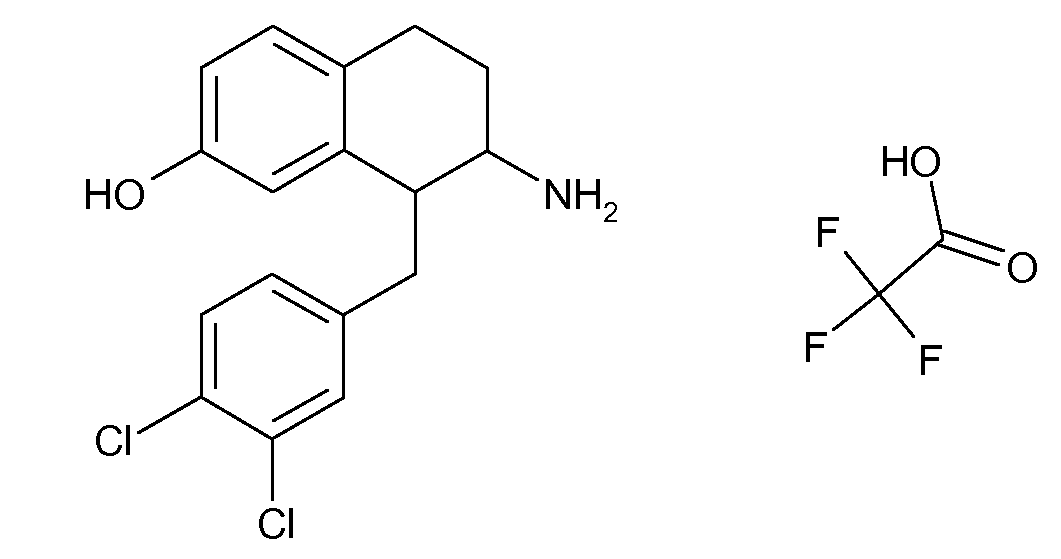
См. также пример 34a.
ESI-MS [M+H+]=322, рассчитано для C17H17Cl2NO=321.
Пример 36: 1-(4-хлорбензил)-7-(дифторметокси)-1,2,3,4-тетрагидронафтален-2-амина гидрохлорид
36.1 трет-Бутил [1-(4-хлорбензил)-7-(дифторметокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
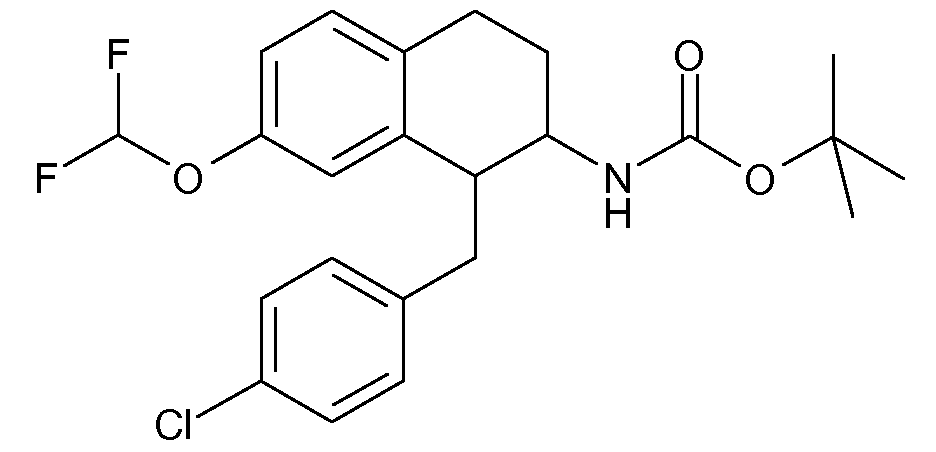
Трет-бутил [1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат (180 мг, 0,464 ммоль, полученный аналогично трет-бутил [1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамату, см. также пример 34.2) и гидроксид калия (1.4 г, 25 ммоль) суспендируют в ацетонитриле (4 мл). После перемешивания двухфазной системы в течение 45 мин при комнатной температуре реакционную смесь охлаждают до -15°C и добавляют по каплям раствор 2-хлор-2,2-дифтор-1-фенилэтанона (442 мг, 2,32 ммоль) в ацетонитриле (1 мл) в течение 30 мин. Реакционную смесь нагревают до комнатной температуры и затем нагревают при 80°C в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и разбавляют этилацетатом. Водный слой экстрагируют этилацетатом. Объединенные экстракты сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (дихлорметан, силикагель). Выход: 30 мг (0,069 ммоль, 15%).
ESI-MS [M-изобутен+CH3CN+H+]=423, рассчитано для C23H26ClF2NO3=437.
36.2 1-(4-Хлорбензил)-7-(дифторметокси)-1,2,3,4-тетрагидронафтален-2-амина гидрохлорид
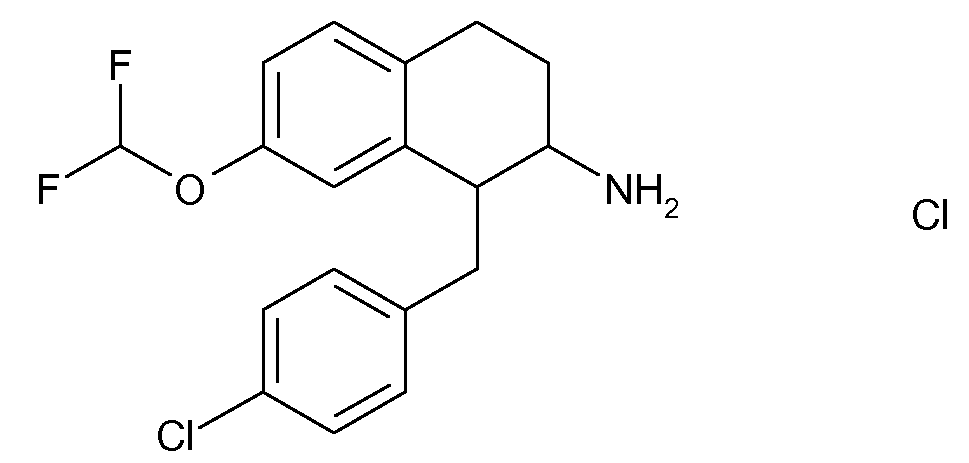
трет-Бутил [1-(4-хлорбензил)-7-(дифторметокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (30 мг, 0,069 ммоль) растворяют в дихлорметане (2 мл). Добавляют 5N раствор хлористоводородной кислоты в изопропаноле (0,3 мл), и реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Растворители упаривают в вакууме. Выход: 26 мг (0,069 ммоль, 100%, бесцветное твердое вещество).
ESI-MS [M+H+]=338, рассчитано для C18H18ClF2NO=337.
Пример 37: Бензил [1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат
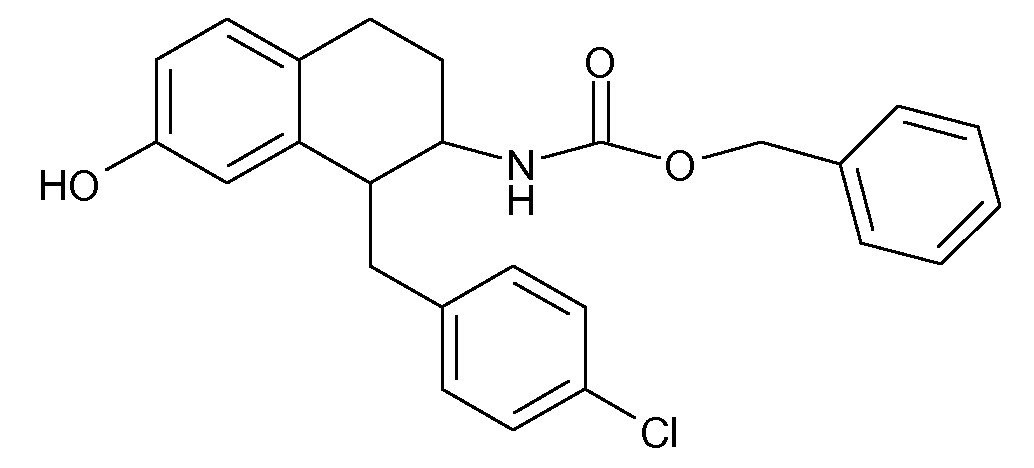
трет-Бутил [1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамат (2 г, 6,95 ммоль, полученный аналогично трет-бутил [1-(3,4-дихлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбамату, см. также пример 34.2) суспендируют в диметилформамиде (40 мл). Добавляют триэтиламин (0,969 мл, 6,95 ммоль) и бензилкарбонохлоридат (1,186 г, 6,95 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают в вакууме. К неочищенному продукту добавляют этилацетат и воду. Водный слой экстрагируют этилацетатом. Объединенные органические слои сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 393 мг (0,931 ммоль, 13,4%, бесцветная пена).
ESI-MS [M+H+]=422, рассчитано для C25H24ClNO3=421.
Пример 38: трет-Бутил [7-(аминометил)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
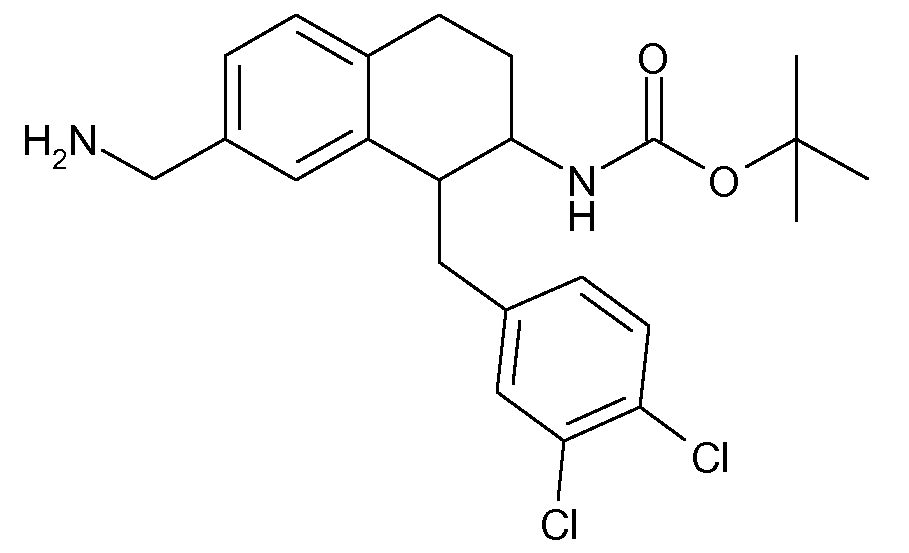
трет-Бутил [7-циано-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (30 мг, 0,07 ммоль, см. также пример 34d) растворяют в метаноле (3 мл). Добавляют никель Ренея (10 мг), и реакционную смесь перемешивают при комнатной температуре в атмосфере водорода в течение 4 ч. Катализатор удаляют фильтрацией, и метанол упаривают в вакууме. Выход: 18 мг (0,041 ммоль, 59%).
ESI-MS [M+H+]=435, рассчитано для C23H28Cl2N2O2=434.
Пример 39: трет-Бутил [1-(3,4-дихлорбензил)-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат
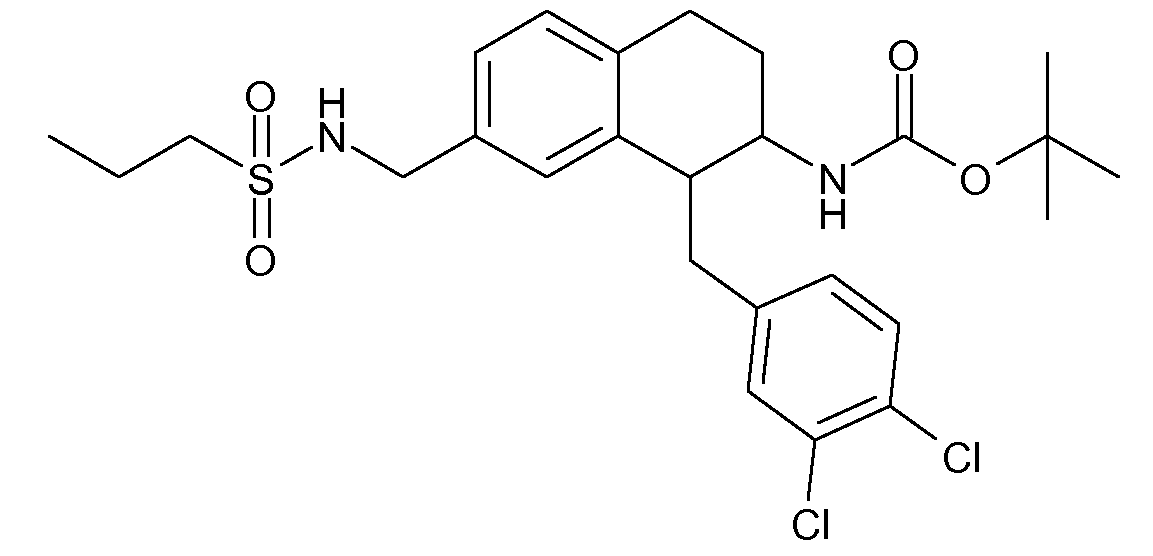
трет-Бутил [7-(аминометил)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (120 мг, 0,276 ммоль, см. также пример 38) растворяют в дихлорметане (5 мл). Добавляют 4-диметиламинопиридин (35 мг, 0,289 ммоль). После перемешивания при комнатной температуре в течение 5 мин добавляют пропан-1-сульфонилхлорид (39 мг, 0,031 ммоль), и перемешивание продолжают в течение ночи. Реакционную смесь разбавляют дихлорметаном и промывают последовательно 0,5N раствором хлористоводородной кислоты (2Ч2 мл) и насыщенным раствором NaHCO3 (1Ч2 мл). Органическую фазу сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт используют на следующей стадии без дополнительной очистки. Выход: 125 мг (0,231 ммоль, 84%).
ESI-MS [M+Na+]=563, рассчитано для C26H34Cl2N2O4S=540.
Пример 40: N-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
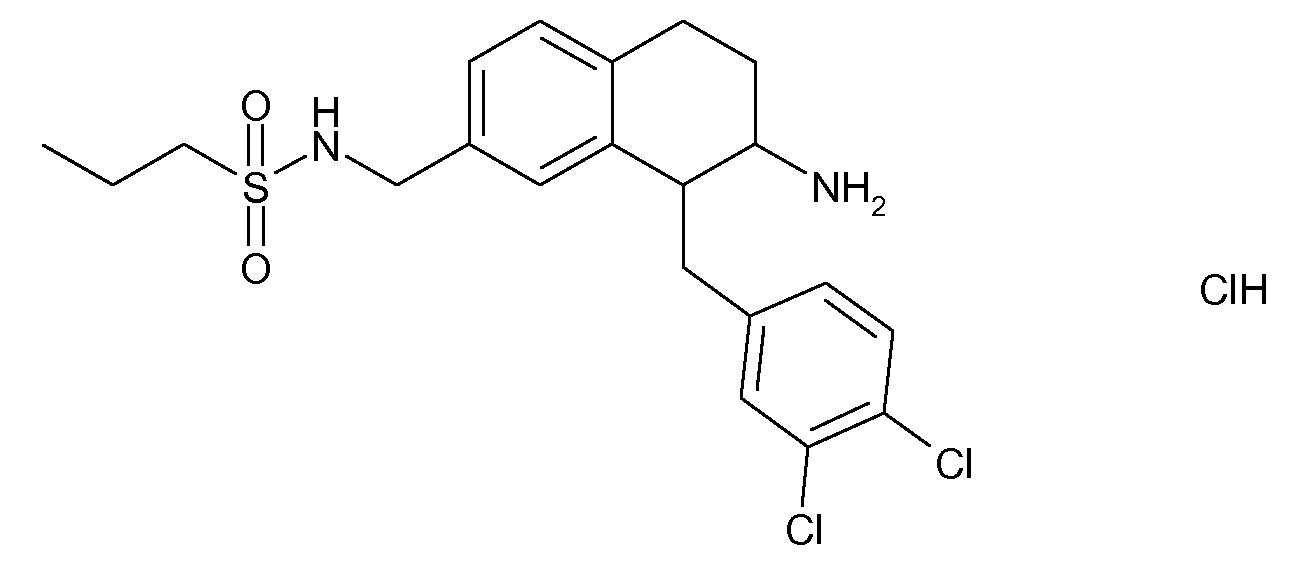
Трет-бутил [1-(3,4-дихлорбензил)-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат (120 мг, 0,222 ммоль, см. также пример 39) растворяют в 5N расворе хлористоводородной кислоты в изопропаноле (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Растворитель упаривают, и продукт сушат в вакууме. Выход: 101 мг (0,211 ммоль, 95%).
ESI-MS [M+H+]=441, рассчитано для C21H26Cl2N2O2S=440.
Пример 41: N-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-3-фторпропан-1-сульфонамида гидрохлорид
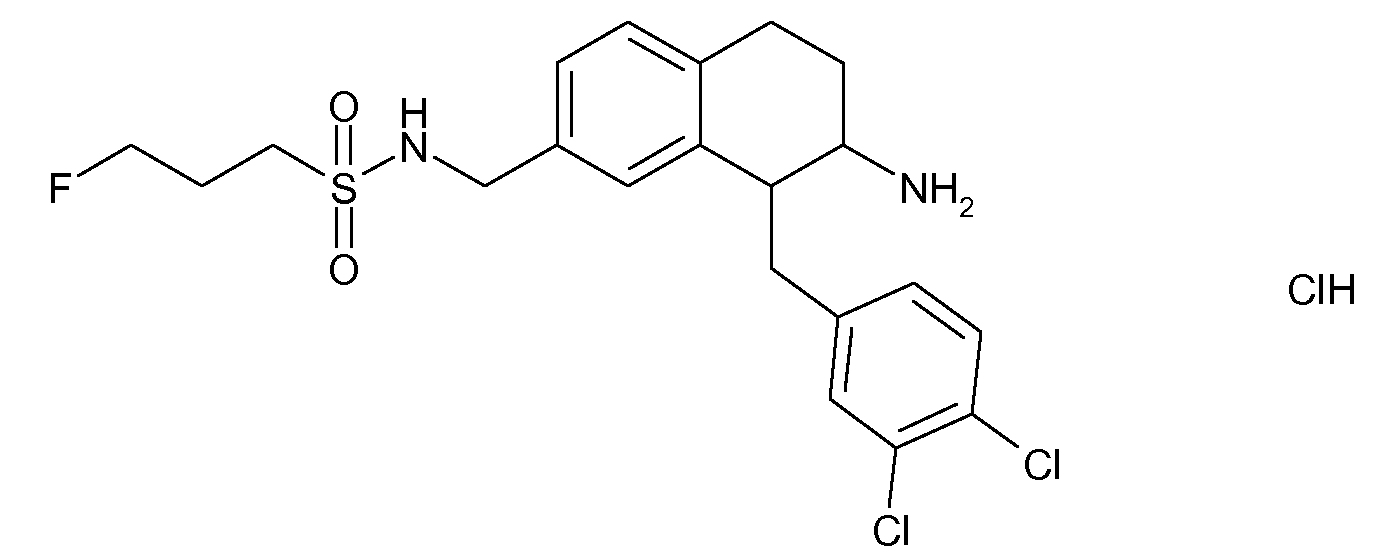
Соединение получают по способу примера 40, используя 3-фторпропан-1-сульфонилхлорид вместо н-пропан-1-сульфонилхлорида.
ESI-MS [M+H+]=459, рассчитано для C21H25Cl2FN2O2S=458.
Пример 42: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида трифторацетат
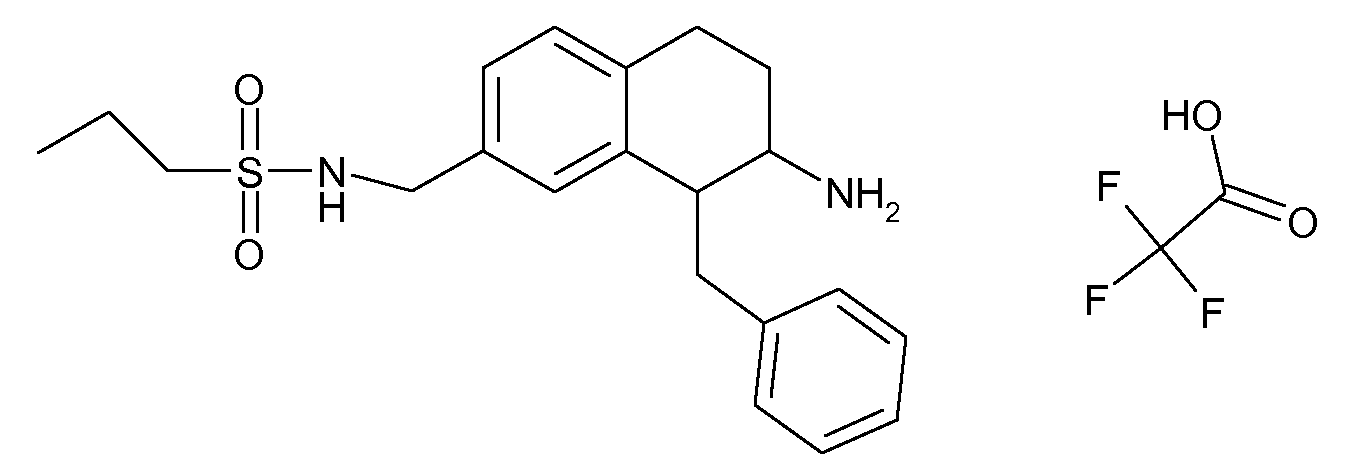
N-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид (40 мг, 0,084 ммоль, см. также пример 40) растворяют в метаноле (4 мл) и гидрируют на H-кубе (1 ч, 40°C, 30 бар, 20% Pd/C). Растворитель упаривают, и неочищенный продукт очищают методом препаративной ВЭЖХ (колонка xTerra prep MS C18, 19Ч150 мм, 5 мкм; градиент: вода, ацетонитрил, содержащий 0,1% трифторуксусной кислоты, скорость потока: 20 мл/мин). Выход: 4,9 мг (0,0102 ммоль, 12%).
ESI-MS [M+H+]=373, рассчитано для C21H28N2O2S=372.
Пример 43: N-{[цис-7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорид
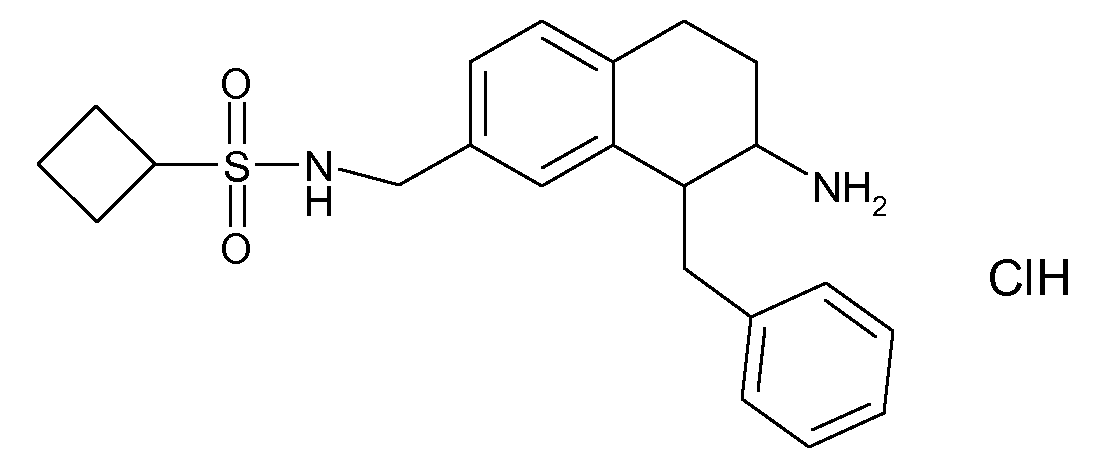
Соединение получают по способу примера 40, используя циклобутилсульфонилхлорид вместо н-пропан-1-сульфонилхлорида.
ESI-MS [M+H+]=385, рассчитано для C22H28N2O2S=384.
Пример 44: N-{[цис-7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-циклопропилметансульфонамида гидрохлорид
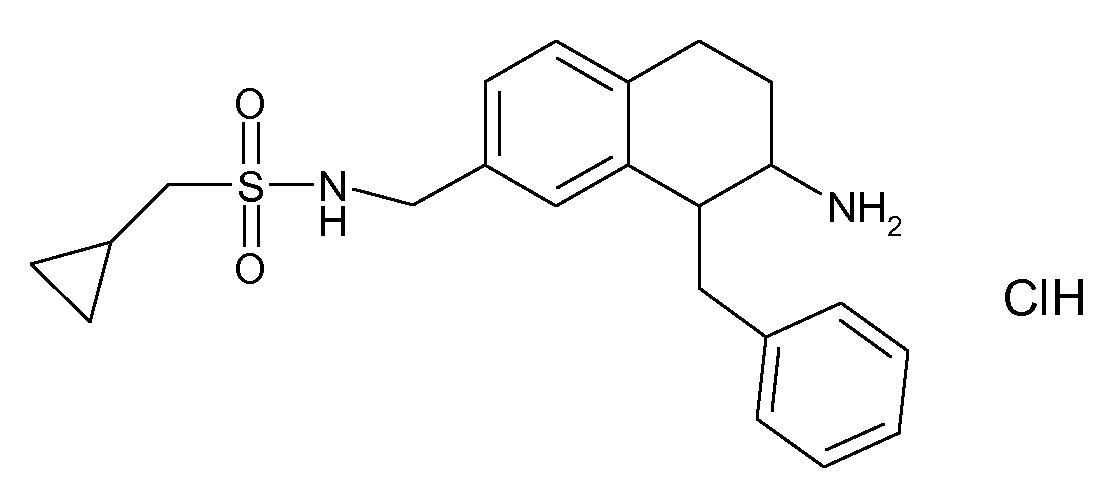
Соединение получают по способу примера 40, используя циклопропилметансульфонилхлорид вместо н-пропан-1-сульфонилхлорида.
ESI-MS [M+H+]=385, рассчитано для C22H28N2O2S=384.
Пример 45: N-{[цис-7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-N-метилпропан-1-сульфонамида гидрохлорид
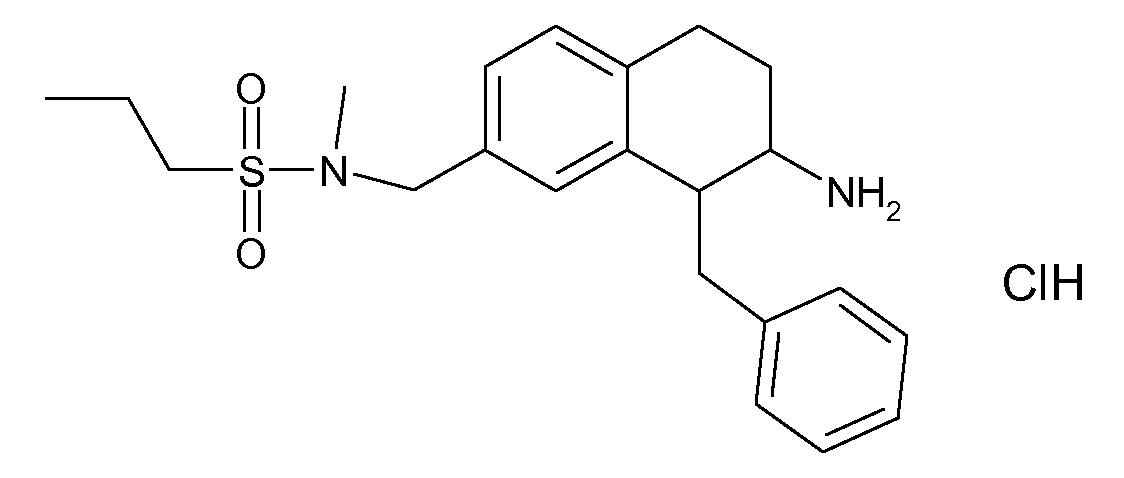
Трет-бутил-1-бензил-7-(пропилсульфонамидометил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (35 мг, 0,074 ммоль, полученный по способу примера 40) растворяют в ацетонитриле (1 мл). Добавляют последовательно карбонат цезия (29 мг, 0,09 ммоль)) и метилиодид (12 мкл, 0,19 ммоль), и реакционную смесь нагревают в микроволновой печи при 100°C в течение 3 ч. Растворители упаривают в вакууме. Остаток обрабатывают дихлорметаном и промывают водой. Органический слой сушат (MgSO4) и концентрируют. Неочищенный продукт растворяют в изопропаноле и обрабатывают 5 M раствором хлористоводородной кислоты в изопропаноле. Растворитель упаривают в вакууме, получая конечный продукт в виде бесцветного твердого вещества. Выход: 18 мг (0,043 ммоль, 58%).
ESI-MS [M+H+]=387, рассчитано для C22H30N2O2S=386.
Пример 46: {1-(3-Хлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
46.1 7-(2-трет-Бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
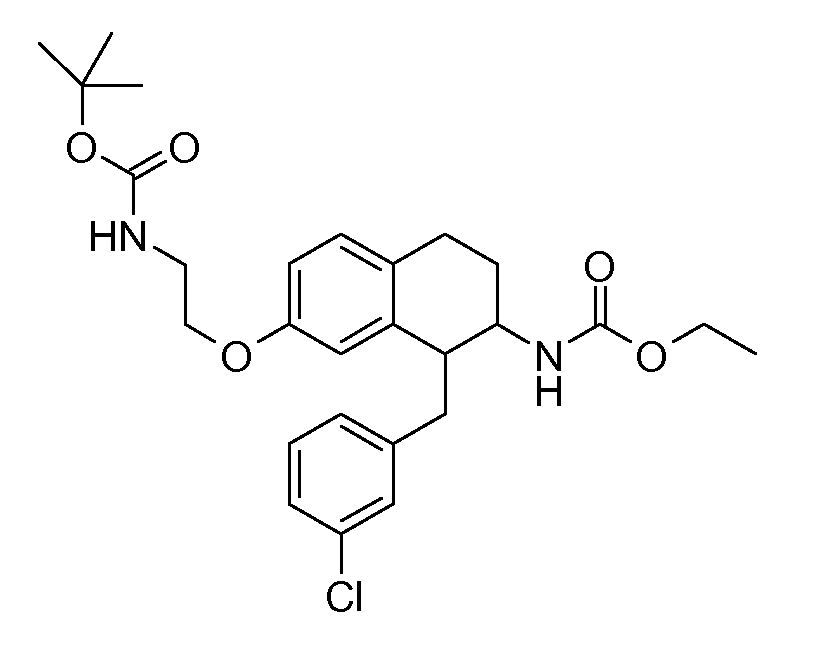
7-(2-трет-Бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир получают по способу примера 1, используя 1-бромметил-3-хлорбензол вместо 4-(бромметил)-1,2-дихлорбензола.
ESI-MS [M+H+]=503, рассчитано для C27H35ClN2O5=502.
46.2 {1-(3-Хлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
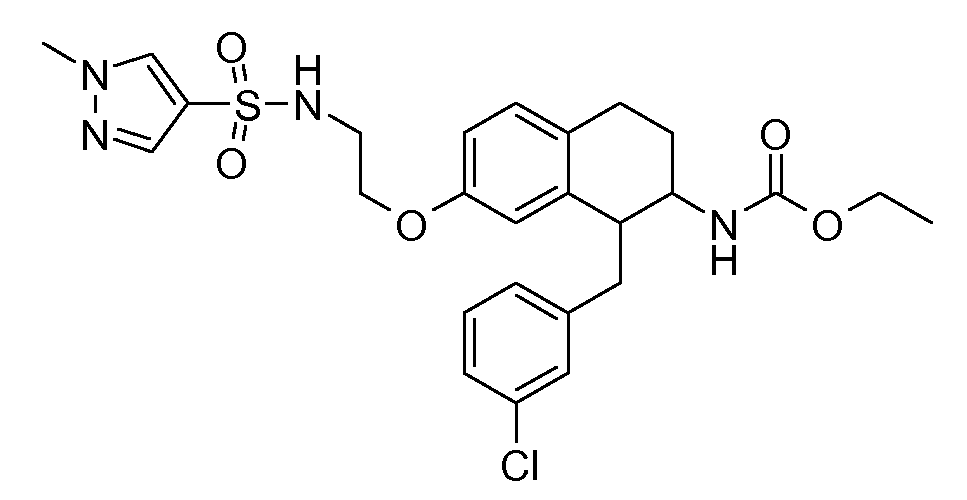
{1-(3-Хлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир получают по способу примера 2, используя в качестве исходного вещества 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир, полученный на предыдущей стадии, и 1-метил-1H-пиразол-4-сульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=547, рассчитано для C26H31ClN4O5=546.
Пример 47: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
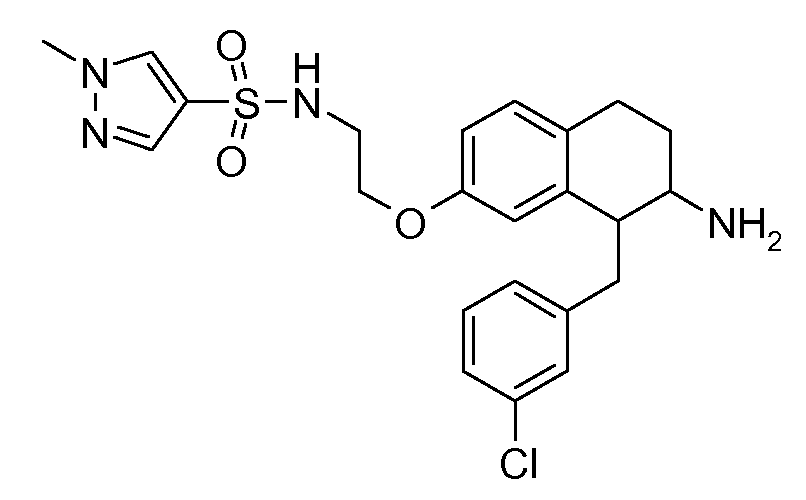
1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя в качестве исходного вещества {1-(3-хлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир (пример 46).
ESI-MS [M+H+]=475, рассчитано для C23H27ClN4O3S=474.
Пример 48: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
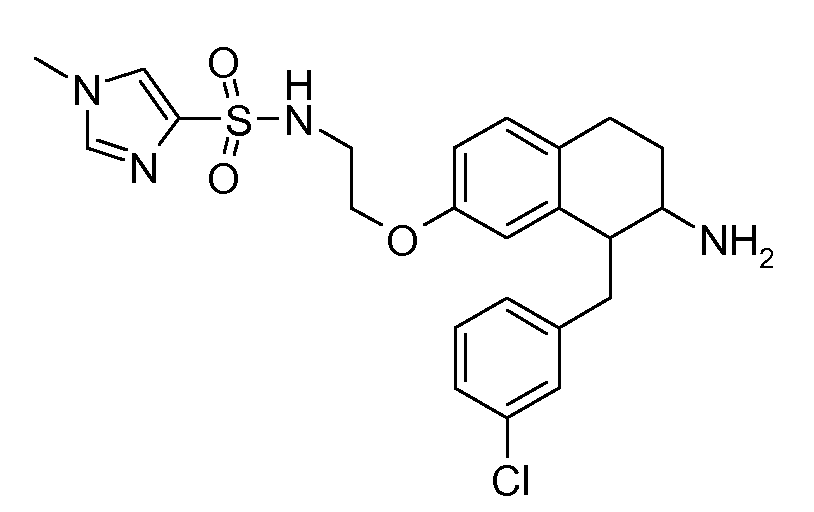
1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают в три стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 47, используя 1-метил-1H-имидазол-4-сульфонилхлорид.
ESI-MS [M+H+]=475, рассчитано для C23H27ClN4O3S=474.
Пример 49: {1-(3-Хлорбензил)-7-[2-(2,4-диметилтиазол-5-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
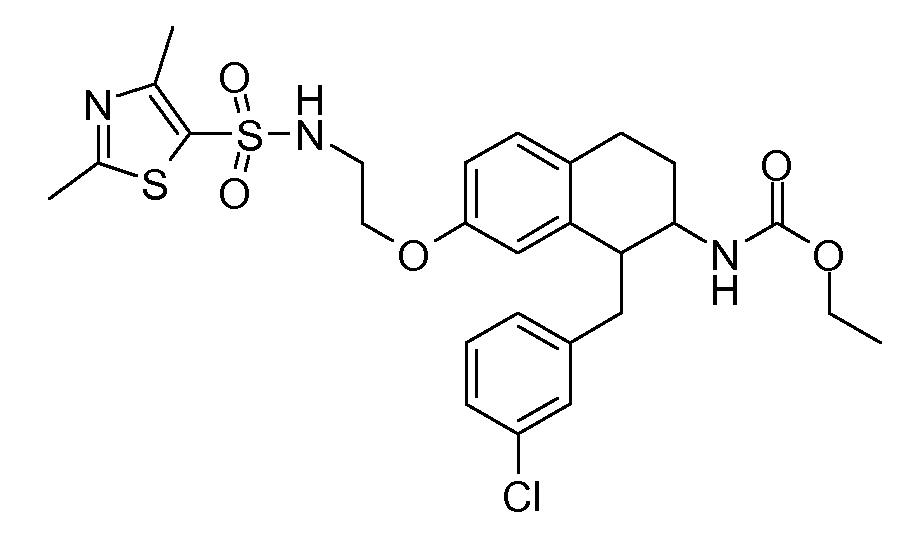
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 2,4-диметилтиазол-5-сульфонилхлорид.
ESI-MS [M+H+]=578, рассчитано для C27H32ClN3O5S2=577.
Пример 50: {1-(3-Хлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
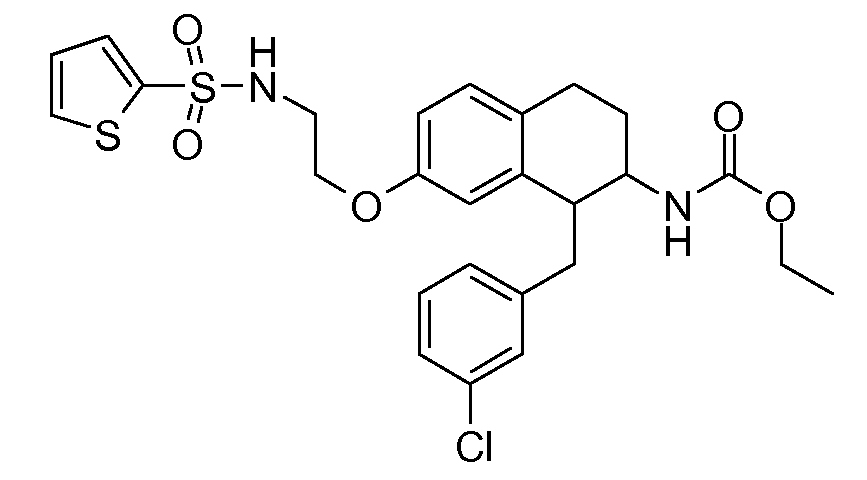
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя тиофен-2-сульфонилхлорид.
ESI-MS [M+H+]=549, рассчитано для C26H29ClN2O5S2=548.
Пример 51: {1-(3-Хлорбензил)-7-[2-(5-хлортиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
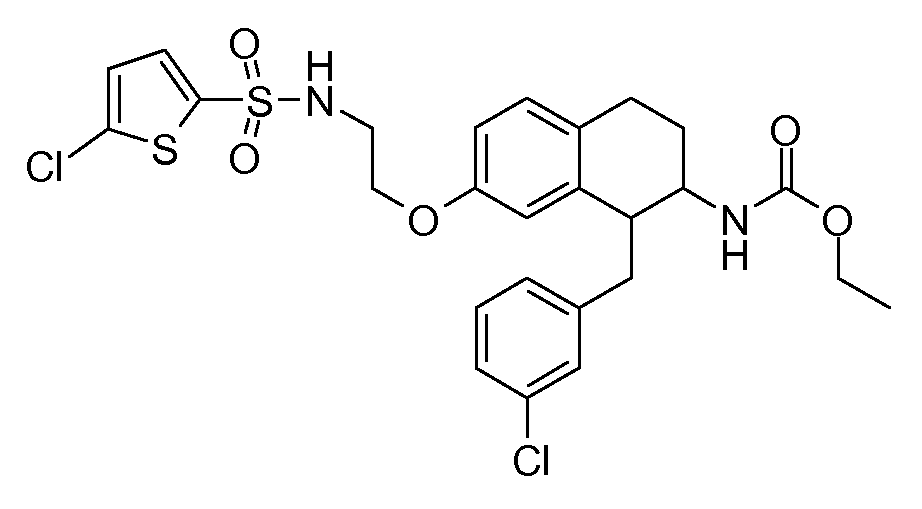
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 5-хлортиофен-2-сульфонилхлорид.
ESI-MS [M+H+]=583, рассчитано для C26H28Cl2N2O5S2=582.
Пример 52: {1-(3-Хлорбензил)-7-[2-(2-метил-3H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
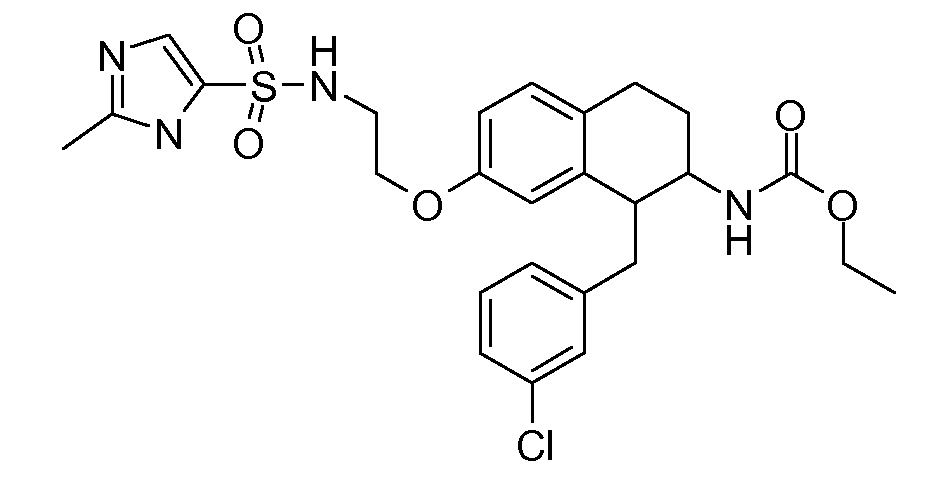
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 2-метил-3H-имидазол-4-сульфонилхлорид.
ESI-MS [M+H+]=547, рассчитано для C26H31ClN4O5S=546.
Пример 53: {1-(3-Хлорбензил)-7-[2-(5-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
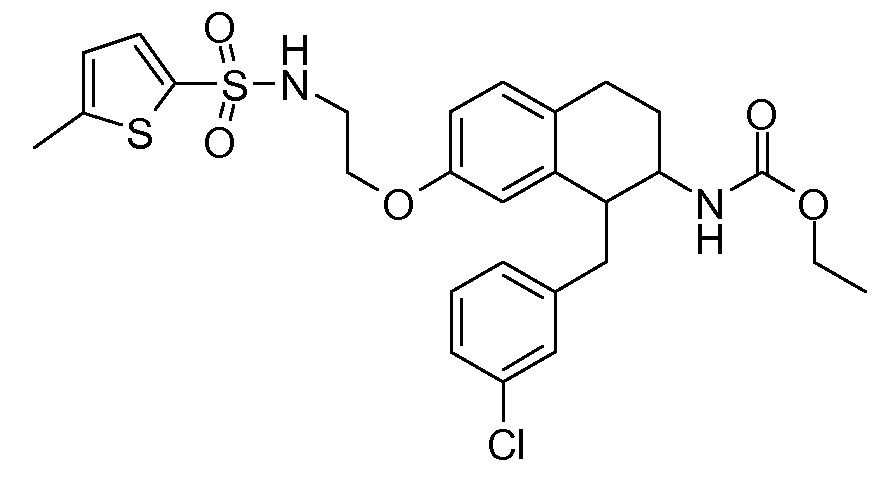
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 5-метилтиофен-2-сульфонилхлорид.
ESI-MS [M+H+]=563, рассчитано для C27H31ClN2O5S2=562.
Пример 54: {1-(3-Хлорбензил)-7-[2-(4-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
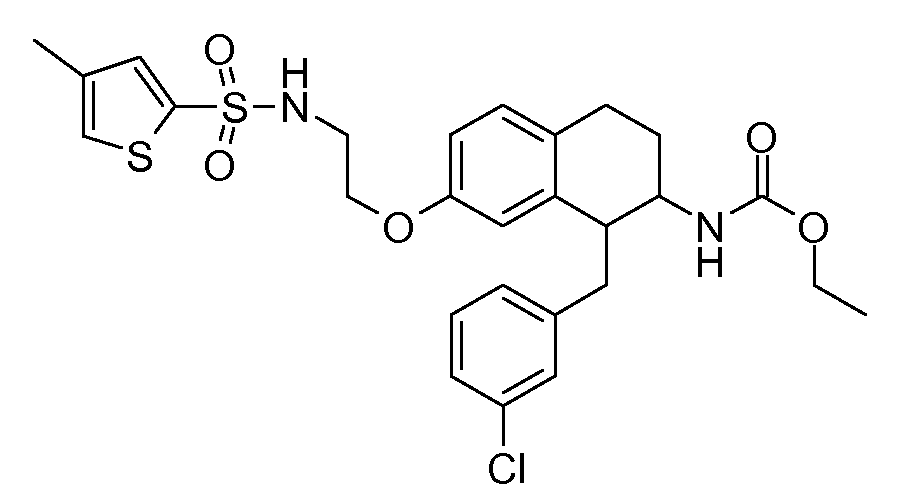
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 4-метилтиофен-2-сульфонилхлорид.
ESI-MS [M+H+]=563, рассчитано для C27H31ClN2O5S2=562.
Пример 55: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
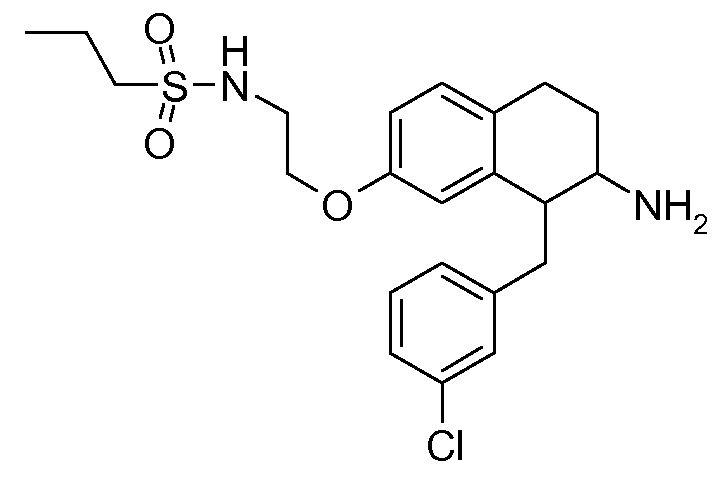
Получают в три стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 48, используя пропан-1-сульфонилхлорид.
ESI-MS [M+H+]=437, рассчитано для C22H29ClN2O3S=436.
Пример 56: Тиофен-2-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
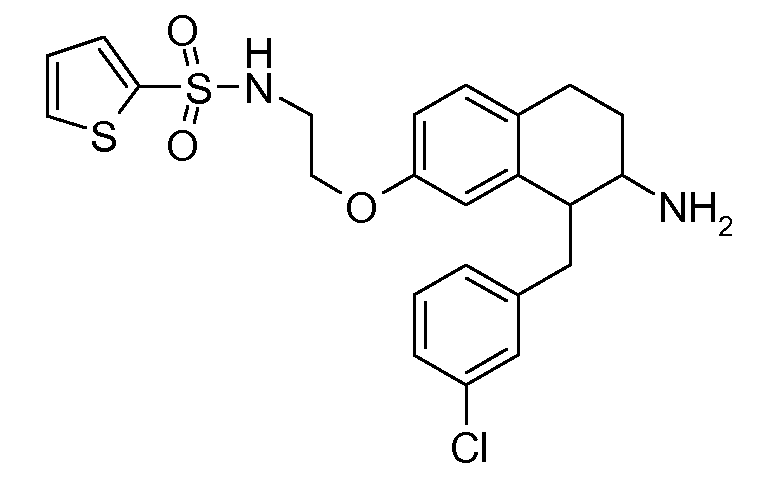
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира по способу примера 48.
ESI-MS [M+H+]=477, рассчитано для C23H25ClN2O3S2=476.
Пример 57: 2,4-Диметилтиазол-5-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
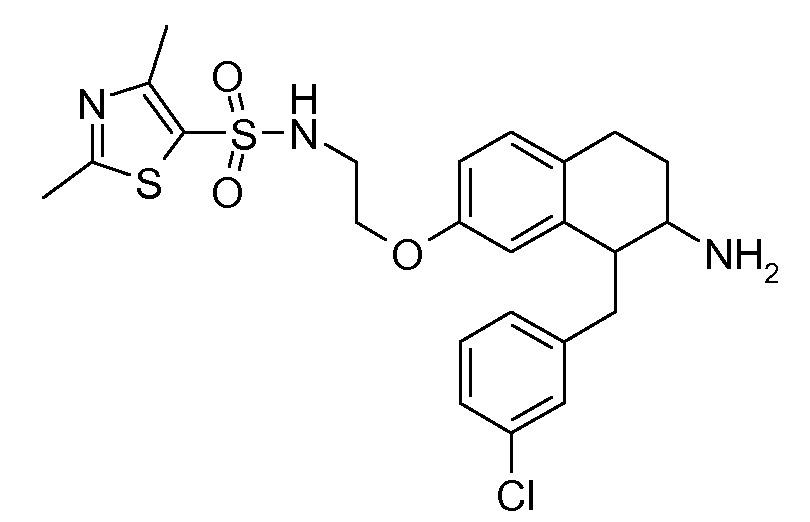
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(2,4-диметилтиазол-5-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 49) по способу примера 48.
ESI-MS [M+H+]=506, рассчитано для C24H28ClN3O3S2=505.
Пример 58: 2-Метил-3H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
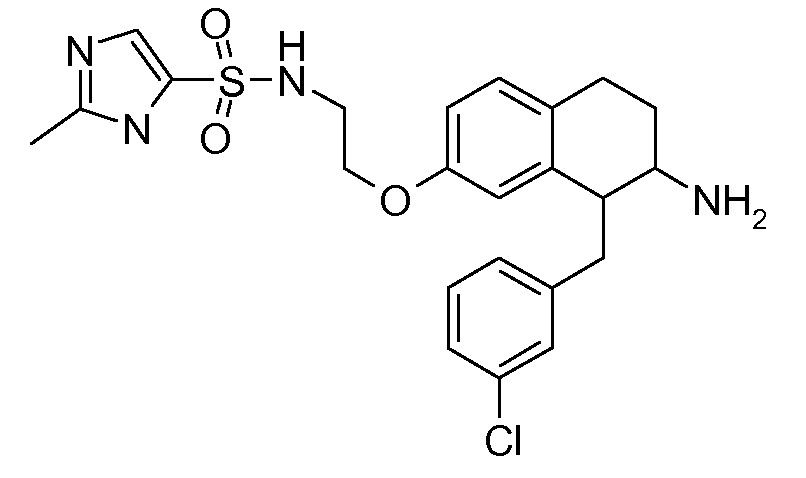
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(2-метил-3H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 52) по способу примера 48.
ESI-MS [M+H+]=475, рассчитано для C23H27ClN4O3S=474.
Пример 59: 5-Хлортиофен-2-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
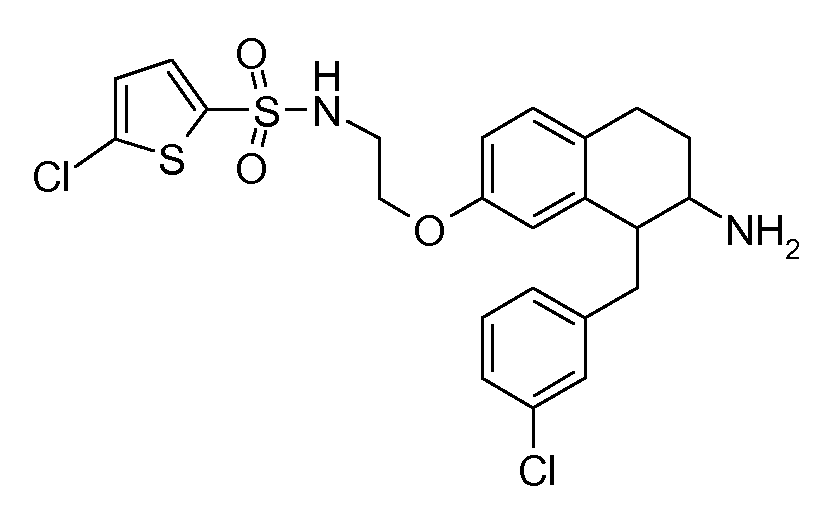
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(5-хлор-тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 51) по способу примера 48.
ESI-MS [M+H+]=511, рассчитано для C23H24Cl2N2O3S2=510.
Пример 60: {1-(3-Хлорбензил)-7-[2-(2,5-диметилтиофен-3-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
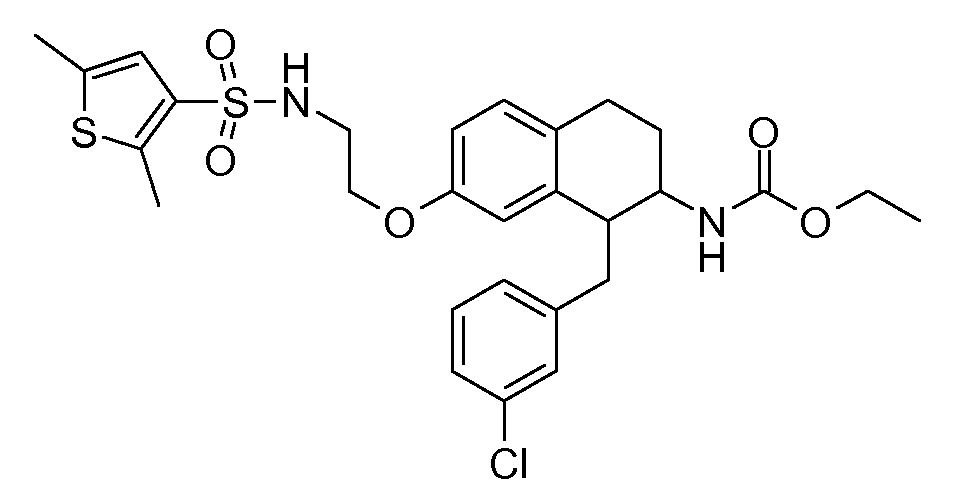
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 2,5-диметилтиофен-3-сульфонилхлорид.
ESI-MS [M+H+]=577, рассчитано для C28H33ClN2O5S2=576.
Пример 61: {1-(3-Хлорбензил)-7-[2-(1-этил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
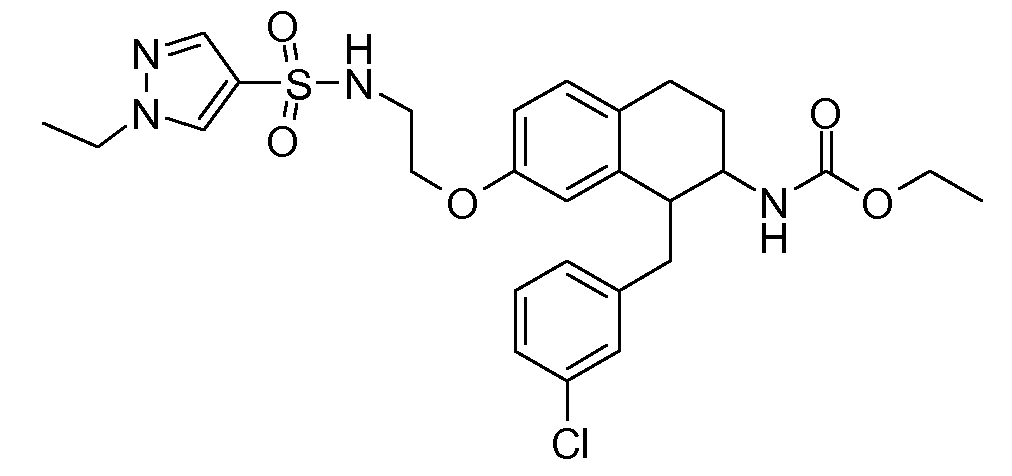
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 1-Этил-1H-пиразол-4-сульфонилхлорид.
ESI-MS [M+H+]=561, рассчитано для C27H33ClN4O5S=560.
Пример 62: {1-(2,4-Дихлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
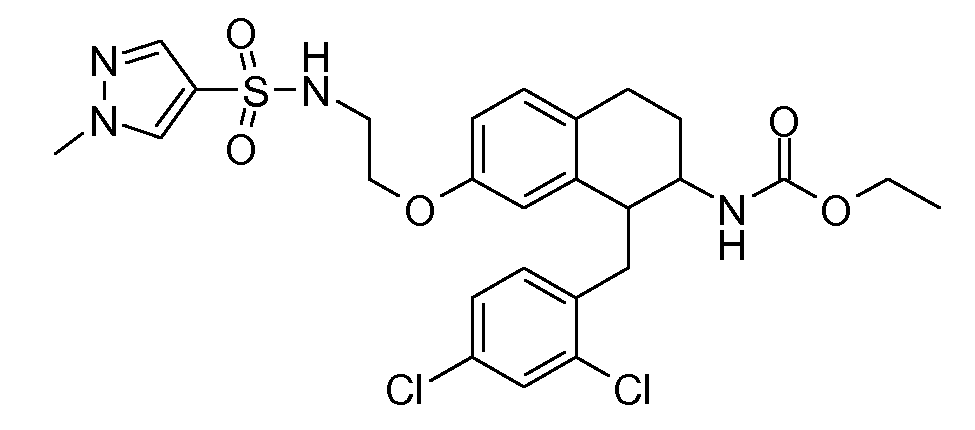
Получают по способу примера 46, используя 1-бромметил-2,4-дихлорбензол вместо 4-(бромметил)-3-хлорбензола.
ESI-MS [M+H+]=581, рассчитано для C26H30Cl2N4O5S=580.
Пример 63: {1-(2,4-Дихлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
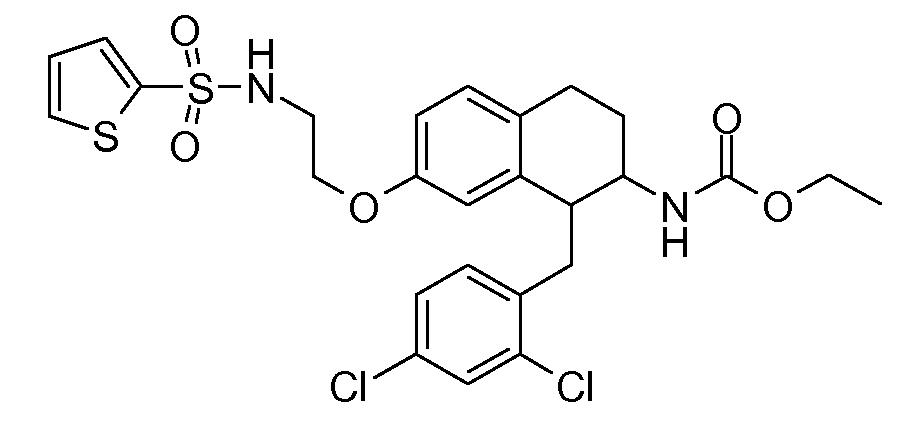
Получают по способу примера 62, используя тиофен-2-сульфонилхлорид вместо 1-метил-1H-пиразол-4-сульфонилхлорида.
ESI-MS [M+H+]=583, рассчитано для C26H28Cl2N4O5S2=582.
Пример 64: {1-(2,4-Дихлорбензил)-7-[2-(5-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
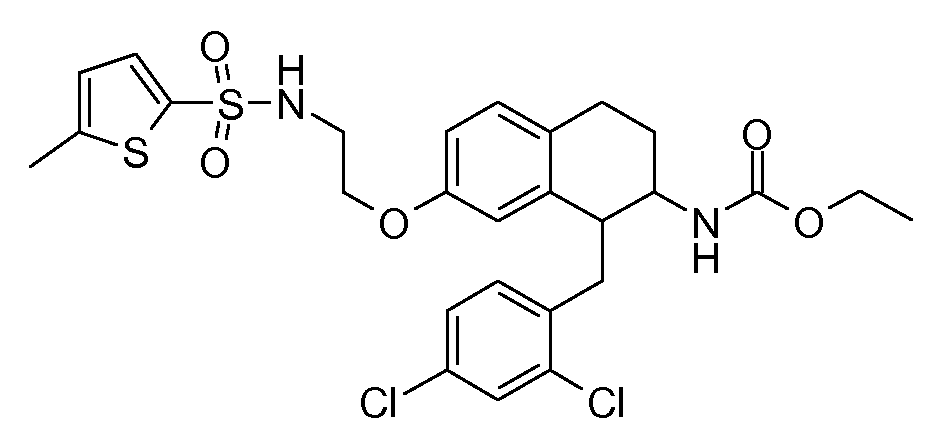
Получают по способу примера 62, используя 5-метилтиофен-2-сульфонилхлорид вместо 1-метил-1H-пиразол-4-сульфонилхлорида.
ESI-MS [M+H+]=597, рассчитано для C27H30Cl2N2O5S2=596.
Пример 65: [1-(3-Хлорбензил)-7-(2-этансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
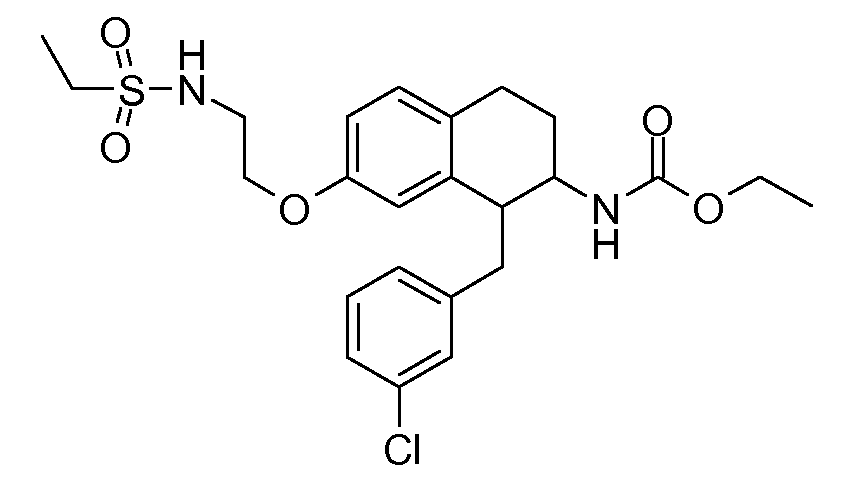
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя этансульфонилхлорид.
ESI-MS [M+H+]=495, рассчитано для C24H31ClN2O5S=494.
Пример 66: 1-Этил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
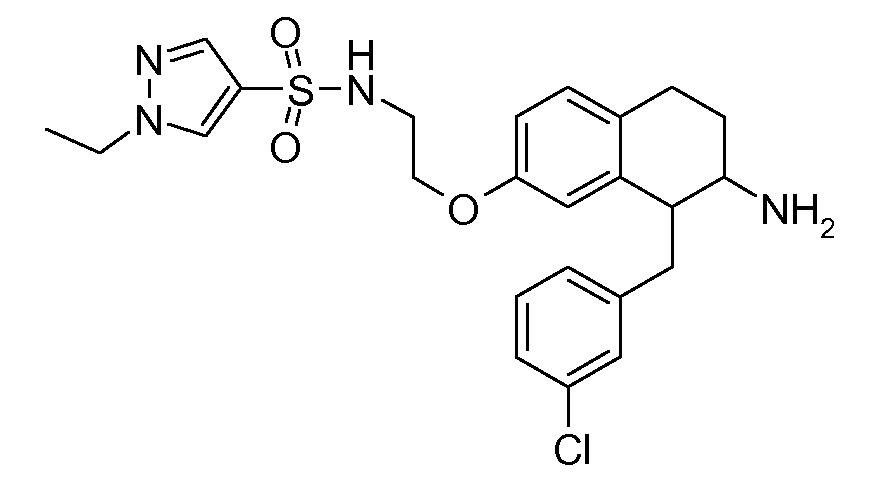
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(1-этил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 61) по способу примера 48.
ESI-MS [M+H+]=489, рассчитано для C24H29ClN4O3S=488.
Пример 67: 4-Метилтиофен-2-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
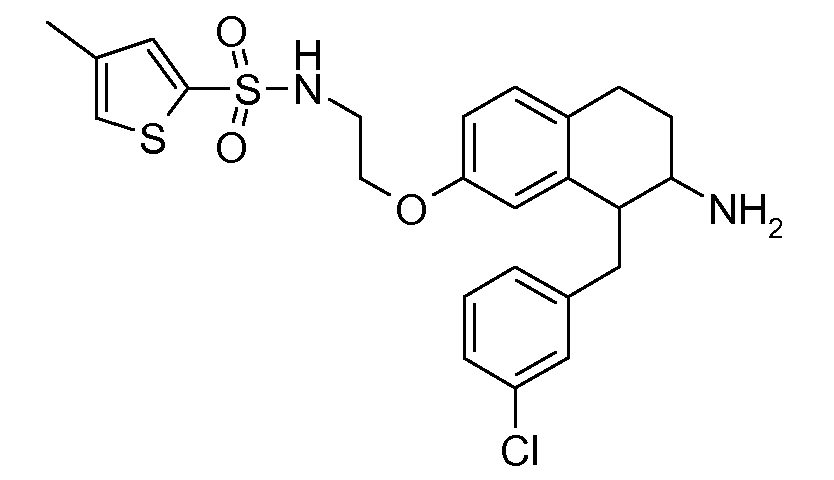
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(2-метил-3H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 53) по способу примера 48.
ESI-MS [M+H+]=491, рассчитано для C24H27ClN2O3S2=490.
Пример 68: 5-Метилтиофен-2-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
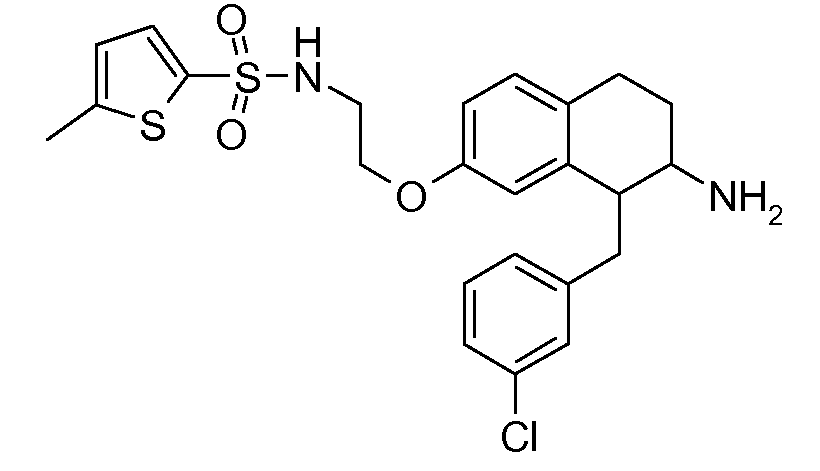
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(5-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 53) по способу примера 48.
ESI-MS [M+H+]=491, рассчитано для C24H27ClN2O3S2=490.
Пример 69: 2,5-Диметилтиофен-3-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
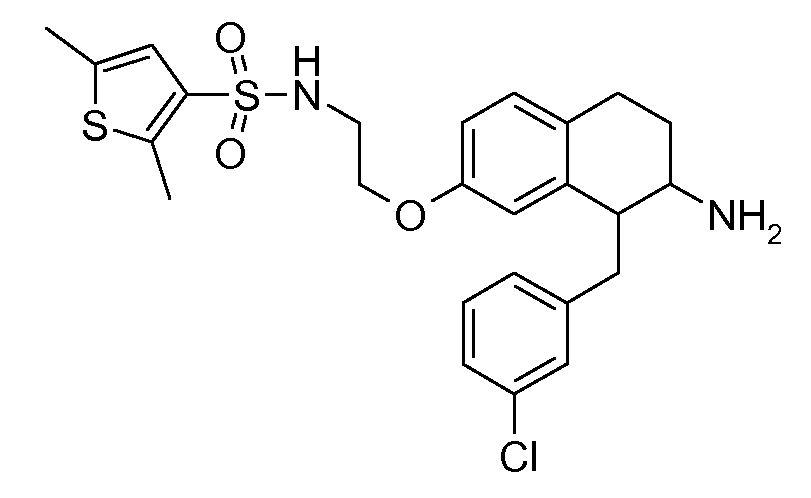
Получают в одну стадию из {1-(3-хлорбензил)-7-[2-(2,5-диметилтиофен-3-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 60) по способу примера 48.
ESI-MS [M+H+]=505, рассчитано для C25H29ClN2O3S2=504.
Пример 70: Этансульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
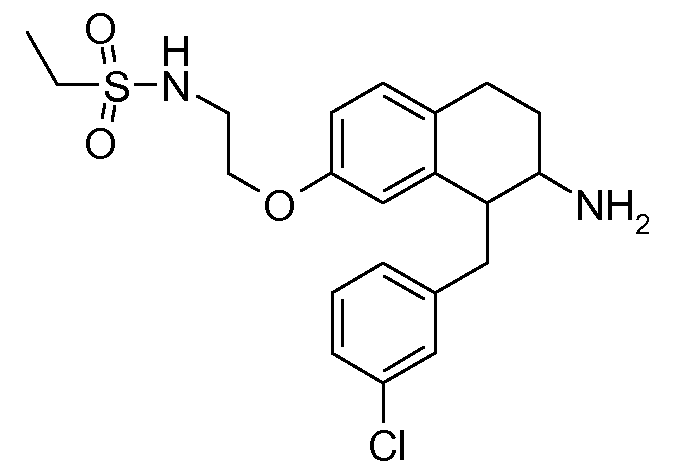
Получают в одну стадию из [1-(3-хлорбензил)-7-(2-этансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира (пример 65) по способу примера 48.
ESI-MS [M+H+]=423, рассчитано для C21H27ClN2O3S=422.
Пример 71: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(2,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
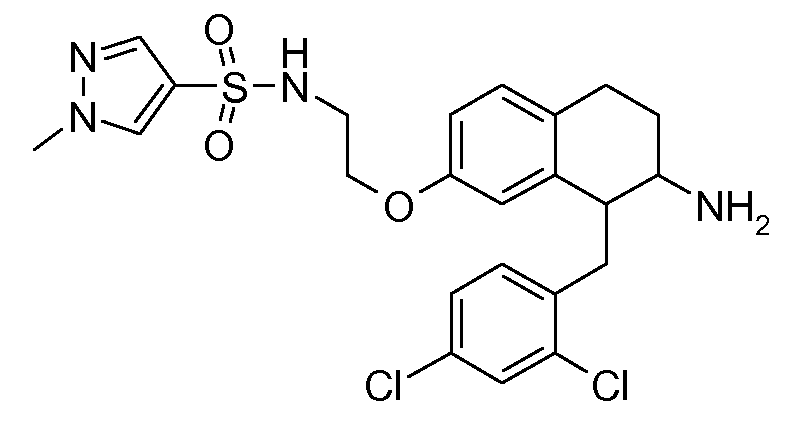
Получают в одну стадию из {1-(2,4-дихлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 62) по способу примера 48.
ESI-MS [M+H+]=509, рассчитано для C23H26Cl2N4O3S=508.
Пример 72: Тиофен-2-сульфоновой кислоты {2-[7-амино-8-(2,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
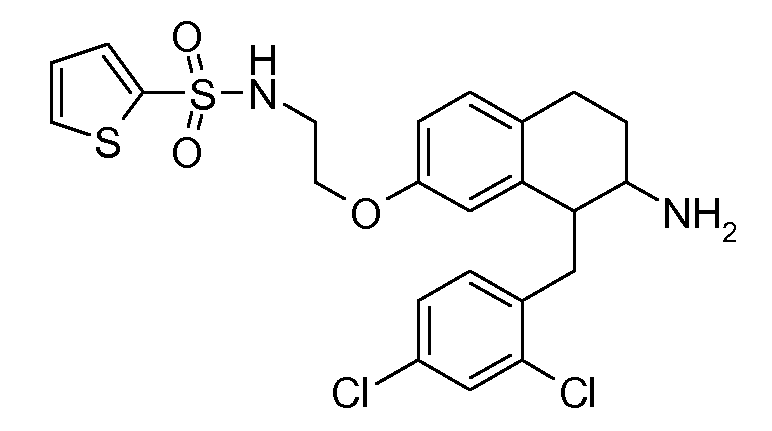
Получают в одну стадию из {1-(2,4-дихлорбензил)-7-[2-(тиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 63) по способу примера 48.
ESI-MS [M+H+]=511, рассчитано для C23H24Cl2N2O3S2=510.
Пример 73: 5-Метилтиофен-2-сульфоновой кислоты {2-[7-амино-8-(2,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
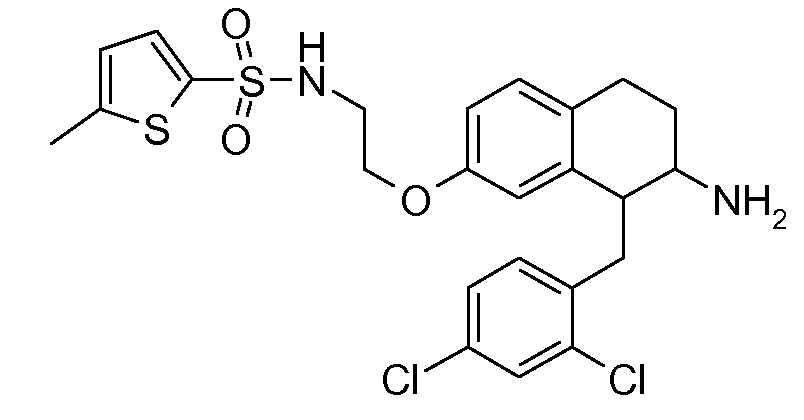
Получают в одну стадию из {1-(2,4-дихлорбензил)-7-[2-(5-метилтиофен-2-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 64) по способу примера 48.
ESI-MS [M+H+]=525, рассчитано для C24H26Cl2N2O3S2=524.
Пример 74: {1-(2,4-Дихлорбензил)-7-[2-(пропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
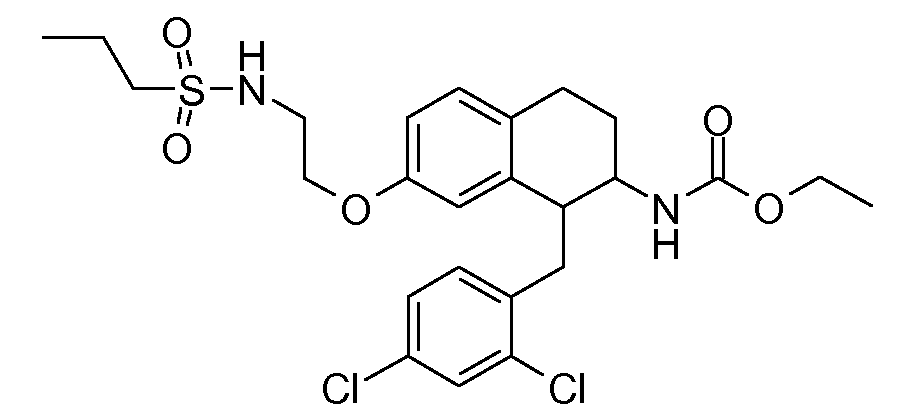
Получают по способу примера 62, используя пропан-1-сульфонилхлорид вместо 1-метил-1H-пиразол-4-сульфонилхлорида.
ESI-MS [M+H+]=543, рассчитано для C25H32Cl2N2O5S=542.
Пример 75: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(2,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
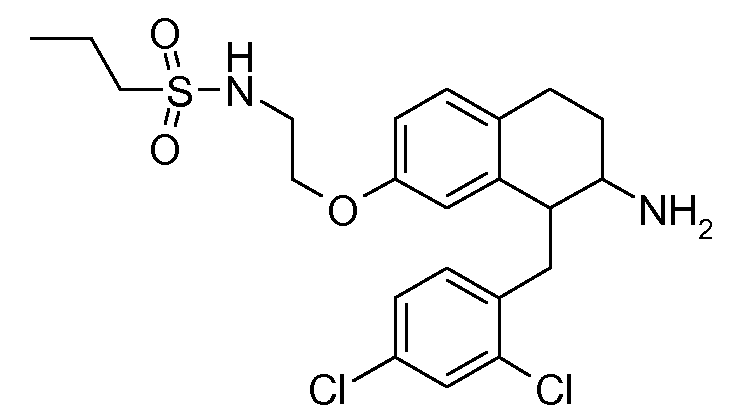
Получают в одну стадию из {1-(2,4-дихлорбензил)-7-[2-(пропан-1-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира (пример 74) по способу примера 48.
ESI-MS [M+H+]=471, рассчитано для C22H28Cl2N2O3S=470.
Пример 76: (1-(4-Хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
76.1 2-(N-метилпропилсульфонамидо)этил пропан-1-сульфонат
К охлажденному раствору (0-5°C) 2-(метиламино)этанола (8,56 мл, 107 ммоль) в 100 мл DCM добавляют по каплям раствор пропан-1-сульфонилхлорида (13,1 мл, 117 ммоль) в 50 мл DCM в течение 1 ч. Полученную смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и 10% лимонную кислоту и затем экстрагируют DCM, сушат над MgSO4, фильтруют и упаривают, получая желто-оранжевое масло (13,6 г). После хроматографии получают 2,75 г продукта.
76.2 (1-(4-Хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
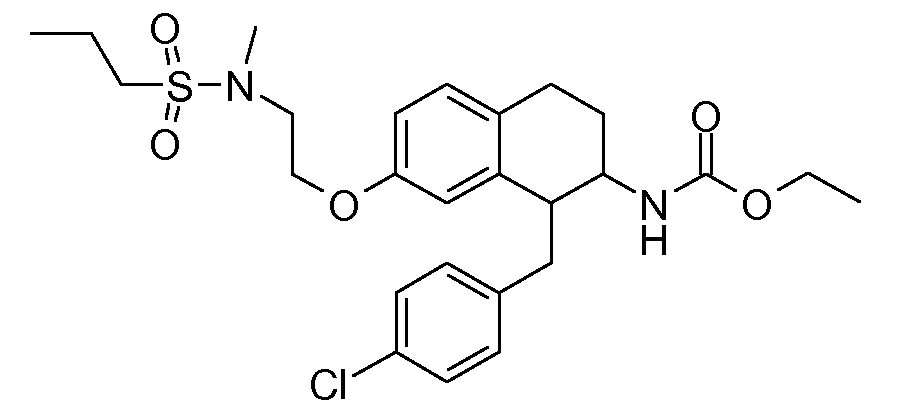
Раствор этил 1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата (0,128 г, 0,355 ммоль) в DMF в атмосфере N2 обрабатывают гидридом натрия (0,014 г, 0,568 ммоль), и реакционную смесь перемешивают в течение 30 минут при комнатной температуре. Добавляют раствор 2-(N-метилпропилсульфонамидо)этил пропан-1-сульфоната (0,102 г, 0,355 ммоль) (см. стадию 1) в DMF, и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Смесь распределяют между этилацетатом и водой. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают, получая коричневые/белые кристаллы. После добавления нескольких капель смеси этилацетат/циклогексан (1:4) образуется белый осадок. Выход 43 мг.
ESI-MS [M+H+]=523, рассчитано для C26H35ClN2O5S=522.
Пример 77: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}метиламида гидрохлорид
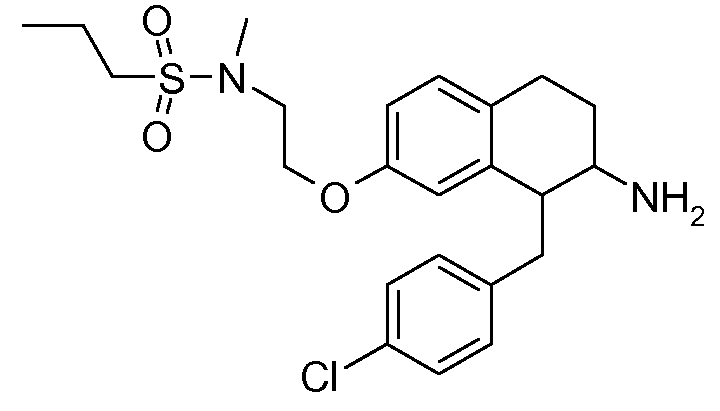
Получают в одну стадию из (1-(4-хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этилового эфира (пример 76) по способу примера 48.
ESI-MS [M+H+]=451, рассчитано для C23H31ClN2O3S=450.
Пример 78: (1-(3-Хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
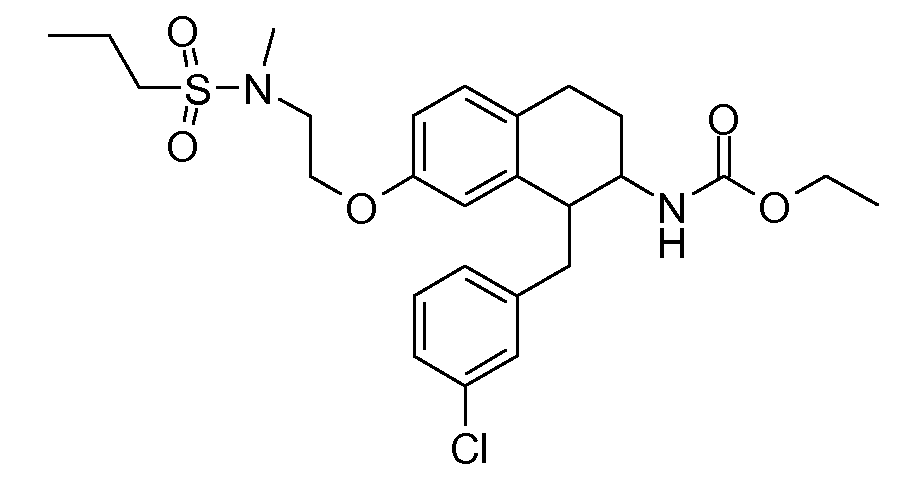
Получают из [1-(3-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 77.
ESI-MS [M+H+]=523, рассчитано для C26H35ClN2O5S=522.
Пример 79: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}метиламида гидрохлорид
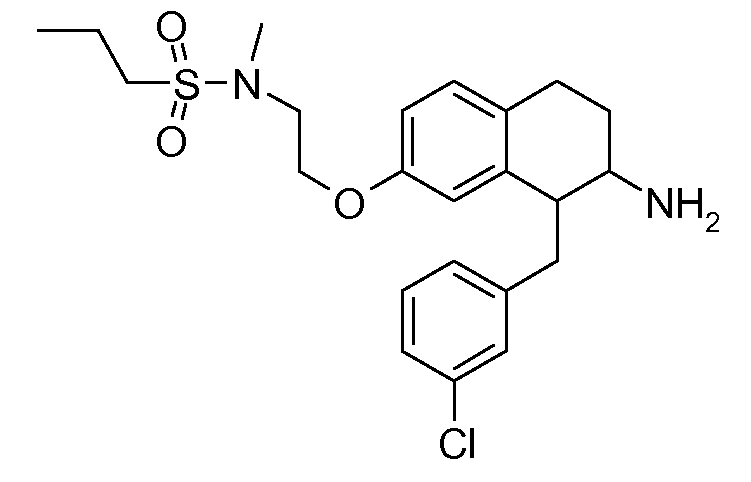
Получают в одну стадию из (1-(3-хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этилового эфира (пример 78) по способу примера 48.
ESI-MS [M+H+]=451, рассчитано для C23H31ClN2O3S=450.
Пример 80: {1-(3-Хлорбензил)-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
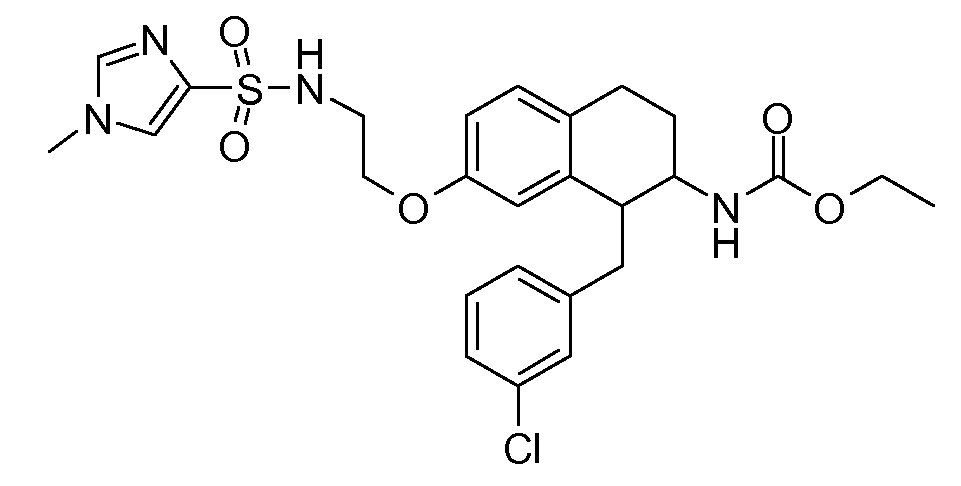
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 1-метил-1H-имидазол-4-сульфонилхлорид.
ESI-MS [M+H+]=547, рассчитано для C26H31ClN4O5S=546.
Пример 81: {1-(3-Хлорбензил)-7-[2-(1-дифторметил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
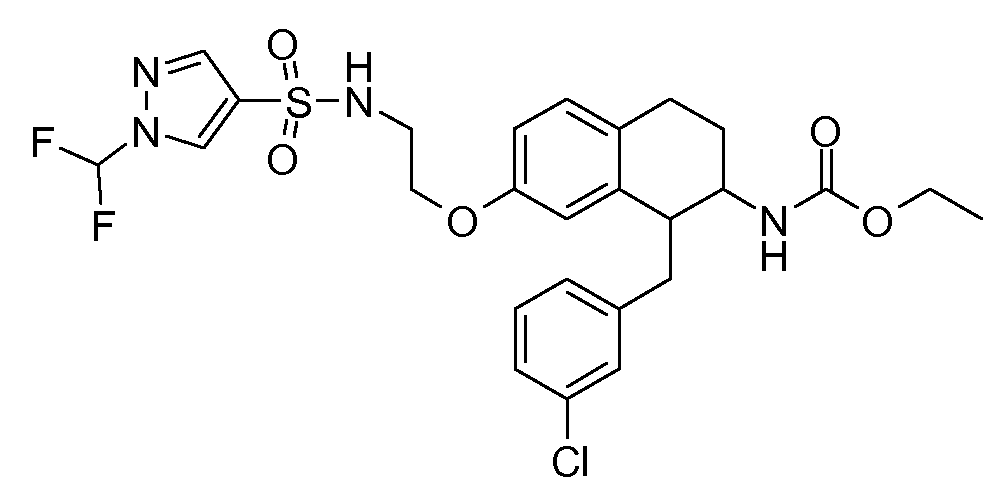
Получают в две стадии из 7-(2-трет-бутоксикарбониламиноэтокси)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 46, используя 1-дифторметил-1H-пиразол-4-сульфонилхлорид.
ESI-MS [M+H+]=583, рассчитано для C26H29ClF2N4O5S=582.
Пример 82: 1-(3-Хлорбензил)-7-[(R)-1-(пропан-1-сульфонил)пирролидин-2-илметокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
82.1 (Пропан-1-сульфоновой кислоты (R)-1-(пропан-1-сульфонил)-пирролидин-2-илметиловый эфир
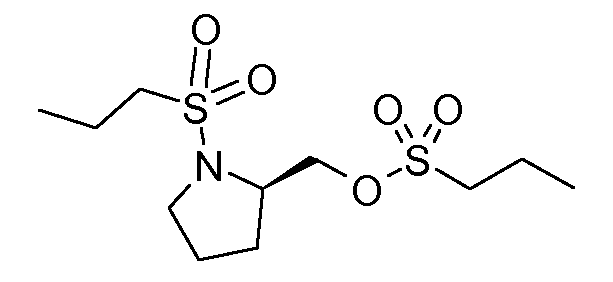
Получают по способу, описанному для 2-(N-метилпропилсульфонамидо)этил пропан-1-сульфоната (пример 76, стадия 1), используя (R)-1-пирролидин-2-илметанол вместо 2-(метиламино)этанола.
82.2 1-(3-Хлорбензил)-7-[(R)-1-(пропан-1-сульфонил)-пирролидин-2-илметокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
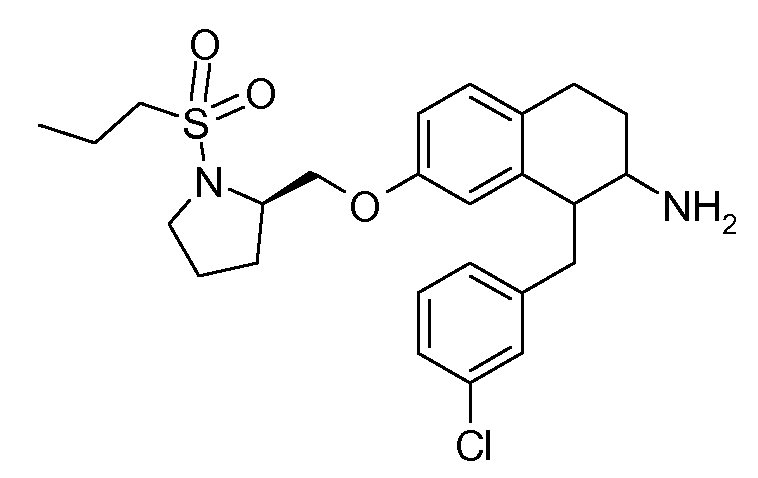
Получают в две стадии из (пропан-1-сульфоновой кислоты (R)-1-(пропан-1-сульфонил)пирролидин-2-илметилового эфира (см. предыдущую стадию) и этил 1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата, как описано в примере 77.
ESI-MS [M+H+]=477, рассчитано для C25H33ClN2O3S=476.
Пример 83: 1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
83.1 1-(Пропан-1-сульфонил)азетидин-3-ол
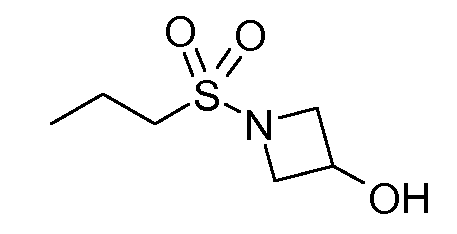
К охлажденному раствору (0-5°C) азетидин-3-ола гидрохлорида (1 г, 9,13 ммоль) в 10 мл дихлорметана, содержащего диизопропилэтиламин (2,391 мл, 13,69 ммоль), добавляют по каплям раствор пропан-1-сульфонилхлорида (1,126 мл, 10,04 ммоль) в 5 мл дихлорметана в течение 1 ч. Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Добавляют лимонную кислоту (10%), экстрагируют дихлорметаном, сушат над MgSO4, фильтруют и упаривают растворитель, получая 597 мг желтого масла, которое очищают хроматографией (выход 470 мг).
83.2 Метансульфоновой кислоты 1-(пропан-1-сульфонил)азетидин-3-иловый эфир
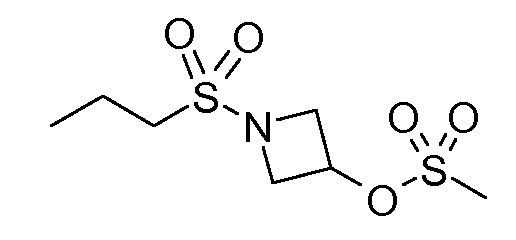
К раствору 1-(пропан-1-сульфонил)азетидин-3-ола (236 мг, 1,317 ммоль) в пиридине добавляют по каплям метансульфонилхлорид (205 мкл, 2,63 ммоль) при 0°C. Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 3 ч. Добавляют дихлорметан. Смесь последовательно промывают водой, насыщенным раствором NaHCO3 и насыщенным соляным раствором, сушат (MgSO4) и фильтруют. Растворитель упаривают, получая 293 мг неочищенного продукта, который используют без дополнительной очистки.
83.3 1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
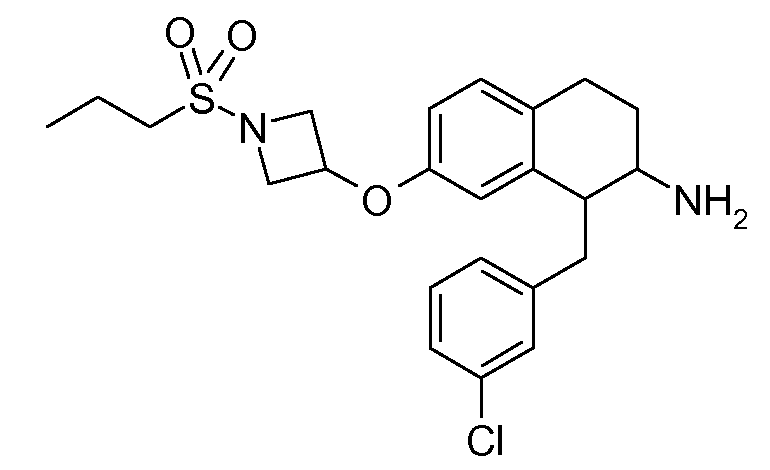
Получают в две стадии из метансульфоновой кислоты 1-(пропан-1-сульфонил)азетидин-3-илового эфира (см. предыдущую стадию) и этил 1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата, как описано в примере 77.
ESI-MS [M+H+]=449, рассчитано для C23H29ClN2O3S=448.
Пример 84: 1-(3-Хлорбензил)-7-(3-этансульфонилпропокси)-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
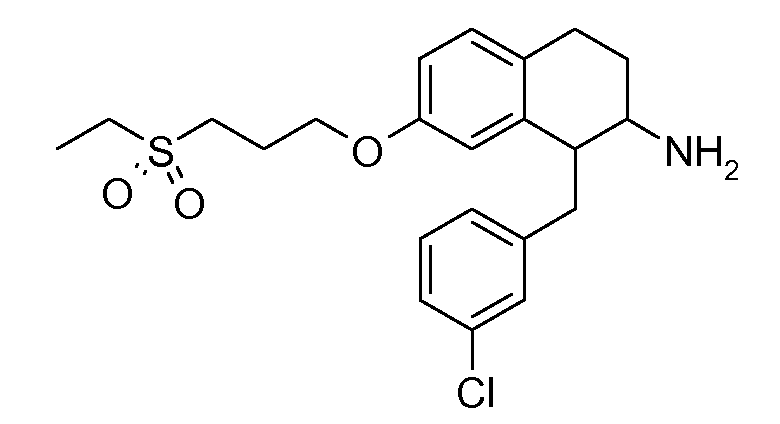
Получают в две стадии из 1-хлор-3-этансульфонилпропана (см.: Synthetic Communications, 19(9-10), 1583-91; 1989) и этил 1-(4-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата по способу примера 77.
ESI-MS [M+H+]=422, рассчитано для C22H28ClNO3S=421.
Пример 85: Циклогексансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
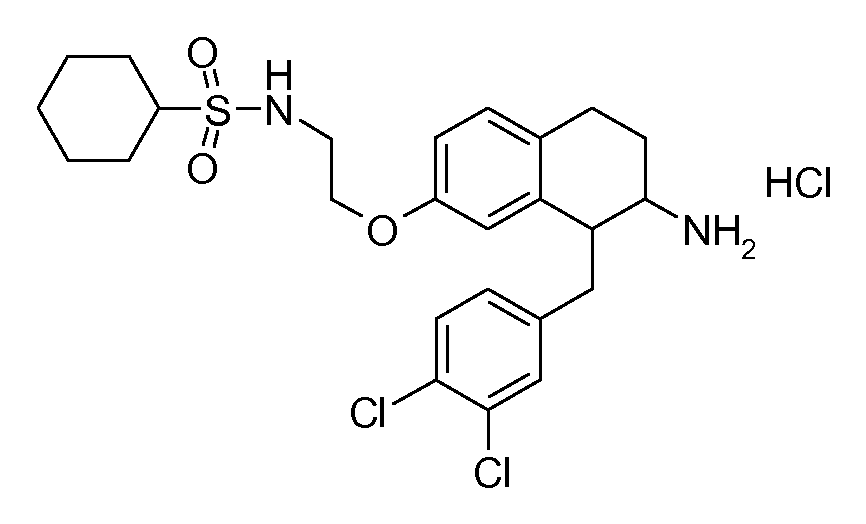
Циклогексансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3, используя циклогексилсульфонилхлорид вместо 1-метил-1H-имидазол-4-сульфонилхлорида.
ESI-MS [M+H+]=511, рассчитано для C25H32Cl2N2O3S=510.
Пример 86: 2-Триметилсиланилэтансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
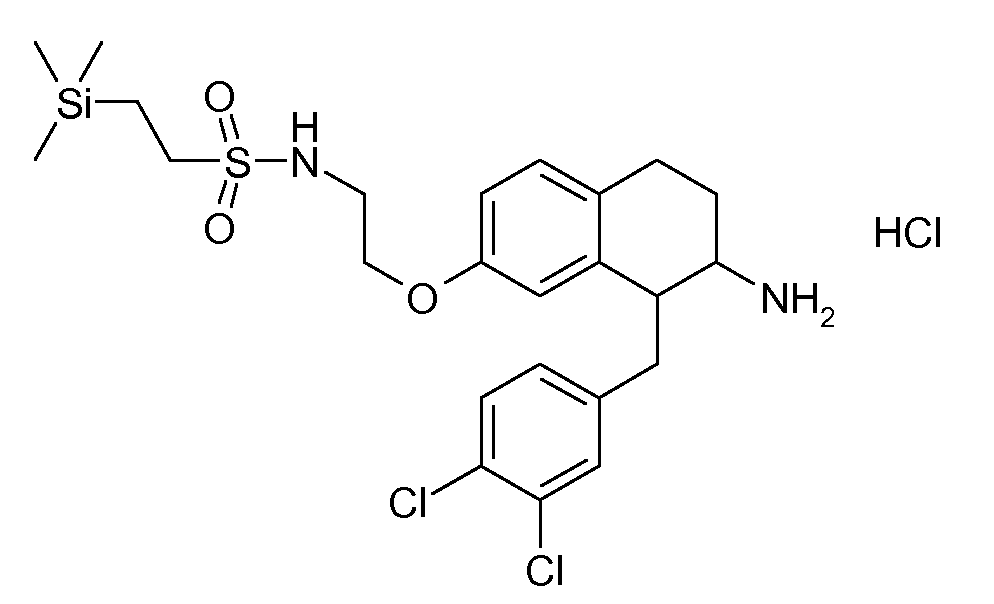
2-Триметилсиланилэтансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=529, рассчитано для C24H34Cl2N2O3SSi=528.
Пример 87: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-(5-метилизоксазол-3-ил)-метансульфонамида гидрохлорид
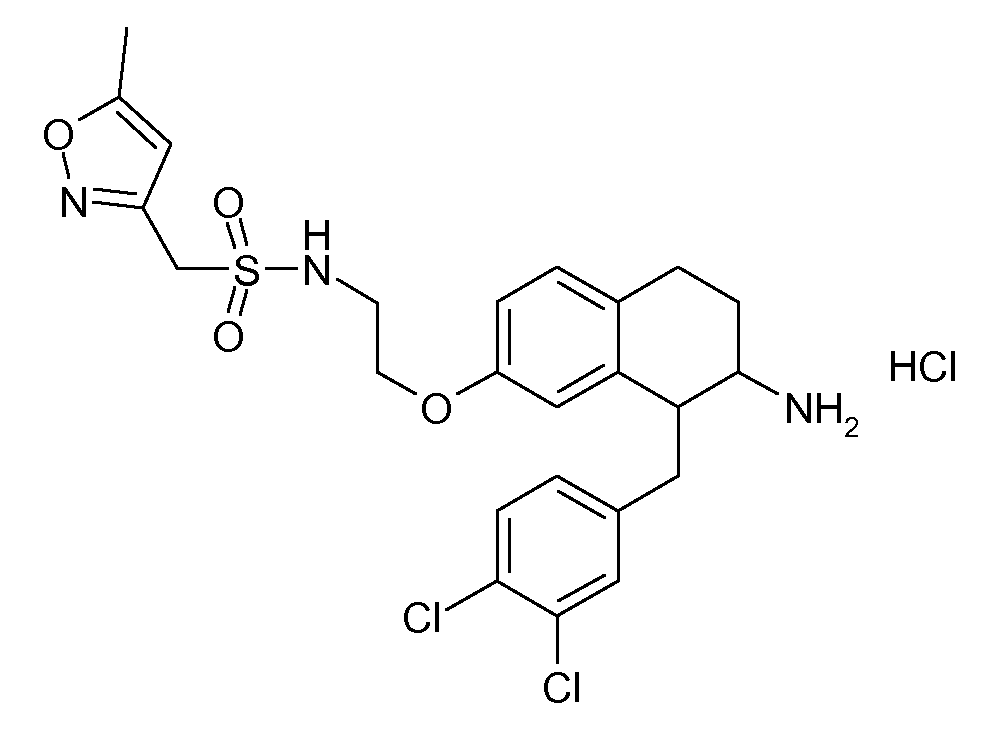
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-(5-метилизоксазол-3-ил)метансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=524, рассчитано для C24H27Cl2N3O4S=523.
Пример 88: Циклобутансульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
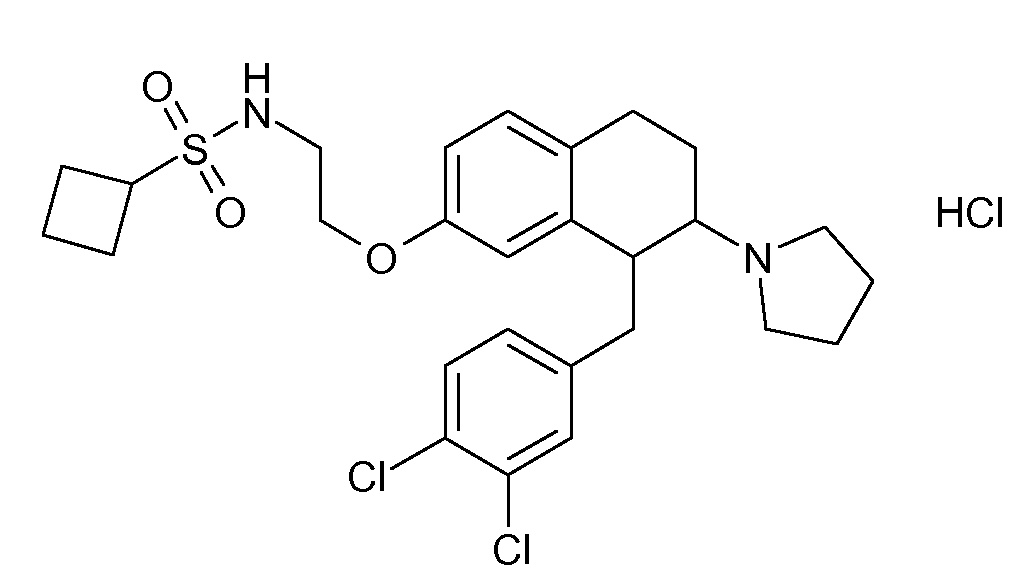
88.1 1-(1-(3,4-Дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил)пирролидин
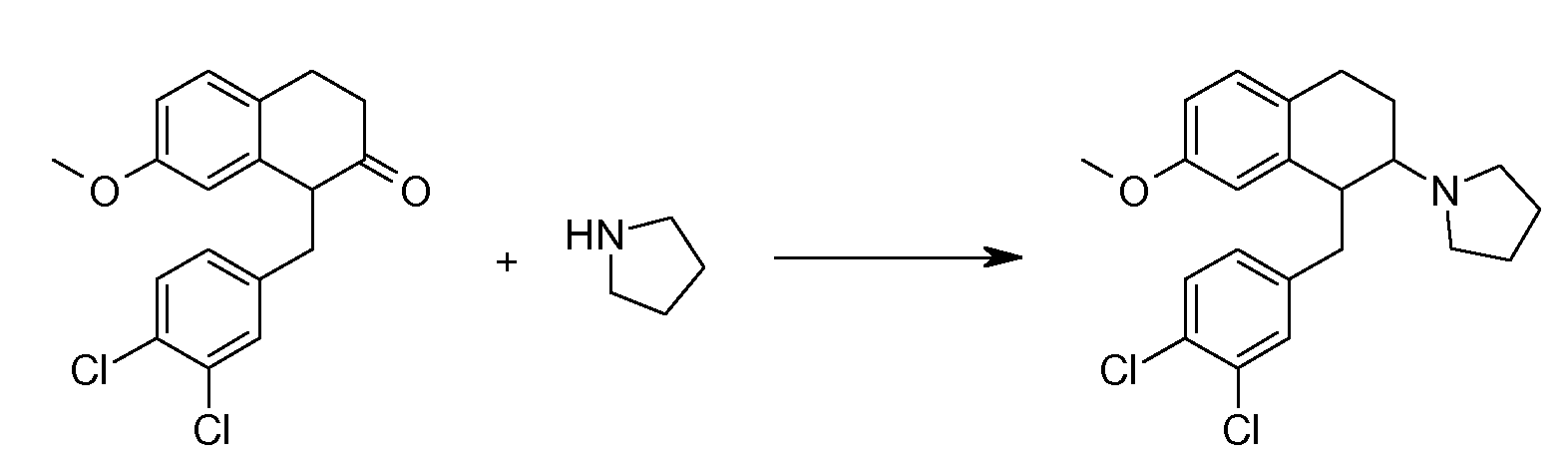
1-(3,4-Дихлорбензил)-7-метокси-3,4-дигидронафтален-2(1H)-он (5,5 г, 16,4 ммоль, пример 1), пирролидин (1,40 г, 19,7 ммоль), и п-толуолсульфоновой кислоты моногидрат (31,0 мг, 0,164 ммоль) растворяют в толуоле (100 мл) и нагревают с обратным холодильником в течение 2 ч, используя конденсатор Дина-Старка. Растворитель удаляют, и после добавления MeOH (50 мл) и цианогидрида натрия (1,57 г, 24,6 ммоль) смесь перемешивают в течение 4 дней при комнатной температуре в атмосфере азота. Добавляют воду, органическую фазу отделяют и водную фазу экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют, получая остаток, который очищают флэш-хроматографией (силикагель, MeOH/CH2Cl2 3:97→5:95). После осаждения из смеси этилацетат/диизопропиловый эфир (1:1) получают твердый продукт бежевого цвета (1,6 г, 25%).
88.2 8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол

1-(1-(3,4-Дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил)пирролидин (1,6 г, 4,10 ммоль) растворяют в CH2Cl2 (100 мл) и добавляют BBr3 (1-молярный раствор в CH2Cl2, 12,3 мл, 12,3 ммоль) при -10°C. Перемешивают в течение 2 ч, после чего температуру повышают до комнатной. Добавляют воду со льдом, органическую фазу отделяют и водную фазу экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором NaHCO3 и раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток. После осаждения из этилацетата получают твердый продукт бежевого цвета (1,2 г, 78%).
88.3 трет-Бутил 2-(8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этилкарбамат
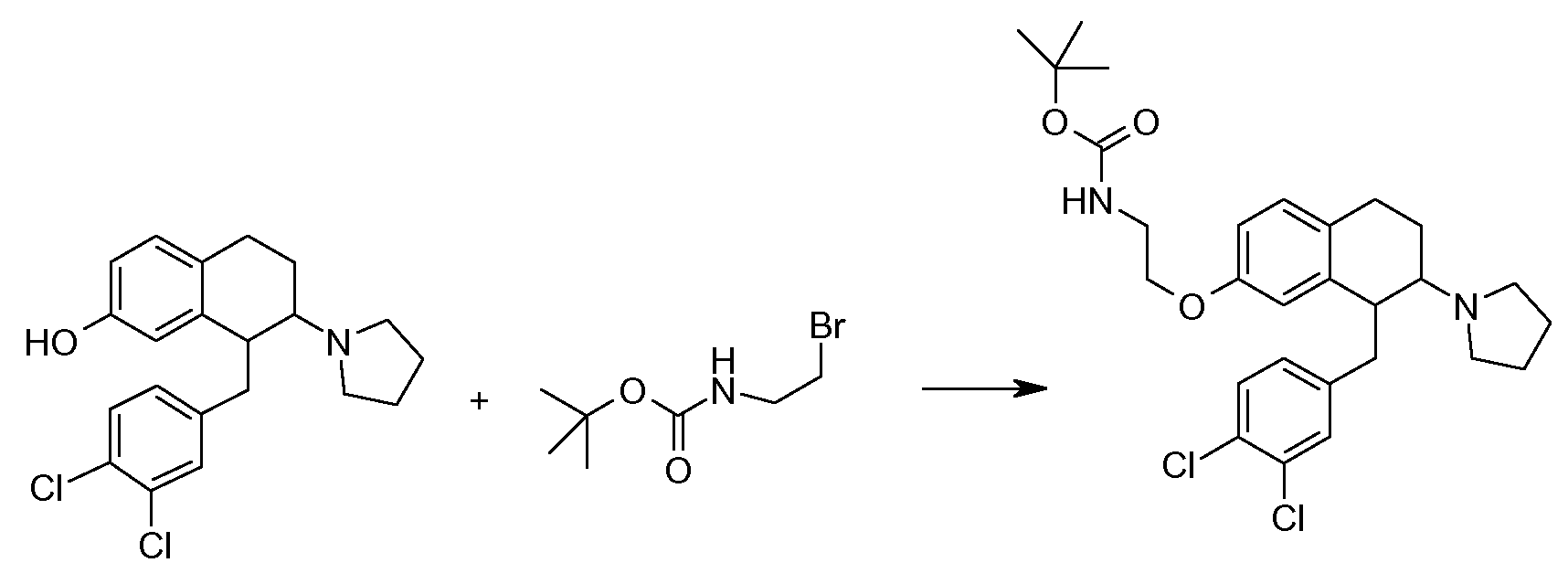
NaH в парафине (0,278 г, 6,38 ммоль, 55% в парафине) промывают н-гексаном и суспендируют в DMA (30 мл). Добавляют 8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол (1,2 г, 3,19 ммоль) в DMA (20 мл). После перемешивания в течение 1 ч при комнатной температуре добавляют порциями трет-бутил 2-бромэтилкарбамат (2,14 г, 6,38 ммоль), и смесь перемешивают в течение 48 ч. Добавляют воду, и водную фазу экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток, который очищают флэш-хроматографией (силикагель, MeOH/CH2Cl2 3:97). Продукт (1,6 г, 97%) получают в виде желтого масла.
88.4 2-(8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этанамина гидрохлорид
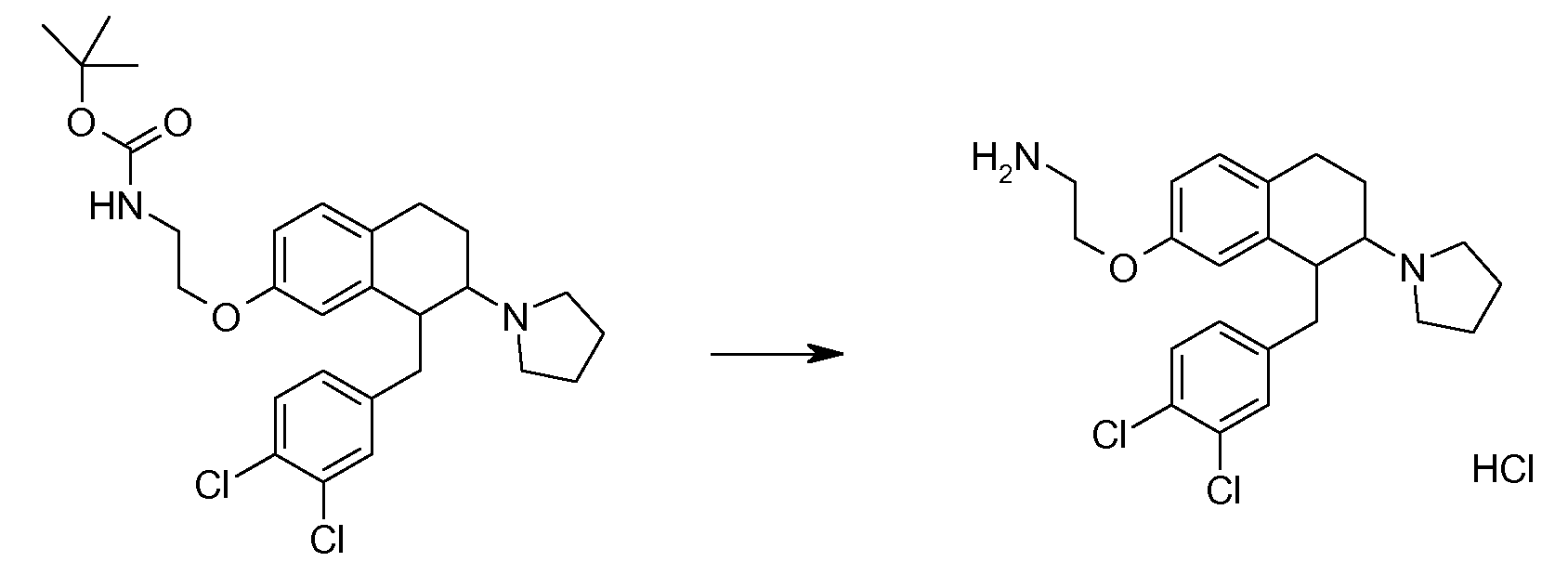
трет-Бутил 2-(8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этилкарбамат (1,6 г, 3,08 ммоль) растворяют в CH2Cl2 (70 мл) и добавляют HCl в iPrOH. Перемешивают в течение 14 ч при комнатной температуре, после чего температуру повышают до комнатной. Растворитель удаляют, получая белую соль (1,2 г, 85%).
88.5 Циклобутансульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
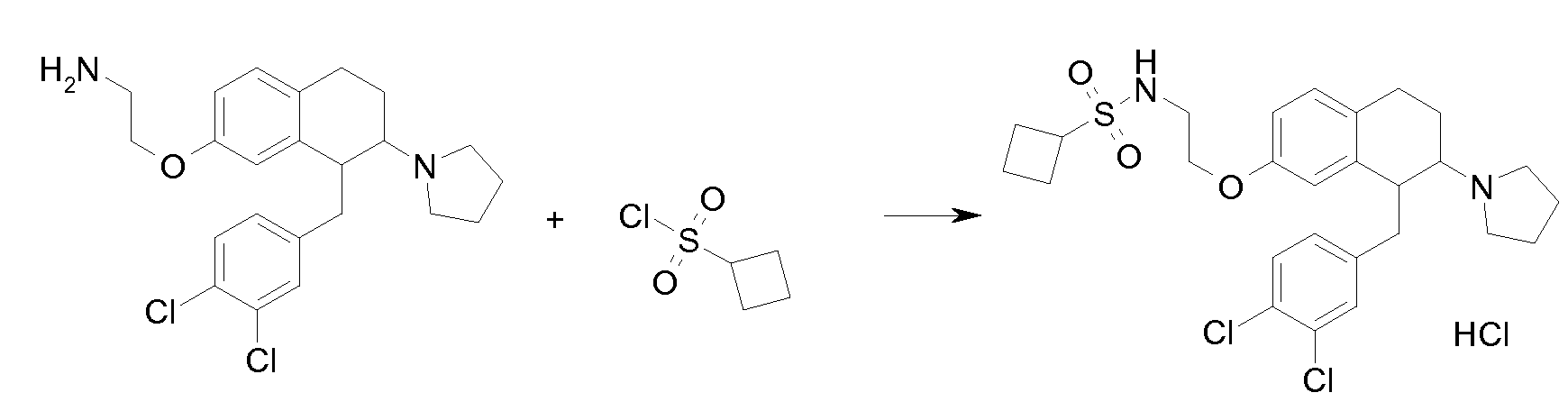
2-(8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этанамин (120 мг, 0,286 ммоль), пара-(N,N-диметиламино)пиридин (1,40 г, 19,7 ммоль) и циклобутансульфонилхлорид (46,5 мг, 0,30 ммоль) растворяют в CH2Cl2 (20 мл) и перемешивают в течение 14 ч при комнатной температуре. Добавляют 0,5N HCl, органическую фазу отделяют, и водную фазу экстрагируют CH2Cl2. Объединенные органические слои промывают водой, раствором NaHCO3 и насыщенным раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток, который очищают флэш-хроматографией (силикагель, MeOH/CH2Cl2 3:97→5:95). Твердый продукт белого цвета (164 мг, 32%) превращают в соль HCl и осаждают из диизопропилового эфира.
ESI-MS [M+H+]=537, рассчитано для C27H34Cl2N2O3S=536.
Пример 89: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метиламида гидрохлорид
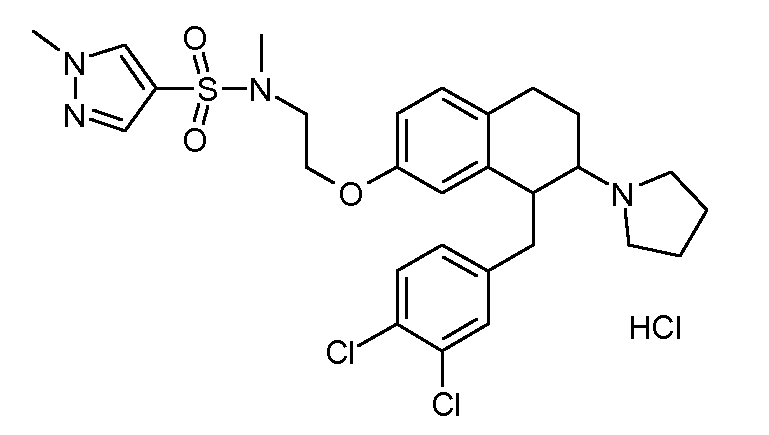
N-(2-(8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-пиразол-4-сульфонамида гидрохлорид (41 мг, 0,068 ммоль, пример 91), иодметан (11,6 мг, 0,082 ммоль), карбонат цезия (49,0 мг, 0,150 ммоль) растворяют в ацетонитриле (3 мл) и перемешивают в течение 1 ч при 100°C в микроволновой печи. После добавления другой порции иодметана (11,6 мг, 0,082 ммоль) и карбоната цезия (49,0 мг, 0,150 ммоль) смесь перемешивают еще 1 ч при 100°C в микроволновой печи. Добавляют воду и CH2Cl2, органическую фазу отделяют, и водную фазу экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток, который очищают флэш-хроматографией (силикагель, MeOH/CH2Cl2 3:97→5:95). Твердый продукт белого цвета (42 мг, 38%) превращают в соль HCl и осаждают из диизопропилового эфира.
ESI-MS [M+H+]=577, рассчитано для C28H34Cl2N4O3S=576.
Пример 90: Бутан-1-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
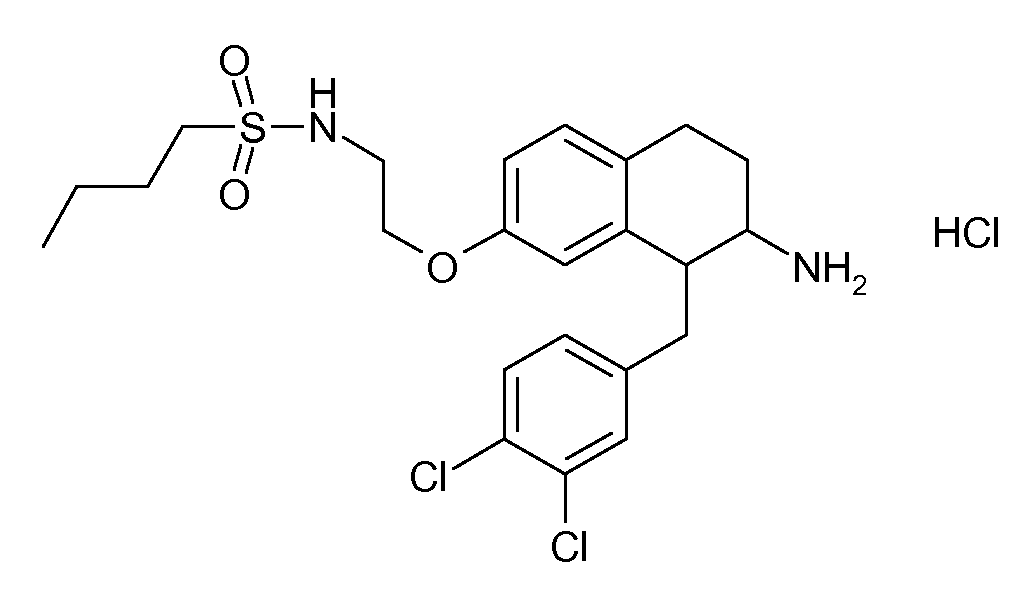
Бутан-1-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=485, рассчитано для C23H30Cl2N2O3S=484.
Пример 91: Пропан-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
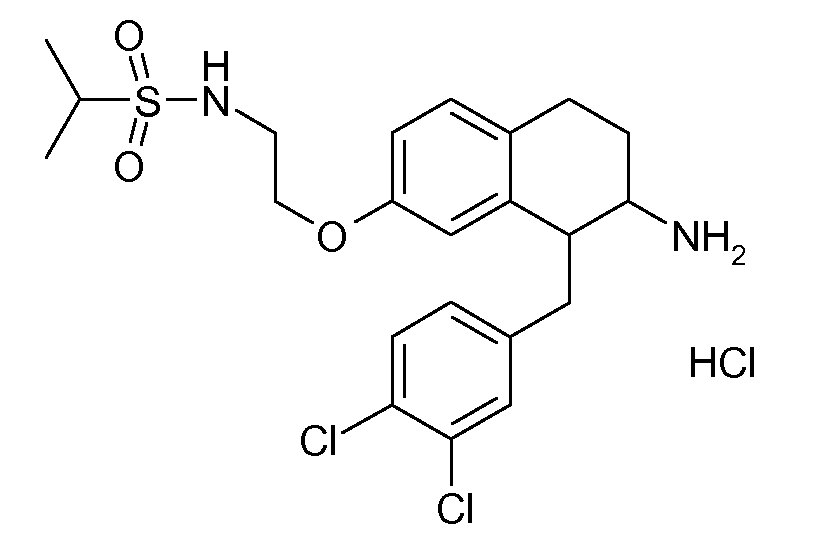
Пропан-2-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=471, рассчитано для C22H28Cl2N2O3S=470.
Пример 92: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
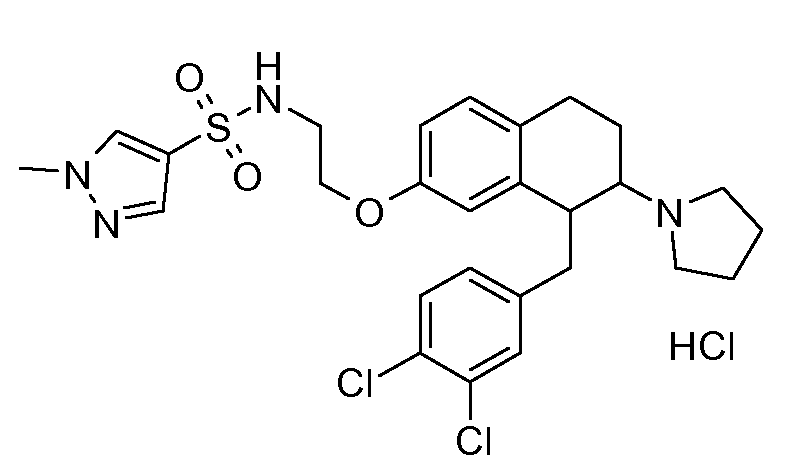
1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 88. ESI-MS [M+H+]=563, рассчитано для C27H32Cl2N4O3S=562.
Пример 93: 2-Этоксиэтансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
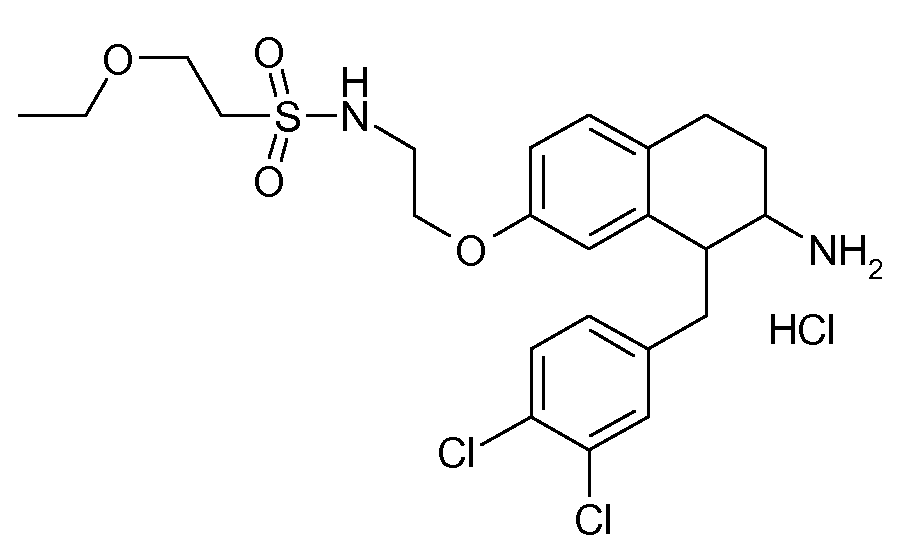
2-Этоксиэтансульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=501, рассчитано для C23H30Cl2N2O4S=500.
Пример 94: Циклобутансульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метиламида гидрохлорид
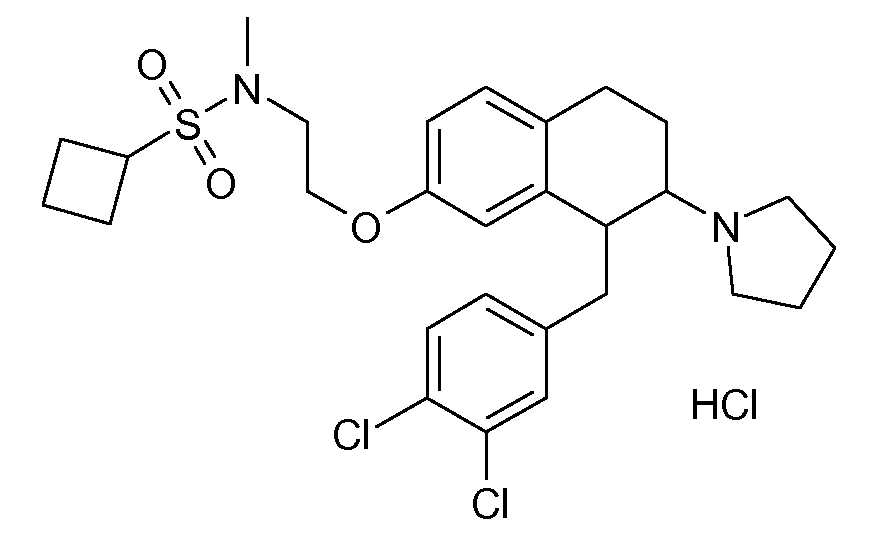
Циклобутансульфоновой кислоты {2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метиламида гидрохлорид получают из N-(2-(8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)циклобутансульфонамида гидрохлорида (пример 88) по способу примера 89.
ESI-MS [M+H+]=551, рассчитано для C28H36Cl2N2O3S=550.
Пример 95: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
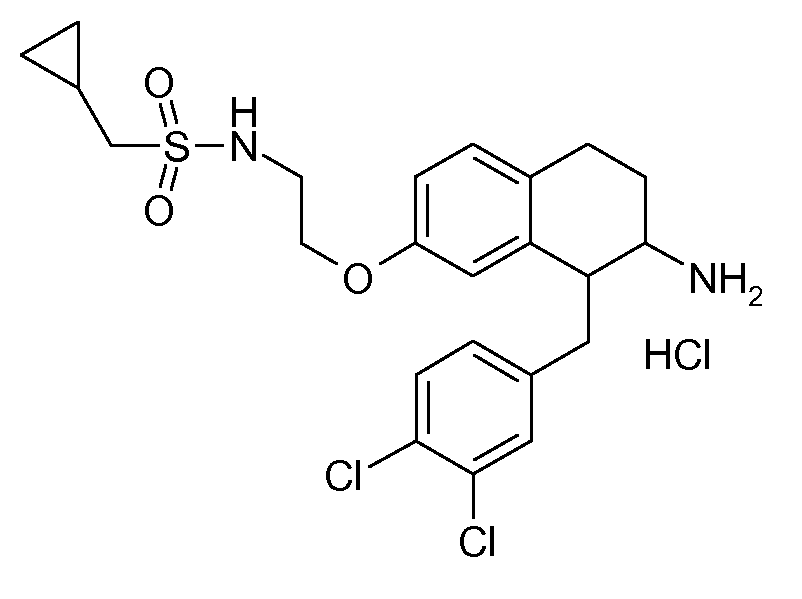
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=483, рассчитано для C23H28Cl2N2O3S=482.
Пример 96: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(4-метоксибензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
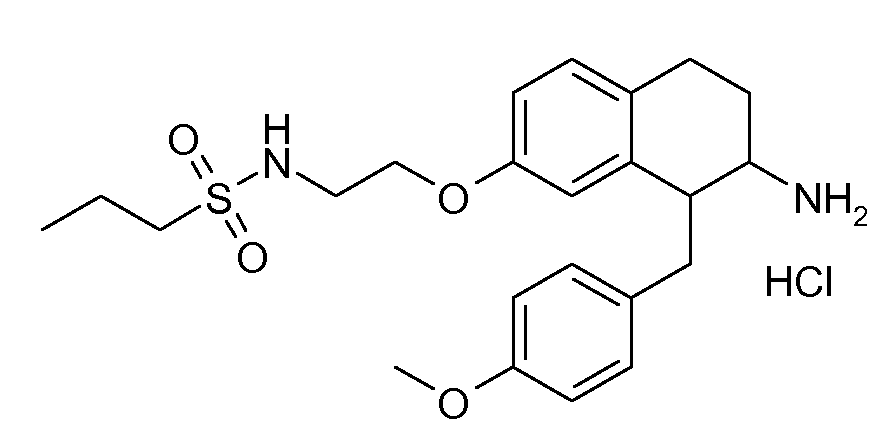
Пропан-1-сульфоновой кислоты {2-[7-амино-8-(4-метоксибензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=433, рассчитано для C23H32N2O4S2=432.
Пример 97: N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метансульфонамида гидрохлорид
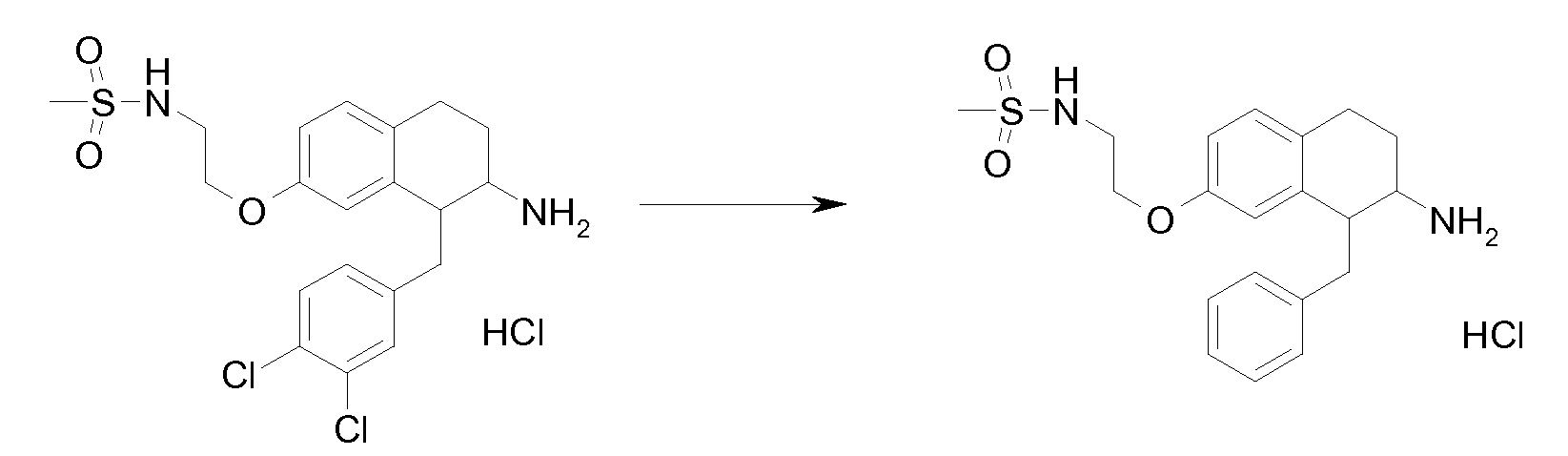
N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)метансульфонамида гидрохлорид (50,0 мг, 0,104 ммоль), Pd-C 10% (1,10 мг) и моногидрат гидразина (522 мг, 10,4 ммоль) суспендируют в этаноле (5 мл) и перемешивают в течение 4 ч при нагревании с обратным холодильником. Добавляют воду и CH2Cl2, смесь фильтруют, и фильтрат экстрагируют CH2Cl2. Объединенные органические слои промывают водой, насыщенный раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток, который очищают осаждением из диизопропилового эфира. Остаток превращают в соль HCl, и получают продукт в виде белого твердого вещества (31 мг, 72%).
ESI-MS [M+H+]=375, рассчитано для C20H26N2O3S=374.
Пример 98: 1-Метил-1H-имидазол-4-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид
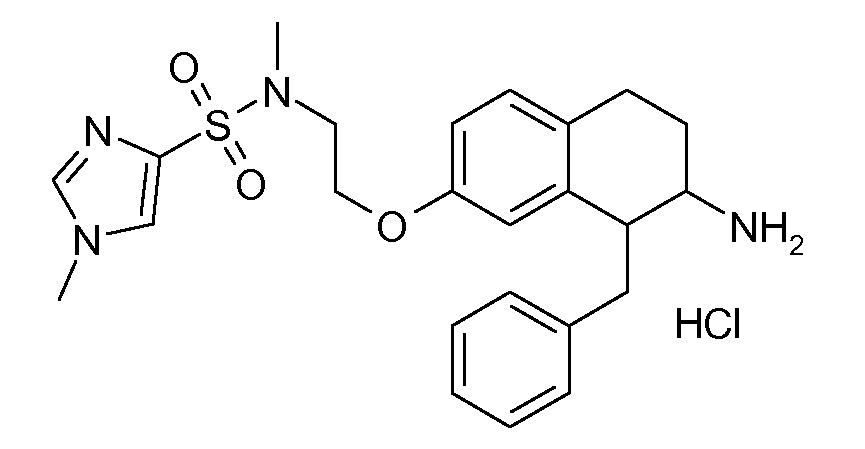
1-Метил-1H-имидазол-4-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид получают по способу примера 3 и 89.
ESI-MS [M+H+]=455, рассчитано для C24H30N4O3S=454.
Пример 99: N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]бензолсульфонамида гидрохлорид
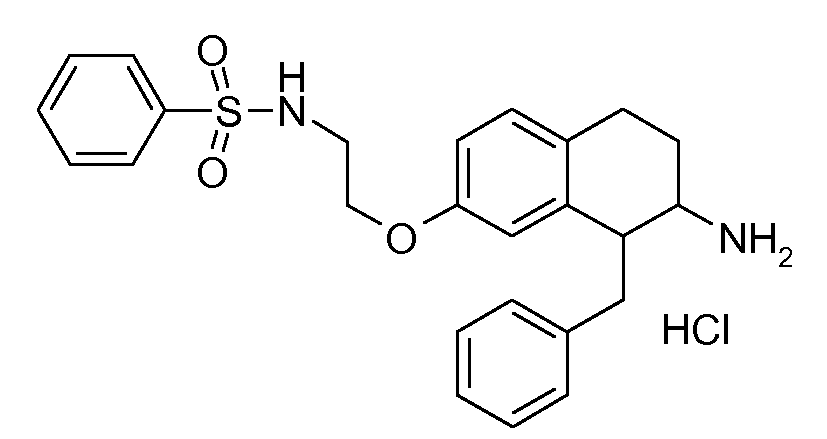
N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]бензолсульфонамида гидрохлорид получают из N-{2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}бензолсульфонамида гидрохлорида (пример 16) по способу примера 3 и 97.
ESI-MS [M+H+]=437, рассчитано для C25H28N2O3S=436.
Пример 100: 3,3,3-Трифторпропан-1-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида гидрохлорид
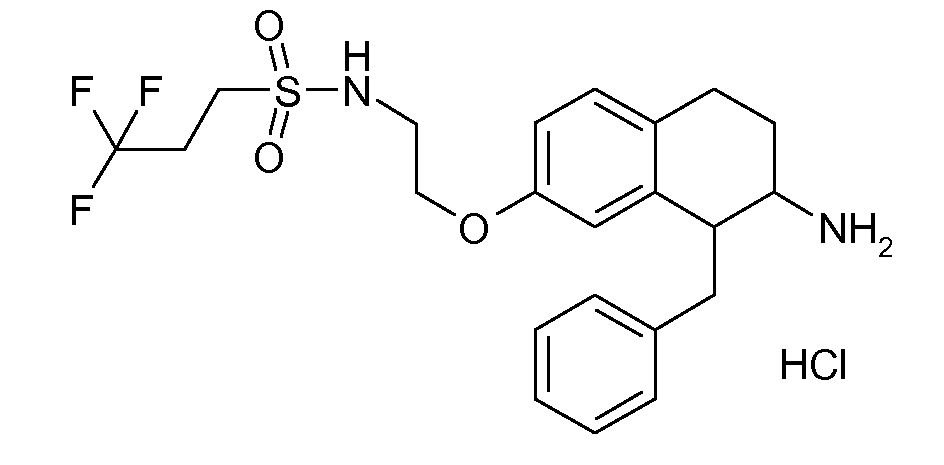
3,3,3-Трифторпропан-1-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида гидрохлорид получают по способу примера 3 и 97.
ESI-MS [M+H+]=457, рассчитано для C22H27F3N2O3S=456.
Пример 101: 1-Метил-1H-имидазол-4-сульфоновой кислоты [2-(8-бензил-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид
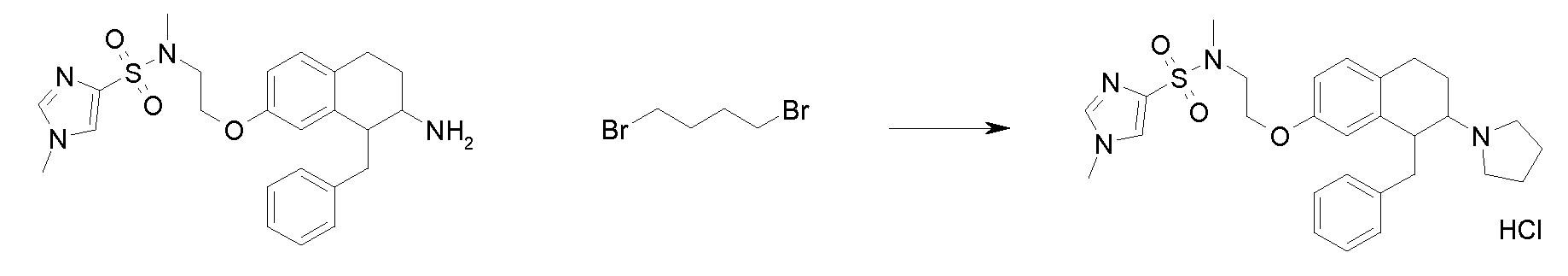
N-(2-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N,1-диметил-1H-имидазол-4-сульфонамида гидрохлорид (98), 1,4-дибромбутан (49,9 мг, 0,231 ммоль) и триэтиламин (31,2 мг, 0,308 ммоль) растворяют в ацетонитриле (3 мл) и перемешивают в течение 2 ч при 130°C в микроволновой печи. Добавляют воду и этилацетат, и органическую фазу отделяют. После экстракции водной фазы этилацетатом объединенные органические слои промывают насыщенным раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток, который очищают флэш-хроматографией (силикагель, MeOH/CH2Cl2 5:95). Остаток превращают в соль HCl и получают продукт в виде белого твердого вещества (8,5 мг, 10%) после осаждения из диизопропилового эфира.
ESI-MS [M+H+]=509, рассчитано для C28H36N4O3S=508.
Пример 102: Циклопропансульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида гидрохлорид
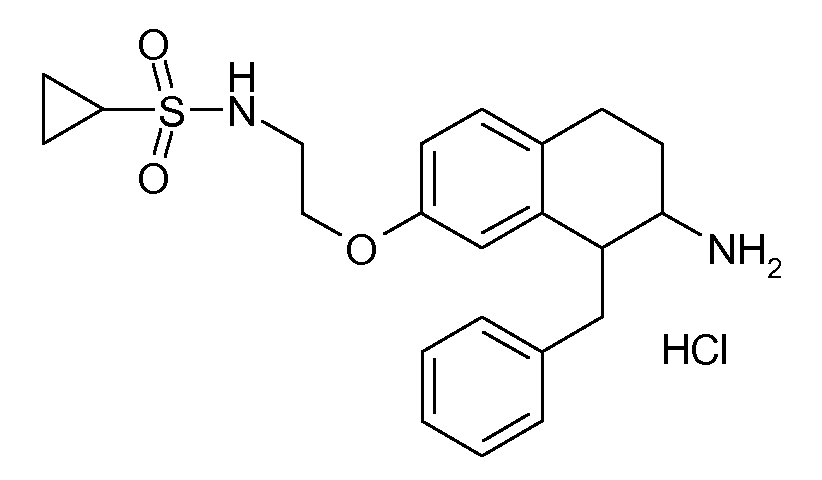
Циклопропансульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида гидрохлорид получают по способу примера 3 и 97.
ESI-MS [M+H+]=401, рассчитано для C22H28N2O3S=400.
Пример 103: N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]пропионамида гидрохлорид
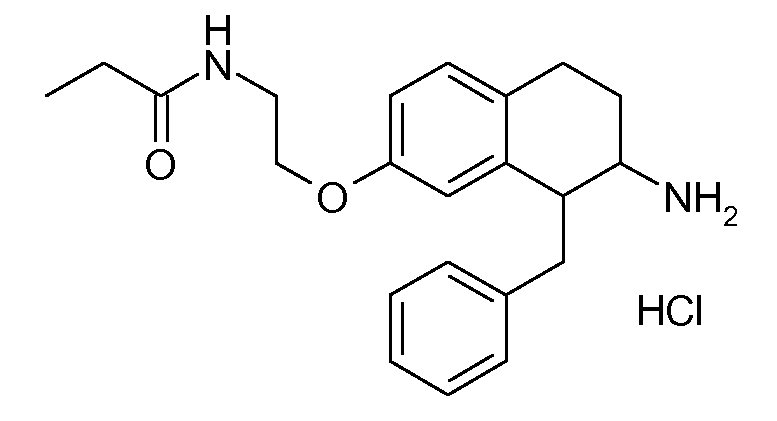
Этил 7-(2-аминоэтокси)-1-(3,4-дихлорбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамата гидрохлорид (пример 2.1, 100 мг, 0,229 ммоль) и N,N-диметиламинопиридин (30,7 мг, 0,252 ммоль) растворяют в CH2Cl2 (20 мл) и при комнатной температуре добавляют пропионилхлорид (30,7 мг, 0,252 ммоль). После перемешивания при комнатной температуре в течение 14 ч добавляют 0,5N HCl и смесь экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором NaHCO3 и раствором NaCl, сушат над Na2SO4 и концентрируют, получая остаток. После осаждения из этилацетата получают белый твердый этил 1-(3,4-дихлорбензил)-7-(2-пропионамидоэтокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (98 мг, 87%). В результате последующего превращения по способу примера 2 и 97 получают N-[2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]пропионамида гидрохлорид.
ESI-MS [M+H+]=353, рассчитано для C22H28N2O2=352.
Пример 104: 1-Метил-1H-[1,2,4]триазол-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
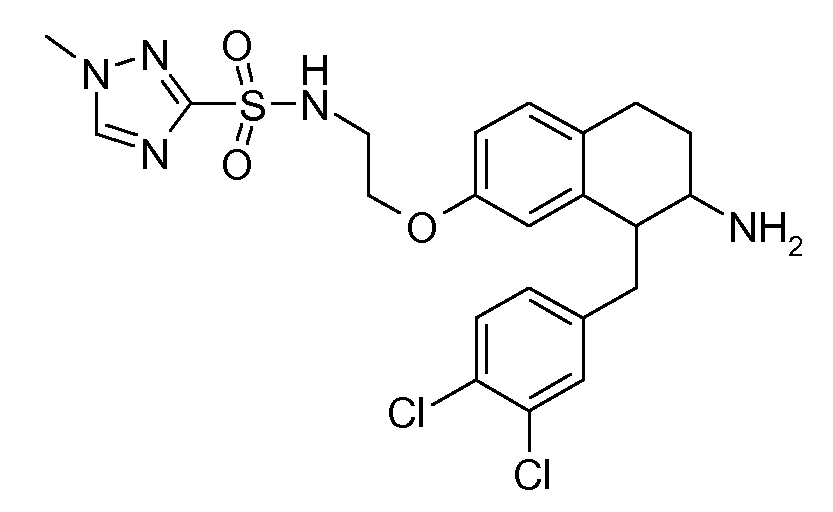
1-Метил-1H-[1,2,4]триазол-3-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид получают по способу примера 3.
ESI-MS [M+H+]=510, рассчитано для C22H25Cl2N5O3S=509.
Пример 105: 1-Метил-1H-имидазол-4-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламид
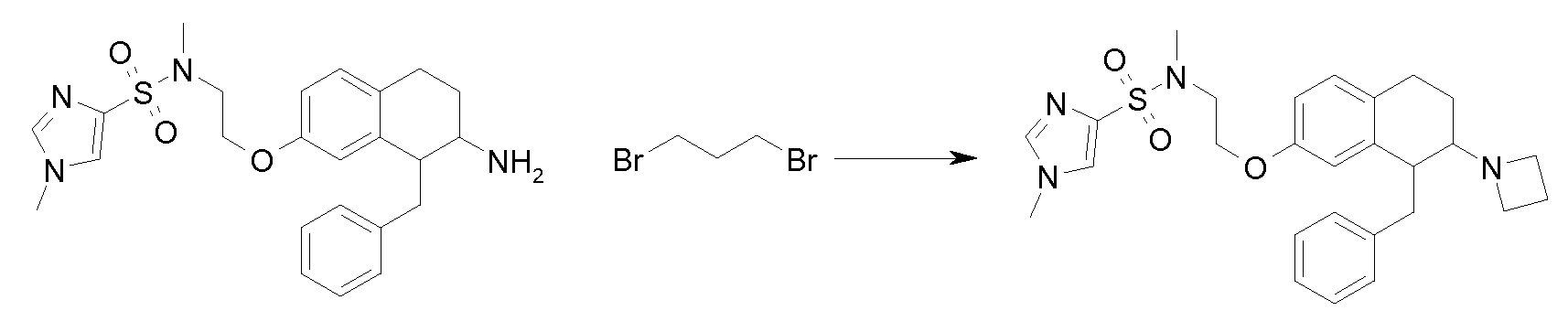
1-Метил-1H-имидазол-4-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламид получают по способу примера 101.
ESI-MS [M+H+]=495, рассчитано для C27H34N4O3S=494.
Пример 106: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклобутилметансульфонамида гидрохлорид
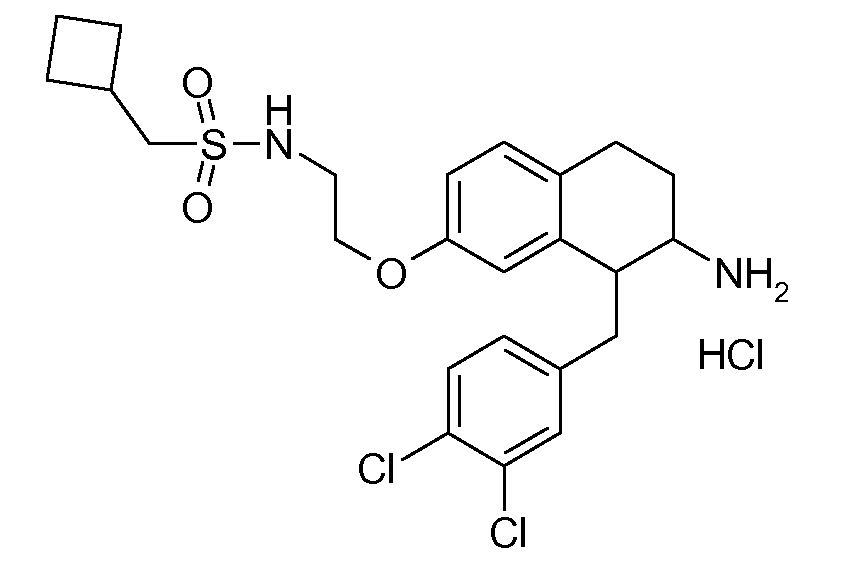
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклобутилметансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=497, рассчитано для C24H30Cl2N2O3S=496.
Пример 107: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
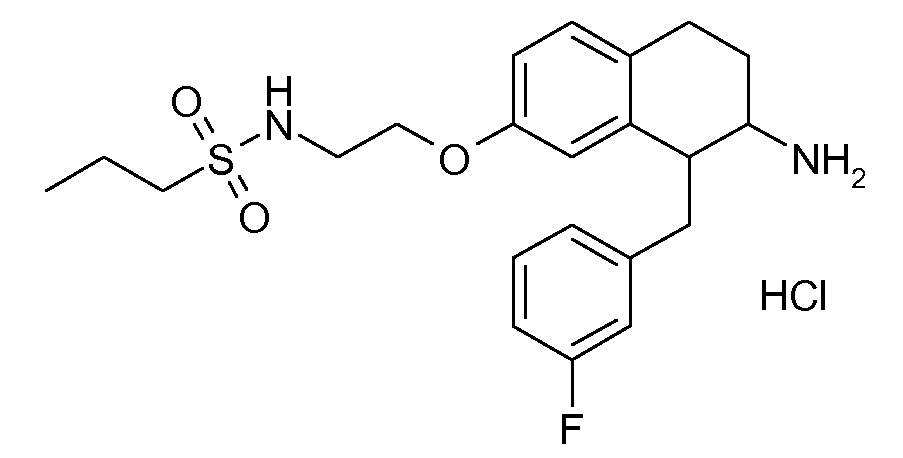
Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=421, рассчитано для C22H29FN2O3S=420.
Пример 108: N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропил-N-метилметансульфонамида гидрохлорид
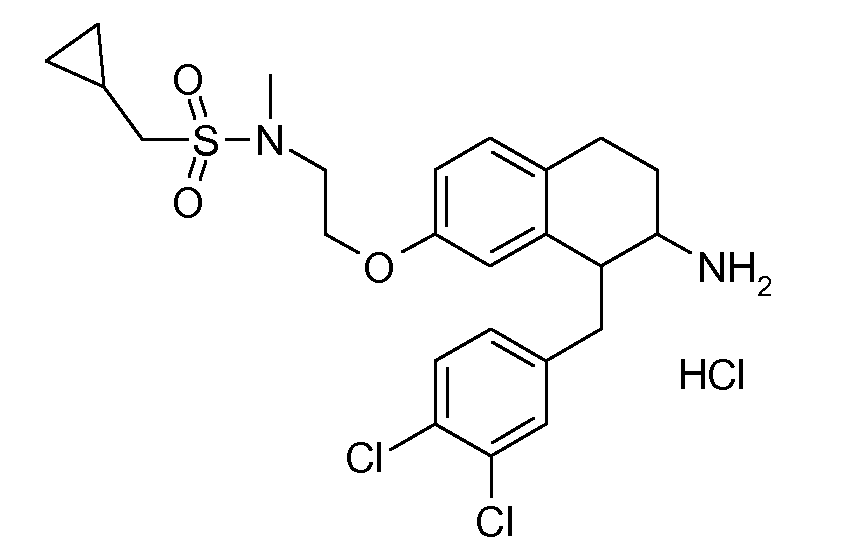
N-{2-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропил-N-метилметансульфонамида гидрохлорид получают по способу примера 11.
ESI-MS [M+H+]=497, рассчитано для C24H30Cl2N2O3S=496.
Пример 109: 1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламид
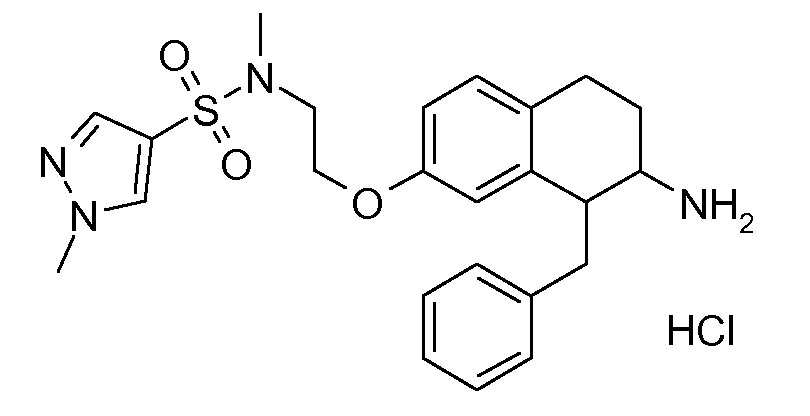
1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламид получают по способу примера 3 и 89.
ESI-MS [M+H+]=455, рассчитано для C24H30N4O3S=454.
Пример 110: N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-этил-1-метил-1H-пиразол-4-сульфонамид
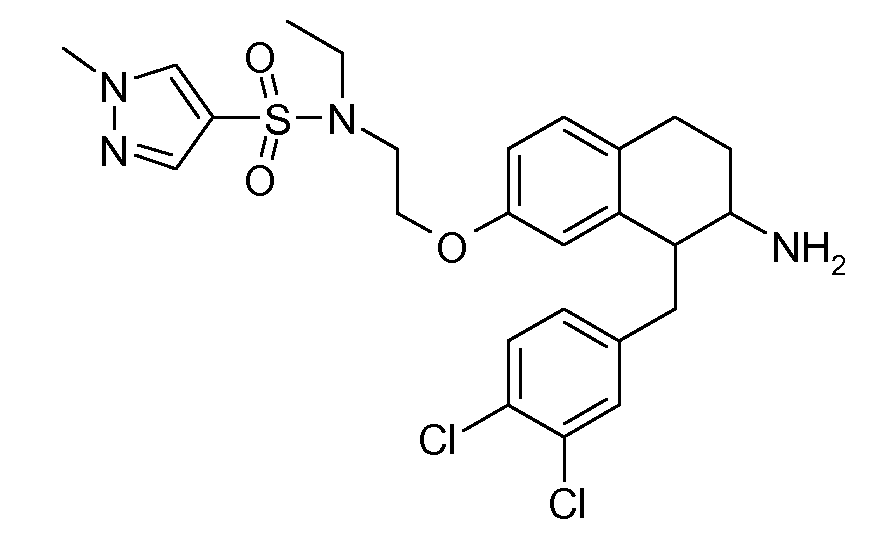
N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-этил-1-метил-1H-пиразол-4-сульфонамид получают по способу примера 11.
ESI-MS [M+H+]=537, рассчитано для C25H30Cl2N4O3S=536.
Пример 111: 1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(8-бензил-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид
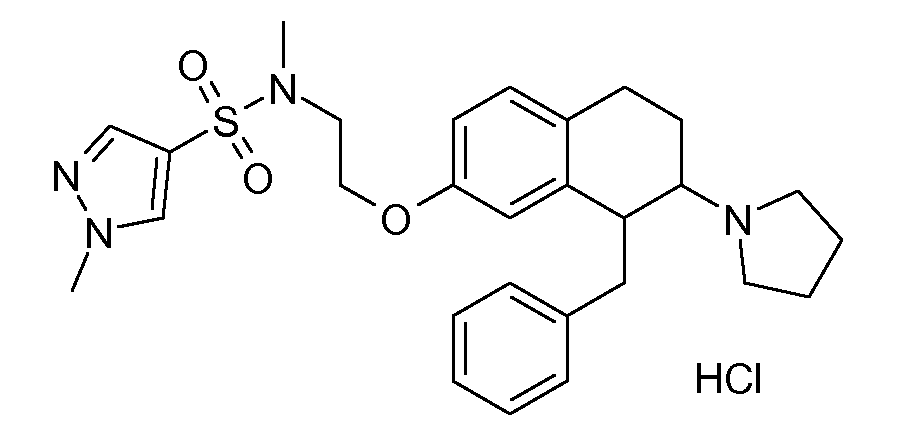
1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(8-бензил-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид получают по способу примера 50.
ESI-MS [M+H+]=509, рассчитано для C28H36N4O3S=508.
Пример 112: 1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид
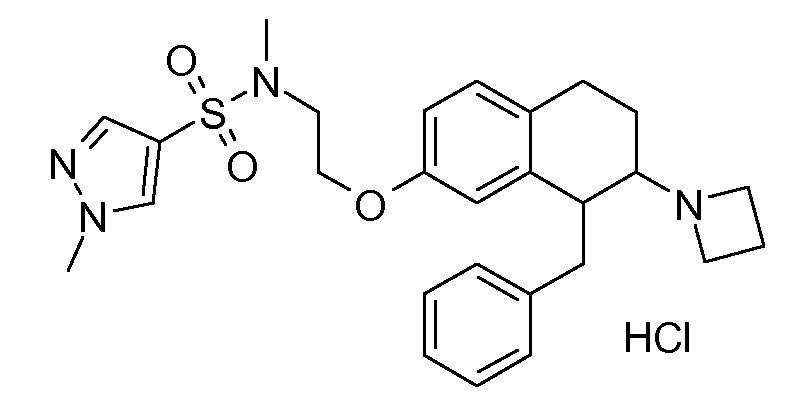
1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]метиламида гидрохлорид получают по способу примера 50.
ESI-MS [M+H+]=495, рассчитано для C27H34N4O3S=494.
Пример 113: N-(2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-этил-1-метил-1H-пиразол-4-сульфонамида гидрохлорид
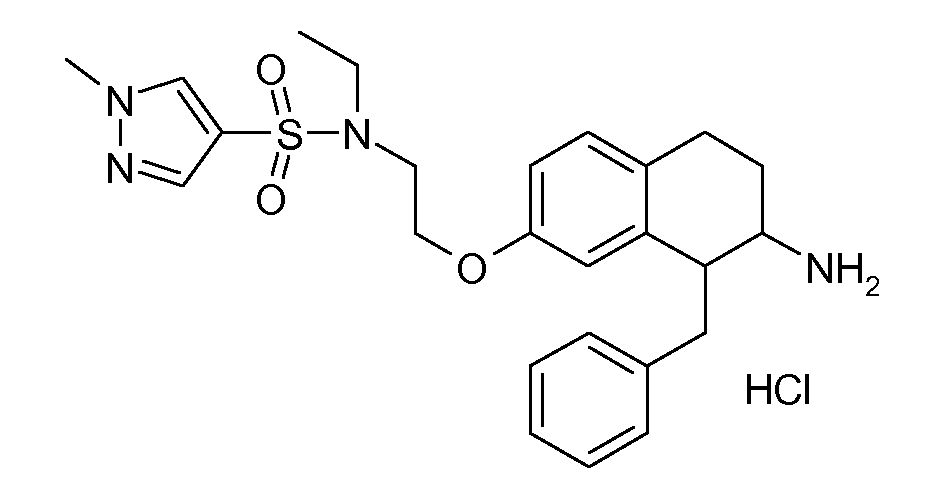
N-(2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-этил-1-метил-1H-пиразол-4-сульфонамида гидрохлорид получают по способу примера 3 и 89.
ESI-MS [M+H+]=469, рассчитано для C25H32N4O3S=468.
Пример 114: N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)пентан-1-сульфонамида гидрохлорид
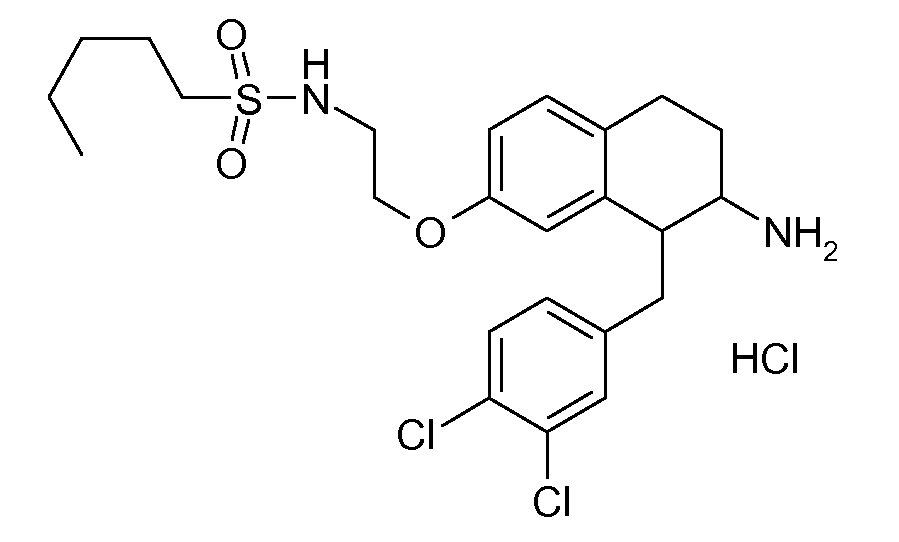
N-(2-(7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)пентан-1-сульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=499, рассчитано для C24H32Cl2N2O3S=498.
Пример 115: N-(2-(8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
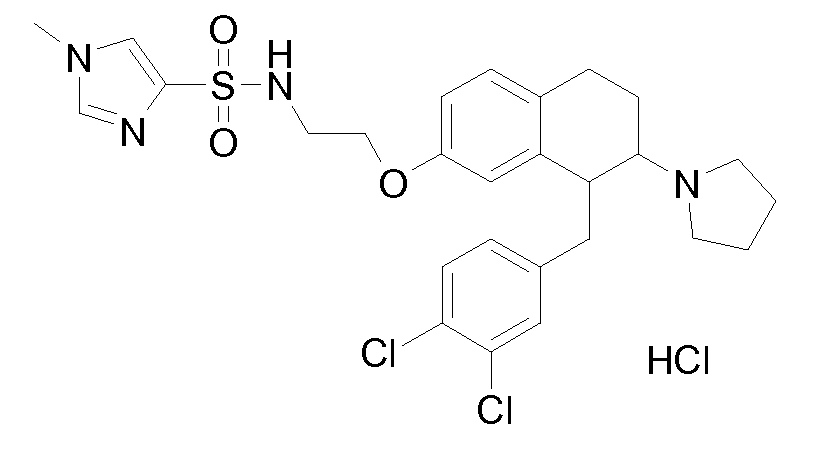
N-(2-(8-(3,4-Дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способу примера 88.
ESI-MS [M+H+]=536, рассчитано для C27H32Cl2N4O3S=535.
Пример 116: N-(2-(8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
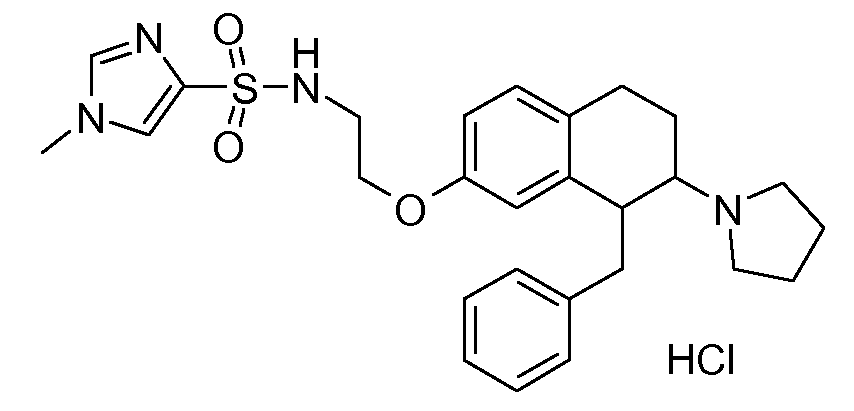
N-(2-(8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид получают из N-(2-(8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида (пример 115) по способу примера 97.
ESI-MS [M+H+]=495, рассчитано для C27H34N4O3S=494.
Пример 117, 118 (Энантиомеры 1 и 2 соединения примера 116)
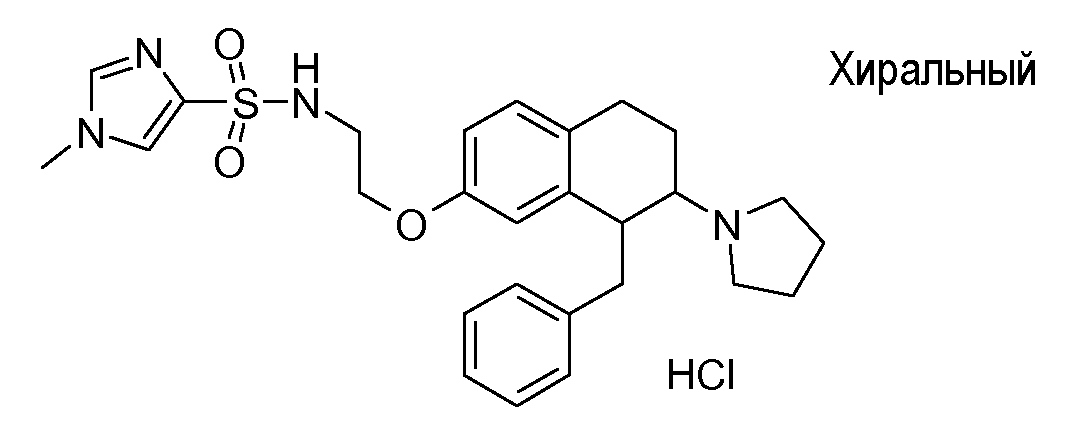
Рацемат N-(2-(8-бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорида (пример 116) разделяют методом хиральной хроматографии на Chiracel AD (н-гептан/этанол 35:65, 0,1% TEA, 9 мл/мин) с получением (после превращения в солевую форму) (-)-N-(2-(8-бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорида ([α]=-76,0° в MeOH, c=1,040 г/100 мл [пример 117]) и (+)-N-(2-(8-бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорида ([α]=-77,7° в MeOH, c=0,382 г/100 мл [пример 118]).
ESI-MS [M+H+]=495, рассчитано для C27H34N4O3S=494.
Пример 119: N-(2-(8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-пиразол-4-сульфонамида гидрохлорид
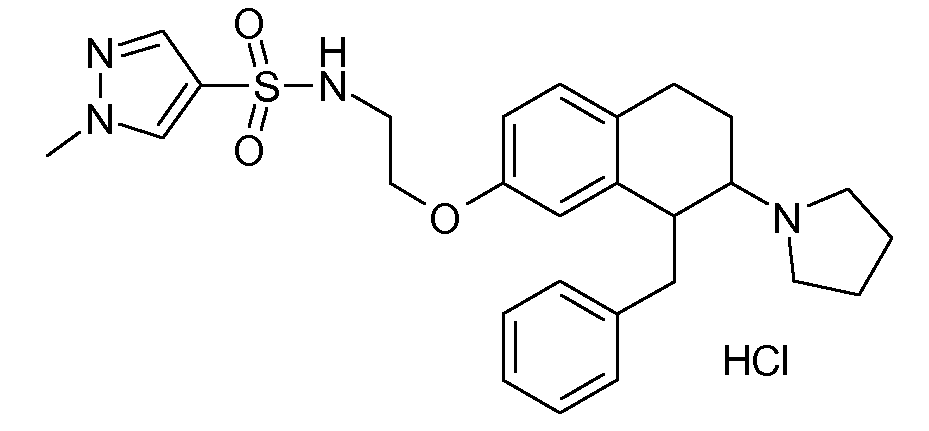
N-(2-(8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-пиразол-4-сульфонамида гидрохлорид получают из N-(2-(8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-пиразол-4-сульфонамида (пример 114) по способу примера 97.
ESI-MS [M+H+]=495, рассчитано для C27H34N4O3S=494.
Пример 120: N-(2-{[7-Амино-8-(3-хлор-4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)пропан-1-сульфонамида гидрохлорид
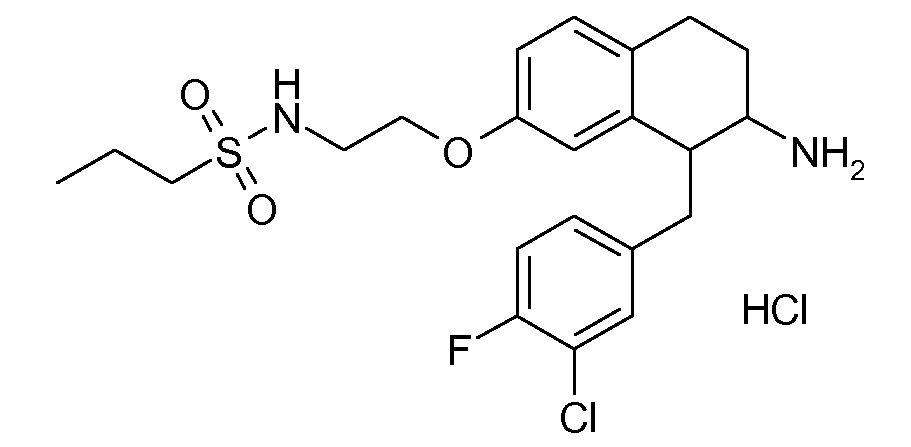
N-(2-{[7-Амино-8-(3-хлор-4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)пропан-1-сульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=455, рассчитано для C22H28ClFN2O3S=454.
Пример 121: N-(2-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
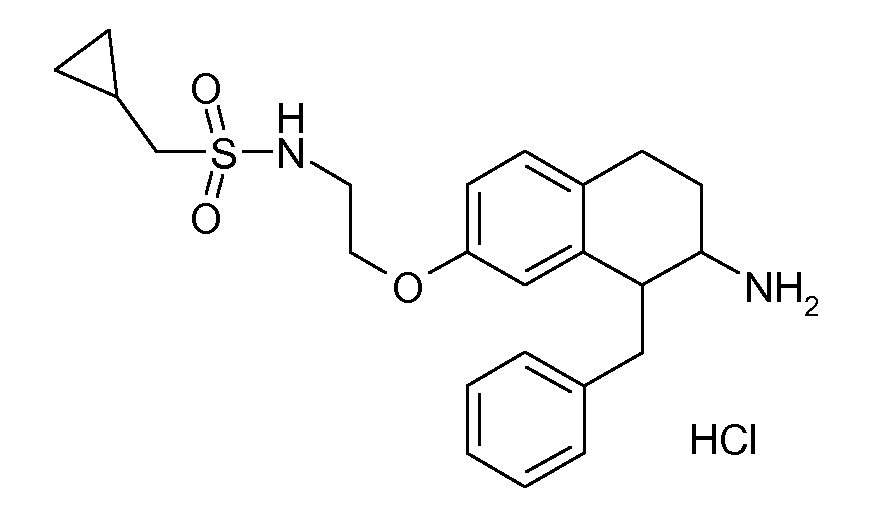
N-(2-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамид гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=415, рассчитано для C23H30N2O3S=414.
Пример 122: N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-2-циклопропилацетамида гидрохлорид
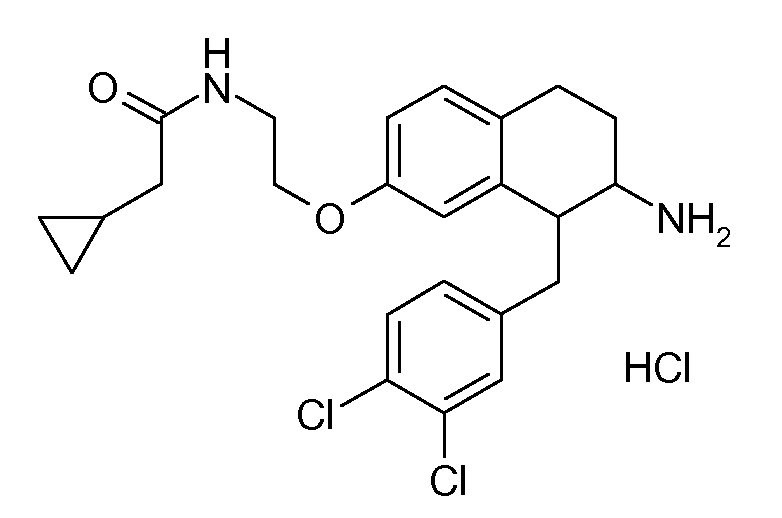
N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-2-циклопропилацетамида гидрохлорид синтезируют по способу примера 103.
ESI-MS [M+H+]=447, рассчитано для C24H28Cl2N2O2=446.
Пример 123: N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)бензамида гидрохлорид
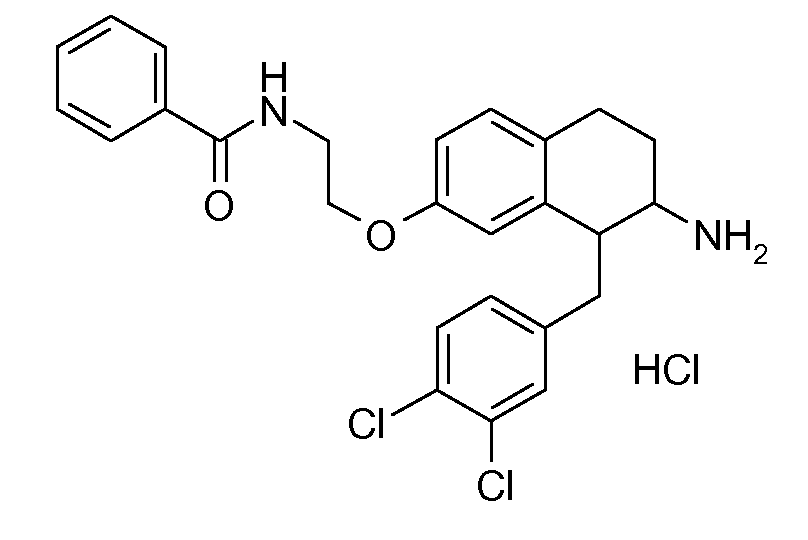
N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)бензамида гидрохлорид синтезируют по способу примера 103.
ESI-MS [M+H+]=469, рассчитано для C26H26Cl2N2O2=468.
Пример 124: N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N-этил-1-метил-1H-пиразол-4-сульфонамида гидрохлорид
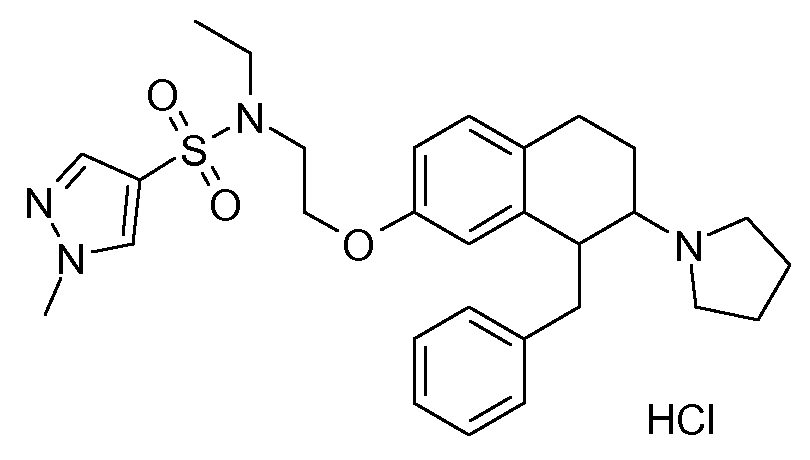
N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N-этил-1-метил-1H-пиразол-4-сульфонамида гидрохлорид синтезируют из N-(2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-N-этил-1-метил-1H-пиразол-4-сульфонамида гидрохлорида (пример 113) по способу примера 97.
ESI-MS [M+H+]=523, рассчитано для C29H38N4O3S=522.
Пример 125: N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-2-циклопропилэтансульфонамида гидрохлорид
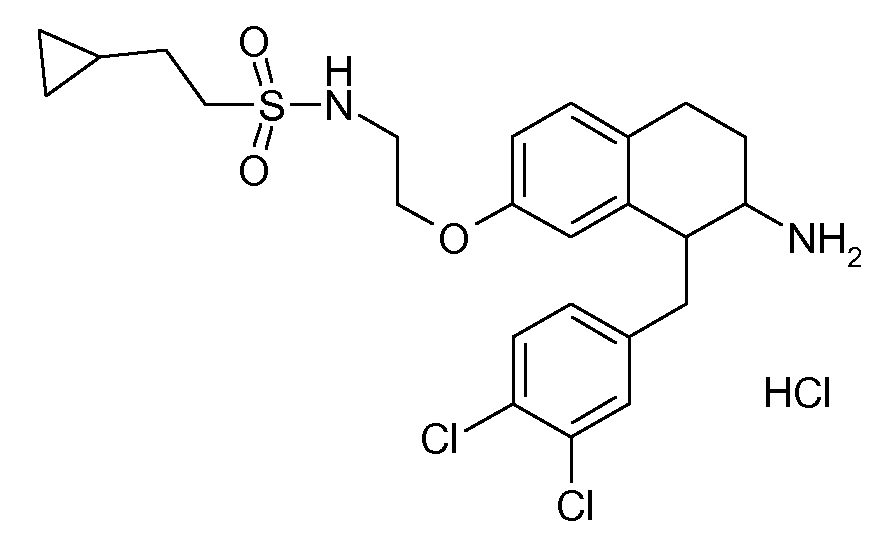
N-(2-{[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-2-циклопропилэтансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=497, рассчитано для C24H30Cl2N2O3S=496.
Пример 126: C-Циклопропил-N-{2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}-N-метилметансульфонамида гидрохлорид
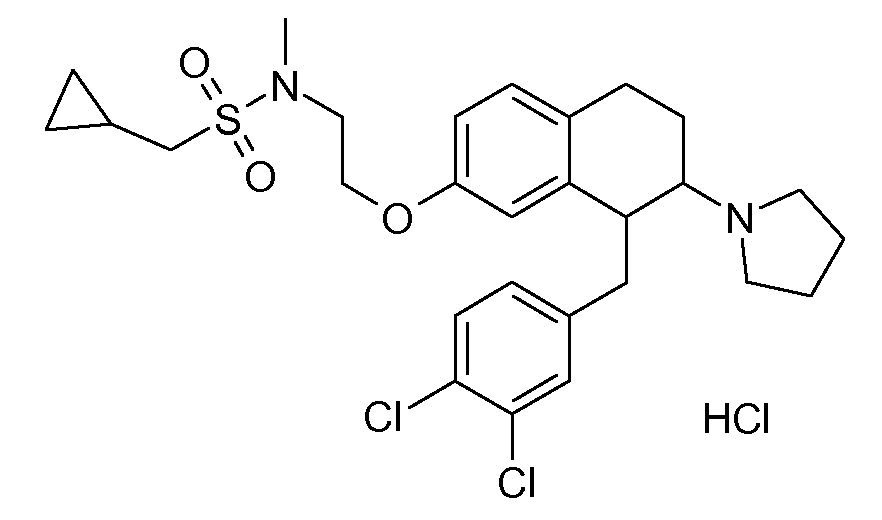
C-Циклопропил-N-{2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}-N-метилметансульфонамида гидрохлорид синтезируют по способам примеров 89, 97, 101.
ESI-MS [M+H+]=551, рассчитано для C28H36Cl2N2O3S=550.
Пример 127: N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропил-N-метилметансульфонамида гидрохлорид
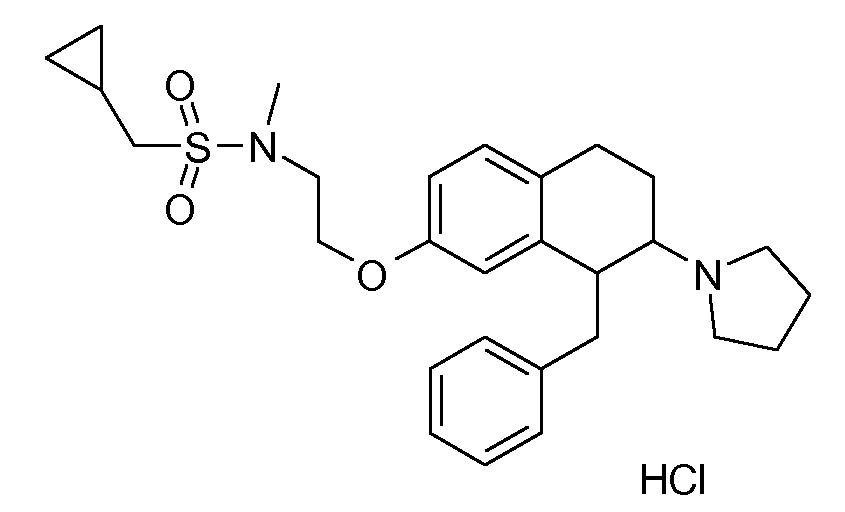
N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропил-N-метилметансульфонамида гидрохлорид синтезируют из 1-циклопропил-N-(2-{[8-(3,4-дихлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-N-метилметансульфонамида гидрохлорида по способу примера 97.
ESI-MS [M+H+]=483, рассчитано для C28H38N2O3S=482.
Пример 128: N-(2-{[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
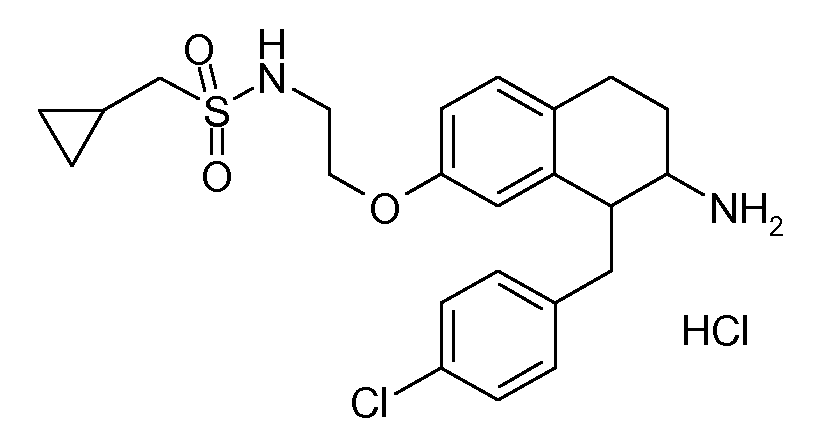
N-(2-{[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=449, рассчитано для C23H29ClN2O3S=448.
Пример 129: N-(2-{[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропил-N-метилметансульфонамида гидрохлорид
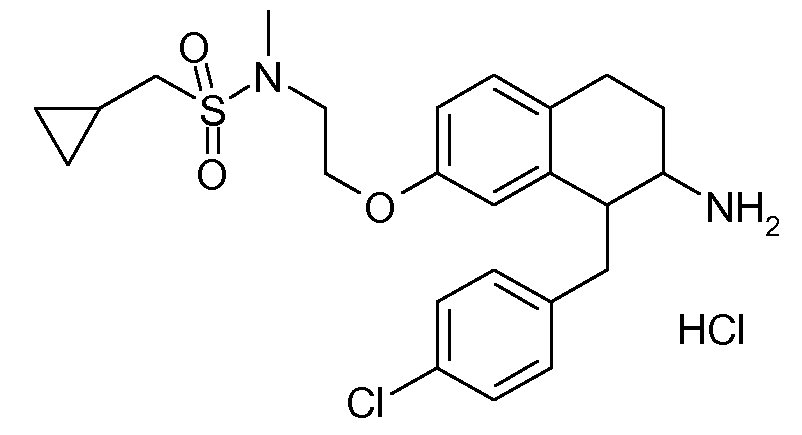
N-(2-{[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропил-N-метилметансульфонамида гидрохлорид получают по способу примера 3, N-метилирование проводят по способу примера 89.
ESI-MS [M+H+]=463, рассчитано для C24H31ClN2O3S=462.
Пример 130: N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]-C-циклопропил-N-метилметансульфонамида гидрохлорид
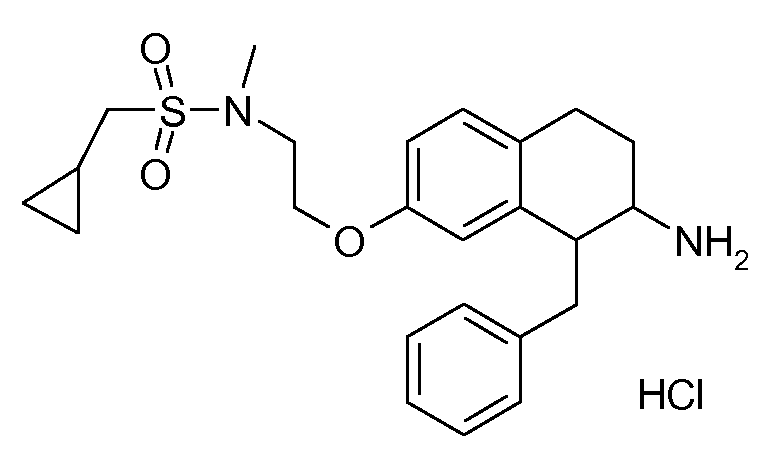
N-[2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]-C-циклопропил-N-метилметансульфонамида гидрохлорид получают из N-(2-{[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропил-N-метилметансульфонамида гидрохлорида (пример 108) по способу примера 97.
ESI-MS [M+H+]=429, рассчитано для C24H32N2O3S=428.
Пример 131: N-(2-{[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
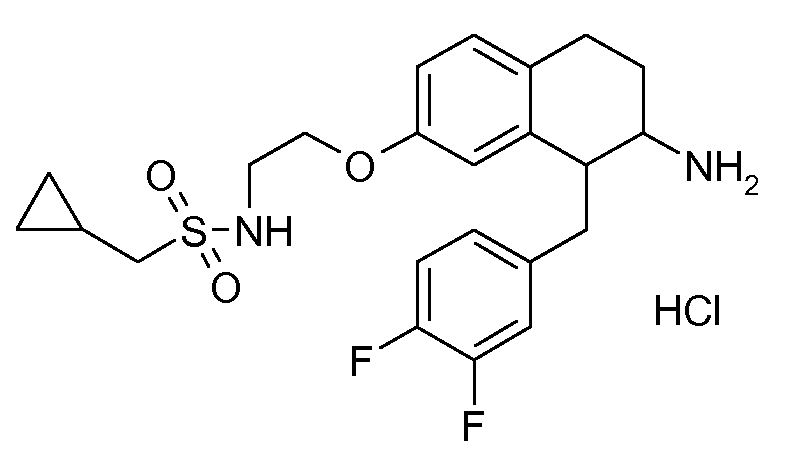
N-(2-{[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид получают по способу примера 3.
ESI-MS [M+H+]=451, рассчитано для C23H28F2N2O3S=450.
Пример 132: C-Циклопропил-N-{2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорид
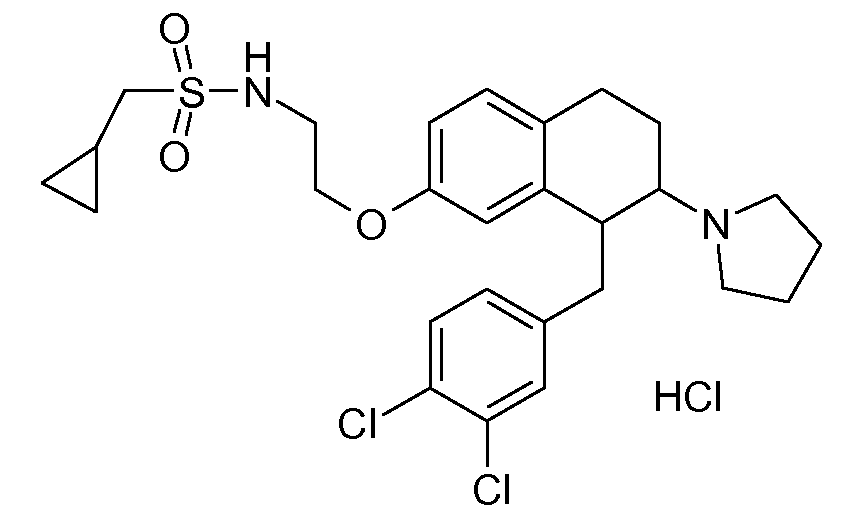
C-Циклопропил-N-{2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорид получают по способу примера 88.
ESI-MS [M+H+]=537, рассчитано для C27H34Cl2N2O3S=536.
Пример 133: N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
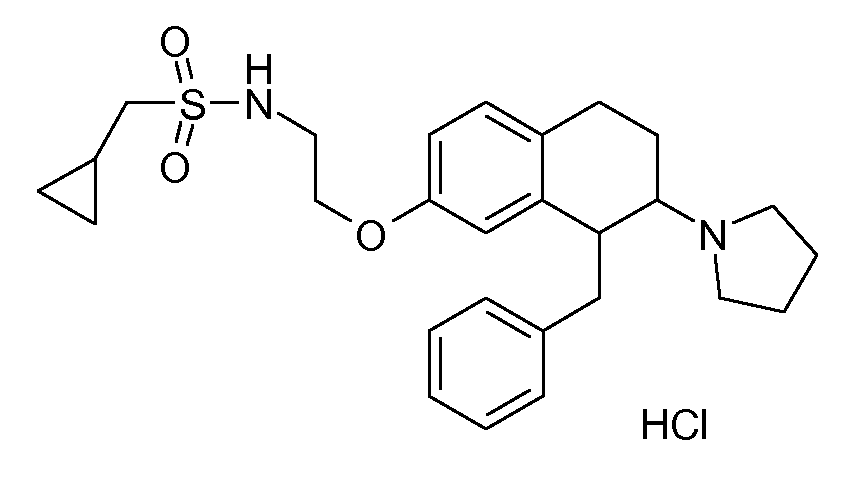
N-(2-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид получают из C-циклопропил-N-{2-[8-(3,4-дихлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорида (пример 132) по способу примера 97.
ESI-MS [M+H+]=469, рассчитано для C27H36N2O3S=468.
Пример 134: 1-Циклопропил-N-[2-({8-(3,4-дихлорбензил)-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]метансульфонамид
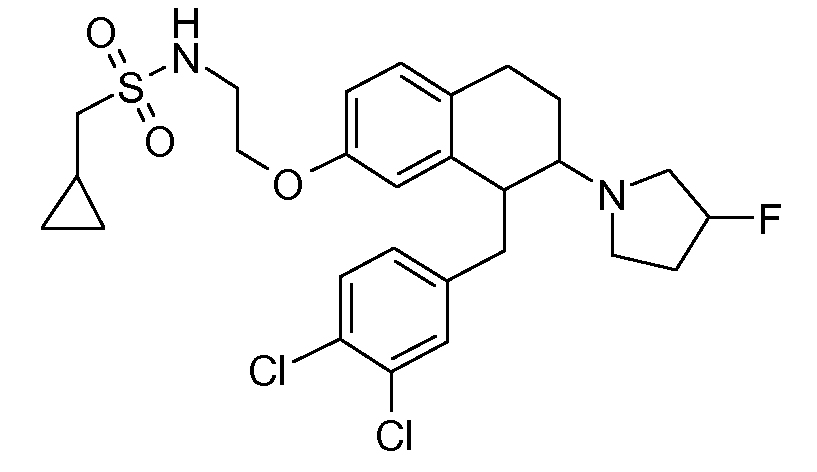
7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ол (691 мг, 2,146 ммоль, пример 34), 2 экв. 1,4-дибром-2-фторбутана и 3 экв. триэтиламина растворяют в ацетонитриле (10 мл) и нагревают в микроволновой печи в течение 2 ч. После добавления воды с этилацетатом, промывания органической фазы насыщенным раствором NaHCO3, NaCl, сушки над Na2SO4 и флэш-хроматографии (силикагель, CH2Cl2/MeOH 95:5) получают 8-(3,4-дихлорбензил)-7-(3-фторпирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол (330 мг, 39%). Этиленсульфонамидную боковую цепь добавляют по способу примеров 1, 7, 8, получая 1-циклопропил-N-[2-({8-(3,4-дихлорбензил)-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]метансульфонамид.
ESI-MS [M+H+]=555, рассчитано для C27H33Cl2FN2O3S=554.
Пример 135: N-(2-{[7-(Азетидин-1-ил)-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамид
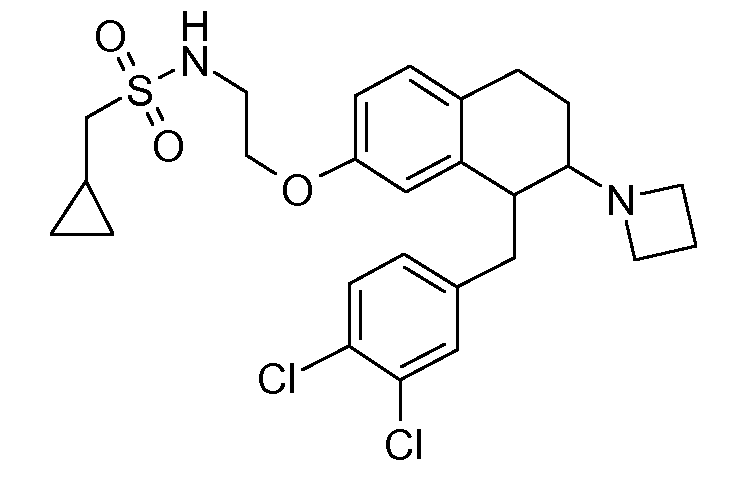
N-(2-{[7-(Азетидин-1-ил)-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамид получают по способу примера 320.
ESI-MS [M+H+]=523, рассчитано для C26H32Cl2N2O3S=522.
Пример 136: N-[2-({8-Бензил-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]-1-циклопропилметансульфонамида гидрохлорид
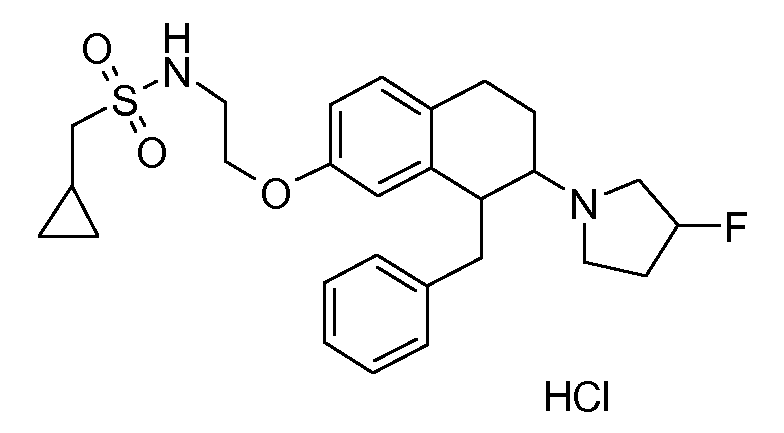
N-[2-({8-Бензил-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]-1-циклопропилметансульфонамида гидрохлорид синтезируют из 1-циклопропил-N-[2-({8-(3,4-дихлорбензил)-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]метансульфонамида (пример 134) по способу примера 97.
ESI-MS [M+H+]=487, рассчитано для C27H35FN2O3S=486.
Пример 137: N-(2-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
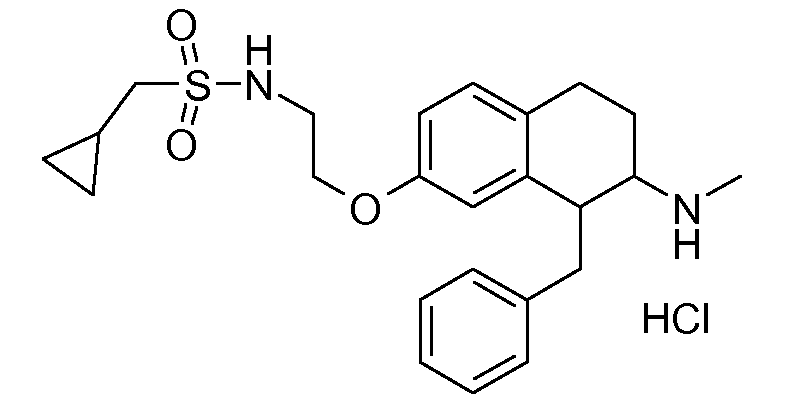
Синтез проводят, используя в качестве исходного вещества этил 1-бензил-7-(2-(циклопропилметилсульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (синтезируют по способу примера 3), который растворяют в ТГФ (50 мл), после чего при комнатной температуре добавляют LiAlH4, и смесь перемешивают в течение 8 ч при нагревании с обратным холодильником. Затем добавляют 2N водный раствор NaOH, экстрагируют CH2Cl2, органические слои промывают насыщенным раствором NaHCO3 и насыщенным раствором NaCl, упаривают растворитель, и получают остаток, который обрабатывают iPrOH/HCl, после чего осаждается продукт. После фильтрования получают белую соль (287 мг, 58%).
ESI-MS [M+H+]=429, рассчитано для C24H32N2O3S=428.
Пример 138: 1-Циклопропил-N-(2-{[8-(3-фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорид
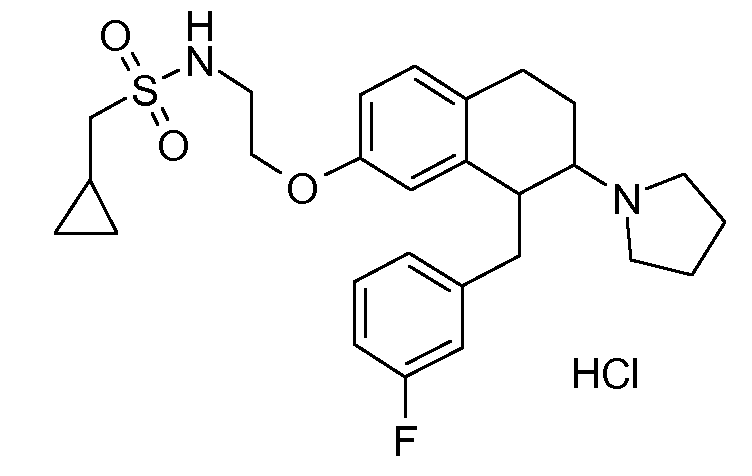
1-Циклопропил-N-(2-{[8-(3-фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=487, C27H35FN2O3S=486.
Пример 139: N-(2-{[7-(Азетидин-1-ил)-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
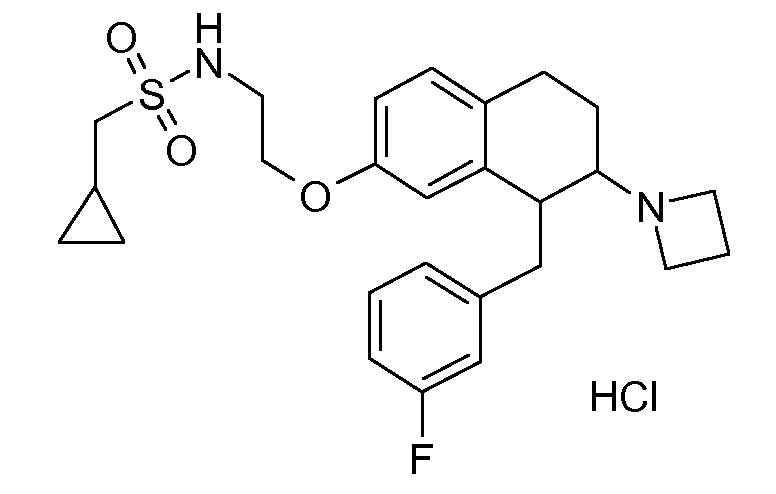
N-(2-{[7-(Азетидин-1-ил)-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид синтезируют по способу примера 320.
ESI-MS [M+H+]=473, C26H33FN2O3S=472.
Пример 140: N-(2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
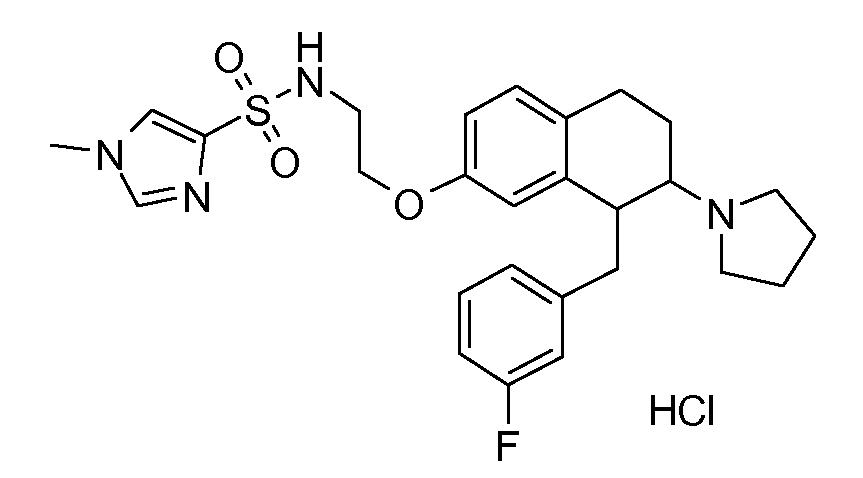
N-(2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=513, C27H33FN4O3S=512.
Пример 141: N-(2-{[7-(Азетидин-1-ил)-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
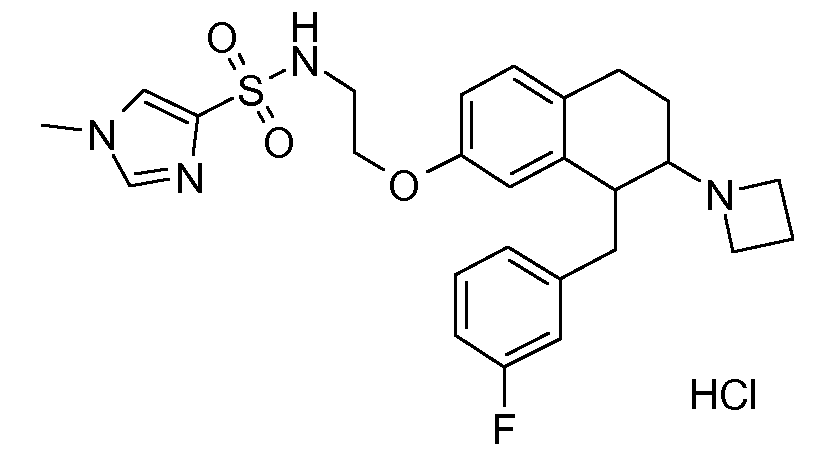
N-(2-{[7-(Азетидин-1-ил)-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способу примера 320.
ESI-MS [M+H+]=499 C26H31FN4O3S=498.
Пример 142: N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
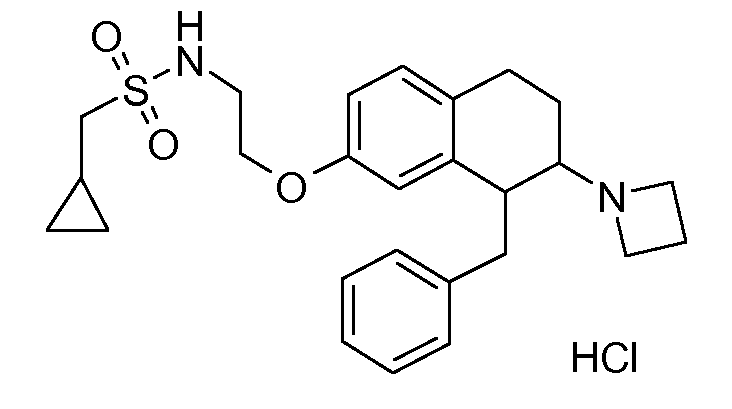
N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид синтезируют по способу примера 320.
ESI-MS [M+H+]=455 C26H34N2O3S=454.
Примеры 143, 144 (Энантиомеры 1 и 2 соединения примера 142)
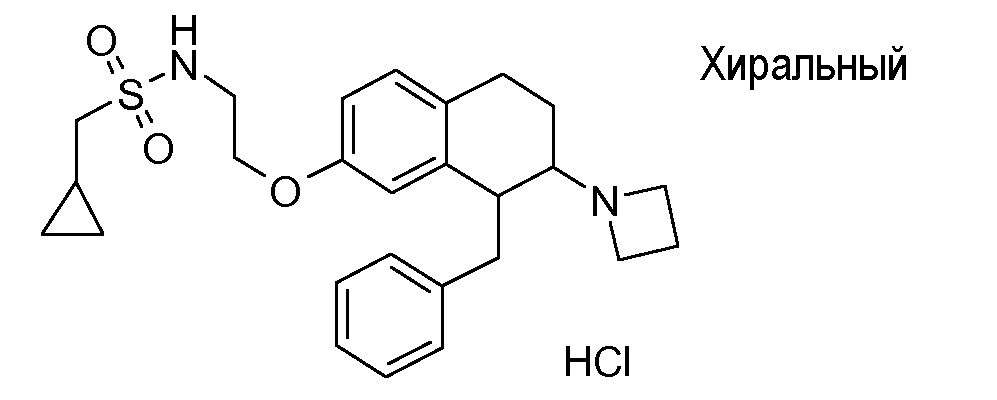
Рацемат N-(2-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорида (пример 142) разделяют хиральной хроматографией на Chiracel AD (н-гептан/этанол 35:65, 0,1% TEA, 9 мл/мин), получая (после превращения в солевую форму) (-)-N-(2-(7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-циклопропилметансульфонамид ([α]=-103,0° в MeOH, c=0,461 г/100 мл [пример 143]) и (+)-N-(2-(7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-циклопропилметансульфонамида сукцинат ([α]=+57,0° в MeOH, c=0,508 г/100 мл [пример 144]).
ESI-MS [M+H+]=455, C26H34N2O3S=454.
Пример 145: N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамид
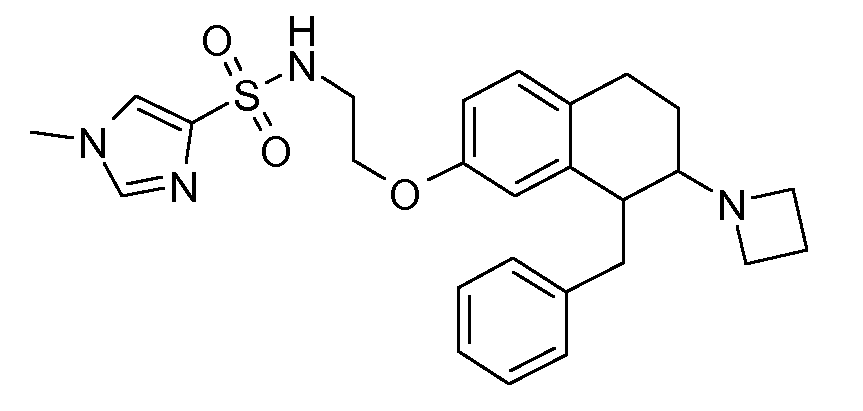
N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамид синтезируют по способу примера 320.
ESI-MS [M+H+]=481, C26H32N4O3S=480.
Пример 146:
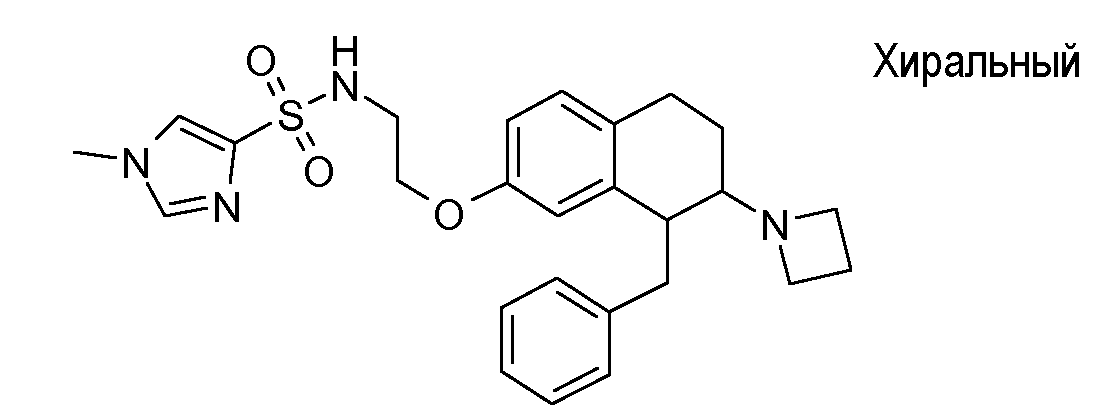
Рацемат N-(2-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида (145) можно разделить хиральной хроматографией с получением (после превращения в солевую форму) (-)-N-(2-((7S,8R)-7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида фумарата ([α]=-81,4° в MeOH, c=0,409 г/100 мл).
ESI-MS [M+H+]=481, рассчитано для C27H34N4O3S=480.
Пример 147: N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)циклобутансульфонамид
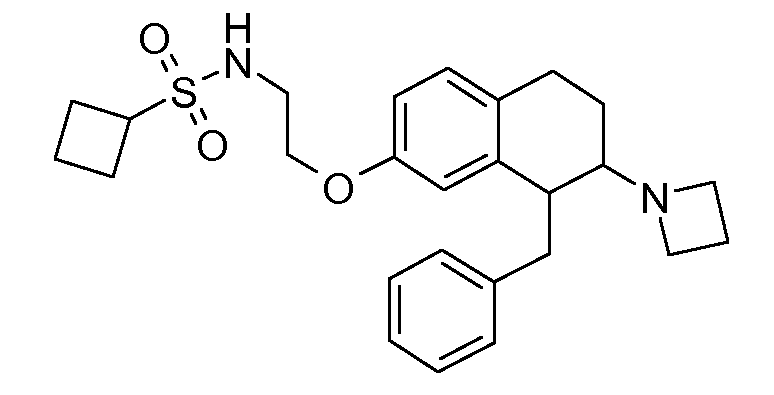
N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)циклобутансульфонамид синтезируют по способу примера 320.
ESI-MS [M+H+]=455, C26H34N2O3S=454.
Пример 148: Пропан-1-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амид
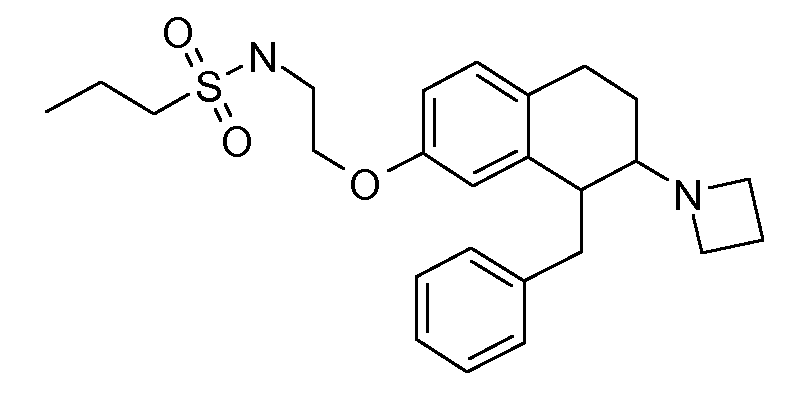
Пропан-1-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амид синтезируют по способу примера 320.
ESI-MS [M+H+]=443, C25H34N2O3S=442.
Пример 149: N-(2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамида гидрохлорид
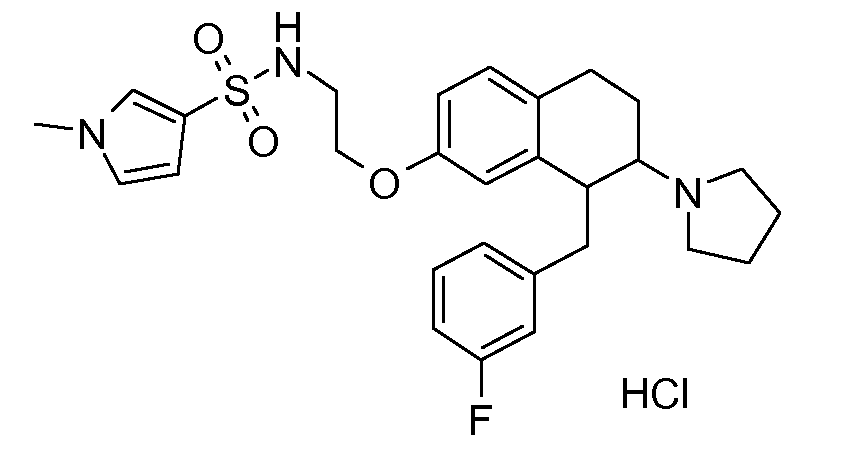
N-(2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамида гидрохлорид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=512, C28H34FN3O3S=511.
Пример 150: N-(2-{[7-Амино-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
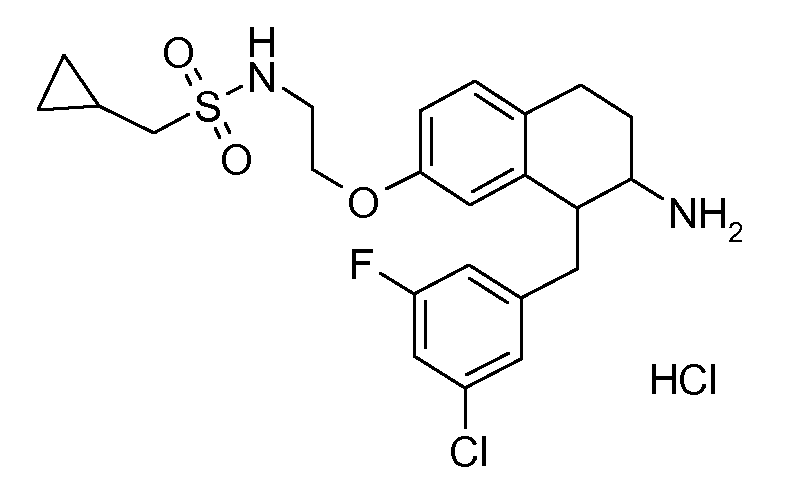
N-(2-{[7-Амино-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид синтезируют по способу примера 3.
ESI-MS [M+H+]=467, C23H28ClFN2O3S=466.
Пример 151: N-(2-{[7-Амино-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
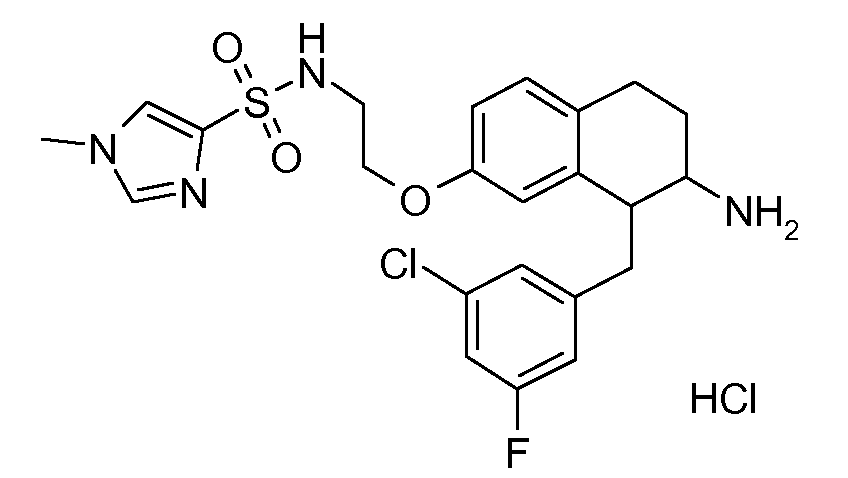
N-(2-{[7-Амино-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способу примера 3.
ESI-MS [M+H+]=493, C23H26ClFN4O3S=492.
Пример 152: N-[2-({8-Бензил-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
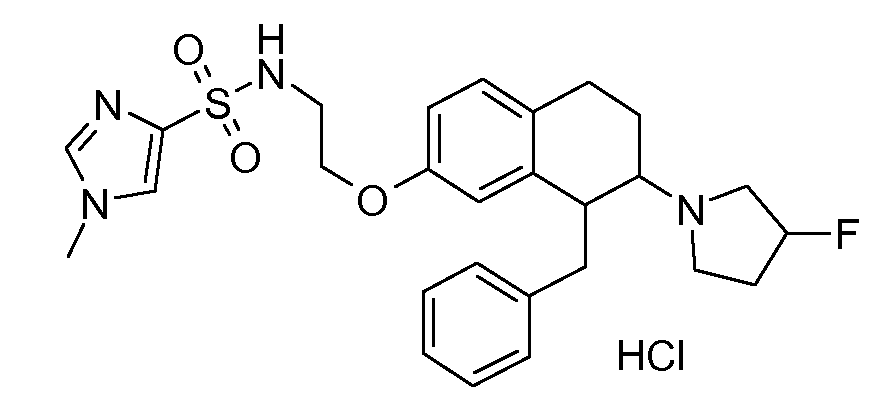
N-[2-({8-Бензил-7-[3-фторпирролидин-1-ил]-5,6,7,8-тетрагидронафтален-2-ил}окси)этил]-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способу примера 264/88.
ESI-MS [M+H+]=513, C27H33FN4O3S=512.
Пример 153: N-(2-{[8-(3-Цианобензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамид
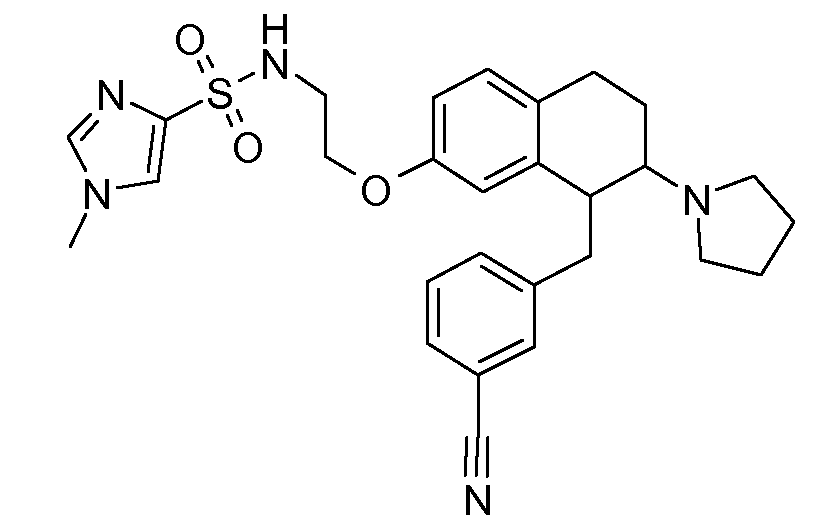
N-(2-{[8-(3-Цианобензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамид синтезируют по способу примера 264/88.
ESI-MS [M+H+]=520, C28H33N5O3S=519.
Пример 154: N-(2-{[8-(3-Цианобензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
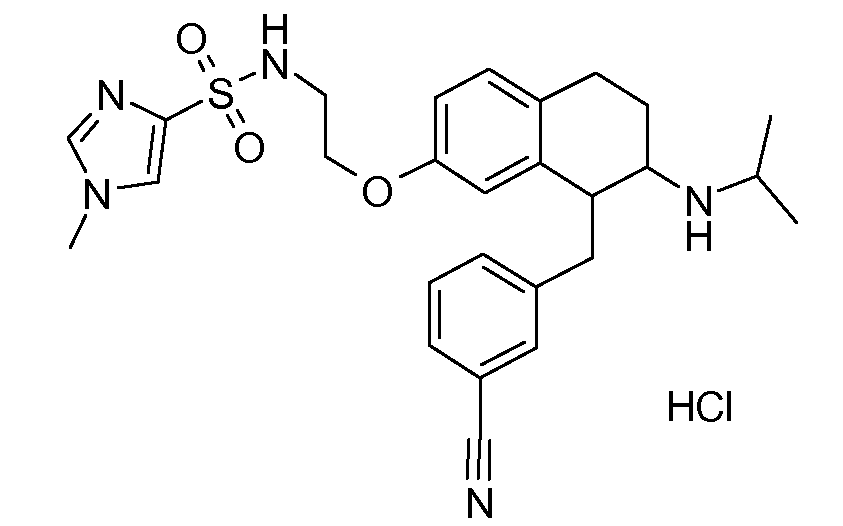
N-(2-{[8-(3-Цианобензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способу примера 88.
ESI-MS [M+H+]=508, C27H33N5O3S=507.
Пример 155: N-(2-{[8-(3-Цианобензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
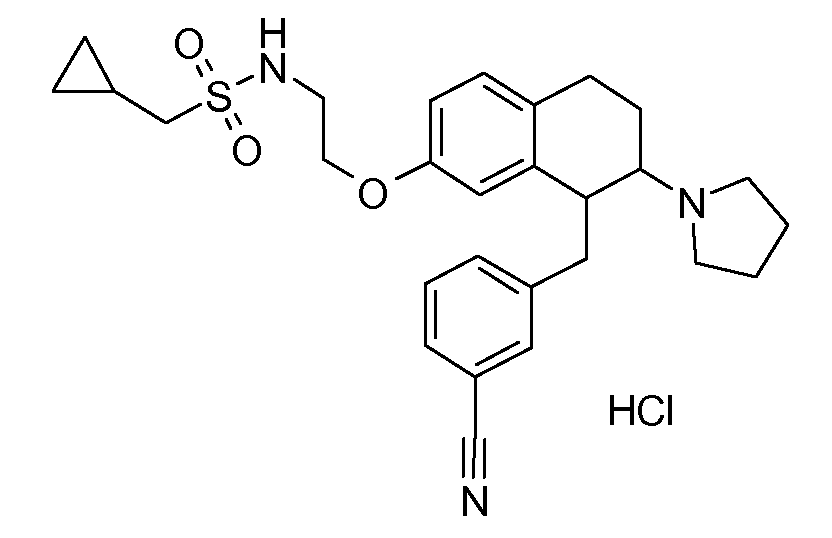
N-(2-{[8-(3-Цианобензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=494, C28H35N3O3S=493.
Пример 156: N-(2-{[8-(3-Цианобензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
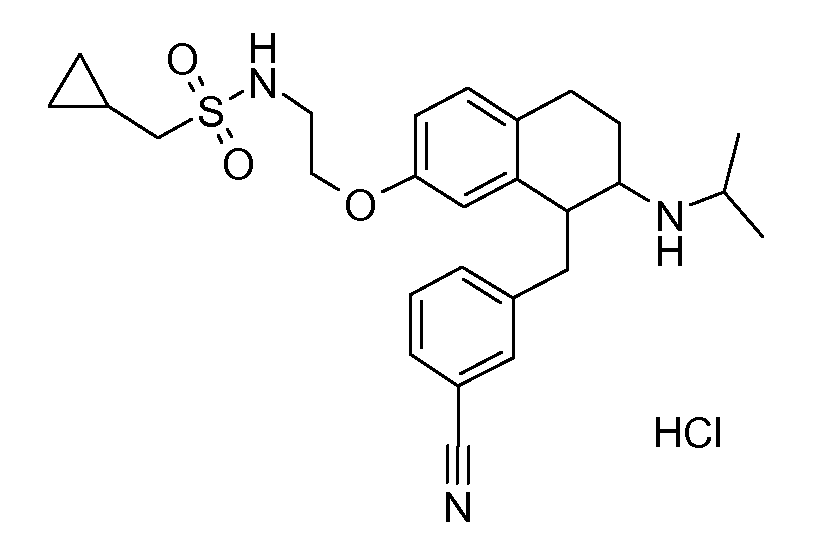
N-(2-{[8-(3-Цианобензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид синтезируют по способу примера 88.
ESI-MS [M+H+]=482, C27H35N3O3S=481.
Пример 157: N-(2-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)пропан-1-сульфонамида гидрохлорид
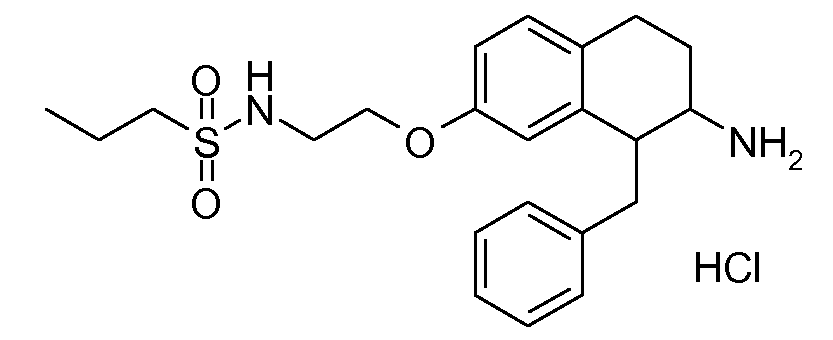
N-(2-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)пропан-1-сульфонамида гидрохлорид синтезируют из пропан-1-сульфоновой кислоты {2-[7-амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорида (пример 8) по способу примера 97.
ESI-MS [M+H+]=403, C22H30N2O3S=402.
Пример 158: N-(2-{[8-(3-Хлор-5-фторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
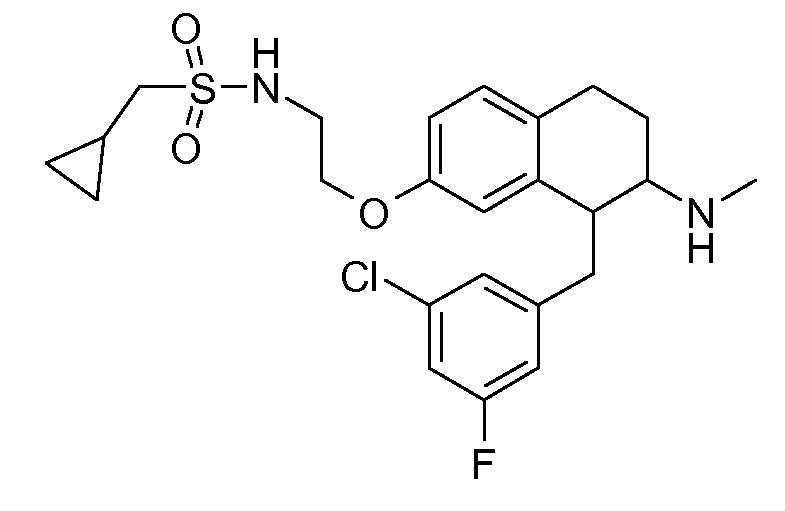
Синтез проводят, используя в качестве исходного вещества этил 1-(3-хлор-5-фторбензил)-7-(2-(циклопропилметилсульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (синтезированный по способу примера 3), который растворяют в ТГФ (50 мл), после чего при комнатной температуре добавляют LiAlH4, и смесь перемешивают в течение 8 ч при нагревании с обратным холодильником. После добавления 2N водного раствора NaOH, экстракции CH2Cl2, промывания органических слоев насыщенным раствором NaHCO3 и насыщенным раствором NaCl и упаривания растворителя получают остаток, который обрабатывают iPrOH/HCl, после чего осаждается продукт. После фильтрации получают белую соль (134 мг, 39%).
ESI-MS [M+H+]=481, рассчитано для C24H30ClFN2O3S=480.
Пример 159: N-(2-{[7-(Азетидин-1-ил)-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида (2E)-бут-2-ендиоат
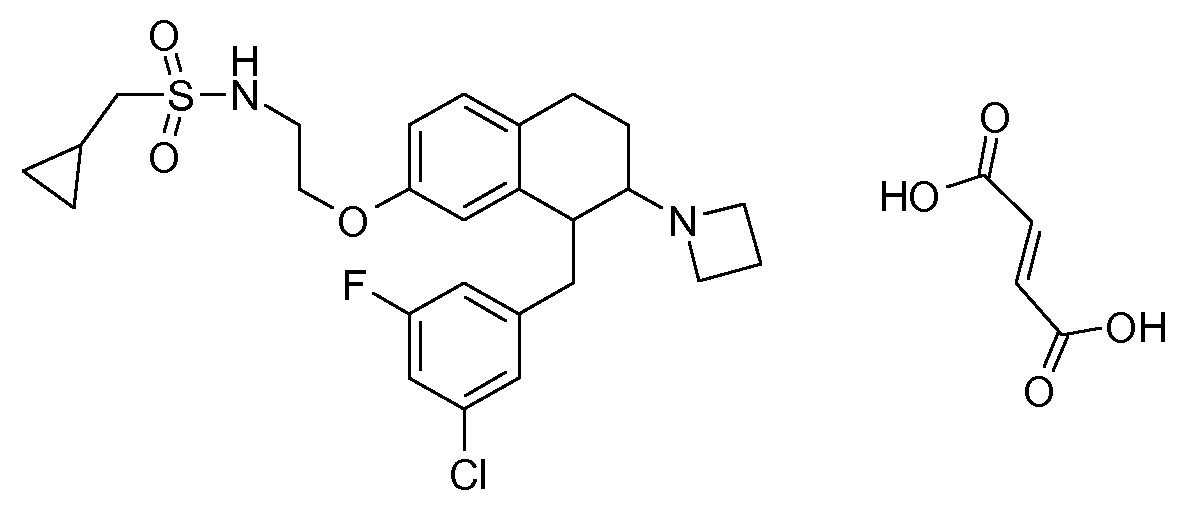
N-(2-{[7-(Азетидин-1-ил)-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида (2E)-бут-2-ендиоат синтезируют по способу примера 320.
ESI-MS [M+H+]=507, C26H32ClFN2O3S=506.
Пример 160: N-(2-{[7-(Азетидин-1-ил)-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида (2E)-бут-2-ендиоат
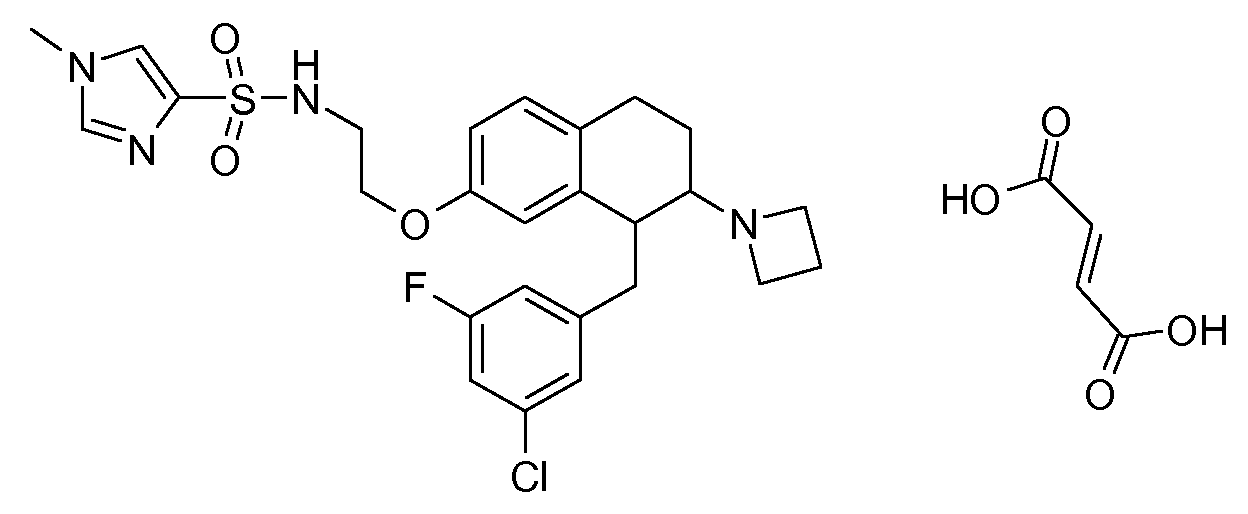
N-(2-{[7-(Азетидин-1-ил)-8-(3-хлор-5-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида (2E)-бут-2-ендиоат синтезируют по способу примера 320.
ESI-MS [M+H+]=533, C26H30ClFN4O3S=532.
Пример 161: 1-Циклопропил-N-(2-{[8-(4-фторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамид
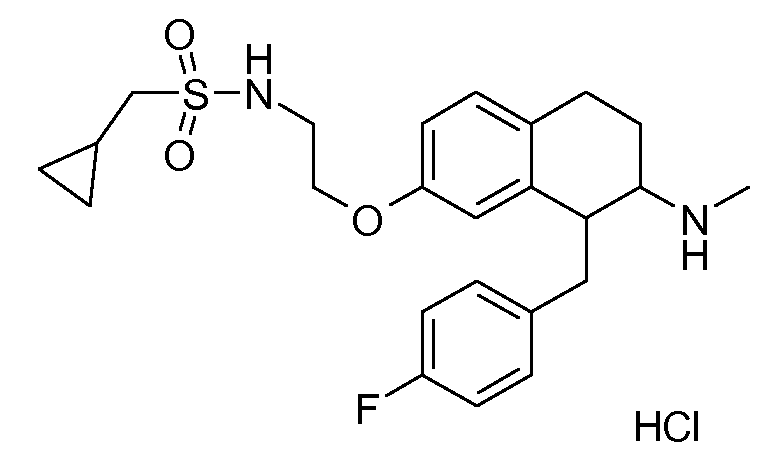
Синтез проводят, используя в качестве исходного вещества этил 7-(2-(циклопропилметилсульфонамидо)этокси)-1-(4-фторбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (синтезированный по способу примера 3), который растворяют в ТГФ (50 мл), после чего добавляют LiAlH4 при комнатной температуре, и смесь перемешивают в течение 8 ч при нагревании с обратным холодильником. Добавляют 2N водный раствор NaOH, экстрагируют CH2Cl2, органические слои промывают насыщенным раствором NaHCO3 и насыщенным раствором NaCl, и упаривают растворитель, получая остаток, который обрабатывают iPrOH/HCl, после чего осаждается продукт. После фильтрации получают белую соль (89 мг, 76%).
ESI-MS [M+H+]=447, C24H31FN2O3S=446.
Пример 162: (-)-N-(2-(8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
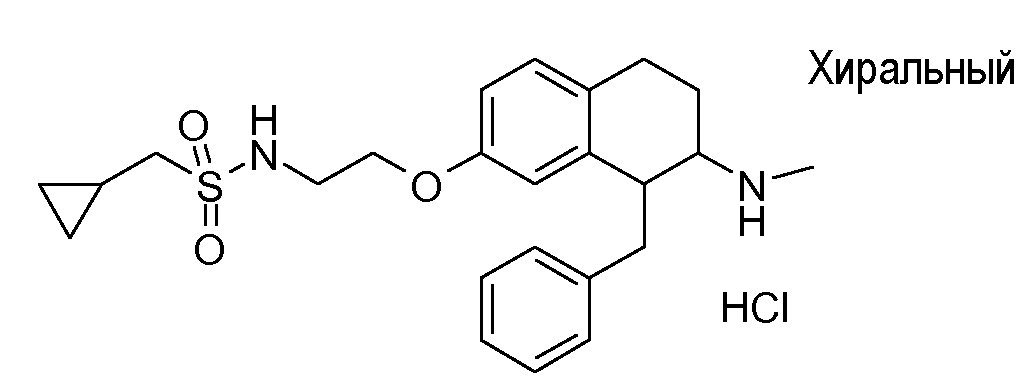
Синтез проводят, используя в качестве исходного вещества (-)этил 1-бензил-7-(2-(циклопропилметилсульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат (137), который растворяют в ТГФ (50 мл), после чего добавляют LiAlH4 при комнатной температуре, и смесь перемешивают в течение 8 ч при нагревании с обратным холодильником. Добавляют 2N водный раствор NaOH, экстрагируют CH2Cl2, органические слои промывают насыщенным раствором NaHCO3 и насыщенным раствором NaCl, и упаривают растворитель, получая остаток, который обрабатывают iPrOH/HCl, после чего осаждается продукт. После фильтрации получают белую соль (102 мг, 79%). Рацемат разделяют методом хиральной хроматографии на Chiracel AD (н-гептан/этанол/трет-бутанол 800:150:50), получая (после превращения в солевую форму) (-)-N-(2-(8-бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид ([α]=-80,5° в MeOH, c=0,191 г/100 мл).
ESI-MS [M+H+]=429, C24H32N2O3S=428.
Пример 163: 1-Метил-N-(2-{[8-(3-метилбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1H-имидазол-4-сульфонамид
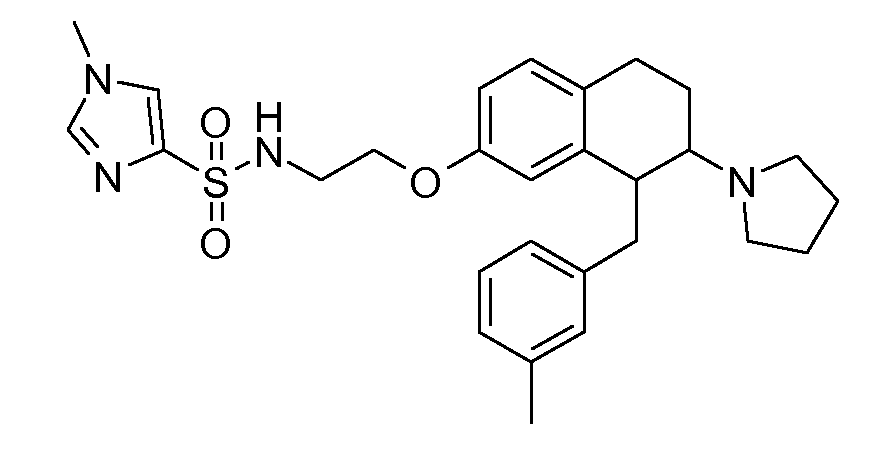
1-Метил-N-(2-{[8-(3-метилбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1H-имидазол-4-сульфонамид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=509, C28H36N4O3S=508.
Пример 164: N-(2-{[8-(3-Метоксибензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
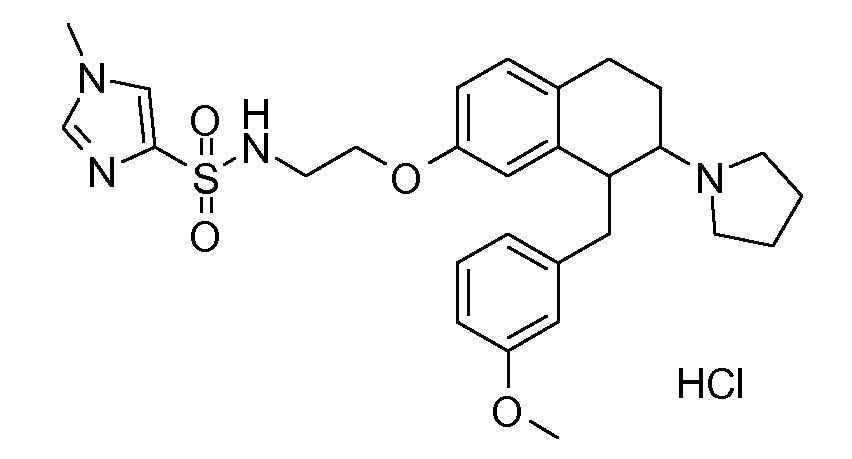
N-(2-{[8-(3-Метоксибензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорид синтезируют по способам примеров 264/88.
ESI-MS [M+H+]=525, C28H36N4O4S=524.
Пример 165: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-трифторметилбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
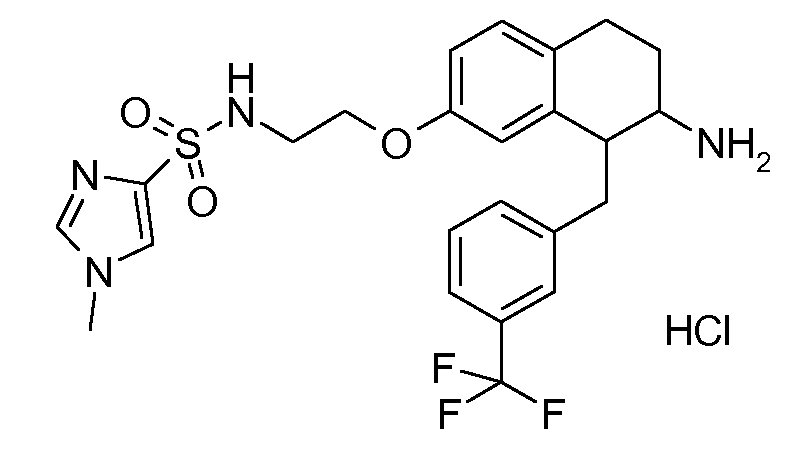
1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-трифторметилбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид синтезируют по способу примера 3.
ESI-MS [M+H+]=509, C24H27F3N4O3S=508.
Соединения нижеследующих примеров получают по способу примера 40:
Пример 166: N-{[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
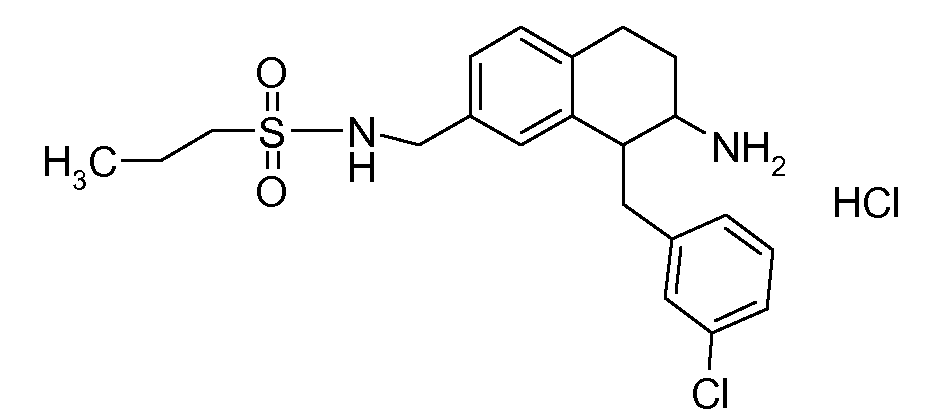
ESI-MS [M+H+]=407, рассчитано для C24H27ClN2O2S=406.
Пример 167: N-[(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил]метансульфонамида гидрохлорид
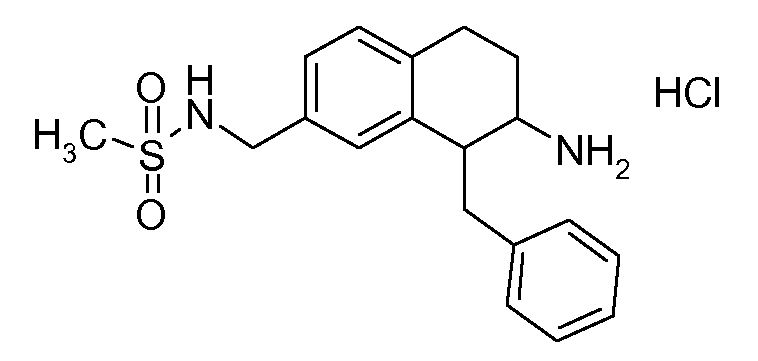
ESI-MS [M+H+]=345, рассчитано для C19H24N2O2S=344.
Пример 168: N-[(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил]бензолсульфонамида гидрохлорид
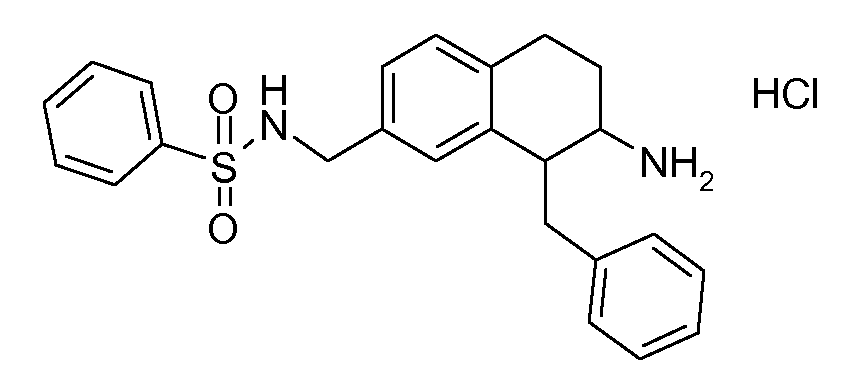
ESI-MS [M+H+]=407, рассчитано для C24H26N2O2S=406.
Пример 169: Энантиомер 2 N-{[7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорида
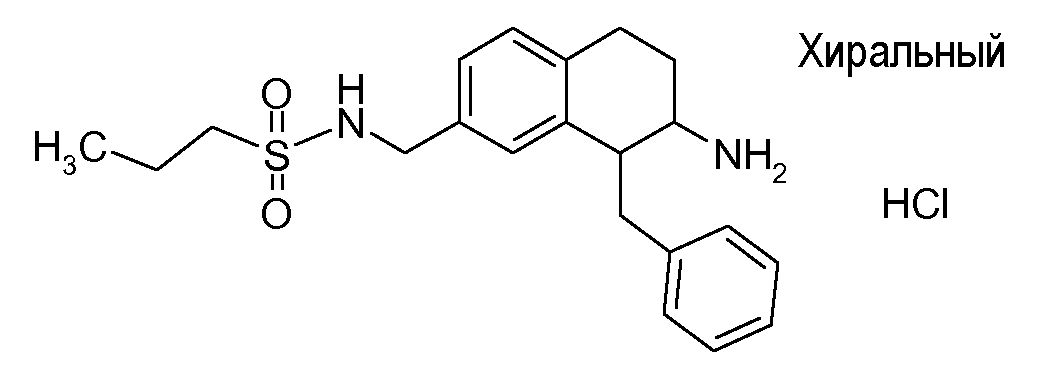
Соединение получают после хиральной хроматографии (Chiralpak AD-H, 30 мм ID × 250 мм, н-гексан/EtOH/MeOH/диэтиламин = 20/40/40/0,1) из рацемического соединения (пример 42) в виде пика, который элюируется первым. Оптическое вращение = -50° (589 нм, 25°C, c=0,1 в метаноле).
ESI-MS [M+H+]=373, рассчитано для C21H28N2O2S=372.
Пример 170: Энантиомер 1 N-{[7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорида
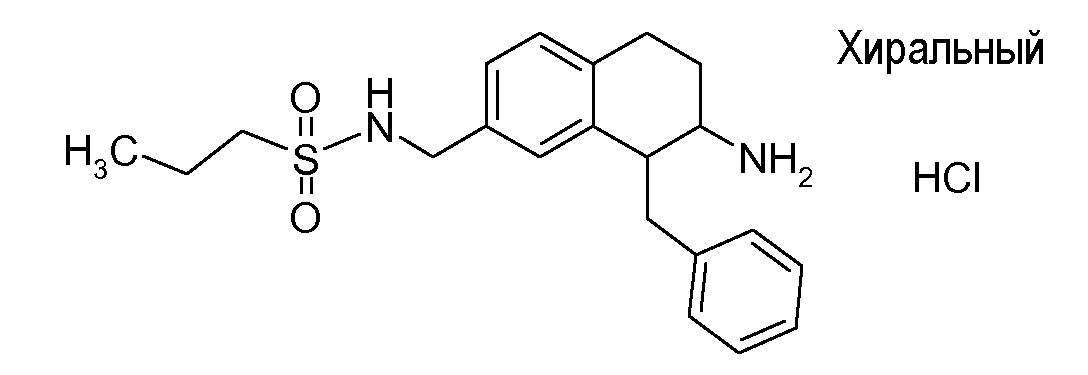
Соединение получают после хиральной хроматографии (Chiralpak AD-H 30 мм ID Ч 250 мм, н-гексан/EtOH/MeOH/диэтиламин=20/40/40/0,1) из рацемического соединения (пример 42) в виде пика, который элюируется вторым. Оптическое вращение = +49° (589 нм, 25°C, c=0,1 в метаноле).
ESI-MS [M+H+]=373, рассчитано для C21H28N2O2S=372.
Пример 171: N-{[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
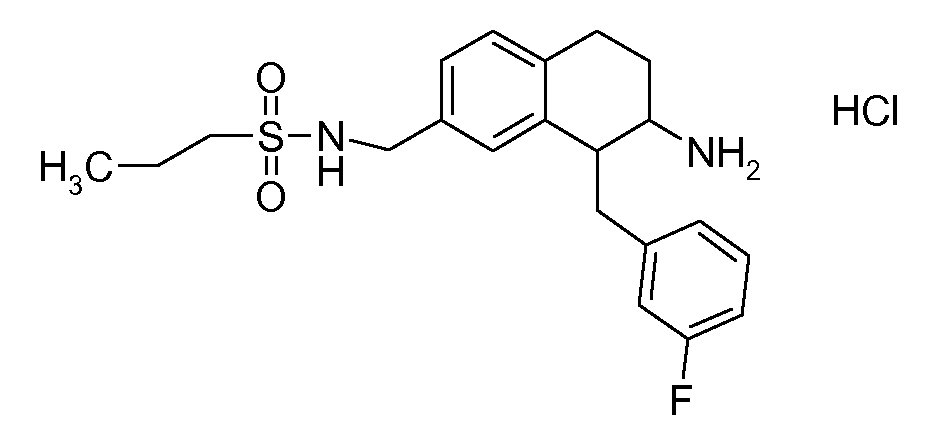
ESI-MS [M+H+]=391, рассчитано для C21H27FN2O2S=390.
Пример 172: N-[(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил]-1-метил-1H-пиразол-4-сульфонамида гидрохлорид
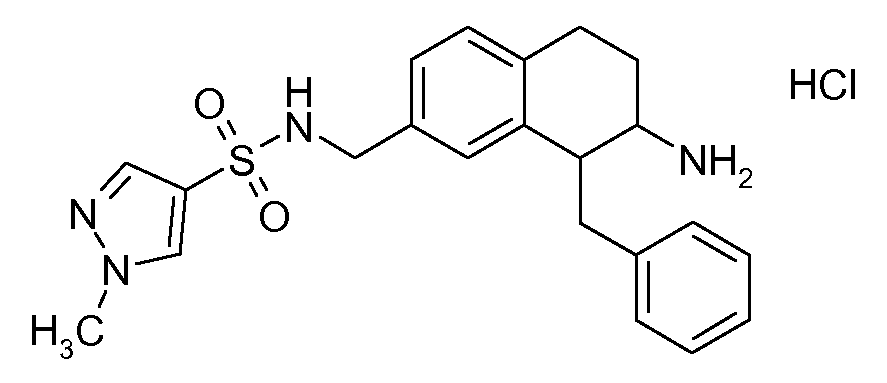
ESI-MS [M+H+]=411, рассчитано для C22H26N4O2S=410.
Пример 173: N-[(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил]-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
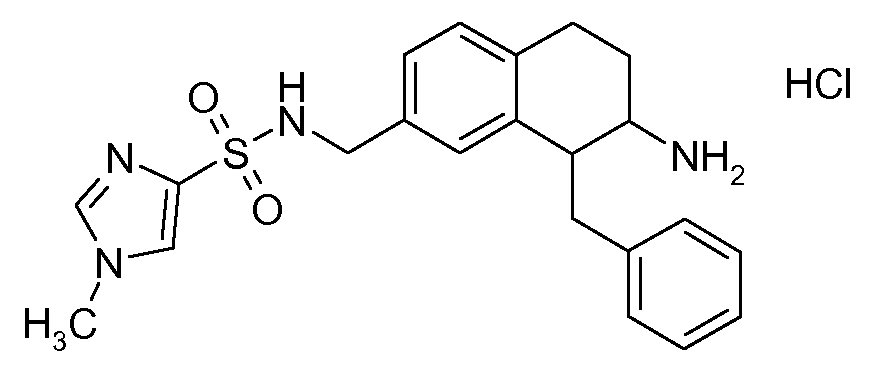
ESI-MS [M+H+]=411, рассчитано для C22H26N4O2S=410.
Пример 174: N-{[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорид
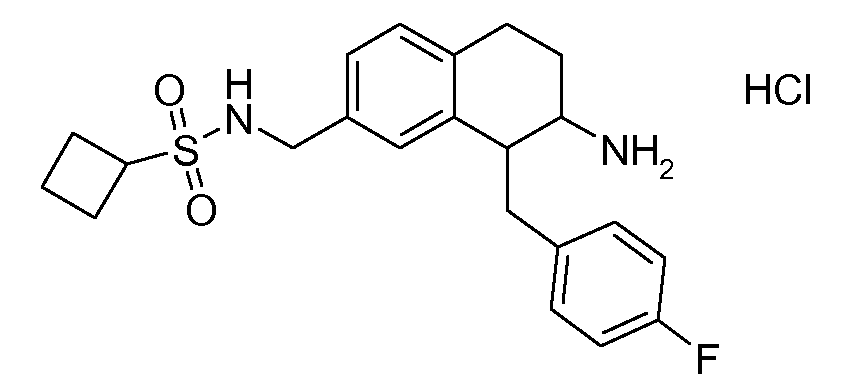
ESI-MS [M+H+]=403, рассчитано для C22H27FN2O2S=402.
Пример 175: N-{[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
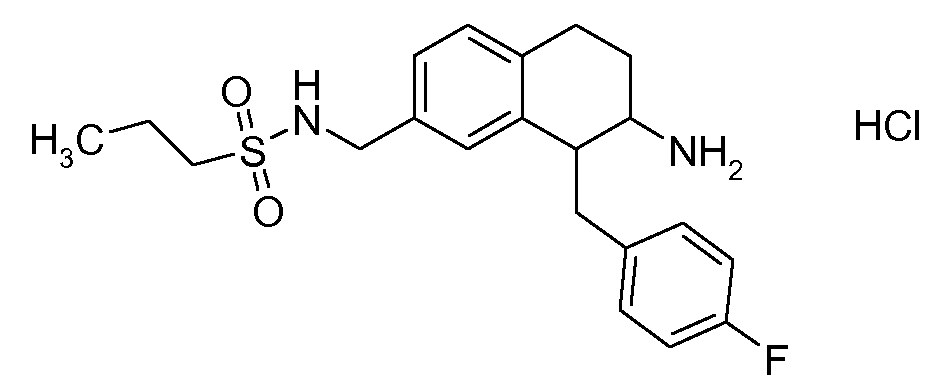
ESI-MS [M+H+]=391, рассчитано для C21H27FN2O2S=390.
Пример 176: N-{[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
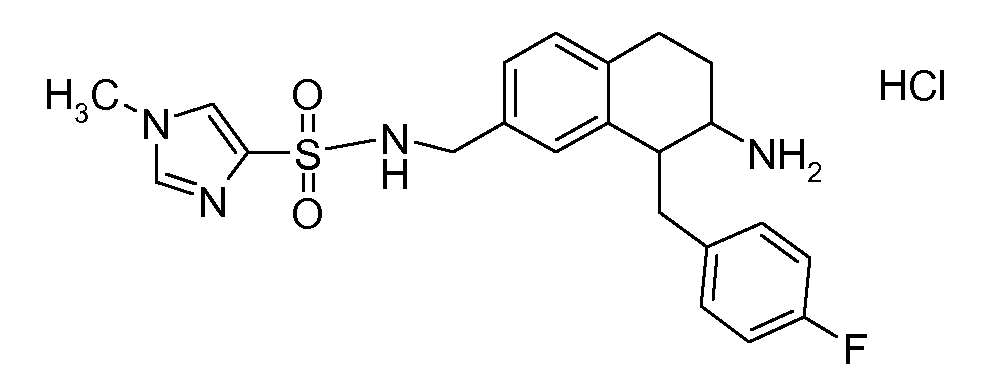
ESI-MS [M+H+]=429, рассчитано для C22H25FN4O2S=428.
Пример 177: N-{[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
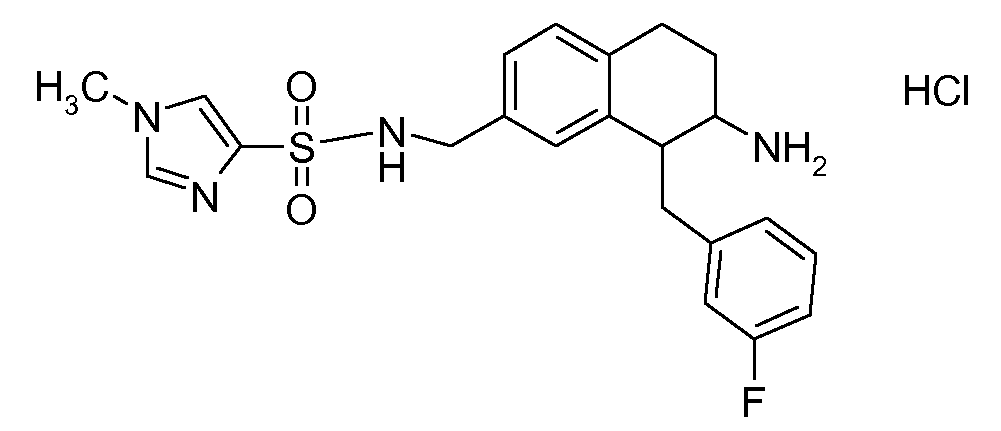
ESI-MS [M+H+]=429, рассчитано для C22H25FN4O2S=428.
Пример 178: N-{[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-4-сульфонамида гидрохлорид
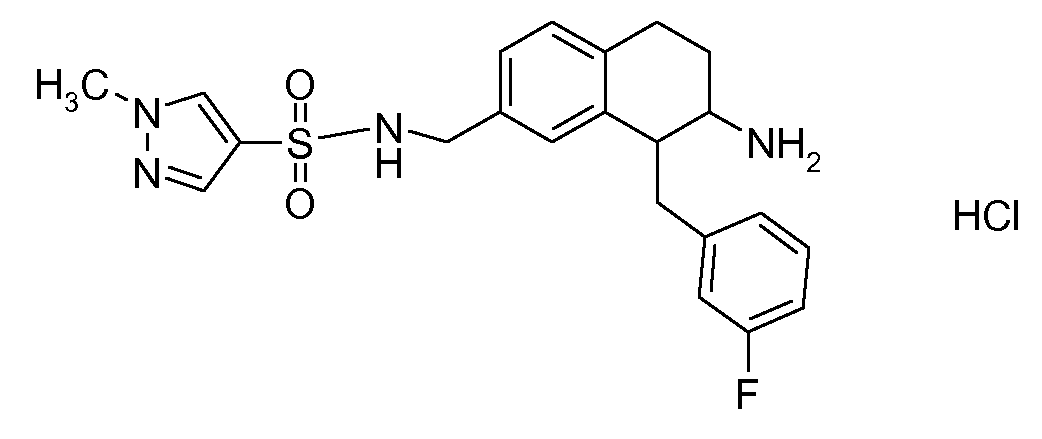
ESI-MS [M+H+]=429, рассчитано для C22H25FN4O2S=428.
Пример 179: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-3-метилбензолсульфонамида гидрохлорид
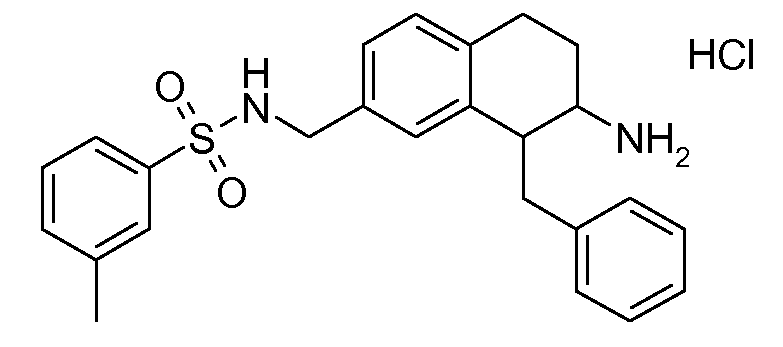
ESI-MS [M+H+]=421, рассчитано для C25H28N2O2S=420.
Пример 180: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиррол-3-сульфонамида гидрохлорид
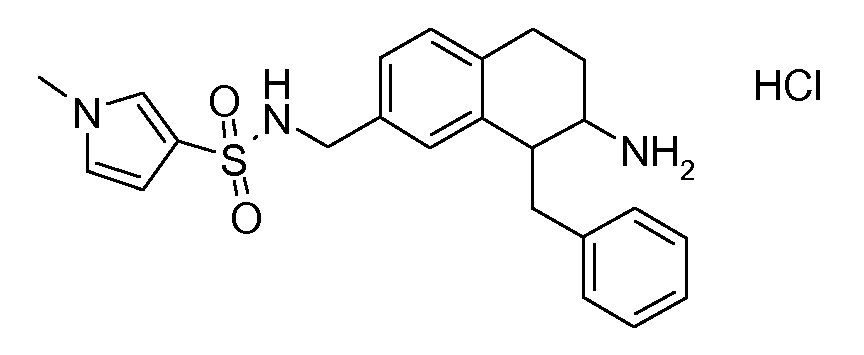
ESI-MS [M+H+]=410, рассчитано для C23H27N3O2S=409.
Пример 181: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пиридин-3-сульфонамида дигидрохлорид
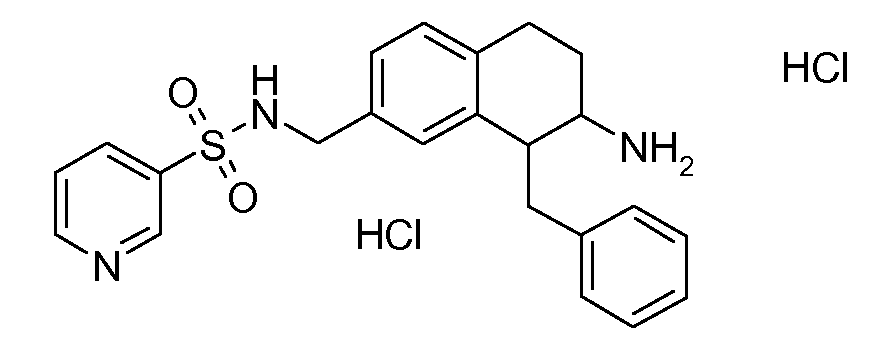
ESI-MS [M+H+]=408, рассчитано для C23H25N3O2S=407.
Пример 182: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-3-(трифторметил)-1H-пиразол-4-сульфонамида гидрохлорид
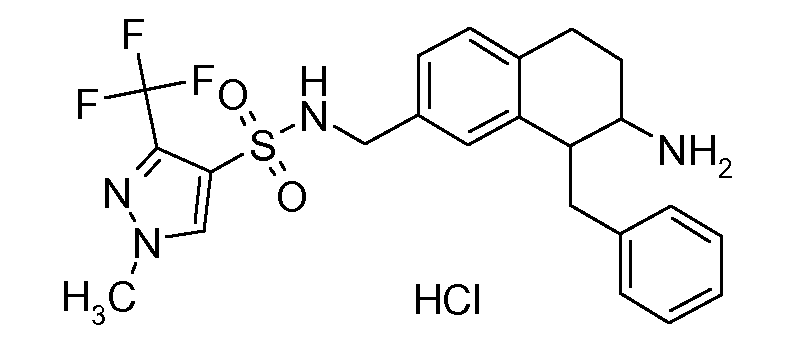
ESI-MS [M+H+]=479, рассчитано для C23H25F3N4O2S=478.
Пример 183: N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-3-сульфонамида гидрохлорид
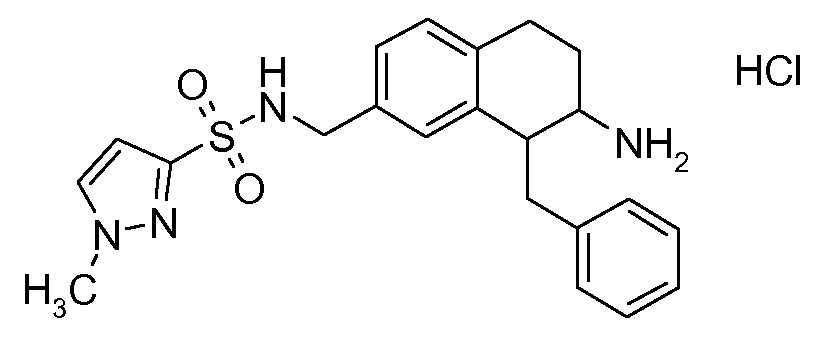
ESI-MS [M+H+]=411, рассчитано для C22H26N4O2S=410.
Пример 184: N-{[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорид
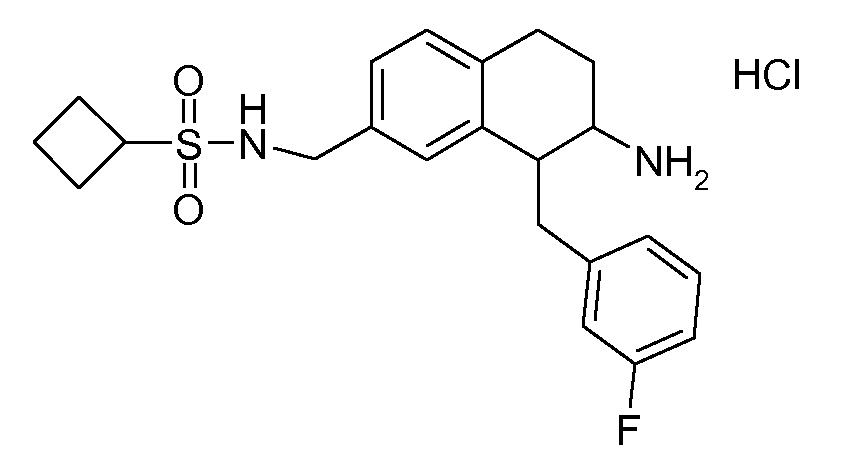
ESI-MS [M+H+]=403, рассчитано для C22H27FN2O2S=402.
Пример 185: N-{[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-циклопропилметансульфонамида гидрохлорид
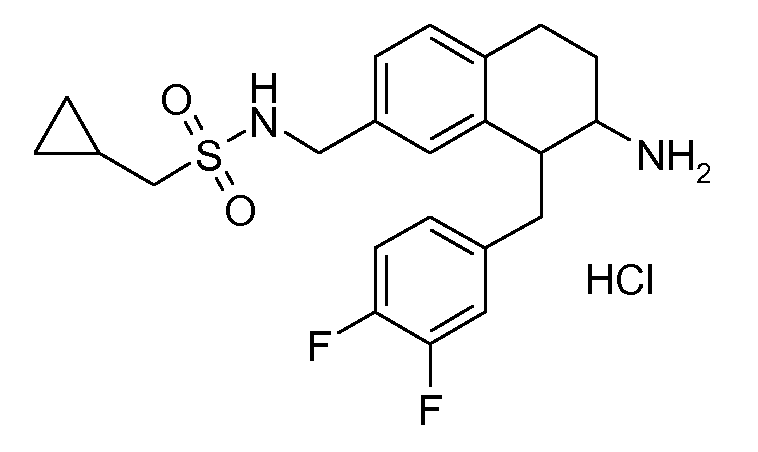
ESI-MS [M+H+]=421, рассчитано для C22H26F2N2O2S=420.
Пример 186: N-{[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорид
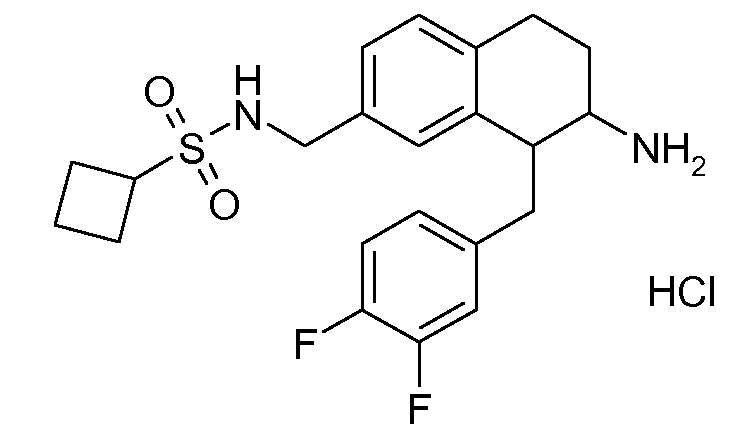
ESI-MS [M+H+]=421, рассчитано для C22H26F2N2O2S=420.
Пример 187: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
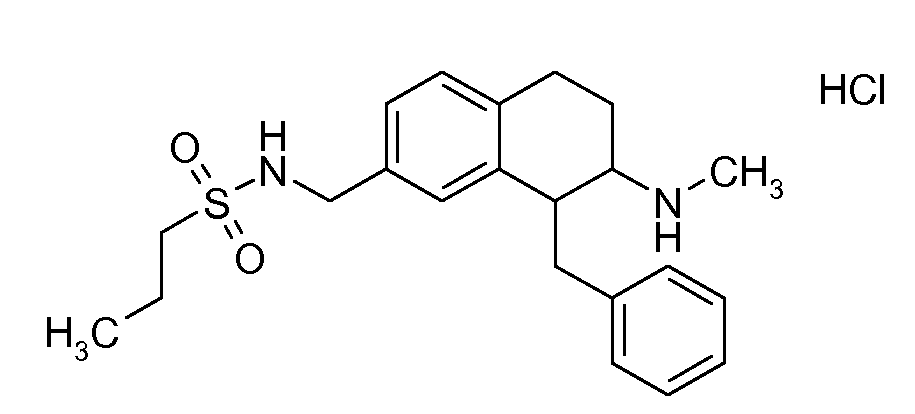
трет-Бутил [1-бензил-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат, полученный по способу примера 39 (1240 мг, 2,62 ммоль), растворяют в тетрагидрофуране (50 мл). При комнатной температуре по каплям добавляют раствор гидрида лития алюминия (1 M в тетрагидрофуране, 7,87 мл, 7,87 ммоль). Затем реакционную смесь нагревают при 60°C в течение 1 ч. После обработки водой, очистки экстрагированного продукта флэш-хроматографией (силикагель, дихлорметан, метанол) и обработки 1,25 M раствором хлористоводородной кислоты в этаноле с последующей концентрацией в вакууме получают целевой продукт. Выход: 590 мг (1,4 ммоль, 53%).
ESI-MS [M+H+]=425, рассчитано для C22H30N2O2S=424.
По способу примера 187 получают соединения следующих примеров:
Пример 188: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорид
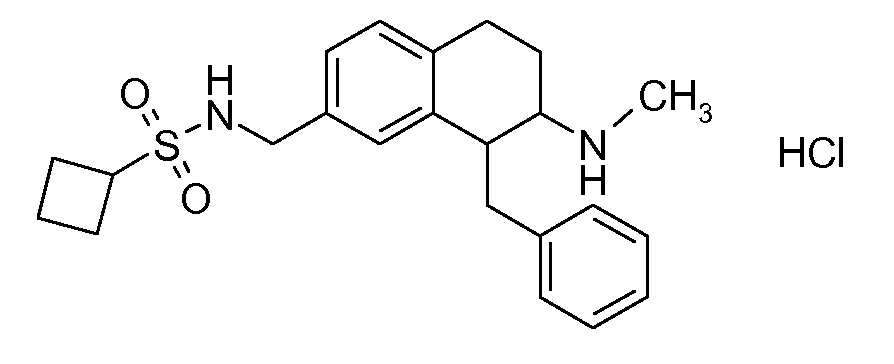
ESI-MS [M+H+]=400, рассчитано для C23H30N2O2S=399.
Пример 189: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}-3-метилбензолсульфонамида гидрохлорид
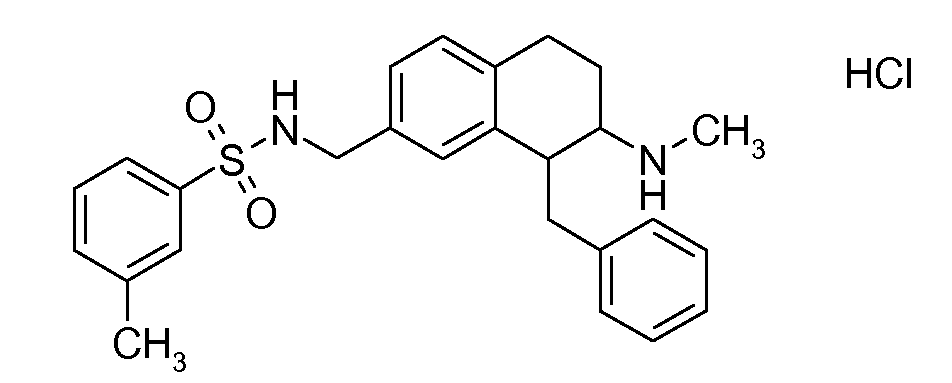
ESI-MS [M+H+]=435, рассчитано для C26H30N2O2S=434.
Пример 190: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиррол-3-сульфонамида гидрохлорид
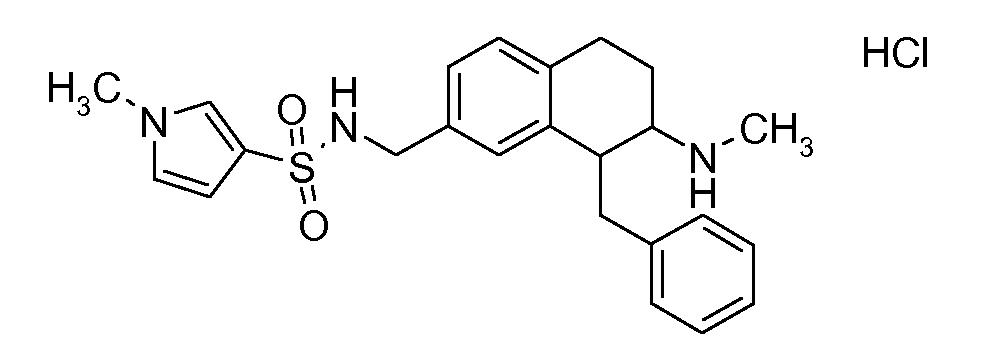
ESI-MS [M+H+]=424, рассчитано для C24H29N3O2S=423.
Пример 191: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-3-сульфонамида гидрохлорид
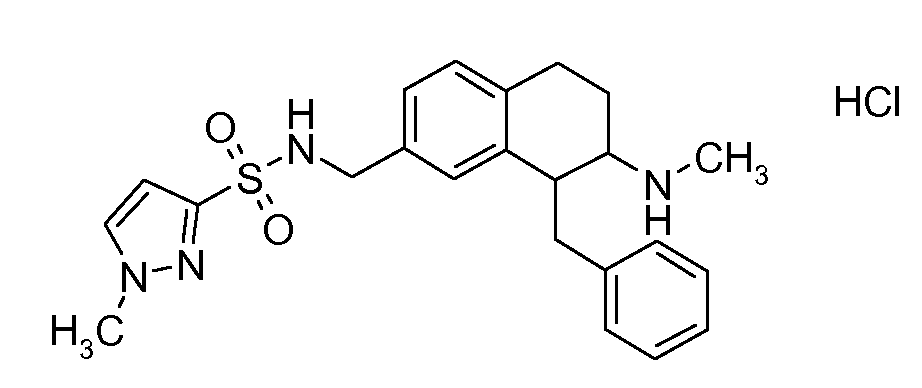
ESI-MS [M+H+]=425, рассчитано для C23H28N4O2S=424.
Пример 192: Энантиомер 1 N-{[8-бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорида
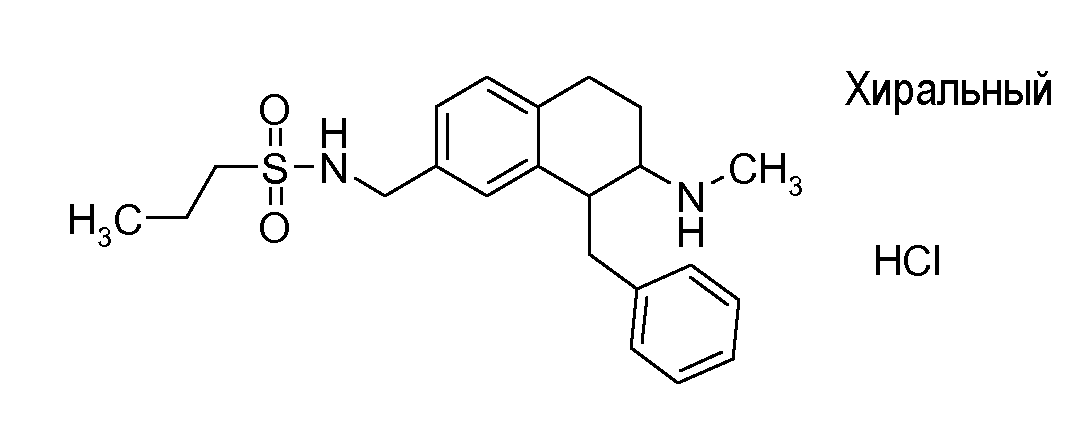
Для синтеза используют хиральный структурный элемент, т.е. энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата.
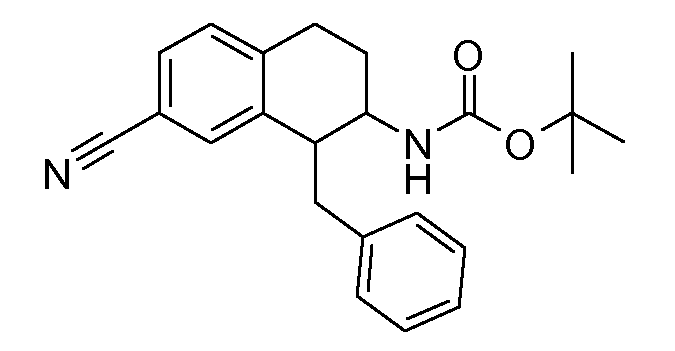
трет-Бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамат можно получить по способу, используемому для получения дихлор-производного, описанному в примере 34. Цис-изомер можно разделить на энантиомеры методом хиральной хроматографии (Daicel, Chiralpak IC, 250Ч4,6 мм ID, 5 мкм, смесь н-гептан/этанол=1/9, содержащая 0,1% триэтиламина). Энантиомер, элюирующийся вторым, используют для описанного выше синтеза.
ESI-MS [M+H+]=387, рассчитано для C22H30N2O2S=386.
Пример 193: Энантиомер 1 N-{[8-бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамида гидрохлорида
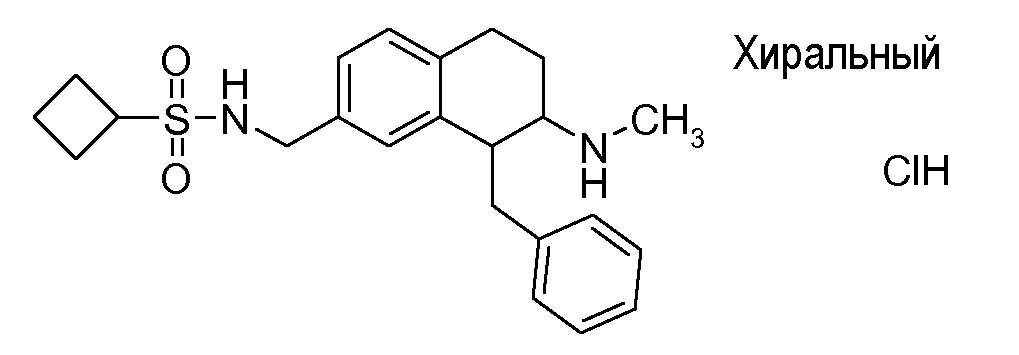
Энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата, описанный в примере 192, используют для синтеза в качестве хирального структурного элемента.
ESI-MS [M+H+]=399, рассчитано для C23H30N2O2S=398.
Пример 194: N-{[транс-8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
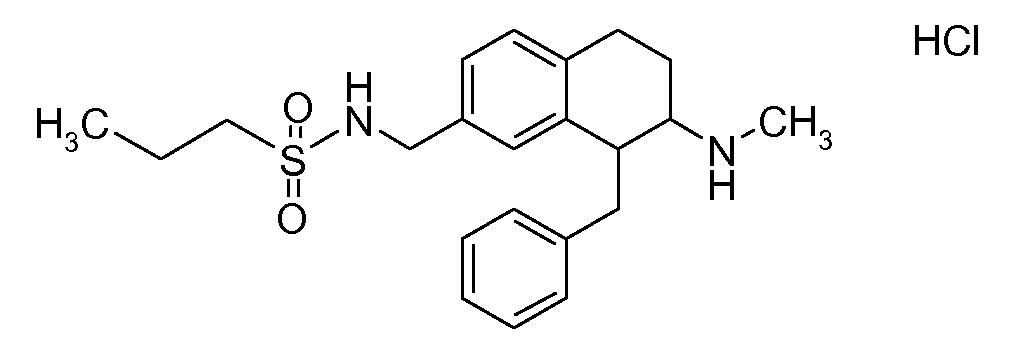
Получают из транс-производного, образующегося в качестве побочного продукта при перекристаллизации
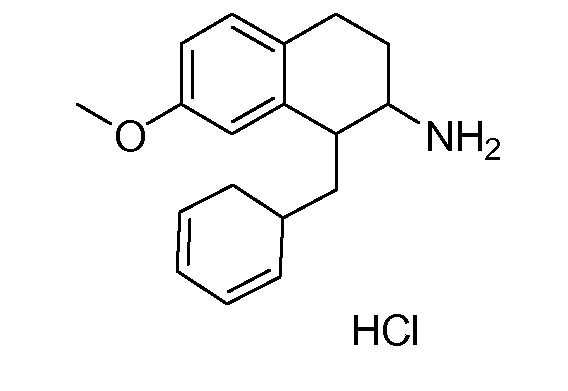
(см. также пример 1).
ESI-MS [M+H+]=387, рассчитано для C22H30N2O2S=386.
Пример 195: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
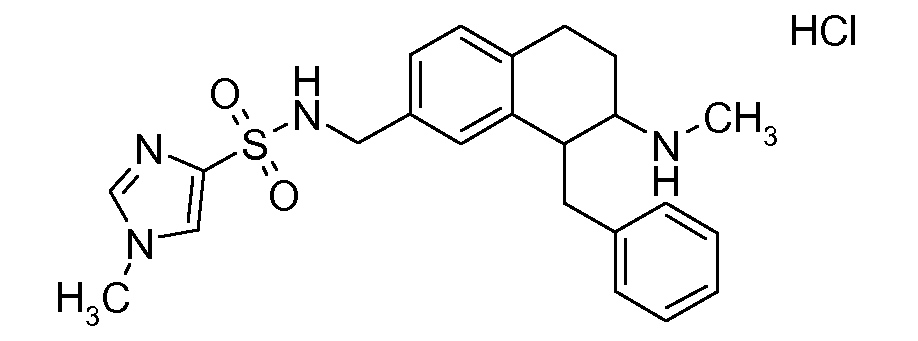
ESI-MS [M+H+]=425, рассчитано для C23H28N4O2S=424.
Пример 196: N-(1-Бензил-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил)ацетамид
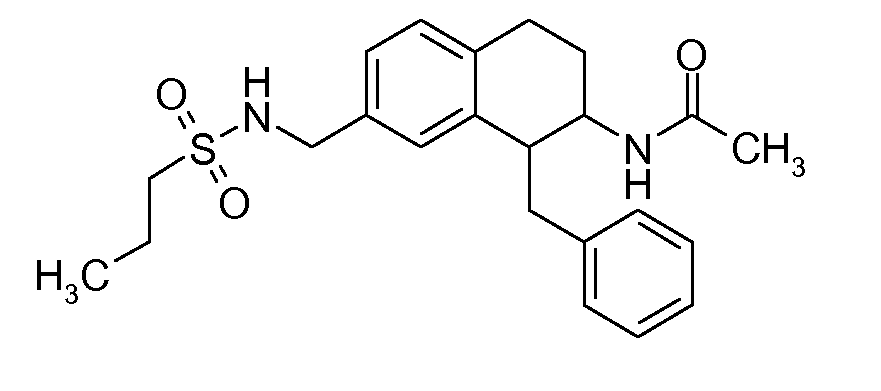
N-{[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамид (см. также пример 42) ацетилируют в дихлорметане ацетилхлоридом в присутствии этилдиизопропиламина при комнатной температуре.
ESI-MS [M+H+]=415, рассчитано для C23H30N2O3S=414.
Пример 197: N-[(1-(4-Фторбензил)-7-({[(1-метил-1H-имидазол-4-ил)сульфонил]амино}метил)-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
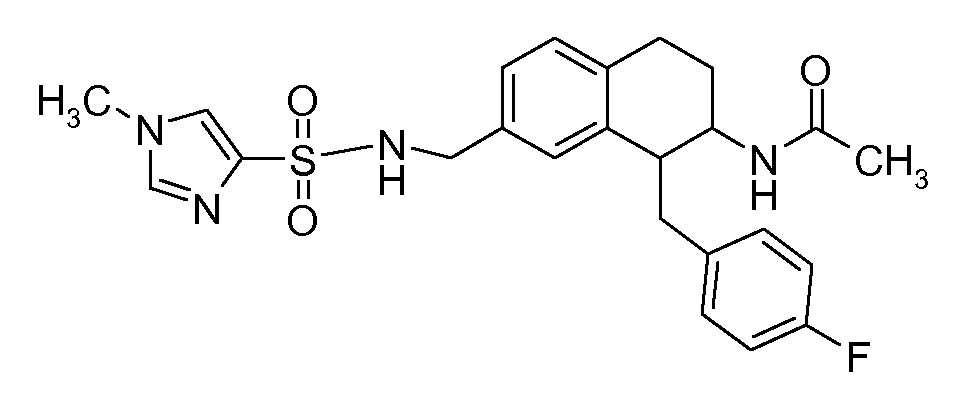
Указанное соединение получают по способу примера 196.
ESI-MS [M+H+]=471, рассчитано для C24H27FN4O3S=470.
Пример 198: N-{[8-Бензил-7-(этиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамида гидрохлорид
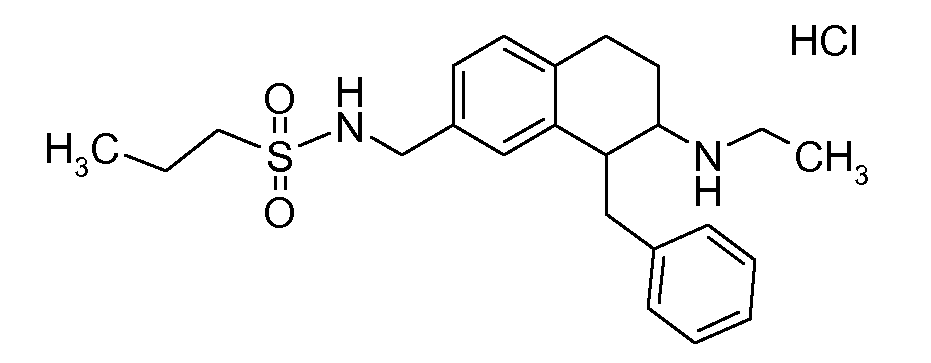
N-(1-Бензил-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил)ацетамид (пример 196, 153 мг, 0,37 ммоль) растворяют в тетрагидрофуране (5 мл). Добавляют 1 M раствор комплекса боран-диметилсульфид в тетрагидрофуране (852 мкл, 8,52 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду, и смесь экстрагируют дихлорметаном (три раза). Объединенные органические экстракты сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Добавляют избыток 6 M раствора хлористоводородной кислоты в изопропаноле. Растворитель упаривают, и продукт сушат в вакууме. Выход: 70 мг (0,16 ммоль, 36%).
ESI-MS [M+H+]=401, рассчитано для C23H32N2O2S=400.
Соединения нижеследующих примеров получают по способу примера 198:
Пример 199: 1-Метил-1H-имидазол-4-сульфоновой кислоты [7-этиламино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-илметил]амида гидрохлорид
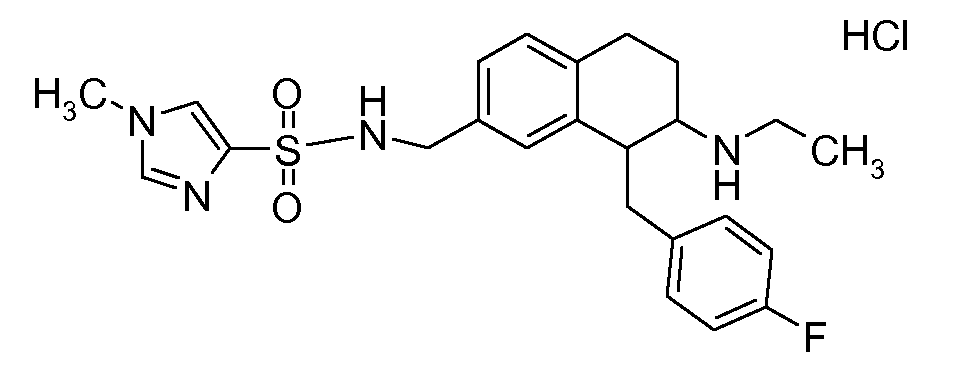
ESI-MS [M+H+]=457, рассчитано для C24H29FN4O2S=456.
Пример 200: 1-Метил-1H-пиразол-4-сульфоновой кислоты [7-этиламино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-илметил]амида гидрохлорид
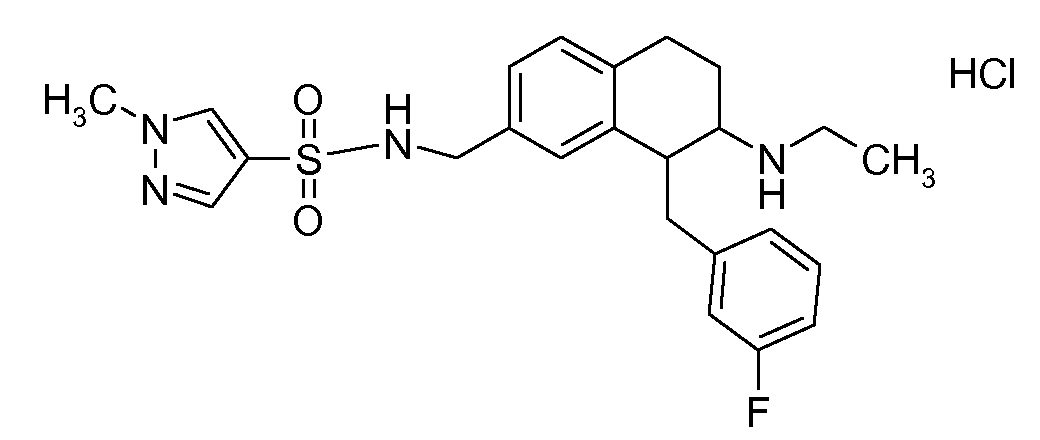
ESI-MS [M+H+]=457, рассчитано для C24H29FN4O2S=456.
Пример 201: N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
201.1 трет-Бутил [1-(4-хлорбензил)-7-{3-[(пропилсульфонил)амино]пропил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат
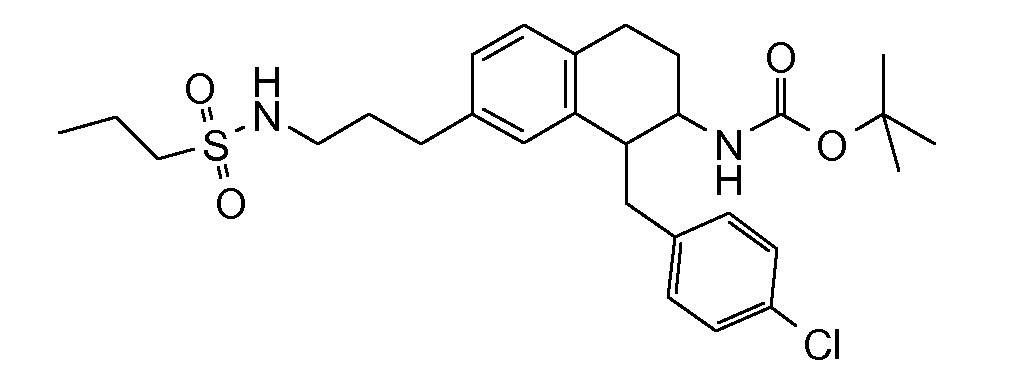
К раствору 9-BBN (0,5 M в тетрагидрофуране, 8,85 мл, 4,42 ммоль) добавляют по каплям раствор N-аллилпропан-1-сульфонамида (1152 мг, 7,06 ммоль) в тетрагидрофуране (1 мл) при 0°C. После перемешивания при температуре от 0°C до 5°C в течение 3,5 часов добавляют диоксан (25 мл) и затем 7-(трет-бутоксикарбониламино)-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (1000 мг, 1,923 ммоль, полученный по способу примера 34.3), ацетат палладия (43,2 мг, 0,192 ммоль), трифенилфосфин (101 мг, 0,385 ммоль) и карбонат цезия (1253 мг, 3,85 ммоль). Желтую реакционную смесь нагревают с обратным холодильником в течение 3 часов. Реакционную смесь разбавляют этилацетатом (60 мл) и промывают водой (2Ч40 мл). Органический слой сушат и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 854 мг (1,596 ммоль, 83%).
201.2 N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
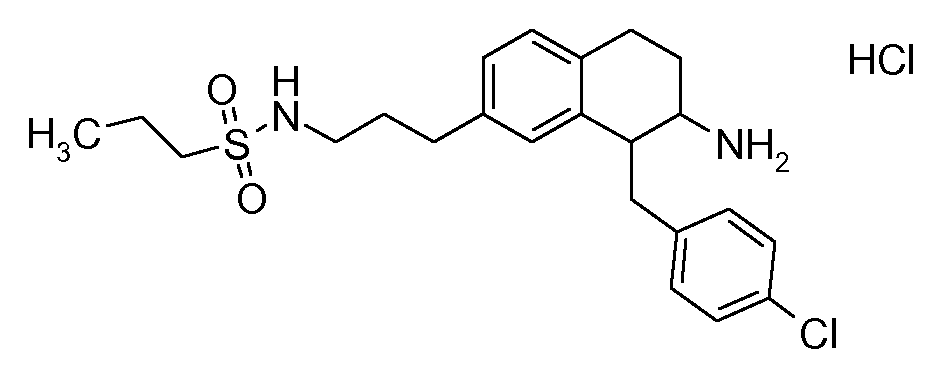
трет-Бутил [1-(4-хлорбензил)-7-{3-[(пропилсульфонил)амино]пропил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат (150 мг, 0,281 ммоль) растворяют в дихлорметане (3 мл) и добавляют раствор хлористоводородной кислоты (0,5 мл, 5 M в изопропаноле). После перемешивания при комнатной температуре в течение 2 часов растворитель удаляют в вакууме. Добавляют воду (15 мл), и pH доводят до 9, используя насыщенный водный раствор бикарбоната натрия, после чего смесь экстрагируют дихлорметаном (3×15 мл). Объединенные органические экстракты сушат и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Продукт растворяют в дихлорметане (2 мл) и добавляют раствор хлористоводородной кислоты в этаноле (1,25 M). Растворитель удаляют в вакууме. Выход: 31,4 мг (0,187 ммоль, 36%).
ESI-MS [M+H+]=435, рассчитано для C23H31ClN2O2S=434.
Соединения нижеследующих примеров получают по способу примера 201:
Пример 202: N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
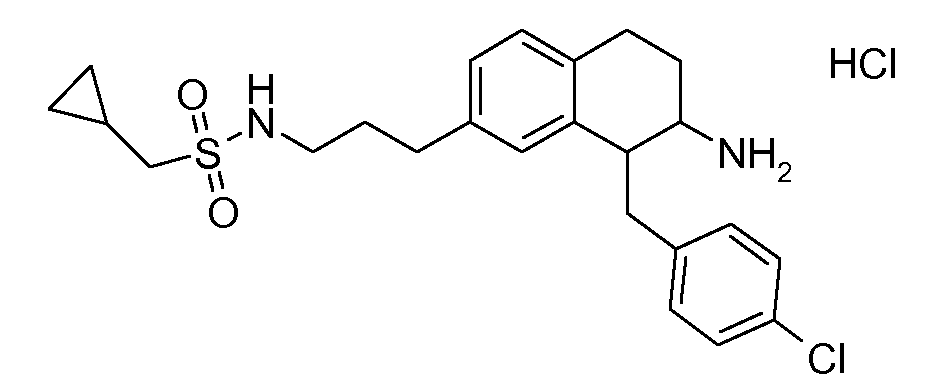
ESI-MS [M+H+]=447, рассчитано для C24H31ClN2O2S=446.
Пример 203: N-{3-[7-Амино-8-(3,4-дихлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
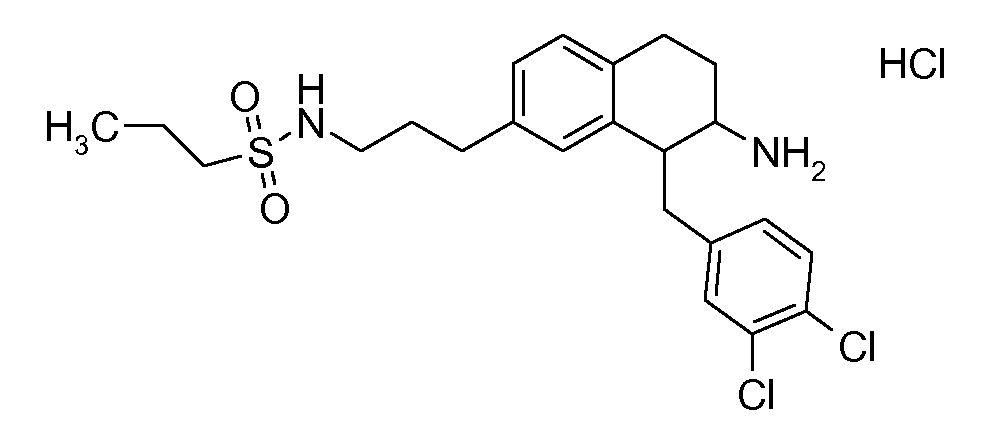
ESI-MS [M+H+]=469, рассчитано для C23H30Cl2N2O2S=468.
Пример 204: N-{3-[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-C-циклопропилметансульфонамида гидрохлорид
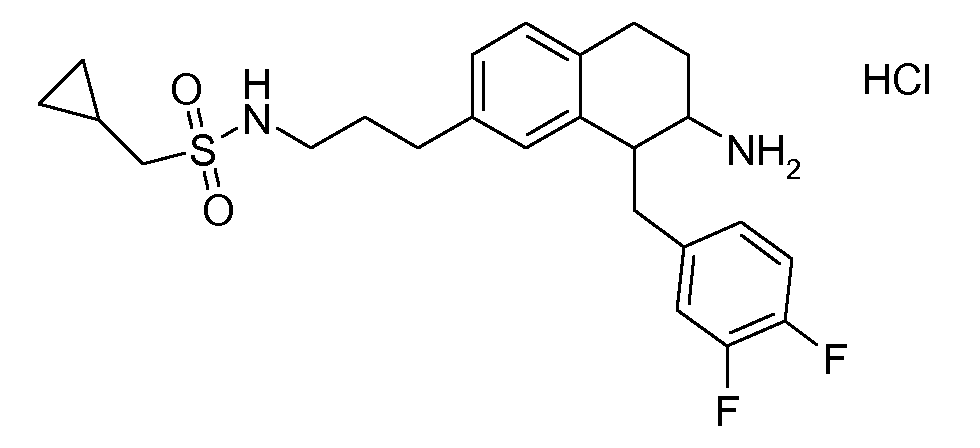
ESI-MS [M+H+]=449, рассчитано для C24H30F2N2O2S=448.
Пример 205: N-{3-[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
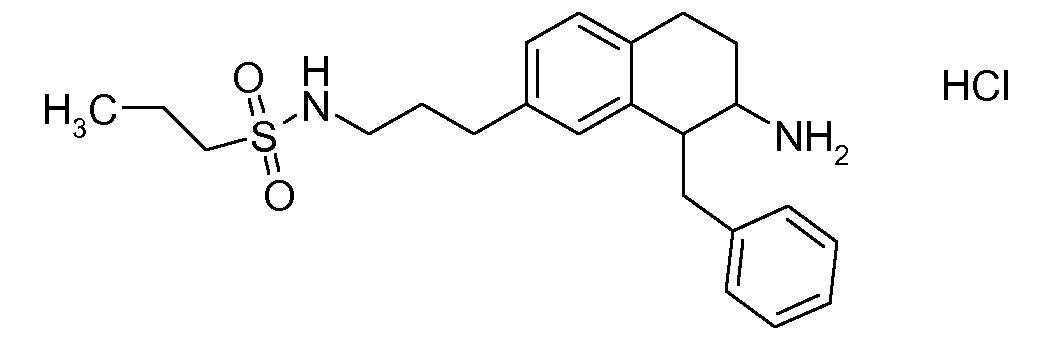
ESI-MS [M+H+]=401, рассчитано для C23H32N2O2S=400.
Пример 206: N-{3-[7-Амино-8-(3,4-дифторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
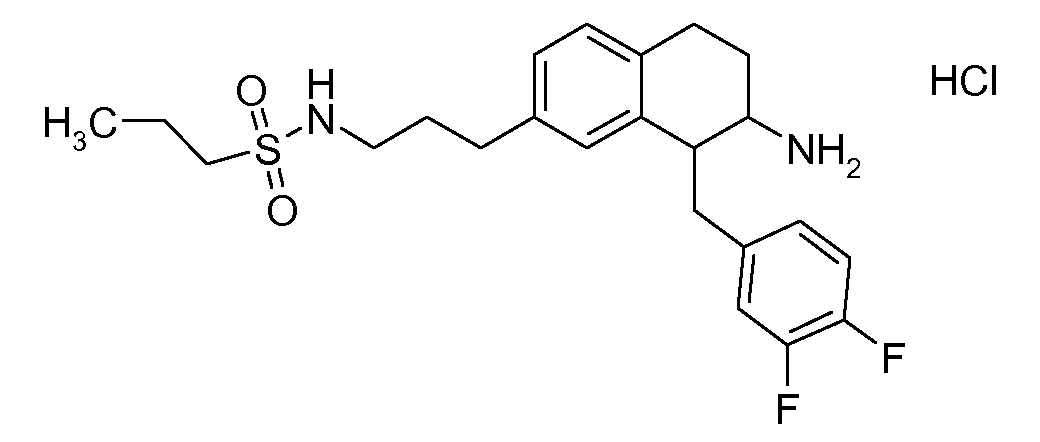
ESI-MS [M+H+]=437, рассчитано для C23H30F2N2O2S=436.
Пример 207: N-{3-[7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида трифторацетат
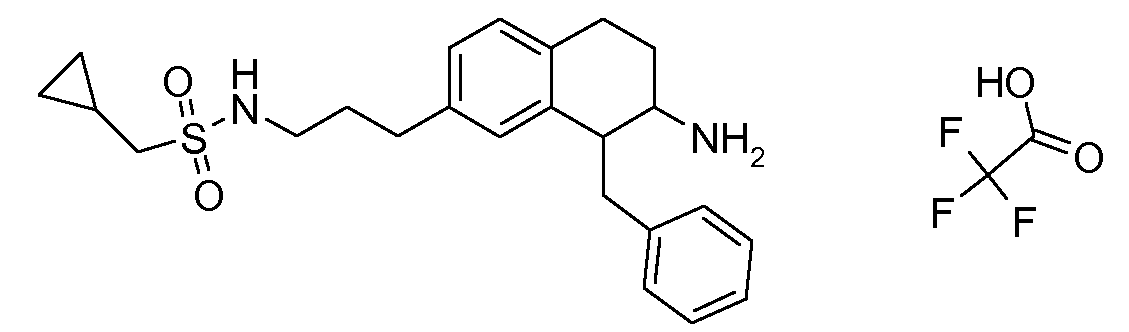
ESI-MS [M+H+]=413, рассчитано для C24H32N2O2S=412.
Пример 208: N-{3-[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
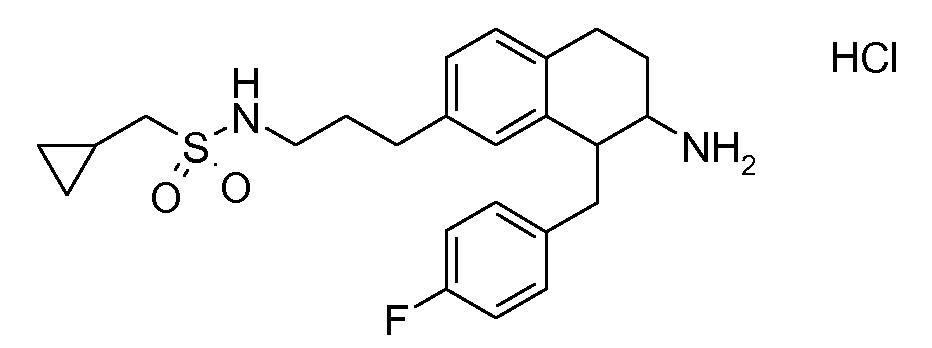
ESI-MS [M+H+]=431, рассчитано для C24H31FN2O2S=430.
Пример 209: N-{3-[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид

ESI-MS [M+H+]=419, рассчитано для C23H31FN2O2S=418.
Пример 210: N-{3-[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
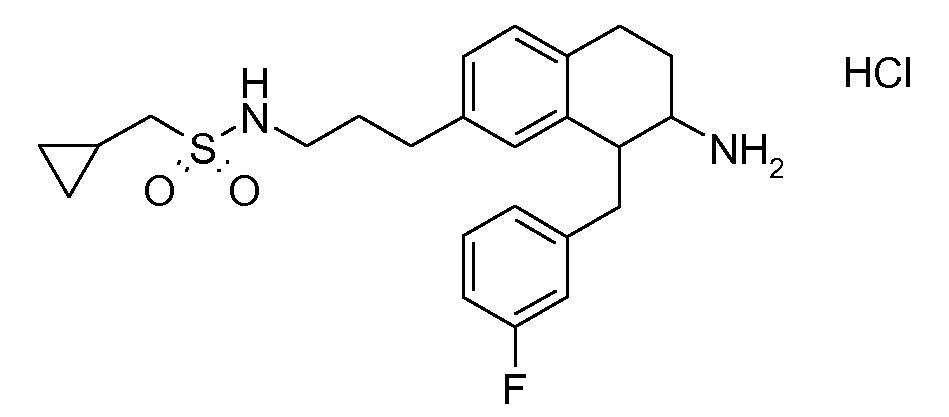
ESI-MS [M+H+]=431, рассчитано для C24H31FN2O2S=430.
Пример 211: N-{3-[7-Амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
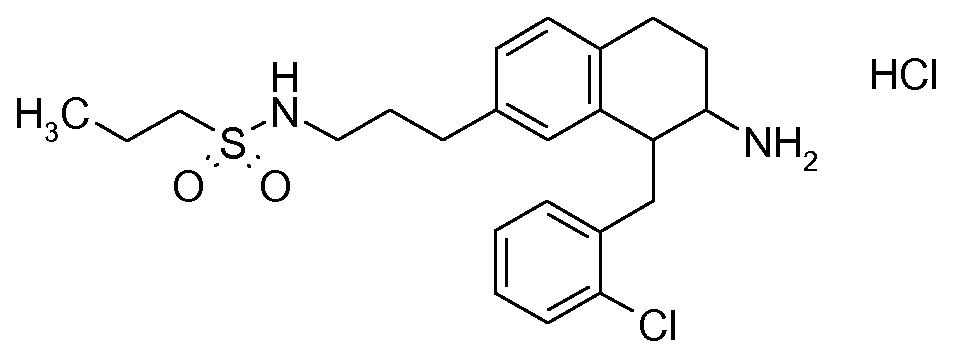
ESI-MS [M+H+]=435, рассчитано для C23H31ClN2O2S=434.
Пример 212: N-{3-[7-Амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-C-циклопропилметансульфонамида гидрохлорид
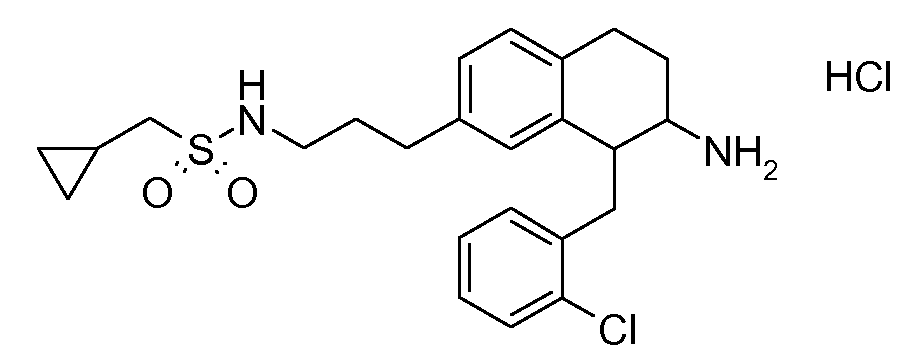
ESI-MS [M+H+]=447, рассчитано для C24H31ClN2O2S=446.
Пример 213: N-{3-[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
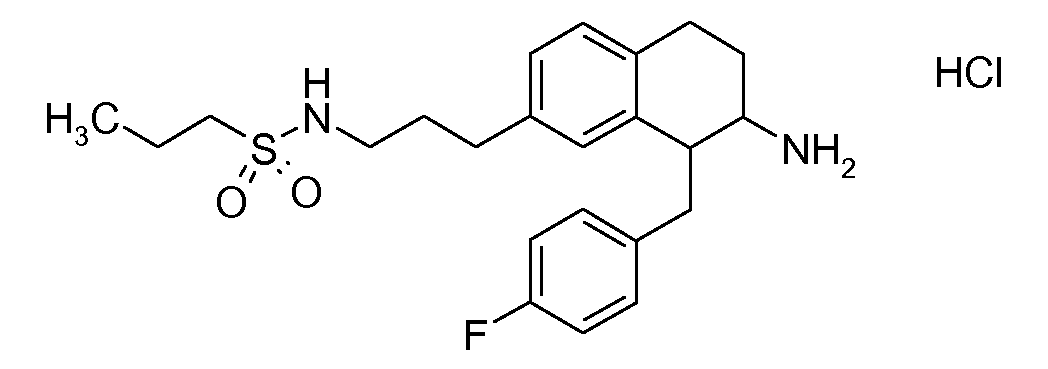
ESI-MS [M+H+]=419, рассчитано для C23H31FN2O2S=418.
Пример 214: N-[1-(3-Фторбензил)-7-{3-[(пропилсульфонил)амино]пропил}-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
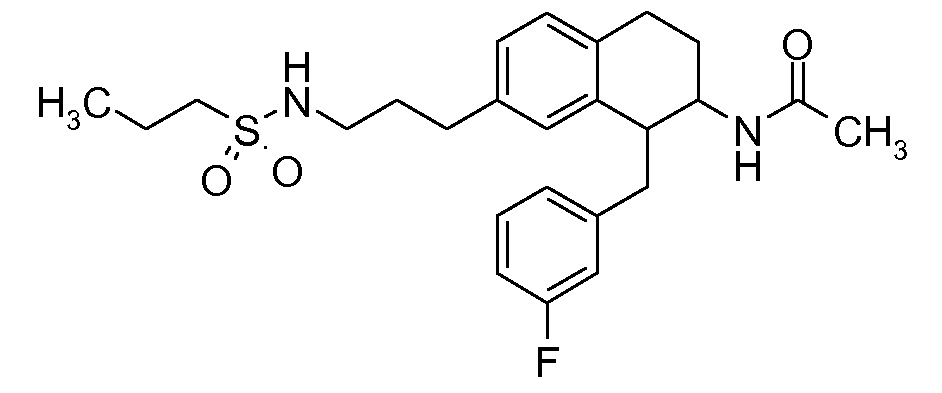
N-(3-(7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил)пропил)пропан-1-сульфонамид (см. также пример 209: 45 мг, 0,108 ммоль) и триэтиламин (15 мкл, 0,108 ммоль) растворяют в дихлорметане (2 мл). Добавляют ацетилхлорид (7,64 мкл, 0,108 ммоль). Реакционную смесь перемешивают в течение 12 часов при комнатной температуре. Реакционную смесь разбавляют дихлорметаном и последовательно промывают хлористоводородной кислотой, водой и насыщенным раствором хлорида натрия. Органический слой сушат и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 37 мг (0,08 ммоль, 75%).
ESI-MS [M+H+]=461, рассчитано для C25H33FN2O3S=460.
По способу примера 214 получают соединения следующих примеров:
Пример 215: N-[1-(4-Фторбензил)-7-{3-[(пропилсульфонил)амино]пропил}-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
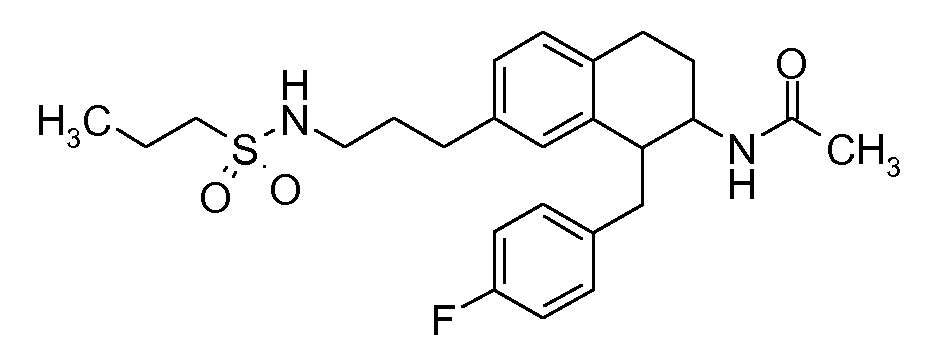
ESI-MS [M+H+]=461, рассчитано для C25H33FN2O3S=460.
Пример 216: N-[1-Бензил-7-(3-{[(циклопропилметил)сульфонил]амино}пропил)-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
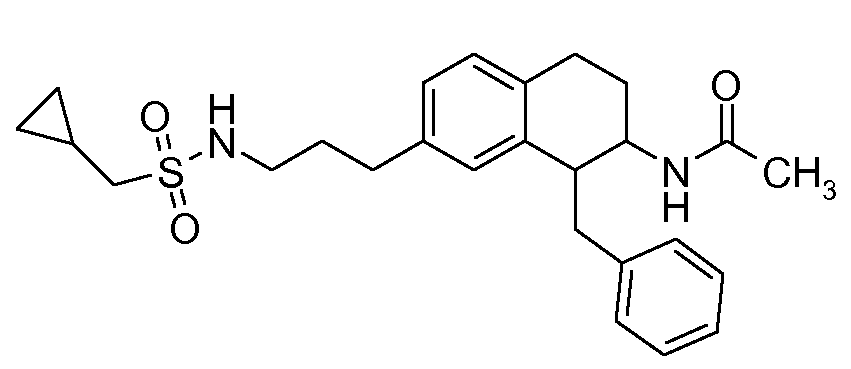
ESI-MS [M+H+]=455, рассчитано для C26H34N2O3S=454.
Пример 217: N-[1-Бензил-7-{3-[(пропилсульфонил)амино]пропил}-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
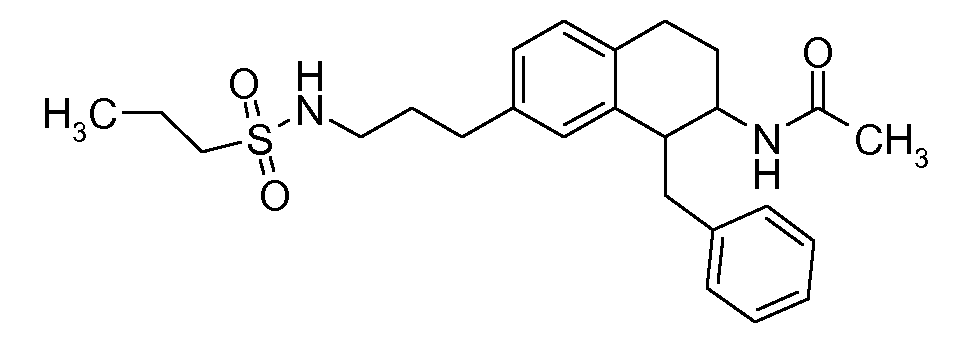
ESI-MS [M+H+]=443, рассчитано для C25H34N2O3S=442.
Пример 218: N-[7-(3-{[(Циклопропилметил)сульфонил]амино}пропил)-1-(3-фторбензил)-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
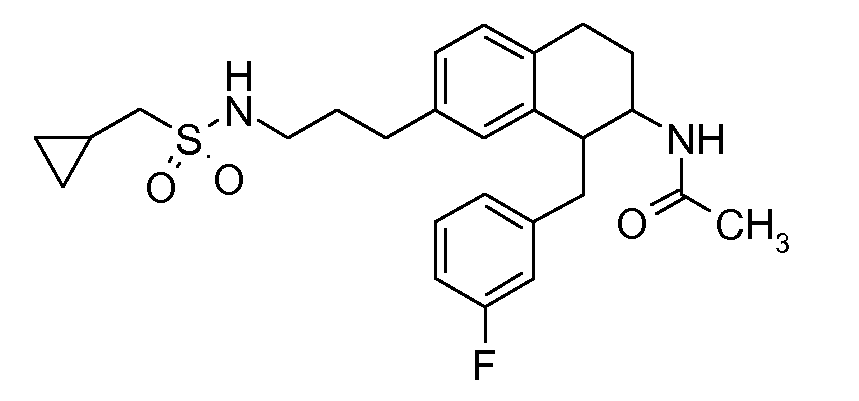
ESI-MS [M+H+]=473, рассчитано для C26H33FN2O3S=472.
Пример 219: Пропан-1-сульфоновой кислоты {3-[7-этиламино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}амида гидрохлорид
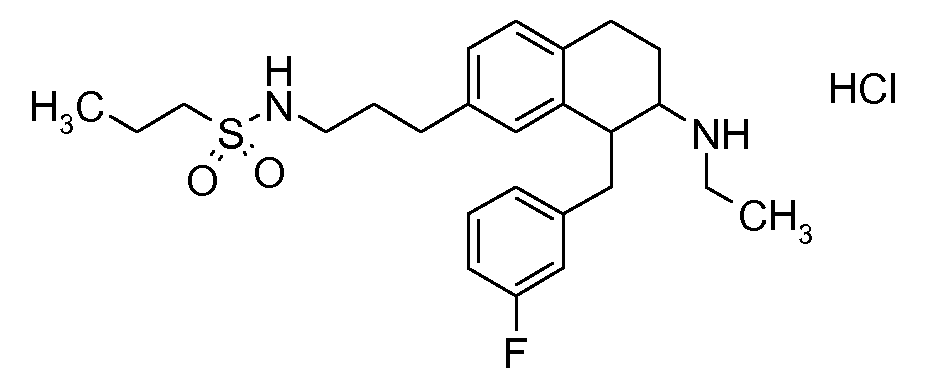
N-(1-(3-Фторбензил)-7-(3-(пропилсульфонамидо)пропил)-1,2,3,4-тетрагидронафтален-2-ил)ацетамид (см. также пример 214, 19,5 мг, 0,042 ммоль) растворяют в тетрагидрофуране (1 мл) и добавляют борандиметилсульфид (106 мкл, 0,212 ммоль). Реакционную смесь перемешивают в течение 5 часов при 50°C. После охлаждения до комнатной температуры добавляют водный раствор хлористоводородной кислоты. Смесь подщелачивают путем добавления бикарбоната натрия и экстрагируют несколько раз дихлорметаном. Объединенные органические экстракты сушат (MgSO4), концентрируют в вакууме, и неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). К очищенному продукту добавляют избыток 1 M раствора хлористоводородной кислоты в эфире и эфир отгоняют. Выход: 7 мг (0,016 ммоль, 37%).
ESI-MS [M+H+]=447, рассчитано для C25H35FN2O2S=446.
Соединения нижеследующих примеров получают по способу примера 219:
Пример 220: N-{3-[7-(Этиламино)-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
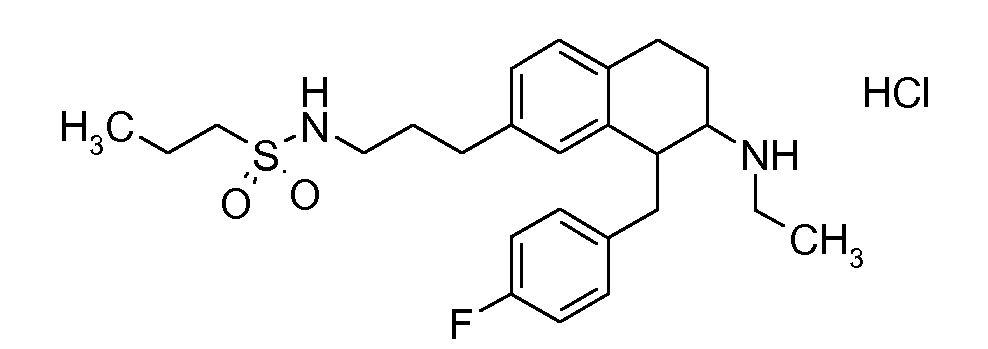
ESI-MS [M+H+]=447, рассчитано для C25H35FN2O2S=446.
Пример 221: C-Циклопропил-N-{3-[7-этиламино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}метансульфонамида гидрохлорид
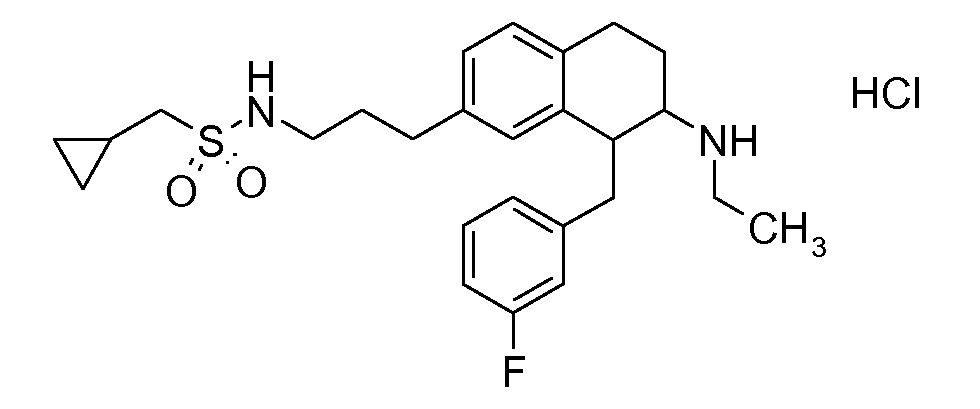
ESI-MS [M+H+]=459, рассчитано для C26H35FN2O2S=458.
Пример 222: Пропан-1-сульфоновой кислоты {3-[8-(2-хлорбензил)-7-этиламино-5,6,7,8-тетрагидронафтален-2-ил]пропил}амида гидрохлорид
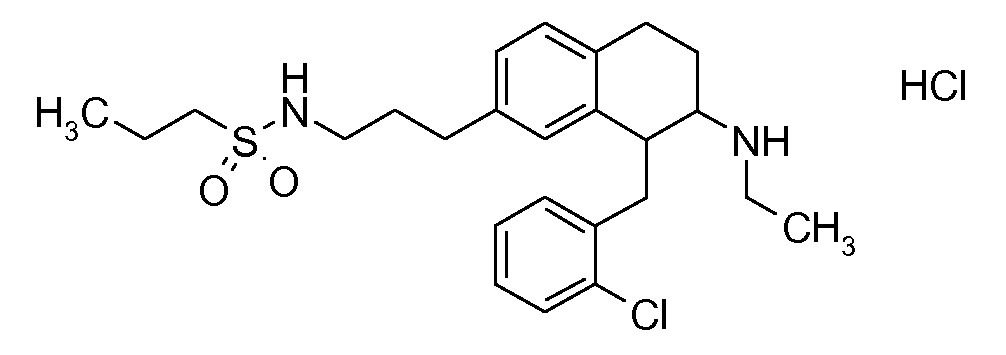
ESI-MS [M+H+]=463, рассчитано для C25H35ClN2O2S=462.
Пример 223: N-{3-[8-Бензил-7-(этиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
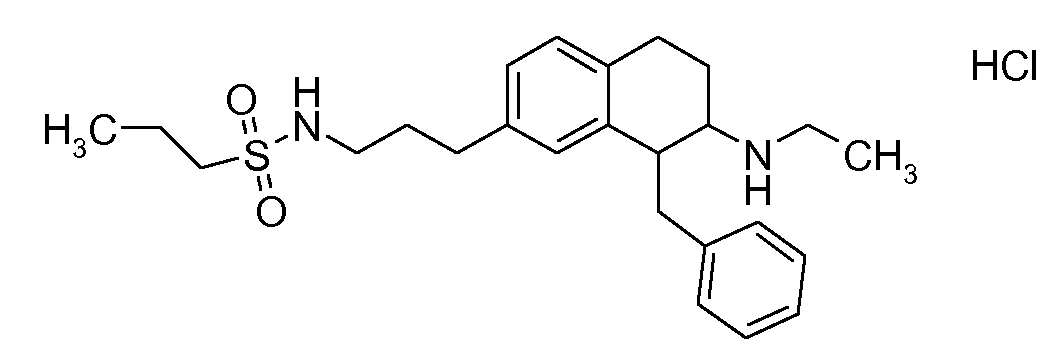
ESI-MS [M+H+]=429, рассчитано для C25H36N2O2S=428.
Пример 224: N-{3-[8-Бензил-7-(этиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
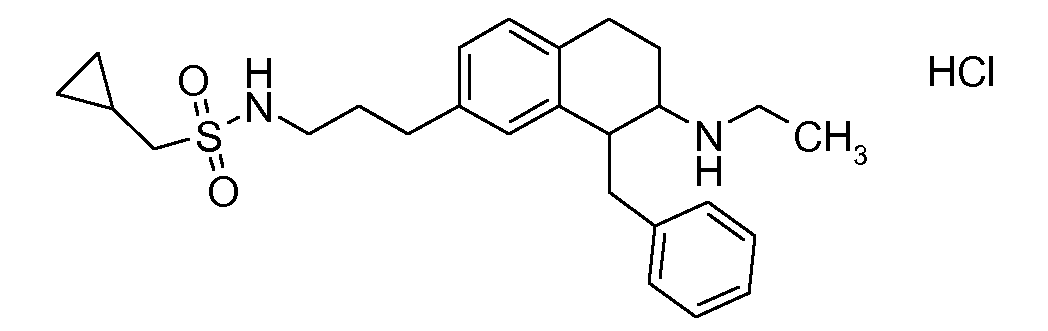
ESI-MS [M+H+]=441, рассчитано для C26H36N2O2S=440.
Пример 225: N-{3-[8-(3,4-Дифторбензил)-7-(этиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида трифторацетат
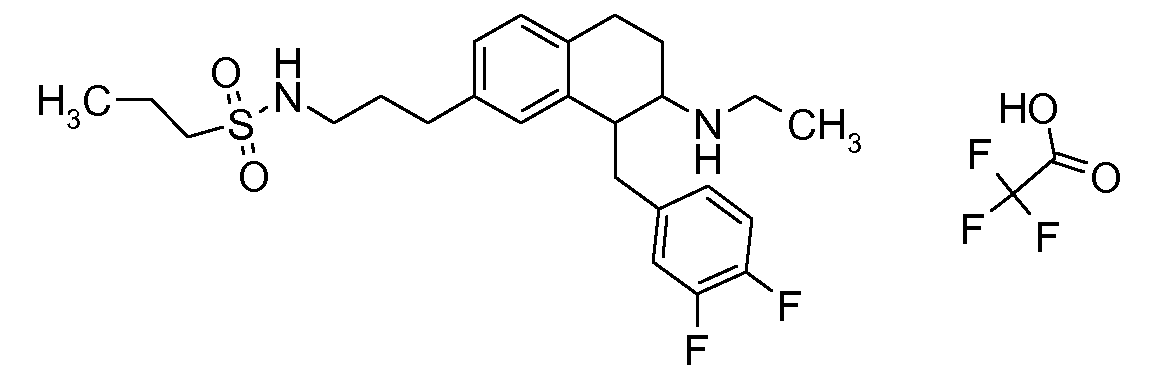
ESI-MS [M+H+]=465, рассчитано для C25H34F2N2O2S=464.
Пример 226: 1-Циклопропил-N-{3-[8-(3,4-дифторбензил)-7-(этиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}метансульфонамида трифторацетат
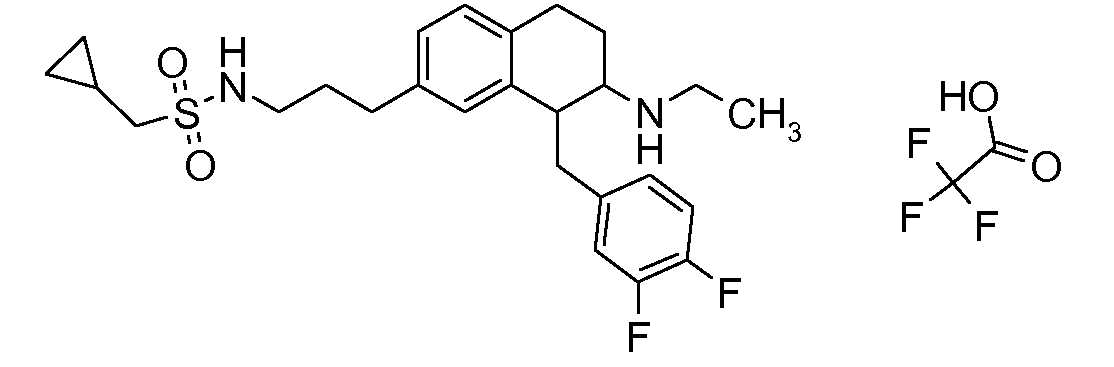
ESI-MS [M+H+]=477, рассчитано для C26H34F2N2O2S=476.
Пример 227: N-{3-[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-N-метилпропан-1-сульфонамида гидрохлорид
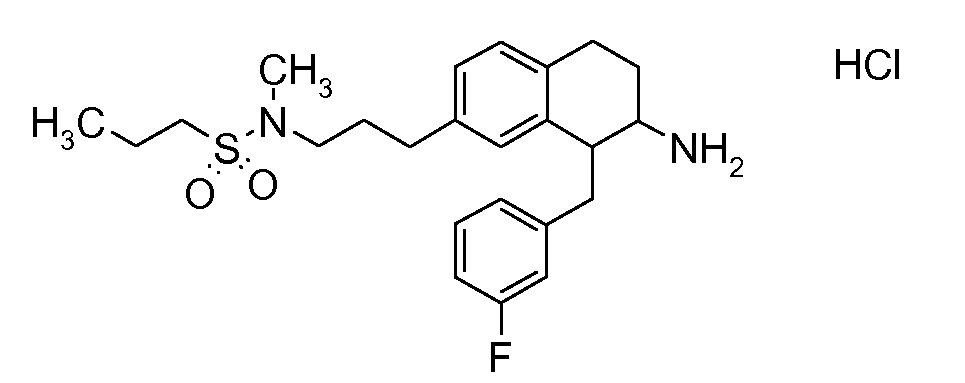
трет-Бутил (1-(3-фторбензил)-7-(3-(пропилсульфонамидо)пропил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (см. также 209 и 201a, 65 мг, 0,125 ммоль) растворяют в ацетонитриле (800 мкл) и добавляют метилиодид (24 мкл, 0,376 ммоль) и карбонат цезия (0,102 г, 0,313 ммоль). Реакционную смесь нагревают в течение 24 часов в герметично закрытом сосуде при 80°C. Реакционную смесь разбавляют этилацетатом. Этилацетатный раствор последовательно промывают водой и насыщенным раствором хлорида натрия. Органическую фазу сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают препаративной тонкослойной хроматографией (силикагель, дихлорметан, метанол). Полученный трет-бутил 1-(3-фторбензил)-7-(3-(N-метилпропилсульфонамидо)пропил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (65 мг, 0,122 ммоль) растворяют в 4 M растворе хлористоводородной кислоты в изопропаноле и перемешивают при комнатной температуре в течение 4 часов. Растворитель удаляют в вакууме. Добавляют диэтиловый эфир, и осадок удаляют фильтрацией и сушат. Выход: 22 мг (0,047 ммоль, 38%).
ESI-MS [M+H+]=433, рассчитано для C24H33FN2O2S=432.
Соединения нижеследующих примеров получают по способу примера 227:
Пример 228: N-{3-[7-Амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]-пропил}-C-циклопропил-N-метилметансульфонамида гидрохлорид
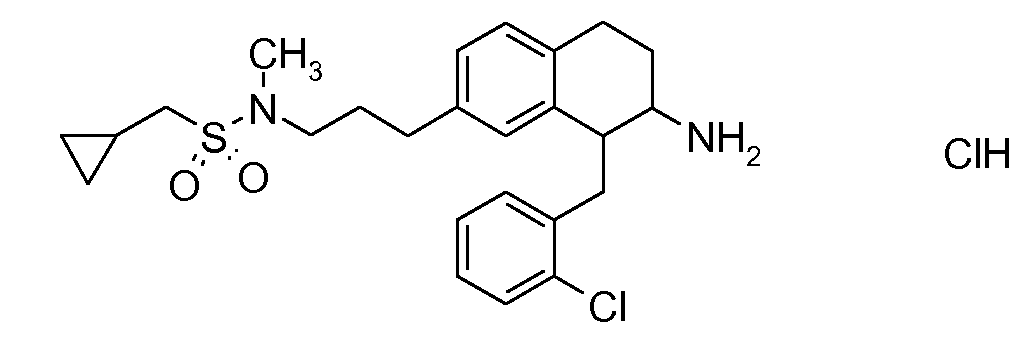
ESI-MS [M+H+]=461, рассчитано для C25H33ClN2O2S=460.
Пример 229: Пропан-1-сульфоновой кислоты {3-[7-амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}метиламида гидрохлорид
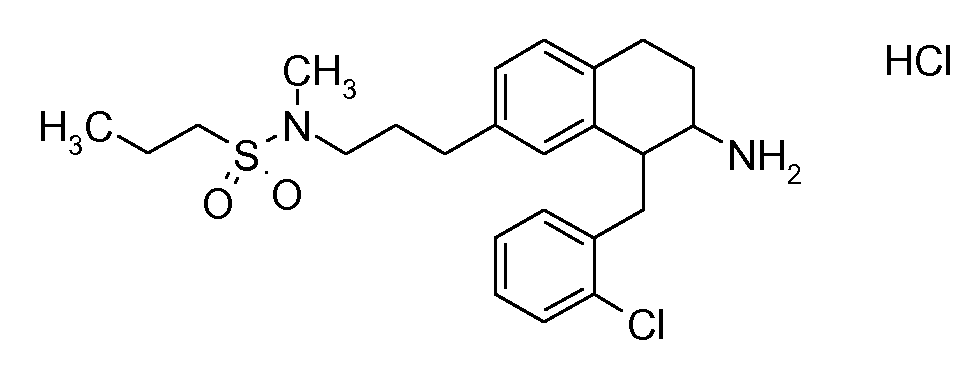
ESI-MS [M+H+]=449, рассчитано для C24H33ClN2O2S=448.
Пример 230: N-{3-[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропил-N-метилметансульфонамида гидрохлорид
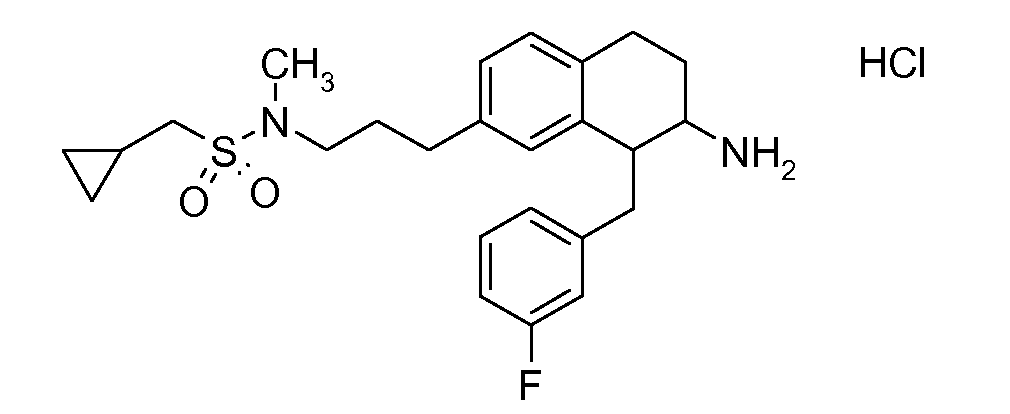
ESI-MS [M+H+]=445, рассчитано для C25H33FN2O2S=444.
Пример 231: N-{3-[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропил-N-метилметансульфонамида гидрохлорид
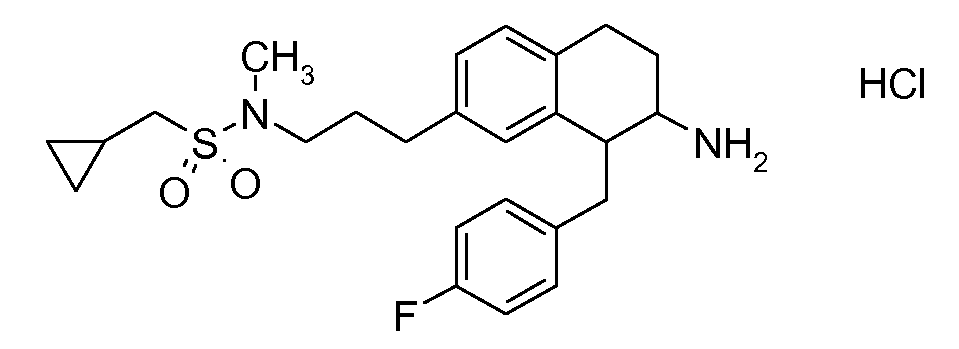
ESI-MS [M+H+]=445, рассчитано для C25H33FN2O2S=444.
Пример 232: N-{3-[7-Амино-8-(4-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-N-метилпропан-1-сульфонамида гидрохлорид
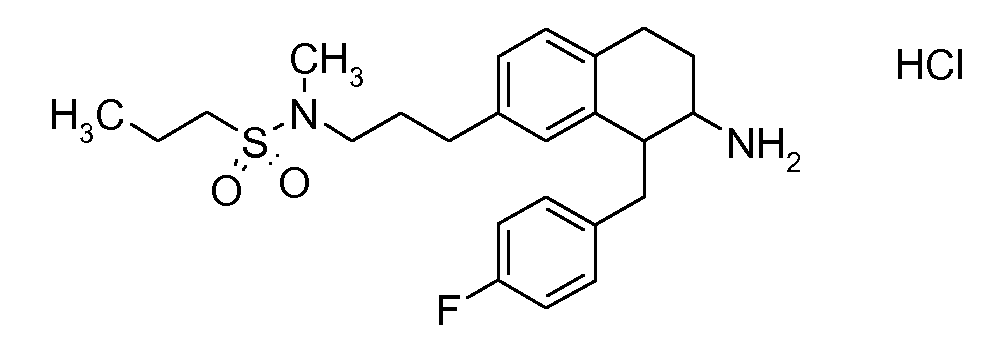
ESI-MS [M+H+]=433, рассчитано для C24H33FN2O2S=432.
Пример 233: N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропил-N-метилметансульфонамида гидрохлорид
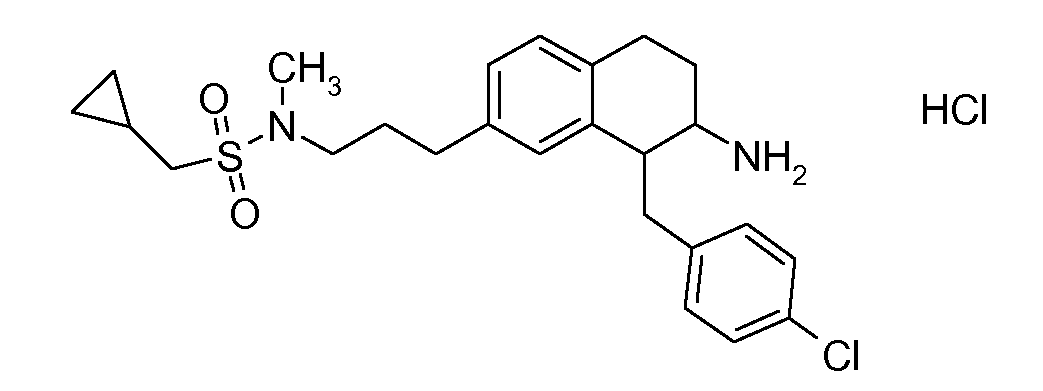
ESI-MS [M+H+]=461, рассчитано для C25H33ClN2O2S=460.
Пример 234: N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-N-метилпропан-1-сульфонамида гидрохлорид

ESI-MS [M+H+]=449, рассчитано для C24H33ClN2O2S=448.
Соединение примера 235 получают по способу примера 47:
N-(2-{[7-Амино-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-циклопропилметансульфонамида гидрохлорид
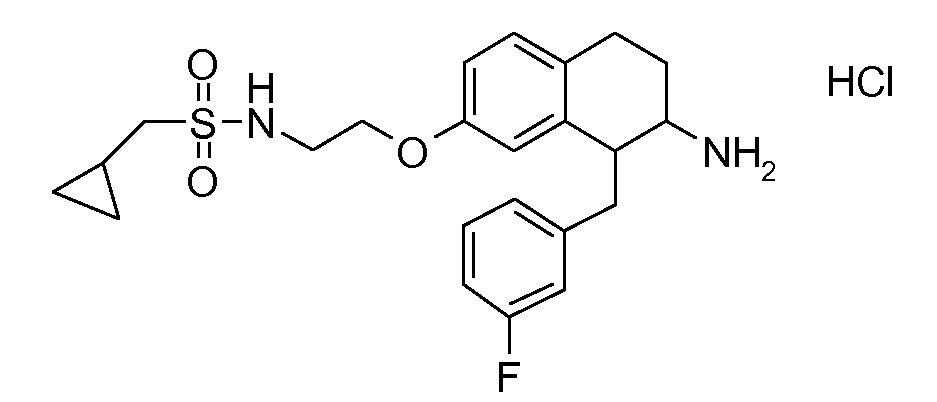
ESI-MS [M+H+]=433, рассчитано для C23H29FN2O3S=432.
Соединения нижеследующих примеров получают по способу примера 46:
Пример 236: Этил [1-(3,5-дифторбензил)-7-(2-{[(1-метил-1H-пиррол-3-ил)сульфонил]амино}этокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
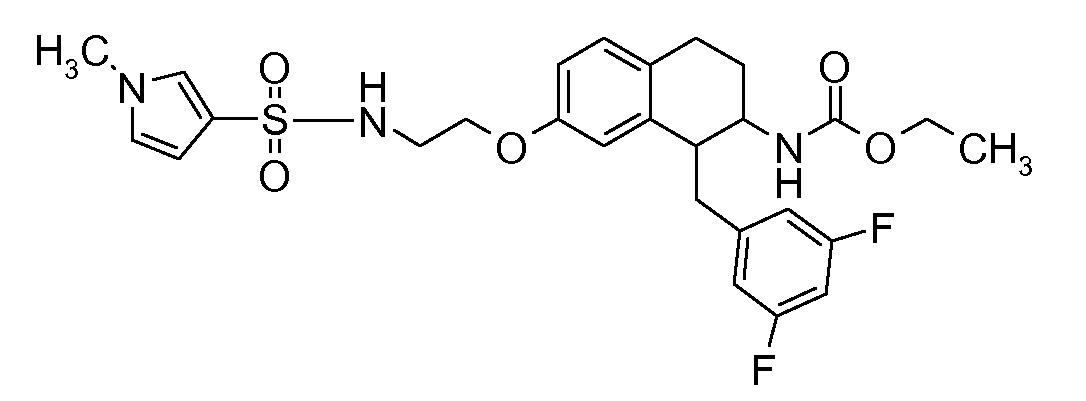
ESI-MS [M+H+]=548, рассчитано для C27H31F2N3O5S=547.
Пример 237: Этил [7-(2-{[(циклопропилметил)сульфонил]амино}этокси)-1-(3,5-дифторбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
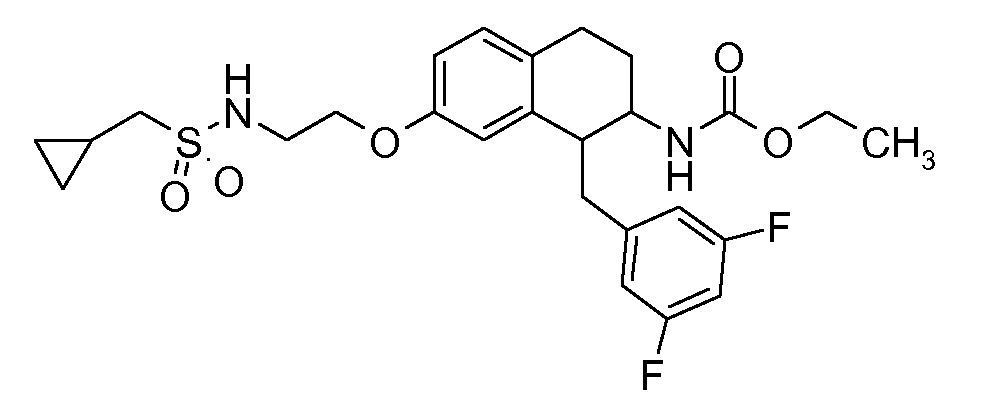
ESI-MS [M+H+]=523, рассчитано для C26H32F2N2O5S=522.
Соединение примера 238 получают по способу примера 47:
Энантиомер 1 N-(2-{[7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-имидазол-4-сульфонамида гидрохлорида
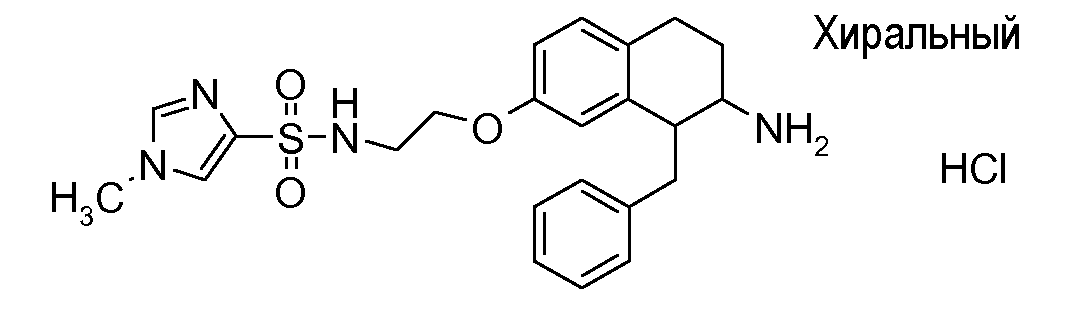
Указанное соединение можно выделить путем хиральной хроматографии конечного или промежуточного соединения.
ESI-MS [M+H+]=441, рассчитано для C23H28N4O3S=440.
Соединения нижеследующих примеров получают по способу примера 137:
Пример 239: Энантиомер 2 C-циклопропил-N-{2-[8-(3-фторбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорида
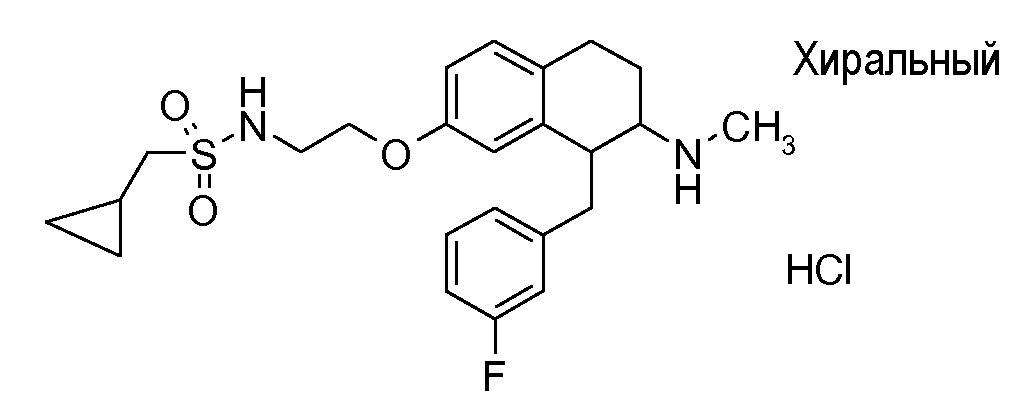
C-Циклопропил-N-{2-[8-(3-фторбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамид (Daicel, Chiralpak IC, 250Ч4,6 мм ID, 5 мкм, метил трет-бутиловый эфир/дихлорметан/метанол/триэтиламин=900/50/50/1). Энантиомер, который элюируется вторым, используют для синтеза конечного соединения.
ESI-MS [M+H+]=447, рассчитано для C24H31FN2O3S=446.
Пример 240: Энантиомер 1 1-циклопропил-N-(2-{[8-(3-фторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорида
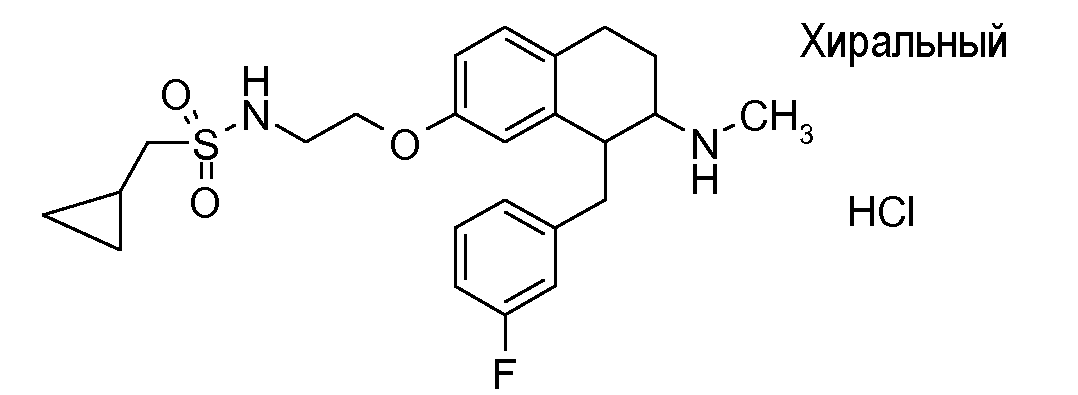
Этил 7-(2-(циклопропилметилсульфонамидо)этокси)-1-(3-фторбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамат выделяют путем хиральной хроматографии (Daicel, Chiralpak IC, 250Ч4,6 мм ID, метил трет-бутиловый эфир/дихлорметан/метанол/триэтиламин = 900/50/50/1). Энантиомер, который элюируется первым, используют для синтеза конечного соединения.
ESI-MS [M+H+]=447, рассчитано для C24H31FN2O3S=446.
Пример 241: Энантиомер 1 N-(2-{[8-(3,5-дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамида гидрохлорида
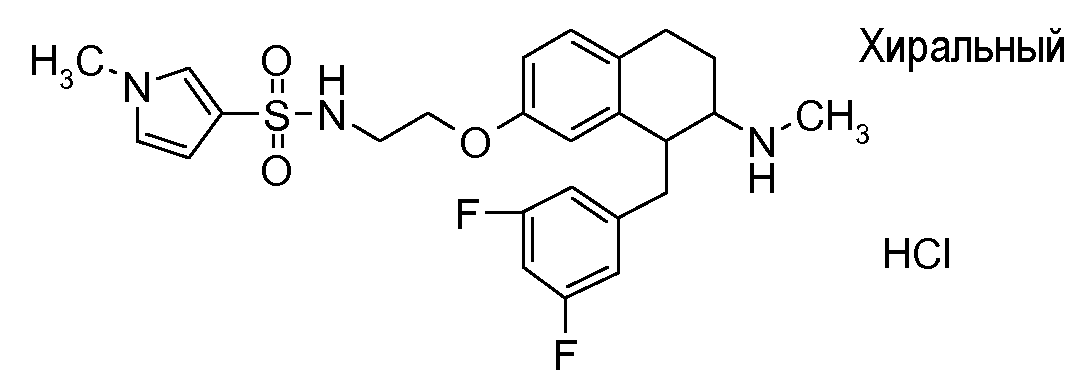
Этил 1-(3,5-дифторбензил)-7-(2-(1-метил-1H-пиррол-3-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат выделяют путем хиральной хроматографии (Daicel, Chiralpak AD, 250×20 мм ID, 10 мкм, н-гептан/этанол/триэтиламин=35/65/1). Энантиомер, который элюируется вторым, используют для синтеза конечного соединения. Его можно выделить путем хиральной хроматографии конечного или промежуточного соединения.
ESI-MS [M+H+]=490, рассчитано для C25H29F2N3O3S=489.
Пример 242: Энантиомер 2 N-(2-{[8-(3,5-дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамида гидрохлорида
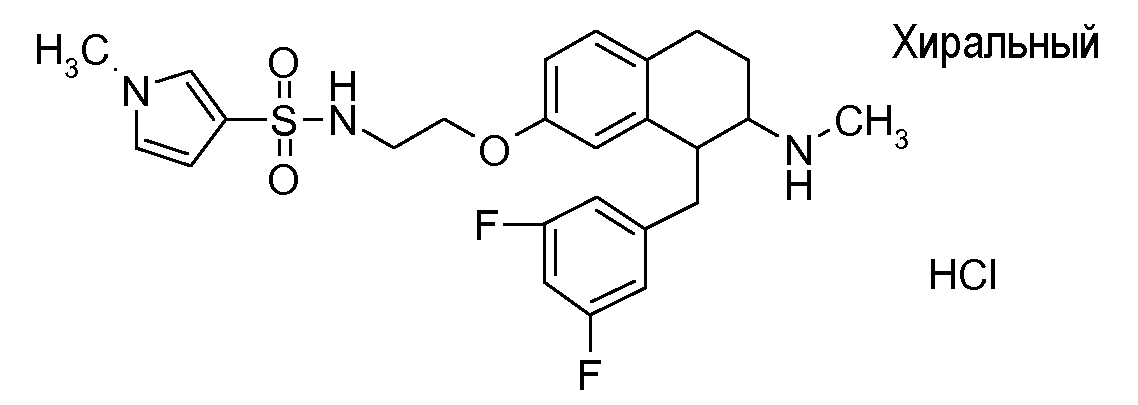
Этил 1-(3,5-дифторбензил)-7-(2-(1-метил-1H-пиррол-3-сульфонамидо)этокси)-1,2,3,4-тетрагидронафтален-2-илкарбамат выделяют методом хиральной хроматографии (Daicel, Chiralpak AD, 250×20 мм ID, 10 мкм, н-гептан/этанол/триэтиламин=35/65/1). Для синтеза конечного соединения используют энантиомер, который элюируется первым.
ESI-MS [M+H+]=490, рассчитано для C25H29F2N3O3S=489.
Пример 243: 1-Циклопропил-N-(2-{[8-(3,5-дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорид
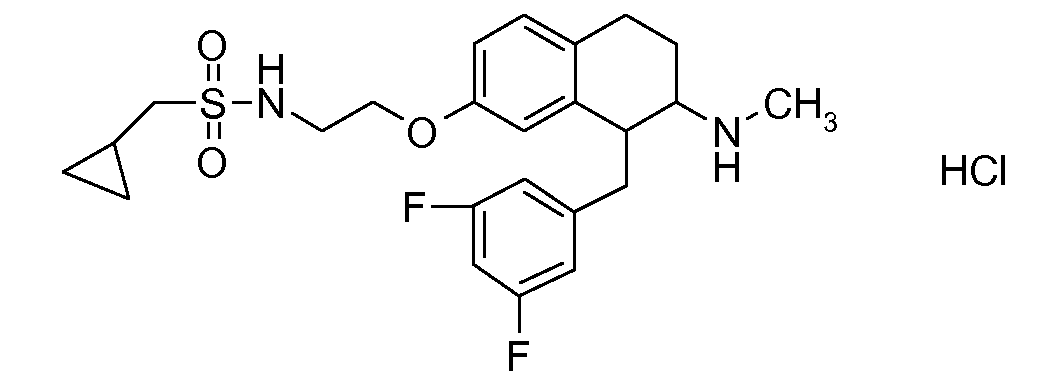
ESI-MS [M+H+]=465, рассчитано для C24H30F2N2O3S=464.
Пример 244: Энантиомер 2 1-циклопропил-N-(2-{[8-(3,5-дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорида
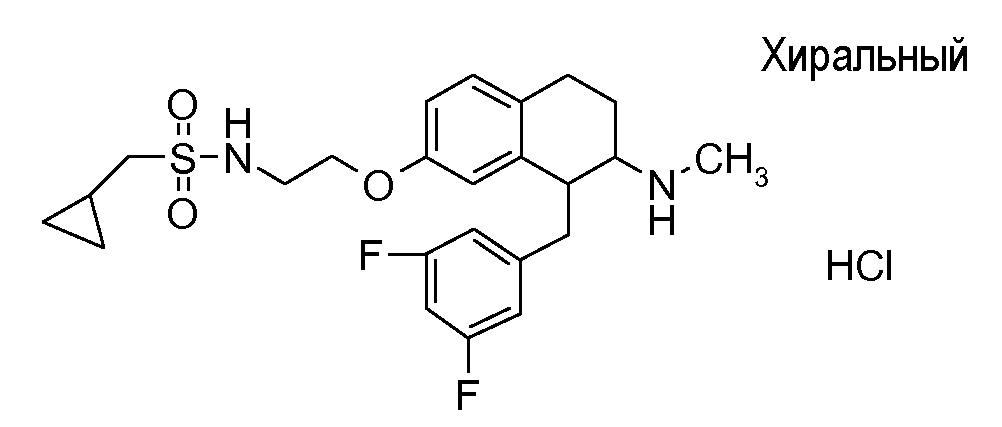
Этил 7-(2-(циклопропилметилсульфонамидо)этокси)-1-(3,5-дифторбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамат выделяют методом хиральной хроматографии (Daicel, Chiralpak AD, 250×20 мм ID, 10 мкм, н-гептан/этанол/трет-бутанол=800/150/50). Для синтеза конечного соединения используют энантиомер, элюирующийся первым.
ESI-MS [M+H+]=465, рассчитано для C24H30F2N2O3S=464.
Пример 245: Энантиомер 1 1-циклопропил-N-(2-{[8-(3,5-дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорида
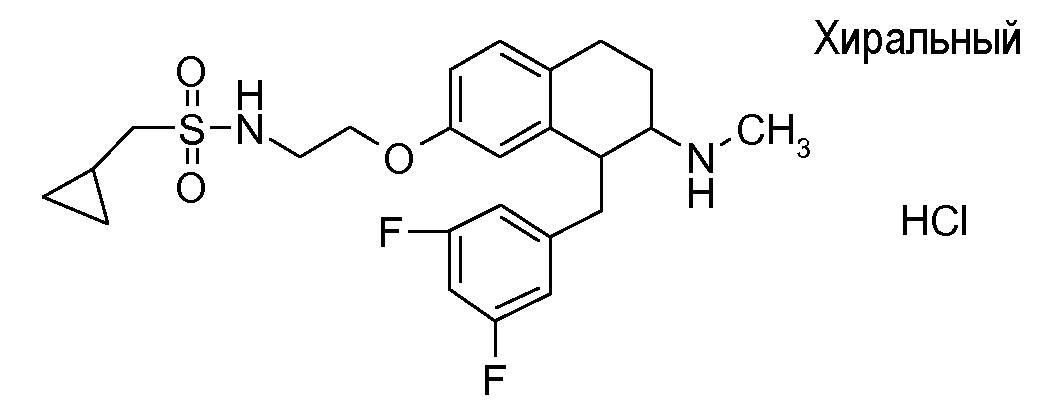
Этил 7-(2-(циклопропилметилсульфонамидо)этокси)-1-(3,5-дифторбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамат выделяют методом хиральной хроматографии (Daicel, Chiralpak AD, 250×20 мм ID, 10 мкм, н-гептан/этанол/трет-бутанол=800/150/50). Для синтеза конечного соединения используют энантиомер, который элюируется вторым.
ESI-MS [M+H+]=465, рассчитано для C24H30F2N2O3S=464.
Пример 246: N-(2-{[8-(3,5-Дифторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамида гидрохлорид
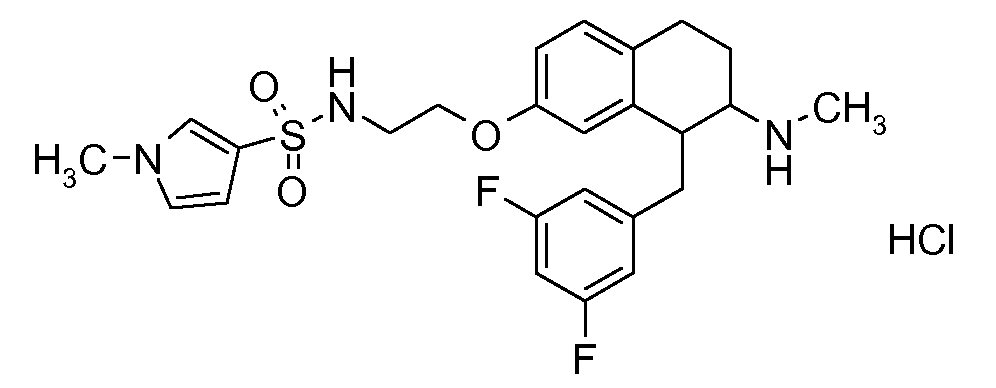
ESI-MS [M+H+]=490, рассчитано для C25H29F2N3O3S=489.
Пример 247: 1-Циклопропил-N-(2-{[8-(3-фторбензил)-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)метансульфонамида гидрохлорид
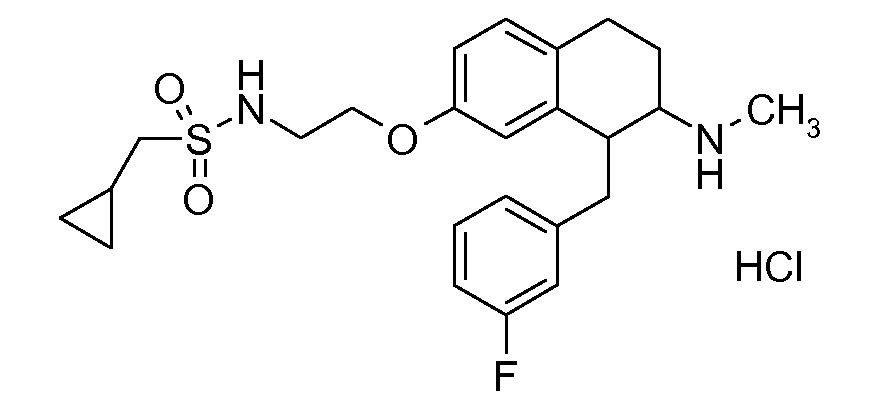
ESI-MS [M+H+]=447, рассчитано для C24H31FN2O3S=446.
Пример 248: N-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамид
248.1 7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-карбонитрил
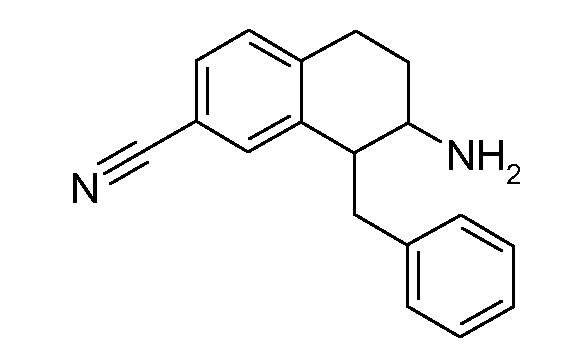
Трет-бутил 1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-илкарбамат (1,1 г, 3,03 ммоль) растворяют в дихлорметане (20 мл) и добавляют 5 M раствор хлористоводородной кислоты в изопропаноле (2 мл). Реакционную смесь перемешивают 12 ч при комнатной температуре и затем 4 ч при 35°C. Растворитель упаривают в вакууме. Добавляют воду (30 мл), и pH доводят до pH 9, используя насыщенный водный раствор бикарбоната натрия. Водный слой экстрагируют дихлорметаном. Объединенные экстракты сушат (MgSO4), и растворитель упаривают в вакууме. Выход: 790 мг (3,03 ммоль, 100%).
248.2 7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-карбонитрил
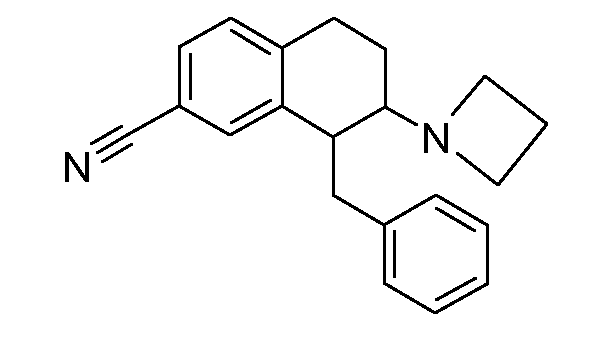
7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-карбонитрил (790 мг, 3,03 ммоль), 1,3-дибромпропан (0,4 мл, 3,93 ммоль) и триэтиламин (0,914 мл, 6,56 ммоль) растворяют в ацетонитриле (8 мл), и реакционную смесь нагревают при 120°C в микроволновой печи в течение 2 ч. Растворитель упаривают в вакууме. Добавляют воду (30 мл) и этилацетат (40 мл). Слои разделяют, и водный слой экстрагируют этилацетатом. Объединенные органические экстракты сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 346 мг (1,14 ммоль, 37,6%).
248.3 1-[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метанамин
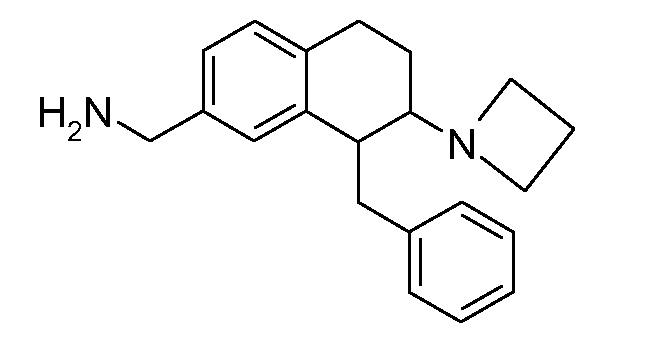
7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-карбонитрил (340 мг, 1,12 ммоль) растворяют в сухом метаноле (20 мл) в атмосфере азота. Добавляют никель Ренея (900 мг, 3,36 ммоль) в атмосфере азота, и реакционную смесь перемешивают при комнатной температуре в течение 48 ч в атмосфере водорода. Добавляют метанол (20 мл) и дихлорметан (30 мл). После перемешивания при комнатной температуре в течение 20 минут катализатор удаляют фильтрацией, и растворитель упаривают в вакууме. Выход: 338 мг (1,10 ммоль, 98%).
248.4 N-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамид
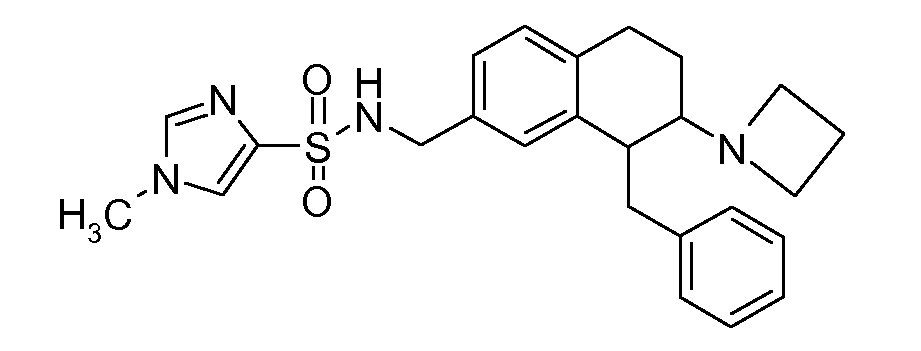
(7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метанамин (250 мг, 0,816 ммоль) и N,N-диметил-4-аминопиридин (199 мг, 1,632 ммоль) растворяют в дихлорметане (18 мл). Добавляют по каплям 1-метил-1H-имидазол-4-сульфонилхлорид (147 мг, 0,816 ммоль), растворенный в дихлорметане (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Затем реакционную смесь разбавляют дихлорметаном (20 мл) и промывают последовательно насыщенным раствором хлорида аммония (3Ч15 мл) и водой (2Ч10 мл). Органическую фазу сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 64 мг (0,142 ммоль, 17%).
ESI-MS [M+H+]=451, рассчитано для C25H30N4O2S=450.
Соединения нижеследующих примеров получают по способу примера 248:
Пример 249: N-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамид
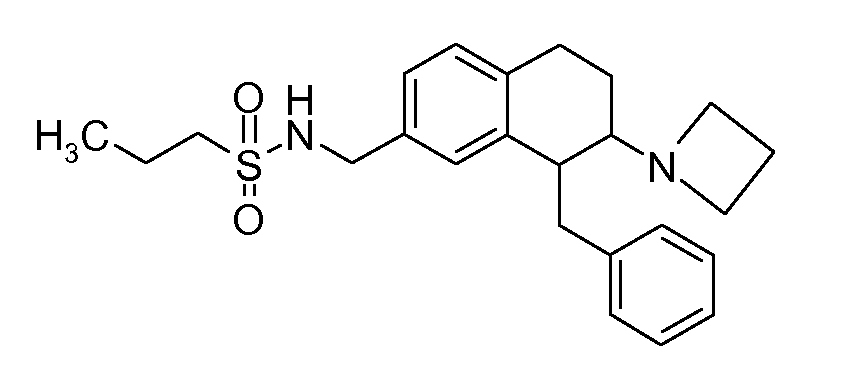
ESI-MS [M+H+]=413, рассчитано для C24H32N2O2S=412.
Пример 250: N-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-4-сульфонамид
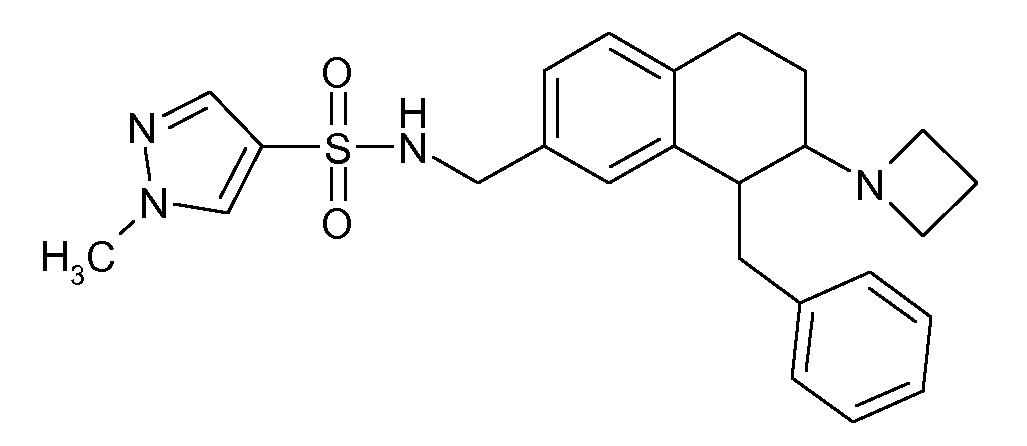
ESI-MS [M+H+]=451, рассчитано для C25H30N4O2S=450.
Пример 251: N-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиррол-3-сульфонамида трифторацетат
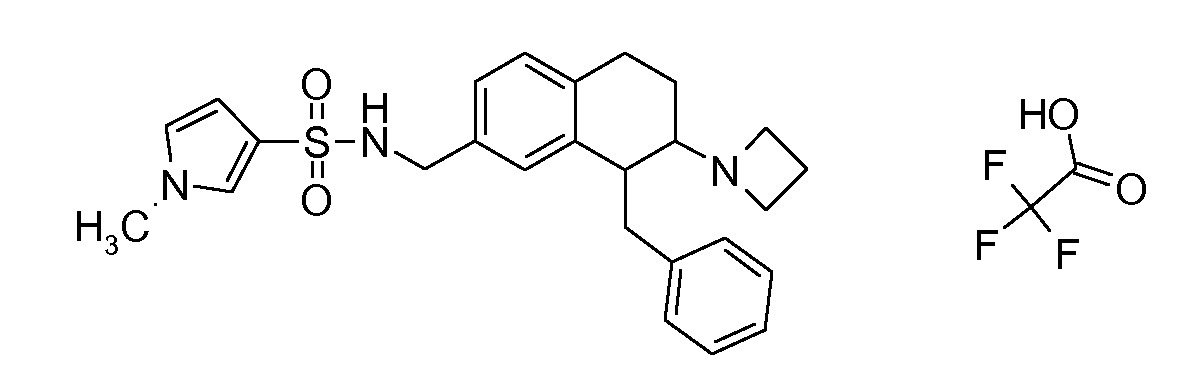
ESI-MS [M+H+]=450, рассчитано для C26H31N3O2S=449.
Пример 252: Энантиомер 1 N-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамида
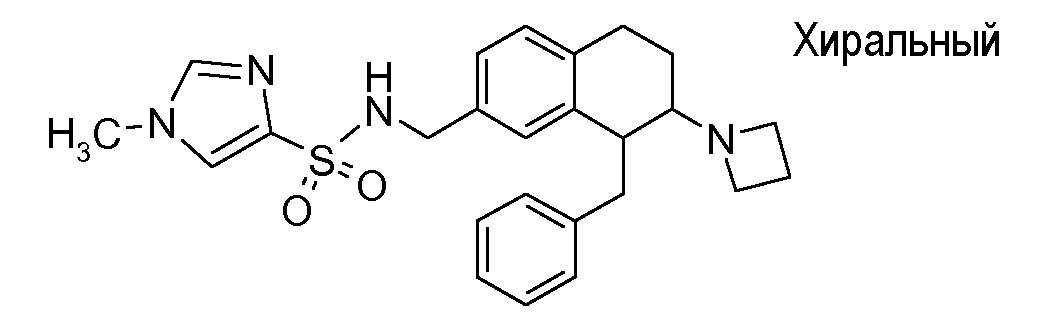
Энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата, описанный в примере 192, используют для синтеза в качестве хирального элемента структуры.
ESI-MS [M+H+]=451, рассчитано для C25H30N4O2S=450.
Пример 253: Энантиомер 1 N-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}пиридин-2-сульфонамида
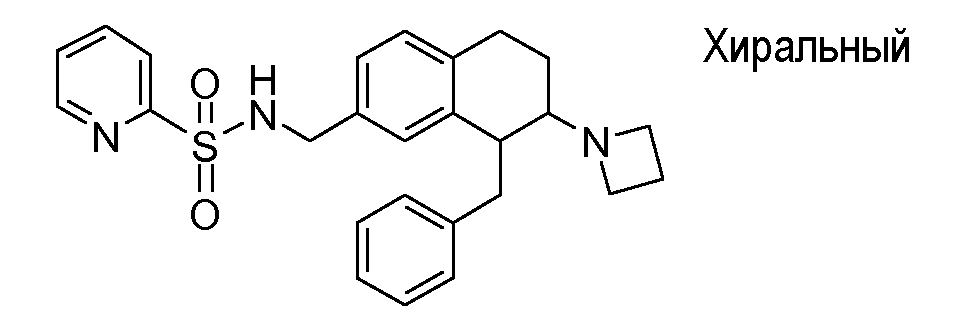
Энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата, описанный в примере 192, используют для синтеза в качестве хирального элемента структуры.
ESI-MS [M+H+]=448, рассчитано для C26H29N3O2S=447.
Пример 254: Энантиомер 1 N-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-4-сульфонамида
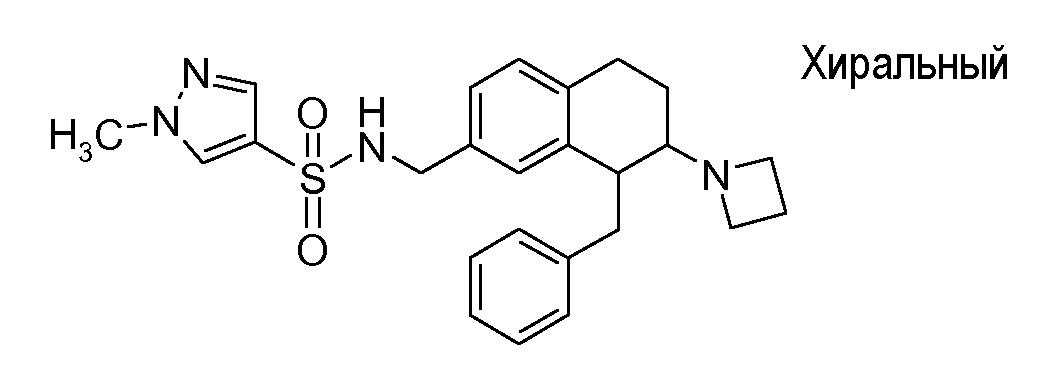
Энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата, описанный в примере 192, используют для синтеза в качестве хирального элемента структуры.
ESI-MS [M+H+]=451, рассчитано для C25H30N4O2S=450.
Пример 255: Энантиомер 1 N-{[7-(азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]метил}тиофен-2-сульфонамида
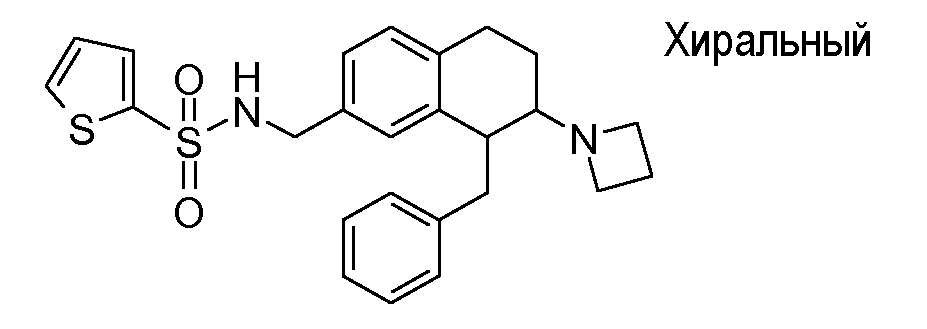
Энантиомер трет-бутил (1-бензил-7-циано-1,2,3,4-тетрагидронафтален-2-ил)карбамата, описанный в примере 192, используют для синтеза в качестве хирального элемента структуры.
ESI-MS [M+H+]=453, рассчитано для C25H28N2O2S2=452.
Пример 256: N-{[7-(Азетидин-1-ил)-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамида гидрохлорид
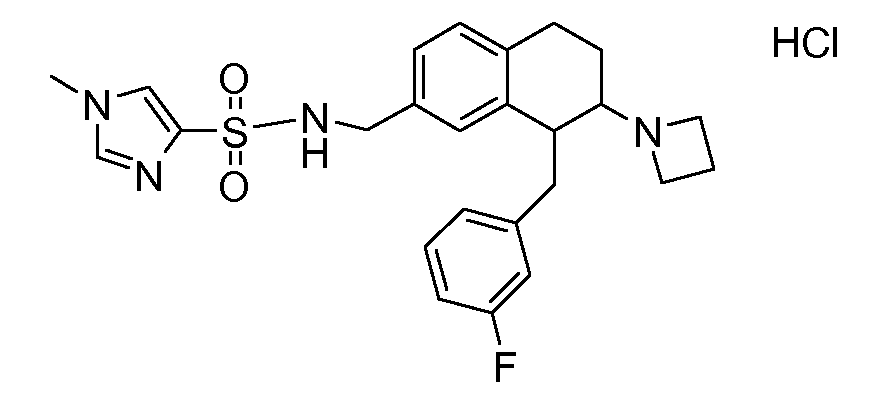
ESI-MS [M+H+]=469, рассчитано для C25H29FN4O2S=468.
Пример 257: N-{[8-Бензил-7-(морфолин-4-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамид
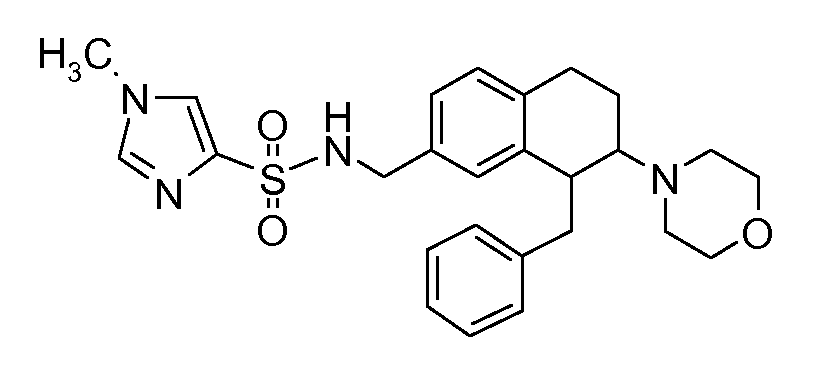
Указанное соединение получают по способу примера 248, используя 1-бром-2-(2-бромэтокси)этан вместо 1,3-дибромпропана.
ESI-MS [M+H+]=481, рассчитано для C26H32N4O3S=480.
Соединения нижеследующих примеров получают по способу примера 257:
Пример 258: N-{[8-Бензил-7-(морфолин-4-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-пиразол-4-сульфонамид
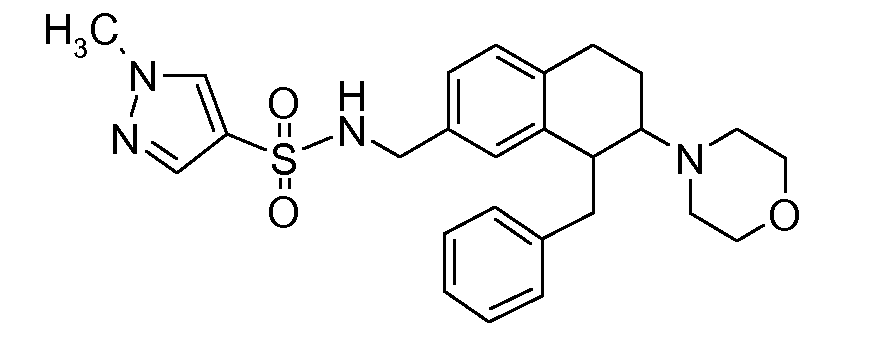
ESI-MS [M+H+]=481, рассчитано для C26H32N4O3S=480.
Пример 259: N-{[8-Бензил-7-(морфолин-4-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-циклопропилметансульфонамид
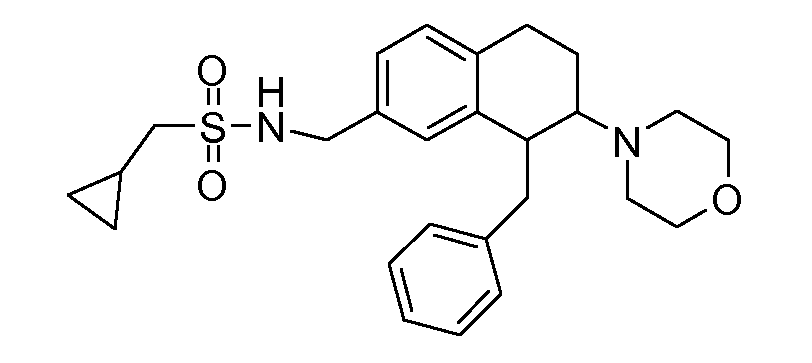
ESl-MS [M+H+]=455, рассчитано для C26H34N2O3S=454.
Пример 260: N-{[8-Бензил-7-(морфолин-4-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}пропан-1-сульфонамид
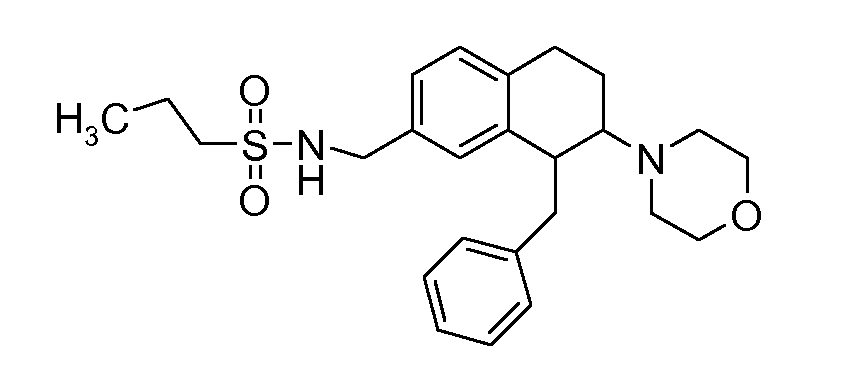
ESl-MS [M+H+]=443, рассчитано для C25H34N2O3S=442.
Пример 261: N-{[8-Бензил-7-(морфолин-4-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}циклобутансульфонамид
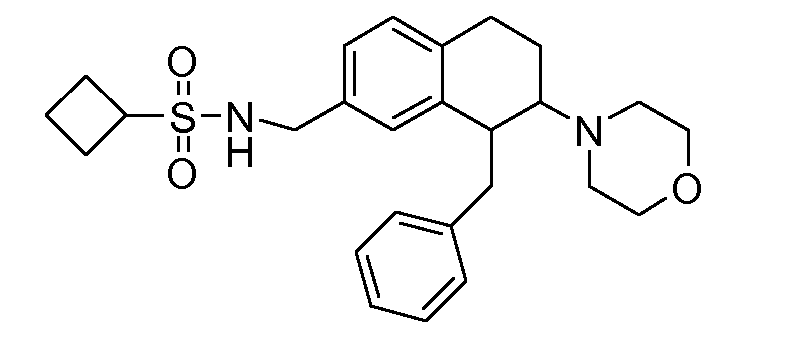
ESI-MS [M+H+]=455, рассчитано для C26H34N2O3S=454.
Пример 262: N-{[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамид
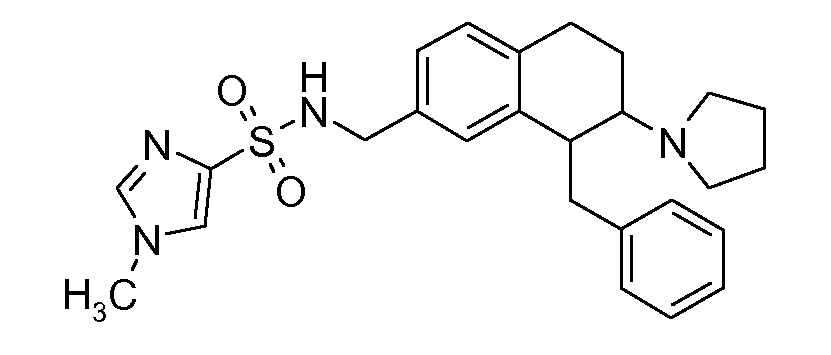
Указанное соединение получают по способу примера 248, используя 1,4-дибромбутан вместо 1,3-дибромпропана.
ESI-MS [M+H+]=465, рассчитано для C26H32N4O2S=464.
Пример 263: N-{[8-Бензил-7-(2-оксопирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]метил}-1-метил-1H-имидазол-4-сульфонамид
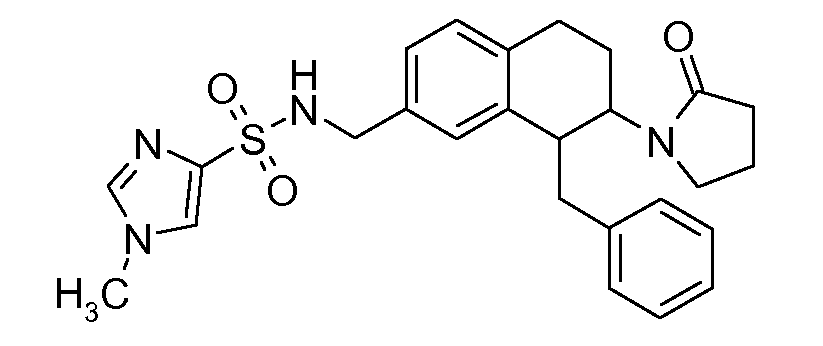
N-((7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил)-1-метил-1H-имидазол-4-сульфонамид (271 мг, 0,66 ммоль, см. также 173) растворяют в дихлорметане (10 мл). Добавляют пиридин (0,191 мл, 2,357 ммоль). Затем по каплям добавляют 4-хлорбутаноил хлорид (0,116 мл, 1,038 ммоль). Через 2 ч добавляют N,N-диметил-4-аминопиридин (46 мг, 0,378 ммоль), и перемешивание продолжают в течение ночи. Добавляют 1N раствор гидроксида натрия, и смесь экстрагируют дихлорметаном. Объединенные органические экстракты сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт суспендируют в сухом тетрагидрофуране, и добавляют суспензию гидрида натрия (60% в масле, 179 мг, перед добавлением дважды промывают пентаном) в тетрагидрофуране (3 мл). Реакционную смесь нагревают при 45°C в течение 1 ч. Добавляют воду, и смесь экстрагируют дихлорметаном (3Ч20 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 98 мг (0,205 ммоль, 46%).
ESI-MS [M+H+]=479, рассчитано для C26H30N4O3S=478.
Пример 264: N-{3-[8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
264.1 1-[1-(3-Хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил]пирролидин
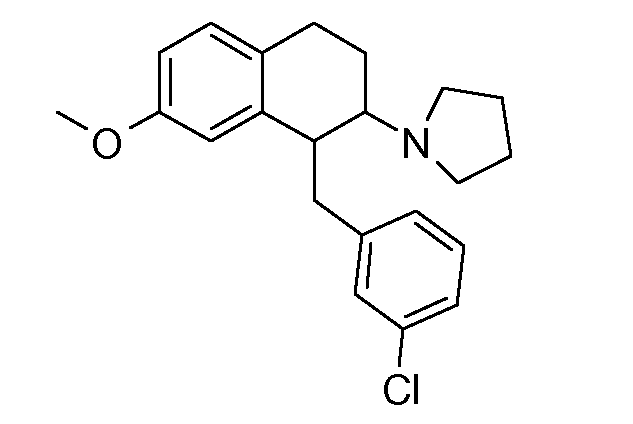
1-(3-Хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амин (6 г, 19,88 ммоль) растворяют в ацетонитриле (150 мл). Добавляют 1,4-дибромбутан (2,61 мл, 21,87 ммоль) и триэтиламин (6,1 мл, 43,7 ммоль), после чего реакционную смесь нагревают с обратным холодильником в течение 3 ч. Реакционную смесь выливают на лед и экстрагируют дихлорметаном. Объединенные органические экстракты последовательно промывают водой и насыщенным соляным раствором, сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт (6,6 г) используют на следующей стадии без дополнительной очистки.
264.2 8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол
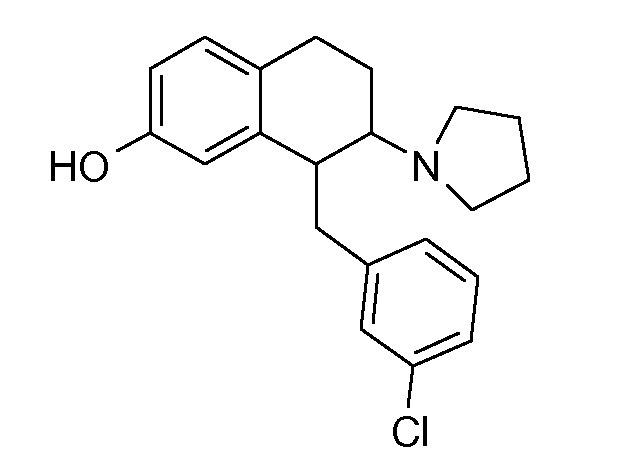
1-(1-(3-Хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил)пирролидин (6,6 г, 18,54 ммоль) растворяют в дихлорметане (100 мл). По каплям добавляют 1 M раствор бортрибромида в дихлорметане (55,6 мл, 55,6 ммоль) при охлаждении, поддерживая температуру реакционной смеси на уровне комнатной. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь выливают на лед, подщелачивают гидроксидом натрия. Водную фазу экстрагируют этилацетатом, и объединенные органические экстракты промывают последовательно раствором бикарбоната натрия и насыщенным соляным раствором. Объединенные экстракты сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт (5,5 г) используют на следующей стадии без дополнительной очистки.
264.3 8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат
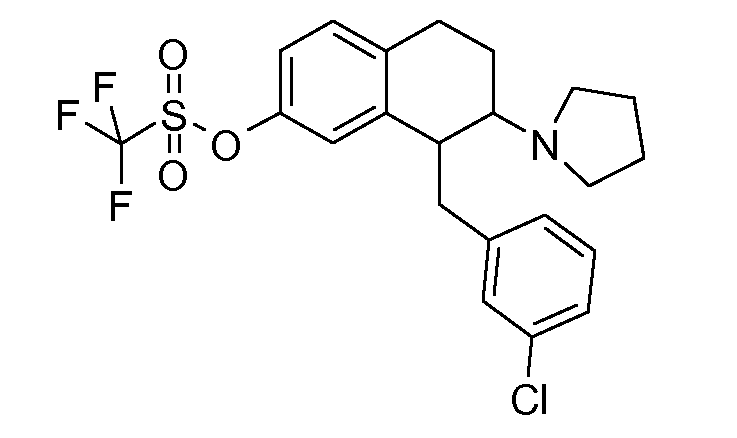
8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол (5,5 г, 16,09 ммоль) растворяют в дихлорметане (150 мл). При 0°С добавляют 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (6,9 г, 19,31 ммоль) и затем раствор триэтиламина (4,48 мл, 32,2 ммоль) в дихлорметане (50 мл). Реакционную смесь оставляют нагреваться до комнатной температуры, и перемешивание продолжают в течение ночи. Реакционную смесь выливают на лед и экстрагируют дихлорметаном. Объединенные экстракты промывают последовательно раствором хлорида аммония, водой и насыщенным соляным раствором. Экстракты сушат (Na2SO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 6,33 г (13,36 ммоль, 83%).
264.4 N-{3-[8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
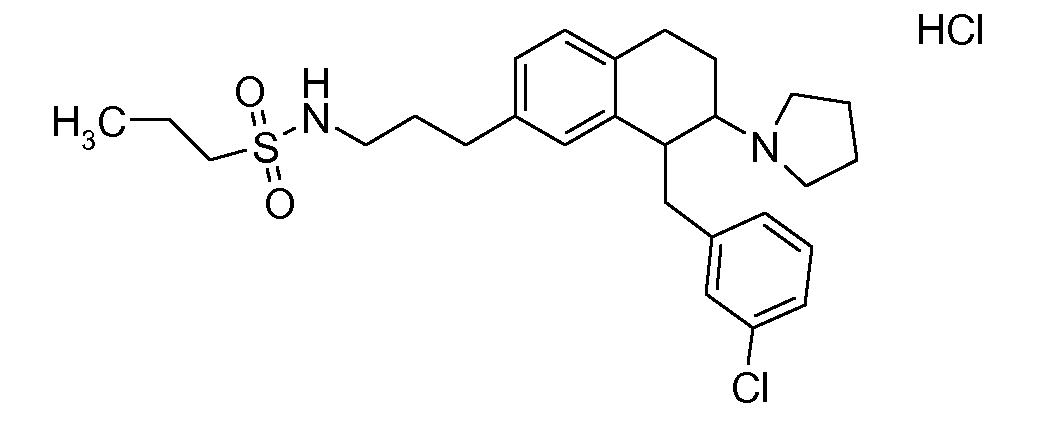
N-аллилпропан-1-сульфонамид (0,238 г, 1,456 ммоль) добавляют к раствору 9-борабицикло[3.3.1]нонана (0,185 г, 1,519 ммоль) в тетрагидрофуране (4 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. (7R,8S)-8-(3-Хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (0,3 г, 0,633 ммоль) растворяют в тетрагидрофуране (2 мл) и добавляют гидроксид натрия (0,063 г, 1,582 ммоль в 0,06 мл воды) и тетракистрифенилфосфин палладия (0,073 г, 0,063 ммоль). Реакционную смесь нагревают с обратным холодильником в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают 1 M раствором гидроксида натрия. Водную фазу экстрагируют еще два раза этилацетатом. Объединенные органические экстракты промывают насыщенным соляным раствором, сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают препаративной тонкослойной хроматографией (силикагель, дихлорметан, метанол). Продукт растворяют в дихлорметане. Добавляют избыток 5N хлористоводородной кислоты в этаноле. Растворитель упаривают, и продукт сушат в вакууме. Выход: 53 мг (0,108 ммоль, 17%).
ESI-MS [M+H+]=489, рассчитано для C27H37ClN2O2S=488.
Соединения нижеследующих примеров получают по способу примера 264:
Пример 265: Пропан-1-сульфоновой кислоты [3-(8-бензил-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-ил)пропил]амида гидрохлорид
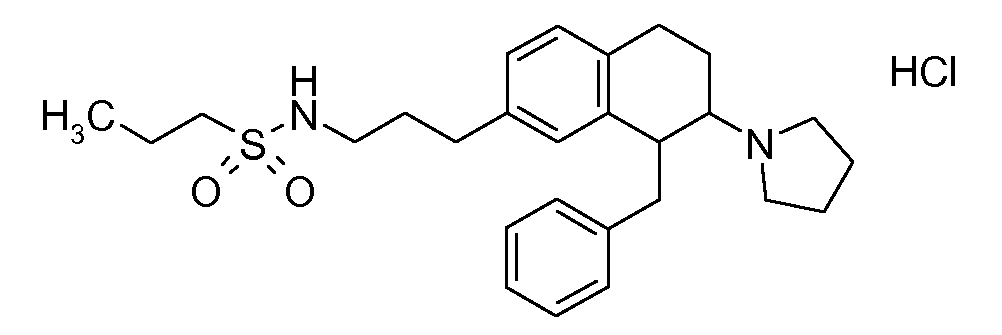
ESI-MS [M+H+]=455, рассчитано для C27H38N2O2S=454.
Пример 266: N-{3-[8-Бензил-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
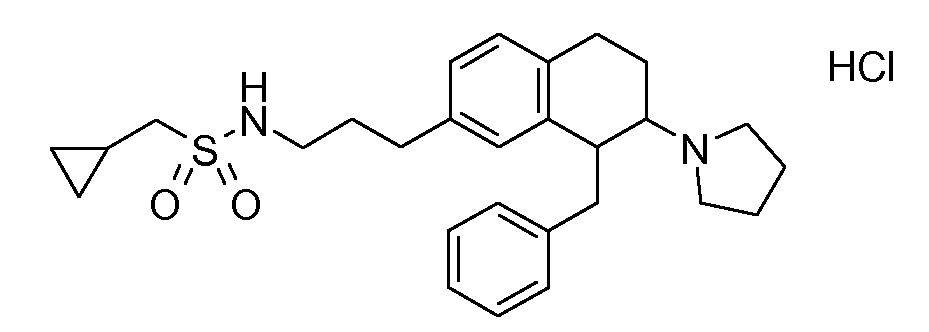
ESI-MS [M+H+]=467, рассчитано для C28H38N2O2S=466.
Пример 267: N-(2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамид
267.1 8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол
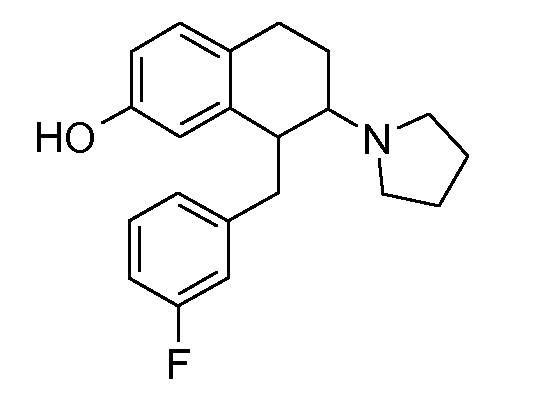
8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ол получают по способу получения 8-(3-хлорбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ола (см. также 264).
267.2 2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этанамин
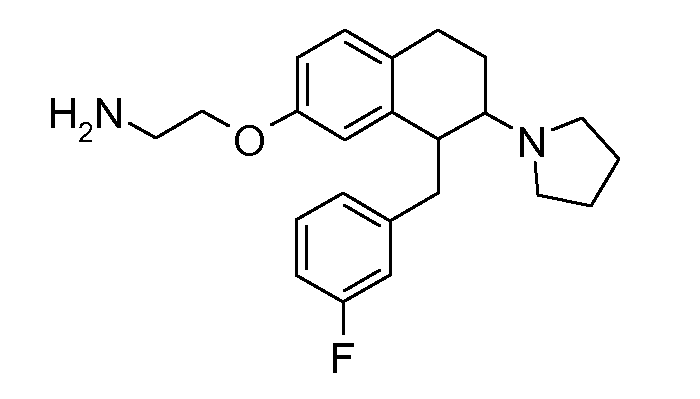
2-{[8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этанамин получают по способу примеров 1 и 2 из 8-(3-фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ола.
267.3 N-(2-{[8-(3-фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамид
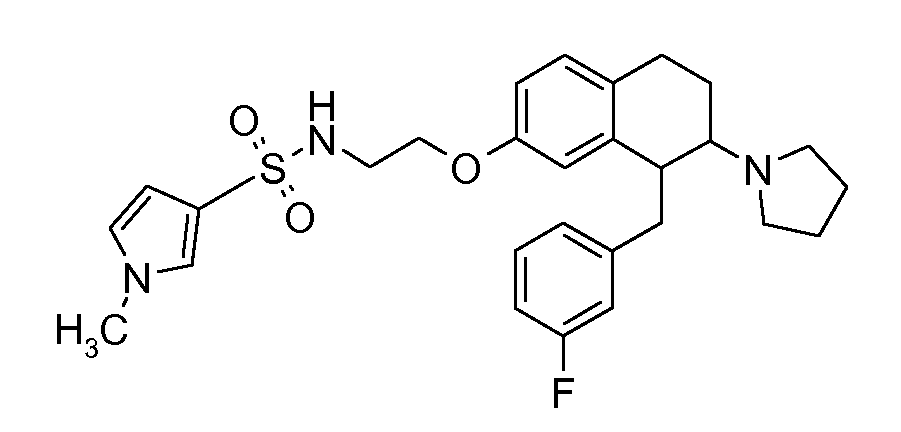
2-(8-(3-Фторбензил)-7-(пирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси)этанамин (50 мг, 0,136 ммоль) растворяют в дихлорметане (2 мл). Последовательно добавляют N,N-диметил-4-аминопиридин (49,7 мг, 0,407 ммоль) и 1-метил-1H-пиррол-3-сульфонилхлорид (24,4 мг, 0,136 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь разбавляют дихлорметаном и промывают водой. Органическую фазу сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 31 мг (0,061 ммоль, 45%).
ESI-MS [M+H+]=512, рассчитано для C28H34FN3O3S=511.
Соединения нижеследующих примеров получают по способу примера 267:
Пример 268: N-(2-{[7-(Азетидин-1-ил)-8-бензил-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамид
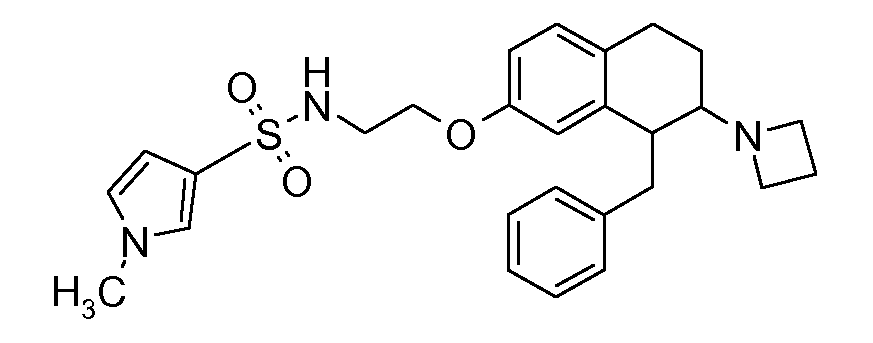
ESI-MS [M+H+]=480, рассчитано для C27H33N3O3S=479.
Пример 269: 1-Метил-1H-пиррол-3-сульфоновой кислоты {2-[7-азетидин-1-ил-8-(3-фторбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
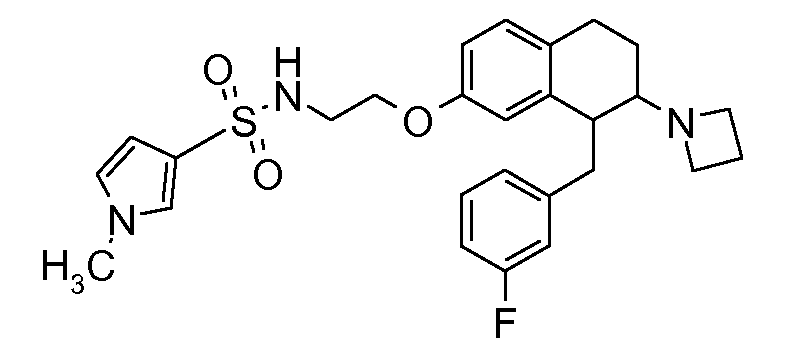
ESI-MS [M+H+]=498, рассчитано для C27H32FN3O3S=497.
Пример 270: Энантиомер 1 N-{1-бензил-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}пропионамида
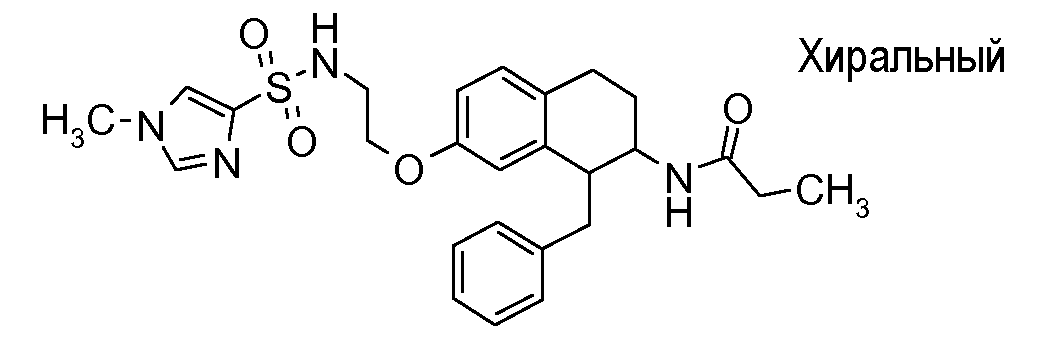
N-{1-Бензил-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}-пропионамид получают по способу примера 2, используя пропионилхлорид вместо этилхлорформиата. Указанное соединение можно выделить путем хиральной хроматографии конечного или промежуточного соединения.
ESI-MS [M+H+]=497, рассчитано для C26H32N4O4S=496.
Пример 271: N-(2-{[8-(3,5-Дифторбензил)-7-(формиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамид
271.1 Этил [1-(3,5-дифторбензил)-7-(2-{[(1-метил-1H-пиррол-3-ил)сульфонил]амино}этокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат
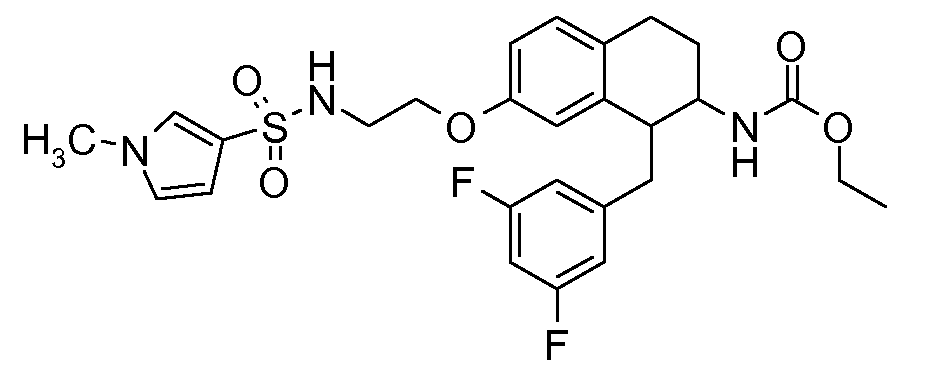
Этил[1-(3,5-дифторбензил)-7-(2-{[(1-метил-1H-пиррол-3-ил)сульфонил]амино}этокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат получают по способу примера 2.
271.2 N-(2-{[8-(3,5-Дифторбензил)-7-(формиламино)-5,6,7,8-тетрагидронафтален-2-ил]окси}этил)-1-метил-1H-пиррол-3-сульфонамид
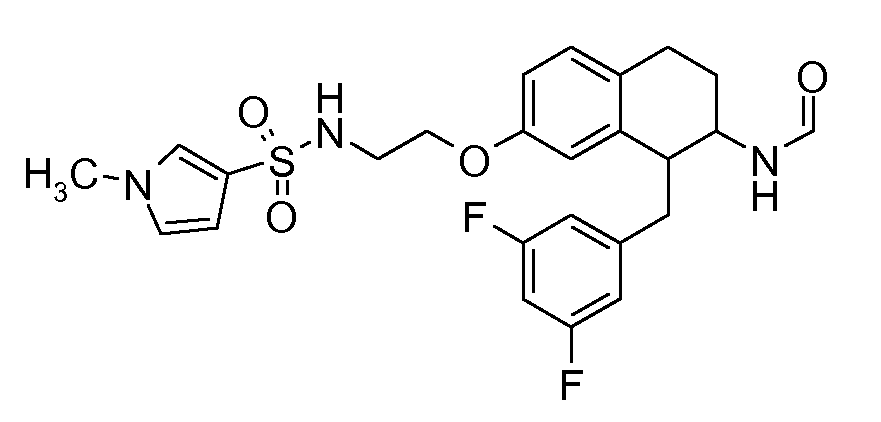
Этил[1-(3,5-дифторбензил)-7-(2-{[(1-метил-1H-пиррол-3-ил)сульфонил]амино}этокси)-1,2,3,4-тетрагидронафтален-2-ил]карбамат (200 мг, 0,365 ммоль) растворяют в тетрагидрофуране (16 мл). При комнатной температуре по каплям добавляют 1 M раствор гидрида лития алюминия в тетрагидрофуране (0,73 мл, 0,73 ммоль). Реакционную смесь нагревают при 50°C в течение 2 ч. При охлаждении по каплям добавляют 2N раствор гидроксида натрия (3 мл). Затем добавляют воду (30 мл) и этилацетат (30 мл). Водную фазу экстрагируют дважды этилацетатом. Объединенные экстракты сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 61 мг (0,116 ммоль, 32%).
ESI-MS [M+H+]=504, рассчитано для C25H27F2N3O4S=503.
Пример 272: N-{3-[8-(3,4-Дихлорбензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамид
272.1 1-(3,4-Дихлорбензил)-7-метокси-N-(пропан-2-ил)-1,2,3,4-тетрагидронафтален-2-амин
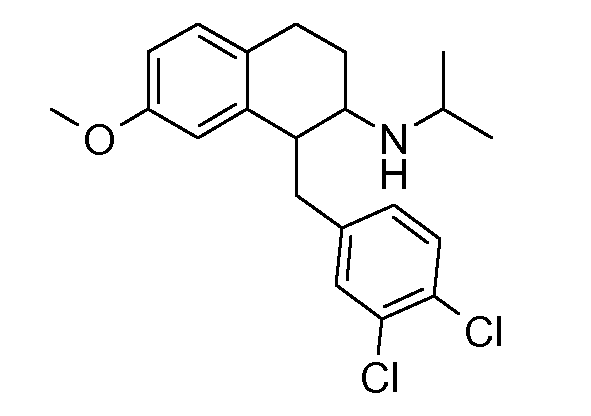
1-(3,4-Дихлорбензил)-7-метокси-N-(пропан-2-ил)-1,2,3,4-тетрагидронафтален-2-амин выделяется в виде минорного побочного продукта при перекристаллизации 1-(3,4-дихлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-амина гидрохлорида из изопропанола.
272.2 N-{3-[8-(3,4-Дихлорбензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамид
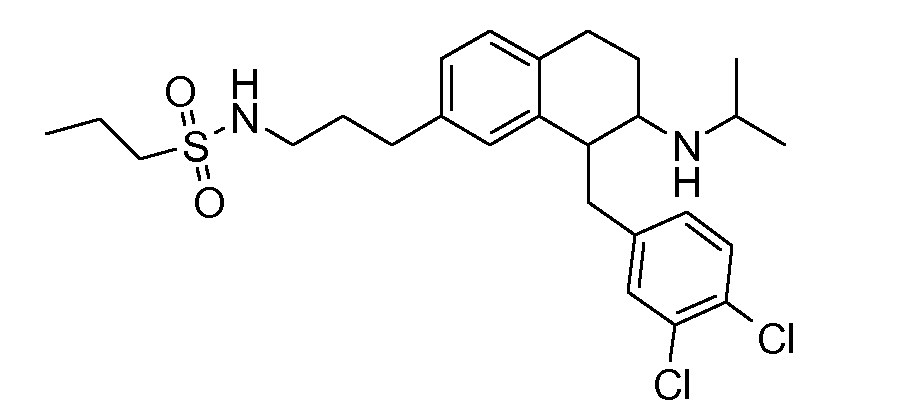
N-{3-[8-(3,4-Дихлорбензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамид получают по способу примера 264, используя 1-(3,4-дихлорбензил)-7-метокси-N-(пропан-2-ил)-1,2,3,4-тетрагидронафтален-2-амин вместо 1-[1-(3-хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил]пирролидина.
ESI-MS [M+H+]=511, рассчитано для C25H32Cl2N2O3S=510.
Пример 273: N-{3-[8-Бензил-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамида гидрохлорид
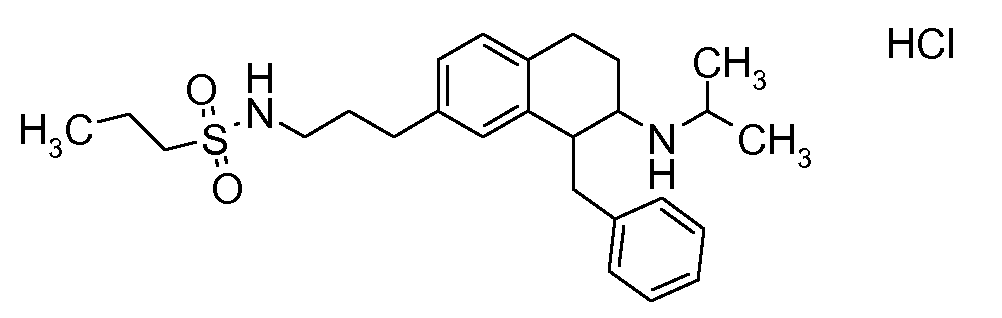
N-{3-[8-(3,4-Дихлорбензил)-7-(пропан-2-иламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}пропан-1-сульфонамид (70 мг, 0,137 ммоль) растворяют в метаноле (1,5 мл) и добавляют гидроксид палладия (30 мг, 0,214 ммоль). Реакционную смесь нагревают с обратным холодильником в атмосфере водорода в течение 6 ч. Катализатор удаляют фильтрацией, и неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Полученный амин растворяют в дихлорметане (2 мл) и добавляют 5N раствор хлористоводородной кислоты в изопропаноле (0,3 мл). Растворитель упаривают, и продукт сушат в вакууме. Выход: 30 мг (0,63 ммоль, 46%).
ESI-MS [M+H+]=443, рассчитано для C26H38N2O2S=442.
Пример 274: N-{3-[8-(4-Хлорбензил)-7-(диэтиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
274.1 N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамид
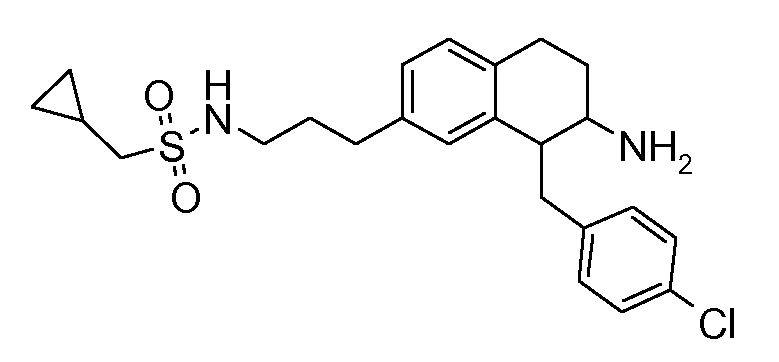
N-{3-[7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамид (см. также 202).
274.2 N-{3-[8-(4-Хлорбензил)-7-(диэтиламино)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-1-циклопропилметансульфонамида гидрохлорид
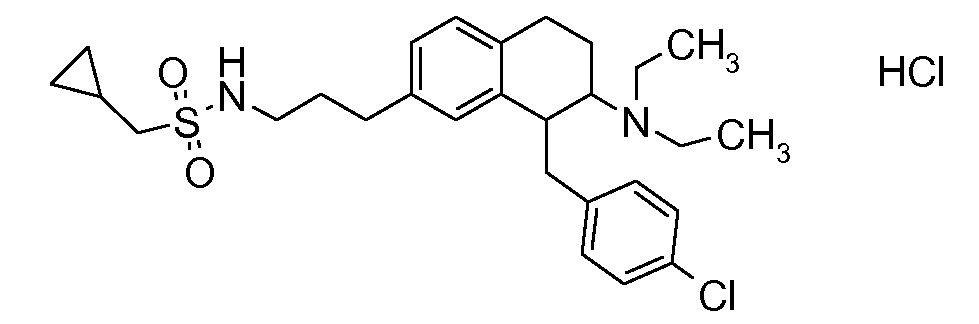
N-(3-(7-Амино-8-(4-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил)пропил)-1-циклопропилметансульфонамид (49 мг, 0,11 ммоль) растворяют в дихлорметане (2 мл). Добавляют уксусную кислоту (7 мкл, 0,11 ммоль), затем ацетальдегид (18 мкл, 0,322 ммоль) в дихлорметане (2 мл) и триацетоксиборгидрид натрия (34 мг, 0,16 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь разбавляют дихлорметаном (20 мл) и промывают водой (2Ч10 мл). Органический слой сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Амин растворяют в дихлорметане (3 мл) и добавляют избыток хлористоводородной кислоты в этаноле. Растворители упаривают, и продукт сушат в вакууме. Выход: 22 мг (0,041 ммоль, 38%).
ESI-MS [M+H+]=503, рассчитано для C28H39ClN2O2S=502.
Пример 275: N-{[8-Бензил-7-(метиламино)-5,6,7,8-тетрагидронафтален-2-ил]метил}-N-метилпропан-1-сульфонамида трифторацетат
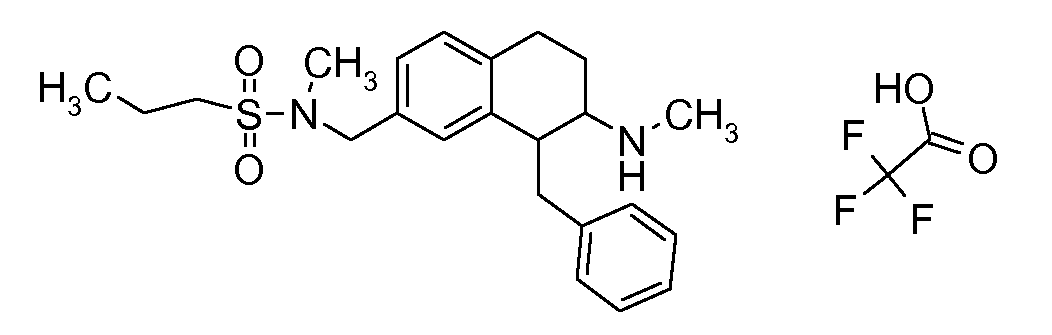
Указанное соединение можно получить по способу примера 227, используя трет-бутил [(1S,2R)-1-бензил-7-{[(пропилсульфонил)амино]метил}-1,2,3,4-тетрагидронафтален-2-ил]карбамат вместо трет-бутил 1-(3-фторбензил)-7-(3-(пропилсульфонамидо)пропил)-1,2,3,4-тетрагидронафтален-2-илкарбамата (алкилирование сульфонамида). Затем трет-бутилкарбамат можно восстановить гидридом лития алюминия по способу примера 187.
ESI-MS [M+H+]=401, рассчитано для C23H32N2O2S=400.
Пример 276: N-[1-Бензил-7-{3-[(пропилсульфонил)амино]проп-1-ин-1-ил}-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
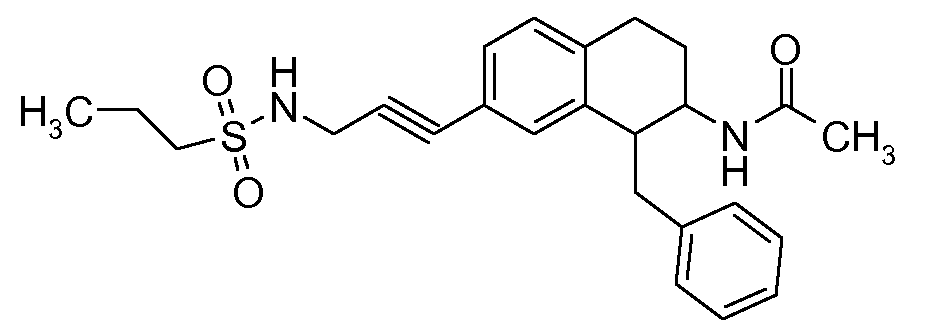
7-Ацетамидо-8-бензил-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонат (100 мг, 0,234 ммоль; полученный по способу получения 8-(3,4-дихлорбензил)-7-[(этоксикарбонил)амино]-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфоната, пример 29), N-(проп-2-инил)пропан-1-сульфонамид (75 мг, 0,468 ммоль), тетракистрифенилфосфин палладия (54 мг, 0.047 ммоль), иодид меди(I) (35,6 мг, 0,187 ммоль) и триэтиламин (65 мкл, 0,468 ммоль) в диоксане (3 мл) нагревают с обратным холодильником в течение 16 ч. Затем добавляют воду (15 мл), и смесь экстрагируют дихлорметаном (3Ч20 мл). Объединенные органические экстракты сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 56 мг (0,132 ммоль, 57%).
ESI-MS [M+H+]=439, рассчитано для C25H30N2O3S=438.
Пример 277: N-(2-(8-Бензил-7-(оксетан-3-иламино)-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-циклопропилметансульфонамид
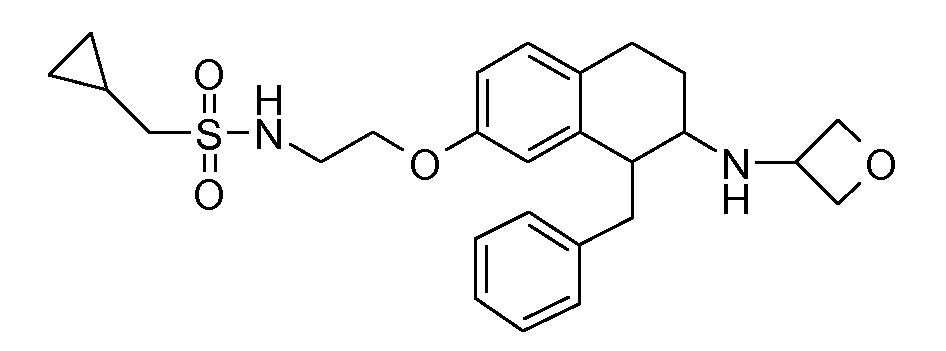
N-(2-(7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил)-1-циклопропилметансульфонамид (50 мг, 0,121 ммоль) растворяют в метаноле. При 0°С добавляют оксетан-3-он (87 мг, 1,21 ммоль), хлорид цинка (66 мг, 0,482 ммоль) и цианоборгидрид натрия (23 мг, 0,362 ммоль). Затем реакционную смесь нагревают при 40°C в течение 5 ч. Добавляют водный раствор хлорида аммония, и водный слой экстрагируют этилацетатом. Объединенные органические экстракты промывают насыщенным соляным раствором, сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол). Выход: 3 мг (6,4 мкмоль, 5%).
ESI-MS [M+H+]=471, рассчитано для C26H34N2O4S=470.
Пример 278: Пропан-1-сульфоновой кислоты (8-бензил-7-циклопропиламино-5,6,7,8-тетрагидронафтален-2-илметил)амида гидрохлорид
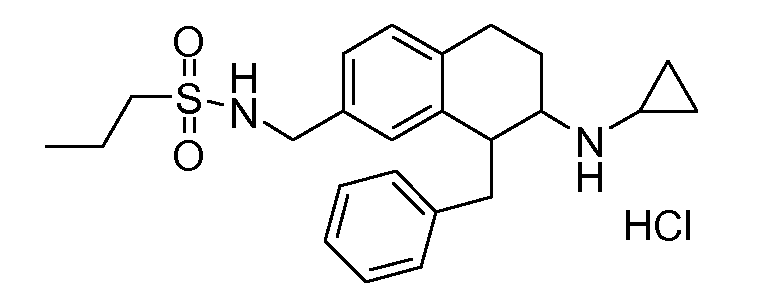
N-((7-Амино-8-бензил-5,6,7,8-тетрагидронафтален-2-ил)метил)пропан-1-сульфонамид (51 мг, 0,137 ммоль), (1-этоксициклопропокси)триметилсилан (26 мг, 0,151 ммоль), уксусную кислоту (0,078 мл, 1,37 ммоль), цианоборгидрид натрия (26 мг, 0,411 ммоль) и молекулярное сито (50 мг) в метаноле (1,5 мл) нагревают в микроволновой печи при 100°C в течение 25 мин. Растворитель упаривают, неочищенный продукт очищают флэш-хроматографией (силикагель, дихлорметан, метанол) и превращают в гидрохлорид. Выход: 18 мг (0,04 ммоль, 29%).
ESI-MS [M+H+]=413, рассчитано для C24H32N2O2S=412.
Пример 279: (1-(4-Хлорбензил)-7-{2-[метил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
279.1 Пропан-1-сульфоновой кислоты циклопропиламид
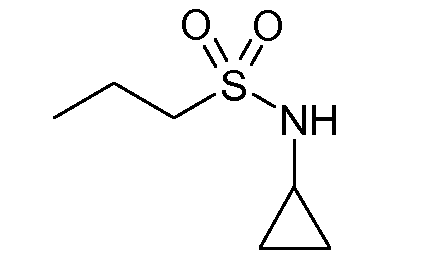
К раствору циклопропиламина (1,2 мл, 17,5 ммоль) в 100 мл CH2Cl2 и DMAP (2,4 г, 17,5 ммоль) добавляют по каплям раствор пропан-1-сульфонилхлорида (2,3 мл, 19,2 ммоль) в 50 мл CH2Cl2. Полученную смесь перемешивают при комнатной температуре в течение ночи и разбавляют 50 мл CH2Cl2. Смесь экстрагируют последовательно водой, 1 M HCl и насыщенным соляным раствором, сушат над Na2SO4, фильтруют, и растворитель упаривают, получая 2,8 г продукта (масло), который используют на следующей стадии без дополнительной очистки.
279.2 Уксусной кислоты 2-[циклопропил(пропан-1-сульфонил)амино]этиловый эфир
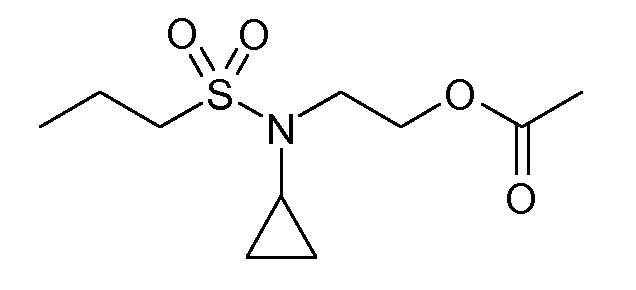
Смесь пропан-1-сульфоновой кислоты циклопропиламида (1,3 г, 8 ммоль), K2CO3 (2,4 г, 14,4 ммоль) и уксусной кислоты 2-бром-этилового эфира (9,5 г, 16 ммоль) в 10 мл ацетона нагревают в течение 6 ч при 120°C в микроволновой печи (Biotage). После охлаждения смесь фильтруют и растворитель упаривают, получая 1,7 г продукта в виде масла, который используют без дополнительной очистки на следующей стадии.
279.3 Пропан-1-сульфоновой кислоты циклопропил(2-гидроксиэтил)амид
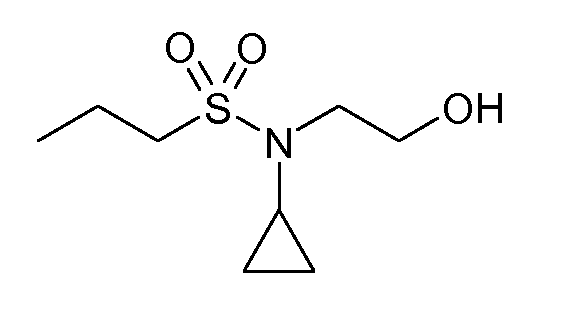
Смесь уксусной кислоты 2-[циклопропил(пропан-1-сульфонил)амино]этилового эфира (1,7 г, 6,8 ммоль) и KOH (0,57 г, 10,2 ммоль) в 30 мл метанола перемешивают в течение ночи при комнатной температуре. Растворитель упаривают, остаток растворяют в этилацетате и последовательно экстрагируют водой и 1 M KOH, сушат над Na2SO4, и растворитель упаривают, получая 0,46 г продукта, который используют после очистки хроматографией (253,5 мг бесцветного масла)
279.4 Пропан-1-сульфоновой кислоты 2-[циклопропил(пропан-1-сульфонил)амино]этиловый эфир
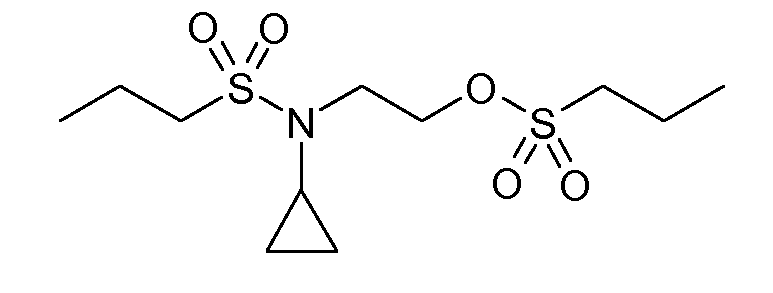
К раствору пропан-1-сульфоновой кислоты циклопропил-(2-гидроксиэтил)амида (150 мг, 0,8 ммоль) в CH2Cl2 и DMAP (97 мг, 0,8 ммоль) добавляют по каплям раствор пропан-1-сульфонилхлорида (97 мг, 0,8 ммоль) в CH2Cl2. Полученную смесь перемешивают при комнатной температуре в течение ночи, разбавляют 50 мл CH2Cl2, экстрагируют последовательно водой, 1 M HCl и насыщенным соляным раствором, сушат над Na2SO4, фильтруют и упаривают растворитель, получая 197,5 мг продукта, который используют на следующей стадии без дополнительной очистки.
279.5 1-(3-Хлорбензил)-7-{2-[циклопропил(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
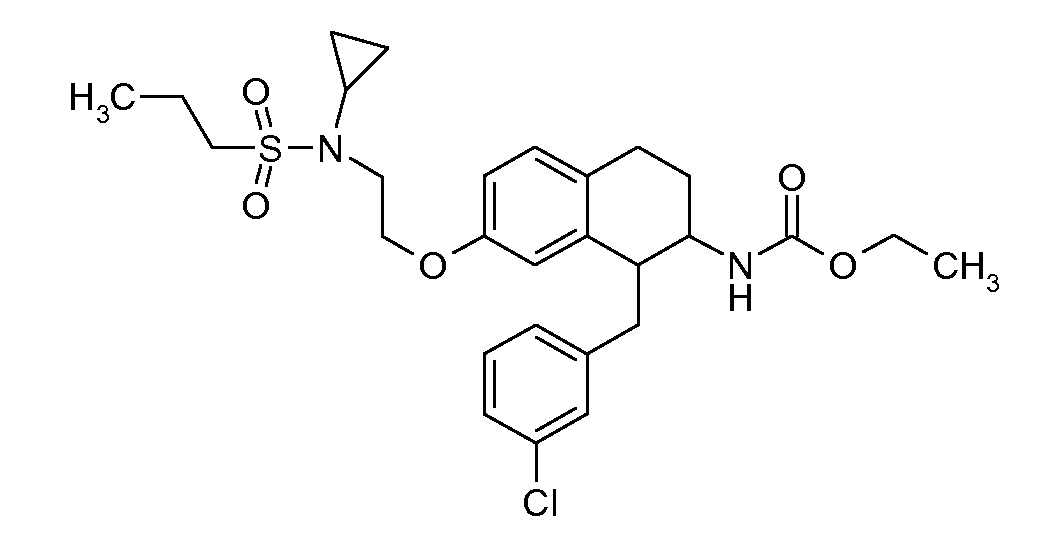
Получают в одну стадию из этил 1-(3-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата (полученного по способу примера 1d) и пропан-1-сульфоновой кислоты 2-[циклопропил(пропан-1-сульфонил)амино]этилового эфира по способу примера 76.
ESI-MS [M+H+]=549, рассчитано для C28H37ClN2O5S=548.
Пример 280: 1-Бензил-7-{2-[циклопропил-(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этиловый эфир
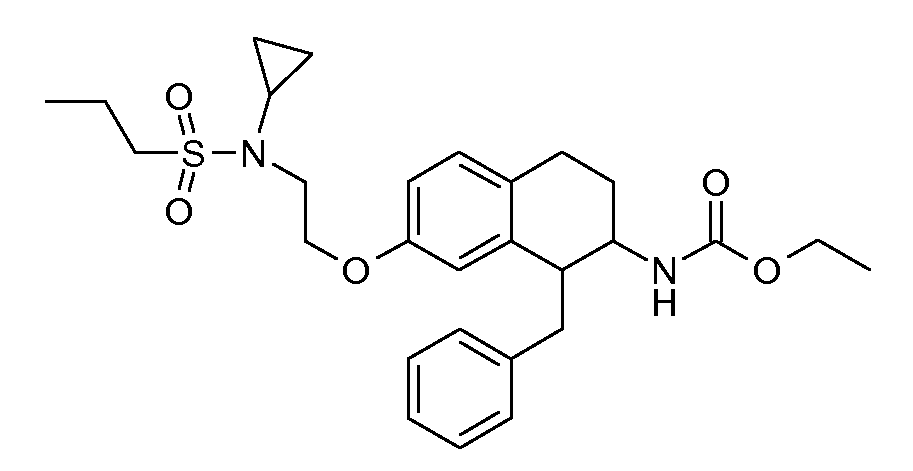
Получают в одну стадию из этил 1-бензил-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата (полученного по способу примера 1d) и пропан-1-сульфоновой кислоты 2-[циклопропил(пропан-1-сульфонил)амино]этилового эфира по способу примера 76.
ESI-MS [M+H+]=515, рассчитано для C28H38N2O5S=514.
Пример 281: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}циклопропиламида гидрохлорид
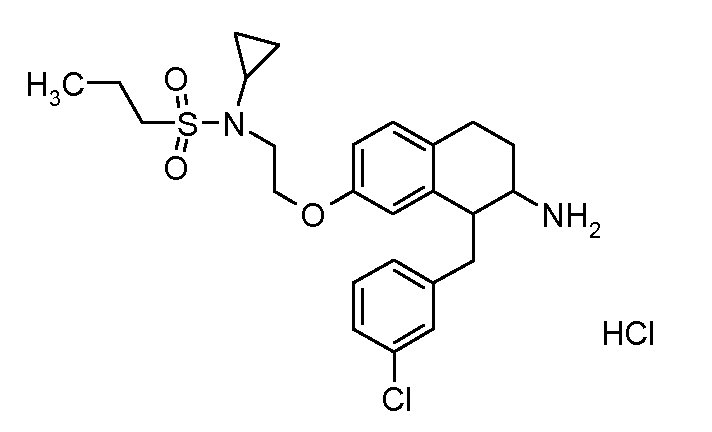
Получают в одну стадию из 1-(3-Хлорбензил)-7-{2-[циклопропил(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этилового эфира (пример 279) по способу примера 3.
ESI-MS [M+H+]=477, рассчитано для C25H33ClN2O3S=476.
Пример 282: Пропан-1-сульфоновой кислоты [2-(7-амино-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]циклопропиламида гидрохлорид
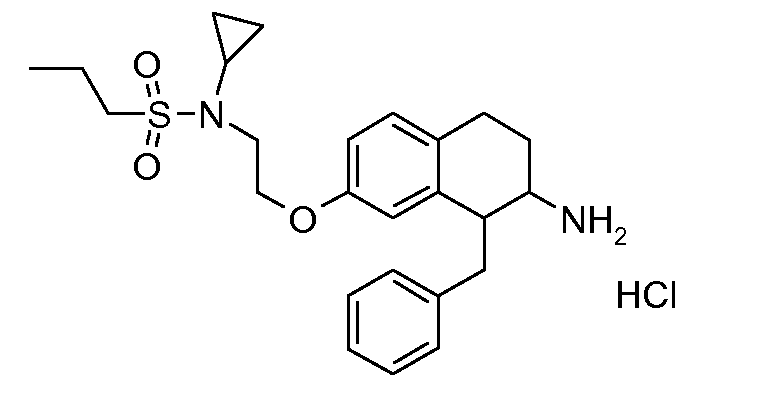
Получают в одну стадию из 1-бензил-7-{2-[циклопропил(пропан-1-сульфонил)амино]этокси}-1,2,3,4-тетрагидронафтален-2-ил)карбаминовой кислоты этилового эфира (пример 280) по способу примера 3.
ESI-MS [M+H+]=443, рассчитано для C25H34N2O3S=442.
Пример 283: 1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-ил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
283.1 3-[8-(3-Хлорбензил)-7-этоксикарбониламино-5,6,7,8-тетрагидронафтален-2-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир
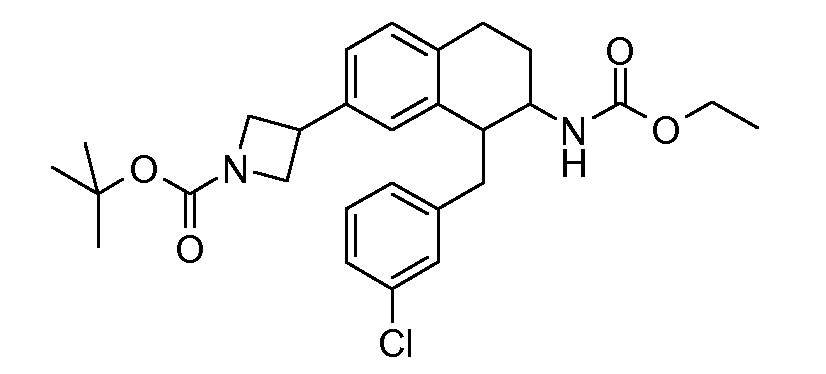
Суспензию цинкового порошка (152 мг, 2,3 ммоль) в 1 мл DMA в сухой колбе нагревают в атмосфере N2 до 65-70°C. Добавляют по каплям смесь TMS-Cl (28 мг, 0,26 ммоль) и 1,2-дибромэтана (49 мг, 0,26 ммоль), перемешивают в течение 30 мин и затем медленно (15 мин) добавляют 3-иод-азетидин-1-карбоновой кислоты трет-бутиловый эфир (510 мг, 1,8 ммоль) в 1 мл DMA. Реакционную смесь медленно охлаждают (3 ч) до комнатной температуры, добавляют к смеси 8-(3,4-хлорбензил)-7-[(этоксикарбонил)амино]-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфоната (633 мг, 1,3 ммоль, полученного по способу примера 29), CuI (74 мг, 0,39 ммоль) и PdCl2(dppf) (63 мг, 0,08 ммоль) в 4 мл DMA, заранее нагретого до 70°C, перемешивают в течение 7 ч при 70°C, добавляют воду и MTB (1:1 20 мл), и полученную смесь фильтруют. Органический слой отделяют, сушат (Na2SO4), и растворитель упаривают. После очистки хроматографией получают 560 мг продукта (белая пена).
283.2 1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-ил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
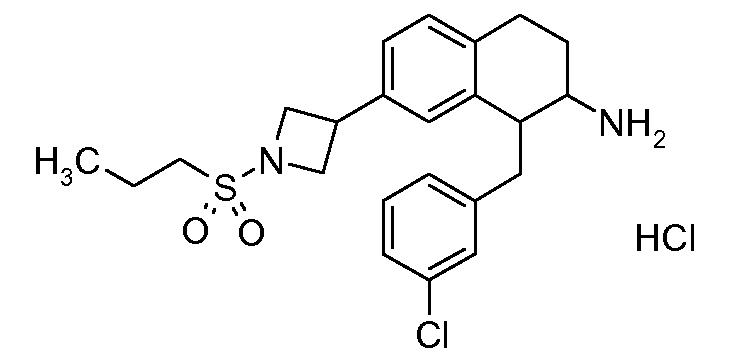
Получают в три стадии из 3-[8-(3-хлорбензил)-7-этоксикарбониламино-5,6,7,8-тетрагидронафтален-2-ил]-азетидин-1-карбоновой кислоты трет-бутилового эфира по способу примеров 46/47. Отщепление группы Boc проводят в муравьиной кислоте.
ESI-MS [M+H+]=433, рассчитано для C23H29ClN2O2S=432.
Пример 284: 1-Бензил-7-[1-(пропан-1-сульфонил)азетидин-3-ил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
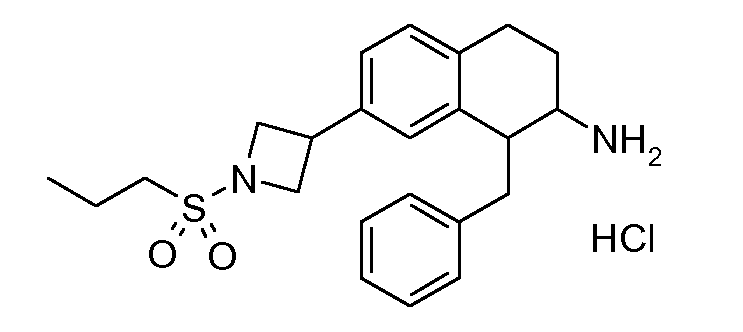
Получают по способу примера 283.
ESI-MS [M+H+]=399, рассчитано для C23H30N2O2S=398.
Пример 285: {1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илметокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
285.1 1-(Пропан-1-сульфонил)азетидин-3-карбоновой кислоты метиловый эфир
Получают стандартным способом из азетидин-3-карбоновой кислоты метилового эфира и пропан-1-сульфонилхлорида (см., например, пример 279).
285.2 [1-(Пропан-1-сульфонил)азетидин-3-ил]метанол
Получают путем восстановления 1-(пропан-1-сульфонил)азетидин-3-карбоновой кислоты метилового эфира под действием LiAlH4 в ТГФ при температуре от комнатной до 50°C (например, пример 300).
285.3 Метансульфоновой кислоты 1-(пропан-1-сульфонил)азетидин-3-илметиловый эфир
Получают стандартным способом из [1-(пропан-1-сульфонил)азетидин-3-ил]метанола и метан-1-сульфонилхлорида (например, пример 40)
285.4 {1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илметокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
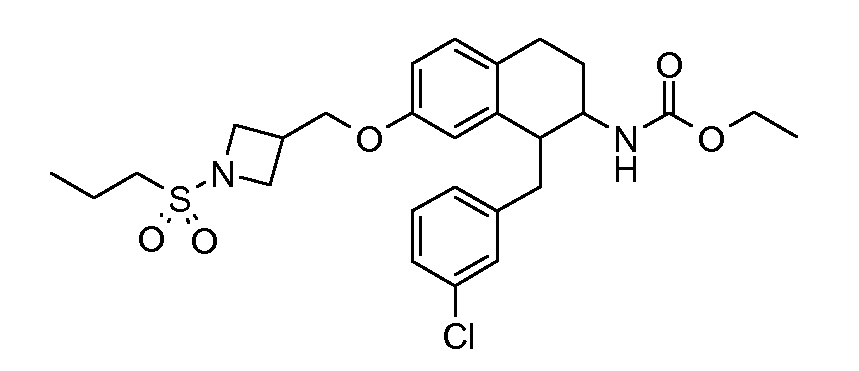
Получают из 1-(3-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата и метансульфоновой кислоты 1-(пропан-1-сульфонил)азетидин-3-илметилового эфира по способу примера 315.
ESI-MS [M+H+]=536, рассчитано для C27H35ClN2O5S=535.
Пример 286: 1-(3-Хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илметокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
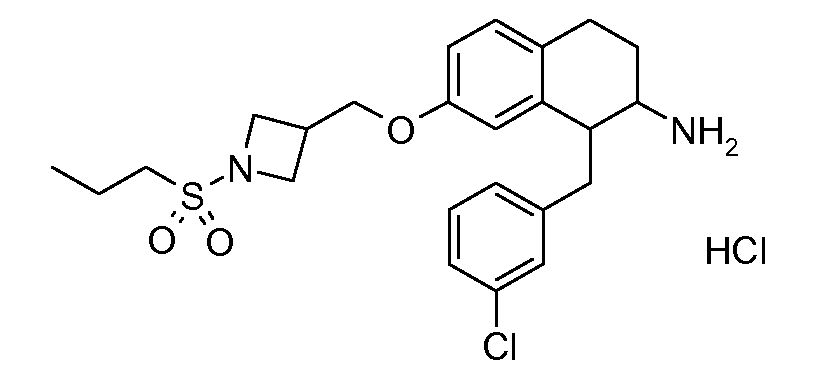
Получают из {1-(3-хлорбензил)-7-[1-(пропан-1-сульфонил)азетидин-3-илметокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира по способу примера 3.
ESI-MS [M+H+]=463, рассчитано для C24H31ClN2O3S=462.
Пример 287: [1-(3-Хлорбензил)-7-(2-циклопропилметансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
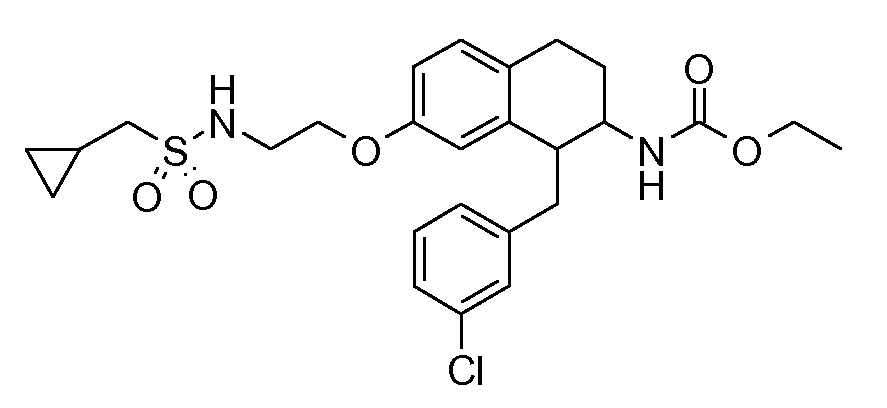
Получают по способу примера 3.
ESI-MS [M+H+]=521, рассчитано для C26H33ClN2O5S=520.
Пример 288: N-{2-[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
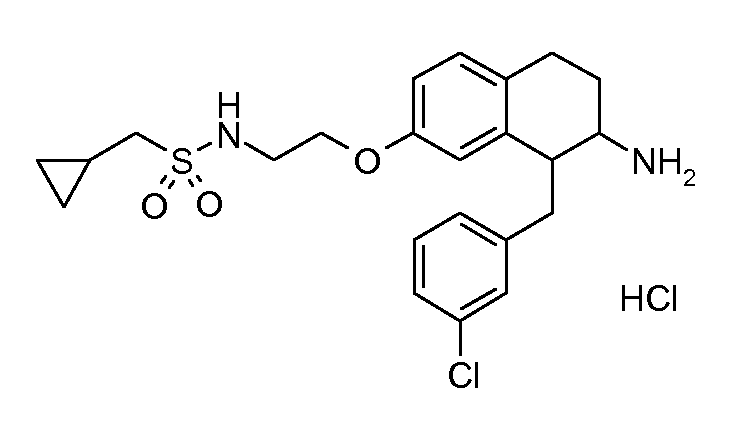
Получают из [1-(3-хлорбензил)-7-(2-циклопропилметансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 3.
ESI-MS [M+H+]=449, рассчитано для C23H29ClN2O3S=448.
Пример 289: [1-(3-Хлорбензил)-7-(1-циклопропилметансульфонилазетидин-3-илметокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
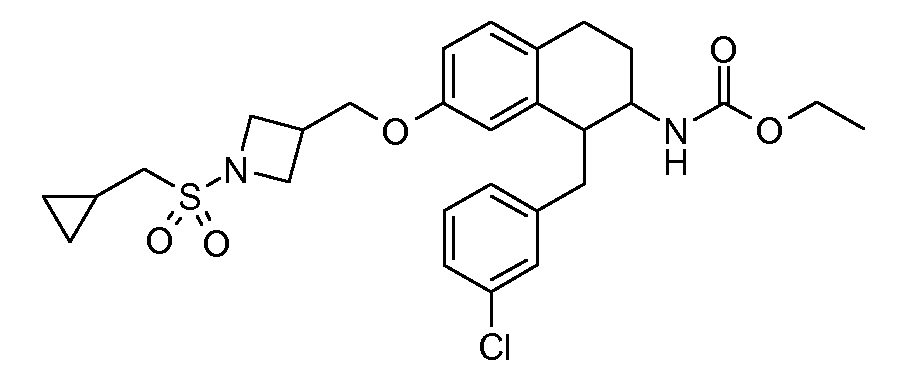
Получают из 1-(3-хлорбензил)-7-гидрокси-1,2,3,4-тетрагидронафтален-2-илкарбамата и метансульфоновой кислоты 1-циклопропилметансульфонилазетидин-3-илметилового эфира (полученного по способу примера 285) по способу примера 315.
ESI-MS [M+H+]=547, рассчитано для C28H35ClN2O5S=546.
Пример 290: {1-(3-Хлорбензил)-7-[2-(циклопропилметансульфонилметиламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
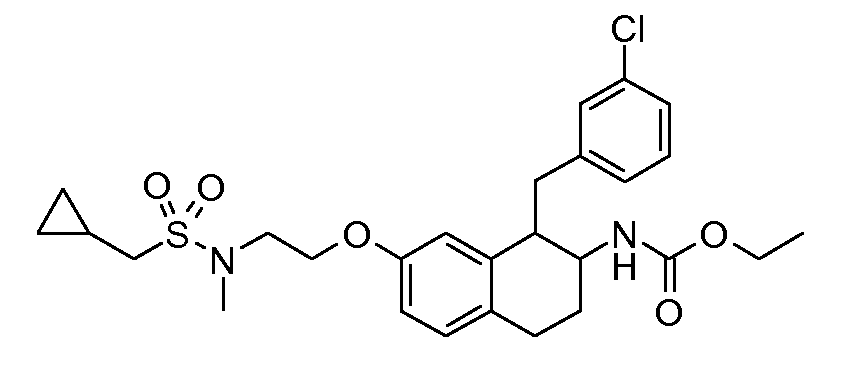
Получают из [1-(3-хлорбензил)-7-(2-циклопропилметансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 45.
ESI-MS [M+H+]=535, рассчитано для C27H35ClN2O5S=534.
Пример 291: N-{2-[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропил-N-метилметансульфонамид
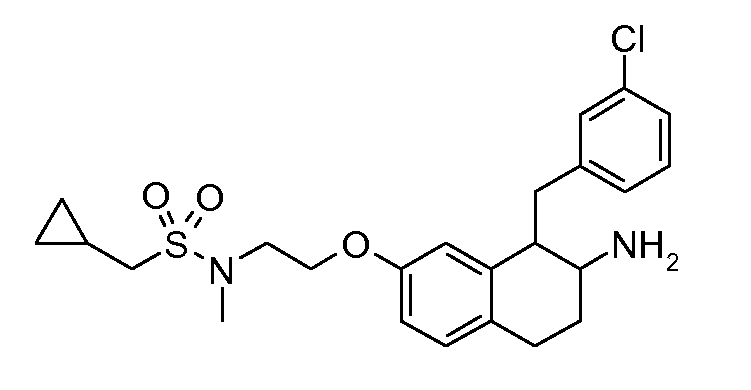
Получают из {1-(3-Хлорбензил)-7-[2-(циклопропилметансульфонилметиламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этилового эфира по способу примера 3.
ESI-MS [M+H+]=463, рассчитано для C24H31ClN2O3S=462.
Пример 292: 1-Бензил-7-[1-(пропан-1-сульфонил)азетидин-3-илметокси]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
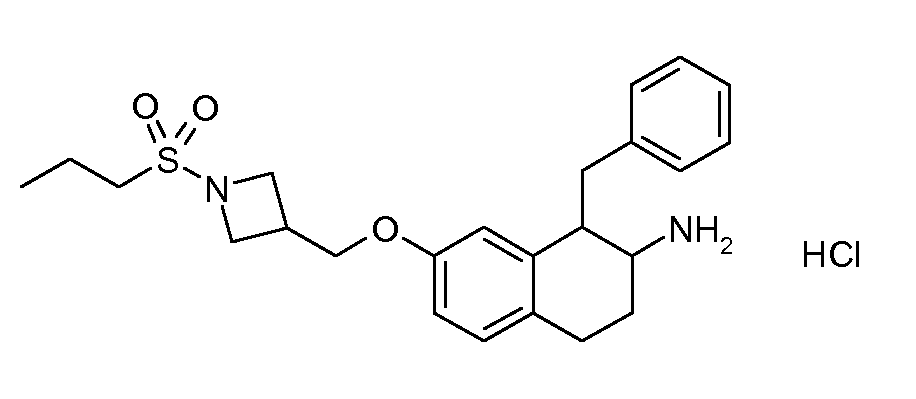
Получают по способу примера 46.
ESI-MS [M+H+]=429, рассчитано для C24H31ClN2O3S=428.
Пример 293: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
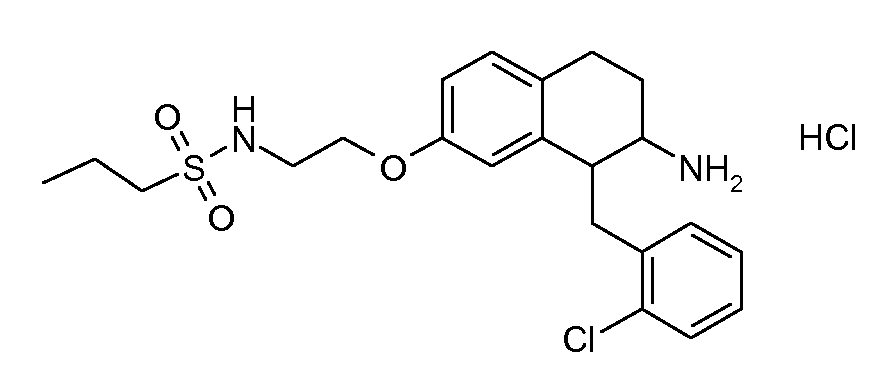
Получают по способу примера 3.
ESI-MS [M+H+]=437, рассчитано для C22H29ClN2O3S=436.
Пример 294: Циклопропансульфоновой кислоты {2-[7-амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
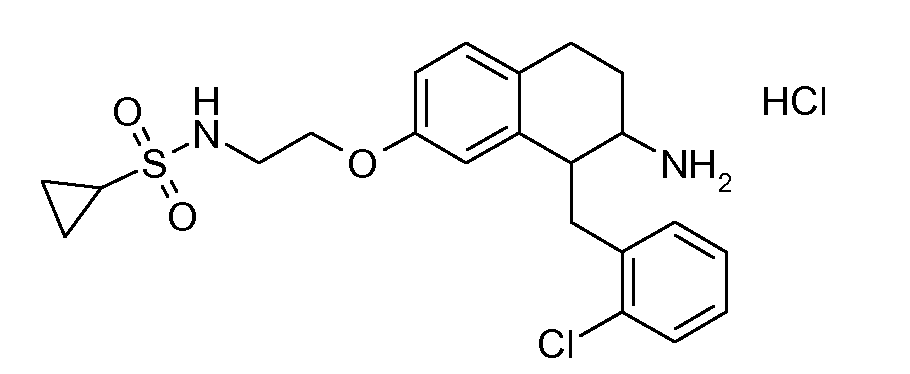
Получают по способу примера 3.
ESI-MS [M+H+]=435, рассчитано для C22H27ClN2O3S=434.
Пример 295: N-{2-[7-Амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
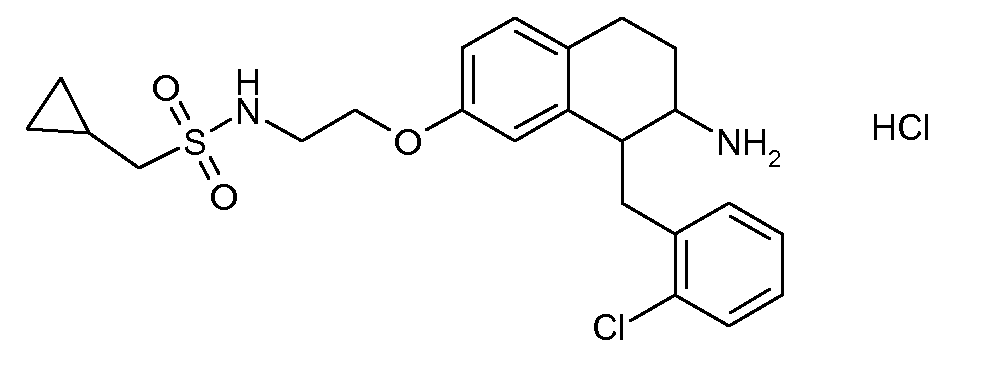
Получают по способу примера 3.
ESI-MS [M+H+]=449, рассчитано для C23H29ClN2O3S=448.
Пример 296: N-{3-[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}-C-циклопропилметансульфонамида гидрохлорид
296.1 [7-(3-трет-бутоксикарбониламинопропил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
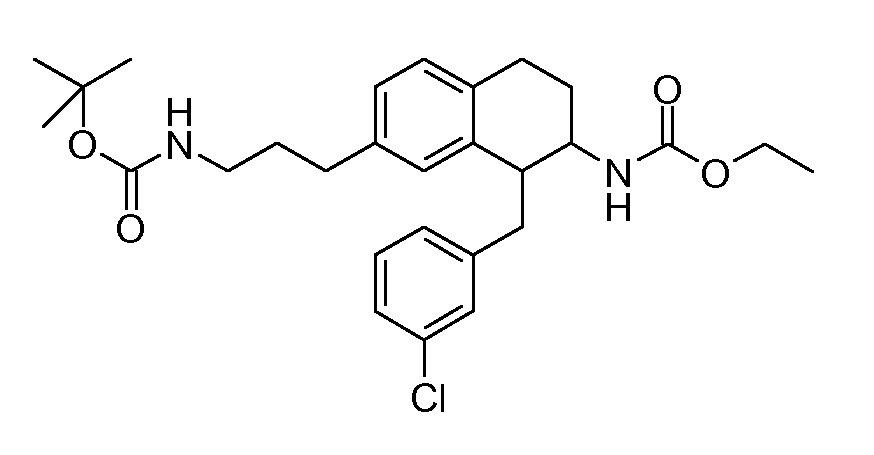
Раствор трет-бутил аллилкарбамата (297 мг, 1,9 ммоль) в сухом ТГФ в атмосфере азота добавляют по каплям при 0°C к 9-BBN, растворенному в ТГФ (0,5 M, 2,3 мл, 1,2 ммоль) и перемешивают в течение 4 ч. Полученную смесь последовательно обрабатывают 8-(3,4-хлорбензил)-7-[(этоксикарбонил)амино]-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфонатом (250 мг, 0,5 ммоль), ацетатом палладия(II) (11,5 мг, 0,05 ммоль), трифенилфосфином (27 мг, 0,1 ммоль) и карбонатом цезия (333 мг, 1 ммоль), после чего смесь нагревают с обратным холодильником в течение 2 ч. Растворитель упаривают, остаток растворяют в этилацетате, экстрагируют водой и сушат (Na2SO4). После упаривания растворителя получают 0,51 г коричневого масла, которое обрабатывают диизопропиловым эфиром, получая 91 мг коричневатого порошка.
296.2 N-{3-[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]-пропил}-C-циклопропилметансульфонамида гидрохлорид
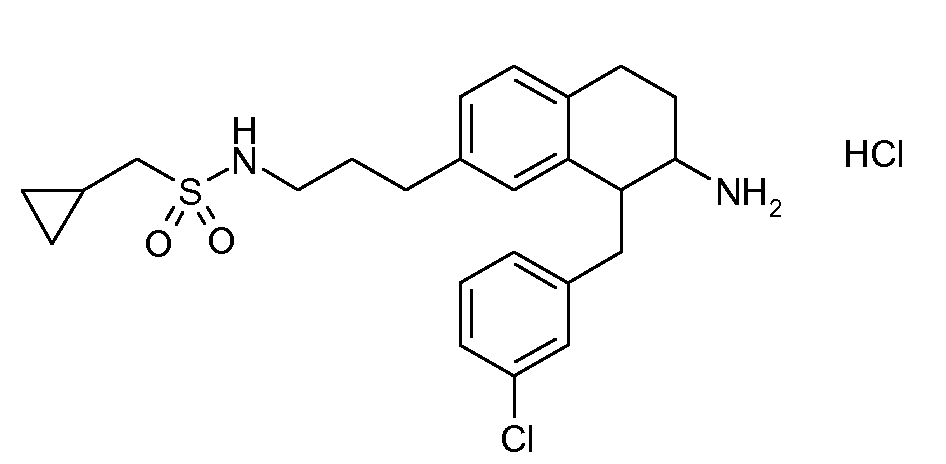
Получают из [7-(3-трет-бутоксикарбониламинопропил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 3.
ESI-MS [M+H+]=447, рассчитано для C24H31ClN2O2S=446.
Пример 297: Пропан-1-сульфоновой кислоты {3-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]пропил}амида гидрохлорид
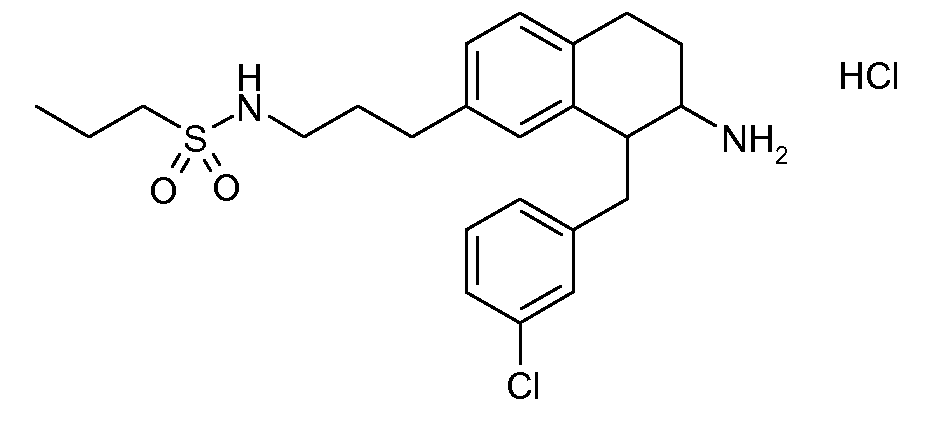
Получают по способу примера 296.
ESI-MS [M+H+]=435, рассчитано для C23H31ClN2O2S=434.
Пример 298: {1-(2-Хлорбензил)-7-[2-(1-метил-1H-имидазол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
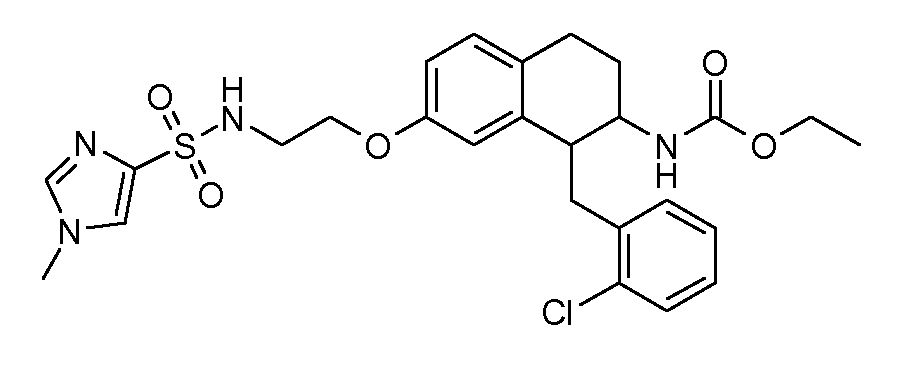
Получают по способу примера 3.
ESI-MS [M+H+]=547, рассчитано для C26H31ClN4O5S=546.
Пример 299: {1-(2-Хлорбензил)-7-[2-(1-метил-1H-пиразол-4-сульфониламино)этокси]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
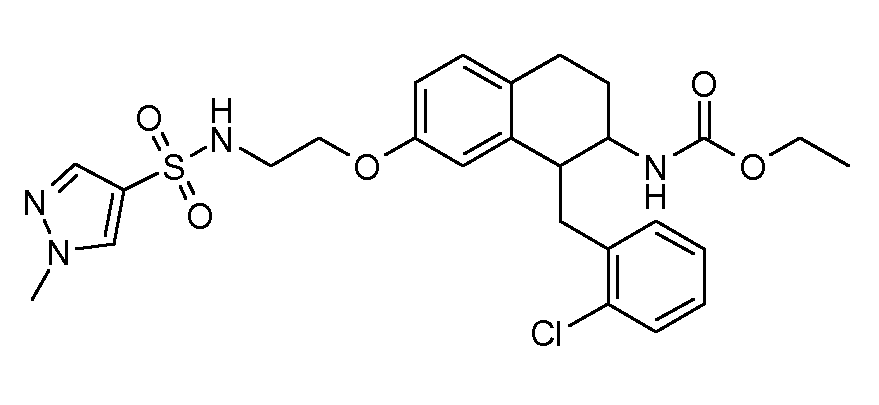
Получают по способу примера 3.
ESI-MS [M+H+]=547, рассчитано для C26H31ClN4O5S=546.
Пример 300: N-{2-[8-(3-Хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
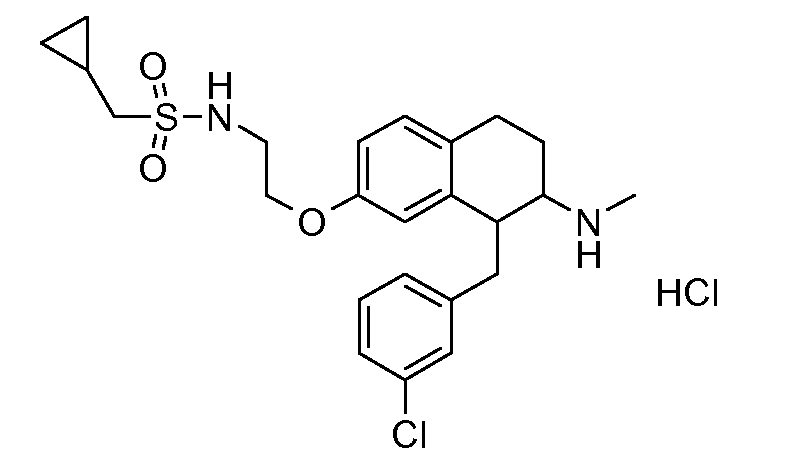
Раствор LiAlH4 в ТГФ (1 M, 1,5 мл, 1,5 ммоль) добавляют по каплям к [1-(3-хлорбензил)-7-(2-циклопропилметансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловому эфиру (523 мг, 1 ммоль, пример 287), растворенному в 100 мл сухого ТГФ. Смесь нагревают с обратным холодильником в течение 1 ч, обрабатывают 2N NaOH и экстрагируют CH2Cl2. Органический слой экстрагируют насыщенным раствором NaHCO3 и насыщенным соляным раствором, сушат (Na2SO4), фильтруют и упаривают растворитель. После очистки хроматографией получают 324 мг продукта в виде бесцветного масла, которое превращают в гидрохлорид путем добавления HCl в изопропаноле. (325 мг, белый порошок)
ESI-MS [M+H+]=463, рассчитано для C24H31ClN2O3S=462.
Пример 301: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
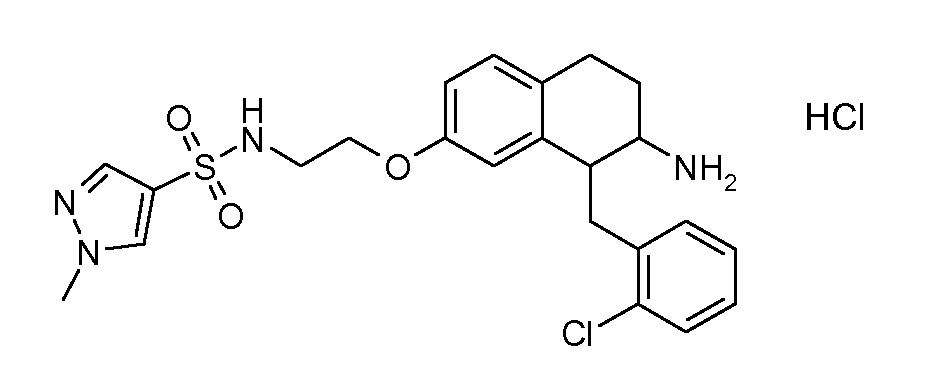
Получают по способу примера 3.
ESI-MS [M+H+]=475, рассчитано для C23H27ClN4O3S=474.
Пример 302: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[8-(2-хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
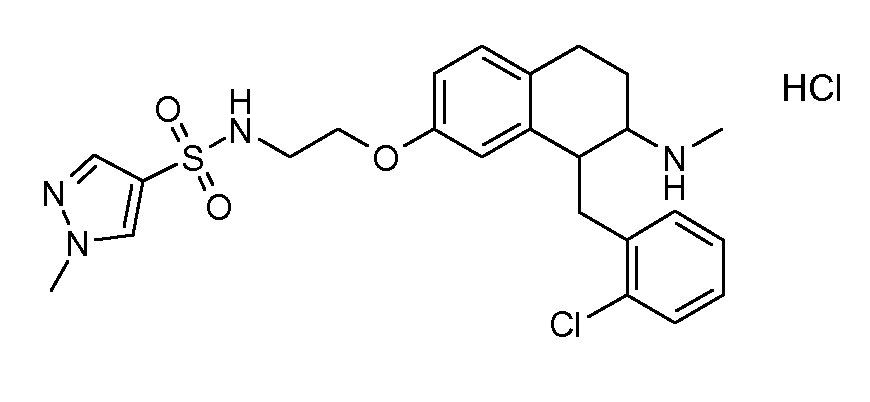
Получают по способу примера 3/300.
ESI-MS [M+H+]=489, рассчитано для C24H29ClN4O3S=488.
Пример 303: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(2-хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
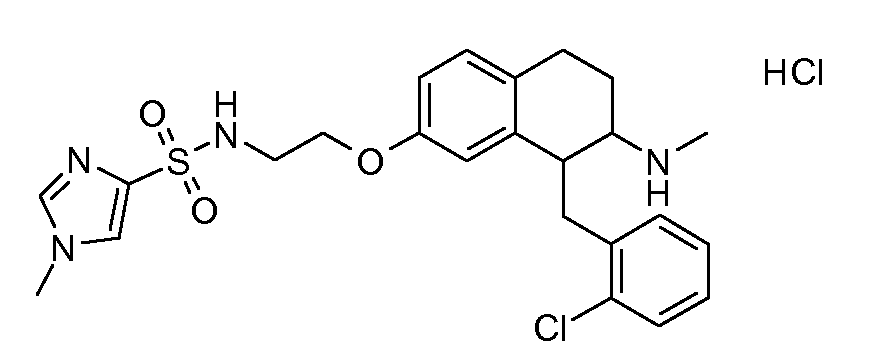
Получают по способу примера 3/300.
ESI-MS [M+H+]=489, рассчитано для C24H29ClN4O3S=488.
Пример 304: Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]этил}амида гидрохлорид
304.1 [7-(2-Бензилоксикарбониламиноэтил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
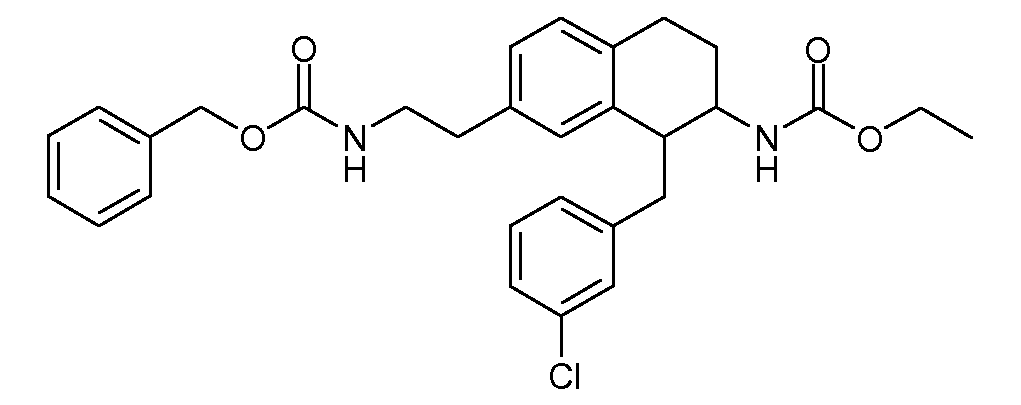
Смесь калия (2-(бензилоксикарбониламино)этил)трифторбората (1,130 г, 3,96 ммоль), карбоната цезия (2,58 г, 7,93 ммоль), 8-(3-хлорбензил)-7-(этоксикарбониламино)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфоната (1,3 г, 2,64 ммоль), Pd(OAc)2 (0,030 г, 0,132 ммоль) и 2-дициклогексилфосфино-2',6'-ди-изо-пропокси-1,1'-бифенила (0,130 г, 0,264 ммоль) в атмосфере N2 в смеси толуол/вода 3:1 (15 мл) нагревают с обратным холодильником в течение 13 ч. Затем реакционную смесь фильтруют, растворитель упаривают, и остаток очищают хроматографией, получая 1,04 г продукта в виде бесцветного масла.
304.2 [7-(2-Аминоэтил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
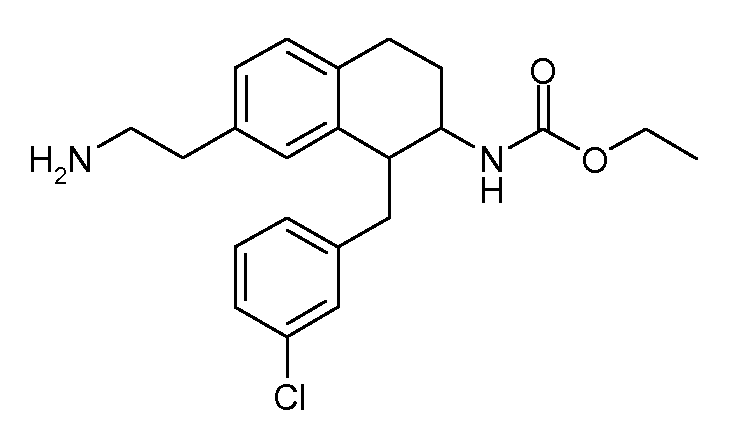
К [7-(2-бензилоксикарбониламиноэтил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловому эфиру (500 мг, 0,960 ммоль) добавляют при комнатной температуре 8 мл 33% раствора HBr в уксусной кислоте. Через 2 ч смесь разбавляют CH2Cl2, промывают дважды NaHCO3, сушат и фильтруют. Растворитель упаривают, получая продукт в виде желтого масла (392 мг), который используют без дополнительной очистки.
304.3 Пропан-1-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]этил}амида гидрохлорид
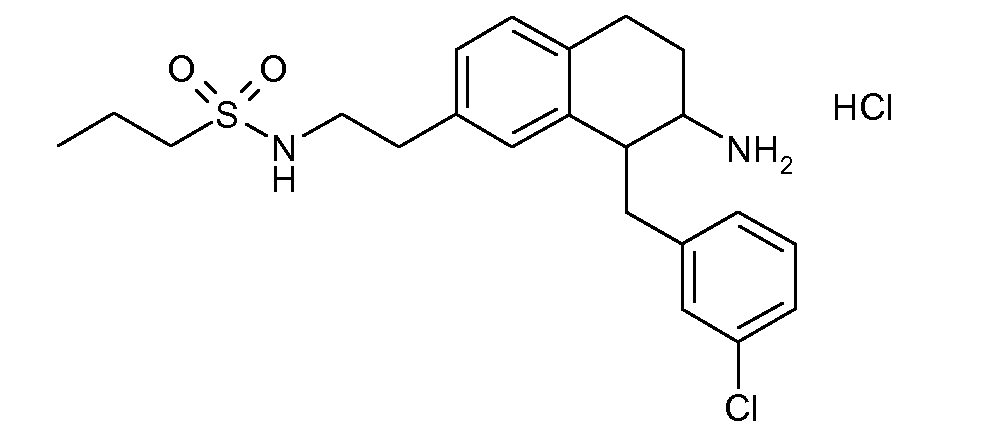
Получают из [7-(2-амино-этил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира по способу примера 3.
ESI-MS [M+H+]=421, рассчитано для C22H29ClN2O2S=420.
Пример 305: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(2-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
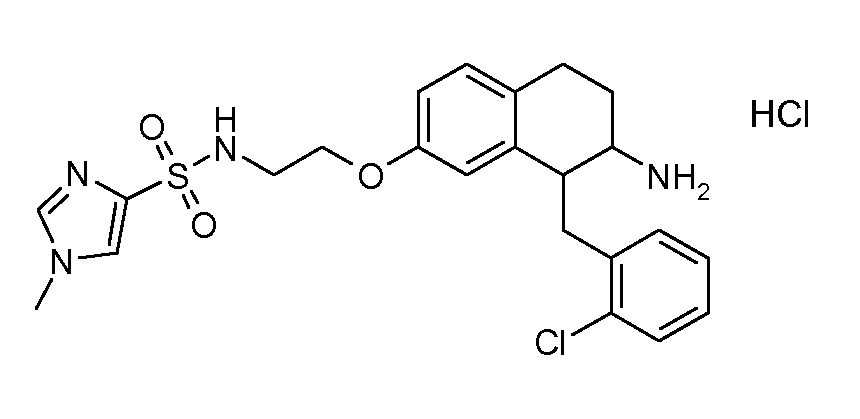
Получают по способу примера 3.
ESI-MS [M+H+]=475, рассчитано для C23H27ClN4O3S=474.
Пример 306: N-[1-(3-Хлорбензил)-7-(2-циклопропилметансульфониламиноэтокси)-1,2,3,4-тетрагидронафтален-2-ил]ацетамид
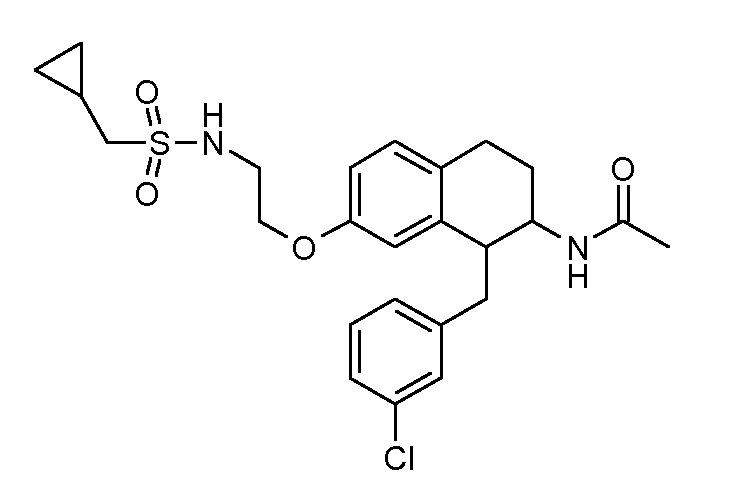
Получают по способу примера 214.
ESI-MS [M+H+]=491, рассчитано для C25H31ClN2O4S=490.
Пример 307: N-{2-[8-(3-Хлорбензил)-7-этиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
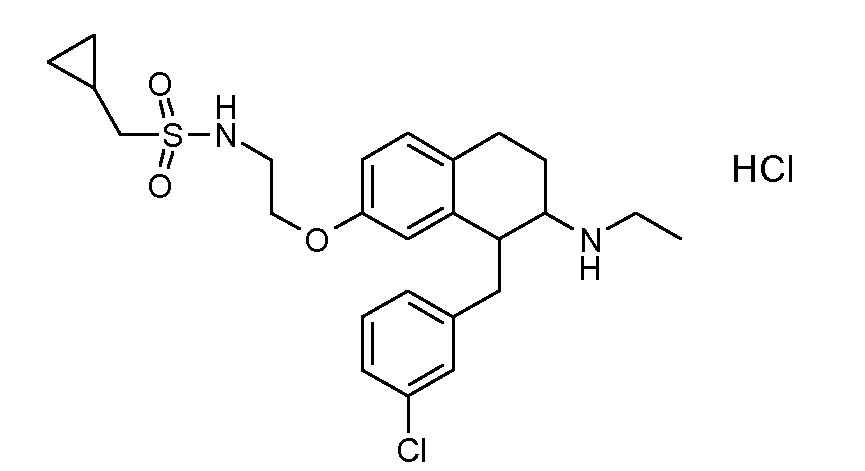
Получают по способу примера 300.
ESI-MS [M+H+]=477, рассчитано для C25H33ClN2O3S=476.
Пример 308: Пропан-1-сульфоновой кислоты {3-[8-(3-хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-ил]пропил}амида гидрохлорид
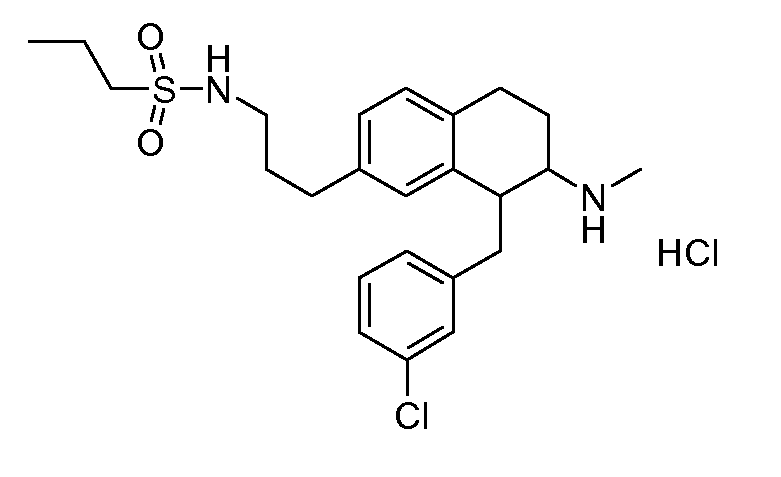
Получают по способам примеров 297/300.
ESI-MS [M+H+]=449, рассчитано для C24H33ClN2O2S=448.
Пример 309: Пропан-1-сульфоновой кислоты {2-[8-(3-хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-ил]этил}амид
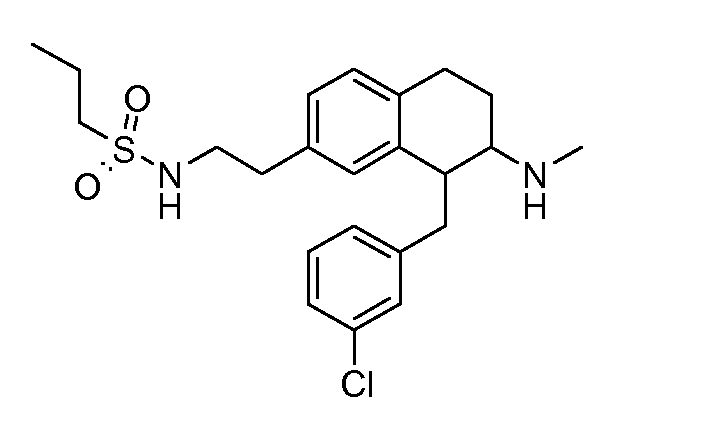
Получают по способам примеров 304/300.
ESI-MS [M+H+]=435, рассчитано для C23H31ClN2O2S=434.
Пример 310: N-{2-[7-Амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-ил]этил}-C-циклопропилметансульфонамида гидрохлорид
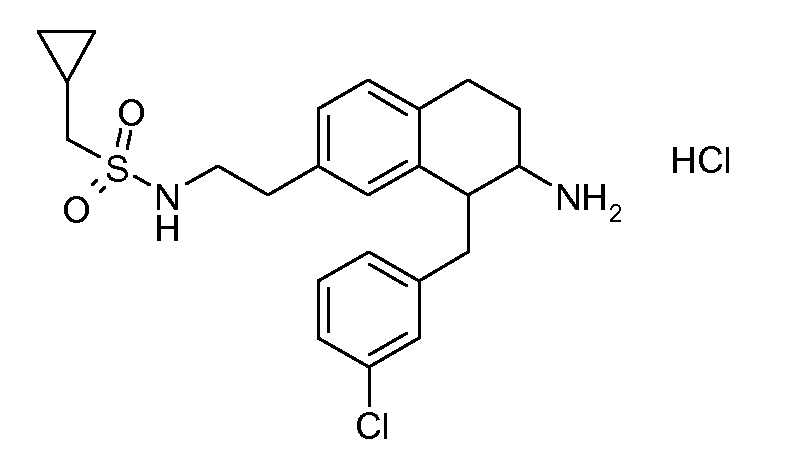
Получают по способу примера 304.
ESI-MS [M+H+]=433, рассчитано для C23H29ClN2O2S=432.
Пример 311: Пропан-1-сульфоновой кислоты {2-[8-(2-фторбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
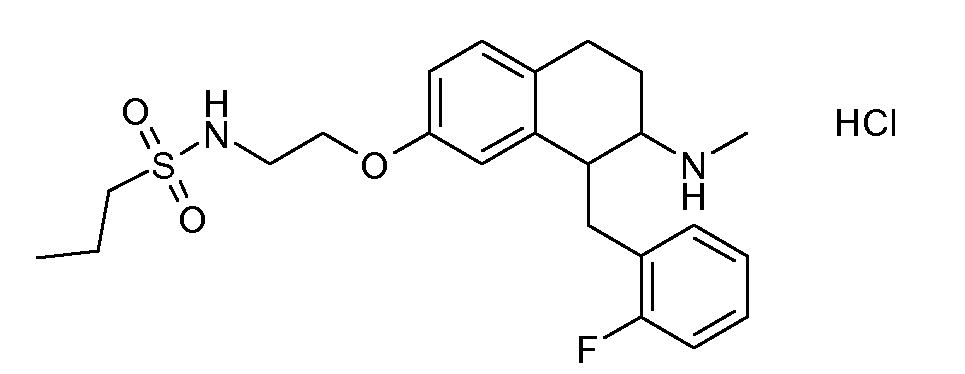
Получают по способам примеров 3/300.
ESI-MS [M+H+]=435, рассчитано для C23H31FN2O3=434.
Пример 312: C-Циклопропил-N-{2-[8-(2-фторбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси]этил}метансульфонамида гидрохлорид
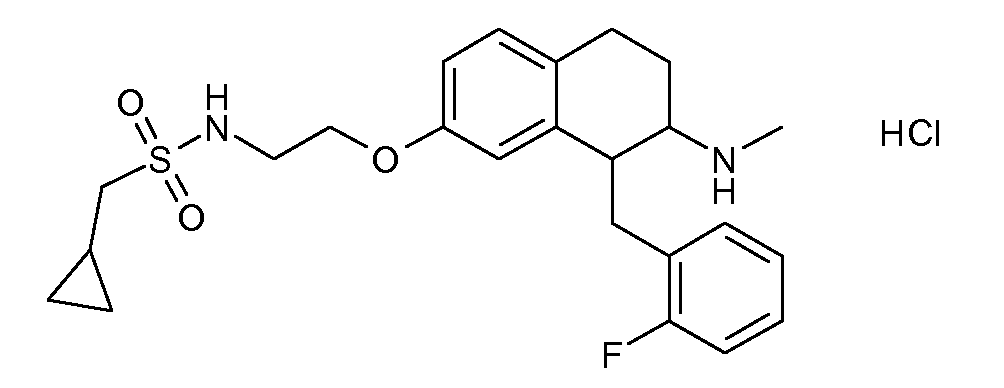
Получают по способам примеров 3/300.
ESI-MS [M+H+]=447, рассчитано для C24H31FN2O3S=446.
Пример 313: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(3-хлорбензил)-7-метиламино-5,6,7,8-тетрагидронафтален-2-ил]этил}амид
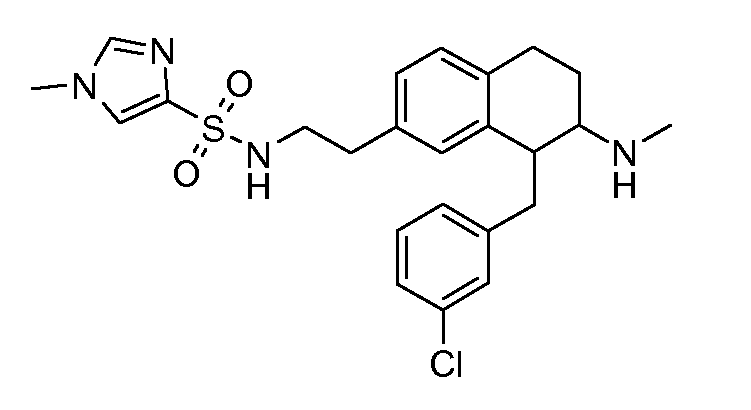
Получают по способам примеров 304/300.
ESI-MS [M+H+]=473, рассчитано для C24H29ClN4O2S=472.
Пример 314: Пропан-1-сульфоновой кислоты [2-(8-циклогексилметил-7-метиламино-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида трифторацетат
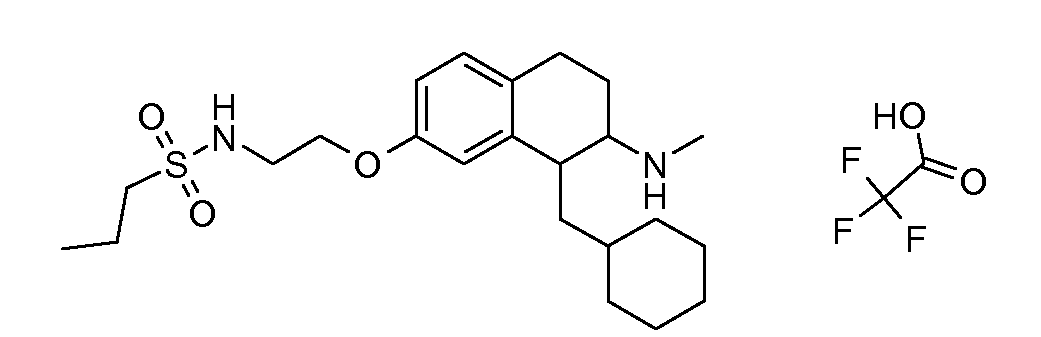
Получают по способам примеров 3/300.
ESI-MS [M+H+]=423, рассчитано для C23H38N2O3S=422.
Пример 315: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(2-хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
315.1 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(2-хлорбензил)-7-(2-оксопирролидин-1-ил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амид
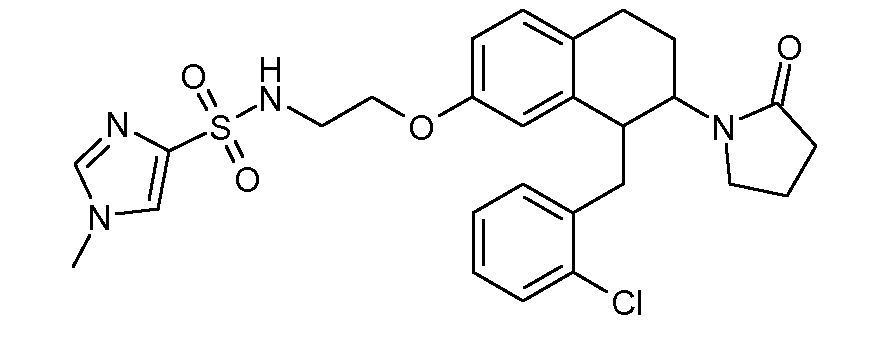
Получают по способу примера 263.
315.2 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(2-хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
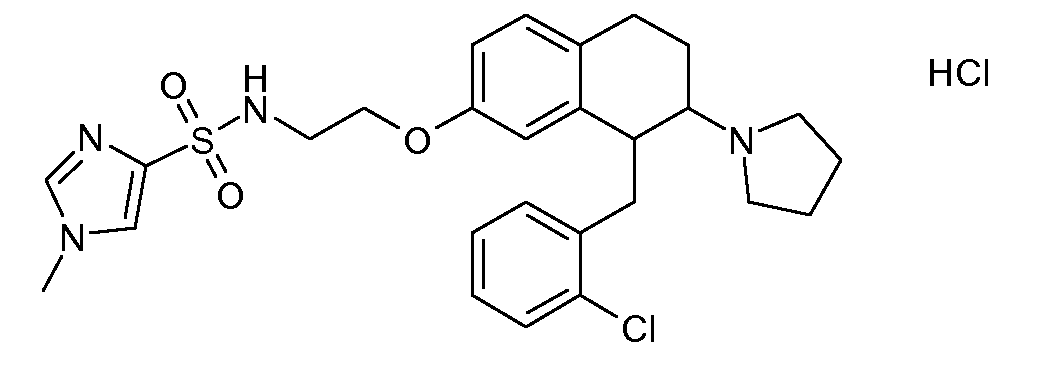
Получают из соединения, полученного на предыдущей стадии, путем восстановления LiAlH4 по способу примера 300.
ESI-MS [M+H+]=529, рассчитано для C27H33ClN4O3S=528.
Пример 316: 1,2-Диметил-1H-имидазол-4-сульфоновой кислоты {2-[7-амино-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
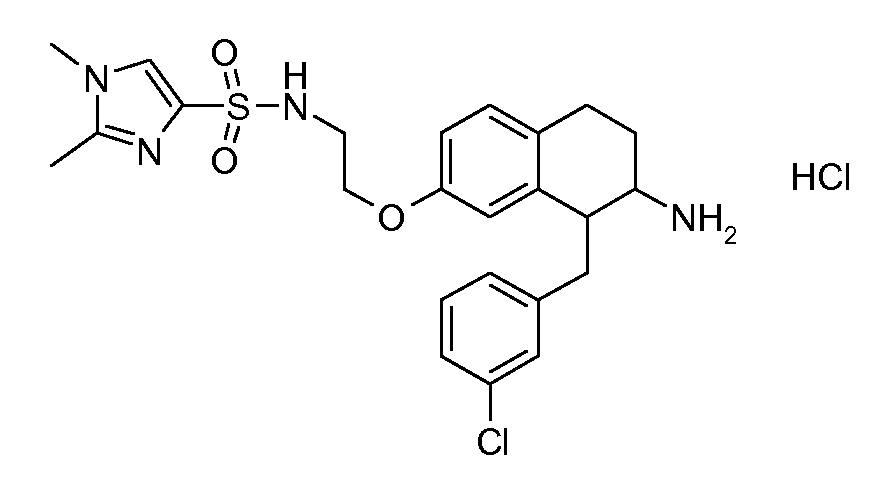
Получают по способу примера 3.
ESI-MS [M+H+]=489, рассчитано для C24H29ClN4O3S=488.
Пример 317: N-{2-[8-(3-Хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамида гидрохлорид
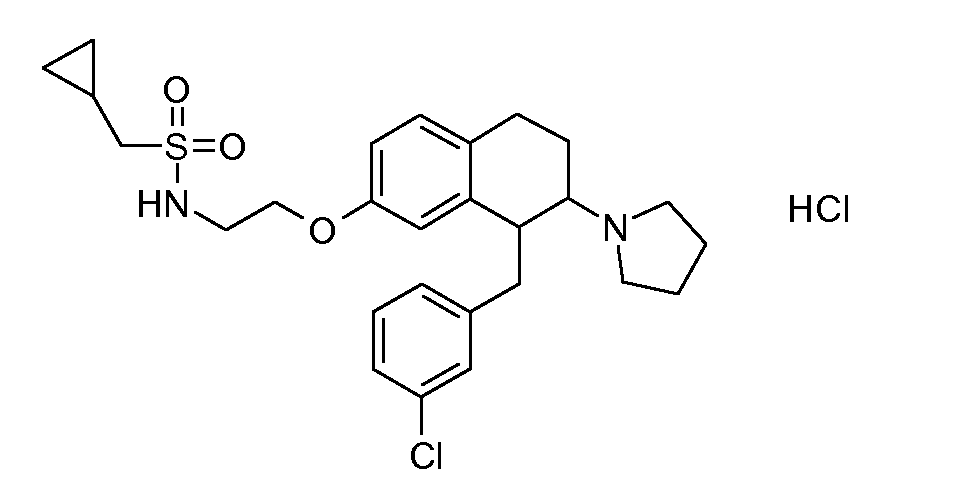
Получают по способам примеров 264/88.
ESI-MS [M+H+]=503, рассчитано для C27H35ClN2O3S=502.
Пример 318: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[8-(3-хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
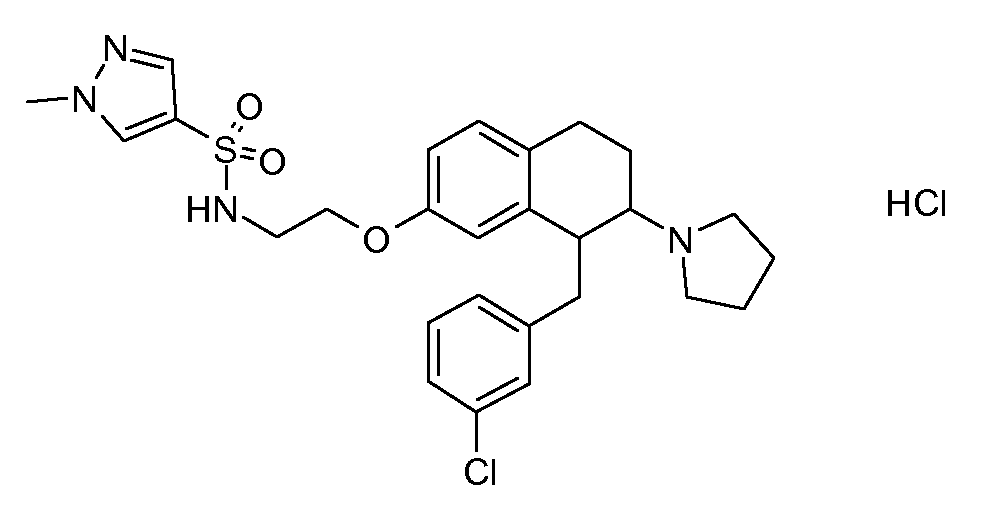
Получают по способам примеров 264/88.
ESI-MS [M+H+]=529, рассчитано для C27H33ClN4O3S=528.
Пример 319: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[8-(3-хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид

Получают по способам примеров 264/88.
ESI-MS [M+H+]=529, рассчитано для C27H33ClN4O3S=528.
Пример 320: N-{2-[7-Азетидин-1-ил-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамид
320.1 1-[1-(3-Хлорбензил)-7-метокси-1,2,3,4-тетрагидронафтален-2-ил]азетидин
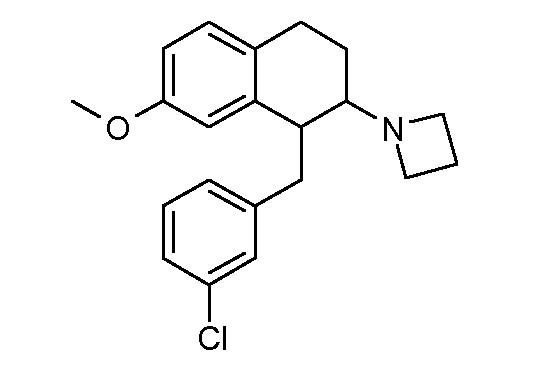
Получают по способу примера 264, используя 1,3-дибромпропан вместо 1,4-дибромбутана.
320.2 N-{2-[7-Азетидин-1-ил-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}-C-циклопропилметансульфонамид
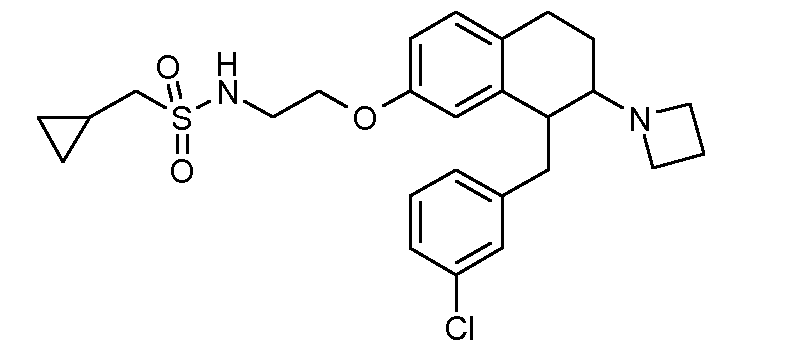
Получают из соединения, полученного на предыдущей стадии, по способу примера 88.
ESI-MS [M+H+]=489, рассчитано для C26H33ClN2O3S=488.
Пример 321: 1-Метил-1H-имидазол-4-сульфоновой кислоты {2-[7-азетидин-1-ил-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
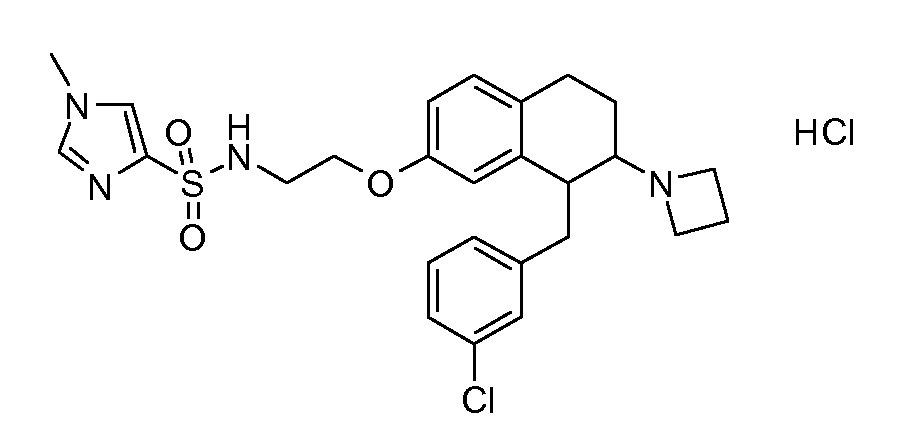
Получают по способу примера 320.
ESI-MS [M+H+]=515, рассчитано для C26H31ClN4O3S=514.
Пример 322: 1-Метил-1H-пиразол-4-сульфоновой кислоты {2-[7-азетидин-1-ил-8-(3-хлорбензил)-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
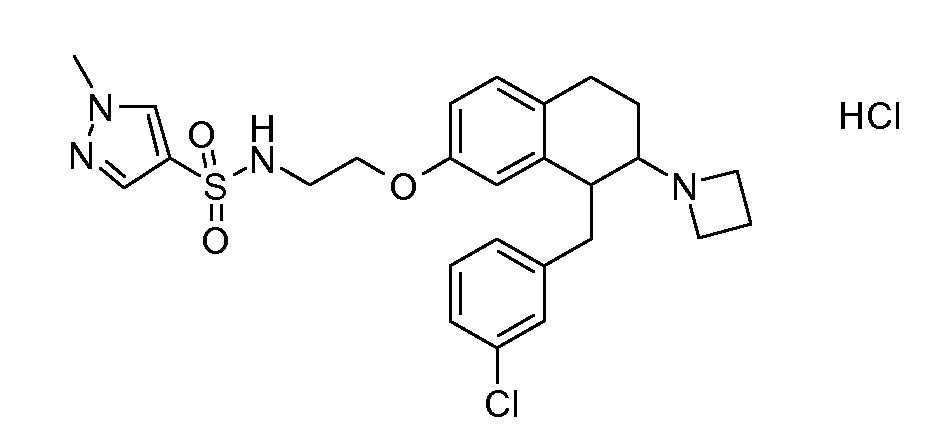
Получают по способу примера 320.
ESI-MS [M+H+]=515, рассчитано для C26H31ClN4O3S=514.
Пример 323: Пропан-1-сульфоновой кислоты {2-[8-(3-хлорбензил)-7-пирролидин-1-ил-5,6,7,8-тетрагидронафтален-2-илокси]этил}амида гидрохлорид
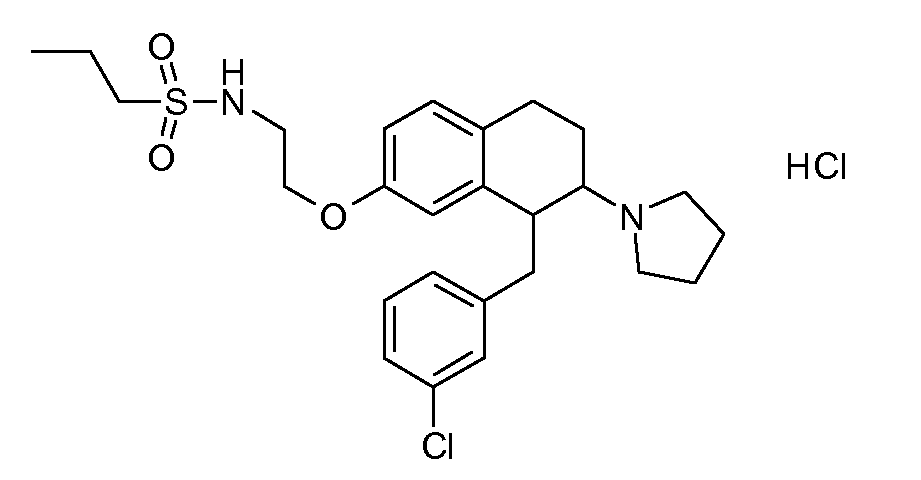
Получают по способам примеров 264/88.
ESI-MS [M+H+]=491, рассчитано для C26H35ClN2O3S=490.
Пример 324: 1-Метил-1H-пиразол-4-сульфоновой кислоты [2-(7-азетидин-1-ил-8-бензил-5,6,7,8-тетрагидронафтален-2-илокси)этил]амида гидрохлорид
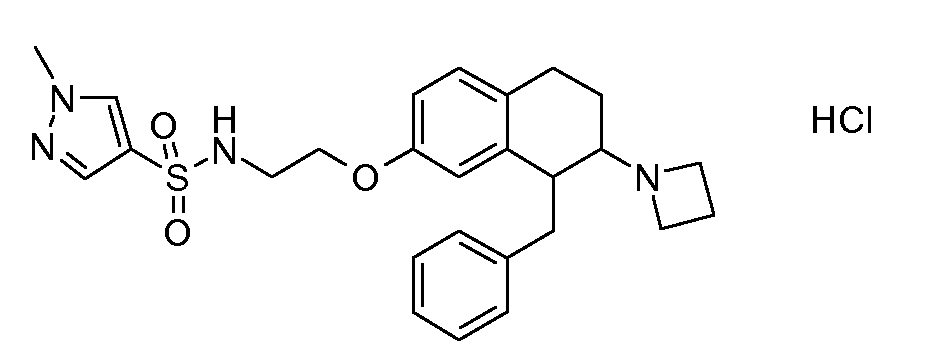
Получают по способу примера 320.
ESI-MS [M+H+]=481, рассчитано для C26H32N4O3S=480.
Пример 325: 1-Бензил-7-[2-(пропан-1-сульфонил)этил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
325.1 [1-(3-Хлорбензил)-7-винил-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
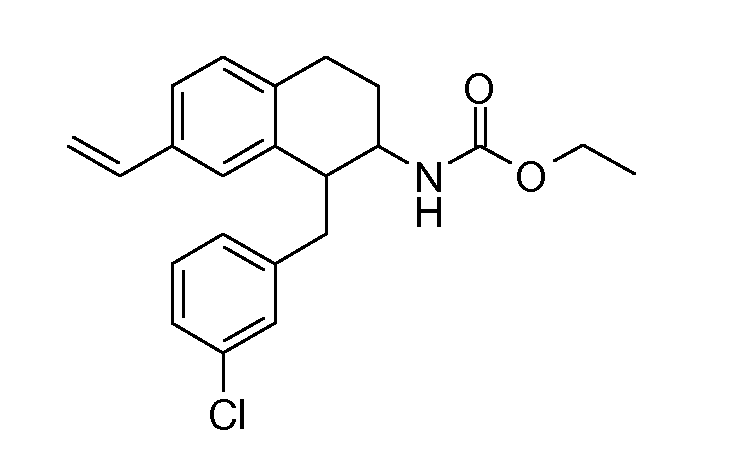
Синтез проводят по аналогии с Organic Letters; 2002, Vol 4; p.107-109. Раствор трифтор(винил)бората калия (1,000 г, 7,46 ммоль), аддукта PdCl2(dppf)-CH2Cl2 (0,102 г, 0,124 ммоль), 8-(3-хлорбензил)-7-(этоксикарбониламино)-5,6,7,8-тетрагидронафтален-2-ила трифторметансульфоната (3,06 г, 6,22 ммоль) и триэтиламина (0,867 мл, 6,22 ммоль) в 100 мл n-BuOH перемешивают в атмосфере N2 при 85-90°C в течение 4 ч и затем охлаждают до комнатной температуры. Добавляют воду и экстрагируют эфиром. Эфирный раствор промывают насыщенным соляным раствором, сушат, фильтруют и упаривают, получая коричневое масло. После хроматографии получают 1,55 г продукта в виде бледно-желтого твердого вещества.
325.2 [1-(3-Хлорбензил)-7-(2-гидроксиэтил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
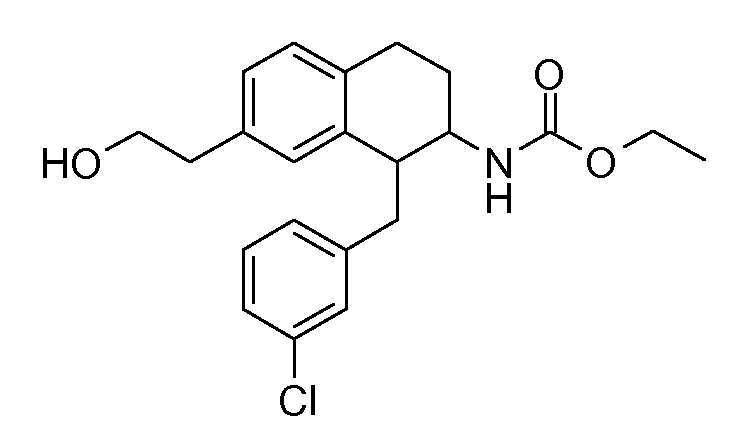
BH3·DMS (1 M в ТГФ, 0,838 мл, 0,838 ммоль) добавляют раствор этил 1-(3-хлорбензил)-7-винил-1,2,3,4-тетрагидронафтален-2-илкарбамата (1,55 г, 4,19 ммоль) в 20 мл сухого ТГФ. Реакционную смесь перемешивают при 60°C в течение 1 ч и охлаждают до комнатной температуры. Добавляют немного воды, чтобы разрушить избыток боранового комплекса, и полученную смесь нагревают с обратным холодильником в течение 1 ч в присутствии 30% H2O2 (8,56 мл, 84 ммоль) и 2N NaOH (9,74 мл, 19,49 ммоль). Реакционную смесь экстрагируют CH2Cl2, промывают водой и насыщенным соляным раствором, сушат, фильтруют и растворитель упаривают, получая бледно-коричневое твердое вещество (1,7 г), которое очищают хроматографией, получая 854 мг продукта в виде белого твердого вещества.
325.3 [7-(2-Бром-этил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
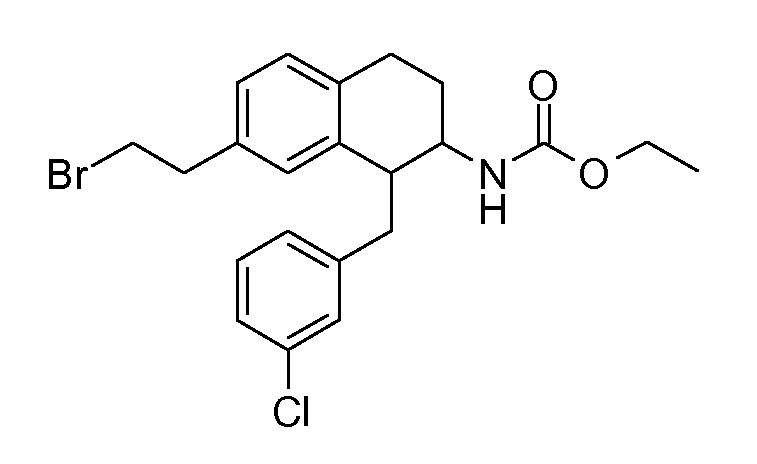
К раствору [1-(3-хлорбензил)-7-(2-гидроксиэтил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира (554 мг, 1,428 ммоль) в 15 мл сухого CH2Cl2, охлажденного до 0°C, добавляют трифенилфосфин (562 мг, 2,142 ммоль) и тетрабромид углерода (0,208 мл, 2,142 ммоль). Смесь перемешивают в течение 1 ч, после чего растворители упаривают. Остаток очищают хроматографией, получая 277 мг продукта в виде белого твердого вещества.
325.4 [1-(3-Хлорбензил)-7-(2-пропилсульфанилэтил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
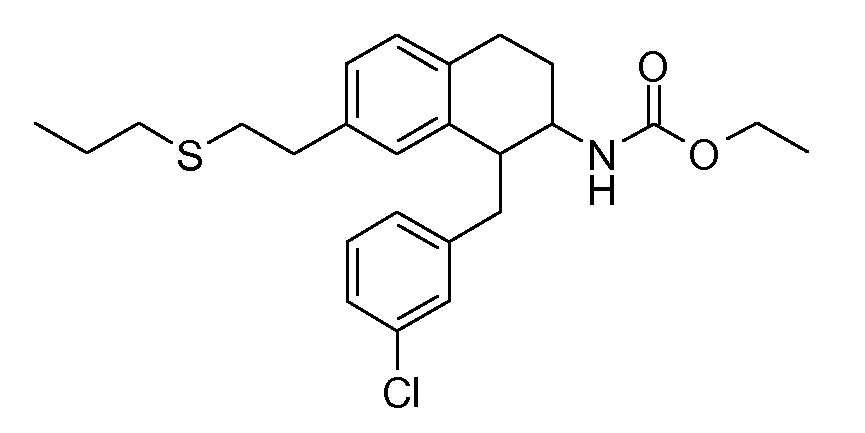
К суспензии NaH (4,73 мг, 0,177 ммоль) в 3 мл сухого DMF в атмосфере N2 добавляют 1-пропантиол (0,012 мл, 0,133 ммоль, растворенный в 1 мл сухого DMF). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, после чего добавляют триэтиламин (0,019 мл, 0,133 ммоль) и этил 7-(2-бромэтил)-1-(3-хлорбензил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (40 мг, 0,089 ммоль, растворенный в 2 мл сухого DMF). Смесь перемешивают при комнатной температуре в течение ночи, растворитель упаривают, остаток перерастворяют в этилацетате, промывают водой, лимонной кислотой, NaHCO3, насыщенным соляным раствором и фильтруют. Растворитель упаривают, получая 31 мг не совсем белого твердого вещества, которое используют без дополнительной очистки.
325.5 {1-(3-Хлорбензил)-7-[2-(пропан-1-сульфонил)этил]-1,2,3,4-тетрагидронафтален-2-ил}карбаминовой кислоты этиловый эфир
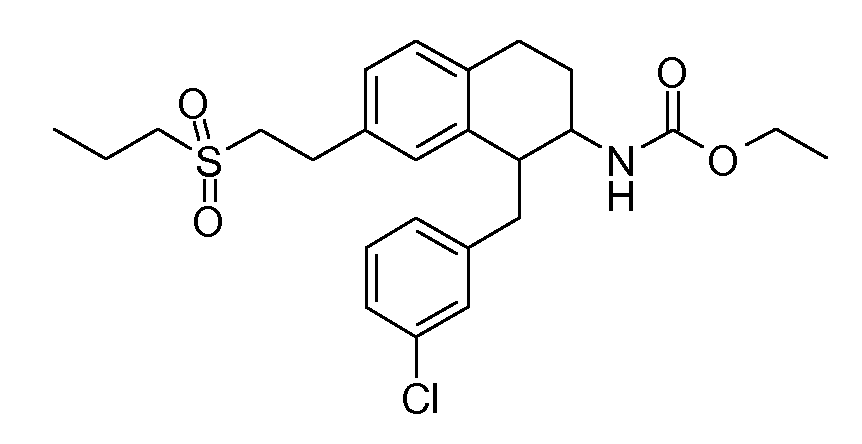
К охлажденной смеси (0°C) этил 1-(3-хлорбензил)-7-(2-(пропилтио)этил)-1,2,3,4-тетрагидронафтален-2-илкарбамата (31,4 мг, 0,070 ммоль) в 2 мл этилацетата добавляют m-CPBA (33,4 мг, 0,155 ммоль). Реакционную смесь перемешивают в течение 2 ч, позволяя ей нагреваться до комнатной температуры. Затем смесь разбавляют этилацетатом, промывают NaHCO3, водой и насыщенным соляным раствором, сушат, фильтруют и растворитель упаривают, получая белое твердое вещество, которое очищают хроматографией (27 мг).
325.6 [1-Бензил-7-(2-пропилсульфанилэтил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этиловый эфир
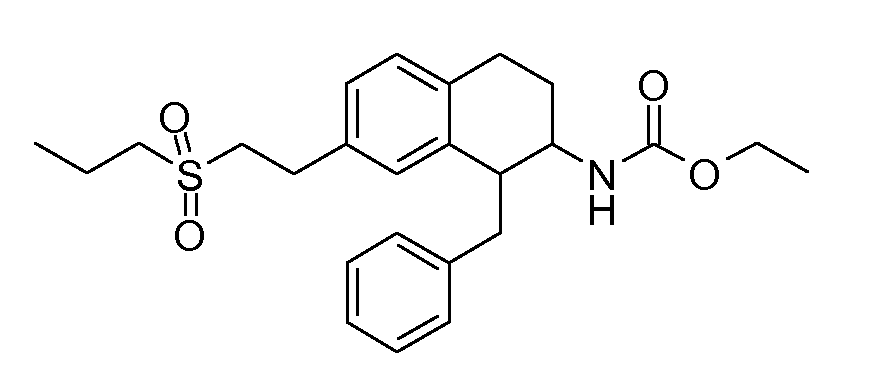
Этил 1-(3-хлорбензил)-7-(2-(пропилсульфонил)этил)-1,2,3,4-тетрагидронафтален-2-илкарбамат (27,1 мг, 0,057 ммоль) и формиат аммония (71,5 мг, 1,134 ммоль) растворяют в 5 мл MeOH. Добавляют Pd/C (0,845 мг, 7,94 мкмоль) и перемешивают при 80°C в течение 4 ч. Смесь фильтруют, растворитель упаривают, остаток перерастворяют в этилацетате и последовательно промывают водой, NaHCO3 и насыщенным соляным раствором, сушат, фильтруют. Растворитель упаривают, получая белое твердое вещество, которое очищают хроматографией с получением 12,7 мг продукта в виде белого твердого вещества.
325.7 1-Бензил-7-[2-(пропан-1-сульфонил)этил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
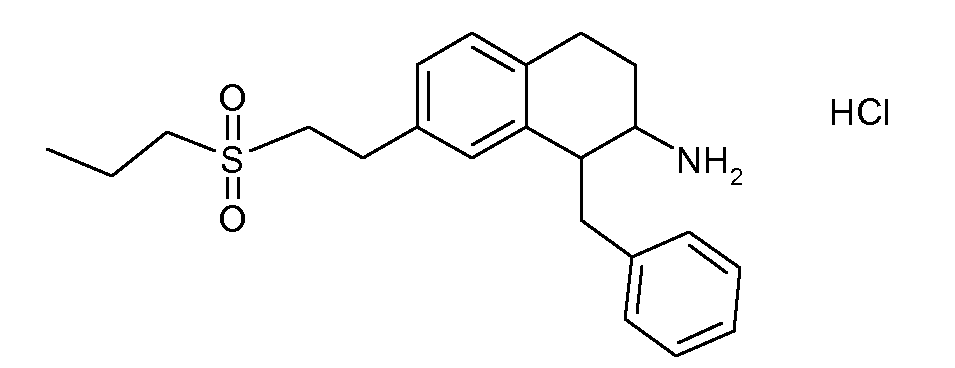
Получают по способу примера 3 из [1-бензил-7-(2-пропилсульфанилэтил)-1,2,3,4-тетрагидронафтален-2-ил]карбаминовой кислоты этилового эфира.
ESI-MS [M+H+]=372, рассчитано для C22H29NO2S=371.
Пример 326: 1-(3-Хлорбензил)-7-[2-(пропан-1-сульфонил)этил]-1,2,3,4-тетрагидронафтален-2-иламина гидрохлорид
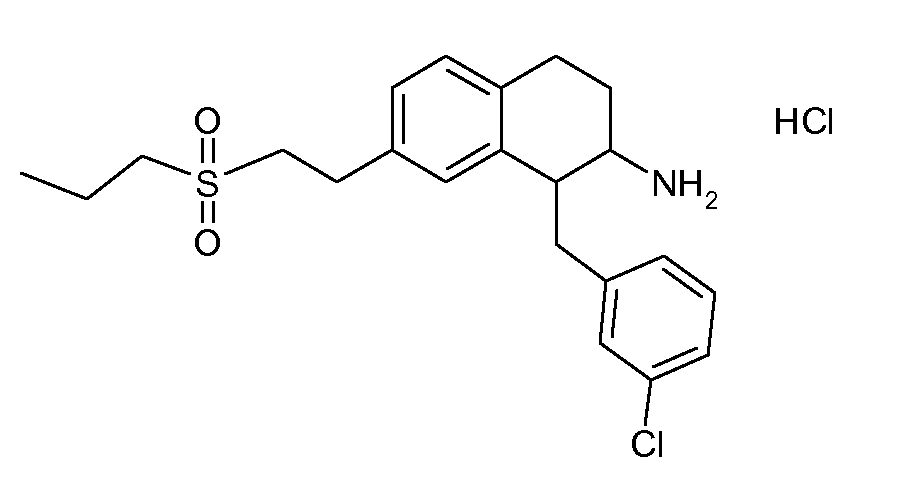
Получают по способу примера 325, пропуская стадию дехлорирования.
ESI-MS [M+H+]=406, рассчитано для C22H28ClNO2S=405.
Биологическое тестирование
1. Поглощение [3H]-глицина рекомбинантными клетками CHO, экспрессирующими человеческий GlyT1:
Рекомбинантные клетки hGlyT1c_5_CHO, экспрессирующие человеческий GlyT1c, помещают в 96-луночные сцинтилляционные микропланшеты Cytostar-T (Amersham Biosciences) в количестве 20000 клеток на лунку и культивируют почти до слияния в течение 24 ч. Чтобы провести анализ поглощения глицина, культуральную среду отсасывают и клетки промывают один раз 100 мкл HBSS (Gibco BRL, #14025-050), содержащей 5 мМ L-аланин (Merck #1007). Добавляют 80 мкл буфера HBSS, затем 10 мкл ингибитора или носителя (10% ДМСО) и 10 мкл [3H]-глицина (TRK71, Amersham Biosciences) до конечной концентрации 200 нМ для инициации поглощения глицина. Планшеты помещают в Wallac Microbeta (PerkinElmer) и непрерывно подсчитывают методом твердофазной сцинтилляционной спектрометрии в течение периода до 3 часов. Неспецифическое поглощение определяют в присутствии 10 мкМ Org24598. IC50 рассчитывают методом четырех-параметрической логарифмической нелинейной регрессии (GraphPad Prism), используя значения в диапазоне линейного увеличения включения [3H]-глицина в интервале от 60 до 120 мин.
2. Анализ связывания радиомеченного лиганда с использованием мембран рекомбинантных клеток CHO, экспрессирующих человеческий GlyT1:
Связывание радиомеченного лиганда с мембранами, экспрессирующими транспортер человеческого GlyT1c, проводят по способу, описанному в Mezler et al., Molecular Pharmacology 74:1705-1715, 2008.
Ниже приведены результаты анализа соединений, раскрытых в примерах:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ ПО БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
|
|
Все соединения имеют цис-конфигурацию на индановом кольце
|
|
|
|
|
|
|
|
|